Композиции i-phk для серпина c1 и способы их применения - RU2691580C2
Код документа: RU2691580C2
Чертежи

































































































































































































































































































































































































































Описание
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по временной заявке США № 61/638952, поданной 26 апреля 2012 года, по временной заявке США № 61/669249, поданной 9 июля 2012 года, по временной заявке США № 61/734573, поданной 7 декабря 2012 года, и по заявке США № 13/837129, поданной 15 марта 2013 года. Полное содержание каждой из указанных выше заявок включено в настоящее описание в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Серпин c1 является представителем суперсемейства ингибиторов сериновых протеаз (серпинов). Серпин c1 является ингибитором протеаз плазмы, который ингибирует тромбин, а также другие активированные сериновые протеазы системы свертывания, такие как факторы X, IX, XI, XII и VII, и, таким образом, регулирует каскад свертывания крови (смотрите, например, фиг. 1). Противосвертывающая активность серпина c1 усиливается присутствием гепарина и других родственных гликозаминогликанов, которые катализируют образование комплексов тромбин:антитромбин (TAT).
Геморрагические нарушения, как врожденные, так и приобретенные, представляют собой состояния, при которых свертывание крови является недостаточным. Например, гемофилия представляет собой группу наследственных генетических геморрагических нарушений, которые нарушают способность организма контролировать свертывание или коагуляцию крови. Гемофилия A представляет собой рецессивное X-сцепленное генетическое нарушение, вовлекающее отсутствие функционального фактора свертывания VIII, и она соответствует 80% случаев гемофилии. Гемофилия B представляет собой рецессивное X-сцепленное генетическое нарушение, вовлекающее отсутствие функционального фактора свертывания IX. Она составляет приблизительно 20% случаев гемофилии. Гемофилия C представляет собой аутосомное генетическое нарушение, вовлекающее отсутствие функционального фактора свертывания XI. Гемофилия C не является полностью рецессивной, поскольку гетерозиготные индивидуумы также имеют усиленные кровотечения.
Хотя в настоящее время не существует способа излечения гемофилии, ее можно контролировать регулярными инфузиями дефицитного фактора свертывания, например, фактора VIII при гемофилии A. Однако у некоторых гемофиликов вырабатываются антитела (ингибиторы) против заместительных факторов, вводимых им, и, таким образом, они становятся рефрактерными к заместительному фактору свертывания. Таким образом, кровотечения у таких индивидуумов невозможно контролировать надлежащим образом.
Выработка высоких титров ингибиторов, например, для фактора VIII и других факторов свертывания, является наиболее серьезным препятствием терапии гемофилии, и это приводит к тому, что лечение кровотечения является очень трудным. В настоящее время единственной стратегией для остановки кровотечений у таких индивидуумов является применение "шунтирующих средств", таких как средство, шунтирующее активность ингибитора фактора восемь, (FEIBA) и активированный рекомбинантный фактор VII (rFVIIa), плазмаферез, непрерывное замещение факторов и обеспечивающая иммунную толерантность терапия, ни одно из которых не является полностью эффективным. Таким образом, в данной области существует потребность в альтернативных способах лечения индивидуумов, имеющих геморрагическое нарушение, такое как гемофилия.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям i-РНК, которые осуществляют опосредуемое индуцируемым РНК комплексом подавления (RISC) расщепление РНК-транскриптов гена серпина c1. Ген серпина c1 может находиться в клетке, например, в клетке индивидуума, такого как человек. Настоящее изобретение также относится к способам применения и к применениям композиций i-РНК композиции по изобретению для ингибирования экспрессии гена серпина c1 и/или для лечения индивидуума, имеющего нарушение, для которого может быть полезным ингибирование или снижение экспрессии гена серпина c1, например, геморрагическое нарушение, такое как гемофилия.
Таким образом, в одном аспекте настоящее изобретение относится к двухцепочечным рибонуклеиновым кислотам (дцРНК (dsRNA)) для ингибирования экспрессии серпина c1. дцРНК содержат смысловую цепь и антисмысловую цепь, где смысловая цепь содержит по меньшей мере 15 последовательно расположенных нуклеотидов, отличающихся не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:1, и антисмысловая цепь содержит по меньшей мере 15 последовательно расположенных нуклеотидов, отличающихся не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:5.
В другом аспекте настоящее изобретение относится к двухцепочечным рибонуклеиновым кислотам (дцРНК) для ингибирования экспрессии серпина c1. дцРНК содержат смысловую цепь и антисмысловую цепь, причем антисмысловая цепь содержит область комплементарности, которая содержит по меньшей мере 15 последовательно расположенных нуклеотидов, отличающихся не более чем 3 нуклеотидами от любой из антисмысловых последовательностей, приведенных в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21.
В одном варианте осуществления смысловая и антисмысловая цепи содержат последовательности, выбранные из группы, состоящей из AD-50487.1, AD-50477.1, AD-50483.1, AD-50475.1, AD-50495.1, AD-50476.1, AD-50499.1, AD-50478.1, AD-50489.1, AD-50501.1, AD-50507.1, AD-50484.1, AD-50515.1, AD-50540.1, AD-50528.1, AD-50549.1, AD-50539.1, AD-50534.1, AD-50527.1, AD-50514.1, AD-50509.1, AD-50529.1, AD-54944, AD-56813, AD-57205, AD-57214 и AD-57213, и любой из последовательностей, приведенных в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, или последовательностей, которые по меньшей мере на 95%, 96%, 97%, 98% или 99% идентичны этим последовательностям. В определенных вариантах осуществления изобретения дцРНК содержат по меньшей мере один модифицированный нуклеотид. В одном варианте осуществления по меньшей мере один из модифицированных нуклеотидов выбран из группы, состоящей из 2'-O-метил-модифицированного нуклеотида, нуклеотида, содержащего 5'-фосфоротиоатную группу, и концевого нуклеотида, связанного с холестерильным производным или бисдециламидной группой додекановой кислоты. В другом варианте осуществления модифицированный нуклеотид выбран из группы, состоящей из 2'-дезокси-2'-фтор-модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, замкнутого нуклеотида, абазического нуклеотида, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинонуклеотида, фосфорамидата и нуклеотида, содержащего неприродное основание.
Область комплементарности дцРНК может составлять по меньшей мере 17 нуклеотидов в длину, от 19 до 21 нуклеотида в длину или 19 нуклеотидов в длину.
В одном варианте осуществления каждая цепь дцРНК имеет длину не более 30 нуклеотидов.
По меньшей мере одна цепь дцРНК может содержать 3'-выступающий конец из по меньшей мере 1 нуклеотида или по меньшей мере 2 нуклеотидов.
В определенных вариантах осуществления дцРНК дополнительно содержит лиганд. В одном варианте осуществления лиганд конъюгирован с 3'-концом смысловой цепи дцРНК.
В некоторых вариантах осуществления лиганд представляет собой одно или несколько производных N-ацетилгалактозамина (GalNAc), связанных через двухвалентный или трехвалентный разветвленный линкер. В конкретных вариантах осуществления лиганд представляет собой

В некоторых вариантах осуществления средство РНК-i конъюгировано с лигандом, как показано на следующей схеме

В другом варианте осуществления средство РНК-i конъюгировано с лигандом, как показано на следующей схеме, где X представляет собой O или S.

В одном варианте осуществления область комплементарности дцРНК состоит из одной из антисмысловых последовательностей любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21.
В другом варианте осуществления дцРНК содержит смысловую цепь, состоящую из последовательности смысловой цепи, выбранной из последовательностей любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, и антисмысловую цепь, состоящую из последовательности антисмысловой цепи, выбранной из последовательностей любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21.
В другом аспекте настоящее изобретение относится к клетке, содержащей дцРНК по изобретению.
В другом аспекте настоящее изобретение относится к вектору, кодирующему по меньшей мере одну цепь дцРНК, где дцРНК содержит область комплементарности по меньшей мере с частью мРНК, кодирующей серпин c1, где дцРНК имеет длину 30 п.о. или менее, и где дцРНК нацеливает мРНК на расщепление.
Область комплементарности может иметь длину по меньшей мере 15 нуклеотидов или от 19 до 21 нуклеотида.
В следующем аспекте настоящее изобретение относится к клетке, содержащей вектор, кодирующий по меньшей мере одну цепь дцРНК, где дцРНК содержит область комплементарности по меньшей мере с частью мРНК, кодирующей серпин c1, где дцРНК имеет длину 30 п.о. или менее, и где дцРНК нацеливает мРНК на расщепление.
В одном аспекте настоящее изобретение относится к фармацевтической композиции для ингибирования экспрессии гена серпина c1, содержащей дцРНК или вектор по изобретению.
В одном варианте осуществления фармацевтическая композиция дополнительно содержит липидный состав, такой как состав MC3, SNALP или XTC.
В другом аспекте настоящее изобретение относится к способам ингибирования экспрессии серпина c1 в клетке. Способы включают контактирование клетки с дцРНК или вектором по изобретению и поддержание клетки в течение периода времени, достаточного для достижения деградации мРНК-транскрипта гена серпина c1, тем самым ингибируя экспрессию гена серпина c1 в клетке.
Клетка может находиться в индивидууме, таком как человек, например человек, страдающий геморрагическим нарушением, например, гемофилией.
В одном варианте осуществления способов по изобретению экспрессия серпина c1 ингибируется по меньшей мере на приблизительно 30%, по меньшей мере на приблизительно 35%, по меньшей мере на приблизительно 40%, по меньшей мере на приблизительно 45%, по меньшей мере на приблизительно 50%, по меньшей мере на приблизительно 55%, по меньшей мере на приблизительно 60%, по меньшей мере на приблизительно 65%, по меньшей мере на приблизительно 70%, по меньшей мере на приблизительно 75%, по меньшей мере на приблизительно 80%, по меньшей мере на приблизительно 85%, по меньшей мере на приблизительно 90%, по меньшей мере на приблизительно 91%, по меньшей мере на приблизительно 92%, по меньшей мере на приблизительно 93%, по меньшей мере на приблизительно 94%, по меньшей мере на приблизительно 95%, по меньшей мере на приблизительно 96%, по меньшей мере на приблизительно 97%, по меньшей мере на приблизительно 98% или по меньшей мере на приблизительно 99%.
В другом аспекте настоящее изобретение относится к способам лечения индивидуума, имеющего нарушение, при котором может быть полезным снижение экспрессии серпина c1, например, геморрагическое нарушение, такое как гемофилия. Способы включают введение индивидууму терапевтически эффективного количества дцРНК или вектора по изобретению, тем самым осуществляя лечение индивидуума.
В одном аспекте изобретение относится к способам профилактики по меньшей мере одного симптома, например кровотечения, у индивидуума, имеющего нарушение, при котором может быть полезным снижение экспрессии серпина c1, например, гемофилию. Способы включают введение индивидууму терапевтически эффективного количества i-РНК, например дцРНК, или вектора по изобретению, тем самым осуществляя профилактику по меньшей мере одного симптома у индивидуума, имеющего нарушение, при котором может быть полезным снижение экспрессии серпина c1.
Нарушение может представлять собой геморрагическое нарушение, такое как гемофилия.
В одном варианте осуществления введение дцРНК индивидууму вызывает повышение свертываемости крови и/или снижение экспрессии и/или накопления белка серпина c1.
В одном варианте осуществления дцРНК конъюгирована с лигандом, например, на 3'-конце смысловой цепи дцРНК. В одном варианте осуществления лиганд представляет собой производное N-ацетилгалактозамина (GalNAc).
В одном варианте осуществления дцРНК вводят в дозе от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг, например, от приблизительно 0,05 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,2 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,2 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,3 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,3 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,4 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,4 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 1 мг/кг до приблизительно 5 мг/кг, от приблизительно 1 мг/кг до приблизительно 10 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 2 мг/кг до приблизительно 2,5 мг/кг, от приблизительно 2 мг/кг до приблизительно 10 мг/кг, от приблизительно 3 мг/кг до приблизительно 5 мг/кг, от приблизительно 3 мг/кг до приблизительно 10 мг/кг, от приблизительно 3,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 4 мг/кг до приблизительно 5 мг/кг, от приблизительно 4,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 4 мг/кг до приблизительно 10 мг/кг, от приблизительно 4,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 5 мг/кг до приблизительно 10 мг/кг, от приблизительно 5,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 6 мг/кг до приблизительно 10 мг/кг, от приблизительно 6,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 7 мг/кг до приблизительно 10 мг/кг, от приблизительно 7,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 8 мг/кг до приблизительно 10 мг/кг, от приблизительно 8,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 9 мг/кг до приблизительно 10 мг/кг или от приблизительно 9,5 мг/кг до приблизительно 10 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, также являются частью настоящего изобретения.
Например, дцРНК можно вводить в дозе приблизительно 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9 или приблизительно 10 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
В другом варианте осуществления дцРНК вводят в дозе от приблизительно 0,5 до приблизительно 50 мг/кг, от приблизительно 0,75 до приблизительно 50 мг/кг, от приблизительно 1 до приблизительно 50 мг/мг, от приблизительно 1,5 до приблизительно 50 мг/кг, от приблизительно 2 до приблизительно 50 мг/кг, от приблизительно 2,5 до приблизительно 50 мг/кг, от приблизительно 3 до приблизительно 50 мг/кг, от приблизительно 3,5 до приблизительно 50 мг/кг, от приблизительно 4 до приблизительно 50 мг/кг, от приблизительно 4,5 до приблизительно 50 мг/кг, от приблизительно 5 до приблизительно 50 мг/кг, от приблизительно 7,5 до приблизительно 50 мг/кг, от приблизительно 10 до приблизительно 50 мг/кг, от приблизительно 15 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 30 до приблизительно 50 мг/кг, от приблизительно 35 до приблизительно 50 мг/кг, от приблизительно 40 до приблизительно 50 мг/кг, от приблизительно 45 до приблизительно 50 мг/кг, от приблизительно 0,5 до приблизительно 45 мг/кг, от приблизительно 0,75 до приблизительно 45 мг/кг, от приблизительно 1 до приблизительно 45 мг/мг, от приблизительно 1,5 до приблизительно 45 мг/кг, от приблизительно 2 до приблизительно 45 мг/кг, от приблизительно 2,5 до приблизительно 45 мг/кг, от приблизительно 3 до приблизительно 45 мг/кг, от приблизительно 3,5 до приблизительно 45 мг/кг, от приблизительно 4 до приблизительно 45 мг/кг, от приблизительно 4,5 до приблизительно 45 мг/кг, от приблизительно 5 до приблизительно 45 мг/кг, от приблизительно 7,5 до приблизительно 45 мг/кг, от приблизительно 10 до приблизительно 45 мг/кг, от приблизительно 15 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 30 до приблизительно 45 мг/кг, от приблизительно 35 до приблизительно 45 мг/кг, от приблизительно 40 до приблизительно 45 мг/кг, от приблизительно 0,5 до приблизительно 40 мг/кг, от приблизительно 0,75 до приблизительно 40 мг/кг, от приблизительно 1 до приблизительно 40 мг/мг, от приблизительно 1,5 до приблизительно 40 мг/кг, от приблизительно 2 до приблизительно 40 мг/кг, от приблизительно 2,5 до приблизительно 40 мг/кг, от приблизительно 3 до приблизительно 40 мг/кг, от приблизительно 3,5 до приблизительно 40 мг/кг, от приблизительно 4 до приблизительно 40 мг/кг, от приблизительно 4,5 до приблизительно 40 мг/кг, от приблизительно 5 до приблизительно 40 мг/кг, от приблизительно 7,5 до приблизительно 40 мг/кг, от приблизительно 10 до приблизительно 40 мг/кг, от приблизительно 15 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 30 до приблизительно 40 мг/кг, от приблизительно 35 до приблизительно 40 мг/кг, от приблизительно 0,5 до приблизительно 30 мг/кг, от приблизительно 0,75 до приблизительно 30 мг/кг, от приблизительно 1 до приблизительно 30 мг/мг, от приблизительно 1,5 до приблизительно 30 мг/кг, от приблизительно 2 до приблизительно 30 мг/кг, от приблизительно 2,5 до приблизительно 30 мг/кг, от приблизительно 3 до приблизительно 30 мг/кг, от приблизительно 3,5 до приблизительно 30 мг/кг, от приблизительно 4 до приблизительно 30 мг/кг, от приблизительно 4,5 до приблизительно 30 мг/кг, от приблизительно 5 до приблизительно 30 мг/кг, от приблизительно 7,5 до приблизительно 30 мг/кг, от приблизительно 10 до приблизительно 30 мг/кг, от приблизительно 15 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 25 до приблизительно 30 мг/кг, от приблизительно 0,5 до приблизительно 20 мг/кг, от приблизительно 0,75 до приблизительно 20 мг/кг, от приблизительно 1 до приблизительно 20 мг/мг, от приблизительно 1,5 до приблизительно 20 мг/кг, от приблизительно 2 до приблизительно 20 мг/кг, от приблизительно 2,5 до приблизительно 20 мг/кг, от приблизительно 3 до приблизительно 20 мг/кг, от приблизительно 3,5 до приблизительно 20 мг/кг, от приблизительно 4 до приблизительно 20 мг/кг, от приблизительно 4,5 до приблизительно 20 мг/кг, от приблизительно 5 до приблизительно 20 мг/кг, от приблизительно 7,5 до приблизительно 20 мг/кг, от приблизительно 10 до приблизительно 20 мг/кг или от приблизительно 15 до приблизительно 20 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Например, индивидуумам можно вводить терапевтическое количество i-РНК, такое как приблизительно 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5, 21, 21,5, 22, 22,5, 23, 23,5, 24, 24,5, 25, 25,5, 26, 26,5, 27, 27,5, 28, 28,5, 29, 29,5, 30, 31, 32, 33, 34, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или приблизительно 50 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
дцРНК, например, конъюгированную с лигандом, можно вводить индивидууму один раз в неделю или два раза в месяц.
В другом аспекте настоящее изобретение относится к способам ингибирования экспрессии серпина c1 у индивидуума. Способы включают введение индивидууму терапевтически эффективного количества дцРНК или вектора по изобретению, тем самым ингибируя экспрессию серпина c1 у индивидуума.
В одном варианте осуществления дцРНК конъюгирована с лигандом, например, на 3'-конце смысловой цепи дцРНК. В одном варианте осуществления лиганд представляет собой производное N-ацетилгалактозамина (GalNAc).
В одном варианте осуществления дцРНК вводят в дозе от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг, например, от приблизительно 0,05 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,2 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,2 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,3 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,3 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,4 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,4 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 1 мг/кг до приблизительно 5 мг/кг, от приблизительно 1 мг/кг до приблизительно 10 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 2 мг/кг до приблизительно 2,5 мг/кг, от приблизительно 2 мг/кг до приблизительно 10 мг/кг, от приблизительно 3 мг/кг до приблизительно 5 мг/кг, от приблизительно 3 мг/кг до приблизительно 10 мг/кг, от приблизительно 3,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 4 мг/кг до приблизительно 5 мг/кг, от приблизительно 4,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 4 мг/кг до приблизительно 10 мг/кг, от приблизительно 4,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 5 мг/кг до приблизительно 10 мг/кг, от приблизительно 5,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 6 мг/кг до приблизительно 10 мг/кг, от приблизительно 6,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 7 мг/кг до приблизительно 10 мг/кг, от приблизительно 7,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 8 мг/кг до приблизительно 10 мг/кг, от приблизительно 8,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 9 мг/кг до приблизительно 10 мг/кг или от приблизительно 9,5 мг/кг до приблизительно 10 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Например, дцРНК можно вводить в дозе приблизительно 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9 или приблизительно 10 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
В другом варианте осуществления дцРНК вводят в дозе от приблизительно 0,5 до приблизительно 50 мг/кг, от приблизительно 0,75 до приблизительно 50 мг/кг, от приблизительно 1 до приблизительно 50 мг/мг, от приблизительно 1,5 до приблизительно 50 мг/кг, от приблизительно 2 до приблизительно 50 мг/кг, от приблизительно 2,5 до приблизительно 50 мг/кг, от приблизительно 3 до приблизительно 50 мг/кг, от приблизительно 3,5 до приблизительно 50 мг/кг, от приблизительно 4 до приблизительно 50 мг/кг, от приблизительно 4,5 до приблизительно 50 мг/кг, от приблизительно 5 до приблизительно 50 мг/кг, от приблизительно 7,5 до приблизительно 50 мг/кг, от приблизительно 10 до приблизительно 50 мг/кг, от приблизительно 15 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 30 до приблизительно 50 мг/кг, от приблизительно 35 до приблизительно 50 мг/кг, от приблизительно 40 до приблизительно 50 мг/кг, от приблизительно 45 до приблизительно 50 мг/кг, от приблизительно 0,5 до приблизительно 45 мг/кг, от приблизительно 0,75 до приблизительно 45 мг/кг, от приблизительно 1 до приблизительно 45 мг/мг, от приблизительно 1,5 до приблизительно 45 мг/кг, от приблизительно 2 до приблизительно 45 мг/кг, от приблизительно 2,5 до приблизительно 45 мг/кг, от приблизительно 3 до приблизительно 45 мг/кг, от приблизительно 3,5 до приблизительно 45 мг/кг, от приблизительно 4 до приблизительно 45 мг/кг, от приблизительно 4,5 до приблизительно 45 мг/кг, от приблизительно 5 до приблизительно 45 мг/кг, от приблизительно 7,5 до приблизительно 45 мг/кг, от приблизительно 10 до приблизительно 45 мг/кг, от приблизительно 15 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 30 до приблизительно 45 мг/кг, от приблизительно 35 до приблизительно 45 мг/кг, от приблизительно 40 до приблизительно 45 мг/кг, от приблизительно 0,5 до приблизительно 40 мг/кг, от приблизительно 0,75 до приблизительно 40 мг/кг, от приблизительно 1 до приблизительно 40 мг/мг, от приблизительно 1,5 до приблизительно 40 мг/кг, от приблизительно 2 до приблизительно 40 мг/кг, от приблизительно 2,5 до приблизительно 40 мг/кг, от приблизительно 3 до приблизительно 40 мг/кг, от приблизительно 3,5 до приблизительно 40 мг/кг, от приблизительно 4 до приблизительно 40 мг/кг, от приблизительно 4,5 до приблизительно 40 мг/кг, от приблизительно 5 до приблизительно 40 мг/кг, от приблизительно 7,5 до приблизительно 40 мг/кг, от приблизительно 10 до приблизительно 40 мг/кг, от приблизительно 15 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 30 до приблизительно 40 мг/кг, от приблизительно 35 до приблизительно 40 мг/кг, от приблизительно 0,5 до приблизительно 30 мг/кг, от приблизительно 0,75 до приблизительно 30 мг/кг, от приблизительно 1 до приблизительно 30 мг/мг, от приблизительно 1,5 до приблизительно 30 мг/кг, от приблизительно 2 до приблизительно 30 мг/кг, от приблизительно 2,5 до приблизительно 30 мг/кг, от приблизительно 3 до приблизительно 30 мг/кг, от приблизительно 3,5 до приблизительно 30 мг/кг, от приблизительно 4 до приблизительно 30 мг/кг, от приблизительно 4,5 до приблизительно 30 мг/кг, от приблизительно 5 до приблизительно 30 мг/кг, от приблизительно 7,5 до приблизительно 30 мг/кг, от приблизительно 10 до приблизительно 30 мг/кг, от приблизительно 15 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 25 до приблизительно 30 мг/кг, от приблизительно 0,5 до приблизительно 20 мг/кг, от приблизительно 0,75 до приблизительно 20 мг/кг, от приблизительно 1 до приблизительно 20 мг/мг, от приблизительно 1,5 до приблизительно 20 мг/кг, от приблизительно 2 до приблизительно 20 мг/кг, от приблизительно 2,5 до приблизительно 20 мг/кг, от приблизительно 3 до приблизительно 20 мг/кг, от приблизительно 3,5 до приблизительно 20 мг/кг, от приблизительно 4 до приблизительно 20 мг/кг, от приблизительно 4,5 до приблизительно 20 мг/кг, от приблизительно 5 до приблизительно 20 мг/кг, от приблизительно 7,5 до приблизительно 20 мг/кг, от приблизительно 10 до приблизительно 20 мг/кг или от приблизительно 15 до приблизительно 20 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Например, индивидуумам можно вводить терапевтическое количество i-РНК, такое как приблизительно 0,5, 0,6, 0,7. 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5, 21, 21,5, 22, 22,5, 23, 23,5, 24, 24,5, 25, 25,5, 26, 26,5, 27, 27,5, 28, 28,5, 29, 29,5, 30, 31, 32, 33, 34, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или приблизительно 50 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
дцРНК, например, конъюгированную с лигандом, можно вводить индивидууму один раз в неделю или два раза в месяц.
В другом аспекте изобретение относится к наборам для выполнения способов по изобретению. В одном варианте осуществления изобретение относится к набору для выполнения способа ингибирования экспрессии серпина c1 в клетке путем контактирования клетки с двухцепочечным средством РНК-i в количестве, эффективном для ингибирования экспрессии гена серпина c1 в клетке. Набор содержит средство РНК-i и инструкции по применению и, необязательно, средство для введения средства РНК-i индивидууму.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлена схема каскада свертывания крови.
На фиг. 2A и 2B представлены графики, на которых показано ингибирование экспрессии серпина c1 в клетках Hep3B после однократной дозы указанных i-РНК.
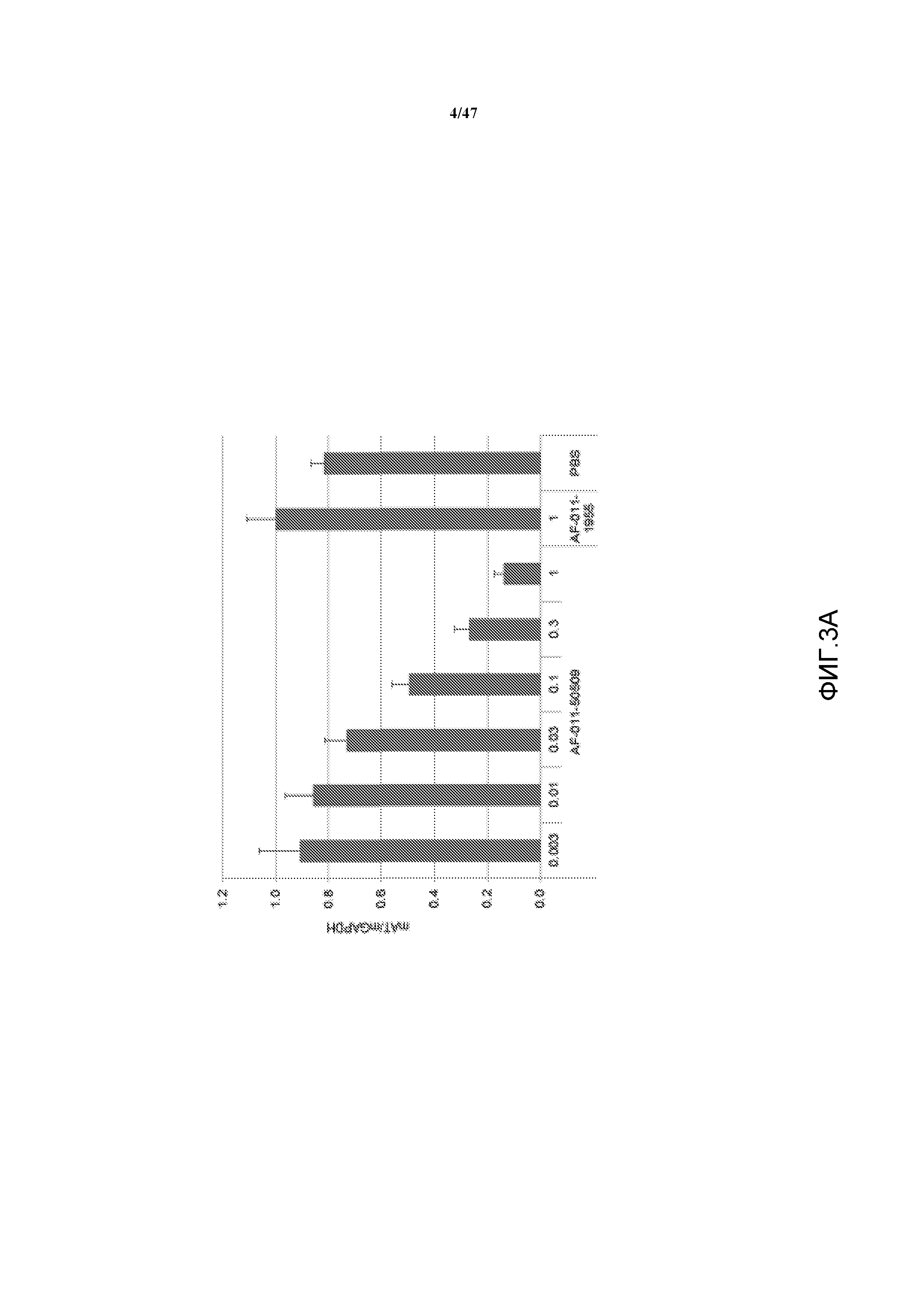
На фиг. 3A и 3B представлены графики, на которых показано ингибирование экспрессии мРНК (A) и белка (B) серпина c1 у мышей CD-1 после однократной дозы, как указано, состава AD-50509 или AD-1955.
На фиг. 4A и 4B представлены графики, на которых показана продолжительность ингибирования экспрессии мРНК (A) и белка (B) серпина c1 у мышей CD-1 после однократной дозы 1 мг/кг состава LNP AD-50509 или AD-1955. На фиг. 4C представлен график, на котором показано ингибирование активности серпина c1 и экспрессии белка серпина c1 у мышей CD1 после однократной дозы 1 мг/кг состава LNP AD-50509 или AD-1955.
На фиг. 5 представлен график, на котором показан процентный нокдаун уровней мРНК и белка серпина c1 после однократной дозы 10 мг/кг указанной i-РНК, конъюгированной с GalNAc.
На фиг. 6 представлен график, на котором показано ингибирование экспессии белка серпина c1 у мышей C57BL/6 после однократной дозы 5 мг/кг, 10 мг/кг, 25 мг/кг, 50 мг/кг и 75 мг/кг, и повторяющейся дозы 5×5 мг/кг AD-54944, конъюгированного с GalNAc.
На фиг. 7A и 7B представлены графики, на которых показан эффект повторяющегося дозирования на продолжительность ингибирования экспрессии белка серпина c1 у мышей C57BL/6 с помощью AD-54944, конъюгированного с GalNAc.
На фиг. 8 и 9 представлены графики, на которых показаны эффекты указанных режимов фракционированного дозирования на продолжительность подавления экспрессии белка серпина c1 у мышей C57BL/6, которым вводили AD-54944, конъюгированный с GalNAc.
На фиг. 10A и 10B представлены графики, на которых показан процентный нокдаун уровней белка серпина c1 после однократной дозы 10 мг/кг (A) или 3 мг/кг (B) указанной i-РНК, конъюгированной с GalNAc.
На фиг. 11 представлен график, на котором показан процентный нокдаун уровней белка серпина c1 после однократной дозы 10 мг/кг или 3 мг/кг указанной i-РНК, конъюгированной с GalNAc.
На фиг. 12 представлен график, на котором показан процентный нокдаун активности серпина c1 после однократной дозы 10 мг/кг или 3 мг/кг указанной i-РНК, конъюгированной с GalNAc.
На фиг. 13 представлен график, на котором показан эффект дозы для однократной дозы AD-57213.
На фиг. 14 представлен график, на котором показана продолжительность подавления серпина c1 с помощью AD-57213 после однократной дозы, составляющей 1 мг/кг, 3 мг/кг или 10 мг/кг, у мышей с гемофилией A.
На фиг. 15 представлен график, на котором показано ингибирование экспрессии мРНК серпина c1 у мышей C57BL/6 после однократной дозы AD-57213, составляющей 30 мг/кг, 10 мг/кг, 3 мг/кг, 1 мг/кг и 0,3 мг/кг.
На фиг. 16A-16C представлены графики, на которых показана продолжительность подавления серпина c1 с помощью AD-57213 (A), AD-57205 (B) и AD-57214 (C) после однократной дозы, как указано.
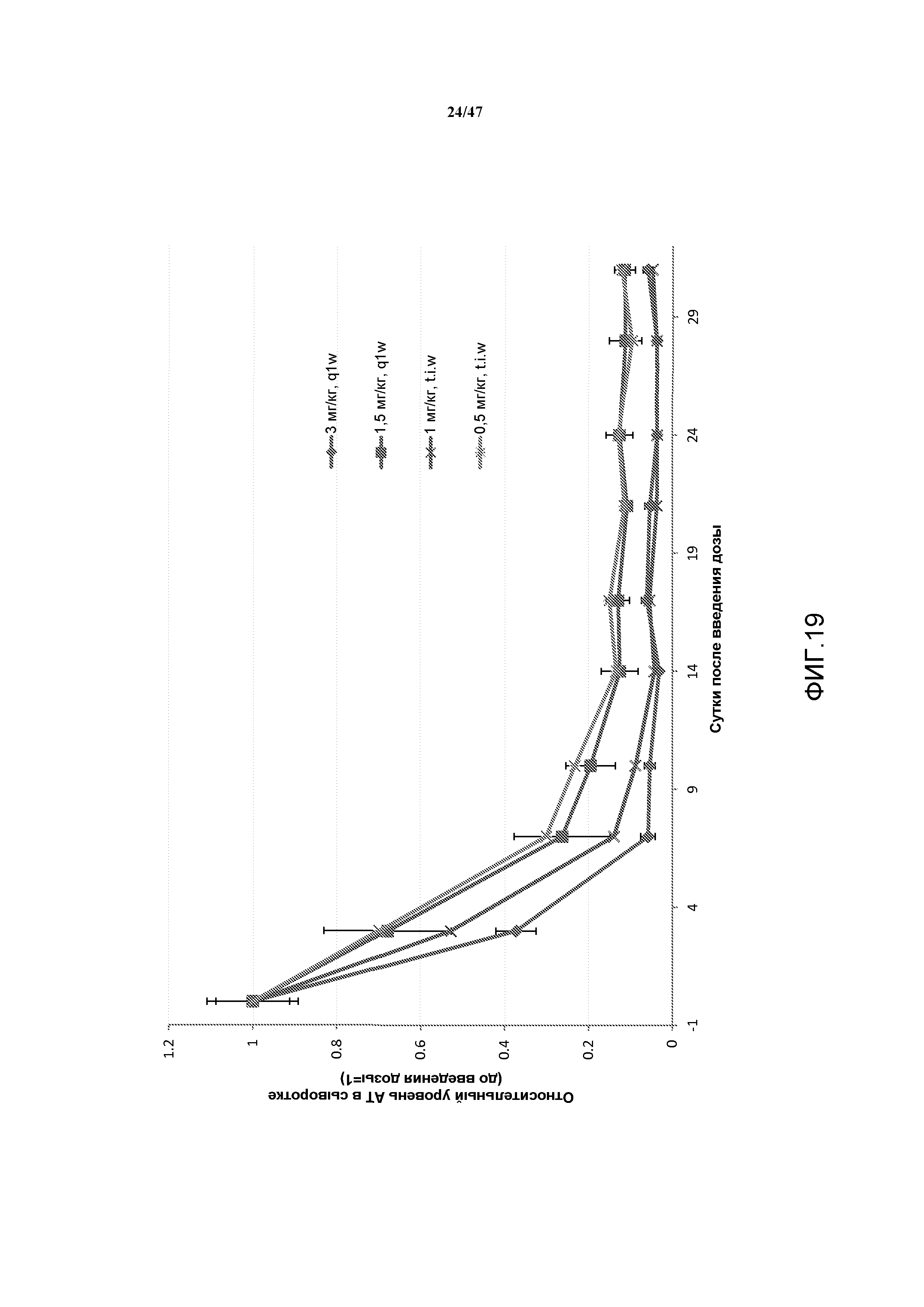
На фиг. 17-19 представлены графики, демонстрирующие эффекты указанных режимов фракционированных доз на продолжительность подавления экспрессии белка серпина c1 у мышей C57BL/6, которым вводили AD-57213, конъюгированный с GalNAc.
На фиг. 20 представлен график, на котором показаны эффекты скрининга однократной дозы указанных соединений на продолжительность экспрессии белка серпина c1 у не являющихся человеком приматов.
На фиг. 21 представлен график, на котором показаны эффекты скрининга однократной дозы AD-57213, конъюгированного с GalNAc, на длительность экспрессии белка серпина c1 у не являющихся человеком приматов.
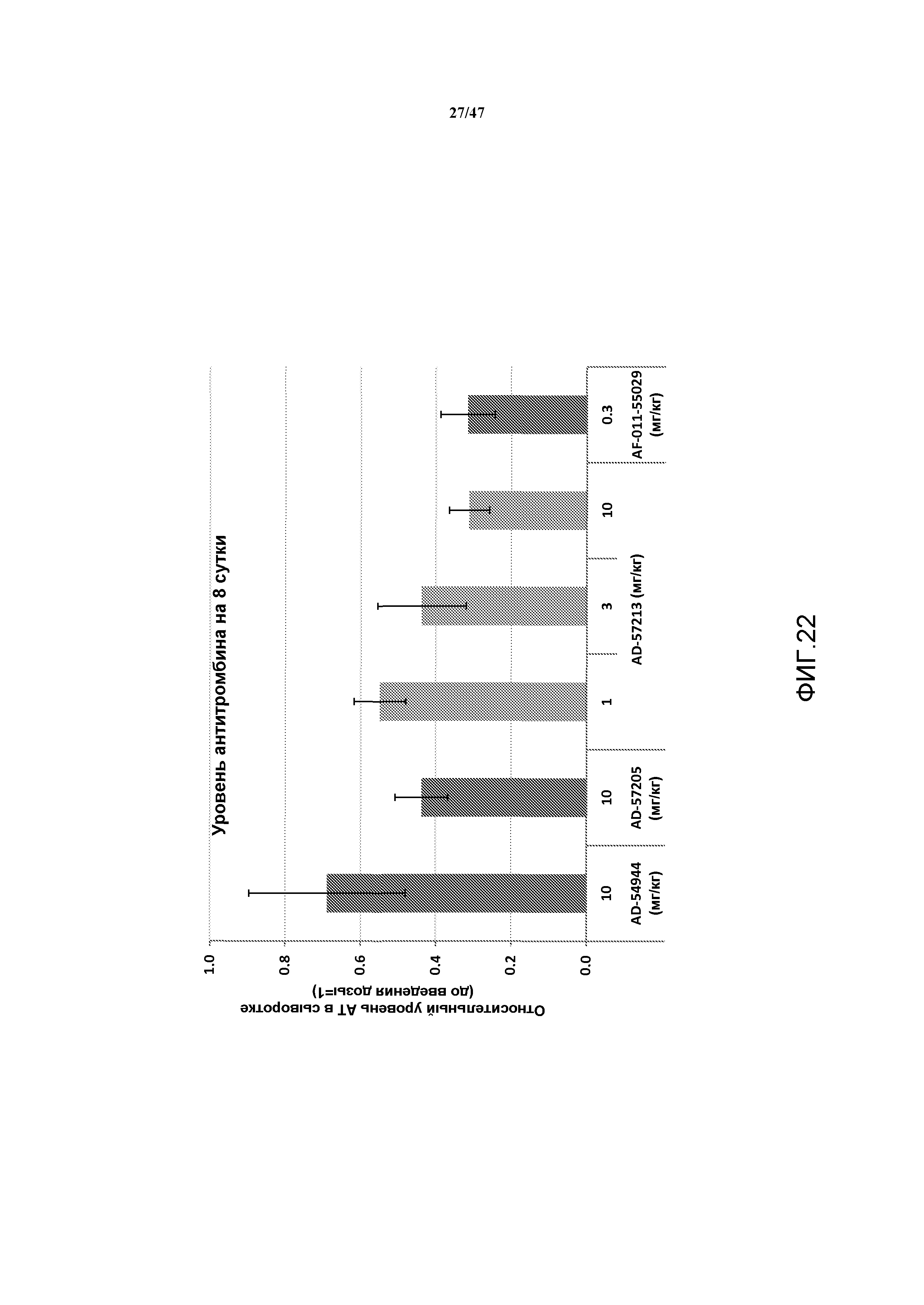
На фиг. 22 представлен график, на котором показаны эффекты скрининга однократной дозы указанных соединений на продолжительность экспрессии белка серпина c1 у не являющихся человеком приматов.
На фиг. 23 представлен график, на котором показаны эффекты однократной дозы соединения AD-57213 на уровни антитромбина в сыворотке (серпин c1) у не являющихся человеком приматов.
На фиг. 24A-24D представлены графики, демонстрирующие эффекты однократной дозы соединения AD-57213 в дозе A) 1 мг/кг, B) 3 мг/кг, C) 10 мг/кг и D) 30 мг/кг на взаимосвязь между уровнями антитромбина (серпин c1) в сыворотке и кратностью изменения пиковых уровней тромбина в плазме у не являющихся человеком приматов. Кратность изменения пикового уровня тромбина представлена на вторичной оси y (серый) и относительный уровень антитромбина представлен на первичной оси y (черный).
На фиг. 25 представлен график, на котором показаны эффекты AD-57213 в качестве увеличения кратности изменения пикового уровня тромбина в зависимости от относительного подавления антитромбина (серпин c1).
На фиг. 26A и 26B представлены графики, на которых показаны эффекты введения многократной дозы (0,5 мг/кг qw, 1 мг/кг q2w, 1,5 мг/кг qw, 3 мг/кг q2w) миРНК (siRNA) серпина c1 на уровни антитромбина в сыворотке у не являющихся человеком приматов. Точки данных соответствуют среднему значению для группы, планки погрешностей соответствуют стандартному отклонению (N=3). (qw = раз в неделю; q2w = раз в две недели).
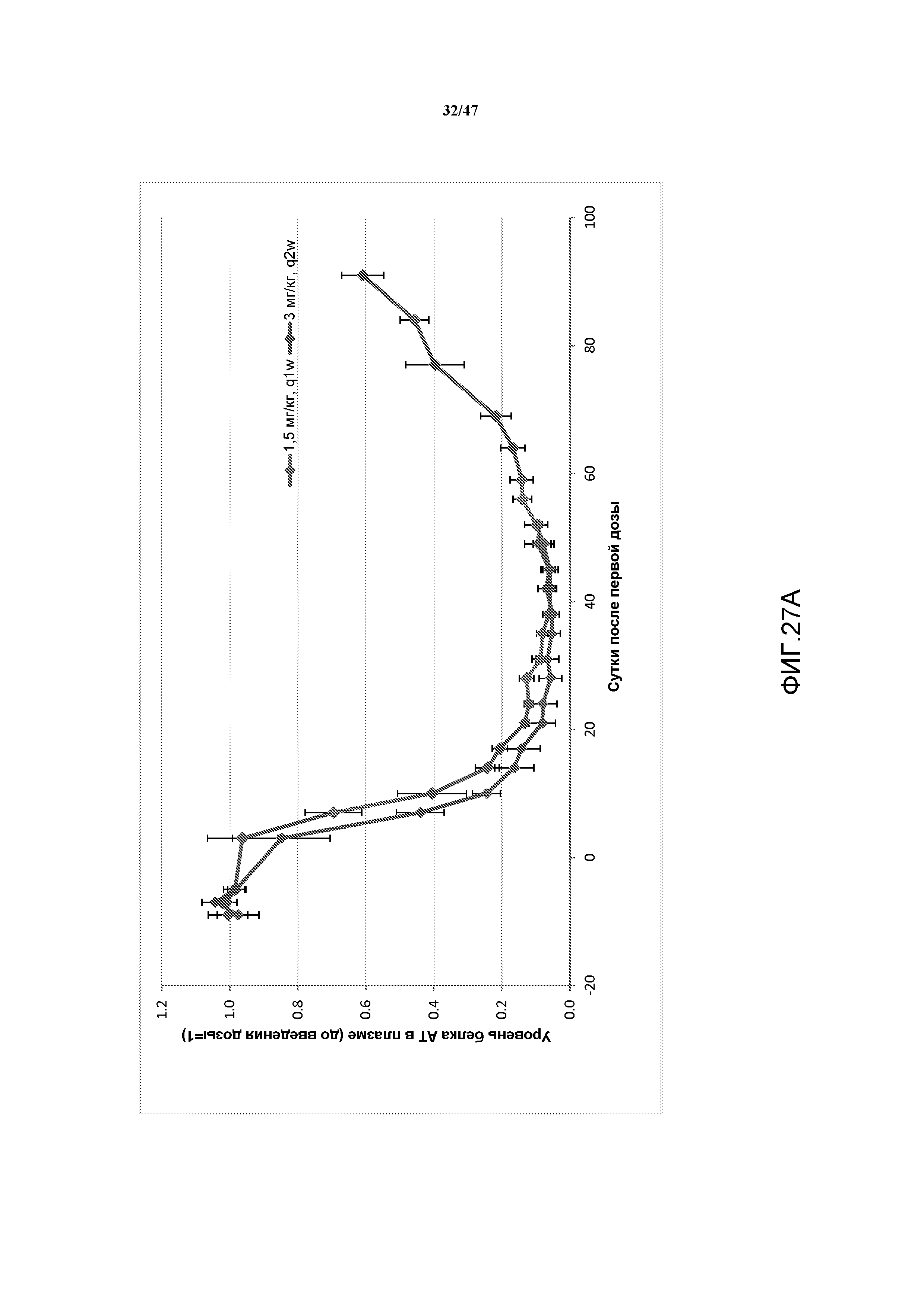
На фиг. 27A и 27B представлены графики, на которых показаны совокупные эффекты подавления серпина c1 у не являющихся человеком приматов.
На фиг. 28A представлен график, на котором показан эффект подавления серпина c1 на накопление тромбоцитов после повреждения микрососудов лазером. На графике показаны средние величины для всех нанесенных повреждений.
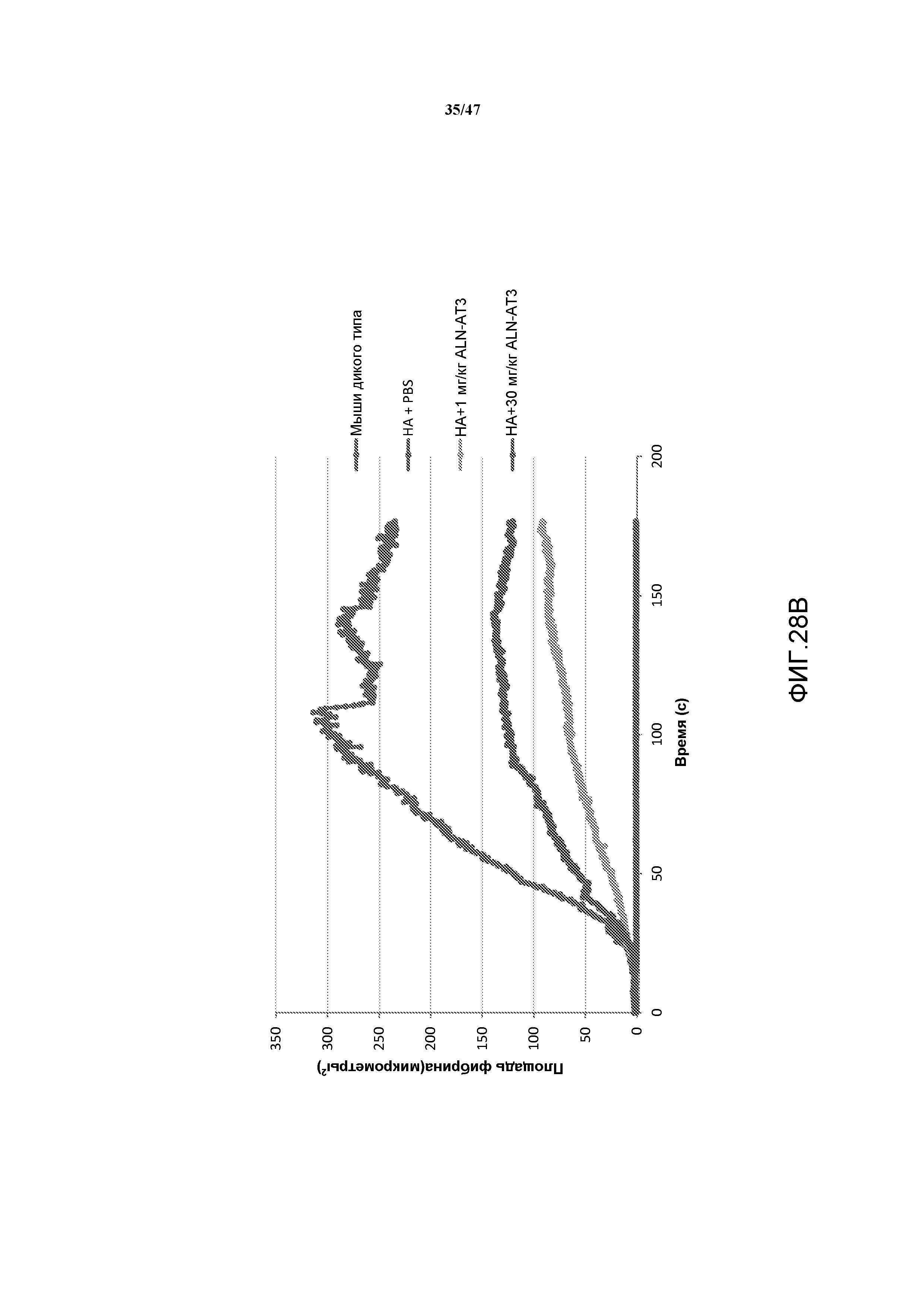
На фиг. 28B представлен график, на котором показан эффект подавления серпина 1 на площадь фибрина после повреждения микрососудов лазером. На графике представлены средние величины для всех нанесенных повреждений.
На фиг. 29 представлен график, на котором показана продолжительность подавления серпина c1 после введения соединения AD-57213, составленного в виде липидной частицы с нуклеиновой кислотой.
На фиг. 30A представлена нуклеотидная последовательность серпинового ингибитора пептидазы Homo sapiens, клад C (антитромбин), представитель 1 (серпин c1) (SEQ ID NO:1); на фиг. 30B представлена нуклеотидная последовательность серпинового ингибитора пептидазы Macaca mulatta, клад C (антитромбин), представитель 1 (серпин c1) (SEQ ID NO:2); на фиг. 30C представлена нуклеотидная последовательность ингибитора сериновых (или цистеиновых) пептидаз Mus musculus, клад C (антитромбин), представитель 1 (серпин c1) (SEQ ID NO:3); на фиг. 30D представлена нуклеотидная последовательность серпинового ингибитора протеаз Rattus norvegicus, клад C (антитромбин), представитель 1 (серпин c1) (SEQ ID NO:4); на фиг. 30E представлена обратная комплементарная последовательность для SEQ ID NO:1 (SEQ ID NO:5); на фиг. 30F представлена обратная комплементарная последовательность для SEQ ID NO:2 (SEQ ID NO:6); на фиг. 30G представлена обратная комплементарная последовательность для SEQ ID NO:3 (SEQ ID NO:7); на фиг. 30H представлена обратная комплементарная последовательность для SEQ ID NO:4 (SEQ ID NO:8); и на фиг. 30I представлена аминокислотная последовательность иллюстративного гидрофобного MTS-содержащего пептида RFGF (SEQ ID NO:9); аминокислотная последовательность иллюстративного аналога RFGF (SEQ ID NO:10); аминокислотная последовательность белка Tat ВИЧ (SEQ ID NO:11); аминокислотная последовательность белка Drosophila Antennapedia (SEQ ID NO:12); и аминокислотная последовательность иллюстративной пептидной расщепляемой линкерной группы.
На фиг. 31A и 31B представлены графики, на которых показано, что снижение уровня антитромбина увеличивает образование тромбина в плазме человека после истощения фактора IX in vitro.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям i-РНК, которые обеспечивают опосредуемое индуцируемым РНК комплексом подавления (RISC) расщепление РНК-транскриптов гена серпина c1. Ген серпина c1 может находиться внутри клетки, например, клетки индивидуума, такого как человек. Также настоящее изобретение относится к способам применения композиций i-РНК по изобретению для ингибирования эксперессии гена серпина c1 и/или для лечения индивидуума, имеющего нарушение, при котором является полезным ингибирование или снижение экспрессии гена серпина c1, например, геморрагическое нарушение, такое как гемофилия. Кроме того, настоящее изобретение относится к способам профилактики по меньшей мере одного симптома, например кровотечения, у индивидуума, имеющего нарушение, при котором является полезным ингибирование или снижение экспрессии гена серпина c1, например геморрагического нарушения, такого как гемофилия.
i-РНК по изобретению включают цепь РНК (антисмысловая цепь), имеющую область, которая имеет длину приблизительно 30 нуклеотидов или менее, например, 15-30, 15-29, 15-28, 15-27, 15- 26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18- 27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19- 25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20- 23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 нуклеотидов, причем эта область по существу комплементарна по меньшей мере части мРНК-транскрипта гена серпина c1. Применение этих i-РНК обеспечивает направленную деградацию мРНК гена серпина c1 у млекопитающих. Очень низкие дозировки i-РНК серпина c1, в частности, могут специфически и эффективно опосредовать РНК-интерференцию (РНК-i), что приводит к значительному ингибированию экспрессии гена серпина c1. Авторы настоящего изобретения продемонстрировали, что i-РНК, нацеленные на серпин c1, могут опосредовать РНК-i in vitro и in vivo, что приводит к значительному ингибированию экспрессии гена серпина c1. Таким образом, способы и композиции, включающие эти i-РНК, являются пригодными для лечения индивидуума, для которого является полезным снижение уровней и/или активности белка серпина c1, такого как индивидуум, имеющий геморрагическое нарушение, например, гемофилию.
В представленном ниже подробном описании описано, как получать и применять композиции, содержащие i-РНК, для ингибирования экспрессии гена серпина c1, а также описаны композиции, применения и способы для лечения индивидуумов, имеющих заболевания и нарушения, при которых является полезным ингибирование и/или снижение экспрессии этого гена.
I. Определения
Чтобы настоящее изобретение было более понятным, сначала определены определенные термины. Кроме того, следует отметить, что, когда указаны величина или диапазон величин для параметра, подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Форму единственного числа используют в настоящем описании для обозначении одного или более одного (т.е. по меньшей мере одного) грамматического объекта. В качестве примера, "элемент" означает один элемент или более одного элемента, например, множество элементов.
Термин "включающий" используют в настоящем описании для обозначения выражения и его используют взаимозаменяемо с выражением "включая, но не ограничиваясь ими".
Термин "или" используют в настоящем описании для обозначения термина и его используют взаимозаменяемо с термином "и/или", если контекст явно не указывает на иное.
Как используют в рамках изобретения, "серпин c1" относится к конкретному полипептиду, экспрессируемому в клетке. Серпин c1 также известен как серпиновый ингибитор протеаз, клад C (антитромбин), представитель 1; антитромбин III; AT3; антитромбин и кофактор гепарина 1. Последовательность мРНК-транскрипта серпина c1 человека может быть найдена, например, в качестве последовательности GenBank под номером доступа № GI:254588059 (NM_000488; SEQ ID NO:1). Последовательность мРНК серпина c1 макака-резус может быть найдена, например, в качестве последовательности GenBank под номером доступа № GI:157167169 (NM_001104583; SEQ ID NO:2). Последовательность мРНК серпина c1 мыши может быть найдена, например, в качестве последовательности GenBank под номером доступа № GI:237874216 (NM_080844; SEQ ID NO:3). Последовательность мРНК серпина c1 крысы может быть найдена, например, в качестве последовательности GenBank под номером доступа № GI:58865629 (NM_001012027; SEQ ID NO:4).
Термин "серпин c1", как используют в рамках изобретения, также относится к конкретному полипептиду, экспрессируемому в клетке вследствие встречающихся в природе изменений последовательности ДНК гена серпина c1, таких как однонуклеотидный полиморфизм в гене серпина c1. Многочисленные SNP в гене серпина c1 были идентифицированы, и они могут быть найдены, например, в NCBI dbSNP (смотрите, например, www.ncbi.nlm.nih.gov/snp). Неограничивающие примеры SNP в гене серпина c1 могут быть найдены в последовательностях NCBI dbSNP под номером доступа № rs677, rs5877, rs5878, rs5879, rs941988, rs941989, rs1799876, rs19637711, rs2008946 и rs2227586.
Как используют в рамках изобретения, "последовательность-мишень" относится к непрерывному участку нуклеотидной последовательности молекулы мРНК, образовавшемуся во время транскрипции гена серпина c1, включая мРНК, которая является продуктом процессинга РНК, являющейся первичным продуктом транскрипции. В одном варианте осуществления участок-мишень последовательности является по меньшей мере достаточно длинным, чтобы служить в качестве субстрата для опосредуемого i-РНК расщепления в этом участке или вблизи этого участка нуклеотидной последовательности молекулы мРНК, образовавшейся при транскрипции гена серпина c1.
Последовательность-мишень может иметь длину приблизительно 9-36 нуклеотидов, например, приблизительно 15-30 нуклеотидов. Например, длина последовательности-мишени может составлять приблизительно 15-30 нуклеотидов, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 нуклеотидов. Также предусматривается, что диапазоны и длины, являющиеся промежуточными для указанных выше диапазонов и длин, являются частью изобретения.
Как используют в рамках изобретения, термин "цепь, содержащая последовательность," относится к олигонуклеотиду, содержащему цепь нуклеотидов, которая описывается последовательностью, отображенной с использованием стандартной номенклатуры нуклеотидов.
Каждый из "G", "C", "A" и "U" относится, главным образом, к нуклеотиду, который содержит гуанин, цитозин, аденин и урацил в качестве основания, соответственно. Однако будет понятно, что термин "рибонуклеотид" или "нуклеотид" также может относится к модифицированному нуклеотиду, как подробно описано ниже, или к заместительной части (смотрите, например, таблицу 2). Квалифицированному специалисту хорошо известно, что гуанин, цитозин, аденин и урацил можно заменять другими группами без существенного изменения свойств олигонуклеотида, содержащего нуклеотид, обладающий такой заместительной группой. Например, но не ограничиваясь этим, нуклеотид, содержащий инозин в качестве его основания, может образовывать пары с нуклеотидами, содержащими аденин, цитозин или урацил. Таким образом, нуклеотиды, содержащие урацил, гуанин или аденин, могут быть заменены в нуклеотидных последовательностях дцРНК по настоящему изобретению нуклеотидом, содержащим, например, инозин. В другом примере аденин и цитозин где-либо в олигонуклеотиде может быть заменен гуанином и урацилом, соответственно, с образованием "качающейся" пары оснований G-U с мРНК-мишенью. Последовательности, содержащие такие заместительные части, являются пригодными для композиций и способов по настоящему изобретению.
Термины "i-РНК", "средство РНК-i", "средство i-РНК", "средство РНК-интерференции", как используют в настоящем описании взаимозаменяемо, относятся к средству, которое содержит РНК, как определено в настоящем описании, и которое опосредует направленное расщепление РНК-транскрипта через каскад индуцируемого РНК комплекса подавления (RISC). i-РНК опосредует специфическую деградацию последовательности мРНК через процесс, известный как РНК-интерференция (РНК-i). i-РНК модулирует, например ингибирует, экспрессию серпина c1 в клетке, например, в клетке индивидуума, такого как млекопитающее.
В одном варианте осуществления средство РНК-i по изобретению включает одноцепочечную РНК, которая взаимодействует с являющейся мишенью последовательностью РНК, например, с являющейся мишенью последовательностью мРНК серпина c1, опосредуя расщепление РНК-мишени. Без связи с теорией, полагают, что длинная двухцепочечная РНК, введенная в клетки, разрушается на миРНК эндонуклеазой типа III, известной как Dicer (Sharp et al. (2001) Genes Dev. 15:485). Dicer - фермент, подобный рибонуклеазе III, процессирует дцРНК до коротких интерферирующих РНК длиной 19-23 пар оснований с характерными 3'-выступающими концами из двух оснований (Bernstein, et al., (2001) Nature 409:363). Затем миРНК включается в индуцируемый РНК комплекс подавления (RISC), где одна или несколько хеликаз расплетают дуплекс миРНК, позволяя комплементарной антисмысловой цепи обеспечивать распознавание мишени (Nykanen, et al, (2001) Cell 107:309). При связывании с соответствующей мРНК-мишенью, одна или несколько эндонуклеаз в RISC расщепляют мишень, индуцируя подавление (Elbashir, et al., (2001) Genes Dev. 15:188). Таким образом, в одном аспекте изобретение относится к одноцепочечной РНК (миРНК), образовавшейся в клетке, которая обеспечивает образование комплекса RISC для осуществления подавления гена-мишени, т.е. гена серпина c1. Таким образом, термин "миРНК" также используют в настоящем описании для обозначения РНК-i, как описано выше.
В другом варианте осуществления средство РНК-i может представлять собой одноцепочечную миРНК, которую вводят в клетку или организм для ингибирования мРНК-мишени. Одноцепочечные миРНК, как правило, имеют 15-30 нуклеотидов и являются химически модифицированными. Конструирование и исследование одноцепочечных миРНК описано в патенте США № 8101348 и в Lima et al. (2012) Cell 150: 883-894, полное содержание каждого из которых включено в настоящее описание в качестве ссылки. Любую из антисмысловых нуклеотидных последовательностей, описанных в настоящем описании, можно использовать в качестве одноцепочечной миРНК, как описано в настоящем описании или как химически модифицировано способами, описанными в Lima et al. (2012) Cell 150; 883-894.
В другом аспекте средство представляет собой одноцепочечную антисмысловую молекулу РНК, которая ингибирует мишень через механизм антисмыслового ингибирования. Одноцепочечная антисмысловая молекула РНК является комплементарной последовательности в мРНК-мишени. Антисмысловая РНК может ингибировать трансляцию стехиометрическим образом посредством спаривания оснований с мРНК и физического препятствования трансляционному аппарату, смотрите Dias N. et al. (2002) Mol Cancer Ther 1:347-355. Альтернативно одноцепочечная антисмысловая молекула РНК ингибирует мРНК-мишень путем гибридизации с мишенью и расщепления мишени посредством акта расщепления РНК-азой H. Одноцепочечная антисмысловая молекула РНК может иметь длину от приблизительно 15 до приблизительно 30 нуклеотидов и имеет последовательность, которая комплементарна последовательности-мишени. Например, одноцепочечная антисмысловая молекула РНК может содержать последовательность, которая комплементарна по меньшей мере на приблизительно 15, 16, 17, 18, 19, 20 или более последовательно расположенных нуклеотидов из любой из антисмысловых последовательностей любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21.
В другом варианте осуществления "i-РНК" для применения в композициях, применениях и способах по изобретению представляет собой двухцепочечную РНК, и она обозначается в настоящем описании как "средство на основе двухцепочечный РНК-i", "двухцепочечная молекула РНК (дцРНК)", "средство дцРНК" или "дцРНК". Термин "дцРНК", относится к комплексу молекул рибонуклеиновой кислоты, имеющих дуплексную структуру, содержащую две антипараллельных и по существу комплементарных цепи нуклеиновой кислоты, обозначаемые как имеющие "смысловую" и "антисмысловую" ориентацию в отношении РНК-мишени, т.е. гена серпина c1. В некоторых вариантах осуществления изобретения двухцепочечная РНК (дцРНК) запускает деградацию РНК-мишени, например мРНК, посредством механизма посттрансляционного подавления генов, обозначаемого в настоящем описании как РНК-интерференция или РНК-i.
Дуплексная область может иметь любую длину, которая обеспечивает специфическую деградацию желаемой РНК-мишени посредством каскада RISC, и ее длина может находиться в диапазоне приблизительно от 9 до 36 пар оснований, например, приблизительно 15-30 пар оснований, например, приблизительно 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, и 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 или 36 пар оснований, как например, приблизительно 15-30, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 пар оснований. Также предусматривается, что диапазоны и длины, являющиеся промежуточными для указанных выше диапазонов и длин, являются частью изобретения.
Две цепи, образующие дуплексную структуру, могут представлять собой различные части одной более крупной молекулы РНК, или они могут представлять собой отдельные молекулы РНК. Когда две цепи являются частью одной более крупной молекулы, и, таким образом, соединены непрерывной цепью нуклеотидов между 3'-концом одной цепи и 5'-концом соответствующей другой цепи, образующей дуплексную структуру, соединяющую цепь РНК обозначают как "петля шпильки". Петля шпильки может содержать по меньшей мере один неспаренный нуклеотид. В некоторых вариантах осуществления петля шпильки может содержать по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 20, по меньшей мере 23 или более неспаренных нуклеотидов.
Когда две по существу комплементарных цепи дцРНК содержатся в отдельных молекулах РНК, эти молекулы не должны, но могут быть ковалентно связанными. Когда две цепи связаны ковалентно способом, отличным от непрерывной цепи нуклеотидов между 3'-концом одной цепи и 5'-концом соответствующей другой цепи, образующей дуплексную структуру, соединяющую структуру называют "линкером". Цепи РНК могут иметь одинаковое или отличающееся количество нуклеотидов. Максимальное количество пар оснований представляет собой количество нуклеотидов в наиболее короткой цепи дцРНК минус любые выступающие концы, которые присутствуют в дуплексе. В дополнение к дуплексной структуре РНК-i может содержать один или несколько нуклеотидных выступающих концов.
Как используют в настоящем документе, термин "нуклеотидный выступающий конец" относится по меньшей мере к одному неспаренному нуклеотиду, который выступает из дуплексной структуры i-РНК, например, дцРНК. Например, когда 3'-конец одной цепи дцРНК продолжается за пределами 5'-конца другой цепи, или наоборот, существует нуклеотидный выступающий конец. дцРНК может содержать выступающий конец из по меньшей мере одного нуклеотида; альтернативно выступающий конец может содержать по меньшей мере два нуклеотида, по меньшей мере три нуклеотида, по меньшей мере четыре нуклеотида, по меньшей мере пять нуклеотидов или более. Нуклеотидный выступающий конец может содержать или может состоять из нуклеотидного/нуклеозидного аналога, включая дезоксинуклеотид/нуклеозид. Выступающий конец(концы) может быть на смысловой цепи, на антисмысловой цепи или на любой их комбинации. Более того, нуклеотид(ы) выступающего конца могут находиться на 5'-конце, 3'-конце или обоих концах либо антисмысловой, либо смысловой цепи дцРНК.
В одном варианте осуществления антисмысловая цепь дцРНК имеет выступающий конец из 1-10 нуклеотидов, например 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов, на 3'-конце и/или 5'-конце. В одном варианте осуществления смысловая цепь дцРНК имеет выступающий конец из 1-10 нуклеотидов, например 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов, на 3'-конце и/или на 5'-конце. В другом варианте осуществления один или несколько из нуклеотидов выступающего конца заменены нуклеозидтиофосфатом.
Термины "тупой" или "с тупым концом", как используют в рамках изобретения в отношении дцРНК, означают, что не существует неспаренных нуклеотидов или нуклеотидных аналогов на данном конце дцРНК, т.е. не существует нуклеотидного выступающего конца. Один или оба конца дцРНК могут быть тупыми. Когда оба конца дцРНК являются тупыми, дцРНК называют имеющей тупые концы. Для пояснения дцРНК "с тупыми концами" представляет собой дцРНК, оба конца которой являются тупыми, т.е. отсутствует нуклеотидный выступ на каком-либо из концов молекулы. Наиболее часто такая молекула является двухцепочечной по всей ее длине.
Термин "антисмысловая цепь" или "направляющая цепь" относится к цепи i-РНК, например, дцРНК, которая включает область, которая по существу комплементарна последовательности-мишени, например, мРНК серпина c1. Как используют в рамках изобретения, термин "область комплементарности" относится к области на антисмысловой цепи, которая по существу комплементарна последовательности, например, последовательности-мишени, например, нуклеотидной последовательности серпина c1, как определено в настоящем описании. Когда область комплементарности не полностью комплементарна последовательности-мишени, несоответствия могут находиться во внутренних или на концевых участках молекулы. Как правило, наиболее допустимые несоответствия находится на концевых участках, например, в пределах 5, 4, 3 или 2 нуклеотидов от 5'- и/или 3'-конца i-РНК.
Термин "смысловая цепь" или "цепь-пассажир", как используют в рамках изобретения, относится к цепи i-РНК, которая включает область, которая по существу комплементарна области антисмысловой цепи, как этот термин определен в настоящем описании.
Как используют в рамках изобретения и если нет иных указаний, термин "комплементарный", когда его используют для описания первой нуклеотидной последовательности в отношении второй нуклеотидной последовательности, относится к способности олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, гибридизоваться и образовывать дуплексную структуру в определенных условиях с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, как будет понятно специалисту в данной области. Такие условия могут представлять собой, например, жесткие условия, где жесткие условия могут включать: 400 мМ NaCl, 40 мМ PIPES pH 6,4, 1 мМ ЭДТА, 50°C или 70°C в течение 12-16 часов с последующим промыванием (смотрите, например, "Molecular Cloning: A Laboratory Manual, Sambrook, et al. (1989) Cold Spring Harbor Laboratory Press). Можно использовать другие условия, такие как соответствующие физиологическим условия, которые могут встречаться в организме. Квалифицированный специалист способен определить набор условий, наиболее подходящих для исследования комплементарности двух последовательностей в соответствии с конечным применением гибридизованных нуклеотидов.
Комплементарные последовательности в i-РНК, например, в дцРНК, как описано в настоящем описании, включают спаривание оснований олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, на протяжении всей длины одной или обеих нуклеотидных последовательностей. Такие последовательности в настоящем описании могут быть обозначены как "полностью комплементарные" в отношении друг друга. Однако, когда первую последовательность обозначают в настоящем описании как "по существу комплементарная" в отношении второй последовательности, две последовательности могут быть полностью комплементарными, или они при гибридизации могут образовывать одну или несколько, но обычно не более 5, 4, 3 или 2 несоответствующих пар оснований, для дуплекса из вплоть до 30 пар оснований, при сохранении способности гибридизоваться в условиях, в наибольшей степени соответствующих их конечному применению, например, ингибированию экспрессии генов через каскад RISC. Однако когда два олигонуклеотида сконструированы так, чтобы они при гибридизации образовывали один или несколько одноцепочечных выступающих концов, такие выступающие концы не будут считаться несоответствиями с точки зрения определения комплементарности. Например, дцРНК, содержащая один олигонуклеотид длиной 21 нуклеотид и другой олигонуклеотид длиной 23 нуклеотида, где более длинный олигонуклеотид содержит последовательность из 21 нуклеотида, которая полностью комплементарна более короткому олигонуклеотиду, все еще может называться "полностью комплементарной" для целей, описанных в настоящем описании.
"Комплементарные" последовательности, как используют в рамках изобретения, также могут включать или могут быть образованы полностью из пар оснований, не являющихся парами оснований Уотсона-Крика, и/или пар оснований, образованных из неприродных и модифицированных нуклеотидов, при условии, что указанные выше требования в отношении их способности гибридизоваться удовлетворяются. Такие пары оснований, не являющиеся парами оснований Уотсона-Крика, включают, но не ограничиваются ими, "качающиеся" пары оснований G:U или хугстиновские пары оснований.
Термины "комплементарный", "полностью комплементарный" и "по существу комплементарный" в настоящем описании можно использовать в отношении соответствия оснований между смысловой цепью и антисмысловой цепью дцРНК, или между антисмысловой цепью средства i-РНК и последовательностью-мишенью, как будет понятно из контекста их применения.
Как используют в рамках изобретения, полинуклеотид, который является "по существу комплементарным по меньшей мере части матричной РНК (мРНК)", относится к полинуклеотиду, который по существу комплементарен непрерывной части представляющей интерес мРНК (например, мРНК, кодирующей серпин c1). Например, полинуклеотид комплементарен по меньшей мере части мРНК серпина c1, если последовательность по существу комплементарна непрерывной части мРНК, кодирующей серпин c1.
Как правило, большинство нуклеотидов на каждой цепи представляют собой рибонуклеотиды, однако, как подробно описано в настоящем описании, каждая или обе цепи также могут включать один или несколько нуклеотидов, на являющихся рибонуклеотидами, например дезоксирибонуклеотид и/или модифицированный нуклеотид. Кроме того, "i-РНК" может включать рибонуклеотиды с химическими модификациями. Такие модификации могут включать все типы модификаций, описанные в настоящем описании или известные в данной области. Любые такие модификации, используемые в молекуле i-РНК, охватываются "i-РНК" для целей настоящего описания и формулы изобретения.
Термин "ингибирование", как используют в рамках изобретения, используют взаимозаменяемо со "снижением", "подавлением", "отрицательной регуляцией", "супрессией" и другими сходными терминами, и он включает любой уровень ингибирования.
Выражение "ингибирование экспрессии серпина c1", как используют в рамках изобретения, включает ингибирование экспрессии любого гена серпина c1 (например, такого как ген серпина c1 мыши, ген серпина c1 крысы, ген серпина c1 обезьяны или ген серпина c1 человека), а также варианты или мутанты гена серпина c1, который кодирует белок серпина c1.
"Ингибирование экспрессии гена серпина c1" включает любой уровень ингибирования гена серпина c1, например, по меньшей мере частичное подавление экспрессии гена серпина c1, такое как ингибирование по меньшей мере приблизительно на 5%, по меньшей мере на приблизительно 10%, по меньшей мере на приблизительно 15%, по меньшей мере на приблизительно 20%, по меньшей мере на приблизительно 25%, по меньшей мере на приблизительно 30%, по меньшей мере на приблизительно 35%, по меньшей мере на приблизительно 40%, по меньшей мере на приблизительно 45%, по меньшей мере на приблизительно 50%, по меньшей мере на приблизительно 55%, по меньшей мере на приблизительно 60%, по меньшей мере на приблизительно 65%, по меньшей мере на приблизительно 70%, по меньшей мере на приблизительно 75%, по меньшей мере на приблизительно 80%, по меньшей мере на приблизительно 85%, по меньшей мере на приблизительно 90%, по меньшей мере на приблизительно 91%, по меньшей мере на приблизительно 92%, по меньшей мере на приблизительно 93%, по меньшей мере на приблизительно 94%, по меньшей мере на приблизительно 95%, по меньшей мере на приблизительно 96%, по меньшей мере на приблизительно 97%, по меньшей мере на приблизительно 98% или по меньшей мере на приблизительно 99%.
Экспрессию гена серпина c1 можно оценивать, исходя из уровня любой переменной, ассоциированной с экспрессией гена серпина c1, например, уровня мРНК серпина c1, уровня белка сепина c1, или, например, уровней комплекса тромбин:антитромбин в качестве показателя потенциала к образованию тромбина, времени кровотечения, протромбинового времени (PT), количества тромбоцитов и/или активированного частичного тромбопластинового времени (aPTT). Ингибирование можно оценивать по снижению абсолютного или относительного уровня одной или нескольких из этих переменных по сравнению с контрольным уровнем. Контрольный уровень может представлять собой любой тип контрольного уровня, который используют в данной области, например, исходный уровень до дозирования или уровень, определенный у сходного индивидуума, в сходной клетке или образце, которые не были подвергнуты воздействию или были подвергнуты воздействию контроля (например, такого как контроль в виде только буфера или контроль в виде неактивного средства).
В одном варианте осуществления по меньшей мере частичное подавление экспрессии гена серпина c1 оценивают по снижению количества мРНК серпина c1, которое может быть выделено из или обнаружено в первой клетке или группе клеток, в которых ген серпина c1 транскрибируется, и которые обработали так, чтобы экспрессия гена серпина c1 ингибировалась, по сравнению со второй клеткой или группой клеток, по существу идентичной первой клетке или группе клеток, но которая не была обработана таким образом (контрольные клетки). Степень ингибирования можно выражать в значениях
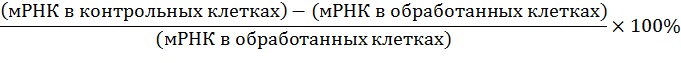
Выражение "контактирование клетки со средством РНК-i", таким как дцРНК, как используют в рамках изобретения, включает контактирование клетки любым возможным способом. Контактирование клетки со средством РНК-i включает контактирование клетки in vitro с i-РНК или контактирование клетки in vivo с i-РНК. Контактирование можно проводить прямо или непрямо. Таким образом, например, средство РНК-i можно приводить в физический контакт с клеткой путем индивидуального выполнения способа или, альтернативно, средство РНК-i можно помещать в условия, которые позволят или обеспечат впоследствии ее контактирование с клеткой.
Контактирование клетки in vitro можно проводить, например, путем инкубации клетки со средством РНК-i. Контактирование клетки in vivo можно проводить, например, путем инъекции средства РНК-i в ткань или вблизи ткани, где расположена клетка, или путем инъекции средства РНК-i в другую область, например, кровоток или подкожное пространство, так чтобы средство впоследствии достигало ткани, где расположена клетка, подлежащая контактированию. Например, средство РНК-i может содержать и/или может быть связано с лигандом, например GalNAc3, который направляет средство РНК-i в представляющую интерес область, например, в печень. Также возможны комбинации способов контактирования in vitro и in vivo. Например, клетку можно контактировать in vitro со средством РНК-i, а затем трансплантировать индивидууму.
В одном варианте осуществления контактирование клетки с i-РНК включает "введение" или "доставку i-РНК в клетку" путем способствования или обеспечения захвата или всасывания в клетку. Всасывание или захват i-РНК может происходить посредством самопроизвольных диффузионных или активных клеточных процессов, или с помощью вспомогательных средств или устройств. Введение i-РНК в клетку можно проводить in vitro и/или in vivo. Например, для введения in vivo i-РНК можно инъецировать в область ткани или вводить системно. Доставку in vivo также можно проводить с помощью системы доставки на основе бета-глюкана, такой как системы, описанные в патентах США № 5032401 и 5607677, и в публикации США № 2005/0281781, полное содержание которых включено в настоящее описание в качестве ссылки. Введение в клетку in vitro включает способы, известные в данной области, такие как электропорация и липофекция. Дополнительные подходы описаны в настоящем описании ниже и/или известны в данной области.
Термин "липидная наночастица" или "LNP" представляет собой везикулу, содержащую липидный слой, инкапсулирующий фармацевтически активную молекулу, такую как молекула нуклеиновой кислоты, например, i-РНК или плазмида, с которой i-РНК транскрибируется. LNP описаны, например, в патентах США № 6858225, 6815432, 8158601 и 8058069, полное содержание которых включено в настоящее описание в качестве ссылки.
Термин "SNALP" относится к стабильной частице нуклеиновая кислота-липид. SNALP представляет собой везикулу из липидов, покрывающих сжатую водную внутреннюю часть, содержащую нуклеиновую кислоту, такую как i-РНК или плазмида, с которой транскрибируется i-РНК. SNALP описаны, например, в публикациях патентных заявок США № 20060240093, 20070135372 и в международной заявке № WO 2009082817, полное содержание которых включено в настоящее описание в качестве ссылок. Примеры составов "SNALP" описаны ниже.
Как используют в рамках изобретения, "индивидуумом" является животное, такое как млекопитающее, включая примата (такого как человек, не являющийся человеком примат, например, обезьяна и шимпанзе), не являющееся приматом животное (такое как корова, свинья, верблюд, лама, лошадь, коза, кролик, овца, хомяк, морская свинка, кошка, собака, крыса, мышь, лошадь и кит) или птица (например, утка или гусь). В одном варианте осуществления индивидуумом является человек, такой как человек, у которого проводят лечение или оценку заболевания, нарушения или состояния, при котором является полезным снижение экспрессии серпина c1; человек, имеющий риск заболевания, нарушения или состояния, при котором является полезным снижение экспрессии серпина c1; человек, имеющий заболевание, нарушение или состояние, при котором является полезным снижение экспрессии серпина c1; и/или человек, которого лечат от заболевания, нарушения или состояния, при котором является полезным снижение экспрессии серпина c1, как описано в настоящем описании. Как используют в рамках изобретения, термины "проведение лечения" или "лечение" относятся к благоприятному или желаемому результату, включая, но не ограничиваясь ими, ослабление или смягчение одного или нескольких симптомов, уменьшение объема кровотечения, стабилизированное (т.е. без ухудшение) состояние кровотечения, смягчение или ослабление кровотечения, как поддающиеся выявлению, так и не поддающиеся выявлению. "Лечение" также может означать увеличение выживаемости по сравнению с ожидаемой выживаемостью в отсутствие лечения.
Под "снижением" в контексте маркера заболевания или симптома подразумевают статистически значимое снижение такого уровня. Снижение может представлять собой, например, снижение по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или более, и предпочтительно оно происходит до уровня, принятого в качестве находящегося в диапазоне нормальных значений для индивидуума без такого нарушения.
Как используют в рамках изобретения, термины "профилактика" или "осуществление профилактики", когда их используют в отношении заболевания, нарушения или их состояния, при которых является полезным снижение экспрессии гена серпина c1, относится к уменьшению вероятности того, что у индивидуума разовьется симптом, ассоциированный с таким заболеванием, нарушением или состоянием, например, такой симптом, как кровотечение. Вероятность развития кровотечения снижается, например, когда у индивидуума, имеющего один или несколько факторов риска кровотечения, либо не развивается кровотечение, либо развивается кровотечение с меньшей тяжестью относительно популяции, которая имеет те же факторы риска и в которой не проводили лечение, как описано в настоящем описании. Отсутствие развития заболевания, нарушения или состояния, или снижение развития симптома, ассоциированного с таким заболеванием, нарушением или состоянием (например, по меньшей мере на приблизительно 10% по клинически принятой шкале для этого заболевания или нарушения), или замедленное проявление симптомов (например, на дни, недели, месяца или годы) считают эффективной профилактикой.
Как используют в рамках изобретения, термин "геморрагическое нарушение" представляет собой заболевание или нарушение, которое приводит к плохому свертыванию крови и/или чрезмерному кровотечению. Геморрагическое нарушение может представлять собой врожденное нарушение, такое как гемофилия или болезнь фон Виллебранда, или приобретенное нарушение, ассоциированное, например, с диссеминированным внутрисосудистым свертыванием, обусловленной беременностью эклампсией, дефицитом витамина K, аутоиммунным нарушением, воспалительным заболеванием кишечника, язвенным колитом, дерматологическим нарушением (например, псориаз, пемфигус), респираторным заболеванием (например, астма, хроническое обструктивное заболевание легких), аллергическое реакцией на лекарственное средство, например, в результате приема лекарственных средств, таких как аспирин, гепарин и варфарин, диабетом, острой инфекцией гепатитом B, острой инфекцией гепатитом C, злокачественной опухолью или солидной опухолью (например, злокачественная опухоль предстательной железы, легкого, толстого кишечника, поджелудочной железы, желудка, желчных протоков, головы и шеи, шейки матки, молочной железы, меланома, злокачественная опухоль почки и/или гематологическая злокачественная опухоль). В одном варианте осуществления врожденное геморрагическое нарушение представляет собой гемофилию, например, гемофилию A, B или C. В одном варианте осуществления у индивидуума, имеющего врожденное геморрагическое нарушение, например, гемофилию, выработались ингибиторы, например ингибиторы на основе аллоантител к заместительным терапевтическим средствам для факторов свертывания, и его обозначают в настоящем описании как "индивидуум с ингибированием". В одном варианте осуществления индивидуум с ингибирование имеет гемофилию A. В другом варианте осуществления индивидуум с ингибированием имеет гемофилию B. В другом варианте осуществления индивидуум с ингибированием имеет гемофилию C.
"Терапевтически эффективное количество", как используют в рамках изобретения, включает количество средства РНК-i, которое при введении индивидууму, имеющему геморрагическое нарушение или кровотечение, является достаточным для осуществления лечения заболевания (например, путем уменьшения, смягчения или поддержания существующего заболевания или одного или нескольких симптомов заболевания). "Терапевтически эффективное количество" может варьировать в зависимости от средства РНК-i, того, каким образом средство вводят, заболевания и его тяжести и анамнеза, возраста, массы тела, семейного анамнеза, генетического фона, типов предшествующих и сопутствующих терапий при их наличии и других индивидуальных характеристик индивидуума, подвергаемого лечению.
"Профилактически эффективное количество", как используют в рамках изобретения, включает количество i-РНК, которое при введении индивидууму, имеющему геморрагическое нарушение, но не кровотечение, например индивидууму, имеющему геморрагическое нарушение и ожидающему хирургическую операцию, является достаточным для профилактики или смягчения заболевания или одного или нескольких симптомов заболевания. Смягчение заболевания включает замедление течения заболевания или снижение тяжести заболевания, которое разовьется позднее. "Профилактически эффективное количество" может варьировать в зависимости от i-РНК, того, как вводят средство, степени риска заболевания, и анамнеза, возраста, массы тела, семейного анамнеза, генетического фона, типов предшествующих и сопутствующих терапий при их наличии и других индивидуальных характеристик пациента, подлежащего лечению.
"Терапевтически эффективное количество" или "профилактически эффективное количество" также включает количество средства РНК-i, которое обеспечивает некоторый желаемый локальный или системный эффект при приемлемом соотношении польза/риск, подходящем для любого способа лечения. i-РНК, используемую в способах по настоящему изобретению, можно вводить в достаточном количестве для обеспечения приемлемого соотношения польза/риск, подходящего для такого лечения.
Выражение "фармацевтически приемлемый" используют в настоящем описании для обозначения соединений, материалов, композиций и/или дозированных форм, которые по мнению медицинского практикующего специалиста, являются пригодными для применения в контакте с тканями человека и животного без избыточной токсичности, раздражения, аллергического ответа или другой проблемы или осложнения, в соответствии с приемлемым соотношением польза/риск.
Выражение "фармацевтически приемлемый носитель", как используют в рамках изобретения, означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, производственную добавку (например, смазывающее вещество, тальк, стеарат магния, кальция или цинка или стеариновая кислота), или растворимый инкапсулирующий материал, вовлеченный в перенос или транспорт рассматриваемого соединения из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть "приемлемым" с точки зрения совместимости с другими ингредиентами состава и не вредоносным для индивидуума, подвергаемого лечению. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлоза и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошковый трагакант; (5) солод; (6) желатин; (7) смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) не содержащую пирогенов воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) pH-забуференные растворы; (21) полиэфиры, поликарбонаты и/или полиангидриды; (22) увеличивающие объем средства, такие как полипептиды и аминокислоты (23) компонент сыворотки, такой как сывороточный альбумин, HDL и LDL; и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических составах.
Термин "образец", как используют в рамках изобретения, включает коллекцию сходных жидкостей, клеток или тканей, взятых от индивидуума, а также жидкостей, клеток или тканей, присутствующих у индивидуума.
Примеры биологических жидкостей включают кровь, сыворотку и серозную жидкость, плазму, цереброспинальную жидкость, глазную жидкость, лимфу, мочу, слюну и т.п. Образцы тканей могут включать образцы из тканей, органов или локализованных областей. Например, образцы могут происходить из конкретных органов, частей органов или жидкостей или клеток в этих органах. В определенных вариантах осуществления образцы могут происходить из печени (например, целая печень или определенные сегменты печени или определенные типы клеток печени, например, такие как гепатоциты). В некоторых вариантах осуществления "образец, происходящий из индивидуума," относится к крови или плазме, взятым у индивидуума.
II. i-РНК по изобретению
В настоящем описании описаны i-РНК, которые ингибируют экспрессию гена серпина c1. В одном варианте осуществления средство i-РНК включает молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК) для ингибирования экспрессии гена серпина c1 в клетке, такой как клетка индивидуума, например, млекопитающего, такого как человек, имеющий геморрагическое нарушение, например, врожденное геморрагическое нарушение. дцРНК включает антисмысловую цепь, имеющую область комплементарности, которая комплементарна по меньшей мере части мРНК, образовавшейся при экспрессии гена серпина c1. Область комплементарности имеет длину приблизительно 30 нуклеотидов или менее (например, приблизительно 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19 или 18 нуклеотидов или менее в длину). При контакте с клеткой, экспрессирующей ген серпина c1, i-РНК ингибирует экспрессию гена серпина c1 (например, ген серпина c1 человека, примата, не являющегося приматом животного или птицы) по меньшей мере на приблизительно 10% при анализе, например, способом ПЦР или способом на основе разветвленной ДНК (b-ДНК), или способом на основе белка, таким как иммунофлуоресцентный анализ, с использованием, например, вестерн-блоттинга или способов проточной цитометрии.
дцРНК включает две цепи РНК, которые являются комплементарными и гибридизуются с образованием дуплексной структуры в условиях, в которых будет использована дцРНК. Одна цепь дцРНК (антисмысловая цепь) включает область комплементарности, которая по существу комплементарна, и, как правило, полностью комплементарна, последовательности-мишени. Последовательность-мишень может происходить из последовательности мРНК, образовавшейся во время экспрессии гена серпина c1. Другая цепь (смысловая цепь) включает область, которая комплементарна антисмысловой цепи, так что две цепи гибридизуются и образуют дуплексную структуру, когда их комбинируют в подходящих условиях. Как описано в настоящем описании и как известно в данной области, комплементарные последовательности дцРНК также могут содержаться в качестве самокомплементарных областей одной молекулы нуклеиновой кислоты, в противоположность отдельным олигонуклеотидам.
Как правило, дуплексная структура имеет длину от 15 до 30 пар оснований, например, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 пар оснований в длину. Также предусматривается, что диапазоны и длины, являющиеся промежуточными для указанных выше диапазонов и длин, являются частью изобретения.
Аналогично, область комплементарности с последовательностью-мишенью имеет длину от 15 до 30 нуклеотидов, например, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 нуклеотидов в длину. Также предусматривается, что диапазоны и длины, являющиеся промежуточными для указанных выше диапазонов и длин, являются частью изобретения.
В некоторых вариантах осуществления дцРНК имеет длину от приблизительно 15 до приблизительно 20 нуклеотидов или от приблизительно 25 до приблизительно 30 нуклеотидов. Как правило, дцРНК является достаточно длинной, чтобы служить в качестве субстрата для фермента Dicer. Например, в данной области хорошо известно, что дцРНК длиной более чем приблизительно 21-23 нуклеотида могут служить в качестве субстратов для Dicer. Как также будет понятно специалисту в данной области, область РНК, нацеленная на расщепление, наиболее часто является частью более крупной молекулы РНК, часто молекулы мРНК. Когда это приемлемо, "часть" мРНК-мишени представляет собой непрерывную последовательность мРНК-мишени достаточной длины, чтобы позволить ей быть субстратом для контролируемого РНК-i расщепления (т.е. расщепление через каскад RISC).
Специалисту в данной области также будет понятно, что основной функциональной частью дцРНК является дуплексная область, например, дуплексная область из приблизительно от 9 до 36 пар оснований, например, из приблизительно 10-36, 11-36, 12-36, 13-36, 14-36, 15-36, 9-35, 10-35, 11-35, 12-35, 13-35, 14-35, 15-35, 9-34, 10-34, 11-34, 12-34, 13-34, 14-34, 15-34, 9-33, 10-33, 11-33, 12-33, 13-33, 14-33, 15-33, 9-32, 10-32, 11-32, 12-32, 13-32, 14-32, 15-32, 9-31, 10-31, 11-31, 12-31, 13-32, 14-31, 15-31, 15-30, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 пар оснований. Таким образом, в одном варианте осуществления, при условии процессирования в функциональный дуплекс, например, из 15-30 пар оснований, который нацеливает желаемую РНК на расщепление, молекула РНК или комплекс молекул РНК, имеющих дуплексную область более 30 пар оснований, представляет собой дцРНК. Таким образом, специалисту в данной области будет понятно, что в одном варианте осуществления микроРНК представляет собой дцРНК. В другом варианте осуществления дцРНК не является встречающейся в природе микроРНК. В другом варианте осуществления средство i-РНК, пригодное для нацеливания на экспрессию серпина c1, не образуется в клетке-мишени путем расщепления более крупной дцРНК. дцРНК, как описано в настоящем описании, может дополнительно включать один или несколько одноцепочечных нуклеотидных выступающих концов, например, из 1, 2, 3 или 4 нуклеотидов. дцРНК, имеющие по меньшей мере один нуклеотидный выступающий конец, могут иметь неожиданно более высокие ингибиторные свойства относительно их аналогов с тупыми концами. Нуклеотидный выступающий конец может содержать или состоять из нуклеотидного/нуклеозидного аналога, включая дезоксинуклеотид/нуклеозид. Выступающий конец(концы) может находиться на смысловой цепи, антисмысловой цепи или на любой их комбинации. Более того, нуклеотид(ы) выступающего конца может находиться на 5'-конце, 3'-конце или на обоих концах либо антисмысловой, либо смысловой цепи дцРНК.
дцРНК можно синтезировать стандартными способами, известными в данной области, как дополнительно рассмотрено ниже, например, с использованием автоматизированного устройства для синтеза ДНК, такого как устройство, коммерчески доступное, например, от Biosearch, Applied Biosystems, Inc.
Соединения i-РНК по изобретению можно получать с использованием двухстадийной методики. Сначала отдельные цепи двухцепочечной молекулы РНК получают по отдельности. Затем составляющие цепи подвергают отжигу. Индивидуальные цепи соединения миРНК можно получать с использованием органического синтеза в жидкой фазе или в твердой фазе, или обоих из них. Органический синтез обеспечивает преимущество, состоящее в том, что можно без труда получать олигонуклеотидные цепи, содержащие неприродные или модифицированные нуклеотиды. Одноцепочечные олигонуклеотиды по изобретению можно получать с использованием органического синтеза в жидкой фазе или в твердой фазе или обоих из них.
В одном аспекте дцРНК по изобретению включает по меньшей мере две нуклеотидные последовательности: смысловую последовательность и антисмысловую последовательность. Смысловая цепь выбрана из группы последовательностей, предоставленных в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, и соответствующая антисмысловая цепь для смысловой цепи выбрана из последовательностей любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21. В этом аспекте одна из двух последовательностей комплементарна другой из двух последовательностей, причем одна из последовательностей по существу комплементарна последовательности мРНК, полученной при экспрессии гена серпина c1. По существу, в этом аспекте дцРНК включает два олигонуклеотида, где один олигонуклеотид описан как смысловая цепь в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, а второй олигонуклеотид описан как соответствующая антисмысловая цепь для смысловой цепи в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21. В одном варианте осуществления по существу комплементарные последовательности дцРНК находятся на отдельных олигонуклеотидах. В другом варианте осуществления по существу комплементарные последовательности дцРНК находятся на одном олигонуклеотиде.
Будет понятно, что, хотя некоторые из последовательностей, приведенных в таблицах 3, 4, 8, 11, 12, 14, 15, 20 и 21, описаны в качестве модифицированных и/или конъюгированных последовательностей, РНК в i-РНК по изобретению, например, дцРНК по изобретению, может содержать любую из последовательностей, указанных в таблицах 3, 4, 8, 11, 12, 14, 15, 20 и 21, которая является немодифицированной, неконъюгированной и/или модифицированной и/или конъюгированной иначе, чем описано в них.
Квалифицированному специалисту хорошо известно, что дцРНК, имеющие дуплексную структуру из приблизительно от 20 до 23 пар оснований, например, из 21 пары оснований, были признаны особенно эффективными в отношении индукции РНК-интерференции (Elbashir et al, EMBO 2001, 20:6877-6888). Однако другие исследователи обнаружили, что более короткие или более длинные дуплексные структуры РНК также могут быть эффективными (Chu and Rana (2007) RNA 14: 1714-1719; Kim et al. (2005) Nat Biotech 23:222-226). В вариантах осуществления, описанных выше, вследствие природы олигонуклеотидных последовательностей, предоставленных в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, дцРНК, как описано в настоящем описании, могут включать по меньшей мере одну цепь длиной минимум 21 нуклеотид. Можно обоснованно ожидать, что более короткие дуплексы, имеющие одну из последовательностей любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21 минус только несколько нуклеотидов на одном или обоих концах, аналогично могут быть эффективными по сравнению с дцРНК, как описано выше. Таким образом, дцРНК, имеющие последовательность из по меньшей мере 15, 16, 17, 18, 19, 20 или более последовательно расположенных нуклеотидов, происходящих из одной из последовательностей любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, и отличающиеся их способностью ингибировать экспрессию гена серпина c1 не более чем на приблизительно 5, 10, 15, 20, 25 или 30% относительно дцРНК, содержащей полную последовательность, считаются входящими в объем настоящего изобретения.
Кроме того, РНК, представленные в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, идентифицируют участок(участки) в транскрипте серпина c1, который является чувствительным к опосредуемому RISC расщеплению. По существу, настоящее изобретение, кроме того, относится к i-РНК, которые нацелены на один из этих участков. Как используют в рамках изобретения, i-РНК называют нацеливающейся на конкретный участок РНК-транскрипта, если i-РНК стимулирует расщепление транскрипта где-либо в конкретном участке. Такая i-РНК, как правило, включает по меньшей мере приблизительно 15 последовательно расположенных нуклеотидов из одной из последовательностей, предоставленных в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, связанной с дополнительными нуклеотидными последовательностями, взятыми из области, соседней с выбранной последовательностью в гене серпина c1.
Хотя последовательность-мишень, как правило, имеет длину приблизительно 15-30 нуклеотидов, существует широкое варьирование пригодности конкретных последовательностей в этом диапазоне для обеспечения расщепления любой данной РНК-мишени. В различных пакетах программ и руководствах, представленных в настоящем описании, предоставлено руководство по идентификации оптимальных последовательностей-мишеней для любого данного гена-мишени, однако также можно использовать эмпирический подход, при котором "окно" или "рамку" данного размера (в качестве неограничивающего примера, 21 нуклеотид), буквально или условно (в том числе, например, in silico) помещают в являющуюся мишенью последовательность РНК для идентификации последовательностей в этом диапазоне размеров, которые могут служить последовательностями-мишенями. Путем перемещения "окна" последовательности на один нуклеотид выше или ниже исходного расположения последовательности-мишени, можно идентифицировать следующую потенциальную последовательность-мишень до тех пор, пока для данного выбранного размера мишени не будет идентифицирован полный набор возможных последовательностей. Этот процесс, сопряженный с системным синтезом и исследованием идентифицированных последовательностей (с использованием анализов, как описано в настоящем описании или как известно в данной области) для идентификации последовательностей, которые имеют оптимальные характеристики, может идентифицировать последовательности РНК, которые при нацеливании на них средства i-РНК опосредуют наилучшее ингибирование экспрессии гена-мишени. Таким образом, в то время как последовательности, идентифицированные, например, в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, представляют собой эффективные последовательности-мишени, предусматривается, что дальнейшей оптимизации эффективности ингибирования можно достигать путем постепенного "смещения окна" на один нуклеотид выше или ниже данных последовательностей для идентификации последовательностей с равными или лучшими характеристиками ингибирования.
Кроме того, предусматривается, что для любой последовательности, идентифицированной, например, в любой из таблиц 3, 4, 8, 11, 12, 14, 15, 20 и 21, дальнейшей оптимизации можно достигать либо путем систематического добавления, либо путем систематического удаления нуклеотидов для получения более длинных или более коротких последовательностей, и исследования этих полученных последовательностей путем смещения окна более длинного или более короткого размера вверх или вниз от этой точки РНК-мишени. Вновь, объединение этого подхода для получения новых мишеней-кандидатов с исследованием эффективности i-РНК на основе этих последовательностей-мишеней в анализе ингибирования, как известно в данной области и/или как описано в настоящем описании, может привести к дальнейшему повышению эффективности ингибирования. Более того, такие оптимизированные последовательности можно корректировать, например, путем внесения модифицированных нуклеотидов, как описано в настоящем описании или как известно в данной области, добавления или изменений выступающего конца, или других модификаций, как известно в данной области и/или как рассмотрено в настоящем описании, для дальнейшей оптимизации молекулы (например, увеличение стабильности в сыворотке или времени полужизни в кровотоке, увеличение температурной стабильности, усиление трансмембранной доставки, нацеливание на конкретную область или тип клеток, увеличение взаимодействием с ферментами каскада подавления, увеличение высвобождения из эндосом) в качестве ингибитора экспрессии.
i-РНК, как описано в настоящем описании, может содержать одно или несколько оснований, несоответствующих с последовательности-мишени. В одном варианте осуществления i-РНК, как описано в настоящем описании, содержит не более 3 несоответствующих оснований. Если антисмысловая цепь i-РНК содержит основания, несоответствующие последовательности-мишени, предпочтительно, чтобы область несоответствия не была расположена в центре области комплементарности. Если антисмысловая цепь i-РНК содержит основания, несоответствующие последовательности-мишени, предпочтительно, чтобы несоответствие было ограничено областью в пределах последних 5 нуклеотидов либо с 5'-конца, либо с 3'-конца области комплементарности. Например, для средства i-РНК из 23 нуклеотидов цепь, которая комплементарна области гена серпина c1, как правило, не содержит никакого несоответствия оснований в пределах центральных 13 нуклеотидов. Способы, описанные в настоящем описании, или способы, известные в данной области, можно использовать для определения того, является ли i-РНК, содержащая несоответствие последовательности-мишени, эффективной в отношении ингибирования экспрессии гена серпина c1. Учет эффективности i-РНК с несоответствиями оснований в отношении ингибирования экспрессии гена серпина c1 является важным, особенно если известно, что конкретная область комплементарности в гене серпина c1 обладает полиморфным варьированием последовательности в популяции.
III. Модифицированные i-РНК по изобретению
В одном варианте осуществления РНК в i-РНК по изобретению, например дцРНК, является немодифицированной и не содержит, например, химических модификаций и/или конъюгаций, известных в данной области и описанных в настоящем описании. В другом варианте осуществления РНК в i-РНК по изобретению, например дцРНК, является химически модифицированной для повышения стабильности или других благоприятных характеристик. Нуклеиновые кислоты по настоящему изобретению можно синтезировать и/или модифицировать способами, общеизвестными в данной области, такими как способы, описанные в "Current protocols in nucleic acid chemistry", Beaucage, S.L. et al. (Edrs.), John Wiley & Sons, Inc., New York, NY, USA, которая включена в настоящее описание в качестве ссылки. Модификации включают, например, концевые модификации, например, 5'-концевые модификации (фосфорилирование, конъюгация, инвертированные связи) или 3'-концевые модификации (конъюгация, нуклеотиды ДНК, инвертированные связи и т.д.); модификации оснований, например, замена стабилизирующими основаниями, дестабилизирующими основаниями или основаниями, которые образуют пары с расширенным репертуаром партнеров, удаление оснований (абазические нуклеотиды) или конъюгированные основания; модификации сахаров (например, в 2'-положении или 4'-положении) или замену сахара; и/или модификации основной цепи, включая модификацию или замену фосфодиэфирных связей. Конкретные примеры соединений i-РНК, пригодных в вариантах осуществления, описанных в настоящем описании, включают, но не ограничиваются ими РНК, содержащие модифицированные остовы или не содержание природных межнуклеозидных связей. РНК, обладающие модифицированной основной цепью, включают, среди прочих, РНК, которые не имеют атома фосфора в основной цепи. Для целей настоящего описания, и, как иногда упоминается в данной области, модифицированные РНК, которые не содержат атома фосфора в их межнуклеозидном остове, также можно считать олигонуклеозидами. В некоторых вариантах осуществления модифицированные i-РНК имеют атом фосфора в их межнуклеозидном остове.
Модифицированные остовы РНК включают, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил и другие алкилфосфонаты, включая 3'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры и боранофосфаты, имеющие нормальные 3'-5'-связи, их 2'-5'-связанные аналоги и аналоги, имеющие обратную полярность, где соседние пары нуклеозидных элементов связаны 3'-5' с 5'-3' или 2'-5' c 5'-2'. Также включены различные соли, смешанные соли с формы свободных кислот.
Репрезентативные патенты США, в которых описано получение описанных выше фосфорсодержащих связей, включают, но не ограничиваются ими, патенты США № 3687808, 4469863, 4476301, 5023243, 5177195, 5188897, 5264423, 5276019, 5278302, 5286717, 5321131, 5399676, 5405939, 5453496, 5455233, 5466677, 5476925, 5519126, 5536821, 5541316, 5550111, 5563253, 5571799, 5587361, 5625050, 6028188, 6124445, 6160109, 6169170, 6172209, 6239265, 6277603, 6326199, 6346614, 6444423, 6531590, 6534639, 6608035, 6683167, 6858715, 6867294, 6878805, 7015315, 7041816, 7273933, 7321029 и патент США RE39464, полное содержание которых включено в настоящее описание в качестве ссылки.
Модифицированные остовы РНК, которые не включают атом фосфора, имеют остовы, которые образованы короткоцепочечными алкильными или циклоалкильными межнуклеозидными связями, смешанными гетероатомами и алкильными или циклоалкильными межнуклеозидными связями, или одной или несколькими короткоцепочечными гетероатомными или гетероциклическими межнуклеозидными связями. Они включают остовы, имеющие морфолиносвязи (частично образованные из части сахара в нуклеозиде); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетильные и тиоформацетильные остовы; метиленформацетильные и тиоформацетильные остовы; алкенсодержащие остовы; сульфаматные остовы; метиленимино и метиленгидразиноостовы; сульфонатные и сульфонамидные остовы; амидные остовы и другие остовы, имеющие смешанные составные части N, O, S и CH2.
Репрезентативные патенты США, в которых описано получение описанных выше олигонуклеозидов, включают, но не ограничиваются ими, патенты США № 5034506, 5166315, 5185444, 5214134, 5216141, 5235033, 5264562, 5264564, 5405938, 5434257, 5466677, 5470967, 5489677, 5541307, 5561225, 5596086, 5602240, 5608046, 5610289, 5618704, 5623070, 5663312, 5633360, 5677437 и 5677439, полное содержание которых включено в настоящее описание в качестве ссылки.
В других вариантах осуществления предусматриваются пригодные миметики РНК для применения в i-РНК, в которых как цепь сахара, так и межнуклеозидная связь, т.е. остов нуклеотидных элементов, заменены новыми группами. Элементы оснований сохранены для гибридизации с соответствующим соединением нуклеиновой кислоты-мишени. Одно такое олигомерное соединение-миметик РНК, который, как было показано, обладает превосходными свойствами гибридизации, называют пептидной нуклеиновой кислотой (PNA). В соединениях PNA остов сахара в РНК заменен амидсодержащим остовом, в частности остовом аминоэтилглицина. Нуклеотидные основания сохранены и связаны прямо или непрямо с атомами азота азагруппы амидной части остова. Репрезентативные патенты США, в которых описано получение соединений PNA, включают, но не ограничиваются ими, патенты США № 5539082, 5714331 и 5719262, полное содержание каждого из которых включено в настоящее описание в качестве ссылки. Дополнительные соединения PNA, пригодные для применения в i-РНК по изобретению, описаны, например, в Nielsen et al, Science, 1991, 254, 1497-1500.
Некоторые варианты осуществления изобретения включают РНК с фосфоротиоатными остовами и олигонуклеозиды с остовами с гетероатомами, и, в частности, -CH2-NH-CH2-, -CH2-N(CH3)-O-CH2- [известный как остов метилен(метилимино) или MMI], -CH2-O-N(CH3)-CH2-, -CH2-N(CH3)-N(CH3)-CH2- и -N(CH3)-CH2-CH2- [где нативный фосфодиэфирный остов соответствует -O-P-O-CH2-] описанного выше патента США № 5489677, и амидные остовы описанного выше патента США № 5602240. В некоторых вариантах осуществления РНК, описанные в настоящем описании, имеют структуры морфолиноостовов описанного выше патента США № 5034506.
Модифицированные РНК также могут содержать одну или несколько замещенных цепей сахаров. i-РНК, например дцРНК по изобретению, могут включать одно из следующих в 2'-положении: OH; F; O-, S- или N-алкил; O-, S- или N-алкенил; O-, S- или N-алкинил; или O-алкил-O-алкил, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-C10алкил или C2-C10алкенил и алкинил. Иллюстративные пригодные модификации включают O[(CH2)nO]mCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(CH2)nON[(CH2)nCH3)]2, где n и m составляют от 1 до приблизительно 10. В других вариантах осуществления дцРНК включают одно из следующих в 2'-положении: низший C1-C10алкил, замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, CI, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, уходящая группа РНК, репортерная группа, интеркалятор, группа для улучшения фармакокинетических свойств i-РНК, или группа для улучшения фармакодинамических свойств i-РНК, и другие заместители, имеющие сходные свойства. В некоторых вариантах осуществления модификация включает 2'-метоксиэтокси (2'-O-CH2CH2OCH3, также известный как 2'-O-(2-метоксиэтил) или 2'-MOE) (Martin et al, Helv. Chim. Acta, 1995, 78:486-504), т.е. группу алкокси-алкокси. Другой иллюстративной модификацией является 2'-диметиламинооксиэтокси, т.е. группа O(CH2)2ON(CH3)2, также известная как 2'-DMAOE, как описано в примерах ниже, и 2'-диметиламиноэтоксиэтокси (также известный в данной области как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е. 2'-O-CH2-O-CH2-N(CH2)2.
Другие модификации включают 2'-метокси (2'-OCH3), 2'-аминопропокси (2'-OCH2CH2CH2NH2) и 2'-фтор (2'-F). Также можно вносить сходные модификации в других положениях на РНК в i-РНК, в частности в 3'-положении сахара на 3'-концевом нуклеотиде или в 2'-5'-связанных дцРНК и в 5'-положении 5'-концевого нуклеотида. i-РНК также могут иметь миметики сахаров, такие как циклобутильные части, вместо пентафуранозильного сахара. Репрезентативные патенты США, в которых описано получение таких модифицированных структур сахаров, включают, но не ограничиваются ими, патенты США № 4981957, 5118800, 5319080, 5359044, 5393878, 5446137, 5466786, 5514785, 5519134, 5567811, 5576427, 5591722, 5597909, 5610300, 5627053, 5639873, 5646265, 5658873, 5670633 и 5700920, некоторые из которых находятся в совместном владении с настоящей заявкой. Полное содержание каждого из указанных выше патентов включено в настоящее описание в качестве ссылки.
i-РНК также могут включать модификации или замены нуклеотидных оснований (часто в данной области просто обозначаемых как "основания"). Как используют в рамках изобретения, "немодифицированные" или "природные" нуклеотидные основания включают пуриновые основания аденин (A) и гуанин (G), и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеотидные основания включают другие синтетические и природные нуклеотидные основания, такие как 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропильные и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и цитозин, 5-пропинилурацил и цитозин, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. Следующие нуклеотидные основания включают основания, описанные в патенте США № 3687808, основания, описанные в Modified Nucleosides in Biochemistry, Biotechnology and Medicine, Herdewijn, P. ed. Wiley-VCH, 2008; основания, описанные в The Concise Encyclopedia Of Polymer Science And Engineering, pages 858-859, Kroschwitz, J. L, ed. John Wiley & Sons, 1990, основания, описанные в Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613, и основания, описанные в Sanghvi, Y S., Chapter 15, dsRNA Research and Applications, pages 289-302, Crooke, S. T. and Lebleu, B., Ed., CRC Press, 1993. Некоторые из этих нуклеотидных оснований являются особенно пригодными для повышения аффинности связывания олигомерных соединений по изобретению. Они включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и O-6-замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Было показано, что замены на 5-метилцитозин повышают стабильность дуплекса нуклеиновых кислот на 0,6-1,2°C (Sanghvi, Y. S., Crooke, S. T. and Lebleu, B., Eds., dsRNA Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278), и они являются иллюстративными заменами оснований, еще более конкретно, когда они комбинированы с модификациями сахаров 2'-O-метоксиэтилом.
Репрезентативные патенты США, в которых описано получение некоторых из описанных выше модифицированных нуклеотидных оснований, а также других модифицированных нуклеотидных оснований, включают, но не ограничиваются ими, описанные выше патенты США № 3687808, 4845205, 513030, 5134066, 5175273, 5367066, 5432272, 5457187, 5459255, 5484908, 5502177, 5525711, 5552540, 5587469, 5594121, 5596091, 5614617, 5681941, 5750692, 6015886, 6147200, 6166197, 6222025, 6235887, 6380368, 6528640, 6639062, 6617438, 7045610, 7427672 и 7495088, полное содержание которых включено в настоящее описание в качестве ссылки.
РНК в i-РНК также могут быть модифицированы включением одной или нескольких замкнутых нуклеиновых кислот (LNA). Замкнутая нуклеиновая кислота представляет собой нуклеотид, имеющий модифицированную часть рибозы, где часть рибозы содержит дополнительный мостик, соединяющий 2'- и 4'-атомы углерода. Эта структура эффективно "замыкает" рибозу в структурной конформации 3'-эндо. Было показано, что добавление замкнутых нуклеиновых кислот к миРНК увеличивает стабильность миРНК в сыворотке и уменьшает нецелевые эффекты (Elmen, J. et al., (2005) Nucleic Acids Research 33(1):439-447; Mook, OR. et al, (2007) Mol Cane Ther 6(3):833-843; Grunweller, A. et al., (2003) Nucleic Acids Research 31(12):3185-3193).
Репрезентативные патенты США, в которых описано получение замкнутых нуклеотидов нуклеиновых кислот, включают, но не ограничиваются ими, следующие: патенты США № 6268490, 6670461, 6794499, 6998484, 7053207, 7084125 и 7399845, полное содержание каждого из которых включено в настоящее описание в качестве ссылки.
Потенциально стабилизирующие модификации концов молекул РНК могут включать N-(ацетиламинокапроил)-4-гидроксипролинол (Hyp-C6-NHAc), N-(капроил-4-гидроксипролинол (Hyp-C6), N-(ацетил-4-гидроксипролинол (Hyp-NHAc), тимидин-2'-O-дезокситимидин (простой эфир), N-(аминокапроил)-4-гидроксипролинол (Hyp-C6-амино), 2-докозаноилуридин-3"-фосфат, инвертированное основание dT(idT) и прочие. Описание этой модификации может быть найдено в публикации PCT № WO 2011/005861.
IV. i-РНК, конъюгированные с лигандами
Другая модификация РНК в i-РНК по изобретению вовлекает химическое связывание с РНК одного или нескольких лигандов, частей или конъюгатов, которые усиливают активность, распределение в клетках или клеточный захват i-РНК. Такие части включают, но не ограничиваются ими, липидные части, такие как холестериновая часть (Letsinger et al., Proc. Natl. Acid. Sci. USA, 1989, 86: 6553-6556), холевая кислота (Manoharan et al., Biorg. Med. Chem. Let., 1994, 4: 1053-1060), простой тиоэфир, например, берил-S-тритилтиол (Manoharan et al., Ann. N Y. Acad. Sci., 1992, 660:306-309; Manoharan et al., Biorg. Med. Chem. Let., 1993, 3:2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20:533-538), алифатическую цепь, например, додекандиольные или ундецильные остатки (Saison-Behmoaras et al., EMBO J, 1991, 10: 1111-1118; Kabanov et al., FEBS Lett., 1990, 259:327-330; Svinarchuk et al., Biochimie, 1993, 75:49-54), фосфолипид, например, дигексадецил-rac-глицерин или триэтиламмоний 1,2-ди-O-гексадецил-rac-глицеро-3-фосфонат (Manoharan et al., Tetrahedron Lett., 1995, 36:3651-3654; Shea et al., Nucl. Acids Res., 1990, 18:3777-3783), цепь полиамина или полиэтиленгликоля (Manoharan et al., Nucleosides & Nucleotides, 1995, 14:969-973), или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36:3651-3654), пальмитиловую часть (Mishra et al., Biochim. Biophys. Acta, 1995, 1264:229-237), или октадециламиновую или гексиламиноарбонилоксихолестериновую часть (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277:923-937).
В одном варианте осуществления лиганд изменяет распределение, нацеливание или время жизни средства i-РНК, в которую он включен. В предпочтительных вариантах осуществления лиганд обеспечивает усиленную аффинность к выбранной мишени, например, молекуле, клетке или типу клеток, компартменту, например, компартменту клетки или органа, ткани, органу или части тела, например, по сравнению с видом, в котором отсутствует такой лиганд. Предпочтительные лиганды не участвуют в образовании пар оснований дуплекса в дуплексной нуклеиновой кислоте.
Лиганды могут включать встречающееся в природе вещество, такое как белок (например, сывороточный альбумин человека (HSA), липопротеин низкой плотности (LDL) или глобулин); углевод (например, декстран, пуллулан, хитин, хитозан, инулин, циклодекстрин, N-ацетилгалактозамин или гиалуроновая кислота); или липид. Лиганд также может представлять собой рекомбинантную или синтетическую молекулу, такую как синтетический полимер, например, синтетическая полиаминокислота. Примеры полиаминокислот включают полилизин (PLL), поли-L-аспарагиновую кислоту, поли-L-глутаминовую кислоту, сополимер стирол-ангидрид малеиновой кислоты, сополимер L-лактида и гликолида), сополимер дивиниловый простой эфир-малеиновый ангидрид, N-(2-гидроксипропил)метакриламидный сополимер (HMPA), полиэтиленгликоль (PEG), поливиниловый спирт (PVA), полиуретан, поли(2-этилакриловая кислота), N-изопропилакриламидные полимеры или полифосфазин. Примеры полиаминов включают: полиэтиленимин, полилизин (PLL), спермин, спермидин, полиамин, псевдопептид-полиамин, пептидомиметик-полиамин, дендример-полиамин, аргинин, амидин, протамин, катионный липид, катионный порфирин, четвертичную соль полиамина или альфа-спиральный пептид.
Лиганды также могут включать нацеливающие группы, например, нацеливающее на клетку или ткань средство, например, лектин, гликопротеин, липид или белок, например, антитело, которое связывается с определенным типом клеток, таким как клетка почки. Нацеливающая группа может представлять собой тиротропин, меланотропин, лектин, гликопротеин, белок A сурфактанта, углевод муцина, поливалентную лактозу, поливалентную галактозу, N-ацетилгалактозамин, N-ацетилглюкозамин, поливалентную маннозу, поливалентную фукозу, гликозилированные полиаминокислоты, поливалентную галактозу, трансферрин, бисфосфонат, полиглутамат, полиаспартат, липид, холестерин, стероид, желчную кислоту, фолат, витамин B12, витамин A, биотин или пептид RGD или миметик пептида RGD.
Другие примеры лигандов включают красители, интеркалирующие агенты (например акридины), поперечно-сшивающие агенты (например псорален, митомицин C), порфирины (TPPC4, тексафирин, сапфирин), полициклические ароматические углеводороды (например, феназин, дигидрофеназин), искусственные эндонуклеазы (например ЭДТА), липофильные молекулы, например холестерин, холевую кислоту, адамантануксусную кислоту, 1-пиренмасляную кислоту, дигидротестостерон, 1,3-бис-O(гексадецил)глицерин, геранилоксигексильную группу, гексадецилглицерин, борнеол, ментол, 1,3-пропандиол, гептадецильную группу, пальмитиновую кислоту, миристиновую кислоту, O3-(олеоил)литохолевую кислоту, O3-(олеоил)холиновую кислоту, диметокситритил или феноксазин) и пептидные конъюгаты (например, пептид Antennapedia, пептид Tat), алкилирующие средства, фосфат, амино, меркапто, PEG (например, PEG-40K), MPEG, [MPEG] 2, полиамино, алкил, замещенный алкил, радиоактивно меченные маркеры, ферменты, гаптены (например биотин), средства, облегчающие транспорт/всасывание (например, аспирин, витамин E, фолиевая кислота), синтетические рибонуклеазы (например, имидазол, бисимидазол, гистамин, имидазольные кластеры, акридин-имидазольные конъюгаты, Eu3+ комплексы тетраазамакроциклов), динитрофенил, HRP или AP.
Лиганды могут представлять собой белки, например, гликопротеины или пептиды, например, молекулы, обладающие специфической аффинностью в отношении дополнительного лиганда, или антитела, например антитела, которое связывается с конкретным типом клеток, таким как клетка печени. Лиганды также могут включать гормоны и рецепторы гормонов. Они также могут включать непептидные структуры, такие как липиды, лектины, углеводы, витамины, кофакторы, поливалентная лактоза, поливалентная галактоза, N-ацетилгалактозамин, N-ацетилглюкозамин, поливалентная манноза или поливалентная фукоза. Лиганд может представлять собой, например, липополисахарид, активатор MAP-киназы p38 или активатор NF-κB.
Лиганд может представлять собой вещество, например, лекарственное средство, которое может повышать захват i-РНК в клетку, например, путем разрушения цитоскелета клеток, например, путем разрушения клеточных микротрубочек, микрофиламентов и/или промежуточных филаментов. Лекарственное средство может представлять собой, например, таксон, винкристин, винбластин, цитохалазин, нокодазол, яплакинолид, латрункулин A, фаллоидин, свинхолид A, инданоцин или миосервин.
В некоторых вариантах осуществления лиганд, связанный с i-РНК, как описано в настоящем описании, действует в качестве модулятора фармакокинетики (модулятор PK). Модуляторы PK включают липофильные соединения, желчные кислоты, стероиды, аналоги фосфолипидов, пептиды, связывающие белок соединения, PEG, витамины и т.д. Иллюстративные модуляторы PK включают, но не ограничиваются ими, холестерин, жирные кислоты, холевую кислоту, литохолевую кислоту, диалкилглицериды, диацилглицерид, фосфолипиды, сфинголипиды, напроксен, ибупрофен, витамин E, биотин и т.д. Также известно, что олигонуклеотиды, которые содержат ряд фосфоротиоатных связей, связываются с сывороточным белком, таким образом, также в рамках настоящего изобретения в качестве лигандов (например, модулирующих PK лигандов) пригодны олигонуклеотиды, например, олигонуклеотиды из приблизительно 5 оснований, 10 оснований, 15 оснований или 20 оснований, содержащие множество фосфоротиоатных связей в остове. Кроме того, также для применения в качестве модулирующих PK лигандов в вариантах осуществления, описанных в настоящем описании, пригодны аптамеры, которые связывают компоненты сыворотки (например, сывороточные белки).
Конъюгированные с лигандом олигонуклеотиды по изобретению можно синтезировать с использованием олигонуклеотида, который содержит выступающую реакционноспособную функциональную группу, такую как группа, полученная путем присоединения линкерной молекулы к олигонуклеотиду (как описано). Этот реакционноспособный олигонуклеотид можно подвергать реакции непосредственно с коммерчески доступными лигандами, лигандами, которые синтезированы так, чтобы они содержали любую из множества защитных групп, или лигандами, которые имеют присоединенную к ним линкерную часть.
Олигонуклеотиды, используемые в конъюгатах по настоящему изобретению, можно удобным и обычным способом получать с помощью хорошо известной технологии твердофазного синтеза. Оборудование для такого синтеза продается несколькими поставщиками, включая, например, Applied Biosystems (Foster City, Calif.). Дополнительно или альтернативно, можно использовать любые другие средства для такого синтеза, известные в данной области. Также известно использование сходных технологий для получения других олигонуклеотидов, таких как фосфоротиоаты и алкилированные производные.
В конъюгированных с лигандом олигонуклеотидах и молекуле лиганда, содержащей связанные с ней специфичные к последовательности нуклеозиды по настоящему изобретению, олигонуклеотиды и олигонуклеозиды могут быть собраны на подходящем устройстве для синтеза ДНК с использованием стандартных нуклеотидных или нуклеозидных предшественников, или нуклеотидных или нуклеозидных предшественников конъюгатов, которые уже содержат линкерную часть, предшественников лиганд-нуклеотид или нуклеозид-конъюгат, которые уже содержат молекулу лиганда, или ненуклеозидных содержащих лиганд структурных элементов.
При использовании нуклеотидных предшественников конъюгатов, которые уже содержат линкерную часть, осуществляют синтез специфичных к последовательности связанных к нуклеозидов, как правило, а затем молекулу лиганда подвергают реакции с линкерной частью с образованием конъюгированного с лигандом олигонуклеотида. В некоторых вариантах осуществления олигонуклеотиды или присоединенные нуклеозиды по настоящему изобретению синтезируют с помощью автоматического устройства для синтеза с использованием фосфорамидитов, происходящих из конъюгатов лиганд-нуклеозид в дополнение к стандартным фосфорамидитам и нестандартным фосфорамидитам, которые являются коммерчески доступными и обычно используются в синтезе олигонуклеотидов.
A. Конъюгаты липидов
Лигандом или конъюгатом является липид или молекула на основе липида. Такой липид или молекула на основе липида предпочтительно связывается с сывороточным белком, например сывороточным альбумином человека (HSA). HSA-связывающий лиганд обеспечивает распределение конъюгата в ткани-мишени, например, в ткани организма, не происходящей из почки. Например, ткань-мишень может представлять собой печень, включая паренхимные клетки печени. Также в качестве лигандов можно использовать другие молекулы, которые могут связывать HSA. Например, можно использовать напроксен или аспирин. Липид или лиганд на основе липида может (a) повышать устойчивость к деградации конъюгата, (b) увеличивать нацеливание или транспорт в клетку-мишень или клеточную мембрану, и/или (c) может быть использован для модулирования связывания с белком сыворотки, например, HSA.
Лиганд на основе липида можно использовать для ингибирования, например, для контроля связывания конъюгата с тканью-мишенью. Например, липид или конъюгат на основе липидов, который связывается с HSA более прочно, с меньшей вероятностью будет нацеливаться на почку и, таким образом, с меньшей вероятностью будет выводиться из организма. Липид или лиганд на основе липида, который связывается с HSA менее прочно, можно использовать для нацеливания конъюгата в почку.
В предпочтительном варианте осуществления лиганд на основе липидов связывает HSA. Предпочтительно, он связывает HSA с достаточной аффинностью чтобы конъюгат предпочтительно распределялся в ткань, не являющуюся тканью почки. Однако предпочтительно, чтобы аффинность не была настолько высокой, чтобы связывание HSA-лиганд нельзя было обратить вспять.
В другом предпочтительном варианте осуществления лиганд на основе липида связывает HSA слабо или совсем не связывает, так чтобы конъюгат предпочтительно распределялся в почку. Другие части, которые нацеливаются на клетки почки, также можно использовать вместо или в дополнение к лиганду на основе липидов.
В другом аспекте лиганд представляет собой часть, например, витамин, которая захватывается клеткой-мишенью, например, пролиферирующей клеткой. Он является особенно пригодным для лечения нарушений, характеризующихся нежелательной пролиферацией клеток, например, злокачественного или незлокачественного типа, например, злокачественных клеток. Иллюстративные витамины включают витамин A, E и K. Другие иллюстративные витамины представляют собой витамин B, например, фолиевую кислоту, B12, рибофлавин, биотин, пиридоксаль или другие витамины или питательные вещества, захватываемые клетками-мишенями, такими как клетки печени. Также включены HSA и липопротеин низкой плотности (LDL).
B. Средства, повышающие проникновение в клетку
В другом аспекте лиганд представляет собой средство, повышающее проникновение в клетку, предпочтительно средство, повышающее проникновение в клетку со спиральной структурой. Предпочтительно, средство является амфипатическим. Иллюстративное средство представляет собой пептид, такой как tat или antennopedia. Если средство представляет собой пептид, он может быть модифицированным, включая пиптедильный миметик, инвертомеры, непептидные или псевдопептидные связи и использование D-аминокислот. Средство со спиральной структурой предпочтительно представляет собой средство с альфа-спиральной структурой, которое предпочтительно имеет липофильную и липофобную фазу.
Лиганд может представлять собой пептид или пептидомиметик. Пептидомиметик (также обозначаемый в настоящем описании как олигопептидомиметик) представляет собой молекулу, способную укладываться в определенную трехмерную структуру, сходную с природным пептидом. Связывание пептида и пептидомиметика со средствами i-РНК может повлиять на фармакокинетическое распределение i-РНК, например, путем усиления распознавания и всасывания клетками. Часть в виде пептида или пептидомиметика может иметь длину приблизительно 5-50 аминокислот, например, длину приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот.
Пептид или пептидомиметик может представлять собой, например, пептид, повышающий проникновение в клетку, катионный пептид, амфипатические пептид или гидрофобный пептид (например, состоящий в основном из Tyr, Trp или Phe). Пептидная часть может представлять собой дендримерный пептид, скрепленный пептид или сшитый пептид. В другой альтернативе пептидная часть может включать последовательность для переноса через гидрофобную мембрану (MTS). Иллюстративный гидрофобный MTS-содержащий пептид представляет собой RFGF, имеющий аминокислотную последовательность AAVALLPAVLLALLAP (SEQ ID NO:9). Аналог RFGF (например, аминокислотная последовательность AALLPVLLAAP (SEQ ID NO:10), содержащий гидрофобную MTS, также может представлять собой нацеливающую часть. Пептидная часть может представлять собой пептид для "доставки", который может содержать крупные полярные молекулы, включая пептиды, олигонуклеотиды и белок, через мембраны клеток. Например, было выявлено, что последовательности из белка Tat ВИЧ (GRKKRRQRRRPPQ (SEQ ID NO:11) и белка Antennapedia Drosophila (RQIKIWFQNRRMKWKK (SEQ ID NO:12), способны функционировать в качестве пептидов для доставки. Пептид или пептидомиметик, могут кодироваться случайной последовательностью ДНК, такой как пептид, идентифицированный из библиотеки фагового дисплея или комбинаторной библиотеки одна гранула-одно соединение (OBOC) (Lam et al., Nature, 354:82-84, 1991). Примерами пептида или пептидомиметика, связанных со средством дцРНК через включенный мономерный элемент для целей нацеливания на клетку, являются пептид аргинин-глицин-аспарагиновая кислота (RGD) или миметик RGD. Длина пептидной части может находиться в диапазоне от приблизительно 5 аминокислот до приблизительно 40 аминокислот. Пептидные части могут иметь структурную модификацию, такую как модификация для повышения стабильности или обеспечения конформационных свойств. Можно использовать любую из структурных модификаций, описанных ниже.
Пептид RGD для применения в композициях и способах по изобретению может быть линейным или циклическим, и он может быть модифицированным, например, гликозилированным или метилированным, чтобы облегчить нацеливание на конкретную ткань(и). RGD-содержащие пептиды и пептидомиметики могут включать D-аминокислоты, также как и синтетические миметики RGD. В дополнение к RGD, можно использовать другие части, которые нацелены на лиганд-интегрин. Предпочтительные конъюгаты этого лиганда нацелены на PECAM-1 или VEGF.
"Пептид, повышающий проникновение в клетку," способен проникать в клетку, например, микробную клетку, такую как бактериальная клетка или клетка грибов, или клетку млекопитающих, такую как клетка человека. Микробный пептид, повышающий проникновение в клетку, может представлять собой, например, α-спиральный линейный пептид (например, LL-37 или Ceropin PI), содержащий дисульфидную связь пептид (например, α-дефензин, β-дефензин или бактенецин), или пептид, содержащий только одну или две доминирующих аминокислоты (например, PR-39 или индолицидин). Пептид, повышающий проникновение в клетку, также может включать сигнал ядерной локализации (NLS). Например, пептид, повышающий проникновение в клетку, может представлять собой амфипатический пептид из двух частиц, такой как MPG, который получен путем слияния пептидного домена gp41 ВИЧ-1 и большого T-антигена NLS SV40 (Simeoni et al., Nucl. Acids Res. 31: 2717-2724, 2003).
C. Конъюгаты углеводов
В некоторых вариантах осуществления композиций и способов по изобретению олигонуклеотид i-РНК дополнительно содержит углевод. Конъюгированные с углеводом i-РНК являются преимущественными для доставки нуклеиновых кислот in vivo, а также в качестве композиций, пригодных для терапевтического применения in vivo, как описано в настоящем описании. Как используют в рамках изобретения, "углевод" относится к соединению, которое представляет собой либо непосредственно углевод, состоящий из одного или нескольких моносахаридных элементов, имеющих по меньшей мере 6 атомов углерода (который может быть линейным, разветвленным или циклическим) с атомом кислорода, азота или серы, связанным с каждым атомом углерода; либо соединение, имеющее в качестве его части углеводную часть, состоящую из одного или нескольких моносахаридных элементов, каждый из которых имеет по меньшей мере шесть атомов углерода (которая может быть линейной, разветвленной или циклической), с атомом кислород, азота или серы, связанным с каждым атомом углерода. Репрезентативные углеводы включают сахара (моно-, ди-, три- и олигосахариды, содержащие приблизительно 4, 5, 6, 7, 8 или 9 моносахаридных элементов), и полисахариды, такие как крахмалы, гликоген, целлюлоза и полисахаридные камеди. Конкретные моносахариды включают сахара C5 и выше (например, C5, C6, C7 или C8); ди- и трисахариды включают сахара, имеющие два или три моносахаридных элемента (например, C5, C6, C7 или C8).
В одном варианте осуществления конъюгат углевода для применения в композициях и способах по изобретению представляет собой моносахарид. В одном варианте осуществления моносахарид представляет собой

В другом варианте осуществления конъюгат углевода для применения в композициях и способах по изобретению выбран из группы, состоящей из:
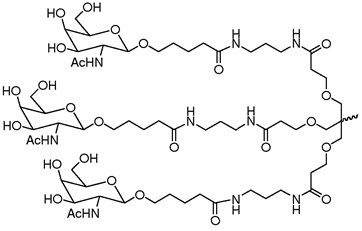
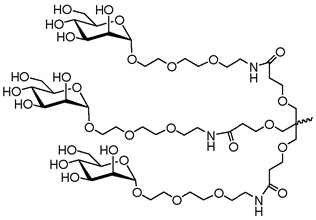




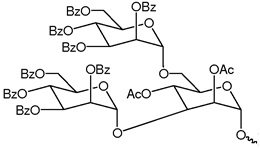












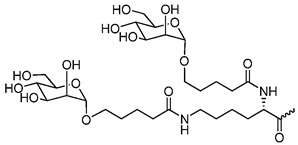

Другой репрезентативный конъюгат углевода для применения в вариантах осуществления, описанных в настоящем описании, включает, но не ограничивается ими,

формула XXIII,
где один из X или Y представляет собой олигонуклеотид, другой представляет собой водород.
В некоторых вариантах осуществления конъюгат углевода дополнительно содержит один или несколько дополнительных лигандов, как описано выше, таких как, но не ограничиваясь ими, модулятор PK и/или пептид, повышающий проникновение в клетку.
D. Линкеры
В некоторых вариантах осуществления конъюгат или лиганд, описанные в настоящем описании, могут быть связаны с олигонуклеотидом i-РНК с помощью различных линкеров, которые могут быть расщепляемыми или нерасщепляемыми.
Термин "линкер" или "линкерная группа" означает органическую часть, которая соединяет две части соединения, например, ковалентно связывает две части соединения. Линкеры, как правило, содержат прямую связь или атом, такой как кислород или сера, элемент, такой как NR8, C(O), C(O)NH, SO, SO2, SO2NH или цепь атомов, такую как, но не ограничиваясь ими, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арилалкил, арилалкенил, арилалкинил, гетероарилалкил, гетероарилалкенил, гетероарилалкинил, гетероциклилалкил, гетероциклилалкенил, гетероциклилалкинил, арил, гетероарил, гетероциклил, циклоалкил, циклоалкенил, алкиларилалкил, алкиларилалкенил, алкиларилалкинил, алкениларилалкил, алкениларилалкенил, алкениларилалкинил, алкиниларилалкил, алкиниларилалкенил, алкиниларилалкинил, алкилгетероарилалкил, алкилгетероарилалкенил, алкилгетероарилалкинил, алкенилгетероарилалкил, алкенилгетероарилалкенил, алкенилгетероарилалкинил, алкинилгетероарилалкил, алкинилгетероарилалкенил, алкинилгетероарилалкинил, алкилгетероциклилалкил, алкилгетероциклилалкенил, алкилгетероциклилалкинил, алкенилгетероциклилалкил, алкенилгетероциклилалкенил, алкенилгетероциклилалкинил, алкинилгетероциклилалкил, алкинилгетероциклилалкенил, алкинилгетероциклилалкинил, алкиларил, алкениларил, алкиниларил, алкилгетероарил, алкенилгетероарил, алкинилгетероарил, причем один или несколько метиленов могут прерываться или оканчиваться O, S, S(O), SO2, N(R8), C(O), замещенным или незамещенным арилом, замещенным или незамещенным гетероарилом, замещенным или незамещенным гетероциклическим соединением; где R8 представляет собой водород, ацил, алифатическую группу или замещенную алифатическую. В одном варианте осуществления линкер имеет приблизительно 1-24 атома, 2-24, 3-24, 4-24, 5-24, 6-24, 6-18, 7-18, 8-18 атомов, 7-17, 8-17, 6-16, 7-16 или 8-16 атомов.
Расщепляемая линкерная группа представляет собой группу, которая является достаточно стабильной вне клетки, но которая при проникновении в клетку-мишень расщепляется с высвобождением двух частей, которые линкер удерживал вместе. В предпочтительном варианте осуществления расщепляемая линкерная группа расщепляется по меньшей мере приблизительно в 10 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или более, или по меньшей мере приблизительно в 100 раз быстрее в клетке-мишени или в первых эталонных условиях (которые, например, могут быть выбраны так, чтобы они имитировали или отражали внутриклеточные условия), чем в крови индивидуума, или во вторых эталонных условиях (которые, например, могут быть выбраны так, чтобы они имитировали или отражали условия, встречающиеся в крови или сыворотке).
Расщепляемые линкерные группы являются чувствительными к расщепляющим агентам, например, pH, окислительно-восстановительный потенциал или присутствие расщепляющих молекул. Как правило, расщепляющие агенты являются более распространенными или встречаются при более высоких уровнях или с более высокой активностью в клетках, чем в сыворотке или в крови. Примеры таких расщепляющих агентов включают: окислительно-восстановительные агенты, которые выбраны для конкретных субстратов или которые не обладают субстратной специфичностью, включая, например, окислительные или восстановительные ферменты или восстановительные агенты, такие как меркаптаны, присутствующие в клетках, которые могут расщеплять окислительно-восстановительную линкерную группу путем восстановления; эстеразы; эндосомы или средства, которые могут создавать кислую среду, например, средства, которые обеспечивают значение pH, равное пяти или ниже; ферменты, которые могут гидролизовать или деградировать расщепляемую кислотой линкерную группу путем действия в качестве обычной кислоты, пептидазы (которые могут быть специфичными к субстрату) и фосфатазы.
Расщепляемая линкерная группа, такая как дисульфидная связь, может быть чувствительной к pH. pH сыворотки человека составляет 7,4, в то время как среднее внутриклеточное значение pH является несколько более низким, находясь в диапазоне приблизительно 7,1-7,3. Эндососмы имеют более кислое значение pH в диапазоне 5,5-6,0, и лизосомы имеют еще более кислое значение pH на уровне приблизительно 5,0. Некоторые линкеры имеют расщепляемую линкерную группу, которая расщепляется при предпочтительном значении pH, тем самым, освобождая катионный липид от лиганда внутри клетки, или в желаемом компартменте клетки.
Линкер может включать расщепляемую линкерную группу, которая расщепляется конкретным ферментом. Тип расщепляемой линкерной группы, включенной в линкер, может зависеть от клетки, на которую осуществляют нацеливание. Например, нацеливающий в печень лиганд может быть связан с катионным липидом через линкер, который включает сложноэфирную группу. Клетки печени обогащены эстеразами, и, таким образом, линкер более эффективно расщепляется в клетках печени, чем в типах клеток, которые не обогащены эстеразой. Другие типы клеток, обогащенные эстеразами, включают клетки легкого, коры почки и семенников.
Линкеры, которые содержат пептидные связи, можно использовать при нацеливании на типы клеток, обогащенные пептидазами, такие как клетки печени и синовиоциты.
Как правило, пригодность являющейся кандидатом расщепляемой линкерной группы можно оценивать путем исследования способности расщепляющего агента (или условий) расщеплять являющуюся кандидатом линкерную группу. Также является желательным исследование являющейся кандидатом расщепляемой линкерной группы в отношении способности не поддаваться расщеплению в крови и при контакте с другой не являющейся мишенью тканью. Таким образом, можно определить относительную чувствительность к расщеплению между первым и вторыми условиями, где первые условия выбраны так, чтобы они указывали на расщепление в клетке-мишени, а вторые условия выбраны так, чтобы они указывали на расщепление в других тканях или биологических жидкостях, например, крови или сыворотке. Оценку можно проводить в бесклеточных системах, в клетках, в клеточной культуре, в культуре органа или ткани, или у животных целиком. Может быть пригодным проведение первоначальной оценки в бесклеточных условиях или условиях культивирования и подтверждение посредством дальнейшей оценки у животных целиком. В предпочтительных вариантах осуществления пригодные соединения-кандидаты расщепляются по меньшей мере приблизительно в 2, 4, 10, 20, 30, 40, 50, 60, 70, 80, 90 или приблизительно в 100 раз быстрее в клетке (или в условиях in vitro, выбранных так, чтобы они имитировали внутриклеточные условия) по сравнению с кровью или сывороткой (или в условиях in vitro, выбранных так, чтобы они имитировали внеклеточные условия).
i. Расщепляемые в условиях восстановления-окисления линкерные группы
В одном варианте осуществления расщепляемая линкерная группа представляет собой расщепляемую в условиях восстановления-окисления линкерную группу, которая расщепляется при восстановлении или окислении. Примером расщепляемой в условиях восстановления линкерной группы является дисульфидная линкерная группа (-S-S-). Для определения того, является ли являющаяся кандидатом расщепляемая линкерная группа пригодной "расщепляемой в условиях восстановления линкерной группой", или например является ли она пригодной для применения с конкретной частью i-РНК и конкретным нацеливающим агентом, можно использовать способы, описанные в настоящем описании. Например, кандидата можно оценивать посредством инкубации с дитиотреитолом (DTT), или другим восстановителем с использованием реагентов, известных в данной области, которые имитируют скорость расщепления, которая наблюдается в клетке, например, в клетке-мишени. Кандидатов также можно оценивать в условиях, которые выбраны так, чтобы имитировать условия в крови или сыворотке. В одном варианте осуществления соединения-кандидаты расщепляются не более чем на 10% в крови. В других вариантах осуществления пригодные соединения-кандидаты расщепляются по меньшей мере приблизительно в 2, 4, 10, 20, 30, 40, 50, 60, 70, 80, 90 или приблизительно в 100 раз быстрее в клетке (или в условиях in vitro, выбранных так, чтобы имитировать внутриклеточные условия) по сравнению с кровью (или в условиях in vitro, выбранных так, чтобы они имитировали внеклеточные условия). Скорость расщепления соединений-кандидатов можно определять с использованием стандартных ферментных анализов кинетики в условиях, выбранных так, чтобы они имитировали внутриклеточную среду, и сравнивать с условиями, выбранными так, чтобы они имитировали внеклеточную среду.
ii. Расщепляемые линкерные группы на основе фосфата
В другом варианте осуществления расщепляемый линкер содержит расщепляемую линкерную группу на основе фосфата. Расщепляемая линкерная группа на основе фосфата расщепляется средствами, которые деградируют или гидролизуют фосфатную группу. Примером средства, который расщепляет фосфатные группы в клетках, являются ферменты, такие как фосфатазы, в клетках. Примерами линкерных групп на основе фосфата являются -O-P(O)(ORk)-O-, -O-P(S)(ORk)-O-, -O-P(S)(SRk)-O-, -S-P(O)(ORk)-O-, -O-P(O)(ORk)-S-, -S-P(O)(ORk)-S-, -O-P(S)(ORk)-S-, -S-P(S)(ORk)-O-, -O-P(O)(Rk)-O-, -O-P(S)(Rk)-O-, -S-P(O)(Rk)-O-, -S-P(S)(Rk)-O-, -S-P(O)(Rk)-S-, -O-P(S)(Rk)-S-. Предпочтительными вариантами осуществления являются -O-P(O)(OH)-O-, -O-P(S)(OH)-O-, -O-P(S)(SH)-O-, -S-P(O)(OH)-O-, -O-P(O)(OH)-S-, -S-P(O)(OH)-S-, -O-P(S)(OH)-S-, -S-P(S)(OH)-O-, -O-[P](O)([H])-O-, -O-P(S)(H)-O-, -S-P(O)(H)-O, -S-P(S)(H)-O-, -S-P(O)(H)-S-, -O-P(S)(H)-S-. Предпочтительным вариантом осуществления является -O-P(O)(OH)-O-. Этих кандидатов можно оценивать с использованием способов, аналогичных способам, описанным выше.
iii. Расщепляемые кислотой линкерные группы
В другом варианте осуществления расщепляемый линкер содержит расщепляемую кислотой линкерную группу. Расщепляемая кислотой линкерная группа представляет собой линкерную группу, которая расщепляется в кислых условиях. В предпочтительных вариантах осуществления расщепляемые кислотой линкерные группы расщепляются в кислой среде с pH приблизительно 6,5 или ниже (например, приблизительно 6,0, 5,75, 5,5, 5,25, 5,0 или ниже), или средствами, такими как ферменты, которые могут действовать как обычная кислота. В клетке определенные органеллы с низким значением pH, такие как эндосомы и лизосомы, могут обеспечить условия расщепления для расщепляемых кислотой линкерных групп. Примеры расщепляемых кислотой линкерных групп включают, но не ограничиваются ими, гидразоны, сложные эфиры и сложные эфиры аминокислот. Расщепляемые кислотой группы могут иметь общую формулу -C=NN-, C(O)O или -OC(O). Предпочтительным вариантом осуществления является вариант осуществления, где атом углерода, связанный с кислородом сложного эфира (алкоксигруппа), представляет собой арильную группу, замещенную алкильную группу или третичную алкильную группу, такую как диметилпентил или трет-бутил. Эти кандидаты можно оценивать с использованием способов, аналогичных способам, описанным выше.
iv. Линкерные группы на основе сложного эфира
В другом варианте осуществления расщепляемый линкер содержит расщепляемую линкерную группу на основе сложного эфира. Расщепляемая линкерная группа на основе сложного эфира расщепляется ферментами, такими как эстеразы и амидазы, в клетках. Примеры расщепляемых линкерных групп на основе сложного эфира включают, но не ограничиваются ими, сложные эфиры алкиленовой, алкениленой и алкиниленовой групп. Сложноэфирные расщепляемые линкерные группы имеют общую формулу -C(O)O- или -OC(O)-. Эти кандидаты можно оценивать с использованием способов, аналогичных способам, описанным выше.
v. Уходящие группы на основе пептидов
В другом варианте осуществления расщепляемый линкер содержит расщепляемую линкерную группу на основе пептида. Расщепляемая линкерная группа на основе пептида расщепляется ферментами, такими как пептидазы и протеазы, в клетках. Линкерные группы на основе пептидов представляют собой пептидные связи, образованные между аминокислотами, с образованием олигопептидов (например, дипептиды, трипептиды и т.д.) и полипептидов. Расщепляемые группы на основе пептидов не включают амидную группу (-C(O)NH-). Амидная группа может быть образована между любым алкиленом, алкениленом или алкиниленом. Пептидная связь представляет собой определенный тип амидной связи, образованный между аминокислотами, с образованием пептидов и белков. Расщепляемая группа на основе пептида обычно ограничивается пептидной связью (т.е. амидная связь), образованной между аминокислотами, с образованием пептидов и белков, и она не включает полную амидную функциональную группу. Расщепляемые линкерные группы на основе пептида имеют общую формулу -NHCHRAC(O)NHCHRBC(O)-, где RA и RB представляют собой группы R двух соседних аминокислот. Эти кандидаты можно оценивать с использованием способов, аналогичных способам, описанным выше.
В одном варианте осуществления i-РНК по изобретению конъюгирована с углеводом через линкер. Неограничивающие примеры конъюгатов i-РНК с углеводами с линкерами композиций и способов по изобретению включают, но не ограничиваются ими,

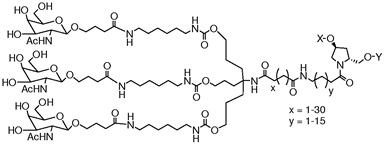

формула XXVI,

формула XXVII,

формула XXVIII,

формула XXIX и

формула XXX,
где один из X или Y представляет собой олигонуклеотид, другой представляет собой водород.
В определенных вариантах осуществления композиций и способов по изобретению, лиганд представляет собой одно или несколько производных "GalNAc" (N-ацетилгалактозамин), связанных через двухвалентный или трехвалентный разветвленный линкер.
В одном варианте осуществления дцРНК по изобретению конъюгирована с двухвалентным или трехвалентным разветвленным линкером, выбранным из группы структур, представленных в любой из формул формулы (XXXI)-(XXXIV):
где:
q2A, q2B, q3A, q3B, q4A, q4B, q5A, q5B и q5C в каждом случае независимо равно 0-20 и где повторяющийся элемент может быть одинаковым или может отличаться;
P2A, P2B, P3A, P3B, P4A, P4B, P5A, P5B, P5C, T2A, T2B, T3A, T3B, T4A, T4B, T5A, T5B, T5C в каждом случае независимо отсутствует, представляет собой CO, NH, O, S, OC(O), NHC(O), CH2, CH2NH или CH2O;
Q2A, Q2B, Q3A, Q3B, Q4A, Q4B, Q5A, Q5B, Q5C в каждом случае независимо отсутствует, представляет собой алкилен, замещенный алкилен, где, где один или несколько метиленов могут прерываться или завершаться одним или несколькими из O, S, S(O), SO2, N(RN), C(R')≡C(R"), C≡C или C(O);
R2A, R2B, R3A, R3B, R4A, R4B, R5A, R5B, R5C в каждом случае независимо отсутствует, представляет собой NH, O, S, CH2, C(O)O, C(O)NH, NHCH(Ra)C(O), -C(O)-CH(Ra)-NH-, CO, CH=N-O,




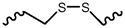
L2A, L2B, L3A, L3B, L4A, L4B, L5A, L5B, L5C представляют собой лиганд; т.е. каждый из них независимо в каждом случае представляет собой моносахарид (такой как GalNAc), дисахарид, трисахарид, тетрасахарид, олигосахарид или полисахарид; и Ra представляет собой H или боковую цепь аминокислоты. Тривалентные производные GalNAc для конъюгации особенно пригодны для применения со средствами РНК-i для ингибирования экспрессии гена-мишени, такие как производные формулы (XXXV):

формула XXXV,
где L5A, L5B и L5C представляют собой моносахарид, такой как производное GalNAc.
Примеры пригодных двухвалентных и трехвалентных разветвленных линкерных групп, конъюгированных с производными GalNAc, включают, но не ограничиваются ими, структуры, приведенные выше в качестве формул II, VII, XI, X и XIII.
Репрезентативные патенты США, в которых описано получение конъюгатов РНК, включают, но не ограничиваются ими, патенты США № 4828979, 4948882, 5218105, 5525465, 5541313, 5545730, 5552538, 5578717, 5580731, 5591584, 5109124, 5118802, 5138045, 5414077, 5486603, 5512439, 5578718, 5608046, 4587044, 4605735, 4667025, 4762779, 4789737, 4824941, 4835263, 4876335, 4904582, 4958013, 5082830, 5112963, 5214136, 5082830, 5112963, 5214136, 5245022, 5254469, 5258506, 5262536, 5272250, 5292873, 5317098, 5371241, 5391723, 5416203, 5451463, 5510475, 5512667, 5514785, 5565552, 5567810, 5574142, 5585481, 5587371, 5595726, 5597696, 5599923, 5599928 и 5688941, 6294664, 6320017, 6576752, 6783931, 6900297, 7037646, 8106022, полное содержание каждого из которых включено в настоящее описание в качестве ссылки.
Не является необходимым для всех положений в данном соединении, чтобы они были единообразно модифицированными, и в действительности более одной из упомянутых выше модификаций может быть включено в одно соединение или даже в один нуклеозид в i-РНК. Настоящее изобретение также включает соединения i-РНК, которые являются химерными соединениями.
"Химерные" соединения i-РНК или "химеры" в контексте настоящего изобретения представляют собой соединения i-РНК, предпочтительно дцРНК, которые содержат две или более химически обособленных области, каждая из которых состоит по меньшей мере из одного мономерного элемента, т.е. нуклеотида в случае соединения дцРНК. Эти i-РНК, как правило, содержат по меньшей мере одну область, где РНК модифицирована так, чтобы i-РНК сообщалась увеличенная устойчивость к деградации нуклеазами, увеличенный клеточный захват и/или увеличенная аффинность связывания с нуклеиновой кислотой-мишенью. Дополнительная область i-РНК может служить в качестве субстрата для ферментов, способных расщеплять гибриды РНК:ДНК или РНК:РНК. В качестве примера, РНКаза H представляет собой клеточную эндонуклеазу, которая расщепляет цепь РНК дуплекса РНК:ДНК. Активация РНКазы H, таким образом, приводит к расщеплению РНК-мишени, тем самым, значительно повышая эффективность ингибирования посредством i-РНК экспрессии генов. Следовательно, сравнимые результаты часто можно получить с помощью более коротких i-РНК, когда используют химерные дцРНК, по сравнению с фосфоротиоатдезокси-дцРНК, гибридизующимися с той же областью-мишенью. Расщепление РНК-мишени можно стандартным образом обнаруживать с помощью гель-электрофореза и, если необходимо, связанными с ним способами гибридизации нуклеиновых кислот, известными в данной области.
В определенных случаях РНК в i-РНК может быть модифицировано не являющейся лигандом группой. Ряд не являющихся лигандом молекул конъюгируют с i-РНК для повышения активности, распределения в клетки и клеточного захвата i-РНК, и методики проведения такой конъюгации доступны в научной литературе. Такие не являющиеся лигандом части включают липидные части, такие как холестерин (Kubo, T. et al., Biochem. Biophys. Res. Comm., 2007, 365(1):54-61; Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86:6553), холевая кислота (Manoharan et al., Bioorg. Med. Chem. Lett., 1994, 4:1053), простой тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N. Y. Acad. Sci., 1992, 660:306; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3:2765), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20:533), алифатическая цепь, например, додекандиольные или ундецильные остатки (Saison-Behmoaras et al., EMBO J., 1991, 10:111; Kabanov et al., FEBS Lett., 1990, 259:327; Svinarchuk et al., Biochimie, 1993, 75:49), фосфолипид, например, дигексадецил-rac-глицерин или триэтиламмоний 1,2-ди-O-гексадецил-rac-глицеро-3-H-фосфонат (Manoharan et al., Tetrahedron Lett., 1995, 36:3651; Shea et al., Nucl. Acids Res., 1990, 18:3777), цепь полиамина или полиэтиленгликоля (Manoharan et al., Nucleosides & Nucleotides, 1995, 14:969), или адамантануксусная кислота (Manoharan et al., Tetrahedron Lett., 1995, 36:3651), пальмитильная часть (Mishra et al., Biochim. Biophys. Acta, 1995, 1264:229) или октадециламин или гексиламино-карбонилоксихолестериновая часть (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277:923). Репрезентативные патенты США, в которых описано получение таких конъюгатов РНК, приведены выше. Типичные протоколы конъюгации вовлекают синтез РНК, содержащих аминолинкер в одном или нескольких положениях последовательности. Затем аминогруппу подвергают реакции с молекулой, конъюгированной с использованием подходящих реагентов для связывания или активирующих реагентов. Реакцию конъюгации можно проводить либо с помощью РНК, все еще связанной с твердой подложкой, либо после отщепления РНК в фазе раствора. Очистка конъюгата РНК с помощью ВЭЖХ, как правило, обеспечивает чистый конъюгат.
IV. Доставка i-РНК по изобретению
Доставку i-РНК по изобретению в клетку, например, клетку индивидуума, такого как человек (например, человек, нуждающийся в этом, такой как индивидуум, имеющий геморрагическое нарушение) можно осуществлять рядом способов. Например, доставку можно проводить путем контактирования клетки с i-РНК по изобретению либо in vitro, либо in vivo. Доставку in vivo также можно проводить прямо посредством введения композиции, содержащей i-РНК, например, дцРНК, индивидууму. Альтернативно доставку in vivo можно проводить непрямо посредством введения одного или нескольких векторов, которые кодируют и контролируют экспрессию i-РНК. Эти альтернативы рассмотрены ниже.
Как правило, для применения с i-РНК по изобретению можно адаптировать любой способ доставки молекулы нуклеиновой кислоты (in vitro или in vivo) (смотрите, например, Akhtar S. and Julian RL. (1992) Trends Cell. Biol. 2(5): 139-144 и WO94/02595, которые включены в настоящее описание в качестве ссылок в полном объеме). Для доставки in vivo факторы, учитываемые для доставки молекулы i-РНК, включают, например, биологическую стабильность доставляемой молекулы, предупреждение неспецифических эффектов и накопление доставляемой молекулы в ткани-мишени. Неспецифические эффекты i-РНК можно минимизировать посредством локального введения, например, посредством прямой инъекции или имплантации в ткань или мкстного введения препарата. Локальное введение в подвергаемую лечению область максимизирует локальную концентрацию средства, ограничивает воздействие средства на ткани организма, которые в ином случае повреждались бы средством или которые могли бы деградировать средство, и позволяет введение более низкой общей дозы молекулы i-РНК. В нескольких исследованиях был показан успешный нокдаун продуктов генов при локальном введении i-РНК. Например, было показано, что как внутриглазаная доставка дцРНК к VEGF посредством инъекции в стекловидное тело у яванских макаков (Tolentino, MJ., et al. (2004) Retina 24: 132-138), так и субретинальных инъекций у мышей (Reich, SJ., et al. (2003) Mol. Vis. 9:210-216) препятствуют неоваскуляризации в экспериментальной модели связанной со старением дегенерации желтого пятна. Кроме того, прямая внутриопухолевая инъекция дцРНК у мышей уменьшает объем опухоли (Pille, J., et al. (2005) Mol. Ther. 11: 267-274) и может продлевать выживание у мышей, имеющих опухоль (Kim, WJ., et al. (2006) Mol. Ther. 14:343-350; Li, S., et al. (2007) Mol. Ther. 15:515-523). РНК-интерференция также продемонстрировала успешность локальной доставки в ЦНС посредством прямой инъекции (Dorn, G., et al. (2004) Nucleic Acids 32:e49; Tan, PH., et al. (2005) Gene Ther. 12:59-66; Makimura, H., et al. (2002) BMC Neurosci. 3: 18; Shishkina, GT., et al. (2004) Neuroscience 129:521-528; Thakker, ER., et al. (2004) Proc. Natl. Acad. Sci. U.S.A. 101: 17270-17275; Akaneya, Y., et al. (2005) J. Neurophysiol. 93:594-602) и в легкие посредством интраназального введения (Howard, KA., et al. (2006) Mol. Ther. 14:476-484; Zhang, X., et al. (2004) J. Biol. Chem. 279: 10677-10684; Bitko, V., et al. (2005) Nat. Med. 11:50-55). Для системного введения i-РНК для лечения заболевания РНК можно модифицировать или альтернативно доставлять с использованием системы для доставки лекарственного средства; оба способа действуют, предотвращая быструю деградацию дцРНК посредством эндо- и экзонуклеаз in vivo. Модификация РНК или фармацевтического носителя также может позволить нацеливание композиции i-РНК на ткань-мишень и избежать направленных не на мишень эффектов. Молекулы i-РНК можно модифицировать химической конъюгацией с липофильными группами, такими как холестерин, для усиления клеточного захвата и предупреждения деградации. Например, i-РНК, направленную против ApoB, конъюгированного с липофильной холестериновой частью, инъецировали системно мышам, и это приводило к нокдауну мРНК apoB как в печени, так и в тощей кишке (Soutschek, J., et al. (2004) Nature 432: 173-178). Было показано, что конъюгация i-РНК с аптамером ингибирует рост опухоли и опосредует регрессию опухоли в модели рака предстательной железы на мышах (McNamara, JO., et al. (2006) Nat. Biotechnol. 24: 1005-1015). В альтернативном варианте осуществления i-РНК можно доставлять с использованием систем для доставки лекарственных средств, таких как наночастица, дендример, полимер, липосомы или катионная система для доставки. Положительно заряженные катионные системы для доставки облегчают связывание молекулы i-РНК (отрицательно заряженной) и также усиливают взаимодействия на отрицательно заряженной клеточной мембране, чтобы обеспечить эффективный захват i-РНК клеткой. Катионные липиды, дендримеры или полимеры могут быть либо связаны с i-РНК, либо индуцированы к образованию везикулы или мицеллы (смотрите, например, Kim SH., et al. (2008) Journal of Controlled Release 129(2): 107-116), которая содержит в себе i-РНК. Образование везикул или мицелл, кроме того, препятствует деградации i-РНК при системном введении. Способы получения и введения комплексов катионная система-i-РНК также входят в пределы способностей специалиста в данной области (смотрите, например, Sorensen, DR., et al. (2003) J. Mol. Biol 327:761-766; Verma, UN., et al. (2003) Clin. Cancer Res. 9: 1291-1300; Arnold, AS et al. (2007) J. Hypertens. 25: 197-205, которые включены в настоящее описание в качестве ссылок в полном объеме). Некоторые неограничивающие примеры систем для доставки лекарственного средства, пригодных для системной доставки i-РНК, включают DOTAP (Sorensen, DR., et al. (2003), выше; Verma, UN., et al. (2003), выше), олигофектамин, "твердые липидные частицы с нуклеиновой кислотой" (Zimmermann, TS., et al. (2006) Nature 441: 111-114), кардиолипин (Chien, PY., et al. (2005) Cancer Gene Ther. 12:321-328; Pal, A., et al. (2005) Int J. Oncol. 26: 1087-1091), полиэтиленимин (Bonnet ME., et al. (2008) Pharm. Res. Aug 16, Epub в преддверии печати; Aigner, A. (2006) J. Biomed. Biotechnol. 71659), пептиды Arg-Gly-Asp (ROD) (Liu, S. (2006) Mol. Pharm. 3:472-487) и полиамидоамины (Tomalia, DA., et al. (2007) Biochem. Soc. Trans. 35:61-67; Yoo, H., et al. (1999) Pharm. Res. 16: 1799-1804). В некоторых вариантах осуществления i-РНК образует комплекс с циклодекстрином для системного введения. Способы введения и фармацевтических композиций i-РНК и циклодекстринов могут быть найдены в патенте США № 7427605, который включен в настоящее описание в качестве ссылки в полном объеме.
A. Кодируемые вектором i-РНК по изобретению
i-РНК, нацеленные на ген серпина c1, могут экспрессироваться с элементов транскрипции, встроенных в ДНК- или РНК-векторы (смотрите, например, Couture, A, et al., TIG. (1996), 12:5-10; Skillern, A., et al., международная публикация PCT № WO 00/22113, Conrad, международная публикация PCT № WO 00/22114, и Conrad, патент США № 6054299). Экспрессия может быть временной (порядка от нескольких часов до нескольких недель) или длительной (от недель до месяцев или дольше), в зависимости от конкретной используемой конструкции и типа ткани-мишени или клетки-мишени. Эти трансгены можно вводить в качестве линейной конструкции, кольцевой плазмиды или вирусного вектора, которые могут представлять собой встраивающийся или не встраивающийся вектор. Трансген также можно конструировать так, чтобы позволить ему наследоваться в качестве внехромосомной плазмиды (Gassmann, et al., Proc. Natl. Acad. Sci. USA (1995) 92: 1292).
Отдельная цепь или цепи i-РНК могут транскрибироваться с промотора на экспрессирующем векторе. Когда две отдельных цепи экспрессируются с образованием, например, дцРНК, два отдельных экспрессирующих вектора можно вводить совместно (например, посредством трансфекции или инфекции) в клетку-мишень. Альтернативно каждая отдельная цепь дцРНК может транскрибироваться промоторами, оба из которых расположены на одной и той же экспрессирующей плазмиде. В одном варианте осуществления дцРНК экспрессируется в качестве полинуклеотидов с инвертированными повторами, связанных линкерной полинуклеотидной последовательностью, так что дцРНК имеет структуру стебля и петли.
Экспрессирующие векторы для i-РНК, как правило, представляют собой ДНК-плазмиды или вирусные векторы. Экспрессирующие векторы, совместимые с эукариотическими клетками, предпочтительно экспрессирующие векторы, совместимые с клетками позвоночных, можно использовать для получения рекомбинантных конструкций для экспрессии i-РНК, как описано в настоящем описании. Экспрессирующие векторы эукариотических клеток хорошо известны в данной области и доступны из ряда коммерческих источников. Как правило, предусматриваются такие векторы, содержащие удобные участки рестрикции для встраивания желаемого сегмента нуклеиновой кислоты. Доставка векторов для экспрессии i-РНК может быть системной, такой как внутривенное или внутримышечное введение, путем введения в клетки-мишени, эксплантированные из пациента с последующим введение пациенту, или с помощью любых других средств, которые позволяют введение в желаемую клетку-мишень.
Экспрессирующие плазмиды для i-РНК можно трансфицировать в клетки-мишени в качестве комплекса с катионными липидными носителями (например, олигофектамин) или некатионными носителями на основе липидов (например, Transit-TKO™). Также изобретение предусматривает множественные трансфекции липидов для опосредуемого i-РНК нокдауна, нацеленного на различные области РНК-мишени, в течение периода, составляющего неделю или более. Мониторинг успешного введения векторов в клетки-хозяева можно проводить с использованием различных известных способов. Например, сигнал в случае временной трансфекции может осуществляться с помощью репортера, такого как флуоресцентный маркер, такой как зеленый флуоресцентный белок (GFP). Стабильную трансфекцию клеток ex vivo можно обеспечивать с использованием маркеров, которые обеспечивают трансфицированной клетке устойчивость к конкретным факторам окружающей среды (например, антибиотики и лекарственные средства), такую как устойчивость к гигромицину B.
Вирусные векторные системы, которые можно использовать в способах и композициях, описанных в настоящем описании, включают, но не ограничиваются ими, (a) аденовирусные векторы; (b) ретровирусные векторы, включая, но не ограничиваясь ими, лентивирусные векторы, вирус лейкоза мышей Молони и т.д.; (c) векторы на основе аденоассоциированных вирусов; (d) векторы на основе вирус простого герпеса; (e) векторы на основе SV40; (f) векторы на основе вируса полиомы; (g) векторы на основе вируса папилломы; (h) векторы на основе пикорнавирусов; (i) векторы на основе поксвирусов, такие как векторы на основе ортопоксвирусов, например, вируса осповакцины, или авипоксвирусов, например, вирусов оспы канареек и вируса оспы домашней птицы; и (j) зависимый от помощника или аденовирус с усеченным геномом. Также могут быть преимущественными вирусы с дефектом репликации. Различные векторы встраиваются или не встраиваются в геном клеток. Если желательно, конструкции могут включать вирусные последовательности для трансфекции. Альтернативно конструкция может быть включена в векторы, способные к эписомальной репликации, например, векторы EPV и EBV. Конструкции для рекомбинантной экспрессии i-РНК, как правило, требуют регуляторных элементов, например, промоторов, энхансеров и т.д. для обеспечения экспрессии i-РНК в клетках-мишенях. Другие аспекты, учитываемые для векторов и конструкции, дополнительно описаны ниже.
Векторы, пригодные для доставки i-РНК, включают регуляторные элементы (промотор, энхансер и т.д.), достаточные для экспрессии i-РНК в желаемой клетке-хозяине или ткани-хозяине. Регуляторные элементы могут быть выбраны для обеспечения либо конститутивной, либо регулируемой/индуцибельной экспрессии.
Экспрессию i-РНК можно точно регулировать, например, с использованием индуцибельной регуляторной последовательности, которая является чувствительной к определенным физиологическим регуляторам, например, циркулирующим уровням глюкозы или гормонам (Docherty et al., 1994, FASEB J. 8:20-24). Такие индуцибельные экспрессирующие системы, пригодные для контроля экспрессии дцРНК в клетках или у млекопитающих, включают, например, регуляцию экдизоном, эстрогеном, прогестероном, тетрациклином, химическими индукторами димеризации и изопропил-бета-D1-тиогалактопиранозид (IPTG). Специалист в данной области способен выбрать подходящую регуляторную/промоторную последовательность, исходя из предполагаемого применения трансгена i-РНК.
Можно использовать вирусные векторы, которые содержат последовательности нуклеиновых кислот, кодирующие i-РНК. Например, можно использовать ретровирусный вектор (смотрите Miller et al., Meth. Enzymol. 217:581-599 (1993)). Эти ретровирусные векторы содержат компоненты, необходимые для правильного упаковывания генома вируса и встраивания в ДНК клетки-хозяина. Последовательности нуклеиновых кислот, кодирующие i-РНК, клонируют в один или несколько векторов, которые облегчают доставку нуклеиновой кислоты пациенту. Более подробное описание ретровирусных векторов может быть найдено, например, в Boesen et al., Biotherapy 6:291-302 (1994), где описано применение ретровирусного вектора для доставки гена mdr1 в гемопоэтические стволовые клетки для получения стволовых клеток, более устойчивых к химиотерапии. Другими источниками, иллюстрирующими применение ретровирусных векторов для генной терапии, являются: Clowes et al., J. Clin. Invest. 93:644-651 (1994); Kiem et al., Blood 83: 1467-1473 (1994); Salmons and Gunzberg, Human Gene Therapy 4: 129-141 (1993); и Grossman and Wilson, Curr. Opin., Genetics and Devel. 3: 110-114 (1993). Лентивирусные векторы, предусматриваемые для применения, включают, например, векторы на основе ВИЧ, описанные в патентах США № 6143520, 5665557 и 5981276, которые включены в настоящее описание в качестве ссылок.
Также для доставки i-РНК по изобретению предусматриваются аденовирусы. Аденовирусы являются особенно привлекательными носителями, например, для доставки генов в эпителий дыхательных путей. Аденовирусы естественным образом инфицируют дыхательный эпителий, где они вызывают мягкое заболевание. Другими мишенями для систем для доставки на основе аденовируса являются печень, центральная нервная система, эндотелиальные клетки и мышцы. Аденовирусы имеют преимущество, состоящее в том, что они способны инфицировать неделящиеся клетки. В Kozarsky and Wilson, Current Opinion in Genetics and Development 3:499-503 (1993) представлен обзор генной терапии на основе аденовируса. Bout et al., Human Gene Therapy 5:3-10 (1994) продемонстрировали применение аденовирусных векторов для переноса гена в эпителий дыхательных путей макаков-резус. Другие примеры применения аденовирусов в генной терапии могут быть найдены в Rosenfeld et al., Science 252:431-434 (1991); Rosenfeld et al., Cell 68: 143-155 (1992); Mastrangeli et al., J. Clin. Invest. 91:225-234 (1993); публикация PCT WO94/12649; и Wang, et al., Gene Therapy 2:775-783 (1995). Пригодный AV-вектор для экспрессии i-РНК по изобретению, способ конструирования рекомбинантного AV-вектора и способ доставки вектора в клетки-мишени, описаны в Xia H et al. (2002), Nat. Biotech. 20: 1006-1010.
Векторы на основе аденоассоциированного вируса (AAV) также можно использовать для доставки i-РНК по изобретению (Walsh et al., Proc. Soc. Exp. Biol. Med. 204:289-300 (1993); патент США № 5436146). В одном варианте осуществления i-РНК можно экспрессировать в качестве двух отдельных комплементарных одноцепочечных молекул РНК из рекомбинантного AAV-вектора, имеющего, например, РНК-промоторы либо U6, либо H1, или промотор цитомегаловируса (CMV). Пригодные AAV-векторы для экспрессии дцРНК по изобретению, способы конструирования рекомбинантного AV-вектора и способы доставки векторов в клетки-мишени, описаны в Samulski R et al. (1987), J. Virol. 61: 3096-3101; Fisher K J et al. (1996), J. Virol, 70: 520-532; Samulski R et al. (1989), J. Virol. 63: 3822-3826; патенте США № 5252479; патенте США № 5139941; международной патентной заявке № WO 94/13788; и международной патентной заявке № WO 93/24641, полное содержание каждой из которых включено в настоящее описание в качестве ссылки.
Другим вирусным вектором, пригодным для доставки i-РНК по изобретению, является поксвирус, такой как вирус осповакцины, например ослабленный вирус осповакцины, такой как модифицированный вирус Анкара (MVA) или NYVAC, авипоксвирус, такой как вирус оспы домашней птицы или вирус оспы канареек.
Тропизм вирусных векторов может быть модифицирован посредством псевдотипирования векторов с белками оболочки или другими поверхностными антигенами из других вирусов, или посредством замены различных белков капсида вируса, в зависимости от ситуации. Например, лентивирусные векторы можно псевдотипировать с поверхностными белками из вируса везикулярного стоматита (VSV), бешенства, Эбола, Мокола и т.п. AAV-векторы можно получать для нацеливания на различные клетки с помощью модификации способами инженерии векторов для экспрессии различных серотипов капсидных белков; смотрите, например, Rabinowitz J E et al. (2002), J Virol 76:791-801, полное содержание которой включено в настоящее описание в качестве ссылки.
Фармацевтический препарат вектора может включать вектор в приемлемом разбавителе, или он может включать матрикс с замедленным высвобождением, в который погружен носитель для доставки гена. Альтернативно, когда полный вектор для доставки можно получить интактным из рекомбинантных клеток, например, ретровирусные векторы, фармацевтический препарат может включать одну или несколько клеток, которые продуцируют систему для доставки генов.
V. Фармацевтические композиции по изобретению
Настоящее изобретение также относится к фармацевтическим композициям и составам, которые включают i-РНК по изобретению. В одном варианте осуществления в объеме настоящего изобретения предусматриваются фармацевтические композиции, содержащие i-РНК, как описано в настоящем описании, и фармацевтически приемлемый носитель. Фармацевтические композиции, содержащие i-РНК, являются пригодными для лечения заболевания или нарушения, ассоциированных с экспрессией или активностью гена серпина c1, например, геморрагического нарушения. Такие фармацевтические композиции составляют исходя из способа доставки. Одним примером являются композиции, которые составлены для системного введения посредством парентеральной доставки, например, посредством внутривенной (в/в) доставки. Другим примером являются композиции, которые составлены для прямой доставки в паренхиму головного мозга, например, путем инфузии в головной мозг, например, путем непрерывной инфузии с помощью насоса. Фармацевтические композиции по изобретению можно вводить в дозировках, достаточных для ингибирования экспрессии гена серпина c1. Как правило, пригодная доза i-РНК по изобретению находится в диапазоне от приблизительно 0,001 до приблизительно 200,0 миллиграмм на килограмм массы тела реципиента в сутки, как правило, в диапазоне приблизительно от 1 до 50 мг на килограмм массы тела в сутки. Например, дцРНК можно вводить в дозе приблизительно 0,01 мг/кг, приблизительно 0,05 мг/кг, приблизительно 0,5 мг/кг, приблизительно 1 мг/кг, приблизительно 1,5 мг/кг, приблизительно 2 мг/кг, приблизительно 3 мг/кг, приблизительно 10 мг/кг, приблизительно 20 мг/кг, приблизительно 30 мг/кг, приблизительно 40 мг/кг или приблизительно 50 мг/кг на единичную дозу.
Например, дцРНК можно вводить в дозе приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9 или приблизительно 10 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
В другом варианте осуществления дцРНК вводят в дозе от приблизительно 0,1 до приблизительно 50 мг/кг, от приблизительно 0,25 до приблизительно 50 мг/кг, от приблизительно 0,5 до приблизительно 50 мг/кг, от приблизительно 0,75 до приблизительно 50 мг/кг, от приблизительно 1 до приблизительно 50 мг/мг, от приблизительно 1,5 до приблизительно 50 мг/кг, от приблизительно 2 до приблизительно 50 мг/кг, от приблизительно 2,5 до приблизительно 50 мг/кг, от приблизительно 3 до приблизительно 50 мг/кг, от приблизительно 3,5 до приблизительно 50 мг/кг, от приблизительно 4 до приблизительно 50 мг/кг, от приблизительно 4,5 до приблизительно 50 мг/кг, от приблизительно 5 до приблизительно 50 мг/кг, от приблизительно 7,5 до приблизительно 50 мг/кг, от приблизительно 10 до приблизительно 50 мг/кг, от приблизительно 15 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 30 до приблизительно 50 мг/кг, от приблизительно 35 до приблизительно 50 мг/кг, от приблизительно 40 до приблизительно 50 мг/кг, от приблизительно 45 до приблизительно 50 мг/кг, от приблизительно 0,1 до приблизительно 45 мг/кг, от приблизительно 0,25 до приблизительно 45 мг/кг, от приблизительно 0,5 до приблизительно 45 мг/кг, от приблизительно 0,75 до приблизительно 45 мг/кг, от приблизительно 1 до приблизительно 45 мг/мг, от приблизительно 1,5 до приблизительно 45 мг/кг, от приблизительно 2 до приблизительно 45 мг/кг, от приблизительно 2,5 до приблизительно 45 мг/кг, от приблизительно 3 до приблизительно 45 мг/кг, от приблизительно 3,5 до приблизительно 45 мг/кг, от приблизительно 4 до приблизительно 45 мг/кг, от приблизительно 4,5 до приблизительно 45 мг/кг, от приблизительно 5 до приблизительно 45 мг/кг, от приблизительно 7,5 до приблизительно 45 мг/кг, от приблизительно 10 до приблизительно 45 мг/кг, от приблизительно 15 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 30 до приблизительно 45 мг/кг, от приблизительно 35 до приблизительно 45 мг/кг, от приблизительно 40 до приблизительно 45 мг/кг, от приблизительно 0,1 до приблизительно 40 мг/кг, от приблизительно 0,25 до приблизительно 40 мг/кг, от приблизительно 0,5 до приблизительно 40 мг/кг, от приблизительно 0,75 до приблизительно 40 мг/кг, от приблизительно 1 до приблизительно 40 мг/мг, от приблизительно 1,5 до приблизительно 40 мг/кг, от приблизительно 2 до приблизительно 40 мг/кг, от приблизительно 2,5 до приблизительно 40 мг/кг, от приблизительно 3 до приблизительно 40 мг/кг, от приблизительно 3,5 до приблизительно 40 мг/кг, от приблизительно 4 до приблизительно 40 мг/кг, от приблизительно 4,5 до приблизительно 40 мг/кг, от приблизительно 5 до приблизительно 40 мг/кг, от приблизительно 7,5 до приблизительно 40 мг/кг, от приблизительно 10 до приблизительно 40 мг/кг, от приблизительно 15 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 30 до приблизительно 40 мг/кг, от приблизительно 35 до приблизительно 40 мг/кг, от приблизительно 0,1 до приблизительно 30 мг/кг, от приблизительно 0,25 до приблизительно 30 мг/кг, от приблизительно 0,5 до приблизительно 30 мг/кг, от приблизительно 0,75 до приблизительно 30 мг/кг, от приблизительно 1 до приблизительно 30 мг/мг, от приблизительно 1,5 до приблизительно 30 мг/кг, от приблизительно 2 до приблизительно 30 мг/кг, от приблизительно 2,5 до приблизительно 30 мг/кг, от приблизительно 3 до приблизительно 30 мг/кг, от приблизительно 3,5 до приблизительно 30 мг/кг, от приблизительно 4 до приблизительно 30 мг/кг, от приблизительно 4,5 до приблизительно 30 мг/кг, от приблизительно 5 до приблизительно 30 мг/кг, от приблизительно 7,5 до приблизительно 30 мг/кг, от приблизительно 10 до приблизительно 30 мг/кг, от приблизительно 15 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 25 до приблизительно 30 мг/кг, от приблизительно 0,1 до приблизительно 20 мг/кг, от приблизительно 0,25 до приблизительно 20 мг/кг, от приблизительно 0,5 до приблизительно 20 мг/кг, от приблизительно 0,75 до приблизительно 20 мг/кг, от приблизительно 1 до приблизительно 20 мг/мг, от приблизительно 1,5 до приблизительно 20 мг/кг, от приблизительно 2 до приблизительно 20 мг/кг, от приблизительно 2,5 до приблизительно 20 мг/кг, от приблизительно 3 до приблизительно 20 мг/кг, от приблизительно 3,5 до приблизительно 20 мг/кг, от приблизительно 4 до приблизительно 20 мг/кг, от приблизительно 4,5 до приблизительно 20 мг/кг, от приблизительно 5 до приблизительно 20 мг/кг, от приблизительно 7,5 до приблизительно 20 мг/кг, от приблизительно 10 до приблизительно 20 мг/кг или от приблизительно 15 до приблизительно 20 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Например, дцРНК можно вводить в дозе приблизительно 0,01, 0,02, 0,03, 0,04, 0,05, 0,06, 0,07, 0,08, 0,09, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9 или приблизительно 10 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
В другом варианте осуществления дцРНК вводят в дозе от приблизительно 0,5 до приблизительно 50 мг/кг, от приблизительно 0,75 до приблизительно 50 мг/кг, от приблизительно 1 до приблизительно 50 мг/мг, от приблизительно 1,5 до приблизительно 50 мг/кг, от приблизительно 2 до приблизительно 50 мг/кг, от приблизительно 2,5 до приблизительно 50 мг/кг, от приблизительно 3 до приблизительно 50 мг/кг, от приблизительно 3,5 до приблизительно 50 мг/кг, от приблизительно 4 до приблизительно 50 мг/кг, от приблизительно 4,5 до приблизительно 50 мг/кг, от приблизительно 5 до приблизительно 50 мг/кг, от приблизительно 7,5 до приблизительно 50 мг/кг, от приблизительно 10 до приблизительно 50 мг/кг, от приблизительно 15 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 30 до приблизительно 50 мг/кг, от приблизительно 35 до приблизительно 50 мг/кг, от приблизительно 40 до приблизительно 50 мг/кг, от приблизительно 45 до приблизительно 50 мг/кг, от приблизительно 0,5 до приблизительно 45 мг/кг, от приблизительно 0,75 до приблизительно 45 мг/кг, от приблизительно 1 до приблизительно 45 мг/мг, от приблизительно 1,5 до приблизительно 45 мг/кг, от приблизительно 2 до приблизительно 45 мг/кг, от приблизительно 2,5 до приблизительно 45 мг/кг, от приблизительно 3 до приблизительно 45 мг/кг, от приблизительно 3,5 до приблизительно 45 мг/кг, от приблизительно 4 до приблизительно 45 мг/кг, от приблизительно 4,5 до приблизительно 45 мг/кг, от приблизительно 5 до приблизительно 45 мг/кг, от приблизительно 7,5 до приблизительно 45 мг/кг, от приблизительно 10 до приблизительно 45 мг/кг, от приблизительно 15 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 30 до приблизительно 45 мг/кг, от приблизительно 35 до приблизительно 45 мг/кг, от приблизительно 40 до приблизительно 45 мг/кг, от приблизительно 0,5 до приблизительно 40 мг/кг, от приблизительно 0,75 до приблизительно 40 мг/кг, от приблизительно 1 до приблизительно 40 мг/мг, от приблизительно 1,5 до приблизительно 40 мг/кг, от приблизительно 2 до приблизительно 40 мг/кг, от приблизительно 2,5 до приблизительно 40 мг/кг, от приблизительно 3 до приблизительно 40 мг/кг, от приблизительно 3,5 до приблизительно 40 мг/кг, от приблизительно 4 до приблизительно 40 мг/кг, от приблизительно 4,5 до приблизительно 40 мг/кг, от приблизительно 5 до приблизительно 40 мг/кг, от приблизительно 7,5 до приблизительно 40 мг/кг, от приблизительно 10 до приблизительно 40 мг/кг, от приблизительно 15 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 30 до приблизительно 40 мг/кг, от приблизительно 35 до приблизительно 40 мг/кг, от приблизительно 0,5 до приблизительно 30 мг/кг, от приблизительно 0,75 до приблизительно 30 мг/кг, от приблизительно 1 до приблизительно 30 мг/мг, от приблизительно 1,5 до приблизительно 30 мг/кг, от приблизительно 2 до приблизительно 30 мг/кг, от приблизительно 2,5 до приблизительно 30 мг/кг, от приблизительно 3 до приблизительно 30 мг/кг, от приблизительно 3,5 до приблизительно 30 мг/кг, от приблизительно 4 до приблизительно 30 мг/кг, от приблизительно 4,5 до приблизительно 30 мг/кг, от приблизительно 5 до приблизительно 30 мг/кг, от приблизительно 7,5 до приблизительно 30 мг/кг, от приблизительно 10 до приблизительно 30 мг/кг, от приблизительно 15 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 25 до приблизительно 30 мг/кг, от приблизительно 0,5 до приблизительно 20 мг/кг, от приблизительно 0,75 до приблизительно 20 мг/кг, от приблизительно 1 до приблизительно 20 мг/мг, от приблизительно 1,5 до приблизительно 20 мг/кг, от приблизительно 2 до приблизительно 20 мг/кг, от приблизительно 2,5 до приблизительно 20 мг/кг, от приблизительно 3 до приблизительно 20 мг/кг, от приблизительно 3,5 до приблизительно 20 мг/кг, от приблизительно 4 до приблизительно 20 мг/кг, от приблизительно 4,5 до приблизительно 20 мг/кг, от приблизительно 5 до приблизительно 20 мг/кг, от приблизительно 7,5 до приблизительно 20 мг/кг, от приблизительно 10 до приблизительно 20 мг/кг, или от приблизительно 15 до приблизительно 20 мг/кг. В одном варианте осуществления, дцРНК вводят в дозе от приблизительно 10 мг/кг до приблизительно 30 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Например, индивидуумам можно вводить терапевтическое количество i-РНК, такое как приблизительно 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5, 21, 21,5, 22, 22,5, 23, 23,5, 24, 24,5, 25, 25,5, 26, 26,5, 27, 27,5, 28, 28,5, 29, 29,5, 30, 31, 32, 33, 34, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или приблизительно 50 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Фармацевтическую композицию можно вводить один раз в сутки, или i-РНК можно вводить в качестве двух, трех или более частей дозы с соответствующими интервалами в течение суток или даже с использованием непрерывной инфузии или доставки с помощью состава с контролируемым высвобождением. В этом случае количество i-РНК, содержащееся в каждой части дозы, должно быть соответственно меньшим, чтобы обеспечить общую суточную дозировку. Дозированную единицу также можно составлять для доставки в течение нескольких суток, например, с использованием общепринятого состава с замедленным высвобождением, который обеспечивает замедленное высвобождение i-РНК в течение периода, составляющего несколько суток. Составы с замедленным высвобождением хорошо известны в данной области и особенно пригодны для доставки средств в конкретную область, например, составы, которые можно использовать со средствами по настоящему изобретению. В этом варианте осуществления дозированная единица содержит соответствующую долю суточной дозы.
В других вариантах осуществления единичная доза фармацевтических композиций может иметь длительное действие, так что последующие дозы вводят с интервалами не более 3, 4 или 5 суток, или не более 1, 2, 3 или 4 недель. В некоторых вариантах осуществления изобретения единичную дозу фармацевтических композиций по изобретению вводят один раз в неделю. В других вариантах осуществления изобретения единичную дозу фармацевтических композиций по изобретению вводят два раза в месяц.
Квалифицированному специалисту будет понятно, что определенные факторы могут влиять на дозировку и время, требуемые для эффективного лечения индивидуума, включая, но не ограничиваясь ими, тяжесть заболевания или нарушения, предшествующие способы лечения, общее состояние здоровья и/или возраст индивидуума и другие присутствующие заболевания. Более того, лечение индивидуума терапевтически эффективным количеством композиции может включать однократное лечение или серию лечений. Оценку эффективных дозировок и времени полужизни in vivo для отдельных i-РНК, охватываемых изобретением, можно проводить с использованием общепринятых методологий или на основе исследования in vivo с использованием соответствующей модели на животных, как описано в настоящем описании.
Достижения генетики мышей обеспечили ряд моделей на мышах для исследования различных заболеваний человека, таких как геморрагическое нарушение, при котором является полезным снижение экспрессии серпина c1. Такие модели можно использовать для исследования i-РНК in vivo, а также для определения терапевтически эффективной дозы. Подходящие модели на мышах известны в данной области и включают, например, модели на мышах гемофилии A и модели на мышах гемофилии B, например, мыши, имеющие нокаут гена фактора свертывания, такие как мыши, описанные в Bolliger, et al. (2010) Thromb Haemost 103: 1233-1238, Bi L, et al. (1995) Nat Genet 10: 119-21, Lin et al. (1997) Blood 90: 3962-6, Kundu et al. (1998) Blood 92: 168-74, Wang et al. (1997) Proc Natl Acad Sci U S A 94: 11563-6, и Jin, et al. (2004) Blood 104: 1733.
Фармацевтические композиции по настоящему изобретению можно вводить множеством способов в зависимости от того, является ли желательным локальное или системное лечение, и от области, подлежащей лечению. Введение может быть местным (например, с помощью трансдермального пластыря), легочным, например, посредством ингаляции или инсуффляции порошков или аэрозолей, в том числе с помощью небулайзера; внутритрахеальным, интраназальным, эпидермальным и трансдермальным, пероральным или парентеральным. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или инфузию; подкожное введение, например, с помощью имплантируемого устройства; или внутричерепное, например, посредством интрапаренхиматозного, интратекального или внутрижелудочкого введения. i-РНК можно доставлять так, чтобы она нацеливалась на конкретную ткань, такую как печень (например, гепатоциты печени). Фармацевтические композиции и составы для местного введения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Могут быть необходимыми или желательными общепринятые фармацевтические носители, водные, порошковые или масляные основы, загустители и т.п. Также могут быть пригодными покрытые презерватив, перчатки и т.п. Пригодные местные составы включают составы, в которых i-РНК по изобретению находятся в смеси со средством для местной доставки, таким как липиды, липосомы, жирные кислоты, сложные эфиры жирных кислот, стероиды, хелатирующие агенты и поверхностно-активные вещества. Пригодные липиды и липосомы включают нейтральные (например, диолеилфосфатидил DOPE этаноламин, димиристоилфосфатидилхолин DMPC, дистеароилфосфатидилхолин), отрицательные (например, димиристоилфосфатидилглицерин DMPG) и катионные (например, диолеилтетраметиламинопропил DOTAP и диолеилфосфатидилэтаноламин DOTMA). i-РНК по изобретению могут быть инкапсулированы в липосомы или могут образовывать с ними комплексы, в частности, с катионными липосомами. Альтернативно, i-РНК могут находиться в комплексе с липидами, в частности, с катионными липидами. Пригодные жирные кислоты и сложные эфиры включают, но не ограничиваются ими, арахидоновую кислоту, олеиновую кислоту, эйкозановую кислоту, лауриновую кислоту, каприловую кислоту, каприновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолеиновую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин, дилаурин, глицерил 1-монокпрат, l-додецилазациклогептан-2-он, ацилкарнитин, ацилхолин или C1-20 алкиловый сложный эфир (например, изопропилмиристат IPM), моноглицерид, диглицерид или их фармацевтически приемлемую соль). Местные составы подробно описаны в патенте США № 6747014, который включен в настоящее описание в качестве ссылки.
A. Составы i-РНК, содержащие мембранные молекулярные ансамбли
i-РНК для применения в композициях и способах по изобретению могут быть составлены для доставки в мембранной молекулярном ансамбле, например, липосоме или мицелле. Как используют в рамках изобретения, термин "липосома" относится к везикуле, состоящей из амфипатических жидкостей, организованных в виде по меньшей мере одного бислоя, например, одного бислоя или множества бислоев. Липосомы включают однослойные и многослойные везикулы, которые имеют мембрану, образованную из липофильного материала и водной внутренней среды. Водная часть содержит композицию i-РНК. Липофильный материал изолирует водную внутреннюю среду от водной внешней среды, которая, как правило, не включает композицию i-РНК, хотя в некоторых примерах, она может их включать. Липосомы пригодны для переноса и доставки активных ингредиентов в область действия. Поскольку липосомальная мембрана структурно сходна с биологическими мембранами, когда липосомы вводят в ткань, происходит слияние липосомального бислоя с бислоем клеточных мембран. По мене слияния липосом и клеток внутреннее водное содержимое, которое включает i-РНК, доставляется в клетку, где i-РНК может специфически связываться с РНК-мишенью и может опосредовать РНК-i. В некоторых случаях липосомы также специфически нацеливают, например, для направления i-РНК к конкретным типам клеток.
Липосому, содержащую средство РНК-i, можно получать различными способами. В одном примере липидный компонент липосомы растворяют в детергенте так, чтобы образовывались мицеллы с липидным компонентом. Например, липидный компонент может представлять собой амфипатический катионный липид или конъюгат липида. Детергент может иметь высокую критическую концентрацию мицелл и может быть неионным. Иллюстративные детергенты включают холат, CHAPS, октилглюкозид, дезоксихолат и лауроилсаркозин. Затем препарат средства РНК-i добавляют к мицеллам, которые включают липидный компонент. Катионные группы на липиде взаимодействуют со средством РНК-i и конденсируются вокруг средства РНК-i с образованием липосомы. После конденсации детергент удаляют, например, диализом, с получением липосомального препарата средства РНК-i.
Если необходимо, в ходе реакции конденсации можно добавлять соединение носителя, которое способствует конденсации, например, путем контролируемого добавления. Например, соединение носителя может представлять собой полимер, отличный от нуклеиновой кислоты (например, спермин или спермидин). Также для способствования конденсации можно корректировать pH.
Способы получения носителей для стабильной доставки полинуклеотидов, которые включают комплекс полинуклеотид/катионный липид в качестве структурных компонентов носителя для доставки, дополнительно описаны, например, в WO 96/37194, полное содержание которой включено в настоящее описание в качестве ссылки. Формирование липосом также может включать один или несколько аспектов иллюстративных способов, описанных в Feigner, P. L. et al., Proc. Natl. Acad. Sci., USA 8:7413-7417, 1987; патенте США № 4897355; патенте США № 5171678; Bangham, et al. M. Mol. Biol. 23:238, 1965; Olson, et al. Biochim. Biophys. Acta 557:9, 1979; Szoka, et al. Proc. Natl. Acad. Sci. 75: 4194, 1978; Mayhew, et al. Biochim. Biophys. Acta 775: 169, 1984; Kim, et al. Biochim. Biophys. Acta 728:339, 1983; и Fukunaga, et al. Endocrinol. 115:757, 1984. Широко используемые способы для получения липидных агрегатов подходящего размера для применения в качестве носителей для доставки включают обработку ультразвуковым излучением и замораживание-размораживание с экстракцией (смотрите, например, Mayer, et al. Biochim. Biophys. Acta 858: 161, 1986). Когда являются желательными стабильно небольшие (от 50 до 200 нм) и относительно единообразные агрегаты (Mayhew, et al. Biochim. Biophys. Acta 775: 169, 1984). Эти способы полностью адаптированы для упаковывания препаратов средств РНК-i в липосомы.
Липосомы подразделяются на два широких класса. Катионные липосомы представляют собой положительно заряженные липосомы, которые взаимодействуют с отрицательно заряженными молекулами нуклеиновой кислоты с образованием стабильного комплекса. Положительно заряженный комплекс нуклеиновая кислота/липосома связывается с отрицательно заряженной клеточной поверхностью и нейтрализуется в эндосоме. Вследствие кислого значения pH в эндосоме, липосомы разрушаются, высвобождая их содержимое в цитоплазму клеток (Wang et al., Biochem. Biophys. Res. Commun., 1987, 147, 980-985).
Липосомы, которые являются чувствительными к pH или отрицательно заряженными, окружают нуклеиновые кислоты, а не образуют комплекс с ними. Поскольку как нуклеиновая кислота, так и липид, заряжены сходным образом, происходит отторжение, а не образование комплекса. Тем не менее, немного нуклеиновой кислоты удерживается в водной среде этих липосом. Чувствительные к pH липосомы используют для доставки нуклеиновых кислот, кодирующих ген тимидинкиназы, в монослои клеток в культуре. Экспрессию экзогенного гена выявляли в клетках-мишенях (Zhou et al., Journal of Controlled Release, 1992, 19, 269-274).
Один из основных типов липосомальной композиции включает фосфолипиды, отличные от фосфатидилхолина естественного происхождения. Нейтральные липосомальные композиции, например, могут быть образованы из димиристоилфосфатидилхолина (DMPC) или дипальмитоилфосфатидилхолина (DPPC). Композиции анионных липосом, как правило, образованы из димиристоилфосфатидилглицерина, в то время как анионные фузогенные липосомы образованы в основном из диолеилфосфатидилэтаноламина (DOPE). Другой тип липосомальной композиции образован из фосфатидилхолина (PC), например, такого как PC сои и яичный PC. Другой тип образован из смесей фосфолипида, и/или фосфатидилхолина, и/или холестерина.
Примеры других способов введения липосом в клетку in vitro и in vivo включают патент США № 5283185; патент США № 5171678; WO 94/00569; WO 93/24640; WO 91/16024; Feigner, J. Biol. Chem. 269:2550, 1994; Nabel, Proc. Natl. Acad. Sci. 90: 11307, 1993; Nabel, Human Gene Ther. 3:649, 1992; Gershon, Biochem. 32:7143, 1993, и Strauss EMBO J. 11:417, 1992.
Неионные липосомальные сиситемы также исследовали для определения их применимости для доставки лекарственных средств в кожу, в частности, системы, содержащие неионное поверхностно-активное вещество и холестерин. Неионные липосомальные составы, содержащие Novasome™ I (глицерилдилаурат/холестерин/полиоксиэтилен-10-стеариловый эфир) и Novasome™ II (глицерилдистеарат/холестеринполиоксиэтилен-10-стеариловый эфир) использовали для доставки циклоспорина-A в дерму кожи мыши. Результаты показали, что такие неионные липосомальные системы являются эффективными для способствования отложению циклоспорина A в различных слоях кожи (Hu et al. S. T.P.Pharma. Sci., 1994, 4(6) 466).
Липосомы также включают "пространственно стабилизированные" липосомы, этот термин, как используют в рамках изобретения, относится к липосомам, содержащим один или несколько специализированных липидов, которые, когда они включены в липосомы, приводят к увеличенному времени циркуляции относительно липосом, лишенных таких специализированных липидов. Примерами пространственно стабилизированных липосом являются липосомы, в которых часть образующей везикулу липидной части липосомы (A) содержит один или несколько гликолипидов, таких как моносиалоганглиозид GMI, или (B) образует производное с одним или несколькими гидрофильными полимерами, такими как часть полиэтиленгликоля (PEG). Без связи с конкретной теорией, в данной области полагают, что, по меньшей мере для пространственно стабилизированных липосом, содержащих ганглиозиды, сфингомиелин или липиды, образующие производное с PEG, увеличенное время циркуляции этих пространственно стабилизированных липосом является результатом сниженного захвата в клетки ретикулоэндотелиальной системы (RES) (Allen et al., FEBS Letters, 1987, 223, 42; Wu et al., Cancer Research, 1993, 53, 3765).
Различные липосомы, содержащие один или несколько ликолипидов, известны в данной области. Papahadjopoulos et al. (Ann. N. Y. Acad. Sci., 1987, 507, 64) сообщили о способности моносиалоганглиозида GMI, сульфата галактоцереброзида и фосфатидилинозитола увеличивать время полужизни липосом. Эти данные изложены Gabizon et al. (Proc. Natl. Acad. Sci. U.S.A., 1988, 85, 6949). В патенте США № 4837028 и WO 88/04924, оба Allen et al., описаны липосомы, содержащие (1) сфингомиелин и (2) ганглиозид GMI или сложный эфир сульфата галактоцереброзида. В патенте США № 5543152 (Webb et al.) описаны липосомы, содержащие сфингомиелин. Липосомы, содержащие 1,2-sn-димиристоилфосфатидилхолин, описаны в WO 97/13499 (Lim et al.).
В одном варианте осуществления используют катионные липосомы. Катионные липосомы обладают преимуществом, состоящим в том, что они способны к слиянию с мембраной клеток. Некатионные липосомы, хотя и не способны к настолько же эффективному слиянию с плазматической мембраной, захватываются макрофагами in vivo, и их можно использовать для доставки средств РНК-i в макрофаги.
Преимущества липосом являются следующими: липосомы, полученные из природных фосфолипидов, являются биологически совместимыми и биологически деградируемыми; липосомы могут заключать в себе широкий диапазон растворимых в воде и липидах лекарственных средств; липосомы могут защищать инкапсулированные средства РНК-i в их внутренних компартментах от метаболизма и деградации (Rosoff, "Pharmaceutical Dosage Forms", Lieberman, Rieger and Banker (Eds.), 1988, volume 1, p. 245). Важными факторами при получении липосомальных составов являются заряд липидной поверхности, размер везикулы и водный объем липосом.
Положительно заряженный синтетический катионный липид, хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA), можно использовать для формирования небольших липосом, которые самопроизвольно взаимодействуют с нуклеиновой кислотой с образованием комплексов липид-нуклеиновая кислота, которые способны к слиянию с отрицательно заряженными липидами клеточных мембран клеток культуры тканей, что приводит к доставке средства РНК-i (смотрите, например, Feigner, P. L. et al., Proc. Natl. Acad. Sci., USA 8:7413-7417, 1987, и патент США № 4897355 для описания DOTMA и его применения с ДНК).
Аналог DOTMA, 1,2-бис(олеилокси)-3-(триметиламмиак)пропан (DOTAP), можно использовать в комбинации с фосфолипидом для формирования везикул, образующих комплексы с ДНК. Lipofectin™ (Bethesda Research Laboratories, Gaithersburg, Md.) является эффективным средством для доставки высокоанионных нуклеиновых кислот в клетки культуры живой ткани, которое содержит положительно заряженные липосомы DOTMA, которые самопроизвольно взаимодействуют с отрицательно заряженными полинуклеотидами с образованием комплексов. Когда используют достаточно положительно заряженные липосомы, суммарный заряд на полученных комплексов также является положительным. Положительно заряженные комплексы, полученные таким образом, самопроизвольно связываются с отрицательно заряженными поверхностями клеток, осуществляют слияние с плазматической мембраной и эффективно доставляют функциональные нуклеиновые кислоты, например, в клетки культуры тканей. Другой коммерчески доступный катионный липид, 1,2-бис(олеилокси)-3,3-(триметиламмиак)пропан ("DOTAP") (Boehringer Mannheim, Indianapolis, Indiana) отличается от DOTMA тем, что олеоильные части связаны сложноэфирными, а не простыми эфирными связями.
Другие соединения катионных липидов включают соединения, конъюгированные с различными частями, включая, например, карбоксиспермин, который конъюгирован с одним из двух типов липидов и включает соединения, такие как 5-карбоксиспермилглициндиоктаолеоиламид ("DOGS") (Transfectam™, Promega, Madison, Wisconsin) и дипальмитоилфосфатидилэтаноламин-5-карбоксиспермиламид ("DPPES") (смотрите, например, патент США № 5171678).
Другой конъюгат катионного липида включает производное липида с холестерином ("DC-Chol"), которое составлено в виде липосом в комбинации с DOPE (Смотрите, Gao, X. and Huang, L., Biochim. Biophys. Res. Commun. 179:280, 1991). Было описано, что липополилизин, полученный путем конъюгации полилизина с DOPE, является эффективным для трансфекции в присутствии сыворотки (Zhou, X. et al., Biochim. Biophys. Acta 1065:8, 1991). Для определенных клеточных линий эти липосомы, содержащие конъюгированные катионные липиды, считают проявляющими более низкую токсичность и обеспечивающими более эффективную трансфекцию, чем содержащие DOTMA композиции. Другие коммерчески доступные продукты на основе катионных липидов включают DMRIE и DMRIE-HP (Vical, La Jolla, California) и Lipofectamin (DOSPA) (Life Technology, Inc., Gaithersburg, Maryland). Другие катионные липиды, пригодные для доставки олигонуклеотидов, описаны в WO 98/39359 и WO 96/37194.
Липосомальные составы особенно пригодны для местного введения: липосомы обладают несколькими преимуществами над другими составами. Такие преимущества включают меньшие побочные эффекты, связанные с высоким системным всасыванием введенного лекарственного средства, увеличенное накопление введенного лекарственного средства в желаемой мишени и возможность введения средства РНК-i в кожу. В некоторых вариантах осуществления липосомы используют для доставки средства РНК-i в эпидермальные клетки и также для усиления проникновения средства РНК-i в дермальные кожи, например, в кожу. Например, липосомы можно применять местно. Местная доставка лекарственных средств, составленных в качестве липосом, в кожу была документирована (смотрите, например, Weiner et al., Journal of Drug Targeting, 1992, vol. 2,405-410, и du Plessis et al., Antiviral Research, 18, 1992, 259-265; Mannino, R. J. and Fould-Fogerite, S., Biotechniques 6:682-690, 1988; Itani, T. et al. Gene 56:267-276. 1987; Nicolau, C. et al. Meth. Enz. 149: 157-176, 1987; Straubinger, R. M. and Papahadjopoulos, D. Meth. Enz. 101:512-527, 1983; Wang, C. Y. and Huang, L., Vroc. Natl. Acad. Sci. USA 84:7851-7855, 1987).
Неионные липосомальные системы также исследовали для определения их пригодности для доставки лекарственных средств в кожу, в частности, системы, содержащие неионное поверхностно-активное вещество и холестерин. Неионные липосомальные составы, содержащие Novasome I (глицерилдилаурат/холестерин/полиоксиэтилен-10-стеариловый эфир) и Novasome II (глицерилдистеарат/холестерин/полиоксиэтилен-10-стеариловый эфир) использовали для доставки лекарственного средства в дерму кожи мыши. Такие составы со средством РНК-i пригодны для лечения дерматологического нарушения.
Липосомы, которые включают i-РНК, могут быть высокодеформируемыми. Такая деформируемость может обеспечить проникновение липосом через пору, которая меньше среднего радиуса липосомы. Например, типом деформируемых липосом являются трансферсомы. Трансферсомы можно получать путем добавления активаторов поверхности, обычно поверхностно-активных веществ, в стандартную липосомальную композицию. Трансферсомы, которые включают средством РНК-i, можно доставлять, например, подкожно посредством инфицирования, чтобы доставить средством РНК-i в кератиноциты кожи. Для прохождения интактными через кожу млекопитающих, липидные везикулы должны проходить через ряд тонких пор, каждая из которых имеет диаметр менее 50 нм, под воздействием подходящего трансдермального градиента. Кроме того, благодаря свойствам липидов, эти трансферсомы могут быть самооптимизиующимися (адаптивными к форме пор, например, в коже), самовосстанавливающимися и часто могут достигать их мишеней без фрагментации, и часто самонагружающимися.
Другие составы, пригодные для настоящего изобретения, описаны в предварительных заявках США с серийными номерами № 61/018616, поданной 2 января 2008 года; 61/018611, поданной 2 января 2008 года; 61/039748, поданной 26 марта 2008 года; 61/047087, поданной 22 апреля 2008 года, и 61/051528, поданной 8 мая 2008 года. В заявке PCT № PCT/US2007/080331, поданной 3 октября 2007 года, также описаны составы, которые пригодны для настоящего изобретения.
Трансферосмы, являются другим типом липосом, и они являются высокодеформируемыми липидными агрегатами, которые являются привлекательными кандидатами в качестве носителей лекарственных средств. Трансферсомы могут быть описаны как липидные капли, которые являются настолько высокодеформируемыми, что они способны без труда проникать через поры, которые являются меньшими, чем капля. Трансферсомы адаптируются к окружающей среде, в которой их используют, например, они являются самооптимизирующимися (адаптивными к форме пор в коже), самовосстанавливающимися, часто достигают их мишеней без фрагментации, и часто являются самонагружающимися. Чтобы получить трансферсомы, можно добавить активаторы поверхности, особенно поверхностно-активные вещества, к стандартной липосомальной композиции. Трансферсомы используют для доставки сывороточного альбумина в кожу. Было показано, что опосредуемая трансферсомами доставка сывороточного альбумина является настолько же эффективной, как и подкожная инъекция раствора, содержащего сывороточный альбумин.
Поверхностно-активные вещества являются применимыми в составах, таких как эмульсии (включая микроэмульсии) и липосомы. Наиболее частым способом классификации и ранжирования свойств многих различных типов поверхностно-активных веществ, как природных, так и синтетических, является применение гидрофильного/липофильного баланса (HLB). Природа гидрофильной группы (также известной как "головка") обеспечивает наиболее полезное средство для категоризации различных поверхностно-активных веществ, используемых в составах (Rieger, Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p. 285).
Если молекула поверхностно-активного вещества не является ионизированной, ее классифицируют как неионное поверхностно-активное вещество. Неионные поверхностно-активные вещества широко пригодны в фармацевтических и косметических продуктах и являются применимыми в широком диапазоне величин pH. Как правило, их величины HLB находятся в диапазоне от 2 до приблизительно 18 в зависимости от их структуры. Неионные поверхностно-активные вещества включают неионные сложные эфиры, такие как сложные эфиры этиленгликоля, сложные эфиры пропиленгликоля, глицерильные сложные эфиры, полиглицерильные сложные эфиры, сложные эфиры сорбитана, сложные эфиры сахарозы и этоксилированные сложные эфиры. Также в этот класс входят неионные алканоламиды и простые эфиры, такие как этоксилаты жирных спиртов, пропоксилированные спирты и этоксилированные/пропоксилированные блок-полимеры. Полиоксиэтиленовые поверхностно-активные вещества являются наиболее распространенными представителями класса неионных поверхностно-активных веществ.
Если молекула поверхностно-активного вещества имеет отрицательный заряд, когда она растворена или диспергирована в воде, поверхностно-активное вещество классифицируют как анионное. Анионные поверхностно-активные вещества включают карбоксилаты, такие как мыла, ациллактилаты, ациламиды аминокислот, сложные эфиры серной кислоты, такие как алкилсульфаты и этоксилированные алкилсульфаты, сульфонаты, такие как алкилбензолсульфонаты, ацилизетионаты, ацилтаураты и сульфосукцинаты и фосфаты. Наиболее важными представителями класса анионных поверхностно-активных веществ являются алкилсульфаты и мыла.
Если молекула поверхностно-активного вещества имеет положительный заряд, когда она растворена или диспергирована в воде, поверхностно-активное вещество классифицируют как катионное. Катионные поверхностно-активные вещества включают четвертичные соли аммония и этоксилированные амины. Четвертичные соли аммония являются наиболее часто используемыми представителями этого класса.
Если молекула поверхностно-активного вещества способна иметь положительный или отрицательный заряд, поверхностно-активное вещество классифицируют как амфотерное. Амфотерные поверхностно-активные вещества включают производные акриловой кислоты, замещенные алкиламиды, N-алкилбетаины и фосфатиды.
Применение поверхностно-активных веществ в лекарственных продуктах, составах и эмульсиях, было описано (Rieger, Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p. 285).
i-РНК для применения в способах по изобретению могут быть предоставлены в качестве мицеллярных составов. "Мицеллы" определяют в настоящем описании как конкретный тип молекулярного ансамбля, в котором амфипатические молекулы организованы в сферическую структуру, так что все гидрофобные части молекул направлены внутрь, оставляя гидрофильные части в контакте с окружающей водной фазой. Обратная организация существует, если окружающая среда является гидрофобной.
Смешанный мицеллярный состав, пригодный для доставки через трансдермальные мембраны, можно получать путем смешения водного раствора композиции ми-РНК, C8-C22 алкилсульфата щелочного металла и образующих мицеллы соединений. Иллюстративные образующие мицеллы соединения включают лецитин, гиалуроновую кислоту, фармацевтически приемлемые соли гиалуроновой кислоты, гликолевую кислоту, молочную кислоту, экстракт ромашки, экстракт огурца, олеиновую кислоту, линолеиновую кислоту, линоленовую кислоту, моноолеин, моноолеаты, монолаураты, масло бурачника, масло первоцвета вечернего, ментол, тригидроксиоксохоланил глицин и него фармацевтически приемлемые соли, глицерин, полиглицерин, лизин, полилизин, триолеин, простые эфиры полиоксиэтилена и их аналоги, алкильные простые эфиры полидоканола и их аналоги, хенодезоксихолат, дезоксихолат и их смеси. Образующие мицеллы соединения можно добавлять одновременно или после добавления алкилсульфата щелочного металла. Смешанные мицеллы образуются по существу при любом типе смешения ингредиентов, кроме энергичного смешения, чтобы обеспечить мицеллы меньшего размера.
В одном способе получают первую мицеллярную композицию, которая содержит композицию ми-РНК и по меньшей мере алкилсульфат щелочного металла. Затем первую мицеллярную композицию смешивают по меньшей мере с тремя образующими мицеллу соединениями с образованием мицеллярной композиции. В другом способе мицеллярную композицию получают путем смешения композиции ми-РНК, алкилсульфата щелочного металла и по меньшей мере одного из образующих мицеллу соединений, с последующим добавлением остальных образующих мицеллу соединений, при энергичном перемешивании.
К смешанной мицеллярной композиции можно добавлять фенол и/или м-крезол для стабилизации состава и защиты от роста бактерий. Альтернативно можно добавлять фенол и/или м-крезол с образующими мицеллу ингредиентами. Также после образования смешанной мицеллярной композиции можно добавлять обеспечивающее изотоничность средство, такое как глицерин. Для доставки мицеллярного состава в качестве спрея, состав можно помещать в устройства для распыления аэрозоля и устройство для распыления заряжать пропеллентом. Пропеллент, находящийся под давлением, находится в устройстве для распределения в жидкой форме. Соотношения ингредиентов корректируют таким образом, чтобы водная фаза и фаза пропеллента стали одной фазой, т.е. существовала одна фаза. Если существует две фазы, необходимо встряхивать устройство для распределения перед распределением части содержимого, например, через дозирующий клапан. Распределенная доза фармацевтического средства выталкивается из дозирующего клапана в виде мелкораспыленной струи.
Пропелленты могут включать водородсодержащие хлорфторуглероды, водородсодержащие фторуглероды, диметиловый эфир и диэтиловый эфир. В определенных вариантах осуществления можно использовать HFA 134a (1,1,1,2-тетрафторэтан).
Конкретные концентрации необходимых ингредиентов можно определять с помощью относительного простого экспериментирования. Для всасывания через полость рта, часто является увеличение, например, по меньшей мере в два или в три раза, дозировки, предназначенной для инъекции или введения через желудочно-кишечный тракт.
B. Липидные частицы
i-РНК, например дцРНК, по изобретению может быть полностью инкапсулированной в липидный состав, например, LNP, например, с образованием SPLP, pSPLP, SNALP или другой частицы нуклеиновая кислота-липид.
Как используют в рамках изобретения, термин "SNALP" относится к стабильной частице нуклеиновая кислота-липид, включая SPLP. Как используют в рамках изобретения, термин "SPLP" относится к частице нуклеиновая кислота-липид, содержащей плазмидную ДНК, инкапсулированную в липидную везикулу. SNALP и SPLP, как правило, содержат катионный липид, некатионный липид и липид, который препятствует агрегации частицы (например, конъюгат PEG-липид). SNALP и SPLP являются чрезвычайно полезными для системных применений, поскольку они проявляют увеличенное время жизни в циркуляции после внутривенной (в.в.) инъекции и накапливаются в отдаленных областях (например, областях, физически отделенных от области введения). SPLP включают "pSPLP", которые включают инкапсулированный комплекс конденсирующий агент-нуклеиновая кислота, как указано в публикации PCT № WO 00/03683. Частицы по настоящему изобретению, как правило, имеют средний диаметр от приблизительно 50 нм до приблизительно 150 нм, более конкретно, от приблизительно 60 нм до приблизительно 130 нм, более конкретно от приблизительно 70 нм до приблизительно 110 нм, наиболее часто, от приблизительно 70 нм до приблизительно 90 нм, и они являются по существу нетоксичными. Кроме того, нуклеиновые кислоты, когда они присутствуют в частицах нуклеиновая кислота-липид по настоящему изобретению, являются устойчивыми в водном растворе к деградации нуклеазой. Частицы нуклеиновая кислота-липид и способ их получения описаны, например, в патентах США № 5976567; 5981501; 6534484; 6586410; 6815432; публикации США № 2010/0324120 и публикации PCT № WO 96/40964.
В одном варианте осуществления соотношение липид/лекарственное средство (соотношение масса/масса) (например, соотношение липида к дцРНК) находится в диапазоне от приблизительно 1:1 до приблизительно 50:1, от приблизительно 1:1 до приблизительно 25:1, от приблизительно 3:1 до приблизительно 15:1, от приблизительно 4:1 до приблизительно 10:1, от приблизительно 5:1 до приблизительно 9:1, или от приблизительно 6:1 до приблизительно 9:1. Диапазоны, являющиеся промежуточными для указанных выше диапазонов, также рассматриваются как часть изобретения.
Катионный липид может представлять собой, например, хлорид N,N-диолеил-N,N-диметиламмония (DODAC), бромид N,N-дистеарил-N,N-диметиламмония (DDAB), хлорид N-(1-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTAP), хлорид N-(1-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTMA), N,N-диметил-(2,3-диолеилокси)пропиламин (DODMA), 1,2-дилинолеилокси-N,N-диметиламинопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLenDMA), 1,2-дилинолеилкарбамоилокси-3-диметиламинопропан (DLin-C-DAP), 1,2-дилинолеилокси-3-(диметиламино)ацетоксипропан (DLin-DAC), 1,2-дилинолеилокси-3-морфолинопропан (DLin-MA), 1,2-дилинолеоил-3-диметиламинопропан (DLinDAP), 1,2-дилинолеилтио-3-диметиламинопропан (DLin-S-DMA), 1-линолеоил-2-линолеилокси-3-диметиламинопропан (DLin-2-DMAP), хлорид 1,2-дилинолеилокси-3-триметиламинопропана (DLin-TMA.C1), хлорид 1,2-дилинолеоил-3-триметиламинопропана (DLin-TAP.C1), 1,2-дилинолеилокси-3-(N-метилпиперазино)пропан (DLin-MPZ) или 3-(N,N-дилинолеиламино)-1,2-пропандиол (DLinAP), 3-(N,N-диолеиламино)-1,2-пропандиол (DOAP), 1,2-дилинолеилоксо-3-(2-N,N-диметиламино)этоксипропан (DLin-EG-DMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLinDMA), 2,2-дилинолеил-4-диметиламинометил-[1,3]-диоксолан (DLin-K-DMA) или его аналоги, (3aR,5s,6aS)-N,N-диметил-2,2-ди((9Z,12Z)-октадека-9,12-диенил)тетрагидро-3aH-циклопента[d][1,3]диоксол-5-амин (ALN100), (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил 4-(диметиламино)бутаноат (MC3), 1,1'-(2-(4-(2-((2-(бис(2-гидроксидодецил)амино)этил)(2-гидроксидодецил)амино)этил)пиперазин-1-ил)этилазепандиил)дидодекан-2-ол (Tech G1) или их смесь. Катионный липид может составлять от приблизительно 20 моль.% до приблизительно 50 моль.% или приблизительно 40 моль.% от общего содержания липидов в частице. В другом варианте осуществления соединение 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолан можно использовать для получения наночастиц липид-ми-РНК. Синтез 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолана описан во временной патентной заявке США под номером № 61/107998, поданной 23 октября 2008 года, которая включена в настоящее описание в качестве ссылки.
В одном варианте осуществления частица липид-ми-РНК включает 40% 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолана: 10% DSPC: 40% холестерина: 10% PEG-C-DOMG (молярный процент) с размером частиц 63,0±20 нм и соотношением ми-РНК/липид 0,027.
Ионизируемый/некатионный липид может представлять собой анионный липид или нейтральный липид, включая, но не ограничиваясь ими, дистеароилфосфатидилхолин (DSPC), диолеилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), диолеилфосфатидилглицерин (DOPG), дипальмитоилфосфатидилглицерин (DPPG), диолеил-фосфатидилэтаноламин (DOPE), пальмитоилолеоилфосфатидилхолин (POPC), пальмитоилолеоилфосфатидилэтаноламин (POPE), диолеилфосфатидилэтаноламин-4-(N-малеимидометил)циклогексан-1-карбоксилат (DOPE-mal), дипальмитоилфосфатидилэтаноламин (DPPE), димиристоилфосфоэтаноламин (DMPE), дистеароилфосфатидилэтаноламин (DSPE), 16-O-монометил-PE, 16-O-диметил-PE, 18-1-транс-PE, 1-стеароил-2-олеоилфосфатидилэтаноламин (SOPE), холестерин или их смесь. Неактионный липид может составлять от приблизительно 5 моль.% до приблизительно 90 моль.%, приблизительно 10 моль.% или приблизительно 58 моль.%, если включен холестерин, от общего содержания липида, присутствующего в частице.
Конъюгированный липид, который ингибирует агрегацию частиц, может представлять собой, например, полиэтиленгликоль (PEG)-липид, включающий, но не ограничивающийся ими, PEG-диацилглицерин (DAG), PEG-диалкилоксипропил (DAA), PEG-фосфолипид, PEG-церамид (Cer) или их смесь. Конъюгат PEG-DAA может представлять собой, например, PEG-дилаурилоксипропил (Ci2), PEG-димиристилоксипропил (Ci4), PEG-дипальмитилоксипропил (Ci6) или PEG-дистеарилоксипропил (Ci8). Конъюгированный липид, который препятствует агрегации частиц, может составлять от 0 моль.% до приблизительно 20 моль.% или приблизительно 2 моль.% от общего содержания липидов в частице.
В некоторых вариантах осуществления частица нуклеиновая кислота-липид дополнительно включает холестерин, например, в количестве от приблизительно 10 моль.% до приблизительно 60 моль.% или приблизительно 48 моль.% от общего содержания липидов в частице.
В одном варианте осуществления для получения наночастиц липид-дцРНК (т.е. частиц LNP01) можно использовать липидоид ND98-4HC1 (ММ 1487) (смотрите патентную заявку США № 12/056230, поданную 3/26/2008, которая включена в настоящее описание в качестве ссылки), холестерин (Sigma-Aldrich) и PEG-церамид C16 (Avanti Polar Lipids). Исходные растворы каждого из них в этаноле можно получать следующим образом: ND98, 133 мг/мл; холестерин, 25 мг/мл, PEG-церамид C16, 100 мг/мл. Затем исходные растворы ND98, холестерина и PEG-церамида C16 можно объединять, например, в молярном соотношении 42:48:10. Объединенный раствор липидов можно смешивать с водным раствором дцРНК (например, в ацетате натрия, pH 5), так чтобы конечная концентрация этанола составляла приблизительно 35-45% и конечная концентрация ацетата натрия составляла приблизительно 100-300 мМ. Наночастицы липид-дцРНК, как правило, образуются самопроизвольно при перемешивании. В зависимости от желаемого распределения размера частиц, конечную смесь наночастиц можно экструдировать через поликарбонатную мембрану (например, с пороговым значением 100 нм) с использованием, например, термического барабанного экструдера, такого как экструдер Lipex (Northern Lipids, Inc). В некоторых случаях, стадию экструдии можно исключать. Удаление этанола и одновременную замену буфера можно проводить, например, посредством диализа или проточной фильтрации вдоль потока. Буфер можно заменять, например, фосфатно-солевым буфером (PBS) при приблизительно pH 7, например, приблизительно pH 6,9, приблизительно pH 7,0, приблизительно pH 7,1, приблизительно pH 7,2, приблизительно pH 7,3 или приблизительно pH 7,4.

формула 1
Составы LNP01 описаны, например, в публикации международной заявки № WO 2008/042973, которая включена в настоящее описание в качестве ссылки. Дополнительные иллюстративные составы липид-дцРНК описаны в таблице 1.
DSPC: дистеароилфосфатидилхолин
DPPC: дипальмитоилфосфатидилхолин
PEG-DMG: PEG-дидимиристоилглицерин (C14-PEG или PEG-C14) (PEG со средней молекулярной массой 2000)
PEG-DSG: PEG-дистирилглицерин (C18-PEG или PEG-C18) (PEG со средней молекулярной массой 2000)
PEG-cDMA: PEG-карбамоил-1,2-димиристилоксипропиламин (PEG со средней молекулярной массой 2000)
Содержащие SNALP (1,2-дилиноленилокси-N,N-диметиламинопропан (DLinDMA)) составы описаны в международной публикации № WO2009/127060, поданной 15 апреля 2009 года, которая включена в настоящее описание в качестве ссылки.
Содержащие XTC составы описаны, например, в условной заявке США с серийным номером № 61/148366, поданной 29 января 2009 года; условной заявке США № 61/156851, поданной 2 марта 2009 года; условной заявке США с серийным №, поданной 10 июня 2009 года; условной заявке США с серийным № 61/228373, поданной 24 июля 2009 года; условной заявке США с серийным № 61/239686, поданной 3 сентября 2009 года, и международной заявке № PCT/US2010/022614, поданной 29 января 2010 года, которые включены в настоящее описание в качестве ссылок.
Содержащие MC3 составы описаны, например, в публикации США № 2010/0324120, поданной 10 июня 2010 года, полное содержание которой включено в настоящее описание в качестве ссылки.
Содержащие ALNY-100 составы описаны, например, в международной патентной заявке № PCT/US09/63933, поданной 10 ноября 2009 года, которая включена в настоящее описание в качестве ссылки.
Содержащие C12-200 составы описаны в условной заявке США с серийным № 61/175770, поданной 5 мая 2009 года, и в международной заявке № PCT/US10/33777, поданной 5 мая 2010 года, которые включены в настоящее описание в качестве ссылок.
Синтез ионизируемых/катионных липидов
Любые соединения, например, катионные липиды и т.п., используемые в частицах нуклеиновая кислота-липид по изобретению, можно получать известными способами органического синтеза, включая способы, более подробно описанные в разделе "Примеры". Все заместители являются такими, как определено ниже, если нет иных указаний.
"Алкил" означает неразветвленный или разветвленный, нециклический или циклический, насыщенный алифатический углеводород, содержащий от 1 до 24 атомов углерода. Репрезентативные насыщенные неразветвленные алкилы включают метил, этил, н-пропил, н-бутил, н-пентил, н-гексил и т.п; в то время как разветвленные алкилы включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил и т.п. Репрезентативные насыщенные циклические алкилы включают циклопропил, циклобутил, циклопентил, циклогексил и т.п.; в то время как ненасыщенные циклические алкилы включают циклопентенил и циклогексенил, и т.п.
"Алкенил" означает алкил, как определено выше, содержащий по меньшей мере одну двойную связь между соседними атомами углерода. Алкенилы включают как цис-, так и транс-изомеры. Репрезентативные неразветвленные и разветвленные алкенилы включают этиленил, пропиленил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2-бутенил, 2,3-диметил-2-бутенил и т.п.
"Алкинил" означает любой алкил или алкенил, как определено выше, который, кроме того, содержит по меньшей мере одну тройную связь между соседними атомами углерода. Репрезентативные неразветвленные и разветвленные алкинилы включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-бутинил и т.п.
"Ацил" означает любой алкил, алкенил или алкинил, где атом углерода в точке присоединения замещен оксогруппой, как определено ниже. Например, -C(=O)алкил, -C(=O)алкенил и -C(=O)алкинил являются ацильными группами.
"Гетероцикл" означает 5-7-членное моноциклическое или 7-10-членное бициклическое, гетероциклическое кольцо, которое является либо насыщенным, либо ненасыщенным, либо ароматическим, и которое содержит 1 или 2 гетероатома, независимо выбранных из азота, кислорода и серы, и где гетероатомы азота и серы необязательно могут быть окисленными, и гетероатом азота необязательно может быть кватернизированным, включая бициклические кольца, в которых любой из указанных выше гетероциклов слит с бензольным кольцом. Гетероцикл может быть присоединен через любой гетероатом или атом углерода. Гетероциклы включают гетероарилы, как определено ниже. Гетероциклы включают морфолинил, пирролидинонил, пирролидинил, пиперидинил, пиперизинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и т.п.
Термины "необязательно замещенный алкил", "необязательно замещенный алкенил", "необязательно замещенный алкинил", "необязательно замещенный ацил" и "необязательно замещенный гетероцикл" означают, что, когда они замещены, по меньшей мере один атом водорода заменен заместителем. В случае оксозаместителя (=O) замещены два атома водорода. В связи с этим, заместители включают оксо, галоген, гетероцикл, -CN, -ORx, -NRxRy, -NRxC(=O)Ry, -NRxSO2Ry, -C(=O)Rx, -C(=O)ORx, -C(=O)NRxRy, -SOnRx и -SOnNRxRy, где n равно 0, 1 или 2, Rx и Ry являются одинаковыми или различаются и независимо представляют собой водород, алкил или гетероцикл, и каждый из указанных алкильных и гетероциклических заместителей может быть далее замещен одним или несколькими из оксо, галогена, -OH, -CN, алкила, -ORx, гетероцикла, -NRxRy, -NRxC(=O)Ry, -NRxSO2Ry, -C(=O)Rx, -C(=O)ORx, -C(=O)NRxRy, -SOnRx и -SOnNRxRy.
"Галоген" означает фтор, хлор, бром и йод.
В некоторых вариантах осуществления в способах по изобретению может требоваться использование защитных групп. Методология внесения защитных групп хорошо известна специалистам в данной области (смотрите, например, Protective Groups in Organic Synthesis, Green, T.W. et al., Wiley-Interscience, New York City, 1999). В кратком изложении, защитные группы в контексте настоящего изобретения представляют собой любую группу, которая снижает или устраняет нежелательную реакционную активность функциональной группы. Защитную группу можно добавлять к функциональной группе, чтобы скрыть ее реакционную активность во время определенных реакций, а затем удалять, освобождая исходную функциональную группу. В некоторых вариантах осуществления используют "защитную группу спирта". "Защитная группа спирта" представляет собой любую группу, которая снижает или устраняет нежелательную реакционную активность спиртовой функциональной группы. Защитные группы можно добавлять или удалять с использованием способов, хорошо известных в данной области.
Синтез соединения формулы A
В некоторых вариантах осуществления частицы нуклеиновая кислота-липид по изобретению составлены с использованием катионного липида формулы A:

где R1 и R2 независимо представляют собой алкил, алкенил или алкинил, каждый из которых может быть необязательно замещенным, и R3 и R4 представляют собой независимо низший алкил, или R3 и R4 могут быть взяты вместе с образованием необязательно замещенного гетероциклического кольца. В некоторых вариантах осуществления катионный липид представляет собой XTC (2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолан). Как правило, липид формулы A, выше, можно получать по схемам реакции 1 или 2, где все заместители являются такими, как определено выше, если нет иных указаний.
Схема 1
Липид A, где R1 и R2 независимо представляют собой алкил, алкенил или алкинил, каждый из которых может быть необязательно замещенным, и R3 и R4 независимо представляют собой низший алкил, или R3 и R4, взятые вместе, могут образовывать необязательно замещенное гетероциклическое кольцо, можно получать по схеме 1. Кетон 1 и бромид 2 можно приобретать или получать способами, известными средним специалистам в данной области. Реакция 1 и 2 дает кеталь 3. Обработка кеталя 3 амином 4 дает липиды формулы A. Липиды формулы A можно конвертировать в соответствующую соль аммония с помощью органической соли формулы 5, где X представляет собой анионный противоион, выбранный из галогена, гидроксида, фосфата, сульфата и т.п.
Схема 2
Альтернативно исходный материал кетона 1 можно получать по схеме 2.
Реагент Гриньяра 6 и цианид 7 можно приобретать или получать способами, известными средним специалистам в данной области. Реакция 6 и 7 дает кетон 1. Преобразование кетона 1 в соответствующие липиды формулы A является таким, как описано на схеме 1.
Синтез MCS
Получение DLin-M-C3-DMA (т.е. (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил 4-(диметиламино)бетаноата) проводили следующим образом. Раствор (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ола (0,53 г), гидрохлорида 4-N,N-диметиламиномасляной кислоты (0,51 г), 4-N,N-диметиламинопиридина (0,61 г) и гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (0,53 г) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение ночи. Раствор промывали разбавленной хлористоводородной кислотой, а затем разбавленным водным раствором бикарбоната натрия. Органические фракции сушили над безводным сульфатом магния, фильтровали, и растворитель удаляли на роторном вакуумном испарителе. Остаток пропускали через колонку с силикагелем (20 г) с использованием градиента для элюирования 1-5% метанол/дихлорметан. Фракции, содержавшие очищенный продукт, объединяли и растворитель удаляли с получением бесцветного масла (0,54 г).
Синтез ALNY-100
Синтез кеталя 519 [ALNY-100] проводили с использованием следующей схемы 3:
Синтез соединения 515
К перемешиваемой суспензии LiAlH4 (3,74 г, 0,09852 моль) в 200 мл безводного ТГФ в RBF с двумя горлышками (1 л), медленно добавляли раствор соединения 514 (10 г, 0,04926 моль) в 70 мл ТГФ при 0°C в атмосфере азота. После завершения добавления реакционную смесь нагревали до комнатной температуры, а затем нагревали до температуры кипения с обратным холодильником в течение 4 ч. Мониторинг хода реакции проводили с помощью TLC. После завершения реакции (согласно TLC) смесь охлаждали до 0°C и гасили осторожным добавлением насыщенного раствора Na2SO4. Реакционную смесь перемешивали в течение 4 ч при комнатной температуре и отфильтровывали. Осадок хорошо промывали ТГФ. Фильтрат и промывочную жидкость смешивали и разбавляли 400 мл диоксана и 26 мл конц. HCl и перемешивали в течение 20 минут при комнатной температуре. Летучие вещества удаляли в вакууме с получение гидрохлорида соединения 515 в виде белого твердого вещества. Выход: 7,12 г,1H-ЯМР (ДМСО, 400 МГц): δ=9,34 (уширенный, 2H), 5,68 (с, 2H), 3,74 (м, 1H), 2,66-2,60 (м, 2H), 2,50-2,45 (м, 5H).
Синтез соединения 516
К перемешиваемому раствору соединения 515 в 100 мл сухого DCM в 250-мл RBF с двумя горлышками, добавляли NEt3 (37,2 мл, 0,2669 моль) и охлаждали до 0°C в атмосфере азота. После медленного добавления N-(бензилоксикарбонилокси)сукцинимида (20 г, 0,08007 моль) в 50 мл сухом DCM, реакционной смеси позволяли нагреться до комнатной температуры. После завершения реакции (2-3 ч согласно TLC) смесь последовательно промывали 1 н. раствором HCl (1×100 мл) и насыщенным раствором NaHCO3 (1×50 мл). Затем органический слой сушили над безводным Na2SO4, и растворитель выпаривали с получением неочищенного материала, очищали колоночной хроматографией на силикагеле с получением соединения 516 в виде клейкой массы. Выход: 11 г (89%).1H-ЯМР (CDCl3, 400 МГц): δ=7,36-7,27 (м, 5H), 5,69 (с, 2H), 5,12 (с, 2H), 4,96 (уширенный, 1H) 2,74 (с, 3H), 2,60 (м, 2H), 2,30-2,25 (м, 2H). ЖХ-МС [M+H] -232,3 (96,94%).
Синтез соединений 517A и 517B
Циклопентен 516 (5 г, 0,02164 моль) растворяли в растворе 220 мл ацетона и воды (10:1) в 500-мл RBF с одним горлышком и к нему добавляли N-метилморфолин-N-оксид (7,6 г, 0,06492 моль), а затем 4,2 мл 7,6% раствора OsO4 (0,275 г, 0,00108 моль) в трет-бутаноле при комнатной температуре. После завершения реакции (~3 ч), смесь гасили добавлением твердого Na2SO3 и полученную смесь перемешивали в течение 1,5 ч при комнатной температуре. Реакционную смесь разбавляли DCM (300 мл) и промывали водой (2×100 мл), а затем насыщенным раствором NaHCO3 (1×50 мл), водой (1×30 мл) и, наконец, солевым раствором (1×50 мл). Органическую фазу сушили над Na2SO4 и растворитель удаляли в вакууме. Хроматографическая очистка неочищенного материала на колонке с силикагелем обеспечила смесь диастереомеров, которые разделяли препаративной ВЭЖХ. Выход: ~6 г неочищенного вещества.
517A-пик-1 (белое твердое вещество), 5,13 г (96%).1H-ЯМР (ДМСО, 400 МГц): δ=7,39-7,31 (м, 5H), 5,04 (с, 2H), 4,78-4,73 (м, 1H), 4,48-4,47 (д, 2H), 3,94-3,93 (м, 2H), 2,71 (с, 3H), 1,72-1,67 (м, 4H). ЖХ-МС-[M+H]-266,3, [M+NH4+]-283,5, присутствует, ВЭЖХ-97,86%. Стереохимия подтверждена с помощью рентгеновского анализа.
Синтез соединения 518
С использованием методики, аналогичной методике, описанной для синтеза соединения 505, соединение 518 (1,2 г, 41%) получали в виде бесцветного масла.1H-ЯМР (CDCl3, 400 МГц): δ=7,35-7,33 (м, 4H), 7,30-7,27 (м, 1H), 5,37-5,27 (м, 8H), 5,12 (с, 2H), 4,75 (м, 1H), 4,58-4,57 (м, 2H), 2,78-2,74 (м, 7H), 2,06-2,00 (м, 8H), 1,96-1,91 (м, 2H), 1,62 (м, 4H), 1,48 (м, 2H), 1,37-1,25 (ушир.м, 36H), 0,87 (м, 6H). ВЭЖХ-98,65%.
Общая методика синтеза соединения 519
Раствор соединения 518 (1 экв.) в гексане (15 мл) капельно добавляли к ледяному раствору LAH в ТГФ (1 M, 2 экв.). После завершения добавления смесь нагревали при 40°C в течение 0,5 ч, а затем вновь охлаждали на ледяной бане. Смесь осторожно гидролизовали насыщенным водным Na2SO4, а затем фильтровали через целит и восстанавливали до масла. Колоночная хроматография обеспечила чистое соединение 519 (1,3 г, 68%), которое получали в виде бесцветного масла.13C-ЯМР δ=130,2, 130,1 (×2), 127,9 (×3), 112,3, 79,3, 64,4, 44,7, 38,3, 35,4, 31,5, 29,9 (×2), 29,7, 29,6 (×2), 29,5 (×3), 29,3 (×2), 27,2 (×3), 25,6, 24,5, 23,3, 226, 14,1; электрораспылительная МС (+ve): молекулярная масса для C44H80NO2 (M+H)+ вычислено: 654,6, найдено: 654,6.
Составы, полученные либо стандартным способом, либо способом без экструзии, могут быть охарактеризованы сходным образом. Например, составы, как правило, охарактеризовывают визуальным исследованием. Они должны представлять собой беловатые прозрачные растворы без агрегатов или осадка. Размер частиц и распределение размера частиц для липидных наночастиц можно измерять по рассеянию света с использованием, например, Malvern Zetasizer Nano ZS (Malvern, США). Частицы должны иметь размер приблизительно 20-300 нм, такой как 40-100 нм. Распределение размера частиц должно быть одномодальным. Общую концентрацию дцРНК в составе, а также удерживаемую фракцию, оценивают с использованием анализа исключения красителя. Образец составленной дцРНК можно инкубировать со связывающим РНК красителем, таким как Ribogreen (Molecular Probes) в присутствии или в отсутствие разрушающего состав поверхностно-активного вещества, например, 0,5% Triton-X100. Общую дцРНК в составе можно определять по сигналу от образца, содержащего поверхностно-активное вещество, относительно стандартной кривой. Удерживаемую фракцию определяют путем вычитания содержания "свободной" дцРНК (при измерении по сигналу в отсутствие поверхностно-активного вещества) из общего содержания дцРНК. Процент удерживаемой дцРНК, как правило, составляет >85%. Для состава SNALP, размер частиц составляет по меньшей мере 30 нм, по меньшей мере 40 нм, по меньшей мере 50 нм, по меньшей мере 60 нм, по меньшей мере 70 нм, по меньшей мере 80 нм, по меньшей мере 90 нм, по меньшей мере 100 нм, по меньшей мере 110 нм и по меньшей мере 120 нм. Пригодный диапазон, как правило, составляет от приблизительно по меньшей мере 50 нм до приблизительно по меньшей мере 110 нм, от приблизительно по меньшей мере 60 нм до приблизительно по меньшей мере 100 нм, или от приблизительно по меньшей мере 80 нм до приблизительно по меньшей мере 90 нм.
Композиции и составы для перорального введения включают порошки или гранулы, микрочастицы, наночастицы, суспензии или растворы в водной или неводной среде, капсулы, желатиновые капсулы, саше, таблетки или минитаблетки. Могут быть желательными загустители, вкусовые добавки, разбавители, эмульгаторы, диспергирующие добавки или связующие вещества. В некоторых вариантах осуществления пероральные составы представляют собой составы, в которых дцРНК по изобретению вводят вместе с одним или несколькими усиливающими проникновение поверхностно-активными веществами и хелаторами. Пригодные поверхностно-активные вещества включают жирные кислоты и/или их сложные эфиры или соли, желчные кислоты и/или их соли. Пригодные желчные кислоты/соли включают хенодезоксихолевую кислоту (CDCA) и урсодезоксихенодезоксихолевую кислоту (UDCA), холевую кислоту, дегидрохолевую кислоту, дезоксихолевую кислоту, глухолевую кислоту, глихолевую кислоту, гликодезоксихолевую кислоту, таурохолевую кислоту, тауродезоксихолевую кислоту, тауро-24,25-дигидрофузидат натрия и гликодигидрофузидат натрия. Пригодные жирные кислоты включают арахидоновую кислоту, ундекановую кислоту, олеиновую кислоту, лауриновую кислоту, каприловую кислоту, каприновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолеиновую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин, дилаурин, глицерил-1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитин, ацилхолин или моноглицерид, диглицерид или их фармацевтически приемлемую соль (например, с натрием). В некоторых вариантах осуществления используют комбинации усиливающих проникновение средств, например, жирные кислоты/соли в комбинации с желчными кислотами/солями. Одной иллюстративной комбинацией является натриевая соль лауриновой кислоты, каприновая кислота и UDCA. Следующие усиливающие проникновение средства включают полиоксиэтилен-9-лауриловый эфир, полиоксиэтилен-20-цетиловый эфир. дцРНК по изобретению можно доставлять перорально, в гранулярной форме, включая высушенные распылением частицы, или в комплексе соединениями, образующими микрочастицы или наночастицы. Образующие комплексы с дцРНК средства включают полиаминокислоты; полиимины; полиакрилаты; полиалкилакрилаты, полиоксиэтаны, полиалкилцианоакрилаты; катионизированные желатины, альбумины, крахмалы, акрилаты, полиэтиленгликоли (PEG) и крахмалы; полиалкилцианоакрилаты; производные полииминов с DEAE, пуллуланы, целлюлозы и крахмалы. Пригодные образующие комплекс средства включают хитозан, N-триметилхитозан, поли-L-лизин, полигистидин, полиорнитин, полиспермины, протамин, поливинилпиридин, политиодиэтиламинометилэтилен P (TDAE), полиаминостирол (например, п-амино), поли(метилцианоакрилат), поли(этилцианоакрилат), поли(бутилцианоакрилат), поли(изобутилцианоакрилат), поли(изогексилцианоакрилат), DEAE-метакрилат, DEAE-гексилакрилат, DEAE-акриламид, DEAE-альбумин и DEAE-декстран, полиметилакрилат, полигексилакрилат, поли(D,L-молочная кислота), сополимер DL-молочная кислота гликолевая кислота (PLGA), альгинат и полиэтиленгликоль (PEG). Пероральные составы для дцРНК и их получение подробно описаны в патенте США 6887906, публикации США № 20030027780 и патенте США № 6747014, каждый из которых включен в настоящее описание в качестве ссылки.
Композиции и составы для парентерального, интрапаренхиматозного (в головной мозг), интратекальногго, внутрижелудочкового или внутрипеченочного введения могут включать стерильные водные растворы, которые также могут содержать буферы, разбавители и другие пригодные добавки, такие как, но не ограничиваясь ими, усиливающие проникновение средства, соединения носителей и другие фармацевтически приемлемые носители или эксципиенты.
Фармацевтические композиции по настоящему изобретению включают, но не ограничиваются ими, растворы, эмульсии и содержащие липосомы составы. Эти композиции можно получать из различных компонентов, которые включают, но не ограничиваются ими, предварительно составленные жидкости, самоэмульгирующиеся твердые вещества и самоэмульгирующиеся полутвердые вещества. Особенно предпочтительными являются составы, которые нацелены на печень, при лечении нарушений печени, таких как карцинома печени.
Фармацевтические составы по настоящему изобретению, которые удобно предоставлять в единичной дозированной форме, можно получать общепринятыми способами, хорошо известными в фармацевтической промышленности. Такие способы включают стадию объединения активных ингредиентов с фармацевтическим носителем(ями) или эксципиентом(ами). Как правило, составы приготавливают посредством единообразного и равномерного объединения активных ингредиентов с жидкими носителями ли мелкоизмельченными твердыми носителями, или с обоими из них, а затем, если необходимо, придания продукту формы.
Композиции по настоящему изобретению можно составлять в любую из множества возможных дозированных форм, таких как, но не ограничиваясь ими, таблетки, капсулы, желатиновые капсулы, жидкие сиропы, мягкие гели, суппозитории и клизмы. Композиции по настоящему изобретению также могут быть составлены в качестве суспензий в водных, неводных или смешанных средах. Водные суспензии, кроме того, могут содержать вещества, которые повышают вязкость суспензий, включая, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран. Суспензия также может содержать стабилизаторы.
C. Дополнительные составы
i. Эмульсии
Композиции по настоящему изобретению можно получать и составлять в качестве эмульсий. Эмульсии, как правило, представляют собой гетерогенные системы из одной жидкости, диспергированной в другой жидкости в форме капель, диаметр которых обычно превышает 0,1 мкм (смотрите, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., Volume 1, p. 245; Block in Pharmaceutical Dosage Forms, Lieberman, Rieger и Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 2, p. 335; Higuchi et al., in Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 301). Эмульсии часто представляют собой двухфазные системы, содержащие две несмешивающихся жидких фазы тщательно перемешанных и диспергированных друг с другом. Как правило, эмульсии могут представлять собой эмульсии либо типа "вода-в-масле" (w/o), либо "масло-в-воде" (o/w). Когда водная фаза мелко раздроблена и диспергирована на мелкие капли в объемной масляной фазе, полученную композицию называют эмульсией типа "вода-в-масле" (w/o). Альтернативно, когда масляная фаза мелко раздроблена и диспергирована на мелкие капли в объемной водной фазе, полученную композицию называют эмульсией типа "масло-в-воде" (o/w). Эмульсии могут содержать дополнительные компоненты в дополнение к диспергированным фазам, и активное лекарственное средство, которое может присутствовать в качестве раствора либо в водной фазе, либо в масляной фазе, либо сама по себе в качестве отдельной фазы. Также при необходимости в эмульсиях могут присутствовать фармацевтические эксципиенты, такие как эмульгаторы, стабилизаторы, красители и антиоксиданты. Фармацевтические эмульсии также могут представлять собой гетерогенные эмульсии, которые содержат более двух фаз такие как, например, эмульсии типа "масло-в-воде-в-масле" (o/w/o) и "вода-в-масле-в-воде" (w/o/w). Такие комплексные составы часто обеспечивают особенные преимущества, которые простые бинарные системы не обеспечивают. Гетерогенные эмульсии, в которых индивидуальные масляные капли эмульсии типа o/w заключают в себе мелкие водяные капли, представляют собой эмульсию типа w/o/w. Аналогично, система масляных капель, заключенных в капли воды, стабилизированные в масляной непрерывной фазе, обеспечивает эмульсию типа o/w/o.
Эмульсии характеризуются малой термодинамической стабильностью или ее отсутствием. Часто, диспергированная или непрерывная фаза эмульсии хорошо диспергирована во внешней или непрерывной фазе и поддерживается в этой форме с помощью эмульгаторов или вязкости состава. Любая из фаз эмульсии может быть полутвердой или твердой, как в случае основ мазей и кремов эмульсионного типа. Другие способы стабилизации эмульсий включают применение эмульгаторов, которые могут быть включены в любую фазу эмульсии. Эмульгаторы можно ориентировочно подразделить на четыре категории: синтетические поверхностно-активные вещества, встречающиеся в природе эмульгаторы, абсорбирующая основы и мелкодисперсные твердые вещества (смотрите, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., и Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Синтетические поверхностно-активные вещества, также известные как поверхностно-активные вещества, широко применяются при составлении эмульсий и описаны в литературе (смотрите, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., и Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rieger, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285; Idson, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), Marcel Dekker, Inc., New York, N.Y., 1988, volume 1, p. 199). Поверхностно-активные вещества, как правило, являются амфифильными и содержат гидрофильную и гидрофобную часть. Соотношение гидрофильной и гидрофобной природы поверхностно-активного вещества называют гидрофильным/липофильным равновесием (HLB), и оно является ценным инструментом при распределении на категории и выборе поверхностно-активных веществ при получении составов. Поверхностно-активные вещества могут быть подразделены на различные классы, исходя из природы гидрофильной группы: неионные, анионные, катионные и амфотерные (смотрите, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., и Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY Rieger, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285).
Встречающиеся в природе эмульгаторы, используемые в эмульсионных составах, включают ланолин, пчелиный воск, фосфатиды, лецитин и гуммиарабик. Абсорбирующие основы обладают липофильными свойствами, так что они могут впитывать воду с образованием эмульсий типа w/o, но, тем не менее, сохранять их полутвердую консистенцию, такие как безводный ланолин и гидрофильный вазелин. Мелкодисперсные твердые вещества используют в качестве хороших эмульгаторов, особенно в комбинации с поверхностно-активными веществами и в вязких препаратах. Они включают полярные неорганические твердые вещества, такие как гидроксиды тяжелых металлов, неразбухающие глины, такие как бентонит, аттапульгит, гекторит, каолин, монтмориллонит, коллоидный силикат алюминия и коллоидный алюмосиликат магния, пигменты и неполярные твердые вещества, такие как углерод или глицерилтристеарат.
Широкое множество неэмульгирующих материалов также включено в эмульсионные составы, и они вносят вклад в свойства эмульсий. Они включают жиры, масла, воски, жирные кислоты, жирные спирты, жирные сложные эфиры, увлажнители, гидрофильные коллоидные вещества, консерванты и антиоксиданты (Block, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335; Idson, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Гидрофильные коллоидные вещества или гидроколлоидные вещества включают встречающиеся в природе камеди и синтетические полимеры, такие как полисахариды (например, гуммиарабик, агар, альгиновая кислота, каррагенан, гуаровая камедь, камедь карайи и трагакант), производные целлюлозы (например, карбоксиметилцеллюлоза и карбоксипропилцеллюлоза) и синтетические полимеры (например, карбомеры, простые эфиры целлюлозы и карбоксивиниловые полимеры). Они диспергируются и разбухают в воде с образованием коллоидных растворов, которые стабилизируют эмульсии путем образования сильных межповерхностных пленок вокруг капель дисперсной фазы и путем увеличения вязкости внешней фазы.
Поскольку эмульсии часто содержат ряд ингредиентов, таких как углеводы, белки, стерины и фосфатиды, которые могут хорошо поддерживать рост микроорганизмов, эти составы часто включают консерванты. Широко используемые консерванты, включенные в эмульсионные составы, включают метилпарабен, пропилпарабен, четвертичные соли аммония, хлорид бензалкония, сложные эфиры п-гидроксибензойной кислоты и борную кислоту. Антиоксиданты также часто добавляют в эмульсионные составы для предотвращения порчи состава. Используемые антиоксиданты могут представлять собой ловушки свободных радикалов, такие как токоферолы, алкилгаллаты, бутилированный гидроксианизол, бутилированный гидрокситолуол или восстановители, такие как аскорбиновая кислота и метабисульфит натрия, и синергисты антиоксидантов, такие как лимонная кислота, виннокаменная кислота и лецитин.
Применение эмульсионных составов дерматологическими, пероральными и парентеральными путями и способы их изготовления рассмотрены в литературе (смотрите, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HQ, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Эмульсиионные составы для пероральной доставки очень широко используют, вследствие простоты составления, а также эффективности с точки зрения всасывания и биодоступности (смотрите, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Idson, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Слабительные средства на основе минерального масла, жирорастворимые витамины и питательные препараты с высоким содержанием жиров находятся среди материалов, которые часто вводят перорально в качестве эмульсий типа o/w.
ii. Микроэмульсии
В одном варианте осуществления настоящего изобретения композиции i-РНК и нуклеиновые кислоты составляют в качестве микроэмульсий. Микроэмульсия может быть определена как система воды, масла и амфифильного вещества, которая представляет собой единый оптически изотропный и термодинамически стабильный жидкий раствор (смотрите, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., и Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245). Как правило, микроэмульсии представляют собой системы, которые получают, сначала диспергируя масло в водном растворе поверхностно-активного вещества, а затем добавляя достаточное количество четвертого компонента, как правило, спирта средней длины цепи, с получением прозрачной системы. Таким образом, микроэмульсии описаны как термодинамически стабильные, изотропно прозрачные дисперсии двух несмешивающихся жидкостей, которые стабилизированы межповерхностными пленками поверхностно-активных молекул (Leung and Shah, Controlled Release of Drug: Polymers and Aggregate Systems, Rosoff, M., Ed., 1989, VCH Publishers, New York, pages 185-215). Микроэмульсии часто получают с помощью комбинации от трех до пяти компонентов, которые включают масло, воду, поверхностно-активное вещество, дополнительное поверхностно-активное вещество и электролит. То, является ли микроэмульсия микроэмульсией типа "вода-в-масле" (w/o) или "масло-в-воде" (o/w), зависит от свойств используемого масла и поверхностно-активного вещества и от структуры и геометрической укладки полярных головок и углеводородных хвостов молекул поверхностно-активного вещества (Schott, Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 271).
Был широко исследован феноменологический подход с использованием фазовых диаграмм, и он обеспечил обширную информацию специалисту в данной области о том, как составлять микроэмульсии (смотрите, например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC, 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Block, Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335). По сравнению с общепринятыми эмульсиями, микроэмульсии обеспечивают преимущество солюбилизации нерастворимых в воде лекарственных средств в составе термодинамически стабильных капель, которые образуются самопроизвольно.
Поверхностно-активные вещества, используемые для получения микроэмульсий, включают, но не ограничиваются ими, ионные поверхностно-активные вещества, неионные поверхностно-активные вещества, Brij 96, олеиловые эфиры полиоксиэтилена, сложные эфиры жирных кислот и полиглицерина, монолаурат тетраглицерина (ML310), моноолеат тетраглицерина (MO310), гексаглицерин моноолеат (PO310), гексаглицерин пентаолеат (PO500), декаглицерин монокапрат (MCA750), декаглицерин моноолеат (MO750), декаглицерин секвиолеат (SO750), декаглицерин декаолеат (DAO750), отдельно или в комбинации с дополнительными поверхностно-активными веществами. Дополнительное поверхностно-активное вещество, обычно спирт короткой цепи, такой как этанол, 1-пропанол и 1-бутанол, служит для увеличения поверхностной текучести посредством проникновения в пленку поверхностно-активного вещества и последующего образования разупорядоченной пленки вследствие пустоты, между молекулами поверхностно-активного вещества. Однако микроэмульсии можно получать без использования дополнительных поверхностно-активных веществ, и бесспиртовые самоэмульгирующиеся микроэмульсионные системы известны в данной области. Водная фаза, как правило, может представлять собой, но не ограничиваться ими, воду, водный раствор лекарственного средства, глицерин, PEG300, PEG400, полиглицерины, пропиленгликоли и производные этиленгликоля. Масляная фаза может включать, но не ограничиваться ими, материалы, такие как Captex 300, Captex 355, Capmul MCM, сложные эфиры жирных кислот, моно, ди и три-глицериды средней длины цепи (C8-C12), полиоксиэтилированные глицериловые сложные эфиры жирных кислот, жирные спирты, полигликолированные глицериды, насыщенные полигликолированные C8-C10 глицериды, растительные масла и силиконовое масло.
Микроэмульсии представляют особый интерес с точки зрения солюбилизации лекарственного средства и усиленного всасывания лекарственных средств. Было предположено, что микроэмульсии на основе липидов (как o/w, так и w/o) повышают пероральную биодоступность лекарственных средств, включая пептиды (смотрите, например, патенты США № 6191105; 7063860; 7070802; 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385-1390; Ritschel, Meth. Find. Exp. Clin. Pharmacol., 1993, 13, 205). Микроэмульсии обеспечивают преимущества увеличенной солюбилизации лекарственного средства, защиты лекарственного средства от ферментативного гидролиза, возможного усиления всасывания лекарственного средства вследствие индуцированных поверхностно-активным веществом изменений текучести и проницаемости мембраны, простоты получения, простоты перорального введения относительно твердых дозированных форм, увеличенной клинической эффективности и сниженной токсичности (смотрите, например, патенты США № 6191105; 7063860; 7070802; 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385; Ho et al., J. Pharm. Sci., 1996, 85, 138-143). Часто микроэмульсии могут образовываться самопроизвольно, когда их компоненты объединяют при температуре окружающей среды. Это может быть особенно преимущественным при составлении термолабильных лекарственных средств, пептидов или i-РНК. Микроэмульсии также являются эффективными в отношении трансдермальной доставки активных компонентов как в косметических, так и в фармацевтических применениях. Ожидается, что микроэмульсионные композиции и составы по настоящему изобретению будут способствовать увеличенному системному всасыванию i-РНК и нуклеиновых кислот из желудочно-кишечного тракта, а также увеличат локальный клеточный захват i-РНК и нуклеиновых кислот.
Микроэмульсии по настоящему изобретению также могут содержать дополнительные компоненты и добавки, такие как сорбитан моностеарат (Grill 3), Labrasol и усиливающие проникновение средства для улучшения свойств состава и для усиления всасывания i-РНК и нуклеиновых кислот по настоящему изобретению. Усиливающие проникновения средства, используемые в микроэмульсиях по настоящему изобретению, могут быть классифицированы как принадлежащие одной из пяти широких категорий: поверхностно-активные вещества, жирные кислоты, желчные соли, хелатирующие агенты и нехелатирующие не поверхностно-активные вещества (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p. 92). Каждый из этих классов рассмотрен выше.
iii. Микрочастицы
Средство РНК-i по изобретению может быть включено в частицу, например, микрочастицу. Микрочастицы можно получать распылительной сушкой, но также их можно получать другими способами, включающими лиофилизацию, выпаривание, сушку в псевдоожиженном слое, вакуумную сушку или комбинацию этих способов.
iv. Усиливающие проникновение средства
В одном варианте осуществления в рамках настоящего изобретения используются различные усиливающие проникновение средства для обеспечения эффективной доставки нуклеиновых кислот, в частности i-РНК, в кожу животных. Большинство лекарственных средств находятся в растворе как в ионизированной, так и в неионизированной формах. Однако обычно только растворимые в липидах и липофильные лекарственные средства без труда проходят через клеточные мембраны. Было обнаружено, что даже нелипофильные лекарственные средства могут проходить через клеточные мембраны, если мембрану, подлежащую прохождению, обработать усиливающим проникновение средством. В дополнение к способствованию диффузии нелипофильных лекарственных средств через клеточные мембраны, усиливающие проникновение средства также усиливают проницаемость липофильных лекарственных средств.
Усиливающие проникновение средства могут быть классифицированы как принадлежащие одной из пяти широких категорий, т.е. поверхностно-активные вещества, жирные кислоты, желчные соли, хелатирующие агенты и нехелатирующие неповерхностно-активные вещества (смотрите, например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92). Каждый из упомянутых выше классов усиливающих проникновение средств более подробно описан ниже.
Сефактанты (или "поверхностно-активные вещества") представляют собой химические соединения, которые при растворении в водном растворе уменьшают поверхностное натяжение раствора или межповерхностное натяжение между водным раствором и дрогой жидкостью, результатом чего является то, что всасывание i-РНК через слизистую оболочку усиливается. В дополнение к желчным солям и жирным кислотам, эти усиливающие проникновение вещества включают, например, лаурилсульфат натрия, полиоксиэтилен-9-лауриловый эфир и полиоксиэтилен-20-цетиловый эфир) (смотрите, например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92); и перфторхимические эмульсии, такие как FC-43. Takahashi et al., J. Pharm. Pharmacol., 1988, 40, 252).
Различные жирные кислоты и их производные, которые действуют в качестве усиливающих проникновение средств, включают, например, олеиновую кислоту, лауриновую кислоту, каприновую кислоту (н-декановую кислоту), миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолеиновая кислота, линоленовую кислоту, дикапрат, трикапрат, моноолеин (1-моноолеил-rac-глицерин), дилаурин, каприловую кислоту, арахидоновую кислоту, глицерин 1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитины, ацилхолины, их C1-20алкиловые сложные эфиры (например, метиловый, изопропиловый и трет-бутиловый) и их моно- и диглицериды (т.е. олеат, лаурат, капрат, миристат, пальмитат, стеарат, линолеат и т.д.) (смотрите, например, Touitou, E., et al. Enhancement in Drug Delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p. 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; El Hariri et al., J. Pharm. Pharmacol., 1992, 44, 651-654).
Физиологическая роль желчи включает способствование диспергированию и всасыванию липидов и жирорастворимых витаминов (смотрите, например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Brunton, Chapter 38 in: Goodman & Oilman's The Pharmacological Basis of Therapeutics, 9th Ed., Hardman et al. Eds., McGraw-Hill, New York, 1996, pp. 934-935). Различные природные соли желчных кислот и их синтетические производные действуют в качестве усиливающих проникновение средств. Таким образом, термин "желчные соли" включают любые из встречающихся в природе компонентов желчи, а также любые из их синтетических производных. Пригодные желчные соли включают, например, холевую кислоту (или ее фармацевтически приемлемую натрий соль холат натрия), дегидрохолевую кислоту (дегидрохолат натрия), дезоксихолевую кислоту (дезоксихолат натрия), глухолевую кислоту (глухолат натрия), глихолевую кислоту (гликохолат натрия), гликодезоксихолевую кислоту (гликодезоксихолат натрия), таурохолевую кислоту (таурохолат натрия), тауродезоксихолевую кислоту (тауродезоксихолат натрия), хенодезоксихолевую кислоту (хенодезоксихолат натрия), урсодезоксихолевую кислоту (UDCA), тауро-24,25-дигидрофузидат натрия (STDHF), гликодигидрофузидат натрия и полиоксиэтилен-9-лауриловый эфир (POE) (смотрите, например, Malmsten, M. Drugs and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Swinyard, Chapter 39 In: Remington's Pharmaceutical Sciences, 18th Ed., Gennaro, ed., Mack Publishing Co., Easton, Pa., 1990, pages 782-783; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Yamamoto et al., J. Pharm. Exp. Ther., 1992, 263, 25; Yamashita et al., J. Pharm. Sci., 1990, 79, 579-583).
Хелатирующие агенты, как используют применительно к настоящему изобретению, могут быть определены как соединения, которые удаляют ионы металла из раствора посредством образования комплексов с ними, в результате чего всасывание i-РНК через слизистую оболочку усиливается. Что касается их применения в качестве усиливающих проникновение средств в рамках настоящего изобретения, хелатирующие агенты обеспечили дополнительное преимущество, состоящее в том, что они также служат в качестве ингибиторов ДНК-азы, поскольку для наиболее охарактеризованных ДНК-нуклеаз требуется двухвалентный ион металла для катализа и, таким образом, они ингибируются хелатирующими агентами (Jarrett, J. Chromatogr., 1993, 618, 315-339). Пригодные хелатирующие агенты включают, но не ограничиваются ими, динатрий этилендиаминтатраацетат (ЭДТА), лимонную кислоту, салицилаты (например, салицилат натрия, 5-метоксисалицилат и гомованилат), N-ацильные производные коллагена, лаурет-9 и N-аминоацилпроизводные бета-дикетонов (енамины) (смотрите, например, Katdare, A. et al., Excipient development for pharmaceutical, biotechnology, and drug delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Buur et al., J. Control Rel, 1990, 14, 43-51).
Как используют в рамках изобретения, нехелатирующие неповерхностно-активные усиливающие проникновение соединения могут быть определены как соединения, которые демонстрируют незначительную активность в качестве хелатирующих агентов или в качестве поверхностно-активных веществ, но, тем не менее, повышают всасывание i-РНК через слизистую оболочку пищеварительного тракта (смотрите, например, Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33). Этот класс усиливающих проникновение средств включает, например, ненасыщенную циклическую мочевину, производные 1-алкил- и 1-алкенилазациклоалканона (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92); и нестероидные противовоспалительные средства, такие как диклофенак натрий, индометацин и фенилбутазон (Yamashita et al., J. Pharm. Pharmacol., 1987, 39, 621-626).
Также в фармацевтические и другие композиции по настоящему изобретению можно добавлять средства, которые повышают захват i-РНК на клеточном уровне. Например, известно, что катионные липиды, такие как липофектин (Junichi et al., патент США № 5705188), катионные производные глицерина и поликатионные молекулы, такие как полилизин (Lollo et al., заявка PCT № WO 97/30731) повышают захват клетками дцРНК. Примеры коммерчески доступных реагентов для трансфекции включают, например Lipofectamine™ (Invitrogen; Carlsbad, CA), Lipofectamine 2000™ (Invitrogen; Carlsbad, CA), 293fectin™ (Invitrogen; Carlsbad, CA), Cellfectin™ (Invitrogen; Carlsbad, CA), DMRIE-C™ (Invitrogen; Carlsbad, CA), FreeStyle™ MAX (Invitrogen; Carlsbad, CA), Lipofectamine™ 2000 CD (Invitrogen; Carlsbad, CA), Lipofectamine™ (Invitrogen; Carlsbad, CA), RNAiMAX (Invitrogen; Carlsbad, CA), Oligofectamine™ (Invitrogen; Carlsbad, CA), Optifect™ (Invitrogen; Carlsbad, CA), X-tremeGENE Q2 Transfection Reagent (Roche; Grenzacherstrasse, Швейцария), DOTAP Liposomal Transfection Reagent (Grenzacherstrasse, Швейцария), DOSPER Liposomal Transfection Reagent (Grenzacherstrasse, Швейцария) или Fugene (Grenzacherstrasse, Швейцария), Transfectam® Reagent (Promega; Madison, WI), TransFast™ Transfection Reagent (Promega; Madison, WI), Tfx™-20 Reagent (Promega; Madison, WI), Tfx™-50 Reagent (Promega; Madison, WI), DreamFect™ (OZ Biosciences; Marseille, France), EcoTransfect (OZ Biosciences; Marseille, France), TransPassa D1 Transfection Reagent (New England Biolabs; Ipswich, MA, USA), LyoVec™/LipoGen™ (Invitrogen; San Diego, CA, США), PerFectin Transfection Reagent (Genlantis; San Diego, CA, США), NeuroPORTER Transfection Reagent (Genlantis; San Diego, CA, США), GenePORTER Transfection Reagent (Genlantis; San Diego, CA, США), GenePORTER 2 Transfection Reagent (Genlantis; San Diego, CA, США), Cytofectin Transfection Reagent (Genlantis; San Diego, CA, США), BaculoPORTER Transfection Reagent (Genlantis; San Diego, CA, США), TroganPORTER™ Transfection Reagent (Genlantis; San Diego, CA, США), RiboFect (Bioline; Taunton, MA, США), PlasFect (Bioline; Taunton, MA, США), UniFECTOR (B-Bridge International; Mountain View, CA, США), SureFECTOR (B-Bridge International; Mountain View, CA, США) или HiFect™ (B-Bridge International, Mountain View, CA, США), среди прочих.
Для повышения проникновения вводимых нуклеиновых кислот можно использовать другие средства, в том числе гликоли, такие как этиленгликоль и пропиленгликоль, пирролы, такие как 2-пиррол, азоны и терпены, такие как лимонен и ментон.
v. Носители
Состав определенных композиций по настоящему изобретению также включает соединения носителей. Как используют в рамках изобретения, "соединение носителя" или "носитель" может относиться к нуклеиновой кислоте или ее аналогу, которые являются инертными (т.е. сами по себе не обладают биологической активностью), однако распознается как нуклеиновая кислота в процессах in vivo, которые снижают биодоступность нуклеиновой кислоты, имеющей биологическую активность, например, посредством разрушения биологически активной нуклеиновой кислоты или стимуляции ее удаления из циркуляции. Совместное введение нуклеиновой кислоты и соединения носителя, как правило, с избытком последнего из веществ, может приводить к значительному уменьшению количества нуклеиновой кислоты, утилизированного в печени, почке или других внециркуляторных резервуарах, предположительно вследствие конкуренции между соединением носителя и нуклеиновой кислотой за общий рецептор. Например, утилизация частично фосфоротиоатной дцРНК в ткани печени может быть снижена, если ее совместно вводить с полиинозировой кислотой, сульфатом декстрана, полицтидиновой кислотой или 4-ацетамидо-4'-изотиоцианостилбен-2,2'-дисульфоновой кислотой (Miyao et al., DsRNA Res. Dev., 1995, 5, 115-121; Takakura et al., DsRNA & Nucl. Acid Drug Dev., 1996, 6, 177-183.
vi. Эксципиенты
В противоположность соединению носителя, "фармацевтический носитель" или "эксципиент" представляет собой фармацевтически приемлемый растворитель, суспендирующее вещество или любой другой фармакологически инертный носитель для доставки одной или нескольких нуклеиновых кислот животному. Эксципиент может представлять собой жидкость или твердое вещество, и его выбирают, учитывая планируемый способ введения, так, чтобы обеспечивать желаемый объем, консистенцию и т.д., при комбинировании с нуклеиновой кислотой и другими компонентами данной фармацевтической композиции. Типичные фармацевтические носители включают, но не ограничиваются ими, связующие вещества (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза, и т.д.); наполнители (например, лактоза и другие сахара, микрокристаллическая целлюлоза, пектин, желатин, сульфат кальция, этилцеллюлоза, полиакрилаты или гидрофосфат кальция, и т.д.); смазывающие вещества (например, стеарат магния, тальк, диоксид кремния, коллоидный диоксид кремния, стеариновая кислота, металлсодержащие стеараты, гидрогенизированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия и т.д.); дезинтегрирующие вещества (например, крахмал, натрия крахмала гликолят, и т.д.); и смачивающие вещества (например, лаурилсульфат натрия, и т.д.).
Также для составления композиций по настоящему изобретению можно использовать фармацевтически приемлемые органические или неорганические эксципиенты, пригодные для непарентерального введения, которые не реагируют неблагоприятным образом с нуклеиновыми кислотами. Пригодные фармацевтически приемлемые носители включают, но не ограничиваются ими, воду, солевые растворы, спирты, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и т.п.
Составы для местного введения нуклеиновых кислот могут включать стерильные и нестерильные водные растворы, неводные растворы в обычных растворителях, таких как спирты, или растворы нуклеиновых кислот в жидкой или твердой масляных основах. Растворы также могут содержать буферы, разбавители и другие пригодные добавки. Можно использовать фармацевтически приемлемые органические или неорганические эксципиенты, пригодные для непарентерального введения, которые не реагируют неблагоприятным образом с нуклеиновыми кислотами.
Пригодные фармацевтически приемлемые эксципиенты включают, но не ограничиваются ими, воду, солевые растворы, спирт, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и т.п.
vii. Другие компоненты
Композиции по настоящему изобретению, кроме того, могут содержать другие дополнительные компоненты, обычно присутствующие в фармацевтических композициях, на уровнях, установленных для них в данной области. Таким образом, например, композиции могут содержать дополнительные совместимые фармацевтически активные материалы, например, такие как противозудные средства, вяжущие средства, местные анестетики или противовоспалительные средства, или они могут содержать дополнительные материалы, пригодные для физического составления различных дозированных форм композиций по настоящему изобретению, такие как красители, вкусовые добавки, консерванты, антиоксиданты, замутнители, загустители и стабилизаторы. Однако такие материалы при добавлении не должны ненадлежащим образом препятствовать биологической активности компонентов композиций по настоящему изобретению. Составы можно стерилизовать и, если желательно, смешивать со вспомогательными средствами, например, смазывающими веществами, консервантами, стабилизаторами, смачивающими веществами, эмульгаторами, солями для влияния на осмотическое давление, буферами, красителями, вкусовыми добавками и/или ароматическими веществами и т.п., которые не взаимодействуют неблагоприятным образом с нуклеиновой кислотой(ами) состава.
Водные суспензии могут содержать вещества, которые повышают вязкость суспензии, включая, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран. Суспензия также может содержать стабилизаторы.
В некоторых вариантах осуществления фармацевтические композиции по изобретению включают (a) одно или несколько соединений i-РНК и (b) одно или несколько средств, которые функционируют посредством механизма, не обусловленного РНК-i, и которые пригодны для лечения геморрагического нарушения. Примеры таких средств включают, но не ограничиваются ими, противовоспалительное средство, средство против стеатоза, противовирусное средство и/или антифибротическое средство. Кроме того, также вместе с i-РНК, описанными в настоящем описании, можно использовать вещества, обычно используемые для защиты печени, такие как силимарин. Другие средства, пригодные для лечения заболеваний печени, включают телбувидин, энтекавир и ингибиторы протеазы, такие как телепревир, и другие средства, описанные, например, в Tung et al., публикациях заявок США № 2005/0148548, 2004/0167116 и 2003/0144217; и в Hale et al., публикация заявки США № 2004/0127488.
Токсичность и терапевтическую эффективность таких соединений можно определять с помощью стандартных фармацевтических способов в культурах клеток или у экспериментальных животных, например, для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная в 50% популяции). Соотношение доз между токсическими и терапевтическими эффектами представляет собой терапевтический индекс, и он может быть выражен как соотношение LD50/ED50. Предпочтительными являются соединения, которые проявляют высокие терапевтические индексы.
Данные, полученные в анализах клеточной культуры и в исследованиях на животных, можно использовать при составлении ряда дозировок для применения у человека. Дозировка композиций по изобретению, как правило, находится в диапазоне циркулирующих концентраций, которые включают ED50 с малой токсичностью или без токсичности. Дозировка может варьировать в этом диапазоне в зависимости от используемой дозированной формы и используемого пути введения. Для любого соединения, используемого в способах по изобретению, терапевтически эффективную дозу можно первоначально оценивать в анализах культур клеток. Дозу можно составлять в моделях на животных так, чтобы достигнуть диапазона циркулирующих концентраций в плазме для соединения или, в соответствующих случаях, полипептидного продукта с заданной последовательностью (например, достижение сниженной концентрации полипептида), которые включают IC50 (т.е. концентрация исследуемого соединения, которая обеспечивает полумаксимальное ингибирование симптомов) при определении в клеточной культуре. Такую информацию можно использовать, чтобы более точно определить пригодные дозы у человека. Уровни в плазме можно измерять, например, с помощью высокоэффективной жидкостной хроматографии.
В дополнение к их введению, как рассмотрено выше, i-РНК по изобретению можно вводить в комбинации с другими известными средствами, эффективными для лечения патологических процессов, опосредуемых экспрессией серпина c1. В любом случае осуществляющий введение врач может корректировть количество и время введения i-РНК, исходя из результатов, выявляемых с использованием стандартных показателей эффективности, известных в данной области или описанных в настоящем описании.
VI. Способы по изобретению
Настоящее изобретение также относится к способам применения i-РНК по изобретению и/или композиции, содержащей i-РНК по изобретению, для снижения и/или ингибирования экспрессии серпина c1 в клетке. В других аспектах настоящее изобретение относится к i-РНК по изобретению и/или композиции, содержащей i-РНК по изобретению, для применения для снижения и/или ингибирования экспрессии серпина c1 в клетке. В других аспектах, предусматривается применение i-РНК по изобретению и/или композиции, содержащей i-РНК по изобретению, для изготовления лекарственного средства для снижения и/или ингибирования экспрессии серпина c1 в клетке.
Способы и применения включают контактирование клетки с i-РНК, например дцРНК, по изобретению и поддержание клетки в течение периода времени, достаточного для достижения деградации мРНК-транскрипта гена серпина c1, тем самым ингибируя экспрессию гена серпина c1 в клетке. Снижение экспрессии гена можно оценивать любыми способами, известными в данной области. Например, снижение экспрессии серпина c1 можно определять путем определения уровня экспрессии мРНК серпина c1 с использованием способов, известных специалисту в данной области, например, нозерн-блоттинга, qRT-ПЦР, путем определения уровня белка серпина c1 с использованием способов, известных специалисту в данной области, таких как вестерн-блоттинг, иммунологические способы, и/или путем определения биологической активности серпина c1, такого как влияние на одну или несколько молекул, ассоциированных с клеточным механизмом свертывания крови (или, в условиях in vivo, само свертывание крови).
В способах и применениях по изобретению клетку можно контактировать in vitro или in vivo, т.е. клетка может находиться в индивидууме.
Клетка, пригодная для обработки с использованием способов по изобретению, может представлять собой любую клетку, которая экспрессирует ген серпина c1. Клетка, пригодная для применения в способах и применениях по изобретению, может представлять собой клетку млекопитающего, например, клетку примата (такую как клетка человека или клетка не являющегося человеком примата, например, клетка обезьяны или клетка шимпанзе), клетку не являющегося человеком примата (такую как клетка коровы, клетка свиньи, клетка верблюда, клетка ламы, клетка лошади, клетка козы, клетка кролика, клетка овцы, клетка хомяка, клетка морской свинки, клетка кошки, клетка собаки, клетка крысы, клетка мыши, клетка льва, клетка тигра, клетка медведя или клетка буйвола), клетку птицы (например, клетка утки или клетка гуся) или клетку кита. В одном варианте осуществления клетка представляет собой клетку человека, например, клетку печени человека.
Экспрессия серпина c1 может ингибироваться в клетке по меньшей мере на приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или приблизительно 100%.
Способы и применения in vivo могут включать введение индивидууму композиции, содержащей i-РНК, где i-РНК включает нуклеотидную последовательность, которая комплементарна по меньшей мере части РНК-транскрипта гена серпина c1 млекопитающего, подлежащего лечению. Когда организм, подлежащий лечению, представляет собой млекопитающее, такое как человек, композицию можно вводить любым способом, известным в данной области, включая, но не ограничиваясь ими, пероральный, внутрибрюшинный или парентеральный пути, включая внутричерепное (например, внутрижелудочковое, интрапаренхиматозное и интратекальное введение), внутривенное, внутримышечное, подкожное, трансдермальное введение, введение через дыхательные пути (аэрозоль), назальное, ректальное и местное (включая буккальное и сублингвальное) введение. В определенных вариантах осуществления композиции вводят путем внутривенной инфузии или инъекции.
В некоторых вариантах осуществления введение осуществляют посредством депо-инъекции. Депо-инъекция может высвобождать i-РНК непрерывным образом в течение длительного периода времени. Таким образом, депо-инъекция может снижать частоту дозирования, необходимую для получения желаемого эффекта, например, желаемое ингибирование серпина c1, или терапевтический или профилактический эффект. Депо-инъекция также может обеспечить более постоянные концентрации в сыворотке. Депо-инъекции могут включать подкожные инъекции или внутримышечные инъекции. В предпочтительных вариантах осуществления депо-инъекция представляет собой подкожную инъекцию.
В некоторых вариантах осуществления введение осуществляют через насос. Насос может представлять собой внешний насос или хирургически имплантируемый насос. В определенных вариантах осуществления насос представляет собой подкожно имплантируемый осмотический насос. В других вариантах осуществления насос представляет собой инфузионный насос. Инфузионный насос можно использовать для внутривенных, подкожных, артериальных или эпидуральных инфузий. В предпочтительных вариантах осуществления инфузионный насос представляет собой насос для подкожных инфузий. В других вариантах осуществления насос представляет собой хирургически имплантируемый насос, который доставляет i-РНК в печень. Способ введения может быть выбран, исходя из того, является ли желательным локальное или системное введение, и от области, подлежащей лечению. Путь и область введения могут быть выбраны так, чтобы усилить нацеливание.
В одном аспекте настоящее изобретение также относится к способам ингибирования экспрессии гена серпина c1 у млекопитающего, например, человека. Настоящее изобретение также относится к композиции, содержащей i-РНК, например, дцРНК, которая нацелена на ген серпина c1 в клетке млекопитающего для применения для ингибирования экспрессии гена серпина c1 у млекопитающего. В другом аспекте настоящее изобретение относится к применению i-РНК, например, дцРНК, которая нацелена на ген серпина c1 в клетке млекопитающего, для изготовления лекарственного средства для ингибирования экспрессии гена серпина c1 у млекопитающего.
Способы и применения включают введение млекопитающему, например человеку, композиции, содержащей i-РНК, например дцРНК, которая нацелена на ген серпина c1, в клетке млекопитающего и поддержание у млекопитающего в течение периода времени, достаточного для деградации мРНК-транскрипта гена серпина c1, тем самым, ингибируя экспрессию гена серпина c1 у млекопитающего.
Снижение экспрессии гена можно оценивать способами, известными в данной области и способами, например qRT-ПЦР, описанными в настоящем описании. Снижение продукции белка можно оценивать любыми способами, известными в данной области, и способами, например ELISA, описанными в настоящем описании. В одном варианте осуществления пункционный биоптат печени служит в качестве тканевого материала для снижения экспрессии гена и/или белка серпина c1. В другом варианте осуществления образец крови служит в качестве тканевого материала для мониторинга снижения экспрессии гена и/или белка серпина c1. В других вариантах осуществления мониторинг ингибирования экспрессии гена серпина c1 проводят непрямо, например, посредством определения экспрессии и/или активности гена в каскаде серпина c1 (смотрите, например, фиг. 1). Например, можно осуществлять мониторинг активности фактора Xa для определения ингибирования экспрессии гена серпина c1. Также можно измерять уровни антитромбина, образование сгустка и/или эндогенный потенциал тромбина в образце, например, образце крови или печени. Подходящие анализа дополнительно описаны в разделе "Примеры" ниже.
Кроме того, настоящее изобретение относится к способам лечения индивидуума, имеющего нарушение, при котором является полезным снижение экспрессии серпина c1, например, гемофилии. Способы лечения (и применения) по изобретению включают введение индивидууму, например человеку, терапевтически эффективного количества i-РНК, нацеленной на ген серпина c1, или фармацевтической композиции, содержащей i-РНК, нацеленную на ген серпина c1, тем самым, осуществляя лечение индивидуума, имеющего нарушение, при котором является полезным снижение экспрессии серпина c1.
В одном аспекте изобретение относится к способам предупреждения по меньшей мере одного симптома у индивидуума, имеющего нарушение, при котором является полезным снижение экспрессии серпина c1. Способы включают введение индивидууму терапевтически эффективного количества i-РНК, например дцРНК, или вектора по изобретению, тем самым, предотвращая по меньшей мере один симптом у индивидуума, имеющего нарушение, при котором является полезным снижение экспрессии серпина c1. Например, изобретение относится к способам предупреждения кровотечения у индивидуума, страдающего нарушением, при котором является полезным снижение экспрессии серпина c1, например, гемофилией.
В другом аспекте настоящее изобретение относится к применению терапевтически эффективного количества i-РНК по изобретению для лечения индивидуума, например, индивидуума, для которого является полезным снижение и/или ингибирование экспрессии серпина c1. i-РНК включает i-РНК, нацеленную на ген серпина c1, или фармацевтическую композицию, содержащую i-РНК, нацеленную на ген серпина c1.
В другом аспекте настоящее изобретение относится к применению i-РНК по изобретению, нацеленной на ген серпина c1, или фармацевтической композиции, содержащей i-РНК, нацеленную на ген серпина c1, для изготовления лекарственного средства для лечения индивидуума, например, индивидуума, для которого является полезным снижение и/или ингибирование экспрессии серпина c1.
В другом аспекте изобретение относится к применениям i-РНК, например дцРНК, по изобретению для предупреждения по меньшей мере одного симптома у индивидуума, страдающего нарушением, при котором является полезным снижение и/или ингибирование экспрессии серпина c1, таким как геморрагическое нарушение, например гемофилия.
В следующем аспекте настоящее изобретение относится к применениям i-РНК по изобретению для изготовления лекарственного средства для предупреждения по меньшей мере одного симптома у индивидуума, страдающего нарушением, при котором является полезным снижение и/или ингибирование экспрессии серпина c1, такого как геморрагическое нарушение, например, гемофилия. i-РНК по изобретению можно вводить в "голой" форме, или в качестве "свободной i-РНК". Голую i-РНК вводят в отсутствие фармацевтической композиции. Голая i-РНК может находиться в подходящем буферном растворе. Буферный раствор может содержать ацетат, цитрат, протамин, карбонат или фосфат, или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буфер (PBS). pH и осмолярность буферного раствора, содержащего i-РНК, можно корректировать так, чтобы они были пригодными для введения индивидууму.
Альтернативно i-РНК по изобретению можно вводить в качестве фармацевтической композиции, такой как липосомальный состав дцРНК.
Индивидуумы, для которых является полезным снижение и/или ингибирование экспрессии гена серпина c1, представляют собой индивидуумов, имеющих геморрагическое нарушение, например, наследственное геморрагическое нарушение или приобретенное геморрагическое нарушение, как описано в настоящем описании. В одном варианте осуществления индивидуум, имеющий наследственное геморрагическое нарушение, имеет гемофилию, например, гемофилию A, B или C. В одном варианте осуществления индивидуум, имеющий наследственное геморрагическое нарушение, например гемофилию, представляет собой индивидуума с ингибированием. В одном варианте осуществления индивидуум с ингибированием имеет гемофилию A. В другом варианте осуществления индивидуум с ингибированием имеет гемофилию B. В другом варианте осуществления индивидуум с ингибированием имеет гемофилию C. Лечение индивидуума, для которого является полезным снижение и/или ингибирование экспрессии гена серпина c1, включает терапевтическое (например, по необходимости, например, индивидуум имеет кровотечение (спонтанное кровотечение или кровотечение в результате травмы) и несвертываемость) и профилактическое (например, индивидуум не имеет кровотечения и/или ему предстоит хирургическая операция) лечение.
Кроме того, изобретение относится к способам и применениям i-РНК или их фармацевтической композиции, например, для лечения индивидуума, для которого является полезным снижение и/или ингибирование экспрессии серпина c1, например, индивидуума, имеющего геморрагическое нарушение, в комбинации с другими фармацевтическими препаратами и/или другими терапевтическими способами, например, с известными фармацевтическими препаратами и/или известными терапевтическими способами, например, такими как способы, которые в настоящее время используют для лечения этих нарушений. Например, в определенных вариантах осуществления i-РНК, нацеленную на серпин c1, вводят, например, в комбинации со средством, пригодным для лечения геморрагического нарушения, как описано в настоящем описании. Например, дополнительные терапевтические средства и способы терапии, пригодны для лечения индивидуума, для которого является полезным снижение экспрессии серпина c1, например, индивидуума, имеющего геморрагическое нарушение, включают свежезамороженную плазму (FFP); рекомбинантный FVIIa; рекомбинантный FIX; концентраты FXI; инактивированные вирусом содержащие vWF концентраты FVIII; десенсибилизирующую терапию, которая может включать крупные дозы FVIII или FFX, вместе со стероидами или внутривенным иммуноглобулином (IVIG) и циклофосфамидом; плазмаферез вместе с иммуносупресссией и инфузией FVIII или FFX, с антифибринолитической терапией или без нее; индукцию иммунной толерантности (ITI), с иммунодепрессивной терапией или без нее (например, циклофосфамид, преднизон и/или антитело против CD20); десмопрессин ацетат [DDAVP]; антифибринолитические средства, такие как аминокапроновая кислота и транексамовая кислота; концентрат активированного протромбинового комплекса (PCC); антигемофильные средства; кортикостероиды; иммунодепрессивные средства и эстрогены. Введение i-РНК и дополнительного лекарственного средства и/или способ лечения можно проводить одновременно и/или в одной и той же комбинации, например парентерально, или дополнительное лекарственное средство можно вводить в качестве части отдельной композиции или в отдельное время и/или другим способом, известным в данной области или описанным в настоящем описании.
В одном варианте осуществления способы и применения включают введение композиции по изобретению так, чтобы экспрессия являющегося мишенью гена серпина c1 снижалась, например, в течение приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 12, 16, 18, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76 или приблизительно 80 часов. В одном варианте осуществления экспрессия являющегося мишенью гена серпина c1 снижается на продолжительный период времени, например, по меньшей мере на приблизительно двое, трое, четверо, пять, шесть, семь суток или более, например, на приблизительно одну неделю, две недели, три недели или приблизительно четыре недели или более.
Предпочтительно, i-РНК, пригодные для способов, применений и композиций по изобретению, специфически нацелены на РНК (первичные или процессированные) являющегося мишенью гена серпина c1. Композиции, применения и способы для ингибирования экспрессии этих генов с использованием i-РНК, можно получать и выполнять, как описано в настоящем описании.
Введение дцРНК в соответствии со способами и применениями по изобретению может приводить к снижению тяжести, признаков, симптомов и/или маркеров таких заболеваний или нарушений у пациентов с геморрагическим нарушением. Под "снижением" в этом контексте подразумевают статистически значимое снижение такого уровня. Снижение может составлять, например, по меньшей мере приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или приблизительно 100%.
Эффективность лечения или профилактики заболевания можно оценивать, например путем измерения прогрессирования заболевания, ремиссии заболевания, тяжести симптомов, частоты кровотечений, уменьшения боли, качества жизни, дозы лекарственного средства, требуемой для поддержания эффекта лечения, уровня маркера заболевания или любого другого поддающегося измерению параметра, пригодного для данного заболевания, подвергаемого лечению или профилактике. Специалист в данной области способен осуществлять мониторинг эффективности лечения или профилактики посредством измерения любого из таких параметров или любой комбинации параметров. Например, эффективность лечения геморрагического нарушения можно оценивать, например, путем периодического мониторинга уровней тромбин:антитромбин.
Сравнения более поздних данных с исходными данными обеспечивает информацию для терапевта о том, является ли лечение эффективным. Специалист в данной области способен осуществлять мониторинг эффективности лечения или профилактики путем измерения любого из таких параметров или любой комбинации параметров. Применительно к введению i-РНК, нацеленной на серпин c1, или ее фармацевтической композиции, "эффективный против" геморрагического нарушение указывает на то, что введение клинически подходящим способом приводит к благоприятному эффекту по меньшей мере для статистически значимой доли пациентов, такому как улучшение симптомов, излечение, уменьшение тяжести заболевания, продление выживания, улучшение качества жизни или другой эффект, общепризнанный в качестве положительного врачами, знакомыми с лечением геморрагических нарушений или сходных с ними процессами.
Об эффекте лечения или профилактики свидетельствует то, что существует статистически значимое улучшение одного или нескольких параметров статуса заболевания, или отсутствие ухудшения или развития симптомов, когда они в ином случае ожидаются. В качестве примера, на эффективное лечение может указывать благоприятное изменение по меньшей мере на 10% поддающегося измерению параметра заболевания, и предпочтительно по меньшей мере на 20%, 30%, 40%, 50% или более. Об эффективности данного лекарственного средства на основе i-РНК или состава этого лекарственного средства можно судить с использованием экспериментальной модели на животных для данного заболевания, как известно в данной области. При использовании экспериментальной модели на животных, об эффективности лечения свидетельствует наблюдение статистически значимого снижения маркера или симптома.
Альтернативно эффективность можно измерять по снижению тяжести заболевания, определяемому специалистом в области диагностики, исходя из клинически признанной шкалы градации тяжести заболевания, такой как, в качестве одного примера, показатель Child-Pugh (иногда называемый показателем Child-Turcotte-Pugh). Любое положительное изменение, приводящее, например, к снижению тяжести заболевания, измеряемому с использованием соответствующей шкалы, отражает адекватное лечение с использованием i-РНК или состава i-РНК, как описано в настоящем описании.
Индивидуумам можно вводить терапевтическое количество i-РНК, такое как приблизительно 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,1 мг/кг, 0,15 мг/кг, 0,2 мг/кг, 0,25 мг/кг, 0,3 мг/кг, 0,35 мг/кг, 0,4 мг/кг, 0,45 мг/кг, 0,5 мг/кг, 0,55 мг/кг, 0,6 мг/кг, 0,65 мг/кг, 0,7 мг/кг, 0,75 мг/кг, 0,8 мг/кг, 0,85 мг/кг, 0,9 мг/кг, 0,95 мг/кг, 1,0 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2,0 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,3 мг/кг, 2,4 мг/кг, 2,5 мг/кг дцРНК, 2,6 мг/кг дцРНК, 2,7 мг/кг дцРНК, 2,8 мг/кг дцРНК, 2,9 мг/кг дцРНК, 3,0 мг/кг дцРНК, 3,1 мг/кг дцРНК, 3,2 мг/кг дцРНК, 3,3 мг/кг дцРНК, 3,4 мг/кг дцРНК, 3,5 мг/кг дцРНК, 3,6 мг/кг дцРНК, 3,7 мг/кг дцРНК, 3,8 мг/кг дцРНК, 3,9 мг/кг дцРНК, 4,0 мг/кг дцРНК, 4,1 мг/кг дцРНК, 4,2 мг/кг дцРНК, 4,3 мг/кг дцРНК, 4,4 мг/кг дцРНК, 4,5 мг/кг дцРНК, 4,6 мг/кг дцРНК, 4,7 мг/кг дцРНК, 4,8 мг/кг дцРНК, 4,9 мг/кг дцРНК, 5,0 мг/кг дцРНК, 5,1 мг/кг дцРНК, 5,2 мг/кг дцРНК, 5,3 мг/кг дцРНК, 5,4 мг/кг дцРНК, 5,5 мг/кг дцРНК, 5,6 мг/кг дцРНК, 5,7 мг/кг дцРНК, 5,8 мг/кг дцРНК, 5,9 мг/кг дцРНК, 6,0 мг/кг дцРНК, 6,1 мг/кг дцРНК, 6,2 мг/кг дцРНК, 6,3 мг/кг дцРНК, 6,4 мг/кг дцРНК, 6,5 мг/кг дцРНК, 6,6 мг/кг дцРНК, 6,7 мг/кг дцРНК, 6,8 мг/кг дцРНК, 6,9 мг/кг дцРНК, 7,0 мг/кг дцРНК, 7,1 мг/кг дцРНК, 7,2 мг/кг дцРНК, 7,3 мг/кг дцРНК, 7,4 мг/кг дцРНК, 7,5 мг/кг дцРНК, 7,6 мг/кг дцРНК, 7,7 мг/кг дцРНК, 7,8 мг/кг дцРНК, 7,9 мг/кг дцРНК, 8,0 мг/кг дцРНК, 8,1 мг/кг дцРНК, 8,2 мг/кг дцРНК, 8,3 мг/кг дцРНК, 8,4 мг/кг дцРНК, 8,5 мг/кг дцРНК, 8,6 мг/кг дцРНК, 8,7 мг/кг дцРНК, 8,8 мг/кг дцРНК, 8,9 мг/кг дцРНК, 9,0 мг/кг дцРНК, 9,1 мг/кг дцРНК, 9,2 мг/кг дцРНК, 9,3 мг/кг дцРНК, 9,4 мг/кг дцРНК, 9,5 мг/кг дцРНК, 9,6 мг/кг дцРНК, 9,7 мг/кг дцРНК, 9,8 мг/кг дцРНК, 9,9 мг/кг дцРНК, 9,0 мг/кг дцРНК, 10 мг/кг дцРНК, 15 мг/кг дцРНК, 20 мг/кг дцРНК, 25 мг/кг дцРНК, 30 мг/кг дцРНК, 35 мг/кг дцРНК, 40 мг/кг дцРНК, 45 мг/кг дцРНК или приблизительно 50 мг/кг дцРНК. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
В определенных вариантах осуществления, например, когда композиция по изобретению содержит дцРНК, как описано в настоящем описании, и липид, индивидуумам можно вводить терапевтическое количество i-РНК, такое как от приблизительно 0,01 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,05 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,2 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,2 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,3 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,3 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,4 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,4 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 1 мг/кг до приблизительно 5 мг/кг, от приблизительно 1 мг/кг до приблизительно 10 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 1,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 2 мг/кг до приблизительно about 2,5 мг/кг, от приблизительно 2 мг/кг до приблизительно 10 мг/кг, от приблизительно 3 мг/кг до приблизительно 5 мг/кг, от приблизительно 3 мг/кг до приблизительно 10 мг/кг, от приблизительно 3,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 4 мг/кг до приблизительно 5 мг/кг, от приблизительно 4,5 мг/кг до приблизительно 5 мг/кг, от приблизительно 4 мг/кг до приблизительно 10 мг/кг, от приблизительно 4,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 5 мг/кг до приблизительно 10 мг/кг, от приблизительно 5,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 6 мг/кг до приблизительно 10 мг/кг, от приблизительно 6,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 7 мг/кг до приблизительно 10 мг/кг, от приблизительно 7,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 8 мг/кг до приблизительно 10 мг/кг, от приблизительно 8,5 мг/кг до приблизительно 10 мг/кг, от приблизительно 9 мг/кг до приблизительно 10 мг/кг или от приблизительно 9,5 мг/кг до приблизительно 10 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Например, дцРНК можно вводить в дозе приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9 или приблизительно 10 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
В других вариантах осуществления, например, когда композиция по изобретению содержит дцРНК, как описано в настоящем описании, и N-ацетилгалактозамин, индивидуумам можно вводить терапевтическое количество i-РНК, такое как доза от приблизительно 0,1 до приблизительно 50 мг/кг, от приблизительно 0,25 до приблизительно 50 мг/кг, от приблизительно 0,5 до приблизительно 50 мг/кг, от приблизительно 0,75 до приблизительно 50 мг/кг, от приблизительно 1 до приблизительно 50 мг/мг, от приблизительно 1,5 до приблизительно 50 мг/кг, от приблизительно 2 до приблизительно 50 мг/кг, от приблизительно 2,5 до приблизительно 50 мг/кг, от приблизительно 3 до приблизительно 50 мг/кг, от приблизительно 3,5 до приблизительно 50 мг/кг, от приблизительно 4 до приблизительно 50 мг/кг, от приблизительно 4,5 до приблизительно 50 мг/кг, от приблизительно 5 до приблизительно 50 мг/кг, от приблизительно 7,5 до приблизительно 50 мг/кг, от приблизительно 10 до приблизительно 50 мг/кг, от приблизительно 15 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 20 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 25 до приблизительно 50 мг/кг, от приблизительно 30 до приблизительно 50 мг/кг, от приблизительно 35 до приблизительно 50 мг/кг, от приблизительно 40 до приблизительно 50 мг/кг, от приблизительно 45 до приблизительно 50 мг/кг, от приблизительно 0,1 до приблизительно 45 мг/кг, от приблизительно 0,25 до приблизительно 45 мг/кг, от приблизительно 0,5 до приблизительно 45 мг/кг, от приблизительно 0,75 до приблизительно 45 мг/кг, от приблизительно 1 до приблизительно 45 мг/мг, от приблизительно 1,5 до приблизительно 45 мг/кг, от приблизительно 2 до приблизительно 45 мг/кг, от приблизительно 2,5 до приблизительно 45 мг/кг, от приблизительно 3 до приблизительно 45 мг/кг, от приблизительно 3,5 до приблизительно 45 мг/кг, от приблизительно 4 до приблизительно 45 мг/кг, от приблизительно 4,5 до приблизительно 45 мг/кг, от приблизительно 5 до приблизительно 45 мг/кг, от приблизительно 7,5 до приблизительно 45 мг/кг, от приблизительно 10 до приблизительно 45 мг/кг, от приблизительно 15 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 20 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 25 до приблизительно 45 мг/кг, от приблизительно 30 до приблизительно 45 мг/кг, от приблизительно 35 до приблизительно 45 мг/кг, от приблизительно 40 до приблизительно 45 мг/кг, от приблизительно 0,1 до приблизительно 40 мг/кг, от приблизительно 0,25 до приблизительно 40 мг/кг, от приблизительно 0,5 до приблизительно 40 мг/кг, от приблизительно 0,75 до приблизительно 40 мг/кг, от приблизительно 1 до приблизительно 40 мг/мг, от приблизительно 1,5 до приблизительно 40 мг/кг, от приблизительно 2 до приблизительно 40 мг/кг, от приблизительно 2,5 до приблизительно 40 мг/кг, от приблизительно 3 до приблизительно 40 мг/кг, от приблизительно 3,5 до приблизительно 40 мг/кг, от приблизительно 4 до приблизительно 40 мг/кг, от приблизительно 4,5 до приблизительно 40 мг/кг, от приблизительно 5 до приблизительно 40 мг/кг, от приблизительно 7,5 до приблизительно 40 мг/кг, от приблизительно 10 до приблизительно 40 мг/кг, от приблизительно 15 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 20 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 25 до приблизительно 40 мг/кг, от приблизительно 30 до приблизительно 40 мг/кг, от приблизительно 35 до приблизительно 40 мг/кг, от приблизительно 0,1 до приблизительно 30 мг/кг, от приблизительно 0,25 до приблизительно 30 мг/кг, от приблизительно 0,5 до приблизительно 30 мг/кг, от приблизительно 0,75 до приблизительно 30 мг/кг, от приблизительно 1 до приблизительно 30 мг/мг, от приблизительно 1,5 до приблизительно 30 мг/кг, от приблизительно 2 до приблизительно 30 мг/кг, от приблизительно 2,5 до приблизительно 30 мг/кг, от приблизительно 3 до приблизительно 30 мг/кг, от приблизительно 3,5 до приблизительно 30 мг/кг, от приблизительно 4 до приблизительно 30 мг/кг, от приблизительно 4,5 до приблизительно 30 мг/кг, от приблизительно 5 до приблизительно 30 мг/кг, от приблизительно 7,5 до приблизительно 30 мг/кг, от приблизительно 10 до приблизительно 30 мг/кг, от приблизительно 15 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 20 до приблизительно 30 мг/кг, от приблизительно 25 до приблизительно 30 мг/кг, от приблизительно 0,1 до приблизительно 20 мг/кг, от приблизительно 0,25 до приблизительно 20 мг/кг, от приблизительно 0,5 до приблизительно 20 мг/кг, от приблизительно 0,75 до приблизительно 20 мг/кг, от приблизительно 1 до приблизительно 20 мг/мг, от приблизительно 1,5 до приблизительно 20 мг/кг, от приблизительно 2 до приблизительно 20 мг/кг, от приблизительно 2,5 до приблизительно 20 мг/кг, от приблизительно 3 до приблизительно 20 мг/кг, от приблизительно 3,5 до приблизительно 20 мг/кг, от приблизительно 4 до приблизительно 20 мг/кг, от приблизительно 4,5 до приблизительно 20 мг/кг, от приблизительно 5 до приблизительно 20 мг/кг, от приблизительно 7,5 до приблизительно 20 мг/кг, от приблизительно 10 до приблизительно 20 мг/кг или от приблизительно 15 до приблизительно 20 мг/кг. В одном варианте осуществления, когда композиция по изобретению содержит дцРНК, как описано в настоящем описании, и N-ацетилгалактозамин, индивидуумам можно вводить терапевтическое количество дцРНК, составляющее от приблизительно 10 до приблизительно 30 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
Например, индивидуумам можно вводить терапевтическое количество i-РНК, такое как приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, 10, 10,5, 11, 11,5, 12, 12,5, 13, 13,5, 14, 14,5, 15, 15,5, 16, 16,5, 17, 17,5, 18, 18,5, 19, 19,5, 20, 20,5, 21, 21,5, 22, 22,5, 23, 23,5, 24, 24,5, 25, 25,5, 26, 26,5, 27, 27,5, 28, 28,5, 29, 29,5, 30, 31, 32, 33, 34, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или приблизительно 50 мг/кг. Также подразумевается, что величины и диапазоны, являющиеся промежуточными для указанных величин, являются частью настоящего изобретения.
i-РНК можно вводить посредством внутривенной инфузии в течение периода времени, например, в течение периода 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и 21, 22, 23, 24, или приблизительно 25 минут. Введение можно повторять, например, регулярно, например, раз в неделю, раз в две недели (т.е. каждые две недели) в течение одного месяца, двух месяцев, трех месяцев, четырех месяцев или более. После первоначального режима лечения введение можно проводить менее часто. Например, после введения раз в неделю или раз в две недели в течение трех месяцев, введение можно повторять один раз в месяц в течение шести месяцев или года или более.
В одном варианте осуществления настоящее изобретение относится к способам лечения индивидуума, страдающего геморрагическим нарушением, например, гемофилией, путем подкожного введения указанному индивидууму соединения AD-57213 в совокупной недельной дозе от приблизительно 0,5 мг/кг до приблизительно 5 мг/кг, или от приблизительно 1 мг/кг до приблизительно 3 мг/кг. В одном варианте осуществления способы могут включать подкожное введение индивидууму совокупной недельной дозе приблизительно 0,5 мг/кг. Например, в одном варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 0,5 мг/кг в качестве 0,5 мг/кг каждую неделю. В другом варианте осуществления, способы могут включать введение индивидууму совокупной недельной дозы приблизительно 0,5 мг/кг в качестве 1 мг/кг каждые две недели.
В другом варианте осуществления способы могут включать подкожное введение индивидууму совокупной недельной дозы приблизительно 1,5 мг/кг. Например, в одном варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 1,5 мг/кг в качестве 1,5 мг/кг каждую неделю. В другом варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 1,5 мг/кг в качестве 3 мг/кг каждые две недели.
В другом варианте осуществления способы могут включать подкожное введение индивидууму совокупной недельной дозы приблизительно 2 мг/кг. Например, в одном варианте осуществления, способы могут включать введение индивидууму совокупной недельной дозы приблизительно 2 мг/кг в качестве 2 мг/кг каждую неделю. В другом варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 2 мг/кг в качестве 4 мг/кг каждые две недели.
В другом варианте осуществления способы могут включать подкожное введение индивидууму совокупной недельной дозы приблизительно 3 мг/кг. Например, в одном варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 3 мг/кг в качестве 3 мг/кг каждую неделю. В другом варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 3 мг/кг в качестве 6 мг/кг каждые две недели.
В другом варианте осуществления настоящее изобретение относится к способам профилактики у индивидуума по меньшей мере одного симптома геморрагического нарушения, например, гемофилии, путем подкожного введения индивидууму соединения AD-57213 в совокупной недельной дозе от приблизительно 0,5 мг/кг до приблизительно 5 мг/кг или от приблизительно 1 мг/кг до приблизительно 3 мг/кг.
В одном варианте осуществления способы могут включать подкожное введение индивидууму совокупной недельной дозы приблизительно 0,5 мг/кг. Например, в одном варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 0,5 мг/кг в качестве 0,5 мг/кг каждую неделю. В другом варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 0,5 мг/кг в качестве 1 мг/кг каждые две недели. В другом варианте осуществления, способы могут включать подкожное введение индивидууму совокупной недельной дозы приблизительно 1,5 мг/кг. Например, в одном варианте осуществления, способы могут включать введение индивидууму совокупной недельной дозы приблизительно 1,5 мг/кг в качестве 1,5 мг/кг каждую неделю. В другом варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 1,5 мг/кг в качестве 3 мг/кг каждые две недели.
В другом варианте осуществления способы могут включать подкожное введение индивидууму совокупной недельной дозы приблизительно 2 мг/кг. Например, в одном варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 2 мг/кг в качестве 2 мг/кг каждую неделю. В другом варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 2 мг/кг в качестве 4 мг/кг каждые две недели.
В другом варианте осуществления способы могут включать подкожное введение индивидууму совокупной недельной дозы приблизительно 3 мг/кг. Например, в одном варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 3 мг/кг в качестве 3 мг/кг каждую неделю. В другом варианте осуществления способы могут включать введение индивидууму совокупной недельной дозы приблизительно 3 мг/кг в качестве 6 мг/кг каждые две недели.
Введение i-РНК может снижать уровни серпина c1, например, в клетке, ткани, крови, моче или другой части тела пациента по меньшей мере на приблизительно 5%, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, и 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 39, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или по меньшей мере на приблизительно 99% или более.
В одном варианте осуществления способы лечения и/или профилактики включают подкожное введение индивидууму соединения AD-57213 в дозе, достаточной для снижения уровней серпина c1, например, в клетке, ткани, крови, моче или другой части тела пациента по меньшей мере на приблизительно 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 69, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или на приблизительно 80%.
До введения полной дозы i-РНК, пациентам можно вводить меньшую дозу, такую как 5% от дозы инфузионной реакции, и можно осуществлять мониторинг неблагоприятных эффектов, таких как аллергическая реакция. В другом примере у пациента можно проводить мониторинг нежелательных эффектов иммунной стимуляции, таких как увеличенные уровни цитокинов (например, TNF-альфа или INF-альфа). Благодаря ингибиторным эффектом на экспрессию серпина c1, композиция по изобретению или фармацевтическая композиция, полученная из нее, могут повышать качество жизни. Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. Хотя для применения на практике или исследования i-РНК и способов по изобретению можно использовать способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем описании, пригодные способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем описании, включены в качестве ссылок в полном объеме. В случае противоречий, настоящее описание, в том числе определения, будет решающим. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
ПРИМЕРЫ
Пример 1. Синтез i-РНК
Источник реагентов
Когда источник реагента не указан конкретно в настоящем описании, такой реагент может быть получен от любого поставщика реагентов для молекулярной биологии в качестве/при чистоте, являющихся стандартными для применения в молекулярной биологии.
Транскрипты
Моделирование ми-РНК проводили для идентификации ми-РНК, нацеливающихся на транскрипты серпина c1 человека, макака-резус (Macaca mulatta), собаки, мыши и крысы, приведенные в базе данных NCBI Gene (http://www.ncbi.nlm.nih.gov/gene/). Для моделирования использовали следующие транскрипты из коллекции NCBI RefSeq: человек - NM_000488.2, NM_000488.3; макак-резус - NM 001104583.1; собака - XM_856414.1; мышь -NM_080844/4; крыса - NM_001012027.1. Вследствие высокой дивергенции последовательностей приматов/собак/грызунов, дуплексы ми-РНК моделировали в виде нескольких отдельных партий, включая, но не ограничиваясь ими, партии, содержащие дуплексы, соответствующие только транскриптам человека и макака-резус; транскрипты, соответствующие только человеку, макаку-резус и собаке; транскрипты, соответствующие только человеку, макаку-резус, мыши и крысе; и транскрипты, соответствующие только транскриптам мыши и крысы. Были смоделированы все дуплексы ми-РНК, которые обладали 100% идентичностью с приведенным транскриптом человека и транскриптами других видов, учтенных в каждой моделируемой партии (выше).
Моделирование ми-РНК, прогнозирование специфичности и эффективности
Прогнозировали прогнозируемую специфичность для всех 19-меров из каждой последовательности. Затем отбирали являющиеся кандидатами 19-меры, лишенные повторов длиннее 7 нуклеотидов. Эти являющиеся кандидатами 874 ми-РНК человек/макак-резус, 67 ми-РНК человек/макак-резус/собака, 103 ми-РНК человек/макак-резус/мышь/крыса и 569 ми-РНК мышь/крыса использовали в детальном поиске против соответствующих транскриптов (определяемых как набор записей NM_ и XM_ в наборах NCBI Refseq для человека, макака-резус, собаки, мыши или крысы) с использованием исчерпывающего алгоритма "в лоб", выполненного в скрипте пайтон "BruteForce.py". Далее скрипт интерпретировал результаты выравнивания транскрипт-олигонуклеотид с получением показателя на основе положения и количества несоответствий между ми-РНК и любым потенциальным "не являющимся мишенью" транскриптом. Показатель для не являющегося мишенью транскрипта оценивается для выявления отличий в "затравочной" области ми-РНК в положениях 2-9 с 5'-конца молекулы.
Каждой паре олигонуклеотид-транскрипт после поиска "в лоб" присваивался показатель несоответствия посредством суммирования индивидуальных показателей несоответствия; несоответствия в положении 2-9 оценивали как 2,8, несоответствия в положениях участка расщепления 10-11 оценивали как 1,2, и несоответствия в области 12-19 оценивали как 1,0. Дополнительное прогнозирование для не являющихся мишенью транскриптов проводили путем сравнения частоты гептамеров и октамеров, полученной для 3 различных, происходящих из затравок, гексамеров каждого олигнуклеотида. Гексамеры в положениях 2-7 относительно 5'-конца использовали для создания 2 гептамеров и одного октамера. "Гептамер 1" был получен добавлением 3'-A к гексамеру; гептамер 2 был получен добавлением 5'-A к гексамеру; октамер был получен добавлением A как к 5'-, так и к 3'-концу гексамера. Предварительно вычисляли частоты октамеров и гептамеров в наборе 3'-UTR (определяемом как подпоследовательность транскриптома из базы данных NCBI's Refseq, где конец кодирующей области "CDS" четко определен) человека, макака-резус, мыши или крысы. Частоту октамера нормализовали к частоте гептамера с использованием средней величины из диапазона частот октамеров. Затем вычисляли показатель "mirSeedScore" путем вычисления суммы ((3× нормализованное количество октамеров)+(2× количество гептамера 2)+(1× количество гептамера 1)).
Обе цепи ми-РНК приписывали к категории специфичности в соответствии с вычисленными показателями: показатель выше 3 считают высокоспецифическим, показатель, равный 3, считают специфическим, и показатель от 2,2 до 2,8 считают умеренно специфическим. Дуплексы сортировали по специфичности антисмысловой цепи и отбирали дуплексы, антисмысловые олигонуклеотиды которых были лишены GC в первом положении, лишены G в обоих положениях 13 и 14, и имели 3 или боле U или A в затравочной области.
Выбор последовательности ми-РНК
Синтезировали всего 66 происходящих из смысловых и 66 происходящих из антисмысловых последовательностей олигонуклеотидов ми-РНК человека/макака-резус, 6 происходящих из смысловых и 6 происходящих из антисмысловых последовательностей олигонуклеотидов ми-РНК человека/макака-резус/мыши, 12 олигонуклеотидов ми-РНК человека/макак-резус/мыши/крысы и 21 происходящих из смысловых и 21 происходящих из антисмысловых последовательностей олигонуклеотидов ми-РНК мыши/крысы и преобразовывали в дуплексы. Подробный перечень последовательностей смысловой и антисмысловой цепей серпина c1 представлен в таблицах 3 и 4.
Синтез ми-РНК
I. Общая методика мелкомасштабного и среднемасштабного синтеза РНК
РНК-олигонуклеотиды синтезировали в масштабах 0,2-500 мкмоль с использованием коммерчески доступных 5'-O-(4,4'-диметокситритил)-2'-O-трет-бутилдиметилсилил-3'-O-(2-цианоэтил-N,N-диизопропил)фосфорамидитных мономеров уридина, 4-N-ацетилцитидина, 6-N-бензоиладенозина и 2-N-изобутирилгуанозина и соответствующих 2'-O-метил и 2'-фтор-фосфорамидитов в соответствии со стандартными протоколами твердофазного синтеза олигонуклеотидов. Растворы амидита приготавливали в концентрации 0,1-0,15 M и в качестве активатора использовали 5-этилтио-1H-тетразол (0,25-0,6 M в ацетонитриле). Модификации фосфоротиоатного остова для стадии окисления вносили во время синтеза с использованием 0,2 M фенилацетилдисульфида (PADS) в смеси лутидин:ацетонитрил (1:1) (об.:об.) или 0,1 M 3-(диметиламинометилен)-амино-3H-1,2,4-дитиазол-5-тиона (DDTT) в пиридине. После завершения синтеза последовательности отщепляли от твердой подложки, и защитные группы удаляли с использованием метиламина, а затем триэтиламина.3HF для удаления любых присутствующих 2'-O-трет-бутилдиметилсилил-защитных групп.
Для синтеза в масштабе 5-500 мкмоль и полностью 2'-модифицированных последовательностей (2'-фтор и/или 2'-O-метил или их комбинации) из олигонуклеотидов удаляли защитную группу с использованием 3:1 (об./об.) этанола и концентрированного (28-32%) водного раствора аммиака либо при 35°C в течение 16 ч, либо при 55°C в течение 5,5 ч. Перед удалением защитной группы аммиака олигонуклеотиды обрабатывали 0,5 M пиперидином в ацетонитриле в течение 20 мин на твердой подложке. Неочищенные олигонуклеотиды анализировали с помощью ЖХ-МС и анионообменной ВЭЖХ (IEX-ВЭЖХ). Очистку олигонуклеотидов проводили с помощью IEX-ВЭЖХ с использованием: 20 мМ фосфата, 10-15% ACN, pH=8,5 (буфер A) и 20 мМ фосфата, 10-15% ACN, 1 M NaBr, pH=8,5 (буфер B). Фракции анализировали в отношении чистоты с помощью аналитической ВЭЖХ. Содержащие продукт фракции с подходящей чистотой объединяли и концентрировали на роторном испарителе перед обессоливанием. Образцы обессоливали с помощью эксклюзионной хроматографии и лиофилизировали до сухого состояния. Равные молярные количества смысловых и антисмысловых цепей подвергали отжигу в 1× буфере PBS с получением соответствующих дуплексов ми-РНК.
Для мелкого масштаба (0,2-1 мкмоль) синтез проводили на устройстве для синтеза MerMade 192 в 96-луночном формате. В случае полностью 2'-модифицированных последовательностей (2'-фтор и/или 2'-O-метил или их комбинации) из олигонуклеотидов удаляли защитную группу с использованием метиламина при комнатной температуре в течение 30-60 мин с последующей инкубацией при 60°C в течение 30 мин или с использованием 3:1 (об./об.) этанола и концентрированного (28-32%) водного аммиака при комнатной температуре в течение 30-60 мин с последующей инкубацией при 40°C в течение 1,5 часа. Затем неочищенные олигонуклеотиды осаждали в растворе ацетонитрил:ацетон (9:1) и выделяли центрифугированием и декантацией супернатанта. Неочищенный осадок из олигонуклеотидов ресуспендировали в 20 мМ буфере NaOAc и анализировали с помощью ЖХ-МС и анионообменной ВЭЖХ. Неочищенные олигонуклеотидные последовательности обессоливали в 96-луночных планшетах с глубокими лунками на 5-мл колонке HiTrap Sephadex G25 (GE Healthcare). В каждую лунку собирали приблизительно 1,5 мл образцов, соответствующих индивидуальной последовательности. Эти очищенные обессоленные олигонуклеотиды анализировали с помощью ЖХ-МС и анионообменной хроматографии. Дуплексы получали посредством отжига эквимолярных количеств смысловых и антисмысловых последовательностей на роботе Tecan. Концентрацию дуплексов доводили до 10 мкМ в 1× буфере PBS.
II. Синтез конъюгированных с GalNAc олигонуклеотидов для анализа in vivo
Олигонуклеотиды, конъюгированные с GalNAc-лигандом на их 3'-конце, синтезировали в масштабе 0,2-500 мкмоль с использованием твердой подложки, предварительно нагруженной линкером в форме Y, содержащим 4,4'-диметокситритил (DMT)-защищенную первичную гидроксигруппу для синтеза олигонуклеотидов и GalNAc-лиганд, присоединенный через связь.
Для синтеза конъюгатов с GalNAc в масштабе 5-500 мкмоль следовали указанному выше протоколу синтеза РНК со следующими модификациями: для подложек для синтеза на основе полистирола использовали 5% дихлоруксусную кислоту в толуоле для отщепления DMT во время синтеза. Отщепление от подложки и удаление защитной группы проводили, как описано выше. Обогащенные фосфоротиоатом последовательности (обычно >5 фосфоротиоатов) синтезировали без удаления последней группы 5'-DMT ("с DMT") и после отщепления и удаления защитной группы, как описано выше, очищали с помощью обращенно-фазовой ВЭЖХ с использованием 50 мМ ацетата аммония в воде (буфер A) и 50 мМ ацетата аммония в 80% ацетонитриле (буфер B). Фракции анализировали в отношении чистоты с помощью аналитической ВЭЖХ и/или ЖХ-МС. Содержание продукт фракции с подходящей чистотой объединяли и концентрировали на роторном испарителе. Группу DMT удаляли с использованием 20-25% уксусной кислоты в воде до завершения. Эти образцы обессоливали с помощью эксклюзионной хроматографии и лиофилизировали до сухого состояния. Равные молярные количества смысловых и антисмысловых цепей подвергали отжигу в 1× буфере PBS с получением соответствующих дуплексов ми-РНК.
Для мелкомасштабного синтеза конъюгатов GalNAc (0,2-1 мкмоль), включающих последовательности с множеством фосфоротиоатных связей, использовали протоколы, описанные выше для синтеза РНК или полностью 2'-F/2'-OMe-содержащих последовательностей на платформе MerMade. Синтез проводили на предварительно упакованных колонках, содержащих функционализированную с помощью GalNAc стеклянную подложку с контролируемым размером пор.
Пример 2. Скрининг in vitro
Культивирование клеток и трансфекция
Клетки Hep3B (ATCC, Manassas, VA) выращивали практически до смыкания монослоя при 37°C в атмосфере 5% CO2 в минимальной эссенциальной среде Игла (ATCC), дополненной 10% FBS, стрептомицином и глутамином (ATCC), а затем открепляли от чашек посредством трипсинизации. Для перекрестно-реагирующих дуплексов мыши, первичные гепатоциты мыши (PMH) выделяли свежими менее чем за 1 час до трансфекций и выращивали в среде для первичных гепатоцитов. Как для Hep3B, так и для PMH, трансфекцию проводили добавлением 14,8 мкл Opti-MEM с 0,2 мкл Lipofectamine RNAiMax на лунку (Invitrogen, Carlsbad CA. по каталогу № 13778-150) к 5 мкл каждого дуплекса ми-РНК в отдельную лунку 96-луночного планшета. Затем смесь инкубировали при комнатной температуре в течение 15 минут. Затем в смесь ми-РНК добавляли восемьдесят мкл полной среды для роста без антибиотика, содержавшей ~2×104 клеток Hep3B. Клетки инкубировали в течение 24 часов перед очисткой РНК. Эксперименты с однократной дозой проводили при конечной концентрации дуплекса 10 нМ и 0,1 нМ и эксперименты по эффекту дозы проводили с использованием 8×5-кратных серийных разведений в диапазоне от 10 нМ до 128 пМ (смотрите фиг. 2A и 2B).
Трансфекция посредством свободного захвата
Пять мкл каждой конъюгированной с GalNac ми-РНК в PBS объединяли с 4×104 свежеразмороженных криосохраненных гепатоцитов яванского макака, ресуспендированных в 95 мкл среды In Vitro Gro CP (In Vitro Technologies-Celsis, Baltimore, MD) в каждой лунке 96-луночного планшета. Смесь инкубировали в течение приблизительно 24 ч при 37°C в атмосфере 5% CO2. ми-РНК исследовали в конечных концентрациях 100 нМ, 10 нМ и 0,1 нМ для анализов эффективности посредством свободного захвата.
Выделение тотальной РНК с использованием набора DYNABEADS mRNA Isolation (Invitrogen, партия №: 610-12)
Клетки собирали и лизировали в 150 мкл буфера для лизиса/связывания, а затем перемешивали в течение 5 минут при 850 об./мин. с использованием Eppendorf Thermomixer (скорость смешения была одинаковой во время всего процесса). Десять микролитров магнитных гранул и 80 мкл буфера для лизиса/связывания добавляли в планшет с круглым дном и перемешивали в течение 1 минуты. Магнитные гранулы улавливали с использованием магнитного стенда и супернатант удаляли, не нанося вреда гранулам. После удаления супернатанта лизированные клетки добавляли к оставшимся гранулам и перемешивали в течение 5 минут. После удаления супернатанта магнитные гранулы промывали 2 раза 150 мкл буфера для промывания A и перемешивали в течение 1 минуты. Гранулы вновь улавливали и супернатант удаляли. Затем гранулы промывали 150 мкл буфера для промывания B, улавливали и супернатант удаляли. Далее гранулы промывали 150 мкл буфера для элюирования, улавливали и супернатант удаляли. Наконец, гранулам позволяли высохнуть в течение 2 минут. После высушивания добавляли 50 мкл буфера для элюирования и перемешивали в течение 5 минут при 70°C. Гранулы улавливали на магнит в течение 5 минут. 40 мкл супернатанта удаляли и добавляли в другой 96-луночный планшет.
Синтез кДНК с использованием набора для обратной транскрипции кДНК ABI High capacity (Applied Biosystems, Foster City, CA, по каталогу #4368813)
Основную смесь 2 мкл 10× буфера, 0,8 мкл 25×dNTP, 2 мкл случайных праймеров, 1 мкл обратной транскриптазы, 1 мкл ингибитора РНКазы и 3,2 мкл H2O на реакционную смесь добавляли к 10 мкл тотальной РНК. кДНК получали с использованием термоциклера Bio-Rad C-1000 или S-1000 (Hercules, CA) с помощью следующих стадий: 25°C в течение 10 минут, 37°C в течение 120 минут, 85°C в течение 5 секунд и удержание при 4°C.
ПЦР в реальном времени
Два мкл кДНК добавляли к основной смеси, содержавшей 0,5 мкл зонда для GAPDH человека TaqMan (Applied Biosystems, по каталогу #4326317E), 0,5 мкл зонда для серпина c1 человека TaqMan (Applied Biosystems, по каталогу # Hs00892758_m1) для клеток человека или 0,5 мкл зонда для GAPDH мыши TaqMan (Applied Biosystems, по каталогу #4308313), 0,5 мкл зонда для серпина c1 TaqMan (Applied Biosystems, по каталогу # Mm00446573_m1) для клеток мыши и 5 мкл основной смеси для зондов Lightcycler 480 (Roche, по каталогу #04887301001) на лунку в 384-луночных планшетах. ПЦР в реальном времени проводили в системе ABI 7900HT Real Time PCR (Applied Biosystems) с использованием анализа AACt(RQ). Каждый дуплекс исследовали в двух независимых трансфекциях и каждую трансфекцию анализировали в двух экземплярах, если нет иных указаний в сводных таблицах.
Для вычисления относительного кратного изменения уровней мРНК серпина c1, данные, полученные в реальном времени, анализировали с использованием способа AACt и нормализовали к результатам анализа, проведенным с клетками, трансфицированными 10 нМ AD-1955, или клетками с имитирующей трансфекцией. IC50 вычисляли с использованием модели с 4-параметрической аппроксимацией с использованием XLFit и нормализовали к клеткам, трансфицированным AD-1955 в том же диапазоне доз или к его собственной наименьшей дозе. В таблице 5 представлены результаты скрининга с однократной дозой в клетках Hep3B и в клетках PMH, трансфицированных указанными i-РНК. В таблице 6 представлены результаты эффекта дозы указанных i-РНК, трансфицированных в клетки Hep3B и PMH.
Смысловая и антисмысловая последовательности AD-1955 представляют собой:
Смысловая: cuuAcGcuGAGuAcuucGAdTsdT - (SEQ ID NO:13)
Антисмысловая: UCGAAGuACUcAGCGuAAGdTsdT - (SEQ ID NO:14).
Также синтезировали набор ми-РНК с модификациями 2'-OMe, и дуплексы этих ми-РНК в составах с Lipofectamine использовали для трансфекции клеток Hep3B. Результаты скрининга однократной дозы для модифицированных дуплексов представлены в таблице 7.
Примеры 3-4. Оптимизация основных образцов и исследование in vivo
В таблице 8 представлен подробный перечень последовательностей дуплексных ми-РНК, нацеленных на серпин c1, которые были составлены в качестве липидной наночастицы (LNP) (т.е. с MC3) или конъюгированы с GalNAc для оптимизации лидирующих последовательностей и доставки in vivo.
Пример 3: Опосредуемая LNP доставка ми-РНК
Исходя из результатов для однократной дозы in vitro и результатов IC50, описанных выше, модифицированный AD-50509 был выбран для составления в форме липидной наночастицы (LNP). Для определения эффективной дозы для опосредуемой LNP доставки AD-50509, мышам CD1 внутривенно инъецировали однократную дозу состава LNP (AF-011) с ми-РНК AD-50509 в количестве 0,003, 0,01, 0,03, 0,1, 0,3 или 1,0 мг/кг. Через 48 часов животных умерщвляли и определяли уровень мРНК серпина c1 относительно GAPDH и уровень белка серпина c1, как описано в настоящем описании. Как показано на фиг. 3A и 3B, максимальное подавление мРНК серпина c1, составляющее 85%, с помощью AF-011-AD-50509 обеспечивалось при ED50 приблизительно 0,1 мг/кг (фиг. 3A) и максимальное подавление белка серпина c1, составляющее 90%, было достигнуто при ED50 приблизительно 0,05 мг/кг (фиг. 3B).
Длительность подавления для состава LNP с ми-РНК AD-50509 (AF-011-50509) определяли у мышей CD1 после однократной внутривенной инъекции 1 мг/кг ми-РНК. Животных умерщвляли на 1, 2, 3, 7, 14, 21 или 28 сутки после введения, и определяли относительный уровень мРНК серпина c1 и уровень белка серпина c1. На фиг. 4A продемонстрировано, что AD-50509 составленный с AF-011, обеспечивал подавление мРНК серпина c1 приблизительно 90% в течение 24 часов после введения, и что происходило приблизительно 50% восстановление относительного уровня мРНК серпина c1 приблизительно через две недели после введения. На фиг. 4B продемонстрировано, что AD-50509, составленный с AF-011, обеспечивал подавление белка серпина c1, составляющее приблизительно 90%, в течение приблизительно 72 часов после введения, и что приблизительно через две недели после введение происходило приблизительно 50% восстановление относительного количества белка серпина c1. Активность серпина c1 также определяли посредством измерения активности фактора Xa с использованием коммерчески доступного набора (Aniara) у мышей CD1 после однократной внутривенной инъекции 1 мг/кг ми-РНК AD-50509, составленной с LNP. Животных умерщвляли на 1, 2, 3, 7, 14, 21 или 28 сутки после введения и определяли уровень относительной активности белка серпина c1. На фиг. 4C показано, что существует высокая корреляция между уровнем белка серпина c1 и активностью серпина c1.
Пример 4: ми-РНК, конъюгированные с GalNAc
Сорок четыре модифицированных дуплекса ми-РНК серпина c1 конъюгировали с трехвалентным GALNAc на 3'-конце смысловой цепи. Эти дуплексы анализировали в отношении эффективности свободного поглощения однократной дозы конъюгированных дуплексов в гепатоцитах яванского макака. Результаты этих анализов представлены в таблице 9.
Эти дуплексы также анализировали в отношении эффекта дозы в анализах свободного поглощения и трансфекции.
В таблице 10 представлены результаты этих анализов и ранговый порядок дуплексов как для свободного поглощения, так и для трансфекции. 5 дуплексов с наилучшими IC50 выделены светло-серым цветом и нижние 5 дуплексов выделены темно-серым цветом. Ранговый порядок IC50 дуплексов сохраняется между свободным поглощением и опосредуемым трансфекцией поглощением конъюгатов с GalNAc.
Пример 5: Оптимизация AD-54944
Как описано в примере 4, выше, AD-54944 был одним из наиболее активных конъюгированных с GalNAc дуплексов ми-РНК при определении в анализах как свободного захвата, так и трансфекции, и, таким образом, он был выбран для дальнейшей оптимизации и исследования in vivo.
Двадцать девять соединений было получено на основе одной и той же родительской последовательности AD-54944, и их подвергали скринингу в отношении эффективности in vivo с использованием однократной дозы 10 мг/кг. Животным (C57BL/6) проводили подкожную инъекцию на 0 сутки и умерщвляли на 3 сутки. Уровни белка серпина c1 в сыворотке определяли с помощью анализа ELISA и уровень мРНК серпина c1 определяли с помощью QRT-ПЦР с использованием образцов печени от животных. В таблицах 11 и 12 представлены последовательности дуплексов и результаты скрининга однократной дозы с этими дуплексами в качестве процентного нокдауна уровней белка серпина c1 относительно PBS. На фиг. 5 представлены результаты скрининга однократной дозы в качестве процентного нокдауна мРНК серпина c1 и уровни белка относительно PBS.
Эффект дозы AD-54944, конъюгированного с GalNAc, in vivo определяли посредством введения однократной подкожной дозы мышам C57BL/6J (n=5). AD-54944, конъюгированный с GalNAc, также вводили подкожно в качестве многократной суточной дозы 5 мг/кг мышам C57BL/6J (n=5) в течение 5 суток. Животных умерщвляли через 72 часа после введения и уровень белка и активности серпина c1 определяли в образцах печени и сыворотки, как описано выше.
Как показано на фиг. 6, однократная подкожная доза AD-54944, конъюгированного с GalNAc, приводила к EC50 для белка приблизительно 10 мг/кг и многократная доза 5×5 мг/кг каждые сутки приводила к подавлению белка на приблизительно 75%.
Дополнительное многократное дозирование AD-54944, конъюгированного с GalNAc, у мышей C57BL/6J также проводили в течение 8 недель для определения эффективности и длительности подавления. На фиг. 7A и 7B представлены результаты этих исследований.
Пример 6: Продолжительность действия фракционированной дозы AD-54944
Для дальнейшей оценки нокдауна соединением AD-54944 экспрессии и активности серпина c1 проводили эксперимент с фракционированным дозированием. Мышам C57BL/6 подкожно вводили AD-54944, конъюгированный с GalNAc, эффект введения 3 раза в неделю 1/3 дозы AD-54944 сравнивали с эффектом введения 1 раз в неделю полностью концентрированной дозы AD-54944. Обобщение схемы исследования представлено в таблице 13. Сывороточные уровни белка серпина c1 определяли на 0, 3, 7, 10, 14, 17, 21, 24, 29, 31 и 35 сутки.
Результаты скрининга фракционированной дозы с введением один раз в неделю в качестве процентного нокдауна уровней белка серпина c1 относительно уровней до введения дозы представлены на фиг. 8, и результаты для скрининга с введением три раза в неделю в качестве процентного нокдауна уровней белка серпина c1 относительно уровней до введения дозы представлены на фиг. 9. Результаты демонстрируют, что существует эффект дозы в случае AD-54944, конъюгированного с GalNAc, в обеих группах, и что дозировки как 30 мг/кг один раз в неделю, так и 10 мг/кг три раза в неделю приводят к длительному подавлению серпина c1.
Пример 7: Дальнейшая оптимизация AD-54944
Для дальнейшего повышения эффективности AD-54944 получали дополнительные соединения на основе исходной последовательности AD-54944. Как правило, модификации включали добавление фосфоротиоатных связей, C16(гексадецил)-модификации, 5'-концевые кэппирующие группы и 2'-метильные группы. Новые соединения подвергали скринингу в отношении эффективности in vivo с использованием как однократной дозы 3 мг/мг, так и однократной дозы 10 мг/кг. Животным (C57BL/6) проводили подкожную инъекцию на 0 сутки, и их умерщвляли на 3 сутки. Уровни белка серпина c1 в сыворотки определяли с помощью анализа ELISA. Анализ ELISA проводили с использованием набора Antithrombin III Mouse ELISA, приобретенного от Abeam. В кратком изложении, сыворотку разбавляли (например, приблизительно 1:10000) и использовали в соответствии с инструкциями изготовителя. Считывание планшетов проводили при 450 нм в конце анализа.
В таблице 14 представлены последовательности дуплексов и результаты скринингов с однократной дозой с этими дуплексами в качестве процентного нокдауна уровней белка серпина c1 относительно PBS. На фиг. 10A и 10B представлены результаты скрининга с однократной дозой в качестве процентного нокдауна уровней белка серпина c1 относительно PBS. Как можно видеть в таблице 14 и на фиг. 10, соединение AD-56813 было выявлено в качестве нового лидирующего соединения, исходя из уровня нокдауна уровней белка серпина c1.
Следующие соединения получали на основе исходной последовательности AD-56813, в которой количество 2'-метоксиэтильных и фосфоротиоатных связей было уменьшено для определения минимальных химических модификаций, требуемых для стабильности соединений, которые сохраняли активность соединений. Новые соединения подвергали скринингу в отношении эффективности in vivo с использованием как однократной дозы 3 мг/мг, так и однократной дозы 10 мг/кг. Животным (C57BL/6) проводили подкожную инъекцию на 0 сутки, и их умерщвляли на 3 сутки. Активность серпина c1 (AT3) и уровни белка серпина c1 в сыворотке определяли с помощью анализа ELISA. Анализ ELISA проводили, как описано выше. Активность серпина c1 определяли с использованием набора для анализа активности BIOPHEN (анализ активности против фактора Xa). В кратком изложении, образцы сыворотки разбавляли от приблизительно 1:20 до приблизительно 1:60 и обрабатывали в соответствии с инструкциями изготовителя. Считывание планшетов проводили при 450 нм в конце анализа.
Последовательности дуплексов, которые были вновь полученными, и результаты скрининга однократной дозы с этими дуплексами в качестве процентного нокдауна уровней белка серпина c1 относительно PBS представлены в таблице 15. На фиг. 11 представлены результаты скрининга с однократной дозы в качестве процентного нокдауна уровней белка серпина относительно PBS и на фиг. 12 представлены результаты скрининга с однократной дозой в качестве процентного нокдауна активности серпина c1 относительно PBS.
Как можно видеть в таблице 15 и на фиг. 11 и 12, хотя количество модификаций соединения было значительно уменьшено, соединение AD-57213 сохраняло нокдаун экспрессии и активности серпина c1 и, таким образом, оказалось новым лидирующим соединением. Однократная доза AD-57213 10 мг/кг обеспечила ED90 однократная доза 3 мг/кг обеспечила ED50.
Пример 8: Нокдаун серпина c1 у мышей с гемофилией
Самцам и самкам мышей, имеющим делецию фактора VIII (гибриды C57BL/6/129) и проявляющим фенотип гемофилии A, и контрольным мышам или мышам дикого типа (самки C57BL/6) подкожно инъецировали однократную дозу соединения AD-57213, конъюгированного с GalNAc, в дозе 30 мг/кг, 10 мг/кг, 3 мг/кг или 1 мг/кг на 0 сутки, животных умерщвляли на 3 сутки и определяли активность серпина c1, как описано выше. На фиг. 13 показано, что однократная доза AD-57213 не только эффективно осуществляет нокдаун активности серпина c1, но что также существует эффект дозы AD-57213.
Для исследования влияния снижения уровня антитромбина на образование тромбина при гемофилии, проводили исследования по получению тромбина для плазмы человека, из которой удалены фактор IX (FIX) и антитромбин (AT). (Устранение FIX воспроизводит фенотип гемофилии B). Затем AT обратно добавляли к образцам плазмы на различных уровнях (1 МЕ/мл = 100%) с получением образцов плазмы, из которой устранен FIX, с различными уровнями антитромбина (0-100%). Контрольную плазму получали, обратно добавляя 1 МЕ/мл антитромбина и 5 мкг/мл FIX (100%) в плазму с устранением обоих факторов. На фиг. 31A представлено получение тромбина и плазма человека, из которой устранены FIX и AT (тканевой фактор = 5 пМ). На фиг. 31B представлен пиковый уровень тромбина в плазме человека, из которой устранены FIX и AT (тканевойв фактор = 5 пМ). Как указано на этих фигурах, снижение уровней антитромбина увеличивает образование тромбина в плазме человека, из которой устранен фактор IX, in vitro.
Пример 9: Длительность действия дозы AD-57213
Для оценки длительности подавления антитромбина у мышей с гемофилией A (B6; 129S4-F8tm1/Kaz/J; Jackson Labs) после однократной дозы AD-57213, конъюгированного с GalNAc, мышам подкожно инъецировали соединения AD-57214, AD-57205 или AD-57213, или PBS. Проводили взятие цельной крови ретроорбитальным путем и ее анализировали в отношении уровней мРНК серпина c1 и активности серпина c1. Результаты скрининга с однократной дозой соединения AD-57213, введенного в дозе 10 мг/кг, 3 мг/кг или 1 мг/кг, в качестве процентного нокдауна активности серпина c1 относительно PBS на 3, 7, 10, 14, 17, 21, 28 и 36 сутки, представлены на фиг. 14. На фиг. 16 представлены результаты скрининга с однократной дозой для соединений AD-57213, AD-57205, и AD-57214, введенных в дозах, указанных на фигурах, в качестве процентного нокдауна активности серпина c1 относительно PBS на 3, 7, 10, 14, 17, 21 и 25 сутки.
мРНК в печени, антиген AT в сыворотке и активность AT измеряли у мышей с гемофилией A (B6; 129S4-F8tm1/Kaz/J; Jackson labs), которым подкожно инъецировали AD-57213 в дозе 30 мг/кг, 10 мг/кг, 3 мг/кг, 1 мг/кг, или PBS на 0 сутки. Животных умерщвляли на 3 сутки после инъекции, как описано выше. На фиг. 15 представлены результаты скрининга однократной дозы в качестве процентного нокдауна уровней антигена серпина c1 относительно PBS, и в качестве процентного нокдауна активности серпина c1 относительно PBS на 3 сутки для AD-57213.
Как представлено на фиг. 14-16, введение соединения AD-57213 приводит к мощному зависимому от дозы подавлению серпина c1 у мышей HA в случае однократной дозы ED50 менее 1 мг/кг на 7 сутки. Подавление серпина c1 было длительным и коррелировало с максимальным достигнутым уровнем подавления антитромбина. Однократная доза 1 мг/кг привела к поддержанию 50% подавления в течение приблизительно 15 суток, в то время как доза 10 мг/кг привела более чем к 80% подавлению, поддерживающемуся в течение 28 суток.
Пример 10: Длительность действия дозы в случае AD-57213 с фракционированной дозой
Для дальнейшей оценки нокдауна соединением AD-57213 экспрессии и активности серпина c1, проводили эксперимент с фракционированными дозами. Мышам C57BL/6 подкожно вводили AD-57213, конъюгированный с GalNAc, и эффект введения 3 раза в неделю 1/3 дозы AD-57213 сравнивали с эфффектом полной объединенной дозы AD-57213 1 раз в неделю. Обобщение схемы исследования представлено в таблице 16. Определяли уровни белка серпина c1 в сыворотке.
Результаты дозирования один раз в неделю (q1w) в качестве процентного нокдауна уровней белка серпина c1 относительно PBS представлены на фиг. 17, и результаты дозирования три раза в неделю (t.i.w.) в качестве процентного нокдауна уровней белка серпина c1 относительно PBS представлены на фиг. 18.
Как показано на фиг. 17 и 18, многократное дозирование соединения AD-57213 привело к дозозависимому длительному ответу с некоторым аддитивным эффектом. Животные, которым дозировали 3 мг/кг, достигали нокдауна с наиболее низким уровнем >95%, после 2 доз раз в неделю в то время как группы с более низкими дозами раз в неделю достигали нокдауна с наиболее низким уровнем после 3 доз раз в неделю (~90% нокдаун для 1,5 мг/кг и ~80% для 0,75 мг/кг).
Для дальнейшего исследования различных режимов дозирования, в различных группах одну и ту же недельную дозу фракционировали и вводили три раза в неделю, например, 1,5 мг/кг q1w сравнивали с 0,5 мг/кг tiw. Как показано на фиг. 19, совокупная недельная доза обеспечила одинаковый уровень нокдауна. Например, уровни серпина c1, достигнутые с помощью 1,5 мг/кг (q1w), были эквивалентными уровням серпина c1, достигнутым с помощью 0,5 мг/кг, введенных три раза в неделю.
Пример 11: Введение не являющемуся человеком примату ми-РНК серпина c1
Соединение AD-57213 исследовали в отношении эффективности не являющихся человеком приматов, как представлено в таблице 17. Сывороточные уровни белка серпина c1 определяли на сутки -14, -8, -4, сутки 1 через 4 часа после введения дозы, на сутки 2, 4, 8, 11, 15, 22, 29, 37, 44, 51 и 58.
На фиг. 20 представлены результаты скрининга с однократной дозой для всех исследованных соединений в качестве среднего значения для группы относительных уровней серпина c1 в сыворотке по сравнению с уровнями серпина c1 до дозирования и продемонстрировано, что все из исследованных ми-РНК эффективно осуществляют нокдаун уровней белка серпина c1.
На фиг. 21 представлены результаты скрининга с однократной дозой для соединения AD-57213 в качестве среднего значения для группы относительных уровней в сыворотке серпина c1 по сравнению с уровнями серпина c1 до введения.
На фиг. 22 представлены результаты скрининга с однократной дозой для всех исследованных соединений в качестве среднего значения для группы относительных уровней серпина c1 по сравнению с уровнями серпина c1 до введения на 8 сутки.
В целом, результаты демонстрируют, что происходит дозозависимый нокдаун уровней белка серпина c1 с помощью AD-57213 у не являющихся человеком приматов и что как AD-57213, так и AD-57205, демонстрируют увеличенную эффективность относительно исходного соединения AD-52444.
Пример 12: Введение не являющемуся человеком примату терапевтической ми-РНК серпина c1
Соединение AD-57213 исследовали в отношении эффективности у не являющихся человеком приматов. Яванским макакам вводили соединение AD-57213, как описано в таблице 18, ниже. Взятие плазмы проводили в различные моменты времени после введения AD-57213 и ее анализировали в отношении уровней белка антитромбина (серпин c1) с помощью ELISA.
На фиг. 23 представлены результаты скрининга с однократной дозы для соединения AD-57213 в качестве среднего значения для группы относительных уровней серпина c1 в сыворотке по сравнению со средним значением трех показателей до введения дозы. Результаты демонстрируют дозозависимое подавление серпина c1 приблизительно с 50, 70, 80 и >90 подавлением в дозе 1, 3, 10 и 30 мг/кг, соответственно. Точки данных соответствуют среднему значению для группы и планки погрешностей соответствуют стандартному отклонению.
На фиг. 24A-D представлена взаимосвязь между относительным уровнем серпина c1 в сыворотке и кратным изменением пикового уровня тромбина в плазме при однократной дозе A) 1 мг/кг, B) 3 мг/кг, C) 10 мг/кг, и D) 30 мг/кг соединения AD57213. Уровни c1 представлены относительно среднего значения для трех показателей до введения дозы. Кривые образования тромбина получали для образцов плазмы, полученных в различные моменты времени, с использованием откалиброванного автоматического тромбиноскопа (тканевой фактор = 1 пМ). Кратное изменение пикового уровня тромбина вычисляли относительно средней пиковой величины тромбина для двух величин до введения дозы для каждого животного. Точки данных соответствуют среднему значению для группы и планки погрешностей соответствуют стандартному отклонению. На фиг. 25 представлена сводная диаграмма разброса увеличения кратного изменения пикового уровня тромбина в зависимости от относительного подавления серпина c1.
Животным также проводили введение трех доз AD-57213 по 30 мг/кг раз в неделю и уровни белка и мРНК серпина c1 определяли в образцах крови, взятых от животных. Результаты этих исследований представлены на фиг. 26A (уровни белка серпина c1 относительно уровней до кровопускания) и 26B (уровни мРНК серпина c1 относительно GAPDH).
В целом, результаты демонстрируют, что существует длительное дозозависимое ингибирование уровней белка серпина c1 с помощью соединения AD-57213 у не являющихся человеком приматов, которое приводит к увеличению вплоть до 4 раз образования тромбина.
Пример 13: Многократное введение ми-РНК серпина c1 при введении не являющемуся человеком примату
Соединение AD-57213 исследовали в отношении эффективности и для оценки совокупного эффекта соединения у не являющихся человеком приматов с помощью протокола многократного введения. Яванским макакам вводили соединение AD-57213 в дозе 0,5 мг/кг q1w; 1 мг/кг q2w (раз в две недели), в течение 2 месяцев и 1,5 мг/кг q1w; 3 мг/кг q2w в течение 6 недель. Взятие сыворотки проводили в различные моменты времени, как проиллюстрировано на фиг. 27, и анализировали в отношении уровня белка антитромбина (серпин c1) с помощью ELISA. Уровни антитромбина были представлены относительно среднего значения для трех показателей до введения дозы.
Первые две группы доз с совокупной дозой 0,5 мг/кг в неделю имели 80% снижение уровней AT через 5 недель. Последние две группы с совокупной недельной дозой 1,5 мг/кг имели максимальный нокдаун >95%. На фиг. 27A представлены данные для двух последних групп. Животных, которым вводил дозу 3 мг/кг, умерщвляли на 54 сутки, и животным, которым вводили 1,5 мг/кг q1w, вводили дополнительную 6-ую недельную дозу на 36 сутки и проводили их мониторинг в отношении восстановления исходных уровней. На фиг. 27B представлены уровни AT после совокупной недельной дозы 0,5 мг/кг.
Данные демонстрируют, что дозозависимое подавление антитромбина наблюдали при обоих режимах дозирования и стационарного уровня подавления достигали к 25 суткам.
Пример 14: Корректирование гемостаза после введения соединения AD-57213 мышам с гемофилией
Животные с гемофилией имеют меньший потенциал к образованию тромбина и у них не могут образовываться стабильные сгустки. Снижение уровня белка антитромбина у этих животных должно помочь восстановить равновесие при гемостазе, увеличить потенциал к образованию эндогенного тромбина и обеспечить образование сгустка. Эту гипотезу исследовали у мышей с гемофилией A и гемофилией B в модели лазерного повреждения микрососудов, сопровождающегося прижизненной визуализацией. Мышам инъецировали соединение AD-57213 и через 10 суток после введения индуцировали повреждение. Накопление тромбоцитов и фибрина в области повреждения визуализировали, регистрировали и количественно определяли. На фиг. 28A представлены средние величины накопления тромбоцитов с течением времени после лазерной хирургической операции и на фиг. 28B представлены средние величины фибрина для всех причиненных повреждений с течением времени после лазерной хирургической операции. Как продемонстрировано с помощью фиг. 28A и 28B, соединение AD-57213, инъецированное в дозе 1 мг/кг или 30 мг/кг, привело отложению тромбоцитов и фибрина, ведущему к образованию сгустка при 100% повреждений. В таблице 19 обобщенно представлены результаты двух отдельных экспериментов с животными HA и HB.
Пример 15: Эффективность состава AD-57213 LNP in vivo
Соединения AD-55029 (неконъюгированное) и AD-57213 (конъюгированное с GalNAc) составляли в виде липидной частицы с нуклеиновой кислотой (AF-11) и животным дикого типа вводили дозы 0,03 мг/кг, 0,1 мг/кг и 0,3 мг/кг этих составленных с LNP соединений. В качестве контроля использовали люциферазу (AF11-1955).
Оба соединения привели к >95 нокдауну в дозе 0,3 мг/кг, однако AF11-57213 поддерживал уровни в течение 15 суток против 8 суток в случае AF11-55029 (смотрите фиг. 29). При более низких дозах наблюдали сходное отличие в длительности действия между двумя соединениями.
Пример 16: Конструирование, синтез и скрининг in vitro дополнительных ми-РНК
Конструирование ми-РНК
Дуплексы ми-РНК длиной 19 нуклеотидов как для смысловой, так и для антисмысловой цепи, конструировали с использованием последовательности мРНК серпина c1 мРНК последовательность, обозначаемой номером доступа GenBank № NM_000488.3. Первоначально был идентифицирован тысяча пятьсот восемьдесят один дуплекс, которые не содержали повторы длиннее 7 нуклеотидов, охватывающий весь транскрипт из 1599 нуклеотидов. Затем все 1581 дуплексов оценивали в отношении спрогнозированной эффективности в соответствии с линейной моделью, которая оценивает нуклеотидную пару в каждом положении дуплекса, и дозу и клеточную линию для применения в скрининге. Также дуплексы сопоставляли со всеми транскриптами в коллекции RefSeq человека с использованием специализированного алгоритма "в лоб", и оценивали в отношении наиболее низких количеств несовпадений (на цепь) с транскриптами, отличными от серпина c1. Затем дуплексы, подлежащие синтезу и скринингу, выбирали из 1581 дуплекса в соответствии со следующей схемой: начиная с 5'-конце транскрипта, выбирали дуплекс в "окне" из каждых 10+2 нуклеотида, который
1) имел наиболее высокую спрогнозированную эффективность,
2) имел по меньшей мере одно несоответствие на обеих цепях со всеми транскриптами, отличными от серпина c1,
3) еще не был синтезирован и подвергнут скринингу в качестве части других наборов дуплексов. Если в данном окне не может быть идентифицирован дуплекс, который удовлетворяет всем критериям, тогда окно пропускают. Было идентифицировано сто шестьдесят четыре дуплекса, которые удовлетворяли этим критериям.
Детальный перечень последовательностей смысловой и антисмысловой цепи серпина c1 представлены в таблицах 20 и 21.
Культура клеток и трансфекция
Клетки Hep3B (ATCC, Manassas, VA) выращивали практически до смыкания монослоя при 37°C в атмосфере 5% CO2 в минимальной эссенциальной среде Игла (ATCC), дополненной 10% FBS, стрептомицином и глутамином (ATCC), а затем открепляли от чашек посредством трипсинизации. Трансфекцию проводили посредством добавления 14,8 мкл Opti-MEM вместе с 0,2 мкл Lipofectamine RNAiMax на лунку (Invitrogen, Carlsbad CA., каталожный номер # 13778-150) к 5 мкл каждого из 164 дуплексов ми-РНК в индивидуальную лунку 96-луночного планшета. Затем смесь инкубировали при комнатной температуре в течение 15 минут. Затем к смеси миРНК добавляли 80 мкл полной среды для роста без антибиотика, содержавшей ~2,5×104 клеток HepG2. Клетки инкубировали в течение 24 часов, а затем РНК очищали. Эксперименты проводили при 20 нМ и они включали наивные клетки и клетки, трансфицированные AD-1955, нацеленной на люциферазу ми-РНК, в качестве отрицательного контроля.
Выделение тотальной РНК с использованием набора для выделения мРНК DYNABEADS mRNA Isolation Kit (Invitrogen, партия №: 610-12)
Клетки собирали и лизировали в 150 мкл буфера для лизиса/связывания, а затем перемешивали в течение 5 минут при 700 об./мин. на устройстве для встряхивания с платформой (скорость перемешивания была одинаковой в ходе процесса). Десять микролитров магнитных гранул и 80 мкл буфера для лизиса/связывания добавляли в планшет с круглым дном и перемешивали в течение 1 минуты. Магнитные гранулы улавливали с использованием магнитного стенда, и супернатант удаляли, не нанося вреда гранулам. После удаления супернатанта лизированные клетки добавляли к оставшимся гранулам и перемешивали в течение 5 минут. После удаления супернатанта магнитные гранулы промывали 2 раза 150 мкл буфера для промывания A и перемешивали в течение 1 минуты. Гранулы вновь улавливали, и супернатант удаляли. Затем гранулы промывали 150 мкл буфера для промывания B, улавливали, и супернатант удаляли. Далее гранулы промывали 150 мкл буфера для элюирования, улавливали, и супернатант удаляли. Гранулам позволяли высохнуть в течение 2 минут. После высушивания добавляли 50 мкл буфера для элюирования и перемешивали в течение 5 минут при 70°C. Гранулы улавливали на магнит в течение 5 минут. Сорок мкл супернатанта, содержавшего выделенную РНК, удаляли и добавляли в другой 96-луночный планшет.
Синтез кДНК с использованием набора для обратной транскрипции кДНК ABI High capacity (Applied Biosystems, Foster City, CA, по каталогу #4368813)
Основную смесь 2 мкл 10× буфера, 0,8 мкл 25×dNTP, 2 мкл случайных праймеров, 1 мкл обратной транскриптазы, 1 мкл ингибитора РНКазы и 3,2 мкл H2O на реакционную смесь добавляли к 10 мкл тотальной РНК. кДНК получали с использованием термоциклера Bio-Rad C-1000 или S-1000 (Hercules, CA) с помощью следующих стадий: 25°C в течение 10 минут, 37°C в течение 120 минут, 85°C в течение 5 секунд и удержание при 4°C.
ПЦР в реальном времени
Два мкл кДНК добавляли к основной смеси, содержавшей 0,5 мкл зонда для GAPDH человека TaqMan (Applied Biosystems, по каталогу #4326317E), 0,5 мкл зонда для серпина c1 человека TaqMan (Applied Biosystems, по каталогу # Hs00892758_m1) для клеток человека и 5 мкл основной смеси для зондов Lightcycler 480 (Roche, по каталогу #04887301001) на лунку в 384-луночном планшете (Roche, по каталогу № 04887301001). ПЦР в реальном времени проводили в системе LC480 Real Time ПЦР machine (Roche). Для вычисления относительного кратного изменения данные, полученные в реальном времени, анализировали с использованием способа AACt и нормализовали к результатам анализа, проведенным с помощью клеток, трансфицированных 20 нМ AD-1955.
В таблице 22 представлены результаты скрининга с однократной дозой указанных i-РНК в HepG2.
Реферат
Изобретение относится к биотехнологии. Описано средство на основе двухцепочечной рибонуклеиновой кислоты (дцРНК) для ингибирования экспрессии серпина c1, где указанное средство на основе дцРНК содержит смысловую цепь и антисмысловую цепь, где указанная антисмысловая цепь содержит область комплементарности, которая содержит по меньшей мере 19 последовательно расположенных нуклеотидов, отличающихся не более чем на 3 нуклеотида от нуклеотидной последовательности 5’-UUGAAGUAAAUGGUGUUAACCAG-3’(SEQ ID NO: 562), где указанная смысловая цепь независимо имеет длину по меньшей мере 19 нуклеотидов и где лиганд, включающий одно или более производных N-ацетилгалактозамина (GalNAc), конъюгирован с 3’-концом указанной смысловой цепи указанного средства на основе дцРНК. Также описаны композиции, нацеленные на ген серпина c1, и способы с использованием таких средств для ингибирования экспрессии серпина c1 и лечения индивидуумов, имеющих геморрагическое нарушение, такое как гемофилия. Изобретение расширяет арсенал средств для ингибирования экспрессии серпина c1. 22 н. и 162 з.п. ф-лы, 31 ил., 22 табл., 16 пр.
Формула















Комментарии