Способы и антитела для модуляции иммунного ответа - RU2757489C2
Код документа: RU2757489C2
Чертежи






























Описание
Область техники, к которой относится изобретение
Изобретение относится к области иммунотерапии, а именно, к способам и антителам для модуляции иммунного ответа путем регуляции экспрессии антигена CD11b на клетках.
Уровень техники
Широко распространено мнение о том, что раковые клетки экспрессируют иммуногенные антигены, которые могут индуцировать эффективный иммунный ответ, направленный против образования опухолей. Помимо этого, микроокружение опухоли богато компонентами, которые могут запускать передачу сигналов через Толл-подобные рецепторы (TLR) для активации противоопухолевого иммунного ответа (Standiford TJ, Keshamouni VG (2012) Breaking the tolerance for tumor: Targeting negative regulators of TLR signaling. Oncoimmunology 1: 340-345). Это означает, что на начальных стадиях заболевания, имеется шанс распознания и отторжения раковых клеток иммунной системой, которая оказывает как защитное воздействие в отношении организма хозяина, так и моделирующее воздействие на опухоль при развивающихся опухолях. Однако раковые клетки также обладают множеством механизмов негативной регуляции, обеспечивающих ускользание от иммунологического надзора, такими как негативная регуляция молекул главного комплекса гистосовместимости (ГКГС) или механизмов процессирования и презентации антигенов, увеличение секреции ингибирующих цитокинов и экспрессирование ингибирующих молекул, приводящих к индукции иммунной толерантности в отношении раковых клеток. Поэтому онкологических пациентов часто рассматривают как имеющих слабый иммунитет.Таким образом, по-прежнему имеется необходимость в разработке агента или терапии для устранения иммуносупрессии, связанной с раковыми заболеваниями.
Интегрин альфа-М (CD11b, CR3A и ITGAM) представляет собой одну из белковых субъединиц, образующих гетеродимерные молекулы интегрина αМβ2, которые экспрессируются на поверхности многих иммунных клеток, включая моноциты, гранулоциты, макрофаги, дендритные клетки, натуральные киллеры и супрессорные клетки миелоидного происхождения. Интегрин αМβ2 опосредует воспаление путем регуляции клеточной адгезии, миграции, хемотаксиса и фагоцитоза за счет набора разнородных лигандов. Проведенное недавно исследование показало его критическую роль в развитии воспаления за счет модуляции TLR4-ответа (Han С, Jin J, Xu S, Liu H, Li N, et al. (2010) Integrin CD11b negatively regulates TLR-triggered inflammatory responses by activating Syk and promoting degradation of MyD88 and TRIF via Cbl-b. Nat Immunol 11: 734-742). Разнообразные лиганды эндогенного интегрина αМβ2, присутствующие внутри кровеносных сосудов, такие как фибриноген, могут запускать сигнальный путь TLR4. Высокоавидное связывание ITAM с интегрином β2 приводит к кратковременной активации TLR, однако быстро ингибируют передачу сигнала через TLR за счет воздействия на MyD88 и TRIF для Cbl-b-опосредованной протеолитической деградации. Таким образом, интегрин αМβ2 может служить в качестве отрицательного регулятора избирательно ингибируемых компонентов сигнального пути TLR для блокирования эффектов рецепторов семейства TLR (Wang L, Gordon RA, Huynh L, Su X, Park Min KH, et al. (2010) Indirect inhibition of Toll-like receptor and type I interferon responses by ITAM-coupled receptors and integrins. Immunity 32: 518-530).
PD-L1 является одним из ко-ингибиторных белков, который экспрессируется в иммунных клетках многих типов в различных количествах, и конститутивно экспрессируется в моноцитах, макрофагах и дендритных клетках, Т-клетках, В-клетках, эпителиальных клетках и клетках эндотелия сосудов. При наличии положительной индукции, такой как IFN-γ и митогенная стимуляция, возможна дополнительная повышающая регуляция PD-L1. PD-L1 связывается со своим рецептором, PD-1, находящимся на активированных Т-клетках, что приводит к выраженной иммуносупрессии за счет индукции передачи в активированные Т-клетки ко-ингибирующего сигнала, который приводит к апоптозу и анергии Т-клеток {Butte MJ, Keir ME, Phamduy ТВ, Sharpe AH, Freeman GJ (2007) Programmed death-1 ligand 1 interacts specifically with the B7-1 costimulatory molecule to inhibit T cell responses. Immunity 27: 111-122; Francisco LM, Salinas VH, Brown KE, Vanguri VK, Freeman GJ, et ah (2009) PD-L1 regulates the development, maintenance, and function of induced regulatory T cells. J Exp Med 206: 3015-3029). Ненарушенность взаимодействия PD-L1/PD-1 также важна для предотвращения возникновения избыточного иммунного ответа. Нарушения взаимодействия между PD-L1 и PD-1 могут привести к неконтролируемому развитию иммунных ответов, ведущему к таким состояниям как аутоиммунные заболевания, гиперчувствительность, отторжение трансплантатов и возникновение реакций «трансплантат против хозяина».
Патент США № US 8,008,449 описывает выделенные моноклональные антитела, а именно, человеческие моноклональные антитела, которые специфично связываются с PD-1. Патент США № US 8,354,509 относится к антителам, которые блокируют связывание человеческого рецептора программируемой смерти 1 (hPD-1) с его лигандами (hPD-L1 или hPD-L2). Патент США № US 8,900,587 раскрывает изобретение, относящееся к антителам, которые блокируют связывание hPD-1 с hPD-L1 или hPD-L2 и способу повышения активности (или уменьшения негативной модуляции) иммунных клеток через сигнальный путь PD-1. Патенты США № US 9,067,999 и US 9,073,994 описывают композиции, предназначенные для лечения рака или инфекций путем иммунопотенциирования, обусловленного ингибированием иммуноподавляющего сигнала, индуцируемого PD-1, PD-L1 или PD-L2, и способы терапии с использованием указанных композиций. Однако для антител, описанных в указанных выше патентах, характерна низкая частота ответа на терапию. Патент США № US 20140099254 А1 описывает способ индукции иммунного ответа на раковые или инфекционные заболевания, включающий введение пациенту с раковым или инфекционным заболеванием комбинации двух или более агентов, выбираемых из группы, включающей в себя (i) перенацеливающие лейкоциты биспецифические антитела, включая ADAM17, CD2, CD3, CD4, CD5, CD6, CD8, CD11a, CD11b, CD14, CD16, CD16b, CD25, CD28, CD30, CD32a, CD40, CD40L, CD44, CD45, CD56, CD57, CD64, CD69, CD74, CD89, CD90, CD137, CD177, CEACAM6, CEACAM8, альфа-цепь HLA-DR, KIR и SLC44A2; (ii) интерферон; (iii) антитела-ингибиторы контрольных точек иммунного ответа, включая CTLA4, PD1, PD-L1, LAG3, В7-Н3, В7-Н4. KIR и TIM3; и (iv) конъюгат антитело-лекарственное средство (ADC). Однако указанный патент включает в себя только указание на ряд известных ингредиентов, связанных с иммунной системой, без описания взаимодействий между ингредиентами.
Раскрытие изобретения
Неожиданно было обнаружено, что экспрессия PD-L1 может быть подавлена модуляторами CD11b, связывающимися с CD11b на иммунных клетках и/или других клетках. Связывание модулятора CD11b с CD11b может уменьшать экспрессию PD-L1 на моноцитах, примированных липополисахаридом (ЛПС). У ЛПС-иммуносупрессированных моноцитов или моноцитов пациентов с септическим шоком связывание модулятора CD11b с CD11b также уменьшает экспрессирование PD-L1 в тех случаях, когда клетки подвергнуты воздействию ЛПС.
В соответствии с настоящим изобретением, предлагается способ ингибирования экспрессии PD-L1 в иммунных клетках, включающий контактирование указанных иммунных клеток с модулятором CD11b, который связывается с CD11b на поверхности клетки, что обеспечивает регуляцию экспрессии PD-L1 в иммунных клетках.
В соответствии с настоящим изобретением, предлагается способ предотвращения подавления иммунитета или истощения иммунной системы или индукции существующего иммунитета в иммунных клетках, включающий контактирование указанных иммунных клеток с модулятором CD11b, который связывается с CD11b на поверхности клетки.
В соответствии с настоящим изобретением, предлагается способ выявления пациентов, восприимчивых к модулятору CD11b, указанный способ включает в себя определение того, происходит ли ингибирование PD-L1 в образце биологического материала или в организме пациента при контакте иммунных клеток с модулятором CD11b, и выявление ингибирования PD-L1 на иммунных клетках под действием модулятора CD11b, при этом ингибирование PD-L1 указывает на то, что пациент является восприимчивым к модулятору CD11b.
В некоторых вариантах осуществления изобретения, модулятор CD11b, описанный выше, представляет собой агент РНК-интерференции, ингибирующий экспрессию CD11b, антитела к CD11b или низкомолекулярное соединение, модулирующее CD11b.
В одном из вариантов осуществления изобретения, иммунная клетка представляет собой Т-клетку, или моноцит, или гранулоцит, или макрофаг, или супрессорную клетку миелоидного происхождения, или клетку-натуральный киллер. В одном из вариантов осуществления изобретения, связывание CD11b увеличивает количество IFN-γ, IL-12 или CD8 Т-клеток. В другом варианте осуществления изобретения, связывание модулятора CD11b с CD11b на клетке обеспечивает лечение и/или профилактику заболевания, связанного с иммуносупрессией. В другом варианте осуществления изобретения, заболевание, связанное с иммуносупрессией или истощением иммунной системы, представляет собой истощение популяции Т-клеток при острой и/или хронической инфекции, сепсисе, иммунодефиците при раке или старении иммунной системы с возрастом.
В одном из вариантов осуществления изобретения, способ предотвращения и/или лечения рака включает в себя применение дополнительного активного агента или терапии. В некоторых вариантах осуществления изобретения, дополнительный активный агент представляет собой терапию на основе иммунных контрольных точек, радиотерапию или химиотерапию.
В соответствии с настоящим изобретением, также предлагаются антитела KCD11b или антигенсвязывающая часть указанных антител, включающая в себя, по меньшей мере, один участок, определяющий комплементарность 1 (H-CDR1) тяжелой цепи, состоящий из аминокислотных остатков NYWIN (идентификационный номер последовательности: 1), или GFSLTSNSIS (идентификационный номер последовательности: 2), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 1 или 2; участок CDR2 тяжелой цепи (H-CDR2), состоящий из аминокислотных остатков NIYPSDTYINHNQKFKD (идентификационный номер последовательности: 3) или AIWSGGGTDYNSDLKS (идентификационный номер последовательности: 4), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 3 или 4; и участок тяжелой цепи CDR3 (H-CDR3), состоящий из аминокислотных остатков SAYANYFDY (идентификационный номер последовательности: 5) или RGGYPYYFDY (идентификационный номер последовательности: 6), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 5 или 6; и, по меньшей мере, один участок CDR1 легкой цепи (L-CDR1), состоящий из аминокислотных остатков RASQNIGTSIH (идентификационный номер последовательности: 7) или KSSQSLLYSENQENYLA (идентификационный номер последовательности: 8), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 7 или 8; участок CDR2 легкой цепи (L-CDR2), состоящий из аминокислотных остатков YASESIS (идентификационный номер последовательности: 9) или WASTRQS (идентификационный номер последовательности: 10) или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 9 или 10; и участок CDR3 легкой цепи (L-CDR3), состоящий из аминокислотных остатков QQSDSWPTLT (идентификационный номер последовательности: 11) или QQYYDTPLT (идентификационный номер последовательности: 12), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 11 или 12; таким образом, что указанное выделенное антитело или его антигенсвязывающая часть связывается с CD11b.
В некоторых вариантах осуществления изобретения, описанные выше участки, определяющие комплементарность (CDR), включают в себя одну или более инсерцию, замену и/или делецию.
В другом варианте осуществления изобретения, в соответствии с настоящим изобретением предлагаются антитела к CD11b или антигенсвязывающая часть указанных антител, включающая в себя (i) вариабельную область тяжелой цепи, представляющую собой вариабельную область тяжелой цепи, включающую в себя участок H-CDR1, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 1, участок H-CDR2, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 3, и участок H-CDR3, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 5, и (и) вариабельные области легкой цепи, включающие в себя участок L-CDR1, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 7, участок L-CDR2, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 9, и участок L-CDR3, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 11; или (iii) вариабельную область тяжелой цепи, представляющую собой вариабельную область тяжелой цепи, включающую в себя участок H-CDR1, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 2, участок H-CDR2, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 4, и участок H-CDR3, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 6, или (iv) вариабельные области легкой цепи, включающие в себя участок L-CDR1, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 8, участок L-CDR2, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 10, и участок L-CDR3, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 12. В другом варианте осуществления изобретения участок H-CDR1 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 1 или 2; участок H-CDR2 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 3 или 4; участок H-CDR3 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 5 или 6; участок L-CDR1 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 7 или 8; участок L-CDR2 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 9 или 10 и участок L-CDR3 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 11 или 12.
Помимо этого, в соответствии с настоящим изобретением, предлагаются гуманизированные антитела к CD11b антигенсвязывающая часть указанных антител, включающие в себя:
(а) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 13, и (ii) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 23;
(с) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 14, и (ii) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 24;
(е) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с
идентификационным номером: 15, и (f) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 25;
(g) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 16, и (h) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 26;
(i) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 17, и (j) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 27;
(k) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 18, и (l) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 28;
(m) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 19, и (n) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 29;
(о) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 20, и (р) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 30;
(q) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 21, и (r) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 31;
(s) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 22, и (t) вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 32.
В соответствии с настоящим изобретением, также предлагаются композиции, включающие в себя антитела к CD11b или антигенсвязывающую часть указанных антител. В соответствии с настоящим изобретением, также предлагаются способы, которые включают в себя введение пациенту гуманизированных антител к CD11b, являющихся объектом настоящего изобретения. Такие способы включают в себя способы ингибирования экспрессии PD-L1 в иммунной клетке, обращение вспять иммуносупрессии или истощения иммунной системы, или индукцию существующего иммунитета в иммунной клетке, определения PD-L1 в организме пациента и лечение или профилактики острой и/или хронической инфекции, сепсиса, иммунодефицита при раке или старения иммунной системы с возрастом. Антитела к CD11b, являющиеся объектом настоящего изобретения, могут быть использованы в указанных выше способах.
Краткое описание чертежей
На Фиг. 1 показано, что связывание CD11b с антителом к CD11b изменяет поверхностную экспрессию PD-L1. Моноциты человека были подвергнуты стимуляции ЛПС (100 нг/мл) в присутствии либо контрольного изотипа IgG, либо антител к CD11b (ICRF44), в течение 18 часов. Клетки были собраны, молекулы HLA-DR, PD-L1, CD80 и С086были подвергнуты анализу с использованием проточной цитометрии. Экспрессию молекул на поверхности клеток оценивали по средней интенсивности флуоресценции (MFI). Значения представлены как среднее ± стандартная ошибка среднего, по результатам 3 независимых экспериментов.
На Фиг. 2 и 3 показано влияние адгезии клеток к фибриногену и сокращение экспрессии PD-L1 при связывании с CD11b, соответственно. Фиг. 2 иллюстрирует влияние ML-C19-A на адгезию клеток K562/CD11b к фибриногену. Оценивали адгезию 25 ООО клеток K562/CD11b к дну лунок, покрытых фибриногеном (20 мкг/мл) в присутствии 10 мкМ ML-C19-A или ДМСО при температуре 37°С в течение 20 минут. Количественную оценку результатов проводили с использованием набора для титрования на основе люциферазы CellTiter-Glo (Promega CO.). Каждый столбик диаграммы представляет среднее ± стандартная ошибка среднего, по результатам трех определений в репрезентативном эксперименте Фиг. 3 показывает, что связывание CD11b с антагонистом CD11b приводит к снижению экспрессии PD-L1 в моноцитах. Моноциты человека были подвергнуты стимуляции ЛПС (100 нг/мл) в присутствии либо контроля (ДМСО), либо 10 мкМ ML-C19-A, в течение 18 часов. Клетки были собраны, молекулы PD-L1 были подвергнуты анализу с использованием проточной цитометрии. Экспрессию молекул на поверхности клеток оценивали по средней интенсивности флуоресценции (MFI). Значения представлены как среднее значение ± стандартная ошибка среднего, по результатам 10 независимых экспериментов.
На Фиг. 4 показано влияние монотерапии антителами к CD11b на рост опухоли B16F10. Мышам C57BL/6 проводили подкожное введение 2×105 клеток B16F10 в день 0. В день 7 мышам (n=5 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо крысиные антитела к мышиному CD11b. Инъекции повторяли каждые три-четыре дня. В день 18 мыши были умерщвлены. Было проведено измерение объема опухолей, результаты представлены в виде среднего значения±стандартная ошибка среднего.
На Фиг. 5 показана величина популяции супрессорных клеток миелоидного происхождения (MDSC) и CD8 Т-клеток среди инфильтрирующих опухоль лейкоцитов после терапии антителами к CD11b. Мышам C57BL/6 проводили подкожное введение 2×105 клеток B16F10 в день 0. В день 7 мышам (п=5 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо крысиные антитела к мышиному CD11b. Инъекции повторяли каждые три-четыре дня. В день 18 мыши были умерщвлены. Опухоли подвергали расщеплению под действием коллагеназы, анализ содержания инфильтрирующих опухоль лейкоцитов проводили путем проточной цитометрии.
На Фиг. 6 показана экспрессия PD-L1 на поверхности лейкоцитов и IAIE+/CD8 Т-клеток в крови после терапии антителами к CD11b. В день 0 каждой мыши вводили в хвостовую вену 2×105 клеток B16F10. В день 1 мышам (n=3 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо антитела к мышиному CD11b (5 мг/кг). Инъекции повторяли каждые три-четыре дня. В день 15 мыши были умерщвлены. Лейкоциты были собраны, молекулы PD-L1 и IAIE+/CD8 Т-клетки были подвергнуты анализу с использованием проточной цитометрии.
На Фиг. 7 показано, что продукция IFN-γ, IL-12 и TNF-α у мышей-опухоленосителей изменялась после терапии антителами к CD11b. В день 0 каждой мыши вводили в хвостовую вену 2×105 клеток B16F10. В день 1 мышам (n=3 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо крысиные антитела к мышиному CD11b (5 мг/кг). Инъекции повторяли каждые три-четыре дня. В день 9 мыши были умерщвлены. Количественное определение цитокинов в плазме проводили с использованием набора для оценки уровня воспаления у мышей BD СВА Mouse Inflammation Kit.
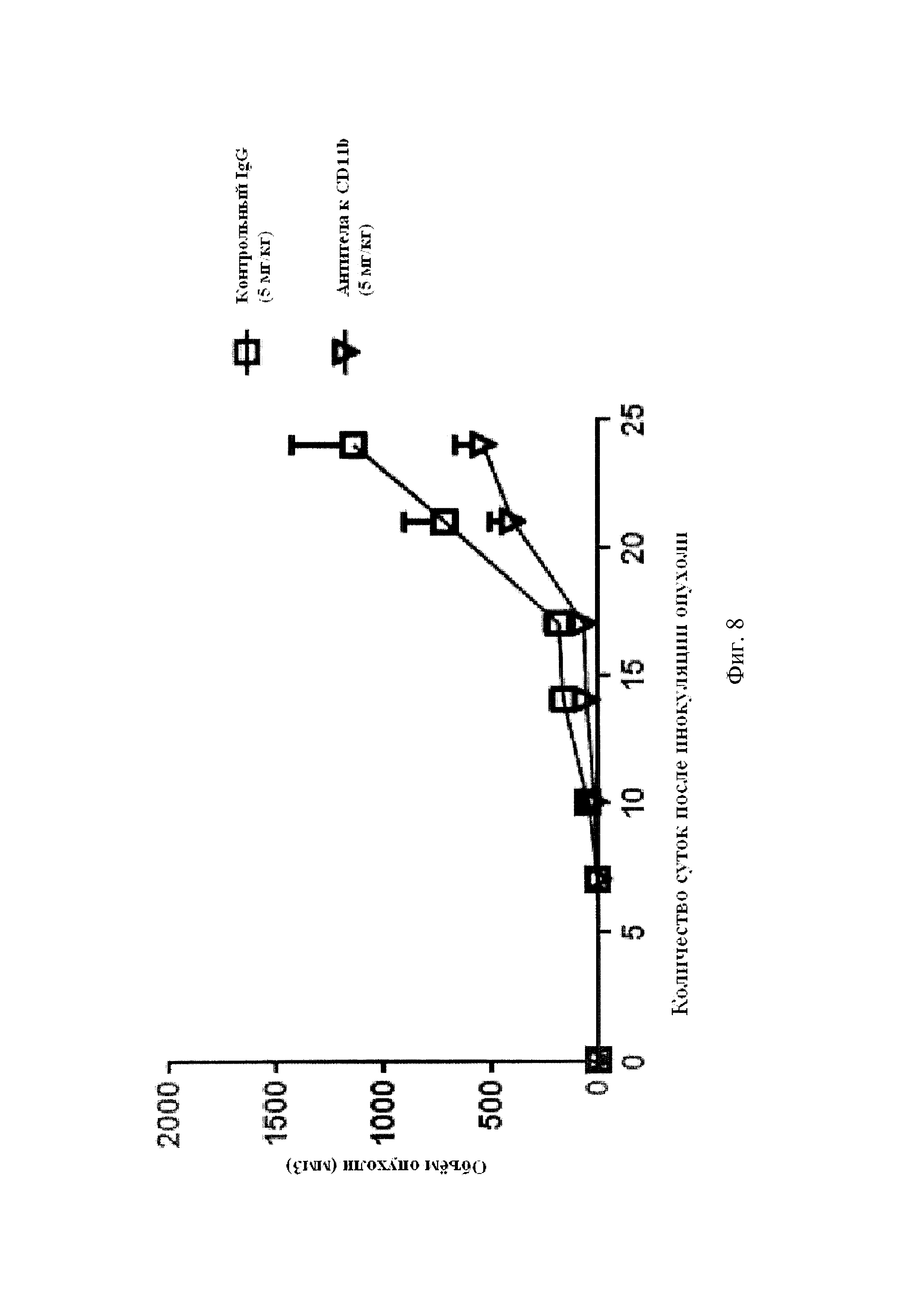
На Фиг. 8 показано влияние монотерапии антителами к CD11b на рост опухоли LLC1. Мышам C57BL/6 проводили подкожное введение 1×106 клеток LLC1 в день 0. В день 7 мышам (n=5 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо крысиные антитела к мышиному CD11b. Инъекции повторяли каждые три-четыре дня. Было проведено измерение объема опухолей, результаты представлены в виде среднего значения ± стандартная ошибка среднего.
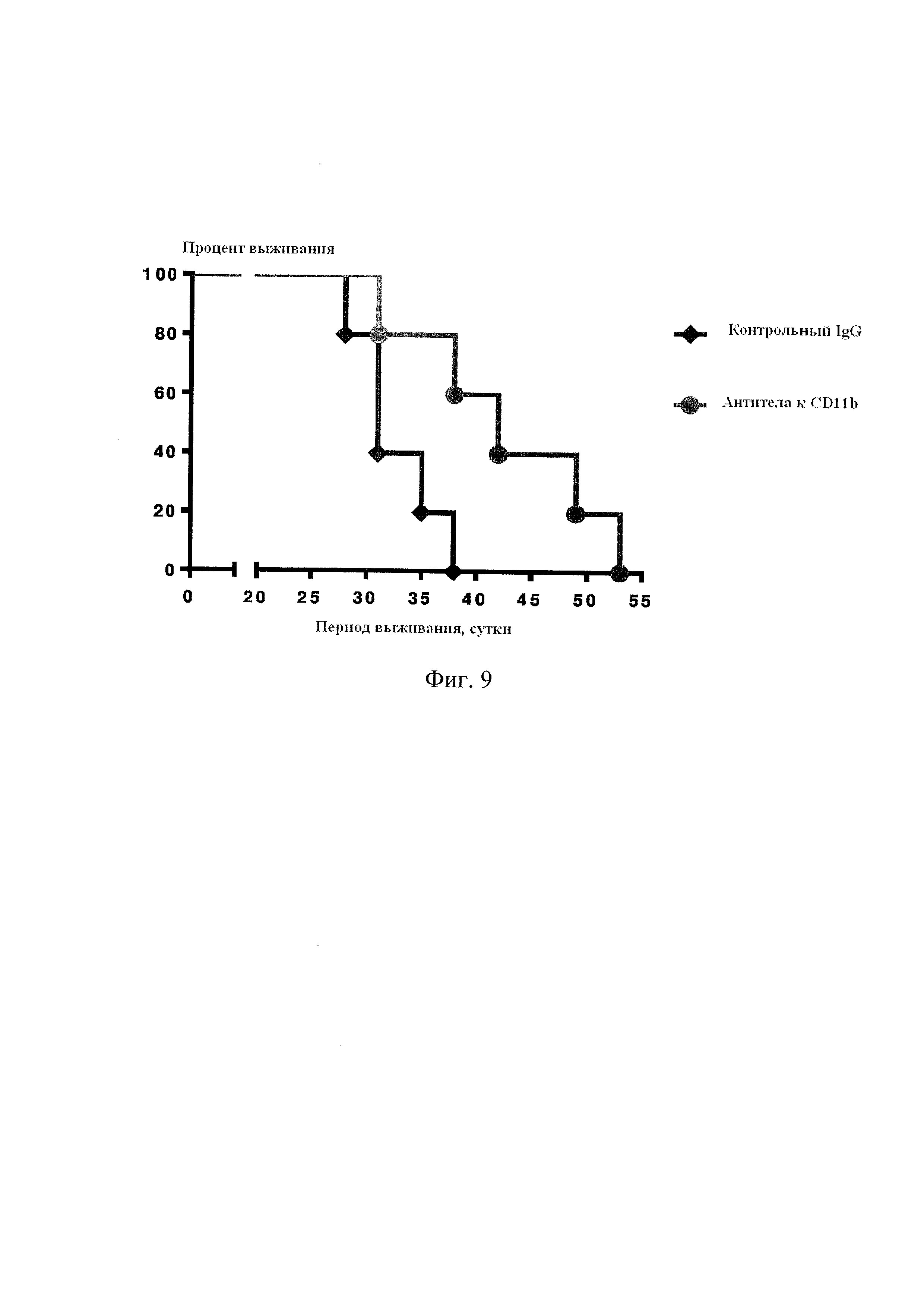
На Фиг. 9 показано влияние монотерапии антителами к CD11b на выживание в модели опухоли LLC1. Мышам C57BL/6 проводили подкожное введение 1×106 клеток LLC1 в день 0. В день 7 мышам (n=5 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо крысиные антитела к мышиному CD11b. Инъекции повторяли каждые три-четыре дня. Был проведен анализ влияния антител к CD11b на долгосрочное выживание мышей, подвергнутых терапии, в каждой из групп.
На Фиг. 10 показано влияние комбинированной терапии антителами к CD11b и антителами к PD1 на модель легочных метастаз LLC1. В день 0 каждой мыши вводили в хвостовую вену 2×106 клеток LLC1. В день 1 мышам (n=3 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо антитела к мышиному CD11b (10 мг/кг), либо антитела к PD1 (10 мг/кг), либо антитела CD11b (10 мг/кг) + антитела к PD1 (10 мг/кг). Инъекции повторяли каждые три-четыре дня. В день 15 мыши были умерщвлены, диссеминацию опухоли оценивали как общее количество узлов, присутствующих в легких и выявляемых при микроскопическом исследовании.
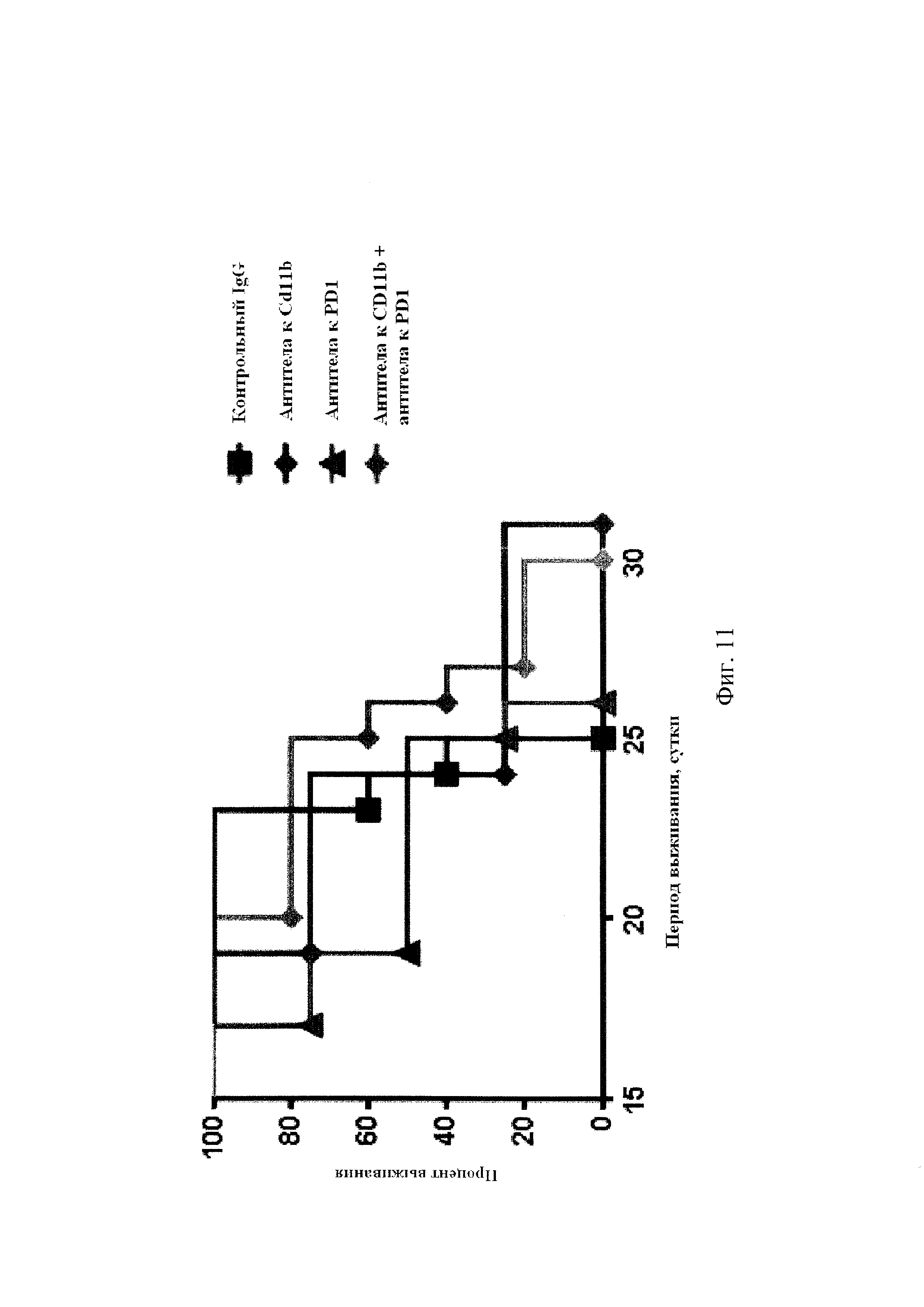
На Фиг. 11 показано влияние комбинированной терапии антителами к CD11b и антителами к PD1 на выживание в модели легочных метастаз. В день 0 каждой мыши вводили в хвостовую вену 2×106 клеток LLC1. В день 1 мышам (n=4-5 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо антитела к мышиному CD11b (10 мг/кг), либо антитела к PD1 (10 мг/кг), либо антитела CD11b (10 мг/кг) + антитела к PD1 (10 мг/кг). Инъекции повторяли каждые три-четыре дня. Был проведен анализ влияния комбинированной терапии на долгосрочное выживание мышей, подвергнутых терапии, в каждой из групп.
На Фиг. 12 показано влияние комбинированной терапии антителами к CD11b и препаратом Таксол на рост опухоли B16F10. Мышам C57BL/6 проводили подкожное введение 2×105 клеток B16F10 в день 0. В день 7 мышам (n=5 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо антитела к мышиному CD11b (5 мг/кг), Таксол (10 мг/кг) + контрольный IgG (5 мг/кг), либо Таксол (10 мг/кг) + антитела к CD11b (5 мг/кг). Инъекции повторяли каждые три-четыре дня. Было проведено измерение объема опухолей, результаты представлены в виде среднего значения ± стандартная ошибка среднего.
На Фиг. 13 и 14 показано влияние комбинированной терапии антителами к CD11b и препаратом Таксол на выживание в модели B16F10. Мышам C57BL/6 проводили подкожное введение 2×105 клеток B16F10 в день 0. В день 7 мышам (n=5 на группу) вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо антитела к мышиному CD11b (5 мг/кг), Таксол (10 мг/кг) + контрольный IgG (5 мг/кг), либо Таксол (10 мг/кг) + антитела к CD11b (5 мг/кг). Инъекции повторяли каждые три-четыре дня. Был проведен анализ влияния комбинированной терапии на долгосрочное выживание мышей, подвергнутых терапии, в каждой из групп.
На Фиг. 15 показано, что связывание CD11b с антителами к CD11b уменьшает экспрессию PD-L1 в ЛПС-иммуносупрессированных моноцитах, подвергнутых воздействию 1 мкг/мл ЛПС.(А) Человеческие моноциты были взяты у здоровых добровольцев и подвергнуты предварительной обработке 10 нг/мл ЛПС в течение 2 дней для индукции иммуносупрессии. (Б) ЛПС-иммуносупрессированные моноциты были подвергнуты воздействию 1 мкг/мл ЛПС в течение 18 часов в присутствии 10 мкг/мл IgG1 или антител к CD11b (ICRF44). Подвергнутые воздействию клетки были промыты и проанализированы путем проточной цитометрии. Экспрессию PD-L1 на поверхности клеток оценивали по средней интенсивности флуоресценции (MFI).
На Фиг. 16 показано, что связывание CD11b с антителами к CD11b уменьшает экспрессию PD-L1 в ЛПС-иммуносупрессированных моноцитах, взятых у пациентов с септическим шоком, в тех случаях, когда клетки подвергнуты воздействию 1 мкг/мл ЛПС. Человеческие моноциты были взяты у пациента с септическим шоком и подвергнуты воздействию 1 мкг/мл ЛПС в течение 18 часов в присутствии 10 мкг/мл IgG1 или антител к CD11b (ICRF44). Подвергнутые воздействию клетки были промыты и проанализированы путем проточной цитометрии. Экспрессию PD-L1 на поверхности клеток оценивали по средней интенсивности флуоресценции (MFI).
На фиг. 17 показаны аминокислотные последовательности вариабельной области легкой цепи гуманизированных антител CD11b. Участки CDR показаны подчеркнутыми буквами.
На фиг. 18 показаны аминокислотные последовательности вариабельной области тяжелой цепи гуманизированных антител CD11b. Участки CDR показаны подчеркнутыми буквами.
На Фиг. 19 показана активность связывания гуманизированных антител к CD11b. Клетки К562 или клетки, трансфицированные человеческим CD11b (K562/CD11b), инкубировали с 10 мкг/мл гуманизированных антител к CD11b в течение 30 минут. Детекцию связанных антител проводили с использованием FITC-конъюгированного мышиного IgG к человеческому антигену. Клетки были проанализированы путем проточной цитометрии. Пунктирная линия показывает количество антител, связавшихся с клетками К562. Сплошная линия показывает количество антител, связавшихся с клетками K562/CD11b.
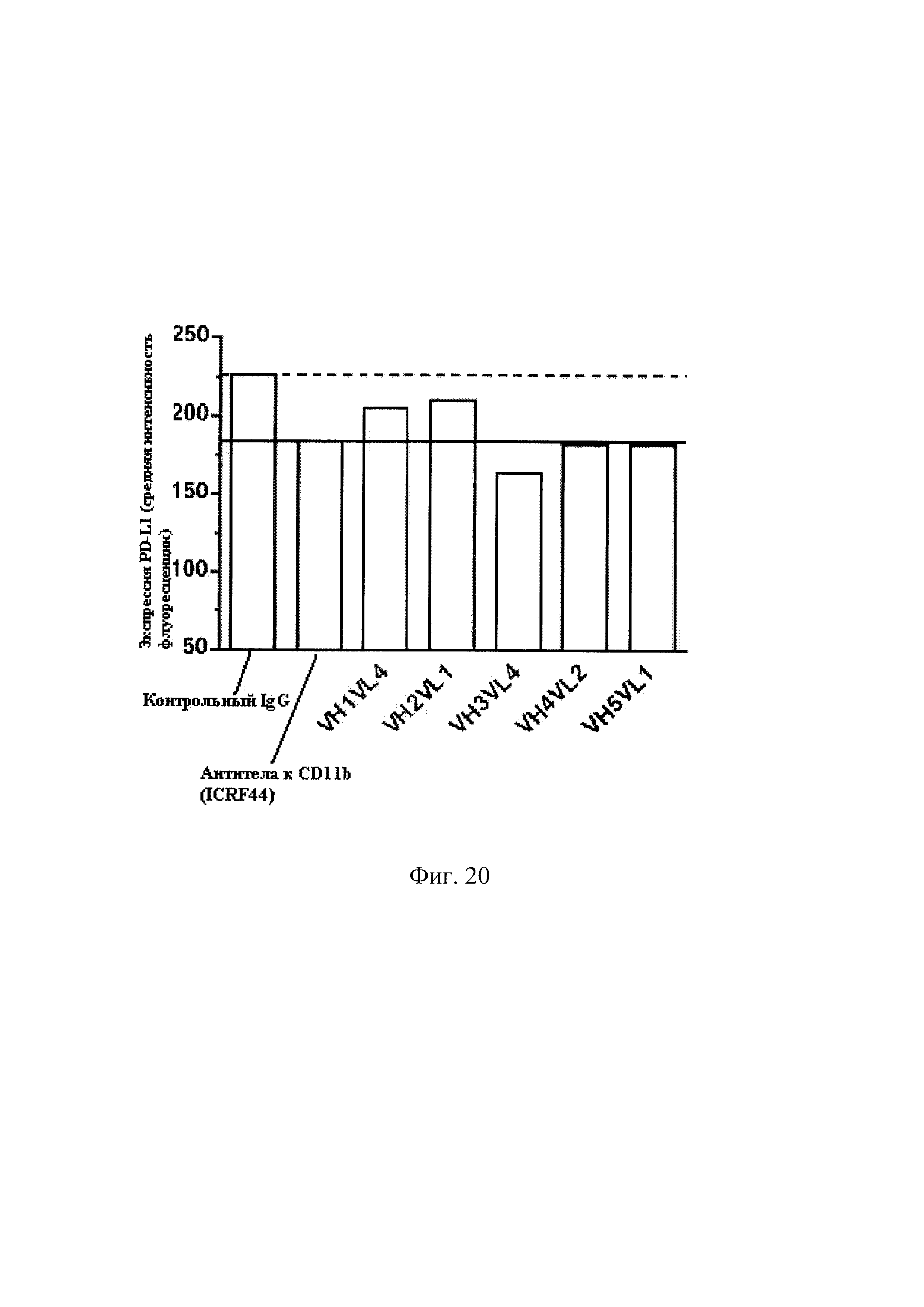
На Фиг. 20 показано, что связывание CD11b с антителами к CD11b уменьшает экспрессию PD-L1 на человеческих моноцитах, примированных ЛПС.Примированные моноциты инкубировали в присутствие либо контрольного изотипа IgG, либо антител к CD11b (ICRF44), либо гуманизированных антител к CD11b, в течение 18 часов. Клетки были собраны, экспрессия PD-L1 в моноцитах была подвергнута анализу с использованием проточной цитометрии.
Осуществлени изобретения
Перед началом описания композиций, способов и принципов выделения антител, являющихся объектом настоящего изобретения, необходимо подчеркнуть, что настоящее изобретение ими не ограничивается, поскольку такие композиции, способы и условия могут варьироваться. Также необходимо учитывать, что терминология, использованная в настоящем документе, применена только для целей описания конкретных вариантов осуществления изобретения, и не является ограничивающей.
Неожиданно было обнаружено, что экспрессия PD-L1 может быть подавлена при воздействии модуляторов CD11b на иммунные клетки и/или другие клетки, что может служить средством лечения и/или предотвращения заболеваний, связанных с иммуносупрессией, таких как хронические инфекции, сепсис, иммунодефицит при раке или старение иммунной системы с возрастом.
Определения
Если не указано иное, все технические и научные термины, использованные в настоящем документе, имеют общепринятые значения, понятные обычному специалисту в области техники, к которой относится изобретение. Любые способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, могут быть использованы при реализации или испытаниях настоящего изобретения в случае, если будет понятно, что модификации и вариации не выходят за пределы сущности и объема раскрытия настоящего изобретения.
Если не указано иное, в тех случаях, когда термин употреблен в единственном числе, это подразумевает «один или более».
В контексте употребления в материалах настоящей заявки, аминокислотные остатки обозначаются следующими сокращенными обозначениями: аланин (Ala; А), аспарагин (Asn; N), аспарагиновая кислота (Asp; D), аргинин (Arg; R), цистеин (Cys; С), глутаминовая кислота (Glu; Е), глутамин (Gin; Q), глицин (Gly; G), гистидин (His; Н), изолейцин (Ile; I), лейцин (Leu; L), лизин (Lys; К), метионин (Met; M), фенилаланин (Phe; F), пролин (Pro; P), серии (Ser; S), треонин (Thr; T), триптофан (Trp; W), тирозин (Tyr; Y) и валин (Val; V).
В контексте употребления в материалах настоящей заявки, термин «CD11b» обозначает интегрин альфа-М (ITGAM), который является одной из субъединиц гетеродимерного интегрина аМβ2. Вторая субъединица интегрина аМ(32 представляет собой обычную субъединицу интегрина Р2, известную как CD 18. Интегрин аМР2, который также называют антигеном макрофагов-1 (Мас-1) или рецептором комплемента 3-го типа (CR3), экспрессируется на поверхности лейкоцитов, включая моноциты, гранулоциты, макрофаги и клетки-натуральные киллеры.
В контексте употребления в материалах настоящей заявки, обозначение «PD-L1» указывает на лиганд белка программируемой смерти 1 (PD-L1), кластер дифференцировки 274 (CD274) или гомолог 1 В7 (В7-Н1). PD-L1 представляет собой трансмембранный белок типа 1 с молекулярной массой 40 кДа, который играет существенную роль в подавлении иммунной системы во время определенных состояний, таких как беременность, аутоиммунные заболевания, рак, сепсис и другие инфекционные заболевания, такие как микобактериальный туберкулез, цитомегаловирусная инфекция и гепатит.
В контексте употребления в материалах настоящей заявки, термин «моноцит», также называемый мононуклеарным лейкоцитом, принадлежит к типу лейкоцитов, участвующих в защитном механизме первой линии и признается способным к дифференциации в дендритную клетку или прекурсор макрофага. В норме моноциты движутся в кровеносной системе. В ответ на внешние стимулирующие сигналы моноциты секретируют множество иммунорегулирующих цитокинов, перемещаются к месту инфекции в тканях и дифференциируются в макрофаги.
В контексте употребления в материалах настоящей заявки, термин «модуляция» включает «увеличение» или «стимулирование», а также «уменьшение» или «сокращение», как правило, в статистически значимых или физиологических значимых количествах, по сравнению с контролем.
В контексте употребления в материалах настоящей заявки, термин «пациент» обозначает человека или другое животное, выбранное для лечения или терапии.
В контексте употребления в материалах настоящей заявки, термин «идентичность» указывает на взаимосвязь между двумя или более последовательностями полипептидов или белков, определяемую путем сравнения последовательностей. В современной терминологии соответствующей области техники термин «идентичность» также обозначает степень родственности между последовательностями полипептидов или белков, определяемую путем сопоставления между аминокислотными цепочками таких последовательностей. «Идентичность» можно легко вычислить с использованием известных биоинформационных способов. «Процент идентичности» двух полинуклеотидных или двух полипептидных последовательностей определяют путем сравнения последовательностей с использованием компьютерной программы GAP (часть GCG Wisconsin Package, версия 10.3 (Accelrys, Сан-Диего, Калифорния)) с использованием параметров по умолчанию.
В контексте употребления в материалах настоящей заявки, каждый из терминов «пептид», «полипептид» и «белок» обозначает молекулу, состоящую из двух или более аминокислотных остатков, соединенных между собой пептидными связями. Эти термины охватывают, например, нативные и искусственные белки, фрагменты белков и полипептидные аналоги (такие как мутеины, варианты и составные белки) последовательности белка, а также белки, претерпевшие посттрансляционные или иные модификации, как ковалентные, так и нековалентные. Пептид, полипептид или белок может быть мономерным или полимерным.
В контексте употребления в материалах настоящей заявки, термин «аффинность» обозначает силу суммы общих и нековалентных взаимодействий между единичным сайтом связывания молекулы (например, антитела) и партнером связывания (например, антигеном). Если не указано иное, В контексте употребления в материалах настоящей заявки, термин «аффинность связывания» обозначает собственную аффинность связывания, которая отражает взаимодействие 1:1 между членами пары связывания (например, антитело и антиген). Аффинность молекулы X в отношении ее партнера Y, как правило, может быть представлена в виде константы диссоциации (Kd). Аффинность может быть измерена с использованием обычных способов, существующих в соответствующей области, включая способы, описанные в настоящем документе. Ниже описаны конкретные иллюстративные примеры вариантов осуществления изобретения для измерения аффинности связывания.
В контексте употребления в материалах настоящей заявки, термин «антитело» используется в наиболее широком смысле и, в частности, включает в себя моноклональные антитела (включая моноклональные антитела полной длины), поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), моновалентные антитела, мультивалентные антитела и фрагменты антител в случае, если они обнаруживают необходимую биологическую активность (например, фрагменты Fab или фрагменты в виде одного плеча молекулы антитела).
В контексте употребления в материалах настоящей заявки, термин «фрагмент антитела» обозначает молекулу, отличную от интактного антитела, которая включает в себя часть интактного антитела, которая связывается с антигеном, с которым связывается интактное антитело. Примерами фрагментов антител являются (не ограничиваясь приведенным списком) Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; одноцепочечные молекулы антител (например, scFv); и мультиспецифичные антитела, образованные из фрагментов антител.
В контексте употребления в материалах настоящей заявки, термин «антигенсвязывающий фрагмент» антитела обозначает одну или более частей антитела, которые обладают способностью к специфичному связыванию с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами молекулы антитела полной длины. Примерами связывающих фрагментов, обозначаемых термином «антигенсвязывающий фрагмент», являются (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, включающий в себя два фрагмента Fab, связанных дисульфидной связью в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча молекулы антитела, (v) фрагмент dAb, состоящий из домена VH; и (vi) выделенный участок, определяющий комплементарность (CDR). Указанные фрагменты антител были получены с использованием общепринятых способов, таких как способы протеолитической фрагментации, описанных в руководстве J. Goding, Monoclonal Antibodies: Principles and Practice, pp 98-118 (N.Y. Academic Press 1983). Скрининг фрагментов для выявления полезности проводят таким же образом, как и скрининг интактных антител.
В контексте употребления в материалах настоящей заявки, термин «участки, определяющие комплементарность» (CDR) обозначает участки молекул антител, на которых эти белки соответствуют форме антигенов. Аббревиатура CDR контексте настоящего документа используется для обозначения «участка, определяющего комплементарность».
«Вариабельная область» антитела обозначает вариабельную область легкой цепи молекулы антитела или вариабельную область тяжелой цепи молекулы антитела, как по отдельности, так и в сочетании. Вариабельные области тяжелых и легких цепей включают по четыре каркасные области (framework regions, FR), соединенные тремя CDR, обозначаемыми как гипервариабельные области. Участки CDR каждой цепи удерживаются в тесной близости друг к другу за счет областей FR и, вместе с участками CDR другой цепи, участвуют в образовании антигенсвязывающего сайта антитела. Примерами систем, которые могут быть использованы для выявления границ участков CDR, являются, например, определение по Кабату и определение по Чотиа. Определение по Кабату основано на изменчивости последовательностей (см. Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C.), определение по Чотиа основано на расположении структурных участков типа «петля» (Chothia et al., 1989, Nature 342:877-883). К другим подходам выявления участков CDR относятся «определение IMGT» (Lefranc, М.-Р. et al., 1999, Nucleic Acids Res. 27:209-212) и «определение AbM», которое представляет собой компромисс между системами по Кабату и по Чотиа и выведено с использованием Оксфордской программой молекулярного моделирования антител АЬМ, или «контактное определение» участков CDR, основанное на наблюдаемых контактах с антигеном, описанное в работе MacCallum et al., 1996, J. Mol. Biol. 262:732-745. В контексте употребления в материалах настоящей заявки, термин «CDR» может обозначать участки CDR, определенные в соответствии с системой нумерации по Кабату.
В контексте употребления в материалах настоящей заявки, термин «гуманизированное антитело» или «фрагмент гуманизированного антитела» обозначает особый тип химерного антитела, который включает в себя вариант аминокислотной последовательности иммуноглобулина, или фрагмент указанной последовательности, который способен к связыванию с определенным антигеном и который включает в себя одну или более каркасную область (FR), аминокислотная последовательность которой по существу соответствует аминокислотной последовательности человеческого иммуноглобулина, и один или более участков, определяющих комплементарность (CDR), аминокислотная последовательность которых по существу соответствует аминокислотной последовательности не-человеческого иммуноглобулина. Указанную нечеловеческую аминокислотную последовательность часто обозначают как «импортированную» последовательность, как правило, взятую из домена «импортируемого» антитела, в частности, вариабельного домена. Как правило, гуманизированное антитело включает в себя, по меньшей мере, участок CDR или гипервариабельную область (HVL) нечеловеческого антитела, расположенную между каркасными областями (FR) вариабельного домена человеческой тяжелой или легкой цепи.
В контексте употребления в материалах настоящей заявки, термин «человеческие антитела» обозначает антитела, обладающие аминокислотной последовательностью, которая соответствует аминокислотной последовательности антител, синтезируемых в организме человека, или в клетках человека, или полученных из не относящегося к организму человека источника с использованием наборов человеческих антител, или другим человеческим последовательностям, кодирующим антитела. Такое определение человеческих антител, в частности, включает гуманизированные антитела, включающие в себя не относящиеся к организму человека антигенсвязывающие аминокислотные остатки.
В контексте употребления в материалах настоящей заявки, термин «химерное антитело» обозначает антитело, которое содержит один или более участков одного антитела и один или более участков одного или более других антител.
В контексте употребления в материалах настоящей заявки, термин «тяжелая цепь» включает тяжелую цепь полной длины и фрагменты указанной цепи, имеющие последовательность вариабельной области, достаточную для обеспечения специфичности в отношении эпитопа. Тяжелая цепь полной длины включает домен вариабельной области, VH, и три домена константной области, CH1, CH2 и CH3. Домен VH находится на амино-конце полипептида, домен СН3 находится на карбоксильном конце.
В контексте употребления в материалах настоящей заявки, термин «легкая цепь» включает легкую цепь полной длины и фрагменты указанной цепи, имеющие последовательность вариабельной области, достаточную для обеспечения специфичности в отношении эпитопа. Легкая цепь полной длины включает домен вариабельной области, VL, и домен константной области, CL. Как и в случае тяжелой цепи, домен вариабельной области легкой цепи находится на амино-конце полипептида.
В контексте употребления в материалах настоящей заявки, термин «фармацевтически приемлемый носитель» обозначает ингредиент в составе фармацевтической композиции, отличный от активного ингредиента, который является нетоксичным для пациента. К фармацевтически приемлемым носителям относятся (не ограничиваясь приведенным списком) буфер, вспомогательное вещество, стабилизатор или консервант.
В контексте употребления в материалах настоящей заявки, термин «пациент» обозначает организм, относящийся к позвоночным животным, предпочтительно к млекопитающим, и наиболее предпочтительно - являющийся человеком. К млекопитающим относятся (не ограничиваясь приведенным списком) человек, сельскохозяйственные животные, спортивные животные и домашние питомцы.
В контексте употребления в материалах настоящей заявки, термин «эффективное количество» обозначает количество, достаточное для достижения положительного эффекта или требуемых клинических результатов. Эффективное количество может быть введено за один или несколько приемов. Применительно к настоящему изобретению, эффективное количество представляет собой количество, достаточное, для диагностики, облегчения состояния, достижения улучшения, стабилизации, обращения вспять, замедления или задержки прогресса заболевания.
В контексте употребления в материалах настоящей заявки, термины «терапия», «лечение», «лечить» и т.п., как правило, обозначают достижение требуемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим, то есть может заключаться в полном или частичном предотвращении возникновения заболевания или его симптома, и/или может быть терапевтическим, то есть может заключаться в частичной или полной стабилизации, или излечении заболевания и/или нежелательного эффекта, связанного с заболеванием. «Терапия», В контексте употребления в материалах настоящей заявки,, охватывает любую терапию заболевания у млекопитающих, в частности, у человека, и включает: (а) предотвращение возникновения заболевания или его симптомов у пациента, который может быть предрасположен к возникновению этого заболевания или симптома, однако ему еще не был поставлен соответствующий диагноз; (b) ингибирование симптома, т.е., прерывание его развития; или (с) снятие симптома заболевания, т.е., обеспечение регрессии заболевания или симптома.
В контексте употребления в материалах настоящей заявки, термин «предотвращение» обозначает предупреждающую или профилактическую меру, которая не дает заболеванию или состоянию возникнуть у пациента. Предотвращение также может включать уменьшение вероятности возникновения заболевания или состояния у пациента и препятствование или приостановку наступления указанного заболевания или состояния.
В тех случаях, когда указан диапазон значений, подразумевается, что каждое промежуточное значение, до десятой части нижней границы диапазона, если контекст четко не диктует иное, находящееся между верхней и нижней границей указанного диапазона, и любое другое указанное или промежуточное значение, находящееся в указанном диапазоне, входит в объем настоящего изобретения. Верхние и нижние границы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны, и также входят в объем настоящего изобретения, с учетом любого специально исключенного предела в указанном диапазоне. В тех случаях, когда указанный диапазон включает одну или обе границы, диапазоны, исключающие одну или обе указанные включенные границы, также входят в объем настоящего изобретения.
Связывание модуляторов CD-11b влияет на экспрессию PD-L1
Неожиданно было обнаружено уменьшение симптомов, связанные с состоянием иммуносупрессии, наблюдающихся при сепсисе, хронической инфекции и раке после терапии модулятором CD11b, обладающим реактивностью в отношении молекул CD11b, экспрессирующихся на поверхности иммунных клеток.
В соответствии с одним из объектов настоящего изобретения, предлагается способ ингибирования экспрессии PD-L1 в иммунных клетках, включающий контактирование указанных иммунных клеток с модулятором CD11b, который связывается с CD11b на поверхности клетки, что обеспечивает ингибирование экспрессии PD-L1 в иммунных клетках. Другими словами, в соответствии с настоящим изобретением, предлагается использование модулятора CD11b при производстве препаратов для ингибирования экспрессии PD-L1 в иммунных клетках. В соответствии с настоящим изобретением, также предлагается модулятор CD11b для ингибирования экспрессии PD-L1 в иммунных клетках.
В соответствии с другим объектом настоящего изобретения предлагается способ предотвращения подавления иммунитета или истощения иммунной системы или индукции существующего иммунитета в иммунных клетках, включающий контактирование указанных иммунных клеток с модулятором CD11b, который связывается с CD11b на поверхности клетки. Другими словами, в соответствии с настоящим изобретением, предлагается использование модулятора CD11b при производстве препаратов для предотвращения подавления иммунитета или истощения иммунной системы или индукции существующего иммунитета в иммунных клетках. В соответствии с настоящим изобретением, также предлагается использование модулятора CD11b для предотвращения подавления иммунитета или истощения иммунной системы или индукции существующего иммунитета в иммунных клетках.
В соответствии с другим объектом настоящего изобретения, предлагается способ выявления пациентов, восприимчивых к модулятору CD11b, указанный способ включает в себя определение того, происходит ли ингибирование PD-L1 в образце биологического материала или в организме пациента при контакте иммунных клеток с модулятором CD11b, и выявление ингибирования PD-L1 на иммунных клетках под действием модулятора CD11b, при этом ингибирование PD-L1 указывает на то, что пациент является восприимчивым к модулятору CD11b.
В одном из вариантов осуществления изобретения, модулятор CD11b, описанный выше, представляет собой агент РНК-интерференции, ингибирующий экспрессию CD11b, антитела к CD11b или низкомолекулярное соединение, модулирующее CD11b.
В некоторых вариантах осуществления изобретения, агент РНК-интерференции представляет собой микроРНК или малую интерферирующую РНК, ингибирующую экспрессию cCD11b. В некоторых вариантах осуществления изобретения, антитело CD11b представляет собой моноклональное, химерное, гуманизированное, человеческое или биспецифичное антитело к CD11b.
В некоторых вариантах осуществления изобретения, примерами низкомолекулярных соединений, модулирующих CD11b, являются (но не ограничиваясь приведенным списком) соединения, описанные в патентах № US 8,268,816, US 20120035154, WO 002007039616, WO 002006111371, WO 002007054128, WO 00199901258, и в публикациях J Immunol 2010, 184, pp. 3917-26, и Cancer Discov, 2012, 2, pp. 1091-99. Предпочтительно, что соединение выбирают из группы, состоящей и нижеследующего:

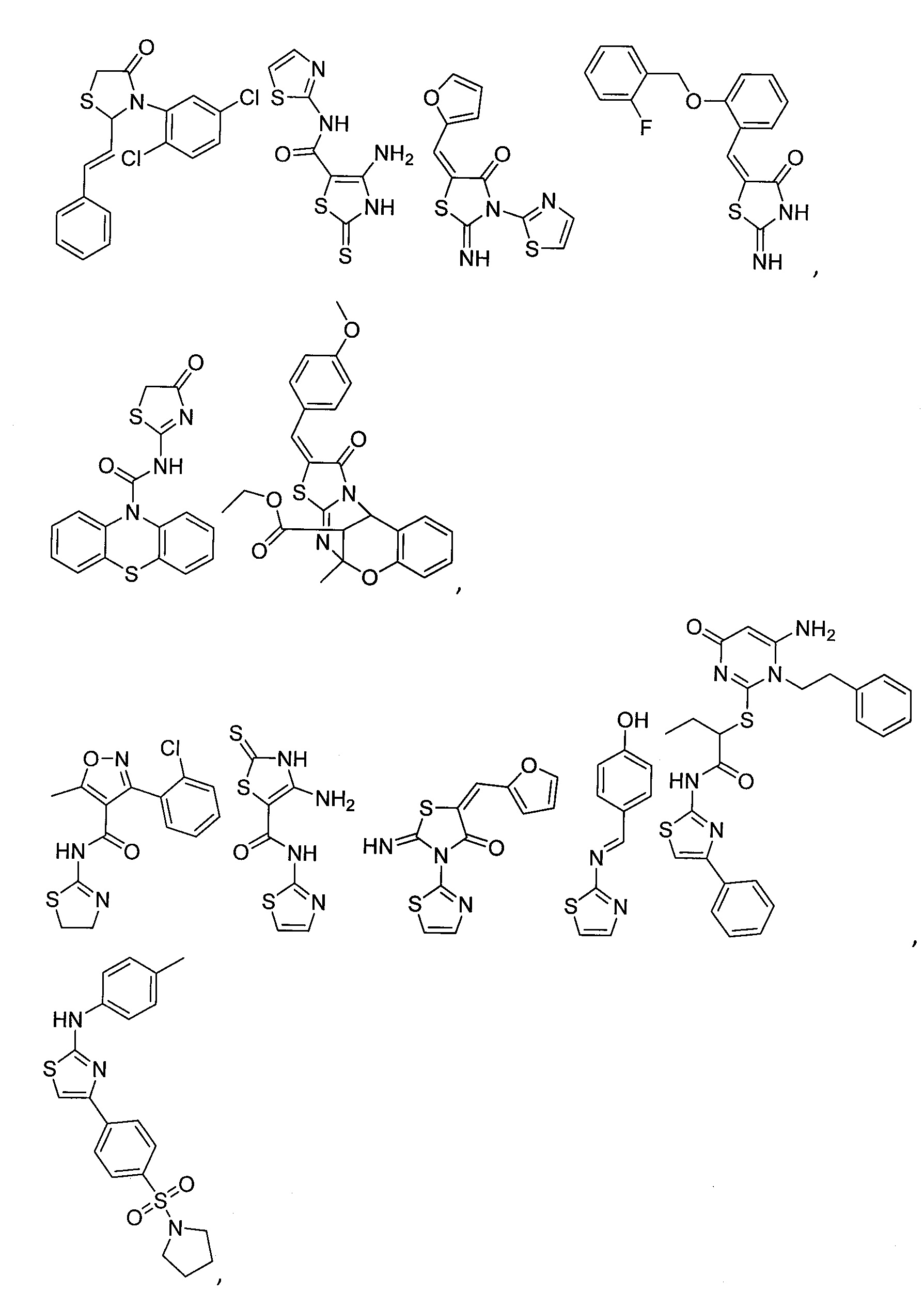

В одном из вариантов осуществления изобретения, иммунная клетка представляет собой моноцит, гранулоцит, макрофаг, супрессорную клетку миелоидного происхождения, клетку-натуральный киллер или Т-клетку.
В одном из вариантов осуществления изобретения, связывание CD11b увеличивает количество IFN-γ, IL-12 или CD8 Т-клеток. В другом варианте осуществления изобретения связывание модулятора CD11b с CD11b на клетке обеспечивает лечение и/или профилактику заболевания, связанного с иммуно супрессией.
В другом варианте осуществления изобретения заболевание, связанное с иммуносупрессией или истощением иммунной системы, представляет собой истощение популяции Т-клеток при острой и/или хронической инфекции, сепсисе, иммунодефиците при раке или старении иммунной системы с возрастом. Соответственно, настоящим изобретением предлагается способ лечения или предотвращения острой и/или хронической инфекции, сепсиса, иммунодефицита при раке или старения иммунной системы с возрастом, включающий введение пациенту эффективного количества модулятора CD1lb.
В одном из вариантов осуществления изобретения, указанный рак представляет собой рак, восприимчивый к иммунотерапии. Примерами рака, восприимчивого к иммунотерапии, являются (не ограничиваясь приведенным списком): меланома, рак легких, плоскоклеточная карцинома легких, рак головы и шеи, рак молочной железы, рак яичника, рак матки, рак предстательной железы, карцинома желудка, рак шейки матки, карцинома пищевода, рак мочевого пузыря, рак почки, рак головного мозга, рак печени, рак толстой кишки, рак костей, рак поджелудочной железы, рак кожи, кожная или внутриглазная злокачественная меланома, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак яичка, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома женских наружных половых органов, болезнь Ходжкина, неходжкинская лимфома, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркома мягких тканей, рак мочеиспускательного канала, рак полового члена, хронические или острые лейкемии, включая острую миелоидную лейкемию, хроническую миелоидную лейкемию, острую лимфобластную лейкемию, хроническую лейкоцитарную лейкемию, солидные опухоли детского возраста, лимфоцитарная лимфома, карцинома почечной лоханки, новообразование центральной нервной системы (ЦНС), первичная лимфома ЦНС, ангиогенез опухоли, опухоль спинного мозга, глиома ствола головного мозга, аденома гипофиза, саркома Капоши, эпидермоидный рак, плоскоклеточный рак, Т-клеточная лимфома.
В одном из вариантов осуществления изобретения, рак представляет собой метастаз, рефрактерный рак, рецидивирующий рак или распространенный рак.
В одном из вариантов осуществления изобретения, способ предотвращения и/или лечения рака включает в себя применение дополнительного активного агента или терапии. В некоторых вариантах осуществления изобретения, дополнительный активный агент представляет собой терапию на основе иммунных контрольных точек, радиотерапию или химиотерапию.
В одном из вариантов осуществления изобретения, модулятор CD11b и терапию на основе иммунных контрольных точек, радиотерапию или химиотерапию используют одновременно, последовательно или раздельно. В другом варианте осуществления изобретения, терапия на основе иммунных контрольных точек включает в себя введение белка иммунных контрольных точек. Предпочтительно, белок иммунных контрольных точек представляет собой лиганд антител к PD-1, или антитела к CTLA-4, или антитела к PD-L1, или антигенсвязывающий фрагмент указанных агентов, или любую комбинацию указанных агентов. Примерами лиганда антител к PD-1 являются (не ограничиваясь приведенным списком) антитела к PD-1 (такие как ниволумаб и пембролизумаб) и антитела к CTLA-4 (такие как ипилимумаб).
В другом варианте осуществления изобретения,химиотерапия включает в себя введение химиотерапевтического агента. Примерами химиотерапевтических агентов являются (не ограничиваясь приведенным списком) алкилирующий агент, антиметаболит, антимикротубулиновый агент, ингибитор топоизомеразы или цитотоксический антибиотик. Предпочтительно, что химиотерапевтический агент представляет собой цисплатин, 5-Fu, таксол, доцетаксел, винорелбин, виндезин, винфлунин, гемцитабин, метотрексат, гефитиниб, лапатиниб или эрлотиниб.
Указанные модулятор CD11b и другие указанные агенты могут быть представлены в виде композиции или состава. Введение фармацевтических композиций или составов, являющихся объектом настоящего изобретения, может осуществляться различными путями, в зависимости от того, является предпочтительной местная или системная терапия, а также от зоны, требующей терапии. Может быть использовано введение внутрь или парентеральное введение.
В некоторых вариантах осуществления изобретения, соединения и композиции, описанные в настоящем документе, вводят парентерально. Парентеральное введение включает внутривенные, внутриартериальные, подкожные, интраперитонеальные и внутримышечные инъекции или инфузии.
В некоторых вариантах осуществления изобретения, композиции или составы для парентерального введения включают стерильные водные растворы, которые также могут содержать буферы, разбавители и другие подходящие добавки, такие как (не ограничиваясь приведенным списком) средства, улучшающие проникновение, соединения-носители и другие фармацевтически приемлемые носители или вспомогательные вещества.
В некоторых вариантах осуществления изобретения, композиции или составы для введения внутрь могут включать (не ограничиваясь приведенным списком) фармацевтические носители, вспомогательные вещества, порошки или гранулы, микрочастицы, наночастицы, суспензии или растворы в воде или в неводной среде, капсулы, гелевые капсулы, саше, таблетки или мини-таблетки. Желательным может быть включение загустителей, вкусоароматических агентов, разбавителей, эмульгаторов, диспергирующих агентов или связующих агентов.
Режим дозирования зависит от тяжести заболевания и его восприимчивости к терапии, курс терапии может составлять от нескольких дней до нескольких месяцев, либо до достижения излечения, либо до ухудшения состояния. Режим дозирования также зависит от активности лекарственного средства и от метаболизма.
Уровень экспрессии PD-L1 в иммунных клетках может служить в качестве новой терапевтической цели для устранения иммуносупрессии и истощения иммунной системы и для индукции существующего иммунитета. Антитела к CD11b, являющиеся объектом настоящего изобретения
В соответствии с настоящим изобретением, предлагаются новые антитела к CD11b и способы их использования для лечения и/или предотвращения заболеваний, связанных с иммуносупрессией и истощением иммунной системы, например, при иммунотерапии рака, при истощении популяции Т-клеток при хронических инфекциях, сепсисе, иммунодефиците при раке и старении иммунной системы с возрастом.
В соответствии с одним из объектов настоящего изобретения предлагаются антитела KCD11b или антигенсвязывающая часть указанных антител, включающая в себя, по меньшей мере, один участок, определяющий комплементарность 1 (H-CDR1) тяжелой цепи, состоящий из аминокислотных остатков NYWIN (идентификационный номер последовательности: 1), или GFSLTSNSIS (идентификационный номер последовательности: 2), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 1 или 2; участок CDR2 тяжелой цепи (H-CDR2), состоящий из аминокислотных остатков NIYPSDTYINHNQKFKD (идентификационный номер последовательности: 3) или AIWSGGGTDYNSDLKS (идентификационный номер последовательности: 4), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 3 или 4; и участок тяжелой цепи CDR3 (H-CDR3), состоящий из аминокислотных остатков SAYANYFDY (идентификационный номер последовательности: 5) или RGGYPYYFDY (идентификационный номер последовательности: 6), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 5 или 6; и, по меньшей мере, один участок CDR1 легкой цепи (L-CDR1), состоящий из аминокислотных остатков RASQNIGTSIH (идентификационный номер последовательности: 7) или KSSQSLLYSENQENYLA (идентификационный номер последовательности: 8), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 7 или 8; участок CDR2 легкой цепи (L-CDR2), состоящий из аминокислотных остатков YASESIS (идентификационный номер последовательности: 9) или WASTRQS (идентификационный номер последовательности: 10) или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 8 5%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 9 или 10; и участок CDR3 легкой цепи (L-CDR3), состоящий из аминокислотных остатков QQSDSWPTLT (идентификационный номер последовательности: 11) или QQYYDTPLT (идентификационный номер последовательности: 12), или вариант, имеющий аминокислотную последовательность, по меньшей мере, на 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностью с идентификационным номером 11 или 12; таким образом, что указанное выделенное антитело или его антигенсвязывающая часть связывается с CD11b.
В некоторых вариантах осуществления изобретения, описанные выше участки, определяющие комплементарность (CDR), включают в себя одну или более инсерцию, замену и/или делецию.
В другом варианте осуществления изобретения в соответствии с настоящим изобретением предлагаются антитела к CD11b или антигенсвязывающая часть указанных антител, включающая в себя (i) вариабельную область тяжелой цепи, представляющую собой вариабельную область тяжелой цепи, включающую в себя участок H-CDR1, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 1, участок H-CDR2, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 3, и участок H-CDR3, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 5, и (ii) вариабельные области легкой цепи, включающие в себя участок L-CDR1, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 7, участок L-CDR2, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 9, и участок L-CDR3, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 11; или (iii) вариабельную область тяжелой цепи, представляющую собой вариабельную область тяжелой цепи, включающую в себя участок H-CDR1, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 2, участок H-CDR2, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 4, и участок H-CDR3, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 6, или (iv) вариабельные области легкой цепи, включающие в себя участок L-CDR1, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 8, участок L-CDR2, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 10, и участок L-CDR3, включающий в себя последовательность, соответствующую последовательности с идентификационным номером 12. В другом варианте осуществления изобретения участок H-CDR1 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 1 или 2; участок H-CDR2 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 3 или 4; участок H-CDR3 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 5 или 6; участок L-CDR1 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 7 или 8; участок L-CDR2 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 9 или 10 и участок L-CDR3 имеет аминокислотную последовательность, включающую аминокислотную последовательность, соответствующую последовательности с идентификационным номером 11 или 12.
В соответствии с одним из объектов настоящего изобретения, предлагается вариабельная область тяжелой цепи или антигенсвязывающая часть указанной области, включающая в себя вариабельную область тяжелой цепи, включающую участок H-CDR1, имеющий аминокислотную последовательность, соответствующую последовательности с идентификационным номером 1 или 2, участок H-CDR2, имеющий аминокислотную последовательность, соответствующую последовательности с идентификационным номером 3 или 4 и участок H-CDR3, имеющий аминокислотную последовательность, соответствующую последовательности с идентификационным номером 5 или 6.
В соответствии с одним из объектов настоящего изобретения, предлагается вариабельная область легкой цепи или антигенсвязывающая часть указанной области, включающая в себя участок L-CDR1, имеющий аминокислотную последовательность, соответствующую последовательности с идентификационным номером 7 или 8, участок L-CDR2, имеющий аминокислотную последовательность, соответствующую последовательности с идентификационным номером 9 или 10 и участок L-CDR3, имеющий аминокислотную последовательность, соответствующую последовательности с идентификационным номером 11 или 12..
В одном из вариантов осуществления изобретения, предлагаются гуманизированные антитела к CD11b или антигенсвязывающая часть указанных антител, включающие в себя (i) вариабельную область тяжелой цепи, включающую в себя аминокислотную последовательность, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностями с идентификационными номерами с 13 по 22, и (и) вариабельную область легкой цепи, включающую в себя аминокислотную последовательность, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% совпадающую с последовательностями с идентификационными номерами с 23 по 32.
В другом варианте осуществления изобретения, предлагаются гуманизированные антитела к CD11b или антигенсвязывающая часть указанных антител, включающие в себя вариабельную область тяжелой цепи, включающую в себя аминокислотную последовательность, совпадающую с последовательностью с идентификационным номером с 13 по 22, вариабельную область легкой цепи, включающую в себя аминокислотную последовательность, совпадающую с последовательностью с идентификационным номером с 23 по 32.
В соответствии с настоящим изобретением предпочтительно предлагаются гуманизированные антитела к CD11b антигенсвязывающей части указанных антител, включающие в себя:
(а) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 13, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 23;
(b) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 14, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 24;
(c) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 15, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 25;
(d) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 16, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 26;
(e) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 17, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 27;
(f) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 18, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 28;
(g) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 19, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 29;
(h) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 20, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 30;
(i) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с
идентификационным номером: 21, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 31; или
(j) вариабельную область тяжелой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 22, и вариабельную область легкой цепи, включающей в себя аминокислотную последовательность, соответствующую последовательности с идентификационным номером: 32.
Аминокислотные последовательности с идентификационными номерами с 13 по 32 приведены ниже:
Вариабельная область тяжелой цепи гуманизированных антител к CD11b, являющихся объектом настоящего изобретения: (идентификационные номера последовательностей: с 13 по 22)





Методики получения моноклональных антител практически к любому антигену-мишени хорошо известны специалистам в соответствующей области. См., например, Kohler and Milstein, Nature 256: 495 (1975), and Coligan et al. (eds.), Current Protocols In Immunology, Vol. 1, pages 2.5.1-2.6.7 (John Wiley & Sons 1991). Моноклональные антитела могут быть получены путем введения мышам или курам композиции, содержащей антиген, удаления селезенки для получения В-лимфоцитов, объединения В-лимфоцитов с клетками миеломы для получения гибридом, клонирования гибридом, отбора положительных клонов, продуцирующих антитела к антигену, культивирования клонов, продуцирующих антитела к антигену, и выделения антител из культур гибридом.
Различные методики, такие как получение химерных или гуманизированных антител, могут включать процедуры клонирования и конструирования антител. Антигенсвязывающие последовательности вариабельных областей легкой цепи и тяжелой цепи требуемых антител могут быть получены с применением различных методик молекулярного клонирования. Химерное антитело представляет собой рекомбинантный белок, в котором вариабельные области человеческого антитела были заменены на вариабельные области, например, мышиного антитела, включающие участки, определяющие комплементарность (CDR) мышиного антитела. Химерные антитела демонстрируют пониженную иммуногенность и повышенную стабильность при введении в организм пациента. Способы конструирования химерных антител хорошо известны специалистам в соответствующей области. Химерные моноклональные антитела могут быть гуманизированы путем переноса мышиных участков CDR из вариабельных областей тяжелой и легкой цепей мышиного иммуноглобулина в соответствующие вариабельные домены человеческих антител. Также при получения химерных моноклональных антител производят замену мышиных каркасных областей (FR) на последовательности FR из человеческих антител.
Например, нуклеиновая кислота, кодирующая область VL и/или VH гуманизированного антитела, которая специфично связывается с CD11b, может быть клонирована или амплифицирована с использованием способов in vitro, таких как полимеразная цепная реакция (ПЦР), лигазная цепная реакция (ЛЦР), система опосредованной транскрипцией амплификации (TAS) и т.д. Например, полинуклеотид, кодирующий белок, может быть выделен путем полимеразной цепной реакции кДНК с использованием праймеров, основанных на последовательности ДНК молекулы. Специалистам в соответствующей области известно широкое разнообразие методик клонирования и амплификации in vitro. Полинуклеотиды также могут быть выделены путем скрининга библиотек геномной ДНК или кДНК с использованием праймеров, отобранных из последовательностей требуемого полинуклеотида в жестких условиях гибридизации.
Полинуклеотиды включают рекомбинантную ДНК, которая встроена в вектор; в автономно реплицирующуюся плазмиду или вирус; или в геномную ДНК прокариота или эукариота, или которая существует в виде отдельной молекулы (например, кДНК), независимо от других последовательностей. Нуклеотиды, описываемые в изобретении, могут представлять собой рибонуклеотиды, дезоксирибонуклеотиды или модифицированные формы указанных нуклеотидов. Термин включает как одноцепочечные, так и двухцепочечные формы ДНК.
Последовательности ДНК, кодирующие VL и/или VH гуманизированных антител, специфично связывающихся с CD11b, могут быть экспрессированы in vitro путем переноса ДНК в подходящую клетку-хозяин. Клетка может быть прокариотической или эукариотической. Термин также включает любое потомство клетки-хозяина. Необходимо иметь в виду, что потомство может не быть идентичным родительской клетке, поскольку в ходе репликации могут происходить мутации. Способы осуществления стабильного переноса, обеспечивающие длительное сохранение инородной ДНК в клетке-хозяине, известны специалистам в соответствующей области.
Полинуклеотидные последовательности, кодирующие VL и/или VH гуманизированных антител, специфично связывающихся с CD11b, могут быть функционально связаны с последовательностями контроля экспрессии. Последовательность контроля экспрессии, функционально связанная с кодирующей последовательностью, лигирована таким образом, чтобы экспрессия кодирующей последовательности происходила при условиях, совместимых с последовательностями контроля экспрессии. Последовательность контроля экспрессии включает (не ограничиваясь приведенным списком) соответствующие промотеры, энхансеры, терминаторы транскрипции, старт-кодон (например, ATG) перед геном, кодирующим белок, сигнал сплайсинга для интронов, участок контроля правильности рамки считывания гена для обеспечения правильной трансляции мРНК и стоп-кодоны.
Полинуклеотидные последовательности, кодирующие VL и/или VH гуманизированных антител, специфично связывающихся с CD11b, могут быть встроены в экспрессионный вектор. Примерами экспрессионных векторов являются (не ограничиваясь приведенным списком) плазмида, вирус или другой носитель, который пригоден для манипуляции с целью вставки или встраивания последовательностей, и который может экспрессироваться как в прокариотических, так и в эукариотических клетках. Хозяевами могут быть микроорганизмы, дрожжевые грибы, насекомые и млекопитающие. Способы экспрессии последовательностей ДНК, имеющих эукариотические или вирусные последовательности, в прокариотических клетках известны специалистам в соответствующей области. Биологически функциональные вирусные и плазмидные ДНК-векторы, способные к экспрессии и репликации в организме хозяина, известны специалистам в соответствующей области. Трансформация рекомбинантной ДНК в клетку хозяина может быть проведена с использованием общепринятых методик, известных специалистам в соответствующей области.
Выделение и очистка рекомбинантно экспрессируемых полипептидов могут быть проведены с использованием общепринятых средств, включая препаративную хроматографию и иммунологическое разделение.
Гуманизирование может быть проведено, в целом, в соответствии с общепринятыми способами, известными специалистам в соответствующей области, путем замены участков CDR или последовательностей CDR грызунов на соответствующие последовательности из человеческих антител. Соответственно, такие «гуманизированные» антитела представляют собой антитела, в которых часть человеческой вариабельной области, существенно меньшая целой вариабельной области, была заменена на соответствующую последовательность, взятую из антител другого вида организмов. На практике, гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки участка CDR и, возможно, некоторые остатки каркасной области (FR) заменены на остатки из аналогичных сайтов антител другого организма, например, грызунов.
Выбор человеческих вариабельных областей, как на легкой, так и на тяжелой цепи, для использования в создании гуманизированных антител имеет очень большое значение для уменьшения антигенности. Последовательность вариабельной области антител грызунов подвергают скринингу с использованием полной библиотеки известных последовательностей вариабельной области человеческих антител. Последовательность человеческих антител, наиболее близкая к последовательности из антител грызунов, выбирают в качестве человеческой каркасной области (FR) для гуманизированных антител. В другом способе используют определенный каркас, полученный на основе консенсусной последовательности всех человеческих антител определенной подгруппы легких или тяжелых цепей. Один и тот же каркас может быть использован для нескольких различных гуманизированных антител.
Антигенсвязывающие части включают, например, Fab, Fab', F(ab)2, F(ab')2, Fv, scFv и т.п. Указанные фрагменты получают из интактных антител с использованием способов, известных специалистам в соответствующей области, например, путем протеолитического расщепления с применением ферментов, таких как папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab')2).
В нуклеиновую кислоту, кодирующую полипептид, описанный в настоящем документе, могут быть внесены модификации, без потери биологической активности. Некоторые модификации могут быть внесены как способствующие клонированию, экспрессии или встраиванию специфичной молекулы в гибридный белок. Такие модификации известны специалистам в соответствующей области и включают, например, терминирующие кодоны, добавочный метионин на амино-конце для обеспечения сайта инициации, дополнительные аминокислоты, находящиеся на любом из концов, для создания удобно расположенных сайтов рестрикции, или дополнительные аминокислоты для облегчения этапов очистки. В дополнение к рекомбинантным способам, антитела, раскрываемые в настоящем изобретении, также могут быть сконструированы целиком или частично с использованием стандартного синтеза пептидов, известного специалистам в соответствующей области.
В соответствии с другим объектом настоящего изобретения, предлагаются композиции, содержащие антитела к CD11b, являющиеся объектом настоящего изобретения. В некоторых вариантах осуществления изобретения такие композиции могут вводиться в организм пациентов. В некоторых вариантах осуществления изобретения антитела к CD11b, являющиеся объектом настоящего изобретения, могут быть включены в композицию, в который входит один или более компонентов, включая (но не ограничиваясь приведенным списком) фармацевтически приемлемые носители, адъюванты, увлажняющие или эмульгирующие агенты, буферные агенты для поддержания рН, консерванты и/или любые другие компоненты, пригодные для применения в соответствии с назначением композиций. Такие композиции могут быть выполнены в форме растворов, суспензий, эмульсий и т.п. Термин «фармацевтически приемлемый носитель» включает различные разбавители, вспомогательные вещества и/или носители. К фармацевтически приемлемым носителям относятся (не ограничиваясь приведенным списком) носители, признанные безопасными при использовании для доставки в организм человека и/или других животных, и/или одобренные регуляторным агентством федерального или регионального правительства, и/или указанные в Фармакопее США, и/или в другой общепризнанной фармакопее, и/или получившие специальное или индивидуальное разрешение на использование у человека и/или других животных в одном или более общепризнанных регуляторных агентств. К таким фармацевтически приемлемым носителям относятся (не ограничиваясь приведенным списком) вода, водные растворы (такие как солевые растворы, буферы и т.п.), органические растворители (такие как определенные спирты и масла, включая масла минерального, животного, растительного и синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло) и т.п.
В одном из вариантов осуществления изобретения, гуманизированные антитела к CD11b, раскрываемые в настоящем изобретении, могут быть представлены в виде компонента композиции, который включает в себя один или более «химиотерапевтических агентов», которые представляют собой химические соединения, используемые для лечения рака, также называемые противоопухолевыми лекарственными средствами. Противоопухолевые лекарственные средства, как правило, классифицируют на основе различий химической структуры и происхождения лекарственного средства, выделяя следующие категории: алкилирующие агенты, антиметаболиты, противоопухолевые антибиотики, антрациклиновые антибиотики, растительные противоопухолевые средства и гормональные средства. В зависимости от специфичности в отношении цикла и фазы химиотерапевтические лекарственные средства, предназначенные для лечения опухолей, могут быть разделены на следующие классы: (1) агенты, не специфичные в отношении клеточного цикла (cell cycle non-specific agents, CCNSA), такие как алкилирующие агенты, противоопухолевые антибиотики, координационные комплексы платины и т.д., и (2) агенты, специфичные в отношении клеточного цикла (cell cycle specific agents, CCSA), такие как антиметаболиты, алкалоиды барвинка и т.д.
В некоторых вариантах осуществления изобретения, композиции, являющиеся объектом настоящего изобретения, содержат «эффективное количество» антител к CD11b, являющихся объектом настоящего изобретения. «Эффективное количество» представляет собой количество, необходимое для достижения требуемого конечного результата. Количество гуманизированных антител к CD11b, являющихся объектом настоящего изобретения, которое является эффективным для достижения требуемого конечного результата, будет зависеть от различных факторов, включая (но не ограничиваясь приведенным списком), вид, к которому относится организм (человек или некоторые другие виды животных), возраст и/или пол пациента, планируемый путь введения, планированный режим дозирования, серьезность любых имеющихся заболеваний или состояний и т.п. Эффективное количество - которое может быть представлено в виде диапазона значений эффективного количества - может быть определено с использованием стандартных методик без каких-либо избыточных экспериментов, например, с использованием анализов in vitro и/или анализов in vivo на соответствующих видах организмов, или на любой подходящей модели на животных. Подходящие анализы включают (не ограничиваясь приведенным списком) анализы, предусматривающие экстраполяцию на основе кривых зависимости доза-ответ и/или на основе других данных, полученных на модельных системах in vitro и/или in vivo. В некоторых вариантах осуществления изобретения, эффективное количество может быть определено по усмотрению врача или ветеринара, с учетом конкретных условий.
В одном из вариантов осуществления изобретения, эффективное количество гуманизированных антител к CD11b находится в диапазоне от приблизительно 0,01 мг/кг до приблизительно 40 мг/кг массы тела; предпочтительно, от приблизительно 0,01 мг/кг до приблизительно 30 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 20 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг, от приблизительно 1 мг/кг до приблизительно 40 мг/кг, от приблизительно 1 мг/кг до приблизительно 30 мг/кг, от приблизительно 1 мг/кг до приблизительно 20 мг/кг, от приблизительно 1 мг/кг до приблизительно 10 мг/кг, от приблизительно 2 мг/кг до приблизительно 40 мг/кг, от приблизительно 2 мг/кг до приблизительно 30 мг/кг, от приблизительно 2 мг/кг до приблизительно 20 мг/кг, от приблизительно 2 мг/кг до приблизительно 10 мг/кг, от приблизительно 5 мг/кг до приблизительно 40 мг/кг, от приблизительно 5 мг/кг до приблизительно 30 мг/кг, от приблизительно 5 мг/кг до приблизительно 20 мг/кг или от приблизительно 5 мг/кг до приблизительно 10 мг/кг или от приблизительно 1 мг/кг до приблизительно 5 мг/кг.
В некоторых вариантах осуществления изобретения, в соответствии с настоящим изобретением предлагаются способы, которые включают в себя введение пациенту гуманизированных антител к CD11b, являющихся объектом настоящего изобретения. Такие способы включают в себя способы ингибирования экспрессии PD-L1 в иммунных клетках, предотвращения подавления иммунитета или истощения иммунной системы или индукции существующего иммунитета в иммунных клетках, выявления PD-L1 у пациента, а также лечения или предотвращения острой и/или хронической инфекции, сепсиса, иммунодефицита при раке или старения иммунной системы с возрастом. Антитела к CD11b, являющиеся объектом настоящего изобретения, могут быть использованы в указанных выше способах.
Рак, описываемый в настоящем документе, представляет собой рак, восприимчивый к иммунотерапии, примеры видов такого рака приведены в настоящем документе. Способ предотвращения и/или лечения рака включает в себя применение дополнительного активного агента или терапии. Дополнительные активные агенты, варианты их осуществления и пути введения соответствуют описанным в настоящем документе.
Пациентами, которым могут быть введены (например, в ходе применения способа лечения) антитела к CD11b, раскрываемые в настоящем изобретении, или композиции, содержащие антитела к CD11b, могут являться любые виды животных. В некоторых вариантах осуществления изобретения, пациенты являются представителями видов млекопитающих. К пациентам, являющимся представителями видов млекопитающих, относятся (не ограничиваясь приведенным списком) человек, другие приматы помимо человека, грызуны, кролики и хорьки.
Специалистам в соответствующей области известны различные системы доставки, для введения пациентам композиций, раскрываемых в настоящем изобретении, может быть использована любая подходящая система доставки. Указанные системы доставки включают (не ограничиваясь приведенным списком) системы интрадермальной, внутримышечной, интраперитонеальной, внутривенной, подкожной, интраназальной, эпидуральной и пероральной доставки. Композиции, раскрываемые в настоящем изобретении, могут быть введены любым подходящим путем, например, путем инфузии или болюсного введения, путем абсорбции через эпителиальные или кожно-слизистые выстилки (например, слизистая оболочка полости рта, прямой кишки и кишечника и т.д.), и могут быть введены совместно с другими биологически активными агентами. Применение может быть системным или местным.
В некоторых таких вариантах осуществления изобретения предпочтительно однократное введение. Однако, в других вариантах осуществления изобретения, с целью достижения требуемого эффекта могут быть введения дополнительные дозы, таким же или другим путем. В некоторых вариантах осуществления изобретения, схема применения может включать в себя однократное введение. В других вариантах осуществления изобретения, схема применения может включать в себя многократное введение.
Примеры
Материалы и способы, использованные в указанных далее примерах, описаны ниже.
Материалы и способы
Выделение человеческих клеток и культивирование клеток
Концентраты лейкоцитов, взятых у здоровых добровольцев, были получены из Тайваньского фонда службы крови (Taiwan Blood Service Foundation) (Тайбэй, Тайвань). Было получено информированное согласие на участие в исследовании в письменной форме, которое было одобрено Экспертным советом организации Мемориальной больницы МакКай. Человеческие моноциты были выделены как описано выше. Вкратце, мононуклеарные клетки периферической крови (РВМС) были выделены с использованием центрифугирования в градиенте состава Ficoll-Paque Plus (GE Healthcare). Затем моноциты были подвергнуты очистке путем проведения отбора CD 14 с применением микросфер CD 14 MACS (Miltenyi Biotec). Чистота моноцитов, подтвержденная с использованием анализа способом проточной цитометрии, составляла приблизительно 90%.
Линии клеток животных и опухолей.
Мыши линии C57BL/6 (в возрасте от 6 до 8 недель) были приобретены в National Laboratory Animal Center (Taipei, Taiwan). Все эксперименты на животных были проведены в специальных условиях отсутствия патогенов и в соответствии с указаниями, утвержденными Комитетом по уходу за животными и их использованию Мемориальной больницы МакКай (Тайбэй, Тайвань). Массу тела каждой мыши измеряли в начале терапии и каждый день в течение периода терапии. Клетки B16F10 представляют собой клетки мышиной меланомы, клетки LLC1 представляют собой клетки мышиной карциномы легкого Льюиса. Все клетки были взяты у мышей C57BL/6. Клетки выращивали в среде Игла, модифицированной по способу Дульбекко (DMEM), 10% фетальная телячья сыворотка, инактивированная нагреванием, 2 мМ L-глутамин, пенициллин (100 ЕД/мл) и стрептомицин (100 мкг/мл) при температуре 37°С в увлажненной атмосфере с содержанием 5% СО2.
Антитела и реактивы
Для исследования на моноцитах человека
ЛПС, произведенный в культуре Е. coli (0111:В4), был получен от компании Sigma. Мышиные антитела, специфичные в отношении человеческого CD11b (ICRF44) и мышиный IgG1, использованный в качестве контрольных антител, были приобретены у компании Biolegend.
Для модели рака у мышей
Крысиные антитела, специфичные в отношении мышиного CD11b (M1/70), контрольные крысиные антитела IgG2b (LTF-2), антитела серого хомячка к мышиному PD1 (J43), и контрольный IgG серого хомячка были приобретены у компании BioXcell. Таксол представляет собой химиотерапевтическое лекарственное средство, полученное из Мемориальной больницы МакКай.
Протокол лечения рака
Модель подкожных опухолей
Мышам C57BL/6 подкожно вводили 2×105 клеток B16F10 или 1×106 клеток LLC1. Через 7 дней после инокуляции опухоли была начата терапия. Мышам-опухоленосителям вводили интраперитонеально (и/п) различные антитела и химиотерапевтический препарат два раза в неделю. Мышей подвергали мониторингу с оценкой образования пальпируемых опухолей дважды в неделю, и умерщвляли в том случае, если размер опухолей превышал установленную величину 3000 мм3. Для определения объема опухолей проводили измерения с помощью штангенциркуля и использовали следующую формулу для вычислений: А × В2 × 0,54, где А - наибольший диаметр, В - наименьший диаметр.
Модель легочных метастаз
В день 0 каждой мыши вводили в хвостовую вену 2×105 клеток B16F10 или клеток LLC1. В день 1 мышам вводили интраперитонеально различные антитела. Инъекции повторяли каждые три-четыре дня. В день 15 мыши были умерщвлены, диссеминацию опухоли оценивали как общее количество узлов, присутствующих в легких и выявляемых при микроскопическом исследовании. В других экспериментах был проведен анализ влияния комбинированной терапии на долгосрочное выживание мышей, подвергнутых терапии, в каждой из групп.
Анализ способом проточной цитометрии
Для исследования на моноцитах человека
Моноциты подвергали предварительному инкубированию с антителами к CD11b (ICRF44) или контрольными антителами соответствующего изотипа в течение 1 часа. После этого к клеткам прибавляли 100 нг/мл ЛПС и проводили инкубирование в течение ночи. Для анализа поверхностного фенотипа ЛПС-примированных моноцитов клетки инкубировали в течение 30 минут на льду в темноте со следующими моноклональными антителами, разведенными в фосфатном буферном растворе (ФБР), содержащем 1% бычьего сывороточного альбумина (БСА): PD-L1-FITC, CD80-PE, CD86-PE, HLA-DR-PE и CD14-PerCP (BD Biosciences). Моноциты, полиморфоядерные лейкоциты (PMN) и лимфоциты отбирали на основе их характеристик FSC/SSC. Детекцию флуоресценции осуществляли с использованием FACS Calibur, анализ данных проводили с использованием программного обеспечения FCS Express, версия 3 (De Novo Software).
Для исследования рака у мышей
Для получения лейкоцитов, инфильтрирующих опухоль, опухолевую ткань расщепляли под действием коллагеназы IV (Sigma). Суспензии одиночных клетокобрабатывали следующими антителами: CD45-PE, Ly-6G-FITC, Ly-6C-APC и CD8b.2-FITC. Лейкоциты, инфильтрирующие опухоль, отбирали из популяций CD45+. Детекцию флуоресценции осуществляли с использованием FACS Calibur, анализ данных проводили с использованием программного обеспечения FCS Express, версия 3 (De Novo Software).
Для выделения лейкоцитов крови в каждом эксперименте клетки цельной крови подвергали лизису в буфере, разрушающем эритроциты. Суспензии одиночных клетокобрабатывали следующими антителами: PD-L1-АРС, IAIE-APC и CD8b.2-FITC (Biolegend). Моноциты, полиморфоядерные лейкоциты (PMN) и лимфоциты отбирали на основе их характеристик FSC/SSC. Детекцию флуоресценции осуществляли с использованием FACS Calibur, анализ данных проводили с использованием программного обеспечения FCS Express, версия 3 (De Novo Software).
Количественное определение цитокинов
Детекцию человеческих IL-6, IL-10, IL-12 и TNF-α в супернатанте культуральной жидкости проводили с использованием коммерческого твердофазного иммуноферментного анализа (ELISA; R&D Systems) в соответствии с инструкциями производителя. Количественное определение мышиных IL-12, IFN-γ и TNF-αв плазме проводили с использованием набора для оценки уровня воспаления у мышей BD СВА Mouse Inflammation Kit.
Пример 1 Связывание CD11b может уменьшать экспрессию PD-L1 на моноцитах, примироваиных ЛПС
В этом примере мы исследовали, может ли блокада интегрина αМβ2 (Мас-1) функционально увеличить TLR-ответ. Как показано на Фиг. 1, введение агента, связывающегося с CD11b, такого как антитела к CD11b (ICRF44), может уменьшить ЛПС-индуцированную экспрессию PD-L1 в моноцитах. Напротив, терапия антителами к CD11b не изменяло уровень экспрессии HLA-DR, CD80 и CD86 на ЛПС-примированных моноцитах. Связывание CD11b с ML-C19-A, низкомолекулярным антагонистом CD11b (Фиг. 2), также приводило к ингибированию экспрессии PD-L1 на ЛПС-примированных моноцитах (Figure 2В). В совокупности эти результаты показывают, что CD11b играет критическую роль в индукции экспрессии PD-L1 на ЛПС-примированных моноцитах.
Пример 2 Влияние связывания с CD11b на противоопухолевый иммунитет
Для оценки влияния связывания с CD11b на противоопухолевый иммунитет было проведено испытание использования антител к мышиному CD11b (Ml/70) в качестве монотерапии в модели опухоли B16F10 на мышах. Мышам C57BL/6 проводили подкожное введение клеток B16F10 в день 0. В день 7 мышам вводили интраперитонеально (и/и) либо контрольный IgG (5 мг/кг), либо антитела к мышиному CD11b (5 мг/кг). Инъекции повторяли каждые три-четыре дня. Эффективность определяли путем мониторинга объема опухолей и долгосрочного выживания в каждой группе. Как показано на Фиг. 4, связывание CD11b с антителами к мышиному CD11b оказывает сильное ингибирующее действие на подкожный рост опухолей of B16F10 (контрольный IgG в сравнении с антителами к CD11b=1054±385,4 мм3 в сравнении с 502,7±268,2 мм в день 18). Мы провели оценку соотношения популяций иммунных клеток в опухоли. В день 18 после инокуляции опухоли связывание CD11b с антителами к CD11b привело к сокращению местной аккумуляции инфильтрирующих опухоль супрессорных клеток миелоидного происхождения (MDSC), которые подавляют Т-клетки, что привело к увеличению популяции инфильтрирующих опухоль CD8 Т-клеток (Фиг. 5). В общей сложности, связывание CD11b с антителами к CD11b сдвигает условия микроокружения опухоли от иммуносупрессивного к иммуностимулирующему состоянию, что вносит вклад в противоопухолевый эффект.Также мы провели оценку соотношения популяций иммунных клеток в периферической крови после терапии антителами к CD11b. На день 15 после инъекции опухоли терапия антителами к CD11b приводила к уменьшению экспрессии PD-L1 в CD 1 lb-положительных лейкоцитах, тогда как процент IAIE-положительных CD 8 Т-клеток, активированных Т-клеток, в популяции CD8 Т-клеток увеличился (Figure 5). Уровни содержания IFN-γ, IL-12 и TNF-α в плазме отражают иммуностимулирующее состояние при различных воспалительных или злокачественных заболеваниях. Мы провели измерения содержания IFN-γ, IL-12 и TNF-α в плазме у мышей-опухоленосителей после терапии антителами к CD11b. По сравнению с контрольной терапией IgG, у мышей, получавших антитела к CD11b, наблюдалось повышенное содержание IFN-γ, IL-12 и TNF-α в плазме (Фиг. 7).
Связывание CD11b также показало эффективность в модели сингенных опухолей LLC1. Терапия с использованием 5 мг/кг антител CD11b оказывала сильное ингибирующее воздействие на рост опухоли LLC1 (Фиг. 8) и увеличивала время выживания животных (Фиг. 9) (медиана продолжительности выживания: контрольный IgG: 31 день; антитела к CD11b: 42 дня).
Пример 3 Синергетическое влияние связывания CD11b и терапии на основе иммунных контрольных точек на противоопухолевый иммунитет
Связывание CD11b также показало эффективность в модели сингенных легочных метастаз LLC1. Терапия с использованием антител к CD11b (10 мг/кг)+антител к PD-1 (10 мг/кг) сильно уменьшала опухолевые узлы LLC1 (Фиг. 10) (контрольный IgG в сравнении с антителами к CD11b, в сравнении с антителами к PD-1, в сравнении с антителами к CD11b + антителами к PD-1=200±13 в сравнении с 167, в сравнении с 164±11, в сравнении с 131±2 в день 15) и увеличивала время выживания животных (Фиг. 11) (медиана продолжительности выживания: контрольный IgG: 24 дня; антитела к CD11b: 24 дня; антитела к PD-1: 22 дня; антитела к CD11b + антитела к PD-1: 26 дней).
Пример 4 Синергетическое влияние связывания CD11b и химиотерапии на противоопухолевый иммунитет
Связывание CD11b также усиливает эффект химиотерапии. В этом примере клетки B16F10 были имплантированы в день 0. В день 7 мышам вводили интраперитонеально либо контрольный IgG (5 мг/кг), либо антитела к мышиному CD11b (5 мг/кг), Таксол (10 мг/кг) + контрольный IgG (5 мг/кг), либо Таксол (10 мг/кг) + антитела к CD11b (5 мг/кг). Инъекции повторяли каждые три-четыре дня. Как показано на фиг. 12, терапия с использованием комбинации Таксол плюс антитела к CD11b обеспечивала эффективный контроль роста опухоли. Эффективность комбинированной терапии также была подтверждена показателями долгосрочного выживания (Фиг. 13) (медиана продолжительности выживания: контрольный IgG: 25 дня; антитела к CD11b: 32 дня; Таксол + контрольный IgG: 25 дней; Таксол + антитела к CD11b: 32 дней).
Пример 5 У ЛПС-иммуносупрессированных моноцитов или моноцитов пациентов с септическим шоком связывание CD11b с антителами к CD11b также уменьшает экспрессию PD-L1 в тех случаях, когда клетки подвергнуты воздействию ЛПС.
Сепсис, системный синдром воспалительного ответа, вызываемый тяжелой инфекцией, остается актуальной проблемой здравоохранения по всему миру и заболеванием, угрожающим жизни. Все больше становится ясно, что сепсис запускает двухфазную иммунологическую реакцию, которая изменяется со временем. В ходе начальной фазы сепсиса системный гипервоспалительный иммунный ответ может приводить к системному синтезу воспалительных цитокинов, включая интерлейкин 1 (IL-1), IL-6 и фактор некроза опухоли альфа (TNF-α), которые могут обуславливать гемодинамическую нестабильность, мультиорганную недостаточность, нарушения свертывания крови и шок. Параллельно с развитием гипервоспалительного иммунного ответа почти одновременно происходит синтез противовоспалительных цитокинов, включая IL-10 и фактор роста опухоли бета (TGF-β); иммунная система быстро переходит в состояние иммунной гипореактивности, называемое иммунопараличом, которое проявляется как неспособность к уничтожению первичной инфекции и к развитию поздних нозокомиальных инфекций. Индикаторы иммунопаралича, наблюдемые у пациентов с сепсисом, включают отклонения лимфоцитов, деактивацию моноцитов с уменьшенной поверхностной экспрессией человеческого лейкоцитарного антигена-DR (HLA-DR) и низкий уровень продукции TNF-α в условиях имитации ex vivo. Устойчивое сокращение экспрессии HLA-DR в моноцитах указывает на высокий риск нозокомиальной инфекции и смерти у пациентов с сепсисом. Недавно было обнаружено повышение уровня экспрессии лиганда белка программируемой смерти-1 (PD-L1) в моноцитах у пациентов с септическим шоком, которое было связано с повышенной частотой возникновения вторичных нозокомиальных инфекций и повышенной смертностью (Guignant С, Lepape A, Huang X, Kherouf Н, Denis L, et al. (2011) Programmed death-1 levels correlate with increased mortality, nosocomial infection and immune dysfunctions in septic shock patients. Crit Care 15: R99). Поэтому уровень экспрессии PD-L1 в моноцитах может служить в качестве нового маркера иммунопаралича. Имеются данные о том, что предварительная обработка моноцитов ЛПС в течение 2 дней может сделать их иммуносупрессированными моноцитами (Wolk К, Docke WD, von Baehr V, Volk HD, and Sabat R. (2000) Impaired antigen presentation by human monocytes during endotoxin tolerance. Blood 96: 218). Клинически, такие клетки связаны с иммунопараличом и смертностью. Нами были воспроизводимо получены ЛПС-иммуносупрессированные моноциты, путем предварительного инкубирования человеческих моноцитов с 100 нг/мл ЛПС в течение 2 дней. По сравнению со свежевыделенными человеческими моноцитами, моноциты с ЛПС-индуцированной иммуносупрессией демонстрировали более высокий уровень экспрессии PD-L1 на поверхности клеток (Фиг. 14). Для оценки влияния модуляторов CD11b на моноциты с ЛПС-индуцированной иммуносупрессией, клетки подвергали воздействию 1 мкг/мл ЛПС в течение 18 часов в присутствии IgG1 или антител к CD11b (ICRF44). Как показано на Фиг. 15, связывание CD11b с антителами к CD11b (ICRF44) приводило к уменьшению экспрессии PD-L1 в ЛСП-иммуносупрессированных моноцитах в тех случаях, когда клетки подвергнуты воздействию ЛПС. Кроме того, терапия антителами к CD11b (ICRF44) также приводила к сокращению экспрессии PD-L1 в моноцитах, взятых у пациентов с септическим шоком, при стимуляции ЛПС in vitro (Фиг. 16).
Пример 6 Гуманизированные антитела, которые связываются с человеческим CD11b
Был проведен поиск последовательностей, гомологичных последовательностям вариабельной области мышиных антител к CD11b по базе данных последовательностей человеческих антител. 10 наборов человеческих каркасных последовательностей, гомологичных мышиным антителам к CD11b были выбраны в качестве человеческих акцепторов, как для легкой, так и для тяжелой цепей. Также был проведен анализ N-гликозилированных мотивов. Таким образом, наличия потенциальных сайтов гликозилирования в отбираемых в качестве кандидатов вариабельных областях человеческих антител необходимо было избегать. Гуманизированные вариабельные области 10 легких цепей были обозначены как VL1, VL2, VL3, VL4, VL5, LCI, LC2, LC3, LC4 и LC5 (Фиг. 17); тогда как гуманизированные вариабельные области 10 тяжелых цепей были обозначены как VH1, VH2, VH3, VH4, VH5, НС1, НС2, НС3, НС4 и НС5 (Фиг. 18). Указанные пептидные последовательности легкой цепи и тяжелой цепи могут обеспечить получение гуманизированных антител или антигенсвязывающих частей указанных антител, которые связываются с человеческим CD11b с высоким уровнем аффинности.
Пример 7 Функциональная активность гуманизированных антител к CD11b
Специфичность гуманизированных антител к CD11b определяли путем проточной цитометрии с использованием клеток К562, экспрессирующих CD11b. Как показано на Фиг. 19, все гуманизированные антитела к CD11b в этом примере были способны к связыванию с клетками К562, трансцифированными CD11b. Напротив, с клетками К562 эти антитела не связывались. В совокупности эти результаты показывают, что гуманизированные антитела к CD11b могут специфично связываться с эпитопом CD11b.
Для оценки функциональной активности гуманизированных антител к CD11b антитела были использованы в эксперименте с ЛПС-примированными моноцитами, для измерения способности антител к ингибированию экспрессии PD-L1 на поверхности моноцитов. Как показано на Фиг. 20, повышающая регуляция PD-L1 под действием ЛПС может быть значимо уменьшена за счет влияния гуманизированных антител к CD11b.
Таким образом, в общей сложности мы описали ряд гуманизированных антител к CD11b к человеческому домену αМ. Связывание гуманизированных антител к CD11b было способно обеспечивать уменьшение экспрессии PD-L1 на моноцитах, примированных липополисахаридом (ЛПС).
Реферат
Изобретение относится к биотехнологии, в частности касается антител к CD11b или антигенсвязывающей части указанных антител, а также эффективных способов и использования антител для модуляции иммунного ответа путем регуляции экспрессии CD11b в клетках. Изобретение позволяет эффективно регулировать экспрессию CD11b в клетках. 2 н. и 9 з.п. ф-лы, 20 ил., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Рекомбинантное антитело, специфичное к фактору некроза опухоли и маркеру иммунных клеток миелоидного ряда

Комментарии