Кирнк и их использование в способах и композициях для ингибирования экспрессии гена nrarp - RU2738971C2
Код документа: RU2738971C2
Чертежи

















Описание
Область, к которой относится изобретение
Настоящее изобретение относится к киРНК-продуктам и к их применению в способах и композициях для лечения и/или профилактики заболеваний сетчатки, ассоциированных с неоваскуляризацией, а более конкретно, для лечения и/или профилактики заболеваний сетчатки, ассоциированных с неоваскуляризацией, связанной с высокими уровнями экспрессии и/или активности гена NRARP.
Предпосылки создания изобретения
Здоровая сетчатка необходима для хорошего зрения. Заболевания сетчатки могут вызывать частичную или полную потерю зрения. Многие заболевания сетчатки имеют общие симптомы и их методы лечения, но каждое из них имеет свои уникальные особенности. Целью лечения заболеваний сетчатки является прекращение или замедление прогрессирования заболевания и сохранение зрения или восстановление его потери.
Нейросетчатка представляет собой комплексную нервную ткань, состоящую из сети восьми соединенных между собой клеточных слоев, ответственных за преобразование видимого света в электромеханическую информацию, которая посылается в головной мозг и интерпретируется в головном мозге через зрительный нерв. Нервные клетки должны быть расположены в сетчатке так, чтобы свет проходил через большинство клеточных слоев и достигал фоторецепторов, расположенных в задней части сетчатки, после чего фоторецепторы передают информацию нейронам сетчатки для локальной обработки визуальной информации и ее передачи в зрительную зону коры головного мозга. Существует два типа фоторецепторов, палочки и колбочки. Фоторецепторы обоих типов присутствуют во всей сетчатке, при этом палочки преобладают в периферической области, а колбочки наиболее плотно расположены в центре сетчатки. Центр сетчатки, также известный как желтое пятно, является специализированной областью сетчатки с плотно упакованными колбочами и высокой концентрацией пигментов, где зрение является наиболее острым. Одной из основных характеристик сетчатки является ее прозрачность. Прозрачность позволяет свету достигать самого дальнего слоя сетчатки, где расположены фоторецепторы. Такая прозрачность требуется для того, чтобы сосудистая система, необходимая для питания и поддержанимя сетчатки, была в высокой степени специализированной. Кровоснабжение сетчатки обеспечивается основными источниками: сосудистой сетью сетчатки и хориоидальной оболочкой. Хориоидальная оболочка представляет собой в высокой степени васкуляризованную, пигментированную ткань, расположенную между сетчаткой и склерой. Хориоидальная оболочка обеспечивает питание, метаболизм и газообмен сетчатки посредством диффузии через хориокапилляры. Пигментный эпителий сетчатки (ПЭС) представляет собой монослой пигментированных клеток, расположенных между нейросетчаткой и хориоидальной оболочкой. Клетки ПЭС защищают, поддерживают и питают светочувствительную сетчатку. Конкретное окружение нейросетчатки поддерживается сосудисто-ретинальным барьером, также называемым гематоретинальным барьером (ГРБ). ГРБ образован внутренним гематоретинальным барьером и внешним гематоретинальным барьером. Внутренний гематоретинальный барьер образован плотными стыками между капиллярными эндотелиальными клетками сосудистой сети сетчатки. Внешний гематоретинальный барьер образован плотными стыками клеток ПЭС. Плотные стыки между клетками ПЭС играют важную роль в регуляции транспорта жидких и растворимых соединений через ГРБ, а также препятствуют поступлению токсичных веществ в сетчатку.
Кровеносные сосуды образуются в сетчатке благодаря двум главным процессам: васкуляризации или ангиогенезу. Васкуляризация происходит в результате дифференцировки клеток-предшественников, которые уже присутствуют в ткани, с образованием эндотелиальных клеток, которые участвуют в образовании кровеносных сосудов. Ангиогенез отличается тем, что новые кровеносные сосуды образуются посредством разрастания уже существующей сосудистой сети. Для ангиогенеза необходимы пролиферация, миграция и дифференцировка эндотелиальных клеток, а также созревание новообразованных сосудов. Количество эндотелиальных клеток у взрослого организма обычно является стабильным, и такая стабильность в эндотелии контролируется балансом концентрации ангиогенных и антиангиогенных факторов.
Изменения в балансе факторов приводят к индуцированию или подавлению ангиогенеза. Васкуляризация и ангиогенез являются природными процессами, которые происходят во время развития организма и других событий, таких как заживление ран, но эти процессы также играют определенную роль в патогенезе некоторых заболеваний. Патологическая неоваскуляризация обычно представляет собой комбинацию васкуляризации и ангиогенеза. Существуют два типа неоваскуляризации, которые происходят в сетчатке и могут приводить к потере зрения, а именно к неоваскуляризации сетчатки (НВС), при которой новые сосуды разрастаются из капилляров сетчатки и проникают в стекловидное тело и в нейронные слои сетчатки, и к хориоидальной неоваскуляризации (ХНВ), при которой новые сосуды разрастаются из хориоидальной сосудистой сети и проникают в субретинальное пространство. Хотя НВС и ХНВ происходят из различных сосудистых сетей и проникают в различные слои сетчатки, однако, их прогрессирование стимулируют общие молекулярные механизмы. НВС и ХНВ являются самыми распространенными причинами тяжелой потери зрения у людей в развитых странах и требуют разработки новых методов лечения.
Васкулярный эндотелиальный фактор роста (VEGF), который является одним из самых важных медиаторов ангиогенеза, активируется во время НВС и ХНВ. За последнее десятилетие, учеными было разработано несколько новых лекарственных средств против VEGF. Эти лекарственные средства стимулируют блокирование аномальных кровеносных сосудов, замедляют их утечку и способствуют уменьшению потери зрения. Лечение с использованием лекарственных средств против VEGF осуществляют посредством инъекций в стекловидное тело.
Инъекция в стекловидное тело (IVT) является самым распространенным методом доставки лекарственных средств в заднюю часть глаза, и такой метод включает использование всех апробированных в настоящее время лекарственных средств для лечения заболеваний сетчатки, за исключением вертепорфина. Вертепорфин вводят путем внутривенной инъекции с последующей лазерной обработкой, но его применение значительно сокращается из-за поступления на рынок современных препаратов против VEGF. Причинами широко распространенного применения IVT-инъекций являются эффективность доставки лекарственных средств, уровень осведомленности врачей, занимающихся лечением сетчатки, и возможность контролировать врачом соблюдение пациентом режима лечения (Rowe-Rendleman et al., 2014). Однако, этот метод имеет ряд очень специфических недостатков, которые включают дискомфорт пациента, риск эндофтальмита, образование катаракты и отслоение сетчатки, а также высокая стоимость лечения, связанная с клиническом делопроизводством. Другие способы введения включают периокулярную инъекцию, инъекцию в надхориоидальное пространстко, инъекцию в область под теноновой капсулой, а также глазные капли. Однако, существует некоторый скептицизм относительно достаточной эффективности лечения заболеваний сетчатки с использованием глазных капель, поскольку активный ингредиент должен быть доставлен из роговицы к участку его действия в сетчатке. Существуют значительные барьеры и пути элиминации, которые препятствуют доставке лекарственных средств в заднюю часть глаза. Во-первых, только 1-7% от введенного препарата поглощается глазом, а большая часть вводимого лекарственного средства в виде глазных капель вытекает из глаза или поглощаются через носослезный проток в системный кровоток. Кроме того, лекарственные средства быстро выводятся из жидкой части стекловидного тела. Существуют два пути клиренса из задней полости, а именно, передний и задний. Первый путь осуществляет клиренс в переднюю камеру посредством потока внутриглазной жидкости (AH), с последующим оттоком AH через угол передней камеры. В последнем пути осуществляется элиминация через гематоретинальный барьер. Таким образом, лекарственные средства, которые могут легко проникать через гематоретинальный барьер, будут иметь очень короткое время полужизни в жидкости стекловидного тела.
Альтернативой препаратам против VEGF для лечения заболеваний сетчатки, ассоциированных с неоваскуляризацией, являются лекарственные средства на основе РНК-интерференции (РНКи).
РНКи представляет собой природный пост-транскрипционный механизм регуляции, который осуществляется в большинстве эукариотических клеток с использованием небольших молекул двухцепочечной РНК (дцРНК) для направленного сайленсинга генов в зависимости от гомологии. За открытие этого механизма у червей C. elegans, ученые Fire и Mello {Fire et al., 1998} были удостоены Нобелевской премии в 2006 году. Вскоре после первого описания этого механизма, было также обнаружено, что РНКи происходит в клетках млекопитающих посредством небольших двухцепочечных интерферирующих РНК (киРНК) длиной в 21 нуклеотид {Elbashir et al., 2001}.
Считается, что процесс РНК-интерференции происходит по эволюционно-консервативному механизму клеточной защиты, предотвращающей экспрессию чужеродных генов, и обычно является общим для различных типов организмов и флоры, и этот процесс называется пост-транскрипционным сайленсингом гена. Так как открытие механизма РНКи сделало прорыв в науке и позволило открыть новые соединения, которые могут селективно изменять экспрессию гена, то этот механизм можно рассматривать как новый способ лечения человека путем нацеливания на мишени, который так или иначе «не дружен» с традиционными фармацевтическими подходами, включающими небольшие молекулы или белки.
В соответствии с имеющимися в настоящее время научными данными, механизм РНКи инициируется в том случае, когда длинные двухцепочечные РНК процессируются белком, подобным РНКазе III и известным как Dicer. Белок Dicer обычно содержит N-концевой домен РНК-геликазы, РНК-связывающий домен, также называемый доменом Piwi/Argonaute/Zwille (PAZ), два домена РНКазы III и домен, связывающийся с двухцепочечной РНК (dsRBD) {Collins et al. 2005}, и его активность приводит к процессингу длинных двухцепочечных РНК с образованием двухцепочечных киРНК длиной 21-24 нуклеотида с 2 выступающими 3'-концами оснований и с 5'-фосфатной и 3'-гидроксильной группой. Затем, полученные киРНК- дуплексы вводят в эффекторный комплекс, известный как комплекс РНК-индуцированного сайленсинга (RISC), где антисмысловая или руководящая цепь киРНК сообщает комплексу RISC способность распознавать и расщеплять последовательности мРНК-мишени {Elbashir et al. 2001} после аденозин-трифосфат (АТФ)-зависимого расплетания молекулы двухцепочечной киРНК посредством активности РНК-геликазы {Nykanen et al 2001}. Каталитическая активность RISC, приводящая к деградации мРНК, опосредуется эндонуклеазой Argonaute 2 (AGO2) {Liu et al. 2004; Song et al. 2004}. AGO2 принадлежит к семейству высококонсервативных белков Argonaute. Белки Argonaute представляют собой высокоосновные белки размером ~100 кДа, которые содержат два общих домена, а именно, домены Piwi и PAZ {Cerutti et al., 2000}. Домен PIWI играет важную роль во взаимодействии с Dicer и обладает нуклеазной активностью, ответственной за расщепление киРНК. AGO2 использует одну цепь киРНК-дуплекса в качестве ориентира для выявления матричных РНК, содержащих комплементарные последовательности, и расщепляет фосфодиэфирный остов между основаниями 10 и 11 по отношению к 5'-концу руководящей цепи {Elbashir et al., 2001}. Важной стадией в процессе активации RISC является расщепление смысловой цепи или цепи-«пассажира» под действием AGO2 с удалением этой цепи из комплекса {Rand et al., 2005}. Кристаллографические исследования, проводимые для анализа взаимодействия между руководящей цепью киРНК и доменом PIWI, показали, что эта цепь содержит только нуклеотиды 2-8, которые составляют «затравочную последовательность», обеспечивающую распознавание мРНК-мишени посредством RISC, и что несоответствие одного нуклеотида в этой последовательности может существенно повлиять на способность молекулы к сайленсингу {Ма et al., 2005; Doench et al., 2004; Lewis et al., 2003}. После расщепления мРНК, обусловленного присутствием незащищенных концов РНК во фрагментах, мРНК снова расщепляется и разрушается под действием внутриклеточных нуклеаз и больше уже не транслируется в белки {Orban et al., 2005}, в то время как RISC будет подвергаться повторному циклу с последующими раундами {Hutvagner et al., 2002}. Этот механизм представляет собой каталитический процесс, приводящий к селективному восстановлению специфических молекул мРНК и соответствующих белков. Этот природный механизм сайленсинга гена может быть использован в целях регуляции любого(ых) выбранного(ых) гена(ов) посредством прямой доставки эффекторов киРНК в клетки или ткани, где они будут активировать RISC и продуцировать эффективный и специфический сайленсинг мРНК-мишени. РНКи применяется в медико-биологических исследованиях, например, для лечения ВИЧ-инфекции, вирусного гепатита, сердечно-сосудистых и цереброваскулярных заболеваний, метаболического заболевания, нейродегенеративных расстройств и рака {Angaji SA et al., 2010}.
Было опубликовано много исследований, где описано, что киРНК обладает идеальными свойствами, позволяющими достигать максимальной эффективности, и к ним относятся длина, структура, химический состав и последовательность. Исходные параметры для конструирования киРНК были изложены Tuschl и сотрудниками в WO02/44321, хотя с тех пор было опубликовано много других исследований, алгоритмов и/или усовершенствований. По мере появления механистических деталей, способы отбора киРНК стали более сложными, и кроме того, последующий анализ уже имеющихся новых данных дал дополнительную информацию об уточнениях этих подходов {Walton SP et al., 2010}. Альтернативно, в некоторых последних исследованиях сообщалось о конструировании и анализе новых РНКи-запускающих структур, которые отличаются от классической 19+2-структуры киРНК, и которые не соответствуют ключевым признакам классической киРНК, таким как выступающий конец, длина или симметрия, и обсуждалась гибкость РНКи-механизма в клетках млекопитающих {Chang CI et al., 2011}.
Кроме того, было предпринято множество попыток повысить стабильность киРНК, поскольку считается, что стабильность является одной из самых главных проблем в терапии на основе киРНК, если учесть разнообразные природные свойства РНКаз в биологических жидкостях. Еще одной проблемой, связанной с молекулами киРНК, является их иммуногенность, так как было обнаружено, что киРНК индуцируют неспецифическую активацию врожденной иммунной системы. «Нокдаун» генов (мРНК), не являющихся мишенями, представляет собой хорошо известный побочный эффект киРНК-опосредованного сайленсинга генов. Это происходит в результате частичной комплементарности между киРНК и мРНК, не являющимися нужными мишенями, и вызывает нежелательные эффекты (OTE) из-за присутствия генов, имеющих последовательность, комплементарную любой цепи киРНК. Одной из основных стратегий повышения стабильности и уменьшения ОТЕ является использование модифицированных нуклеотидов, таких как 2'-O-метилнуклеотиды, 2'-аминонуклеотиды или нуклеотиды, содержащие 2'-О- или 4'-C-метиленовые мостики. Кроме того, была описана модификация рибонуклеотидного остова, соединяющего смежные нуклеотиды, главным образом, путем введения нуклеотидов, модифицированных фосфортиоатом. Считается, что повышение стабильности и/или снижение иммуногенности часто обратно пропорциональны эффективности {Parrish, 2000}, и только определенное количество, положения и/или комбинации модифицированных нуклеотидов могут приводить к стабильному и неиммуногенному сайленсингу соединения. Поскольку это является значительным препятствием для проведения лечения на основе киРНК, то были опубликованы и другие исследования, в которых описаны определенные паттерны модификации, дающие хорошие результаты, и примерами таких публикаций являются EP1527176, WO2008/050329, W02008/104978 или WO2009/044392, хотя в литературе можно найти и многие другие публикации {Sanghvi YS. 2011; Deleavey et al., 2012}.
Глаз представляет собой относительно изолированный орган тканей организма, что обеспечивает преимущества в применении лекарственных средств на основе киРНК для лечения заболеваний сетчатки, ассоциированных с неоваскуляризацией. Целесообразность использования киРНК для лечения ХНВ была продемонстрирована на использовании киРНК, направленных против VEGF или рецептора VEGF1 (VEGFR1), и вводимых путем инъекции в стекловидное тело {Campochiaro PA. 2006}. Доставка киРНК посредством местной инстилляции в задний сегмент реально затруднена из-за относительно большого расстояния, которое придется пройти киРНК через стекловидное тело прежде, чем она достигнет сетчатки {Guzman-Aranguez A. et al. 2013}. Кроме того, фармацевтическое лечение заболеваний сетчатки, влияющих на задний сегмент глаза, также затруднено из-за ограничивающих гематоокулярных барьеров, таких как водный гематоокулярный барьер (ВГБ) и ГРБ, которые отделяют глаз от системного кровотока. Кроме того, компартментализованная структура глаза ограничивает прохождение киРНК из передней камеры в задний сегмент глаза {Duvvuri S. et al., 2003}. И наконец, после успешного проникновения киРНК в заднюю часть глаза, начинают действовать эффективные механизмы клиренса, позволяющие быстро удалять доставленные молекулы {Del Amo EM et al., 2008}. Таким образом, прямая инъекция в полость стекловидного тела становится наиболее эффективным способом доставки терапевтических средств на основе киРНК в задний сегмент глаза {Edelhauser HF et al. 2010}. Интравитреальная инъекция киРНКа позволяет вводить высокие концентрации киРНК, которые будут проникать в ткани сетчатки, ограничивая при этом системное воздействие. Однако, концентрации киРНК быстро истощаются из заднего сегмента из-за разложения киРНК эндонуклеазами стекловидного тела и/или из-за проникновения через ГРБ и диффузии через стекловидное тело в переднюю камеру. Таким образом, для поддержания оптимальных концентраций киРНК в заднем сегменте глаза необходимо множество интравитреальных инъекциий. Основным недостатком этого способа введения является то, что множество интравитреальных инъекций ассоциируется с повышенным внутриглазным давлением, кровоизлиянием в стекловидное тело или сетчатку, отслоением сетчатки, разрывом сетчатки, эндофтальмитом, катарактами, «летающими мушками» и временным нечетким зрением {Edelhauser HF et al. 2010}. Поэтому, хотя интравитреальные инъекции обеспечивают доставку высокой концентрации киРНК в сетчатку, однако, этот метод введения также связан с рядом конкретных рисков. Следовательно, местное введение киРНК может снизить такие риски и сделать этот способ введения более удобным для пациента.
Было показано, что «оголенные» киРНК достигают определенных областей после местного применения, но для доступа в более глубокие области, такие как внутренний слой сетчатки, и для эффективного поглощения клетками необходимо разработать стратегии, которые обеспечивали бы достаточную концентрацию соединения, достигающую цитоплазмы клеток, расположенных в области-мишени, и стимулировали желаемый физиологический или терапевтический ответ. Физическими подходами к доставке киРНК через барьер рогового слоя являются микроиглоукалывание (Chong, Gonzalez-Gonzalez et al., 2013), интрадермальная инъекция (Leachman, Hickerson et al., 2010), электропорация (Nakai, Kishida et al., 2007), ионтофорез (Kigasawa, Kajimoto et al., 2010) и т.п. Модификации молекул и/или препарата могут также способствовать проникновению молекулы в нужную область и улучшению ее поглощения клетками.
Было описано местное введение терапевтических средств на основе киРНК для лечения заболеваний сетчатки; например, в US20130123330 раскрывается лечение диабетической ретинопатии и других ассоциированных с неоваскуляризацией заболеваний глаз путем введения по меньшей мере киРНК-дуплекса, связывающегося с молекулами мРНК, кодирующими VEGF или VEGFR2, или коктейля, содержащего комбинацию киРНК-дуплексов, нацеленных на оба гена VEGF и VEGFR2. В этой патентной заявке описано, что киРНК-дуплексы могут быть введены в глаза местно, под конъюнктиву или в стекловидное тело. Однако, это описание включает только примеры соединений, вводимых в стекловидное тело или под конъюнктиву. В WO2010048352 (Quark Pharmaceuticals) раскрывается использование химически модифицированных соединений киРНКа для лечения глазных болезней, расстройств и повреждений, ассоциированных с дегенерацией или гибелью ганглиозных клеток сетчатки, включая пигментный ретинит (ПР), диабетическую ретинопатию (ДР), диабетический отек желтого пятна (ДОЖП) и возрастную дегенерацию желтого пятна (ВДЖП). Хотя местная доставка в ткань сетчатки была продемонстрирована для соединений киРНК, которые ингибируют экспрессию генов-мишеней, ассоциированных с потерей этих клеток, таких как гены CASP2, RTP801, TIGASEII и р53, однако, было подтверждено, что лишь соединения киРНК, нацеленные на каспазу 2, обеспечивают глазной нейропротективный эффект, благодаря увеличению продолжительности жизни ганглиозных клеток сетчатки.
Выбор гена-мишени играет ключевую роль при лечении и/или профилактике заболеваний сетчатки, ассоциированных с неоваскуляризацией, с использованием терапевтических средств на основе киРНК. Notch-регулируемый белок анкириновых повторов (NRARP) индуцируется геном Notch на новообразованных точках ветвления, где он дифференциально модулирует активность передачи сигнала Notch и Wnt с осуществлением баланса между пролиферацией «стебля» и стабильностью сосудов. киРНК-опосредуемое ингибирование NRARP в HUVEC коррелирует с повышением уровня Notch, который в стеблевых клетках транслируется с последующей регрессией сосудов, и такой повышенный уровень Notch приводит к образованию новых TIP-клеток {Phng LK, Потенте М., и др. 2009}. Следовательно, вполне вероятно, что NRARP играет важную роль в регуляции процессов ангиогенеза и/или неоваскуляризации в тканях сетчатки.
Терапевтические средства на основе киРНК могут замедлять и предупреждать прогрессирование НВС и ХНВ при заболеваниях сетчатки, но эти терапевтические эффекты могут быть снижены в результате неэффективной доставки киРНК и ограниченной биодоступности киРНК, что потребует проведения длительных схем лечения путем повторных интравитреальных инъекций. Таким образом, усовершенствованные и неинвазивные терапевтические средства на основе киРНК, нацеленные на новые гены-мишени и гены-мишени согласно изобретению, должны быть разработаны для лечения и/или профилактики заболеваний сетчатки, ассоциированных с неоваскуляризацией.
Сущность изобретения
Настоящее изобретение относится к улучшенным продуктам для снижения экспрессии NRARP, и, следовательно, для лечения заболеваний сетчатки, ассоциированных с неоваскуляризацией. Одно из преимуществ способов лечения ассоциированных с неоваскуляризацией заболеваний сетчатки с использованием продуктов киРНК по сравнению с традиционными антиангиогенными терапевтическими средствами заключается в более длительном эффекте, который достигается при лечении с использованием киРНК. Эта особенность обусловлена тем, что киРНК блокируют синтез белка-мишени. При прекращении лечения, клетки будут синтезировать новые белки-мишени с нуля; в то время как традиционные методы лечения оставляют целевой белок интактным, и готовым снова стать активным после удаления ингибитора. Еще одним преимуществом может быть повышение эффективности с помощью комбинации различных киРНК для лечения заболевания, причем, это может быть достигнуто путем объединения киРНК, нацеленных на NRARP, с другими модуляторами NRARP и/или другими молекулярными медиаторами неоваскуляризации, такими как VEGF или VEGFR2. Механизм действия киРНК заключается в том, что после достижения активной молекулой цитоплазмы, эта молекула может быть использована для опосредования разложения многих молекул мРНК, но этого не происходит в случае использования антител, которые требуют стехиометрического соотношения 1:1. Поэтому предполагается, что для достижения той же самой клинической эффективности и, возможно, снижения побочных эффектов потребуются более низкие дозы соединений.
Описание чертежей
Фигура 1. На этой фигуре показаны короткие фрагменты последовательности гена-мишени NRARP, выбранные в качестве последовательностей-мишеней для киРНК согласно изобретению.
Фигура 2. На этой фигуре показаны олигонуклеотидные последовательности для молекул киРНК согласно изобретению, нацеленных на NRARP согласно изобретению. Последовательности SEQ ID NOS, представленные на этой фигуре, представляют собой смысловую (5' ® 3') цепь; при этом, обычно киРНК вводят в виде дцРНК, а поэтому киРНК будут включать смысловую цепь и комплементарную ей антисмысловую цепь. SEQ ID NO. 10 - SEQ ID NO. 18 представляют собой киРНК, нацеленные на SEQ ID NO. 1 - SEQ ID NO. 9, соответственно. Обычно, киРНК включает смысловую и антисмысловую цепь, но может также включать 3'-динуклеотидные выступающие концы (например, dTdT). Однако это не имеет большого значения.
Фигура 3. Модифицированные киРНК, нацеленные на NRARP. SEQ ID NO: 19 - SEQ ID NO 40 представляют собой модифицированную смысловую (5' ® 3') цепь и модифицированную антисмысловую цепь (5' ® 3') киРНК SEQ ID NO 10, которые нацелены на последовательность SEQ ID NO: 1 гена NRARP. Надписи: смысловая цепь (S), антисмысловая цепь (АС), строчные буквы (2'-OMe- рибонуклеотиды),* (PS или фосфотиоатная связь), строчные буквы (4'-тиорибоза или 4'S), pU или 5pU (5-пропинилурацил-3'), ПРОПИСНЫЕ БУКВЫ (2'F-рибонуклеотиды), строчные буквы (5'-метилуридин или 5MU), dT (дезокситимин или 2'-Н-тимин).
Фигура 4. Уровни экспрессии гена NRARP in vitro после трансфекции одной из нижеследующих киРНК, нацеленных на NRARP: SEQ ID NO. 10 (SYL136001), SEQ ID NO. 11 (SYL136005), SEQ ID NO. 12 (SYL136003) и SEQ ID NO.13 (SYL136004) в человеческих клетках HeLa.
Фигура 5. Жизнеспособность клеток in vitro после трансфекции одной из нижеследующих киРНК, нацеленных на NRARP: SEQ ID NO. 10 (SYL136001), SEQ ID NO. 11 (SYL136005), SEQ ID NO. 12 (SYL136003) и SEQ ID NO. 13 (SYL136004) в человеческих клетках HeLa.
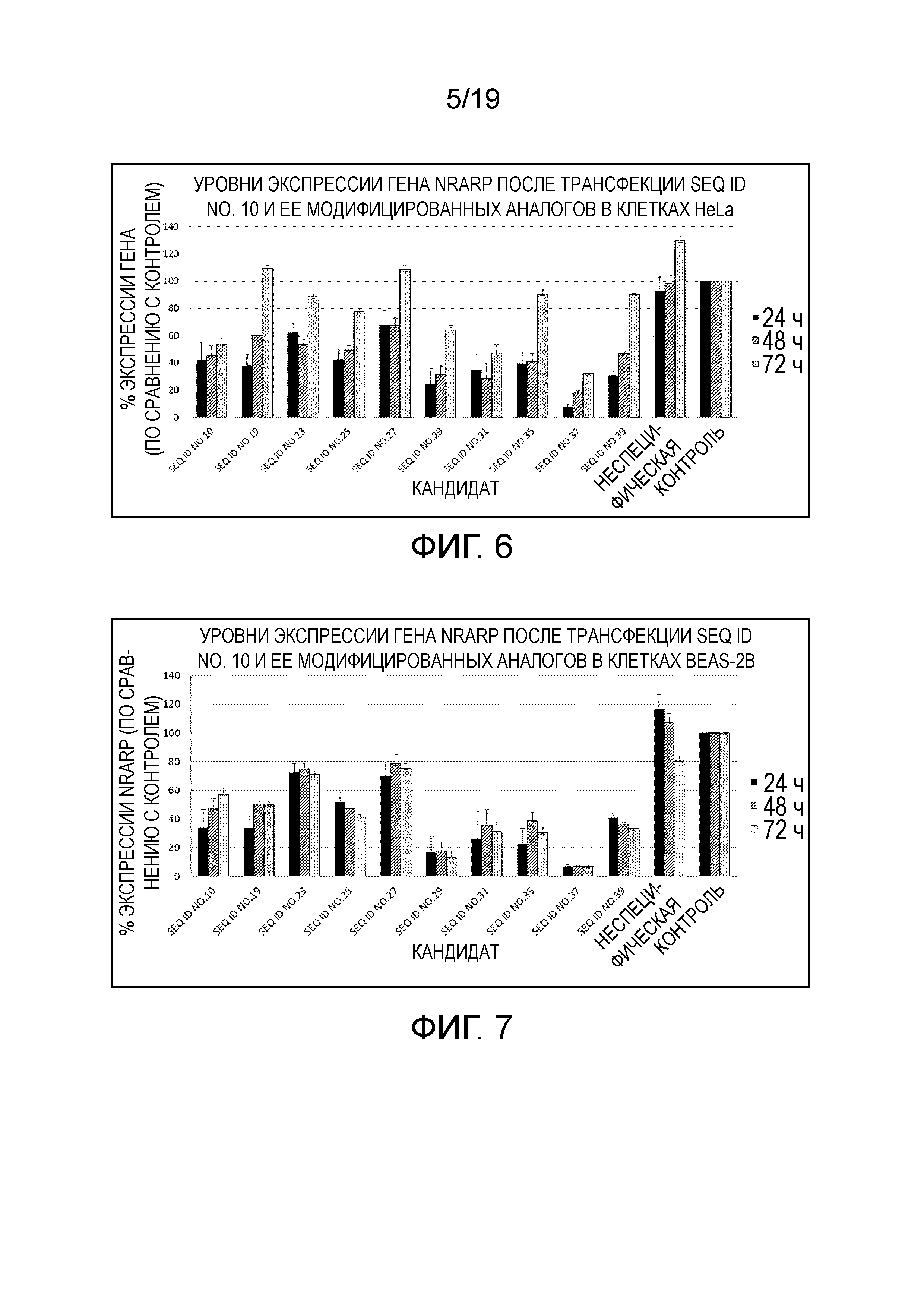
Фигура 6. Уровни экспрессии гена NRARP in vitro после трансфекции киРНК SEQ ID NO. 10, нацеленной на NRARP и его модифицированные аналоги: SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 в человеческих клетках HeLa.
Фигура 7. Уровни экспрессии гена NRARP in vitro после трансфекции киРНК SEQ ID NO. 10, нацеленной на NRARP и его модифицированные аналоги: SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 в человеческих клетках BEAS-2B.
Фигура 8. Уровни экспрессии гена NRARP in vitro после трансфекции SEQ ID NO. 10 и его модифицированных аналогов: SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 в мышиных клетках С2С12.
Фигура 9. Уровни экспрессии гена NRARP in vitro после трансфекции либо SEQ ID NO. 10, либо SEQ ID NO. 37 в крысиных клетках ARL6.
Фигура 10. Жизнеспособность клеток in vitro после трансфекции SEQ ID NO. 10 и его модифицированных аналогов: SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 в человеческих клетках HeLa.
Фигура 11. Жизнеспособность клеток in vitro после трансфекции SEQ ID NO. 10 и его модифицированных аналогов: SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 в человеческих клетках BEAS-2B.
Фигура 12. Жизнеспособность клеток in vitro после трансфекции SEQ ID NO. 10 и его модифицированных аналогов: SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 в мышиных клетках С2С12.
Фигура 13. Жизнеспособность клеток in vitro после трансфекции SEQ ID NO. 10 или SEQ ID NO. 37 в крысиных клетках ARL6.
Фигура 14. Уровни мРНК NRARP в сетчатке после индуцирования ХНВ с помощью лазера. Данные представляют собой среднее±ср.кв.откл. для трех животных (шесть глаз) на определенный момент времени.
Фигура 15. Уровни мРНК NRARP в хориоидальной оболочке/RPE после индуцирования ХНВ с помощью лазера. Данные представляют собой среднее±ср.кв.откл. по меньшей мере для двух животных (четыре глаза) на определенный момент времени.
Фигура 16. Гистограмма измерений поражений через три недели после лазерной обработки либо носителем, либо SEQ ID NO. 37 (5 мг/мл), которые вводят местно или путем интравитреальной инъекции анти-VEGF антитела (5 мкг/глаз). Области поражения определяли с помощью флуоресцеиновой ангиографии и количественно оценивали (в пикселях2) с использованием компьютерной программы для анализа изображений, за исключением неваскуляризованной области в центре поражения. Данные представляют собой среднее±ср.кв.откл. для шести животных (двенадцать глаз) на определенный момент времени.
Фигура 17. Исследуемые переменные величины для оценки структуры: 1 - число главных стыков; 2 - Число главных сегментов; 3 - Общая длина главного сегмента; 4 - Число сеток; 5 - Вся площадь сетки.
Фигура 18. Изменение различных исследуемых параметров в ответ на полную среду. Представлены следующие параметры: число главных стыков; число главных сегментов; общая длина главных сегментов; число сеток; вся площадь сетки. Результаты были получены для клеток, засеянных на покрытые матригелем чашки для культивирования, с использованием среды EBM без добавок, в качестве негативного контроля (базальной), или полной среды с добавками и 10% FCS (позитивный контроль).
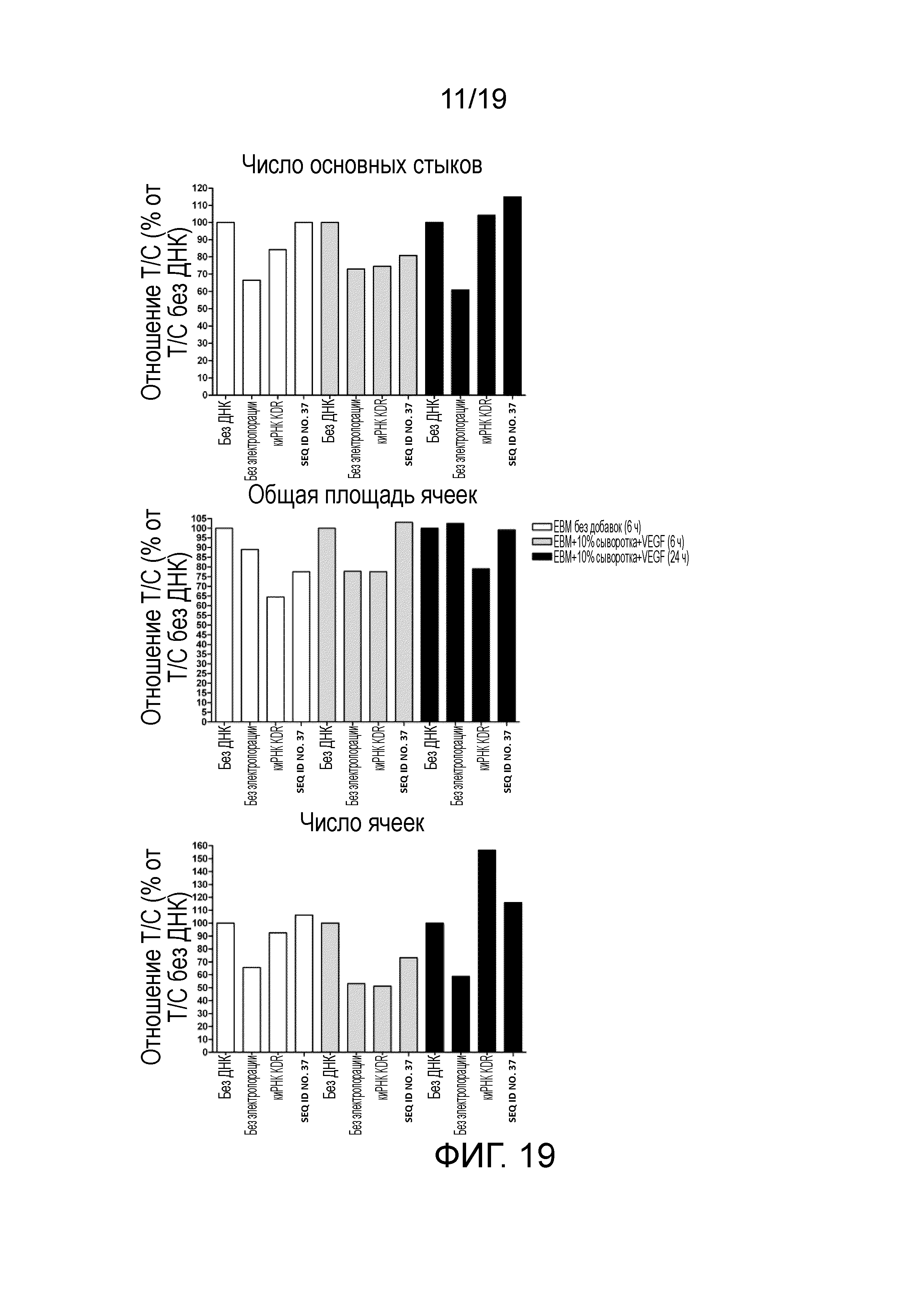
Фигура 19. Анализ различных исследуемых параметров в ответ на SEQ ID NO. 37 или киРНК KDR.
Фигура 20. Фотографии структур, образующихся при различных условиях.
Фигура 21. А. Пролиферация клеток HUVEC в ответ на различные концентрации VEGF. B. Ингибирование VEGF-индуцированной пролиферации с помощью бевабизумаба.
Фигура 22. Влияние анти-KDR киРНК или киРНК SEQ ID No. 37 на пролиферацию, индуцированную полной средой (10% FCS и 100 нг/мл VEGF) в клетках HUVEC.
Фигура 23. Миграция клеток HUVEC в ответ на возрастающие дозы VEGF.
Фигура 24. Влияние анти-KDR киРНК или киРНК SEQ ID NO. 37 на миграцию клеток HUVEC, индуцированную средой без добавок и полной средой (10% FCS+100 нг/мл VEGF).
Фигура 25. Фотографии клеток в верхнем отделении (мигрирующий) при различных условиях.
Фигура 26. А. Количественная оценка заживления ран в базальных условиях и в ответ на 10 нг/мл VEGF. B. Фотографии поражений на время 0 и через 24 часа после индуцирования.
Фигура 27. Количественная оценка заживления ран в базальных условиях и в ответ на полную среду (10% FCS и 100 нг/мл VEGF).
Фигура 28. Фотографии, иллюстрирующие раны на время 0 и через 16 часов после индуцирования в различных анализируемых условиях.
Фигура 29. Уровни мРНК NRARP в клетках HUVEC.
Подробное описание изобретения
В своем первом аспекте, настоящее изобретение относится к получению молекулы киРНК для ее использования в качестве лекарственного средства в целях лечения и/или профилактики глазного заболевания, характеризуютщегося повышенным уровнем экспрессии и/или активности NRARP, где указанная молекула специфически нацелена на последовательность, выбранную из группы, включающей или состоящий из SEQ ID NO. 1 - SEQ ID NO. 9, и снижает уровень экспрессии гена NRARP при ее введении в клетку. Предпочтительно, последовательность-мишень содержит или состоит из SEQ ID NO. 1.
Ген является «мишенью» для киРНК согласно изобретению, если, например, молекула киРНК селективно снижает или ингибирует экспрессию гена. Используемый здесь термин «селективно снижает или ингибирует» относится к киРНК, которые влияют на экспрессию одного гена, а в данном случае, NRARP. Альтернативно, киРНК нацелена на ген, если киРНК (одна ее цепь) гибридизуется в жестких условиях с генным транскриптом, то есть, его мРНК. Гибридизация «в жестких условиях» означает гибридизацию с областью мРНК-мишени в стандартных условиях, например, при высокой температуре и/или при низким содержании соли, которые имеют тенденцию к снижению степени гибридизации. Подходящий протокол (с использованием 0,1 × SSC, 68°C в течение 2 часов) описан в руководстве Maniatis, T., et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, 1982, на страницах 387-389.
Указанные здесь последовательности нуклеиновых кислот, записываются в направлении 5' ® 3', если это не оговорено особо. Термин «нуклеиновая кислота» означает ДНК или РНК или их модифицированную форму, содержащие пуриновые или пиримидиновые основания, присутствующие в ДНК (аденин «А», цитозин «С», гуанин «G», тимин «Т») или в РНК (аденин «А», цитозин «С», гуанин «G», урацил «U»). Описанные здесь интерферирующие РНК могут содержать основания «T», например, у 3'-концов, хотя основания «Т» не встречаются в природной РНК. В некоторых случаях, эти основания могут быть обозначены «dT» для идентификации дезоксирибонуклеотидов, присутствующих в цепи рибонуклеотидов.
Определенная выше последовательность-мишень описана как последовательность ДНК-мишени, используемая для определения вариантов транскриптов в базах данных, применямых для конструирования киРНК, в то время как конкретно используемые соединения представляют собой определенные таким образом последовательности РНК.
Специалист в данной области может получить доступ к любой последовательности гена-мишени в общедоступных базах данных. Так, например, в GenBank, человеческая мРНК NRARP имеет регистрационный номер NP_001004354.1 и NM_001004354.2 (Gene ID: 441478). Кроме того, ENSEMBL (MBL-EBI/Wellcome Trust Sanger Institute) имеет следующий номер доступа к человеческому NRARP: ENSG00000198435. Вся эта информация имеется в базе данных Ensembl в свободном доступе.
Указанная предпочтительная область-мишень, идентифицированная в настоящем изобретении, содержит, или состоит из нее, по меньшей мере одну последовательность, выбранную из SEQ ID NO. 1 - SEQ ID NO. 9.
В предпочтительном варианте осуществления изобретения, указанная предпочтительная область-мишень содержит или состоит из SEQ ID NO. 1.
Эти последовательности имеют 100% гомологию с последовательностями следующих видов: Homo sapiens, Mus musculus, Rattus norvegicus, Canis lupus familiaris и Sus scrofa domestica.
В области РНКи, если исследования in vitro продемонстрировали, что человеческая киРНК не способна индуцировать «нокдаун» гена у животного-модели, то было синтезировано суррогатное соединение (аналог, являющийся активным у животного) для анализа эффективности киРНК у соответствующего животного-модели. Этот суррогат был сконструирован против той же области, которая присутствует и в человеческой киРНК, и таким образом, две киРНК имеют одну и ту же последовательность за исключением нескольких нуклеотидов, в зависимости от гомологии генов-мишененй у человека и животного. Такой подход широко применяется для получения других олигонуклеотидов, а в частности, для токсикологических исследований и оценки эффективности {Kornbrust D. et al., 2013}.
В более предпочтительном варианте осуществления изобретения, указанная предпочтительная область-мишень содержит или состоит из SEQ ID NO. 1 (5'-CACCAGGACATCGTGCTCT-3').
Следовательно, киРНК согласно аспектам настоящего изобретения предпочтительно содержит двухцепочечную молекулу РНК, антисмысловая цепь которой содержит последовательность РНК, по существу, комплементарную по меньшей мере одной последовательности, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, а смысловая цепь которой содержит последовательность РНК, комплементарную антисмысловой цепи, где обе эти цепи гибридизуются посредством спаривания стандартных оснований нуклеотидов. Более предпочтительно, киРНК согласно аспектам настоящего изобретения предпочтительно содержит двухцепочечную молекулу РНК, антисмысловая цепь которой содержит последовательность РНК, по существу, комплементарную SEQ ID NO. 1 - SEQ ID NO. 9, а еще более предпочтительно, антисмысловая цепь содержит, или состоит из нее, последовательность РНК, по существу, комплементарную SEQ ID NO. 1.
Используемый в настоящем изобретении термин «по существу, комплементарный» последовательности мРНК-мишени, можно также понимать как «по существу идентичный» указанной последовательности-мишени. Термин «идентичность», известный специалистам в данной области, означает степень сходства между нуклеотидными последовательностями, как это было определено путем сопоставления порядка расположения и идентичности нуклеотидов в этих последовательностях. В одном из вариантов осуществления изобретения, антисмысловая цепь киРНК, которая на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% комплементарна последовательности мРНК-мишени, рассматриваются как, по существу, комплементарная и может быть использована в настоящем изобретении. Процент комплементарности означает процент смежных нуклеотидов в первой молекуле нуклеиновой кислоты, которые могут образовывать пары оснований в соответствии с правилами Уотсона-Крика, с рядом смежных нуклеотидов во второй молекуле нуклеиновой кислоты. В предпочтительном варианте осуществления изобретения, антисмысловая цепь киРНК на 100% комплементарна последовательности мРНК-мишени, а смысловая цепь на 100% комплементарна антисмысловой цепи по всей двухцепочечной части киРНК. киРНК может также включать неспаренные выступающие концы, например, 3'-динуклеотидные выступающие концы, предпочтительно dTdT.
В предпочтительном варианте осуществления изобретения, указанное глазное заболевание (предпочтительно заболевание сетчатки глаза), идентифицируемое в настоящем изобретении, представляет собой заболевание или расстройство, ассоциированное с неоваскуляризацией. Более предпочтительно, указанное глазное заболевание выбрано из возрастной дегенерации желтого пятна (ВДЖП), ишемической ретинопатии, диабетического отека желтого пятна (ДОЖП), пролиферативной диабетической ретинопатии (ПДР), диабетической ишемии сетчатки (ДИС), диабетического отека сетчатки (ДОС), неоваскуляризации, приводящей к близорукости, и ретинопатии недоношенных (РНД) и их комбинаций.
Как известно из предшествующего уровня техники, для достижения РНК-интерференции было предложено множество различных структур. Обычно, эти двухцепочечные молекулы имеют длину приблизительно от 19 до 25 нуклеотидов и включают затупленные по концам структуры, а также структуры с выступающими концами. Выступающие концы, как было описано, являются предпочтительными, и могут присутствовать у 5'-концов или у 3'-концов любой цепи, поскольку они снижают уровень распознавания под действием РНКаз и имитируют природный субстрат фермента Dicer. Некоторые авторы рекомендуют присоединять выступающие концы к обоим 3'-концам молекул, а другие авторы считают, что достаточно присутствия и одного выступающего конца. Другими авторами было описано использование затупленных по концам структур со специфическими паттернами модификации (EP1527176, WO2005062937, WO2008104978, EP2322617, EP2348133, US20130130377 и многие другие).
Выступающие концы могут состоять из 1-5 нуклеотидов, но обычно выступающие концы состоят из динуклеотидов. Классические молекулы, используемые в этой области, содержат двухцепочечную молекулу в 19 нуклеотидов, которая дополнительно содержит 3'-динуклеотидные выступающие концы, предпочтительно содержащие дезоксинуклеотиды, как описано в первых исследованиях Tuschl (WO0244321). Считается, что эти выступающие концы повышают резистентность к разложению нуклеазами (РНКзами). Позже, Kim и др., 2005, показали, что 21-мерные продукты (содержащие динуклеотидные выступающие концы) необходимы для загрузки в RISC. Кроме того, Bramsen и др., 2009, описали введение возможных дестабилизирующих модификаций в выступающие концы для дальнейшего повышения эффективности сайленсинга.
Таким образом, предпочтительный вариант различных аспектов настоящего изобретения относится к молекулам киРНК, нацеленным по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, которые содержат по меньшей мере один выступающий конец, а предпочтительно 3'- выступающий конец в смысловой и/или антисмысловой цепи. Более предпочтительно, указанные молекулы киРНК нацелены на SEQ ID NO. 1. Если настоящее изобретение относится к молекуле киРНК, нацеленной по меньшей мере на одну последовательность, выбранную из SEQ ID NO. 1 - SEQ ID NO. 9, то киРНК будет включать антисмысловую цепь эквивалентной длины и цепь, комплементарную мишени, и смысловую цепь эквивалентной длины и цепь, комплементарную антисмысловой цепи. Антисмысловые и смысловые цепи могут также включать дополнительные основания, которые не являются комплементарными другой цепи или мишени, и/или которые не спариваются в двухцепочечной части киРНК. Так, например, SEQ ID NO: 1 представляет собой нуклеотидную последовательность длиной в 19 нуклеотидов, где киРНК может включать двухцепочечную область в 19 п.н. по всей этой части идентичной последовательности и дополнительные динуклеотидные выступающие концы.
Предпочтительный вариант различных аспектов настоящего изобретения относится к молекулам киРНК, нацеленным по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, где каждая цепь двухцепочечных молекул киРНК имеет длину приблизительно от 18 до 28 или более (например, приблизительно 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 или 28 или более) нуклеотидов.
Другой предпочтительный вариант различных аспектов настоящего изобретения относится к молекулам киРНК длиной 18-28 нуклеотидов или более, где указанные молекулы содержат нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO. 10 - SEQ ID NO. 18. Более предпочтительно, молекулы двухцепочечной киРНК имеют длину по меньшей мере 19 нуклеотидов и выбраны из группы, состоящей из SEQ ID NO. 10 - SEQ ID NO. 18.
Другой альтернативный вариант различных аспектов настоящего изобретения относится к затупленным по концам молекулам.
Кроме того, предпочтительный вариант осуществления изобретения относится к киРНК, содержащей, или состоящей из нее, двухцепочечную структуру в 19 нуклеотидов, нацеленную по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9. Более предпочтительно, киРНК, содержит, или состоит из нее, двухцепочечную структуру в 19 нуклеотидов, нацеленную по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, а более предпочтительно, на SEQ ID NO. 1.
Конкретный вариант осуществления настоящего изобретения относится к двухцепочечной затупленной по концам киРНК в 19 нуклеотидов, нацеленной по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9. Более предпочтительно, киРНК нацелена по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, а еще более предпочтительно, киРНК нацелена на SEQ ID NO. 1. В другом конкретном варианте осуществления изобретения, это соединение содержит или состоит из нее, по меньшей мере одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 10 - SEQ ID NO. 18. В другом предпочтительном варианте осуществления изобретения, антисмысловая цепь этой киРНК по меньшей мере на 80%, а предпочтительно, по меньшей мере на 90%, комплементарна по меньшей мере одной последовательности, выбранной из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9.
В предпочтительном варианте осуществления изобретения, это соединение содержит, или состоит из нее, по меньшей мере одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 10 - SEQ ID NO. 18.
В другом предпочтительном варианте осуществления изобретения, это соединение содержит, или состоит из нее, смысловую цепь, которая содержит, или состоит из нее, по меньшей мере одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 10 до SEQ ID NO. 18, и антисмысловую цепь, которая комплементарна смысловой цепи.
В более предпочтительном варианте осуществления изобретения, это соединение содержит, или состоит из нее, SEQ ID NO. 10 (смысловую цепь 5'-CACCAGGACAUCGUGCUCU-2' и антисмысловую цепь 5'-AGAGCACGAUGUCCUGGUG-3'), что соответствует рассматриваемому здесь соединению, обозначаемому SYL136001.
Кроме того, как описано в разделе, озаглавленном «Предпосылки создания изобретения», серьезной проблемой, связанной с использованием молекул киРНК, является их нестабильность в биологических жидкостях, что обусловлено действием природных и повсеместно встречающихся РНКаз. Следовательно, использование многих различных химических модификаций нуклеотидов было описано в целях повышения стабильности соединения.
Другой проблемой, связанной с использованием молекул киРНК, является их иммуногенность, так как было обнаружено, что киРНК индуцируют неспецифическую активацию врожденной иммунной системы, включая активацию некоторых цитокинов, например, интерферона типа I и/или типа II, а также продуцирование IL-12, IL-6 и/или TNF-альфа. Считается, что природа этих эффектов обусловлена активацией ловушко-подобных рецепторов, таких как TLR7, TLR8 и/или TLR3 под действием киРНК.
Оба эти эффекта, а именно, распознавание РНКзами и иммуногенность, также были описаны как последовательность-зависимые.
Некоторые из химических модификаций, которые повышают стабильность соединения за счет снижения восприимчивости к РНКзам, также способны снижать индуцирование иммунного распознавания и, следовательно, уменьшать последующий иммунный ответ. Однако, введение химически модифицированных нуклеотидов в киРНК может также привести к снижению эффективности сайленсинга, как описано в предыдущем разделе, а поэтому, такое введение должно быть осуществлено с осторожностью.
Следовательно, в предпочтительном варианте различных аспектов настоящего изобретения, киРНК дополнительно содержит по меньшей мере один нуклеотид с химической модификацией.
Предпочтительными химическими модификациями, которые повышают стабильность и снижают иммуногенные эффекты, являются 2'-O-метилнуклеотиды, 2'-фторнуклеотиды, 2'-аминонуклеотиды, 2'-дезоксинуклеотиды или нуклеотиды, содержащие 2'-О или 4'-C-метиленовые мостики. Другие предпочтительные химические модификации для защиты от экзонуклеазы включают паттерн модификации ExoEndoLight (EEL): замену всех пиримидинов в смысловой цепи на 2'-O-метиловые остатки и замену всех пиримидинов в мотиве 5'-UA-3' или 5'-CA-3' в антисмысловой цепи на 2'-O-метиловые остатки. Кроме того, положение 1 в смысловой цепи может быть также заменено на 2'-O-метил для предотвращения 5'-фосфорилирования смысловой цепи и, таким образом, для повышения специфичности киРНК к цепи. Кроме того, смысловая цепь может также включать 2'-O-метил-модификацию в положении 14, поскольку 2'-O-Me-остатки в этом положении инактивируют смысловую цепь, и, следовательно, увеличивают специфичность киРНК к цепи. Кроме того, другие предпочтительные химические модификации для защиты от нуклеаз включают паттерн метил-фтор-модификации (MEF): поочередные 2'-фтор- и 2'-O-метил-модификации (у 5'-конца), начиная с 2'-F на смысловой цепи и с 2'-O-Me на антисмысловой цепи. Кроме того, положение 1 в смысловой цепи может быть также заменено на 2'-O-Me, а положение 1 антисмысловой цепи может быть также заменено на 2'-F (поскольку 2'-F-остатки являются совместимыми с 5'-фосфорилированием, тогда как 2'-O-Me-остатки являются слишком крупными и, как правило, ухудшают фосфорилирование). Этот паттерн модификации не только стабилизирует молекулу, но также и отключает способность RISC использовать смысловую цепь и тем самым стимулировать специфичность к цепи. Кроме того, модификация рибонуклеотидного остова может быть осуществлена посредством связывания нуклеотидов с использованием фосфоротиоатных связей вместо фосфодиэфирных связей. Кроме того, другая предпочтительная химическая модификация согласно изобретению включает 4'-тиорибозу, 5'-пропинилурацил-3', 5'-метилуридин или замену урацил-рибонуклеотидов дезокситимидином (дезоксирибонуклеотидами). В другом предпочтительном варианте осуществления изобретения, по меньшей мере один химически модифицированный нуклеотид и/или по меньшей мере одна химическая модификация в рибонуклеотидном остове присутствует на смысловой цепи, на антисмысловой цепи или на обеих цепях киРНК.
Соответственно, в одном варианте осуществления изобретения, киРНК содержит, или состоит из нее, по меньшей мере одну последовательность со смысловой цепью и/или антисмысловой цепью, выбранную из группы, состоящей из SEQ ID NO. 19 - SEQ ID NO. 66.
В предпочтительном варианте осуществления изобретения, киРНК содержит, или состоит из нее, смысловую цепь, которая содержит, или состоит из нее, по меньшей мере одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 19, SEQ ID NO. 21, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 33, SEQ ID NO. 35, SEQ ID NO. 37, SEQ ID NO. 39, SEQ ID NO. 41, SEQ ID NO. 43, SEQ ID NO. 45, SEQ ID NO. 47, SEQ ID NO. 49, SEQ ID NO. 51, SEQ ID NO. 53, SEQ ID NO. 55, SEQ ID NO. 57, SEQ ID NO. 59, SEQ ID NO. 61, SEQ ID NO. 63 и SEQ ID NO. 65, и антисмысловую цепь, которая комплементарна смысловой цепи и выбрана из группы, состоящей из SEQ ID NO. 20, SEQ ID NO. 22, SEQ ID NO. 24, SEQ ID NO. 26, SEQ ID NO. 28, SEQ ID NO. 30, SEQ ID NO. 32, SEQ ID NO. 34, SEQ ID NO. 36, SEQ ID NO. 38, SEQ ID NO. 40, SEQ ID NO. 42, SEQ ID NO. 44, SEQ ID NO. 46, SEQ ID NO. 48, SEQ ID NO. 50, SEQ ID NO. 52, SEQ ID NO. 54, SEQ ID NO. 56, SEQ ID NO. 58, SEQ ID NO. 60, SEQ ID NO. 62, SEQ ID NO. 64 и SEQ ID NO. 66, соответственно.
Описанные выше молекулы киРНК могут быть доставлены вовнутрь клетки в их нативной структуре с применением методов, известных специалистам. Так, например, при исследовании сайленсинга гена in vitro, эти соединения вводят с использованием стандартных реагентов для трансфекции. Для достижения эффектов in vivo, эти соединения могут быть также введены в «оголенной» форме или с использованием агентов для улучшения доставки, таких как, например, липосомы; посредством конъюгирования со специфической молекулой и т.п., хотя специалистам известны и многие другие альтернативные методы, применение которых зависит от нужного сайта-мишени в организме.
Альтернативно, молекулы киРНК согласно различным аспектам изобретения могут экспрессироваться в клетках из эукариотических промоторов. Рекомбинантные векторы, способные экспрессировать молекулы киРНК, могут быть доставлены в клетки-мишени и могут сохраняться в этих клетках. Альтернативно, могут быть использованы векторы, которые обеспечивают временную экспрессию молекул нуклеиновых кислот. Такие векторы могут быть повторно введены по мере необходимости. После экспрессии молекула киРНК взаимодействует с мРНК-мишенью и генерирует РНК-интерферирующий ответ. Молекулы киРНК, полученные таким образом, часто называются кшРНК (короткой шпилечной РНК), поскольку их смысловые и антисмысловые цепи связаны с небольшой петлей нуклеотидов. Доставка векторов, экспрессирующих молекулы киРНК, может быть системной, например, она может быть осуществлена путем внутривенного или внутримышечного введения, путем введения в клетки-мишени, взятые у индивидуума, с последующим их возвращением индивидууму, или любым другим способом, позволяющим вводить такие векторы в нужную клетку-мишень.
Еще один аспект настоящего изобретения относится к применению киРНК, нацеленной по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, в целях приготовлении лекарственного средства для применения в способе лечения глазного заболевания, характеризующегося повышенной экспрессией и/или активностью NRARP. Более предпочтительно, указанной последовательностью является SEQ ID NO. 1. Этот способ включает ингибирование экспрессии NRARP у пациента. Используемый здесь термин «ингибирование» означает снижение или подавление экспрессии или активности. Предпочтительно, глазным заболеванием является заболевание или расстройство, ассоциированное с неоваскуляризацией. В одном из вариантов осуществления изобретения глазное заболевание выбрано из группы, включающей возрастную дегенерацию желтого пятна (ВДЖП), ишемическую ретинопатию, диабетический отек желтого пятна (ДОЖП), пролиферативную диабетическую ретинопатию (ПДР), диабетическую ишемию сетчатки (ДИС), диабетический отек сетчатки (ДОС), хориоидальную неоваскуляризацию, приводящую к близорукости (также обычно называемую субретинальной неоваскуляризацией, пятном Фукса или сетчаточным пятном Форстера-Фукса и дисковидной дегенерацией при патологической близорукости), и ретинопатию недоношенных (РНД) и их комбинации.
Настоящее изобретение также относится к способу лечения глазного заболевания, характеризующегося повышенной экспрессией и/или активностью NRARP. Этот способ включает ингибирование экспрессии NRARP у пациента. Этот способ может включать введение киРНК, нацеленной по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9. Более предпочтительно, указанной последовательностью является SEQ ID NO. 1.
Предполагается, что терапевтическое лечение с использованием киРНК, нацеленных против мРНК NRARP, будет более эффективным по сравнению с лечением традиционными антиангиогенными терапевтическими средствами, поскольку эти киРНК обладают специфичностью, стабильностью, эффективностью, природным механизмом действия и такой же химической природой, как и другие киРНК-агенты, нацеленные на одинаковые или различные гены-мишени, так как они отличаются только нуклеотидной последовательностью. Лечение на основе киРНК блокирует синтез белка-мишени, который будет стимулировать устойчивое снижение экспрессии гена NRARP и более длительный эффект, что позволит избежать неблагоприятных последствий интравитреальной инъекции. Это особенно важно в тех случаях, когда заболевания или расстройства, ассоциированные с неоваскуляризацией, включают, но не ограничиваются ими, возрастную дегенерацию желтого пятна (ВДЖП), ишемическую ретинопатию, диабетический отек желтого пятна (ДОЖП), пролиферативную диабетическую ретинопатию (ПДР), диабетическую ишемию сетчатки (ДИС), диабетический отек сетчатки (ДОС), неоваскуляризацию, приводящую к близорукости, и ретинопатию недоношенных (РНД), поскольку такие заболевания представляют собой хронические состояния, лечение которых требует введения многочисленных интравитреальных инъекций. Повторные внутриглазные инъекции повышают риск развития негативных побочных эффектов, которые включают, среди прочих, повышенное внутриглазное давление, воспаление, кровотечение, инфекцию, повреждение сетчатки или окружающих ее нервов или структур, потерю зрения, а также побочные эффекты, вызываемые лекарствами, которые используются во время такой процедуры, например, лекарствами, которые были получены с использованием антибиотиков или препаратов для расширения зрачков. Кроме того, киРНК могут быть сконструированы так, чтобы они стимулировали сайленсинг экспрессии аллелей мутантных генов, отличающихся от аллелей генов дикого типа по меньшей мере одним нуклеотидом. Таким образом, способы лечения на основе киРНК могут преимущественно модулировать экспрессию генов, имеющих точковые мутации, что будет приводить к замедлению прогрессирования заболевания или даже к его предотвращению благодаря селективной инактивации мутантных аллелей, вызывающих заболевание, а также сохранению экспрессии белка дикого типа.
При приготовлении такого лекарственного средства следует иметь в виду, что киРНК согласно различным аспектам настоящего изобретения может быть приготовлена в виде фармацевтической композиции. Предпочтительно, композиции и препараты указанных киРНК могут быть введены местно в представляющий интерес орган. В еще более предпочтительном варианте осуществления изобретения, эти препараты приготавливают для местного введения в глаза, а предпочтительно, на поверхность роговицы глаза. Нанесение на поверхность роговицы может быть осуществлено, например, с помощью глазных капель, геля, лосьона, крема или глазных вставок. Другие формы введения в глаза могут включать инъекцию в глаза.
Еще один предпочтительный вариант различных аспектов настоящего изобретения относится к киРНК, специфически нацеленной по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, как описано в предыдущих параграфах, где эта киРНК используется в качестве лекарственного средства для лечения глазного заболевания, характеризующегося повышенной экспрессией и/или активностью NRARP. Более предпочтительно, указанной последовательностью является SEQ ID NO. 1. Как описано выше, такой последовательностью может быть киРНК, содержащая, или состоящая из нее, двухцепочечную структуру из 19 нуклеотидов, нацеленную по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9. Эта киРНК может быть затуплена по концам. Предпочтительно, киРНК содержит или состоит из нее, по меньшей мере одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 10 - SEQ ID NO. 18.
Другая киРНК для ее использования в соответствии с настоящим изобретением содержит, или состоит из нее, по меньшей мере одну последовательность со смысловой цепью и/или с антисмысловой цепью, выбранной из группы, состоящей из SEQ ID NO. 19 - SEQ ID NO. 66.
В контексте настоящего изобретения, термин «специфически нацеленная» последовательность означает киРНК согласно изобретению, которая предпочтительно содержит по меньшей мере ту же самую затравочную последовательность. Таким образом, любая последовательность согласно изобретению, которая специфически нацелена по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, предпочтительно идентична в положениях 2-8 антисмысловой цепи. Более предпочтительно, указанной выбранной и специфически нацеленной последовательностью является SEQ ID NO. 1.
Несмотря на все вышесказанное, киРНК различных аспектов настоящего изобретения могут быть использованы для подавления экспрессии NRARP не только в тканях глаза, но и в других тканях. Следовательно, указанные киРНК должна быть приготовлены соответствующим образом.
Так, например, молекула киРНК может содержать носитель для доставки, включая липосомы для введения индивидууму. В фармацевтически приемлемых препаратах могут присутствовать носители и разбавители и их соли. Молекулы нуклеиновой кислоты могут быть введены в клетки различными методами, известными специалистам, включая, но не ограничиваясь ими, инкапсулирование в липосомах, ионтофорез, включение в другие носители, такие как биоразлагаемые полимеры, гидрогели, циклодекстрины, сополимеры молочной и гликолевой кислоты (PLGA) и PLCA-микросферы, биоразлагаемые нанокапсулы и биоадгезивные микросферы или белковые векторы. Внутриклеточные компоненты для доставки могут также представлять собой вирусные компоненты, которыми являются, но не ограничиваются ими, фузогенный вирусный пептид, разрушающий эндосомы, что позволяет предотвращать разложение лизосом нуклеиновой кислотой; вирусные белки, поддерживающие экспрессию (например, интеграза, элементы LTR, белки rep, белки oriP и EBNA-1), или вирусные компоненты, которые взаимодействуют с белками клеточной поверхности. Подходящими вирусными компонентами внутриклеточной доставки являются, но не ограничиваются ими, ретровирусы, вирусы простого герпеса, аденовирусы, а предпочтительно, аденоассоциированные вирусы (AAV). В одном из вариантов осуществления изобретения, молекулу киРНК доставляют посредством клетко-специфического носителя киРНК, который содержит компоненты вируса и липосомы. В другом варианте осуществления изобретения, молекулы нуклеиновой кислоты согласно изобретению могут быть также приготовлены в виде препарата или в виде комплекса с полиэтиленимином и его производными, такими как производные полиэтиленимин-полиэтиленгликоль-N-ацетилгалактозамина (PEI-PEG-GAL) или полиэтиленимин-полиэтиленгликоль-три-N-ацетилгалактозамина (PEI-PEG-triGAL). Предпочтительными композициями согласно изобретению являются водные растворы, а в частности, физиологические растворы, такие как забуференный фосфатом физиологический раствор (PBS) с рН в интервале приблизительно от 7,0 до 7,4, а предпочтительно, с рН 7,2±0,5.
Молекула киРНК согласно изобретению может представлять собой комплекс с агентами, разрушающими мембрану, и/или с катионным липидом или липидной молекулой-хелпером.
Системы доставки, которые могут быть использованы в настоящем изобретении, включают, например, водные и безводные гели, кремы, множественные эмульсии, микроэмульсии, липосомы, мази, водные и безводные растворы, лосьоны, аэрозоли, углеводородные основы и порошки, и могут содержать наполнители, такие как солюбилизаторы, усилители проницаемости (например, жирные кислоты, сложные эфиры жирных кислот, жирные спирты и аминокислоты) и гидрофильные полимеры (например, поликарбофил и поливинилпирролидон). В одном из вариантов осуществления изобретения, фармацевтически приемлемый носитель представляет собой липосому или агент, стимулирующий трансдермальную доставку.
Фармацевтическую композицию согласно изобретению приготавливают в форме, подходящей для введения, например, для системного или местного введения в клетку или индивидууму, в том числе, человеку. Подходящие формы, в частности, зависят от применения или способа введения, например перорального введения, трансдермального введения или введения посредством инъекции. Специалистам известны и другие факторы, которые, в зависимости от конкретных ситуаций, включают такие факторы, как токсичность и формы, которые предохраняют композицию или препарат от воздействия токсического эффекта.
Настоящее изобретение также включает композиции, приготовленные для хранения или введения и содержащие фармацевтически эффективное количество нужных соединений в фармацевтически приемлемом носителе или разбавителе. Носители или разбавители, приемлемые для терапевтического применения, хорошо известны специалистам-фармацевтам. Так, например, могут быть введены консерванты, стабилизаторы, красители и отдушки. Такими агентами являются бензоат натрия, сорбиновая кислота и сложные эфиры п-гидроксибензойной кислоты. Кроме того, могут быть использованы антиоксиданты и суспендирующие агенты.
Фармацевтически эффективной дозой является доза, необходимая для предотвращения, подавления развития или лечения (облегчения симптомов, до некоторой степени, а предпочтительно всех симптомов) патологического состояния. Фармацевтически эффективная доза обычно зависит от типа заболевания, используемой композиции, способа введения, типа млекопитающего, подвергаемого лечению, физических свойств конкретного млекопитающего, одновременно проводимого медикаментозного лечения и других факторов, известных специалистам-медикам.
Терапевтически эффективное количество может также означать количество киРНК, достаточное для замедления или минимизации развития глазного заболевания, ассоциированного с неоваскуляризацией, предпочтительно, хориоидальной оболочки или сетчатки. Терапевтически эффективное количество может также означать количество терапевтического средства, которое обеспечивает терапевтический эффект при лечении или терапии глазного заболевания, ассоциированного с неоваскуляризацией, предпочтительно, хориоидальной оболочки или сетчатки. Кроме того, терапевтически эффективное количество киРНК согласно изобретению означает количество терапевтического средства, взятого отдельно или в комбинации с другими видами терапии, которое обеспечивает терапевтический эффект при лечении или терапии глазного заболевания, ассоциированного с неоваскуляризацией, предпочтительно, хориоидальной оболочки или сетчатки. Этот термин, если он используется в комбинации с количеством киРНК согласно изобретению, может охватывать количество, которое улучшает общий эффект терапии, снижает или устраняет нежелательные эффекты или повышает терапевтическую эффективность или синергический эффект с другим терапевтическим средством.
Терапевтическим эффектом при лечении или терапии глазного заболевания, ассоциированного с неоваскуляризацией, является устойчивое снижение степени неоваскуляризации. Принимая во внимание тот факт, что киРНК снижает уровни NRARP в клетке, то после прекращения лечения, клетка должна повторно синтезировать новые белки. Таким образом, способы лечения на основе киРНК будут давать более устойчивый эффект, чем способы, которые могут быть осуществлены с использованием небольших молекул, сконструированных для ингибирования NRARP или блокирования функции рецепторов VEGF или других белков, ассоциированных с неоваскуляризацией. Описанный способ рассматривается как способ, значительно повышающий терапевтическую эффективность.
Дополнительным преимуществом использования киРНК является минимальная вероятность побочных эффектов или токсичности, возникающих в результате ее присутствия в системном кровотоке, что часто происходит при проведении некоторых видов терапии с использованием глазных капель. Это связано с тем фактом, что при поступлении соединения в кровоток, оно будет быстро разлагаться под действием РНКаз, присутствующих в крови.
С другой стороны, тот факт, что молекула киРНК может быть продаваться во флаконах с разовой дозой, означает, что можно не добавлять в препарат антимикробных консервантов. Эти консерванты могут вызывать непереносимость препарата некоторыми пациентами, что приведет к необходимости прекратить лечение.
Одним из предпочтительных способв введения является местное введение, то есть, инстилляция непосредственно в глаза, предпочтительно, с использованием глазных капель. Принимая во внимание то, что подавляющее большинство апробированных в настоящее время лекарственных средств для лечения заболеваний сетчатки доставляется путем инъекции в стекловидное тело, то качество жизни пациентов, как и ожидается, также повысится, поскольку глазные капли вызывают незначительный дискомфорт и меньше побочных эффектов, чем инъекции в стекловидное тело.
Однако, как объяснялось выше, могут быть также применены и другие способы введения, отличающиеся от непосредственного введения в глаза. Точная дозировка и схема введения препарата, также зависят от способа введения. Специалисту в данной области очевидно, что точная дозировка и схема введения также зависят от тяжести расстройства и должны быть назначены лечащим врачом с учетом всех особенностей каждого пациента. Также следует отметить, что конкретный уровень дозы для любого конкретного индивидуума зависит от ряда факторов, включая активность конкретно используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, способ введения и скорость экскреции, комбинацию лекарственных средств и тяжесть конкретного заболевания, подвергаемого терапии.
Описанные здесь препараты или киРНК согласно изобретению могут быть введены в виде унифицированных доз, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и/или наполнители. Эти препараты могут быть приготовлены в форме, подходящей для перорального введения, например, в виде таблеток, пастилок, лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов, или эликсиров. Композиции, предназначенные для перорального применения, могут быть приготовлены любым методом, известным специалисту в области приготовления фармацевтических композиций, и такие композиции могут содержать один или более из таких агентов, как подсластители, отдушки, красители или консерванты для придания препаратам фармацевтически элегантного вида и приемлемых вкусовых качеств. Таблетки содержат активный ингредиент в смеси с нетоксическими фармацевтически приемлемыми наполнителями, подходящими для приготовления таблеток.
Такими наполнителями могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например, кукурузный крахмал или альгиновая кислота; связующие агенты, например крахмал, желатин или аравийская камедь; и лубриканты, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут не иметь покрытия, либо они могут быть покрытие, нанесенное известными методами. В некоторых случаях, такие покрытия могут быть получены известными методами в целях замедления дезинтеграции и всасывания в желудочно-кишечном тракте и, тем самым, для обеспечения пролонгированного действия в течение более длительного периода времени. Так, например, может быть использовано вещество для пролонгированного высвобождения, такое как глицерилмоностеарат или глицерилдистеарат.
Композиции для перорального применения могут быть также приготовлены в виде жестких желатиновых капсул, в которых активный ингредиент смешан с твердым инертным разбавителем, например, с карбонатом кальция, фосфатом кальция или каолином, либо в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или с масляной средой, например с арахисовым маслом, жидким вазелиновым маслом или оливковым маслом.
Водные суспензии содержат активные вещества в смеси с наполнителями, подходящими для приготовления водных суспензий. Такими наполнителями являются суспендирующие агенты, например, натрий-содержащая карбоксиметилцеллюлоза, метилцеллюлоза, гидропропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующими или смачивающими агентами могут быть природный фосфатид, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например, полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, происходящими от жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с неполными сложными эфирами, происходящими от жирных кислот и ангидридов гексита, например моноолеат полиэтиленсорбитана. Водные суспензии могут также содержать один или более консервантов, например, этил- или н-пропил-п-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза или сахарин.
Масляные суспензии могут быть приготовлены путем суспендирования активных ингредиентов в растительном масле, например, в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий вазелиновое масло. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители и вкусовые агенты могут быть добавлены для придания пероральным препаратам приятных вкусовых качеств. Эти композиции могут храниться благодаря добавлению антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии путем добавлением воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и с одним или более консервантами. Подходящими диспергирующими или смачивающими агентами или суспендирующими агентами являются агенты, которые уже упоминались выше. Могут также присутствовать и дополнительные наполнители, например, подсластители, отдушки и красители.
Фармацевтические композиции согласно изобретению могут быть также приготовлены в виде эмульсий типа «масло в воде». Масляной фазой может быть растительное масло или минеральное масло или их смеси. Подходящими эмульгирующими агентами могут быть природные камеди, например, аравийская камедь или трагакантовая камедь, природные фосфатиды, например, соевые бобы, лецитин и сложные эфиры или неполные сложные эфиры, происходящие от жирных кислот и гексита; ангидриды, например моноолеат сорбитана, и продукты конденсации указанных неполных сложных эфиров с этиленоксидом, например, моноолеат полиоксиэтиленсорбитана. Эмульсии могут также содержать подсластители и ароматизаторы.
Сиропы и эликсиры могут быть приготовлены вместе с подсластителями, например, с глицерином, пропиленгликолем, сорбитом, глюкозой или сахарозой. Такие препараты могут также содержать средство, уменьшающее раздражение, консервант, отдушку и краситель. Описанные здесь фармацевтические композиции или киРНК согласно изобретению могут быть приготовлены в форме стерильной инъецируемой водной или масляной суспензии.
Эту суспензию можно приготовить известными способами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше.
Стерильный препарат для инъекций также может представлять собой стерильный раствор для инъекций или суспензию в нетоксическом парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Приемлемыми носителями и растворителями, которые могут быть использованы, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные жирные масла. Для этой цели могут быть использованы любые мягкие жирные масла, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят свое применение для приготовления инъекций.
В предпочтительных вариантах осуществления изобретения, композиции согласно изобретению приготавливают в виде раствора, предпочтительно, в виде забуференного физиологического раствора, такого как PBS или гель для местного введения в глаза, например, в виде глазных капель. В таких вариантах осуществления изобретения, препаратами могут быть катионные эмульсии и/или препараты, содержащие биополимеры, включая, но не ограничиваясь ими, сополилимер лактида и гликолида, карбопол, гиалуроновую кислоту и полиакриловую кислоту.
Молекулы нуклеиновой кислоты согласно изобретению могут быть также введены в форме суппозиториев, например, для ректального введения лекарственного средства. Эти композиции могут быть приготовлены путем смешивания лекарственного средства с подходящим нераздражающим наполнителем, который является твердым при обычной температуре, но жидким при температуре прямой кишки, то есть, где он расплавляется с высвобождением лекарственного средства. Такими веществами являются масло какао и полиэтиленгликоли.
Молекулы нуклеиновой кислоты согласно изобретению могут быть введены парентерально в стерильной среде. Такое лекарственное средство, в зависимости от используемого носителя и концентрации, может быть суспендировано или растворено в носителе. Предпочтительно, адъюванты, такие как местные анестетики, консерванты и забуферивающие агенты могут быть растворены в носителе.
Таким образом, еще один предпочтительный вариант осуществления изобретения относится к фармацевтической композиции, где указанная композиция содержит по меньшей мере киРНК, нацеленную по меньшей мере на одну последовательность, выбранную из группы, состоящей из SEQ ID NO. 1 - SEQ ID NO. 9, как было описано в предыдущих параграфах. Более предпочтительно, указанной последовательностью является SEQ ID NO. 1.
Молекулы нуклеиновой кислоты согласно изобретению могут быть также введены индивидууму в комбинации с другими терапевтическими соединениями для повышения общего терапевтического эффекта. Использование нескольких соединений для лечения заболеваний может повышать благоприятные эффекты и снижать вероятность появления побочных эффектов.
Для лучшего понимания настоящего изобретения приводятся нижеследующие определения.
Под понятием «лечение» заявители подразумевают медикаментозное лечение. Этот термин включает введение соединения согласно изобретению для ослабления симптомов заболевания сетчатки, таких как снижение остроты зрения, которое сопровождается дегенерацией желтого пятна, а также для устранения физиологических изменений, ассоциированных с таким заболеванием, а именно, аномального роста кровеносных сосудов, которое обычно наблюдается при таком заболевании.
Термин «заболевание сетчатки» означает любое заболевание, при котором сетчатка поражается заболеваниями различной этиологии и их вариантами.
Термин «васкуляризация» означает процесс образования функциональных микрососудистых сетей с перфузией эритроцитов.
Термин «ангиогенез» означает выступание и разрастание капиллярных почек и отростков из уже существующих кровеносных сосудов.
Термин «неоваскуляризация сетчатки (НВС)» означает рост новых сосудов в сетчатке.
Термин «хориоидальная неоваскуляризация (ХНВ)» означает рост новых сосудов из хориоидальной сосудистой сети.
Термин «заболевание или расстройство, ассоциированное с неоваскуляризацией» относится к любому заболеванию или расстройству, при котором образуются указанные выше патологические новые сосуды. Такими заболеваниями или расстройствами могут быть, но не ограничиваются ими, возрастная дегенерация желтого пятна (ВДЖП), ишемическая ретинопатия, диабетический отек желтого пятна (ДОЖП), пролиферативная диабетическая ретинопатия (ПДР), диабетическая ишемия сетчатки (ДИС), диабетический отек сетчатки (ДОС), неоваскуляризация, приводящая к близорукости, окклюзия центральной вены сетчатки (ОЦВС) и ретинопатия недоношенных (РНД) и т.п. Другими глазными заболеваниями или расстройствами, ассоциированными с неоваскуляризацией, являются, например, неоваскуляризация радужки (покраснение радужной оболочки) и неоваскуляризация роговицы (НР). Неоваскуляризация радужки часто ассоциируется с диабетом, ретинобластомой, окклюзией центральной вены сетчатки, глазным ишемическим синдромом или хроническим отслоением сетчатки. Неоваскуляризация роговицы часто вызывается ношением контактных линз, хотя она может также связана с воспалением в результате травмы или повреждения, а также с блефаритом, увеитом, или кератитом, язвой роговицы, глаукомой и другими заболеваниями глазной поверхности, такими как розацея или волчанка.
Дегенерация желтого пятна, также называемая возрастной дегенерацией желтого пятна (ВДЖП), является наиболее распространенной причиной потери зрения в Соединенных Штатах у людей в возрасте 50 лет или старше, и ее распространенность увеличивается с возрастом. Основной причиной, вызывающей ВДЖП, вероятно, является аккумуляция остаточного материала, продуцируемого в процессе обновления внешней части фоторецепторов сетчатки в пигментном эпителии сетчатки (ПЭС). Аккумуляция этого неразлагаемого материала, известного как друзы в ПЭС, приводит к продуцированию медиаторов воспаления, вызывающих дегенерацию фоторецепторов в центральной сетчатке или в желтом пятне (Bird AC, 2010). Центр желтого пятна, называемый ямкой, ответственен за высокую остроту зрения, а поэтому, ее дегенерация приводит к серьезной потере зрения. На ранних стадиях этого заболевания, аккумуляция друз является небольшой и часто наблюдаются вместе с гипо- или гиперпигментацией ПЭС. По мере прогрессирования заболевания, размер и количество друз увеличиваются. ВДЖП классифицируется как мокрая (неоваскулярная) или сухая (не-неоваскулярная). Сухая форма заболевания является наиболее распространенной. Она встречается в том случае, когда центральная сетчатка разрывается, пигментируется или чаще всего утончается, то есть, в процессе, ассоциированном с атрофией пигментного эпителия сетчатки и потерей фоторецепторов желтого пятна. В результате развивается центральная региональная атрофия. Мокрая форма этого заболевания является более тяжелой, чем сухая форма, и приводит к серьезной потере зрения. Мокрая форма, как правило, связана со старением, но, при этом, существуют и другие заболевания, которые могут вызвать мокрую дегенерацию желтого пятна, включая сильную близорукость и некоторые внутриглазные инфекции, такие как гистоплазмоз, которые могут обостряться у больных СПИД'ом. Мокрая форма характеризуется аномальным ростом кровеносных сосудов, проходящих через пигментный эпителий сетчатки, что приводит к кровоизлиянию, экссудации, рубцеванию или отслоению сетчатки.
Ишемическая ретинопатия является общим компонентом в патогенезе при ХНВ и НВС. Ишемия вызывает клеточную гипоксию, которая активирует пути передачи клеточных сигналов и усиливает экспрессию стимуляторов ангиогенеза, таких как васкулярный эндотелиальный фактор роста (VEGF). VEGF представляет собой секретируемый гликопротеин с сильной про-ангиогенной активностью. VEGF связывается с рецепторами VEGF (VEGFR) на эндотелиальных клетках, что приводит к стимуляции пролиферации и миграции клеток. Многочисленные исследования показали, что VEGF активируется в процессе патогенеза ХНВ и НВС, и что VEGF является ключевым медиатором патогенеза ХНВ и НВС.
Диабетическая ретинопатия (ДР) остается главной причиной слепоты среди лиц трудоспособного возраста в развитых странах. Пролиферативная диабетическая ретинопатия (ПДР) является самым распространенным поражением, угрожающим потерей зрения при диабете типа 1, а диабетический отек желтого пятна (ДОЖП) является основной причиной низкой остроты зрения у больных диабетом типа 2. Из-за высокой распространенности диабета типа 2, ДОЖП является главной причиной нарушения зрения у пациентов с диабетом. Исследования, проводимые с участием большой группы населения, показали, что заболеваемость ДОЖП в течение 10 лет наблюдалась у 20% пациентов с диабетом типа 1, в то время как этот показатель составлял почти 40% у пациентов с диабетом типа 2. Кроме того, ДОЖП почти всегда присутствует у пациентов с диабетом типа 2, у которых наблюдалась ПДР. Неоваскуляризация, вызываемая тяжелой гипоксией, является основным признаком ПДР, а утечка сосудов, вызываемая ослаблением ГРБ, представляет собой основное событие, участвующее в патогенезе ДОЖП.
Ретинопатия недоношенных (РН) наблюдается у недоношенных детей, которые подвергались воздействию относительной гипероксии до завершения ангиогенной фазы развития сетчатки. Это создает определенную проблему, поскольку ангиогенная фаза развития сетчатки, как правило, обусловлена гипоксией в матке. Таким образом, нормальное ангиогенное развитие сетчатки нарушается при РН, что приводит к облитерации сосудов и к образованию в значительной степени не-васкулярной сетчатки. В отсутствии достаточного кровоснабжения, не-васкулярная сетчатка становится ишемической, что способствует развитию деструктивной НВС и может приводить к отслоению сетчатки и образованию рубцовой ткани и, тем самым, к перманентной потере зрения.
Используемый здесь термин «пациент» относится к животным, включая млекопитающих, а предпочтительно человека.
Настоящее изобретение более подробно описано в нижеследующих неограничивающих примерах.
ПРИМЕРЫ
1. Анализ in vitro
1.1. Уровни экспрессии генов NRARP после трансфекции SEQ ID NO. 10, SEQ ID NO: 11, SEQ ID NO. 12 и SEQ ID NO. 13
Человеческие клетки HeLa трансфецировали 100 нМ одной из затупленных по концам дцРНК размером в 19 п.н., состоящей из смысловой цепи, состоящей из одной из нижеследующих последовательностей SEQ ID NO. 10 (SYL136001), SEQ ID NO. 11 (SYL136005), SEQ ID NO. 12 (SYL136003) и SEQ ID NO. 13 (SYL136004), вместе с комплементарной антисмысловой цепью, с использованием липофектамина 2000 в качестве трансфецирующего агента. Обозначение SYL после каждой SEQ ID NO. означает эталонное соединение дцРНК. Следует отметить, что во всех этих примерах (если из контекста описания не следует обратное), где упоминается введение или трансфекция конкретной SEQ ID NO, это указывает на то, что была введена или трансфецирована дцРНК в 19 п.н., состоящая из смысловой цепи, состоящей из SEQ ID NO, и комплементарной антисмысловой цепи, как показано на фигурах 2 и 3. Все трансфекцим осуществляли в соответствии со стандартными инструкциями производителей. В этом же самом эксперименте, неспецифическую последовательность киРНК использовали в качестве контроля специфичности интерференции. Клеточный осадок собирали и обрабатывали для оценки возможных изменений уровней мРНК как следствие механизма действия киРНК. Уровни РНК были количественно определены с помощью ПЦР в реальном времени с применением методом относительной количественной оценки, то есть, методом определения сравнительного порога 2-ΔΔCT. {Livak & Schmittgen, 2001}. Все эксперименты, проведенные с помощью количественной ПЦР в реальном времени, были осуществлены с тремя повторностями, а затем были повторно осуществлены в трех независимых экспериментах. Затем вычисляли среднее и ср.кв.откл., и эти данные были представлены на чертежах. Как показано на фигуре 4, уровни мРНК NRARP значительно снижались (на 50-60%) в человеческих клетках HeLa в ответ на трансфекцию SEQ ID NO. 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13 в три исследуемых момента времени. Как и следовало ожидать, неспецифическая последовательность киРНК не модулировала уровни экспрессии NRARP в любом из исследуемых моментов времени.
1.2. Жизнеспособность клеток человеческих клеточных линий после трансфекции киРНК согласно изобретению
Для анализа жизнеспособности клеток после трансфекции киРНК согласно изобретению, токсичность in vitro оценивали после трансфекции 100 нМ одной из следующих последовательностей: SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 и SEQ ID NO. 13 с использованием липофектамина 2000 в качестве трансфецирующего агента в человеческих клетках HeLa. Все трансфекции осуществляли в соответствии со стандартными инструкциями производителя. В этом же самом эксперименте, неспецифическую последовательность киРНК использовали в качестве контроля специфичности интерференции. Клеточный осадок собирали через 24, 48 и 72 часа после трансфекции и обрабатывали для оценки возможных изменений жизнеспособности клеток. Жизнеспособность клеток оценивали с помощью анализа на пролиферацию водных не-радиоактивных клеток CellTiter 96® от Promega. Этот метод основан на способности живых клеток восстанавливать MTS-тетразолий до формазана. Количество формазана оценивали путем измерения оптической плотности на длине волны 490 нм. Затем вычисляли среднее и ср. кв.откл., и по полученным данным строили график, приведенный на фигуре 5. На фигуре 5 показано отсутствие каких-либо изменений жизнеспособности клеток в ответ на трансфекцию любой из следующих последовательностей: SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 и SEQ ID NO. 13. В результате было обнаружено, что киРНК согласно изобретению являются нетоксичными и хорошо переносятся пациентом.
1.3. Уровни экспрессии NRARP после трансфекции немодифицированной и химически модифицированной киРНК согласно изобретению в различных клеточных линиях
Для повышения стабильности киРНК согласно изобретению и для гарантии отсутствия иммуногенной активации, различные киРНК- оптимизированные химические модификации были введены в каноническую последовательность SEQ ID NO. 10 (SYL136001); и таким образом были получены нижеследующие новые химически модифицированные молекулы: SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39. Новые химически модифицированные последовательности были отдельно трансфецированы в человеческие, мышиные и крысиные клетки для анализа их способности к снижению уровней мРНК NRARP. Химические модификации подробно описаны на фигуре 3. Человеческие клетки HeLa, человеческие клетки BEAS-2B и мышиные клетки С2С12 были выбраны потому, что эти клетки экспрессировали высокие уровни NRARP и считаются хорошими моделями для изучения влияния киРНК на экспрессию NRARP. Клетки отдельно трансфецировали 100 нМ одной из следующих последовательностей: SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 с использованием липофектамина (клетки HeLa), Mirus Transit-X2 (BEAS-2B), Dharmarfect 3 (C2C12) и siPORT NeoFX (ARL6) в качестве трансфицирующих агентов. Экспрессию гена анализировали в три определенных момента времени (через 24, 48 и 72 часа) после трансфекции. Все трансфекции осуществляли в соответствии со стандартными инструкциями производителя. В этом же самом эксперименте, неспецифическую последовательность киРНК использовали в качестве контроля специфичности интерференции. Уровни РНК количественно определяли с помощью ПЦР в реальном времени с применением метода относительной количественной оценки, то есть, метода определения сравнительного порога 2-ΔΔCT{Livak & Schmittgen, 2001}. Все эксперименты, проведенные с помощью количественной ПЦР в реальном времени, осуществляли с тремя повторностями, и были повторно проведены в трех независимых экспериментах. Затем вычисляли среднее и ср.кв.откл., и эти данные представлены на графиках фигур 6-9. На фигуре 6 показаны результаты, полученные для клеток HeLa. В этой клеточной линии, SEQ ID NO. 10 (SYL136001) снижала уровни мРНК NRARP на 60% через 24 часа после трансфекции и на 50% через 48 часов и 72 часа после трансфекции. Химически модифицированная SEQ ID NO. 19 снижала уровни мРНК NRARP на 60% через 24 часа после трансфекции и на 40% через 48 часов после трансфекции, причем через 72 часа после трансфекции базальные уровни были полностью восстановливались. SEQ ID NO. 23 снижала уровни мРНК NRARP на 40% через 24-48 часов после трансфекции и на 10% через 72 часа после трансфекции. SEQ ID NO. 25 снижала уровни мРНК NRARP на 50-60% через 24-48 часов после трансфекции и на 20% через 72 часа после трансфекции. SEQ ID NO. 27 снижала уровни мРНК NRARP на 30% через 24-48 часов после трансфекции, и базальные уровни восстановливались через 72 часа после трансфекции. SEQ ID NO. 29 очень эффективно снижала уровни мРНК NRARP. Снижение приблизительно на 80% наблюдалось через 24-48 часов после трансфекции в ответ на эту последовательность, а затем уровни мРНК повышались, но все же были на 40% ниже базальных уровней через 72 часа после трансфекции. SEQ ID NO. 31 эффективно снижала уровни NRARP, при этом наблюдалось снижение на 60% по сравнению с базальными уровнями, наблюдаемыми в трех исследуемых моментах времени. SEQ ID NO. 35 снижала уровни мРНК NRARP на 60% через 24-48 часов после трансфекции; причем резкое восстановление уровней мРНК было обнаружено через 72 часа после трансфекции, и таким образом, уровни мРНК NRARP были на 10% ниже базальных уровней. SEQ ID NO. 37 представляет собой соединение, которое вызывает наибольшее снижение уровней мРНК NRARP. Снижение на 90%, 80% и 70% наблюдалось через 24, 48 и 72 часа после трансфекции этого соединения. SEQ ID NO. 39 снижала уровни мРНК NRARP на 70% через 24 часа после трансфекции и на 50% через 48 часов после трансфекции, после чего уровни мРНК резко увеличивались, но базальные уровни полностью не восстановливались через 72 часа после трансфекции. На фигуре 7 показаны результаты, полученные для человеческих клеток BEAS-2B. В этой клеточной линии, SEQ ID NO. 10 (SYL136001) и SEQ ID NO. 19 снижали уровни NRARP на 70% через 24 часа после трансфекции, после чего уровни мРНК медленно увеличивалась, но базальные уровни полностью не восстановливались в эти исследуемые интервалы времени, причем, уровни мРНК NRARP были на 50% ниже базальных уровней через 48 часов после трансфекции и на 40%-50% через 72 часа после трансфекции. SEQ ID NO. 23 и SEQ ID NO. 27 слегка снижали уровни мРНК NRARP в человеческих клетках BEAS-2B, причем, такое снижение составило приблизительно 20-30% в три исследуемых момента времени; и базальные уровни полностью не восстановливались через 72 часа после трансфекции. SEQ ID NO. 25 и SEQ ID NO. 39 постепенно и в зависимости от времени снижали уровни мРНК NRARP, причем максимальное снижение составляло 50%-60% через 72 часа после трансфекции. SEQ ID NO. 31 и SEQ ID NO. 35 эффективно снижали уровни мРНК NRARP; причем уровни мРНК были приблизительно на 60-70% ниже базальных уровней в ответ на любые соединения в три исследуемых момента времени. SEQ ID NO. 29 и SEQ ID NO. 37 представляли собой наиболее эффективные продукты, снижающие уровни мРНК NRARP в этой клеточной линии, в результате чего наблюдалось резко и устойчивое снижение приблизительно на 80% и 90%, соответственно, в три исследуемых момента времени. Как и ожидалось, неспецифическая последовательность киРНК не снижала уровни экспрессии NRARP в любые исследуемые моменты времени. На фигуре 8 показаны результаты, полученные для мышиных клеток С2С12. SEQ ID NO. 10 (SYL136001) снижала уровни мРНК NRARP 60% через 24 часа после трансфекции, после чего уровни мРНК медленно повышались, но базальные уровни полностью не восстановливались через 72 часа после трансфекции, причем в этот момент времени уровни мРНК NARP были еще на 40% ниже базальных уровней. SEQ ID NO. 19 снижала уровни мРНК NRARP приблизительно на 30% через 24 часа после трансфекции, при этом, резкое сокращение на 80% наблюдалось через 48 часов после трансфекции, а затем уровни повышались, но через 72 часа после трансфекции, уровни мРНК NARP были еще на 40% ниже базальных уровней. SEQ ID NO. 23, SEQ ID NO. 25 и SEQ ID NO. 27 слегка снижали уровни мРНК NRARP, причем такое снижение, наблюдаемое в ответ на трансфекцию каждой из этих последовательностей, составляло приблизительно 20-40% в три исследуемых момента времени. SEQ ID NO. 29 и SEQ ID NO. 39 эффективно снижали уровни мРНК NRARP через 24 и 48 часов после трансфекции, причем, уровни в эти моменты времени были на 50% и 60% ниже базальных уровней, соответственно. Ответом на обе последовательности через 72 часа после трансфекции было увеличение уровней по сравнению с уровнями в предыдущие моменты времени, хотя базальные уровни в этот момент времени не восстановливались. SEQ ID NO. 31 снижала уровни мРНК NRARP приблизительно на 40% через 24 часа после трансфекции, причем, такое значительное снижение на 70% наблюдалось через 48 часов после трансфекции, а затем уровни повышались, но через 72 часа после трансфекции уровни мРНК NRARP были еще на 40% ниже базальных. SEQ ID NO. 35 и SEQ ID NO. 37 представляют собой соединения, которые вызывали наибольшее снижение уровней мРНК NRARP в этой клеточной линии, причем, SEQ ID NO. 35 и SEQ ID NO. 37 снижали уровни мРНК NRARP на 60% через 24 часа после трансфекции и приблизительно на 80% через 48 часов после трансфекции. Частичное восстановление базальных уровней наблюдалось через 72 часа после трансфекции. И в этом случае, как и ожидалось, неспецифическая последовательность киРНК не снижала уровни мРНК NRARP в любые исследуемые моменты времени в клетках С2С12. На фигуре 9 показаны результаты, полученные для крысиных клеток ARL6. SEQ ID NO. 10 (SYL136001) снижала уровни мРНК NRARP на 50% через 24-48 часов после трансфекции и на 60% через 72 часа после трансфекции. SEQ ID NO. 37 снижала уровни NRARP на 50% через 24 часа после трансфекции, на 60% через 48 часов после трансфекции и на 70% через 72 часа после трансфекции.
1.4. Жизнеспособность клеток человеческих клеточных линий после трансфекции немодифицированными киРНК и химически модифицированными киРНК согласно изобретению в различных клеточных линиях
Для анализа жизнеспособности клеток после трансфекции киРНК согласно изобретению, токсичность in vitro оценивали после трансфекции 100 нМ одной из следующих последовательностей: SEQ ID NO. 10 (SYL13600), SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 в человеческих клетках HeLa и BEAS-2B и в мышиных клетках С2С12 с использованием липофектамина 2000, Mirus Transit-X2, Dharmarfect 3 в качестве трансфецирующих агентов, соответственно. Все трансфекции осуществляли в соответствии со стандартными инструкциями производителя. В том же самом эксперименте, неспецифическую последовательность киРНК использовали в качестве контроля специфичности интерференции. Клеточный осадок собирали через 24, 48 и 72 часа после трансфекции и обрабатывали для оценки возможных изменений жизнеспособности клеток после трансфекции киРНК. Жизнеспособность клеток оценивали с помощью анализа на пролиферацию водных не-радиоактивных клеток CellTiter 96® от Promega. Этот метод основан на способности живых клеток восстанавливать MTS-тетразолиевое соединение до формазана, который оценивали путем измерения оптической плотности на длине волны 490 нм. Затем вычисляли среднее и ср. кв.откл. для каждого эксперимента, и по полученным данным строили график, приведенный на фигурах 10-12. На фигурах 10, 11 и 12 показано отсутствие каких-либо изменений жизнеспособности клеток в ответ на трансфекцию любой из следующих последовательностей: SEQ ID NO. 10 (SYL13600), SEQ ID NO. 19, SEQ ID NO. 23, SEQ ID NO. 25, SEQ ID NO. 27, SEQ ID NO. 29, SEQ ID NO. 31, SEQ ID NO. 35, SEQ ID NO. 37 и SEQ ID NO. 39 в любых используемых клеточных линиях. Кроме того, уровни жизнеспособности клеток также оценивали в крысиных клетках ARL6 в ответ на трансфекцию одной из следующих последовательностей: SEQ ID NO. 10 (SYL136001) и SEQ ID NO. 37 с использованием SIPORT NeoFX в качестве трансфецирующего агента. На фигуре 13 продемонстрировано отсутствие каких-либо значимых изменений жизнеспособности клеток ARL6 в ответ на любые тестируемые последовательности. Таким образом, можно сделать вывод, что все киРНК согласно изобретению является нетоксичными и хорошо переносимыми пациентом.
1.5. Влияние киРНК согласно изобретению на ангиогенез у in vitro-модели клеток HUVEC
Для исследования влияния киРНК согласно изобретению на ангиогенез были проведены эксперименты на клетках HUVEC и анализ экспрессии NRARP в этих клетках.
В частности, целью этой серии исследований является изучение антиангиогенного эффекта модифицированной NRARP киРНК SEQ ID NO. 37 (затупленной по концам и химически модифицированной дцРНК в 19 п.н., имеющий смысловую цепь, состоящую из последовательности SEQ ID NO. 37, и комплементарную антисмысловую цепь, состоящую из последовательности SEQ ID NO. 38) in vitro-модели клеток HUVEC.
1.5.1. Введение
Ангиогенез представляет собой образование новых вен из уже существующих. Этот процесс, главным образом, во время развития и ряда других физиологических процессов в глазах может быть нарушен, что приводит к развитию заболеваний сетчатки различных типов, таких как возрастная дегенерация желтого пятна (ВДЖП) и диабетическая ретинопатия (ДР). Человеческие эндотелиальные клетки пупочной вены (HUVEC) являются первичными клетками, которые были сохранены после 1-3 пассажей из исходного материала источника. Эти клетки могут быть индуцированы с образованием трубчатых структур в ответ на ангиогенные агенты, такие как VEGF.
1.5.2. Материалы
Обратная транскриптаза, Multiscribe 50 ед./мл (Applied Biosystems P/N 4311235).
Ингибитор РНКазы 20ϋ ед./мкл (Applied Biosystems P/N N8080119).
Универсальная смесь TaqMan 2X Master Mix.
Микронабор Qiagen»RNeasy © MicroKit 74004.
Зонд для детектирования человеческого Nrarp: Анализ на экспрессию гена Taqman Hs01104102_sl.
Эндогенный контроль GAPDH: Анализ на экспрессию гена Taqman Hs00266705_gl.
Зонд для детектирования крысиного Nrarp: Анализ на экспрессию гена Taqman Rn 03810258_sl
Эндогенный контроль 18S: Анализ на экспрессию гена Taqman Taqman Hs99999901_sl.
1.5.3. Методы
i) Клетки
Клетки HUVEC (рег. №: CC-2519/номер партии: 000191772) были получены от Lonza. Все эксперименты проводили с одной и той же партией клеток при 6-9 пассажах и плотности клеточных культур 75-85%. Трансфекции осуществляли с использованием SIPORT NeoFX™ в соответствии со стандартной процедурой. Для электропорации проводили процедуру, описанную в публикации «Hernandez JL et al., 2004. Angiogenesis. 7:235-241», где, вкратце, 1×106 клеток подвергали электропорации путем подачи 20 мс-импульса при 1200 мкФ с использованием ячейки манипулятора® 600 (BTX). Каждую электропорацию проводили с использованием 2 мкг генетического материала.
Для исследования эффективности, клетки трансфецировали в соответствии с протоколом электропорации и оставляли для восстановления на 24 часа, а затем клетки высевали в 96-луночные планшеты при плотности 30000 клеток/лунку, и вышеупомянутые параметры анализировали через 6 часов после посева. После анализа структуры клетки, среду и матригель переносили в пробирку, не содержащую РНКазы, и добавляли 600 мкл буфера RLT+β-меркаптоэтанол.
ii) Анализ экспрессии гена-мишени
(1) Выделение и ретротранскрипция РНК
Общую РНК выделяли из клеточных культур с использованием набора для экстракции РНК RNeasy (Invitrogen, CA, USA). 4 мкг общей РНК подвергали ретротранскрипции с использованием набора для архивирования кДНК высокой плотности (Applied Biosystems, Inc., Foster City, CA, USA) в соответствии с инструкциями производителя.
(2) кол.ПЦР
кол.ПЦР проводили с использованием системы детектирования StepOne Plus (Applied Biosystems). 50 нанограммов каждого образца амплифицировали в универсальной смеси TaqMan 2× Master Mix в следующих условиях: 95°С в течение 10 минут, а затем 40 циклов при 95°С в течение 15 секунд и 60°С в течение 1 минуты.
1.5.4. Результаты
Учитывая успешные результаты электропорации, проводимой для введения киРНК в клетки HUVEC, этот метод был применен в последующих исследованиях, в которых оценивали роль модифицированной киРНК NRARP SEQ ID NO. 37 в формировании капиллярных структур на матригеле, в миграции, в заживлении ран и в анализах на пролиферацию.
i) Формирование капиллярных структур
(1) План проведения анализа
15000 клеток/лунку, истощенных за период времени 4 часа, высевали на 96-луночный планшет, покрытый матригелем. Эндотелиальные клетки базальной среды (ЕВМ) без добавок использовали в качестве негативного контроля (без образования структур), тогда как полную среду с добавками (hEGF, гидрокортизон, бычий экстракт головного мозга, гентамицин, гепарин) и 10% FCS использовали в качестве позитивного контроля, индуцирующего максимальное число трубчатых структур. Анализы проводили с тремя повторностями в 3-6 независимых экспериментах. Культуры были проанализированы через 24 часа после посева.
Кроме того, был разработан новый метод анализа структур. Этот метод основан на количественной оценке 5 параметров с использованием компьютерной программы для анализа ангиогенеза, разработанной Gilles Carpentier для NIH ImageJ. Эта компьютерная программа позволяет осуществлять полный просмотр всего процесса ангиогенеза. Исследуемые параметры представлены на фигуре 17.
На фигуре 18 показано изменение исследуемых параметров в ответ на полную среду (добавки+10% FCS). Как показано на этой фигуре, полная среда способствует значительному увеличению числа образованных структур без изменения их общей площади.
(2) Эффективность киРНК SEQ ID NO. 37
Клетки трансфецировали путем электропорации и оставляли для восстановления в полной среде в течение 24 часов, а затем оставляли еще на 2 часа для удаления сыворотки, после чего клетки высевали при плотности 30000 клеток/лунку на 96-луночные покрытые матригелем планшеты для обеспечения образования структур. Образованные структуры анализировали через 6 часов и 24 часа после посева. Для оценки эффективности SEQ ID NO. 37 проводили анализы в следующих условиях:
- Нетрансфецированные клетки
- Клетки, подвергнутые ложной электропорации
- Клетка, трансфецированные 1 мкМ киРНК против KDR (Life Technologies, Ref: 145034)
- Клетки, трансфецированные 1 мкМ киРНК SEQ ID NO: 37.
Все условия были проанализированы в среде без добавок и в среде с добавлением 10% FCS и 100 нг/мл VEGF.
Первый анализ проводили на клетках, которые были истощены в бессывороточной среде за 2 часа до посева клеток на матригель. Эта процедура приводила к небольшой дестабилизации структур, а поэтому ее повторяли без стадии истощения. Результаты последнего исследования показаны на фигурах 19 и 20.
В итоге, электропорация значительно влияла на функцию клеток, а поэтому были проведены сравнения между состоянием клеток при ложной электропорации и клеток в экспериментальных условиях. В отсутствии добавок, киРНК-KDR и киРНК-NRARP SEQ ID NO. 37 снижали уровни образования ангиогенных структур, причем эффект киРНК-KDR был выше, чем эффект киРНК SEQ ID NO. 37. Ингибирующее действие обеих киРНК на образование ангиогенных структур было более заметным в присутствии полной среды с добавками на момент времени 6 часов, и это может быть обысловлено тем, что удаление сыворотки и добавок из клеток может снижать жизнеспособность клеток. Анализ, проведенный через 24 часа после посева клеток на матригель, не дал убедительных результатов, поскольку структуры уже начали разрушаться.
ii) Влияние на пролиферацию
(1) Планирвание анализа
Истощенные через 24 часа клетки высевали в 96-луночные планшеты при плотности 3000 клеток/лунку и культивировали в различных условиях. Через пять дней оценивали пролиферацию с помощью МТТ-анализа. Были использованы следующие условия: 2% FCS, и различные концентрации VEGF (20-30-50 нг/мл). 2% FCS необходим для поддержания базального уровня пролиферации клеток и предотвращения остановки клеточного цикла культуры. На фигуре 21A показано 3-кратное индуцирование пролиферации клеток в ответ на VEGF, независимо от тестируемой концентрации. Для анализа ингибирующего эффекта анти-VEGF агента, эти клетки культивировали в присутствии 30 нг/мл VEGF и с уменьшающимися концентрациями (разведения 1:2, начиная с 12 нМ) бевацизумаба (Авастина) для определения IC50. Как показано на фигуре 21B, IC50 бевацизумаба составляла 0,85 нМ.
(2) Эффективность киРНК SEQ ID NO. 37
Клетки подвергали электропорации и высевали при плотности 5000 клеток/лунку в 96-луночный планшет, покрытый 1% желатином, после чего клетки оставляли на 24 часа для восстановления. После восстановления клеток, их культивировали в базальной среде с добавлением 10% FCS и 100 нг/мл VEGF. Через три дня после посева, пролиферацию клеток анализировали с помощью МТТ. Анализ проводили в следующих условиях:
- Нетрансфецированные клетки
- Клетки, подвергнутые ложной электропорации
- Клетка, трансфецированные 1 мкМ киРНК против KDR (Life Technologies, Ref: 145034)
- Клетки, трансфецированные 1 мкМ киРНК SEQ ID NO: 37.
Результаты, представленные на фигуре 22, показали, что киРНК против KDR и киРНК SEQ ID NO. 37 уменьшали скорость пролиферации, индуцируемой VEGF, приблизительно на 40% по сравнению с клетками, подвергнутыми ложной электропорации.
iii) Влияние на миграцию
(1) Планирование анализа
Эти исследования проводили в 24-луночных планшетах системы Transwell с непрозрачными мембранными 8 мкм-фильтрами (Transwell HTS FluroBlok™ Multiwell Insert System de Becton Dickinson). Обе поверхности мембраны покрывали коллагеном типа I в концентрации 15 мкг/мл в течение 2 часов при 37°C для облегчения поглощения клетками. Клетки высевали при плотности 50000 клеток/лунку, после чего их оставляли на 4 часа для удаления сыворотки, а затем добавляли стимулятор миграции. Через 24 часа после добавления этого стимулятора на нижнюю часть лунок Transwell, число клеток, которые мигрировали в верхнее отделение, анализировали после окрашивания кальцеином-AM.
Число мигрировавших клеток в полной среде (10% FCS и добавки) использовали в качестве позитивного контроля клеточной миграции, и этот ответ сравнивали с ответом, наблюдаемым при увеличении концентраций VEGF (1-10-100 нг/мл).
Как показано на фигуре 23, VEGF индуцирует дозозависимое увеличение числа клеток, мигрирующих в верхнее отделение. Максимальное увеличение ответа на VEGF наблюдалось в ответ на наибольшую концентрацию VEGF (100 нг/мл), а величина ответа была приблизительно в 5-6 раз выше по сравнению с ответом в базальных условиях.
(2) Эффективность киРНК SEQ ID NO. 37
Клетки подвергали электропорации и оставляли для восстановления на 24 часа, после чего клетки высевали при плотности 10000 клеток/лунку на 96-луночные планшеты системы Transwell с непрозрачными мембранными 8 мкм-фильтрами, покрытыми 15 мкг/мл коллагена. Все тестируемые условия анализировали в присутствии базальной среды и полной среды (с добавлением 10% FCS и 100 нг/мл VEGF). После посева и окрашивания клеток кальцеином-AM проводили анализ на миграцию в течение 24 часов в нижеследующих условиях испытания:
- Нетрансфецированные клетки
- Клетки, подвергнутые ложной электропорации
- Клетка, трансфецированные 1 мкМ киРНК против KDR (Life Technologies, Ref: 145034)
- Клетки, трансфецированные 1 мкМ киРНК SEQ ID NO: 37.
Полученные результаты показали, что электропорация оказывает негативное воздействие на способность клеток к миграции, а поэтому, обработанные клетки сравнивали с клетками, подвергнутыми ложной электропорации, для устранения эффекта электропорации. Клетки в базальной среде не мигрировали, а присутствие 10% FCS и 100 нг/мл VEGF стимулировало миграцию клеток к противоположной лунке в системе Transwell. Эффект 10% FCS и 100 нг/мл VEGF был частично блокирован (на 30%) путем электропорации либо киРНК SEQ ID NO. 37, либо анти-KDR киРНК (фигуры 24 и 25).
iv) Исследования по заживлению ран
(1) Планирование анализа
Клетки высевали при плотности 50000 клеток/лунку в 96-луночные планшеты, покрытые 1% желатином, и культивировали в базальной среде в течение 24 часов. После этого инициировали поражение путем соскабливания узкой области культуры и в эту культуру добавляли 10 нг/мл VEGF. Сразу после поражения и через 24 часа после поражения измеряли их площади и сравнивали с помощью компьютерной программы NIH ImageJ. Процент площади заживления количественно оценивали следующим образом:
Заживление ран (%)=Конечная площадь/начальная площадь × 100
Как показано на фигуре 26, 10 нг/мл VEGF индуцировало 2,5-кратное увеличение скорости заживления ран по сравнению с необработанным контролем.
(2) Эффективность киРНК SEQ ID NO. 37
Клетки подвергали электропорации и оставляли на 24 часа для восстановления, после чего клетки высевали при плотности 70000 клеток/лунку в 96-луночные планшеты, покрытые 1% желатином. Через 24 часа после посева инициировали поражения путем соскабливания узкой области клеток, и культуры анализировали через 16 часов после индуцирования поражения. Анализ проводили путем окрашивания клеток 10 мкМ кальцеина-AM и оценки соскобленных площадей для определения процента площади, которая снова была покрыта клетками. Все условия испытания анализировали в присутствии базальной среды и полной среды (с добавлением 10% FCS и 100 нг/мл VEGF). Через 24 часа после посева анализировали миграцию в следующих условиях испытания:
- Нетрансфецированные клетки
- Клетки, подвергнутые ложной электропорации
- Клетка, трансфецированные 1 мкМ киРНК против KDR (Life Technologies, Ref: 145034)
- Клетки, трансфецированные 1 мкМ киРНК SEQ ID NO: 37.
Как и в предыдущих экспериментах, результаты указывали на негативное влияние электропорации на заживление ран, и по этой причине все условия сравнивали с условиями для клеток, подвергнутых ложной электропорации. Как показано на фигурах 27 и 28, киРНК SEQ ID NO. 37 очень эффективно снижала скорость заживления ран в базальной среде. Эффект киРНК SEQ ID NO. 37 был даже выше, чем эффект анти-KDR киРНК, служащей в качестве позитивного контроля. Однако, это влияние на заживление ран маскировалось, когда клетки культивировали в полной среде, что скорее всего обусловлено сильным влиянием FCS на миграцию клеток.
v) Уровни мРНК NRARP в клетках, используемых в вышеупомянутых экспериментах
Клетки HUVEC в вышеупомянутых исследованиях собирали, и общую РНК экстрагировали для анализа с помощью кол.ПЦР на уровни гена-мишени NRARP. На фигуре 29 показано снижение уровней мРНК NRARP в ответ на электропорацию киРНК SEQ ID NO. 37.
В целом, из результатов, представленных в настоящем исследовании, можно сделать вывод, что киРНК SEQ ID NO. 37 обладает антиангиогенным эффектом в клетках HUVEC, на что указывает снижение уровней пролиферации, миграции и образования капиллярных структур.
2. Анализ in vivo
2.1. Экспрессия NRARP в сетчатке и в хориоидальной оболочке у крысиной модели хориоидальной неоваскуляризации, индуцированной лазерной обработкой
2.1.1. Цель
Целью настоящего исследования является оценка экспрессии NRARP в различные моменты времени в сетчатке и в хориоидальной оболочке Норвежских коричневых крыс, у которых ХНВ была индуцирована лазерной обработкой. Анализ на экспрессию этого гена-мишени был проведен с двойной целью: i) для того, чтобы определить, может ли NRARP активироваться в ответ на ХНВ и для того, чтобы определить, является ли эта мишень кандидатом на сайленсинг при разработке нового соединения для лечения заболевания сетчатки, ассоциированных с неоваскуляризацией, и ii) чтобы изучить временную экспрессию NRARP и определить наилучшее время сайленсинга гена-мишени для лечения животных.
2.1.2. Введение
ХНВ представляет собой неспецифическое поражение, характерное для нескольких хориоретинальных заболеваний. Эти поражения характеризуются последовательностью событий, которые влекут за собой разрыв или разрушение мембраны Бранша, индуцирование воспаления и ангиогенез с инвазией хориокапиллярных эндотелиальных клеток, перицитов и воспалительных клеток в субретинальное пространство и/или субретинальный пигментный эпителий {Grossniklaus HE et al., 2010}. Проникновение хориокапилляров в субретинальное пространство является общим отличительным признаком нескольких заболеваний сетчатки. Некоторыми примерами таких заболеваний являются ВДЖП, ПДР или ДОС.
ХНВ может быть вызвана у животных-моделей путем индуцирования повреждения мембраны Бранша; это повреждение инициирует молекулярные события, приводящие к полному устранению ХНВ, характеризующейся повышением уровней ангиогенных факторов и медиаторов воспаления.
Авторами была использована индуцированная лазером модель ХНВ у Норвежских коричневых крыс, подтвержденная в EyeCRO, для анализа экспрессии выбранных мишеней через различные промежутки времени после индуцирования очагов поражения. Для этого индуцировали три поражения в каждом глазу у 18 животных, которые впоследствии были умерщвлены, а глаза собраны и отправлены в Sylentis для дальнейшего анализа. Анализируемой мишенью является NRARP. NRARP представляет собой гликопротеин, который ассоциируется с активацией васкулярных эндотелиальных клеток. Этот ген сверхэкспрессируется в целом ряде раковых опухолей, и его сверхэкспрессия коррелирует с метастазами и короткой продолжительностью жизни. Кроме того, уровни экспрессии этого гена при раке молочной железы человека коррелируют с образованием кровеносных сосудов, и было обнаружено, что белок, кодируемый этим геном, играет определенную роль в миграции эндотелиальных клеток и в образовании сосудистой системы независимо от VEGF {Faibish MR et al., 2011}.
2.1.3. Методы
i) Животные
Таблица 1. Животные
ii) Экспериментальные группы
Таблица 2 - Экспериментальные группы
iii) Критерии исключения
Любые глаза, где кровоизлияние проявляется в≥2 из 3 лазерных повреждений сразу после лазерной обработки.
Все образцы тканей были помещены в соответствующим образом идентифицированные криотрубки и сразу заморажены в жидком азоте. Криотрубки идентифицировали в экспериментальных условиях и помещали на сухой лед для отправки в Sylentis.
iv) Анализ экспрессии гена-мишени
(1) Выделение РНК и ретротранскрипция
Общую РНК выделяли из сетчатки и хориоидальной оболочки с помощью набора для экстракции РНК RNeasy (Invitrogen, CA, USA). 4 мкг общей РНК подвергали ретротранскрипции с использованием набора для архивирования кДНК высокой плотности (Applied Biosystems, Inc., Foster City, CA, USA) в соответствии с инструкциями производителя.
(2) кол.ПЦР
кол.ПЦР проводили с использованием системы детектирования StepOne Plus (Applied Biosystems). 500 нанограммов каждого образца амплифицировали в универсальной смеси TaqMan 2× Master Mix в следующих условиях: 95°С в течение 10 минут, а затем 40 циклов при 95°С в течение 15 секунд и 60°С в течение 1 минуты. Все кол.ПЦР-амплификации проводили с тремя повторностями и повторяли по меньшей мере в двух независимых экспериментах, причем, в каждом случае включали контроль с обратной транскрипцией и контроль, не содержащий матрицу.
2.1.4. Результаты - Экспрессия NRARP
Экспрессия NRARP была проанализирована в сетчатке и ПЭС/ хориоидальной оболочке в различные моменты времени после индуцирования ХНВ с помощью лазера. Полученные результаты показали некоторое снижение уровней мРНК NRARP в сетчатке через 24 часа после индуцирования поражений лазером. Через 72 часа после индуцирования поражений, уровни мРНК NRARP немного увеличивались (в 1,5 раза со времени=0). В конце исследования (t=504 часа), уровни NRARP были эквивалентны уровням, наблюдаемым до индуцирования поражений (фигура 14).
Уровни мРНК NRARP резко повышались в хориоидальной оболочке/ПЭС через 6 часов после индуцирования ХНВ (в ~2,7 раза), а затем они начинали медленно снижаться. Базальные уровни не восстановливались во время исследования в указанных временных рамках (фигура 15).
2.1.5. Выводы
Принимая во внимание результаты этого исследования, можно сделать вывод, что NRARP является эффективной мишенью, против которой может быть разработано лечение неоваскуляризации сетчатки. Паттерн его экспрессии в сетчатке и в хориоидальной оболочке показал, что он может быть хорошим кандидатом на сайленсинг, если учесть высокий уровень индуцирования его экспрессии в модели, используемой в данном исследовании, и его роль в ангиогенезе.
2.2. Оценка влияния киРНК, нацеленной на NRARP, на снижение размера повреждений и утечки в крысиной модели хориоидальной неоваскуляризации, индуцированной лазером.
2.2.1. Цель
Для определения действия одного тестируемого агента на антиангиогенные/сосудистые нарушения (киРНК SEQ ID NO: 37) после его местного введения крысам с моделью хориоидальной неоваскуляризации, индуцированной лазером (лазерной ХНВ).
2.2.2. Результаты исследования
Было проведено 26-дневное исследование на самках Норвежских коричневых крыс для определения антиангиогенных/сосудистых эффектов местной инстилляции SEQ ID NO: 37 в модели хориоидальной неоваскуляризации, индуцированной лазером.
Все 18 крыс были разделены на 3 группы по 6 крыс в каждой группе. На дни 1-26, группам 1 и 3 проводили местную инстилляцию носителя один раз в день (группа 1) или 5 мг/мл SEQ ID NO: 37 (группа 3). На 7-й день, группе 3 вводили билатеральную интравитреальную инъекцию 5 мкг/глаз анти-VEGF (позитивный контроль).
На 3-й день проводили лазерную обработку с использованием теплового лазера на 520 нм для индуцирования всего трех поражений на каждый глаз.
На день 26 (через 3 недели после лазерной обработки) проводили флуоресцеиновую ангиографию и определяли площадь поражения с помощью компьютерной программы для анализа изображений (ImageJ). У крыс, получавших либо 5 мкг/глаз анти-VEGF Ab, либо местную инстилляцию 5 мг/мл SEQ ID NO: 37, наблюдалось значительное снижение размера поражений по сравнению с соответствующей контрольной группой, которой вводили носитель.
2.2.3. Материалы и методы
2.2.3.1. Индуцированная лазером хориоидальная неоваскуляризация (ХНВ) у крыс на дни 1-26: местная инстилляция носителя или тестируемого агента, QD (Группы 1, 2)
День 5: Билатеральная лазерная обработка для инициации 3 поражений на глаз
День 7: Билатеральная интравитреальная инъекция группе позитивного контроля (группа 3)
День 26: Флуоресцеиновая ангиография in vivo
День 26: Удаление глаз и отдельный сбор сетчатки и ПЭС/хориоидальной оболочки в экспериментальных группах
2.2.3.2. Экспериментальные группы
Таблица 3. Распределение по группам
2.2.3.3. Животные
Линия: Норвежские коричневые крысы
Пол: Самки
Возрастной диапазон: 6-8 недель
Весовой диапазон: 120-150 г
Поставщик: Charles River Laboratories
Число исследуемых животных: 18
2.2.3.4. Требования к содержанию животных
Все животные были размещены в группах по 3 в больших клетках на вентилируемых стендах в стандартных условиях ухода за животными.
2.2.3.5. Приготовление и хранение препаратов
Для приготовления всех препаратов были использованы материалы USP (Фармакопеи США) и стерильные сосуды со следующими аликвотами тестируемого материала:
Носитель для местного применения - 26 аликвот/130 мкл каждого+2 дополнительных.
киРНК SEQ ID No 37-5 мг/мл, 26 аликвот/130 мкл каждой+2 дополнительных.
Все препараты хранили при 4±3°С.
2.2.3.6. Анестезия
Кетамин и ксилазин смешивали с помощью шприца U-100 с использованием 20 единиц кетамина (100 мг/мл) и 100 единиц ксилазина (20 мг/мл). Смесь для анестезии вводили с помощью внутрибрюшинной (IP) инъекции в дозе 1 мкл/г (массы тела).
2.2.3.7. Применение лазеров для инициации ХНВ-поражений
Глаза животных расширяли с помощью 1% раствора циклогила и защищали от света. После наблюдаемой дилатации, животных анестезировали кетамином/ксилазином. Затем проводили наблюдение глазного дна анестезированных животных, и данные регистрировали с помощью офтальмоскопа для небольших животных с использованием Micron III (Phoenix Research). Лазерную обработку осуществляли с помощью теплового лазера, подсоединенного посредством специального лазерного крепления Micron III. В целом, было инициировано 3 поражения на глаз на длине волны 520 нм. Полученные изображения глазного дна регистрировали и оценивали для того, чтобы подтвердить успешное прохождение пузырьков через мембрану Бранша.
2.2.3.8. Введение в стекловидное тело
Животных анестезировали кетамином/ксилазином и зрачки расширяли путем местного введения циклогила и/или тропикамида. После анестезии и дилатации, общий объем 5 мкл на глаз вводили путем инъекции в плоскую часть стекловидного тела с помощью шприца Гамильтона с иглой калибром 33.
2.2.3.9 Исключения
Из анализа были исключены любые глаза, в которых наблюдались признаки кровоизлияния после лазерной обработки или инъекции в стекловидное тело.
2.2.3.10. Флуоресцеиновая ангиография
Животных анестезировали кетамином/ксилазином, а затем им вводили IP-инъекцию 10% флуоресцеин-натрия в дозе 1 мкл/г массы тела. Изображения глазного дна фиксировали как 8-битовые файлы TIFF с помощью камеры Micron III и фильтров-возбудителей/барьерных фильтров для мишени на длине волны 488 нм. Стандартные цветные фотографии глазного дна также фиксировали для каждого глаза.
2.2.3.11. Количественная оценка изображений и поражений
Все изображения TIFF количественно оценивали с помощью компьютерной программы для анализа изображений (ImageJ, NIH, USA). Поражения индивидуально оценивали вручную для анализа площади в пикселях, и цветные фотографии глазного дна использовали в качестве эталона для определения локализации поражения. Области с отсутствием васкуляризации в центре поражений были исключены из расчетов площади. Если наблюдалось кровоизлияние или совмещение двух поражений, то эти поражения были исключены из анализа.
2.2.3.12. Сбор ткани
Животных анестезировали кетамином/ксилазином (80/10 мг/кг), а затем умерщвляли путем IP-введения эвтазола (пентобарбитала) в дозе 200 мг/кг. После эвтаназии, глаза удаляли и отдельно фиксировали в 4% параформальдегиде. После фиксации, все глаза хранили в отдельных 2-миллилитровых полипропиленовых пробирках с завинчивающимися крышками.
2.2.3.13. Статистический анализ
Статистические анализы проводили с помощью компьютерной программы GraphPad Prism (версия 4.0) с использованием двухстороннего t-критерия Манна-Уитни. Статистически значимыми считались только изменения с величиной р <0,05.
2.2.4. Результаты
Эффект введения SEQ ID NO: 37 путем местной инстилляции оценивали у крыс с моделью ХНВ, индуцированной лазером. Через 3 недели после лазерной обработки проводили флуоресцеиновую ангиографию для количественного определения размера (площади в пикселях) поражений ХНВ в глазах крыс.
Местное введение 5 мг/мл SEQ ID NO: 37 приводило к снижению размера поражений в глазах крыс по сравнению с введением только носителя. Различия в средних размерах поражений по сравнению с поражениями в группе, которой вводили носитель, рассматривались как значимые (фигура 16; *, р≤0,05, непарный t-критерий вместе с двухсторонним постериорным критерием Манна-Уитни).
Билатеральная интравитреальная инъекция позитивного контроля, то есть, анти-VEGF антитела приводила к значительному снижению размера поражений по сравнению с контролем (фигура 16; **, р≤0,01, непарный t-критерий вместе с двухсторонним постериорным критерием Манна-Уитни).
2.2.5. Выводы
У крыс с моделью хориоидальной неоваскуляризации, местная инстилляция 5 мг/мл SEQ ID NO 37 приводила к значительному снижению размера поражений по сравнению с местной инстилляцией только носителя.
Библиография
Angaji S.A, Hedayati S.S, Poor R.H, et al. ʺApplication of RNA interference in treating human diseasesʺ J Genet. 2010. Vol. 89. 4. 527-37.
Bird AC. ʺTherapeutic targets in age-related macular diseaseʺ. J Clin Invest. 2010 Sep;120(9):3033-41.
Bramsen J.B., Laursen M.B., Nielsen A. F., et al. ʺA large-scale chemical modification screen identifies design rules to generate siRNAs with high activity, high stability and low toxicityʺ Nucleic Acids Res 2009 Vol. 37 Issue: 9 Pages: 2867-81.
Campochiaro PA. "Potential applications for RNAi to probe pathogenesis and develop new treatments for ocular disordersʺ. Gene Ther. 2006 Mar;13(6):559-62.
Cerutti, L., N. Mian, et al."Domains in gene silencing and cell differentiation proteins: the novel PAZ domain and redefinition of the Piwi domain." Trends Biochem Sci. 2000 25(10): 481-2.
Collins, R. E. and X. Cheng. "Structural domains in RNAi." FEBS Lett 2005 579(26): 5841-9.
Chang C.I, Kim H.A, Dua P, et al. ʺStructural Diversity Repertoire of Gene Silencing Small Interfering RNAsʺ Nucleic Acid Ther. 2011. Vol. 21. 3. 125-31.
Chong RH, Gonzalez-Gonzalez E, et al. ʺGene silencing following siRNA delivery to skin via coated steel microneedles: In vitro and in vivo proof-of-conceptʺ. J Control Release 2013, 166:211-9.
Del Amo EM and Urtti A. ʺCurrent and future ophthalmic drug delivery systems. A shift to the posterior segmentʺ. Drug Discov Today 2008, 13:135-143.
Deleavey G.F and Damha M.J. ʺDesigning chemically modified oligonucleotides for targeted gene silencingʺ. Chem Biol. 2012 Vol.19.8. 937-54.
Duvvuri S, Majumdar S, Mitra AK. ʺDrug delivery to the retina: challenges and opportunitiesʺ. Expert Opin Biol Ther 2003, 3:45-56.
Edelhauser HF, Rowe-Rendleman CL, Robinson MR, Dawson DG, et al. ʺOphthalmic drug delivery systems for the treatment of retinal diseases: basic research to clinical applicationsʺ. Invest Ophthalmol Vis Sci 2010, 51:5403-5420.
Elbashir, S. M., W. Lendeckel, et al. "RNA interference is mediated by 21- and 22-nucleotide RNAs." Genes Dev. 2001 15(2): 188-200.
Faibish M, Francescone R, Bentley B, et al. ʺA YKL-40-Neutralizing Antibody Blocks Tumor Angiogenesis and Progression: A Potential Therapeutic Agent in Cancersʺ. Mol Cancer Ther 2011;10:742-751.
Fire A, Xu S, et al. "Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans." Nature. 1998 391(6669): 806-11.
Grossniklaus HE, Kang SJ, et al. "Animal models of choroidal and retinal neovascularization" Prog Retin Eye Res 2010 29(6): 500-19.
Guzman-Aranguez A, Loma P and Pintor J. ʺSmall-interfering RNAs (siRNAs) as a promising tool for ocular therapyʺ. British Journal of Pharmacology. 2013. 170 730-747.
Hutvagner G, and Zamore PD. "A microRNA in a multiple-turnover RNAi enzyme complex." Science. 2002. 297(5589): 2056-60.
Kigasawa K, Kajimoto K, et al. ʺNoninvasive delivery of siRNA into the epidermis by iontophoresis using an atopic dermatitis-like model ratʺ. Int J Pharm 2010, 383:157-60.
Kim DH, Behlke MA, Rose SD, et al. ʺSynthetic dsRNA Dicer substrates enhance RNAi potency and efficacyʺ Nat Biotechnol 2005. Vol. 23 Issue: 2 Pages: 222-6.
Kornbrust D, Cavagnaro J, Levin A, et al. ʺOligo safety working group exaggerated pharmacology subcommittee consensus documentʺ Nucleic Acid Ther 2013 Vol. 23, 1, Pag: 21-8.
Leachman SA, Hickerson RP, et al. ʺFirst-in-human mutation-targeted siRNA phase Ib trial of an inherited skin disorderʺ. Mol Ther 2010, 18:442-6.
Lewis BP, Shih I, et al. ʺPrediction of mammalian micro RNA targets.ʺ Cell. 2003 115:787-798.
Liu J, Carmell MA, et al. "Argonaute2 is the catalytic engine of mammalian RNAi." Science. 2004 305(5689): 1437-41.
Livak KJ and Schmittgen TD. ʺAnalysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Methodʺ Methods. 2001; Vol: 25, Issue: 4, Pages: 402-8.
Ma JB, Yuan YR, et al. "Structural basis for 5'-end-specific recognition of guide RNA by the A. fulgidus Piwi.
Maniatis T, et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, 1982, at pages 387-389.
Nakai N, Kishida T, et al. ʺTherapeutic RNA interference of malignant melanoma by electrotransfer of small interfering RNA targeting Mitfʺ. Gene Ther 2007, 14:357-65.
Nykanen A, Haley B, et al. "ATP requirements and small interfering RNA structure in the RNA interference pathway." Cell 2001 107(3): 309-21.
Orban TI and Izaurralde E. "Decay of mRNAs targeted by RISC requires XRN1, the Ski complex, and the exosome." Rna. 2005 11(4): 459-69.
Phng LK, Potente M, et al. "Nrarp coordinates endothelial Notch and Wnt signaling to control vessel density in angiogenesis." Dev Cell 2009 16(1): 70-82.
Rand TA, Petersen S, et al. "Argonaute2 cleaves the anti-guide strand of siRNA during RISC activation." Cell. 2005 123(4): 621-9.
Rowe-Rendleman CL, Durazo SA, et al. "Drug and gene delivery to the back of the eye: from bench to bedside." Investigative ophthalmology & visual science. 2014 55(4): 2714-30.
Sanghvi YS. ʺA status update of modified oligonucleotides for chemotherapeutics applicationsʺ Curr Protoc Nucleic Acid Chem. 2011 Vol. 4. 4 1 1-22.
Song JJ, Smith SK, et al. "Crystal structure of Argonaute and its implications for RISC slicer activity." Science. 2004 305(5689): 1434-7.
Walton SP, Wu M, Gredell JA and Chan C. ʺDesigning highly active siRNAs for therapeutic applicationsʺ FEBS J.2010. Vol. 277. 23. 4806-13.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Sylentis SAU
<120> киРНК и их использование в способах и композициях
для ингибирования экспрессии гена NRARP.
<130> PC927801WO
<150> EP15382440.4
<151> 2015-09-08
<160> 66
<170> BiSSAP 1.3
<210> 1
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 1
caccaggacatcgtgctct 19
<210> 2
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 2
acatcgtgctctatctcat 19
<210> 3
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 3
aggacatcgtgctctatct 19
<210> 4
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 4
gacatcgtgctctatctca 19
<210> 5
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 5
tgctctatctcatcaccaa 19
<210> 6
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 6
ccaggacatcgtgctctat 19
<210> 7
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 7
atcgtgctctatctcatca 19
<210> 8
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 8
gtgctctatctcatcacca 19
<210> 9
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> кДНК
<400> 9
accaggacatcgtgctcta 19
<210> 10
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Смысловая цепь киРНК
<400> 10
caccaggacaucgugcucu 19
<210> 11
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Смысловая цепь киРНК
<400> 11
acaucgugcucuaucucau 19
<210> 12
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> Смысловая цепь киРНК
<400> 12
aggacaucgugcucuaucu 19
<210> 13
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<400> 13
gacaucgugcucuaucuca 19
<210> 14
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<400> 14
ugcucuaucucaucaccaa 19
<210> 15
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<400> 15
ccaggacaucgugcucuau 19
<210> 16
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<400> 16
aucgugcucuaucucauca 19
<210> 17
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<400> 17
gugcucuaucucaucacca 19
<210> 18
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<400> 18
accaggacaucgugcucua 19
<210> 19
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,3,5,11,14
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 13,16,19,22
<223> /мод_основание="um"
<400> 19
nannnangga nanngngcnncn 22
<210> 20
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> misc_связывание
<222> 2
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 16,19
<223> /мод_основание="um"
<220>
<221> модифицированное_основание
<222> 18,20
<223> /мод_основание="gm"
<400> 20
angagcacgauguccngnnn 20
<210> 21
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,3,5,11,14
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 13,16,19,22
<223> /мод_основание="um"
<400> 21
nannnanggananngngcnncn 22
<210> 22
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> misc_связывание
<222> 2
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 16,19
<223> /мод_основание="ДРУГОЕ"
/примечание="уридин с 4'-тиорибозной модификацией"
<220>
<221> модифицированное_основание
<222> 17,20
<223> /мод_основание="gm"
<400> 22
angagcacgauguccnngnn 20
<210> 23
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,3,5,11,14
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 13,16,19,22
<223> /мод_основание="um"
<400> 23
nannnanggananngngcnncn 22
<210> 24
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> misc_связывание
<222> 2
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 16,19
<223> /мод_основание="ДРУГОЕ"
/примечание="5pU (5-Пропинилурацил 3')"
<400> 24
angagcacgauguccnggng 20
<210> 25
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,3,5,11,14
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 13,16,19,22
<223> /мод_основание="um"
<400> 25
nannnanggananngngcnncn 22
<210> 26
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 15,18
<223> /мод_основание="ДРУГОЕ"
/примечание="5-метилуридин"
<220>
<221> модифицированное_основание
<222> 19
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Гуанозин"
<400> 26
agagcacgauguccnggnn 19
<210> 27
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,3,5,11,14
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 13,16,19,22
<223> /мод_основание="um"
<400> 27
nannnanggananngngcnncn 22
<210> 28
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 15,18
<223> /мод_основание="um"
<220>
<221> модифицированное_основание
<222> 17
<223> /мод_основание="gm"
<220>
<221> модифицированное_основание
<222> 19
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Гуанозин"
<400> 28
agagcacgauguccngnnn 19
<210> 29
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F цитидин"
<220>
<221> модифицированное_основание
<222> 3,5,11,14
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 13,16,19,22
<223> /мод_основание="um"
<400> 29
nannnanggananngngcnncn 22
<210> 30
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 15,18
<223> /мод_основание="um"
<220>
<221> модифицированное_основание
<222> 17
<223> /мод_основание="gm"
<220>
<221> модифицированное_основание
<222> 19
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Гуанозин"
<400> 30
agagcacgauguccngnnn 19
<210> 31
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,3,4,9,12,16,18
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 11,14,17,19
<223> /мод_основание="um"
<400> 31
nannaggananngngnnnn 19
<210> 32
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Аденозин"
<220>
<221> модифицированное_основание
<222> 5
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 6
<223> /мод_основание="ДРУГОЕ"
/примечание="2'-O-метиладенозин"
<220>
<221> модифицированное_основание
<222> 10,15,18
<223> /мод_основание="um"
<400> 32
ngagnncganguccnggng 19
<210> 33
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Цитидин"
<220>
<221> модифицированное_основание
<222> 3,4,9,12,16,18
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 11,14,17,19
<223> /мод_основание="um"
<400> 33
nannaggananngngnnnn 19
<210> 34
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,6
<223> /мод_основание="ДРУГОЕ"
/примечание="2'-O- метиладенозин"
<220>
<221> модифицированное_основание
<222> 5
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 10,15,18
<223> /мод_основание="um"
<400> 34
ngagnncganguccnggng 19
<210> 35
<211> 21
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 20,21
<223> /мод_основание="ДРУГОЕ"
/примечание="дезокситимин (2'H тимин)"
<400> 35
caccaggacaucgugcucunn 21
<210> 36
<211> 21
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 20,21
<223> /мод_основание="ДРУГОЕ"
/примечание="дезокситимин (2'H тимин)"
<400> 36
agagcacgauguccuggugnn 21
<210> 37
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,4,12,16,18
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 2,8,10
<223> /мод_основание="ДРУГОЕ"
/примечание="2'-O-метиладенозин"
<220>
<221> модифицированное_основание
<222> 3,9
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Цитидин"
<220>
<221> модифицированное_основание
<222> 5
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Аденозин"
<220>
<221> модифицированное_основание
<222> 6
<223> /мод_основание="gm"
<220>
<221> модифицированное_основание
<222> 7,13,15
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Гуанозин"
<220>
<221> модифицированное_основание
<222> 11,17,19
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Уридин"
<220>
<221> модифицированное_основание
<222> 14
<223> /мод_основание="um"
<400> 37
nnnnnnnnnnnnnnnnnnn 19
<210> 38
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,6
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Аденозин"
<220>
<221> модифицированное_основание
<222> 2,4,8,16
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Гуанозин"
<220>
<221> модифицированное_основание
<222> 3,9
<223> /мод_основание="ДРУГОЕ"
/примечание="2'-O- метиладенозин"
<220>
<221> модифицированное_основание
<222> 5,7,13
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 10,12,18
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Уридин"
<220>
<221> модифицированное_основание
<222> 11,17,19
<223> /мод_основание="gm"
<220>
<221> модифицированное_основание
<222> 14
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Цитидин"
<220>
<221> модифицированное_основание
<222> 15
<223> /мод_основание="um"
<400> 38
nnnnnnnnnnnnnnnnnnn 19
<210> 39
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,3,4,9,12,16,18
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 11,14,17,19
<223> /мод_основание="um"
<400> 39
nannaggananngngnnnn 19
<210> 40
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 5
<223> /мод_основание="cm"
<400> 40
agagnacgauguccuggug 19
<210> 41
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 16
<223> /мод_основание="um"
<400> 41
acanucngugcucuancucnau 22
<210> 42
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 15
<223> /мод_основание="gm"
<220>
<221> модифицированное_основание
<222> 17,19
<223> /мод_основание="um"
<400> 42
augagauagagcacnangn 19
<210> 43
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,19
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 9,14,16
<223> /мод_основание="um"
<400> 43
ananucngngcucnancunnau 22
<210> 44
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 15
<223> /мод_основание="gm"
<220>
<221> модифицированное_основание
<222> 17,19
<223> /мод_основание="um"
<400> 44
augagauagagcacnangn 1
<210> 45
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,19
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 9,14,16
<223> /мод_основание="um"
<400> 45
ananucngngcucnancunnau 22
<210> 46
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 17,19
<223> /мод_основание="ДРУГОЕ"
/примечание="5pU (5-Пропинилурацил 3')"
<400> 46
augagauagagcacgangn 19
<210> 47
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,19
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 9,14,16
<223> /мод_основание="um"
<400> 47
ananucngngcucnancunnau 22
<210> 48
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> misc_признак
<222> 2
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 18,20
<223> /мод_основание="ДРУГОЕ"
/примечание="уридин с 4'-тиорибозной модификацией"
<400> 48
anugagauagagcacgangn 20
<210> 49
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,19
<223> /мод_основание="cm"
<220>
<221> misc_признак
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 9,14,16
<223> /мод_основание="um"
<400> 49
ananucngngcucnancunnau 22
<210> 50
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 17,19
<223> /мод_основание="ДРУГОЕ"
/примечание="уридин с 4'-тиорибозной модификацией "
<220>
<221> модифицированное_основание
<222> 18
<223> /мод_основание="gm"
<400> 50
augagauagagcacgannn 19
<210> 51
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,19
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиоатная связь"
<220>
<221> модифицированное_основание
<222> 9,14,16
<223> /мод_основание="um"
<400> 51
ananucngngcucnancunnau 22
<210> 52
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,17,19
<223> /мод_основание="ДРУГОЕ"
/примечание="уридин с 4'-тиорибозной модификацией"
<220>
<221> модифицированное_основание
<222> 18
<223> /мод_основание="gm"
<400> 52
angagauagagcacgannn 19
<210> 53
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,19
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,20
<223> /примечание="фосфотиатная связь"
<220>
<221> модифицированное_основание
<222> 9,14,16
<223> /мод_основание="um"
<400> 53
ananucngngcucnancunnau 22
<210> 54
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> misc_связывание
<222> 2
<223> /примечание="фосфотиатная связь"
<220>
<221> модифицированное_основание
<222> 18,20
<223> /мод_основание="ДРУГОЕ"
/примечание="5pU (5-Пропинилурацил 3')"
<400> 54
anugagauagagcacgangn 20
<210> 55
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,6,13,17,19
<223> /мод_основание="cm"
<220>
<221> misc_связывание
<222> 4,7,21
<223> /примечание="фосфотиатная связь"
<220>
<221> модифицированное_основание
<222> 5,9,12,14,16,18
<223> /мод_основание="um"
<400> 55
anannnngngcnnnannnnanu 22
<210> 56
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> misc_связывание
<222> 2
<223> /примечание="фосфотиатная связь"
<220>
<221> модифицированное_основание
<222> 18,20
<223> /мод_основание="ДРУГОЕ"
/примечание="5'метилуридин (5mU)"
<400> 56
anugagauagagcacgangn 20
<210> 57
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Аденозин"
<220>
<221> модифицированное_основание
<222> 2,5,9,11,15,17
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 4,7,10,12,14,16,19
<223> /мод_основание="um"
<400> 57
nnanngngnnnnannnnan 19
<210> 58
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,7,17,19
<223> /мод_основание="um"
<400> 58
angaganagagcacgangn 19
<210> 59
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1
<223> /мод_основание="ДРУГОЕ"
/примечание="2'-O-метиладенозин"
<220>
<221> модифицированное_основание
<222> 2,5,9,11,15,17
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 4,7,10,12,14,16,19
<223> /мод_основание="um"
<400> 59
nnanngngnnnnannnnan 19
<210> 60
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Аденозин"
<220>
<221> модифицированное_основание
<222> 2,7,17,19
<223> /мод_основание="um"
<400> 60
nngaganagagcacgangn 19
<210> 61
<211> 21
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 20,21
<223> /мод_основание="ДРУГОЕ"
/примечание="дезокситимин (2'H тимин)"
<400> 61
acaucgugcucuaucucaunn 21
<210> 62
<211> 21
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 20,21
<223> /мод_основание="ДРУГОЕ"
/примечание=" дезокситимин (2'H тимин)"
<400> 62
augagauagagcacgaugunn 21
<210> 63
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 2,5,9,11,15,17
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 4,7,10,12,14,16,19
<223> /мод_основание="um"
<400> 63
ananngngnnnnannnnan 19
<210> 64
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 7
<223> /мод_основание="um"
<220>
<221> модифицированное_основание
<222> 12
<223> /мод_основание="cm"
<400> 64
augaganagagnacgaugu 19
<210> 65
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,18
<223> /мод_основание="ДРУГОЕ"
/примечание="2'-O-метиладенозин"
<220>
<221> модифицированное_основание
<222> 2
<223> /мод_основание="cm"
<220>
<221> модифицированное_основание
<222> 3,13
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Аденозин
<220>
<221> модифицированное_основание
<222> 4,10,12,14,16
<223> /мод_основание="um"
<220>
<221> модифицированное_основание
<222> 5,9,11,15,17
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Цитидин"
<220>
<221> модифицированное_основание
<222> 6,8
<223> /мод_основание="gm"
<220>
<221> модифицированное_основание
<222> 7,19
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Уридин"
<400> 65
nnnnnnnnnnnnnnnnnnn 19
<210> 66
<211> 19
<212> РНК
<213> Искусственная последовательность
<220>
<223> киРНК
<220>
<221> модифицированное_основание
<222> 1,4,6,8,10,16
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Аденозин"
<220>
<221> модифицированное_основание
<222> 2
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Уридин"
<220>
<221> модифицированное_основание
<222> 3,5,9,11,15
<223> /мод_основание="gm"
<220>
<221> модифицированное_основание
<222> 7,17,19
<223> /мод_основание="um"
<220>
<221> модифицированное_основание
<222> 12
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Цитидин"
<220>
<221> модифицированное_основание
<222> 18
<223> /мод_основание="ДРУГОЕ"
/примечание="2'F Гуанозин"
<400> 66
nnnnnnnnnnnnacnnnnn 19
<---
Реферат
Изобретение относится к биотехнологии. Раскрыто применение киРНК для лечения и/или профилактики глазного заболевания или расстройства, ассоциированного с неоваскуляризацией, характеризующейся повышенным уровнем экспрессии и/или активности гена NRARP, где указанное глазное заболевание выбрано из группы, включающей возрастную дегенерацию желтого пятна (ВДЖП), ишемическую ретинопатию, диабетический отек желтого пятна (ДОЖП), пролиферативную диабетическую ретинопатию (ПДР), диабетическую ишемию сетчатки (ДИС), диабетический отек сетчатки (ДОС) и ретинопатию недоношенных (РНД) и их комбинации. 4 н. и 23 з.п. ф-лы, 3 табл., 2 пр., 29 ил.
