Способы и композиции для лечения ассоциированного с serpinc1 расстройства - RU2754188C2
Код документа: RU2754188C2
Чертежи
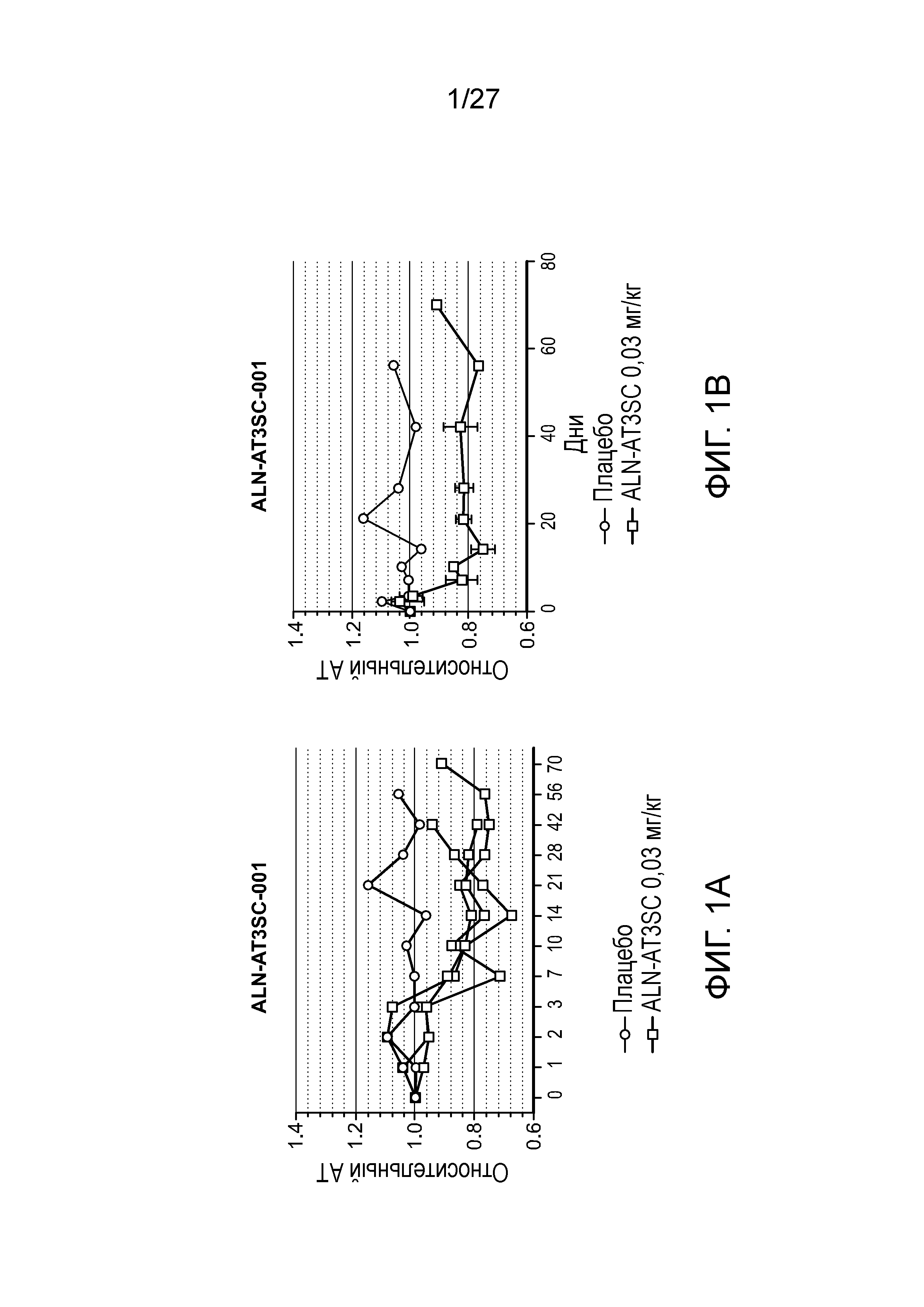


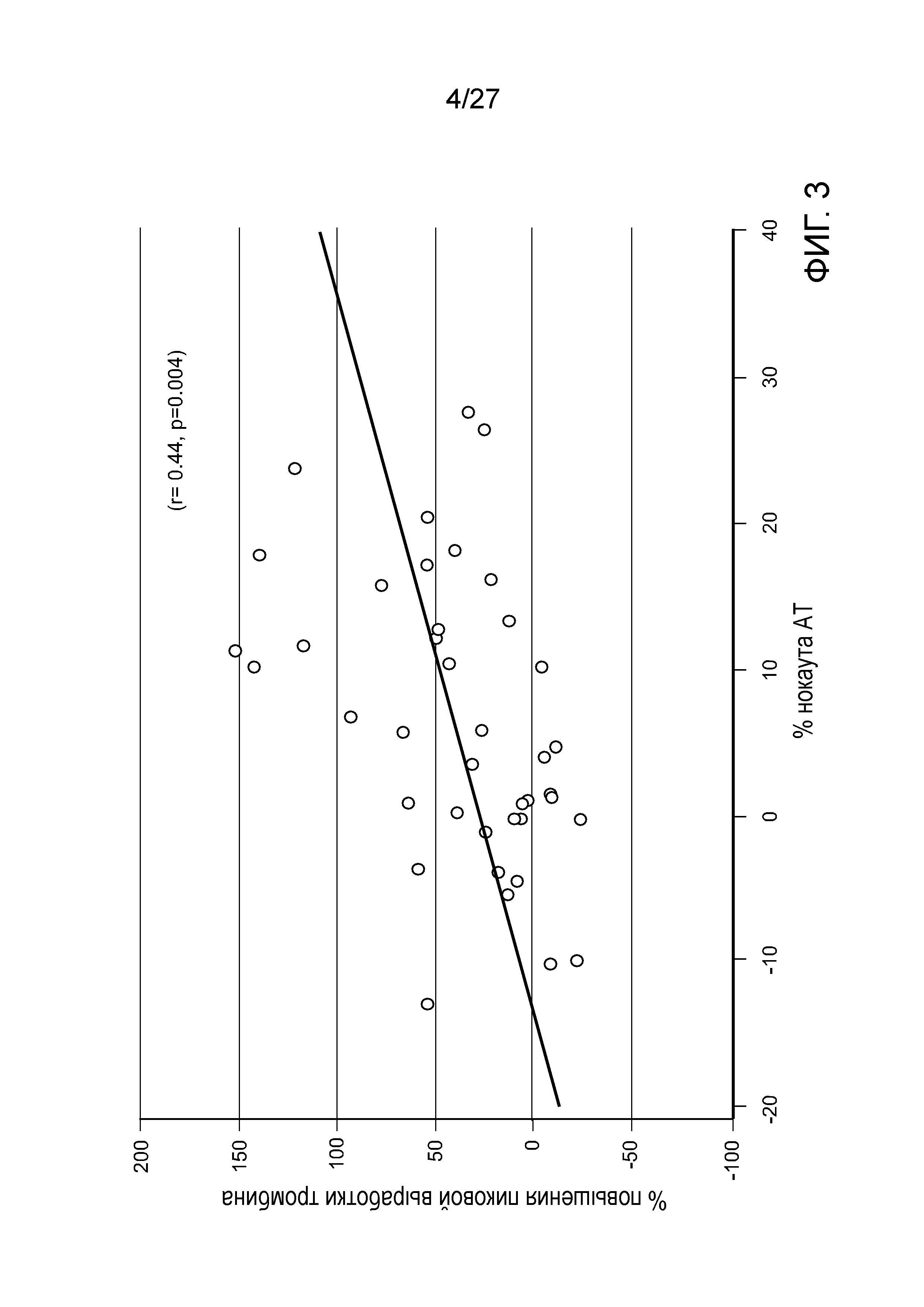
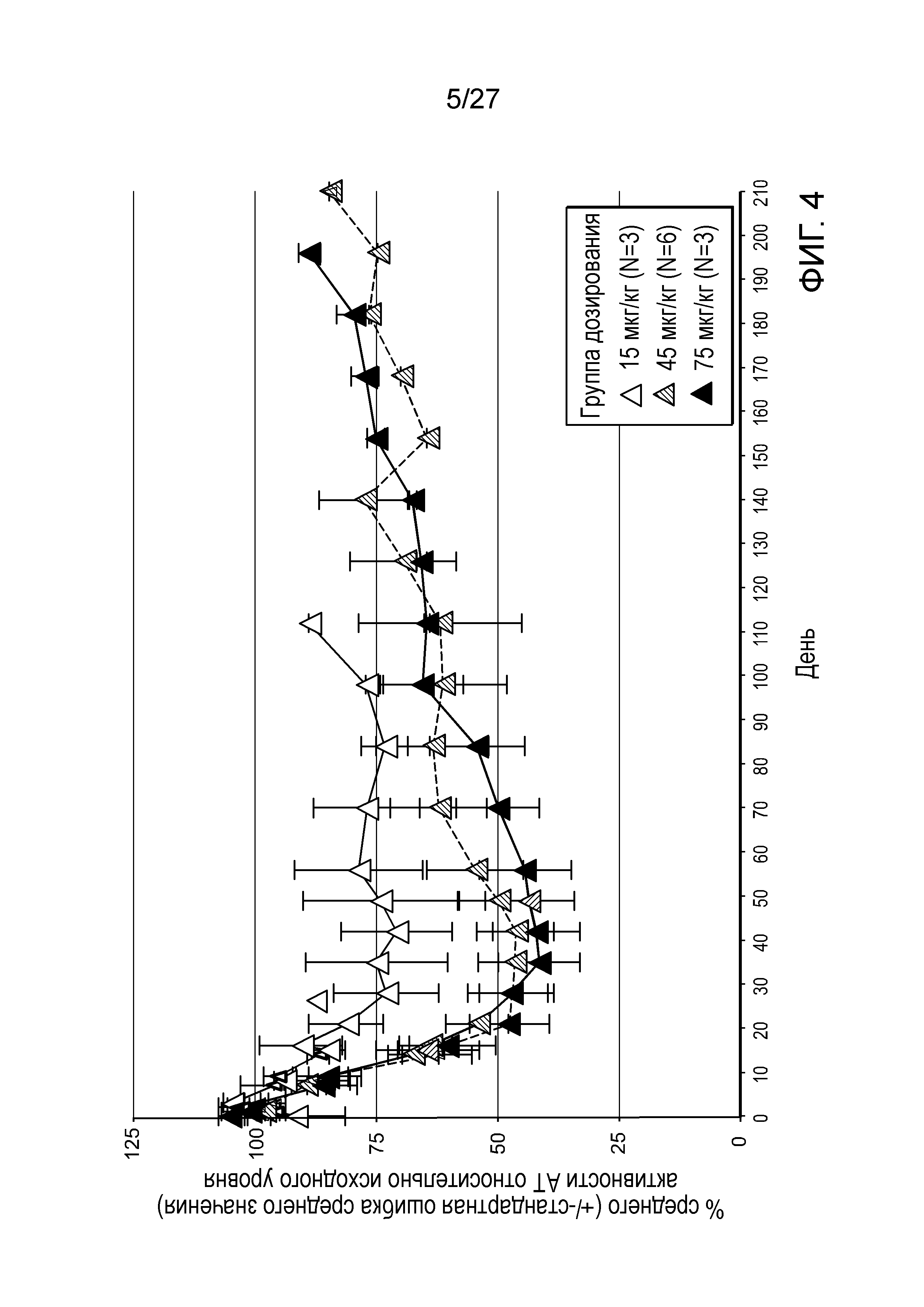

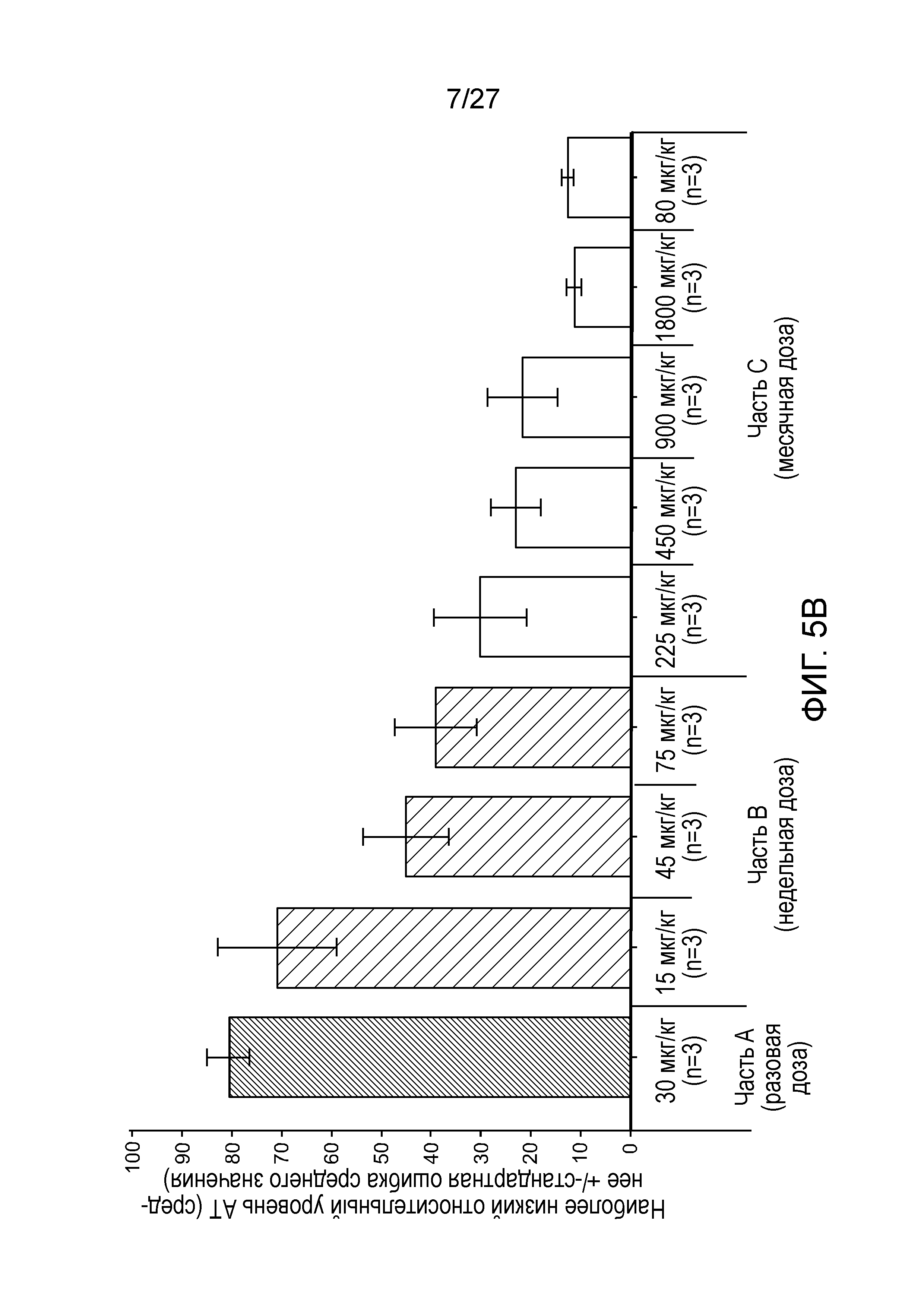


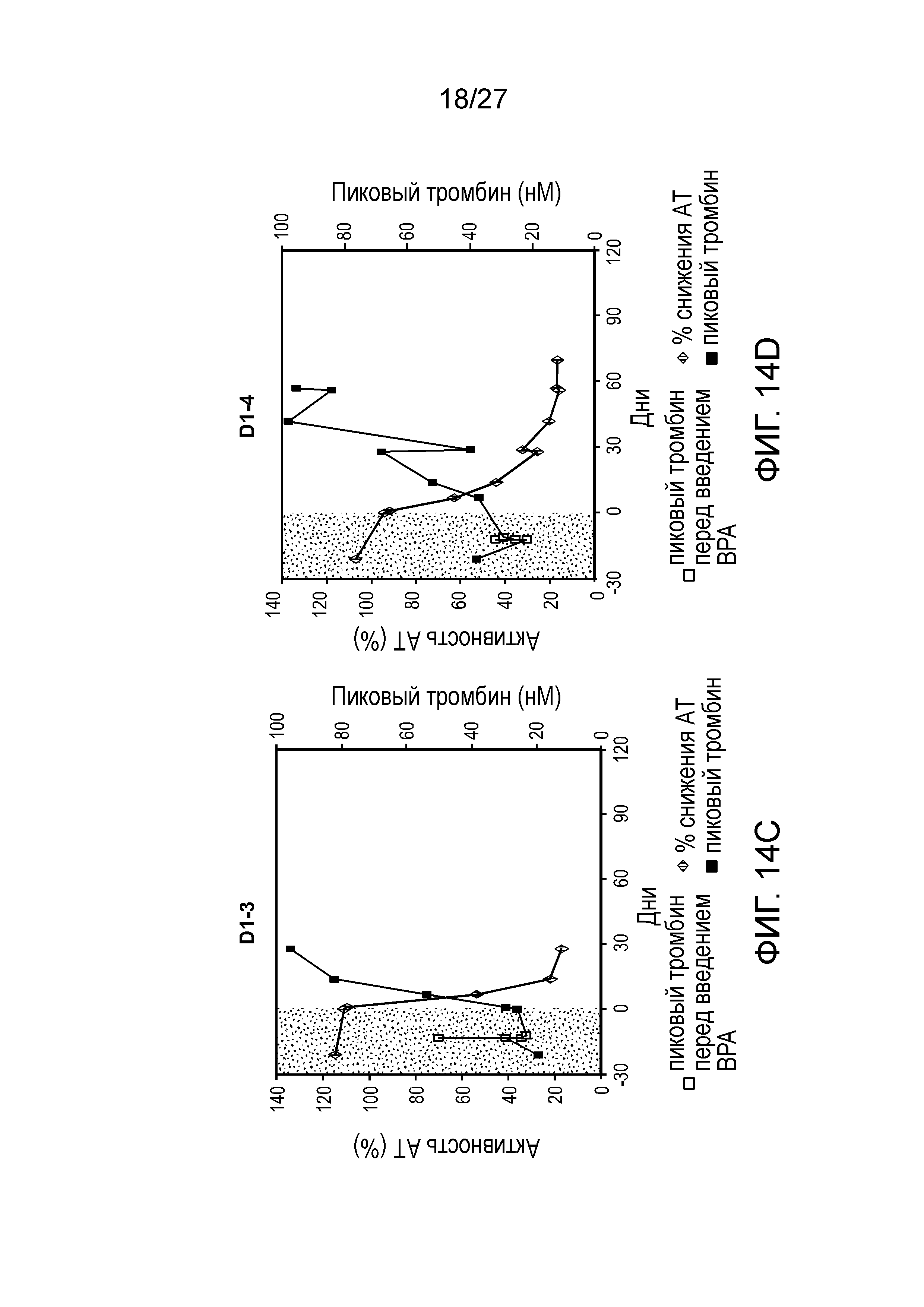
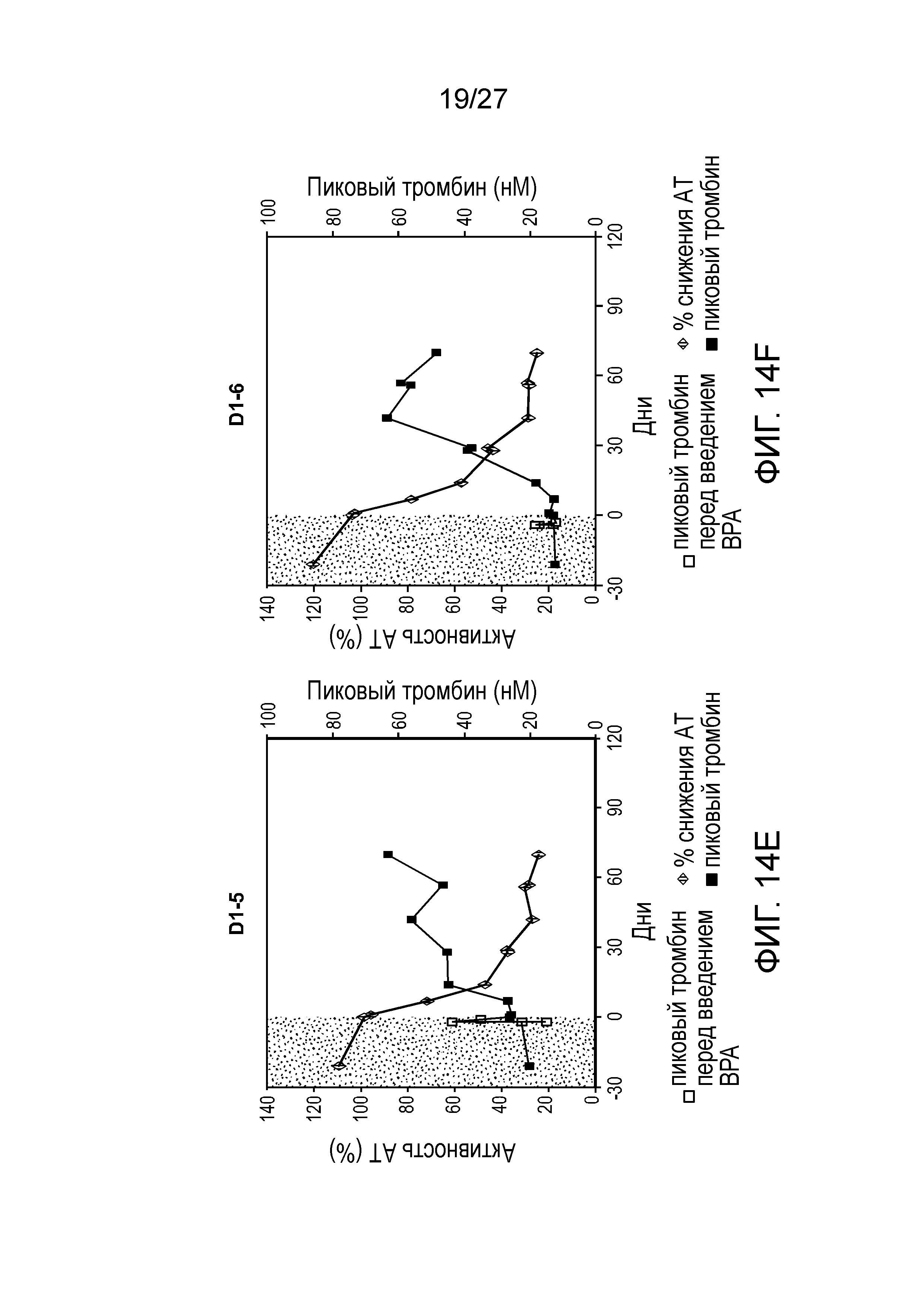

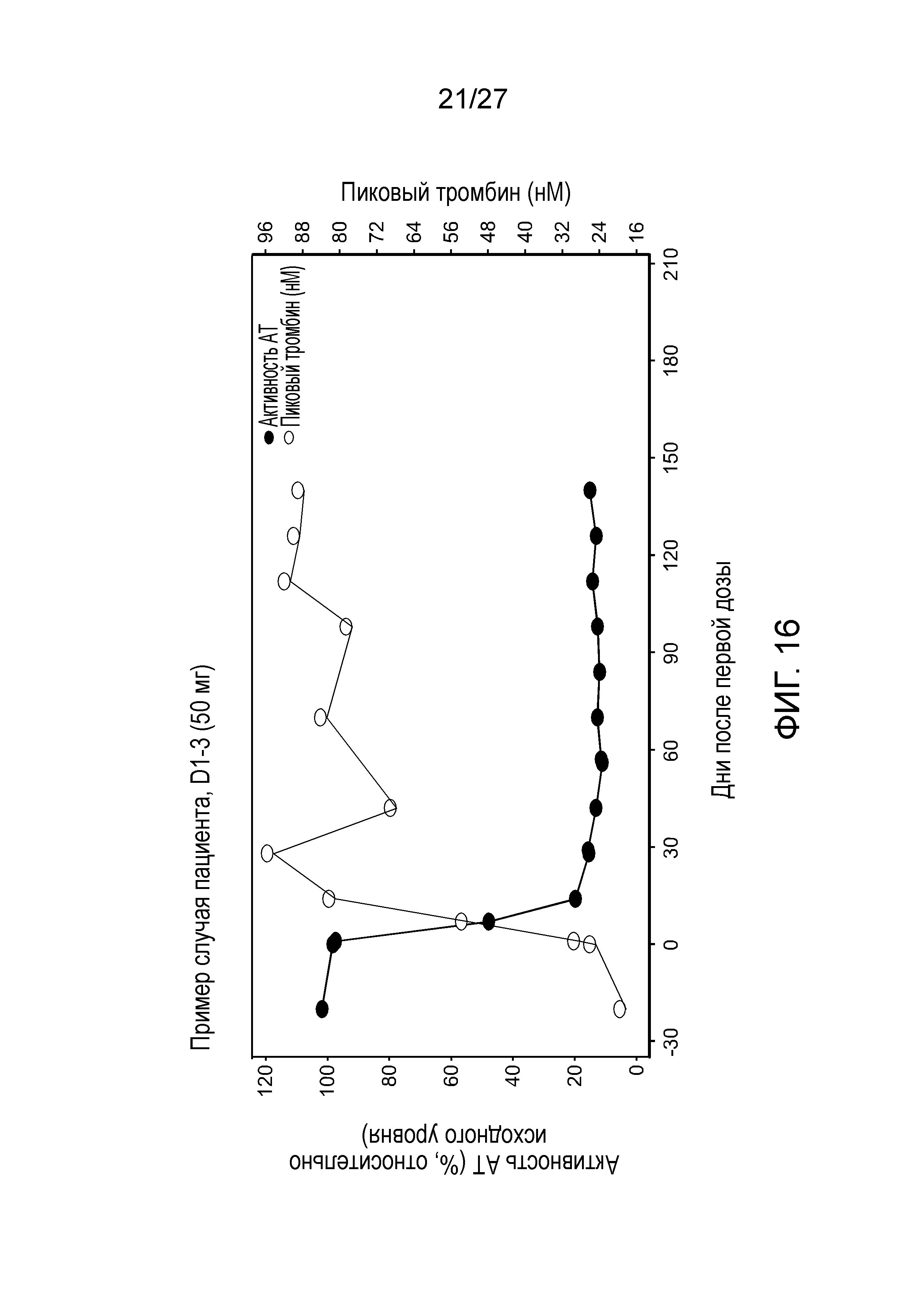

Описание
Родственные заявки
Данная заявка испрашивает преимущество приоритета предварительной патентной заявки США №: 62/264013, поданной 7 декабря 2015 года, предварительной патентной заявки США №: 62/315228, поданной 30 марта 2016 года, предварительной патентной заявки США №: 62/366304, поданной 25 июля 2016 года и предварительной патентной заявки США №: 62/429241, поданной 2 декабря 2016 года. Полное содержание каждой из вышеприведенных патентных заявок включено в данный документ посредством ссылки.
Данная заявка связана с предварительной патентной заявкой США №: 61/992057, поданной 12 мая 2014 года, предварительной патентной заявкой США №: 62/089018, поданной 8 декабря 2014 года, предварительной патентной заявкой США №: 62/102281, поданной 12 января 2015 года, и PCT Патентной заявкой PCT/US2015/030337, поданной 12 мая 2015 года. Полное содержание каждой из вышеприведенных патентных заявок включено в данный документ посредством ссылки.
Кроме того, данная заявка связана с предварительной патентной заявкой США №: 61/638952, поданной 26 апреля 2012 года, предварительной патентной заявкой США №: 61/669249, поданной 9 июля 2012 года, предварительной патентной заявкой США №: 61/734573, поданной 7 декабря 2012 года, патентной заявкой США №: 13/837129, поданной 15 марта 2013 года, теперь патентом США №: 9127274, патентной заявкой США №: 14/806084, поданной 22 июля 2015 года, теперь патентом США №: 9376680, патентной заявкой США №: 15/070358, поданной 15 марта 2016 года, и PCT патентной заявкой № PCT/US2013/038218, поданной 25 апреля 2013 года. Данная заявка также связана с PCT патентной заявкой № PCT/US2012/065601, поданной 16 ноября 2012 года. Полное содержание каждой из вышеприведенных патентных заявок включено в данный документ посредством ссылки.
Список последовательностей
Настоящая заявка содержит список последовательностей, который был представлен в электронном виде в формате ASCII и включен в данный документ посредством ссылки в полном объеме. Указанная копия ASCII, созданная 6 декабря 2016 года, называется 121301-05220_SL.TXT и имеет размер 21140 байт.
Уровень техники настоящего изобретения
Serpinc1 является членом суперсемейства ингибиторов сериновых протеиназ (серпинов). Serpinc1 является ингибитором плазменных протеаз, который ингибирует тромбин, а также другие активированные сериновые протеазы свертывающей системы, такие как факторы X, IX, XI, XII и VII и, таким образом, регулирует каскад свертывания крови. Противосвертывающая активность Serpinc1 усиливается в присутствии гепарина и других родственных гликозаминогликанов, которые катализируют образование комплексов тромбин:антитромбин (ТАТ).
Расстройства, сопровождающиеся кровоточивостью, как наследственные, так и приобретенные, являются условиями, при которых происходит неадекватное свертывание крови. Например, гемофилия представляет собой группу наследственных генетических нарушений, сопровождающихся кровоточивостью, которые нарушают способность организма контролировать образование кровяного сгустка или свертываемость. Гемофилия А является рецессивным X-сцепленным генетическим расстройством, связанным с отсутствием функционального фактора свертывания VIII и составляет 80% случаев гемофилии. Гемофилия B является рецессивным X-сцепленным генетическим расстройством, связанным с отсутствием функционального фактора свертывания IX. Она включает приблизительно 20% случаев гемофилии. Гемофилия C является аутосомным генетическим расстройством, связанным с отсутствием функционального фактора свертывания XI. Гемофилия C не является полностью рецессивной, так как гетерозиготные особи также демонстрируют повышенную кровоточивость.
Хотя в настоящее время нет лечения для гемофилии, ее можно контролировать с помощью регулярных инфузий дефицитного фактора свертывания крови, например, фактора VIII при гемофилии А. Однако у некоторых больных гемофилией вырабатываются антитела (ингибиторы) против вводимых им заместительных факторов и, таким образом, становятся невосприимчивыми к заместительным факторам свертывания. Соответственно, кровотечения у таких субъектов невозможно надлежащим образом контролировать.
Развитие высоких титров ингибиторов, например, к фактору VIII и другим факторам свертывания является наиболее серьезным осложнением терапии гемофилии и делает лечение кровотечений весьма сложным. В настоящее время единственными стратегиями прекращения кровотечений у таких субъектов являются использование «средств обходного действия», таких как функция обхода ингибиторов к фактору VIII (FEIBA) и рекомбинантный активированный фактор VII (rFVIIa), плазмаферез, непрерывное замещение фактора и терапия иммунной толерантности, ни один из которых не является полностью эффективным. Соответственно, в данной области существует потребность в альтернативных методах лечения субъектов, страдающих расстройством, сопровождающимся кровоточивостью, таким как гемофилия.
Сущность изобретения
В настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь ингибирование или уменьшение экспрессии гена Serpinc1, например, расстройства, сопровождающегося кровоточивостью, такого как гемофилия, с использованием композиций иРНК, которые воздействуют на опосредованное индуцируемым РНК комплексом сайленсинга (RISC) расщепление транскриптов РНК гена Serpinc1 для подавления экспрессии гена Serpinc1.
Настоящее изобретение по меньшей мере частично основано на неожиданном открытии, что очень низкие дозы (например, дозы, по меньшей мере примерно в 30 раз ниже, чем дозы, практикуемые в данной области) связанного с GalNAc средства двухцепочечной RNAi, включая конкретные химические модификации, показывают исключительную эффективность для подавления экспрессии Serpinc1, а также исключительную продолжительность подавления экспрессии Serpinc1. Конкретно, низкие дозы средств RNAi, содержащих лиганд GalNAc и смысловую нить и антисмысловую нить, в которых по существу все нуклеотиды являются модифицированными, такие как средства RNAi, содержащие один или более мотивов трех идентичных модификаций трех последовательных нуклеотидов, включая один такой мотив на участке расщепления средств или около него, шесть тиофосфатных связей, и лиганд GalNAc, показаны в данном изобретении исключительно эффективными и продолжительными по подавлении активности гена Serpinc1.
Соответственно, в одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства двухцепочечной RNAi, которая содержит смысловую нить и антисмысловую нить, образующие двухцепочечную область, при этом смысловая нить содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:1, а антисмысловая нить содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:5, при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, например, лиганд присоединен на 3'-конце смысловой нити.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства двухцепочечной RNAi, при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, образующие двухцепочечную область, при этом смысловая нить содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:1, а антисмысловая нить содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:5, при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами.
В другом варианте осуществления смысловая нить и антисмысловая нить содержат область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от любой одной из последовательностей, перечисленных в любой одной из таблиц 2 и 3.
В некоторых вариантах осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2'-O-метил модифицированного нуклеотида, 2'-фтор модифицированного нуклеотида, нуклеотида, содержащего 5'-тиофосфатную группу, и концевого нуклеотида, связанного с производным холестерила или бисдециламидной группы додекановой кислоты. В дополнительных вариантах осуществления модифицированный нуклеотид выбирают из группы, состоящей из 2'-дезокси-2'-фтор модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотида, неблокированного нуклеотида, конформационно ограниченного нуклеотида, ограниченного этилом нуклеотида, нуклеотида с удаленным азотистым основанием, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, 2'-O-аллил модифицированного нуклеотида, 2'-C-аллил модифицированного нуклеотида, 2'-гидроксил модифицированного нуклеотида, морфолинового нуклеотида, фосфорамидата и нуклеотида, содержащего искусственное основание.
В другом варианте осуществления средство двухцепочечной RNAi, по меньшей мере одна нить содержит 3' «липкий» конец по меньшей мере из 1 нуклеотида. В другом варианте осуществления по меньшей мере одна нить содержит 3' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна нить средства RNAi содержит 5' «липкий» конец по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна нить содержит 5' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления и 3'-, и 5'-конец одной нити средства RNAi содержит «липкий» конец по меньшей мере из 1 нуклеотида.
В некоторых вариантах осуществления лигандом является N-ацетилгалактозамин (GalNAc). Лиганд может представлять собой один или более GalNAc, прикрепленный к средству RNAi через моновалентный, бивалентный или трехвалентный разветвленный линкер. Лиганд можно конъюгировать с 3'-концом смысловой нити средства двухцепочечной RNAi, 5'-концом смысловой нити средства двухцепочечной RNAi, 3'-концом антисмысловой нити средства двухцепочечной RNAi или 5'-концом антисмысловой нити средства двухцепочечной RNAi.
В некоторых вариантах осуществления средства двухцепочечной RNAi изобретения содержат множество, например, 2, 3, 4, 5 или 6, GalNAc, каждый из которых независимо прикреплен к множеству нуклеотидов средства двухцепочечной RNAi через множество моновалентных линкеров.
В некоторых вариантах осуществления лиганд представляет собой
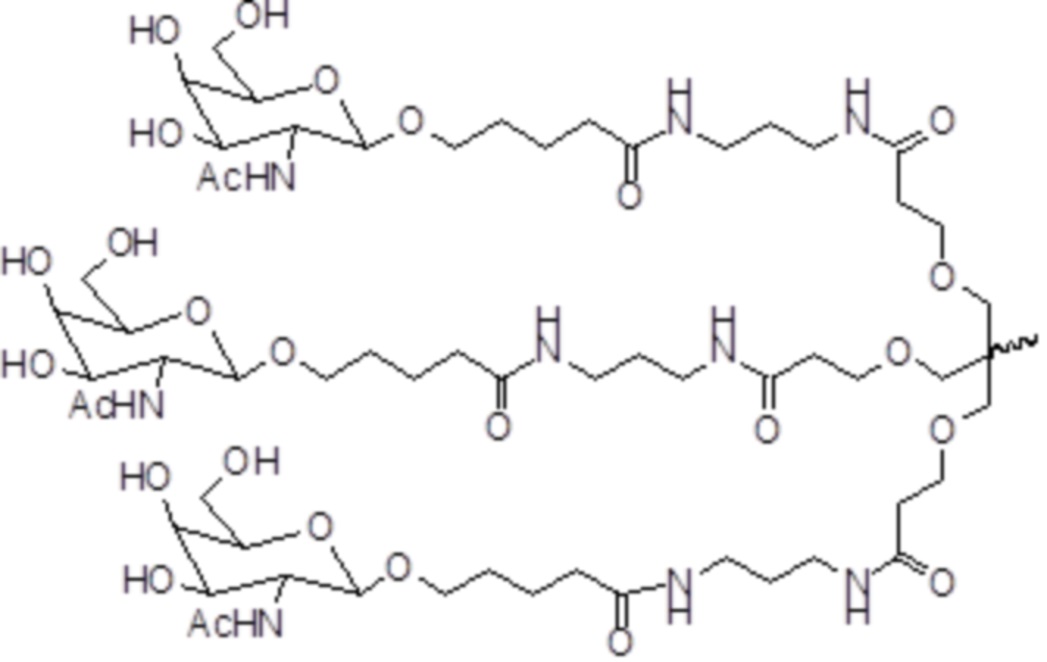
В другом аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства двухцепочечной RNAi, при этом средство двухцепочечной RNAi содержит смысловую нить, комплементарную антисмысловой нити, при этом антисмысловая нить содержит область комплементарности части мРНК, кодирующей Serpinc1, при этом каждая нить составляет в длину от приблизительно 14 до приблизительно 30 нуклеотидов, при этом средство двухцепочечной RNAi представлено формулой (IIIe):
смысловая: 5' -Na -Y Y Y-Na-3'
антисмысловая: 3' np'-Na'-Y'Y'Y'-Na'-5' (IIIe)
при этом:
np' представляет собой «липкий» конец из 2 нуклеотидов, а каждый нуклеотид внутри np' связан с соседним нуклеотидом посредством тиофосфатной связи;
каждый Na и Na' независимо представляет олигонуклеотидную последовательность, содержащую 0-25 нуклеотидов, которые являются либо модифицированными, либо немодифицированными, или их комбинациями, причем каждая последовательность содержит по меньшей мере два разных модифицированных нуклеотида;
YYY и Y'Y'Y' каждый независимо представляют один мотив трех идентичных модификаций трех последовательных нуклеотидов, и при этом модификации представляют собой 2'-O-метил или 2'-фтор модификации;
при этом смысловая нить и антисмысловая нить каждая независимо содержат две тиофосфатные связи на 5'-конце; и
при этом смысловую нить конъюгируют по меньшей мере с одним лигандом, при этом лиганд представляет собой одно или более производное GalNAc, присоединенное через моновалентный, бивалентный или трехвалентный разветвленный линкер,
тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства двухцепочечной RNAi, при этом средство двухцепочечной RNAi содержит смысловую нить, комплементарную антисмысловой нити, при этом антисмысловая нить содержит область комплементарности части мРНК, кодирующей Serpinc1, при этом каждая нить составляет в длину от приблизительно 14 до приблизительно 30 нуклеотидов, при этом средство двухцепочечной RNAi представлено формулой (IIIe):
смысловая: 5' -Na -Y Y Y-Na-3'
антисмысловая: 3' np'-Na'-Y'Y'Y'-Na'-5' (IIIe)
при этом:
np' представляет собой «липкий» конец из 2 нуклеотидов, а каждый нуклеотид внутри np' связан с соседним нуклеотидом посредством тиофосфатной связи;
каждый Na и Na' независимо представляет олигонуклеотидную последовательность, содержащую 0-25 нуклеотидов, которые являются либо модифицированными, либо немодифицированными, или их комбинациями, причем каждая последовательность содержит по меньшей мере два разных модифицированных нуклеотида;
YYY и Y'Y'Y' каждый независимо представляют один мотив трех идентичных модификаций трех последовательных нуклеотидов, и при этом модификации представляют собой 2'-O-метил или 2'-фтор модификации;
при этом смысловая нить и антисмысловая нить каждая независимо содержат две тиофосфатные связи на 5'-конце; и
при этом смысловую нить конъюгируют по меньшей мере с одним лигандом, при этом лиганд представляет собой одно или более производное GalNAc, прикрепленное через моновалентный, бивалентный и трехвалентный разветвленный линкер,
тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту в разовой дозе или в двух или более дозах, например, в 3, 4, 5 или 6 дозах.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц, каждые шесть недель, каждые 2 месяца, каждые три месяца или при необходимости.
Средство двухцепочечной RNAi можно вводить субъекту в виде, например, месячной дозы от приблизительно 0,200 до приблизительно 1,825 мг/кг, от 0,200 до приблизительно 1,800 мг/кг, от приблизительно 0,200 до приблизительно 1,700 мг/кг, от приблизительно 0,200 до приблизительно 1,600 мг/кг, от приблизительно 0,200 до приблизительно 1,500 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,200 мг/кг, от приблизительно 0,200 до приблизительно 1,100 мг/кг, от приблизительно 0,200 до приблизительно 1,000 мг/кг, от приблизительно 0,200 до приблизительно 0,900 мг/кг, от приблизительно 0,200 до приблизительно 0,800 мг/кг, от приблизительно 0,200 до приблизительно 0,700 мг/кг, от приблизительно 0,200 до приблизительно 0,600 мг/кг, от приблизительно 0,200 до приблизительно 0,500 мг/кг, от приблизительно 0,200 до приблизительно 0,400 мг/кг, от приблизительно 0,225 до приблизительно 1,825 мг/кг, от приблизительно 0,225 до приблизительно 1,800 мг/кг, от приблизительно 0,225 до приблизительно 1,700 мг/кг, от приблизительно 0,225 до приблизительно 1,600 мг/кг, от приблизительно 0,225 до приблизительно 1,500 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,200 мг/кг, от приблизительно 0,225 до приблизительно 1,100 мг/кг, от приблизительно 0,225 до приблизительно 1,000 мг/кг, от приблизительно 0,225 до приблизительно 0,900 мг/кг, от приблизительно 0,225 до приблизительно 0,800 мг/кг, от приблизительно 0,225 до приблизительно 0,700 мг/кг, от приблизительно 0,225 до приблизительно 0,600 мг/кг, от приблизительно 0,225 до приблизительно 0,500 мг/кг, от приблизительно 0,225 до приблизительно 0,400 мг/кг, от приблизительно 0,250 до приблизительно 1,825 мг/кг, от приблизительно 0,250 до приблизительно 1,800 мг/кг, от приблизительно 0,250 до приблизительно 1,700 мг/кг, от приблизительно 0,250 до приблизительно 1,600 мг/кг, от приблизительно 0,250 до приблизительно 1,500 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,200 мг/кг, от приблизительно 0,250 до приблизительно 1,100 мг/кг, от приблизительно 0,250 до приблизительно 1,000 мг/кг, от приблизительно 0,250 до приблизительно 0,900 мг/кг, от приблизительно 0,250 до приблизительно 0,800 мг/кг, от приблизительно 0,250 до приблизительно 0,700 мг/кг, от приблизительно 0,250 до приблизительно 0,600 мг/кг, от приблизительно 0,250 до приблизительно 0,500 мг/кг, от приблизительно 0,250 до приблизительно 0,400 мг/кг, от приблизительно 0,425 до приблизительно 1,825 мг/кг, от приблизительно 0,425 до приблизительно 1,800 мг/кг, от приблизительно 0,425 до приблизительно 1,700 мг/кг, от приблизительно 0,425 до приблизительно 1,600 мг/кг, от приблизительно 0,425 до приблизительно 1,500 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,200 мг/кг, от приблизительно 0,425 до приблизительно 1,100 мг/кг, от приблизительно 0,425 до приблизительно 1,000 мг/кг, от приблизительно 0,425 до приблизительно 0,900 мг/кг, от приблизительно 0,425 до приблизительно 0,800 мг/кг, от приблизительно 0,425 до приблизительно 0,700 мг/кг, от приблизительно 0,425 до приблизительно 0,600 мг/кг, от приблизительно 0,425 до приблизительно 0,500 мг/кг, от приблизительно 0,450 до приблизительно 1,825 мг/кг, от приблизительно 0,450 до приблизительно 1,800 мг/кг, от приблизительно 0,450 до приблизительно 1,700 мг/кг, от приблизительно 0,450 до приблизительно 1,600 мг/кг, от приблизительно 0,450 до приблизительно 1,500 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,200 мг/кг, от приблизительно 0,450 до приблизительно 1,100 мг/кг, от приблизительно 0,450 до приблизительно 1,000 мг/кг, от приблизительно 0,450 до приблизительно 0,900 мг/кг, от приблизительно 0,450 до приблизительно 0,800 мг/кг, от приблизительно 0,450 до приблизительно 0,700 мг/кг, от приблизительно 0,450 до приблизительно 0,600 мг/кг, от приблизительно 0,450 до приблизительно 0,500 мг/кг, от приблизительно 0,475 до приблизительно 1,825 мг/кг, от приблизительно 0,475 до приблизительно 1,800 мг/кг, от приблизительно 0,475 до приблизительно 1,700 мг/кг, от приблизительно 0,475 до приблизительно 1,600 мг/кг, от приблизительно 0,475 до приблизительно 1,500 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,200 мг/кг, от приблизительно 0,475 до приблизительно 1,100 мг/кг, от приблизительно 0,475 до приблизительно 1,000 мг/кг, от приблизительно 0,475 до приблизительно 0,900 мг/кг, от приблизительно 0,475 до приблизительно 0,800 мг/кг, от приблизительно 0,475 до приблизительно 0,700 мг/кг, от приблизительно 0,475 до приблизительно 0,600 мг/кг, от приблизительно 0,475 до приблизительно 0,500 мг/кг, от приблизительно 0,875 до приблизительно 1,825 мг/кг, от приблизительно 0,875 до приблизительно 1,800 мг/кг, от приблизительно 0,875 до приблизительно 1,700 мг/кг, от приблизительно 0,875 до приблизительно 1,600 мг/кг, от приблизительно 0,875 до приблизительно 1,500 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,200 мг/кг, от приблизительно 0,875 до приблизительно 1,100 мг/кг, от приблизительно 0,875 до приблизительно 1,000 мг/кг, от приблизительно 0,875 до приблизительно 0,900 мг/кг, от приблизительно 0,900 до приблизительно 1,825 мг/кг, от приблизительно 0,900 до приблизительно 1,800 мг/кг, от приблизительно 0,900 до приблизительно 1,700 мг/кг, от приблизительно 0,900 до приблизительно 1,600 мг/кг, от приблизительно 0,900 до приблизительно 1,500 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,200 мг/кг, от приблизительно 0,900 до приблизительно 1,100 мг/кг, от приблизительно 0,900 до приблизительно 1,000 мг/кг, от приблизительно 0,925 до приблизительно 1,825 мг/кг, от приблизительно 0,925 до приблизительно 1,800 мг/кг, от приблизительно 0,925 до приблизительно 1,700 мг/кг, от приблизительно 0,925 до приблизительно 1,600 мг/кг, от приблизительно 0,925 до приблизительно 1,500 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,200 мг/кг, от приблизительно 0,925 до приблизительно 1,100 мг/кг, или приблизительно 0,925 до приблизительно 1,000 мг/кг, в виде, например, месячной дозы в течение одного, двух, трех, четырех, пяти, шести, семи, восьми месяцев или более.
Субъектом может быть человек, такой как человек, имеющий расстройство, сопровождающееся кровоточивостью, такое как приобретенное расстройство, сопровождающееся кровоточивостью, или врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилия, например, гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления субъект страдает гемофилией A и является субъектом с ингибиторами. В другом варианте осуществления, субъект страдает гемофилией B и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией C и является субъектом с ингибиторами.
В одном варианте осуществления введение субъекту средства двухцепочечной RNAi вызывает увеличение свертываемости крови и/или снижение накопления белка Serpinc1.
В одном варианте осуществления способы дополнительно предусматривают измерение уровней тромбина у субъекта.
Средство двухцепочечной RNAi можно вводить подкожно или внутривенно.
В одном варианте осуществления по существу все нуклеотиды антисмысловой нити и по существу все нуклеотиды смысловой нити средства RNAi содержат модификацию, выбираемую из группы, состоящей из 2'-O-метил модификации и 2'-фтор модификации. В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой цепи средства RNAi являются модифицированными нуклеотидами.
В одном варианте осуществления мотив YYY возникает на участке расщепления смысловой нити или около него.
В одном варианте осуществления мотив Y'Y'Y' возникает в позициях 11, 12 и 13 антисмысловой нити от 5'-конца.
Двухцепочечная область может составлять 15-30 нуклеотидных пар в длину, 17-23 нуклеотидных пар в длину, 17-25 нуклеотидных пар в длину, 23-27 нуклеотидных пар в длину,19-21 нуклеотидных пар в длину или 21-23 нуклеотидных пар в длину.
Каждая нить может иметь 15-30 нуклеотидов или 19-30 нуклеотидов.
В одном варианте осуществления смысловая нить имеет всего 21 нуклеотида, а антисмысловая нить имеет всего 23 нуклеотида.
В одном варианте осуществления лиганд представляет собой

В одном варианте осуществления лиганд прикреплен к 3-концу смысловой нити.
В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

при этом X представляет собой O или S.
В одном варианте осуществления пара оснований в 1 позиции 5-конца антисмысловой нити дуплекса представляет собой пару оснований AU.
В одном варианте осуществления средство RNAi представляет собой AD-57213 ((Смысловой (от 5' к 3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf (SEQ ID NO:13); Антисмысловой (от 5' к 3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь)).
В одном варианте осуществления средство вводят в виде фармацевтической композиции. В одном варианте осуществления средство RNAi вводят в незабуференном растворе, таком как физиологический солевой раствор или вода.
В другом варианте осуществления миРНК вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
Средство двухцепочечной RNAi можно вводить субъекту в двух или более дозах.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц. В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые шесть недель. В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые 2 месяца. В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые три месяца.
Средство двухцепочечной RNAi можно вводить субъекту в виде, например, месячной дозы от приблизительно 0,200 до приблизительно 1,825 мг/кг, от 0,200 до приблизительно 1,800 мг/кг, от приблизительно 0,200 до приблизительно 1,700 мг/кг, от приблизительно 0,200 до приблизительно 1,600 мг/кг, от приблизительно 0,200 до приблизительно 1,500 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,200 мг/кг, от приблизительно 0,200 до приблизительно 1,100 мг/кг, от приблизительно 0,200 до приблизительно 1,000 мг/кг, от приблизительно 0,200 до приблизительно 0,900 мг/кг, от приблизительно 0,200 до приблизительно 0,800 мг/кг, от приблизительно 0,200 до приблизительно 0,700 мг/кг, от приблизительно 0,200 до приблизительно 0,600 мг/кг, от приблизительно 0,200 до приблизительно 0,500 мг/кг, от приблизительно 0,200 до приблизительно 0,400 мг/кг, от приблизительно 0,225 до приблизительно 1,825 мг/кг, от приблизительно 0,225 до приблизительно 1,800 мг/кг, от приблизительно 0,225 до приблизительно 1,700 мг/кг, от приблизительно 0,225 до приблизительно 1,600 мг/кг, от приблизительно 0,225 до приблизительно 1,500 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,200 мг/кг, от приблизительно 0,225 до приблизительно 1,100 мг/кг, от приблизительно 0,225 до приблизительно 1,000 мг/кг, от приблизительно 0,225 до приблизительно 0,900 мг/кг, от приблизительно 0,225 до приблизительно 0,800 мг/кг, от приблизительно 0,225 до приблизительно 0,700 мг/кг, от приблизительно 0,225 до приблизительно 0,600 мг/кг, от приблизительно 0,225 до приблизительно 0,500 мг/кг, от приблизительно 0,225 до приблизительно 0,400 мг/кг, от приблизительно 0,250 до приблизительно 1,825 мг/кг, от приблизительно 0,250 до приблизительно 1,800 мг/кг, от приблизительно 0,250 до приблизительно 1,700 мг/кг, от приблизительно 0,250 до приблизительно 1,600 мг/кг, от приблизительно 0,250 до приблизительно 1,500 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,200 мг/кг, от приблизительно 0,250 до приблизительно 1,100 мг/кг, от приблизительно 0,250 до приблизительно 1,000 мг/кг, от приблизительно 0,250 до приблизительно 0,900 мг/кг, от приблизительно 0,250 до приблизительно 0,800 мг/кг, от приблизительно 0,250 до приблизительно 0,700 мг/кг, от приблизительно 0,250 до приблизительно 0,600 мг/кг, от приблизительно 0,250 до приблизительно 0,500 мг/кг, от приблизительно 0,250 до приблизительно 0,400 мг/кг, от приблизительно 0,425 до приблизительно 1,825 мг/кг, от приблизительно 0,425 до приблизительно 1,800 мг/кг, от приблизительно 0,425 до приблизительно 1,700 мг/кг, от приблизительно 0,425 до приблизительно 1,600 мг/кг, от приблизительно 0,425 до приблизительно 1,500 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,200 мг/кг, от приблизительно 0,425 до приблизительно 1,100 мг/кг, от приблизительно 0,425 до приблизительно 1,000 мг/кг, от приблизительно 0,425 до приблизительно 0,900 мг/кг, от приблизительно 0,425 до приблизительно 0,800 мг/кг, от приблизительно 0,425 до приблизительно 0,700 мг/кг, от приблизительно 0,425 до приблизительно 0,600 мг/кг, от приблизительно 0,425 до приблизительно 0,500 мг/кг, от приблизительно 0,450 до приблизительно 1,825 мг/кг, от приблизительно 0,450 до приблизительно 1,800 мг/кг, от приблизительно 0,450 до приблизительно 1,700 мг/кг, от приблизительно 0,450 до приблизительно 1,600 мг/кг, от приблизительно 0,450 до приблизительно 1,500 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,200 мг/кг, от приблизительно 0,450 до приблизительно 1,100 мг/кг, от приблизительно 0,450 до приблизительно 1,000 мг/кг, от приблизительно 0,450 до приблизительно 0,900 мг/кг, от приблизительно 0,450 до приблизительно 0,800 мг/кг, от приблизительно 0,450 до приблизительно 0,700 мг/кг, от приблизительно 0,450 до приблизительно 0,600 мг/кг, от приблизительно 0,450 до приблизительно 0,500 мг/кг, от приблизительно 0,475 до приблизительно 1,825 мг/кг, от приблизительно 0,475 до приблизительно 1,800 мг/кг, от приблизительно 0,475 до приблизительно 1,700 мг/кг, от приблизительно 0,475 до приблизительно 1,600 мг/кг, от приблизительно 0,475 до приблизительно 1,500 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,200 мг/кг, от приблизительно 0,475 до приблизительно 1,100 мг/кг, от приблизительно 0,475 до приблизительно 1,000 мг/кг, от приблизительно 0,475 до приблизительно 0,900 мг/кг, от приблизительно 0,475 до приблизительно 0,800 мг/кг, от приблизительно 0,475 до приблизительно 0,700 мг/кг, от приблизительно 0,475 до приблизительно 0,600 мг/кг, от приблизительно 0,475 до приблизительно 0,500 мг/кг, от приблизительно 0,875 до приблизительно 1,825 мг/кг, от приблизительно 0,875 до приблизительно 1,800 мг/кг, от приблизительно 0,875 до приблизительно 1,700 мг/кг, от приблизительно 0,875 до приблизительно 1,600 мг/кг, от приблизительно 0,875 до приблизительно 1,500 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,200 мг/кг, от приблизительно 0,875 до приблизительно 1,100 мг/кг, от приблизительно 0,875 до приблизительно 1,000 мг/кг, от приблизительно 0,875 до приблизительно 0,900 мг/кг, от приблизительно 0,900 до приблизительно 1,825 мг/кг, от приблизительно 0,900 до приблизительно 1,800 мг/кг, от приблизительно 0,900 до приблизительно 1,700 мг/кг, от приблизительно 0,900 до приблизительно 1,600 мг/кг, от приблизительно 0,900 до приблизительно 1,500 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,200 мг/кг, от приблизительно 0,900 до приблизительно 1,100 мг/кг, от приблизительно 0,900 до приблизительно 1,000 мг/кг, от приблизительно 0,925 до приблизительно 1,825 мг/кг, от приблизительно 0,925 до приблизительно 1,800 мг/кг, от приблизительно 0,925 до приблизительно 1,700 мг/кг, от приблизительно 0,925 до приблизительно 1,600 мг/кг, от приблизительно 0,925 до приблизительно 1,500 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,200 мг/кг, от приблизительно 0,925 до приблизительно 1,100 мг/кг или от приблизительно 0,925 до приблизительно 1,000 мг/кг.
В некоторых вариантах осуществления дозу средства двухцепочечной RNAi вводят субъекту в виде месячной дозы от приблизительно 0,200 мг/кг до приблизительно 0,250 мг/кг; или в виде месячной дозы от приблизительно 0,425 мг/кг до приблизительно 0,475 мг/кг; или в виде месячной дозы от приблизительно 0,875 мг/кг до приблизительно 0.925 мг/кг; или в виде месячной дозы от приблизительно 1,775 мг/кг до приблизительно 1,825 мг/кг.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту в виде месячной дозы, составляющей 0,225 мг/кг.
В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту в виде месячной дозы, составляющей 0,450 мг/кг.
В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту в виде месячной дозы, составляющей 0,900 мг/кг.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту в виде месячной дозы, составляющей 1,800 мг/кг.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
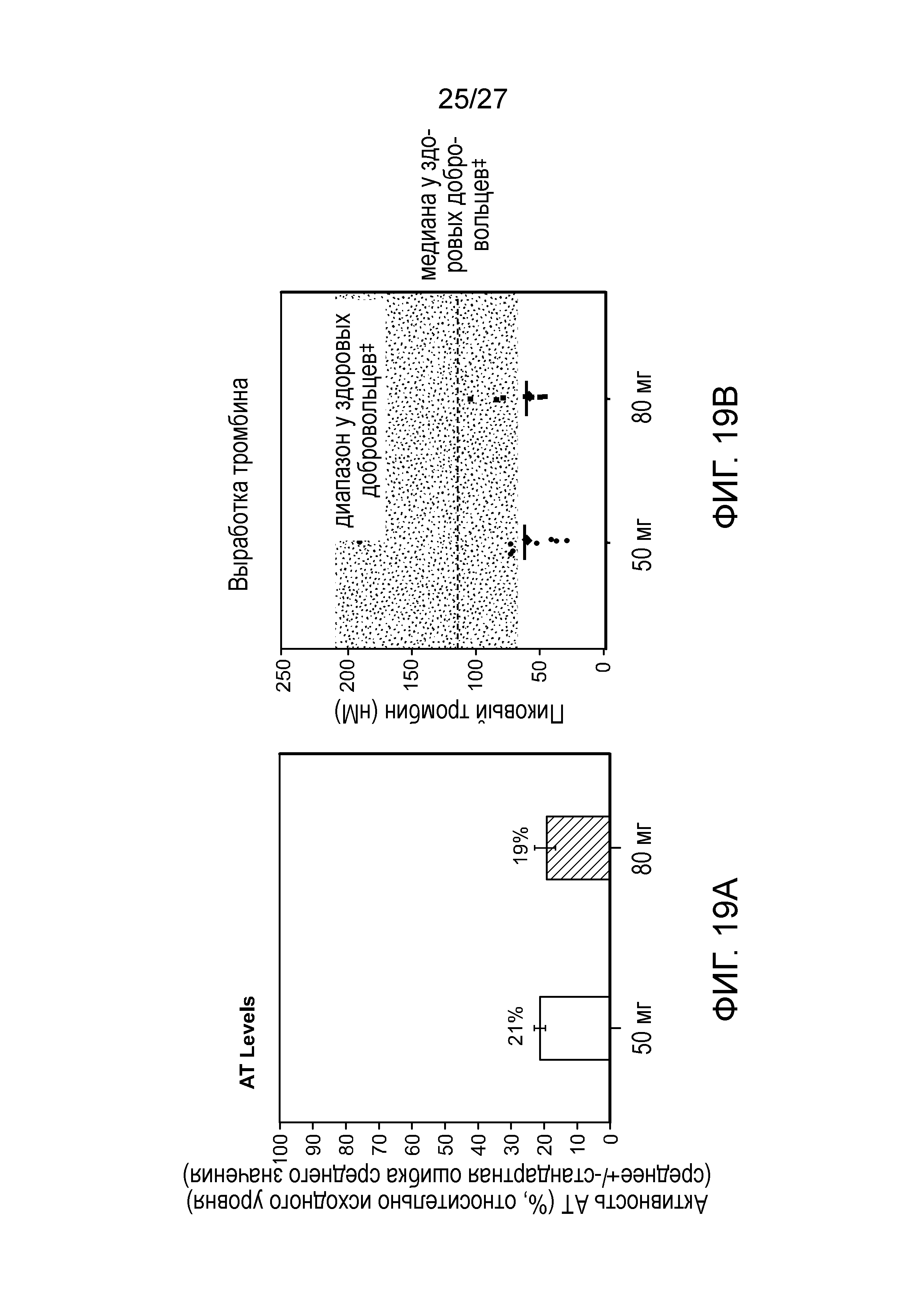
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту снижает у субъекта активность Serpinc1 на от приблизительно 70% до приблизительно 95%.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту повышает пиковые уровни тромбина у субъекта до диапазона пиковых уровней тромбина у субъекта, у которого нет расстройства, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для доведения пиковых уровней выработки тромбина у субъекта до приблизительно такого же уровня, который достигается посредством введения субъекту фактора VIII.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для достижения пиковых уровней выработки тромбина у субъекта выше, чем приблизительно 40%.
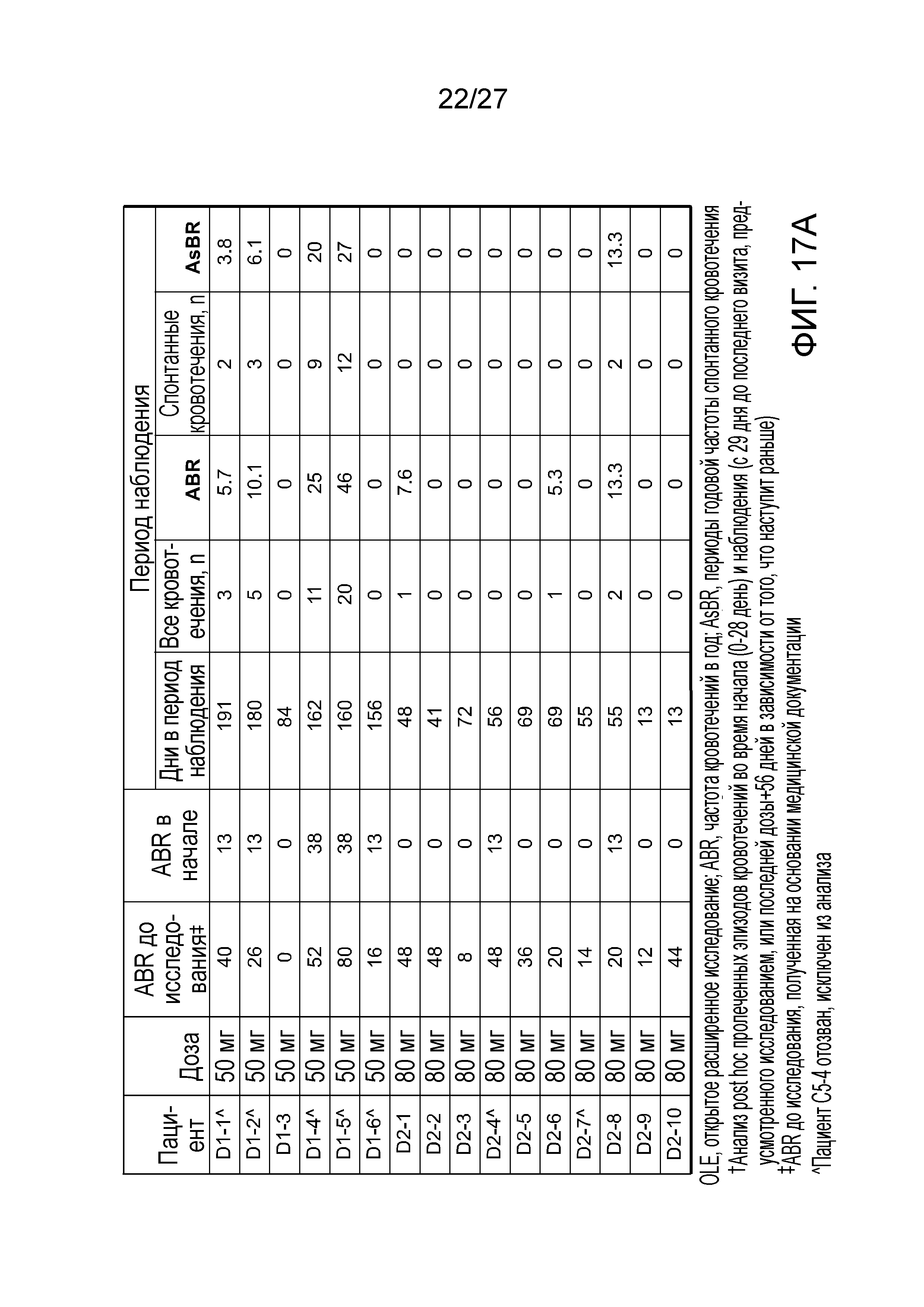
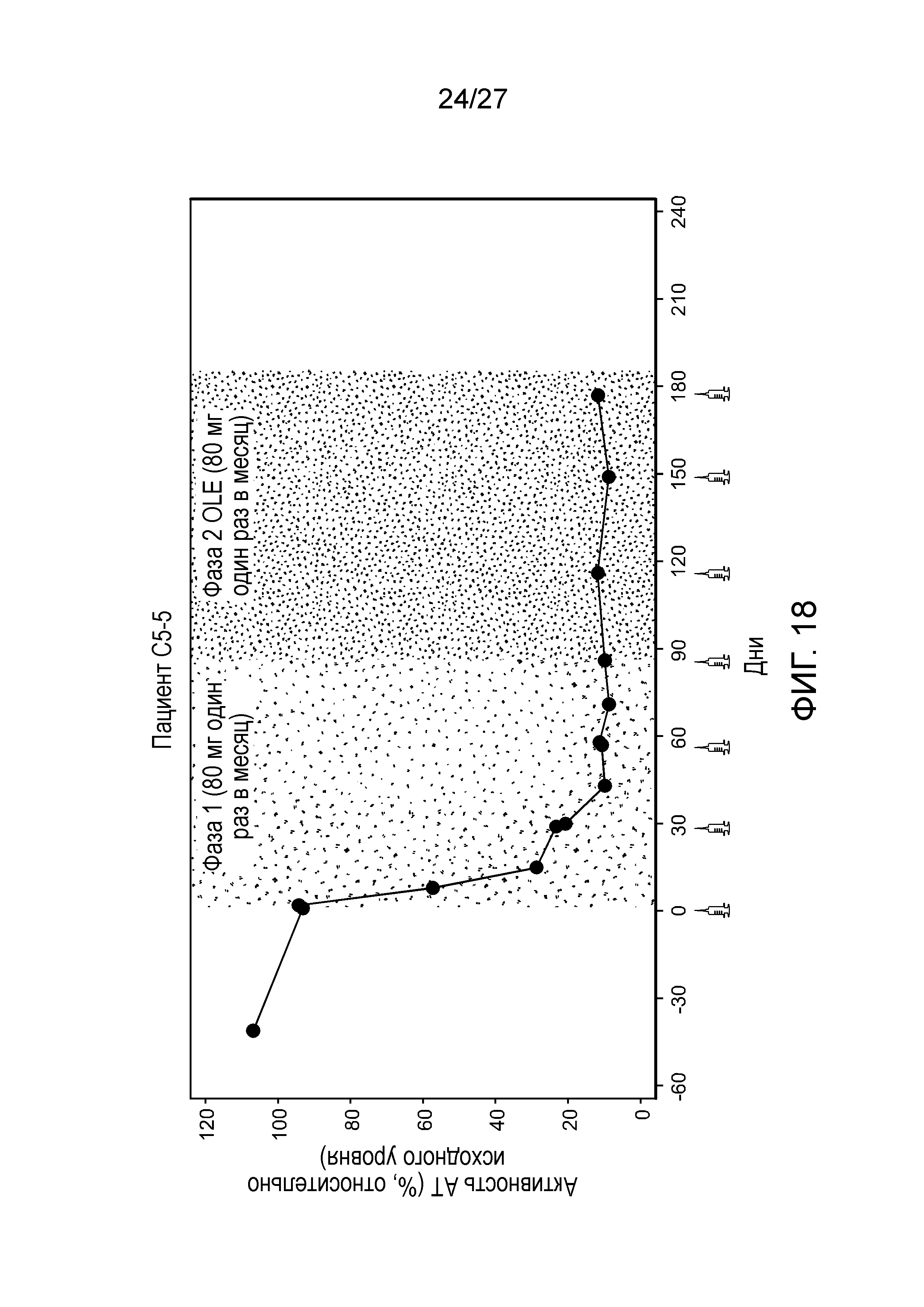
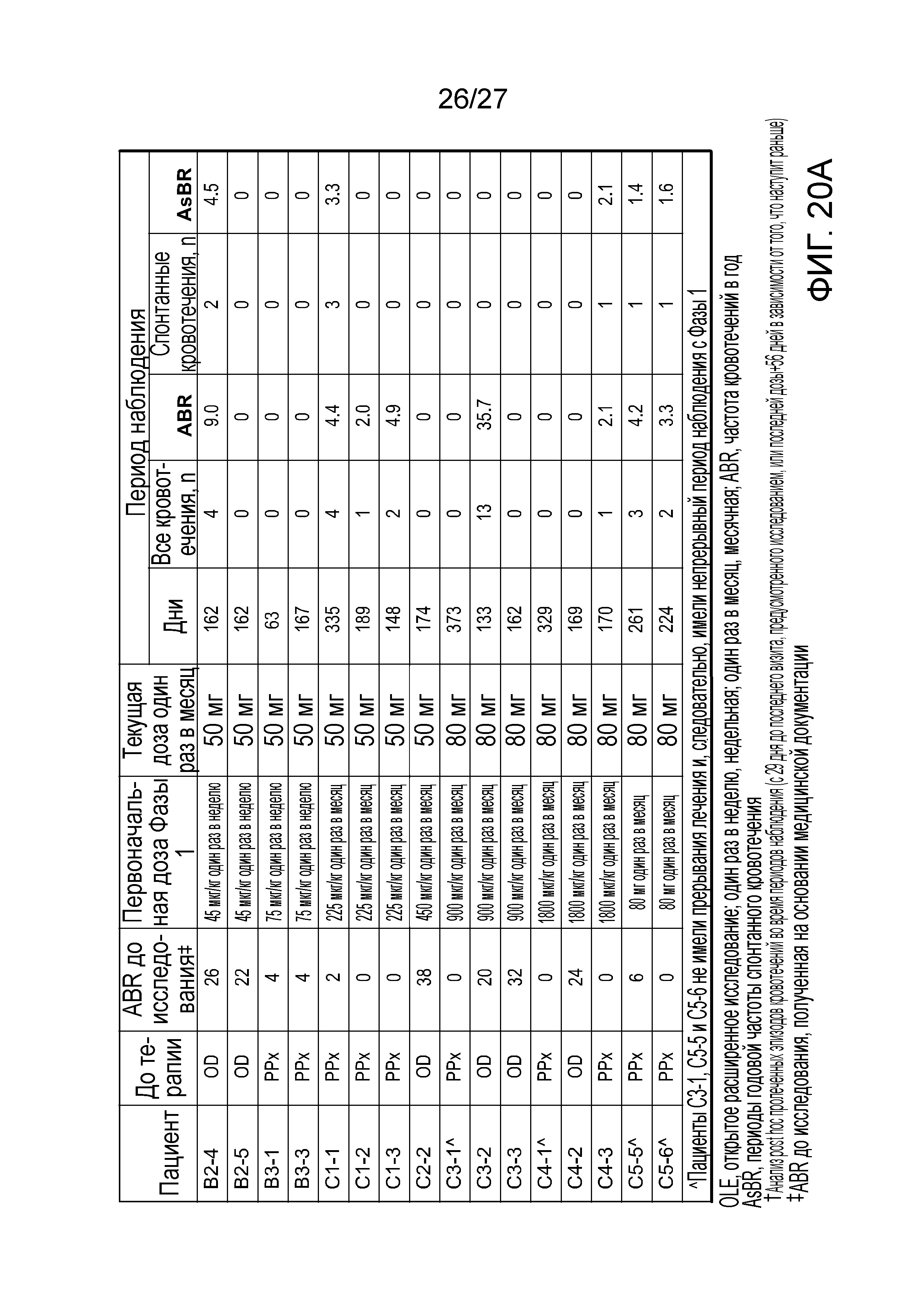
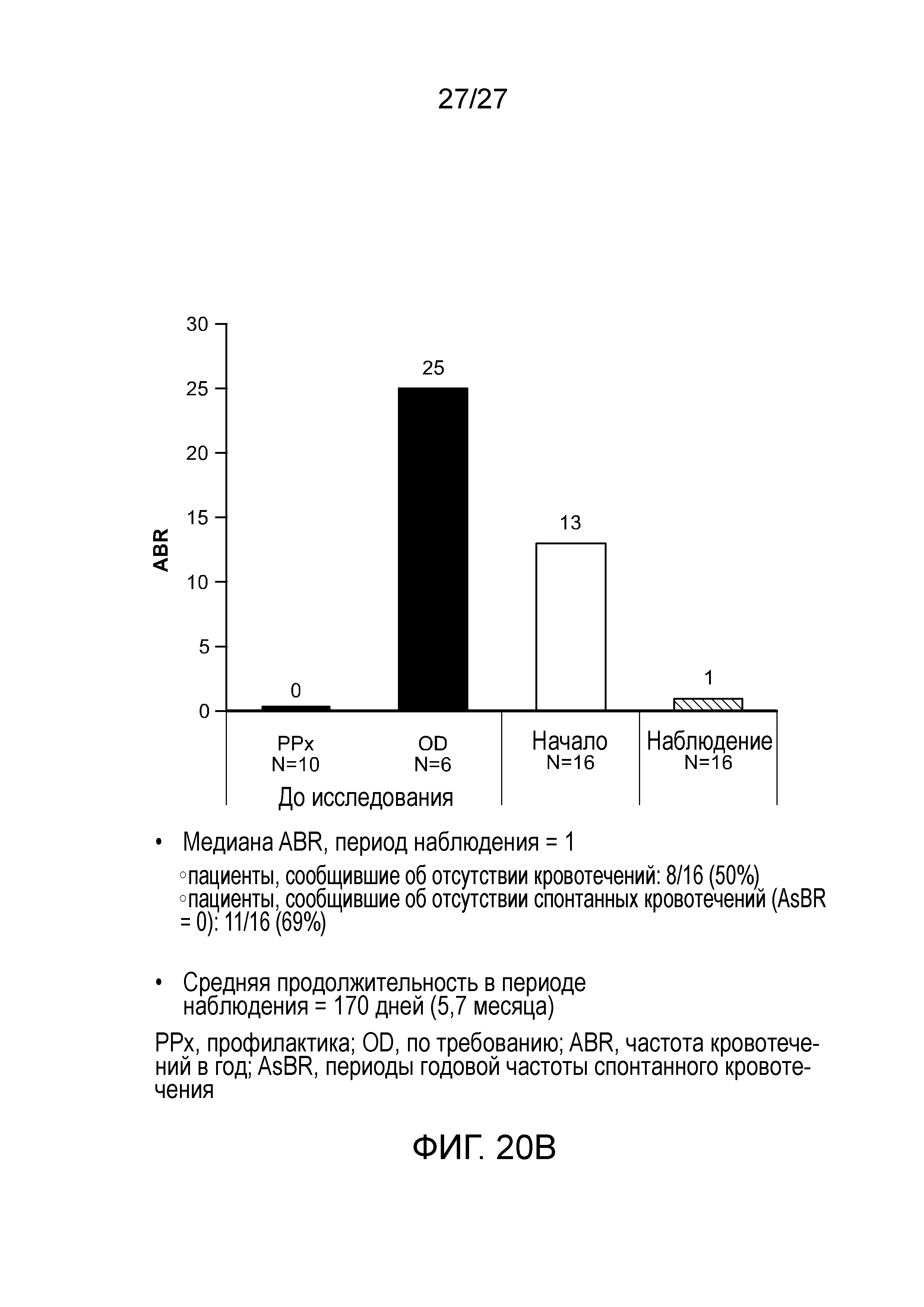
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту уменьшает частоту кровотечений в год (ABR) у субъекта на от приблизительно 80 до приблизительно 95% по сравнению со средней анамнестической зарегистрированной ABR у субъектов, имеющих расстройство, которому могло бы помочь снижение экспрессии Serpinc1, которым не вводили средство двухцепочечной RNAi.
В одном варианте осуществления средство двухцепочечной RNAi вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном варианте осуществления субъектом является человек.
Расстройство может представлять собой расстройство, сопровождающееся кровоточивостью, такое как приобретенное расстройство, сопровождающееся кровоточивостью, или врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилия, например, гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления субъект страдает гемофилией A и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией B и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией C и является субъектом с ингибиторами.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами.
В одном варианте осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2'-дезокси-2'-фтор модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотида, нуклеотида с удаленным азотистым основанием, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинового нуклеотида, фосфорамидата и нуклеотида, содержащего искусственное основание.
Область комплементарности может составлять по меньшей мере 17 нуклеотидов в длину или 19 нуклеотидов в длину.
В одном варианте осуществления область комплементарности составляет между 19 и 21 нуклеотидом в длину. В другом варианте осуществления область комплементарности составляет между 21 и 23 нуклеотидами в длину.
В одном варианте осуществления каждая нить составляет не более чем 30 нуклеотидов в длину.
По меньшей мере одна нить средства двухцепочечной RNAi может содержать 3' «липкий» конец по меньшей мере из 1 нуклеотида или 3' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна цепь средства RNAi содержит 5' «липкий» конец по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна цепь содержит 5' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления и 3'-, и 5'-конец одной нити средства RNAi содержат «липкий» конец по меньшей мере из 1 нуклеотида.
В некоторых вариантах осуществления лигандом является N-ацетилгалактозамин (GalNAc). Лиганд может представлять собой один или более GalNAc, прикрепленный к средству RNAi через моновалентный, бивалентный или трехвалентный разветвленный линкер. Лиганд можно конъюгировать с 3'-концом смысловой нити средства двухцепочечной RNAi, 5'-концом смысловой нити средства двухцепочечной RNAi, 3'-концом антисмысловой нити средства двухцепочечной RNAi или 5'-концом антисмысловой нити средства двухцепочечной RNAi.
В некоторых вариантах осуществления средства двухцепочечной RNAi изобретения содержат множество, например, 2, 3, 4, 5 или 6 GalNAc, каждый из которых независимо прикреплен к множеству нуклеотидов средства двухцепочечной RNAi через множество моновалентных линкеров.
В некоторых вариантах осуществления лиганд представляет собой

В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления X представляет собой O.
В одном варианте осуществления область комплементарности состоит из нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15).
В одном варианте осуществления средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3'(SEQ ID NO: 16), а антисмысловая нить содержит нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15).
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), а антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной RNAi, которая содержит смысловую нить и антисмысловую нить, образующие двухцепочечную область, при этом смысловая нить содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:1, и антисмысловая нить содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:5, при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной RNAi, при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, образующие двухцепочечную область, при этом смысловая нить содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:1, и антисмысловая нить содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности SEQ ID NO:5, при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами.
В другом варианте осуществления смысловая нить и антисмысловая нить содержат область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от любой одной из последовательностей, перечисленных в любой одной из таблиц 2 и 3.
В некоторых вариантах осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2'-O-метил модифицированного нуклеотида, 2'-фтор модифицированного нуклеотида, нуклеотида, содержащего 5'-тиофосфатную группу, и концевого нуклеотида, связанного с производным холестерила или бисдециламидной группы додекановой кислоты. В дополнительных вариантах осуществления модифицированный нуклеотид выбирают из группы, состоящей из 2'-дезокси-2'-фтор модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотид, неблокированного нуклеотида, конформационно ограниченного нуклеотида, ограниченного этилом нуклеотида, нуклеотида с удаленным азотистым основанием, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, 2'-O-аллил модифицированного нуклеотида, 2'-C-аллил модифицированного нуклеотида, 2'-гидроксил модифицированного нуклеотида, морфолинового нуклеотида, фосфорамидата и нуклеотида, содержащего искусственное основание.
В другом варианте осуществления средства двухцепочечной RNAi, по меньшей мере одна цепь содержит 3' «липкий» конец по меньшей мере из 1 нуклеотида. В другом варианте осуществления по меньшей мере одна цепь содержит 3' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна цепь средства RNAi содержит 5' «липкий» конец по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна цепь содержит 5' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления и 3'-, и 5'-конец одной нити средства RNAi содержит «липкий» конец по меньшей мере из 1 нуклеотида.
В другом аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной RNAi, при этом средство двухцепочечной RNAi содержит смысловую нить, комплементарную антисмысловой нити, при этом антисмысловая нить содержит область комплементарности части мРНК, кодирующей Serpinc1, при этом каждая нить составляет в длину от приблизительно 14 до приблизительно 30 нуклеотидов, при этом средство двухцепочечной RNAi представлено формулой (IIIe):
смысловая: 5' -Na -Y Y Y-Na-3'
антисмысловая: 3' np'-Na'-Y'Y'Y'-Na'-5' (IIIe)
при этом:
np' представляет собой «липкий» конец из 2 нуклеотидов, а каждый нуклеотид внутри np' связан с соседним нуклеотидом через тиофосфатную связь;
каждый Na и Na' независимо представляет олигонуклеотидную последовательность, содержащую 0-25 нуклеотидов, которые являются либо модифицированными, либо немодифицированными, или их комбинации, причем каждая последовательность содержит по меньшей мере два разных модифицированных нуклеотида;
YYY и Y'Y'Y' каждый независимо представляет один мотив трех идентичных модификаций трех последовательных нуклеотидов, и при этом модификации представляют собой 2'-O-метил или 2'-фтор модификации;
при этом смысловая нить и антисмысловая нить каждая независимо содержат две тиофосфатные связи на 5'-конце; и
при этом смысловую нить конъюгируют по меньшей мере с одним лигандом, при этом лиганд представляет собой одно или более производное GalNAc, прикрепленное через моновалентный, бивалентный или трехвалентный разветвленный линкер,
тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной RNAi, при этом средство двухцепочечной RNAi содержит смысловую нить, комплементарную антисмысловой нити, при этом антисмысловая нить содержит область комплементарности части мРНК, кодирующей Serpinc1, при этом каждая нить составляет в длину от приблизительно 14 до приблизительно 30 нуклеотидов, при этом средство двухцепочечной RNAi представлено формулой (IIIe):
смысловая: 5' -Na -Y Y Y-Na-3'
антисмысловая: 3' np'-Na'-Y'Y'Y'-Na'-5' (IIIe)
при этом:
np' представляет собой «липкий» конец из 2 нуклеотидов, а каждый нуклеотид внутри np' связан с соседним нуклеотидом через тиофосфатную связь;
каждый Na и Na' независимо представляет олигонуклеотидную последовательность, содержащую 0-25 нуклеотидов, которые являются либо модифицированными, либо немодифицированными или их комбинациями, причем каждая последовательность содержит по меньшей мере два разных модифицированных нуклеотида;
YYY и Y'Y'Y' каждый независимо представляют один мотив трех идентичных модификаций трех последовательных нуклеотидов, и при этом модификации представляют собой 2'-O-метил или 2'-фтор модификации;
при этом смысловая нить и антисмысловая нить каждая независимо содержат две тиофосфатные связи на 5'-конце; и
при этом смысловую нить конъюгируют по меньшей мере с одним лигандом, при этом лиганд представляет собой одно или более производное GalNAc, прикрепленное через моновалентный, бивалентный и трехвалентный разветвленный линкер,
тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту в разовой дозе или в двух или более дозах, например, в 3, 4, 5 или 6 дозах.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц, однократно каждые пять недель, каждые шесть недель, однократно каждые семь недель, каждые 2 месяца, каждые три месяца или при необходимости.
Средство двухцепочечной RNAi можно вводить субъекту в виде, например, фиксированной дозы, составляющей между приблизительно 25 мг и приблизительно 100 мг, например, между приблизительно 25 мг и приблизительно 95 мг, между приблизительно 25 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 85 мг, между приблизительно 25 мг и приблизительно 80 мг, между приблизительно 25 мг и приблизительно 75 мг, между приблизительно 25 мг и приблизительно 70 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 25 мг и приблизительно 60 мг, между приблизительно 25 мг и приблизительно 50 мг, между приблизительно 50 мг и приблизительно 100 мг, между приблизительно 50 мг и приблизительно 95 мг, между приблизительно 50 мг и приблизительно 90 мг, между приблизительно 50 мг и приблизительно 85 мг, между приблизительно 50 мг и приблизительно 80 мг, между приблизительно 30 мг и приблизительно 100 мг, между приблизительно 30 мг и приблизительно 90 мг, между приблизительно 30 мг и приблизительно 80 мг, между приблизительно 40 мг и приблизительно 100 мг, между приблизительно 40 мг и приблизительно 90 мг, между приблизительно 40 мг и приблизительно 80 мг, между приблизительно 60 мг и приблизительно 100 мг, между приблизительно 60 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 55 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 30 мг и приблизительно 95 мг, между приблизительно 30 мг и приблизительно 85 мг, между приблизительно 30 мг и приблизительно 75 мг, между приблизительно 30 мг и приблизительно 65 мг, между приблизительно 30 мг и приблизительно 55 мг, между приблизительно 40 мг и приблизительно 95 мг, между приблизительно 40 мг и приблизительно 85 мг, между приблизительно 40 мг и приблизительно 75 мг, между приблизительно 40 мг и приблизительно 65 мг, между приблизительно 40 мг и приблизительно 55 мг, или между приблизительно 45 мг и приблизительно 95 мг as например, фиксированной дозы в течение одного, двух, трех, четырех, пяти, шести, семи, восьми месяцев или более.
В некоторых вариантах осуществления средство двухцепочечной RNAi можно вводить субъекту в виде фиксированной дозы, составляющей приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг.
Субъектом может быть человек, такой как человек, имеющий расстройство, сопровождающееся кровоточивостью, такое как приобретенное расстройство, сопровождающееся кровоточивостью, или врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилия, например, гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления субъект страдает гемофилией A и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией B и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией C и является субъектом с ингибиторами.
В одном варианте осуществления введение субъекту средства двухцепочечной RNAi вызывает увеличение свертываемости крови и/или уменьшает накопление белка Serpinc1.
В одном варианте осуществления способы дополнительно предусматривают измерение уровней тромбина у субъекта.
Средство двухцепочечной RNAi можно вводить подкожно или внутривенно.
В одном варианте осуществления по существу все нуклеотиды антисмысловой нити и по существу все нуклеотиды смысловой нити средства RNAi содержат модификацию, выбираемую из группы, состоящей из 2'-O-метил модификации и 2'-фтор модификации. В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой цепи средства RNAi являются модифицированными нуклеотидами.
В одном варианте осуществления мотив YYY возникает на участке расщепления смысловой нити или около него.
В одном варианте осуществления мотив Y'Y'Y' возникает в позициях 11, 12 и 13 антисмысловой нити от 5'-конца.
Двухцепочечная область может составлять 15-30 нуклеотидных пар в длину, 17-23 нуклеотидных пар в длину, 17-25 нуклеотидных пар в длину, 23-27 нуклеотидных пар в длину,19-21 нуклеотидных пар в длину или 21-23 нуклеотидных пар в длину.
Каждая нить может иметь 15-30 нуклеотидов или 19-30 нуклеотидов.
В одном варианте осуществления смысловая нить имеет всего 21 нуклеотид, и антисмысловая нить имеет всего 23 нуклеотида.
В одном варианте осуществления лиганд представляет собой
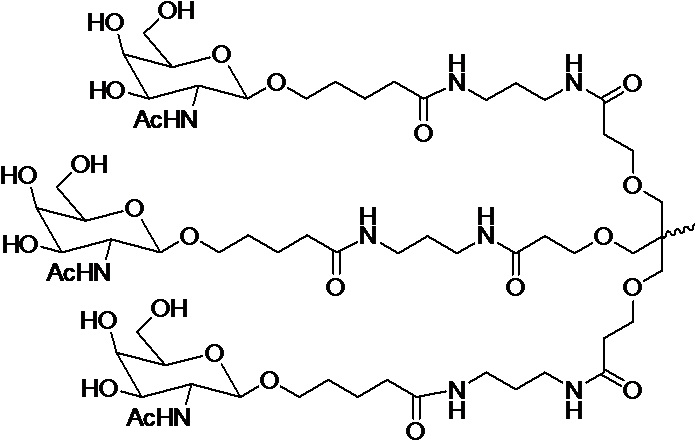
В одном варианте осуществления лиганд прикреплен к 3'-концу смысловой нити.
В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

при этом X представляет собой O или S.
В одном варианте осуществления пара оснований в 1 позиции 5'-конца антисмысловой нити дуплекса представляет собой пару оснований AU.
В одном варианте осуществления средство RNAi представляет собой AD-57213 ((Смысловой (от 5' к 3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf (SEQ ID NO:13); Антисмысловой (от 5' к 3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G или U; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь)).
В одном варианте осуществления средство вводят в виде фармацевтической композиции. В одном варианте осуществления средство RNAi вводят в незабуференном растворе, таком как солевой раствор или вода.
В другом варианте осуществления миРНК вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3'(SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3'(SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
Средство двухцепочечной RNAi можно вводить субъекту в двух или более дозах.
В некоторых вариантах осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц, однократно каждые пять недель, каждые шесть недель, однократно каждые семь недель, каждые 2 месяца, каждые три месяца или при необходимости.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц. В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые шесть недель. В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые 2 месяца. В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые три месяца.
Средство двухцепочечной RNAi можно вводить субъекту в виде, например, фиксированной дозы, составляющей между приблизительно 25 мг и приблизительно 100 мг, например, между приблизительно 25 мг и приблизительно 95 мг, между приблизительно 25 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 85 мг, между приблизительно 25 мг и приблизительно 80 мг, между приблизительно 25 мг и приблизительно 75 мг, между приблизительно 25 мг и приблизительно 70 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 25 мг и приблизительно 60 мг, между приблизительно 25 мг и приблизительно 50 мг, между приблизительно 50 мг и приблизительно 100 мг, между приблизительно 50 мг и приблизительно 95 мг, между приблизительно 50 мг и приблизительно 90 мг, между приблизительно 50 мг и приблизительно 85 мг, между приблизительно 50 мг и приблизительно 80 мг, между приблизительно 30 мг и приблизительно 100 мг, между приблизительно 30 мг и приблизительно 90 мг, между приблизительно 30 мг и приблизительно 80 мг, между приблизительно 40 мг и приблизительно 100 мг, между приблизительно 40 мг и приблизительно 90 мг, между приблизительно 40 мг и приблизительно 80 мг, между приблизительно 60 мг и приблизительно 100 мг, между приблизительно 60 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 55 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 30 мг и приблизительно 95 мг, между приблизительно 30 мг и приблизительно 85 мг, между приблизительно 30 мг и приблизительно 75 мг, между приблизительно 30 мг и приблизительно 65 мг, между приблизительно 30 мг и приблизительно 55 мг, между приблизительно 40 мг и приблизительно 95 мг, между приблизительно 40 мг и приблизительно 85 мг, между приблизительно 40 мг и приблизительно 75 мг, между приблизительно 40 мг и приблизительно 65 мг, между приблизительно 40 мг и приблизительно 55 мг, или между приблизительно 45 мг и приблизительно 95 мг.
В некоторых вариантах осуществления средство двухцепочечной RNAi можно вводить в виде фиксированной дозы, составляющей приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг.
В некоторых вариантах осуществления средство двухцепочечной RNAi вводят субъекту в виде фиксированной дозы, составляющей приблизительно 25 мг; или в виде фиксированной дозы, составляющей приблизительно 50 мг; или в виде фиксированной дозы, составляющей приблизительно 80 мг; или в виде фиксированной дозы, составляющей приблизительно 100 мг.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту снижает у субъекта активность Serpinc1 на от приблизительно 70% до приблизительно 95%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или более чем на 95%.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту повышает пиковые уровни тромбина у субъекта до диапазона пиковых уровней тромбина у субъекта, у которого нет расстройства, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для доведения пиковых уровней выработки тромбина у субъекта до приблизительно такого же уровня, который достигается посредством введения субъекту фактора VIII.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для достижения пиковых уровней выработки тромбина выше, чем приблизительно 40%, 45%, 50%, 55%, или выше, чем приблизительно 60% у субъекта.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту уменьшает частоту кровотечений в год (ABR) у субъекта на от приблизительно 80% до приблизительно 95%, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90% или от приблизительно 90% до приблизительно 95% по сравнению со средней анамнестической зарегистрированной ABR у субъектов, имеющих расстройство, которому могло бы помочь снижение экспрессии Serpinc1, которым не вводили средство двухцепочечной RNAi.
В одном варианте осуществления средство двухцепочечной RNAi вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном варианте осуществления субъектом является человек.
Расстройство может представлять собой расстройство, сопровождающееся кровоточивостью, такое как приобретенное расстройство, сопровождающееся кровоточивостью, или врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилия, например, гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления субъект страдает гемофилией A и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией B и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией C и является субъектом с ингибиторами.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами.
В одном варианте осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2'-дезокси-2'-фтор модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотида, нуклеотида с удаленным азотистым основанием, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинового нуклеотида, фосфорамидата и нуклеотида, содержащего искусственное основание.
Область комплементарности может составлять по меньшей мере 17 нуклеотидов в длину или 19 нуклеотидов в длину.
В одном варианте осуществления область комплементарности составляет между 19 и 21 нуклеотидом в длину. В другом варианте осуществления область комплементарности составляет между 21 и 23 нуклеотидами в длину.
В одном варианте осуществления каждая нить составляет не более чем 30 нуклеотидов в длину.
По меньшей мере одна цепь средства двухцепочечной RNAi может содержать 3' «липкий» конец по меньшей мере из 1 нуклеотида, или 3' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна цепь средства RNAi содержит 5' «липкий» конец по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна цепь содержит 5' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления и 3'-, и 5'-конец одной нити средства RNAi содержит «липкий» конец по меньшей мере из 1 нуклеотида.
В некоторых вариантах осуществления лигандом является N-ацетилгалактозамин (GalNAc). Лиганд может представлять собой один или более GalNAc, прикрепленный к средству RNAi через моновалентный, бивалентный или трехвалентный разветвленный линкер. Лиганд можно конъюгировать с 3'-концом смысловой нити средства двухцепочечной RNAi, 5'-концом смысловой нити средства двухцепочечной RNAi, 3'-концом антисмысловой нити средства двухцепочечной RNAi или 5'-концом антисмысловой нити средства двухцепочечной RNAi.
В некоторых вариантах осуществления средства двухцепочечной RNAi изобретения содержат множество, например, 2, 3, 4, 5 или 6, GalNAc, каждый из которых независимо прикреплен к множеству нуклеотидов средства двухцепочечной RNAi через множество моновалентных линкеров.
В некоторых вариантах осуществления лиганд представляет собой

В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления X представляет собой O.
В одном варианте осуществления область комплементарности состоит из нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3'(SEQ ID NO: 15).
В одном варианте осуществления средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3'(SEQ ID NO: 16), и антисмысловая нить содержит нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3'(SEQ ID NO: 15).
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь.
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь; и при этом смысловую нить конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления средство вводят в виде фармацевтической композиции. В одном варианте осуществления средство RNAi вводят в незабуференном растворе, таком как физиологический солевой раствор или вода.
В другом варианте осуществления миРНК вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В дополнительном аспекте в настоящем изобретении предоставлены наборы для осуществления способов изобретения. Наборы могут содержать средство RNAi изобретения и инструкции по применению, и необязательно средство для введения средства RNAi субъекту.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 50 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 50 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту снижает у субъекта активность Serpinc1 на от приблизительно 70% до приблизительно 95%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или более чем на 95%.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту повышает пиковые уровни тромбина у субъекта до диапазона пиковых уровней тромбина у субъекта, у которого нет расстройства, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для доведения пиковых уровней выработки тромбина у субъекта до приблизительно такого же уровня, который достигается посредством введения субъекту фактора VIII.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для достижения пиковых уровней выработки тромбина выше, чем приблизительно 40%, 45%, 50%, 55%, или выше чем приблизительно 60% у субъекта.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту уменьшает частоту кровотечений в год (ABR) у субъекта на от приблизительно 80% до приблизительно 95%, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90% или от приблизительно 90% до приблизительно 95% по сравнению со средней анамнестической зарегистрированной ABR у субъектов, имеющих расстройство, которому могло бы помочь снижение экспрессии Serpinc1, которым не вводили средство двухцепочечной RNAi.
В одном варианте осуществления средство двухцепочечной RNAi вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном варианте осуществления субъектом является человек.
Расстройство может представлять собой расстройство, сопровождающееся кровоточивостью, такое как приобретенное расстройство, сопровождающееся кровоточивостью, или врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилия, например, гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления субъект страдает гемофилией A и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией B и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией C и является субъектом с ингибиторами.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту длительно.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами.
В одном варианте осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2'-дезокси-2'-фтор модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотида, нуклеотида с удаленным азотистым основанием, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинового нуклеотида, фосфорамидата и нуклеотида, содержащего искусственное основание.
Область комплементарности может составлять по меньшей мере 17 нуклеотидов в длину или 19 нуклеотидов в длину.
В одном варианте осуществления область комплементарности составляет между 19 и 21 нуклеотидом в длину. В другом варианте осуществления область комплементарности составляет между 21 и 23 нуклеотидами в длину.
В одном варианте осуществления каждая нить составляет не более чем 30 нуклеотидов в длину.
По меньшей мере одна цепь средства двухцепочечной RNAi может содержать 3' «липкий» конец по меньшей мере из 1 нуклеотида, или 3' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна цепь средства RNAi содержит 5' «липкий» конец по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна цепь содержит 5' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления и 3'-, и 5'-конец одной нити средства RNAi содержит «липкий» конец по меньшей мере из 1 нуклеотида.
В некоторых вариантах осуществления лигандом является N-ацетилгалактозамин (GalNAc). Лиганд может представлять собой один или более GalNAc, прикрепленный к средству RNAi через моновалентный, бивалентный или трехвалентный разветвленный линкер. Лиганд можно конъюгировать с 3'-концом смысловой нити средства двухцепочечной RNAi, 5'-концом смысловой нити средства двухцепочечной RNAi, 3'-концом антисмысловой нити средства двухцепочечной RNAi или 5'-концом антисмысловой нити средства двухцепочечной RNAi.
В некоторых вариантах осуществления средства двухцепочечной RNAi изобретения содержат множество, например, 2, 3, 4, 5 или 6, GalNAc, каждый из которых независимо прикреплен к множеству нуклеотидов средства двухцепочечной RNAi через множество моновалентных линкеров.
В некоторых вариантах осуществления лиганд представляет собой

В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления X представляет собой O.
В одном варианте осуществления область комплементарности состоит из нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15).
В одном варианте осуществления средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3'(SEQ ID NO: 16), и антисмысловая нить содержит нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15).
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь.
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь; и при этом смысловую нить конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления средство вводят в виде фармацевтической композиции. В одном варианте осуществления средство RNAi вводят в незабуференном растворе, таком как физиологический солевой раствор или вода.
В другом варианте осуществления миРНК вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В дополнительном аспекте в настоящем изобретении предоставлены наборы для осуществления способов изобретения. Наборы могут содержать средство RNAi изобретения и инструкции по применению, и необязательно средство для введения средства RNAi субъекту.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 50 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 50 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3'(SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту снижает у субъекта активность Serpinc1 на от приблизительно 70% до приблизительно 95%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или более чем на 95%.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту повышает пиковые уровни тромбина у субъекта до диапазона пиковых уровней тромбина у субъекта, у которого нет расстройства, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для доведения пиковых уровней выработки тромбина у субъекта до приблизительно такого же уровня, который достигается посредством введения субъекту фактора VIII.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для достижения пиковых уровней выработки тромбина выше, чем приблизительно 40%, 45%, 50%, 55%, или выше, чем приблизительно 60% у субъекта.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту уменьшает частоту кровотечений в год (ABR) у субъекта на от приблизительно 80% до приблизительно 95%, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90%, или от приблизительно 90% до приблизительно 95% по сравнению со средней анамнестической зарегистрированной ABR у субъектов, имеющих расстройство, которому могло бы помочь снижение экспрессии Serpinc1, которым не вводили средство двухцепочечной RNAi.
В одном варианте осуществления средство двухцепочечной RNAi вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном варианте осуществления субъектом является человек.
Расстройство может представлять собой расстройство, сопровождающееся кровоточивостью, такое как приобретенное расстройство, сопровождающееся кровоточивостью, или врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилия, например, гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления субъект страдает гемофилией A и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией B и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией C и является субъектом с ингибиторами.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту длительно.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами.
В одном варианте осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2'-дезокси-2'-фтор модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотида, нуклеотида с удаленным азотистым основанием, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинового нуклеотида, фосфорамидата и нуклеотида, содержащего искусственное основание.
В одном варианте осуществления каждая нить составляет не более чем 30 нуклеотидов в длину.
По меньшей мере одна цепь средства двухцепочечной RNAi может содержать 3' «липкий» конец по меньшей мере из 1 нуклеотида, или 3' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна цепь средства RNAi содержит 5' «липкий» конец по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна цепь содержит 5' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления и 3'-, и 5'-конец одной нити средства RNAi содержит «липкий» конец по меньшей мере из 1 нуклеотида.
В некоторых вариантах осуществления лигандом является N-ацетилгалактозамин (GalNAc). Лиганд может представлять собой один или более GalNAc, прикрепленный к средству RNAi через моновалентный, бивалентный или трехвалентный разветвленный линкер. Лиганд можно конъюгировать с 3'-концом смысловой нити средства двухцепочечной RNAi, 5'-концом смысловой нити средства двухцепочечной RNAi, 3'-концом антисмысловой нити средства двухцепочечной RNAi или 5'-концом антисмысловой нити средства двухцепочечной RNAi.
В некоторых вариантах осуществления средства двухцепочечной RNAi изобретения содержат множество, например, 2, 3, 4, 5 или 6, GalNAc, каждый из которых независимо прикреплен к множеству нуклеотидов средства двухцепочечной RNAi через множество моновалентных линкеров.
В некоторых вариантах осуществления лиганд представляет собой

В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления X представляет собой O.
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь.
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь; и при этом смысловую нить конъюгируют с лигандом, как показано в следующей схеме

В другом варианте осуществления миРНК вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В дополнительном аспекте в настоящем изобретении предоставлены наборы для осуществления способов изобретения. Наборы могут содержать средство RNAi изобретения и инструкции по применению, и необязательно средство для введения средства RNAi субъекту.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего гемофилию, например, гемофилию A (с ингибиторами или без ингибиторов), гемофилию B (с ингибиторами или без ингибиторов) или гемофилию C (с ингибиторами или без ингибиторов). Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 50 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего гемофилию, например, гемофилию A (с ингибиторами или без ингибиторов), гемофилию B (с ингибиторами или без ингибиторов) или гемофилию C (с ингибиторами или без ингибиторов). Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 50 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего гемофилию, например, гемофилию A (с ингибиторами или без ингибиторов), гемофилию B (с ингибиторами или без ингибиторов) или гемофилию C (с ингибиторами или без ингибиторов). Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего гемофилию, например, гемофилию A (с ингибиторами или без ингибиторов), гемофилию B (с ингибиторами или без ингибиторов) или гемофилию C (с ингибиторами или без ингибиторов). Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего гемофилию, например, гемофилию A (с ингибиторами или без ингибиторов), гемофилию B (с ингибиторами или без ингибиторов) или гемофилию C (с ингибиторами или без ингибиторов). Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 50 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего гемофилию, например, гемофилию A (с ингибиторами или без ингибиторов), гемофилию B (с ингибиторами или без ингибиторов) или гемофилию C (с ингибиторами или без ингибиторов). Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 50 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего гемофилию, например, гемофилию A (с ингибиторами или без ингибиторов), гемофилию B (с ингибиторами или без ингибиторов) или гемофилию C (с ингибиторами или без ингибиторов). Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего гемофилию, например, гемофилию A (с ингибиторами или без ингибиторов), гемофилию B (с ингибиторами или без ингибиторов) или гемофилию C (с ингибиторами или без ингибиторов). Способы предусматривают введение субъекту фиксированной дозы, составляющей приблизительно 80 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом фиксированную дозу средства двухцепочечной RNAi вводят субъекту приблизительно один раз в месяц, при этом средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит нуклеотидную последовательность 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту снижает у субъекта активность Serpinc1 на от приблизительно 70% до приблизительно 95%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или более чем на 95%.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту повышает пиковые уровни тромбина у субъекта до диапазона пиковых уровней тромбина у субъекта, у которого нет расстройства, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для доведения пиковых уровней выработки тромбина у субъекта до приблизительно такого же уровня, который достигается посредством введения субъекту фактора VIII.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для достижения пиковых уровней выработки тромбина выше, чем приблизительно 40%, 45%, 50%, 55%, или выше, чем приблизительно 60% у субъекта.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту уменьшает частоту кровотечений в год (ABR) у субъекта на от приблизительно 80% до приблизительно 95%, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90% или от приблизительно 90% до приблизительно 95% по сравнению со средней анамнестической зарегистрированной ABR у субъектов, имеющих расстройство, которому могло бы помочь снижение экспрессии Serpinc1, которым не вводили средство двухцепочечной RNAi.
В одном варианте осуществления средство двухцепочечной RNAi вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном варианте осуществления субъектом является человек.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту длительно.
В некоторых вариантах осуществления лиганд представляет собой

В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления X представляет собой O.
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь; и при этом смысловую нить конъюгируют с лигандом, как показано в следующей схеме

В другом варианте осуществления миРНК вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В дополнительном аспекте в настоящем изобретении предоставлены наборы для осуществления способов изобретения. Наборы могут содержать средство RNAi изобретения и инструкции по применению, и необязательно средство для введения средства RNAi субъекту.
В одном аспекте в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
Средство двухцепочечной RNAi можно вводить субъекту в двух или более дозах.
В некоторых вариантах осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц, однократно каждые пять недель, каждые шесть недель, однократно каждые семь недель, каждые 2 месяца, каждые три месяца или при необходимости.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц. В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые шесть недель. В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые 2 месяца. В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые три месяца.
Средство двухцепочечной RNAi можно вводить субъекту в виде, например, фиксированной дозы, составляющей между приблизительно 50 мг и приблизительно 90 мг, между приблизительно 50 мг и приблизительно 85 мг, между приблизительно 50 мг и приблизительно 80 мг, между приблизительно 40 мг и приблизительно 80 мг, между приблизительно 60 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 55 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 40 мг и приблизительно 85 мг, между приблизительно 40 мг и приблизительно 75 мг, между приблизительно 40 мг и приблизительно 65 мг, или между приблизительно 40 мг и приблизительно 55 мг.
В некоторых вариантах осуществления средство двухцепочечной RNAi можно вводить в виде фиксированной дозы, составляющей приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг или приблизительно 90 мг.
В некоторых вариантах осуществления средство двухцепочечной RNAi вводят субъекту в виде фиксированной дозы, составляющей приблизительно 40 мг; или в виде фиксированной дозы, составляющей приблизительно 50 мг; или в виде фиксированной дозы, составляющей приблизительно 80 мг; или в виде фиксированной дозы, составляющей приблизительно 90 мг.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту снижает у субъекта активность Serpinc1 на от приблизительно 70% до приблизительно 95%.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту повышает пиковые уровни тромбина у субъекта до диапазона пиковых уровней тромбина у субъекта, у которого нет расстройства, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для доведения пиковых уровней выработки тромбина у субъекта до приблизительно такого же уровня, который достигается посредством введения субъекту фактора VIII.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для достижения пиковых уровней выработки тромбина у субъекта выше, чем приблизительно 40%.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту уменьшает частоту кровотечений в год (ABR) у субъекта на от приблизительно 80 до приблизительно 95% по сравнению со средней анамнестической зарегистрированной ABR у субъектов, имеющих расстройство, которому могло бы помочь снижение экспрессии Serpinc1, которым не вводили средство двухцепочечной RNAi.
В одном варианте осуществления средство двухцепочечной RNAi вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном варианте осуществления субъектом является человек.
Расстройство может представлять собой расстройство, сопровождающееся кровоточивостью, такое как приобретенное расстройство, сопровождающееся кровоточивостью, или врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилия, например, гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления субъект страдает гемофилией A и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией B и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией C и является субъектом с ингибиторами.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами.
В одном варианте осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2'-дезокси-2'-фтор модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотида, нуклеотида с удаленным азотистым основанием, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинового нуклеотида, фосфорамидата и нуклеотида, содержащего искусственное основание.
Область комплементарности может составлять по меньшей мере 17 нуклеотидов в длину или 19 нуклеотидов в длину.
В одном варианте осуществления область комплементарности составляет между 19 и 21 нуклеотидом в длину. В другом варианте осуществления область комплементарности составляет между 21 и 23 нуклеотидами в длину.
В одном варианте осуществления каждая нить составляет не более чем 30 нуклеотидов в длину.
По меньшей мере одна цепь средства двухцепочечной RNAi может содержать 3' «липкий» конец по меньшей мере из 1 нуклеотида, или 3' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна цепь средства RNAi содержит 5' «липкий» конец по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна цепь содержит 5' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления и 3'-, и 5'-конец одной нити средства RNAi содержит «липкий» конец по меньшей мере из 1 нуклеотида.
В некоторых вариантах осуществления лигандом является N-ацетилгалактозамин (GalNAc). Лиганд может представлять собой один или более GalNAc, прикрепленный к средству RNAi через моновалентный, бивалентный или трехвалентный разветвленный линкер. Лиганд можно конъюгировать с 3'-концом смысловой нити средства двухцепочечной RNAi, 5'-концом смысловой нити средства двухцепочечной RNAi, 3'-концом антисмысловой нити средства двухцепочечной RNAi, или 5'-концом антисмысловой нити средства двухцепочечной RNAi.
В некоторых вариантах осуществления средства двухцепочечной RNAi изобретения содержат множество, например, 2, 3, 4, 5 или 6, GalNAc, каждый из которых независимо прикреплен к множеству нуклеотидов средства двухцепочечной RNAi через множество моновалентных линкеров.
В некоторых вариантах осуществления лиганд представляет собой

В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления X представляет собой O.
В одном варианте осуществления область комплементарности состоит из нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15).
В одном варианте осуществления средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15).
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь.
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь; и при этом смысловую нить конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления средство вводят в виде фармацевтической композиции. В одном варианте осуществления средство RNAi вводят в незабуференном растворе, таком как физиологический солевой раствор или вода.
В другом варианте осуществления миРНК вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В дополнительном аспекте в настоящем изобретении предоставлены наборы для осуществления способов изобретения. Наборы могут содержать средство RNAi изобретения и инструкции по применению, и необязательно средство для введения средства RNAi субъекту.
В одном аспекте в настоящем изобретении предоставлены способы подавления экспрессии Serpinc1 у субъекта. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
В другом аспекте в настоящем изобретении предоставлены способы подавления экспрессии Serpinc1 у субъекта. Способы предусматривают введение субъекту фиксированной дозы от приблизительно 40 мг до приблизительно 90 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), при этом средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом средство двухцепочечной RNAi содержит лиганд, например, смысловую нить средства двухцепочечной RNAi конъюгируют с лигандом, прикрепленным к 3'-концу смысловой нити.
Средство двухцепочечной RNAi можно вводить субъекту в двух или более дозах.
В некоторых вариантах осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц, однократно каждые пять недель, каждые шесть недель, однократно каждые семь недель, каждые 2 месяца, каждые три месяца или при необходимости.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту один раз в месяц. В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые шесть недель. В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые 2 месяца. В другом варианте осуществления средство двухцепочечной RNAi вводят субъекту каждые три месяца.
Средство двухцепочечной RNAi можно вводить субъекту в виде, например, фиксированной дозы, составляющей между приблизительно 50 мг и приблизительно 90 мг, между приблизительно 50 мг и приблизительно 85 мг, между приблизительно 50 мг и приблизительно 80 мг, между приблизительно 40 мг и приблизительно 80 мг, между приблизительно 60 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 55 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 40 мг и приблизительно 85 мг, между приблизительно 40 мг и приблизительно 75 мг, между приблизительно 40 мг и приблизительно 65 мг, или между приблизительно 40 мг и приблизительно 55 мг.
В некоторых вариантах осуществления средство двухцепочечной RNAi можно вводить в виде фиксированной дозы, составляющей приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг или приблизительно 90 мг.
В некоторых вариантах осуществления средство двухцепочечной RNAi вводят субъекту в виде фиксированной дозы, составляющей приблизительно 40 мг; или в виде фиксированной дозы, составляющей приблизительно 50 мг; или в виде фиксированной дозы, составляющей приблизительно 80 мг; или в виде фиксированной дозы, составляющей приблизительно 90 мг.
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту снижает у субъекта активность Serpinc1 на от приблизительно 70% до приблизительно 95%.
В одном варианте осуществления субъектом является человек.
В одном варианте осуществления субъект имеет расстройство, которому могло бы помочь снижение экспрессии Serpinc1. Расстройство может представлять собой расстройство, сопровождающееся кровоточивостью, такое как приобретенное расстройство, сопровождающееся кровоточивостью, или врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилия, например, гемофилия A, гемофилия B или гемофилия C.
В одном варианте осуществления субъект страдает гемофилией A и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией B и является субъектом с ингибиторами. В другом варианте осуществления субъект страдает гемофилией C и является субъектом с ингибиторами.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту повышает пиковые уровни тромбина у субъекта до диапазона пиковых уровней тромбина у субъекта, у которого нет расстройства, которому могло бы помочь снижение экспрессии Serpinc1.
В одном варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для доведения пиковых уровней выработки тромбина у субъекта до приблизительно такого же уровня, который достигается посредством введения субъекту фактора VIII.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту достаточно для достижения пиковых уровней выработки тромбина выше чем приблизительно 40% у субъекта.
В другом варианте осуществления введение дозы средства двухцепочечной RNAi субъекту уменьшает частоту кровотечений в год (ABR) у субъекта на от приблизительно 80 до приблизительно 95% по сравнению со средней анамнестической зарегистрированной ABR у субъектов, имеющих расстройство, которому могло бы помочь снижение экспрессии Serpinc1, которым не вводили средство двухцепочечной RNAi.
В одном варианте осуществления средство двухцепочечной RNAi вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В одном варианте осуществления средство двухцепочечной RNAi вводят субъекту подкожно.
В одном варианте осуществления все нуклеотиды смысловой нити и все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами.
В одном варианте осуществления модифицированные нуклеотиды независимо выбирают из группы, состоящей из 2'-дезокси-2'-фтор модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, блокированного нуклеотида, нуклеотида с удаленным азотистым основанием, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинового нуклеотида, фосфорамидата и нуклеотида, содержащего искусственное основание.
Область комплементарности может составлять по меньшей мере 17 нуклеотидов в длину или 19 нуклеотидов в длину.
В одном варианте осуществления область комплементарности составляет между 19 и 21 нуклеотидом в длину. В другом варианте осуществления область комплементарности составляет между 21 и 23 нуклеотидами в длину.
В одном варианте осуществления каждая нить составляет не более чем 30 нуклеотидов в длину.
По меньшей мере одна цепь средства двухцепочечной RNAi может содержать 3' «липкий» конец по меньшей мере из 1 нуклеотида, или 3' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления по меньшей мере одна цепь средства RNAi содержит 5' «липкий» конец по меньшей мере из 1 нуклеотида. В некоторых вариантах осуществления по меньшей мере одна цепь содержит 5' «липкий» конец по меньшей мере из 2 нуклеотидов, например, из 2, 3, 4, 5, 6, 7, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В других вариантах осуществления и 3'-, и 5'-конец одной нити средства RNAi содержит «липкий» конец по меньшей мере из 1 нуклеотида.
В некоторых вариантах осуществления лигандом является N-ацетилгалактозамин (GalNAc). Лиганд может представлять собой один или более GalNAc, прикрепленный к средству RNAi через моновалентный, бивалентный или трехвалентный разветвленный линкер. Лиганд можно конъюгировать с 3'-концом смысловой нити средства двухцепочечной RNAi, 5'-концом смысловой нити средства двухцепочечной RNAi, 3'-концом антисмысловой нити средства двухцепочечной RNAi или 5'-концом антисмысловой нити средства двухцепочечной RNAi.
В некоторых вариантах осуществления средства двухцепочечной RNAi изобретения содержат множество, например, 2, 3, 4, 5 или 6, GalNAc, каждый из которых независимо прикреплен к множеству нуклеотидов средства двухцепочечной RNAi через множество моновалентных линкеров.
В некоторых вариантах осуществления лиганд представляет собой

В одном варианте осуществления средство RNAi конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления X представляет собой O.
В одном варианте осуществления область комплементарности состоит из нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15).
В одном варианте осуществления средство двухцепочечной RNAi содержит смысловую нить, содержащую нуклеотидную последовательность 5'-GGUUAACACCAUUUACUUCAA-3' (SEQ ID NO: 16), и антисмысловую нить, содержащую нуклеотидную последовательность 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15).
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь.
В одном варианте осуществления смысловая нить содержит 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13), и антисмысловая нить содержит 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь; и при этом смысловую нить конъюгируют с лигандом, как показано в следующей схеме

В одном варианте осуществления средство вводят в виде фармацевтической композиции. В одном варианте осуществления средство RNAi вводят в незабуференном растворе, таком как физиологический солевой раствор или вода.
В другом варианте осуществления миРНК вводят с буферным раствором, таким как буферный раствор, содержащий ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS).
В дополнительном аспекте в настоящем изобретении предоставлены наборы для осуществления способов изобретения. Наборы могут содержать средство RNAi изобретения и инструкции по применению, и необязательно средство для введения средства RNAi субъекту.
Краткое описание чертежей
На фиг. 1A представлен график, отображающий действие однократной подкожно введенной дозы 0,03 мг/кг AD-57213 на уровни выработки тромбина в плазме у одного здорового субъекта-человека.
На фиг. 1B представлен график, отображающий действие однократной подкожно введенной дозы 0,03 мг/кг AD-57213 на уровни выработки тромбина в плазме у одного здорового субъекта-человека.
На фиг. 1C представлен график, отображающий действие однократной подкожно введенной дозы 0,03 мг/кг AD-57213 на уровни выработки тромбина в плазме у одного здорового субъекта-человека.
На фиг. 1D представлен график, отображающий действие однократной подкожно введенной дозы 0,03 мг/кг AD-57213 на уровни выработки тромбина в плазме у одного здорового субъекта-человека.
На фиг. 2A представляют собой график, отображающий действие однократной подкожно введенной дозы 0,03 мг/кг AD-57213 на уровни белка (Serpinc1) АТ в плазме у одного здорового субъекта-человека.
На фиг. 2B представляют собой график, отображающий действие однократной подкожно введенной дозы 0,03 мг/кг AD-57213 на уровни белка (Serpinc1) АТ в плазме у одного здорового субъекта-человека.
На фиг. 3 представлен график, отображающий связь между процентным выражением нокаута AT (Serpinc1) и процентным выражением повышения пиковой выработки тромбина у здоровых субъектов, которым подкожно вводили однократную дозу 0,03 мг/кг AD-57213.
На фиг. 4 представлен график, отображающий действие множественных доз 0,015 мг/кг, 0,045 мг/кг, или 0,075 мг/кг AD-57213 на уровни белка (Serpinc1) АТ в плазме у субъектов-людей, имеющих гемофилию A или B.
На фиг. 5A представлен график, отображающий действие множественных доз 0,225 мг/кг, 0,450 мг/кг, 0,900 мг/кг, 1,800 мг/кг, или 80 мг AD-57213 на уровни белка (Serpinc1) АТ в плазме у субъектов-людей, имеющих гемофилию A или B.
На фиг. 5B представлен график, отображающий дозозависимое действие AD-57213 на уровни белка (Serpinc1) АТ в плазме у субъектов-людей.
На фиг. 6A представлен график, отображающий действие множественных доз 0,015 мг/кг или 0,045 мг/кг AD-57213 на пиковые уровни тромбина у субъектов-людей, имеющих гемофилию A или B.
На фиг. 6B представлен график, отображающий действие множественных доз 0,015 мг/кг или 0,045 мг/кг AD-57213 на выработку тромбина в виде процентного изменения по сравнению с исходным уровнем группы у субъектов-людей, имеющих гемофилию A или B.
На фиг. 7 представлен график, отображающий действие множественных доз 0,045 мг/кг AD-57213 на время образования сгустка и время свертывания у одного субъекта, имеющего гемофилию A (субъект 101-009).
На фиг. 8 представлен график, отображающий среднее максимальное снижение AT за счет эквивалентной ежемесячной дозы.
На фиг. 9 представлен график, отображающий действие множественных доз AD-57213 на выработку тромбина за счет квартилей снижения AT.
На фиг. 10A представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта, которому вводили 225 мкг/кг qM AD-57213.
На фиг. 10B представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта, которому вводили 1800 мкг/кг qM AD-57213.
На фиг. 10C представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта, которому вводили 80 мг qM AD-57213.
На фиг. 11 представлен график, отображающий действие множественных доз AD-57213 на эпизоды кровотечения в квартилях снижения AT.
На фиг. 12 представлена таблица, демонстрирующая данные об эпизодах кровотечения для субъектов, включенных в часть C клинического испытания фазы I AD-57213.
На фиг. 13A представлен график, демонстрирующий среднюю частоту кровотечений в год (ABR) перед началом исследования в начальной части исследования и во время наблюдательной части исследования для всех когорт дозирования в части C клинического испытания фазы I AD-57213.
На фиг. 13B представлен график, демонстрирующий среднюю частоту кровотечений в год (ABR) перед началом исследования в начальной части исследования и во время наблюдательной части исследования для когорты 80 мг ежемесячно (80 мг qM x3) в части C клинического испытания фазы I AD-57213.
На фиг. 14A представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта с ингибиторами, которому вводили фиксированную месячную дозу 50 мг AD-57213.
На фиг. 14B представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта с ингибиторами, которому вводили фиксированную месячную дозу 50 мг AD-57213.
На фиг. 14C представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта с ингибиторами, которому вводили фиксированную месячную дозу 50 мг AD-57213.
На фиг. 14D представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта с ингибиторами, которому вводили фиксированную месячную дозу 50 мг AD-57213.
На фиг. 14E представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта с ингибиторами, которому вводили фиксированную месячную дозу 50 мг AD-57213.
На фиг. 14F представлен график, отображающий относительную активность АТ по отношению к пиковой выработке тромбина в процентах, достигнутой с фактором VIII, которую определяли у субъекта с ингибиторами, которому вводили фиксированную месячную дозу 50 мг AD-57213.
На фиг. 15 представлен график, отображающий действие множественных доз 50 мг или 80 мг AD-57213 на среднюю активность АТ (Serpinc1) по сравнению с исходным уровнем у субъектов-людей, имеющих гемофилию A или B с ингибиторами.
На фиг. 16 представлен график, отображающий, что понижающее АТ действие множественных доз 50 мг AD-57213 коррелирует с увеличенной выработкой тромбина у субъекта, имеющего гемофилию A.
На фиг. 17A представлена таблица, демонстрирующая данные об эпизодах кровотечения для субъектов, включенных в часть D клинического испытания фазы I AD-57213.
На фиг. 17B представлен график, демонстрирующий среднюю частоту кровотечений в год (ABR) перед началом исследования, в начальной части исследования и во время наблюдательной части исследования для всех субъектов в части D клинического испытания фазы I AD-57213.
На фиг. 18 представлен график, отображающий действие множественных доз 80 мг AD-57213 на среднюю активность АТ (Serpinc1) по сравнению с исходным уровнем у субъекта-человека, имеющего гемофилию без ингибиторов в фазе II открытого расширенного исследования (OLE) AD-57213.
На фиг. 19A представлен график, отображающий действие множественных доз 50 мг или 80 мг AD-57213 на среднюю активность АТ (Serpinc1) по сравнению с исходным уровнем у субъектов-людей, имеющих гемофилию A или B без ингибиторов в фазе II открытого расширенного исследования (OLE) AD-57213.
На фиг. 19B представлен график, отображающий действие множественных доз 50 мг или 80 мг AD-57213 на пиковую выработку тромбина у субъектов-людей, имеющих гемофилию A или B без ингибиторов в фазе II открытого расширенного исследования (OLE) AD-57213. Заштрихованная часть графика представляет диапазон пиковых уровней тромбина, наблюдаемых у здоровых людей-добровольцев (HV), которым вводили AD-57213, и с менее чем 25% нокаутом АТ в фазе I испытания AD-57213, описанного в примере 1. Пунктирная линия через диапазон HV представляет средний пиковый уровень тромбина, наблюдаемый у здоровых людей-добровольцев (HV) и с менее чем 25% нокаутом АТ, которым вводили AD-57213 в фазе I испытания AD-57213, описанного в примере 1.
На фиг. 20A представлена таблица, демонстрирующая данные об эпизодах кровотечения для субъектов, включенных в фазу II OLE клинического испытания AD-57213.
На фиг. 20B представлен график, демонстрирующий среднюю частоту кровотечений в год (ABR) перед началом исследования, в начальной части исследования и во время наблюдательной части исследования для всех субъектов в фазе II OLE клинического испытания AD-57213.
Подробное описание изобретения
Настоящее изобретение основано по меньшей мере частично на неожиданном открытии, что очень низкие дозы (например, дозы по данным мере примерно в 30 раз ниже, чем дозы, практикуемые в данной области) связанного с GalNAc средства двухцепочечной RNAi, включая конкретные химические модификации, демонстрирует исключительную эффективность для подавления экспрессии Serpinc1, а также исключительную продолжительность подавления экспрессии Serpinc1. Конкретно, низкие дозы средств RNAi, содержащих лиганд GalNAc, в которых по существу все нуклеотиды являются модифицированными нуклеотидами, таких как средство RNAi, содержащее один или более мотивов трех идентичных модификаций трех последовательных нуклеотидов, включая один такой мотив на участке расщепления средств или около него, шесть тиофосфатных связей и лиганд GalNAc, как показано в данном документе, являются исключительно эффективными и продолжительными по подавлению активности гена Serpinc1.
Соответственно, в настоящем изобретении предоставлены способы предотвращения по меньшей мере одного симптома, например, кровотечения, у субъекта, имеющего расстройство, которому могло бы помочь ингибирование или уменьшение экспрессии гена Serpinc1, например, заболевание, ассоциированное с Serpinc1, такое как гемофилия (например, гемофилия A, гемофилия B или гемофилия C), с использованием композиций иРНК, которые воздействуют на опосредованное индуцируемым РНК комплексом сайленсинга (RISC) расщепление транскриптов РНК гена Serpinc1. Настоящее изобретение дополнительные предоставляет способы лечения субъекта, имеющего расстройство, которому могло бы помочь ингибирование или уменьшение экспрессии гена Serpinc1, например, расстройство, сопровождающееся кровоточивостью, такое как гемофилия (например, гемофилия A, гемофилия B или гемофилия C), с использованием композиций иРНК, которые воздействуют на опосредованное индуцируемым РНК комплексом сайленсинга (RISC) расщепление транскриптов РНК гена Serpinc1.
Средства iRNA для применения в способах изобретения, как правило, содержат нить РНК (антисмысловую нить), имеющую область, которая составляет приблизительно 30 нуклеотидов или менее в длину, например, 15-30, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 нуклеотида в длину, и эта область по существу комплементарна по меньшей мере части транскрипта мРНК гена Serpinc1.
В других вариантах осуществления одна или обе нити двухцепочечных средств RNAi изобретения составляет вплоть до 66 нуклеотидов в длину, например, 36-66, 26-36, 25-36, 31-60, 22-43, 27-53 нуклеотида в длину, с областью, составляющей по меньшей мере 19 смежных нуклеотидов, которая по существу комплементарна по меньшей мере части транскрипта мРНК гена Serpinc1. В некоторых вариантах осуществления смысловая и антисмысловая нити образуют дуплекс, состоящий из 18-30 смежных нуклеотидов.
В некоторых вариантах осуществления средства iRNA для применения в способах изобретения содержат нить РНК (антисмысловую нить), которая может составлять вплоть до 66 нуклеотидов в длину, например, 36-66, 26-36, 25-36, 31-60, 22-43, 27-53 нуклеотидов в длину, с областью, составляющей по меньшей мере 19 смежных нуклеотидов, которая по существу комплементарна по меньшей мере части транскрипта мРНК гена Serpinc1. В некоторых вариантах осуществления такие средства iRNA, имеющие более длинные антисмысловые нити, могут содержать вторую нить РНК (смысловую нить) из 20-60 нуклеотидов в длину, при этом смысловая и антисмысловая нити образуют дуплекс, состоящий из 18-30 смежных нуклеотидов.
Следующее подробное описание раскрывает, как получать и применять композиции, содержащие iRNA, для подавления экспрессии гена Serpinc1, а также композиции, применение и способы для лечения субъектов, имеющих заболевания и расстройства, которым могло бы помочь ингибирование или уменьшение экспрессии этого гена.
I. Определения
Для того, чтобы настоящее изобретение было более понятным, сначала определены некоторые термины. Кроме того, следует отметить, что всякий раз, когда указано значение или диапазон значений параметра, предполагается, что значения и диапазоны, промежуточные по отношению к указанным значениям, также являются частью настоящего изобретения.
Неопределенные артикли используются в данном документе для обозначения одного или более чем одного (то есть по меньшей мере одного) грамматического объекта пункта. В качестве примера «элемент» означает один элемент или более чем один элемент, например, множество элементов.
Термин «содержащий» используются в данном документе для обозначения и используется взаимозаменяемо с фразой «включая, но без ограничения».
Термин «или» используются в данном документе для обозначения и используется взаимозаменяемо с термином «и/или», если контекст явно не указывается на иное.
В рамках изобретения «Serpinc1» относится к конкретному полипептиду, экспрессируемому в клетке. Serpinc1 также известен как ингибитор серпиновых пептидаз, клада C (антитромбин; AT), член 1; антитромбин III; AT3; антитромбин; и кофактор гепарина 1. Последовательность транскрипта мРНК Serpinc1 человека можно найти, например, в GenBank Номер доступа GI:254588059 (NM_000488; SEQ ID NO:1). Последовательность мРНК Serpinc1 макак-резусов можно найти, например, в GenBank Номер доступа GI:157167169 (NM_001104583; SEQ ID NO:2). Последовательность мРНК Serpinc1 мышей можно найти, например, в GenBank Номер доступа GI:237874216 (NM_080844; SEQ ID NO:3). Последовательность мРНК Serpinc1 крыс можно найти, например, в GenBank Номер доступа GI:58865629 (NM_001012027; SEQ ID NO:4).
Термин «Serpinc1», в рамках изобретения также относится к конкретному полипептиду, экспрессируемому в клетке в виде вариантов последовательностей ДНК природного происхождения гена Serpinc1, таких как одиночный нуклеотидный полиморфизм гена Serpinc1. Внутри гена Serpinc1 идентифицирован ряд SNP и их можно найти, например, в NCBI dbSNP (см., например, www.ncbi.nlm.nih.gov/snp). Неограничивающие примеры SNP внутри гена Serpinc1 можно найти в NCBI dbSNP Номера доступа rs677; rs5877; rs5878; rs5879; rs941988; rs941989; rs1799876; rs19637711; rs2008946 и rs2227586.
В рамках изобретения «субъект» представляет собой животное, такое как млекопитающее, включая приматов (например, человека, примата, не относящегося к человеку, например, обезьяну и шимпанзе), не приматов (таких как корова, свинья, верблюд, лама, лошадь, коза, кролик, овца, хомяк, морская свинка, кошка, собака, крыса, мышь, лошадь и кит) или птица (например, утка или гусь). В одном варианте осуществления субъектом является человек, такой как человек, подлежащий лечению или обследованный на предмет заболевания, расстройства или состояния, которому могло бы помочь уменьшение экспрессии Serpinc1; человек с риском заболевания, расстройства или состояния, которому могло бы помочь уменьшение экспрессии Serpinc1; человек, имеющий заболевание, расстройство или состояние, которому могло бы помочь уменьшение экспрессии Serpinc1; и/или человек, подлежащий лечению заболевания, расстройства или состояния, которому могло бы помочь уменьшение экспрессии Serpinc1, согласно настоящему изобретению.
В рамках изобретения термины «лечение» или «обработка» относятся к благоприятному или желаемому результату, включающему, без ограничения, облегчение или улучшение одного или нескольких симптомов, уменьшение степени кровотечения, стабилизированное (то есть не ухудшающееся) состояние кровотечения, улучшение или ослабление кровотечения, независимо от того, обнаружено оно или не обнаружено. «Лечение» также может означать продление выживаемости по сравнению с ожидаемой выживаемостью в отсутствие лечения. В способах изобретения лечение включает в себя лечение по требованию и контроль эпизодов кровотечения, периоперационное управление кровотечениями и рутинную профилактику для снижения частоты эпизодов кровотечения.
Термин «нижний» в контексте уровня Serpinc1 у субъекта или маркера или симптома болезни относится к статистически значимому снижению такого уровня. Уменьшение может составлять, например, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, или более и предпочтительно до уровня, принятого в качестве пределах нормы для индивидуума без такого расстройства.
В рамках изобретения «профилактика» или «предотвращение» при использовании в связи с заболеванием, расстройством или его состоянием, которому могло бы помочь уменьшение экспрессии гена Sertpinc1, относится к уменьшению вероятности того, что у субъекта будет развиваться симптом, связанный с таким заболеванием, расстройством или состоянием, например, такой симптом как кровотечение. Вероятность развития кровотечения снижается, например, когда у человека, имеющего один или несколько факторов риска кровотечения, кровотечение либо не развивается, либо кровотечение развивается с меньшей степенью тяжести по сравнению с популяцией, имеющей те же факторы риска и не получающей лечение согласно настоящему изобретению. Эффективной профилактикой считается невозможность развития заболевания, расстройства или состояния или уменьшение развития симптома, связанного с таким заболеванием, расстройством или состоянием (например, по меньшей мере, примерно на 10% в клинически приемлемом масштабе для этого заболевания или расстройства) или противодействие отсроченных симптомов, отсроченных (например, на дни, недели, месяцы или годы).
В рамках изобретения термин «расстройство, сопровождающееся кровоточивостью» представляет собой заболевание или расстройство, которое приводит к плохой свертываемости крови и/или чрезмерной кровоточивости. Расстройством, сопровождающимся кровоточивостью, может быть врожденное расстройство, такое как гемофилия или болезнь Виллебранда, или приобретенное расстройство, ассоциированное, например, с диссеминированным внутрисосудистым свертыванием, эклампсией беременных, дефицитом витамина К, аутоиммунным расстройством, воспалительным заболеванием кишечника, язвенным колитом, дерматологическим расстройство (например, псориазом, пузырчаткой), респираторным заболеванием (например, астмой, хроническим обструктивным заболеванием легких), аллергической реакцией на лекарственные препараты, например, результатом медикаментозного лечения, таким как аспирин, гепарин и варфарин, диабетом, инфекцией острым гепатитом В, инфекцией острым гепатитом С, злокачественной опухолью или солидной опухолью (например, простаты, легких, толстой кишки, поджелудочной железы, желудка, желчных протоков, головы и шеи, шейки матки, молочной железы, меланомы, почки и/или гематологической злокачественной опухолью). В одном варианте осуществления врожденным расстройством, сопровождающимся кровоточивостью, является гемофилия, например, гемофилия A, B или C. В одном варианте осуществления у субъекта, имеющего врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилию, вырабатываются ингибиторы, например, ингибиторы аллоантител, для заместительной терапии свертывания, и они упоминаются в данном документе как «субъект с ингибитором». В одном варианте осуществления субъект с ингибитором имеет гемофилию A. В другом варианте осуществления субъект с ингибитором имеет гемофилию B. В другом варианте осуществления субъект с ингибитором имеет гемофилию C.
«Терапевтически эффективное количество», в рамках изобретения предназначено для включения количества средства RNAi, которое при введении субъекту, имеющему расстройство, сопровождающееся кровоточивостью, и кровотечение, является достаточным для эффективного лечения заболевания (например, посредством уменьшения, улучшения или поддержания существующего заболевания или одного или более симптомов заболевания). «Терапевтически эффективное количество» может варьировать в зависимости от средства RNAi, от того, как средство вводят, от заболевания и степени его тяжести и анамнеза, пола, массы, семейного анамнеза, набора генов, типов предшествующего или сопутствующего лечения, при наличии, и других индивидуальных характеристик субъекта, подлежащего лечению.
«Профилактически эффективное количество», в рамках изобретения предназначено для включения количества средства RNAi, которое при введении субъекту, имеющему расстройство, сопровождающееся кровоточивостью, но не кровотечение, например, субъекту, имеющему расстройство, сопровождающееся кровоточивостью и которому запланировано хирургическое вмешательство (например, периоперационное лечение), является достаточным для предотвращения или улучшения заболевания или одного или более симптомов заболевания. Улучшение заболевания включает замедление течения заболевания или уменьшение степени тяжести развившегося позже заболевание. «Профилактически эффективное количество» может варьировать в зависимости от iRNA, как вводят средство, степени риска заболевания, и анамнеза, пола, массы, семейного анамнеза, набора генов, типов предшествующего или сопутствующего лечения, при наличии, и других индивидуальных характеристик субъекта, подлежащего лечению.
«Терапевтически эффективное количество» или «профилактически эффективное количество» также включает количество средства RNAi, которое приводит к желаемому локальному или системному эффекту при разумном соотношении выгода/риск, применимому к любому лечению. iRNA, задействованную в способах настоящего изобретения, можно вводить в достаточном количестве для получения разумного соотношения выгода/риск, применимого к такому лечению.
Фразу «фармацевтически приемлемый» используют в данном документе со ссылкой на те соединения, композиции и/или лекарственные формы, которые в рамках здравого медицинского суждения, являются приемлемыми для применения в контакте с тканями субъектов-людей и субъектов-животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримых с разумным соотношением выгода/риск.
В рамках изобретения фраза «фармацевтически приемлемый носитель» обозначает фармацевтически приемлемый материал, композицию или наполнитель, такой как жидкий или твердый наполнитель, растворитель, эксципиент, производственное приспособление (например, любрикант, тальк, стеарат магния, кальция или цинка или стеариновую кислоту) или материал для инкапсулирования растворителя, участвующий в переносе или транспортировке исследуемого соединения из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть «приемлемым» в смысле совместимости с другими ингредиентами состава и не наносить вреда субъекту, подлежащему лечению. Некоторые примеры материалов, которые служат фармацевтически приемлемыми носителями, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, таким как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и целлюлозы ацетат; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) смазывающие средства, такие как магния стеарат, лаурилсульфат натрия и тальк; (8) эксципиенты, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, масло сафлор, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, таким как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) буферные растворы для поддержания pH; (21) полиэстеры, поликарбонаты и/или полиангидриды; (22) объемобразующие средства, такие как полипептиды и аминокислоты (23) компонент сыворотки, такой как сывороточный альбумин, HDL и LDL; и (22) другие нетоксичные совместимые вещества, задействованные в фармацевтических составах.
В рамках изобретения «целевая последовательность» относится к смежному участку нуклеотидной последовательности молекулы мРНК, образованному во время транскрипции гена Serpinc1, содержащему мРНК, который представляет собой продукт процессинга РНК первичного продукта транскрипции. В одном варианте осуществления целевой участок последовательности будет по меньшей мере достаточно длинным, чтобы служить в качестве iRNA-направленного расщепления в том участке или вблизи того участка нуклеотидной последовательности молекулы мРНК, образованной во время транскрипции гена Serpinc1.
Целевая последовательность может состоять из приблизительно 9-36 нуклеотидов в длину, например, приблизительно 15-30 нуклеотидов в длину. Например, целевая последовательность может состоять из приблизительно 15-30 нуклеотидов, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 нуклеотида в длину. Диапазоны и длины, промежуточные к указанным выше диапазонам и длинам, также считаются частью изобретения.
В рамках изобретения термин «нить, содержащая последовательность» относится к олигонуклеотиду, содержащему цепь нуклеотидов, которая описывается последовательностью, относящейся к стандартной нуклеотидной номенклатуре.
«G», «C», «A», «T» и «U» каждый, как правило, расшифровывает нуклеотид, который включает гуанин, цитозин, аденин, тимидин и урацил в качестве основания, соответственно. Однако будет понятно, что термин «рибонуклеотид» или «нуклеотид» также может относиться к модифицированному нуклеотиду, как дополнительно подробно описано ниже, или к фрагменту суррогатного замещения (см., например, таблицу 1). Специалист в данной области хорошо понимает, что гуанин, цитозин, аденин, и урацил могут быть заменены другими фрагментами по существу без изменения свойств парных оснований олигонуклеотида, содержащего нуклеотид, несущий такой замещающий фрагмент. Например, без ограничения, нуклеотид, содержащий инозин в качестве основания, может образовывать пару с нуклеотидами, содержащими аденин, цитозин или урацил. Следовательно, нуклеотиды, содержащие урацил, гуанин или аденин, могут быть замещены в нуклеотидных последовательностях двухцепочечной РНК, представленных в изобретении, нуклеотидом, содержащим, например, инозин. В другом примере аденин и цитозин повсеместно в олигонуклеотиде могут быть замещены гуанином и урацилом, соответственно, для образования неоднозначной пары оснований G-U с мРНК-мишенью. Последовательности, содержащие такие замещающие фрагменты, пригодны для композиций и способов, представленных в изобретении.
Термины «iRNA», «средство RNAi» «средство iRNA», «средство РНК-интерференции», которые взаимозаменяемо используются в данном документе, относятся к средству, которое содержит РНК, согласно определению термина в рамках изобретения, и который опосредует целевое расщепление транскрипта РНК через путь индуцируемого РНК комплекса сайленсинга (RISC). iRNA направляет сиквенс-специфичную деградацию мРНК через процесс, известный как РНК-интерференция (RNAi). iRNA модулирует, например, подавляет, экспрессию Serpinc1 в клетке, например, клетке субъекта, такого как субъект-млекопитающее.
В одном варианте осуществления средство RNAi изобретения содержит однонитевую РНК, которая взаимодействует с целевой последовательностью РНК, например, с целевой последовательностью мРНК Serpinc1, чтобы направлять расщепление целевой РНК. Не желая связывать себя теорией, предполагается, что длинная двухцепочечная РНК, проникающая в клетки, расщепляется до миРНК эндонуклеазой III типа, известной как Dicer (Sharp et al. (2001) Genes Dev. 15:485). Dicer, фермент, подобный рибонуклеазе-III, процессирует двухцепочечную РНК на короткие интерферирующие РНК из 19-23 пар оснований с характерными 3'-«липкими» концами из двух оснований (Bernstein, et al., (2001) Nature 409:363). Затем миРНК встраиваются в индуцируемый РНК комплекс сайленсинга (RISC), в котором одна или более геликаз раскручивает дуплекс миРНК, позволяя комплементарной антисмысловой нити направлять распознавание мишени (Nykanen, et al., (2001) Cell 107:309). При связывании с соответствующей мРНК-мишенью одна или несколько эндонуклеаз внутри RISC расщепляют мишень для индуцирования сайленсинга (Elbashir, et al., (2001) Genes Dev. 15:188). Таким образом, в одном аспекте изобретение относится к однонитевой РНК (миРНК), вырабатывающейся в клетке, которая способствует образованию комплекса RISC для осуществления сайленсинга гена-мишени, т.е., гена Serpinc1. Соответственно, термин «миРНК» также используют в данном документе со ссылкой на RNAi, как описано выше.
В другом варианте осуществления средство RNAi может представлять собой одноцепочечную миРНК, которую вводят в клетку или организм для ингибирования целевой РНК. Одноцепочечные средства RNAi связываются с RISC эндонуклеазой, Argonaute 2, которая затем расщепляет целевую мРНК. Одноцепочечные миРНК, как правило, состоят из 15-30 нуклеотидов и являются химически модифицированными. Разработка и тестирование одноцепочечных миРНК описаны в патенте США № 8101348 и у Lima et al., (2012) Cell 150: 883-894, полное содержание каждого из которых настоящим включено в данный документ посредством ссылки. Любую из антисмысловых нуклеотидных последовательностей в рамках изобретения можно использовать в виде одноцепочечной миРНК согласно настоящему изобретению или химически модифицированными посредством способов, описанных у Lima et al., (2012) Cell 150;:883-894.
В другом варианте осуществления «iRNA» для применения в композициях, путях использования и способах изобретения представляет собой двухцепочечную РНК и в данном документе называется «средство двухцепочечной RNAi», «двухцепочечная молекула РНК (двухцепочечная РНК)», «средство двухцепочечной РНК» или «двухцепочечная РНК». Термин «двухцепочечная РНК» относится к комплексу молекул рибонуклеиновых кислот, имеющему структуру дуплекса, содержащему две антипараллельные и по существу комплементарные нити нуклеиновых кислот, упоминаемые, как имеющие «смысловую» и «антисмысловую» ориентацию по отношению к целевой РНК, т.е. Гену Serpinc1. В некоторых вариантах осуществления изобретения двухцепочечная РНК (двухцепочечная РНК) инициирует деградацию целевой РНК, например, мРНК, посредством механизма посттранскрипционного сайленсинга генов, называемого в данном документе РНК-интерференцией или RNAi.
В общем, большинство нуклеотидов каждой нити молекулы двухцепочечной РНК представляют собой рибонуклеотиды, но, как подробно описано в данном документе, каждая или обе нити также могут содержать один или более нерибонуклеотидов, например, дезоксирибонуклеотид и/или модифицированный нуклеотид. Кроме того, в рамках изобретения «средство RNAi» может содержать рибонуклеотиды с химическими модификациями; средство RNAi может содержать существенные модификации множества нуклеотидов.
В рамках изобретения термин «модифицированный нуклеотид» относится к нуклеотиду, независимо имеющему модифицированный сахарный фрагмент, модифицированную межнуклеотидную связь и/или модифицированное нуклеооснование. Таким образом, термин модифицированный нуклеотид охватывает замещения, дополнения или удаление, например, функциональной группы или атома, межнуклеозидных связей, фрагментой сахара или нуклеооснований. Модификации, пригодные для применения в средствах изобретения, включают все типы модификаций, раскрытых в данном документе или известных в данной области. Любые такие модификации, которые используются в молекуле типа миРНК, охвачены «средством RNAi» для целей настоящего описания и формулы изобретения.
Дуплексная область может иметь любую длину, которая допускает специфическую деградацию желаемой целевой РНК через путь RISC и может составлять от 9 до 36 пар оснований в длину, например, около 15-30 пар оснований в длину, например, приблизительно 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 или 36 пар оснований в длину, например, приблизительно 15-30, 15-29, 15-28, 15-27, 15-26, 15-25, 15-24, 15-23, 15-22, 15-21, 15-20, 15-19, 15-18, 15-17, 18-30, 18-29, 18-28, 18-27, 18-26, 18-25, 18-24, 18-23, 18-22, 18-21, 18-20, 19-30, 19-29, 19-28, 19-27, 19-26, 19-25, 19-24, 19-23, 19-22, 19-21, 19-20, 20-30, 20-29, 20-28, 20-27, 20-26, 20-25, 20-24,20-23, 20-22, 20-21, 21-30, 21-29, 21-28, 21-27, 21-26, 21-25, 21-24, 21-23 или 21-22 пар оснований в длину. Диапазоны и длины, промежуточные к указанным выше диапазонам и длинам, также считаются частью изобретения
Две нити, образующие дуплексную структуру, могут являться различными частями одной более крупной молекулы РНК, или они могут быть отдельными молекулами РНК. Если две нити являются частью одной более крупной молекулы и поэтому связаны непрерывной цепочкой нуклеотидов между 3'-концом одной нити и 5'-концом соответствующей другой нити, образующей дуплексную структуру, связывающая цепь РНК называется «шпилечной петлей». Шпилечная петля может содержать по меньшей мере один неспаренный нуклеотид. В некоторых вариантах осуществления шпилечная петля может содержать по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 20, по меньшей мере 23 или более неспаренных нуклеотидов.
Когда две по существу комплементарные нити двухцепочечной РНК состоят из отдельных молекул РНК, нет необходимости, но возможно, чтобы эти молекулы были ковалентно связаны. Если две нити ковалентно соединены с помощью иных средств, чем непрерывная цепь нуклеотидов между 3'-концом одной нити и 5'-концом соответствующей другой нити, образующей дуплексную структуру, соединительная структура называется «линкер». Нити РНК могут иметь одинаковое или различное количество нуклеотидов. Максимальное число пар оснований составляет количество нуклеотидов в самой короткой цепи двухцепочечной РНК минус любые «липкие» концы, присутствующие в дуплексе. В дополнение к дуплексной структуре RNAi может содержать один или несколько нуклеотидных «липких» концов.
В одном варианте осуществления средство RNAi изобретения представляет собой двухцепочечную РНК из 24-30 нуклеотидов, которая взаимодействует с целевой РНК последовательностью, например, целевой последовательностью мРНК Serpinc1, чтобы направлять расщепление целевой РНК. Не желая связывать себя теорией, длинная двухцепочечная РНК, вводимая в клетки, расщепляется до миРНК эндонуклеазой III типа, известной как Dicer (Sharp et al. (2001) Genes Dev. 15:485). Dicer, фермент, подобный рибонуклеазе-III, процессирует двухцепочечную РНК на короткие интерферирующие РНК из 19-23 пар оснований с характерными 3'-«липкими» концами из двух оснований (Bernstein, et al., (2001) Nature 409:363). Затем миРНК встраиваются в индуцируемый РНК комплекс сайленсинга (RISC), в котором одна или более геликаз раскручивает дуплекс миРНК, давая возможность комплементарной антисмысловой нити направлять распознавание (Nykanen, et al., (2001) Cell 107:309). При связывании с соответствующей мРНК-мишенью одна или несколько эндонуклеаз внутри RISC расщепляют мишень, индуцируя сайленсинг (Elbashir, et al., (2001) Genes Dev. 15:188).
В рамках изобретения термин «нуклеотидный «липкий» конец» относится по меньшей мере к одному неспаренному нуклеотиду, который выпячивается из дуплексной структуры iRNA, например, двухцепочечной РНК. Например, нуклеотидный «липкий» конец имеется когда 3'-конец одной нити двухцепочечной РНК простирается за 5'-конец другой нити или наоборот. Двухцепочечная РНК может содержать «липкий» конец, составляющий по меньшей мере один нуклеотид; в качестве альтернативы «липкий» конец может содержать по меньшей мере два нуклеотида, по меньшей мере три нуклеотида, по меньшей мере четыре нуклеотида, по меньшей мере пять нуклеотидов или более. Нуклеотидный «липкий» конец может содержать или состоять из нуклеотидного/нуклеозидного аналога, содержащего дезоксинуклеотид/нуклеозид. «Липкий» конец (концы) может быть на смысловой нити, антисмысловой нити или любой их комбинации. Более того, нуклеотид (нуклеотиды) «липкого» конца могут присутствовать на 5'-конце, 3'-конце или обоих концах либо антисмысловой, либо смысловой нити двухцепочечной РНК.
В одном варианте осуществления антисмысловая нить двухцепочечной РНК на 3'-конце и/или 5'-конце имеет «липкий» конец, состоящий из 1-10 нуклеотидов, например, из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов. В одном варианте осуществления смысловая нить двухцепочечной РНК на 3'-конце и/или 5'-конце имеет «липкий» конец, состоящий из 1-10 нуклеотидов, например, из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов. В другом варианте осуществления один или более нуклеотидов в «липком» конце замещены нуклеозидтиофосфатом.
В некоторых вариантах осуществления «липкий» конец на смысловой нити или антисмысловой нити или и той и другой может иметь увеличенную длину более 10 нуклеотидов, например 10-30 нуклеотидов, 10-25 нуклеотидов, 10-20 нуклеотидов или 10-15 нуклеотидов в длину. В некоторых вариантах осуществления протяженный «липкий» конец находится на смысловой нити дуплекса. В некоторых вариантах осуществления протяженный «липкий» конец находится на 3'-конце смысловой нити дуплекса. В некоторых вариантах осуществления протяженный «липкий» конец находится на 5'-конце смысловой нити дуплекса. В некоторых вариантах осуществления протяженный «липкий» конец находится на антисмысловой нити дуплекса. В некоторых вариантах осуществления протяженный «липкий» конец находится на 3'-конце антисмысловой нити дуплекса. В некоторых вариантах осуществления протяженный «липкий» конец находится на 5'-конце антисмысловой нити дуплекса. В некоторых вариантах осуществления один или более нуклеотидов в протяженном «липком» конце замещены нуклеозидтиофосфатом.
«Тупой» или «тупой конец» означает, что на этом конце средства двухцепочечной RNAi нет неспаренных нуклеотидов, то есть нет нуклеотидного «липкого» конца. Средство RNAi «с тупым концом» представляет собой двухцепочечную РНК, которая является двухцепочечной по всей своей длине, то есть не имеет нуклеотидного «липкого» конца на обоих концах молекулы. Средства RNAi изобретения включают средства RNAi с нуклеотидными «липкими» концами на одном конце (т.е., средства с одним «липким» концом и одним тупым концом) или с нуклеотидными «липкими» концами на обоих концах.
Термин «антисмысловая нить» или «направляющая нить» относится к нити iRNA, например, двухцепочечной РНК, которая содержит область, по существу комплементарную целевой последовательности, например, мРНК Serpinc1. В рамках изобретения термин «область комплементарности» относится к области на антисмысловой нити, которая по существу комплементарна последовательности, например, целевой последовательности, например, нуклеотидной последовательности Serpinc1 в рамках изобретения. Когда область комплементарности не полностью комплементарна целевой последовательности, во внутренней или терминальных областях молекулы могут быть несоответствия. Как правило, наиболее допустимые несоответствия находятся в терминальных областях, например, в пределах 5, 4, 3 или 2 нуклеотидов 5'-и/или 3'-конца iRNA.
Термин «смысловая нить» или «сопровождающая нить» в рамках изобретения относится к нити iRNA, которая содержит область, по существу комплементарную области антисмысловой нити согласно определению термина в рамках изобретения.
В рамках изобретения термин «область расщепления» относится к области, которая расположена непосредственно рядом с участком расщепления. Участок расщепления представляет собой участок на мишени, на котором происходит расщепление. В некоторых вариантах осуществления область расщепления содержит три основания на обоих концах участка расщепления и непосредственно вблизи с участком расщепления. В некоторых вариантах осуществления область расщепления содержит два основания на обоих концах участка расщепления и непосредственно вблизи с участком расщепления. В некоторых вариантах осуществления участок расщепление конкретно возникает на участке, связанном 10 и 11 нуклеотидами антисмысловой нити, а область расщепления содержит 11, 12 и 13 нуклеотиды.
В рамках изобретения и если не указано иное, термин «комплементарный» при использовании для описания первой нуклеотидной последовательности по отношению ко второй нуклеотидной последовательности относится к способности олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, гибридизировать и образовывать дуплексную структуру при определенных условиях с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, как должно быть понятно специалисту в данной области. Такие условия могут быть, например, строгими условиями, причем строгие условия могут включать: 400 мМ NaCl, 40 мМ PIPES с pH 6,4, 1 мМ ЭДТА, 50°C или 70°C в течение 12-16 часов с последующим промыванием (см., например, «Molecular Cloning: A Laboratory Manual, Sambrook, et al. (1989) Cold Spring Harbor Laboratory Press). Можно применять другие условия, такие как физиологически значимые условия, которые могут встречаться внутри организма. Специалист в данной области сможет определить набор условий, наиболее подходящих для проверки комплементарности двух последовательностей в соответствии с конечным применением гибридизированных нуклеотидов.
Комплементарные последовательности в iRNA, например, в пределах двухцепочечной РНК согласно настоящему изобретению включают спаренные основания олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность по всей длине одной или обеих нуклеотидных последовательностей. Такие последовательности можно назвать «полностью комплементарными» по отношению друг к другу в данном документе. Однако когда в данном документе первая последовательность называется «по существу комплементарной» по отношению ко второй последовательности, две последовательности могут быть полностью комплементарными, или они могут образовывать одну или более, но, как правило, не более 5, 4, 3 или 2 ошибочно спаренных пар оснований при гибридизации для дуплекса до 30 пар оснований, сохраняя при этом способность гибридизоваться в условиях, наиболее значимых для их конечного применения, например, подавления экспрессии гена через путь RISC. Однако когда два олигонуклеотида предназначены для образования при гибридизации одного или нескольких однонитевых «липких» концов, такие «липкие» концы не должны рассматриваться как несоответствия в отношении определения комплементарности. Например, двухцепочечная РНК, содержащая 21 нуклеотид в длину одного олигонуклеотида и 23 нуклеотида в длину другого олигонуклеотида, при этом более длинный олигонуклеотид содержит последовательность из 21 нуклеотида, которая полностью комплементарна более короткому олигонуклеотиду, может все-таки называться «полностью комплементарной» для целей в рамках изобретения.
«Комплементарные» последовательности, в рамках изобретения также могут содержать или быть полностью образованы из не-Уотсон-Криковских пар оснований и/или пар оснований, образованных из ненатуральных и модифицированных нуклеотидов, в той мере, в которой выполняются вышеуказанные требования в отношении их способности к гибридизации. Такие не-Уотсон-Криковские пары оснований включают, без ограничения, неоднозначные или Хугстиновские пары оснований G:U.
Термины «комплементарный», «полностью комплементарный» и «по существу комплементарный» в данном документе можно использовать в отношении сопоставления оснований между смысловой нитью и антисмысловой нитью двухцепочечной РНК или между антисмысловой нитью средства iRNA и целевой последовательностью, как будет понятно из контекста их использования.
В рамках изобретения полинуклеотид, «по существу комплементарный по меньшей мере части» сопровождающей РНК (мРНК), относится к полинуклеотиду, по сути комплементарному смежному участку рассматриваемой мРНК (например, мРНК, кодирующей Serpinc1). Например, полинуклеотид комплементарен по меньшей мере части мРНК Serpinc1, если последовательность по существу комплементарна непрерывному участку мРНК, кодирующей Serpinc1.
Соответственно, в некоторых вариантах осуществления полинуклеотиды антисмысловой нити согласно настоящему документу полностью комплементарны целевой последовательности Serpinc1. В других вариантах осуществления полинуклеотиды антисмысловой нити согласно настоящему документу по существу комплементарны целевой последовательности Serpinc1 и содержат смежную нуклеотидную последовательность, которая по меньшей мере приблизительно на 80% комплементарна по всей своей длине эквивалентной области нуклеотидной последовательности SEQ ID NO:1, или фрагменту SEQ ID NO:1, например, комплементарна приблизительно на 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно % 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно на 99%.
В одном варианте осуществления средство RNAi изобретения содержит смысловую нить, по существу комплементарную антисмысловому полинуклеотиду, который, в свою очередь, комплементарен целевой последовательности Serpinc1, и при этом полинуклеотид смысловой нити содержит смежную нуклеотидную последовательность, которая по меньшей мере приблизительно на 80% комплементарна по всей своей длине эквивалентной области нуклеотидной последовательности SEQ ID NO:5, или фрагменту любой из SEQ ID NO:5, например, комплементарна на приблизительно 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно % 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или на приблизительно 99%.
В одном аспекте изобретения средство для применения в способах и композициях изобретения представляет собой одноцепочечную антисмысловую молекулу РНК, которая ингибирует целевую РНК через механизм антисмыслового ингибирования. Одноцепочечная молекула антисмысловой РНК комплементарна последовательности в пределах мРНК-мишени. Одноцепочечные антисмысловые олигонуклеотиды могут ингибировать трансляцию стехиометрическим образом путем спаривания оснований с мРНК и физическим препятствием для механизма трансляции, см. Dias, N. et al., (2002) Mol Cancer Ther 1:347-355. Одноцепочечная молекула антисмысловой РНК может иметь от приблизительно 15 до приблизительно 30 нуклеотидов в длину и иметь последовательность, комплементарную целевой последовательности. Например, одноцепочечная молекула антисмысловой РНК может содержать последовательность по меньшей мере из приблизительно 15, 16, 17, 18, 19, 20 или более смежных нуклеотидов из любой одной из антисмысловых последовательностей в рамках изобретения.
Термин «ингибирование» в рамках изобретения используют взаимозаменяемо с «уменьшением», «сайленсингом», «понижающим регулированием», «подавлением» и другими сходными терминами и включает любой уровень ингибирования.
Фраза «подавление экспрессии Serpinc1», в рамках изобретения включает подавление экспрессии любого гена Serpinc1 (такого как, например, ген Serpinc1 мышей, ген Serpinc1 крыс, ген Serpinc1 обезьян или ген Serpinc1 человека), а также варианты или мутанты гена Serpinc1, которые кодируют белок Serpinc1.
«Подавление экспрессии гена Serpinc1» включает любой уровень подавления гена Serpinc1, например, по меньшей мере частичной супрессии экспрессии гена Serpinc1, такой как подавление по меньшей мере на приблизительно 5%, по меньшей мере на приблизительно 10%, по меньшей мере на приблизительно 15%, по меньшей мере на приблизительно 20%, по меньшей мере на приблизительно 25%, по меньшей мере на приблизительно 30%, по меньшей мере на приблизительно 35%,по меньшей мере на приблизительно 40%, по меньшей мере на приблизительно 45%, по меньшей мере на приблизительно 50%, по меньшей мере на приблизительно 55%, по меньшей мере на приблизительно 60%, по меньшей мере на приблизительно 65%, по меньшей мере на приблизительно 70%, по меньшей мере на приблизительно 75%, по меньшей мере на приблизительно 80%, по меньшей мере на приблизительно 85%, по меньшей мере на приблизительно 90%, по меньшей мере на приблизительно 91%, по меньшей мере на приблизительно 92%, по меньшей мере на приблизительно 93%, по меньшей мере на приблизительно 94%, по меньшей мере на приблизительно 95%, по меньшей мере на приблизительно 96%, по меньшей мере на приблизительно 97%, по меньшей мере на приблизительно 98% или по меньшей мере на приблизительно 99%.
Экспрессию гена Serpinc1 можно оценить на основе уровня любой переменной, связанной с экспрессией гена Serpinc1, например, уровня мРНК Serpinc1, уровня белка Serpinc1, или, например, уровня комплекса тромбин:антитромбин в качестве показателя потенциала выработки тромбина, времени кровотечения, протромбинового времени (PT), подсчета тромбоцитов и/или активированного частичного тромбопластинового времени (aPTT). Ингибирование можно оценить посредством уменьшения абсолютного или относительного уровня одной или более из этих переменных по сравнению с контрольным уровнем. Контрольным уровнем может быть любой тип контрольного уровня, который используется в данной области техники, например, исходный уровень перед введением дозы или уровень, определенный у аналогичного субъекта, в клетке или образце, которые не обрабатывали или обрабатывали контролем (например, только буферным контролем или контролем неактивным средством).
В одном варианте осуществления подавление экспрессии гена Serpinc1 оценивают путем уменьшения количества мРНК Serpinc1, которую можно выделить или обнаружить в первой клетке или группе клеток, в которой транскрибируется ген Serpinc1, и которая обработана или была обработана таким образом, что экспрессия гена Serpinc1 подавляется по сравнению со второй клеткой или группой клеток, по существу идентичной первой клетке или группе клеток, но которая была или не была обработана таким образом(контрольные клетки). Степень подавления можно выразить в показателях
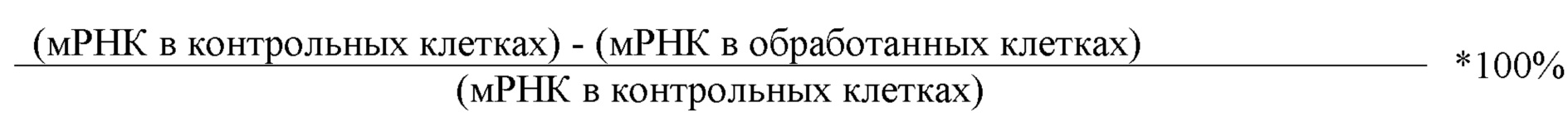
Фраза «контакт клетки со средством RNAi», таким как двухцепочечная РНК, в рамках изобретения включает контакт клетки любыми возможными средствами. Контакт клетки со средством RNAi включает контакт клетки с iRNA in vitro или контакт клетки с iRNA in vivo. Контакт можно осуществить напрямую или опосредованно. Таким образом, например, человек, осуществляющий этот способ, может привести средство RNAi в физический контакт с клеткой, или в качестве альтернативы, средство RNAi можно поместить в ситуацию, которая позволит или заставит его впоследствии вступать в контакт с клеткой.
Контакт клетки in vitro можно осуществить, например, инкубируя клетки со средством RNAi. Контакт клетки in vivo можно осуществить, например, посредством инъецирования средства RNAi в ткань или вблизи ткани, где расположены клетки, или посредством инъецирования средства RNAi в другую зону, например, кровоток или подкожное пространство, так чтобы средство впоследствии достигло ткани, в которой расположены клетки, подлежащие контакту. Например, средство RNAi может содержать и/или быть соединено с лигандом, например, GalNAc3, который направляет средство RNAi в интересующий сайт, например, печень. Также возможны комбинации способов контакта in vitro и in vivo. Например, клетка также может контактировать in vitro со средством RNAi и в последующем быть трансплантирована субъекту.
В одном варианте осуществления контакт клетки с iRNA включает «введение» или «доставку iRNA в клетку» путем облегчения или осуществления поглощения или всасывания в клетку. Абсорбция или поглощение iRNA может происходить посредством процессов самостоятельной диффузии или активных клеточных процессов или с помощью вспомогательных средств или устройств. Введение iRNA в клетку может быть in vitro и/или in vivo. Например, для введения in vivo iRNA можно инъецировать в участок ткани или вводить системно. Доставка in vivo также может осуществляться с помощью системы доставки бета-глюкана, такой как описана в патентах США №№ 5032401 и 5607677, и публикации США № 2005/0281781, полное содержание которых включено настоящим в данный документ посредством ссылки. Введение в клетку in vitro включает способы, известные в данной области, такие как электропорация и липофекция. Дополнительные подходы описаны в данном документе ниже и/или известны в данной области.
II. Способы изобретения
В настоящем изобретении предоставлены терапевтические и профилактические способы, которые включают введение субъекту, имеющему заболевание, ассоциированное с Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию (например, гемофилию A, гемофилию B или гемофилию C), средства iRNA или фармацевтической композиции, содержащей средство iRNA изобретения. В некоторых аспектах изобретения способы дополнительно предусматривают введение субъекту дополнительного терапевтического средства.
В некоторых вариантах осуществления изобретения, например, когда средство двухцепочечной RNAi содержит один или более мотивов трех идентичных модификаций трех последовательных нуклеотидов, включая один такой мотив на участке расщепления средств или около него, шесть тиофосфатных связей и лиганд GalNAc, такое средство вводят в дозе, составляющей от приблизительно 0,200 до приблизительно 1,825 мг/кг, от 0,200 до приблизительно 1,800 мг/кг, от приблизительно 0,200 до приблизительно 1,700 мг/кг, от приблизительно 0,200 до приблизительно 1,600 мг/кг, от приблизительно 0,200 до приблизительно 1,500 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,400 мг/кг, от приблизительно 0,200 до приблизительно 1,200 мг/кг, от приблизительно 0,200 до приблизительно 1,100 мг/кг, от приблизительно 0,200 до приблизительно 1,000 мг/кг, от приблизительно 0,200 до приблизительно 0,900 мг/кг, от приблизительно 0,200 до приблизительно 0,800 мг/кг, от приблизительно 0,200 до приблизительно 0,700 мг/кг, от приблизительно 0,200 до приблизительно 0,600 мг/кг, от приблизительно 0,200 до приблизительно 0,500 мг/кг, от приблизительно 0,200 до приблизительно 0,400 мг/кг, от приблизительно 0,225 до приблизительно 1,825 мг/кг, от приблизительно 0,225 до приблизительно 1,800 мг/кг, от приблизительно 0,225 до приблизительно 1,700 мг/кг, от приблизительно 0,225 до приблизительно 1,600 мг/кг, от приблизительно 0,225 до приблизительно 1,500 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,400 мг/кг, от приблизительно 0,225 до приблизительно 1,200 мг/кг, от приблизительно 0,225 до приблизительно 1,100 мг/кг, от приблизительно 0,225 до приблизительно 1,000 мг/кг, от приблизительно 0,225 до приблизительно 0,900 мг/кг, от приблизительно 0,225 до приблизительно 0,800 мг/кг, от приблизительно 0,225 до приблизительно 0,700 мг/кг, от приблизительно 0,225 до приблизительно 0,600 мг/кг, от приблизительно 0,225 до приблизительно 0,500 мг/кг, от приблизительно 0,225 до приблизительно 0,400 мг/кг, от приблизительно 0,250 до приблизительно 1,825 мг/кг, от приблизительно 0,250 до приблизительно 1,800 мг/кг, от приблизительно 0,250 до приблизительно 1,700 мг/кг, от приблизительно 0,250 до приблизительно 1,600 мг/кг, от приблизительно 0,250 до приблизительно 1,500 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,400 мг/кг, от приблизительно 0,250 до приблизительно 1,200 мг/кг, от приблизительно 0,250 до приблизительно 1,100 мг/кг, от приблизительно 0,250 до приблизительно 1,000 мг/кг, от приблизительно 0,250 до приблизительно 0,900 мг/кг, от приблизительно 0,250 до приблизительно 0,800 мг/кг, от приблизительно 0,250 до приблизительно 0,700 мг/кг, от приблизительно 0,250 до приблизительно 0,600 мг/кг, от приблизительно 0,250 до приблизительно 0,500 мг/кг, от приблизительно 0,250 до приблизительно 0,400 мг/кг, от приблизительно 0,425 до приблизительно 1,825 мг/кг, от приблизительно 0,425 до приблизительно 1,800 мг/кг, от приблизительно 0,425 до приблизительно 1,700 мг/кг, от приблизительно 0,425 до приблизительно 1,600 мг/кг, от приблизительно 0,425 до приблизительно 1,500 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,400 мг/кг, от приблизительно 0,425 до приблизительно 1,200 мг/кг, от приблизительно 0,425 до приблизительно 1,100 мг/кг, от приблизительно 0,425 до приблизительно 1,000 мг/кг, от приблизительно 0,425 до приблизительно 0,900 мг/кг, от приблизительно 0,425 до приблизительно 0,800 мг/кг, от приблизительно 0,425 до приблизительно 0,700 мг/кг, от приблизительно 0,425 до приблизительно 0,600 мг/кг, от приблизительно 0,425 до приблизительно 0,500 мг/кг, от приблизительно 0,450 до приблизительно 1,825 мг/кг, от приблизительно 0,450 до приблизительно 1,800 мг/кг, от приблизительно 0,450 до приблизительно 1,700 мг/кг, от приблизительно 0,450 до приблизительно 1,600 мг/кг, от приблизительно 0,450 до приблизительно 1,500 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,400 мг/кг, от приблизительно 0,450 до приблизительно 1,200 мг/кг, от приблизительно 0,450 до приблизительно 1,100 мг/кг, от приблизительно 0,450 до приблизительно 1,000 мг/кг, от приблизительно 0,450 до приблизительно 0,900 мг/кг, от приблизительно 0,450 до приблизительно 0,800 мг/кг, от приблизительно 0,450 до приблизительно 0,700 мг/кг, от приблизительно 0,450 до приблизительно 0,600 мг/кг, от приблизительно 0,450 до приблизительно 0,500 мг/кг, от приблизительно 0,475 до приблизительно 1,825 мг/кг, от приблизительно 0,475 до приблизительно 1,800 мг/кг, от приблизительно 0,475 до приблизительно 1,700 мг/кг, от приблизительно 0,475 до приблизительно 1,600 мг/кг, от приблизительно 0,475 до приблизительно 1,500 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,400 мг/кг, от приблизительно 0,475 до приблизительно 1,200 мг/кг, от приблизительно 0,475 до приблизительно 1,100 мг/кг, от приблизительно 0,475 до приблизительно 1,000 мг/кг, от приблизительно 0,475 до приблизительно 0,900 мг/кг, от приблизительно 0,475 до приблизительно 0,800 мг/кг, от приблизительно 0,475 до приблизительно 0,700 мг/кг, от приблизительно 0,475 до приблизительно 0,600 мг/кг, от приблизительно 0,475 до приблизительно 0,500 мг/кг, от приблизительно 0,875 до приблизительно 1,825 мг/кг, от приблизительно 0,875 до приблизительно 1,800 мг/кг, от приблизительно 0,875 до приблизительно 1,700 мг/кг, от приблизительно 0,875 до приблизительно 1,600 мг/кг, от приблизительно 0,875 до приблизительно 1,500 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,400 мг/кг, от приблизительно 0,875 до приблизительно 1,200 мг/кг, от приблизительно 0,875 до приблизительно 1,100 мг/кг, от приблизительно 0,875 до приблизительно 1,000 мг/кг, от приблизительно 0,875 до приблизительно 0,900 мг/кг, от приблизительно 0,900 до приблизительно 1,825 мг/кг, от приблизительно 0,900 до приблизительно 1,800 мг/кг, от приблизительно 0,900 до приблизительно 1,700 мг/кг, от приблизительно 0,900 до приблизительно 1,600 мг/кг, от приблизительно 0,900 до приблизительно 1,500 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,400 мг/кг, от приблизительно 0,900 до приблизительно 1,200 мг/кг, от приблизительно 0,900 до приблизительно 1,100 мг/кг, от приблизительно 0,900 до приблизительно 1,000 мг/кг, от приблизительно 0,925 до приблизительно 1,825 мг/кг, от приблизительно 0,925 до приблизительно 1,800 мг/кг, от приблизительно 0,925 до приблизительно 1,700 мг/кг, от приблизительно 0,925 до приблизительно 1,600 мг/кг, от приблизительно 0,925 до приблизительно 1,500 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,400 мг/кг, от приблизительно 0,925 до приблизительно 1,200 мг/кг, от приблизительно 0,925 до приблизительно 1,100 мг/кг или приблизительно 0,925 до приблизительно 1,000 мг/кг. Значения и диапазоны, промежуточные к вышеперечисленным значениям, также предназначены для того, чтобы быть частью этого изобретения, например, средство RNAi можно вводить субъекту в дозе, составляющей от приблизительно 0,015 мг/кг до приблизительно 0,45 мг/мг.
Например, средство RNAi, например, средство RNAi в фармацевтической композиции, можно вводить в дозе, составляющей приблизительно 0,2 мг/кг, 0,225 мг/кг, 0,25 мг/кг, 0,275 мг/кг, 0,3 мг/кг, 0,325 мг/кг, 0,35 мг/кг, 0,375 мг/кг, 0,4 мг/кг, 0,425 мг/кг, 0,45 мг/кг, 0,475 мг/кг, приблизительно 0,5 мг/кг, 0,525 мг/кг, 0,55 мг/кг, 0,575 мг/кг, приблизительно 0,6 мг/кг, 0,625 мг/кг, 0,65 мг/кг, 0,675 мг/кг, приблизительно 0,7 мг/кг, 0,725 мг/кг, 0,75 мг/кг, 0,775 мг/кг, приблизительно 0,8 мг/кг, 0,925 мг/кг, 0,95 мг/кг, 0,975 мг/кг, приблизительно 1,0 мг/кг, 1,025 мг/кг, 1,05 мг/кг, 1,075 мг/кг, приблизительно 1,1 мг/кг, 1,125 мг/кг, 1,15 мг/кг, 1,175 мг/кг, приблизительно 1,2 мг/кг, 1,225 мг/кг, 1,25 мг/кг, 1,275 мг/кг, приблизительно 1,3 мг/кг, 1,325 мг/кг, 1,35 мг/кг, 1,375 мг/кг, приблизительно 1,4 мг/кг, 1,425 мг/кг, 1,45 мг/кг, 1,475 мг/кг, приблизительно 1,5 мг/кг, 1,525 мг/кг, 1,55 мг/кг, 1,575 мг/кг, приблизительно 1,6 мг/кг, 1,625 мг/кг, 1,65 мг/кг, 1,675 мг/кг, приблизительно 1,7 мг/кг, 1,725 мг/кг, 1,75 мг/кг, 1,775 мг/кг, или приблизительно 1,8 мг/кг. Значения, являющиеся промежуточными по отношению к вышеуказанным указанным значениям, также предназначены для того, чтобы быть частью этого изобретения.
Соответственно, В одном аспекте изобретение предоставляет способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию. Способы предусматривают введение субъекту профилактически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг, средства iRNA, например, двухцепочечную РНК изобретения, (например, фармацевтической композиции, содержащей двухцепочечную РНК изобретения), тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию, которые включают введение субъекту, например, человеку, терапевтически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,800 мг/кг, средства iRNA, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей средство iRNA, нацеленный на ген Serpinc1, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте изобретение предоставляет виды применения профилактически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг, iRNA, например, двухцепочечной РНК изобретения, для предотвращения по меньшей мере одного симптома у субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройства, сопровождающегося кровоточивостью, например, гемофилии.
В дополнительном аспекте в настоящем изобретении предоставлены виды применения профилактически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства iRNA изобретения, при получении лекарственного средства для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилии.
В другом аспекте в настоящем изобретении предоставлены виды применения терапевтически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства iRNA изобретения для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1.
В еще одном аспекте в настоящем изобретении предоставлены применение средства iRNA, например, двухцепочечной РНК изобретения, нацеленной на ген Serpinc1, или фармацевтической композиции, содержащему терапевтически эффективную дозу, например, дозу, составляющую от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг, средства iRNA, нацеленного на ген Serpinc1, при получении лекарственного средства для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1, такого как субъект, имеющий расстройство, сопровождающееся кровоточивостью, например, гемофилию.
В некоторых вариантах осуществления изобретения, например, когда средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, такое средство вводят в дозе, составляющей от приблизительно 0,200 до приблизительно 1,825 мг/кг, например, в виде дозы от приблизительно 0,200 мг/кг до приблизительно 0,250 мг/кг; или в виде дозы от приблизительно 0,425 мг/кг до приблизительно 0,475 мг/кг; или в виде дозы от приблизительно 0,875 мг/кг до приблизительно 0,925 мг/кг; или в виде дозы от приблизительно 1,775 мг/кг до приблизительно 1,825 мг/кг.
Соответственно, в одном аспекте изобретение предоставляет способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию. Способы предусматривают введение субъекту профилактически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, при этом антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу (например, фармацевтической композиция содержащему средство RNAi), тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию, которые включают введение субъекту, например, человеку, терапевтически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, при этом антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, или фармацевтической композиции, содержащей средство iRNA, нацеленное на ген Serpinc1, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте изобретение предоставляет виды применения профилактически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, при этом антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилии.
В дополнительном аспекте в настоящем изобретении предоставлены виды применения профилактически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, при этом антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, при получении лекарственного средства для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилии.
В другом аспекте в настоящем изобретении предоставлены виды применения терапевтически эффективной дозы, например, дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, при этом антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1.
В еще одном аспекте в настоящем изобретении предоставлено применение средства iRNA, например, двухцепочечной РНК изобретения, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, дозу, составляющую от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, при этом антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, при получении лекарственного средства для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1, такого как субъект, имеющий расстройство, сопровождающееся кровоточивостью, например, гемофилию.
В некоторых вариантах осуществления средство iRNA изобретения вводят субъекту в виде фиксированной дозы. «Фиксированная доза» (например, доза в мг) означает, что одну дозу средства iRNA применяют для всех субъектов независимо от любых конкретных связанных с субъектом факторов, таких как масса. В одном конкретном варианте осуществления фиксированная доза, составляющая средство iRNA изобретения, основывается на заранее определенной массе или возрасте.
В некоторых вариантах осуществления средство RNAi вводят в виде фиксированной дозы, составляющей между приблизительно 25 мг и приблизительно 100 мг, например, между приблизительно 25 мг и приблизительно 95 мг, между приблизительно 25 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 85 мг, между приблизительно 25 мг и приблизительно 80 мг, между приблизительно 25 мг и приблизительно 75 мг, между приблизительно 25 мг и приблизительно 70 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 25 мг и приблизительно 60 мг, между приблизительно 25 мг и приблизительно 50 мг, между приблизительно 50 мг и приблизительно 100 мг, между приблизительно 50 мг и приблизительно 95 мг, между приблизительно 50 мг и приблизительно 90 мг, между приблизительно 50 мг и приблизительно 85 мг, между приблизительно 50 мг и приблизительно 80 мг, между приблизительно 30 мг и приблизительно 100 мг, между приблизительно 30 мг и приблизительно 90 мг, между приблизительно 30 мг и приблизительно 80 мг, между приблизительно 40 мг и приблизительно 100 мг, между приблизительно 40 мг и приблизительно 90 мг, между приблизительно 40 мг и приблизительно 80 мг, между приблизительно 60 мг и приблизительно 100 мг, между приблизительно 60 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 55 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 30 мг и приблизительно 95 мг, между приблизительно 30 мг и приблизительно 85 мг, между приблизительно 30 мг и приблизительно 75 мг, между приблизительно 30 мг и приблизительно 65 мг, между приблизительно 30 мг и приблизительно 55 мг, между приблизительно 40 мг и приблизительно 95 мг, между приблизительно 40 мг и приблизительно 85 мг, между приблизительно 40 мг и приблизительно 75 мг, между приблизительно 40 мг и приблизительно 65 мг, между приблизительно 40 мг и приблизительно 55 мг, или между приблизительно 45 мг и приблизительно 95 мг.
В некоторых вариантах осуществления средство RNAi вводят в виде фиксированной дозы, составляющей приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг.
Соответственно, в одном аспекте изобретение предоставляет способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию. Способы предусматривают введение субъекту профилактически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, средства iRNA, например, двухцепочечной РНК изобретения (например, фармацевтической композиции, содержащей двухцепочечную РНК изобретения), тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. В одном варианте осуществления способы предусматривают введение субъекту профилактически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 50 мг, средства iRNA, например, двухцепочечной РНК, изобретения (например, фармацевтической композиции, содержащей двухцепочечную РНК изобретения), тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. В другом варианте осуществления способы предусматривают введение субъекту профилактически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 80 мг, средства iRNA, например, двухцепочечной РНК, изобретения (например, фармацевтической композиции, содержащей двухцепочечную РНК изобретения), тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию, которые включают введение субъекту, например, человеку, терапевтически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, средства iRNA, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей средство iRNA, нацеленный на ген Serpinc1, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. В одном варианте осуществления способы предусматривают введение субъекту терапевтически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 50 мг, средства iRNA, например, двухцепочечной РНК, изобретения (например, фармацевтической композиции, содержащей двухцепочечную РНК изобретения), тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. В другом варианте осуществления способы предусматривают введение субъекту терапевтически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 80 мг, средства iRNA, например, двухцепочечнойо РНК изобретения (например, фармацевтической композиции, содержащей двухцепочечную РНК изобретения), тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1.
В другом аспекте изобретение предоставляет виды применения профилактически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг iRNA, например, двухцепочечной РНК изобретения для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилия. В одном варианте осуществления изобретение предоставляет виды применения профилактически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 50 мг, iRNA, например, двухцепочечной РНК изобретения для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилия. В другом варианте осуществления изобретение предоставляет виды применения профилактически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 80 мг iRNA, например, двухцепочечной РНК изобретения для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилия.
В дополнительном аспекте в настоящем изобретении предоставлены виды применения профилактически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства iRNA изобретения при получении лекарственного средства для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилия. В одном варианте осуществления в настоящем изобретении предоставлены виды применения профилактически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 50 мг средства iRNA изобретения при получении лекарственного средства для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилия. В другом варианте осуществления в настоящем изобретении предоставлены виды применения профилактически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 80 мг средства iRNA изобретения при получении лекарственного средства для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилия.
В другом аспекте в настоящем изобретении предоставлены виды применения терапевтически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, средства iRNA изобретения для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1. В одном варианте осуществления в настоящем изобретении предоставлены виды применения терапевтически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 50 мг, средства iRNA изобретения для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1. В другом варианте осуществления в настоящем изобретении предоставлены виды применения терапевтически эффективной дозы, например, фиксированной дозы, составляющей приблизительно 80 мг, средства iRNA изобретения для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1.
В еще одном аспекте в настоящем изобретении предоставлены применение средства iRNA, например, двухцепочечной РНК изобретения, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, фиксированную дозу, составляющую от приблизительно 25 мг до приблизительно 100 мг, средства iRNA, нацеленного на ген Serpinc1, при получении лекарственного средства для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1, такого как субъект, имеющий расстройство, сопровождающееся кровоточивостью, например, гемофилию. В одном варианте осуществления в настоящем изобретении предоставлены применение средства iRNA, например, двухцепочечной РНК изобретения, нацеленной на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, фиксированную дозу, составляющую приблизительно 50 мг, средства iRNA, нацеленного на ген Serpinc1, при получении лекарственного средства для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1, такого как субъект, имеющий расстройство, сопровождающееся кровоточивостью, например, гемофилию. В другом варианте осуществления в настоящем изобретении предоставлены применение средства iRNA, например, двухцепочечной РНК изобретения, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, фиксированную дозу, составляющую приблизительно 80 мг, средства iRNA, нацеленного на ген Serpinc1, при получении лекарственного средства для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1, такого как субъект, имеющий расстройство, сопровождающееся кровоточивостью, например, гемофилию.
В некоторых вариантах осуществления изобретения например, когда средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, такое средство вводят в фиксированной дозе, составляющей от приблизительно 25 мг до приблизительно 100 мг, например, в виде фиксированной дозы, составляющей приблизительно 25 мг; или в виде фиксированной дозы, составляющей приблизительно 50 мг; или в виде фиксированной дозы, составляющей приблизительно 80 мг; или в виде фиксированной дозы, составляющей приблизительно 100 мг. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
Соответственно, в одном аспекте изобретение предоставляет способы предотвращения по меньшей мере одного симптома у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию. Способы предусматривают введение субъекту профилактически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу (например, фармацевтическая композиция, содержащая средство RNAi), тем самым предотвращая по меньшей мере один симптом у субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В другом аспекте в настоящем изобретении предоставлены способы лечения субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1, например, расстройство, сопровождающееся кровоточивостью, например, гемофилию, которые включают введение субъекту, например, человеку, терапевтически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу или фармацевтическая композиция, содержащая средство iRNA нацеленный на ген Serpinc1, тем самым осуществляя лечение субъекта, имеющего расстройство, которому могло бы помочь снижение экспрессии Serpinc1. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В другом аспекте изобретение предоставляет виды применения профилактически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилии. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В дополнительном аспекте в настоящем изобретении предоставлены виды применения профилактически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, при получении лекарственного средства для предотвращения по меньшей мере одного симптома субъекта, страдающего от расстройства, которому могло бы помочь уменьшение и/или подавление экспрессии Serpinc1, такого как расстройство, сопровождающееся кровоточивостью, например, гемофилии. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В другом аспекте в настоящем изобретении предоставлены виды применения терапевтически эффективной дозы, например, фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
В еще одном аспекте в настоящем изобретении предоставлены применение средства iRNA, например, двухцепочечной РНК изобретения, нацеленного на ген Serpinc1, или фармацевтической композиции, содержащей терапевтически эффективную дозу, например, фиксированную дозу, составляющую от приблизительно 25 мг до приблизительно 100 мг, средства двухцепочечной рибонуклеиновой кислоты (RNAi), содержащего смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, при получении лекарственного средства для лечения субъекта, например, субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1, такого как субъект, имеющий расстройство, сопровождающееся кровоточивостью, например, гемофилию. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
Способы и виды применения изобретения включают введение композиции, описанной в данном документе, так что экспрессия гена-мишени Serpinc1 снижена, например, в течение приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или приблизительно 80 дней. В одном варианте осуществления экспрессия гена-мишени Serpinc1 снижена в течение продолжительного срока, например, по меньшей мере приблизительно семи дней или более, например, приблизительно одной недели, двух недель, трех недель, приблизительно четырех недель, приблизительно 5 недель, приблизительно 6 недель, приблизительно 2 месяцев, приблизительно квартала или дольше.
Уменьшение экспрессии гена можно оценить любыми способами, известными в данной области. Например, уменьшение экспрессии можно определить посредством определения уровня экспрессии мРНК Serpinc1 с использованием способов, общепринятых для специалистов в данной области, например, нозерн-блоттинга, количественной ПЦР в реальном времени, посредством определения уровня белка Serpinc1, используя способы, общепринятые для специалистов в данной области, такие как вестерн-блоттинг, иммунологические методики, и/или посредством определения биологической активности Serpinc1, таким как влияние на одну или более молекул, ассоциированных с клеточным механизмом свертывания крови (или в условиях in vivo самого свертывания крови). В одном варианте осуществления время выработки тромбина, время образования сгустка и/или время свертывания определяют для оценки экспрессии Serpinc1, используя, например, тромбоэластометрический анализ цельной крови ROTEM®.
Введение двухцепочечной РНК в соответствии со способами и видами применения изобретения могут привести к уменьшению степени тяжести, признаков, симптомов и/или маркеров таких заболеваний или расстройств у пациента с заболеванием, ассоциированным с Serpinc1. В данном контексте «уменьшением» обозначают статистически значимое снижение такого уровня. Уменьшение может быть, например, по меньшей мере приблизительно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или приблизительно на 100%.
Эффективность лечения или предотвращения заболевания можно оценить, например, измеряя прогрессирование заболевания, ремиссию заболевания, степень тяжести симптомов, частоту кровотечений, уменьшение боли, качество жизни, дозу лекарственного средства, требуемого для поддержания лечебного эффекта, уровня маркеров заболевания или любого другого измеряемого параметра, соответствующего данному заболеванию, подлежащего лечению или предназначенного для предотвращения. В компетенцию специалиста в данной области входит осуществление мониторинга эффективности лечения или предотвращения, измеряя любой из таких параметров или любую комбинацию параметров. Например, эффективность лечения расстройства, сопровождающегося кровоточивостью, можно оценить, например, посредством периодического мониторинга уровней тромбина:антитромбина. Сравнение более поздних показаний с первичными показаниями предоставляет врачу указание на то, является ли лечение эффективным. В возможность специалиста в данной области входит мониторинг эффективности лечения или предотвращения, измеряя любой из таких параметров или любую комбинацию параметров. В связи с введением iRNA, нацеленной на Serpinc1, или его фармацевтической композиции, «эффективное против» расстройства, сопровождающегося кровоточивостью, указывает на то, что введение клинически подходящим образом приводит к благоприятному эффекту, по меньшей мере, для статистически значимой части пациентов, такому как улучшение симптомов, лечения, уменьшение заболевания, продление жизни, улучшение качества жизни или другие эффекты, которые в целом признаны позитивными врачами, знакомыми с лечением расстройств, сопровождающихся кровоточивостью, и связанными с ними причинами.
Лечебный или профилактический эффект очевидны, когда имеется статистически значимое улучшение одного или нескольких параметров состояния заболевания или неспособность ухудшения или развития симптомов, когда их ожидали в противном случае. В качестве примера, об эффективном лечении может свидетельствовать благоприятное изменение, составляющее по меньшей мере 10% измеряемого параметра заболевания, а предпочтительно по меньшей мере 20%, 30%, 40%, 50% или более. Об эффективности данного лекарственного препарата iRNA или готовой формы такого лекарственного препарата также можно судить, используя экспериментальную животную модель для данного заболевания, как известно в данной области. При использовании экспериментальной животной модели эффективность лечения очевидна, когда наблюдается статистически значимое уменьшение маркера или симптома.
В качестве альтернативы, эффективность может определяться уменьшением степени тяжести заболевания, которое определяет специалист в области диагностики на основе клинически приемлемой шкалы оценки тяжести заболевания. Любое положительное изменение, приводящее, например, к уменьшению степени тяжести заболевания, измеренного с использованием соответствующей шкалы, представляет адекватное лечение с использованием iRNA или готовой формы iRNA, согласно настоящему изобретению.
iRNA (или фармацевтическую композицию, содержащую iRNA) можно вводить субъекту приблизительно один раз в неделю, приблизительно два раза в месяц, приблизительно каждые шесть недель, приблизительно каждые 2 месяца или каждые три месяца.
Двухнитевое средство iRNA можно вводить субъекту в виде одной или более доз. Например, двухнитевое средство iRNA можно вводить субъекту в виде месячной дозы от приблизительно 0,200 мг/кг до приблизительно 1,825 мг/кг. В качестве альтернативы, двухнитевое средство iRNA можно вводить субъекту в виде фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг.
В одном варианте осуществления средство двухцепочечной RNAi, содержащее смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, вводят субъекту в виде месячной дозы от приблизительно 0,200 мг/кг до приблизительно 0,250 мг/кг, например, приблизительно 0,225 мг/кг.
В другом варианте осуществления средство двухцепочечной RNAi, содержащее смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, вводят субъекту в виде месячной дозы, составляющей т приблизительно 0,425 мг/кг до приблизительно 0,475 мг/кг, например, приблизительно 0,450 мг/кг.
В другом варианте осуществления средство двухцепочечной RNAi, содержащее смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, вводят субъекту в виде месячной дозы от приблизительно 0,875 мг/кг до приблизительно 0,925 мг/кг, например, приблизительно 0,900 мг/кг.
В одном варианте осуществления средство двухцепочечной RNAi, содержащее смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, вводят субъекту в виде месячной дозы от приблизительно 1,775 мг/кг до приблизительно 1,825, мг/кг, например, приблизительно 1,800 мг/кг.
В одном варианте осуществления средство двухцепочечной RNAi, содержащее смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, вводят субъекту в виде фиксированной дозы, составляющей приблизительно 25 до приблизительно 100 мг, например, приблизительно 25 мг, 50 мг, 80 мг, или 100 мг. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
Введение можно повторять, например, регулярно, например, ежемесячно, в течение одного месяца, двух месяцев, трех месяцев, четырех месяцев или дольше. После первоначальной схемы лечения лечение можно проводить менее часто. Например, после ежемесячного введения в течение трех месяцев введение можно повторять один раз в квартал, в течение года или дольше.
Соответственно, в некоторых вариантах осуществления средство RNAi вводят в режиме дозирования, который включает «фазу загрузки» близко расположенных введений, за которой может следовать «поддерживающая фаза», при которой средство RNAi вводят с более длинными интервалами.
Режим дозирования загрузки и/или поддерживающий режим дозирования необязательно можно повторить в течение один или более повторений. Количество повторений от достижения желаемого эффекта, например, подавления гена Serpinc1 и/или достижения терапевтического или профилактического эффекта, например, увеличения свертывания крови, уменьшения времени образования сгустка и/или уменьшения время свертывания.
Введение iRNA может снизить уровни Serpinc1, например, в клетке, ткани, крови, моче или другом компартменте пациента, по меньшей мере, приблизительно на 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% или более.
IRNA можно вводить с помощью внутривенной инфузии в течение периода времени, например, в течение периода 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или приблизительно 25 минут.
Перед введением всей дозы iRNA пациентам можно ввести меньшую дозу, такую как 5% инфузию, и контролировать неблагоприятные эффекты, такие как аллергическая реакция. В другом примере можно проводить мониторинг пациента на нежелательные иммуностимулирующие эффекты, такие как повышенный уровень цитокинов (например, TNF-альфа или INF-альфа).
Благодаря ингибирующему действию на экспрессию Serpinc1 композиция в соответствии с изобретением или полученная из нее фармацевтическая композиция могут повысить качество жизни.
iRNA изобретения можно вводить в «голой» форме или в виде «свободной iRNA». Голую iRNA вводят в отсутствие фармацевтической композиции. Голая iRNA может находиться в подходящем буферном растворе. Буферный раствор может содержать ацетат, цитрат, проламин, карбонат или фосфат или любую их комбинацию. В одном варианте осуществления буферный раствор представляет собой фосфатно-солевой буферный раствор (PBS). pH и осмолярность буферного раствора, содержащего iRNA, можно регулировать так, чтобы он был подходящим для введения субъекту.
В качестве альтернативы, iRNA изобретения можно вводить в виде фармацевтической композиции, такой как липосомальная готовая форма двухцепочечной РНК.
Субъектами, на которых уменьшение и/или подавление экспрессии гена Serpinc1 окажет благотворное воздействие, являются субъекты, имеющие расстройство, сопровождающееся кровоточивостью, например, врожденное расстройство, сопровождающееся кровоточивостью, или приобретенное расстройство, сопровождающееся кровоточивостью, согласно настоящему изобретению. В одном варианте осуществления субъект, имеющий врожденное расстройство, сопровождающееся кровоточивостью, имеет гемофилию, например, гемофилию A, B, или C. В одном варианте осуществления субъект, имеющий врожденное расстройство, сопровождающееся кровоточивостью, например, гемофилию, является субъектом с ингибиторами (субъект который стал невосприимчивым к заместительным факторам свертывания). В одном варианте осуществления субъект с ингибитором имеет гемофилию A. В другом варианте осуществления субъект с ингибитором имеет гемофилию B. В другом варианте осуществления субъект с ингибитором имеет гемофилию C. Лечение субъекта, на которого уменьшение и/или подавление экспрессии гена Serpinc1 окажет благотворное воздействие, включает терапевтическое (например, по требованию, например, при кровотечении у субъекта (спонтанное кровотечение или кровотечение в результате травмы) и неспособности к образованию сгустка) и профилактическое (например, у субъекта нет кровотечения и/или он подвергается хирургическому вмешательству) лечение.
Изобретение дополнительно предоставляет способы и виды применения для применения iRNA или его фармацевтической композиции, например, для лечения субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1, например, субъекта, имеющего расстройство, сопровождающееся кровоточивостью, в комбинации с другими фармацевтическими средствами и/или другим терапевтическими способами, например, с известными фармацевтическими средствами и/или известными терапевтическими способами, такими как, например, задействованные в настоящее время для лечения этих расстройств.
Например, В некоторых вариантах осуществления iRNA. Нацеливающий Serpinc1, вводят в комбинации, например, со средством, пригодным для лечения расстройства, сопровождающегося кровоточивостью, как описано в другом месте данного документа. Например, дополнительные терапевтические средства и терапевтические способы, пригодные для лечения субъекта, которому могло бы принести пользу уменьшение и/или подавление экспрессии Serpinc1, например, субъекта, имеющего расстройство, сопровождающееся кровоточивостью, включают свежезамороженную плазму (FFP); рекомбинантный FVIIa; рекомбинантный FIX; концентраты FXI; вирус-инактивированные, vWF-содержащие концентраты FVIII; десенсибилизирующая терапия, которая может включать большие дозы FVIII или FIX, наряду со стероидами или внутривенным иммуноглобулином (IVIG) и циклофосфамидом; плазмаферез в сочетании с иммуносупрессией и инфузией FVIII или FIX, с антифибринолитической терапией или без нее; стимуляция иммунной толерантности (ITI) с иммуносупрессивной терапией (например, циклофосфамид, преднизон и/или анти-CD20) или без нее; десмопрессин ацетат [DDAVP]; антифибринолитики, такие как аминокапроновая кислота и транексамовая кислота; концентрат факторов активированного протромбинового комплекса (PCC); антигемофильные средства; кортикостероиды; иммунодепрессанты и эстрогены.
iRNA и дополнительный терапевтический средство и/или лечение можно вводить в одно и то же время и/или в одной и той же комбинации, например, парентерально, или дополнительный терапевтический средство можно вводить в виде части отдельной композиции или в разное время и/или другим способом, известным в данной области или описанным в данном документе.
В одном варианте осуществления в настоящем изобретении предоставлены способы лечения субъекта, страдающего от расстройства, сопровождающееся кровоточивостью, например, гемофилии, путем подкожного введения субъекту соединения AD-57213 (Смысловая нить: 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13) и антисмысловая нить: 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь) в дозе, составляющей от приблизительно 0,200 мг/кг до приблизительно 1,800 мг/кг, например, месячной дозе, составляющей от приблизительно 0,200 мг/кг до приблизительно 0,250 мг/кг; от приблизительно 0,425 мг/кг до приблизительно 0,475 мг/кг; от приблизительно 0,875 мг/кг до приблизительно 0,925 мг/кг; или от приблизительно 1,775 мг/кг до приблизительно 1,825 мг/кг.
В другом варианте осуществления в настоящем изобретении предоставлены способы лечения субъекта, страдающего от расстройства, сопровождающегося кровоточивостью, например, гемофилии, путем подкожного введения субъекту соединения AD-57213 (Смысловая нить: 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13) и антисмысловая нить: 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь) в фиксированной дозе, составляющей от приблизительно 25 мг до приблизительно 100 мг, например, фиксированной дозе, составляющей приблизительно 25 мг, приблизительно 50 мг, приблизительно 80 мг или приблизительно 100 мг. В одном варианте осуществления фиксированная доза составляет 50 мг. В другом варианте осуществления фиксированная доза составляет 80 мг.
III. iRNA для применения в способах изобретения
В данном документе описаны способы применения усовершенствованных средств двухцепочечной RNAi, которые ингибируют экспрессию гена Serpinc1 в клетке, например, в клетке субъекта, например, млекопитающего, такого как человек, имеющего ассоциированное с Serpinc1 расстройство, например, нарушение свертываемости, например, гемофилию.
Соответственно, изобретение предоставляет средства двухцепочечной RNAi с химическими модификациями, способными ингибировать экспрессию гена-мишени (т.е., гена Serpinc1) in vivo. В некоторых аспектах изобретения по существу все нуклеотиды iRNA изобретения являются модифицированными. В других вариантах осуществления изобретения все нуклеотиды iRNA изобретения являются модифицированными. iRNA изобретения, в которых «по существу все нуклеотиды являются модифицированными», модифицированы в значительной степени, но не целиком и могут содержать не более чем 5, 4, 3, 2 или 1 немодифицированных нуклеотидов.
Средство RNAi содержит смысловую нить и антисмысловую нить. Каждая нить средства RNAi может варьировать от 12-30 нуклеотидов в длину. Например, каждая нить может быть между 14-30 нуклеотидов в длину, 17-30 нуклеотидов в длину, 19-30 нуклеотидов в длину, 25-30 нуклеотидов в длину, 27-30 нуклеотидов в длину, 17-23 нуклеотида в длину, 17-21 нуклеотидов в длину, 17-19 нуклеотидов в длину, 19-25 нуклеотидов в длину, 19-23 нуклеотида в длину, 19-21 нуклеотид в длину, 21-25 нуклеотидов в длину или 21-23 нуклеотида в длину.
Смысловая нить и антисмысловая нить обычно образуют дуплексную двухцепочечную РНК («dsRNA»), также называемую в данном документе «средство RNAi». Дуплексная область средства RNAi может быть 12-30 нуклеотидных пар в длину. Например, дуплексная область может быть между 14-30 нуклеотидных пар в длину, 17-30 нуклеотидных пар в длину, 27-30 нуклеотидных пар в длину, 17-23 нуклеотидных пар в длину, 17-21 нуклеотидных пар в длину, 17-19 нуклеотидных пар в длину, 19-25 нуклеотидных пар в длину, 19-23 нуклеотидных пар в длину, 19-21 нуклеотидных пар в длину, 21-25 нуклеотидных пар в длину или 21-23 нуклеотидных пар в длину. В другом примере дуплексную область выбирают из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 и 27 нуклеотидов в длину.
В одном варианте осуществления средство RNAi может содержать одну или более «липких» концевых областей и/или блокирующих групп на 3'-конце, 5'-конце или обоих концах одной или обеих нитей. «Липкий» конец может иметь 1-6 нуклеотидов в длину, например, 2-6 нуклеотидов в длину, 1-5 нуклеотидов в длину, 2-5 нуклеотидов в длину, 1-4 нуклеотида в длину, 2-4 нуклеотида в длину, 1-3 нуклеотида в длину, 2-3 нуклеотида в длину или 1-2 нуклеотида в длину. «Липкие» концы могут быть результатом одной нити, более длинной чем другие, или результатом двух нитей одинаковой длины, являющихся ступенчатыми. «Липкий» конец может иметь несовместимость с мРНК-мишенью, или он может быть комплементарным последовательностям генов, являющихся мишенями, или может иметь другую последовательность. Первую и вторую нити также можно объединить, например, с помощью дополнительных оснований с образованием шпильки или с помощью других неосновных линкеров.
В одном варианте осуществления нуклеотиды в «липкой» концевой области средства RNAi каждый независимо может представлять собой модифицированный или немодифицированный нуклеотид, включая, без ограничения 2'-сахар модифицированный, например, 2-F, 2'-O-метил, тимидин (T), 2`-O-метоксиэтил-5-метилуридин (Teo), 2'-O-метоксиэтиладенозин (Aeo), 2'-O-метоксиэтил-5-метилцитидин (m5Ceo) и любые их комбинации. Например, TT может представлять собой «липкую» концевую последовательность для каждого конца на каждой нити. «Липкий» конец может образовать несовместимость с мРНК-мишенью, или он может быть комплементарным последовательностям генов, являющихся мишенями, или может иметь другую последовательность.
5'-или 3'-«липкие» концы в смысловой нити, антисмысловой нити или в обеих нитях средства RNAi могут быть фосфорилированы. В некоторых вариантах осуществления «липкая» концевая область (области) содержат два нуклеотида, имеющих тиофосфат между двумя нуклеотидами, причем два нуклеотида могут быть одинаковыми или отличаться. В одном варианте осуществления «липкий» конец находится на 3'-конце смысловой нити, антисмысловой нити или обеих нитей. В одном варианте осуществления этот 3'-«липкий» конец находится в антисмысловой нити. В одном варианте осуществления этот 3'-«липкий» конец находится в смысловой нити.
Средство RNAi может содержать только единственный «липкий» конец, который может усилить интерференционную активность RNAi, не влияя на ее общую стабильность. Например, одноцепочечный «липкий» конец может находиться в 3'-концевой области смысловой нити или в качестве альтернативы в 3'-концевой области антисмысловой нити. RNAi также может иметь тупой конец, находящийся на 5'-конце антисмысловой нити (или 3'-конце смысловой нити) или vice versa. Как правило, антисмысловая нить RNAi имеет «липкий» конец нуклеотида на 3'-конце, а 5'-конец является тупым. Не желая связывать себя теорией, ассиметричный тупой конец на 5'-конце антисмысловой нити и 3'-«липкий» конец антисмысловой нити способствуют направлению загрузки нити в процесс RISC.
Любую из нуклеиновых кислот, представленных в изобретении, можно синтезировать и/или модифицировать способами, хорошо зарекомендованными в данной области, такими как способы, описанные в ʺCurrent protocols in nucleic acid chemistry,ʺ Beaucage, S.L. et al. (Edrs.), John Wiley & Sons, Inc., New York, NY, USA, который включен настоящим в данный документ посредством ссылки. Модификации включают, например, концевые модификации, например, 5'-концевые модификации (фосфорилирование, конъюгация, перевернутые связи) или 3'-концевые модификации (конъюгация, ДНК нуклеотиды, перевернутые связи, и т.д.); модификации оснований, например, замену стабилизирующими основаниями, дестабилизирующими основаниями или основаниями, которые имеют пару оснований с расширенным репертуаром партнеров, удаление оснований (нуклеотидов с удаленным азотистым основанием), или конъюгированных оснований; модификации сахаров (например, в 2'-позиции или 4'-позиции) или замену сахара; и/или модификацию остова, включая модификацию или замену сложных фосфодиэфирных связей. Конкретные примеры соединений iRNA, используемых в вариантах осуществления в рамках изобретения, включают, без ограничения RNA, содержащие модифицированные остовы или без натуральных межнуклеозидных связей. RNA, имеющие модифицированные остовы, среди прочего включают RNA, которые не имеют в остове атома фосфора. Для цели этого описания и в качестве определенной ссылки на данную область модифицированные RNA, которые не имеют атома фосфора в их интернуклеозидном остове, также можно считать олигонуклеозидами. В некоторых вариантах осуществления модифицированная iRNA будет иметь атом фосфора в своем интернуклеозидном остове.
Модифицированные РНК остовы содержат, например, тиофосфаты, хиральные тиофосфаты, дитиофосфаты, фосфотрисложные эфиры, аминоалкилфосфотрисложные эфиры, метиловые и другие алкиловые фосфонаты, содержащие 3'-алкиленовые фосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотрисложные эфиры и боранофосфаты, имеющие нормальные 3'-5' связи, 2'-5'-связанные их аналоги, и аналоги, имеющие перевернутую полярность, при этом соседние пары нуклеозидных единиц связаны 3'-5' с 5'-3' или 2'-5' с 5'-2'. Также включены разные соли, смешанные соли и свободные кислые формы.
Типовые патенты США, которые излагают получение приведенных выше фосфорсодержащих связей, включают, без ограничения, патент США № 3,687,808; 4,469,863; 4,476,301; 5,023,243; 5,177,195; 5,188,897; 5,264,423; 5,276,019; 5,278,302; 5,286,717; 5,321,131; 5,399,676; 5,405,939; 5,453,496; 5,455,233; 5,466,677; 5,476,925; 5,519,126; 5,536,821; 5,541,316; 5,550,111; 5,563,253; 5,571,799; 5,587,361; 5,625,050; 6,028,188; 6,124,445; 6,160,109; 6,169,170; 6,172,209; 6, 239,265; 6,277,603; 6,326,199; 6,346,614; 6,444,423; 6,531,590; 6,534,639; 6,608,035; 6,683,167; 6,858,715; 6,867,294; 6,878,805; 7,015,315; 7,041,816; 7,273,933; 7,321,029; и US Pat RE39464, полное содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Модифицированные РНК остовы, которые не содержат в себе атом фосфора, имеют остовы, которые образованы короткоцепочечными алкиловыми или циклоалкиловыми межнуклеозидным связям, смешанными гетероатомами и алкиловыми или циклоалкиловыми межнуклеозидными связями, или одной или более короткоцепочечными гетероатомными или гетероциклическими межнуклеозидными связями. Они включают связи, имеющие морфолино связи (образованные частично из сахарной части нуклеозида); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетиловые и тиоформацетиловые остовы; метиленовые формацетиловые и тиоформацетиловые остовы; алкенсодержащие остовы; сульфаматовые остовы; метилениминовые и метиленгидразиновые остовы; сульфонатовые и сульфонамидные остовы; амидные остовы; и другие имеющие смешанные составные части N, O, S и CH2.
Типовые патенты США, которые излагают получение приведенных выше олигонуклеозидов включают, без ограничения, патент США № 5,034,506; 5,166,315; 5,185,444; 5,214,134; 5,216,141; 5,235,033; 5,64,562; 5,264,564; 5,405,938; 5,434,257; 5,466,677; 5,470,967; 5,489,677; 5,541,307; 5,561,225; 5,596,086; 5,602,240; 5,608,046; 5,610,289; 5,618,704; 5,623,070; 5,663,312; 5,633,360; 5,677,437; и, 5,677,439, полное содержание каждого из которых включено настоящим в данный документ посредством ссылки.
В других вариантах осуществления для применения в iRNA предусмотрены пригодные РНК миметики, в которых как сахарная, так и интернуклеозидная связь, т.е. остов нуклеотидных единиц замещены новыми группами. Базовые единицы сохранены для гибридизации с подходящим целевым соединением нуклеиновой кислоты. Одно такое олигомерное соединение, РНК миметик, которое было показано обладающим превосходными гибридизационными свойствами, называется пептидная нуклеиновая кислота (PNA). В соединениях PNA сахарный остов РНК замещен амидосодержащим остовом, в частности аминоэтилглициновым остовом. Нуклеооснования удерживаются и связаны непосредственно или опосредованно с аза атомами азота амидной части остова. Типовые патенты США, которые излагают получение соединений PNA, включают, без ограничения, патент США № 5,539,082; 5,714,331; и 5,719,262, полное содержание каждого из которых включено настоящим в данный документ посредством ссылки. Дополнительные соединения PNA, пригодные для применения в iRNA изобретения, описаны, например, у Nielsen et al., Science, 1991, 254, 1497-1500,
Некоторые варианты осуществления, представленные в изобретении, включают RNA с тиофосфатными остовами и олигонуклеозиды с гетероатомными остовами, и в частности --CH2--NH--CH2-, --CH2--N(CH3)--O--CH2--[известный как метиленовый (метилимино) или MMI остов], --CH2--O--N(CH3)--CH2--, --CH2--N(CH3)--N(CH3)--CH2-- и --N(CH3)--CH2--CH2--[при этом нативный сложный фосфодиэфирный остов представлен как --O--P--O--CH2--], приведенного выше патента США № 5,489,677, и амидные остовы, приведенные выше в патенте США № 5,602,240. В некоторых вариантах осуществления RNA, приведенные в данном документе, имеют структуры морфолино остова, приведенные выше в патенте США № 5,034,506.
Модифицированные RNA также могут содержать один или более замещенных фрагментов сахаров. iRNA, например, двухцепочечные РНК, приведенные в данном документе, могут содержать одно из следующего в 2'-позиции: OH; F; O-, S- или N-алкил; O-, S- или N-алкенил; O-, S-или N-алкинил; или O-алкил-O-алкил, при этом алкил, алкенил и алкинил может представлять собой замещенный или незамещенный C1-C10 алкил или C2-C10 алкенил и алкинил. Иллюстративные пригодные модификации включают O[(CH2)nO]mCH3, O(CH2).nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2, и O(CH2)nON[(CH2)nCH3)]2, причем n и m составляют от 1 до приблизительно 10. В других вариантах осуществления двухцепочечные РНК содержат одно из следующего в 2' позиции: C1-C10 низший алкил, замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, расщепляющую РНК группу, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств iRNA или группу для улучшения фармакодинамических свойств iRNA и другие заместители, имеющие похожие свойства. В некоторых вариантах осуществления модификация включает 2'-метоксиэтокси (2'-O--CH2CH2OCH3, также известный как 2'-O-(2-метоксиэтил) или 2'-MOE) (Martin et al., Helv. Chim. Acta, 1995, 78:486-504) т.е., группу алкокси-алкокси. Другой иллюстративной модификацией является 2'-диметиламинооксиэтокси, т.е., группа O(CH2)2ON(CH3)2, также известная как 2'-DMAOE, согласно примерам в данном документе ниже, и 2'-диметиламиноэтоксиэтокси (также известный в данной области как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е., 2'-O--CH2--O--CH2--N(CH2)2.
Другие модификации включают 2'-метокси (2'-OCH3), 2'-аминопропокси (2'-OCH2CH2CH2NH2) и 2'-фтор (2'-F). Похожие модификации также можно сделать в других позициях на РНК iRNA, особенно в 3' позиции сахара на 3'-концевом нуклеотиде или в 2'-5' связанных двухцепочечных РНК и в 5' позиции 5' концевого нуклеотида. iRNA также могут иметь сахарные миметики, такие как циклобутиловые фрагменты вместо пентофуранозилового сахара. Типовые патенты США, которые излагают получение таких структур модифицированного сахара, включают, без ограничения, патент США № 4,981,957; 5,118,800; 5,319,080; 5,359,044; 5,393,878; 5,446,137; 5,466,786; 5,514,785; 5,519,134; 5,567,811; 5,576,427; 5,591,722; 5,597,909; 5,610,300; 5,627,053; 5,639,873; 5,646,265; 5,658,873; 5,670,633; и 5,700,920, некоторые из которых имеют общего владельца с рассматриваемой в данный момент заявкой. Полное содержание каждого из изложенного выше включено настоящим в данный документ посредством ссылки.
iRNA также может содержать модификации или замещения нуклеооснования (часто называемого в данной области просто «основание»). В рамках изобретения «немодифицированные» или «натуральные» нуклеооснования включают пуриновые основания аденин (A) и гуанин (G) и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеооснования включают другие синтетические и натуральные нуклеооснования, такие как дезокси-тимин (dT), 5-метилцитозин (5-me-C), 5-гидроксиметил цитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и цитозин, 5-пропинил урацил и цитозин, 6-азо урацил, цитозин и тимин, 5-урацил (всевдоурацил), 4-тиоурацил, 8-гало, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-гало, особенно 5-бромо, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-даазааденин и 3-деазагуанин и 3-деазааденин. Дополнительные нуклеооснования включают нуклеооснования, раскрытые в патенте США № 3,687,808, нуклеооснования, раскрытые в Modified Nucleosides in Biochemistry, Biotechnology and Medicine, Herdewijn, P. ed. Wiley-VCH, 2008; нуклеооснования, раскрытые в The Concise Encyclopedia Of Polymer Science And Engineering, pages 858-859, Kroschwitz, J. L, ed. John Wiley & Sons, 1990, нуклеооснования, раскрытые Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613, и нуклеооснования, раскрытые Sanghvi, Y S., Chapter 15, dsRNA Research and Applications, pages 289-302, Crooke, S. T. and Lebleu, B., Ed., CRC Press, 1993. Некоторые из этих нуклеооснований особенно используются для повышения связывающей аффинности олигомерных соединений, представленных в изобретении. Они включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и 0-6 замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Было показано, что 5-метилцитозиновые замещения увеличивают дуплексную стабильность нуклеиновых кислот на 0,6-1,2°C (Sanghvi, Y. S., Crooke, S. T. and Lebleu, B., Eds., dsRNA Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278), и они являются иллюстративными замещениями оснований, еще более конкретно, при комбинировании с 2'-O-метоксиэтиловыми модификациями сахаров.
Типовые патенты США, которые излагают получение некоторых приведенных выше отмеченных модифицированных нуклеооснований, а также других модифицированных нуклеооснований, включают, без ограничения, отмеченный выше патент США № 3,687,808, 4,845,205; 5,130,30; 5,134,066; 5,175,273; 5,367,066; 5,432,272; 5,457,187; 5,459,255; 5,484,908; 5,502,177; 5,525,711; 5,552,540; 5,587,469; 5,594,121, 5,596,091; 5,614,617; 5,681,941; 5,750,692; 6,015,886; 6,147,200; 6,166,197; 6,222,025; 6,235,887; 6,380,368; 6,528,640; 6,639,062; 6,617,438; 7,045,610; 7,427,672; и 7,495,088, полное содержание каждого из которых включено настоящим в данный документ посредством ссылки.
РНК iRNA также может быть модифицирована, чтобы содержать один или более бициклических фрагментов сахаров. «Бициклический сахар» представляет собой фуранозильное кольцо, модифицированное за счет мостика из двух атомов. «Бициклический нуклеозид» («BNA») представляет собой нуклеозид, имеющий фрагмент сахара, содержащий мостик, соединяющий два атома углерода сахарного кольца, образуя тем самым бициклическую кольцевую систему. В некоторых вариантах осуществления мостик соединяет 4'-углерод и 2'-углерод сахарного кольца. Таким образом, в некоторых вариантах осуществления средство изобретения может содержать РНК, или iRNA также можно модифицировать, чтобы она содержала одну или более заблокированных нуклеиновых кислот (LNA). Заблокированная нуклеиновая кислота представляет собой нуклеотид, имеющий модифицированный фрагмент рибозы, при этом фрагмент рибозы содержит дополнительный мостик, соединяющий 2' и 4' углерод. Другими словами, LNA представляет собой нуклеотид, содержащий бициклический фрагмент сахара, содержащий 4'-CH2-O-2' мостик. Эта структура эффективно «блокирует» рибозу в 3'-концевой структурной конформации. Было показано, что присоединение заблокированных нуклеиновых кислот к миРНК повышает стабильность миРНК в сыворотке и уменьшает ненаправленные действия (Elmen, J. et al., (2005) Nucleic Acids Research 33(1):439-447; Mook, OR. et al., (2007) Mol Canc Ther 6(3):833-843; Grunweller, A. et al., (2003) Nucleic Acids Research 31(12):3185-3193).
Примеры бициклических нуклеозидов для применения в полинуклеотидах изобретения включают без ограничения нуклеозиды, содержащие мостик между 4' и 2' атомами кольца рибозы. В некоторых вариантах осуществления средства изобретения с антисмысловыми полинуклеотидами содержат один или более бициклических нуклеозидов, содержащих 4'-2' мостик. Примеры таких бициклических нуклеозидов с 4'-2' мостиком включают без ограничения 4'-(CH2)-O-2' (LNA); 4'-(CH2)-S-2'; 4'-(CH2)2-O-2' (ENA); 4'-CH(CH3)-O-2' (также называемый «ограниченный этил» или «cEt») и 4'-CH(CH2OCH3)-O-2' (и его аналоги; см., например, патент США № 7,399,845); 4'-C(CH3)(CH3)-O-2' (и его аналоги; см., например, патент США № 8,278,283); 4'-CH2-N(OCH3)-2' (и его аналоги; см., например, патент США № 8,278,425); 4'-CH2-O-N(CH3)-2' (см., например, публикацию патента США № 2004/0171570); 4'-CH2-N(R)-O-2', при этом R представляет собой H, C1-C12 алкил или защитную группу (см., например, патент США № 7,427,672); 4'-CH2-C(H)(CH3)-2' (см., например, Chattopadhyaya et al., J. Org. Chem., 2009, 74, 118-134); и 4'-CH2-C(=CH2)-2' (и его аналоги; см., например, патент США № 8,278,426). Полное содержание каждого из изложенного выше включено настоящим в данный документ посредством ссылки.
Дополнительные типовые патенты США и публикации патентов США, которые излагают получение нуклеотидов заблокированных нуклеиновых кислот, включают, без ограничения, следующее: патент США № 6,268,490; 6,525,191; 6,670,461; 6,770,748; 6,794,499; 6,998,484; 7,053,207; 7,034,133;7,084,125; 7,399,845; 7,427,672; 7,569,686; 7,741,457; 8,022,193; 8,030,467; 8,278,425; 8,278,426; 8,278,283; US 2008/0039618; и US 2009/0012281, полное содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Может быть получен любой из вышеизложенных бициклических нуклеозидов, имеющий одну или более стереохимических конфигурций сахаров, включая, например α-L-рибофураноз и β-D-рибофураноз (см. WO 99/14226).
РНК iRNA также можно модифицировать, чтобы она содержала один или более ограниченных этилом нуклеотидов. В рамках изобретения «ограниченный этилом нуклеотид» или «cEt» представляет собой заблокированную нуклеиновую кислоту, содержащую бициклический фрагмент сахара, содержащий 4'-CH(CH3)-0-2' мостик. В одном варианте осуществления ограниченный этилом нуклеотид находится в конформации S, называемой в данном документе «S-cEt».
iRNA изобретения также может содержать один или более «конформационно ограниченных нуклеотидов» («CRN»). CRN представляют собой аналоги нуклеотидов с линкером, соединяющим C2' и C4' атомы углерода рибозы или C3 и -C5' атомы углерода рибозы. CRN запирают кольцо рибозы в устойчивую структуру и повышают аффинность гибридизации с мРНК. Линкер имеет достаточную длину для помещения кислорода в оптимальное положение для стабильности и аффинности, приводящее к меньшей деформации кольца рибозы.
Типовые публикации, которые излагают получение некоторых из приведенных выше отмеченных CRN, включают, без ограничения, публикацию патента США № 2013/0190383; и публикацию PCT WO 2013/036868, полное содержание каждой из которых включено настоящим в данный документ посредством ссылки.
Один или более нуклеотидов iRNA изобретения также может содержать замещенный гидроксиметилом нуклеотид. «Замещенный гидроксиметилом нуклеотид» представляет собой aциклический 2'-3'-секо-нуклеотид, также называемый модификация «незаблокированной нуклеиновой кислоты» («UNA»).
Типовые Публикации США, которые излагают получение UNA, включают, без ограничения, патент США № 8,314,227; и публикацию патента США № 2013/0096289; 2013/0011922; и 2011/0313020, полное содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Потенциально стабилизирующие модификации на концах молекул РНК могут включать N-(ацетиламинокапроил)-4-гидроксипролинол (Hyp-C6-NHAc), N-(капроил-4-гидроксипролинол (Hyp-C6), N-(ацетил-4-гидроксипролинол (Hyp-NHAc), тимидин-2'-0-дезокситимидин (эфир), N-(аминокапроил)-4-гидроксипролинол (Hyp-C6-амино), 2-докосаноил-уридин-3''-фосфат, перевернутое основание dT(idT) и другие. Раскрытие этой модификации можно найти в публикации PCT № WO 2011/005861.
A. Модифицированные iRNA, Содержащие Мотивы изобретения
В некоторых аспектах изобретения средства двухцепочечной RNAi изобретения включают средства с химическими модификациями, которые раскрыты, например, в предварительной заявке США № 61/561,710, поданной 18 ноября 2011 года, или в PCT/US2012/065691, поданной 16 ноября 2012 года, полное содержание каждой из которых включено в данный документ посредством ссылки.
Как показано в данном документе, в предварительной заявке № 61/561,710, и в PCT/US2012/065691, превосходный результат может быть получен посредством введения одного или более мотивов трех идентичных модификаций трех последовательных нуклеотидов в смысловую нить и/или антисмысловую нить средства RNAi, особенно на участке расщепления или около него. В некоторых вариантах осуществления смысловую нить и антисмысловую нить средства RNAi можно полностью модифицировать иным образом. Введение этих мотивов прерывает схему модификации, при наличии, смысловой и/или антисмысловой нити. Средство RNAi необязательно можно конъюгировать с лигандом производного GalNAc, например, на смысловой нити. Полученные в результате средства RNAi обеспечивают превосходную активность выключения генов.
Более конкретно, было неожиданно открыто, что когда смысловую нить и антисмысловую нить средства двухцепочечной RNAi модифицируют с наличием одного или более мотивов трех идентичных модификаций на трех последовательных нуклеотидах на или около участка расщепления по меньшей мере одной нити средства RNAi, значительно улучшается активность выключения генов средства RNAi.
В одном варианте осуществления средство RNAi представляет собой двусторонний блантмер из 19 нуклеотидов в длину, при этом смысловая нить содержит по меньшей мере один мотив из трех 2'-F модификаций трех последовательных нуклеотидов в позициях 7, 8, 9 от 5' конца. Антисмысловая нить содержит по меньшей мере один мотив из трех 2'-O-метиловых модификаций трех последовательных нуклеотидов в позициях 11, 12, 13 от 5' конца.
В другом варианте осуществления средство RNAi представляет собой двусторонний блантмер из 20 нуклеотидов в длину, при этом смысловая нить содержит по меньшей мере один мотив из трех 2'-F модификаций трех последовательных нуклеотидов в позициях 8, 9, 10 от 5' конца. Антисмысловая нить содержит по меньшей мере один мотив из трех 2'-O-метил модификаций трех последовательных нуклеотидов в позициях 11, 12, 13 от 5' конца.
В другом варианте осуществления средство RNAi представляет собой двусторонний блантмер из 21 нуклеотида в длину, при этом смысловая нить содержит по меньшей мере один мотив из трех 2'-F модификаций трех последовательных нуклеотидов в позициях 9, 10, 11 от 5' конца. Антисмысловая нить содержит по меньшей мере один мотив из трех 2'-O-метил модификаций трех последовательных нуклеотидов в позициях 11, 12, 13 от 5' конца.
В одном варианте осуществления средство RNAi содержит 21 нуклеотидную смысловую нить и 23 нуклеотидную антисмысловую нить, при этом смысловая нить содержит по меньшей мере один мотив из трех 2'-F модификаций трех последовательных нуклеотидов в позициях 9, 10, 11 от 5' конца; антисмысловая нить содержит по меньшей мере один мотив из трех 2'-O-метил модификаций трех последовательных нуклеотидов в позициях 11, 12, 13 от 5' конца, при этом один конец средства RNAi является тупым, тогда как другой конец содержит «липкий» конец из 2 нуклеотидов. Предпочтительно, «липкий» конец из 2 нуклеотидов находится на 3'-конце антисмысловой нити. Когда «липкий» конец из 2 нуклеотидов находится на 3'-конце антисмысловой нити, между концевыми тремя нуклеотидами могут быть две тиофосфатные межнуклеотидные связи, при этом два из трех нуклеотидов представляют собой «липкие» концевые нуклеотиды, а третий нуклеотид представляет собой парный нуклеотид рядом с «липким» концевым нуклеотидом. В одном варианте осуществления средство RNAi дополнительно имеет две тиофосфатные межнуклеотидные связи между концевыми тремя нуклеотидами на обоих 5'-концах смысловой нити и на 5'-конце антисмысловой нити. В одном варианте осуществления каждый нуклеотид в смысловой нити и антисмысловой нити средства RNAi, включая нуклеотиды, которые составляют часть мотивов, являются модифицированными нуклеотидами. В одном варианте осуществления каждый остаток независимо модифицируют 2'-O-метилом или 3'-фтором, например, в чередующемся мотиве. Необязательно, средство RNAi дополнительно содержит лиганд (предпочтительно GalNAc3).
В одном варианте осуществления средство RNAi содержит смысловую и антисмысловую нити, при этом средство RNAi содержит первую нить, имеющую длину, которая составляет по меньшей мере 25, а самое большее 29 нуклеотидов, и вторую нить, имеющую длину, которая составляет самое большее 30 нуклеотидов по меньшей мере с одним мотивов из трех 2'-O-метил модификаций трех последовательных нуклеотидов в позиции 11, 12, 13 от 5' конца; при этом 3'-конец первой нити и 5'-конец второй нити образуют тупой конец, а вторая нить на 1-4 нуклеотида длиннее на своем 3' конце, чем первая нить, при этом дуплексная область, которая составляет по меньшей мере 25 нуклеотидов в длину, и вторая нить является достаточно комплементарными целевой мРНК вдоль длины второй нити по меньшей мере из 19 нуклеотидов для уменьшения экспрессии гена-мишени, когда средство RNAi вводят в клетку млекопитающего, и при этом расщепление дайсера средством RNAi предпочтительно приводит к миРНК, содержащей 3'-конец второй нити, тем самым уменьшая экспрессию гена-мишени у млекопитающего. Необязательно, средство RNAi дополнительно содержит лиганд.
В одном варианте осуществления смысловая нить средства RNAi содержит по меньшей мере один мотив трех идентичных модификаций трех последовательных нуклеотидов, причем один из мотивов возникает в смысловой нити на участке расщепления.
В одном варианте осуществления антисмысловая нить средства RNAi также может содержать по меньшей мере один мотив трех идентичных модификаций трех последовательных нуклеотидов, причем один из мотивов возникает в антисмысловой нити на участке расщепления или около него.
Для средства RNAi, имеющего дуплексную область из 17-23 нуклеотидов в длину, участок расщепления антисмысловой нити обычно находится приблизительно в 10, 11 и 12 позициях от 5'-конца. Таким образом мотивы трех идентичных модификаций могут возникать в 9, 10, 11 позициях; 10, 11, 12 позициях; 11, 12, 13 позициях; 12, 13, 14 позициях; или 13, 14, 15 позициях антисмысловой нити, считая начиная с 1ого нуклеотида от 5'-конца антисмысловой нити, или, считая начиная с 1ого парного нуклеотида внутри дуплексной области от 5'-конца антисмысловой нити. Участок расщепления в антисмысловой нити также может изменяться согласно длине области дуплекса RNAi от 5'-конца.
Смысловая нить средства RNAi может содержать по меньшей мере один мотив трех идентичных модификаций трех последовательных нуклеотидов на участке расщепления нити; и антисмысловая нить может иметь по меньшей мере один мотив трех идентичных модификаций трех последовательных нуклеотидов на участке расщепления нити или около него. Когда смысловая нить и антисмысловая нить образуют двухцепочечный РНК дуплекс, смысловую нить и антисмысловую нить можно выровнять так, что один мотив из трех нуклеотидов на смысловой нити и один мотив из трех нуклеотидов на антисмысловой нити имеют перекрытие по меньшей мере из одного нуклеотида, т.е., по меньшей мере один из трех нуклеотидов мотива в смысловой нити образует пару оснований с по меньшей мере одним из трех нуклеотидов мотива в антисмысловой нити. В качестве альтернативы, перекрываться могут по меньшей мере два нуклеотида, или перекрываться могут все три нуклеотида.
В одном варианте осуществления смысловая нить средства RNAi может содержать более чем один мотив трех идентичных модификаций трех последовательных нуклеотидов. Первый мотив может возникать на участке расщепления нити или около него, а другие мотивы могут представлять собой крыльевую модификацию. Термин «крыльевая модификация» в данном документе относится к мотиву, возникающему в другой части нити, которая отделена от мотива на участке расщепления одной и той же нити или около него. Крыльевая модификация находится либо рядом с первым мотивом, либо отделена по меньшей мере одним или более нуклеотидами. Когда мотивы расположены непосредственно рядом друг с другом, то химический состав мотивов отличается друг от друга, а когда мотивы разделены одним или более нуклеотидом, то химические составы могут быть одинаковыми или отличаться. Может иметься две или более крыльевых модификации. Например, когда имеются две крыльевые модификации, каждая крыльевая модификация может возникать в одном конце относительно первого мотива, который находится на сайте расщепления или около него или на какой-либо стороне переднего мотива.
Как смысловая нить, антисмысловая нить средства RNAi может содержать более чем один мотив трех идентичных модификаций трех последовательных нуклеотидов, с по меньшей мере одним из мотивов, возникающих на участке расщепления нити или около него. Эта антисмысловая нить также может содержать одну или более крыльевых модификаций, выровненных по аналогии с крыльевыми модификациями, которые могут иметься на смысловой нити.
В одном варианте осуществления крыльевая модификация на смысловой нити или антисмысловой нити средства RNAi обычно не содержит первые один или два концевых нуклеотида на 3'-конце, 5'-конце или обоих концах нити.
В другом варианте осуществления крыльевая модификация на смысловой нити или антисмысловой нити средства RNAi обычно не содержит первые один или два парных нуклеотида внутри дуплексной области на 3'-конце, 5'-конце или обоих концах нити.
Когда смысловая нить и антисмысловая нить средства RNAi каждая содержит по меньшей мере одну крыльевую модификацию, крыльевые модификации могут попадать на один и тот же конец дуплексной области, и иметь перекрытие одним, двумя или тремя нуклеотидами.
Когда смысловая нить и антисмысловая нить средства RNAi каждая содержит по меньшей мере две крыльевых модификации, смысловую нить и антисмысловую нить можно выровнять так, что две модификации каждая из одной нити попадают на один конец дуплексной области, имеющей перекрытие из одного, двух или трех нуклеотидов; две модификации каждая из одной нити попадают на другой конец дуплексной области, имеющей перекрытие из одного, двух или трех нуклеотидов; две модификации из одной нити попадают с каждой стороны переднего мотива, имеющего перекрытие из одного, двух или трех нуклеотидов в дуплексной области.
В одном варианте осуществления можно модифицировать каждый нуклеотид в смысловой нити и антисмысловой нити средства RNAi, содержащие нуклеотиды, которые составляют часть мотивов. Каждый нуклеотид можно модифицировать с однимаковой или с разными модификациями, которые могут включать одну или более альтераций одного или обоих несвязанных атомов кислорода фосфата и/или одного или более связанных атомов кислорода фосфата; альтерацию составной части сахара рибозы, например, 2' гидроксила сахара рибозы; массовую замену фрагмента фосфата «деосфо» линкерами; модификацию или замену основания природного происхождения; и замену или модификацию рибозо-фосфатного остова.
Так как нуклеиновые кислоты являются полимерами субъединиц, много модификаций возникает в позиции, которая повторяется внутри нуклеиновой кислоты, например, модификация основания или фрагмента фосфата или несвязанного O фрагмента фосфата. В некоторых случаях модификация будет возникать во всех объектных позициях в нуклеиновой кислоте, но во многих случаях нет. В качестве примера модификация может возникать только в 3' или 5' концевой позиции, может возникать только в концевой области, например, в позиции на концевом нуклеотиде или в последних 2, 3, 4, 5 или 10 нуклеотидах нити. Модификация может происходить в области двойной нити, в области одинарной нити или в обеих. Модификация может происходить только в области двойной нити РНК или может происходить только в области одинарной нити RNA. Например, модификация тиофосфата в позиции несвязанного O может происходить только на одном или обоих концах, может происходить только в концевой области, например, в позиции на концевом нуклеотиде или в последних 2, 3, 4, 5 или 10 нуклеотидах нити, или может происходить в областях двойной нити и одинарной нити, особенно на концах. 5'-конец или концы могут быть фосфорилированы.
Может быть возможно, например, повысить стабильность, включить конкретные основания в «липкие» концы или включить модифицированные нуклеотиды или нуклеотидные суррогаты на «липких» концах одинарной нити, например, на 5' или 3' «липком» конце или на обоих. Например, может быть необходимо включить пуриновые нуклеотиды в «липкие» концы. В некоторых вариантах осуществления можно модифицировать все или некоторые из оснований на 3' или 5' «липком» конце, например, с помощью модификации в рамках изобретения. Модификации могут включать, например, использование модификаций в 2' позиции сахара рибозы с помощью модификаций, которые известны в данной области, например, использование дезоксирибонуклеотидов, 2'-дезокси-2'-фтор (2'-F) или 2'-O-метил модифицированных вместо рибосахара нуклеооснования, и модификации в фосфатной группе, например, модификации тиофосфата. Надо, чтобы «липкие» концы были гомологичными с последовательностью-мишенью.
В одном варианте осуществления каждый остаток смысловой нити и антисмысловой нити независимо модифицируют LNA, HNA, CeNA, 2'-метоксиэтилом, 2'-O-метилом, 2'-O-аллилом, 2'-C-аллилом, 2'-дезокси, 2'-гидроксилом или 2'-фтором. Нити могут содержать более чем одну модификацию. В одном варианте осуществления каждый остаток смысловой нити и антисмысловой нити независимо модифицируют 2'-O-метилом или 2'-фтором.
На смысловой нити и антисмысловой нити обычно имеются по меньшей мере две разные модификации. Эти две модификации могут быть 2'-O-метил или 2'-фтор модификации или другие.
В одном варианте осуществления Na и/или Nb содержат модификации чередующейся схемы. Термин «чередующийся мотив» в рамках изобретения относится к мотиву, имеющему одну или более модификации, каждая модификация возникает на чередующихся нуклеотидах одной нити. Чередующийся нуклеотид может относиться к одному на каждые два нуклеотида или к одному на каждые три нуклеотида или в похожей схеме. Например, если A, B и C каждый представляет один тип модификации нуклеотида, чередующимся мотивом может быть «ABABABABABAB…», «AABBAABBAABB…», «AABAABAABAAB…», «AAABAAABAAAB…», «AAABBBAAABBB…» или «ABCABCABCABC…» и т.д.
Тип модификаций, содержащихся в чередующемся мотиве, может быть одинаковым или отличаться. Например, если A, B, C, D каждый представляет на нуклеотиде модификацию одного типа, чередующаяся схема, т.е., модификации на каждом другом нуклеотиде, могут быть одинаковыми, но каждую смысловую нить или антисмысловую нить можно выбирать из нескольких возможностей модификаций внутри чередующегося мотива, таких как «ABABAB…», «ACACAC…» «BDBDBD…» или «CDCDCD…» и т.д.
В одном варианте осуществления средство RNAi изобретения содержит схему модификации для чередующегося мотива на смысловой нити относительно схемы модификации для чередующегося мотива на антисмысловой нити со сдвигом. Сдвиг может быть такой, что модифицированная группа нуклеотидов смысловой нити соответствует иным образом модифицированной группе нуклеотидов антисмысловой нити и наоборот. Например, смысловая нить при спаривании с антисмысловой нитью в двухцепочечном РНК дуплексе, чередующийся мотив в смысловой нити может начинаться с «ABABAB» от 5' 3' нити, а чередующийся мотив в антисмысловой нити может начинаться с «BABABA» от 5'-3' нити внутри дуплексной области. В качестве другого примера чередующийся мотив в смысловой нити может начинаться с «AABBAABB» от 5' 3' нити, а чередующийся мотив в антисмысловой нити может начинаться с «BBAABBAA» от 5'-3' нити внутри дуплексной области, так что происходит полный или частичный сдвиг схем модификации между смысловой нитью и антисмысловой нитью.
В одном варианте осуществления средство RNAi содержит схему чередующегося мотива 2'-O-метил модификации, а 2'-F модификация на смысловой нити первоначально имеет сдвиг относительно первоначальной схемы чередующегося мотива 2'-O-метил модификации и 2'-F модификации на антисмысловой нити, т.е., 2'-O-метил модифицированный нуклеотид на паре оснований смысловой нити с 2'-F модифицированным нуклеотидом на антисмысловой нити и vice versa. 1 позиция смысловой нити может начинаться с 2'-F модификации, а 1 позиция антисмысловой нити может начинаться с 2'-O-метил модификации.
Введение в смысловую нить и/или антисмысловую нить одного или более мотивов трех идентичных модификаций трех последовательных нуклеотидов прерывает первоначальную схему модификации, имеющуюся в смысловой нити и/или в антисмысловой нити. Это прерывание схемы модификации смысловой и/или антисмысловой нити посредством введения в смысловую и/или антисмысловую нить одного или более мотивов трех идентичных модификаций трех последовательных нуклеотидов неожиданно усиливает активность выключения генов для гена-мишени.
В одном варианте осуществления, когда мотив трех идентичных модификаций трех последовательных нуклеотидов вводят в любую из нитей, модификация нуклеотида рядом с мотивом представляет собой иную модификацию, чем модификация мотива. Например, часть последовательности, содержащей мотив, составляет «…NaYYYNb…», причем «Y» представляет модификацию мотива трех идентичных модификаций на трех последовательных нуклеотидах, и «Na» и «Nb» представляет модификацию нуклеотида рядом с мотивом «YYY», которая отличается от модификации Y, и причем Na и Nbмогут быть одинаковыми или различными модификациями. Альтернативно, Na и/или Nb может иметься или отсутствовать, когда имеется крыльевая модификация.
Средство RNAi может дополнительно содержать по меньшей мере одну тиофосфатную или метилфосфонатную межнуклеотидную связь. Модификация тиофосфатной или метилфосфонатной межнуклеотидной связи может происходить на любой нуклеотидной смысловой нити или антисмысловой нити или обеих нитях в любой позиции нити. Например, модификация межнуклеотидной связи может происходить на каждом нуклеотиде на смысловой нити и/или антисмысловой нити; каждая модификация межнуклеотидной связи может происходить в чередующейся схеме на смысловой нити и/или антисмысловой нити; или смысловая нить или антисмысловая нить может содержать обе модификации межнуклеотидной связи в чередующейся схеме. Чередующаяся схема модификации межнуклеотидной связи на смысловой нити может быть одинаковой или отличаться от антисмысловой нити, а чередующаяся схема модификации межнуклеотидной связи на смысловой нити может иметь сдвиг относительно чередующейся схемы модификации межнуклеотидной связи на антисмысловой нити.
В одном варианте осуществления RNAi содержит модификация межнуклеотидной связи тиофосфата или метилфосфоната в «липкой» концевой области. Например, «липкая» концевая область может содержать два нуклеотида, имеющие тиофосфатную или метилфосфонатную межнуклеотидную связь между двумя нуклеотидами. Модификации межнуклеотидной связи также можно сделать для связи «липких» концевых нуклеотидов с концевыми парными нуклеотидами внутри дуплексной области. Например, по меньшей мере 2, 3, 4 или все «липкие» концевые нуклеотиды могут быть связаны через тиофосфатную или метилфосфонатную межнуклеотидную связь, и необязательно, могут иметься дополнительные тиофосфатные или метилфосфонатные межнуклеотидные связи, связывающие «липкий» концевой нуклеотид с парным нуклеотидом, который находится рядом с «липким» концевым нуклеотидом. Например, может быть по меньшей мере две тиофосфатные межнуклеотидные связи между концевыми тремя нуклеотидами, в которых два из трех нуклеотидов представляют собой «липкие» концевые нуклеотиды, а третий представляет собой парный нуклеотид рядом с «липким» концевым нуклеотидом. Эти три концевые нуклеотиды могут быть на 3'-конце антисмысловой нити, 3'-конце смысловой нити, 5'-конце антисмысловой нити и/или 5'-конце антисмысловой нити.
В одном варианте осуществления «липкий» конец из 2 нуклеотидов находится на 3'-конце антисмысловой нити, и между концевыми тремя нуклеотидами имеется две тиофосфатные межнуклеотидные связи, при этом два из трех нуклеотидов представляют собой «липкие» концевые нуклеотиды, а третий нуклеотид представляет собой парный нуклеотид рядом с «липким» концевым нуклеотидом. Необязательно, средство RNAi может дополнительно иметь две тиофосфатные межнуклеотидные связи между концевыми тремя нуклеотидами на обоих 5'-концах смысловой нити и на 5'-конце антисмысловой нити.
В одном варианте осуществления средство RNAi имеет несовместимость (несовместимости) с мишенью, внутри дуплекса, или их комбинации. «Несовместимостью» может быть неканоническое спаривание оснований или отличающееся от канонического спаривание нуклеотидов. Несовместимость может происходить в «липкой» концевой области или дуплексной области. Пару оснований можно ранжировать на основе их способности содействовать диссоциации или плавлению (например, при свободной энергии ассоциации или диссоциации конкретного спаривания, самый простой подход состоит в том, чтобы исследовать пары на основе индивидуальных пар, хотя также можно использовать следующих соседей или похожий анализ). С точки зрения содействия диссоциации: A:U предпочтительнее чем G:C; G:U предпочтительнее чем G:C; и I:C предпочтительнее чем G:C (I=инозин). Ошибочные нуклеотиды, например, неканонического или отличающегося от канонического спаривания (как описано в другом месте в данном документе) предпочтительнее, чем канонические (A:T, A:U, G:C) спаривания; и спаривания, которые содержат универсальное основание, предпочтительнее, чем канонические спаривания. «универсальное основание» представляет собой основание, которое демонстрирует способность заменять любое из четырех нормальных оснований (G, C, A и U) без существенной дестабилизации взаимодействий соседних пар оснований или нарушения ожидаемой функциональной биохимической полезности модифицированного олигонуклеотида. Неограничивающие примеры универсальных оснований включают 2'-дезоксиинозин (гипоксантин дезоксинуклеотид) или его производные, аналоги нитроазола и гидрофобные ароматические основания без водородных связей.
В одном варианте осуществления средство RNAi содержит по меньшей мере одно из первых 1, 2, 3, 4 или 5 пар оснований внутри дуплексных областей от 5'-конца антисмысловой нити независимо выбираютной из группы: A:U, G:U, I:C, и ошибочно спаренных пары, например, неканонические или отличающиеся от канонических спаривания или спаривания, которые содержат универсальное основание, способствующее диссоциации антисмысловой нити на 5'-конце дуплекса.
В одном варианте осуществления нуклеотид в 1 позиции внутри дуплексной области от 5'-конца в антисмысловой нити выбирают из группы, состоящей из A, dA, dU, U и dT. В качестве альтернативы, по меньшей мере одно из первых 1, 2 или 3 пары оснований внутри дуплексной области от 5'-конца антисмысловой нити представляет собой пару оснований AU. Например, первая пара оснований внутри дуплексной области от 5'-конца антисмысловой нити представляет собой пару оснований AU.
В другом варианте осуществления нуклеотидом на 3'-конце смысловой нити является дезокси-тимин (dT). В другом варианте осуществления нуклеотидом на 3'-конце антисмысловой нити является дезокси-тимин (dT). В одном варианте осуществления имеется короткая последовательность дезокси-тимин нуклеотидов, например, два dT нуклеотида на 3'-конце смысловой и/или антисмысловой нити.
В одном варианте осуществления последовательность смысловой нити может быть представлена формулой (I):
5' np-Na-(X X X )i-Nb-Y Y Y -Nb-(Z Z Z )j-Na-nq 3' (I)
при этом:
i и j каждый независимо составляет 0 или 1;
p и q каждый независимо составляет 0-6;
каждый Na независимо представляет олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, каждая последовательность содержит по меньшей мере два разных модифицированных нуклеотида;
каждый Nb независимо представляет олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
каждый np и nq независимо представляет «липкий» концевой нуклеотид;
при этом Nb и Y не имеют одинаковую модификацию; и
XXX, YYY и ZZZ каждый независимо представляет один мотив трех идентичных модификаций трех последовательных нуклеотидов. Предпочтительно YYY представляет собой все 2'-F модифицированные нуклеотиды.
В одном варианте осуществления Na и/или Nb содержат модификации чередующейся схемы.
В одном варианте осуществления мотив YYY возникает на участке расщепления смысловой нити или около него. Например, когда средство RNAi имеет дуплексную область из 17-23 нуклеотидов в длину, мотив YYY может возникать на участке расщепления или поблизости от него (например: может возникать в позициях 6, 7, 8, 7, 8, 9, 8, 9, 10, 9, 10, 11, 10, 11, 12 или 11, 12, 13) смысловой нити, начиная подсчет с 1го нуклеотида от 5'-конца; или необязательно начиная подсчет с 1го парного нуклеотида внутри дуплексной области от 5'-конца.
В одном варианте осуществления i составляет 1, а j составляет 0, или i составляет 0, а j составляет 1, или как i, так и j составляют 1. Вследствие этого смысловая нить может быть представлена следующими формулами:
5' np-Na-YYY-Nb-ZZZ-Na-nq 3' (Ib);
5' np-Na-XXX-Nb-YYY-Na-nq 3' (Ic); или
5' np-Na-XXX-Nb-YYY-Nb-ZZZ-Na-nq 3' (Id).
Когда смысловая нить представлена формулой (Ib), Nb представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na независимо может представлять собой олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда смысловая нить представлена в виде формулы (Ic), Nb представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na может независимо представлять олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда смысловая нить представлена в виде формулы (Id), каждый Nb независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Предпочтительно, Nb составляет 0, 1, 2, 3, 4, 5 или 6. Каждый Na может независимо представлять олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Каждый из X, Y и Z может быть одинаковым или отличаться друг от друга.
В других вариантах осуществления i составляет 0, а j составляет 0, а смысловая нить может быть представлена формулой:
5' np-Na-YYY-Na-nq 3' (Ia).
Когда смысловая нить представлена формулой (Ia), каждый Na независимо может представлять собой олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В одном варианте осуществления антипоследовательность смысловой нити RNAi может быть представлена формулой (II):
5' nq'-Na'-(Z'Z'Z')k-Nb'-Y'Y'Y'-Nb'-(X'X'X')l-N'a-np' 3' (II)
при этом:
k и l каждый независимо составляет 0 или 1;
p' и q' каждый независимо составляет 0-6;
каждый Na' независимо представляет олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, каждая последовательность содержит по меньшей мере два разных модифицированных нуклеотида;
каждый Nb' независимо представляет олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
каждый np' и nq' независимо представляет «липкий» концевой нуклеотид;
при этом Nb' и Y' не имеют одинаковой модификации;
а
X'X'X', Y'Y'Y' и Z'Z'Z' каждый независимо представляют один мотив трех идентичных модификаций трех последовательных нуклеотидов.
В одном варианте осуществления Na' и/или Nb' содержат модификации чередующейся схемы.
Мотив Y'Y'Y' возникает на участке расщепления антисмысловой нити или около него. Например, когда средство RNAi имеет дуплексную область из 17-23 нуклеотидов в длину, мотив Y'Y'Y' может возникать в позициях 9, 10, 11;10, 11, 12; 11, 12, 13; 12, 13, 14; или 13, 14, 15 антисмысловой нити, начиная подсчет с 1го нуклеотида, от 5'-конца; или необязательно, начиная подсчет на 1ом парном нуклеотиде внутри дуплексной области, от 5'-конца. Предпочтительно, мотив Y'Y'Y' возникает в позициях 11, 12, 13.
В одном варианте осуществления Y'Y'Y' мотив представляет собой все 2'-OMe модифицированные нуклеотиды.
В одном варианте осуществления k составляет 1 и l составляет 0, или k составляет 0, а l составляет 1, или и k и l составляют 1.
Антисмысловая нить может вследствие этого быть представлена следующими формулами:
5' nq'-Na'-Z'Z'Z'-Nb'-Y'Y'Y'-Na'-np' 3' (IIb);
5' nq'-Na'-Y'Y'Y'-Nb'-X'X'X'-np' 3' (IIc); или
5' nq'-Na'-Z'Z'Z'-Nb'-Y'Y'Y'-Nb'-X'X'X'-Na'-np' 3' (IId).
Когда антисмысловая нить представлена формулой (IIb), Nb' представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na' независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда антисмысловая нить представлена в виде формулы (IIc), Nb' представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na' независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда антисмысловая нить представлена в виде формулы (IId), каждый Nb' независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na' независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов. Предпочтительно, Nb составляет 0, 1, 2, 3, 4, 5 или 6.
В других вариантах осуществления k составляет 0, а l составляет 0, а антисмысловая нить может быть представлена формулой:
5' np'-Na'-Y'Y'Y'-Na'-nq' 3' (Ia).
Когда антисмысловая нить представлена в виде формулы (IIa), каждый Na' независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Каждый из X', Y' и Z' может быть одинаковым или отличаться друг от друга.
Каждый нуклеотид смысловой нити и антисмысловой нити может быть независимо модифицирован LNA, HNA, CeNA, 2'-метоксиэтилом, 2'-O-метилом, 2'-O-аллилом, 2'-C-аллилом, 2'-гидроксилом или 2'-фтором. Например, каждый нуклеотид смысловой нити и антисмысловой нити независимо модифицируют 2'-O-метилом или 2'-фтором. Каждый X, Y, Z, X', Y' и Z', в частности, может представлять 2'-O-метил модификацию или 2'-фтор модификацию.
В одном варианте осуществления смысловая нить средства RNAi может содержать YYY мотив, возникающий в 9, 10 и 11 позициях нити, когда дуплексная область составляет 21 нуклеотид, начиная подсчет с 1го нуклеотида от 5'-конца, или необязательно, начиная подсчет с 1го парного нуклеотида внутри дуплексной области, от 5'-конца; и Y представляет 2'-F модификацию. Смысловая нить может дополнительно содержать XXX мотив или ZZZ мотивы в виде крыльевых модификаций на противоположном конце дуплексной области; и XXX и ZZZ каждый независимо представляет 2'-OMe модификацию или 2'-F модификацию.
В одном варианте осуществления антисмысловая нить может содержать Y'Y'Y' мотив, возникающий в позициях 11, 12, 13 нити, начиная подсчет с 1го нуклеотида от 5'-конца, или необязательно, начиная подсчет на 1ом парном нуклеотиде внутри дуплексной области от 5'-конца; и Y' представляет 2'-O-метил модификацию. Антисмысловая нить может дополнительно содержать X'X'X' мотив или Z'Z'Z' мотивы в виде крыльевых модификаций на противоположном конце дуплексной области; и X'X'X' и Z'Z'Z' каждый независимо представляет 2'-OMe модификацию или 2'-F модификацию.
Смысловая нить, представленная любой одной из приведенных выше формул (Ia), (Ib), (Ic) и (Id), образует дуплекс с антисмысловой нитью, представленной любой одной из формул (IIa), (IIb), (IIc) и (IId), соответственно.
Соответственно, средства RNAi для применения в способах изобретения могут содержать смысловую нить и антисмысловую нить, причем каждая нить имеет 14-30 нуклеотидов, дуплекс RNAi представлен формулой (III):
смысловая: 5' np-Na-(X X X)i-Nb-Y Y Y -Nb-(Z Z Z)j-Na-nq 3'
антисмысловая: 3' np'-Na'-(X'X'X')k-Nb'-Y'Y'Y'-Nb'-(Z'Z'Z')l-Na'-nq' 5'
(III)
при этом:
i, j, k и l каждый независимо составляет 0 или 1;
p, p', q и q' каждый независимо составляет 0-6;
каждый Na и Na' независимо представляет олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, каждая последовательность содержит по меньшей мере два разных модифицированных нуклеотида;
каждый Nb и Nb' независимо представляет олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
при этом
каждый np', np, nq' и nq, каждый из которых может иметься или не иметься, независимо представляет «липкий» концевой нуклеотид; а
XXX, YYY, ZZZ, X'X'X', Y'Y'Y' и Z'Z'Z', каждый независимо представляет один мотив трех идентичных модификаций трех последовательных нуклеотидов.
В одном варианте осуществления i составляет 0, а j составляет 0; или i составляет 1, а j составляет 0; или i составляет 0, а j составляет 1; или и i и j составляют 0; или и i и j составляют 1. В другом варианте осуществления k составляет 0, а l составляет 0; или k составляет 1, а l составляет 0; k составляет 0, а l составляет 1; или и k и l составляют 0; или и k и l составляют 1.
Иллюстративные комбинации смысловой нити и антисмысловой нити, образующие дуплекс RNAi, содержат формулы ниже:
5' np-Na-Y Y Y -Na-nq 3'
3' np'-Na'-Y'Y'Y' -Na'nq' 5'
(IIIa)
5' np-Na-Y Y Y -Nb-Z Z Z -Na-nq 3'
3' np'-Na'-Y'Y'Y'-Nb'-Z'Z'Z'-Na'nq' 5'
(IIIb)
5' np-Na-X X X -Nb-Y Y Y-Na-nq 3'
3' np'-Na'-X'X'X'-Nb'-Y'Y'Y'-Na'-nq' 5'
(IIIc)
5' np-Na-X X X -Nb-Y Y Y -Nb-Z Z Z -Na-nq 3'
3' np'-Na'-X'X'X'-Nb'-Y'Y'Y'-Nb'-Z'Z'Z'-Na-nq' 5'
(IIId)
5'-Na-Y Y Y -Na-3'
3' np'-Na'-Y'Y'Y' -Na' 5'
(IIIe)
Когда средство RNAi представлено формулой (IIIa), каждый Na независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда средство RNAi представлено формулой (IIIb), каждый Nb независимо представляет олигонуклеотидную последовательность, содержащую 1-10, 1-7, 1-5 или 1-4 модифицированных нуклеотида. Каждый Na независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда средство RNAi представлено в виде формулы (IIIc), каждый Nb, Nb' независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Когда средство RNAi представлено в виде формулы (IIId), каждый Nb, Nb' независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na, Na' независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов. Каждый из Na, Na', Nb и Nb' независимо содержит модификации чередующейся схемы.
Когда средство RNAi представлено в виде формулы (IIId), каждый Nb, Nb' независимо представляет олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na, Na' независимо представляет олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов. Каждый из Na, Na', Nb и Nb' независимо содержит модификации чередующейся схемы.
Когда средство RNAi представлено в виде формулы (IIIe), каждый Na и Na' независимо представляет олигонуклеотидную последовательность, содержащую 0-25 нуклеотидов, которые являются либо модифицированными, либо немодифицированными или их комбинациями, причем каждая последовательность содержит по меньшей мере два разных модифицированных нуклеотида.
Каждый из X, Y и Z в формулах (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe) может быть одинаковым или отличаться друг от друга.
Когда средство RNAi представлено формулой (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe), по меньшей мере один из Y нуклеотидов может образовать пару оснований с одним из Y' нуклеотидов. В качестве альтернативы, по меньшей мере два из Y нуклеотидов образуют пары оснований с соответствующими Y' нуклеотидами; или все три Y нуклеотида все образуют пары оснований с соответствующими Y' нуклеотидами.
Когда средство RNAi представлено формулой (IIIb) или (IIId), по меньшей мере один из Z нуклеотидов может образовать пару оснований с одним из Z' нуклеотидов. В качестве альтернативы, по меньшей мере два из Z нуклеотидов образуют пары оснований с соответствующими Z' нуклеотидами; или все три Z нуклеотидов все образуют пары оснований с соответствующими Z' нуклеотидами.
Когда средство RNAi представлено в виде формулы (IIIc) или (IIId), по меньшей мере один из X нуклеотидов может образовать пару оснований с одним из X' нуклеотидов. В качестве альтернативы, по меньшей мере два из X нуклеотидов образуют пары оснований с соответствующими X' нуклеотидами; или все три X нуклеотида все образуют пары оснований с соответствующими X' нуклеотидами.
В одном варианте осуществления модификация Y нуклеотида иная чем модификация Y' нуклеотида, модификация Z нуклеотида иная чем модификация Z' нуклеотида и/или модификация X нуклеотида иная чем модификация X' нуклеотида.
В одном варианте осуществления, когда средство RNAi представлено формулой (IIId), модификации Na представляют собой 2'-O-метил или 2'-фтор модификации. В другом варианте осуществления, когда средство RNAi представлено формулой (IIId), модификации Na представляют собой 2'-O-метил или 2'-фтор модификации, и np' >0, а по меньшей мере один np' связан с соседним нуклеотидом посредством тиофосфатной связи. В другом варианте осуществления, когда средство RNAi представлено формулой (IIId), модификации Na представляют собой 2'-O-метил или 2'-фтор модификации, np' >0, и по меньшей мере один np' связан с соседним нуклеотидом посредством тиофосфатной связи, и смысловую нить конъюгируют с одним или более производными GalNAc, присоединенными с помощью моновалентного, бивалентного или трехвалентного разветвленного линкера. В другом варианте осуществления, когда средство RNAi представлено формулой (IIId), Na модификации представляют собой 2'-O-метил или 2'-фтор модификации, np' >0, и по меньшей мере один np' связан с соседним нуклеотидом посредством тиофосфатной связи, смысловая нить содержит по меньшей мере одну тиофосфатную связь, и смысловую нить конъюгируют с одним или более производными GalNAc, присоединенными с помощью моновалентного, бивалентного или трехвалентного разветвленного линкера.
В одном варианте осуществления, когда средство RNAi представлено формулой (IIIa), Na модификации представляют собой 2'-O-метил или 2'-фтор модификации, np' >0, и по меньшей мере один np' связан с соседним нуклеотидом посредством тиофосфатной связи, смысловая нить содержит по меньшей мере одну тиофосфатную связь, и смысловую нить конъюгируют с одним или более производными GalNAc, присоединенными с помощью моновалентного, бивалентного или трехвалентного разветвленного линкера.
В одном варианте осуществления средство RNAi представляет собой мультимер, содержащий по меньшей мере два дуплекса, представленный формулой (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe), при этом дуплексы связаны линкером. Линкер может быть расщепляемым или нерасщепляемым. Необязательно, мультимер дополнительно содержит лиганд. Каждый из дуплексов может выделять один и тот же ген или два разных гена; или каждый из дуплексов может выделять один и тот же ген на двух разных сайтах-мишенях.
В одном варианте осуществления средство RNAi представляет собой мультимер, содержащий три, четыре, пять, шесть или более дуплексов, представленных формулой (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe), при этом дуплексы связаны линкером. Линкер может быть расщепляемым или нерасщепляемым. Необязательно, мультимер дополнительно содержит лиганд. Каждый из дуплексов может выделять один и тот же ген или два разных гена; или каждый из дуплексов может выделять один и тот же ген на двух разных сайтах-мишенях.
В одном варианте осуществления два средства RNAi, представленные формулой (III), (IIIa), (IIIb), (IIIc), (IIId) и (IIIe), соединены друг с другом на 5'-конце и на одном или обоих 3'-концах и необязательно конъюгируюты с лигандом. Каждое из средств может выделять один и тот же ген или два разных гена; или каждое из средств может выделять один и тот же ген на двух разных сайтах-мишенях.
В разных публикациях описаны мультимерные средства RNAi, которые можно использовать в способах изобретения. Такие публикации включают WO2007/091269, патент США № 7858769, WO2010/141511, WO2007/117686, WO2009/014887 и WO2011/031520, полное содержание каждого из которых включено настоящим в данный документ посредством ссылки.
В средстве RNAi, в котором содержатся конъюгации одного или более углеводных фрагментов со средством RNAi, можно оптимизировать одно или более свойств средства RNAi. Во многих случаях углеводный фрагмент будет прикреплен к модифицированной субъединице средства RNAi. Например, сахар рибоза одной или более рибонуклеотидных субъединиц средства двухцепочечного РНК может быть замещен другим фрагментом, например, неуглеводным (предпочтительно циклическим) носителем, к которому присоединен углеводный лиганд. Рибонуклеотидная субъединица, в которой сахар рибоза субъединицы был замещен таким образом, называется согласно изобретению субъединица модификации замены рибозы (RRMS). Циклическим носителем может быть карбоциклическая кольцевая система, т.е. все атомы кольца представляют собой атомы углерода, или гетероциклическая кольцевая система, т.е. один или более атомов кольца может представлять собой гетероатом, например, азот, кислород, серу. Циклическим носителем может быть моноциклическая кольцевая система, или он может содержать два или более колец, например слитые кольца. Циклический носитель может представлять собой полностью насыщенную кольцевую систему, или он может содержать один или более двойных связей.
Лиганд может быть прикреплен к полинуклеотиду посредством носителя. Носители содержат (i) по меньшей мере одну «точку прикрепления остова», предпочтительно две «точки прикрепления остова» и (ii) по меньшей мере одну «точку прикрепления связи». «Точка прикрепления остова» в рамках изобретения относится к функциональной группе, например, к гидроксильной группе, или как правило к связи, доступной для включения носителя в остов рибонуклеиновой кислоты и которая для этого подходит, например, остов, содержащий фосфат или, например, модифицированный фосфат, серу. «точка прикрепления связи» (TAP) в некоторых вариантах осуществления относится к составляющему атому кольца циклического носителя, например, к атому углерода или гетероатому (отличающемуся от атома, который предоставляет точку прикрепления остова), который соединяется с выбираютным фрагментом. Фрагментом может быть, например, углевод, например, моносахарид, дисахарид, трисахарид, тетрасахарид, олигосахарид и полисахарид. Необязательно, выбранный фрагмент соединяют промежуточной связью с циклическим носителем. Таким образом, циклический носитель будет часто содержать функциональную группу, например, амино группу, или как правило, обеспечивать связь, которая подходит для включения или привязки другого химического объекта, например, лиганда к составляющему кольцу.
Средства RNAi можно конъюгировать с лигандом посредством носителя, при этом носителем может быть циклическая группа или aциклическая группа; предпочтительно, циклическую группу выбирают из пирролидинила, пиразолинила, пиразолидинила, имидазолинила, имидазолидинила, пиперидинила, пиперазинила, [1,3]диоксолана, оксазолидинила, изоксазолидинила, морфолинила, тиазолидинила, изотиазолидинила, квиноксалинила, пиридазинонила, тетрагидрофурила и декалина; предпочтительно, aциклическую группу выбирают из серинольного остова или диэтаноламинного остова.
В некоторых конкретных вариантах осуществления средством RNAi для применения в способах изобретения является AD-57213 (смысловая нить: 5'-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3' (SEQ ID NO:13) и антисмысловая нить: 5'-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3' (SEQ ID NO:14), при этом A, c, g и u представляют собой A, C, G или U рибозы; a, c, g и u представляют собой A, C, G или U 2'-O-метил (2'-OMe) рибозы; Af, Cf, Gf или Uf представляют собой 2'-фтор A, C, G или U; и s представляет собой тиофосфатную связь.
Эти средства могут дополнительно содержать лиганд.
Лиганды
Средства изобретения с двухнитевой РНК (двухцепочечной РНК) необязательно можно конъюгировать с одним или более лигандами. Лиганд можно прикрепить к смысловой нити, антисмысловой нити или к обеим нитям, на 3'-конце, 5'-конце или на обоих концах. Например, лиганд можно конъюгировать со смысловой нитью. В предпочтительных вариантах осуществления лиганд конъюгируют с 3'-концом смысловой нити.
В одном варианте осуществления лиганд представляет собой конъюгат углевода, такого как моносахарид. В одном варианте осуществления лигандом является N-ацетилгалактозамин (GalNAc) GalNAc или производное GalNAc. В некоторых вариантах осуществления изобретения GalNAc или производное GalNAc прикрепляют к средству iRNA изобретения посредством моновалентного линкера. В некоторых вариантах осуществления GalNAc или производное GalNAc прикрепляют к средству iRNA изобретения посредством бивалентного линкера. В других вариантах осуществления изобретения GalNAc или производное GalNAc прикрепляют к средству iRNA изобретения посредством трехвалентного линкера.
В одном варианте осуществления конъюгат углевода для применения в композициях и способах изобретения выбирают из группы, состоящей из:
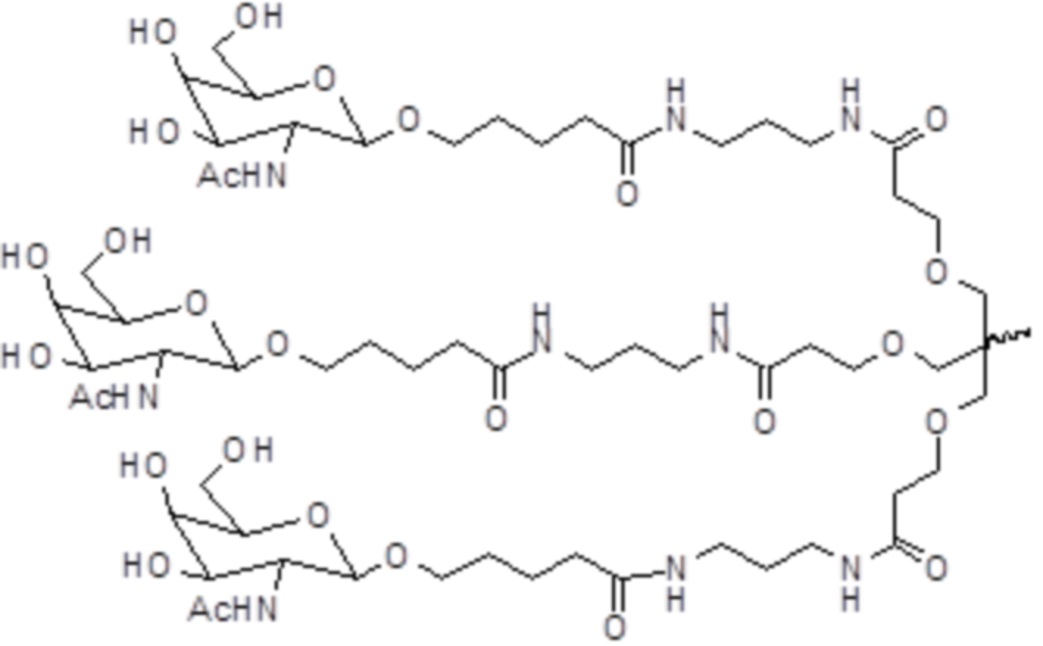
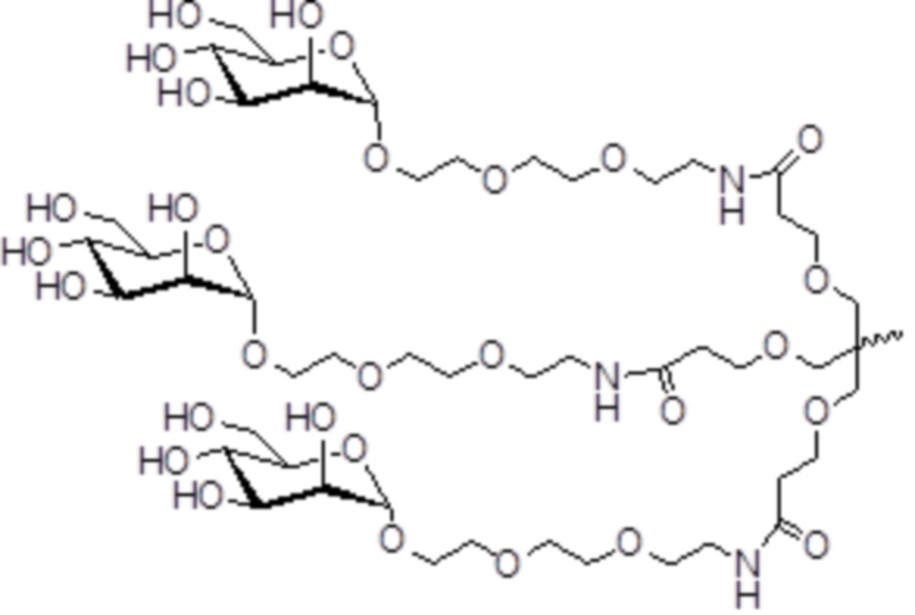





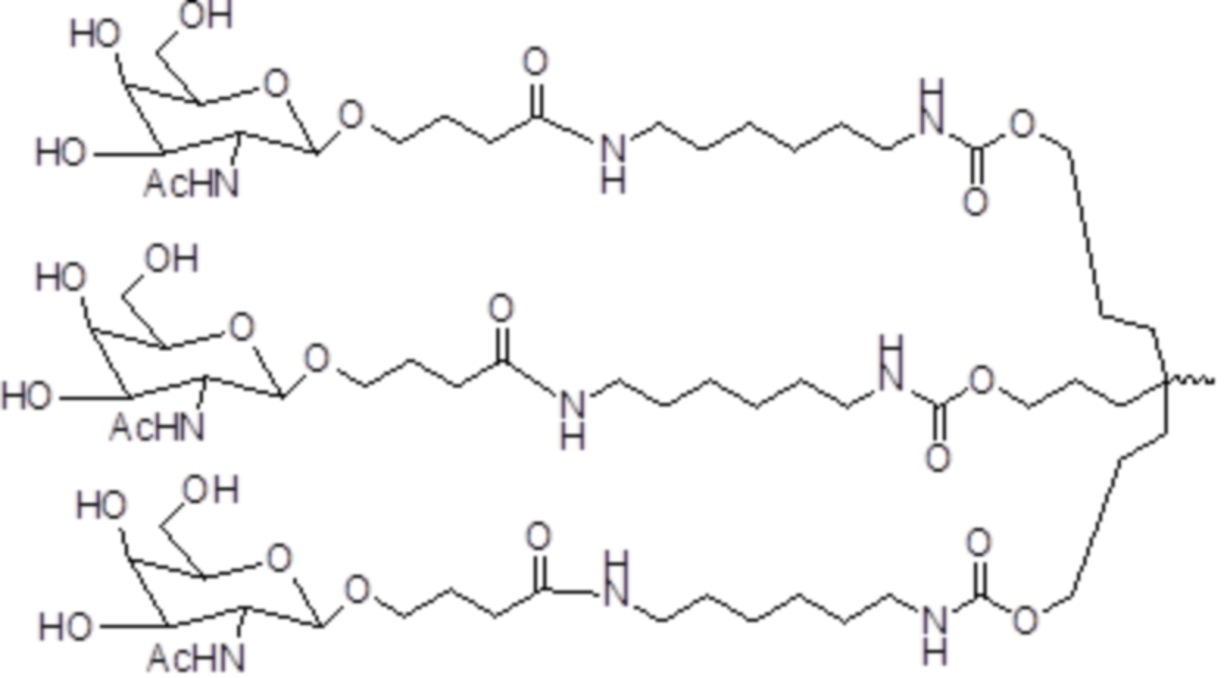
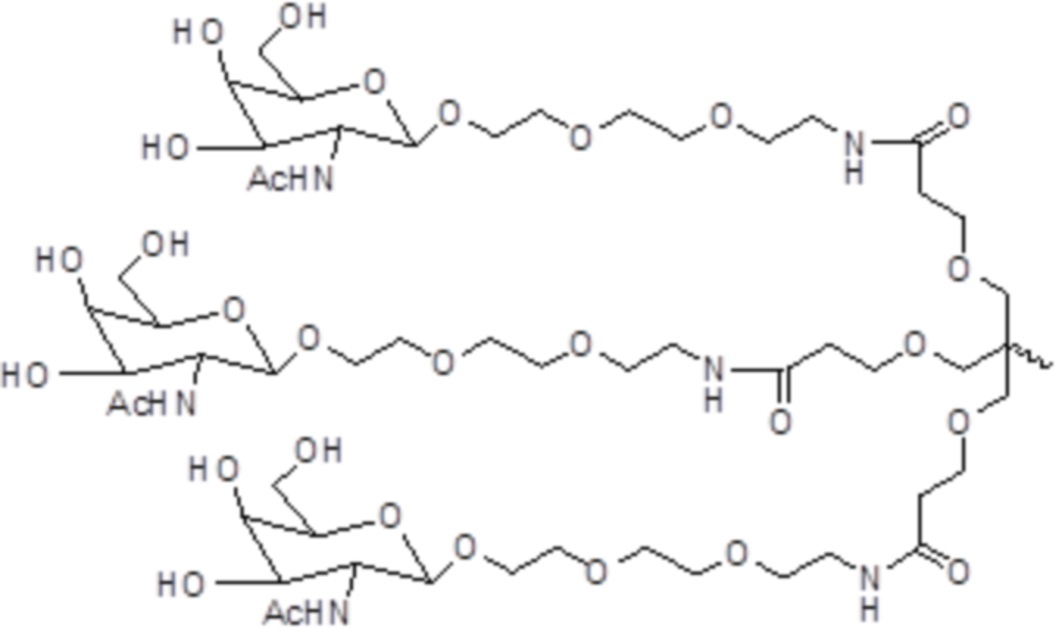
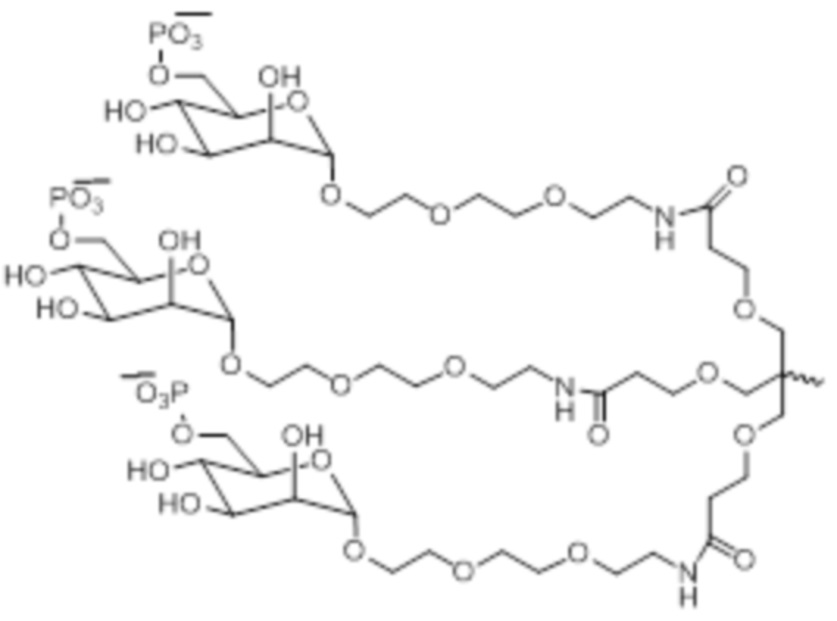
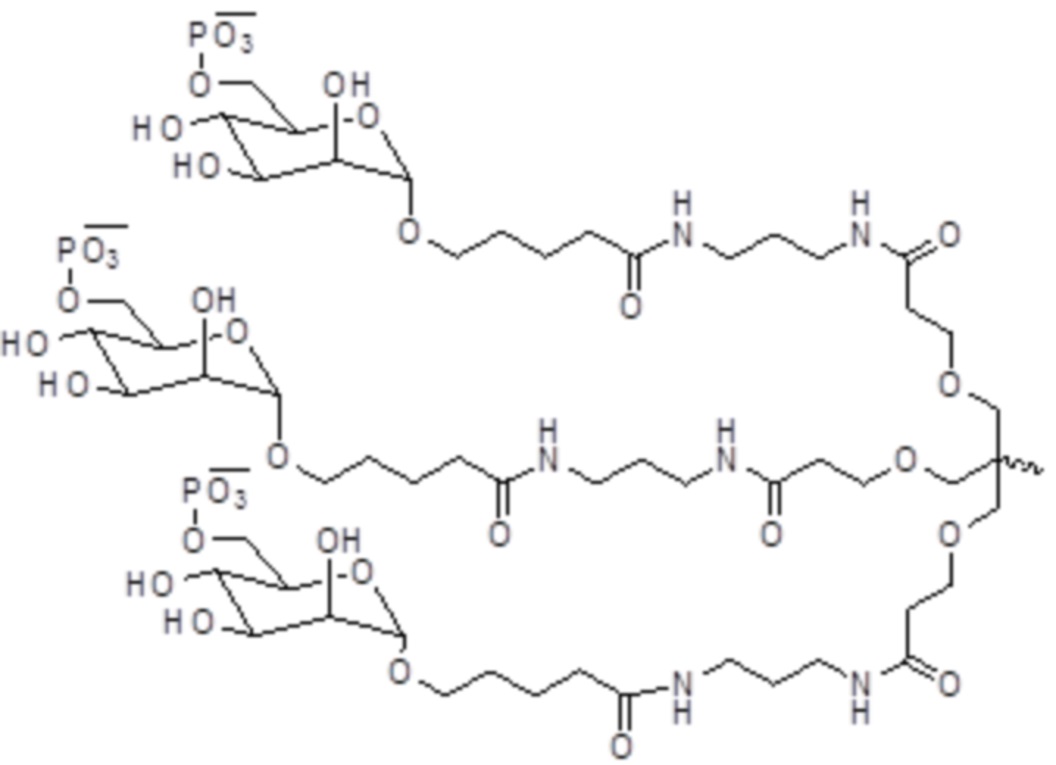
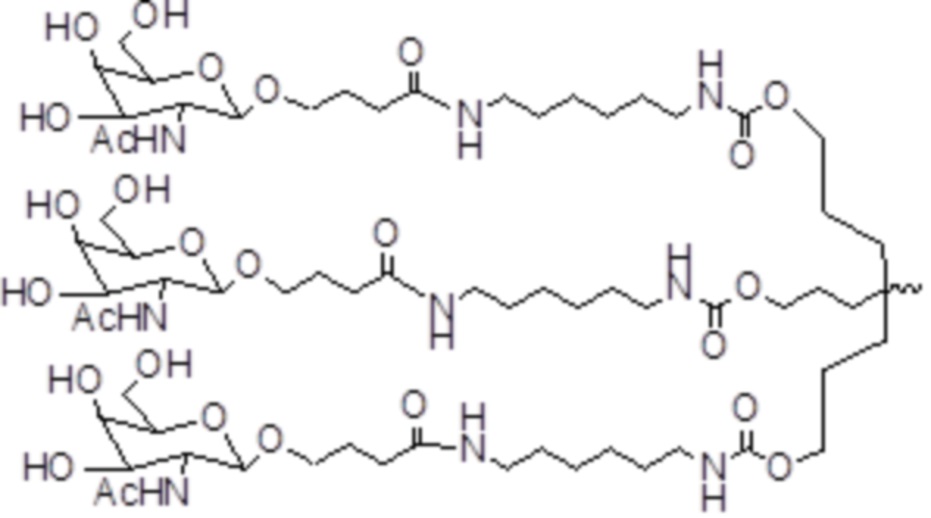



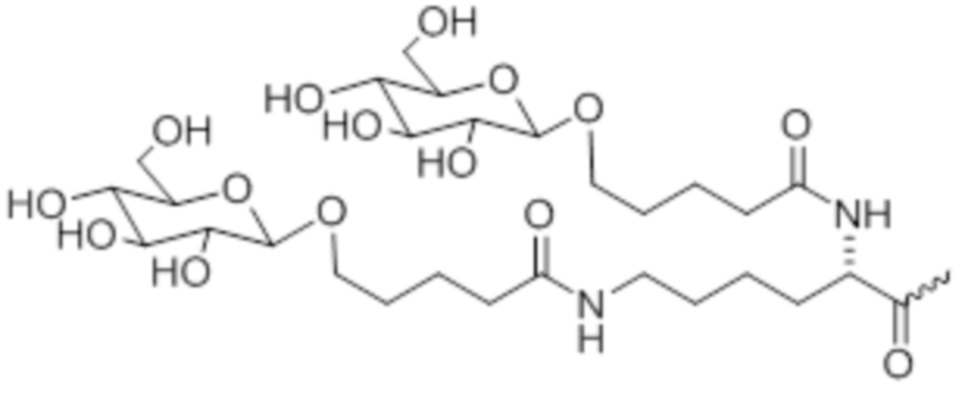

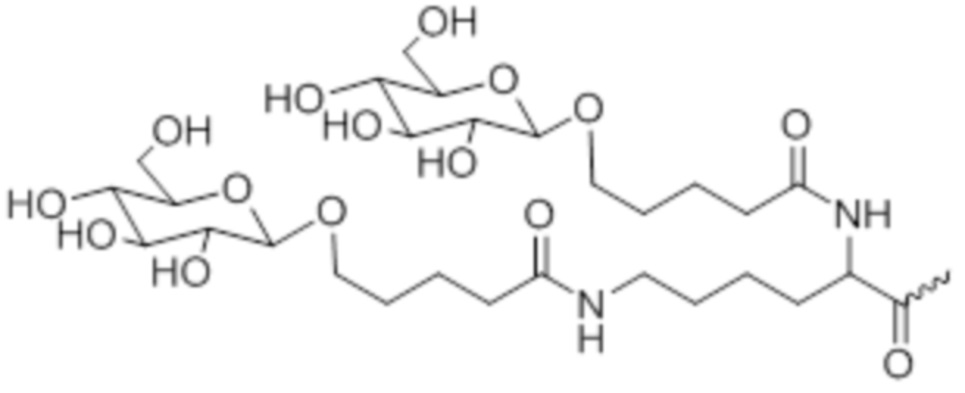
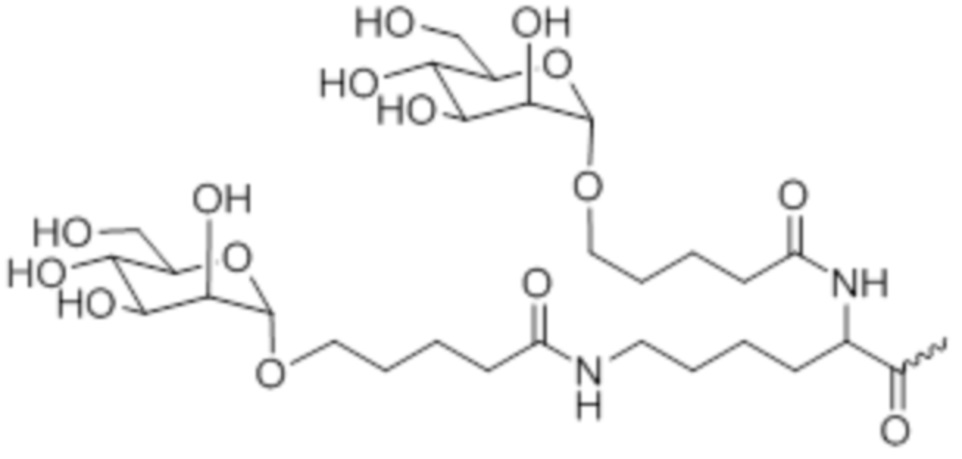


В одном варианте осуществления GalNAc или производное GalNAc представляет собой GalNAc3:

В некоторых вариантах осуществления лиганд, например, лиганд GalNAc, прикреплен к 3-концу средства RNAi. В одном варианте осуществления средство RNAi конъюгируют с лигандом, например, с лигандом GalNAc, как показано в следующей схеме

где X представляет собой O или S. В одном варианте осуществления X представляет собой O.
Со средствами RNAi настоящего изобретения можно соединить большое множество соединений. Предпочтительными фрагментами являются лиганды, которые соединены, предпочтительно ковалентно, либо непосредственно, либо опосредованно посредством промежуточной связи.
В предпочтительных вариантах осуществления лиганд изменяет распределение, выделение или срок действия молекулы, в которую он включен. В предпочтительных вариантах осуществления лиганд обеспечивает улучшенную аффинность для выбранных мишеней, например, молекулы, клетки или типа клеток, пространства, рецептора, например, клеточного или органного пространства, ткани, органа или области организма, например, по сравнению с видами, у которых отсутствует такой лиганд. Лиганды, обеспечивающие улучшенную аффинность для выбранных мишеней, также называют целевые лиганды.
Некоторые лиганды могут обладать эндосомолитическими свойствами. Эндосомолитические лиганды способствуют лизису эндосомы и/или транспортировке композиции изобретения или ее компонентов из эндосомы в цитоплазму клетки. Эндосомолитическим лигандом может быть полианионный пептид или пептидомиметик, который показывает pH-зависимую мембранную активность и фузогеничность. В одном варианте осуществления эндосомолитический лиганд принимает свою активную структуру при эндосомальном pH. «Активной» структурой является та структура, в которой эндосомолитический лиганд способствует лизису эндосомы и/или транспортировке композиции изобретения или ее компонентов из эндосомы в цитоплазму клетки. Иллюстративные эндосомолитические лиганды включают GALA пептид (Subbarao et al., Biochemistry, 1987, 26: 2964-2972), EALA пептид (Vogel et al., J. Am. Chem. Soc., 1996, 118: 1581-1586), и их производные (Turk et al., Biochem. Biophys. Acta, 2002, 1559: 56-68). В одном варианте осуществления эндосомолитический компонент может содержать химическую группу (например, аминокислоту), которая будет подвергаться изменению заряда или протонирования в ответ на изменение pH. Эндосомолитический компонент может быть линейным или разветвленным.
Лиганды могут улучшать транспортировку, гибридизацию и свойства специфичности, а также могут улучшать устойчивость к нуклеазе получающегося в результате натурального или модифицированного олигорибонуклеотида или полимерной молекулы, содержащей любую комбинацию мономеров в рамках изобретения и/или натуральных или модифицированных рибонуклеотидов.
Лиганды в общем могут включать терапевтические модификаторы, например, для усиления поглощения; диагностических соединений или репортерных групп, например, для мониторинга распределения; поперечно-сшивающие вещества; и обеспечивающие устойчивость к нуклеазам фрагменты. Общие примеры включают липиды, стероиды, витамины, сахара, белки, пептиды, полиамины и пептидомиметики.
Лиганды могут включать вещество природного происхождения, такое как белок (например, человеческий сывороточный альбумин (HSA), липопротеин низкой плотности (LDL), липопротеин высокой плотности (HDL) или глобулин); углевод (например, декстран, пуллулан, хитин, хитозан, инулин, циклодекстрин или гиаулороновая кислота); или липид. Лиганд также может представлять собой рекомбинантную или синтетическую молекулу, такую как синтетический полимер, например, синтетическую полиаминокислоту, олигонуклеотид (например, аптамер). Примеры полиаминокислот включают: полиаминокислота представляет собой полилизин (PLL), поли L-аспарагиновую кислоту, поли L-глутаминовую кислоту, сополимер стирола и ангидрида малеиновой кислоты, сополимер поли(L-лактид-ко-гликолид), сополимер дивинилового эфира и малеинового ангидрида, сополимер N-(2-гидроксипропил)метакриламида (HMPA), полиэтиленгликоль (PEG), поливиниловый спирт (PVA), полиуретан, поли(2-этилакриловая кислота), полимеры N-изопропилакриламиды или полифосфазин. Пример полиаминов включают: полиэтиленимин, полилизин (PLL), спермин, спермидин, полиамин, псевдопептид-полиамин, пептидомиметик полиамин, дендример полиамин, аргинин, амидин, протамин, катионный липид, катионный порфирин, четвертичная соль полиамина или альфа спиральный пептид.
Лиганды также могут содержать выделяющие группы, например, выделяющее клетку или ткань средство, например, лектин, гликопротеин, липид или белок, например, антитело, которое связывается с заданным типом клеток, таким как клетка почки. Выделяющей группой может быть тиротропин, меланотропин, лектин, гликопротеин, поверхностно-активный белок A, углевод муцина, многовалентная лактоза, многовалентная галактоза, N-ацетил-галактозамин, N-ацетил-глюкозамин многовалентная манноза, многовалентная фукоза, гликозилированные полиаминокислоты, многовалентная галактоза, трансферрин, бисфосфонат, полиглутамат, полиаспартат, липид, холистерин, стероид, желчная кислота, фолат, витамин B12, биотин, RGD пептид, RGD пептидомиметик или аптамер.
Другие примеры лигандов включают красители, интеркалирующие средства (например, акридины), перекрестносшивающие аегнты (например, псорален, митомицин C), порфирины (TPPC4, тексафирин, сапфирин), полициклические ароматические углеводороды (например, феназин, дигидрофеназин), искуственные эндонуклеазы или хелатирующее средство (например, EDTA), липофильные молекулы, например, холистерин, холевая кислота, адамантановая уксусная кислота, 1-пирен масляная кислота, дигидротестостерон, 1,3-Бис-O(гексадецил)глицерин, геранилоксигексиловая группа, гексадецилглицерин, борнеол, ментол, 1,3-пропандиол, гептадециловая группа, пальмитиновая кислота, миристиновая кислота, O3-(олеоил)литохолевая кислота, O3-(олеоил)холеновая кислота, диметокситритил или феноксазин) и пептидные конъюгаты (например, antennapedia пептид, Tat пептид), алкилирующие средства, фосфат, амино, меркапто, PEG (например, PEG-40K), MPEG, [MPEG]2, полиамино, алкил, замещенный алкил, радиомеченые маркеры, ферменты, гаптены (например, биотин), облегчающие транспортировку/абсорбцию средсва (например, аспирин, витамин E, фолиевая кислота), синтетическую рибонуклеазы (например, имидазол, бисимидазол, гистамин, кластеры имидазола, конъюгаты акридина и имидазола, Eu3+ комплексы тетраазамакроциклов), динитрофенил, HRP или AP.
Лигандами могут быть белки, например, гликопротеины или пептиды, например, молекулы, обладающие специфической аффинностью для колиганда, или антитела, например, антитело, которое связывается с заданным типом клеток, таким как раковая клетка, эндотелиальная клетка или костная клетка. Лиганды также могут включать гормоны и рецепторы гормонов. Они также могут включать непептидные виды, такие как липиды, лектины, углеводы, витамины, кофакторы, многовалентную лактозу, многовалентную галактозу, N-ацетил-галактозамин, N-ацетил-глюкозамин многовалентную маннозу, многовалентную фукозу или аптамеры. Лигандом может быть, например, липополисахарид, активатор p38 MAP киназы или активатор NF-κB.
Лигандом может быть вещество, например, лекарственное вещество, которое может увеличивать поглощение средства iRNA в клетку, например, за счет нарушения цитоскелета клетки, например, за счет нарушения микротрубочек, микрофиламентов клетки и/или промежуточных филаментов. Лекарственным веществом может быть, например, таксон, винкристин, винбластин, цитохалазин, носодазол, джаплакинолид, латрункулин A, фаллоидин, свинголид A, инданоцин или миосервин.
Лиганд может увеличивать поглощение олигонуклеотида в клетку, например, за счет активации противовоспалительного ответа. Иллюстративные лиганды, которые могут иметь такое действие, включают фактор некроза опухоли альфа (TNFальфа), интелейкин-1 бета или интерферон гамма.
В одном аспекте лиганд представляет собой липид или основанную на липиде молекулу. Такой липид или основанная на липиде молекула предпочтительно связывает белок сыворотки, например, человеческий сывороточный альбумин (HSA). HSA связывающий лиганд предусматривает распределение конъюгата в ткань-мишень, например, непочечную ткань-мишень организма. Например, тканью-мишенью может быть печень, содержащая паренхимные клетки печени. В качестве лигандов также можно использовать другие молекулы, которые могут связывать HSA. Например, можно использовать напроксен или аспирин. Липид или основанный на липиде лиганд может (a) увеличивать устойчивость к деградации конъюгата, (b) увеличивать выделение или транспортировку в мишень, клетку или клеточную мембрану, и/или (c) его можно использовать для регулировки связывания с белком сыворотки, например, HSA.
Основанный на липиде лиганд можно использовать для модулирования, например, управления связыванием конъюгата с тканью-мишенью. Например, липид или основанный на липиде лиганд, который связывается с HSA более сильно, менее вероятно будет будет выделен в почке и вследствие этого менее вероятно будет удален из организма. Липид или основанный на липиде лиганд, который связывается с HSA менее сильно, можно использовать для выделения конъюгата в почке.
В предпочтительном варианте осуществления основанный на липиде лиганд связывает HSA. Предпочтительно, он связывает HSA с достаточной аффинностью, так что конъюгат будет предпочтительно распределяться в непочечную ткань. Однако, предпочтительно чтобы аффинность была не столь сильной, чтобы связь HSA-лиганд не могла быть обратимой.
В другом предпочтительном варианте осуществления основанный на липиде лиганд связывает HSA слабо или не связывает совсем, так что конъюгат будет предпочтительно распределяться в почку. Вместо или в дополнение к основанному на липиде лиганду также можно использовать другие фрагменты, которые выделяют клетки почки.
В другом аспекте лиганд представляет собой фрагмент, например, витамин, который поглощает клетка-мишень, например, пролиферирующая клетка. Это особенно полезно для лечения расстройств, характеризующихся нежелательной клеточной пролиферацией, например, злокачественного или незлокачественного типа, например, раковые клетки. Иллюстративные витамины включают витамин A, E и K. Другие иллюстративные витамины включают витамины B, например, фолиевую кислоту, B12, рибофлавин, биотин, пиродоксал или другие витамины или питательные вещества, поглощаемые раковыми клетками. Также включены HAS, липопротеин низкой плотности (LDL) и липопротеин высокой плотности (HDL).
В другом аспекте лиганд представляет собой проникающее в клетку средство, предпочтительно спиральное проникающее в клетку средство. Предпочтительно, средство является амфипатическим. Иллюстративное средство представляет собой пептид, такое как tat или antennopedia. Если средство представляет собой пептид, он может быть модифицированным, включая пептидилмиметик, инвертомеры, непептидные или псевдопептидные связи, и использование D-аминокислот. Спиральным средством предпочтительно является альфа-спиральное средство, которое предпочтительно имеет липофильную и липофобную фазу.
Лигандом может быть пептид или пептидомиметик. Пептидомиметик (также называемый в данном документе олигопептидомиметик) представляет собой молекулу, способную складываться в определенную трехмерную конструкцию, похожую на натуральный пептид. Фрагмент пептида или пептидомиметика может иметь длину приблизительно 5-50 аминокислот, например, длину приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот. Пептидом или пептидомиметиком может быть, например, проникающий в клетку пептид, катионный пептид, амфифатический пептид или гидрофобный пептид (например, состоящий главным образом из Tyr, Trp или Phe). Фрагментом пептида может быть дендримерный пептид, ограниченный пептид или поперечносшитый пептид. В другом альтернативном варианте фрагмент пептида может содержать гидрофобную последовательность транслокации мембраны (MTS). Иллюстративным содержащим гидрофобную MTS пептидом является RFGF, имеющий аминокислотную последовательность AAVALLPAVLLALLAP (SEQ ID NO: 9). Аналогом RFGF (например, аминокислотной последовательности AALLPVLLAAP (SEQ ID NO: 10)), содержащим гидрофобную MTS, также может быть выделяющий фрагмент. Пептидным фрагментом может быть «доставляющий» пептид, который может нести большие полярные молекулы, содержащие пептиды, олигонуклеотиды и белок поперек клеточных мембран. Например, было обнаружено, что последовательности из белка HIV Tat (GRKKRRQRRRPPQ (SEQ ID NO: 11)) и белка Drosophila Antennapedia (RQIKIWFQNRRMKWKK (SEQ ID NO: 12)) способны функционировать в качестве доставляющих пептидов. Пептид или пептидомиметик может быть закодирован случайной последовательностью ДНК, такой как пептид, идентифицированный из библиотеки фаговых дисплеев или из комбинаторной библиотеки один-шарик-одно-соединение (OBOC) (Lam et al., Nature, 354:82-84, 1991). Предпочтительно пептид или пептидомиметик, привязанный к средству iRNA посредством инкопорированной мономерной единицы, представляет собой выделяющий клетку пептид, такой как аргинин-глицин-аспарагиновая кислота (RGD)-пептид, или имитатор RGD. Фрагмент пептида может варьировать в длину от приблизительно 5 аминокислот до приблизительно 40 аминокислот. Фрагменты пептида могут иметь структурную модификацию, например, для увеличения стабильности или прямых конформационных свойств. Можно использовать любую из структурных модификаций, описанных ниже. Фрагмент пептида RGD можно использовать для выделения опухолевой клетки, такой как эндотелиальная опухолевая клетка или опухолевая клетка рака молочной железы (Zitzmann et al., Cancer Res., 62:5139-43, 2002). RGD пептид может облегчать выделение средством iRNA опухолей множества других тканей, включая легкие, почку, селезенку или печень (Aoki et al., Cancer Gene Therapy 8:783-787, 2001). Предпочтительно, RGD пептид облегчит выделение почки средством iRNA. RGD пептид может быть линейным или циклическим и может быть модифицирован, например, гликозилирован или метилирован для облегчения выделения конкретных тканей. Например, гликозилированный RGD пептид может доставлять средство iRNA в опухолевую клетку, экспрессирующую αVβ3 (Haubner et al., Jour. Nucl. Med., 42:326-336, 2001). Можно использовать пептиды, которые выделяют маркеры, обогащенные в пролиферирующих клетках. Например, содержащие RGD пептиды и пептидомиметики могут выделять раковые клетки, в частности клетки, которые демонстрируют интегрин. Таким образом, можно использовать RGD пептиды, циклические пептиды, содержащие RGD, RGD пептиды, которые содержат D-аминокислоты, а также синтетические RGD имитаторы. В дополнение к RGD можно использовать другие фрагменты, которые выделяют интегрин лиганд. Как правило, такие лиганды можно использовать для управления пролиферирующими клетками и ангиогенезом. Предпочтительные конъюгаты этого типа лиганда выделяют PECAM-1, VEGF или другой раковый ген, например, раковый ген в рамках изобретения.
«Проникающий в клетку пептид» способен проникать в клетку, например, в микробную клетку, такую как клетка бактерий или грибов, или в клетку млекопитающих, такую как клетка человека. Проникающим в микробную клетку пептидом может быть, например, α-спиральный линейный пептид (например, LL-37 или Ceropin P1), содержащий дисульфидную связь пептид (например, α-дефензин, β-дефензин или бактенецин), или пептид, содержащий только одну или две доминирующие аминокислоты (например, PR-39 или индолицидин). Проникающий в клетку пептид также может содержать клеточный сигнал внутриядерной локализации (NLS). Например, проникающим в клетку пептидом может быть состоящий из двух частей амфипатический пептид, такой как MPG, который получают в результате слияния пептидного домена HIV-1 gp41 и NLS большого T антигена SV40 (Simeoni et al., Nucl. Acids Res. 31:2717-2724, 2003).
В одном варианте осуществления выделяющим пептидом может быть амфипатический α-спиральный пептид. Иллюстративный амфипатический α-спиральный пептиды включают, без ограничения, цекропин, ликотоксины, парадаксины, буфорин, CPF, бомбилинподобный пептид (BLP), кателицидины, цератотоксины, S. clava пептиды, миксиновые желудочные антимикробные пептиды (HFIAP), маганинины, бревининс-2, дермазептины, меллитины, плеуроцидин, H2A пептиды, Xenopus пептиды, esculentinis-1, и caerins. Ряд факторов будут считатаься предпочтительными для поддержания целостности стабильности спирали. Например, будет использовано максимальное количество стабилизирующих спираль остатков (например, leu, ala или lys), и будет использовано минимальное количество дестабилизирующих спираль остатков (например, пролин или циклических мономерных звеньев. Кэпирующим остатком будет считаться, например Gly, который представляет собой иллюстративный N-кэпирующий остаток, и/или для стабилизации спирали для обеспечения дополнительной H-связи можно использовать C-концевое амидирование. Стабильность может обеспечить образование солевых мостиков между остатками с противоположными зарядами, разделенными позициями i ± 3, или i ± 4. Например, катионные остатки, такие как лизин, аргинин, гомоаргинин, орнитин или гистидин, могут образовать солевые мостики с анионными остатками, глутаматом или аспартатом.
Пептидные и пептидомиметические лиганды включают лиганды, имеющие пептиды природного происхождения или модифицированные, например, D или L пептиды; α, β или γ пептиды; N-метил пептиды; азапептиды; пептиды, имеющие один или более амид, т.е., пептидные связи, замещенные одной или более мочевинной, тиомочевинной, карбаматной или сульфонил мочевинной связями; или циклические пептиды.
Выделяющим лигандом может быть любой лиганд, который способен выделять специфический рецептор. Примерами являются: фолат, GalNAc, галактоза, манноза, манноза-6P, кластеры сахаров, такие как кластер GalNAc, кластер маннозы, кластер галактозы, или аптамер. Кластер представляет собой комбинацию двух или более сахарных звеньев. Выделяющие лиганды также включают лиганды рецепторов интегрина, лиганды рецепторов хемокина, трансферрин, биотин, лиганды рецепторов серотонина, PSMA, эндотелин, GCPII, соматостатин, лиганды LDL и HDL. Лиганды также могут быть основаны на нуклеиновой кислоте, например, аптамер. Аптамер может быть немодифицированным или иметь любую комбинацию модификаций согласно настоящему документу.
Средства эндосомального высвобождения включают имидазолы, поли или олигоимидазолы, PEI, пептиды, фузогенные пептиды, поликарбоксилаты, поликатионы, маскированные олиго или поли катионы или анионы, ацетали, полиацетали, кетали/поликетали, ортосложные эфиры, полимеры с маскированными или немаскированными катионными или анионными зарядами, дендримеры с маскированными или немаскированными катионными или анионными зарядами.
Стенды ФК модуляторов для фармакокинетического модулятора. ФК модуляторы включают липофилы, желчные кислоты, стероиды, аналоги фосфолипидов, пептиды, связывающие белки средства, PEG, витамины и т.д. Иллюстративные ФК модуляторы включают, без ограничения, холистерин, жирные кислоты, холевую кислоту, литохолевую кислоту, диалкилглицериды, диацилглицерид, фосфолипиды, сфинголипиды, напроксен, ибупрофен, витамин E, биотин и т.д. Также известны олигонуклеотиды, которые содержат ряд тиофосфатных связей, связывающихся с белком сыворотки, таким образом с короткими олигонуклеотидами, например, олигонуклеотидами, составляющими приблизительно 5 оснований, 10 оснований, 15 оснований или 20 оснований, включая многочисленные тиофосфатные связи в остове также подходящие для настоящего изобретения в качестве лигандов (например, в качестве модулирующих ФК лигандов).
Кроме того, аптамеры, которые связывают компоненты сыворотки (например, белки сыворотки) также подходят для настоящего изобретения в качестве модулирующих ФК лигандов.
Другие конъюгаты лигандов, подходящие для изобретения, описаны в Патентных заявках США USSN: 10/916,185, поданной 10 августа 2004 года; USSN: 10/946,873, поданной 21 сентября 2004 года; USSN: 10/833,934, поданной 3 августа 2007 года; USSN: 11/115,989 поданной 27 апреля 2005 года и USSN: 11/944,227 поданной 21 ноября 2007 года, которые включены посредством ссылки во всей полноте для всех целей.
Когда имеется два или более лигандов, все лиганды могут иметь одинаковые свойства, все могут иметь разные свойства, или некоторые лиганды могут иметь одинаковые свойства, тогда как другие могут иметь разные свойства. Например, лиганд может иметь свойства выделения, обладать эндосомолитической активностью или иметь модулирующие ФК свойства. В предпочтительном варианте осуществления все лиганды имеют разные свойства.
Лиганды можно соединять с олигонуклеотидами в разных местах, например, на 3'-конце, 5'-конце и/или во внутренней позиции. В предпочтительных вариантах осуществления лиганд прикрепляют к олигонуклеотидам посредством промежуточной связи, например, посредством носителя в рамках изобретения. Лиганд или связанный лиганд может иметься на мономере, когда мономер встроен в растущую нить. В некоторых вариантах осуществления лиганд можно встроить за счет соединения с мономером «предшественником» после встраивания мономера «предшественника» в растующую нить. Например, мономер, имеющий, например, концевую амино связь (т.е., не имеющий ассоциированного лиганда), например, TAP-(CH2)nNH2 можно встраивать в растущую олигонуклеотидную нить. В последующей операции т.е. После встраивания мономера предшественника в нить, лиганд, имеющий электрофильную группу, например, пентафторфенильный сложный эфир или альдегидную группу, можно впоследствии прикрепить к мономеру предшественнику путем соединения электрофильной группы лиганда с концевой нуклеофильной группой связи мономера предшественника.
В другом примере можно встроить мономер, обладающий химической группой, пригодной для участия в реакции клик-химии, например, азидовую или алкиновую концевую связь/линкер. В последующей операции, т.е., после встраивания мономера предшественника в нить, лиганд, имеющий комплементарную химическую группу, например, алкин или азид, можно прикрепить к мономеру предшественнику путем соединения вместе алкина и азида.
Для двухнитевых олигонуклеотидов лиганды можно прикрепить к одной или обеим нитям. В некоторых вариантах осуществления двухнитевое средство iRNA содержит лиганд, конъюгируютный со смысловой нитью. В других вариантах осуществления двухнитевое средство iRNA содержит лиганд, конъюгируютный с антисмысловой нитью.
В некоторых вариантах осуществления лиганд можно конъюгировать с нуклеооснованиями, фрагментами сахаров или интернуклеозидными связями молекул нуклеиновых кислот. Конъюгация с пуриновыми нуклеооснованиями или их производными может возникать в любой позиции, включая, эндоциклические и экзоциклические атомы. В некоторых вариантах осуществления 2-, 6-, 7-, или 8-позиции пуринового нуклеооснования прикрепляют к фрагменту конъюгату. Конъюгация с пиримидиновыми нуклеооснованиями или их производными также может происходить в любой позиции. В некоторых вариантах осуществления 2-, 5- и 6-позиции пиримидиновых нуклеооснований могут быть замещены фрагментом конъюгата. Конъюгация с фрагментами сахаров нуклеозидов может происходить в любом атоме углерода. Иллюстративные атомы углерода фрагмента сахара, которые можно прикрепить к фрагменту конъюгата, включают 2', 3' и 5' атомы углерода. 1' позиция также может быть прикреплена к фрагменту конъюгата, например, в остатке с удаленным азотистым основанием. Интернуклеозидные связи также могут нести фрагменты конъюгатов. Для фосфорсодержащих связей (например, сложных фосфодиэфиров, тиофосфата, дитиофосфата, фосфорамидата и тому подобное) фрагмент конъюгата можно прикрепить непосредственно к атому фосфора или к атому O, N или S, связанному с атомом фосфора. Для амин- или амид- содержащих интернуклеозидных связей (например, PNA), фрагмент конъюгата можно прикрепить к атому азота амина или амида или к соседнему атому углерода.
Можно использовать любой пригодный лиганд в области РНК-интерференции, хотя лиганд обычно представляет собой углевод, например, моносахарид (такой как GalNAc), дисахарид, трисахарид, тетрасахарид, полисахарид.
Линкеры, которые конъюгируют лиганд с нуклеиновой кислотой, включают обсуждавшиеся выше линкеры. Например, лигандом может быть одно или более производных GalNAc (N-ацетилглукозамина), присоединенных с помощью моновалентного, бивалентного или трехвалентного разветвленным линкер.
В одном варианте осуществления двухцепочечную РНК изобретения конъюгируют с бивалентными и трехвалентными разветвленными линкерами, содержащим структуры, показанные в любой из формул (IV) -(VII):


при этом:
q2A, q2B, q3A, q3B, q4A, q4B, q5A, q5B и q5C представляет независимо для каждого случая 0-20 и при этом повторяющийся элемент может быть одинаковым или отличаться;
P2A, P2B, P3A, P3B, P4A, P4B, P5A, P5B, P5C, T2A, T2B, T3A, T3B, T4A, T4B, T4A, T5B, T5C каждый независимо отсутствует для каждого случая, CO, NH, O, S, OC(O), NHC(O), CH2, CH2NH или CH2O;
Q2A, Q2B, Q3A, Q3B, Q4A, Q4B, Q5A, Q5B, Q5C независимо отсутствуют для каждого случая, представляют собой алкилен, замещенный алкилен, при этом один или более метиленов могут быть нарушены или завершены одним или более из O, S, S(O), SO2, N(RN), C(R')=C(R''), C≡C или C(O);
R2A, R2B, R3A, R3B, R4A, R4B, R5A, R5B, R5C каждый независимо отсутствует для каждого случая, представляют собой NH, O, S, CH2, C(O)O, C(O)NH, NHCH(Ra)C(O), -C(O)-CH(Ra)-NH-, CO, CH=N-O,

L2A, L2B, L3A, L3B, L4A, L4B, L5A, L5B и L5C представляет лиганд; т.е. Каждый независимо для каждого случая моносахарид (такой как GalNAc), дисахарид, трисахарид, тетрасахарид, олигосахарид или полисахарид; и
Ra представляет собой H или боковую цепь аминокислоты.
Трехвалентные конъюгирующие производные GalNAc особенно подходят для применения со средствами RNAi для ингибирования экспрессии гена-мишени, такие как производные формулы (VII):

в которой L5A, L5B и L5C представляют моносахарид, такой как производное GalNAc.
Примеры подходящих бивалентных и трехвалентных разветвленных линкерных групп, конъюгирующих производные GalNAc, включают, без ограничения, следующие соединения:



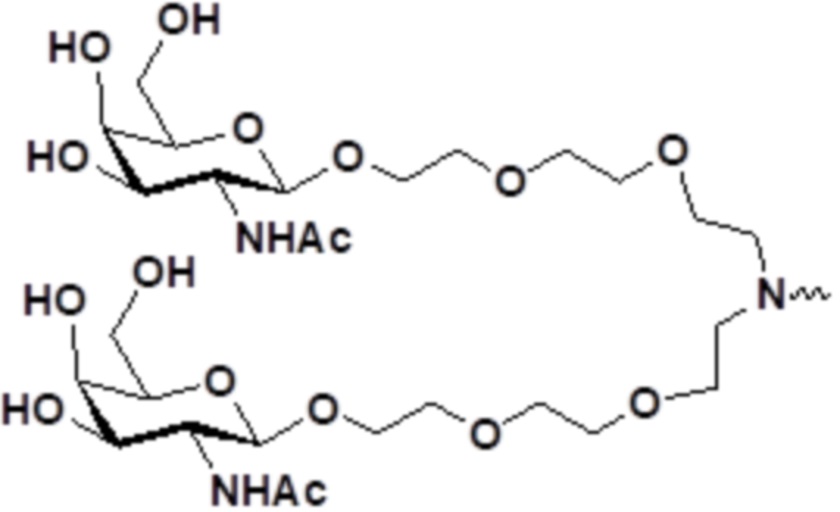






Типовые патенты США, которые излагают получение РНК конъюгатов, включают, без ограничения, патент США № 4,828,979; 4,948,882; 5,218,105; 5,525,465; 5,541,313; 5,545,730; 5,552,538; 5,578,717, 5,580,731; 5,591,584; 5,109,124; 5,118,802; 5,138,045; 5,414,077; 5,486,603; 5,512,439; 5,578,718; 5,608,046; 4,587,044; 4,605,735; 4,667,025; 4,762,779; 4,789,737; 4,824,941; 4,835,263; 4,876,335; 4,904,582; 4,958,013; 5,082,830; 5,112,963; 5,214,136; 5,082,830; 5,112,963; 5,214,136; 5,245,022; 5,254,469; 5,258,506; 5,262,536; 5,272,250; 5,292,873; 5,317,098; 5,371,241, 5,391,723; 5,416,203, 5,451,463; 5,510,475; 5,512,667; 5,514,785; 5,565,552; 5,567,810; 5,574,142; 5,585,481; 5,587,371; 5,595,726; 5,597,696; 5,599,923; 5,599,928 и 5,688,941; 6,294,664; 6,320,017; 6,576,752; 6,783,931; 6,900,297; 7,037,646; 8,106,022, полное содержание каждого из которых включено настоящим в данный документ посредством ссылки.
Нет необходимости, чтобы все позиции в заданном соединении были однородно модифицированы, и в действительности более чем одна из вышеупомянутых модификаций может быть встроена в единственное соединение или даже в единственный нуклеозид внутри iRNA. Настоящее изобретение также включает iRNA соединения, представляющие собой химерные соединения.
«Химерные» iRNA соединения или «химеры» в контексте этого изобретения представляют собой iRNA соединения, предпочтительно двухцепочечные РНК, которые содержат две или более химически различные области, каждая из которых состоит по меньшей мере из одной мономерной единицы, т.е., нуклеотида в случае двухцепочечного РНК соединения. Эти iRNA обычно содержат по меньшей мере одну область, в которой РНК модифицирована таким образом, чтобы при повышенной устойчивости iRNA к деградации нуклеазы придавать целевой нуклеиновой кислоте повышенное клеточное поглощение и/или повышенную аффинность связывания. Дополнительная область iRNA может служить в качестве субстрата для ферментов, способных расщеплять гибриды RNA:DNA или RNA:RNA. В качестве примера, RNase H представляет собой клеточную эндонуклеазу, которая расщепляет нить РНК дуплекса RNA:DNA. Вследствие этого, активация RNase H приводит к расщеплению РНК мишени, тем самым значительно повышая эффективность iRNA подавления экспрессии гена. Следовательно, при использовании химерных двухцепочечных РНК часто можно получать сравнимые результаты с более короткими iRNA по сравнению с дезокситиофосфат двухцепочечной РНК, гибридизированной с одной и той же целевой областью. Расщепление РНК мишени можно обычно обнаружить с помощью гель-электрофореза, и если необходимо с помощью известных в данной области связанных методик гибридизации нуклеиновой кислоты.
В некоторых случаях РНК iRNA можно модифицировать с помощью нелигандной группы. В научной литературе имеется количество нелигандных молекул, конъюгируютных с iRNA для повышения активности, клеточного распределения или клеточного поглощения iRNA, и методики для проведения конъюгации. Такие нелигандные фрагменты содержат липидные фрагменты, такие как холистерин (Kubo, T. et al.,Biochem. Biophys. Res. Comm., 2007, 365(1):54-61; Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86:6553), холевая кислота (Manoharan et al., Bioorg. Med. Chem. Lett., 1994, 4:1053), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660:306; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3:2765), тиохолистерин (Oberhauser et al., Nucl. Acids Res., 1992, 20:533), алифатическая цепь, например, остатки додекандиола или ундецила (Saison-Behmoaras et al., EMBO J., 1991, 10:111; Kabanov et al., FEBS Lett., 1990, 259:327; Svinarchuk et al., Biochimie, 1993, 75:49), фосфолипид, например, дигексадецил-rac-глицерин или триэтиламмоний 1,2-ди-O-гексадецил-rac-глицеро-3-H-фосфонат (Manoharan et al., Тетраhedron Lett., 1995, 36:3651; Shea et al., Nucl. Кислоты Res., 1990, 18:3777), полиамин или полиэтиленгликолевая цепь Manoharan et al., Nucleosides & Nucleotides, 1995, 14:969), или адамантановая уксусная кислота (Manoharan et al., Тетраhedron Lett., 1995, 36:3651), палмитиловый фрагмент (Mishra et al., Biochim. Biophys. Acta, 1995, 1264:229) или октадециламин или гексиламино-карбонил-оксихолистериновый фрагмент (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277:923). Типовые патенты США, которые излагают получение таких РНК конъюгатов, были перечислены выше. Типичные протоколы конъюгации включают синтез RNA, несущих аминолинкер в одной или более позициях последовательности. Затем аминогруппу вводят в реакцию с молекулой, конъюгируютной с использованием подходящих соединяющих или активирующих реагентов. Реакцию конъюгации можно проводить либо с РНК, все еще связанной с твердой подложкой, либо после расщепления RNA в фазе раствора. Очистка конъюгата РНК с помощью HPLC обычно дает чистый конъюгат.
В некоторых вариантах осуществления средством двухцепочечной RNAi изобретения является AD-57213.
VI. Доставка iRNA изобретения
Доставка iRNA изобретения в клетку, например, в клетку субъекта, такого как субъект-человек (например, нуждающийся в этом субъект, такой как субъект, имеющий расстройство, сопровождающееся кровоточивостью), может достигаться рядом разных путей. Например, доставку можно выполнять за счет контакта клетки с iRNA изобретения либо in vitro, либо in vivo. Доставку In vivo можно выполнять непосредственно путем введения субъекту композиции, содержащей iRNA, например, двухцепочечную РНК. В качестве альтернативы, доставку In vivo можно выполнять опосредованно путем введения одного или более векторов, которые кодируют и направляют экспрессию iRNA. Эти альтернативы дополнительно обсуждаются ниже.
В общем, любой способ доставки молекулы нуклеиновой кислоты (in vitro или in vivo) может быть адаптирован для применения с iRNA изобретения (см. например, Akhtar S. and Julian RL. (1992) Trends Cell. Biol. 2(5):139-144 и WO94/02595, которые включены в данный документ посредством ссылки во всей полноте). Для доставки In vivo, факторы, которые следует учитывать для доставки молекул iRNA, включают, например, биологическую стабильность доставляемых молекул, предотвращение неспецифических действий и аккумулирование доставляемых молекул в ткани-мишени. Неспецифические действия iRNA можно свести к минимуму за счет локального введения, например, за счет прямой инъекции или имплантации в ткань или местного введения препарата. Локальное введение в место лечения делает максимальным локальную концентрацию средства, ограничивает воздействие средства на системные ткани, которые в противном случае могут повреждаться средством или которые могут разрушать средство, и обеспечивает низкую общую дозу молекул iRNA, подлежащую введению. В нескольких исследованиях было показано успешное снижение количества генных продуктов при локальном введении iRNA. Например, внутриглазная доставка двухцепочечной РНК VEGF посредством интравитреальной инъекции яванским макакам (Tolentino, MJ., et al (2004) Retina 24:132-138) и субретинальных инъекций мышам (Reich, SJ., et al (2003) Mol. Vis. 9:210-216) обе показали предотвращение неоваскуляризации в экспериментальной модели возрастной макулярной дистрофии. Кроме того, прямая внутриопухолевая инъекция двухцепочечной РНК у мышей уменьшает объем опухоли (Pille, J., et al (2005) Mol. Ther.11:267-274) и может пролонгировать выживание имеющих опухоль мышей (Kim, WJ., et al (2006) Mol. Ther. 14:343-350; Li, S., et al (2007) Mol. Ther. 15:515-523). РНК-интерференция также продемонстрировала успех локальной доставки в CNS путем прямой инъекции (Dorn, G., et al. (2004) Нуклеиновые кислоты 32:e49; Tan, PH., et al (2005) Gene Ther. 12:59-66; Makimura, H., et al (2002) BMC Neurosci. 3:18; Shishkina, GT., et al (2004) Neuroscience 129:521-528; Thakker, ER., et al (2004) Proc. Natl. Acad. Sci. U.S.A. 101:17270-17275; Akaneya,Y., et al (2005) J. Neurophysiol. 93:594-602) и в легкие путем интраназального введения (Howard, KA., et al (2006) Mol. Ther. 14:476-484; Zhang, X., et al (2004) J. Biol. Chem. 279:10677-10684; Bitko, V., et al (2005) Nat. Med. 11:50-55). Для введения iRNA системно для лечения заболевания РНК можно модифицировать или в качестве альтернативы доставлять с использованием системы доставки лекарственных веществ; оба способа действуют для предотвращения быстрой деградации двухцепочечной РНК посредством эндо- и экзо-нуклеазы in vivo. Модификация РНК или фармацевтического носителя также может обеспечить выделение iRNA композицией ткани-мишени и избежать нежелательных побочных явлений. iRNA молекулы можно модифицировать путем химической конъюгации с липофильными группами, такими как холистерин, для повышения клеточного поглощения и предотвращения деградации. Например, iRNA, направленную против ApoB, конъюгируютного с фрагментом липофильного холистерина, системно инъецировали мышам, что приводило к резкому снижению apoB мРНК как в печени, так и в тонкой кишке (Soutschek, J., et al (2004) Nature 432:173-178). Было показано, что конъюгация iRNA с аптамером ингибирует рост опухоли и опосредует регрессию опухоли в мышиной модели рака предстательной железы (McNamara, JO., et al (2006) Nat. Biotechnol. 24:1005-1015). В альтернативном варианте осуществления iRNA можно доставлять с использованием систем доставки лекарственных веществ, таких как наночастица, дендример, полимер, липосомы или система катионной доставки. Положительно заряженные катионные системы доставки облегчают связывание молекул iRNA (отрицательно заряженных), а также усиливают взаимодействия на отрицательно заряженных клеточных мембранах, обеспечивая эффективное поглощение iRNA клеткой. Катионные липиды, дендримеры или полимеры могут либо связываться с iRNA, либо индуцировать образование везикул или мицелл (см. например, Kim SH., et al (2008) Journal of Controlled Release 129(2):107-116), которые заключают iRNA. Образование везикул или мицелл при системном введении дополнительно предотвращает деградацию iRNA. Способы создания и введения катионных комплексов iRNA хорошо известны специалистам в данной области (см. например, Sorensen, DR., et al (2003) J. Mol. Biol 327:761-766; Verma, UN., et al (2003) Clin. Cancer Res. 9:1291-1300; Arnold, AS et al (2007) J. Hypertens. 25:197-205, которые включены в данный документ посредством ссылки во всей полноте). Некоторые неограничивающие примеры систем доставки лекарственных веществ, используемых для системной доставки iRNA, включают DOTAP (Sorensen, DR., et al (2003), supra; Verma, UN., et al (2003), supra), олигофектамин, «твердые липидные частицы нуклеиновой кислоты» (Zimmermann, TS., et al (2006) Nature 441:111-114), кардиолипин (Chien, PY., et al (2005) Cancer Gene Ther. 12:321-328; Pal, A., et al (2005) Int J. Oncol. 26:1087-1091), полиэтиленимин (Bonnet ME., et al (2008) Pharm. Res. Aug 16 Epub ahead of print; Aigner, A. (2006) J. Biomed. Biotechnol. 71659), пептиды Arg-Gly-Asp (RGD) (Liu, S. (2006) Mol. Pharm. 3:472-487), и полиамидоамины (Tomalia, DA., et al (2007) Biochem. Soc. Trans. 35:61-67; Yoo, H., et al (1999) Pharm. Res. 16:1799-1804). В некоторых вариантах осуществления iRNA образует комплекс с циклодекстрином для системного введения. Способы введение и фармацевтические композиции iRNA и циклодекстринов можно найти в патенте США № 7,427,605, который включен в данный документ посредством ссылки во всей полноте.
Вектор, кодированный iRNA изобретения
iRNA, выделяющую ген Serpinc1, можно экспрессировать из транскрипционных единиц, введенных в ДНК или РНК векторы (см., например, Couture, A, et al., TIG. (1996), 12:5-10; Skillern, A., et al., Международная публикация PCT № WO 00/22113, Conrad, Международная публикация PCT № WO 00/22114, и Conrad, патент США № 6,054,299). Экспрессия может быть временной (порядка от часов до недель) или длительной (от недель до месяцев или дольше) в зависимости от специфического используемого конструкта и типа ткани- или клетки-мишени. Эти трансгены можно вводить в виде линейного конструкта, кольцевой плазмиды или вирусного вектора, который может представлять собой интегрированный или не интегрированный вектор. Трансген также может быть сконструирован так, чтобы он мог наследоваться, как экстрахромосомная плазмида (Gassmann, et al., Proc. Natl. Acad. Sci. USA (1995) 92:1292).
Отдельную нить или нити iRNA можно транскрибировать с промотора на вектор экспрессии. Когда две отдельные нити необходимо экспрессировать для получения, например, двухцепочечной РНК, два отдельных вектора экспрессии можно совместно ввести (например, путем трансфекции или инфекции) в клетку-мишень. В качестве альтернативы каждую отдельную нить двухцепочечной РНК можно транскрибировать промоторами, которые оба находятся на одной и той же плазмиде экспрессии. В одном варианте осуществления двухцепочечную РНК экспрессируют в виде перевернутых повторяющихся полинуклеотидов, соединенных последовательностью полинуклеотидных линкеров, так чтобы двухцепочечная РНК имела структуру петли на стебле.
Векторами экспрессии iRNA как правило являются ДНК плазмиды или вирусные векторы. Векторы экспрессии, совместимые с эукариотическими клетками, предпочтительно векторы экспрессии, совместимые с клетками позвоночных, можно использовать для получения рекомбинантных конструктов для экспрессии iRNA согласно настоящему изобретению. Векторы экспрессии эукариотических клеток хорошо известны в данной области и доступны из ряда коммерческих источников. Обычно, предоставляют такие векторы, которые содержат удобные сайты рестрикции для введения сегмента требуемой нуклеиновой кислоты. Доставка экспрессирующих векторов iRNA может быть системной, например, путем внутривенного или внутримышечного введенияе, путем введения в клетки-мишени, эксплантироанные у пациента, с последующим повторным введение пациенту, или путем любого другого средства, которое предусматривает введение в требуемую клетку-мишень.
Плазмиды экспрессии iRNA можно трансфицировать в клетки-мишени в виде комплекса с катионными липидными носителями (например, олигофектамином) или некатионными основанными на липидах носителями (например, Transit-TKO™). В изобретении также предусматриваются многочисленные липидные трансфекции для iRNA-опосредованных резких снижений, выделяющих разные области целевой РНК в течение периода недели или более. Успешное введение векторов в клетки-хозяева можно отслеживать с использованием разных известных способов. Например, о временной трансфекции может сигнализировать репортер, такой как флуоресцентный маркер, такой как Зеленый Флуоресцентный Белок (GFP). Устойчивую трансфекцию клеток ex vivo можно обеспечить с использованием маркеров, которые снабжают трансфицированную клетку устойчивостью к специфическим окружающим факторам (например, анибиотикам и лекарственным веществам), например, устойчивостью к гигромицину B.
Вирусные векторные системы, которые можно использовать со способами и композициями в рамках изобретения, включают, без ограничения, (a) аденовирусные векторы; (b) ретровирусные векторы, содержащие без ограничения лентивирусные векторы, вирус мышиного лейкоза Молони и т.д.; (c) аденоассоциированные вирусные векторы; (d) векторы вируса простого герпеса; (e) SV 40 векторы; (f) векторы вируса полиомы; (g) векторы вируса папилломы; (h) пикорнавирусные векторы; (i) покс вирусные векторы, такие как ортопокс, например, вектор на основе вируса осповакцины или авипоксвируса, например, поксвирус канареек или оспа птиц; и (j) хелпер-зависимый или безрезультатный аденовирус. Также могут быть предпочтительными вирусы с дефектной репликацией. Разные векторы будут встраиваться или не встраиваться в клеточный геном. При необходимости конструкты могут содержать вирусные последовательности для трансфекции. В качестве альтернативы, конструкт можно встраивать в векторы, способные к эписомальной репликации, например EPV и EBV векторы. Конструктам для рекомбинантной экспрессии iRNA как правило будут требоваться регуляторные элементы, например, промоторы, энхансеры и т.д., для обеспечения экспрессии iRNA в клетки-мишени. Другие аспекты рассмотрения для векторов и конструктов дополнительно описаны ниже.
Векторы, используемые для доставки iRNA, будут содержать регуляторные элементы (промотор, энхансер и т.д.), достаточные для экспрессии iRNA в требуемой клетке или ткани-мишени. Регуляторные элементы можно выбирать, чтобы обеспечить либо конститутивную, либо регулируемую/индуцируемую экспрессию.
Экспрессия iRNA может быть точно регулируемой, например, за счет использования индуцируемой регуляторной последовательности, которая чувствительна к некоторым физиологическим регуляторам, например, к уровням циркулирующей глюкозы или гормонам (Docherty et al., 1994, FASEB J. 8:20-24). Такие индуцируемые системы экспрессии, пригодные для управления экспрессией двухцепочечной РНК в клетках или у млекопитающих включают, например, регуляцию экдизолом, эстрогеном, прогестероном, тетрациклином, химическими индукторами димеризации и изопропил-бета-D1-тиогалактопиранозидом (IPTG). Специалист в данной области будет способен выбрать подходящую регуляторную/промоторную последовательность, основанную на предполагаемом применении iRNA трансгена.
Можно использовать вирусные векторы, которые содержат последовательности нуклеиновых кислот, кодирующие iRNA. Например, можно использовать ретровирусный вектор (см. Miller et al., Мет. Enzymol. 217:581-599 (1993)). Эти ретровирусные векторы содержат компоненты, необходимые для правильной упаковки вирусного генома и интеграции в клетку-хозяин ДНК. Последовательности нуклеиновых кислот, кодирующие iRNA, клонируют в один или более векторов, которые облегчают доставку нуклеиновой кислоты пациенту. Более подробную информацию о ретровирусных векторах можно найти, например, в Boesen et al., Biotherapy 6:291-302 (1994), в котором описано применение ретровирусного вектора для доставки гена mdr1 в гематопоэтические стволовые клетки для того, чтобы сделать стволовые клетки более устойчивыми к химиотерапии. Другие ссылки, иллюстрирующие применение ретровирусных векторов в генной терапии: Clowes et al., J. Clin. Invest. 93:644-651 (1994); Kiem et al., Blood 83:1467-1473 (1994); Salmons and Gunzberg, Human Gene Therapy 4:129-141 (1993); and Grossman and Wilson, Curr. Opin. in Genetics и Devel. 3:110-114 (1993). Лентивирусные векторы, предусмотренные для применения, включают, например, HIV основанные векторы, описанные в патенте США № 6,143,520; 5,665,557; и 5,981,276, которые включены в данный документ посредством ссылки.
Аденовирусы также предусмотрены для применения в доставке iRNA изобретения. Аденовирусы являются особенно привлекательными наполнителями, например, для доставки генов в дыхательный эпителий. Аденовирусы в обычных условиях инфецируют дыхательный эпителий, где они вызывают среднее заболевание. Другими мишенями для основанных на аденовирусах системах доставки являются печень, центральная нервная система, эндотелиальные клетки и мышцы. Аденовирусы имеют преимущество в том, что они способны инфицировать неделящиеся клетки. Kozarsky and Wilson, Current Opinion in Genetics and Development 3:499-503 (1993) представляют обзор генной терапии, основанной на аденовирусах. Bout et al., Human Gene Therapy 5:3-10 (1994) продемонстрировал применение аденовирусных векторов для переноса генов в дыхательный эпителий резус-макак. Другие примеры применения аденовирусов в генной терапии можно найти у Rosenfeld et al., Science 252:431-434 (1991); Rosenfeld et al., Cell 68:143-155 (1992); Mastrangeli et al., J. Clin. Invest. 91:225-234 (1993); PCT Publication WO94/12649; and Wang, et al., Gene Therapy 2:775-783 (1995). У Xia H et al. (2002), Nat. Biotech. 20: 1006-1010 описаны подходящий AV вектор для экспрессии iRNA, представленный в изобретении, способ конструирования рекомбинантного AV вектора и способ доставки вектора в клетки-мишени.
Аденоассоциированные вирусные (AAV) векторы также можно использовать для доставки iRNA изобретения (Walsh et al., Proc. Soc. Exp. Biol. Med. 204:289-300 (1993); патент США № 5,436,146). В одном варианте осуществления iRNA можно экспрессировать в виде двух отдельных, комплементарных одноцепочечных РНК молекул из рекомбинантного AAV вектора, имеющего, например, либо U6, либо H1 промоторы РНК, или промотор цитомегаловируса (CMV). Подходящие AAV векторы для экспрессии двухцепочечной РНК, представленные в изобретении, способы конструирования рекомбинантного AV вектора и способы доставки векторов в клетки-мишени описаны у Samulski R et al. (1987), J. Virol. 61: 3096-3101; Fisher K J et al. (1996), J. Virol, 70: 520-532; Samulski R et al. (1989), J. Virol. 63: 3822-3826; патент США № 5,252,479; в патенте США № 5,139,941; в международной патентной заявке № WO 94/13788; и в международной патентной заявке № WO 93/24641, полные раскрытия которых включены в данный документ посредством ссылки.
Другой вирусный вектор, пригодный для доставки iRNA изобретения, представляет собой поксвирус, такой как вирус вакцины, например, ослабленная вакцина, такая как модифицированный Virus Ankara (MVA) или NYVAC, avipox, такая как оспа птиц или канареечная оспа.
Тропизм вирусных векторов можно модифицировать путем псевдотипирования векторов с белками оболочки или другими поверхностными антигенами от других вирусов или путем замещения по необходимости белков капсид разных вирусов. Например, лентивирусные векторы можно псевдотипировать поверхностными белками вируса везикулярного стоматита (VSV), бешенства, эбола, мокола и тому подобное. AAV векторы можно получить для выделения разных клеток путем конструирования векторов для экспрессии разных серотипов белка капсид; см., например, Rabinowitz J E et al. (2002), J Virol 76:791-801, полное раскрытие которого включено в данный документ посредством ссылки.
Фармацевтический препарат вектора может содержать вектор в приемлемом растворителе или может содержать матрикс замедленного высобождения, в который погружен наполнитель для доставки гена. В качестве альтернативы, когда из рекомбинантных клеток можно получить полный интактный вектор доставки гена, например, ретровирусные векторы, фармацевтический препарат может содержать одну или более клеток, которые продуцируют систему доставки гена.
V. Фармацевтические Композиции изобретения
В настоящем изобретении также предоставлены фармацевтические композиции и готовые формы, которые содержат iRNA изобретения. В одном варианте осуществления в данном документе предоставлены фармацевтические композиции, содержащие iRNA согласно настоящему изобретению, и фармацевтически приемлемый носитель. Фармацевтические композиции, содержащие iRNA, используют для лечения заболевания или расстройства, связанного с экспрессией или активностью гена Serpinc1, например, заболевания, ассоциированного с Serpinc1. Такие фармацевтические композиции составляют на основе режима доставки. Одним примером являются композиции, которые составляют для системного введения посредством парентеральной доставки, например, посредством подкожной (SC) или внутривенной (IV) доставки. Другим примером являются композиции, которые составляют для прямой доставки в мозговую паренхиму, например, путем инфузии в мозг, например, путем непрерывной помповой инфузии. Фармацевтические композиции изобретения можно вводить в дозировках, достаточных для подавления экспрессии гена Serpinc1.
В некоторых вариантах осуществления изобретения, например, когда фармацевтическая композиция, содержащая средство двухцепочечной RNAi, включает один или более мотивов трех идентичных модификаций трех последовательных нуклеотидов, включая один такой мотив на участке расщепления средства или около него, шесть тиофосфатных связей, и лиганд GalNAc, такую композицию вводят в дозе от 0,200 до приблизительно 1,825 мг/кг, от 0,200 до приблизительно 1,800 мг/кг, приблизительно от 0,200 до приблизительно 1,700 мг/кг, приблизительно от 0,200 до приблизительно 1,600 мг/кг, приблизительно от 0,200 до приблизительно 1,500 мг/кг, приблизительно от 0,200 до приблизительно 1,400 мг/кг, приблизительно от 0,200 до приблизительно 1,400 мг/кг, приблизительно от 0,200 до приблизительно 1,200 мг/кг, приблизительно от 0,200 до приблизительно 1,100 мг/кг, приблизительно от 0,200 до приблизительно 1,000 мг/кг, приблизительно от 0,200 до приблизительно 0,900 мг/кг, приблизительно от 0,200 до приблизительно 0,800 мг/кг, приблизительно от 0,200 до приблизительно 0,700 мг/кг, приблизительно от 0,200 до приблизительно 0,600 мг/кг, приблизительно от 0,200 до приблизительно 0,500 мг/кг, приблизительно от 0,200 до приблизительно 0,400 мг/кг, приблизительно 0,225 до приблизительно 1,825 мг/кг, приблизительно 0,225 до приблизительно 1,800 мг/кг, приблизительно 0,225 до приблизительно 1,700 мг/кг, приблизительно 0,225 до приблизительно 1,600 мг/кг, приблизительно 0,225 до приблизительно 1,500 мг/кг, приблизительно 0,225 до приблизительно 1,400 мг/кг, приблизительно 0,225 до приблизительно 1,400 мг/кг, приблизительно 0,225 до приблизительно 1,200 мг/кг, приблизительно 0,225 до приблизительно 1,100 мг/кг, приблизительно 0,225 до приблизительно 1,000 мг/кг, приблизительно 0,225 до приблизительно 0,900 мг/кг, приблизительно 0,225 до приблизительно 0,800 мг/кг, приблизительно 0,225 до приблизительно 0,700 мг/кг, приблизительно 0,225 до приблизительно 0,600 мг/кг, приблизительно 0,225 до приблизительно 0,500 мг/кг, приблизительно 0,225 до приблизительно 0,400 мг/кг, приблизительно 0,250 до приблизительно 1,825 мг/кг, приблизительно 0,250 до приблизительно 1,800 мг/кг, приблизительно 0,250 до приблизительно 1,700 мг/кг, приблизительно 0,250 до приблизительно 1,600 мг/кг, приблизительно 0,250 до приблизительно 1,500 мг/кг, приблизительно 0,250 до приблизительно 1,400 мг/кг, приблизительно 0,250 до приблизительно 1,400 мг/кг, приблизительно 0,250 до приблизительно 1,200 мг/кг, приблизительно 0,250 до приблизительно 1,100 мг/кг, приблизительно 0,250 до приблизительно 1,000 мг/кг, приблизительно 0,250 до приблизительно 0,900 мг/кг, приблизительно 0,250 до приблизительно 0,800 мг/кг, приблизительно 0,250 до приблизительно 0,700 мг/кг, приблизительно 0,250 до приблизительно 0,600 мг/кг, приблизительно 0,250 до приблизительно 0,500 мг/кг, приблизительно 0,250 до приблизительно 0,400 мг/кг, приблизительно 0,425 до приблизительно 1,825 мг/кг, приблизительно 0,425 до приблизительно 1,800 мг/кг, приблизительно 0,425 до приблизительно 1,700 мг/кг, приблизительно 0,425 до приблизительно 1,600 мг/кг, приблизительно 0,425 до приблизительно 1,500 мг/кг, приблизительно 0,425 до приблизительно 1,400 мг/кг, приблизительно 0,425 до приблизительно 1,400 мг/кг, приблизительно 0,425 до приблизительно 1,200 мг/кг, приблизительно 0,425 до приблизительно 1,100 мг/кг, приблизительно 0,425 до приблизительно 1,000 мг/кг, приблизительно 0,425 до приблизительно 0,900 мг/кг, приблизительно 0,425 до приблизительно 0,800 мг/кг, приблизительно 0,425 до приблизительно 0,700 мг/кг, приблизительно 0,425 до приблизительно 0,600 мг/кг, приблизительно 0,425 до приблизительно 0,500 мг/кг, приблизительно 0,450 до приблизительно 1,825 мг/кг, приблизительно 0,450 до приблизительно 1,800 мг/кг, приблизительно 0,450 до приблизительно 1,700 мг/кг, приблизительно 0,450 до приблизительно 1,600 мг/кг, приблизительно 0,450 до приблизительно 1,500 мг/кг, приблизительно 0,450 до приблизительно 1,400 мг/кг, приблизительно 0,450 до приблизительно 1,400 мг/кг, приблизительно 0,450 до приблизительно 1,200 мг/кг, приблизительно 0,450 до приблизительно 1,100 мг/кг, приблизительно 0,450 до приблизительно 1,000 мг/кг, приблизительно 0,450 до приблизительно 0,900 мг/кг, приблизительно 0,450 до приблизительно 0,800 мг/кг, приблизительно 0,450 до приблизительно 0,700 мг/кг, приблизительно 0,450 до приблизительно 0,600 мг/кг, приблизительно 0,450 до приблизительно 0,500 мг/кг, приблизительно 0,475 до приблизительно 1,825 мг/кг, приблизительно 0,475 до приблизительно 1,800 мг/кг, приблизительно 0,475 до приблизительно 1,700 мг/кг, приблизительно 0,475 до приблизительно 1,600 мг/кг, приблизительно 0,475 до приблизительно 1,500 мг/кг, приблизительно 0,475 до приблизительно 1,400 мг/кг, приблизительно 0,475 до приблизительно 1,400 мг/кг, приблизительно 0,475 до приблизительно 1,200 мг/кг, приблизительно 0,475 до приблизительно 1,100 мг/кг, приблизительно 0,475 до приблизительно 1,000 мг/кг, приблизительно 0,475 до приблизительно 0,900 мг/кг, приблизительно 0,475 до приблизительно 0,800 мг/кг, приблизительно 0,475 до приблизительно 0,700 мг/кг, приблизительно 0,475 до приблизительно 0,600 мг/кг, приблизительно 0,475 до приблизительно 0,500 мг/кг, приблизительно 0,875 до приблизительно 1,825 мг/кг, приблизительно 0,875 до приблизительно 1,800 мг/кг, приблизительно 0,875 до приблизительно 1,700 мг/кг, приблизительно 0,875 до приблизительно 1,600 мг/кг, приблизительно 0,875 до приблизительно 1,500 мг/кг, приблизительно 0,875 до приблизительно 1,400 мг/кг, приблизительно 0,875 до приблизительно 1,400 мг/кг, приблизительно 0,875 до приблизительно 1,200 мг/кг, приблизительно 0,875 до приблизительно 1,100 мг/кг, приблизительно 0,875 до приблизительно 1,000 мг/кг, приблизительно 0,875 до приблизительно 0,900 мг/кг, приблизительно 0,900 до приблизительно 1,825 мг/кг, приблизительно 0,900 до приблизительно 1,800 мг/кг, приблизительно 0,900 до приблизительно 1,700 мг/кг, приблизительно 0,900 до приблизительно 1,600 мг/кг, приблизительно 0,900 до приблизительно 1,500 мг/кг, приблизительно 0,900 до приблизительно 1,400 мг/кг, приблизительно 0,900 до приблизительно 1,400 мг/кг, приблизительно 0,900 до приблизительно 1,200 мг/кг, приблизительно 0,900 до приблизительно 1,100 мг/кг, приблизительно 0,900 до приблизительно 1,000 мг/кг, приблизительно 0,925 до приблизительно 1,825 мг/кг, приблизительно 0,925 до приблизительно 1,800 мг/кг, приблизительно 0,925 до приблизительно 1,700 мг/кг, приблизительно 0,925 до приблизительно 1,600 мг/кг, приблизительно 0,925 до приблизительно 1,500 мг/кг, приблизительно 0,925 до приблизительно 1,400 мг/кг, приблизительно 0,925 до приблизительно 1,400 мг/кг, приблизительно 0,925 до приблизительно 1,200 мг/кг, приблизительно 0,925 до приблизительно 1,100 мг/кг, или приблизительно 0,925 до приблизительно 1,000 мг/кг. Значения и промежуточные диапазоны для вышеизложенных перечисленных значений также предназначены составлять часть этого изобретения, например, средство RNAi можно вводить субъекту в дозе, составляющей приблизительно 0,015 мг/кг до приблизительно 0,45 мг/мг.
Например, средство RNAi, например, средство RNAi в фармацевтической композиции можно вводить в дозе, составляющей приблизительно 0,2 мг/кг, 0,225 мг/кг, 0,25 мг/кг, 0,275 мг/кг, 0,3 мг/кг, 0,325 мг/кг, 0,35 мг/кг, 0,375 мг/кг, 0,4 мг/кг, 0,425 мг/кг, 0,45 мг/кг, 0,475 мг/кг, приблизительно 0,5 мг/кг, 0,525 мг/кг, 0,55 мг/кг, 0,575 мг/кг, приблизительно 0,6 мг/кг, 0,625 мг/кг, 0,65 мг/кг, 0,675 мг/кг, приблизительно 0,7 мг/кг, 0,725 мг/кг, 0,75 мг/кг, 0,775 мг/кг, приблизительно 0,8 мг/кг, 0,925 мг/кг, 0,95 мг/кг, 0,975 мг/кг, приблизительно 1,0 мг/кг, 1,025 мг/кг, 1,05 мг/кг, 1,075 мг/кг, приблизительно 1,1 мг/кг, 1,125 мг/кг, 1,15 мг/кг, 1,175 мг/кг, приблизительно 1,2 мг/кг, 1,225 мг/кг, 1,25 мг/кг, 1,275 мг/кг, приблизительно 1.3 мг/кг, 1.325 мг/кг, 1.35 мг/кг, 1.375 мг/кг, приблизительно 1,4 мг/кг, 1,425 мг/кг, 1,45 мг/кг, 1,475 мг/кг, приблизительно 1,5 мг/кг, 1,525 мг/кг, 1,55 мг/кг, 1,575 мг/кг, приблизительно 1,6 мг/кг, 1,625 мг/кг, 1,65 мг/кг, 1,675 мг/кг, приблизительно 1,7 мг/кг, 1,725 мг/кг, 1,75 мг/кг, 1,775 мг/кг или приблизительно 1,8 мг/кг. Промежуточные значения для вышеизложенных перечисленных значений также предназначены составлять часть этого изобретения.
В некоторых вариантах осуществления изобретения, например, когда средство двухцепочечной RNAi содержит смысловую нить и антисмысловую нить, причем антисмысловая нить содержит область комплементарности, которая содержит по меньшей мере 15 смежных нуклеотидов, отличаясь не более чем 3 нуклеотидами от нуклеотидной последовательности 5'-UUGAAGUAAAUGGUGUUAACCAG-3' (SEQ ID NO: 15), при этом по существу все нуклеотиды смысловой нити и по существу все нуклеотиды антисмысловой нити являются модифицированными нуклеотидами, и при этом смысловую нить конъюгируют с лигандом, прикрепленным к 3'-концу, такое средство в фармацевтической композиции вводят в дозе, составляющей приблизительно от 0,200 до приблизительно 1,825 мг/кг, от 0,200 до приблизительно 1,800 мг/кг, приблизительно от 0,200 до приблизительно 1,700 мг/кг, приблизительно от 0,200 до приблизительно 1,600 мг/кг, приблизительно от 0,200 до приблизительно 1,500 мг/кг, приблизительно от 0,200 до приблизительно 1,400 мг/кг, приблизительно от 0,200 до приблизительно 1,400 мг/кг, приблизительно от 0,200 до приблизительно 1,200 мг/кг, приблизительно от 0,200 до приблизительно 1,100 мг/кг, приблизительно от 0,200 до приблизительно 1,000 мг/кг, приблизительно от 0,200 до приблизительно 0,900 мг/кг, приблизительно от 0,200 до приблизительно 0,800 мг/кг, приблизительно от 0,200 до приблизительно 0,700 мг/кг, приблизительно от 0,200 до приблизительно 0,600 мг/кг, приблизительно от 0,200 до приблизительно 0,500 мг/кг, приблизительно от 0,200 до приблизительно 0,400 мг/кг, приблизительно 0,225 до приблизительно 1,825 мг/кг, приблизительно 0,225 до приблизительно 1,800 мг/кг, приблизительно 0,225 до приблизительно 1,700 мг/кг, приблизительно 0,225 до приблизительно 1,600 мг/кг, приблизительно 0,225 до приблизительно 1,500 мг/кг, приблизительно 0,225 до приблизительно 1,400 мг/кг, приблизительно 0,225 до приблизительно 1,400 мг/кг, приблизительно 0,225 до приблизительно 1,200 мг/кг, приблизительно 0,225 до приблизительно 1,100 мг/кг, приблизительно 0,225 до приблизительно 1,000 мг/кг, приблизительно 0,225 до приблизительно 0,900 мг/кг, приблизительно 0,225 до приблизительно 0,800 мг/кг, приблизительно 0,225 до приблизительно 0,700 мг/кг, приблизительно 0,225 до приблизительно 0,600 мг/кг, приблизительно 0,225 до приблизительно 0,500 мг/кг, приблизительно 0,225 до приблизительно 0,400 мг/кг, приблизительно 0,250 до приблизительно 1,825 мг/кг, приблизительно 0,250 до приблизительно 1,800 мг/кг, приблизительно 0,250 до приблизительно 1,700 мг/кг, приблизительно 0,250 до приблизительно 1,600 мг/кг, приблизительно 0,250 до приблизительно 1,500 мг/кг, приблизительно 0,250 до приблизительно 1,400 мг/кг, приблизительно 0,250 до приблизительно 1,400 мг/кг, приблизительно 0,250 до приблизительно 1,200 мг/кг, приблизительно 0,250 до приблизительно 1,100 мг/кг, приблизительно 0,250 до приблизительно 1,000 мг/кг, приблизительно 0,250 до приблизительно 0,900 мг/кг, приблизительно 0,250 до приблизительно 0,800 мг/кг, приблизительно 0,250 до приблизительно 0,700 мг/кг, приблизительно 0,250 до приблизительно 0,600 мг/кг, приблизительно 0,250 до приблизительно 0,500 мг/кг, приблизительно 0,250 до приблизительно 0,400 мг/кг, приблизительно 0,425 до приблизительно 1,825 мг/кг, приблизительно 0,425 до приблизительно 1,800 мг/кг, приблизительно 0,425 до приблизительно 1,700 мг/кг, приблизительно 0,425 до приблизительно 1,600 мг/кг, приблизительно 0,425 до приблизительно 1,500 мг/кг, приблизительно 0,425 до приблизительно 1,400 мг/кг, приблизительно 0,425 до приблизительно 1,400 мг/кг, приблизительно 0,425 до приблизительно 1,200 мг/кг, приблизительно 0,425 до приблизительно 1,100 мг/кг, приблизительно 0,425 до приблизительно 1,000 мг/кг, приблизительно 0,425 до приблизительно 0,900 мг/кг, приблизительно 0,425 до приблизительно 0,800 мг/кг, приблизительно 0,425 до приблизительно 0,700 мг/кг, приблизительно 0,425 до приблизительно 0,600 мг/кг, приблизительно 0,425 до приблизительно 0,500 мг/кг, приблизительно 0,450 до приблизительно 1,825 мг/кг, приблизительно 0,450 до приблизительно 1,800 мг/кг, приблизительно 0,450 до приблизительно 1,700 мг/кг, приблизительно 0,450 до приблизительно 1,600 мг/кг, приблизительно 0,450 до приблизительно 1,500 мг/кг, приблизительно 0,450 до приблизительно 1,400 мг/кг, приблизительно 0,450 до приблизительно 1,400 мг/кг, приблизительно 0,450 до приблизительно 1,200 мг/кг, приблизительно 0,450 до приблизительно 1,100 мг/кг, приблизительно 0,450 до приблизительно 1,000 мг/кг, приблизительно 0,450 до приблизительно 0,900 мг/кг, приблизительно 0,450 до приблизительно 0,800 мг/кг, приблизительно 0,450 до приблизительно 0,700 мг/кг, приблизительно 0,450 до приблизительно 0,600 мг/кг, приблизительно 0,450 до приблизительно 0,500 мг/кг, приблизительно 0,475 до приблизительно 1,825 мг/кг, приблизительно 0,475 до приблизительно 1,800 мг/кг, приблизительно 0,475 до приблизительно 1,700 мг/кг, приблизительно 0,475 до приблизительно 1,600 мг/кг, приблизительно 0,475 до приблизительно 1,500 мг/кг, приблизительно 0,475 до приблизительно 1,400 мг/кг, приблизительно 0,475 до приблизительно 1,400 мг/кг, приблизительно 0,475 до приблизительно 1,200 мг/кг, приблизительно 0,475 до приблизительно 1,100 мг/кг, приблизительно 0,475 до приблизительно 1,000 мг/кг, приблизительно 0,475 до приблизительно 0,900 мг/кг, приблизительно 0,475 до приблизительно 0,800 мг/кг, приблизительно 0,475 до приблизительно 0,700 мг/кг, приблизительно 0,475 до приблизительно 0,600 мг/кг, приблизительно 0,475 до приблизительно 0,500 мг/кг, приблизительно 0,875 до приблизительно 1,825 мг/кг, приблизительно 0,875 до приблизительно 1,800 мг/кг, приблизительно 0,875 до приблизительно 1,700 мг/кг, приблизительно 0,875 до приблизительно 1,600 мг/кг, приблизительно 0,875 до приблизительно 1,500 мг/кг, приблизительно 0,875 до приблизительно 1,400 мг/кг, приблизительно 0,875 до приблизительно 1,400 мг/кг, приблизительно 0,875 до приблизительно 1,200 мг/кг, приблизительно 0,875 до приблизительно 1,100 мг/кг, приблизительно 0,875 до приблизительно 1,000 мг/кг, приблизительно 0,875 до приблизительно 0,900 мг/кг, приблизительно 0,900 до приблизительно 1,825 мг/кг, приблизительно 0,900 до приблизительно 1,800 мг/кг, приблизительно 0,900 до приблизительно 1,700 мг/кг, приблизительно 0,900 до приблизительно 1,600 мг/кг, приблизительно 0,900 до приблизительно 1,500 мг/кг, приблизительно 0,900 до приблизительно 1,400 мг/кг, приблизительно 0,900 до приблизительно 1,400 мг/кг, приблизительно 0,900 до приблизительно 1,200 мг/кг, приблизительно 0,900 до приблизительно 1,100 мг/кг, приблизительно 0,900 до приблизительно 1,000 мг/кг, приблизительно 0,925 до приблизительно 1,825 мг/кг, приблизительно 0,925 до приблизительно 1,800 мг/кг, приблизительно 0,925 до приблизительно 1,700 мг/кг, приблизительно 0,925 до приблизительно 1,600 мг/кг, приблизительно 0,925 до приблизительно 1,500 мг/кг, приблизительно 0,925 до приблизительно 1,400 мг/кг, приблизительно 0,925 до приблизительно 1,400 мг/кг, приблизительно 0,925 до приблизительно 1,200 мг/кг, приблизительно 0,925 до приблизительно 1,100 мг/кг или приблизительно 0,925 до приблизительно 1,000 мг/кг. Промежуточные значения и диапазоны вышеизложенных перечисленных значений также предназначены составлять часть этого изобретения, например, средство RNAi можно вводить субъекту в дозе, составляющей приблизительно 0,015 мг/кг до приблизительно 0,45 мг/кг.
Например, средство RNAi, например, средство RNAi в фармацевтической композиции, можно вводить в дозе, составляющей приблизительно 0,2 мг/кг, 0,225 мг/кг, 0,25 мг/кг, 0,275 мг/кг, 0,3 мг/кг, 0,325 мг/кг, 0,35 мг/кг, 0,375 мг/кг, 0,4 мг/кг, 0,425 мг/кг, 0,45 мг/кг, 0,475 мг/кг, приблизительно 0,5 мг/кг, 0,525 мг/кг, 0,55 мг/кг, 0,575 мг/кг, приблизительно 0,6 мг/кг, 0,625 мг/кг, 0,65 мг/кг, 0,675 мг/кг, приблизительно 0,7 мг/кг, 0,725 мг/кг, 0,75 мг/кг, 0,775 мг/кг, приблизительно 0,8 мг/кг, 0,925 мг/кг, 0,95 мг/кг, 0,975 мг/кг, приблизительно 1,0 мг/кг, 1,025 мг/кг, 1,05 мг/кг, 1,075 мг/кг, приблизительно 1,1 мг/кг, 1,125 мг/кг, 1,15 мг/кг, 1,175 мг/кг, приблизительно 1,2 мг/кг, 1,225 мг/кг, 1,25 мг/кг, 1,275 мг/кг, приблизительно 1.3 мг/кг, 1.325 мг/кг, 1.35 мг/кг, 1.375 мг/кг, приблизительно 1,4 мг/кг, 1,425 мг/кг, 1,45 мг/кг, 1,475 мг/кг, приблизительно 1,5 мг/кг, 1,525 мг/кг, 1,55 мг/кг, 1,575 мг/кг, приблизительно 1,6 мг/кг, 1,625 мг/кг, 1,65 мг/кг, 1,675 мг/кг, приблизительно 1,7 мг/кг, 1,725 мг/кг, 1,75 мг/кг, 1,775 мг/кг или приблизительно 1,8 мг/кг. Промежуточные значения вышеизложенных перечисленных значения также предназначены составлять часть этого изобретения.
В некоторых вариантах осуществления фармацевтическая композиция, содержащая средство iRNA, вводят субъекту в виде фиксированной дозы. «Фиксированная доза» (например, доза в мг) означает, что одну дозу средства iRNA используют для всех субъектов независимо от любых специфических связанных с субъектом факторов, таких как масса. В одном конкретном варианте осуществления фиксированная доза, составляющая средство iRNA изобретения, основана на заданной массе или возрасте.
В некоторых вариантах осуществления фармацевтическую композицию, содержащую средство iRNA, вводят в виде фиксированной дозы, составляющей между приблизительно 25 мг и приблизительно 100 мг, например, между приблизительно 25 мг и приблизительно 95 мг, между приблизительно 25 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 85 мг, между приблизительно 25 мг и приблизительно 80 мг, между приблизительно 25 мг и приблизительно 75 мг, между приблизительно 25 мг и приблизительно 70 мг, между приблизительно 25 мг и приблизительно 65 мг, между приблизительно 25 мг и приблизительно 60 мг, между приблизительно 25 мг и приблизительно 50 мг, между приблизительно 50 мг и приблизительно 100 мг, между приблизительно 50 мг и приблизительно 95 мг, между приблизительно 50 мг и приблизительно 90 мг, между приблизительно 50 мг и приблизительно 85 мг, между приблизительно 50 мг и приблизительно 80 мг, между приблизительно 30 мг и приблизительно 100 мг, между приблизительно 30 мг и приблизительно 90 мг, между приблизительно 30 мг и приблизительно 80 мг, между приблизительно 40 мг и приблизительно 100 мг, между приблизительно 40 мг и приблизительно 90 мг, между приблизительно 40 мг и приблизительно 80 мг, между приблизительно 60 мг и приблизительно 100 мг, между приблизительно 60 мг и приблизительно 90 мг, между приблизительно 25 мг и приблизительно 55 мг, между приблизительно 30 мг и приблизительно 95 мг, между приблизительно 30 мг и приблизительно 85 мг, между приблизительно 30 мг и приблизительно 75 мг, между приблизительно 30 мг и приблизительно 65 мг, между приблизительно 30 мг и приблизительно 55 мг, между приблизительно 40 мг и приблизительно 95 мг, между приблизительно 40 мг и приблизительно 85 мг, между приблизительно 40 мг и приблизительно 75 мг, между приблизительно 40 мг и приблизительно 65 мг, между приблизительно 40 мг и приблизительно 55 мг или между приблизительно 45 мг и приблизительно 95 мг.
В некоторых вариантах осуществления фармацевтическую композицию, содержащую средство iRNA, вводят в виде фиксированной дозы, составляющей приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг.
Фармацевтическую композицию, содержащую iRNA, можно вводить субъекту приблизительно один раз в месяц, приблизительно однократно каждые пять недель, приблизительно каждые шесть недель, приблизительно каждые 2 месяца или каждые три месяца.
Фармацевтическую композицию, содержащую средство iRNA, можно вводить субъекту в виде одной или более доз. В некоторых вариантах осуществления фармацевтические композиции, содержащие двухнитевое средство iRNA, можно вводить субъекту в виде месячной дозы, составляющей от приблизительно 0,200 мг/кг до приблизительно 0,250 мг/кг, месячной дозы, составляющей от приблизительно 0,425 мг/кг до приблизительно 0,475 мг/кг, месячной дозы, составляющей от приблизительно 0,875 мг/кг до приблизительно 0,925 мг/кг, или в виде месячной дозы, составляющей от приблизительно 1,775 мг/кг до приблизительно 1,825 мг/кг. В некоторых вариантах осуществления фармацевтические композиции, содержащие двухнитевое средство iRNA, можно вводить субъекту в виде фиксированной дозы от приблизительно 25 мг до приблизительно 100 мг, например, приблизительно 25 мг, приблизительно 50 мг, приблизительно 80 мг или приблизительно 100 мг.
Фармацевтическую композицию можно вводить путем внутривенной инфузии в течение периода времени, например, в течение 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и 21, 22, 23, 24 или приблизительно 25 минутного периода. Введение можно повторять, например, на регулярной основе, например, раз в неделю, раз в две недели (т.е., каждые две недель), ежемесячно, каждые два месяца, каждые три месяца, каждые четыре месяца или дольше. После режима первоначального лечения лечение можно давать на менее частой основе. Например, после введения раз в неделю или раз в две недели в течение трех месяцев, введение можно повторять один раз в месяц, в течение шести месяцев или года или дольше.
Фармацевтическую композицию можно вводить один раз в день, или iRNA можно вводить в виде двух, трех или более субдоз с подходящими интервалами в течение дня или даже с использованием непрерывной инфузии или доставки посредством готовой формы с регулируемым высвобождением. В этом случае iRNA, содержащаяся в каждой субдозе, должна быть соответственно меньше для того, чтобы достигать общей суточной дозировки. Единица дозировки также может быть составлена для доставки в течение нескольких дней, например, с использованием обычной готовой формы с длительным высвобождением, которая обеспечивает длительное высвобождение iRNA в течение периода нескольких дней. Готовые формы с длительным высвобождением хорошо известны в данной области и особенно подходят для доставки средств в конкретный участок, например, их можно использовать со средствами настоящего изобретения. В этом варианте осуществления единица дозировки содержит соответствующее кратное значение суточной дозы.
В других вариантах осуществления разовая доза фармацевтических композиций может иметь длительный эффект, так что последующие дозы вводят не более чем с 1, 2, 3, 4, 5, 6, 7 или 8 недельными интервалами. В некоторых вариантах осуществления изобретения разовую дозу фармацевтических композиций изобретения вводят один раз в месяц.
Специалисту должно быть понятно, что некоторые факторы могут влиять на дозировку и время, необходимые для эффективного лечения субъекта, включая, без ограничения степени тяжести заболевания или расстройства, предшествующее лечение, общее здоровье и/или возраст субъекта и другие имеющиеся заболевания. Кроме того, лечение субъекта терапевтически эффективным количеством композиции может включать единичное лечение или серию лечений. Оценки эффективных дозировок и периодов полувыведения in vivo для отдельных iRNA, охваченных изобретением, можно получить с использованием обычных методик или на основе тестирования in vivo с использованием подходящих животной модели, как описано в другом месте в данном документе.
В развитии генетики мышей создан ряд мышиных моделей для изучения разных человеческих заболеваний, таких как расстройство, сопровождающееся кровоточивостью, которое могло бы быть полезным в результате уменьшения экспрессии Serpinc1. Такие модели можно использовать для тестирования iRNA in vivo, а также для определения терапевтически эффективной дозы. В данной области известны пригодные мышиные модели, которые включают, например, мышиные модели Гемофилии A и мышиные модели Гемофилии B, например, у мышей, содержащих инактивирование гена фатора свертывания крови, такого как ген, описанный у Bolliger, et al. (2010) Thromb Haemost 103:1233-1238, Bi L, et al. (1995) Nat Genet 10: 119-21, Lin et al. (1997) Blood 90: 3962-6, Kundu et al. (1998) Blood 92: 168-74, Wang et al. (1997) Proc Natl Acad Sci U S A 94: 11563-6, and Jin, et al. (2004) Blood 104:1733.
Фармацевтические композиции настоящего изобретения можно вводить множеством способов в зависимости от того, желательно ли местное или системное лечение и от области, подлежащей лечению. Введение может быть местным (например, с помощью трансдермального пластыря), легочным, например, с помощью ингаляции или вдыхания порошков или аэрозолей, в том числе с помощью небулайзера; внутритрахеальным, интраназальным, эпидермальным и трансдермальным, пероральным или парентеральным. Парентеральное введение включает внутривенную, внутреартериальную, подкожную, интраперитонеальную или внутримышечную инъекцию или инфузию; субдермальную, например, посредством имплантированного устройства; или интракраниального, например, путем внутрипаренхимного, интратекального или интравентрикулярного введения.
iRNA можно доставлять способом для выделения конкретной ткани, такой как печень (например, гепатоцитов печени).
Фармацевтические композиции и готовые формы для местного введения могут содержать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Могут быть необходимы или желательны обычные фармацевтические носители, водные, порошковые или масляные основы, загустители и тому подобное. Также можно использовать презервативы, перчатки с нанесенным покрытием и тому подобное. Пригодные местные готовые формы включают готовые формы, в которых iRNA, представленные в изобретении, смешаны со средством местной доставки, таким как липиды, липосомы, жирные кислоты, сложные эфиры жирных кислот, стероиды, комплексообразующие средства и поверхностно-активные вещества. Местные готовые формы подробно описаны в патенте США № 6,747,014, который включен в данный документ посредством ссылки.
Дополнительные Готовые формы
Эмульсии
Композиции настоящего изобретения можно получать и составлять в виде эмульсий. Эмульсии обычно представляют собой гетерогенные системы из одной жидкости, диспергированной в другой в виде капель, обычно превышающих 0,1 мкм в диаметре (см. например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., Volume 1, p. 245; Block in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 2, p. 335; Higuchi et al., in Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 301). Эмульсии часто являются двухфазными системами, содержащими две несмешиваемые жидкие фазы тщательно перемешанные и диспергированные друг с другом. В общем, эмульсии могут представлять собой вариант либо вода-в-масле (w/o) или масло-в-воде (o/w). Когда водную фазу в итоге делят на и диспергируют в виде мельчайших капель в объемную масляную фазу, полученную в результате композицию называют эмульсия вода-в-масле (w/o). В качестве альтернативы, когда масляную фазу в итоге делят на и диспергируют в виде мельчайших капель в объемную водную фазу, полученную в результате композицию называют эмульсия масло-в-воде (o/w). Эмульсии могут содержать дополнительные компоненты в дополнение к диспергированным фазам, и активное лекарственное вещество, которое может присутсвовать в виде раствора в каждой из водной фазы, масляной фазы, либо само по себе в виде отдельной фазы. Также при необходимости в эмульсии могут иметься фармацевтические эксципиенты, такие как эмульгаторы, стабилизаторы, красители и антиоксиданты. Фармацевтическими эмульсиями также могут быть многочисленные эмульсии, которые состоят из более чем двух фаз, как, например, в случае эмульсии масло-в-воде-в-масле (o/w/o) и вода-в-масле-в-воде (w/o/w). Такие комплексные готовые формы часто обеспечивают некоторые преимущества, которые не обеспечивают простые двойные эмульсии. Многочисленные эмульсии, в которых отдельные масляные капли o/w эмульсии окружают небольшие водные капли, составляют эмульсию w/o/w. Также система масляных капель, заключенных в глобулы воды, стабилизированной в масляной непрерывной фазе, обеспечивает эмульсию o/w/o.
Эмульсии характеризуются небольшой термодинамической стабильностью или ее отсутствием. Часто, диспергированная или несплошная фаза эмульсии хорошо диспергируется во внешнюю или непрерывную фазу и сохраняется в таком виде через среднее значение эмульгаторов или вязкость готовой формы. Любая из фаз эмульсии может быть полутвердой или твердой, как в случае основ для мазей в виде эмульсии и кремов. Другое средство стабилизации эмульсии влечет за собой применение эмульгаторов, которые можно встраивать в каждую фазу эмульсии. Эмульгаторы можно широко классифицировать на четыре категории: синтетические поверхностно-активные вещества, эмульгаторы природного происхождения, абсорбирующие основания и тонко диспергированные твердые вещества (см. например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Синтетические поверхностно-активные вещества, также известные как поверхностно-активные средства, выявили широкую применимость в составлении эмульсий и были рассмотрены в литературе (см. например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rieger, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), Marcel Dekker, Inc., New York, N.Y., 1988, volume 1, p. 199). Поверхностно-активные вещества обычно являются амфифильными и содержат гидрофильную и гидрофобную часть. Отношение гидрофильной к гидрофобной сущности поверхностно-активного вещества назвали гидрофильный/липофильный баланс (HLB), и оно представляет собой ценный инструмент для категоризации и отбора поверхностно-активных веществ при получении готовых форм. Поверхностно-активные вещества можно классифицировать на разные классы на основании природы гидрофильной группы: неионные, анионные, катионные и амфотерные (см. например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY Rieger, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285).
Эмульгаторы природного происхождения, используемые в готовых формах эмульсий, включают ланолин, пчелиный воск, фосфатиды, лецитин и акацию. Абсорбирующие основания обладают гидрофильными свойствами, так что они могут впитывать воду с образованием эмульсий w/o, сохраняя также свою полутвердую консистенцию, например безводный ланолин и гидрофильный вазелин. Мелко разделенные твердые вещества также используют в качестве хороших эмульгаторов особенно в комбинации с поверхностно-активными веществами и в вязких препаратах. Они содержат полярные неорганические твердые вещества, такие как гидроксиды тяжелых металлов, ненабухающие глины, такие как бентонит, аттапульгит, гекторит, каолин, монтморрилонит, коллоидный силикат алюминия и коллоидный алюмосиликат магния, пигменты и неполярные твердые вещества, такие как углерод или глицерилтристеарат.
большое множество неэмульгирующих материалов также включены в готовые формы эмульсии и вносят вклад в свойства эмульсий. Они включают жиры, масла, воски, жирные кислоты, жирные спирты, жирные сложные эфиры, увлажнители, гидрофильные коллоиды, консерванты и антиоксиданты (Block, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Гидрофильные коллоиды или гидроколлоиды включают камеди природного происхождения и синтетические полимеры, такие как полисахариды (например, акация, агар, альгиновая кислота, каррагенан, гуаровая камедь, камедь карайи и трагакант), производные целлюлозы (например, карбоксиметилцеллюлозу и карбоксипропилцеллюлозу) и синтетическую полимеры (например, карбополы, эфиры целлюлозы и карбоксивиниловые полимеры). Они диспергируют или набухают в воде с образованием коллоидных растворов, которые стабилизируют эмульсии путем образования прочных пленок на поверхности раздела вокруг капель диспергированной фазы и путем повышения вязкости внешней фазы.
Поскольку эмульсии часто содержат ряд таких ингредиентов, как углеводы, белки, стеролы и фосфатиды, которые могут легко поддерживать рост микробов, эти готовые формы часто содержат консерванты. Обычно используемые консерванты, содержащиеся в готовых формах эмульсии, содержат метилпарабен, пропилпарабен, соли четвертичного аммония, бензалкония хлорид, сложные эфиры p-оксибензойной кислоты и борная кислота. Для предотвращения ухудшения готовой формы в готовые формы эмульсии также обычно добавляют антиоксиданты. Используемыми антиоксидантами могут быть поглотители свободных радикалов, такие как токоферолы, алкилгаллаты, бутилированный гидроксианизол, бутилированный гидрокситолуен или восстанавливающие средства, такие как аскорбиновая кислота и натрия метабисульфит, и антиоксидантные синергисты, такие как лимонная кислота, винная кислота и лецитин.
Нанесение готовых форм эмульсии посредством дерматологических, пероральных и парентеральных путей и способы их получения было рассмотрено в литературе (см. например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Готовые формы эмульсии для пероральной доставки очень широко используют по причине легкого состава, а также с точки зрения эффективности абсорбции и биодоступности (см. например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Среди материалов, которые обычно вводят перорально в виде эмульсий o/w, находятся слабительные на масляно-минеральной основе, маслорастворимые витамины и высокожирные питательные препараты.
ii. Микроэмульсии
В одном варианте осуществления настоящего изобретения композиции iRNA и нуклеиновые кислоты получают в виде готовых форм микроэмульсий. Микроэмульсию можно определить как систему воды, масла и амфифильного вещества, которое представляет собой единый оптически изотропный и термодинамически устойчивый жидкий раствор (см. например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245). Обычно микроэмульсии представляют собой системы, которые получают путем диспергирования сперва масла в водном поверхностно-активном растворе, а затем добавления достаточного количества четвертого компонента, как правило спирта с цепью с промежуточной длиной с образованием прозрачной системы. Вследствие этого, микроэмульсии также описаны как термодинамически устойчивые, изотропно чистые дисперсии двух несмешиваемых жидкостей, которые стабилизируют путем пленок на поверхности раздела поверхность-активных молекул (Leung and Shah, in: Controlled Release of Drugs: Polymers and Aggregate Systems, Rosoff, M., Ed., 1989, VCH Publishers, New York, pages 185-215). Микроэмульсии обычно получают посредством комбинации от трех до пяти компонентов, которые содержат масло, воду, поверхностно-активное вещество, вспомогательное поверхностно-активное вещество и электролит. Относится ли микроэмульсия к типу вода-в-масле (w/o) или масло-в-воде (o/w) зависит от свойств используемого масла и поверхностно-активного вещества и от структурной и геометрической упаковки полярных головок и углеводородных хвостов поверхностно-активных молекул (Schott, in Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 271).
Широко изучали феноменологический подход с использованием фазовых диаграмм, и он дал специалисту в данной области всесторонние знания, как составить микроэмульсии (см. например, Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Block, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335). По сравнению с обычными эмульсиями микроэмульсии предлагают преимущество солюбилизации нерастворимых в воде лекарственных веществ в составе термодинамически устойчивых капель, которые спонтанно образуются.
Поверхностно-активные вещества, используемые при получении микроэмульсии, включают, без ограничения, ионные поверхностно-активные вещества, неионные поверхностно-активные вещества, Brij 96, полиоксиэтилен олеил эфиры, сложные эфиры полиглицерина и жирных кислот, тетраглицерин монолаурат (ML310), тетраглицерин моноолеат (MO310), гексаглицерин моноолеат (PO310), гексаглицерин пентаолеат (PO500), декаглицерин монокапрат (MCA750), декаглицерин моноолеат (MO750), декаглицерин секвиолеат (SO750), декаглицерин декаолеат (DAO750), отдельно или в комбинации со вспомогательными поверхностно-активными веществами. Вспомогательные поверхностно-активные вещества, обычно спирт с короткой цепью, такой как этанол, 1-пропанол и 1-бутанол, служат для увеличения межфазной текучести за счет проникновения в пленку поверхностно-активного вещества и следовательно создания неупорядоченной пленки по причине ппустого пространства, получающегося между молекулами поверхностно-активного вещества. Однако, микроэмульсии можно получать без применения вспомогательных поверхностно-активных веществ и не содержащих спирта самоэмульгирующихся микроэмульсионных систем, известных в данной области. Обычно водной фазой может быть, но без ограничения, вода, водный раствор лекарственного вещества, глицерин, PEG300, PEG400, полиглицерины, пропиленгликоли и производные этиленгликоля. Масляная фаза может содержать, но без ограничения такие материалы как Captex 300, Captex 355, Capmul MCM, сложные эфиры жирных кислот, (C8-C12) моно, ди и триглицериды со средней цепью, полиоксиэтилированные сложные эфиры глицерина и жирных кислот, жирные спирты, полигликозилированные глицериды, насыщенные полигликозилированные C8-C10 глицериды, растительные масла и силиконовое масло.
Микроэмульсии представляют особенный интерес с точки зрения солюбилизации лекарственных веществ и улучшенной абсорбции лекарственных веществ. Микроэмульсии на основе липидов (и o/w и w/o) были предложены для повышения пероральной биодоступности лекарственных веществ, содержащих пептиды (см. например, патент США № 6,191,105; 7,063,860; 7,070,802; 7,157,099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385-1390; Ritschel, Meth. Find. Exp. Clin. Pharmacol., 1993, 13, 205). Микроэмульсии обеспечивают преимущества улучшенной солюбилизации лекарственных веществ, защиты лекарственных веществ от ферментного гидролиза, возможного усиления абсорбции лекарственных веществ вследствие вызванных поверхностно-активным веществом изменений текучести и проницаемости мембраны, легкости получения, легкости перорального введения по сравнению с твердыми лекарственными формами, улучшенной клинической эффективности и уменьшенной токсичности (см. например, патент США № 6,191,105; 7,063,860; 7,070,802; 7,157,099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385; Ho et al., J. Pharm. Sci., 1996, 85, 138-143). Часто микроэмульсии могут образовываться спонтанно, когда их компоненты сводят вместе при внешней температуре. Это может быть особенно предпочтительно при составлении термолабильных лекарственных веществ, пептидов или iRNA. Микроэмульсии также являются эффективными в трансдермальной доставке активных компонентов как в косметических, так и в фармацевтических вариантах применения. Ожидается, что микроэмульсионные композиции и готовые формы настоящего изобретения облегчат повышенную системную абсорбцию iRNA и нуклеиновых кислот из желудочно-кишечного тракта, а также улучшат локальное клеточное поглощение iRNA и нуклеиновых кислот.
Микроэмульсии настоящего изобретения также могут содержать дополнительные компоненты и добавки, такие как сорбитанмоностеарат (Grill 3), Labrasol, и усилители проникновения для улучшения свойств готовой формы и повышения абсорбции iRNA и нуклеиновых кислот настоящего изобретения. Усилители проникновения, используемые в микроэмульсиях настоящего изобретения, можно классифицировать как относящиеся к одной из пяти больших категорий--поверхностно-активные вещества, жирные кислоты, желчные соли, комплексообразующие средства и некомплексообразующие неповерхностно-активные вещества (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p. 92). Каждый из этих классов обсуждался выше.
iii. Микрочастицы
Средство RNAi изобретения можно встраивать в частицу, например, микрочастицу. Микрочастицы можно получать путем сушки распылением, но также можно получать другими способами, включая лиофилизацию, испарение, сушку в псевдосжиженном слое, вакуумную сушку или комбинацию этих методик.
iv. Усилители проникновения
В одном варианте осуществления в настоящем изобретении используют разные усилители проникновения для осуществления эффективной доставки нуклеиновых кислот, особенно iRNA, в кожу животных. Большая часть лекарственных веществ присутствует в растворе как в ионизированной, так и в неионизированной формах. Однако, обычно только жирорастворимые или липофильные лекарственные вещества легко пересекают клеточные мембраны. Было обнаружено, что даже нелипофильные лекарственные вещества могут пересекать клеточные мембраны, если мембрану, подлежащую пересечению, обрабатывают усилителем проникновения. В дополнение к содействию диффузии нелипофильных лекарственных веществ через клеточные мембраны, усилители проникновения также усиливают проницаемость липофильных лекарственных веществ.
Усилители проникновения можно классифицировать, как относящиеся к одной из пяти широких категорий, т.е., поверхностно-активные вещества, жирные кислоты, желчная соли, комплексообразующие средства и некомплексообразующие неповерхностно-активные вещества (см. например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92). Каждый из приведенных выше классов усилителей проникновения описан ниже более подробно.
Поверхностно-активные вещества (или «поверхностно-активные средства») представляют собой химические объекты, которые при растворении в водном растворе уменьшают поверхностное натяжение раствора или межфазное натяжение между водным раствором и другой жидкостью с улучшением в результате абсорбции iRNA через слизистую оболочку. В дополнение к желчным солям и жирным кислотам эти усилители проникновения содержат, например, лаурилсульфат натрия, полиоксиэтилен-9-лауриловый эфир и полиоксиэтилен-20-цетиловый эфир) (см. например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92); и перфторированные эмульсии, такие как FC-43. Takahashi et al., J. Pharm. Pharmacol., 1988, 40, 252).
Разные жирные кислоты и их производные, которые выступают в качестве усилителей проникновения, включают, например, олеиновую кислоту, лауриновую кислоту, каприновую кислоту (n-декановую кислоту), миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин (1-моноолеоил-rac-глицерин), дилаурин, каприловую кислоту, арахидоновую кислоту, глицерин 1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитины, ацилхлорины, их C1-20 алкиловые сложные эфиры (например, метил, изопропил и t-бутил) и их моно- и ди-глицериды (т.е., олеат, лаурат, капрат, миристат, пальмитат, стеарат, линолеат и т.д.) (см. например, Touitou, E., et al. Enhancement in Drug Delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; El Hariri et al., J. Pharm. Pharmacol., 1992, 44, 651-654).
Физиологическая роль желчи включает облегчение дисперсии и абсорбции липидов и жирорастворимых витаминов (см. например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Brunton, Chapter 38 in: Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9th Ed., Hardman et al. Eds., McGraw-Hill, New York, 1996, pp. 934-935). Разные натуральные желчные соли и их синтетические производные выступают в качестве усилителей проникновения. Таким образом термин «желчные соли» включает любой из компонентов желчи природного происхождения, а также любое из их синтетических производных. Пригодные желчные соли включают, например, холевую кислоту (или ее фармацевтически приемлемую натриевую соль, натрия холат), дегидрохолевую кислоту (натрия дегидрохолат), дезоксихолевую кислоту (натрия дезоксихолат), глюхолевую кислоту (натрия глюхолат), глихолевую кислоту (натрия гликохолат), гликодезоксихолевую кислоту (натрия гликодезоксихолат), таурохолевую кислоту (натрия таурохолат), тауродезоксихолевую кислоту (натрия тауродезоксихолат), хенодезоксихолевую кислоту (натрия хенодезоксихолат), урсодезоксихолевую кислоту (UDCA), натрия тауро-24,25-дигидро-фузидат (STDHF), натрия гликодигидрофузидат и полиоксиэтилен-9-лауриловый эфир (POE) (см. например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Swinyard, Chapter 39 In: Remington's Pharmaceutical Sciences, 18th Ed., Gennaro, ed., Mack Publishing Co., Easton, Pa., 1990, pages 782-783; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Yamamoto et al., J. Pharm. Exp. Ther., 1992, 263, 25; Yamashita et al., J. Pharm. Sci., 1990, 79, 579-583).
Комплексообразующие средства в рамках настоящего изобретения можно определить, как соединения, которые удаляют ионы металла из раствора за счет образования с ними комплексов, в результате чего улучшается абсорбция iRNA через слизистую оболочку. Что касается их применения в настоящем изобретении в качестве усилителей проникновения, комплексообразующие средства добавляют преимущество, выступая также в качестве ингибиторов ДНКазы, поскольку большинству охарактеризованных ДНК нуклеаз для катализа требуется ион двухвалентного металла, и они таким образом ингибируются комплексообразующими средствами (Jarrett, J. Chromatogr., 1993, 618, 315-339). Пригодные комплексообразующие средства включают без ограничения динатрия этилендиаминтетраацетат (EDTA), лимонную кислоту, салицилаты (например, натрия салицилат, 5-метоксисалицилат и гомовалинат), N-ациловые производные коллагена, лаурет-9 и N-аминоациловые производные бетадикетонов (енаминов) (см. например, Katdare, A. et al., Excipient development for pharmaceutical, biotechnology, and drug delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Buur et al., J. Control Rel., 1990, 14, 43-51).
В рамках изобретения некомплексообразующие неповерхностно-активные усиливающие проникновение соединения можно определить, как соединения, которые демонстрируют незначительную активность в качестве комплексообразующих средств или в качестве поверхностно-активных веществ, но которые тем не менее усиливают абсорбцию iRNA через алиментарную слизистую оболочку (см. например, Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33). Этот класс усилителей проникновения включает, например, ненасыщенные циклические мочевины, 1-алкил- и 1-алкенилазацикло-алконовые производные (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92); и нестероидные противовоспалительные средства, такие как диклофенак натрия, индометацин и фенилбутазон (Yamashita et al., J. Pharm. Pharmacol., 1987, 39, 621-626).
В фармацевтические и другие композиции настоящего изобретения также можно добавлять средства, которые усиливают поглощение iRNA на клеточном уровне,. Например, для повышения клеточного поглощения двухцепочечных РНК также известны катионные липиды, такие как липофектин (Junichi et al, патент США № 5,705,188), производные катионного глицерина и поликатионные молекулы, такие как полилизин (Lollo et al., заявка PCT WO 97/30731). Примеры коммерчески доступных реагентов для трансфекции среди прочего включают, например Lipofectamine™ (Invitrogen; Carlsbad, CA), Lipofectamine 2000™ (Invitrogen; Carlsbad, CA), 293fectin™ (Invitrogen; Carlsbad, CA), Cellfectin™ (Invitrogen; Carlsbad, CA), DMRIE-C™ (Invitrogen; Carlsbad, CA), FreeStyle™ MAX (Invitrogen; Carlsbad, CA), Lipofectamine™ 2000 CD (Invitrogen; Carlsbad, CA), Lipofectamine™ (Invitrogen; Carlsbad, CA), RNAiMAX (Invitrogen; Carlsbad, CA), Oligofectamine™ (Invitrogen; Carlsbad, CA), Optifect™ (Invitrogen; Carlsbad, CA), X-tremeGENE Q2 Transfection Reagent (Roche; Grenzacherstrasse, Switzerland), DOTAP Liposomal Transfection Reagent (Grenzacherstrasse, Switzerland), DOSPER Liposomal Transfection Reagent (Grenzacherstrasse, Switzerland), or Fugene (Grenzacherstrasse, Switzerland), Transfectam® Reagent (Promega; Madison, WI), TransFast™ Transfection Reagent (Promega; Madison, WI), Tfx™-20 Reagent (Promega; Madison, WI), Tfx™-50 Reagent (Promega; Madison, WI), DreamFect™ (OZ Biosciences; Marseille, France), EcoTransfect (OZ Biosciences; Marseille, France), TransPassª D1 Transfection Reagent (New England Biolabs; Ipswich, MA, USA), LyoVec™/LipoGen™ (Invitrogen; San Diego, CA, USA), PerFectin Transfection Reagent (Genlantis; San Diego, CA, USA), NeuroPORTER Transfection Reagent (Genlantis; San Diego, CA, USA), GenePORTER Transfection reagent (Genlantis; San Diego, CA, USA), GenePORTER 2 Transfection reagent (Genlantis; San Diego, CA, USA), Cytofectin Transfection Reagent (Genlantis; San Diego, CA, USA), BaculoPORTER Transfection Reagent (Genlantis; San Diego, CA, USA), TroganPORTER™ transfection Reagent (Genlantis; San Diego, CA, USA ), RiboFect (Bioline; Taunton, MA, USA), PlasFect (Bioline; Taunton, MA, USA), UniFECTOR (B-Bridge International; Mountain View, CA, USA), SureFECTOR (B-Bridge International; Mountain View, CA, USA), или HiFect™ (B-Bridge International, Mountain View, CA, USA).
Для повышения проникновения введенных нуклеиновых кислот можно использовать другие средства, включая гликоли, такие как этиленгликоль и пропиленгликоль, пирролы, такие как 2-пиррол, азоны и терпены, такие как лимонен и ментон.
v. Носители
Некоторые композиции настоящего изобретения также содержат в готовой форме соединения-носители. В рамках изобретения «соединение-носитель» или «носитель» может относиться к нуклеиновой кислоте или его аналогу, являющемуся инертным (т.е., сам по себе не обладает биологической активностью), но распознается в качестве нуклеиновой кислоты с помощью способов in vivo, которые уменьшают биодоступность нуклеиновой кислоты, имеющей биологическую активность, например, за счет разрушения биологически активной нуклеиновой кислоты или содействия ее удалению из кровотока. Совместное введение нуклеиновой кислоты и соединения-носителя, обычно с избытком последнего вещества, может приводить к существенному уменьшению количества нуклеиновой кислоты, восстанавливаемой в печене, почке или в других дополнительных резервуарах кровотока, предположительно вследствие конкуренции между соединением-носителем и нуклеиновой кислотой за общий рецептор. Например, извлечение частично тиофосфатной двухцепочечной РНК в ткани печени можно уменьшить, когда ее вводят совместно с полиинозиновой кислотой, декстрана сульфатом, полицитидиловой кислотой или 4-ацетамидо-4'изотиоциано-стильбен-2,2'-дисульфоновой кислотой (Miyao et al., DsRNA Res. Dev., 1995, 5, 115-121; Takakura et al., DsRNA & Nucl. Acid Drug Dev., 1996, 6, 177-183.
Эксципиенты
В отличие от соединения-носителя «фармацевтический носитель» или «эксципиент» представляет собой фармацевтически приемлемый растворитель, суспендирующее средство или любой другой фармакологически инертный наполнитель для доставки животному одной или более нуклеиновых кислот. Эксципиент может быть жидкий или твердый, и его выбирают с учетом планируемого способа введения таким образом, чтобы обеспечить требуемый объем, консистенцию и т.д. При комбинировании с нуклеиновой кислотой и другими компонентами заданной фармацевтической композиции. Типичные фармацевтические носители включают, без ограничения, связывающие средства (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу и т.д.); наполнители (например, лактозу и другие сахара, микрокристаллическую целлюлозу, пектин, желатин, кальция сульфат, этилцеллюлозу, полиакрилаты или дикальций фосфат и т.д.); любриканты (например, магния стеарат, тальк, кремнезем, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрогенированные растительные масла, кукурузный крахмал, полиэтиленгликоли, натрия бензоат, натрия ацетат и т.д.); разрыхлители (например, крахмал, натрия крахмал гликолят и т.д.); и смачивающие средства (например, натрия лаурил сульфат, и т.д.).
Для составления композиций настоящего изобретения также можно использовать фармацевтически приемлемые органические или неорганические эксципиенты, пригодные для непарентерального введения, которые не реагируют пагубно с нуклеиновыми кислотами. Пригодные фармацевтически приемлемые носители включают, без ограничения, воду, солевые растворы, спирты, полиэтиленгликоли, желатин, лактозу, амилоза, магний стеарат, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Готовые формы для местного введения нуклеиновых кислот могут содержать стерильные и нестерильные водные растворы, неводные растворы в обычных растворителях, таких как спирты, или растворы нуклеиновых кислот в жидких или твердых масляных основаниях. Растворы также могут содержать буферы, растворители и другие пригодные добавки. Можно использовать фармацевтически приемлемые органические или неорганические эксципиенты, пригодные для непарентерального введения, которые не реагируют пагубно с нуклеиновыми кислотами.
Пригодные фармацевтически приемлемые эксципиенты включают, без ограничения воду, солевые растворы, спирт, полиэтиленгликоли, желатин, лактозу, амилозу, магния стеарат, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Другие Компоненты
Композиции настоящего изобретения могут дополнительно содержать другие дополнительные компоненты, обычно находящиеся в фармацевтических композициях при их утвердившихся в данной области уровнях использования. Таким образом, например, композиции могут содержать дополнительные совместимые, фармацевтически активные материалы, такие как, например, противозудные средства, вяжущие средства, локальные анестетические средства или противовоспалительные средства, или могут содержать дополнительные материалы, используемые в физически составляемых разных лекарственных формах композиций настоящего изобретения, такие как красители, ароматизирующие средства, консерванты, антиоксиданты, придающие непрозрачность средства, загущающие средства и стабилизаторы. Однако, такие материалы при добавлении не должны чрезмерно мешать биологической активности компонентов композиции настоящего изобретения. Готовые формы можно стерилизовать и при необходимости смешивать со вспомогательными средствами, например, любрикантами, консервантами, стабилизаторами, смачивающими средствами, эмульгаторами, солями для влияния на осмотическое давление, буферами, красителями, вкусовыми и/или ароматическими веществами и тому подобное, которые не взаимодействуют пагубно с нуклеиновой кислотой (кислотами) готовой формы.
Водные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, включая, например, натрия карбоксиметилцеллюлозу, сорбитол и/или декстран. Суспензия также может содержать стабилизаторы.
В некоторых вариантах осуществления фармацевтические композиции, представленные в изобретении, содержат (a) одно или более iRNA соединений и (b) одно или более средств, которые не функционируют по механизму RNAi и которые используют при лечении гемолитического расстройства. Примеры таких средств включают, но без ограничения противовоспалительное средство, средство против ожирения, противовирусное и/или противофиброзное средство. Кроме того, в сочетании с iRNA согласно настоящему изобретению также можно использовать другие вещества, обычно используемые для защиты печени, такие как силимарин. Другие средства, используемые для лечения заболеваний печени, включают телбивуден, энтекавир и ингибиторы протеаз, такие как телапревир и другие, раскрытые, например, у Tung et al., публикация заявки США № 2005/0148548, 2004/0167116, и 2003/0144217; и у Hale et al., публикация заявки США № 2004/0127488.
Токсичность и терапевтическую эффективность таких соединений можно определить с помощью стандартных фармацевтических методик в культурах клеток или экспериментальных животных, например, для определения LD50 (летальной дозы для 50% популяции) и ED50 (терапевтически эффективной дозы в 50% популяции). Соотношение дозы между токсическим и терапевтическим действиями является терапевтическим индексом, и его можно выразить, как отношение LD50/ED50. Предпочтительные являются соединения, которые демонстрируют высокие терапевтические индексы.
Данные, полученные из анализов культуры клеток и исследований животных, можно использовать при составлении диапазона дозировки для применения у людей. Дозировка композиций изобретения, приведенных в данном документе, как правило находится в пределах диапазона концентраций в кровотоке, которые содержат ED50 с небольшой токсичностью или без нее. Дозировки могут варьировать в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения, используемого в способах, представленных в изобретении, терапевтически эффективную дозу можно оценить первоначально из анализов культуры клеток. В животных моделях дозу можно составить для достижения диапазона концентрации в плазме кровотока соединения или при необходимости полипептидного продукта целевой последовательности (например, для достижения пониженной концентрации полипептида), которая включает ISERPINC10 (т.е., концентрацию тестируемого соединения, которая достигает половины максимального подавления симптомов), которую определяют в культуре клеток. Такую информацию можно использовать для более точного определения используемых доз у людей. Уровни в плазме можно измерить, например, с помощью высокоэффективной жидкостной хроматографии.
В дополнение к их введению, как обсуждалось выше, iRNA, представленные в изобретении, можно вводить в комбинации с другими известными средствами, эффективными при лечении патологических процессов, опосредованных экспрессией Serpinc1. В любом случае лечащий врач может регулировать количество и время введения iRNA на основе результатов, наблюдаемых с использованием стандартных мер эффективности, известные в данной области или в рамках изобретения.
VI. Наборы
В настоящем изобретении также предоставлены наборы для проведения любого из способов изобретения. Такие наборы содержат одно или более средство (средства) RNAi и инструкции для применения, например, инструкции для введения профилактически или терапевтически эффективного количества средства (средств) RNAi. Наборы необязательно могут дополнительно содержать средство введения средства RNAi (например, инъекционное устройство), или средство для измерения ингибирования Serpinc1 (например, средство для измерения ингибирования мРНК Serpinc1, белка Serpinc1 и/или активности Serpinc1). Такое средство для измерения ингибирования Serpinc1 может содержать средство для получения пробы субъекта, такой как, например, проба плазмы. Наборы изобретения необязательно могут дополнительно содержать средство определения терапевтически эффективного или профилактически эффективного количества.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют такое значение, которое обычно понятно рядовому специалисту в области, к которой относится это изобретение. Ниже описаны пригодные способы и материалы, хотя для реализации на практике или тестировании iRNA и способов представленных в изобретении, можно использовать способы и материалы, аналогичные или эквивалентные способам и материалам в рамках изобретения. Все публикации, патентные заявки, патенты и другие ссылки, упоминаемые в данном документе, включены посредством ссылки во всей полноте. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
ПРИМЕРЫ
Таблица 1: Сокращения мономеров нуклеотидов, используемых в представлении последовательности нуклеиновых кислот. Должно быть понятно, что эти мономеры, когда имеются в олигонуклеотиде, взаимно связаны с помощью 5'-3'-сложных фосфодиэфирных связей.
Пример 1: Введение разовой дозы AD-57213 здоровым субъектам-людям
Двадцати четырем здоровым добровольцам-людям в когортах 3:1 (активное вещество:плацебо) вводили разовую дозу, равную 0,03 мг/кг, 0,1 мг/кг, 0,3 мг/кг, 0,6 мг/кг или 1,0 мг/кг AD-57213 (Смысловая (5'-3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO:13); Антисмысловая (5'-3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)). Пробы плазмы собирали на 0, 1, 2, 3, 7, 10, 14, 21, 28, 42, 56 и 70 день после введения для мониторинга уровней белка AT, активности AT и продолжительности сайленсинга белка AT. уровни белка AT отслеживали с использованием ELISA, и уровни активности AT отслеживали путем создания кривых генерирования тромбина с использованием калибровочного автоматического тромбиноскопа (тканевый фактор=1 пМ). Кратность изменения пикового тромбина расчитывали относительно значения среднего пикового тромбина для двух значений для каждого субъекта перед применением дозы.
Серьезные побочные явления не наблюдались, 3 легкие побочные явления вероятно не были связаны с введением средства, и 1 легкое побочное явление (головная боль) было потенциально связано с введением средства. Также не было реакций в месте инъекции, и физические наблюдения, показатели жизнедеятельности и электрокардиограммы всех субъектов были внутри нормальных границ. Кроме того, все тесты функции печени, уровни общего билирубина, международное нормализованное отношение протромбинового времени (PT/INR), количество тромбоцитов, уровни гемоглобина и коагуляционные пробы (т.е., активированное частичное тромбопластиновое время (APTT), протромбиновое время (PT), уровни фибриногенов и уровни D-димера фибрина) всех субъектов не изменялись в ходе исследования и были внутри нормальных границ.
Фиг. 1A-D и 2A-B показывают, что разовая доза 0,03 мг/кг AD-57213 приводит к приблизительно 20% и до 33% уменьшению уровней белка AT (Фиг. 2A и 2B) и соответствующему уменьшению активности AT (Фиг. 1A-D) со стойкостью снижения больше, чем 60 дней.
Фиг. 3 дополнительно показал, что имеется существенная связь между нокаутом АТ и выработкой пикового тромбина. Конкретно, наблюдали до 152% повышения пиковой выработки тромбина со средним максимальным увеличением пикового тромбина 138% ± 8,9% (среднее ± SEM). Кроме того и в соответствии с повышенной выработкой тромбина с повышенным нокаутом АТ, уровни фактора VIII или IX были нормальные.
Пример 2: Введение Множественных Доз AD-57213 пациентам-людям, имеющим Гемофилию A или B
Клинические испытания Фаза I - Части B, C и D
В Части B Фазы I клинического испытания AD-57213 (Смысловая (5'-3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO:13); Антисмысловая (5'-3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)), трем пациентам, имеющим Гемофилию A (n=2) или B (n=1), подкожно вводили AD-57213 0,015 мг/кг раз в неделю в течение трех недель (15 микрограмм/кг qw x 3; 15 мкг/кг); шести пациентам, имеющим Гемофилию A, подкожно вводили AD-57213 0,045 мг/кг раз в неделю в течение трех недель (45 микрограмм/кг qw × 3; 45 мкг/кг); и трем пациентам, имеющим Гемофилию A (n=2) или B (n=1), подкожно вводили AD-57213 0,075 мг/кг раз в неделю в течение трех недель (75 микрограмм/кг qw × 3; 75 мкг/кг).
В части C Фазы I клинического испытания AD-57213 (Смысловой (5'-3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO:13); Антисмысловой (5'-3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)), трем пациентам, имеющим Гемофилию A (n=2) или B (n=1), подкожно вводили AD-57213 ежемесячно в дозе 0,225 мг/кг в течение трех месяцев (225 микрограмм/кг qm x 3; 225 мкг/кг); трем пациентам, имеющим Гемофилию A (n=2) или B (n=1), подкожно вводили AD-57213 ежемесячно в дозе 0,450 мг/кг в течение трех месяцев (450 микрограмм/кг qm x 3; 450 мкг/кг); трем пациентам, имеющим Гемофилию A, подкожно вводили AD-57213 ежемесячно в дозе 0,900 мг/кг в течение трех месяцев (900 микрограмм/кг qm x 3; 900 мкг/кг); трем пациентам, имеющим Гемофилию A, подкожно вводили AD-57213 ежемесячно в дозе 1,800 мг/кг в течение трех месяцев (1800 микрограмм/кг qm x 3; 1800 мкг/кг); и шести пациентам, имеющим Гемофилию A (n=3) или B (n=3), подкожно вводили ежемесячно фиксированную дозу 80 мг AD-57213 в течение трех месяцев (80 мг qM × 3).
В части D фазы I клинического испытания AD-57213 (Смысловой (5'-3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO:13); Антисмысловой (5'-3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)), шести пациентам с ингибиторами, имеющим Гемофилию A (n=5) или B (n=1), и используя средства обходного действия (BPA) для управления кровотечением подкожно вводили фиксированную дозу, составляющую 50 мг AD-57213, ежемесячно в течение трех месяцев (50 мг qM x 3); и 10 пациентам, имеющим Гемофилию A, и используя средства обходного действия (BPA) для управления кровотечением подкожно вводили фиксированную дозу, составляющую 80 мг AD-57213 ежемесячно в течение трех месяцев (80 мг qM × 3).
Пробы плазмы собирали после введения AD-57213 для мониторинга уровней белка AT, активности AT и продолжительности сайленсинга белка AT. Уровни белка AT отслеживали с использованием ELISA, и уровни активности AT отслеживали путем создания кривых выработки тромбина с использованием калибровочного автоматического тромбиноскопа (тканевый фактор = 1 пМ). Кратность изменения пикового тромбина расчитывали относительно значения среднего пикового тромбина для двух значений для каждого субъекта перед применением дозы.
В Таблице 2 предоставлены демографические и базовые характеристики пациентов, участвующих в частях B, C и D исследования.
Таблица 2. Демографические и базовые характеристики исследуемых участников
Для частей B, C и D исследования не было серьезных побочных явлений, не было досрочных завершений, не было реакций в месте инъекции, и физические обследования, показатели жизнедеятельности и электрокардиограммы всех пациентов были внутри нормальных границ. Кроме того, все тесты функции печени и полный анализ крови всех пациентов не изменились в ходе исследования и были внутри нормальных границ. Также в ходе этого исследования ни у одного из пациентов не было тромбоэмболических явлений и не было клинически значимых увеличений уровня D-димера фибрина. Любыми явлениями кровотечения успешно управляли с помощью стандартного заместительного фактора или введения средства обходного действия. Более того, не было случаев образования антител против лекарственного вещества (ADA).
Нокаут уровней AT в когортах 15 мкг/кг, 45 мкг/кг и 75 мкг /кг, показанное как средний нокаут АТ по сравнению с исходным уровнем, показан на фиг. 4. Фиг. 4 показал, что еженедельные дозы 0,015 мг/кг в течение трех недель AD-57213 приводят к среднему максимальному нокауту АТ, равному 29% ± 12% (среднее ± SEM). Максимальный нокаут АТ был до 53%. Фиг. 4 также показал, что еженедельные дозы 0,045 мг/кг AD-57213 в течение трех недель приводят к среднему максимальному нокауту АТ 55 ± 9% (среднее ± SEM) и максимальному нокауту АТ 86%. Кроме того, Фиг. 4 также показал, что еженедельные дозы 0,075 мг/кг в течение трех недель AD-57213 приводят среднему максимальному нокауту АТ 61 ± 8% (среднее ± SEM) и максимальному нокауту АТ 74%.
Нокаут уровней AT в когортах 225 мкг/кг, 450 мкг/кг, 900 мкг/кг, 1800 мкг/кг и 80 мг, показанный в виде среднего нокаута АТ по сравнению с исходным уровнем, показан на фиг. 5A. Фиг. 5A показал, что ежемесячные дозы 0,225 мг/кг в течение трех месяцев AD-57213 приводят к среднему максимальному нокауту АТ 70% ± 9% (среднее ± SEM). Максимальный нокаут АТ был до 80%. Фиг. 5A также показал, что ежемесячные дозы 0,450 мг/кг в течение трех месяцев AD-57213 приводят к среднему максимальному нокауту АТ 77 ± 5% (среднее ± SEM) и максимальному нокауту АТ 85%. Кроме того, Фиг. 5A также показал, что ежемесячные дозы AD-57213 0,900 мг/кг в течение трех месяцев приводят к среднему максимальному нокауту АТ 78 ± 7% (среднее ± SEM) и максимальному нокауту АТ 88%. Кроме того, Фиг. 5A показал, что ежемесячные дозы AD-57213 1,800 мг/кг в течение трех месяцев приводят к среднему максимальному нокауту АТ 79 ± 3% (среднее ± SEM) и максимальному нокауту АТ 84%. Фиг. 5A также показал, что ежемесячные дозы AD-57213 80 мг в течение трех месяцев приводят к среднему максимальному нокауту АТ 87 ± 1% (среднее ± SEM).
Как показано на фиг. 5B, на которой в виде диаграммы показана доза AD-57213 в зависимости относительной низшей точки уровней белка AT, введение AD-57213 пациентам-людям понижает уровни белка AT дозозависимым образом.
Оценка выработки тромбина у здоровых людей-добровольцев (Пример 1) и пациентов, имеющих гемофилию A или B, продемонстрировала, что еженедельные дозы AD-57213 приводили к увеличению выработки тромбина до 334% (по сравнению с исходным уровнем) у пациентов с гемофилией со средним увеличением выработки тромбина 112 ± 38% (p<0,05) по сравнению с исходным уровнем при нокауте AT на ≥50% (Фиг. 6B). На Фиг. 6A представлено, что максимальный пиковый тромбин, достигаемый у пациентов с гемофилией A или B, которым вводили еженедельные дозы AD-57213, был в низком диапазоне выработки тромбина у нормальных субъектов.
Анализ тромбоэластометрии на ROTEM® (см., например, Young, et al. (2013) Blood 121:1944) цельной крови одного субъекта (субъект 101-009) показал, что введение AD-57213 при 0,045 мг/кг раз в неделю в течение трех недель не только приводит к повышению пиковой выработки тромбина, но также приводит к выраженному и продолжительному улучшению образования сгустков цельной крови, как показано за счет уменьшения времени образования сгустка и време свертывания (Фиг. 7). У субъекта 101-009 не было явлений кровотечения со 2 дня, и нет кровотечения до текущего 47 дня.
Ретроспективный анализ выработки тромбина по квартилям снижения AT (Части B и C) показал, что в квартиле с самым большим снижением AT (снижение AT >75), происходит увеличение средней выработки тромбина на 289% по сравнению с исходным уровнем (Фиг. 9). Этот уровень выработки тромбина находится внутри диапазона выработки тромбина, наблюдаемой у здоровых добровольцев.
В дополнительном исследовании трех пациентов изучали эквивалентность введения AD-57213 и введения Фактора VIII. Коротко, фактор VIII вводили каждому из трех пациентов, и у пациентов собирали плазму через -0,5, 1, 2, 6, 24 и 48 часов после введения. Пробы каждого субъекта анализировали на уровни фактора VIII и уровни выработки тромбина и использовали для устанолвения индивидуализированных взаимосвязей выработки фактора VIII и пикового тромбина. Затем эти данные использовали для сравнения с пиковыми уровнями выработки тромбина, достигаемыми при введении AD-57213. Как показано на фиг. 10A-10C, введение AD-57213 достаточно для достижения пиковых уровней выработки тромбина у субъекта до приблизительно такого же уровня, который достигается посредством введения субъекту фактора VIII и достаточно для достижения пиковых уровней выработки тромбина у субъекта выше, чем приблизительно 40%.
Ретроспективный анализ явлений кровотечения в квартиле снижения AT (Части B и C) показал, что имеется тенденция уменьшения кровотечения с повышением уровней снижения AT, причем средняя оценка скорости годовых кровотечений (ABR) составляет 5 ± 2 (медиана=1) в квартиле с самым высоким снижением AT (Фиг. 11). Этот анализ включает более чем 1100 кумулятивных дней со снижением AT >75% у 16 пациентов.
Также провели ретроспективный анализ явлений кровотечения в когорте части C. На Фиг. 12 представлены данные пациентов, используемые для этого анализа. Как показано на фиг. 13A, историческая медиана ABR для всех пациентов, включенных в когорту C и получающих профилактические заместительные факторы (PPx) составляла 2, а историческая медиана ABR для всех пациентов, включенных в когорту C и получающих заместительные факторы по необходимости (OD) составляла 28. Введение AD-57213 этим пациентам приводило к значительному уменьшению медианы ABR. В частности, введение AD-57213 приводило к медиане, равной 53% у пациентов, не сообщивших о кровотечении во время периода наблюдения (с 29 дня до последнего визита исследования или до последней дозы +56 дней, что наступило раньше), и медиане, равной 82% у пациентов, не сообщивших о спонтанных кровотечениях во время периода наблюдения. На Фиг. 13B показано, что для пациентов, получающих ежемесячно AD-57213 в дозе 80 мг в когорте C и получающих профилактические (PPx) заместительные факторы, средняя анамнестическая ABR была 6. однако, после введения AD-57213 медиана ABR во время периода наблюдения была 0.
В части D Фазы I изучения оценивали эффект введения AD-57213 у пациентов, имеющих Гемофилию A или B, у которых развились антитела (ингибиторы) против получаемых ими заместительных факторов, и которые, таким образом, стали отражением заместительного фактора свертывания. Соответственно, для того, чтобы оценить пиковый тромбиновый ответ у этих пациентов перед введением AD-57213, пациентам, включенным в когорту 50 мг, вводили их стандартное средство обходного действия (BPA) (например, активированный концентрат протромбинового комплекса (APCC) и/или рекомбинантный активированный FVII (rFVIIa)), пробы плазмы собирали через -1, 2, 6 и 24 часов после введения BPA, и пробы анализировали на выработку тромбина. Как показано на фиг. 14A-14F, снижение AT и выработка тромбина у пациентов с ингибиторами, которым вводили AD-57213, сравнимы со снижениеи AT и выработкой тромбина, наблюдаемых после введения AD-57213 с похожими дозами у пациентов без ингибиторов. Более того, на Фиг. 14A-14F показано, что выработка тромбина после введения AD-57213 последовательно превышает временные уровни, достигаемые при введении BPA.
Как показано на фиг. 15, подкожное введение дозы AD-57213 один раз в месяц по 50 мг и 80 мг достигает дозозависимого снижения AT, составляющего приблизительно 80% у пациентов с гемофилией с ингибиторами. Более того, как показано на фиг. 16, эффект снижения AT достигаемый у пациентов, которым вводили AD-57213, коррелирует с повышенной выработкой тромбина.
Также проводили ретроспективный анализ исследования явлений кровотечения у пациентов в части D исследования. На Фиг. 17A показано, что введение AD-57213 пациентам с ингибиторами, имеющим Гемофилию A или B один раз в месяц в дозе либо 50 мг, либо 80 мг приводит к значительному уменьшению ABR перед исследованием. Более того, как показано на фиг. 17B, средняя частота кровотечений в год (ABR) равняется нулю для всех пациентов с ингибиторами, которым вводили AD-57213 в части D этой фазы I изучения, и у 56% пациентов кровотечений не было, и 69% пациентов испытывали ноль спонтанный кровотечений.
В итоге, AD-57213 хорошо переносится у пациентов с гемофилией A и B с ингибиторами и без них. Не было SAE, связанных с лекарственным веществом исследования и не было тромбоэмболических явлений. Данные демонстрируют, что имеется клиническая активность и коррекция гемофилического фенотипа у пациентов без ингибиторов. Данные дополнительно демонстрируют, что происходит дозозависимое снижение AT и увеличение выработки тромбина при схеме подкожного введения дозы один раз в месяц и что введение фиксированной дозы AD-57213 50 мг или 80 мг обеспечивает последовательное снижение AT приблизительно на 80%.
Более того, данные демонстрируют, что введение AD-57213 пациентам с ингибиторами приводит к снижению AT и последовательному увеличению выработки тромбина у пациентов без ингибиторов и что увеличения выработки тромбина последовательно превышают увеличения, временно достигаемые при введении BPA.
Пример 3: Введение Множественных Доз AD-57213 пациентам-людям, Имеющим Гемофилию A или B
Фаза II открытого дополнительного (OLE) Клинического испытания
В Фазе II OLE изучения AD-57213 (Смысловой (5'-3'): GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAfL96 (SEQ ID NO:13); Антисмысловой (5'-3'): usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg (SEQ ID NO:14)), пациенты без ингибиторов, которым ранее вводили AD-57213 в фазе I Часть B и C клинических испытаний, описанных выше, отобрали для включения в Фазу II открытого дополнительного (OLE) изучения. Двенадцать пациентов из Фазы I Часть B изучения, имеющих Гемофилию A или B, которым подкожно вводили AD-57213 0,015 мг/кг раз в неделю в течение трех недель (15 микрограмм/кг qw x 3; 15 мкг/кг); или которым подкожно вводили AD-57213 0,045 мг/кг раз в неделю в течение трех недель (45 микрограмм/кг qw x 3; 45 мкг/кг); или которым подкожно вводили AD-57213 0,075 мг/кг раз в неделю в течение трех недель (75 микрограмм/кг qw x 3; 75 мкг/кг); и 18 пациентов из Фазы I Часть C изучения, имеющих Гемофилию A или B, которым подкожно вводили ежемесячно дозу AD-57213 0,225 мг/кг в течение трех месяцев (225 микрограмм/кг qm x 3; 225 мкг/кг); или которым подкожно вводили ежемесячно дозу AD-57213 0,450 мг/кг в течение трех месяцев (450 микрограмм/кг qm x 3; 450 мкг/кг); или которым подкожно вводили ежемесячно дозу AD-57213 0,900 мг/кг в течение трех месяцев (900 микрограмм/кг qm x 3; 900 мкг/кг); или которым подкожно вводили ежемесячно дозу AD-57213 1,800 мг/кг в течение трех месяцев (1800 микрограмм/кг qm x 3; 1800 мкг/кг); или которым подкожно вводили ежемесячно фиксированную дозу 80 мг AD-57213 в течение трех месяцев (80 мг qM x 3) отобрали для включения в это исследование.
Было включено шестнадцать пациентов. Восьми пациентам, имеющим Гемофилию A (n=6) или Гемофилию B (n=2), подкожно вводили фиксированную дозу, составляющую 50 мг AD-57213 ежемесячно в течение трех месяцев (50 мг qM × 3); и 8 пациентам, имеющим Гемофилию A (n=7) или Гемофилию B (n=1), подкожно вводили фиксированную дозу, составляющую 80 мг AD-57213 ежемесячно в течение трех месяцев (50 мг qM x 3). Демографические и базовые характеристики пациентов, включенных в это исследование, показаны в Таблице 3 ниже.
Таблица 3. Демографические и базовые характеристики участников исследования
AD-57213 было как правило хорошо переносился пациентами без ингибиторов в фазе II OLE с самым длинным периодом воздействия до 14 месяцев непрерывного лечения, и не было связанных с лекарственным веществом серьезных побочных явлений (SAE), не было досрочных завершений вследствие побочных явлений и не было тромбоэмболических явлений или лабораторного подтверждения патологического образования сгустков. Все побочные явления (AE) по тяжести были легкими или умеренными, причем наиболее общие AE составляли легкие реакции в месте инъекции (ISR) у 4/16 (25 процентов) пациентов. Бессимптомные увеличения аланиновой аминотрансферазы (ALT) более чем в 3 раза верхнего предела нормы (ULN) без параллельного повышения билирубина более чем в 2 раза ULN, наблюдалось у 3 пациентов, у которых у всех в анамнезе имелась инфекция гепатита C. Всеми явлениями кровотечения на фоне профилактического лечения успешно управляли с помощью заместительного фактора. Более того, не было случаев образования антител против лекарственного вещества (ADA).
На Фиг. 19A и 19B дополнительно показана клиническая активность введения AD-57213. Конкретно, как показано на фиг. 19A, подкожное введение один раз в месяц дозы AD-57213 при 50 мг или 80 мг достигает дозозависимого снижения AT на ~80% и как показано на фиг. 19B, подкожное введение дозы AD-57213 один раз в месяц при 50 мг или 80 мг достигает уровней выработки тромбина, приближающихся к нижнему концу нормального диапазона.
Также провели ретроспективный анализ исследования явлений кровотечения у пациентов без ингибиторов в фазе II OLE изучения. На Фиг. 20A показано, что введение AD-57213 пациентам, имеющим Гемофилию A или B, один раз в месяц в дозе либо 50 мг, либо 80 мг приводит к значительному уменьшению ABR перед исследованием. Более того, как показано на фиг. 20B, введение AD-57213 пациентам, имеющим Гемофилия A или B, один раз в месяц в дозе либо 50 мг, либо 80 мг уменьшает среднюю частоту кровотечений в год (ABR) до 1 и уменьшает до нуля медиану нормы спонтанных кровотечений (AsBR) в год.
Кроме того, во время Фазы II OLE одного пациента (субъекта C1-3) подвергли плановой хирургической процедуре. Конкретно, пациента с тяжелой гемофилией A, получающего AD-57213 50 мг ежемесячно, подвергли плановой пластике носовой перегородки. Процедура была проведена успешно без связанных побочных явлений. Кроме того, как сообщил исследователь посредством личного сообщения, кумулятивное перипроцедурное использование рекомбинантного фактора VIII было приблизительно в 5 раз меньше, чем обычно использует исследователь для этого типа хирургического вмешательства для пациента с тяжелой гемофилией A. На основании оценки эффективности гемостаза Международного Общества Тромбоза и Гемостаза (ISTH) исследователь оценил управление гемостазом во внутреоперационный, 24 часовой послеоперационный и 7 дневный послеоперативный периоды, как все прошло «превосходно».
В итоге, AD-57213 в целом хорошо переносился пациентами с гемофилией A и B без ингибиторов. Не было SAE и не было тромбоэмболических явлений, связанных с введением AD-57213. Кроме того, данные демонстрируют, что AD-57213 имеет клиническую активность в том, что при подкожном введении один раз в месяц дозы при 50 мг и 80 мг достигается дозозависимое снижение AT на ~80%, а уровни выработки тромбина приближаются к нижнему концу нормального диапазона. Более того, ретроспективный анализ исследования явлений кровотечение у пациентов, имеющих Гемофилию A или B без ингибиторов, показал, что введение AD-57213 уменьшало медиану ABR до 1, а медиану годовой спонтанной нормы кровотечений (AsBR) до нуля. Восемь из шестнадцати (50%) пациентов не имели кровотечений, а одиннадцать из шестнадцати (69%) пациентов испытывали ноль спонтанных кровотечений. Кроме того, во время первого хирургического события у субъекта, имеющего тяжелую Гемофилию A и которому вводили AD-57213, для поддержания гемостаза у субъекта использовали значительное уменьшение заместительного фактора.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ALNYLAM PHARMACEUTICALS, INC.
AKINC, AKIN
SORENSEN, BENNY
GARG, PUSHKAL
ROBBIE, GABRIEL
<120> СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВА, АССОЦИИРОВАННОГО С SERPINC1
<130> 121301-05220
<140>
<141>
<150> 62/429,241
<151> 2016-12-02
<150> 62/366,304
<151> 2016-07-25
<150> 62/315,228
<151> 2016-03-30
<150> 62/264,013
<151> 2015-12-07
<160> 16
<170> PatentIn version 3.5
<210> 1
<211> 1599
<212> ДНК
<213> Homo sapiens
<400> 1
tctgccccac cctgtcctct ggaacctctg cgagatttag aggaaagaac cagttttcag 60
gcggattgcc tcagatcaca ctatctccac ttgcccagcc ctgtggaaga ttagcggcca 120
tgtattccaa tgtgatagga actgtaacct ctggaaaaag gaaggtttat cttttgtcct 180
tgctgctcat tggcttctgg gactgcgtga cctgtcacgg gagccctgtg gacatctgca 240
cagccaagcc gcgggacatt cccatgaatc ccatgtgcat ttaccgctcc ccggagaaga 300
aggcaactga ggatgagggc tcagaacaga agatcccgga ggccaccaac cggcgtgtct 360
gggaactgtc caaggccaat tcccgctttg ctaccacttt ctatcagcac ctggcagatt 420
ccaagaatga caatgataac attttcctgt cacccctgag tatctccacg gcttttgcta 480
tgaccaagct gggtgcctgt aatgacaccc tccagcaact gatggaggta tttaagtttg 540
acaccatatc tgagaaaaca tctgatcaga tccacttctt ctttgccaaa ctgaactgcc 600
gactctatcg aaaagccaac aaatcctcca agttagtatc agccaatcgc ctttttggag 660
acaaatccct taccttcaat gagacctacc aggacatcag tgagttggta tatggagcca 720
agctccagcc cctggacttc aaggaaaatg cagagcaatc cagagcggcc atcaacaaat 780
gggtgtccaa taagaccgaa ggccgaatca ccgatgtcat tccctcggaa gccatcaatg 840
agctcactgt tctggtgctg gttaacacca tttacttcaa gggcctgtgg aagtcaaagt 900
tcagccctga gaacacaagg aaggaactgt tctacaaggc tgatggagag tcgtgttcag 960
catctatgat gtaccaggaa ggcaagttcc gttatcggcg cgtggctgaa ggcacccagg 1020
tgcttgagtt gcccttcaaa ggtgatgaca tcaccatggt cctcatcttg cccaagcctg 1080
agaagagcct ggccaaggta gagaaggaac tcaccccaga ggtgctgcaa gagtggctgg 1140
atgaattgga ggagatgatg ctggtggtcc acatgccccg cttccgcatt gaggacggct 1200
tcagtttgaa ggagcagctg caagacatgg gccttgtcga tctgttcagc cctgaaaagt 1260
ccaaactccc aggtattgtt gcagaaggcc gagatgacct ctatgtctca gatgcattcc 1320
ataaggcatt tcttgaggta aatgaagaag gcagtgaagc agctgcaagt accgctgttg 1380
tgattgctgg ccgttcgcta aaccccaaca gggtgacttt caaggccaac aggcctttcc 1440
tggtttttat aagagaagtt cctctgaaca ctattatctt catgggcaga gtagccaacc 1500
cttgtgttaa gtaaaatgtt cttattcttt gcacctcttc ctatttttgg tttgtgaaca 1560
gaagtaaaaa taaatacaaa ctacttccat ctcacatta 1599
<210> 2
<211> 1545
<212> ДНК
<213> Macaca mulatta
<400> 2
ggcacgagga ccatctccac ttgcccagcc ctgtggaaga ttagcgacca tgtattccaa 60
tgtgatagga accgtagcct ctggaaaaag gaaggtttat cttctgtcct tgctgctcat 120
tggcctctgg gactgtatga cctgtcacgg gagccctgtg gacatctgca cagccaagcc 180
gcgggacatt cccatgaatc ccatgtgcat ttaccgctcc ccggagaaga aggcaactga 240
ggatgagggc tcagaacaga agatccccga ggccaccaac cggcgcgtct gggaactgtc 300
caaggccaat tcccgctttg ctaccacttt ctatcagcac ctggcagatt ccaagaacga 360
caaggataac attttcctgt cacccctgag tgtctccacg gcttttgcta tgaccaagct 420
gggtgcctgt aatgacaccc tcaagcaact gatggaggta tttaagtttg acaccatatc 480
tgagaaaaca tctgatcaga tccacttctt ctttgccaaa ctgaactgcc gactctatcg 540
aaaagccaac aaatcctcca agttagtatc agccaatcgc ctttttggag acaaatccct 600
taccttcaat gagacctacc aggacatcag tgagttggta tacggagcca agctccagcc 660
cctggacttc aaggaaaatg cagagcaatc cagagcggcc atcaacaaat gggtgtccaa 720
taagaccgaa ggccgaatca ccgatgtcat tcccccggaa gccatcaacg agctcactgt 780
tctggtgctg gttaacacca tttacttcaa gggcctgtgg aagtcaaagt ttagccctga 840
gaacacaagg atggaaccgt tctacaaggc tgatggagag tcgtgttcag cgtctatgat 900
gtaccaggaa ggcaagttct gttatcggcg cgtggctgaa ggcacccagg tgcttgagtt 960
gcccttcaag ggtgatgaca tcaccatggt gctcatcctg cccaagcctg agaagagcct 1020
gaccaaggtg gagcaggaac tcaccccaga ggtgctgcag gagtggctgg atgagttgga 1080
ggagatgatg ctggtggttc acatgccccg cttccgcatt gaggacggct tcagtttgaa 1140
ggagcagctg caagacatgg gccttgtcga tctgttcagc cctgaaaagt ccaaactccc 1200
aggtattgtt gcagaaggcc gggatgacct ctatgtctcc gatgcattcc ataaggcatt 1260
tcttgaggta aatgaagaag gcagtgaagc agctgcaagt accgccattg ggattgctgg 1320
ccgttcgcta aaccccaaca gggtgacctt caaggccaac aggcctttcc tggtttttat 1380
aagagaagtt cctctgaaca ctattatctt catgggcaga gtagccaacc cttgtgtgag 1440
ctaaactgtt cttattcttt gtacctcttc ctattttggt ttgtgaatag aagtaaaaat 1500
aaatacaact actcccatct tacattaaaa aaaaaaaaaa aaaaa 1545
<210> 3
<211> 2171
<212> ДНК
<213> Mus musculus
<400> 3
ataggtaatt ttagaaatag atctgatttg tatctgagac attttagtga agtggtgaga 60
tataagacat aatcagaaga catatctacc tgaagacttt aaggggagag ctccctcccc 120
cacctggcct ctggacctct cagatttagg ggaaagaacc agttttcgga gtgatcgtct 180
cagtcagcac catctctgta ggagcatcgg ccatgtattc ccctggggca ggaagtgggg 240
ctgctggtga gaggaagctt tgtctcctct ctctgctcct catcggtgcc ttgggctgtg 300
ctatctgtca cggaaaccct gtggacgaca tctgcatagc gaagccccga gacatccccg 360
tgaatccctt gtgcatttac cgctcccctg ggaagaaggc caccgaggag gatggctcag 420
agcagaaggt tccagaagcc accaaccggc gggtctggga actgtccaag gccaattcgc 480
gatttgccac taacttctac cagcacctgg cagactccaa gaatgacaac gacaacattt 540
tcctgtcacc cttgagcatc tccactgctt ttgctatgac caagctgggt gcctgtaacg 600
acactctcaa gcagctgatg gaggttttta aatttgatac catctccgag aagacatccg 660
accagatcca cttcttcttt gccaaactga actgccgact ctatcgaaaa gccaacaagt 720
cctctgactt ggtatcagcc aaccgccttt ttggagacaa atccctcacc ttcaacgaga 780
gctatcaaga tgttagtgag gttgtctatg gagccaagct ccagcccctg gacttcaagg 840
agaatccgga gcaatccaga gtgaccatca acaactgggt agctaataag actgaaggcc 900
gcatcaaaga tgtcatccca cagggcgcca ttaacgagct cactgccctg gttctggtta 960
acaccattta cttcaagggc ctgtggaagt caaagttcag ccctgagaac acaaggaagg 1020
aaccgttcta taaggtcgat gggcagtcat gcccagtgcc tatgatgtac caggaaggca 1080
aattcaaata ccggcgcgtg gcagagggca cccaggtgct agagctgccc ttcaaggggg 1140
atgacatcac catggtgctc atcctgccca agcctgagaa gagcctggcc aaggtggagc 1200
aggagctcac cccagagctg ctgcaggagt ggctggatga gctgtcagag actatgcttg 1260
tggtccacat gccccgcttc cgcaccgagg atggcttcag tctgaaggag cagctgcaag 1320
acatgggcct cattgatctc ttcagccctg aaaagtccca actcccaggg atcgttgctg 1380
gaggcaggga cgacctctat gtctccgacg cattccacaa agcatttctt gaggtaaatg 1440
aggaaggcag tgaagcagca gcgagtactt ctgtcgtgat tactggccgg tcactgaacc 1500
ccaatagggt gaccttcaag gccaacaggc ccttcctggt tcttataagg gaagttgcac 1560
tgaacactat tatattcatg gggagagtgg ctaatccttg tgtgaactaa aatattctta 1620
atctttgcac cttttcctac tttggtgttt gtgaatagaa gtaaaaataa atacgactgc 1680
cacctcacga gaatggactt ttccacttga agacgagaga ctggagtaca gatgctacac 1740
cacttttggg caagtgaagg gggagcagcc agccacggtg gcacaaacct atatcctggt 1800
gcttttgaag gtagaagcag ggcggtcagg agttaaggcc agttgaggct gggctgcaga 1860
gtgaaagacc atgtctcaag atggtctttc tcctccccaa agtagaaaag aaaaccataa 1920
aaacaagagg taaatatatt actatttcat cttagaggat agcaggcatc ttgaaagggt 1980
agagggacct taaattctca ttattgcccc catactacaa actaaaaaac aaacccgaat 2040
caatctccca taaagacaga gattcaaata agagtattaa acgttttatt tctcaaacca 2100
ctcacatgca taatgttctt atacacagtg tcaaaataaa gagaaatgca tttttataca 2160
aaaaaaaaaa a 2171
<210> 4
<211> 1561
<212> ДНК
<213> Rattus norvegicus
<400> 4
cggagggatt gctcagcact gtctccacgg cttctctgca gaagcgtcca ccatgtattc 60
cccgggaata ggaagtgcgg ttgctggaga gaggaagctt tgtctcctct ctctgctact 120
cattggtgcc ttgggctgtg ctgtctgtca tggaaaccct gtggacgaca tctgcatagc 180
gaagccccga gacatccccg tgaaccccat gtgcatttac cgctcccctg cgaagaaggc 240
cacggaggag gatgtcctag agcagaaggt tccggaagcc accaaccggc gggtctggga 300
actgtccaag gccaattctc gatttgccac taacttctat cagcacctgg cagactccaa 360
gaacgacaac gacaacattt tcctgtcacc cttgagcatc tccacggcgt ttgctatgac 420
caagctgggt gcttgtaata acaccctcaa gcagctgatg gaggttttta aatttgatac 480
catctccgag aagacatccg accagatcca cttcttcttt gccaaactga actgccgact 540
ctatcgaaaa gccaacaagt cctctaactt ggtgtcagcc aaccgccttt ttggagacaa 600
atcccttacc ttcaatgaga gctatcaaga cgttagtgag attgtctatg gagccaagct 660
tcagcccctg gacttcaagg agaatccgga gcaatccaga gtgaccatca acaactgggt 720
agctaataag actgaaggcc gcatcaaaga cgtcatcccc caaggagcca ttgatgagct 780
cactgccctg gtgctggtta acaccattta cttcaagggc ctgtggaagt caaagttcag 840
ccctgagaac acaaggaagg aaccattcca caaagttgat gggcagtcat gcctggtgcc 900
catgatgtac caggaaggca aattcaaata caggcgtgtg ggagagggta cccaggtgct 960
agagatgccc ttcaaggggg acgacatcac catggtgctc atcctgccca agcctgagaa 1020
gagcctggct aaggtggagc aggaactcac cccggagctg ctgcaggagt ggctggatga 1080
gctgtcggag gtcatgcttg tggtccacgt gccccgcttc cgcatcgagg acagcttcag 1140
tctgaaggag cagctgcaag acatgggcct tgttgatctc ttcagccctg agaagtccca 1200
actcccaggg atcattgctg aaggcaggga cgacctcttt gtctccgatg cattccacaa 1260
agcgtttctt gaggtaaatg aggaaggcag tgaagcagca gcgagtactt ctgtcgtgat 1320
tactggccgg tcactgaacc ccagtagggt gaccttcaag gccaacaggc ccttcctggt 1380
tcttataagg gaagtcgcac tgaacactat tatattcatg gggagagtgt ctaatccttg 1440
tgtgaactaa aatattctta atctttgcac cttttcctat ctcggtgttt gttaatggaa 1500
gtaaaaataa atatgactgc cacctcaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
a 1561
<210> 5
<211> 1599
<212> ДНК
<213> Homo sapiens
<400> 5
taatgtgaga tggaagtagt ttgtatttat ttttacttct gttcacaaac caaaaatagg 60
aagaggtgca aagaataaga acattttact taacacaagg gttggctact ctgcccatga 120
agataatagt gttcagagga acttctctta taaaaaccag gaaaggcctg ttggccttga 180
aagtcaccct gttggggttt agcgaacggc cagcaatcac aacagcggta cttgcagctg 240
cttcactgcc ttcttcattt acctcaagaa atgccttatg gaatgcatct gagacataga 300
ggtcatctcg gccttctgca acaatacctg ggagtttgga cttttcaggg ctgaacagat 360
cgacaaggcc catgtcttgc agctgctcct tcaaactgaa gccgtcctca atgcggaagc 420
ggggcatgtg gaccaccagc atcatctcct ccaattcatc cagccactct tgcagcacct 480
ctggggtgag ttccttctct accttggcca ggctcttctc aggcttgggc aagatgagga 540
ccatggtgat gtcatcacct ttgaagggca actcaagcac ctgggtgcct tcagccacgc 600
gccgataacg gaacttgcct tcctggtaca tcatagatgc tgaacacgac tctccatcag 660
ccttgtagaa cagttccttc cttgtgttct cagggctgaa ctttgacttc cacaggccct 720
tgaagtaaat ggtgttaacc agcaccagaa cagtgagctc attgatggct tccgagggaa 780
tgacatcggt gattcggcct tcggtcttat tggacaccca tttgttgatg gccgctctgg 840
attgctctgc attttccttg aagtccaggg gctggagctt ggctccatat accaactcac 900
tgatgtcctg gtaggtctca ttgaaggtaa gggatttgtc tccaaaaagg cgattggctg 960
atactaactt ggaggatttg ttggcttttc gatagagtcg gcagttcagt ttggcaaaga 1020
agaagtggat ctgatcagat gttttctcag atatggtgtc aaacttaaat acctccatca 1080
gttgctggag ggtgtcatta caggcaccca gcttggtcat agcaaaagcc gtggagatac 1140
tcaggggtga caggaaaatg ttatcattgt cattcttgga atctgccagg tgctgataga 1200
aagtggtagc aaagcgggaa ttggccttgg acagttccca gacacgccgg ttggtggcct 1260
ccgggatctt ctgttctgag ccctcatcct cagttgcctt cttctccggg gagcggtaaa 1320
tgcacatggg attcatggga atgtcccgcg gcttggctgt gcagatgtcc acagggctcc 1380
cgtgacaggt cacgcagtcc cagaagccaa tgagcagcaa ggacaaaaga taaaccttcc 1440
tttttccaga ggttacagtt cctatcacat tggaatacat ggccgctaat cttccacagg 1500
gctgggcaag tggagatagt gtgatctgag gcaatccgcc tgaaaactgg ttctttcctc 1560
taaatctcgc agaggttcca gaggacaggg tggggcaga 1599
<210> 6
<211> 1545
<212> ДНК
<213> Macaca mulatta
<400> 6
tttttttttt ttttttttta atgtaagatg ggagtagttg tatttatttt tacttctatt 60
cacaaaccaa aataggaaga ggtacaaaga ataagaacag tttagctcac acaagggttg 120
gctactctgc ccatgaagat aatagtgttc agaggaactt ctcttataaa aaccaggaaa 180
ggcctgttgg ccttgaaggt caccctgttg gggtttagcg aacggccagc aatcccaatg 240
gcggtacttg cagctgcttc actgccttct tcatttacct caagaaatgc cttatggaat 300
gcatcggaga catagaggtc atcccggcct tctgcaacaa tacctgggag tttggacttt 360
tcagggctga acagatcgac aaggcccatg tcttgcagct gctccttcaa actgaagccg 420
tcctcaatgc ggaagcgggg catgtgaacc accagcatca tctcctccaa ctcatccagc 480
cactcctgca gcacctctgg ggtgagttcc tgctccacct tggtcaggct cttctcaggc 540
ttgggcagga tgagcaccat ggtgatgtca tcacccttga agggcaactc aagcacctgg 600
gtgccttcag ccacgcgccg ataacagaac ttgccttcct ggtacatcat agacgctgaa 660
cacgactctc catcagcctt gtagaacggt tccatccttg tgttctcagg gctaaacttt 720
gacttccaca ggcccttgaa gtaaatggtg ttaaccagca ccagaacagt gagctcgttg 780
atggcttccg ggggaatgac atcggtgatt cggccttcgg tcttattgga cacccatttg 840
ttgatggccg ctctggattg ctctgcattt tccttgaagt ccaggggctg gagcttggct 900
ccgtatacca actcactgat gtcctggtag gtctcattga aggtaaggga tttgtctcca 960
aaaaggcgat tggctgatac taacttggag gatttgttgg cttttcgata gagtcggcag 1020
ttcagtttgg caaagaagaa gtggatctga tcagatgttt tctcagatat ggtgtcaaac 1080
ttaaatacct ccatcagttg cttgagggtg tcattacagg cacccagctt ggtcatagca 1140
aaagccgtgg agacactcag gggtgacagg aaaatgttat ccttgtcgtt cttggaatct 1200
gccaggtgct gatagaaagt ggtagcaaag cgggaattgg ccttggacag ttcccagacg 1260
cgccggttgg tggcctcggg gatcttctgt tctgagccct catcctcagt tgccttcttc 1320
tccggggagc ggtaaatgca catgggattc atgggaatgt cccgcggctt ggctgtgcag 1380
atgtccacag ggctcccgtg acaggtcata cagtcccaga ggccaatgag cagcaaggac 1440
agaagataaa ccttcctttt tccagaggct acggttccta tcacattgga atacatggtc 1500
gctaatcttc cacagggctg ggcaagtgga gatggtcctc gtgcc 1545
<210> 7
<211> 2171
<212> ДНК
<213> Mus musculus
<400> 7
tttttttttt ttgtataaaa atgcatttct ctttattttg acactgtgta taagaacatt 60
atgcatgtga gtggtttgag aaataaaacg tttaatactc ttatttgaat ctctgtcttt 120
atgggagatt gattcgggtt tgttttttag tttgtagtat gggggcaata atgagaattt 180
aaggtccctc taccctttca agatgcctgc tatcctctaa gatgaaatag taatatattt 240
acctcttgtt tttatggttt tcttttctac tttggggagg agaaagacca tcttgagaca 300
tggtctttca ctctgcagcc cagcctcaac tggccttaac tcctgaccgc cctgcttcta 360
ccttcaaaag caccaggata taggtttgtg ccaccgtggc tggctgctcc cccttcactt 420
gcccaaaagt ggtgtagcat ctgtactcca gtctctcgtc ttcaagtgga aaagtccatt 480
ctcgtgaggt ggcagtcgta tttattttta cttctattca caaacaccaa agtaggaaaa 540
ggtgcaaaga ttaagaatat tttagttcac acaaggatta gccactctcc ccatgaatat 600
aatagtgttc agtgcaactt cccttataag aaccaggaag ggcctgttgg ccttgaaggt 660
caccctattg gggttcagtg accggccagt aatcacgaca gaagtactcg ctgctgcttc 720
actgccttcc tcatttacct caagaaatgc tttgtggaat gcgtcggaga catagaggtc 780
gtccctgcct ccagcaacga tccctgggag ttgggacttt tcagggctga agagatcaat 840
gaggcccatg tcttgcagct gctccttcag actgaagcca tcctcggtgc ggaagcgggg 900
catgtggacc acaagcatag tctctgacag ctcatccagc cactcctgca gcagctctgg 960
ggtgagctcc tgctccacct tggccaggct cttctcaggc ttgggcagga tgagcaccat 1020
ggtgatgtca tcccccttga agggcagctc tagcacctgg gtgccctctg ccacgcgccg 1080
gtatttgaat ttgccttcct ggtacatcat aggcactggg catgactgcc catcgacctt 1140
atagaacggt tccttccttg tgttctcagg gctgaacttt gacttccaca ggcccttgaa 1200
gtaaatggtg ttaaccagaa ccagggcagt gagctcgtta atggcgccct gtgggatgac 1260
atctttgatg cggccttcag tcttattagc tacccagttg ttgatggtca ctctggattg 1320
ctccggattc tccttgaagt ccaggggctg gagcttggct ccatagacaa cctcactaac 1380
atcttgatag ctctcgttga aggtgaggga tttgtctcca aaaaggcggt tggctgatac 1440
caagtcagag gacttgttgg cttttcgata gagtcggcag ttcagtttgg caaagaagaa 1500
gtggatctgg tcggatgtct tctcggagat ggtatcaaat ttaaaaacct ccatcagctg 1560
cttgagagtg tcgttacagg cacccagctt ggtcatagca aaagcagtgg agatgctcaa 1620
gggtgacagg aaaatgttgt cgttgtcatt cttggagtct gccaggtgct ggtagaagtt 1680
agtggcaaat cgcgaattgg ccttggacag ttcccagacc cgccggttgg tggcttctgg 1740
aaccttctgc tctgagccat cctcctcggt ggccttcttc ccaggggagc ggtaaatgca 1800
caagggattc acggggatgt ctcggggctt cgctatgcag atgtcgtcca cagggtttcc 1860
gtgacagata gcacagccca aggcaccgat gaggagcaga gagaggagac aaagcttcct 1920
ctcaccagca gccccacttc ctgccccagg ggaatacatg gccgatgctc ctacagagat 1980
ggtgctgact gagacgatca ctccgaaaac tggttctttc ccctaaatct gagaggtcca 2040
gaggccaggt gggggaggga gctctcccct taaagtcttc aggtagatat gtcttctgat 2100
tatgtcttat atctcaccac ttcactaaaa tgtctcagat acaaatcaga tctatttcta 2160
aaattaccta t 2171
<210> 8
<211> 1561
<212> ДНК
<213> Rattus norvegicus
<400> 8
tttttttttt tttttttttt tttttttttt tttttgaggt ggcagtcata tttattttta 60
cttccattaa caaacaccga gataggaaaa ggtgcaaaga ttaagaatat tttagttcac 120
acaaggatta gacactctcc ccatgaatat aatagtgttc agtgcgactt cccttataag 180
aaccaggaag ggcctgttgg ccttgaaggt caccctactg gggttcagtg accggccagt 240
aatcacgaca gaagtactcg ctgctgcttc actgccttcc tcatttacct caagaaacgc 300
tttgtggaat gcatcggaga caaagaggtc gtccctgcct tcagcaatga tccctgggag 360
ttgggacttc tcagggctga agagatcaac aaggcccatg tcttgcagct gctccttcag 420
actgaagctg tcctcgatgc ggaagcgggg cacgtggacc acaagcatga cctccgacag 480
ctcatccagc cactcctgca gcagctccgg ggtgagttcc tgctccacct tagccaggct 540
cttctcaggc ttgggcagga tgagcaccat ggtgatgtcg tcccccttga agggcatctc 600
tagcacctgg gtaccctctc ccacacgcct gtatttgaat ttgccttcct ggtacatcat 660
gggcaccagg catgactgcc catcaacttt gtggaatggt tccttccttg tgttctcagg 720
gctgaacttt gacttccaca ggcccttgaa gtaaatggtg ttaaccagca ccagggcagt 780
gagctcatca atggctcctt gggggatgac gtctttgatg cggccttcag tcttattagc 840
tacccagttg ttgatggtca ctctggattg ctccggattc tccttgaagt ccaggggctg 900
aagcttggct ccatagacaa tctcactaac gtcttgatag ctctcattga aggtaaggga 960
tttgtctcca aaaaggcggt tggctgacac caagttagag gacttgttgg cttttcgata 1020
gagtcggcag ttcagtttgg caaagaagaa gtggatctgg tcggatgtct tctcggagat 1080
ggtatcaaat ttaaaaacct ccatcagctg cttgagggtg ttattacaag cacccagctt 1140
ggtcatagca aacgccgtgg agatgctcaa gggtgacagg aaaatgttgt cgttgtcgtt 1200
cttggagtct gccaggtgct gatagaagtt agtggcaaat cgagaattgg ccttggacag 1260
ttcccagacc cgccggttgg tggcttccgg aaccttctgc tctaggacat cctcctccgt 1320
ggccttcttc gcaggggagc ggtaaatgca catggggttc acggggatgt ctcggggctt 1380
cgctatgcag atgtcgtcca cagggtttcc atgacagaca gcacagccca aggcaccaat 1440
gagtagcaga gagaggagac aaagcttcct ctctccagca accgcacttc ctattcccgg 1500
ggaatacatg gtggacgctt ctgcagagaa gccgtggaga cagtgctgag caatccctcc 1560
g 1561
<210> 9
<211> 16
<212> PRT
<213> неизвестно
<220>
<221> источник
<223> /примечание ="описание неизвестного:
пептид RFGF"
<400> 9
Ala Ala Val Ala Leu Leu Pro Ala Val Leu Leu Ala Leu Leu Ala Pro
1 5 10 15
<210> 10
<211> 11
<212> PRT
<213> неизвестно
<220>
<221> источник
<223> /примечание="описание неизвестного:
аналога пептида RFGF"
<400> 10
Ala Ala Leu Leu Pro Val Leu Leu Ala Ala Pro
1 5 10
<210> 11
<211> 13
<212> PRT
<213> вирус иммунодефицита человека
<400> 11
Gly Arg Lys Lys Arg Arg Gln Arg Arg Arg Pro Pro Gln
1 5 10
<210> 12
<211> 16
<212> PRT
<213> Drosophila sp.
<400> 12
Arg Gln Ile Lys Ile Trp Phe Gln Asn Arg Arg Met Lys Trp Lys Lys
1 5 10 15
<210> 13
<211> 21
<212> RNA
<213> искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 13
gguuaacacc auuuacuuca a 21
<210> 14
<211> 23
<212> RNA
<213> искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 14
uugaaguaaa ugguguuaac cag 23
<210> 15
<211> 23
<212> RNA
<213> искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 15
uugaaguaaa ugguguuaac cag 23
<210> 16
<211> 21
<212> RNA
<213> искусственная последовательность
<220>
<221> источник
<223> /примечание="описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 16
gguuaacacc auuuacuuca a 21
<---
Реферат
Группа изобретений относится к области медицины, а именно к гематологии и наследственным заболеваниям, и предназначена для лечения субъектов, имеющих заболевания, ассоциированные с Serpinc1. Для предотвращения по меньшей мере одного симптома гемофилии у субъекта, у которого имеется гемофилия A или гемофилия B, подкожно вводят субъекту, нуждающемуся в этом, дозу от 50 мг до 90 мг молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК) один раз в месяц. Молекула дцРНК включает смысловую цепь и антисмысловую цепь, где смысловая цепь содержит последовательность 5’-GfsgsUfuAfaCfaCfCfAfuUfuAfcUfuCfaAf-3’ (SEQ ID NO:13) и антисмысловая цепь содержит последовательность 5’-usUfsgAfaGfuAfaAfuggUfgUfuAfaCfcsasg-3’ (SEQ ID NO:14), где a, c, g и u представляют собой 2'-O-метил (2'-OMe) A, C, G и U соответственно; Af, Cf, Gf и Uf представляют собой 2'-фтор A, C, G и U соответственно; и s представляет собой фосфоротиоатную связь. Также представлены способ лечения субъекта, у которого имеется гемофилия A или гемофилия B; способ уменьшения частоты эпизодов кровотечений у субъекта, у которого имеется гемофилия A или гемофилия B; способ снижения частоты кровотечений в год (ABR) у субъекта, у которого имеется гемофилия A или гемофилия B; и способ снижения ежегодной частоты спонтанных кровотечений (AsBR) у субъекта, у которого имеется гемофилия A или гемофилия В. В других воплощениях обеспечиваются альтернативные варианты выполнения указанных способов и набор для осуществления указанных способов. Использование группы изобретений позволяет повысить эффективность лечения субъектов, имеющих ассоциированные с Serpinc1 заболевания, за счет исключительно эффективного подавления экспрессии Serpinc1 и исключительной продолжительности подавления экспрессии Serpinc1. 16 н. и 24 з.п. ф-лы, 20 ил., 3 табл., 3 пр.
Формула

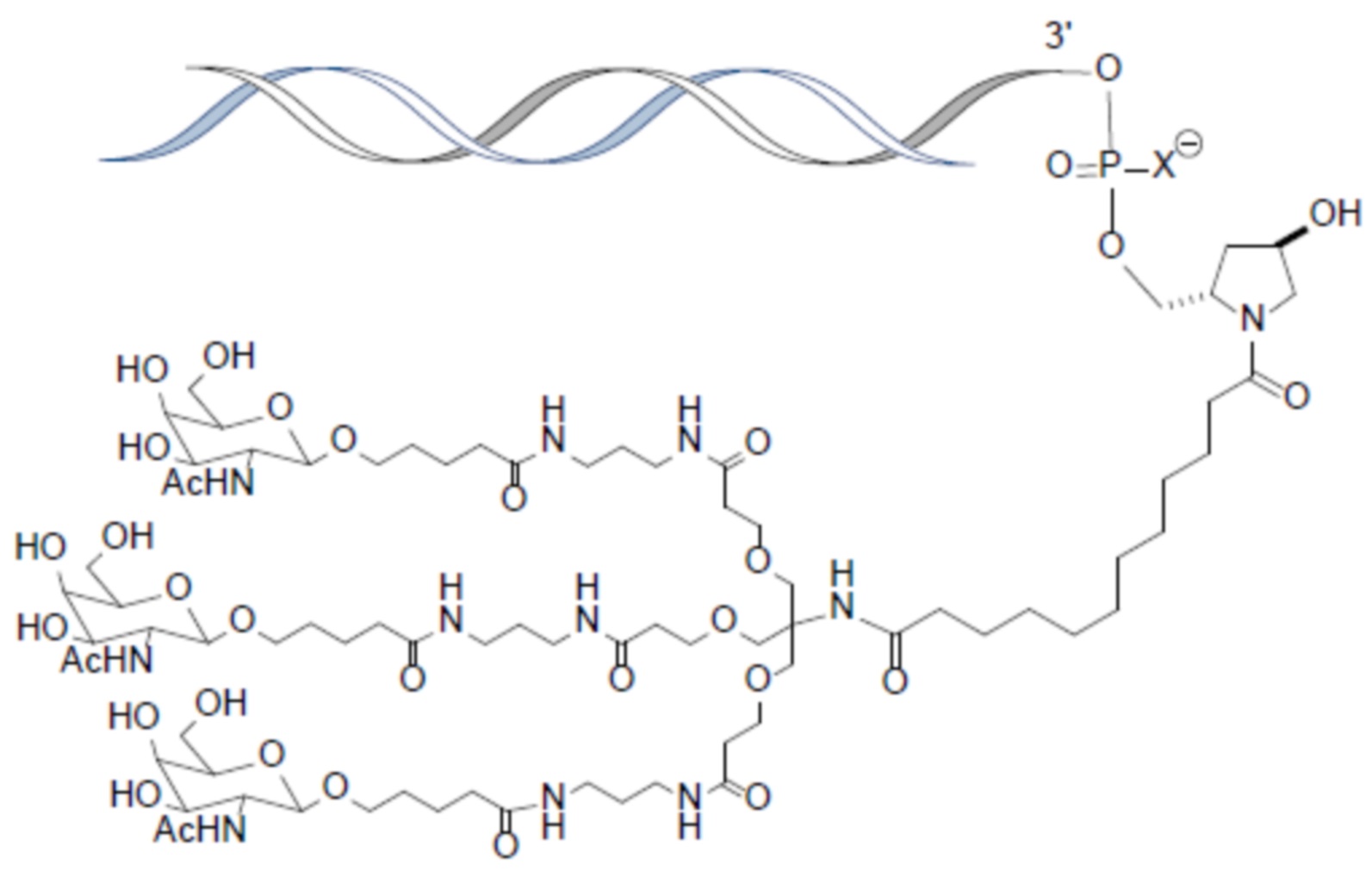
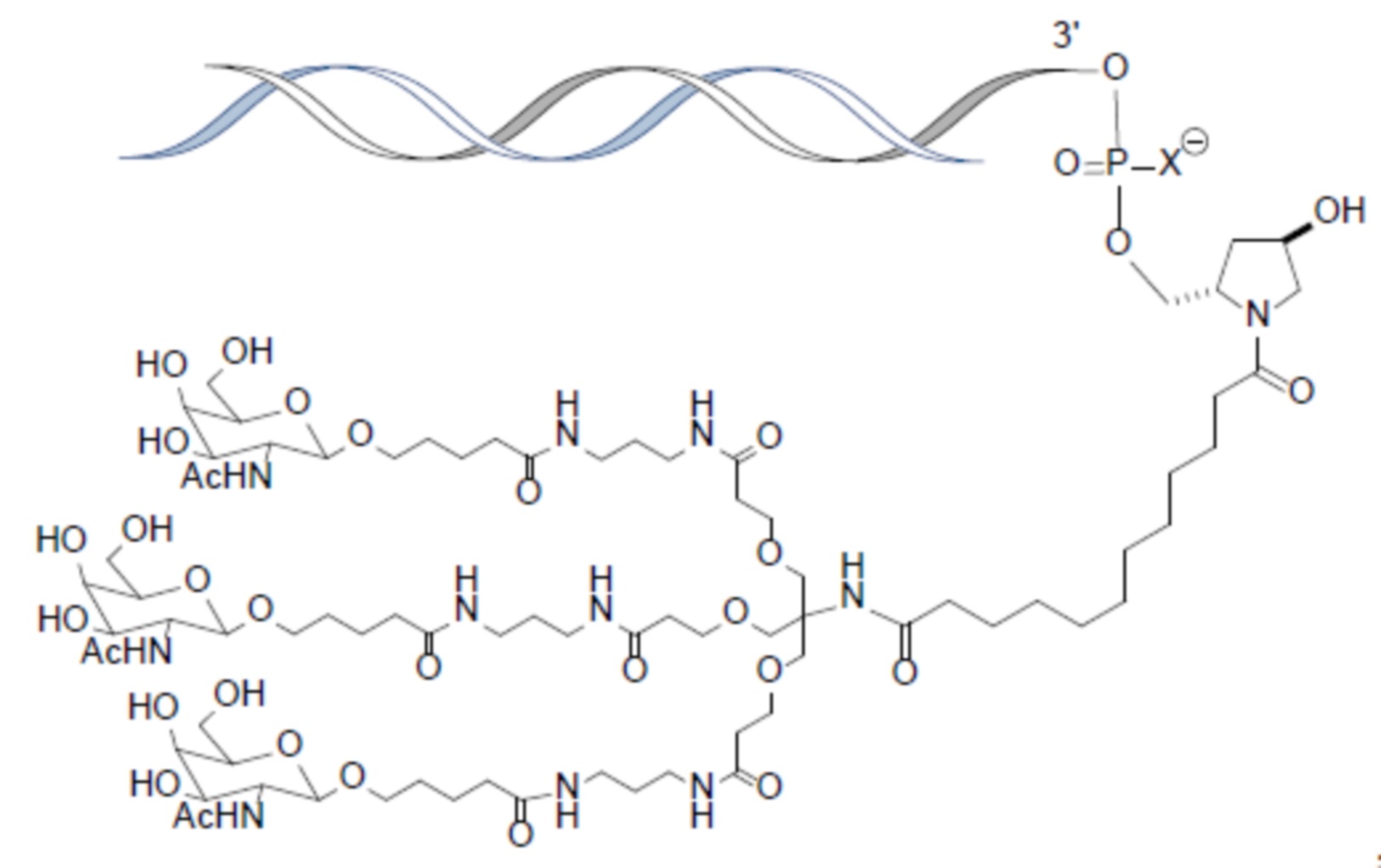
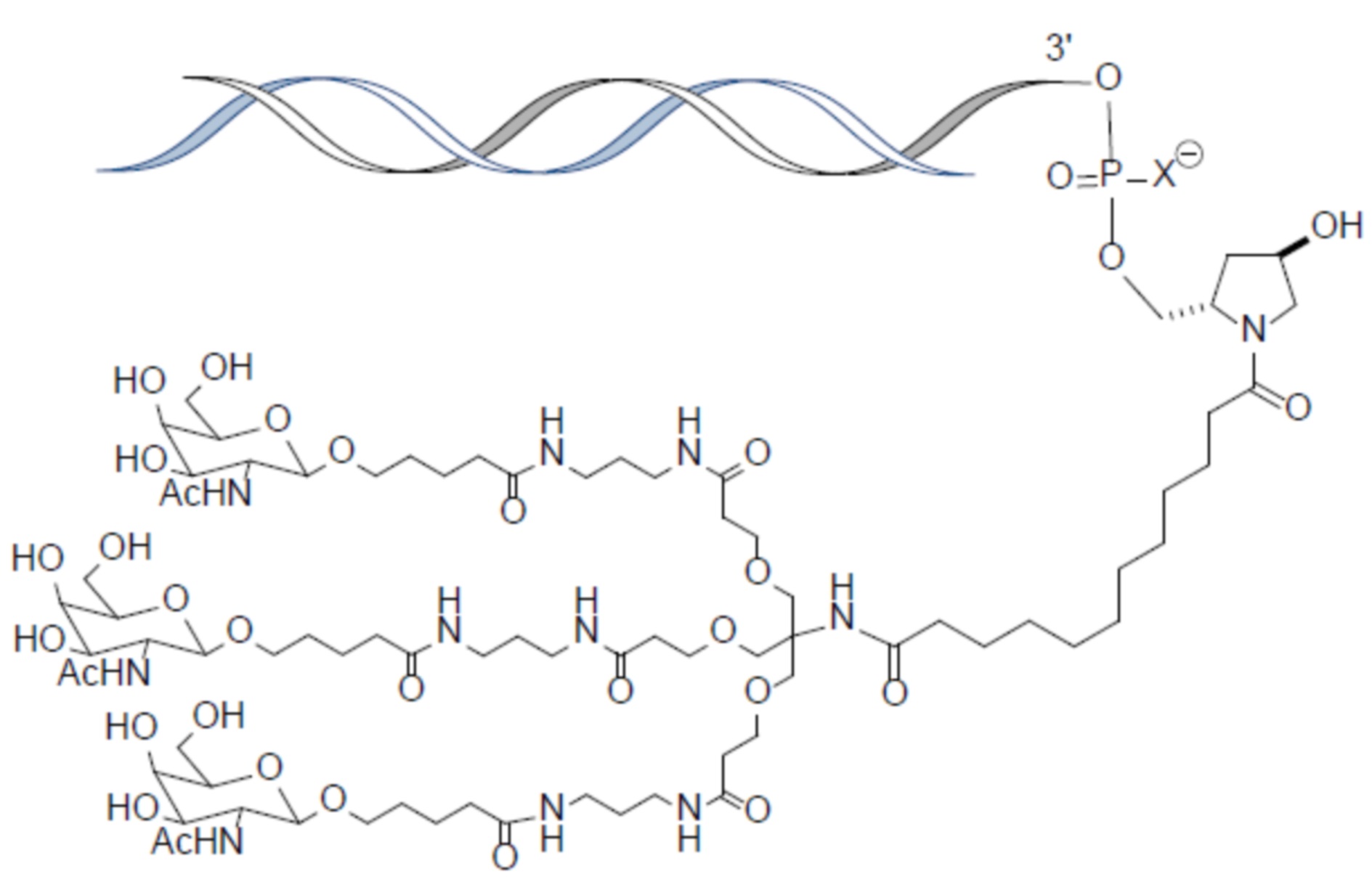
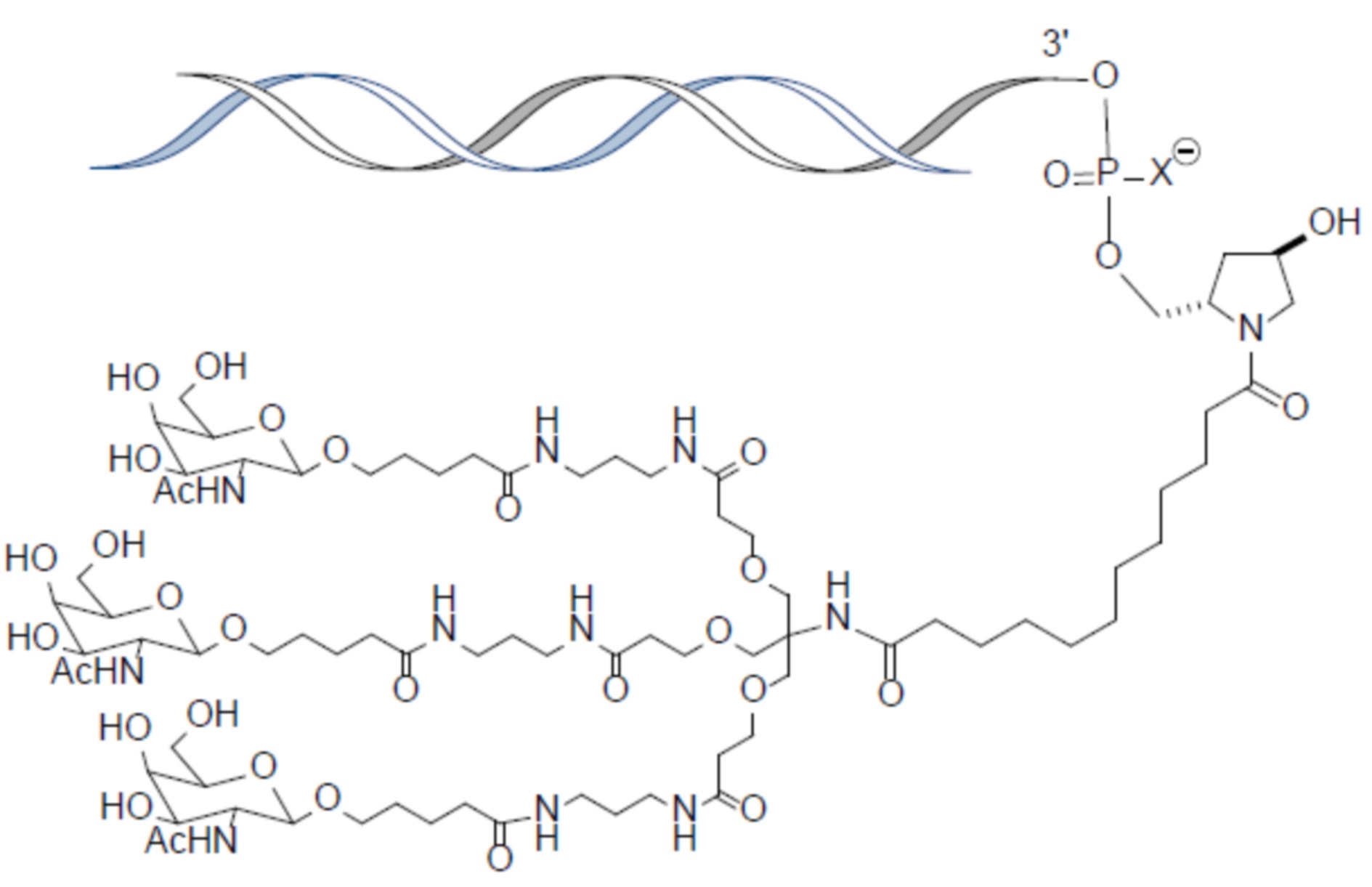
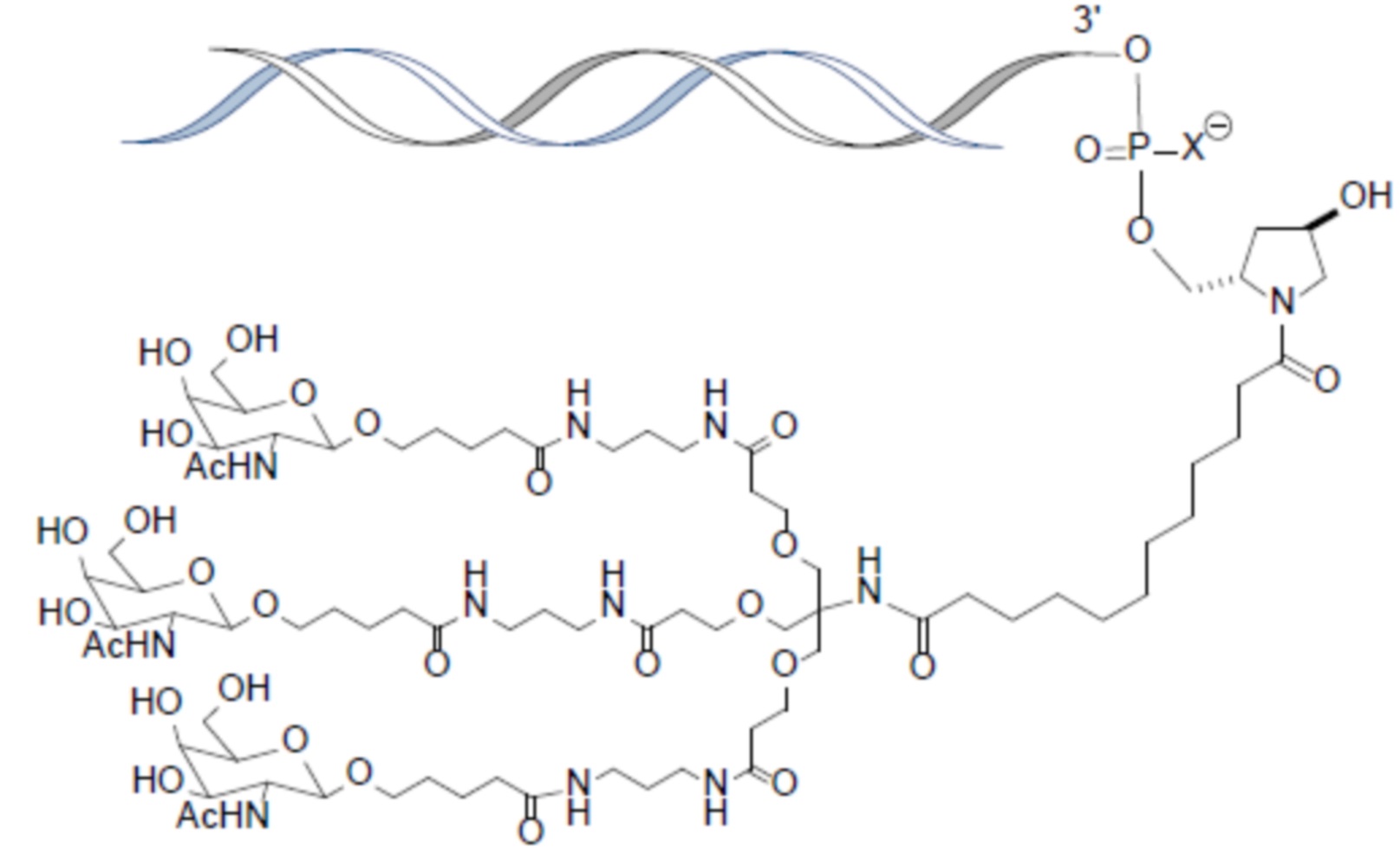

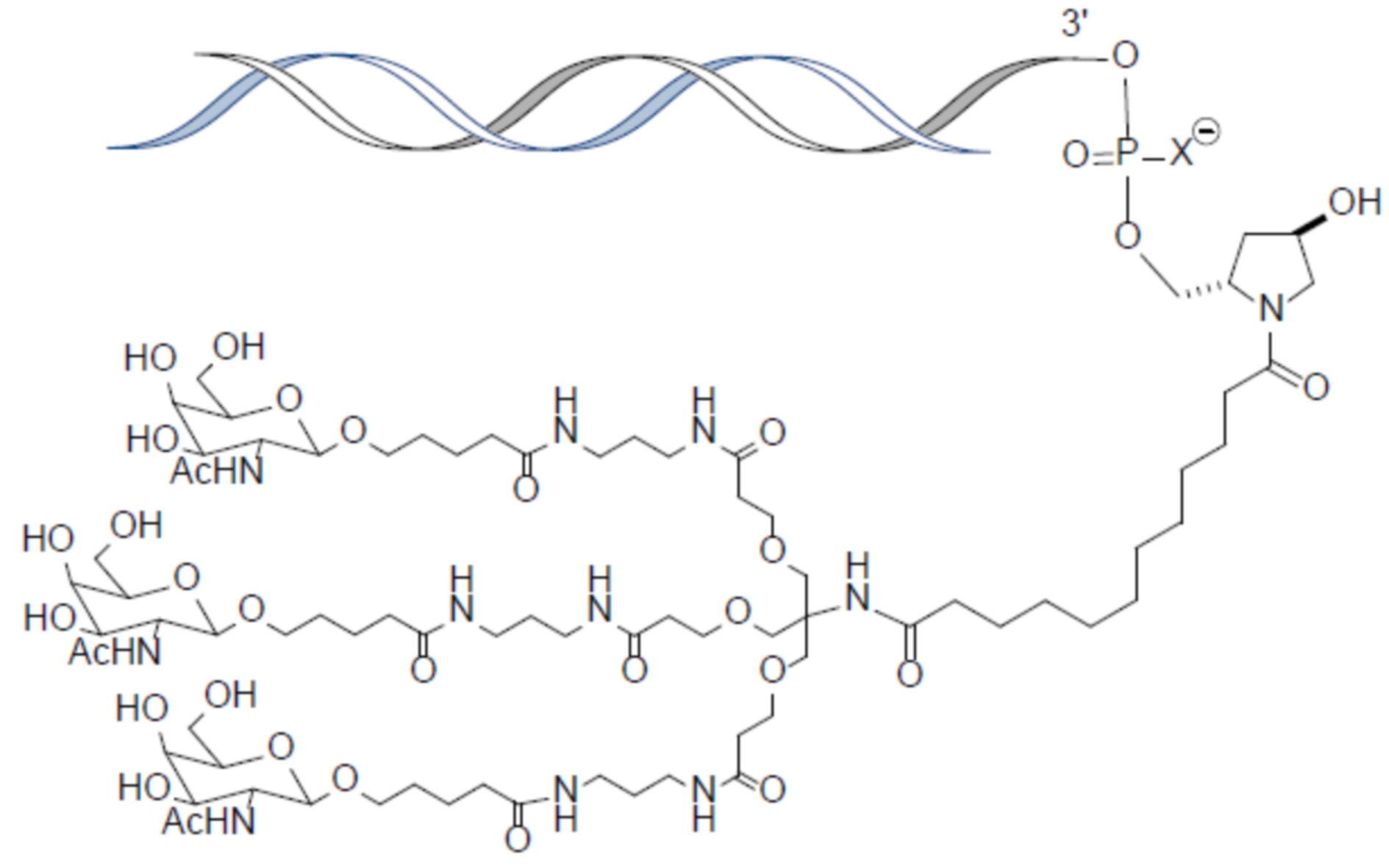


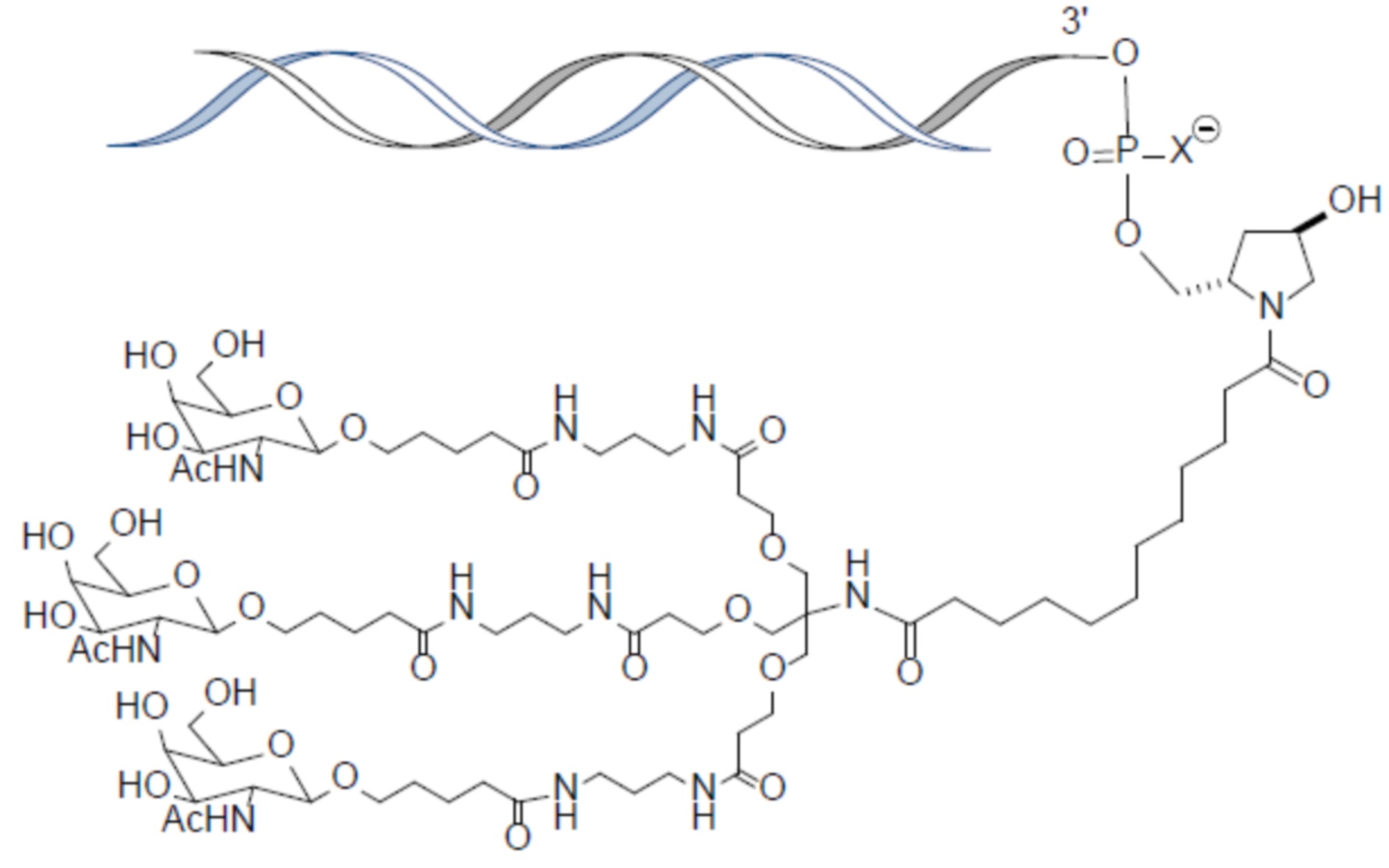

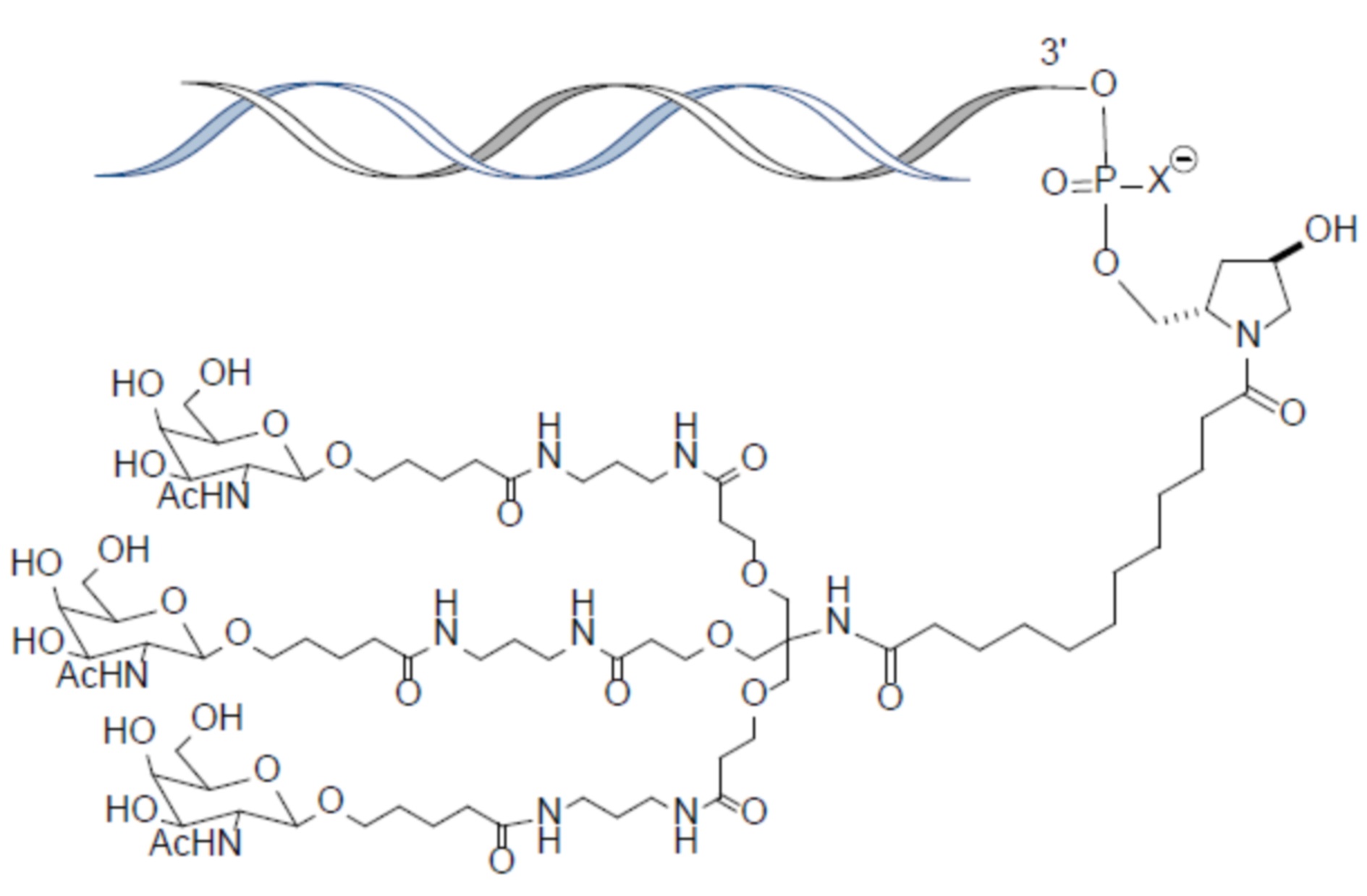



Комментарии