Способы и композиции для лечения персистирующих инфекций - RU2596491C2
Код документа: RU2596491C2
Чертежи
























Описание
ЗАЯВЛЕНИЕ О ФЕДЕРАЛЬНО-СПОНСИРУЕМЫХ ИССЛЕДОВАНИЯХ
Данное изобретение было сделано при поддержке правительства США в рамках грантов Национального Института Здоровья (NIH) AI39671 и CA84500. Правительство имеет определенные права на данное изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В целом, настоящее изобретение относится к способам и композициям для лечения персистирующей инфекции и рака.
УРОВЕНЬ ТЕХНИКИ
Несмотря на то, что развитие профилактических вакцин значительно снизило процент смертности от вирусных инфекций, использование указанных вакцин против вирусов, вызывающих персистирующие инфекции (например, вирус гепатита С), имело ограниченный успех. В отличие от вирусов, которые вызывают острые и самокупирующиеся инфекции, иммунный ответ, который устанавливается против микробов, вызывающих персистирующие инфекции, часто неустойчив и не достаточен для удаления инфекции. Как результат, инфекционный микроб остается внутри инфицированного субъекта длительное время, необязательно нанося постоянный ущерб организму.
Большим препятствием для устранения микробов, вызывающих персистирующие инфекции, является способность данных микробов обходить иммунную систему организма хозяина. Например, некоторые вирусы и паразиты подавляют у хозяина экспрессию молекул, необходимых для Т-клеточного распознавания инфекционных клеток. Персистирующие инфекции также вызывают функциональную недостаточность антигенспецифических CD8+ Т-клеток, которые являются жизненно необходимыми для контроля и устранения вирусных инфекций. Несмотря на то, что комбинация терапевтических вакцин с цитокиновыми адъювантами была обнадеживающей, получаемые иммунные ответы не устраняли патоген.
Таким образом, нужны улучшенные способы лечения, предотвращения или ослабления персистирующих инфекций.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способы и композиции для лечения, предотвращения или уменьшения, или альтернативно, смягчения одного или более симптомов персистирующей инфекции или рака. Изобретение основано на открытии, что антигенспецифические CD8+ T-клетки становятся функционально толерантными ("истощенными") к инфекционному агенту, в результате индукции полипептида 1 программированной смерти (PD-1). Соответственно, при уменьшении экспрессии или активности PD-1, PD-L1 или PDL-2 пролиферация функционально толерантных CD8+ T клеток, продукция цитокинов, и скорость удаления инфекционного агента (например, вирусного, бактериального, грибкового, паразитарного, микоплазменного или ракового) увеличивается, так что иммунный ответ, специфичный к инфекционному агенту, усиливается.
Соответственно, изобретение предоставляет способ ослабления или предотвращения симптома персистирующей инфекции (например, вирусной инфекции, бактериальной инфекции, грибковой инфекции, микоплазменной инфекции и паразитарной инфекции) или рака путем введения нуждающемуся в этом субъекту (например, человеку) соединения, которое уменьшает активность или экспрессию члена CD28-подобного семейства (например, PD-1, CTLA-4, BTLA и их функционального фрагмента или варианта) или лигандов CD28-подобного семейства (например, PD-L1 или PD-L1). Альтернативно, субъекту вводят антигенспецифические Т-клетки или В-клетки, на которые действовали соединением, которое снижает экспрессию или активность полипептида PD-1 в клетках. Например, антигенспецифические Т-клетки или В-клетки являются специфичными к вирусному антигену. Т-клетки или В-клетки происходят из аутологичного источника или происходят из другого субъекта того же вида или другого вида, нежели чем субъект, получающий лечение.
Кроме того, изобретение включает способ увеличения цитотоксической активности Т-клетки (например, анергической Т-клетки или Т-клетки, имеющей увеличенную толерантность к антигенам) взаимодействием Т-клетки с соединением, которое уменьшает активность или экспрессию полипептида PD-1.
Во всех вышеизложенных аспектах изобретения персистирующие вирусные инфекции являются результатом таких инфекций как вирус гепатита, вирус иммунодефицита человека (ВИЧ), Т-лимфотоксический вирус человека (HTLV), вирус герпеса, вирус Эпштейна-Барр или вирус папилломы человека. Персистирующие вирусные инфекции могут также включать в себя инфекции, вызванные латентным вирусом. Раковые заболевания включают в себя лимфопролиферативные нарушения, такие как ангиоиммунобластная лимфома и нодулярная с лимфоидным преобладанием лимфома Ходжкина. Желательно, чтобы соединение изобретения увеличивало антигенспецифический иммунный ответ путем увеличения цитотоксической Т-клеточной активности (например, увеличение цитотоксической продукции цитокинов, таких как INFγ,TNFα, IL-2, увеличение Т-клеточной пролиферации или увеличение выведения вирусов) у субъекта, получающего лечение. Например, соединение уменьшает экспрессию или активность PD лиганда 1 (PD-L1) или PD лиганда 2 (PD-L2) или уменьшает взаимодействие между PD-1 и PD-L1 или взаимодействие между PD-1 и PD-L2. Типичные соединения включают в себя антитела (например, анти-PD-1 антитело, анти-PD-L1 антитело, и анти-PD-L2 антитело), молекулы РНКи (например, анти-PD-1 РНКи молекулы, анти-PD-L1 РНКи и анти-PD-L2 РНКи), антисмысловые молекулы (например, анти-PD-1 антисмысловая РНК, анти-PD-L1 антисмысловая РНК и анти-PD-L2 антисмысловая РНК), доминантно-негативные белки (например, доминантно-негативный PD-1 белок, доминантно-негативный PD-L1 белок, и доминантно-негативный PD-L2 белок) и малые молекулы-ингибиторы. Антитела включают в себя моноклональные антитела, гуманизированные антитела и Ig-слитые белки. Типичное анти-PD-L1 антитело содержит клон EH12.
В дополнение к соединению, которое уменьшает PD-1 экспрессию или активность, субъекту, получающему лечение, может также быть введена вакцина, которая может содержать или не содержать адъювант или первую бустер-инъекцию. При желании, субъекту вводят второе соединение, такое как противовирусное соединение (например, видарабин, ацикловир, ганцикловир, валганцикловир, нуклеозид - аналог ингибитора обратной транскриптазы (NRTI), такой как AZT (зидовудин), ddI (диданозин), ddC (залцитабин), d4T(ставудин), или 3ТС (ламивудин), ненуклеозидный ингибитор обратной транскриптазы (NNRTI), такой как невирапин или делавирдин, ингибитор протеаз, такой как саквинавир, ритонавир, индинавир или нелфинавир, рибавирин и интерферон), противобактериальное соединение, противогрибковое соединение, противопаразитарное соединение, противовоспалительное соединение, антинеопластическое соединение или анальгетик. Второе соединение также может быть соединением, которое снижает экспрессию или активность цитотоксического Т-лимфоцитарного антигена 4 (CTLA-4), или В- и Т-лимфоцитарным аттенюатором (BTLA). Другие типичные соединения, которое могут быть введены субъекту, представляют собой анти-CTLA-4 антитела, анти-BTLA антитела, анти-CD28 антитела, анти-ICOS антитела, анти-ICOS-L антитела, анти-B7-1 антитела, анти-B7-2 антитела, анти-B7-H3 антитела или анти-B7-H4 антитела.
Настоящее изобретение далее предоставляет способ идентификации соединения-кандидата, которое бы изменяло активность или экспрессию полипептида PD-1, который включает в себя стадии: (а) воздействие на клетку, экспрессирующую PD-1 ген, (например, PD-1 гибридный ген) соединением-кандидатом; (b) измерение экспрессии или активности PD-1 в клетке (например, путем измерения экспрессии PD-1 мРНК или белка); (с) сравнение экспрессии или активности PD-1 в клетке с указанной экспрессией или активностью в контрольной клетке, на которую не действовали соединением. Увеличение или уменьшение экспрессии или активности PD-1 указывает на соединение-кандидат, как пригодное для изменения активности или экспрессии полипептида PD-1.
Альтернативно, метод скрининга может включать в себя стадии: (а) воздействие на Т-клетку, которая избыточно экспрессирует PD-1 ген, соединением-кандидатом; (b) определение цитотоксической активности Т-клетки; (с) сравнение цитотоксической активности Т-клетки с данной активностью в контрольной клетке, на которую не действовали соединением. Увеличение или уменьшение данной активности указывает на соединение-кандидат, как пригодное для изменения активности или экспрессии полипептида PD-1. Цитотоксическая активность включает в себя продукцию цитокинов, Т-клеточную пролиферацию и удаление вирусов.
Изобретение далее предоставляет способ скрининга, включающий в себя стадии: (а) воздействие на полипептид PD-1 соединением-кандидатом; (b) определение того, взаимодействует ли соединение-кандидат с полипептидом PD-1; (с) идентификация соединения-кандидата, как пригодного для изменения активности или экспрессии PD-1. Желательно, чтобы соединение-кандидат взаимодействовало с полипептидом PD-1 и снижало его активность.
Соединение-кандидат, установленное методами скрининга, описанными в настоящем документе, может уменьшать взаимодействие между PD-1 и PD-L1 или взаимодействие между PD-1 и PD-L2. Клетка, используемая в любом из методов скрининга, описанных в настоящем документе, включает в себя клетки млекопитающих, таких как клетки грызунов или клетки человека. Клетка является иммунной клеткой, такой как Т-клетка. Желательно, чтобы полипептид PD-1, применяемый в данных методах скрининга, представлял собой человеческий полипептид PD-1.
В настоящем документе также предоставлен способ диагностики субъекта, имеющего персистирующую инфекцию или рак или с повышенным риском их иметь, включающий в себя стадии: (а) предоставление образца, содержащего иммунные клетки (например, Т-клетку или В-клетку) субъекта, и (b) измерение экспрессии или активности PD-1 в образце. Увеличение экспрессии или активности PD-1 по сравнению с соответствующей экспрессией или активностью в контрольном образце идентифицирует субъекта, как имеющего персистирующую инфекцию или рак или с повышенным риском их иметь. Желательно, чтобы стадия (b) включала в себя иммунные клетки, специфически идентифицирующие антигены, такие как вирусный антиген, бактериальный антиген, паразитарный антиген или грибковый антиген.
Также описан способ выбора лечения для субъекта, имеющего или с повышенным риском иметь персистирующую инфекцию или рак. Данный метод включает в себя стадии: (а) предоставление пробы, содержащей иммунные клетки (например, Т-клетку или В-клетку) от субъекта, и (b) измерение экспрессии или активности PD-1 в иммунных клетках, так что увеличение экспрессии или активности PD-1 по сравнению с данной экспрессией или активностью в контрольном образце идентифицирует субъекта, как имеющего персистирующую инфекцию или рак или с повышенным риском их иметь; (с) выбор метода лечения для субъекта, у которого диагностированы персистирующая инфекция или рак или существует высокий риск их иметь, так что лечение включает в себя соединение, которое снижает экспрессию или активность PD-1. Желательно, чтобы стадия (b) включала в себя иммунные клетки, специфически идентифицирующие антигены, такие как вирусный антиген, бактериальный антиген, паразитарный антиген или грибковый антиген.
Образцы, полученные от субъектов, включают в себя пробы крови, биопсии тканей, образцы костного мозга. Кроме того, контрольные клетки могут быть получены от субъекта, у которого не обнаружена персистирующая инфекция или нет ее повышенного риска.
Далее, изобретение предоставляет композицию, которая содержит: (а) соединение, которое снижает уровень или активность PD-1; и (b) второй компонент, такой как противовирусное соединение, противобактериальное соединение, противогрибковое соединение, противопаразитарное соединение, противовоспалительное соединение, анальгетик, анти-CTLA-4 антитело, анти-BTLA антитело, анти-CD28 антитело, анти-ICOS антитело, анти-ICOS-L антитело, анти-B7-1 антитело, анти-B7-2 антитело, анти-B7-H3 антитело или анти-B7-H4 антитело.
Изобретение также предоставляет набор, который содержит (а) соединение, которое снижает или активность PD-1; и (b) инструкции по отпуску соединения субъекту. Альтернативно, набор содержит (а) первый компонент, который снижает уровень или активность PD-1; (b) второй компонент, такой как противовирусное соединение, противобактериальное соединение, противогрибковое соединение, противопаразитарное соединение, противовоспалительное соединение, анальгетик, анти-CTLA-4 антитело, анти-BTLA антитело, анти-CD28 антитело, анти-ICOS антитело, анти-ICOS-L антитело, анти-B7-1 антитело, анти-B7-2 антитело, анти-B7-H3 антитело или анти-B7-H4 антитело; и (с) инструкции по отпуску первого соединения и второго соединения субъекту.
Настоящее изобретение предоставляет значительные преимущества по сравнению со стандартными терапиями для лечения, предотвращения и уменьшения, или, альтернативно, ослабления одного или более симптомов персистирующих инфекций. Введение терапевтического агента, который снижает уровень или активность PD-1, увеличивает CD8+ T-клеточную цитотоксичность, которая в свою очередь увеличивает иммунный ответ на инфекционный агент, способный вызвать персистирующую инфекцию. Кроме того, способы скрининга соединения-кандидата, предоставленные настоящим изобретением, предусматривают идентификацию новых лекарств, которые изменяют процесс повреждения, скорее, чем просто смягчают симптомы.
За исключением определенных иным образом, все технические и научные термины, использованные в настоящем документе, имеют то же значение, что и обычно понимаемо специалистом с обычными навыками в области, к которой принадлежит изобретение. Хотя способы и материалы, похожие или эквивалентные тем, которые описаны в настоящем документе, могут быть использованы на практике или при тестировании настоящего изобретения, подходящие способы и материалы описаны далее. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем документе, включены целиком в виде ссылок. В случае конфликтования настоящее патентное описание, включая определения, будет иметь преимущественную силу. Кроме того, материалы, способы и примеры являются только иллюстрациями и не мыслятся в качестве ограничений.
Другие особенности и преимущества изобретения станут очевидными из последующего детального описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1А представляет собой столбчатую диаграмму, изображающую уровни PD-1 мРНК в DbGP33-41 и/или DbGP276-286 специфических Т-клетках интактных трансгенных мышей, Армстронг-иммунных мышей, зараженных вирусом лимфатического хориоменингита (LCMV) (приблизительно 30 дней постинфекции), или CD4-истощенных LCMV-C1-13 инфицированных мышей (приблизительно 30 дней постинфекции), измеренные с помощью анализа генных панелей.
Фиг.1В представляет собой серию изображений эксперимента проточной цитометрии, показывающих поверхностную экспрессию PD-1 на CD8+ тетрамер+ Т-клетках у LCMV Армстронг-иммунных мышей и у CD4-истощенных LCMV-C1-13 инфицированных мышей, 60 дней постинфекции. Анергические CD8+ Т-клетки экспрессируют высокий уровень полипептида PD-1 на поверхности клетки спустя приблизительно 60 дней хронической инфекции, вызванной вирусом LCMV-C1-13 (отмечены как "хронические"), но вирус-специфические CD8+ Т-клетки не экспрессируют полипептид PD-1 после устранения острой LCMV Армстронг инфекции (отмечены как "иммунные").
Фиг.1С представляет собой серию изображений эксперимента проточной цитометрии, показывающих наличие PD-L1 на лимфоцитах хронически инфицированных и неинфицированных мышей. Показано, что экспрессия PD-L1 является самой высокой на спленоцитах, которые инфицированы вирусом.
Фиг.2А представляет ряд диаграмм разброса, показывающие, что, если С1-13 инфицированные мыши получали лечение с 23 по 37 день после инфицирования, то наблюдалось приблизительно 3-х кратное увеличение количества DbNP396-404 специфических и DbGP33-41 специфических CD8 Т-клеток, по сравнению с контрольной группой, не получавшей лечение. Для определения функциональных изменений, измеряли продукцию IFN-γ и TNF-α в ответ на 8 различных LCMV эпитопов.
Фиг.2В представляет собой диаграмму разброса, показывающую, что если измерить все известные CD8 T-клеточные специфичности, то наблюдается увеличение в 2,3 раза общего количества LCMV-специфических CD8 T-клеток.
Фиг.2С представляет собой серию графиков проточной цитометрии, на которых представлена продукция IFN-γ и TNF-α в ответ на восемь различных LCMV эпитопов.
Фиг.2D представляет собой диаграмму разброса, показывающую, что более вирус-специфические CD8 T-клетки у мышей, получавших лечение, имеют способность продуцировать TNF-α.
Фиг.2Е представляет собой серию столбчатых диаграмм, показывающую, что блок PD-L1 также приводит к увеличению вирусного контроля в селезенке, печени, легких и сыворотке крови.
Фиг.3А представляет собой график, на котором показано увеличение DbGP33-41 и DbGP276-286 специфических CD8 Т-клеток (отмеченных как "GP33" и "GP276") у CD4 истощенных С1-13 инфицированных мышей, которые получали анти-PD-L1 (обозначены как "αPD-L1") с 46 по 60 день постинфекции, по сравнению с контролем (обозначенным как "untx"), который показывает, что мыши, получавшие анти-PD-L1, имели приблизительно в 7 раз больше DbGP276-286 специфических селезеночных CD8 Т-клеток и приблизительно в 4 раза больше DbGP33-41 специфических селезеночных CD8 Т-клеток, чем контрольные мыши.
Фиг.3В представляет собой серию изображений, на которых показана повышенная частота встречаемости DbGP33-41 и DbGP276-286 специфических CD8+ Т-клеток в селезенке CD4 истощенных С1-13 инфицированных мышей, получавших анти-PD-L1 (обозначены как "αPD-L1 Tx") с 46 по 60 день постинфекции, по сравнению с контролем (обозначенным как "untx").
Фиг.3С представляет собой серию изображений, на которых показана увеличенная пролиферация DbGP276-286 специфических CD8+ Т-клеток у мышей, получавших анти-PD-L1, измеренная путем поглощения BrdU и экспрессии Ki67.
Фиг.3D представляет собой график, на котором показано, что мыши с высоким уровнем размножения CD8+ Т-клеток демонстрируют существенный ответ мононуклеарных клеток периферической крови (PBMC), как показано путем сравнения DbGP276-286 специфических CD8+ Т-клеток в PBMC и DbGP276-286 специфических CD8+ Т-клеток в селезенке.
Фиг.4А представляет собой серию графиков, на которых показано увеличение DbGP276-286 и DbGP33-41 специфических CD8+ Т-клеток, продуцирующих IFN-γ, у мышей, получавших анти-PD-L1, по сравнению с контролем. Повышенную частоту встречаемости DbNP396-404, KbNP205-212, DbNP166-175 и DbGP92-101 специфических CD8+ Т-клеток также обнаружили у мышей, получавших анти-PD-L1.
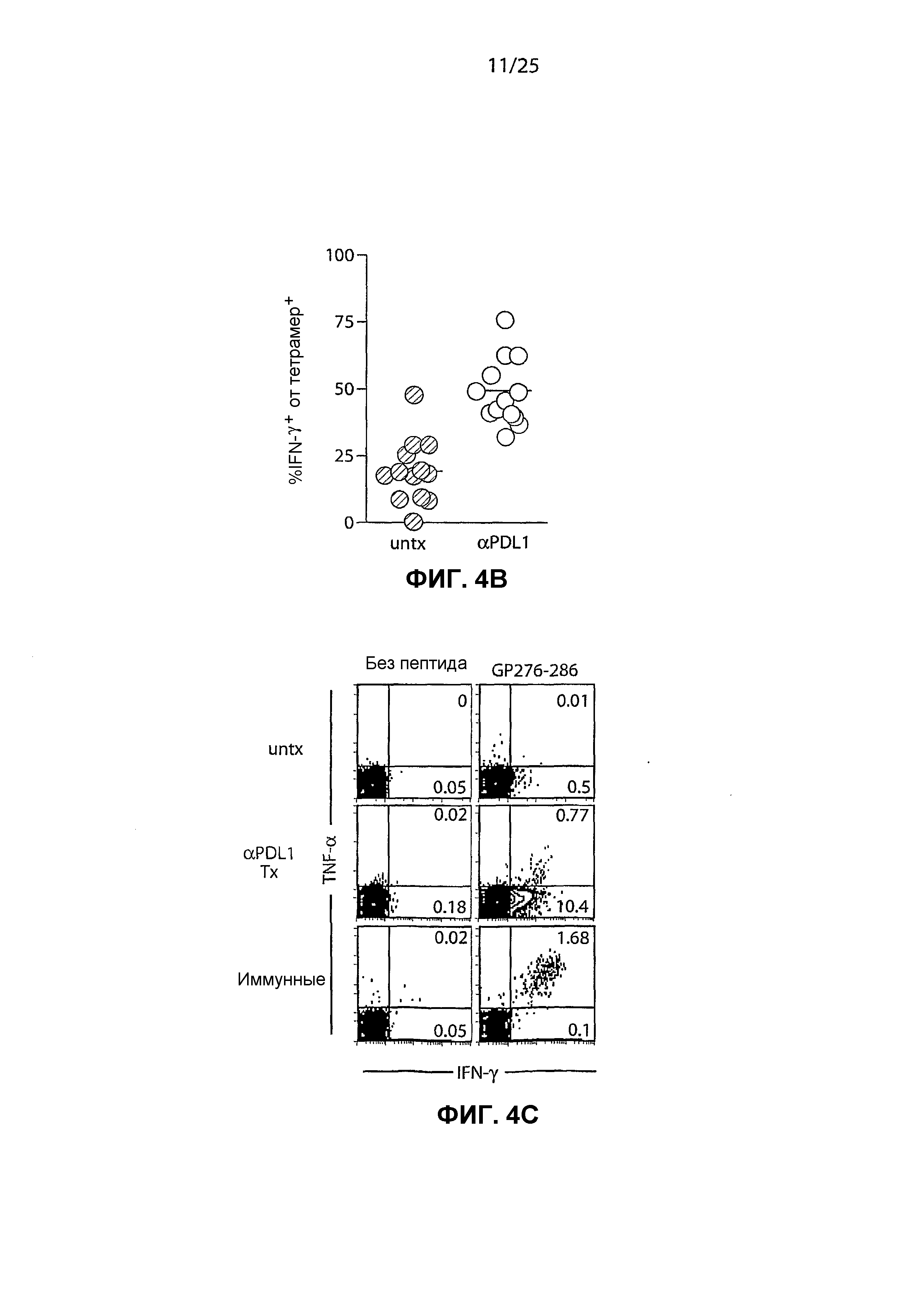
Фиг.4В представляет собой график, на котором показано, что у мышей, получавших анти-PD-L1, 50% DbGP276-286 специфических CD8+ Т-клеток продуцируют IFN-γ, по сравнению с 20% DbGP276-286 специфических CD8+ Т-клеток у мышей контрольной группы.
Фиг.4С представляет собой серию графиков, на которых показано, что хронически инфицированные мыши, получавшие анти-PD-L1, продуцируют более высокий уровень TNF-α, чем хронически инфицированные мыши, не получавшие анти-PD-L1, но, однако, они продуцируют более низкий уровень TNF-α, чем иммунные мыши, инфицированные вирусом LCMV Армстронга.
Фиг.4D представляет собой график, на котором показано, что лечение мышей, инфицированных LCMV-С1-13, с помощью анти-PD-L1 восстанавливает ex vivo литическую активность вирус-специфических Т-клеток, измеренную по высвобождению51Cr, по сравнению с инфицированными мышами, не получавшими лечения.
Фиг.4E представляет собой серию графиков, на которых показано уменьшение вирусных титров в различных органах после лечения α-PD-L1 мышей, инфицированных LCMV-С1-13. Вирусные титры снижались приблизительно в 3 раза в селезенке, в 4 раза в печени, в 2 раза в легких и в 2 раза в сыворотке крови через 2 недели анти-PD-L1 лечения, по сравнению с мышами, не получавшими лечения.
Фиг.5А представляет собой серию изображений проточной цитометрии, на которых показана поверхностная экспрессия PD-1, использующая 10 ВИЧ тетрамеров, специфичных к доминантным эпитопам, целевых при хронической инфекции клада С ВИЧ. В процентах показан процент тетрамер+ клеток, которые являются PD-1+.
Фиг.5В представляет собой серию графиков, на которых показано что процентное содержание и MFI PD-1 значительно возрастают на ВИЧ-специфических CD8 Т-клетках, по сравнению с общей популяцией CD8 Т-клеток (р<0,0001), при противоретровирусной терапии интактных субъектов, и PD-1 увеличивается в общей популяции CD8 Т-клеток у ВИЧ-инфицированных, по сравнению с ВИЧ-серонегативным контролем (р=0,0033 и р<0,0001, соответственно). В исследование были включены 120 ВИЧ тетрамерных мазков от 65 ВИЧ-инфицированных субъектов и 11 ВИЧ-серонегативных контролей.
Фиг.5С представляет собой серию графиков, на которых показаны среднее процентное содержание и MFI экспрессии PD-1 на тетрамер+ клетках в зависимости от специфичности эпитопа.
Фиг.5D представляет собой график, на котором изображены вариации процентного содержания PD-1+клеток в различных эпитоп-специфических популяциях у субъектов с множественными определяемыми ответами. Горизонтальные линии показывают среднее процентное значение PD-1+ ВИЧ тетрамер+ клеток у каждого субъекта.
Фиг.6А представляет собой серию графиков, на которых показано отсутствие корреляции между количеством ВИЧ-специфических CD8 Т-клеток, установленным по окраске тетрамера, и по вирусной нагрузкой плазмы крови, тогда как есть положительная корреляция как между процентным содержанием так и между MFI PD-1 на тетрамер+ клетках и вирусной нагрузкой плазмы крови (р=0,0013 и р<0,0001, соответственно).
Фиг.6В представляет собой серию графиков, на которых показано отсутствие корреляции между количеством ВИЧ тетрамер+ клеток и общим количеством CD4, в то время как существует обратная зависимость между процентным содержанием и MFI PD-1 на ВИЧ тетрамер+ клетках и общим количеством CD4 (р=0,0046 и р=0,0150, соответственно).
Фиг.6С представляет собой серию графиков, на которых показано, что процентное содержание и MFI PD-1 в общей популяции CD8 Т-клеток находятся в прямой связи с вирусной нагрузкой плазмы крови (р=0,0021 и р<0,0001, соответственно).
Фиг.6D представляет собой серию графиков, на которых показано, что процентное содержание и MFI экспрессии PD-1 в общей популяции CD8 Т-клеток находятся в обратной связи с общим количеством CD4 (р=0,0049 и р<0,0006, соответственно).
Фиг.7А представляет собой серию изображений эксперимента проточной цитометрии, представляющих показательное фенотипическое окрашивание B*4201 TL9-специфических CD8 Т-клеток от субъекта SK222, у которого 98% B*4201 TL9-специфических CD8 Т-клеток являются PD-1+.
Фиг.7В представляет собой график, иллюстрирующий обобщение фенотипических данных субъектов, у которых >95% ВИЧ-специфических CD8 Т-клеток являются PD-1+. Исследовали от 7 до 19 образцов для каждого из указанных фенотипических маркеров. Горизонтальные линии обозначают среднее процентное содержание тетрамер+ PD-1+ клеток, которые являлись положительными на указанный маркер.
Фиг.8А представляет собой серию изображений эксперимента проточной цитометрии, на которых показаны результаты исследования пролиферации у B*4201 положительного субъекта. Через 6 дней стимуляции пептидом процентное содержание B*4201 TL9-специфических CD8 Т-клеток возросло с 5,7% до 12,4% в присутствии анти-PD-L1 блокирующего антитела.
Фиг.8В представляет собой линейчатый график, на котором изображены данные исследования суммарной пролиферации, которые показывают значительное увеличение пролиферации ВИЧ-специфических CD8 Т-клеток в присутствии анти-PD-L1 блокирующего антитела (n=28, p=0,0006, парный t-критерий Стьюдента).
Фиг.8С представляет собой столбчатую диаграмму, на которой показаны различные эффекты PD-1/PD-L1 блокирования на пролиферацию ВИЧ-специфических CD8 Т-клеток у индивидуальных пациентов. Белыми столбцами показано кратное увеличение тетрамер+ клеток в присутствии только пептида, черными столбцами показано кратное увеличение тетрамер+ клеток в присутствии пептида плюс анти-PD-L1 блокирующего антитела. Субъекты, у которых CFSE исследование проводили более чем для одного эпитопа, отмечены звездочкой, квадратом и треугольником.
ПОДРОБНОЕ ОПИСАНИЕ
Применение антибиотиков и вакцин в последние десятилетия значительно снизило уровень смертности от микробных инфекций. Однако успех возможностей противомикробного лечения ограничен из-за способности некоторых инфекционных агентов обходить иммунную систему организма хозяина и, в свою очередь, вызывать персистирующую инфекцию. Например, иммунный ответ, который устанавливается против вирусов, таких как вирус гепатита или ВИЧ, является недостаточным для удаления инфекционного агента, который остается в инфицированном субъекте. При данных инфекциях антигенспецифические CD8+ Т-клетки становятся функционально толерантными к инфекционному агенту в состоянии, известном как "толерантность" или "истощение". Толерантные Т-клетки теряют свою цитотоксическую активность, т.е. свою способность продуцировать цитокины, пролиферировать и удалять инфекционный агент.
Настоящее изобретение основано на неожиданном открытии, что Т-клеточная толерантность сопровождается индукцией экспрессии PD-1. и что экспрессия PD-1 имеет связь с определенными типами лимфопролиферативных заболеваний. Таким образом, изобретение предоставляет способы увеличения Т-клеточной цитотоксичности путем взаимодействия Т-клетки с агентом, который снижает экспрессию или активность PD-1, PD-1 лиганда (PD-L1) или PD-1 лиганда 2 (PD-L2). Более подробно, изобретение предоставляет способы лечения или предотвращения персистирующей инфекции или лимфопролиферативных заболеваний (например, раковых заболеваний, таких как ангиоиммунобластическая лимфома и нодулярная с лимфоидным преобладанием лимфома Ходжкина) путем введения субъекту антигена, который снижает экспрессию или активность PD-1. Снижение экспрессии или активности PD-1, PD-L1 или PD-L2 приводит к увеличению цитотоксической Т-клеточной активности, увеличению специфического иммунного ответа на инфекционный агент. Представленные в настоящем документе результаты показывают, что введение антител, блокирующих лиганд-1 программируемой смерти (PD-L1), увеличивает цитотоксическую активность толерантных Т-клеток. В частности, нарушение PD-1 передачи сигнала вызывает распространение толерантных CD8+ Т-клеток, усиленную продукцию цитокинов и увеличенное удаление вирусов из организма.
Кроме того, CD8+ Т-клетки, образованные при персистирующих инфекциях CD4 истощенных мышей, пролиферировали и восстанавливали многие свои функции при лечении анти- PD-L1. Для того чтобы Т-клетки реагировали на чужеродные белки, антигенпредставляющие клетки (APC) должны дать два сигнала покоящимся Т-лимфоцитам. Первый сигнал, который придает специфичность иммунному ответу, передается через Т-клеточный рецептор (TCR) после распознавания чужеродного антигенного пептида, представленного в связи с главным комплексом гистосовместимости (MHC). Второй сигнал, называемый костимуляцией, стимулирует Т-клетки к пролиферации и становлению функциональными. Костимуляция не является ни антигенспецифической, ни MHC-ограниченной, и обеспечивается одним или двумя определенными полипептидами на клеточной поверхности, экспрессируемыми АРС. Если Т-клетки стимулируются только через Т-клеточный рецептор, без получения дополнительного костимулирующего сигнала то они становятся не отвечающими, истощенными или погибают, что приводит к ослаблению иммунного ответа.
Белки CD80(B7-1) и CD86 (B7-2), экспрессируемые на АРС, являются критическими костимуляторными полипептидами. В то время как B7-2 играет главную роль в первичном иммунном ответе, B7-1 активируется позднее в ходе иммунного ответа для продления первичного Т-клеточного ответа или костимуляции вторичного Т-клеточного ответа. Полипептиды В7 способны давать иммунным клеткам костимуляторные или ингибиторные сигналы для стимулирования или ингибирования иммунных клеточных реакций. Например, при связывании с костимуляторным рецептором PD-L1 (B7-4) вызывает костимуляцию иммунных клеток или, если он представлен в растворимой форме, то ингибирует костимуляцию иммунных клеток. При связывании с ингибиторным рецептором молекулы B7-4 могут передавать ингибиторный сигнал иммунной клетке. Типичные члены семейства B7 включают в себя B7-1, B7-2, B7-3 (распознаваемый антителом BB-I), B7h (PD-Ll) и B7-4, а также их растворимые фрагменты и производные. Члены семейства B7 связываются с одним или более рецептором на иммунной клетке, такими как CTLA4, CD28, ICOS, PD-I и/или другими рецепторами и в зависимости от рецептора способны передать ингибиторный сигнал или костимуляторный сигнал иммунной клетке.
CD28 представляет собой рецептор, который экспрессируется на покоящихся Т-клетках. После передачи сигнала через Т-клеточный рецептор, лигирования CD28 и преобразования стимулирующий сигнал стимулирует Т-клетки к пролиферации и секреции IL-2. CTLA4 (CD152), рецептор гомологичный CD28, не представлен на покоящихся Т-клетках, но его экспрессия стимулируется после Т-клеточной активации. CTLA4 играет роль в отрицательной регуляции Т-клеточного ответа. ICOS, полипептид, относящийся к CD28 и CTLA4, участвует в продукции IL-10. PD-1, рецептор с которым связываются PD-L1 и PD-L2, также быстро активируется на поверхности Т-клеток. PD-1 также экспрессируется на поверхности В-клеток (в ответ на анти-IgM) и на субпопуляциях тимоцитов и миелоидных клеток.
Захват PD-1 (например, путем образования перекрестных связей или агрегации) приводит к передаче ингибиторного сигнала в иммунную клетку, дающего в результате уменьшение иммунного ответа, сопровождающегося увеличением толерантности иммунной клетки. Члены семейства PD-1 связываются с одним или более рецепторами, таким как PD-L1 и PD-L2 на антигенпредставляющих клетках. PD-L1 и PD-L2, которые представляют собой человеческие PD-1 лигандные полипептиды, являются членами семейства В7 полипептидов. Каждый лиганд PD-1 содержит сигнальную последовательность, домен IgV, домен IgC, трансмембранный домен и короткий цитоплазматический хвост. Данные лиганды экспрессируются в плаценте, селезенке, лимфатических узлах, тимусе и сердце. PD-L2 также экспрессируется в поджелудочной железе, легких, печени, в то время как PD-L1 экспрессируется в фетальной печени, на активированных Т-лимфоцитах и эндотелиальных клетках. Оба PD-1 лиганда активируются на активированных моноцитах и дендритных клетках.
ОПРЕДЕЛЕНИЯ
Используемым в настоящем документе термином "персистирующая инфекция" обозначают инфекцию, при которой инфекционный агент (например, вирус, бактерия, паразит, микоплазма или грибок) не удаляется или не уничтожается в инфицированном хозяине, даже после активации иммунного ответа.
Персистирующие инфекции могут быть хроническими инфекциями, латентными инфекциями или медленными инфекциями. В то время как острые инфекции являются относительно кратковременными (длящимися от нескольких дней до нескольких недель) и устраняются из организма иммунной системой, персистирующие инфекции могут длится месяцами, годами или даже на протяжении всей жизни. Данные инфекции также могут возникать вновь через продолжительный период времени, включая в себя стадии латентной и продуктивной инфекции без истребления клеток или даже избыточного повреждения клеток хозяина. Инфекционные агенты также могут быть обнаружены в хозяине (например, внутри специфических клеток инфицированных субъектов) даже после того, как иммунный ответ разрешился, с помощью специальных методов. Млекопитающих диагностируют как имеющих персистирующую инфекцию, согласно любому стандартному способу, известному в данной области техники и описанному, например, в патентах США № 6368832, 6579854 и 6808710 и публикациях патентных заявок США № 20040137577, 20030232323, 20030166531, 20030064380, 20030044768, 20030039653, 20020164600, 20020160000, 20020110836, 20020107363 и 20020106730, которые включены в виде ссылок в настоящий документ. Например, у субъекта может быть диагностирована персистирующая хламидийная инфекция после определения видов хламидии в биологической пробе от данного субъекта ПЦР анализом. Млекопитающих не нужно диагностировать на персистирующую инфекцию, чтобы проводить лечение согласно данному изобретению. Микробные агенты, способные вызвать персистирующую инфекцию включают в себя вирусы (например, вирус папилломы, вирус гепатита, вирус иммунодефицита человека и вирус герпеса), бактерии (например, виды Escherichia coli и Chlamydia), паразиты (например, Plasmodium, виды Leishmania, виды Schistosoma, виды Trypanosoma, виды Toxoplasma) и грибы.
Под термином "облегчение симптома персистирующей инфекции" понимают улучшение любого из состояний или симптомов, связанных с персистирующей инфекцией до или после того, как она проявляется. Альтернативно, облегчение симптома персистирующей инфекции может подразумевать снижение инфекционной микробной (например, вирусной, бактериальной, грибковой, микоплазменной или паразитарной) нагрузки у субъекта, относительно данной нагрузки в контроле без лечения. По сравнению с эквивалентным контролем без лечения, указанное снижение или степень профилактики составляет, по меньшей мере, 5%, 10%, 20%, 40%, 50%, 60%, 80%, 90%, 95% или 100% при измерении любым стандартным методом. Предпочтительно, персистирующая инфекция полностью устраняется согласно измерению любым стандартным методом, известным в данной области техники, и в таком случае персистирующую инфекцию расценивают как излеченную. Пациент, который получает лечение от персистирующей инфекции, является тем, у кого медицинский работник диагностировал данное состояние. Диагноз может быть установлен любыми подходящими способами. Диагноз и мониторинг может включать в себя, например, определение уровня микробной нагрузки в биологической пробе (например, образец ткани, проба крови или проба мочи), определение уровня идентификационного маркера микробной инфекции в биологической пробе, обнаружение симптомов, связанных с персистирующей инфекцией, или обнаружение иммунных клеток, вовлеченных в иммунный ответ, типичный для персистирующих инфекций (например, определение антигенспецифических Т-клеток, которые являются толерантными). Пациент, у которого предотвращено развитие персистирующей инфекции, может получить или не получить данный диагноз. Специалист в данной области понимает, что данные пациенты могли быть подвергнуты тем же самым стандартным тестам, что и описанные выше, или они могли быть определены без обследования, как имеющие высокий риск, вследствие наличия одного или более факторов риска (например, история семьи или воздействие инфекционного агента).
В настоящем документе под "PD-1" понимают полипептид, который образует комплекс с белками PD-L1 или PD-L2 и таким образом вовлекается в иммунный ответ, такой как костимуляция Т-клеток. Белки PD-1 изобретения являются, по существу, идентичными обнаруженным в природе PD-1 (смотри, например, Ishida и др. EMBO J. 11: 3887-3895, 1992, Shinohara и др. Genomics 23:704-706, 1994; и патент США № 5698520, включенный в виде ссылки в настоящий документ). Передача PD-1сигнала может уменьшить, например, CD8+ Т-клеточную цитотоксичность путем уменьшения Т-клеточной пролиферации, продукции цитокинов или уменьшением удаления вирусов. Согласно настоящему изобретению, полипептид PD-1 уменьшает CD8+ Т-клеточную цитотоксичность, по меньшей мере, на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, или более чем на 100% ниже контрольных значений при измерении любым стандартным методом.
Под "PD-1 геном" понимают нуклеиновую кислоту, которая кодирует белок PD-1.
Под "PD-1 гибридным геном" понимают PD-1 промотор и /или весь или часть PD-1 кодирующий регион, связанный со второй гетерозиготной нуклеиновой последовательностью. В предпочтительных воплощениях вторая гетерозиготная последовательность нуклеиновых кислот является репортерным геном, который представляет собой ген, экспрессия которого может быть анализирована; репортерные гены включают в себя, без ограничения, те, которые кодируют глукоронидазу (GUS), люциферазу, хлорамфениколтрансацетилазу (САТ), зеленый флуоресцентный белок (GFP), щелочную фосфатазу и бета-галактозидазу.
Под "уменьшением экспрессии или активности PD-1" понимают уменьшение уровня или биологической активности PD-1 относительно уровня или биологической активности PD-1 в контроле без лечения. Согласно настоящему изобретению указанный уровень или активность снижаются, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или даже более чем на 100% относительно контроля без лечения. Например, биологическая активность PD-1 уменьшается, если уменьшается связывание PD-1 с PD-L1, PD-L2 или с ними обоими, что вызывает уменьшение передачи PD-1 сигнала и, следовательно, приводит к увеличению CD8+ Т-клеточной цитотоксичности. Использованный в настоящем документе термин "активность" в отношении полипептида PD-1 включает в себя любую активность, которая характерна для существующего в природе белка PD-1, такую как способность изменять ингибиторный сигнал в активированной иммунной клетке, например, путем соединения с натуральным лигандом на антигенпредставляющей клетке. Указанное изменение ингибиторного сигнала в иммунной клетке дает в результате изменение пролиферации и/или секреции цитокинов иммунной клеткой. PD-1 также может изменять костимуляторный сигнал путем конкурирования с костимуляторным рецептором для связывания молекулы В7. Таким образом, термин "активность PD-1" включает в себя способность полипептида PD-1 связываться со своим природным лигандом (лигандами), способность изменять костимуляторные и ингибиторные сигналы в иммунных клетках и способность изменять иммунный ответ. Соответственно уменьшение активности PD-1 включает в себя уменьшение взаимодействия PD-1 с PD-L1 или с PD-L2. Уменьшение активности PD-1 может быть достигнуто, например, блокированием PD-L1 или PD-L2.
Под "иммунной клеткой" понимают клетку гематопоэтического происхождения, которая играет роль в иммунном ответе. Иммунные клетки включают в себя лимфоциты (например, В-клетки и Т-клетки), натуральные киллерные клетки и миелоидные клетки (например, моноциты, макрофаги, эозинофилы, тучные клетки, базофилы и гранулоциты).
Под "Т-клеткой" понимают CD4+ или CD8+ Т-клетку. Термин "Т-клетка" включает в себя как TH1, так и TH2 клетки.
Термин "Т-клеточная цитотоксичность" включает в себя любой иммунный ответ, который опосредуется CD8+ Т-клеточной активностью. Типичные иммунные ответы включают в себя продукцию цитокинов, CD8+ Т-клеточную пролиферацию, продукцию гранзима или перфорина и удаление инфекционного агента.
Термин "отсутствие отвечаемости" относится к неспособности иммунных клеток реагировать на стимуляцию, например, на стимуляцию, опосредованную активацией рецептора или на стимуляцию цитокином. Отсутствие отвечаемости может возникнуть, например, из-за воздействия иммунодепрессантов или воздействия высоких доз анитигена. В настоящем документе термин "анергия" или "толерантность" относится к неспособности реагировать на активирующую рецептор-опосредованную стимуляцию. Данное отсутствие реакции обычно является антигенспецифическим и сохраняется после прекращения воздействия антигена, вызывающего толерантность. Например, толерантность Т-клеток (в отличие от отсутствия отвечаемости) характеризуется отсутствием продукции цитокинов, например, IL-2. Т-клеточная толерантность наблюдается, когда Т-клетки подвергаются воздействию антигена и получают первый сигнал (сигнал опосредован через Т-клеточный рецептор или CD-3 опосредованный сигнал) при отсутствии второго сигнала (костимуляторный сигнал). При данных условиях повторное воздействие на клетки тем же самым антигеном (даже если повторное воздействие происходит в присутствии костимулирующей молекулы) приводит к отсутствию продукции цитокинов и, таким образом, к отсутствию пролиферации. Однако толерантные Т-клетки могут отвечать на неродственные антигены и могут пролиферировать при культивировании с цитокинами (например, IL-2). Например, Т-клеточную толерантность также можно наблюдать при недостатке продукции IL-2 Т-лимфоцитами, который измеряют ИФА или в пролиферативном тесте на индикаторной клеточной линии. Альтернативно, может быть использована конструкция репортерного гена. Например, толерантные Т-клетки не в состоянии инициировать транскрипцию гена IL-2, индуцированную гетерологичным промотором под контролем 5' энхансера гена IL-2 или мультимером АР1 последовательности, которая может быть обнаружена внутри энхансера (Kang и др. Science 257: 1134, 1992). Толерантные антигенспецифические Т-клетки могут иметь снижение цитотоксической активности, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или даже на 100% относительно соответствующих контрольных антигенспецифических Т-клеток.
Под "очищенным антителом" понимают антитело, которое, по меньшей мере, на 60% (по весу) свободно от белков или природных органических молекул с которыми оно связано естественным образом. Предпочтительно, препарат является, по меньшей мере, на 75%, более предпочтительно на 90%, и наиболее предпочтительно, по меньшей мере, на 99% (по весу) антителом, например, PD-I, PD-Ll и PD-L2 специфическим антителом. Очищенные антитела можно получить, например, аффинной хроматографией с использованием рекомбинантного белка или пептидов с консервативными мотивами и стандартными способами.
Под "связывается специфически" понимают антитело, которое распознает и связывает антиген, такой как PD-I, PD-Ll или PD-L2 полипептиды, но которое в основном не распознает и не связывает другие не антигенные молекулы в пробе, например, в биологическом образце, который по своей природе содержит белок. Предпочтительное антитело связывается с PD-I, PD-Ll или PD-L2 полипептидами, раскрытыми в патенте США № 6808710 публикациях патентных заявок США № 20040137577, 20030232323, 20030166531, 20030064380, 20030044768, 20030039653, 20020164600, 20020160000, 20020110836, 20020107363, и 20020106730, которые включены в настоящий документ в виде ссылок.
Под "нейтрализующими антителами" понимают антитела, которые препятствуют проявлению любой из биологических активностей полипептида PD-I, в частности способности полипептида PD-I снижать иммунный ответ, такой как цитотоксичность Т-клеток. Нейтрализующие антитела могут уменьшать способность полипептида PD-I снижать иммунный ответ, предпочтительно, на 50%, более предпочтительно, на 70%, и наиболее предпочтительно, на 90% и более. Любое стандартное исследование для измерения иммунного ответа, включая исследования, описанные в настоящем документе, может быть использовано для оценки потенциально нейтрализующих антител.
Под термином "в основном идентичный" в отношении белка или полипептида понимают белок или полипептид, демонстрирующий, по меньшей мере, 75%, предпочтительно, 85%, более предпочтительно 90%, наиболее предпочтительно 95%, или даже 99% идентичности с контрольной аминокислотной последовательностью. Для белков и полипептидов длина сравниваемых последовательностей обычно составляет, по меньшей мере, 20 аминокислот, предпочтительно, по меньшей мере, 30 аминокислот, более предпочтительно, по меньшей мере, 40 аминокислот и наиболее предпочтительно 50 аминокислот или полноразмерный белок или полипептид. Нуклеиновые кислоты, которые кодируют данные "в основном идентичные" белки или полипептиды, представляют собой пример "в основном идентичных" нуклеиновых кислот; учитывается, что, вследствие вырожденности генетического кода, нуклеиновые кислоты имеют в своем составе любую последовательность, которая кодирует их белки или полипептиды. Кроме того, "в основном идентичная" последовательность нуклеиновых кислот также содержит полинуклеотид, который гибридизирован с контрольной молекулой нуклеиновой кислоты при строгих условиях.
Под "строгими условиями" понимают любой набор условий, которые характеризуются высокой температурой и низкой ионной концентрацией и допускают гибридизацию, сравнимую с той, которую получают при использовании пробы ДНК длиной, по меньшей мере, 40 нуклеотидов, в буфере, содержащем 0,5М NaHPO4, pH 7,2, 7% SDS, 1 мM ЭДТА и 1% БСА (фракция V) при температуре 65°C, или в буфере, содержащем 48% формамид, 4,8XSSC, 0,2M Трис-Cl, pH 7,6, 1 X раствор Denhardt's, 10% декстран сульфат и 0,1% SDS, при температуре 42°C. Другие условия для строгой гибридизации, такой как для ПЦР, норзерн, саузерн или in situ гибридизации, ДНК секвенирования и т.д. хорошо известны специалистам в области молекулярной биологии. Для примера смотри F. Ausubel и соавт., Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y., 1998, включенный в настоящий документ в виде ссылки.
Под "в основном очищенной" понимают нуклеиновую кислоту, полипептид или другую молекулу, которую отделили от природных сопутствующих ей компонентов. Обычно полипептид является в основном очищенным, если он, по меньшей мере, на 60%, 70%, 80%, 90%, 95%, или даже на 99% (по весу) свободен от белков и естественных органических молекул, с которыми он связан по своей природе. Например, в основном очищенный полипептид может быть получен экстракцией из природного источника, экспрессией рекомбинантной нуклеиновой кислоты в клетке, которая сама исходно не экспрессирует данный белок, или химическим синтезом.
Термин "выделенная ДНК" означает, что ДНК не содержит генов, фланкирующих ее природном геноме организма, из которого получают указанную ДНК. Таким образом, термин "выделенная ДНК" охватывает, например, кДНК, клонированную геномную ДНК и синтетическую ДНК.
Под "эффективным количеством" понимают количество соединения, отдельно или в комбинации, необходимое для уменьшения или предотвращения гипертензии или лечения или предотвращения хронической инфекции у млекопитающих. Эффективное количество активного соединения (соединений) меняется в зависимости от пути введения, возраста, массы тела и общего состояния здоровья субъекта. В конечном счете, врач или ветеринар определяет подходящее количество и схему приема соединения.
Под "соединением-кандидатом" понимают препарат натурального или искусственного происхождения. Соединения-кандидаты могут включать в себя, например, пептиды, полипептиды, синтетические органические молекулы, органические молекулы натурального происхождения, молекулы пептидно-нуклеиновых кислот и их компоненты и производные. Например, эффективное соединение-кандидат согласно настоящему изобретению уменьшает связывание PD-1 с PD-L1, PD-L1 или с ними обоими.
Термин "фармацевтическая композиция" обозначает любую композицию, которая содержит, по меньшей мере, один терапевтически или биологически активный агент и подходит для введения пациенту. Любое из данных соединений может быть приготовлено с помощью хорошо известных и общепринятых способов в данной области техники. В качестве примера смотри Remington: The Science and Practice of Pharmacy, 20.sup.th edition, (ed. A R Gennaro), Mack Publishing Co., Easton, Pa., 2000
МЕТОДЫ ПРОВЕДЕНИЯ ЛЕЧЕНИЯ
Т-клеточная цитотоксичность увеличивается при взаимодействии Т-клетки с соединением, которое уменьшает экспрессию или активность PD-1. Т-клетка представляет собой нативную Т-клетку, Т-клетку памяти или активированную Т-клетку. Альтернативно, Т-клетка представляет собой антигенспецифическую Т-клетку. Антигенспецифическая Т-клетка является анергической или толерантной к инфекционному агенту. Т-клеточная цитотоксичность характеризуется увеличением клеточной пролиферации или высвобождением цитокинов.
Способы являются пригодными для уменьшения симптомов различных инфекций и раковых заболеваний. Инфекцию или рак лечат, предотвращают, либо уменьшают их симптомы введением субъекту ингибитора PD-1. Субъект представляет собой млекопитающее, такое как человек, примат, мышь, крыса, собака, кошка, корова, лошадь и свинья. Субъект имеет инфекцию или имеет повышенный риск ее развития. Субъекта, имеющего инфекцию или повышенный риск ее развития, выявляют стандартными способами, соответствующими конкретной инфекции.
Инфекция, например, бактериальная, вирусная, грибковая, микоплазменная или паразитарная представляет собой персистирующую инфекцию. Персистирующие инфекции, в противоположность острым инфекциям, не удаляются эффективно путем индукции иммунного ответа хозяина. Инфекционный агент и иммунный ответ достигают равновесия, так что инфицированный субъект остается инфекционным в течение долгого периода времени, необязательно с проявлениями симптомов. Персистирующие инфекции включают в себя, например, латентные, хронические и медленные инфекции.
При хронической инфекции инфекционный агент может быть определен в организме в любое время. Однако признаки и симптомы заболевания могут присутствовать или могут отсутствовать продолжительный период времени. Примеры хронических инфекций включают в себя гепатит В (вызванный HBV) и гепатит С (вызванный HCV), аденовирус, цитомегаловирус, вирус Эпштейна-Барр, вирус простого герпеса типа 1, вирус простого герпеса типа 2, человеческий вирус герпеса 6 типа, вирус Варицелла-Зостер, вирус гепатита В, вирус гепатита D, вирус папилломы, парвовирус В19, полиомавирус ВК, полиомавирус JC, вирус кори, вирус краснухи, вирус иммунодефицита человека, вирус Т-клеточной лейкемии человека I и вирус Т-клеточной лейкемии человека II. Паразитарные персистирующие инфекции могут возникать в результате инфицирования лейшманией, токсоплазмой, трипаносомой, плазмодием, шистосомой и энцефалитозооном.
При латентной инфекции инфекционный агент (например, вирус) на вид кажется неактивным и бездействующим, но субъект всегда проявляет признаки и симптомы заболевания. При латентной вирусной инфекции вирус сохраняет равновесие с хозяином в течение долгих периодов времени перед тем, как симптомы появятся вновь; однако действующие вирусы не могут быть определены до повторной активации заболевания. Примеры латентных инфекций включают в себя инфекции, вызванные HSV-1 (герпетическая лихорадка), HSV-2 (генитальный герпес) и VZV (ветряная оспа).
При медленной инфекции инфекционные агенты постепенно увеличиваются в количестве в течение долгого периода времени, во время которого не наблюдается существенных признаков или симптомов заболевания.
Примеры медленных инфекций включают в себя СПИД (вызываемый ВИЧ-1 и ВИЧ-2), лентивирусы, которые вызывают опухоли у животных, и прионы.
Кроме того, персистирующие инфекции часто возникают как поздние осложнения острых инфекций. Например, подострый склерозирующий панэнцефалит (SSPE) может возникнуть в результате острой инфекции кори или регрессивный энцефалит может развиться в результате инфекции краснухи.
Онкологические заболевания включают в себя например ангиоиммунобластную лимфому или нодулярную с лимфоидным преобладанием лимфому Ходжкина.
Ангиоиммунобластная лимфома (AIL) представляет собой агрессивный (быстро развивающийся) тип Т-клеточной неходжкинской лимфомы, отмеченный увеличенными лимфоузлами и гипергаммаглобулинемией (увеличение количества антител в крови). Другие симптомы могут включать в себя кожную сыпь, лихорадку, потерю веса, положительную пробу Кумбса и ночной пот. Данная злокачественная опухоль обычно появляется у взрослых. Пациентами обычно являются люди в возрасте 40-90 лет (среднее значение составляет около 65), чаще мужчины. При прогрессировании AIL могут развиться гепатоспленомегалия, гемолитическая анемия и поликлональная гипергаммаглобулинемия. Кожа вовлечена у, примерно, 40-50% пациентов.
Нодулярная с лимфоидным преобладанием лимфома Ходжкина представляет собой В-клеточную опухоль, которая происходит из В-клеток герминальных центров с мутированными, нефункциональными иммуноглобулиновыми генами.
Подобно ангиоиммунобластической лимфоме, неопластические клетки связаны с сетью фолликулярных дендритных клеток. Экспрессия PD-1 определяется в Т-клетках, тесно связанных с неопластическими CD20+ клетками при нодулярной с лимфоидным преобладанием лимфоме Ходжкина, по образцу, сходному с наблюдаемым для CD57+ Т-клеток. CD57+ идентифицированы как другой маркер Т-клеток, связанных с герминальным центром, наряду с CXCR5, данные о которых поддерживают заключение, что неопластические клетки при нодулярной с лимфоидным преобладанием лимфоме Ходжкина имеют тесную связь с Т-клетами, связанными с герминальным центром.
Ингибитором PD-1 является любой агент способный уменьшить экспрессию или активность PD-1, PD-L1 или PD-2 в клетке. Экспрессия или активность PD-1 уменьшается, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с данной экспрессией или активностью в контрольной клетке. Контрольная клетка представляет собой клетку, которая не обработана ингибитором PD-1. Экспрессия или активность PD-1 определяется любым стандартным способом в данной области техники, включая описанные в настоящем документе. По желанию ингибитор PD-1 ингибирует или уменьшает связывание PD-1 с PD-L1, PD- L2 или с ними обоими. Ингибиторы PD-1 включают в себя полипептиды, полинуклеотиды, маленькие молекулы антагонистов и siPHK.
PD-1 ингибиторный полипептид включает в себя, например, антитело или его фрагмент, который уменьшает экспрессию PD-1 или передачу сигнала PD-1. Типичные антитела включают в себя анти-PD-1 антитела, анти-PD-L1 антитела, анти-PD-L2 антитела, анти-CTLA-4 антитела, анти-BTLA антитела, анти-CD28 антитела, анти-ICOS антитела, анти-ICOS-L антитела, анти-B7-1 антитела, анти-B7-2 антитела, анти-B7-H3 антитела или анти-B7-H4 антитела.
Альтернативно, ингибитор PD-1 представляет собой доминатно-негативный белок или нуклеиновую кислоту, кодирующую доминатно-негативный белок, который препятствует биологической активности PD-1 (например, связывание с PD-1 с PD-L1, PD-L2 или с ними обоими). Доминатно-негативный белок представляет собой любую аминокислотную молекулу, имеющую последовательность, которая имеет, по меньшей мере, 50%, 70%, 80%, 90%, 95%, или даже 99% идентичности с, по меньшей мере, 10, 20, 35, 50, 100 или более чем 150 аминокислотами белка дикого типа, которому соответствует доминантный негативный белок. Например, доминантно-негативный PD-1 имеет такую мутацию, что он не способен связаться с PD-L1.
Доминантно-негативный белок может быть введен в виде вектора экспрессии. Вектор экспрессии может быть невирусным или вирусным вектором (например, ретровирус, рекомбинантный адено-ассоциированный вирус или рекомбинантный аденовирусный вектор). Альтернативно, доминантно-негативный белок может быть введен непосредственно в виде рекомбинантного белка системно или в инфицированный участок, используя, например, технику микроинъекций.
Маленькие молекулы включают в себя (но не ограничиваются этим), пептиды, пептидомиметики, (например, пептоиды), аминокислоты, аналоги аминокислот, полинуклеотиды, аналоги полинуклеотидов, нуклеотиды, аналоги нуклеотидов, органические и неорганические соединения (включая гетероорганические и органометаллические соединения), имеющие молекулярный вес менее 5000 грамм на моль, органические и неорганические соединения, имеющие молекулярный вес менее 2000 грамм на моль, органические и неорганические соединения, имеющие молекулярный вес менее 1000 грамм на моль, органические и неорганические соединения, имеющие молекулярный вес менее 500 грамм на моль, и соли и эфиры, и другие фармацевтически приемлемые формы данных соединений.
Ингибитор PD-1 представляет собой антисмысловую молекулу, малую интерферирующую РНК (siPHK) молекулу или малую молекулу антагониста, которая воздействует на PD-1 экспрессию или активность. Под термином "siPHK" понимают двухцепочечную молекулу РНК, которая предотвращает трансляцию целевой мРНК. Используются стандартные технологии выведения siPHK в клетку, включая технологии, в которых ДНК является матрицей, по которой siPHK транскрибируется. siPHK включает в себя смысловую нуклеиновую последовательность PD-1, PD-Ll или PD-L2, антисмысловую нуклеиновую последовательность PD-1, PD-Ll или PD-L2 или обе. По желанию, siPHK конструируют таким образом, что единичный транскрипт имеет обе, смысловую и комплементарную антисмысловую, последовательности из целевого гена, например, "шпильку". Связывание siPHK с PD-1, PD-Ll или PD-L2 транскриптом в клетке-мишени приводит к уменьшению продукции клеткой PD-I, PD-Ll или PD-L2. Длина олигонуклеотида составляет, по меньшей мере, 10 нуклеотидов и может быть такой же длины, как и натуральные транскрипты PD-1, PD-Ll или PD-L2. Предпочтительно, олигонуклеотид имеет длину 19-25 нуклеотидов. Более предпочтительно, имеет длину менее чем 75, 50, 25 нуклеотидов.
Другие подходящие ингибиторы PD-1 описаны, например, в патенте США № 6808710 и в публикациях патентных заявок США № 20040137577, 20030232323, 20030166531, 20030064380, 20030044768, 20030039653, 20020164600, 20020160000, 20020110836, 20020107363 и 20020106730, которые включены в настоящий документ в виде ссылок.
Предпочтительная доза ингибитора PD-1 равна биологически активной дозе. Биологически активная доза равна дозе, которая индуцирует увеличение CD8+ Т-клеточной цитотоксической активности в иммунном ответе, специфическом для инфекционного агента. Предпочтительно, ингибитор PD-1 способен уменьшать экспрессию или активность PD-1 в антигенспецифических иммунных клетках (например, Т-клетках, таких как CD8+ Т-клетки), по меньшей мере, на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, или более чем на 100% ниже, чем значения необработанного контроля. Значения или активность PD-1 измеряют в иммунных клетках любым способом, известным в данной области, включая, например, вестерн-блот анализ, иммуногистохимию, ИФА, нозерн-блот анализ. Альтернативно, биологическую активность PD-1 измеряют, оценивая связывание PD-1 с PD-Ll, PD-L2 или с ними обоими. Биологическую активность PD-1 определяют по его способности увеличивать CD8+ Т-клеточную цитотоксичность, включая, например, продукцию цитокинов, удаление инфекционного агента и пролиферацию антигенспецифических CD8+ Т-клеток. Предпочтительно, агент, который уменьшает экспрессию или активность PD-1, может увеличить иммунный ответ, специфический к инфекционному агенту, по меньшей мере, на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, или более чем 100% выше значений в необработанном контроле. Таким образом, агент настоящего изобретения представляет собой любой агент, обладающий одной или более из указанных активностей. Несмотря на то, что агент настоящего изобретения предпочтительно экспрессируется в CD8+ Т-клетках, понятно, что любая клетка, которая может влиять на иммунный ответ на персистирующие инфекции, также доступна для способов изобретения и включает в себя, например, В-клетки.
По желанию субъекту вводят один или более дополнительный терапевтический агент. Дополнительные терапевтические агенты включают в себя, например, противовирусные соединения (например, видарабин, ацикловир, ганцикловир, валганцикловир, нуклеозид - аналог ингибитора обратной транскриптазы (NRTI) (например, AZT (зидовудин), ddI (диданозин), ddC (залцитабин), d4T(ставудин), или 3ТС (ламивудин)), ненуклеозидный ингибитор обратной транскриптазы (NNRTI) (например, невирапин или делавирдин), ингибитор протеаз, (саквинавир, ритонавир, индинавир или нелфинавир), рибавирин и интерферон), противобактериальные соединения, противогрибковые соединения, противопаразитарные соединения, противовоспалительные соединения, антинеопластические соединения или анальгетики.
Дополнительный терапевтический агент вводится до, одновременно, или после введения ингибитора PD-1. Например, ингибитор PD-1 и дополнительный агент вводят в отдельных композициях в пределах 1, 2, 4, 6, 10, 12, 18 или более чем 24 часа отдельно друг от друга. Если дополнительный агент представлен в другой композиции, то могут быть использованы разные пути введения. Агент вводят в дозах, которые эффективны для данного агента для лечения, уменьшения или предотвращения инфекции.
Концентрации ингибитора PD-1 и дополнительного агента зависят от различных факторов, включая способы введения, целевые области, физиологическое строение млекопитающего и другие введенные лекарства. Таким образом, лечебные дозировки могут быть оттитрованы для оптимизации безопасности и эффективности специалистом в данной области. Определение правильной дозировки и режима ее введения в конкретной ситуации находится в рамках навыков специалиста в данной области техники.
По желанию субъекту затем вводят вакцину, которая вызывает защитный иммунный ответ против инфекционного агента, который вызывает персистирующую инфекцию. Например, субъект получает вакцину, которая вызывает иммунный ответ против вируса иммунодефицита человека (ВИЧ), туберкулеза, гриппа или гепатита С. Типичные вакцины описаны, например, в Berzofsky и др. (J. Clin. Invest. 114:456-462, 2004). По желанию, вакцину можно вводить с первой бустер-инъекцией или с адъювантами.
Ингибиторы PD-1 вводят в количестве, достаточном для увеличения Т-клеток, например, CD8+ Т-клеток, цитотоксичности. Увеличение Т-клеточной цитотоксичности приводит к увеличению иммунного ответа и уменьшению персистирующей инфекции. Увеличение иммунного ответа измеряют, например, по увеличению пролиферации иммунных клеток, например, Т-клеток или В-клеток, по увеличению продукции цитокинов, и по увеличению удаления инфекционного агента из организма. Такое уменьшение включает в себя ослабление одного или более симптомов, связанных с персистирующей инфекцией. Введение ингибитора PD-1 уменьшает персистирующую инфекцию или ослабляет один или более симптом, связанный с персистирующей инфекцией, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% по сравнению с субъектом, не получавшим лечения.
Лечение является эффективным, если лечение приводит к клиническому улучшению такому, как уменьшение нагрузки инфекционным агентом у субъекта. Если лечение проводят профилактически, то "эффективный" означает, что лечение замедляет или предотвращает формирование инфекции. Эффективность может быть определена любым известным методом диагностики или лечения определенной инфекции.
ТЕРАПЕВТИЧЕСКОЕ ВВЕДЕНИЕ
Изобретение включает в себя введение субъекту композиции, которая включает в себя компонент, который уменьшает экспрессию или активность PD-1 (именуемый в настоящем документе как "ингибитор PD-1" или "терапевтическое соединение").
Эффективное количество терапевтического соединения составляет предпочтительно от примерно 0,1 мг/кг до примерно 150 мг/кг. Эффективные дозы изменяют, как установлено специалистами в данной области техники, в зависимости от способа введения, использования носителя и совместного введения с терапевтическими препаратами, включая использование других противоинфекционных агентов для лечения, предотвращения или ослабления симптомов определенной инфекции или онкологического заболевания. Схему лечения выполняют путем выявления млекопитающего, например, пациента, страдающего от (или имеющего повышенный риск развития) инфекции или рака, с использованием стандартных способов.
Фармакологический компонент вводят данному субъекту способами, известными в данной области техники. Предпочтительно, соединение вводят орально, ректально, назально, местно или парентерально, например, подкожно, внутрибрюшинно, внутримышечно и внутривенно. Соединение вводят профилактически или после определения инфекции. Соединение по желанию включают в композицию как компонент "коктейля" терапевтических лекарств для лечения инфекции. Примеры композиций для парентерального введения включают в себя водные растворы активного агента в изотоническом физиологическом растворе, 5% раствор глюкозы или другой стандартный фармацевтически приемлемый носитель. Стандартные солюбилизирующие агенты, такие, как PVP или циклодекстрины также используют в качестве фармацевтических наполнителей для доставки терапевтических соединений.
Терапевтические соединения, описанные в настоящем документе, включают в композиции для других путей введения, использующих общепринятые способы. Например, ингибитор PD-1 включают в состав композиции в капсуле или в таблетке для орального введения. Капсулы могут содержать любые стандартные фармацевтически приемлемые материалы, такие как желатин или целлюлоза. Таблетки могут быть созданы в соответствии с общепринятыми процедурами компрессией смесей фармацевтического компонента и твердого носителя и скользящего вещества. Примеры твердых носителей включают в себя крахмал и сахарный бентонит. Соединение вводят в форме таблетки с твердой оболочкой или капсулы, содержащей связующее вещество, например, лактозу или маннитол, общепринятый наполнитель и таблетирующий агент. Другие композиции включают в себя мазь, суппозиторий, пасту, спрей, пластырь, крем, гель, рассасывающуюся губку или пену. Данные композиции производят используя способы, хорошо известные в данной области техники.
В случае если фармацевтическое соединение представляет собой нуклеиновую кислоту, кодирующую белок, терапевтическую нуклеиновую кислоту вводят in vivo для активизации экспрессии кодируемого белка, путем встраивания ее в подходящий вектор экспрессии и введения его внутрь клетки (например, с помощью ретровирусного вектора, прямой инъекции, бомбардировки микрочастицами, покрытием липидами или рецепторами клеточной поверхности или переносящими агентами или введением его в соединении с гомеобокс-подобным пептидом, который входит в ядро (смотри Joliot, и др., 1991. Proc Natl Acad Sci USA 88:1864-1868). Альтернативно, нуклеиновый лечебный препарат вводится внутриклеточно и включается в ДНК клетки-хозяина для экспрессии с помощью гомологичной рекомбинации, либо же он остается эписомальным.
Для местного введения ДНК используют стандартные векторы для генной терапии. Данные векторы включают в себя вирусные векторы, включая те, которые происходят от реплекативно-дефектных вирусов гепатита (например, HBV и HCV), ретровирусов (смотри, например, WO 89/07136; Rosenberg и др., 1990, N. Eng. J. Med. 323(9):570-578), аденовирусов (смотри, например,., Morsey и др., 1993, J. Cell. Biochem., Supp. 17E5), аденосвязанных вирусов (Kotin и др., 1990, Proc. Natl. Acad. Sci. USA 87:2211-2215,), реплекативно-дефектных вирусов простого герпеса (HSV; Lu и др., 1992, Abstract, page 66, Abstracts of the Meeting on Gene Therapy, Sept. 22-26, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York), и любых других модифицированных версий данных векторов. Изобретение может использовать любые другие системы доставки, которые выполняют in vivo доставку нуклеиновых кислот внутрь эукариотических клеток. Например, нуклеиновые кислоты могут быть упакованы в липосомы, например, катионные липосомы (липофектин), рецептор-опосредованные системы доставки, невирусные векторы на основе нуклеиновых кислот, тени эритроцитов или микросферы (например, микрочастицы; смотри в качестве примера патент США № 4925673; патент США № 3625214; Gregoriadis, 1979, Drug Carriers in Biology and Medicine, pp. 287-341 (Academic Press,)). Также может быть введена депротеинизированная ДНК. ДНК для генной терапии может быть введена пациентам, например, внутривенно, подкожно, внутримышечно и внутрибрюшинно. ДНК или агент, содержащий ДНК, вводят в фармацевтически приемлемом носителе, например, биологически совместимом носителе, который подходит для введения животному, например, физиологический раствор. Терапевтически эффективное количество представляет собой количество, которое необходимо для получения желаемого, с медицинской точки зрения, результата, например, уменьшения продукта PD-1 гена у животного, получившего лечение. Данное количество может быть определено специалистом в данной области техники. Как хорошо известно в медицинской области, дозирование для данного пациента зависит от многих факторов, включая размеры пациента, площадь поверхности тела, возраст, конкретное вводимое соединение, пол, время и путь введения, общее состояние здоровья и другие лекарства, вводимые одновременно. Дозировки могут меняться, но предпочтительная дозировка для внутривенного введения ДНК составляет примерно от 106 до 1022 копий молекул ДНК. Обычно плазмиды вводят млекопитающим в количестве около от 1 нанограмма до 500 микрограммов ДНК. Предпочтительно, композиция содержит от около 5 нанограмм до 1000 микрограмм ДНК, от 10 нанограмм до 800 микрограмм ДНК, от 0,1 микрограмм до 500 микрограмм ДНК, от 1 микрограмм ДНК до 350 микрограмм ДНК, от 25 микрограмм до 250 микрограмм ДНК или от 100 микрограмм ДНК до 200 микрограмм ДНК. Альтернативно, введение рекомбинантных аденовирусных векторов, кодирующих ингибитор PD-1 у млекопитающего, может быть проведено в концентрации, по меньшей мере, 105, 106, 107, 108, 109, 1010 или 1011 колониеобразующих единиц (КОЕ).
Продукты гена PD-1 вводят пациенту внутривенно, в фармацевтически приемлемом носителе, таком как физиологический раствор. Могут быть использованы стандартные методы для внутриклеточной доставки пептидов, например, упаковка в липосомы. Данные методы хорошо известны специалистам в данной области техники. Предполагают, что внутривенная дозировка вводилась бы в количестве примерно от 1 до 100 молей полипептида изобретения на кг массы тела в день. Композиции изобретения применимы для парентерального введения такого, как внутривенное, подкожное, внутримышечное и внутрибрюшинное.
Ингибиторы PD-1 являются эффективными после прямого контакта соединения с пораженной тканью. Альтернативно, ингибиторы PD-1 могут быть введены системно. Альтернативно, соединения могут быть введены имплантированием (либо прямо в орган (например, кишечник или печень), либо подкожно) твердой или рассасывающейся матрицы, которая медленно высвобождает соединение в прилежащие и окружающие ткани субъекта. Например, для лечения желудочно-кишечной инфекции соединение может быть введено системно (например, внутривенно, ректально или орально) или местно (например, непосредственно в ткани желудка). Альтернативно, пластину, или растворимую губку, пропитанную ингибитором PD-1, размещают в прямом контакте с тканями желудка. Ингибитор PD-1 медленно высвобождается in vivo при диффузии лекарства из пластины и разрушении полимерного матрикса. Как другой пример, инфекцию печени (например, гепатит) лечат инфузией в сосудистую систему печени раствора, содержащего ингибитор PD-1.
Для лечения неврологических инфекций ингибитор PD-1 может быть введен внутривенно или интратекально (например, прямой инфузией в спинно-мозговую жидкость). Для локального введения пропитанную соединением пластину или растворимую губку помещают в прямом контакте с тканью ЦНС. Соединение или смесь соединений медленно высвобождается in vivo при диффузии лекарства из пластины и разрушении полимерного матрикса. Альтернативно соединение вводят в мозг или спинно-мозговую жидкость стандартными методами. Например, устанавливают кольцо трепанационного отверстия с катетером для ввода инъекций в трепанационное отверстие в черепе. Резервуар для жидкости, подсоединенный к катетеру, подключают с помощью иглы или стилета, вставленного через перегородку, расположенную поверх кольца трепанационного отверстия. Катетерная установка (описанная, например, в патенте США № 5954687) обеспечивает прохождение потока жидкости, подходящее для подачи жидкости к выбранному месту или из него, рядом мозгом или внутри него, чтобы сделать возможным введение лекарства на протяжении периода времени.
При сердечных инфекциях соединение может быть доставлено, например, в ткань сердца (например, миокард, перикард или эндокард) прямой интракоронарной инъекцией через грудную стенку или с использованием стандартного чрезкожного катетера под флуороскопическим контролем введения. Таким образом, ингибитор может быть введен прямо в ткань или может быть введен инфузией через стент или катетер, который вставляют в отверстие в теле. Для введения соединения может быть использован любой вид коронарного или перфузионного катетера. Альтернативно соединением покрывают или пропитывают стент, который помещают в коронарный сосуд.
Легочные инфекции можно лечить, например, введением соединения ингаляцией. Компоненты принимают в форме аэрозольного спрея из контейнера под давлением или из распылителя, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или из ингалятора.
Специалисту в данной области понятно, что пациентам, получившим лечение согласно изобретению, могут быть проведены такие же тесты, как и для диагностирования субъекта с персистирующей инфекцией, или они могут быть определены без обследования, как имеющие повышенный риск вследствие присутствия одного или более факторов риска (например, воздействие инфекционного агента, воздействие инфицированного субъекта, генетическая предрасположенность или наличие патологического состояния, провоцирующего вторичные инфекции). Уменьшение симптомов персистирующей инфекции или повреждения может также включать в себя, но не ограничивается этим, ослабление симптомов, уменьшение распространения заболевания, стабилизированное (т.е. не ухудшающееся) состояние болезни, откладывание или замедление прогрессирования заболевания, улучшение или временное облегчение состояния болезни. Лечение может проводиться дома при внимательном наблюдении медицинского работника или в медицинском учреждении.
СПОСОБЫ ИЗМЕРЕНИЯ ИММУННОГО ОТВЕТА
Способы измерения иммунного ответа после лечения согласно настоящему изобретению хорошо известны в данной области техники. Активность Т-клеток можно оценить, например, по анализам определения продукции цитокинов, по анализам измерения Т-клеточной пролиферации, по исследованиям, в которых определяют удаление микробного агента, и по исследованиям, в которых измеряют CD8+ Т-клеточную цитотоксичность. Данные исследования описаны, например, в патенте США №6808710 и в публикациях патентных заявок США № 20040137577, 20030232323, 20030166531, 20030064380, 20030044768, 20030039653, 20020164600, 20020160000, 20020110836, 20020107363 и 20020106730, которые включены в настоящий документ в виде ссылок.
По желанию способность ингибитора PD-1 увеличивать CD8+ Т-клеточную цитотоксичность оценивают по анализам, в которых измеряют пролиферацию CD8+ Т-клеток (например, поглощение тимидина, исследование с помощью БДУ, окрашивание на маркеры клеточного цикла (например, Ki67 и SFSE), описанные, например, Dong и соавт. (Nature 5:1365-1369, 1999). В одном примере Т-клеточную пролиферацию исследуют культивированием очищенных Т-клеток, экспрессирующих PD-1, в присутствии ингибитора PD-1, первичного активирующего сигнала, как описано ранее, и3Н-тимидина. Уровень Т-клеточной пролиферации определяют по включению тимидина.
CD8+ Т-клеточную цитотоксичность также оценивают по литическим тестам (например, исследования высвобождения51Cr или анализы, определяющие высвобождение перфорина или гранзима), по тестам определения активации каспазы или по исследованиям, в которых определяют удаление микробного агента из инфицированного субъекта. Например, вирусная нагрузка в биологическом образце от инфицированного субъекта (например, сыворотка крови, печень, легкие или ткань, к который вирус является тропным) может быть измерена до и после лечения.
Также может быть измерена продукция цитокинов, таких как IFN-γ, TNF-α и IL-2. Например, очищенные Т-клетки культивируют в присутствии белка-ингибитора PD-1 и первичного активирующего сигнала. Уровень различных цитокинов в супернатанте может быть определен твердофазными иммуноферментными методами анализа или другими общепринятыми способами, описанными, например, Dong с et al. (Nature 5:1365-1369, 1999).
По желанию эффективность ингибитора PD-1 оценивают по его способности вызывать стимуляцию Т-клеток. Например, способ in vitro Т-клеточной костимуляции включает в себя предоставление очищенным Т-клеткам, которые экспрессируют PD-1, первого или второго активирующего сигнала анти-CD3 моноклональными антителами или форболовым эфиром или антигеном, в соединении с классом II MHC. Способность соединения кандидата-агента уменьшать экспрессию или активность PD-1 и, таким образом, предоставлять второй или костимуляторный сигнал, необходимый для изменения иммунной функции в данных Т-клетках, затем может быть оценена любым из нескольких общепринятых тестов, хорошо известных в данной области техники.
В-клеточный ответ оценивают антиген-специфичным ИФА (например, LCMV, ВИЧ,туберкулез или малярия) в ELISPOT плазматических клеток, исследованием В-клеток памяти, фенотипированием В-клеток и в иммуногистохимическим исследованием герминальных центров.
СКРИНИНГОВЫЕ ИССЛЕДОВАНИЯ
Настоящее изобретение предоставляет способы скрининга для выявления соединений, которые могут ингибировать экспрессию или активность PD-1. Подходящие соединения включают в себя любой агент, который ингибирует биологическую активность или уменьшает клеточный уровень PD-1. Например, соединения-кандидаты могут уменьшать связывание PD-1 с PD-Ll, PD-L2 или с ними обоими. При использовании такие соединения, как например, ведущие соединения, настоящие скрининговые методы также делают возможным распознавание других новых специфических ингибиторов PD-1, которые лечат, уменьшают или предотвращают инфекции или, альтернативно, которые ослабляют один или более симптом, связанный с данными инфекциями. Метод скрининга может включать в себя высокопроизводительные технологии.
Под "соединением-кандидатом" понимают химический продукт, встречающийся в природе или произведенный искусственно. Соединения-кандидаты могут включать в себя, например, пептиды, полипептиды, синтетические органические молекулы, органические молекулы натурального происхождения, молекулы пептидно-нуклеиновых кислот и их компоненты и производные. Например, подходящие соединения-кандидаты согласно настоящему изобретению уменьшают связывание PD-1 с PD-Ll, PD-L2 или с ними обоими.
Существует ряд методов для проведения данных скрининговых исследований. Согласно одному подходу, соединения-кандидаты добавляют в различных концентрациях к культуре клеток, экспрессирующих PD-1. Под "PD-1 геном" понимают нуклеиновую кислоту, которая кодирует белок PD-1. Под "PD-1 гибридным геном" понимают PD-1 промотер и/или весь или часть PD-1 кодирующего региона функционально, связанную со второй, гетерологичной последовательностью нуклеиновых кислот. В предпочтительных воплощениях вторая, гетерологичная последовательность нуклеиновых кислот представляет собой репортерный ген, который является геном, экспрессия которого может быть измерена; репортерные гены охватывают без ограничения, гены, кодирующие глюкуронидазу (GUS), люциферазу, хлорамфениколтрансацетилазу (CAT), зеленый флюоресцентный белок (GFP), щелочную фосфатазу и бета-галактозидазу.
Затем измеряют экспрессию PD-1 гена, например, методом стандартного нозерн-блоттинга (Ausubel et al., supra), с использованием в качестве гибридизационного зонда любого подходящего фрагмента молекулы нуклеиновой кислоты PD-1, или методом ПЦР в реальном времени с использованием подходящих праймеров. Сравнивают уровень экспрессии гена в присутствии соединения-кандидата с уровнем, измеренным в контрольной среде без молекулы-кандидата. По желанию воздействие соединений-кандидатов может быть измерено по уровню полипептида PD-1, с использованием того же общего подхода и стандартных иммунологических технологий, как вестерн-блоттинг или иммунопреципитация с антителами, специфичными, например, к PD-1. Например, иммунологические анализы могут быть использованы для определения или проверки уровня PD-1. Поликлональные или моноклональные антитела, которые способны к связыванию PD-1, могут быть использованы в любом формате стандартного иммунологического анализа (например, ИФА или РИА) для измерения уровней PD-1. PD-1 также может быть определен масс-спектроскопией, высокоэффективной жидкостной хроматографией, спектрофотометрическими или флюорометрическими методами или их комбинациями.
Альтернативно, скрининговые методы изобретения могут быть использованы для определения соединений-кандидатов, которые снижают биологическую активность PD-1 уменьшением связывания PD-1 с PD-Ll, PD-L2 или с ними обоими, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, или 100%, по сравнению с необработанным контролем. Например, может быть проверена способность соединения-кандидата снижать активность PD-1 в клетках, которые естественным образом эскпрессируют PD-1, после трансфекции кДНК для PD-1, или в растворах без клеток, содержащих PD-1, как описано далее. Воздействие соединения-кандидата на связывание или активацию PD-1 может быть исследовано радиоактивным или нерадиоактивным анализом связывания, анализом конкурентного связывания, анализом рецепторной передачи сигнала.
В качестве специфического примера, клетки млекопитающих (например, клетки грызунов) которые экспрессируют нуклеиновую кислоту, кодирующую PD-1, культивируют в присутствии соединения-кандидата (например, пептида, полипептида, синтетической органической молекулы, органической молекулы естественного происхождения, молекулы нуклеиновой кислоты или их компонентов). Клетки могут или экспрессировать PD-1 эндогенно или, альтернативно, могут быть генетически сконструированы любым стандартным методом, известным в данной области техники (например, трансфекцией или вирусной инфекцией) для сверхпродукции PD-1. Уровень экспрессии PD-1 измеряют в данных клетках посредством Вестерн блота и затем сравнивают с уровнем экспрессии того же белка в контрольных клетках, которые не контактировали с соединением-кандидатом. Соединение, которое вызывает снижение уровня активности PD-1 в результате уменьшения его синтеза или биологической активности, считают применимым в изобретении.
В одном частном примере, соединение, которое препятствует связыванию PD-1 с PD-Ll, PD-L2 или с ними обоими (тем самым уменьшая биологическую активность PD-1), приводящее к увеличению иммунного ответа, является применимым согласно настоящему изобретению. С учетом способности снижать биологическую активность PD-1, данная молекула может быть использована в качестве терапевтического агента для лечения, уменьшения или предотвращения персистирующей инфекции, или альтернативно, для ослабления одного или более симптома, связанного с данными инфекциями. В качестве специального примера, соединение-кандидат может контактировать с двумя белками, с первым белком, являющимся полипептидом, в основном идентичным PD-1, и втором белком, являющимся либо PD-Ll либо PD-L2 (например, белок, который связывается с полипептидом PD-1 при условиях, которые позволяют связывание, и который вызывает сниженный иммунный ответ). Согласно данному конкретному методу скрининга, взаимодействие между данными двумя белками измеряют после добавления соединения-кандидата. Уменьшение связывания PD-1 со вторым полипептидом после добавления соединения-кандидата (относительно связывания в отсутствии соединения) определяет соединение-кандидат как имеющее способность ингибировать взаимодействие между двумя белками. И наконец, скрининговое исследование изобретения может быть выполнено, например, в системе без клеток или с использованием двугибридной системы дрожжей. По желанию, один из белков или соединение-кандидат могут быть иммобилизованы на подложке, как описано выше, или могут иметь обнаруживаемую группу.
Альтернативно или дополнительно, среди соединений-кандидатов могут быть отобраны те, которые специфически связываются и, тем самым, ингибируют PD-1. Эффективность данного соединения-кандидата определяют по его способности взаимодействовать с PD-1. Указанное взаимодействие может быть легко оценено с помощью любого количества стандартных методов связывания или в функциональных тестах (например, описанных Ausubel с соав, supra). Например, соединение-кандидат может быть проверено in vitro на взаимодействие и связывание с PD-1, и его способность изменять иммунный ответ может быть установлена любыми стандартными тестами (например, описанными в настоящем документе).
Например, соединение-кандидат, которое связывается с PD-1, может быть установлено методами на основе хроматографии. Например, рекомбинантный PD-1 может быть выделен стандартными технологиями из клеток, сконструированных для экспрессии PD-1 (например, описанных ранее), и может быть иммобилизован на колонке. Альтернативно, натуральный PD-1 может быть иммобилизован на колонке. Затем через колонку пропускают раствор соединений-кандидатов, и соединение специфичное к PD-1, определяют на основе его способности связываться с PD-1 и иммобилизовываться на колонке. Для выделения соединения колонку промывают, чтобы удалить не специфически связанные молекулы, и затем нужное соединение освобождают с колонки и собирают. Соединения, выделенные данным способом (или любым другим подходящим способом), по желанию затем могут быть очищены (например, высокоэффективной жидкостной хроматографией).
Скрининг новых ингибиторов и оптимизация лидирующих соединений могут быть оценены стандартных способами, например, по их способности изменять цитотоксическую Т-клеточную активность или иммунный ответ. Кроме того, данные соединения-кандидаты могут быть проверены на их способность действовать в качестве противомикробных агентов (например, как описано в настоящем документе). Соединения, выделенные при данном подходе, также могут быть использованы как лекарства для лечения, уменьшения или предотвращения персистирующих инфекций, или, альтернативно, для ослабления одного или более симптомов, связанных с данными инфекциями. Соединения, которые определены как связывающиеся с PD-1, с константой аффинности менее или равной 10 мМ, расценивают как особенно применимые в изобретении.
Потенциальные терапевтические агенты включают в себя органические молекулы, пептиды, пептидные миметики, полипептиды и антитела, которые связываются с последовательностью нуклеиновых кислот, которая кодирует PD-1 или полипептидом, и тем самым ингибируют или ослабляют его активность. Потенциальные противомикробные агенты также включают в себя малые молекулы, которые связываются и занимают участки связывания данных полипептидов, тем самым, предотвращая связывание с клеточными связывающими молекулами, так, что нормальная биологическая активность делается невозможной. Другие потенциальные анти-микробные агенты включают антисмысловые молекулы.
ДИАГНОСТИЧЕСКИЕ И ПРОГНОСТИЧЕСКИЕ МЕТОДЫ
Рак, например, ангиоиммунобластическую Т-клеточную лимфому или нодулярную с лимфоидным преобладанием лимфому Ходжкина обнаруживают, анализируя количество полипептида PD-1 в тестовом образце (т. е. образце, полученном от пациента). Изменение уровня полипептида PD-1 по сравнению с контрольным образцом является показателем наличия рака у субъекта. Изменение может быть увеличением или уменьшением полипептида PD-1 по сравнению с контрольным образцом. Контрольный образец готовят (т.е. фракционируют) тем же способом, как и тестовый образец.
Образец представляет собой, например, кровь, сыворотку крови, асцитическую жидкость, мочу или другие жидкости тела. Предпочтительно, образец представляет собой Т-клетки или В-клетки.
Количество PD-1 определяют в тестовом образце и сравнивают с экспрессией нормального контрольного уровня. Под нормальным контрольным уровнем понимают уровень экспрессии полипептида PD-1 обычно обнаруживаемый у субъекта, не страдающего раком. Увеличение уровня в образце PD-1, полученном от пациента, показывает, что у субъекта рак или имеет место повышенный риск развития рака. В отличие от указанного случая, если способы применяют профилактически, сходный уровень или снижение уровня полипептида PD-1 в образце, полученном от пациента, показывает, что субъект не имеет рака или повышенного риска его развития. Увеличение уровня в образце полипептида PD-1, полученном от пациента, показывает, что субъект страдает раком или существует повышенный риск развития у субъекта рака.
Изменение количества полипептида PD-1 является статистически значимым. Под статистически значимым понимают то, когда изменение больше, чем то, которое можно ожидать, что произойдет случайно. Статистическую значимость определяют способами, известными в данной области техники. Например, статистическую значимость определяют по р величине. Величина р представляет собой меру вероятности, что отличие между группами в ходе эксперимента произошло случайно. (Р(Z≥Zнаблюдаемое)). Например, р величина 0,01 означает, что существует 1 шанс из 100, что результат получен случайно. Чем ниже величина р, тем более вероятно, что различие между группами вызвано лечением. Изменение является статистически значимым, если величина р равна, по меньшей мере, 0,05. Предпочтительно, величина р равна 0,04, 0,03, 0,02, 0,01, 0,005, 0,001 или меньше.
"Диагностическая точность" теста, исследования или метода касается способности теста, исследования или метода различать пациентов, имеющих рак или имеющих повышенный риск его развития, и основывается на том, имеют ли пациенты "клинически значимое присутствие" полипептида PD-1. Под "клинически значимым присутствием" понимают, что присутствие полипептида PD-1 у пациента (обычно в образце пациента) - выше или ниже, чем заранее определенная точка отсечения патологических значений (cut-off) (или пороговая величина) для того полипептида PD-1, и таким образом, служит показателем наличия у пациента рака, маркером которого является большое количество данного белка.
Термины "высокая степень диагностической точности" и "очень высокая степень диагностической точности" относятся к тесту или исследованию полипептида PD-1 с заранее определенной точкой отсечения патологических значений, безошибочно (точно) показывающему наличие или отсутствие рака. Идеальный тест имел бы идеальную точность. Таким образом, у субъектов с диабетом тест показывал бы только положительные результаты и не представлял бы никого из указанных субъектов, как имеющего "отрицательный" результат (не было бы ни одного "ложно отрицательного" результата). Другими словами, "чувствительность" теста (доля истинно положительных случаев) была бы 100%. С другой стороны, для субъектов без диабета тест показывал бы только отрицательные результаты и не представлял бы никого из указанных субъектов, как имеющего "положительный" результат (не было бы ни одного "ложно положительного" результата). Другими словами, "специфичность" теста (доля истинно отрицательных случаев) была бы 100%. Для примера смотри O'Marcaigh AS, Jacobson RM, "Estimating The Predictive Value OfA Diagnostic Test, How To Prevent Misleading Or Confusing Results," Clin. Ped. 1993, 32(8): 485-491, где обсуждают специфичность, чувствительность и прогностические ценности положительного и отрицательного результата теста, например, клинического диагностического теста.
Изменение точки отсечения или пороговой величины теста (или исследования) обычно меняет чувствительность и специфичность, но в качественно обратной зависимости. Например, если точку отсечения снижают, то больше субъектов в тестируемой популяции будет иметь результаты теста выше, чем точка отсечения или пороговая величина.
Поскольку субъектов, которые имеют результаты теста выше точки отсечения, представляют, как имеющих заболевание, состояние или синдром, для которого данный тест проводится, то понижение точки отсечения будет причиной того, что больше субъектов будут представлены как имеющие положительные результаты (т.е., что они имеют рак). Таким образом, более высокий процент тех, кто имеет рак, будет выявлен данным тестом. Соответственно чувствительность (доля истинно положительных случаев) теста будет увеличиваться. Однако, в то же время, будет больше ложно положительных результатов, потому что больше людей, которые не имеют заболевания, состояния или синдрома (т.е. люди, которые являются "истинно отрицательными") будут выявлены тестом, как имеющие величины полипептида PD-1 выше чем разделяющая точка, и следовательно, будут представлены как "положительные" (т.е. люди, которые имеют заболевание, состояние или синдром) скорее чем, они будут правильно определены тестом как "отрицательные". Соответственно, специфичность теста (доля истинно отрицательных случаев) теста будет уменьшаться.
Подобным образом повышение точки отсечения будет способствовать уменьшению чувствительности и увеличению специфичности. Поэтому при оценке точности и пригодности предложенного медицинского теста, исследования или метода определения состояния пациента следует учитывать как чувствительность, так и специфичность и смотреть, что является точкой отсечения, в которой описываются чувствительность и специфичность, потому что чувствительность и специфичность могут значительно изменяться в пределах диапазона точек отсечения.
Однако существует индикатор, который позволяет изобразить чувствительность и специфичность теста, исследования или метода на протяжении полного ряда точек отсечения только одним значением. Данный индикатор получают из рабочей характеристической кривой ("ROC") для теста, рассматриваемого исследования или метода. Для примера смотри Shultz, "Clinical Interpretation Of Laboratory Procedures," глава 14 in Teitz, Fundamentals of Clinical Chemistry, Burtis and Ashwood (eds.), 4th edition 1996, W.B. Saunders Company, pages 192-199; и Zweig и соав., "ROC Curve Analysis: An Example Showing The Relationships Among Serum Lipid And Apolipoprotein Concentrations In Identifying Patients With Coronory Artery Disease," Clin. Chem., 1992, 38(8): 1425-1428.
Кривая ROC представляет собой график чувствительности по оси у, со шкалой от 0 до 1 (т.е. 100%) в зависимости от значения, равного единица минус специфичность, на оси х, со шкалой от 0 до 1 (т.е. 100%). Другими словами, это график доли истинно положительных случаев как функции доли ложно положительных случаев для теста, исследования или метода. Для построения ROC кривой для теста, исследования или метода в задаче пациентов оценивают идеально точным методом или методом "золотого стандарта", который является независимым от рассматриваемого теста, исследования или метода определения, являются ли пациенты истинно "положительными" "или отрицательными" на заболевание, состояние или синдром (например, коронарная ангиография является методом "золотого стандарта" на наличие коронарного атеросклероза). Пациентов также проверяют, используя необходимый тест, исследование, или метод и для разных точек отсечения, пациентов представляют как "положительных" "или отрицательных" согласно тесту, исследованию, или методу. Чувствительность (доля истинно положительных значений) и величина, равная единица минус специфичность (величина, которая равна доле ложно положительных значений), определяются для каждой точки отсечения, и каждая пара значений х-у наносится как одна точка на х-у график. Кривая, соединяющая данные точки, является ROC кривой.
Область под кривой ("AUC") представляет собой показатель, который позволяет изобразить чувствительность и специфичность теста исследования или метода на протяжении всего ряда точек отсечения только одной величиной. Максимум AUC равен единице (идеальный тест) и минимальная область равна одной второй. Чем ближе AUC к единице, тем выше точность теста.
Под "высокой степенью диагностической точности" понимают тест или исследование (такой как тест изобретения для определения клинически значимого присутствия полипептида PD-1, который таким образом определяет наличие диабета) в котором AUC (область под ROC кривой теста или исследования) равна, по меньшей мере, 0,7, желательно, по меньшей мере, 0,75, более желательно, по меньшей мере, 0,8, предпочтительно, по меньшей мере, 0,85, более предпочтительно, по меньшей мере, 0,9 и наиболее предпочтительно, по меньшей мере, 0,95.
Под "очень высокой степенью диагностической точности" понимают тест или исследование, в котором AUC (область под ROC кривой теста или исследования) равна, по меньшей мере, 0,875, желательно, по меньшей мере, 0,9, более желательно, по меньшей мере, 0,925, предпочтительно, по меньшей мере, 0,975, и наиболее предпочтительно, по меньшей мере, 0,98.
По желанию также может быть определена экспрессия других известных биомаркеров для конкретного ракового заболевания, в качестве еще одного свидетельства, имеет или нет субъект рак. Например, определяют CDlO, bcl-6, CD20, CD57 или CXCR5.
Полипептид PD-1 и дополнительные биомаркеры обнаруживают любым удобным способом, но обычно - через взаимодействие образца от пациента с антителами, которые связывают PD-1 или биомаркер, и затем определяют присутствие или отсутствие продукта реакции. Антитела могут быть моноклональными, поликлональными, химерными или их фрагментами, как подробно обсуждалось ранее, и стадия определения продукта реакции может быть проведена любым удобным иммунным методом исследования. Образец от пациента обычно представляет собой биологическую жидкость, как описано выше, и может быть таким же образцом биологической жидкости, как образец, использованный для проведения описанного выше метода.
Экспрессия полипептида PD-1 также делает возможным мониторинг в ходе лечения рака. В данном методе предоставляют биологический образец от субъекта, получающего лечение, например, хирургическое, химиотерапевтическое или гормональное лечение рака. По желанию биологические образцы от пациента получают в разные моменты времени: до, во время или после лечения. Затем определяют экспрессию PD-1 и сравнивают с эталоном, например, контролем, в котором точно установлен или не установлен рак. Эталонный образец подвергают обработке. Альтернативно, эталонный образец не подвергают обработке. По желанию, данный мониторинг проводят заранее перед плановой вторичной хирургической ревизией и последующими хирургическими контрольными процедурами. Например, образцы могут быть собраны у субъектов, которые получили начальное хирургическое лечение рака и последующее лечение антинеопластическим агентами, для наблюдения процесса лечения рака.
Если эталонный образец получен от субъекта, который не имеет рака, то сходное количество или снижение количества полипептида PD-1 в тестовом образце и в эталонном образце показывает, что лечение является эффективным. Однако увеличение количества полипептида PD-1 в тестовом образце и в эталонном образце указывает на менее благоприятный клинический исход или прогноз.
Под "эффективным" понимают то, когда лечение приводит к уменьшению количества полипептида PD-1 или к уменьшению размера, распространения или метастатического потенциала опухоли у субъекта. Оценку ракового заболевания производят по стандартным клиническим протоколам. Эффективность определяют во взаимосвязи с любым известным способом диагностики или лечения определенной опухоли. Экспрессия полипептида PD-1 также позволяет выявить пациентов, которые будут восприимчивы к системному, например, химиотерапевтическому, гормональному или радиационному лечению. В данном методе предоставляют биологический образец от пациента до проведения хирургического лечения рака. Затем определяют экспрессию полипептида PD-1 и сравнивают с биологическим образцом субъекта после хирургического удаления рака. Пациент наверняка будет восприимчив к системному лечению, если количество полипептида PD-1 снижается после хирургического удаления рака. В отличие от этой ситуации, пациент наверняка не будет восприимчив к системному лечению, если количество полипептида PD-1 остается постоянным или увеличивается после хирургического удаления рака.
Экспрессию полипептида PD-1 или других раковых биомаркеров определяют в терминах белка или нуклеиновой кислоты любым методом, известным в данной области техники. Например, для определения экспрессии генов может быть использован нозерн гибридизационный анализ с использованием зондов, которые специфически узнают одну или более из данных последовательностей. Альтернативно, экспрессию измеряют, используя ПЦР на основе обратной транскрипции, например, используя праймеры, специфичные для дифференциально экспрессированной последовательности генов. Экспрессию также определяют на уровне белка, т.е. измерением уровней пептидов кодированных генетическими продуктами, описанными в настоящем документе, или их активностей. Данные способы хорошо известны в данной области техники и включают в себя, например, иммунологические методы исследования, основанные на антителах к белкам, кодированным данными генами. Любой биологический материал может быть использован для определения/количественного анализа белка или его активности. Альтернативно, может быть выбран подходящий способ для определения активности белков, кодируемых маркерными генами, по активности каждого анализируемого белка.
Субъект предпочтительно представляет собой млекопитающее. Млекопитающим является, например, человек, примат, мышь, крыса, собака, кошка, лошадь или корова. В основном субъектами являются женщины или мужчины. У субъекта ранее было диагностирован рак, и, возможно, он уже получил противораковое лечение. Альтернативно, у субъекта ранее не было диагностировано рака. Настоящее изобретение применимо для всех пациентов, имеющих повышенный риск наличия рака. Хотя каждый тип рака имеет собственный набор факторов риска, риск развития рака возрастает, например, с возрастом, полом, расой, так и личной и семейной историей болезни. Другие факторы риска в основном относятся к выбору образа жизни, в то же время определенные инфекции, воздействия на рабочем месте и некоторые факторы окружающей среды также могут быть связаны с развитием рака.
Диагноз «рак» обычно устанавливают путем идентификации тела опухоли на исследовании, однако он также может быть установлен с помощью других средств, таких как радиологическое диагностирование или ультразвук.
Лечение обычно представляет собой циторедуктивную операцию с последующей терапией антинеопластическими агентами, такими как доцетаксел, винорелбин, гемцитабин, капецитабин или комбинации циклофосфамида, метотрексата и флуороурацила; циклофосфамида, доксорубицина и флуороурацила; доксорубицина и циклофосфамида; доксорубицина и циклофосфамида с паклитакселем; доксорубицина с последующим CMF; или циклофосфамида, эпирубицина и флуороурацила. Кроме того, многим пациентам требуется радиотерапия.
Иммунологические исследования, проведенные в соответствии с настоящим изобретением, могут быть гомогенными исследованиями или гетерогенными исследованиями. При гомогенном исследовании иммунологическая реакция обычно включает в себя специфические антитела (например, полипептид PD-1), меченое вещество-аналит, и представляющий интерес образец. Сигнал, происходящий из метки, модифицируется прямо или косвенно после связывания антитела с меченым веществом-аналитом. Иммунологическая реакция и определение ее величины проводятся в гомогенном растворе. Иммунохимические метки, которые могут быть применены, включают в себя свободные радикалы, радиоизотопы, флуоресцентные красители, ферменты, бактериофаги или коферменты.
При гетерогенном исследовании реагенты обычно представляют собой образец, антитела и средства для производства детектируемого сигнала. Могут быть использованы образцы, описанные выше. Антитела обычно иммобилизуются на подложке, такой как бусы, планшет или стекло, и на них воздействуют образцом, предположительно содержащим антиген в жидкой фазе. Затем подложку отделяют от жидкой фазы и проверяют либо фазу на подложке, либо жидкую фазу на детектируемый сигнал, используя средства для производства данного сигнала. Сигнал связан с присутствием аналита в пробе. Средства для производства детектируемого сигнала включают в себя использование радиоактивных меток, флуоресцентных меток или ферментных меток. Например, если антиген, который определяют, имеет второй участок связывания, то антитело, которое связывается с данным участком, может быть конъюгировано с детектируемой группой, добавлено в раствор жидкой фазы реакции перед стадией разделения. Наличие детектируемых групп на твердой подложке указывает на присутствие антигена в тестируемом образце. Примерами подходящих методов иммуноанализа являются радиоиммуноанализ, методы иммунофлуоресценции или иммунные методы, связанные с ферментом.
Специалисты в данной области знакомы с многочисленными специфическими формами и вариантами иммуноанализов, которые могут быть применены для выполнения способа, раскрытого в настоящем документе. В целом, смотри E. Maggio, Enzyme-Immunoassay, (1980) (CRC Press, Inc., Boca Raton, FIa.); также смотри патент США № 4727022, Skold и соав. под названием "Methods for Modulating Ligand-Receptor Interactions and their Application," смотри патент США № 4659678, Forrest с соав. под названием "Immunoassay of Antigens," патент США № 4376110, David и соав., под названием "Immunometric Assays Using Monoclonal Antibodies," патент США №. 4275149 Litman и соав., под названием "Macromolecular Environment Control in Specific Receptor Assays," патент США № 4233402, Maggio и соав., под названием "Reagents and Method Employing Channeling" и патент США № 4230767 Boguslaski и соавт., под названием "Heterogeneous Specific Binding Assay Employing a Coenzyme as Label." Антитела конъюгируют с твердой подложкой, подходящей для диагностического исследования (например, бусы, планшеты, стекла или лунки, созданные из таких материалов как латекс или полистирол) в соответствии с известными техниками, такими как преципитация. Антитела, как описано в настоящем документе, могут быть таким же образом конъюгированы с детектируемыми группами, такими как радиометки (например, 35 S, 125 I, 131 I), ферментные метки (например, пероксидаза хрена, щелочная фосфатаза) и флуоресцентные метки (например, флуоресцеин) в соответствии с известными техниками.
Диагностические наборы для проведения методов, описанные в настоящем документе, производят разными способами. В одном воплощении диагностический набор включает в себя (а) антитело (например, PD-1 полипептид), конъюгированное с твердой подложкой и (b) второе антитело изобретения, конъюгированное с детектируемой группой. Реагенты могут также включать в себя дополнительные агенты, такие как буферные агенты и белковые стабилизирующие агенты, например, полисахариды и подобные агенты. Далее диагностический набор может включать в себя при необходимости другие элементы сигнал-продуцирующей системы, элементом которой является детектируемая группа (например, ферментативные субстраты), агенты для уменьшения фоновой интерференции в тесте, контрольные реагенты, приспособления для проведения теста и т.д.
Альтернативно, тестовый набор содержит (a) антитело и (b) специфически связывающийся партнер для антитела, конъюгированного с детектируемой группой. Также могут быть дополнительные агенты, как описано выше. Тестовый набор может быть упакован любым удобным способом, обычно со всеми элементами в отдельном контейнере вместе с инструкциями по проведению теста.
Данное изобретение отчасти основано на экспериментах, описанных в следующих примерах. Данные примеры предоставлены для иллюстрации и их не следует считать ограничением.
Пример 1
Ингибирование PD-1 пути анти-PD-L1 антителами у мышей с хронической инфекцией
Для изучения действия хронической вирусной инфекции на CD8+Т-клеточную функцию использовали мышей, инфицированных различными штаммами вируса лимфоцитарного хориоменингита (LCMV). Штамм LCMV Армстронга вызывает острую инфекцию, которая удаляется в течение 8 дней, оставляя после себя долгоживущую популяцию высоко функциональных покоящихся CD8+Т-клеток памяти. В отличие от него, Штамм С1-13 LCMV вызывает у хозяина персистирующую инфекцию, характеризующуюся вирусемией, которая длится до 3 месяцев. Вирус навсегда остается в тех же тканях и антигенспецифичные CD8+Т-клетки становятся функционально поврежденными. DbNP396-404 CD8+ T-клетки физически удаляются, в то время как DbGP33-41 иbGP276-286 CD8+ T-клетки остаются, но теряют способность пролиферировать или секретировать противовирусные цитокины, такие как IFN-γ и TNF-α.
Мыши C57BL/6 были приобретены в Национальном Институте Рака (Фредерик, MD, США). Мышам вводили внутривенной инъекцией 2×106 КОЕ LCMV-Cl-13. CD4 элиминацию проводили в день инъекции и на следующий день введением 500 мкг GK1,5 в фосфатном буфере. LCMV иммунных мышей получают введением мышам внутрибрюшинно 2×105 КОЕ LCMV Армстронга.
Анализ с помощью панелей генов выполняли на FACS-очищенных интактных DbGP33-41 специфических P14 трансгенных CD8+ T-клетках, DbGP33-41 специфических CD8+ T-клетках памяти от LCMV Армстронга иммунных мышей и на DbGP33-41 специфических или DbGP276-286 специфических CD8+ T-клетках от CD4 истощенных LCMV-Cl-13 инфицированных мышей. Выделение РНК и анализ генных панелей выполняли, как описано Kaech и соав., (Cell 111:837-51, 2002). В истощенных CD8+ T-клетках наблюдали высокую экспрессию мРНК PD-1, по сравнению с CD8+ T-клетками памяти (Фиг.1А). Более того, PD-1 экспрессировался на поверхности CD8+ T-клеток LCMV-Cl-13 инфицированных мышей, но он не был представлен на поверхности CD8+ T-клеток после удаления из организма LCMV Армстронга (Фиг.1В).
Мыши с хронической инфекцией также экспрессировали более высокий уровень одного из лигандов PD-1 - PD-L1 на большинстве лимфоцитов и APC, по сравнению с неинфицированными мышами. Таким образом, персистирование вирусного агента и истощение CD8+ T-клеток сопровождаются индукцией экспрессии PD-1.
Для проверки гипотезы, что блокирование PD-1/PD-Ll пути может восстановить Т-клеточную функцию и усилить вирусный контроль при хронической LCMV инфекции, PD-1/PD-Ll коингибиторный путь нарушали αPD-Ll блокирующими антителами при хронической LCMV инфекции. Блокирующие моноклональные антитела против PD-Ll вводили внутрибрюшинно каждый третий день мышам, инфицированным LCMV С1-13 (200 мкг крысиных антимышиных PD-Ll IgG2b моноклональных антител (клон 10F.5C5 или 10F.9C2)) с 23 дня по 37 день постинфекции. На 37 день у обработанных мышей было примерно в 2,5 раза больше DbNP396-404 специфических CD8+ T-клеток и в 3 раза больше DbGP33-41 специфических CD8+ T-клеток, по сравнению с контролем (Фиг.2А). Индукция пролиферации была специфической для CD8+ T-клеток, поскольку количество CD4+ T-клеток в селезенке оставалось примерно одинаковым у обработанных мышей и не обработанных мышей (~6×104 IAbGP61-80 CD4+ T-клеток на селезенку).
В дополнение к увеличению CD8+ T-клеточной пролиферации, ингибирование PD-1 сигнального пути также привело к увеличению продукции противовирусных цитокинов вирус-специфическими CD8+ T-клетками. Определяли продукцию CD8+T-клетками IFN-γ и TNF-α к восьми различным CTL эпитопам. Общий ответ у обработанных мышей был в 2,3 раза выше, чем у необработанных мышей (Фиг.2В и 2С). После обработки также наблюдали 2-х кратное увеличение концентрации клеток, продуцирующих TNF-α (Фиг.2D). Вирусный клиренс также увеличивался, поскольку вирус удалялся из сыворотки крови, селезенки и печени обработанных мышей. У обработанных мышей наблюдали уменьшение вирусных титров в легких и почках (~ в 10 раз) на 37 день постинфекции (14 дней после начала лечения). При этом необработанные мыши демонстрировали значительные уровни вируса во всех указанных тканях (Фиг.2Е). Вирусные титры в сыворотке крови и гомогенатах тканей определяли, используя клетки Vero, как описано Ahmed и соав (J. Virol. 51:34-41, 1984). Результаты, показывающие, что ингибитор PD-1 увеличивает CD8+ T-клеточную пролиферацию и вирусный клиренс, свидетельствуют, что ингибирование PD-1 сигнального пути восстанавливает CD8+ T-клеточную функцию. Более того, ингибирование PD-1 сигналов также усилило ответ В-клеток, поскольку число секретирующих антитела клеток, специфичных к LCMV в селезенке тоже увеличилось (> чем в 10 раз) в результате лечения.
CD4+ T-клетки играют ключевую роль в образовании и поддержании ответа CD8+ T-клеток. При этом, CD4+ T-клетки подвергнутые первичному воздействию антигена в отсутствии CD4+ T-клеток (так называемые "беспомощные" CD8+ T-клетки) не способны к нормальному иммунному ответу. Кроме того, хроническая LCMV инфекция является более серьезной при отсутствии CD4+ T-клеток. Соответственно "беспомощные" Т-клетки образованные во время LCMV-С1-13 инфекции демонстрируют еще более выраженные функциональные нарушения, чем T-клетки, образованные в присутствии CD4+ T-клеток. DbNP396-404 специфические CD8+ T-клетки уничтожаются до неопределяемого уровня, и DbGP33-41 и DbGP276-286 CD8+ T-клетки полностью теряют способность секретировать IFN-γ и TNF-α.
CD4+ T-клетки истощались во время LCMV-С1-13 инфекции и мышей обрабатывали анти-PD-L1 антителами в ходе лечения с 46 по 60 день постинфекции. До и после лечения CD4+ T-клетки не выявлялись окрашиванием на внутриклеточный IFN-γ. После лечения обработанные мыши имели примерно в 7 раз больше DbGP276-286 CD8+ T-клеток и в 4 раза больше DbGP33-41 CD8+ T-клеток в селезенке, чем необработанные мыши контрольной группы (Фиг.3А). Количество вирус-специфических CD8+ T-клеток в селезенке также возрастало (Фиг. 3В). Данное увеличение количества вирус-специфических CD8+ T-клеток у обработанных мышей объясняется увеличением пролиферации, выявленным с помощью включения BrdU. У необработанных мышей 43% DbGP276-286 CD8+ T-клеток имело средний уровень поглощения BrdU и 2% имело высокий уровень включения BrdU, в то время как у обработанных мышей 50% DbGP276-286 CD8+ T-клеток имело средний уровень поглощения BrdU и 37% имело высокий уровень включения BrdU. При проведении BrdU анализа 1мг/мл BrdU давали в питьевой воде в ходе лечения, и окрашивание проводили согласно протоколу производителя (BD Biosciences, Сан Диего, США). Кроме того, обработанные мыши имели более высокое процентное содержание CD8+ T-клеток, экспрессирующих белок Ki67, ассоциированный с клеточным циклом, (60% против 19% у необработанных мышей, Фиг. 3С). Ответ на лечение CD8+ T-клеток в РВМС был ограничен мышами, имеющими высокие уровни размножения CD8+ T-клеток.
Ингибирование PD-1 также увеличивало продукцию противовирусных цитокинов в "беспомощных", истощенных вирус-специфических CD8+ T-клетках. После лечения число DbGP33-41 и DbGP276-286 CD8+ T-клеток, которые продуцируют IFN-γ значительно увеличивалось (Фиг.4А), хотя у обработанных мышей также обнаружили более высокое количество DbNP396-404, KbNP205-212, DbNP166-175 и DbGP92-101 специфических CD8+ T-клеток (Фиг. 4А). У обработанных мышей могут продуцировать IFN-γ 50% DbGP276-286 специфических CD8+ T-клеток, по сравнению с 20% DbGP276-286 специфических CD8+ T-клеток у контрольных необработанных мышей (Фиг.4В). Однако, уровень IFN-γ и TNF-α, продуцируемый специфическими CD8+ T-клетками от обработанных мышей, был ниже, чем у полностью функциональных DbGP276-286 специфических клеток памяти (Фиг.4С).
Ингибирование PD-1 также увеличивало литическую активность "беспомощных", истощенных вирус-специфических CD8+ T-клеток. Ex vivo литическую активность вирус-специфических CD8+ T-клеток определяли после лечения, методом анализа высвобождения51Cr (Wherry и соав., 2003. J. Virol. 77:4911-27). Вирусные титры снижались примерно в 3 раза в селезенке, в 4 раза в печени, в 2 раза в легких и в 2 раза в сыворотке крови через 2 недели лечения, по сравнению с необработанными мышами (Фиг.4Е).
Таким образом, данные результаты показывают, что блокирование PD-1 пути разрушает CTL периферическую толерантность к хронической вирусной инфекции, и что истощенные CD8+ T-клетки, лишенные помощи CD4+ T-клеток, не являются необратимо инактивированными.
Пример 2
Ведение противовирусной вакцины и ингибитора PD-1
Один подход для усиления Т-клеточного ответа при персистирующей инфекции представляет собой терапевтическую вакцинацию. Логическим обоснованием данного подхода является то, что эндогенные антигены могут быть не представлены оптимальным или иммуногенным образом при хронической вирусной инфекции и предоставление антигена в виде вакцины может обеспечить более эффективный стимул для вирус-специфических T- и В-клеток. Используя модель хронического LCMV, мышам вводили рекомбинантный вакцинальный вирус, экспрессирующий LCMV GP33 эпитоп, в качестве терапевтической вакцины (VVGP33), которая дала в результате небольшое усиление CD8+ T-клеточного ответа у некоторых мышей с хронической инфекцией. Четыре из девяти мышей с хронической инфекцией, которые получали терапевтическую вакцину, демонстрировали положительный ответ, в то же время, ни одна из контрольных мышей не имела значительного увеличения иммунного ответа против PG33. Когда терапевтическую вакцинацию совмещали с ингибитором PD-L1, LCMV специфический Т-клеточный ответ усиливался в большей степени, чем по сравнению с каждым типом лечения по отдельности, проводимым отдельно, и эффект комбинированного лечения был больше, чем слагаемый эффект.
Пример 3
Ингибирование PD-1 пути у мышей с хронической инфекцией, с использованием РНКи PD-1
РНК интерференция (РНКи) способна отключить экспрессию генов в клетках млекопитающих. Длинные двухцепочечные РНК (dsPHK) вводятся в клетки и затем перерабатываются в меньшие интерферирующие РНК (siPHK), которые атакуют специфические мРНК молекулы или маленькую группу мРНК. Данная технология особенно полезна в ситуациях, где антитела являются неэффективными. Например, РНКи может быть использована в ситуации, в которой уникальные сплайсинговые модификации производят растворимые формы PD-1 и CTLA-4.
PD-1 малые интерферирующие РНК вставляют в коммерчески доступный вектор экспрессии siPHK, такой как pSilencerTM или аденовирусные векторы (Ambion, Austin, TX). Затем данные векторы встраивают в целевые истощенные Т-клетки in vivo или ex vivo (смотри Пример 4).
Пример 4
Омолаживание ex vivo истощенных Т-клеток
Вирус-специфические истощенные T-клетки выделяют у мышей с хронической инфекцией LCMV-Cl-13, используя магнитные бусы или центрифугирование на градиенте плотности. Трансфицированные CD8+ T-клетки вводят в контакт с моноклональными антителами, которые выявляют PD-L1, PD-L2 или PD-1. Как описано в Примере 1, ингибирование PD-1 пути приводит к омоложению CD8+ T-клеток. Соответственно, например, имеется увеличение пролиферации CD8+ T-клеток или продукции цитокинов. Данные омоложенные CD8+ T-клетки вновь вносят инфицированным мышам и измеряют вирусную нагрузку как описано в Примере 1.
Пример 5
Скрининг новых CD8+ T-клеточных соединений-восстановителей in vitro
Соединения, которые регулируют PD-1 путь, могут быть выявлены методами скрининга in vivo и ex vivo, основанными на их способности отменять CD8+ T-клеточное истощение, возникшее в результате хронической вирусной инфекции.
Истощенные CD8+ T-клетки получают от мышей с LCMV-C1-13 хронической инфекцией и затем вводят их в контакт с тестовым соединением. Количество противовирусных цитокинов (например, IFN-γ и TNF-α), выделенных Т-клетками после контакта, измеряют, например, методом ИФА или другим количественным методом и сравнивают с количеством цитокина, если он вообще присутствует, который высвобождается истощенной Т-клеткой, не контактировавшей с тестовым соединением. Увеличение количества противовирусного цитокина, выделяемого обработанными клетками, по сравнению с количеством, выделяемым необработанными клетками, определяет соединение как ингибитор PD-1, пригодный для модуляции Т-клеточной активности.
Пример 6
Скрининг новых CD8+ T-клеточных соединений-восстановителей in vivo
Истощенные CD8+ T-клетки получают от мышей с LCMV-C1-13 хронической инфекцией. Тестовое соединение вводят внутривенно инфицированным мышам. Количество противовирусных цитокинов (например, IFN-γ и TNF-α), которое высвобождается в сыворотку у обработанных и необработанных мышей, измеряют, например, методом ИФА или другим количественным методом и сравнивают. Увеличение количества противовирусного цитокина, обнаруженное в сыворотке обработанных мышей, по сравнению с количеством, обнаруженным у необработанных мышей, определяет соединение как ингибитор PD-1. Альтернативно, может быть определен вирусный титр (например, сывороточный вирусный титр) до и после лечения тестовым соединением.
Пример 7
Шимпанзе как модель иммунотерапии персистирующей HCV инфекции
Шимпанзе обеспечивают модель HCV персистирования у человека. Дефекты Т-клеточного иммунитета, приводящие к пожизненному вирусному персистированию, включают в себя дефицит HCV-специфических CD4+ хелперных T-клеток и ослабленную или измененную CD8+ эффекторную T-клеточную активность. Шимпанзе с персистирующей инфекцией лечат антителами против CTLA-4, PD-I или их комбинацией. Определяют эффективность блокирования ингибиторных путей, в сочетании с вакцинацией рекомбинантными структурными и неструктурными HCV белками, и могут ли данные стратегии увеличивать концентрацию и продолжительность жизни вирус-специфических Т-клеток памяти. Дефект Т-клеточного иммунитета является исключительно HCV-специфическим у человека и шимпанзе с персистирующей инфекцией. Кровь и печень инфицированных шимпанзе проверяют на экспрессию CTLA-4, PD-I, BTLA и их лигандов и на наличие Т регуляторных клеток. Затем противовирусная активность может быть восстановлена введением шимпанзе гуманизированных моноклональных антител, которые блокируют прохождение сигнала с участием данных молекул.
Шимпанзе с персистирующей инфекцией обрабатывают человеческими αCTLA-4 антителами (MDX-010, Medarex) или α PD-I антителами. Начальная доза MDX-010 составляет 0,3 мг/кг, последующие 2 недели по 1,0 мг/кг и затем 3,10, 30 мг/кг с интервалом по 3 недели. После лечения антителами к костимуляторным молекулам проверяют гуморальный и клеточный иммунный ответ и HCV РНК нагрузку. Образцы собирают на 1, 2, 3, 4, 5 и 8 неделе и затем с месячными интервалами. Образцы включают в себя: 1) сыворотку крови для анализа на трансаминаз, аутоантител, нейтрализующие антитела к HCV и цитокиновый ответ, 2) плазму крови на вирусную нагрузку и геномную эволюцию, 3) PBMC для in vitro измерений иммунитета, функции и экспрессии костимуляторных/ингибиторных рецепторов, 4) свежую (нефиксированную) печень для выделения печеночных лимфоцитов и РНК, и 5) фиксированная (заключенная в формалин/парафин) печень для гистологического и иммуногистохимического анализа. Региональные лимфатические узлы также могут быть взяты в 2 или 3 разных временных точках для оценки экспрессии коингибиторных молекул и сплайсинговых вариантов с помощью иммуногистохимии и молекулярных технологий. Анализы для оценки эффективности и безопасности данного лечения будут проведены, как описано в настоящем документе.
Чтобы проверить потенциирует ли вакцинирование HCV антигенами терапевтический эффект антител к PD-1, шимпанзе обрабатывают следующим образом: 1)внутримышечная иммунизация рекомбинантными оболочечными гликопротеинами Е1 и Е2 (в адъюванте MF59) и другими белками (core плюс NS 3, 4 и 5 в соединении с ISCOMS) в недели 0, 4 и 24; 2) внутримышечная иммунизация вакциной, использованной в пункте 1), но в совместном введении с αCTLA-4 антителами (30мг каждого/кг массы тела, внутривенно в недели 0, 4 и 24 когда вводят вакцину); 3) идентично пункту 2) за исключением того, что CTLA-4 антитела заменяют на αPD-1 (или BTLA) антитела; 4) идентично группам 2 и 3 за исключением того, что комбинацию CTLA-4 и PD-1 (или BTLA) используют в дополнение к вакцине. HCV-специфический Т- и В-клеточный ответ наблюдают с месячными интервалами после иммунизации в течение 1 года.
Маркеры, проверяемые на HCV-тетрамер+ и общие Т-клетки в данном анализе, включают в себя маркеры дифференцировки (например, CD45RA/RO, CD62L, CCR7 и CD27), активации (например, CD25, CD69, CD38 и HLA-DR), выживания/пролиферации (например, bcl-2 и Ki67), цитотоксического потенциала (например, гранзимы и перфорин) и цитокиновых рецепторов (CD122 и CD127). Имеет место интересная корреляция между титрами хемокина IP-10 до лечения и ответом на PEG IFN-γ/рибавирин. Титры IP-10 измеряют, чтобы исследовать возможную корреляцию между отрицательными регуляторными путями или HCV-специфическим Т-клеточным ответом и титрами IP-10. Экспрессию ингибиторных рецепторов и лигандов на PBMC осуществляют проточной цитометрией.
Пример 8
Иммуноокрашивание на PD-1 в реактивной лимфоидной ткани
Материалы
Исследуемый материал получили из Brigham & Women's Hospital (Бостон, США) в соответствии с правилами учреждения. Все диагнозы были основаны на гистологических и иммунофенотипических признаках, описанных в системе классификации лимфом Всемирной организации здравоохранения (Jaffe ES, et al. 2001) и во всех случаях диагностируемый материал проверял гематопатолог.
Иммуноокрашивание
Иммуноокрашивание на PD-1 проводили на срезе ткани, фиксированной в формалине и залитой в парафин, с последующим определением антигена в микроволновым диапазоне, в 10мМ цитратном буфере, рН 6,0, описанными ранее моноклональными антителами к PD-1 человека (2Н7;5), используя стандартный непрямой метод с авидином и биотинированной пероксидазой хрена и проявлением диаминобензидином, как описано (Jones D, и соав. 1999; Dorfman DM, и соав. 2003). Образцы расценивали как иммунореактивные на PD-1, если, по меньшей мере, 25% неопластических клеток имели положительное окрашивание. Для подтверждения специфичности окрашивания сравнивали PD-1 окрашивание с окрашиванием контрольных мышиных IgG изотипических антител, разведенных до идентичной концентрации белка для всех исследованных образцов.
Моноклональное антитело 2Н7 на PD-1 использовали для окрашивания фиксированных в формалине и залитых в парафин образцов реактивной лимфоидной ткани, тимуса и в ряде случаев В-клеточных и Т-клеточных лимфопролиферативных заболеваний. В образцах миндалевидной железы обнаружены реактивные изменения, включающие в себя фолликулярную гиперплазию, популяцию главным образом малых лимфоцитов в герминальных центрах, показанных цитоплазматическим окрашиванием на PD-1, с редко встречающимися PD-1 положительными клетками, видимыми в интерфолликулярных Т-клеточных зонах. Картина PD-1 окрашивания в герминальных центрах была практически идентичной той, что видна с антителами к CD3, общему Т-клеточному маркеру, в то время как антитела к CD20, общему В-клеточному маркеру, окрашивали значительное большинство В-клеток герминального центра. Сходные результаты окрашивания были видны в гистологических срезах реактивного лимфоузла и селезенки. PD-1 окрашивание не наблюдали во взрослом тимусе.
Пример 9
Иммуноокрашивание на PD-1 заключенных в парафин срезах ткани при В-клеточных и Т-клеточных лимфопролиферативных заболеваниях
Исследовали ряд В-клеточных и Т-клеточных лимфопролиферативных заболеваний на экспрессию PD-1; результаты представлены в Таблице 1. Сорок два случая В-клеточных лимфопролиферативных заболеваний проверяли на экспрессию PD-1, включая репрезентативные случаи В-лимфобластного лейкоза из клеток предшественников /лимфобластной лимфомы и ряда лимфопролиферативных заболеваний зрелых В-клеток, включающих в себя В-клеточные неходжкинские лимфомы фолликулярного происхождения, включая 6 случаев фолликулярной лимфомы и 7 случаев лимфомы Буркитта. Окрашивание на PD-1 не было обнаружено ни при одном из В-клеточных лимфопролиферативных заболеваний. В некоторых случаях присутствовала не неопластическая реактивная лимфоидная ткань, которая давала картину PD-1 окрашивания для миндалевидной железы и другой реактивной лимфоидной ткани, упомянутой выше.
Подобным образом в 25 случаях ходжкинской лимфомы, включая 11 случаев классической ходжкинской лимфомы и 14 случаев ходжкинской лимфомы с лимфоидным преобладанием, неопластические клетки не демонстрировали окрашивания на PD-1. Интересно, что во всех 14 случаях ходжкинской лимфомы с лимфоидным преобладанием Т-клетки, окружающие неопластические CD20-позитивные L&H клетки были иммунореактивными для PD-1, что сходно с примером окрашивания, указанным для CD57+Т-клеток при ходжкинской лимфоме с лимфоидным преобладанием. Данные PD-1 позитивные клетки являются субпопуляцией общей CD3+ N-клеточной популяции.
Ряд Т-клеточных лимфопролиферативных заболеваний был исследован на экспрессию PD-1; результаты представлены в Таблице 1. Случаи Т-клеточного лимфобластического лейкоза из клеток-предшественников/лимфобластной лимфомы, опухоли незрелых Т-клеток, были отрицательными на PD-1, как и опухоли из периферических пост-тимусных Т-клеток, включая случаи Т-клеточного пролимфоцитарного лейкоза, периферической Т-клеточной лимфомы неуточненной, анапластической крупноклеточной лимфомы и Т-клеточного лейкоза/лимфомы взрослых. В отличие от этого, все 19 случаев ангиоиммунобластической лимфомы содержали очаги PD-1 положительных клеток, которые также были иммунореактивными на общие Т-клеточные маркеры, такие как CD3. PD-1 положительные клетки постоянно обнаруживали в очагах распространенных CD21+ фолликулярных дендритных клеточных (FDC) сетей, что является характерной особенностью ангиоиммунобластической лимфомы.
Сокращения: B-LL/LL - В-клеточная лимфобластная лимфома/лимфобластный лейкоз из клеток-предшественников; CLL - хронический лимфоцитарный лейкоз; MCL -лимфома из клеток мантийной зоны; FL - фолликулярная лимфома; MZL - лимфома маргинальной зоны; HCL - волосатоклеточный лейкоз; DLBCL - диффузная В-крупноклеточная лимфома; BL - лимфома Буркитта; LPL - лимфоплазмоцитарная лимфома; MM - множественная миелома; T-LL/L - Т-лимфобластная лимфома/лейкоз из клеток-предшественников; T-PLL - Т-клеточный пролимфоцитарный лейкоз; AIL - ангиоиммунобластная Т-клеточная лимфома; PTCL - периферическая Т-клеточная лимфома, неуточненная; ALCL - анапластическая крупноклеточная лимфома; ATLL- Т-клеточная лимфома/лейкоз взрослых.
* число иммунореактивных случаев/общее число случаев.
** PD-I-положительные клетки из розеток вокруг неопластических L&H клеток в 14/14 случаях.
Пример 10
Общие методы изучения экспрессии PD-1 на ВИЧ- специфических человеческих CD8+ клетках
Следующие методы были использованы для проведения экспериментов, подробно представленных в Примерах 11-14.
Субъекты исследования
Участников исследования с хроническим кладом С ВИЧ-1 инфекции отбирали в поликлинике при госпитале McCord, Durban, и госпитале Святой Марии, Mariannhill, ЮАР. Образцы периферческой крови получили от 65 пациентов данной группы, которые не получали лечения против ретровирусов на момент исследования. Субъектов отбирали на основании экспрессии у них HLA аллелей, соответствующих десяти тетрамерам класса I, которые были сконструированы (смотри далее). Средняя вирусная нагрузка группы составляла 42800 РНК копий ВИЧ-1/мл плазмы (размах 163 - 750000) и среднее абсолютное число CD4 составляло 362 (размах 129 - 1179). Данные о продолжительности инфекции были не доступны. Все субъекты давали письменное согласие на исследование, которое было одобрено местными экспертными советами организаций.
Получение антител PD-1 и PD-L1
Моноклональные антитела к PD-Ll человека (29E.2A3, мышиные IgG2b) и PD-I (EH12, мышиные IgGl) получили, как описано выше, и показали, что они блокируют взаимодействие PD-I:PD-Ll.
Тетрамеры класса I МНС
В исследовании были использованы десять тетрамеров класса I МНС, синтезированных, как описано ранее (Airman JD и соавт. 1996): A*0205 GL9 (p24, GAFDLSFFL; SEQ ID NO:1), A*3002 KIY9 (hitegrase, KIQNFRVYY; SEQ ID NO:2), B*0801 DI8 (p24, DIYKRWII; SEQ ID NO:3), B*0801 FL8 (Nef, FLKEKGGL; SEQ ID NO:4), B*4201 RM9 (Nef, RPQVPLRPM; SEQ ID NO:5), B*4201 TL9 (p24, TPQDLNTML; SEQ ID NO:6), B*4201 TLlO (Nef, TPGPGVRYPL; SEQ ID NO:7), B*4201 YL9 (RT, YPGIKVKQL; SEQ ID NO:8), B*8101 TL9 (p24, TPQDLNTML; SEQ ID NO:9) и Cw0304 YL9 (p24, YVDRFFKTL; SEQ ID NO: 10). Плазмидные конструкции, экспрессирующие A*0205, A*3002, and Cw*0304, были любезно предоставлены доктором Евгением Равковым и доктором Джоном Алтманом, NIH Tetramer Core Facility, Атланта, США.
Окрашивание тетрамеров класса I МНС и фенотипический анализ
Свежевыделенные мононуклеарные клетки периферической крови (PBMC, 0,5 миллиона) окрашивали с тетрамером 20 минут, при 37°С. Затем клетки отмывали один раз фосфатным буферным раствором (PBS), осаждали центрифугированием и окрашивали непосредственно конъюгированными с флуоресцеинизотиоцианатом (FITC) анти-CD8 (Becton Dickinson), конъюгированными с фикоэритрином анти-PD-1 (клон ЕН12) и ViaProbe (Becton Dickinson). Клетки инкубировали 20 минут при комнатной температуре, отмывали один раз PBS и ресуспендировали в 200 мкл PBS с 1% параформальдегида и считывали данные на флуоресцентно-активирующем клеточном сортере (FACSCalibur, Becton Dickinson). Минимально на FACSCalibur считали 100000 результатов.
Анализ пролиферации CFSE
Один миллион свежевыделенных PBMC отмывали два раза в PBS, осаждали центрифугированием и ресуспендировали в 1 мл 0,5 мкМ сукцинимидного эфира карбоксифлуоресцеин диацетата (CFSE, Molecular Probes) в течение 7 минут, при 37°С. Клетки дважды отмывали в PBS и ресуспендировали в 1 мл среды R10 (среда RPMI 1640, дополненная глутатионом, пенициллином, стрептомицином и 10% фетальной телячьей сывороткой [FCS]) и помещали в одну лунку 24-луночного планшета. Начальные исследования показали, что конечная концентрация пептида 0,2 мкг/мл дала оптимальные пролиферативные ответы, поэтому данная концентрация и являлась конечной концентрацией пептида в лунке для каждой пробы. Лунки с отрицательным контролем содержали только РВМС в среде или РВМС в среде с очищенным анти-PD-L1 (10 мкг/мл) и лунки с положительным контролем стимулировали 10 мкг/мл фитогемагглютинина (РНА). После 6-дневной инкубации в инкубаторе при 37°С клетки отмывали 2 мл PBS и окрашивали РЕ-конъюгированными тетрамерами класса I МНС, ViaProbe (Becton Dickinson) и анти-CD8-APC антителами. Клетки подсчитывали на FACSCalibur и данные анализировали с помощью программы CellQuest® (Becton Dickinson). Клетки пропускали на ViaProbe- CD8+лимфоциты. Возрастание в разы тетрамер+ клеток подсчитывали делением процентного количества CD8+тетрамер+ клеток в присутствии пептида на процентное количество CD8+тетрамер+ клеток в отсутствие пептидной стимуляции.
Статистический анализ
Выполняли анализ корреляции по Спирмену, тест Манна-Уитни и парный t-критерий Стьюдента с помощью программы GraphPad Prism, версия 4.0a. Все критерии являлись двусторонними и значения р расценивали как статистически значимые при р<0,05.
Пример 11
Экспрессия PD-1 на ВИЧ- специфических CD8+ клетках
Синтезировали набор из 10 тетрамеров класса I МНС, специфических для доминантных ВИЧ-1 клада С вирусных CD8 Т-клеточных эпитопов на основе преобладающих HLA аллелей и часто встречающихся целевых эпитопов в Gag, Nef, Integrase и RT (Kiepiela P, и соавт. 2004), которая позволяет прямую визуализацию поверхностной экспрессии PD-1 на данных клетках. На полной группе субъектов провели HLA типирование с высоким разрешением и отобрали субпопуляцию из 65 человек, не получавших лечение против ретровирусов, для исследования, основанного на экспрессии преобладающих HLA аллелей. Всего было проверено 120 индивидуальных эпитопов, показательное ex vivo окрашивание PD-1 на ВИЧ тетрамер+ клетках показано на Фиг.5А. Экспрессия PD-1 была хорошо различима на данных тетрамер+ клетках и она была значительно выше, чем в общей популяции CD8 Т-клеток тех же субъектов (р<0,0001); в свою очередь экспрессия PD-1 и на тетрамер+ CD8 Т-клетках и на общей популяции CD8 Т-клеток была значительно выше, чем в группе ВИЧ-серонегативного контроля (Фиг.5В). Был выявлен, по меньшей мере, один субъект, у которого для восьми из десяти тестируемых тетрамеров уровень экспрессии на CD8 Т-клетках составлял 100% (Фиг.5С). PBMC от 3 до 25 субъектов были окрашены на каждый ВИЧ тетрамерный ответ, со средними уровнями экспрессии PD-1, изменявшимися в пределах от 68% до 94% тетрамер+ клеток (Фиг.5С). Данные результаты затем были подтверждены анализом средней интенсивности флуоресценции (MFI) PD-1 на тетрамер+ клетках и на общей популяции CD8 Т-клеток (Фиг.5В, С).
Затем определили, существует ли доказательство для эпитоп-специфических различий в значениях уровней экспрессии PD-1 у субъектов с множественными определяемыми ответами. Из 65 обследованных человек, 16 субъектов имели от 3 до 5 тетрамер-положительных ответов, каждый. Экспрессия PD-1 была практически одинаковой и достигала 100% у трех из шестнадцати субъектов; при этом остальные 13 субъектов показывали различные примеры экспрессии PD-1 в зависимости от эпитопа (Фиг.5D). Полученные данные показывают, что экспрессия PD-1 может быть различно выраженной на существующих в одно и тоже время эпитоп-специфических CD8 Т-клетках у одного человека, что возможно согласуется с современными данными, показывающими эпитоп-специфические различия в противовирусной эффективности (Tsomides TJ, и соавт. 1994; Yang O, и соавт. 1996; Loffredo JT, и соавт. 2005).
Пример 12
Взаимосвязь между экспрессий PD-1 и развитием ВИЧ заболевания
Определяли взаимосвязь между экспрессией PD-1 на ВИЧ CD8 Т-клетках и вирусной нагрузкой в плазме крови и количеством CD4, которые являются показателями развития ВИЧ заболевания. Предыдущие исследования взаимосвязи между числом тетрамер-положительных клеток и вирусной нагрузкой или количеством CD4 не показали достоверной корреляции (Фиг.6А, В). В отличие от этого, были достоверные положительные корреляции вирусной нагрузки, как с процентным содержанием, так и с MFI экспрессии PD-1 на ВИЧ тетрамер-положительных клетках (p=0,0013 и p<0,0001, соответственно; Фиг.6A). Также были обратные корреляции между количеством CD4 и процентным содержанием и MFI PD-1 на ВИЧ тетрамер-положительных клетках (p=0,0046 и p=0,0150, соответственно; Фиг.6B).
Поскольку определяемые тетрамеры с большой вероятностью представляли только фракцию ВИЧ-специфической CD8 Т-клеточной популяции у указанных субъектов, то также проверяли наличие взаимосвязи между экспрессией PD-1 на всех CD8 клетках и данными параметрами. Были достоверные положительные корреляции между вирусной нагрузкой и процентным содержанием и MFI экспрессии PD-1 на общей CD8 Т-клеточной популяции (p=0,0021 и p<0,0001, соответственно; Фиг.6C), и также наблюдали обратные корреляции между количеством CD4 и процентным содержанием и MFI экспрессии PD-1 на всей CD8 Т-клеточной популяции (p=0,0049 и p=0,0006, соответственно; Фиг.6D). У 5 субъектов этой же группы проверяли экспрессию PD-1 на CMV-специфических CD8 Т-клетках, и на данных клетках экспрессировалось достоверно меньше PD-1, по сравнению с ВИЧ-специфическими CD8 Т-клетками (среднее значение 23% для CMV тетрамер+ PD-I+, p=0,0036, данные не показаны) и экспрессия PD-1 не отличалась от экспрессии на остальных CD8 Т-клетках этих же субъектов, что показывает, что высокая экспрессия PD-1 не является общей особенностью всех вирус-специфических CD8 Т-клеток. Полученные данные позволяют предположить, что увеличение количества антигена при хронической ВИЧ инфекции приводит к увеличению экспрессии PD-1 на CD8 Т-клетках, что согласуется с данными, полученными при хронической LCMV инфекции мышей, при которой экспрессия PD-1 ассоциируется с функциональным истощением CD8 Т-клеток (Barber DL, et al. 2005). Более того, впервые в большом исследовании, включающем в себя анализ множественных эпитопов, данные ясно показывают взаимосвязь между ВИЧ-специфическими CD8 Т-клетками и вирусной нагрузкой или количеством CD4.
Пример 13
Взаимосвязь между экспрессий PD-1 и статусом и функцией CD8 Т-клеток памяти
Затем экспрессию PD-1 исследовали в связи с несколькими дополнительными фенотипическими маркерами, связанными со статусом и функцией CD8 Т-клетками памяти, включая CD27, CD28, CD45RA, CD57, CD62L, CD127, CCR7, перфорин, гранзим В и Ki67 (Фиг.7). Показательное окрашивание на данные маркеры на B*4201 TL9 тетрамер+ клетках от одного субъекта показано на Фиг.7А, и суммарные данные 13 субъектов показаны на Фиг.7В. Данные исследования были ограничены теми ответами на тетрамеры, которые были больше чем на 95% PD-1 положительными, поскольку мультипараметрическая проточная цитометрия с более чем 4 цветами не доступна в KwaZulu Natal. ВИЧ тетрамер+ PD-I+клетки экспрессируют высокий уровень CD27 и гранзима В, очень низкий уровень CD28, CCR7 и внутриклеточного Ki67, низкий уровень CD45RA и перфорина и средний уровень CD57 и CD62L (Фиг.7В). Данные показывают, что ВИЧ-специфические PD-I+ Т-клетки проявляют фенотип эффектор/эффектор памяти, что согласуется с предыдущими сообщениями о искаженном созревании ВИЧ-специфических СВ8 Т-клеток (Champagne P, и соавт 2001; Appay V, и соавт. 2002; Hess C, и соавт. 2004). Кроме того, проводили вирусное секвенирование чтобы определить осуществляют ли данные клетки ускользание от иммунного надзора (Brown JA, и соавт. 2003). Из 45 установленных тетрамер-положительных ответов, только у 5 вирусные эпитопы отличались от конценсусной последовательности южноафриканского клада С, что показывает (данные не показаны), что данные клетки оказывают незначительное селекционное давление in vivo.
Предыдущие эксперименты на LCMV модели мышей показали, что блокирование in vivo взаимодействия PD-1/PD-L1 инфузией анти- PD-L1 блокирующих антител приводит к увеличению функциональной активности LCMV-специфических CD8 Т-клеток, как установили по продукции цитокинов, способности к цитолизу, пролиферативной способности и, что наиболее удивительно, по уменьшению вирусной нагрузки (Barber DL и соавт. 2005).
Пример 14
Влияние блокады пути PD-1/PD-L1 на пролиферацию ВИЧ-специфических CD8 Т-клеток
Поскольку ВИЧ-специфические CD8 Т-клетки демонстрируют также ослабленную пролиферативную способность (Migueles SA и соавт. 2002; Lichterfeld M, и соавт. 2004), было определено, может ли усилить блокирование пути PD-1/PD-L1 данную функцию in vitro. Показательные данные B*4201-положительного субъекта представлены на Фиг.8А. Инкубация свежевыделенных CFSE-меченных PBMC только в среде культивирования или в среде с анти-PD-L1 антителами дала в результате сохранение популяции B*4201-TL9-специфических CD8 T-клеток (1.2% CD8 T-клеток), которые оставались CFSEhi после 6 дней в культуре. Стимуляция CFSE-меченных PBMC в течение 6 дней только пептидом TL9 дала в результате увеличение в 4,8 раз CFSE10 B*4201 TL9 тетрамер+ клеток, тогда как стимуляция CFSE-меченных PBMC пептидом TL9 в присутствии анти-PD-L1 блокирующих антител далее усиливала пролиферацию TL9-специфических клеток, приводя к увеличению в 10,3 раза тетрамер+ клеток. Исследование CFSE пролиферации проводили на 28 образцах в присутствии или без очищенных блокирующих антител к PD-L1 человека. Наблюдали значительное увеличение пролиферации ВИЧ-специфических CD8+ Т-клеток в присутствии пептида и анти-PD-L1 блокирующих антител, по сравнению с пролиферацией после стимуляции только пептидом (Фиг.8В; p=0,0006, парный t-критерий Стьюдента). Значительный рост тетрамер+-клеток в присутствии анти-PD-L1 блокирующих антител варьировал у субъектов и в зависимости от эпитопа у одного и того же субъекта (Фиг.8С), что опять предполагает эпитоп-специфические различия в степени функционального истощения данных ответов.
ДРУГИЕ ВОПЛОЩЕНИЯ ИЗОБРЕТЕНИЯ
В то время как изобретение описано в соединении с данным подробным описанием, упомянутое описание предназначается для пояснения и оно не ограничивает рамки изобретения, которое определяется рамками прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в рамках следующей формулы изобретения.
Реферат
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована композиция для лечения персистирующей инфекции, ангиоиммунобластической лимфомы или нодулярной с лимфоидным преобладанием лимфомы Ходжкина. Композиция содержит ингибитор активности или экспрессии PD-1. Группа изобретений относится также к композиции, содержащей антиген-специфичную Т-клетку, приведенную в контакт с соединением, которое понижает экспрессию или активность PD-1. Использование данной группы изобретений позволяет блокировать уровень экспрессии PD-1, что приводит к повышенной пролиферации CD8+ Т-клеток. 2 н. и 19 з.п. ф-лы, 8 ил., 1 табл., 14 пр.

Комментарии