Композиции и способы модулирования экспрессии аполипопротеина (а) - RU2699985C2
Код документа: RU2699985C2
Чертежи



































































































































































































Описание
Настоящее изобретение зарегистрировано вместе с перечнем последовательностей в электронном формате. Перечень последовательностей представлен в виде файла под названием BIOL0250WOSEQ_ST25.txt, созданного 1 мая 2014 года, размером 432 Кб. Информация о перечне последовательностей в электронном формате в полном объеме включена в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Принцип, лежащий в основе антисмысловой технологии, заключается в том, что антисмысловое соединение гибридизуется с целевой нуклеиновой кислотой и модулирует количество, активность и/или функцию целевой нуклеиновой кислоты. Например, в некоторых случаях антисмысловые соединения приводят к изменению транскрипции или трансляции мишени. Такое модулирование экспрессии может быть достигнуто, например, разрушением мРНК-мишени или ингибированием на основании оккупации. Пример модулирования целевой функции РНК за счет разрушения представляет собой разрушение за счет РНКазы Н целевой РНК при гибридизации с ДНК-подобным антисмысловым соединением. Другой пример модулирования генной экспрессии за счет разрушения мишени представляет собой РНК-интерференция (РНКи). РНКи относится к антисмысл-опосредованному сайленсингу гена по механизму, в котором применяется РНК-индуцируемый комплекс сайленсинга (RISC). Дополнительный пример модулирования целевой функции РНК представляет собой механизм на основании оккупации, такой как использует в естественных условиях микроРНК. МикроРНК представляют собой небольшие некодирующие РНК, которые регулируют экспрессию РНК, кодирующих белки. Связывание антисмыслового соединения с микроРНК препятствует связыванию микроРНК с ее матричными РНК мишенями, и, следовательно, затрудняет функцию микроРНК. МикроРНК-миметики могут усиливать естественную функцию микроРНК. Некоторые антисмысловые соединения изменяют сплайсинг пре-мРНК. Независимо от конкретного механизма, специфичность в отношении последовательностей делает антисмысловые соединения перспективными в качестве средств для подтверждения нацеленности и функционализации генов, а также в качестве терапевтических средств для селективного модулирования
экспрессии генов, участвующих в патогенезе заболеваний.
Антисмысловая технология представляет собой эффективный способ модулирования экспрессии одного или более специфических генных продуктов и, следовательно, может быть признана исключительно подходящей в ряде терапевтических, диагностических и исследовательских применений. Химически модифицированные нуклеозиды могут быть внедрены в антисмысловые соединения для усиления одного или более свойств, таких как устойчивость к нуклеазе, фармакокинетика или аффинность к целевой нуклеиновой кислоте. В 1998 году антисмысловое соединение Vitravene® (фомивирсен; разработанный компанией Isis Pharmaceuticals Inc., Карлсбад, штат Калифорния) стал первым антисмысловым лекарством, получившим разрешение на продажу от Администрации США по пищевым продуктам и лекарственным веществам (FDA), и в настоящее время представляет собой средство для лечения вызванного цитомегаловирусом (CMV) ретинита у пациентов со СПИДом.
Новые химические модификации обладают улучшенной активностью и эффективностью антисмысловых соединений, раскрывая потенциал для пероральной доставки, а также для усовершенствования подкожного введения, снижения возможных побочных эффектов, и являются более удобными для пациента. Химические модификации, усиливающие активность антисмысловых соединений, позволяют осуществлять введение более низких доз, что снижает возможность токсичности, а также уменьшает общую стоимость лечения. Модификации, увеличивающие устойчивость к разрушению, приводят к более медленному выведению из организма, обеспечивая возможность менее частого введения доз. Различные типы химических модификаций могут быть комбинированы в одном соединении для дальнейшей оптимизации эффективности соединения.
Липопротеины представляют собой глобулярные мицеллоподобные частицы, которые состоят из неполярного ядра из ацилглицеринов и холестериловых сложных эфиров, окруженного амфифильной оболочкой из белков, фосфолипидов и холестерина. Липопротеины классифицируют на пять крупных категорий по их функциональным и физическим свойствам: хиломикроны, липопротеины очень низкой плотности (VLDL), липопротеины средней плотности (IDL), липопротеины низкой плотности (LDL) и липопротеины высокой плотности (HDL). Хиломикроны переносят пищевые липиды из кишечника к ткани. VLDL, IDL и LDL переносят триацилглицерины и холестерин из печени к тканям. HDL переносят эндогенный холестерин от тканей к печени.
Частицы липопротеинов подвергаются непрерывной метаболической переработке и имеют различные свойства и состав. Плотность липопротеинов увеличивается без увеличения диаметра частицы, поскольку плотность их внешней оболочки меньше, чем плотность внутреннего ядра. Белковые компоненты липопротеинов известны также как аполипопротеины. В различных липопротеинах человека в значительных количествах содержатся по меньшей мере девять аполипопротеинов.
Частица липопротеина (a) [Lp(a)] была идентифицирована около 50 лет назад, и она состоит из весьма уникальной частицы LDL, в которой один белок аполипопротеина В (ароВ) связан дисульфидной связью с одним белком аполипопротеина (а) [аро(а)]. Белок аро(а) имеет высокую степень гомологии с плазминогеном, особенно в повторяющемся крингл домене IV 2 типа. Уровни циркулирующего Lp(a) обратно пропорциональны количеству вариабельных повторов крингл IV 2 типа в молекуле и, поскольку у индивидуума совместно экспрессируются обе аллели, могут демонстрировать гетерозиготные профили изоформ плазмы (Kraft et al., Eur J Hum Genet, 1996; 4(2): 74-87). Предполагают, что этот повторяющийся крингл домен в аро(а) может отвечать за его протромботические и антифибринолитические свойства, потенциально усиливая атеросклеротическое прогрессирование.
Аро(а) транскрипционно регулируется IL-6, а в исследованиях на пациентах с ревматоидным артритом, которых лечили ингибитором IL-6 (тоцилизумабом), уровни в плазме были снижены на 30% спустя 3 месяца лечения (Schultz et al., PLoS One 2010; 5:el4328).
Было показано, что apo(a) предпочтительно связывает окисленные фосфолипиды и потенцирует сосудистое воспаление (Bergmark et al., J Lipid Res 2008; 49:2230-2239; Tsimikas et al., Circulation. 2009; 119(13):1711-1719).
Кроме того, выполненные исследования позволяют предположить, что частица Lp(a) также может стимулировать эндотелиальную проницаемость, инициировать экспрессию ингибитора плазминогенного активатора типа 1 и активировать секрецию макрофагального интерлейкина-8 (Koschinsky and Marcovina, Curr Opin Lipidol 2004; 15:167-174). Важно отметить, что в недавних исследованиях генетической связи было выявлено, что Lp(a) представляет собой независимый фактор риска для инфаркта миокарда, инсульта, болезни периферических сосудов и аневризмы брюшной аорты (Rifai et al., Clin Chem 2004; 50:1364-71; Erqou et al., JAMA 2009;302:412-23; Kamstrup et al., Circulation 2008; 117:176-84). Более того, в недавнем исследовании преждевременной болезни коронарных артерий
(PROCARDIS), Clarke et al. (Clarke et al., NEJM (2009)361; 2518-2528), описаны прочные и независимые связи между коронарной болезнью серца и концентрациями Lp(a) в плазме. Кроме того, ученые Solfrizzi et al., предположили, что повышенное содержание Lp(а) в сыворотке может быть связано с повышенным риском болезни Альцгеймера (AD) (Solfrizzi et al., J Neurol Neurosurg Psychiatry 2002, 72:732-736. В настоящее время, в клинических, условиях примеры косвенных ингибиторов аро(а) для лечения сердечно-сосудистых. заболеваний включают аспирин, ниаспан, мипомерсен, анацетрапиб, эпиротиром и ломитапид, которые снижают уровни Lp(a) в плазме на 18%, 39%, 32%, 36%, 43% и 17%, соответственно. Кроме того, в клинических условиях может быть использован аферез Lp(a) для снижения содержания аро(а)-содержащих частиц Lp(a).
В настоящее время существует ограниченное число терапевтических стратегий для лечения сердечно-сосудистых заболеваний, прямо нацеленных на уровни аро(а).. Были разработаны рибозимные олигонуклеотиды (патент США 5877022) и антисмысловые олигонуклеотиды (WO 2005/000201; WO 2003/014397; WO 2013/177468; US 20040242516; патенты США №8138328, 8673632 и 7259150; Merki et al., J Am Coll Cardiol 2011; 57:1611-1621; каждая публикация включена в настоящий документ посредством ссылки в полном объеме), но ни один из них не был одобрен для промышленного применения.
Следовательно, сохраняется очевидная неудовлетворенная медицинская потребность в новых агентах, которые могут эффективно и селективно снижать уровни аро(а) у пациентов с повышенным риском сердечно-сосудистых явлений из-за хронически повышенных уровней Lp(a) в плазме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе представлены композиции и способы модулирования экспрессии мРНК и белка аро(а). В некоторых вариантах реализации изобретения специфический ингибитор аро(а) снижает экспрессию мРНК и белка аро(а). В настоящем документе представлены композиции и способы модулирования экспрессии уровней Lp(a).
В некоторых вариантах реализации изобретения композиция представляет собой специфический ингибитор аро(а). В некоторых вариантах реализации специфический ингибитор аро(а) представляет собой нуклеиновую кислоту, белок или небольшую молекулу. В некоторых вариантах реализации специфический ингибитор аро(а) представляет собой антисмысловый олигонуклеотид, нацеленный на аро(а), и конъюгат. В некоторых вариантах реализации специфический ингибитор аро(а) представляет собой модифицированный
олигонуклеотид и конъюгат, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и содержит последовательность азотистых оснований, содержащую часть из по меньшей мере 8 смежных азотистых оснований, комплементарную равной по длине части азотистых оснований3901-3920 в SEQ ID NO:1, причем указанная последовательность азотистых оснований модифицированного олигонуклеотида поменьшей мере на 80% комплементарна SEQ ID NO:1. В некоторых вариантах реализации специфический ингибитор аро(а) представляет собой модифицированный олигонуклеотид и конъюгат, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых основанийпоследовательности азотистых оснований SEQ ID NO: 1-130, 133, 134. В некоторых вариантах реализации специфический ингибитор аро(а) представляет собой модифицированный олигонуклеотид и конъюгат, при этом модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых основанийлюбой из SEQ ID NO: 58, при этом модифицированный олигонуклеотид содержит: (а) сегмент гэп состоящий из десяти связанных дезоксинуклеозидов; (b) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (с) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; и при этом, сегмент гэп находится между сегментом 5'-крыла и сегментом 3'-крыла, и каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар, и по меньшей мере одна межнуклеозидных связей представляет собой тиофосфатную связь, а каждый цитозиновый остаток представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения приведена композиция, содержащая конъюгированное антисмысловое соединение, описанное в настоящем документе, или его соль и фармацевтически приемлемый носитель или разбавитель.
В некоторых вариантах реализации модулирование экспрессии аро(а) происходит в клетке или ткани. В некоторых вариантах реализации модулирование происходит в клетке или ткани животного. В некоторых вариантах реализации животное представляет собой человека. В некоторых вариантах реализации модулирование представляет собой снижение уровня мРНК аро(а). В некоторых вариантах реализации модулирование представляет собой снижение уровня белка аро(а). В некоторых вариантах реализации снижаются и уровни
мРНК, и уровни белка аро(а). В некоторых вариантах реализации модулирование представляет собой снижение уровня Lp(a). Такое снижение может происходить в зависимости от времени или в зависимости от дозы.
В некоторых вариантах реализации приведены конъюгированные антисмысловые композиции и способы их применения в терапии. В некоторых вариантах реализации приведены композиции и способы предупреждения, лечения, отсрочки, замедления прогрессирования и/или облегчения заболеваний, расстройств и состояний, связанных с аро(а). В некоторых вариантах реализации приведены композиции и способы предупреждения, лечения, отсрочки, замедления прогрессирования и/или облегчения заболеваний, расстройств и состояний, связанных с Lp(a). В некоторых вариантах реализации такие заболевания, расстройства и состояния представляют собой воспалительные, сердечнососудистые и/или метаболические заболевания, расстройства и состояния. В некоторых вариантах реализации композиции и способы терапии включают введение аро(а)-специфического ингибитора индивидууму, нуждающемуся в этом. В некоторых вариантах реализации аро(а)-специфический ингибитор представляет собой нуклеиновую кислоту. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации, антисмысловое соединение представлявляет собой модифицированный олигонуклеотид. В некоторых вариантах реализации, антисмысловое соединение представляет собой модифицированный олигонуклеотид с конъюгатом.
В некоторых вариантах реализации настоящего описания представлены конъюгированные антисмысловые соединения. В некоторых вариантах реализации настоящего описания представлены конъюгированные антисмысловые соединения, содержащие антисмысловый олигонуклеотид, комплементарный транскрипту нуклеиновой кислоты. В некоторых вариантах реализации настоящего описания представлены способы, включающие контакт клетки с конъюгированным антисмысловым соединением, содержащим антисмысловый олигонуклеотид, комплементарный транскрипту нуклеиновой кислоты. В некоторых вариантах реализации настоящего описания представлены способы, включающие контакт клетки с конъюгированным антисмысловым соединением, содержащим антисмысловый олигонуклеотид, и уменьшение количества или активности транскрипта нуклеиновой кислоты в клетке.
Ранее был описан асиалогликопротеиновый рецептор (ASGP-R). См., например, Park et al., PNAS, том 102, №47, cc. 17125-17129 (2005). Такие рецепторы экспрессируются на
клетках печени, в частности, гепатоцитах. Кроме того, было показано, что соединения, содержащие кластеры трех N-ацетилгалактозаминовых (GalNAc) лигандов, способны связываться с ASGP-R, приводя к захвату указанного соединения в клетку. См., например, Khorev et al., Bioorganic and Medicinal Chemistry, 16, 9, cc. 5216-5231 (май, 2008). Соответственно, конъюгаты, содержащие такие кластеры GalNAc, применяли для облегчения захвата некоторых соединений в клетки печени, в частности, гепатоциты. Например, было показано, что некоторые GalNAc-содержащие конъюгаты увеличивают активность дуплексных миРНК соединений в клетках печени in vivo. В таких случаях GalNAc-содержащий конъюгат, как правило, прикрепляется к смысловой спирали дуплекса миРНК. Поскольку смысловая спираль отбрасывается перед окончательной гибридизацией антисмысловой спирали с целевой нуклеиновой кислотой, то маловероятно, что такси конъюгат будет влиять на активность. Как правило, конъюгат присоединяется к 3'-концу смысловой спирали миРНК. См., например, патент США 8106022. Некоторые конъюгирующие группы, описанные в настоящем документе, более активны и/или синтезируются легче, чем конъюгирующие группы, описанные ранее.
В некоторых вариантах реализации настоящего изобретения конъюгаты присоединяются к односпиральным антисмысловым соединениям, включая, но не ограничиваясь ими, антисмысловые соединения на основе РНКазы Н и антисмысловые соединения, которые изменяют сплайсинг целевой нуклеиновой кислоты пре-мРНК. В такик вариантах реализации конъюгат должен оставаться присоединенным к антисмысловому соединению достаточно долго для обеспечения преимущества (улучшенного захвата в клетки), но затем он должен либо расщепляться, либо иным образом не препятствовать последующим стадиям, необходимым для активности, таким как гибридизация с целевой нуклеиновой кислотой и взаимодействие с РНКазой Н или ферментами, связанными со сплайсингом или модулированием сплайсинга. Такой баланс свойств более важен при осаждении односпиральных антисмысловых соединений, чем соединений миРНК, где конъюгат может быть просто присоединен к смысловой спирали. В настоящем документе описаны односпиральные антисмысловые соединения, обладающие улучшенной активностью в клетках печени in vivo, по сравнению с таким же антисмысловым соединением, не имеющим конъюгата. Учитывая необходимый баланс свойств для этих соединений, такая улучшенная активность является неожиданной.
В некоторых вариантах реализации конъюгирующие группы по настоящему документу содержат расщепляемый фрагмент. Как было отмечено, не ограничиваясь каким-либо
механизмом, логично, что конъюгат должен сохраняться у соединения достаточно долго для обеспечения усиления захвата, но после этого желательно, чтобы некоторая его часть или, в идеале, весь конъюгат расщеплялся, выделяя исходное соединение (например, антисмысловое соединение) в его наиболее активной форме. В некоторых вариантах реализации расщепляемый фрагмент представляет собой расщепляемый нуклеозид. Такие варианты реализации обладают преимуществом эндогенных нуклеаз в клетке за счет присоединения остальной части конъюгата (кластера) к антисмысловому олигонуклеотиду через нуклеозид при помощи одной или более расщепляемых связей, таких как фосфодиэфирные связи. В некоторых вариантах реализации кластер связан с расщепляемым нуклеозидом через фосфодиэфирную связь. В некоторых вариантах реализации расщепляемый нуклеозид присоединен к антисмысловому олигонуклеотиду (антисмысловому соединению) фосфодиэфирной связью. В некоторых вариантах реализации конъюгирующая группа может содержать два или три расщепляемых нуклеозида. В таких вариантах реализации указанные расщепляемые нуклеозиды связаны друг с другом, с антисмысловым соединением и/или с кластером посредством расщепляемых связей (таких как фосфодиэфирная связь). Некоторые конъюгаты по настоящему документу не содержат расщепляемый нуклеозид, а вместо этого содержат расщепляемую связь. Показано, что достаточное расщепление конъюгата из олигонуклеотида обеспечивается по меньшей мере за счет одной связи, которая легко поддается расщеплению в клетке (расщепляемая связь).
В некоторых вариантах реализации конъюгированные антисмысловые соединения представляют собой пролекарства. Такие пролекарства вводят животному, и они в конечном итоге метаболизируются до более активной формы. Например, конъюгированные антисмысловые соединения расщепляются с удалением всего или части конъюгата, приводя к активной (или более активной) форме антисмыслового соединения, не содержащего всего или части конъюгата.
В некоторых вариантах реализации конъюгаты присоединены на 5'-конце олигонуклеотида. Некоторые такие 5'-конъюгаты расщепляются более эффективно, чем аналоги, имеющие такую же конъюгирующую группу, присоединенную на 3'-конце. В некоторых вариантах реализации улучшенная активность может коррелировать с улучшенным расщеплением. В некоторых вариантах реализации олигонуклеотиды, содержащие конъюгат на 5'-конце, обладают более высокой эффективностью, чем олигонуклеотиды, содержащие конъюгат на 3'-конце (см., например, Примеры 56, 81, 83 и 84). Кроме того, 5'-присоединение обеспечивает более простой синтез олигонуклеотида. Как
правило, олигонуклеотиды синтезируют на твердой подложке в направлении от 3' к 5'. Для получения 3'-конъюгированного олигонуклеотида, как правило присоединяют предварительно конъюгированный 3'-нуклеозид к твердой подложке, а затем обычным путем создают олигонуклеотид. Однако присоединение такого конъюгированного нуклеозида к твердой подложке усложняет синтез. Кроме того, применяя такой подход, конъюгат затем присутствует в ходе всего синтеза олигонуклеотида и может разрушаться во время последующих стадий или может ограничивать типы реакций и реагентов, которые можно применять. Применяя структуры и методики, описанные в настоящем документе для 5'-конъюгированных олигонуклеотидов, можно синтезировать олигонуклеотид при помощи стандартных автоматизированных методик и внедрять в конъюгат окончательный (5'-ближайший) нуклеозид или после отделения олигонуклеотида от твердой подложки.
С учетом известного уровня техники и настоящего описания, специалисты в данной области техники могут легко получить любые из конъюгатов и конъюгированных олигонуклеотидов, описанных в настоящем документе. Кроме того, синтез некоторых таких конъюгатов и конъюгированных олигонуклеотидов, описанных в настоящем документе, проще и/или требует меньше стадий и, следовательно, менее дорогой, чем синтез ранее описанных конъюгатов, что дает преимущество при производстве. Например, синтез некоторых конъюгирующих групп состоит из меньшего количество синтетических стадий, что приводит к увеличению выхода, по сравнению с ранее описанными конъюгирующими группами. Конъюгирующие группы, такие как GalNAc3-10 в Примере 46 и GalNAc3-7 в Примере 48, гораздо проще, чем ранее описанные конъюгаты, такие как описаны в публикациях U.S. 8106022 или U.S. 7262177, для которых необходима сборка большего количества химических промежуточных соединений. Соответственно, эти и другие конъюгаты, описанные в настоящем документе, обладают преимуществом по сравнению с ранее описанными соединениями для применения с любым олигонуклеотидом, включая односпиральные олигонуклеотиды и любую спираль двухспиральных олигонуклеотидов (например, миРНК).
Точно так же в настоящем документе описаны конъюгирующие группы, имеющие только один или два лиганда GalNAc. Как показано, такие конъюгированные группы усиливают активность антисмысловых соединений. Такие соединения гораздо проще получить, чем конъюгаты, содержащие три лиганда GalNAc. Конъюгирующие группы, содержащие один или два лиганда GalNAc, могут быть присоединены к любым антисмысловым соединениям, включая односпиральные олигонуклеотиды и любую спираль
двухспиральных олигонуклеотидов (например, миРНК).
В некоторых вариантах реализации конъюгаты, описанные в настоящем документе, существенно не изменяют некоторые показатели переносимости. Например, в настоящем документе показано, что конъюгированные антисмысловые соединения являются не более иммуногенными, чем не конъюгированные исходные соединения. Поскольку активность улучшается, то варианты реализации, в которых переносимость остается такой же (или, в действительности, если даже переносимость ухудшается лишь незначительно, по сравнению с приростом активности), обладают улучшенными характеристиками для терапии.
В некоторых вариантах реализации конъюгация позволяет изменять антисмысловые соединения так, чтобы они обладали менее выраженными последствиями в отсутствие конъюгации. Например, в некоторых вариантах реализации замена одной или более тиофосфатных связей полностью тиофосфатного антисмыслового соединения на фосфодиэфирные связи приводит к улучшению некоторых показателей переносимости. Например, в некоторых случаях такие антисмысловые соединения, имеющие один или более фосфодиэфиров, являются менее иммуногенными, чем такие же соединения, в которых каждая связь представляет собой тиофосфат. Однако в некоторых случаях, как показано в Примере 26, такое же замещение одной или более тиофсофатных связей на фосфодиэфирные связи приводит также к снижению клеточного захвата и/или к снижению активности. В некоторых вариантах реализации конъюгированные антисмысловые соединения, описанные в настоящем документе, допускают такое изменение связей с небольшим снижением или без снижения захвата и активности, по сравнению с конъюгированным полностью тиофосфатным аналогом. В действительности, в некоторых вариантах реализации, например, в Примерах 44, 57, 59 и 86, олигонуклеотиды, содержащие конъюгат и по меньшей мере одну фосфодиэфирную межнуклеозидную связь, фактически демонстрируют повышенную активность in vivo даже по сравнению с полностью тиофосфатным аналогом, также содержащим такой же конъюгат. Более того, поскольку конъюгация приводит к значительному увеличению захвата/активности, то небольшое снижение такого существенного прироста может быть приемлемым для достижения улучшенной переносимости. Соответственно, в некоторых вариантах реализации конъюгированные антисмысловые соединения содержат по меньшей мере одну фосфодиэфирную связь.
В некоторых вариантах реализации конъюгация антисмысловых соединений по настоящему документу приводит к улучшенной доставке, захвату и активности в гепатоцитах. Следовательно, в ткань печени доставляется большее количество соединения.
Однако в некоторых вариантах реализации изобретения такая улучшенная доставка сама по себе не объясняет общего увеличения активности. В некоторых таких вариантах реализации изобретения большее количество соединения поступает в гепатоциты. В некоторых вариантах реализации изобретения даже такой улучшенный захват гепатоцитов сам по себе не объясняет общего увеличения активности. В таких вариантах реализации изобретения увеличивается продуктивный захват конъюгированного соединения. Например, как показано в Примере 102, некоторые варианты реализации GalNAc-содержащих конъюгатов увеличивают обогащение антисмысловых олигонуклеотидов в гепатоцитах, по сравнению с не паренхимальными клетками. Такое обогащение преимущественно для олигонуклеотидов, которые нацелены на гены, экспрессируемые в гепатоцитах.
В некоторых вариантах реализации конъюгированные антисмысловые соединения по настоящему документу приводят к уменьшению воздействия на почки. Например, как показано в Примере 20, концентрации антисмысловых олигонуклеотидов, содержащих некоторые варианты реализации GalNAc-содержащих конъюгатов, в почках ниже, чем концентрации антисмысловых олигонуклеотидов, не имеющих GalNAc-содержащего конъюгата. Это имеет несколько преимущественных терапевтических применений. Для терапевтических показаний, в которых не требуется проявление активности в почках, воздействие на почки подвергает их риску токсичности без соответствующей пользы. Более того, высокая концентрация в почках обычно приводит к выводу соединения с мочой, обеспечивая более быстрое выведение. Соответственно, для внепочечных мишеней накопление в почках является нежелательным.
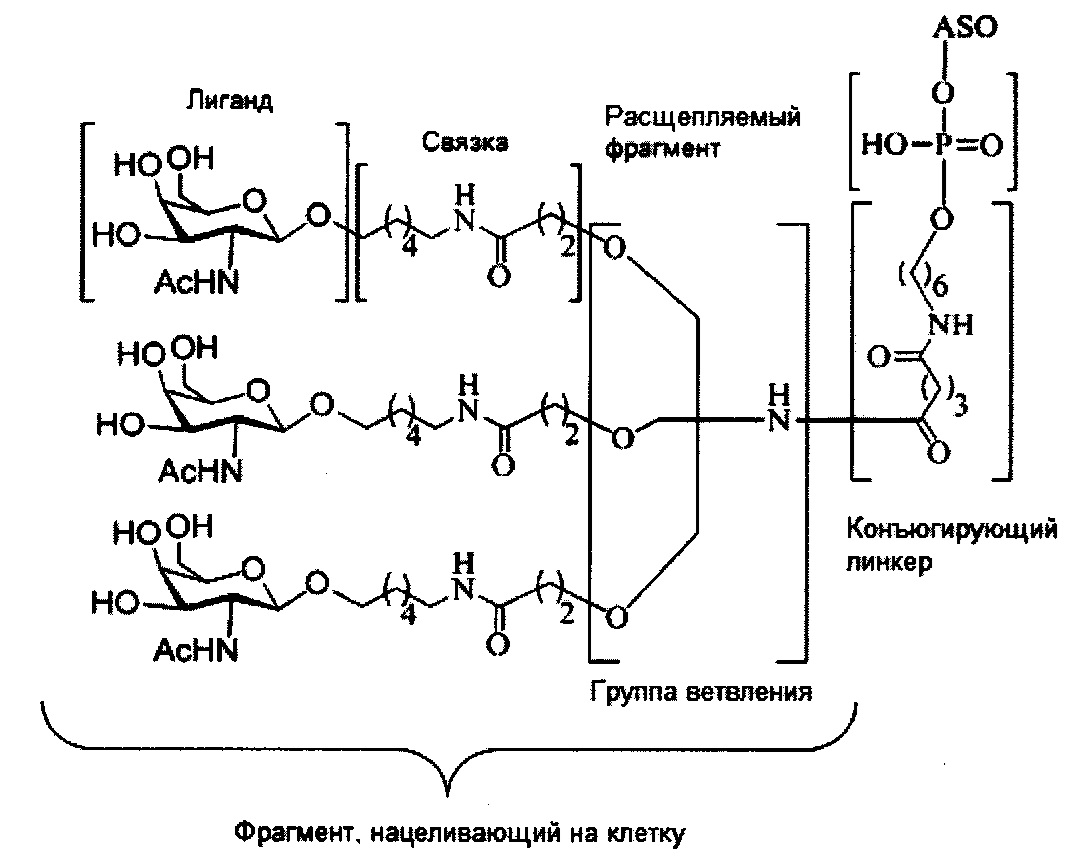
В некоторых вариантах реализации настоящего описания представлены конъюгированные антисмысловые соединения, представленные формулой:
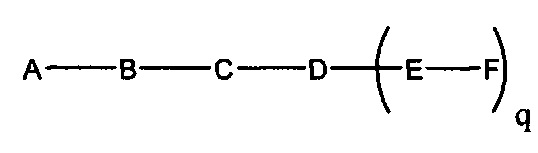
где
А представляет собой антисмысловый олигонуклеотид;
В представляет собой расщепляемый фрагмент;
С представляет собой конъюгирующий линкер;
D представляет собой группу ветвления;
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
На представленной выше схеме и в аналогичных схемах в настоящем документе группа ветвления «D» разветвляется такое количество раз, которое необходимо для соответствия количеству групп (E-F), указанному количеством «q». Так, если q=1, то формула представляет собой:

если q=2, то формула представляет собой:
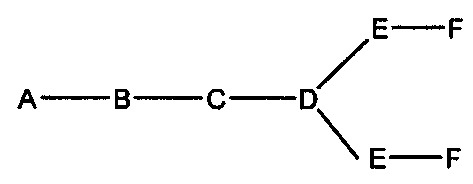
если q=3, то формула представляет собой:

если q=4, то формула представляет собой:

если q=5, то формула представляет собой:
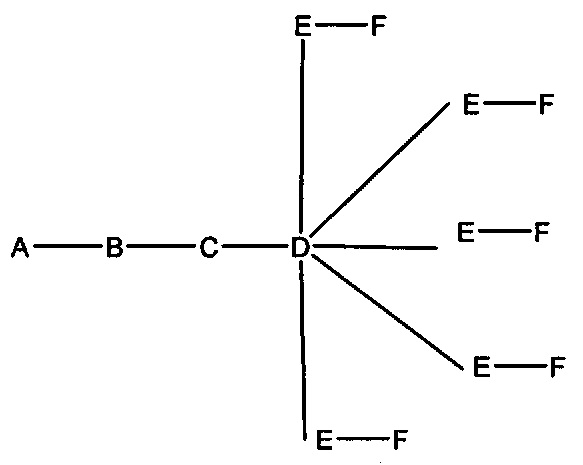
В некоторых вариантах реализации изобретения приведены конъюгированные антисмысловые соединения, имеющие структуру:

В некоторых вариантах реализации изобретения приведены конъюгированные антисмысловые соединения, имеющие структуру:
В некоторых вариантах реализации изобретения приведены конъюгированные антисмысловые соединения, имеющие структуру:

В некоторых вариантах реализации изобретения приведены конъюгированные антисмысловые соединения, имеющие структуру:
В настоящем описании представлены следующие не ограниченные нумерованные варианты реализации изобретения:
В вариантах реализации, имеющих более одной конкретной переменной (например, более одного «m» или «n»), если не указано иное, каждая такая конкретная переменная выбрана независимо. Следовательно, для структуры, имеющей более одного n, каждый n выбран независимо, так что они могут быть или не быть одинаковыми между собой.
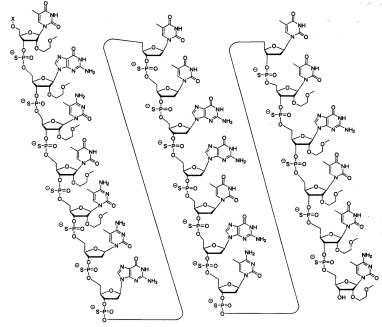
В некоторых вариантах реализации настоящего описания приведены конъюгированные антисмысловые соединения, представленные следующей структурой. В некоторых вариантах реализации антисмысловое соединение содержит модифицированный олигонуклеотид ISIS 494372 с 5'-Х, где X представляет собой конъюгированную группу, содержащую GalNAc. В некоторых вариантах реализации антисмысловое соединение состоит из модифицированного олигонуклеотида ISIS 494372 с 5'-Х, где X представляет собой конъюгированную группу, содержащую GalNAc.
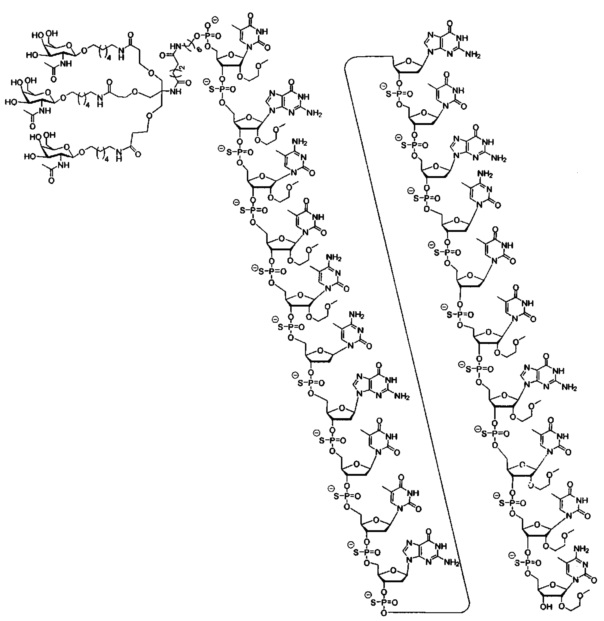
В некоторых вариантах реализации настоящего описания приведены конъюгированные антисмысловые соединения, представленные следующей структурой. В некоторых вариантах реализации антисмысловое соединение содержит конъюгированный модифицированный олигонуклеотид ISIS 681251. В некоторых вариантах реализации антисмысловое соединение состоит из конъюгированного модифицированного олигонуклеотида ISIS 681251.
В некоторых вариантах реализации изобретения в настоящем описании приведены конъюгированные антисмысловые соединения, представленные следующей структурой. В некоторых вариантах реализации антисмысловое соединение содержит конъюгированный модифицированный олигонуклеотид ISIS 681257. В некоторых вариантах реализации антисмысловое соединение состоит из конъюгированного модифицированного олигонуклеотида ISIS 681257.

В некоторых вариантах реализации изобретения в настоящем описании приведены конъюгированные антисмысловые соединения, представленные следующей структурой. В некоторых вариантах реализации антисмысловое соединение содержит модифицированный олигонуклеотид с SEQ ID NO: 58 с 5'-GalNAc с вариабельностью в сахарных структурах крыльев. В некоторых вариантах реализации антисмысловое соединение состоит из модифицированного олигонуклеотида с SEQ ID NO: 58 с 5'-GalNAc с вариабельностью в сахарных структурах крыльев.
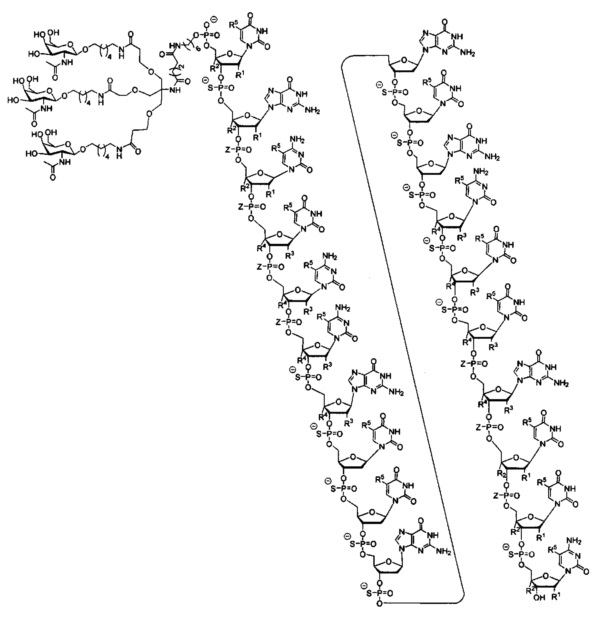
где либо R1 представляет собой -ОСН2СН2ОСН3 (МОЕ), и R2 представляет собой Н; либо R1 и R2 вместе образуют мостик, где R1 представляет собой -О-, и R2 представляет собой -СН2-, -СН(СН3)- или -СН2СН2-, и R1 и R2 связаны напрямую, так что образующийся мостик выбран из: -O-СН2-, -O-СН(СН3)- и -O-СН2СН2-;
и для каждой пары R3 и R4 у одного кольца, независимо для каждого кольца: либо R3 выбран из Н и -ОСН2СН2ОСН3, и R4 представляет собой Н; либо R3 и R4 вместе образуют мостик, где R3 представляет собой -О-, и R4 представляет собой -СН2-, -СН(СН3)- или -СН2СН2-, и R3 и R4 связаны напрямую, так что образующийся мостик выбран из: -О-СН2-, -О-СН(СН3)- и -O-СН2СН2-;
и R5 выбран из Н и - СН3;
и Z выбран из S- и О-.
В настоящем описании приведены следующие неограничивающие нумерованные варианты реализации изобретения:
Подробное описание
Следует понимать, что и представленное выше общее описание, и следующее подробное описание являются лишь типичными и пояснительными, и они не ограничивают настоящее описание. В настоящем документе использование единственного числа включает множественное число, если специально не указано иное. При использовании в настоящем документе, термин «или» означает «и/или», если не указано иное. Кроме того, использование термина «включая», а также других форм, таких как «включает» и «включенный», не является ограничивающим. Также, такие термины как «элемент» или «компонент» охватывают как элементы и компоненты, содержащие одну единицу, так и элементы и компоненты, которые содержат более одной субъединицы, если специально не указано иное.
Названия разделов, используемые в настоящем документе, предназначены лишь для организационных целей, и их не следует толковать как ограничение описанного объекта изобретения. Все документы или части документов, цитируемые в настоящей заявке, включая, но не ограничиваясь ими, патенты, патентные заявки, статьи, книги и монографии, в явной форме включены в настоящий документ посредством ссылки в полном объеме для всех целей.
А. Определения
При отсутствии конкретных определений, номенклатура, используемая в связи с ними, а также в связи с приемами и методиками аналитической химии, синтетической органической химии, а также медицинской и фармацевтической химии, описанная в настоящем документе, является общеизвестной и общепринятой в данной области техники. Для химического синтеза и химического анализа могут быть использованы стандартные методики. Некоторые такие методики и приемы представлены, например, в публикациях "Carbohydrate Modifications in Antisense Research" под редакцией Sangvi и Cook, American Chemical Society, федеральный округ Вашингтон, 1994; "Remington's Pharmaceutical Sciences," Mack Publishing Co.; Истон, штат Пенсильвания, 21е издание, 2005; и "Antisense Drug Technology, Principles, Strategies, and Applications" под
редакцией Stanley Т. Crooke, CRC Press, Бока-Ратон, штат Флорида; а также в книге Sambrook et al., "Molecular Cloning, A laboratory Manual," 2е издание, Cold Spring Harbor Laboratory Press, 1989, которые включены в настоящий документ посредством ссылки для всех целей.
Если это допустимо, все патенты, заявки, опубликованные заявки и другие публикации, а также другие данные, упоминаемые в тексте настоящего описания, включены в настоящий документ посредством ссылки в полном объеме. Если не указано иное, следующие термины имеют следующие значения:
При использовании в настоящем документе, «нуклеозид» означает соединение, содержащее фрагмент азотистого основанияи сахарный фрагмент. Нуклеозиды включают, но не ограничиваются ими, природные нуклеозиды (которые находятся в ДНК и РНК) и модифицированные нуклеозиды. Нуклеозиды могут быть связаны с фосфатным фрагментом.
При использовании в настоящем документе, «химическая модификация» означает химическое отличие в соединении, по сравнению с природным аналогом. Химические модификации олигонуклеотидов включают нуклеозидные модификации (включая модификации сахарного фрагмента и модификации азотистого основания) и модификации межнуклеозидных связей. В отношении олигонуклеотида химическая модификация включает не только отличия в последовательности азотистых оснований.
При использовании в настоящем документе, «фуранозил» означает структуру, содержащую 5-членное кольцо, содержащее четыре атома углерода и один атом кислорода.
При использовании в настоящем документе, «природный сахарный фрагмент» означает рибофуранозил, встречающийся в природной РНК, или дезоксирибофуранозил, встречающийся в природной ДНК.
При использовании в настоящем документе, «сахарный фрагмент» означает природный сахарный фрагмент или модифицированный сахарный фрагмент нуклеозида.
При использовании в настоящем документе, «модифицированный сахарный фрагмент» означает замещенный сахарный фрагмент или заменитель сахара.
При использовании в настоящем документе, «замещенный сахарный фрагмент» означает фуранозил, который не является природным сахарным фрагментом. Замещенные сахарные фрагменты включают, но не ограничиваются ими, фуранозилы, содержащие заместители в 2'-положении, 3'-положении, 5'-положении и/или 4'-положении. Некоторые замещенные сахарные фрагменты представляют собой бициклические сахарные фрагменты.
При использовании в настоящем документе, «2'-замещенный сахарный фрагмент» означает фуранозил, содержащий заместитель в 2'-положении, отличный от Н или ОН. Если не указано иное, то 2'-замещенный сахарный фрагмент не является бициклическим сахарным фрагментом (т.е. 2'-заместитель 2'-замещенного сахарного фрагмента не образует мостик с другим атомом радикала фуранозного кольца).
При использовании в настоящем документе, «МОЕ» означает -ОСН2СН2ОСН3.
При использовании в настоящем документе, «2'-F нуклеозид» относится к нуклеозиду, содержащему сахар, который содержит фтор в 2'-положении. Если не указано иное, то фтор в 2'-F нуклеозиде находится в рибо-положении (заменяя ОН природной рибозы).
При использовании в настоящем документе, термин «заменитель сахара» означает структуру, которая не содержит фуранозила и способна заменять природный сахарный
фрагмент нуклеозида, так что образующиеся нуклеозидные субъединицы могут связываться вместе и/или связываться с другими нуклеозидами с образованием олигомерного соединения, которое может гибридизоваться с комплементарным олигомерным соединением. Такие струтуры включают кольца, содержащие другое количество атомов, чем фуранозил (например, 4, 6 или 7-членные кольца); замену кислорода фуранозила некислородным атомом (например, углеродом, серой или азотом); или одновременное изменение количество атомов и замену кислорода. Такие структуры также могут содержать замещения, соответствующие замещениям, описанным для замещенных сахарных фрагментов (например, 6-членные карбоциклические бициклические заменители сахара, необязательно содержащие дополнительные заместители). Заменители сахара включают также более сложные сахарные заместители (например, некольцевые системы пептидной нуклеиновой кислоты). Заменители сахара включают, без ограничения, морфолино, циклогексенилы и циклогекситолы.
При использовании в настоящем документе, «бициклический сахарный фрагмент» означает модифицированный сахарный фрагмент, содержащий 4-7-членное кольцо (включая, но не ограничиваясь фуранозилом), содержащее мостик, связывающий два атома 4-7-членного кольца с образованием второго кольца, что приводит к получению бициклической структуры. В некоторых вариантах реализации 4-7-членное кольцо представляет собой сахарное кольцо. В некоторых вариантах реализации 4-7-членное кольцо представляет собой фуранозил. В некоторых таких вариантах реализации мостик соединяет 2'-углерод и 4'-углерод фуранозила.
Используемый в настоящем документе термин «нуклеиновая кислота» относится к молекулам, состоящим из мономерных нуклеотидов. «Нуклеиновая кислота» включает рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), одноцепочечные нуклеиновые кислоты (оцДНК), двухцепочечные нуклеиновые кислоты (дцДНК), малые интерферирующие рибонуклеиновые кислоты (миРНК) и микроРНК (микроРНК). Нуклеиновая кислота может также содержать любую комбинацию этих элементов в одной молекуле.
При использовании в настоящем документе, «нуклеотид» означает нуклеозид, дополнительно содержащий фосфатную связывающую группу. При использовании в настоящем документе, «связанные нуклеозиды» могут быть или не быть связаны фосфатными связями и, следовательно, включают, но не ограничиваются ими, «связанные нуклеотиды». При использовании в настоящем документе; «связанные нуклеозиды» представляют собой нуклеозиды, которые связаны в непрерывную последовательность (т.е. между связанными нуклеозидами нет дополнительных нуклеозидов).
При использовании в настоящем документе, «азотистое основание» означает группу атомов, которая может быть связана с сахарным фрагментом с образованием нуклеозида, который может быть внедрен в олигонуклеотид, и при этом указанная группа атомов может связываться с комплементарным природным азотистым основанием другого олигонуклеотида или нуклеиновой кислоты. Азотистые основания могут быть природными или могут быть модифицированными. При использовании в настоящем документе
«последовательность азотистых оснований» обозначает порядок смежных азотистых оснований, независимый от какого-либо сахара, связи или модификации азотистого основания.
При использовании в настоящем документ, термины «немодифицированное азотистое основание» или «природное азотистое основание» означают природные гетероциклические азотистые основания РНК или ДНК: пуриновые основания аденин (А) и гуанин (G) и пиримидиновые основания тимин (Т), цитозин (С) (включая 5-метил С) и урацил (U).
При использовании в настоящем документе, «модифицированное азотистое основание» означает любое азотистое основание, которое не является природным азотистым основанием.
При использовании в настоящем документе, «модифицированный нуклеозид» означает нуклеозид, содержащий по меньшей мере одну химическую модификацию, по сравнению с природными нуклеозидами РНК или ДНК. Модифицированные нуклеозиды содержат модифицированный сахарный фрагмент и/или модифицированное азотистое основание.
При использовании в настоящем документе, «бициклический нуклеозид» или «BNA» означает нуклеозид, содержащий бициклический сахарный фрагмент.
При использовании в настоящем документе, «стерически затрудненный этил-нуклеозид» или «cEt» означает нуклеозид, содержащий бициклический сахарный фрагмент, который содержит мостик 4'-СН(СН3)-O-2'.
При использовании в настоящем документе, «нуклеозид закрытой нуклеиновой кислоты» или «LNA» означает нуклеозид, содержащий бициклический сахарный фрагмент, который содержит мостик 4'-СН2-O-2'.
При использовании в настоящем документе, «2'-замещенный нуклеозид» означает нуклеозид, содержащий заместитель в 2'-положении, отличный от Н или ОН. Если не указано иное, то 2'-замещенный нуклеозид не является бициклическим нуклеозидом.
При использовании в настоящем документе, «дезоксинуклеозид» означает нуклеозид, содержащий 2'-Н фуранозильный сахарный фрагмент, находящийся в природных дезоксирибонуклеозидах (ДНК). В некоторых вариантах реализации 2'-дезоксинуклеозид может содержать модифицированное азотистое основание или может содержать азотистое основание РНК (например, урацил).
При использовании в настоящем документе, «олигонуклеотид» означает соединение, содержащее множество связанных нуклеозидов. В некоторых вариантах реализации олигонуклеотид содержит один или более немодифицированных рибонуклеозидов (РНК) и/или немодифицированных дезоксирибонуклеозидов (ДНК), и/или один или более модифицированных нуклеозидов.
При использовании в настоящем документе, «олигонуклеозид» означает олигонуклеотид, в котором ни один из межнуклеозидных связей не содержит атом фосфора. При использовании в настоящем документе, олигонуклеотиды включают олигонуклеозиды.
При использовании в настоящем документе, «модифицированный олигонуклеотид» означает олигонуклеотид, содержащий по меньшей мере один модифицированный нуклеозид и/или по меньшей мере одну модифицированную межнуклеозидную связь.
При использовании в настоящем документе, «связь» или «связывающая группа» означает группу атомов, которая связывает вместе две или более других групп атомов.
При использовании в настоящем документе, «межнуклеозидная связь» означает ковалентную связь между соседними нуклеозидами в олигонуклеотиде.
При использовании в настоящем документе, «природная межнуклеозидная связь» означает фосфодиэфирную связь 3' с 5'.
При использовании в настоящем документе, «модифицированная межнуклеозидная связь» означает любую межнуклеозидную связь, отличную от природной межнуклеозидной связи.
При использовании в настоящем документе, «концевая межнуклеозидная связь» означает связь между последними двумя нуклеозидами олигонуклеотида или его определенной области.
При использовании в настоящем документе, «фосфорная связывающая группа» означает связывающую группу, содержащую атом фосфора. Фосфорные связывающие группы включают, без ограничения, группы, имеющие формулу:
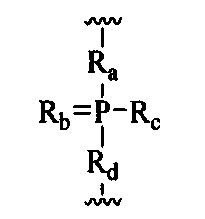
где:
Ra и Rd, каждый независимо, представляют собой О, S, СН2, NH или NJ1, где J1 представляет собой С1-С6 алкил или замещенный С1-С6 алкил;
Rb представляет собой О или S;
Rc представляет собой ОН, SH, C1-С6 алкил, замещенный C1-С6 алкил, C1-С6 алкокси, замещенный C1-С6 алкокси, амино или замещенный амино; и
J1представляет собой R6 представляет собой О или S.
Фосфорные связывающие группы включают, без ограничения, фосфодиэфир, тиофосфат, дитиофосфат, фосфонат, фосфорамидат, фосфортиоамидат, тионоалкил-фосфонат, фосфотриэфиры, тионоалкил-фосфотриэфиры и боранофосфат.
При использовании в настоящем документе, «межнуклеозидная фосфорная связывающая группа» означает фосфорную связывающую группу, которая напрямую связывает два нуклеозида.
При использовании в настоящем документе, «не межнуклеозидная фосфорная связывающая группа» означает фосфорную связывающую группу, которая не связывает напрямую два нуклеозида. В некоторых вариантах реализации не межнуклеозидная
фосфорная связывающая группа связывает нуклеозид с группой, отличной от нуклеозида. В некоторых вариантах реализации не межнуклеозидная фосфорная связывающая группа связывает две группы, ни одна из которых не является нуклеозидом.
При использовании в настоящем документе, «нейтральная связывающая группа» означает связывающую группу, которая не имеет заряда. Нейтральные связывающие группы включают, без ограничения, фосфотриэфиры, метилфосфонаты, MMI (-СН2-N(СН3)-O-), амид-3 (-CH2-C(=O)-N(H)-), амид-4 (-CH2-N(H)-C(=O)-), формацеталь (-O-СН2-O-) и тиоформацеталь (-S-CH2-O-). Дополнительные нейтральные связывающие группы включают неионные связи, содержащие силоксан (диалкилсилоксан), карбоксильный эфир, карбоксамид, сульфид, сульфоновый эфир и амиды (см., например: Carbohydrate Modifications in Antisense Research; под ред. Y.S. Sanghvi и P.D. Cook, ACS Symposium, серия 580; главы 3 и 4, (cc. 40-65)). Дополнительные нейтральные связывающие группы включают неионные связи, содержащие смешанные составные части N, О, S и СН2.
При использовании в настоящем документе, «межнуклеозидная нейтральная связывающая группа» означает нейтральную связывающую группу, которая напрямую связывает два нуклеозида.
При использовании в настоящем документе, «не межнуклеозидная нейтральная связывающая группа» означает нейтральную связывающую группу, которая не связывает напрямую два нуклеозида. В некоторых вариантах реализации не межнуклеозидная нейтральная связывающая группа связывает нуклеозид с группой, отличной от нуклеозида. В некоторых вариантах реализации не межнуклеозидная нейтральная связывающая группа связывает две группы, ни одна из которых не является нуклеозидом.
При использовании в настоящем документе, «олигомерное соединение» означает полимерную структуру, содержащую две или более субструктур. В некоторых вариантах реализации олигомерное соединение содержит олигонуклеотид. В некоторых вариантах реализации олигомерное соединение содержит одну или более конъюгированных групп и/или концевых групп. В некоторых вариантах реализации олигомерное соединение состоит из олигонуклеотида. Олигомерные соединения включают также природные нуклеиновые кислоты. В некоторых вариантах реализации олигомерное соединение содержит скелет одной или более связанных мономерных субъединиц, при этом каждая связанная мономерная субъединица прямо или косвенно присоединена к гетероциклическому основному фрагменту. В некоторых вариантах реализации олигомерные соединения могут содержать также мономерные субъединицы, которые не связаны с гетероциклическим основным фрагментом, обеспечивая таким образом сайты с удаленными основаниями. В
некоторых вариантах реализации связи, соединяющие мономерные субъединицы, сахарные фрагменты или заменители и гетероциклические основные фрагменты, могут быть независимо модифицированы. В некоторых вариантах реализации единица связь-сахар, которая может содержать или не содержать гетероциклическое основание, может быть замещена миметиком, таким как мономеры в пептидных нуклеиновых кислотах.
При использовании в настоящем документе, «концевая группа» означает один или более атомов, присоединенных к любому или к обоим 3'- или 5'-концам олигонуклеотида. В некоторых вариантах реализации концевая группа представляет собой конъюгирующую группу. В некоторых вариантах реализации концевая группа содержит один или более нуклеозидов концевой группы.
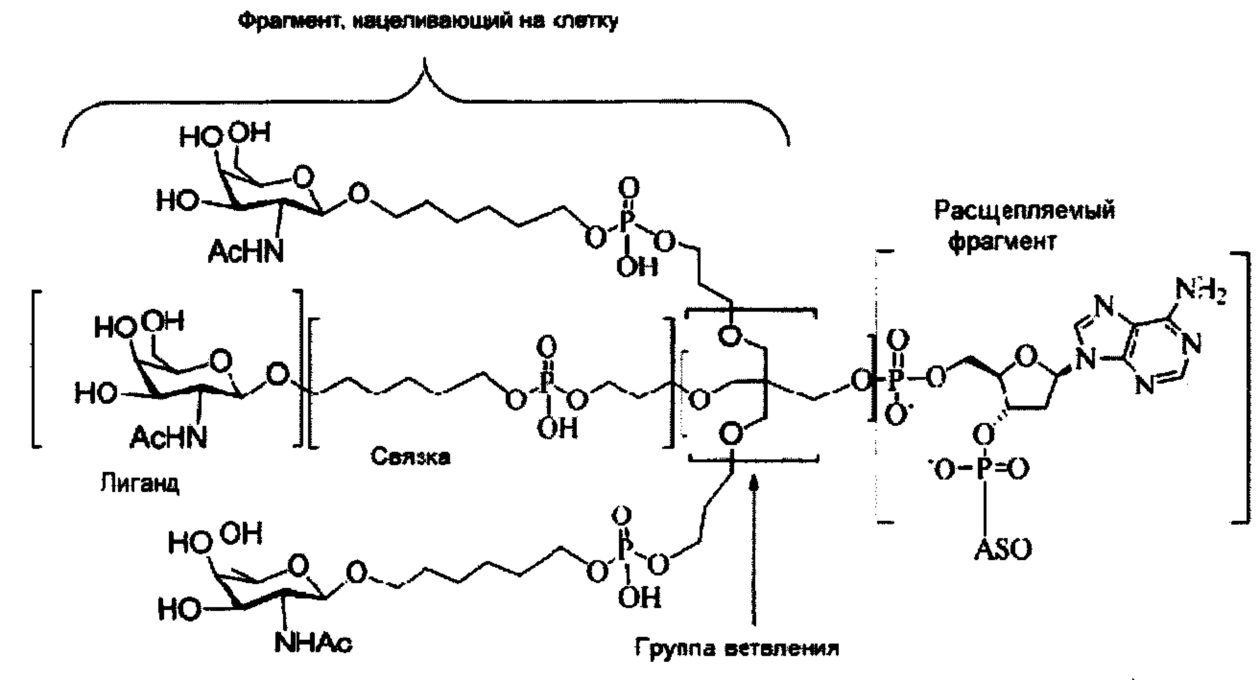
При использовании в настоящем документе, «конъюгат» или «конъюгирующая группа» означает атом или группу атомов, связанную с олигонуклеотидом или олигомерным соединением. Как правило, конъюгирующие группы модифицируют одно или более свойств соединения, к которому они присоединены, включая, но не ограничиваясь ими, свойства фармакодинамики, фармакокинетики, связывания, поглощения, клеточного распределения, клеточного захвата, заряда и/или выведения.
При использовании в настоящем документе, «конъюгирующий линкер» или «линкер» в контексте конъюгирующие группы означает часть конъюгирующие группы, содержащую любой атом или группу атомов и ковалентно связывающую (1) олигонуклеотид с другой частью конъюгирующие группы или (2) две или более частей конъюгирующие группы.
Конъюгирующие группы показаны в настоящем документе как радикалы, обеспечивающие связь для образования ковалентного присоединения к олигомерному соединению, такому как антисмысловый олигонуклеотид. В некоторых вариантах реализации точка присоединения у олигомерного соединения представляет собой 3'-атом кислорода 3'-гидроксильной группы 3'-концевого нуклеозида олигомерного соединения. В некоторых вариантах реализации точка присоединения у олигомерного соединения представляет собой 5'-атом кислорода 5'-гидроксильной группы 5'-концевого нуклеозида олигомерного соединения. В некоторых вариантах реализации связь для образования присоединения к олигомерному соединению представляет собой расщепляемую связь. В некоторых таких вариантах реализации такая расщепляемая связь составляет весь или часть расщепляемого фрагмента.
В некоторых вариантах реализации конъюгирующие группы содержат расщепляемый фрагмент (например, расщепляемую связь или расщепляемый нуклеозид) и часть углеводного кластера, такую как часть кластера GalNAc. Такая часть углеводного кластера содержит: нацеливающий фрагмент и, необязательно, конъюгирующий линкер. В некоторых вариантах реализации часть углеводного кластера определяют по количеству и сущности лиганда. Например, в некоторых вариантах реализации часть углеводного кластера содержит три группы GalNAc и обозначена «GalNAc3». В некоторых вариантах реализации часть углеводного кластера содержит 4 группы GalNAc и обозначена «GalNAc4». Конкретные части углеводных кластеров (имеющие конкретную связку, группы ветвления и конъюгирующего линкера) описаны в настоящем документе
и обозначены римской цифрой с последующим нижним индексом «а». Соответственно, «GalNac3-1a» относится к конкретной части углеводного кластера конъюгирующие группы, имеющей 3 группы GalNac и конкретно определенную связку, группы ветвления и линкера. Такой фрагмент углеводного кластера присоединен к олигомерному соединению через расщепляемый фрагмент, такой как расщепляемая связь или расщепляемый нуклеозид.
При использовании в настоящем документе, «расщепляемый фрагмент» означает связь или группу, которая может быть расщеплена при физиологических условиях. В некоторых вариантах реализации расщепляемый фрагмент расщепляется внутри клетки или во внутриклеточных отделах, таких как лизосома. В некоторых вариантах реализации расщепляемый фрагмент расщепляется эндогенными ферментами, такими как нуклеазы. В некоторых вариантах реализации расщепляемый фрагмент содержит группу атомов, имеющую один, два, три, четыре или более четырех расщепляемых связей.
При использовании в настоящем документе, «расщепляемая связь» означает любую химическую связь, которая может быть расщеплена. В некоторых вариантах реализации расщепляемая связь выбрана из: амида, полиамида, сложного эфира, эфира, одного или обоих сложных эфиров фосфодиэфира, фосфатного сложного эфира, карбамата, дисульфида или пептида.
При использовании в настоящем документе, «углеводный кластер» означает соединение, имеющее один или более углеводных остатков, присоединенных к скелету или связывающей группе, (см., например, публикацию Maier et al., "Synthesis of Antisense Oligonucleotides Conjugated to a Multivalent Carbohydrate Cluster for Cellular Targeting," Bioconjugate Chemistry, 2003, (14): 18-29, которая в полном объеме включена в настоящий документ посредством ссылки, или Rensen et al., "Design and Synthesis of Novel N-Acetylgalactosamine-Terminated Glycolipids for Targeting of Lipoproteins to the Hepatic Asiaglycoprotein Receptor," J. Med. Chem. 2004, (47): 5798-5808, где представлены примеры углеводных конъюгированных кластеров).
При использовании в настоящем документе, «модифицированный углевод» означает любой углевод, имеющий одну или более модификаций, по сравнению с природными углеводами.
При использовании в настоящем документе, «производное углевода» означает любое соединение, которое может быть синтезировано с использованием углевода в качестве исходного материала или промежуточного соединения.
При использовании в настоящем документе, «углевод» означает природный углевод, модифицированный углевод или производное углевода.
При использовании в настоящем документе, «защитная группа» означает любое соединение или защитную группу, известную специалистам в данной области техники. Не ограничивающие примеры защитных групп представлены в публикации "Protective Groups in Organic Chemistry", Т. W. Greene, P. G. M. Wuts, ISBN 0-471-62301-6, John Wiley & Sons, Inc Нью-Йорк, полное содержание которой включено в настоящий документ посредством ссылки.
При использовании в настоящем документе, «односпиральное» означает олигомерное соединение, которое не гибридизовано с его комплементом и которое не имеет достаточной самокомплементарностью для образования усточивого собственного дуплекса.
При использовании в настоящем документе, «двухспиральное» означает пару олигомерных соединений, которые гибридизованы друг с другом, или одно самокомплементарное олигомерное соединение, которое образует шпилечную структуру. В некоторых вариантах реализации двухспиральное олигомерное соединение содержит первое и второе олигомерное соединение.
При использовании в настоящем документе, «антисмысловое соединение» означает соединение, содержащее или состоящее из олигонуклеотида, по меньшей мере часть которого комплементарна целевой нуклеиновой кислоте, с которой возможна его гибридизация, что приводит к получению по меньшей мере одной антисмысловой активности.
При использовании в настоящем документе, «антисмысловая активность» означает любое обнаруживаемое и/или измеримое изменение, обусловленное гибридизацией антисмыслового соединения с его целевой нуклеиновой кислотой. В некоторых вариантах реализации антисмысловая активность включает модулирование количества или активности транскрипта целевой нуклеиновой кислоты (например, мРНК). В некоторых вариантах реализации антисмысловая активность включает модулирование сплайсинга пре-мРНК.
При использовании в настоящем документе, «антисмысловое соединение на основе РНКазы Н» означает антисмысловое соединение, в котором по меньшей мере часть антисмысловой активности антисмыслового соединения обусловлена гибридизацией антисмыслового соединения с целевой нуклеиновой кислотой и последующим расщеплением целевой нуклеиновой кислоты под действием РНКазы Н.
При использовании в настоящем документе, «антисмысловое соединение на основе RISC» означает антисмысловое соединение, в котором по меньшей мере часть антисмысловой активности антисмыслового соединения обусловлена РНК-индуцируемым комплексом сайленсинга (RISC).
При использовании в настоящем документе, «обнаружение» или «измерение» означает, что выполнено испытание или анализ для обнаружения или измерения. Такое обнаружение и/или измерение может приводить к результату с нулевым значением. Следовательно, даже если испытание для обнаружения или измерения приводит к обнаружению отсутствия активности (нулевой активности), то стадия обнаружения или измерения активности была выполнена.
При использовании в настоящем документе, «обнаруживаемая и/или измеримая активность» означает статистически значимую активность, которая не является нулевой.
При использовании в настоящем документе, «по существу не измененный» означает небольшое или
отсутствие изменения конкретного параметра, в частности, по сравнению с другим параметром, который изменился гораздо больше. В некоторых вариантах реализации параметр является по существу не измененным, если его изменение составило менее 5%. В некоторых вариантах реализации параметр является по существу не измененным, если его изменение составило менее двух раз, тогда как изменение другого параметра составило по меньшей мере десять раз. Например, в некоторых вариантах реализации антисмысловая активность представляет собой изменение количества целевой нуклеиновой кислоты. В некоторых таких вариантах реализации количество нецелевой нуклеиновой кислоты является по существу не измененным если оно изменяется гораздо меньше, чем изменяется количество целевой нуклеиновой кислоты, но это изменение не обязательно должно быть нулевым.
При использовании в настоящем документе, «экспрессия» означает процесс, посредством которого ген в конечном итоге преобразуется в белок. Экспрессия включает, но не ограничивается этим, транскрипцию, посттранскрипционную модификацию (например, сплайсинг, полиаденилирование, добавление 5'-кэпа) и трансляцию.
При использовании в настоящем документе, «целевая нуклеиновая кислота» означает молекулу нуклеиновой кислоты, с которой предполагается гибридизация антисмыслового соединения с получением желаемой антисмысловой активности. Антисмысловые олигонуклеотиды обладают достаточной комплементарностью с их целевыми нуклеиновыми кислотами для обеспечения гибридизации при физиологических условиях.
При использовании в настоящем документе, «комплементарность азотистого основания» или «комплементарность» в отношении азотистых оснований означает азотистое основание, которое способно к спариванию оснований с другим азотистое основанием. Например, в ДНК аденин (А) комплементарен тимину (Т). Например, в РНК аденин (А) комплементарен урацилу (U). В некоторых вариантах реализации комплементарное азотистое основание означает азотистое основание антисмыслового соединения, которое способно к спариванию оснований с азотистым основанием его целевой нуклеиновой кислоты. Например, если азотистое основание в определенном положении антисмыслового соединения способно к водородному связыванию с азотистым основанием в определенном положении целевой нуклеиновой кислоты, то это положение водородного связывания между олигонуклеотидом и целевой нуклеиновой кислотой считается комплементарным по этой паре азотистых оснований. Азотистые основания, содержащие определенные модификации, могут сохранять способность к спариванию с противоположным азотистым основанием и, следовательно, все еще могут обладать комплементарностью азотистых оснований.
При использовании в настоящем документе, «не комплементарные» в отношении азотистых оснований означает пару азотистых оснований, которые не образуют водородные связи друг с другом.
При использовании в настоящем документе, «комплементарные» в отношении олигомерных соединений (например, связанных нуклеозидов, олигонуклеотидов или нуклеиновых кислот) означает способность таких олигомерных соединений или их областей к гибридизации с другим олигомерным соединением или его областью за счет комплементарности азотистых оснований. Комплементарные олигомерные соединения не обязательно должны обладать комплементарностью азотистых оснований в каждом нуклеозиде. До не которой степени допустимы некоторые несоответствия. В некоторых вариантах реализации
комплементарные олигомерные соединения или области комплементарны по 70% азотистых оснований (комплементарность 70%). В некоторых вариантах реализации комплементарные олигомерные соединения или области комплементарны на 80%. В некоторых вариантах реализации комплементарные олигомерные соединения или области комплементарны на 90%. В некоторых вариантах реализации комплементарные олигомерные соединения или области комплементарны на 95%. В некоторых вариантах реализации комплементарные олигомерные соединения или области комплементарны на 100%.
При использовании в настоящем документе, «несоответствие» означает азотистое основание первого олигомерного соединения, которое не способно спариваться с азотистым основанием в соответствующем положении второго олигомерного соединения при выравнивании первого и второго олигомерного соединения. Любое или оба первое и второе олигомерные соединения могут быть олигонуклеотидами.
При использовании в настоящем документе, «гибридизация» означает спаривание комплементарных олигомерных соединений (например, антисмыслового соединения и его целевой нуклеиновой кислоты). Не ограничиваясь конкретным механизмом, наиболее распространенный механизм спаривания включает водородное связывание, которое может представлять собой уотсон-криковское, хугстиновское или обратное хугстиновское водородное связывание между комплементарными азотистыми основаниями.
При использовании в настоящем документе, «специфически гибридизуется» означает способность олигомерного соединения гибридизоваться с одним сайтом нуклеиновой кислоты с большей аффинностью, чем оно гибридизуется с другим сайтом нуклеиновой кислоты.
При использовании в настоящем документе, «полностью комплементарный» в отношении олигонуклеотида или его части означает, что каждое азотистое основание олигонуклеотида или его части способно к спариванию с азотистым основанием комплементарной нуклеиновой кислоты или ее непрерывной частью. Следовательно, полностью комплементарная область не содержит несоответствий или не гибридизованных азотистых оснований в обеих спиралях.
При использовании в настоящем документе, «процент комплементарности» означает процент азотистых оснований олигомерного соединения, которые комплементарны равной по длине части целевой нуклеиновой кислоты. Процент комплементарности рассчитывают делением количества азотистых оснований олигомерного соединения, которые комплементарны азотистым основаниям в соответствующих положениях целевой нуклеиновой кислоты, на общую длину олигомерного соединения.
При использовании в настоящем документе, «процент идентичности» означает количество азотистых оснований в первой нуклеиновой кислоте, которые относятся к тому же типу (независимо от химической модификации), что и азотистые основания в соответствующих положениях второй нуклеиновой кислоты, деленное на общее количество азотистых оснований в первой нуклеиновой кислоте.
При использовании в настоящем документе, «модулирование» означает изменение количества или качества молекулы, функции или активности, по сравнению с количеством или качеством молекулы, функции или активности до модулирования. Например, модулирование включает изменение, как увеличение (стимуляцию или индукцию), так и снижение (ингибирование или уменьшение) генной экспрессии. В качестве дополнительного примера, модулирование экспрессии может включать изменение выбора сайта сплайсинга при процессинге пре-мРНК, что приводит к изменению абсолютного или относительного количества определенного сплайс-варианта, по сравнению с его количеством в отсутствие модулирования.
При использовании в настоящем документе, «химический мотив» означает характерный участок химических модификаций в олигонуклеотиде или его области. Мотивы могут быть определены по модификациям в определенных нуклеозидах и/или в определенных связывающих группах олигонуклеотида.
При использовании в настоящем документе, «нуклеозидный мотив» означает характерный участок нуклеозидных модификаций в олигонуклеотиде или его области. Связи такого олигонуклеотида могут быть модифицированными или немодифицированными. Если не указано иное, мотивы, описывающие в настоящем документе только нуклеозиды, представляют собой нуклеозидные мотивы. Следовательно, в таких случаях связи не ограничены.
При использовании в настоящем документе, «сахарный мотив» означает характерный участок сахарных модификаций в олигонуклеотиде или его области.
При использовании в настоящем документе, «связывающий мотив» означает характерный участок связывающих модификаций в олигонуклеотиде или его области. Нуклеозиды такого олигонуклеотида могут быть модифицированными или немодифицированными. Если не указано иное, мотивы, описывающие в настоящем документе только связи, представляют собой связывающие мотивы. Следовательно, в таких случаях нуклеозиды не ограничены.
При использовании в настоящем документе, «мотив модификации азотистого основания» означает характерный участок модификаций азотистых оснований вдоль олигонуклеотида. Если не указано иное, то мотив модификации азотистого основания не зависит от последовательности азотистых оснований.
При использовании в настоящем документе, «мотив последовательности» означает характерный участок азотистых оснований, расположенных вдоль олигонуклеотида или его
части. Если не указано иное, то мотив последовательности не зависит от химических модификаций и, следовательно, может иметь любую комбинацию химических модификация, включая отсутствие химических модификаций.
При использовании в настоящем документе, «тип модификации» в отношении нуклеозида или нуклеозида определенного «типа» означает химическую модификацию нуклеозида и включает модифицированные и немодифицированные нуклеозиды. Соответственно, если не указано иное, «нуклеозид, имеющий модификацию первого типа» может быть немодифицированным нуклеозидом.
При использовании в настоящем документе, «по-разному модифицированные» означает химические модификации или химические заместители, которые отличны друг от друга, включая их отсутствие или модификации. Так, например, МОЕ нуклеозид и немодифицированный нуклеозид ДНК являются «по-разному модифицированными», даже несмотря на то, что нуклеозид ДНК является немодифицированным. Точно так же ДНК и РНК являются «по-разному модифицированными», даже несмотря на то, что оба представляют собой природные немодифицированные нуклеозиды. Нуклеозиды, которые являются одинаковыми но содержат различные азотистые основания, не являются по-разному модифицированными. Например, нуклеозид, содержащий 2'-ОМе модифицированный сахар и немодифицированное адениновое азотистое основание, и нуклеозид, содержащий 2'-ОМе модифицированный сахар и немодифицированное тиминовое азотистое основание, не являются по-разному модифицированными.
При использовании в настоящем документе, «модификации одного типа» относится к модификациям, которые являются одинаковыми друг относительно друга, включая отсутствие модификаций. Так, например, два немодифицированных нуклеозида ДНК имеют «модификацию одного типа», даже несмотря на то, что нуклеозид ДНК является немодифицированным. Такие нуклеозиды, имеющие модификацию одного типа, могут содержать различные азотистые основания.
При использовании в настоящем документе, «отдельные области» означает части олигонуклеотида, в которых химические модификации или мотив химических модификаций любой из соседних частей содержит по меньшей мере одно отличие для обеспечения возможности различать области друг от друга.
При использовании в настоящем документе, «фармацевтически приемлемый носитель или разбавитель» означает любое вещество, подходящее для использования при введении животному. В некоторых вариантах реализации фармацевтически приемлемый носитель или разбавитель представляет собой стерильный соленой раствор. В некоторых вариантах реализации такой стерильный солевой раствор представляет собой солевой раствор фармацевтической марки.
При использовании в настоящем документе, термин «метаболическое расстройство» означает заболевание или состояние, которое характеризуется, прежде всего, дисрегуляцией метаболизма - сложного набора химических реакций, связанных с расщеплением пищи с выработкой энергии.
При использовании в настоящем документе, термин «сердечно-сосудистое расстройство» означает заболевание или состояние, которое характеризуется, прежде всего, ухудшенной функцией сердца или кровеносных сосудов.
При использовании в настоящем документе, термин «моно- или полициклическая кольцевая система» включает все кольцевые системы, выбранные из одиночных или
полициклических радикальных кольцевых систем, в которых указанные кольца конденсированы или связаны, и включает одиночные или смешанные кольцевые системы, индивидуально выбранные из алифатических, алициклических, арильных, гетероарильных, аралкильных, арилалкильных, гетероциклических, гетероарильных, гетероароматических и гетероарилалкильных. Такие моно- и полициклические структуры могут содержать кольца, каждое из которых имеет одинаковую степень насыщенности, или каждое независимо имеет переменные степени насыщенности, включая полностью насыщенные, частично насыщенные или полностью ненасыщенные. Каждое кольцо может содержать кольцевые атомы, выбранные из С, N, О и S с образованием гетероциклических колец, а также колец, содержащих только кольцевые атомы С, которые могут быть представлены в смешанном мотиве, как, например, в бензимидазоле, в котором одно кольцо имеет только кольцевые атомы углерода, а конденсированное кольцо имеет два атома азота. Моно- или полициклическая кольцевая система может быть дополнительно замещена группами заместителей, как, например, фталимид, который имеет две группы=O, присоединенные к одному из колец. Моно- или полициклические кольцевые системы могут быть присоединены к исходным молекулам при помощи различных способов, таких как непосредственно через кольцевой атом, путем конденсации через несколько кольцевых атомов, через группу заместителя или через бифункциональный связывающий фрагмент.
При использовании в настоящем документе, «пролекарство» означает неактивную или менее активную форму соединения, которая при введении субъекту метаболизируется с образованием активного или более активного соединения (например, лекарства).
При использовании в настоящем документе, «заместитель» и «группа заместителя» означает атом или группу, которая вытесняет атом или группу указанного исходного соединения. Например, заместитель модифицированного нуклеозида представляет собой любой атом или группу, которая отлична от атома или группы, находящейся в природном нуклеозиде (например, модифицированный 2'-заместитель представляет собой любой атом или группу в 2'-положении нуклеозида, отличную от Н или ОН). Группы заместителей могут быть защищенными или не защищенными. В некоторых вариантах реализации соединения настоящего описания имеют заместители в одном или более чем в одном положении исходного соединения. Заместители также могут быть дополнительно замещены другими группами заместителей и могут быть присоединены напрямую или через связывающую группу, такую как алкильная или углеводородная группа, к исходному соединению.
Точно так же, при использовании в настоящем документе, «заместитель» в отношении химической функциональной группы означает атом или группу атомов, которая отлична от атома или группы атомов, обычно содержащихся в указанной функциональной группе. В некоторых вариантах реализации заместитель вытесняет атом водорода функциональной группы (например, в некоторых вариантах реализации заместитель замещенной метильной группы представляет собой атом или группу, отличную от водорода, которая вытесняет один или более атомов водорода незамещенной метильной группы). Если не указано иное, группы, которые могут быть использованы в качестве заместителей, включают, без ограничения, галоген, гидроксил, алкил, алкенил, алкинил, ацил (-C(O)Raa), карбоксил (-C(O)O-Raa), алифатические группы, алициклические группы, алкокси, замещенный окси (-O-Raa), арил, аралкил, гетероциклический радикал, гетероарил, гетероарилалкил, амино (-N(Rbb)(Rcc)), имино (=NRbb), амидо (-C(O)N(Rbb)(Rcc) или -N(Rbb)C(O)Raa), азидо (-N3), нитро (-NO2), циано (-CN), карбамидо (-OC(O)N(Rbb)(Rcc) или -N(Rbb)C(O)ORaa), уреидо (-N(Rbb)C(O)N(Rbb)(Rcc)), тиоуреидо (-N(Rbb)C(S)N(Rbb)(Rcc)), гуанидинил (-N(Rbb)C(=NRbb)N(Rbb)(Rcc)), амидинил (-C(=NRbb)N(Rbb)(Rcc) или -N(Rbb)C(=NRbb)(Raa)), тиол (-SRbb), сульфинил (-S(O)Rbb), сульфонил (-S(O)2Rbb) и сульфонамидил (-S(O)2N(Rbb)(Rcc) или -N(Rbb)S(O)2Rbb). Где каждый Raa, Rbb и Rcc независимо представляет собой Н, необязательно связанную химическую функциональную группу или дополнительную группу заместителя, при этом предпочтительный перечень включает, без ограничения, алкил, алкенил, алкинил, алифатические, алококси, ацил, арил, аралкил, гетероарил, алициклические, гетероциклические и гетероарилалкил. Выбранные заместители с соединениями, описанными в настоящем документе, находятся в рекурсивной степени.
При использовании в настоящем документе, «алкил», используемый в настоящем документе, означает насыщенный прямой или разветвленный углеводородный радикал, содержащий до двадцати четырех атомов углерода. Примеры алкильных групп включают, без ограничения, метил, этил, пропил, бутил, изопропил, н-гексил, октил, децил, додецил и т.п. Алкильные группы обычно содержат от 1 до около 24 атомов углерода, более часто от 1 до около 12 атомов углерода (С1-С12 алкил), при этом более предпочтительно от 1 до около 6 атомов углерода.
При использовании в настоящем документе, «алкенил» означает прямой или разветвленный углеводородный радикал, содержащий до двадцати четырех атомов углерода и имеющий по меньшей мере одну двойную углерод-углеродную связь. Примеры
алкенильных групп включают, без ограничения, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил, диены, такие как 1,3-бутадиен и т.п. Алкенильные группы обычно содержат от 2 до около 24 атомов углерода, более часто от 2 до около 12 атомов углерода, при этом более предпочтительно от 2 до около 6 атомов углерода. Алкенильные группы, используемые в настоящем документе, могут необязательно содержать одну или более дополнительных групп заместителей.
При использовании в настоящем документе, «алкинил» означает прямой или разветвленный углеводородный радикал, содержащий до двадцати четырех атомов углерода и имеющий по меньшей мере одну тройную углерод-углеродную связь. Примеры алкинильных групп включают, без ограничения, этинил, 1-пропинил, 1-бутинил и т.п. Алкинильные группы обычно содержат от 2 до около 24 атомов углерода, более часто от 2 до около 12 атомов углерода, при этом более предпочтительно от 2 до около 6 атомов углерода. Алкинильные группы, используемые в настоящем документе, могут необязательно содержать одну или более дополнительных групп заместителей.
При использовании в настоящем документе, «ацил» означает радикал, образованный за счет удаления гидроксильной группы от органической кислоты, и имеет общую формулу -С(O)-Х, где X обычно является алифатическим, алициклическим или ароматическим. Примеры включают алифатические карбонилы, ароматические карбонилы, алифатические сульфонилы, ароматические сульфинилы, алифатические сульфинилы, ароматические фосфаты, алифатические фосфаты и т.п. Ацильные группы, используемые в настоящем документе, могут необязательно содержать дополнительные группы заместителей.
При использовании в настоящем документе, «алициклическая» означает циклическую кольцевую систему, в которой кольцо является алифатическим. Кольцевая система может содержать одно или более колец, при этом по меньшей мере одно кольцо является алифатическим. Предпочтительные алициклические системы включают кольца, имеющие от около 5 до около 9 атомов углерода в кольце. Алициклические группы, используемые в настоящем документе, могут необязательно содержать дополнительные группы заместителей.
При использовании в настоящем документе, «алифатический» означает прямой или разветвленный углеводородный радикал, содержащий до двадцати четырех атомов углерода, в котором насыщенность между любыми двумя атомами углерода представляет собой
одинарную, двойную или тройную связь. Алифатическая группа предпочтительно содержит от 1 до около 24 атомов углерода, более часто от 1 до около 12 атомов углерода, при этом более предпочтительно от 1 до около 6 атомов углерода. Прямая или разветвленная цепь алифатической группы может быть прервана одним или более гетероатомами, которые включают азот, кислород, серу и фосфор. Такие алифатические группы, прерванные гетероатомами, включают, без ограничения, полиалкокси, такие как полиалкиленгликоли, полиамины и полиимины. Алифатические группы, используемые в настоящем документе, могут необязательно содержать дополнительные группы заместителей.
При использовании в настоящем документе, «алкокси» означает радикал, образованный между алкильной группой и атомом кислорода, при этом атом кислорода используется для присоединения алкокси-группы к исходной молекуле. Примеры алкокси-групп включают, без ограничения, метокси, этокси, пропокси, изопропокси, н-бутокси, втор-бутокси, трет-бутокси, н-пентокси, неопентокси, н-гексокси и т.п. Алкокси-группы, используемые в настоящем документе, могут необязательно содержать дополнительные группы заместителей.
При использовании в настоящем документе, «аминоалкил» означает аминезамещенный С1-С12алкильный радикал. Алкильная часть указанного радикала образует ковалентную связь с исходной молекулой. Аминогруппа может быть расположена в любом положении, и аминоалкильная группа может быть замещена дополнительной группой заместителя в алкильной и/или амино-части.
При использовании в настоящем документе, «аралкил» и «арилалкил» означает ароматическую группу, которая ковалентно связана с С1-С12 алкильным радикалом. Часть алкильного радикала образовавшейся аралкильной (или арилалкильной) группы образует ковалентную связь с исходной молекулой. Примеры включают, без ограничения, бензил, фенетил и т.п. Аралкильные группы, используемые в настоящем документе, могут необязательно содержать дополнительные группы заместителей, присоединенные к алкильной, арильной или к обеим группам, которые образуют указанную радикальную группу.
При использовании в настоящем документе, «арил» и «ароматический» означат, радикалы моно- или полициклической карбоциклической кольцевой системы, имеющие одно или более ароматических колец. Примеры арильных групп включают, без ограничения,
фенил, нафтил, тетрагидронафтил, инданил, инденил и т.п. Предпочтительные арильные кольцевые системы имеют от около 5 до около 20 атомов углерода в одном или более кольцах. Арильные группы, используемые в настоящем документе, могут необязательно содержать дополнительные группы заместителей.
При использовании в настоящем документе, «галогено» и «галоген» означает атом, выбранный из фтора, хлора, брома и йода.
При использовании в настоящем документе, «гетероарил» и «гетероароматический» означает радикал, содержащий моно- или полициклическое ароматическое кольцо, кольцевую систему или конденсированную кольцевую систему, в котором по меньшей мере одно из колец является ароматическим и содержит один или более гетероатомов. Гетероарил включает также конденсированные кольцевые системы, включая системы, в которых одно или более из конденсированных колец не содержат гетероатомов. Гетероарильные группы, как правило, содержат один кольцевой атом, выбранный из серы, азота или кислорода. Примеры гетероарильных групп включают, без ограничения, пиридинил, пиразинил, пиримидинил, пирролил, пиразолил, имидазолил, тиазолил, оксазолил, изооксазолил, тиадиазолил, оксадиазолил, тиофенил, фуранил, хинолинил, изохинолинил, бензимидазолил, бензоксазолил, хиноксалинил и т.п. Гетероарильные радикалы могут быть присоединены к исходной молекуле напрямую или через связывающий фрагмент, такой как алифатическая группа или гетероатом. Гетероарильные группы, используемые в настоящем документе могут необязательно содержать дополнительные группы заместителей.
При использовзании в настоящем документе, «конъюгированное соединение» означает любые атомы, группы атомов или группу связанных атомов, подходящую для применения в качестве конъюгирующие группы. В некоторых вариантах реализации конъюгированные соединения могут обладать или влиять на одно или более свойств, включая, но не ограничиваясь этим, свойства фармакодинамики, фармакокинетики, связывания, адсорбции, клеточного распределения, клеточного захвата, заряда и/или выведения.
При использовании в настоящем документе, если не указано или немодифицировано иным образом, «двухспиральные» относится к двум отдельным олигомерным соединениям, которые гибридизованы друг с другом. Такие двухспиральные соединения могут иметь один или более не гибридизованных нуклеозидов у одного или обоих концов одной или обеих спиралей (выступы) и/или один или более внутреннийх не
гибридизованных нуклеозидов (несоответствий), при условии, что существует достаточная комплементарность для сохранения гибридизации при физиологически релевантных условиях.
При использовании в настоящем документе «5'-сайт-мишень» относится к нуклеотиду целевой нуклеиновой кислоты, который комплементарен 5'-основному нуклеотиду конкретного антисмыслового соединения.
При использовании в настоящем документе термин «около» обозначает в пределах ± 10% от значения. Например, если указано, что «маркер может быть увеличен на около 50%», то подразумевается, что маркер может быть увеличен на значение в диапазоне 45%-55%.
При использовании в настоящем документе выражение «введенные параллельно» относится к совместному введению двух средств любым способом, при котором фармакологическое действие обоих средств проявляется у пациента одновременно. При параллельном введении не требуется, чтобы оба агенты были введены в одной фармацевтической композиции, в одной лекарственной форме или одним способом введения. Действие обоих средств не обязательно должно проявляться одновременно. Их действие должно лишь перекрываться в течение определенного периода времени, и оно не обязательно должно иметь одинаковую протяженность по времени.
При использовании в настоящем документе термин «введение» обозначает предоставление фармацевтического агента индивидууму, и включает, но не ограничивается этим, введение медицинским специалистом или самостоятельное введение. Введение фармацевтического агента индивидууму может быть непрерывным, хроническим, кратковременным или периодическим. Введение может быть парентеральным или не парентеральным.
При использовании в настоящем документе «агент» обозначает активное вещество, которое может обеспечивать благоприятный терапевтический эффект при введении животному. «Первый агент» обозначает терапевтическое соединение согласно настоящему изобретению. Например, первое средство может быть антисмысловым олигонуклеотидом, нацеленным на аро(а). «Второй агент» обозначает второе терапевтическое соединение согласно настоящему изобретению (например, второй антисмысловый олигонуклеотид, нацеленный на аро(а)) и/или не-аро(а) терапевтическое соединение.
При использовании в настоящем документе «улучшение» или «улучшать», или «улучшающий» относится к снижению по меньшей мере одного показателя, признака или симптома ассоциированного заболевания, расстройства или состояния. Тяжесть показателей может быть определена при помощи субъективных или объективных оценок, известных специалистам в данной области.
Используемый в настоящем документе термин «животное» относится к человеку или животному, не являющемуся человеком, включая, но не ограничиваясь ими, мышей, крыс, кроликов, собак, котов, свиней и приматов, не являющихся человеком, включая, но не ограничиваясь ими, обезьян и шимпанзе.
При использовании в настоящем документе «apo(a)» означает любую последовательность нуклеиновых кислот или белковую последовательность, кодирующую аро(а). Например, в некоторых вариантах реализации аро(а) включает последовательность ДНК, кодирующую аро(а), последовательность РНК, транскрибированную из ДНК, кодирующей аро(а) (включая геномную ДНК, содержащую интроны и экзоны), последовательность мРНК, кодирующую аро(а), или пептидную последовательность, кодирующую аро(а).
При использовании в настоящем документе «нуклеиновая кислота аро(а)» означает любую нуклеиновую кислоту, кодирующую аро(а). Например, в некоторых вариантах реализации нуклеиновая кислота аро(а) включает последовательность ДНК, кодирующую аро(а), последовательность РНК, транскрибированную из ДНК, кодирующей аро(а) (включая геномную ДНК, содержащую интроны и экзоны), и последовательность мРНК, кодирующую аро(а).
При использовании в настоящем документе «мРНК аро(а)» означает мРНК, кодирующую белок аро(а).
При использовании в настоящем документе «белок аро(а)» означает любую белковую последовательность, кодирующую Аро(а).
При использовании в настоящем документе «специфический ингибитор аро(а)» относится к любому агенту, способному специфически ингибировать экспрессию нуклеиновой кислоты аро(а) и/или белка аро(а). Например, специфические ингибиторы аро(а) включают нуклеиновые кислоты (в том числе антисмысловые соединения), пептиды, антитела, небольшие молекулы и другие агенты, способные ингибировать экспрессию нуклеиновую кислоту аро(а) и/или белка аро(а). В некоторых вариантах реализации изобретения за счет специфического модулирования экспрессии нуклеиновой кислоты аро(а)
и/или экспрессии белка аро(а), специфические ингибиторы аро(а) могут влиять на другие компоненты липидной транспортной системы, включая последующие компоненты. Точно так же, в некоторых вариантах реализации специфические ингибиторы аро(а) могут влиять на другие молекулярные процессы у животного.
При использовании в настоящем документе «атеросклероз» означает затвердевание артерий, поражающее крупные и средние артерии, и характеризуется наличием жировых отложений. Жировые отложения называют «атеромами» или «бляшками», которые состоят, в основном, из холестерина и других жиров, кальция и рубцовой ткани, и они повреждают выстилку артерий.
При использовании в настоящем документе «коронарная болезнь сердца (CHD)» означает сужение мелких кровяных сосудов, которые поставляют кровь и кислород в сердце, что зачастую приводит к атеросклерозу.
При использовании в настоящем документе «сахарный диабет» или «диабет» представляет собой синдром, характеризующийся нарушенным метаболизмом и патологически высоким содержанием сахара в крови (гипергликемией) из-за недостаточного содержания инсулина или сниженной чувствительности к инсулину. Характерные симптомы представляют собой избыточное выделение мочи (полиурия) из-за высокого содержания глюкозы в крови, избыточную жажду и повышенное потребление жидкости (полидипсия) в попытке компенсировать усиленное мочевыделение, расплывчатое зрение из-за того, что высокое содержание глюкозы в крови влияет на оптические свойства глаз, необъяснимую потерю веса и летаргию.
При использовании в настоящем документе «диабетическая дислипидемия» или «диабет 2 типа с дислипидемией» означает состояние, характеризующееся диабетом 2 типа, сниженным содержанием HDL-C, повышенным уровнем триглицеридов (TG) и повышенным уровнем мелких, плотных частиц LDL.
При использовании в настоящем документе «разбавитель» обозначает ингредиент в композиции, который не обладает фармакологической активностью, но является фармацевтически необходимым или желательным. Например, разбавитель в композиции для инъекций может быть жидкостью, например, солевым раствором.
При использовании в настоящем документе «дислипидемия» относится к нарушению метаболизма липидов и/или липопротеинов, включая избыточную выработку или дефицит липидов и/или липопротеинов. Дислипидемия может проявляться в повышении содержания
липидов, таких как хиломикрон, холестерин и триглицериды, а также липопротеинов, таких как холестерин липопротеинов низкой плотности (LDL).
При использовании в настоящем документе «лекарственная форма» означает форму, в которой представлен фармацевтический агент, например, пилюлю, таблетку или другую лекарственную форму, известную в данной области техники. В некоторых вариантах реализации изобретения лекарственная форма представляет собой ампулу, содержащую лиофилизированный антисмысловый олигонуклеотид. В некоторых вариантах реализации лекарственная форма представляет собой ампулу, содержащую восстановленный антисмысловый олигонуклеотид.
При использовании в настоящем документе «доза» обозначает определенное количество фармацевтического агента, которое обеспечивается при разовом введении или в течение определенного периода времени. В некоторых вариантах реализации доза может быть введена одним, двумя или более болюсами, таблетками или инъекциями. Например, в некоторых вариантах реализации, в которых желательно подкожное введение, для требуемой дозы необходим объем, который трудно ввести за одну инъекцию, поэтому можно использовать две или более инъекций для достижения требуемой дозы. В некоторых вариантах реализации фармацевтический агент вводят инфузией в течение продолжительного периода времени или непрерывно. Дозы могут быть определены как количество фармацевтического средства в час, день, неделю или месяц. Дозы также могут быть указаны в мг/кг или г/кг.
При использовании в настоящем документе «эффективное количество» или «терапевтически эффективное количество» означает количество активного фармацевтического агента, достаточное для достижения желаемого физиологического результата у индивидуума, нуждающегося в таком агенте. Эффективное количество может варьироваться у различных индивидуумов в зависимости от состояния здоровья и физического состояния индивидуума, подлежащего лечению, таксономической группы индвидуумов, подлежащих лечению, состава композиции, оценки индивидуального, состояния здоровья и других релевантных факторов.
При использовании в настоящем документе «полная комплементарность» или «100% комплементарность» означает, что каждое азотистое основание последовательности азотистых оснований первой нуклеиновой кислоты имеет комплементарное азотистое основание во второй последовательности азотистых оснований второй нуклеиновой кислоты В некоторых вариантах реализации первая нуклеиновая кислота представляет собой
антисмысловое соединение, а вторая нуклеиновая кислота представляет собой целевую нуклеиновую кислоту.
При использовании в настоящем документе «глюкоза» представляет собой моносахарид, используемый клетками в качестве источника энергии и воспалительного посредника. «Глюкоза в плазме» относится к содержанию глюкозы в плазме.
При использовании в настоящем документе «холестерин липопротеина высокой плотности» или «HDL-С» означает холестерин, связанный с частицами липопротеина высокой плотности. Концентрацию HDL-С в сыворотке (или в плазме) обычно определяют в мг/дл или в нмоль/л. «HDL-С в сыворотке» и «HDL-С в плазме» означает содержание HDL-С в сыворотке и плазме, соответственно.
При использовании в настоящем документе «ингибитор редуктазы HMG-СоА» означает агент, который действует за счет ингибирования фермента редуктазы HMG-CoA, такой как аторвастатин, розувастатин, флувастатин, ловастатин, правастатин и симвастатин.
При использовании в настоящем документе «гиперхолестеринемия» означает патологическое состояние, характеризующееся повышенным холестерином или циркулирующим холестерином (в плазме), LDL-холестерином и VLDL-холестерином, согласно указаниям Заключения экспертной группы Национальной холестериновой образовательной программы (NCEP) по определению, оценке и лечению высокого уровня холестерина у взрослых людей (см., Arch. Int. Med. (1988) 148, 36-39).
При использовании в настоящем документе «гиперлипидемия» или «гиперлипемия» представляет собой патологическое состояние, характеризующееся повышенным, содержанием липидов в сыворотке или циркулирующих липидов (в плазме). Это состояние проявляется в патологически высоких концентрациях жиров. Липидная фракция в циркулирующей крови представляет собой холестерин, липопротеины низкой плотности, липопротеины очень низкой плотности, хиломикроны и триглицериды. Классификация гиперлипидемий по Фредриксону основана на каскаде TG и содержании богатых на холестерин липопротеиновых частиц, измеренном электрофорезом или ультрацентрифугированием и обычно используемом для характеристики основных причин гиперлипидемий, таких как гипертриглицеридемия (Fredrickson and Lee, Circulation. 1965, 31:321-327; Fredrickson et al., New Eng J Med, 1967,276 (1): 34-42).
При использовании в настоящем документе «гипертриглицеридемия» означает состояние, характеризующееся повышенными уровнями триглицеридов. Ее этиология включает первичные (т.е. генетические причины) и вторичные (другие первопричины, такие
как диабет, метаболический синдром/инсулинорезистентность, ожирение, физическая инертность, табакокурение, избыточное употребление алкоголя и пищи с очень высоким содержанием углеводов) факторы или, более часто, комбинацию обоих факторов (Yuan et al. CMAJ, 2007, 176:1113-1120).
При использовании в настоящем документе «идентификация» или «выбор животного с метаболическим или сердечно-сосудистым заболеванием» означает определение или выбор субъекта, предрасположенного или диагностированного с метаболическим заболеванием, сердечно-сосудистым заболеванием или метаболическим синдромом; или определение или выбор субъекта, имеющего любой симптом метаболического заболевания, сердечно-сосудистого заболевания или метаболического синдрома, включая, но не ограничиваясь ими, гиперхолестеринемию, гипергликемию, гиперлипидемию, гипертриглицеридемию, гипертонию, повышенную инсулинорезистентность, пониженную чувствительность к инсулину, увеличенную массу тела и/или увеличенное содержание жира у, или любую их комбинацию. Такая идентификация может быть выполнена любым способом, включая, но не ограничиваясь ими, стандартные клинические испытания или оценки, такие как измерение холестерина в сыворотке или циркулирующего холестерина (в плазме), измерение глюкозы в сыворотке или циркулирующей глюкозы (в плазме), измерение триглицеридов в сыворотке или циркулирующих триглицеридов (в плазме), измерение кровяного давления, измерение содержания жира у, измерение массы тела и т.п.
При использовании в настоящем документе, «улучшенный сердечно-сосудистый результат» означает снижение возникновения неблагоприятных сердечно-сосудистых явлений или их риска. Примеры неблагоприятных сердечно-сосудистых явлений включают, без ограничения, смерть, повторный инфаркт, инсульт, кардиогенный шок, отек легких, остановку сердца и атриальную аритмию.
При использовании в настоящем документе «непосредственно рядом» означает, что между элементами, расположенными непосредственно рядом, не существует промежуточных элементов, например, между областями, сегментами, нуклеотидами и/или нуклеозидами.
При использовании в настоящем документе «увеличение HDL» или «повышение HDL» означает повышение уровня HDL у животного после введения по меньшей мере одного соединения согласно настоящему изобретению, по сравнению с уровнем HDL у животного, которому не вводили ни одного соединения.
При использовании в настоящем документе «индивидуум» или «субъект», или «животное» означает человека или животное, не являющееся человеком, выбранное для лечения или терапии.
При использовании в настоящем документе «индивидуум, нуждающийся в этом» относится к человеку или животному, не являющемуся человеком, выбранному для лечения или терапии, которое нуждается в таком лечении или терапии.
При использовании в настоящем документе «вызывает», «ингибирует», «потенцирует», «повышает», «увеличивает», «снижает», «уменьшает» или подобные термины означают количественное различие между двумя состояниями. Например, «количество, эффективное для ингибирования активности или экспрессии аро(а)», обозначает, что уровень активности или экспрессии аро(а) в обработанном образце отличается от уровня активности или экспрессии аро(а) в необработанном образце. Такие термины применяют, например, к уровням экспрессии и уровням активности.
При использовании в настоящем документе «воспалительное состояние» относится к заболеванию, болезненному состоянию, синдрому или другому состоянию, приводящему к воспалению. Например, ревматоидный артрит и фиброз печени представляют собой воспалительные состояния. Другие примеры воспалительных состояний включают сепсис, ишемию миокарда/реперфузионное повреждение, респираторный дистресс-синдром взрослых, нефрит, отторжение трансплантата, воспалительную болезнь кишечника, рассеянный склероза, артериосклероз, атеросклероз и васкулит.
При использовании в настоящем документе «ингибирование экспрессии или активности» относится к снижению или блокированию экспрессии или активности РНК или белка и не обязательно обозначает полное исключение экспрессии или активности.
При использовании в настоящем документе «инсулинорезистентность» определяется как состояние, при котором нормальные количества инсулина недостаточны для получения нормального ответа на инсулин от жировых, мышечных и печеночных клеток. Инсулинорезистентность в жировых клетках приводит к гидролизу запасенных триглицеридов, что повышает содержание свободных жирных кислот в плазме крови. Инсулинорезистентность в мышцах снижает поглощение глюкозы, а инсулинорезистентность в печени снижает запас глюкозы, и оба эффекта приводят к повышению глюкозы в крови. Высокие уровни инсулина и глюкозы в плазме из-за инсулинорезистентности зачастую приводят к метаболическому синдрому и диабету 2 типа.
При использовании в настоящем документе «чувствительность к инсулину» представляет собой меру эффективности переработки глюкозы у индивидуума. Индивидуум
с высокой чувствительностью к инсулину эффективно перерабатывает глюкозу, тогда как индивидумм с низкой чувствительностью к инсулину перерабатывает глюкозу неэффективно.
При использовании в настоящем документе «понижение содержания липидов» означает уменьшение содержания одного или более липидов (например, LDL, VLDL) у субъекта. «Повышение содержания липидов» означает увеличение содержания липидов (например, HDL) у субъекта. Понижение или повышение уровня липидов может возникать при введении одной или более доз с течением времени.
При использовании в настоящем документе «терапия для понижения содержания липидов» или «агент для понижения содержания липидов» означает терапевтический режим, предоставленный субъекту для снижения содержания одного или более липидов у субъекта. В некоторых вариантах реализации терапия для понижения содержания липидов предоставлена для снижения одного или более из аро(а), СЕТР, ароВ, общего холестерина, LDL-C, VLDL-C, IDL-C, не-HDL-C, триглицеридов, мелких плотных частиц LDL и Lp(a) у субъекта. Примеры терапии для понижения содержания липидов включают, но не ограничиваются ими, ингибиторы ароВ, статины, фибраты и ингибиторы МТР.
При использовании в настоящем документе «липопротеин», такой как VLDL, LDL и HDL, относится к группе белков, находящихся в сыворотке, плазме и лимфе, которые важны для транспорта липидов. Химический состав каждого липопротеина различен, например, HDL имеет более высокое содержание белка по сравнению с липидом, a VLDL имеет более низкое содержание белка по сравнению с липидом.
При использовании в настоящем документе термин «Lp(a)» включает аро(а) и LDL-подобные частицы, содержащие ароВ. Аро(а) связан с ароВ дисульфидной связью.
При использовании в настоящем документе «холестерин липопротеина низкой плотности (LDL-C)» означает холестерин, содержащийся в частицах липопротеина низкой плотности. Концентрацию LDL-C в сыворотке (или в плазме) обычно определяют в м.г/дл или в нмоль/л. «LDL-С в сыворотке» и «LDL-С в плазме» означает содержание LDL-C в сыворотке и плазме, соответственно.
При использовании в настоящем документе «основные факторы риска» относится к факторам, которые способствуют высокому риску конкретного заболевания или состояния. В некоторых вариантах реализации изобретения основные факторы риска для коронарной болезни сердца включают, без ограничения, табакокурение, гипертонию, высокое содержание LDL, низкое содержание HDL-C, семейный анамнез коронарной болезни сердца, возраст и другие факторы, описанные в настоящем документе.
При использовании в настоящем документе «метаболическое расстройство» или «метаболическое заболевание» относится к состоянию, характеризующемуся изменением или
нарушением метаболической функции. «Метаболический» и «метаболизм» представляют собой термины, общеизвестные в данной области техники, и обычно включают весь диапазон биохимических процессов, происходящих в живом организме. Метаболические расстройства включают, но не ограничиваются ими, гипергликемию, преддиабет, диабет (типа 1 и типа 2), ожирение, инсулинорезистентность, метаболический синдром и дислипидемию на фоне диабета 2 типа.
При использовании в настоящем документе «метаболический синдром» означает состояние, характеризующееся кластерообразование липидных и нелипидных сердечно-сосудистых факторов риска метаболического происхождения. В некоторых вариантах реализации изобретения метаболический синдром определяют по наличию любых 3 из следующих факторов: окружность талии более 102 см у мужчин или более 88 см у женщин; содержание триглицеридов в сыворотке по меньшей мере 150 мг/дл; содержание HDL-C менее 40 мг/дл у мужчин или менее 50 мг/дл у женщин; кровяное давление по меньшей мере 130/85 мм рт. ст.; и содержание глюкозы натощак по меньшей мере 110 мг/дл. Эти детерминанты могут быть легко измерены в клинической практике (JAMA, 2001, 285: 2486 - 2497).
«Парентеральное введение» обозначает введение инъекцией или инфузией. Парентеральное введение включает подкожное введение, внутривенное введение, внутримышечное введение, внутриартериальное введение, внутрибрюшинное введение или внутричерепное введение, например, интратекальное или интрацеребровентрикулярное введение. Введение может быть непрерывным, хроническим, кратковременным или периодическим.
При использовании в настоящем документе «пептид» обозначает молекулу, образованную связыванием по меньшей мере двух аминокислот амидными связями. Пептид относится к полипептидам и белкам.
При использовании в настоящем документе «фармацевтический агент» обозначает вещество, которое обеспечивает благоприятный терапевтический эффект при введении индивидууму. Например, в некоторых вариантах реализации изобретения антисмысловый олигонуклеотид, нацеленный на аро(а), представляет собой фармацевтический агент.
При использовании в настоящем документе «фармацевтическая композиция» или «композиция» означает смесь веществ, подходящая для введения индивидууму. Например, фармацевтическая композиция может содержать один или более активных агентов и фармацевтический носитель, например, стерильный водный раствор.
При использовании в настоящем документе «фармацевтически приемлемое производное» включает производные соединений, описанных в настоящем документе, такие как сольваты, гидраты, сложные эфиры, пролекарства, полиморфы, изомеры, меченные изотопами разновидности, фармацевтически приемлемые соли и другие производные, известные в данной области техники.
При использовании в настоящем документе «фармацевтически приемлемые соли» обозначает физиологически и фармацевтически приемлемые соли антисмысловых соединений, то есть соли, которые сохраняют желаемую биологическую активность исходного соединения и не наделяют его нежелательным токсикологическим действием. Термин «фармацевтически приемлемая соль» или «соль» включает соль, полученную из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические или органические кислоты и основания. «Фармацевтически приемлемые соли» соединений, описанных в настоящем документе, могут быть получены по общеизвестным в данной области техники способам. Обзор фармацевтически приемлемых солей представлен в публикации Stahl и Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection and Use (Wiley-VCH, Вайнхайм, Германия, 2002). Натриевые соли антисмысловых олигонуклеотидов являются пригодными и приемлемыми для терапевтического введения людям. Соответственно, в одном из вариантов реализации соединения, описанные в настоящем документе, представлены в форме натриевой соли.
При использовании в настоящем документе «часть» обозначает определенное количество смежных (то есть связанных) азотистых оснований нуклеиновой кислоты. В некоторых вариантах реализации часть является определенным количеством смежных азотистых оснований целевой нуклеиновой кислоты. В некоторых вариантах реализации часть является определенным количеством смежных азотистых оснований антисмыслового соединения.
При использовании в настоящем документе «предупреждать» или «предупреждение» относится к отсрочке или предотвращению возникновения или развития заболевания, расстройства или состояния в течение периода времени от нескольких минут до бесконечности. Предупреждение означает также снижение риска развития заболевания, расстройства или состояния.
При использовании в настоящем документе «повышение» означает увеличение количества. Например, повышение уровня HDL в плазме означает увеличение количества HDL в плазме.
При использовании в настоящем документе «снижение» означает уменьшение до меньшей степени, размера, количества или числа. Например, снижение уровня триглицеридов в плазме означает уменьшение количества триглицеридов в плазме.
При использовании в настоящем документе «область» или «целевая область» определяют как часть целевой нуклеиновой кислоты, имеющую по меньшей мере одну идентифицируемую структуру, функцию или характеристику. Например, целевая область может охватывать 3' нетранслируемую область (UTR), 5' нетранслируемую область, экзон, интрон, экзон-интронное сочленение, кодирующую область, область инициации трансляции, область обрыва трансляции или другую определенную область нуклеиновой кислоты. Структурно определенные области для аро(а) могут быть получены по номеру доступа из базы данных последовательностей, такой как NCBI, и такая информация включена в настоящий документ путем ссылки. В некоторых вариантах реализации целевая область может охватывать последовательность от 5' сайта-мишени любого целевого сегмента в пределах целевой области от 3' сайта-мишени другого целевого сегмента в пределах целевой области.
При использовании в настоящем документе «второй агент» или «второй терапевтический агент» означает агент, который может быть использован в комбинации с «первым агентом». Второй терапевтический агент может включать, но не ограничивается ими, антисмысловые олигонуклеотиды, нацеленные на аро(а) или ароВ. Второй агент также может включать анти-аро(а) антитела, ингибиторы пептида аро(а), агенты для понижения холестерина, агенты для понижения липидов, агенты для понижения глюкозы и противовоспалительные агенты.
При использовании в настоящем документе «сегменты» определяют как более мелкие или субфрагменты областей нуклеиновой кислоты. Например, «целевой сегмент» обозначает последовательность нуклеотидов целевой нуклеиновой кислоты, на которую нацелено одно или несколько антисмысловых соединений. «Сайт-мишень 5'» относится к 5'-основному нуклеотиду целевого сегмента.«Сайт-мишень 3'» относится к 3'-основному нуклеотиду целевого сегмента. Альтернативно, «сайт инициации» может относиться к 5'-основному нуклеотиду целевого сегмента, а «терминирующий сайт» относится к 3'-основному нуклеотиду целевого сегмента. Целевой сегмент также может начинаться с «сайта инициации» одной последовательности и заканчиваться у «терминирующего сайта» другой последовательности.
При использовании в настоящем документе «статин» означает агент, который подавляет активность редуктазы HMG-CoA.
При использовании в настоящем документе «подкожное введение» обозначает введение непосредственно под кожу.
При использовании в настоящем документе «субъект» обозначает человека или животное, не являющееся человеком, выбранное для лечения или терапии.
При использовании в настоящем документе «симптом сердечно-сосудистого заболевания или расстройства» означает явление, которое возникает в результате и сопутствует сердечно-сосудистому заболеванию или расстройству и служит его признаком. Например, симптомы сердечно-сосудистого заболевания или расстройства представляют собой стенокардия; боль в груди, одышка, учащенное сердцебиение; слабость; головокружение; тошнота; потоотделение; тахикардия; брадикардия; аритмия; мерцательная аритмия; опухание нижних конечностей; цианоз; усталость; обморок; онемение лица; онемение конечностей, хромота или судороги мышц; вздутие живота; или лихорадка.
При использовании в настоящем документе «нацеливание» или «нацеленный» обозначает процесс разработки и выбора антисмыслового соединения, которое будет специфически гибридизоваться с целевой нуклеиновой кислотой и вызывать требуемый эффект.
При использовании в настоящем документе «терапевтически эффективное количество» обозначает количество фармацевтического агента, которое обеспечивает индивидууму благоприятный терапевтический эффект.
При использовании в настоящем документе «терапевтическое изменение образа жизни» означает изменение питания и образа жизни, направленное на снижение массы жировой/адипозной ткани и/или холестерина. Такое изменение может снижать риск развития сердечного заболевания и может включать рекомендации по диетическому употреблению общих суточных калорий, общих жиров, насыщенных жиров, полиненасыщенных жиров, мононенасыщенных жиров, углеводов, белков, холестерина, нерастворимых волокон, а также рекомендации по физической активности.
При использовании в настоящем документе «лечить» или «лечение» относится к введению соединения, описанного в настоящем документе, для обеспечения изменения или облегчения заболевания, расстройства или состояния.
При использовании в настоящем документе «триглицерид» или «TG» обозначает липид или нейтральный жир, состоящий из глицерина, связанного с тремя молекулами жирной кислоты.
При использовании в настоящем документе «диабет 2 типа» (известный также как «сахарный диабет 2 типа», «сахарный диабет, 2 тип», «инсулинонезависимый диабет», «NIDDM», «диабет на фоне ожирения» или «диабет взрослого возраста») представляет, собой метаболическое расстройство, которое характеризуется, главным образом, инсулинорезистентностью, относительным дефицитом инсулина и гипергликемией.
Некоторые варианты реализации изобретения
В некоторых вариантах реализации соединение содержит миРНК или антисмысловый олигонуклеотид, нацеленный на аполипопротеин (а) (аро(а)), известный в данной области техники, и конъюгирующую группу, описанную в настоящем документе. Примеры антисмысловых олигонуклеотидов, нацеленных на аро(а), которые подходят для конъюгации, включают, но не ограничиваются ими, те, которые описаны в WO 2013/177468; US 8,673,632; US 7,259,150; и публикации заявки на патент США №US 2004/0242516; полное содержание которых включено в настоящий документ посредством ссылки. В некоторых вариантах реализации соединение содержит антисмысловый олигонуклеотид, имеющий последовательность азотистых оснований любой из SEQ ID NO 12-130, 133, 134, описанных в WO 2013/177468, и конъюгирующую группу, описанную в настоящем документе. В некоторых вариантах реализации соединение содержит антисмысловый олигонуклеотид, имеющий последовательность азотистых оснований любой из SEQ ID NO 11-45 и 85-96, описанных в US 8673632, и конъюгирующую группу, описанную в настоящем документе. В некоторых вариантах реализации соединение содержит антисмысловый олигонуклеотид, имеющий последовательность азотистых оснований любой из SEQ ID NO 11-45, описанных в US 7259150, и конъюгирующую группу, описанную в настоящем документе. В некоторых вариантах реализации соединение содержит антисмысловый олигонуклеотид, имеющий последовательность азотистых оснований любой из SEQ ID NO 7-41, описанных в публикации заявки на патент США №US 2004/0242516, и конъюгирующую группу, описанную в настоящем документе. Последовательности азотистых оснований всех вышеупомянутых справочных SEQ ID NO включены в настоящий документ посредством ссылки.
В некоторых вариантах реализации изобретения приведены соединения и способы снижения экспрессии мРНК и белка аро(а). В некоторых вариантах реализации соединение представляет собой специфический ингибитор аро(а) для лечения, предупреждения или облегчения заболевания, связанного с аро(а). В некоторых вариантах реализации соединение представляет собой антисмысловый олигонуклеотид, нацеленный на аро(а). В некоторых вариантах реализации соединение представляет собой антисмысловый олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу.
В некоторых вариантах реализации приведены соединения и способы снижения уровней Lp(a). В некоторых вариантах реализации соединение представляет собой специфический ингибитор аро(а) для лечения, предупреждения или облегчения заболевания, связанного с Lp(a). В некоторых вариантах реализации соединение представляет собой антисмысловый олигонуклеотид, нацеленный на аро(а). В некоторых вариантах реализации соединение представляет собой антисмысловый олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов. В некоторых вариантах реализации модифицированный олигонуклеотид с конъюгирующей группой состоит из 15-30, 18-24, 19-22, 13-25, 14-25, 15-25 связанных нуклеозидов, в некоторых вариантах реализации модифицированный олигонуклеотид с конъюгирующей группой содержит по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26, по меньшей мере 27, по меньшей мере 28, по меньшей мере 29 или 30 связанных нуклеозидов. В некоторых вариантах реализации модифицированный олигонуклеотид с конъюгирующей группой состоит из 20 связанных нуклеозидов.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а) и конъюгирующую группу, при этом модифицированный олигонуклеотид содержит по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей
мере 18, по меньшей мере 19 или 20 смежных азотистых оснований, комплементарных равной по длине части любой из SEQ ID NO: 1-4.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на сегмент аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид содержит по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований, комплементарных равной по длине части любого из целевых сегментов, представленных, например, в Примерах 114 и 117. В этих таблицах «сайт инициации» относится к 5'-основному нуклеотиду целевого сегмента, а «терминирующий сайт» относится к 3'-основному нуклеотиду целевого сегмента. Целевой сегмент может иметь длину от сайта инициации до терминирующего сайта каждой последовательности, перечисленной в таблицах. Альтернативно, целевой сегмент может иметь длину от сайта инициации одной последовательности до конца терминирующего сайта другой последовательности. Например, как показано в Таблице 125, целевой сегмент может иметь длину от 3901 до 3920, от сайта инициации до терминирующего сайта SEQ ID NO: 58. В другом примере, как показано в Таблице 125, целевой сегмент может иметь длину от 3900 до 3923, от сайта инициации SEQ ID NO: 57 до терминирующего сайта SEQ ID NO: 61.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом последовательность азотистых оснований модифицированного олигонуклеотида по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% комплементарна любой из SEQ ID NO: 1-4. В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом последовательность азотистых оснований модифицированного олигонуклеотида по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или на 100% комплементарна любому из целевых сегментов, представленных, например, в Примерах 114 и 117.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и содержит последовательность азотистых оснований, содержащую часть из по меньшей мере
8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований, комплементарных равной по длине части азотистых оснований 3901-3920 SEQ ID NO:1, причем указанная последовательность азотистых оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна к SEQ ID NO:1.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и содержит последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26, по меньшей мере 27, по меньшей мере 28, по меньшей мере 29 или 30 смежных азотистых оснований, комплементарных равной по длине части азотистых оснований 3900-3923 SEQ ID NO:1, причем указанная последовательность азотистых оснований модифицированного олигонуклеотида по меньшей мере на 80% комплементарна к SEQ ID NO:1.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO: 12-130, 133, 134. В некоторых вариантах реализации модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:12-130, 133,134. В некоторых вариантах реализации соединение состоит из любой из SEQ ID NO:12-130, 133, 134 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:12-20, 22-33, 35-44, 47-50, 51, 53, 57-62, 65-66, 68, 70-79, 81, 85-86, 89-90, 92-94, 97, 105-110, 103-104, 133-134. В некоторых вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO:12-20, 22-33, 35-44, 47-50, 51, 53, 57-62, 65-66, 68, 70-79, 81, 85-86, 89-90, 92-94, 97, 105-110, 103-104, 133-134 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:12-19, 26-30, 32, 35, 38-44, 46-47, 50, 57-58, 61, 64-66, 68, 72-74, 76-77, 92-94, 103-110. В некоторых вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO:12-19, 26-30, 32, 35, 38-44, 46-47, 50, 57-58, 61, 64-66, 68, 72-74, 76-77, 92-94, 103-110 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:111, 114-121, 123-129. В некоторых
вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO:111, 114-121, 123-129 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:14, 17, 18, 26-28, 39, 71, 106-107. В некоторых вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO:14, 17, 18, 26-28, 39, 71, 106-107 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:14,26-29, 39-40, 82. В некоторых вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO: 14,26-29, 39-40, 82 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей море 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:14, 16-18. В некоторых вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO:14, 16-18 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из ' последовательностей азотистых оснований SEQ ID NO: 26-27, 107. В некоторых вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO:26-27, 107 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по, меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:28-29, 39-40, 47. В некоторых вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO::28-29, 39-40, 47 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований любой из последовательностей азотистых оснований SEQ ID NO:28, 93, 104, 134. В некоторых вариантах реализации соединение состоит из любой из последовательностей азотистых оснований SEQ ID NO:28, 93, 104, 134 и конъюгирующие группы.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и имеет
последовательность азотистых оснований, содержащую по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или 20 смежных азотистых оснований последовательности азотистых оснований SEQ ID NO:58. В некоторых вариантах реализации модифицированный олигонуклеотид с конъюгирующей группой имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований последовательности азотистых оснований SEQ ID NO: 58. В некоторых вариантах реализации соединение состоит из SEQ ID NO: 58 и конъюгирующие группы.
В некоторых вариантах реализации настоящего описания представлены конъюгированные антисмысловые соединения, представленные следующей структурой. В некоторых вариантах реализации антисмысловое соединение содержит модифицированный олигонуклеотид ISIS 494372 с 5'-Х, где X представляет собой конъюгирующую группу, содержащую GalNAc. В некоторых вариантах реализации антисмысловое соединение состоит из модифицированного олигонуклеотида ISIS 494372 с 5'-Х, где X представляет собой конъюгирующую группу, содержащую GalNAc.
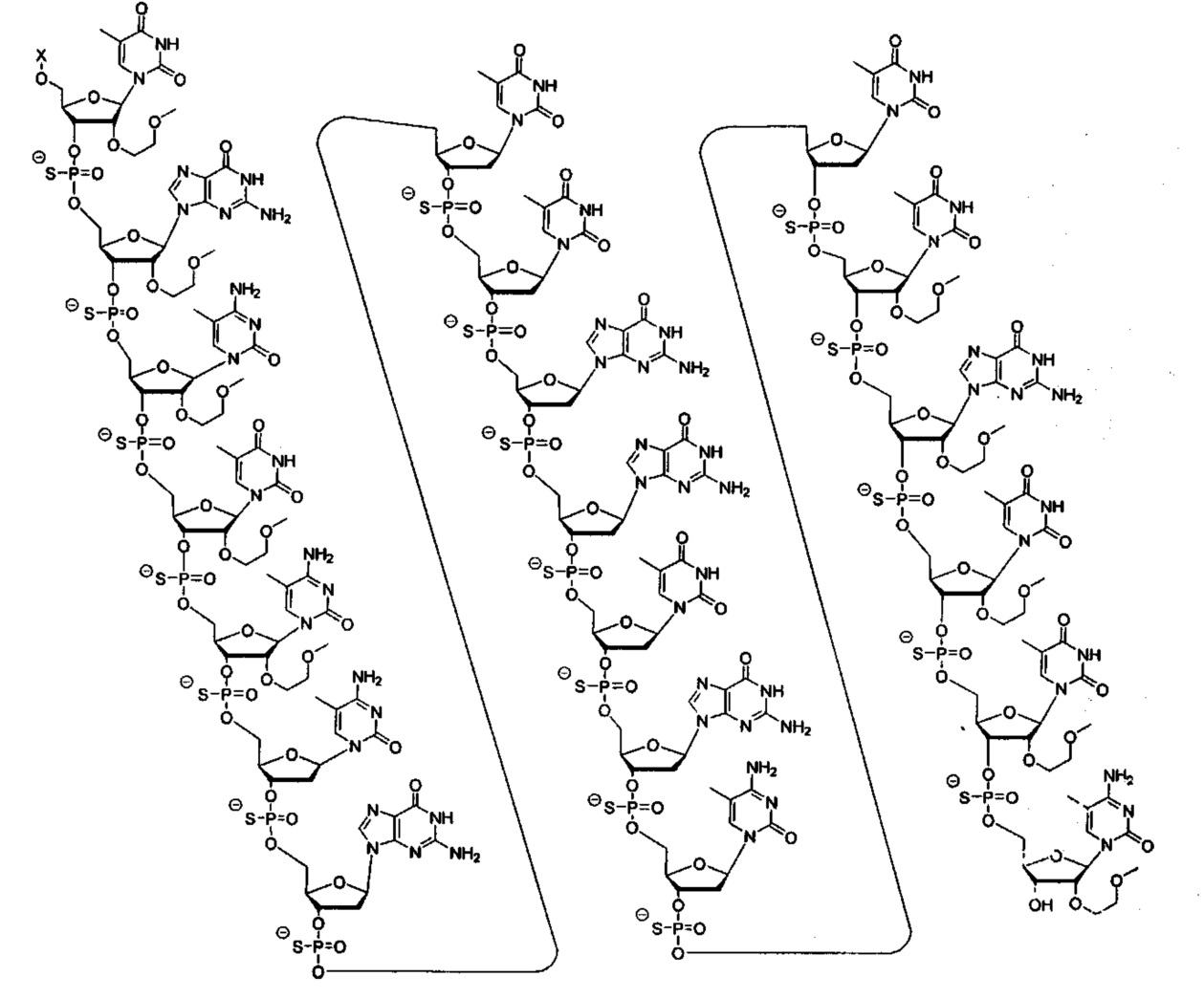
В некоторых вариантах реализации настоящего описания представлены конъюгированные антисмысловые соединения, представленные следующей структурой. В некоторых вариантах реализации антисмысловое соединение содержит конъюгированный модифицированный олигонуклеотид ISIS 681251. В некоторых вариантах реализации антисмысловое соединение состоит из конъюгированного модифицированного олигонуклеотида ISIS 681251.
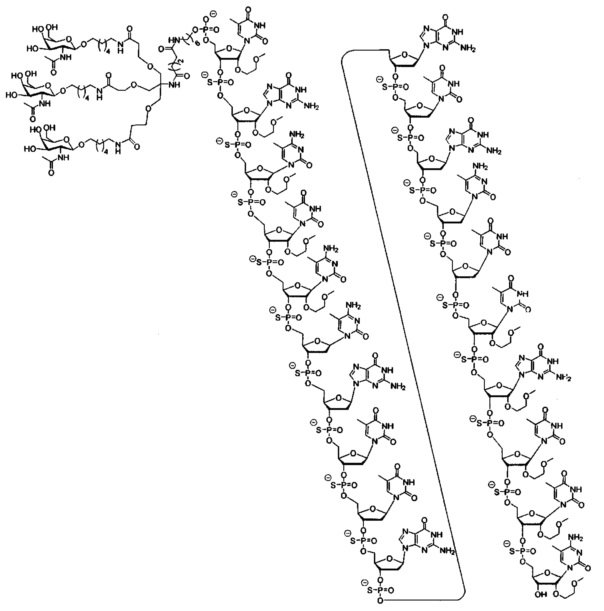
В некоторых вариантах реализации настоящего описания представлены конъюгированные антисмысловые соединения, представленные следующей структурой. В некоторых вариантах реализации антисмысловое соединение содержит конъюгированный модифицированный олигонуклеотид ISIS 681257. В некоторых вариантах реализации антисмысловое соединение состоит из конъюгированного модифицированного олигонуклеотида ISIS 681257.
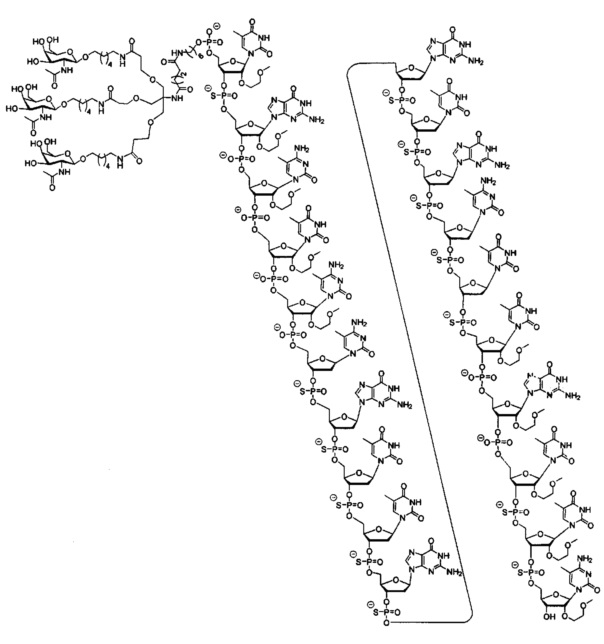
В некоторых вариантах реализации настоящего описания представлены конъюгированные антисмысловые соединения, представленные следующей структурой. В некоторых вариантах реализации антисмысловое соединение содержит модифицированный олигонуклеотид с последовательностью азотистых оснований SEQ ID NO: 58 с 5'-GalNAc с вариабельностью в сахарных структурах крыльев. В некоторых вариантах реализации антисмысловое соединение состоит из модифицированного олигонуклеотида с последовательностью азотистых оснований SEQ ID NO:58 с 5'-GalNAc с вариабельностью в сахарных структурах крыльев.
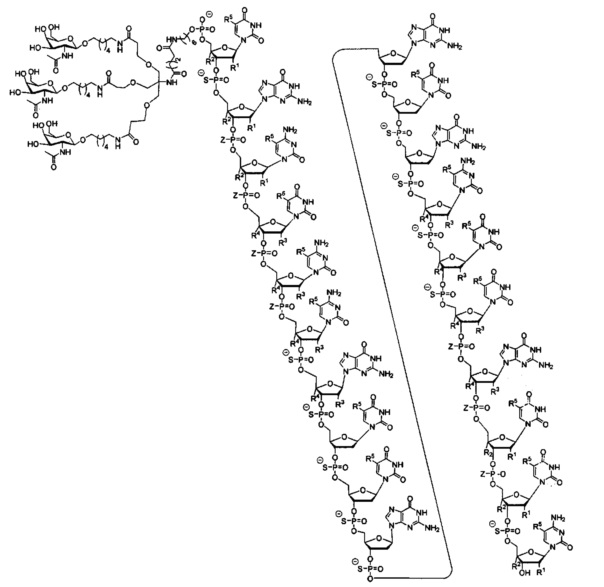
где либо R1 представляет собой -ОСН2СН2ОСН3 (МОЕ), и R2 представляет собой Н; либо R1 и R2 вместе образуют мостик, где R1 представляет собой -О-, и R2 представляет собой -СН2-, -СН(СН3)- или -СН2СН2-, и R1 и R2 связаны напрямую, так что образующийся мостик выбран из: -O-СН2-, -O-СН(СН3)- и -O-СН2СН2-;
и для каждой пары R3 и R4 у одного кольца, независимо для каждого кольца: либо R3выбран из Н и -ОСН2СН2ОСН3, и R4 представляет собой Н; либо R3 и R4 вместе образуют мостик, где R3 представляет собой -О-, и R4 представляет собой -СН2-, -СН(СН3)- или -СН2СН2-, и R3 и R4 связаны напрямую, так что образующийся мостик выбран из: -О-СН2-, -О-СН(СН3)- и -О-СН2СН2-;
и R5 выбран из Н и -СН3;
и Z выбран из S- и О-.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид является одноцепочечным.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом по меньшей мере одна межнуклеозидная связь представляет собой модифицированную межнуклеозидную связь. В некоторых вариантах реализации, модифицированная межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь. В некоторых вариантах реализации по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 межнуклеозидных связей указанного модифицированного олигонуклеотида представляют собой тиофосфатные межнуклеозидные связи. В некоторых вариантах реализации каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь. В некоторых вариантах реализации модифицированный олигонуклеотид содержит по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 фосфодиэфирных межнуклеозидных связей. В некоторых вариантах реализации каждая межнуклеозидная связь модифицированного олигонуклеотида выбрана из фосфодиэфирной межнуклеозидной связи и тиофосфатной межнуклеозидной связи.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при
этом по меньшей мере один нуклеозид содержит модифицированное азотистое основание. В некоторых вариантах реализации, модифицированнле азотистое основание представляет собой 5-метилцитозин.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид содержит по меньшей мере один модифицированный сахар. В некоторых вариантах реализации модифицированный сахар представляет собой бициклический сахар. В некоторых вариантах реализации модифицированный сахар содержит 2'-O-метоксиэтиловый, стерически затрудненный этиловый, 3'-фтор-ГНК (hexitol nucleic acid (HNA)) или 4'-(CH2)n-O-2' мостик, где n равен 1 или 2.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов и содержит: (а) сегмент гэп, состоящий из связанных дезоксинуклеозидов; (b) сегмент 5'-крыла, состоящий из связанных нуклеозидов; (с) сегмент 3'-крыла, состоящий из связанных нуклеозидов; и при этом сегмент гэп находится между сегментом 5'-крыла и сегментом 3'-крыла, и каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов и содержит: (а) сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов; (b) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (с) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; и при этом сегмент гэп находится между сегментом 5'-крыла и сегментом 3'-крыла, и каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар, и по меньшей мере одна межнуклеозидных связей представляет собой тиофосфатную связь, а каждый цитозиновый остаток представляет собой 5-метилцитозин.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгированную группу, при этом модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных
азотистых оснований любой из SEQ ID NO:12-130, 133, 134, при этом модифицированный олигонуклеотид содержит: (а) сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов; (b) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (с) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; и при этом сегмент гэп находится между сегментом 5'-крыла и сегментом 3'-крыла, и каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар, и по меньшей мере одна межнуклеозидных связей представляет собой тиофосфатную связь, а каждый цитозиновый остаток представляет собой 5-метилцитозин.
В некоторых вариантах реализации приведено соединение, содержащее модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгированную группу, при этом модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов и имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований SEQ ID NO:58, при этом модифицированный олигонуклеотид содержит: (а) сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов; (b) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (с) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; и при этом сегмент гэп находится между сегментом 5'-крыла и сегментом 3'-крыла, и каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтиловый сахар, и по меньшей мере одна межнуклеозидных связей представляет собой тиофосфатную связь, а каждый цитозиновый остаток представляет собой 5-метилцитозин.
В некоторых вариантах реализации приведен модифицированный олигонуклеотид, нацеленный на аро(а), и конъюгирующая группа, при этом модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов с последовательностью азотистых оснований SEQ ID NO:58, при этом модифицированный олигонуклеотид содержит: (а) сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов; (b) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (с) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов; и при этом сегмент гэп находится между сегментом 5'-крыла и сегментом 3'-крыла, и каждый нуклеозид каждого сегмента крыла содержит 2'-O- метоксиэтиловый сахар, и по меньшей мере одна межнуклеозидных связей представляет собой тиофосфатную связь, а каждый цитозиновый остаток представляет собой 5-метилцитозин.
В некоторых вариантах реализации конъюгирующая группа связана с модифицированным олигонуклеотидом на 5'-конце модифицированного олигонуклеотида. В
некоторых вариантах реализации конъюгирующая группа связана с модифицированным олигонуклеотидом на 3'-конце модифицированного олигонуклеотида.
В некоторых вариантах реализации изобретения конъюгирующая группа содержит один или более лигандов. В некоторых вариантах реализации изобретения конъюгирующая группа содержит два или более лигандов. В некоторых вариантах реализации изобретения конъюгирующая группа содержит три или более лигандов. В некоторых вариантах реализации изобретения конъюгирующая группа содержит три лиганда. В некоторых вариантах реализации каждый лиганд выбран из: полисахарида, модифицированного полисахарида, маннозы, галактозы, производного маннозы, производного галактозы, D-маннопиранозы, L-маннопиранозы, D-арабинозы, L-галактозы, D-ксилофуранозы, L-ксилофуранозы, D-глюкозы, L-глюкозы, D-галактозы, L-галактозы, α-D-маннофуранозы, β-D-маннофуранозы, α-D-маннопиранозы, β-D-маннопиранозы, α-D-глюкопиранозы, β-D-глюкопиранозы, α-D-глюкофуранозы, β-D-глюкофуранозы, α-D-фруктофуранозы, α-D-фруктопиранозы, α-D-галактопиранозы, β-D-галактопиранозы, α-D-галактофуранозы, β-D-галактофуранозы, глюкозамина, сиаловой кислоты, α-D-галактозамина, N-ацетилгалактозамина, 2-амино-3-O-[(R)-1-карбоксиэтил]-2-дезокси-β-D-глюкопиранозы, 2-дезокси-2-метиламино-L-глюкопиранозы, 4,6-дидезокси-4-формамидо-2,3-ди-O-метил-D-маннопиранозы, 2-дезокси-2-сульфоамино-D-глюкопиранозы, N-гликолоил-α-нейраминовой кислоты, 5-тио-β-D-глюкопиранозы, метил-2,3,4-три-O-ацетил-1-тио-6-O-тритил-α-D-глюкопиранозида, 4-тио-β-D-галактопиранозы, этил-3,4,6,7-тетра-O-ацетил-2-дезокси-1,5-дитио-α-D-глюко-гептопиранозида, 2,5-ангидро-D-аллононитрила, рибозы, D-рибозы, D-4-тиорибозы, L-рибозы, L-4-тиорибозы. В некоторых вариантах реализации каждый лиганд представляет собой N-ацетилгалактозамин.
В некоторых вариантах реализации каждый лиганд представляет собой N-ацетилгалактозамин.
В некоторых вариантах реализации конъюгирующая группа содержит:

В некоторых вариантах реализации конъюгирующая группа содержит:

В некоторых вариантах реализации конъюгирующая группа содержит:

В некоторых вариантах реализации конъюгирующая группа содержит:
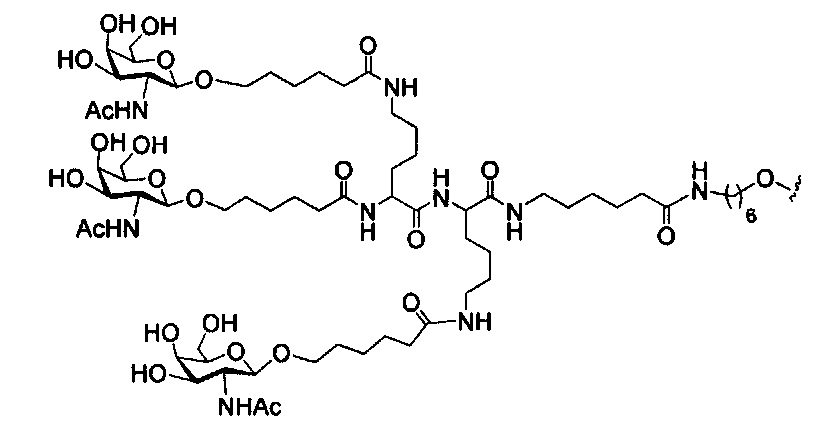
В некоторых вариантах реализации конъюгирующая группа содержит:
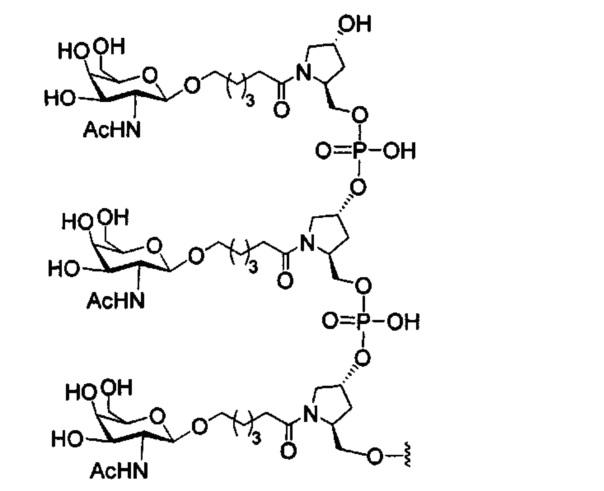
В некоторых вариантах реализации изобретения конъюгирующая группа содержит по меньшей мере одну фосфорную связывающую группу или нейтральную связывающую группу.
В некоторых вариантах реализации конъюгирующая группа содержит структуру, выбранную из:
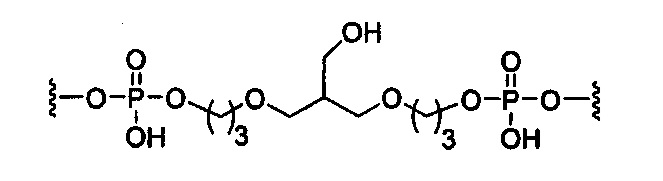
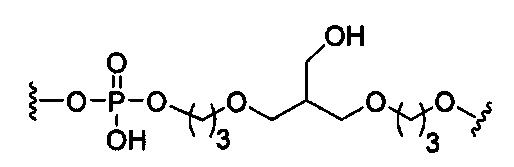
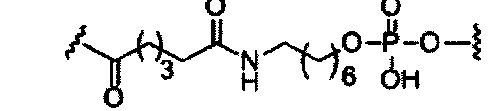




где n равен от 1 до 12; и
где m равен от 1 до 12.
В некоторых вариантах реализации изобретения конъюгирующая группа содержит связку, имеющую структуру, выбранную из:


где L представляет собой либо фосфорную связывающую группу, либо нейтральную связывающую группу;
Z1 представляет собой C(=O)O-R2;
Z2 представляет собой Н, С1-С6 алкил или замещенный С1-С6 алкил;
R2 представляет собой Н, С1-С6 алкил или замещенный С1-С6 алкил;
и каждый m1 независимо равен от 0 до 20, при этом по меньшей мере один m1 больше 0 для каждой связки.
В некоторых вариантах реализации изобретения конъюгирующая группа содержит связку, имеющую структуру, выбранную из:

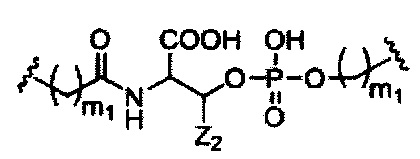
где Z2 представляет собой Н или СН3; и
каждый m1 независимо равен от 0 до 20, при этом по меньшей мере один m1 больше 0 для каждой связки.
В некоторых вариантах реализации изобретения конъюгирующая группа содержит связку, имеющую структуру, выбранную из:

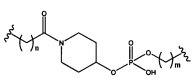
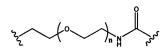
где n равен от 1 до 12; и
где m равен от 1 до 12.
В некоторых вариантах реализации изобретения конъюгирующая группа ковалентно связана с модифицированным олигонуклеотидом.
В некоторых вариантах реализации соединение имеет структуру, представленную формулой:
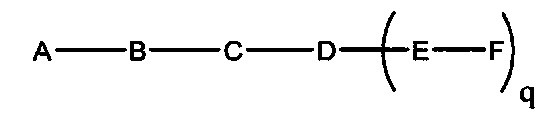
где
А представляет собой модифицированный олигонуклеотид;
В представляет собой расщепляемый фрагмент
С представляет собой конъюгирующий линкер
D представляет собой группу ветвления
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации соединение имеет структуру, представленную формулой:

где:
А представляет собой модифицированный олигонуклеотид;
В представляет собой расщепляемый фрагмент
С представляет собой конъюгирующий линкер
D представляет собой группу ветвления
каждый Е представляет собой связку;
каждый F представляет собой лиганд;
каждый n независимо равен 0 или 1; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации соединение имеет структуру, представленную формулой:

где
А представляет собой модифицированный олигонуклеотид;
В представляет собой расщепляемый фрагмент;
С представляет собой конъюгирующий линкер;
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации соединение имеет структуру, представленную формулой:
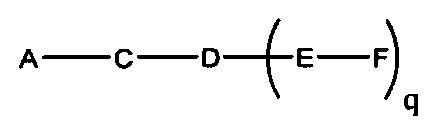
где
А представляет собой модифицированный олигонуклеотид;
С представляет собой конъюгирующий линкер;
D представляет собой группу ветвления;
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации соединение имеет структуру, представленную формулой:
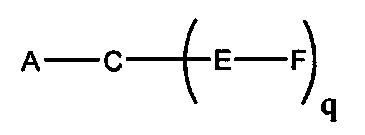
где
А представляет собой модифицированный олигонуклеотид;
С представляет собой конъюгирующий линкер;
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации соединение имеет структуру, представленную формулой:
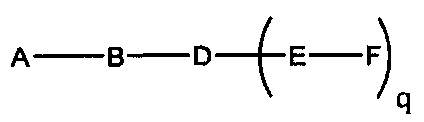
где
А представляет собой модифицированный олигонуклеотид;
В представляет собой расщепляемый фрагмент;
D представляет собой группу ветвления;
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации соединение имеет структуру, представленную формулой:

где
А представляет собой модифицированный олигонуклеотид;
В представляет собой расщепляемый фрагмент;
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации соединение имеет структуру, представленную формулой:
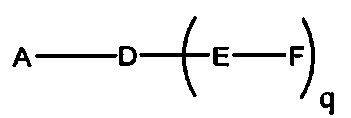
где
А представляет собой модифицированный олигонуклеотид;
D представляет собой группу ветвления;
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:



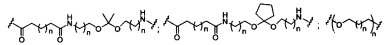
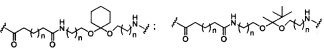
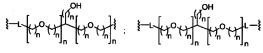


где каждый L независимо представляет собой либо фосфорную связывающую группу, либо нейтральную связывающую группу; и
каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:

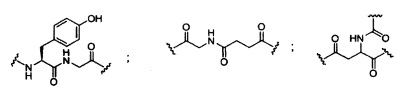
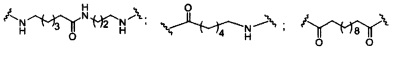
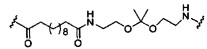
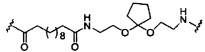
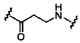
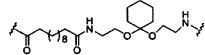



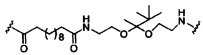

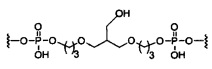
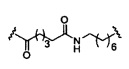

В некоторых вариантах реализации изобретения конъюгирующий линкер имеет следующую структуру:
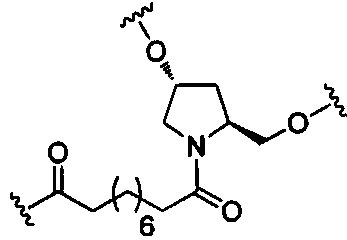
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:


В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную
из:


В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:


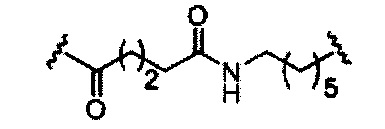
В некоторых вариантах реализации конъюгирующий линкер содержит пирролидин. В некоторых вариантах реализации конъюгирующий линкер не содержит пирролидин. В некоторых вариантах реализации конъюгирующий линкер содержит ПЭГ. В некоторых вариантах реализации конъюгирующий линкер содержит амид. В некоторых вариантах реализации конъюгирующий линкер содержит по меньшей мере два амида. В некоторых вариантах реализации конъюгирующий линкер не содержит амид. В некоторых вариантах реализации конъюгирующий линкер содержит полиамид. В некоторых вариантах реализации конъюгирующий линкер содержит амин. В некоторых вариантах реализации изобретения конъюгирующий линкер содержит одну или более дисульфидных связей. В некоторых
вариантах реализации конъюгирующий линкер содержит белок-связывающий фрагмент. В некоторых вариантах реализации белок-связывающий фрагмент содержит липид.
В некоторых вариантах реализации каждый белок-связывающий фрагмент выбран из: холестерина, холевой кислоты, адамантан-уксусной кислоты, 1-пиренмасляной кислоты, дигидротестостерона, 1,3-бис-O(гексадецил)глицерина, геранилоксигексиловой группы, гексадецилглицерина, борнеола, ментола, 1,3-пропандиола, гептадециловой группы, пальмитиновой кислоты, миристиновой кислоты, O3-(олеоил)литохолевой кислоты, O3-(олеил)холеновой кислоты, диметокситритила или феноксазина, витамина (например, фолата, витамина А, витамина Е, биотина, пиридоксаля), пептида, углевода (например, моносахарида, дисахарида, трисахарида, тетрасахарида, олигосахарида, полисахарида), эндосомолитического компонента, стероида (например, уваола, гецигенина, диосгенина), терпена (например, тритерпена, например, сарсасапогенина, фриделина, эпифриделанол-дериватизованной литохолевой кислоты) или катионного липида.
В некоторых вариантах реализации каждый белок-связывающий фрагмент выбран из: насыщенной или ненасыщенной жирной кислоты с длиной цепи С16-С22, холестерина, холевой кислоты, витамина Е, адамантана или 1-пентафторпропила.
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:
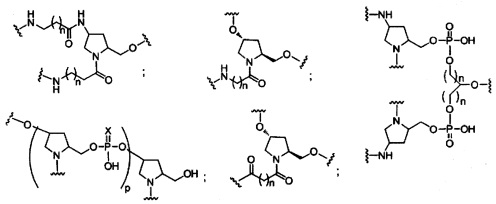
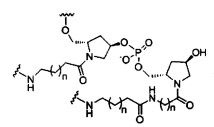
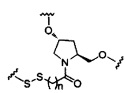
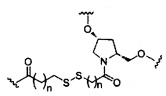
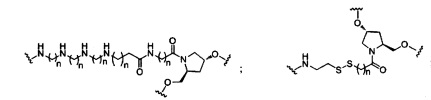
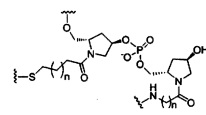

где каждый n независимо равен от 1 до 20; и р равен от 1 до 6.
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную
из:
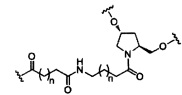







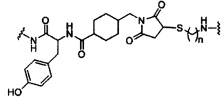
где каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:
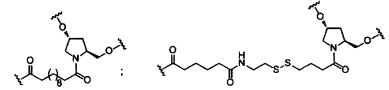


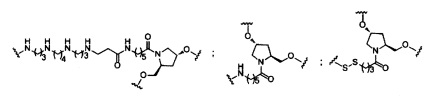
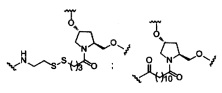
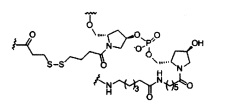
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:

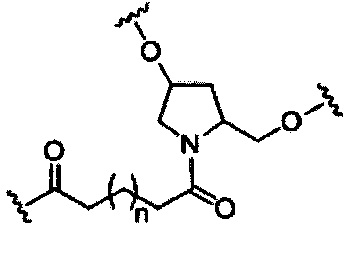
где n равен от 1 до 20.
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:
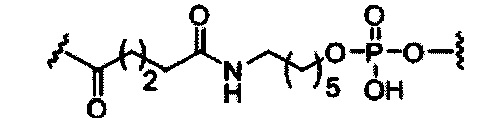
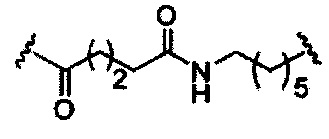
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет структуру, выбранную из:
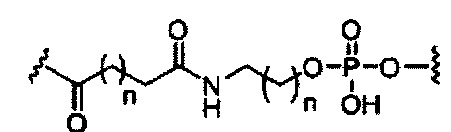

где каждый n независимо равен 0, 1, 2, 3, 4, 5, 6 или 7.
В некоторых вариантах реализации изобретения конъюгирующий линкер имеет следующую структуру:
В некоторых вариантах реализации изобретения группа ветвления имеет одну из следующих структур:

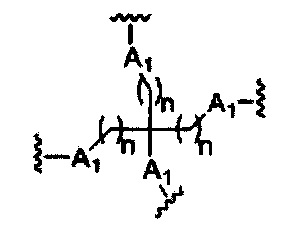

где каждый A1 независимо представляет собой О, S, С=O или NH; и
каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации изобретения группа ветвления имеет одну из следующих структур:

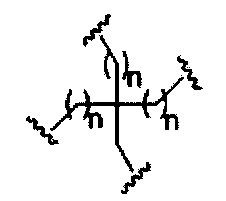
где каждый А1 независимо представляет собой О, S, С=O или NH; и
каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации изобретения группа ветвления имеет следующую структуру:
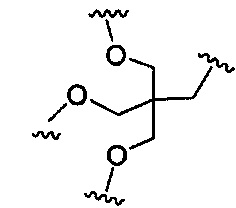
В некоторых вариантах реализации изобретения группа ветвления имеет следующую структуру:

В некоторых вариантах реализации изобретения группа ветвления имеет следующую структуру:
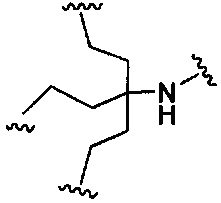
В некоторых вариантах реализации изобретения группа ветвления имеет следующую структуру:

В некоторых вариантах реализации изобретения группа ветвления содержит простой эфир.
В некоторых вариантах реализации изобретения группа ветвления имеет следующую структуру:
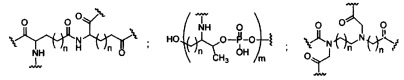


каждый n независимо равен от 1 до 20; и
m равен от 2 до 6.
В некоторых вариантах реализации изобретения группа ветвления имеет следующую структуру:

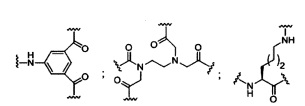
В некоторых вариантах реализации изобретения грауппа ветвления имеет следующую структуру:
В некоторых вариантах реализации группа ветвления содержит:


где каждый j представляет собой целое число от 1 до 3; и
где каждый n представляет собой целое число от 1 до 20.
В некоторых вариантах реализации группа ветвления содержит:

В некоторых вариантах реализации каждая связка выбрана из:
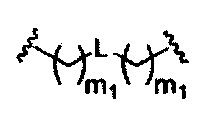
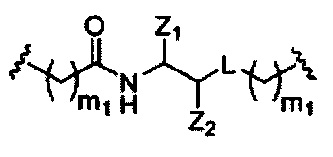
где L выбран из фосфорной связывающей группы и нейтральной связывающей группы;
Z1 представляет собой C(=O)O-R2;
Z2 представляет собой Н, С1-С6 алкил или замещенный С1-С6 алкил;
R2 представляет собой Н, С1-С6 алкил или замещенный С1-С6 алкил; и
каждый m1 независимо равен от 0 до 20, при этом по меньшей мере один m1 больше 0 для каждой связки.
В некоторых вариантах реализации каждая связка выбрана из:
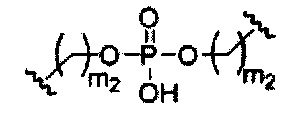

где Z2 представляет собой Н или СН3; и
каждый m2 независимо равен от 0 до 20, при этом по меньшей мере один m2 больше 0 для каждой связки.
В некоторых вариантах реализации каждая связка выбрана из:



где n равен от 1 до 12; и
где m равен от 1 до 12.
В некоторых вариантах реализации изобретения по меньшей мере одна связка содержит этиленгликоль. В некоторых вариантах реализации изобретения по меньшей мере одна связка содержит амид. В некоторых вариантах реализации изобретения по меньшей мере одна связка содержит полиамид. В некоторых вариантах реализации изобретения по меньшей мере одна связка содержит амин. В некоторых вариантах реализации по меньшей мере две связки отличны друг от друга. В некоторых вариантах реализации все связки являются одинаковыми.В некоторых вариантах реализации каждая связка выбрана из:

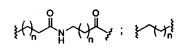
где каждый n независимо равен от 1 до 20; и
каждый р равен от 1 до около 6.
В некоторых вариантах реализации каждая связка выбрана из:


В некоторых вариантах реализации изобретения каждая связка имеет следующую структуру:

где каждый n независимо равен от 1 до 20. В некоторых вариантах реализации изобретения каждая связка имеет следующую структуру:

В некоторых вариантах реализации изобретения связка имеет структуру, выбранную из:


В некоторых вариантах реализации изобретения связка имеет структуру, выбранную из:
В некоторых вариантах реализации изобретения лиганд представляет собой галактозу. В некоторых вариантах реализации изобретения лиганд представляет собой манноза-6-фосфат.
В некоторых вариантах реализации каждый лиганд выбран из:
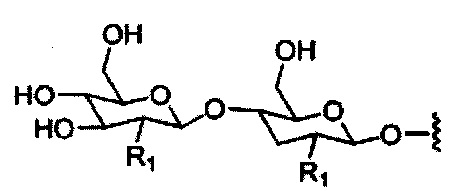

где каждый R1 выбран из ОН и NHCOOH.
В некоторых вариантах реализации каждый лиганд выбран из:
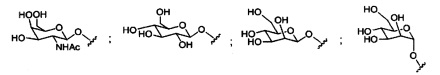

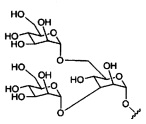
В некоторых вариантах реализации изобретения каждый лиганд имеет следующую структуру:
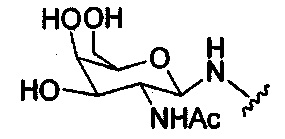
В некоторых вариантах реализации изобретения каждый лиганд имеет следующую структуру:
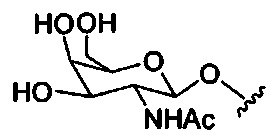
В некоторых вариантах реализации конъюгирующая группа содержит фрагмент, нацеливающий на клетку.
В некоторых вариантах реализации конъюгирующая группа содержит фрагмент, нацеливающий на клетку, имеющий следующую структуру:

где каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, имеет следующую структуру:
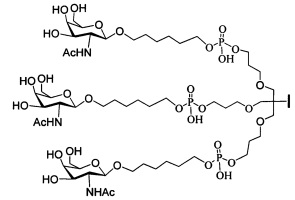
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, имеет следующую структуру:

где каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, имеет следующую структуру:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
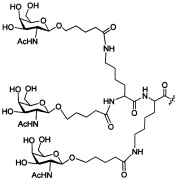
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
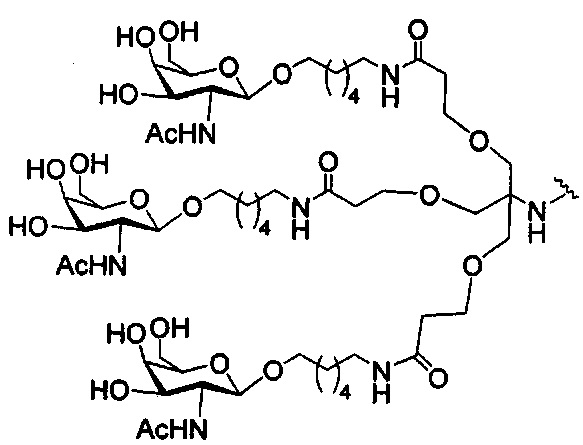
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
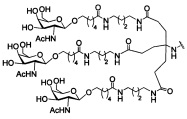
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
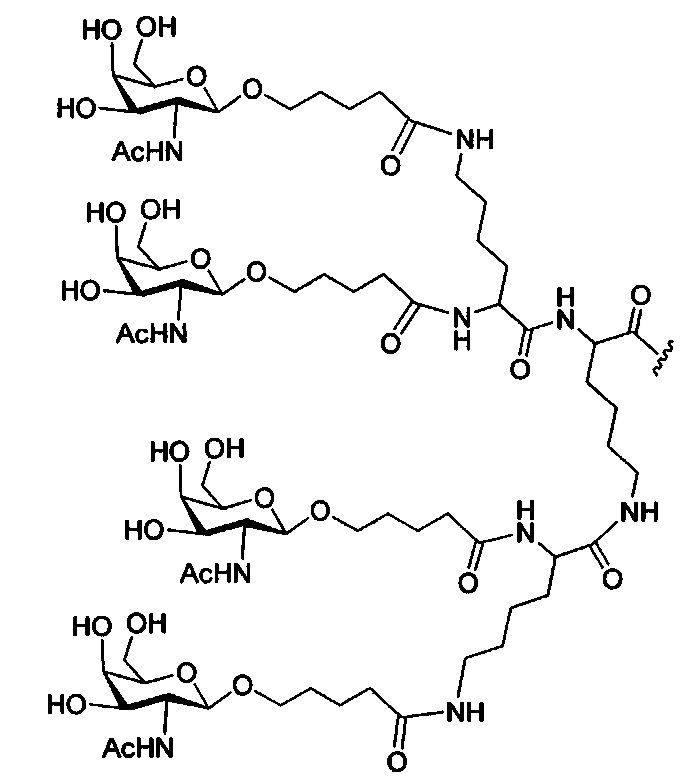
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
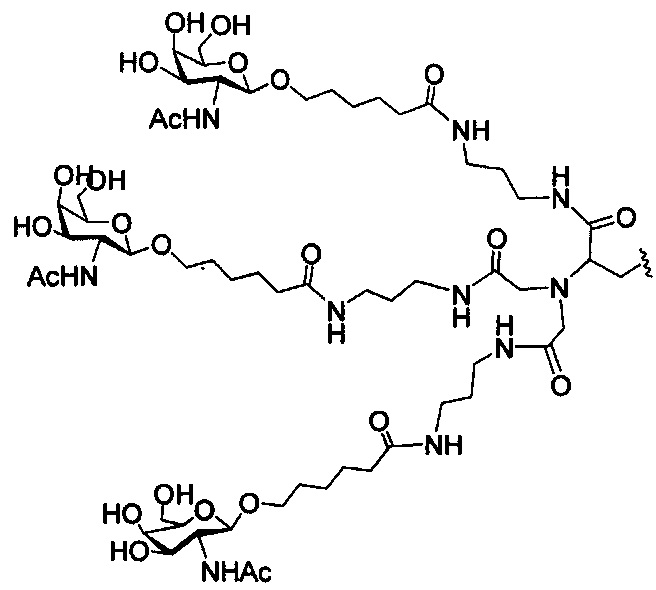
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
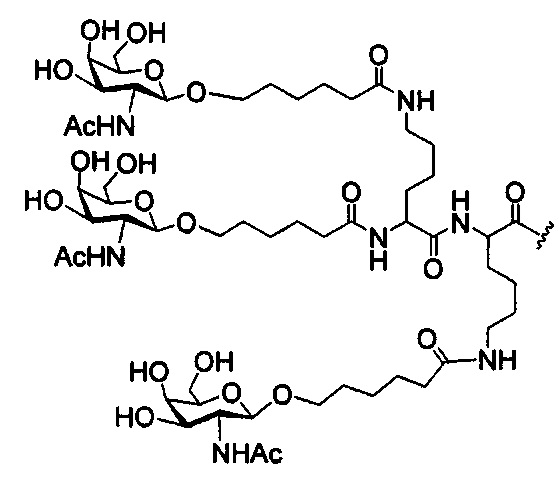
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
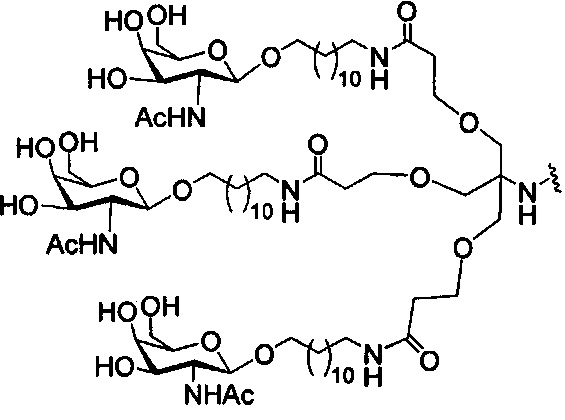
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
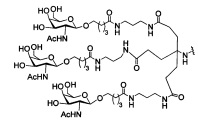
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
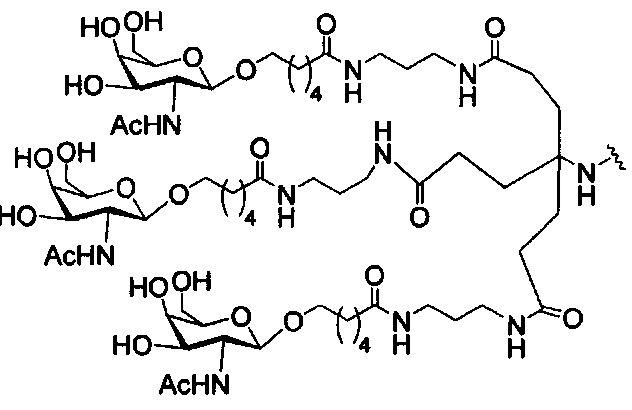
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
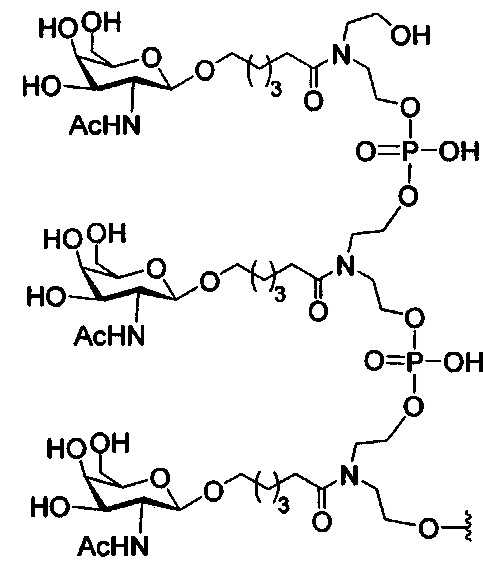
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
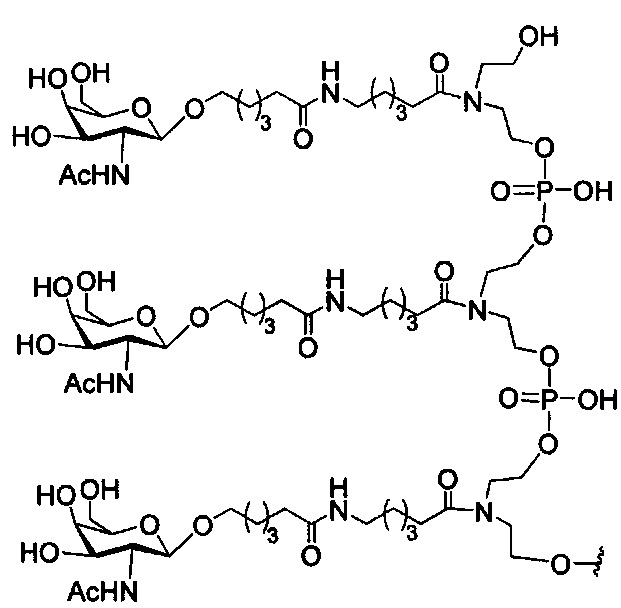
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
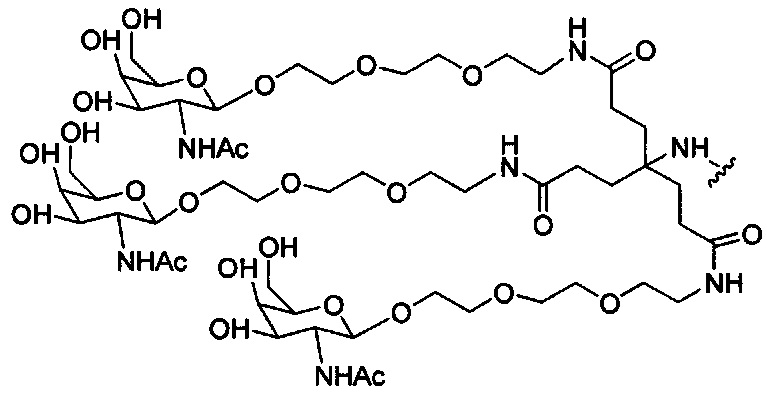
В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:

В некоторых вариантах реализации изобретения фрагмент, нацеливающий на клетку, содержит:
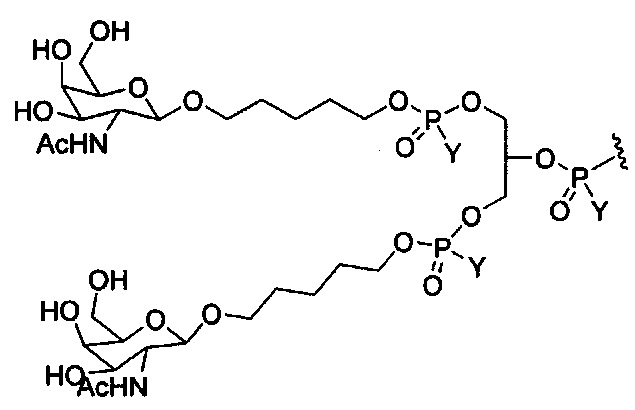
где каждый Y выбран из О, S, замещенного или незамещенного С1-С10 алкила, амино, замещенного амино, азидо, алкенила или алкинила.
В некоторых вариантах реализации конъюгирующая группа содержит:
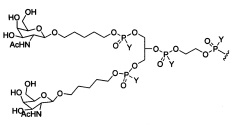
где каждый Y выбран из О, S, замещенного или незамещенного С1-С10 алкила, амино, замещенного амино, азидо, алкенила или алкинила.
В некоторых вариантах реализации конъюгирующая группа содержит:

где каждый Y выбран из О, S, замещенного или незамещенного С1-С10 алкила, амино, замещенного амино, азидо, алкенила или алкинила.
В некоторых вариантах реализации конъюгирующая группа содержит:
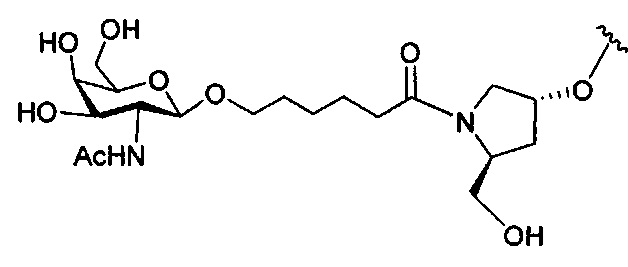
В некоторых вариантах реализации конъюгирующая группа содержит:

В некоторых вариантах реализации конъюгирующая группа содержит:
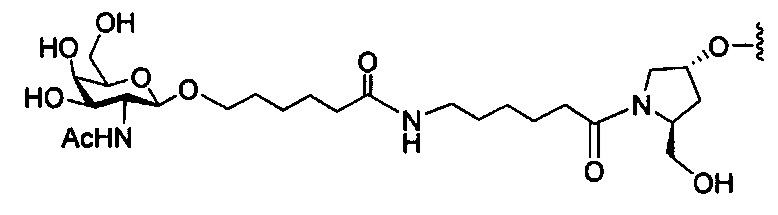
В некоторых вариантах реализации конъюгирующая группа содержит:
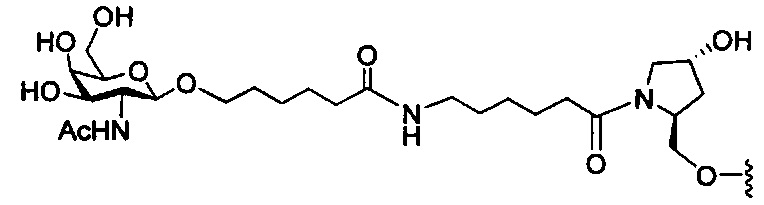
В некоторых вариантах реализации конъюгирующая группа содержит фрагмент, выбранный из: фосфодиэфира, амида или сложного эфира.
В некоторых вариантах реализации конъюгирующая группа содержит фосфодиэфирный расщепляемый фрагмент.
В некоторых вариантах реализации изобретения конъюгирующая группа не содержит расщепляемого фрагмента, и при этом конъюгирующая группа содержит тиофосфатную связь между конъюгирующей группой и олигонуклеотидом. В некоторых вариантах реализации конъюгирующая группа содержит амидный расщепляемый фрагмент.В некоторых вариантах реализации конъюгирующая группа содержит сложноэфирный расщепляемый фрагмент.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
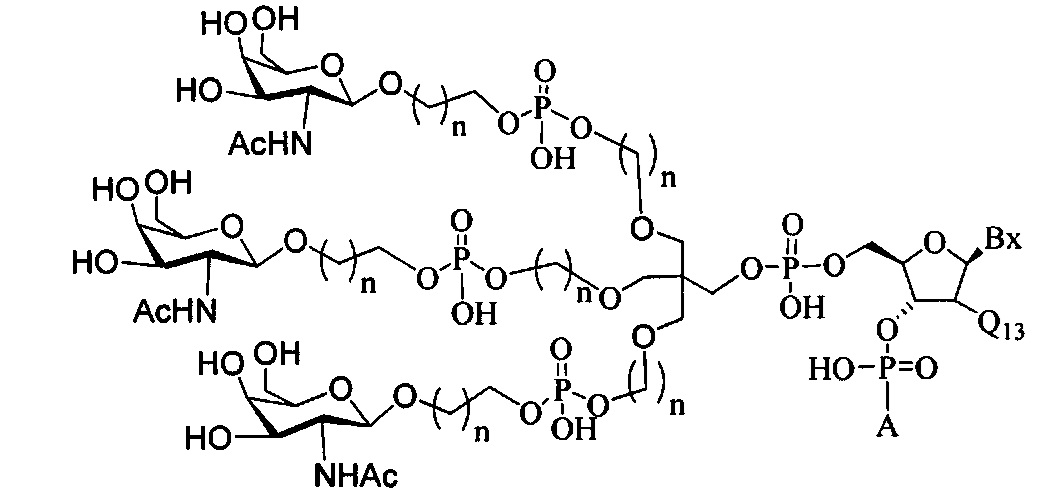
где каждый n независимо равен от 1 до 20;
Q13 представляет собой Н или O(СН2)2-ОСН3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
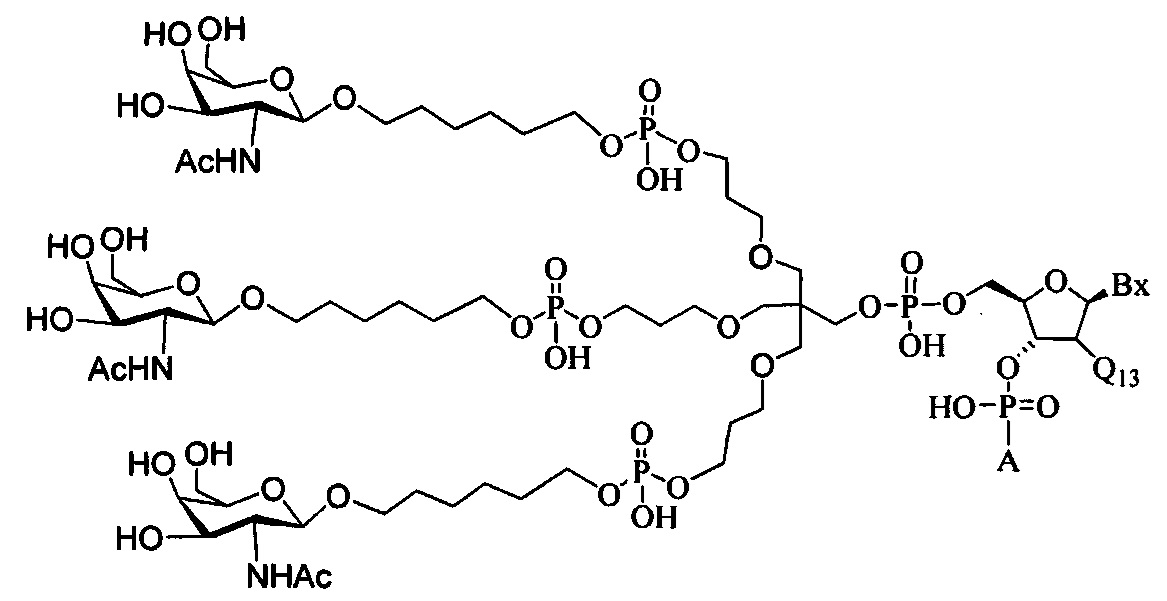
где каждый n независимо равен от 1 до 20;
Q13 представляет собой Н или O(СН2)2-ОСН3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:

где каждый n независимо равен от 1 до 20;
Q13 представляет собой Н или O(СН2)2-ОСН3;
А представляет собой модифицированный олигонуклеотид;
Z представляет собой Н или связанную твердую подложку; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
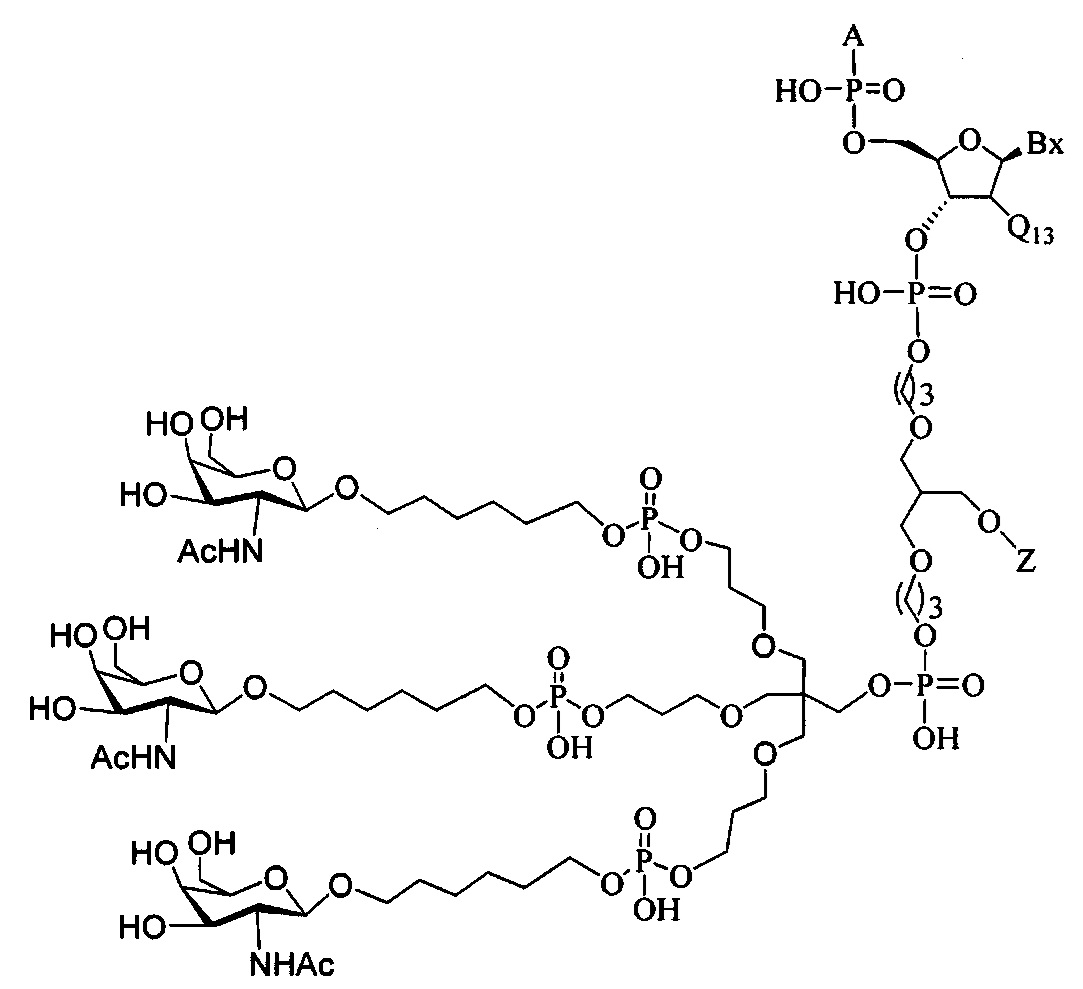
где каждый n независимо равен от 1 до 20;
Q13 представляет собой Н или O(СН2)2-ОСН3;
А представляет собой модифицированный олигонуклеотид;
Z представляет собой Н или связанную твердую подложку; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:

где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
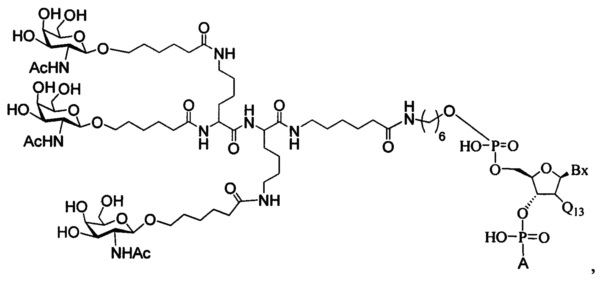
где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
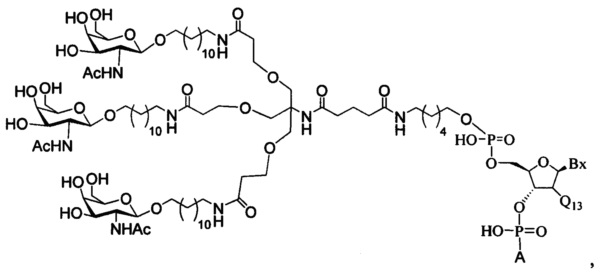
где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:

где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:

где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
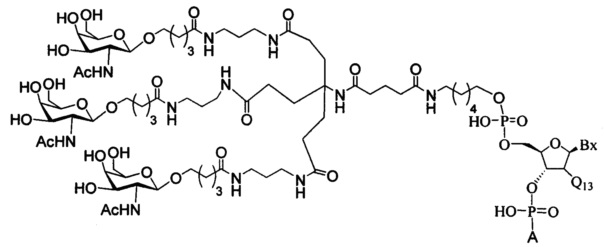
где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
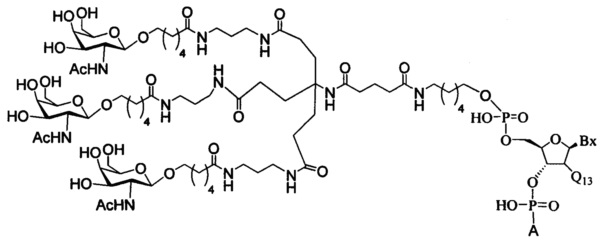
где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:

где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
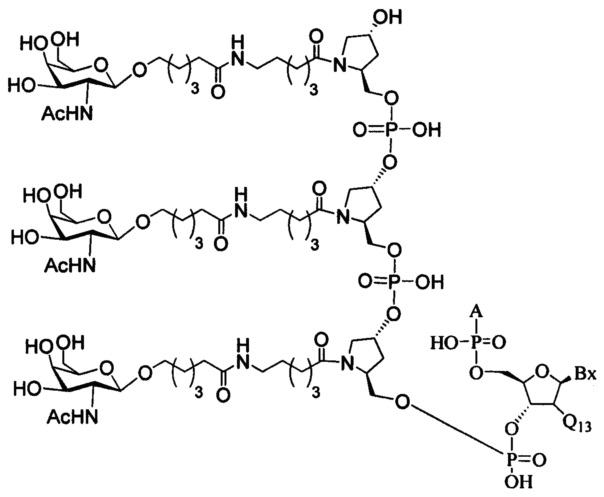
где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:

где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения соединение имеет следующую структуру:
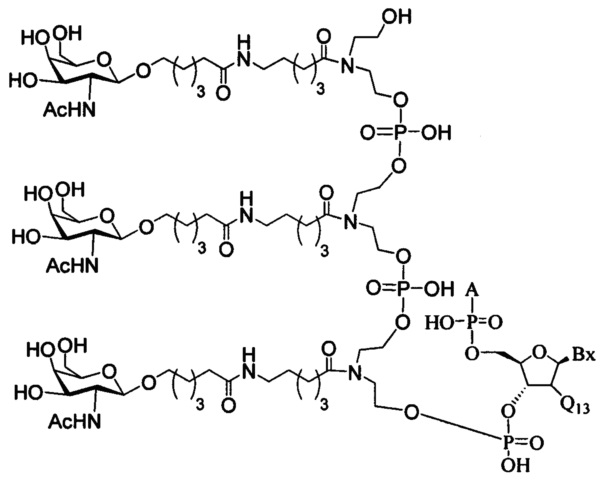
где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации конъюгирующая группа содержит:

где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации конъюгирующая группа содержит:
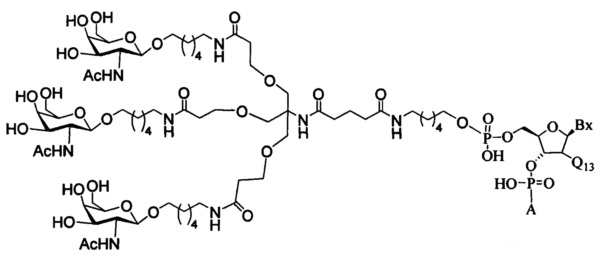
где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации конъюгирующая группа содержит:

где Q13 представляет собой Н или O(СН2)2-OCH3;
А представляет собой модифицированный олигонуклеотид; и
Вх представляет собой фрагмент гетероциклического основания.
В некоторых вариантах реализации изобретения Вх выбран из аденина, гуанина, тимина, урацила или цитозина, или 5-метилцитозина. В некоторых вариантах реализации Вх представляет собой аденин. В некоторых вариантах реализации Вх представляет собой тимин. В некоторых вариантах реализации Q13 представляет собой O(СН2)2-OCH3. В некоторых вариантах реализации Q13 представляет собой Н.
В некоторых вариантах реализации соединение представлено в форме соли. В дополнительных вариантах реализации соединение дополнительно содержит фармацевтически приемлемый носитель или разбавитель. В некоторых вариантах реализации соединение содержит модифицированный олигонуклеотид, нацеленный на аро(а), и
конъюгирующую группу, или его соль, и фармацевтически приемлемый носитель или разбавитель.
В некоторых вариантах реализации приведен а композиция, содержащая конъюгированное антисмысловое соединение, описанное в настоящем документе, при этом степень вязкости указанного соединения составляет менее 40 сантипуаз (сП). В некоторых вариантах реализации изобретения конъюгированные антисмысловые соединения, описанные в настоящем документе, являются эффективными благодаря вязкости менее 40 сП, менее 35 сП, менее 30 сП, менее 25 сП, менее 20 сП, менее 15 сП, измеренной по таким параметрам, как описано в Примере 125.
В некоторых вариантах реализации приведены композиции и способы, включающие введение животному конъюгированного антисмыслового соединения или композиции, описанной в настоящем документе. В некоторых вариантах реализации введение конъюгированного антисмыслового соединения предупреждает, лечит, облегчает или замедляет прогрессирование сердечно-сосудистого, метаболического и/или воспалительного заболевания.
В некоторых вариантах реализации приведены композиции и способы применил в терапии для лечения заболевания, расстройства или состояния, связанного с аро(а). В некоторых вариантах реализации приведены композиции и способы применил в терапии для лечения заболевания, расстройства или состояния, связанного с Lp(а). В некоторых вариантах реализации у животного повышены уровни аро(а) и/или Lp(а). В некоторых вариантах реализации композиция представляет собой соединение, содержащее аро(а)-специфический ингибитор. В некоторых вариантах реализации аро(а)-специфический ингибитор представляет собой нуклеиновую кислоту. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации антисмысловое соединение представляет собой модифицированный олигонуклеотид, нацеленный на аро(а). В некоторых вариантах реализации антисмысловое соединение представляет собой модифицированный олигонуклеотид, нацеленный на аро(а), с конъюгирующей группой. В некоторых вариантах реализации модифицированный олигонуклеотид, нацеленный на аро(а), с конъюгирующей группой используют при лечении, предупреждении, замедлении прогрессирования, облегчении сердечно-сосудистого и/или метаболического заболевания, расстройства или состояния. В некоторых вариантах реализации композиции и способы терапии включают введение аро(а)-специфического ингибитора индивидууму, нуждающемуся в этом.
В некоторых вариантах реализации приведены композиции и способы снижения уровней аро(а). В некоторых вариантах реализации приведены композиции и способы снижения уровней Lp(а). В некоторых вариантах реализации изобретения снижение уровней аро(а) в ткани, органе или организме субъекта улучшает соотношение LDL к HDL или соотношение TG к HDL. В некоторых вариантах реализации изобретения приведены композиции и способы снижения экспрессии мРНК или белка аро(а) у животного, включающие введение указанному животному конъюгированного антисмыслового соединения или композиции, описанной в настоящем документе, для снижения экспрессии мРНК или белка аро(а) у животного. В некоторых вариантах реализации изобретения приведены композиции и способы уровней Lp(а) у животного, включающие введение указанному животному конъюгированного антисмыслового соединения или композиции, описанной в настоящем документе, для снижения экспрессии мРНК или белка аро(а) у животного.
В некоторых вариантах реализации приведены композиции и способы предупреждения, лечения, отсрочки, замедления прогрессирования и/или облегчения, заболеваний, расстройств и состояний, связанных с аро(а), у субъекта, нуждающегося в этом. В некоторых вариантах реализации приведены композиции и способы предупреждения, лечения, отсрочки, замедления прогрессирования и/или облегчения заболеваний, расстройств и состояний, связанных с Lp(а), у субъекта, нуждающегося в этом. В некоторых вариантах реализации такие заболевания, расстройства и состояния включают воспалительные, сердечно-сосудистые и/или метаболические заболевания, расстройства и состояния. Некоторые такие сердечно-сосудистые заболевания, расстройства или состояния включают, но не ограничиваются ими, стеноз аортального отверстия, аневризму (например, аневризма брюшной аорты), стенокардию, аритмию, атеросклероз, церебро-сосудистое заболевание, коронарно-артериальное заболевание, коронарную болезнь сердца, дислипидемию, гиперхолестеринемию, гиперлипидемию, гипертонию, гипертриглицеридемию, инфаркт миокада, болезнь периферических сосудов (например, болезнь периферической артерии, окклюзионная болезнь периферической артерии), окклюзию сосудов сетчатки или инсульт. Некоторые такие метаболические заболевания, расстройства или состояния включают, но не ограничиваются ими, гипергликемию, преддиабет, диабет (типа I и типа II), ожирение, инсулинорезистентность, метаболический синдром и диабетическую дислипидемию. Некоторые такие воспалительные заболевания, расстройства или состояния включают, но не ограничиваются ими, стеноз аортального отверстия, коронарно-артериальную болезнь
(CAD), болезнь Альцгеймера и тромбоэмболические заболевания, расстройства или состояния. Некоторые тромбоэмболические заболевания, расстройства или состояния включают, но не ограничиваются ими, инсульт, тромбоз (например, венозный тромбоэмболизм), инфаркт миокарда и болезнь периферических сосудов. В некоторых вариантах реализации приведены композиции и способы предупреждения, лечения, отсрочки, замедления прогрессирования и/или улучшения стеноза аортального отверстия.
В некоторых вариантах реализации изобретения приведен способ уменьшения по меньшей мере одного симптома сердечно-сосудистого заболевания, расстройства или состояния. В некоторых вариантах реализации симптомы включают, но не ограничиваются ими, стенокардию, боль в груди, одышку, учащенное сердцебиение, слабость, головокружение, тошноту, потоотделение, тахикардию, брадикардию, аритмию, мерцательную аритмию, опухание нижних конечностей, цианоз, усталость, обморок, онемение лица, онемение конечностей, хромоту или судороги мышц, вздутие живота и лихорадку. В некоторых вариантах реализации приведен способ ослабления по меньшей мере одного симптома стеноза аортального отверстия.
В некоторых вариантах реализации модулирование экспрессии аро(а) или Lp(а) происходит в клетке, ткани или органе. В некоторых вариантах реализации модулирование происходит в клетке, ткани или органе животного. В некоторых вариантах реализации модулирование представляет собой снижение уровня мРНК аро(а). В некоторых вариантах реализации модулирование представляет собой снижение уровня белка аро(а). С некоторых вариантах реализации снижаются и уровни мРНК, и уровни белка аро(а). В некоторых вариантах реализации модулирование представляет собой снижение уровня Lp(а). Такое снижение может происходить в зависимости от времени или в зависимости от дозы.
В некоторых вариантах реализации субъект или животное представляет собой человека.
В некоторых вариантах реализации изобретения конъюгированное антисмысловое соединение вводят парентерально. В дополнительных вариантах реализации парентеральное введение является подкожным.
В некоторых вариантах реализации изобретения конъюгированное антисмысловое соединение или композицию вводят вместе со вторым агентом или терапией. В некоторых вариантах реализации конъюгированное антисмысловое соединение или композицию и второй агент вводят параллельно.
В некоторых вариантах реализации изобретения второй агент представляет собой агент, понижающий уровень глюкозы. В некоторых вариантах реализации второй агент представляет собой агент, понижающий уровень LDL, TG или холестерина. В некоторых вариантах реализации изобретения второй агент представляет собой противовоспалительный агент. В некоторых вариантах реализации изобретения второй агент представляет собой противовоспалительный агент. В некоторых вариантах реализации второй агент может быть, но не ограничиваясь этим, нестероидным противовоспалительным лекарством (NSAID, например, аспирин), ниацином (например, ниаспан), никотиновой кислотой, ингибитором ароВ (например, мипомерсен), ингибитором СЕТР (например, анасетрапиб), ингибитором аро(а), аналогом гормона щитовиной железы (например, эпротиром), ингибитором редуктазы HMG-СоА (например, статин), фибратом (например, гемфиброзил) и ингибитором микросомального белка-переносчика триглицеридов (например, ломитапид). Терапия может быть, но не ограничивается этим, аферез Lp(а). Агенты или терапии могут быть введены совместно или параллельно. Агенты или терапии могут быть введены последовательно или позже.
В некоторых вариантах реализации приведено применение конъюгированного антисмыслового соединения, нацеленного на аро(а), для снижения уровней аро(а) у животного. В некоторых вариантах реализации приведено применение конъюгированного антисмыслового соединения, нацеленного на аро(а), для снижения уровней Lp(а) у животного. В некоторых вариантах реализации приведено применение конъюгированных: антисмысловых соединений, нацеленных на аро(а), для лечения, предупреждения или облегчения заболевания, расстройства или состояния, связанного с аро(а). В некоторых вариантах реализации приведено применение конъюгированных антисмысловых соединений, нацеленных на аро(а), для лечения, предупреждения или облегчения заболевания, расстройства или состояния, связанного с Lp(а).
В некоторых вариантах реализации приведено применение конъюгированного антисмыслового соединения, нацеленного на аро(а), для получения лекарственного средства для снижения уровней аро(а) у животного. В некоторых вариантах реализации приведено применение конъюгированного антисмыслового соединения, нацеленного на аро(а), для получения лекарственного средства для снижения уровней Lp(а) у животного. В некоторых вариантах реализации приведено применение конъюгированного антисмыслового соединения для получения лекарственного средства для лечения, предупреждения или облегчения заболевания, расстройства или состояния, связанного с аро(а). В некоторых
вариантах реализации приведено применение конъюгированного антисмыслового соединения для получения лекарственного средства для лечения, предупреждения или облегчения заболевания, расстройства или состояния, связанного с Lp(а).
В некоторых вариантах реализации приведено применение конъюгированного антисмыслового соединения, описанного в настоящем документе, в производстве лекарственного средства для лечения, облегчения, отсрочки или предупреждения одного или более заболеваний, связанных с аро(а) и/или Lp(а).
В некоторых вариантах реализации приведен набор для лечения, предупреждения или облегчения заболевания, расстройства или состояния, описанного в настоящем документе, который содержит: (i) аро(а)-специфический ингибитор, описанный в настоящем документе; и необязательно (ii) второй агент или терапию, описанную в настоящем документе.
Набор согласно настоящему изобретению может дополнительно содержать инструкции по применению набора для лечения, предупреждения, облегчения заболевания, расстройства или состояния, описанного в настоящем документе, при помощи комплексной терапии, описанной в настоящем документе.
В. Некоторые соединения
В некоторых вариантах реализации настоящего изобретения представлены конъюгированные антисмысловые соединения, содержащие антисмысловые олигонуклеотиды и конъюгат.
а. Некоторые антисмыловые олигонуклеотиды
В некоторых вариантах реализации настоящего изобретения представлены антисмысловые олигонуклеотиды. Такие антисмысловые олигонуклеотиды содержат связанные нуклеозиды, и каждый нуклеозид содержит сахарный фрагмент и азотистое основание. Структура таких антисмысловых олигонуклеотидов может быть рассмотрена с точки зрения химических особенностей (например, модификаций и характерных участков модификаций) и последовательности азотистых оснований (например, последовательность антисмыслового олигонуклеотида, сущность и последовательность целезой нуклеиновой кислоты).
i. Некоторые химические особенности
В некоторых вариантах реализации антисмысловый олигонуклеотид содержит одну или более модификаций. В некоторых таких вариантах реализации антисмысловые олигонуклеотиды содержат один или более модифицированных нуклеозидов и/или модифицированных межнуклеозидных связей. В некоторых вариантах реализации модифицированные нуклеозиды содержат модифицированный сахарный фрагмент и/или модифицированное азотистое основание.
1. Некоторые сахарные фрагменты
В некоторых вариантах реализации соединения настоящего описания содержат один или более модифицированных нуклеозидов, содержащих модифицированный сахарный фрагмент. Такие соединения, содержащие один или более модифицированных по сахару
нуклеозидов, могут обладать желаемыми свойствами, такими как улучшенная стабильность к нуклеазе или увеличенная связывающая аффинность к целевой нуклеиновой кислоте, по сравнению с олигонуклеотидом, содержащим только нуклеозиды, которые содержат природные сахарные фрагменты. В некоторых вариантах реализации модифицированные сахарные фрагменты представляют собой замещенные сахарные фрагменты. В некоторых вариантах реализации модифицированные сахарные фрагменты представляют собой заменители сахара. Такие заменители сахара могут содержать одно или более замещений, соответствующих замещениям замещенных сахарных фрагментов.
В некоторых вариантах реализации модифицированные сахарные фрагменты представляют собой замещенные сахарные фрагменты, содержащие один или более немостиковых сахарных заместителей, включая, но не ограничиваясь этим, заместители в 2' и/или 5'-положениях. Примеры заместителей сахара, подходящих для 2'-положения, включают, но не ограничиваются ими: 2'-F, 2'-ОСН3 («ОМе» или «О-метил») и 2'-O(СН2)2OCH3 («МОЕ»). В некоторых вариантах реализации заместитель сахара в 2'-положении выбран из аллила, амино, азидо, тио, О-аллила, О-С1-С10 алкила, О-С1-С10 замещенного алкила; OCF3, O(СН2)2SCH3, O(СН2)2-O-N(Rm)(Rn) и O-СН2-С(=O)-N(Rm)(Rn), где каждый Rm и Rn независимо представляет собой Н или замещенный или незамещенный С1-С10 алкил. Примеры заместителей сахара в 5'-положении включают, но не ограничиваются ими: 5'-метил (R или S), 5'-винил и 5'-метокси. В некоторых вариантах реализации замещенные сахара содержат более одного немостикового сахарного заместителя, например, 2'-F-5'-метил-сахарные фрагменты (см., например, Международную заявку РСТ WO 2008/101157, где представлены дополнительные 5', 2'-бис-замещенные сахарные фрагменты и нуклеозиды).
Нуклеозиды, содержащие 2'-замещенные сахарные фрагменты, упоминаются как 2'-замещенные нуклеозиды. В некоторых вариантах реализации 2'-замещенный нуклеозид содержит 2'-группу заместителя, выбранную из галогена, аллила, амино, азидо, SH, CN, OCN, CF3, OCF3, О, S или N(Rm)-алкила; О, S или N(Rm)-алкенила; О, S или N(Rm)-алкинила; О-алкиленил-О-алкила, алкинила, алкарила, аралкила, О-алкарила, О-аралкила; O(СН2)2SCH3, O-(СН2)2-O-N(Rm)(Rn) или O-СН2-С(=O)-N(Rm)(Rn), где каждый Rm и Rn независимо представляет собой Н, аминозащитную группу или замещенный или незамещенный С1-С10 алкил. Эти 2'-группы заместителей могут быть дополнительно замещены одной или более группами заместителей, независимо выбранными из гидроксила,
амино, алкокси, карбокси, бензила, фенила, нитро (NO2), тиола, тиоалкокси (S-алкила), галогена, алкила, арила, алкенила и алкинила.
В некоторых вариантах реализации 2'-замещенный нуклеозид содержит 2'-группу заместителя, выбранную из F, NH2, N3, OCF3, O-СН3, O(СН2)3NH2, СН2-СН=СН2, О-СН2-СН=СН2, ОСН2СН2ОСН3, O(СН2)2SCH3, O-(СН2)2-O-N(Rm)(Rn), O(СН2)2O(СН2)2N(СН3)2 и N-замещенного ацетамида (O-СН2-С(=O)-N(Rm)(Rn), где каждый Rm и Rn независимо представляет собой Н, аминозащитную группу или замещенный или незамещенный С1-С10 алкил.
В некоторых вариантах реализации 2'-замещенный нуклеозид содержит сахарный фрагмент, содержащий 2'-группу заместителя, выбранную из F, OCF3, О-CH3, ОСН2СН2ОСН3, O(СН2)2SCH3, O-(СН2)2-O-N(СН3)2, -O(СН2)2O(СН2)2N(СН3)2 и O-СН2-С(=O)-N(Н)СН3.
В некоторых вариантах реализации 2'-замещенный нуклеозид содержит сахарный фрагмент, содержащий 2'-группу заместителя, выбранную из F, O-СН3 и OCH2CH2OCH3.
Некоторые модифицированные сахарные фрагменты содержат мостиковый сахарный заместитель, который образует второе кольцо, что приводит к получению бициклического сахарного фрагмента. В некоторых таких вариантах реализации бициклический сахарный фрагмент содержит мостик между 4' и 2' атомами фуранозного кольца. Примеры таких 4'-2' сахарных заместителей включают, но не ограничиваются ими: -[С(Ra)(Rb)]n-, -[С(Ra)(Rb)]n-O-, -С(RaRb)-N(R)-O- или -С(RaRb)-O-N(R)-; 4'-СН2-2', 4'-(СН2)2-2', 4'-(СН2)3-2', 4'-(СН2)-O-2' (LNA); 4'-(СН2)-S-2'; 4'-(СН2)2-O-2' (ENA); 4'-СН(СН3)-O-2' (cEt) и 4'-СН(CH2OCH3)-O-2', и его аналоги (см., например, патент США 7399845, выданный 15 июля 2008 года); 4'-С(СН3)(СН3)-O-2' и его аналоги (см., например, WO 2009/006478, опубликованный 8 января 2009 года); 4'-СН2-N(OCH3)-2' и его аналоги (см., например, WO 2008/150729, опубликованный 11 декабря 2008 года); 4'-СН2-O-N(СН3)-2' (см., например, US 2004/0171570, опубликованный 2 сентября 2004 года); 4'-СН2-O-N(R)-2' и 4'-СН2-N(R)-O-2'-, где каждый R независимо представляет собой Н, защитную группу или С1-С12 алкил; 4'-СН2-N(R)-O-2', где R представляет собой Н, С1-С12 алкил или защитную группу (см., например, патент США 7427672, выданный 23 сентября 2008 года); 4'-СН2-С(Н)(CH3)-2' (см., например, Chattopadhyaya, et al., J. Org. Chem., 2009, 74, 118-134); и 4'-СН2-С(=СН2)-2' и его аналоги (см.
опубликованную Международную заявку РСТ WO 2008/154401, опубликованную 8 декабря 2008 года).
В некоторых вариантах реализации такие мостики 4'-2' независимо содержат от 1 до 4 связанных групп, независимо выбранных из -[C(Ra)(Rb)]n-, -C(Ra)=C(Rb)-, -C(Ra)=N-, -C(=NRa)-, -С(=O)-, -C(=S)-, -О-, -Si(Ra)2-, -S(=O)x- и -N(Ra)-;
где:
x равен 0, 1 или 2;
n равен 1, 2, 3 или 4;
каждый Ra и Rb независимо представляет собой Н, защитную группу, гидроксил, C1-С12 алкил, замещенный С1-С12 алкил, С2-С12 алкенил, замещенный С2-С12 алкенил, С2-С12 алкинил, замещенный C2-C12 алкинил, С5-С20 арил, замещенный С5-С20 арил, гетероциклический радикал, замещенный гетероциклический радикал, гетероарил, замещенный гетероарил, С5-С7 алициклический радикал, замещенный С5-С7 алициклический радикал, галоген, OJ1, NJ1J2, SJ1, N3, COOJ1, ацил (C(=O)-H), замещенный ацил, CN, сульфонил (S(=O)2-J1) или сульфоксил (S(=O)-J1); и
каждый J1 и J2 независимо представляет собой Н, С1-С12 алкил, замещенный С1-С12 алкил, С2-С12 алкенил, замещенный C2-C12 алкенил, С2-С12 алкинил, замещенный C2-C12 алкинил, С5-С20 арил, замещенный С5-С20 арил, ацил (С(=O)-Н), замещенный ацил, гетероциклический радикал, замещенный гетероциклический радикал, С1-С12 аминоалкил, замещенный С1-С12 аминоалкил или защитную группу.
Нуклеозиды, содержащие бициклические сахарные фрагменты, упоминаются как бициклические нуклеозиды или BNA. Бициклические нуклеозиды включают, но не ограничиваются ими, (А) α-L-метиленокси (4'-СН2-O-2') BNA, (В) β-D-метиленокси (4'-СН2-O-2') BNA (также упоминаемый как закрытая нуклеиновая кислота или LNA), (С) этиленокси (4'-(СН2)2-O-2') BNA, (D) аминоокси (4'-CH2-O-N(R)-2') BNA, (Е) оксиамино (4'-CH2-N(R)-O-2') BNA, (F) метил(метиленокси) (4'-СН(СН3)-O-2') BNA (также упоминаемый как стерически затрудненный этил или cEt), (G) метилен-тио (4'-CH2-S-2') BNA, (Н) метилен-амино (4'-CH2-N(R)-2') BNA, (I) метил-карбоциклический (4'-СН2-СН(СН3)-2') BNA и (J) пропилен-карбоциклический (4'-(СН2)3-2') BNA, как показано ниже.


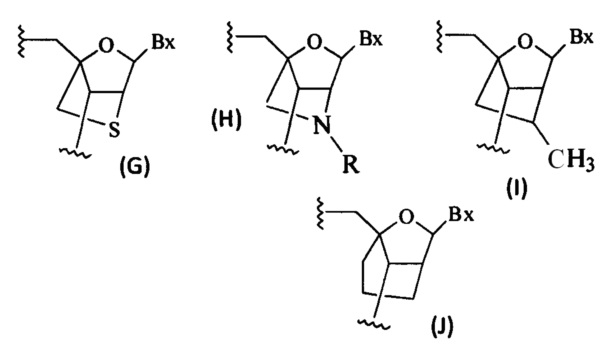
где Вх представляет собой фрагмент азотистого основания, a R независимо представляет собой Н, защитную группу или С1-С12 алкил.
В данной области техники известны дополнительные бициклические сахарные фрагменты, например: Singh et al., Chem. Commun., 1998, 4, 455-456; Koshkin et al., Tetrahedron, 1998, 54, 3607-3630; Wahlestedt et al., Proc. Natl. Acad. Sci. U. S. A., 2000, 97, 5633-5638; Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222; Singh et al., J. Org. Chem., 1998, 63, 10035-10039; Srivastava et al., J. Am. Chem. Soc, 129(26) 8362-8379 (4 июля 2007 года); Elayadi et al, Curr. Opinion Invens. Drugs, 2001, 2, 558-561; Braasch et al., Chem. Biol., 2001, 8, 1-7; Orum et al., Curr. Opinion Mol. Ther., 2001, 3, 239-243; патенты США №7053207 6268490 6770748 6794499 7034133 6525191 6670461 и 7399845; WO 2004/106356, WO 1994/14226, WO 2005/021570 и WO 2007/134181; публикации патентов США № US 2004/0171570, US 2007/0287831 и US 2008/0039618; патенты США с серийными номерами 12/129154 60/989574 61/026995 61/026998 61/056564 61/086231 61/097787 и 61/099844; и Международные заявки РСТ № PCT/US 2008/064591, PCT/US 2008/066154 и PCT/US 2008/068922.
В некоторых вариантах реализации бициклические сахарные фрагменты и
нуклеозиды, содержащие такие бициклические сахарные фрагменты, дополнительно определяют по изомерной конфигурации. Например, нуклеозид, содержащий мостик 4'-2'-метилен-окси, может быть в α-L конфигурации или в β-D конфигурации. Ранее α-L-метиленокси (4'-СН2-O-2') бициклические нуклеозиды были внедрены в антисмысловые олигонуклеотиды, которые обладают антисмысловой активностью (Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372).
В некоторых вариантах реализации замещенные сахарные фрагменты содержат один или более немостиковых сахарных заместителей и один или более мостиковых сахарных заместителей (например, 5'-замещенные и 4'-2'-мостиковые сахара), (см., например, Международную заявку РСТ WO 2007/134181, опубликованную 11/22/07, в которой замещена, например, 5'-метильной или 5'-виниловой группой).
В некоторых вариантах реализации модифицированные сахарные фрагменты представляют собой заменители сахара. В некоторых таких вариантах реализации атом кислорода природного сахара является замещенным, например, атомом серы, углерода или азота. В некоторых таких вариантах реализации такой модифицированный сахарный фрагмент содержит также мостиковые и/или немостиковые заместители, как описало выше. Например, некоторые заменители сахара содержат 4'-атом серы и замещение в 2'-положении (см., например, опубликованную патентную заявку США US 2005/0130923, опубликованную 16 июня 2005 года) и/или 5'-положении. В качестве дополнительного примера, были описаны карбоциклические бициклические нуклеозиды, имеющие мостик 4'-2' (см., например, Freier et al., Nucleic Acids Research, 1997, 25(22), 4429-4443 и Albaek et al., J. Org. Chem., 2006, 71, 7731-7740).
В некоторых вариантах реализации заменители сахара содержат кольца, имеющие не 5 атомов. Например, в некоторых вариантах реализации заменитель сахара содержит морфолино. Морфолино-соединения и их применение в олигомерных соединениях было описано в многочисленных патентах и опубликованных статьях (см., например: Braasch et al., Biochemistry, 2002, 41, 4503-4510; и патенты США 5698685; 5166315; 5185444; и 5034506). При использовании в настоящем документе, термин «морфолино» означает заменитель сахара, имеющий следующую структуру:
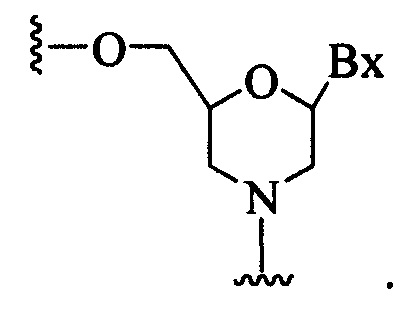
В некоторых вариантах реализации морфолино могут быть модифицированными, например, добавлением или изменением различных групп заместителей в представленной выше структуре морфолино. Такие заменители сахара упомянуты в настоящем документе как «модифицированные морфолино».
В качестве другого примера, в некоторых вариантах реализации заменитель сахара содержит шестичленный тетрагидропиран. Такие тетрагидропираны могут быть дополнительно модифицированы или замещены. Нуклеозиды, содержащие такие модифицированные тетрагидропираны, включают, но не ограничиваются ими, гекситоловую нуклеиновую кислоту (HNA), анитоловую нуклеиновую кислоту (ANA), манитоловую нуклеиновую кислоту (MNA) (см. Leumann, CJ. Bioorg. & Med. Chem. (2002) 10:841-854), фтор-HNA (F-HNA) и соединения, имеющие Формулу VI:
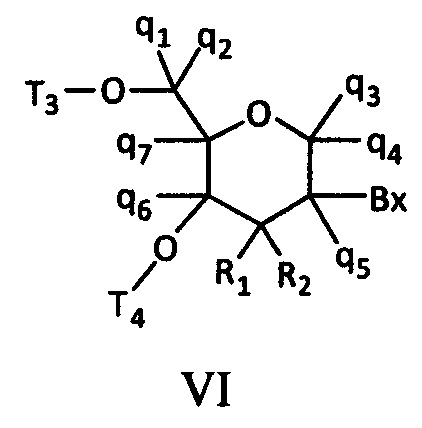
где независимо для каждого из указанного по меньшей мере одного тетрагидропиранового нуклеозидного аналога Формулы VI:
Вх представляет собой фрагмент азотистого основания;
Т3 и Т4, каждый независимо, представляют собой межнуклеозидную связывающую группу, связывающую тетрагидропирановый нуклеозидный аналог с антисмысловым соединением, или один из Т3 и T4 представляет собой межнуклеозидную связывающую группу, связывающую тетрагидропирановый нуклеозидный аналог с антисмысловым соединением, а другой из Т3 и T4 представляет собой Н, гидроксил-защитную группу, связанную конъюгирующую группу или 5' или 3'-концевую группу;
q1, q2, q3, q4, q5, q6 и q7, каждый независимо, представляют собой Н, С1-С6 алкил, замещенный С1-С6 алкил, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или
замещенный С2-С6 алкинил; и
каждый из R1 и R2 независимо выбран из: водорода, галогена, замещенного или незамещенного алкокси, NJ1J2, SJ1, N3, ОС(=Х)J1, ОС(=Х)NJ1J2, NJ3C(=Х)NJ1J2 и CN, где X представляет собой О, S или NJ1, и каждый J1, J2 и J3 независимо представляет собой Н или C1-С6 алкил.
В некоторых вариантах реализации приведены модифицированные ТНР нуклеозиды Формулы VI, в которых каждый q1, q2, q3, q4, q5, q6 и q7 представляет собой Н. В некоторых вариантах реализации по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 отличен от Н. В некоторых вариантах реализации по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 представляет собой метил. В некоторых вариантах реализации приведены ТНР нуклеозиды Формулы VI, в которых один из R1 и R2 представляет собой F. В некоторых вариантах реализации R1 представляет собой фтор, а R2 представляет собой Н, R1 представляет собой метокси, а R2 представляет собой Н, и R1 представляет собой метоксиэтокси, а R2 представляет собой Н.
В данной области техники известны также мноие другие бициклические и три циклические кольцевые системы заменителей сахара, которые могут быть использованы для модификации нуклеозидов для внедрения в антисмысловые соединеия (см., например, обзорную статью: Leumann, J.С, Bioorganic & Medicinal Chemistry, 2002, 10, 841-854).
Без ограничения, представлены также комбинации модификаций, такие как 2'-F-5' метил-замещенные нуклеозиды (см. Международную заявку РСТ 2008/101157, опубликованную 8/21/08, где описаны другие 5', 2'-бис-замещенные нуклеозиды) и замена атома кислорода рибозильного кольца на S и дополнительное замещение в 2'-положении (см. опубликованную заявку на патент США US 2005-0130923, опубликованную 16 июня 2005 года) или, альтернативно, 5'-замещение бициклической нуклеиновой кислоты (см. Международную заявку РСТ WO 2007/134181, опубликованную 11/22/07, в которой 4'-СН2-O-2' бициклический нуклеозид дополнительно замещен в 5'-положении 5'-метильной или 5'-виниловой группой). Был описан также синтез и получение карбоциклических бициклических нуклеозидов вместе с их олигомеризацией и биохимическими исследованиями (см., например, Srivastava et al., J. Am. Chem. Soc. 2007, 129(26), 8362-8379).
В некоторых вариантах реализации настоящего описания представлены олигонуклеотиды, содержащие модифицированные нуклеозиды. Такие модифицированные нуклеотиды могут содержать модифицированные сахара, модифицированные азотистые основания и/или модифицированные связи. Конкретные модификации
выбирают так, чтобы полученные олигонуклеотиды обладали желаемыми характеристиками. В некоторых вариантах реализации олигонуклеотиды содержат один или более РНК-подобных нуклеозидов. В некоторых вариантах реализации олигонуклеотиды содержат один или более ДНК-подобных нуклеотидов.
2. Некоторые модификации азотистых оснований
В некоторых вариантах реализации нуклеозиды настоящего описания содержат одно или более немодифицированных азотистых оснований. В некоторых вариантах реализаций нуклеозиды настоящего описания содержат одно или более модифицированных азотистых оснований.
В некоторых вариантах реализации модифицированные азотистые основания выбраны из: универсальных оснований, гидрофобных оснований, смещанных оснований, увеличенных в размере оснований и фторированных оснований, описанных в настоящем документе. 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и О-6-замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил; 5-пропинилцитозин; 5-гидроксиметил-цитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил (-С≡С-CH3) урацил и цитозин и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности, 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин, 2-деазагуанин и 3-деазааденин, универсальные основания, гидрофобные основания, смешанные основания, увеличенные в размере основания и фторированные основания, описанные в настоящем документе. Допонительные модифицированные азотистые основания включают трициклические пиримидины, такие как феноксазина цитидин ([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазина цитидин (1Н-пиримидо[5,4-b][1,4]бензотиазин-2(3H)-он), так называемые G-clamp, такие как замещенный феноксазина цитидин (например, 9-(2-аминоэтокси)-Н-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), карбазола цитидин (2Н-пиримидо[4,5-b]индол-2-он), пиридоиндола цитидин (Н-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он). Модифицированные азотистые основания также могут включать азотистые основания, в которых пуриновое или пиримидиновое основание заменено другими гетероциклами, например, 7-деаза-аденин, 7-деазагуанозин, 2-аминопиридин и 2-пиридон. Дополнительные азотистые основания включают азотистые
основания, описанные в патенте США №3687808, описанные в публикации The Concise Encyclopedia Of Polymer Science And Engineering, Kroschwitz, J.I., ред., John Wiley & Sons, 1990, 858-859; описанные авторами English et al., Angewandte Chemie, Международное издание, 1991, 30, 613; и описанные в публикации Sanghvi, Y.S., глава 15, Antisense Research and Application, Crooke, S.Т. и Lebleu, В., ред., СRС Press, 1993, 273-288.
Типичные патенты США, в которых описано получение некоторых из вышеупомянутых модифицированных азотистых оснований, а также других модифицированных азотистых оснований, включают, без ограничения, U.S. 3687808; 4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121; 5596091; 5614617; 5645985; 5681941; 5750692; 5763588; 5830653 и 6005096, некоторые из которых находятся на рассмотрении одновременно с настоящей заявкой, и каждый из которых включен в настоящий документ посредством ссылки в полном объеме.
3. Некоторые межнуклеозидные связи
В некоторых вариантах реализации настоящего описания представлены олигонуклеотиды, содержащие связанные нуклеозиды. В таких вариантах реализации нуклеозиды могут быть связаны вместе при помощи любой межнуклеозидной связи. Два основных класса межнуклеозидных связывающих групп определяются по наличию пли отсутствию атома фосфора. Типичные фосфорсодержащие межнуклеозидные связи включают, но не ограничиваются мими, фосфодиэфиры (РО), фосфотриэфиры, метилфосфонаты, фосфорамидаты и тиофосфаты (PS). Типичные не содержащие фосфора межнуклеозидные связывающие группы включают, но не ограничиваются ими, метиленметилимино (-СН2-N(СН3)-O-СН2-), тиодиэфир (-O-С(O)-S-), тионокарбамат (-O-С(O)(NH)-S-); силоксан (-O-Si(Н)2-O-); и N,N’-диметилгидразин (-СН2-N(СН3)-N(СН3)-). Модифицированные связи, в сравнении с природными фосфодиэфирными связями, могут быть использованы для изменения, обычно увеличения устойчивости олигонуклеотида к нуклеазе. В некоторых вариантах реализации межнуклеозидные связи, имеющие хиральный атом, могут быть получены в виде рацемической смеси или в виде отдельных энантиомеров. Типичные хиральные связи включают, но не ограничиваются ими, алкилфосфонаты и тиофосфаты. Способы получения фосфорсодержащих и не содержащих фосфора межнуклеозидных связей хорошо известны специалистам в данной области техники.
Олигонуклеотиды, описанные в настоящем документе, содержат один или более асимметричных центров и, следовательно, могут образовывать энантиомеры, диастереомеры и другие стереоизомерные конфигурации, которые в соответствии с абсолютной стереохимией могут быть определены как (R) или (S), или, как для аномеров сахара, или как
(D) или (L), как для аминокислот и т.д. В антисмысловые соединения, представленные в настоящем документе, включены все такие возможные изомеры, а также их рацемические и оптически чистые формы.
Нейтральные связывающие линкеры включают, без ограничения, фосфотриэфиры, метилфосфонаты, MMI (3'-СН2-N(CH3)-О-5'), амид-3 (3'-СН2-С(=O)-N(H)-5'), амид-4 (3'-СН2-N(Н)-С(=O)-5'), формацеталь (3'-О-СН2-O-5') и тиоформацеталь (3'-S-СН2-O-5'). Дополнительные нейтральные межнуклеозидные связи включают неионные связи, содержащие силоксан (диалкилсилоксан), карбоксильный эфир, карбоксамид, сульфид, сульфоновый эфир и амиды (см., например: Carbohydrate Modifications in Antisense Research; Y.S. Sanghvi и Р.D. Cook, ред., ACS Symposium Series 580; главы 3 и 4, 40-65). Дополнительные нейтральные межнуклеозидные связи включают неионные связи, содержащие смешанные составные части N, О, S и СН2.
4. Некоторые мотивы
В некоторых вариантах реализации антисмысловые олигонуклеотиды содержат один или более модифицированных нуклеозидов (например, нуклеозид, содержащий модифицированный сахар и/или модифицированное азотистое основание) и/или один или более модифицированных межнуклеозидных связей. Характерный участок таких модификаций в олигонуклеотиде упоминается в настоящем документе как мотив. В некоторых вариантах реализации мотивы сахара, азотистого основания и линкера не зависят друг от друга.
а. Некоторые сахарные мотивы
В некоторых вариантах реализации олигонуклеотиды содержат один или более типов модифицированных сахарных фрагментов и/или природных сахарных фрагментов, расположенных вдоль олигонуклеотида или его области определенным образом или в виде мотива сахарной модификации. Такие мотивы могут содержать любые сахарные модификации, рассмотренные в настоящем документе и/или другие известные модификации сахара.
В некоторых вариантах реализации олигонуклеотиды содержат или состоят из области, имеющей сахарный мотив гэпмера, который содержит две внешних области или «крыла» и центральную или внутреннюю область, или «гэп». Эти три области сахарного мотива гэпмера (5'-крыло, гэп и 3'-крыло) образуют непрерывную последовательность азотистых оснований, в которой по меньшей мере некоторые из сахарных фрагментов нуклеозидов в каждом крыле отличаются по меньшей мере от некоторых сахарных фрагментов нуклеозидов в гэпе. В частности, по меньшей мере те сахарные фрагменты нуклеозидов каждого крыла, которые расположены ближе всего к гэпу (3'-ближайший нуклеозид 5'-крыла и 5'-ближайший нуклеозид 3'-крыла), отличаются от сахарного фрагмента соседних нуклеозидов в гэпе, определяя таким образом границу между крыльями и гэпом. В некоторых вариантах реализации сахарные фрагменты в гэпе являются
одинаковыми между собой. В некоторых вариантах реализации гэп содержит один или более нуклеозидов, имеющих сахарный фрагмент, который отличается от сахарного фрагмента одного или более других нуклеозидов в гэпе. В некоторых вариантах реализации сахарные мотивы двух крыльев являются одинаковыми между собой (симметричный сахарный гэпмер). В некоторых вариантах реализации сахарные мотивы 5'-крыла отличаются от сахарного мотива 3'-крыла (асимметричный сахарный гэпмер).
1. Некоторые 5'-крылья
В некоторых вариантах реализации 5'-крыло гэпмера состоит из 1-8 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 1-7 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 1-6 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 1-5 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 2-5 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 3-5 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 4 или 5 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 1-4 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 1-3 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 1 или 2 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 2-4 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 2 или 3 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 3 или 4 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 1 нуклеозида. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 2 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 3 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 4 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 5 связанных нуклеозидов. В некоторых вариантах реализации 5'-крыло гэпмера состоит из 6 связанных нуклеозидов.
В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере два бициклических нуклеозида. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере три бициклических нуклеозида. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере четыре бициклических нуклеозида.
В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один нуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет собой бициклический нуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет, собой стерически затрудненный этил-нуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет собой LNA нуклеозид.
В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один не бициклический модифицированный нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один 2'-замещенный нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один 2'-МОЕ нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один 2'-ОМе нуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет собой не бициклический модифицированный нуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет собой 2'-замещенный нуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет собой 2'-МОЕ нуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет собой 2'-ОМе нуклеозид.
В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет собой 2'-дезоксинуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один рибонуклеозид. В некоторых вариантах реализации каждый нуклеозид 5'-крыла гэпмера представляет собой рибонуклеозид. В некоторых вариантах реализации один, более одного или каждый из нуклеозидов 5'-крыла представляет собой РНК-подобный нуклеозид.
В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один не бициклический модифицированный нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-замещенный нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-МОЕ нуклеозид. В некоторых
вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-ОМе нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один не бициклический модифицированный нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один 2'-замещенный нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один 2'-МОЕ нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один 2'-ОМе нуклеозид. В некоторых вариантах реализации 5'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
ii. Некоторые 3'-крылья
В некоторых вариантах реализации 3'-крыло гэпмера состоит из 1-8 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 1-7 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 1-6 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 1-5 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 2-5 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 3-5 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 4 или 5 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 1-4 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 1-3 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 1 или 2 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 2-4 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 2 или 3 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 3 или 4 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 1 нуклеозида. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 2 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера
состоит из 3 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 4 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 5 связанных нуклеозидов. В некоторых вариантах реализации 3'-крыло гэпмера состоит из 6 связанных нуклеозидов.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один нуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла гэпмера представляет собой бициклический нуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла гэпмера представляет собой стерически затрудненный этил-нуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла гэпмера представляет собой LNA нуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один не бициклический модифицированный нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере два не бициклических модифицированных нуклеозида. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере три не бициклических модифицированных нуклеозида. В некоторых вариантах реализаций 3'-крыло гэпмера содержит по меньшей мере четыре не бициклических модифицированных нуклеозида. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один 2'-замещенный нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один 2'-МОЕ нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один 2'-ОМе нуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла гэпмера представляет собой не бициклический модифицированный нуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла гэпмера представляет собой 2'-замещенный нуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла гэпмера представляет собой 2'-МОЕ нуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла гэпмера представляет собой 2'-ОМе нуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла
гэпмера представляет собой 2'-дезоксинуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один рибонуклеозид. В некоторых вариантах реализации каждый нуклеозид 3'-крыла гэпмера представляет собой рибонуклеозид. В некоторых вариантах реализации один, более одного или каждый из нуклеозидов 5'-крыла представляет собой РНК-подобный нуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один не бициклический модифицированный нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-замещенный нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-МОЕ нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-ОМе нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один не бициклический модифицированный нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один 2'-замещенный нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один 2'-МОЕ нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один 2'-ОМе нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один LNA нуклеозид и по меньшей мере один не бициклический модифицированный нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один LNA нуклеозид и по меньшей мере один 2'-замещенный нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один LNA нуклеозид и по меньшей
мере один 2'-МОЕ нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один LNA нуклеозид и по меньшей мере один 2'-ОМе нуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид, по меньшей мере один не бициклический модифицированный нуклеозид и по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид, по меньшей мере один не бициклический модифицированный нуклеозид и по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один LNA нуклеозид, по меньшей мере один не бициклический модифицированный нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид, по меньшей мере один 2'-замещенный нуклеозид и по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид, по меньшей мере один 2'-замещенный нуклеозид и по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один LNA нуклеозид, по меньшей мере один 2'-замещенный нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид, по меньшей мере один 2'-МОЕ нуклеозид и по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид, по меньшей мере один 2'-МОЕ нуклеозид и по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один LNA нуклеозид, по меньшей мере один 2'-МОЕ нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один бициклический нуклеозид, по меньшей мере один 2'-ОМе нуклеозид и по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации 3'-крыло гэпмера содержит по меньшей мере один стерически затрудненный этил-нуклеозид, по меньшей мере один 2'-ОМе нуклеозид и по меньшей мере один 2'-дезоксинуклеозид. В некоторых вариантах реализации
3'-крыло гэпмера содержит по меньшей мере один LNA нуклеозид, по меньшей мере один 2'-ОМе нуклеозид и по меньшей мере один 2'-дезоксинуклеозид.
iii. Некоторые центральные области (гэпы)
В некоторых вариантах реализации гэп гэпмера состоит из 6-20 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 6-15 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 6-12 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 6-10 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 6-9 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 6-8 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 6 или 7 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 7-10 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 7-9 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 7 или 8 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 8-10 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 8 или 9 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 6 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 7 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 8 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 9 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 10 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 11 связанных нуклеозидов. В некоторых вариантах реализации гэп гэпмера состоит из 12 связанных нуклеозидов.
В некоторых вариантах реализации каждый нуклеозид гэпа гэпмера представляет собой 2'-дезоксинуклеозид. В некоторых вариантах реализации гэп содержит один или более модифицированных нуклеозидов. В некоторых вариантах реализации каждый нуклеозид гэпа гэпмера представляет собой 2'-дезоксинуклеозид или представляет собой модифицированный «ДНК-подобный» нуклеозид. В таких вариантах реализации «ДНК-подобный» означает, что нуклеозид имеет такие же характеристики, что и ДНК, то есть что дуплекс, содержащий гэпмер и молекулу РНК может активировать РНКазу Н. Например, было показано, что при некоторых условиях 2'-(ara)-Р поддерживает активацию РНКазы Н и, следовательно, является ДНК-подобным. В некоторых вариантах реализации один или более
нуклеозидов гэпа гэпмера не представляет собой 2'-дезоксинуклеозид и не является ДНК-подобным. В некоторых таких вариантах реализации гэпмер тем не менее поддерживает активацию РНКазы Н (например, за счет количества или положения не-ДНК нуклеозидов).
В некоторых вариантах реализации гэпы содержат участок немодифицированного 2'-дезоксинуклеозида, прерванный одним или более модифицированными нуклеозидамй, что приводит к образованию трех субрайонов (двух участков одного или более 2'-дезоксинуклеозидов и участка одного или более прерывающих модифицированных нуклеозидов). В некоторых вариантах реализации ни один участок немодифицированных 2'-дезоксинуклеозидов не длиннее 5, 6 или 7 нуклеозидов. В некоторых вариантах реализации такие короткие участки образуются за счет использования коротких гэп-областей. В некоторых вариантах реализации короткие участки образуются за счет прерывания более длинной области гэп.
В некоторых вариантах реализации гэп содержит один или более модифицированных нуклеозидов. В некоторых вариантах реализации гэп содержит один или более модифицированных нуклеозидов, выбранных из cEt, FHNA, LNA и 2-тиотимидина. В некоторых вариантах реализации гэп содержит один модифицированный нуклеозид. В некоторых вариантах реализации гэп содержит 5'-замещенный сахарный фрагмент, выбранный из 5'-Ме и 5'-(R)-Ме. В некоторых вариантах реализации гэп содержит два модифицированных нуклеозида. В некоторых вариантах реализации гэп содержит три модифицированных нуклеозида. В некоторых вариантах реализации гэп содержит четыре модифицированных нуклеозида. В некоторых вариантах реализации гэп содержит два или более модифицированных нуклеозидов, и каждый модифицированный нуклеозид является таким же. В некоторых вариантах реализации гэп содержит два или более модифицированных нуклеозидов, и каждый модифицированный нуклеозид является другим.
В некоторых вариантах реализации гэп содержит одну или более модифицированных связей. В некоторых вариантах реализации гэп содержит одну или более метилфосфонатных связей. В некоторых вариантах реализации гэп содержит две или более модифицированных связей. В некоторых вариантах реализации гэп содержит одну или более модифицированных связей и один или более модифицированных нуклеозидов. В некоторых вариантах реализации гэп содержит одну модифицированную связь и один модифицированный
нуклеозид. В некоторых вариантах реализации гэп содержит две модифицированных связи и два или более модифицированных нуклеозидов.
b. Некоторые мотивы межнуклеозидных связей
В некоторых вариантах реализации олигонуклеотиды содержат модифицированные межнуклеозидные связи, расположенные вдоль олигонуклеотида или его области определенным образом или в виде мотива модифицированной межнуклеозидной связи. В некоторых вариантах реализации олигонуклеотиды содержат область, имеющую мотив чередующихся межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотиды по настоящему описанию содержат область одинаково модифицированных межнуклеозидных связей. В некоторых таких вариантах реализации олигонуклеотид содержит область, которая равномерно связана тиофосфатными межнуклеозидными связями. В некоторых вариантах реализации олигонуклеотид равномерно связан тиофосфатными межнулеозидными связями. В некоторых вариантах реализации каждая межнуклеозидная связь олигонуклеотида выбран из фосфодиэфира и тиофосфата. В некоторых вариантах реализации каждая межнуклеозидная связь олигонуклеотида выбран из фосфодиэфира и тиофосфата, и по меньшей мере одна межнуклеозидная связь представляет собой тиофосфат.
В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 6 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 7 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 8 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 9 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 10 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 11 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 12 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 13 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере 14 тиофосфатных межнуклеозидных связей.
В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок по меньшей мере из 6 последовательных тиофосфатных межнуклеозидных связей. В
некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок по меньшей мере из 7 последовательных тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок по меньшей мере из 8 последовательных тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок по меньшей мере из 9 последовательных тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок по меньшей мере из 10 последовательных тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок по меньшей мере из 12 последовательных тиофосфатных межнуклеозидных связей. В некоторых таких вариантах реализации по меньшей мере один такой блок расположен на 3'-конце олигонуклеотида. В некоторых таких вариантах реализации по меньшей мере один такой блок расположен в пределах 3 нуклеозидов 3'-конца олигонуклеотида. В некоторых вариантах реализации олигонуклеотид содержит менее 15 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 14 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 13 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 12 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 11 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 10 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 9 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 8 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 7 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 6 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит менее 5 тиофосфатных межнуклеозидных связей.
с. Некоторые мотивы модификаций азотистых оснований
В некоторых вариантах реализации олигонуклеотиды содержат химические модификации азотистых оснований, расположенные вдоль олигонуклеотида или его области определенным образом или в виде мотива модификации азотистых оснований. В некоторых таких вариантах реализации модификации азотистых оснований расположены в разорванном
мотиве. В некоторых вариантах реализации модификации азотистых оснований расположены в чередующемся мотиве. В некоторых вариантах реализации каждое азотистое основание является модифицированным. В некоторых вариантах реализации ни одно из азотистых оснований не является химически модифицированным.
В некоторых вариантах реализации олигонуклеотиды содержат блок модифицированных азотистых оснований. В некоторых таких вариантах реализации блок находится на 3'-конце олигонуклеотида. В некоторых вариантах реализации блок находится в пределах 3 нуклеотидов 3'-конца олигонуклеотида. В некоторых таких вариантах реализации блок находится на 5'-конце олигонуклеотида. В некоторых вариантах реализации блок находится в пределах 3 нуклеотидов 5'-конца олигонуклеотида.
В некоторых вариантах реализации модификации азотистых оснований зависят от природного основания в конкретном положении олигонуклеотида. Например, в некоторых вариантах реализации каждый пурин или каждый пиримидин в олигонуклеотиде является модифицированным. В некоторых вариантах реализации модифицированным является каждый аденин. В некоторых вариантах реализации модифицированным является каждый гуанин. В некоторых вариантах реализации модифицированным является каждый тимин. В некоторых вариантах реализации модифицированным является каждый цитозин. В некоторых вариантах реализации модифицированным является каждый урацил.
В некоторых вариантах реализации некоторые, все или никакие из цитозиновых фрагментов в олигонуклеотиде не представляют собой 5-метилцитозиновые фрагменты. В настоящем документе 5-метилцитозин не является «модифицированным азотистым основанием». Соответственно, если не указано иное, то немодифицированные азотистые основания включают как цитозиновые остатки, содержащие 5-метил, так и те, которые не содержат 5-метил. В некоторых вариантах реализации оговорено состояние метилирования всех или некоторых цитозиновых азотистых оснований.
В некоторых вариантах реализации химические модификации азотистых оснований включают присоединение некоторых конъюгирующих групп к азотистым основаниям. В некоторых вариантах реализации каждый пурин или каждый пиримидин в олигонуклеотиде может быть необязательно модифицирован так, чтобы он содержал конъюгирующую группу.
d. Некоторые общие длины
В некоторых вариантах реализации настоящего описания представлены олигонуклеотиды любого из различных диапазонов длин. В некоторых вариантах реализации олигонуклеотиды содержат от X до Y связанных нуклеозидов, где X представляет собой наименьшее количество нуклеозидов в диапазоне, а Y представляет собой наибольшее количество нуклеозидов в диапазоне. В некоторых таких вариантах реализации каждый X и Y независимо выбран из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 и 50; при условии, что Х≤Y. Например, в некоторых вариантах реализации олигонуклеотид может состоять из 8-9, 8-10, 8-11, 8-12, 8-13, 8-14, 8-15, 8-16, 8-17, 8-18, 8-19, 8-20, 8-21, 8-22, 8-23, 8-24, 8-25, 8-26, 8-27, 8-28, 8-29, 8-30, 9-10, 9-11, 9-12, 9-13, 9-14, 9-15, 9-16, 9-17, 9-18, 9-19, 9-20, 9-21, 9-22, 9-23, 9-24, 9-25, 9-26, 9-27, 9-28, 9-29, 9-30, 10-11, 10-12, 10-13, 10-14, 10-15, 10-16, 10-17, 10-18, 10-19, 10-20, 10-21, 10-22, 10-23, 10-24, 10-25, 10-26, 10-27, 10-28, 10-29, 10-30, 11-12, 11-13, 11-14, 11-15, 11-16, 11-17, 11-18, 11-19, 11-20, 11-21, 11-22, 11-23, 11-24, 11-25, 11-26, 11-27, 11-28, 11-29, 11-30, 12-13, 12-14, 12-15, 12-16, 12-17, 12-18, 12-19, 12-20, 12-21, 12-22, 12-23, 12-24, 12-25, 12-26, 12-27, 12-28, 12-29, 12-30, 13-14, 13-15, 13-16, 13-17, 13-18, 13-19, 13-20, 13-21, 13-22, 13-23, 13-24, 13-25, 13-26, 13-27, 13-28, 13-29, 13-30, 14-15, 14-16, 14-17, 14-18, 14-19, 14-20, 14-21, 14-22, 14-23, 14-24, 14-25, 14-26, 14-27, 14-28, 14-29, 14-30, 15-16, 15-17, 15-18, 15-19, 15-20, 15-21, 15-22, 15-23, 15-24, 15-25, 15-26, 15-27, 15-28, 15-29, 15-30, 16-17, 16-18, 16-19, 16-20, 16-21, 16-22, 16-23, 16-24, 16-25, 16-26, 16-27, 16-28, 16-29, 16-30, 17-18, 17-19, 17-20, 17-21, 17-22, 17-23, 17-24, 17-25, 17-26, 17-27, 17-28, 17-29, 17-30, 18-19, 18-20, 18-21, 18-22, 18-23, 18-24, 18-25, 18-26, 18-27, 18-28, 18-29, 18-30, 19-20, 19-21, 19-22, 19-23, 19-24, 19-25, 19-26, 19-29, 19-28, 19-29, 19-30, 20-21, 20-22, 20-23, 20-24, 20-25, 20-26, 20-27, 20-28, 20-29, 20-30, 21-22, 21-23, 21-24, 21-25, 21-26, 21-27, 21-28, 21-29, 21-30, 22-23, 22-24, 22-25, 22-26, 22-27, 22-28, 22-29, 22-30, 23-24, 23-25, 23-26, 23-27, 23-28, 23-29, 23-30, 24-25, 24-26, 24-27, 24-28, 24-29, 24-30, 25-26, 25-27, 25-28, 25-29, 25-30, 26-27, 26-28, 26-29, 26-30, 27-28, 27-29, 27-30, 28-29, 28-30 или 29-30 связанных нуклеозидов. В тех вариантах реализации, в которых количество нуклеозидов в олигонуклеотиде соединения является ограниченным, либо до диапазона, либо до определенного числа, то соединение может, тем не менее, дополнительно содержать другие дополнительные заместители. Например, олигонуклеотид, содержащий 8-30 нуклеозидов, исключает олигонуклеотиды, имеющие 31 нуклзозид, но, если не указано иное, такой олигонуклеотид может дополнительно содержать, например, одну или более конъюгирующих групп, концевых групп или других заместителей.
Более того, если олигонуклеотид описан общим диапазоном длины и областями, имеющими определенную длину, и если сумма указанных длин областей меньше, чем верхняя граница диапазона общей длины, то олигонуклеотид может иметь дополнительные нуклеозиды, помимо тех, которые находятся в указанных областях, при условии, что общее количество нуклеозидов не превышает верхнюю границу диапазона общей длины.
5. Некторые химические мотивы антисмысловых олигонуклеотидов
В некоторых вариантах реализации химические структурные особенности антисмысловых олигонуклеотидов описываются их сахарным мотивом, мотивом межнуклеозидной связи, мотивом модификации азотистого основания и общей длиной. В некоторых вариантах реализации такие параметры не зависят друг от друга. Так, каждая межнуклеозидная связь олигонуклеотида, имеющий сахарный мотив гэпмера, может быть модифицированным или немодифицированным и может повторять или не повторять характер модификации сахарных модификаций гэпмера. Следовательно, межнуклеозидные связи в областях крыльев
сахара-гэпмера могут быть одинаковыми или отличными друг от друга и могут быть одинаковыми или отличными от межнуклеозидных связей области гэп. Точно так же, такие сахар-гэпмерные олигонуклеотиды могут содержать одно или более модифицированных азотистых оснований, независимо от характера сахарных модификаций гэпмера. Специалистам в данной области техники понятно, что такие мотивы могут быть комбинированы с получением множества олигонуклеотидов.
В некоторых вариантах реализации выбор межнуклеозидной связи и модификации нуклеозида не зависят друг от друга.
i. Некоторые последовательности и мишени
В некоторых вариантах реализации настоящего изобретения представлены антисмысловые олигонуклеотиды, имеющие последовательность, комплементарную целевой нуклеиновой кислоте. Такие антисмысловые соединения могут гибридизоваться с целевой нуклеиновой кислотой с получением по меньшей мере одной антисмысловой активности. В некоторых вариантах реализации антисмысловые соединения специфически гибридизуются с одной или более целевыми нуклеиновыми кислотами. В некоторых вариантах реализации специфически гибридизующееся антисмысловое соединение имеет последовательность азотистых оснований, содержащую область с достаточной комплементарностью целевой нуклеиновой кислоте для обеспечения возможности гибридизации и получению антисмысловой активности, и недостаточной комплементарностью любой нецелевой нуклеиновой кислоте для предотвращения или снижения неспецифической гибридизации с последовательностями нецелевых нуклеиновых кислот в условиях, в которых необходима специфическая гибридизация (например, в физиологических условиях для in vivo или терапевтических применений и в условиях выполнения анализов - в случае in vitro анализов). В некоторых вариантах реализации олигонуклеотиды являются селективными между мишенью и не мишенью, даже если мишень и не мишень содержат целевую последовательность. В таких вариантах реализации селективность может быть результатом относительной доступности целевой области одной молекулы нуклеиновой кислоты, по сравнению с другой.
В некоторых вариантах реализации настоящего описания представлены антисмысловые соединения, содержащие олигонуклеотиды, которые полностью комплементарны целевой нуклеиновой кислоте по всей длине олигонуклеотида. В некоторых вариантах реализации олигонуклеотиды на 99% комплементарны целевой нуклеиновой кислоте. В некоторых вариантах реализации олигонуклеотиды на 95% комплементарны
целевой нуклеиновой кислоте. В некоторых вариантах реализации такие олигонуклеотиды на 90% комплементарны целевой нуклеиновой кислоте.
В некоторых вариантах реализации такие олигонуклеотиды на 85% комплементарны целевой нуклеиновой кислоте. В некоторых вариантах реализации такие олигонуклеотиды на 80% комплементарны целевой нуклеиновой кислоте. В некоторых вариантах реализации антисмысловое соединение содержит область, которая полностью комплементарна целевой нуклеиновой кислоте, и по меньшей мере на 80% комплементарно целевой нуклеиновой кислоте по всей длине олигонуклеотида. В некоторых таких вариантах реализации область полной комплементарности имеет от 6 до 14 нуклеозидов в длину.
В некоторых вариантах реализации олигонуклеотиды содержат область гибридизации и концевую область. В некоторых таких вариантах реализации область гибридизации состоит из 12-30 связанных нуклеозидов и полностью комплементарна целевой нуклеиновой кислоте. В некоторых вариантах реализации область гибридизации содержит одно несоответствие в сравнении с целевой нуклеиновой кислотой. В некоторых вариантах реализации область гибридизации содержит два несоответствия в сравнении с целевой нуклеиновой кислотой. В некоторых вариантах реализации область гибридизации содержит три несоответствия в сравнении с целевой нуклеиновой кислотой. В некоторых вариантах реализации концевая область состоит из 1-4 концевых нуклеозидов. В некоторых вариантах реализации концевые нуклеозиды находятся на 3'-конце. В некоторых вариантах реализации один или более концевых нуклеозидов не комплементарны целевой нуклеиновой кислоте.
Антисмысловые механизмы включают любой механизм, затрагивающий гибридизацию олигонуклеотида с целевой нуклеиновой кислотой, при этом гибридизация приводит к биологическому эффекту. В некоторых вариантах реализации такая гибридизация приводит либо к разрушению, либо к применению целевой нуклеиновой кислоты с сопутствующим подавлением или стимулированием клеточного механизма, затрагивающего, например, трансляцию, транскрипцию или сплайсинг целевой нуклеиновой кислоты.
Один из типов антисмыслового механизма, затрагивающий разрушение целевой РНК представляет собой антисмысл, опосредованный РНКазой Н. РНКаза Н представляет собой клеточную эндонуклеазу, которая расщепляет спираль РНК дуплекса РНК:ДНК. В данной области техники известно, что односпиральные антисмысловые соединения, которые являются «ДНК-подобными», вызывают активность РНКазы Н в клетках млекопитающих.
Следовательно, активация РНКазы Н приводит к расщеплению РНК-мишени, посредством этого в значительной степени усиливая эффективность подавления генной экспрессии, опосредованного ДНК-подобным олигонуклеотидом.
В некоторых вариантах реализации конъюгирующая группа содержит расщепляемый фрагмент. В некоторых вариантах реализации конъюгирующая группа содержит одну или более расщепляемых связей. В некоторых вариантах реализаций конъюгирующая группа содержит линкер. В некоторых вариантах реализации линкер содержит белковый связывающий фрагмент. В некоторых вариантах реализации конъюгирующая группа содержит фрагмент, нацеливающий на клетку (упоминаемый также как группа, нацеливающая на клетку). В некоторых вариантах реализации фрагмент, нацеливающий на клетку, содержит группу ветвления. В некоторых вариантах реализации фрагмент, нацеливающий на клетку, содержит одну или более связок. В некоторых вариантах реализации фрагмент, нацеливающий на клетку, содержит углевод или углеводный кластер.
ii. Некоторые расщепляемые фрагменты
В некоторых вариантах реализации расщепляемый фрагмент представляет собой расщепляемую связь. В некоторых вариантах реализации расщепляемый фрагмент содержит расщепляемую связь. В некоторых вариантах реализации конъюгирующая группа содержит расщепляемый фрагмент. В некоторых таких вариантах реализации расщепляемый фрагмент присоединяется к антисмысловому олигонуклеотиду. В некоторых таких вариантах реализации расщепляемый фрагмент присоединяется непосредственно к фрагменту, нацеливающему на клетку. В некоторых таких вариантах реализации расщепляемый фрагмент присоединяется к конъюгирующему линкеру. В некоторых вариантах реализации расщепляемый фрагмент содержит фосфат или фосфодиэфир. В некоторых вариантах реализации расщепляемый фрагмент представляет собой расщепляемый нуклеозид или нуклеозидный аналог. В некоторых вариантах реализации нуклеозид или нуклеозидный аналог содержит необязательно защищенное гетероциклическое основание, выбранное из пурина, замещенного пурина, пиримидина или замещенного пиримидина. В некоторых вариантах реализации расщепляемый фрагмент представляет собой нуклеозид, содержащий необязательно защищенное гетероциклическое основание, выбранное из урацила, тимина, цитозина, 4-N-бензоилцитозина, 5-метилцитозина, 4-N-бензоил-5-метилцитозина, аденина, 6-N-бензоиладенина, гуанина и 2-N-изобутирилгуанина. В некоторых вариантах реализации расщепляемый фрагмент представляет собой 2'-дезоксинуклеозид, который присоединен к
3'-положению антисмыслового олигонуклеотида фосфодиэфирной связью и присоединен к линкеру фосфодиэфирной или тиофосфатной связью. В некоторых вариантах реализации расщепляемый фрагмент представляет собой 2'-дезоксиаденозин, который присоединен к 3'-положению антисмыслового олигонуклеотида фосфодиэфирной связью и присоединен к линкеру фосфодиэфирной или тиофосфатной связью. В некоторых вариантах реализации расщепляемый фрагмент представляет собой 2'-дезоксиаденозин, который присоединен к 3'-положению антисмыслового олигонуклеотида фосфодиэфирной связью и присоединен к линкеру фосфодиэфирной связью.
В некоторых вариантах реализации расщепляемый фрагмент присоединен к 3'-положению антисмыслового олигонуклеотида. В некоторых вариантах реализации расщепляемый фрагмент присоединен к 5'-положению антисмыслового олигонуклеотида. В некоторых вариантах реализации расщепляемый фрагмент присоединен к 2'-положению антисмыслового олигонуклеотида. В некоторых вариантах реализации расщепляемый фрагмент присоединен к антисмысловому олигонуклеотиду фосфодиэфирной связью. В некоторых вариантах реализации расщепляемый фрагмент присоединен к указанному линкеру либо фосфодиэфирной, либо тиофосфатной связью. В некоторых вариантах реализации расщепляемый фрагмент присоединен к указанному линкеру фосфодиэфирной связью. В некоторых вариантах реализации конъюгирующая группа не содержит расщепляемый фрагмент.
В некоторых вариантах реализации расщепляемый фрагмент расщепляется после введения указанного комплекса животному только после его поглощения целевой клеткой. Внутри клетки расщепляемый фрагмент расщепляется, высвобождая таким образом активный антисмысловый олигонуклеотид. Не ограничиваясь теорией, предполагается, что расщепляемый фрагмент расщепляется под действием одной или более нуклеаз внутри клетки. В некоторых вариантах реализации одна или более нуклеаз расщепляют фосфодиэфирную связь между расщепляемым фрагментом и линкером. В некоторых вариантах реализации расщепляемый фрагмент имеет структуру, выбранную из следующих:
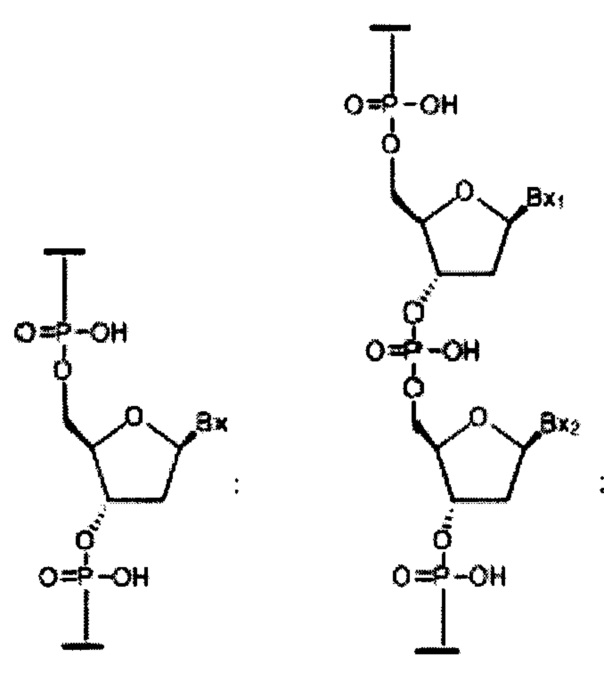
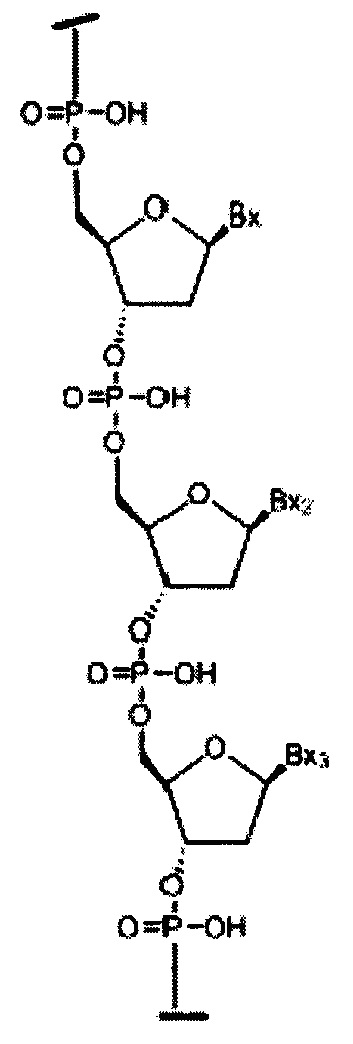
где каждый из Вх, Вх1, Вх2 и Вх3 независимо представляет собой фрагмент гетероциклического основания. В некоторых вариантах реализации расщепляемый фрагмент имеет структуру, выбранную из следующих:
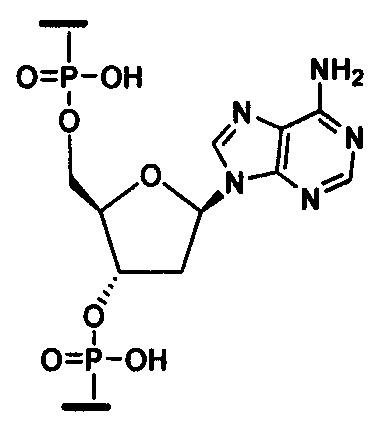
iii. Некоторые линкеры
В некоторых вариантах реализации конъюгирующие группы содержат линкер. В некоторых таких вариантах реализации линкер ковалентно связан с расщепляемым фрагментом. В некоторых таких вариантах реализации линкер ковалентно связан с антисмысловым олигонуклеотидом. В некоторых вариантах реализации линкер ковалентно связан с фрагментом, нацеливающим на клетку. В некоторых вариантах реализации линкер дополнительно содержит ковалентное присоединение к твердой подложке. В некоторых вариантах реализации линкер дополнительно содержит ковалентное присоединение к белковому связывающему фрагменту. В некоторых вариантах реализации линкер дополнительно содержит ковалентное присоединение к твердой подложке и дополнительно содержит ковалентное присоединение к белковому связывающему фрагменту. В некоторых
вариантах реализации линкер содержит несколько положений для присоединения связанных лигандов. В некоторых вариантах реализации линкер содержит несколько положений для присоединения связанных лигандов и не присоединен к группе ветвления. В некоторых вариантах реализации линкер дополнительно содержит одну или более расщепляемых связей. В некоторых вариантах реализации конъюгирующая группа не содержит линкер.
В некоторых вариантах реализации линкер содержит по меньшей мере одну. линейную группу, содержащую группы, выбранные из алкильных, амидных, дисульфидных, полиэтиленгликолевых, тиоэфирных (-S-) и гидроксиламино (-О-N(Н)-) групп. В некоторых вариантах реализации линейная группа содержит группы, выбранные из алкильных, амидных и простых эфирных групп. В некоторых вариантах реализации линейная группа содержит группы, выбранные из алкильных и простых эфирных групп. В некоторых вариантах реализации линейная группа содержит по меньшей мере одну фосфорную связывающую группу. В некоторых вариантах реализации линейная группа содержит по меньшей мере одну фосфодиэфирную группу. В некоторых вариантах реализации линейная группа содержит по меньшей мере одну нейтральную связывающую группу. В некоторых вариантах реализации линейная группа ковалентно присоединена к фрагменту, нацеливающему на клетку, и к расщепляемому фрагменту. В некоторых вариантах реализации линейная группа ковалентно присоединена к фрагменту, нацеливающему на клетку, и к антисмысловому олигонуклеотиду. В некоторых вариантах реализации линейная группа ковалентно присоединена к фрагменту, нацеливающему на клетку, к расщепляемому фрагменту и к твердой подложке. В некоторых вариантах реализации линейная группа ковалентно присоединена к фрагменту, нацеливающему на клетку, к расщепляемому фрагменту, к твердой подложке и к белковому связывающему фрагменту. В некоторых вариантах реализации линейная группа содержит одну или более расщепляемых связей.
В некоторых вариантах реализации линкер содержит линейную группу, ковалентно присоединенную к группе скелета. В некоторых вариантах реализации скелет содержит разветвленную алифатическую группу, которая содержит группы, выбранные из алкильных, амидных, дисульфидных, полиэтиленгликолевых, простых эфирных, тиоэфирных и гидроксиламино-групп. В некоторых вариантах реализации скелет содержит разветвленную алифатическую группу, которая содержит группы, выбранные из алкильных, амидных и простых эфирных групп. В некоторых вариантах реализации скелет содержит по меньшей мере одну моно- или полициклическую кольцевую систему. В некоторых вариантах
реализации скелет содержит по меньшей мере две моно- или полициклические кольцевые системы. В некоторых вариантах реализации линейная группа ковалентно присоединена к группе скелета, а группа скелета ковалентно присоединена к расщепляемому фрагменту и линкеру. В некоторых вариантах реализации линейная группа ковалентно присоединена к группе скелета, а группа скелета ковалентно присоединена к расщепляемому фрагменту, линкеру и твердой подложке. В некоторых вариантах реализации линейная группа ковалентно присоединена к группе скелета, а группа скелета ковалентно присоединена к расщепляемому фрагменту, линкеру и белковому связывающему фрагменту. В некоторых вариантах реализации линейная группа ковалентно присоединена к группе скелета, а группа скелета ковалентно присоединена к расщепляемому фрагменту, линкеру, белковому связывающему фрагменту и твердой подложке. В некоторых вариантах реализации группа скелета содержит одну или более расщепляемых связей.
В некоторых вариантах реализации линкер содержит белковый связывающий фрагмент. В некоторых вариантах реализации белковый связывающий фрагмент представляет собой липид, такой как, например, включая, но не ограничиваясь ими, холестерин, холевая кислота, адамантан-уксусная кислота, 1-пирен-масляная кислота, дигидротестостерон, 1,3-бис-O(гексадецил)глицерин, геранилоксигексиловая группа, гексадецилглицерин, борнеол, ментол, 1,3-пропандиол, гептадециловая группа, пальмитиновая кислота, миристиновая кислота, O3-(олеоил)литохолевая кислота, О3-(олеоил)холеновая кислота, диметокситритил или феноксазин, витамин (например, фолат, витамин А, витамин Е, биотин, пиридоксаль), пептид, углевод (например, моносахарид, дисахарид, трисахарид, тетрасахарид, олигосахарид, полисахарид), эндосомолитический компонент, стероид (например, уваол, гецигенин, диосгенин), терпен (например, тритерпен, например, сарсасапогенин, фриделин, литохолевая кислота, дериватизованная эпифриделанолом) или катионный липид. В некоторых вариантах реализации белковый связывающий фрагмент представляет собой насыщенную или ненасыщенную жирную кислоту с длиной цепи от С16 до С22, холестерин, холевую кислоту, витамин Е, адамантан или 1-пентафторпропил.
В некоторых вариантах реализации линкер имеет структуру, выбранную из:
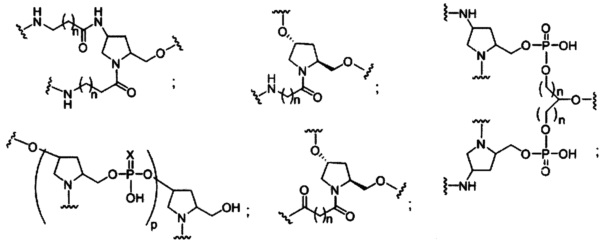

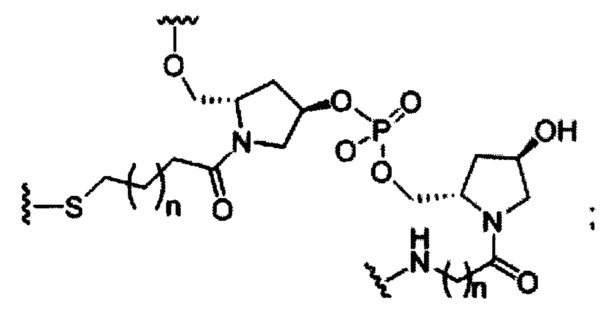

где каждый n независимо равен от 1 до 20; и р равен от 1 до 6.
В некоторых вариантах реализации линкер имеет структуру, выбранную из:
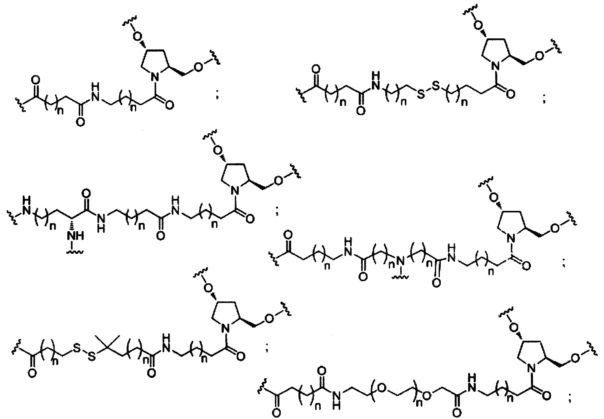
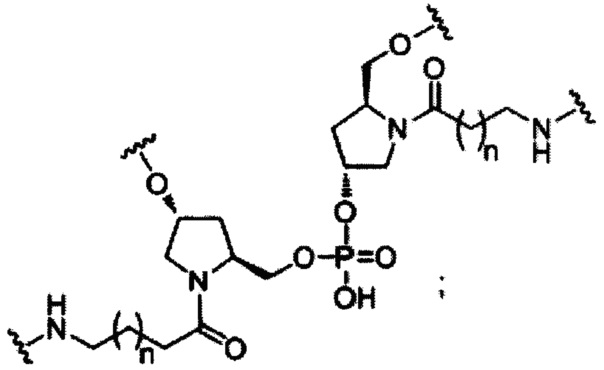

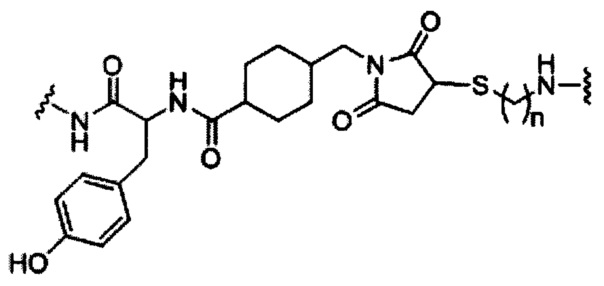
где каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации линкер имеет структуру, выбранную из:
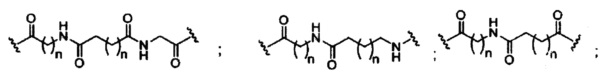
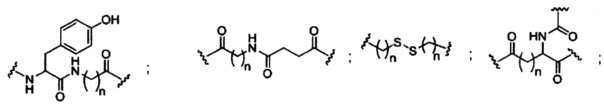
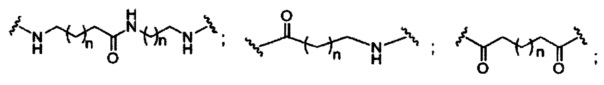



где n равен от 1 до 20.
В некоторых вариантах реализации линкер имеет структуру, выбранную из:

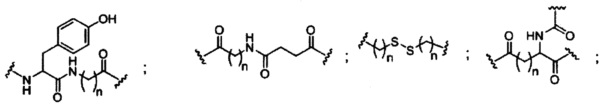


где каждый L независимо представляет собой фосфорную связывающую группу или нейтральную связывающую группу; и
каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации линкер имеет структуру, выбранную из:
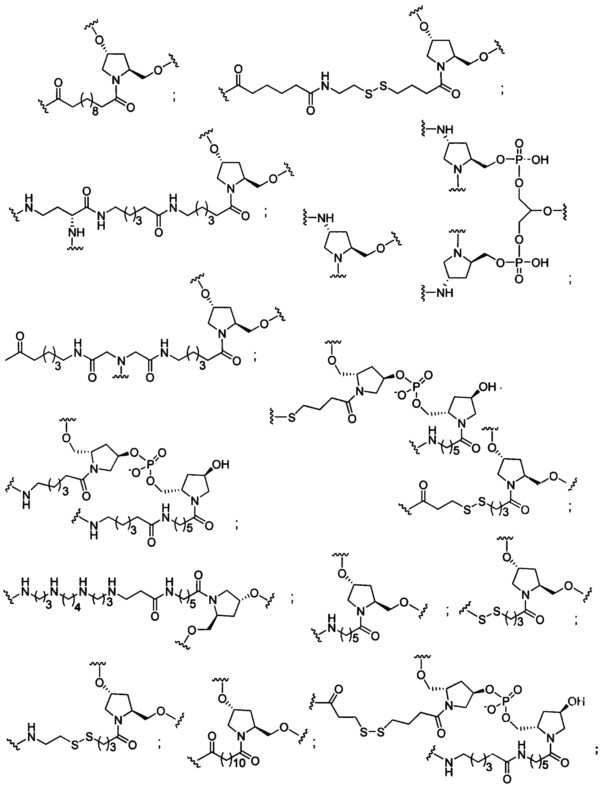

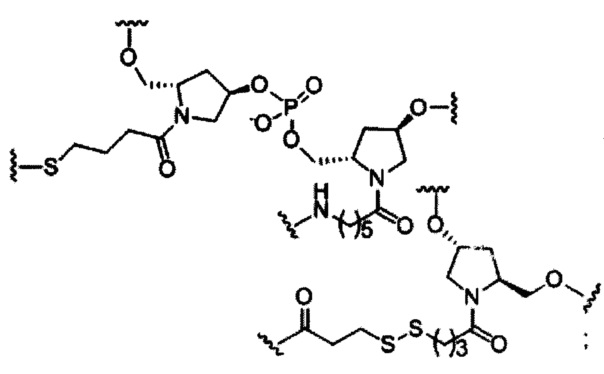
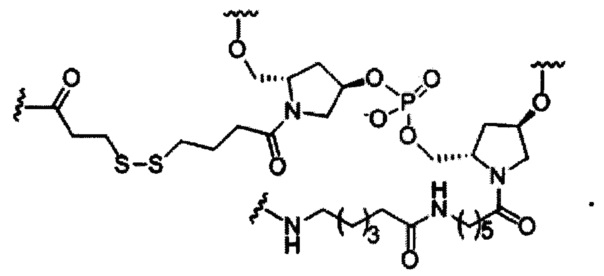
В некоторых вариантах реализации линкер имеет структуру, выбранную из:



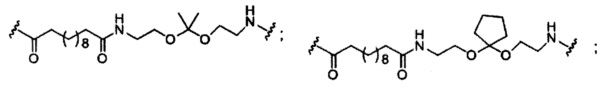
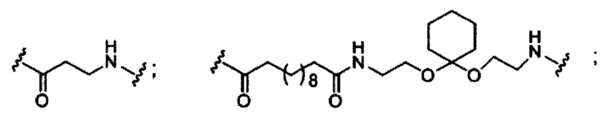

В некоторых вариантах реализации линкер имеет структуру, выбранную из:
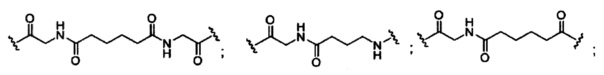
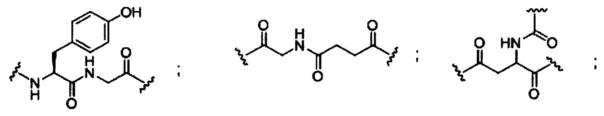
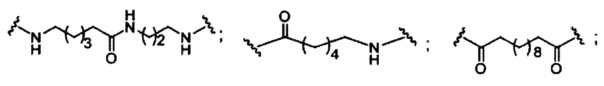
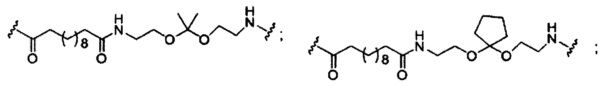
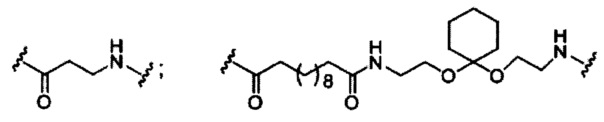

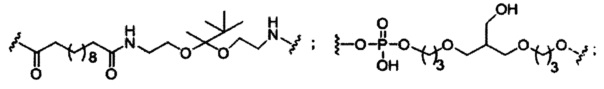


В некоторых вариантах реализации линкер имеет структуру, выбранную из:

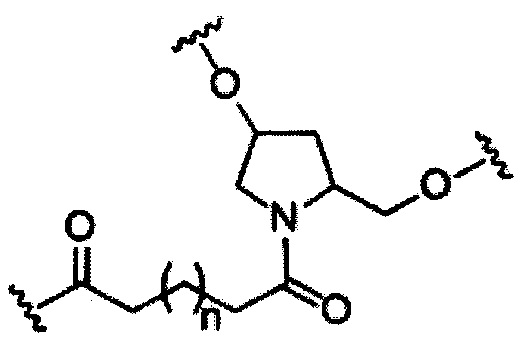
где n равен от 1 до 20.
В некоторых вариантах реализации линкер имеет структуру, выбранную из:


В некоторых вариантах реализации линкер имеет структуру, выбранную из:


В некоторых вариантах реализации линкер имеет структуру, выбранную из:


В некоторых вариантах реализации конъюгирующий линкер имеет структуру:
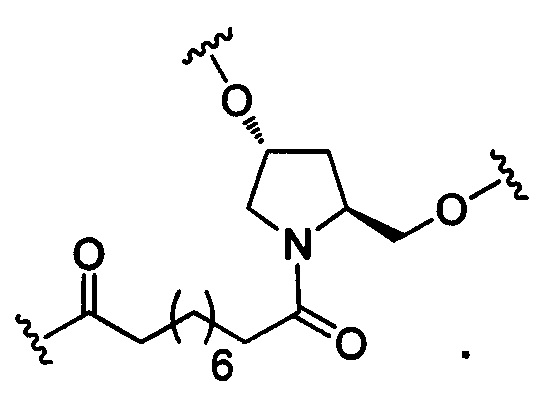
В некоторых вариантах реализации конъюгирующий линкер имеет структуру:

В некоторых вариантах реализации линкер имеет структуру, выбранную из:


В некоторых вариантах реализации линкер имеет структуру, выбранную из:

где каждый n независимо равен 0, 1, 2, 3, 4, 5, 6 или 7.
iv. Некоторые фрагменты, нацеливающие на клетку
В некоторых вариантах реализации конъюгирующие группы содержат фрагменты, нацеливающие на клетку. Некоторые такие фрагменты, нацеливающие на клетку, увеличивают клеточный захват антисмысловых соединений. В некоторых вариантах реализации фрагменты, нацеливающие на клетку, содержат группу ветвления, одну или более связок и один или более лигандов. В некоторых вариантах реализации фрагменты, нацеливающие на клетку, содержат группу ветвления, одну или более связок, один или более лигандов и одну или более расщепляемых связей.
1. Некоторые группы ветвления
В некоторых вариантах реализации конъюгирующие группы содержат нацеливающий фрагмент, содержащий группу ветвления и по меньшей мере два связанных лиганда. В некоторых вариантах реализации группа ветвления присоединяет конъюгирующий линкер. В некоторых вариантах реализации группа ветвления присоединяет расщепляемый фрагмент. В некоторых вариантах реализации группа ветвления присоединяет антисмысловый олигонуклеотид. В некоторых вариантах реализации группа ветвления ковалентно присоединена к линкеру и каждому из связанных лигандов. В некоторых вариантах реализации группа ветвления содержит разветвленную алифатическую группу, которая содержит группы, выбранные из алкильных, амидных, дисульфидных, полиэтиленгликолевых, простых эфирных, тиоэфирных и гидроксиламино-групп. В некоторых вариантах реализации группа ветвления содержит группы, выбранные из алкильных, амидных и простых эфирных групп. В некоторых вариантах реализации группа ветвления содержит группы, выбранные из алкильных и простых эфирных групп. В некоторых вариантах реализации группа ветвления содержит моно- или полициклическую кольцевую систему. В некоторых вариантах реализации группа ветвления содержит одну или
более расщепляемых связей. В некоторых вариантах реализации конъюгирующая группа не содержит группу ветвления.
В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:

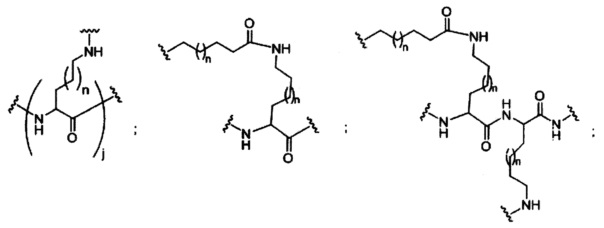


где каждый n независимо равен от 1 до 20;
j равен от 1 до 3; и
m равен от 2 до 6.
В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:

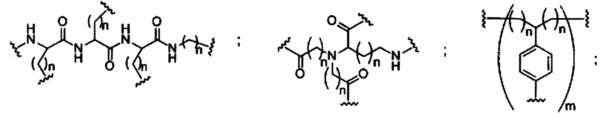

где каждый n независимо равен от 1 до 20; и
m равен от 2 до 6.
В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:
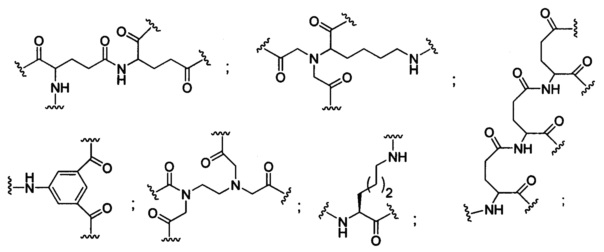

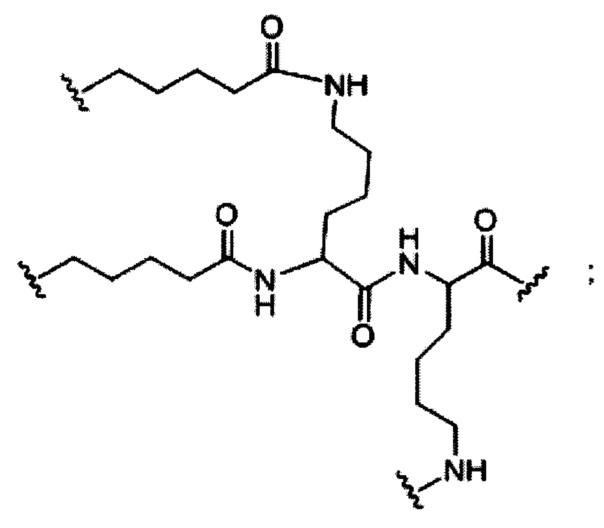

В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:

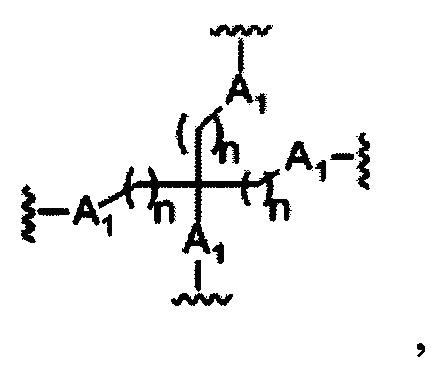
где каждый А1 независимо представляет собой О, S, С=O или NH; и
каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:


где каждый А1 независимо представляет собой О, S, С=O или NH; и
каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:
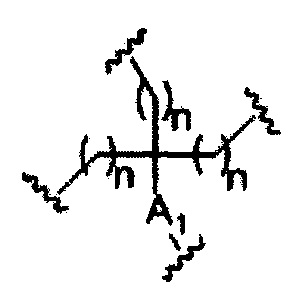
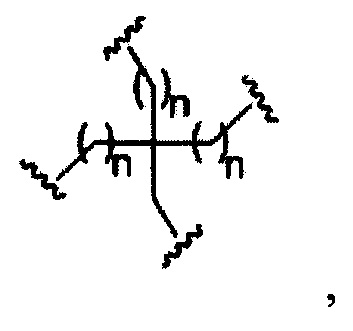
где А1 представляет собой О, S, С=O или NH; и
каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:
В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:

В некоторых вариантах реализации группа ветвления имеет структуру, выбранную из:

2. Некоторые связки
В некоторых вариантах реализации конъюгирующие группы содержат одну или более связок, ковалентно присоединенных к группе ветвления. В некоторых вариантах реализации конъюгирующие группы содержат одну или более связок, ковалентно присоединенных к связывающей группе. В некоторых вариантах реализации каждая связка представляет собой линейную алифатическую группу, содержащую одну или более групп, выбранных из алкильных, простых эфирных, тиоэфирных, дисульфидных, амидных и полиэтиленгликолевых групп в любой комбинации. В некоторых вариантах реализации каждая связка представляет собой линейную алифатическую группу, содержащую одну или более групп, выбранных из алкильных, замещенных алкильных, простых эфирных, тиоэфирных, дисульфидных, амидных, фосфодиэфирных и полиэтиленгликолевых групп в любой комбинации. В некоторых вариантах реализации каждая связка представляет собой линейную алифатическую группу, содержащую одну или более групп, выбранных из алкильных, простых эфирных и амидных групп в любой комбинации. В некоторых вариантах реализации каждая связка представляет собой линейную алифатическую группу, содержащую одну или более групп, выбранных из алкильных, замещенных алкильных, фосфодиэфирных, простых эфирных и амидных групп в любой комбинации. В некоторых вариантах реализации каждая связка представляет собой линейную алифатическую группу, содержащую одну или более групп, выбранных из алкила и фосфодиэфира в любой комбинации. В некоторых вариантах реализации каждая связка содержит по меньшей мере одну фосфорную связывающую группу или нейтральную связывающую группу.
В некоторых вариантах реализации связка содержит одну или более расщепляемых связей. В некоторых вариантах реализации связка присоединена к группе ветвления через амидную или простую эфирную группу. В некоторых вариантах реализации связка присоединена к группе ветвления через фосфордиэфирную группу. В некоторых вариантах реализации связка присоединена к группе ветвления через фосфорную связывающую группу или через нейтральную связывающую группу. В некоторых вариантах реализации связка присоединена к группе ветвления через простую эфирную группу. В некоторых вариантах
реализации связка присоединена к лиганду либо через амидную, либо через простую эфирную группу. В некоторых вариантах реализации связка присоединена к лиганду через простую эфирную группу. В некоторых вариантах реализации связка присоединена к лиганду либо через амидную, либо через простую эфирную группу. В некоторых вариантах реализации связка присоединена к лиганду через простую эфирную группу.
В некоторых вариантах реализации каждая связка имеет длину от около 8 до около 20 атомов в цепи между лигандом и группой ветвления. В некоторых вариантах реализации каждая связка имеет длину от около 10 до около 18 атомов в цепи между лигандом и группой ветвления. В некоторых вариантах реализации каждая связка имеет длину около 13 атомов в цепи.
В некоторых вариантах реализации связка имеет структуру, выбранную из:

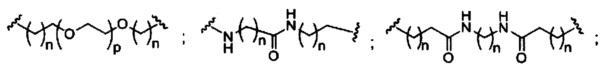


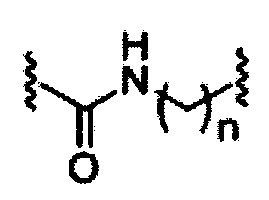
где каждый n независимо равен от 1 до 20; и
каждый р равен от 1 до около 6.
В некоторых вариантах реализации связка имеет структуру, выбранную из:

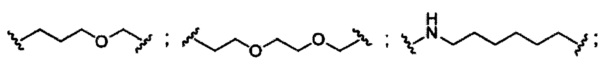
В некоторых вариантах реализации связка имеет структуру, выбранную из:

где каждый n независимо равен от 1 до 20.
В некоторых вариантах реализации связка имеет структуру, выбранную из:


где L представляет собой либо фосфорную связывающую группу, либо нейтральную связывающую группу;
Z1 представляет собой С(=O)O-R2;
Z2 представляет собой Н, С1-С6 алкил или замещенный С1-С6 алкил;
R2 представляет собой Н, С1-С6 алкил или замещенный С1-С6 алкил; и
каждый m1 независимо равен от 0 до 20, при этом по меньшей мере один m1 больше 0 для каждой связки.
В некоторых вариантах реализации связка имеет структуру, выбранную из:
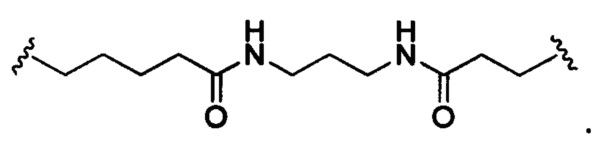
В некоторых вариантах реализации связка имеет структуру, выбранную из:

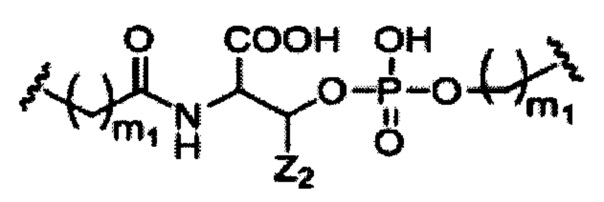
где Z2 представляет собой Н или СН3; и
каждый m1 независимо равен от 0 до 20, при этом по меньшей мере один m1 больше 0 для каждой связки.
В некоторых вариантах реализации связка имеет структуру, выбранную из:


В некоторых вариантах реализации связка содержит фосфорную связывающую группу. В некоторых вариантах реализации связка не содержит ни одной амидной связи. В некоторых вариантах реализации связка содержит фосфорную связывающую группу и не содержит ни одной амидной связи.
3. Некоторые лиганды
В некоторых вариантах реализации настоящего описания представлены лиганды, при этом каждый лиганд ковалентно присоединен к связке. В некоторых вариантах реализации каждый лиганд выбран так, чтобы он обладал аффинностью по меньшей мере к одному типу рецептора на клетке-мишени. В некоторых вариантах реализации лиганды выбраны так, чтобы они обладали аффинностью по меньшей мере к одному типу рецептора на поверхности клетки печени млекопитающего. В некоторых вариантах реализации лиганды выбраны так, чтобы они обладали аффинностью к печеночному асиалогликопротеиновому рецептору (ASGP-R). В некоторых вариантах реализации каждый лиганд представляет собой углевод. В некоторых вариантах реализации каждый лиганд независимо выбран из галактозы, 14-ацетилгалактозамина, маннозы, глюкозы, глюкозамина и фукозы. В некоторых вариантах реализации каждый лиганд представляет собой N-ацетилгалактозамин (GalNAc). В некоторых вариантах реализации нацеливающий фрагмент содержит 2-6 лигандов. В некоторых вариантах реализации нацеливающий фрагмент содержит 3 лиганда. В некоторых вариантах реализации нацеливающий фрагмент содержит 3 N-ацетилгалактозаминовых лиганда.
В некоторых вариантах реализации лиганд представляет собой углевод, углеводное производное, модифицированный углевод, поливалентный углеводный кластер, полисахарид, модифицированный полисахарид или полисахаридное производное. В некоторых вариантах
реализации лиганд представляет собой аминосахар или тиосахар. Например, аминосахара могут быть выбраны из любого количества соединений, известных в данной области техники, например, глюкозамина, сиаловой кислоты, α-D-галактозамина, N-ацетилгалактозамина, 2-ацетамидо-2-дезокси-D-галактопиранозы (GalNAc), 2-амино-3-O-[(R)-1-карбоксиэтил]-2-дезокси-β-D-глюкопиранозы (β-мурамовой кислоты), 2-дезокси-2-метиламино-L-глюкопиранозы, 4,6-дидезокси-4-формамидо-2,3-ди-O-метил-D-маннопиранозы, 2-дезокси-2-сульфоамино-D-глюкопиранозы и N-сульфо-D-глюкозамина, и N-гликолоил-α-нейраминовой кислоты. Например, тиосахара могут быть выбраны из группы, состоящей из 5-тио-β-D-глюкопиранозы, метил 2,3,4-три-O-ацетил-1-тио-6-O-тритил-α-D-глюкопиранозида, 4-тио-β-D-галактопиранозы и этил 3,4,6,7-тетра-O-ацетил-2-дезокси-1,5-дитио-α-D-глюко-гептопиранозида.
В некоторых вариантах реализации «GalNAc» или «Gal-NAc» относится к 2-(ацетиламино)-2-дезокси-D-галактопиранозе, обычно упоминаемой в литературе как N-ацетилгалактозамин. В некоторых вариантах реализации «N-ацетилгалактозамин» относится к 2-(ацетиламино)-2-дезокси-D-галактопиранозе. В некоторых вариантах реализации «GalNAc» или «Gal-NAc» относится к 2-(ацетиламино)-2-дезокси-D-галактопиранозе. В некоторых вариантах реализации «GalNAc» или «Gal-NAc» относится к 2-(ацетиламино)-2-дезокси-D-галактопиранозе, которая включает и β-форму: 2-(ацетиламино)-2-дезокси-β-D-галактопиранозу, и α-форму: 2-(ацетиламино)-2-дезокси-D-галактопиранозу: В некоторых вариантах реализации обе формы, β-форма: 2-(ацетиламино)-2-дезокси-β-D-галактопираноза, и α-форма: 2-(ацетиламино)-2-дезокси-D-галактопираноза, могут быть использованы взаимозаменяемо. Соответственно, в структурах, в которых изображена одна форма, подразумевается, что эти структуры включают также и другую форму. Например, если показана структура для α-формы: 2-(ацетиламино)-2-дезокси-D-галактопиранозы, то подразумевается, что эта структура включает также и другую форму. В некоторых предпочтительных вариантах реализации β-форма 2-(ацетиламино)-2-дезокси-D-галактопиранозы является предпочтительным вариантом реализации.
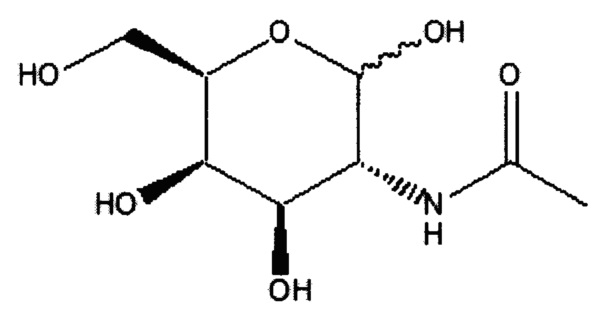
2-(Ацетиламино)-2-дезокси-D-галактопираноза

2-(Ацетиламино)-2-дезокси-β-D-галактопираноза
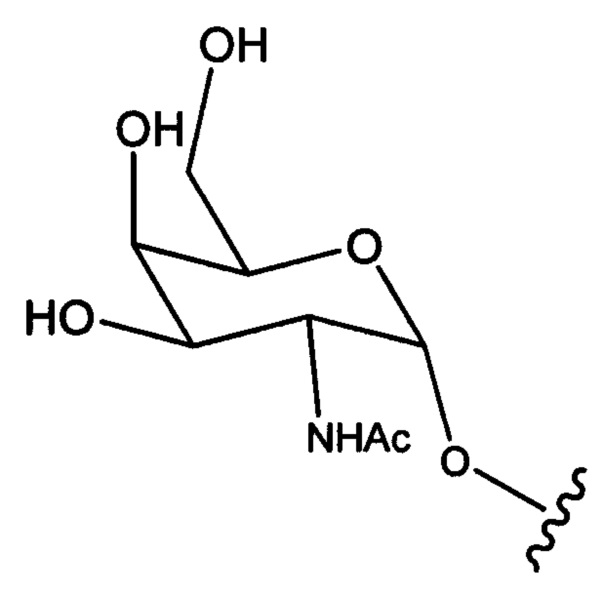
2-(Ацетиламино)-2-дезокси-α-D-галактопираноза
В некоторых вариантах один или более лигандов имеют структуру, выбранную из:
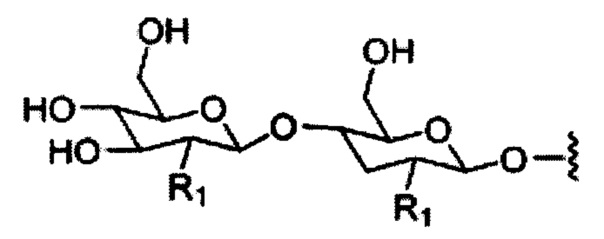
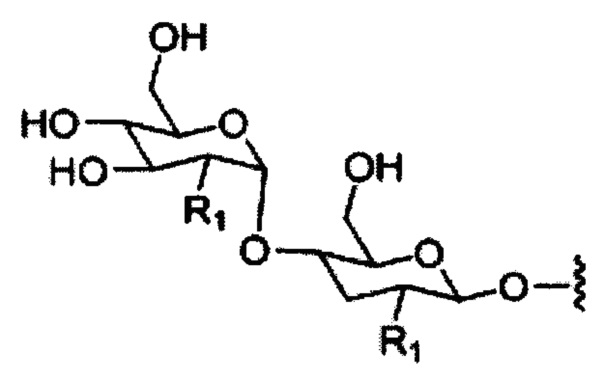
где каждый R1 выбран из OH и NHCOOH.
В некоторых вариантах один или более лигандов имеют структуру, выбранную из:

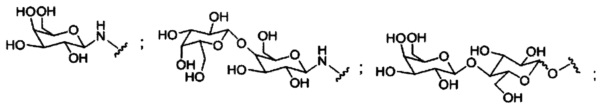

В некоторых вариантах один или более лигандов имеют структуру, выбранную из:

В некоторых вариантах один или более лигандов имеют структуру, выбранную из:
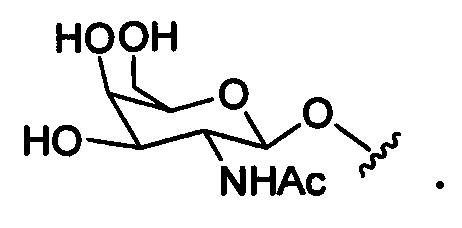
i. Некоторые конъюгаты
В некоторых вариантах реализации конъюгирующие группы содержат структурные особенности, представленные выше. В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

где каждый n независимо равен от 1 до 20.
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
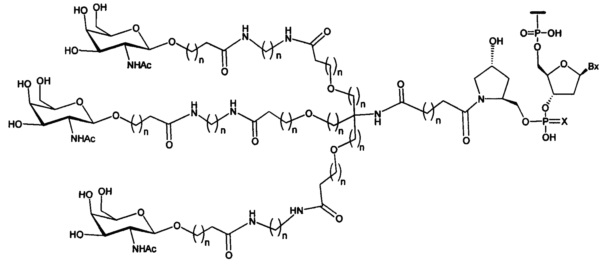
где каждый n независимо равен от 1 до 20;
Z представляет собой Н или связанную твердую подложку;
Q представляет собой антисмысловое соединение;
X представляет собой О или S; и
Вх представляет собой гетероциклический основной фрагмент.
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
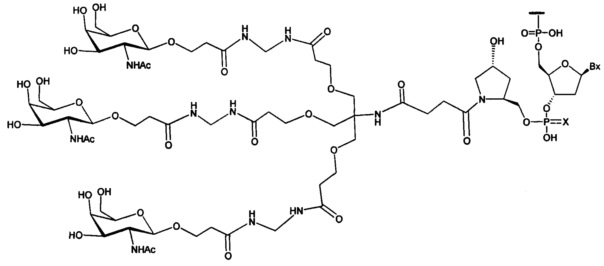
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
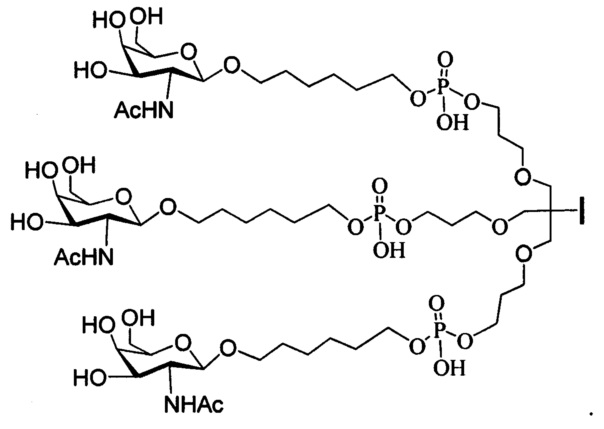
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
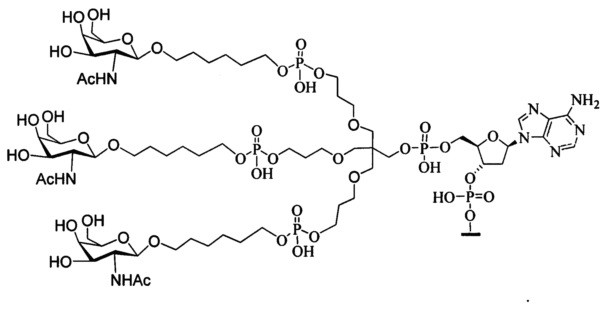
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
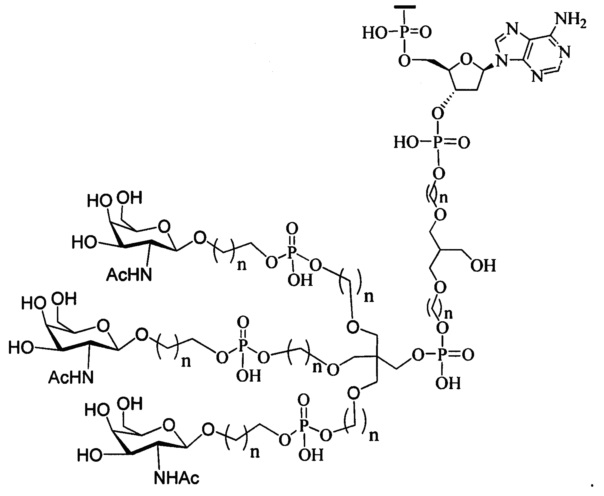
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых вариантах реализации конъюгаты не содержат пирролидин.
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
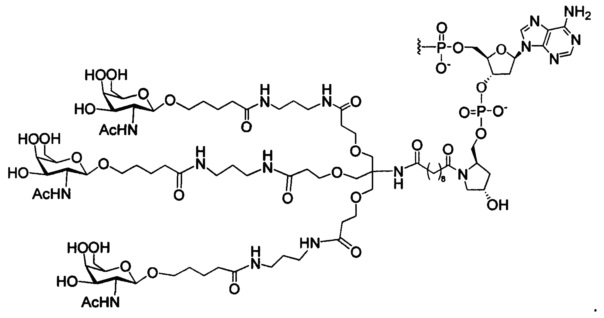
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
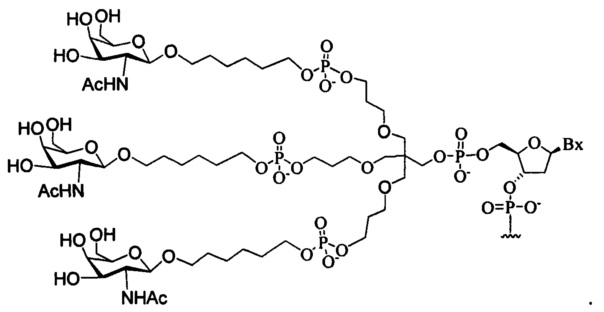
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
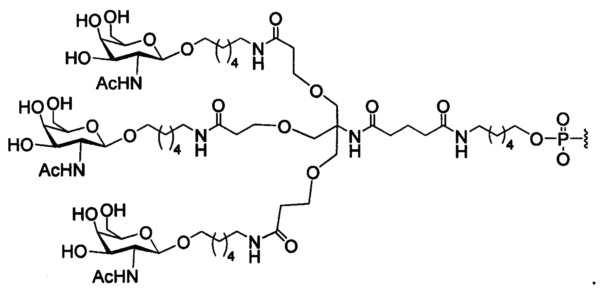
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
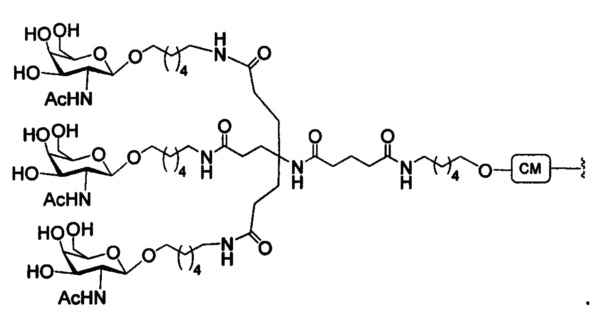
В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:

В некоторых таких вариантах реализации конъюгирующие группы имеют следующую структуру:
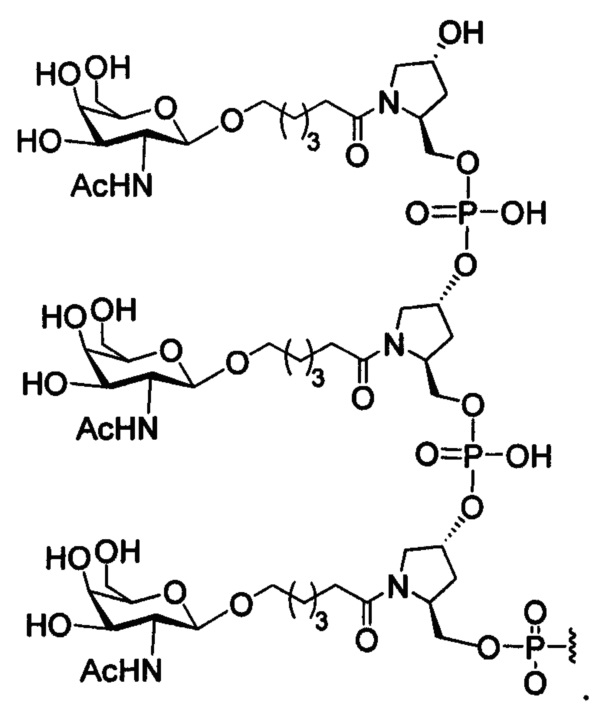
В некоторых вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:
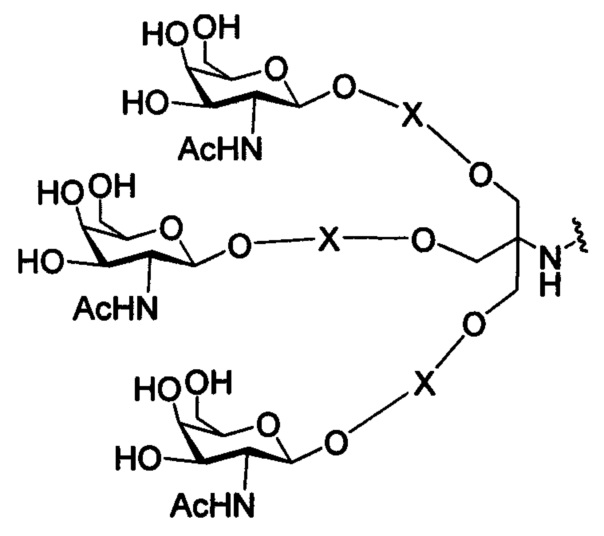
где X представляет собой замещенную или незамещенную связку из шести-одиннадцати последовательно связанных атомов.
В некоторых вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где X представляет собой замещенную или незамещенную связку из десяти последовательно связанных атомов.
В некоторых вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:
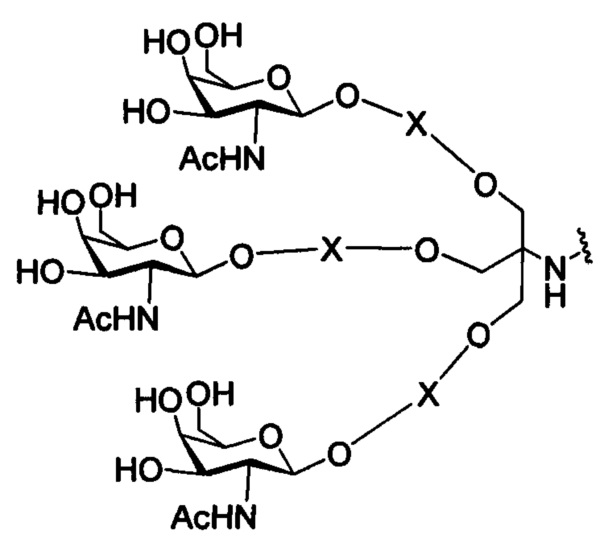
где X представляет собой замещенную или незамещенную связку из четырех-одиннадцати последовательно связанных атомов, и при этом указанная связка содержит только одну амидную связь.
В некоторых вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где Y и Z независимо выбраны из С1-С12 замещенной или незамещенной алкильной, алкенильной или алкинильной группы или группы, содержащей эфир, кетон, амид, сложный эфир, карбамат, амин, пиперидин, фосфат, фосфодиэфир, тиофосфат, триазол, пирролидин, дисульфид или тиоэфир.
В некоторых таких вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где Y и Z независимо выбраны из С1-С12 замещенной или незамещенной алкильной группы или группы, содержащей только один эфир или только два эфира, амид, амин, пиперидин, фосфат, фосфодиэфир или тиофосфат.
В некоторых таких вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где Y и Z независимо выбраны из С1-С12 замещенной или незамещенной алкильной группы.
В некоторых таких вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где тип независимо выбраны из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 и 12.
В некоторых таких вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:
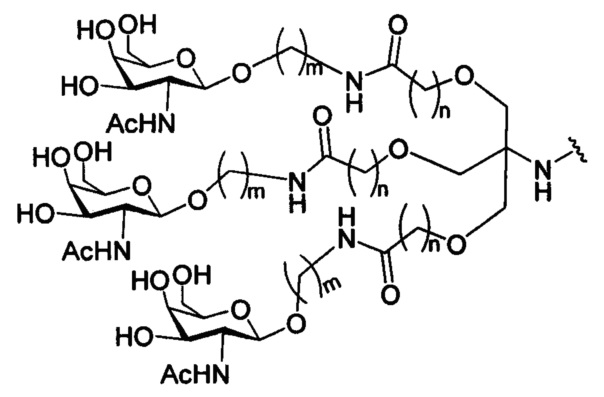
где m равен 4, 5, 6, 7 или 8, и n равен 1, 2, 3 или 4.
В некоторых вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:
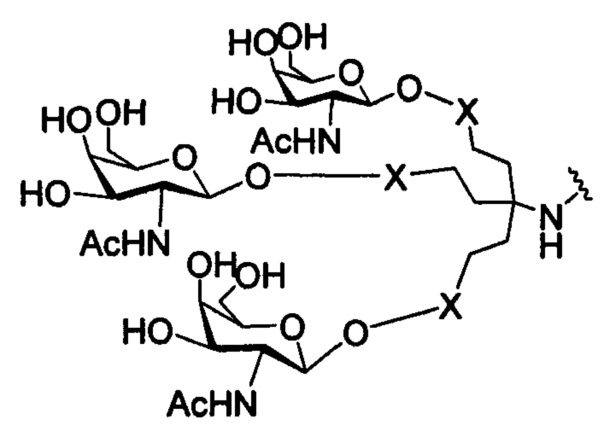
где X представляет собой замещенную или незамещенную связку из четырех-тринадцати последовательно связанных атомов, и при этом X не содержит эфирную группу.
В некоторых вариантах реализации фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:
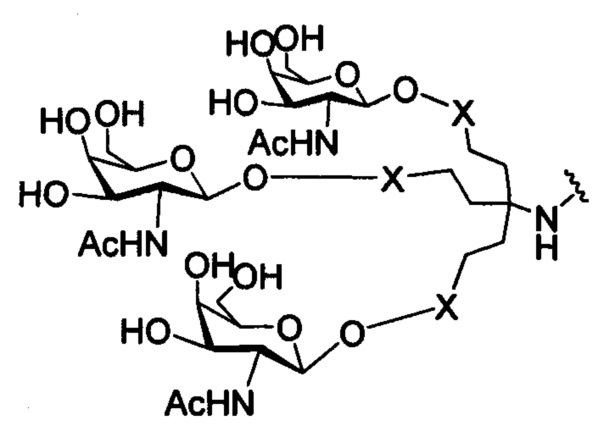
где X представляет собой замещенную или незамещенную связку из восьми последовательно связанных атомов, и при этом X не содержит простую эфирную группу.
В некоторых вариантах реализации изобретения фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где X представляет собой замещенную или незамещенную связку из от четырех до тринадцати последовательно связанных атомов, и при этом указанная связка содержит толькс одну амидную связь, и X не содержит простую эфирную группу.
В некоторых вариантах реализации изобретения фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где X представляет собой замещенную или незамещенную связку из от четырех до тринадцати последовательно связанных атомов, и при этом указанная связка состоит из амидной связи и замещенной или незамещенной С2-С11 алкильной группы.
В некоторых вариантах реализации изобретения фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:
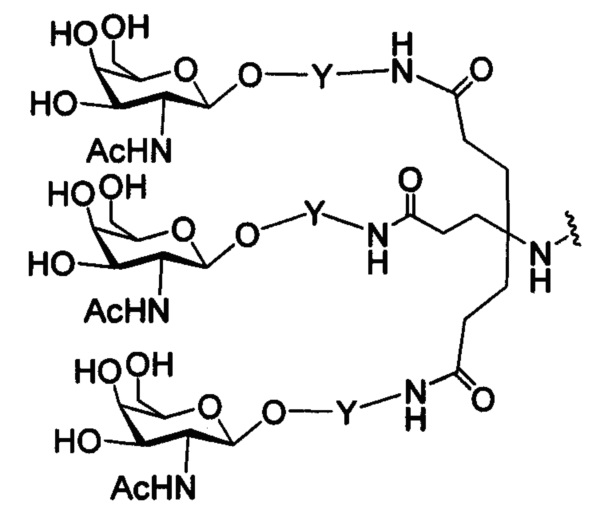
где Y выбран из С1-С12 замещенной или незамещенной алкильной, алкенильной или алкинильной группы или группы, содержащей простой эфир, кетон, амид, сложный эфир, карбамат, амин, пиперидин, фосфат, фосфодиэфир, тиофосфат, триазол, пирролидин, дисульфид или тиоэфир.
В некоторых таких вариантах реализации изобретения фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где Y выбран из С1-С12 замещенной или незамещенной алкильной группы или группы, содержащей простой эфир, амин, пиперидин, фосфат, фосфодиэфир или тиофосфат.
В некоторых таких вариантах реализации изобретения фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где Y выбран из С1-С12 замещенной или незамещенной алкильной группы.
В некоторых таких вариантах реализации изобретения фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:
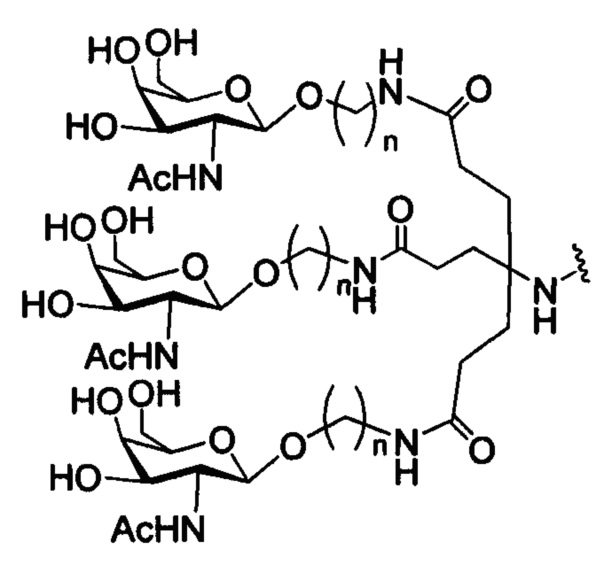
где n равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12.
В некоторых таких вариантах реализации изобретения фрагмент конъюгирующей группы, нацеливающий на клетку, имеет следующую структуру:

где n равен 4, 5, 6, 7 или 8.
b. Некоторые конъюгированные антисмысловые соединения
В некоторых вариантах реализации конъюгаты связаны с нуклеозидом антисмыслового олигонуклеотида в 2', 3' или 5' положении нуклеозида. В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет следующую структуру:

где
А представляет собой антисмысловый олигонуклеотид;
В представляет собой расщепляемый фрагмент
С представляет собой конъюгирующий линкер
D представляет собой группу ветвления
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет следующую структуру:
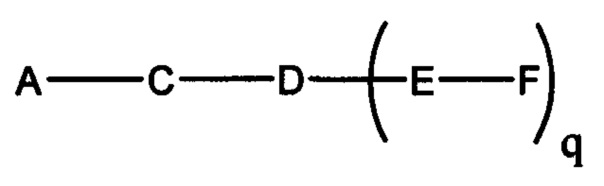
где
А представляет собой антисмысловый олигонуклеотид;
С представляет собой конъюгирующий линкер
D представляет собой группу ветвления
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых таких вариантах реализации конъюгирующий линкер содержит по меньшей мере одну расщепляемую связь.
В некоторых таких вариантах реализации группа ветвления содержит по меньшей мере одну расщепляемую связь.
В некоторых вариантах реализации каждая связка содержит по меньшей мере одну расщепляемую связь.
В некоторых вариантах реализации конъюгаты связаны с нуклеозидом антисмыслового олигонуклеотида в 2', 3' или 5' положении нуклеозида.
В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет следующую структуру:
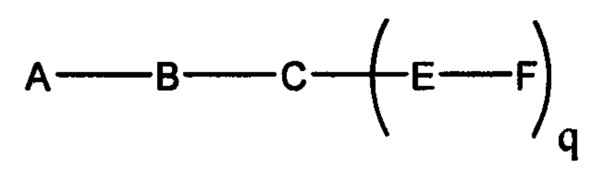
где
А представляет собой антисмысловый олигонуклеотид;
В представляет собой расщепляемый фрагмент
С представляет собой конъюгирующий линкер
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации конъюгаты связаны с нуклеозидом антисмыслового олигонуклеотида в 2', 3' или 5' положении нуклеозида. В некоторых вариантах реализаиии конъюгированное антисмысловое соединение имеет следующую структуру:
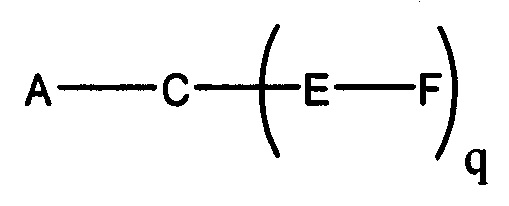
где
А представляет собой антисмысловый олигонуклеотид;
С представляет собой конъюгирующий линкер
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет следующую структуру:
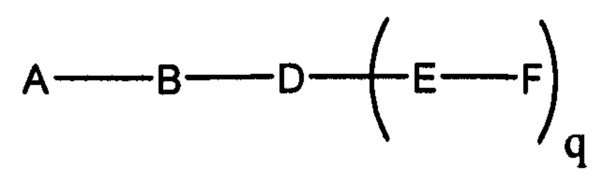
где
А представляет собой антисмысловый олигонуклеотид;
В представляет собой расщепляемый фрагмент
D представляет собой группу ветвления
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет следующую структуру:

где
А представляет собой антисмысловый олигонуклеотид;
D представляет собой группу ветвления
каждый Е представляет собой связку;
каждый F представляет собой лиганд; и
q представляет собой целое число от 1 до 5.
В некоторых таких вариантах реализации конъюгирующий линкер содержит по меньшей мере одну расщепляемую связь.
В некоторых вариантах реализации каждая связка содержит по меньшей мере одну расщепляемую связь.
В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет структуру, выбранную из следующих:

В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет структуру, выбранную из следующих:
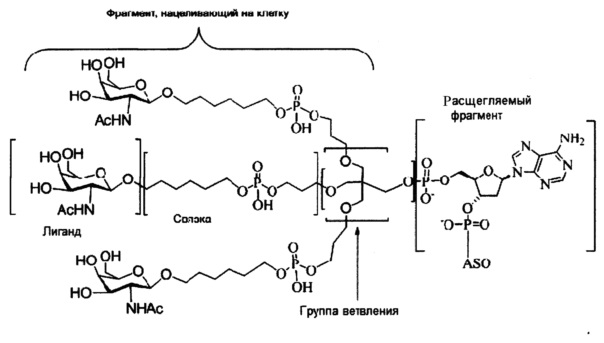
В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет структуру, выбранную из следующих:

В некоторых вариантах реализации конъюгированное антисмысловое соединение имеет следующую структуру:

Типичные патенты Соединенных штатов Америки, публикации патентных заявок Соединенных штатов Америки и публикации международных патентных заявок, в которых описано получение некоторых из указанных выше конъюгатов, конъюгированных антисмысловых соединений, связок, линкеров, групп ветвления, лигандов, расщепляемых фрагментов, а также других модификаций, включают, без ограничения, US 5994517, US 6300319, US 6660720, US 6906182, US 7262177, US 7491805, US 8106022, US 7723509, US 2006/0148740, US 2011/0123520, WO 2013/033230 и WO 2012/037254, каждая из которых включена в настоящий документ посредством ссылки в полном объеме.
Типичные публикации, в которых описано получение некоторых из указанных выше конъюгатов, конъюгированных антисмысловых соединений, связок, линкеров, групп ветвления, лигандов, расщепляемых фрагментов, а также других модификаций, включают, без ограничения, BIESSEN et al., "The Cholesterol Derivative of a Triantennary Galactoside with High Affinity for the Hepatic Asialoglycoprotein Receptor: a Potent Cholesterol Lowering Agent" J. Med. Chem. (1995) 38:1846-1852, BIESSEN et al., "Synthesis of Cluster Galactosides with High Affinity for the Hepatic Asialoglycoprotein Receptor" J. Med. Chem. (1995) 38:1538-1546, LEE et al., "New and more efficient multivalent glyco-ligands for asialoglycoprotein receptor of mammalian hepatocytes" Bioorganic & Medicinal Chemistry (2011) 19:2494-2500, RENSEN et al., "Determination of the Upper Size Limit for Uptake and Processing of Ligands by the Asialoglycoprotein Receptor on Hepatocytes in Vitro and in Vivo" J. Biol. Chem. (2001) 276(40):37577-37584, RENSEN et al., "Design and Synthesis of Novel N-Acetylgalactosamine-Terminated Glycolipids for Targeting of Lipoproteins to the Hepatic Asialoglycoprotein Receptor" J. Med. Chem. (2004) 47:5798-5808, SLIEDREGT et al., "Design and Synthesis of Novel Amphiphilic Dendritic Galactosides for Selective Targeting of Liposomes to the Hepatic Asialoglycoprotein Receptor" J. Med. Chem. (1999) 42:609-618 и Valentijn et al., "Solid-phase synthesis of lysine-based cluster galactosides with high affinity for the Asialoglycoprotein Receptor" Tetrahedron, 1997, 53(2), 759-770, каждая из которых включена в настоящий документ посредством ссылки в полном объеме.
В некоторых вариантах реализации конъюгированные антисмысловые соединения содержат олигонуклеотид на основе РНКазы Н (такой как гэпмер) или сплайс-модулирующий олигонуклеотид (такой как полностью модифицированный олигонуклеотид) и любую конъюгирующую группу, содержащую по меньшей мере одну, две или три группы GalNAc. В некоторых вариантах реализации конъюгированное антисмысловое Соединение содержит любую конъюгирующую группу, представленную в следующих ссылках: Lee, Carbohydr Res, 1978, 67, 509-514; Connolly et al., J Biol Chem, 1982, 257, 939-945; Pavia et al., Int J Pep Protein Res, 1983, 22, 539-548; Lee et al., Biochem, 1984, 23, 4255-4261; Lee et al., Glycoconjugate J, 1987, 4, 317-328; Toyokuni et al., Tetrahedron Lett, 1990, 31, 2673-2676; Biessen et al., J Med Chem, 1995, 38, 1538-1546; Valentijn et al., Tetrahedron, 1997, 53, 759-770; Kim et al., Tetrahedron Lett, 1997, 38, 3487-3490; Lee et al., Bioconjug Chem, 1997, 8, 762-765; Kato et al., Glycobiol, 2001, 11, 821-829; Rensen et al., J Biol Chem, 2001, 276, 37577-37584; Lee et al., Methods Enzymol, 2003, 362, 38-43; Westerlind et al., Glycoconj J, 2004, 21, 227-241; Lee et
al., Bioorg Med Chem Lett, 2006, 16(19), 5132-5135; Maierhofer et al., Bioorg Med Cherrt, 2007, 15, 7661-7676; Khorev et al., Bioorg Med Chem, 2008, 16, 5216-5231; Lee et al., Bidorg Med Chem, 2011, 19, 2494-2500; Kornilova et al., Analyt Biochem, 2012, 425, 43-46; Pujol et al., Angew Chemie Int Ed Engl, 2012, 51, 7445-7448; Biessen et al., J Med Chem, 1995, 38, 1846-1852; Sliedregt et al., J Med Chem, 1999, 42, 609-618; Rensen et al., J Med Chem, 2004, 47, 5798-5808; Rensen et al., Arterioscler Thromb Vasc Biol, 2006, 26, 169-175; van Rossenberg et al., Gene Ther, 2004, 11, 457-464; Sato et al., J Am Chem Soc, 2004, 126, 14013-14022; Lee et al., J Org Chem, 2012, 77, 7564-7571; Biessen et al., FASEB J, 2000, 14, 1784-1792; Rajur et al., Bioconjug Chem, 1997, 8, 935-940; Duff et al., Methods Enzymol, 2000, 313, 297-321; Maier et al., Bioconjug Chem, 2003, 14, 18-29; Jayaprakash et al., Org Lett, 2010, 12, 5410-5413; Manoharan, Antisense Nucleic Acid Drug Dev, 2002, 12, 103-128; Merwin et al., Bioconjug Chem, 1994, 5, 612-620; Tomiya et al., Bioorg Med Chem, 2013, 21, 5275-5281; Международные заявки WO 1998/013381; WO 2011/038356; WO 1997/046098; WO 2008/098788; WO 2004/101619; WO 2012/037254; WO 2011/120053; WO 2011/100131; WO 2011/163121; WO 2012/177947; WO 2013/033230; WO 2013/075035; WO 2012/083185; WO 2012/083046; WO 2009/082607; WO 2009/134487; WO 2010/144740; WO 2010/148013; WO 1997/020563; WO 2010/088537; WO 2002/043771; WO 2010/129709; WO 2012/068187; WO 2009/126933; WO 2004/024757; WO2010/054406; WO 2012/089352; WO 2012/089602; WO 2013/166121; WO 2013/165816; патенты США 4751219; 8552163; 6908903; 7262177; 5994517; 6300319; 8106022; 7491805; 7491805; 7582744; 8137695; 6383812;6525031; 6660720; 7723509; 8541548; 8344125; 8313772; 8349308; 8450467; 8501930; 8158601; 7262177; 6906182; 6620916; 8435491; 8404862; 7851615; опубликованные заявки на патент США US 2011/0097264; US 2011/0097265; US 2013/0004427; US 2005/0164235; US 2006/0148740; US 2008/0281044; US 2010/0240730; US 2003/0119724; US 2006/0183886; US 2008/0206869; US 2011/0269814; US 2009/0286973; US 2011/0207799; US 2012/0136042; US 2012/0165393; US 2008/0281041; US 2009/0203135; US 2012/0035115; US 2012/0095075; US 2012/0101148; US 2012/0128760; US 2012/0157509; US 2012/0230938; US 2013/0109817; US 2013/0121954; US 2013/0178512; US 2013/0236968; US 2011/0123520; US 2003/0077829; US 2008/0108801; и US 2009/0203132; каждая из которых включена посредством ссылки в полном объеме.
С. Некоторые применения и особенности
В некоторых вариантах реализации конъюгированные антисмысловые соединения демонстрируют эффективное снижение целевой РНК in vivo. В некоторых вариантах
реализации неконъюгированные антисмысловые соединения накапливаются в почках; В некоторых вариантах реализации конъюгированные антисмысловые соединения накапливаются в печени. В некоторых вариантах реализации конъюгированные антисмысловые соединения являются хорошо переносимыми. Такие свойства делают конъюгированные антисмысловые соединения особенно пригодными для ингибирования многих целевых РНК, включая, но не ограничиваясь ими, те, которые участвуют в метаболических, сердечно-сосудистых и других заболеваниях, расстройства или состояниях. Таким образом, в настоящем документе представлены способы лечения таких заболеваний, расстройств или состояний приведением тканей печени в контакт с конъюгированными антисмысловыми соединениями, нацеленными на РНК, связанные с такими заболеваниями, расстройствами или состояниями. Следовательно, представлены также способы улучшения любых из множества метаболических, сердечно-сосудистых и других заболеваний, расстройств или состояний при помощи конъюгированных антисмысловых соединений настоящего изобретения.
В некоторых вариантах реализации конъюгированные антисмысловые соединения являются более эффективными, чем неконъюгированные аналоги при определенной концентрации в ткани. Не ограничиваясь какой-либо теорией или механизмом, в некоторых вариантах реализации конъюгат может обеспечивать возможность более эффективного вхождения конъюгированного антисмыслового соединения в клетку или возможность более продуктивного вхождения в клетку. Например, в некоторых вариантах реализации конъюгированные антисмысловые соединения могут демонстрировать более значительное снижение мишени, по сравнению с неконъюгированным аналогом, при этом и конъюгированное антисмысловое соединение, и его неконъюгированный аналог находятся в ткани в одинаковых концентрациях. Например, в некоторых вариантах реализации конъюгированные антисмысловые соединения могут демонстрировать более значительное снижение мишени, по сравнению с их неконъюгированным и аналогами, при этом и конъюгированное антисмысловое соединение, и его неконъюгированный аналог находятся в печени в одинаковых концентрациях.
Ранее был рассмотрен продуктивный и непродуктивный захват олигонуклеотидов (см., например, Geary, R.S., Е. Wancewicz, et al. (2009). "Effect of Dose and Plasma Concentration on Liver Uptake and Pharmacologic Activity of а 2'-Methoxyethyl Modified Chimeric Antisense Oligonucleotide Targeting PTEN." Biochem. Pharmacol. 78(3): 284-91; и
Koller, Е., Т.М. Vincent, et al. (2011). "Mechanism of single-stranded phosphorothioate modified antisense oligonucleotide accumulation in hepatocytes." Nucleic Acids Res. 39(11): 4795-807). Конъюгирующие группы, описанные в настоящем документе, могут улучшать продуктивный захват.
В некоторых вариантах реализации конъюгирующие группы, описанные в настоящем документе, могут дополнительно усиливать эффективность за счет увеличения аффинности конъюгированного антисмыслового соединения к конкретному типу клетки или ткани. В некоторых вариантах реализации конъюгирующие группы, описанные в настоящем документе, могут дополнительно усиливать эффективность за счет увеличения распознавания конъюгированного антисмыслового соединения одним или более рецепторами клеточной поверхности. В некоторых вариантах реализации конъюгирующие группы, описанные в настоящем документе, могут дополнительно усиливать эффективность за счет облегчения эндоцитоза конъюгированного антисмыслового соединения.
В некоторых вариантах реализации расщепляемый фрагмент может дополнительно усиливать эффективность за счет обеспечения возможности расщепления конъюгата из антисмыслового олигонуклеотида после попадания конъюгированного антисмыслового соединения в клетку. Соответственно, в некоторых вариантах реализации конъюгированные антисмысловые соединения могут быть введены в более низких дозах, чем необходимы для неконъюгированных антисмысловых олигонуклеотидов.
Ранее в антисмысловые олигонуклеотиды уже были внедрены тиофосфатные связи. Такие тиофосфатные связи являются устойчивыми к нуклеазам и за счет этого улучшают стабильность олигонуклеотида. Кроме того, тиофосфатные связи связывают также некоторые белки, что приводит к накоплению антисмыслового олигонуклеотида в печени. Олигонуклеотиды с меньшим количеством тиофосфатных связей меньше накапливаются в печени и больше - в почках (см., например, Geary, R., "Pharmacokinetic Properties of 2'-O-(2-Methoxyethyl)-Modified Oligonucleotide Analogs in Rats," Journal of Pharmacology and Experimental Therapeutics, том 296, №3, 890-897; и Pharmacological Properties of 2'-O-Methoxyethyl Modified Oligonucleotides in Antisense а Drug Technology, глава 10, Crooke, S.Т., ред., 2008). В некоторых вариантах реализации олигонуклеотиды с меньшим количеством тиофсофатных межнуклеозидных связей и с большим количеством фосфодиэфирных межнуклеозидных связей меньше накапливаются в печени и больше - в почках. При лечении
заболеваний печени это нежелательно по нескольким причинам: (1) меньше лекарства попадает в центр желаемого действия (печень); (2) лекарство выводится с мочой; (3) почки подвергаются воздействию относительно высокой концентрации лекарства, что может приводить к токсичности в почках. Следовательно, для заболеваний печени тиофсофатные связи обеспечивают важное преимущество.
Однако в некоторых вариантах реализации введение олигонуклеотидов, равномерно связанных тиофсофатными межнуклеозидными связями, вызывает одну или более провоспалительных реакций. (См., например: J Lab Clin Med. 1996 Sep; 128(3):329-38. "Amplification of antibody production by phosphorothioate oligodeoxynucleotides". Branda et al.; и см. также, например: Toxicologic Properties in Antisense а Drug Technology, глава 12, страницы 342-351, Crooke, S.Т., ред., 2008). В некоторых вариантах реализации введение олигонуклеотидов, в которых большая часть межнуклеозидных связей содержит тиофосфатные межнуклеозидные связи, вызывает одну или более провоспалительных реакций.
В некоторых вариантах реализации степень провоспалительного эффекта может зависеть от нескольких переменных (например, модификация скелета, нецелевое действие, модификации азотистых оснований и/или модификации нуклеозида), см., например: Toxicologic Properties in Antisense а Drug Technology, глава 12, страницы 342-351, Crooke, S.Т., ред., 2008). В некоторых вариантах реализации степень провоспалительного эффекта может быть ослаблена за счет подбора одной или более переменных. Например, степень провоспалительного эффекта данного олигонуклеотида может быть ослаблена за счет замены любого количества тиофосфатных межнуклеозидных связей на фосфодиэфирные межнуклеозидные связи с уменьшением посредством этого общего количества тиофосфатных межнуклеозидных связей.
В некоторых вариантах реализации может быть желательно снизить количество тиофосфатных связей, если это может быть выполнено без потери стабильности и без сдвига распределения из печени в почки. Например, в некоторых вариантах реализации количество тиофосфатных связей может быть уменьшено за счет замены тиофосфатных связей на фосфодиэфирные связи. В таком варианте реализации антисмысловое соединение, имеющее меньшее количество тиофосфатных связей и большее количество фосфодиэфирных связей, может вызывать меньшее количество провоспалительных реакций или не вызывать
провоспалительных реакций. Хотя антисмысловое соединение, имеющее меньшее количество тиофосфатных связей и большее количество фосфодиэфирных связей, может вызывать меньшее количество провоспалительных реакций, антисмысловое соединение, имеющее меньшее количество тиофосфатных связей и большее количество фосфодиэфирных связей, может не накапливаться в печени и может быть менее эффективным в такси же или аналогичной дозе, по сравнению с антисмысловым соединением, имеющим большее количество тиофосфатных связей. Поэтому в некоторых вариантах реализации желательно разработать антисмысловое соединение, которое имеет множество фосфодиэфирных связей и множество тиофосфатных связей, но которое при этом обладает также стабильностью и хорошим распределением в печени.
В некоторых вариантах реализации конъюгированные антисмысловые соединения больше накапливаются в печени и меньше - в почках, чем неконъюгированные аналоги, даже если некоторые тиофосфатные связи заменены менее провоспалительными фосфодиэфирными межнуклеозидными связями. В некоторых вариантах реализации конъюгированные антисмысловые соединения больше накапливаются в печени и не так сильно выводятся с мочой, как их неконъюгированные аналоги, даже если некоторые тиофосфатные связи заменены менее провоспалительными фосфодиэфирными межнуклеозидными связями. В некоторых вариантах реализации применение конъюгата обеспечивает возможность разрабатывать более эффективные и лучше переносимые антисмысловые лекарства. Действительно, в некоторых вариантах реализации конъюгированные антисмысловые соединения имеют более широкий терапевтический индекс, чем неконъюгированные аналоги. Это позволяет вводить конъюгированное антисмысловое соединение в более высокой абсолютной дозе благодаря меньшему риску провоспалительной реакции и меньшему риску токсичности для почек. Такая более высокая доза дает возможность вводить дозу реже, поскольку ожидается такой же коэффициент очищения (метаболизм). Кроме того, поскольку соединение является более эффективным, как описано выше, то можно допускать снижение концентрации перед введением следующей дозы, без потери терапевтической активности, что обеспечивает еще более продолжительные периоды между введениями доз.
В некоторых вариантах реализации сохраняется необходимость во внедрении некоторого количества тиофосфатных связей. Например, концевые связи легко подвергаются действию экзонуклеаз, и поэтому в некоторых вариантах реализации эти связи представляют
собой тиофосфатные или другие модифицированные связи. Межнуклеозидные связи, соединяющие два дезоксинуклеозида, легко подвергаются действию эндонуклеаз, и поэтому в некоторых вариантах реализации эти связи представляют собой тиофосфатные или другие модифицированные связи. Межнуклеозидные связи между модифицированным нуклеозидом и дезоксинуклеозидом, где дезоксинуклеозид расположен на 5'-стороне связывающего дезоксинуклеозида, легко подвергаются действию эндонуклеаз, и поэтому в некоторых вариантах реализации эти связи представляют собой тиофосфатные или другие модифицированные связи. Межнуклеозидные связи между двумя модифицированными нуклеозидами определенных типов и между дезоксинуклеозидом и модифицированным нуклеозидом определенного типа, где модифицированный нуклеозид расположен на 5'-стороне линкера, являются достаточно устойчивыми к нуклеазному расщеплению, поэтому связь может быть фосфодиэфиром.
В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 16 тиофосфатных связей, В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 15 тиофосфатных связей. В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 14 тиофосфатных связей. В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 13 тиофосфатных связей. В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 12 тиофосфатных связей. В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 11 тиофосфатных связей. В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 10 тиофосфатных связей. В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 9 тиофосфатных связей. В некоторых вариантах реализации антисмысловый олигонуклеотид конъюгированного антисмыслового соединения содержит менее 8 тиофосфатных связей.
В некоторых вариантах реализации антисмысловые соединения, содержащие одну или более конъюгирующих групп, описанных в настоящем документе, обладают повышенной активностью и/или эффективностью, и/или переносимостью, по сравнению с
исходным антисмысловым соединением, не имеющим такой одной или нескольких конъюгирующих групп. Соответственно, в некоторых вариантах реализации присоединение таких конъюгирующих групп к олигонуклеотиду является желательным. Такие конъюгирующие группы могут быть присоединены на 5'- и/или 3'-конце олигонуклеотида. В некоторых случаях синтетически желательно присоединение на 5'-конце. Как правило, олигонуклеотиды синтезируют присоединением 3'-концевого нуклеозида к твердой подложке с последующим связыванием нуклеозидов от 3' к 5' при помощи методик, общеизвестных в данной области техники. Соответственно, если конъюгирующая группа необходима на 3'-конце, то можно (1) присоединить конъюгирующую группу к 3'-концевому нуклеозиду и присоединить этот конъюгированный нуклеозид к твердой подложке для последующего получения олигонуклеотида или (2) присоединить конъюгирующую группу к 3'-концевому нуклеозиду готового олигонуклеотида после синтеза. Ни один из этих подходов не является особенно эффективным, и поэтому оба они затратны. В частности, присоединение конъюгированного нуклеозида к твердой подложке, хотя и представлено в настоящем документе в разделе «Примеры», не является эффективным способом. В некоторых вариантах реализации присоединение конъюгирующие группы к 5'-концевому нуклеозиду синтетически проще, чем присоединение к 3'-концу. Можно присоединить неконъюгированный 3'-концевой нуклеозид к твердой подложке и получить олигонуклеотид по стандартным и хорошо описанным реакциям. Затем нужно лишь присоединить 5'-нуклеозид, имеющий конъюгирующую группу, на последней стадии связывания. В некоторых вариантах реализации это более эффективно, чем присоединение конъюгированного нуклеозида непосредственно к твердой подложке, как это обычно делают для получения 3'-конъюгированного олигонуклеотида. В представленных в настоящем документе Примерах показано присоединение к 5'-концу. Кроме того, некоторые конъюгирующие группы имеют синтетические преимущества. Например, некоторые конъюгирующие группы, содержащие фосфорные связывающие группы, получают синтетически проще и более эффективно, чем другие конъюгирующие группы, включая конъюгирующие группы, описанные ранее (например, WO/2012/037254).
В некоторых вариантах реализации конъюгированные антисмысловые соединения вводят субъекту. В таких вариантах реализации антисмысловые соединения, содержащие одну или более конъюгирующих групп, описанных в настоящем документе, обладают повышенной активностью и/или эффективностью, и/или переносимостью, по сравнению с
исходным антисмысловым соединением, не имеющим такой одной или нескольких конъюгирующих групп. Не ограничиваясь механизмом, предполагается, что конъюгирующая группа способствует распределению, доставке и/или поглощению в целевой клетке или ткани. В некоторых вариантах реализации, после попадания в целевую клетку или ткань желательно, чтобы вся или часть конъюгирующие группы расщеплялась с высвобождением активного олигонуклеотида. В некоторых вариантах реализации не обязательно, чтобы из олигонуклеотида расщеплялась вся конъюгирующая группа. Например, в Примере 20а конъюгированный олигонуклеотид вводили мышам и обнаруживали множество различных химических частиц, каждая из которых содержала различные части конъюгирующие группы, оставшиеся на олигонуклеотиде (Таблица 23а). Это конъюгированное антисмысловое соединение показало хорошую эффективность (Таблица 23). Так, в некоторых вариантах реализации такой метаболитный профиль многократного частичного расщепления конъюгирующие группы не влияет на активность/эффективность. Тем не менее, в некоторых вариантах реализации желательно, чтобы пролекарство (конъюгированный олигонуклеотид) давало одно активное соединение. В некоторых случаях, при обнаружении многочисленных форм активного соединения, может быть необходимо определить относительные количества и действие для каждой из них. В некоторых вариантах реализации, при необходимости регуляционного тестирования (например, FDA США или другого органа), желательно иметь одну (или преимущественно одну) активную частицу. В некоторых таких вариантах реализации желательно, чтобы такая одна активная частица представляла собой антисмысловый олигонуклеотид, не содержащий никаких частей конъюгирующие группы. В некоторых вариантах реализации конъюгирующие группы на 5'-конце более вероятно приводят к полному метаболизму конъюгирующие группы. Не ограничиваясь механизмом, может быть, что эндогенные ферменты, отвечающие за метаболизм на 5'-конце (например, 5'-нуклеазы), более активны/эффективны, чем 3'-аналоги. В некоторых вариантах реализации определенные конъюгирующие группы более подвержены метаболизму до одной активной частицы. В некоторых вариантах реализации некоторые конъюгирующие группы более подвержены метаболизму до олигонуклеотида.
D. Антисенс
В некоторых вариантах реализации олигомерные соединения настоящего изобретения представляют собой антисмысловые соединения. В таких вариантах реализации олигомерное соединение комплементарно целевой нуклеиновой кислоте. В некоторых
вариантах реализации целевая нуклеиновая кислота представляет собой РНК. В некоторых вариантах реализации целевая нуклеиновая кислота представляет собой некодирующую РНК. В некоторых вариантах реализации целевая нуклеиновая кислота кодирует белок. В некоторых вариантах реализации целевая нуклеиновая кислота выбрана из мРНК, пре-мРНК, микроРНК, некодирующей РНК, включая малую некодирующую РНК, и промотор-направляемой РНК. В некоторых вариантах реализации олигомерные соединения по меньшей мере частично комплементарны более чем одной целевой нуклеиновой кислоте. Например, олигомерные соединения настоящего изобретения могут представлять собой миметики микроРНК, которые обычно связываются с несколькими мишенями.
В некоторых вариантах реализации антисмысловые соединения содержат часть, имеющую последовательность азотистых оснований, которая по меньшей мере на 70% комплементарна последовательности азотистых оснований целевой нуклеиновой кислоты. 3 некоторых вариантах реализации антисмысловые соединения содержат часть, имеющую последовательность азотистых оснований, которая по меньшей мере на 80% комплементарна последовательности азотистых оснований целевой нуклеиновой кислоты. В некоторых вариантах реализации антисмысловые соединения содержат часть, имеющую последовательность азотистых оснований, которая по меньшей мере на 90% комплементарна последовательности азотистых оснований целевой нуклеиновой кислоты. В некоторых вариантах реализации антисмысловые соединения содержат часть, имеющую последовательность азотистых оснований, которая по меньшей мере на 95% комплементарна последовательности азотистых оснований целевой нуклеиновой кислоты. В некоторых вариантах реализации антисмысловые соединения содержат часть, имеющую последовательность азотистых оснований, которая по меньшей мере на 98% комплементарна последовательности азотистых оснований целевой нуклеиновой кислоты. В некоторых вариантах реализации антисмысловые соединения содержат часть, имеющую последовательность азотистых оснований, которая на 100% комплементарна последовательности азотистых оснований целевой нуклеиновой кислоты. В некоторых вариантах реализации антисмысловые соединения по меньшей мере на 70%, 80%, 90%, 95%, 98% или 100% комплементарны последовательности азотистых оснований целевой нуклеиновой кислоты по всей длине антисмыслового соединения.
Антисмысловые механизмы включают любой механизм, затрагивающий гибридизацию олигомерного соединения с целевой нуклеиновой кислотой, при этом
гибридизация приводит к биологическому эффекту. В некоторых вариантах реализации такая гибридизация приводит либо к разрушению, либо к применению целевой нуклеиновой кислоты с сопутствующим подавлением или стимулированием клеточного механизма, затрагивающего, например, трансляцию, транскрипцию или полиаденилированией целевой нуклеиновой кислоты или нуклеиновой кислоты, с которой целевая кислота может взаимодействовать иным образом.
Один из типов антисмыслового механизма, затрагивающий разрушение целевой РНК представляет собой антисмысл, опосредованный РНКазой Н. РНКаза Н представляет собой клеточную эндонуклеазу, которая расщепляет спираль РНК дуплекса РНК:ДНК. В данной области техники известно, что односпиральные антисмысловые соединения, которые являются «ДНК-подобными», вызывают активность РНКазы Н в клетках млекопитающих. Следовательно, активация РНКазы Н приводит к расщеплению РНК-мишени, посредством этого в значительной степени усиливая эффективность подавления генной экспрессии, опосредованного ДНК-подобным олигонуклеотидом.
Антисмысловые механизмы включают также, без ограничения, РНКи механизмы, в которых используется путь RISC. Такие РНКи механизмы включают, без ограничения, миРНК, оцРНК и микроРНК механизмы. Такие механизмы включают создание миметика микроРНК и/или анти-микро РНК.
Антисмысловые механизмы включают также, без ограничения, механизмы, которые гибридизуют или имитируют некодирующую РНК, отличную от микроРНК или мРНК. Такие некодирующие РНК включают, но не ограничиваются ими, промотор-нацеленную РНК и малую и длинную РНК, которая влияет на транскрипцию или трансляцию одной или более нуклеиновых кислот.
В некоторых вариантах реализации олигонуклеотиды, содержащие описанное в настоящем документе конъюгаты, представляют собой РНКи соединения. В некоторых вариантах реализации олигомерные олигонуклеотиды, содержащие описанные в настоящем документе конъюгаты, представляют собой оцРНК соединения. В некоторых вариантах реализации олигонуклеотиды, содержащие описанные в настоящем документе конъюгаты, спарены со вторым олигомерным соединением с образованием миРНК. В некоторых таких вариантах реализации второе олигомерное соединение также содержит конъюгат. В некоторых вариантах реализации второе олигомерное соединение представляет собой любую
модифицированную или немодифицированную нуклеиновую кислоту. В некоторых вариантах реализации олигонуклеотиды, содержащие описанные в настоящем документе конъюгаты, представляют собой антисмысловую цепь в миРНК соединении. В некоторых вариантах реализации олигонуклеотиды, содержащие описанные в настоящем документе конъюгаты, представляют собой смысловую цепь в миРНК соединении. В тех вариантах реализации, в которых конъюгированное олигомерное соединение представляет собой двухцепочечную миРНК, конъюгат может находиться на смысловой цепи, антисмысловой цепи или и на смысловой цепи, и на антисмысловой цепи.
С. Аполипопротеин (а) (аро(а))
В некоторых вариантах реализации конъюгированные антисмысловые соединения нацелены на любую нуклеиновую кислоту аро(а). В некоторых вариантах реализации целевая нуклеиновая кислота кодирует белок-мишень аро(а), который является клинически значимым. В таких вариантах реализации модулирование целевой нуклеиновой кислоты приводит к клиническому преимуществу.
Процесс нацеливания обычно включает определение по меньшей мере одной целевой области, сегмента или сайта в целевой нуклеиновой кислоте для антисмыслового взаимодействия с возникновением в результате такого желаемого эффекта.
В некоторых вариантах реализации целевая область представляет собой структурно определенную область нуклеиновой кислоты. Например, в некоторых таких вариантах реализации целевая область может охватывать 3' UTR, 5' UTR, экзон, интрон, кодирующую область, область инициации трансляции, область терминации трансляции или другую определенную область или целевой сегмент нуклеиновой кислоты.
В некоторых вариантах реализации целевой сегмент представляет собой часть целевой области по меньшей мере примерно из 8 азотистых оснований, на которую нацелено конъюгированное антисмысловое соединение. Целевые сегменты могут содержать последовательности ДНК или РНК, которые содержат по меньшей мере 8 смежных азотистых оснований от 5'-конца одного из целевых сегментов (остальные азотистые основания тянутся друг за другом из той же ДНК или РНК, начинаясь сразу перед 5'-концом целевого сегмента и продолжаясь до момента, когда ДНК или РНК будет содержать от около 8 до около 30 азотистых оснований). Целевые сегменты представлены также последовательности ДНК или РНК, которые содержат по меньшей мере 8 смежных
азотистых оснований от 3'-конца одного из целевых сегментов (остальные азотистые основания тянутся друг за другом из той же ДНК или РНК, начинаясь сразу после 3'-конца целевого сегмента и продолжаясь до момента, когда ДНК или РНК будет содержать от около 8 до около 30 азотистых оснований). Целевые сегменты также могут быть представлены последовательностями ДНК или РНК, которые содержат по меньшей мере 8 смежных азотистых оснований из внутренней части последовательности целевого сегмента, и могут тянуться в любом или в обоих направлениях до момента, когда конъюгированное антисмысловое соединение будет содержать от около 8 до около 30 азотистых оснований.
В некоторых вариантах реализации антисмысловые соединения, нацеленные на нуклеиновую кислоту аро(а), могут быть модифицированы так, как описано в настоящем документе. В некоторых вариантах реализации антисмысловые соединения могут иметь модифицированный сахарный фрагмент, модифицированный сахарный фрагмент или смесь модифицированных и немодифицированных сахарных фрагментов, как описано в настоящем документе. В некоторых вариантах реализации антисмысловые соединения могут иметь модифицированная межнуклеозидная связь, немодифицированная межнуклеозидная связь или смесь модифицированных и немодифицированных межнуклеозидных связей, как описано в настоящем документе. В некоторых вариантах реализации антисмысловые соединения могут иметь модифицированное азотистое основание, немодифицированное азотистое основание или смесь модифицированных и немодифицированных азотистых оснований, как описано в настоящем документе. В некоторых вариантах реализации антисмысловые соединения могут иметь мотив, описанный в настоящем документе.
В некоторых вариантах реализации антисмысловые соединения, нацеленные на нуклеиновые кислоты аро(а), могут быть конъюгированы так, как описано в настоящем документе.
Один белок аро(а) связан дисульфидной связью с одним белком аполипопротеина В (ароВ) с образованием частицы липопротеина (а) (Lp(а)). Белок аро(а) имеет высокую степень гомологии с плазминогеном, в частности, в повторяющемся крингл домене IV типа 2. Предполагается, что повторяющийся крингл домен в аро(а) может отвечать за его протромботические и антифибринолитические свойства, потенциально усиливая атеросклеротическое прогрессирование. Аро(а) транскрипционно регулируется посредством IL-6, и в исследованиях пациентов с ревматоидным артритом, проходивших лечение
ингибитором IL-6 (тоцилизумаб), уровни в плазме были снижены на 30% через 3 месяца лечения. Было показано, что Аро(а) предпочтительно связывает окисленные фосфолипиды и усиливает васкулярное воспаление. Кроме того, исследования позволяют предположить, что частица Lp(а) может также стимулировать эндотелиальную проницаемость, вызывать экспрессию ингибитора плазминогенного активатора типа 1 и активировать секрецию макрофагального интерлейкина-8. Важно, что в недавних исследованиях генетических ассоциаций было выявлено, что Lp(а) представляет собой независимый фактор риска для инфаркта миокарда, инсульта, болезни периферических сосудов и аневризма брюшной аорты. Кроме того, в исследовании ранней ишемической болезни сердца (PROCARDIS) ученые Clarke et al. описали достоверные и независимые связи между ишемической болезнью сердца и концентрациями Lp(а) в плазме. Кроме того, Solfrizzi et al. предположили, что повышенная концентрация Lp(а) в сыворотке может быть связана с повышенным риском болезни Альцгеймера (AD). Антисмысловые соединения, нацеленные на аро(а), были ранее описаны в WO 2005/000201 и US 2010-0331390, полное содержание которых включено в настоящий документ посредством ссылки. Антисмысловое олигонуклеиновое основание, нацеленное на Аро(а), ISIS-APOARx, было испытано на I фазе клинических испытаний, выполненных для изучения профиля его безопасности.
Некоторые конъюгированные антисмысловые соединения, нацеленные на нуклеиновую кислоту Аро(а)
В некоторых вариантах реализации изобретения конъюгированные антисмысловые соединения нацелены на нуклеиновую кислоту Аро(а), имеющую последовательность с номером доступа GENBANK® NM_005577.2, включенную в настоящий документ как SEQ ID NO: 1, с номером доступа GENBANK NT_007422.12, усеченную по нуклеотидам с 3230000 по 3380000, включенную в настоящий документ как SEQ ID NO: 2, с номером доступа GENBANK NT_025741.15, усеченную по нуклеотидам с 65120000 по 65258000, обозначенную в настоящем документе как SEQ ID NO: 3, и GENBANK с номером доступа NM_005577.1, включенную в настоящий документ как SEQ ID NO: 4. В некоторых таких вариантах реализации изобретения конъюгированное антисмысловое соединение по меньшей мере на 90%, по меньшей мере на 95% или на 100% комплементарно любой из последовательностей азотистых оснований SEQ ID NO: 1-4.
В некоторых вариантах реализации конъюгированное антисмысловое соединение, нацеленное на любую из последовательностей азотистых оснований SEQ ID NO: 1-4, содержит по меньшей мере 8 смежных последовательностей азотистых оснований, выбранных из любой из последовательностей азотистых оснований SEQ ID NO: 12-130, 133, 134. В некоторых вариантах реализации конъюгированное антисмысловое соединение, нацеленное на любую из SEQ ID NO: 1-4, содержит последовательность азотистых оснований, выбранную из любой из последовательностей азотистых оснований SEQ ID NO: 12-130, 133, 134.
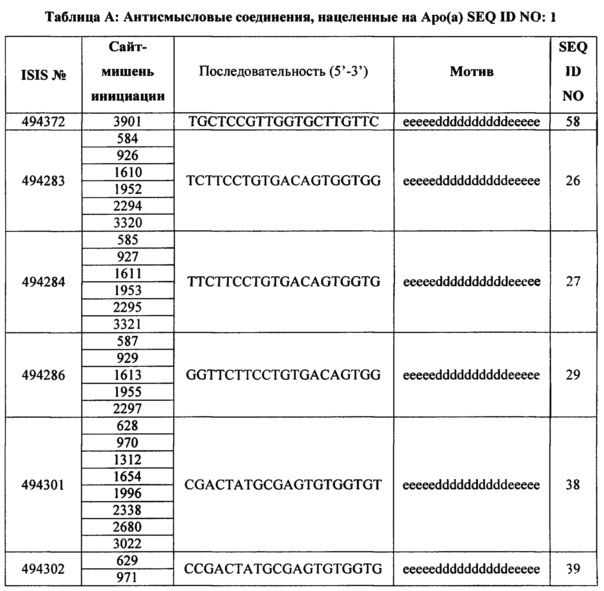

Терапевтические показания для Аро(а)
В некоторых вариантах реализации настоящего изобретения представлены способы применения конъюгированного антисмыслового соединения, нацеленного на нуклеиновую кислоту аро(а), для модулирования экспрессии аро(а) у субъекта. В некоторых вариантах реализации экспрессия аро(а) снижена.
В некоторых вариантах реализации в настоящем документе представлены способы лечения субъекта, включающие введение одной или более фармацевтических композиций, описанных в настоящем документе. В некоторых вариантах реализации настоящего изобретения представлены способы применения конъюгированного антисмыслового соединения, нацеленного на нуклеиновую кислоту аро(а), в фармацевтической композиции для лечения субъекта. В некоторых вариантах реализации изобретения индивидуум страдает от заболевания, связанного с аро(а). В некоторых вариантах реализации изобретения индивидуум страдает от заболевания, связанного с Lp(a). В некоторых вариантах реализации индивидуум страдает от воспалительного, сердечно-сосудистого и/или метаболического заболевания, расстройства или состояния.
В некоторых вариантах реализации субъект страдает от воспалительного, сердечнососудистого и/или метаболического заболевания, расстройства или состояния.
В некоторых вариантах реализации изобретения сердечно-сосудистые заболевания, расстройства или состояния включают, но не ограничиваются ими, стеноз аортального отверстия, аневризму (например, аневризма брюшной аорты), стенокардию, аритмию, атеросклероз, церебро-сосудистое заболевание, коронарно-артериальное заболевание, коронарную болезнь сердца, дислипидемию, гиперхолестеринемию, гиперлипидемию, гипертонию, гипертриглицеридемию, инфаркт миокада, болезнь периферических сосудов (например, болезнь периферической артерии), инсульт и т.п.
В некоторых вариантах реализации соединения, нацеленные на аро(а) и описанные в настоящем документе, модулируют физиологические маркеры или фенотипы сердечнососудистого заболевания, расстройства или состояния. Например, введение указанных
соединений животным может снижать уровни LDL и холестерина у этих животных, по сравнению с животными, не получавшими лечения. В некоторых вариантах реализации изобретения модулирование физологических маркеров или фенотипов может быть связано с ингибированием аро(а) указанными соединениями.
В некоторых вариантах реализации физиологические маркеры сердечно-сосудистого заболевания, расстройса или состояния могут быть определены количественно. Например, могут быть измерены и количественно определены уровни LDL или холестерина, например, стандартными тестами липидов. Для таких маркеров в некоторых вариантах реализации маркер может быть снижен на около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или на значение в диапазоне между любыми двумя из указанных значений.
В настоящем документе представлены также способы предупреждения, лечения или облегчения симптома, связанного с сердечно-сосудистым заболеванием, расстройством или состоянием, у субъекта, нуждающегося в этом. В некоторых вариантах реализации приведен способ снижения скорости возникновения симптома, связанного с сердечно-сосудистым заболеванием, расстройством или состоянием. В некоторых вариантах реализации приведен способ уменьшения тяжести симптома, связанного с сердечно-сосудистым заболеванием, расстройством или состоянием. В таких вариантах реализации указанные способы включают введение терапевтически эффективного количества соединения, нацеленного на нуклеиновую кислоту аро(а), индивидууму, нуждающемуся в этом.
Сердечно-сосудистое заболевание, расстройство или состояние может характеризоваться множеством физических симптомов. Любой симптом, известный специалистам в данной области, связанный с сердечно-сосудистым заболеванием, расстройством или состоянием, может быть предупрежден, вылечен, облегчен или иным образом изменен при помощи соединений и способов, описанных в настоящем документе. В некоторых вариантах реализации симптом быть любым из, но не ограничивается ими, стенокардии, боли в груди, одышки, учащенного сердцебиения, слабости, головокружение, тошноту, потоотделение, тахикардию, брадикардию, аритмию, мерцательной аритмии, опухания нижних конечностей, цианоза, усталости, обморока, онемения лица, онемения конечностей, хромоты или судорог мышц, вздутия живота или лихорадки.
В некоторых вариантах реализации метаболические заболевания, расстройства или состояния включают, но не ограничиваются ими, гипергликемию, преддиабет, диабет (I типа
и II типа), ожирение, инсулинорезистентность, метаболический синдром и диабетическую дислипидемию.
В некоторых вариантах реализации соединения, нацеленные на аро(а) и описанные в настоящем документе, модулируют физиологические маркеры или фенотипы метаболического заболевания, расстройства или состояния. Например, введение указанных соединений животным может снижать уровни глюкозы и инсулинорезистентность у этих животных, по сравнению с животными, не получавшими лечения. В некоторых вариантах реализации изобретения модулирование физологических маркеров или фенотипов может быть связано с ингибированием аро(а) указанными соединениями.
В некоторых вариантах реализации физиологические маркеры метаболического заболевания, расстройса или состояния могут быть определены количественно. Например, уровни глюкозы или инсулинорезистентность могут быть измерены и количественно определены стандартными тестами, известными в данной области техники. Для таких маркеров в некоторых вариантах реализации маркера может быть снижен на около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или на значение в диапазоне между любыми двумя из указанных значений. В другом примере чувствительность к инсулину может быть измерена и количественно определена стандартными тестами, известными в данной области техники. Для таких маркеров в некоторых вариантах реализации маркер может быть повышен на около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или на значение в диапазоне между любыми двумя из указанных значений.
В настоящем документе представлены также способы предупреждения, лечения или облегчения симптома, связанного с метаболическим заболеванием, расстройством или состоянием, у субъекта, нуждающегося в этом. В некоторых вариантах реализации приведен способ снижения скорости возникновения симптома, связанного с метаболическим заболеванием, расстройством или состоянием. В некоторых вариантах реализации приведен способ уменьшения тяжести симптома, связанного с метаболическим заболеванием, расстройством или состоянием. В таких вариантах реализации указанные способы включают введение терапевтически эффективного количества соединения, нацеленного на нуклеиновую кислоту аро(а), индивидууму, нуждающемуся в этом.
Метаболическое заболевание, расстройство или состояние может характеризоваться множеством физических симптомов. Любой симптом, известный специалистам в данной области, связанный с метаболическим заболеванием, расстройством или состоянием, может
быть предупрежден, вылечен, облегчен или иным образом изменен при помощи соединений и способов, описанных в настоящем документе. В некоторых вариантах реализации симптом может быть любым из, но не ограничивается ими, избыточного выделения мочи (полиурии), избыточной жажды и повышенного потребления жидкости (полидипсии), расплывчатого зрения, необъяснимой потери веса и летаргии.
В некоторых вариантах реализации воспалительные заболевания, расстройства или состояния включают, но не ограничиваются ими, стеноз аортального отверстия, коронарно-артериальную болезнь (CAD), болезнь Альцгеймера и тромбоэмболические заболевания, расстройства или состояния. Некоторые тромбоэмболические заболевания, расстройства или состояния включают, но не ограничиваются ими, инсульт, тромбоз, инфаркт миокарда и болезнь периферических сосудов.
В некоторых вариантах реализации соединения, нацеленные на аро(а) и описанные в настоящем документе, модулируют физиологические маркеры или фенотипы воспалительного заболевания, расстройства или состояния. Например, введение указанных соединений животным может снижать уровни воспалительных цитокинов или других воспалительных маркеров у этих животных, по сравнению с животными, не получавшими лечения. В некоторых вариантах реализации изобретения модулирование физологических маркеров или фенотипов может быть связано с ингибированием аро(а) указанными соединениями.
В некоторых вариантах реализации физиологические маркеры воспалительногозаболевания, расстройса или состояния могут быть определены количественно. Например, уровни цитокина могут быть измерены и определены количественно стандартными тестами, известными в данной области техники. Для таких маркеров в некоторых вариантах реализации маркер может быть снижен по меньшей мере на около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%, или на любое значение между двумя указанными значениями.
В настоящем документе представлены также способы предупреждения, лечения или облегчения симптома, связанного с воспалительным заболеванием, расстройством или состоянием, у субъекта, нуждающегося в этом. В некоторых вариантах реализации приведен способ снижения скорости возникновения симптома, связанного с воспалительным заболеванием, расстройством или состоянием. В некоторых вариантах реализации приведен способ уменьшения тяжести симптома, связанного с воспалительным заболеванием, расстройством или состоянием. В таких вариантах реализации указанные способы включают
введение терапевтически эффективного количества соединения, нацеленного на нуклеиновую кислоту аро(а), индивидууму, нуждающемуся в этом.
В некоторых вариантах реализации изобретения приведены способы лечения индивидуума с заболеванием, расстройством или состоянием, связанным с аро(а), включающие введение терапевтически эффективного количества одной или более фармацевтических композиций, описанных в настоящем документе. В некоторых вариантах реализации изобретения индивидуум страдает от повышенных уровней аро(а). В некоторых вариантах реализации изобретения приведены способы лечения индивидуума с заболеванием, расстройством или состоянием, связанным с Lp(a), включающие введение терапевтически эффективного количества одной или более фармацевтических композиций, описанных в настоящем документе. В некоторых вариантах реализации изобретения индивидуум страдает от повышенных уровней Lp(a). В некоторых вариантах реализации индивидуум страдает от воспалительного, сердечно-сосудистого и/или метаболического заболевания, расстройства или состояния. В некоторых вариантах реализации введение терапевтически эффективного количества антисмыслового соединения, нацеленного на нуклеиновую кислоту аро(а), сопровождают наблюдением уровней аро(а) или Lp(a) В некоторых вариантах реализации изобретения введение терапевтически эффективного количества антисмыслового соединения, нацеленного на нуклеиновую кислоту аро(а), сопровождают наблюдением маркеров воспалительного, сердечно-сосудистого и/или метаболического заболевания, или другого болезненного процесса, связанного с экспрессией аро(а), для определения реакции индивидуума на антисмысловое соединение. Реакцию индивидуума на введение антисмыслового соединения, нацеленного на аро(а), врач может использовать для определения количества и продолжительности терапевтического вмешательствас применением указанного соединения.
В некоторых вариантах реализации изобретения введение антисмыслового соединения, нацеленного на нуклеиновую кислоту аро(а), приводит к снижению экспрессии аро(а) по меньшей мере на около 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%, или на любое значение в диапазоне между двумя указанными значениями. В некоторых вариантах реализации экспрессия аро(а) снижается до по меньшей мере ≤100 мг/дл, ≤90 мг/дл, ≤80 мг/дл, ≤70 мг/дл, ≤60 мг/дл, ≤50 мг/дл, ≤40 мг/дл, ≤30 мг/дл, ≤20 мг/дл или ≤10 мг/дл.
В некоторых вариантах реализации изобретения введение антисмыслового соединения, нацеленного на нуклеиновую кислоту Lp(a), приводит к снижению экспрессии аро(а) по меньшей мере на около 15%, 20%, 25%,
30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%, или на любое значение в диапазоне между двумя указанными значениями. В некоторых вариантах реализации экспрессия Lp(a) снижается до по меньшей мере ≤200 мг/дл, ≤190 мг/дл, ≤180 мг/дл, ≤175 мг/дл, ≤170 мг/дл, ≤160 мг/дл, ≤150 мг/дл, ≤140 мг/дл, ≤130 мг/дл, ≤120 мг/дл, ≤110 мг/дл, ≤100 мг/дл, ≤90 мг/дл, ≤80 мг/дл, ≤70 мг/дл, ≤60 мг/дл, ≤55 мг/дл, ≤50 мг/дл, ≤45 мг/дл, ≤40 мг/дл, ≤35 мг/дл, ≤30 мг/дл, ≤25 мг/дл, ≤20 мг/дл, ≤15 мг/дл или ≤10 мг/дл.
В некоторых вариантах реализации изобретения приведены способы применения конъюгированного антисмыслового соединения, нацеленного на нуклеиновую кислоту аро(а), при получении лекарственного средства. В некоторых вариантах реализации фармацевтические композиции, содержащие конъюгированное антисмысловое соединение, нацеленное на аро(а), используют для получения лекарственного средства для лечения пациента, страдающего или предрасположенного к воспалительному, сердечно-сосудистому и/илиметаболическому заболеванию, расстройству или состоянию.
Группы лечения аро(а)
Некоторые субъекты с высокими уровнями Lp(a) имеют значительный риск различных заболеваний (Lippi et al., Clinica Chimica Acta, 2011, 412:797-801; Solfrizz et al.). У многих субъектов с высокими уровнями Lp(a) текущее лечение не может обеспечивать снижение уровней Lp(a) до безопасных значений. Аро(а) играет важную роль в образовании Lp(a), поэтому снижение аро(а) может приводить к снижению Lp(a) и предотвращать, лечить или улучшать заболевание, связанное с Lp(a).
В некоторых вариантах реализации изобретения лечение при помощи соединений и способов, описанных в настоящем документе, показано для животных и людей с повышенными уровнями аро(а) и/или уровнями Lp(a). В некоторых вариантах реализации уровни аро(а) у человека составляют ≥10 мг/дл, ≥20 мг/дл, ≥30 мг/дл, ≥40 мг/дл, ≥50 мг/дл, ≥60 мг/дл, ≥70 мг/дл, ≥80 мг/дл, ≥90 мг/дл или ≥100 мг/дл. В некоторых вариантах реализации уровни Lp(a) у человека составляют ≥10 мг/дл, ≥15 мг/дл, ≥20 мг/дл, ≥25 мг/дл, ≥30 мг/дл, ≥35 мг/дл, ≥40 мг/дл, ≥50 мг/дл, ≥60 мг/дл, ≥70 мг/дл, ≥80 мг/дл, ≥90 мг/дл, ≥100 мг/дл, ≥110 мг/дл, ≥120 мг/дл, ≥130 мг/дл, ≥140 мг/дл, ≥150 мг/дл, ≥160 мг/дл, ≥170 мг/дл, ≥175 мг/дл, ≥180 мг/дл, ≥190 мг/дл, ≥200 мг/дл.
D. Некоторые Фармацевтические композиции
В некоторых вариантах реализации настоящего описания представлены фармацевтические композиции, содержащие одно или более антисмысловых соединений. В некоторых вариантах реализации такая фармацевтическая композиция содержит подходящий фармацевтически приемлемый разбавитель или носитель. В некоторых вариантах реализации фармацевтическая композиция содержит стерильный солевой раствор и одно или более
антисмысловых соединений. В некоторых вариантах реализации такая фармацевтическая композиция состоит из стерильного солевого раствора и одного или более антисмысловых соединений. В некоторых вариантах реализации стерильный солевой раствор представляет собой солевой раствор фармацевтической марки. В некоторых вариантах реализации фармацевтическая композиция содержит одно или более антисмысловых соединений и стерильную воду. В некоторых вариантах реализации фармацевтическая композиция состоит из одного или более антисмысловых соединений и стерильной воды. В некоторых вариантах реализации стерильный солевой раствор представляет собой воду фармацевтической марки. В некоторых вариантах реализации фармацевтическая композиция содержит одно или более антисмысловых соединений и фосфатно-солевой буферный раствор (PBS). В некоторых вариантах реализации фармацевтическая композиция состоит из одного или более антисмысловых соединений и фосфатно-солевого буферного раствора (PBS). В некоторых вариантах реализации стерильный солевой раствор представляет собой PBS фармацевтической марки.
В некоторых вариантах реализации антисмысловые соединения могут быть смешаны с фармацевтически приемлемыми активными и/или инертными веществами для получения фармацевтических композиций или составов. Композиции и способы составления фармацевтических композиций зависят от множества критериев, включая, но не ограничиваясь этим, способ введения, тяжесть заболевания или дозу, подлежащую введению.
Фармацевтические композиции, содержащие антисмысловые соединения, охватывают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров. В некоторых вариантах реализации фармацевтические композиции, содержащие антисмысловые соединения, содержат один или более олигонуклеотидов, которые при введении млекопитающему, включая человека, могут обеспечивать (прямо или косвенно) его биологически активный метаболит или остаток. Соответственно, например, настоящее описание относится также к фармацевтически приемлемым солям антисмысловых соединений, пролекарствам, фармацевтически приемлемым солям таких пролекарств и к другим биоэквивалентам. Подходящие фармацевтически приемлемые соли включают, но не ограничиваются ими, соли натрия и калия.
Пролекарство может включать внедрение дополнительных нуклеозидов у одного или обоих концов олигонуклеотида, которые расщепляются в организме под действием эндогенных нуклеаз с образованием активного антисмыслового олигонуклеотида.
В многочисленных способах в терапиях с нуклеиновыми кислотами были применены липидные фрагменты. В некоторых таких способах нуклеиновую кислоту вводят в предварительно сформированные липосомы или липоплексы, полученные из смесей катионных липидов и нейтральных липидов. В некоторых способах получают ДНК комплексы с моно- или поликатионными липидами без участия нейтрального липида. В некоторых вариантах реализации липидный фрагмент выбиран для улучшения распределения фармацевтического агента в определенной клетке или ткани. В некоторых вариантах реализации липидный фрагмент выбиран для улучшения распределения фармацевтического агента в жировой ткани. В некоторых вариантах реализации липидный фрагмент выбиран для улучшения распределения фармацевтического агента в мышечной ткани.
В некоторых вариантах реализации фармацевтические композиции, представленные в настоящем документе, содержат один или более модифицированных олигонуклеотидов и одно или более вспомогательных веществ. В некоторых таких вариантах реализации вспомогательные вещества выбраны из воды, солевых растворов, спирта, полиэтиленгликолей, желатина, лактозы, амилазы, стеарата магния, талька, кремниевой кислоты, вязкого парафина, гидроксиметилцеллюлозы и поливинилпирролидона.
В некоторых вариантах реализации фармацевтическая композиция, представленная в настоящем документе, содержит систему доставки. Примеры систем доставки включают, но не ограничиваются ими, липосомы и эмульсии. Некоторые системы доставки подходят для получения некоторых фармацевтических композиций, включая композиции, содержащие гидрофобные соединения. В некоторых вариантах реализации применяют некоторые органические растворители, такие как диметилсульфоксид.
В некоторых вариантах реализации фармацевтическая композиция, представленная в настоящем документе, содержит одну или более тканеспецифичных молекул доставки, предназначенных для доставки одного или более фармацевтических агентов настоящего описания в определенную ткань или типы клеток. Например, в некоторых вариантах реализации фармацевтические композиции включают липосомы, покрытые тканеспецифичным антителом.
В некоторых вариантах реализации фармацевтическая композиция, представленная в настоящем документе, содержит систему совместного растворителя. Некоторые такие системы совместных растворителей содержат, например, бензиловый спирт, неполярное поверхностно-активное вещество, смешиваемый с водой органический полимер и водную фазу. В некоторых вариантах реализации такие системы совместных растворителей применяют для гидрофобных соединений. Не ограничивающий пример такой системы совместных растворителей представляет собой система совместных растворителей VPD, которая представляет собой раствор абсолютного этанола, содержащего 3% масс./об. бензилового спирта, 8% масс./об. неполярного поверхностно-активного вещества Polysorbate 80™ и 65% масс./об. полиэтиленгликоля 300. Пропорции таких систем совместных растворителей могут существенно варьироваться без значителного изменения их характеристик растворимости и токсичности. Кроме того, может варьироваться сущность компонентов совместных растворителей: например, вместо Polysorbate 80™ могут быть применены другие поверхностно-активные вещества; может варьироваться размер фракции полиэтиленгликоля; вместо полиэтиленгликоля могут быть применены другие биосовместимые полимеры, например, поливинилпирролидон; и вместо декстрозы могут быть применены другие сахара или полисахариды.
В некоторых вариантах реализации фармацевтическую композицию, представленную в настоящем документе, получают для перорального введения. В некоторых вариантах реализации фармацевтические композиции получают для буккального введения.
В некоторых вариантах реализации фармацевтическую композицию получают для введения инъекцией (например, внутривенной, подкожной, внутримышечной и т.д.). В некоторых таких вариантах реализации фармацевтическая композиция содержит носитель и составлена в водном растворе, таком как вода или физиологически совместимые буферы, такие как раствор Хэнкса, раствор Рингера или физиологический солевой буфер. В некоторых вариантах реализации включены другие ингредиенты (например, ингредиенты, улучшающие растворимость или служащие консервантами). В некоторых вариантах реализации суспензии для инъекций получают при помощи подходящих жидких носителей, суспендирующих агентов и т.п. Некоторые фармацевтические композиции для инъекций представлены в форме разовой дозы, например, в ампулах, или в многодозовых контейнерах. Некоторые фармацевтические композиции для инъекций представляют собой суспензии, растворы или эмульсии в масляных или водных жидких носителях, и они могут содержать
вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Некоторые растворители, подходящие для применения в фармацевтических композициях для инъекций, включают, но не ограничиваются ими, липофильные растворители и жирные масла, такие как кунжутное масло, синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, и липосомы. Водные суспензии для инъекций могут содержать вещества, которые увеличивают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Такие суспензии могут также необязательно содержать подходящие стабилизаторы или агенты, которые увеличивают растворимость фармацевтических агентов с обеспечением возможности получения высококонцентрированных растворов.
В некоторых вариантах реализации фармацевтическую композицию получают для трансмукозального введения. В некоторых таких вариантах реализации в составе применяют пенетранты, соответствующие барьеру, через который необходимо проникнуть. Такие пенетранты общеизвестны в данной области техники.
В некоторых вариантах реализации фармацевтическая композиция, представленная в настоящем документе, содержит олигонуклеотид в терапевтически эффективном количестве. В некоторых вариантах реализации терапевтически эффективное количество является достаточным для предотвращения, облегчения или улучшения симптомов заболевания или для увеличения продолжительности жизни субъекта, подлежащего лечению. Определение терапевтически эффективного количества находится в пределах возможностей специалистов в данной области техники.
В некоторых вариантах реализации один или более модифицированных олигонуклеотидов, представленных в настоящем документе, составляют в виде пролекарства. В некоторых вариантах реализации при введении in vivo пролекарство химически превращается в биологически, фармацевтически или терапевтически более активную форму олигонуклеотида. В некоторых вариантах реализации пролекарства пригодны благодаря тому, что их проще вводить, чем соответствующую активную форму. Например, в некоторых случаях пролекарство может быть более биодоступным (например, при пероральном введении), чем соответствующая активная форма. В некоторых случаях пролекарство может обладать улучшенной растворимостью, по сравнению с соответствующей активной формой. В некоторых вариантах реализации пролекарства менее растворимы в воде, чем
соответствующая активная форма. В некоторых случаях такие пролекарства обладают превосходной передачей через клеточные мембраны, при этом растворимость в воде ухудшает их подвижность. В некоторых вариантах реализации пролекарство представляет собой сложный эфир. В некоторых таких вариантах реализации сложный эфир при введении метаболически гидролизуется до карбоновой кислоты. В некоторых случаях соединение, содержащее карбоновую кислоту, представляет собой соответствующую активную форму. В некоторых вариантах реализации пролекарство содержит короткий пептид (полиаминокислоту), связанный с кислотной группой. В некоторых таких вариантах реализации пептид расщепляется при введении с образованием соответствующей активной формы.
В некоторых вариантах реализации настоящего описания представлены композиции и способы снижения количества или активности целевой нуклеиновой кислоты в клетке. В некоторых вариантах реализации клетка находится у животного. В некоторых вариантах реализации животное представляет собой млекопитающее. В некоторых вариантах реализации животное представляет собой грызуна. В некоторых вариантах реализации животное представляет собой примата. В некоторых вариантах реализации животное представляет собой примата, не являющегося человеком. В некоторых вариантах реализации животное представляет собой человека.
В некоторых вариантах реализации настоящего описания представлены способы введения животному фармацевтической композиции, содержащей олигонуклеотид настоящего описания. Подходящие способы введения включают, но не ограничиваются ими, пероральный, ректальный, трансмукозальный, интестинальный, энтеральный, местный, суппозитории, через ингаляции, интратекальный, интрацеребровентрикулярный, внутрибрюшинный, интраназальный, интраокулярный, внутриопухолевый и парентеральный (например, внутривенный, внутримышечный, интрамедуллярный и подкожный). В некоторых вариантах реализации вводят фармацевтические интратекальные средства для достижения местного, а не системного воздействия. Например, фармацевтические композиции могут быть введены инъекцией непосредственно в область желаемого эффекта (например, в печень).
Неограничивающее описание и включение посредством ссылки
Несмотря на то, что некоторые соединения, композиции и способы, описанные в настоящем документе, были подробно описаны в соответствии с некоторыми вариантами реализации изобретения, следующие примеры служат лишь для иллюстрации соединений, описанных в настоящем документе, и их не следует считать их ограничением. Каждая из ссылок, номера доступа GenBank и подобные ссылки, упоминаемые в настоящей заявке, включены в настоящий документ посредством ссылки в полном объеме.
Несмотря на то, что перечень последовательностей, сопровождающий этот файл, указывает каждую последовательность либо как «РНК», либо как «ДНК», по необходимости, в действительности эти последовательности могут быть модифицированы любой комбинацией химических модификаций. Специалистам в данной области техники понятно, что такое обозначение как «РНК» или «ДНК» для описания
модифицированных олигонуклеотидов, является в некоторых случаях произвольным. Например олигонуклеотид, содержащий нуклеозид, содержащий 2'-ОН сахарный фрагмент и тиминовое основание, может быть описан как ДНК, имеющая модифицированный сахар (2'-ОН вместо природного 2'-Н в ДНК) или как РНК, имеющая модифицированное основание (тимин (метилированный урацил) вместо природного урацила в РНК).
Соответственно, последовательности нуклеиновых кислот, представленные в настоящем документе, включая, но не ограничиваясь ими, последовательности в перечне последовательностей, предназначены для охвата нуклеиновых кислот, содержащих любую комбинацию природных или модифицированных РНК и/или ДНК, включая, но не ограничиваясь ими, такие нуклеиновые кислоты, которые содержат модифицированные азотистые основания. В качестве дополнительного примера и без ограничения, олигонуклеотид, содержащий последовательность азотистых оснований «ATCGATCG», хватывает любые олигонуклеотиды, имеющие такую последовательность азотистых оснований, модифицированных или немодифицированных, включая, но не ограничиваясь ими, такие соединения, которые содержат РНК основания, такие как те, которые имеют последовательность «AUCGAUCG», и те, которые имеют некоторые ДНК основания и некоторые РНК основания, такие как «AUCGATCG», а также олигонуклеотиды, имеющие другие модифицированные основания, такие как «ATmeCGAUCG», гдеmeС означает цитозиновое основание, содержащее метиловую группу в 5-положении.
Примеры
Следующие примеры иллюстрируют некоторые варианты реализации настоящего описания и не являются ограничивающими. Более того, если представлены конкретные варианты реализации, авторы изобретения подразумевают общее применение указанных конкретных вариантов реализации. Например, описание олигонуклеотида, содержащего конкретный мотив, дает обоснованное основание для дополнительных олигонуклеотидов, содержащих такой же или похожий мотив. И, например, если конкретная высокоаффинная модификация возникает в определенном положении, то в этом же положении считаются подходящими другие высокоаффинные модификации, если не указано иное.
Пример 1. Общий способ получения фосфорамидитов, Соединений 1, 1а и 2
Вх представляет собой гетероциклическое основание
Соединения 1, 1a и 2 получили по методикам, общеизвестным в данной области техники, описанным в данном описании (см. Seth et al., Bioorg. Med. Chem., 2011, 21(4), 1122-1125, J. Org. Chem., 2010, 75(5), 1569-1581, Nucleic Acids Symposium Series, 2008, 52(1), 553-554); и см. также опубликованные Международные заявки РСТ (WO 2011/115818, WO 2010/077578, WO 2010/036698, WO 2009/143369, WO 2009/006478 и WO 2007/090071) и патент США 7569686).
Пример 2. Получение Соединения 7
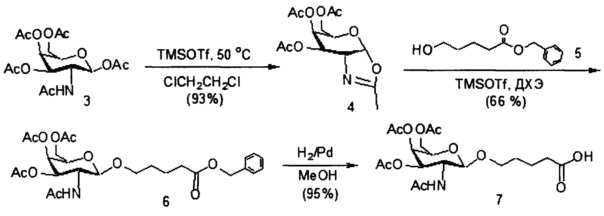
Соединение 3 (2-ацетамидо-1,3,4,6-тетра-O-ацетил-2-дезокси-β-D-галактопираноза или галактозамина пентаацетат) коммерчески доступно. Соединение 5 получили по опубликованным методикам (Weber et al., J. Med. Chem., 1991, 34, 2692).
Пример 3. Получение Соединения 11
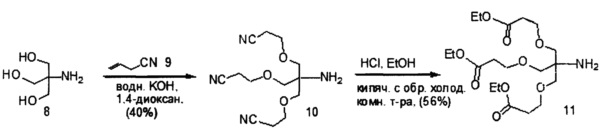
Соединения 8 и 9 коммерчески доступны.
Пример 1. Получение Соединения 18

Соединение 11 получили по методикам, описанным в Примере 3. Соединение 14 коммерчески доступно. Соединение 17 получили по такому же способу, как описан в публикации Rensen et al., J. Med. Chem., 2004, 47, 5798-5808.
Пример 1. Получение Соединения 23

Соединения 19 и 21 коммерчески доступны.
Пример 6. Получение Соединения 24

Соединения 18 и 23 получили так, как описано в способах в Примерах 4 и 5.
Пример 7. Получение Соединения 25

Соединение 24 получили по способам, представленным в Примере 6.

Соединение 24 получили по способам, представленным в Примере 6.
Пример 9. Общее получение конъюгированных ASO, содержащих GalNAc3-1 на 3'-конце, Соединения 29

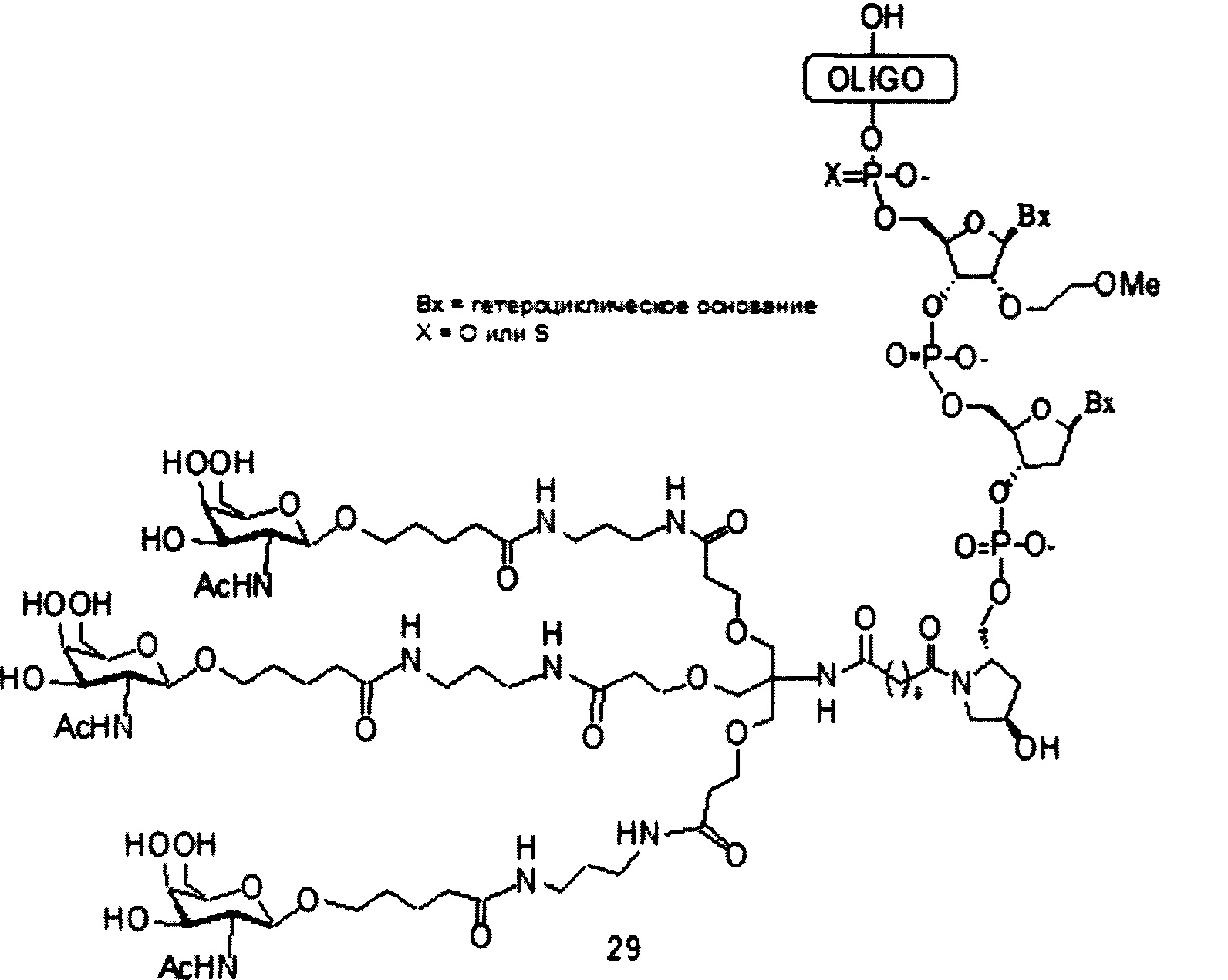
Где защищенный GalNAc3-1 имеет структуру:
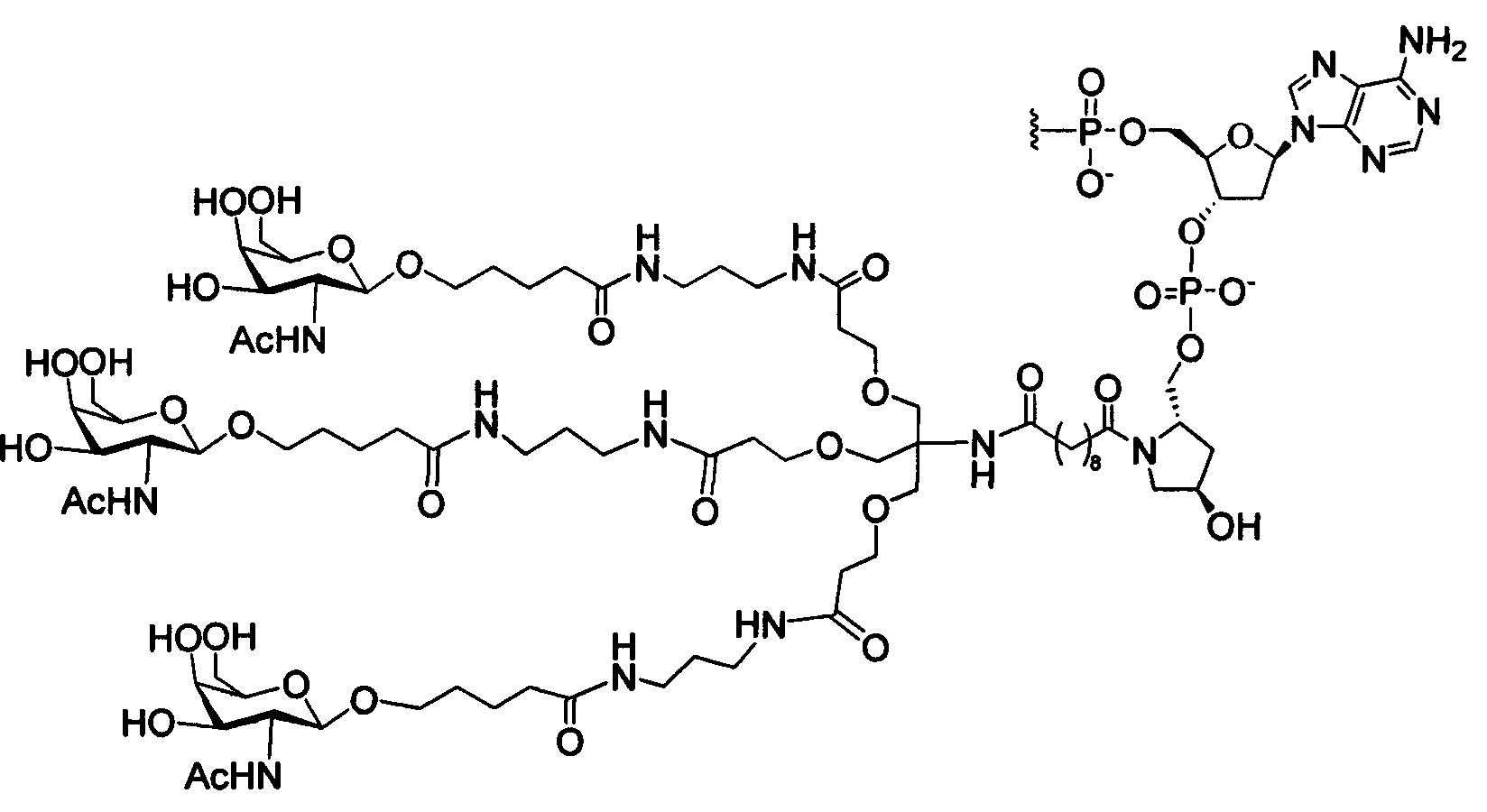
Кластерная часть GalNAc3 конъюгирующие группы GalNAc3-1 (GalNAc3-1a) может быть комбинирована с любым расщепляемым фрагментом с получением различных конъюгирующих групп. При этом GalNAc3-1a имеет формулу:

Твердую подложку, связывающую защищенный GalNAc3-1, Соединение 25, получили по способам, представленным в Примере 7. Олигомерное Соединение 29, содержащее GalNAc3-1 на 3'-конце, получили по стандартным методика в автоматическом синтезаторе ДНК/РНК (см. Dupouy et al., Angew. Chem. Int. ред., 2006, 45, 3623-3627). Фосфорамидитные строительные блоки, Соединения 1 и 1a, получили по способам, представленным в Примере 1. Изображенные фосфорамидиты являются типичными и не предназначены для ограничения, поскольку могут быть применены другие фосфорамидитные строительные блоки для получения олигомерных соединений, имеющих желаемую последовательность и состав. Порядок и количество фосфорамидитов, добавляемых к твердой подложке, может быть подобрано для получения разорванных олигомерных соединений, описанных в настоящем документе. Такие разорванные олигомерные соединения могут иметь заданный состав и последовательность оснований, продиктованную любой данной мишенью.
Пример 10. Общее получение конъюгированных ASO, содержащих GalNAc3-1 на 5'-конце, Соединения 34

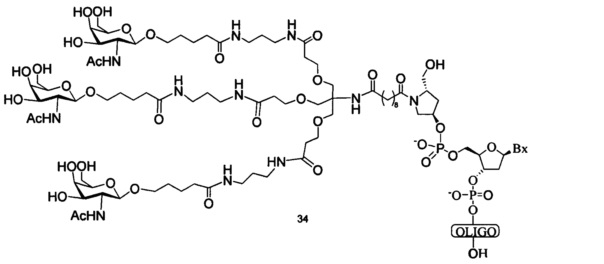
Unylinker™ 30 коммерчески доступно. Олигомерное соединение 34, содержащее кластер GalNAc3-1 на 5'-конце, получили по стандартным способам в автоматическом синтезаторе ДНК/РНК (см. Dupouy et al., Angew. Chem. Int. Ed., 2006, 45, 3623-3627). Фосфорамидитные строительные блоки, Соединения 1 и 1a, получили по способам, представленным в Примере 1. Изображенные фосфорамидиты являются типичными и не предназначены для ограничения, поскольку могут быть применены другие фосфорамидитные строительные блоки для получения олигомерного соединения, имеющего желаемую последовательность и состав. Порядок и количество фосфорамидитов, добавляемых к твердой подложке, может быть подобрано для получения разорванных олигомерных соединений, описанных в настоящем документе. Такие разорванные олигомерные соединения могут иметь заданный состав и последовательность оснований, продиктованную любой данной мишенью.
Пример 11. Получение Соединения 39

Соединения 4, 13 и 23 получили по способам, описанным в Примерах 2, 4 и 5. Соединение 35 получили по таким же способам, как описаны в публикации Rouchaud et al., Eur. J. Org. Chem., 2011, 12, 2346-2353.
Пример 12. Получение Соединения 40
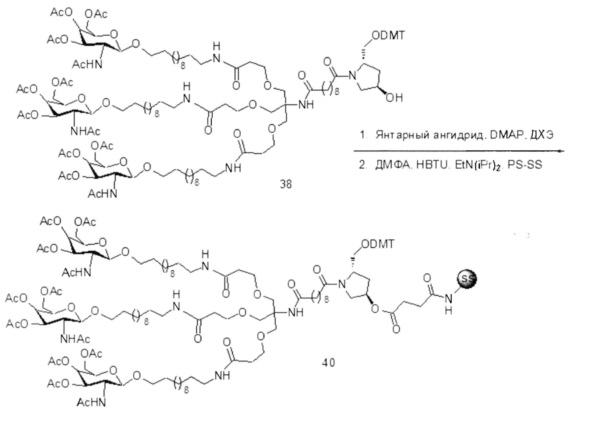
Соединение 38 получили по способам, представленным в Примере 11.
Пример 13. Получение Соединения 44
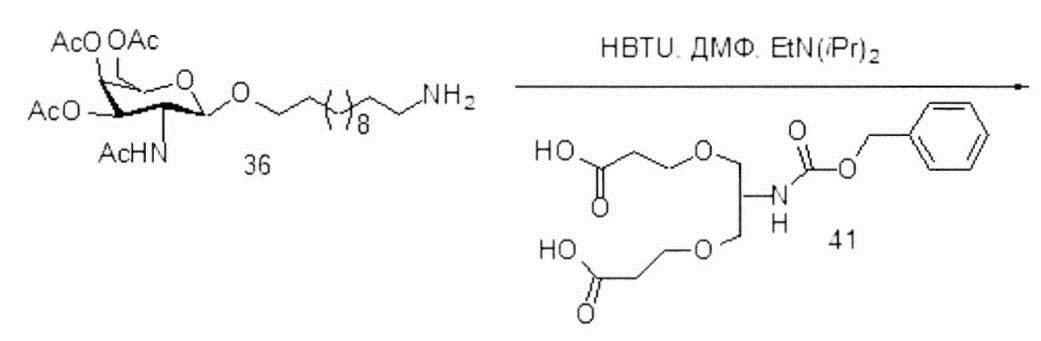
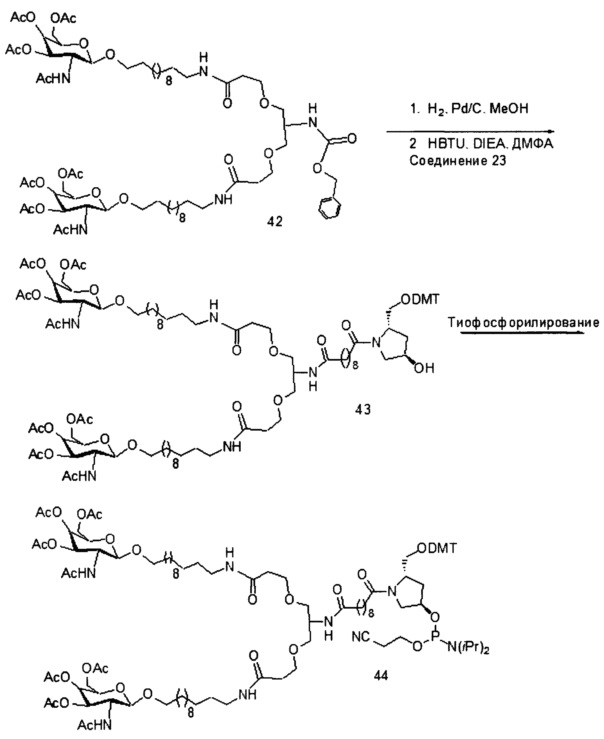
Соединения 23 и 36 получили по способам, представленным в Примерах 5 и 11. Соединение 41 получили по таким же способам, как описаны в публикации WO 2009082607.

Соединение 43 получили по способам, представленным в Примере 13.
Пример 15. Получение Соединения 47
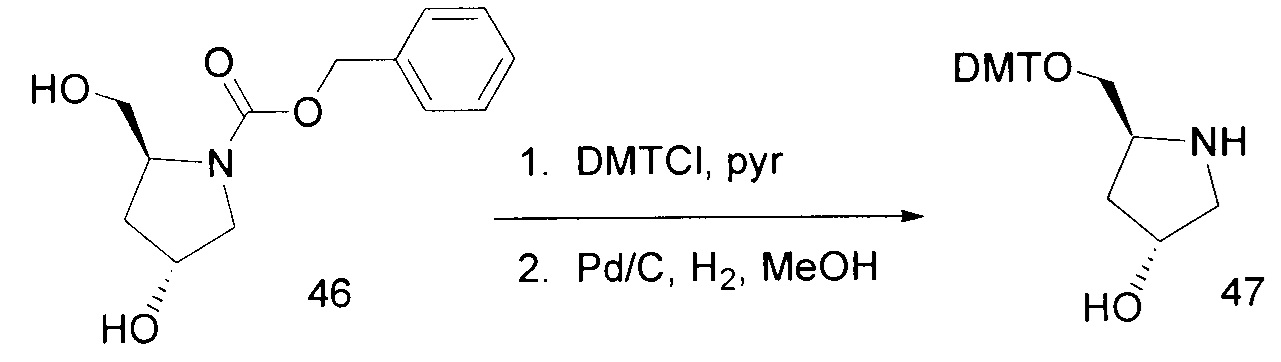
Соединение 46 коммерчески доступно.
Пример 16. Получение Соединения 53

Соединения 48 и 49 коммерчески доступны. Соединения 17 и 47 получили так, как описано в способах в Примерах 4 и 15.
Пример 17. Получение Соединения 54

Соединение 53 получили по способам, представленным в Примере 16.
Пример 18. Получение Соединения 55
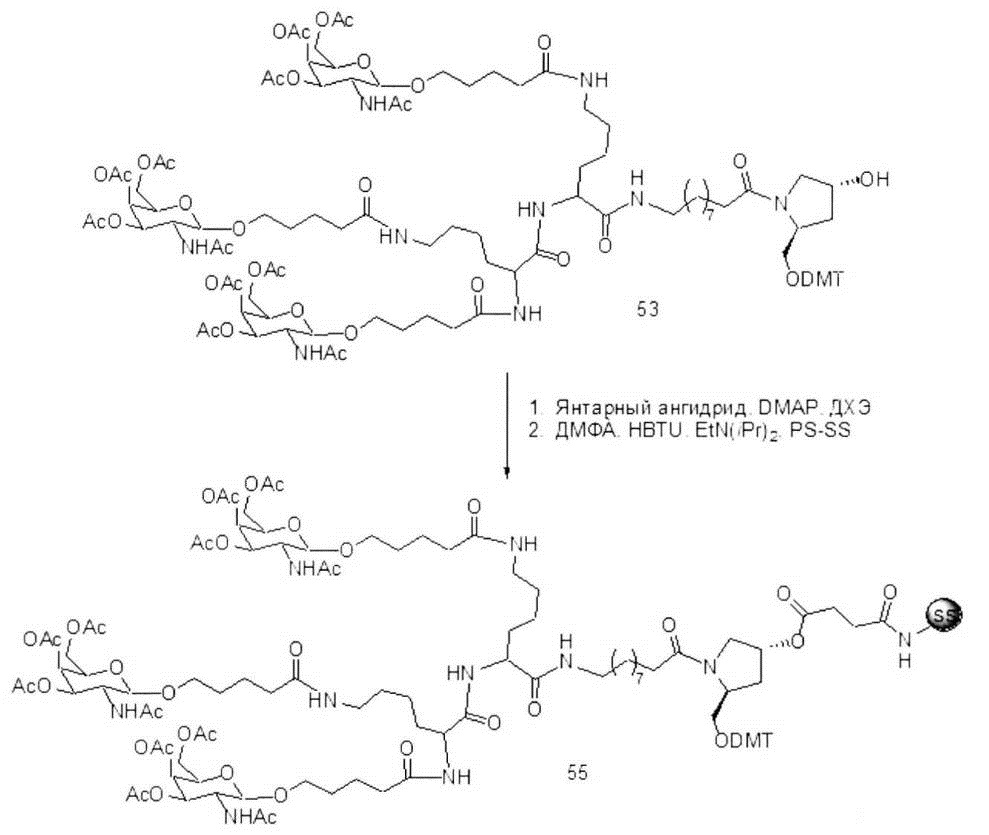
Соединение 53 получили по способам, представленным в Примере 16.
Пример 19. Общий способ получения конъюгированных ASO, содержащих GalNAc3-1 в 3'-положении, при помощи твердофазных методик (получение ISIS 647535, 647536 и 651900)
Если не указано иное, все реагенты и растворы, применяемые для синтеза олигомерных соединений, приобретены у коммерческих поставщиков. Стандартные фосфорамидитные строительные блоки и твердую подложку применили для внедрения нуклеозидных остатков, которые включают, например, остатки Т, A, G иmС. 0,1 М раствор фосфорамидита в безводном ацетонитриле применили для β-D-2'-дезоксирибонуклеозида и 2'-МОЕ.
Синтез антисмысловых олигонуклеотидов (ASO) выполнили на синтезаторе ABI 394 (в масштабе 1-2 мкмоль) или на синтезаторе
После сборки требуемой последовательности цианоэтил-фосфатные защитные группы снимали при помощи 1:1 (об./об.) смеси триэтиламина и ацетонитрила в течение 45 минут времени контакта. Связанные с твердой подложкой ASO суспендировали в водном растворе аммиака (28-30 масс. %) и нагревали при 55°С в течение 6 часов.
Затем отфильтровывали не связанные ASO и выпаривали аммиак кипячением. Остаток очищали жидкостной хроматографией высокого давления на сильной анионообменной колонке (GE Healthcare Bioscience, Source 30Q, 30 мкм, 2,54×8 см, А=100 мМ ацетата аммония в 30% водном CH3CN, В=1,5 М NaBr в А, 0-40% В за 60 мин., скорость потока 14 мл.мин-1, λ=260 нм). Остаток обессоливали при помощи ВЭЖХ на обращенно-фазовой колонке с получением заданных ASO с выделенным выходом 15-30% относительно первоначальной загрузки на твердую подложку. ASO характеризовали при помощи ион-парной ВЭЖХ, совмещенной с МС-анализом на системе Agilent 1100 MSD.
Антисмысловые олигонуклеотиды, не содержащие конъюгат, синтезировали по стандартным способам синтеза олигонуклеотидов, общеизвестным в данной области техники.
Применяя эти способы, получили три отдельных антисмысловых соединения, нацеленных на АроС III. Как показано ниже в Таблице 17, каждое из трех антисмысловых соединений, нацеленных на АроС III, имеет одну и ту же последовательность азотистых
оснований. ISIS 304801 представляет собой 5-10-5 МОЕ гэпмер, содержащий только тиофосфатные связи; ISIS 647535 является таким же, как ISIS 304801, за исключением того, что он содержит GalNAc3-1, конъюгированный у его 3'-конца; и ISIS 647536 является таким же, как ISIS 647535, за исключением того, что некоторые межнуклеозидные связи этого соединения представляют собой фосфодиэфирные связи. Как дополнительно показано в Таблице 17, были синтезированы два отдельных антисмысловых соединения, нацеленных на SRB-1. ISIS 440762 представляет собой 2-10-2 cEt гэпмер, содержащий только тиофосфатные межнуклеозидные связи; ISIS 651900 является таким же, как ISIS 440762, за исключением того, что он содержит GalNAc3-1 у его 3'-конца.

Нижние индексы: «е» означает 2'-МОЕ модифицированный нуклеозид; «d» означает β-D-2'-дезоксирибонуклеозид; «k» означает 6'-(S)-СН3 бициклический нуклеозид (например, сЕt); «s» означает тиофосфатные межнуклеозидные связи (PS); «о» означает фосфодиэфирные межнуклеозидные связи (РО); и «o'» означает -O-Р(=O)(ОН)-. Верхний индекс «m» означает 5-метилцитозины. «GalNAc3-1» означает конъюгирующую группу, имеющую структуру, изображенную ранее в Примере 9. Следует отметить, что GalNAc3-1 содержит расщепляемый аденозин, который связывает ASO с остальной частью конъюгата, который обозначен как «GalNAc3-1a». Номенклатура, используемая в представленной выше таблице, показывает полную последовательность азотистых оснований, включая аденозин, который является частью конъюгата. Следовательно, в представленной выше таблице последовательности
также могут быть перечислены с окончанием «GalNAc3-1», без «Аdo». Такое условное применение нижнего индекса «а» для обозначения части конъюгирующие группы, не содержащей расщепляемого нуклеозида или расщепляемого фрагмента, используется во всех представленных Примерах. Эта часть конъюгирующие группы, не содержащая расщепляемого фрагмента, упоминается в настоящем документе как «кластер» или «кластер конъюгата» или «кластер GalNAc3». В некоторых случаях конъюгирующая группа для удобства описана путем отдельного представления ее кластера и ее расщепляемого фрагмента.
Пример 20. Дозозависимое антисмысловое ингибирование человеческого АроС III у huApoC III трансгенных мышей
ISIS 304801 и ISIS 647535, каждый из которых нацелен на человеческий АроС III и описан выше, отдельно испытывали и оценивали в дозозависимом исследовании на их способность ингибировать человеческий АроС III у трансгенных мышей с человеческим АроС III.
Лечение
Трансгенных мышей с человеческим АроСIII содержали при 12-часовом цикле освещения/темноты и обеспечивали свободный доступ к пище Teklad lab. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Приготовили ASO в PBS и стерилизовали фильтрованием через фильтр 0,2 микрона. ASO растворили в 0,9% PBS для инъекций.
Трансгенным мышам с человеческим АроС III один раз в неделю в течение двух неделю внутрибрюшинно вводили инъекции ISIS 304801 или 647535 при 0,08, 0,25, 0,75, 2,25 или 6,75 мкмоль/кг или PBS в качестве контрольного образца. Каждая экспериментальная группа состояла из 4 животных. Через сорок восемь часов после введения последней дозы каждую мышь обескровили и усыпили, и собрали ткани.
Анализ мРНК АроС III
Уровни мРНК АроС III в печени мышей определили при помощи ПЦР в реальном времени и реагента для количественного определения РНК RIBOGREEN® (Molecular Probes, Inc. Юджин, штат Орегон) по стандартным протоколам. Уровни мРНК АроС III определяли
относительно общей РНК (при помощи Ribogreen), затем нормализовали к контрольному образцу, обработанному PBS. Результаты, показанные ниже, представлены как средний процент уровней мРНК АроС III для каждой экспериментальной группы, нормализованных к контрольному образцу, обработанному PBS, и обозначены как «% PBS». Ниже в Таблице 18 представлена также полумаксимальная эффективная доза (ED50) для каждого ASO.
Показано, что оба антисмысловых соединения снижают РНК АроС III, по сравнению с контрольным образцом, обработанным PBS. Кроме того, антисмысловое соединение, конъюгированное с GalNAc3-1 (ISIS 647535), было значительно более эффективным, чем антисмысловое соединение, не содержащее конъюгат GalNAc3-1 (ISIS 304801).
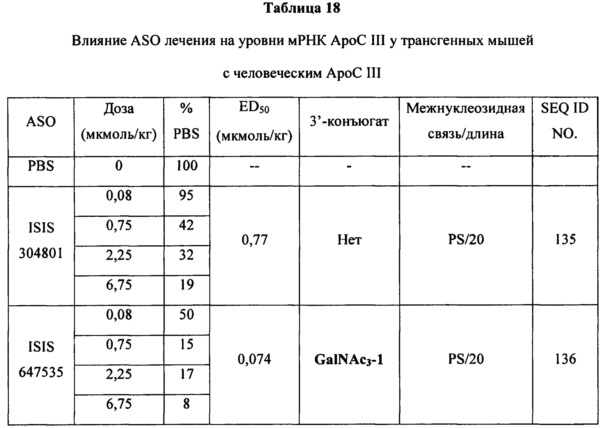
Анализ белка АроС III (турбидиметрический анализ)
Анализ белка АроС III в плазме выполнили по способам, описанным в работе Graham et al, Circulation Research, до печати опубликованной онлайн 29 марта 2013 года.
Приблизительно 100 мкл плазмы, выделенной из мышей, анализировали без разбавления, применяя клинический анализатор Olympus и имеющийся в продаже турбидиметрический аналитический набор АроС III (Kamiya, кат. № KAI-006, Kamiya Biomedical, Сиэтл, штат Вашингтон). Протокол анализа выполняли по описанию поставщика.
Как показано ниже в Таблице 19, оба антисмысловых соединения снижают белок АроС III, по сравнению с PBS контрольным образцом. Кроме того, антисмысловое соединение, конъюгированное с GalNAc3-1 (ISIS 647535), было значительно более эффективным, чем антисмысловое соединение, не содержащее конъюгат GalNAc3-1 (ISIS 304801).

Триглицериды и холестерин плазмы выделили по способу Bligh и Dyer (Bligh, E.G. аnd Dyer, W.J. Can. J. Biochem. Physiol. 37: 911-917, 1959) (Bligh, E and Dyer, W, Can J Biochem Physiol, 37, 911-917, 1959) (Bligh, E and Dyer, W, Can J Biochem Physiol, 37, 911-917, 1959) и измерили при помощи клинического анализатора Beckmann Coulter и имеющихся в продаже реагентов.
Уровни триглицеридов измерили относительно мышей, инъецированных PBS, и выразили как «% PBS». Результаты представлены в Таблице 20. Показано, что оба антисмысловых соединения снижают уровни триглицеридов. Кроме того, антисмысловое соединение, конъюгированное с GalNAc3-1 (ISIS 647535), было значительно, более эффективным, чем антисмысловое соединение, не содержащее конъюгат GalNAc3-1 (ISIS 304801).

Образцы плазмы анализировали при помощи ВЭЖХ для определения количества общего холестерина и различных фракций холестерина (HDL и LDL). Результаты представлены в Таблицах 21 и 22. Показано, что оба антисмысловых соединения снижают общие уровни холестерина; оба снижают LDL; и оба повышают HDL. Кроме того, антисмысловое соединение, конъюгированное с GalNAc3-1 (ISIS 647535), было значительно более эффективным, чем антисмысловое соединение, не содержащее конъюгат GalNAc3-1 (ISIS 304801). Увеличение уровней HDL и снижение уровней LDL представляет собой преимущественный сердечно-сосудистый эффект антисмыслового ингибирования-АроС III.

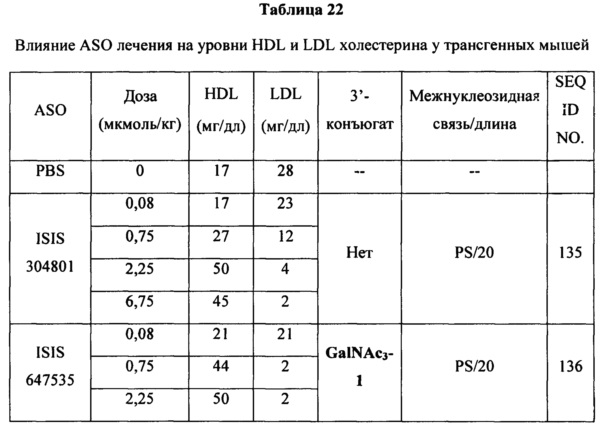

Фармакокинетический анализ (ФК)
Оценили также ФК ASO. Образцы печени и почек измельчили и экстрагировали по стандартным протоколам. Образцы анализировали на MSD1 при помощи ИП-ВЭЖХ-МС. Определили содержание (мкг/г) в ткани ISIS 304801 и 647535 полной длины, и результаты представлены в Таблице 23. Показано, что концентрации в печени антисмысловых соединений полной длины были схожими для двух антисмысловых соединений. Следовательно, даже несмотря на то, что GаINАс3-1-конъюгированное антисмысловое соединение является более активным в печени (как показано по данным РНК и белка, представленным выше), его содержание в печени не намного выше. Действительно, рассчитанное значение ЕС50 (представленное в Таблице 23) подтверждает, что наблюдаемое увеличение эффективности конъюгированного соединения не может быть приписано исключительно повышенному накоплению. Такой результат позволяет предположить, что конъюгат улучшает эффективность по другому механизму, чем простое накопление в печени, возможно за счет увеличения продуктивного захвата антисмыслового соединения в клетки.
Эти результаты показывают также, что концентрация GalNAc3-1-конъюгированного антисмыслового соединения почках ниже, чем концентрация антисмыслового соединения, не содержащего конъюгат GalNAc. Это имеет несколько преимущественных терапевтически, применений. Для терапевтических показаний, в которых не требуется проявление активности в почках, воздействие на почки подвергает их риску токсичности без соответствующей пользы. Более того, высокая концентрация в почках обычно приводит к выводу соединения с мочой, обеспечивая более быстрое выведение. Соответственно, для внепочечных мишеней накопление в почках является нежелательным. Эти данные позволяют предположить, что конъюгация с GalNAc3-1 снижает накопление в почках.

Идентифицировали также метаболиты ISIS 647535 и подтвердили их массы при помощи масс-спектрометрического анализа высокого разрешения. Сайты расщепления и структуры наблюдаемых метаболитов представлены ниже. Относительный % от общей длины ASO рассчитали по стандартным приемам, а результаты представлены в Таблице 23а. Основной метаболит ISIS 647535 представляет собой ASO полной длины без всего конъюгата (то есть ISIS 304801), который образуется в результате расщепления по сайту расщепления А, представленному ниже. Кроме того, наблюдали также дополнительные метаболиты, образующиеся из других сайтов расщепления. Эти результаты позволяют предположить, что может быть пригодным также внедрение других расщепляемых связей, таких как сложные эфиры, пептиды, дисульфиды, фосфорамидаты или ацил-гидразоны, между caxapoм. GalNAc3-1 и ASO, которые могут расщепляться под действием ферментов внутри клетки или которые могут расщепляться в восстановительной среде цитозоля, или которые лабильны в кислотном pН внутри эндосом и лизосом.




Пример 21. Антисмысловое ингибирование человеческого АроС III у трансгенных мышей с АроС III в исследовании одного введения
ISIS 304801, 647535 и 647536, каждый из которых нацелен на человеческий АроС III и описан в Таблице 17, дополнительно оценивали в исследовании однокраного введения на их способность ингибировать человеческий АроС III у трансгенных мышей с человеческим АроС III.
Лечение
Трансгенных мышей с человеческим АроСIII содержали при 12-часовом цикле освещения/темноты и обеспечивали свободный доступ к пище Teklad lab. До начала эксперимента животных акклиматизировали по меньшей мере в течение 7 дней в исследовательской лаборатории. Приготовили ASO в PBS и стерилизовали фильтрованием через фильтр 0,2 микрона. ASO растворили в 0,9% PBS для инъекций.
Трансгенным мышам с человеческим АроС III внутрибрюшинно ввели однократную инъекцию дозы, представленной ниже, соединения ISIS 304801, 647535 или 647536 (описанных выше), или PBS в качестве контрольного образца. Экспериментальная группа состояла из 3 животных, а контрольная группа состояла из 4 животных. Перед лечением, а также после последней дозы у каждой мыши брали кровь и анализировали образцы плазмы. Мышей усыпили через 72 часа после последнего введения.
Образцы собрали и анализировали для определения уровней мРНК АроС III и белка в печени; триглицеридов в плазме; и холестерина, включая фракции HDL и LDL, которые анализировали так, как описано выше (Пример 20). Данные этих анализов представлены ниже в Таблицах 24-28. Уровни трансаминазы в печени, аланин-аминотрансферазы (ALT) и аспартат-аминотрансферазы (AST) в сыворотке измеряли относительно мышей, инъецированных солевым раствором, применяя стандартные протоколы. Уровни ALT и AST показали, что антисмысловые соединения хорошо переносятся при всех введенных дозах.
Эти результаты демонстрируют усиление эффективности антисмысловых соединений, содержащих конъюгат GalNAc3-1 на 3'-конце (ISIS 647535 и 647536), по сравнению с антисмысловым соединением, не содаржащим конъюгат GalNAc3-1 (ISIS 304801). Кроме того, ISIS 647536, который содержит конъюгат GalNAc3-1 и несколько
фосфодиэфирных связей, был таким же эффективным, как ISIS 647535, который содержит тот же конъюгат, и все межнуклеозидные связи в этом ASO являются тиофосфатными.

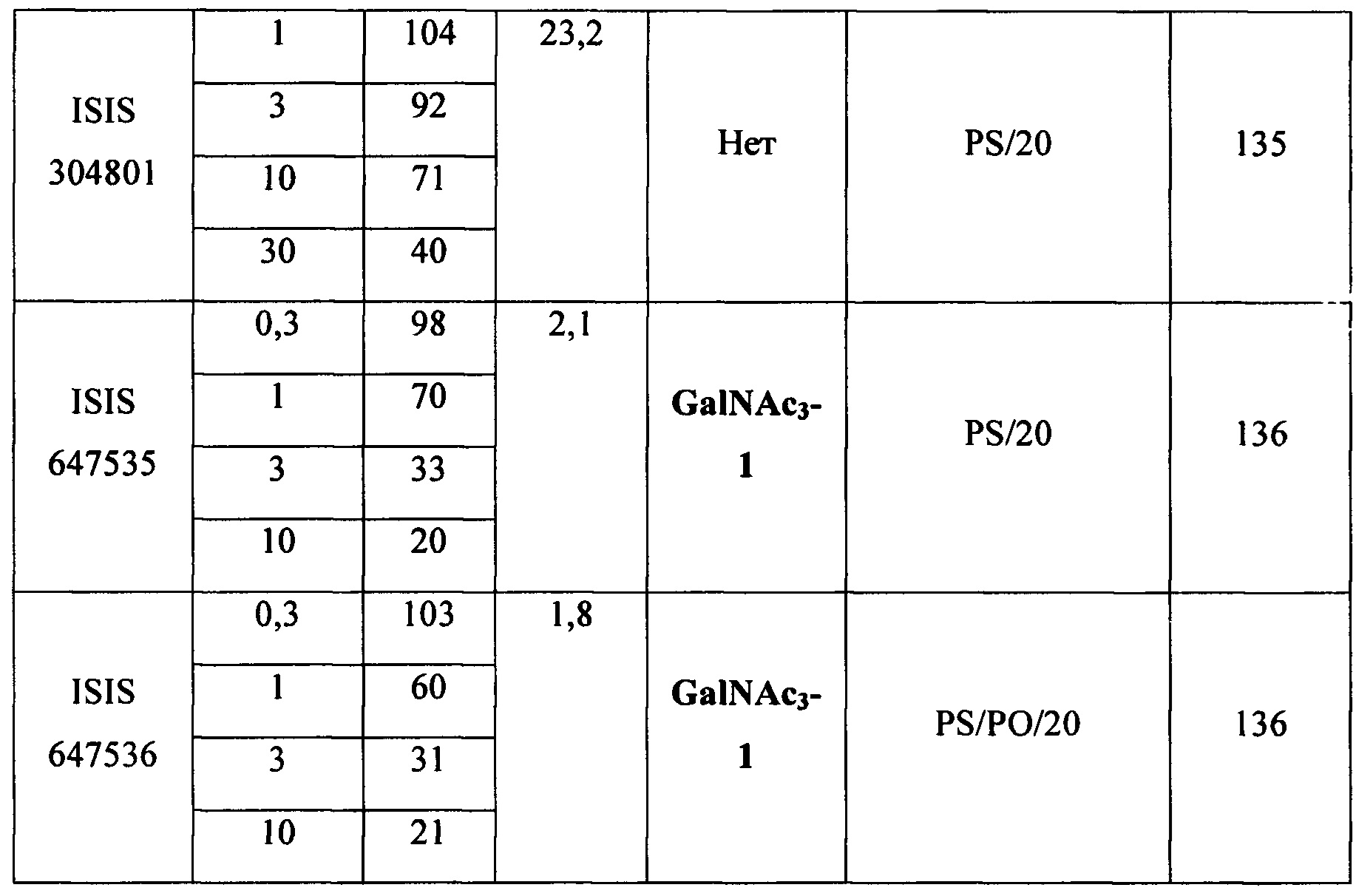



Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая соединение, специфически ингибирующее экспрессию нуклеиновой кислоты аро(а) и/или белка аро(а), композиция для лечения, предупреждения или замедления прогрессирования заболевания, связанного с повышенной экспрессией аро(а) и/или повышенной экспрессией Lp(a), содержащая терапевтически эффективное количество соединения, cпособ предупреждения, лечения, облегчения или замедления прогрессирования заболевания, связанного с повышенной экспрессией аро(а) и/или повышенной экспрессией Lp(a), включающий введение животному вышеуказанного соединения или композиции. В одном из вариантов изобретения соединение содержит модифицированный олигонуклеотид и конъюгирующую группу, при этом модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов, нацеленных на аро(а). Изобретение расширяет арсенал средств для ингибирования экспрессии нуклеиновой кислоты аро(а) и/или белка аро(а). 5 н. и 32 з.п. ф-лы, 185 табл., 124 пр.
Формула
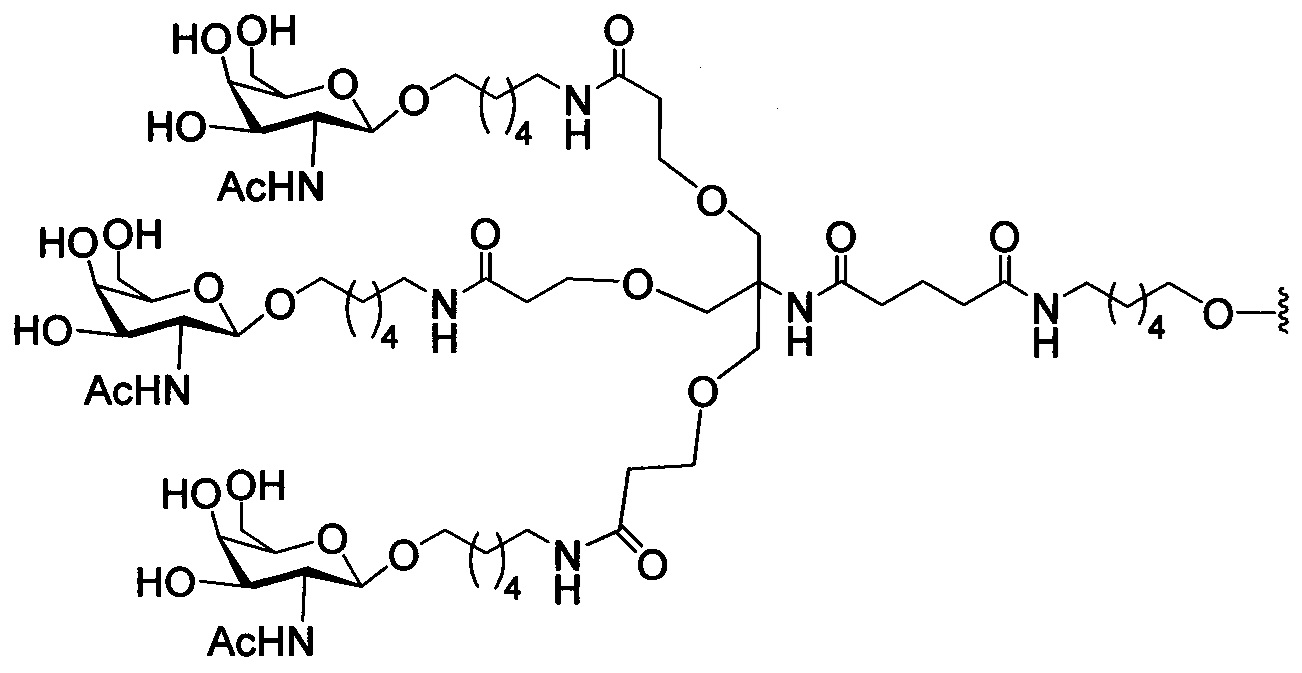


Комментарии