Способы лечения колоректального рака - RU2674147C2
Код документа: RU2674147C2
Чертежи












Описание
По данной заявке испрашивается приоритет по предварительной патентной заявке США 61/790488, поданной 15 марта 2013 года, и предварительной патентной заявке США 61/847287, поданной 17 июля 2013 года, полное содержание каждой из которых включено в настоящий документ путем отсылки.
Область техники, к которой относится изобретение
В целом, настоящее изобретение относится к способам лечения и/или предупреждения колоректального рака и роста клеток колоректального рака путем введения ингибиторов SMAD7, в частности, антисмысловых олигонуклеотидов, направленных против SMAD7, а также фармацевтическим композициям, содержащим ингибиторы SMAD7, для применения в лечении колоректального рака.
Сведения о предшествующем уровне техники
Колоректальный рак представляет собой заболевание, которое характеризуется неконтролируемой пролиферацией клеток толстого кишечника, включая клетки толстой кишки и прямой кишки. Полагают, что опухоли колоректального рака развиваются в нормальной слизистой оболочке. Онкогенез связан с появлением кластеров увеличенных крипт, демонстрирующих пролиферативные и биохимические аномалии. Пролиферация эпителиальных клеток, которые несут каузативную мутацию или мутации, может привести к образованию опухолей ранней стадии, характеризующихся дисплазией высокой степени. Дальнейший рост может привести к инвазивному росту в мышечные слои и через стенку желудка. В случае отсутствия лечения эти опухоли могут распространяться в региональные лимфатические узлы и затем метастазировать в отдаленные участки, и тогда они становятся в высокой степени не поддающимися лечению существующими методами (Markowitz and Bertagnolli (2009) N. Engl. J. Med. 361(25): 2449-2460). Несмотря на то, что опухоли могут возникать de novo, имеются свидетельства того, что приблизительно 60% карцином развиваются из ранее существующих аденом (Soreide et al., (2011) Discov. Med. 12(66):393-404). Таким образом, подавляющее большинство опухолей колоректального рака могут быть классифицировано как аденокарцинома, но в некоторых случаях может также наблюдаться лимфома и плоскоклеточная карцинома. Генетические мутации, которые приводят к онкогенезу, включают мутации члены семейства TGF-β1 и SMAD, белков, которые регулируют баланс между клеточной пролиферацией и гибелью клеток, таких как ТР53, и других белков, таких как DCC (Reya and Clevers (2005) Nature 434(7035):843-850; Baker et al., (1989) Science 244:217-221; Markowitz and Bertagnolli, supra). Ненормальная активация PI3K/Akt-сигнального пути и нисходящего сигнального пути mTOR ассоциируются с онкогенезом колоректального рака (Rychahou et al., (2006) Ann. Surg. 243(6):833-842). Также, в клеточных линиях колоректального рака наблюдаются высокие уровни экспрессии EGFR, которые коррелируют с прогрессированием опухоли колоректального рака (Ciardiello et al., (1991) Proc. Natl. Acad. Sci. USA 88(17):7792-7796). Помимо семейных и генетических факторов, факторы риска развития колоректального рака могут включать низкие уровни физической активности, употребление алкоголя, избыточное употребление жиров и мяса, и низкое употребление пищевых волокон и овощей. Симптомы колоректального рака обычно включают ректальное кровотечение, анемию, констипацию, кровь в стуле, потерю веса, повышение температуры, потерю аппетита, а также тошноту или рвоту.
Колоректальный рак является второй наиболее распространенной формой рака среди мужчин и женщин в США, имеющих рак (Siegel et al., (2012) СА Cancer J. Clin. 62(4):220-41). Кроме того, колоректальный рак является одной из трех основных наиболее распространенных причин смертности от рака в западных странах (Soreide et al., (2011) Discov. Med. 12(66):393-404). Недавняя адаптация многих стран Азии к западному стилю жизни также привела к значительному росту заболеваемости колоректальным раком у этих популяций (Yang et al., (2011) Dig. Surg. 28(5-6):379-385). По имеющимся оценкам, в 2012 году в США насчитывалось 1,2 миллиона индивидуумов с ранее диагностированным колоректальным раком. Для этого же года прогнозировалось выявление 143460 дополнительных случаев заболевания. Средний возраст на момент постановки диагноза колоректального рака составляет 68 лет у мужчин и 72 года у женщин (Howlader et al., (2011) SEER Cancer Statistics Review, 1975-2008. Bethesda, MD: National Cancer Institute). Несмотря на частоту случаев возникновения колоректального рака в пожилом возрасте, только у 59,1% индивидуумов в возрасте старше 50 лет проводился скрининг колоректального рака согласно руководствам (American Cancer Society (2012) Cancer Prevention & Early Detection Facts & Figures. Atlanta, GA: American Cancer Society). Отсутствие раннего выявления привело к тому, что только у 39% диагностированных пациентов рак не прогрессировал от начальной стадии (Howlader et al., supra). С учетом роста количества пациентов, страдающих колоректальным раком, существует потребность в разработке надежных методов лечения, особенно для большого числа пациентов, у которых рак не был выявлен при раннем скрининге.
Краткое описание изобретения
Изобретение, описанное здесь, обеспечивает новые способы лечения колоректального рака путем ингибирования SMAD7, эффективно используя роль SMAD7 в качестве ключевого антагониста TGF-β-сигнального пути. Хотя для лечения колоректального рака были предложены другие потенциальные мишени для терапевтического вмешательства, в настоящем изобретении предлагается новая терапия, которая, как показано, предупреждает, замедляет, останавливает или вызывает регресс клеточного роста колоректальной опухоли.
Настоящее изобретение обеспечивает способ лечения колоректального рака путем ингибирования SMAD7. В частности, изобретение обеспечивает способ ингибирования SMAD7 в колоректальной опухоли у пациента. Также, изобретение обеспечивает способ ингибирования роста клеток колоректального рака путем ингибирования SMAD7. Также, изобретение обеспечивает способ ингибирования SMAD7, лечения колоректального рака и/или ингибирования роста клеток колоректального рака путем введения эффективного количества ингибитора SMAD7. Например, ингибиторов SMAD7 (например. анти-SMAD7 антисмысловых терапий, то есть антисмыслового олигонуклеотида против SMAD7, и антител против SMAD7). Используемый здесь термин «антисмысловой олигонуклеотид» относится к короткой синтетической олигонуклеотидной последовательности, комплементарной матричной РНК (мРНК), которая кодирует белок-мишень (например, SMAD7). Антисмысловые олигонуклеотидные последовательности гибридизируются с мРНК, образуя двухцепочечный гибрид, что может привести к активации универсальных каталитических ферментов, таких как РНКаза Н, которые расщепляют цепи гибрида ДНК/РНК, предотвращая, таким образом, трансляцию белка.
Ингибитор SMAD7 может представлять собой специфический ингибитор SMAD7, такой как антисмысловой олигонуклеотид, или другие средства направленного воздействия на SMAD7 с высокой степенью специфичности. Антисмысловой олигонуклеотидный ингибитор SMAD7 может быть выбран, но без ограничения, из описанной здесь группы, состоящей из: SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12. Например, антисмысловой олигонуклеотидный ингибитор SMAD7 может включать SEQ ID NO: 5 или SEQ ID NO: 9, или может включать SEQ ID NO: 6 или SEQ ID NO: 10. Примером антисмыслового олигонуклеотида против SMAD7 согласно настоящему изобретению является последовательность, представленная формой SEQ ID NO: 6, в которой все фосфатные связи представляют собой фосфоротиоатные связи (SEQ ID NO: 10, называемая здесь как GED-0301).
Используемый здесь термин «ингибитор» относится к агенту, способному уменьшать экспрессию гена или последовательности ДНК, предотвращать или подавлять продукцию, активность или трансляцию РНК-продукта гена в белок, или предотвращать или подавлять активность белкового продукта гена посредством прямого или непрямого взаимодействия с геном, РНК-продуктом или белковым продуктом гена, или с любыми переходными формами этих единиц, или с другой молекулярной единицей, активность или экспрессия которой нарушается под влиянием активности или экспрессии предполагаемой мишени. Такие ингибиторы могут включать, но без ограничения, например, антитела, малые молекулы, которые связываются со специфической молекулярной мишенью, и антисмысловые олигонуклеотиды, направленно воздействующие на специфические транскрипты мРНК. Таким образом, используемый здесь термин «ингибитор SMAD7» относится к агенту, способному уменьшать экспрессию SMAD7, предотвращать или подавлять продукцию, активность или трансляцию РНК-продукта SMAD7 в белок, или предотвращать или подавлять активность белкового продукта SMAD7 посредством прямого или непрямого взаимодействия с геном, РНК-продуктом или белковым продуктом SMAD7, или с любыми переходными формами этих единиц, или с другой молекулярной единицей, активность или экспрессия которой препятствует активности или экспрессии SMAD7.
Кроме того, настоящее изобретение обеспечивает способы лечения колоректального рака путем введения специфических ингибиторов SMAD7. Используемый здесь термин «специфический ингибитор» относится к агенту, который обладает структурными и/или функциональными свойствами, которые позволяют ему непосредственно или с высокой степенью селективности воздействовать на молекулярную мишень. Таким образом, специфический ингибитор SMAD7 обладает внутренней функциональной способностью направленно воздействовать на ген SMAD7, его РНК- или белковые продукты, или другую молекулярную единицу, активность или экспрессия которой препятствует активности или экспрессии SMAD7 или его продуктов, непосредственно или с высокой степенью специфичности. В случае антител-ингибиторов SMAD7 специфичность может быть введена в антитело путем включения белковых последовательностей, которые, как известно, связываются с эпитопами белка SMAD7 с высокой степенью специфичности. В случае низкомолекулярных ингибиторов SMAD7 в состав малой молекулы могут быть включены химические группы, которые обеспечивают возможность связывания со специфическими компонентами белка SMAD7. Антисмысловые олигонуклеотиды могут быть сконструированы таким образом, что нацеливающая часть введенной нуклеотидной последовательности каждого антисмыслового олигонуклеотида является полностью или почти полностью комплементарной последовательности мРНК SMAD7. Введение таких комплементарных или почти комплементарных нуклеотидных последовательностей позволяет сконструировать антисмысловые олигонуклеотиды с высокой степенью специфичности в отношении заданной мишени. Специфичность можно оценить путем измерения параметров, таких как константа диссоциации, или другого критерия, такого как изменения уровней экспрессии белка или РНК, или других анализов, в которых измеряется активность или экспрессия SMAD7.
Специфические ингибиторы SMAD7 могут включать, например, малые связывающие молекулы, например, природные и синтетические соединения, антитела, аптамеры, интрамеры, РНК-интерференцию (RNAi) (двухцепочечную РНК, малую интерферирующую РНК (siRNA)) и анти-SMAD7 антисмысловые молекулы для лечения колоректального рака и/или ингибирования роста клеток колоректального рака. Ингибиторы SMAD7 могут также включать укороченные и/или мутировавшие молекулы SMAD7, которые препятствуют активности SMAD7, партнеры связывания или субстраты, и которые, таким образом, ингибируют функцию SMAD7.
Используемый здесь термин «эффективное количество», относится к количеству агента, которое является достаточным для по меньшей мере частичного лечения патологического состояния при введении пациенту. Терапевтически эффективное количество будет различаться в зависимости от патологического состояния, пути введения компонента и возраста, веса и т.п. пациента, подлежащего лечению. Таким образом, эффективное количество специфического ингибитора SMAD7 представляет собой такое количество, которое необходимо для лечения колоректального рака у пациента, таким образом, что введение агента предотвращает возникновение колоректального рака у пациента, предотвращает прогрессирование колоректального рака (например, предотвращает возникновение явлений, таких как онкогенез, рост опухоли или образование метастазов), или же ослабляет или полностью снимает все связанные с колоректальным раком симптомы, то есть вызывает регрессию заболевания.
Кроме того, настоящее изобретение обеспечивает способ лечения колоректального рака путем введения фармацевтической композиции, содержащей антисмысловой олигонуклеотид против SMAD7. В другом аспекте изобретение обеспечивает фармацевтическую композицию для применения в лечении колоректального рака. Фармацевтическая композиция может состоять из ингибитора SMAD7, такого как антисмысловой олигонуклеотид, который направленно воздействует на SMAD7, и фармацевтически приемлемого носителя. Используемый здесь термин «фармацевтическая композиция» означает, например, смесь, содержащую определенное количество терапевтического соединения, например, терапевтически эффективное количество терапевтического соединения в фармацевтически приемлемом носителе, подлежащую введению млекопитающему, например человеку, для лечения колоректального рака. В некоторых вариантах осуществления рассматриваются фармацевтические композиции, которые содержат рассматриваемый антисмысловой олигонуклеотид против SMAD7 и фармацевтически приемлемый носитель. В другом аспекте в изобретении раскрыто использование антисмыслового олигонуклеотида против SMAD7 в изготовлении лекарственных средств, предназначенных для лечения колоректального рака. Используемый здесь термин «лекарственное средство» имеет по существу такое же значение, что и термин «фармацевтическая композиция».
Используемый здесь термин «фармацевтически приемлемый носитель» означает буферы, носители и вспомогательные вещества, подходящие для применения в контакте с тканями человека и животных без избыточной токсичности, раздражения, аллергической реакции, или других проблем или осложнения, в соответствии с разумным отношением благоприятный эффект/риск. Носитель (носители) должен быть «приемлемым» в том смысле, что он должен быть совместимым с другими ингредиентами композиций и не оказывать вредного воздействия на реципиента. Фармацевтически приемлемые носители включают буферы, растворители, дисперсионные среды, покрытия, придающие изотоничность и замедляющие абсорбцию агенты, и т.п., которые являются совместимыми с фармацевтическим введением. Применение такой среды и агентов для фармацевтически активных соединений хорошо известно в данной области. В одном варианте осуществления вводимая перорально фармацевтическая композиция включает энтеросолюбильное покрытие, подходящее для регулирования участка всасывания инкапсулированных веществ в пределах пищеварительной системы или кишечника. Например, энтеросолюбильное покрытие может включать сополимер этилакрилата и метакриловой кислоты.
В одном варианте осуществления рассматриваемый антисмысловой олигонуклеотид против SMAD7 и любую его фармацевтическую композицию можно вводить одним или несколькими способами, в том числе перорально, местно, парентерально, например, путем подкожной инъекции, путем ингаляционного распыления или ректально. Используемый здесь термин «парентерально» включает подкожные инъекции, интрапанкреатическое введение, внутривенную, внутримышечную, интраперитонеальную, интрастернальную инъекцию или методы инфузии. Например, антисмысловой олигонуклеотид против SMAD7 можно вводить субъекту подкожно. В другом примере антисмысловой олигонуклеотид против SMAD7 можно вводить субъекту перорально. В другом примере антисмысловой олигонуклеотид против SMAD7 можно вводить субъекту непосредственно в колоректальную опухоль или клетки колоректального рака путем парентерального введения.
Краткое описание чертежей
На фигуре 1(A) показан контрольный изотип IgG (Изотип, слева) и иммуноокрашивание SMAD7 в неопухолевой (NT) и опухолевой (Т) областях (средняя и правая стороны, соответственно) у пациента со спорадическим колоректальным раком; на фигуре 1(B) представлен Вестерн-блот, демонстрирующий уровни SMAD7 и β-актина в неопухолевой (NT) и опухолевой (Т) ткани от двух пациентов со спорадическим колоректальным раком (слева), и денситометрический анализ сигнала Вестерн-блота SMAD7 (справа); на фигуре 1(C) представлен Вестерн-блот, показывающий уровни SMAD7 и β-актина в клетках IEC, DLD-1 и НСТ-116; на фигуре 1(D) показан FACS-анализ сигнала FITC-конъюгированного контрольного изотипа IgG (Изотип) и антитела к SMAD7 в клетках НСТ-116 (слева) и DLD-1 (справа); и на фигуре 1(E) показан Вестерн-блот (слева), демонстрирующий уровни экспрессии SMAD7 и β-актина в четырех клеточных линиях колоректального рака (НСТ-116, НСТ-115, НТ-29 и DLD-1) и одной клеточной линии гепатоцеллюлярной карциномы (HepG2), и денситометрический анализ сигнала Вестерн-блота SMAD7 от этого же самого блота (правая сторона).
На фигуре 2(A) представлены серии дот-блотов, показывающие общее количество клеток и указывающие процентное содержание иодид пропидий (PI)- и флуоресцентных (РГТС)-положительных клеток НСТ-116, трансфицированных либо немеченым смысловым олигонуклеотидом против SMAD7 или возрастающими дозами FITC-конъюгированного антисмыслового олигонуклеотида GED-0301 против SMAD7 (FITC-конъюгированный GED-0301); на фигуре 2(B) представлен Вестерн-блот, показывающий уровни SMAD7 и β-актина в клетках НСТ-116 после трансфекции смысловыми или GED-0301 олигонуклеотидами против SMAD7; на фигуре 2(C) представлена диаграмма, показывающая процент пролиферирующих клеток НСТ-116 (черные столбцы) или DLD-1 (белые столбцы) в случае отсутствия обработки (Untr) или после трансфекции смысловыми или GED-0301 олигонуклеотидами против SMAD7 (слева), и гистограммы, показывающие процент пролиферирующих клеток НСТ-116 после трансфекции смысловыми (верхняя) или GED-0301 (нижняя) олигонуклеотидами против SMAD7; на фигуре 2 (D) представлена диаграмма, показывающая процентное содержание клеток НСТ-116 в различных фазах клеточного цикла в случае отсутствия обработки (Untr) или после трансфекции смысловыми или GED-0301 олигонуклеотидами против SMAD7; и на фигуре 2(E) показан процент пролиферирующих клеток НСТ-116, трансфицированных смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7, и оставленных без обработки или подвергнутых воздействию избыточного количества белка TGF-β (TGF-β) или антитела к TGF-β (Анти-TGF-β).
На фигуре 3(A) показаны диаграммы, показывающие процент гибели клеток НСТ-116 через 24 (верхняя) или 48 часов (нижняя) в случае отсутствия обработки (Untr) или после трансфекции либо смысловыми или GED-0301 олигонуклеотидами против SMAD7, и дот-блоты (внизу), иллюстрирующие окрашивание PI и аннексином V (AV) после трансфекции смысловыми или GED-0301 олигонуклеотидами против SMAD7; на фигуре 4(B) показаны серии дот-блотов, количественно оценивающих активную каспазу-3 в клетках НСТ-116 в различные моменты времени в случае отсутствия обработки (Untr) или после трансфекции смысловыми или GED-0301 олигонуклеотидами против SMAD7; на фигуре 4(C) представлен график, показывающий процент клеток, подвергнутых воздействию N-(2-хинолил)валил-аспартил-(2,6-дифторфенокси)метилкетона (Q-VD-OPH) с активной каспазой-3 в случае отсутствия обработки или после трансфекции смысловыми или GED-0301 олигонуклеотидами против SMAD7; на фигуре 4(D) представлена диаграмма, показывающая процент гибели клеток в клетках, подвергнутых воздействию Q-VD-ОРН с последующим отсутствием обработки или трансфекцией смысловыми или GED-0301 олигонуклеотидами против SMAD7; и на фигуре 4(E) представлена диаграмма, показывающая процент пролиферирующих клеток, подвергнутых воздействию Q-VD-OPH с последующим отсутствием обработки или трансфекцией смысловыми или GED-0301 олигонуклеотидами против SMAD7.
На фигуре 4(A) показан Вестерн-блот экстрактов клеток НСТ-116, полученных из клеток, которые были нетрансфицированы (Untr) или трансфицированы смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7 и подвергнуты анализу на фосфорилированный CDK2 (p-CDK2 (Thr-14/Tyr-15)), CDK2, циклин А и β-актин; на фигуре 4(B) показан Вестерн-блот экстрактов клеток НСТ-116 из клеток, которые были нетрансфицированы (Untr) или трансфицированы смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7 и подвергнуты анализу на CDC25A, CDC25B и CDC25C; на фигуре 4(C) показано количественное определение экспрессии мРНК CDC25A в различные моменты времени в клетках НСТ-116, трансфицированных смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7; на фигуре 4(D) показан Вестерн-блот клеточных экстрактов, полученных из клеток, которые были трансфицированы смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7 и анализированы на CDC25A или β-актин после подвергают воздействию ингибиторов протеасомы MG115 и MG132; на фигуре 4(E) показан Вестерн-блот клеточных экстрактов, полученных из клеток, трансфицированных смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7 и анализированных на фосфорилированный EiF2α (p-EiF2α (Ser 51)), общий EiF2α, CDC25A, циклин А и β-актин в различные моменты времени; на фигуре 4(F) показан Вестерн-блот клеточных экстрактов НСТ-116, анализированных на p-EiF2α (Ser 51), EiF2α, CDC25A и β-актин после подвергания воздействию диметилсульфоксида (DMSO) или салубринала; на фигуре 4(G) показаны Вестерн-блоты клеточных экстрактов, полученных из клеток НСТ-116 (слева) или клеток первичного колоректального рака (справа), подвергнутых иммунопреципитации с антителом против SMAD7 и меченых антителом против протеинфосфатазы 1 (верхние), EiF2α (средние) или SMAD7; и на фигуре 4(H) показан Вестерн-блот клеточных экстрактов НСТ-116, полученных из клеток, которые были трансфицированы смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7, подвергнуты иммунопреципитации с антителом против РР1 или EiF2α, и мечены соответствующим антителом.
На фигуре 5(A) показано иммуноокрашивание SMAD7 в неопухолевой или опухолевой ткани от мышей после обработки азоксиметаном или декстраном сульфатом натрия (AOM+DSS), и на фигуре 5(B) представлена диаграмма, показывающая сравнительную экспрессию мРНК SMAD7 в неопухолевой и опухолевой ткани после обработки AOM+DSS.
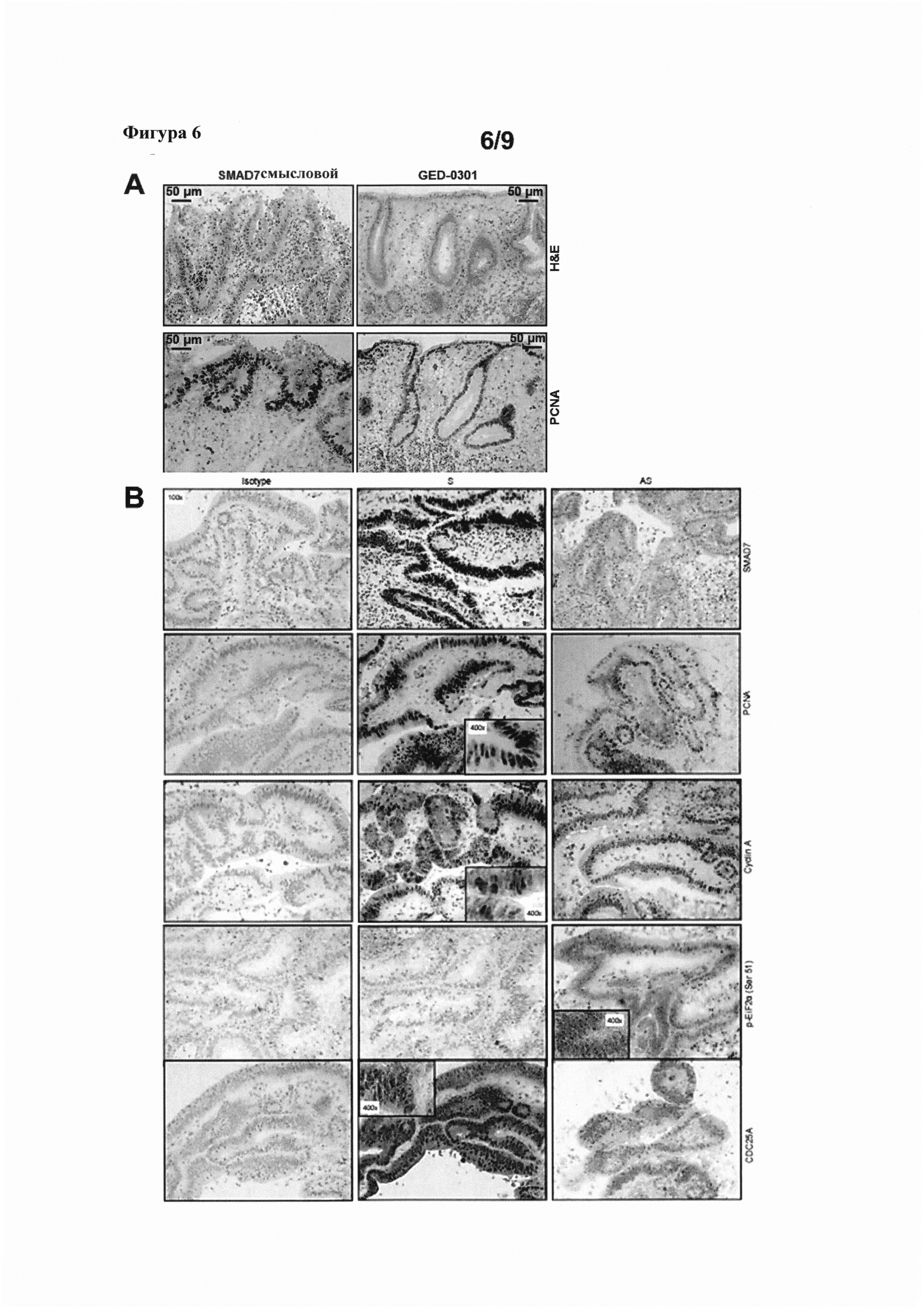
На фигуре 6(A) показано окрашивание гематоксилином и эозином (Н&Е) и иммуноокрашивание на ядерный антиген пролиферирующих клеток (PCNA) эксплантатов ткани колоректального рака, трансфицированных либо смысловыми или GED-0301 олигонуклеотидами к SMAD7; и на фигуре 6(B) показано окрашивание на SMAD7, PCNA, циклин A, p-EiF2α (Ser 51) и CDC25A эксплантатов ткани колоректального рака человека, трансфицированных либо смысловыми или GED-0301 олигонуклеотидами к SMAD7.
На фигуре 7(A) показано распределение сигнала FITC в ксенотрансплантатах, полученных из НСТ-116, подвергнутых однократной инъекции PBS (CTR) или FITC-конъюгированного GED-0301 после инъекции в НСТ-116-колонизированных мышей Rag1-/-; на фигуре 7(B) представлен Вестерн-блот, показывающий экспрессию SMAD7 и β-актина в белковых экстрактах ксенотрансплантатов, полученных из НСТ-116, подвергнутых воздействию либо смысловых или GED-0301 олигонуклеотидов против SMAD7; на фигуре 7(C) представлена диаграмма, показывающая количественное определение объема опухоли ксенотрансплантатов, полученных от мышей, обработанных смысловыми или GED-0301 олигонуклеотидами против SMAD7 (слева) и иллюстративный снимок ксенотрансплантатов из этого же эксперимента; и на фигуре 7(D) показано иммуноокрашивание на SMAD7, PCNA и циклин А ксенотрансплантатов, обработанных смысловыми или GED-0301 олигонуклеотидами против SMAD7.
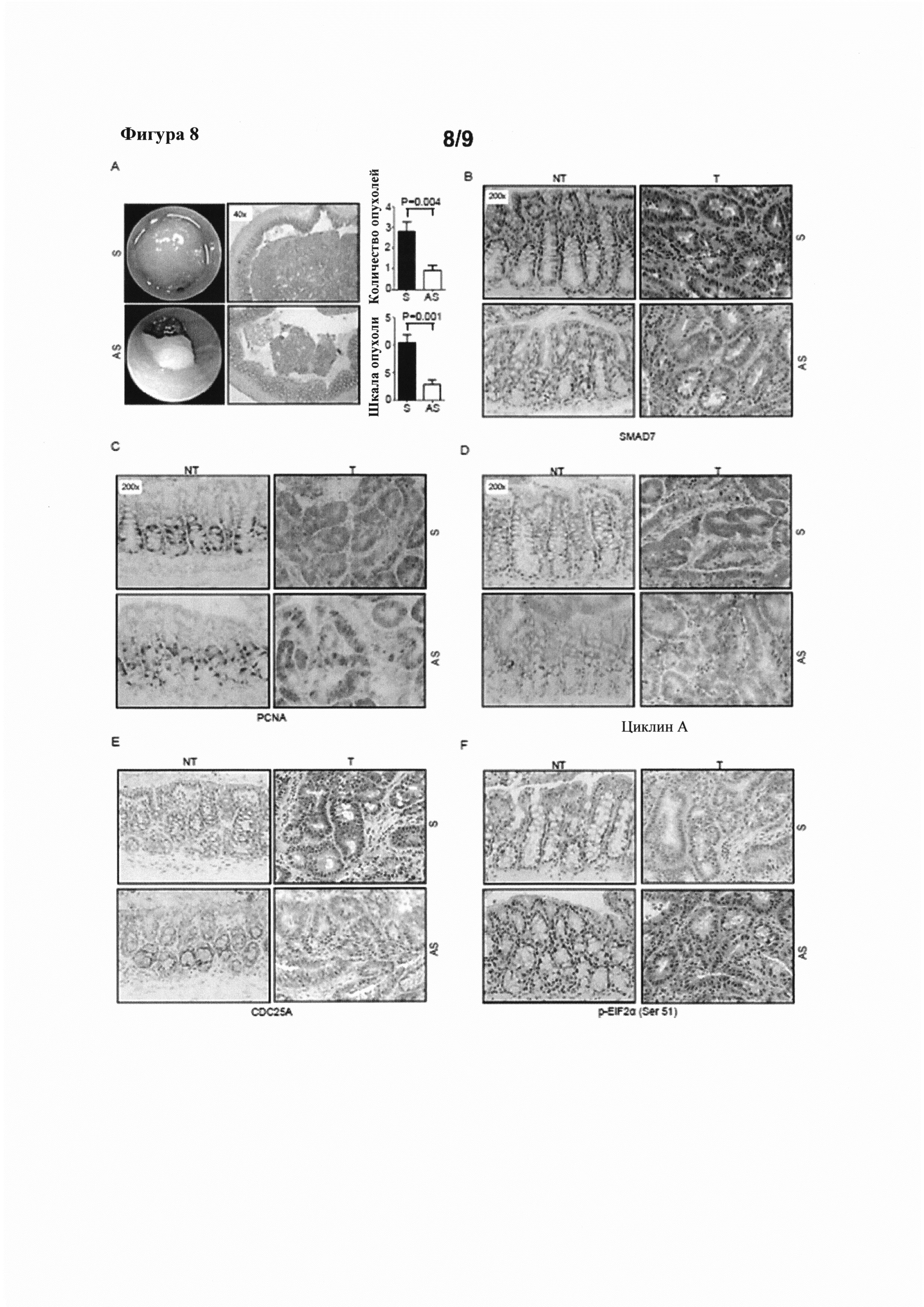
На фигуре 8(A) показаны эндоскопические изображения (слева), полученные у мышей Аре (Min/+), подвергнутых воздействию АОМ, и затем обработанных смысловым или антисмысловым олигонуклеотидом против SMAD7, а также эндоскопический анализ количества опухолей и оценка по шкале опухолей (диаграммы справа), и окрашивание Н&Е участков толстой кишки мышей Аре (Min/+) (в середине); на фигуре 8(B)-(F) показаны срезы опухолевой (Т) и неопухолевой ткани (NT) от мышей, обработанных смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7, иммуноокрашенных, соответственно, на SMAD7, PCNA, циклин А, CDC25A и p-EiF2α (Ser 51); и на фигуре 8(G) показана локализация FITC-конъюгированного антисмыслового олигонуклеотида в интестинальной ткани у мышей Аре (Min/+).
Подробное описание изобретения
Колоректальный рак
Настоящее изобретение обеспечивает способы лечения колоректального рака. Используемый здесь термин «колоректальный рак» относится к заболеванию, которое характеризуется неконтролируемой пролиферацией клеток толстого кишечника, включая клетки толстой кишки и прямой кишки. Колоректальный рак обычно развивается в эпителиальных клетках толстого кишечника, при этом клетками-предшественниками по всей вероятности являются стволовые клетки кишечной крипты. Генетические мутации, которые вызывают канцерогенез, включают мутации компонентов сигнального пути Wnt, таких как β-катенин, APC, AXIN1, AXIN2, TCF7L2 и NKD1, компонентов клеточного сигнального пути TGF-β, таких как TGF-β1, и членов семейства SMAD, белков, которые регулируют баланс между клеточной пролиферацией и клеточной гибелью, таких как ТР53, и других белков, таких как DCC. Пролиферация эпителиальных клеток, которая несет каузативную мутацию или мутации, может вызывать инвазивный рост в мышечные слои и через стенку кишечника. Симптомы колоректального рака обычно включают ректальное кровотечение, анемию, констипацию, кровь в стуле, потерю веса, температуру, потерю аппетита, а также тошноту или рвоту. Подавляющее большинство опухолей колоректального рака можно классифицировать как аденокарциному, тогда как в более редких случаях наблюдается лимфома и плоскоклеточная карцинома. Таким образом, термин «колоректальная опухоль», используемый здесь, относится к любому ненормальному злокачественному росту ткани, связанному с клетками, развивающимися в толстом кишечнике, или патологии колоректального рака.
Термин «клетки колоректального рака», используемый здесь, относится к любой клетке-предшественнице, способствующей возникновению колоректального рака или колоректальной опухоли, клетке, связанной с онкогенезом, ростом, развитием, сохранением или поддержкой колоректальной опухоли, или любой другой клетке, связанной с патологическим проявлением колоректального рака. Используемое здесь выражение «рост клеток колоректального рака» относится к неконтролируемой или ненормальной пролиферации клеток, связанных с клетками-предшественниками колоректального рака, клеткой колоректальной опухоли или любой клеткой, связанной с проявлением патологии колоректального рака. Рост клеток колоректального рака может являться результатом ненормальной активности клеточного цикла, неспособности индуцировать контрольные точки клеточного цикла, неспособности индуцировать апоптоз или потери других опухоль-супрессорных активностей.
Лечение и оценка
Термины «лечить», «лечение» и т.п. используются в описании для общего обозначения способа достижения желательного фармакологического и/или физиологического эффекта. Эффект может быть профилактическим, то есть полное или частичное предотвращение заболевания или его симптомов, и/или может быть терапевтическим, то есть частичное или полное излечение от заболевания и/или неблагоприятного воздействия, относящегося к заболеванию. Используемый здесь термин «лечение» охватывает любое лечение заболевания у млекопитающего, в частности человека, и включает: (а) предупреждение возникновения заболевания у субъекта, который может быть предрасположен к заболеванию, но у которого еще не диагностировано данное заболевание; (b) ингибирование заболевания, то есть приостановку его развития; или (с) облегчение заболевания, то есть инициирование регрессии заболевания.
Эффективность лечения можно оценить путем анализа всех симптомов, связанных с колоректальным раком, гистологического анализа ткани, биохимического анализа, методов визуализации, таких как, например, магнитно-резонансная визуализация, или других известных способов. Например, эффективность лечения можно оценить путем анализа анемического состояния, ректального кровотечения, размера опухоли или других аспектов макропатологии, связанных с колоректальным раком, после введения ингибитора SMAD7 пациенту с колоректальным раком. Эффективность лечения можно также оценить на тканевом или клеточном уровне, например, получения посредством биопсии образца ткани или опухоли, и оценки макроскопической морфологии ткани или опухоли, или характеристик окрашивания. Биохимические анализы, в которых изучают экспрессию белка или РНК, также можно использовать для оценки эффективности лечения. Например, можно оценить PCNA, р-CDK2 (Thr-14/Tyr-15) или уровни другого белка, указывающие на активность в отношении клеточной пролиферации или клеточной гибели в диссоциированных клетках или недиссоциированной ткани посредством иммуноцитохимического, иммуногистохимического метода или Вестерн-блоттинга. Кроме того, можно оценить присутствие или уровень экспрессии подходящих биомаркеров, обнаруженных в плазме или же в опухолевой или неопухолевой ткани, для оценки прогрессирования рака и эффективности лечения.
Для оценки эффективности лечения могут быть выбраны подходящие контроли для обеспечения достоверной оценки. Например, можно провести сравнение симптомов, оцененных у пациента с колоректальным раком после введения ингибитора SMAD7, с симптомами у того же самого пациента до лечения, или у другого пациента, у которого не был диагностирован колоректальный рак. В альтернативном случае можно провести сравнение результатов биохимического или гистологического анализа опухолевой ткани после введения ингибитора SMAD7 с результатами анализа неопухолевой ткани, взятой от этого же пациента или индивидуума, у которого не был диагностирован колоректальный рак, или этого же пациента до введения ингибитора SMAD7.
Достоверность ингибирования SMAD7 может быть подтверждена путем прямой или непрямой оценки уровней экспрессии или активности SMAD7. Например, для оценки общего ингибирования SMAD7 можно использовать биохимические анализы, в которых измеряется экспрессия SMAD7 или РНК. Например, можно измерить уровни белка SMAD7 в опухолевой ткани с помощью Вестерн-блоттинга для оценки общих уровней SMAD7. Можно также измерить уровни мРНК SMAD7 с помощью Нозерн-блоттинга или количественной полимеразной цепной реакции для определения общего ингибирования SMAD7. Можно также оценить уровни белка SMAD7 или уровни другого белка, указывающие на активность SMAD7 в диссоциированных клетках или недиссоциированной ткани, посредством иммуноцитохимических или иммуногистохимических методов. Ингибирование SMAD7 также можно оценить косвенно путем измерения параметров, таких как распределение по фазам клеточного цикла, окрашивания маркерами клеточной гибели, такими как Аннексии V или Каспаза III, или путем измерения изменения других параметров, коррелирующих с изменениями активности SMAD7. Например, можно измерить уровни активной каспазы-3 в клетках опухоли, обработанных ингибитором SMAD7 в качестве индикатора активности SMAD7 в указанных клетках. Можно также оценить присутствие или уровень экспрессии подходящих биомаркеров, обнаруженных в плазме, или опухолевой или неопухолевой ткани, для оценки эффективности ингибирования SMAD7.
Для оценки эффективности нокдауна SMAD7, подходящие контроли могут быть выбраны для обеспечения достоверной оценки. Например, можно провести сравнение результатов биохимического или гистологического анализа опухолевой ткани после введения ингибитора SMAD7 с результатами, полученными от этого же пациента или индивидуума, у которого не был диагностирован колоректальный рак, или от этого же пациента до введения ингибитора SMAD7.
Термин «пациент», как описано здесь, относится к любому животному, имеющему риск развития или страдающему колоректальным раком, включая, но без ограничения, млекопитающих, приматов и человека. Например, пациент может представлять собой индивидуума, у которого диагностирован высокий риск развития колоректального рака, или индивидуума, у которого диагностирован колоректальный рак. В определенных вариантах осуществления пациент может представлять собой млекопитающее, не относящееся к человеку, такое как, например, кошка, собака или лошадь.
Ингибиторы SMAD7
В определенных вариантах осуществления антисмысловой олигонуклеотид против SMAD7 может направленно воздействовать на сайт 403, 233, 294, 295, 296, 298, 299 и/или 533 {то есть нуклеотиды 403, 233, 294, 295, 296, 298, 299 и 533, соответственно) мРНК SMAD7 человека. В иллюстративном варианте осуществления антисмысловой олигонуклеотид против SMAD7 направленно воздействует на нуклеиновые кислоты 403-423 мРНК SMAD7 человека.
В определенных вариантах осуществления антисмысловой олигонуклеотид может быть получен из следующего антисмыслового олигонуклеотида против SMAD7 5'-GTCGCCCCTTCTCCCCGCAGC-3' (SEQ ID NO: 3).
В настоящем документе предполагается, что антисмысловой олигонуклеотид, направленно воздействующий на SMAD7, может содержать смешанную основную цепь, в которой цитозиновые остатки в паре CpG заменены на 5'-метилцитозин (сокращенно Me-dC). Метилфосфонатные связи могут быть также помещены на 5'-и/или 3'-концах антисмыслового олигонуклеотида (сокращенно МеР). Фосфатная основная цепь рассматриваемого антисмыслового олигонуклеотида против SMAD7 может необязательно включать 1, 2, 3, 4 или более фосфоротиоатных связей (например, фосфоротиоатные связи будут заменять фосфодиэфирные связи). В одном варианте осуществления все фосфатные связи могут представлять собой фосфоротиоатные связи.
Иллюстративные терапии на основе антисмысловых олигонуклеотидов, которые направленно воздействуют на SMAD7, включают, но без ограничения:
5'-GTXYCCCCTTCTCCCXYCAG-3' (SEQ ID NO: 4), где X представляет собой нуклеотид, содержащий азотистое основание, выбранное из группы, состоящей из цитозина и 5-метилцитозина, или нуклеозид 2-О-метилцитозин, и где Y представляет собой нуклеотид, содержащий азотистое основание, выбранное из группы, состоящей из гуанина и 5-метилгуанина, или нуклеозид 2'-O-метилгуанин, при условии, что по меньшей мере один из нуклеотидов X или Y содержит метилированное азотистое основание;
5'-GTXGCCCCTTCTCCCXGCAG-3' (SEQ ID NO: 5), где X представляет собой 5-метил 2'-деоксицитидин 5'-монофосфат;
5'-GTXGCCCCTTCTCCCXGCAGC-3' (SEQ ID NO: 6), где X представляет собой 5-метил 2'-деоксицитидин 5'-монофосфат;
5'-ZTXGCCCCTTCTCCCXGCAZ-3' (SEQ ID NO: 7), где X представляет собой 5-метил-2'-деоксицитидин-5'-монофосфат, и Ζ представляет собой 2'-деоксигуанозин-метилфосфонат;
5'-ZTXGCCCCTTCTCCCXGCAZC-3' (SEQ ID NO: 8), где X представляет собой 5-метил 2'-деоксицитидин-5'-монофосфат, и Ζ представляет собой 2-деоксигуанозин-метилфосфонат.
В конкретном варианте осуществления рассматриваемый антисмысловой олигонуклеотид против SMAD7 может представлять собой последовательность, содержащую одно из следующего:
5'-GTXGCCCCTTCTCCCXGCAG-3' (SEQ ID NO: 9), где X представляет собой 5-метил 2'-деоксицитидин-5'-монофосфоротиоат;
5'-GTXGCCCCTTCTCCCXGCAGC-3' (SEQ ID NO: 10), где X представляет собой 5-метил 2'-деоксицитидин-5'-монофосфоротиоат;
5'-ZTXGCCCCTTCTCCCXGCAZ-3' (SEQ ID NO: 11), где X представляет собой 5-метил 2'-деоксицитидин-5'-монофосфат, и Ζ представляет собой 2'-деоксигуанозин-метилтиофосфонат;
5'-ZTXGCCCCTTCTCCCXGCAZC-3' (SEQ ID NO: 12), где X представляет собой 5-метил 2'-деоксицитидин-5'-монофосфат, и Ζ представляет собой 2'-деоксигуанозин-метилтиофосфонат.
Например, последовательности SEQ ID NO. 9-12 включают 1, 2, 3, 4 или более фосфоротиоатных связей. В одном варианте осуществления все О,O-фосфонатные связи последовательностей SEQ ID NO. 9-12 представляют собой фосфоротиоатные связи.
Фармацевтические композиции и способы введения
Фармацевтические композиции, содержащие антисмысловой олигонуклеотид против SMAD7, например такие, которые описаны в настоящем документе, могут быть представлены в виде стандартной лекарственной формы и могут быть приготовлены любым подходящим способом. Фармацевтическая композиция должна быть формулирована таким образом, чтобы быть совместимой с предполагаемым путем введения. Подходящие композиции могут быть приготовлены способами, хорошо известными в фармацевтической области. Например, смотри Remington's Pharmaceutical Sciences, 18th ed. (Mack Publishing Company, 1990).
Фармацевтические композиции предпочтительно являются стерильными. Стерилизация может быть выполнена, например, путем фильтрации через мембрану, подходящую для стерилизующей фильтрации. В случае лиофилизированной композиции стерилизация фильтрацией может быть выполнена до или после лиофилизации и восстановления.
Парентеральное введение
Фармацевтические композиции согласно изобретению могут быть формулированы для парентерального введения, например, формулированы для инъекции путем внутривенного, внутримышечного, подкожного, внутриочагового или интраперитонеального введения. Приготовление водной композиции, такой как водная фармацевтическая композиция, содержащая ингибитор SMAD7, известно специалистам в данной области в свете настоящего изобретения. Как правило, такие композиции могут быть приготовлены для инъекции в виде жидких растворов или суспензий; также, могут быть приготовлены твердые формы, подходящие для приготовления растворов или суспензий путем добавления жидкости до введения; и также, композиции могут быть эмульгированными.
Фармацевтические формы, подходящие для введения путем инъекции, включают в себя стерильные водные растворы или дисперсии; композиции, содержащие кунжутное масло, арахисовое масло или водный раствор пропиленгликоля; и стерильные порошки для получения стерильных растворов или дисперсий для инъекций, предназначенных для немедленного приема. Во всех случаях такая форма должна быть стерильной и должна быть жидкой до той степени, при которой она может быть легко введена шприцем. Она должна быть стабильной в условиях получения и хранения, и должна быть защищена от контаминирующего действия микроорганизмов, таких как бактерии и грибы.
Растворы активных соединений в виде свободного основания или их фармакологически приемлемых солей могут быть приготовлены в воде, соответствующим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии могут быть также приготовлены в глицерине, в жидких полиэтиленгликолях и в их смесях, а также в маслах. Кроме того, в качестве растворителя или суспендирующей среды можно использовать стерильные нелетучие масла. Для этой цели можно использовать любое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для приготовления инъекционных композиций можно использовать жирные кислоты, такие как олеиновая кислота. Стерильная инъекционная композиция также может представлять собой стерильный инъекционный раствор, суспензию или эмульсию в нетоксичном разбавителе или растворителе, приемлемом для парентерального введения, например, раствор в 1,3-бутандиоле. К числу приемлемых носителей и растворителей, которые могут быть использованы, относятся вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. В одном варианте осуществления ингибитор SMAD7 может быть суспендирован в жидкости-носителе, содержащем 1% (масса/объем) натрий-карбоксиметилцеллюлозы и 0,1% (об/об) TWEEN™ 80. В обычных условиях хранения и применения данные композиции содержат консервант для предотвращения роста микроорганизмов.
Инъекционные композиции, например, стерильные инъекционные водные или масляные суспензии, могут быть формулированы в соответствии с известными способами с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Как правило, дисперсии получают путем добавления различных стерилизованных активных ингредиентов в стерильный носитель, который содержит базовую диспергирующую среду и требуемые другие ингредиенты из тех, которые перечислены выше. Стерильные инъекционные растворы согласно изобретению могут быть приготовлены путем введения ингибитора SMAD7 в требуемое количество подходящего растворителя с различными другими ингредиентами, перечисленными выше, при необходимости, с последующей стерилизацией фильтрованием. В случае стерильных порошков для приготовления стерильных инъекционных растворов, предпочтительными способами получения являются методы вакуумной сушки и лиофилизации, которые позволяют получить порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из их раствора, предварительно стерилизованного фильтрованием. Инъекционные композиции могут быть стерилизованы, например, путем фильтрации через удерживающий бактерии фильтр.
Также рассматривается приготовление более концентрированных или высококонцентрированных растворов для внутримышечной инъекции. При этом предпочтительно применение в качестве растворителя DMSO, поскольку это приводит к очень быстрому проникновению, созданию высоких концентраций ингибитора SMAD7 на малой площади.
Подходящие консерванты для применения в таком растворе включают хлорид бензалкония, хлорид бензетония, хлорбутанол, тимеросал и тому подобное. Подходящие буферы включают борную кислоту, бикарбонаты натрия и калия, бораты натрия и калия, карбонаты натрия и калия, ацетат натрия, бифосфат натрия и тому подобное, в количествах, достаточных для поддержания рН в диапазоне от рН 6 до рН 8, и предпочтительно в диапазоне от рН 7 до рН 7,5. Подходящими средствами для поддержания тоничности являются декстран 40, декстран 70, декстроза, глицерин, хлорид калия, пропиленгликоль, хлорид натрия и тому подобное, так что эквивалент хлорида натрия глазном растворе находится в диапазоне 0,9 плюс или минус 0,2%. Подходящие антиоксиданты и стабилизаторы включают бисульфит натрия, метабисульфит натрия, тиосульфит натрия, тиомочевину и тому подобное. Подходящие смачивающие и осветляющие вещества включают полисорбат 80, полисорбат 20, полоксамер 282 и тилоксапол. Подходящие загустители включают декстран 40, декстран 70, желатин, глицерин, гидроксиэтилцеллюлозу, гидроксиметилпропилцеллюлозу, ланолин, метилцеллюлозу, вазелин, полиэтиленгликоль, поливиниловый спирт, поливинилпирролидон, карбоксиметилцеллюлозу и тому подобное.
В иллюстративном варианте осуществления фармацевтическая композиция для подкожного введения антисмыслового олигонуклеотида против SMAD7 содержит антисмысловой олигонуклеотид, например такой, который представлен SEQ ID NO: 6, или его фармацевтически приемлемую соль (такую как соль натрия) и фармацевтически приемлемый носитель.
Пероральное введение
В некоторых вариантах осуществления в настоящем документе рассматриваются композиции, подходящие для пероральной доставки антисмыслового олигонуклеотида, например, таблетки, которые содержат энтеросолюбильное покрытие, например, покрытие, устойчивое к воздействию желудочной кислоты, так что композиции могут доставлять антисмысловое соединение, например, в толстую кишку пациента. Например, такое введение может приводить к местному эффекту, по существу местному применению антисмыслового соединения непосредственно в пораженной части толстой кишки пациента. Такое введение в некоторых вариантах осуществления позволяет по существу избежать нежелательной системной абсорбции антисмыслового соединения.
Например, предложена таблетка для перорального введения, которая содержит гранулы (например, по меньшей мере, частично образована из гранул), которые содержат раскрытое антисмысловое соединение, например, GED-0301, и фармацевтически приемлемые вспомогательные вещества. Такая таблетка может содержать энтеросолюбильное покрытие. Рассматриваемые таблетки могут содержать фармацевтически приемлемые вспомогательные вещества, такие как наполнители, связующие вещества, дезинтегрирующие вещества и/или смазывающие вещества, а также окрашивающие агенты, агенты, регулирующие высвобождение, покрывающие агенты, подсластители, вкусовые добавки, такие как арбуз, апельсин, ксилол, сорбит, фруктоза и мальтодекстрин, и ароматизаторы, консерванты и/или антиоксиданты.
В некоторых вариантах осуществления рассматриваемые фармацевтические композиции включают внутригранулярную фазу, которая содержит рассматриваемое антисмысловое соединение, например GED-0301, или фармацевтически приемлемую соль, например GED-0301, и фармацевтически приемлемый наполнитель. Например, GED-0301 и наполнитель могут быть необязательно смешаны вместе с другими вспомогательными веществами и формованы в гранулы. В некоторых вариантах осуществления внутригранулярная фаза может быть формована путем влажного гранулирования, например, жидкость (например, воду) добавляют в смесь антисмыслового соединения и наполнителя, и затем комбинацию сушат, измельчают и/или пропускают через сито для получения гранул. Специалисту в данной области будет понятно, что для получения внутригранулярной фазы могут быть использованы другие способы.
В некоторых вариантах осуществления рассматриваемые композиции включают экстра-гранулярную фазу, которая может содержать одно или несколько фармацевтически приемлемых вспомогательных веществ и может быть смешана с внутригранулярной фазой для получения описанной композиции.
Описанная композиция может включать внутригранулярную фазу, которая содержит наполнитель. Иллюстративные наполнители включают, но без ограничения, целлюлозу, желатин, фосфат кальция, лактозу, сахарозу, глюкозу, маннит, сорбит, микрокристаллическую целлюлозу, пектин, полиакрилаты, декстрозу, ацатат целлюлозы, гидроксипропилметилцеллюлозу, частично прежелатинизированный крахмал, карбонат кальция и другие вещества, включая их комбинации.
В некоторых вариантах осуществления описанная композиция может включать внутригранулярную фазу и/или экстра-гранулярную фазу, которая содержит связующее вещество, которое может, в целом, удерживать вместе ингредиенты фармацевтической композиции. Примеры связующих веществ согласно изобретению включают, но без ограничения, следующие вещества: крахмалы, сахара, целлюлозу или модифицированную целлюлозу, такую как гидроксипропилцеллюлоза, лактозу, прежелатинизированный маисовый крахмал, поливинилпирролидон,
гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу с низкой степенью замещения, натрий-карбоксиметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, сахарные спирты и другие вещества, включая их комбинации.
Рассматриваемые композиции, например композиции, которые включают внутригранулярную фазу и/или экстра-гранулярную фазу, могут содержать дезинтегрирующий агент, такой как, но без ограничения, крахмал, целлюлоза, поперечносшитый поливинилпирролидон, натрия крахмала гликолят, натрий-карбоксиметилцеллюлозу, альгинаты, кукурузный крахмал, кросмеллозу натрия, поперечносшитую карбоксиметилцеллюлозу, гидроксипропилцеллюлозу с низкой степенью замещения, аравийскую камедь и другие вещества, включая их комбинации. Например, внутригранулярная фаза и/или экстра-гранулярная фаза может содержать дезинтегрирующий агент.
В некоторых вариантах осуществления рассматриваемая композиция включает внутригранулярную фазу, содержащую описанное антисмысловое соединение и вспомогательные вещества, выбранные из маннита, микрокристаллической целлюлозы, гидроксипропилметилцеллюлозы и натрия крахмала гликолята или их комбинаций, и экстра-гранулярную фазу, содержащую одно или несколько веществ, выбранных из микрокристаллической целлюлозы, натрия крахмала гликолята и стеарата магния или их смесей.
В некоторых вариантах осуществления рассматриваемая композиция может включать смазывающее вещество, например, экстра-гранулярная фаза может содержать смазывающее вещество. Смазывающие вещества включают, но без ограничения, тальк, кремнезем, жиры, стеарин, стеарат магния, фосфат кальция, диоксид кремния, силикат кальция, фосфат кальция, коллоидный диоксид кремния, стеараты металлов, гидрогенизированное растительное масло, кукурузный крахмал, бензоат натрия, полиэтиленгликоли, ацетат натрия, стеарат кальция, лаурилсульфат натрия, хлорид натрия, лаурилсульфат магния, тальк и стеариновую кислоту.
В некоторых вариантах осуществления фармацевтическая композиция содержит энтеросолюбильное покрытие. Как правило, энтеросолюбильные покрытия создают барьер для перорального лекарственного средства, который контролирует место, в котором лекарственное средство абсорбируется в пищеварительном тракте. Энтеросолюбильные покрытия могут включать полимер, который растворяется с различной скоростью в зависимости от рН. Энтеросолюбильные покрытия могут включать, например, ацетат-фталат целлюлозы, сополимеры метилакрилата и метакриловой кислоты, ацетат-сукцинат целлюлозы, фталат гидроксипропилметилцеллюлозы, сополимеры метилметакрилата и метакриловой кислоты, сополимеры этилакрилата и метакриловой кислоты, сополимер метакриловой кислоты типа С, поливинилацетат фталат и ацетат-фталат целлюлозы.
Иллюстративные энтеросолюбильные покрытия включают торговые марки Opadry® АМВ, Acryl-EZE®, Eudragit®. В некоторых вариантах осуществления энтеросолюбильное покрытие может составлять примерно от 5% до 10%, примерно от 5% до 20%, примерно от 8 до 15%, примерно от 8% до 18%, примерно от 10% до 12%, или примерно от 12 до 16% от массы рассматриваемой таблетки. Например, энтеросолюбильное покрытие может включать сополимер этилакрилата и метакриловой кислоты.
Например, предлагается таблетка, которая содержит или состоит в основном из примерно от 0,5 масс. % до 70 масс. %, например, примерно от 0,5 масс. % до 10 масс. %, или примерно от 1 масс. % до 20 масс. % антисмыслового олигонуклеотида или его фармацевтически приемлемой соли (например, GED-0301). Такая таблетка может включать, например, примерно от 0,5 масс. % до 60 масс. % маннита, например, примерно от 30 масс. % до 50 масс. % маннита, например, примерно 40 масс. % маннита; и/или примерно от 20 масс. % до 40 масс. % микрокристаллической целлюлозы, или примерно от 10 масс. % до 30 масс. % микрокристаллической целлюлозы. Например, предложенная таблетка может содержать внутригранулярную фазу, которая включает примерно от 30 масс. % до 60 масс. %, например, примерно от 45 масс. % до 65 масс. %, или, альтернативно, примерно от 5 масс. % до 10 масс. % GED-0301, примерно от 30 масс. % до 50 масс. % или, альтернативно, примерно от 5 масс. % до 15 масс. % маннита, примерно от 5 масс. % до 15 масс. % микрокристаллической целлюлозы, примерно от 0 масс. % до 4 масс. %, или примерно от 1 масс. % до 7 масс. % гидроксипропилметилцеллюлозы, и примерно от 0 масс. % до 4 масс. %, например, примерно от 2 масс. % до 4 масс. % натрия крахмала гликолята.
В другом варианте осуществления фармацевтическая композиция в форме таблетки для перорального введения антисмыслового олигонуклеотида против SMAD7 содержит внутригранулярную фазу, при этом внутригранулярная фаза включает антисмысловой олигонуклеотид, такой как GED-0301, или его фармацевтически приемлемую соль (такую как соль натрия), и фармацевтически приемлемый наполнитель, и может также содержать экстра-гранулярную фазу, которая может включать фармацевтически приемлемое вспомогательное вещество, такое как дезинтегрирующий агент. Экстра-гранулярная фаза может включать компоненты, выбранные из микрокристаллической целлюлозы, стеарата магния и их смесей. Фармацевтическая композиция может также включать энтеросолюбильное покрытие, составляющее примерно от 12% до 15% от массы таблетки. Например, фармацевтически приемлемая таблетка для перорального применения может содержать примерно от 5 масс. % до 10 масс. % антисмыслового олигонуклеотида, например, GED-0301, или его фармацевтически приемлемую соль, примерно от 30 масс. % до 50 масс. % маннита, примерно от 10 масс. % до 30 масс. % микрокристаллической целлюлозы, и энтеросолюбильное покрытие, содержащее сополимер этилакрилата и метакриловой кислоты.
В другом примере фармацевтически приемлемая таблетка для перорального применения может содержать внутригранулярную фазу, содержащую примерно от 5 масс. % до 10 масс. % антисмыслового олигонуклеотида, например, GED-0301, или его фармацевтически приемлемую соль, примерно 40 масс. % маннита, примерно 8 масс. % микрокристаллической целлюлозы, примерно 5 масс. % гидропропилметилцеллюлозы и примерно 2 масс. % натрия крахмала гликолята; экстра-гранулярную фазу, содержащую примерно 17 масс. % микрокристаллической целлюлозы, примерно 2 масс. % натрия крахмала гликолята, примерно 0,4 масс. % стеарата магния; и энтеросолюбильное покрытие на таблетке, содержащее сополимер этилакрилата и метакриловой кислоты.
В некоторых вариантах осуществления фармацевтическая композиция может содержать энтеросолюбильное покрытие, содержащее примерно 13 масс. % или примерно 15 масс. %, 16 масс. %, 17 масс. % или 18 масс. %, например, AcyrlEZE® (смотри, например, публикацию РСТ №WO2010/054826, полное содержание которой включено здесь путем отсылки).
Скорость растворения покрытия определяется скоростью его растворения в указанный момент времени и высвобождением активного ингредиента. В одном варианте осуществления рассматриваемая таблетка может иметь профиль растворения, например, при тестировании в аппарате USP/EP Тип 2 (лопастной) при 100 об/мин и 37°С в фосфатном буфере при рН 7,2, соответствующий высвобождению примерно от 50% до 100% олигонуклеотида примерно через 120-240 минут, например, через 180 минут. В другом варианте осуществления рассматриваемая таблетка может иметь профиль растворения, например, при тестировании в аппарате USP/EP Тип 2 (лопастной) при 100 об/мин и 37°С в разбавленной HCl при рН 1,0, при котором по существу ни один из олигонуклеотидов не высвобождается через 120 минут. В другом варианте осуществления рассматриваемая таблетка может иметь профиль растворения, например, при тестировании в аппарате USP/EP Тип 2 (лопастной) при 100 об/мин и 37°С в фосфатном буфере при рН 6,6, соответствующий высвобождению примерно от 10% до 30% или не более 50% олигонуклеотида через 30 минут.
Раскрытые композиции, например таблетки, в некоторых вариантах осуществления при пероральном введении пациенту могут приводить к минимальной концентрации олигонуклеотида в плазме у пациента. В другом варианте осуществления раскрытые композиции при пероральном введении пациенту, осуществляют доставку в определенное место в толстую кишку или прямую кишку пациента, например, пораженный или больной участок пациента.
В некоторых вариантах осуществления предложенные здесь способы могут дополнительно включать введение, по меньшей мере, одного другого агента, который направлен на лечение заболеваний и нарушений, раскрытых здесь. В одном варианте осуществления предполагаемые другие агенты можно вводить совместно (например, последовательно или одновременно).
Предполагаемые агенты включают иммуносупрессорные агенты, включая глюкокортикоиды, цитостатики, антитела, агенты, действующие на иммунофилины, интерфероны, опиоиды, TNF-связывающие белки, микофенолат и малые биологические агенты. Например, предполагаемые иммуносупрессорные агенты включают, но без ограничения: такролимус, циклоспорин, пимекролимус, сиролимус, эверолимус, микофенольную кислоту, финголимод, дексаметазон, флударабин, циклофосфамид, метотрексат, азатиоприн, лефлуномид, терифлуномид, анакинра, антитимоцитарный глобулин, антилимфоцитарный глобулин, муромонаб-CD3, афутузумаб, ритуксимаб, теплизумаб, эфализумаб, даклизумаб, базиликсимаб, адалимумаб, инфликсимаб и этанерцепт.
Доза и частота введения
Иллюстративные композиции включают лекарственные формы, которые содержат или состоят по существу из антисмыслового олигонуклеотида против SMAD7 в количестве от около 35 мг до около 500 мг. Например, в настоящем документе предполагаются композиции, которые содержат около 35 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг, 200 мг или 250 мг антисмыслового олигонуклеотида против SMAD7. В одном варианте осуществления композиция может содержать около 40 мг, 80 мг или 160 мг антисмыслового олигонуклеотида против SMAD7. В некоторых вариантах осуществления композиция может содержать, по меньшей мере, 100 мкг антисмыслового олигонуклеотида против SMAD7. Например, композиции могут содержать около 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 1 мг, 5 мг, 10 мг, 15 мг, 20 мг или 25 мг антисмыслового олигонуклеотида против SMAD7. Вводимое количество будет зависеть от переменных, таких как тип и степень заболевания, или симптома, подлежащего лечению, общего состояния здоровья и параметров пациента, in vivo активности антисмыслового олигонуклеотида, фармацевтической композиции и пути введения. Начальная доза может быть увеличена выше верхнего уровня для быстрого достижения желаемого уровня в крови или ткани. В альтернативном варианте начальная доза может быть меньше, чем оптимальная, и дозу можно постепенно увеличивать в течение курса лечения. Доза для человека может быть оптимизирована, например, в стандартном исследовании Фазы I с эскалацией дозы от 40 мг до 160 мг. Частота дозирования может изменяться в зависимости от таких факторов, как способ введения, размер дозы и заболевание, подлежащее лечению. Иллюстративной частотой введения доз является введение один раз в день, один раз в неделю и один раз каждые две недели. В некоторых вариантах осуществления введение дозы осуществляют один раз в день в течение 7 дней.
ПРИМЕРЫ
Изобретение дополнительно проиллюстрировано следующими примерами. Примеры представлены лишь в иллюстративных целях и не должны рассматриваться как ограничивающие объем или содержание изобретения каким-либо образом.
Пример 1: Уровни экспрессии белка SMAD7 в клетках колоректального рака
Уровни экспрессии белка SMAD7 оценивали с использованием парных образцов опухолевой и неопухолевой слизистой оболочки толстой кишки, взятых у 6 пациентов с колоректальным раком, подвергнутых резекции толстой кишки по поводу колоректального рака. Иммуноокрашивание SMAD7 опухолевой (Т) и неопухолевой (NT) ткани выявило значительное накопление белка SMAD7 в опухолевой ткани по сравнению с неопухолевой тканью, тогда как окрашивание не наблюдалось при инкубации гистологических срезов колоректального рака с контрольным изотипом IgG (Изотип; фигура 1А, репрезентативные данные трех отдельных экспериментов, в которых анализировали срезы от шести пациентов с колоректальным раком). Кроме того, уровни белка SMAD7 в 14 соответствующих парах опухолевой (Т) и соседней неопухолевой (NT) ткани от пациентов с колоректальным раком оценивали с помощью Вестерн-блоттинга. Вестерн-блоттинг клеточного экстракта показал заметно более высокие уровни SMAD7 в опухолевой ткани по сравнению с неопухолевой тканью (фигура 1В, показан Вестерн-блоттинг экстракта из двух иллюстративных образцов, полученных от пациента). В качестве нагрузочного контроля использовали β-актин. Количественное определение уровней экспрессии SMAD7 в этих же самых блотах с использованием денситометрического анализа подтвердило, что уровни SMAD7 были значительно увеличены в образцах колоректального рака по сравнению с неопухолевой слизистой оболочкой от тех же самых пациентов (фигура 1В).
Экспрессию белка SMAD7 также исследовали в клеточных линиях колоректального рака. Тотальные экстракты белка собирали из клеток клеточных линий колоректального рака DLD-1 и НСТ-116, а также из нормальных толстокишечных эпителиальных клеток (IEC) и оценивали на экспрессию SMAD7 с помощью Вестерн-блоттинга (фигура 1С). Толстокишечные эпителиальные клетки (IEC) выделяли из макроскопически и микроскопически непораженной слизистой оболочки пациентов, подвергнутых колэктомии по поводу спорадического колоректального рака. Вестерн блоттинг выявил значительно более высокую экспрессию белка SMAD7 в клетках DLD-1 и НСТ-116 по сравнению с толстокишечными эпителиальными клетками (IEC). Специфичность сигнала антитела к SMAD7 была подтверждена с помощью FACS-анализа клеток НСТ-116 и DLD-1, меченых FITC-конъюгированным антителом против SMAD7 (SMAD7) или контрольным изотипом IgG (изотип; фигура 1D). Кроме того, детекция с помощью Вестерн-блоттинга и денситометрический анализ уровней белка SMAD7 в экстрактах, собранных из серий клеточных линий колоректального рака, включая НСТ-116, НТ-115, НТ-29 и DLD-1, выявили высокие уровни экспрессии SMAD7 (фигура 1Е). В этом же эксперименте экспрессию SMAD7 оценивали в клетках HepG2, клеточной линии гепатоцеллюлярной карциномы, которая, как известно, экспрессирует высокие уровни белка SMAD7. β-Актин использовали в качестве нагрузочного контроля в обоих экспериментах Вестерн-блоттинга и в качестве маркера нормализации для анализа полосы посредством денситометрического анализа, показанного на фигуре 1Е.
Пример 2: Нокдаун уровней белка SMAD7 в клетках колоректального рака антисмысловым олигонуклеотидов против SMAD7
Трансфекцию раковых клеток антисмысловым олигонуклеотидом GED-0301 против SMAD7 оценивали в клетках клеточной линии НСТ-116. Клетки НСТ-116 трансфицировали немеченым смысловым (смысловым SMAD7) олигонуклеотидом или возрастающими дозами (0,5 мкг/мл, 1 мкг/мл или 2 мкг/мл) FITC-конъюгированного GED-0301 в течение шести часов. На фигуре 2А показаны репрезентативные дот-блоты, количественно оценивающие процентное содержание PI-положительных и FITC-положительных трансфицированных клеток НСТ-116. Была достигнута высокая эффективность трансфекции с очень низкими уровнями гибели клеток по данным PI- и FITC-окрашивания. Один из двух репрезентативных экспериментов, в которых были получены сходные результаты, показан на фигуре 2А.
Нокдаун уровней белка SMAD7 после трансфекции различных количеств GED-0301 также оценивали в клетках НСТ-116. Клетки НСТ-116 трансфицировали смысловым олигонуклеотидом к SMAD7 (при 2 мкг/мл) или GED-0301 (при 0,5 мкг/мл, 1 мкг/мл или 2 мкг/мл) в течение двенадцати часов. Клетки затем промывали фосфатно-буферным солевым раствором (PBS), культивировали со свежей средой в течение шести часов, снова промывали PBS и культивировали дополнительно в течение 24 часов. Уровни SMAD7 and β-актина затем анализировали с помощью Вестерн-блоттинга. На фигуре 2 В показано три репрезентативных эксперимента, демонстрирующие заметный нокдаун уровней белка SMAD7 в клетках, трансфицированных возрастающими количествами GED-0301, по сравнению с клетками, трансифицированными смысловым олигонуклеотидом против SMAD7. Данные результаты демонстрируют, что антисмысловой олигонуклеотид против SMAD7 (GED-0301) может быть трансфицирован в клетки колоректального рака и может индуцировать устойчивый нокдаун уровней белка SMAD7.
Пример 3: Введение антисмыслового олигонуклеотида против SMAD7 влияет на динамику клеточного цикла в клетках колоректального рака
Клеточную пролиферацию оценивали в клетках НСТ-116 и DLD-1 после введения смыслового и GED-0301 олигонуклеотидов против SMAD7. Клетки НСТ-116 и DLD-1 оставляли нетрансфицированными (Untr) или трансфицировали смысловым или GED-0301 олигонуклеотидом против SMAD7 при концентрации 1 мкг/мл. Через двенадцать часов после трансфекции клетки промывали PBS, культивировали еще в течение шести часов, повторно промывали PBS и метили сукцинимидиловым эфиром диацетата карбоксифлуоресцеина (CFSE) в течение 30 минут. Меченые клетки затем промывали PBS и повторно культивировали в свежей среде дополнительно в течение 24 часов. Процентное содержание пролиферирующих клеток оценивали с помощью проточной цитометрии. Значительное уменьшение клеточной пролиферации наблюдалось как в клетках DLD-1 (белые столбцы), так и в клетках НСТ-116 (черные столбцы), трансфицированных GED-0301, по сравнению с клетками, трансфицированными смысловым олигонуклеотидом против SMAD7 (фигура 2С; НСТ-116: клетки, трансфицированные смысловым олигонуклеотидом против SMAD7 в сравнении с GED-0301-трансфицированным клетками, *Р0.001; DLD-1: клетки, трансфицированные смысловым олигонуклеотидом против SMAD7 в сравнении с GED-0301-трансфицированными клетками, † Р<0.001). Данные на графике показывают среднее значение ± стандартное отклонение (SD) из трех экспериментов. Гистограммы на фигуре 2С показывают общий процент клеточной пролиферации в клетках НСТ-116, трансфицированных смысловыми (82%) или GED-0301 (47%) олигонуклеотидами против SMAD7 из одного эксперимента. Таким образом, в клеточных линиях колоректальной карциномы НСТ-116 и DLD-1 введение антисмыслового олигонуклеотида против SMAD7 приводит к значительному уменьшению клеточной пролиферации.
Распределение клеток в различных фазах клеточного цикла также анализировали в клетках НСТ-116 после трансфекции GED-0301. Клетки НСТ-116 оставляли нетрансфицированными (Untr) или трансфицировали смысловыми или GED-0301 олигонуклеотидами против SMAD7. Клетки НСТ-116 трансфицировали смысловыми или GED-0301 олигонуклеотидами против SMAD7 при концентрации 1 мкг/мл. Через двенадцать часов после трансфекции клетки промывали PBS и культивировали в свежей среде дополнительно в течение 24 часов. Процентное содержание клеток в различных фазах клеточного цикла оценивали с помощью проточной цитометрии. Статистически значимое увеличение процентного содержания клеток, находящихся в фазе S, и статистически значимое сопутствующее уменьшение процентного содержания клеток, составляющих популяцию клеток в фазе G0/G1, наблюдали в клетках, трансфицированных GED-0301, по сравнению с контролями (фигура 2D; GED-0301-трансфицированные клетки в сравнении с клетками, трансфицированными смысловым олигонуклеотидом против SMAD7, для фазы S, ** Р=0.001; для фазы G0/G1, * Р=0.01). Показан один из трех репрезентативных экспериментов, в которых были получены сходные результаты. Эти результаты демонстрируют, что нокдаун белка SMAD7, стимулированный введением антисмыслового олигонуклеотида GED-0301 против SMAD7, привел к изменению распределения клеточной популяции по фазам клеточного цикла в клетках колоректального рака.
Клетки колоректального рака часто несут мутации в генах, которые опосредуют передачу сигнала TGF-β1, делая их невосприимчивыми к изменениям в активности TGF-β1. Таким образом, зависимость между наблюдаемыми эффектами на клеточную пролиферацию, индуцированную изменениями в активности SMAD7, и сигнальной активностью TGF-β1 исследовали в клеточных линиях колоректального рака человека НСТ-116 и DLD-1. Клетки, трансфицированные смысловым олигонуклеотидом (S) против SMAD7, подвергали воздействию белка TGF-β1 или нейтрализующего антитела против TGF-β1. Ни подвергание воздействию повышенных концентраций TGF-β1, ни ингибирование активности TGF-β1 посредством воздействия антитела не привело к заметному изменению клеточной пролиферации. Кроме того, клетки, трансфицированные GED-0301 (AS) и подвергнутые таким же обработками, также не показали изменения в клеточной пролиферации по сравнению с необработанными GED-0301-трансфицированными клетками (фигура 2Е, показаны данные для НСТ-116). Эти результаты демонстрируют, что промитотические эффекты передачи сигнала SMAD7, наблюдаемые в клетках колоректального рака, не зависят от активности TGF-β1.
Пример 4: Введение антисмыслового олигонуклеотида против SMAD7 вызывает увеличенную клеточную гибель в клетках колоректального рака
Гибель клеток оценивали в клетках НСТ-116 после введения антисмыслового олигонуклеотида GED-0301 против SMAD7 для определения корреляции между наблюдаемыми изменениями в распределении клеток по фазам клеточного цикла и активацией программ гибели клеток. Для изучения клеточной гибели клетки НСТ-116 оставляли необработанными (Untr) или трансфицировали смысловым или GED-0301 олигонуклеотидом против SMAD7 при концентрации 1 мкг/мл в течение двенадцати часов. Клетки затем промывали PBS, культивировали дополнительно в течение шести часов, повторно промывали PBS, и культивировали в свежей среде дополнительно в течение от 24 до 48 часов (фигура 3А, вверху и в середине, соответственно). Гибель клеток оценивали методом проточной цитометрии путем окрашивания аннексином (AV) и/или пропидий йодидом (PI). Значительное увеличение процента гибели клеток, оцененное с помощью объединенных популяций AV-/PI+, AV+/PI+ и AV+/PI-, наблюдалось через 48 часов для клеток НСТ-116, трансфицированных GED-0301, по сравнению с клетками, трансфицированными смысловым олигонуклеотидом против SMAD7 (фигура 3А, в середине; смысловой олигонулеотид против SMAD7 в сравнении с GED-0301, Р0.001). Результаты представлены как среднее значение ± SD из трех экспериментов. Соответствующие дот-блоты (фигура 3А, внизу) показывают процентное содержание AV- и/или PI-положительных клеток НСТ-116 через 48 часов после трансфекции.
Для дальнейшей оценки активации путей клеточной гибели в клетках колоректального рака после нокдауна SMAD7 исследовали процент клеток, экспрессирующих активную каспазу-3 в клетках, трансфицированных GED-0301. Клетки НСТ-116 оставляли необработанными (Untr) или трансфицировали смысловыми или GED-0301 олигонуклеотидами против SMAD7 при концентрации 1 мкг/мл в течение двенадцати часов. Клетки затем промывали PBS и культивировали еще в течение шести часов со свежей полной средой перед промывкой PBS и культивировали в свежей среде дополнительно в течение 16, 24 или 36 часов. Активацию каспазы-3 оценивали с помощью проточной цитометрии. Дот-блоты на фигуре 3В показывают заметное увеличение активной каспазы-3 в GED-0301-трансфицированных клетках по сравнению с клетками, трансфицированными смысловыми олигонуклеотидами против SMAD7 и нетрансфицированными клетками. Кроме того, трансфекция GED-0301 привела к прогрессивному увеличению процентного содержания активной каспазы-3 в клетках в каждый момент времени. Эти результаты демонстрируют, что в клеточной линии колоректального рака НСТ-116 введение GED-0301 приводит к значительному увеличению процента клеток, подвергающихся клеточной гибели или экспрессирующих активную каспазу-3, по сравнению с контролями.
Для определения, может ли быть блокирована гибель клеток в клетках, трансфицированных GED-0301, клетки культивировали в нормальной среде или в присутствии ингибитора панкаспазы Q-VD-OPH или DMSO в течение одного часа и затем оставляли необработанными или трансфицировали смысловыми или GED-0301 нуклеотидами против SMAD7 в течение 36 часов. Процент клеток, экспрессирующих активную каспазу-3, оценивали с помощью проточной цитометрии. Несмотря на то, что значительного различия не наблюдалось в любой из нетрансфицированных или трансфицированных смысловыми олигонуклеотидами против SMAD7 групп, значительное снижение процента клеток, экспрессирующих активную каспазу-3, наблюдалось в GED-0301-трансфицированных клетках, не обработанных лекарственным средством или обработанных Q-VD-OPH (фигура ЗС; отсутствие лекарственного средства в сравнении с Q-VD-OPH, Р=0.002).
Для оценки процента гибели клеток использовали такой же протокол, за исключением того, что клетки оценивали через 48 часов после трансфекции, и процент гибели клеток оценивали путем изучения объединенных AV- и/или PI-положительных популяций в пределах общей клеточной популяции. Несмотря на то, что значительного различия не наблюдалось ни в одной из нетрансфицированных или трансфицированных смысловыми олигонуклеотидами против SMAD7 групп, значительное уменьшение процента клеток, подвергшихся клеточной гибели, наблюдалось в GED-0301-трансфицированных клетках, не обработанных лекарственным средством или обработанных Q-VD-OPH (фигура 3D; отсутствие лекарственного средства в сравнении с Q-VD-OPH, Р=0.008).
Для определения, происходит ли индуцированное GED-0301 прекращение роста клеток НСТ-116 на фоне индукции клеточной гибели, клеточную пролиферацию оценивали в GED-0301-трансфицированных клетках, подвергнутых воздействию Q-VD-OPH. Клетки культивировали в нормальной среде, или в присутствии или в отсутствие Q-VD-OPH или DMSO в течение одного часа, и затем либо оставляли необработанными или трансфицировали смысловым олигонуклеотидом против SMAD7 или GED-0301. Через 24 часа процентное содержание пролиферирующих клеток оценивали с помощью проточной цитометрии. Несмотря на воздействие Q-VD-OPH, все GED-0301-трансфицированные клеточные популяции показали снижение процента пролиферирующих клеток по сравнению с трансфицированными смысловым олигонуклеотидом против SMAD7 или нетрансфицированными группами, демонстрируя, что клеточная гибель являются вторичным эффектом уменьшенной пролиферации в клетках колоректального рака, подвергнутых нокдауну белка SMAD7 (фигура 3Е). Результаты, показанные на фигуре 3С-Е, представляют собой среднее значение ± SD из трех экспериментов.
Пример 5: Антисмысловой олигонуклеотид против SMAD7 нарушает взаимодействие нижележащих компонентов сигнального пути TGFB1 и влияет на экспрессию и активность регуляторного белка клеточного цикла
Прохождение через клеточный цикл регулируется циклинзависимыми киназами (CDK), которые связаны с активирующими партнерами, известными как циклины, для регулирования активности белков, которые участвуют в развитии клеточного цикла. Активность CDK модулируется как ингибирующим, так и активирующим фосфорилированием. Например, комплекс CDK-циклин может быть ингибирован фосфорилированием по остаткам Thr-14 и Tyr-15 в пределах АТР-связывающего кармана CDK. CDK2 играет главную роль по контролю S-фазы, связыванию с циклином Ε или циклином А для регулирования G1/S-перехода и развития S-фазы, соответственно.
Для анализа влияния экспрессии SMAD7 на активность CKD/циклин в клетках колоректального рака, состояние фосфорилирования CDK2 анализировали в клетках НСТ-116 после трансфекции GED-0301. Клетки НСТ-116 оставляли либо необработанными (Untr) или трансфицировали смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7 при концентрации 1 мкг/мл. Через шесть часов после трансфекции клетки промывали PB S и повторно культивировали со свежей средой дополнительно в течение 16 часов. Уровни p-CDK2 (Thr-14/Tyr-15), CDK2, циклина А и β-актина анализировали путем Вестерн-блоттинга клеточных экстрактов. Один из трех иллюстративных экспериментов, в которых были получены сходные результаты, показан на фигуре 4А. Блот на фигуре 4А демонстрирует, что трансфекция НСТ-116-клеток GED-0301 привела к заметному увеличению уровней p-CDK2 (Thr-14/Tyr-15) по сравнению с контролями, а также уменьшению уровней циклина А, обеспечивая механизм для объяснения накопления клеток в фазе S после введения GED-0301.
Активация CDK2 находится в строгой зависимости от активности специфической фосфатазы CDC25, которая дефосфорилирует и активирует комплексы CDK/циклин. Существует три члена семейства CDC25 человека. CDC25A контролирует прохождение через фазу S, тогда как CDC25B и CDC25C участвуют в контроле перехода из G2 в митоз. Уровни членов семейства CDC25 исследовали для определения наличия связи между инактивацией/фосфорилированием CDK2 в SMAD7-дефицитных клетках и ослабленной экспрессией белков CDC25. Клетки НСТ-116 либо оставляли необработанными (Untr) или трансфицировали смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7 при концентрации 1 мкг/мл в течение 20 часов в бессывороточной среде. Затем клетки промывали PBS и культивировали в среде, содержащей 10%-ную фетальную бычью сыворотку (FBS), в течение дополнительно 24 часов. Нокдаун SMAD7 сопровождался значительным уменьшением экспрессии белка CDC25A, тогда как уровни CDC25B и CDC25C оставались без изменений (фигура 4В; представлены результаты трех экспериментов). Таким образом, оказалось, что активность SMAD7 необходима для устойчивой экспрессии CDC25A в клетках колоректального рака.
Внутриклеточная концентрация CDC25A может быть регулирована на различных уровнях. Для определения, возникает ли индуцированная антисмысловым олигонуклеотидом против SMAD7 понижающая регуляция белка CDC25A в результате ингибирования транскрипции CDC25A, тотальную РНК экстрагировали из клеток НСТ-116, трансфицированных смысловыми (S) или антисмысловыми (AS) олигонуклеотдами против SMAD7, и культивировали в течение различных периодов времени, после чего анализировали на уровни мРНК CDC25A при помощи PCR в режиме реального времени. Сигнал PCR в режиме реального времени CDC25A нормализовали относительно сигнала β-актина. Все клетки трансфицировали олигонуклеотидом при концентрации 1 мкг/мл в течение 20 часов в бессывороточной среде, промывали PBS и культивировали в среде, содержащей 10% FBS. Затем через 4 часа клетки повторно промывали и культивировали в бессывороточной среде в течение указанных моментов времени. Уровни транскриптов мРНК CDC25A были скорее повышены, чем понижающе регулированы в клетках, обработанных антисмысловым олигонуклеотидом против SMAD7 (черные столбцы) по сравнению с клетками, обработанными смысловым олигонуклеотидом против SMAD7 (белые столбцы; фигура 4С показывает среднее значение ± стандартная ошибка среднего (SEM) из трех экспериментов). Эти данные демонстрируют разделение между уровнями белка CDC25A и РНК в SMAD7-дефицитных клетках колоректального рака, и дают основание предполагать, что регулирование экспрессии белка CDC25A белком SMAD7 возникает посредством трансляционного или пост-трансляционного (например, протеасом-зависимого) механизма.
Для определения, можно ли считать протеасом-зависимый механизм причиной наблюдаемого уменьшения CDC25A в клетках с нокдауном SMAD7, клетки, трансфицированные смысловыми (S) или антисмысловыми (AS) олигонуклеотидами против SMAD7, подвергали воздействию протеасомных ингибиторов MG115 и MG132 в течение 24 часов после трансфекции. Обработка клеток колоректального рака этими протеасомными ингибиторами не предотвратила ингибирование экспрессии белка CDC25A (фигура 4D; репрезентативный блот из одного из трех экспериментов).
Экспрессия белка CDC25A также регулируется фактором инициации эукариот альфа (EiF2α), который является важным для ослабления трансляции различных белков (Tomko и Lazo, (2008) Cancer Res. 68(18):7457-7465). Активность EiF2α регулируется фосфорилированием по Ser 51, которое приводит к секвестрации EiF2α (Wek et al., (2006) Biochem. Soc. Trans. 34:7-11). Таким образом, гиперфосфорилирование EiF2α приводит к значительному уменьшению экспрессии белка CDC25A. Статус фосфорилирования EiF2α в клетках колоректального рака, обработанных антисмысловым олигонуклеотидом против SMAD7, таким образом, исследовали для определения, могут ли изменения в активности EiF2α быть причиной наблюдаемых изменений в уровнях CDC25A. Клетки трансфицировали при концентрации 1 мкг/мл в течение 20 часов в бессывороточной среде, промывали PBS, и культивировали со средой, содержащей 10% FBS. Затем клетки повторно промывали через 4 часа и культивировали в бессывороточной среде в течение указанных моментов времени (фигура 4Е; 12, 18 или 24 часа). Сайленсинг SMAD7 в клетках НСТ116 и DLD-1 посредством подвергания воздействию антисмыслового олигонуклеотида (AS) против SMAD7 увеличил фосфорилирование EiF2α по Ser 51 и превзошел понижающее регулирование CDC25A и белка циклин А (фигура 4Е; показан один из трех репрезентативных блотов).
Для подтверждения связи между активностью EiF2α и экспрессией CDC25A в клетках колоректального рака, функцию EiF2α специфически ингибировали в клетках НСТ116 и DLD-1 салубриналом, соединением, которое препятствует дефосфорилированию EiF2α по Ser51. Клетки НСТ-116 обрабатывали DMSO или салубриналом в течение от 6 до 24 часов, и клеточные экстракты затем анализировали с помощью Вестерн-блоттинга на p-EiF2α (Ser 51), общий EiF2α, CDC25A или β-актин. Обработка клеток колоректального рака салубриналом вызвала увеличение уровней фосфорилированного EiF2α и сопутствующее уменьшение уровней белка CDC25A относительно контролей, обработанных DMSO (фигура 4F; показан один из трех реперезентативных блотов). Эти результаты демонстрируют, что нокдаун SMAD7 изменяет фосфорилирование EiF2α, которое, в свою очередь, влияет на уровни экспрессии CDC25A в клетках колоректального рака.
Кроме того, SMAD7 взаимодействует с белком, вызывающим прекращение роста и повреждение ДНК (Growth Arrest and DNA Damage Protein (GADD34)), регуляторной субъединицей галофермента протеинфосфазаты 1 (РР1), способствуя тем самым передаче сигнала рецептору TGFβ типа I. Комплекс GAD334/PP1 может также взаимодействовать с EiF2α и способствовать дефосфорилированию EiF2α. Связь между этими различными молекулярными компонентами в клетках колоректального рака исследовали путем проведения экспериментов по иммунопреципитации и Вестерн-блоттингу. Иммунопреципитацию общих клеточных экстрактов из клеток НСТ-116 (слева), DLD-1 (не показано) и клеток первичного колоректального рака (справа) выполняли с использованием антитела против SMAD7 с последующим Вестерн-блот-анализом с анти-PP1 (верхний), анти-EiF2α (средний) или анти-SMAD7 (нижний) антителами (фигура 4G, один из трех репрезентативных блотов показан для каждого эксперимента; IP = иммунопреципитация, n.s. = неспецифическая полоса). Блоты также метили изотип-специфическими контрольными антителами (правая линия в каждом блоте; ve-). Этот эксперимент показал, что эндогенный SMAD7 взаимодействует с РР1 и EiF2α в клеточных линиях колоректального рака, и с первичными клетками, выделенными из свежей опухолевой ткани колоректального рака.
Последующие эксперименты по иммунопреципитации/иммуноблоттингу в клетках НСТ-116, трансфицированных смысловым (S) или антисмысловым (AS) олигонуклеотидом против SMAD7, показали, что сайленсинг SMAD7 значительно уменьшает связь между РР1 и EiF2α (фигура 4Н; один из трех репрезентативных блотов показан для каждого эксперимента; n.s. = неспецифический сигнал). Экстракты клеток НСТ-116 из трансфицированных клеток подвергали иммунопреципитации антителом РР1 и исследовали методом Вестерн-блота с использованием антитела против EiF2α (верхний), или наоборот (нижний). Блоты также метили изотип-специфическим антителом (Ve-) в качестве контроля. Таким образом, SMAD7 играет важную роль в опосредовании связи между голоферментом РР1 и EiF2α, наделяя EiF2α активностью. Кроме того, введение антисмыслового олигонуклеотида против SMAD7 приводит к нарушению связи между этими компонентами и, в результате, уменьшению экспрессии циклина А и CDC25A, обеспечивая механизм для объяснения изменения клеточной пролиферации и развития клеточного цикла, которые наблюдаются в клетках колоректального рака при подвергании воздействию антисмыслового олигонуклеотида против SMAD7.
Пример 6: Экспрессия in vivo белка SMAD7 и мРНК увеличилась в мышиной модели индуцированного колоректального рака
Экспрессию белка SMAD7 и мРНК оценивали в опухолевых и неопухолевых областях мышей с колоректальным раком, ассоциированным с колитом, для определения наличия связи индукции колоректального рака in vivo с повышенными уровнями SMAD7. В модели, используемой в настоящем описании, мышам C57BL/6J вводили АОМ с последующим повторным пероральным введением DSS (AOM+DSS), вызывая воспаление толстой кишки и последующее развитие множественных опухолей толстой кишки. Животных умерщвляли через 84 дня после обработки AOM+DSS. Уровни белка SMAD7 оценивали путем иммуноокрашивания неопухолевых и опухолевых областей ткани, взятой у мышей с колит-ассоциированным колоректальным раком. На фигуре 5А показано отчетливое увеличение иммуноокрашивания SMAD7 в опухолевых областях мышей, обработанных AOM+DSS. Изображение взято из одного из трех проведенных экспериментов. Экспрессия мРНК SMAD7 также была увеличена в опухолевых областях по сравнению с неопухолевыми областями мышей, обработанных AOM+DSS, по данным измерений при помощи PCR в режиме реального времени (фигура 5В). Величины на фигуре 5В представляют среднее значение ± SEM, и шесть мышей было включено в каждую группу. Таким образом, увеличенная экспрессия мРНК SMAD7, в частности, экспрессия белка in vivo коррелировала с индукцией колоректального рака исключительно в опухолевой ткани.
Пример 7: Введение антисмыслового олигонуклеотида против SMAD7 вызывает уменьшение клеточной пролиферации в эксплантатах ткани
Для оценки влияния нокдауна, вызванного антисмысловым олигонуклеотидом против SMAD7, на клеточную пролиферацию в ткани проводили окрашивание гематоксилином-эозином (Н&Е) или иммунное окрашивание на PCNA срезов, полученных из ex-vivo эксплантатов тканей колоректального рака. Свежеприготовленные эксплантаты тканей трансфицировали смысловыми или GED-0301 олигонуклеотидами против SMAD7 в течение 36 часов и затем окрашивали. На фигуре 6А показаны репрезентативные изображения срезов, окрашенных гематоксилином-эозином (Н&Е) и на PCNA, полученных из свежих эксплантатов. Отчетливое уменьшение иммунного сигнала как на окрашивание Н&Е, так и PCNA наблюдали в эксплантатах тканей, трансфицированных GED-0301, по сравнению с эксплантатами, трансфицированными смысловым олигонуклеотидом против SMAD7, демонстрируя, что GED-0301 эффективно уменьшает клеточную пролиферацию в трансфицированной ткани. Показаны изображения, полученные в одном из двух репрезентативных экспериментов.
Аналогичным образом, смысловой (S) или антисмысловой (AS) олигонуклеотид против SMAD7 добавляли в органные культуры эксплантатов тканей колоректального рака человека, и через 24 часа проводили анализ роста клеток и связанных с клеточным циклом белков. Иммуногистохимический анализ серийных срезов эксплантатов тканей колоректального рака показал, что антисмысловой олигонуклеотид против SMAD7 уменьшает долю клеток колоректального рака, экспрессирующих SMAD7, PCNA, циклин А и CDC25A, и увеличивает процентное содержание клеток положительных на p-EiF2α (Ser51) (фигура 6В). На изображениях показан один из пяти репрезентативных результатов, при этом окрашивание контрольного изотипа (Изотип) показано слева.
Пример 8: Введение антисмыслового олигонуклеотида против SMAD7 уменьшает рост опухоли и клеточную пролиферацию колоректального рака in vivo в мышиной модели ксенотрансплантата
Модель ксенотрансплантата НСТ-116 использовали для оценки эффекта введения GED-0301 на развитие опухоли колоректального рака и пролиферацию клеток колоректального рака. С этой целью мышей Rag-1-/- инокулировали клетками НСТ-116 (5×105 клеток в 500 мкл матригеля). Через неделю после инокуляции мышам вводили однократную интраперитонеальную инъекцию либо PBS (фигура 7A, CTR) или 100 мкг FITC-конъюгированного GED-0301 (фигура 7А, FITC-конъюгированный GED-0301). Мышей умерщвляли через 24 часа после инъекции реагента, опухоли извлекали, и распределение FITC-конъюгированного GED-0301 оценивали по иммунофлуоресцентному сигналу. Сигнал FITC четко солокализовался с сигналом в ядрах клеток ксенотрансплантата (фигура 7А, сторона Dapi/FITC).
Сигнал белка SMAD7 также оценивали в ксенотрансплантатах от животных, подвергнутых введению GED-0301. Клетки НСТ-116 инокулировали мышам Rag-1-/-, и животных обрабатывали интраперитонеально либо смысловым или GED-0301 олигонуклеотидом против SMAD7. Оба олигонуклеотида вводили в дозе 100 мкг/мышь ежедневно, начиная через 7 дней после инъекции НСТ-116. Мышей умерщвляли через 21 день после инокуляции клеток НСТ-116. Вестерн-блоттинг тотального белкового экстракта из ткани ксенотрансплантата выявил заметно уменьшенные уровни сигнала SMAD7 в образцах от мышей, обработанных GED-0301, но не мышей, обработанных смысловым олигонуклеотидом против SMAD7 (фигура 7 В). β-Актин использовали в качестве нагрузочного контроля. Таким образом, GED-0301 оказался способным к нокдауну уровней белка SMAD7 в клетках ксенотрансплантата колоректального рака in vivo.
Ксенотрансплантаты, взятые у мышей, подвергнутых такому же протоколу, который описан выше, анализировали на объем опухолей, генерированных в каждой группе. Значительное уменьшение объема опухоли наблюдалось у НСТ-116-инокулированных мышей, обработанных GED-0301, по сравнению с мышами, обработанными смысловым олигонуклеотидом против SMAD7 (фигура 7С). На диаграмме на фигуре 7С показан средний объем опухоли через 21 день для мышей, обработанных смысловым или GED-0301 олигонуклеотидом против SMAD7 (фигура 7С, слева; смысловой олигонуклеотид против SMAD7 в сравнении с GED-0301, Р<0.001; среднее двух независимых экспериментов, ≥12 мышей на группу; столбцы указывают среднее значение ± SD). На фигуре 7С (справа) представлен репрезентативный снимок ксенотрансплантатов, развитых у мышей, обработанных смысловым (верхний ряд) и GED-0301 (нижний ряд) олигонуклеотидом против SMAD7. Результаты отчетливо демонстрируют, что нокдаун SMAD7 антисмысловым олигонулкеотидом GED-0301 ингибировал рост колоректальной опухоли в модели ксенотрансплантата.
Иммуноокрашивание на SMAD7, маркер клеточной пролиферации PCNA и партнер CDK2 циклин А также выполняли на срезах ткани ксенотрансплантата, взятых у мышей, которые были подвергнуты такому же протоколу, который описан выше. Репрезентативные изображения срезов ксенотрансплантата, окрашенных на SMAD7, PCNA и циклин А, показаны на фигуре 7D. Показаны изображения, полученные в одном из шести репрезентативных экспериментов. Окрашивание контрольного изотипа показано в левой колонке (Изотип). Уменьшение всех трех сигналов наблюдалось в срезах тканей, взятых из ксенотрансплантатов, развитых у мышей, обработанных антисмысловым олигонуклеотидом (AS) GED-0301 по сравнению с мышами, обработанными смысловым (S) олигонуклеотидом против SMAD7, что свидетельствует о том, что нокдаун белка SMAD7, опосредованный антисмысловым олигонуклеотидом против SMAD7, приводит к уменьшению клеточной пролиферации в клетках колоректального рака in vivo.
Пример 9: Введение антисмыслового олигонуклеотида против SMAD7 ингибирует онкогенез в модели спонтанного колоректального рака
Способность антисмыслового олигонуклеотида против SMAD7 ингибировать интестинальный онкогенный потенциал in vivo исследовали с использованием мышиной модели спонтанного колоректального рака. В частности, для этих экспериментов использовали мышей с множественной интестинальной неоплазией (Min), которые несут доминантную мутацию в гене аденоматозного полипоза толстой кишки (Apc). Данная мышиная модель сходна с человеческим заболеванием, известным как семейный аденоматозный полипоз, также вызываемое мутациями в гене АРС. Обработка мышей Аре (Min/+) канцерогеном азоксиметаном (АОМ) увеличивает частоту возникновения опухолей, количество и размер, особенно в толстой кишке. Мышей обрабатывали интраперитонеально (i.p) АОМ (10 мг/кг) один раз в неделю в течение двух недель и контролировали образование опухолей. Через неделю после последней инъекции АОМ мышей обрабатывали перорально либо антисмысловым (AS) или смысловым (S) олигонуклеотидом против SMAD7 в дозе 125 мкг/мышь три раза в неделю до умерщвления на день 80. Параллельно мышам давали пероральные дозы немеченого олигонуклеотида (CTR) или FITC-конъюгированного антисмыслового олигонуклеотида против SMAD7 (FITC-конъюгированный AS; 125 мкг/мышь) и умерщвляли через 8 часов для оценки всасывания олигонуклеотида в кишечнике (фигура 8G). Анализ срезов интестинальной ткани выявил присутствие сигнала FITC, что указывало на то, что антисмысловой олигонуклеотид локализован в ткани-мишени.
Эндоскопия на день 72 показала, что мыши, обработанные смысловым олигонуклеотидом против SMAD7, развили множество крупных опухолей, тогда как количество и размер опухолей уменьшились в толстой кишке мышей, обработанных антисмысловым олигонуклеотидом против SMAD7 (фигура 8А, слева). Эндоскопический анализ количества опухолей и оценка по шкале опухоли выявили значительное снижение этих параметров у мышей, обработанных антисмысловым олигонуклеотидом против SMAD7, по сравнению с мышами, обработанными смысловым олигонуклеотидом против SMAD7 (фигура 8А, диаграммы; количество опухолей, S в сравнении с AS, Р=0,004; шкала опухоли, S в сравнении с AS, Р=0,001; для обеих диаграмм столбцы указывают среднее значение ± SEM, 3 отдельных эксперимента, ≥5 мышей на группу). Эти результаты были подтверждены прямой оценкой опухолей у мышей, умерщвленных на день 80. В частности, окрашивание ткани толстой кишки гематоксилином и эозином (Н&Е) выявило присутствие крупных опухолей у мышей, обработанных смысловым олигонуклеотидом против SMAD7, но не у мышей, обработанных антисмысловым олигонуклеотидом против SMAD7 (фигура 8А, в середине).
Иммуногистохимический анализ опухолевых (Т) и неопухолевых (NT) срезов показал, что экспрессия SMAD7 была повышенной в неопластических областях, подвергнутых воздействию смыслового олигонуклеотида (S) против SMAD7, и ингибирована обработкой антисмысловым олигонуклеотидом (AS, фигура 8В). Окрашивание PCNA подтвердило антипролиферативный эффект антисмыслового олигонуклеотида против Smad7 (фигура 8С). Кроме того, обработка антисмысловым олигонуклеотидом уменьшила уровни циклина А и CDC25 А (фигура 8D, Е) и повысила уровни p-EiF2α (Ser 51) (фигура 8F) в опухолевых областях. Таким образом, GED-0301 успешно ингибировал образование и рост опухолей in vivo во многих животных моделях колоректального рака.
Включение путем отсылки
Полное раскрытие каждого из патентных документов и научных статей, цитированных в настоящем документе, включено путем отсылки для всех целей.
Эквиваленты
Изобретение может быть осуществлено в других специфических формах с отступлением от его главных характеристик. Указанные выше варианты его осуществления следует рассматривать скорее как иллюстративные, а не ограничивающие описанное здесь изобретение. Объем изобретения определяется скорее прилагаемыми пунктами формулы изобретения, а не указанным выше описанием, и все изменения, находящиеся в пределах смысла и диапазона эквивалентности пунктов формулы изобретения, должны быть охвачены их объемом.
Реферат
Группа изобретений относится к медицине и предназначена для лечения колоректального рака. Для этого используется антисмысловой олигонуклеотид против SMAD7. Варианты применения включают применение фармацевтической композиции, содержащей антисмысловой олигонуклеотид против SMAD7 или его фармацевтически приемлемую соль в дозе от 100 мкг до 500 мг. Группа изобретений позволяет расширить арсенал терапевтических средств. 8 н. и 21 з.п. ф-лы, 8 ил., 9 пр.

Комментарии