Cpg-олигонуклеотидные аналоги, содержащие гидрофобные т-аналоги с усиленной иммуностимулирующей активностью - RU2477315C2
Код документа: RU2477315C2
Чертежи






































































Описание
Область изобретения
Настоящее изобретение относится в целом к области иммунологии. Более конкретно, изобретение относится к терапевтическим олигонуклеотидам с усиленной иммуностимулирующей способностью.
Предшествующий уровень техники
Бактериальная ДНК обладает иммуностимулирующими эффектами для активации В-клеток и клеток естественных киллеров в отличие от ДНК позвоночных животных (Tokunaga, Т., et al., 1988. Jpn. J. Cancer Res. 79:682-686; Tokunaga, Т., et al., 1984, JNCl 72:955-962; Messina, J.P., et al., 1991, J. Immunol. 147:1759-1764; и обзор в Krieg, 1998, В: Applied Onnronucleotide Technology, C.A. Stein and A.M. Krieg, (Eds.), John Wiley and Sons, Inc., New York, NY, pp.431-448). В настоящее время понятно, что эти иммуностимулирующие эффекты бактериальной ДНК являются результатом присутствия неметилированных CpG-динуклеотидов, в частности основных контекстов (CpG-мотивы), которые являются обычными для бактериальной ДНК, но метилированными и недостаточно представленными в ДНК позвоночных животных (Krieg et al., 1995 Nature 374:546-549; Krieg, 1999 Biochim. Biophys. Acta 93321:1-10). Иммуностимулирующие эффекты бактериальной ДНК могут быть имитированы синтетическими олигодезоксинуклеотидами (ODN), содержащими эти CpG-мотивы. Такие CpG-ODN обладают высокостимулирующими эффектами в отношении человеческих и мышиных лейкоцитов, включая пролиферацию В-клеток; секрецию цитокинов и иммуноглобулинов; литическую активность клеток естественных киллеров (NK) и секрецию IFN-γ (гамма-интерферона); и активацию дендритных клеток (DC) и других антигенпрезентирующих клеток для экспрессии костимулирующих молекул и секреции цитокинов, в особенности Th1-подобных цитокинов, которые важны для активирования развития Th1-подобных ответов Т-клеток. Эти иммуностимулирующие эффекты нативного фосфодиэфирного каркаса CpG-ODN являются в высокой степени CpG-специфическими в том, что эффекты значительно уменьшаются, если CpG-мотив метилирован, изменен на GpC или иным образом удален или изменен (Krieg et al., 1995 Nature 374:546-549; Hartmann et al., 1999 Proc. Natl. Acad. Sci USA 96:9305-10).
В ранних исследованиях полагали, что иммуностимулирующий CpG-мотив соответствует формуле пурин-пурин-СрG-пиримидин-пиримидин (Krieg et al., 1995 Nature 374:546-549; Pisetsky, 1996 J. Immunol. 156:421-423; Hacker et al., 1998 EMBO J. 17:6230-6240; Lipford et al., 1998 Trends in Microbiol. 6:496-500). Тем не менее, в настоящее время ясно, что мышиные лимфоциты достаточно хорошо реагируют на фосфодиэфирные CpG-мотивы, которые не соответствуют этой "формуле" (Yi et al., 1998 J. Immunol. 160:5898-5906), и то же самое справедливо для человеческих В-клеток и дендритных клеток (Hartmann et al., 1999 Proc. Natl. Acad. Sci USA 96:9305-10; Liang, 1996 J. Clin. Invest. 98:1119-1129).
Недавно было описано несколько различных классов CpG-нуклеиновых кислот. Один из классов обладает потенциалом в отношении активации В-клеток, но относительно малоэффективен в отношении индукции активации IFN-α и NK-клеток; этот класс назван В-классом. В-класс CpG-нуклеиновых кислот, как правило, полностью стабилизирован и включает неметилированный CpG-динуклеотид в некоторых предпочтительных основных контекстах. См., например, патенты США №№6194388; 6207646; 6214806; 6218371; 6239116 и 6339068. Другой класс CpG-нуклеиновых кислот активирует В-клетки и NK-клетки и индуцирует IFN-α; этот класс назван С-классом. С-класс CpG-нуклеиновых кислот, охарактеризованный первым, как правило, полностью стабилизированный, включает последовательность типа В-класса и GC-богатый палиндром или близкий к палиндрому. Этот класс описан в находящейся на одновременном рассмотрении предварительной заявке на патент США 60/313273, поданной 17 августа 2001 года, и 10/224523, поданной 19 августа 2002 года, и родственной РСТ-заявке PCT/US02/26468, опубликованной под номером международной публикации WO 03/015711.
Краткое изложение сущности изобретения
Изобретение относится к олигонуклеотиду, включающему одну или более чем одну модификацию, который вызывает усиленную иммуностимулирующую способность. В частности, изобретение основано на обнаружении того, что специфические подклассы олигонуклеотидов, имеющие по меньшей мере один липофильный замещенный нуклеотидный аналог, высокоэффективны в опосредовании иммунного ответа. Эти олигонуклеотиды полезны терапевтически и профилактически для индукции иммунного ответа и для лечения заболеваний и расстройств, таких как рак и вирусные инфекции.
В одном из аспектов изобретение представляет собой композицию, содержащую последовательность: R1YZR2, где R1 и R2 представляют собой липофильный замещенный нуклеотидный аналог (L), нуклеотид и связь, где по меньшей мере один из R1 и R2 представляет собой липофильный замещенный нуклеотидный аналог (L), где Y представляет собой пиримидиновый нуклеотид, и где Z представляет собой пурин, пиримидин или остаток, лишенный азотистого основания.
В некоторых воплощениях L содержит 5- или 6-членный кольцевой аналог нуклеинового основания.
В других воплощениях этого аспекта изобретения L представляет собой группу формулы I
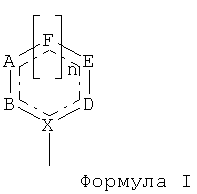
имеющую следующие элементы: А, В, X, D, Е и F представляют собой С (углерод) или N (азот), возможно несущие водород или заместитель; n равен 0 или 1; пунктирные линии указывают на возможные двойные связи; где по меньшей мере один заместитель не выбран из группы, состоящей из оксо, тио, гидрокси, меркапто, имино, амино, метила и водорода, и где в совокупности атомы А, В, X, D, Е и F составляют не более 3 атомов азота (N). В некоторых случаях n равен 1, а в других случаях n равен 0. В некоторых воплощениях все атомы А, В, X, D, Е, F представляют собой углерод (С). В некоторых воплощениях один, два или три атома А, В, X, D, Е, F представляют собой азот (N). В соответствии с некоторыми воплощениями по меньшей мере один из атомов А, В, X, D, Е, F замещен одним из следующих: F, Cl, Br, I, алкил, алкенил, алкинил, галогенированный алкил, галогенированный алкенил, циклоалкил, O-алкил, O-алкенил, -NH-алкил, -N(алкил)2; -S-алкил, -SO-алкил, -SO2-алкил, нитро, циано, карбоксиэфир, фенил, тиофенил, бензил, оксо, тио, гидрокси, меркапто и имино, где по меньшей мере один заместитель не представляет собой оксо, тио, гидрокси, меркапто, имино, амино или метил. В соответствии с другими воплощениями один из двух атомов А или Е замещен одним из следующих: F, Cl, Br, I, С2-С6-алкил, алкенил, алкинил, галогенированный алкил, галогенированный алкенил, циклоалкил, O-алкил, O-алкенил, -NH-алкил, -N(алкил)2; -S-алкил, -SO-алкил, -SO2-алкил, нитро, циано, карбоксиэфир, фенил, тиофенил, бензил или метил, при условии, что если метил, то А, В, X, D, Е и F все представляют собой С.
В некоторых воплощениях формула 1 содержит замещенный пиримидин, урацил, толуол, имидазол или пиразол либо триазол. В соответствии с другими воплощениями формула 1 выбрана из следующих: 5-хлор-урацил, 5-бром-урацил, 5-йод-урацил, 5-этил-урацил, 5-пропил-урацил, 5-пропинил-урацил, (Е)-5-(2-бромвинил)-урацил и 2,4-дифтор-толуол. В соответствии с одним из воплощений изобретения формула 1 конденсирована с 3-6-членной ароматической или алифатической кольцевой системой. В соответствии с другими воплощениями формула 1 связана с 5-6-членной группировкой сахара, включающей пентозу или гексозу. В некоторых случаях пентоза представляет собой фуранозу, а гексоза представляет собой пиранозу, которые возможно могут быть замещены группами F, амино, алкокси, алкокси-этокси, амонипропил, алкенил, алкинил или O2,С4-алкиленовым мостиком. В других случаях фураноза представляет собой рибозу или дезоксирибозу.
В соответствии с некоторыми воплощениями изобретения оба из R1 и R2 представляют собой L. В некоторых воплощениях R1 представляет собой L, и R2 представляет собой нуклеотид. Альтернативно, в некоторых случаях R1 представляет собой L, и R2 представляет собой связь, так что олигонуклеотид содержит структуру 5'-R1CG-3'. Другие воплощения включают олигонуклеотид, где R1 представляет собой L, и R2 представляет собой связь, и где R3 расположен с 5'-конца относительно R1YZ, так что олигонуклеотид содержит структуру 5'-R3R1YZ-3'. В некоторых воплощениях R1 представляет собой L, и R2 представляет собой связь, и где второй R1 расположен с 5'-конца относительно R1YZ, разделенный одним нуклеотидом N, так что олигонуклеотид содержит структуру 5'-R1NR1YZ-3'. В некоторых случаях олигонуклеотид может включать два мотива 5'-R1NR1YZ-3'.
В соответствии с некоторыми воплощениями олигонуклеотид включает Y, представляющий собой один из следующих пиримидинов: цитозин, 5-метил-цитозин, 5-гидрокси-цитозин, 5-гидроксиметил-цитозин, 5-галогено-цитозин, 2-тио-цитозин, 4-тио-цитозин, N3-метил-цитозин, N4-алкил-цитозин или 6-замещенный цитозин.
В соответствии с некоторыми воплощениями олигонуклеотид включает Z, представляющий собой пуриновый нуклеотид, включающий: гуанин, 7-деаза-гуанин, гипоксантин, 7-деаза-гипоксантин, 2-амино-пурин, 4-тио-пурин, 2,6-диамино-пурин, 8-оксо-7,8-дигидрогуанин, 7-тиа-8-оксо-7,8-дигидрогуанин, 7-аллил-8-оксо-7,8-дигидрогуанин, 7-деаза-8-аза-гуанин, 8-аза-гуанин, N1-метил-гуанин или пурин. В других воплощениях Z представляет собой пиримидиновый нуклеотид, включающий Т.
В соответствии с некоторыми воплощениями изобретения R2 представляет собой L, и R1 представляет собой нуклеотид.
В соответствии с некоторыми воплощениями олигонуклеотид имеет длину 3-100 нуклеотидов; например, олигонуклеотид имеет длину 3-6 нуклеотидов, 3-100 нуклеотидов или 7-100 нуклеотидов. В некоторых случаях олигонуклеотид является Т-обогащенным, так что по меньшей мере 80% нуклеотидов представляют собой Т.
Изобретение включает воплощения, содержащие по меньшей мере одну палиндромную последовательность. Например, в некоторых случаях олигонуклеотид включает две палиндромные последовательности.
В соответствии с изобретением некоторые воплощения включают 1-4 неметилированных CG-динуклеотида. В некоторых воплощениях олигонуклеотид может включать по меньшей мере одну (G)m последовательность, где m равен 4-10. В некоторых случаях CG-динуклеотиды от по меньшей мере одного вплоть до всех являются неметилированными. В соответствии с некоторыми воплощениями олигонуклеотид дополнительно может содержать ненуклеотидную модификацию. Ненуклеотидные модификации включают: С6-С48-полиэтиленгликоль, С3-C20-алкан-диол, С3-C18-алкиламиновый линкер, С3-С18-алкилтиольный линкер, холестерин, желчную кислоту, насыщенную или ненасыщенную жирную кислоту, фолат, гексадецил-глицериновую или дигексадецил-глицериновую группу, октадецил-глицериновую или диоктадецил-глицериновую группу, группу витамина Е, но не ограничены ими. В других воплощениях олигонуклеотид по изобретению дополнительно содержит ненуклеотидную разветвляющую группировку или нуклеотидную разветвляющую группировку. В некоторых воплощениях олигонуклеотид включает разветвляющую группировку, где олигонуклеотиды имеют по меньшей мере два 5'-конца.
В соответствии с изобретением некоторые воплощения включают по меньшей мере два нуклеотида данного олигонуклеотида, имеющие стабилизированную связь, включающие: фосфоротиоат, фосфородитиоат, метилфосфонат, метилфосфонотиоат боранофосфонат, фосфорамидат или дефосфосвязь, либо в виде энантиомерной смеси, либо в виде энантиомерно чистой S- или R-конфигурации.
В некоторых воплощениях YZ в R1YZR2 имеет фосфодиэфирную связь или фосфоротиоатную связь. В некоторых случаях R1Y и/или ZR2 в R1YZR2 имеет фосфоротиоатную связь. В некоторых воплощениях все другие нуклеотиды имеют фосфоротиоатную связь.
В соответствии с некоторыми воплощениями изобретения олигонуклеотид не содержит микроносителя, включая липидный носитель.
В соответствии с изобретением олигонуклеотиды могут представлять собой олигонуклеотид А-класса, олигонуклеотид В-класса, олигонуклеотид С-класса, олигонуклеотид Р-класса или олигонуклеотид Т-класса. Для олигонуклеотида В-класса по изобретению некоторые воплощения включают последовательность 5'-TCN1TX1X2CGX3X4-3', где X1 представляет собой G или А; Х2 представляет собой Т, G или А; Х3 представляет собой Т или С, и Х4 представляет собой Т или С; и N представляет собой любой нуклеотид, и N1 и N2 представляют собой последовательности нуклеиновых кислот приблизительно по 0-25 нуклеотидов каждая.
В соответствии с некоторыми воплощениями изобретения олигонуклеотид содержит по меньшей мере одну 3'-3' связь и/или по меньшей мере одну 5'-5' связь.
В еще одном аспекте изобретение представляет собой композицию олигонуклеотидов, описанных здесь в комбинации с антигеном или другим терапевтическим соединением, таким как противомикробный агент. Противомикробный агент может представлять собой, например, противовирусный агент, противопаразитарный агент, бактерицидный агент или противогрибковый агент.
В соответствии с еще одним аспектом изобретения предложена композиция в виде средства длительного высвобождения, включающая описанные здесь олигонуклеотиды.
Композиция может включать фармацевтический носитель и/или может быть приготовлена в виде средства для доставки. В некоторых воплощениях средство для доставки выбрано из группы, состоящей из катионных липидов, белков, проникающих в клетки, и средств длительного высвобождения. В одном из воплощений средство длительного высвобождения представляет собой биоразрушаемый полимер или микрочастицу.
В соответствии с еще одним аспектом изобретения предложен способ стимуляции иммунного ответа. Способ включает введение субъекту олигонуклеотида в количестве, эффективном для индукции у данного субъекта иммунного ответа. Предпочтительно, олигонуклеотид вводят перорально, местно, в виде средства длительного высвобождения, через слизистую оболочку, системно, парентерально или внутримышечно. Когда олигонуклеотид вводят через поверхность слизистых оболочек, он может быть доставлен в количестве, эффективном для индукции иммунного ответа слизистых оболочек или системного иммунного ответа. В предпочтительных воплощениях поверхность слизистых оболочек выбрана из группы, состоящей из поверхности ротовой полости, назальной, ректальной, вагинальной и глазной поверхности.
В некоторых воплощениях способ включает воздействие на субъекта антигена, где иммунный ответ представляет собой антигенспецифический иммунный ответ. В некоторых воплощениях антиген выбран из группы, состоящей из опухолевого антигена, вирусного антигена, бактериального антигена, паразитарного антигена и пептидного антигена.
Олигонуклеотиды полезны для лечения рака у субъекта, страдающего раком, или у субъекта, имеющего риск развития рака (например, снижение риска развития рака). Рак может быть выбран из группы, состоящей из рака желчных путей, рака молочной железы, рака шейки матки, хориокарциномы, рака толстой кишки, рака эндометрия, рака желудка, внутриэпителиальных новообразований, лимфом, рака печени, рака легкого (например, мелкоклеточного и немелкоклеточного), меланомы, нейробластом, рака ротовой полости, рака яичников, рака поджелудочной железы, рака предстательной железы, рака прямой кишки, сарком, рака щитовидной железы и рака почки, а также других карцином и сарком. В некоторых важных воплощениях рак выбран из группы, состоящей из рака кости, головного мозга и рака ЦНС (центральной нервной системы), рака соединительной ткани, рака пищевода, рака глаза, ходжкинской лимфомы, рака гортани, рака ротовой полости, рака кожи и рака семенников.
Олигонуклеотиды также могут быть использованы для повышения чувствительности раковой клетки к терапии рака (например, противоопухолевой терапии), возможно когда иммуностимулирующий CpG-олигонуклеотид вводят в комбинации с противоопухолевой терапией. Противоопухолевая терапия может представлять собой химиотерапию, вакцину (например, вакцину примированных in vitro дендритных клеток или вакцину на основе ракового антигена) или терапию на основе антитела. Последняя терапия также может включать введение антитела, специфичного в отношении антигена клеточной поверхности, например, раковой клетки, где иммунный ответ приводит в результате к антителозависимой клеточно-опосредованной цитотоксичности (ADCC). В одном из воплощений антитело может быть выбрано из группы, состоящей из рибутаксина, герцептина, квадрамета, панорекса, IDEC-Y2B8, ВЕС2, С225, онколима, SMART M195, ATRAGEN, оварекса, бексара, LDP-03, иора t6, MDX-210, MDX-11, MDX-22, OV103, 3622W94, антител против VEGF (фактора роста эндотелия сосудов), зенапакса, MDX-220, MDX-447, MELIMMUNE-2, MELIMMUNE-1, CEACIDE, претаргета, NovoMAb-G2, TNT, глиомаба-Н, GNI-250, EMD-72000, ЛимфоЦида, СМА 676, монофарма-С, 4 В5, иора egf.r3, иора с5, BABS, антител против FLK-2, MDX-260, ANA Ab, SMART 1D10Ab, SMART ABL 364 Ab и ImmuRAIT-CEA.
Таким образом, в соответствии с некоторыми аспектами по изобретению, субъекту, страдающему раком или имеющему риск развития рака, вводят олигонуклеотид и противоопухолевую терапию. В некоторых воплощениях противоопухолевая терапия выбрана из группы, состоящей из химиотерапевтического агента, иммунотерапевтического агента и противораковой вакцины.
Изобретение в других аспектах относится к способам предотвращения заболевания у субъекта. Способ включает введение субъекту олигонуклеотида на систематической основе, для того чтобы способствовать увеличению реактивности иммунной системы для предотвращения заболевания у субъекта. Примеры заболеваний или состояний, которые предполагается предотвращать с использованием профилактических способов по изобретению, включают микробные инфекции (например, заболевания, передаваемые половым путем) и анафилактический шок в результате пищевых аллергий.
В других аспектах изобретение представляет собой способ индукции врожденного иммунного ответа путем введения субъекту олигонуклеотида в количестве, эффективном для активации врожденного иммунного ответа.
В соответствии с еще одним аспектом изобретения предложен способ лечения вирусной или ретровирусной инфекции. Способ включает введение субъекту, страдающему вирусной или ретровирусной инфекцией или имеющему риск ее возникновения, количества любой из композиций по изобретению, эффективного для лечения вирусной или ретровирусной инфекции. В некоторых воплощениях вирусная инфекция вызвана вирусом гепатита, например гепатита В, гепатита С, вирусом иммунодефицита человека (HIV), вирусом герпеса или вирусом папилломы.
В соответствии с еще одним аспектом изобретения предложен способ лечения бактериальной инфекции. Способ включает введение субъекту, страдающему бактериальной инфекцией или имеющему риск ее возникновения, количества любой из композиций по изобретению, эффективного для лечения бактериальной инфекции. В одном из воплощений причиной бактериальной инфекции являются внутриклеточные бактерии.
В еще одном аспекте изобретение представляет собой способ лечения паразитарной инфекции путем введения субъекту, страдающему паразитарной инфекцией или имеющему риск ее возникновения, количества любой из композиций по изобретению, эффективного для лечения паразитарной инфекции. В одном из воплощений причиной паразитарной инфекции является внутриклеточный паразит. В еще одном воплощении причиной паразитарной инфекции является негельминтный паразит.
В некоторых воплощениях субъект представляет собой человека, а в других воплощениях субъект представляет собой позвоночное животное, отличное от человека, выбранное из группы, состоящей из собаки, кошки, лошади, коровы, свиньи, индейки, козы, рыбы, обезьяны, цыпленка, крысы, мыши и овцы.
В еще одном аспекте изобретение относится к способу лечения аутоиммунного заболевания путем введения субъекту, страдающему аутоиммунным заболеванием или имеющему риск его возникновения, количества любой из композиций по изобретению, эффективного для лечения или предотвращения аутоиммунного заболевания.
Изобретение в некоторых аспектах представляет собой способ лечения ремоделирования дыхательных путей, астмы или аллергии, включающий введение субъекту любой из композиций по изобретению в эффективном количестве для лечения ремоделирующей дыхательные пути астмы или аллергии у субъекта. В одном из воплощений субъект страдает астмой, хроническим обструктивным заболеванием легких, или является курильщиком. В других воплощениях субъект не страдает симптомами астмы.
Применение олигонуклеотида по изобретению для стимуляции иммунного ответа также предложено в качестве одного из аспектов изобретения.
Также предложен способ изготовления лекарственного средства на основе олигонуклеотида по изобретению для стимуляции иммунного ответа.
Каждый из признаков настоящего изобретения может охватывать различные воплощения изобретения. Таким образом, подразумевают, что каждый из признаков изобретения, в который включен любой элемент или комбинация элементов, может быть включен в каждый аспект изобретения. Изобретение не ограничивается в настоящей заявке подробным описанием создания и распределения компонентов, указанных в представленном ниже описании или проиллюстрированном в графических материалах. Изобретение допускает другие воплощения и может применяться на практике или осуществлено различными путями. Кроме того, используемая здесь фразеология и терминология предназначена только для целей описания, и ее не следует рассматривать как ограничивающую. Подразумевают, что применение терминов "включающий", "содержащий" или "имеющий", "охватывающий", "вовлекающий" и их вариантов включает элементы, перечисленные далее, и их эквиваленты, а также дополнительные элементы.
Краткое описание графических материалов
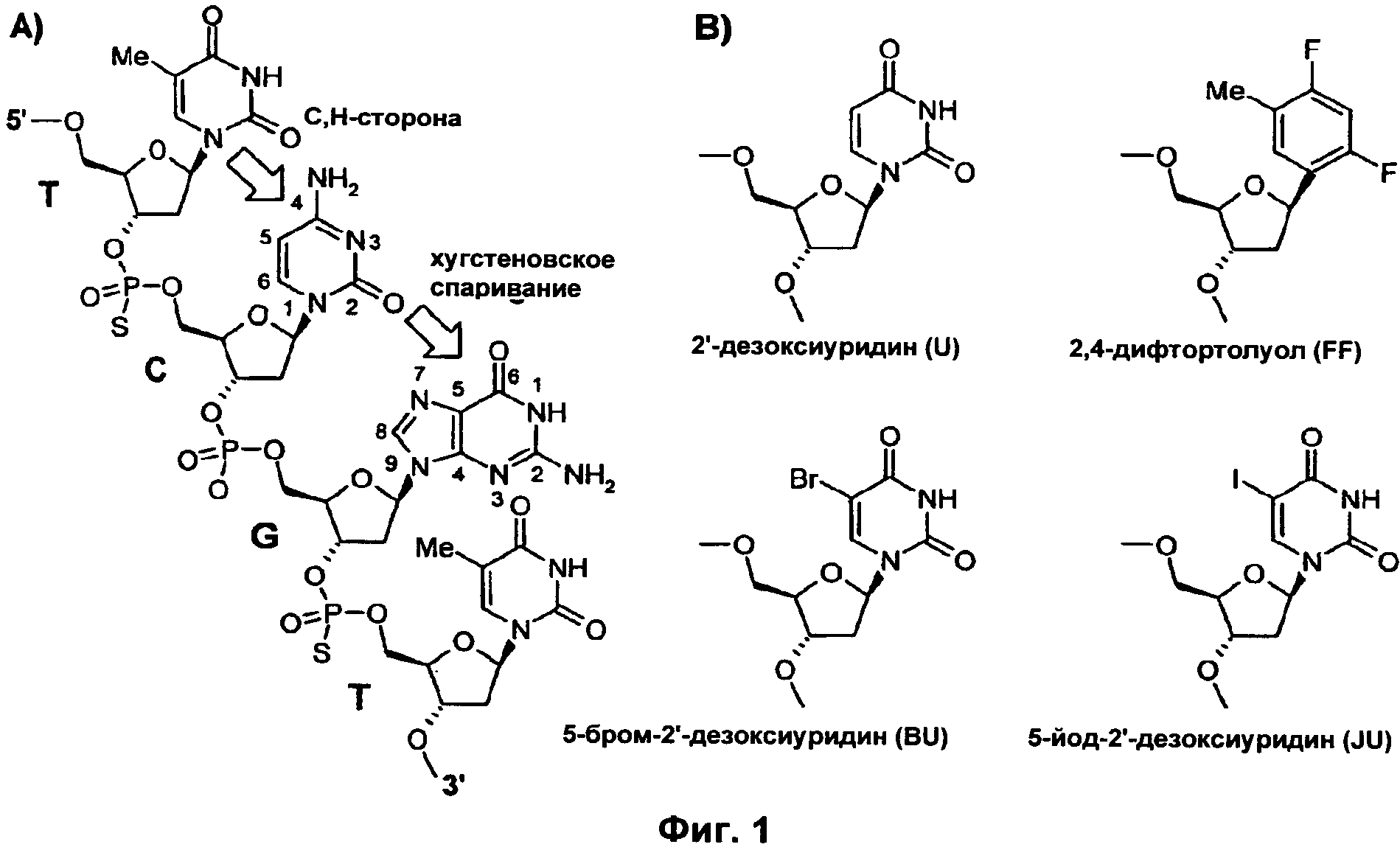
Фиг.1 представляет собой два изображения, иллюстрирующие структуру модифицированных оснований по изобретению. Фиг.1а демонстрирует участок CpG-гексамерного мотива (GTCGTT). Фиг.1b демонстрирует включенные аналоги гидрофобной формы 2'-дезокситимидина: 2,4-дифтортолуол (FF), 5-бромуридин (BU) и 5-йодуридин (JU).
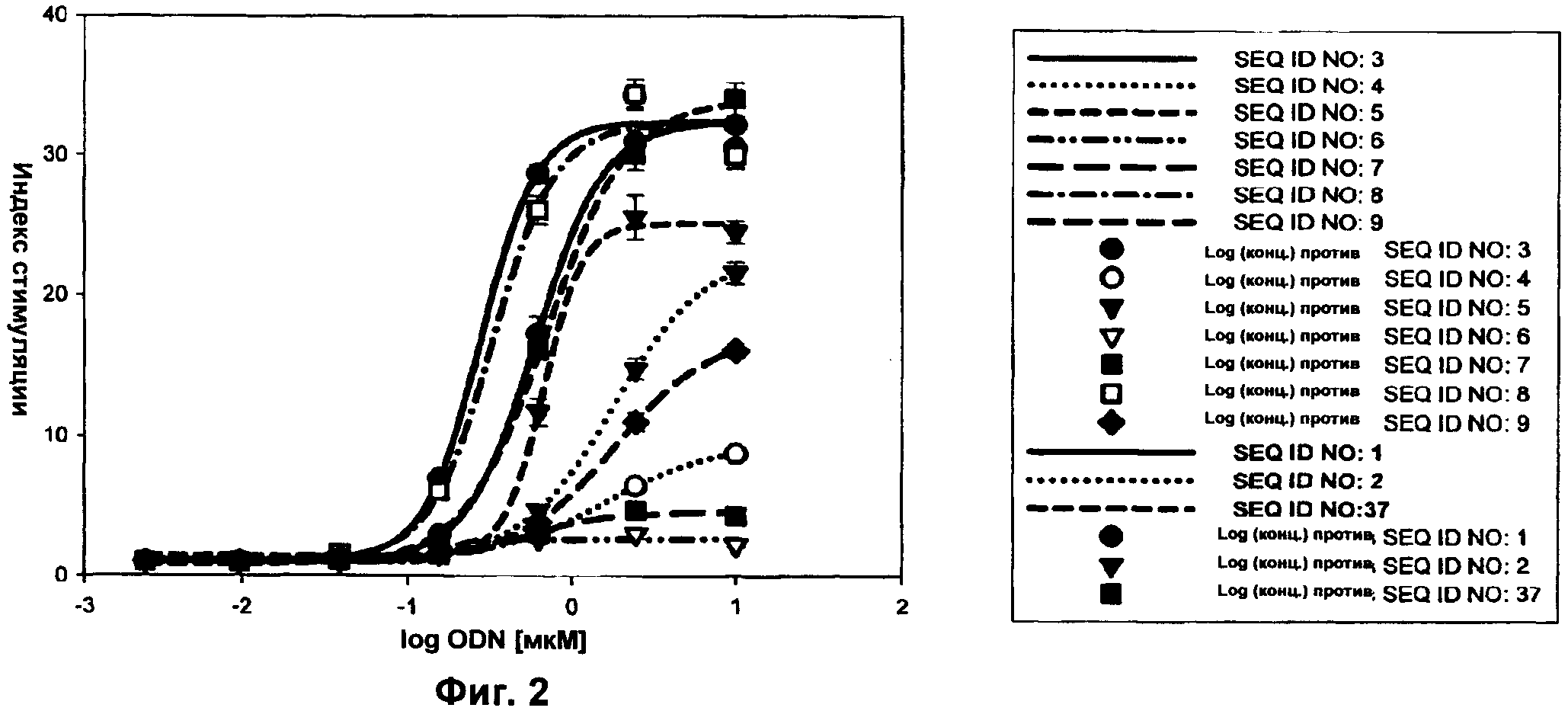
Фиг.2 представляет собой график, демонстрирующий результаты люциферазного анализа с В-классом олигонуклеотидов (ODN), модифицированных аналогом тиминовой формы 2,4-дифтортолуола (FF). Активность FF-модифицированных ODN (SEQ ID NO:3-9) сравнивали с активностью немодифицированной родительской последовательности В-класса (SEQ ID NO:1), полностью PS родительской последовательности (SEQ ID NO:2) и третьего немодифицированного ODN В-класса (SEQ ID NO:37). Клетки hTLR9-LUC-293 стимулировали указанными количествами ODN и стимуляцию NF-κВ определяли путем измерения люциферазной активности через 16 ч. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.3 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN В-класса. Тимидин (Т) замещен на 5-бром-2'-дезоксиуридин (BU) (SEQ ID NO:10-12) и 5-йод-2'-дезоксиуридин (JU) (SEQ ID NO:13-15). Их активность сравнивали с активностью немодифицированной родительской последовательности В-класса (SEQ ID NO:1), полностью PS родительской последовательности (SEQ ID NO:2), и третьего немодифицированного ODN В-класса (SEQ ID NO:37). Клетки hTLR9-LUC-293 стимулировали указанными количествами ODN и стимуляцию NF-κВ определяли путем измерения люциферазной активности через 16 ч. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.4 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN В-класса. 2'-Дезокситимидин (Т) замещен 2'-дезоксиуридином (U) (SEQ ID NO:16-18). Активность U-модифицированного ODN сравнивали с активностью немодифицированной родительской последовательности В-класса (SEQ ID NO:1), полностью PS родительской последовательности (SEQ ID NO:2) и третьего немодифицированного ODN В-класса (SEQ ID NO:37). Клетки hTLR9-LUC-293 стимулировали указанными количествами ODN и стимуляция NF-κВ определяли путем измерения люциферазной активности через 16 ч. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.5 представляет собой два графика, демонстрирующие результаты люциферазного анализа и анализа РВМС (мононуклеарных клеток периферической крови) с модифицированным ODN В-класса. Относительную активность ODN с 5-этил-2'-дезоксиуридином (EU) (SEQ ID NO:42), 2'-дезоксиуридином (U) (SEQ ID NO:16), 5-йод-2'-дезоксиуридином (JU) (SEQ ID NO:13), 5-бром-2'-дезоксиуридином (BU) (SEQ ID NO:10) и 5-хлор-2'-дезоксиуридином (CU) (SEQ ID NO:41) сравнивали с активностью родительской последовательности (SEQ ID NO:1). Фиг.5а демонстрирует активность TLR9, а Фиг.5b демонстрирует продукцию IFN-альфа. Показано среднее значение +/- СО (стандартное отклонение) для трех доноров. Оси х представляют собой концентрацию ODN в мкМ, а оси у представляют собой относительный индекс стимуляции (Фиг.5а) или концентрацию IFN-альфа в пг/мл (Фиг.5b).
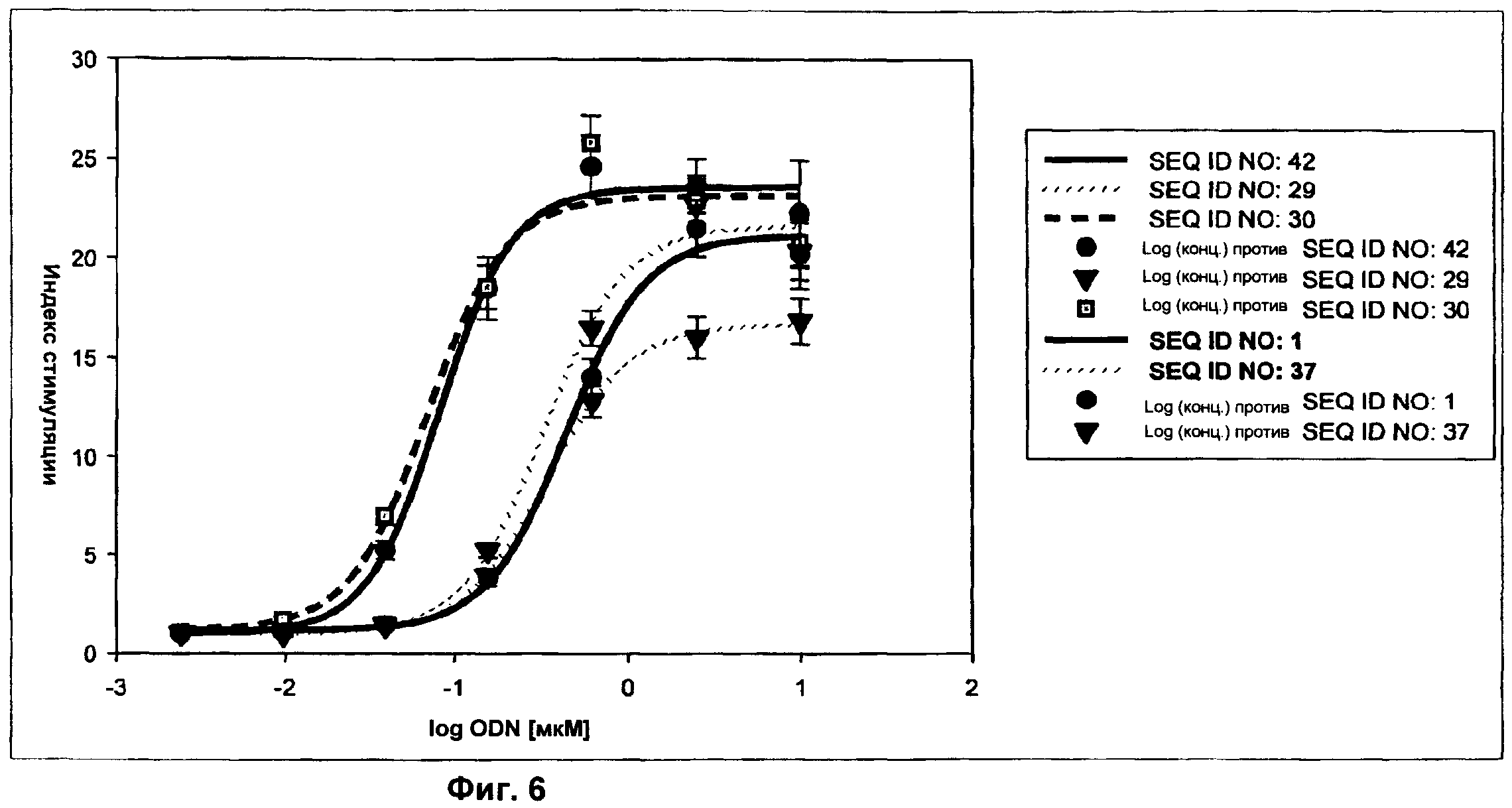
Фиг.6 представляет собой график, демонстрирующий результаты люциферазного анализа с EU-модифицированным ODN. Активность EU-модифицированного ODN SEQ ID NO:29, 30 и 42 сравнивали с активностью родительской последовательности (SEQ ID NO:1) и другого немодифицированного ODN В-класса (SEQ ID NO:37). Ось x представляет собой концентрацию ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
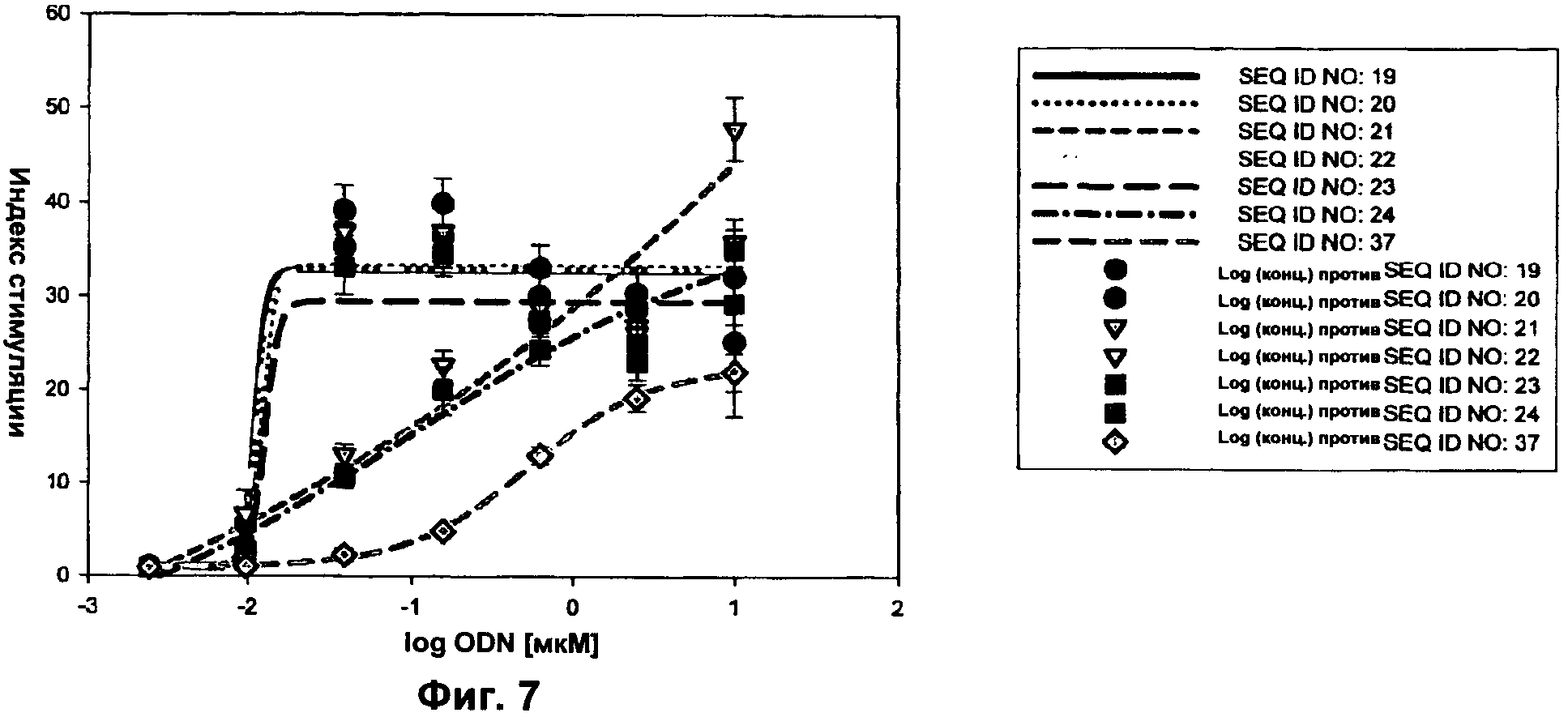
Фиг.7 представляет собой график, демонстрирующий результаты люциферазного анализа модифицированным ODN В-класса. Активность JU-модифицированных SEQ ID NO:19-24 сравнивали с активностью родительской последовательности SEQ ID NO:37. Ось x представляет собой концентрацию ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
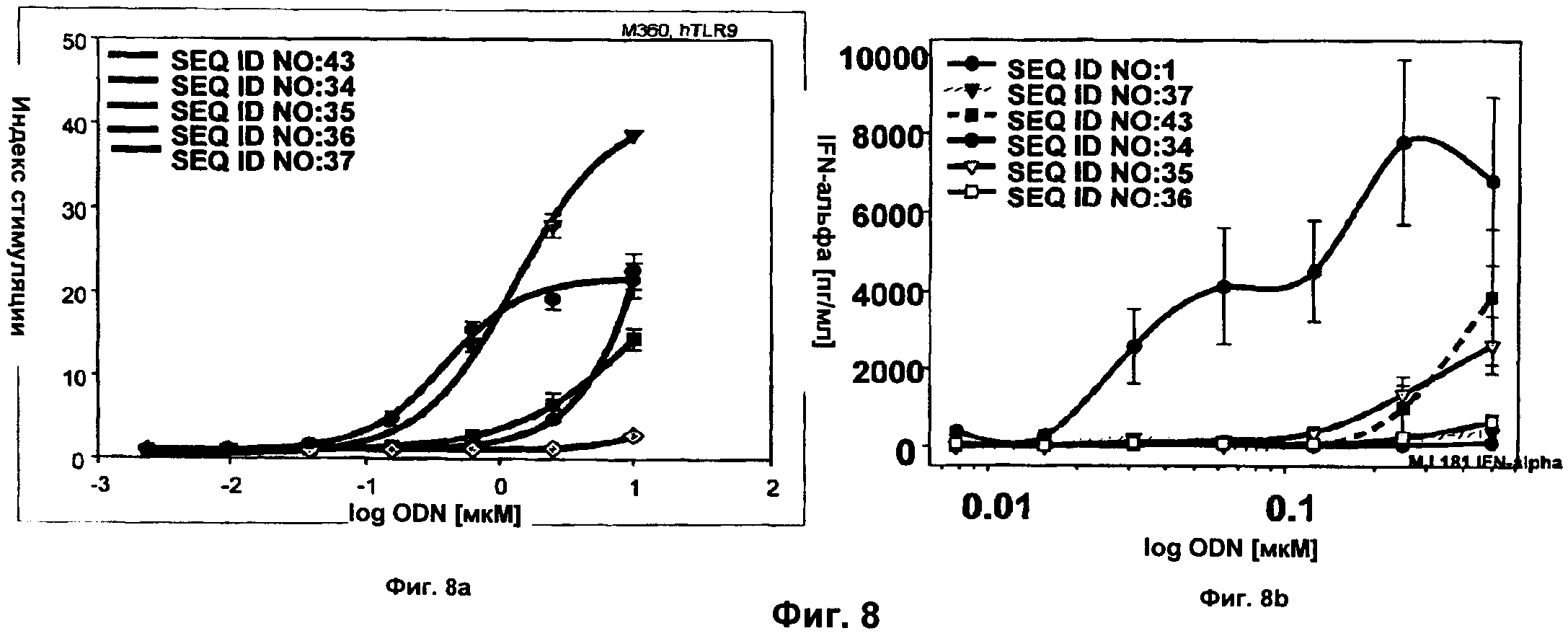
Фиг.8 представляет собой два графика, демонстрирующие результаты люциферазного анализа и анализа РВМС с модифицированным ODN А-класса. Активность JU-модифицированных SEQ ID NO:35-37 сравнивали с активностью немодифицированной родительский последовательности (SEQ ID NO:43) и немодифицированного ODN SEQ ID NO:1 В-класса. Фиг.8а демонстрирует активность TLR9, а Фиг.8b демонстрирует продукцию IFN-альфа. Показано среднее значение +/- СО для трех доноров. Оси x представляют собой log концентрации ODN (Фиг.8а) или концентрацию ODN (Фиг.8b) в мкМ, а оси у представляют собой относительный индекс стимуляции (Фиг.8а) или концентрацию IFN-альфа в пг/мл (Фиг.8b).
Фиг.9 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN С-класса. Активность JU-модифицированных ODN С-класса SEQ ID NO:27-28 и 44-45 сравнивали с активностью немодифицированной родительской последовательности SEQ ID NO:45 и немодифицированного ODN В-класса (SEQ ID NO:37). Ось x представляет собой концентрацию ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.10 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN Р-класса. Активность JU-модифицированных SEQ ID NO:31-33 сравнивали с активностью немодифицированной родительской последовательности (SEQ ID NO:52). Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.11 представляет собой график, демонстрирующий результаты люциферазного анализа с модифицированным ODN Т-класса. Активность JU-модифицированных SEQ ID NO:47-50 и U-модифицированной SEQ ID NO:51 сравнивали с активностью немодифицированной родительской последовательности SEQ ID NO:25. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
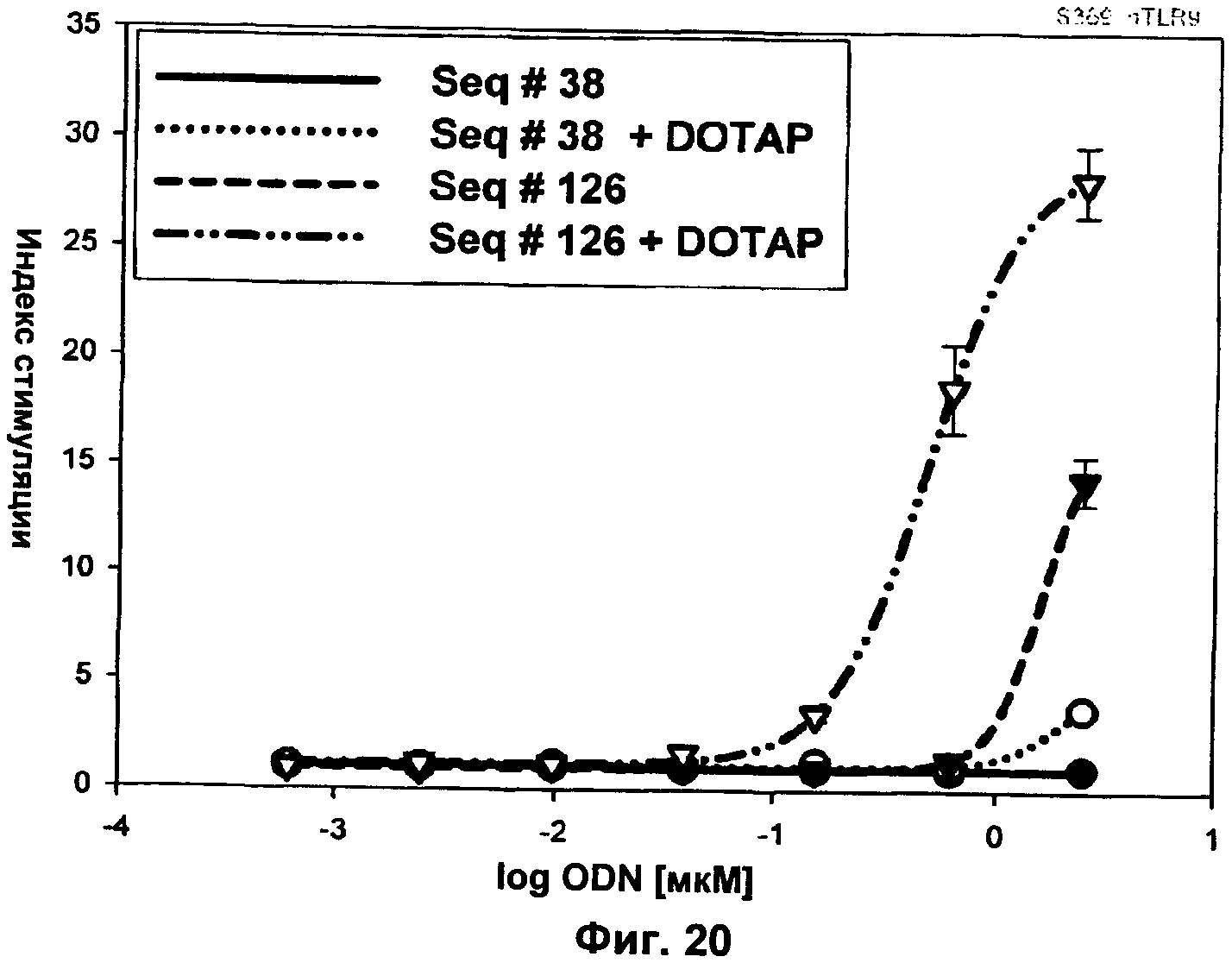
Фиг.12 представляет собой график, демонстрирующий результаты люциферазного анализа с коротким ODN. Активность JU-модифицированного короткого ODN SEQ ID NO:39-40 сравнивали с активностью немодифицированной родительской последовательности SEQ ID NO:38 и с ODN SEQ ID NO:37 В-класса. ODN получали с и без DOTAP (1,2-диолеоил-3-триметиламмонийпропан). Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.13 представляет собой четыре графика, демонстрирующие результаты ИФА (твердофазного иммуноферментного анализа), измеряющего концентрацию цитокина в супернатантах культуры спленоцитов, где спленоциты мышей BALB/c культивировали с различными ODN. Супернатанты культуры собирали на момент времени 6 часов (для TNF-альфа) или 24 часа (для IL-6, IL-10 и IL-12). Сравнивали активности JU-модифицированного ODN В-класса (SEQ ID NO:13), немодифицированного ODN В-класса (SEQ ID NO:37) и не-CpG ODN в качестве отрицательного контроля (SEQ ID NO:26). Фиг.13a-d демонстрируют концентрацию TNF-альфа, IL-6, IL-10 и IL-12, соответственно. Оси х представляют собой концентрацию ODN в мкг/мл, а оси у представляют собой концентрацию цитокина в пг/мл.
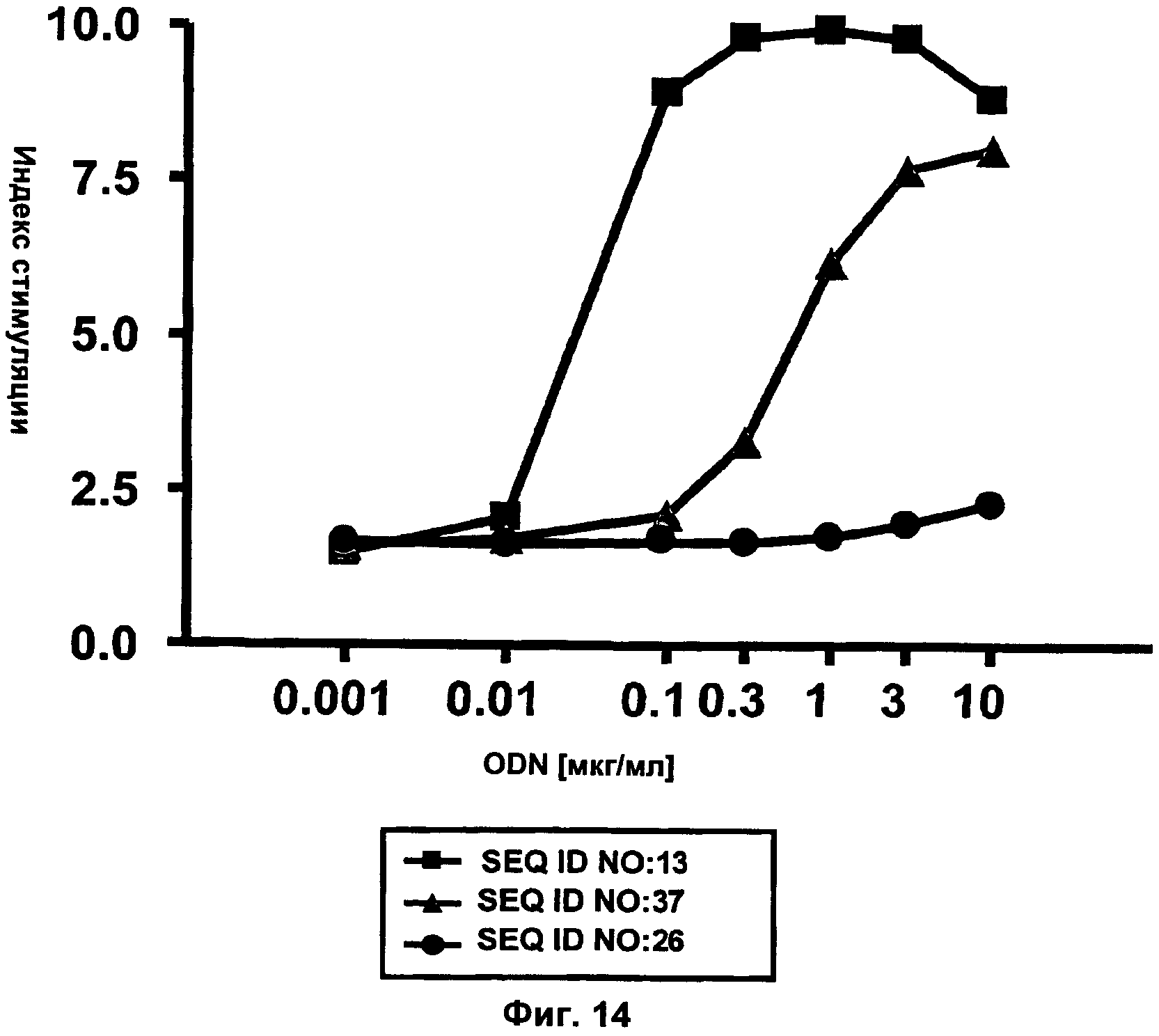
Фиг.14 представляет собой график, демонстрирующий результаты анализа FACS (клеточный сортер с активацией флуоресценции) пролиферации В-клеток. Окрашенные CFSE (карбоксифлуоресцеинсукцинимидильный эфир) спленоциты мыши BALB/c (4×105/лунку) инкубировали с 0,001, 0,01, 0,1, 0,3, 1, 3 или 10 мкг/мл ODN. Через 72 часа после инкубации клетки окрашивали в отношении CD19 и пролиферацию В-клеток определяли при помощи FACS с последующим анализом с использованием программного обеспечения ModFit. Сравнивали активности JU-модифицированного ODN В-класса (SEQ ID NO:13), немодифицированного ODN В-класса (SEQ ID NO:37) и не-CpG ODN в качестве отрицательного контроля (SEQ ID NO:26). Ось x представляет собой концентрацию ODN в мкг/мл, а ось у представляет собой относительную пролиферацию В-клеток.
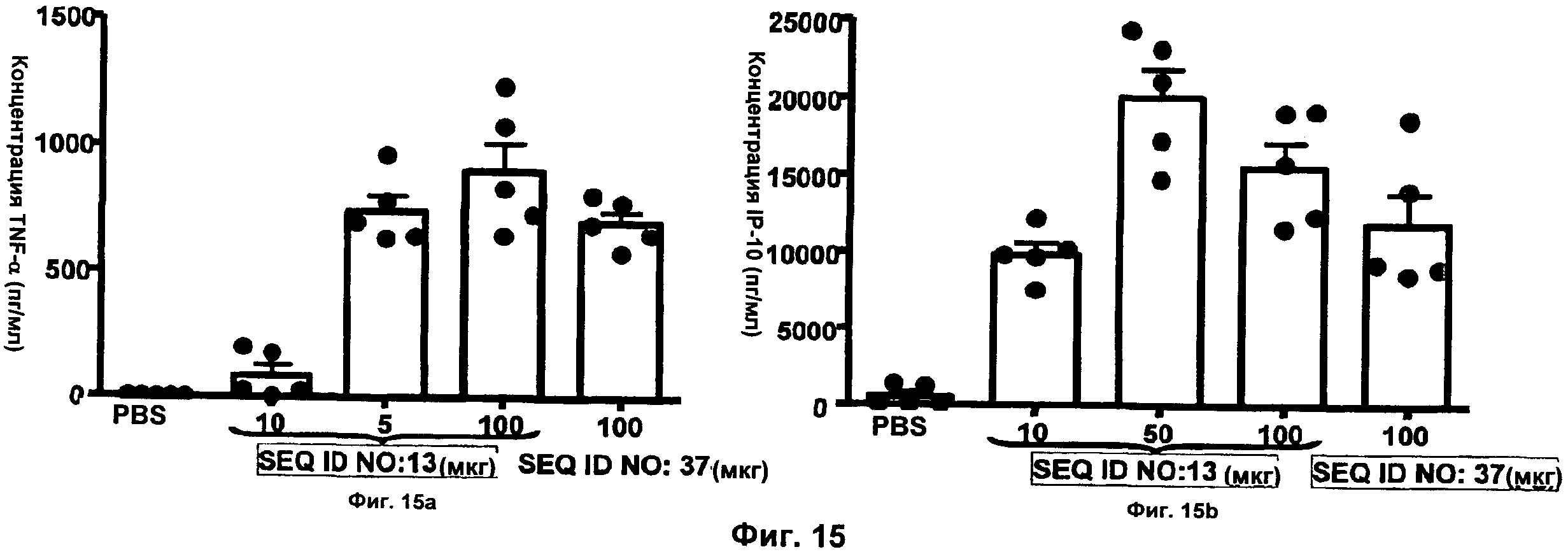
Фиг.15 представляет собой два графика, демонстрирующие продукцию цитокина in vivo, измеренную посредством ИФА. Мышам BALB/c (5 на группу) подкожно инъецировали 10, 50 или 100 мкг ODN. Контрольная группа получала 100 мкл только PBS. У животных отбирали кровь при помощи сердечной пункции через 1 час (для TNF-альфа) или 3 часа (для IP-10) после инъекции и образцы плазмы крови анализировали в отношении TNF-альфа и IP-10 при помощи ИФА. Сравнивали активности JU-модифицированного ODN В-класса (SEQ ID NO:13) и немодифицированного ODN В-класса (SEQ ID NO:37). Фиг.15а демонстрирует концентрацию TNF-альфа, а Фиг.15b демонстрирует концентрацию IP-10. Оси х представляют собой дозу ODN в мкг, а оси у представляют собой концентрацию цитокина в пг/мл.
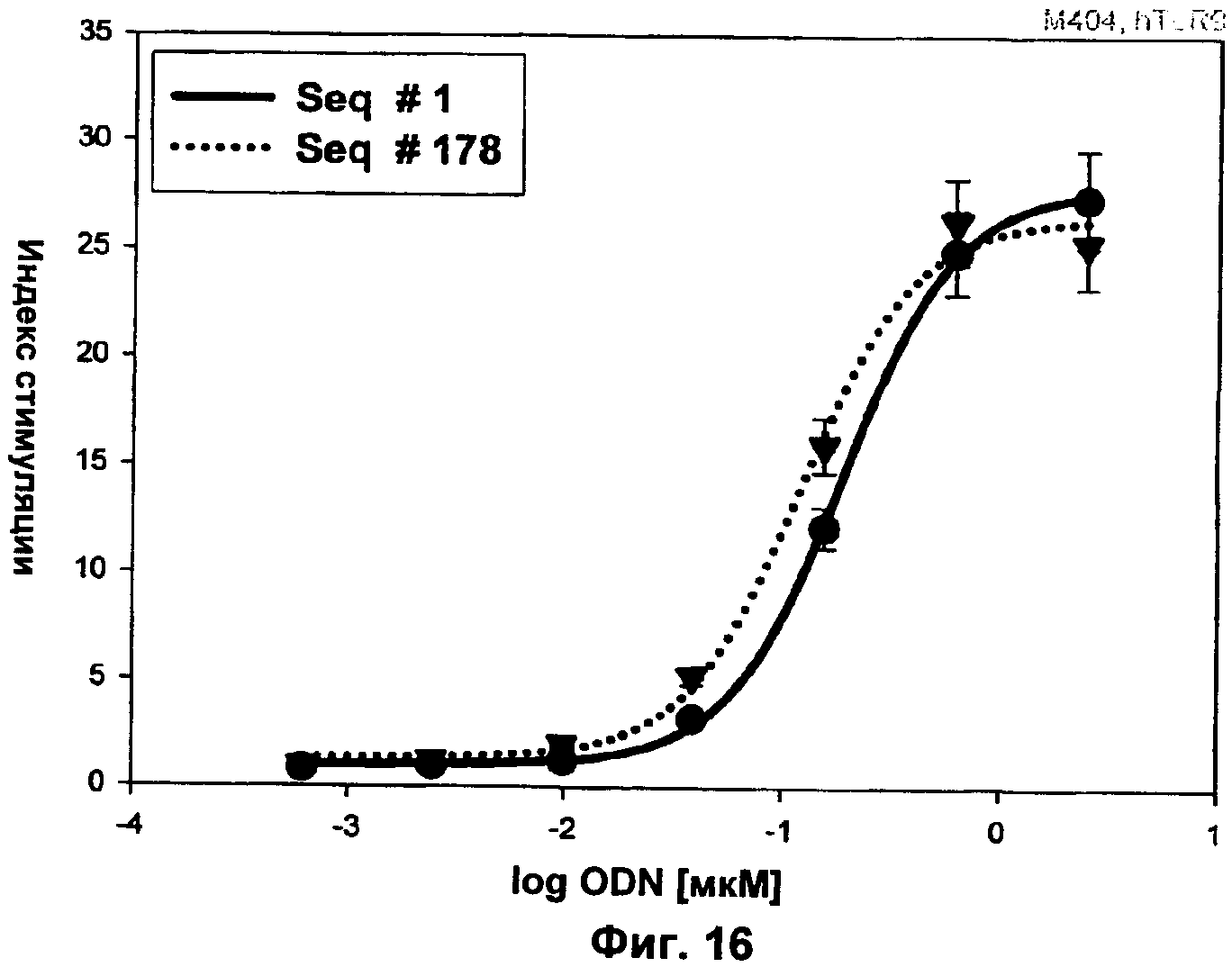
Фиг.16 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ ODN В-класса с универсальным основанием (6-нитробензимидазолом) (SEQ ID NO:178) вместо тимидина в родительской последовательности (SEQ ID NO:1). Клетки hTLR9-LUC-293 инкубировали указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.17 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ ODN В-класса с 5-(2-бромвинил)-уридином (SEQ ID NO:153 и 154) вместо тимина в родительской последовательности (SEQ ID NO:1). Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.18 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ ODN В-класса с модификацией сахара (2'-O-метилгуанозин) в дополнение к липофильному замещенному нуклеотидному аналогу (SEQ ID NO:111-113). Активность этих ODN сравнивали с активностью родительской последовательности (SEQ ID NO:1) и той же самой последовательности только с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:13). Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
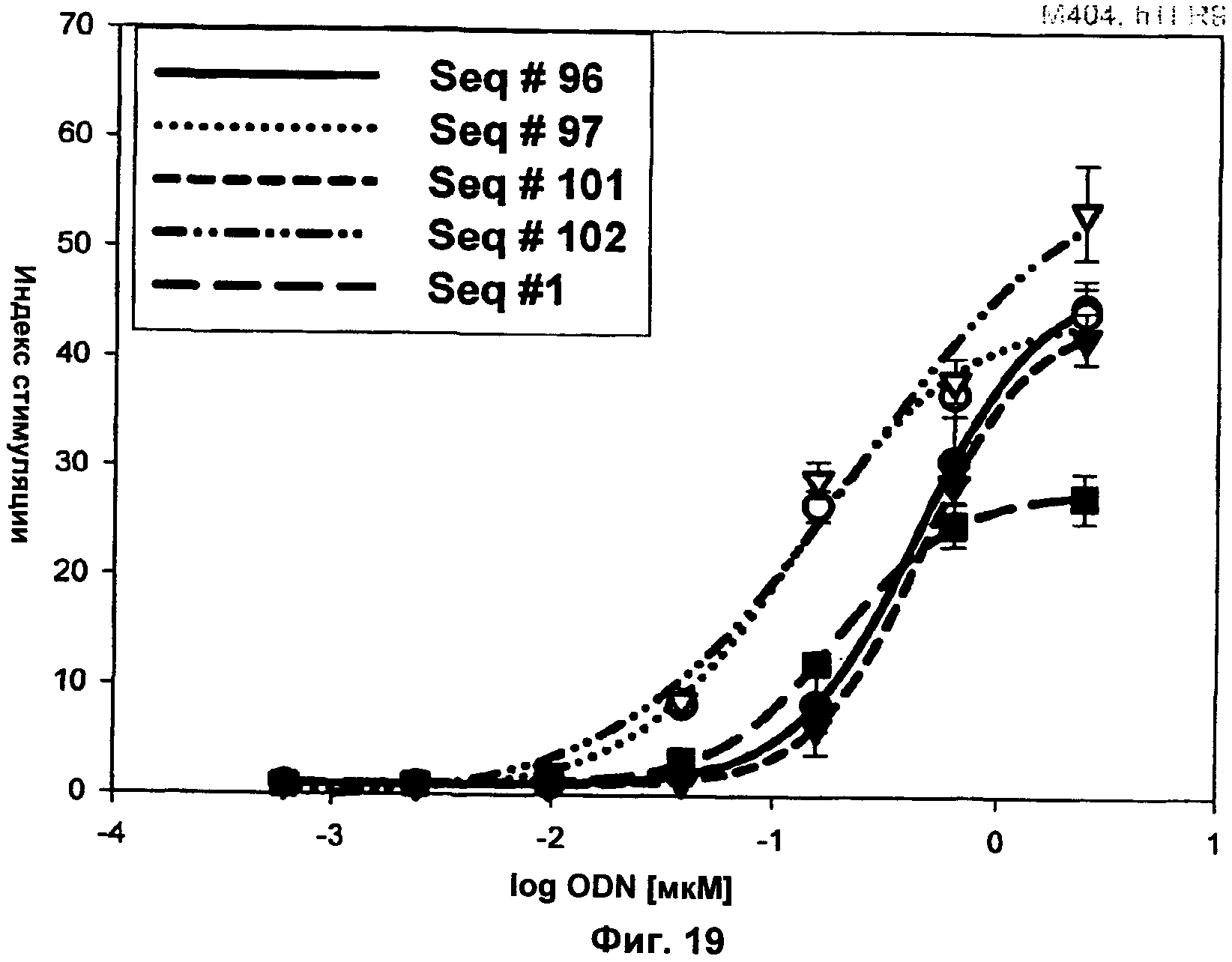
Фиг.19 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ разветвленным ODN В-класса со множественными 5' доступными концами. Активность разветвленного ODN (SEQ ID NO:96, 97, 101 и 102) сравнивали с активностью SEQ ID NO:1. Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.20 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ коротким немодифицированным ODN В-класса (SEQ ID NO:38) и ODN той же самой последовательности с липофильным замещенным нуклеотидным аналогом и липофильным 3' tag (SEQ ID NO:126). Оба получали с и без DOTAP. Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
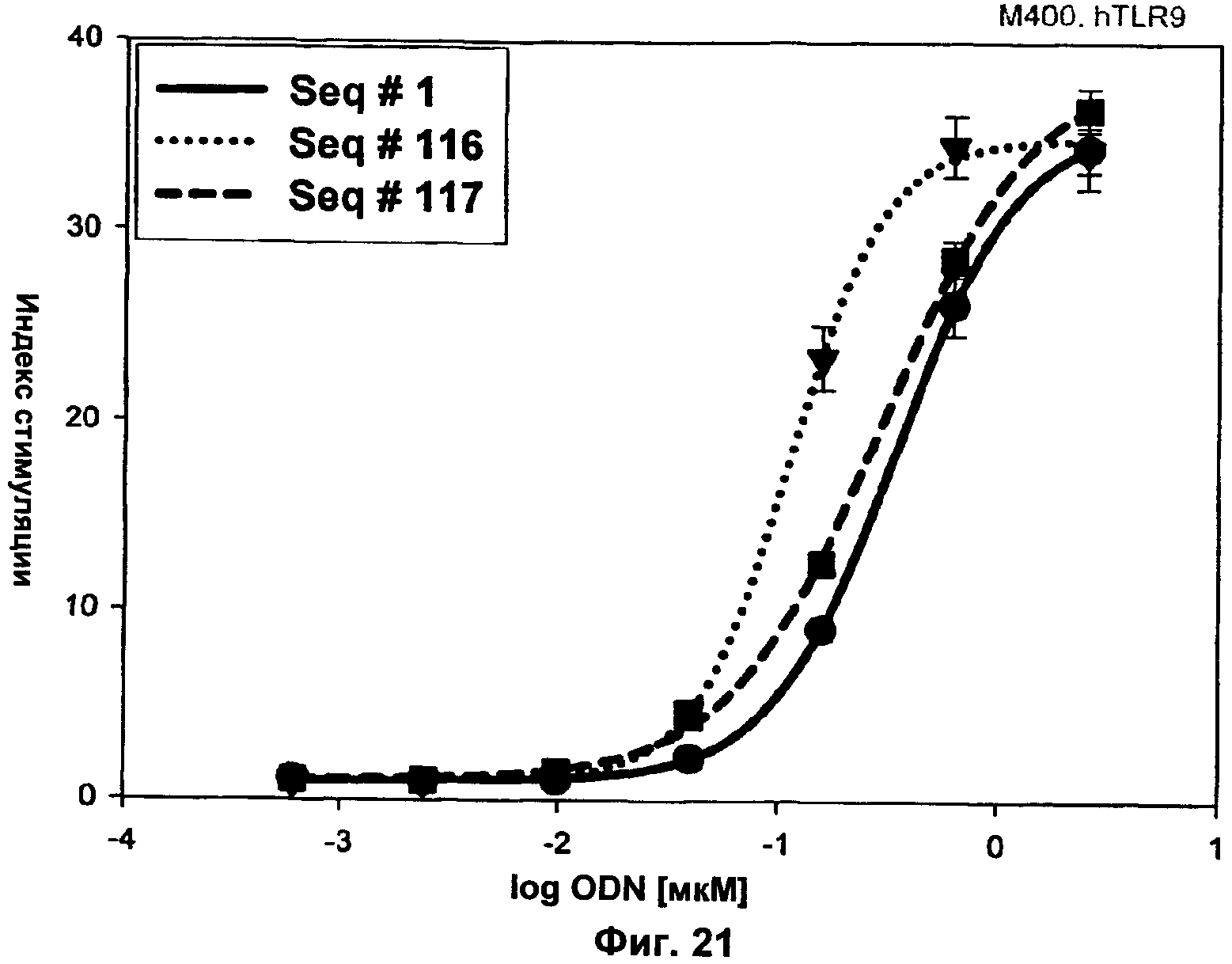
Фиг.21 представляет собой график, демонстрирующий TLR9-опосредованную активацию NF-κВ двумя ODN В-класса с 5-проинил-dU (SEQ ID NO:116 и 117) вместо тимина родительской последовательности (SEQ ID NO:1). Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.22 представляет собой график, демонстрирующий hTLR9-опосредованную активацию NF-κВ ODN В-класса со вторым нуклеотидным аналогом в дополнение к липофильному замещенному нуклеотидному аналогу (SEQ ID NO:138, 7-деаза-dG; SEQ ID NO:139, инозин; SEQ ID NO:140, 5-метил-dC). Активность этих ODN сравнивали с активностью родительской последовательности (SEQ ID NO:1) и той же самой последовательностью только с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:13). Клетки DTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.23 представляет собой график, демонстрирующий hTLR9-опосредованную активацию NF-κВ ODN Т-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:132-134). Их активность сравнивали с активностью иммуностимулирующего ODN С-класса (SEQ ID NO:198), Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой концентрацию IFN-α в пг/мл.
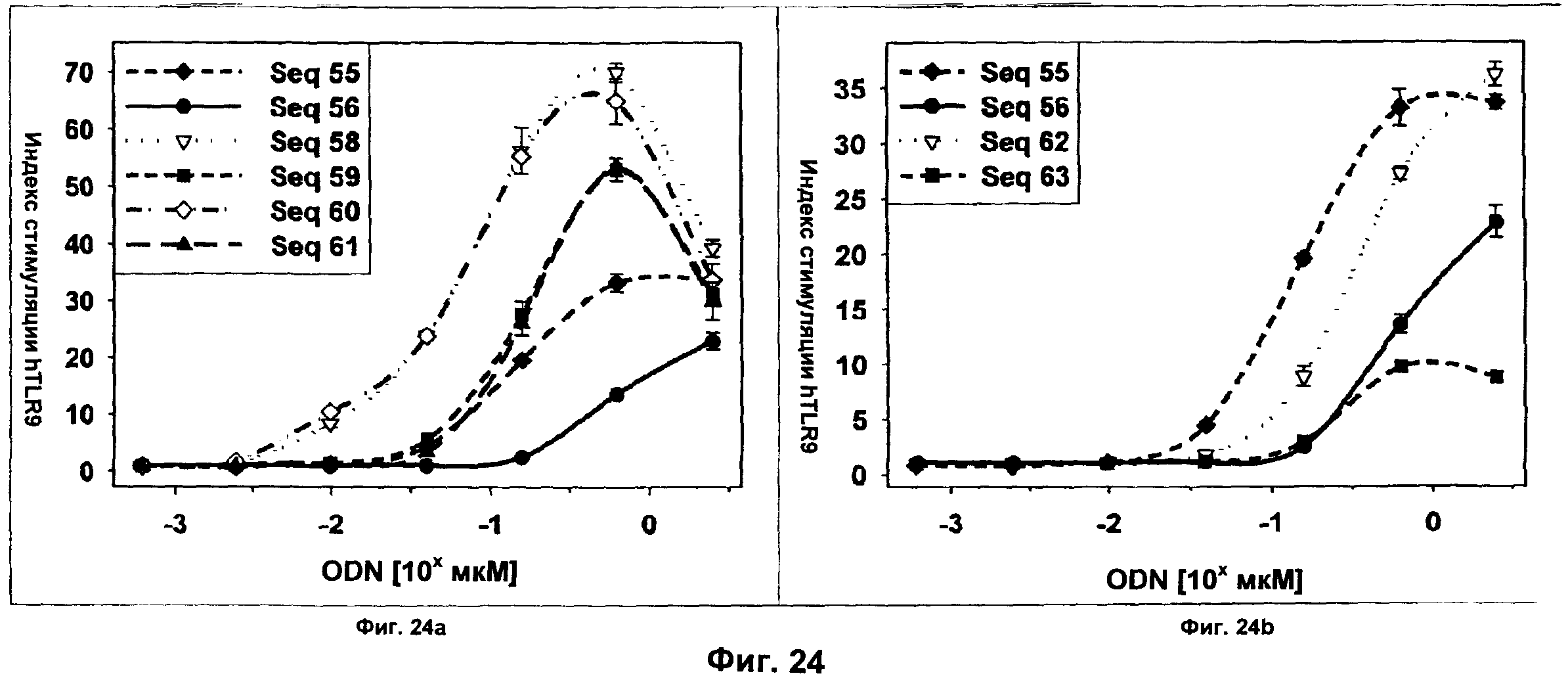
Фиг.24 представляет собой два графика, демонстрирующие DTLR9-опосредованную активацию NF-κВ ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58-63). Фиг.24а демонстрирует активность SEQ ID NO:58-61 по сравнению с В-классом в качестве положительного контроля (SEQ ID NO:55) и немодифицированным ODN Р-класса (SEQ ID NO:56). Фиг.24b демонстрирует активность SEQ ID NO:62-63 по сравнению с активностью того же самого положительного и отрицательного контролей. Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
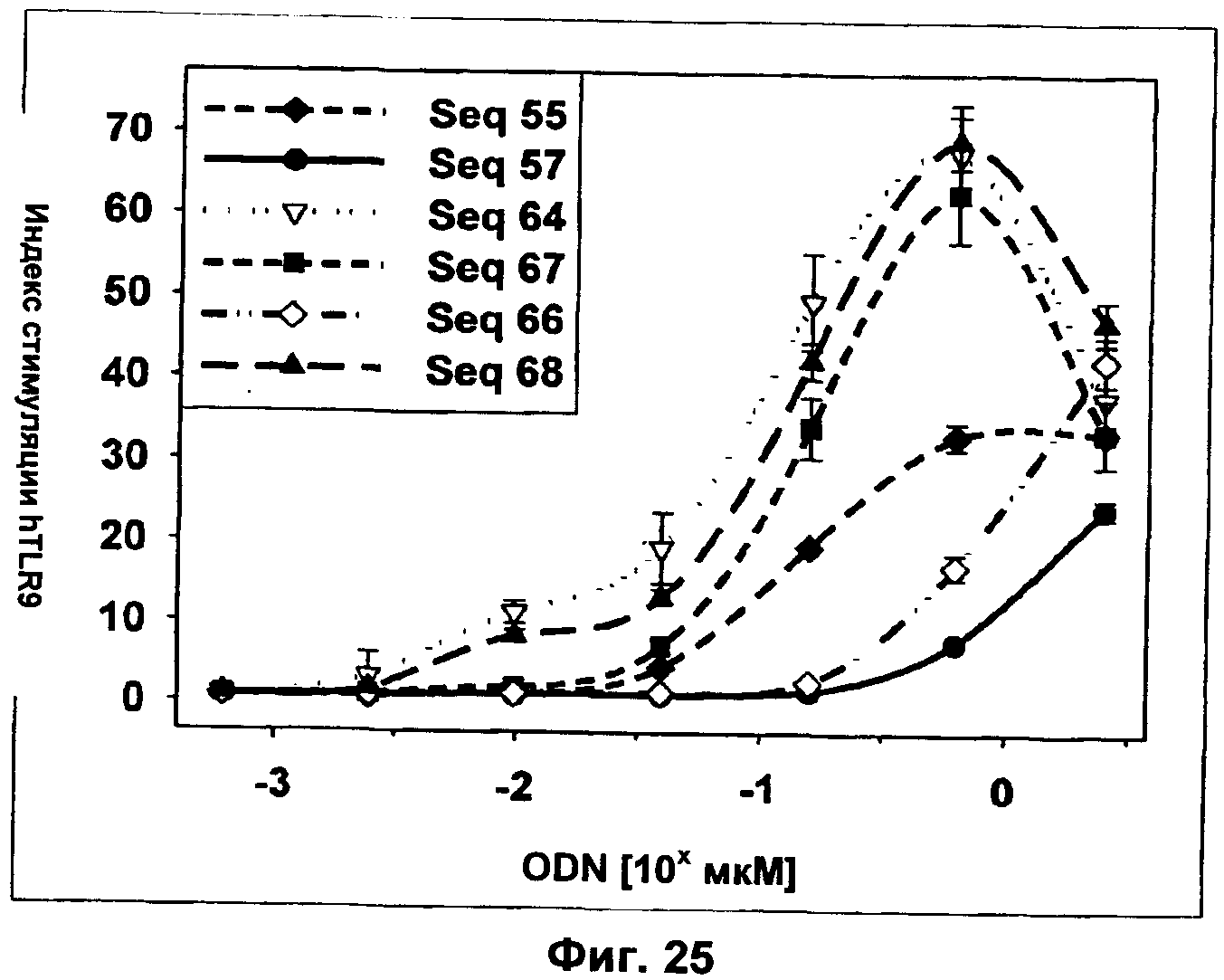
Фиг.25 представляет собой график, демонстрирующий DTLR9-опосредованную активацию NF-κВ ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:64, 66-67). Их активность сравнивали с активностью В-класса в качестве положительного контроля (SEQ ID NO:55), ODN С-класса (SEQ ID NO:68) и немодифицированного ODN Р-класса (SEQ ID NO:57). Клетки hTLR9-LUC-293 инкубировали с указанными количествами нуклеиновых кислот и активацию NF-κВ определяли через 16 ч путем измерения люциферазной активности. Ось x представляет собой Log концентрации ODN в мкМ, а ось у представляет собой относительный индекс стимуляции.
Фиг.26 представляет собой два графика, демонстрирующие индукцию IFN-α ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58-63). Фиг.26а демонстрирует активность SEQ ID NO:58-61 по сравнению с активностью В-класса в качестве положительного контроля (SEQ ID NO:55) и немодифицированного ODN Р-класса (SEQ ID NO:56). Фиг.26b демонстрирует активность SEQ ID NO:62-63 по сравнению с активностью того же самого положительного и отрицательного контролей. Человеческие РВМС инкубировали с указанными ODN в течение 48 часов. IFN-α затем определяли в супернатантах культуры клеток посредством ИФА. Оси х представляют собой концентрацию ODN в мкМ, а оси у представляют собой концентрацию IFN-α в пг/мл.
Фиг.27 представляет собой график, демонстрирующий индукцию IFN-α ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:64, 66-67). Их активность сравнивали с активностью В-класса в качестве положительного контроля (SEQ ID NO:55), ODN C-класса (SEQ ID NO:68) и немодифицированного ODN Р-класса (SEQ ID NO:57). Человеческие РВМС инкубировали с указанным ODN в течение 48 часов. IFN-α затем определяли в супернатантах культуры клеток посредством ИФА. Оси х представляют собой концентрацию ODN в мкМ, а оси у представляют собой концентрацию IFN-α в пг/мл.
Фиг.28 представляет собой два графика, демонстрирующие индукцию IL-6 ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58, 60-62, Фиг.28а) (SEQ ID NO:64 и 67, Фиг.28b). Активность сравнивали с активностью немодифицированного ODN В-класса (SEQ ID NO:55) и не модифицированного ODN С-класса (SEQ ID NO:54), ODN в качестве отрицательного контроля (SEQ ID NO:53) и не модифицированного ODN Р-класса (SEQ ID NO:56). РВМС от трех доноров инкубировали с ODN в течение 24 часов и супернатанты анализировали с использованием luminex. Показано среднее значение +/- СО. Оси x представляют собой концентрацию ODN в мкМ, а оси у представляют собой концентрацию IL-6 в пг/мл.
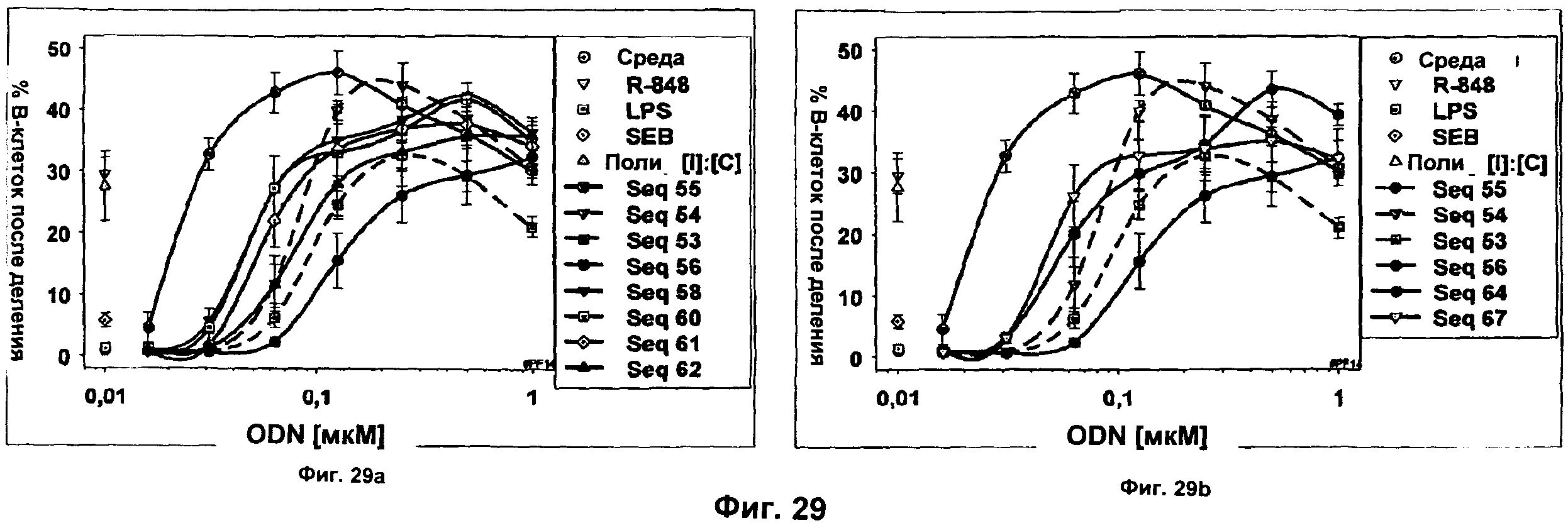
Фиг.29 представляет собой два графика, демонстрирующие пролиферацию В-клеток после обработки ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58, 60-62, Фиг.29а) (SEQ ID NO:64 и 67, Фиг.29b). Активность сравнивали с активностью немодифицированного ODN В-класса (SEQ ID NO:55), немодифицированного ODN С-класса (SEQ ID NO:54), ODN в качестве отрицательного контроля (SEQ ID NO:53), немодифицированного ODN Р-класса (SEQ ID NO:56), LPS, R-848, SEB и поли[1]:[С] ODN. CFSE-меченые PBMC от трех доноров инкубировали с ODN в течение 5 суток и затем окрашивали антителом CD19. Определяли процент В-клеток с уменьшенным CFSE. Оси х представляют собой концентрацию ODN в мкМ, а оси у представляют собой % В-клеток с уменьшенным окрашиванием после деления.
Фиг.30 представляет собой график, демонстрирующий индукцию мышиного IFN-α ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58, 60-62, 64 и 67). Их активность сравнивали с активностью В-класса в качестве положительного контроля (SEQ ID NO:55) и отрицательного контроля (SEQ ID NO:26). Мышам BALB/c (5 на группу) инъецировали п.к. (подкожно) различные дозы ODN. Кровь у животных отбирали через 3 ч после инъекции и образцы плазмы тестировали в отношении IFN-альфа посредством ИФА. Ось x представляет собой дозу ODN в мкг, а ось у представляет собой концентрацию IFN-α в пг/мл.
Фиг.31 представляет собой два графика, демонстрирующие действие ODN на объем опухоли в модели опухоли SA1N. Самкам мышей A/J (10 на группу) инъецировали п.к. 5×105 опухолевых клеток SaI/N на 0 сутки. Мышей обрабатывали 35 мкг (Фиг.31а) или 100 мкг (Фиг.31b) ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:60, 64 и 67), немодифицированным ODN С-класса, немодифицированным ODN В-класса (SEQ ID NO:55) или только PBS (физиологическим раствором, забуференным фосфатом), которые вводили п.к. один раз в неделю, начиная на 8 сутки после индукции опухоли. Животных контролировали в отношении выживания и объема опухоли. Размер опухоли (длину и ширину) измеряли с использованием цифрового штангенциркуля. Объем опухоли расчитывали с использованием формулы: Объем опухоли = (0,4)(ab2), где а = большой диаметр и b=меньший диаметр. На осях х показаны сутки после индукции опухоли, а на осях у показан объем опухоли в мм3.
Подробное описание изобретения
Изобретение основано, в части, на CpG-олигонуклеотидах, проявляющих усиленную иммуностимулирующую способность. CpG-олигонуклеотиды, как известно, стимулируют иммунную систему, например, путем взаимодействия с Toll-подобным рецептором 9 (TLR9). Стимуляция TLR9 имеет множество эффектов, включая стимуляцию Th1-иммунного ответа, активацию NK-клеток и активацию В-клеток. Изобретение относится в некоторых аспектах к идентификации иммуностимулирующих олигонуклеотидов с измененной структурой, которая влияет на их взаимодействие с TLR9. Авторы изобретения обнаружили, что олигонуклеотиды с липофильными замещенными нуклеотидными аналогами вне CpG-мотива обладают усиленной способностью стимулировать продукцию интерферона-α (IFN-α) и индуцировать активацию TLR9. Этот эффект обнаружен для всех классов протестированных иммуностимулирующих олигонуклеотидов. Эти модифицированные олигонуклеотиды с усиленной стимулирующей способностью названы олигонуклеотидами Е-класса.
Модифицированные олигонуклеотиды Е-класса по настоящему изобретению в некоторых случаях обладают усиленной способностью индуцировать иммунный ответ. Индукция иммунного ответа относится к любому увеличению количества или активности иммунных клеток, или увеличению экспрессии или абсолютных уровней иммунного фактора, такого как цитокин. Иммунные клетки включают NK-клетки, CD4+ Т-лимфоциты, CD8+ Т-лимфоциты, В-клетки, дендритные клетки, макрофаги и другие антигенпрезентирующие клетки, но не ограничены ими. Цитокины включают интерлейкины, TNF-α (фактор некроза опухолей альфа), IFN-α, β и γ, Flt-лиганд и костимулирующие молекулы, но не ограничены ими.
Известно, что олигонуклеотиды, содержащие неметилированные CpG-мотивы, способны стимулировать иммунные ответы через путь Toll-подобного рецептора 9 (TLR9). Индукция множества цитокинов кореллирует с активацией TLR9. Такая индукция возрастает по мере увеличения стимуляции TLR9. Тем не менее, в общем существует обратная корреляция между TLR9 и индукцией IFN-α для CpG ODN. Обнаружено, что некоторые из модификаций по изобретению могут приводить к модифицированной картине передачи сигнала, так что наблюдается более прямая корреляция, нежели чем обратная корреляция между активацией TLR9 и IFN-α.
Авторы изобретения попытались исследовать влияние липофильных остатков в области, окружающей CpG-мотив. Как описано в нижеприведенных примерах, несколько различных типов липофильных замещенных нуклеотидных аналогов, таких как 2,4-дифтортолуол, 5-бромурацил и 5-йодурацил, было включено в CpG-олигонуклеотид с 5'- или 3'-конца CpG-мотива. Неожиданно то, что включение этих липофильных замещенных нуклеотидных аналогов приводит к необычно сильному увеличению активности hTLR9, а также индукции IFN-α в человеческих РВМС. Замещение не-липофильным нуклеотидом, таким как урацильный остаток (структурно близкий тимину, но лишенный метильной группы), приводило к сильному снижению стимуляции hTLR9. Для протестированных олигонуклеотидов увеличение стимуляции TLR9 по-видимому лучше, если липофильный замещенный нуклеотидный аналог раположен с 5'-конца относительно CpG-мотива, чем когда он расположен с 3'-конца относительно данного мотива. Двойная замена (т.е. липофильный замещенный нуклеотидный аналог с замещением по 5'- и 3'-концам) приводит в результате к наиболее сильной стимуляции протестированных нуклеотидов. Наоборот, замена гуанина или цитозина на 2,4-дифтортолуол в CpG-мотиве в обоих случаях вызывает сильное уменьшение индекса стимуляции TLR9.
Модификация в виде липофильных замещенных нуклеотидных аналогов приводит в результате к существенному усилению индукции IFN-α. В особенности для ODN, модифицированных 5-бромурацилом и 5-йодурацилом, по-видимому, существует хорошая корреляция между стимуляцией TLR9 и индукцией IFN-α. Как упомянуто выше, это наблюдение является неожиданным, поскольку (1) родительская молекула 21317 по существу неактивна в индукции IFN-α, и (2) обычно существует обратная корреляция между TLR9 и индукцией IFN-α для CpG ODN, которые не содержат этих модификаций.
В некоторых аспектах изобретения олигонуклеотид имеет последовательность R1YZR2. Олигонуклеотид может включать один или более чем один такой мотив. R1 и R2 независимо представляют собой любой из липофильного замещенного нуклеотидного аналога (L), нуклеотида или связи. Тем не менее, предпочтительно, чтобы по меньшей мере один из R1 и R2 представлял собой липофильный замещенный нуклеотидный аналог (L). В некоторых случаях оба R1 и R2 представляют собой L. Как представлено в нижеприведенном разделе "примеры", олигонуклеотиды, имеющие L как с 5'-, так и 3'-конца относительно CpG-мотива, являлись особенно стимулирующими. Тем не менее, иногда только один R представляет собой L. Например, R1 может представлять собой L, и R2 представляет собой нуклеотид, или наоборот. Альтернативно, R1 может представлять собой L, а R2 может представлять собой связь, так что олигонуклеотид содержит структуру 5'-R1CG-3'.
В некоторых случаях олигонуклеотид имеет последовательность R1N1YZN2R2, где N1 и N2 представляют собой нуклеотиды длиной 0-3 нуклеотида. Другие возможные варианты включают структуры, такие как 5'-R1NiR1YZ N2-3', 5'-R3R1YZ-3 и R1ZN2R2.
Y представляет собой пиримидиновый нуклеотид. Z представляет собой пурин, пиримидин или остаток, лишенный азотистого основания. В некоторых воплощениях Z предпочтительно представляет собой пурин.
L представляет собой липофильный замещенный нуклеотидный аналог, который может представлять собой, например, 5- или 6-членный кольцевой аналог нуклеинового основания. Пример 5- или 6-членного кольцевого аналога нуклеинового основания показан в следующей группе формулы I:

А, В, X, D, Е и F независимо представляют собой одно из следующего: С (углерод) или N (азот), возможно несущий водород или заместитель, такой как, например, F, Cl, Br, I, алкил, алкенил, алкинил, галогенированный алкил, галогенированный алкенил, циклоалкил, O-алкил, O-алкенил, -NH-алкил, -N(алкил)2; -S-алкил, -SO-алкил, -SO2-алкил, нитро, циано, карбоксиэфир, фенил, тиофенил, бензил, оксо, тио, гидрокси, меркапто и имино, но не ограничены ими. В некоторых случаях, по меньшей мере один заместитель не представляет собой оксо, тио, гидрокси, меркапто, имино, амино или метил; n равен 0 или 1. Пунктирные линии указывают на возможные двойные связи. Однако по меньшей мере один заместитель не выбран из группы, состоящей из оксо, тио, гидрокси, меркапто, имино, амино, метила и водорода. Дополнительно, всего из атомов А, В, X, D, Е и F не более 3 атомов азота (N). В некоторых воплощениях все атомы А, В, X, D, Е, F представляют собой углерод (С). Альтернативно, по меньшей мере один, два или три атома А, В, X, D, Е, F представляют собой азот (N).
Соединение формулы может представлять собой, например, любое из следующих липофильных замещенных нуклеотидных аналогов: замещенный пиримидин, замещенный урацил, замещенный толуол, замещенный имидазол или пиразол, замещенный триазол, 5-хлор-урацил, 5-бром-урацил, 5-йод-урацил, 5-этил-урацил, 5-пропил-урацил, 5-пропинил-урацил, (Е)-5-(2-бромвинил)-урацил или 2,4-дифтор-толуол.
Липофильные замещенные нуклеотидные аналоги могут быть отдельными или могут быть конденсированы с другим соединением. Например, они могут быть конденсированы с 3-6-членной ароматической или алифатической кольцевой системой. Они также могут быть связаны с 5-6-членной группировкой сахара, такой как, например, пентоза или гексоза. Пример пентозы представляет собой фуранозу, такую как рибоза или дезоксирибоза, и пример гексозы представляет собой пиранозу. Пентоза или гексоза может быть возможно замещена группой F, амино, алкокси, алкокси-этокси, амонипропил, алкенил, алкинил или O2, С4-алкиленовым мостиком.
Олигонуклеотид также может включать ненуклеотидную модификацию, такую как С6-С48-полиэтиленгликоль, С3-С20-алкан-диол, С3-С18-алкиламино линкер, С3-С18-алкилтиоловый линкер, холестерин, желчная кислота, насыщенная или ненасыщенная жирная кислота, фолат, гексадецил-глицерин, дигексадецил-глицериновая группа, октадецил-глицериновая или диоктадецил-глицериновая группа или группа витамина Е.
Липофильные замещенные нуклеотидные аналоги могут быть включены в любой иммуностимулирующий олигонуклеотид. В некоторых воплощениях по изобретению иммуностимулирующие олигонуклеотиды включают иммуностимулирующие мотивы, которые представляют собой "CpG-динуклеотиды". CpG-динуклеотид может быть метилированным или неметилированным. Иммуностимулирующая нуклеиновая кислота, содержащая по меньшей мере один неметилированный CpG-динуклеотид, представляет собой молекулу нуклеиновой кислоты, которая содержит неметилированную цитозин-гуанин динуклеотидную последовательность (т.е. неметилированный 5'-цитидин с последующим 3'-гуанозином, связанные фосфатной связью) и которая активирует иммунную систему; такая имуностимулирующая нуклеиновая кислота представляет собой CpG-нуклеиновую кислоту. CpG-нуклеиновые кислоты описаны во множестве выданных патентов, опубликованных заявках на патенты и других публикациях, включая патенты США №№6194388; 6207646; 6214806; 6218371; 6239116 и 6339068. Иммуностимулирующая нуклеиновая кислота, содержащая по меньшей мере один метилированный CpG-динуклеотид, представляет собой нуклеиновую кислоту, которая содержит метилированную цитозин-гуанин динуклеотидную последовательность (т.е. метилированный 5'-цитидин с последующим 3'-гуанозином, связанные фосфатной связью) и которая активирует иммунную систему. В других воплощениях иммуностимулирующие олигонуклеотиды не содержат CpG-динуклеотиды. Эти олигонуклеотиды, которые не содержат CpG-динуклеотиды, названы не-СрG-олигонуклеотидами, и они имеют не-CpG иммуностимулирующие мотивы. Предпочтительно они представляют собой Т-обогащенные ODN, такие как ODN, имеющие по меньшей мере 80% Т.
Е-класс ODN по изобретению может включать мотивы и свойства других классов CpG ODN, таких как А-класс, В-класс, С-класс, Т-класс и Р-класс, а также они включают липофильные замещенные нуклеотидные аналоги 5'- и/или 3'-мотива YGZ.
"А-класс" иммуностимулирующих CpG-нуклеиновых кислот описан в непредварительной заявке на патент США №09/672126 и опубликованной РСТ заявке PCT/US00/26527 (WO 01/22990), обе поданы 27 сентября 2000 года. Эти нуклеиновые кислоты характеризуются способностью индуцировать высокие уровни интерферона-альфа при минимальном воздействии на В-клеточную активацию. А-класс иммуностимулирующей CpG-нуклеиновой кислоты не обязательно содержит гексамерный палиндром GACGTC, AGCGCT или AACGTT, описанный Yamamoto и соавторами (Yamamoto S et al. J Immunol 148:4072-6(1992)).
Примеры последовательностей А-класса иммуностимулирующих нуклеиновых кислот описаны в непредварительной заявке на патент США №09/672126 и опубликованной РСТ заявке PCT/US00/26527 (WO 01/22990), обе поданы 27 сентября 2000 года.
"В-класс" ODN эффективен в отношении активации В-клеток, но относительно малоэффективен в индукции IFN-α и активации NK-клеток. В-класс CpG-нуклеиновых кислот, как правило, полностью стабилизирован и включает неметилированный CpG-динуклеотид в некоторых предпочтительных контекстах оснований. См., например, патенты США №№6194388; 6207646; 6214806; 6218371; 6239116 и 6339068. Еще один класс эффективен в индукции IFN-α и активации NK-клеток, но относительно малоэффективен в отношении стимуляции В-клеток; этот класс назван "А-классом". А-класс CpG-нуклеиновых кислот, как правило, имеет стабилизированные поли-G последовательности на 5'- и 3'-концах и палиндромную фосфодиэфирную CpG-динуклеотид-содержащую последовательность из по меньшей мере 6 нуклеотидов. См., например, опубликованную заявку PCT/US00/26527.
Еще один класс CpG-нуклеиновых кислот активирует В-клетки и NK-клетки и индуцирует IFN-α; этот класс назван С-классом. "С-класс" иммуностимулирующих нуклеиновых кислот содержит по меньшей мере два отличающихся мотива, оказывает специфичные и желаемые стимулирующие действия на клетки иммунной системы. Некоторые из этих ODN имеют как традиционную "стимулирующую" CpG-последовательность, так и "GC-обогащенный" или "нейтрализующий В-клетки" мотив. Эти нуклеиновые кислоты с комбинацией мотивов обладают иммуностимулирующими эффектами, которые являются промежуточными между эффектами, ассоциированными с традиционными CpG-ODN "В-класса", являющимися сильными индукторами активации В-клеток и активации дендритных клеток (DC), и эффектами, ассоциированными с недавно описанным классом иммуностимулирующих нуклеиновых кислот (CpG-ODN "А-класса"), являющихся сильными индукторами активации IFN-α и клеток-естественных киллеров (NK), но относительно слабыми индукторами активации В-клеток и DC. Krieg A.M. et аl. (1995) Nature 374:546-9; Ballas Z.K. et al. (1996) J. Immunol. 157:1840-5; Yamamoto S. et al. (1992) J. Immunol. 148:4072-6. В то время как предпочтительные CpG-ODN В-класса часто имеют фосфортиоатные каркасы, а предпочтительные CpG-ODN А-класса имеют смешанные или химерные каркасы, иммуностимулирующие нуклеиновые кислоты С-класса, содержащие комбинацию мотивов, могут иметь стабилизированные, например фосфортиоатные, химерные или фосфодиэфирные каркасы, и в некоторых предпочтительных воплощениях они имеют полутвердые каркасы. Этот класс описан в заявке на патент США 10/224523, поданной 19 августа 2002 года, полное содержание которой включено здесь путем ссылки.
"Р-класс" иммуностимулирующих олигонуклеотидов имеет несколько доменов, включая домен активации 5TLR, 2 области, образующие дуплекс, и возможный спейсер и 3'-хвост. Этот класс олигонуклеотидов обладает способностью в некоторых случаях индуцировать гораздо более высокие уровни секреции IFN-α по сравнению с С-классом. Р-класс олигонуклеотидов обладает способностью к спонтанной самосборке в конкатамеры in vitro и/или in vivo. Не желая быть связанными с конкретной теорией в отношении способа действия этих молекул, одна из возможных гипотез состоит в том, что это свойство наделяет Р-класс олигонуклеотидов более высокой способностью перекрестно связывать TLR9 внутри некоторых иммунных клеток, индуцируя картину иммунной активации, отличную от ранее описанных классов CpG-олигонуклеотидов. Перекрестное связывание TLP9-рецепторов может индуцировать активацию более сильной секреции IFN-α через обратную петлю IFNR I типа в плазмацитоидных дендритных клетках. Олигонуклеотиды Р-класса описаны по меньшей мере в заявке на патент США №11/706561.
"Т-класс" олигонуклеотидов индуцирует секрецию более низких уровней IFN-альфа, будучи немодифицированным, как в ODN по изобретению, и IFN-родственных цитокинов и химокинов по сравнению с В-классом или С-классом олигонуклеотидов, в то же время сохраняя способность индуцировать уровни IL-10, подобные олигонуклеотидам В-класса. Олигонуклеотиды Т-класса описаны по меньшей мере в заявке на патент США №11/099683, полное содержание которой включено здесь путем ссылки.
В одном из воплощений иммуностимулирующий ODN по изобретению преимущественно объединен с катионным липидом. В одном из воплощений катионный липид представляет собой DOTAP (метилсульфат N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония). Другие агенты с подобными свойствами, включая миграцию в эндосомальный компартмент, могут быть использованы вместо или дополнительно к DOTAP. Другие липидные препараты включают, например, EFFECTENE™ (нелипосомальный липид, имеющий специальный ДНК-конденсирующий энхансер) и SUPERFECT™ (новая действующая дендримерная технология). Липосомы имеются в продаже от GibcoBRL, например в виде LIPOFECTIN™ и LIPOFECTACE™, которые образуются катионными липидами, такими как хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA) и бромид диметил-диоктадециламмония (DDAB). Способы получения липосом хорошо известны в данной области техники и описаны во множестве публикаций. Обзор липосом также приведен в Gregoriadis G (1985) Trends Biotechnol 3:235-241.
В других воплощениях иммуностимулирующий ODN не изготавливают в виде препарата в катионных липосомах. Благодаря липофильной природе модифицированных аналогов в ODN, даже для коротких ODN, таких как длиной 3 нуклеотида, может не требоваться препарат для эффективного действия in vivo.
В одном из воплощений иммуностимулирующие ODN по изобретению находятся в форме ковалентно замкнутых молекул в форме гантели, имеющих первичную и вторичную структуру. В одном из воплощений такие циклические олигорибонуклеотиды включают две одноцепочечные петли, связанные промежуточным двухцепочечным сегментом. В одном из воплощений по меньшей мере одна одноцепочечная петля включает иммуностимулирующий ДНК-мотив по изобретению. Другие ковалентно замкнутые молекулы в форме гантели по изобретению включают химерные молекулы ДНК:РНК, в которых, например, двухцепочечный сегмент по меньшей мере частично представляет собой ДНК (например, гомодимерную dsDNA (двухцепочечная ДНК) или гетеродимерную ДНК:РНК), и по меньшей мере одна одноцепочечная петля включает иммуностимулирующий ДНК-мотив по изобретению. Альтернативно, двухцепочечный сегмент химерной молекулы представляет собой ДНК.
В некоторых воплощениях иммуностимулирующий ODN выделен. Выделенная молекула представляет собой молекулу, которая является по существу чистой и не содержит другие вещества, с которыми ее обычно обнаруживают в природе или в системах in vivo, в степени, практической и подходящей для предполагаемого применения. В частности, иммуностимулирующий ODN является достаточно чистым и в достаточной степени свободным от других биологических компонентов клеток, так чтобы быть полезным в, например, изготовлении фармацевтических препаратов. Поскольку выделенный иммуностимулирующий ODN по изобретению может быть смешан с фармацевтически приемлемым носителем в фармацевтическом препарате, иммуностимулирующий ODN может содержать только небольшой процент по массе от массы препарата. Тем не менее, иммуностимулирующий ODN является по существу чистым в том, что он по существу отделен от веществ, с которыми он может быть ассоциирован в живых системах.
Иммуностимулирующие молекулы нуклеиновых кислот могут иметь химерный каркас. Для целей настоящего изобретения химерный каркас относится к частично стабилизированному каркасу, где по меньшей мере одна межнуклеотидная связь является фосфодиэфирной или подобной фосфодиэфирной, и где по меньшей мере одна другая межнуклеотидная связь представляет собой стабилизированную межнуклеотидную связь, где по меньшей мере одна фосфодиэфирная или подобная фосфодиэфирной связь и по меньшей мере одна стабилизированная связь являются разными. Поскольку сообщалось о том, что боранофосфонатные связи являются стабилизированными по сравнению с фосфодиэфирными связями, с точки зрения химерной природы каркаса боранофосфонатные связи можно классифицировать либо как подобные фосфодиэфирной, либо как стабилизированные, в зависимости от контекста. Например, химерный каркас согласно настоящему изобретению в одном из воплощений может включать по меньшей мере одну фосфодиэфирную (фосфодиэфирную или подобную фосфодиэфирной) связь и по меньшей мере одну боранофосфонатную (стабилизированную) связь. В еще одном воплощении химерный каркас согласно настоящему изобретению может включать боранофосфонатную (фосфодиэфирную или подобную фосфодиэфирной) и фосфоротиоатную (стабилизированную) связи. "Стабилизированная межнуклеотидная связь" означает межнуклеотидную связь, которая относительно устойчива к разложению in vivo (например, посредством экзо- или эндонуклеазы), по сравнению с фосфодиэфирной межнуклеотидной связью. Предпочтительные стабилизированные межнуклеотидные связи включают фосфоротиоатную, фосфородитиоатную, метилфосфонатную и метилфосфоротиоатную, но не ограничены ими. Другие стабилизированные межнуклеотидные связи включают пептидную, алкильную, дефосфо и другие связи, как описано выше, но не ограничены ими.
Модифицированные каркасы, такие как фосфоротиоаты, могут быть синтезированы с использованием автоматизированных способов, использующих либо фосфорамидатные, или Н-фосфонатные химические группы. Арил- и алкилфосфонаты могут быть получены, например, как описано в патенте США №4469863; и алкилфосфотриэфиры (в которых группа заряженного кислорода является алкилированной, как описано в патенте США №5023243 и европейском патенте №092574) могут быть получены посредством автоматизированного твердофазного синтеза с использованием имеющихся в продаже реагентов. Описаны способы получения других модификаций и замен каркаса ДНК. Uhlmann E et al. (1990) Chem. Rev. 90:544; Goodchild J (1990) Bioconjugate Chem. 1:165. Способы получения химерных олигонуклеотидов также известны. Например, такие способы описаны в патентах, выданных Uhlmann et al.
Модифицированный ODN со смешанным каркасом может быть синтезирован с использованием имеющегося в продаже синтезатора ДНК и стандартной химии фосфорамидитов (F.E. Eckstein, "Oligonucleotides and Analogues - A Practical Approach" IRL Press. Oxford. UK. 1991, и M.D.Matteucci and M.H.Caruthers, Tetrahedron Lett. 21. 719 (1980)). После сочетания вводят связи PS посредством сульфуризации с использованием реагента Beaucage (R.P. Iyer, W. Egan, J.B. Regan и S.L. Beaucage, J. Am. Chem. Soc. 112. 1253 (1990)) (0,075 М в ацетонитриле) или фенилацетилдисульфида (PADS) с последующим кэппированием уксусным ангидридом, 2,6-лутидином в тетрагидрофуране (1:1:8; об.:об.:об.) и N-метилимидазолом (16% в тетрагидрофуране). Эту стадию кэппирования проводят после реакции сульфуризации для минимизации образования нежелательных фосфодиэфирных (РО) связей в положениях, где должна быть расположена фосфоротиоатная связь. В случае введения фосфодиэфирной связи, например в CpG-динуклеотид, промежуточный фосфор-III окисляют путем обработки раствором йода в смеси вода/пиридин. После отщепления от твердой подложки и конечного удаления защитной группы путем обработки концентрированным аммиаком (15 часов при 50°С) ODN анализируют посредством ВЭЖХ на колонке Gen-Pak Fax (Millipore-Waters) с использованием градиента NaCl (например, буфер А: 10 мМ NaH2PO4 в смеси ацетонитрил/вода = 1:4/об.:об., рН 6,8; буфер В: 10 мМ NaH2PO4, 1,5 М NaCl в смеси ацетонитрил/вода = 1:4/об.:об.; от 5 до 60% В в течение 30 минут при 1 мл/мин) или посредством капиллярного гель-электрофореза. ODN может быть очищен посредством ВЭЖХ или посредством FPLC (жидкостной хроматографии быстрого разрешения) на колонке Source High Performance (Amersham Pharmacia). Гомогенные фракции ВЭЖХ объединяют и обессоливают с помощью колонки С18 или путем ультрафильтрации. ODN анализировали посредством масс-спектрометрии MALDI-TOF (времяпролетная масс-спектрометрия с ионизацией методом лазерной десорбции из матрицы) для подтверждения рассчитанной массы.
Нуклеиновые кислоты по изобретению также могут включать другие модификации. Они включают неионные аналоги ДНК, такие как алкил- и арилфосфаты (в которых заряженный кислород фосфоната замещен алкильной или арильной группой), фосфодиэфир и алкилфосфотриэфиры, в которых группа заряженного кислорода является алкилированной. Также показано, что нуклеиновые кислоты, которые содержат диол, такой как тетраэтиленгликоль или гексаэтиленгликоль, на любом одном или на обоих концах являются по существу устойчивыми к разложению нуклеазой.
В некоторых воплощениях олигонуклеотиды могут представлять собой гибкие или полугибкие олигонуклеотиды. Гибкий олигонуклеотид представляет собой иммуностимулирующий олигонуклеотид, имеющий частично стабилизированный каркас, в котором фосфодиэфирные или подобные фосфодиэфирной межнуклеотидные связи встречаются только в пределах по меньшей мере одного внутреннего пиримидин-пурин динуклеотида (YZ) и непосредственно рядом с ним. Предпочтительно YZ представляет собой YG, пиримидин-гуанозин (YG) динуклеотид. По меньшей мере один внутренний динуклеотид YZ сам по себе имеет фосфодиэфирную или подобную фосфодиэфирной межнуклеотидную связь. Фосфодиэфирная или подобная фосфодиэфирной межнуклеотидная связь, расположенная непосредственно рядом с по меньшей мере одним внутренним YZ динуклеотидом, может находиться с 5'-, 3'-, или и 5'-, и 3'-конца относительно по меньшей мере одного внутреннего YZ динуклеотида.
В частности, фосфодиэфирные или подобные фосфодиэфирной межнуклеотидные связи вовлекают "внутренние динуклеотиды". Внутренний динуклеотид, как правило, означает любую пару соседних нуклеотидов, связанных межнуклеотидной связью, где ни один из нуклеотидов в паре нуклеотидов не является концевым нуклеотидом, т.е. ни один нуклеотид в паре нуклеотидов не представляет собой нуклеотид, определяющий 5'- или 3'-конец олигонуклеотида. Таким образом, линейный олигонуклеотид, длина которого составляет n нуклеотидов, имеет всего n-1 динуклеотидов и только n-3 внутренних динуклеотидов. Каждая межнуклеотидная связь во внутреннем динуклеотиде представляет собой внутреннюю межнуклеотидную связь. Таким образом, линейный олигонуклеотид, который имеет длину n нуклеотидов, имеет всего n-1 межнуклеотидных связей и только n-3 внутренних межнуклеотидных связей. Стратегически расположенные фосфодиэфирные или подобные фосфодиэфирной межнкулеотидные связи, таким образом, относятся к фосфодиэфирным или подобным фосфодиэфирной межнуклеотидным связям, расположенным между любой парой нуклеотидов в последовательности нуклеиновых кислот. В некоторых воплощениях фосфодиэфирные или подобные фосфодиэфирной межнуклеотидные связи не располагаются между какой-либо парой нуклеотидов, находящейся наиболее близко к 5'- или 3'-концу.
Предпочтительно фосфодиэфирная или подобная фосфодиэфирной межнуклеотидная связь, расположенная непосредственно рядом с по меньшей мере одним внутренним YZ динуклеотидом, сама по себе представляет собой внутреннюю межнуклеотидную связь. Таким образом, для последовательности N1YZN2, где каждый из N1 и N2 независимо друг от друга представляет собой любой единичный нуклеотид, YZ динуклеотид имеет фосфодиэфирную или подобную фосфодиэфирной межнуклеотидную связь, и, в дополнение, (а) N1 и Y связаны фосфодиэфирной или подобной фосфодиэфирной межнуклеотидной связью, когда N1 представляет собой внутренний нуклеотид, (б) Z и N2 связаны фосфодиэфирной или подобной фосфодиэфирной межнуклеотидной связью, когда N2 представляет собой внутренний нуклеотид, или (в) N1 и Y связаны фосфодиэфирной или подобной фосфодиэфирной межнуклеотидной связью, когда N1 представляет собой внутренний нуклеотид, и Z и N2 связаны фосфодиэфирной или подобной фосфодиэфирной межнуклеотидной связью, когда N2 представляет собой внутренний нуклеотид.
В олигонуклеотиде по изобретению по меньшей мере один YZ в R1YZR2 может иметь фосфодиэфирную связь. Альтернативно, YZ в R1YZR2 может иметь фосфоротиоатную связь. В некоторых воплощениях R1Y и/или ZR2 в R1YZR2 имеет фосфоротиоатную связь.
Полагают, что гибкие олигонуклеотиды по настоящему изобретению являются относительно чувствительными к расщеплению нуклеазой по сравнению с полностью стабилизированными олигонуклеотидами. Без связи с конкретной теорией или механизмом, полагают, что гибкие олигонуклеотиды по изобретению являются чувствительными к расщеплению до фрагментов со сниженной или отсутствующей иммуностимулирующей активностью относительно полноразмерных гибких олигонуклеотидов. Полагают, что встраивание по меньшей мере одной чувствительной к нуклеазе межнуклеотидной связи, особенно вблизи центра олигонуклеотида, обеспечивает некий "выключатель", который изменяет фармакокинетику олигонуклеотида таким образом, чтобы происходило снижение продолжительности максимальной иммуностимулирующей активности олигонуклеотида. Это может иметь определенную значимость в тканях и в клиническом применении, где желательно избегать повреждения, связанного с хроническим местным воспалением или иммуностимуляцией, например в почках.
Полугибкий олигонуклеотид представляет собой иммуностимулирующий олигонуклеотид, имеющий частично стабилизированный каркас, в котором фосфодиэфирные или подобные фосфодиэфирной межнуклеотидные связи встречаются только в пределах по меньшей мере одного внутреннего пиримидин-пурин (YZ) динуклеотида. Полугибкие олигонуклеотиды, как правило, обладают повышенной иммуностимулирующей эффективностью относительно соответствующих полностью стабилизированных иммуностимулирующих олигонуклеотидов. Вследствие более высокой эффективности полугибких олигонуклеотидов, полугибкие олигонуклеотиды могут быть использованы в целях достижения требуемого биологического эффекта, в некоторых случаях, в более низких концентрациях и с более низкими эффективными дозами по сравнению с обычными полностью стабилизированными иммуностимулирующими олигонуклеотидами.
Полагают, что указанные выше свойства полугибких олигонуклеотидов, как правило, усиливаются с повышением "дозы" фосфодиэфирных или подобных фосфодиэфирной межнуклеотидных связей, включающих внутренние YZ динуклеотиды. Таким образом, полагают, например, что главным образом для данной олигонуклеотидной последовательности с пятью внутренними YZ динуклеотидами, олигонуклеотид с пятью внутренними фосфодиэфирными или подобными фосфодиэфирной YZ межнуклеотидными связями является более иммуностимулирующим, чем олигонуклеотид с четырьмя внутренними фосфодиэфирными или подобными фосфодиэфирной YZ межнуклеотидными связями, который, в свою очередь, является более иммуностимулирующим, чем олигонуклеотид с тремя внутренними фосфодиэфирными или подобными фосфодиэфирной YZ межнуклеотидными связями, который, в свою очередь, является более иммуностимулирующим, чем олигонуклеотид с двумя внутренними фосфодиэфирными или подобными фосфодиэфирной YZ межнуклеотидными связями, который, в свою очередь, является более иммуностимулирующим, чем олигонуклеотид с одной внутренней фосфодиэфирной или подобной фосфодиэфирной YZ межнуклеотидной связью. Важно, что включение даже одной внутренней фосфодиэфирной или подобной фосфодиэфирной YZ межнуклеотидной связи будет иметь преимущества по сравнению с отсутствием внутренней фосфодиэфирной или подобной фосфодиэфирной YZ межнуклеотидной связи. В дополнение к количеству фосфодиэфирных или подобных фосфодиэфирной межнуклеотидных связей, также на эффективность может влиять положение по длине нуклеиновой кислоты.
Гибкие и полугибкие олигонуклеотиды, как правило, включают, в дополнение к фосфодиэфирным или подобным фосфодиэфирной межнуклеотидным связям в предпочтительных внутренних положениях, 5'- и 3'-концы, которые являются устойчивыми к разложению. Такие устойчивые к разложению концы могут включать любую подходящую модификацию, которая приводит к повышенной устойчивости против расщепления экзонуклеазой по сравнению с соответствующими немодифицированными концами. Например, 5'- и 3'-концы могут быть стабилизированы путем включения в них по меньшей мере одной фосфатной модификации каркаса. В предпочтительном воплощении по меньшей мере одна фосфатная модификация каркаса на каждом конце независимо представляет собой фосфоротиоатную, фосфородитиоатную, метилфосфонатную или метилфосфоротиоатную межнуклеотидную связь. В другом воплощении устойчивый к разложению конец включает одну или более нуклеотидных единиц, соединенных пептидной или амидной связями на 3'-конце.
Фосфодиэфирная межнуклеотидная связь представляет собой тип связи, характерный для нуклеиновых кислот, обнаруживаемых в природе. Фосфодиэфирная межнуклеотидная связь включает атом фосфора, фланкированный двумя образующими мостик атомами кислорода и связанный также двумя дополнительными атомами кислорода, где один является заряженным и другой является незаряженным. Фосфодиэфирная межнуклеотидная связь является особенно предпочтительной, когда важно сократить время полужизни олигонуклеотида в ткани.
Подобная фосфодиэфирной межнуклеотидная связь представляет собой фосфор-содержащую мостиковую группу, которая химически и/или диастереомерно подобна фосфодиэфирной. Признаки подобия фосфодиэфиру включают чувствительность к расщеплению нуклеазой и способность к активации РНКазы H. Таким образом, например, фосфодиэфирные, но не фосфоротиоатные олигонуклеотиды являются чувствительными к расщеплению нуклеазой, в то время как фосфодиэфирные, так и фосфоротиоатные олигонуклеотиды активируют РНКазу Н. В предпочтительном воплощении подобная фосфодиэфирной межнуклеотидная связь представляет собой боранофосфатную (или эквивалентно, боранофосфонатную) связь. Патент США №5177198; патент США №5859231; патент США №6160109; патент США №6207819; Sergueev et al., (1998) J Am. Chem. Soc. 120:9417-27. В другом предпочтительном воплощении подобная фосфодиэфирной межнуклеотидная связь представляет собой диастереомерно чистый фосфоротиоат Rp. Полагают, что диастереомерно чистый фосфоротиоат Rp является более чувствительным к расщеплению нуклеазой и лучше активирует РНКазу Н, чем смешанный или диастереомерно чистый фосфоротиоат Sp. Стереоизомеры CpG-олигонуклеотидов представляют собой объекты находящейся на одновременном рассмотрении опубликованной заявки США 09/361575, поданной 27 июля 1999 года, и опубликованной РСТ заявке PCT/US99/17100 (WO 00/06588). Также следует отметить, что для целей настоящего изобретения термин "подобная фосфодиэфирной межнуклеотидная связь" конкретно исключает фосфородитиоатную и метилфосфонатную межнуклеотидные связи.
Как описано выше, гибкий и полугибкий олигонуклеотиды по изобретению могут обладать подобными фосфодиэфирными связями между С и G. Одним из примеров подобной фосфодиэфирной связи является фосфоротиоатная связь в Rp конформации. р-Хиральность олигонуклеотида по-видимому может оказывать противоположные эффекты на иммунную активность CpG-олигонуклеотида, в зависимости от момента времени, в который измеряют активность. В ранний момент времени, составляющий 40 минут, стереоизомер Rp, но не Sp, фосфоротиоатного CpG-олигонуклеотида индуцирует фосфорилирование JNK в клетках селезенки мыши. Напротив, при оценке в более поздний момент времени, составляющий 44 часа, стереоизомер Sp, но не Rp, является активным в отношении стимуляции пролиферации клеток селезенки. Это различие в кинетике и биологической активности стереоизомеров Rp и Sp возникает не в результате различий захвата клетками, а, наиболее вероятно, вследствие противоположной биологической роли р-хиральности. Во-первых, повышенная активность стереоизомера Rp по сравнению с Sp в отношении стимуляции иммунных клеток в ранние моменты времени указывает на то, что Rp может быть более эффективным в отношении взаимодействия с рецептором для CpG, TLR9, или индукции последующих каскадов передачи сигнала. С другой стороны, более быстрое разложение PS-олигонуклеотидов Rp по сравнению с Sp приводит к значительно более короткой продолжительности передачи сигнала, так что PS-олигонуклеотиды Sp оказываются более биологически активными при тестировании в более поздние моменты времени.
Неожиданно сильный эффект достигается благодаря р-хиральности в отношении самого CpG-динуклеотида. По сравнению со стереослучайным CpG-олигонуклеотидом, компонент, в котором отдельный CpG-динуклеотид связан в Rp, слегка более активен, тогда как компонент, содержащий связь Sp, практически неактивен в отношении индукции пролиферации клеток селезенки.
Термины "нуклеиновая кислота" и "олигонуклеотид" также охватывают нуклеиновые кислоты или олигонуклеотиды с заменами или модификациями, такими как в основаниях и/или сахарах. Например, они включают нуклеиновые кислоты, имеющие сахара каркаса, ковалентно присоединенные к низкомолекулярным органическим группам, отличным от гидроксильной группы в 2'-положении и отличным от фосфатной группы или гидроксигруппы в 5'-положении. Таким образом, модифицированные нуклеиновые кислоты могут включать группу 2'-O-алкилированной рибозы. Дополнительно, модифицированные нуклеиновые кислоты могут включать сахара, такие как арабиноза или 2'-фторарабиноза вместо рибозы. Таким образом, нуклеиновые кислоты могут быть гетерогенными в составе каркаса, при этом содержащими любую возможную комбинацию полимерных единиц, связанных вместе, таких как пептид-нуклеиновые кислоты (которые имеют аминокислотный каркас с основаниями нуклеиновых кислот).
Нуклеиновые кислоты также включают замещенные пурины и пиримидины, такие как С-5 пропинпиримидиновые и 7-деаза-7-замещенные пуринмодифицированные основания. Wagner RW et al. (1996) Nat Biotechnol 14:840-4. Пурины и пиримидины включают аденин, цитозин, гуанин, тимин, 5-метилцитозин, 5-гидроксицитозин, 5-фторцитозин, 2-аминопурин, 2-амино-6-хлорпурин, 2,6-диаминопурин, гипоксантин и другие встречающиеся и не встречающиеся в природе нуклеиновые основания, замещенные и незамещенные ароматические группировки, но не ограничены ими. Другие такие модификации хорошо известны специалистам в данной области техники.
Иммуностимулирующие олигонуклеотиды по настоящему изобретению могут охватывать различные химические модификации и замены по сравнению с природной РНК и ДНК, включая фосфодиэфирный межнуклеотидный мостик, мономер β-D-рибозы и/или природное нуклеотидное основание (аденин, гуанин, цитозин, тимин, урацил). Примеры химических модификаций известны квалифицированному специалисту и описаны, например, в Uhlmann E et al. (1990) Chem. Rev. 90:543; "Protocols for Oligonucleotides and Analogs" Synthesis and Properties & Synthesis and Analytical Techniques, S. Agrawal, Ed, Humana Press, Totowa, USA 1993; Crooke ST et al., (1996) Annu Rev. Pharmacol. Toxicol. 36:107-129; и Hunziker J et al. (1995) Mod. Synth. Methods 7:331-417. Олигонуклеотид по изобретению может иметь одну или более чем одну модификацию, где каждая модификация расположена в конкретном фосфодиэфирном межнуклеотидном мостике и/или в конкретном мономере β-D-рибозы и/или в конкретном природном нуклеотидном основании по сравнению с олигонуклеотидом с такой же последовательностью, который состоит из природной ДНК или РНК.
Например, изобретение относится к олигонуклеотиду, который может содержать одну или более чем одну модификацию, и где каждая модификация независимо выбрана из:
а) замены фосфодиэфирного межнуклеотидного мостика, расположенного на 3'- и/или 5'-конце нуклеотида, модифицированным межнуклеотидным мостиком,
б) замены фосфодиэфирного мостика, расположенного на 3'- и/или 5'-конце нуклеотида, дефосфомостиком,
в) замены сахар-фосфатного мономера из сахар-фосфатного каркаса другим мономером,
г) замены мономера β-D-рибозы мономером модифицированного сахара и
д) замены природного нуклеотидного основания модифицированным нуклеотидным основанием.
Более подробные примеры химической модификации олигонуклеотида являются следующими.
Фосфодиэфирный межнуклеотидный мостик, расположенный на 3'- и/или 5'-конце нуклеотида, может быть замещен модифицированным межнуклеотидным мостиком, где модифицированный межнуклеотидный мостик выбран, например, из фосфоротиоатного, фосфородитиоатного, NR1R2-фосфорамидатного, боранофосфатного, α-гидроксибензилфосфонатного, фосфат-(С1-С21)-O-алкилового эфира, фосфат-[(С6-С12)арил-(С1-С21)-O-алкилового] эфира, (С1-С8)алкилфосфонатного и/или (С6-С12)арилфосфонатного мостиков, (С7-С12)-α-гидроксиметил-арила (например, раскрытого в WO 95/01363), где (С6-С12)арил, (С6-С20)арил и (С6-С14)арил возможно замещены галогеном, алкилом, алкокси, нитро, циано, и где R1 и R2 независимо друг от друга представляют собой водород, (С1-С18)-алкил, (С6-С20)-арил, (С6-С14)-арил-(С1-С8)-алкил, предпочтительно водород, (С1-С8)-алкил, предпочтительно (С1-С4)-алкил и/или метоксиэтил, или R1 и R2 вместе с атомом азота, к которому они присоединены, образуют 5-6-членное гетероциклическое кольцо, которое дополнительно может содержать дополнительный гетероатом из группы из О, S и N.
Замещение фосфодиэфирного мостика находится на 3'- и/или на 5'-конце нуклеотида с дефосфо-мостиком (дефосфо-мостики описаны, например, в Uhlmann E and Peyman А в "Methods in Molecular Biology", Vol.20, "Protocols for Oligonucleotides and Analogues", S. Agrawal, Ed., Humana Press, Totowa 1993, Chapter 16, pp.355 ff), где дефосфо-мостик, например, выбран из групп формацеталя, 3'-тиоформацеталя, метилгидроксиламина, оксима, метилендиметилгидразо, диметиленсульфона и/или силила дефосфо-мостиков.
Сахар-фосфатный мономер (т.е. β-D-рибоза и фосфодиэфирный межнуклеотидный мостик, вместе образующие сахар-фосфатный мономер) сахар-фосфатного каркаса (т.е. сахар-фосфатный каркас состоит из сахар-фосфатных мономеров) может быть замещен другим мономером, где другой мономер, например, является подходящим для создания "морфолино-производного" олигомера (как описано, например, в Stirchak EP et al. (1989) Nucleic Acids Res 17:6129-41), т.е., например, для замены морфолино-производным мономером; или для создания полиамидной нуклеиновой кислоты ("PNA"; как описано, например, в Nielsen РЕ et al. (1994) Bioconjug Chem 5:3-7), т.е., например, для замены мономером каркаса PNA, например, 2-аминоэтилглицином.
Мономер β-рибозы или мономер β-D-2'-дезоксирибозы может быть замещен модифицированным мономером сахара, где модифицированный мономер сахара, например, выбран из β-D-рибозы, α-D-2'-дезоксирибозы, L-2'-дезоксирибозы, 2'-F-2'-дезоксирибозы, 2'-F-арабинозы, 2'-O-(C1-С6)алкилрибозы, предпочтительно 2'-O-(С1-С6)алкилрибоза представляет собой 2'-O-метилрибозу, 2'-O-(С2-С6)алкенилрибозы, 2'-[O-(С1-С6)алкил-O-(С1-С6)алкил]рибозы, 2'-NH2-2'-дезоксирибозы, β-D-ксилофуранозы, α-арабинофуранозы, 2,4-дидезокси-β-D-эритро-гексопиранозы, и карбоциклическими аналогами сахаров (описанными, например, в Froehler J (1992) Am. Chem. Soc. 114:8320)
и/или аналогами сахаров с открытой цепью (описанными, например, в Vandendriessche et al. (1993) Tetrahedron 49:7223) и/или аналогами бициклосахаров (описанными, например, в Tarkov M et al. (1993) Helv Chim Acta 76:481).
В некоторых предпочтительных воплощениях сахар представляет собой 2'-O-метилрибозу, в частности, в случае одного или обоих нуклеотидов, связанных фосфодиэфирной или подобной фосфодиэфирной межнуклеотидной связью.
Нуклеиновые кислоты также включают замещенные пурины и пиримидины, такие как С-5-пропинпиримидин и 7-деаза-7-замещенные пуриновые модифицированные основания. Wagner RW et al. (1996) Nat Biotechnol 14: 840-4. Пурины и пиримидины включают аденин, цитозин, гуанин и тимин и другие встречающиеся и не встречающиеся в природе нуклеиновые основания, замещенные и незамещенные ароматические группировки, но не ограничены ими.
Модифицированное основание представляет собой любое основание, химически отличающееся от встречающегося в природе основания, обычно обнаруживаемого в ДНК и РНК, такого как Т, С, G, А и U, но которое содержит общие химические структуры этих встречающихся в природе оснований. Модифицированное нуклеотидное основание может быть выбрано, например, из гипоксантина, урацила, дигидроурацила, псевдоурацила, 2-тиоурацила, 4-тиоурацила, 5-аминоурацила, 5-(С1-С6)-алкилурацила, 5-(С2-С6)-алкенилурацила, 5-(С2-С6)-алкинилурацила, 5-(гидроксиметил)урацила, 5-хлорурацила, 5-фторурацила, 5-бромурацила, 5-гидроксицитозина, 5-(C1-C6)-алкилцитозина, 5-(С2-С6)-алкенилцитозина, 5-(С2-С6)-алкинилцитозина, 5-хлорцитозина, 5-фторцитозина, 5-бромцитозина, N2-диметилгуанина, 2,4-диаминопурина, 8-азапурина, замещенного 7-деазапурина, предпочтительно 7-деаза-7-замещенного и/или 7-деаза-8-замещенного пурина, 5-гидроксиметилцитозина, N4-алкилцитозина, например N4-этилцитозина, 5-гидроксидезоксицитидина, 5-гидроксиметил-дезоксицитидина, N4-алкилдезоксицитидина, например N4-этилдезоксицитидина, 6-тиодезоксигуанозина, и дезоксирибонуклеотидов из нитропиррола, С5-пропинилиримидина и диаминопурина, например 2,6-диаминопурина, инозина, 5-метилцитозина, 2-аминопурина, 2-амино-6-хлорпурина, гипоксантина или других модификаций природных нуклеотидных оснований. Данный список является примерным и не должен интерпретироваться как ограничивающий.
В конкретных формулах, описанных в настоящем описании, определен набор модифицированных оснований. Например, букву Y используют для обозначения пиримидина и, в некоторых воплощениях, нуклеотида, содержащего цитозин или модифицированный цитозин. Использованный здесь модифицированный цитозин представляет собой встречающийся или не встречающийся в природе аналог пиримидинового основания цитозина, который может заменять это основание без снижения иммуностимулирующей активности олигонуклеотида. Модифицированные цитозины включают 5-замещенные цитозины (например, 5-метилцитозин, 5-фторцитозин, 5-хлорцитозин, 5-бромцитозин, 5-йодцитозин, 5-гидроксицитозин, 5-гидроксиметилцитозин, 5-дифторметилцитозин и незамещенный или замещенный 5-алкинилцитозин), 6-замещенные цитозины, N4-замещенные цитозины (например, N4-этилцитозин), 5-азацитозин, 2-меркаптоцитозин, изоцитозин, псевдоизоцитозин, аналоги цитозина с системами конденсированных колец (например, N,N'-пропиленцитозин или феноксазин), и урацил и его производные (например, 5-фторурацил, 5-бромурацил, 5-бромвинилурацил, 4-тиоурацил, 5-гидроксиурацил, 5-пропинилурацил). Некоторые из предпочтительных цитозинов включают 5-метилцитозин, 5-фторцитозин, 5-гидроксицитозин, 5-гидроксиметилцитозин и N4-этилцитозин, но не ограничены ими. В другом воплощении изобретения цитозиновое основание замещено универсальным основанием (например, 3-нитропирролом, Р-основанием), ароматической кольцевой системой (например, фторбензолом или дифторбензолом) или атомом водорода (d-спейсер).
Букву Z используют для обозначения пурина, пиримидина или остатка, лишенного нуклеотидного основания и, в некоторых воплощениях, гуанина или модифицированного гуанинового основания. Используемый здесь модифицированный гуанин представляет собой встречающийся или не встречающийся в природе аналог пуринового основания гуанина, который может замещать это основание без снижения иммуностимулирующей активности олигонуклеотида. Модифицированные гуанины включают 7-деазагуанин, 7-деаза-7-замещенный гуанин (такой как 7-деаза-7-(С2-С6)алкинилгуанин), 7-деаза-8-замещенный гуанин, гипоксантин, N2-замещенные гуанины (например, N2-метилгуанин), 5-амино-3-метил-3Н,6Н-тиазоло[4,5-а]пиримидин-2,7-дион, 2,6-диаминопурин, 2-аминопурин, пурин, индол, аденин, замещенные аденины (например, N6-метиладенин, 8-оксоаденин), 8-замещенный гуанин (например, 8-гидроксигуанин и 8-бромгуанин) и 6-тиогуанин, но не ограничены ими. В другом воплощении изобретения гуаниновое основание замещено универсальным основанием (например, 4-метилиндолом, 5-нитроиндолом и К-основанием), ароматической кольцевой системой (например, бензимидазолом или дихлорбензимидазолом, амидом 1-метил-1Н-[1,2,4]триазол-3-карбоновой кислоты) или атомом водорода (d-спейсер).
Олигонуклеотиды могут иметь один или несколько доступных 5'-концов. Можно также получить модифицированные олигонуклеотиды, имеющие два таких 5'-конца. Этого можно достичь, например, путем присоединения двух олигонуклеотидов посредством 3'-3'-связи с получением олигонуклеотида, имеющего один или два доступных 5'-конца. Указанная 3'-3'-связь может представлять собой фосфодиэфирный, фосфоротиоатный или любой другой модифицированный межнуклеотидный мостик. Способы осуществления такого связывания известны в данной области техники. Например, такие связи описаны в Seliger H et al. (1991) Oligonucleotide analogs with terminal 3'-3'- and 5'-5'-internucleotidic linkages as antisense inhibitors of viral gene expression, Nucleosides & Nucleotides 10: 469-77 and Jiang Z et al. (1999) Pseudo-cyclic oligonucleotides: in vitro and in vivo properties, Bioorganic & Medicinal Chemistry 7:2727-2735.
Дополнительно, 3'-3'-связанные нуклеиновые кислоты, где связь между 3'-концевыми нуклеотидами не представляет собой фосфодиэфирный, фосфоротиоатный или другой модифицированный мостик, можно получить с использованием дополнительного спейсера, такого как три- или тетраэтиленгликольфосфатная группировка (Durand M et al. (1992) Triple-helix formation by an Oligonucleotide containing one (dA) 12 and two (dT) 12 sequences bridged by two hexaethylene glycol chains, Biochemistry (1992) 31(38): 9197-204; патент США №5658738 и патент США №5668265). Альтернативно, ненуклеотидный линкер может быть получен из этандиола, пропандиола или из дезоксирибозного мономера, лишенного азотистого основания (d-спейсер) (Fontanel, Marie Laurence et al., Sterical recognition by T4 polynucleotide kinase of non-nucleosidic moieties 5'-attached to oligonucleotides; Nucleic Acids Research (1994), 22(11), 2022-7) с использованием обычной фосфорамидитной химии. Ненуклеотидные линкеры могут быть включены один или несколько раз, или комбинированы друг с другом, давая возможность для любого желательного расстояния между 3'-концами двух ODN, подлежащих связыванию.
Олигонуклеотиды частично устойчивы к разложению (например, являются стабилизированными). "Стабилизированная олигонуклеотидная молекула" означает олигонуклеотид, относительно устойчивый к разложению in vivo (например, посредством экзо- или эндонуклеазы). Стабилизация нуклеиновой кислоты может быть осуществлена путем модификации каркаса. Олигонуклеотиды, имеющие фосфоротиоатные связи, обеспечивают максимальную активность и защищают олигонуклеотид от разложения внутриклеточными экзо- и эндонуклеазами. Другие модифицированные олигонуклеотиды включают нуклеиновые кислоты с фосфодиэфирной модификацией, комбинации фосфодиэфирных и фосфоротиоатных нуклеиновых кислот, метилфосфонат, метилфосфоротиоат, фосфородитиоат, пара-этокси и их комбинации.
Модифицированные каркасы, такие как фосфоротиоаты, могут быть синтезированы с применением автоматизированных методик, использующих фосфорамидатные или Н-фосфонатные химические способы. Арил- или алкил-фосфонаты могут быть получены, например, как описано в патенте США №4469863; и алкилфосфотриэфиры (в которых заряженная кислородная группа алкилирована, как описано в патенте США №5023243 и европейском патенте №092574) могут быть получены автоматизированным твердофазным синтезом с использованием имеющихся в продаже реагентов. Способы получения других модификаций и замещений каркаса ДНК были описаны (например, Uhlmann, E. and Peyman, A., Chem. Rev. 90:544, 1990; Goodchild J (1990) Bioconjugate Chem. 1:165, 1990).
Другие стабилизированные олигонуклеотиды включают: неионные ДНК-аналоги, такие как алкил- и арилфосфаты (в которых заряженный кислород фосфоната заменен алкильной или арильной группой), фосфодиэфиры и алкилфосфотриэфиры, в которых заряженная кислородная группа алкилирована. Также показано, что нуклеиновые кислоты, содержащие диол, такой как тетраэтиленгликоль или гексаэтиленгликоль, на одном или на обоих концах, являются по существу устойчивыми к разложению нуклеазами.
В некоторых воплощениях олигонуклеотид содержит одну или более чем одну палиндромную последовательность. Используемые здесь "палиндром" и, эквивалентно, "палиндромная последовательность" относятся к инвертированному повтору, т.е. последовательности, такой как ABCDEE'D'C'B'A', где А и А', В и В' и т.д. представляют собой основания, способные образовывать обычные пары оснований Уотсона-Крика. В некоторых случаях палиндром является GC-обогащенным. GC-обогащенный палиндром представляет собой палиндром, имеющий состав оснований, состоящих по меньшей мере на две трети из G и С. В некоторых воплощениях GC-обогащенный домен предпочтительно расположен на 3'-конце относительно "домена, стимулирующего В-клетки". В случае, когда GC-обогащенный палиндром имеет длину в 10 оснований, то этот палиндром содержит по меньшей мере 8 G и С. В случае, когда GC-обогащенный палиндром имеет длину в 12 оснований, то этот палиндром также содержит по меньшей мере 8 G и С. В случае, когда GC-обогащенный палиндром имеет длину в 14 оснований, то по меньшей мере десять оснований этого палиндрома представляют собой G и С. В некоторых воплощениях GC-обогащенный палиндром состоит исключительно из G и С. В некоторых воплощениях олигонуклеотид содержит более чем одну палиндромную последовательность.
ДНК представляет собой полимер из дезоксирибонуклеотидов, связанных через 3'-5'-фосфодиэфирные связи. Мономеры полимера по изобретению также могут быть связаны через 3'-5'-фосфодиэфирные связи. Тем не менее, изобретение также охватывает полимеры, имеющие необычные межнуклеотидные связи, включая конкретно 5'-5'-, 3'-3'-, 2'-2'-, 2'-3'- и 2'-5'-межнуклеотидные связи. В одном из воплощений такие необычные связи исключены из иммуностимулирующего ДНК-мотива, даже если одна или более чем одна из таких связей может находиться где-либо в полимере. Для полимеров, имеющих свободные концы, включение одной 3'-3'-межнуклеотидной связи может приводить в результате к полимеру, имеющему два свободных 5'-конца. Напротив, для полимеров, имеющих свободные концы, включение одной 5'-5'-межнуклеотидной связи может приводить в результате к полимеру, имеющему два свободных 3'-конца.
Иммуностимулирующая композиция по данному изобретению может содержать два или более чем два иммуностимулирующих ДНК-мотива, которые могут быть связаны через разветвляющий мономер. Межнуклеотидные связи могут представлять собой связи 3'-5', 5'-5', 3'-3', 2'-2', 2'-3' или 2'-5'. Таким образом, номенклатура 2'-5' выбрана в соответствии с атомом углерода дезоксирибозы. Тем не менее, если использованы неприродные группировки сахара, такие как увеличенные за счет кольца аналоги сахара (например, гексаноза, циклогексен или пираноза) или би- или трициклические аналоги сахара, то эта номенклатура меняется в соответствии с номенклатурой мономера. Необычная межнуклеотидная связь может представлять собой фосфодиэфирную связь, но она альтернативно может быть модифицирована в виде фосфоротиоата или любой другой описанной здесь модифицированной связи. Формула IV демонстрирует общую структуру разветвленных олигомеров ДНК и модифицированных олигорибонуклеотидных аналогов по изобретению через нуклеотидный разветвляющий мономер. Таким образом, Nu1, Nu2 и Nu3 могут быть связаны через 3'-5'-, 5'-5'-, 3'-3'-, 2'-2'-, 2'-3'- или 2'-5'-связи. Разветвление ДНК олигомеров также может включать применение ненуклеотидных линкеров и спейсеров, лишенных азотистых оснований. В одном из воплощений Nu1, Nu2, и Nu3 представляют собой идентичные или разные иммуностимулирующие ДНК-мотивы.
Модифицированный олигорибонуклеотидный аналог может содержать удваивающий или утраивающий мономер (Glen Research, Sterling, VA), в частности, такие модифицированные олигодезоксирибонуклеотидные аналоги с 3'3'-связью. Удваивающий мономер в одном из воплощений может быть на основе 1,3-бис-[5-(4,4'-диметокситритилокси)пентиламидо]пропил-2-[(2-цианоэтил)-(N,N-диизопропил)]фосфорамидита. Утраивающий мономер в одном из воплощений может быть основан на включении трис-2,2,2-[3-(4,4'-диметокситритилокси)пропилоксиметил]этил-[(2-цианоэтил)-(N,N-диизопропил)]фосфорамидита. Разветвление модифицированных олигорибонуклеотидных аналогов множественными удваивающими, утраивающими или другими множественными мономерами приводит к дендримерам, представляющими собой дополнительные воплощения изобретения. Разветвленные модифицированные олигорибонуклеотидные аналоги могут приводить к перекрестному связыванию рецепторов, в особенности в отношении комбинаций иммуностимулирующей РНК и ДНК, таких как TLR3, TLR7, TLR8 и TLR9, с отличающимися иммунными эффектами по сравнению с неразветвленными формами аналогов. Дополнительно, синтез разветвленных или иных мультимерных аналогов может стабилизировать ДНК против разложения и может приводить к достаточно слабым или частично эффективным последовательностям ДНК, проявляющим терапевтически полезный уровень иммунной активности. Модифицированные олигодезоксирибонуклеотидные аналоги также могут содержать линкерные единицы, образующиеся реагентами, модифицирующими пептиды, или реагентами, модифицирующими олигонуклеотиды (Glen Research). Кроме того, модифицированные олигодезоксирибонуклеотидные аналоги могут содержать один или более чем один природный или неприродный аминокислотный остаток, связанный с полимером пептидными (амидными) связями.
3'-5'-, 5'-5'-, 3'-3'-, 2'-2'-, 2'-3'- и 2'-5'-межнуклеотидные связи могут быть прямыми или непрямыми. Прямые связи в этом контексте относятся к раскрытой здесь фосфатной или модифицированной фосфатной связи без промежуточной линкерной группировки. Промежуточная линкерная группировка представляет собой органическую группировку, отличную от раскрытой здесь фосфатной или модифицированной фосфатной связи, которая может включать, например, полиэтиленгликоль, триэтиленгликоль, гексаэтиленгликоль, d-спейсер (т.е. дезоксинуклеотид, лишенный азотистого основания), удваивающий мономер или утраивающий мономер.
Связи предпочтительно содержат С, Н, N, О, S, В, Р и галоген и содержат от 3 до 300 атомов. Примером с 3 атомами является ацетальная связь (ODN1-3'-O-CH2-O-3'-ODN2), соединяющая, например, 3'-гидроксигруппу одного нуклеотида с 3'-гидроксигруппой второго олигонуклеотида. Примером с примерно 300 атомами является PEG-40 (тетраконтаполиэтиленгликоль). Предпочтительными связями являются фосфодиэфирная, фосфоротиоатная, метилфосфонатная, фосфорамидатная, боранфосфонатная, амидная, простая эфирная, тиоэфирная, ацетальная, тиоацетальная, мочевинная, тиомочевинная, сульфонамидная, азометиновая и дисульфидная связи. Также возможно использование системы Solulink BioConjugation, т.е. (www.trilinkbiotech.com).
Если олигонуклеотид состоит из двух или более чем двух частей последовательности, то эти части могут быть идентичными или разными. Таким образом, в олигонуклеотиде с 3'3'-связью последовательности могут быть идентичными, например 5'-ODN1-3'3'-ODN1-5', или разными, например 5'-ODN1-3'3'-ODN2-5'. Кроме того, химическая модификация различных частей олигонуклеотида, так же как соединяющий их линкер, могут быть разными. Так как захват коротких олигонуклеотидов, по-видимому, менее эффективен, чем длинных олигонуклеотидов, соединение двух или более коротких последовательностей приводит к улучшенной иммунной стимуляции. Длина коротких олигонуклеотидов предпочтительно составляет 2-20 нуклеотидов, более предпочтительно 3-16 нуклеотидов, но наиболее предпочтительно 5-10 нуклеотидов. Предпочтительными являются связанные олигонуклеотиды, имеющие два или более чем два несвязанных 5'-конца.
Частичные последовательности олигонуклеотидов могут также быть связаны ненуклеотидными линкерами. Используемый здесь "ненуклеотидный линкер" относится к любому линкерному элементу, не представляющему собой нуклеотид или его полимер (т.е. полинуклеотид), где нуклеотид включает пуриновое или пиримидиновое нуклеиновое основание и фосфат сахара, в частности линкеры, лишенные азотистого основания (d-спейсеры), триэтиленгликолевые мономеры или гексаэтиленгликолевые мономеры. Дополнительно, предпочтительные линкеры представляют собой алкиламинолинкеры, такие как С3-, С6-, С12-аминолинкеры, и также алкилтиольные линкеры, такие как С3- или С6-тиольные линкеры. Олигонуклеотиды могут также быть связаны ароматическими остатками, которые могут быть дополнительно замещены алкильными или замещенными алкильными группами.
Для облегчения захвата клетками длина иммуностимулирующих олигонуклеотидов в некоторых воплощениях находится в диапазоне 3-100 оснований. В некоторых воплощениях олигонуклеотиды имеют длину 7-100 оснований. Как правило, нуклеиновые кислоты любого размера более 6 нуклеотидов (даже имеющих много пар оснований (п.о.) в длину) способны индуцировать иммунный ответ в соответствии с изобретением, если присутствует достаточное количество иммуностимулирующих мотивов. Тем не менее, улучшенную иммуностимулирующую способность модифицированных олигонуклеотидов по изобретению дают гораздо более короткие иммуностимулирующие молекулы. В некоторых воплощениях иммуностимулирующие олигонуклеотиды имеют длину 3-6 оснований.
Иммуностимулирующие CpG-олигонуклеотиды в некоторых аспектах изобретения полезны в качестве вакцины для лечения субъекта, имеющего риск развития аллергии или астмы, инфекции, вызванной инфекционным организмом, или рака, для которого идентифицирован специфический опухолевый антиген. Иммуностимулирующие CpG-олигонуклеотиды также могут быть введены без антигена или аллергена для защиты от инфекции, аллергии или рака, и в этом случае повторные дозы могут обеспечить более длительную защиту. Субъект, подверженный риску, как здесь используют, представляет собой субъекта, имеющего любой риск воздействия вызывающего инфекцию патогена или аллергена или риск развития рака. Например, субъектом, подверженным риску, может являться субъект, планирующий поездку в регион, где обнаружен конкретный тип инфекционного агента, или им может являться субъект, который вследствие образа жизни или медицинских процедур подвержен воздействию жидкостей организма, которые могут содержать инфекционные организмы, или непосредственно организма, или даже им может являться любой субъект, живущий в регионе, где идентифицирован инфекционный организм или аллерген. Субъекты, подверженные риску развития инфекции, также включают общие популяции, которым медицинские организации рекомендуют вакцинацию конкретным антигеном инфекционного организма. Если антиген является аллергеном, и у субъекта развиваются аллергические ответы на данный конкретный антиген, и субъект может быть подвержен воздействию антигена, т.е. во время сезона цветения, тогда данный субъект является подверженным риску воздействию данного антигена. Субъект, подверженный риску развития аллергии или астмы, включает субъектов, идентифицированных как страдающие аллергией или астмой, но не имеющие активной стадии данного заболевания во время лечения иммуностимулирующими CpG-олигонуклеотидами, а также субъектов, считающихся подверженными риску развития аллергии или астмы из-за генетических факторов или факторов окружающей среды.
Субъектом, подверженным риску развития рака, является субъект, имеющий высокую вероятность развития рака. Такие субъекты включают, например, субъектов, имеющих генетическую аномалию, для которой показана корреляционная связь с повышенной вероятностью развития рака, и субъектов, подверженных воздействию ассоциированных с раком агентов, таких как табак, асбест или другие химические токсины, или субъектов, которые ранее лечились от рака и находятся в выраженной ремиссии. Когда подверженного развитию рака субъекта лечат антигеном, специфическим для типа рака, риску развития которого подвержен этот субъект, и иммуностимулирующим CpG-олигонуклеотидом, у данного субъекта может развиться способность уничтожать раковые клетки при их развитии. Если у субъекта начинает формироваться опухоль, у этого субъекта будет развиваться специфический иммунный ответ против данного опухолевого антигена.
В дополнение к применению иммуностимулирующих CpG-олигонуклеотидов для профилактического лечения изобретение также охватывает применение иммуностимулирующих CpG-олигонуклеотидов для лечения субъекта, страдающего инфекцией, аллергией, астмой или раком.
Субъект, страдающий инфекцией, представляет собой субъекта, который подвергался воздействию инфекционного патогена и имеет острые или хронические обнаруживаемые уровни этого патогена в организме. Иммуностимулирующие CpG-олигонуклеотиды могут быть использованы с антигеном или без него для повышения антигенспецифического системного иммунного ответа или иммунного ответа слизистых оболочек, способного снижать уровень инфекционного патогена или уничтожать его. Используемое здесь инфекционное заболевание представляет собой заболевание, развивающееся вследствие присутствия чужеродного микроорганизма в организме. Особенно важно разрабатывать эффективные вакцинные стратегии и способы лечения для защиты поверхностей слизистых оболочек организма, являющихся первичным местом внедрения патогена.
Субъект, страдающий аллергией, представляет собой субъекта, имеющего аллергическую реакцию в ответ на аллерген или имеющего риск развития такой аллергической реакции. Аллергия относится к приобретенной гиперчувствительности к веществу (аллергену). Аллергические состояния включают экзему, аллергический ринит или острый ринит, поллиноз, конъюнктивит, бронхиальную астму, уртикарную сыпь (крапивницу) и пищевые аллергии и другие атопические состояния, но не ограничены ими.
Аллергии, как правило, вызваны образованием антител IgE против безопасных аллергенов. Цитокины, индуцируемые системным введением или введением через слизистые оболочки иммуностимулирующих CpG-олигонуклеотидов, преимущественно относятся к классу, называемому Th1 (примерами являются IL-12, IP-10, IFN-α и IFN-γ), и индуцируют как гуморальный, так и клеточный иммунные ответы. Другой основной тип иммунного ответа, ассоциированного с продукцией цитокинов IL-4 и IL-5, является иммунный ответ, называемый Th2. Как правило, аллергические заболевания, по-видимому, вызваны иммунными ответами Th2-типа. Основываясь на способности иммуностимулирующих CpG-олигонуклеотидов сдвигать иммунный ответ у субъекта от преобладающего Th2 (который ассоциирован с продукцией антител IgE и аллергией) к сбалансированному ответу Th2/Th1 (который является защитным против аллергических реакций), эффективная для индукции иммунного ответа доза иммуностимулирующих CpG-олигонуклеотидов может быть введена субъекту для лечения или предупреждения астмы и аллергии.
Таким образом, иммуностимулирующие CpG-олигонуклеотиды обладают значительной терапевтической пользой в лечении аллергических и неаллергических состояний, таких как астма. Уровни Th2-цитокинов, особенно IL-4 и IL-5, повышены в дыхательных путях субъектов, страдающих астмой. Эти цитокины стимулируют важные аспекты астматического воспалительного ответа, включая переключение изотипа IgE, хемотаксис и активацию эозинофилов и рост тучных клеток. Th1-цитокины, особенно IFN-γ и IL-12, могут подавлять формирование Th2-клонов и продукцию Th2-цитокинов. Астма относится к заболеваниям респираторной системы, характеризующимся воспалением, сужением дыхательных путей и повышенной реактивностью дыхательных путей к вдыхаемым веществам. Астма часто, хотя не исключительно, ассоциирована с атопическими или аллергическими симптомами.
Субъект, страдающий раком, представляет собой субъекта, имеющего обнаруживаемые злокачественные клетки. Опухоль может представлять собой злокачественную или незлокачественную опухоль. Раковые заболевания или опухоли включают рак желчных путей; рак головного мозга; рак молочной железы; рак шейки матки; хориокарциному; рак толстой кишки; рак эндометрия; рак пищевода; рак желудка; интраэпителиальные неоплазии; лимфомы; рак печени; рак легкого (например, мелкоклеточный и немелкоклеточный); меланому; нейробластомы; рак полости рта; рак яичника; рак поджелудочной железы; рак предстательной железы; рак прямой кишки; саркомы; рак кожи; рак яичка; рак щитовидной железы и рак почки, а также другие карциномы и саркомы, но не ограничены ими. В одном из воплощений рак представляет собой лейкоз ворсистых клеток, хронический миелолейкоз, кожный Т-клеточный лейкоз, множественную миелому, фолликулярную лимфому, злокачественную меланому, плоскоклеточную карциному, почечно-клеточную карциному, рак предстательной железы, рак мочевого пузыря или рак толстой кишки.
Субъект означает человека или позвоночное животное, включая собаку, кошку, лошадь, корову, свинью, овцу, козу, индейку, курицу, примата, например обезьяну, и рыбу (аквакультурные виды), например лосося, но не ограничен ими. Таким образом, соединения можно применять для лечения рака и опухолей, инфекций и аллергии/астмы у субъектов, не представляющих собой человека. Рак является одной из главных причин смерти животных, являющихся домашними питомцами (т.е. кошек и собак).
Используемый здесь термин "лечить", "подвергающийся лечению" или "лечение" в отношении расстройства, такого как инфекционное заболевание, рак, аллергия или астма, относится к профилактическому лечению, которое увеличивает устойчивость субъекта к развитию заболевания (например, к инфекции патогеном) или, другими словами, уменьшает вероятность того, что у субъекта разовьется заболевание (например, инфицирование патогеном), а также лечению после того, как у субъекта разовьется заболевание, для борьбы с этим заболеванием (например, уменьшение или устранение инфекции) или предотвращения ухудшения заболевания.
В случаях, когда CpG-олигонуклеотид вводят вместе с антигеном, субъект может быть подвержен воздействию этого антигена. Используемый здесь термин "подвержен воздействию" относится к активной стадии контактирования субъекта с антигеном или к пассивному воздействию антигена на субъекта in vivo. Способы активного воздействия антигена на субъекта хорошо известны в данной области техники. Как правило, антиген вводят непосредственно субъекту любыми способами, такими как внутривенное, внутримышечное, пероральное, трансдермальное введение, введение через слизистую оболочку, интраназальное, интратрахеальное или подкожное введение. Антиген может быть введен системно или местно. Способы введения антигена и иммуностимулирующего CpG-олигонуклеотида более подробно описаны ниже. Субъект пассивно подвергается воздействию антигена, если антиген становится доступным для воздействия иммунных клеток в организме. Субъект может пассивно подвергаться воздействию антигена, например, при внедрении чужеродного патогена в организм или при развитии опухолевой клетки, экспрессирующей чужеродный антиген на своей поверхности.
Способы, при которых субъект пассивно подвергается воздействию антигена, могут, в частности, зависеть от времени введения иммуностимулирующего CpG-олигонуклеотида. Например, для субъекта, подверженного риску развития рака, или инфекционного заболевания, или аллергического или астматического ответа, данному субъекту можно вводить иммуностимулирующий CpG-олигонуклеотид на регулярной основе, когда риск является наибольшим, например во время сезона аллергии или после воздействия агента, вызывающего рак. Кроме того, иммуностимулирующий CpG-олигонуклеотид можно вводить путешественникам перед их поездкой в зарубежные страны, где они подвержены риску воздействия инфекционных агентов. Аналогично, иммуностимулирующий CpG-олигонуклеотид можно вводить солдатам или гражданскому населению при риске воздействия биологического оружия для индукции системного иммунного ответа или иммунного ответа слизистых оболочек на антиген, когда и если субъект подвергается его воздействию.
Используемый здесь антиген представляет собой молекулу, способную вызывать иммунный ответ. Антигены включают клетки, клеточные экстракты, белки, полипептиды, пептиды, полисахариды, полисахаридные конъюгаты, пептидные и непептидные миметики полисахаридов и других молекул, небольшие молекулы, липиды, гликолипиды, углеводы, вирусы и вирусные экстракты и многоклеточные организмы, такие как паразиты и аллергены, но не ограничены ими. Термин "антиген" в широком смысле относится к любому типу молекулы, распознаваемой иммунной системой хозяина как чужеродная. Антигены включают опухолевые антигены, микробные антигены и аллергены, но не ограничены ими.
Используемый здесь опухолевый антиген представляет собой соединение, такое как пептид или белок, ассоциированное с поверхностью опухолевой или раковой клетки и способное вызывать иммунный ответ при экспрессии на поверхности антигенпрезентирующей клетки в контексте молекулы МНС (главного комплекса гистосовместимости). Опухолевые антигены можно получить из раковых клеток путем получения неочищенных экстрактов раковых клеток, например, как описано в Cohen PA et al. (1994) Cancer Res 54: 1055-8, или путем частичной очистки антигенов, или с использованием рекомбинантной технологии или синтеза известных антигенов cte novo. Опухолевые антигены включают антигены, экспрессированные рекомбинантным способом, их иммуногенный фрагмент или целую опухолевую или раковую клетку, но не ограничены ими. Такие антигены могут быть выделены или получены рекомбинантным или любыми другими способами, известными в данной области техники.
Используемый здесь микробный антиген представляет собой антиген микроорганизма и включает вирусы, бактерии, паразиты и грибы, но не ограничены ими. Такие антигены включают интактный микроорганизм, а также природные изоляты и их фрагменты или производные, а также синтетические соединения, идентичные или подобные природным антигенам микроорганизмов и индуцирующие иммунный ответ, специфический для данного микроорганизма. Соединение является подобным природному антигену микроорганизма, если оно индуцирует иммунный ответ (гуморальный и/или клеточный) на природный антиген микроорганизма. Такие антигены традиционно используют в данной области техники, и они хорошо известны специалистам в данной области техники.
Вирусы представляют собой небольшие инфекционные агенты, которые, как правило, содержат кор из нуклеиновой кислоты и белковую оболочку, но самостоятельно не представляют собой живые организмы. Вирусы также могут принимать форму инфекционных нуклеиновых кислот, лишенных белка. Вирус не может выживать в отсутствие живой клетки, в которой он может реплицироваться. Вирусы проникают в специфические живые клетки путем эндоцитоза или непосредственного инфицирования ДНК (фаг) и размножаются, вызывая заболевание. Размноженный вирус затем может высвобождаться и инфицировать дополнительные клетки. Некоторые вирусы представляют собой ДНК-содержащие вирусы, а другие представляют собой РНК-содержащие вирусы. ДНК-вирусы включают вирус оспы, вирус герпеса, аденовирус, паповавирус, парвовирус и гепаднавирус. РНК-вирусы включают пикорнавирус, калицивирус, астровирус, тогавирус, флавивирус, коронавирус, парамиксовирус, ортомиксовирус, буньявирус, аренавирус, рабдовирус, филовирус, борнавирус, реовирус и ретровирус. В некоторых аспектах изобретение также относится к лечению заболеваний, при которых прионы вовлечены в развитие заболевания, такие как, например, бычья губчатая энцефалопатия (т.е. заболевание бешенства коров, BSE) или почесуха у животных, или болезнь Крейтцфельда-Якоба у людей.
Вирусы включают энтеровирусы (включая вирусы семейства Picomaviridae, такие как полиовирус, вирус Коксаки, эховирус, но не ограниченные ими), ротавирусы, аденовирус и вирус гепатита, такого как гепатит А, В, С, D и Е, но не ограничены ими. Специфические примеры вирусов, которые обнаруживаются у людей, включают Retroviridae (например, вирусы иммунодефицита человека, такие как HIV-1 (на который ссылаются также как на HTLV-III, LAV или HTLV-III/LAV или HIV-III; и другие изоляты, такие как HIV-LP); Picomaviridae (например, полиовирусы, вирус гепатита А; энтеровирусы, вирусы Коксаки человека, риновирусы, эховирусы); Calciviridae (например, штаммы, вызывающие гастроэнтерит); Togaviridae (например, вирус энцефалита лошадей, вирусы краснухи); Flaviviridae (например, вирусы лихорадки Денге, вирусы энцефалита, вирусы желтой лихорадки); Coronaviridae (например, коронавирусы); Rhabdoviridae (например, вирусы везикулярного стоматита, вирусы бешенства); Filoviridae (например, вирусы Эбола); Paramyxoviridae (например, вирусы парагриппа, вирус свинки, вирус кори, респираторно-синцитиальный вирус); Orthomyxoviridae (например, вирусы гриппа); Bunyaviridae (например, хантавирусы, буньявирусы, флебовирусы и найровирусы); Arenaviridae (вирусы геморрагической лихорадки); Reoviridae (например, реовирусы, орбивирусы и ротавирусы); Bimaviridae; Hepadnaviridae (вирус гепатита В); Parvoviridae (парвовирусы); Papovaviridae (вирусы папилломы, вирусы полиомы); Adenoviridae (большинство аденовирусов); Herpesvindae (вирус простого герпеса (HSV) 1 и 2, вирус ветряной оспы, цитомегаловирус (CMV)); Poxviridae (вирусы натуральной оспы, вирусы коровьей оспы, поксвирусы); Iridoviridae (например, вирус африканской лихорадки свиней) и другие вирусы: вирус острого ларинготрахеобронхита, альфавирус, вирус герпеса, асоциированный с саркомой Калоши, вирус псевдочумы птиц, вирус Нипах, вирус Норуолк, вирус папилломы, вирус парагриппа, вирус птичьего гриппа, вирус атипичной пневмонии, вирус лихорадки Западного Нила, но не ограничены ими.
Способы по изобретению особенно полезны в некоторых воплощениях для лечения вируса иммунодефицита человека (HIV) и вируса гепатита. HIV, представляющий собой вид ретровируса, также известного как Т-клеточный лимфотропический вирус III человека (HTLV III), является причиной нарушения, приводящего в результате к расстройству, известному как СПИД (синдром приобретенного иммунодефицита). HIV инфицирует и разрушает Т-клетки, нарушая общий баланс иммунной системы, приводя в результате к потере способности пациентов бороться с другими инфекциями, и предрасположенности пациента к оппортунистическим инфекциям, которые часто оказываются смертельными.
Вирусный гепатит представляет собой воспаление печени, которое может вызывать увеличение, болезненность и иногда хроническое повреждение печени. Если воспаление печени продолжается в течение по меньшей мере шести месяцев или дольше, его называют хроническим гепатитом. Существует по меньшей мере пять различных вирусов, которые, как известно, вызывают вирусный гепатит, включающие гепатит А, В, С, D и Е. Гепатит А, как правило, переносится через пищу или питьевую воду, контаминированную человеческими экскрементами. Гепатит В, как правило, распространяется через жидкости организма, такие как кровь. Например, он может передаваться от матери к ребенку при рождении, при половом контакте, переливаниях зараженной крови и через иглы. Гепатит С весьма распространен и, как и гепатит В, часто передается при переливаниях крови и через зараженные иглы. Гепатит D наиболее часто обнаруживается у лиц, внутривенно вводящих лекарства, которые являются носителями вируса гепатита В, с которым он соассоциирован. Гепатит Е подобен вирусному гепатиту А и, как правило, ассоциирован с плохой гигиеной.
Как грамотрицательные, так и грамположительные бактерии служат антигенами у позвоночных животных. Такие грамположительные бактерии включают виды Pasteurella, виды Staphylococci и виды Streptococcus, но не ограничены ими. Грамотрицательные бактерии включают Escherichia coli, виды Pseudomonas и виды Salmonella, но не ограничены ими. Конкретные примеры инфекционных бактерий включают Helicobacter pylons, Borrelia burgdorferi, Legionella pneumophilia, Mycobacteria sps (например, M. tuberculosis, M. avium, M. intracellulare, M. kansasii, M. gordonae), Staphylococcus aureus, Neisseria gonorrhoeae, Neisseria meningitidis, Listeria monocytogenes, Streptococcus pyogenes (Streptococcus группы A), Streptococcus agalactiae (Streptococcus группы В), Streptococcus (группы viridans), Streptococcus faecalis, Streptococcus bovis, Streptococcus (анаэробные виды), Streptococcus pneumoniae, патогенные виды Campylobacter, виды Enterococcus, Haemophilus influenzae, Bacillus anthracis, Corynebacterium diphtheriae, виды Corynebacterium, Erysipelothrix rhusiopathiae, Clostridium perfringens, Clostridium tetani, Enterobacter aerogenes, Klebsiella pneumoniae, Pasturella multocida, виды Bacteroides, Fusobacterium nucleatum, Streptobacillus moniliformis, Treponema pallidum, Treponema pertenue, Leptospira, Rickettsia и Actinomyces israelli, но не ограничены ими.
Примеры грибов включают Cryptococcus neoformans, Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis, Chlamydia trachomatis, Candida albicans.
Другие инфекционные организмы (т.е. простейшие) включают Plasmodium spp, такие как Plasmodium falciparum, Plasmodium malariae, Plasmodium ovale и Plasmodium vivax, и Toxoplasma gondii. Переносимые с кровью и/или тканевые паразиты включают Plasmodium spp, Babesia microti, Babesia divergens, Leishmania tropica, Leishmania spp, Leishmania braziliensis, Leishmania donovani, Trypanosoma gambiense и Trypanosoma rhodesiense (африканский трипаносомоз), Trypanosoma cruzi (болезнь Шагаса) и Toxoplasma gondii.
Другие значимые с медицинской точки зрения микроорганизмы широко описаны в литературе, например, см. C.G.A Thomas, Medical Microbiology, Bailliere Tindall, Great Britain 1983, которая включена здесь путем ссылки.
Аллерген относится к веществу (антигену), которое может индуцировать аллергическую или астматическую реакцию у чувствительного субъекта. Перечень аллергенов огромен и может включать пыльцу, яды насекомых, перхоть животных, пыль, споры грибов и лекарственные средства (например, пенициллин). Примеры природных аллергенов, аллергенов животных и растений включают белки, специфические для следующих родов: Canine (Canis familiaris); Dermatophagoides (например, Dermatophagoides farinae); Felis (Felis domesticus); Ambrosia (Ambrosia artemiisfolia; Lolium (например, Lolium perenne или Lolium multiflorum); Cryptomeria (Cryptomeria japonica); Alternaria (Alternaria alternata); Alder; Alnus (Alnus gultinoasa); Betula (Betula verrucosa); Quercus (Quercus alba); Olea (Olea europa); Artemisia (Artemisia vulgaris); Plantago (например, Plantago lanceolata); Parietaria (например, Parietaria officinalis или Parietaria judaica); Blattella (например, Blattella germanica); Apis (например, Apis multiflorum); Cupressus (например, Cupressus sempervirens, Cupressus arizonica и Cupressus macrocarpa); Juniperus (например, Juniperus sabinoides, Juniperus virginiana, Juniperus communis и Juniperus ashei); Thuya (например, Thuya orientalis); Chamaecyparis (например, Chamaecyparis obtusa); Periplaneta (например, Periplaneta americana); Agropyron (например, Agropyron repens); Secale (например, Secale cereale); Triticum (например, Triticum aestivum); Dactylis (например, Dactylis glomerata); Festuca (например, Festuca elatior); Poa (например, Poa pratensis или Poa compressa); Avena (например, Avena sativa); Holcus (например, Holcus la natus); Anthoxanthum (например, Anthoxanthum odoratum); Arrhenatherum (например, Arrhenatherum elatius); Agrostis (например, Agrostis alba); Phleum (например, Phleum pratense); Phalaris (например, Phalaris arundinacea); Paspalum (например, Paspalum notatum); Sorghum (например, Sorghum halepensis); и Bromus (например, Bromus inermis), но не ограничены ими.
Используемый здесь термин "по существу очищенный" относится к полипептиду, который по существу не содержит другие белки, липиды, углеводы или другие вещества, с которыми он ассоциирован в природе. Специалист в данной области техники может очистить вирусные или бактериальные полипептиды с использованием стандартных способов очистки белка. По существу, чистый полипептид часто дает единичную основную полосу на невосстанавливающем полиакриламидном геле. В случае частично гликозилированных полипептидов или полипептидов, которые имеют несколько стартовых кодонов, может быть несколько полос на невосстанавливающем полиакриламидном геле, но они образуют отличающуюся картину для данного полипептида. Чистота вирусного или бактериального полипептида также может быть определена посредством анализа аминоконцевой последовательности аминокислот. Другие типы антигенов, не кодируемые вектором нуклеиновой кислоты, такие как полисахариды, небольшие молекулы, миметики и т.д., включены в данное изобретение.
Олигонуклеотиды по изобретению могут быть введены субъекту вместе с противомикробным средством. Используемое здесь противомикробное средство относится к природному или синтетическому соединению, способному уничтожать или ингибировать инфекционные микроорганизмы. Тип противомикробного средства, полезного по изобретению, зависит от типа микроорганизма, которым субъект инфицирован или подвержен риску инфицирования. Противомикробные средства включают противобактериальные средства, противовирусные средства, противогрибковые средства и противопаразитарные средства, но не ограничены ими. Такие фразы как "противомикробное средство", "противобактериальное средство", "противовирусное средство", "противогрибковое средство", "противопаразитарное средство" и "средство для уничтожения паразитов" имеют общепринятые значения для специалистов в данной области техники и определены в стандартных медицинских руководствах. Кратко, противобактериальные средства уничтожают или ингибируют бактерии и включают антибиотики, а также другие синтетические или природные соединения, обладающие подобными функциями. Антибиотики представляют собой низкомолекулярные молекулы, продуцируемые в виде вторичных метаболитов клетками, такими как микроорганизмы. Как правило, антибиотики нарушают одну или более бактериальных функций или структур, которые специфичны для микроорганизма и которые не присутствуют в клетках-хозяевах. Противовирусные средства могут быть выделены из природных источников или синтезированы и использованы для уничтожения или ингибирования вирусов. Противогрибковые средства применяют для лечения поверхностных грибковых инфекций, а также условно-патогенных и первичных системных грибковых инфекций. Противопаразитарные средства уничтожают или ингибируют паразитов.
Примеры противопаразитарных средств, на которые ссылаются также как на средства для уничтожения паразитов, включают, но не ограничены ими, альбендазол, амфотерицин В, бензнидазол, битионол, хлорохин HCl, хлорохина фосфат, клиндамицин, дегидроэметин, диэтилкарбамазин, дилоксанида фуроат, эфлорнитин, фуразолидон, глюкокортикоиды, галофантрин, иодохинол, ивермектин, мебендазол, мефлохин, меглумин антимониат, меларсопрол, метрифонат, метронидазол, никлозамид, нифуртимокс, оксамнихин, паромомицин, пентамидина изэтионат, пиперазин, празиквантел, примахина фосфат, прогуанил, пирантела памоат, пириметамин-сульфонамиды, пириметамин-сульфадоксин, хинакрин HCl, хинина сульфат, хинидина глюконат, спирамицин, стибоглюконат натрия (глюконат сурьмы натрия), сурамин, тетрациклин, доксициклин, тиабендазол, тинидазол, триметроприм-сульфаметоксазол и трипарсамид, некоторые из которых применяют самостоятельно или в комбинации с другими.
Противобактериальные средства уничтожают бактерии или ингибируют их рост или функцию. Большой класс противобактериальных средств представляет собой антибиотики. Антибиотики, эффективные для уничтожения или ингибирования широкого ряда бактерий, называют антибиотиками широкого спектра действия. Другие типы антибиотиков преимущественно эффективны против бактерий грамположительного или грамотрицательного классов. Данные типы антибиотиков названы антибиотиками узкого спектра действия. Другие антибиотики, эффективные против отдельного организма или заболевания и не эффективные против других типов бактерий, названы антибиотиками ограниченного спектра действия. Иногда противобактериальные средства классифицируют по их первичному способу действия. Как правило, противобактериальные средства являются ингибиторами синтеза клеточной стенки, ингибиторами клеточной мембраны, ингибиторами белкового синтеза, ингибиторами синтеза нуклеиновых кислот или функциональными ингибиторами и конкурентными ингибиторами.
Противовирусные средства представляют собой соединения, предотвращающие инфицирование клеток вирусами или репликацию вируса внутри клетки. Противовирусных средств намного меньше, чем противобактериальных средств, так как процесс вирусной репликации настолько тесно связан с репликацией ДНК в клетке-хозяине, что неспецифические противовирусные средства часто являются токсичными для хозяина. В процессе вирусной инфекции существует несколько стадий, которые можно блокировать или ингибировать противовирусными средствами. Данные стадии включают прикрепление вируса к клетке-хозяину (иммуноглобулин или связывающие пептиды), декапсидацию вириона (например, амантадин), синтез или трансляцию вирусной мРНК (например, интерферон), репликацию вирусной РНК или ДНК (например, нуклеозидные аналоги), созревание белков нового вируса (например, ингибиторы протеаз) и активную репликацию вируса в результате проникновения в клетку и высвобождение вируса.
Аналоги нуклеотидов представляют собой синтетические соединения, подобные нуклеотидам, но имеющие неполную или аномальную дезоксирибозную или рибозную группу. После попадания нуклеотидных аналогов в клетку они подвергаются фосфорилированию, образуя трифосфатную форму, конкурирующую с нормальными нуклеотидами за включение в вирусную ДНК или РНК. После включения трифосфатной формы нуклеотидного аналога в растущую цепь нуклеиновой кислоты происходит необратимое ассоциирование с вирусной полимеразой и, таким образом, терминация цепи. Аналоги нуклеотидов включают ацикловир (применяемый для лечения от вируса простого герпеса и вируса ветряной оспы), ганцикловир (применяемый для лечения от цитомегаловируса), идоксуридин, рибавирин (применяемый для лечения от респираторно-синцитиального вируса), дидезоксиинозин, дидезоксицитидин, зидовудин (азидотимидин), имиквимод и резимиквимод, но не ограничены ими.
Интерфероны представляют собой цитокины, секретируемые клетками, инфицированными вирусом, а также иммунными клетками. Интерфероны действуют посредством связывания со специфическими рецепторами на клетках, соседних с инфицированными клетками, вызывая в клетке изменение, защищающее ее от инфекции вирусом. α- и β-Интерферон также индуцируют экспрессию молекул МНС класса I и класса II на поверхности инфицированной клетки, приводя к увеличенной презентации антигена для распознавания иммунными клетками хозяина. α- и β-Интерфероны доступны в виде рекомбинантных форм, и их применяют для лечения хронической инфекции гепатита В и С. В дозах, эффективных для противовирусного лечения, интерфероны проявляют тяжелые побочные эффекты, такие как лихорадка, дискомфорт и потеря массы.
Противовирусные средства, применяемые по изобретению, включают иммуноглобулины, амантадин, интерфероны, аналоги нуклеозидов и ингибиторы протеаз, но не ограничены ими. Конкретные примеры противовирусных средств включают ацеманнан; ацикловир; ацикловир натрия; адефовир; аловудин; алвирцепт судотокс; амантадина гидрохлорид; аранотин; арилдон; атевирдина мезилат; авридин; цидофовир; ципамфилин; цитарабина гидрохлорид; делавирдина мезилат; десцикловир; диданозин; дизоксарил; эдоксудин; энвираден; энвироксим; фамцикловир; фамотина гидрохлорид; фиацитабин; фиалуридин; фозарилат; фоскарнет натрия; фосфонет натрия; ганцикловир; ганцикловир натрия; идоксиуридин; кетоксал; ламивудин; лобукавир; мемотина гидрохлорид; метисазон; невирапин; пенцикловир; пиродавир; рибавирин; римантадина гидрохлорид; саквинавира мезилат; сомантадина гидрохлорид; соривудин; статолон; ставудин; тилорона гидрохлорид; трифлуридин; валацикловира гидрохлорид; видарабин; видарабина фосфат; видарабина фосфат натрия; вироксим; зальцитабин; зидовудин и зинвироксим, но не ограничены ими.
Противогрибковые средства полезны для лечения и предупреждения от инфекционных грибов. Иногда противогрибковые средства классифицируют по механизму действия. Некоторые противогрибковые средства действуют как ингибиторы клеточной стенки посредством ингибирования синтазы глюкозы. Они включают базиунгин/ЕСВ (basiungin/ECB), но не ограничены ими. Другие противогрибковые средства действуют посредством дестабилизации целостности мембраны. Они включают имидазолы, такие как клотримазол, сертаконзол, флуконазол, итраконазол, кетоконазол, миконазол и вориконакол, а также FK 463, амфотерицин В, BAY 38-9502, МК 991, прадимицин, UK 292, бутенафин и тербинафин, но не ограничены ими. Другие противогрибковые средства действуют посредством разрушения хитина (например, хитиназа) или иммуносупрессии (крем 501).
Иммуностимулирующие CpG-олигонуклеотиды можно объединять с другими терапевтическими средствами, такими как адъюванты, для усиления иммунных ответов. Иммуностимулирующий CpG-олигонуклеотид и другое терапевтическое средство можно вводить одновременно или последовательно. Когда другие терапевтические средства вводят одновременно, их можно вводить в том же или раздельных препаратах, но вводить в одно и то же время. Другие терапевтические средства вводят последовательно друг за другом и с иммуностимулирующим CpG-олигонуклеотидом, когда введение других терапевтических средств и иммуностимулирующего CpG-олигонуклеотида разделено во времени. Разделение по времени между введением этих соединений может составлять несколько минут или может длиться дольше. Другие терапевтические средства включают адъюванты, цитокины, антитела, антигены и т.д., но не ограничены ими.
Композиции по изобретению можно также вводить с адъювантами, отличными от нуклеиновых кислот. Адъювант, отличный от нуклеиновой кислоты, представляет собой любую молекулу или соединение, за исключением описанных здесь иммуностимулирующих CpG-олигонуклеотидов, которое может стимулировать гуморальный и/или клеточный иммунный ответ. Адъюванты, отличные от нуклеиновых кислот, включают, например, адъюванты, создающие эффект депо, иммуностимулирующие адъюванты и адъюванты, создающие эффект депо и стимулирующие иммунную систему.
Иммуностимулирующие CpG-олигонуклеотиды также полезны в качестве адъювантов для слизистых оболочек. Ранее обнаружено, что и системный иммунитет, и иммунитет слизистых оболочек индуцируют введением CpG-нуклеиновых кислот через слизистые оболочки. Таким образом, олигонуклеотиды можно вводить в комбинации с другими адъювантами для слизистых оболочек.
Иммунные ответы могут также быть индуцированы или усилены совместным введением или колинеарной экспрессией цитокинов (Bueler & Mulligan, 1996; Chow et al., 1997; Geissler et al., 1997; Iwasaki et al., 1997; Kirn et al., 1997) или костимулирующих молекул В7 (Iwasaki et al., 1997; Tsuji et al., 1997) с иммуностимулирующими CpG-олигонуклеотидами. Используемый здесь термин "цитокин" применяют как общее название группы разнообразных растворимых белков и пептидов, которые действуют как гуморальные регуляторы в концентрациях от нано- до пикомолярных и в нормальных или патологических условиях модулируют функциональную активность индивидуальных клеток и тканей. Данные белки также напрямую опосредуют взаимодействия между клетками и регулируют процессы, происходящие во внеклеточной среде. Примеры цитокинов включают интерлейкин-1 (IL-1), IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12, IL-15, IL-18, гранулоцитарно-макрофагальный колониестимулирующий фактор роста (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), интерферон-гамма (IFN-γ), IFN-α, IFN-β, фактор некроза опухолей (TNF), трансформирующий фактор роста бета (TGF-β), FLT-3-лиганд и CD40-лиганд, но не ограничены ими.
Олигонуклеотиды полезны также для переключения иммунного ответа с Th2-иммунного ответа на Th1 -иммунный ответ. Это приводит к получению относительно сбалансированной Th1/Th2-среды. Переключение иммунного ответа с Th2- на Th1 -иммунный ответ можно оценить путем измерения уровней цитокинов, полученных в ответ на нуклеиновую кислоту (например, посредством индукции моноцитов и других клеток для продукции Th1-цитокинов, включая IL-12, IFN-γ и GM-CSF). Переключение или изменение баланса иммунного ответа с Th2- на Th1-ответ особенно полезно для лечения или предупреждения астмы. Например, эффективным количеством для лечения астмы может быть количество, полезное для переключения Th2-типа иммунного ответа, ассоциированного с астмой, на Th1-тип ответа или сбалансированную Th1/Th2-среду. Уровни Th2-цитокинов, особенно IL-4 и IL-5, повышены в дыхательных путях субъектов, страдающих астмой. Иммуностимулирующие CpG-олигонуклеотиды по изобретению вызывают повышение уровня Th1-цитокинов, что помогает восстанавливать равновесие иммунной системы, предотвращать или уменьшать неблагоприятные эффекты, ассоциированные с преимущественным Th2-иммунным ответом.
Олигонуклеотиды по изобретению могут также быть полезны для лечения ремоделирования дыхательных путей. Ремоделирование возникает в результате пролиферации гладкомышечных клеток и/или утолщения под слизистой оболочкой в дыхательных путях и в конечном итоге вызывает сужение дыхательных путей, приводящее к ограниченному потоку воздуха. Олигонуклеотиды по изобретению могут предотвращать дальнейшее ремоделирование и возможно даже уменьшают нарастание ткани в результате процесса ремоделирования.
Олигонуклеотиды также полезны для улучшения выживания, дифференцировки, активации и созревания дендритных клеток. Иммуностимулирующие CpG-олигонуклеотиды обладают уникальной способностью стимулировать клеточное выживание, дифференцировку, активацию и созревание дендритных клеток.
Иммуностимулирующие CpG-олигонуклеотиды повышают также литическую активность клеток - естественных киллеров и антителозависимую клеточно-опосредованную цитотоксичность (ADCC). ADCC можно достичь с использованием иммуностимулирующего CpG-олигонуклеотида в комбинации с антителом, специфичным к клеточной мишени, такой как раковая клетка. Когда иммуностимулирующий CpG-олигонуклеотид вводят субъекту в сочетании с антителом, иммунная система субъекта вовлекается в уничтожение раковой клетки. Антитела, полезные для процедуры ADCC, включают антитела, взаимодействующие с клеткой в организме. Многие такие антитела, специфичные в отношении клеточных мишеней, описаны в данной области техники и многие имеются в продаже.
Иммуностимулирующие CpG-олигонуклеотиды можно вводить также в сочетании с противоопухолевым лечением. Противоопухолевое лечение включает противоопухолевые лекарственные средства, облучение и хирургические процедуры. Используемый здесь термин "противоопухолевое лекарственное средство" относится к средству, вводимому субъекту с целью лечения рака. Используемый здесь термин "лечение рака" включает предупреждение развития рака, уменьшение симптомов рака и/или ингибирование роста развившейся опухоли. В других аспектах противоопухолевое лекарственное средство вводят субъекту, подверженному риску развития рака, с целью уменьшения риска развития рака. Здесь описаны различные типы лекарственных средств для лечения рака. Для задачи данного описания противоопухолевые лекарственные средства классифицированы как химиотерапевтические средства, иммунотерапевтические средства, противоопухолевые вакцины, гормональное лечение и модификаторы биологического ответа.
Дополнительно, способы по изобретению предназначены охватывать применение более чем одного противоопухолевого лекарственного средства вместе с иммуностимулирующими CpG-олигонуклеотидами. В качестве примера, когда это целесообразно, иммуностимулирующие CpG-олигонуклеотиды можно вводить как с химиотерапевтическим средством, так и с иммунотерапевтическим средством. Альтернативно, противоопухолевое лекарственное средство может охватывать иммунотерапевтическое средство и противоопухолевую вакцину, или химиотерапевтическое средство и противоопухолевую вакцину, или химиотерапевтическое средство, иммунотерапевтическое средство и противоопухолевую вакцину, все вводимые одному субъекту с целью лечения субъекта, страдающего раком или подверженного риску развития рака.
Химиотерапевтическое средство может быть выбрано из группы, состоящей из метотрексата, винкристина, адриамицина, цисплатина, не содержащих сахаров хлорэтилнитрозомочевин, 5-фторурацила, митомицина С, блеомицина, доксорубицина, дакарбазина, таксола, фрагилина, мегламина GLA, валрубицина, кармустаина и полиферпосана, ММ1270, BAY 12-9566, ингибитора RAS-фарнезилтрансферазы, ингибитора фарнезилтрансферазы, ММР, MTA/LY231514, LУ264618/лометексола, гламолека, CI-994, TNP-470, гикамтина/топотекана, РКС412, валсподара/Р5С833, новантрона/митроксантрона, метарета/сурамина, батимастата, Е7070, ВСН-4556, CS-682, 9-АС, AG3340, AG3433, инцела/VХ-710, VX-853, ZD0101, ISI641, ODN 698, ТА2516/мармистата, ВВ2516/мармистата, CDP 845, D2163, PD183805, DX8951f, лемонала DP2202, FK 317, пицибанила/ОК-432, А032/валрубицина, метастрона/производного стронция, темодала/темозоломида, эвацета/липосомального доксорубицина, ютаксана/паклитаксела, таксола/паклитаксела, кселоада/капецитабина, фуртулона/доксифлуридина, циклопакса/перорального паклитаксела, перорального таксоида, SPU-077/цисплатина, HMR 1275/флавопиридола, СР-358 (774)/EGFR, СР-609(754)/ингибитора онкогена RAS, BMS-182751/пероральной платины, UFT(тегафура/урацила), эргамизола/левамизола, енилурацила/776С85/5FU-энхансера, кампто/левамизола, камптозара/иринотекана, тумодекса/ралитрекседа, лейстатина/кладрибина, паксекса/паклитаксела, доксила/липосомального доксорубицина, келикса/липосомального доксорубицина, флудара/флударабина, фармарубицина/эпирубицина, ДепоЦита, ZD1839, LU79553/бис-нафталимида, LU 103793/доластина, кетикса/липосомального доксорубицина, гемзара/гемцитабина, ZD 0473/анормеда, YM 116, кристаллов лодина, ингибиторов CDK4 и CDK2, ингибиторов PARP, 04809/дексифосфамида, ифеса/меснекса/ифосфамида, вумона/тенипозида, параплатина/карбоплатина, плантинола/цисплатина, вепезида/этопозида, ZD 9331, таксотера/доцетаксела, пролекарства гуанина арабинозида, аналога таксана, нитрозомочевин, алкилирующих агентов, таких как мелфелан и циклофосфамид, аминоглутетимида, аспарагиназы, бусульфана, карбоплатина, хлоромбуцила, цитарабина HCl, дактиномицина, даунорубицина HCl, эстрамустина фосфата натрия, этопозида (VP16-213), флоксуридина, фторурацила (5-FU), флутамида, гидроксимочевины (гидроксикарбамида), ифосфамида, интерферона альфа-2а, альфа-2b, лейпролида ацетата (аналога фактора высвобождения LHRH), ломустина (CCNU), мехлорэтамина HCl (азотного аналога горчичного газа), меркаптопурина, месны, митотана (o,p'-DDD), митоксантрона HCl, октреотида, пликамицина, прокарбазина HCl, стрептозоцина, тамоксифена цитрата, тиогуанина, тиотепы, винбластина сульфата, амсакрина (m-AMSA), азацитидина, эритропоэтина, гексаметилмеламина (НММ), интерлейкина 2, митогуазона (метил-GAG; метилглиоксаль-бис-гуанилгидразона; MGBG), пентостатина (2'-дезоксиформицин), семустина (метил-CCNU), тенипозида (VM-26) и виндезина сульфата, но не ограниченной ими.
Иммунотерапевтическое средство может быть выбрано из группы, состоящей из рибутаксина, герцептина, квадрамета, панорекса, IDEC-У2 В8, ВЕС2, С225, онколима, SMART M195, ATRAGEN, оварекса, бексара, LDP-03, иора t6, MDX-210, MDX-11, MDX-22, OV103, 3622W94, анти-VEGF, зенапакса, MDX-220, MDX-447, MELIMMUNE-2, MELIMMUNE-1, CEACIDE, претаргета, NovoMAb-G2, TNT, глиомаба-Н, GNI-250, EMD-72000, ЛимфоЦида, СМА 676, монофарма-С, 4 В5, иора egf.r3, иора с5, BABS, анти-FLK-2, MDX-260, ANA Ab, SMART 1D10 Ab, SMART ABL 364 Ab и ImmuRAIT-CEA, но не ограниченной ими.
Противооопухолевая вакцина может быть выбрана из группы, состоящей из EGF (эпидермального фактора роста), антиидиотипических противоопухолевых вакцин, антигена Gp75, GMK-вакцины против меланомы, конъюгированной с ганглиозидом вакцины MGV, Her2/neu, оварекса, M-Vax, O-Vax, L-Vax, тератопа STn-KHL, BLP25 (MUC-1), липосомальной идиотипической вакцины, мелацина, вакцин с пептидными антигенами, токсин/антигенных вакцин, вакцины на основе MVA, PACIS, BCG-вакцины, TA-HPV, TA-CIN, DISC-вируса и ImmuCyst/TheraCys, но не ограниченной ими.
Применение иммуностимулирующих CpG-олигонуклеотидов в сочетании с иммунотерапевтическими средствами, такими как моноклональные антитела, способно увеличивать длительную выживаемость по ряду механизмов, включая значительное увеличение ADCC (как обсуждалось выше), активацию NK-клеток и увеличение уровней IFN-α. Нуклеиновые кислоты, когда их применяют в комбинации с моноклональными антителами, служат для снижения дозы антитела, необходимого для достижения биологического результата.
Используемые здесь термины "раковый антиген" и "опухолевый антиген" используют взаимозаменяемо для обозначения антигенов, которые дифференцировано экспрессируются раковыми клетками и поэтому могут быть использованы для нацеливания на раковые клетки. Раковые антигены представляют собой антигены, которые потенциально могут стимулировать, по-видимому, опухолеспецифические иммунные ответы. Некоторые из этих антигенов кодируются, хотя не обязательно экспрессируются, нормальными клетками. Эти антигены могут быть охарактеризованы как антигены, которые обычно являются молчащими (т.е. не экспрессируются) в нормальных клетках, антигены, которые экспрессируются только на некоторых стадиях дифференцировки, и антигены, которые экспрессируются временно, такие как эмбриональные и фетальные антигены. Другие раковые антигены кодируются мутантными клеточными генами, такими как онкогены (например, активированный онкоген ras), супрессорные гены (например, мутантный р53), слитые белки, появляющиеся в результате внутренних делеций или хромосомных транслокаций. Другие раковые антигены могут кодироваться вирусными генами, такими как гены, несущие РНК и ДНК вызывающих опухоли вирусов.
Иммуностимулирующие CpG-олигонуклеотиды также полезны для лечения и предупреждения аутоиммунного заболевания. Аутоиммунное заболевание представляет собой класс заболеваний, при которых собственные антитела субъекта реагируют с тканью хозяина, или при которых иммунные эффекторные Т-клетки являются аутореактивными в отношении эндогенных собственных пептидов и вызывают деструкцию ткани. Таким образом, возникает иммунный ответ против собственных антигенов субъекта, названных аутоантигенами. Аутоиммунные заболевания включают ревматоидный артрит, болезнь Крона, рассеянный склероз, системную красную волчанку (SLE), аутоиммунный энцефаломиелит, злокачественную миастению (MG), тиреоидит Хашимото, синдром Гудпасчера, пузырчатку (например, обыкновенную пузырчатку), болезнь Грэйвса, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопеническую пурпуру, склеродермию с антителами против коллагена, смешанное заболевание соединительной ткани, полимиозит, пернициозную анемию, идиопатическую болезнь Аддисона, аутоиммунно-ассоциированное бесплодие, гломерулонефрит (например, серповидный гломерулонефрит, пролиферативный гломерулонефрит), буллезный пемфигоид, синдром Шегрена, инсулинорезистентность и аутоиммунный сахарный диабет, но не ограничены ими.
Используемый здесь "аутоантиген" относится к антигену нормальной ткани хозяина. Нормальная ткань хозяина не включает раковые клетки. Таким образом, иммунный ответ, возникающий против аутоантигена, в контексте аутоиммунного заболевания, представляет собой нежелательный иммунный ответ и вносит вклад в разрушение и повреждение нормальной ткани, тогда как иммунный ответ, возникающий против ракового антигена, представляет собой желательный иммунный ответ и вносит вклад в разрушение опухоли или рака. Таким образом, в некоторых аспектах изобретения, направленных на лечение аутоиммунных расстройств, не рекомендуется, чтобы иммуностимулирующие CpG-нуклеиновые кислоты вводили с аутоантигенами, в частности теми, которые представляют собой мишени при аутоиммунном расстройстве.
В других случаях иммуностимулирующие CpG-нуклеиновые кислоты могут быть доставлены с низкими дозами аутоантигенов. Множество исследований на животных продемонстрировало, что введение через слизистые оболочки низких доз антигена может привести в результате к состоянию иммунной гипореактивности или "толерантности." По-видимому, активный механизм заключается в опосредованном цитокинами отклонении иммунной системы от Тh1 в направлении преимущественно Th2 и Th3 (т.е. доминирование TGF-β) ответов. Активная супрессия с доставкой низкой дозы антигена также может подавлять несвязанный иммунный ответ (неспецифическая супрессия), что представляет значительный интерес при лечении аутоиммунных заболеваний, например ревматоидного артрита и SLE. Неспецифическая супрессия включает секрецию Th1-обратнорегуляторных супрессорных цитокинов в локальную среду, где провоспалительные и Th1-цитокины высвобождаются антигенспецифическим или антигеннеспецифическим образом. Используемый здесь термин "толерантность" используют для обозначения этого явления. В действительности, толерантность при пероральном введении эффективна в лечении множества аутоиммунных заболеваний у животных, включая: экспериментальный аутоиммунный энцефаломиелит (ЕАЕ), экспериментальную аутоиммунную злокачественную миастению, вызванный коллагеном артрит (CIA) и инсулинозависимый сахарный диабет. В этих моделях предупреждение и подавление аутоиммунного заболевания ассоциировано со сдвигом антигенспецифического гуморального и клеточного ответов с ТМ на ответ Th2/Th3.
Изобретение также включает способ индуцирования неспецифической к антигену активации врожденного иммунитета и широкого спектра устойчивости к инфекционному заражению с использованием иммуностимулирующих CpG-олигонуклеотидов. Используемый здесь термин "неспецифическая к антигену активация врожденного иммунитета" относится к активации иммунных клеток, отличных от В-клеток, и может, например, включать активацию NK-клеток, Т-клеток или других иммунных клеток, которые могут отвечать антиген-независимым образом, или некоторой комбинации этих клеток. Широкий спектр устойчивости к инфекционному заражению индуцируется, поскольку иммунные клетки находятся в активной форме и примированы для ответа на любое внедряющееся соединение или микроорганизм. Клетки необязательно должны быть специфически примированы против конкретного антигена. Это особенно полезно против биологического оружия или в других ситуациях, описанных выше, таких как путешествия.
Иммуностимулирующие CpG-олигонуклеотиды могут быть непосредственно введены субъекту или могут быть введены в сочетании с комплексом доставки нуклеиновой кислоты. Комплекс доставки нуклеиновой кислоты означает молекулу нуклеиновой кислоты, ассоциированную (например, ионно или ковалентно связанную с, или инкапсулированную в) со средствами для направленной доставки (например, с молекулой, осуществляющей высокоаффинное связывание с клеткой-мишенью). Примеры комплексов доставки нуклеиновых кислот включают нуклеиновые кислоты, ассоциированные со стерином (например, холестерином), липидом (например, катионным липидом, виросомой или липосомой), или агентом, специфически связывающимся с клеткой-мишенью (например, лигандом, распознаваемым специфическим рецептором клетки-мишени). Предпочтительные комплексы могут быть достаточно стабильными in vivo для предотвращения значительного разъединения перед интернализацией клеткой-мишенью. Однако комплекс можно расщепить в подходящих условиях внутри клетки, высвобождая олигонуклеотид в функциональной форме.
Описаны носители для доставки или устройства для доставки антигена и олигонуклеотидов к поверхностям. Иммуностимулирующий CpG-олигонуклеотид, и/или антиген, и/или другие терапевтические средства могут быть введены сами по себе (например, в физиологическом растворе или буфере) или с использованием любых носителей для доставки, известных в данной области техники. Например, описаны следующие носители для доставки: кохлеаты; эмульсомы, ISCOMs; липосомы; живые бактериальные векторы (например, Salmonella, Escherichia coli, Bacillus calmatte-guerin, Shigella, Lactobacillus); живые вирусные векторы (например, Vaccinia, adenovirus, Herpes Simplex); микросферы; вакцины нуклеиновых кислот; полимеры; полимерные кольца; протеосомы; фторид натрия; трансгенные растения; виросомы; вирусоподобные частицы. Другие носители для доставки известны в данной области, и некоторые дополнительные примеры представлены ниже в обсуждении векторов.
Термин "эффективное количество иммуностимулирующего CpG-олигонуклеотида" относится к количеству, необходимому или достаточному для реализации желаемого биологического эффекта. Например, эффективное количество иммуностимулирующего CpG-олигонуклеотида, вводимого с антигеном для индукции иммунитета слизистых оболочек, представляет собой количество, необходимое для того, чтобы под действием антигена вызвать развитие IgA в ответ на антиген, тогда как такое количество, которое требуется для индукции системного иммунитета, представляет собой количество, необходимое для того, чтобы под действием антигена вызвать развитие IgG в ответ на антиген. В сочетании с приведенными здесь объяснениями, посредством выбора среди различных активных соединений и оценки факторов, таких как активность, относительная биодоступность, масса тела пациента, тяжесть неблагоприятных побочных эффектов и предпочтительный способ введения, можно планировать эффективную схему профилактического или терапевтического лечения, не приводящую к существенной токсичности и все еще полностью эффективную для лечения конкретного субъекта. Эффективное количество для любого конкретного применения может варьировать в зависимости от таких факторов, как заболевание или состояние, которое лечат, конкретный вводимый иммуностимулирующий CpG-олигонуклеотид, размер субъекта или тяжесть заболевания или состояния. Специалист в данной области техники может эмпирически определить эффективное количество конкретного иммуностимулирующего CpG-олигонуклеотида и/или антигена и/или другого терапевтического агента без необходимости проведения лишних экспериментов.
Дозы описанных здесь соединений для введения через слизистые оболочки или местного введения субъекту, как правило, находятся в диапазоне от приблизительно 0,1 мкг до 10 мг на одно введение, в зависимости от того, что возможно ежедневное, еженедельное или ежемесячное применение, или с любым другим количеством времени между применениями. Более типично, дозы для введения через слизистые оболочки или местного введения находятся в диапазоне от приблизительно 10 мкг до 5 мг на введение, и наиболее типично, от приблизительно 100 мкг до 1 мг, с 2-4 введениями, разделенными друг от друга сутками или неделями. Более типично, дозы иммуностимулятора находятся в диапазоне от приблизительно 1 мкг до 10 мг на введение, и наиболее типично, от 10 мкг до 1 мг, с ежесуточными или еженедельными введениями. Дозы для парентеральной доставки субъекту описанных здесь соединений с целью индукции антигенспецифического иммунного ответа, где соединения доставляют с антигеном, но не с другим лекарственным средством, обычно в 5-10000 раз превышают эффективную дозу для применений вакцинного адъюванта или иммунностимулятора через слизистые оболочки, более типично превышают в 10-1000 раз и наиболее типично в 20-100 раз. Дозы описанных выше соединений для парентеральной доставки с целью индукции врожденного иммунного ответа или для увеличения ADCC или для индукции антигенспецифического иммунного ответа, когда иммуностимулирующие CpG-олигонуклеотиды вводят в комбинации с другими терапевтическими агентами, обычно находятся в диапазоне от приблизительно 0,1 мкг до 10 мг на введение, в зависимости оттого, что возможно ежесуточное, еженедельное или ежемесячное применение, или с любым другим количеством времени между применениями. Более типично, парентеральные дозы для данных целей находятся в диапазоне от приблизительно 10 мкг до 5 мг на введение, и наиболее типично, от приблизительно 100 мкг до 1 мг, с 2-4 введениями, разделенными друг от друга сутками или неделями. Тем не менее, в некоторых воплощениях парентеральные дозы для данных целей можно применять в диапазоне, в 5-10000 раз превышающем обычные дозы, описанные выше.
Для любого описанного здесь соединения терапевтически эффективное количество можно сначала определить на модельных животных. Терапевтически эффективную дозу можно определить также по данным для человека для CpG-олигонуклеотидов, которые тестировали на людях (для людей начаты клинические испытания), и для соединений, для которых известно, что они демонстрируют подобные фармакологические активности, таких как другие адъюванты, например LT и другие антигены, для целей вакцинации. Более высокие дозы могут требоваться для парентерального введения. Применяемую дозу можно регулировать на основе относительной биодоступности и активности вводимого соединения. Так как регулирование дозы для достижения максимальной эффективности, основанное на описанных выше способах, и другие способы хорошо известны в данной области техники, они находятся в компетенции специалистов в данной области техники.
Препараты по изобретению вводят в фармацевтически приемлемых растворах, которые стандартно могут содержать фармацевтически приемлемые концентрации соли, буферных агентов, консервантов, совместимых носителей, адъювантов и, возможно, других терапевтических ингредиентов.
Для применения в терапии эффективное количество иммуностимулирующего CpG-олигонуклеотида можно вводить субъекту любым способом, доставляющим олигонуклеотид к желаемой поверхности, например через слизитую оболочку, системно. Введение фармацевтической композиции по настоящему изобретению можно осуществлять любыми способами, известными специалистам в данной области техники. Предпочтительные пути введения включают пероральный, парентеральный, внутримышечный, интраназальный, сублингвальный, интратрахеальный, ингаляционный, внутриглазной, вагинальный и ректальный, но не ограничены ими.
Для перорального введения соединения (т.е. иммуностимулирующие CpG-олигонуклеотиды, антигены и другие терапевтические агенты) можно легко приготовить путем объединения активного соединения(й) с фармацевтически приемлемыми носителями, хорошо известными в данной области техники. Такие носители позволяют изготавливать препараты соединения по изобретению в форме таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.п. для перорального введения субъекту, которого лечат. Фармацевтические препараты для перорального применения могут быть получены в виде твердого эксципиента, возможно с измельчением полученной в результате смеси и обработкой смеси гранул после добавления подходящих вспомогательных веществ, если желательно, с получением ядра таблеток или драже. Подходящие эксципиенты представляют собой, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовую камедь, метилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу натрия и/или поливинилпирролидон (PVP). Если желательно, могут быть добавлены разрыхлители, такие как поперечно-сшитый поливинилпирролидон, агар или альгиновая кислота или их соль, такая как альгинат натрия. Возможно, препараты для перорального применения также могут быть приготовлены в физиологическом растворе или буферах, т.е. ЭДТА (этилендиаминтетрауксусная кислота) для нейтрализации внутренних кислых условий, или могут быть введены без каких-либо носителей.
Также специально рассмотрены лекарственные формы для перорального введения вышеуказанного компонента или компонентов. Компонент или компоненты могут быть химически модифицированы таким образом, чтобы пероральная доставка производного была эффективной. Как правило, рассматриваемая химическая модификация представляет собой присоединение к самой молекуле компонента по меньшей мере одной группировки, где указанная группировка делает возможным (а) ингибирование протеолиза и (б) поступление в кровоток из желудка или кишечника. Также желательным является увеличение общей стабильности компонента или компонентов и увеличение времени циркуляции в организме. Примеры таких группировок включают: полиэтиленгликоль, сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон и полипролин. Abuchowski and Davis, 1981, "Soluble Polymer-Enzyme Adducts" In: Enzymes as Drugs, Hocenberg and Roberts, eds., Wiley-lnterscience, New York, NY, pp.367-383; Newmark et al., 1982, J. Appl. Biochem. 4:185-189. Другие полимеры, которые могут быть использованы, представляют собой поли-1,3-диоксолан и поли-1,3,6-тиоксокан. Предпочтительными для фармацевтического применения, как указано выше, являются группировки полиэтиленгликоля.
Для компонента (или производного) место высвобождения может представлять собой желудок, тонкую кишку (двенадцатиперстную кишку, тощую кишку или подвздошную кишку) или толстую кишку. Специалисту в данной области техники доступны препараты, которые не растворяются в желудке, высвобождают материал в двенадцатиперстную кишку или где-либо еще в тонкой кишке. Предпочтительно, такое высвобождение позволяет избежать вредного воздействия среды желудка посредством защиты олигонуклеотида (или производного) или путем высвобождения биологически активного вещества за пределами желудочной среды, например в тонкой кишке.
Для обеспечения полной устойчивости к среде желудка существенным является оболочка, непроницаемая до по меньшей мере рН 5,0. Примерами наиболее общепринятых инертных ингредиентов, которые используют в качестве энтеросолюбильных оболочек, являются тримеллитат ацетат целлюлозы (CAT), фталат гидроксипропилметилцеллюлозы (НРМСР), НРМСР 50, НРМСР 55, поливинилацетатфталат (PVAP), Eudragit L30D, Aquateric, фталат ацетат целлюлозы (CAP), Eudragit L, Eudragit S и Shellac. Такие покрытия могут быть использованы в виде смешанных пленок.
Для таблеток можно также использовать оболочку или смесь оболочек, которые не предназначены для защиты от желудочной среды. Такие оболочки включают сахарные оболочки или оболочки, которые облегчают глотание таблетки. Капсулы могут состоять из твердой оболочки (такой как желатин) для доставки сухого терапевтического агента, т.е. порошка; для жидких форм можно использовать мягкую желатиновую оболочку. Материалом оболочки саше может быть плотный крахмал или другая пригодная для употребления в пищу бумага. Для пилюль, лепешек, формованных таблеток и растертых в порошок таблеток могут быть использованы способы влажной компоновки.
Терапевтический агент может быть включен в препарат в виде множества тонкоизмельченных частиц в форме гранул или шариков, имеющих размер частиц приблизительно 1 мм. Препарат материала для введения в капсулы также может находиться в виде порошка, слегка прессованных включений или даже в виде таблеток. Терапевтический агент можно приготовить путем прессования.
Могут быть включены красители и корригенты. Например, олигонуклеотид (или производное) можно приготовить в виде препарата (например, посредством инкапсуляции в липосомы или микросферы) и затем включить в пригодный для употребеления в пищу продукт, такой как охлажденный напиток, содержащий красители и корригенты.
Терапевтический агент можно разбавить или увеличить его объем с помощью инертного вещества. Такие разбавители могут включать углеводы, в частности маннит, α-лактозу, безводную лактозу, целлюлозу, сахарозу, модифицированные декстраны и крахмал. Можно также использовать в качестве наполнителей некоторые неорганические соли, включая трифосфат кальция, карбонат магния и хлорид натрия. Некоторые имеющиеся в продаже разбавители представляют собой Fast-Flo, Emdex, STA-Rx 1500, Emcompress и Avicell.
В препарат терапевтического агента в твердой лекарственной форме могут быть включены разрыхлители. Материалы, используемые в качестве разрыхлителей, включают крахмал, в том числе имеющийся в продаже разрыхлитель на основе крахмала, Explotab. Можно использовать крахмалгликолят натрия, амберлит, карбоксиметилцеллюлозу натрия, ультраамилопектин, альгинат натрия, желатин, апельсиновую цедру, кислую карбоксиметилцеллюлозу, природную губку и бентонит. Другую форму разрыхлителей представляют нерастворимые катионообменные смолы. Измельченные камеди могут быть использованы в качестве разрыхлителей и в качестве связующих веществ, и они могут включать измельченные камеди, такие как агар, камедь карайи или трагакант. В качестве разрыхлителей используют также альгиновую кислоту и ее натриевую соль.
Для удерживания вместе терапевтического агента с образованием твердой таблетки можно использовать связующие агенты, и они включают природные продукты, такие как аравийская камедь, трагакант, крахмал и желатин. Другие связующие агенты включают метилцеллюлозу (МС), этилцеллюлозу (ЕС) и карбоксиметилцеллюлозу (CMC). Как поливинилпирролидон, так и гидроксипропилметилцеллюлозу (НРМС) можно использовать в спиртовых растворах для грануляции терапевтического агента.
В препарат терапевтического агента может быть включен антифрикционный агент для предотвращения прилипания во время процесса приготовления. Смазывающие вещества можно использовать в виде слоя между терапевтическим агентом и стенкой матрицы, и они включают стеариновую кислоту, включая ее соли магния и кальция, политетрафторэтилен (PTFE), жидкий парафин, растительные масла и воски, но не ограничены ими. Можно также использовать растворимые смазывающие вещества, такие как лаурилсульфат натрия, лаурилсульфат магния, полиэтиленгликоль различной молекулярной массы, Carbowax 4000 и 6000.
Могут быть добавлены скользящие вещества, которые могут улучшать характеристики текучести лекарственного средства во время приготовления и способствовать перераспределению во время прессования. Скользящие вещества могут включать крахмал, тальк, пирогенный диоксид кремния и гидрированный силикоалюминат.
Чтобы способствовать растворению терапевтического средства в водную среду, поверхностно-активное вещество может быть добавлено в качестве увлажняющего агента. Поверхностно-активные вещества могут включать анионные детергенты, такие как лаурилсульфат натрия, диоктилсульфосукцинат натрия и диоктилсульфонат натрия. Катионные детергенты могут быть использованы и могут включать хлорид бензалкония или хлорид бензетония. Перечень возможных неионных детергентов, которые могут быть включены в препарат в качестве поверхностно-активных веществ, представляет собой: лауромакрогол 400, полиоксил-40-стеарат, полиоксиэтилен гидрированное касторовое масло 10, 50 и 60, глицеринмоностеарат, полисорбат 40, 60, 65 и 80, эфир сахарозы с жирной кислотой, метил целлюлоза и карбоксиметилцеллюлоза. Эти поверхностно-активные вещества могут присутствовать в препарате олигонуклеотида или производного либо одни, либо в виде смеси в различных соотношениях.
Фармацевтические препараты, которые могут быть использованы перорально, включают заполненные капсулы, изготовленные из желатина, а также мягкие герметизированные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит.Заполненные капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связывающими веществами, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния, и, возможно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Могут также быть использованы микросферы, изготовленные для перорального введения. Такие микросферы подробно охарактеризованы в данной области техники. Все препараты для перорального введения должны находиться в дозах, подходящих для такого введения.
Для трансбуккального введения композиции могут принимать форму таблеток или лепешек, изготовленных обычным способом.
Для введения путем ингаляции соединения, используемые в соответствии с настоящим изобретением, можно обычным образом доставить в форме аэрозольного спрея из упаковок под давлением или распылителя с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением единицу дозы можно определить с помощью клапана для доставки отмеренного количества. Капсулы и картриджи, например из желатина, для использования в ингаляторе или инсуффляторе могут быть приготовлены таким образом, что они содержат порошкообразную смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал.
Также здесь предусмотрена доставка олигонуклеотидов (или их производных) в легкие. Олигонуклеотид (или производное) доставляется в легкие млекопитающего при вдыхании и проходит через эпителиальную выстилку легких в кровоток. Другие сообщения о вдыхаемых молекулах включают Adjei et al., 1990, Pharmaceutical Research, 7:565-569; Adjei et al., 1990, International Journal of Pharmaceutics, 63:135-144 (лейпролида ацетат); Braquet et al., 1989, Journal of Cardiovascular Pharmacology, 13 (suppl. 5): 143-146 (эндотелин-1); Hubbard et al., 1989, Annals of Internal Medicine, 111:206-212 (альфа-1 -антитрипсин); Smith et al., 1989, J. Clin. Invest. 84:1145-1146 (a-1-протеиназа); Oswein et al., 1990, "Aerosolization of Proteins", Proceedings of Symposium on Respiratory Drug Delivery II, Keystone, Colorado, March (рекомбинантный гормон роста человека); Debs et al., 1988, J. Immunol. 140:3482-3488 (интерферон-гамма и фактор некроза опухоли альфа) и Platz et al., патент США №5284656 (гранулоцитарный колониестимулирующий фактор). Способ и композиция для доставки в легкие лекарственных средств для системного эффекта описаны в патенте США №5451569, выданном 19 сентября 1995 Wong et al.
Для практического применения изобретения предусмотрен широкий диапазон механических устройств, предназначенных для доставки в легкие терапевтических продуктов, включая распылители, дозирующие ингаляторы и порошковые ингаляторы, все из которых известны специалистам в данной области техники, но не ограничиваясь ими.
Некоторые конкретные примеры имеющихся в продаже устройств, подходящих для практического применения изобретения, представляют собой распылитель Ultravent, производимый Mallinckrodt, Inc., St. Louis, Missori; распылитель Acorn II, производимый Marquest Medical Products, Englewood, Colorado; дозирующий ингалятор Ventolin, производимый Glaxo Inc., Research Triangle Park, North Carolina и порошковый ингалятор Spinhaler, производимый Fisons Corp., Bedford, Massachusetts.
Для всех таких устройств требуется применение препаратов, подходящих для распределения олигонуклеотида (или производного). Как правило, каждый препарат является специфическим в отношении типа используемого устройства и может включать использование подходящего материала пропеллента в дополнение к обычным разбавителям, адъювантам и/или носителям, применяемым в терапии. Также предусмотрено использование липосом, микрокапсул или микросфер, комплексов включения или других типов носителей. Химически модифицированный олигонуклеотид также может быть приготовлен в виде различных препаратов в зависимости от типа химической модификации или типа используемого устройства.
Препараты, подходящие для применения с распылителем, или струйным, или ультразвуковым, обычно включают олигонуклеотид (или производное), растворенный в воде в концентрации от приблизительно 0,1 до 25 мг биологически активного олигонуклеотида на мл раствора. Препарат может также включать буфер или простой сахар (например, для стабилизации олигонуклеотида и регуляции осмотического давления). Препарат распылителя может также содержать поверхностно-активное вещество для уменьшения или предотвращения индуцированной на поверхности агрегации олигонуклеотида, вызванной распылением раствора при образовании аэрозоля.
Препараты для применения в дозирующем ингаляторе, как правило, включают тонкоизмельченный порошок, содержащий олигонуклеотид (или производное), суспендированный в пропелленте с помощью поверхностно-активного вещества. Пропеллент может представлять собой любое традиционное вещество, используемое для данной цели, такое как хлорфторуглерод, гидрохлорфторуглерод, гидрофторуглерод или углеводород, включая трихлорфторметан, дихлордифторметан, дихлортетрафторэтанол и 1,1,1,2-тетрафторэтан или их комбинации. Подходящие поверхностно-активные вещества включают сорбитантриолеат и соевый лецитин. В качестве поверхностно-активного вещества также может быть полезна олеиновая кислота.
Препараты для распределения из порошкового ингалятора содержат тонкоизмельченный сухой порошок, содержащий олигонуклеотид (или производное), и может также включать наполнитель, такой как лактоза, сорбит, сахароза или маннит, в количествах, которые облегчают диспергирование порошка из устройства, например 50-90% от массы препарата. Олигонуклеотид (или производное) наиболее благоприятно готовить в форме частиц со средним размером менее 10 мкм (микрон), наиболее предпочтительно 0,5-5 мкм, для наиболее эффективной доставки в дистальные участки легких.
Также предусмотрена назальная доставка фармацевтической композиции по настоящему изобретению. Назальная доставка дает возможность проникновения фармацевтической композиции по настоящему изобретению в кровоток непосредственно после введения терапевтического продукта в нос, без необходимости осаждения данного продукта в легком. Препараты для назальной доставки включают препараты с декстраном или циклодекстраном.
Для назального введения полезное устройство представляет собой небольшой твердый флакон, к которому присоединен дозирующий распылитель. В одном из воплощений отмеренная доза доставляется с помощью втягивания раствора фармацевтической композиции по настоящему изобретению в камеру определенного объема, которая имеет отверстие нужного размера для распыления аэрозольного препарата путем образования спрея, когда жидкость в камере сжата. Камеру сжимают для введения фармацевтической композиции по настоящему изобретению. В конкретном воплощении настоящего изобретения камера представляет собой поршневое устройство. Такие устройства имеются в продаже.
Альтернативно, используют пластиковый сжимаемый флакон с отверстием определенного размера для распыления аэрозольного препарата путем образования спрея при сжатии. Отверстие обычно находится наверху флакона, и верх обычно является тонким и удлиненным для того, чтобы частично вставлять в носовые ходы для эффективного введения аэрозольного препарата. Предпочтительно назальный ингалятор обеспечивает отмеренное количество аэрозольного препарата для введения отмеренной дозы лекарства.
Соединения, когда желательно доставить их системно, могут быть изготовлены в виде препарата для парентерального введения путем инъекции, например болюсной инъекции или непрерывной инфузии. Препараты для инъекции могут быть представлены в стандартной лекарственной форме, например в ампулах или в многодозовых контейнерах, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать агенты, используемые для приготовления препарата, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты.
Фармацевтические препараты для парентерального введения включают водные растворы активных соединений в водорастворимой форме. Кроме того, суспензии активных соединений могут быть приготовлены в виде соответствующих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, увеличивающие вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Возможно, суспензия может также содержать подходящие стабилизаторы или агенты, увеличивающие растворимость соединений, которые дают возможность для приготовления высококонцентрированных растворов.
Альтернативно, активные соединения могут находиться в порошкообразной форме для разведения перед применением подходящим разбавителем, например стерильной апирогенной водой.
Из соединений можно также изготовить ректальные или вагинальные композиции, такие как суппозитории или удерживающие клизмы, например содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды.
Помимо описанных выше препаратов, соединения также могут быть приготовлены в виде депо-препаратов. Такие препараты длительного действия можно приготовить с использованием подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в приемлемом масле) или ионообменных смол, или в виде умеренно растворимых производных, например в виде умеренно растворимой соли.
Фармацевтические композиции также могут содержать подходящие носители твердой или гелевой фазы или эксципиенты. Примеры таких носителей или эксципиентов включают карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли, но не ограничены ими.
Подходящие жидкие или твердые формы фармацевтических препаратов представляют собой, например, водные или физиологические растворы для ингаляций, микроинкапсулированные, помещенные внутрь кохлеата, нанесенные на микроскопические частицы из золота, содержащиеся в липосомах, распыляемые, аэрозоли, гранулы для имплантации в кожу или высушенные на остром предмете, делающем царапины на коже. Фармацевтические композиции также включают гранулы, порошки, таблетки, покрытые таблетки, (микро)капсулы, суппозитории, сиропы, эмульсии, суспензии, кремы, капли или препараты с длительным высвобождением активных компонентов, в которых обычно используют, как описано выше, эксципиенты и добавки и/или вспомогательные вещества, такие как разрыхлители, связующие вещества, агенты для покрытия, агенты, вызывающие набухание, смазывающие вещества, корригенты, подсластители или солюбилизаторы. Фармацевтические композиции подходят для применения в различных системах доставки лекарства. Краткий обзор способов доставки лекарства см. в Langer, Science 249:1527-1533, 1990, которая включена здесь путем ссылки.
Иммуностимулирующие CpG-олигонуклеотиды и, возможно, другие лекарственные средства и/или антигены могут быть введены сами по себе (чистые) или в форме фармацевтически приемлемой соли. При применении в медицине соли должны быть фармацевтически приемлемыми, однако для удобства можно применять фармацевтически неприемлемые соли для получения из них фармацевтически приемлемых солей. Такие соли включают соли, полученные из следующих кислот: соляной, бромистоводородной, серной, азотной, ортофосфорной, малеиновой, уксусной, салициловой, пара-толуолсульфоновой, винной, лимонной, метансульфоновой, муравьиной, малоновой, янтарной, нафталин-2-сульфоновой и бензолсульфоновой, но не ограничены ими. Такие соли можно получить также в виде солей щелочных или щелочноземельных металлов, таких как соли натрия, калия или кальция, с группой карбоновой кислоты.
Подходящие буферные агенты включают уксусную кислоту и соль (1-2% масс./об.); лимонную кислоту и соль (1-3% масс./об.); борную кислоту и соль (0,5-2,5% масс./об.); и ортофосфорную кислоту и соль (0,8-2% масс./об.). Подходящие консерванты включают хлорид бензалкония (0,003-0,03% масс./об.); хлорбутанол (0,3-0,9% масс./об.); парабены (0,01-0,25% масс./об.) и тимеросал (0,004-0,02% масс./об.).
Фармацевтические композиции по изобретению содержат эффективное количество иммуностимулирующего CpG-олигонуклеотида и, возможно, антигены и/или другие терапевтические агенты, возможно включенные в фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" означает один или более чем один совместимый твердый или жидкий наполнитель, разбавитель или инкапсулирующее вещество, подходящие для введения человеку или другому позвоночному животному. Термин "носитель" означает органический или неорганический ингредиент, природный или синтетический, с которым объединен активный ингредиент для облегчения применения. Компоненты фармацевтических композиций также способны смешиваться с соединениями по настоящему изобретению и друг с другом таким образом, что не возникает взаимодействия, существенно нарушающего желаемую фармацевтическую эффективность.
Настоящее изобретение далее проиллюстрировано следующими примерами, которые не следует рассматривать как дополнительное ограничение. Полное содержание всех ссылок (включая литературные ссылки, выданные патенты, опубликованные заявки на патенты и находящиеся в одновременном рассмотрении заявки на патенты), цитированных в данной заявке, специально включено путем ссылки.
ПРИМЕРЫ
Материалы и методы
Олигодезоксинуклеотиды (ODN) и реагенты
Все ODN синтезированы в соответствии со стандартными протоколами фосфорамидитной химии с контролем идентичности и чистоты от Coley Pharmaceutical GmbH, и уровни эндотоксина в соответствии с анализом Limulus в них не обнаруживаются (<0,1 Е/мл) (BioWhittaker, Verviers, Belgium). ODN суспендированы в стерильной, не содержащей эндотоксин Tris-ЭДТА (этилендиаминтетрауксусная кислота) (Sigma, Deisenhofen, Germany), и их хранили и обрабатывали в асептических условиях для предупреждения контаминации микробами и эндотоксинами. Все разведения осуществляли с использованием не содержащей эндотоксины Tris-ЭДТА.
Анализы TLR
Клетки НЕК293 трансфицировали путем электропорации векторами, экспрессирующими соответствующий человеческий TLR и 6×NF-kB-люциферазную плазмиду-репортер. Стабильные трансфектанты (3×104 клеток/лунку) инкубировали с указанными количествами ODN в течение 16 ч при 37°С в увлажненном инкубаторе. Каждую точку данных получали в трех параллелях. Клетки лизировали и анализировали в отношении активности гена люциферазы (с использованием набора BriteLite от Perkin-Elmer, Zaventem, Belgium). Индексы стимуляции рассчитывали относительно активности гена-репортера в среде без добавления ODN.
Очистка клеток
Препараты лейкоцитарной пленки периферической крови здоровых людей-доноров получали из банка крови University of Düsseldorf (Germany) и PBMC (мононуклеарные клетки периферической крови) очищали путем центрифугирования над Ficoll-Hypaque (Sigma). Клетки культивировали во влажной камере при 37°С в среде RPMI 1640, дополненной 5% (об./об.) инактивированной нагреванием человеческой сывороткой АВ (BioWhittaker) или 10% (об./об.) инактивированной нагреванием FCS (фетальная телячья сыворотка), 2 мМ L-глутамина, 100 Е/мл пенициллина и 100 мкг/мл стрептомицина (все от Sigma).
Обнаружение цитокина и анализ путем проточной цитометрии
PBMC ресуспендировали в концентрации 5×106 клеток/мл и добавляли в 96-луночные круглодонные планшеты (250 мкл/лунку). PBMC инкубировали с ODN и культуральные супернатанты (SN) собирали в указанные моменты времени. Если SN не использовали сразу, их хранили при -20°С до использования.
Количества цитокинов в SN оценивали с использованием твердофазного иммуноферментного анализа (ИФА) в отношении IFN-α с окрашиванием с использованием имеющегося в продаже антитела (PBL, New Brunswick, NJ, USA) или мультиплексной системы Luminex (Luminex Corporation, 12212 Technology Boulevard, Austin, Texas 78727-6115).
Животные
Самок мышей BALB/с (в возрасте 6-8 недель) приобретали в Charles River Canada (Quebec, Canada) и содержали в микроизоляторах в условиях содержания животных в Coley Pharmaceutical Group Canada. Все исследования осуществляли в соответствии с указаниями комитета по содержанию животных в Coley Canada под руководством совета Канады по содержанию животных. Все животные не подвергались ранее лечению CpG ODN.
Модель опухоли SA1N: Самкам мышей A/J (10 на группу) подкожно инъецировали 5×105 опухолевых клеток SaI/N на 0 сутки. Мышей обрабатывали 100 мкг ODN или только PBS, вводимых подкожно раз в неделю, начиная на 8 сутки после индукции опухоли. Животных контролировали в отношении выживания и объема опухоли. Размер опухоли (длину и ширину) измеряли с использованием цифрового штангенциркуля. Объем опухоли рассчитывали с использованием формулы: Объем опухоли = (0,4) (ab2), где а представляет собой большой диаметр, и b представляет собой меньший диаметр.
Анализы in vitro
Для анализов in vitro применяли спленоциты мышей BALB/c, не подвергавшихся ранее лечению (из групп по 3-5 животных). Животных анестезировали изофлуораном и умерщвляли смещением шейных позвонков. Селезенки удаляли в асептических условиях и помещали в PBS+0,2% бычий сывороточный альбумин (Sigma Chemical Company). Селезенки гомогенизировали и спленоциты ресуспендировали в среде для выращивания культуры тканей RPMI 1640 (Life Technologies, Grand Island, NY), дополненной 2% нормальной мышиной сывороткой (Cedarlane Laboratories, Ontario, Canada), раствором пенициллин-стрептомицин (конечная концентрация 1000 Ед/мл и 1 мг/мл, соответственно; Sigma Chemical Company) и 5×10-5 М β-меркаптоэтанола (Sigma Chemical Company).
Анализы пролиферации В-клеток
Спленоциты мышей BALB/c, окрашенные карбокси-флуоресцеин-диацетатом, сукцинимидильным эфиром (CFSE) (Invitrogen, Eugene, Oregon, USA) (4°105/лунку), инкубировали с различными концентрациями ODN в увлажненном 5% CO2 инкубаторе при 37°С в течение 5 суток. Клетки затем окрашивали антителом против CD19, конъюгированным с РЕ (BD Pharmingen, San Diego, CA, USA), в отношении CD19 и пролиферацию В-клеток определяли с использованием FACS с последующим анализом при помощи программного обеспечения ModFit Software V3.0 (Verity Software House Inc., Topsham, ME, USA).
Пример 1: Исследование взаимосвязи структуры и активности для CpG-мотива
Известно, что олигонуклеотиды, содержащие неметилированные CpG-мотивы, способны стимулировать иммунные ответы через путь, опосредованный Toll-подобным рецептором 9 (TLR9). Для идентификации олигонуклеотидов, обладающих наибольшей способностью стимулировать путь TLR9, проводили всесторонее исследование взаимодействия структуры и активности (SAR) для CpG-мотива. Результаты продемонстрировали, что замена гуанина на гипоксантин и 6-тиогуанин приводит к подобной активности в анализе hTLR9, тогда как замена на пурин, 2-аминопурин, 2,6-диаминопурин, 8-оксо-7,8-дигидрогуанин и 7-деазагуанин приводит в результате к 40-80% уменьшению в стимуляции hTLR9. Дополнительно, модификация по С5 и N4 приводит в результате к отсутствию стимуляции пути hTLR9. Эти наблюдения приводят в результате к модели SAR, в которой гуанин распознается через хугстеновский сайт, тогда как цитозин связывается по С,Н-стороне с TLR9-рецептором (см. Фиг.1а). Таким образом, никакая модификация по хугстеновскому сайту распознавания гуанина, а также по С,Н-стороне цитозина не возможна без значительной потери активности hTLR9. Ни одна из исследованных модификаций оснований по динуклеотидному мотиву не была более активной, чем немодифицированный CpG-мотив.
Пример 2: эффект гидрофобных аналогов, имеющих форму тиминового основания около CpG-мотива
Для исследования влияния остатков dT в непосредственной близости с CpG-мотивом несколько гидрофобных аналогов, имеющих форму тиминового основания, таких как 2,4-дифтортолуол (FF) (SEQ ID NO:3-9), 5-бром-2'-дезоксиуридин (BU) и 5-йод-2'-дезоксиуридин (JU), включили за пределами CpG-мотива (см. Таблицу 1 и Фиг.2-3). Неожиданно оказалось, что включение всех протестированных гидрофобных аналогов тимина приводило к необычно сильному увеличению активности hTLR9, тогда как замена урацильными остатками (тимин без метильной группы, Фиг.4) приводит к сильному уменьшению стимуляции hTLR9. Увеличение стимуляции TLR9 проявлялось, когда модификация располагалась с 5'-конца относительно CpG-мотива. Двойная замена 5-йодурацилом (JU) по 5'- и 3'-концам CpG-мотива привела в результате к наиболее сильной стимуляции тестируемых веществ. Наоборот, замена гуанина и цитозина на 2,4-дифтортолуол в CpG-мотиве в обоих случаях приводила к сильному уменьшению индекса стимуляции TLR9.
Включение гидрофобных Т-аналогов также приводило в результате к сильному увеличению индукции IFN-альфа в человеческих РВМС. Неожиданно оказалось, что модификация ODN (SEQ ID NO:1), которая по существу не активна в отношении индукции IFN-альфа 5-бромуридином и 5-йодуридином, в частности, приводила в результате к увеличению стимуляции TLR9 и индукции IFN-альфа. Обычно существует обратная корреляция между TLR9 и индукцией IFN-альфа для CpG ODN, которые не содержат этих модификаций.
Пример 3: Активация TLR9 заменами, имеющими форму липофильного основания
Поскольку различные типы липофильных замен основания у 5'-конца CpG-мотива вызывали значительное увеличение стимуляции hTLR9, исследовали другие аналоги оснований, такие как 5-хлор-урацил, 5-трифторметил-урацил, фенил, арил и замещенные арильные остатки в отношении их способности стимулировать hTLR9 (Таблица 3). Для изучения активации человеческого TLR9 олигонуклеотидами В-класса, модифицированными различными липофильными аналогами основания, ODN SEQ ID NO:1 В-класса модифицировали 5-хлор-2'-дезоксиуридином (CU), 5-бром-2'-дезоксиуридином (BU), 5-йод-2'-дезоксиуридином (JU) и 5-этил-2'-дезоксиуридином (EU). Клетки hTLR9-NFkB-293 инкубировали с указанными ODN (Фиг.5а) в течение 16 часов. Клетки затем лизировали и определяли люциферазную активность. Все CU-модифицированные (SEQ ID NO:41), BU-модифицированные (SEQ ID NO:10) JU-модифицированные (SEQ ID NO:13) и EU-модифицированные (SEQ ID NO:42) олигонуклеотиды демонстрировали более высокую стимуляцию активности TLR9 по сравнению с контролем (SEQ ID NO:1). SEQ ID NO:16 с модифицированным уридином демонстрировала значительно сниженную активность. Во втором эксперименте измеряли продукцию IFN-альфа (Фиг.5b). Человеческие РВМС инкубировали с модифицированным ODN, как указано, в течение 24 ч, после чего супернатанты тестировали посредством ИФА. JU-модифицированный, BU-модифицированный и EU-модифицированный ODN приводил в результате к более сильному повышению продукции IFN-альфа по сравнению с контролем. Эти данные демонстрируют то, что 5'-замена dU в ODN В-класса увеличивает активность TLR9 и продукцию IFN-альфа.
Для того, чтобы дополнительно исследовать эффект EU-модификации на активацию TLR9, эксперимент повторяли с модифицированными олигонуклеотидами, имеющими EU-модификации с 5'-конца CpG (SEQ ID NO:42), 3'-конца CpG (SEQ ID NO:29) и 5'- и 3'-конца CpG (SEQ ID NO:30). SEQ ID NO 42 и 30 демонстрировали значительное увеличение активации TLR9 по сравнению с немодифицированной SEQ ID NO:1 и немодифицированной SEQ ID NO:37 ODN В-класса (Фиг.6).
Пример 4: Липофильная замена в олигонуклеотидах А-, В-, С-, Р- и Т-классов
Для исследования эффектов замены на липофильный аналог основания в ODN различных классов модификации проводили на олигонуклеотидах А-класса, В-класса, С-класса, Р-класса и Т-класса. Некоторые примеры этих олигонуклеотидов приведены в Таблице 3.


Для исследования активации человеческого TLR9 модифицированными олигонуклеотидами В-класса 5-йод-2'-дезоксиуридин-модифицированные производные В-класса с последовательностью SEQ ID NO:37 оценивали в люциферазном анализе в отношении их способности активировать TLR9 (см. материалы и методы). Все модифицированные олигонуклеотиды В-класса демонстрировали значительное увеличение активации TLR9 по сравнению с немодифицированной SEQ ID NO:37 (Фиг.7).
Для исследования активации человеческих TLR9 модифицированными олигонуклеотидами А-класса 5-йод-2'-дезоксиуридин-модифицированные производные А-класса с последовательностью SEQ ID NO:43 тестировали в отношении их способности активировать TLR9 в люциферазном анализе (Фиг.8а) и анализе РВМС (Фиг.8b), как на Фиг.5. Увеличение стимуляции TLR9 проявлялось, когда модификация расположена с 5'-конца относительно CpG-мотива, хотя двойная замена 5-йодурацилом (JU) с 5'- и 3'-конца CpG-мотива приводила в результате к наиболее сильной стимуляции.
Для исследования активации человеческого TLR9 модифицированными олигонуклеотидами С-класса 5-йод-2'-дезоксиуридин-модифицированные производные С-класса с последовательностью SEQ ID NO:46, SEQ ID NO:44 и 45 тестировали в отношении их способности активировать TLR9. Последовательности А-класса SEQ ID NO:43 (немодифицированные) и SEQ ID NO:35 и 36 тестировали одновременно. Как показано на Фиг.9, модифицированные ODN SEQ ID NO:35, 36, 44 и 45 в люциферазном анализе демонстрировали увеличенную стимуляцию TLR9 по сравнению с немодифицированными А- и С-классами. Для исследования активации человеческой TLR9 модифицированными олигонуклеотидами Р-класса 5-йод-2'-дезоксиуридин-модифицированные производные Р-класса с последовательностью SEQ ID NO:46 тестировали в отношении их способности активировать TLR9 в люциферазном анализе. Как показано на Фиг.10, модифицированные ODN SEQ ID NO: 31-33 демонстрировали увеличенную стимуляцию TLR9 по сравнению с немодифицированным ODN.
Для исследования активации человеческого TLR9 модифицированными олигонуклеотидами Т-класса 5-йод-2'-дезоксиуридин-модифицированные производные ODN Т-класса SEQ ID NO:52 тестировали в отношении их способности активировать TLR9. Как показано на Фиг.11, модифицированные ODN SEQ ID NO: 47-50 демонстрировали увеличенную стимуляцию TLR9 по сравнению с немодифицированным ODN Т-класса в люциферазном анализе. Уридиновое производное SEQ ID NO:51 демонстрировало сниженную стимуляцию TLR9.
Как демонстрируют вышеприведенные примеры, замена липофильными Т-аналогами с 5'-конца относительно CpG-мотива приводит в результате к сильному увеличению активации TLR9 во всех тестированных классах и приводит в результате к повышенной способности индуцировать продукцию IFN-альфа.
Пример 5: Стимуляция TLR9 короткими модифицированными олигонуклеотидами
Поскольку модифицированные CpG ODN длиной 20 нуклеотидов демонстрировали необычную аффиность в отношении активации TLR9, очень короткие CpG ODN исследовали в отношении их способности активировать TLR9. Очень короткие олигонуклеотиды обладают значительным преимуществом по сравнению с более длинными олигонуклеотидами при применении в лечении ввиду увеличения легкости захвата клетками, а также возможностью более простого приготовления препарата без использования DOTAP. Исследовали три коротких CpG ODN (короткие олигомеры) (Таблица 3): 6-мерный гексамерный CpG-мотив (SEQ ID NO:38), 5'JU-модификация гексамера (SEQ ID NO:39) и 5'3'JU-модификация гексамера (SEQ ID NO:40) (Таблица 4). Активность коротких олигомеров сравнивали с немодифицированным олигонуклеотидом В-класса SEQ ID NO:37 в люциферазном анализе. Как показано на Фиг.12, в особенности для SEQ ID NO:40, использование модифицированных коротких олигомеров демонстрирует значительный потенциал в качестве улучшенного иммунотерапевтического лекарственного средства.
Пример 6: Активация пути TLR9 in vivo модифицированными олигонуклеотидами
Для того, чтобы определить эффективность модифицированных ODN по изобретению in vivo, ODN с липофильными Т-аналогами тестировали в выделенных мышиных спленоцитах. Спленоциты мышей BALB/c выделяли и инкубировали с модифицированным В-классом (SEQ ID NO:13), немодифицированным В-классом (SEQ ID NO:37) и не-CpG ODN (SEQ ID NO:26) (Таблица 5). Культуральные супернатанты собирали через 6 часов (TNF-альфа) или 24 часа (IL-6, IL-10, IL-12) и концентрацию цитокина измеряли посредством ИФА. Как показано на Фиг.13, инкубация с модифицированным SEQ ID NO:13 приводит в результате к значительно увеличенным уровням всех тестированных цитокинов.
ODN затем тестировали в отношении их способности индуцировать пролиферацию В-клеток в спленоцитах. Окрашенные CFSE спленоциты мышей BALB/c (4×105/лунку) инкубировали с 0,001, 0,01, 0,1, 0,3, 1, 3 или 10 мкг/мл указанного ODN (Фиг.14). Через 72 часа после инкубации клетки окрашивали в отношении маркера CD19 клеточной поверхности и пролиферацию В-клеток определяли посредством FACS с последующим анализом с использованием ModFit Software. Как показано на Фиг.14, инкубация модифицированной SEQ ID NO:13 приводила в результате к значительному увеличению пролиферации В-клеток. Увеличение наиболее всего проявлялось даже при более низкой концентрации ODN.
Для измерения эффекта модифицированных ODN in vivo, мышам BALB/c (5 на группу) подкожно (ПК) инъецировали 10, 50 или 100 мкг SEQ ID NO:13 или 100 мкг SEQ ID NO:37 в общем объеме 100 мкл. Контрольная группа получала 100 мкл одного PBS. Кровь у животных отбирали посредством сердечной пункции через 1 час после инъекции (TNF-альфа) или 3 часа после инъекции (IP-10). Образцы плазмы исследовали посредством ИФА в отношении TNF-альфа (Фиг.15а) и IP-10 (Фиг.15b). Инъекция мышам BALB/c модифицированного SEQ ID NO:13 приводила в результате к более высокой продукции TNF-альфа и IP-10 по сравнению с немодифицированной SEQ ID NO:37, демонстрируя, что ODN с липофильной заменой основания по изобретению приводит в результате к более сильной иммунной стимуляции in vivo по сравнению с немодифицированным иммуностимулирующим ODN.

Пример 7: Олигонуклеотиды с дополнительными модификациями ODN с липофильными аналогами основания тестировали в отношении их способности вызвать TLR9-опосредованную активность NF-κВ в люциферазном анализе (см. материалы и методы). Фиг.16-23 демонстрируют активность ODN с дополнительными модификациями (см. Таблицу 6).
Для тестирования активности других аналогов основания сравнивали активность 6-нитро-бензимидазол(6NB)-модифицированных ODN SEQ ID NO:178 и немодифицированной родительской последовательности SEQ ID NO:1. Как показано на Фиг.12, SEQ ID NO:178 способна активировать TLR9-опосредованный NF-κВ в степени, сравнимой с немодифицированной родительской последовательностью. Затем активность 5-(2-бромвинил)-уридин-модифицированного ODN (SEQ ID NO:153-154) сравнивали с активностью немодифицированной родительской последовательности SEQ ID NO:1. Как показано на Фиг.17, оба модифицированных ODN были более активны в анализе по сравнению с родительской последовательностью. Затем активность двух ODN В-класса с 5-пропинил-du (SEQ ID NO:116 и 117) вместо тимидина родительской последовательности (SEQ ID NO:1). Как показано на Фиг.21, оба модифицированных ODN имеют активность, сравнимую с активностью родительской последовательности. Активность SEQ ID NO:116, в которой модификация расположена с 5'-конца относительно CG-динуклеотида, слегка увеличена по сравнению с родительской последовательностью.
Для тестирования эффекта второго типа модификации в отношении JU-модифицированный ODN 2'O-метилгуанозины включали в JU-модифицированный ODN. Активность 2'-O-метилгуанозина/JU ODN SEQ ID NO:111-113 сравнивали с активностью родительской SEQ ID NO:1 и только JU модифицированной SEQ ID NO:13. Как показано на Фиг.18, все JU-модифицированные ODN были более активными по сравнению с родительским ODN. ODN с 2'O-метилгуанозиновой модификацией с 3'-конца относительно CG-динуклеотида (SEQ ID NO:112-113) был слегка более активен по сравнению с ODN с 2'O-метилгуанозиновой модификацией с 5'-конца относительно CG-динуклеотида (SEQ ID NO:111) или ODN, модифицированным только JU (SEQ ID NO:13).
Затем активность JU-модифицированного разветвленного ODN (SEQ ID NO:96, 97, 101 и 102) сравнивали с активностью SEQ ID NO:1. Как показано на Фиг.19, разветвленный ODN с двумя доступными 5'-концами был в такой же степени активным или более активным по сравнению с активностью немодифицированной SEQ ID NO:1 в данном анализе. SEQ ID NO:101 и 102 с триэтиленгликоль-фосфатным спейсером были более активными по сравнению с активностью SEQ ID NO:96 и 97 с 3'-O-метил-G-спейсером.
Затем сравнивали активность короткого не модифицированного ODN В-класса (SEQ ID NO:38) и ODN с той же самой последовательностью с липофильным замещенным нуклеотидным аналогом и липофильной 3'-tag (SEQ ID NO:126). Оба получали с DOTAP и без него. Как показано на Фиг.20, введение JU-модификации и липофильной tag значительно усиливало активность ODN, как и добавление DOTAP.
Затем активность ODN В-класса со вторым нуклеотидным аналогом в дополнение к липофильному замещенному нуклеотидному аналогу (SEQ ID NO:138, 7-деаза-dG; SEQ ID NO:139, инозин; SEQ ID NO:140, 5-метил-dC) сравнивали с активностью родительской последовательности (SEQ ID NO:1) и той же самой последовательностью только с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:13). Как показано на Фиг.22, все модифицированные ODN были более активны в данном анализе по сравнению с родительским ODN.
Затем активность ODN Т-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:132-134) сравнивали с активностью ODN С-класса (SEQ ID NO:198), который, как известно, является иммуностимулирующим. Как показано на Фиг.23, все модифицированные ODN демонстрировали гораздо более высокую активность в данном анализе по сравнению с немодифицированным ODN С-класса.



Пример 8: Активность модифицированных олигонуклеотидов Р-класса
ODN Р-класса с липофильными аналогами основания тестировали в отношении способности активировать NF-κB путь через TLR9, что измеряют посредством люциферазного анализа. Активность ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58-61) сравнивали с активностью положительного контроля В-класса (SEQ ID NO:55) и немодифицированного ODN Р-класса (SEQ ID NO:56). Как показано на Фиг.24, все модифицированные ODN Р-класса демонстрируют увеличенную стимуляцию TLR9 по сравнению с контролями. Фиг.24а демонстрирует JU-модифицированный ODN Р-класса, а 24b демонстрирует EU-модифицированный ODN Р-класса.
Затем активность модифицированного ODN Р-класса (SEQ ID NO:64 (EU-модифицированный), 66-67 (JU-модифицированный) сравнивали с активностью положительного контроля В-класса (SEQ ID NO:55), ODN С-класса (SEQ ID NO:68) и немодифицированного ODN Р-класса (SEQ ID NO:57). Как показано на Фиг.25, все модифицированные ODN демонстрируют более высокую степень стимуляции TLR9 по сравнению с немодифицированным ODN Р-класса. SEQ ID NO:66 с фосфодиэфирной связью в CG-динуклеотиде демонстрировал пониженную активность по сравнению с полностью фосфоротиоатной SEQ ID NO:67.
Затем модифицированные ODN Р-класса тестировали в отношении их способности индуцировать экспрессию IFN-альфа. Активность ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:58-61) сравнивали с активностью положительного контроля В-класса (SEQ ID NO:55) и немодифицированного ODN Р-класса (SEQ ID NO:56), что измеряли посредством ИФА. Как показано на Фиг.26, все модифицированные ODN Р-класса демонстрировали увеличение индукции IFN-альфа. Фиг.26а демонстрирует JU-модифицированный ODN Р-класса, а 26b демонстрирует EU-модифицированный ODN Р-класса.
Затем модифицированный ODN Р-класса (EU-модифицированный), 66-67 (JU-модифицированный) сравнивали с активностью положительного контроля В-класса (SEQ ID NO:55), ODN С-класса (SEQ ID NO:68) и немодифицированным ODN Р-класса (SEQ ID NO:57) в отношении их способности индуцировать продукцию IFN-альфа, что измеряли посредством ИФА. Как показано на Фиг.27, модифицированный ODN Р-класса демонстрировал усиленную способность индуцировать продукцию IFN-альфа. Как и на Фиг.24, SEQ ID NO:66 демонстрирует пониженную активность по сравнению с SEQ ID NO:67.
Затем модифицированные ODN Р-класса тестировали в отношении способности индуцировать продукцию IL-6 в человеческих РВМС. РВМС трех доноров инкубировали с ODN в указанных концентрациях в течение 24 ч с последующим 25-плексным анализом luminex супернатантов в отношении IL-6. Активность модифицированных ODN Р-класса (SEQ ID NO:58, 60-62, Фиг.28а) (SEQ ID NO:64 и 67, Фиг.28b) сравнивали с активностью немодифицированного ODN В-класса (SEQ ID NO:55) и немодифицированного ODN С-класса (SEQ ID NO:54), отрицательным контролем ODN (SEQ ID NO:53) и немодифицированным ODN Р-класса (SEQ ID NO:56). JU-модифицированный ODN (SEQ ID NO:58, 60-61 и 67) демонстрирует слегка более высокую активацию IL-6 по сравнению с EU-модифицированным ODN (SEQ ID NO:62 и 64). Все модифицированные ODN демонстрируют увеличенную активность по сравнению с немодифицированным ODN.
Затем активность модифицированного ODN Р-класса (SEQ ID NO:58, 60-62, Фиг.29а) (SEQ ID NO:64 и 67, Фиг.29b) сравнивали с активностью немодифицированного ODN В-класса (SEQ ID NO:55), немодифицированного ODN С-класса (SEQ ID NO:54), отрицательного контроля ODN (SEQ ID NO:53), немодифицированного ODN Р-класса (SEQ ID NO:56), LPS, R-848, SEB и поли[I]:[С] ODN. CFSE-меченые РВМС трех доноров инкубировали с ODN в течение 5 суток и затем окрашивали, используя антитело CD19. Определяли процент В-клеток с ослабленным окрашиванием CFSE. Обработка ODN В-класса приводила в результате к наиболее высокому проценту В-клеток после деления. Обработка JU-модифицированным ODN приводила в результате к более высокому проценту В-клеток по сравнению с EU-модифицированным ODN.
Для определения эффекта модифицированного ODN Р-класса in vivo мышам BALB/c (5 на группу) ПК инъецировали различные дозы ODN. У животных отбирали кровь через 3 ч после инъекции и образцы плазмы крови тестировали в отношении IFN-альфа посредством ИФА. Активность модифицированного ODN Р-класса (SEQ ID NO:58, 60-62, 64 и 67) сравнивали с активностью отрицательного контроля В-класса (SEQ ID NO:55) и отрицательного контроля (SEQ ID NO:26). Как показано на Фиг.30, обработка JU-модифицированным ODN SEQ NO:58, 60 и 61 приводила в результате к слегка более высокой индукции IFN-альфа по сравнению с EU-модифицированным ODN SEQ ID NO:64. ODN В-класса SEQ ID NO:55 не вызывал больше продукции мышиного IFN-альфа, как ожидалось.
Затем модифицированные ODN Р-класса оценивали в отношении их способности уменьшать объем опухоли в модели опухоли SA1N у мышей. Самкам мышей A/J (10 на группу) ПК инъецировали 5×105 SaI/N опухолевых клеток на 0 сутки. Мышей обрабатывали 35 мкг (Фиг.31а) или 100 мкг (Фиг.31b) ODN Р-класса с липофильным замещенным нуклеотидным аналогом (SEQ ID NO:60, 64 и 67), немодифицированным ODN С-класса, немодифицированным ODN В-класса (SEQ ID NO:55) или только PBS. ODN вводили ПК один раз в неделю, начиная на 8 сутки после индукции опухоли. Животных контролировали в отношении выживания и объема опухоли. Как показано на Фиг.31а, обработка меньшей дозой модифицированного ODN Р-класса демонстрирует наибольшее сокращение объема опухоли, что свидетельствует о том, что эти ODN будут эффективными в лечении рака. При наиболее высокой дозе в 31b все модифицированные ODN Р-класса и ODN С-класса эффективны в сокращении объема опухоли.


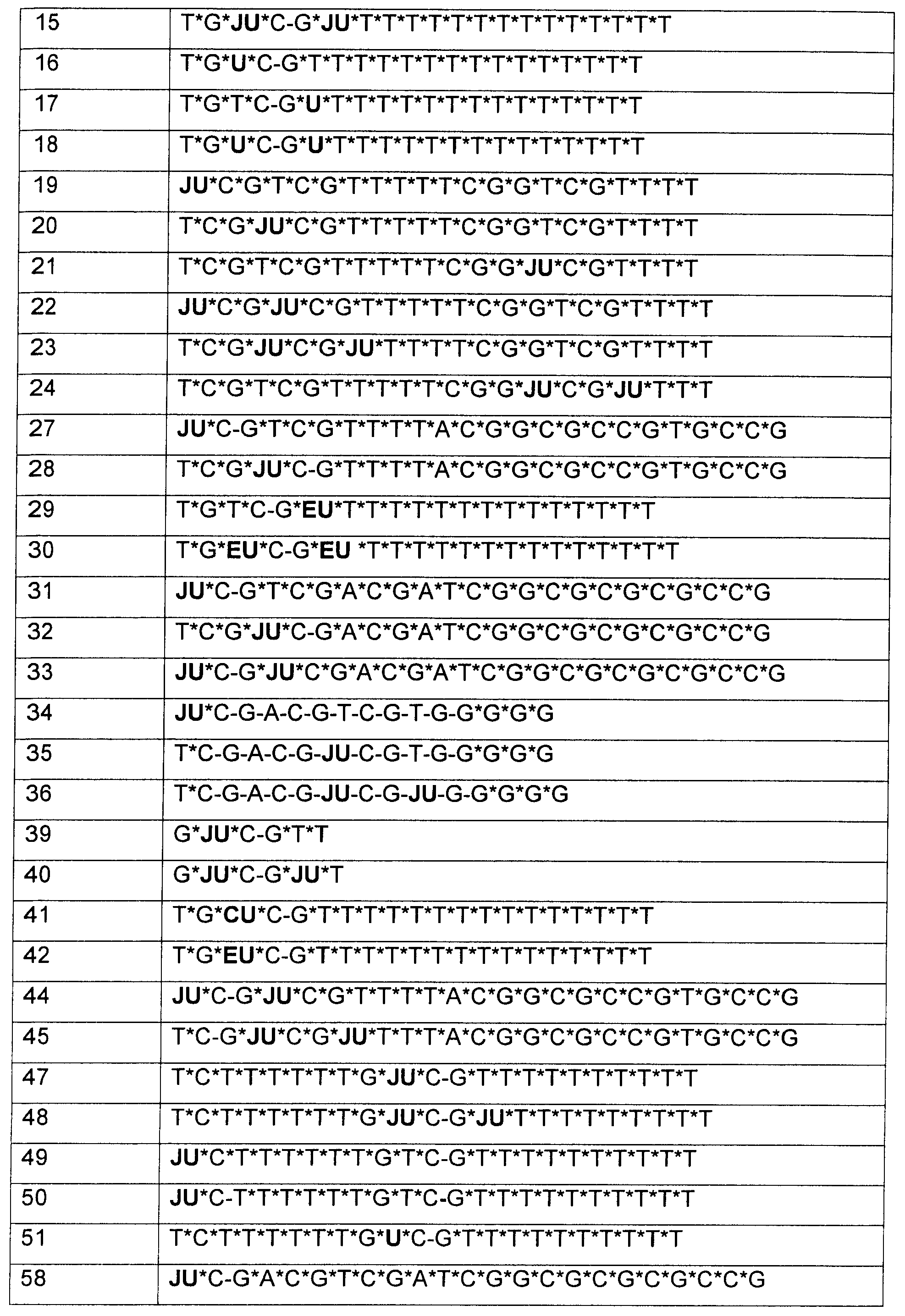



Пояснения
ЭКВИВАЛЕНТЫ
Предполагается, что вышеприведенное описание достаточно для практического применения изобретения специалистом в данной области техники. Объем настоящего изобретения не должен ограничиваться предложенными примерами, поскольку примеры предназначены представлять одну из иллюстраций одного из аспектов изобретения, и другие функционально эквивалентные воплощения находятся в объеме изобретения. Различные модификации изобретения в дополнение к представленным и описанным здесь будут понятны специалистам в данной области техники из предшествующего описания и находятся в объеме формулы изобретения. Преимущества и задачи изобретения не обязательно охватываются каждым воплощением изобретения.
Реферат
Изобретение относится к иммуностимулирующим олигонуклеотидам. Предложен олигонуклеотид длиной 6-100 нуклеотидов, содержащий по меньшей мере одну последовательность 5'RYZR3'. Rи Rвыбирают из группы, состоящей из липофильного замещенного нуклеотидного аналога (L) и нуклеотида. Rможет отсутствовать, так что 5'RYZR3' представляет собой RYZ. По меньшей мере, один из Rи Rпредставляет собой липофильный замещенный нуклеотидный аналог (L). L выбирают из 5-хлор-урацила, 5-бром-урацила или 5-йод-урацила, 5-этил-урацила или (Е)-5-(2-бромвинил)-урацила. Y представляет собой цитозин или 5-метилцитозин. Z выбирают из группы, состоящей из гуанина, 6-тиогуанина, 2'O-метилгуанина, 7-деазагуанина и инозина. Олигонуклеотид не является 5'd[GCGAA(BrU)(BrU)CGC]3', где BrU представляет собой 5-бромурацил. Предложены варианты олигонуклеотида, а также способ индуцирования иммунного ответа на основе нуклеотидов. Описаны варианты применения олигонуклеотидов для получения лекарственного средства для лечения рака или вирусной инфекции. Олигонуклеотиды обладают высокой иммуностимулирующей активностью, что может найти применение в медицине. 8 н. и 7 з.п. ф-лы, 8 табл., 31 ил., 8 пр.
Формула
1) R1 и R2 оба представляют собой L; или
2) R1 представляет собой L и R2 представляет собой нуклеотид; или
3) R1 представляет собой L и R2 отсутствует, так что олигонуклеотид содержит структуру 5'-R1CG-3'; или
4) R1 представляет собой L и R2 отсутствует и где второй R1 расположен с 5'-конца относительно R1YZ, отделенный одним нуклеотидом N, так что олигонуклеотид содержит структуру 5'-R1NR1YZ-3'
1) Z содержит гуанин,
2) R2 представляет собой L, и R1 представляет собой нуклеотид; или
3) олигонуклеотид имеет длину 7-100 нуклеотидов; или
4) олигонуклеотид является Т-обогащенным; или
5) олигонуклеотид включает по меньшей мере 80% Т.
1) содержащий по меньшей мере одну палиндромную последовательность; или
2) содержащий две палиндромные последовательности; или
3) содержащий 1-4 неметилированных CG-динуклеотида; или
4) содержащий по меньшей мере одну последовательность (G)m, где m равен 4-10; или
5) содержащий по меньшей мере один метилированный CG-динуклеотид; или
6) где все CG-динуклеотиды являются неметилированными; или
7) содержащий дополнительно ненуклеотидную модификацию; или
8) дополнительно содержащий ненуклеотидную разветвляющую группировку;
или
9) дополнительно содержащий нуклеотидную разветвляющую группировку;
или
10) дополнительно содержащий разветвляющую группировку, где олигонуклеотид имеет по меньшей мере два 5'-конца; или
11) где по меньшей мере два нуклеотида данного олигонуклеотида имеют стабилизированную связь, которая предпочтительно представляет собой фосфоротиоат, фосфородитиоат, метилфосфонат, метилфосфонотиоат, боранофосфонат, фосфорамидат или дефосфосвязь, в виде энантиомерной смеси или в виде энантиомерно чистой S- или R-конфигурации; или
12) где YZ в 5'R1YZR23' имеет фосфодиэфирную связь; или
13) где YZ в 5'R1YZR23' имеет фосфоротиоатную связь; или
14) где RiY в 5'R1YZR23' имеет фосфоротиоатную связь; или
15) где ZR2 в 5'R1YZR23' имеет фосфоротиоатную связь; или
16) где YZ в 5'R1YZR23' имеет фосфодиэфирную связь и все другие нуклеотиды имеют фосфоротиоатную связь; или
17) где олигонуклеотид не содержит микроноситель, предпочтительно не содержит липидный носитель; или
18) где олигонуклеотид представляет собой олигонуклеотид А-класса; или
19) где олигонуклеотид представляет собой олигонуклеотид В-класса; или
20) где олигонуклеотид представляет собой олигонуклеотид С-класса; или
21) где олигонуклеотид представляет собой олигонуклеотид Р-класса; или
22) где олигонуклеотид представляет собой олигонуклеотид Т-класса; или
23) где олигонуклеотид содержит по меньшей мере одну 3'-3' связь; или
24) где олигонуклеотид содержит по меньшей мере одну 5'-5' связь.
1) где иммунный ответ представляет собой индукцию интерферона-альфа (IFN-α); или
2) дополнительно включающий антиген; или
3) где олигонуклеотид доставляют путем, выбранным из группы, состоящей из перорального, назального, сублингвального, внутривенного, подкожного введения, введения через слизистые оболочки, офтальмологического, респираторного введения, прямой инъекции и внутрикожного введения; или
4) где олигонуклеотид или композицию доставляют субъекту в количестве, эффективном для того, чтобы вызвать экспрессию цитокина и/или хемокина;
или
5) где композицию вводят вместе с дополнительным иммуномодулятором; или
6) где олигонуклеотид доставляют субъекту для лечения аутоиммунного заболевания у субъекта; или
7) где олигонуклеотид доставляют субъекту для лечения ремоделирования дыхательных путей у субъекта; или
8) где олигонуклеотид вводят субъекту без антигена.
1) где рак выбран из группы, состоящей из базальноклеточной карциномы, рака желчных путей, рака мочевого пузыря, рака кости, рака головного мозга и центральной нервной системы (ЦНС), рака молочной железы, рака шейки матки, хориокарциномы, рака толстой и прямой кишки, рака соединительной ткани, рака пищеварительной системы, рака эндометрия, рака пищевода, рака глаза, рака головы и шеи, рака желудка, внутриэпителиального новообразования, рака почки, рака гортани, лейкоза, рака печени, рака легкого, лимфомы, включая ходжкинскую и неходжкинскую лимфомы, меланомы, миеломы, нейробластомы, рака ротовой полости, рака яичника, рака поджелудочной железы, рака предстательной железы, ретинобластомы, рабдомиосаркомы, рака прямой кишки, почечного рака, рака респираторной системы, саркомы, рака кожи, рака желудка, рака семенников, рака щитовидной железы, рака матки, рака мочевой системы и других карцином и сарком; или
2) где композицию вводят вместе с противораковым лекарственным средством или лечением, например, химиотерапевтическими средствами, радиацией; или
3) где олигонуклеотид доставляют путем, выбранным из группы, состоящей из перорального, назального, сублингвального, внутривенного, подкожного введения, введения через слизистые оболочки, офтальмологического, респираторного введения, прямой инъекции и кожного введения; или
4) где субъекта лечат посредством хирургического вмешательства.
1) где вирусная инфекция вызвана вирусом гепатита В (HBV), вирусом гепатита С (HCV), вирусом иммунодефицита человека (HIV), вирусом гриппа, респираторно-синцитиальным вирусом (RSV) или вирусом папилломы человека (HPV); или
2) где олигонуклеотид доставляют путем, выбранным из группы, состоящей из перорального, назального, сублингвального, внутривенного, подкожного введения, введения через слизистые оболочки, офтальмологического, респираторного введения, прямой инъекции и кожного введения; или
3) дополнительно включающее противовирусный агент; или
4) где субъект не чувствителен к противовирусной терапии с использованием не-CpG.
