Модуляция экспрессии транстиретина - RU2592669C2
Код документа: RU2592669C2
Чертежи































Описание
ОБЛАСТЬ ТЕХНИКИ
В данном документе представлены способы, соединения и композиции для снижения экспрессии мРНК и белка транстиретина у животного. Такие способы, соединения и композиции являются пригодными, например, для лечения, профилактики или облегчения транстиретинового амилоидоза.
УРОВЕНЬ ТЕХНИКИ
Транстиретин (TTR) (также известен как преальбумин, гипертироксинемия, диспреальбуминемия, тироксин; старческий системный амилоидоз, амилоидная полиневропатия, амилоидоз I, PALB; дистранстиретинемия, HST2651; ТВРА; диспреальбуминемичная эутиреоидная гипертироксинемия) представляет собой белок сыворотки/плазмы и спинномозговой жидкости, ответственный за транспорт тироксина и ретинола (Sakaki et al., Mol Biol Med. 1989, 6:161-8). Структурно, TTR представляет собой гомотетрамер; точечные мутации и нарушения укладки белка приводят к отложению амилоидных фибрилл и ассоциированы с расстройствами, такими как старческий системный амилоидоз (SSA), семейная амилоидная полиневропатия (FAP) и семейная амилоидная кардиопатия (FAC).
TTR синтезируется преимущественно печенью и сосудистым сплетением головного мозга и, в меньшей степени, сетчаткой у людей (Palha, Clin Chem Lab Med, 2002, 40, 1292-1300). Транстиретин, синтезируемый в печени, секретируется в кровь, тогда как Транстиретин из сосудистого сплетения поступает в спинномозговую жидкость (CSF). Синтез транстиретина в сосудистом сплетении составляет примерно 20% от общего синтеза местного белка и до 25% от общего количества белка CSF (Dickson et al., J Biol Chem, 1986, 261, 3475-3478).
В условиях доступности генетических и иммуногистохимических диагностических тестов, пациенты с транстиретиновым (TTR) амилоидозом были выявлены среди людей многих национальностей во всем мире. Недавние исследования показывают, что TTR-амилоидоз не является редким эндемическим заболеванием, как считалось ранее, и может поражать до 25% населения старших возрастных групп (Tanskanen et al, Ann Med. 2008; 40(3):232-9).
На биохимическом уровне, TTR был идентифицирован как основной белковый компонент амилоидных отложений у пациентов с FAP (Costa et al, Proc. Natl. Acad. Sci. USA 1978, 75:4499-4503), и позднее было обнаружено, что наиболее распространенным молекулярным дефектом, вызывающим заболевание, является замещение метионина на валин в положении 30 белка (Saraiva et al, J. Clin. Invest. 1984, 74: 104-119). При FAP наблюдается широко распространенное системное внеклеточное отложение агрегатов TTR и амилоидных фибрилл в соединительной ткани, особенно, в периферической нервной системе (Sousa and Saraiva, Prog. Neurobiol. 2003, 71: 385-400). После отложения TTR происходит дегенерация аксонов, начиная с немиелинизированных и миелинизированных волокон малого диаметра, в конечном счете приводящая к потере нейронов ганглиев.
Соединения и способы лечения, описанные тут, обеспечивают значительные преимущества по сравнению с возможностями доступных в настоящее время способов лечения расстройств, связанных с TTR. TTR-амилоидоз типично приводит к летальному исходу в течение десяти лет и, до недавнего времени, считался неизлечимым. Трансплантация печени является эффективным способом замены ассоциированного с заболеванием аллеля на аллель дикого типа (WT) в случае семейных заболеваний, потому что печень типично является источником амилоидогенного TTR. Хотя трансплантация печени эффективна как форма генной терапии, она не обходится без своих проблем. Трансплантация осложняется необходимостью инвазивной хирургии для реципиента и донора, долгосрочной посттрансплантационной иммуносупрессорной терапии, нехваткой доноров, высокой стоимостью и большим числом пациентов с TTR-амилоидозом, являющихся малопригодными кандидатами вследствие прогрессирования заболевания. К сожалению, амилоидоз сердца прогрессирует у некоторых пациентов с семейными заболеваниями даже после трансплантации печени, потому что отложение TTR дикого типа часто продолжается. Отложение TTR в центральной нервной системе (CNS) также не уменьшается после трансплантации вследствие его синтеза сосудистым сплетением. Трансплантация не является практически осуществимой возможностью при наиболее распространенном TTR-заболевании - старческом системном амилоидозе (SSA), поражающем приблизительно 25% лиц старше 80 лет вследствие отложения TTR дикого типа.
Находящаяся на стадии становления антисмысловая технология является эффективным средством снижения экспрессии специфических генных продуктов и может поэтому оказаться уникально пригодной в ряде терапевтических, диагностических и исследовательских областей применения для модуляции экспрессии TTR (см. публикации патентов США №№2008/0039418 и 2007/0299027.
Настоящее изобретение предусматривает композиции и способы модуляции экспрессии транстиретина. Антисмысловые соединения для модуляции экспрессии транстиретина раскрыты в вышеупомянутых опубликованных патентных заявках. Однако, сохраняется потребность в дополнительных таких соединениях.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном описании предусматриваются способы, соединения и композиции для модуляции экспрессии мРНК и белка транстиретина (TTR). В определенных вариантах воплощения, соединения, пригодные для модуляции экспрессии мРНК и белка TTR, представляют собой антисмысловые соединения. В определенных вариантах воплощения, антисмысловые соединения представляют собой антисмысловые олигонуклеотиды.
В определенных вариантах воплощения, модуляция может происходить в клетке или ткани. В определенных вариантах воплощения, клетка или ткань находятся в животном. В определенных вариантах воплощения, животное представляет собой человека. В определенных вариантах воплощения снижаются уровни мРНК TTR. В определенных вариантах воплощения снижаются уровни белка TTR. Такое снижение может происходить зависимым от времени образом или зависимым от дозы образом.
Данное описание предусматривает способы, соединения и композиции для модуляции экспрессии транстиретина, и лечение, предупреждение, задержку или облегчение транстиретинового амилоидоза и/или его симптома. В определенных вариантах воплощения предусматриваются способы, соединения и композиции для модуляции экспрессии транстиретина и лечение, предупреждение, задержка или облегчение транстиретинового амилоидного заболевания или транстиретинового амилоидоза или транстиретин-ассоциированного амилоидоза (например, наследственного TTR-амилоидоза, лептоменингеального амилоидоза, транстиретиновой амилоидной полиневропатии, семейной амилоидной полиневропатии, семейной амилоидной кардиомиопатии или старческого системного амилоидоза).
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 20 до 30 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 20 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2, или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2, или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2, или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 или 124.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86 или 87.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86 или 87.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86 или 87.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86 или 87.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86 или 87.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 20 до 30 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 20 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, выбранной из любой из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86 или 87.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 20 до 30 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из от 20 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, животное с риском транстиретинового амилоидоза или с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, где модифицированный олигонуклеотид является комплементарным к транстиретиновой нуклеиновой кислоте, описанной в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов и имеющий последовательность нукпеооснований, содержащую, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, животное с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, где модифицированный олигонуклеотид на 100% комплементарен к транстиретиновой нуклеиновой кислоте, описываемой в SEQ ID NO:1 или SEQ ID NO:2; или терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов и имеющий последовательность нуклеооснований, указанную в SEQ ID NO:80.
В определенных вариантах воплощения, животное с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, где модифицированный олигонуклеотид на 100% комплементарен к транстиретиновой нуклеиновой кислоте, описываемой в SEQ ID NO:1; и где соединение включает модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, имеющих последовательность нуклеооснований, указанную в SEQ ID NO:80.
В определенных вариантах воплощения, животное с транстиретиновым амилоидозом лечат путем введения животному терапевтически эффективного количества соединения, включающего модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, где модифицированный олигонуклеотид на 100% комплементарен к транстиретиновой нуклеиновой кислоте, описываемой в SEQ ID NO:1; где соединение включает модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, имеющих последовательность нуклеооснований, указанную в SEQ ID NO:80; и где модифицированные олигонуклеотиды содержат гэп-сегмент из 10 связанных дезоксинуклеозидов, расположенный между двумя боковыми сегментами, независимо содержащими по 5 связанных модифицированных нуклеозидов. В определенных вариантах воплощения, один или несколько модифицированных нуклеозидов в боковом сегменте содержат модифицированный сахар. В определенных вариантах воплощения, модифицированный нуклеозид представляет собой 2'-замещенный нуклеозид. В определенных вариантах воплощения, модифицированный нуклеозид представляет собой 2'-МОЕ нуклеозид.
В определенных вариантах воплощения, модуляция может происходить в клетке, ткани, органе или организме. В определенных вариантах воплощения, клетка, ткань или орган находятся в животном. В определенных вариантах воплощения, животное представляет собой человека. В определенных вариантах воплощения снижаются уровни мРНК транстиретина. В определенных вариантах воплощения снижаются уровни белка транстиретина. Такое снижение может происходить зависимым от времени образом или зависимым от дозы образом.
Также предусматриваются способы, соединения и композиции, пригодные для предотвращения, лечения и облегчения заболеваний, расстройств и состояний, связанных с транстиретиновым амилоидозом. В определенных вариантах воплощения, такие заболевания, расстройства и состояния представляют собой заболевания, расстройства или состояния, связанные с транстиретиновым амилоидозом.
В определенных вариантах воплощения, способы лечения включают введение антисмыслового соединения TTR нуждающемуся в этом лицу. В определенных вариантах воплощения, способы лечения включают введение антисмыслового олигонуклеотида TTR нуждающемуся в этом лицу.
В определенных вариантах воплощения, способы лечения включают введение антисмыслового олигонуклеотида транстиретина и дополнительную терапию нуждающегося в этом лица.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что как предшествующее общее описание, так и последующее подробное описание являются лишь примерными и пояснительными и не ограничивают заявляемое изобретение. В данном описании использование терминов в единственном числе включает множественное число, если конкретно не указано иное. В используемом тут значении, использование союза "или" означает "и/или", если не указано иное. Кроме того, использование термина "включая", а также других его форм, таких как "включает" и "включенный", не является ограничивающим. Также, такие термины, как "элемент" или "компонент" охватывают как элементы и компоненты, содержащие одну структурную единицу, так и элементы и компоненты, содержащие более одной субъединицы, если конкретно не указано иное.
Заголовки разделов, используемые тут, предназначены только для организационных целей и не должны истолковываться как ограничивающие описываемый объект. Все документы или части документов, упоминаемые в данной заявке, включая, без ограничений, патенты, патентные заявки, статьи, книги и учебные пособия, настоящим явным образом включены в качестве ссылок в отношении рассматриваемых тут частей документа, а также целиком.
Определения
Если не приведены конкретные определения, то номенклатура, используемая в связи с, и процедуры и методики аналитической химии, органического синтеза и медицинской и фармацевтической химии, описанные тут, являются хорошо известными и общеупотребительными в данной области техники. Стандартные методики могут быть использованы для химического синтеза и химического анализа. Там, где это дозволено, все патенты, заявки, опубликованные заявки и другие публикации, Номера доступа GENBANK и ассоциированная с ними информация о последовательностях, которая может быть получена через базы данных, такие как Национальный центр биотехнологической информации (National Center for Biotechnology Information, NCBI) и другие данные, упоминаемые в данном описании, включены в качестве ссылок в отношении рассматриваемых тут частей документов, а также целиком.
Если не указано иное, то следующие термины имеют такие значения:
"2'-O-метоксиэтил" (также 2'-МОЕ и 2'-O(СН2)2-ОСН3) относится к O-метоксиэтильной модификации 2'-положения фурозильного кольца. Сахар, модифицированный 2'-O-метоксиэтилом, представляет собой модифицированный сахар.
"2'-O-метоксиэтил-нуклеотид" означает нуклеотид, содержащий фрагмент сахара, модифицированного 2'-O-метоксиэтилом.
"5-Метилцитозин" означает цитозин, модифицированный метильной группой, присоединенной в 5'-положении. 5-Метилцитозин представляет собой модифицированное нуклеооснование.
"Активный фармацевтический агент" означает вещество или вещества в фармацевтической композиции, которые обеспечивают терапевтически полезный эффект при введении индивиду. Например, в определенных вариантах воплощения, антисмысловой олигонуклеотид, нацеленный на транстиретин, является активным фармацевтическим агентом.
"Активный участок-мишень" или "целевой участок" означает участок, на который нацелены одно или несколько активных антисмысловых соединений. "Активные антисмысловые соединения" означают антисмысловые соединения, которые снижают уровни целевой нуклеиновой кислоты или уровни белка.
"Сопутствующее введение" относится к совместному введению двух агентов любым способом, при котором фармакологические эффекты обоих проявляются у пациента одновременно. Сопутствующее введение не требует, чтобы оба агента вводились в одной фармацевтической композиции, в одной дозированной форме, или одним и тем же путем введения. Эффекты обоих агентов не должны обязательно проявляться одновременно. Эффекты только должны перекрываться на протяжении некоторого периода времени и не должны совпадать по протяженности.
"Введение" обозначает доставку фармацевтического агента индивиду и включает, без ограничения, введение специалистом-медиком и самостоятельное введение.
"Облегчение" относится к ослаблению, по меньшей мере, одного показателя, признака или симптома ассоциированного заболевания, расстройства или состояния. Тяжесть показателей может быть определена с помощью субъективных или объективных критериев, которые известны квалифицированным специалистам в данной области.
"Амилоидоз" представляет собой группу заболеваний или расстройств, вызванных аномальными отложениями белка (амилоид или амилоидные фибриллы) в различных тканях организма. Амилоидные белки могут откладываться в одной определенной области организма (локализованный амилоидоз) или они могут откладываться по всему организму (системный амилоидоз). Существует три типа системного амилоидоза: первичный (AL), вторичный (АА) и семейный (ATTR). Первичный амилоидоз не ассоциирован с какими-либо другими болезнями и считается самостоятельной нозологической единицей. Вторичный амилоидоз возникает в результате другого заболевания. Семейная средиземноморская лихорадка является формой семейного (наследственного) амилоидоза.
"Животное" относится к человеку или не принадлежащему к человеческому роду животному, включая, без ограничений, мышей, крыс, кроликов, собак, кошек, свиней и приматов кроме человека, включая, без ограничений, обезьян и шимпанзе.
"Антисмысловая активность" означает любую детектируемую или измеримую активность, которая может быть отнесена к гибридизации антисмыслового соединения с его целевой нуклеиновой кислотой. В определенных вариантах воплощения, антисмысловая активность представляет собой снижение количества или экспрессии целевой нуклеиновой кислоты или белка, кодируемого такой целевой нуклеиновой кислотой.
"Антисмысловое соединение" означает олигомерное соединение, способное подвергаться гибридизации с целевой нуклеиновой кислотой посредством образования водородной связи.
"Антисмысловое ингибирование" означает снижение уровней целевой нуклеиновой кислоты или уровней целевого белка в присутствии антисмыслового соединения, комплементарного к целевой нуклеиновой кислоте по сравнению с уровнями целевой нуклеиновой кислоты или уровнями целевого белка в отсутствие антисмыслового соединения.
"Антисмысловой олигонуклеотид" означает одноцепочечный олигонуклеотид, имеющий последовательность нуклеооснований, позволяющую протекание гибридизации с соответствующим участком или сегментом целевой нуклеиновой кислоты.
"Бициклический сахар" означает фурозильное кольцо, модифицированное путем образования мостиковой связи между двумя не-геминальными атомами кольца. Бициклический сахар представляет собой модифицированный сахар.
"Бициклическая нуклеиновая кислота" или "БНК" относится к нуклеозиду или нуклеотиду, в котором фуранозная часть нуклеозида или нуклеотида включает мостиковую связь, соединяющую два атома углерода фуранозного кольца, с образованием в результате бициклической кольцевой системы.
"Кэп-структура" или "терминальный кэп-фрагмент" означает химические модификации, включенные на любом конце антисмыслового соединения.
"Центральная нервная система (ЦНС)" относится к нервной системе позвоночного животного, окруженной мозговыми оболочками. Она включает большую часть нервной системы и состоит из головного мозга (у позвоночных животных, имеющих головной мозг) и спинного мозга. ЦНС расположена в дорсальной полости, с головным мозгом в черепной полости и спинным мозгом в спинномозговом канале. Головной мозг также защищен черепом, и спинной мозг, у позвоночных животных, также защищен позвоночником.
"Химически отличный участок" относится к участку антисмыслового соединения, который некоторым образом химически отличается от другого участка этого же антисмыслового соединения. Например, участок, содержащий 2'-O-метоксиэтилированные нуклеотиды, химически отличается от участка, содержащего нуклеотиды без 2'-O-метоксиэтильных модификаций.
"Химерное антисмысловое соединение" означает антисмысловое соединение, содержащее, по меньшей мере, два химически отличных участка.
"Сосудистое сплетение" представляет собой область желудочков головного мозга, в которой вырабатывается спинномозговая жидкость (CSF).
"Совместное введение" означает введение индивиду двух или больше фармацевтических агентов. Два или больше фармацевтических агента могут находиться в одной фармацевтической композиции или могут находиться в отдельных фармацевтических композициях. Каждый из двух или больше фармацевтических агентов может быть введен одним и тем же или разными путями введения. Совместное введение охватывает параллельное или последовательное введение.
"Комплементарность" означает способность к спариванию между нуклеооснованиями первой нуклеиновой кислоты и второй нуклеиновой кислоты.
"Смежные нуклеооснования" означают нуклеооснования, непосредственно прилегающие друг к другу.
"Разбавитель" означает ингредиент композиции, не обладающий фармакологической активностью, но является фармацевтически необходимым или желательным. Например, разбавитель в композиции для инъекции может быть жидкостью, например, солевым раствором.
"Доза" означает определенное количество фармацевтического агента, доставляемое при разовом введении или за определенный период времени. В определенных вариантах воплощения, доза может быть введена в виде одного, двух или нескольких болюсов, таблеток или инъекций. Например, в определенных вариантах воплощения, когда желательным является подкожное введение, желательная доза требует объема, который не может быть легко введен одной инъекцией, поэтому, две или больше инъекций могут быть использованы для достижения желательной дозы. В определенных вариантах воплощения, фармацевтический агент вводят путем инфузии на протяжении длительного периода времени или непрерывно. Дозы могут быть указаны как количество фармацевтического агента в час, за сутки, неделю или месяц.
"Эффективное количество" означает количество активного фармацевтического агента, достаточное для достижения желательного физиологического результата у лица, нуждающегося в таком агенте. Эффективное количество может различаться для разных лиц в зависимости от здоровья и физического состояния лица, лечение которого должно проводиться, таксономической группы лиц, лечение которых должно проводиться, состава композиции, оценки медицинского состояния лица, и других релевантных факторов.
"Семейный амилоидоз" или "наследственный амилоидоз" представляет собой форму наследственно передаваемого амилоидоза.
"Семейная амилоидная полиневропатия" или "FAP" представляет собой нейродегенеративное генетически передаваемое расстройство, характеризующееся системными отложениями амилоидных вариантов транстиретиновых белков, вызывающими прогрессирующую сенсорную и моторную полиневропатию.
"Полностью комплементарный" или "на 100% комплементарный" означает, что каждое нуклеооснование последовательности нуклеооснований первой нуклеиновой кислоты имеет комплементарное нуклеооснование во второй последовательности нуклеооснований второй нуклеиновой кислоты. В определенных вариантах воплощения, первая нуклеиновая кислота представляет собой антисмысловое соединение и целевая нуклеиновая кислота представляет собой вторую нуклеиновую кислоту.
Тапмер" означает химерное антисмысловое соединение, в котором внутренний участок, содержащий множество нуклеозидов, поддерживающих расщепление РНКазой Н, расположен между внешними участками, содержащими один или несколько нуклеозидов, где нуклеозиды, составляющие внутренний участок, химически отличаются от нуклеозида или нуклеозидов, составляющих внешние участки. Внутренний участок может быть назван "гэп-сегментом", и внешние участки могут быть названы "боковыми сегментами".
"Уширенный за счет гэпа" означает химерное антисмысловое соединение, содержащее гэп-сегмент из 12 или больше смежных 2'-дезоксирибонуклеозидов, расположенных между и непосредственно прилегающих к 5'- и 3'-боковым сегментам, содержащим от одного до шести нуклеозидов.
"Наследственный транстиретиновый (TTR) амилоидоз" представляет собой системное заболевание, вызываемое мутациями транстиретина, плазменного транспортного белка тироксина и витамина А. Он наиболее часто ассоциируется с периферической невропатией и рестриктивной кардиомиопатией, но амилоидные отложения в стенках кровеносных сосудов и структурах соединительных тканей по всему организму часто вызывают дисфункцию других систем органов. Эта болезнь обычно сопровождается аномалиями подвижности желудочно-кишечного тракта с запорами, диареей и преждевременным чувством насыщения вследствие замедленного опорожнения желудка. Отложения амилоида в соединительной ткани запястья может вызывать кистевой туннельный синдром. Амилоидные отложения в спинальных кровеносных сосудах и окружающих структурах вызывают спинальный стеноз с симптомами хромоты.
"Гибридизация" означает отжиг молекул комплементарной нуклеиновой кислоты. В определенных вариантах воплощения, молекулы комплементарной нуклеиновой кислоты включают антисмысловое соединение и целевую нуклеиновую кислоту.
"Непосредственно прилегающий" означает отсутствие промежуточных элементов между непосредственно прилегающими элементами.
"Лицо, индивид" означает человека или не относящееся к человеческому роду животное, выбранное для проведения лечения или терапии.
"Интрацеребровентрикулярное введение" или "церебральное интравентрикулярное введение" или "церебрально-вентрикулярное введение" означает введение путем инъекции или инфузии в систему желудочка головного мозга.
"Интраперитонеальное введение" означает введение в полость брюшины.
"Интратекальное введение" означает введение путем инъекции или инфузии в спинномозговую жидкость, омывающую спинной мозг и головной мозг.
"Внутривенное введение" означает введение в вену.
"Интравентрикулярное введение" означает введение в желудочки головного мозга или сердца.
"Межнуклеозидная связь" относится к химической связи между нуклеозидами.
"Лептоменингеальный" означает имеющий отношение к мягкой и паутинной оболочкам мозга, двум внутренним слоям тканей, покрывающим головной мозг и спинной мозг."Лептоменингеальный амилоидоз" относится к амилоидозу мягкой и паутинной оболочек мозга в результате транстиретиновых амилоидных отложений в мягкой и паутинной оболочках мозга.
"Связанные нуклеозиды" означает прилегающие нуклеозиды, соединенные друг с другом.
"Неспаренное" или "некомплементарное нуклеооснование" относится к случаю, когда нуклеооснование первой нуклеиновой кислоты не способно к спариванию с соответствующим нуклеооснованием второй или целевой нуклеиновой кислоты.
"Модифицированная межнуклеозидная связь" относится к замещению или любому изменению встречающейся в природе межнуклеозидной связи (т.е. фосфодиэфирной межнуклеозидной связи).
"Модифицированное нуклеооснование" относится к любому нуклеооснованию кроме аденина, цитозина, гуанина, тимидина или урацила. "Немодифицированное нуклеооснование" означает пуриновые основания аденин (А) и гуанин (G) и пиримидиновые основания тимин (Т), цитозин (С) и урацил (U).
"Модифицированный нуклеотид" означает нуклеотид, содержащий, независимо, фрагмент модифицированного сахара, модифицированную межнуклеозидную связь или модифицированное нуклеооснование. "Модифицированный нуклеозид" означает нуклеозид, содержащий, независимо, фрагмент модифицированного сахара или модифицированное нуклеооснование.
"Модифицированный олигонуклеотид" означает олигонуклеотид, содержащий, по меньшей мере, один модифицированный нуклеотид.
"Модифицированный сахар" относится к замещению или изменению по сравнению с природным сахаром.
"Мотив" означает характерную структуру химически отличных участков антисмыслового соединения.
"Встречающаяся в природе межнуклеозидная связь" означает фосфодиэфирную связь, направленную от 3'- к 5'-концу.
"Фрагмент природного сахара" означает сахар, присутствующий в ДНК (2'-Н) или РНК (2'-ОН).
"Нуклеиновая кислота" относится к молекулам, состоящим из мономерных нуклеотидов. Нуклеиновая кислота включает рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), одноцепочечные нуклеиновые кислоты, двухцепочечные нуклеиновые кислоты, малые интерферирующие рибонуклеиновые кислоты (siPHK) и микроРНК (miPHK). Нуклеиновая кислота может также включать комбинацию этих элементов в одной молекуле.
"Нуклеооснование" означает гетероциклический фрагмент, способный спариваться с основанием другой нуклеиновой кислоты.
"Последовательность нуклеооснований" означает порядок расположения смежных нуклеооснований независимо от каких-либо модификаций сахара, связи или нуклеооснования.
"Нуклеозид" означает нуклеооснование, связанное с сахаром.
"Нуклеотид" означает нуклеозид, содержащий фосфатную группу, ковалентно связанную с сахарной частью нуклеозида.
"Олигомерное соединение" или "олигомер" означает полимер, состоящий из связанных мономерных субъединиц, способный гибридизироваться с, по меньшей мере, участком молекулы нуклеиновой кислоты.
"Олигонуклеотид" означает полимер, состоящий из связанных нуклеозидов, каждый из которых, независимо друг от друга, может быть модифицированным или немодифицированным.
"Парентеральное введение" означает введение путем инъекции или инфузии. Парентеральное введение включает подкожное введение, внутривенное введение, внутримышечное введение, интраартериальное введение, интраперитонеальное введение или внутричерепное введение, например, внутримозговое введение, интратекальное введение, интравентрикулярное введение, вентрикулярное введение, интрацеребровентрикулярное введение, церебральное интравентрикулярное введение или церебрально-вентрикулярное введение. Введение может быть непрерывным или хроническим, или кратковременным, или прерывистым.
"Пептид" означает молекулу, образующуюся при соединении, по меньшей мере, двух аминокислот амидными связями. Пептид относится к полипептидам и белкам.
"Фармацевтическая композиция" означает смесь веществ, пригодную для введения индивиду. Например, фармацевтическая композиция может содержать один или несколько активных фармацевтических агентов и стерильный водный раствор.
"Фармацевтически приемлемые соли" означают физиологически и фармацевтически приемлемые соли антисмысловых соединений, т.е., соли, сохраняющие желательную биологическую активность исходного олигонуклеотида и не создающие нежелательных токсикологических эффектов.
"Фосфоротиоатная связь" означает связь между нуклеозидами, при которой фосфодиэфирная связь модифицируется путем замены одного из немостиковых атомов кислорода на атом серы. Фосфоротиоатная связь представляет собой модифицированную межнуклеозидную связь.
"Участок" означает определенное число смежных (т.е. связанных) нуклеооснований нуклеиновой кислоты. В определенных вариантах воплощения, участок представляет собой определенное число смежных нуклеооснований целевой нуклеиновой кислоты. В определенных вариантах воплощения, участок представляет собой определенное число смежных нуклеооснований антисмыслового соединения.
"Предотвращать" относится к задержке или предупреждению начала или развития заболевания, расстройства или состояния на период времени от минут до неограниченного. Предотвращать также означает снижать риск развития заболевания, расстройства или состояния.
"Пролекарство" означает терапевтический агент, приготовленный в неактивной форме, которая превращается в активную форму в организме или его клетках под действием эндогенных ферментов или других химических соединений или условий.
"Побочные эффекты" означают физиологические ответы, которые могут быть отнесены к лечению, за исключением желательных эффектов. В определенных вариантах воплощения, побочные эффекты включают реакции места инъекции, аномалии теста функции печени, аномалии почечной функции, печеночную токсичность, почечную токсичность, аномалии центральной нервной системы, миопатии и недомогание. Например, повышенные уровни аминотрансферазы в сыворотке могут указывать на печеночную токсичность или аномалию функции печени. Например, повышенный билирубин может указывать на печеночную токсичность или аномалию функции печени.
"Одноцепочечный олигонуклеотид" означает олигонуклеотид, не гибридизированный с комплементарной нитью.
"Специфически гибридизуемый" относится к антисмысловому соединению, имеющему достаточную степень комплементарности между антисмысловым олигонуклеотидом и целевой нуклеиновой кислотой для индуцирования желательного эффекта, при минимальных эффектах воздействия на нецелевые нуклеиновые кислоты или их отсутствии, при условиях, в которых желательно специфическое связывание, т.е. в физиологических условиях в случае in vivo анализов и терапевтического лечения.
"Подкожное введение" означает введение непосредственно под кожу.
"Нацеливание" или "нацеленный" означает процесс конструирования и селекции антисмыслового соединения, которое бы специфически гибридизировалось с целевой нуклеиновой кислотой и индуцировало желательный эффект.
"Целевая нуклеиновая кислота", "целевая РНК" и "транскрипт целевой РНК" все относятся к нуклеиновой кислоте, способной быть мишенью для антисмысловых соединений.
"Целевой сегмент" означает последовательность нуклеотидов целевой нуклеиновой кислоты, на которую нацелено антисмысловое соединение. "5'-Концевой сайт мишени" относится к крайнему с 5'-конца нуклеотиду целевого сегмента. "3'-Концевой сайт мишени" относится к крайнему с 3'-конца нуклеотиду целевого сегмента.
"Терапевтически эффективное количество" означает количество фармацевтического агента, обеспечивающее для индивида терапевтически полезный эффект.
"Транстиретин-специфический ингибитор" или "ингибитор транстиретина" означает любое соединение, способное снижать экспрессию мРНК или белка транстиретина. Примеры таких соединений включают нуклеиновую кислоту, пептид, антитело или ингибитор гистондеацетилазы.
"Транстиретин-специфический модулятор" или "модулятор транстиретина" означает любое соединение, способное повышать или снижать экспрессию мРНК или белка транстиретина.
"Транстиретин-ассоциированный амилоидоз" или "транстиретиновый амилоидоз" или "транстиретиновая амилоидная болезнь", в используемом тут значении, представляет собой любую патологию или болезнь, ассоциированную с дисфункцией или нарушением регуляции транстиретина, приводящим к образованию транстиретин-содержащих амилоидных фибрилл. Транстиретиновый амилоидоз включает, без ограничения, наследственный TTR-амилоидоз, лептоменингеальный амилоидоз, семейную амилоидную полиневропатию (FAP), семейную амилоидную кардиомиопатию, семейный окулолептоменингеальный амилоидоз, старческий амилоидоз сердца или старческий системный амилоидоз.
"Лечить" относится к введению фармацевтической композиции для того, чтобы вызвать изменение или улучшение заболевания, расстройства или состояния.
"Немодифицированный нуклеотид" означает нуклеотид, состоящий из встречающихся в природе нуклеооснований, фрагментов Сахаров и межнуклеозидных связей. В определенных вариантах воплощения, немодифицированный нуклеотид представляет собой РНК-нуклеотид (т.е. β-D-рибонуклеозиды) или ДНК-нуклеотид (т.е. β-D-дезоксирибонуклеозид).
Определенные варианты воплощения
Определенные варианты воплощения предусматривают способы, соединения и композиции для ингибирования экспрессии транстиретина.
Определенные варианты воплощения предусматривают антисмысловые соединения, нацеленные на транстиретиновую нуклеиновую кислоту. В определенных вариантах воплощения, транстиретиновая нуклеиновая кислота представляет собой любую из последовательностей, описанных под №доступа GENBANK NM_000371.2 (включена сюда как SEQ ID NO:1), №доступа GENBANK NT_010966.10, укороченная форма от нуклеотидов 2009236-2017289 (включена сюда как SEQ ID NO:2); экзоны 1-4, выделенные из геномной последовательности макака-резуса, №доступа GENBANK NW_001105671.1, на основании сходства с экзонами человека; и №доступа GENBANK NW_001105671.1, укороченная форма от нуклеотидов 62800O-638000 (включена сюда как SEQ ID NO:4).
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120,122 и 124.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120,122 и 124.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120,122 и 124.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:25, 80, 86 и 87.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 8 до 80 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:80.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 50 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:80.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:80.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:80.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований последовательности, выбранной из последовательностей нуклеооснований, приведенных в SEQ ID NO:80.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 20 до 30 связанных нуклеозидов, в котором связанные нуклеозиды содержат, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18 или, по меньшей мере, 19 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, соединение включает модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, указанных в SEQ ID NO:80.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, в котором связанные нуклеозиды содержат участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины в области, выбранной из нуклеотидов 12O-139, 212-236, 226-245, 293-468, 293-326, 347-381, 425-468, 425-467, 452-478, 452-474, 459-478, 461-519, 462-500, 50O-519, 501-535, 502-531, 505-524, 507-526, 508-527, 514-540, 514-539, 515-534, 516-535, 523-542, 544-606, 544-564, 564-583, 578-601, 58O-608, 58O-599, 584-606, 585-604, 587-606 или 597-617 SEQ ID NO:1. В определенных вариантах воплощения, область выбирают из 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1. В определенных вариантах воплощения, область выбирают из 501-535 или 58O-608 SEQ ID NO:1. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит участок из, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований, участок которых комплементарен с областью, описанной тут.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, в котором связанные нуклеозиды содержат участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины в области, выбранной из нуклеотидов 501-535 или 58O-608 SEQ ID NO:1. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит участок из, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований, комплементарный с областью, описанной тут.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, в котором связанные нуклеозиды содержат участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины в области, выбранной из нуклеотидов 508-527 SEQ ID NO:1. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит участок из, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований, комплементарный с областью, описанной тут.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 15 до 25 связанных нуклеозидов, в котором связанные нуклеозиды содержат участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины в области, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит участок из, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований, комплементарный с областью, описанной тут.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из от 18 до 21 связанных нуклеозидов, в котором связанные нуклеозиды содержат участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины в области, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит участок из, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований, комплементарный с областью, описанной тут.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, в котором связанные нуклеозиды содержат участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины в области, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит участок из, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований, комплементарный с областью, описанной тут. В определенных вариантах воплощения, модифицированный олигонуклеотид на 90%, 95%, 99% или 100% комплементарен к нуклеиновой кислоте, кодирующей транстиретин человека (TTR), например SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, в котором связанные нуклеозиды содержат участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины в области, выбранной из нуклеотидов 508-527 SEQ ID NO:1. В определенных вариантах воплощения, модифицированный олигонуклеотид содержит участок из, по меньшей мере, 9, по меньшей мере, 10, по меньшей мере, 11, по меньшей мере, 12, по меньшей мере, 13, по меньшей мере, 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере, 17, по меньшей мере, 18, по меньшей мере, 19 или, по меньшей мере, 20 смежных нуклеооснований, комплементарный к участку равной длины в области, выбранной из нуклеотидов 508-527 SEQ ID NO:1. В определенных вариантах воплощения, модифицированный олигонуклеотид на 90%, 95%, 99% или 100% комплементарен к нуклеиновой кислоте, кодирующей транстиретин человека (TTR), например SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 60% комплементарных с областью, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 70% комплементарных с областью, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 80% комплементарных с областью, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 90% комплементарных с областью, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 95% комплементарных с областью, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO; 1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 99% комплементарных с областью, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 100% комплементарных с областью, выбранной из нуклеотидов 507-526, 508-527, 515-534, 516-535, 58O-599, 585-604, 587-606 и 589-608 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 60% комплементарных с нуклеотидами 508-527 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 70% комплементарных с нуклеотидами 508-527 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 80% комплементарных с нуклеотидами 508-527 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 90% комплементарных с нуклеотидами 508-527 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 95% комплементарных с нуклеотидами 508-527 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 99% комплементарных с нуклеотидами 508-527 SEQ ID NO:1.
Определенные варианты воплощения предусматривают соединения, включающие модифицированный олигонуклеотид, состоящий из 20 связанных нуклеозидов, на 100% комплементарных с нуклеотидами 508-527 SEQ ID NO:1.
В определенных вариантах воплощения, антисмысловое соединение или модифицированный олигонуклеотид, нацеленный на транстиретиновую нуклеиновую кислоту, нацелены на следующие участки нуклеотидов SEQ ID NO:1: 12O-139, 212-236, 226-245, 293-468, 293-326, 347-381, 425-468, 425-467, 452-478, 452-474, 459-478, 461-519, 462-500, 50O-519, 502-531, 507-526, 505-524, 508-527, 514-540, 514-539, 515-534, 516-535, 523-542, 544-606, 544-564, 564-583, 578-601, 58O-599, 584-606, 585-604, 587-606 или 597-617.
В определенных вариантах воплощения, антисмысловые соединения или модифицированные олигонуклеотиды нацелены на область нуклеиновой кислоты транстиретина. В определенных вариантах воплощения, такие соединения или олигонуклеотиды, нацеленные на область нуклеиновой кислоты транстиретина, содержат участок смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины в области. Например, участок может представлять собой участок из, по меньшей мере, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 смежных нуклеооснований, комплементарный к участку равной длины описанной тут области. В определенных вариантах воплощения, такие соединения или олигонуклеотид нацелены на следующие нуклеотидные области SEQ ID NO:1: 12O-139, 212-236, 226-245, 293-381, 293-366, 353-381, 293-468, 425-468, 425-467, 452-476, 461-481, 461-500, 50O-519, 461-519, 502-531, 502-539, 504-536, 505-525, 506-530, 507-527, 508-527, 508-536, 514-540, 523-542, 544-606, 544-564, 544-583 или 597-617.
В определенных вариантах воплощения, такие соединения или олигонуклеотиды, нацеленные на область нуклеиновой кислоты транстиретина, содержат участок смежных нуклеооснований, комплементарный к участку нуклеооснований равной длины области 501-535 или 58O-608 SEQ ID NO:1.
В определенных вариантах воплощения, следующие нуклеотидные области SEQ ID NO:1, служащие мишенями антисмысловых соединений или олигонуклеотидов, демонстрируют, по меньшей мере, 60% ингибирования: 226-245, 293-366, 357-467, 452-474, 457-476, 459-478, 462-500, 50O-519, 502-531, 504-536, 505-525, 506-530, 507-527, 508-527, 508-536, 514-539, 544-564, 564-583, 578-601, 584-606 или 597-617.
В определенных вариантах воплощения, следующие нуклеотидные области SEQ ID NO:1, служащие мишенями антисмысловых соединений или олигонуклеотидов, демонстрируют, по меньшей мере, 65% ингибирования: 293-366, 357-376, 425-449, 432-467, 452-474, 459-478, 462-500, 50O-519, 502-531, 504-536, 505-525, 506-530, 507-527, 508-527, 508-536, 514-539, 544-563, 564-583, 578-601, 585-606 или 597-617.
В определенных вариантах воплощения, следующие нуклеотидные области SEQ ID NO:1, служащие мишенями антисмысловых соединений или олигонуклеотидов, демонстрируют, по меньшей мере, 70% ингибирования: 293-366, 425-449, 432-467, 452-474, 459-478, 462-500, 50O-519, 502-531, 504-536, 505-525, 506-530, 507-527, 508-527, 508-536, 514-539, 564-583, 578-598, 581-600 или 597-617.
В определенных вариантах воплощения, следующие нуклеотидные области SEQ ID NO:1, служащие мишенями антисмысловых соединений или олигонуклеотидов, демонстрируют, по меньшей мере, 75% ингибирования: 293-322, 347-366, 425-449, 432-467, 452-474, 459-478, 462-500, 50O-519, 503-531, 504-536, 505-525, 506-530, 507-527, 508-527, 508-536, 514-539, 578-598, 581-600 или 597-616.
В определенных вариантах воплощения, следующие нуклеотидные области SEQ ID NO:1, служащие мишенями антисмысловых соединений или олигонуклеотидов, демонстрируют, по меньшей мере, 80% ингибирования: 303-322, 425-449, 432-460, 443-467, 452-473, 481-500, 50O-519, 503-531, 504-536, 505-525, 506-530, 507-527, 508-527, 508-536, 514-536, 519-539, 579-598, 581-600 или 597-616.
В определенных вариантах воплощения, следующие нуклеотидные области SEQ ID NO:1, служащие мишенями антисмысловых соединений или олигонуклеотидов, демонстрируют, по меньшей мере, 85% ингибирования: 427-449, 432-458, 441-460, 443-467, 452-473, 504-531, 504-536, 505-525, 506-530, 507-527, 508-527, 508-536, 514-536, 519-539 или 581-600.
В определенных вариантах воплощения, следующие нуклеотидные области SEQ ID NO:1, служащие мишенями антисмысловых соединений или олигонуклеотидов, демонстрируют, по меньшей мере, 90% ингибирования: 428-449, 432-456, 439-458, 441-460, 445-466, 452-473, 504-525, 508-527 или 515-536.
В определенных вариантах воплощения, следующие нуклеотидные области SEQ ID NO:1, служащие мишенями антисмысловых соединений или олигонуклеотидов, демонстрируют, по меньшей мере, 95% ингибирования: 434-453, 436-456, 441-460, 445-465, 505-524 или 516-535.
В определенных вариантах воплощения, следующие антисмысловые соединения нацелены на область SEQ ID NO:1, нуклеиновой кислоты, кодирующей транстиретин человека, и демонстрируют, по меньшей мере, 60% ингибирования мРНК транстиретина: №№ ISIS: 420954, 420904, 304286, 420874, 420948, 420883, 420955, 420952, 420956, 420957, 420882, 420947, 420950, 304312, 304307, 420879, 420910, 420902, 420908, 420924, 420877, 420880, 304309, 304289, 420906, 304311, 420878, 420911, 304284, 304288, 420909, 304296, 420949, 304290, 304299, 420898, 420920, 420925, 420951, 304287, 420894, 420916, 420918, 420926, 304285, 420919, 420923, 420886, 420900, 420912, 420915, 420917, 420921, 420884, 420885, 420887, 420889, 420892, 420901, 420914, 420897, 420899, 420888, 420895, 420896, 420913, 420922, 420893,420890 или 420891.
В определенных вариантах воплощения, следующие антисмысловые соединения нацелены на область SEQ ID NO:1, нуклеиновой кислоты, кодирующей транстиретин человека, и демонстрируют, по меньшей мере, 65% ингибирования мРНК транстиретина: №№ ISIS: 420955, 420952, 420956, 420957, 420882, 420947, 420950, 304312, 304307, 420879, 420910, 420902, 420908, 420924, 420877, 420880, 304309, 304289, 420906, 304311, 420878, 420911, 304284, 304288, 420909, 304296, 420949, 304290, 304299, 420898, 420920, 420925, 420951, 304287, 420894, 420916, 420918, 420926, 304285, 420919, 420923, 420886, 420900, 420912, 420915, 420917, 420921, 420884, 420885, 420887, 420889, 420892, 420901, 420914, 420897, 420899, 420888, 420895, 420896, 420913, 420922, 420893, 420890 или 420891.
В определенных вариантах воплощения, следующие антисмысловые соединения нацелены на область SEQ ID NO:1, нуклеиновой кислоты, кодирующей транстиретин человека, и демонстрируют, по меньшей мере, 70% ингибирования мРНК транстиретина: №№ ISIS: 304312, 304307, 420879, 420910, 420902, 420908, 420924, 420877, 420880, 304309, 304289, 420906, 304311, 420878, 420911, 304284, 304288, 420909, 304296, 420949, 304290, 304299, 420898, 420920, 420925, 420951, 304287, 420894, 420916, 420918, 420926, 304285, 420919, 420923, 420886, 420900, 420912, 420915, 420917, 420921, 420884, 420885, 420887, 420889, 420892, 420901, 420914, 420897,420899,420888, 420895, 420896, 420913, 420922, 420893, 420890 или 420891.
В определенных вариантах воплощения, следующие антисмысловые соединения нацелены на область SEQ ID NO:1, нуклеиновой кислоты, кодирующей транстиретин человека, и демонстрируют, по меньшей мере, 75% ингибирования мРНК транстиретина: №№ ISIS: 420877, 420878, 420880, 304284, 304285, 420884, 420885, 420886, 420887, 420888, 420889, 420890, 420891, 304287, 420892, 304288, 420893, 304289, 304290, 420894, 420895, 420896, 420897, 420898, 420899, 420900, 420901, 420902, 420906, 420908, 304296, 420909, 420911, 420912, 420913, 420914, 304299, 420915, 420916, 420917, 420918, 420919, 420920, 420921, 420922, 420923, 420924, 420925, 420926, 304309, 420949, 420951 или 304311.
В определенных вариантах воплощения, следующие антисмысловые соединения нацелены на область SEQ ID NO:1, нуклеиновой кислоты, кодирующей транстиретин человека, и демонстрируют, по меньшей мере, 80% ингибирования мРНК транстиретина: №№ ISIS: 304311, 420878, 420911, 304284, 304288, 420909, 304296, 420949, 304290, 304299, 420898, 420920, 420925, 420951, 304287, 420894, 420916, 420918, 420926, 304285, 420919, 420923, 420886, 420900, 420912, 420915, 420917, 420921, 420884, 420885, 420887, 420889, 420892, 420901, 420914, 420897, 420899, 420888, 420895, 420896, 420913, 420922, 420893, 420890 или 420891.
В определенных вариантах воплощения, следующие антисмысловые соединения нацелены на область SEQ ID NO:1, нуклеиновой кислоты, кодирующей транстиретин человека, и демонстрируют, по меньшей мере, 85% ингибирования мРНК транстиретина: №№ ISIS: 304290, 304299, 420898, 420920, 420925, 420951, 304287, 420894, 420916, 420918, 420926, 304285, 420919, 420923, 420886, 420900, 420912, 420915, 420917, 420921, 420884, 420885, 420887, 420889, 420892, 420901, 420914, 420897,420899,420888,420895,420896,420913, 420922, 420893, 420890 или 420891.
В определенных вариантах воплощения, следующие антисмысловые соединения нацелены на область SEQ ID NO:1, нуклеиновой кислоты, кодирующей транстиретин человека, и демонстрируют, по меньшей мере, 90% ингибирования мРНК транстиретина: №№ ISIS: 420923, 420886, 420900, 420912, 420915, 420917, 420921, 420884, 420885, 420887, 420889, 420892, 420901, 420914, 420897, 420899, 420888, 420895, 420896, 420913, 420922, 420893, 420890 или 420891.
В определенных вариантах воплощения, следующие антисмысловые соединения нацелены на область SEQ ID NO:1, нуклеиновой кислоты, кодирующей транстиретин человека, и демонстрируют, по меньшей мере, 95% ингибирования мРНК транстиретина: №№ ISIS: 420888, 420895, 420896, 420913, 420922, 420893, 420890 или 420891.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 12O-139 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 12O-139 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:37. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 12O-139 SEQ ID NO:1, выбирают из № ISIS: 420872.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 212-236 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 212-236 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:8 и 38. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 212-236 SEQ ID NO:1, выбирают из №№ ISIS: 420873 или 304267.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 226-245 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 226-245 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:39. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 226-245 SEQ ID NO:1, выбирают из № ISIS: 420874.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 293-381 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 293-381 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:10, 42-48. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 293-381 SEQ ID NO:1, выбирают из №№ ISIS: 420877, 420878, 420879, 420880, 304280, 420881, 420882 или 420883.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 293-366 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 293-366 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:42-45. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 293-366 SEQ ID NO:1, выбирают из №№ ISIS: 420877, 420878, 420879 или 420880.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 353-381 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 353-381 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:10, 46-48. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 353-381 SEQ ID NO:1, выбирают из №№ ISIS: 304280, 420881, 420882 или 420883.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 293-468 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 293-468 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:1O-18, 42-63. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 293-468 SEQ ID NO:1, выбирают из №№ ISIS: 420877, 420878, 420879, 420880, 304280, 420881, 420882, 420883, 304284, 304285, 420884, 420885, 304286, 420886, 420887, 420888, 420889, 420890, 420891, 304287, 420892, 304288, 420893, 304289, 304290, 420894, 420895, 420896, 420897, 420898 или 304291.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 425-468 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 425-468 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:11-18, 49-63. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 425-468 SEQ ID NO:1, выбирают из №№ ISIS: 304284, 304285, 420884, 420885, 304286, 420886, 420887, 420888, 420889, 420890, 420891, 304287, 420892, 304288, 420893, 304289, 304290, 420894, 420895, 420896, 420897, 420898 или 304291.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 425-467 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 425-468 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:11-17, 49-63. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 425-468 SEQ ID NO:1, выбирают из №№ ISIS: 304284, 304285, 420884, 420885, 304286, 420886, 420887, 420888, 420889, 420890, 420891, 304287, 420892, 304288, 420893, 304289, 304290, 420894, 420895, 420896, 420897 или 420898.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 452-476 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 452-476 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:64-69. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 452-476 SEQ ID NO:1, выбирают из №№ ISIS: 420889, 420890, 420891, 304287, 420892, 304288, 420893, 304289, 304290, 420894, 420895, 420896, 420897, 420898, 304291, 304292, 304293, 420899, 420900, 420901, 420902, 420903 или 420904.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 461-481 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 461-481 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:72-73. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 461-481 SEQ ID NO:1, выбирают из №№ ISIS: 420907 или 420908.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 461-500 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 461-500 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:22, 72 и 73. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 461-500 SEQ ID NO:1, выбирают из №№ ISIS: 420907, 420908 или 304296.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 50O-519 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 50O-519 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:74. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 50O-519 SEQ ID NO:1, выбирают из № ISIS: 420909.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 461-519 SEQ ID NO; 1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 461-519 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:22, 23, 72-74. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 461-519 SEQ ID NO:1, выбирают из №№ ISIS: 420907, 420908, 304296 или 420909.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 502-531 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 502-531 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:25, 75-84. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 502-531 SEQ ID NO:1, выбирают из №№ ISIS: 420910, 420911, 420912, 420913, 420914, 304299, 420915, 420916, 420917, 420918 или 420919.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 502-539 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 502-539 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:25, 26, 75-91. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 502-539 SEQ ID NO:1, выбирают из №№ ISIS: 420910, 420911, 420912, 420913, 420914, 304299, 420915, 420916, 420917, 420918, 420919, 304300, 420920, 420921, 420922, 420923, 420924, 420925 или 420926.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 504-536 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 504-536 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:25, 26, 77-88. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 504-536 SEQ ID NO:1, выбирают из №№ ISIS: 420912, 420913, 420914, 304299, 420915, 420916, 420917, 420918, 420919, 304300, 420920, 420921, 420922 или 420923.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 505-535 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 505-535 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:25, 26, 78-87. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 505-535 SEQ ID NO:1, выбирают из №№ ISIS: 420913, 420914, 304299, 420915, 420916, 420917, 420918, 420919, 304300, 420920, 420921 или 420922.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 506-530 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 506-530 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:25, 79-83. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 506-530 SEQ ID NO:1, выбирают из №№ ISIS: 420913, 420914, 304299, 420915, 420916, 420917, 420918 или 420919.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 507-527 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 507-527 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:25 или 80. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 507-527 SEQ ID NO:1, выбирают из № ISIS: 304299 или 420915.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 508-527 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 508-527 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:80. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 508-527 SEQ ID NO:1, выбирают из № ISIS: 420915.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 514-540 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 514-540 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:85-92. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 514-540 SEQ ID NO:1, выбирают из №№ ISIS: 420920, 420921, 420922, 420923, 420924, 420925, 420926 или 420927.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 523-542 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 523-542 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:94. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 523-542 SEQ ID NO:1, выбирают из № ISIS: 420929.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 544-606 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 544-606 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:3O-33, 112-122. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 544-606 SEQ ID NO:1, выбирают из №№ ISIS: 420947, 420948, 304304, 304307, 304308, 304309, 420949, 420950, 420951, 420952, 420953, 420954, 420955, 420956 или 420957.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 544-564 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 544-564 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:112-113. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 544-564 SEQ ID NO:1, выбирают из №№ ISIS: 420947 или 420948.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 544-583 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 544-583 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:30, 31, 112 и 113. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 544-583 SEQ ID NO:1, выбирают из №№ ISIS: 420947, 420948, 304304 или 304307.
В определенных вариантах воплощения, участком-мишенью являются нуклеотиды 597-617 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение нацелено на нуклеотиды 597-617 SEQ ID NO:1. В определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеиновую кислоту транстиретина, содержит последовательность нуклеооснований, выбранную из SEQ ID NO:34-35. В таких определенных вариантах воплощения, антисмысловое соединение, нацеленное на нуклеотиды 597-617 SEQ ID NO:1, выбирают из №№ ISIS: 304311 или 304312.
В определенных вариантах воплощения, модифицированный олигонуклеотид состоит из одноцепочечного модифицированного олигонуклеотида.
В определенных вариантах воплощения, модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов.
В определенных вариантах воплощения, последовательность нуклеооснований модифицированного олигонуклеотида, по меньшей мере, на 90% комплементарна по ее полной длине последовательности нуклеооснований SEQ ID NO:1, 2 или 4. В определенных вариантах воплощения, последовательность нуклеооснований модифицированного олигонуклеотида, по меньшей мере, на 95% комплементарна по ее полной длине последовательности нуклеооснований SEQ ID NO:1, 2 или 4. В определенных вариантах воплощения, модифицированный олигонуклеотид на, по меньшей мере, 99% комплементарен по его полной длине SEQ ID NO:1, 2 или 4. В определенных вариантах воплощения, последовательность нуклеооснований модифицированного олигонуклеотида на 100% комплементарна по ее полной длине последовательности нуклеооснований SEQ ID NO:1, 2 или 4.
В определенных вариантах воплощения, соединение содержит, по меньшей мере, одну модифицированную межнуклеозидную связь. В определенных вариантах воплощения, межнуклеозидная связь представляет собой фосфоротиоатную межнуклеозидную связь.
В определенных вариантах воплощения, соединение содержит, по меньшей мере, один нуклеозид, включающий модифицированный сахар. В определенных вариантах воплощения, по меньшей мере, один модифицированный сахар представляет собой бициклический сахар. В определенных вариантах воплощения, по меньшей мере, один бициклический сахар содержит мостиковую связь 4'-СН(СН3)-O-2'. В определенных вариантах воплощения, по меньшей мере, один модифицированный сахар содержит 2'-O-метоксиэтил.
В определенных вариантах воплощения, соединение содержит по меньшей мере, один тетрагидропиран-модифицированный нуклеозид, в котором тетрагидропирановое кольцо замещает фуранозное кольцо. В определенных вариантах воплощения, по меньшей мере, один тетрагидропиран-модифицированный нуклеозид имеет структуру:
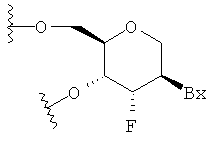
где Вх представляет собой необязательно защищенный фрагмент гетероциклического основания.
В определенных вариантах воплощения, соединение содержит, по меньшей мере, один нуклеозид, включающий модифицированное нуклеооснование. В определенных вариантах воплощения, модифицированное нуклеооснование представляет собой 5-метилцитозин.
В определенных вариантах воплощения, модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из связанных дезоксинуклеозидов;
(ii) 5'-боковой сегмент, состоящий из связанных нуклеозидов;
(iii) 3'-боковой сегмент, состоящий из связанных нуклеозидов, где гэп-сегмент расположен между 5'-боковым сегментом и 3'-боковым сегментом и где каждый нуклеозид каждого бокового сегмента содержит модифицированный сахар.
В определенных вариантах воплощения, модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
(ii) 5'-боковой сегмент, состоящий из пяти связанных нуклеозидов;
(iii) 3'-боковой сегмент, состоящий из пяти связанных нуклеозидов, где гэп-сегмент непосредственно прилегает к, и расположен между 5'-боковым сегментом и 3'-боковым сегментом, где каждый нуклеозид каждого бокового сегмента содержит 2'-O-метоксиэтилированный сахар; и где каждая межнуклеозидная связь представляет собой фосфоротиоатную связь.
В определенных вариантах воплощения, модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
(ii) 5'-боковой сегмент, состоящий из шести связанных нуклеозидов;
(iii) 3'-боковой сегмент, состоящий из шести связанных нуклеозидов, где гэп-сегмент непосредственно прилегает к, и расположен между 5'-боковым сегментом и 3'-боковым сегментом, где каждый нуклеозид каждого бокового сегмента содержит 2'-O-метоксиэтилированный сахар; и где каждая межнуклеозидная связь представляет собой фосфоротиоатную связь.
В определенных вариантах воплощения, модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
(ii) 5'-боковой сегмент, состоящий из пяти связанных нуклеозидов;
(iii) 3'-боковой сегмент, состоящий из пяти связанных нуклеозидов, где гэп-сегмент непосредственно прилегает к, и расположен между 5'-боковым сегментом и 3'-боковым сегментом, где каждый нуклеозид каждого бокового сегмента содержит 2'-O-метоксиэтилированный сахар; и где каждая межнуклеозидная связь представляет собой фосфоротиоатную связь.
В определенных вариантах воплощения, модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
(ii) 5'-боковой сегмент, состоящий из пяти связанных нуклеозидов;
(iii) 3'-боковой сегмент, состоящий из пяти связанных нуклеозидов, где гэп-сегмент непосредственно прилегает к, и расположен между 5'-боковым сегментом и 3'-боковым сегментом, где каждый нуклеозид каждого бокового сегмента содержит 2'-O-метоксиэтилированный сахар; и где каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и где последовательность нуклеооснований включает, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, описанной в SEQ ID NO:80.
В определенных вариантах воплощения, модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
(ii) 5'-боковой сегмент, состоящий из пяти связанных нуклеозидов;
(iii) 3'-боковой сегмент, состоящий из пяти связанных нуклеозидов, где гэп-сегмент непосредственно прилегает к, и расположен между 5'-боковым сегментом и 3'-боковым сегментом, где каждый нуклеозид каждого бокового сегмента содержит 2'-O-метоксиэтилированный сахар; и где каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и где последовательность нуклеооснований описана в SEQ ID NO:80.
Определенные варианты воплощения предусматривают композицию, содержащую соединение, описанное тут, или его соль, и фармацевтически приемлемый носитель или разбавитель. В определенных вариантах воплощения, композиция содержит модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 12 смежных нуклеооснований из последовательности нуклеооснований, выбранных из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124, или его соль и фармацевтически приемлемый носитель или разбавитель.
Определенные варианты воплощения предусматривают композицию, содержащую соединение, описанное тут, или его соль и фармацевтически приемлемый носитель или разбавитель. В определенных вариантах воплощения, композиция содержит модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 12 смежных нуклеооснований из последовательностей нуклеооснований, описанных в SEQ ID NO:80, или его соль и фармацевтически приемлемый носитель или разбавитель.
Определенные варианты воплощения предусматривают композицию, содержащую соединение, описанное тут, где уровень вязкости составляет менее 40 сП. В определенных вариантах воплощения, композиция имеет уровень вязкости менее 15 сП. В определенных вариантах воплощения, композиция имеет уровень вязкости менее 12 сП. В определенных вариантах воплощения, композиция имеет уровень вязкости менееЮсП.
Определенные варианты воплощения предусматривают способы лечения, предотвращения или облегчения транстиретинового амилоидоза.
Определенные варианты воплощения предусматривают способы, включающие введение животному соединения, описанного тут.В определенных вариантах воплощения, способ включает введение животному модифицированного олигонуклеотида, состоящего из от 12 до 30 связанных нуклеозидов и имеющего последовательность нуклеооснований, содержащую, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, выбранных из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120,122 и 124.
Определенные варианты воплощения предусматривают способы, включающие введение животному соединения, описанного тут.В определенных вариантах воплощения, способ включает введение животному соединения или модифицированного олигонуклеотида, состоящего из от 12 до 30 связанных нуклеозидов, где связанные нуклеозиды включают участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку равной длины в области, выбранной из нуклеотидов 501-535 или 58O-608 SEQ ID NO:1.
Определенные варианты воплощения предусматривают способы, включающие введение животному соединения, описанного тут.В определенных вариантах воплощения, способ включает введение животному модифицированного олигонуклеотида, состоящего из от 12 до 30 связанных нуклеозидов, и имеющего последовательность нуклеооснований, содержащую, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, приведенной в SEQ ID NO:80.
Определенные варианты воплощения предусматривают способы, включающие введение животному соединения, описанного тут.В определенных вариантах воплощения, способ включает введение животному соединения или модифицированного олигонуклеотида, состоящего из от 12 до 30 связанных нуклеозидов, где связанные нуклеозиды включают участок из, по меньшей мере, 8 смежных нуклеооснований, комплементарный к участку равной длины в области, выбранной из нуклеотидов 508-527 SEQ ID NO:1.
В определенных вариантах воплощения, животное представляет собой человека.
В определенных вариантах воплощения, введение предотвращает, лечит, облегчает или замедляет развитие транстиретинового амилоидоза, как описано тут.
В определенных вариантах воплощения, соединение вводится совместно со вторым агентом.
В определенных вариантах воплощения, соединение и второй агент вводятся совместно.
В определенных вариантах воплощения, введение представляет собой парентеральное введение. В определенных вариантах воплощения, парентеральное введение представляет собой подкожное введение. В определенных вариантах воплощения, композиция для введения представляет собой соединение в солевом растворе. В определенных вариантах воплощения, соединение включает модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 12 смежных нуклеооснований из последовательности нуклеооснований, выбранных из последовательностей нуклеооснований, описанных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124, или его соль и солевой раствор. В определенных вариантах воплощения, композиция лекарственного средства не содержит каких-либо стабилизаторов или дополнительных стабилизаторов, включая липидные агенты.
В определенных вариантах воплощения, введение представляет собой парентеральное введение. В определенных вариантах воплощения, парентеральное введение представляет собой внутричерепное введение. В определенных вариантах воплощения, внутричерепное введение представляет собой внутримозговое, интратекальное, интравентрикулярное, вентрикулярное, интрацеребровентрикулярное, церебральное интравентрикулярное или церебрально-вентрикулярное введение.
Определенные варианты воплощения дополнительно предусматривают способ снижения экспрессии мРНК или белка транстиретина у животного, включающий введение животному соединения или композиции, описанных тут, для снижения экспрессии мРНК или белка транстиретина у животного. В определенных вариантах воплощения, животное представляет собой человека. В определенных вариантах воплощения, снижение экспрессии мРНК или белка транстиретина предотвращает, лечит, облегчает или замедляет развитие транстиретинового амилоидоза.
Определенные варианты воплощения предусматривают способ лечения человека с транстиретин-ассоциированной болезнью, включающий идентификацию человека с болезнью и введение человеку терапевтически эффективного количества соединения или композиции, описанных тут. В определенных вариантах воплощения, лечение ослабляет симптом, выбранный из группы, состоящей из беспокойства, отсутствия координации, нистагма, спастического парапареза, отсутствия мышечной координации, нарушения зрения, бессонницы, необычных ощущений, миоклонуса, слепоты, потери речи, кистевого туннельного синдрома, эпилептических припадков, субарахноидальных кровоизлияний, инсульта и кровотечения в головном мозге, гидроцефалии, атаксии и спастического паралича, комы, сенсорной невропатии, паратезии, гипестезии, моторной невропатии, автономной невропатии, ортостатической гипотензии, циклического запора, циклической диареи, тошноты, рвоты, пониженного потения, импотенции, замедленного опорожнения желудка, задержки мочевыделения, недержания мочи, прогрессирующей кардиопатии, усталости, одышки, потери веса, отсутствия аппетита, онемения, ощущения покалывания, слабости, увеличенного языка, нефротического синдрома, застойной сердечной недостаточности, одышки при физической нагрузке, периферического отека, аритмий, учащенного сердцебиения, ощущения головокружения, обморока, постуральной гипотензии, проблемы периферических нервов, сенсорно-двигательной недостаточности, невропатии нижних конечностей, невропатии верхних конечностей, гиперальгезии, изменения восприятия температуры, слабости в нижних конечностях, кахексии, периферического отека, гепатомегалии, пурпуры, диастолической дисфункции, экстрасистолы желудочков, черепной невропатии, ослабления глубоких сухожильных рефлексов, амилоидных отложений в стекловидном теле, помутнения стекловидного тела, сухости глаз, глаукомы, зубчатого края зрачков, отечности ног вследствие удерживания воды. В определенных вариантах воплощения, симптом представляет собой когнитивный симптом, выбранный из группы, состоящей из расстройства памяти, расстройства суждения и мышления, расстройства планирования, расстройства гибкости, расстройства абстрактного мышления, расстройства уяснения правил, расстройства инициирования адекватных действий, расстройства ингибирования неадекватных действий, расстройства кратковременной памяти, расстройства длительной памяти, паранойи, дезориентации, спутанности сознания, галлюцинаций и деменции. В определенных вариантах воплощения, симптом представляет собой психиатрический симптом, выбранный из группы, состоящей из деменции; тревожного состояния, депрессии, притупленного аффекта, эгоцентризмов, агрессии, компульсивного поведения, раздражительности, изменений личности, включая расстройства памяти, суждения и мышления и суицидальное мышление.
Дополнительные варианты воплощения предусматривают способ лечения человека с транстиретиновым амилоидозом, приводящим к амилоидозу сердца, и введение человеку терапевтически эффективного количества соединения или композиции, описанных тут. В определенных вариантах воплощения, лечение ослабляет симптом, выбранный из группы, состоящей из застойной сердечной недостаточности, кардиомегалии, одышки при физической нагрузке, периферического отека, аритмий, учащенного сердцебиения, головокружения, обморока, отложения в субэндотелии периферической сосудистой сети могут приводить к тяжелой постуральной гипотензии, диастолической дисфункции, блокаде сердца, экстрасистолам желудочков и различным тахиаритмиям.
Дополнительные варианты воплощения предусматривают способ лечения человека с транстиретиновым амилоидозом, приводящим к периферическим невропатическим расстройствам, и введение человеку терапевтически эффективного количества соединения или композиции, описанных тут. В определенных вариантах воплощения, лечение ослабляет симптом, выбранный из группы, состоящей из проблем периферических нервов, сенсомоторных расстройств, невропатии нижних конечностей, невропатии верхних конечностей, гиперальгезии, изменения восприятия температуры, слабости в нижних конечностях, боли, дисфункции вегетативной системы, часто проявляющейся как сексуальная дисфункция или дисфункция мочевыводящей системы, симметричных сенсорных расстройств и слабости, ортостатической гипотензии, диареи и/или импотенции.
Дополнительные варианты воплощения предусматривают способ лечения человека с транстиретиновым амилоидозом, приводящим к желудочно-кишечным расстройствам, и введение человеку терапевтически эффективного количества соединения или композиции, описанных тут. В определенных вариантах воплощения, лечение ослабляет симптом, выбранный из группы, состоящей из диареи, запора, тошноты, рвоты и родственных расстройств почек и печени.
Дополнительно предусматривается способ ослабления или предотвращения транстиретинового амилоидоза, включающий введение человеку терапевтически эффективного количества соединения или композиции, описанных тут, тем самым снижая или предотвращая транстиретиновый амилоидоз.
Дополнительно предусматривается способ ослабления или предотвращения заболевания сердца, включающий введение человеку терапевтически эффективного количества соединения или композиции, описанных тут, тем самым ослабляя или предотвращая заболевание сердца. Дополнительно предусматривается способ ослабления или предотвращения невропатического заболевания, включающий введение человеку терапевтически эффективного количества соединения или композиции, описанных тут, тем самым ослабляя или предотвращая невропатическое заболевание. Дополнительно предусматривается способ ослабления или предотвращения желудочно-кишечного заболевания, включающий введение человеку терапевтически эффективного количества соединения или композиции, описанных тут, тем самым ослабляя или предотвращая желудочно-кишечное заболевание.
Дополнительно предусматривается способ облегчения симптома транстиретинового амилоидоза, включающий введение нуждающемуся в этом человеку соединения, содержащего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, где указанный модифицированный олигонуклеотид специфически гибридизуется с SEQ ID NO:1, 2 или 4, тем самым облегчая симптом транстиретинового амилоидоза у человека.
Дополнительно предусматривается способ снижения скорости прогрессирования симптома, ассоциированного с транстиретиновым амилоидозом, включающий введение нуждающемуся в этом человеку соединения, содержащего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, где указанный модифицированный олигонуклеотид специфически гибридизуется с SEQ ID NO:1, 2 или 4, тем самым снижая скорость прогрессирования симптома транстиретинового амилоидоза у человека.
Дополнительно предусматривается способ обращения дегенерации, определяемой по симптому, ассоциированному с транстиретиновым амилоидозом, включающий введение нуждающемуся в этом человеку соединения, содержащего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов, где указанный модифицированный олигонуклеотид специфически гибридизуется с SEQ ID NO:1, 2 или 4, тем самым обращая дегенерацию, определяемую по симптому транстиретиновой амилоидной болезни у человека.
Дополнительно предусматривается способ облегчения симптома транстиретинового амилоидоза, включающий введение нуждающемуся в этом человеку соединения, содержащего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, приведенной в SEQ ID NO:80, тем самым облегчая симптом транстиретинового амилоидоза у человека.
Дополнительные варианты воплощения предусматривают способ лечения человека с транстиретиновым амилоидозом, введение нуждающемуся в этом человеку соединения, содержащего модифицированный олигонуклеотид, состоящий из от 12 до 30 связанных нуклеозидов и имеющий последовательность нуклеооснований, содержащую, по меньшей мере, 8 смежных нуклеооснований из последовательности нуклеооснований, приведенной в SEQ ID NO:80, тем самым осуществляя лечение транстиретинового амилоидоза у человека.
В определенных вариантах воплощения, симптом представляет собой физический, когнитивный, психиатрический или периферический симптом. В определенных вариантах воплощения, симптом представляет собой физический симптом, выбранный из группы, состоящей из беспокойства, отсутствия координации, нистагма, спастического парапареза, отсутствия мышечной координации, нарушения зрения, бессонницы, необычных ощущений, миоклонуса, слепоты, потери речи, кистевого туннельного синдрома, эпилептических припадков, субарахноидальных кровоизлияний, инсульта и кровотечения в головном мозге, гидроцефалии, атаксии и спастического паралича, комы, сенсорной невропатии, паратезии, гипестезии, моторной невропатии, автономной невропатии, ортостатической гипотензии, циклического запора, циклической диареи, тошноты, рвоты, пониженного потения, импотенции, замедленного опорожнения желудка, задержки мочевыделения, недержания мочи, прогрессирующей кардиопатии, усталости, одышки, потери веса, отсутствия аппетита, онемения, ощущения покалывания, слабости, увеличенного языка, нефротического синдрома, застойной сердечной недостаточности, одышки при физической нагрузке, периферического отека, аритмий, учащенного сердцебиения, ощущения головокружения, обморока, постуральной гипотензии, проблемы периферических нервов, сенсорно-двигательной недостаточности, невропатии нижних конечностей, невропатии верхних конечностей, гиперальгезии, изменения восприятия температуры, слабости в нижних конечностях, кахексии, периферического отека, гепатомегалии, пурпуры, диастолической дисфункции, экстрасистолы желудочков, черепной невропатии, ослабления глубоких сухожильных рефлексов, амилоидных отложений в стекловидном теле, помутнения стекловидного тела, сухости глаз, глаукомы, зубчатого края зрачков, отечности ног вследствие удерживания воды.
В определенных вариантах воплощения, симптом представляет собой когнитивный симптом, выбранный из группы, состоящей из расстройства памяти, расстройства суждения и мышления, расстройства планирования, расстройства гибкости, расстройства абстрактного мышления, расстройства уяснения правил, расстройства инициирования адекватных действий, расстройства ингибирования неадекватных действий, расстройства кратковременной памяти, расстройства длительной памяти, паранойи, дезориентации, спутанности сознания, галлюцинаций и деменции. В определенных вариантах воплощения, симптом представляет собой психиатрический симптом, выбранный из группы, состоящей из деменции; тревожного состояния, депрессии, притупленного аффекта, эгоцентризмов, агрессии, компульсивного поведения, раздражительности, изменений личности, включая расстройства памяти, суждения и мышления, и суицидальное мышление.
В определенных вариантах воплощения, симптом является, по меньшей мере, одним из, по меньшей мере, одного физического симптома, по меньшей мере, одного когнитивного симптома, по меньшей мере, одного психиатрического симптома и, по меньшей мере, одного периферического симптома.
В определенных вариантах воплощения, физический симптом выбирают из группы, состоящей из беспокойства, отсутствия координации, непреднамеренно инициируемых движений, непреднамеренно незавершенных движений, неустойчивой походки, хореи, ригидности, извивающихся движений, аномального положения тела, неустойчивости, аномального выражения лица, затрудненного жевания, затрудненного глотания, затрудненного разговора, эпилептического припадка и нарушений сна.
В определенных вариантах воплощения, когнитивный симптом выбирают из группы, состоящей из расстройства памяти, расстройства суждения и мышления, расстройства планирования, расстройства гибкости, расстройства абстрактного мышления, расстройства уяснения правил, расстройства инициирования адекватных действий, расстройства ингибирования неадекватных действий, расстройства кратковременной памяти, расстройства длительной памяти, паранойи, дезориентации, спутанности сознания, галлюцинаций и деменции.
В определенных вариантах воплощения, психиатрический симптом выбирают из группы, состоящей из деменции; тревожного состояния, депрессии, притупленного аффекта, эгоцентризмов, агрессии, компульсивного поведения, раздражительности, изменений личности, включая расстройства памяти, суждения и мышления и суицидальное мышление.
В определенных вариантах воплощения, периферический симптом выбирают из группы, состоящей из уменьшенной массы головного мозга, мышечной атрофии, сердечной недостаточности, нарушенной толерантности к глюкозе, потери веса, остеопороза и тестикулярной атрофии.
Также предусматриваются способы и соединения для изготовления лекарственного средства для лечения, предотвращения или облегчения болезни, связанной с центральной нервной системой.
Определенные варианты воплощения предусматривают использование соединения, описанного тут, в производстве лекарственного средства для лечения, облегчения или предотвращения транстиретинового амилоидоза.
Определенные варианты воплощения предусматривают соединение, описанное тут, для использования при лечении, предотвращении или облегчении транстиретинового амилоидоза, описанного тут, с помощью комбинированной терапии с дополнительным агентом или терапией, описанными тут. Агенты или терапии могут использоваться путем совместного или сопутствующего введения.
Определенные варианты воплощения предусматривают использование соединения, описанного тут, в производстве лекарственного средства для лечения, предотвращения или облегчения транстиретинового амилоидоза, описанного тут, с помощью комбинированной терапии с дополнительным агентом или терапией, описанными тут. Агенты или терапии могут использоваться путем совместного или сопутствующего введения.
Определенные варианты воплощения предусматривают использование соединения, описанного тут, в производстве лекарственного средства для лечения, предотвращения или облегчения транстиретинового амилоидоза, описанного тут, у пациента, которому впоследствии вводится дополнительный агент или проводится терапия, описанные тут.
Определенные варианты воплощения предусматривают набор для лечения, предотвращения или облегчения транстиретинового амилоидоза, описанного тут, включающий:
(i) соединение, описанное тут; и, альтернативно
(ii) дополнительный агент или терапию, описанные тут.
Набор, описанный тут, может дополнительно включать инструкции по использованию набора для лечения, предотвращения или облегчения транстиретинового амилоидоза, описанного тут, с помощью комбинированной терапии, описанной тут.
Антисмысловые соединения
Олигомерные соединения включают, без ограничений, олигонуклеотиды, олигонуклеозиды, олигонуклеотидные аналоги, олигонуклеотидные миметики, антисмысловые соединения, антисмысловые олигонуклеотиды и siPHK. Олигомерное соединение может быть "антисмысловым" по отношению к целевой нуклеиновой кислоте, что означает его способность к гибридизации с целевой нуклеиновой кислотой посредством образования водородной связи.
В определенных вариантах воплощения, антисмысловое соединение имеет последовательность нуклеооснований, которая, при записи в направлении от 5'- к 3'-концу, включает обратный комплемент сегмента-мишени целевой нуклеиновой кислоты, на которую оно нацелено. В таких определенных вариантах воплощения, антисмысловой олигонуклеотид имеет последовательность нуклеооснований, которая, при записи в направлении от 5'- к 3'-концу, включает обратный комплемент сегмента-мишени целевой нуклеиновой кислоты, на который он нацелен.
В определенных вариантах воплощения, антисмысловое соединение, нацеленное на транстиретиновую нуклеиновую кислоту, содержит в длину от 12 до 30 нуклеотидов. Другими словами, антисмысловые соединения представляют собой от 12 до 30 связанных нуклеооснований. В других вариантах воплощения, антисмысловое соединение включает модифицированный олигонуклеотид, состоящий из от 8 до 80, от 12 до 50, от 12 до 30, от 15 до 30, от 18 до 24, от 18 до 21, от 19 до 22 или 20 связанных нуклеооснований. В таких определенных вариантах воплощения, антисмысловое соединение включает модифицированный олигонуклеотид, состоящий из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 связанных нуклеооснований в длину, или интервала, образованного любыми двумя из вышеуказанных значений.
В определенных вариантах воплощения, антисмысловое соединение содержит укороченный или усеченный модифицированный олигонуклеотид. Укороченный или усеченный модифицированный олигонуклеотид может иметь делецию одного нуклеозида на 5'-конце (5'-усеченный) или, альтернативно, на 3'-конце (3'-усеченный). Укороченный или усеченный олигонуклеотид может иметь делецию двух нуклеозидов на 5'-конце или, альтернативно, может иметь делецию двух субъединиц на 3'-конце.
Альтернативно, делеции нуклеозидов могут быть разбросаны по модифицированному олигонуклеотиду, например, в антисмысловом соединении, имеющем делецию одного нуклеозида на 5'-конце и делецию одного нуклеозида на 3'-конце.
В случае присутствия одного дополнительного нуклеозида в удлиненном олигонуклеотиде, дополнительный нуклеозид могут быть расположен на 5'- или 3'-конце олигонуклеотида. В случае присутствия двух или больше дополнительных нуклеозидов, добавленные нуклеозиды могут прилегать друг к другу, например, в олигонуклеотиде, имеющем два добавленных нуклеозида на 5'-конце (5'-аддиция) или, альтернативно, на 3'-конце (3'-аддиция) олигонуклеотида. Альтернативно, добавленные нуклеозиды могут быть разбросаны по антисмысловому соединению, например, в олигонуклеотиде, имеющем один добавленный нуклеозид на 5'-конце и одну добавленную субъединицу на 3'-конце.
Возможно увеличение или уменьшение длины антисмыслового соединения, такого как антисмысловой олигонуклеотид, и/или введение неспаривающихся оснований без потери активности. Например, в работе Woolf et al. (Proc. Natl. Acad. Sci. USA 89:7305-7309, 1992), ряд антисмысловых олигонуклеотидов длиной 13-25 нуклеооснований были протестированы на их способность индуцирования расщепления РНК-мишени в модели инъекции ооцита. Антисмысловые олигонуклеотиды длиной 25 нуклеооснований с 8 или 11 неспаривающимися основаниями возле концов антисмысловых олигонуклеотидов были способны управлять специфическим расщеплением РНК-мишени, хотя и в меньшей степени, чем антисмысловые олигонуклеотиды, не содержащие неспаривающихся оснований. Аналогично, специфическое расщепление мишени достигалось при использовании антисмысловых олигонуклеотидов из 13 нуклеооснований, включая содержащие 1 или 3 неспаривающихся оснований.
Gautschi et al (J. Natl. Cancer Inst. 93:463-471, March 2001) продемонстрировали способность олигонуклеотида, имеющего 100% комплементарности к мРНК bcl-2 и 3 неспаривающихся основания с мРНК bcl-xL, к снижению экспрессии как bcl-2, так и bcl-xL, in vitro и in vivo. Кроме того, этот олигонуклеотид продемонстрировал высокую противоопухолевую активность in vivo.
Maher and Dolnick (Nuc. Acid. Res. 16:3341-3358,1988) провели испытания ряда тандемных антисмысловых олигонуклеотидов с 14 нуклеооснованиями и антисмысловых олигонуклеотидов из 28 и 42 нуклеооснований, состоящих из последовательности двух или трех тандемных антисмысловых олигонуклеотидов, соответственно, на их способность останавливать трансляцию человеческой DHFR (дигидрофолатредуктаза) в анализе с использованием ретикулоцитов кролика. Каждый из трех антисмысловых олигонуклеотидов с 14 нуклеооснованиями был способен сам ингибировать трансляцию, хотя и на более низком уровне, чем антисмысловые олигонуклеотиды с 28 или 42 нуклеооснованиями.
Мотивы антисмысловых соединений
В определенных вариантах воплощения, антисмысловые соединения, нацеленные на транстиретиновую нуклеиновую кислоту, содержат химически модифицированные субъединицы, организованные в наборы или мотивы, для придания антисмысловому соединению таких свойств, как повышенная ингибирующая активность, повышенная афинность связывания с целевой нуклеиновой кислотой или устойчивость к деградации in vivo нуклеазами.
Химерные антисмысловые соединения типично содержат, по меньшей мере, один участок, модифицированный таким образом, чтобы придать повышенную устойчивость к деградации нуклеазой, повышенное поглощение клетками, повышенную афинность связывания с целевой нуклеиновой кислотой и/или повышенную ингибирующую активность. Второй участок химерного антисмыслового соединения может, необязательно, служить субстратом РНКазы Н клеточной эндонуклеазы, которая отщепляет нить РНК дуплекса РНК:ДНК.
Антисмысловые соединения, содержащие мотив гапмера, считаются химерными антисмысловыми соединениями. В гапмере внутренний участок, имеющий множество нуклеотидов или связанных нуклеозидов, поддерживающих расщепление РНКазой Н, расположен между внешними участками, содержащими множество нуклеотидов или связанных нуклеозидов, химически отличающихся от нуклеотидов или связанных нуклеозидов внутреннего участка. В случае антисмыслового олигонуклеотида, имеющего мотив гапмера, гэп-сегмент обычно служит субстратом эндонуклеазного расщепления, в то время как боковые сегменты содержат модифицированные нуклеозиды. В определенных вариантах воплощения, области гапмера дифференцируются по типам фрагментов Сахаров, составляющих каждый отличающийся участок. Типы фрагментов Сахаров, используемые для дифференциации областей гапмера, могут в некоторых вариантах воплощения включать β-D-рибонуклеозиды, β-D-дезоксирибонуклеозиды, 2'-модифицированные нуклеозиды (такие 2'-модифицированные нуклеозиды могут включать 2'-МОЕ и 2'-O-СН3, наряду с другими) и модифицированные нуклеозиды с бициклическими сахарами (такие нуклеозиды, модифицированные бициклическими сахарами, могут включать вещества, имеющие мостик 4'-(СН2)n-O-2', где n=1 или n=2). Предпочтительно, каждый отличный участок содержит однотипные фрагменты Сахаров. Мотив "боковой фрагмент-гэп-сегмент-боковой фрагмент" часто описывают как "X-Y-Z", где "X" обозначает длину 5'-бокового участка, "Y" обозначает длину гэп-сегмента и "Z" обозначает длину 3'-бокового участка. В используемом тут значении, гапмер, описанный как "X-Y-Z", имеет такую конфигурацию, чтобы гэп-сегмент непосредственно прилегал к каждому из 5'-бокового сегмента и 3'-бокового сегмента. Таким образом, отсутствуют промежуточные нуклеотиды между 5'-боковым сегментом и гэп-сегментом или гэп-сегментом и 3'-боковым сегментом. Любые антисмысловые соединения, описанные тут, могут содержать мотив гапмера. В некоторых вариантах воплощения, Х и Z являются одинаковыми, в других вариантах воплощения они различаются. В предпочтительном варианте воплощения, Y составляет от 8 до 15 нуклеотидов. X, Y или Z могут иметь любое значение из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30 или больше нуклеотидов. Таким образом, гапмеры включают, без ограничений, например, 5-10-5, 4-8-4, 4-12-3, 4-12-4, 3-14-3, 2-13-5, 2-16-2, 1-18-1, 3-10-3, 2-10-2, 1-10-1, 2-8-2, 6-8-6 или 5-8-5.
В определенных вариантах воплощения, антисмысловое соединение представляет собой мотив "вингмер", имеющий конфигурацию "боковой фрагмент-гэп-сегмент" или "гэп-сегмент-боковой фрагмент", т.е. конфигурацию X-Y или Y-Z, как описано выше для конфигурации гапмера. Таким образом, конфигурации типа вингмер включают, без ограничений, например, 5-10, 8-4, 4-12, 12-4, 3-14, 16-2, 18-1, 1O-3, 2-10, 1-10,8-2, 2-13 или 5-13.
В определенных вариантах воплощения, антисмысловые соединения, нацеленные на транстиретиновую нуклеиновую кислоту, содержат мотив гапмера 5-10-5.
В определенных вариантах воплощения, антисмысловые соединения, нацеленные на транстиретиновую нуклеиновую кислоту, содержат мотив гапмера 6-8-6.
В определенных вариантах воплощения, антисмысловые соединения, нацеленные на транстиретиновую нуклеиновую кислоту, содержат мотив гапмера 5-8-5.
В определенных вариантах воплощения, антисмысловое соединение, нацеленное на транстиретиновую нуклеиновую кислоту, содержит "расширенный за счет гэпа" мотив.
В определенных вариантах воплощения, расширенный за счет гэпа антисмысловой олигонуклеотид, нацеленный на транстиретиновую нуклеиновую кислоту, имеет гэп-сегмент из десяти 2'-дезоксирибонуклеотидов, непосредственно прилегающий к и расположенный между боковыми сегментами из пяти химически модифицированных нуклеозидов. В определенных вариантах воплощения, химическая модификация включает модификацию 2'-сахара. В другом варианте воплощения, химическая модификация включает модификацию 2'-МОЕ сахара.
В определенных вариантах воплощения, расширенный за счет гэпа антисмысловой олигонуклеотид, нацеленный на транстиретиновую нуклеиновую кислоту, имеет гэп-сегмент из восьми 2'-дезоксирибонуклеотидов, непосредственно прилегающий к и расположенный между боковыми сегментами из пяти химически модифицированных нуклеозидов. В определенных вариантах воплощения, химическая модификация включает модификацию 2'-сахара. В другом варианте воплощения, химическая модификация включает модификацию 2'-МОЕ сахара.
В определенных вариантах воплощения, расширенный за счет гэпа антисмысловой олигонуклеотид, нацеленный на транстиретиновую нуклеиновую кислоту, имеет гэп-сегмент из восьми 2'-дезоксирибонуклеотидов, непосредственно прилегающий к и расположенный между боковыми сегментами из шести химически модифицированных нуклеозидов. В определенных вариантах воплощения, химическая модификация включает модификацию 2'-сахара. В другом варианте воплощения, химическая модификация включает модификацию 2'-МОЕ сахара.
Целевые нуклеиновые кислоты, участки и нуклеотидные последовательности-мишени
В определенных вариантах воплощения, транстиретиновая нуклеиновая кислота представляет собой любую из последовательностей, описанных в № доступа GENBANK® NM_000371.2, впервые депонированных в GENBANK® 13 февраля 2008 года (включена сюда как SEQ ID NO:1), №доступа GENBANK® NT_010966.10, усеченная от нуклеотидов 2009236-2017289, впервые депонированная в GENBANK® 1 августа 2002 года (включена сюда как SEQ ID NO:2); экзоны 1-4, выделенные из геномной последовательности макака-резуса №доступа GENBANK® NW_001105671.1, на основании сходства с экзонами человека; и № доступа GENBANK® NW_001105671.1, усеченная от нуклеотидов 62800O-638000 (включена сюда как SEQ ID NO:4), впервые депонированная в GENBANK® 28 марта 2006 года.
Подразумевается, что последовательности, описанные в каждом SEQ ID NO в приведенных тут Примерах, являются независимыми от любых модификаций фрагмента сахара, межнуклеозидной связи или нуклеооснования. Фактически, антисмысловые соединения, определенные SEQ ID NO, могут содержать, независимо, одну или несколько модификаций фрагмента сахара, межнуклеозидной связи или нуклеооснования. Антисмысловые соединения, описанные по Номерам Isis (Isis No) или № ISIS, указывают комбинацию последовательности нуклеооснований и мотива.
В определенных вариантах воплощения, участок-мишень представляет собой структурно определенную область целевой нуклеиновой кислоты. Например, участок-мишень может охватывать 3'-UTR (нетранслируемая область), 5'-UTR, экзон, интрон, сочленение экзон/интрон, кодирующую область, область инициации трансляции, область терминации трансляции или другую определенную область нуклеиновой кислоты. Структурно определенные области транстиретина могут быть получены по номерам доступа из баз данных последовательностей, таких как NCBI, и такая информация включена сюда в качестве ссылок. В определенных вариантах воплощения, участок-мишень может охватывать последовательность от 5'-концевого сайта-мишени одного целевого сегмента участка-мишени до 3'-концевого сайта-мишени другого целевого сегмента участка-мишени.
Нацеливание включает определение, по меньшей мере, одного целевого сегмента, с которым гибридизуется антисмысловое соединение с возникновением желательного эффекта. В определенных вариантах воплощения, желательный эффект представляет собой снижение уровней мРНК целевой нуклеиновой кислоты. В определенных вариантах воплощения, желательный эффект представляет собой снижение уровней белка, кодируемого целевой нуклеиновой кислотой, или фенотипическое изменение, ассоциированное с целевой нуклеиновой кислотой.
Участок-мишень может содержать один или несколько целевых сегментов. Множество целевых сегментов участка-мишени могут быть перекрывающимися. Альтернативно, они могут быть неперекрывающимися. В определенных вариантах воплощения, целевые сегменты участка-мишени разделены не более чем примерно 300 нуклеотидами. В определенных вариантах воплощения, целевые сегменты участка-мишени разделены числом нуклеотидов, составляющим, составляющим примерно, составляющим не более чем, составляющим не более чем примерно, 250, 200, 150, 100, 90, 80, 70, 60, 50, 40, 30, 20 или 10 нуклеотидов целевой нуклеиновой кислоты, или представляющим собой интервал, определенный любыми двумя из предшествующих значений. В определенных вариантах воплощения, целевые сегменты участка-мишени разделены не более чем, или не более чем примерно, 5 нуклеотидами целевой нуклеиновой кислоты. В определенных вариантах воплощения, целевые сегменты являются смежными. Предусматриваются участки-мишени, определенные интервалом, имеющим в качестве начальной нуклеиновой кислоты любую из 5'-концевых сайтов-мишеней или 3'-концевых сайтов-мишеней, указанных тут.
Пригодные целевые сегменты могут присутствовать в 5'-UTR, кодирующей области, 3'-UTR, интроне, экзоне или сочленении экзон/интрон. Целевые сегменты, содержащие инициирующий кодон или терминирующий кодон, также являются пригодными целевыми сегментами. Пригодный целевой сегмент может специфически исключать определенную структурно определенную область, такую как инициирующий кодон или терминирующий кодон.
Определение пригодных целевых сегментов может включать сравнение последовательности целевой нуклеиновой кислоты с другими последовательностями генома. Например, алгоритм BLAST может быть использован для идентификации областей подобия в разных нуклеиновых кислотах. Это сравнение может предотвратить выбор последовательностей антисмыслового соединения, которые могут неспецифично гибридизоваться с последовательностями, отличными от выбранной целевой нуклеиновой кислоты (т.е., нецелевыми или не являющимися мишенями последовательностями).
Могут наблюдаться изменения активности (например, определяемой по проценту снижения уровней целевой нуклеиновой кислоты) антисмысловых соединений в активном участке-мишени. В определенных вариантах воплощения, снижения уровней мРНК транстиретина указывают на ингибирование экспрессии транстиретина. Снижение уровней белка транстиретина также указывает на ингибирование экспрессии мРНК-мишени. Кроме того, фенотипические изменения указывают на ингибирование экспрессии транстиретина. Например, могут проводиться анализы для определения увеличения размера головного мозга до нормального, улучшения координации движений, уменьшения постоянных мышечных спазмов (дистонии), снижения раздражительности и/или тревожного состояния, улучшения памяти или увеличения активности, в числе других фенотипических изменений. Другие фенотипические показатели, например, симптомы, ассоциированные с транстиретиновым амилоидозом, также могут быть определены, как описано ниже.
Гибридизация
В некоторых вариантах воплощения, происходит гибридизация между антисмысловым соединением, раскрытым тут, и транстиретиновой нуклеиновой кислотой. Наиболее распространенный механизм гибридизации включает водородные связи (например, Уотсона-Крика, Хугстиновские или обращенные Хугстиновские водородные связи) между комплементарными нуклеооснованиями молекул нуклеиновой кислоты.
Гибридизация может протекать при различных условиях. Жесткие условия являются зависимыми от последовательности и определяются природой и составом молекул нуклеиновой кислоты, подлежащих гибридизации.
Способы определения того, является ли последовательность специфически гибридизуемой с целевой нуклеиновой кислотой, хорошо известны специалистам. В определенных вариантах воплощения, предусматриваемые тут антисмысловые соединения являются специфически гибридизующимися с транстиретиновой нуклеиновой кислотой.
Комплементарность
Антисмысловое соединение и целевая нуклеиновая кислота являются комплементарными друг к другу, если достаточное число нуклеооснований антисмыслового соединения могут образовывать водородные связи с соответствующими нуклеооснованиями целевой нуклеиновой кислоты, так чтобы достигался желательный эффект (например, антисмысловое ингибирование целевой нуклеиновой кислоты, такой как транстиретиновая нуклеиновая кислота).
Антисмысловое соединение может гибридизироваться с одним или несколькими сегментами нуклеиновой кислоты транстиретина таким образом, что промежуточные или прилегающие сегменты не будут принимать участия в событии гибридизации (например, структура петли, дефект спаривания или структура шпильки).
В определенных вариантах воплощения, антисмысловые соединения, предусматриваемые тут, или их определенный участок, являются комплементарными или, по меньшей мере, на 70%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% комплементарными к транстиретиновой нуклеиновой кислоте, участку-мишени, целевому сегменту или их определенному участку. Процент комплементарности антисмыслового соединения с целевой нуклеиновой кислотой может быть определен с использованием обычных способов.
Например, антисмысловое соединение, в котором 18 из 20 нуклеооснований антисмыслового соединения являются комплементарными к участку-мишени и будут поэтому специфически гибрид изоваться, будут составлять 90 процентов комплементарности. В этом примере, остальные некомплементарные нуклеооснования могут быть сгруппированы или перемежаться с комплементарными нуклеооснованиями и не должны быть смежными друг с другом или с комплементарными нуклеооснованиями. Фактически, антисмысловое соединение, имеющее 18 нуклеооснований в длину и 4 (четыре) некомплементарных нуклеооснования, фланкируемых двумя участками полной комплементарности с целевой нуклеиновой кислотой, будет иметь 77,8% общей комплементарности с целевой нуклеиновой кислотой и, таким образом, будет входить в объем настоящего изобретения. Процент комплементарности антисмыслового соединения с областью целевой нуклеиновой кислоты может быть определен в установленном порядке с использованием программ BLAST (от английского "basic local alignment search tools" - инструмент поиска базового локального выравнивания) и программ PowerBLAST, известных специалистам (Altschul et al., J. Mol. Biol., 1990, 215, 403 410; Zhang and Madden, Genome Res., 1997, 7, 649 656). Процент гомологии, идентичность или комплементарность последовательностей, могут быть определены, например, с помощью программы Gap (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, Madison Wis.), с использованием параметров по умолчанию, которая использует алгоритм Смита-Уотермана (Smith and Waterman) (Adv. Appl. Math., 1981, 2, 482 489).
В определенных вариантах воплощения, антисмысловые соединения, предусматриваемые тут, или их определенные участки, являются полностью комплементарными (т.е. 100% комплементарными) к целевой нуклеиновой кислоте, или их определенному участку. Например, антисмысловое соединение может быть полностью комплементарным к транстиретиновой нуклеиновой кислоте или участку-мишени или целевому сегменту или его последовательности-мишени. В используемом тут значении, "полностью комплементарный" означает, что каждое нуклеооснование антисмыслового соединения способно к точному спариванию с соответствующими нуклеооснованиями целевой нуклеиновой кислоты. Например, антисмысловое соединение из 20 нуклеооснований является полностью комплементарным к последовательности-мишени длиной 400 нуклеооснований, если существует соответствующий участок из 20 нуклеооснований целевой нуклеиновой кислоты, полностью комплементарный к антисмысловому соединению. Полностью комплементарный также может использоваться по отношению к определенному участку первой и/или второй нуклеиновой кислоты. Например, участок из 20 нуклеооснований антисмыслового соединения, состоящего из 30 нуклеооснований, может быть "полностью комплементарным" к целевой последовательности длиной 400 нуклеооснований. Участок из 20 нуклеооснований олигонукпеотида, содержащего 30 нуклеооснований, является полностью комплементарным к целевой последовательности, если целевая последовательность содержит соответствующий участок из 20 нуклеооснований, в котором каждое нуклеооснование является комплементарным к участку из 20 нуклеооснований антисмыслового соединения. Одновременно, антисмысловое соединение в целом, содержащее 30 нуклеооснований, может быть или не быть полностью комплементарным к целевой последовательности, в зависимости от того, являются ли остальные 10 нуклеооснований антисмыслового соединения также комплементарными к целевой последовательности.
Некомплементарное нуклеооснование может находиться на 5'-конце или 3'-конце антисмыслового соединения. Альтернативно, некомплементарное нуклеооснование или нуклеооснования могут быть расположены во внутренней части антисмыслового соединения. В случае присутствия двух или больше некомплементарных нуклеооснований, они могут быть смежными (т.е. связанными) или несмежными. В одном варианте воплощения, некомплементарное нуклеооснование расположено в боковом сегменте гапмера антисмыслового олигонуклеотида.
В определенных вариантах воплощения, антисмысловые соединения, имеющие в длину 12, 13, 14, 15, 16, 17, 18, 19 или 20 нуклеооснований или значения до указанных, содержат не более чем 4, не более чем 3, не более чем 2 или не более чем 1 некомплементарное нуклеооснование (нуклеооснования) по сравнению с целевой нуклеиновой кислотой, такой как транстиретиновая нуклеиновая кислота или ее определенный участок.
В определенных вариантах воплощения, антисмысловые соединения, имеющие в длину 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеооснований или значения до указанных, содержат не более чем 6, не более чем 5, не более чем 4, не более чем 3, не более чем 2 или не более чем 1 некомплементарное нуклеооснование (нуклеооснования) по сравнению с целевой нуклеиновой кислотой, такой как транстиретиновая нуклеиновая кислота или ее определенный участок.
Антисмысловые соединения, предусматриваемые тут, также включают соединения, которые являются комплементарными к участку целевой нуклеиновой кислоты. В используемом тут значении, "участок" относится к определенному числу смежных (т.е. связанных) нуклеооснований внутри области или сегмента целевой нуклеиновой кислоты. "Участок" может также относиться к определенному числу смежных нуклеооснований антисмыслового соединения. В определенных вариантах воплощения, антисмысловые соединения являются комплементарными к состоящему из, по меньшей мере, 8 нуклеооснований участку целевого сегмента. В определенных вариантах воплощения, антисмысловые соединения являются комплементарными к состоящему из, по меньшей мере, 12 нуклеооснований участку целевого сегмента. В определенных вариантах воплощения, антисмысловые соединения являются комплементарными к состоящему из, по меньшей мере, 15 нуклеооснований участку целевого сегмента. Также предусматриваются антисмысловые соединения, которые являются комплементарными к участку целевого сегмента, состоящему из, по меньшей мере, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше нуклеооснований, или величины, находящейся в интервале, определенном любыми двумя из этих значений.
Идентичность
Антисмысловые соединения, предусматриваемые тут, могут также иметь определенный процент идентичности с конкретной нуклеотидной последовательностью, SEQ ID NO или соединением, представленным определенным номером Isis, или его участком. В используемом тут значении, антисмысловое соединение является идентичным с последовательностью, раскрытой тут, если оно обладает такой же способностью к спариванию нуклеооснований. Например, РНК, содержащая урацил вместо тимидина в раскрытой последовательности ДНК, будет считаться идентичной с последовательностью ДНК, поскольку как урацил, так и тимидин спариваются с аденином. Также предусматриваются укороченные и удлиненные варианты антисмысловых соединений, описанные тут, а также соединения, содержащие неидентичные основания по сравнению с антисмысловыми соединениями, предусматриваемыми тут. Неидентичные основания могут прилегать друг к другу или быть разбросаны по антисмысловому соединению. Процент идентичности антисмыслового соединения рассчитывают по числу оснований, демонстрирующих идентичное спаривание оснований по сравнению с последовательностью, с которой оно сравнивается.
В определенных вариантах воплощения, антисмысловые соединения или их участки являются, по меньшей мере, на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичными с одним или несколькими антисмысловыми соединениями или SEQ ID NO или их участками, раскрытыми тут.
Модификации
Нуклеозид представляет собой комбинацию основание-сахар. Часть нуклеозида, представляющая собой нуклеооснование (также называемое основанием), обычно является фрагментом гетероциклического основания. Нуклеотиды представляют собой нуклеозиды, дополнительно включающие фосфатную группу, ковалентно связанную с сахарной частью нуклеозида. В случае нуклеозидов, включающих пентофуранозильный сахар, фосфатная группа может быть связана с 2'-, 3'- или 5'-гидроксильной группой сахара. Олигонуклеотиды образуются посредством образования ковалентной связи прилегающих нуклеозидов друг с другом, с образованием линейного полимерного олигонуклеотида. Обычно говорят, что, в структуре олигонуклеотида, фосфатные группы образуют межнуклеозидные связи олигонуклеотида.
Модификации антисмыслового соединения охватывают замещения или изменения межнуклеозидных связей, фрагментов Сахаров или нуклеооснований. Модифицированные антисмысловые соединения часто являются предпочтительными по сравнению с нативными формами вследствие таких желательных свойств, как, например, повышенное поглощение клетками, повышенная афинность к целевой нуклеиновой кислоте, повышенная стабильность в присутствии нуклеаз или повышенная ингибирующая активность.
Химически модифицированные нуклеозиды также могут быть использованы для повышения афинности связывания укороченного или усеченного антисмыслового олигонуклеотида с его целевой нуклеиновой кислотой. Вследствие этого, сравнимые результаты часто могут быть получены при использовании более коротких антисмысловых соединений, содержащих такие химически модифицированные нуклеозиды.
Модифицированные межнуклеозидные связи
Встречающаяся в природе межнуклеозидная связь РНК и ДНК представляет собой фосфодиэфирную связь 3'- и 5'-концов. Антисмысловые соединения, содержащие одну или несколько модифицированных, т.е. не встречающихся в природе, межнуклеозидных связей, часто выбирают как предпочтительные по сравнению с антисмысловыми соединениями, содержащими встречающиеся в природе межнуклеозидные связи вследствие таких желательных свойств, как, например, повышенное поглощение клетками, повышенная афинность к целевым нуклеиновым кислотам и повышенная стабильность в присутствии нуклеаз.
Олигонуклеотиды, имеющие модифицированные межнуклеозидные связи, включают межнуклеозидные связи, сохраняющие атом фосфора, а также межнуклеозидные связи, не содержащие атом фосфора. Типичные примеры фосфорсодержащих межнуклеозидных связей включают, без ограничений, фосфодиэфирные, фосфотриэфирные, метилфосфонатные, фосфорамидатные и фосфоротиоатные. Способы получения фосфорсодержащих и не содержащих фосфора связей хорошо известны.
В определенных вариантах воплощения, антисмысловые соединения, нацеленные на транстиретиновую нуклеиновую кислоту, содержат одну или несколько модифицированных межнуклеозидных связей. В определенных вариантах воплощения, модифицированные межнуклеозидные связи являются фосфоротиоатными связями. В определенных вариантах воплощения, все межнуклеозидные связи антисмыслового соединения представляют собой фосфоротиоатные межнуклеозидные связи.
Модифицированные фрагменты сахаров
Антисмысловые соединения по изобретению могут необязательно содержать один или несколько нуклеозидов с модифицированной сахарной группой. Такие нуклеозиды с модифицированным сахаром могут обеспечивать повышенную устойчивость к действию нуклеазы, повышенную афинность связывания или некоторые другие благоприятные биологические свойства антисмысловых соединений. В определенных вариантах воплощения, нуклеозиды содержат химически модифицированные фрагменты рибофуранозных колец. Примеры химически модифицированных рибофуранозных колец включают, без ограничений, добавление групп заместителей (включая замещающие группы в 5'- и 2'-положениях), образование мостиковых связей между негеминальными атомами кольца с образованием бициклических нуклеиновых кислот (БНК), замещение атома кислорода рибозильного кольца на S, N(R) или C(R1)(R2) (R, R1 и R2 каждый независимо обозначают Н, C1-C12 алкил или защитную группу) и их комбинации. Примеры химически модифицированных Сахаров включают 2'-F-5'-метилзамещенный нуклеозид (см. Международную заявку РСТ WO 2008/101157, опубликованную 8/21/08, где раскрыты другие 5',2'-бисзамещенные нуклеозиды), или замещение атома кислорода рибозильного кольца на S с дополнительным замещением в 2'-положении (см. опубликованную Патентную заявку США US2005-0130923, опубликованную 16 июня 2005 года) или, альтернативно, 5'-замещение БНК (см. Международную заявку РСТ WO 2007/134181, опубликованную 11/22/07, в которой LNA (замкнутая нуклеиновая кислота) замещена, например, 5'-метильной или 5'-винильной группой).
Примеры нуклеозидов, содержащих модифицированные фрагменты Сахаров, включают без ограничений, нуклеозиды, включающие 5'-винильные, 5'-метильные (R или S), 4'-S, 2'-F, 2'-ОСН3, 2'-ОСН2СН3, 2'-OCH2CH2F и 2'-O(СН2)2OCH3 замещающие группы. Заместитель в 2'-положении также может быть выбран из аллила, амино, азидо, тио, O-аллила, O-C1-С10 алкила, OCF3, OCH2F, O(СН2)2SCH3, O(CH2)2-O-N(Rm)(Rn), O-CH2-C(=O)-N(Rm)(Rn) и O-CH2-C(=O)-N(R1)-(CH2)2-N(Rm)(Rn), где каждый из Rl, Rm и Rn, независимо, обозначает Н или замещенный или незамещенный C1-C10 алкил.
В используемом тут значении, "бициклические нуклеозиды" относятся к модифицированным нуклеозидам, содержащим бициклический фрагмент сахара. Примеры бициклических нуклеозидов включают, без ограничений, нуклеозиды, имеющие мостиковую связь между 4'- и 2'-атомами рибозильного кольца. В определенных вариантах воплощения, антисмысловые соединения, предусматриваемые тут, включают один или несколько бициклических нуклеозидов, содержащих 4'-2'-мостиковую связь. Примеры таких 4'-2' связанных бициклических нуклеозидов включают, без ограничений, одну из следующих формул: 4'-(СН2)-O-2' (LNA); 4'-(CH2)-S-2'; 4'-(CH2)2-O-2' (ENA (бициклические нуклеиновые кислоты с оксиэтиленовой связью)); 4'-СН(СН3)-O-2' и 4'-СН(CH2OCH3)-O-2' (и их аналоги, см. Патент США 7399845, выданный 15 июля 2008 года); 4'-С(СН3)(СН3)-O-2' (и его аналоги, см. опубликованную Международную заявку WO/2009/006478, опубликованную 8 января 2009 года); 4'-СН2-N(ОСН3)-2' (и его аналоги, см. опубликованную Международную заявку WO/2008/150729, опубликованную 11 декабря 2008 года); 4'-СН2-O-N(СН3)-2' (см. опубликованную Патентную заявку США US 2004-0171570, опубликованную 2 сентября 2004 года); 4'-CH2-N(R)-O-2', где R обозначает Н, C1-C12 алкил или защитную группу (см. Патент США 7427672, выданный 23 сентября 2008 года); 4'-СН2-С(Н)(СН3)-2' (см. Chattopadhyaya et a/, J. Org. Chem., 2009, 74, 118-134); и 4'-СН2-С(=СН2)-2' (и его аналоги, см. опубликованную Международную заявку WO 2008/154401, опубликованную 8 декабря 2008 года).
Дополнительные описания, касающиеся бициклических нуклеозидов, также можно найти в опубликованной литературе (см., например: Singh et al., Chem. Commun., 1998, 4, 455-456; Koshkin et al., Tetrahedron, 1998, 54, 3607-3630; Wahlestedt et al., Proc. Natl. Acad. Sci. U.S.A., 2000, 97, 5633-5638; Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222; Singh et al., J. Org. Chem., 1998, 63, 10035-10039; Srivastava et al., J. Am. Chem. Soc., 2007, 129(26) 8362-8379; Elayadi et al., Curr. Opinion Invest. Drugs, 2001, 2, 558-561; Braasch et al., Chem. Biol., 2001, 8, 1-7; и Orum et al., Curr. Opinion Mol. Ther., 2001, 3, 239-243; Патенты США №№6268490; 6525191; 6670461; 6770748; 6794499; 7034133; 7053207; 7399845; 7547684; и 7696345; Публикации патентов США №US2008-0039618; US2009-0012281; Патенты США серийные №№60/989574; 61/026995; 61/026998; 61/056564; 61/086231; 61/097787; и 61/099844; опубликованные Международные заявки РСТ WO 1994/014226; WO 2004/106356; WO 2005/021570; WO 2007/134181; WO 2008/150729; WO 2008/154401; и WO 2009/006478. Каждый из вышеупомянутых бициклических нуклеозидов может быть получен с одной или несколькими стереохимическими конфигурациями сахара, включая, например, α-L-рибофуранозу и β-D-рибофуранозу (см. международную заявку РСТ PCT/DK98/00393, опубликованную 25 марта 1999 года как WO 99/14226).
В определенных вариантах воплощения, бициклические фрагменты Сахаров БНК-нуклеозидов включают, без ограничений, соединения, содержащие, по меньшей мере, одну мостиковую связь между 4'- и 2'-положениями пентофуранозильного фрагмента сахара, где такие мостиковые связи независимо включают 1 или от 2 до 4 связанных групп, независимо выбранных из -[C(Ra)(Rb)]n-, -C(Ra)=C(Rb)-, -C(Ra)=N-, -С(=Щ)-, -C(=NRa)-, -C(=S)-, -O-, -Si(Ra)2-, -S(=O)x- и -N(Ra)-;
где:
x равен О, 1 или 2;
n равен 1, 2, 3 или 4;
каждый из Ra и Rb, независимо, представляет собой Н, защитную группу, гидроксил, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C5-C20 арил, замещенный C5-C20 арил, гетероциклический радикал, замещенный гетероциклический радикал, гетероарил, замещенный гетероарил, С5-С7 алициклический радикал, замещенный C5-C7 алициклический радикал, галоген, OJ1, NJ1J2, SJ1, N3, COOJ1, ацил (С(=O)-Н), замещенный ацил, CN, сульфонил (S(=O)2-J1) или сульфоксил (S(=O)-J1); и
каждый из J1 и J2, независимо, обозначает Н, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, С5-С20 арил, замещенный C5-C20 арил, ацил (С(=O)-Н), замещенный ацил, гетероциклический радикал, замещенный гетероциклический радикал, C1-C12 аминоалкил, замещенный C1-C12 аминоалкил или защитную группу.
В определенных вариантах воплощения, мостиковая связь бициклического фрагмента сахара представляет собой -[C(Ra)(Rb)]n-, -[C(Ra)(Rb)]n-O-, -C(RaRb)-N(R)-O- или -C(RaRb)-O-N(R)-. В определенных вариантах воплощения, мостиковая связь представляет собой 4'-СН2-2', 4'-(СН2)2-2', 4'-(СН2)2-2', 4'-СН2-O-2', 4'-(СН2)2-O-2', 4'-СН2-O-N(R)-2' и 4'-CH2-N(R)-O-2'-, где каждый R, независимо, обозначает Н, защитную группу или C1-C12 алкил.
В определенных вариантах воплощения, бициклические нуклеозиды дополнительно определяются с помощью изомерной конфигурации. Например, нуклеозид, содержащий 4'-2' оксиметиленовую мостиковую связь, может находиться в α-L-конфигурации или в β-D-конфигурации. Ранее, α-L-метиленоксидные (4'-СН2-O-2') БНК были включены в антисмысловые олигонуклеотиды, которые продемонстрировали антисмысловую активность (Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372).
В определенных вариантах воплощения, бициклические нуклеозиды включают, без ограничений, (А) α-L-метиленокси (4'-СН2-O-2') БНК, (В) β-D-метиленокси (4'-СН2-O-2') БНК, (С) этиленокси (4'-(СН2)2-O-2') БНК, (D) аминоокси (4'-CH2-O-N(R)-2') БНК, (Е) оксиамино (4'-CH2-N(R)-O-2') БНК и (F) метил(метиленокси) (4'-СН(СН3)-O-2') БНК, (G) метилентио (4'-CH2-S-2') БНК, (Н) метиленамино (4'-CH2-N(R)-2') БНК, (I) метилкарбоциклическую (4'-СН2-СН(СН3)-2') БНК и (J) пропилен-карбоциклическую (4'-(СН2)3-2') БНК, как изображено ниже.
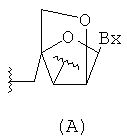
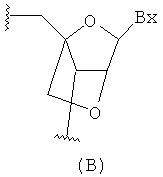
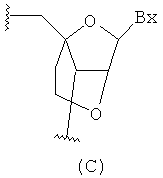
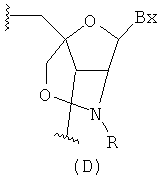
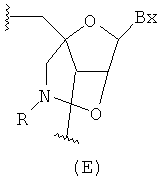
где Вх обозначает фрагмент основания и R независимо обозначает Н, защитную группу или C1-C12 алкил.
В определенных вариантах воплощения, предусматриваются бициклические нуклеозиды, имеющие Формулу I:
где:
Вх представляет собой фрагмент гетероциклического основания;
-Qa-Qb-Qc- обозначает -CH2-N(Rc)-CH2-, -C(=O)-N(Rc)-CH2-, -CH2-O-N(Rc)-, -СН2-N(Rc)-O- или -N(Rc)-O-CH2;
Rc обозначает C1-C12 алкил или защиту аминогруппы; и
Та и Tb каждый независимо обозначают Н, защитную группу гидроксила, конъюгированную группу, группу с реакционноспособным фосфором, фосфорсодержащий фрагмент или ковалентную связь с подложкой.
В определенных вариантах воплощения, предусматриваются бициклические нуклеозиды, имеющие Формулу II:
в которой:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb каждый независимо обозначают Н, защитную группу гидроксила, конъюгированную группу, группу с реакционноспособным фосфором, фосфорсодержащий фрагмент или ковалентную связь с подложкой;
Za обозначает C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, замещенный C1-C6 алкил, замещенный C2-C6 алкенил, замещенный C2-C6 алкинил, ацил, замещенный ацил, замещенный амид, тиол или замещенный тио.
В одном варианте воплощения, каждая из замещенных групп, независимо, является моно- или полизамещенной замещающими группами, независимо выбранными из галогена, оксо, гидроксила, OJc, NJcJd, SJc, N3, OC(=X)Jc и NJeC(=X)NJcJd, где каждый из Jc, Jd и Je, независимо, обозначает Н, C1-C6 алкил или замещенный C1-C6 алкил, и Х обозначает О или NJc.
В определенных вариантах воплощения, предусматриваются бициклические нуклеозиды, имеющие Формулу III:
в которой:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb каждый независимо обозначают Н, защитную группу гидроксила, конъюгированную группу, группу с реакционноспособным фосфором, фосфорсодержащий фрагмент или ковалентную связь с подложкой;
Zb обозначает C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, замещенный C1-C6 алкил, замещенный C2-C6 алкенил, замещенный C2-C6 алкинил или замещенный ацил (С(=O)-).
В определенных вариантах воплощения, предусматриваются бициклические нуклеозиды, имеющие Формулу IV:
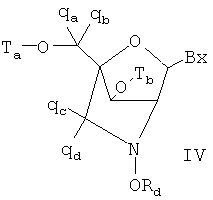
в которой:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb каждый независимо обозначают Н, защитную группу гидроксила, конъюгированную группу, группу с реакционноспособным фосфором, фосфорсодержащий фрагмент или ковалентную связь с подложкой;
Rd обозначает C1-C6 алкил, замещенный C1-C6 алкил, C2-C6 алкенил, замещенный С2-С6 алкенил, C2-C6 алкинил или замещенный С2-С6 алкинил;
каждый из qa, qb, qc и qd, независимо, обозначает Н, галоген, C1-C6 алкил, замещенный C1-C6 алкил, С2-С6 алкенил, замещенный C2-C6 алкенил, C2-C6 алкинил или замещенный C2-C6 алкинил, C1-C6 алкоксил, замещенный C1-C6 алкоксил, ацил, замещенный ацил, C1-C6 аминоалкил или замещенный C1-C6 аминоалкил;
В определенных вариантах воплощения, предусматриваются бициклические нуклеозиды, имеющие Формулу V:
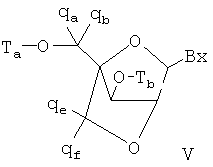
в которой:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb каждый независимо обозначают Н, защитную группу гидроксила, конъюгированную группу, группу с реакционноспособным фосфором, фосфорсодержащий фрагмент или ковалентную связь с подложкой;
qa, qb, qe и qf каждый независимо обозначают водород, галоген, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C1-C12 алкокси, замещенный C1-C12 алкокси, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk;
или qe и qf вместе обозначают=C(qg)(qh);
qg и qh каждый независимо обозначают Н, галоген, C1-C12 алкил или замещенный C1-C12 алкил.
Синтез и получение мономеров метиленокси (4'-СН2-O-2') БНК аденина, цитозина, гуанина, 5-метилцитозина, тимина и урацила, вместе с их олигомеризацией и способностью распознавания нуклеиновой кислоты были описаны (Koshkin et al., Tetrahedron, 1998, 54, 3607-3630). БНК и их получение также описаны в WO 98/39352 и WO 99/14226.
Были получены аналоги метиленокси (4'-CH2-O-2') БНК и 2'-тио-БНК (Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222). Получение замкнутых нуклеозидных аналогов, содержащих олигодезоксирибонуклеотидные дуплексы как субстраты полимераз нуклеиновой кислоты также было описано (Wengel et al., WO 99/14226). Кроме того, синтез 2'-амино-БНК, нового конформационно ограниченного высокоафинного олигонуклеотидного аналога, был описан в литературе (Singh et al., J. Org. Chem., 1998, 63, 10035-10039). Дополнительно, были получены 2'-амино- и 2'-метиламино-БНК и термическая стабильность их дуплексов с комплементарными цепями РНК и ДНК были ранее описаны.
В определенных вариантах воплощения, предусматриваются бициклические нуклеозиды, имеющие Формулу VI:
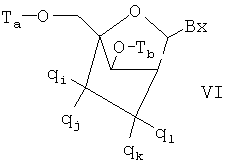
в которой:
Вх представляет собой фрагмент гетероциклического основания;
Ta и Tb каждый независимо обозначают Н, защитную группу гидроксила, конъюгированную группу, группу с реакционноспособным фосфором, фосфорсодержащий фрагмент или ковалентную связь с подложкой;
каждый из qi, qj, qk и ql, независимо, обозначает Н, галоген, C1-C12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный C2-C12 алкинил, C1-C12 алкоксил, замещенный C1-C12 алкоксил, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk; и
qi и qj или ql и qk вместе обозначают=C(qg)(qh), где qg и qh каждый независимо обозначают Н, галоген, C1-C12 алкил или замещенный C1-C12 алкил.
Был описан один карбоциклический бициклический нуклеозид, содержащий 4'-(СН2)3-2' мостиковую связь и алкенильный аналог мостиковой связи 4'-СН=СН-СН2-2' (Freier et al., Nucleic Acids Research, 1997, 25(22), 4429-4443 и Albaek et al., J. Org. Chem., 2006, 71, 7731-7740). Был также описан синтез и получение карбоциклических бициклических нуклеозидов вместе с их олигомеризацией и биохимическими исследованиями (Srivastava et al., J. Am. Chem. Soc., 2007, 129(26), 8362-8379).
В используемом тут значении, "4'-2' бициклический нуклеозид" или "от 4' до 2' бициклический нуклеозид" относится к бициклическому нуклеозиду, содержащему фуранозное кольцо, включающее мостиковую связь, соединяющую два атома углерода фуранозного кольца - соединяющую 2'-атом углерода и 4'-атом углерода сахарного кольца.
В используемом тут значении, "моноциклические нуклеозиды" относятся к нуклеозидам, содержащим модифицированные фрагменты Сахаров, которые не являются бициклическими фрагментами Сахаров. В определенных вариантах воплощения, фрагмент сахара или аналог фрагмента сахара, нуклеозида может быть модифицированным или замещенным в любом положении.
В используемом тут значении, "2'-модифицированный сахар" означает фуранозильный сахар, модифицированный в 2'-положении. В определенных вариантах воплощения, такие модификации включают заместители, выбранные из: галогенида, включая, без ограничений, замещенный и незамещенный алкокси, замещенный и незамещенный тиоалкил, замещенный и незамещенный аминоалкил, замещенный и незамещенный алкил, замещенный и незамещенный аллил и замещенный и незамещенный алкинил. В определенных вариантах воплощения, 2'-модификации выбирают из заместителей, включая, без ограничений: O[(СН2)nO]mCH3, O(CH2)nNH2, O(СН2)nCH3, O(CH2)nF, O(CH2)nONH2, ОСН2С(=O)N(Н)СН3 и O(СН2)nON[(СН2)nCH3]2, где n и m имеют значения от 1 до примерно 10. Другие 2'-замещающие группы также могут быть выбраны из: C1-C12 алкила, замещенного алкила, алкенила, алкинила, алкарила, аралкила, O-алкарила или O-аралкила, SH, SCH3, OCN, Cl, Br, CN, F, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкила, гетероциклоалкарила, аминоалкиламино, полиалкиламино, замещенного силила, группы, расщепляющей РНК, репортерной группы, интеркалятора, группы, улучшающей фармакокинетические свойства, или группы для улучшения фармакодинамических свойств антисмыслового соединения, и другие заместители, имеющие подобные свойства. В определенных вариантах воплощения, модифицированные нуклеозиды содержат 2'-МОЕ боковую цепь (Baker et al., J. Biol. Chem., 1997, 272, 11944-12000). Такое 2'-МОЕ замещение было описано как обладающее улучшенной афинностью связывания по сравнению с немодифицированными нуклеозидами и с другими модифицированными нуклеозидами, такими как 2'-O-метил, O-пропил и O-аминопропил. Было также продемонстрировано, что олигонуклеотиды, содержащие 2'-МОЕ заместитель, являются антисмысловыми ингибиторами генной экспрессии с характеристиками, перспективными для использования in vivo (Martin, Helv. Chim. Acta, 1995, 78, 486-504; Altmann et al., Chimia, 1996, 50, 168-176; Altmann et al., Biochem. Soc. Trans., 1996, 24, 63O-637; и Altmann et al., Nucleosides Nucleotides, 1997, 16, 917-926).
В используемом тут значении, "модифицированный тетрагидропирановый нуклеозид" или "модифицированный ТНР нуклеозид" означает нуклеозид, имеющий шестичленный тетрагидропирановый "сахар", замещенный на пентофуранозильный остаток в нормальных нуклеозидах (суррогатный сахар). Модифицированные ТНР нуклеозиды включают, без ограничений, материалы, известные специалистам как гексит-нуклеиновая кислота (HNA), анитол-нуклеиновая кислота (ANA), маннит-нуклеиновая кислота (MNA) (см. Leumann, Bioorg. Med. Chem., 2002, 10, 841-854), фтор-HNA (F-HNA) или соединения, имеющие Формулу VII:
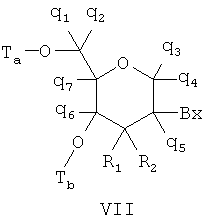
в которой, независимо для каждого из указанных, по меньшей мере, одного тетрагидропиранового нуклеозидного аналога Формулы VII:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb каждый независимо обозначают межнуклеозидную связующую группу, соединяющую тетрагидропирановый нуклеозидный аналог с антисмысловым соединением, или один из Та и Tb представляет собой межнуклеозидную связующую группу, соединяющую тетрагидропирановый нуклеозидный аналог с антисмысловым соединением, и другой из Та и Tb обозначает Н, защитную группу гидроксила, связанную группу с сопряженными связями или 5'- или 3'-терминальную группу;
q1, q2, q3, q4, q5, q6 и q7 каждый независимо обозначают Н, C1-C6 алкил, замещенный C1-C6 алкил, С2-С6 алкенил, замещенный С2-С6 алкенил, С2-С6 алкинил или замещенный С2-С6 алкинил; и каждый из R1 и R2, выбирают из водорода, гидроксила, галогена, замещенного или незамещенного алкокси, NJ1J2, SJ1, N3, OC(=X)J1, OC(=X)NJ1J2, NJ3C(=X)NJ1J2 и CN, где Х обозначает О, S или NJ1 и каждый из J1, J2 и J3, независимо, обозначают Н или C1-C6 алкил.
В определенных вариантах воплощения, предусматриваются модифицированные ТНР нуклеозиды Формулы VII, в которой q1, q2, q3, q4, q5, q6 и q7 все обозначают Н. В определенных вариантах воплощения, по меньшей мере, один из q1, q2, q3, q4, q5, q6 и q7 отличается от Н. В определенных вариантах воплощения, по меньшей мере, один из q1, q2, q3, q4, q5, q6 и q7 является метилом. В определенных вариантах воплощения, предусматриваются ТНР нуклеозиды Формулы VII, в которой один из R1 и R2 представляет собой фтор. В определенных вариантах воплощения, R1 обозначает фтор и R2 обозначает Н; R1 обозначает метокси и R2 обозначает Н и R1 обозначает Н и R2 обозначает метоксиэтокси.
В используемом тут значении, "2'-модифицированный" или "2'-замещенный" относится к нуклеозиду, содержащему сахар, имеющий в 2'-положении заместитель, отличный от Н или ОН. 2'-модифицированные нуклеозиды, включают, без ограничений, бициклические нуклеозиды, в которых мостиковая связь, соединяющая два атома углерода кольца сахара, соединяет 2'-углерод с другим атомом углерода кольца сахара; и нуклеозиды с немостиковыми 2'-заместителями, такими как аллил, амино, азидо, тио, O-аллил, O-C1-C10 алкил, -OCF3, O-(СН2)2-O-СН3, 2'-O(СН2)2SCH3, O-(CH2)2-O-N(Rm)(Rn) или O-CH2-C(=O)-N(Rm)(Rn), где каждый из Rm и Rn независимо обозначает Н или замещенный или незамещенный C1-C10 алкил. 2'-модифицированные нуклеозиды могут дополнительно содержать другие модификации, например, в других положениях сахара и/или в нуклеоосновании.
В используемом тут значении, "2'-F" относится к нуклеозиду, содержащему сахар, имеющий группу фтора в 2'-положении.
В используемом тут значении, "2'-ОМе" или "2'-ОСН3" или "2'-O-метил" все относятся к нуклеозиду, содержащему сахар, включающий группу -ОСН3 в 2'-положении кольца сахара.
В используемом тут значении, "МОЕ" или "2'-МОЕ" или "2'-OCH2CH2OCH3" или "2'-O-метоксиэтил" относятся все к нуклеозиду, содержащему сахар, имеющий группу -OCH2CH2OCH3 в 2'-положении кольца сахара.
В используемом тут значении, "олигонуклеотид" относится к соединению, включающему множество связанных нуклеозидов. В определенных вариантах воплощения, один или несколько из множества нуклеозидов являются модифицированными. В определенных вариантах воплощения, олигонуклеотид включает один или несколько рибонуклеозидов (РНК) и/или дезоксирибонуклеозидов (ДНК).
Специалистам также известны многие другие системы бицикло и трицикло суррогатных колец сахара, которые могут быть использованы для модификации нуклеозидов для включения в антисмысловые соединения (см., например, обзорную статью: Leumann, Bioorg. Med. Chem., 2002, 10, 841-854).
Такие кольцевые системы могут подвергаться различным дополнительным замещениям для увеличения активности.
Способы получения модифицированных Сахаров хорошо известны квалифицированным специалистам в данной области.
В нуклеотидах, включающих модифицированные фрагменты Сахаров, фрагменты нуклеооснований (природных, модифицированных или их комбинаций) сохраняются для гибридизации с соответствующей нуклеиновой кислотой-мишенью.
В определенных вариантах воплощения, антисмысловые соединения включают один или несколько нуклеозидов, имеющих модифицированные фрагменты Сахаров. В определенных вариантах воплощения, фрагмент модифицированного сахара представляет собой 2'-МОЕ. В определенных вариантах воплощения, модифицированные 2'-МОЕ нуклеозиды расположены в мотиве гапмера. В определенных вариантах воплощения, фрагмент модифицированного сахара представляет собой бициклический нуклеозид, содержащий (4'-СН(СН3)-O-2')-мостиковую группу. В определенных вариантах воплощения, (4'-СН(СН3)-O-2')-модифицированные нуклеозиды расположены в боковых сегментах мотива гапмера.
Модифицированные нуклеооснования
Модификации или замещения нуклеооснований (или оснований) являются структурно отличными от, но функционально взаимозаменяемыми с встречающимися в природе или синтетическими немодифицированными нуклеооснованиями. Как природные, так и модифицированные нуклеооснования способны участвовать в водородной связи. Такие модификации нуклеооснований могут придавать антисмысловым соединениям устойчивость к нуклеазам, афинность связывания или некоторые другие полезные биологические свойства. Модифицированные нуклеооснования включают синтетические и природные нуклеооснования, такие как, например, 5-метилцитозин (5-Ме-С). Определенные замещения нуклеооснований, включая 5-метилцитозиновые замещения, являются особенно пригодными для повышения афинности связывания антисмыслового соединения с целевой нуклеиновой кислотой. Например, было показано, что 5-метилцитозиновые замещения повышают стабильность дуплекса нуклеиновой кислоты на 0,6-1,2°С (Sanghvi, Y.S., Crooke, S.T. and Lebleu, В., eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp.276-278).
Дополнительные немодифицированные нуклеооснования включают 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил- и другие алкильные производные аденина и гуанина, 2-пропил- и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и цитозин, 5-пропинил (-С=С-СН3) урацил и цитозин, и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-гало, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-гало, особенно, 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-Р-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-дезазагуанин и 7-дезазааденин и 3-дезазагуанин и 3-дезазааденин.
Фрагменты гетероциклического основания могут также включать материалы, в которых пуриновое или пиримидиновое основание замещено другими гетероциклами, например, 7-дезазааденин, 7-дезазагуанозин, 2-аминопиридин и 2-пиридон. Нуклеооснования, являюициеся особенно пригодными для повышения афинности связывания антисмысловых соединений, включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и O-6 замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин.
В определенных вариантах воплощения, антисмысловые соединения, нацеленные на транстиретиновую нуклеиновую кислоту, включают одно или несколько модифицированных нуклеооснований. В определенных вариантах воплощения, расширенные за счет гэпа антисмысловые олигонуклеотиды, нацеленные на транстиретиновую нуклеиновую кислоту, содержат одно или несколько модифицированных нуклеооснований. В определенных вариантах воплощения, модифицированное нуклеооснование представляет собой 5-метилцитозин. В определенных вариантах воплощения, каждый цитозин представляет собой 5-метилцитозин.
Композиции и способы приготовления фармацевтических композиций
Антисмысловые олигонуклеотиды могут быть смешаны с фармацевтически приемлемым активным или инертным веществом для приготовления фармацевтических композиций или составов. Композиции и способы составления фармацевтических композиций зависят от ряда критериев, включая, без ограничений, путь введения, степень развития болезни или доза, которая должна быть введена.
Антисмысловое соединение, нацеленное на транстиретиновую нуклеиновую кислоту, может быть использовано в фармацевтической композиции путем объединения антисмыслового соединения с пригодным фармацевтически приемлемым разбавителем или носителем. Фармацевтически приемлемый разбавитель включает фосфатно-солевой буфер (PBS). PBS представляет собой разбавитель, пригодный для использования в композициях для парентеральной доставки. Соответственно, в одном варианте воплощения, в описанных тут способах используется фармацевтическая композиция, содержащая антисмысловое соединение, нацеленное на транстиретиновую нуклеиновую кислоту, и фармацевтически приемлемый разбавитель. В определенных вариантах воплощения, фармацевтически приемлемый разбавитель представляет собой PBS. В определенных вариантах воплощения, антисмысловое соединение является антисмысловым олигонуклеотидом.
Фармацевтические композиции, содержащие антисмысловые соединения, охватывают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров или любой другой олигонуклеотид, который, при введении животному, включая человека, способен обеспечить (прямо или косвенно) биологически активный метаболит или его остаток. Соответственно, например, изобретение охватывает фармацевтически приемлемые соли антисмысловых соединений, пролекарства, фармацевтически приемлемые соли таких пролекарств и другие биоэквиваленты. Пригодные фармацевтически приемлемые соли включают, без ограничений, соли натрия и калия.
Пролекарство может включать введение дополнительных нуклеозидов на одном или на обоих концах антисмыслового соединения, которые отщепляются эндогенными нуклеазами в организме, с образованием активного антисмыслового соединения.
Конъюгированные антисмысловые соединения
Антисмысловые соединения могут быть ковалентно связаны с одним или несколькими фрагментами или конъюгатами, которые увеличивают активность, распределение в клетках или поглощение клетками образующихся антисмысловых олигонуклеотидов. Типичные конъюгированные группы включают холестериновые фрагменты и липидные фрагменты. Дополнительные конъюгированные группы включают углеводы, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеин, родамины, кумарины и красители.
Антисмысловые соединения также могут быть модифицированы таким образом, чтобы они содержали одну или несколько стабилизирующих групп, обычно присоединенных к одному или к обоим концам антисмысловых соединений для усиления таких свойств, как, например, устойчивость к нуклеазам. Стабилизирующие группы включают кэп-структуры. Такие терминальные модификации защищают антисмысловое соединение, содержащее терминальную нуклеиновую кислоту, от деградации экзонуклеазой и могут способствовать доставке и/или локализации внутри клетки. Кэп может присутствовать на 5'-конце (5'-кэп) или на 3'-конце (3'-кэп) или может присутствовать на обоих концах. Кэп-структуры хорошо известны специалистам и включают, например, лишенные оснований инвертированные дезокси-кэпы. Дополнительные 3'- и 5'-стабилизирующие группы, которые могут быть использованы в качестве кэпов на одном или обоих концах антисмыслового соединения для придания устойчивости к нуклеазам, включают раскрытые в WO 03/004602, опубликованном 16 января 2003 года.
Культуры клеток и обработка антисмысловыми соединениями
Эффекты антисмысловых соединений на уровень, активность или экспрессию транстиретиновых нуклеиновых кислот могут быть определены in vitro для различных типов клеток. Типы клеток, используемые для таких анализов, являются доступными от коммерческих поставщиков (например, Американская коллекция типовых культур (American Type Culture Collection), Manassus, VA; Zen-Bio, Inc., Research Triangle Park, NC; Clonetics Corporation, Walkersville, MD) и клетки культивируют в соответствии с инструкциями поставщика с использованием коммерчески доступных реагентов (например, Invitrogen Life Technologies, Carlsbad, CA). Иллюстративные примеры типов клеток включают, без ограничений, клетки HepG2, клетки НерЗВ, первичные гепатоциты, клетки А549, фибробласты GM04281 и клетки LLC-MK2.
Испытания антисмысловых олигонуклеотидов in vitro
В данном изобретении описаны способы обработки клеток антисмысловыми олигонуклеотидами, которые могут быть соответствующим образом модифицированы для обработки другими антисмысловыми соединениями.
В общем, клетки обрабатывают антисмысловыми олигонуклеотидами, когда клетки достигают степени слияния приблизительно 60-80% в культуре.
Один из реагентов, обычно используемых для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает реагент для трансфекции катионными липидами LIPOFECTIN® (Invitrogen, Carlsbad, CA). Антисмысловые олигонуклеотиды смешивают с LIPOFECTIN® в OPTI-MEM® 1 (Invitrogen, Carlsbad, CA) для достижения желательной конечной концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTIN®, типично оставляющей от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает LIPOFECTAMINE 2000® (Invitrogen, Carlsbad, CA). Антисмысловой олигонуклеотид смешивают с LIPOFECTAMINE 2000® в среде OPTI-MEM® 1 с пониженным содержанием сыворотки (Invitrogen, Carlsbad, CA) для достижения желательной концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTAMINE®, типично составляющей от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает Cytofectin® (Invitrogen, Carlsbad, CA). Антисмысловой олигонуклеотид смешивают с Cytofectin® в среде OPTI-MEM® 1 с пониженным содержанием сыворотки (Invitrogen, Carlsbad, CA) для достижения желательной концентрации антисмыслового олигонуклеотида и концентрации Cytofectin®, типично составляющей от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другая методика, используемая для введения антисмысловых олигонуклеотидов в культивируемые клетки, включает электропорацию.
Клетки обрабатывают антисмысловыми олигонуклеотидами обычными способами. Клетки типично собирают через 16-24 часов после обработки антисмысловым олигонуклеотидом, измеряя в это время уровни РНК или белка целевых нуклеиновых кислот способами, известными специалистам и описанными тут.Обычно, если обработка проводится с множеством параллельных экспериментов, данные представляют в виде среднего для параллельных экспериментов.
Используемая концентрация антисмыслового олигонуклеотида отличается для разных клеточных линий. Способы определения оптимальной концентрации антисмыслового олигонуклеотида для конкретной клеточной линии хорошо известны специалистам. Антисмысловые олигонуклеотиды типично используются в концентрациях от 1 нМ до 300 нМ при трансфекции с помощью LIPOFECTAMINE2000®, Lipofectin или Cytofectin. Антисмысловые олигонуклеотиды используются в более высоких концентрациях, составляющих от 625 до 20000 нМ при трансфекции способом электропорации.
Выделение РНК
Анализ РНК может быть проведен для полной клеточной РНК или поли(А)+мРНК. Способы выделения РНК хорошо известны специалистам. РНК готовят способами, хорошо известными специалистам, например, с использованием реагента TRIZOL® (Invitrogen, Carlsbad, CA) в соответствии с рекомендованными производителем протоколами.
Анализ ингибирования целевых уровней или экспрессии
Ингибирование уровней или экспрессии нуклеиновой кислоты транстиретина можно оценить различными способами, известными специалистам. Например, уровни целевой нуклеиновой кислоты могут быть количественно определены, например, способом нозерн-блоттинга, конкурентной полимеразной цепной реакции (ПЦР) или количественной ПЦР в реальном масштабе времени. Анализ РНК может быть проведен на полной клеточной РНК или поли(А)+мРНК. Способы выделения РНК хорошо известны специалистам. Нозерн-блоттинг также является обычной методикой в данной области техники. Количественная ПЦР в реальном масштабе времени может быть удобно проведена с использованием коммерчески доступной Системы детектирования последовательностей ABI PRIS М® 7600, 7700 или 7900, поставляемой фирмой РЕ-Applied Biosystems, Foster City, CA в соответствии с инструкциями производителя.
Анализ уровней РНК-мишени способом количественной ПЦР в реальном масштабе времени
Количественное определение уровней РНК-мишеней может быть осуществлено способом количественной ПЦР в реальном масштабе времени с использованием Системы детектирования последовательностей ABI PRISM® 7600, 7700 или 7900 (РЕ-Applied Biosystems, Foster City, CA) в соответствии с инструкциями производителя. Способы количественной ПЦР в реальном масштабе времени хорошо известны специалистам.
Перед ПЦР в реальном масштабе времени, выделенную РНК подвергают реакции с обратной транскриптазой (RT), в результате которой получают комплементарную ДНК (кДНК), используемую затем в качестве субстрата при амплификации в ходе ПЦР в реальном масштабе времени. Реакции с RT и ПЦР в реальном масштабе времени проводят последовательно в одной и той же лунке для образца. Реагенты RT и ПЦР в реальном масштабе времени были получены от фирмы Invitrogen (Carlsbad, CA). Реакции RT, ПЦР в реальном масштабе времени проводят способами, хорошо известными квалифицированным специалистам в данной области.
Количества гена (или РНК)-мишени, полученные в результате ПЦР в реальном масштабе времени нормируют или по уровню экспрессии гена, экспрессия которого является постоянной, такого как циклофилин А, или путем количественного определения общей РНК с использованием RIBOGREEN® (Invitrogen, Inc. Carlsbad, CA). Экспрессию циклофилина А количественно определяют способом ПЦР в реальном масштабе времени, которую проводят одновременно с мишенью, с разделением каналов или отдельно. Общую РНК количественно определяют с помощью реагента для количественного определения РНК RIBOGREEN® (Invitrogen, Inc. Eugene, OR). Способы количественного определения РНК с помощью RIBOGREEN® описаны в Jones, L.J., et al, (Analitycal Biochemistry, 1998, 265, 368-374). Для измерения флуоресценции RIBOGREEN® используется инструмент CYTOFLUOR® 4000 (РЕ Applied Biosystems).
Зонды и праймеры конструируются для гибридизации с транстиретиновой нуклеиновой кислотой. Способы конструирования зондов и праймеров для ПЦР в реальном масштабе времени хорошо известны специалистам и могут включать использование программного обеспечения, такого как PRIMER EXPRESS® Software (Applied Biosystems, Foster City, CA).
Анализ уровней белка
Антисмысловое ингибирование нуклеиновых кислот транстиретина может быть оценено путем измерения уровней белка транстиретина. Уровни белка транстиретина можно оценить или количественно определить различными способами, хорошо известными специалистам, такими как иммунопреципитация, вестерн-блоттинг (иммуноблоттинг), твердофазный иммуноферментный анализ (ELISA), количественные анализы белка, анализы белковой активности (например, анализы активности каспазы), иммуногистохимия, иммуноцитохимия или активируемая флуоресценцией сортировка клеток (FACS). Антитела, нацеленные на мишень, могут быть идентифицированы и получены из различных источников, таких как каталог антител MSRS (Aerie Corporation, Birmingham, Ml), или могут быть приготовлены обычными способами получения моноклональных или поликлональных антител, хорошо известными специалистам. Антитела, пригодные для детектирования человеческого и крысиного транстиретина, являются коммерчески доступными.
Тестирование антисмысловых соединений In vivo
Антисмысловые соединения, например, антисмысловые олигонуклеотиды, испытывают на животных для оценки их способности ингибировать экспрессию транстиретина и продуцировать фенотипические изменения. Испытания могут проводиться на нормальных животных или на экспериментальных моделях болезней. Для введения животным, готовят композиции антисмысловых олигонуклеотидов в фармацевтически приемлемом разбавителе, таком как фосфатно-солевой буфер. Введение включает парентеральные пути введения. После периода лечения антисмысловыми олигонуклеотидами, выделяют РНК из ткани и измеряют изменения экспрессии транстиретиновой нуклеиновой кислоты. Также измеряют изменения уровней белка транстиретина.
Определенные соединения
Были проведены испытания приблизительно двухсот сорока шести заново разработанных антисмысловых соединений с различной длиной, мотивами и составом основной цепи с целью определения из влияния на мРНК транстиретина человека in vitro в нескольких типах клеток. Новые соединения сравнивали с примерно семьюдесятью девятью ранее сконструированными соединениями, включая ISIS №№304267, 304268, 304280, 304284, 304285, 304286, 304287, 304288, 304289, 304290, 304291, 304292, 304293, 304294, 304296, 304297, 304298, 304299, 304300, 304301, 304302, 304303, 304304, 304307, 304308, 304309, 304311 и 304312, которые были ранее определены как относящиеся к наиболее сильнодействующим антисмысловым соединениям in vitro (см., например, Публикации патентов США №№US2005/0244869 и US2009/0082300). Из примерно трехсот двадцати пяти заново разработанных и ранее сконструированных антисмысловых соединений, примерно пятнадцать соединений были выбраны для дальнейших исследований на основании их активности in vitro. Выбранные соединения испытывали на активность in vivo и переносимость в модели трансгенных мышей (см. Пример 10). Из пятнадцати испытанных соединений, одиннадцать были выбраны и подвергнуты испытаниям на системную переносимость (см. Пример 11) и измерения периода полувыведения в печени (см. Пример 12) у CD1 мышей, а также на системную переносимость (см. Пример 13) и фармакокинетическим исследованиям концентрации олигонуклеотида в печени (см. Пример 14) крыс Sprague-Dawley. По результатам этих исследований, семь соединений были подвергнуты испытаниям на доза-зависимое ингибирование и переносимость у трансгенных мышей (см. Пример 15). Кроме того, пятнадцать дополнительных соединений были выбраны из Таблицы 1 и были сконструированы шесть дополнительных соединений с различными мотивами с последовательностями, перекрывающимися с ISIS 420951, который демонстрировал высокую активность и переносимость в вышеописанных анализах. Эти дополнительные соединения сравнивали с ISIS 420951 по активности и переносимости у трансгенных мышей (см. Пример 16). На основании всех этих исследований (Примеры 10-16), было выбрано двадцать два соединения и подвергнуто испытаниям на системную переносимость у CD1 мышей (см. Пример 17). Семь соединений были признаны переносимыми в мышиной модели и дополнительно испытаны на системную переносимость у крыс Sprague-Dawley (см. Пример 18) и для проведения фармакокинетических исследований концентрации олигонуклеотида в печени и почке (см. Пример 19). Семь соединений также были испытаны на дозазависимую активность у трансгенных мышей (см. Пример 20).
Окончательный анализ этих исследований (Примеры 16-20) привел к выбору девяти соединений, имеющих последовательности нуклеооснований, соответствующие последовательностям, указанным в SEQ ID NO:25, 78, 80, 86, 87, 115, 120, 122 и 124. Благодаря комплементарности их последовательностей, соединения являются комплементарными к областям 505-524, 507-526, 508-527, 513-532, 515-534, 516-535, 580-599, 585-604, 587-606 или 589-608 SEQ ID NO:1. В определенных вариантах воплощения, соединения, нацеленные на перечисленные области, как дополнительно описано тут, содержат модифицированный олигонуклеотид, включающий некоторую часть последовательности нуклеооснований, приведенной в SEQ ID NO, как дополнительно описано тут.В определенных вариантах воплощения, соединения, нацеленные на перечисленные области или включающие часть последовательности нуклеооснований, приведенной в перечисленных SEQ ID NO, могут иметь разную длину, как дополнительно описано тут, и могут иметь один из различных мотивов, как дополнительно описано тут. В определенных вариантах воплощения, соединение, нацеленное на область или включающее часть последовательности нуклеооснований, приведенной в перечисленных SEQ ID NO, имеет определенную длину и мотив, указанные номерами ISIS: ISIS 304299, ISIS 420913, ISIS 420915, ISIS 420921, ISIS 420922, ISIS 420950, ISIS 420955, ISIS 420957 или ISIS 420959.
Девять соединений, включающие последовательность нуклеооснований из последовательностей, приведенных в SEQ ID NO:25, 78, 80, 86, 87, 115, 120, 122 и 124, были подвергнуты дополнительным испытаниям на дозазависимое ингибирование в первичных гепатоцитах яванского макака (см. Пример 21). Эти соединения также были испытаны на оптимальную вязкость (Пример 22). Также оценили период полувыведения в печени CD1 мышей семи из соединений, включающих последовательность нуклеооснований из последовательностей, приведенных в SEQ ID NO:78, 86, 87, 115, 120 и 124 (Пример 23).
Окончательный анализ этих исследований (Примеры 1-23), привел к выбору восьми соединений, включающих последовательность нуклеооснований из последовательностей, приведенных в SEQ ID NO:25, 80, 86, 87, 115, 120, 122 и 124. Вследствие комплементарности их последовательностей, соединения являются комплементарными к областям 504-523, 505-524, 512-531, 513-532, 577-596, 582-601, 584-603 и 586-605 SEQ ID NO:1. В определенных вариантах воплощения, соединения, нацеленные на перечисленные области, как дополнительно описано тут, содержат модифицированный олигонуклеотид, включающий некоторую часть последовательности нуклеооснований, приведенной в SEQ ID NO, как дополнительно описано тут, В определенных вариантах воплощения, соединения, нацеленные на перечисленные области или включающие часть последовательности нуклеооснований, приведенной в перечисленных SEQ ID NO, могут иметь разную длину, как дополнительно описано тут, и могут иметь один из различных мотивов, как дополнительно описано тут.В определенных вариантах воплощения, соединение, нацеленное на область или включающее часть последовательности нуклеооснований, приведенной в перечисленных SEQ ID NO, имеет конкретную длину и мотив, указанные номерами ISIS; ISIS 304299, ISIS 420915, ISIS 420921, ISIS 420922, ISIS 420950, ISIS 420955, ISIS 420957 или ISIS 420959.
Эти восемь соединений были подвергнуты испытаниям на эффективность, фармакокинетический профиль и переносимость у яванского макака (Пример 24). Исследования ингибирования у этих обезьян показали, что лечение некоторыми из этих соединений вызывало высокую степень ингибирования mphkttr в печени. Конкретнее, лечение с использованием ISIS 420950, ISIS 420955 и ISIS 420915 вызывало 91%, 79% и 78% ингибирования, соответственно, по сравнению с контролем PBS. Было отмечено, что ISIS 420915 вызывал более сильное ингибирование мРНК TTR (78%) по сравнению с ISIS 304299 (59%), несмотря на то, что эти два олигонуклеотида отличаются друг от друга смещением на одну пару оснований их участка-мишени в SEQ ID NO:1. Анализ белка также дополнил результаты анализа рНК, причем лечение с использованием ISIS 420915 вызывало 76% ингибирования и лечение с использованием ISIS 304299 вызывало 47% ингибирования белка TTR по сравнению с контролем. Как ожидалось, уровни белка RBP4, как белка, ассоциированного с транстиретином, также должны снижаться после введения антисмысловых соединений. Уровни белка RBP4 снижались на 63% после введения ISIS 420915. Введение ISIS 304299 снижало уровни белка RBP4 на 19%. Дополнительно, ISIS 420915 имел лучшую переносимость, чем ISIS 304299, как показали исследования на обезьянах (Пример 24). Уровни трансаминазы у обезьян, получавших ISIS 304299 (ALT 81 IU/л и AST 101 IU/л), были выше, чем у получавших ISIS 420915 (ALT 68 IU/л и AST 62 IU/л). Уровни СЗ комплемента обезьян, получавших ISIS 304299 (96 мг/дл), были ниже, чем у обезьян, получавших ISIS 420915 (104 мг/дл).
Соответственно, предусматриваются антисмысловые соединения с любой одной или несколькими улучшенными характеристиками. В определенных вариантах воплощения предусматриваются соединения, включающие модифицированный олигонуклеотид, как дополнительно описано тут, нацеленный на или специфически гибридизуемый с областью нуклеотидов SEQ ID NO:1.
Соответственно, предусматриваются антисмысловые соединения с любой одной или несколькими улучшенными характеристиками. В определенных вариантах воплощения предусматриваются соединения, включающие модифицированный олигонуклеотид, как дополнительно описано тут, нацеленный на или специфически гибридизуемый с областью нуклеотидов SEQ ID NO:2.
Соответственно, предусматриваются антисмысловые соединения с любой одной или несколькими улучшенными характеристиками. В определенных вариантах воплощения предусматриваются соединения, включающие модифицированный олигонуклеотид, как дополнительно описано тут, нацеленный на или специфически гибридизуемый с областью нуклеотидов SEQ ID NO:4.
В определенных вариантах воплощения, соединения, описанные тут, являются эффективными, поскольку имеют значение, по меньшей мере, одного из in vitro ICao, равное менее 2,9 мкМ, менее 2,2 мкМ, менее 2,0 мкМ, менее 1,5 мкМ, менее 1,4 мкМ, менее 1,3 мкМ, менее 1,0 мкМ, менее 0,7 мкМ, менее 0,6 мкМ, при введении в клеточную линию гепатоцитов яванского макака с помощью электропорации, как описано в Примере 67. В определенных вариантах воплощения, соединения, описанные тут, имеют высокую степень переносимости, что видно по увеличению, по меньшей мере, одного из значений ALT или AST не более чем в 4 раза, в 3 раза или в 2 раза по сравнению с животными, получавшими солевой раствор; или по увеличению веса печени, селезенки или почки не более чем на 30%, 20%, 15%, 12%, 10%, 5% или 2%.
Некоторые показания
В определенных вариантах воплощения предусматриваются способы лечения индивида, включающие введение одной или нескольких фармацевтических композиций, описанных тут. В определенных вариантах воплощения, индивид имеет болезнь, связанную с центральной нервной системой.
Как показано в примерах ниже, было продемонстрировано, что соединения, нацеленные на транстиретин, описанные тут, снижают тяжесть физиологических симптомов болезней, связанных с центральной нервной системой. В определенных экспериментах, соединения снижали скорость образования амилоидных бляшек, например, животные продолжали испытывать симптомы, но симптомы были менее тяжелыми по сравнению с животными, не получавшими лечения. В других экспериментах, однако, соединения, по-видимому, приводили к регенерации функции со временем; например, животные, получавшие лечение на протяжении более длительного периода времени, испытывали менее тяжелые симптомы, чем те, которым соединения вводились на протяжении более короткого периода времени. Способность соединений, указанных ниже, восстанавливать функцию, демонстрирует, таким образом, что симптомы болезни могут быть обращены с помощью лечения соединением, описанным тут.
Соответственно, предусматриваются способы облегчения симптома, ассоциированного с болезнью, связанной с центральной нервной системой, сердечной, невропатологической или желудочно-кишечной у нуждающегося в этом субъекта. В определенных вариантах воплощения предусматривается способ снижения частоты возникновения симптома, ассоциированного с болезнью, связанной с центральной нервной системой, сердечной, невропатологической или желудочно-кишечной. В определенных вариантах воплощения предусматривается способ снижения тяжести симптома, ассоциированного с болезнью, связанной с центральной нервной системой, сердечной, невропатологической или желудочно-кишечной. В таких вариантах воплощения, способы включают введение нуждающемуся в этом лицу терапевтически эффективного количества соединения, нацеленного на транстиретиновую нуклеиновую кислоту.
Транстиретиновый амилоидоз характеризуется многочисленными физическими, неврологическими, психиатрическими и/или периферическими симптомами. Любой симптом, который, как известно квалифицированному специалисту, ассоциирован с транстиретиновым амилоидозом, может быть облегчен или иным образом модулирован, как изложено выше в описанных выше способах. В определенных вариантах воплощения, симптом представляет собой физический, когнитивный, психиатрический или периферический симптом. В определенных вариантах воплощения, симптом представляет собой физический симптом, выбранный из группы, состоящей из беспокойства, отсутствия координации, нистагма, спастического парапареза, отсутствия мышечной координации, нарушения зрения, бессонницы, необычных ощущений, миоклонуса, слепоты, потери речи, кистевого туннельного синдрома, эпилептических припадков, субарахноидальных кровоизлияний, инсульта и кровотечения в головном мозге, гидроцефалии, атаксии и спастического паралича, комы, сенсорной невропатии, паратезии, гипестезии, моторной невропатии, автономной невропатии, ортостатической гипотензии, циклического запора, циклической диареи, тошноты, рвоты, пониженного потения, импотенции, замедленного опорожнения желудка, задержки мочевыделения, недержания мочи, прогрессирующей кардиопатии, усталости, одышки, потери веса, отсутствия аппетита, онемения, ощущения покалывания, слабости, увеличенного языка, нефротического синдрома, застойной сердечной недостаточности, одышки при физической нагрузке, периферического отека, аритмий, учащенного сердцебиения, ощущения головокружения, обморока, постуральной гипотензии, проблемы периферических нервов, сенсорно-двигательной недостаточности, невропатии нижних конечностей, невропатии верхних конечностей, гиперальгезии, изменения восприятия температуры, слабости в нижних конечностях, кахексии, периферического отека, гепатомегалии, пурпуры, диастолической дисфункции, экстрасистолы желудочков, черепной невропатии, ослабления глубоких сухожильных рефлексов, амилоидных отложений в стекловидном теле, помутнения стекловидного тела, сухости глаз, глаукомы, зубчатого края зрачков, отечности ног вследствие удерживания воды. В определенных вариантах воплощения, симптом представляет собой когнитивный симптом, выбранный из группы, состоящей из расстройства памяти, расстройства суждения и мышления, расстройства планирования, расстройства гибкости, расстройства абстрактного мышления, расстройства уяснения правил, расстройства инициирования адекватных действий, расстройства ингибирования неадекватных действий, расстройства кратковременной памяти, расстройства длительной памяти, паранойи, дезориентации, спутанности сознания, галлюцинаций и деменции. В определенных вариантах воплощения, симптом представляет собой психиатрический симптом, выбранный из группы, состоящей из деменции; тревожного состояния, депрессии, притупленного аффекта, эгоцентризмов, агрессии, компульсивного поведения, раздражительности, изменений личности, включая расстройства памяти, суждения и мышления и суицидальное мышление.
В определенных вариантах воплощения, симптом представляет собой беспокойство. В определенных вариантах воплощения, симптом представляет собой отсутствие координации. В определенных вариантах воплощения, симптом представляет собой нистагм. В определенных вариантах воплощения, симптом представляет собой спастический парапарез. В определенных вариантах воплощения, симптом представляет собой отсутствие мышечной координации. В определенных вариантах воплощения, симптом представляет собой нарушение зрения. В определенных вариантах воплощения, симптом представляет собой бессонницу. В определенных вариантах воплощения, симптом представляет собой необычные ощущения. В определенных вариантах воплощения, симптом представляет собой миоклонус.В определенных вариантах воплощения, симптом представляет собой слепоту. В определенных вариантах воплощения, симптом представляет собой потерю речи. В определенных вариантах воплощения, симптом представляет собой кистевой туннельный синдром. В определенных вариантах воплощения, симптом представляет собой эпилептические припадки. В определенных вариантах воплощения, симптом представляет собой субарахноидальные кровоизлияния. В определенных вариантах воплощения, симптом представляет собой инсульт. В определенных вариантах воплощения, симптом представляет собой кровотечение в головном мозге. В определенных вариантах воплощения, симптом представляет собой гидроцефалию. В определенных вариантах воплощения, симптом представляет собой атаксию. В определенных вариантах воплощения, симптом представляет собой спастический паралич. В определенных вариантах воплощения, симптом представляет собой кому. В определенных вариантах воплощения, симптом представляет собой сенсорную невропатию. В определенных вариантах воплощения, симптом представляет собой паратезию. В определенных вариантах воплощения, симптом представляет собой гипестезию. В определенных вариантах воплощения, симптом представляет собой моторную невропатию. В определенных вариантах воплощения, симптом представляет собой автономную невропатию. В определенных вариантах воплощения, симптом представляет собой ортостатическую гипотензию. В определенных вариантах воплощения, симптом представляет собой циклический запор. В определенных вариантах воплощения, симптом представляет собой циклическую диарею. В определенных вариантах воплощения, симптом представляет собой тошноту. В определенных вариантах воплощения, симптом представляет собой рвоту. В определенных вариантах воплощения, симптом представляет собой пониженное потение. В определенных вариантах воплощения, симптом представляет собой импотенцию. В определенных вариантах воплощения, симптом представляет собой замедленное опорожнение желудка. В определенных вариантах воплощения, симптом представляет собой задержку мочевыделения. В определенных вариантах воплощения, симптом представляет собой недержание мочи. В определенных вариантах воплощения, симптом представляет собой прогрессирующую кардиопатию. В определенных вариантах воплощения, симптом представляет собой ощущение усталости. В определенных вариантах воплощения, симптом представляет собой одышку. В определенных вариантах воплощения, симптом представляет собой потерю веса. В определенных вариантах воплощения, симптом представляет собой онемение. В определенных вариантах воплощения, симптом представляет собой ощущение покалывания. В определенных вариантах воплощения, симптом представляет собой ощущение слабости. В определенных вариантах воплощения, симптом представляет собой увеличенный язык. В определенных вариантах воплощения, симптом представляет собой нефротический синдром. В определенных вариантах воплощения, симптом представляет собой застойную сердечную недостаточность. В определенных вариантах воплощения, симптом представляет собой одышку при нагрузке. В определенных вариантах воплощения, симптом представляет собой периферический отек. В определенных вариантах воплощения, симптом представляет собой аритмии. В определенных вариантах воплощения, симптом представляет собой учащенное сердцебиение. В определенных вариантах воплощения, симптом представляет собой ощущение головокружения. В определенных вариантах воплощения, симптом представляет собой обморок. В определенных вариантах воплощения, симптом представляет собой постуральную гипотензию. В определенных вариантах воплощения, симптом представляет собой проблему периферических нервов. В определенных вариантах воплощения, симптом представляет собой сенсорно-двигательную недостаточность. В определенных вариантах воплощения, симптом представляет собой невропатию нижних конечностей. В определенных вариантах воплощения, симптом представляет собой невропатию верхних конечностей. В определенных вариантах воплощения, симптом представляет собой гиперальгезию. В определенных вариантах воплощения, симптом представляет собой изменение восприятия температуры. В определенных вариантах воплощения, симптом представляет собой слабость в нижних конечностях. В определенных вариантах воплощения, симптом представляет собой кахексию. В определенных вариантах воплощения, симптом представляет собой отек. В определенных вариантах воплощения, симптом представляет собой гепатомегалию. В определенных вариантах воплощения, симптом представляет собой пурпуру. В определенных вариантах воплощения, симптом представляет собой диастолическую дисфункцию. В определенных вариантах воплощения, симптом представляет собой экстрасистолу желудочков. В определенных вариантах воплощения, симптом представляет собой черепную невропатию. В определенных вариантах воплощения, симптом представляет собой ослабление глубоких сухожильных рефлексов. В определенных вариантах воплощения, симптом представляет собой амилоидные отложения в стекловидном теле. В определенных вариантах воплощения, симптом представляет собой помутнение стекловидного тела. В определенных вариантах воплощения, симптом представляет собой сухость глаз. В определенных вариантах воплощения, симптом представляет собой глаукому. В определенных вариантах воплощения, симптом представляет собой зубчатый край зрачков. В определенных вариантах воплощения, симптом представляет собой отечность ног вследствие удерживания воды.
В определенных вариантах воплощения, симптом представляет собой расстройство памяти. В определенных вариантах воплощения, симптом представляет собой расстройство суждения и мышления. В определенных вариантах воплощения, симптом представляет собой расстройство планирования. В определенных вариантах воплощения, симптом представляет собой расстройство гибкости. В определенных вариантах воплощения, симптом представляет собой расстройство абстрактного мышления. В определенных вариантах воплощения, симптом представляет собой расстройство уяснения правил. В определенных вариантах воплощения, симптом представляет собой расстройство инициирования адекватных действий. В определенных вариантах воплощения, симптом представляет собой расстройство ингибирования неадекватных действий. В определенных вариантах воплощения, симптом представляет собой расстройство кратковременной памяти. В определенных вариантах воплощения, симптом представляет собой расстройство длительной памяти. В определенных вариантах воплощения, симптом представляет собой паранойю. В определенных вариантах воплощения, симптом представляет собой дезориентацию. В определенных вариантах воплощения, симптом представляет собой спутанность сознания. В определенных вариантах воплощения, симптом представляет собой галлюцинации. В определенных вариантах воплощения, симптом представляет собой деменцию.
В определенных вариантах воплощения, симптом представляет собой деменцию. В определенных вариантах воплощения, симптом представляет собой тревожное состояние. В определенных вариантах воплощения, симптом представляет собой депрессию. В определенных вариантах воплощения, симптом представляет собой притупленный аффект.В определенных вариантах воплощения, симптом представляет собой эгоцентризмы. В определенных вариантах воплощения, симптом представляет собой агрессию. В определенных вариантах воплощения, симптом представляет собой компульсивное поведение. В определенных вариантах воплощения, симптом представляет собой раздражительность. В определенных вариантах воплощения, симптом представляет собой изменения личности. В определенных вариантах воплощения, симптом представляет собой суицидальное мышление.
В определенных вариантах воплощения, предусматриваются способы лечения индивида, включающие введение одной или нескольких фармацевтических композиций, описанных тут.В определенных вариантах воплощения, индивид имеет болезнь, связанную с центральной нервной системой.
В определенных вариантах воплощения, введение антисмыслового соединения, нацеленного на транстиретиновую нуклеиновую кислоту, приводит к снижению экспрессии транстиретина на, по меньшей мере, примерно 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99% или интервал, определенный любыми двумя из этих значений.
В определенных вариантах воплощения, фармацевтические композиции, содержащие антисмысловое соединение, нацеленное на транстиретин, используются для изготовления лекарственного средства для лечения пациента, страдающего от или восприимчивого к болезни, связанной с центральной нервной системой.
В определенных вариантах воплощения, способы, описанные тут, включают введение соединения, включающего модифицированный олигонуклеотид, содержащий участок смежных нуклеооснований, как описано тут, из последовательности, приведенной в SEQ ID NO:25, 78, 80, 86, 87, 115, 120, 122 и 124.
Введение
В определенных вариантах воплощения, соединения и композиции, описанные тут, могут быть введены рядом способов, в зависимости от того, является ли желательным местное или системное лечение, и от участка, лечение которого должно проводиться. Введение может быть местным, легочным, например, путем ингаляции или инсуффляции порошков или аэрозолей, включая с помощью распылителя; интратрахеальным, интраназальным, эпидермальным и трансдермальным, пероральным или парентеральным. Соединения и композиции, описанные тут, могут быть введены таким образом, чтобы они были нацелены на определенную ткань, такую как печень или головной мозг.
В определенных вариантах воплощения, соединения и композиции, описанные тут, вводятся парентерально. "Парентеральное введение" означает введение путем инъекции или инфузии. Парентеральное введение включает подкожное введение, внутривенное введение, внутримышечное введение, интраартериальное введение, интраперитонеальное введение или внутричерепное введение, например, внутримозговое введение, интратекальное введение, интравентрикулярное введение, вентрикулярное введение, интрацеребровентрикулярное введение, церебральное интравентрикулярное введение или церебрально-вентрикулярное введение. Введение может быть непрерывным или хроническим или кратковременным или прерывистым.
В определенных вариантах воплощения, парентеральное введение осуществляется путем инфузии. Инфузия может быть хронической или непрерывной или кратковременной или прерывистой. В определенных вариантах воплощения, вливаемые фармацевтические агенты доставляются с помощью насоса. В определенных вариантах воплощения, парентеральное введение осуществляется путем инъекции.
В определенных вариантах воплощения, парентеральное введение является подкожным.
В дополнительных вариантах воплощения, композиция для введения представляет собой соединения, описанные тут, и солевой раствор.
В определенных вариантах воплощения, соединения и композиции доставляются в ЦНС. В определенных вариантах воплощения, соединения и композиции доставляются в спинномозговую жидкость. В определенных вариантах воплощения, соединения и композиции вводятся в паренхиму головного мозга. В определенных вариантах воплощения, соединения и композиции доставляются животному во множество областей центральной нервной системы (например, во множество областей головного мозга и/или в спинной мозг) путем интратекального введения или интрацеребровентрикулярного введения. Широкое распределение соединений и композиций, описанных тут, в центральной нервной системе может быть достигнуто при интрапаренхимальном введении, интратекальном введении или интрацеребровентрикулярном введении.
В определенных вариантах воплощения, настоящее изобретение включает фармацевтические композиции, которые могут быть введены путем инъекции непосредственно в головной мозг.Инъекция может быть стереотактической инъекцией в определенную область головного мозга (например, черное вещество, сосудистое сплетение, кора головного мозга, гиппокамп, полосатое тело, сосудистое сплетение или бледный шар). Соединение также может быть введено в диффузные области головного мозга (например, диффузная доставка в кору головного мозга).
В определенных вариантах воплощения, парентеральное введение осуществляется путем инъекции. Инъекция может быть введена с помощью шприца или насоса. В определенных вариантах воплощения, инъекция представляет собой болюсную инъекцию. В определенных вариантах воплощения, инъекция вводится непосредственно в ткань, такую как полосатое тело, хвостатое ядро, кора головного мозга, гиппокамп и мозжечок.
В определенных вариантах воплощения, доставка соединения или композиции, описанных тут, может повлиять на фармакокинетический профиль соединения или композиции. В определенных вариантах воплощения, инъекция соединения или композиции, описанных тут, в ткань-мишень улучшает фармакокинетический профиль соединения или композиции по сравнению с инфузией соединения или композиции. В определенном варианте воплощения, инъекция соединения или композиция улучшает действенность по сравнению с обширной диффузией, требуя меньшего количества соединения или композиции для достижения аналогичной фармакологии. В определенных вариантах воплощения, аналогичная фармакология относится к периоду времени, на протяжении которого РНК-мишень и/или белок-мишень подвергается понижающей регуляции (например, длительность действия). В определенных вариантах воплощения, способы специфической локализации фармацевтического агента, такие как с помощью болюсной инъекции, снижают медианную эффективную концентрацию (ЕС50) примерно в 50 раз (например, в 50 раз меньшая концентрация в ткани требуется для достижения такого же или аналогичного фармакодинамического эффекта). В определенных вариантах воплощения, способы специфической локализации фармацевтического агента, такие как с помощью болюсной инъекции, снижают медианную эффективную концентрацию (ЕС50) в 20, 25, 30, 35, 40, 45 или 50 раз. В определенных вариантах воплощения, фармацевтический агент представляет собой антисмысловое соединение, как дополнительно описано тут.В определенных вариантах воплощения, ткань-мишень представляет собой ткань головного мозга. В определенных вариантах воплощения, ткань-мишень представляет собой стриарную ткань. В определенных вариантах воплощения, снижение ЕС50 является желательным, поскольку уменьшает дозу, необходимую для достижения фармакологического результата у нуждающегося в этом пациента.
Период полувыведения олигонуклеотидов МОЕ-гапмера в ткани печени CD1 мышей составляет примерно 21 день (см. Примеры 12).
В определенных вариантах воплощения, антисмысловой олигонуклеотид вводится инъекцией или инфузией раз в месяц, раз в два месяца, раз в 90 дней, раз в 3 месяца, раз в 6 месяцев, два раза в год или раз в год.
Некоторые комбинированные терапии
В определенных вариантах воплощения, одна или несколько фармацевтических композиций по настоящему изобретению вводятся совместно с одним или несколькими другими фармацевтическими агентами. В определенных вариантах воплощения, такие один или несколько других фармацевтических агентов предназначены для лечения той же болезни, расстройства или состояния, что и одна или несколько фармацевтических композиций, описанных тут.В определенных вариантах воплощения, такие один или несколько других фармацевтических агентов предназначены для лечения болезни, расстройства или состояния, отличных от одной или нескольких фармацевтических композиций, описанных тут.В определенных вариантах воплощения, такие один или несколько других фармацевтических агентов предназначены для лечения нежелательных побочных эффектов одной или нескольких фармацевтических композиций, описанных тут.В определенных вариантах воплощения, одна или несколько фармацевтических композиций вводятся совместно с другим фармацевтическим агентом для лечения нежелательного эффекта этого другого фармацевтического агента. В определенных вариантах воплощения, одна или несколько фармацевтических композиций вводятся совместно с другим фармацевтическим агентом для создания комбинированного эффекта. В определенных вариантах воплощения, одна или несколько фармацевтических композиций вводятся совместно с другим фармацевтическим агентом для создания синергического эффекта.
В определенных вариантах воплощения, одна или несколько фармацевтических композиций и один или несколько других фармацевтических агентов вводятся одновременно. В определенных вариантах воплощения, одна или несколько фармацевтических композиций и один или несколько других фармацевтических агентов вводятся в разное время. В определенных вариантах воплощения, одна или несколько фармацевтических композиций и один или несколько других фармацевтических агентов готовятся вместе в одной рецептуре. В определенных вариантах воплощения, одна или несколько фармацевтических композиций и один или несколько других фармацевтических агентов готовятся отдельно.
В определенных вариантах воплощения, второе соединение вводится перед введением фармацевтической композиции по настоящему изобретению. В определенных вариантах воплощения, второе соединение вводится после введения фармацевтической композиции по настоящему изобретению. В определенных вариантах воплощения, второе соединение вводится одновременно с фармацевтической композицией по настоящему изобретению. В определенных вариантах воплощения, доза совместно вводимого второго соединения будет такой же, как и доза, которая использовалась бы при введении одного лишь второго соединения. В определенных вариантах воплощения, доза совместно вводимого второго соединения будет ниже, чем доза, которая использовалась бы при введении одного лишь второго соединения. В определенных вариантах воплощения, доза совместно вводимого второго соединения будет выше, чем доза, которая использовалась бы при введении одного лишь второго соединения.
В определенных вариантах воплощения, совместное введение второго соединения усиливает эффект первого соединения, так чтобы совместное введение соединений приводило к эффекту, превышающему эффект от введения одного лишь первого соединения. В определенных вариантах воплощения, совместное введение приводит к эффектам, являющимся аддитивными для эффектов соединений при их введении по одному. В определенных вариантах воплощения, совместное введение приводит к эффектам, превышающим аддитивные эффекты соединений при их введении по одному. В определенных вариантах воплощения, первое соединение представляет собой антисмысловое соединение. В определенных вариантах воплощения, второе соединение представляет собой антисмысловое соединение.
В определенных вариантах воплощения, фармацевтические агенты, которые могут быть введены совместно с фармацевтической композицией по настоящему изобретению, включают антипсихотические агенты, такие как, например, галоперидол, хлорпромазин, клозапин, кветапин и оланзапин; антидепрессивные агенты, такие как, например, флуоксетин, сертралина гидрохлорид, венлафаксин и нортриптилин; транквилизирующие агенты, такие как, например, бензодиазепины, клоназепам, пароксетин, венлафаксин и бета-блокаторы; агенты, стабилизирующие настроение, такие как, например, литий, валпроат, ламотригин и карбамазепин; паралитические агенты, такие как, например, ботулотоксин; и/или другие экспериментальные агенты, включая, без ограничений, тетрабеназин (ксеназин), креатин, коэнзим Q10, трегалозу, докозагексановые кислоты, ACR16, этил-ЕРА, атомоксетин, циталопрам, димебон, мемантин, натрия фенилбутират, рамелтеон, урсодиол, зипрекса, ксеназин, тиаприд, рилузол, амантадин, [123I]MNI-420, атомоксетин, тетрабеназин, дигоксин, детрометорфан, варфарин, алпрозам, кетоконазол, омепразол и миноциклин.
В определенных вариантах воплощения, фармацевтические агенты, которые могут быть введены совместно с фармацевтической композицией по настоящему изобретению, включают анальгетики, такие как парацетамол (ацетаминофен); нестероидные противовоспалительные лекарственные препараты (NSAID), такие как салицилаты; наркотические лекарственные препараты, такие как морфин, и синтетические лекарственные препараты с наркотическими свойствами, такие как трамадол.
В определенных вариантах воплощения, фармацевтические агенты, которые могут быть введены совместно с фармацевтической композицией по настоящему изобретению, включают миорелаксанты, такие как бензодиазепины и метокарбамол.
Рецептуры композиций
Соединения по изобретению также могут быть смешаны, конъюгированы или иным образом ассоциированы с другими молекулами, молекулярными структурами или смесями соединений, такими как, например, липосомы, нацеленные на рецептор молекулы или другие рецептуры композиций, для улучшения поглощения, распределения и/или всасывания. Типичные примеры патентов США, описывающих приготовление таких улучшающих поглощение, распределение и/или всасывание рецептур композиций, включают, без ограничений, документы US: 5108921; 5354844; 5416016; 5459127; 5521291; 5543158; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575; и 5595756, каждый из которых включен сюда в качестве ссылки.
Антисмысловые соединения по изобретению охватывают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров или любые другие соединения, которые, при введении животному, включая человека, способны обеспечить (прямо или косвенно) биологически активный метаболит или его остаток.
Термин "фармацевтически приемлемые соли" относится к физиологически и фармацевтически приемлемым солям соединений по изобретению: т.е. солям, которые сохраняют желательную биологическую активность исходного соединения и не придают ему нежелательных токсикологических эффектов. Для олигонуклеотидов, предпочтительные примеры фармацевтически приемлемых солей и их применение дополнительно описаны в Патенте США 6287860, который целиком включен сюда. Было показано, что пригодными формами олигонуклеотидных лекарственных препаратов являются соли натрия.
Настоящее изобретение также включает фармацевтические композиции и рецептуры, которые включают антисмысловые соединения по изобретению. Фармацевтические композиции по настоящему изобретению могут быть введены рядом способов в зависимости от того, является ли желательным местное или системное лечение, и от того, какая область требует лечения. Введение может быть парентеральным. Парентеральное введение включает внутривенную, интраартериальную, подкожную, интраперитонеальную или внутримышечную инъекцию или инфузию; или внутричерепное, например, внутримозговое введение, интратекальное введение, интравентрикулярное введение, вентрикулярное введение, интрацеребровентрикулярное введение, церебральное интравентрикулярное введение или церебрально-вентрикулярное введение.
Введение интравентрикулярно является предпочтительным для воздействия на экспрессию транстиретина в сосудистом сплетении. Олигонуклеотиды с, по меньшей мере, одной 2'-O-метоксиэтильной модификацией считаются особенно пригодными для перорального введения. Фармацевтические композиции и рецептуры для местного введения могут включать трансдермальные пластыри, жидкие мази, примочки, кремы, гели, капли, суппозитории, спреи, жидкие средства и порошки. Обычные фармацевтические носители, водные, порошкообразные или масляные основы, загустители и т.п. могут быть необходимыми или желательными. Также могут быть пригодными презервативы, перчатки с нанесенным покрытием и т.п..
Фармацевтические композиции по настоящему изобретению, которые удобно могут быть выполнены в виде стандартных дозированных форм, могут быть приготовлены в соответствии с обычными методиками, хорошо известными в фармацевтической промышленности. Такие методики включают стадию введения в контакт активных ингредиентов с фармацевтическим(и) носителем (носителями) или эксципиентом (эксципиентами). В общем, композиции лекарственных средств готовят путем равномерного и тщательного введения в контакт активных ингредиентов с жидкими носителями, или тонкоизмельченными твердыми носителями, или обоими, и затем, при необходимости, формования продукта.
Композиции по настоящему изобретению может быть изготовлены в виде любой из множества возможных дозированных форм, таких как, без ограничений, таблетки, капсулы, гелевые капсулы, жидкие сиропы, мягкие гели, суппозитории и клизмы. Композиции по настоящему изобретению также могут быть приготовлены в виде суспензий в водной, неводной или смешанной среде. Водные суспензии могут дополнительно содержать вещества, которые увеличивают вязкость суспензии, включая, например, натрия карбоксиметилцеллюлозу, сорбит и/или декстран. Суспензия может также содержать стабилизаторы.
Фармацевтические композиции по настоящему изобретению включают, без ограничений, растворы, эмульсии, пены и содержащие липосомы композиции. Фармацевтические композиции и рецептуры по настоящему изобретению могут содержать одно или несколько средств, усиливающих проницаемость, носителей, эксципиентов или других активных или неактивных ингредиентов.
Эмульсии типично представляют собой гетерогенные системы одной жидкости, диспергированной в другой в форме капелек, обычно, с диаметром более 0,1 мкм. Эмульсии могут содержать дополнительные компоненты в дополнение к диспергированным фазам и активному лекарственному средству, которое может иметь форму раствора в водной фазе, масляной фазе или представлять собой отдельную фазу. Микроэмульсии включены в вариант воплощения настоящего изобретения. Эмульсии и их применение хорошо известны специалистам и дополнительно описаны в патенте США 6287860, который целиком включен сюда.
Рецептуры композиций по настоящему изобретению включают липосомальные композиции. При использовании в настоящем изобретении, термин "липосома" означает везикулу, состоящую из амфифильных липидов, организованных в сферический бислой или бислой. Липосомы представляют собой однослойные или многослойные везикулы, которые имеют мембрану, сформированную из липофильного материала и водную внутреннюю часть, содержащую композицию, которая должна быть доставлена. Катионные липосомы представляют собой положительно заряженные липосомы, которые, как считается, взаимодействуют с отрицательно заряженными молекулами ДНК с образованием стабильного комплекса. Считается, что липосомы, которые являются рН-чувствительными или отрицательно заряженными, захватывают ДНК, а не образуют с ней комплекс. Как катионные, так и некатионные липосомы использовались для доставки ДНК в клетки.
Липосомы также включают "стерически стабилизированные" липосомы, причем этот термин, в используемом тут значении, относится к липосомам, включающим один или несколько специализированных липидов, которые, при включении в липосомы, приводят к увеличению продолжительности нахождения в циркуляции по сравнению с липосомами, не содержащими таких специализированных липидов. Липосомы и их применение дополнительно описаны в Патенте США 6287860, который целиком включен сюда.
В другом варианте воплощения изобретения, рецептуры композиций по настоящему изобретению включают рецептуры композиций в солевом растворе. В определенном варианте воплощения изобретения, композиция состоит из соединений, описанных тут, и солевого раствора. В определенных вариантах воплощения, композиция состоит по существу из соединений, описанных тут, и солевого раствора. В определенных вариантах воплощения, солевой раствор представляет собой фармацевтически приемлемый солевой раствор. В определенных вариантах воплощения, солевой раствор представляет собой забуференный солевой раствор. В определенных вариантах воплощения, солевой раствор представляет собой фосфатно-солевой буфер (PBS).
В определенных вариантах воплощения, рецептура композиции исключает липосомы. В определенных вариантах воплощения, композиция лекарственного средства исключает стерически стабилизированные липосомы. В определенных вариантах воплощения, рецептура композиции исключает фосфолипиды. В определенных вариантах воплощения, композиция лекарственного средства состоит по существу из соединений, описанных тут, и солевого раствора, и исключает липосомы.
Фармацевтические рецептуры и композиции по настоящему изобретению могут также включать поверхностно-активные вещества. Поверхностно-активные вещества и их применение дополнительно описаны в Патенте США 6287860, который целиком включен сюда.
В одном варианте воплощения, настоящее изобретение использует различные средства, усиливающие проницаемость, для обеспечения эффективной доставки нуклеиновых кислот, особенно олигонуклеотидов. Средства, усиливающие проницаемость, и их применение дополнительно описаны в Патенте США 6287860, который целиком включен в данное описание.
Квалифицированному специалисту будет понятно, что рецептуры композиций обычно составляются в соответствии с их предполагаемым применением, т.е. путем введения.
Предпочтительные композиции для местного введения включают такие, в которых олигонуклеотиды по изобретению находятся в смеси с агентом для местной доставки, таким как липиды, липосомы, жирные кислоты, сложные эфиры жирных кислот, стероиды, хелатирующие агенты и поверхностно-активные вещества. Предпочтительные липиды и липосомы включают нейтральные (например, диолеоилфосфатидилэтаноламин (DOPE), димиристоилфосфатидилхолин (DMPC), дистеароилфосфатидилхолин), отрицательно заряженные (например, димиристоилфосфатидилглицерин (DMPG)), и катионные (например, диолеоилтетраметиламинопропил (DOTAP) и диолеоилфосфатидилэтаноламин (DOTMA)).
Композиции и рецептуры для парентерального введения, включая внутривенные, интраартериальные, подкожные, интраперитонеальные, внутримышечные инъекции или инфузии, или внутричерепные, могут включать стерильные водные растворы, которые могут также содержать буферы, разбавители и другие пригодные добавки, такие как, без ограничений, средства, усиливающие проницаемость, соединения-носители и другие фармацевтически приемлемые носители или эксципиенты.
Определенные варианты воплощения данного изобретения предусматривают фармацевтические композиции, содержащие одно или несколько олигомерных соединений и один или несколько других химиотерапевтических агентов, действующих по не-антисмысловому механизму. Примеры таких химиотерапевтических агентов включают, без ограничений, противораковые химиотерапевтические лекарственные препараты, такие как даунорубицин, дауномицин, дактиномицин, доксорубицин, эпирубицин, идарубицин, эсорубицин, блеомицин, мафосфамид, ифосфамид, цитозинарабинозид, бис-хлорэтилнитрозомочевину, бусулфан, митомицин С, актиномицин D, митрамицин, преднизон, гидроксипрогестерон, тестостерон, тамоксифен, дакарбазин, прокарбазин, гексаметилмеламин, пентаметилмеламин, митоксантрон, амсакрин, хлорамбуцил, метилциклогексилнитрозомочевину, азотистые аналоги горчичного газа, мелфалан, циклофосфамид, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-азацитидин, гидроксимочевину, дезоксикоформицин, 4-гидроксипероксициклофосфорамид, 5-фторурацил (5-FU), 5-фтордезоксиуридин (5-FUdR), метотрексат (МТХ), колхицин, таксол, винкристин, винбластин, этопозид (VP-16), триметрексат, иринотекан, топотекан, гемцитабин, тенипозид, цисплатин и диэтилстилбестрол (DES). При использовании с соединениями по изобретению, такие химиотерапевтические агенты могут использоваться индивидуально (например, 5-FU и олигонуклеотид), последовательно (например, 5-FU и олигонуклеотид в течение определенного периода времени, а затем МТХ и олигонуклеотид) или в комбинации с одним или несколькими другими такими химиотерапевтическими агентами (например, 5-FU, МТХ и олигонуклеотид или 5-FU, радиотерапия и олигонуклеотид). Противовоспалительные лекарственные препараты, включая, без ограничений нестероидные противовоспалительные лекарственные препараты и кортикостероиды, и антивирусные лекарственные препараты, включая, без ограничений, рибивирин, видарабин, ацикловир и ганцикловир, также могут быть объединены в композициях по изобретению. Комбинации антисмысловых соединений и других не-антисмысловых лекарственных препаратов также входят в объем настоящего изобретения. Комбинации двух или больше соединений могут быть использованы вместе или последовательно.
В другом родственном варианте воплощения, композиции по изобретению могут содержать одно или несколько антисмысловых соединений, в частности, олигонуклеотиды, нацеленные на первую нуклеиновую кислоту, и одно или несколько дополнительных антисмысловых соединений, нацеленных на вторую нуклеиновую кислоту-мишень. Альтернативно, композиции по изобретению могут содержать два или больше антисмысловых соединений, нацеленных на разные участки одной и той же нуклеиновой кислоты-мишени. Многочисленные примеры антисмысловых соединений известны специалистам. Комбинации двух или больше соединений могут быть использованы вместе или последовательно.
Дозирование
Составление рецептуры терапевтических композиций и их последующее введение (дозирование) считается доступным специалистам в данной области. Дозирование зависит от тяжести и восприимчивости болезненного состояния, нуждающегося в лечении, при продолжительности курса лечения от нескольких дней до нескольких месяцев или до исцеления или до достижения ослабления болезненного состояния. Оптимальные схемы дозирования могут быть рассчитаны по результатам измерений накопления лекарственного средства в организме пациента. Оптимальные дозы могут меняться в зависимости от относительной действенности отдельных олигонуклеотидов и в общем могут быть оценены по значениям ЕСао, определенным как эффективные в in vitro и in vivo животных моделях. В общем, доза составляет от 0,01 мкг до 100 г на кг веса тела и может вводиться один или несколько раз в день, неделю, месяц или год или с желательными интервалами. После успешного лечения, может быть желательным проводить поддерживающую терапию пациента для предотвращения рецидивирования болезненного состояния, при которой олигонуклеотид вводится в поддерживающих дозах, составляющих от 0,01 мкг до 100 г на кг веса тела, один или несколько раз в день.
Хотя настоящее изобретение было описано более конкретно для определенных предпочтительных вариантов воплощения, следующие примеры служат только для иллюстрации изобретения и не предназначены для его ограничения. Все ссылки, номера доступа GenBank и т.п., указанные в настоящей заявке, целиком включены сюда в качестве ссылок.
ПРИМЕРЫ
Неограничивающее раскрытие и включение в качестве ссылок
Хотя определенные соединения, композиции и способы, описанные тут, были изложены более конкретно в соответствии с определенными вариантами воплощения, следующие примеры служат только для иллюстрации соединений, описанных тут, и не предназначены для его ограничения. Все ссылки, указанные в настоящей заявке, целиком включены сюда в качестве ссылок.
Пример 1: Антисмысловое ингибирование транстиретина человека в клетках HepG2
Были сконструированы антисмысловые олигонуклеотиды, нацеленные на транстиретиновую нуклеиновую кислоту, и подвергнуты испытаниям с целью определения их влияния на мРНК транстиретина in vitro. Культивируемые клетки HepG2 при плотности 10000 клеток на лунку трансфицируют с использованием реагента липофектина с 50 нМ антисмыслового олигонуклеотида. После периода обработки, составляющего приблизительно 24 часа, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймеров и зонда человека RTS1396 (прямая последовательность CCCTGCTGAGCCCCTACTC, обозначенная тут как SEQ ID NO:5; обратная последовательность TCCCTCATTCCTTGGGATTG, обозначенная тут как SEQ ID NO:6; последовательность зонда ATTCCACCACGGCTGTCGTCAX, обозначенная тут как SEQ ID NO:7). Уровни мРНК транстиретина устанавливали в соответствии с содержанием общей РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина, по сравнению с необработанными контрольными клетками.
Химерные антисмысловые олигонуклеотиды в Таблицах 1 и 2 были сконструированы в виде гапмеров 5-10-5 МОЕ. Гапмеры имеют 20 нуклеотидов в длину, причем центральный гэп-сегмент состоит из десяти 2'-дезоксинуклеотидов и фланкируется с обеих сторон (в 5'- и 3'-направлениях) боковыми сегментами, содержащими каждый по пять нуклеотидов. Каждый нуклеотид в 5'-боковом сегменте и каждый нуклеотид в 3'-боковом сегменте содержит 2'-МОЕ модификацию. Межнуклеозидные связи в каждом гапмере представляют собой фосфоротиоатные (P=S) связи. Все цитидиновые остатки в каждом гапмере представляют собой 5-метилцитидины. "Целевой инициирующий сайт человека" указывает крайний с 5'-конца нуклеотид, на который нацелен гапмер в генной последовательности человека. "Целевой терминирующий сайт человека" указывает крайний с 3'-конца нуклеотид, на который нацелен гапмер в генной последовательности человека. Каждый гапмер, указанный в Таблице 1, нацелен на мРНК транстиретина человека, обозначенную тут как SEQ ID NO:1 (№Доступа GENBANK NM_300371.2). Были также сконструированы определенные гапмеры, нацеленные на интронные последовательности или интрон-экзонные сочленения геномной последовательности транстиретина человека, обозначенной тут как SEQ ID NO:2 (№Доступа GENBANK NT_010966.10, укороченный из нуклеотидов 2009236-2017289), приведенные в Таблице 2.
Человеческие олигонуклеотиды в Таблицах 1 и 2 также являются перекрестно реактивными с генными последовательностями макака-резуса. "Неспаривающиеся основания" указывают число нуклеооснований, по которым олигонуклеотид человека не спаривается с генной последовательностью макака-резуса. Чем выше комплементарность между олигонуклеотидом человека и последовательностью макака-резуса, тем больше вероятность того, что олигонуклеотид человека может перекрестно реагировать с последовательностью макака-резуса. Человеческие олигонуклеотиды в Таблице 1 сравнивают с экзонами 1-4, выделенными из геномной последовательности макака-резуса №Доступа GENBANK NW_001105671.1, на основании сходства с экзонами человека. Человеческие олигонуклеотиды в Таблице 2 сравнивают с геномной последовательностью макака-резуса, обозначенной тут как SEQ ID NO:4 (№Доступа GENBANK NW_001105671.1 укороченный из нуклеотидов 62800O-638000). "Целевой инициирующий сайт макака-резуса" указывает крайний с 5'-конца нуклеотид, на который нацелен гапмер, в генной последовательности макака-резуса. "Целевой терминирующий сайт макака-резуса" указывает крайний с 3'-конца нуклеотид, на который нацелен гапмер генной последовательности макака-резуса.
Вследствие малой длины мРНК транстиретина человека, второй набор праймер-зонд был сконструирован на некотором расстоянии от первого набора праймер-зонд, RTS1396, во избежание амплификации олигонуклеотидов. Антисмысловые олигонуклеотиды также были подвергнуты испытаниям с целью определения их эффекта на мРНК транстиретина in vitro с использованием нового человеческого набора праймер-зонд RTS3029 (прямая последовательность CTTGCTGGACTGGTATTTGTGTCT, обозначенная тут как SEQ ID NO:161, обратная последовательность AGAACTTTGACCATCAGAGGACACT, обозначенная тут как SEQ ID NO:162; последовательность зонда CCCTACGGGCACCGGTGAATCCX, обозначенная тут как SEQ ID NO:163). Культивируемые клетки HepG2 при плотности 10000 клеток на лунку трансфицируют с использованием реагента липофектина 50 нМ антисмыслового олигонуклеотида. После периода обработки, составляющего приблизительно 24 часа, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Результаты представлены в Таблице 3 как процент ингибирования для набора клеток с PBS-контролем.
На основании результатов определения ингибирования с использованием нового набора праймер-зонд RTS3029, антисмысловые олигонуклеотиды, демонстрирующие 50% или больше ингибирования мРНК транстиретина, были выбраны для дальнейших исследований.
Пример 2: Антисмысловое ингибирование транстиретина человека в клетках HepG2 олигонуклеотидами, сконструированными способом микроскользящего зондирования
Дополнительные гапмеры были сконструированы на основе гапмеров, представленных в Таблице 3, которые продемонстрировали ингибирование, по меньшей мере, 50%. Эти гапмеры были сконструированы путем создания гапмеров, немного смещенных против хода транскрипции и по ходу транскрипции (т.е. "микроскользящее зондирование") оригинальных гапмеров из Таблицы 3. Были также созданы гапмеры с различными мотивами, например, мотивами 5-10-5 МОЕ, 3-14-3 МОЕ, 2-13-5 МОЕ и 4-11-5 МОЕ. Эти гапмеры были подвергнуты испытаниям in vitro. Культивируемые клетки HepG2 при плотности 10000 клеток на лунку трансфицируют с использованием реагента липофектина 50 нМ антисмыслового олигонуклеотида. После периода обработки, составляющего приблизительно 24 часа, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Человеческий набор праймер-зонд RTS3029 используют для измерения уровней мРНК транстиретина. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Результаты представлены в Таблице 4.
Химерные антисмысловые олигонуклеотиды в Таблице 4 были сконструированы в виде гапмеров 5-10-5 МОЕ, 3-14-3 МОЕ, 2-13-5 МОЕ или 4-11-5 МОЕ. Гапмеры, отмеченные звездочкой (*) в Таблице 4, представляют собой оригинальные гапмеры, на основании которых были спроектированы гапмеры ISIS 42565O-425763 с помощью способа микро-скользящего зондирования. Гапмеры 5-10-5 имеют 20 нуклеотидов в длину, причем центральный гэп-сегмент состоит из десяти 2'-дезоксинуклеотидов и фланкируется с обоих сторон (в 5'- и 3'-направлениях) боковыми сегментами, содержащими каждый по пять нуклеотидов. Гапмеры 3-14-3 имеют 20 нуклеотидов в длину, причем центральный гэп-сегмент состоит из четырнадцати 2'-дезоксинуклеотидов и фланкируется с обеих сторон (в 5'- и 3'-направлениях) боковыми сегментами, содержащими каждый по три нуклеотида. Гапмеры 2-13-5 имеют 20 нуклеотидов в длину, причем центральный гэп-сегмент состоит из тринадцати 2'-дезоксинуклеотидов и фланкируется в 5'- и 3'-направлениях боковыми сегментами, содержащими два и пять нуклеотидов, соответственно. Гапмеры 4-11-5 имеют 20 нуклеотидов в длину, причем центральный гэп-сегмент состоит из одиннадцати 2'-дезоксинуклеотидов и фланкируется в 5'- и 3'-направлениях боковыми сегментами, содержащими четыре и пять нуклеотидов, соответственно. Для каждого из мотивов (5-10-5, 3-14-3, 2-13-5 и 4-11-5), каждый нуклеотид в 5'-боковом сегменте и каждый нуклеотид в 3'-боковом сегменте имеют 2'-МОЕ модификацию. Межнуклеозидные связи в каждом гапмере представляют собой фосфоротиоатные (P=S) связи. Все цитидиновые остатки в каждом гапмере представляют собой 5-метилцитидины. "Целевой инициирующий сайт" указывает крайний с 5'-конца нуклеотид, на который нацелен гапмер. "Целевой терминирующий сайт" указывает крайний с 3'-конца нуклеотид, на который нацелен гапмер. Каждый гапмер, указанный в Таблице 4, нацелен на участок-мишень, охватывающий нуклеооснования 481-619 SEQ ID NO:1 (№ Доступа GENBANK NM_000371.2).
Как показано в Таблице 4, несколько гапмеров продемонстрировали, по меньшей мере, 50% ингибирования, включая номера ISIS: 304296, 425655, 425695, 425735, 425649, 425656, 425696, 425736, 420912, 425657, 425697, 425737, 420913, 425658, 425698, 425738, 420914, 425659, 425699, 425739, 304299, 425660, 425700, 425740, 420915, 420916, 425662, 425702, 420919, 425703, 420920, 425664, 425704, 425742, 420921, 425665, 425705, 425743, 420922, 425666, 425706, 420923, 420937, 420944, 425669, 425709, 425746, 425710, 425711, 425747, 420948, 425712, 425748, 425673, 425713, 425749, 425651, 425675, 425715, 425751, 304309, 425676, 425716, 425752, 420949, 425677, 425717, 425753, 420950, 425678, 425718, 425754, 420951, 425679, 425719, 425755, 420952, 425680, 425720, 425756, 420953, 425681, 425721, 425757, 420954, 425722, 425758, 420955, 425759, 425724, 425760, 425762, 304310, 425729, 425764, 425653, 425690, 425730, 425765, 304311, 425691, 425731, 425766, 304312, 425692, 425732, 425767, 425654, 425693, 425733, 425768, 304313, 425734 и 425769.
Несколько гапмеров продемонстрировали, по меньшей мере, 60% ингибирования, включая номера ISIS: 304296, 425655, 425695, 425735, 425649, 425656, 425696, 425736, 420912, 425657, 425697, 425737, 420913, 425658, 425698, 425738, 420914, 425659, 425739, 304299, 425740, 420915, 425702, 420919, 420920, 425742, 420921, 425665, 425705, 425706, 420923, 425746, 425711, 425747, 420948, 425712, 425748, 425651, 425715, 425751, 304309, 425716, 425752, 425677, 425717, 425753, 420950, 425718, 425754, 420951, 425679, 425719, 425755, 420952, 425680, 425720, 420953, 425681, 425721, 425757, 420954, 425722, 425758, 420955, 425724, 425760, 425764, 425653, 425690, 425730, 425765, 304311, 425691, 425731, 425766, 304312, 425692, 425732, 425767, 425654, 425693, 425733, 304313 и 425769.
Несколько гапмеров продемонстрировали, по меньшей мере, 70% ингибирования, включая номера ISIS: 304296, 425655, 425695, 425735, 425649, 425656, 425696, 425736, 420912, 425657, 425737, 420913, 425738, 420914, 425659, 304299, 420915, 420920, 425742, 425712, 425748, 425716, 425754, 420951, 425679, 425719, 425755, 425680, 425721, 425757, 425760, 425653, 425690, 425730, 425765, 304311, 425691, 425731, 425766, 304312, 425767, 425693 и 304313.
Несколько гапмеров продемонстрировали, по меньшей мере, 80% ингибирования, включая номера ISIS: 304296, 425655, 425695, 425736, 420913, 425659, 304299, 420915, 425716, 425754, 425719, 425757, 425765 и 425767.
Несколько гапмеров продемонстрировали, по меньшей мере, 85% ингибирования, включая номера ISIS: 420913, 425716, 425754 и 425719.
Один гапмер, ISIS 425719, продемонстрировал 90% ингибирования.
Пример 3: Дозазависимое антисмысловое ингибирование транстиретина человека в клетках HepG2
Гапмеры по Примеру 2, демонстрирующие значительное in vitro ингибирование транстиретина человека, были подвергнуты испытаниям в разных дозах в клетках HepG2. Клетки высеивают при плотности 20000 клеток на лунку и трансфицируют с помощью электропорации концентрациями антисмыслового олигонуклеотида 625 нМ, 1250 нМ, 2500 нМ, 5000 нМ и 10000 нМ, как указано в Таблице 5. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS3029 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками.
Полумаксимальная ингибирующая концентрация (IC50) каждого олигонуклеотида также представлена в Таблице 5 и рассчитывалась путем построения графика зависимости используемых концентраций олигонуклеотидов от процента ингибирования экспрессии мРНК транстиретина, достигнутого при каждой концентрации, и определения концентрации олигонуклеотида, при которой достигалось 50% ингибирования экспрессии мРНК транстиретина по сравнению с контролем. Как показано в Таблице 5, уровни мРНК транстиретина значительно снижались зависимым от дозы образом в клетках, обработанных антисмысловым олигонуклеотидом.
Также были испытаны гапмеры по Примеру 2 в разных дозах в клетках HepG2 с использованием реагента для трансфекции - липофектина. Клетки высеивают при плотности 10000 клеток на лунку и трансфицируют с помощью электропорации концентрациями антисмыслового олигонуклеотида, равными 6,25 нМ, 12,5 нМ, 25 нМ, 50 нМ и 100 нМ, как указано в Таблице 6. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS3029 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Как показано в Таблице 6, уровни мРНК транстиретина значительно снижались зависимым от дозы образом в клетках, обработанных антисмысловым олигонуклеотидом.
Пример 4: Дозазависимое антисмысловое ингибирование транстиретина человека в клетках HepG2
Гапмеры, выбранные в Примере 3, были подвергнуты испытаниям в разных дозах в клетках HepG2. Клетки высеивают при плотности 20000 клеток на лунку и трансфицируют с помощью электропорации концентрациями антисмыслового олигонуклеотида, равными 0,0617 мкМ, 0,1852 мкМ, 0,5556 мкМ, 1,6667 мкМ и 5 мкМ, как указано в Таблице 7. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS3029 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Как показано в Таблице 7, уровни мРНК транстиретина снижаются зависимым от дозы образом в клетках, обработанных антисмысловым олигонуклеотидом.
Пример 5: Подтверждение дозового ответа антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, в клетках Нер3В
Гапмеры по Примеру 4, демонстрирующие значительное in vitro ингибирование транстиретина человека, были подвергнуты испытаниям в разных дозах в клетках Нер3В. Клетки высеивают при плотности 20000 клеток на лунку и трансфицируют с помощью электропорации концентрациями антисмыслового олигонуклеотида, равными 0,0206 мкМ, 0,062 мкМ, 0,185 мкМ, 0,556 мкМ, 1,667 мкМ и 5 мкМ, как указано в Таблице 8. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS1396 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Как показано в Таблице 8, уровни мРНК транстиретина снижаются зависимым от дозы образом в клетках, обработанных антисмысловым олигонуклеотидом. Значения IC50 для каждого олигонуклеотида также представлены в Таблице 8.
Пример 6: Подтверждение дозового ответа антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, в первичных гепатоцитах трансгенных мышей с транстиретином человека
Гапмеры по Примеру 5 также были испытаны в разных дозах в первичных гепатоцитах трансгенных мышей с транстиретином человека. ISIS 304309, ISIS 304311, ISIS 304312 и ISIS 420951 (см. Пример 2) также были повторно испытаны вместе с этими гапмерами в таких же условиях культивации. Клетки высеивают при плотности 10000 клеток на лунку и трансфицируют с помощью цитофектина концентрациями антисмыслового олигонуклеотида, равными 18,75 нМ, 37,5 нМ, 75 нМ, 150 нМ и 300 нМ, как указано в Таблице 9. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS1396 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Как показано в Таблице 9, уровни мРНК транстиретина снижаются зависимым от дозы образом в клетках, обработанных антисмысловым олигонуклеотидом.
Пример 7: Подтверждение дозового ответа антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, в клетках HepG2
Гапмеры по Примеру 6 были подвергнуты испытаниям в разных дозах в клетках HepG2. Клетки высеивают при плотности 10000 клеток на лунку и трансфицируют с помощью электропорации концентрациями антисмыслового олигонуклеотида, равными 0,062 мкМ, 0,185 мкМ, 0,556 мкМ, 1,66 мкМ и 5,000 мкМ, как указано в Таблице 10. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS1396 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Как показано в Таблице 10, уровни мРНК транстиретина снижаются зависимым от дозы образом в клетках, обработанных антисмысловым олигонуклеотидом.
Пример 8: Подтверждение дозового ответа антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, в первичных гепатоцитах трансгенных мышей с транстиретином человека
Гапмеры по Примеру 6 также были испытаны в разных дозах в первичных гепатоцитах трансгенных мышей с транстиретином человека. Клетки высеивают при плотности 10000 клеток на лунку и трансфицируют с помощью цитофектина концентрациями антисмыслового олигонуклеотида, равными 5 нМ, 10 нМ, 20 нМ, 40 нМ и 80 нМ, как указано в Таблице 11. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS3029 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Как показано в Таблице 11, уровни мРНК транстиретина снижаются зависимым от дозы образом в клетках, обработанных антисмысловым олигонуклеотидом.
Гапмеры также были подвергнуты испытаниям с использованием электропорации в качестве агента трансфекции. Клетки высеивают при плотности 35000 клеток на лунку и трансфицируют с помощью электропорации концентрациями антисмыслового олигонуклеотида, равными 148,148 нМ, 444,444 нМ, 1333,333 нМ, 4000 нМ и 12000 нМ, как указано в Таблице 12. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS3029 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками.
Пример 9: Подтверждение дозового ответа антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, в первичных гепатоцитах яванского макака
Гапмеры по Примеру 6 также были испытаны в разных дозах в первичных гепатоцитах яванского макака. Клетки высеивают при плотности 35000 клеток на лунку и трансфицируют с помощью электропорации концентрациями антисмыслового олигонуклеотида, равными 1250 нМ, 2500 нМ, 5000 нМ, 10000 нМ и 20000 нМ, как указано в Таблице 13. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS1396 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Как показано в Таблице 13, уровни мРНК транстиретина снижаются зависимым от дозы образом в гепатоцитах, обработанных олигонуклеотидами ISIS.
Из-за отсутствия полной генной последовательности яванского макака в базе данных NCBI, олигонуклеотиды были подвергнуты испытаниям на перекрестную реактивность с генной последовательностью макака-резуса, поскольку оба вида принадлежат к одному роду Масаса. Человеческие олигонуклеотиды являются перекрестно реактивными с геном транстиретина макака-резуса, обозначенным тут как SEQ ID NO:4 (экзоны 1-4, выделенные из №Доступа GENBANK NW_301105671.1). "Неспаренные основания" указывают число неспаренных оснований между олигонуклеотидом человека и геном транстиретина макака-резуса, "н.д." указывает, что олигонуклеотид человека имеет более 3 неспаренных оснований с геном транстиретина макака-резуса и потому перекрестно не реагирует с ним.
Пример 10: In vivo ингибирование транстиретина человека у трансгенных мышей с транстиретином человека
Гапмеры по Примеру 6, демонстрирующие значительное ингибирование мРНК транстиретина, были подвергнуты испытаниям на трансгенных мышах, содержащих ген транстиретина человека, с проведением оценки эффективности гапмеров.
Экспериментальное введение
Пятнадцати группам по четыре самки hTTR трансгенных мышей в каждой вводят подкожно два раза в неделю в течение четырех недель 25 мг/кг ISIS 304299, ISIS 304309, ISIS 304311, ISIS 304312, ISIS 420915, ISIS 420951, ISIS 425653, ISIS 425655, ISIS 425656, ISIS 425679, ISIS 425695, ISIS 425736, ISIS 425737, ISIS 425755 или ISIS 425757. Другой группе из четырех самок hTTR трансгенных мышей вводят инъекцией 25 мг/кг контрольного олигонуклеотида ISIS 141923 (CCTTCCCTGAAGGTTCCTCC, обозначенная тут как SEQ ID NO:165) два раза в неделю в течение четырех недель. Другой группе из четырех самок hTTR трансгенных мышей вводят подкожными инъекциями PBS два раза в неделю в течение четырех недель. Мыши, получавшие инъекции PBS, служат контрольной группой. Образцы крови берут у всех групп в недели 0, 1, 2, 3 и 4 для анализа уровня транстиретина плазмы. Мышей умерщвляют через два дня после последней дозы и берут печень для анализа мРНК-мишени.
Анализ РНК
РНК экстрагируют из ткани печени для анализа транстиретина способом ПЦР в реальном масштабе времени с использованием набора праймер-зонд RTS3029. Результаты представлены как процент ингибирования транстиретина человека, по сравнению с PBS-контролем. Как видно из Таблицы 14, введение антисмысловых олигонуклеотидов ISIS приводит к значительному снижению мРНК транстиретина человека по сравнению с PBS-контролем. Введение контрольного олигонуклеотида, ISIS 141923, не приводило к значительному снижению транстиретина, как ожидалось.
Анализ белка
Уровни белка транстиретина человека измеряют в плазме трансгенных мышей способом ELISA с использованием поликлонального антитела против транстиретина (Abeam Ab 37774) и детектирующего антитела овечьей анти-TTR пероксидазы хрена (Abeam, №по каталогу 35217). Цветную реакцию получают с помощью Набора ImmunoPure® TMB Substrate и измеряют поглощение при 450 нм с помощью спектрофотометра для микротитровальных планшетов. Образцы плазмы берут до введения дозы и в дни 7, 14 и 28. Результаты, представленные в Таблице 15, выражены как процент ингибирования по сравнению с уровнями до введения дозы и демонстрируют время-зависимое снижение уровней белка при введении олигонуклеотидов ISIS.
Вес тела и вес органов
Вес тела мышей измеряют до введения дозы и в конце периода введения дозы. Значения веса тела приведены в Таблице 16 и выражены как процент увеличения по сравнению с весом PBS-контроля, определенным перед началом введения. Вес печени, селезенки и почки измеряют в конце исследований и он также приведен в Таблице 16 как процент изменений по сравнению с соответствующим весом органов PBS-контроля. Как видно из Таблицы 16, не наблюдалось значительных изменений веса тела или органов в результате введения антисмыслового олигонуклеотида.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени измеряют концентрации трансаминазы плазмы с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измеряют концентрации в плазме ALT (аланинтрансаминазы) и AST (аспартаттрансаминазы), и результаты, выраженные в IU/л, представлены в Таблице 17. Также измеряют уровни билирубина плазмы с помощью такого же клинического химического анализатора; результаты также приведены в Таблице 17 и выражены в мг/дл.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки, измеряют концентрации в плазме остаточного азота мочевины крови (BUN) с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты приведены в Таблице 18 и выражены в мг/дл. Данные указывают, что антисмысловое ингибирование транстиретина не влияет на уровни BUN у этих трансгенных мышей.
Пример 11: Переносимость антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, у CD1-мышей
CD1®-мыши (Charles River, MA) представляют собой многоцелевую мышиную модель, часто используемую для испытаний на безопасность и эффективность. Мышам вводят ISIS-антисмысловые олигонуклеотиды, выбранные по результатам исследований, описанных в Примере 10, и оценивают изменения уровней различных метаболических маркеров.
Экспериментальное введение
Группам по восемь CD1-мышей в каждой вводят подкожными инъекциями два раза в неделю 50 мг/кг ISIS 304299, ISIS 304309, ISIS 420915, ISIS 420951, ISIS 425655, ISIS 425656, ISIS 425679, ISIS 425695, ISIS 425736, ISIS 425737 и ISIS 425755. По четыре мыши из каждой группы используют для оценки в неделю 2 и неделю 6 периода эксперимента. Через три дня после последней дозы в каждый момент времени, измеряют вес тела, мышей подвергают эвтаназии и органы и плазму собирают для дальнейшего анализа.
Вес тела и органов
Вес тела мышей измеряют до введения дозы и в конце каждого периода введения (две недели и шесть недель). Значения веса тела приведены в Таблицах 19 и 20 и выражены как процент увеличения по сравнению с весом PBS-контроля, определенным перед началом введения. Вес печени, селезенки и почки измеряют в конце исследований, и они также представлены в Таблицах 19 и 20 как процент изменения по сравнению с соответствующим весом органов PBS-контроля.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени измеряют концентрации трансаминазы плазмы с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Концентрации в плазме ALT (аланинтрансаминазы) и AST (аспартаттрансаминазы) измеряют, и результаты, выраженные в IU/л, представлены в Таблицах 21 и 22. Уровни билирубина и альбумина плазмы также измеряют с помощью такого же клинического химического анализатора и результаты также представлены в Таблицах 21 и 22.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки, концентрации в плазме остаточного азота мочевины крови (BUN) и креатинина измеряют с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты, выраженные в мг/дл, приведены в Таблицах 23 и 24.
Гематологические анализы
Кровь, взятую у всех мышей группы, отправляли в Antech Diagnostics для измерений и анализов гематокрита (НСТ), среднего объема эритроцитов (MCV), среднего содержания гемоглобина в эритроцитах (МСН) и средней концентрации эритроцитарного гемоглобина (МСНС), а также для проведения дифференциального анализа клеток крови, таких как белые кровяные клетки (WBC) (нейтрофилы, лимфоциты и моноциты), красные кровяные клетки (RBC) и тромбоциты, и общего содержания гемоглобина. Результаты представлены в Таблицах 25-28. Проценты, приведенные в таблицах, указывают процент изменения общего количества клеток крови по сравнению с PBS-контролем. Антисмысловые олигонуклеотиды, не вызывавшие снижения числа тромбоцитов до значения, составляющего менее 70% от PBS-контроля, или более чем двукратного увеличения числа моноцитов, были выбраны для дальнейших исследований.
Пример 12: Измерение периода полувыведения антисмыслового олигонуклеотида в печени CD1-мышей
CD1-мышам вводят ISIS антисмысловые олигонуклеотиды, определенные по результатам исследований, описанных в Примере 11, и оценивают период полувыведения олигонуклеотида, а также время, проходящее до деградации олигонуклеотида и выведения из печени.
Введение
Группам по двенадцать CD1-мышей каждая вводят подкожными инъекциями два раза в неделю в течение 2 недель 50 мг/кг ISIS 304299, ISIS 304309, ISIS 420915, ISIS 420951, ISIS 425655, ISIS 425656, ISIS 425679, ISIS 425695, ISIS 425736, ISIS 425737 и ISIS 425755. По четыре мыши из каждой группы умерщвляют через 3 дня, 28 дней и 56 дней после последней дозы. Берут печень на анализ.
Измерение концентрации олигонуклеотида
Измеряют концентрацию полноразмерного олигонуклеотида, а также общую концентрацию олигонуклеотида (включая деградированную форму). Используемый способ представляет собой модификацию ранее опубликованных способов (Leeds et al., 1996; Geary et al., 1999), которые состоят в фенол-хлороформенной (жидкость-жидкость) экстракции с последующей твердофазовой экстракцией. Перед экстракцией прибавляют внутренний стандарт (ISIS 355868, 27-мерный 2'-O-метоксиэтил-модифицированный фосфоротиоатный олигонуклеотид, GCGTTTGCTCTTCTTCTTGCGTTTTTT, обозначенный тут как SEQ ID NO:166). Концентрации в образцах тканей рассчитывают с использованием калибровочных кривых, при нижнем пределе количественного определения (LLOQ), равном приблизительно 1,14 мкг/г. Затем рассчитывают периоды полувыведения с помощью прикладной программы WinNonlin (PHARSIGHT).
Результаты представлены в Таблицах 29 и 30, и выражены в мкг/г ткани печени. Период полувыведения каждого олигонуклеотида приведен в Таблице 31. Антисмысловые олигонуклеотиды с периодами полувыведения в пределах 11-34 дней были выбраны для дальнейших исследований.
Пример 13: Переносимость антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, у крыс Sprague-Dawley
Крысам Sprague-Dawley вводят ISIS антисмысловые олигонуклеотиды, выбранные по результатам исследований, описанных в Примерах 11 и 12, и оценивают изменения уровней различных метаболических маркеров.
Введение
Значения веса тела, клинический анализ крови и дифференциальный анализ крови, а также соотношение белок/креатинин в моче крыс оценивают до введения дозы. Группам из четырех крыс Sprague-Dawley вводят каждой подкожными инъекциями два раза в неделю 50 мг/кг ISIS 304299, ISIS 304309, ISIS 420915, ISIS 420951, ISIS 425655, ISIS 425656, ISIS 425679, ISIS 425695, ISIS 425736, ISIS 425737 и ISIS 425755. Через три дня после последней дозы для каждого момента времени измеряют вес тела, крыс подвергают эвтаназии и органы и плазму собирают для дальнейшего анализа.
бес тела и органов
Значения веса тела крыс измеряют до введения дозы и в конце периода введения дозы. Значения веса тела приведены в Таблице 32 и выражены как процент увеличения по сравнению с весом PBS-контроля, определенным перед началом введения. Вес печени, селезенки и почки измеряют в конце исследований и он также приведен в Таблице 32 как процент изменения по сравнению с соответствующим весом органов PBS-контроля.
Как видно из Таблицы 32, определенные соединения демонстрируют менее чем 4-кратное увеличение веса селезенки.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени измеряют концентрации трансаминазы плазмы с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измеряют концентрации в плазме ALT (аланинтрансаминазы) и AST (аспартаттрансаминазы) и в Таблице 33 представлены результаты, выраженные в IU/л. Уровни билирубина и альбумина плазмы также измеряют с помощью такого же клинического химического анализатора и результаты также приведены в Таблице 33.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки, концентрации в плазме остаточного азота мочевины крови (BUN) и креатинина измеряют с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты, выраженные в мг/дл, приведены в Таблице 34. Отношение общего белка мочи к креатинину также оценивалось и представлено в Таблице 35.
Как видно из Таблиц 34 и 35, определенные соединения продемонстрировали менее чем 7-кратное увеличение общего белка мочи/креатинина в почке этих крыс. Кроме того, определенные соединения продемонстрировали менее чем 6-кратное увеличение общего белка мочи/креатинина в почке этих крыс.
Гематологические анализы
Кровь, взятую у всех групп крыс, отправляли в Antech Diagnostics для измерений и анализов гематокрита (НСТ), среднего объема эритроцитов (MCV), среднего содержания гемоглобина в эритроцитах (МСН) и средней концентрации эритроцитарного гемоглобина (МСНС), а также измерений дифференциального количества клеток крови, таких как белые кровяные клетки (WBC) (нейтрофилы, лимфоциты и моноциты), красные кровяные клетки (RBC) и тромбоциты, и общего содержания гемоглобина. Результаты представлены в Таблицах 36 и 37. Проценты, приведенные в таблицах, указывают процент изменения общего количества клеток крови по сравнению с PBS-контролем.
Пример 14: Фармакокинетические исследования концентрации антисмыслового олигонуклеотида в печени и почке крыс Sprague-Dawley
Крысам Sprague-Dawley вводят ISIS-антисмысловые олигонуклеотиды, определенные по результатам исследований, описанных в Примере 13, и оценивают период полувыведения олигонуклеотида, а также время, проходящее до деградации олигонуклеотида и выведения из печени и почки.
Введение
Группам по четыре крысы Sprague Dawley вводят каждой подкожными инъекциями два раза в неделю в течение 2 недель 20 мг/кг ISIS 304299, ISIS 304309, ISIS 420915, ISIS 420951, ISIS 425655, ISIS 425656, ISIS 425679, ISIS 425695, ISIS 425736, ISIS 425737 и ISIS 425755. Через три дня после последней дозы, крыс умерщвляют и печень и почки берут для анализов.
Измерение концентрации олигонуклеотида
Измеряют концентрацию полноразмерного олигонуклеотида, а также общую концентрацию олигонуклеотида (включая деградированную форму). Используемый способ представляет собой модификацию ранее опубликованных способов (Leeds et al., 1996; Geary et al., 1999), которые заключаются в фенол-хлороформенной (жидкость-жидкость) экстракции с последующей твердофазовой экстракцией. Перед экстракцией прибавляют внутренний стандарт (ISIS 355868, 27-мерный 2'-O-метоксиэтил-модифицированный фосфоротиоатный олигонуклеотид, GCGTTTGCTCTTCTTCTTGCGTTTTTT, обозначенный тут как SEQ ID NO:166). Концентрации в образцах тканей рассчитывают с использованием калибровочных кривых, при нижнем пределе количественного определения (LLOQ), равном приблизительно 1,14 мкг/г.Результаты, представленные в Таблицах 38 и 39, выражены в мкг/г ткани печени или почки. Также рассчитывают отношение полноразмерного олигонуклеотида к почке и печени, приведенное в Таблице 38.
Пример 15: In vivo дозазависимое ингибирование транстиретина человека у трансгенных мышей
Трансгенным мышам, содержащим ген транстиретина человека, вводят возрастающие дозы ISIS-олигонуклеотидов, выбранных по результатам исследований, описанных в Примере 14, для оценки эффекта дозазависимого ингибирования транстиретина человека у этих мышей.
Введение
Группам по четыре мыши, два самца и две самки, вводят каждой подкожными инъекциями два раза в неделю в течение 4 недель 4 мг/кг, 10 мг/кг или 25 мг/кг ISIS 304299, ISIS 420915, ISIS 420951, ISIS 425679, ISIS 425736, ISIS 425737 или ISIS 425755. Одной группе из четырех мышей, двух самцов и двух самок, вводят подкожными инъекциями два раза в неделю в течение 4 недель 25 мг/кг контрольного олигонуклеотида, ISIS 141923. Одной контрольной группе из четырех мышей, двух самцов и двух самок, вводят подкожными инъекциями два раза в неделю в течение 4 недель PBS. Образцы плазмы берут в каждой группе в дни 0, 7, 14, 21 и 28. Через два дня после последней дозы мышей подвергают эвтаназии и органы собирают для дальнейших анализов.
Анализ РНК
РНК экстрагируют из ткани печени для анализа транстиретина способом ПЦР в реальном масштабе времени с использованием набора праймер-зонд RTS3029. Результаты представлены как процент ингибирования транстиретина человека, по сравнению с PBS-контролем. Как видно из Таблицы 40, введение антисмысловых олигонуклеотидов ISIS приводит к значительному дозазависимому снижению мРНК транстиретина человека по сравнению с PBS-контролем. Введение контрольного олигонуклеотида, ISIS 141923 не приводило к значительному снижению транстиретина, как ожидалось.
Анализ белка
Уровни белка транстиретина человека измеряют в плазме трансгенных мышей способом ELISA с использованием поликлонального антитела против транстиретина (Abeam Ab37774) и овечьего анти-TTR пероксидаза хрена, детектирующего антитела (Abeam, №по каталогу 35217). Цветную реакцию создают с помощью набора ImmunoPure® TMB Substrate Kit и измеряют поглощение при 450 нм с помощью спектрофотометра для микротитровальных планшетов. Образцы плазмы берут до введения дозы и в дни 7, 14, 21 и 28. Результаты, представленные в Таблице 41, выражены как процент ингибирования по сравнению уровнями до введения дозы и демонстрируют времязависимое и дозазависимое снижение уровней белка при введении олигонуклеотидов ISIS.
Вес тела и вес органов
Вес тела мышей измеряют до введения дозы и в конце периода введения дозы. Значения веса тела приведены в Таблице 42 и выражены как процент увеличения по сравнению с весом PBS-контроля, определенным перед началом введения. Вес печени, селезенки и почки измеряют в конце исследований, и он также приведен в Таблице 42 как процент изменения по сравнению с соответствующим весом органов PBS-контроля.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени измеряют концентрации трансаминазы плазмы с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измеряют концентрации в плазме ALT (аланинтрансаминазы) и AST (аспартаттрансаминазы) и результаты, выраженные в IU/л, представлены в Таблице 43. Также измеряют уровни билирубина плазмы с помощью такого же клинического химического анализатора; результаты также приведены в Таблице 43 и выражены в мг/дл.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки, концентрации в плазме остаточного азота мочевины крови (BUN) измеряют с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты приведены в Таблице 44 и выражены в мг/дл.
Пример 16: In vivo ингибирование транстиретина человека у трансгенных мышей с транстиретином человека
Антисмысловые олигонуклеотиды с мотивами 5-10-5 МОЕ, ISIS 304313, ISIS 420913, ISIS 420919, ISIS 420921, ISIS 420922, ISIS 420937, ISIS 420944, ISIS 420947, ISIS 420949, ISIS 420950, ISIS 420951, ISIS 420952, ISIS 420953, ISIS 420955, ISIS 420957 и ISIS 420959 из Таблицы 4. Эти антисмысловые олигонуклеотиды, демонстрирующие 65% ингибирования мРНК транстиретина или больше, были выбраны и испытаны на трансгенных мышах, содержащих ген транстиретина человека. Дополнительные олигонуклеотиды с последовательностями, перекрывающимися с ISIS 420951 (GTTTTATTGTCTCTGCCTGG (SEQ ID NO:116)), и с различными мотивами, также были конструированы для испытаний на трансгенных мышах. Такими дополнительными олигонуклеотидами были ISIS 450518 (III l ATTGTCTCTGCCTG (SEQ ID NO:5-8-5 МОЕ (SEQ ID NO:167)), ISIS 450519 (GTTTTATTGTCTCTGCCTGG, 6-8-6 МОЕ (SEQ ID NO:116)), ISIS 450520 (GTTTTATTGTCTCTGCCTGG, 3-10-7 МОЕ (SEQ ID NO:116)), ISIS 450521 (GTTTTATTGTCTCTGCCTGG, 7-10-3 МОЕ (SEQ ID NO:116)), ISIS 450522 (GTTTTATTGTCTCTGCCTGG, 2-10-8 МОЕ (SEQ ID NO:116)) и ISIS 450523 (GTTTTATTGTCTCTGCCTGG, 8-10-2 МОЕ (SEQ ID NO:116)).
Введение
Группам по четыре hTTR трансгенных мышей в каждой, два самца и две самки, вводят подкожно два раза в неделю в течение четырех недель 25 мг/кг ISIS 304313, ISIS 420913, ISIS 420919, ISIS 420921, ISIS 420922, ISIS 420937, ISIS 420944, ISIS 420947, ISIS 420949, ISIS 420950, ISIS 420951, ISIS 420952, ISIS 420953, ISIS 420955, ISIS 420957, ISIS 420959, ISIS 425518, ISIS 425519, ISIS 425520, ISIS 425521, ISIS 425522 или ISIS 425523. Контрольной группе из четырех hTTR трансгенных мышей, двух самцов и двух самок, вводят подкожными инъекциями PBS два раза в неделю в течение четырех недель. Образцы крови берут у всех групп в дни 0, 14 и 28 для анализа уровня транстиретина плазмы. Мышей умерщвляют через два дня после последней дозы и берут печень для анализа мРНК-мишени.
Анализ РНК
РНК экстрагируют из ткани печени для анализа транстиретина способом ПЦР в реальном масштабе времени с использованием набора праймер-зонд RTS3029. Результаты представлены как процент ингибирования транстиретина человека по сравнению с PBS-контролем. Как видно из Таблицы 45, введение антисмысловых олигонуклеотидов ISIS приводит к значительному снижению мРНК транстиретина человека по сравнению с PBS-контролем.
Анализ белка
Уровни белка транстиретина человека измеряют в плазме трансгенных мышей способом ELISA с использованием поликлонального антитела против транстиретина (Abeam Ab37774) и овечьего анти-TTR пероксидаза хрена детектирующего антитела (Abeam, №по каталогу 35217). Цветную реакцию создают с помощью набора ImmunoPure® TMB Substrate Kit и измеряют поглощение при 450 нм с помощью спектрофотометра для микротитровальных планшетов. Образцы плазмы берут до введения дозы и в дни 7, 14 и 28. Результаты, представленные в Таблице 46, выражены как процент ингибирования по сравнению с уровнями до введения дозы и демонстрируют время-зависимое снижение уровней белка при введении олигонуклеотидов ISIS.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени измеряют концентрации трансаминазы плазмы с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измеряют концентрации в плазме ALT (аланинтрансаминаза) и AST (аспартаттрансаминаза), и результаты, выраженные в IU/л, представлены в Таблице 47. Также измеряют уровни билирубина плазмы с помощью такого же клинического химического анализатора; результаты также приведены в Таблице 47 и выражены в мг/дл.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки, концентрации в плазме остаточного азота мочевины крови (BUN) измеряют с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты, выраженные в мг/дл, приведены в Таблице 48.
Пример 17: Переносимость антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, у CD1-мышей
CD1-мышам вводят антисмысловые олигонуклеотиды ISIS по Примеру 16 и оценивают изменения уровней различных метаболических маркеров.
Введение
Группам по восемь CD1-мышей в каждой вводят подкожными инъекциями два раза в неделю 50 мг/кг ISIS 304313, ISIS 420913, ISIS 420919, ISIS 420921, ISIS 420922, ISIS 420937, ISIS 420944, ISIS 420947, ISIS 420949, ISIS 420950, ISIS 420951, ISIS 420952, ISIS 420953, ISIS 420955, ISIS 420957, ISIS 420959, ISIS 425518, ISIS 425519, ISIS 425520, ISIS 425521, ISIS 425522 или ISIS 425523. Через три дня после последней дозы для каждого момента времени измеряют вес тела, мышей подвергают эвтаназии и органы и плазму собирают для дальнейшего анализа.
Вес тела и органов
Вес тела мышей измеряют до введения дозы и в конце каждого периода введения (две недели и шесть недель). Значения веса тела приведены в Таблице 49 и выражены как процент увеличения по сравнению с весом PBS-контроля, определенным перед началом введения. Вес печени, селезенки и почки измеряют в конце исследований и он также приведен в Таблице 49 как процент изменения по сравнению с соответствующим весом органов PBS-контроля.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени измеряют концентрации трансаминазы плазмы с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измеряют концентрации в плазме ALT (аланинтрансаминазы) и AST (аспартаттрансаминазы), и результаты, выраженные в IU/л, представлены в Таблице 50. Уровни билирубина и альбумина плазмы также измеряют с помощью такого же клинического химического анализатора, и результаты также приведены в Таблице 50.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки концентрации в плазме остаточного азота мочевины крови (BUN) и креатинина измеряют с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты, выраженные в мг/дл, приведены в Таблице 51.
Гематологические анализы
Кровь, взятую у всех мышей группы, отправляли в Antech Diagnostics для измерений и анализов гематокрита (НСТ), среднего объема эритроцитов (MCV), среднего содержания гемоглобина в эритроцитах (МСН) и средней концентрации эритроцитарного гемоглобина (МСНС), а также измерений дифференциального количества клеток крови, таких как белые кровяные клетки (WBC) (нейтрофилы, лимфоциты и моноциты), красные кровяные клетки (RBC) и тромбоциты, и общего содержания гемоглобина. Результаты представлены в Таблицах 52 и 53. Проценты, приведенные в таблицах, указывают процент изменения общего количества клеток крови по сравнению с PBS-контролем.
Пример 18: Переносимость антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, у крыс Sprague-Dawley
ISIS олигонуклеотиды, выбранные по результатам исследований, описанных в Примере 17, также были испытаны на крысах Sprague-Dawley для оценки изменений уровней различных метаболических маркеров.
Введение
Значения веса тела, клинический анализ крови и дифференциальный анализ крови, а также соотношение белок/креатинин в моче крыс оценивают до введения дозы. Группам из четырех крыс Sprague-Dawley вводят каждой подкожными инъекциями два раза в неделю 50 мг/кг ISIS 420913, ISIS 420921, ISIS 420922, ISIS 420950, ISIS 420955, ISIS 420957 и ISIS 420959. Через три дня после последней дозы для каждого момента времени, измеряют вес тела, крыс подвергают эвтаназии и органы и плазму собирают для дальнейшего анализа.
Вес тела и органов
Значения веса тела крыс измеряют до введения дозы и в конце периода введения дозы. Значения веса тела приведены в Таблице 54 и выражены как процент увеличения по сравнению с весом PBS-контроля, определенным перед началом введения. Вес печени, селезенки и почки измеряют в конце исследований, и они также приведены в Таблице 54 как процент изменения по сравнению с соответствующим весом органов PBS-контроля.
Как видно из Таблицы 54, соединения продемонстрировали менее чем 1O-кратное увеличение веса органов этих крыс. Кроме того, определенные соединения продемонстрировали менее чем 7-кратное увеличение веса органов этих крыс. В то же время определенные соединения продемонстрировали менее чем 6-кратное увеличение веса органов этих крыс. Определенные соединения продемонстрировали менее чем 5-кратное увеличение веса органов этих крыс.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени измеряют концентрации трансаминазы плазмы с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измеряют концентрации в плазме ALT (аланинтрансаминазы) и AST (аспартаттрансаминазы) и результаты, выраженные в IU/л, представлены в Таблице 55. Уровни билирубина и альбумина плазмы также измеряют с помощью такого же клинического химического анализатора, и результаты также приведены в Таблице 55.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки концентрации в плазме остаточного азота мочевины крови (BUN) и креатинина измеряют с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты, выраженные в мг/дл, приведены в Таблице 56. Отношение общего белка мочи к креатинину также оценивалось и представлено в Таблице 56.
Гематологические анализы
Кровь, взятую у всех групп крыс, отправляли в Antech Diagnostics для измерений и анализов гематокрита (НСТ), среднего объема эритроцитов (MCV), среднего содержания гемоглобина в эритроцитах (МСН) и средней концентрации эритроцитарного гемоглобина (МСНС), а также измерений дифференциального количества клеток крови, таких как белые кровяные клетки (WBC) (нейтрофилы, лимфоциты и моноциты), красные кровяные клетки (RBC) и тромбоциты, и общего содержания гемоглобина. Результаты представлены в Таблицах 58 и 59. Проценты, приведенные в таблицах, указывают процент изменения общего количества клеток крови по сравнению с PBS-контролем.
Пример 19: Фармакокинетические исследования периода двукратного снижения концентрации антисмыслового олигонуклеотида в печени и почке крыс Sprague-Dawley
Крысам Sprague-Dawley вводят ISIS-антисмысловые олигонуклеотиды, определенные по результатам исследований, описанных в Примере 18, и оценивают период полувыведения олигонуклеотида, а также время, проходящее до деградации олигонуклеотида и выведения из печени и почки.
Введение
Группам по четыре крысы Sprague Dawley вводят каждой подкожными инъекциями два раза в неделю в течение 2 недель 20 мг/кг ISIS 420913, ISIS 420921, ISIS 420922, ISIS 420950, ISIS 420955, ISIS 420957 и ISIS 420959. Через три дня после последней дозы крыс умерщвляют, и печень и почки берут для анализов.
Измерение концентрации олигонуклеотида
Измеряют концентрацию полноразмерного олигонуклеотида, а также общую концентрацию олигонуклеотида (включая деградированную форму). Используемый способ представляет собой модификацию ранее опубликованных способов (Leeds et al., 1996; Geary et al., 1999), которые заключаются в фенол-хлороформенной (жидкость-жидкость) экстракции с последующей твердофазовой экстракцией. Перед экстракцией прибавляют внутренний стандарт (ISIS 355868, 27-мерный 2'-O-метоксиэтил-модифицированный фосфоротиоатный олигонуклеотид, GCGTTTGCTCTTCTTCTTGCGTTTTTT, обозначенный тут как SEQ ID NO:166). Концентрации в образцах тканей рассчитывают с использованием калибровочных кривых, при нижнем пределе количественного определения (LLOQ), равном приблизительно 1,14 мкг/г.Результаты, представленные в Таблицах 60 и 61, выражены в мкг/г ткани печени или почки. Также рассчитывают отношение концентраций олигонуклеотида в почке к печени, приведенное в Таблицах 60 и 61.
Пример 20: In vivo дозазависимое ингибирование транстиретина человека у трансгенных мышей
ISIS 420913, ISIS 420921, ISIS 420922, ISIS 420957 и ISIS 420959, которые проявляли хорошую эффективность и переносимость, как продемонстрировано в Примерах 16-19, были выбраны для исследований дозазависимого целенаправленного снижения экспрессии у трансгенных мышей гена транстиретина человека. ISIS 420950 и ISIS 420955, которые продемонстрировали 90% или больше целенаправленного снижения экспрессии, но которые также продемонстрировали токсичность у CD1-мышей (Примеры 16-19), также были выбраны для участия в этих исследованиях в целях сравнения.
Введение
Группам по четыре мыши, два самца и две самки, вводят каждой подкожными инъекциями два раза в неделю в течение 4 недель 4 мг/кг, 10 мг/кг или 25 мг/кг ISIS 420913, ISIS 420921, ISIS 420922, ISIS 420950, ISIS 420955, ISIS 420957 или ISIS 420959. Одной группе из четырех мышей, двух самцов и двух самок, вводят подкожными инъекциями два раза в неделю в течение 4 недель 25 мг/кг контрольного олигонуклеотида, ISIS 141923. Одной контрольной группе из четырех мышей, двух самцов и двух самок, вводят подкожными инъекциями два раза в неделю в течение 4 недель PBS. Образцы плазмы берут в каждой группе в дни 0, 14 и 28. Через два дня после последней дозы мышей подвергают эвтаназии и органы собирают для дальнейших анализов.
Анализ РНК
РНК экстрагируют из ткани печени для анализа транстиретина способом ПЦР в реальном масштабе времени с использованием набора праймер-зонд RTS3029. Результаты представлены как процент ингибирования транстиретина человека по сравнению с PBS-контролем. Как видно из Таблицы 62, введение антисмысловых олигонуклеотидов ISIS приводит к значительному дозазависимому снижению мРНК транстиретина человека по сравнению с PBS-контролем. Введение контрольного олигонуклеотида, ISIS 141923 не приводило к значительному снижению транстиретина, как ожидалось.
Анализ белка
Уровни белка транстиретина человека измеряют в плазме трансгенных мышей способом ELISA с использованием конъюгированных с транстиретином поликлональных антител против транстиретина (Abeam Ab37774) и овечьего детектирующего антитела против TTR, конъюгированного с пероксидазой хрена (Abeam, №по каталогу 35217). Цветную реакцию создают с помощью набора ImmunoPure® TMB Substrate Kit и измеряют поглощение при 450 нм с помощью спектрофотометра для микротитровальных планшетов. Образцы плазмы берут до введения дозы и в дни 7, 14, 21 и 28. Результаты, представленные в Таблице 63, выражены как процент ингибирования по сравнению уровнями до введения дозы и демонстрируют времязависимое и дозазависимое снижение уровней белка при введении олигонуклеотидов ISIS.
Вес тела и вес органов
Вес тела мышей измеряют до введения дозы и в конце периода введения дозы. Значения веса тела приведены в Таблице 64 и выражены как процент увеличения по сравнению с весом PBS-контроля, определенным перед началом введения. Вес печени, селезенки и почки измеряют в конце исследований, и он также приведен в Таблице 64 как процент изменения по сравнению с соответствующим весом органов PBS-контроля.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени измеряют концентрации трансаминазы плазмы с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измеряют концентрации в плазме ALT (аланинтрансаминазы) и AST (аспартаттрансаминазы) и результаты, выраженные в IU/л, представлены в Таблице 65. Также измеряют уровни билирубина плазмы с помощью такого же клинического химического анализатора; результаты также приведены в Таблице 65 и выражены в мг/дл.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки концентрации в плазме остаточного азота мочевины крови (BUN) измеряют с помощью автоматического клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты, выраженные в мг/дл, приведены в Таблице 66.
Пример 21: Подтверждение дозового ответа антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, в первичных гепатоцитах яванского макака
Гапмеры, продемонстрировавшие переносимость у CD1-мышей и крыс Sprague Dawley (исследования, описанные в Примерах 17-19), а также действенность у трансгенных мышей (исследования, описанные в Примерах 16 и 20), были выбраны и подвергнуты испытаниям в разных дозах в первичных гепатоцитах яванского макака. Клетки высеивают при плотности 35000 клеток на лунку и трансфицируют с помощью электропорации концентрациями антисмыслового олигонуклеотида 156,25 нМ, 312,5 нМ, 625 нМ, 1250 нМ, 2500 нМ, 5000 нМ, 10000 нМ и 20000 нМ, как указано в Таблице 67. После периода обработки, составляющего приблизительно 16 часов, РНК выделяют из клеток и уровни мРНК транстиретина измеряют способом количественной ПЦР в реальном масштабе времени. Набор праймер-зонд для определения транстиретина человека RTS1396 используют для измерения уровней мРНК. Уровни мРНК транстиретина регулируют в соответствии с общим содержанием РНК, измеренным с помощью RIBOGREEN®. Результаты представлены как процент ингибирования транстиретина по сравнению с необработанными контрольными клетками. Как показано в Таблице 67, уровни мРНК транстиретина снижаются зависимым от дозы образом в гепатоцитах, обработанных всеми ISIS-олигонуклеотидами, которые являются перекрестно реактивными с геном транстиретина макака-резуса, обозначенным тут как SEQ ID NO:4 (экзоны 1-4, выделены из №Доступа GENBANK NW_001105671,1).
Пример 22: Измерение вязкости ISIS антисмысловых олигонуклеотидов, нацеленных на транстиретин человека
Вязкость антисмысловых олигонуклеотидов, использованных для исследований, описанных в Примере 21, измеряют с целью выделения антисмысловых олигонуклеотидов, имеющих вязкость более 40 сП. Олигонуклеотиды, имеющие вязкость более 40 сП, являются слишком труднотекущими для введения какому-либо субъекту.
ISIS-олигонуклеотиды (32-35 мг) взвешивают в стеклянном флаконе, прибавляют 120 мкл воды и антисмысловой олигонуклеотид растворяют до состояния раствор путем нагревания флакона при 50°С. Часть (75 мкл) предварительно нагретого образца переносят пипеткой в микровискозиметр (Cambridge). Устанавливают температуру микровискозиметра, равную 25°С, и измеряют вязкость образца. Другую часть (20 мкл) предварительно нагретого образца переносят пипеткой в 10 мл воды для регистрации спектра УФ-поглощения при 260 нМ при 85°С (Сагу UV instrument). Результаты представлены в Таблице 68 и показывают, что все растворы антисмысловых олигонуклеотидов имеют оптимальную вязкость в соответствии с указанным выше критерием.
Пример 23: Измерение периода полувыведения антисмыслового олигонуклеотида в печени CD1-мышей
CD1-мышам вводят ISIS антисмысловые олигонуклеотиды, определенные по результатам исследований, описанных в Примере 22, и оценивают период полувыведения олигонуклеотида, а также время, проходящее до деградации олигонуклеотида и выведения из печени.
Введение
Группам по двенадцать CD1-мышей каждая вводят подкожными инъекциями два раза в неделю в течение 2 недель 50 мг/кг ISIS 420913, ISIS 420921, ISIS 420922, ISIS 420950, ISIS 420955, ISIS 420957 и ISIS 420959. По четыре мыши из каждой группы умерщвляют через 3 дня, 28 дней и 56 дней после последней дозы. Берут печень на анализ.
Измерение концентрации олигонуклеотида
Измеряют концентрацию полноразмерного олигонуклеотида, а также общую концентрацию олигонуклеотида (включая деградированную форму). Используемый способ представляет собой модификацию ранее опубликованных способов (Leeds et al., 1996; Geary et al., 1999), которые заключаются в фенол-хлороформенной (жидкость-жидкость) экстракции с последующей твердофазовой экстракцией. Перед экстракцией прибавляют внутренний стандарт (ISIS 355868, 27-мерный 2'-O-метоксиэтил-модифицированный фосфоротиоатный олигонуклеотид, GCGTTTGCTCTTCTTCTTGCGTTTTTT, обозначенный тут как SEQ ID NO:166). Концентрации в образцах тканей рассчитывают с использованием калибровочных кривых, при нижнем пределе количественного определения (LLOQ), равном приблизительно 1,14 мкг/г. Затем рассчитывают времена полувыведения с помощью прикладной программы WinNonlin (PHARSIGHT).
Результаты, выраженные в мкг/г ткани печени, представлены в Таблице 69. Период полувыведения каждого олигонуклеотида приведен в Таблице 70.
Пример 24: Эффект ISIS-антисмысловых олигонуклеотидов, нацеленных на транстиретин человека, у яванского макака
Яванским макакам вводят ISIS-антисмысловые олигонуклеотиды, использованные для исследований, описанных в Примерах 21, 22 и 23. Оценивают эффективность и переносимость антисмыслового олигонуклеотида, а также их фармакокинетический профиль в печени и почке.
Введение
Перед исследованиями, обезьян содержат в карантине на протяжении 30-дневного периода времени, во время которого проводят стандартные наборы химических и гематологических анализов сыворотки, анализы образцов кала на яйца и паразитов, и туберкулиновую пробу, для выявления аномальных или нездоровых обезьян. Девяти группам по четыре случайным образом распределенных самца яванского макака вводят каждой подкожными инъекциями три раза в неделю в первую неделю и затем два раза в неделю в течение следующих 11 недель по 25 мг/кг ISIS 304299, ISIS 420915, ISIS 420921, ISIS 420922, ISIS 420950, ISIS 420955, ISIS 420957 или ISIS 420959. Контрольной группе из 4 яванских макак вводят инъекцией PBS подкожно три раза в неделю в первую неделю и затем два раза в неделю в течение следующих 11 недель. Образцы крови берут за 5 дней до введения, а также в разные дни периода исследований и анализируют. Животные голодают, по меньшей мере, 13 часов (в течение ночи) перед взятием крови. Все группы умерщвляют в конце исследований в день 86, через 48 часов после последней дозы.
На протяжении периода исследований, обезьян наблюдают ежедневно для выявления признаков болезни или недомогания. Любое животное с проявлениями нежелательных эффектов на введение препарата исключалось из исследований и направлялось к ветеринару, о чем сообщалось руководителю исследований. Все животные, получившие ISIS 420955, были исключены из исследований в день 31 вследствие симптомов болезни, выявленных у 2 обезьян группы. Аналогично, были исключены из исследований по одной обезьяне из групп, получавших ISIS 420957 и ISIS 420950, в дни 44 и 76, соответственно, вследствие признаков болезни.
Исследования ингибирования
Анализ РНК
В день 86 экстрагируют РНК из ткани печени для анализа транстиретина способом ПЦР в реальном масштабе времени с использованием набора праймер-зонд RTS3029. Результаты представлены как процент ингибирования транстиретина по сравнению с PBS-контролем, нормированный по циклофилину. Аналогичные результаты были получены при нормировании по RIBOGREEN®. Как видно из Таблицы 71, введение антисмысловых олигонуклеотидов ISIS приводит к значительному снижению мРНК транстиретина по сравнению с PBS-контролем. Конкретнее, введение ISIS 420915 вызывало более сильное ингибирование мРНК TTR, чем введение ISIS 304299, несмотря на то, что два олигонуклеотида отличаются друг от друга смещением на одну пару оснований. Данные для животных, получавших ISIS 420955, были получены в день 31.
Анализ белка
Обезьяны голодают в течение ночи перед взятием крови. Берут приблизительно 1 мл крови у всех отвечающих требованиям животных и помещают в пробирки, содержащие калиевую соль ЭДТА (EDTA). Пробирки центрифугируют (3000 об/мин в течение 10 мин при комнатной температуре) для получения плазмы. Измеряют уровни белка транстиретина в плазме с помощью клинического анализатора. Образцы плазмы берут до введения дозы (в день -5) и в дни 1, 9, 16, 23, 30, 44, 58, 72 и 86. Результаты, представленные в Таблице 72, выражены как процент ингибирования по сравнению уровнями до введения дозы и демонстрируют времязависимое снижение уровней белка при введении олигонуклеотидов ISIS. Конечные уровни TTR плазмы приведены в Таблице 73 и демонстрируют сильную корреляцию между снижением уровня белка TTR и ингибированием мРНК TTR (Таблица 71). Конкретнее, введение ISIS 420915 вызывало более сильное ингибирование белка TTR в плазме, чем введение ISIS 304299 (76% ингибирования против 47% ингибирования), несмотря на то, что эти два олигонуклеотида отличаются друг от друга смещением на одну пару оснований.
Также измеряют уровни белка RBP4 в плазме с помощью набора для ELISA. Образцы плазмы берут до введения дозы (в день -5) и в дни 9, 16, 23, 30, 44, 58, 72 и 86. Результаты, представленные в Таблице 74, выражены как процент ингибирования по сравнению уровнями до введения дозы. Некоторые из ISIS-олигонуклеотидов (ISIS 420915, ISIS 420922, ISIS 420950, ISIS 420955 и ISIS 420959) демонстрируют времязависимое снижение уровней белка, сопровождающееся снижением TTR. Конечные уровни RBP4 плазмы приведены в Таблице 75 и также демонстрируют сильную корреляцию между снижением уровней белка RBP4 и TTR (Таблица 73) при введении вышеперечисленных олигонуклеотидов. Конкретнее, введение ISIS 420915 вызывало более сильное ингибирование белка RBP4 в плазме, чем введение ISIS 304299 (63% ингибирования против 19% ингибирования), несмотря на то, что эти два олигонуклеотида отличаются друг от друга смещением на одну пару оснований.
Исследования переносимости
Измерения веса тела и органов
Для оценки эффекта ISIS-олигонуклеотидов на общее состояние здоровья животных, измеряют вес тела и органов в день 86. Данные для животных, получавших ISIS 420955, были собраны в день 31. Вес тела измеряют и сравнивают с уровнем до введения дозы. Вес органов измеряют, и вес для экспериментальной группы сравнивают с соответствующим весом PBS-контроля. Данные представлены в Таблице 76.
Функция печени
Для оценки эффекта ISIS-олигонуклеотидов на функцию печени берут образцы крови у всех экспериментальных групп.Образцы крови собирают в пробирки, не содержащие каких-либо антикоагулянтов для отделения сыворотки. Пробирки выдерживают при комнатной температуре в течение 90 мин и затем центрифугируют (3000 об/мин в течение 10 мин при комнатной температуре) для получения сыворотки. Измеряют концентрации трансаминазы с помощью химического анализатора Toshiba 200FR NEO (Toshiba Co., Japan). Измеряют концентрации в плазме ALT (аланинтрансаминазы) и AST (аспартаттрансаминазы) в день 86 и результаты, выраженные в IU/л, представлены в Таблице 77. Щелочная фосфатаза, которая синтезируется в повышенных количествах пораженными клетками печени, также является маркером болезни печени и аналогично измеряется. С-реактивный белок (CRP), который синтезируется в печени и служит маркером воспаления, также аналогично измеряют в день 86. Результаты определения как щелочной фосфатазы, так и CRP, также приведены в Таблице 77. Билирубин также является метаболическим маркером печени и аналогично измеряется, и результаты, выраженные в мг/дл, представлены в Таблице 77.
Функция почки
Для оценки эффекта ISIS-олигонуклеотидов на функцию почки берут образцы крови у всех экспериментальных групп. Образцы крови собирают в пробирки, не содержащие каких-либо антикоагулянтов для отделения сыворотки. Пробирки выдерживают при комнатной температуре в течение 90 мин и затем центрифугируют (3000 об/мин в течение 10 мин при комнатной температуре) для получения сыворотки. Измеряют концентрации BUN и креатинина в день 86 с помощью химического анализатора Toshiba 200FR NEO (Toshiba Co., Japan). Результаты, выраженные в мг/дл, приведены в Таблице 78.
Образцы мочи собирают с помощью дренажа из специальных поддонов клеток из нержавеющей стали в день 5 перед началом исследований и затем в дни 25 и 84. Измеряют соотношение общего белка мочи к креатинину с помощью химического анализатора Toshiba 200FR NEO (Toshiba Co., Japan) и результаты представлены в Таблице 79.
Гематология
Для оценки возможного воспалительного эффекта ISIS-олигонуклеотидов у яванского макака, берут образцы крови приблизительно по 0,5 мл у всех отвечающих критериям экспериментальных животных в пробирки, содержащие калиевую соль ЭДТА (EDTA). Образцы анализируют на количество красных кровяных клеток (RBC), количество белых кровяных клеток (WBC), процентное содержание индивидуальных белых кровяных клеток, таких как моноциты, нейтрофилы, лимфоциты, а также на количество тромбоцитов и гематокрит (%), с помощью гематологического анализатора ADVIA120 (Bayer, USA). Данные приведены в Таблице 80.
Анализ факторов воспаления
Для оценки эффекта ISIS-олигонуклеотидов на факторы, вовлеченные в воспаление, берут кровь в день 86 у всех отвечающих предъявляемым требованиям животных для анализа комплемента С3, а также для измерения уровней цитокинов. Для анализа комплемента С3, образцы крови собирают в пробирки без антикоагулянта для отделения сыворотки. Пробирки выдерживают при комнатной температуре в течение 90 мин и затем центрифугируют (3000 об/мин в течение 10 мин при комнатной температуре) для получения сыворотки. Комплемент С3 измеряют с помощью автоматического анализатора (химический анализатор Toshiba 200 FR NEO, Toshiba Co., Japan). Данные, выраженные в мг/дл, представлены в Таблице 81.
Для анализов уровня цитокинов, собирают кровь в пробирки, содержащие ЭДТА (EDTA) для отделения плазмы. Пробирки затем центрифугируют (3000 об/мин в течение 10 мин при комнатной температуре) для получения плазмы. Образцы плазмы отправляют в Aushon Biosystems Inc. (Billerica, MA) для измерения уровней хемокинов и цитокинов. Уровни TNF-α измеряют с использованием соответствующих антител приматов и уровни MIP-1α, МСР-1 и MIP-1β измеряют с использованием соответствующих перекрестно реактивных человеческих антител. Измерения проводят за 5 дней до начала введения и в дни 3 и 86. Результаты представлены в Таблицах 82-85.
Тесты на коагуляцию
Для оценки эффекта ISIS-олигонуклеотидов на факторы, вовлеченные в путь коагуляции, используют стандартные тесты на коагуляцию. РТ и аРТТ измеряют с использованием бедной тромбоцитами плазмы (РРР) обезьян на протяжении периода времени 48 часов. Значения РТ и аРТТ приведены в Таблицах 86 и 87 и выражены в секундах. Уровни фибриногена в плазме также количественно определяют на протяжении периода времени 48 часов и данные приведены в Таблице 88. Как видно из Таблиц 86-88, РТ, аРТТ и фибриноген не изменялись значительно у обезьян, получавших олигонуклеотиды ISIS по сравнению с PBS-контролем.
Панельный анализ щитовидной железы
Для оценки эффекта ISIS-олигонуклеотидов на гормоны щитовидной железы, обезьяны голодали в течение ночи и 3,5 мл крови брали у каждого соответствующего критериям исследования животного за 5 дней до начала введения и в дни 51 и 86. Собранные образцы крови хранят в пробирках без антикоагулянта для отделения сыворотки. Пробирки выдерживают в течение 90 мин при комнатной температуре, после чего их центрифугируют (3000 об/мин в течение 10 мин при комнатной температуре) для получения сыворотки. Образцы сыворотки направляют в Biomarkers Core Laboratory, Emory University (Atlanta, GA) для проведения панельного анализа щитовидной железы. Результаты для тиреостимулирующего гормона (TSH) приведены в Таблице 89 и выражены в мкл/мл. Результаты для общего и свободного Т3-гормона приведены в Таблицах 90 и 91. Результаты для общего и свободного Т4-гормона приведены в Таблицах 92 и 93. В общем, панельный анализ щитовидной железы показал, что все животные сохраняли приемлемые уровни гормонов, несмотря на то, что уровни экспрессии транстиретина снижались, указывая, что антисмысловые олигонуклеотиды транстиретина не влияют на уровни гормонов.
Фармакокинетические исследования
Измерение концентрации олигонуклеотида
Измеряют концентрацию полноразмерного олигонуклеотида, а также общую концентрацию олигонуклеотида (включая деградированную форму). Используемый способ представляет собой модификацию ранее опубликованных способов (Leeds et al., 1996; Geary et al., 1999), которые заключаются в фенол-хлороформенной (жидкость-жидкость) экстракции с последующей твердофазовой экстракцией. Перед экстракцией прибавляют внутренний стандарт (ISIS 355868, 27-мерный 2'-O-метоксиэтил-модифицированный фосфоротиоатный олигонуклеотид, GCGTTTGCTCTTCTTCTTGCGTTTTTT, обозначенный тут как SEQ ID NO:166). Концентрации в образцах тканей рассчитывают с использованием калибровочных кривых, при нижнем пределе количественного определения (LLOQ), равном приблизительно 1,14 мкг/г.Рассчитывают соотношение концентраций в почке против печени. Результаты, выраженные в мкг/г ткани, представлены в Таблицах 94 и 95.
Реферат
Настоящее изобретение относится к биохимии, в частности к одноцепочечным модифицированным олигонуклеотидам, способным ингибировать экспрессию транстиретина в клетке. Указанные олигонуклеотиды имеют в длину от 15 до 30 связанных нуклеозидов и могут иметь модифицированную фосфоротиоатную связь, модифицированный сахар и модифицированное нуклеооснование, например, 5-метилцитозин. Олигонуклеотид согласно настоящему изобретению содержит 5'-боковой сегмент, соединенный с гэп-сегментом, который соединен с 3'-боковым сегментом. Настоящее изобретение раскрывает композицию, содержащую указанный олигонуклеотид. Благодаря способности указанной композиции ингибировать экспрессию транстиретина ее применяют для лечения транстиретинового амилоидоза, семейной амилоидной полиневропатии, семейной амилоидной кардиомиопатии и старческого системного амилоидоза у человека. Настоящее изобретение позволяет расширить арсенал средств для ингибирования экспрессии транстиретина в клетке и лечения транстиретинового амилоидоза у человека. 2 н. и 19 з.п. ф-лы, 95 табл., 24 пр.
Формула
(a) состоящий из от 20 до 30 связанных нуклеозидов, где связанные нуклеозиды имеют последовательность нуклеооснований, включающую последовательность, приведенную в SEQ ID NO: 80, 78, 79, 84-86, 101, 102, 109, 112-115, 87, 77, 88, 116-118, 120, 119 или 121-124;
(b) состоящий из от 15 до 30 связанных нуклеозидов, где связанные нуклеозиды имеют последовательность нуклеооснований, включающую по меньшей мере 15 смежных нуклеооснований из последовательности, описанной в SEQ ID NO: 120, 119 или 121-124; или
(c) состоящий из от 18 до 30 связанных нуклеозидов, где связанные нуклеозиды имеют последовательность нуклеооснований, включающую по меньшей мере 18 смежных нуклеооснований из последовательности, описанной в SEQ ID NO: 87, 77, 88, 116-118, 120, 119 или 121-124.
гэп-сегмент, состоящий из связанных дезоксинуклеозидов;
5′-боковой сегмент, состоящий из связанных нуклеозидов; и
3′-боковой сегмент, состоящий из связанных нуклеозидов;
где гэп-сегмент расположен между 5′-боковым сегментом и 3′-боковым сегментом, и где каждый нуклеозид каждого бокового сегмента содержит модифицированный сахар.
гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
5′-боковой сегмент, состоящий из пяти связанных нуклеозидов; и
3′-боковой сегмент, состоящий из пяти связанных нуклеозидов;
где гэп-сегмент расположен между 5′-боковым сегментом и 3′-боковым сегментом, где каждый нуклеозид каждого бокового сегмента содержит 2′-O-метоксиэтилированный сахар; и где каждый цитозин модифицированного олигонуклеотида представляет собой 5-метилцитозин, и где каждая межнуклеозидная связь модифицированного олигонуклеотида представляет собой фосфоротиоатную связь.
гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
5′-боковой сегмент, состоящий из пяти связанных нуклеозидов; и
3′-боковой сегмент, состоящий из пяти связанных нуклеозидов;
где гэп-сегмент расположен между 5′-боковым сегментом и 3′-боковым сегментом, где каждый нуклеозид каждого бокового сегмента содержит 2′-O-метоксиэтилированный сахар; где каждая межнуклеозидная связь представляет собой фосфоротиоатную связь; и где каждый цитозин представляет собой 5-метилцитозин.

Комментарии