Способ лечения вич - RU2765589C9
Код документа: RU2765589C9
Чертежи






Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение представляет собой комбинированный способ (методику) и используется для лечения заболеваний типа вирусных инфекций.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин «иммунотерапия» означает лечение заболеваний путем стимулирования, индукции, усиления или подавления иммунного ответа. Стратегия иммунотерапии заключается в борьбе с болезнями (раком, инфекционными заболеваниями, аллергией и астмой) с помощью активации иммунной системы.
Вирусная инфекция может вызвать состояние, называемое вирусной латентностью и характеризуемое состоянием обратимой непродуктивной инфекции отдельных клеток. Вирусная латентность является важным механизмом обеспечения устойчивости инфекции, препятствующим ее распознаванию иммунитетом (Perng and Jones, Interdiscip Perspect Infect Dis, 2010, p 262415).
Известно, например, что вирусы герпеса используют генетические программы для обеспечения устойчивости своего вирусного генома с минимальной экспрессией вирусного гена. В случае ретровирусов стабильная интеграция обратной транскрипционной вирусной кДНК в геноме клетки-хозяина является важным этапом обеспечения устойчивости вирусного генома в течение жизненного цикла инфицированных клеток. Некоторые ретровирусы вызывают состояние латентной инфекции. Изначально, термин «латентность» использовали для ВИЧ-1 в клиническом смысле для описания продолжительного бессимптомного периода с момента первичного инфицирования до развития СПИД. Тем не менее, стало очевидно, что репликация вируса ВИЧ-1 происходит наиболее активно в период развития инфекции, даже несмотря на отсутствие симптомов. Одним из важнейших механизмов, препятствующих возникновению иммунного ответа на ВИЧ-1, является быстрое развитие эскапических мутаций, которые прерывают распознавание вируса путем нейтрализации антител и цитолитических Т-лимфоцитов (Bailey et al., Curr Opin Immunol 16, p. 470-476, 2004). Как бы то ни было, очевидно, что ВИЧ-1 может вызывать латентную инфекцию на уровне отдельных Т-клеток. Таким образом, устранение латентного резервуара может стать основным фактором повышения качества лечения ВИЧ.
Антиретровирусная терапия (APT) включает лекарственные средства для лечения ретровирусных инфекций, например, ВИЧ-инфекций. Лекарства не уничтожают вирус таким образом, чтобы полностью освободить от него организм пациента. Однако, если лекарства или отдельные препараты используют комбинировано, они могут предотвратить пролиферацию вируса. При замедлении активности вируса замедляется и развитие ВИЧ. В отношении антиретровирусных препаратов чаще всего используют аббревиатуру «АРВ». Под комбинированной АРВ-терапией (кАРТ) чаще всего понимают высокоактивную APT (ВААРТ).
АРВ препараты атакуют ВИЧ различными способами. Они разделены на так называемые классы. Первый класс препаратов, предназначенных для борьбы с ВИЧ-нуклеозидные ингибиторы обратной транскриптазы (НИОТ). Такие лекарства блокируют использование генетического материала ВИЧ для создания ДНК из РНК. Зидовудин является самым известным представителем этого класса.
Другой класс - ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ). Они также блокируют транскрипцию РНК в ДНК.
Препараты, относящиеся к классу ингибиторов протеазы, блокируют этап разделения первичного материала на определенные части для образования нового ВИЧ. Наконец, существует класс ингибиторов входа, препятствующих попаданию ВИЧ в клетку, и класс ингибиторов интеграции ВИЧ, препятствующих внедрению генетического материала ВИЧ в геном клетки-хозяина. В рамках настоящей заявки-термин «кАРТ» означает комбинацию как минимум двух препаратов вышеуказанных классов АРВ.
Недавние исследования показали, что латентное состояние ВИЧ-1 можно безопасно прервать у пациентов, проходящих комбинированную антиретровирусную терапию (кАРТ), путем применения препаратов для обращения латентности (LRA) и, в частности, ингибиторов деацетилазы гистонов (HDACi) (Archin et al., 2012, Nature 487(7408):482-485; Rasmussen et al., 2013, Hum Vaccin Immunother 9(5)). Тем не менее, очевидно, что у большинства пациентов такая реактивация клеток с латентной инфекцией, используемая индивидуально, не приводит к сокращению резервуара ВИЧ-1. Вероятно, такой эффект связан с недостаточным уровнем гибели реактивированных клеток, спровоцированной иммунитетом. Однако активация врожденного и приобретенного иммунитета влечет за собой риск активации ВИЧ-инфицированных клеток, что приводит к прогрессированию заболевания. Таким образом, возникает вопрос: действительно ли иммунная система помогает пациентам с ВИЧ?
В поддержку концепции лечения ВИЧ, сопряженной с иммунотерапией, выступает недавнее исследование in vitro. Оно показало, что Т-клетки CD8+ у пациентов с невиремичным ВИЧ, проходящих кАРТ, могут уничтожать реактивированные инфекционные аутологичные Т-клетки CD4+, однако только в случае, если Т-клетки CD8+ стимулировали антигеном перед совместным культивированием (Shan et al., 2012, Immunity 36(3):491-501).
Следовательно, в настоящее время существует потребность в соединениях, способных выявлять латентные резервуары ВИЧ-инфицированных клеток посредством их активации и таргетинга реактивированных клеток для их уничтожения иммунитетом при помощи фармакологического вмешательства.
Исходя из представленного уровня техники, целью настоящей заявки является представление иммуностимулирующих соединений для реактивации латентных ВИЧ-инфицированных клеток и их распознавания и разрушения иммунной системой, а также их использование в качестве лекарственного средства.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Исходя из известного уровня техники, целью настоящего раскрытия является предоставление некодирующей последовательности дезоксирибонуклеиновых кислот, в которую для лечения вирусных инфекций должен входить, по меньшей мере, один мотив последовательности N1N2CGN3N4, где N означает нуклеотид, содержащий А, С, Т или G (С - дезоксицитидин; G - дезоксигуанозин; А - дезоксиаде-нозин; а Т - дезокситимидин).
Некодирующую последовательность дезоксирибонуклеиновых кислот, представляющую собой настоящее изобретение, предлагается использовать в сочетании с комбинированной антиретровирусной терапией и/или ингибиторами деацетилазы гистонов при вирусных инфекциях и вероятном существовании латентной вирусной инфекции.
Предполагается, что целевым применением некодирующей последовательности дезоксирибонуклеиновых кислот, представляющей собой настоящее изобретение, является лечение ВИЧ-1 (в частности, лечение латентной инфекции ВИЧ-1).
В случае некодирующей последовательности дезоксирибонуклеиновых кислот, представляющей собой настоящее изобретение, N1N2 может быть элементом группы GT, GG, GA, AT и АА, a N3N4 - элементом группы СТ, TG и ТТ.
Некодирующая последовательность дезоксирибонуклеиновых кислот может быть представлена в следующих видах: линейная последовательность с незамкнутой с двух сторон цепью; линейная последовательность с незамкнутой двойной цепью с одной стороны и одноцепочечной шпилькой с другой; гантелеобразный конструкт, частично одноцепочечный, с ковалентно замкнутой цепью дезоксирибонуклеиновых кислот.
Некодирующая последовательность дезоксирибонуклеиновых кислот может содержать по меньшей мере три мотива последовательности N1N2CGN3N4.
В дальнейшем, некодирующая последовательность дезоксирибонуклеиновой кислоты может представлять собой линейную некодирующую последовательность с неразветвленной цепью дезоксирибонуклеиновых кислот, включающую по меньшей мере один нуклеотид в L-образной конформации.
По меньшей мере один из пяти концевых нуклеотидов, расположенных на 5'- и/или 3'-конце одиночной цепи ДНК с линейной, некодирующей последовательностью дезоксирибонуклеиновых кислот с неразветвленной цепью, находится в L-образной конформации. Для специалиста в данной области очевидно, что подобное ограничение в отношение концов означает, что такая последовательность содержится только в пяти концевых нуклеотидах на 5'- и/или 3'-конце в L-образной конформации.
Предполагается, что некодирующая последовательность дезоксирибонуклеиновых кислот может содержать по меньшей мере одну из следующих последовательностей:
а.
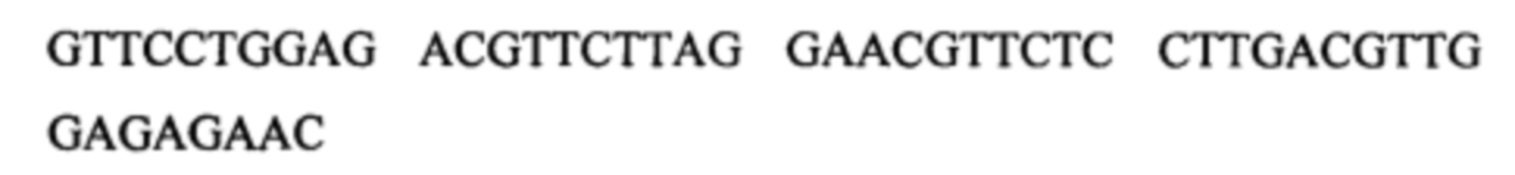
б.

в.

г.
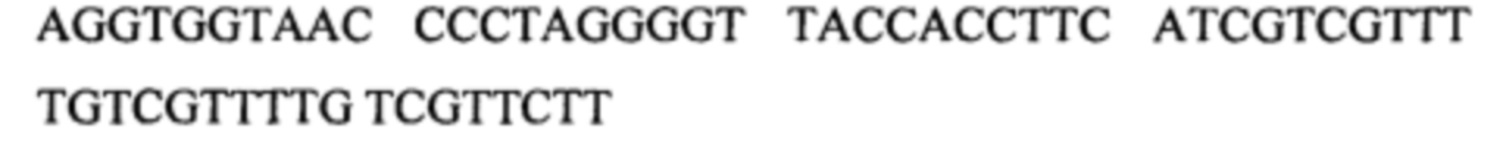
Некодирующая последовательность дезоксирибонуклеиновых кислот, представленная в настоящем документе, может иметь длину от 40 до 200 нуклеотидов или, точнее, от 48 до 116 нуклеотидов.
Вышеуказанная последовательность
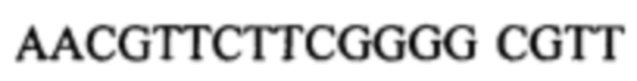
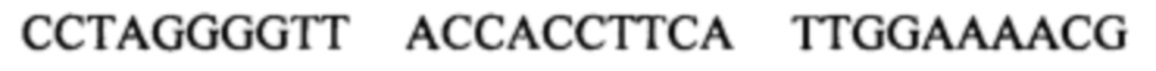


Предполагается, что мотив последовательности N1CGN3N4 может быть частью одноцепочечного участка некодирующей последовательности дезоксирибонуклеиновых кислот.
Еще одной целью настоящего изобретения является комбинированный способ лечения ВИЧ, представляющий собой сочетание некодирующей последовательности дезоксирибонуклеиновых кислот настоящего изобретения и комбинированной антиретровирусной терапии и/или ингибиторов деацетилазы гистонов, применяемых одновременно, с чередованием или последовательно.
Некодирующую последовательность дезоксирибонуклеиновых кислот можно использовать до комбинированной антиретровирусной терапии и/или ингибиторов деацетилазы гистонов. В качестве альтернативного варианта, некодирующую последовательность дезоксирибонуклеиновых кислот можно использовать попеременно с комбинированной антиретровирусной терапией и/или ингибиторами деацетилазы гистонов.
Еще одной целью настоящей заявкиявляется использование некодирующей последовательности дезоксирибонуклеиновых кислот с вышеуказанными признаками в качестве лекарственного средства.
Использование некодирующей последовательности дезоксирибонуклеиновых кислот, представленной в настоящем описании, для изготовления фармацевтической композиции, содержащей некодирующую последовательность дезоксирибонуклеиновых кислот и, возможно, дополнительно ингибиторов АРВ и/или ингибиторов деацетилазы гистонов, также является объектом настоящего описания.
Фармацевтическая композиция может быть вакциной. Она предназначена для использования некодирующей последовательности дезоксирибонуклеиновых кислот с признаками, описанными выше, в качестве адъюванта при терапевтической или профилактической вакцинации для лечения ВИЧ-1.
КРАТКОЕ ОПИСАНИЕ ФИГУР
В дальнейшем, описание изобретения будет проиллюстрировано примерами и фигурами без ограничения по описываемым вариантам осуществления изобретения. Некодирующая последовательность дезоксирибонуклеиновых кислот в рамках настоящего изобретения обозначена как «MGN1703» на Фиг. 1-3, и как «dSLIM» на Фиг. 4. На фигурах представлена следующая информация:
Фиг. 1 А/В MGN1703 активирует экспрессию маркера клеточной активации CD69 на клетках иммунного эффектора периферической крови (естественные клетки-убийцы и Т-клетки CD8)
Фиг. 2 NK-клетки, стимулированные MGN1703, подавляют распространение ВИЧ
Фиг. 3 Некодирующие ДНК-конструкты настоящего изобретения вызывают незначительные изменения в провоспалительных цитокинах ИЛ-6 и ФНО-α. Фиг. 4А/В Активирующий эффект стимуляции NK-клеток с некодирующей иммуностимулирующей последовательностью ДНК
Фиг. 5А/В/С Обработка NK-клеток некодирующими ДНК-конструктами.
Некодирующие ДНК-конструкты усиливают опосредованное NK-клетками уничтожение ВИЧ-1, продуцирующего аутологичные CD4+ Т-клетки.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям и способам лечения вирусных инфекций. В частности, изобретение связано с ретровирусной инфекцией и лече-нием вирусной латентности. Вышеуказанные некодирующие последовательности дезоксирибонуклеотидов должны существенно увеличивать активность NK-клеток и ВИЧ-специфичную цитотоксическую активность клеток CD8+, приводящую к усиленному уничтожению клеток, экспрессирующих ВИЧ.
В рамках настоящей заявки линейная незамкнутая последовательность называется «олигонуклеотид» (ОДН). Указанная последовательность ДНК может быть одноцепочечной или частично или полностью двухцепочечной. Термины «олиго», «олигонуклеотид» и «олигодезоксинуклеотид» являются синонимами. Они никоим образом не означают ограничение длины соответствующей последовательности ДНК. Единственными компонентами олигонуклеотидов являются нуклеотиды.
Олигонуклеотиды можно производить с помощью синтетического и частично или полностью биологического методов. Биологическое происхождение включает генетические методики получения последовательностей ДНК.
L-образные цепи ДНК или нуклеотиды в L-образной конформации означают нуклеотиды, которые включают L-дезоксирибозу в качестве остатка сахара вместо естественной D-дезоксирибозы. L-дезоксирибоза представляет собой энантиомер (зеркальное изображение) D-дезоксирибозы. Олигонуклеотиды, частично или полностью состоящие из нуклеотидов в L-образной конформации, могут быть частично или полностью одно- или двухцепочечными; однако нуклеотиды в L-образной конформации не могут гибридизоваться с нуклеотидами для получения D-образной конформации (Hauser et al., Nucleic Acid Res. 2006 34:5101-11). Растворимость и селективность L-образной ДНК не отличается от D-образной ДНК. Тем не менее, L-образная цепь ДНК устойчива к ферментативной экзоактивности природных ферментов, особенно экзонуклеаз, и, следовательно, такая ДНК защищена от внутриклеточной деградации (Urata et al., Nucleic Acids Res. 1992 20:3325-32). Именно поэтому L-образную цепь ДНК столь широко применяют.
В рамках настоящей заявки «стебель» означает двойную цепь ДНК, образованную спариванием оснований в пределах либо одного олигонуклеотида (который впоследствии является частично самокомплементарным), либо различных олигонуклеотидов (которые являются частично или полностью комплементарными). Внутримолекулярное спаривание оснований означает спаривание оснований внутри одного и того же олигонуклеотида, а спаривание оснований между различными олигонуклеотидами называется межмолекулярным спариванием оснований.
В рамках настоящей заявки «петля» означает непарный одноцепочечный участок как в пределах, так и на конце структуры стебля. «Шпилька» представляет собой особую комбинацию стебля и петли, возникающую, когда две самокомплементарные области одного олигонуклеотида гибридизуются, образуя стебель с неспаренной петлей на одном конце.
«Твердая фаза», с которой нуклеотиды ковалентно или нековалентно связаны, включает, без ограничений, колонку, матрицу, гранулы, стекло, включая модифицированные или функционализированные стекла, кремний или материалы на основе кремния, включая силикон и модифицированный силикон, пластмассы (содержащие полипропилен, полиэтилен, полистирол и сополимеры стирола и других материалов, акрилы, полибутилен, полиуретаны и т.д.), нейлон или нитроцеллюлозу, смолы, полисахариды, углерод, а также неорганические стекла и пластмассы. Таким образом, микротитрационные планшеты также относятся к твердой фазе в соответствии с настоящим документом.
«Иммуномодуляция» в рамках настоящей заявки означает иммуностимуляцию и иммуносупрессию. Иммуностимуляция, главным образом, означает стимулирование эффекторных клеток иммунной системы для их пролиферации, миграции, дифференциации или активации иным образом. Например, В-клеточную пролиферацию можно индуцировать без сопутствующих стимулирующих сигналов иммуностимулирующими олигонуклеотидами, которые обычно требуют сопутствующего стимулирующего сигнала от вспомогательных тимоцитов.
Под иммуносупрессией, с другой стороны, следует понимать снижение активации или эффективности иммунной системы. В целом, иммуносупрессию вызывают намеренно, к примеру, для предотвращения отторжения трансплантированного органа, лечения заболевания «трансплантат против хозяина» после трансплантации костного мозга или лечения аутоиммунного заболевания, например, ревматоидного артрита или болезни Крона.
В рамках настоящей заявки и в соответствии с общепринятым определением «агонист» означает химическое вещество или молекулу, связанную с другой молекулой (например, рецептором или лигандом) и, таким образом, активирующую такую молекулу. В отличие от активирующего агониста, под «антагонистом» понимают химическое вещество или молекулу, блокирующие взаимодействие молекулы, с которой связан антагонист, с соответствующим агонистом. В зависимости от контекста, в рамках настоящего изобретения антагонист может также привести к активации процесса, так как антагонист блокирует взаимодействие другого антагониста, например, с рецептором.
В рамках настоящей заявки термин «фармацевтически применимые или приемлемые соли» означают соли, входящие в состав комбинации и подготовленные при помощи соответствующих нетоксичных (т.е. фармацевтически приемлемых) кислот или оснований, в зависимости от индивидуальных заместителей в соединении, являющемся предметом настоящего изобретения. Например, если соединение, являющееся предметом настоящего документа, имеет кислотные свойства, соли присоединения основания можно получить путем сочетания нейтральных форм таких соединений с достаточным количеством желаемого основания, либо в неразбавленном виде, либо в соответствующем инертном растворе. Среди примеров фармацевтически приемлемых солей присоединения основания можно назвать соли натрия, калия, кальция, аммония, органических аминокислот или соли магния и аналогичные соли. Если соединение, являющееся предметом настоящего документа, имеет свойства основания, соли присоединения кислоты можно получить путем сочетания нейтральных форм таких соединений с достаточным количеством желаемой соли, либо в неразбавленном виде, либо в соответствующем инертном растворе. Фармацевтически приемлемые соли присоединения кислоты включают, без ограничений, следующие соли, полученные из неорганических кислот: соляная, бромистоводородная, азотная, карбоновая, фосфорная, частично нейтрализованная фосфорная кислота, серная, частично нейтрализованная серная, иодистоводородная или фосфористая кислоты и аналогичные им; а также соли, полученные из относительно нетоксичных органических кислот: уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, субериновая, фумаровая, миндальная, фталевая, бензолсульфоновая, п-толилсульфоновая, лимонная, винная, метансульфоновая и аналогичные им. Также включены соли аминокислот (такие как аргинат и аналогичные им) и соли органических кислот (таких как глюкуроновая или галактуроновая кислоты и аналогичные им). Некоторые отдельные соединения, являющиеся предметом настоящего изобретения, могут содержать как основные, так и кислотные функциональные группы, которые позволяют превращать соединения в соли основания или кислоты. Взаимодействие соли с основанием может восстановить нейтральные формы соединений, являющихся предметом настоящего изобретения, или кислоты, и выделение исходного соединения обычным способом. Родительская форма соединения отличается от различных солевых форм некоторыми физическими свойствами, такими как растворимость в полярных растворителях, но в остальном соли эквивалентны исходной форме соединения в рамках настоящего изобретения. Соединения, являющиеся предметом настоящего изобретения, могут содержать хиральные или асимметричные атомы углерода (оптические центры) и/или двойные связи. Настоящее изобретение охватывает рацематы, диастереомеры, геометрические изомеры и отдельные оптические изомеры. Соединения, являющиеся предметом настоящего изобретения, могут существовать в неразбавленных и в разбавленных формах, включая гидратированные формы. Как правило, разбавленные формы эквивалентны неразбавленным формам и также относятся к настоящему изобретению. Соединения, являющиеся предметом настоящего изобретения, могут, кроме того, существовать в нескольких кристаллических или аморфных формах.
Молекулы дезоксирибонуклеиновой кислоты, состоящие из частично одноцепочечной гантелеобразной ковалентно замкнутой цепи дезоксирибонуклеозидных остатков, содержащие одну или несколько последовательностей основания N1N2CGN3N4, где N1N2 представляет собой элемент группы GT, GG, GA, AT или АА, a N3N4 является элементом группы СТ или ТТ, а также детоксицитозин С, де-зоксигуанозин G, деоксиаденозин А и дезокситимидин Т, необходимо использовать в комбинации с антиретровирусными препаратами и/или ингибиторами деацетилазы гистонов.
Молекулы дезоксирибонуклеиновой кислоты, являющиеся предметом настоящего документа, могут иметь длину до 200 нуклеотидов. В частности, речь идет о последовательности длиной от 48 до 116 нуклеотидов.
Гантелеобразные некодирующие последовательности молекул дезоксирибонуклеиновой кислоты могут содержать последовательность оснований N1N2CGN3N4 на одноцепочечных участках.
Иммуностимуляцию выполняют in vitro, ex vivo или in vivo.
Настоящая заявка также описывает линейную незамкнутую последовательность ДНК, содержащую по меньшей мере один CpG-мотив и по меньшей мере один нуклеотид в L-образной конформации. Из-за частичной/полной L-образной конформации последовательность ДНК частично устойчива к экзонуклеазам. В случае, если конструкция имеет на одном конце двойной цепи одноцепочечную петлю, конец также защищен от деградации. Таким образом, ОДН полностью защищены от деградации клеток, при отсутствии необходимости использовать фосфоротиоатную основу, которая, как было показано, является токсичной. Кроме того, ОДН состоят только из минимального количества нуклеотидов, что делает их небольшими по размеру и, следовательно, легко трансфицируются в клетки.
Некодирующая последовательность дезоксирибонуклеиновых кислот, включающая по меньшей мере один фрагмент последовательности N1N2CGN3N4, может быть одноцепочечной или частично или полностью двухцепочечной. Она включает спаривание оснований в пределах либо одной молекулы (внутримолекулярное спаривание), либо нескольких молекул (межмолекулярное спаривание) или любую их комбинацию. Также возможно, что конструкция содержит по меньшей мере одну непарную одноцепочечную область. Дополнительным вариантом осуществления являются структуры-«шпильки». Из-за частичной или полной L-образной конформации обеспечивается более длительный период полувыведения конструкции, поскольку нуклеотиды в L-образной конформации не подвержены разрушению.
Также в рамках настоящей заявки авторы сообщают, что по меньшей мере две молекулы, являющихся одноцепочечными или частично или полностью двухцепочечными, могут лигироваться друг с другом, образуя многомерные конструкции. Таким образом, такие многомерные конструкции включают по меньшей мере столько CpG-мотивов, сколько партнеров по лигированию они имеют. Все мотивы плотно упакованы в одну молекулу и, как ожидается, также будут вызывать значительный иммунный ответ как часть комбинации с Т-клеточными регуляторами. Полученные одноцепочечные или частично или полностью двухцепочечные многомерные конструкции могут быть либо ковалентно замкнуты (включая нуклеотиды в L-образной конформации внутри молекулы), либо незамкнуты и содержать нуклеотиды в L-образной конформации на 5'- и/или 3'-конце для защиты от клеточной деградации.
Кроме того, в настоящей заявке описаны химические модификации, по меньшей мере, одного нуклеотида в некодирующей последовательности дезоксирибонуклеиновых кислот с одним мотивом последовательности N1N2CGN3N4, как минимум, с функциональной группой, отобранной из следующей группы веществ: карбоксил, амин, амид, альдимин, кеталь, ацеталь, сложный эфир, эфир, дисульфид, тиол, альдегид. Они позволяют связать ДНК-конструкт с соединением, выбранным из следующей группы: пептиды, белки, углеводы, антитела, синтетические молекулы, полимеры, бомбардирующие микрочастицы, металлические частицы или твердая фаза. Такую связь обеспечивают, например, путем адсорбции, ковалент-ной или ионной связи.
Модификацию выбирают на индивидуальной основе для выполнения соответствующей цели. Таким образом, конструкт можно использовать, например, для доставки других молекул в конкретную клетку, реагирующую на внедрение CpG-мотива/мотивов. Кроме того, благодаря таким модификациям можно соединить конструкт с бомбардирующими микрочастицами, потенциально используемыми для доставки конструкта в клетку. Конструкт также может быть соединен с твердой фазой, например, микротитровальным планшетом.
На Фиг. 1 показано, что MGN1703 активирует экспрессию маркера клеточной активации CD69 на иммунных эффекторных клетках периферической крови. Все МКПК (n=5, различные доноры) стимулировали с помощью MGN1703 или липо-полисахаридов. После стимуляции клетки анализировали с помощью проточной цитометрии и экспрессии CD69 на NK-клетках (слева) и Т-клетках CD8+ (справа). На рисунке показан среднекратный прирост относительно контрольной среды.
На Фиг. 2 показаны NK-клетки, стимулированные MGN1703, которые подавляют распространение ВИЧ. CD4-обедненные МКПК (один репрезентативный донор со стандартным отклонением) стимулировали с помощью MGN1703 или липополи-сахаридов. После стимуляции клетки инкубировали с аутологичными ВИЧ-инфицированными CD4+ клетками. Капсидный белок ВИЧ (Gagp24) количественно определяли в супернатантах культуры при контроле времени как показателя распространения вируса.
На Фиг. 3 показано, что некодирующие конструкты ДНК практически не влияют на провоспалительные цитокины ИЛ-6 (Фиг. 3А) и ФНО-α (Фиг. 3В). «Н/О» обозначает необработанные контрольные образцы, «MGN1703» обозначает некодирующие ДНК-конструкты, применяемые в концентрациях 0,75 мкМ, 1,5 мкМ и 3 мкМ (слева направо). Таким образом, использование некодирующей иммуностимулирующей последовательности дезоксирибонуклеотидов активировало вирусные инфицированные клетки без нежелательного воспаления, вызванного цитокином.
Для подтверждения активирующего действия стимулирующих NK-клеток с некодирующей иммуностимулирующей последовательностью дезоксирибонуклеотидов было исследовано влияние на активирующие или ингибирующие рецепторы NK-клеток. На Фиг. 4А и 4В показано, что некодирующие последовательности ДНК повышают только экспрессию активирующих рецепторов.
На Фиг. 5 показаны результаты экспериментов, проведенных для подтверждения, что ингибирование вируса, показанное на Фиг. 2, было вызвано специфичным уничтожением ВИЧ, а не неспецифичной гибелью CD4 Т-клеток. Сбор ВИЧ-инфицированных клеток производили на 6-й день и окрашивали для определения внутриклеточного антигена Р24. На Фиг. 5А показаны CD4 Т-клетки, культивируемые отдельно. На Фиг. 5 В показаны CD4 Т-клетки, культивируемые вместе с необработанными NK-клетками. На Фиг. 5С показаны CD4 Т-клетки, культивируемые вместе с обработанными dSLIM NK-клетками. Квадрат на каждом рисунке показывает популяцию ВИЧ-инфицированных клеток. Их процент от общей популяции указан над квадратом.
Результаты, показанные на Фиг. 5, подтверждают, что обработка NK-клеток с помощью некодирующих ДНК-конструктов, описанных в настоящем документе, потенциально значительно сокращает количество ВИЧ-инфицированных клеток.
По существу, настоящее описание демонстрирует, что лечение вирусных инфекций, характеризующихся латентным состоянием, можно подтвердить обработкой некодирующими ДНК-конструктами, являющимися предметом настоящего изобретения. Инфицированные клетки будут активированы или «демаскированы», после чего иммунная система сможет убить их. Таким образом, комбинированное лечение ВИЧ-инфекции с помощью кАРТ, например, подтверждается применением иммуностимулирующей некодирующей ДНК.
Касательно результатов в рамках известного уровня техники, где применяли комбинацию кАРТ и HDACi, кажется возможным, что комбинированная методика лечения ВИЧ, сочетающая два компонента лечения, включая иммуностимулирующие некодирующие ДНК-конструкты, будет эффективна при лечении ВИЧ. В настоящее время ведутся соответствующие эксперименты, направленные на доказательство подобного благоприятного эффекта.
Следует отметить, что некодирующие иммуностимулирующие ДНК-конструкты, представленные в настоящем описании, имеют преимущество в виде исключения стимуляции провоспалительных цитокинов. И напротив, некодирующие ДНК-конструкты, стабилизированные с помощью химических модификаций против деградации нуклеазой, как известно, вызывают выделение провоспалительных цитокинов.
Удивительно, что стимуляция латентных клеток, инфицированных ретровирусами, не приводила к ускоренному прогрессированию ВИЧ-инфекции в СПИД. Непредсказуемым эффектом стимуляции конструктами согласно представленному выше описанию, стало повышение успешности лечения ВИЧ с помощью кАРТ и/или HDACi.
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая молекулу дезоксирибонуклеиновой кислоты (ДНК) для применения при лечении ретровирусной инфекции, содержащую некодирующую последовательность дезоксирибонуклеиновых кислот, которая содержит по меньшей мере один мотив последовательности N1N2CGN3N4, где каждый из N1, N2, N3 и N4 представляет собой нуклеотид, содержащий А, С, Т или G, способ лечения ретровирусной инфекции, применение вышеуказанной молекулы ДНК для изготовления лекарственного средства для лечения ретровирусной инфекции, применение молекулы ДНК в качестве адъюванта при терапевтической или профилактической вакцинации для лечения ВИЧ-1. В одном из вариантов молекула ДНК содержит последовательность AACGTTCTTCGGGG CGTT (SEQ ID NO: 3). Изобретение расширяет арсенал средств для применения при лечении ретровирусной инфекции. 4 н. и 12 з.п. ф-лы, 9 ил.
Формула
Документы, цитированные в отчёте о поиске
Конъюгат полипептид-нуклеиновая кислота для иммунопрофилактики или иммунотерапии неопластических или инфекционных заболеваний

Комментарии