Средство для индукции иммунитета и способ выявления злокачественной опухоли - RU2519675C2
Код документа: RU2519675C2
Чертежи




























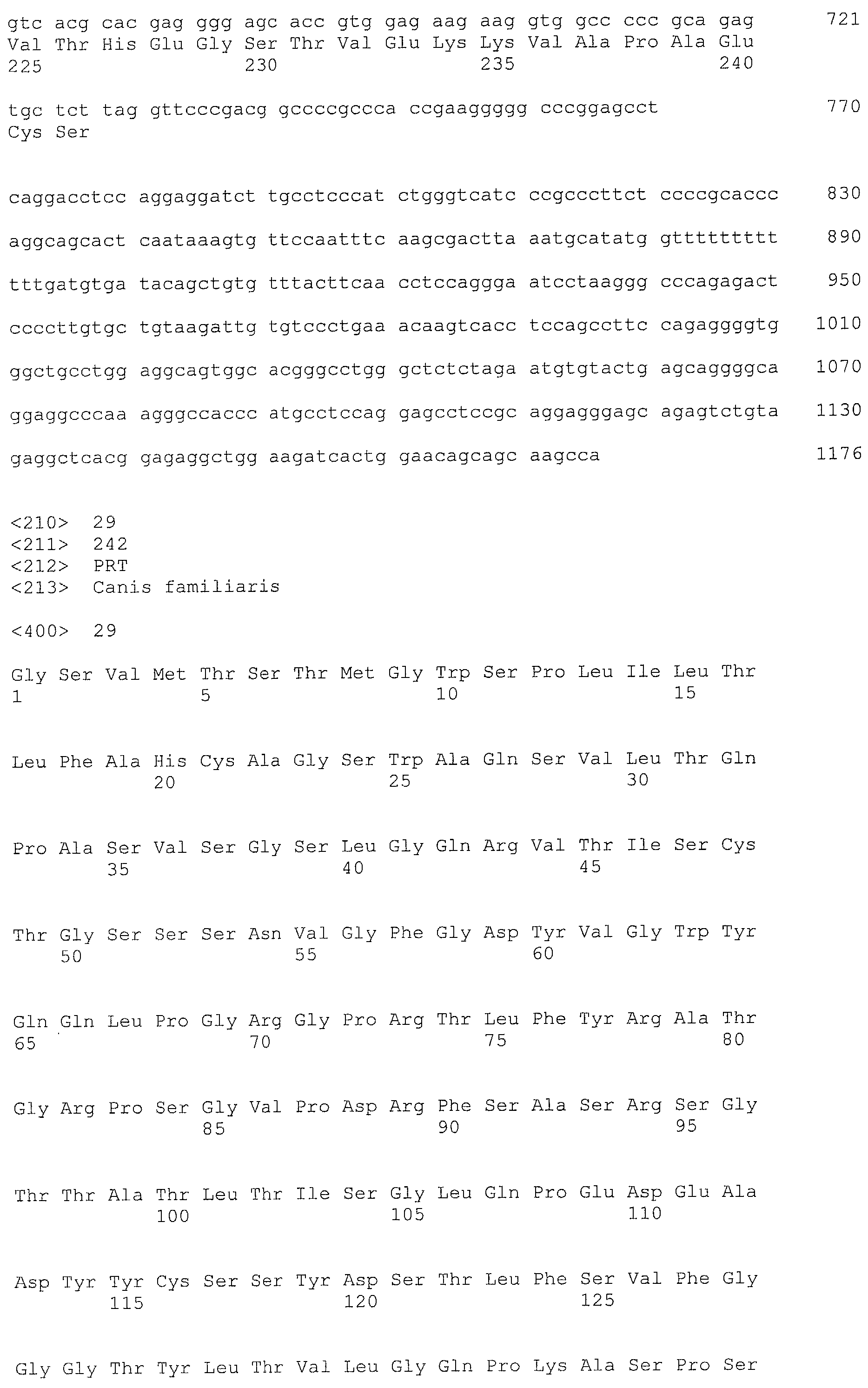














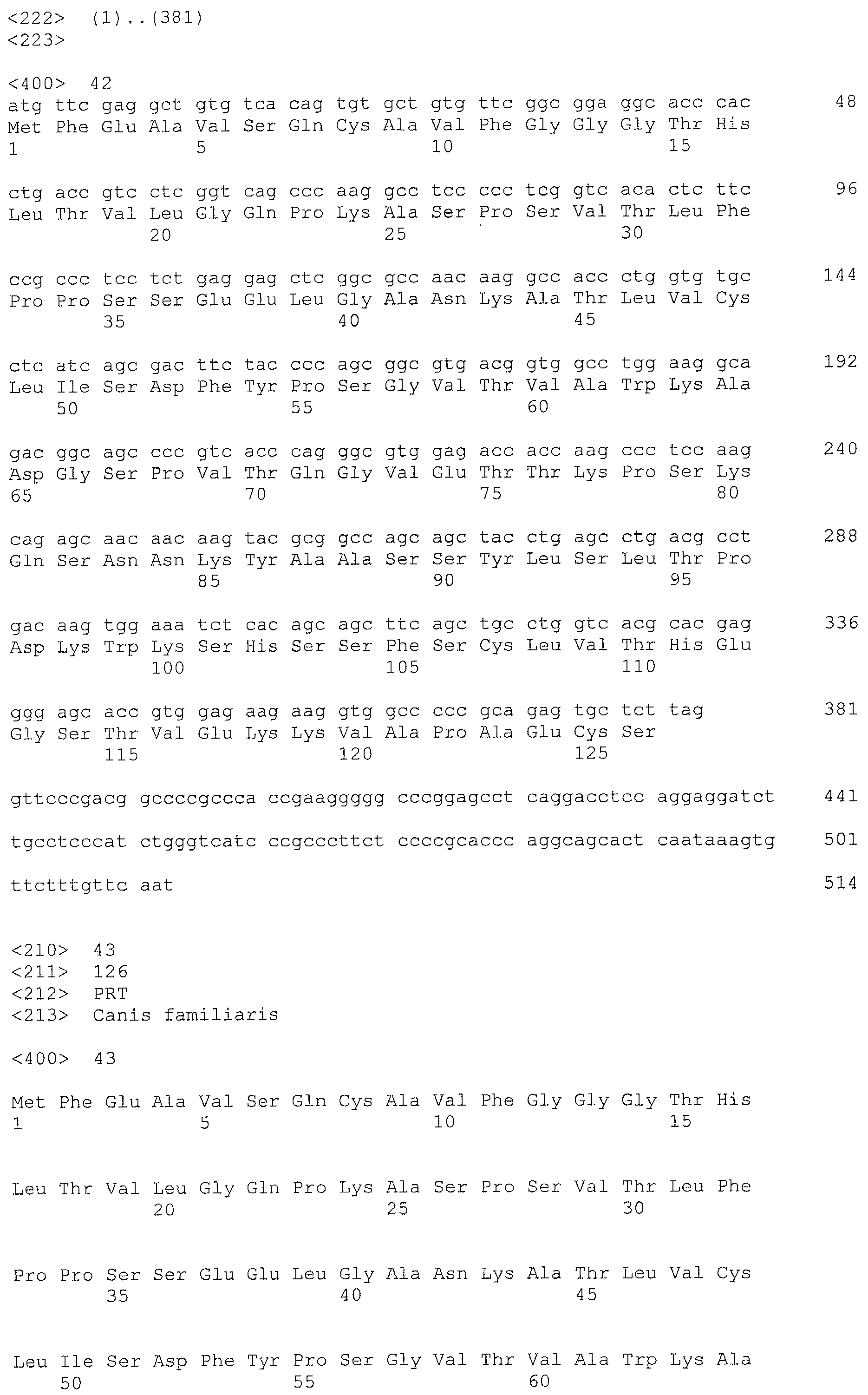


















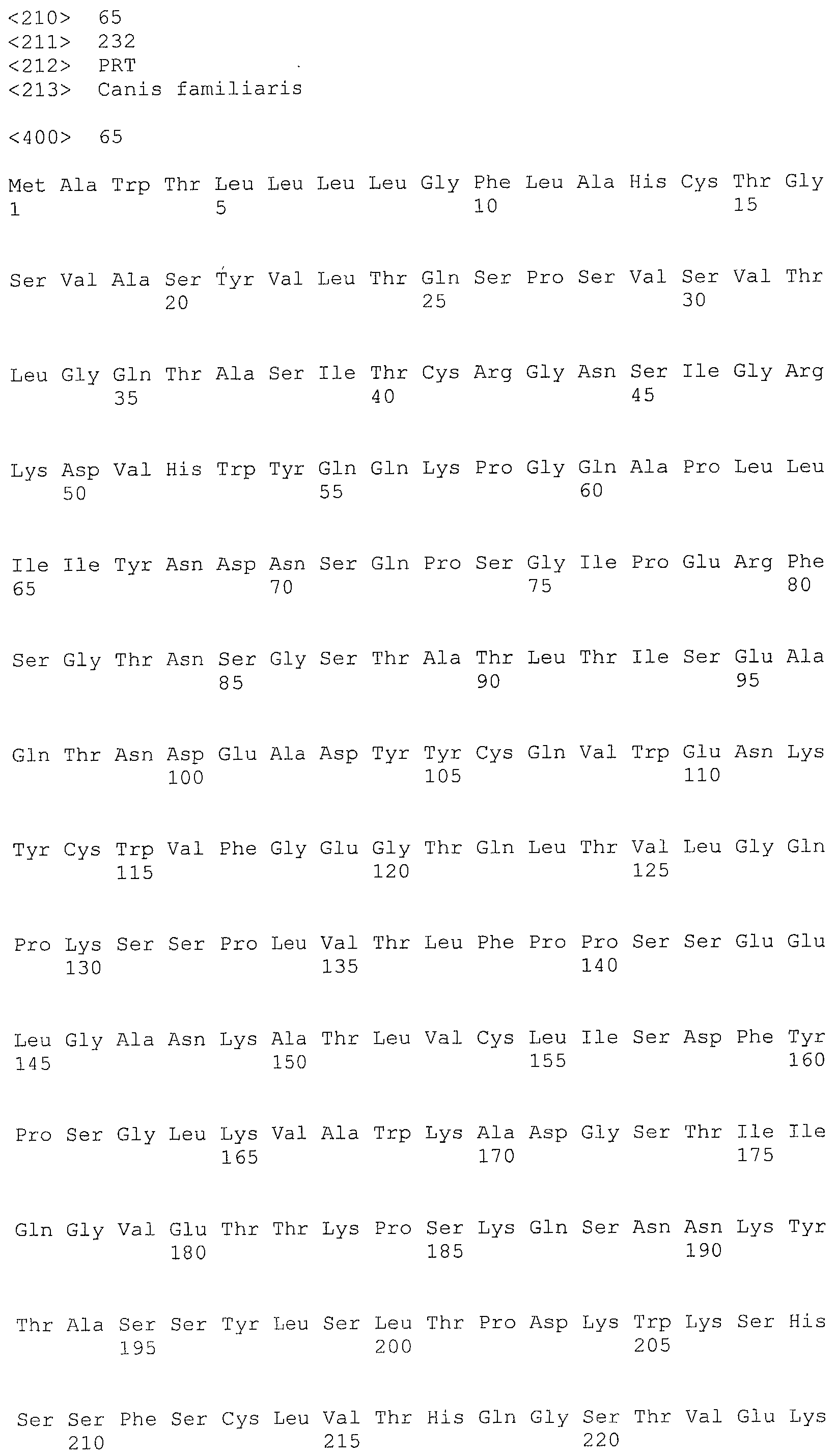






































Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001]
Настоящее изобретение относится к новому, индуцирующему иммунитет средству, используемому в качестве терапевтического средства и/или профилактического средства в случае злокачественной опухоли. Кроме того, настоящее изобретение относится к новому способу выявления злокачественной опухоли.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002]
Злокачественная опухоль (рак) представляет собой наиболее частую причину смерти среди всех причин летального исхода, и проводимая в настоящее время терапия рака в основном включает хирургическое лечение в сочетании с радиотерапией и химиотерапией. Несмотря на развитие новых хирургических методов и разработку в последнее время новых противораковых средств результаты лечения рака к настоящему времени в значительной степени не улучшились, за исключением некоторых видов рака. За последнее время за счет достижений в области молекулярной биологии и иммунологии рака были идентифицированы раковые антигены, распознаваемые цитотоксическими Т-клетками, реактивными в отношении рака, а также гены, кодирующие раковые антигены, что дало надежду на возможность антиген-специфической иммунотерапии рака (непатентный документ 1).
[0003]
При проведении иммунотерапии с целью снижения побочных эффектов необходимо, чтобы пептид, полипептид или белок, распознаваемый как антиген, почти не присутствовал в нормальных клетках, и специфически присутствовал в раковых клетках. В 1991 году Boon et al. в институте Людвига в Бельгии (Ludwig Institute, Бельгия) выделили антиген из меланомы человека MAGE 1, который распознается CD8-положительными Т-клетками, используя метод клонирования экспрессируемой кДНК, в котором применяли аутологичную линию раковых клеток и реактивные к раку Т-клетки (непатентный документ 2). После этого с использованием методики SEREX (серологическая идентификация антигенов путем клонирования продуктов рекомбинантной экспрессии), где опухолевые антигены распознаются антителами, продуцируемыми в живом организме пациента со злокачественной опухолью в ответ на собственные раковые клетки пациента, идентифицировали методом клонирования гена с оценкой генной экспрессии (непатентный документ 3, патентный документ 1), и в результате применения этого метода было выделено несколько раковых антигенов (непатентные документы 4-9). С использованием части выявленных мишеней были начаты клинические тесты для разработки иммунотерапии рака.
[0004]
С другой стороны, как и у человека, так и у собак и кошек также известно множество видов опухолей, таких как рак молочной железы, лейкоз и лимфома, и статистика этих заболеваний у кошек и собак достаточно высока. Однако в настоящее время ни для кошек, ни для собак не было разработано ни терапевтического средства, ни профилактического средства, которое было бы эффективным при раке. Большинство опухолей у кошек и собак выявляется их владельцами только после того, как эти виды рака начинают прогрессировать и во многих случаях бывает уже поздно помещать их в клинику для хирургического удаления опухоли или для введения лекарства, применяемого у человека (противораковый препарат и т.п.), так что собаки и кошки зачастую погибают вскоре после начала лечения. В этих условиях следует ожидать, что если будут доступны терапевтические средства и профилактические средства, эффективные для лечения рака у собак и кошек, то можно будет разработать способы их использования применительно к злокачественным опухолям собак.
[0005]
Поскольку раннее выявление рака приводит к лучшим результатам лечения, способ выявления рака, который легко было бы проводить при тестировании сыворотки крови, мочи или т.п. без серьезного физического или экономического ущерба для пациентов со злокачественной опухолью, весьма необходим. В последнее время широко использовались способы, в соответствии с которыми определяли опухолевые продукты, такие как маркеры опухоли, и эти методы использовались с целью диагностики на образцах крови или мочи. Примеры опухолевых продуктов включают опухолевые антигены, ферменты, специфические белки, метаболиты, опухолевые гены, продукты опухолевых генов и гены-супрессоры опухоли, и в некоторых случаях в качестве опухолевых маркеров при диагностике рака использовали эмбриональный опухолевый антиген CEA, гликопротеины CA19-9 и CA125, специфический антиген простаты PSA, кальцитонин, который является пептидным гормоном, продуцируемым в щитовидной железе и т.п. (непатентный документ 10). Однако в случае большинства видов рака опухолевые маркеры, которые были бы применимы для диагностики рака, отсутствуют. Кроме того, поскольку большинство раковых маркеров, известных к настоящему времени, присутствует в жидкостях организма лишь в очень малых количествах (например, порядка пг/мл), их выявление требует высокоспецифичного способа их определения или специальной методики. В этих условиях если иметь новый способ выявления рака, с помощью которого можно было бы обнаруживать различные виды рака при проведении несложных операций, то это позволило бы разработать диагностику различных видов рака.
[0006]
CD179b известен как часть суррогатной легкой цепи иммуноглобулина и экспрессируется на поверхностях мембран предшественников B-клеток (пре-B-клетки и про-B-клетки). Он исчезает при дифференцировке В-клеток и не экспрессируется в зрелых В-клетках. Однако известно, что CD179b экспрессируется в лейкозных клетках (пре-B лейкозные клетки), образуемых при раковом перерождении пре-B-клеток (непатентные документы 10 и 11). Кроме того, известно, что CD179b экспрессируется также в клетках лимфомы (пре-B-клетки лимфомы), образуемых при раковом перерождении пре-В-клеток, и его можно использовать в качестве диагностического маркера для пре-В-клеточной лимфомы (непатентный документ 12). Однако не сообщалось о его специфичной экспрессии в лейкозных клетках, отличных от пре-В-лейкозных клеток, в лимфомах, отличных от пре-В-клеточной лимфомы, в клетках рака молочной железы и т.п. Кроме того, не было сообщений о том, что усиление иммунитета против CD179b полезно при лечении и/или профилактике рака.
ЛИТЕРАТУРА, ИЗВЕСТНАЯ НА НАСТОЯЩИЙ МОМЕНТ
Патентная литература
[0007]
Патентный документ 1: US 5698396 В
Непатентная литература
[0008]
Непатентный документ 1: Tsuyoshi Akiyoshi, "Cancer and Chemotherapy", 1997, Vol.24, pp. 551-519
Непатентный документ 2: Bruggen P. et al., Science, 254:1643-1647 (1991)
Непатентный документ 3: Proc. Natl. Acad. Sci. USA, 92:11810-11813 (1995)
Непатентный документ 4: Int. J. Cancer, 72:965-971 (1997)
Непатентный документ 5: Cancer Res., 58:1034-1041 (1998)
Непатентный документ 6: Int. J. Cancer, 29:652-658 (1998)
Непатентный документ 7: Int. J. Oncol., 14:703-708 (1999)
Непатентный документ 8: Cancer Res., 56:4766-4772 (1996)
Непатентный документ 9: Hum. Mol. Genet 6:33-39 (1997)
Непатентный документ 10: Adv. Immunol., 63:1-41 (1996)
Непатентный документ 11: Blood, 92:4317-4324 (1998)
Непатентный документ 12: Modern Pathology, 17:423-429 (2004)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
[0009]
Целью настоящего изобретения было обнаружение нового полипептида, пригодного в качестве средства для лечения, и/или профилактики, и/или любого другого воздействия на рак, что позволило бы использовать полипептид в качестве индуцирующего иммунитет средства. Настоящее изобретение также относится к разработке способа выявления рака, пригодного для диагностики рака.
СРЕДСТВА РЕШЕНИЯ УКАЗАННЫХ ПРОБЛЕМ
[0010]
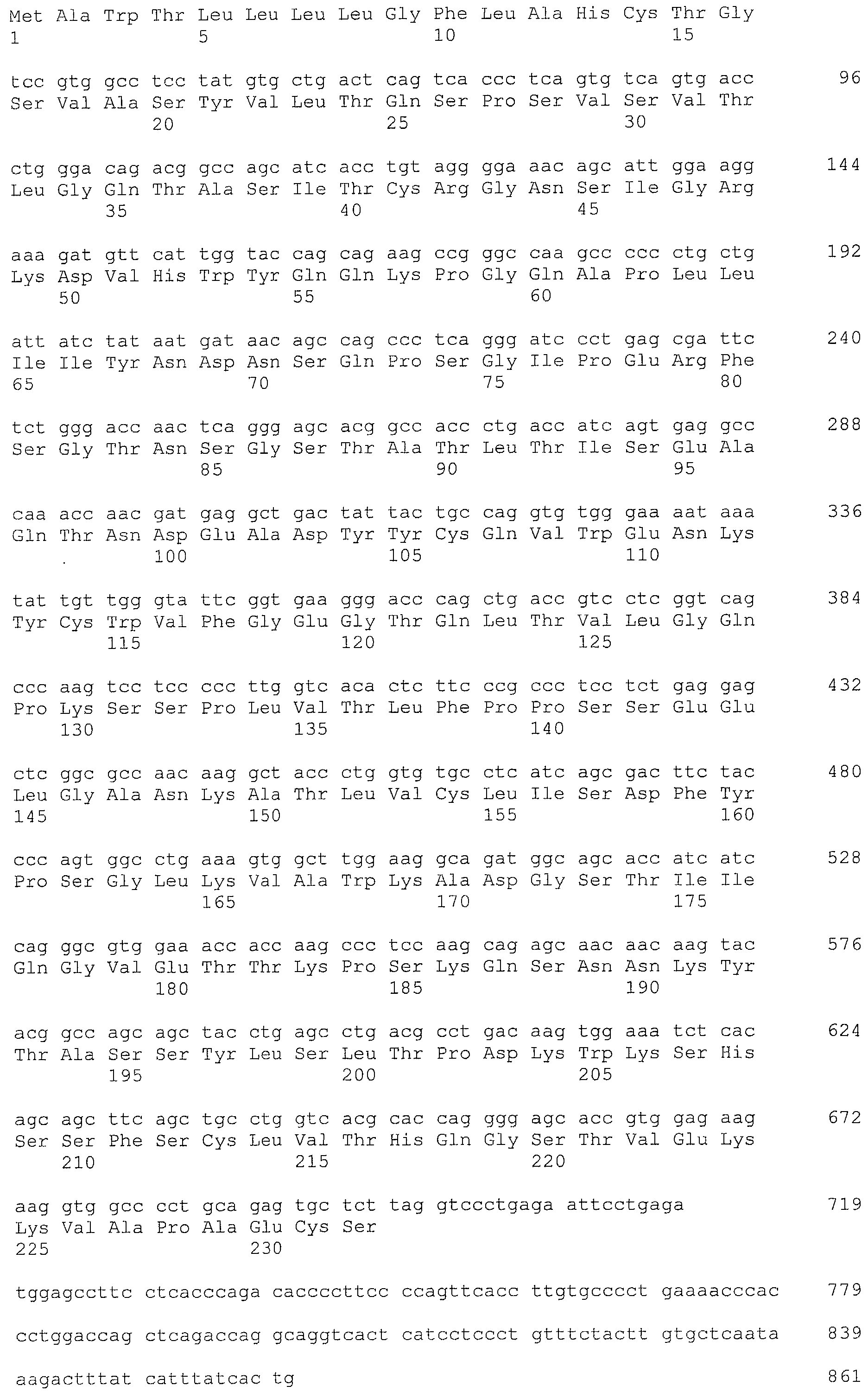
Авторы настоящего изобретения интенсивно изучали по методу SEREX с использованием сыворотки больной собаки, от которой из тканей, пораженных раком молочной железы, была создана библиотека кДНК, где кДНК кодировала белок, который связывается с антителами, имеющимися в сыворотке, полученной от живого организма с опухолью, и на основании кДНК были получены полипептиды собаки CD179b, имеющие аминокислотные последовательности с нечетными номерами SEQ ID NO: 5-95 (что означает SEQ ID NO: 5, 7, 9, 11, 13, 15, …, 91 и 93), приведенными в списке последовательностей. Далее, на основании гомологии полученных генов с человеческим геном, был получен человеческий полипептид CD179b с аминокислотной последовательностью SEQ ID NO: 3 и, аналогично, на основании гомологии с бычьим геном, был получен бычий полипептид CD179b с аминокислотной последовательностью SEQ ID NO: 95. Далее, авторы настоящего изобретения обнаружили, что указанные полипептиды CD179b специфически экспрессируются в клетках рака молочной железы, в лейкозных клетках и клетках лимфомы. Кроме того, авторы настоящего изобретения обнаружили, что при введении указанных CD179b в живой организм в живом организме могут быть индуцированы иммуноциты против CD179b, что может привести к регрессии опухоли в живом организме, экспрессирующем CD179b. Далее, авторы настоящего изобретения обнаружили, что рекомбинантный вектор, включающий полинуклеотид, кодирующий полипептид CD179b или его фрагмент, таким образом, чтобы он мог экспрессироваться, индуцирует противоопухолевый эффект против рака, при котором в живом организме экспрессируется CD179b.
[00011]
Далее, авторы настоящего изобретения обнаружили, что частичный полипептид белка CD179b обладает способностью презентироваться антигенпрезентирующими клетками, что позволяет достичь активации и роста цитотоксических Т-клеток, специфичных для пептида (иммуноиндуцирующая активность), и что, соответственно, такой пептид будет полезен для лечения и/или профилактики рака, и, кроме того, что антигенпрезентирующие клетки, контактирующие с пептидом, и Т-клетки, контактирующие с антиген-презентирующими клетками, могут использоваться для лечения и/или профилактики рака. Кроме того, авторы настоящего изобретения обнаружили, что поскольку рекомбинантный полипептид, полученный на основе аминокислотной последовательности указанного выше белка CD179b, специфически реагирует только с сывороткой из имеющего опухоль живого организма, то этот факт может использоваться для выявления рака. На основании указанных выше открытий и было сделано настоящее изобретение.
[0012]
Таким образом, настоящее изобретение характеризуется следующими положениями.
[0013]
(1) Иммуноиндуцирующее средство, включающее в качество эффективного(ых) ингредиента(ов) по меньшей мере один полипептид, выбранный из представленных ниже полипептидов (a)-(c), где полипептид(ы) обладает(ют) иммуноиндуцирующей активностью/активностями, или в качестве эффективного(ых) ингредиента(ов) рекомбинантный(ые) вектор(а), который(ые) включает(ют) полинуклеотид(ы), кодирующий(ие) полипептид(ы), и способен(ны) экспрессировать полипептид(ы) in vivo:
(a) полипептид, состоящий по существу не менее чем из 7 последовательно соединенных аминокислот в любой из аминокислотных последовательностей с нечетными номерами SEQ ID NO:3-95, приведенными в списке последовательностей;
(b) полипептид, обладающий не менее чем 90% идентичностью последовательности с полипептидом (а) и состоящий по существу не менее чем из 7 аминокислот; и
(c) полипептид, включающий полипептид (a) или (b) в качестве своей частичной последовательности.
[0014]
(2) Иммуноиндуцирующее средство по приведенному выше пункту (1), где полипептид (b) обладает не менее чем 95% идентичностью последовательности с полипептидом (а).
[0015]
(3) Иммуноиндуцирующее средство по приведенному выше пункту (1), где каждый из полипептидов, обладающий иммуноиндуцирующей(ими) активностью/активностями, представляет собой полипептид, состоящий по существу не менее чем из 7 аминокислот, в любой из аминокислотных последовательностей с нечетными номерами SEQ ID NO: 3-95, приведенными в списке последовательностей, или полипептид, включающий указанный полипептид в качестве своей частичной последовательности.
[0016]
(4) Иммуноиндуцирующее средство по приведенному выше пункту (1), где каждый из полипептидов, обладающий иммуноиндуцирующей(ими) активностью/активностями, представляет собой полипептид, имеющий любую из аминокислотных последовательностей с нечетными номерами SEQ ID NO: 3-95, приведенными в списке последовательностей.
[0017]
(5) Иммуноиндуцирующее средство по приведенному выше пункту (3), где каждый из полипептидов, обладающих иммуноиндуцирующей(ими) активностью/активностями, представляет собой полипептид, состоящий по существу не менее чем из 7 последовательных аминокислот на участке аминокислот 1-34 или аминокислот 52-75, в любой из аминокислотных последовательностей с нечетными номерами SEQ ID NO: 3-95, приведенными в списке последовательностей, или полипептид, включающий указанный полипептид в качестве своей частичной последовательности.
[0018]
(6) Иммуноиндуцирующее средство по пункту (5), приведенному выше, где каждый из полипептидов, обладающий иммуноиндуцирующей(ими) активностью/активностями, представляет собой полипептид, состоящий по существу из аминокислотной последовательности SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116 или SEQ ID NO: 117, приведенных в списке последовательностей; или полипептид, включающий в качестве своей частичной последовательности аминокислотную последовательность SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116 или SEQ ID NO: 117, приведенную в списке последовательностей, где указанный полипептид имеет от 8 до 12 аминокислотных остатков.
[0019]
(7) Иммуноиндуцирующее средство по любому из приведенных выше пунктов (1)-(6), включающее один или несколько полипептидов в качестве эффективного(ых) ингредиента(ов).
[0020]
(8) Иммуноиндуцирующее средство по приведенному выше пункту (7), где полипептид(ы) представляет(ют) собой средство(а) для воздействия на антигенпрезентирующие клетки.
[0021]
(9) Иммуноиндуцирующее средство по любому из пунктов (1)-(8), которое используется для лечения и/или профилактики злокачественной(ых) опухоли(ей) у животных.
[0022]
(10) Иммуноиндуцирующее средство по пункту (9), приведенному выше, где злокачественная(ые) опухоль(и) представляет(ют) собой злокачественную(ые) опухоль(и), экспрессирующую(ые) ген CD179b.
[0023]
(11) Иммуноиндуцирующее средство по приведенному выше пункту (10), где злокачественная(ые) опухоль(и) представляет(ют) собой рак молочной железы, лейкоз и/или лимфому.
[0024]
(12) Иммуноиндуцирующее средство по любому из пунктов (1)-(11), приведенных выше, дополнительно содержащее средство, усиливающее иммунитет.
[0025]
(13) Выделенная антигенпрезентирующая клетка, включающая комплекс, образованный между полипептидом с иммуноиндуцирующей активностью и молекулой HLA.
[0026]
(14) Выделенная Т-клетка, которая селективно связывается с комплексом, образованным между полипептидом с иммуноиндуцирующей активностью и молекулой HLA.
[0027]
(15) Способ индукции иммунитета, включающий введение индивидууму по меньшей мере одного полипептида, выбранного из полипептидов (a)-(c), представленных ниже, где полипептид(ы) обладает(ют) иммуноиндуцирующей(ими) активностью/активностями, или рекомбинантного(ых) вектора(ов), который(ые) включает(ют) полинуклеотид(ы), кодирующий(ие) полипептид(ы), и способен(ны) к экспрессии полипептида(ов) in vivo:
(a) полипептид, состоящий по существу не менее чем из 7 последовательных аминокислот в любой из аминокислотных последовательностей, приведенных в списке последовательностей в виде SEQ ID NO: 3-95 с нечетными номерами;
(b) полипептид, обладающий не менее чем 90% идентичностью последовательности с полипептидом (а) и состоящий по существу не менее чем из 7 аминокислот; и
(c) полипептид, включающий полипептид (a) или (b) в качестве своей частичной последовательности.
[0028]
(16) Способ выявления злокачественной(ых) опухоли(ей), где указанный способ применяется в отношении образца, выделенного из живого организма, и где указанный способ включает определение экспрессии по меньшей мере одного из полипептидов (a)-(c), представленных ниже:
(a) полипептид, состоящий по существу не менее чем из 7 последовательных аминокислот в любой из аминокислотных последовательностей, приведенных в списке последовательностей в виде SEQ ID NO:3-95 с нечетными номерами;
(b) полипептид, обладающий не менее чем 90% идентичностью последовательности с полипептидом (а) и состоящий по существу не менее чем из 7 аминокислот; и
(c) полипептид, включающий полипептид (a) или (b) в качестве своей частичной последовательности.
[0029]
(17) Способ по пункту (16), приведенному выше, где указанное определение экспрессии полипептида(ов) проводится путем измерения количества антитела/антител, которые могут содержаться в образце, с использованием иммуноанализа, позволяющего измерять количество антитела/антител, индуцируемых в живом организме против полипептида(ов).
[0030]
(18) Способ выявления злокачественной(ых) опухоли(ей) применительно к образцу, выделенному из живого организма, где указанный способ включает исследование экспрессии гена CD179b, имеющего кодирующий участок, имеющий любую из последовательностей оснований, показанных в виде SEQ ID NO: 1 и SEQ ID NO:4-94 с четными номерами в списке последовательностей, в образце, полученном от пациента со злокачественной опухолью, и его сравнение с уровнем экспрессии гена в образце, полученном от здорового индивидуума.
[0031]
(19) Реагент для выявления злокачественной(ых) опухоли(ей), включающий полипептид, который взаимодействует в реакции «антиген-антитело» с антителом, индуцируемым в живом организме против любого из полипептидов (a)-(c), представленных ниже:
(a) полипептид, состоящий из по существу не менее чем из 7 последовательных аминокислот в любой из аминокислотных последовательностей с нечетными номерами SEQ ID NO: 3-95, приведенными в списке последовательностей;
(b) полипептид, обладающий не менее чем 90% идентичностью последовательности с полипептидом (а) и состоящий по существу не менее чем из 7 аминокислот; и
(c) полипептид, включающий полипептид (а) или (b) в качестве своей частичной последовательности.
ЭФФЕКТ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0032]
В настоящем изобретении предлагается новое иммуноиндуцирующее средство, применяемое для лечения или профилактики рака и/или т.п. Как более подробно будет описано в приведенных примерах, введением полипептида по настоящему изобретению животному с опухолью в указанном организме могут быть индуцированы иммуноциты и может быть достигнуто снижение или даже регресс опухоли.
[0033]
Кроме того, в настоящем изобретении предлагается новый способ выявления рака. Поскольку измерение уровня экспрессии полипептида в образце согласно способу настоящего изобретения позволяет выявить малые, еще незаметные проявления рака, а также те виды рака, которые существуют в глубоких частях тела, то данный способ также применим для раннего выявления рака при медицинском обследовании и в ходе других процедур. Если способ по настоящему изобретению использовать при наблюдении за пациентами после лечения рака, то рецидив рака может быть выявлен на очень ранней стадии. Кроме того, способ по настоящему изобретению позволяет оценивать стадию прогрессирования рака, такую как стадия роста опухоли, стадия инвазии опухоли в окружающие ткани и метастазирование рака в лимфатические узлы и отдаленные органы.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0034]
На фиг. 1 показана диаграмма, демонстрирующая картину экспрессии гена, кодирующего CD179b белок в нормальных тканях и линиях опухолевых клеток. График под номером 1 иллюстрирует характер экспрессии гена, кодирующего белок CD179b; а график под номером 2 демонстрирует характер экспрессии гена GAPDH. На фиг. 1 на ординате графика под номером 1 показан характер экспрессии гена, идентифицированного выше, и график под номером 2 отражает характер экспрессии гена GAPDH, взятого в качестве контроля для целей сравнения.
На фиг. 2 абсцисса графиков с номерами 3, 4, 5, 6, 7, 8, 9 и 10 показывает способность HLA-A0201-положительных CD8-положительных Т-клеток к продукции IFN-γ за счет стимуляции Т2-клеток после пульсовой обработки пептидами SEQ ID NO:108, 109, 110, 113, 114, 115, 116 и 117 соответственно. График под номером 11 показывает результат для пептида SEQ ID NO:118, который использовался в качестве отрицательного контроля (пептид, имеющий последовательность, не соответствующую настоящему изобретению).
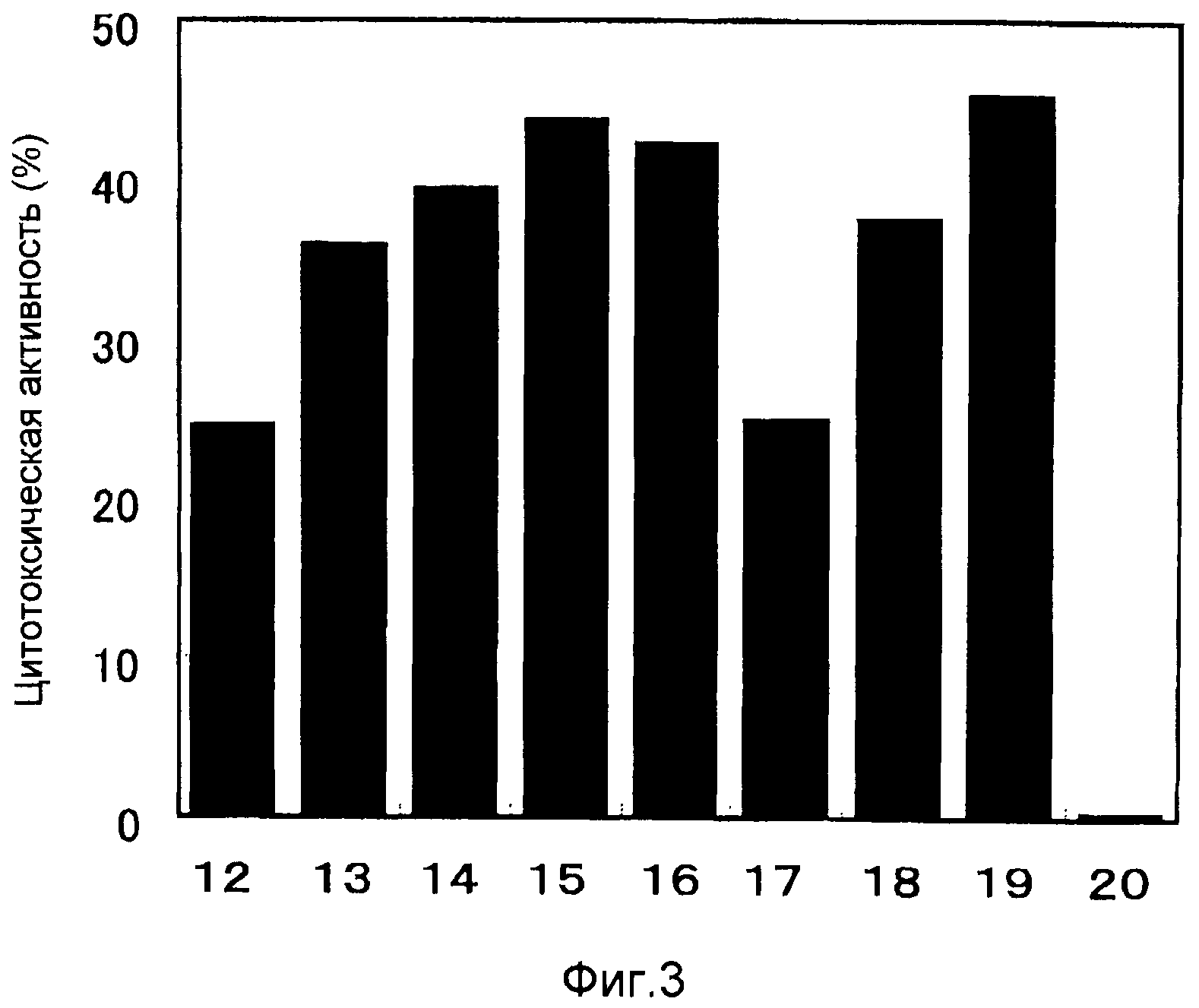
На фиг. 3 абсциссы графиков 12, 13, 14, 15, 16, 17, 18 и 19 показывают цитотоксическую активность HLA-A0201-положительных CD8-положительных Т-клеток против клеток Namalwa, где указанные клетки были стимулированы с использованием SEQ ID NO: 108, 109, 110, 113, 114, 115, 116 и 117 соответственно. График под номером 20 показывает цитотоксическую активность CD8-положительных Т-клеток, индуцированных с использованием пептида, взятого в качестве отрицательного контроля (SEQ ID NO: 118).
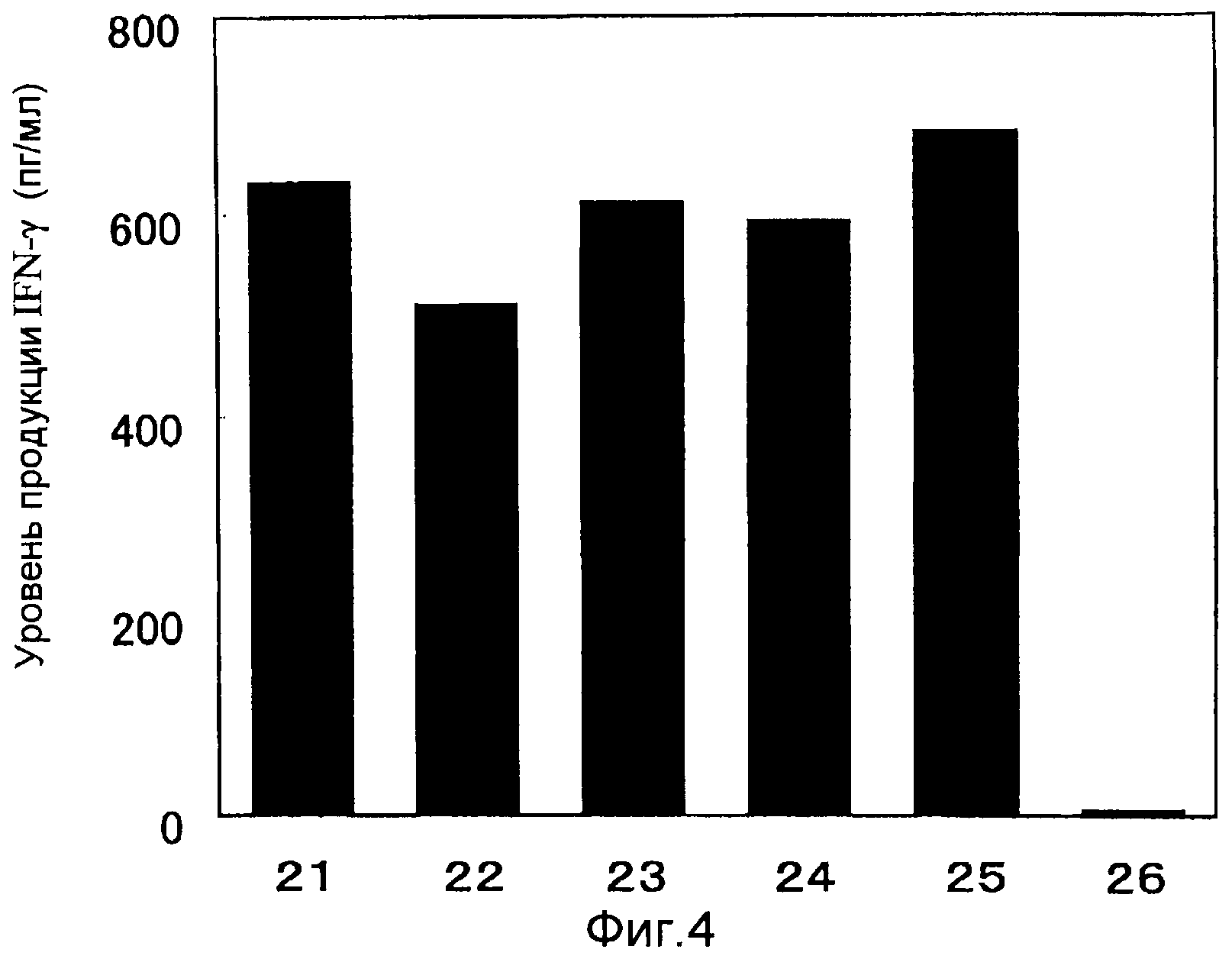
На фиг. 4 абсциссы графиков 21, 22, 23, 24 и 25 показывают способность HLA-A24-положительных CD8-положительных T-клеток к продукции IFN-γ за счет стимуляции JTK-LCL клеток посредством пульсовой обработки пептидами SEQ ID NO: l10, 111, 112, 115 и 116 соответственно. График под номером 26 показывает результат для пептида SEQ ID NO: 118, который использовался в качестве отрицательного контроля.
На фиг. 5 графики с номерами 27, 28, 29, 30 и 31 показывают цитотоксическую активность HLA-A24-проложительных CD8-положительных T-клеток, стимулированных пептидами SEQ ID NO: 110, 111, 112, 115 и 116 соответственно, против JTK-LCL клеток. График под номером 32 показывает цитотоксическую активность CD8-положительных T-клеток, индуцированных пептидом, использованным в качестве отрицательного контроля (SEQ ID NO: 118).
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0035]
Полипептид
Примеры полипептида, содержащегося в иммуноиндуцирующем средстве по настоящему изобретению в качестве активного ингредиента, включают один или несколько полипептидов, выбранных из полипептидов (a), (b) и (c), приведенных ниже:
(a) полипептид, состоящий по существу не менее чем из 7 последовательных аминокислот в полипептиде, имеющем любую из аминокислотных последовательностей с нечетными номерами SEQ ID NO: 3-95, приведенными в списке последовательностей (что означает, соответственно, SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 и 95), который обладает иммуноиндуцирующей активностью;
(b) полипептид, обладающий не менее чем 90% идентичностью последовательности с полипептидом (а), который состоит по существу не менее чем из 7 аминокислот и обладает иммуноиндуцирующей активностью; и
(c) полипептид, включающий полипептид (a) или (b) в качестве своей частичной последовательности и обладающий иммуноиндуцирующей активностью.
[0036]
В контексте настоящего описания термин «полипептид» означает молекулу, образованную множеством аминокислот, соединенных друг с другом пептидными связями, и включает не только полипептидные молекулы, содержащие большое число аминокислот, составляющих их, но также низкомолекулярные молекулы, содержащие небольшое количество аминокислот (олигопептиды) и молекулы полной длины. Согласно настоящему изобретению белки, состоящие из полноразмерных последовательностей SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 и 95, также входят в его область.
[0037]
В контексте настоящего описания термин «с аминокислотной последовательностью» означает, что аминокислотные остатки сгруппированы в определенном порядке. В этой связи, например, термин «полипептид с аминокислотной последовательностью SEQ ID NO: 3» означает полипептид, имеющий аминокислотную последовательность Leu Leu Arg Pro (snip)... Ala Glu Cys Ser, описываемую в виде SEQ ID NO: 3, где указанный полипептид имеет размер в 176 аминокислотных остатков. Кроме того, например, термин «полипептид с аминокислотной последовательностью SEQ ID NO: 3» может быть также записан в сокращенном виде как «полипептид SEQ ID NO: 3». Это также применимо к термину «с последовательностью оснований».
[0038]
В контексте настоящего описания термин «иммуноиндуцирующая активность» означает способность индуцировать иммуноциты, которые секретируют цитокины, такие как интерферон, в живом организме.
[0039]
Обладает ли полипептид иммуноиндуцирующей активностью, можно определить с использованием, например, известного теста ELISPOT. Более конкретно, например, как будет подробно описано в примерах, клетки, такие как мононуклеарные клетки периферической крови, получают из живого организма и в них вводят полипептид, иммуноиндуцирующую активность которого необходимо определить, и затем эти клетки подвергают совместному культивированию с полипептидом, после чего определяют количество(а) цитокина(ов) и/или хемокина(ов), таких как IFN-γ и/или интерлейкин (IL), продуцируемых клетками, с использованием специфических антител, что позволяет определить количество иммуноцитов в клетках и установить наличие иммуноиндуцирующей активности.
[0040]
Альтернативно, как будет описано в приведенных далее примерах, когда рекомбинантный полипептид, полученный на основе аминокислотной последовательности SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, вводят животному с опухолью, размер указанной опухоли может быть снижен или может быть достигнуть регресс опухоли за счет иммуноиндуцирующей активности. Таким образом, указанную выше иммуноиндуцирующую активность можно оценить также как способность подавлять рост раковых клеток, экспрессирующих полипептид SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, или как способность вызывать снижение или удаление раковой ткани (опухоли) (далее обозначаемой как «противоопухолевая активность»). Противоопухолевая активность полипептида может быть подтверждена, например, при определении, снижается ли размер опухоли или она подвергается регрессии, когда полипептид вводят в живой организм с опухолью, как более подробно будет описано ниже в примерах.
[0041]
Альтернативно, противоопухолевую активность полипептида можно оценить также при определении, будут ли стимулированные полипептидом клетки (то есть Т-клетки, приведенные в контакт с антигенпрезентирующими клетками, представляющими полипептид) демонстрировать цитотоксическую активность против опухолевых клеток in vitro. Контакт между Т-клетками и антигенпрезентирующими клетками может быть достигнут при их совместном культивировании в жидкой среде, как будет описано ниже. Определение цитотоксической активности может быть проведено, например, по известному методу, основанному на тесте по высвобождению51Cr, описанному в Int. J. Cancer, 58: p.317, 1994.
[0042]
В тех случаях, когда полипептид используется для лечения и/или профилактики рака, оценка иммуноиндуцирующей активности предпочтительно проводится с использованием противоопухолевой активности в качестве показателя, хотя этот показатель не является ограничивающим.
[0043]
Аминокислотная последовательность, показанная в виде SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 и 95 в списке последовательностей, представляет собой аминокислотную последовательность полипептида, которая связывается в рамках метода SEREX со специфическим антителом, имеющимся в сыворотке, полученной от собаки с опухолью, где используется сыворотка от больной собаки, для которой была создана библиотека кДНК из ткани молочной железы собаки, больной раком, или представляет собой аминокислотную последовательность CD179b, выделенную в качестве гомологичного для человека (гомолог) фактора относительно полипептида (см. пример 1, приведенный ниже). Полипептид (a) представляет собой такой полипептид, который состоит по существу не менее чем из 7 последовательных аминокислот, предпочтительно 8, 9 или не менее чем из 10 последовательных аминокислот в составе полипептида с одной из аминокислотных последовательностей, описанных в виде SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 и 95 в списке последовательностей, и который обладает иммуноиндуцирующей активностью. Как известно в данной области, полипептид, содержащий не менее чем примерно 7 последовательных аминокислотных остатков, может проявлять свои антигенные и иммуногенные свойства. Таким образом, полипептид, содержащий не менее 7 последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, может обладать иммуноиндуцирующей активностью, и в этой связи может использоваться для получения иммуноиндуцирующего средства по настоящему изобретению.
[0044]
Известно, что иммунная индукция, осуществляемая посредством введения антигенного ракового полипептида, основана на следующей последовательности событий: полипептид включается в антигенпрезентирующую клетку и затем разлагается на более мелкие фрагменты пептидазами клетки с последующим презентированием фрагментов на поверхности клетки. Далее, эти фрагменты распознаются цитотоксической Т-клеткой или т.п., которые селективно уничтожают клетки, представляющие антиген. Размер полипептида, представленного на поверхности антигенпрезентирующей клетки, относительно мал и составляет примерно 7-30 аминокислот. В этой связи, с точки зрения возможности представления на поверхности антигенпрезентирующей клетки, предпочтительным вариантом полипептида (а) является полипептид, включающий примерно 7-30 последовательных аминокислот в аминокислотной последовательности, показанной в виде SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, и более предпочтительно полипептид, состоящий из 8-30 или 9-30 аминокислот, является достаточным по размеру для полипептида (a). В некоторых случаях такие относительно малые полипептиды представляются непосредственно на поверхности антигенпрезентирующих клеток без включения их в антигенпрезентирующие клетки.
[0045]
Кроме того, поскольку полипептид, включенный в антигенпрезентирующую клетку, расщепляется пептидазами клетки по случайным сайтам с образованием различных полипептидных фрагментов, которые затем представляются на поверхности антигенпрезентирующей клетки, введение крупного полипептида, такого как полноразмерный участок SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, неизбежно вызовет образование полипептидных фрагментов при их разложении в антигенпрезентирующей клетке, и эти фрагменты будут эффективны для иммунной индукции, осуществляемой через антигенпрезентирующую клетку. В этой связи для иммунной индукции через антигенпрезентирующую клетку может также использоваться крупный полипептид, и такой полипептид может состоять не менее чем из 30, предпочтительно не менее чем из 100, более предпочтительно не менее чем из 200 аминокислот и еще более предпочтительно такой полипептид может состоять из полноразмерной последовательности SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95.
[0046]
Дополнительно, полипептиды по настоящему изобретению можно проверить с использованием соответствующей среды, где можно провести поиск эпитопных пептидов, которые содержат мотивы связывания различных типов HLA и которые состоят из 8-12, предпочтительно из 9-10 аминокислот, например, с использованием программы прогнозирования возможности связывания HLA пептидов (HLA Peptide Binding Predictions) (http://bimas.dcrt.nih.gov/molbio/hla_bind/index.html) в разделе биоинфораматики и молекулярного анализа (Bioinformatics & Molecular Analysis Selection (BIMAS)), для скрининга пептидов, которые могут представлять собой пептиды эпитопов. Более конкретно, полипептид, состоящий не менее чем из 7 последовательных аминокислот на участке аминокислот l-34 или аминокислот 52-75 в аминокислотной последовательности SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, является предпочтительным и применительно к полипептиду с последовательностью SEQ ID NO: 3 полипептиды с последовательностями SEQ ID NO: 108-117 являются более предпочтительными.
[0047]
Полипептид (b) является таким же полипептидом, что и полипептид (a), за исключением того, что небольшое число аминокислотных остатков в нем было замещено, делетировано, добавлено и/или встроено, и этот полипептид характеризуется идентичностью по аминокислотной последовательности на уровне не менее чем 80%, предпочтительно не менее чем 90%, более предпочтительно не менее чем 95%, еще предпочтительно не менее чем 98%, не менее чем 99% или не менее чем 99,5% относительно исходной последовательности, и указанный полипептид обладает иммуноиндуцирующей активностью. В данной области хорошо известны случаи, когда белковый антиген сохраняет по существу такие же антигенные или иммуногенные свойства, что и исходный белок, даже если аминокислотная последовательность белка была модифицирована за счет замещения, делетирования, добавления и/или встраивания небольшого количества аминокислот. В этой связи, поскольку полипептид (b) может также демонстрировать иммуноиндуцирующую активность, он может использоваться для получения иммуноиндуцирующего средства по настоящему изобретению. Кроме того, предпочтительно, полипептид (b) также является таким же полипептидом, что и полипептид с аминокислотной последовательностью SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, за исключением того, что один или несколько аминокислотных остатков в нем замещены, делетированы, добавлены и/или встроены.
[0048]
В контексте настоящего описания термин «идентичность последовательности» применительно к аминокислотным последовательностям или к последовательностям оснований обозначает параметр, рассчитанный при выравнивании двух сравниваемых аминокислотных последовательностей (или последовательностей оснований), так чтобы число спариваемых аминокислотных остатков (или оснований) между аминокислотными последовательностями (последовательностями оснований) стало максимальным, с последующим делением количества спариваемых аминокислотных остатков (или количества спариваемых оснований) на общее количество аминокислотных остатков (или на общее количество оснований), и это значение будет представлять собой процент идентичности (%). При проведении выравнивания один или несколько пропусков (гэпов) встраивают в одну или в обе сравниваемые последовательности при необходимости. Такое выравнивание последовательностей может быть проведено с использованием известной программы, такой как BLAST, FASTA или CLUSTAL W (Karlin and Altschul, Proc. Natl. Acad. Sci. U.S.A., 87:2264-2268, 1993; Altschul et al., Nucleic Acids Res., 25:3389-3402, 1997). Когда один или несколько пропусков (гэпов) встраивают, указанное выше общее количество аминокислотных остатков (или общее количество оснований), рассчитывают при рассмотрении одного пропуска как одного аминокислотного остатка (или основания). В том случае, когда рассчитанное таким образом общее количество аминокислотных остатков (или остатков оснований) различается между двумя сравниваемыми последовательностями, идентичность (%) рассчитывается при делении количества спариваемых аминокислотных остатков (или оснований) на общее количество аминокислотных остатков (или общее количество оснований) в более длинной последовательности.
[0049]
При проведении замещений аминокислотных остатков предпочтительны консервативные замещения аминокислотных остатков. 20 типов аминокислот, составляющих природные белки, могут быть распределены по группам, обладающим сходными свойствами, например, по группам, которые включают нейтральные аминокислоты, содержащие боковые цепи с низкой полярностью (Gly, Ile, Val, Leu, Ala, Met, Pro), нейтральные аминокислоты, содержащие гидрофильные боковые цепи (Asn, Gln, Thr, Ser, Tyr, Cys), кислые аминокислоты (Asp, Glu), основные аминокислоты (Arg, Lys, His) и ароматические аминокислоты (Phe, Tyr, Trp, His). Известно, что в большинстве случаев замещения аминокислот в пределах одной и той же группы, т.е. консервативные замещения, не меняют свойства полипептида. В этой связи, в тех случаях, когда один или несколько аминокислотных остатков в полипептиде (а) по настоящему изобретению подвергают замещению, вероятность сохранения иммуноиндуцирующей активности может быть повышена при проведении указанного(ых) замещения(ий) в пределах одной группы.
[0050]
Полипептид (c) включает полипептид (a) или (b) в качестве своей частичной последовательности и обладает иммуноиндуцирующей активностью. Таким образом, полипептид (c) содержит одну или несколько других аминокислот или один или несколько других полипептидов, добавленных на одном конце или на обоих концах полипептида (a) или (b), и обладает иммуноиндуцирующей активностью. Такой полипептид может также использоваться для получения иммуноиндуцирующего средства по настоящему изобретению.
Описанные выше полипептиды могут быть синтезированы, например, методом химического синтеза, таким как Fmoc метод (метод с использованием флуоренилметилоксикарбонила) или tBoc метод (метод с использованием трет-бутилоксикарбонила). Кроме того, они могут быть синтезированы в рамках традиционных методик с использованием различных типов коммерчески доступных пептидных синтезаторов. Дополнительно, представляющие интерес полипептиды могут быть также получены с использованием известных технологий генной инженерии, путем получения полинуклеотида, кодирующего указанный выше полипептид, и включения данного полипептида в вектор экспрессии, который затем трансфицируют в клетку-хозяина, что приводит к продукции указанного полипептида в клетке-хозяине.
[0051]
Полинуклеотид, кодирующий указанный выше полипептид, может быть легко получен по известной генноинженерной технологии или по традиционному способу с использованием коммерчески доступного синтезатора нуклеиновых кислот. Так, например, ДНК с последовательностью оснований SEQ ID NO: 4 может быть получена при проведении ПЦР с использованием библиотеки хромосомных ДНК или кДНК собаки в качестве матрицы и пары праймеров, разработанных таким образом, чтобы последовательность оснований SEQ ID NO: 4 могла быть амплифицирована. В случае ДНК с последовательностью оснований SEQ ID NO:1 такая ДНК может быть получена аналогичным образом с использованием библиотеки хромосомной ДНК или кДНК человека, взятой в качестве матрицы. Условия для проведения процедур ПЦР могут быть установлены соответствующим образом, и подходящие примеры таких условий включают без ограничения повторение реакций при температуре 94°C в течение 30 секунд (денатурация), при температуре 55°C в течение 30 секунд - 1 минуты (отжиг) и при температуре 72°C в течение 2 минут (расширение) в ходе, например, 30 циклов с последующим проведением реакции при температуре 72°C в течение 7 минут. Способы, условия и аналогичные характеристики для проведения ПЦР описаны, например, в работе Ausubel et al., Short Protocols in Molecular Biology, 3rd ed., A compendium of Methods from Current Protocols in Molecular Biology (1995), John Wiley & Sons (в частности, Chapter 15). Кроме того, желательная ДНК может быть выделена при получении одного или нескольких соответствующих зондов или праймеров на основе имеющейся информации о последовательности оснований и аминокислотной последовательности, показанных в SEQ ID NO: 1-95 в прилагаемом списке последовательностей, при последующем скрининге библиотеки кДНК из человека, собаки, быка или аналогичного источника с использованием соответствующих одного или нескольких зондов или праймеров. Библиотеку кДНК предпочтительно получают из клетки, органа или ткани, которые экспрессируют белок с последовательностью SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95. Описанные выше операции, такие как получение одного или нескольких зондов или праймеров, конструирование библиотеки кДНК, скрининг библиотеки кДНК и клонирование нужного гена, известны специалистам в данной области и могут быть осуществлены по способам, описанным, например, в работах Sambrook et al., Molecular Cloning, Second Edition, Current Protocols in Molecular Biology (1989); и Ausubel et al. (приведена выше). Из полученных таким образом ДНК может быть получена ДНК, кодирующая полипептид (a). Далее, поскольку известны кодоны, кодирующие каждую аминокислоту, может быть легко определена последовательность оснований полинуклеотида, кодирующего конкретную аминокислотную последовательность. Соответственно, последовательности оснований полинуклеотидов, кодирующих полипептид (b) и полипептид (c), могут быть легко определены, и такие полинуклеотиды могут быть без труда синтезированы с использованием коммерчески доступного синтезатора нуклеиновых кислот по известному способу.
[0052]
Природа клеток-хозяев не ограничена, главное, чтобы они экспрессировали описанный выше полинуклеотид, и их примеры включают без ограничения прокариотические клетки, такие как E. coli, и эукариотические клетки, такие как культура клеток из млекопитающих, включая клетки почки обезьяны COS 1, клетки яичника китайского хомяка CHO, клеточную линию эмбриональной почки человека HEK293 и клеточную линию эмбриональных клеток кожи мыши NIH3T3; клетки почкующихся дрожжей, клетки делящихся дрожжей; клетки тутового шелкопряда и яйца Xenopus laevis.
[0053]
В тех случаях, когда в качестве клеток-хозяев используют прокариотические клетки, используют вектор экспрессии с ориджином репликации, который позволяет осуществлять их репликацию в прокариотической клетке, а также соответствующие промотор, сайт связывания рибосом, сайт множественного клонирования, терминатор, ген лекарственной устойчивости, ген, восполняющий нужный питательный комплемент, и/или т.п. Примеры векторов экспрессии для E. coli включают систему pUC, pBluescriptII, систему экспрессии pET и систему экспрессии pGEX. При включении ДНК, кодирующей указанный выше полипептид, в такой вектор экспрессии и при трансформации прокариотических клеток-хозяев таким вектором, с последующим культивированием полученных трансформантов, в прокариотических клетках-хозяевах может быть экспрессирован полипептид, кодируемый данной ДНК. В ходе этого процесса полипептид может быть также синтезирован в виде белка слияния с другим белком (например, с зеленым флуоресцентным белком (GFP) или с глютатион-S-трансферазой (GST)).
[0054]
В тех случаях, когда в качестве клеток-хозяев используют эукариотические клетки, в качестве вектора экспрессии используют вектор экспрессии для эукариотических клеток, содержащий соответствующие промотор, сайт сплайсинга, сайт добавления поли(А) фрагмента и/или т.п. Примеры такого вектора экспрессии включают Pka1, pCDM8, pSVK3, pMSG, pSVL, pBK-CMV, pBK-RSV, EBV вектор, pRS, pcDNA3, pMSG и pYES2. Аналогично, при включении ДНК, кодирующей указанный полипептид, в такой вектор экспрессии и при трансформации эукариотических клеток-хозяев указанным вектором с последующим культивированием полученных трансформантов, в эукариотических клетках-хозяевах может быть синтезирован полипептид, кодируемый такой ДНК. В тех случаях, когда в качестве вектора экспрессии используют pIND/V5-His, pFLAG-CMV-2, pEGFP-N1, pEGFP-C1 или т.п., указанный выше полипептид может быть синтезирован в виде белка слияния, где к молекуле добавляется метка, такая как His метка (например, (His)6-(His)10), FLAG метка, myc метка, HA или GFP метка.
[0055]
Для введения вектора экспрессии в клетки-хозяева могут быть использованы такие известные способы, как электропорация, способ с применением фосфата кальция, способ на основе образования липосом, способ с применением ДЭАЭ-декстрана и микроинъекция.
[0056]
Выделение и очистка нужного полипептида из клеток-хозяев могут быть проведены при сочетании известных операций выделения. Примеры известных процедур выделения включают без ограничения обработку денатурирующим средством, таким как мочевина, или поверхностно-активным веществом, ультразвуковую обработку, ферментативное расщепление, высаливание или фракционное осаждение растворителем, диализ, центрифугирование, ультрафильтрацию, гель-фильтрацию, электрофорез в ДСН ПААГ, изоэлектрофокусирование, ионообменную хроматографию, гидрофобную хроматографию, аффинную хроматографию и хроматографию с обращением фаз.
[0057]
Полипептиды, полученные по указанному выше способу, включают, как указывалось выше, полипептиды, представленные в форме белка слияния с другим произвольно выбранным белком. Примеры таких полипептидов включают белки слияния с глютатион-S-трансферазой (GST) и с His меткой. Такой полипептид в форме белка слияния также включается в область настоящего изобретения как полипептид (c). Кроме того, в некоторых случаях полипептид, экспрессированный в трансформированной клетке после его трансляции, модифицируется в указанной клетке различными путями. Такой полипептид, модифицированный после его трансляции, также входит в область настоящего изобретения, при условии что он обладает иммуноиндуцирующей активностью. Примеры такой пост-трансляционной модификации включают удаление N-концевого метионина, N-концевое ацетилирование, гликозилирование, ограниченное разложение внутриклеточной протеазой, миристоилирование, изопренилирование и фосфорилирование.
[0058]
ИММУНОИНДУЦИРУЮЩЕЕ СРЕДСТВО
Как будет подробно описано в приведенных ниже примерах, указанный полипептид с иммуноиндуцирующей активностью может вызвать регрессию уже существующей опухоли при введении его животному с опухолью. В этой связи иммуноиндуцирующее средство по настоящему изобретению может использоваться как терапевтическое и/или профилактическое средство в случае рака.
[0059]
Термины «рак» и «злокачественная опухоль», используемые в настоящем описании, обозначают злокачественное новообразование и используются взаимозаменяемо.
[0060]
В этом случае подлежащие лечению виды рака включают те виды рака, при которых экспрессируется ген CD179b, такие как те виды рака, при которых экспрессируется ген, кодирующий полипептид SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, предпочтительно рак молочной железы, лейкоз или лимфому. Примеры указанных конкретных видов рака включают без ограничения рак молочной железы (рак молочной железы, комбинированный рак молочной железы, смешанная злокачественная опухоль молочной железы, внутрипроточная папиллярная аденокарцинома и т.п.), лейкозы (хронический лимфолейкоз и т.п.), лимфомы (лимфома желудочно-кишечного тракта, лимфома органа пищеварения, мелкоклеточная/среднеклеточная лимфома и т.п.).
[0061]
Описанный выше полипептид или рекомбинантный вектор, включающий полинуклеотид, кодирующий указанный полипептид и способный экспрессировать указанный полипептид in vivo, может использоваться в рамках способа терапии, направленного на стимуляцию иммунитета. Кроме того, он может использоваться в составе терапевтического способа с целью терапии/профилактики рака у животного, а также может использоваться в рамках терапевтического способа, который включает также усиливающее иммунитет средство.
[0062]
Животное по настоящему изобретению представляет собой млекопитающее, такое как примат, комнатное животное, домашнее животное или животное, используемое в спортивных состязаниях, предпочтительно человек, собака или кошка.
[0063]
Способ введения иммуноиндуцирующего средства по настоящему изобретению в живой организм может включать пероральное введение или парентеральное введение и, предпочтительно, парентеральное введение, такое как внутримышечное введение, подкожное введение, внутривенное введение или внутриартериальное введение. В тех случаях, когда указанное иммуноиндуцирующее средство используют для лечения рака, это средство может вводиться в региональный лимфатический узел вблизи опухоли, подлежащей лечению, как будет описано ниже в примерах, с тем чтобы усилить его противораковую активность. Вводимая доза может представлять собой любую дозу, главное, чтобы эта доза была эффективна для целей индукции иммунитета, и, например, в тех случаях, когда указанное средство используют для лечения и/или профилактики рака, эта доза может быть эффективна для лечения и/или профилактики рака. Кроме того, эта доза может варьировать в зависимости от веса тела, пола (мужской или женский пол), симптомов заболевания и т.п. Доза, эффективная для лечения и/или профилактики рака, может быть соответствующим образом выбрана в зависимости от размера опухоли, симптомов и т.п., и обычно составляет от 0,0001 мкг до 1000 мкг, предпочтительно от 0,001 мкг до 1000 мкг, в расчете на подлежащее лечению животное в день, и эта доза может вводиться один или несколько раз. Указанное средство предпочтительно вводится несколько раз в режиме, варьирующем от 1 раза в несколько дней до 1 раза в несколько месяцев.
[0064]
Как будет конкретно описано в приведенных ниже примерах, иммуноиндуцирующее средство по настоящему изобретению может вызвать снижение или регрессию уже имеющейся опухоли. В этой связи, поскольку данное средство может проявлять свою противораковую активность также против небольшого количества раковых клеток на ранней стадии, развитие или рецидив рака может быть предупрежден при использовании этого средства еще до развития рака или после проведенной терапии рака. Соответственно, иммуноиндуцирующее средство по настоящему изобретению является эффективным как для лечения, так и для профилактики рака.
[0065]
Иммуноиндуцирующее средство по настоящему изобретению может содержать только полипептид или может быть изготовлено при объединении с соответствующей добавкой, такой как фармацевтически приемлемый носитель, разбавитель или наполнитель, подходящей для соответствующего способа введения. Способы изготовления композиций и природа добавок, которые могут при этом использоваться, хорошо известны специалистам в области фармацевтики, и могут использоваться любой из таких способов, а также любая такая добавка. Конкретные примеры добавок включают без ограничения разбавители, такие как физиологические буферные растворы, носители, такие как сахароза, лактоза, кукурузный крахмал, фосфат кальция, сорбит и глицин, связующие вещества, такие как сироп, желатин, аравийская камедь, сорбит, поливинилхлорид и трагакант, и замасливатели, такие как стеарат магния, полиэтиленгликоль, тальк и силикагель. Примеры соответствующей композиции включают пероральные препараты, такие как таблетки, капсулы, гранулы, порошки и сиропы, а также парентеральные препараты, такие как ингаляционные средства, растворы для инъекций, суппозитории и растворы. Эти композиции могут быть изготовлены по стандартным, хорошо известным способам производства.
[0066]
Иммуноиндуцирующее средство по настоящему изобретению может использоваться в сочетании со средством, усиливающим иммунитет, которое способно усиливать иммунный ответ в живом организме. Указанное усиливающее иммунитет средство может входить в состав иммуноиндуцирующего средства по настоящему изобретению или может вводиться в виде отдельной композиции пациенту в сочетании с иммуноиндуцирующим средством по настоящему изобретению.
[0067]
Согласно настоящему описанию указанный пациент представляет собой животное, в особенности млекопитающее, и предпочтительно представляет собой человека, собаку или кошку.
[0068]
Примеры средства, усиливающего иммунитет, включают адъюванты. Адъюванты могут усиливать иммунный ответ за счет создания резервуара антигенов (за пределами клетки или в макрофагах), активирующих магрофаги и стимулирующих специфические объединения лимфоцитов, усиливая тем самым иммунный ответ и, соответственно, противораковое действие. В этой связи, особенно в тех случаях, когда иммуноиндуцирующее средство по настоящему изобретению используется для лечения и/или профилактики рака, иммуноиндуцирующее средство предпочтительно включает адъювант в дополнение к описанному выше полипептиду в качестве эффективного ингредиента. Может использоваться множество типов адъювантов, хорошо известных в данной области. Конкретные примеры адъювантов включают MPL (SmithKline Beecham) и гомологи липополисахарида RE 595 из Salmonella minnesota, получаемые после очистки и кислотного гидролиза липополисахарида, QS21 (SmithKline Beecham), чистый сапонин QA-21, выделенный и очищенный из экстракта Quillja saponaria; DQS21, описанный в WO96/33739 (SmithKline Beecham); QS-7, QS-17, QS-18 и QS-L1 (So et al., «Molecules and cells», 1997, Vol. 7, p. 178-186); неполный адъювант Фрейнда, полный адъювант Фрейнда, витамин Е, монтанид, глинозем, CpG-олигонуклеотиды (описанные, например, в работе Kreig et al., Nature, Vol. 374, p. 546-549), поли-I:C и их производные (например, поли ICLC) и различные эмульсии типа эмульсия вода-в-масле, полученные из биодеградируемых масел, таких как сквален и/или токоферол. Среди них предпочтительными являются неполный адъювант Фрейнда, монтанид, поли-I:C и их производные, а также CpG-олигонуклеотиды. Соотношение при смешивании описанного выше адъюванта и полипептида в типичном случае составляет от 1:10 до 10:1, предпочтительно от 1:5 до 5:1, более предпочтительно 1:1. Однако используемый адъювант не ограничивается описанными выше примерами, и могут использоваться другие, известные в данной области адъюванты, отличные от указанных выше (см., например, Goding, «Monoclonal Antibodies: Principles and Practice, 2nd edition», 1986), в том случае, когда вводится иммуноиндуцирующее средство по настоящему изобретению. Способы получения смесей или эмульсий полипептида и адъюванта известны специалистам в области получения и использования вакцин.
[0069]
Кроме того, в дополнение к описанным выше адъювантам могут использоваться факторы, которые стимулируют иммунный ответ у субъекта, в качестве описанных выше средств, усиливающих иммунитет. Так, например, в качестве средства, усиливающего иммунитет, могут использоваться различные цитокины, обладающие способностью стимулировать лимфоциты и/или антигенпрезентирующие клетки, в сочетании с иммуноиндуцирующим средством по настоящему изобретению. Специалистам в данной области известно множество таких цитокинов, которые способны усиливать иммунный ответ, и их примеры включают без ограничения интерлейкин-12 (IL-12), ГМ-КСФ, IL-18, интерферон-α, интерферон-β, интерферон-ω, интерферон-γ и лиганд Flt3, которые, как было показано, усиливают профилактическое действие вакцин. Такие факторы могут также использоваться в качестве описанного выше средства, усиливающего иммунитет, и могут входить в состав иммуноиндуцирующего средства по настоящему изобретению или могут изготавливаться в виде отдельной композиции, используемой в сочетании с иммуноиндуцирующим средством по настоящему изобретению, которое вводится пациенту.
[0070]
Антигенпрезентирующие клетки
Как будет подробно описано в приведенных ниже примерах, при контакте указанного выше полипептида по настоящему изобретению с антигенпрезентирующими клетками in vitro указанные антигенпрезентирующие клетки могут быть получены таким образом, чтобы они представляли полипептид. Иными словами, описанные выше полипептиды (a)-(c) могут использоваться в качестве средств, оказывающих воздействие на антигенпрезентирующие клетки. Примеры антигенпрезентирующих клеток включают дендритные клетки и В-клетки, а также дендритные клетки и В-клетки, содержащие молекулы главного комплекса совместимости тканей (MHC) класса I, которые являются наиболее предпочтительными для применения. Средства, применимые для воздействия на антигенпрезентирующие клетки, включают средства пульсовой обработки антигенпрезентирующих клеток и, поскольку полученные после пульсовой обработки антигенпрезентирующие клетки могут обладать способностью стимулировать лимфоциты периферической крови, эти клетки могут использоваться в качестве вакцины.
[0071]
Были идентифицированы хорошо известные в настоящее время различные молекулы, входящие в главный комплекс совместимости тканей (MHC) класса I. Молекулы MHC класса в организме человека получили название HLA. Примеры молекул HLA класса I включают HLA-A, HLA-B и HLA-C, более конкретно HLA-A1, HLA-A0201, HLA-A0204, HLA-A0205, HLA-A0206, HLA-A0207, HLA-A11, HLA-A24, HLA-А31, HLA-A6801, HLA-B7, HLA-B8, HLA-B2705, HLA-B37, HLA-Cw0401 и HLA-Cw0602.
[0072]
Дендритные клетки или В-клетки, содержащие молекулы MHC класса I, могут быть получены из периферических клеток крови по известному методу. Например, опухолеспецифические дендритные клетки могут быть индуцированы с использованием индуцирующих дендритных клеток из костного мозга, крови из пупочного канатика или периферической крови пациента с использованием гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) и IL-3 (или IL-4) с последующим добавлением в культуральную систему пептида, относящего к опухоли.
[0073]
При введении эффективного количества таких дендритных клеток может быть индуцирован желательный для лечения рака ответ. В качестве используемых при этом клеток может быть взят костный мозг или кровь из пупочного канатика у здорового индивидуума или из костного мозга, периферической крови или т.п. у самого пациента. В том случае, когда используются аутологичные клетки пациента, может быть достигнута высокая безопасность и можно избежать серьезных побочных эффектов. Периферическая кровь или костный мозг могут представлять собой свежевыделенный образец, образец, используемый после охлаждения, или замороженный образец. В случае периферической крови может культивироваться цельная кровь или могут быть отделены с последующим культивированием только лейкоцитарные компоненты и последний способ является эффективным и в этой связи предпочтительным. Кроме того, из лейкоцитарных компонентов могут быть выделены мононуклеарные клетки. В тех случаях, когда указанные клетки взяты из костного мозга или крови пупочного канатика, может проводиться культивирование цельных клеток, составляющих костный мозг, или из них могут быть выделены мононуклеарные клетки с последующим культивированием. Периферическая кровь и ее лейкоцитарные компоненты, а также клетки костного мозга содержат мононуклеарные клетки, гематопоэтические стволовые клетки и незрелые дендритные клетки, из которых затем развиваются дендритные клетки, а также CD4-положительные клетки и т.п. В том случае, когда используют цитокин, соответствующий способ его получения не ограничивается, и может использоваться природный или рекомбинантный цитокин при условии подтверждения его безопасности и физиологической активности. Предпочтительно, используется препарат с гарантированным качеством для медицинского использования в минимально необходимом количестве. Концентрация одного или нескольких добавляемых цитокинов не ограничивается, при условии что индуцируются дендритные клетки, и обычно общая концентрация одного или нескольких цитокинов составляет предпочтительно примерно 10-1000 нг/мл, более предпочтительно примерно 20-500 нг/мл. Культивирование может проводиться с использованием известной среды, которую обычно применяют для культивирования лейкоцитов. Температура культивирования не ограничивается, главное, чтобы достигалась пролиферация лейкоцитов, и наиболее предпочтительной является температура примерно 37°C, то есть температура тела человека. Атмосферная среда в ходе культивирования не ограничивается, главное, чтобы достигалась пролиферация лейкоцитов и предпочтительно, чтобы имелся поток 5% CO2. Длительность культивирования не ограничивается, главное, чтобы при этом индуцировалось необходимое число клеток, и обычно составляет от 3 дней до 2 недель. Что касается устройств, используемых для выделения и культивирования таких клеток, то в основном применяют такую подходящую для данных целей аппаратуру, для которой была подтверждена безопасность ее применения в медицинских условиях, и где проводимые операции являются стабильными и простыми. В частности, в том, что касается аппарата для культивирования клеток, то не только обычно используемые резервуары и сосуды, такие как чашка Петри, колба и бутыль, но могут также использоваться такие устройства, как резервуар слоистого типа, многокамерный резервуар, роллер-флакон, флакон для центрифугирования, резервуар для культивирования типа мешка, колонка с полыми волокнами и т.п.
[0074]
Приведение в контакт описанного выше пептида с антигенпрезентирующими клетками in vitro может осуществляться по хорошо известному методу. Например, этот контакт может быть достигнут при культивировании антигенпрезентирующих клеток в культуральной среде, содержащей описанный выше полипептид. Концентрация пептида в среде не ограничивается и обычно составляет примерно 1 мкг/мл - 100 мкг/мл, предпочтительно примерно 5 мкг/мл - 20 мкг/мл. Плотность клеток в ходе культивирования не ограничивается и обычно составляет примерно 103 клеток/мл - 107 клеток/мл, предпочтительно примерно 5×104 клеток/мл - 5×106 клеток/мл. Культивирование может проводиться по стандартному методу и предпочтительно проводится при температуре 37°C в атмосфере 5% CO2. Максимальная длина пептида, который может представляться на поверхности антигенпрезентирующих клеток, обычно составляет примерно 30 аминокислотных остатков. В этой связи, в тех случаях, когда антигенпрезентирующие клетки приводятся в контакт с полипептидом in vitro, указанный полипептид может быть получен таким образом, чтобы его длина не превышала примерно 30 аминокислотных остатков, хотя его длина не ограничивается.
[0075]
При культивировании антигенпрезентирующих клеток вместе с описанным выше полипептидом, указанный полипептид включается в молекулы MHC среди антигенпрезентирующих клеток и представляется на поверхности антигенпрезентирующих клеток. В этой связи при использовании описанного выше полипептида могут быть получены изолированные антигенпрезентирующие клетки, содержащие комплекс, образованный между полипептидом и молекулами MHC. Такие антигенпрезентирующие клетки могут представлять полипептид против Т-клеток in vivo или in vitro, и в этой связи индуцировать цитотоксичные Т-клетки, специфичные для полипептида, и способствовать их пролиферации.
[0076]
При контактировании антигенпрезентирующих клеток, полученных согласно приведенному выше описанию, которые содержат комплекс между описанным выше полипептидом и молекулами MHC, с Т-клетками in vitro могут быть индуцированы цитотоксичные Т-клетки, специфичные для полипептида, с последующей их пролиферацией. Это может быть достигнуто при совместном культивировании описанных выше антигенпрезентирующих клеток и Т-клеток в жидкой среде. Например, это может быть достигнуто при суспендировании антигенпрезентирующих клеток в жидкой среде, помещении суспензии в резервуары, такие как лунки микропланшета, при добавлении в них Т-клеток и с последующим культивированием. Соотношение при смешивании антигенпрезентирующих клеток и Т-клеток при их совместном культивировании не ограничивается и обычно составляет примерно от 1:1 до 1:100, предпочтительно примерно от 1:5 до 1:20, применительно к соотношению числа клеток. Плотность антигенпрезентирующих клеток, суспендируемых в жидкой среде, не ограничивается и обычно составляет примерно 100-10000000 клеток/мл, предпочтительно примерно 10000-1000000 клеток/мл. Совместное культивирование предпочтительно проводят при температуре 37°C в атмосфере 5% CO2, согласно стандартной методике. Время культивирования не ограничивается и обычно составляет от 2 дней до 3 недель, предпочтительно, примерно от 4 дней до 2 недель. Совместное культивирование предпочтительно ведется в присутствии одного или нескольких интерлейкинов, таких как IL-2, IL-6, IL-7 и/или IL-12. В этом случае концентрация IL-2 и IL-7 обычно составляет примерно 5 Ед/мл - 20 Ед/мл, концентрация IL-6 обычно составляет примерно 500 Ед/мл - 2000 Ед/мл и концентрация IL-12 обычно составляет примерно 5 нг/мл - 20 нг/мл, хотя концентрация интерлейкинов не ограничивается. В настоящем описании сокращение «Ед» обозначает единицу активности. Указанное выше совместное культивирование может повторяться от одного до нескольких раз при добавлении свежих суспензий антигенпрезентирующих клеток. Так, например, процедура удаления клеточного супернатанта после совместного культивирования и добавления свежей суспензии антигенпрезентирующих клеток для дальнейшего совместного культивирования может повторяться от одного до нескольких раз. Условия каждого из этапов совместного культивирования могут быть такими же, как было описано выше.
[0077]
При проведении описанного выше совместного культивирования достигается индукция и пролиферация цитоксичных Т-клеток, специфичных для полипептида. Таким образом, при использовании описанного выше полипептида могут быть получены изолированные Т-клетки, которые селективно связываются с комплексом между полипептидом и молекулой MHC.
[0078]
Как будет описано в приведенных ниже примерах, гены, кодирующие полипептиды с последовательностями SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 и 95, экспрессируются специфически в клетках рака молочной железы, лейкозных клетках и клетках лимфомы. В этой связи следует полагать, что в клетках этих видов рака существует значительно большее количество полипептида в SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 и 95, чем в нормальных клетках. Когда цитотоксичные Т-клетки, полученные по описанной выше процедуре, вводят в живой организм, то, поскольку часть полипептидов, имеющихся в раковых клетках, представляются на молекулах MHC на поверхностях раковых клеток, цитотоксичные Т-клетки могут повреждать раковые клетки, в случае использования представленных полипептидов в качестве маркеров. Поскольку антигенпрезентирующие клетки, представляющие указанные выше полипептиды, могут индуцировать и цитотоксичные Т-клетки, специфичные для полипептида, также in vivo и способствовать их пролиферации, то раковые клетки могут повреждаться также при введении антигенпрезентирующих клеток в живой организм. Иными словами, цитотоксичные Т-клетки и антигенпрезентирующие клетки, полученные с использованием указанного полипептида, так же эффективны, как и терапевтические и/или профилактические средства, применяемые при раке, аналогично иммуноиндуцирующему средству по настоящему изобретению.
[0079]
В тех случаях, когда указанные выше выделенные антигенпрезентирующие клетки или выделенные Т-клетки вводят в живой организм, их предпочтительно получают при обработке антигенпрезентирующих клеток или Т-клеток, выделенных из организма пациента, который подлежит лечению, описанными выше полипептидами (a)-(c), с тем чтобы избежать иммунного ответа в живом организме, который атакует эти клетки как чужеродные тела.
[0080]
Терапевтическое и/или профилактическое средство для рака, включающее в качестве эффективного ингредиента антигенпрезентирующие клетки или Т-клетки, предпочтительно вводят парентеральным способом, таким как внутривенное или внутриартериальное введение. Доза подбирается соответствующим образом в зависимости от симптомов, цели введения и т.п. и обычно составляет от 1 клетки до 10000000000000 клеток, предпочтительно 1000000 клеток - 1000000000 клеток, где указанная доза предпочтительно вводится с частотой от одного раза в несколько дней до одного раза в несколько месяцев. Такая композиция может представлять собой, например, клетки, суспендированные в физиологическом буферном растворе, и эта композиция может использоваться в сочетании с другими, одним или несколькими, противораковыми препаратами и/или одним или несколькими цитокинами. Кроме того, могут быть введены одна или несколько добавок, известных в области создания фармацевтических препаратов.
[0081]
Генная вакцина
Кроме того, при экспрессии полинуклеотида, кодирующего полипептид (a)-(c) в организме животного по настоящему изобретению, может быть достигнута продукция антител и индукция цитотоксичных Т-клеток в живом организме, и, соответственно, эффект, сравнимый с таковым, получаемым в случае введения полипептида. Иными словами, иммуноиндуцирующее средство по настоящему изобретению может быть таким средством, которое включает в качестве своего эффективного ингредиента рекомбинантный вектор, содержащий полинуклеотид, кодирующий полипептид (a)-(c), где указанный рекомбинантный вектор способен экспрессировать данный полипептид в живом организме. Такой рекомбинантный вектор, способный экспрессировать антигенный полипептид, также носит название генная вакцина.
[0082]
Вектор, используемый для создания генной вакцины, не ограничен, главное, чтобы это был вектор, способный экспрессировать полипептид в клетке данного животного (предпочтительно в клетке млекопитающего), и может представлять собой либо плазмидный вектор, либо вирусный вектор, и при этом может использоваться любой известный в области создания генных вакцин вектор. Как указывалось выше, полинуклеотид, такой как ДНК или РНК, кодирующий описанный выше полипептид, может быть легко получен по известному методу. Включение полинуклеотида в вектор может быть осуществлено с использованием методики, известной специалистам в данной области.
[0083]
Способ введения генной вакцины предпочтительно представляет собой парентеральный способ и включает, например, внутримышечное, подкожное, внутривенное или внутриартериальное введение, вводимая при этом доза может быть соответствующим образом выбрана в зависимости от типа антигена и т.п., и обычно составляет примерно 0,1 мкг - 100 мг, предпочтительно примерно 1 мкг - 10 мг, применительно к весу генной вакцины на 1 кг веса тела.
[0084]
Методы с использованием вирусного вектора включают такие методы, в соответствии с которыми полинуклеотид, кодирующий описанный полипептид, включается в состав РНК вируса или ДНК вируса, такого как ретровирус, аденовирус, аденоассоциированный вирус, вирус герпеса, вирус осповакцины, поксвирус, полиовирус или вирус Синдбис, и затем животное инфицируют полученным вирусом. Среди этих методов особенно предпочтительными являются те методы, где используется ретровирус, аденовирус, аденоассоциированный вирус, вирус осповакцины или т.п.
[0085]
Примеры других способов включают способ, в соответствии с которым плазмиду экспрессии непосредственно вводят внутримышечно (способ на основе ДНК-вакцины), липосомный способ, способ с использованием липофектина, способ микроинъекции, способ с использованием фосфата кальция и способ на основе электропорации, и особенно предпочтительным является способ на основе ДНК-вакцины и липосомный способ.
[0086]
Методы создания гена, кодирующего описанный выше пептид, используемый согласно настоящему изобретению, работают как фармацевтические и включают способ воздействия in vivo, когда ген непосредственно трансфицируют в организм, как способ воздействия ex vivo, когда определенный вид клеток отбирают из организма животного и ген трансфицируют в клетки ex vivo с последующим возвращением клеток в организм (Nikkei Science, 1994, April, p. 20-45; The Pharmaceutical Monthly, 1994, Vol. 36, No. 1, p. 23-18; и содержащиеся в этих работах ссылки). Метод in vivo более предпочтителен.
[0087]
В тех случаях, когда ген вводят по методу in vivo, указанный ген может вводиться с использованием соответствующего способа введения, выбор которого определяется заболеванием, которое подлежит лечению, симптомами и т.п. Он может вводиться, например, внутривенным, внутриартериальным, подкожным, внутримышечными способами или т.п., или может непосредственно вводиться в пораженную зону, где имеется опухоль. В тех случаях, когда ген вводится по способу in vivo, такой ген может быть представлен в форме препарата, такого как раствор, и в основном он изготавливается в виде раствора для инъекций или т.п., где указанный раствор содержит ДНК, кодирующую описанный выше пептид по настоящему изобретению, в качестве эффективного ингредиента. В указанную композицию могут быть введены при необходимости обычно используемые один или несколько носителей. В том случае, когда используют липосому или липосому, слитую с мембраной (вирус Сендаи (HVJ)-липосома или т.п.), который содержит ДНК, указанная липосома может быть введена в состав липосомного препарата, такого как суспензия, замороженный препарат или замороженный препарат, концентрированный центрифугированием.
[0088]
Согласно настоящему изобретению термин «последовательность оснований SEQ ID NO: 1» включает не только ту последовательность оснований, явно приведенную в SEQ ID NO: 1, но также такую последовательность, которая ей комплементарна. Таким образом, термин «полинуклеотид с последовательностью оснований SEQ ID NO: 1» включает одноцепочечный полинуклеотид, имеющий последовательность оснований, соответствующую SEQ ID NO: 1, одноцепочечный полинуклеотид, имеющий последовательность оснований, комплементарную данной последовательности, и двухцепочечный полинуклеотид, состоящий из указанных одноцепочечных полинуклеотидов. В том случае, когда получают полинуклеотид, кодирующий полипептид, используемый в настоящем изобретении, может быть выбрана любая из указанных последовательностей оснований и любой специалист в данной области может легко осуществить такой выбор.
[0089]
Выявление рака
В способе выявления рака по настоящему изобретению экспрессию полипептида, используемого в настоящем изобретении, определяют с использованием образца, выделенного из живого организма. Способ определения уровня экспрессии полипептида с использованием образца включает такой способ, в соответствии с которым определяют антитело против полипептида, где указанное антитело, содержащееся в образце, определяют по результатам иммуноанализа (способ 1); по способу, согласно которому полипептид per se, содержащийся в образце, определяют по результатам иммуноанализа (способ 2); и способ, согласно которому измеряют уровень содержащейся в образце мРНК, которая кодирует полипептид (Method 3). В способе по настоящему изобретению экспрессия полипептида может быть определена с использованием любого из указанных трех способов. Согласно настоящему изобретению термин «измерение» применительно к содержащемуся уровню включает выявление, количественное определение и полуколичественное определение.
[0090]
В настоящем описании CD179b определяется как полипептид, который связывается с антителом (специфичным для рака антителом), который специфически присутствует в сыворотке, полученной от собаки с опухолью, который выявляют по методу SEREX с использованием сыворотки от больной собаки, для которой была получена библиотека кДНК тканей опухоли молочной железы собаки (см. пример 1). Иными словами, в живом организме собаки, имеющей опухоль, специфически индуцируется антитело против CD179b. Таким образом, при измерении уровня антитела против CD179b в живом организме, имеющем опухоль, может быть выявлен рак, экспрессирующий CD179b (см. пример 7). Кроме того, рак у собаки может быть также выявлен при измерении уровня CD179b в качестве антигена по описанному выше методу 2. Кроме того, поскольку, как будет показано ниже в примерах, мРНК, кодирующая антигенный полипептид, экспрессируется на значительно более высоком уровне при раке, особенно при раке молочной железы и в лейкозных клетках, чем в нормальных тканях (см. пример 1), рак собаки может быть также выявлен при измерении уровня мРНК. Известно, как отмечалось выше, что CD179b экспрессируется на поверхностях мембран клеток-предшественников В-клеток (пре-В-клетки), и в этой связи сообщалось, что CD179b экспрессируется в лейкозных клетках (пре-В-клеточный лейкоз), образованных при злокачественном перерождении пре-В-клеток, но тот факт, что лейкозные клетки, отличные от пре-В-клеточных лейкозных клеток, а также клетки рака молочной железы демонстрируют экспрессию CD179b, впервые был обнаружен авторами настоящего изобретения. Соответственно, выявление тех видов лейкоза, где клетки отличаются от клеток пре-В-клеточного лейкоза, а также выявление лимфомы и рака молочной железы, стало возможным при исследовании уровня экспрессии CD179b.
[0091]
Согласно способу 1 измерение уровня специфичных против рака антител, которые могут присутствовать в образце, может быть легко осуществлено в рамках иммуноанализа с использованием антигенного вещества, которое иммунологически взаимодействует с антителом. Иммуноанализ per se представляет собой стандартный способ, подробно описанный ниже. В качестве антигенного вещества, которое может использоваться в иммуноанализе, может быть взят полипептид (a)-(c). Поскольку антитела обладают перекрестной реактивностью, молекула может быть связана с антителом, которое было индуцировано против другого иммуногена, но при этом важно, чтобы молекула имела структуру, аналогичную эпитопу данного иммуногена. Например, полипептиды, обладающие высокой гомологией друг с другом по аминокислотной последовательности, зачастую содержат эпитопы с аналогичными структурами, и в таких случаях оба полипептида могут обладать одинаковой антигенностью. Как будет конкретно описано в приведенных ниже примерах, полученный из организма человека полипептид SEQ ID NO: 3 иммунологически взаимодействует с антителом, индуцированным в организме собаки с опухолью. В этой связи согласно способу 1 по настоящему изобретению может использоваться любой гомологичный фактор млекопитающего в качестве антигена для данного иммуноанализа.
[0092]
Антигенные вещества, имеющие большую молекулярную массу и сложную структуру, такие как белки, обычно имеют множество сайтов на своей поверхности с различными структурами. В этой связи такое антигенное вещество индуцирует множество видов антител, которые, соответственно, распознают каждый из сайтов в живом организме. Иными словами, антитело, индуцированное в живом организме против антигенного вещества, такого как белок, является поликлональным антителом, представляющим собой смесь разных видов антител. Следует отметить, что в тексте настоящего описания термин «поликлональное антитело» обозначает антитело, которое присутствует в сыворотке, полученной из живого организма, содержащего антигенное вещество, и которое было индуцировано в живом организме против антигенного вещества.
[0093]
Определение уровня антитела в образце может быть легко осуществлено по иммуноанализу с использованием в качестве антигена описанного выше полипептида. Иммуноанализы per se хорошо известны в данной области и включают, если проводить классификацию на основе типа реакции, сэндвич-метод, конкурентный метод, метод агглютинации, вестерн-блоттинг и т.п. При классификации на основе метки иммуноанализы включают радиоиммуноанализ, флуоресцентный иммуноанализ, энзиматический иммуноанализ, иммуноанализ с использованием биотина и т.п., и иммунологическое тестирование указанного выше антитела может быть проведено в рамках любого из указанных иммуноанализов. Хотя вид применяемого иммуноанализа не ограничен, сэндвич-ELISA метод и метод агглютинации являются предпочтительными для использования в качестве иммуноанализа для выявления антитела по настоящему изобретению, поскольку эти способы являются простыми и не требуют громоздкой аппаратуры. В тех случаях, когда в качестве метки для антитела используют фермент, фермент конкретно не ограничивается, главное, чтобы он удовлетворял определенным условиям, таким как возможность многократного использования, стабильность фермента, даже когда он связывается с антителом, возможность специфического окрашивания ферментом своего собственного субстрата и т.п. Например, могут использоваться те ферменты, которые используются в стандартном ферментативном иммуноанализе, такие как пероксидаза, β-галактозидаза, щелочная фосфатаза, глюкозооксидаза, ацетилхолинэстераза, глюкозо-6-фосфатдегидрогеназа и малатдегидрогеназа. Могут также использоваться ингибиторы ферментов, коэнзимы и т.п. Связывание этих ферментов с антителами может осуществляться по известному способу с использованием сшивающего средства, такого как малеимидное соединение. В качестве субстрата могут использоваться известные вещества, выбор которых зависит от вида используемого фермента. Так, например, в тех случаях, когда в качестве фермента применяют пероксидазу, может быть использован 3,3',5,5'-тетраметилбензидин, а в тех случаях, когда в качестве фермента используют щелочную фосфатазу, может быть использован пара-нитрофенол или т.п. В качестве радиоактивного изотопа могут быть использованы обычно применяемые в радиоиммуноанализах изотопы, такие какl25I или3H. В качестве флуоресцентного красителя используются красители, обычно применяемые в методах флуоресцентного выявления антител, такие как флуоресцеин-изотиоцианат (FITC), тетраметилродамин-изотиоцианат (TRITC) или т.п.
[0094]
Указанные иммуноанализы per se хорошо известны в данной области и нет необходимости рассматривать эти иммуноанализы в настоящем описании. Вкратце, можно отметить, что, например, в случае сэндвич-иммуноанализов указанный выше полипептид, используемый в качестве антигена, иммобилизуют на твердой фазе и затем подвергают реакции с образцом, таким как сыворотка. После промывки твердой фазы полученный продукт подвергают реакции с соответствующим вторичным антителом. После промывки твердой фазы определяют уровень вторичного антитела, связанного с твердой фазой. В способе выявления рака по настоящему изобретению предпочтительно иммобилизовать антигенный полипептид на твердой фазе, поскольку иммобилизация на твердой фазе упрощает удаление несвязанного вторичного антитела. В качестве вторичного антитела может быть использовано, например, IgG антитело против антигена собаки в тех случаях, когда образец получен от собаки. Уровень вторичного антитела, связанного с твердой фазой, может быть измерен при мечении вторичного антитела описанной выше меткой. Определенное таким образом количество вторичного антитела соответствует количеству указанного выше антитела в образце сыворотки. В тех случаях, когда в качестве метки используют фермент, количества антитела может быть измерено при добавлении субстрата, который разлагается под действием ферментативной активности с развитием окрашивания, и далее проводят оптическое измерение количества разложенного субстрата. В тех случаях, когда в качестве метки используют радиоактивный изотоп, уровень излучения, определяемый радиоактивным изотопом, может быть определен в сцинтилляционном счетчике или т.п.
[0095]
Согласно способу 2 по настоящему изобретению определяют количество полипептида с последовательностью SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, где указанный полипептид может содержаться в образце, полученном из живого организма. Как было описано выше, количество специфичного для рака антитела, которое иммунологически взаимодействуют с полипептидом, имеющим последовательность SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …., 93 или 95, или гомологичным фактором, значительно выше у раковых пациентов, указывая на продукцию полипептида или гомологичного фактора, который является антигеном для специфичного для рака антитела, значительно выше у раковых больных. В этой связи аналогично тому, что было описано выше для способа 1, рак в живом организме может быть выявлен при определении полипептида с последовательностью SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, или соответствующего гомологичного фактора.
[0096]
Определение уровня полипептида в образце может быть легко проведено с использованием известного иммуноанализа. В конкретном случае, например, полипептид с аминокислотной последовательностью SEQ ID NO: 3-95 или соответствующий гомологичный фактор, который имеется в образце, может быть определен при получении антитела или его антиген-связывающего фрагмента, которые иммунологически взаимодействуют с полипептидом, имеющим последовательность SEQ ID NO: 3-95, или с соответствующим гомологом, и затем проводят иммуноанализ с использованием полученного антитела или его фрагмента. Иммуноанализ per se представляет собой известный традиционный способ, описанный выше.
[0097]
Термин «антиген-связывающий фрагмент» в контексте настоящего описания обозначает фрагмент антитела, такой как Fab или F(ab')2 фрагмент, содержащийся в молекуле антитела, который обладает способностью связываться с антигеном. Хотя антитело может быть поликлональным либо моноклональным антителом, моноклональное антитело является предпочтительным для иммуноанализов и т.п., поскольку при этом достигается высокая воспроизводимость результатов. Способы получения поликлонального или моноклонального антитела с использованием полипептида в качестве иммуногена хорошо известны, так что такое получение может быть легко осуществлено по стандартному методу. Так, например, антитела против полипептида могут быть индуцированы путем иммунизации животного иммуногеном, полипептидом, конъюгированным с белком-носителем, таким как гемоцианин из лимфы улитки (KLH) или казеин, вместе с адъювантом. Далее, из иммунизированного животного выделяют антитело-продуцирующее клетки, такие как клетки селезенки или лимфоциты, с последующим слиянием их с миеломными клетками с получением гибридом. Среди гибридом выбирают гибридомы, продуцирующие антитело, которое связывается с полипептидом, имеющим последовательность SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95, или с соответствующим гомологичным фактором, и добиваются пролиферации, после чего моноклональное антитело, для которого соответствующий антиген представляет собой указанный выше белок, может быть выделено из культурального супернатанта. Описанный выше способ представляет собой стандартный, хорошо известный способ анализа.
[0098]
Согласно способу 3 по настоящему изобретению определяют уровень мРНК, кодирующей CD179b, которая может содержаться в образце, полученном из живого организма. Как будет более подробно описано в приведенных ниже примерах, уровень экспрессии мРНК, кодирующей CD179b, значительно выше в раковых клетках, в особенности в клетках рака молочной железы и лейкозных клетках. Соответственно, рак в живом организме может быть выявлен при измерении уровня мРНК в образце.
[0099]
Согласно способу выявления по настоящему изобретению определяют, имеет ли исследуемой живой организм рак, при оценке уровня экспрессии полипептида, проводимой по описанной выше процедуре. Хотя выявление рака может быть проведено просто путем определения уровня экспрессии полипептида в исследуемом живом организме, предпочтительно получить стандартное значение нормы при определении уровня экспрессии полипептида (количество антитела, полипептида или мРНК) в одном или нескольких образцах, взятых у здорового индивидуума, для целей сравнения результата, полученного в исследуемом живом организме, со стандартными для нормы значениями, с тем чтобы повысить точность диагностики. Для того чтобы дополнительно повысить указанную точность выявления, стандартные для случаев наличия рака значения могут быть получены при определении уровня экспрессии полипептида в образцах, полученных от ряда пациентов, у которых уже был диагностирован рак, для сравнения значения, полученного для исследуемого живого организма, с нормальными значениями и стандартными для рака значениями. Указанные выше стандартные значения могут быть определены при выражении уровня экспрессии полипептидов в каждом образце в определенных единицах с последующим расчетом среднего показателя. Нормальные и стандартные для рака значения могут быть определены до измерения уровня экспрессии полипептида у ряда здоровых индивидуумов и больных раком. Таким образом, при проведении сравнения полученной при измерении величины со стандартными значениями согласно способу настоящего изобретения указанные стандартные значения могут быть определены заранее.
[0100]
Способ выявления по настоящему изобретению может проводиться в сочетании со способом, в котором используются другие раковые антигены и/или маркеры рака, так что точность выявления рака может быть повышена.
[0101]
С использованием способа выявления по настоящему изобретению в живом организме могут быть обнаружены определенные виды рака. Способ по настоящему изобретению позволяет обнаруживать даже незаметную, малую опухоль или опухоль, которая имеется в глубинной части организма, и в этой связи данный способ используется для раннего выявления рака. Кроме того, при использовании способа выявления по настоящему изобретению, если его проводить применительно к пациенту на стадии наблюдения после противораковой терапии, можно выявить рецидив рака, если он имеется, на ранней стадии.
[0102]
Чем больше раковых клеток, экспрессирующих описанный выше полипептид, определяемых по настоящему изобретению, пролиферирует в живом организме с опухолью, тем больше в организме аккумулируется полипептидов и мРНК, кодирующих их, что вызывает повышение количества антител против указанных выше полипептидов в сыворотке. С другой стороны, чем меньше раковых клеток, тем ниже в живом организме количество аккумулированных полипептидов и кодирующих их мРНК, что, соответственно, вызывает снижение количества антител против указанных выше полипептидов в сыворотке крови. Таким образом, если уровень экспрессии описанного полипептида высокий, это может говорить о том, что имеют место рост опухоли и/или метастазы рака, то есть идет прогрессирование рака.
[0103]
Кроме того, как будет показано в приведенных ниже примерах, при сравнении одних и тех же видов опухолей, отмечается, что злокачественная опухоль продуцирует значительно большее количество антител, чем доброкачественная. В этой связи, если уровень экспрессии описанных полипептидов высокий, можно определить степень злокачественности опухоли. Таким образом, степень злокачественности опухоли может быть выявлена по способу настоящего изобретения.
[0104]
Кроме того, эффект противораковой терапии можно отслеживать по результатам оценки повышения или снижения экспрессии описанных полипептидов. В этой связи при наблюдении уровня экспрессии указанных выше полипептидов у индивидуума в ходе или после противораковой терапии, критерием для оценки того, насколько эффективным было введенное противораковое средство, или какая часть опухоли была оставлена в организме пациента после ее удаления, а также критерием для выявления метастаз и/или рецидива на максимально возможной ранней стадии, могут быть получены в процессе наблюдения. Соответствующая терапия рака приводит к снижению уровня экспрессии полипептидов в сравнении с результатами оценки состояния организма с опухолью до терапии. В таком случае следует полагать, что эффект терапии, который проводился (проводится) был/является хорошим. В тех случаях, когда уровень экспрессии полипептида повышается или остается постоянным или вначале снижается, а затем повышается, можно сделать вывод, что эффект терапии недостаточно хороший. Такое заключение может быть полезной основной для выбора метода лечения или привести, например, к решению об изменении способа лечения или об изменении дозы противоракового средства.
[0105]
Рак, который может быть выявлен по способу настоящего изобретения, включает те виды рака, которые экспрессируют CD179b (за исключением пре-B-клеточных опухолей), и их примеры включают без ограничения рак молочной железы, комбинированный рак молочной железы, смешанную злокачественную опухоль молочной железы, внутрипроточную папиллярную аденокарциному, лейкозы (предпочтительно, хронические лимфолейкозы, за исключением лейкозов пре-B-клеточного типа) и лимфому (предпочтительно, лимфому желудочно-кишечного тракта, лимфому органа пищеварения, мелкоклеточную/среднеклеточную лимфому, среднеклеточную лимфому и многоцентровую лимфому, за исключением лимфом пре-B-клеточного типа). Живые организмы, в отношении которых может быть применим способ по настоящему изобретению, включают млекопитающих, предпочтительно людей, собак и кошек.
[0106]
Образец, который подвергается анализу согласно способу настоящего изобретения, включает жидкости организма, такие как кровь, сыворотка, плазма, асциты и плевральные выпоты, ткани и клетки. В частности, в указанных выше способах 1 и 2 предпочтительно могут использоваться сыворотка, плазма, асциты и плевральный выпот. Образец ткани и клеточный образец предпочтительны в случае описанного выше способа 3, где измеряется уровень мРНК.
[0107]
Полипептид, используемый в качестве антигена в иммуноанализе по способу 1, может представлять собой реагент для выявления рака. Указанный реагент может состоять только из указанного выше полипептида или может содержать различные добавки, применяемые для стабилизации полипептида и т.п. Указанный реагент может быть также представлен в иммобилизованной форме на твердой фазе, такой как планшет или мембрана.
[0108]
Антитело или его антиген-связывающий фрагмент, которые(ый) иммунологически взаимодействуют с полипептидом SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, …, 93 или 95 или с соответствующим гомологичным фактором, которые(ый) используются для измерения полипептида или соответствующего его гомологичного фактора в иммуноанализе в способе 2, также может быть представлен в виде реагента для выявления рака. Указанный реагент может состоять только из указанного выше антитела или его антиген-связывающего фрагмента или может содержать различные добавки, применяемые для стабилизации антитела или его антиген-связывающего фрагмента и т.п. Указанные антитело или его антиген-связывающий фрагмент могут быть также представлены в конъюгированной форме с металлом, таким как марганец или железо. Поскольку такое конъюгированное с металлом антитело или его антиген-связывающий фермент накапливается в сайте, где имеется большое количество антигенного белка, при его введении в организм, то наличие раковых клеток, которые продуцируют антигенный белок, может быть выявлено при измерении уровня металла по методу MRI или т.п.
[0109]
Кроме того, указанный выше полипептид, применяемый для выявления рака при определении уровня мРНК по методу 3, может быть также включен в состав реагента для выявления рака. Указанный реагент для выявления рака может также состоять только из полинуклеотида или может содержать различные добавки, применяемые для стабилизации полинуклеотида и т.п. Полинуклеотид для выявления рака, содержащийся в реагенте, предпочтительно представляет собой праймер или зонд.
ПРИМЕРЫ
[0110]
Ниже настоящее изобретение будет описано более подробно с помощью примеров, которые никоим образом не ограничивают область настоящего изобретения.
[0111]
Пример 1: Получение нового ракового антигенного белка методом SEREX
(1) Создание библиотеки кДНК
Из полученной в ходе хирургического вмешательства ткани рака молочной железы собаки экстрагируют суммарную РНК по методу, включающему использование кислого гуанидия-фенола-хлороформа и проводят очистку поли(А)+ РНК с использованием набора для очистки мРНК Oligotex-dT30 (производство Takara Shuzo Co., Ltd.) по процедуре, описанной в прилагаемых инструкциях.
[0112]
С использованием полученной мРНК (5 мкг) синтезировали библиотеку кДНК фага на основе ткани рака молочной железы собаки. Создание библиотеки фаговой кДНК проводили с использованием набора для синтеза кДНК (ZAP-cDNA Synthesis Kit) и набора для клонирования кДНК (ZAP-cDNA Gigapack III Gold Cloning Kit) (производство компании STRATAGENE) в соответствии с процедурами, прилагаемыми к наборам. Размер полученной библиотеки фаговых кДНК составлял 2,99×105БОЕ/мл.
[0113]
(2) Скрининг библиотеки кДНК с использованием сыворотки
С использованием библиотеки фаговой кДНК, полученной из ткани рака молочной железы собаки согласно описанной выше процедуре, проводили иммунологический скрининг. Более конкретно, инфицировали клетки-хозяева E. coli (XL1-Blue MRF') с использованием библиотеки, так чтобы 2340 клонов включались в агарозу в планшете Φ90×15 мм NZY, с последующим культивированием при температуре 42°C в течение 3-4 часов до образования бляшек. Планшет закрывали нитроцеллюлозной мембраной (Hybond С Extra; производство компании GE Healthcare Bio-Science), пропитанной IPTG (изопропил-β-D-тиогалактозид), при температуре 37°C в течение 4 часов для индукции и экспрессии белков, что приводило к переносу белков на мембрану. После этого мембрану восстанавливали и погружали в TBS (10 мМ Трис-HCl, 150 мМ NaCl, pH 7,5) с добавкой 0,5% нежирного сухого молока и далее встряхивали при температуре 4°C в течение ночи для подавления неспецифической реакции. Указанный фильтр подвергали реакции с разбавленной в 500 раз сывороткой от больной собаки при комнатной температуре в течение 2-3 часов.
[0114]
Как было описано выше применительно к сыворотке больной собаки, использовали 3 образца сыворотки, которые брали у собак с удаленной раковой опухолью молочной железы. Кроме того, в этом эксперименте использовали также собаку с раком молочной железы. Сыворотки хранили при температуре -80°C и проводили предварительную обработку сразу перед использованием. Предварительная обработка проводилась по описанной ниже методике. В рамках данной процедуры, клетки-хозяева E. coli (XL1-BLue MRF') инфицировали фагом λ ZAP Express, в который не был введен экзогенный ген, и проводили культивирование на планшете NZY при температуре 37°C в течение ночи. Затем к лункам планшета добавляли 0,2 M NaHCO3 буфер (pH 8,3), содержащий 0,5 M NaCl, и планшет оставляли в течение 15 часов при температуре 4°C, после чего восстанавливали супернатант в виде экстракта E. coli/фаг. После этого восстановленный экстракт E. coli/фагпропускали через NHS-колонку (производство компании GE Healthcare Bio-Science) для иммобилизации белков, полученных из объединения E. coli/фаг. Сыворотку от больной собаки пропускали через указанную колонку с иммобилизованным белком и подвергали реакции с белками, удаляя тем самым антитела, которые адсорбируются на E. coli и фаге из сыворотки. Сывороточную фракцию, которая была пропущена через колонку и не адсорбировалась, разбавляли в 500 раз с использованием TBS с добавкой 0,5% нежирного сухого молока, и полученное разведение использовали в качестве материала для иммунологического скрининга.
[0115]
Мембрану, на которой проводили блоттинг обработанной сыворотки и описанных выше слитых белков, промыли 4 раза с использованием TBS-T (0,05% Твин 20/TBS) и использовали козий IgG против антигена собаки (козий IgG-h+I против антигена собаки, конъюгированный с HRP; производство компании BETHYL Laboratories, Inc.), который был разбавлен в 500 раз TBS с добавкой 0,5% нежирного сухого молока, в качестве вторичного антитела, для проведения реакции при комнатной температуре в течение 1 часа. Выявление проводили по ферментативной окрашиваемой реакции с использованием раствора реактива NBT/BCIP (производство компании Roche), и колонии, положения которых были идентичны таковым в положительных сайтах окрашенного продукта реакции, собирали из агарозы с планшета Φ90×l5 мм NZY, после чего их растворяли в 500 мкл SM буфера (100 мМ NaCl, 10 мМ MgClSO4, 50 мМ Трис-HCl, 0,01% желатина, pH 7,5). Второй и третий скрининги повторно проводили по тому же методу, который был описан выше до того момента, когда колонии, положительные по реакции окрашивания, становились одиночными колониями, что привело к выделению 45 положительных клонов после скрининга 92820 фаговых клонов, реактивных с IgG сывороткой.
[0116]
(3) Поиск гомологии для генов выделенного антигена
С целью проведения анализа последовательностей, для 45 положительных клонов, выделенных по указанному выше способу, проводили процедуру преобразования фагового вектора в плазмидный вектор. Более конкретно, с этой целью получали 200 мкл раствора, приготовленного таким образом, чтобы клетки-хозяева E. coli (XL1-Blue MRF'), присутствовали на уровне, соответствующем по поглощению ОП600 1,0; 250 мкл очищенного фагового раствора и 1 мкл хелперной плазмиды ExAssist (производство компании STRATAGENE) смешивали, и полученную смесь подвергали реакции при температуре 37°C в течение 15 минут, и затем добавляли 3 мл бульона LB и культивировали полученную смесь при температуре 37°C в течение 2,5-3 часов. Затем сразу проводили инкубацию в течение 20 минут в водяной бане при температуре 70°C с последующим центрифугированием при 1000 g в течение 15 минут, затем собирали супернатант в виде раствора фагемида. Затем 200 мкл раствора, полученного таким образом, чтобы фагемид для клетки-хозяина E. coli (SOLR) присутствовал на уровне, соответствующем поглощению ОП600 1,0, и смешивали с ним 10 мкл очищенного раствора фагемида, после чего полученную смесь подвергали реакции при температуре 37°C в течение 15 минут и затем раскапывали аликвоты по 50 мкл на среду LB-агара с добавкой ампициллина (50 мкг/мл, конечная концентрация) и проводили культивирование при температуре 37°C в течение ночи. Отбирали одиночные колонии трансформированных SOLR и проводили культивирование в среде LB с добавкой ампициллина (50 мкг/мл, конечная концентрация) при 37°C с последующей очисткой плазмидных ДНК, содержащих нужные вставки, с использованием плазмидного набора QIAGEN plasmid Miniprep (производство компании QIAGEN).
[0117]
Для всех очищенных плазмид проводили анализ полноразмерной последовательности вставки по методу «прогулки» праймера («блуждающей затравки») с использованием Т3 праймера с последовательностью SEQ ID NO: 96 и Т7 праймера с последовательностью SEQ ID NO: 97. В результате анализа последовательностей были получены генные последовательности SEQ ID NO: 4-92. С использованием последовательностей оснований этих генов и соответствующих аминокислотных последовательностей (SEQ ID NO: 5-93) был проведен поиск гомологов против известных генов с использованием программы поиска гомологии BLAST (http://www.ncbi.nlm.nih.gov/BLAST/), в результате которого было показано, что все полученные 45 генов представляли собой гены, кодирующие CD179b. Уровень гомологии среди 45 генов составлял 94%-99% на уровне последовательности оснований и 96%-99% по аминокислотной последовательности. Степень гомологии между этими генами и геном, кодирующим человеческий гомологичный фактор, составляла 62%-82% по последовательности оснований и 69%-80% по аминокислотной последовательности на участке, транслируемом в белок. Последовательность оснований для человеческого гомологичного фактора показана в виде SEQ ID NO: 1, а аминокислотные последовательности человеческого гомологичного фактора имеют последовательности SEQ ID NO: 2 и 3. Дополнительно, степень гомологии между этими генами и геном, кодирующим бычий гомологичный фактор, составлял 68%-82% на уровне последовательности оснований и 56%-77% по аминокислотной последовательности на участке, транслируемом в белок. Последовательность оснований для бычьего гомологичного фактора показана в виде SEQ ID NO: 94, а аминокислотная последовательность гомологичного фактора описана в SEQ ID NO: 95. Гомология между геном, кодирующим человеческий гомологичный фактор, и геном, кодирующим бычий гомологичный фактор, составляла 62% по последовательности основания и 72% по аминокислотной последовательности на участке, транслируемом в белок.
[0118]
(4) Анализ экспрессии в различных тканях
Экспрессия генов, полученных по указанному выше способу, в нормальных тканях собаки и человека и в различных клеточных линиях исследовали по методу ОТ-ПЦР (ПЦР с обратной транскрипцией). Реакцию обратной транскрипции проводили по описанной ниже процедуре. В соответствии с этой процедурой экстрагировали суммарную РНК из 50-100 мг каждой ткани или 5-10×106 клеток каждой клеточной линии с использованием реагента TRIZOL (производство компании INVITROGEN) по процедурам, описанным в прилагаемых инструкциях. С использованием указанной суммарной РНК синтезировали кДНК в системе синтеза одной цепи (Superscript First-Strand Synthesis System) для проведения ОТ-ПЦР (производство компании INVITROGEN) по процедуре, описанной в прилагаемых инструкциях. В качестве кДНК из нормальных тканей человека (головной мозг, гиппокамп, яички, толстая кишка и плацента), использовали кДНК из генного пула (производство компании INVITROGEN), клон кДНК QUICK-Clone (производство компании CLONETECH) и библиотеку крупных вставок кДНК (Large-insert DNA cDNA Library) (производство компании CLONETECH). Реакцию ПЦР проводили по описанной ниже процедуре с использованием праймеров, специфичных для полученных генов собаки (SEQ ID NO: 98 и 99), и гомологичного для них человеческого гена (SEQ ID NO: 100 и 101). Согласно этой процедуре реагенты и соответствующий буфер смешивали таким образом, чтобы концентрация/количество смеси, содержащей 0,25 мкл образца, полученного в реакции обратной транскрипции, по 2 мкМ каждого из указанных выше праймеров, 0,2 мМ каждого из дНТФ и 0,65 Ед ExTaq-полимеразы (производство компании Takara Shuzo Co., Ltd.), составляла/составляло в целом 25 мкл, и проводили реакцию в течение 30 циклов при температуре 94°С в течение 30 секунд, при температуре 60°С в течение 30 секунд и при температуре 72°С в течение 30 секунд с использованием термостатируемого аппарата для циклической обработки (Thermal Cycler) (производство компании BIO RAD). Описанные выше праймеры, специфичные для генов с последовательностью оснований SEQ ID NO: 98-99, использовали для амплификации в положениях 32-341 в последовательности оснований SEQ ID NO: 4, а также для амплификации участка, общего для всех генов CD179b собаки, в последовательностях SEQ ID NO: 4-92. Далее, праймеры, специфичные для генов с последовательностями оснований SEQ ID NO: 100 и 101, использовали для амплификации участка 216-738 в последовательности оснований SEQ ID NO: 1. При этом в качестве контроля для сравнения использовали праймеры, специфичные для GAPDH (SEQ ID NO: 102 и 103). В результате было показано, как видно из фиг. 1, что полученные гены собаки вовсе не экспрессировались в нормальных тканях собаки, но демонстрировали значимую экспрессию в тканях рака молочной железы собаки. Что касается экспрессии гомологичного человеческого гена, то было показано, что костный мозг был единственной нормальной тканью человека, где была подтверждена его экспрессии, тогда как в клетках рака человека экспрессия этого гена была обнаружена в клеточных линиях лейкоза и клеточных линиях рака молочной железы, так что была подтверждена специфическая экспрессия CD179b в лейкозных клеточных линиях и клеточных линиях рака молочной железы.
[0119]
На фиг 1. цифра 1 на ординате отражает характер экспрессии идентифицированного выше гена, а под номером 2 проиллюстрирован характер экспрессии GAPDH гена, взятого в качестве контроля для сравнения.
[0120]
Пример 2: Получение нового антигенного белка из клеток рака собаки и человека
(1) Получение рекомбинантного белка
На основе гена с последовательностью SEQ ID NO: 4, описанного в примере 1, получают рекомбинантный белок по описанному ниже методу. Согласно этому методу реагенты и соответствующий буфер смешивали таким образом, чтобы концентрации/количества смеси, включавшей 1 мкл вектора, полученного из растворов фагемида, согласно процедуре примера 1 и проанализированного по составу последовательности по 0,4 мкМ каждого из двух видов праймеров с сайтами рестрикции NdeI и KpnI (описанных в SEQ ID NO: 104 и 105), по 0,2 мМ дНТФ и 1,25 Ед PrimeSTAR HS-полимеразы (производство компании Takara Shuzo Co., Ltd.) составляли в целом 50 мкл, и проводили ПЦР в течение 30 циклов при температуре 98°C в течение 10 секунд и при температуре 68°C в течение 40 секунд с использованием термостатируемого аппарата (Thermal Cycler) для циклической обработки (производство компании BIO RAD). Указанные выше два вида праймеров представляли собой праймеры, используемые для амплификации участка, кодирующего аминокислоты 5-120 в аминокислотной последовательности SEQ ID NO: 5. После проведения ПЦР провели электрофорез в 2% агарозном геле и далее очищали фрагмент ДНК размером примерно 350 п.н. с использованием набора для экстракции из геля QIAquick Gel Extraction Kit (производство компании QIAGEN).
[0121]
Очищенный фрагмент ДНК лигировали в векторе клонирования pCR-Blunt (производство компании Invitrogen). Клетки E. coli трансформировали полученным лигированным продуктом и затем восстанавливали плазмиды с последующим подтверждением, проводимым путем секвенирования, что последовательность амплифицированного генного фрагмента спаривается с интересующей последовательностью. Плазмиду с последовательностью, которая спаривалась с нужной последовательностью, обработывали ферментами рестрикции NdeI и KpnI и проводили очистку с использованием набора для экстракции из геля QIAquick Gel Extraction, с последующей вставкой нужной генной последовательности в вектор экспрессии для E. coli, pET30b (производство компании Novagen) после предшествующей обработки ферментами рестрикции NdeI и KpnI. Использование данного вектора позволяет достичь продукции рекомбинантного белка слияния с His-меткой. Для экспрессии клетки E. coli BL21 (DE3) трансформировали данной плазмидой и экспрессию нужного белка в E. coli индуцировали с использованием 1 мМ IPTG.
[0122]
С другой стороны, с использованием последовательности гена SEQ ID NO: 1 был получен рекомбинантный белок на основе гомологичного человеческого гена по указанной ниже процедуре. Согласно этому методу реагенты и соответствующий буфер смешивали таким образом, чтобы концентрации/количества смеси, включавшей 1 мкл кДНК, полученной в примере 1, экспрессия которой могла быть подтверждена по ОТ-ПЦР методу для кДНК из разных тканей/клеток, по 0,4 мкМ обоих видов праймеров, содержащих сайт рестрикции EcoRI и SalI (описанных в SEQ ID NO: 106 и 107), по 0,2 мМ дНТФ и 1,25 Ед PraimSTAR HS-полимеразы (производство компании Takara Shuzo Co., Ltd.), составляли в целом 50 мкл, и проводили ПЦР в течение 30 циклов при температуре 98°C в течение 10 секунд и при температуре 68°C в течение 40 секунд с использованием термостатируемого аппарата для циклической обработки (Thermal Cykler) (производство компании BIO RAD). Указанные выше два вида праймеров представляли собой праймеры, используемые для амплификации полноразмерной аминокислотной последовательности SEQ ID NO: 3. После ПЦР проводили электрофорез амплифицированной ДНК в 2% агарозном геле и далее очищали фрагменты ДНК с размером примерно 540 п.н. с использованием набора для экстракции из геля QIAquick Gel Extraction (производство компании QIAGEN).
[0123]
Очищенный фрагмент ДНК лигировали в векторе клонирования pCR-Blunt (производство компании Invitrogen). Клетки E. coli трансформировали полученным лигированным продуктом и далее восстанавливали плазмиды с последующим подтверждением путем секвенирования, что последовательность амплифицированного генного фрагмента спаривается с рассматриваемой последовательности. Плазмиду, содержащую последовательность, которая спаривается с рассматриваемой последовательностью, обрабатывали ферментами рестрикции EcoRI и SalI и очищали с использованием набора для экстракции из геля QIAquick Gel Extraction с последующим встраиванием нужной генной последовательности в вектор экспрессии для E. coli pET30a (производство компании Novagen), после предшествующей обработки ферментами рестрикции EcoRI и SalI. Использование указанного вектора позволяет достичь продукции слитых рекомбинантных белков с His-меткой. Для экспрессии E. coli BL21 трансформировали данной плазмидой, и экспрессию нужного белка в E. coli индуцировали с использованием 1 мМ IPTG.
[0124]
(2) Очистка рекомбинантного белка
Полученные выше рекомбинантные клетки E. coli, которые экспрессируют SEQ ID NO: 1 и SEQ ID NO: 4 соответственно, культивировали в среде LB с добавкой 30 мкг/мл канамицина при температуре 37°C до достижении поглощения при длине волны 600 нм примерно 0,7 и затем добавляли в культуральную среду изопропил-β-D-1-тиогалактопиранозид до конечной концентрации 1 мМ с последующим культивированием при температуре 30°C в течение 20 часов. Затем клетки собирали центрифугированием со скоростью 4800 об/мин в течение 10 минут. Осадок клеток суспендировали в фосфатно-буферном солевом растворе и снова центрифугировали со скоростью 4800 об/мин в течение 10 минут для промывки клеток.
[0125]
Клетки суспендировали в фосфатно-буферном растворе и подвергали обработке ультразвуком на льду. Раствор обработанных ультразвуком клеток E. coli центрифугировали со скоростью 7000 об/мин в течение 20 минут с получением супернатанта в качестве растворимой фракции и осадка в качестве нерастворимой фракции.
[0126]
Нерастворимую фракцию суспендировали в 4% растворе Тритон-Х100 и центрифугировали со скоростью 7000 об/мин в течение 20 минут. Эту операция повторяли дважды и затем проводили удаление протеаз.
[0127]
Остаток суспендировали в 20 мМ фосфатном буфере (pH 8,0), содержащем 6М гуанидингидрохлорида и полученный раствор выдерживали при температуре 4°C в течение 20 часов для денатурации белков. После этого суспензию центрифугировали со скоростью 7000 об/мин в течение 20 минут и полученную растворимую фракцию наносили на колонку, содержащую хелатную форму никеля, полученную по традиционному способу (носитель: хелатированная сефароза (Chelating Sepharose) (торговая марка), быстротекучая (GE Health Care); объем колонки 5 мл; уравновешивающий буфер: 20 мМ фосфатный буфер (pH 8,0), содержащий 6M гуанидингидрохлорида). Фракцию, которая не абсорбировалась на колонке, промывали 10 колоночными объемами 20 мМ фосфатного буфера (pH 8,0), содержащего 6М гуанидингидрохлорида, и 20 мМ фосфатного буфера (pH 8,0), содержащего 10 мМ имидазола, и сразу проводили элюцию с использованием четырехступенчатого градиента плотности в диапазоне 50 мМ-500 мМ имидазола, с получением очищенной фракции, которая затем использовалась в качестве материала для пробного введения.
[0128]
К 1 мл реакционного буфера (20 мМ Трис-HCl, 50 мМ NaCl, 2 мм CaCl2; pH 7,4), добавляли аликвоту 200 мкл очищенного препарата, полученного по описанному выше методу, и 2 мкл энтерокиназы (производство компании Novagen) с последующим выдерживанием смеси при комнатной температуре в течение ночи для расщепления His-метки. Полученный продукт очищали с использованием набора для расщепления энтерокиназой (Enterokinase Cleavage Capture Kit) (производство компании Novagen), согласно инструкции, прилагаемой к набору. Затем буфер, содержавшийся в 1,2 мл очищенного препарата, полученного по описанному выше методу, заменяли физиологическим фосфатным буфером (производство компании Nissui Pharmaceutical) при проведении ультрафильтрации с использованием NANOSEP 10K OMEGA (производство компании PALL) и полученный раствор после фильтрования в асептических условиях с использованием фильтра HT Tuffryn Acrodisc с размером пор 0,22 мкм (производство компании PALL) использовали в дальнейших экспериментах.
[0129]
Пример 3: Тест на введение рекомбинантного белка собаке с опухолью
(1) Противоопухолевый тест
Противоопухолевое действие рекомбинантного белка, который был выделен и очищен по описанной выше процедуре, оценивали по его эффекту на размер опухоли у собаки (рак молочной железы), которая относилась к эпидермальной опухоли.
[0130]
Смешивали 100 мкг (0,5 мл) рекомбинантного полипептида, выделенного и очищенного по описанной выше процедуре, с равным количеством неполного адъюванта Фрейнда (производство компании Wako Pure Chemicals), с получением терапевтического средства для лечения рака. Указанное средство вводили в региональный лимфатический узел вблизи опухоли, в совокупности 3 раза, с последующим введением препарата через 3 дня и 7 дней после первого введения. В результате было показано, что опухоль, имевшая размер 55 мм3 на момент введения указанного противоракового терапевтического средства, уменьшилась до 30 мм3 через 10 дней после введения, до 16 мм3 через 20 дней после первого введения и до 10 мм3 через 30 дней после первого введения.
[0131]
Кроме того, другой собаке, имевшей рак молочной железы, вводили 3 раза указанным выше способом смесь из 100 мкг (0,5 мл) описанного выше полученного от собаки полипептида и 0,5 мл неполного адъюванта Фрейнда. Дополнительно, одновременно с соответствующими введениями инъецировали подкожно 100 мкг интерлейкина-12 собаки. В результате было показано, что опухоль, которая имела размер примерно 155 мм3 на момент введения рассматриваемого противоракового терапевтического средства, полностью регрессировала через 24 дня после первого введения.
[0132]
(2) Тест на индукцию иммунитета
У больной собаки, для которой был продемонстрирован, в рамках описанного выше теста (1), противоопухолевый эффект при введении рассматриваемого препарата, отбирали кровь перед введением указанного противоракового терапевтического средства, а также через 10 и 30 дней после первого введения. Выделяли мононуклеарные клетки из периферической крови по стандартному методу и по процедуре ELISPOT на IFN-γ, оценивали индукцию иммунитета под действием каждого из вводимых рекомбинантных белков.
[0133]
В лунки 96-луночного планшета, производство компании Millipore (MultiScreen-IP, MAIPS 4510), вносили по 100 мкл на лунку 70% этанол и планшет оставляли на 5 минут, после чего удаляли этанол отсасыванием. Планшет промывали стерильной водой и вносили в лунки по 300 мкл на лунку 200 мМ бикарбонат натрия (pH8,2). После выдерживания в течение 5 минут бикарбонат натрия удаляли отсасыванием и планшет промывали. Затем в каждую лунку добавляли по 0,5 мкл моноклонального антитела интерферон-γ против антигена собаки (производство компании R&D, клон 142529, MAB781), смешивали с 200 мМ бикарбонатом натрия и планшет инкубировали при температуре 37°C в течение ночи для иммобилизации первичного антитела. После удаления первичного антитела отсасыванием к лункам добавляли по 300 мкл/лунку блокирующего раствора (1% БСА-5% сахароза-200 мМ бикарбоната натрия, (pH8,2)) и планшет инкубировали при температуре 4°C в течение ночи для блокирования содержимого планшета. После удаления блокирующего раствора отсасыванием в лунки добавляли по 300 мкл/лунку среду RPMI с добавкой 10% фетальной сыворотки теленка (производство компании Invitrogen) и планшеты оставляли на 5 минут, после чего удаляли среду отсасыванием. Затем к лункам планшета добавляли 5×105 клеток/лунку мононуклеарные клетки периферической крови собаки, которые были суспендированы в среде RPMI с добавкой 10% фетальной сыворотки теленка, и добавляли в лунки по 10 мкл/лунку полипептид собаки или человеческий полипептид, использованные в каждом из введений, после чего проводили культивирование клеток при температуре 37°C в атмосфере 5% CO2 в течение 24 часов, с тем чтобы иммуноциты, которые могли присутствовать в мононуклеарных клетках периферической крови, продуцировали интерферон-γ. После завершения культивирования среду удаляли и лунки промывали 6 раз промывочным раствором (0,1% Твин 20-200 мМ бикарбонат натрия (pH 8,2)). В каждую лунку добавляли по 100 мкл кроличьего поликлонального антитела против антигена собаки, разбавленного в 1000 раз описанным выше блокирующим раствором, и планшет инкубировали при температуре 4°C в течение ночи. После промывки лунок 3 раза описанным выше промывочным раствором в каждую лунку добавляли по 100 мкл меченного HRP антитела против антигена кролика в 1000-кратном разбавлении указанным выше блокирующим раствором и проводили реакцию при температуре 37°C в течение 2 часов. После промывки лунок 3 раза описанным выше промывочным раствором полученный продукт окрашивали иммунологическим красителем Konica Immunostain (производство компании Konica) и лунки промывали водой для остановки реакции. После этого мембраны высушивали и подсчитывали количество спотов с использованием KS ELISPOT (производство компании Carl Zeiss, Inc.). В результате было показано, что в образцах мононуклеарных клеток периферической крови, отобранных перед введением полипептида, не выявлялось спотов. С другой стороны, у больной собаки после введения пептида обнаруживались 18 и 87 спотов в мононуклеарных клетках периферической крови, отобранных через 10 и 30 дней соответственно после введения.
[0134]
На основании указанных выше результатов был сделан вывод, что иммуноциты, которые специфически взаимодействовали с введенным рекомбинантным белком и продуцировали интерферон-γ, индуцировались у больной собаки, которой вводили рекомбинантный белок, и это привело к развитию противоопухолевого эффекта, описанного выше в пункте (1), который проявлялся через иммунологические реакции с участием этих иммуноцитов.
[0135]
Пример 4: Индукция CD8-положительных Т-клеток, реактивных с эпитопами пептида, полученного из CD179b
(1) Прогнозирование пептидных мотивов, которые связываются с HLA-A0201 и HLA-A24
Информация по аминокислотной последовательности человеческого белка CD179b была получена из GenBank. Для прогнозирования мотивов связывания с HLA-A0201 и HLA-A24 аминокислотную последовательность человеческого белка CD179b анализировали с использованием компьютерной программы в составе известного программного обеспечения BIMAS (доступен на странице http://bimas.dcrt.nih.gov/molbio/hla_bind/). В результате анализа было выбрано 8 видов пептидов с последовательностями SEQ ID NO: 108-110 и SEQ ID NO: 113-117, которые, как ожидалось, были способны связываться с молекулой HLA-A0201, а также 5 видов пептидов с последовательностями SEQ ID NO: 110-112, SEQ ID NO: 115 и SEQ ID NO: 116, которые, как ожидалось, способны связываться с молекулой HLA-A24.
[0136]
(2) Индукция CD8-положительных Т-клеток, реактивных с пептидным эпитопом
Отбирали периферическую кровь от здорового индивидуума, положительного по HLA-A0201, и указанный образец периферической крови наслаивали на среду для разделения лимфоцитов (OrganonpTeknika, Durham, NC), с последующим центрифугированием со скоростью 1500 об/мин в течение 20 минут при комнатной температуре. Фракцию, содержащую МКПК, восстанавливали и промывали 3 раза (или больше) холодным фосфатным буфером с получением мононуклеарных клеток периферической крови (МКПК). Полученные МКПК суспендировали в 20 мл среды AIM-V (производство компании Life Technologies, Inc., Grand Island, NY), и оставляли до адгезии к стенках колбы для культивирования (производство компании Falcon) при температуре 37°C в атмосфере 5% СО2 на 2 часа. Клетки, которые не прилипли, использовали для получения Т-клеток, а прилипшие клетки использовали для получения дендритных клеток.
[0137]
Прилипшие клетки культивировали в среде AIM-V в присутствии IL-4 (1000 Ед/мл) и ГМ-КСФ (1000 Ед/мл). Через шесть дней среду заменяли другой средой AIM-V, содержащей IL-4 (1000 Ед/мл), ГМ-КСФ (1000 Ед/мл), IL-6 (1000 Ед/мл, Genzyme, Cambridge, MA), IL-1β (10 нг/мл, Genzyme, Cambridge, MA) и TNF-α (10 нг/мл, Genzyme, Cambridge, MA), и культивирование продолжали еще 2 дня. Полученную популяцию клеток, которые не прилипли, использовали в качестве дендритных клеток.
[0138]
Полученные таким образом дендритные клетки суспендировали в среде AIM-V с плотностью клеток 1×106 клеток/мл и пептиды с последовательностями SEQ ID NO: 108-110 или SEQ ID NO: 113-117, которые были показаны выше в пункте (1) и которые, как ожидалось, будут способны связываться с молекулой HLA-A201, добавляли к полученной суспензии в концентрации 10 мкг/мл с последующим культивированием в 96-луночном планшете при температуре 37°C, в атмосфере 5% CO2, в течение 4 часов. После этого клетки облучали рентгеновскими лучами (3000 рад), промывали средой AIM-V, суспендировали в среде AIM-V, содержащей 10% человеческой сыворотки AB (Nabi, Miami, FL), IL-6 (1000 Ед/мл) и IL-12 (10 нг/мл, Genzyme, Cambridge, MA) и внесли в лунки 24-луночного планшета с плотностью 1×105 клеток/лунку. Полученную популяцию Т-клеток добавляли к лункам в количестве 1×106 клеток/лунку и указанные клетки культивировали при температуре 37°C в атмосфере 5% CO2. Через семь дней культуральный супернатант отбрасывали и клетки обрабатывали каждым из пептидов, полученных описанным выше способом. После облучения рентгеновскими лучами дендритные клетки суспендировали в среде AIM-V, содержащей 10% человеческой сыворотки AB (Nabi, Miami, FL), IL-7 (10 Ед/мл, Genzyme, Cambridge, MA) и IL-2 (10 Ед/мл, Genzyme, Cambridge, MA) (плотность клеток: 1×105клеток/мл) и вносили в лунки 24-луночного планшета в количестве 1×105 клеток/лунку и далее культивировали. Указанную операцию повторяли 4-6 раз с интервалами в 7 дней и стимулированные Т-клетки затем восстанавливали, после чего по методу проточной цитометрии подтверждали индукцию CD8-положительных клеток.
[0139]
Аналогично, для пептидов с последовательностями SEQ ID NO: 110, 111, 112, 115 и 116, которые, как ожидалось, способны связываться с HLA-A24 молекулой, была проведена индукция CD8-положительных Т-клеток, реактивных с пептидным эпитопом, с использованием дендритных клеток и индуцированной Т-клеточной популяции из периферической крови здорового пациента, положительного по HLA-A24.
[0140]
В качестве отрицательного контроля использовали пептид, отличный от пептида по настоящему изобретению (SEQ ID NO: 118).
[0141]
Пример 5: Определение антигенных эпитопов цитотоксичных Т-клеток, полученных из CD179b, которые стимулируют HLA-A0201-положительные CD8-положительные Т-клетки
(l) Способность к продукции IFN-γ
Для того чтобы определить специфичность Т-клеток, рост которых был подтвержден среди тех Т-клеток, которые были индуцированы по описанной процедуре, к пептидным эпитопам из 5×103T-клеток добавляли 5×104 T2-клеток (Salter RD et al., Immunogenetics, 21:235-246 (1985), полученные от ATCC), которые были подвергнуты пульсовой обработке каждым из исследуемых пептидов, и экспрессировали HLA-A0201 молекулу (при культивировании в AIM-V среде с добавкой каждого из пептидов в концентрации 10 мкг/мл, при температуре 37°C в атмосфере 5% CO2 в течение 4 часов), при культивировании клеток в среде AIM-V, содержащей 10% человеческой сыворотки AB, в 96-луночном планшете в течение 24 часов. После культивирования выделяли супернатант и определяли количество образованного IFN-γ по методу ELISA. В результате была подтверждена продукция IFN-γ в культуральных супернатантах в лунках с T2 клетками, подвергнутыми пульсовой обработке пептидами SEQ ID NO: 108-110 и SEQ ID NO: 113-117, в сравнении с культуральным супернатантом в лунках с Т2 клетками, которые не подвергались пульсовой обработке пептидом (фиг. 2). На основании этих результатов был сделан вывод, что указанные выше пептиды являются Т-клеточными эпитопными пептидами, обладающими способностью специфически стимулировать и способствовать пролиферации HLA-A0201-положительных CD8-положительных T-клеток, что приводило к индукции образования IFN-γ.
[0142]
На фиг. 2 номера 3, 4, 5, 6, 7, 8, 9 и 10 на абсциссе показывают IFN-γ продуцирующую способность HLA-A0201-положительных CD8-положительных T-клеток под стимулирующим воздействием T2 клеток, после пульсовой обработки пептидами SEQ ID NO: 108, 109, 110, 113, 114, 115, 116 и 117 соответственно. Под номером 11 показан результат для пептида SEQ ID NO: 118, использованного в качестве отрицательного контроля.
[0143]
(2) Тест на цитотоксичность
Далее определяли, презентируются ли пептиды SEQ ID NO: 108-110 и SEQ ID NO: 113-117, использованные в настоящем изобретении, на HLA-A0201 молекулах в опухолевых клетках, которые являются HLA-A0201-положительными и экспрессируют CD179b, и могут ли эти CD8-положительные Т-клетки, стимулированные указанными пептидами, повреждать опухолевые клетки, которые являются HLA-A0201-положительными и экспрессируют CD179b. В центрифужную пробирку объемом 50 мл вносили 106 клеток из В-клеточной лейкозной линии, клетки Namalwa (получены от ATCC), экспрессия в которых CD179b была подтверждена, и добавили 100 µCi хрома 51, после чего провели инкубацию при температуре 37°C в течение 2 часов. Далее клетки промывали три раза средой RPMI (производство компании Gibco), содержащей 10% фетальной сыворотки теленка (производство компании Gibco), и помещали в лунки 96-луночного планшета с V-образным дном в количестве 103 клеток/лунку. Затем к каждой лунке добавляли 5×104 Т-клеток, суспендированных в среде RPMI, содержащей 10% фетальной сыворотки теленка, где указанные клетки были стимулированы каждым из исследуемых пептидов и где указанные клетки были HLA-A0201-положительными, реактивными с пептидным эпитопом и CD8-положительными, после чего проводили культивирование при температуре 37°C в атмосфере 5% CO2 в течение 4 часов. После этого при измерении количества хрома 51 в культуральном супернатанте, который высвободился из поврежденных опухолью клеток, рассчитывали цитотоксическую активность CD8-положительных Т-клеток, стимулированных каждым из исследованных пептидов. В результате было показано, что HLA-A0201-положительные CD8-положительные Т-клетки, стимулированные пептидом, обладают цитотоксической активностью против клеток Namalwa (Фиг. 3). CD8-положительные Т-клетки, индуцированные с использованием пептида, взятого в качестве отрицательного контроля (SEQ ID NO: 118), не демонстрировали цитотоксическую активность. Таким образом, было доказано, что каждый из пептидов по настоящему изобретению (SEQ ID NO: 108-110 и SEQ ID NO: 113-117) презентируется на молекулах HLA-A0201 в опухолевых клетках, которые являются HLA-A0201-положительными и экспрессируют CD179b, и что этот пептид обладает способностью индуцировать CD8-положительные цитотоксические Т-клетки, которые могут повреждать такие опухолевые клетки.
[0144]
Определяли цитотоксическую активность при смешивании согласно приведенному выше описанию 105CD8-положительных Т-клеток, стимулированных и индуцированных каждым из пептидов по настоящему изобретению, и 103 клеток из В-клеточной линии Namalwa, которые были получены для теста по включению хрома 51, с последующим культивированием полученной смеси в течение 4 часов, определяли количества хрома 51, высвобожденного из культуральной среды после культивирования, и далее рассчитывали цитотоксическую активность CD8-положительных Т-клеток против клеток Namalwa по приведенному ниже уравнению*.
[0145]
* Уравнение: Цитотоксическая активность (%) = количество хрома 51, высвобожденного из клеток Namalwa при добавлении CD8-положительных Т-клеток/количество хрома 51, высвобожденного из целевых клеток при добавлении 1 н. хлористоводородной кислоты × 100.
[0146]
На фиг. 3 под номерами 12, 13, 14, 15, 16, 17, 18 и 19 на абсциссе показана цитотоксическая активность HLA-A0201-положительных CD8-положительных Т-клеток против клеток Namalwa, где указанные Т-клетки были стимулированы с использованием SEQ ID NO: 108, 109, 110, 113, 114, 115, 116 и 117 соответственно. Под номером 20 показана цитотоксическая активность CD8-положительных Т-клеток, индуцированных с использованием пептида, взятого в качестве отрицательного контроля (SEQ ID NO: 118).
[0147]
Пример 6: Определение антигенных эпитопов, полученных из CD179b цитотоксических Т-клеток, которые стимулируют HLA-A24- положительные CD8-положительные Т-клетки
(1) Способность продуцировать IFN-γ
Для оценки специфичности реактивных с пептидным эпитопом CD8-положительных Т-клеток, индуцированных согласно примеру 3(2), по процедуре примера 5(1) добавляли к пептидным эпитопам из 5×103 описанных выше Т-клеток 5×104JTK-LCL клеток, экспрессирующих HLA-A24 молекулы (получены от компании RIKEN), где указанные JTK-LCL клетки были подвергнуты пульсовой обработке пептидом SEQ ID NO: 110, 111, 112, 115 или 116 (которые культивировались в среде AIM-V с добавкой каждого пептида в концентрации 10 мкг/мл, при температуре 37°C, в атмосфере 5% CO2 в течение 4 часов) и затем указанные клетки культивировали в среде AIM-V, содержащей 10% человеческой сыворотки AB, в лунках 96-луночного планшета в течение 24 часов. Супернатант после культивирования выделяли и измеряли продукцию IFN-γ по методу ELISA. В результате была подтверждена продукция IFN-γ в культуральных супернатантах в лунках, содержащих JTK-LCL, c клетками после их пульсовой обработки пептидами SEQ ID NO: 110, 111, 112, 115 и 116, в сравнении с культуральными супернатантами в лунках с JTK-LCL клетками, которые не подвергались пульсовой обработке пептидом (фиг. 4). На основании этих результатов был сделан вывод, что указанные выше пептиды представляют собой Т-клеточные эпитопные пептиды, обладающие способностью специфически стимулировать и способствовать пролиферации HLA-A24-положительных CD8-положительных Т-клеток, что приводило к индукции образования IFN-γ.
[0148]
На фиг. 4 под номерами 21, 22, 23, 24 и 25 на абсциссе показана IFN-γ-продуцирующая способность HLA-A24-положительных CD8-положительных Т-клеток за счет стимуляции JTK-LCL клетками, подвергнутыми пульсовой обработке пептидами SEQ ID NO: 110, 111, 112, 115 и 116 соответственно. Под номером 26 показан результат, полученный для пептида SEQ ID NO: 118, который был использован в качестве отрицательного контроля.
[0149]
(2) Тест на цитотоксичность
Далее определяли, могут ли пептиды SEQ ID NO: 110, 111, 112, 115 и 116, использованные в настоящем изобретении, презентироваться на HLA-A24 молекулах в клетках, которые являются HLA-A24-положительными и экспрессируют CD179b, и могут ли CD8-положительные Т-клетки, стимулированные этими пептидами, повреждать опухолевые клетки, которые являются HLA-A24-положительными и экспрессируют CD179b, где указанное определение было проведено по процедуре примера 5(2). В центрифужную пробирку объемом 50 мл вносили 106 JTK-LCL клеток, которые являются HLA-A24-положительными и экспрессируют CD179b, и добавляли 100 µCi хрома 51, с последующей инкубацией при температуре 37°C в течение 2 часов. После этого клетки промывали 3 раза средой RPMI, содержащей 10% фетальной сыворотки теленка, и помещали в лунки 96-луночного планшета с V-образным дном в количестве 103 клеток/лунку. Затем в каждую лунку вносили 5×104 T-клеток, суспендированных в среде RPMI, содержащей 10% фетальной сыворотки теленка, где указанные клетки были стимулированы каждым из исследуемых пептидов и являлись HLA-A24-положительными, реактивными с пептидным эпитопом и CD8-положительными, после чего провели культивирование при температуре 37°C в атмосфере 5% CO2 в течение 4 часов. Затем при измерении количества хрома 51 в культуральном супернатанте, который высвободился из поврежденных клеток, рассчитывали цитотоксическую активность CD8-положительных Т-клеток, стимулированных каждым из исследуемых пептидов. В результате было показано, что HLA-A24-положительные CD8-положительные Т-клетки, стимулированные указанным пептидом, обладают цитотоксической активностью против JTK-LCL клеток (фиг. 5). Таким образом, было доказано, что каждый из пептидов по настоящему изобретению (SEQ ID NO: 110, 111, 112, 115 и 116) презентируется на HLA-A24 молекулах в клетках, которые являются HLA-A24-положительными и экспрессируют CD179b, и что рассматриваемый пептид обладает способностью индуцировать CD8-положительные цитотоксические Т-клетки, которые могут повреждать такие клетки. Указанные CD8-положительные Т-клетки, индуцированные с использованием пептида, взятого в качестве отрицательного контроля (SEQ ID NO: 118), не проявляли цитотоксической активности.
[0150]
На фиг. 5 под номерами 27, 28, 29, 30 и 31 показана цитотоксическая активность HLA-A24-положительных CD8-положительных Т-клеток, стимулированных пептидами SEQ ID NO: 110, 111, 112, 115 и 116 соответственно, против JTK-LCL клеток. Под номером 32 показана цитотоксическая активность CD8-положительных Т-клеток, индуцированных с использованием пептида, взятого в качестве отрицательного контроля (SEQ ID NO: 118).
[0151]
Пример 7: Выявление рака с использованием рекомбинантного белка
(1) Выявление рака у собаки
У 153 больных собак, наличие у которых злокачественной опухоли подтверждено, и у 264 здоровых собак была взята кровь и отделена сыворотка. С использованием антигенного белка рака собаки, полученного в примере 2 (на участке от 5 до 120 аминокислоты в аминокислотной последовательности SEQ ID NO:5), и IgG антитела против антигена собаки, по методу ELISA определяли титр IgG антитела в сыворотках, которые специфически реагировали с полипептидом.
[0152]
Иммобилизацию полученного полипептида в твердой фазе проводили при внесении 100 мкл/лунку раствора рекомбинантного белка, разбавленного до концентрации 100 мкг/мл фосфатно-буферным раствором, в 96-луночном планшете для иммобилизации аминокислот (Immobilizer Amino plate) (производство компании Nunc), с последующим выдерживанием планшета при температуре 4°C в течение ночи. Блокирование проводили при добавлении 100 мкл/лунку раствора, который был получен при растворении 4 г блокирующего порошка Block Ace (производство компании DS Pharma Biomedical Co., Ltd.) в 100 мл очищенной воды и который вносили в лунки, и встряхивали планшет при комнатной температуре в течение 1 часа. К лункам добавляли сыворотку, разбавленную в 1000 раз блокирующим раствором в количестве 100 мкл/лунку, и встряхивали планшет при комнатной температуре в течение 3 часов для проведения реакции. Далее лунки промывали 3 раза фосфатно-буферным раствором, содержащим 0,05% Твин 20 (производство компании Wako Pure Chemical Industries, Ltd., далее называемый как ФБР-T), и добавляли по 100 мкл/лунку HRP-модифицированного IgG антитела собаки (конъюгированный козий IgG(-H+L)HRP против антигена собаки: производство компании BETHYL Laboratories), разбавленного в 3000 раз блокирующим раствором, с последующим встряхиванием планшета при комнатной температуре в течение 1 часа для проведения реакции. После промывки лунок 3 раза ФБР-Т добавляли по 100 мкл/лунку субстрат для HRP- TMB (1-стадийная реакция Turbo-TMB (тетраметиленбензидин), PIERCE) и проводили реакцию фермент-субстрат при комнатной температуре в течение 30 минут. После этого к лункам добавляли по 100 мкл/лунку 0,5 M раствор серной кислоты (производство компании Sigma-Aldrich Japan) для остановки реакции и измеряли поглощение при длине волны 450 нм с использованием счетчика для микропланшетов. В качестве контроля использовали вариант, где проводилась та же операция и тем же способом, что были описаны выше, за исключением того, что полученный рекомбинантный белок не был иммобилизован, или за исключением того, что сыворотка от собаки с опухолью не подвергалась реакции, где указанный вариант использовался для целей сравнения.
[0153]
В качестве тех видов рака, выявление которых проводили по описанной выше методике, использовали 112 образцов из тканей рака молочной железы, 31 образец для лимфомы и 10 образцов для лейкоза, которые были явно диагностированы как злокачественные по результатам патологической диагностики.
[0154]
Образцы из тех вариантов сыворотки, которые были получены из живых организмов собак с опухолями, демонстрировали значительно более высокие титры антител против рекомбинантного белка. Было показано по результатам диагностики образца, демонстрирующего увеличенный в два раза средний показатель, характерный для здоровой собаки, что указывало на злокачественное перерождение, что 61 образец (54%) для рака молочной железы, 21 образец (71%) для лимфомы и 7 образцов (70%) для лейкоза могли быть диагностированы как злокачественные. В том случае, когда тестирование видов рака проводили аналогичным образом с использованием сыворотки от 30 собак, имевших опухоль молочной железы, которые были явно диагностированы как доброкачественные, количество образцов, демонстрирующих двойное в сравнении с показателем у здоровой собаки значение, составляло 0.
[0155]
Таким же образом, с использованием антигенного белка из тканей человеческого рака согласно примеру 2 (аминокислотная последовательность SEQ ID NO: 3) и IgG антитела против антигена собаки определяли по методу ELISA титр IgG антитела, который специфически связывается с полипептидом в каждом из исследованных образцов сыворотки, полученных от собак с опухолью. В результате было показано, что 56 образцов (50%) из тканей, пораженных раком молочной железы, 18 образцов (58%) из тканей лимфомы и 5 образцов (50%) из лейкозных тканей могли рассматриваться как злокачественные.
[0156]
При проведении выявления по описанной выше процедуре с использованием плеврального выпота и асцитов, взятых от больных собак с терминальной стадией рака, получали значения, аналогичные тем результатам, которые были получены в методе выявления с использованием сыворотки, так что диагностика рака была также возможна.
[0157]
(2) Выявление рака у человека
Аналогичным образом, с использованием антигенного белка из тканей рака человека (аминокислотная последовательность SEQ ID NO: 3), использованного в описанной выше процедуре выявления, и IgG антитела против человеческого антигена, определяли титр IgG у здорового индивидуума, где образец специфически взаимодействовал с полипептидом. Использованное вторичное антитело представляло собой HRP-модифицированное IgG антитело против антигена человека (конъюгат HRP козы против IgG(H+L) человека: производство компании Zymed Laboratories), разбавленного в 10000 раз блокирующим раствором. В качестве положительного контроля использовали альбумин из яичного белка, который был получен в концентрации 50 мкг/мл с использованием фосфатно-буферного раствора и иммобилизован на твердой фазе. В результате в случае альбумина из яичного белка семь здоровых индивидуумов продемонстрировали поглощение, равное в среднем 0,45 при длине волны 450 нм, что было высоким значением. С другой стороны, в случае описанного выше полипептида указанное поглощение составляло 0, что означало, что данная реакция выявления не проходила.
[0158]
Далее, таким же образом, как было описано выше, с использованием 17 образцов сывороток, полученных от пациентов со злокачественным раком молочной железы (полученные от компании Promeddx), определяли титр IgG антитела в каждой из сывороток, где указанное антитело специфически связывалось с антигенным белком, характерным для рака человека (аминокислотная последовательность SEQ ID NO: 3). В результате в случае указанного выше полипептида 17 пациентов с раком молочной железы характеризовались поглощением в среднем 0,28 при длине волны 450 нм, что было высоким поглощением. Таким образом, было показано, что рак может быть выявлен у человека при использовании способа по настоящему изобретению.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0159]
Настоящее изобретение может быть использовано для лечения рака, поскольку оно обеспечивает иммуноиндуцирующее средство, содержащее полипептид, который проявляет противоопухолевую активность против одного или нескольких видов рака (опухолей), таких как рак молочной железы, лейкоз/лимфома. Кроме того, настоящее изобретение может быть применимо для диагностики рака, поскольку согласно настоящему изобретению предлагается новый способ выявления рака.
Реферат
Изобретение раскрывает иммуноиндуцирующее средство, включающее в качестве эффективного(ых) ингредиента(ов) по меньшей мере один полипептид, выбранный из следующих полипептидов, где полипептид(ы) обладает(ют) иммуноиндуцирующей активностью/активностями, или в качестве эффективного(ых) ингредиента(ов) рекомбинантный(ые) вектор(а), который(ые) включает(ют) полинуклеотид(ы), кодирующий(ие) полипептид(ы), и способен(ны) к экспрессии полипептида(ов)может использоваться для лечения и/или профилактики злокачественной опухоли: (a) полипептид, состоящий по существу не менее чем из 7 последовательных аминокислот в любой из аминокислотных последовательностей с нечетными номерами SEQ ID NO: 3-95, приведенными в списке последовательностей; (b) полипептид, обладающий не менее чем 90% идентичностью последовательности с указанным полипептидом (а) и состоящий по существу не менее чем из 7 аминокислот; и (с) полипептид, включающий указанный полипептид (a) или (b) в качестве своей частичной последовательности. Данное изобретение эффективно в лечении, профилактике, а также в выявлении рака в живом организме путем измерения уровня антител в образце, поскольку указанный(ые) выше полипептид(ы) взаимодействует(ют) с антителами, специфически присутствующими в сыворотке пациента со злокачественной опухолью. 11 з.п. ф-лы, 5 ил., 7 пр.
Формула
(a) полипептид, состоящий по существу не менее чем из 7 последовательных аминокислот в любой из аминокислотных последовательностей с нечетными номерами SEQ ID NO:3-95, приведенными в списке последовательностей;
(b) полипептид, обладающий не менее чем 80% идентичностью последовательности с указанным полипептидом (a) и состоящий по существу не менее чем из 7 аминокислот; и
(c) полипептид, включающий указанный полипептид (a) или (b), в качестве своей частичной последовательности.

Комментарии