Способы и композиции для лечения заболевания - RU2468820C2
Код документа: RU2468820C2
Чертежи

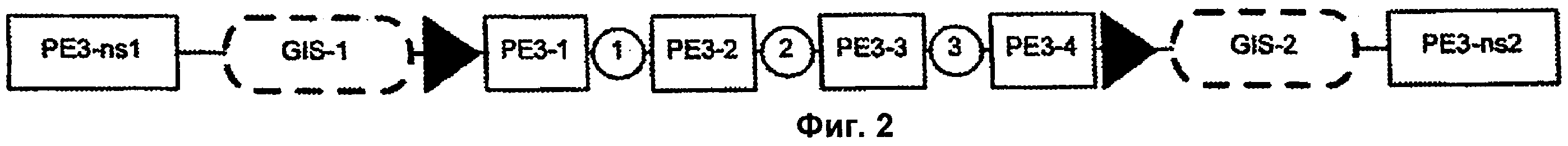





Описание
Предшествующий уровень техники
Область изобретения
Настоящее изобретение относится к способам и композициям для лечения субъекта, предназначенным для разрушения пораженных клеток у этого субъекта посредством селективной экспрессии летального полипептида в клетках, экспрессирующих по меньшей мере один маркерный ген заболевания.
Предшествующий уровень техники
Рак представляет собой набор заболеваний, являющихся результатом неконтролируемого клеточного роста, который вызывает хроническую боль и является причиной смерти более чем 300000 людей за один год только в Соединенных Штатах Америки. Онкогены представляют собой гены, которые по существу стимулируют рост раковых клеток. Полагают, что развитие рака зависит от активации онкогенов и сопутствующей инактивации генов-супрессоров роста (Park, M., "Oncogenes" в The Genetic Basis of Human Cancer (B.Vogelstein et al., eds.) pp.205-228 (1998)). Онкогены представляют собой мутированные, доминантные формы клеточных протоонкогенов, стимулирующие клеточную пролиферацию, в то время как гены-супрессоры опухолей являются рецессивными и в норме ингибируют клеточную пролиферацию.
Лечение раковых пациентов химиотерапевтическими агентами остается важнейшим способом лечения системного заболевания, и имеется прямая связь между интенсивностью химиотерапевтической дозы и показателем клинического ответа. Однако возрастающие дозы химиотерапии оказывают значительные побочные эффекты, включая повсеместную деструкцию гемопоэтических клеток-предшественников костного мозга с сопровождающей ее деструкцией клеточной насыщенности периферических миелоидных и лимфоидных тканей. Для облегчения восстановления гемопоэтической системы после химиотерапии часто в сочетании с высокой дозой химиотерапии используют трансплантацию стволовых клеток.
Часто используют трансплантацию аллогенных стволовых клеток, что представляет собой трансплантацию стволовых клеток донора, отличного от пациента. Однако выполнение протокола аллогенной трансплантации приводит к высокому коэффициенту смертности главным образом из-за реакции "трансплантат против хозяина" (GVD), когда трансплантированные клетки атакуют собственные ткани пациента.
Протокол трансплантации аутологических стволовых клеток представляет собой протокол, где стволовые клетки пациента выделяют до применения высокодозовой химиотерапии и впоследствии вводят путем реинфузии. Аутотрансплантация позволяет избежать осложнений, связанных с GVD, но может приводить к реинфузии опухолевых клеток из содержащего стволовые клетки продукта. Важность реинфузии опухолевых клеток заключается в том, что поступающие путем реинфузии опухолевые клетки могут вносить непосредственный вклад в развитие рецидива заболевания и приводить к плохому клиническому исходу, что было продемонстрировано в исследованиях с маркировкой генов. Например, в случаях лимфомы, лейкоза, рака молочной железы и нейробластомы, по меньшей мере некоторые из примесных опухолевых клеток при выполнении протокола трансплантации стволовых клеток периферической крови обладают способностью к клоногенному росту in vitro (Ross, et al., Blood 82: 2605-2610 (1993)), а также и в организме пациента.
Чтобы избежать реинфузии раковых клеток в организм пациента, подвергаемого трансплантации аутологических стволовых клеток, практикующие врачи предпринимают попытки "очистить" клетки костного мозга от загрязняющих их опухолевых клеток. Разработаны различные подходы для очистки ex vivo популяции стволовых клеток от примесных опухолевых клеток. Например, использование моноклональных антител против мембранных антигенов с цитотоксическими лекарственными средствами, токсинами, фототерапией и биологически активными модификаторами или цитотоксических лекарственных средств может снизить загрязнение опухолевыми клетками на 1-3 порядка по величине (Seiden, et al., J. Infusional Chemotherapy 6:17-22 (1996); включено посредством ссылки). В соответствии с другим протоколом, в попытке очистить опухолевые клетки использовали направленные на опухолевые клетки антитела, конъюгированные с радиоактивными изотопами. Использование цитотоксических лекарственных средств и/или радиоактивных изотопов может не обладать специфичностью, поскольку опухолевые клетки и клетки-предшественники зачастую проявляют схожий фенотип в отношении белков клеточной поверхности, и применение таких методик может препятствовать приживлению трансплантата. Для уменьшения реинфузии опухолевых клеток также применяли селекцию CD34+ гемопоэтических клеток-предшественников, хотя и с гораздо меньшей эффективностью очистки. И вновь, эти способы селекции, основанные на CD34, могут не обладать достаточной специфичностью, поскольку опухолевые клетки часто могут проявлять СD34-антиген.
Таким образом, в данной области существует потребность в разработке новых способов специфичного удаления пораженных клеток из клеточной популяции, предназначенной для аутотрансплантации.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способам и композициям для лечения субъекта, предназначенным для разрушения пораженных клеток у этого субъекта. В одном воплощении способы включают получение популяции клеток от субъекта и определение активности по меньшей мере одного маркерного гена заболевания в популяции полученных клеток. Затем молекулу полинуклеотида, кодирующую селектируемый маркер и летальный полипептид, вводят в клетки, где экспрессия летального полипептида находится под контролем промотора по меньшей мере одного из идентифицированных ранее маркерных генов заболевания. Летальный пептид определяют как полипептид, сам по себе являющийся летальным для данных клеток или который дает продукт, летальный для данных клеток. После введения полинуклеотида клетки подвергают воздействию в условиях селекции с целью получения клеток, содержащих полинуклеотид, и затем клетки обрабатывают в условиях индукции экспрессии летального полипептида с целью разрушения клеток, экспрессирующих маркерный ген(ы) заболевания. После разрушения пораженных клеток оставшиеся живые клетки, которые не экспрессировали летальный полипептид в той степени, которая необходима для того, чтобы убить эти клетки, отделяют от мертвых клеток, и эти живые клетки возвращают в организм субъекта.
В одном воплощении изобретения полинуклеотид, введенный в клетки, удаляют перед возвращением клеток в организм субъекта, в другом воплощении полинуклеотид не удаляют из клеток перед возвращением клеток в организм субъекта. Это позволяет осуществлять деструкцию возвращенных клеток in vivo при появлении рецидива заболевания.
Другое воплощение изобретения относится к способам индивидуализации лечения субъекта, нуждающегося в лечении аномального состояния, включающим получение популяции клеток от субъекта, определение активности по меньшей мере одного маркерного гена заболевания в популяции клеток, выделение по меньшей мере одного промотора маркерного гена заболевания и создание терапевтического полинуклеотида путем прямого или опосредованного связывания промотора с полинуклеотидом, кодирующим полипептид, являющийся летальным для указанных клеток, и размещения его в вектор, дополнительно включающий селектируемый маркер. Терапевтический полинуклеотид вводят в клетки, и клетки подвергают воздействию в условиях селекции с целью получения клеток, содержащих полинуклеотид, и затем обрабатывают в условиях индукции экспрессии летального полипептида, тем самым разрушая клетки, экспрессирующие маркерный ген заболевания. Оставшиеся живые непораженные клетки затем возвращают обратно субъекту.
Краткое описание графических материалов
На Фиг.1 изображена рабочая схема последовательности операций типичного процесса обработки с использованием способов по настоящему изобретению. Способы, изображенные на Фиг.1, включают геномную интеграцию, селекцию и киллинг. Возможно, что конструкции могут быть вырезаны из генома. На рисунке также приведены неограничивающие вариации способов, которые находятся в пределах объема настоящего изобретения. Любой способ геномной интеграции (G1, G2 или G3) может быть комбинирован с любым способом селекции (S1, S2 или S3) и клеточного киллинга (K1, K2, K3 или K4). В свою очередь, также может быть выбран любой способ вырезания из генома (Е1, Е2 или Е3), если в данном геноме присутствуют компоненты, которые будут допускать вырезание.
На Фиг.2 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.2 генная программа (gene program) PE3-1 представляет собой селекторный/репортерный ген геномной интеграции. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией летального полипептида, например DTA (дифтерийный токсин). Генная программа РЕ3-3 представляет собой индуцибельный промотор, например TetO (тетрациклиновый оператор), управляющий экспрессией рекомбиназы, например Cre. Генная программа РЕ3-4 представляет собой конститутивный промотор, управляющий экспрессией индукторной кДНК, например rТТА (обратный тетрациклин-контролируемый трансактиватор). Генные программы РЕ3-ns представляют собой негативные селекторные/репортерные гены, которые могут быть использованы для улучшения целевой эффективности. Символ в виде стрелки означает цис-регуляторные последовательности, например IoxP, которые распознаются ферментом рекомбиназой, например Cre. Круги означают области в полинуклеотидной последовательности, которые могут содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
На Фиг.3 изображено другое воплощение терапевтических полинуклеотидов по настоящему изобретению. На фиг.3 генная программа PE3-1 представляет собой селекторный/репортерный ген геномной интеграции. Генные программы РЕ3-2 и РЕ3-3 каждая представляет собой промотор маркерного гена заболевания, управляющий экспрессией одной из двух половинок транскрипционного фактора Rheo. Генная программа РЕ3-4 представляет собой промотор Rheo, управляющий экспрессией летального полипептида, например DTA. Промотор Rheo требует присутствия транскрипционного фактора Rheo, который состоит из двух субъединиц, связанных вместе в присутствии лиганда. Каждая из субъединиц транскрипционного фактора Rheo экспрессируется под действием генных программ РЕ3-2 и РЕ3-3, соответственно. Генная программа РЕ3-5 представляет собой конститутивный промотор, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-6 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией рекомбиназы, например Cre. Генные программы РЕ3-ns представляют собой негативные селекторные/репортерные гены, которые могут быть использованы для улучшения целевой эффективности. Символ в виде стрелки означает цис-регуляторные последовательности, например IохР, которые распознаются ферментом рекомбиназой, например Cre. Круги означают области в полинуклеотидной последовательности, которые могут содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
На Фиг.4 изображено другое воплощение терапевтических полинуклеотидов по настоящему изобретению. На Фиг.4 генная программа РЕ3-1 представляет собой селекторный/репортерный ген геномной интеграции. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией летального полипептида, например DTA. Генная программа РЕ3-3 представляет собой промотор маркерного гена заболевания, управляющий экспрессией летального полипептида. Промотор и летальный полипептид могут быть идентичными промотору и летальному полипептиду в генной программе РЕ3-2 или отличаться от них. Генная программа РЕ3-4 представляет собой конститутивный промотор, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-5 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией рекомбиназы, например Cre. Генные программы РЕ3-ns представляют собой негативные селекторные/репортерные гены, которые могут быть использованы для улучшения целевой эффективности. Символ в виде стрелки означает цис-регуляторные последовательности, например IохР, которые распознаются ферментом рекомбиназой, например Cre. Круги означают области в полинукпеотидной последовательности, которые могут содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
На Фиг.5 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.5 генная программа РЕ3-1 представляет собой селекторный/репортерный ген геномной интеграции. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией летального полипептида, например DTA. Генная программа РЕ3-3 представляет собой конститутивный промотор, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-4 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией рекомбиназы, например Cre. Генная программа РЕ3-5 представляет собой конститутивный промотор, управляющий экспрессией факторов, которые стимулируют дедифференцировку клеток-предшественников. Генные программы РЕ3-ns представляют собой негативные селекторные/репортерные гены, которые могут быть использованы для улучшения целевой эффективности. Символ в виде стрелки обозначает цис-регуляторные последовательности, например IохР, которые распознаются ферментом рекомбиназой, например Cre. Круги означают области в полинуклеотидной последовательности, которые могут содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
На Фиг.6 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.6 генная программа РЕ3-1 представляет собой селекторный ген neo под контролем конститутивного промотора. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-3 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией летального полипептида, например DTA. Круги означают области в полинуклеотидной последовательности, которые могут содержать домен модификации хроматина (CMD).
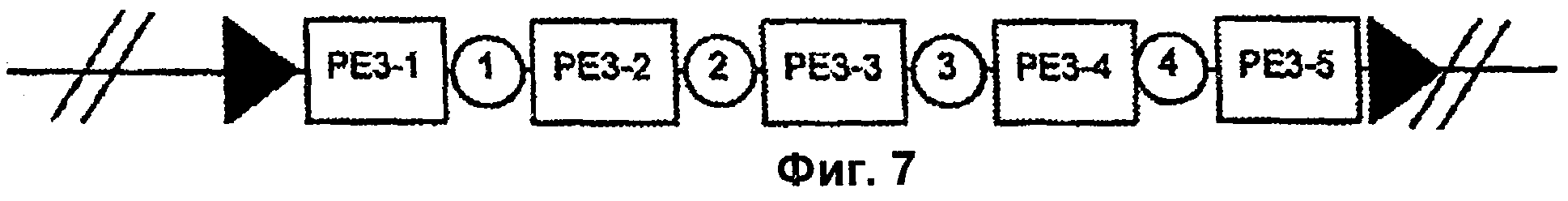
На Фиг.7 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.7 генная программа РЕ3-1 представляет собой селекторный ген геномной интеграции, например neo, управляемый промотором, специфическим для клеток-предшественников. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-3 представляет собой индуцибельный промотор, например TetO, управляющий экспрессией гена-киллера, например DTA. Генная программа РЕ3-4 представляет собой конститутивный промотор, управляющий экспрессией второй индукторной кДНК, например RheoCept®. Генная программа РЕ3-5 представляет собой индуцибельный промотор, например RheoSwitch®, управляющий экспрессией рекомбиназы, например Cre, с целью делетирования конструкции. Символы в виде стрелок обозначают цис-регуляторную последовательность, распознаваемую ферментом рекомбиназой, например сайт IохР. Круги означают область в полинуклеотидной последовательности, которая может содержать домен модификации хроматина (CMD).
На Фиг. 8 изображено одно из воплощений терапевтических полинуклеотидов по настоящему изобретению. На Фиг.8 генная программа РЕ3-1 представляет собой селекторный ген геномной интеграции, управляемый промотором стволовых клеток. Генная программа РЕ3-2 представляет собой промотор маркерного гена заболевания, управляющий экспрессией индукторной кДНК, например rТТА. Генная программа РЕ3-3 представляет собой индуцибельный промотор, например TetO, управляющий субстратом на основе фермента для летальной конверсии гена-киллера, например тимидинкиназы. Генные программы РЕ3-ns представляют собой негативные селекторные гены, например конститутивный промотор, управляющий экспрессией цитозиндеаминазы (CDA) или дифтерийного (DTA) токсина, для улучшения целевой эффективности. Круги означают область в полинуклеотидной последовательности, которая может содержать домен модификации хроматина (CMD). GIS-1 и GIS-2 представляют собой сайты геномной интеграции.
Подробное описание изобретения
Настоящее изобретение относится к способам и композициям для лечения субъекта, направленным на разрушение пораженных клеток у этого субъекта. Способы включают получение популяции клеток от субъекта и определение активности по меньшей мере одного маркерного гена заболевания в популяции полученных клеток. Затем молекулу полинуклеотида, которая кодирует полипептид, летальный в отношении данных клеток, вводят в клетки, где экспрессия летального полипептида находится под контролем промотора по меньшей мере одного из идентифицированных ранее маркерных генов заболевания. После введения полинуклеотида клетки обрабатывают в условиях индукции экспрессии летального полипептида с целью разрушения клеток, экспрессирующих маркерный ген(ы) заболевания. После разрушения пораженных клеток оставшиеся живые клетки, которые не экспрессировали летальный полипептид в той степени, которая необходима для того, чтобы убить эти клетки, отделяют от мертвых клеток, и живые клетки возвращают обратно в организм субъекта.
В одном воплощении изобретения полинуклеотид, введенный в клетки, удаляют перед возвращением клеток в организм субъекта. В другом воплощении полинуклеотид не удаляют из клеток перед возвращением клеток в организм субъекта. Это позволяет осуществлять деструкцию введенных обратно клеток in vivo при появлении рецидива заболевания.
Как использовано в данном описании, термин "пораженная клетка" применяется для обозначения клетки или клеток с отклонениями от нормы либо в метаболизме, гистологии, скорости роста, скорости митоза, либо в фенотипе. Использованный в данном описании в отношении клеток термин "фенотип" применяется для обозначения совокупности белков, которые в норме клетка экспрессирует из конкретных ткани или органа. Например, фенотипы индивидуальных выделенных клеток могут быть оценены или классифицированы на основании наличия или отсутствия маркеров клеточной поверхности, таких как кластеры дифференцировки (CD факторы), которые представляют собой антигены клеточной поверхности. Несмотря на то, что обычно считается, что фенотипом клеток является совокупность белков, которые клетка экспрессирует или содержит, для адекватной классификации клетки в заданной популяции или субпопуляции либо для оценки ее фенотипа может быть необходимо только определить наличие или отсутствие единственного белка. Таким образом, используемый в данном описании термин "фенотип" применяется для соотнесения с конкретной популяцией или субпопуляцией, к которой принадлежит клетка, на основании наличия или отсутствия по меньшей мере одного белка или его части. Например, конкретные воплощения настоящего изобретения включают выделение CD34+-клеток, которые в норме обнаруживаются в периферической крови и костном мозге. Продолжая пример, фенотип заданной популяции или субпопуляции выделенных клеток просто может быть установлен как позитивный по CD34 (CD34+) или негативный по CD34 (CD34-). Несомненно, с целью классификации клетки в заданной популяции или субпопуляции клеток способы по настоящему изобретению также включают определение наличия или отсутствия более чем одного белка. Примеры CD-белков, которые могут быть использованы для классификации клеточных фенотипов, включают, но этим не ограничиваются, CD3, CD38, CD59, CD49, CD54, CD61 (витронектиновый рецептор), CD71, CD73 (SH3), CD90 (Thy-1), CD105 (SH2), CD117, CD133, CD144 и CD166. Для определения фенотипа заданной клетки или популяции клеток также можно использовать и другие белки. Примеры других белков, которые можно использовать для классификации клеточного фенотипа, включают, но этим не ограничиваются, транскрипционные факторы, такие как ОСТ4, cdx2 и Sox2, белки-транспортеры, такие как плацентарный АВС(АТФ-связывающий кассетный)-транспортер (АВС-р), и другие антигены клеточной поверхности, такие как кератинсульфат-ассоциированные антигены, TRA-1-60, TRA-1-81, Thy-1 и стадиеспецифичные эмбриональные антигены (SSEA), например SSEA-1, SSEA-2, SSEA-3 и SSEA-4. Следующие примеры белков, которые могут быть использованы для классификации клеточного фенотипа, включают рецепторы ростовых факторов, такие как рецепторы к фактору роста фибробластов (FGF), трансформирующему ростовому фактору-альфа (TGFα), трансформирующему ростовому фактору-бета (TGFβ), активину IIа и белку, участвующему в остеогенезе (BMP), а также белки главного комплекса гистосовместимости (МНС), т.е. белки МНС класса I и класса II. Следующие примеры маркеров, которые могут быть использованы для идентификации клеточных фенотипов, представляют собой СК (цитокератин) 9, СК19, pdx-1, нестин, Рах-6, Nk×2.2, нейрофиламент, Таи, нейрон-специфическую енолазу (NSE), нейрофиламентозный белок (NF), ассоциированный с микротрубочками белок 2 (МАР2), МАР2-киназу, фибриллярный кислый белок глии (GFAP) и циклонуклеотид-фосфодиэстеразу. К тому же, для оценки или классификации клеточного фенотипа также может оказаться возможным детектировать наличие или отсутствие частей или доменов белков, а не целого белка. Например, некоторые белки могут содержать src-гомологичный домен (SH), такой как SH1, SH2, SH3, SH4 и т.д., наличия или отсутствия которого может быть достаточно для адекватной оценки или классификации клеточного фенотипа, например SH2+ или SH2-. Как описано выше, фенотип клеток также может быть оценен или классифицирован по отсутствию конкретных белков.
Способы идентификации клеточных фенотипов включают, но этим не ограничиваются, стандартные иммуногистохимические методики с использованием антиген-специфических антител, таких как, например анти-CD34 антитела. Другие способы оценки или классификации клеточного фенотипа включают, но этим не ограничиваются, стандартные методики блоттинга, такие как вестерн-блоттинг и нозерн-блоттинг, и методики полимеразной цепной реакции (ПЦР), такие как ПЦР с использованием обратной транскриптазы (ОТ-ПЦР). В самом деле, должно быть очевидно, что непрямые способы, такие как анализы с измерением или детекцией мРНК, например ОТ-ПЦР, можно использовать для оценки или классификации клеточного фенотипа. Другие способы оценки или классификации фенотипов клеток включают методики с применение микромассивов и методики проточной цитометрии. Примеры методик проточной цитометрии, полезных для сортинга клеток, основанных на их фенотипе, описаны в книге Practical Flow Cytometry, 3-е издание, Wiley-Liss, Inc. (1995), которая тем самым включена посредством ссылки.
Пораженная клетка может иметь, например, аномальный фенотип по сравнению с другими клетками, взятыми из того же источника или ткани. Например, гемопоэтические стволовые клетки в норме экспрессируют CD34 и CD59, но не экспрессируют CD4, который в норме экспрессируется тимоцитами, Т-хелперными клетками, макрофагами, клетками Лангерганса, дендритными клетками или гранулоцитами. Поэтому любая гемопоэтическая стволовая клетка, которая экспрессирует CD34, CD59 и CD4, для задач настоящего изобретения может считаться имеющей аномальный фенотип, т.е. являться пораженной клеткой. В одном воплощении клетки включают гемопоэтические стволовые клетки, среди которых по меньшей мере часть гемопоэтических стволовых клеток представляют собой пораженные клетки.
Другие примеры стволовых клеток включают, но этим не ограничиваются, стволовые клетки печени, стволовые клетки молочной железы, панкреатические стволовые клетки, нейронные стволовые клетки, мезенхимные стволовые клетки и эмбриональные стволовые клетки. Стволовые клетки могут быть или могут не быть плюрипотентными. "Плюрипотентные клетки" включают клетки и их потомство, которые могут быть способны к дифференцировке в, или способны давать плюрипотентные, мультипотентные, олигопотентные и унипотентные клетки. "Мультипотентные клетки" включают клетки и их потомство, которые могут быть способны к дифференцировке в, или способны давать мультипотентные, олигопотентные и унипотентные клетки-предшественники и/или один или более чем один тип зрелых или частично зрелых клеток, за исключением того, что типы зрелых или частично зрелых клеток, происходящих из мультипотентных клеток, ограничены клетками конкретной ткани, органа или системы органов. Как использовано в данном описании, "частично зрелыми клетками" являются клетки, которые демонстрируют по меньшей мере одну характерную черту фенотипа, такую как морфология или экспрессия белков, зрелой клетки из того же органа или ткани. Например, мультипотентная гемопоэтическая клетка-предшественник и/или ее потомство обладают способностью к дифференцировке в, или способны давать один или более типов олигопотентных клеток, таких как миелоидные клетки-предшественники и лимфоидные клетки-предшественники, и кроме того способны давать другие зрелые клеточные компоненты, в норме обнаруживаемые в крови. "Олигопотентные клетки" включают клетки и их потомство, чья способность к дифференцировке в зрелые или частично зрелые клетки более ограничена по сравнению с мультипотентными клетками. Однако олигопотентные клетки все еще могут обладать способностью к дифференцировке в олигопотентные и унипотентные клетки и/или один или более чем один тип зрелых или частично зрелых клеток заданной ткани, органа или системы органов. Одним из примеров олигопотентной клетки является миелоидная клетка-предшественник, которая в конечном счете способна давать зрелые или частично зрелые эритроциты, тромбоциты, базофилы, эозинофилы, нейтрофилы и моноциты. "Унипотентные клетки" включают клетки и их потомство, которые обладают способностью к дифференцировке в, или способны давать другие унипотентные клетки и/или один тип зрелых или частично зрелых клеток. Используемый в данном описании термин "клетка-предшественник" применяется для обозначения клеток и их потомства, которые могут дифференцироваться по меньшей мере в частично зрелые клетки, но не обладают способностью к неограниченному самовосстановлению в культуре. Клетки-предшественники, как они использованы в данном описании, могут быть плюрипотентными, мультипотентными, олигопотентными или даже унипотентными.
Способы по настоящему изобретению включают получение популяции клеток от субъекта, нуждающегося в лечении. Используемый в данном описании термин "субъект" применяется взаимозаменяемо с термином "пациент" и используется для обозначения животного, в частности млекопитающего, и еще более конкретно примата, не являющегося или являющегося человеком.
Используемый в данном описании термин "получение", когда он применен в отношении клеток, предназначен для обозначения любого способа изъятия клеток у субъекта. Нет необходимости в выделении или очистке клеток, если они получены от субъекта. Клетки могут быть получены из любой жидкости организма субъекта (например крови, сыворотки, мочи, слюны, цереброспинальной жидкости) или из образцов ткани субъекта (например биоптатов, пунктатов костного мозга). После того как получены, желаемые клетки далее могут быть выделены.
Используемый в данном описании термин "выделенный" или "выделение" либо его варианты, когда он применен в отношении клетки или популяции клеток, означает, что клетка или популяция клеток отделены от большей части присутствующих окружающих молекул и/или веществ, которые окружают клетку или клетки, когда клетка или клетки находились в ассоциации с биологической системой (например, в костном мозге). Концентрацию таких веществ, как вода, соли и буфер, не учитывают, когда определяют, является ли клетка "выделенной". Таким образом, термин "выделенный" не предназначен для обозначения очищенной популяции клеток конкретного фенотипа или указания на нее, также не предназначен для обозначения популяции клеток, полностью свободных от остатков клеток, нежизнеспособных клеток или клеток другого фенотипа. Методы выделения клеток не должны ограничивать объем изобретения, изложенный в данном описании. Например, клетки могут быть выделены с использованием хорошо известных методов, таких как проточная цитометрия или другие методы, использующие клеточный фенотип. Дополнительные методы выделения клеток включают использование позитивных или негативных "селекторов", которые могут содержаться в терапевтических конструкциях, так что клетки могут быть выделены до или после введения терапевтического полинуклеотида в эти клетки. Таким образом, в одном воплощении конструкция может содержать позитивный "селектор", который может быть использован для "выделения" желаемых клеток из других клеток, полученных изначально. Используемый в данном описании термин "очищенный", когда он применен в отношении клетки или популяции клеток, означает, что клетка или клетки отделены по существу от всех веществ, которые в норме окружают клетку или клетки, когда данная клетка или клетки были связаны с биологической системой. Таким образом, термин "очищенный" является относительным и основывается на изменении в состояниях в терминах клеток и/или веществ, очень близких к выделенным клеткам, являющихся очищенными. Таким образом, выделенные гемопоэтические клетки считаются очищенными, даже если после выделения удаляется путем промывания или последующей обработки по меньшей мере некоторое количество клеточных остатков, нежизнеспособных клеток, клеток другого фенотипа или клеток либо таких молекул, как белки и/или углеводы. Термин "очищенный" не используется для обозначения того, что все вещество, предназначенное для удаления, удалено из клеток, являющихся очищенными. Поэтому некоторое количество примесей может присутствовать вместе с очищенными клетками.
В одном воплощении активность по меньшей мере одного маркерного гена заболевания определяют после того, как получены клетки, в другом воплощении активность по меньшей мере одного маркерного гена заболевания определяют до того, как клетки получены. Таким образом, можно допустить или предположить наличие активности одного или более маркерных генов заболевания, если заболевание или аномальное состояние у этого субъекта демонстрирует типичные симптомы или маркеры заболеваний или аномальных состояний, для которых установлена активность набора маркерных генов заболевания. Используемый в данном описании термин "маркерный ген заболевания" предназначен для обозначения гена, уровни экспрессии которого могут быть использованы для оценки, диагностики или помощи в постановке диагноза заболевания или аномального состояния. Маркерные гены заболевания включают гены, которые экспрессируются только в пораженных клетках, и гены, которые экспрессируются в обычных клетках, а в пораженных клетках экспрессируются с повышенными уровнями. Наиболее хорошо известными примерами маркерных генов заболевания являются онкогены, но способы по настоящему изобретению, однако, не ограничены онкогенами. Примеры классов онкогенов включают, но этим не ограничиваются, ростовые факторы, рецепторы ростовых факторов, протеинкиназы, регуляторы программированной клеточной смерти и транскрипционные факторы. Конкретные примеры онкогенов включают, но этим не ограничиваются, sis, erb В, erb B-2, ras, abl, myc и bcl-2 и TERT (теломеразная обратная транскриптаза). Примеры других маркерных генов заболевания включают гены опухолеассоциированных антигенов и другие гены, которые сверхэкспрессируются в пораженных клетках (например MAGE-1 (меланома-ассоциированный антиген 1), карциноэмбриональный антиген, тирозиназа, антиген предстательной железы, поверхностный антиген предстательной железы, р53, MUC-1 (муцин-1), MUC-2, MUC-4, HER-2/neu (рецептор 2 эпидермального фактора роста у людей/грызунов), Т/Th, MART-1 (меланомный антиген, распознаваемый Т-клетками), gp100, GM2 (ганглиозный антиген 2), Tn, sTn и антиген Томсена-Фриденрайха (TF)).
После того как маркерные гены заболевания определены, промоторы этих маркерных генов заболевания помещают в терапевтический полинуклеотид. Используемый в данном описании термин "терапевтический полинуклеотид" применяется для обозначения полинуклеотида, который вводят в популяцию клеток с целью разрушения пораженных клеток. В одном воплощении промотор вставлен в полинуклеотид таким образом, что он функционально связан с частью полинуклеотида, который кодирует полипептид, являющийся летальным в отношении клеток. Поэтому в способах используется аномальная активность пораженной клетки, так что пораженная клетка в конечном счете будет разрушать саму себя. Используемый в данном описании термин "функционально связанный" означает функциональную связь между последовательностью, контролирующей экспрессию нуклеиновой кислоты, (такой как промотор, или совокупность сайтов связывания транскрипционных факторов) и второй нуклеиновокислотной последовательностью, при этом контролирующая экспрессию последовательность управляет транскрипцией нуклеиновой кислоты, соответствующей второй последовательности. В другом воплощении промотор связан с экспрессией летального полипептида опосредованно. Например, промотор маркера заболевания может быть функционально связан с транскрипционным фактором, который активирует второй промотор, функцинально связанный с полинуклеотидом, кодирующим летальный полипептид.
Термин "промотор" применяется в данном описании аналогично его использованию в данной области техники. А именно, термин промотор относится к области ДНК, которая позволяет осуществлять связывание РНК-полимеразы с целью инициации транскрипции генетической последовательности. Последовательность многих маркерных генов заболевания, включая промоторную область, известна в данной области техники, и к ней есть доступ в опубликованных базах данных, например GenBank. Таким образом, после того, как в полученных или выделенных клетках идентифицирован маркерный ген заболевания, последовательность промотора можно легко идентифицировать и получить. Другой аспект настоящего изобретения относится к идентификации маркерного гена заболевания, промотор которого может быть выделен и помещен в терапевтический полинуклеотид. Поэтому идентификация маркерного гена заболевания может быть не критична для конкретных воплощений настоящего изобретения, если только промотор может быть выделен и использован в последующих условиях или окружениях. Следовательно, настоящее изобретение включает применение промоторов маркерных генов заболевания, которые еще будут идентифицированы. После того как новые маркерные гены заболевания идентифицированы, предметом обычной практики или экспериментирования может быть определение генетических последовательностей, необходимых для функционирования промотора. Действительно, существует несколько промышленных протоколов, оказывающих помощь в определении промоторной области генов, представляющих интерес. В качестве примера, Ding и др. недавно раскрыли последовательность промотора нового гена Sprouty4 (Am. J.Physiol. Lung Cell. Mol. Physiol., 287: L52-L59 (2004), что включено посредством ссылки) путем постепенного удаления 5'-фланкирующей последовательности гена Sprouty4 человека. Кратко, после того, как был определен сайт инициации транскрипции, были созданы ПЦР-фрагменты с использованием общих ПЦР-праймеров для клонирования сегментов 5'-фланкирующего сегмента в одном направлении. Образованные сегменты клонировали в люциферазный репортерный вектор и измеряли люциферазную активность с целью определения области промотора гена Sprouty4 человека.
Другой пример протокола получения и подтверждения достоверности промоторов маркерного гена заболевания включает следующие стадии: (1) получения образцов злокачественных и незлокачественных клеток/тканей подобного/того же самого тканевого типа; (2) выделения общей РНК или мРНК из данных образцов; (3) проведения дифференциального анализа с использованием микромассива злокачественных и незлокачественных РНК; (4) идентификации рак-специфических транскриптов-кандидатов; (5) идентификации геномных последовательностей, ассоциированных с рак-специфическими транскриптами; (6) получения или синтеза последовательности ДНК в обратном направлении и в прямом направлении по отношению к прогнозируемому сайту инициации транскрипции рак-специфического транскрипта; (7) конструирования и изготовления промоторных репортерных векторов с использованием ДНК разной длины со стадии 6; и (8) тестирования промоторных репортерных векторов в злокачественных и незлокачественных клетках/тканях, а также в неродственных клетках/тканях.
Источник промотора, который вводят посредством вставки в терапевтический полинуклеотид, может быть природным или синтетическим, и этот источник промотора не должен ограничивать объем изобретения, изложенный в данном описании. Другими словами, промотор может быть клонирован непосредственно из полученных или выделенных клеток, или промотор может быть клонирован заранее из другого источника, или промотор может быть синтезирован.
В одном воплощении промотор функционально связан с полинуклеотидом, кодирующим полипептид, который, если он экспрессирован, является летальным в отношении клетки, экспрессирующей этот полипептид, либо поскольку сам полипептид является летальным, либо полипептид дает соединение, которое является летальным. Использованный в данном описании термин "полипептид, летальный в отношении клеток" также включает полипептиды, которые индуцируют клеточную смерть любым образом, включая некроз, апоптоз и цитотоксичность, но не ограничиваясь этим. Примеры полипептидов, которые могут быть летальными в отношении клеток, включают, но этим не ограничиваются, апоптоз-индуцирующие опухоль-супрессорные гены, такие как р53, Rb и BRCA-1, но не ограничиваются, токсины, такие как дифтерийный токсин (DTA), нейротоксин шигеллы, ботулотоксин, столбнячный токсин, холерный экзотоксин, CSE-V2 и некоторые другие варианты белковых токсинов (из яда) скорпионов, продукты генов-самоубийц, такие как цитозиндеаминаза и тимидинкиназа, и цитотоксических генов, например фактор некроза опухоли, интерферон-альфа. Настоящее изобретение не ограничено индивидуальными чертами летального белка, при условии, что данный белок способен быть летальным в отношении клетки, в которой он экспрессируется.
В другом воплощении промотор маркерного гена заболевания связан с экспрессией летального полипептида опосредованно. В одном воплощении промотор маркерного гена заболевания функционально связан с полинуклеотидом, кодирующим транскрипционный фактор, а полинуклеотид, кодирующий летальный полипептид, функционально связан с промотором, который активируется транскрипционным фактором. Транскрипционный фактор может быть лиганд-зависимым транскрипционным фактором, активирующим транскрипцию только в присутствии лиганда, например члены суперсемейства стероидных рецепторов, активируемые их соответствующими лигандами, (например глюкокортикоид, эстроген, прогестин, ретиноид, экдизон и их аналоги и миметики) или rТТА, активируемый тетрациклином. Транскрипционный фактор может быть полипептидом природного происхождения или химерным полипептидом, содержащим домены от двух или более разных транскрипционных факторов. Например, лиганд-связывающий домен, трансактивирующий домен и ДНК-связывающий домен каждый может быть получен из двух или трех разных транскрипционных факторов. В одном воплощении транскрипционный фактор представляет собой фактор, который жестко регулируется уровнем присутствующего лиганда. В другом воплощении домены транскрипционного фактора могут быть экспрессированы в виде отдельных полипептидов, так что активация транскрипции имеет место только тогда, когда два полипептида образуют совместный димер (и присутствует лиганд). Одним примером такой системы являются химерные системы на основе рецептора экдизона, описанные в патенте США №7091038, опубликованных заявках на патент США №№2002/0110861, 2002/0119521, 2004/0033600, 2004/0096942, 2005/0266457 и 2006/0100416 и опубликованных международных заявках №№WO 01/70816, WO 02/066612, WO 02/066613, WO 02/066614, WO 02/066615, WO 02/29075 и WO 2005/108617; все они включены посредством ссылки во всей своей полноте. Примером системы, регулируемой нестероидным агонистом экдизона, является индуцибельная экспрессирующая система млекопитающих RheoSwitch® (New England Bioiabs, Ipswich, MA).
Для того чтобы ввести терапевтический полинуклеотид в клетки, можно выбрать вектор, содержащий выбранный промотор и полинуклеотид, кодирующий летальный полипептид. Вектором может быть, например плазмидный вектор, вектор на основе одно- или двунитевого фага либо вирусный вектор на основе одно- или двуцепочечной РНК или ДНК. Такие векторы могут быть введены в клетки посредством хорошо известных методик введения ДНК и РНК в клетки. Вирусные векторы могут быть компетентными в отношении репликации или дефектными в отношении репликации. В последнем случае размножение вируса обычно будет происходить только в комплементирующих клетках хозяина. Использованный в данном описании термин "клетка-хозяин" или "хозяин" применяется для обозначения клетки по настоящему изобретению, несущей один или более терапевтических полинуклеотидов.
Таким образом, как минимум, векторы должны включать промотор от маркерного гена заболевания и полинуклеотид, кодирующий летальный полипептид. Другие компоненты вектора могут включать, но этим не ограничиваться, селектируемые маркеры, домены модификации хроматина, дополнительные промоторы, управляющие экспрессией других полипептидов, которые также могут присутствовать в векторе, сайты геномной интеграции, сайты рекомбинации и молекулярные вставки-"стержни" (molecular insertion pivots). Векторы могут содержать любое количество этих дополнительных элементов, таким образом, такая конструкция может быть приспособлена для конкретных задач желаемых способов лечения.
В одном воплощении настоящего изобретения векторы, которые вводят в клетки, дополнительно содержат "селектируемый маркерный ген", который, когда он экспрессирован, показывает, что терапевтическая конструкция по настоящему изобретению интегрирована в геном клетки-хозяина. Таким образом, селекторный ген может быть позитивным маркером для геномной интеграции. Несмотря на то что это не является критическим для способов по настоящему изобретению, присутствие селектируемого маркерного гена позволяет практикующему специалисту отбирать такую популяцию живых клеток, где векторная конструкция интегрирована в геном клеток. Таким образом, некоторые воплощения настоящего изобретения включают отобранные клетки, в которые вектор успешно интегрирован. Использованный в данном описании термин "проводить селекцию" или его вариации, когда он используется в связи с клетками, предназначен для обозначения стандартных, хорошо известных способов выбора клеток с конкретной организацией генома или с конкретным фенотипом. Типичные способы включают, но этим не ограничиваются, культивирование клеток в присутствии антибиотиков, таких как G418, неомицин и ампициллин. Другие примеры селектируемых маркерных генов включают, но этим не ограничиваются, гены, дающие устойчивость к дигидрофолатредуктазе, гигромицину или микофенольной кислоте. Другие способы селекции включают, но этим не ограничиваются, использование селектируемого маркерного гена, который разрешает применение тимидинкиназы, гипоксантин-гуанин-фосфорибозилтрансферазы и аденин-фосфорибозилтрансферазы в качестве селектируемых агентов. Клетки, содержащие векторную конструкцию, включающую в себя ген или гены устойчивости к антибиотику, далее будут толерантны к антибиотику в культуре. Аналогично, клетки, не содержащие векторную конструкцию, включающую в себя ген или гены устойчивости к антибиотику, не будут толерантны к антибиотику в культуре.
При использовании в данном описании, "домен модификации хроматина" (CMD) относится к нуклеотидным последовательностям, которые взаимодействуют с рядом белков, ассоциированных с поддержанием структуры и/или воздействием на структуру хроматина, таких как, но этим не ограничиваясь, ДНК инсуляторы. См. Ciavatta, D., et al., Proc. Nat'l Acad. Sci. U.S.A., 103(26); 9958-9963 (2006), что включено в данное описание посредством ссылки. Примеры CMD включают, но этим не ограничиваются, β-глобулиновый инсулятор цыпленка и гиперчувствительный сайт 4 цыпленка (chicken hypersensitive site; cHS4). Использование разных последовательностей CMD в одной или более генных программах может, например, облегчить применение различных последовательностей ДНК CMD в качестве "плеч минигомологии" для комбинирования с использованием различных микроорганизмов или рекомбинантных технологий in vitro с целью "обмена" генными программами между существующими "челночными" векторами, несущими много генов и несущими один ген. Другие примеры доменов модификации хроматина известны в данной области техники или могут быть легко идентифицированы.
Конкретными векторами для применения в настоящем изобретении являются экспрессирующие векторы, кодирующие белки или их части. Обычно такие векторы содержат цис-действующие контрольные области, эффективные для экспрессии в хозяине, оперативно связанные с полинуклеотидом, который должен быть экспрессирован. Соответствующие транс-действующие факторы обеспечиваются хозяином, обеспечиваются комплементирующим вектором или обеспечиваются самим вектором после введения его в хозяина.
Для экспрессии белков может быть использовано большое разнообразие экспрессирующих векторов. Такие векторы включают хромосомные, эписомные векторы и векторы вирусного происхождения, например векторы, происходящие из бактериальных плазмид, из бактериофага, из эписом дрожжей, из хромосомных элементов дрожжей, из таких вирусов, как аденоассоциированные вирусы, лентивирусы, бакуловирусы, паповавирусы, такие как SV40 (обезьяний вирус), вирус коровьей оспы, аденовирусы, вирусы птичьей оспы, вирусы псевдобешенства и ретровирусы, и векторы, происходящие из их комбинаций, как, например, векторы, происходящие из генетических элементов плазмид и бактериофагов, такие как космиды и фагмиды. Все они могут быть использованы для экспрессии в соответствии с этим аспектом настоящего изобретения. Обычно любой вектор, подходящий для поддержания, размножения или экспрессии полинуклеотидов или белков в хозяине, в этом смысле может быть использован для экспрессии.
Последовательность ДНК в экспрессирующем векторе оперативно связана с соответствующей контролирующей экспрессию последовательностью(ями), включая, например промотор, с целью направления транскрипции мРНК. Типичные представители дополнительных промоторов включают, но этим не ограничиваются, конститутивные промоторы и тканеспецифические или индуцибельные промоторы. Примеры конститутивных промоторов эукариот включают, но этим не ограничиваются, промотор гена металлотионеина I (metallothionein I) мыши (Hamer et al., J. Mol. Appl. Gen. 1: 273-288 (1982)); промотор ТК (тимидинкиназа) вируса герпеса (McKnight, Cell 31: 355-365 (1982)); ранний промотор SV40 (Benoist, et al., Nature (London) 290: 304-310 (1981)); и промотор вируса коровьей оспы. Все перечисленные выше ссылки включены в данное описание посредством ссылки. Дополнительные примеры промоторов, которые могли бы быть использованы для управления экспрессией белка, включают, но этим не ограничиваются, тканеспецифические промоторы и другие эндогенные промоторы конкретных белков, такие как промотор альбумина (гепатоциты), промотор проинсулина (панкреатические бета-клетки) и тому подобное. В общем случае экспрессирующие конструкции будут содержать сайты транскрипции, инициации и терминирования и, в транскрибируемой области, сайт связывания с рибосомой для осуществления трансляции. Кодирующий участок зрелых транскриптов, экспрессируемых посредством данных конструкций, может включать инициирующий трансляцию кодон AUG в начале и терминирующий кодон (UAA, UGA или UAG), соответственно расположенный на конце полипептида, который должен быть транслирован.
К тому же, конструкции могут содержать контрольные участки, которые регулируют, а также вызывают экспрессию. Обычно такие области будут действовать как контролирующие транскрипцию, как например, среди прочего, репрессор-связывающие сайты и энхансеры.
Вектор, содержащий соответствующую нуклеотидную последовательность, а также соответствующий промотор и другие соответствующие контрольные последовательности, может быть введен в клетку по настоящему изобретению с использованием ряда хорошо известных методик, подходящих для экспрессии желаемого полипептида.
Примеры векторов эукариот включают, но этим не ограничиваются, pW-LNEO, pSV2CAT, pOG44, pXT1 и pSG, приобретаемые у Stratagene; pSVK3, pBPV, pMSG и pSVL, приобретаемые у Amersham Pharmacia Biotech; и pCMVDsRed2-express, plRES2-DsRed2, pDsRed2-Mito, pCMV-EGFP, приобретаемые у Clontech. Хорошо известны многие другие векторы, и они имеются в продаже.
Особенно полезные векторы, которые содержат молекулярные вставки-"стержни" для быстрой вставки и удаления элементов генных программ, описаны в опубликованной заявке на патент Соединенных Штатов Америки №2004/0185556, заявке на патент Соединенных Штатов Америки №11/233246 и опубликованных международных заявках №№WO 2005/040336 и WO 2005/116231; все они включены посредством ссылки. Примером таких векторов является продуцирующая система Ultra Vector™ Production System (Intrexon Corp., Blacksburg, VA). Как использовано в данном описании, "генная программа" представляет собой комбинацию генетических элементов, содержащую промотор (Р), экспрессируемую последовательность (Е) и 3'-регуляторную последовательность (3), таким образом "РЕ3", которая представлена на рисунках, является генной программой. Элементы в пределах генной программы легко могут быть поменяны местами между молекулярными "стержнями", которые фланкируют каждый из элементов генной программы. Молекулярный "стержень", использованный в данном описании, определен как полинуклеотид, содержащий по меньшей мере два неизменяющихся редко встречающихся или необычных рестрикционных сайта, расположенных линейно. В одном воплощении молекулярный "стержень" содержит по меньшей мере три неизменяющихся редко встречающихся или необычных рестрикционных сайта, расположенных линейно. В типичном случае любой молекулярный "стержень" не будет включать редко встречающийся или необычный рестрикционный сайт любого другого молекулярного "стержня" в пределах той же генной программы. Схожие последовательности длиной более 6 нуклеотидов, по которым действует заданный рестрикционный фермент, обозначаются как "редко встречающиеся" рестрикционные сайты. Однако имеются рестрикционные сайты в 6 п.о. (пары оснований), которые встречаются более редко, чем это статистически предсказывается, и эти сайты и эндонуклеазы, расщепляющие их, называются "необычными" рестрикционными сайтами. Примеры либо редко встречающихся, либо необычных рестрикционных ферментов включают, но этим не ограничиваются, AsiS I, Рас I, Sbf I, Fse I, Asc I, Mlu I, SnaB I, Not I, Sal I, Swa I, Rsr II, BSiW I, Sfo I, Sgr AI, AfI III, Pvu I, Ngo MIV, Ase I, Flp I, Pme I, Sda I, Sgf I, Srf I и Sse8781 I.
Кроме того, вектор может содержать рестрикционные сайты для второго класса рестрикционных ферментов, называемых ферменты хоминг-эндонуклеазы (НЕ). Ферменты НЕ имеют большие, асимметрические рестрикционные сайты (12-40 пар оснований), и их рестрикционные сайты редко встречаются в природе. Например, прогнозируется, что рестрикционный сайт НЕ, известный как I-Scel, имеющий длину 18 п.о. (5'TAGGGATAACAGGGTAAT3' (SEQ ID NO:1)), встречается только один раз в каждых 7×1010 парах оснований случайной последовательности. Такая частота встречаемости эквивалентна только одному сайту в геноме, в 20 раз превышающем размер генома млекопитающих. Редкая природа НЕ-сайтов значительно увеличивает вероятность того, что генный инженер может вырезать генную программу без разрушения целостности генной программы, если НЕ-сайты были включены в соответствующие местоположения в клонирующей векторной плазмиде.
Отбор соответствующих векторов и промоторов для экспрессии в клетке хозяина является хорошо известной процедурой, и необходимые методики конструирования векторов и введения их в хозяина, а также их экспрессии в хозяине представляют собой рутинную практику в данной области техники.
Введение конструкции в клетки может представлять собой кратковременную трансфекцию, стабильную трансфекцию или может представлять собой локус-специфическую вставку вектора. Кратковременную и стабильную трансфекцию векторов в клетку хозяина можно осуществлять посредством трансфекции фосфатом кальция, DEAE-декстран-опосредованной трансфекции, опосредованной катионными липидами трансфекции, электропорации, трансдукции, инфекции или другими методами. Такие методы описаны во многих стандартных лабораторных руководствах, таких как Davis et al., Basic Methods in Molecular Biology (1986); Keown et al., 1990, Methods Enzymol. 185: 527-37; Sambrook et al., 2001, Molecular Cloning, A Laboratory Manual, 3-е издание, Cold Spring Harbor Laboratory Press, N.Y.; которые тем самым включены посредством ссылки. Такие методы стабильной трансфекции приводят к случайной вставке вектора в геном клетки. Кроме того, количество копий и ориентация векторов также, вообще говоря, случайны.
В одном воплощении изобретения вектор введен посредством вставки в биологически нейтральный сайт в данном геноме. Биологически нейтральный сайт представляет собой сайт в геноме, когда вставка конструкции очень незначительно мешает, если вообще это происходит, нормальному функционированию клетки. Биологически нейтральные сайты могут быть проанализированы с использованием доступных данных биоинформатики. Многие биологически нейтральные сайты известны в данной области техники, например ROSA-эквивалентный локус. Другие биологически нейтральные сайты могут быть идентифицированы с использованием обычных методик, хорошо известных в данной области техники. Характеристику сайта(ов) геномной вставки осуществляют с использованием способов, известных в данной области техники. Для контроля локализации, количества копий и/или ориентации конструкции при введении вектора в клетки могут быть использованы методы локус-специфической вставки. Методы локус-специфической вставки хорошо известны в данной области техники и включают, но этим не ограничиваются, гомологическую рекомбинацию и рекомбиназа-опосредованную геномную вставку. Несомненно, что если в способах по настоящему изобретению должны быть использованы методы локус-специфической вставки, то векторы могут содержать элементы, которые способствуют осуществлению этой локус-специфической вставки, такой как, но этим не ограничиваясь, гомологическая рекомбинация. Например, векторы могут содержать один, два, три, четыре или более сайтов геномной интеграции (GIS). Как он использован в данном описании, термин "сайт геномной интеграции" определен как часть векторной последовательности, нуклеотидная последовательность которого идентична или почти идентична участкам генома в клетках, которые позволяют осуществлять вставку вектора в данный геном. В частности, вектор может содержать два сайта геномной вставки, которые фланкируют по меньшей мере промотор маркерного гена заболевания и полинуклеотид, кодирующий летальный полипептид. Несомненно, GIS могут фланкировать дополнительные элементы, или даже все элементы, представленные в векторе.
В другом воплощении локус-специфическая вставка может быть выполнена посредством рекомбиназа-сайт-специфической генной вставки. Кратко, бактериальные ферменты рекомбиназы, такие как, но этим не ограничиваясь, интеграза PhiС31, могут воздействовать на "псевдо"-сайты рекомбинации в пределах генома человека. Эти псевдо-сайты рекомбинации могут быть мишенями для локус-специфической вставки с использованием рекомбиназ. Рекомбиназа-сайт-специфическая генная вставка описана в работе Thyagarajan В. et al., Mol. Cell Biol. 21(12): 3926-34 (2001), которая включена посредством ссылки. Другие примеры рекомбиназ и соответствующих им сайтов, которые могут быть использованы для рекомбиназа-сайт-специфической генной вставки, включают, но этим не ограничиваются, сериновые рекомбиназы, такие как R4 и ТР901-1.
Дополнительные воплощения настоящего изобретения включают, но этим не ограничиваются, генотипирование клеток. Термин "генотипирование" применяется в данном описании аналогично его использованию в данной области техники. В частности, предложены конкретные воплощения способов по настоящему изобретению для генотипирования клеток либо до, либо после индукции киллинга пораженных клеток. Кроме того, данные способы охватывают генотипирование клеток один или более раз в целях гарантии качества. Генотипирование может быть выполнено любым способом, который дает информацию о генетической последовательности приблизительно всего или части клеточного генома. Например, генотипирование может быть выполнено путем выделения ДНК и последующего секвенирования, или оно может быть выполнено посредством ПЦР-способов или рестрикционного анализа, или любой их комбинации.
Генотипирование клеток субъекта может быть выполнено с целью определения геномного профиля субъекта. Эту информацию можно использовать для определения того, предрасположен ли субъект к мутационным событиям, делающим субъекта более восприимчивым к рецидиву заболевания, в последующих генерациях непораженных клеток, которые были возвращены обратно субъекту. Предрасположенность к мутационным событиям в общем случае может быть идентифицирована путем детекции изменений или мутаций в генах, кодирующих синтез ДНК, и в генах репарации или в других генах, имеющим отношение к мутационным событиям у этого субъекта. Предрасположенность к конкретному типу заболевания может быть идентифицирована путем детекции изменений или мутаций в генах, ассоциированных с этим заболеванием. Знание генотипа субъекта может быть использовано для конструирования соответствующих терапевтических полинуклеотидов для каждого субъекта. Например, если субъект предрасположен к конкретному заболеванию, то наилучшим образом подходящим может быть специфический к конкретному заболеванию промотор или летальный полипептид. Если субъект предрасположен к рецидиву заболевания, предпочтительнее всего не вырезать терапевтический полинуклеотид, так что пораженные клетки могут быть удалены in vivo позже, если будет необходимо. В другом примере генотип субъекта может быть использован для определения конкретного сайта вставки в геном, более или менее подходящего. Конструирование индивидуализированного терапевтического полинуклеотида на основе геномного профиля субъекта может быть основано на выборе каждого параметра полинуклеотида, как показано на Фиг.1. Векторная система, в которой части легко взаимозаменяемы, как описано выше, идеально подходит для сборки субъект-специфических терапевтических полинуклеотидов на основе генотипа субъекта.
Кроме того, конкретные воплощения способов по настоящему изобретению включают вырезание терапевтического полинуклеотида. В общем случае способы по настоящему изобретению будут приводить к введению терапевтических полинуклеотидов во все клетки или большую часть клеток, независимо от болезненного статуса клеток. Поэтому удаление терапевтического полинуклеотида(ов) из непораженных клеток может быть желательно. Следовательно, чтобы помочь в осуществлении собственного вырезания, конструкция может содержать дополнительные элементы, такие как рекомбиназные сайты. Один из примеров рекомбиназного сайта включает, но не ограничивается этим, сайт IoxP в хорошо известных cre-Iox, или рекомбиназные сайты, имеющие отношения к рекомбиназам Int, IHF, Xis, Flp, Fis, Hin, Gin, Cin, резолваза Tn3, ФС31, TndX, XerC и XerD. Могут быть использованы другие рекомбиназные сайты, при условии, что соответствующий фермент рекомбиназа может воздействовать на данный рекомбиназный сайт. Эта конструкция также может содержать гены, кодирующие одну или более рекомбиназ. Экспрессия рекомбиназ может находиться под контролем индуцибельных промоторов, так что вырезание может быть индуцировано в желаемое время.
В одном воплощении изобретения терапевтический полинуклеотид может быть вырезан из выживших клеток после того, как пораженные клетки разрушены, и перед возвращением выживших клеток в организм субъекта. В другом воплощении выжившие клетки могут быть возвращены в организм субъекта без вырезания терапевтического полинуклеотида. В этом воплощении экспрессия летального полипептида может быть индуцирована in vivo в любой момент после возвращения клеток обратно в организм субъекта. Это воплощение можно использовать, если имеется рецидив заболевания у этого субъекта. Рецидив может произойти по любой причине, включая предрасположенность субъекта к мутационным событиям, приводящим к рецидиву заболевания в последующих генерациях непораженных клеток, которые были возвращены обратно в организм субъекта. Рецидив также может произойти вследствие неполного удаления всех пораженных клеток перед возвращением клеток обратно в организм субъекта. Способность разрушать пораженные клетки in vivo (например, в результате присутствия летального полипептида под контролем индуцибельного промотора и предоставления в организм субъекта индуцирующего агента) позволяет субъекту избежать дополнительного цикла трансплантации ех vivo и рисков, ассоциированных с этим циклом (например, облучения/химиотерапии, необходимых для уничтожения костного мозга до трансплантации). Это воплощение также позволяет клиницисту контролировать in vivo начало действия, уровень и продолжительность действия летального полипептида.
В следующем воплощении терапевтический полинуклеотид может содержать ген устойчивости к химиотерапевтическим средствам, например ген множественной лекарственной устойчивости mdrI. Ген устойчивости к химиотерапевтическим средствам может находиться под контролем конститутивного (например CMV) или индуцибельного (например RheoSwitch®) промотора. В этом воплощении, если имеется рецидив заболевания у этого субъекта, клиницист может применить более сильную дозу химиотерапевтического агента с целью разрушения пораженных клеток, в то время как возвращенные обратно клетки будут защищены от этого агента. Путем помещения гена устойчивости к химиотерапевтическим средствам под контроль индуцибельного промотора можно избежать нежелательной экспрессии гена устойчивости к химиотерапевтическим средствам, которая все еще будет возможной в случае рецидива заболевания. Если возвращенные обратно клетки сами становятся пораженными, они все же могут быть разрушены посредством индукции экспрессии летального полипептида, как описано выше.
Следующие дополнительные воплощения охватывают анализ и/или увеличение популяции выживших клеток перед повторным введением клеток в организм субъекта. Например, выжившие клетки могут быть генотипированы и/или фенотипированы с использованием любого из способов или протоколов, изложенных или упомянутых в данном описании, перед возвращением клеток обратно в организм субъекта.
В другом аспекте изобретения предложены наборы, которые могут быть использованы вместе со способами по изобретению. Наборы, соответствующие этому аспекту изобретения, могут содержать один или более контейнеров, которые могут содержать один или более компонентов, выбранных из группы, состоящей из одной или более молекул нуклеиновой кислоты, рестрикционных ферментов и одной или более клеток, содержащих такие молекулы нуклеиновой кислоты. Наборы по изобретению могут дополнительно содержать один или более контейнеров, содержащих клеточные культуральные среды, подходящие для культивирования клеток по изобретению, один или более контейнеров, содержащих антибиотики, подходящие для использования в культивировании клеток по изобретению, один или более контейнеров, содержащих буферы, один или более контейнеров, содержащих реагенты для трансфекции, и/или один или более контейнеров, содержащих субстраты для ферментативных реакций.
Наборы по изобретению могут содержать широкое разнообразие молекул нуклеиновой кислоты, которые могут быть использованы с данным изобретением. Примеры молекул нуклеиновой кислоты, которые могут поставляться в наборах по изобретению, включают молекулы, которые содержат промоторы, последовательности, кодирующие летальные полипептиды, энхансеры, репрессоры, маркеры селекции, сигналы транскрипции, сигналы трансляции, сайты гибридизации праймеров (например, для секвенирования или ПЦР), сайты рекомбинации, рестрикционные сайты и полилинкеры, сайты супрессии терминации трансляции в присутствии супрессорной тРНК, последовательности, кодирующие супрессорную тРНК, последовательности, кодирующие домены и/или области, ориджины репликации, теломеры, центромеры и тому подобное. Молекулы нуклеиновых кислот по изобретению могут содержать любой один или более из этих признаков в дополнение к транскрипционной регуляторной последовательности, как описано выше.
Наборы по изобретению могут содержать контейнеры, содержащие один или более белков для рекомбинации. Подходящие для рекомбинации белки включают, но этим не ограничиваются, Cre, Int, IHF, Xis, Flp, Fis, Hin, Gin, Cin, резолвазу Tn3, ФС31, TndX, XerC и XerD. Другими подходящими сайтами и белками рекомбинации являются таковые, ассоциированные с GATEWAY™ Cloning Technology, приобретаемой у Invitrogen Corp., Carlsbad, CA, и описанные в выпускаемой литературе GATEWAY™ Cloning Technology, полные описания которой включены в данное описание посредством ссылки.
При использовании молекула нуклеиновой кислоты, содержащая один или более промоторов маркерного гена заболевания (Р), предложенных в наборе по изобретению, может быть комбинирована с экспрессирующим полинуклеотидом для летального полипептида (Е) и 3'-регуляторной последовательностью (3) для получения генной программы РЕ3. Молекула нуклеиновой кислоты, содержащая один или более 3'-регуляторных последовательностей, может быть предложена, например, с молекулярным "стержнем" на 5'- и 3'-концах 3'-регуляторной последовательности.
Кроме того, наборы по изобретению могут поставляться с праймерами. Как правило, эти праймеры будут сконструированы с целью отжига молекул, имеющих специфические нуклеотидные последовательности. Например, эти праймеры могут быть сконструированы для применения в ПЦР с целью амплификации молекулы конкретной нуклеиновой кислоты. Праймеры для секвенирования также могут поставляться с данным набором.
В наборах по изобретению могут быть поставлены один или более буферов (например один, два, три, четыре, пять, восемь, десять, пятнадцать). Эти буферы могут быть поставлены в рабочих концентрациях или могут быть поставлены в концентрированной форме и затем разбавлены до рабочих концентраций. Эти буферы зачастую будут содержать соль, ионы металла, кофакторы, агенты, хелатирующие ионы металлов, и т.д. для увеличения активностей или стабилизации либо самого буфера, либо молекул в данном буфере. Кроме того, эти буферы могут быть поставлены в сухих или водных формах. Если буферы поставляются в сухой форме, обычно перед использованием их растворяют в воде.
Наборы по изобретению могут содержать практически любую комбинацию компонентов, приведенных выше или описанных где-либо еще в данном изобретении. Как известно специалисту в данной области техники, компоненты, поставляемые с наборами по изобретению, будут варьировать в соответствии с предполагаемым применением наборов. Таким образом, наборы могут быть составлены с целью осуществления различных функций, упомянутых в данной заявке, и компоненты таких наборов будут соответственным образом варьировать.
Настоящее изобретение далее относится к инструкциям для осуществления одного или более способов по изобретению. В таких инструкциях могут быть даны указания пользователю насчет условий, подходящих для осуществления способов по изобретению. Инструкции по изобретению могут быть в материальной форме, например письменные инструкции (например, отпечатанные на бумаге), или могут быть в нематериальной форме, например доступные через компьютерный диск или через Интернет.
Понятно, что полный текст инструкций для осуществления способа по изобретению или, если инструкции включены в набор, для применения набора необязательно должен быть предоставлен. Одним из примеров ситуации, в которой набор по изобретению, например не будет содержать такие полные инструкции, является ситуация, когда предложенные указания информируют пользователя наборов о том, где получить инструкции для применения на практике способов, для которых можно использовать данный набор. Таким образом, инструкции для осуществления способов по изобретению могут быть получены с web-страниц Интернета, из отдельно продаваемых или выдаваемых справочников или другой выпускаемой литературы и т.д. Таким образом, изобретение включает наборы, которые указывают пользователю набора один или более адресов, где можно найти инструкции, не упакованные и/или не выданные непосредственно с наборами. Такие инструкции могут быть в любой форме, включая, но этим не ограничиваясь, электронные или отпечатанные формы.
Следующие далее примеры иллюстрируют, но не ограничивают, способы по настоящему изобретению. Другие подходящие модификации и адаптации ряда условий и параметров, обычно встречающиеся в медицинском лечении и системах экспрессии генов, и которые очевидны специалистам в данной области техники, находятся в пределах сущности и объема данного изобретения.
Примеры
Пример 1
CD34+-клeтки получают и выделяют из крови пациента с миелоидным лейкозом. Выделенные клетки обрабатывают ex vivo терапевтической полинуклеотидной конструкцией по настоящему изобретению, содержащей неомициновый (neo) ген селекции под контролем конститутивного, убиквитарного цитомегаловирусного (CMV) промотора и индуцибельный трансактиватор rТТА под контролем промотора TERT. Последовательность, кодирующая дифтерийный (DTA) токсин, находится под контролем индуцибельного промотора ТеtO. Затем осуществляют трансформацию клеток в условиях, которые стимулируют случайную интеграцию терапевтической конструкции в геном. Стабильные трансформанты отбирают путем добавления G418. Выжившие колонии затем обрабатывают тетрациклином или доксициклином с целью активации экспрессии летального генного продукта DTA в тех клетках, где промотор TERT запускает экспрессию белкового продукта rТТА. Добавление тетрациклина или доксициклина и экспрессия rТТА приводит к киллингу пораженных клеток, где промотор TERT активен.
Вектор, показанный на Фиг.6, представляет собой один из примеров векторного дизайна, который может быть полезен для способов настоящего примера. Характеристику сайта(ов) геномной вставки осуществляют с использованием способов, известных в данной области техники. В одном воплощении клетки, где данные конструкции вставлены в биологически нейтральный сайт, выращивают и размножают в условиях, которые обеспечивают селекционное давление на клетки, содержащие данные конструкции.
Эти размноженные колонии фенотипируют на наличие или отсутствие маркерных генов заболевания. Кроме того, фенотип может быть оценен с целью определения способности клеток сохранять пластичность клетки-предшественника, что оценено с использованием известных биомаркеров предшественника, включая, но этим не ограничиваясь, CD34+-биoмapкepы. Клеточные популяции, которые проходят этот окончательный фенотипический анализ, затем будут трансплантированы в организм пациента-донора. До трансплантации собственные клетки крови/костный мозг пациента могут быть подвергнуты удалению посредством химической или радиоактивной методологии.
Пример 2
Клетки периферической крови получают и выделяют из крови пациента с раком крови. Выделенные клетки обрабатывают ex vivo терапевтической полинуклеотидной конструкцией по настоящему изобретению, содержащей неомициновый (neo) ген селекции под контролем промотора альдегиддегидрогеназы и индуцибельный трансактиватор rТТА под контролем промотора TERT. Последовательность, кодирующая дифтерийный (DTA) токсин, находится под контролем индуцибельного промотора TetO, а конститутивный промотор CMV контролирует экспрессию трансактиватора RheoCept®. В свою очередь, индуцибельный промотор RheoSwitch® контролирует экспрессию рекомбиназы Cre. LoxP-сайты фланкируют каждую из генных программ конструкции на 5'- и 3'-концах конструкции. Трансформацию клеток выполняют в условиях, которые стимулируют случайную интеграцию гетерологичной ДНК в геном. G418 добавляют в клеточную культуру с целью отбора стабильных трансформантов, показывающих фенотип клетки-предшественника, поскольку промотор альдегиддегидрогеназы экспрессируется с высокими уровнями в клетках-предшественниках, содержащих данную конструкцию. Выжившие колонии затем обрабатывают тетрациклином или доксициклином с целью активации экспрессии летального генного продукта DTA в клетках, где промотор TERT запускает экспрессию белкового продукта rТТА.
Вектор, показанный на Фиг.7, представляет собой один из примеров векторного дизайна, который может быть полезен для способов настоящего примера. Характеристику сайта(ов) геномной вставки осуществляют с использованием способов, известных в данной области техники. В одном воплощении клетки, где данные конструкции вставлены в биологически нейтральный сайт, выращивают и размножают в условиях, которые обеспечивают селекционное давление на клетки, содержащие данные конструкции.
Эти размноженные колонии фенотипируют на наличие или отсутствие маркерных генов заболевания. Кроме того, фенотип может быть оценен с целью определения способности клеток сохранять пластичность клетки-предшественника, что оценено с использованием известных биомаркеров предшественника, включая, но этим не ограничиваясь, CD34+ и альдегиддегидрогеназу. Клеточные популяции, которые проходят этот окончательный фенотипический анализ, затем будут трансплантированы в организм пациента-донора. До трансплантации собственные клетки крови/костный мозг пациента могут быть подвергнуты удалению посредством химической или радиоактивной методологий. Вырезание вектора может быть индуцировано в любой момент путем подвергания клеток воздействию агониста рецептора экдизона для индукции экспрессии рекомбиназы Cre.
Пример 3
Для того чтобы у перенесшего операцию ракового пациента предупредить метастаз и снизить циркуляцию раковых клеток, например клеток рака молочной железы, получают и выделяют клетки периферической крови от пациента, у которого есть или был рак молочной железы. Эти выделенные клетки обрабатывают ex vivo терапевтической конструкцией, содержащей ген цитозиндеаминазы (CDA) под контролем убиквитарного, конститутивно экспрессируемого промотора фосфоглицераткиназы (PGK) и часть ДНК, которая гомологична биологически нейтральному ROSA-эквивалентому локусу. В данной конструкции neo-ген селекции находится под контролем промотора альдегиддегидрогеназы, а индуцибельный трансактиватор rТТА находится под контролем промотора TERT. К тому же, последовательность, кодирующая тимидинкиназу (ТК) вируса простого герпеса (HSV), находится под контролем индуцибельного промотора TetO, а дополнительная область ДНК гомологична биологически нейтральному ROSA-эквивалентному локусу, который лежит на 3'-конце первого участка ДНК. Кроме того, ген дифтерийного (DTA) токсина находится под контролем конститутивно экспрессируемого промотора CMV. Трансформацию клеток выполняют в условиях, которые стимулируют локус-специфическую вставку посредством гомологической рекомбинации. Отбирают стабильные трансформанты, демонстрирующие фенотип клетки-предшественника, путем добавления G418, поскольку промотор альдегиддегидрогеназы экспрессируется с высокими уровнями в клетках-предшественниках.
Вектор, показанный на Фиг.8, представляет собой один из примеров векторного дизайна, который может быть полезен для способов настоящего примера. Конкретно, конструкцию вставляют в геном в биологически нейтральный ROSA-эквивалентный локус. Потеря DТА-"селекторной" конструкции указывает на то, что гомологическая рекомбинация была проведена успешно. Обработка 5-фторцитозином служит в качестве отрицательного "селектора" в отношении потери "селекторного" гена CDA. Характеристику сайта геномной вставки осуществляют с использованием способов, известных в данной области техники.
Отбирают и размножают колонии, где часть конструкции является внутренней по отношению к областям гомологической рекомбинации, которые интегрированы в геном в биологически нейтральный ROSA-эквивалентный локус. Эти размноженные клетки затем обрабатывают тетрациклином или доксициклином в дополнение к ганцикловиру. Обработка тетрациклином или доксициклином будет приводить к активации промотора TetO в клетках, экспрессирующих выбранный маркерный ген заболевания, который в свою очередь будет активировать экспрессию продукта гена ТК. Обработка ганцикловиром избирательно уничтожает клетки, экспрессирующие тимидинкиназу с высокими уровнями экспрессии.
Эти размноженные колонии фенотипируют на наличие или отсутствие маркерных генов заболевания. Кроме того, фенотип может быть оценен с целью определения способности клеток сохранять пластичность клетки-предшественника, что оценено с использованием известных биомаркеров предшественника, включая, но этим не ограничиваясь, CD34+и альдегиддегидрогеназу. Клеточные популяции, которые проходят этот окончательный фенотипический анализ, затем будут трансплантированы в организм пациента-донора. До трансплантации собственные клетки крови/костного мозга пациента могут быть подвергнуты удалению посредством химической или радиоактивной методологий.
Пример 4
Клетки периферической крови получают и выделяют из крови пациента с раком крови. Выделенные клетки обрабатывают ex vivo терапевтической полинуклеотидной конструкцией по настоящему изобретению, содержащей неомициновый (neo) ген селекции под контролем промотора альдегиддегидрогеназы и последовательнось, кодирующую дифтерийный (DTA) токсин, под контролем промотора TERT. Трансформацию клеток выполняют в условиях, которые стимулируют случайную интеграцию гетерологичной ДНК в геном. G418 добавляют в клеточную культуру с целью отбора стабильных трансформантов, показывающих фенотип клетки-предшественника, поскольку промотор альдегиддегидрогеназы экспрессируется с высокими уровнями в клетках-предшественниках, содержащих данную конструкцию.
Характеристику сайта(ов) геномной вставки осуществляют с использованием способов, известных в данной области техники. В одном воплощении клетки, где данные конструкции вставлены в биологически нейтральный сайт, выращивают и размножают в условиях, которые обеспечивают селекционное давление на клетки, содержащие данные конструкции.
Эти размноженные колонии фенотипируют на наличие или отсутствие маркерных генов заболевания. Кроме того, фенотип может быть оценен с целью определения способности клеток сохранять пластичность клетки-предшественника, что оценено с использованием известных биомаркеров предшественника, включая, но этим не ограничиваясь, CD34+и альдегиддегидрогеназу. Клеточные популяции, которые проходят этот окончательный фенотипический анализ, затем будут трансплантированы в организм пациента-донора без вырезания терапевтического полинуклеотида. До трансплантации собственные клетки крови/костного мозга пациента могут быть подвергнуты удалению посредством химической или радиоактивной методологий.
После рецидива рака крови у пациента экспрессия DTA под контролем промотора TERT будет активирована в трансплантированных клетках, и эти клетки будут разрушены.
Пример 5
Клетки периферической крови получают и выделяют из крови пациента с раком крови. Выделенные клетки обрабатывают ex vivo терапевтической полинуклеотидной конструкцией по настоящему изобретению, содержащей неомициновый (neo) ген селекции под контролем промотора альдегиддегидрогеназы и индуцибельный трансактиватор RheoCept® под контролем промотора TERT. В свою очередь, индуцибельный промотор RheoSwitch® контролирует экспрессию DTA. Трансформацию клеток выполняют в условиях, которые стимулируют случайную интеграцию гетерологичной ДНК в геном. G418 добавляют в клеточную культуру с целью отбора стабильных трансформантов, показывающих фенотип клетки-предшественника, поскольку промотор альдегиддегидрогеназы экспрессируется с высокими уровнями в клетках-предшественниках, содержащих данную конструкцию. Выжившие колонии затем обрабатывают агонистом RheoCept® с целью активации экспрессии летального генного продукта DTA в клетках, где промотор TERT управляет экспрессией белкового продукта RheoCept®.
Характеристику сайта(ов) геномной вставки осуществляют с использованием способов, известных в данной области техники. В одном воплощении клетки, где данные конструкции вставлены в биологически нейтральный сайт, выращивают и размножают в условиях, которые обеспечивают селекционное давление на клетки, содержащие данные конструкции.
Эти размноженные колонии фенотипируют на наличие или отсутствие маркерных генов заболевания. Кроме того, фенотип может быть оценен с целью определения способности клеток сохранять пластичность клетки-предшественника, что оценено с использованием известных биомаркеров предшественника, включая, но этим не ограничиваясь, CD34+ и альдегиддегидрогеназу. Клеточные популяции, которые проходят этот окончательный фенотипический анализ, затем будут трансплантированы в организм пациента-донора без вырезания терапевтического полинуклеотида. До трансплантации собственные клетки крови/костного мозга пациента могут быть подвергнуты удалению посредством химической или радиоактивной методологий.
После рецидива рака крови у пациента данному пациенту вводят агонист RheoCept®, тем самым индуцируя экспрессию продукта гена DTA в трансплантированных клетках или их потомстве, где промотор TERT управляет экспрессией белкового продукта RheoCept®.
Имея теперь описанное во всей его полноте изобретение, специалистам в данной области техники будет понятно, что все то же самое может быть выполнено в пределах широкого и эквивалентного диапазона условий, композиций и других параметров без изменения объема изобретения или любого его воплощения. Все процитированные в данном описании патенты, заявки на патент и публикации полностью включены в данное описание посредством ссылки во всей своей полноте.
Реферат
Группа изобретений относится к медицине, конкретно к онкологии, и касается способов лечения или индивидуализации лечения рака у субъекта путем специфичного удаления злокачественных клеток из популяции клеток периферической крови, а также как такового способа специфичного удаления злокачественных клеток из популяции клеток периферической крови, предназначенной для аутотрансплантации. Получают популяцию клеток периферической крови, содержащую злокачественные и незлокачественные клетки, у субъекта, затем определяют активность по меньшей мере одного маркерного гена рака в указанной популяции клеток. Далее вводят в клетки полинуклеотид, кодирующий селектируемый маркер и полипептид, который является летальным для указанных злокачественных клеток, где экспрессия летального полипептида находится под прямым или опосредованным контролем промотора маркерного гена рака. После этого клетки подвергают воздействию в условиях селекции с получением клеток, содержащих указанный полинуклеотид. Далее обрабатывают полученные клетки в условиях индукции экспрессии летального полипептида, который убивает клетки, экспрессирующие маркерный ген рака. Затем убитые клетки отделяются от живых клеток, которые возвращают в организм субъекта. Предложенный новый способ специфичного удаления злокачественных клеток позволяет не только избежать реинфузии раковых клеток в организм пациента при аутотрансплантации, но и дает возможность индивидуализировать лечение злокачественного заболевания у субъекта путем конструирования индивидуального терапевтического полинуклеотида в зависимости от генотипа субъекта. 4 н. и 41 з.�
Формула
(а) получение популяции клеток периферической крови, содержащей злокачественные и незлокачественные клетки, от субъекта;
(б) определение активности по меньшей мере одного маркерного гена рака в указанной популяции указанных клеток;
(в) введение в указанные клетки полинуклеотида, кодирующего селектируемый маркер и полипептид, который сам по себе является летальным в отношении указанных злокачественных клеток, где экспрессия указанного летального полипептида находится под прямым или опосредованным контролем промотора указанного по меньшей мере одного маркерного гена рака;
(г) подвергание указанных клеток воздействию в условиях селекции с получением клеток, содержащих указанный полинуклеотид;
(д) обработку указанных клеток, содержащих указанный полинуклеотид, в условиях индукции экспрессии указанного летального полипептида, где указанная экспрессия указанного летального полипептида убивает клетки, экспрессирующие по меньшей мере один указанный маркерный ген рака;
(е) отделение убитых клеток от живых клеток; и
(ж) возвращение указанных живых клеток в организм указанного субъекта.
(а) получение популяции клеток периферической крови, содержащей злокачественные и незлокачественные клетки, от указанного субъекта;
(б) определение активности по меньшей мере одного маркерного гена рака в указанной популяции указанных клеток;
(в) выделение по меньшей мере одного промотора из указанного по меньшей мере одного маркерного гена рака;
(г) прямое или опосредованное связывание указанного промотора с полинуклеотидом, кодирующим полипептид, который сам по себе является летальным для указанных злокачественных клеток;
(д) помещение указанного связанного полинуклеотида в вектор, содержащий селектируемый маркер;
(е) введение указанного полинуклеотида в указанные клетки;
(ж) подвергание указанных клеток воздействию в условиях селекции с получением клеток, содержащих указанный полинуклеотид;
(з) обработку указанных клеток, содержащих указанный полинуклеотид, в условиях индукции экспрессии указанного летального полипептида, где указанная экспрессия указанного летального полипептида убивает указанные клетки, экспрессирующие по меньшей мере один указанный маркерный ген рака;
(и) отделение убитых клеток от живых клеток; и
(к) возвращение указанных живых клеток в организм указанного субъекта.
(а) получение популяции клеток периферической крови, содержащей злокачественные и незлокачественные клетки, от субъекта;
(б) определение активности по меньшей мере одного маркерного гена рака в указанной популяции указанных клеток;
(в) введение в указанные клетки молекулы полинуклеотида, кодирующего полипептид, который сам по себе является летальным в отношении указанных злокачественных клеток, где экспрессия указанного полипептида находится под контролем промотора по меньшей мере одного указанного маркерного гена рака, и где указанный промотор функционально связан с указанным полинуклеотидом, кодирующим указанный летальный полипептид;
(г) обработку указанных клеток, содержащих указанный полинуклеотид, в условиях индукции экспрессии указанного летального полипептида, где указанная экспрессия указанного летального полипептида убивает указанные клетки, экспрессирующие по меньшей мере один указанный маркерный ген рака;
(д) отделение убитых клеток от живых клеток; и
(е) возвращение указанных живых непораженных клеток в организм указанного субъекта.
(а) получение популяции клеток периферической крови, содержащей злокачественные и незлокачественные клетки, от указанного субъекта;
(б) определение активности по меньшей мере одного маркерного гена рака в указанной популяции указанных клеток;
(в) выделение по меньшей мере одного промотора из указанного по меньшей мере одного маркерного гена рака;
(г) создание терапевтического полинуклеотида путем функционального связывания указанного промотора с полинуклеотидом, кодирующим полипептид, который сам по себе является летальным для указанных злокачественных клеток;
(д) введение указанного терапевтического полинуклеотида в указанные клетки;
(е) обработку указанных клеток, содержащих указанный полинуклеотид, в условиях индукции экспрессии указанного летального полипептида, где указанная экспрессия указанного летального полипептида убивает указанные клетки, экспрессирующие по меньшей мере один указанный маркерный ген рака;
(ж) отделение убитых клеток от живых клеток; и
(з) возвращение указанных живых непораженных клеток в организм указанного субъекта.

Комментарии