Средство лечения болезни гентингтона на основе aav - RU2749971C2
Код документа: RU2749971C2
Чертежи










































Описание
Ссылка на родственные заявки
Согласно настоящей заявке испрашивается приоритет в соответствии с 35 U.S.C. 119(e) по дате подачи предварительной заявки на выдачу патента США под номером 62/398487, поданной 22 сентября 2016 года под названием «СРЕДСТВО ЛЕЧЕНИЯ БОЛЕЗНИ ГЕНТИНГТОНА НА ОСНОВЕ AAV», содержание которой включено в настоящий документ посредством ссылки.
Финансируемое из федерального бюджета исследование
Настоящее изобретение было создано при государственной поддержке в соответствии с NS038194, присужденной Национальными институтами здравоохранения. Правительство имеет определенные права на настоящее изобретение.
Предшествующий уровень техники настоящего изобретения
Болезнь Гентингтона (HD) представляет собой разрушительное наследственное нейродегенеративное заболевание, вызываемое увеличением участка с повторами CAG в экзоне 1 гена гентингтина. Несмотря на то, что белок гентингтина (HTT) экспрессируется во всем организме, белок с увеличенным полиглутамином особенно токсичен для средних шипиковых нейронов в стриатуме и их связей в коре головного мозга. Пациенты борются с эмоциональными симптомами, включая депрессию и беспокойство, а также с характерными нарушениями движения и хореей. В настоящее время нет лекарства от болезни Гентингтона, варианты терапии ограничиваются облегчением симптомов заболевания.
Краткое раскрытие настоящего изобретения
Аспекты настоящего раскрытия относятся к композициям и способам, пригодным для лечения болезни Гентингтона (HD). В соответствии с некоторыми вариантами осуществления, предложены ингибирующие нуклеиновые кислоты (например, микроРНК, такие как искусственные микроРНК), которые специфически гибридизируются и ингибируют экспрессию гентингтина человека (HTT).
Соответственно, согласно некоторым аспектам, настоящее раскрытие относится к выделенной нуклеиновой кислоте, содержащей или кодирующей последовательность, изложенную под любым из SEQ ID NO: 2-10 или 21-22. В соответствии с некоторыми вариантами осуществления, гентингтин человека содержит последовательность, изложенную под SEQ ID NO: 1. В соответствии с некоторыми вариантами осуществления, настоящее раскрытие относится к нуклеиновой кислоте (например, микроРНК), которая комплементарна по меньшей мере двум (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25) смежным основаниям из SEQ ID NO: 1.
Согласно некоторым аспектам, настоящее раскрытие относится к выделенной нуклеиновой кислоте, содержащей первый участок, содержащий первый инвертированный концевой повтор (ITR) аденоассоциированного вируса (AAV) или его вариант; и второй участок, содержащий трансген, кодирующий одну или несколько микроРНК. В соответствии с некоторыми вариантами осуществления, последовательность, кодирующая каждую микроРНК, содержит последовательность, изложенную под любым из SEQ ID NO: 2-10, фланкированную последовательностью, кодирующей остовную последовательность микроРНК.
В соответствии с некоторыми вариантами осуществления, каждая остовная последовательность микроРНК представляет собой остовную последовательность mir-155, остовную последовательность mir-30 или остовную последовательность mir-64.
В соответствии с некоторыми вариантами осуществления, трансген дополнительно содержит последовательность нуклеиновой кислоты, кодирующую промотор. В соответствии с некоторыми вариантами осуществления, промотор представляет собой промотор гена куриного бета-актина (CBA) или промотор U6.
В соответствии с некоторыми вариантами осуществления, трансген дополнительно содержит последовательность нуклеиновой кислоты, кодирующую белок. В соответствии с некоторыми вариантами осуществления, белок представляет собой терапевтический белок (например, немутантный гентингтин) или репортерный белок (например, флуоресцентный белок, такой как GFP).
В соответствии с некоторыми вариантами осуществления, одна или несколько микроРНК локализованы в нетранслируемой части трансгена. В соответствии с некоторыми вариантами осуществления, нетранслируемая часть представляет собой интрон. В соответствии с некоторыми вариантами осуществления, нетранслируемая часть находится между последним кодоном последовательности нуклеиновой кислоты, кодирующей белок, и последовательностью поли-А хвоста. В соответствии с некоторыми вариантами осуществления, нетранслируемая часть находится между последним основанием нуклеиновой кислоты промоторной последовательности и первым основанием последовательности поли-А хвоста.
В соответствии с некоторыми вариантами осуществления, выделенная нуклеиновая кислота дополнительно содержит третий участок, который содержит второй инвертированный концевой повтор (ITR) аденоассоциированного вируса (AAV) или его вариант.
В соответствии с некоторыми вариантами осуществления, в первом или втором варианте ITR отсутствует функциональный сайт концевого разрешения (TRS), необязательно причем вариант ITR представляет собой ITR ΔTRS.
В соответствии с некоторыми вариантами осуществления, по меньшей мере одна из микроРНК гибридизуется и ингибирует экспрессию гентингтина человека.
Согласно некоторым аспектам, настоящее раскрытие относится к вектору, содержащему выделенную нуклеиновую кислоту, которая описана настоящим раскрытием. В соответствии с некоторыми вариантами осуществления, вектор представляет собой плазмиду.
Согласно некоторым аспектам, настоящее раскрытие относится к клетке-хозяину, содержащей выделенную нуклеиновую кислоту или вектор, которые описаны настоящим раскрытием.
Согласно некоторым аспектам, настоящее раскрытие относится к рекомбинантному AAV (rAAV), содержащему капсидный белок и выделенную нуклеиновую кислоту, которая описана настоящим раскрытием.
В соответствии с некоторыми вариантами осуществления, капсидный белок представляет собой капсидный белок AAV9. В соответствии с некоторыми вариантами осуществления, капсидный белок содержит последовательность, изложенную под SEQ ID NO: 20.
В соответствии с некоторыми вариантами осуществления, rAAV является самокомплементарным AAV (scAAV).
В соответствии с некоторыми вариантами осуществления, rAAV составлен для доставки в центральную нервную систему (ЦНС).
Аспекты раскрытия относятся к выделенным нуклеиновым кислотам, способным уменьшать (например, ингибировать) экспрессию патогенного гентингтина, и, следовательно, они могут быть пригодны для лечения болезни Гентингтона. Соответственно, согласно некоторым аспектам, настоящее раскрытие относится к способу лечения болезни Гентингтона у нуждающегося в том субъекта, причем способ предусматривает введение субъекту, имеющему или подверженному риску развития болезни Гентингтона, терапевтически эффективного количества выделенной нуклеиновой кислоты или rAAV, которые описаны настоящим раскрытием.
В соответствии с некоторыми вариантами осуществления, субъект содержит ген гентингтина, имеющий более 36 повторов CAG, более 40 повторов или более 100 повторов. В соответствии с некоторыми вариантами осуществления, возраст субъекта составляет менее 20 лет, или у субъекта диагностировано наличие ювенильной HD.
В соответствии с некоторыми вариантами осуществления, введение приводит в результате к доставке выделенной нуклеиновой кислоты или rAAV в центральную нервную систему (ЦНС) субъекта. В соответствии с некоторыми вариантами осуществления, введение производят посредством инъекции, необязательно внутривенной инъекции или интрастриатальной инъекции.
Согласно некоторым аспектам, настоящее раскрытие относится к выделенной нуклеиновой кислоте, содержащей трансген, кодирующий одну или несколько микроРНК, причем последовательность трансгена, кодирующего каждую микроРНК, содержит последовательность, изложенную под SEQ ID NO: 7 или 8, фланкированную остовной последовательностью микроРНК.
В соответствии с некоторыми вариантами осуществления, каждая остовная последовательность микроРНК представляет собой остовную последовательность mir-155, остовную последовательность mir-30 или остовную последовательность mir-64.
В соответствии с некоторыми вариантами осуществления, трансген содержит промотор. В соответствии с некоторыми вариантами осуществления, промотор представляет собой промотор гена куриного бета-актина (CBA) или промотор U6.
В соответствии с некоторыми вариантами осуществления, трансген содержит последовательность, изложенную под SEQ ID NO: 21 или 22.
В соответствии с некоторыми вариантами осуществления, трансген фланкирован инвертированными концевыми повторами (ITR) аденоассоциированного вируса (AAV) или их вариантами. В соответствии с некоторыми вариантами осуществления, вариант ITR не имеет функционального сайта концевого разрешения (TRS). В соответствии с некоторыми вариантами осуществления, вариант ITR, в котором отсутствует TRS, представляет собой ITR ΔTRS.
Согласно некоторым аспектам, настоящее раскрытие относится к вектору, содержащему выделенную нуклеиновую кислоту, содержащую трансген, кодирующий одну или несколько микроРНК, причем последовательность трансгена, кодирующего каждую микроРНК, содержит последовательность, изложенную под SEQ ID NO: 7 или 8, фланкированную остовной последовательностью микроРНК. В соответствии с некоторыми вариантами осуществления, вектор представляет собой плазмиду.
В соответствии с некоторыми вариантами осуществления, каждая остовная последовательность микроРНК трансгена представляет собой остовную последовательность mir-155, остовную последовательность mir-30 или остовную последовательность mir-64.
В соответствии с некоторыми вариантами осуществления, трансген содержит промотор. В соответствии с некоторыми вариантами осуществления, промотор представляет собой промотор гена куриного бета-актина (CBA) или промотор U6.
В соответствии с некоторыми вариантами осуществления, трансген содержит последовательность, изложенную под SEQ ID NO: 21 или 22.
В соответствии с некоторыми вариантами осуществления, трансген фланкирован инвертированными концевыми повторами (ITR) аденоассоциированного вируса (AAV) или их вариантами. В соответствии с некоторыми вариантами осуществления, вариант ITR не имеет функционального сайта концевого разрешения (TRS). В соответствии с некоторыми вариантами осуществления, вариант ITR, в котором отсутствует TRS, представляет собой ITR ΔTRS.
Согласно некоторым аспектам, настоящее раскрытие относится к рекомбинантному AAV (rAAV), содержащему капсидный белок; и к выделенной нуклеиновой кислоте, содержащей трансген, кодирующий одну или несколько микроРНК, причем последовательность трансгена, кодирующего каждую микроРНК, содержит последовательность, изложенную под SEQ ID NO: 7 или 8, фланкированную остовной последовательностью микроРНК.
В соответствии с некоторыми вариантами осуществления, трансген фланкирован полноразмерными последовательностями ITR AAV. В соответствии с некоторыми вариантами осуществления, трансген фланкирован полноразмерным ITR AAV и ITR ΔTRS.
В соответствии с некоторыми вариантами осуществления, капсидный белок представляет собой капсидный белок AAV9. В соответствии с некоторыми вариантами осуществления, капсидный белок содержит последовательность, изложенную под SEQ ID NO: 20.
Согласно некоторым аспектам, настоящее раскрытие относится к способу лечения болезни Гентингтона у нуждающегося в том субъекта, причем способ предусматривает введение субъекту, имеющему или подверженному риску развития болезни Гентингтона, терапевтически эффективного количества rAAV, который описан в настоящем документе (например, rAAV, содержащего трансген, кодирующий одну или несколько микроРНК, причем последовательность трансгена, кодирующего каждую микроРНК, содержит последовательность, приведенную под SEQ ID NO: 7 или 8, фланкированную остовной последовательностью микроРНК.
В соответствии с некоторыми вариантами осуществления, трансген выделенной нуклеиновой кислоты фланкирован полноразмерными последовательностями ITR AAV. В соответствии с некоторыми вариантами осуществления, трансген фланкирован полноразмерным ITR AAV и ITR ΔTRS.
В соответствии с некоторыми вариантами осуществления, rAAV содержит капсидный белок AAV9.
В соответствии с некоторыми вариантами осуществления, субъект содержит ген гентингтина, имеющий более 36 повторов CAG, более 40 повторов или более 100 повторов. В соответствии с некоторыми вариантами осуществления, возраст субъекта составляет менее 20 лет.
В соответствии с некоторыми вариантами осуществления, введение выполняют посредством инъекции. В соответствии с некоторыми вариантами осуществления, инъекция представляет собой внутривенную инъекцию или интрастриатальную инъекцию.
Краткое описание чертежей
На фиг. 1 показаны клетки HeLa, трансфицированные плазмидой, экспрессирующей mir-HTT-6433, нацеленную на гентингтин человека. Через 48 часов после трансфекции собирали клетки и экстрагировали РНК для количественной RT-PCR (qRT-PCR). Результаты свидетельствуют, что mir-HTT-6433 уменьшает уровень эндогенного гентингтина человека на количество, составляющее до 50%.
На фиг. 2 показана mir-HTT-6433, упакованная в вектор AAV9 и введенная инъекцией непосредственно в стриатум трансгенных мышей, экспрессирующих мутантный гентингтин человека (мышей Yac128). Через один месяц после инъекции уровни мРНК гентингтина человека измеряли с помощью qRT-PCR. В одной группе животных (n=5) уровни гентингтина человека сравнивали на стороне с инъекцией с уровнями на стороне без инъекции. Значимое (р=0,0017) уменьшение уровня мРНК гентингтина наблюдали на стороне с инъекцией. Во второй группе животных (n=5 на группу) уровни мРНК гентингтина сравнивали у животных, которым инъекцией была введена mir-HTT-6433, с животными, которым инъекцией был введен только наполнитель лекарственной формы. У этих животных также наблюдали значимое уменьшение (р=0,0004) уровня гентингтина. В третьей группе животных (n=5 на группу) уровни мРНК гентингтина сравнивали у животных, которым инъекцией была введена mir-HTT-6433, с животными, которым инъекцией была введена AAV9-GFP. У этих животных также имело место значимое (р=0,0064) уменьшение уровня мРНК гентингтина. В целом, данные свидетельствуют, что mir-HTT-6433 уменьшает уровень мРНК гентингтина in vivo в головном мозге на 50%.
На фиг. 3 показана односторонняя инъекция AAV9-mir-HTT-6433 или PBS трансгенным мышам, экспрессирующим мутантный гентингтин (человека). Через шесть месяцев после инъекции мышей тестировали на балке для оценки способности удерживать равновесие. Данные свидетельствуют, что у мышей, обработанных посредством mir-HTT-6433, наблюдали уменьшение времени, необходимого для прохождения по балке, по сравнению с мышами HD, обработанными посредством PBS.
На фиг. 4А-4С показано, что искусственные микроРНК, нацеленные на гентингтин человека, уменьшают уровень мРНК гентингтина в клеточной культуре и in vivo. На фиг. 4А показаны положения целевых сайтов на мРНК гентингтина человека. На фиг. 4В показаны клетки HeLa, трансфицированные плазмидами, экспрессирующими искусственные микроРНК, нацеленные на гентингтин человека; уровни мРНК гентингтина измеряли через 48 часов с помощью количественной ПЦР. Экспрессию гентингтина нормализовали к HPRT для учета варьирования количества клеток среди лунок и выражали относительно необработанного/интактного контроля. «Усами» представлена стандартная ошибка. На фиг. 4C показаны микроРНК-кандидаты, выбранные для проведения in vivo тестирования по результатам в клеточной культуре. Мышам вводили одностороннюю инъекцию в стриатум. Через месяц после инъекции собирали стриатум и иссекали GFP-положительную ткань. Данные нормализованы к HPRT и выражены относительно контроля «только GFP».
На фиг. 5А-5С показано, что экспрессия искусственной микроРНК с промотора U6 не улучшает сайленсинг гентингтина в стриатуме мышей. На фиг. 5А показаны данные, относящиеся к конструкциям AAV9, экспрессирующим микроРНК с промоторов CBA (polII) и U6. МикроРНК под управлением CBA-промотора находится в 3'-UTR гена GFP, при этом конструкция, содержащая искусственную микроРНК под управлением промотора U6, совместно экспрессирует GFP с отдельного промотора. На фиг. 5В показано относительное количество мРНК гентингтина в стриатуме после инъекции искусственной микроРНК под управлением промоторов U6 и CBA, которая нацелена на сайты 5155 (слева) и 6433 (справа). Данные выражены относительно стороны без инъекции. На фиг. 5С показано относительное количество мРНК гентингтина у мышей, которым была введена односторонней инъекцией микроРНК под управлением промоторов U6 и CBA, которая нацелена на сайт 6433. Данные выражены относительно группы мышей, которым был введен инъекцией контрольный вектор, экспрессирующий GFP.
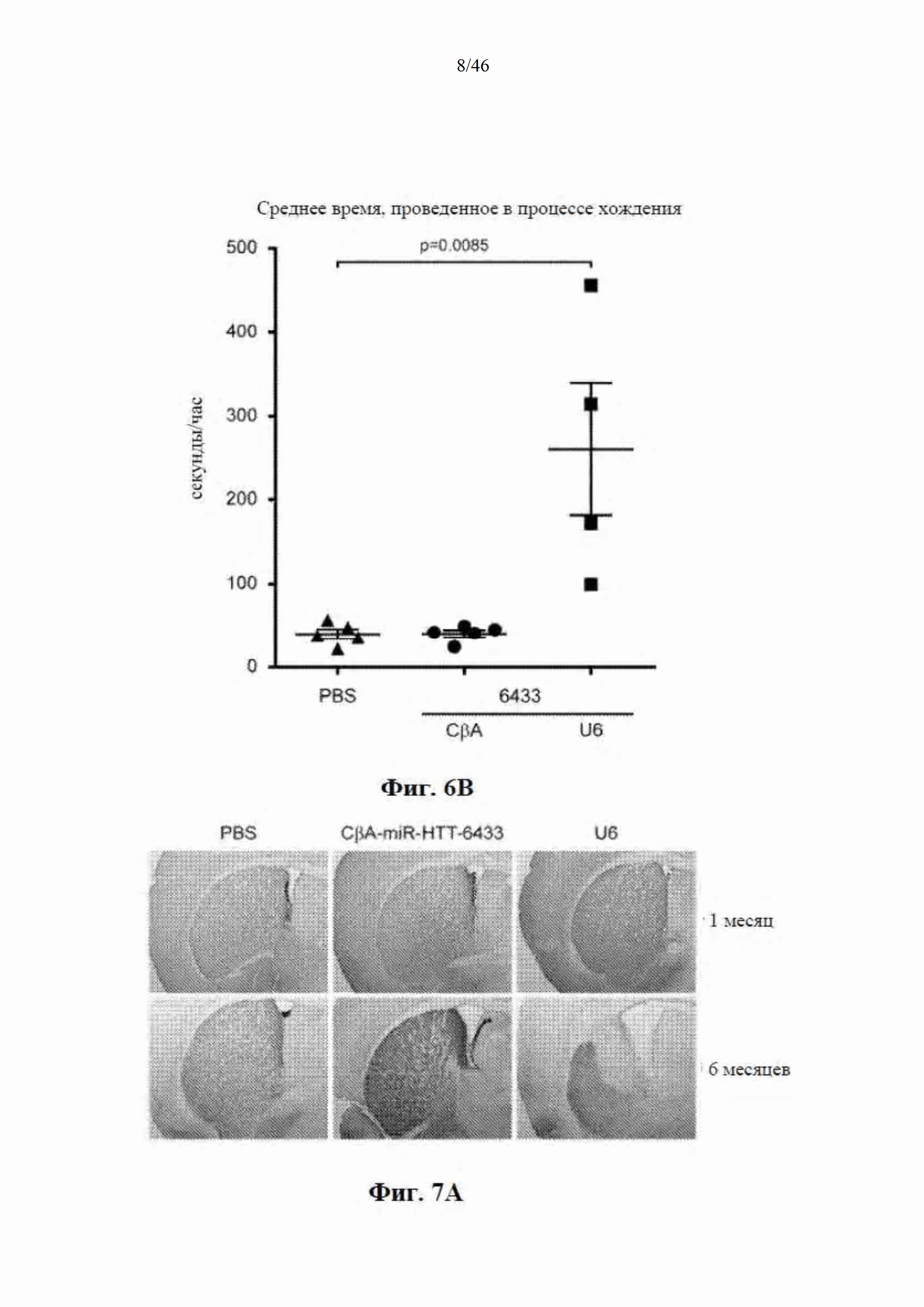
На фиг. 6А-6В показано, что долгосрочная экспрессия в стриатуме mir-HTT-6433 с промотора U6 вызывает поведенческие аномалии. На фиг. 6А показано, что через шесть месяцев после инъекции мыши, которым инъекцией была введена mir-HTT-6433 под управлением промотора U6, не могли обустраивать гнезда. Фотографии были сделаны через 24 часа после размещения новых материалов для гнезд в клетке. На фиг. 6В показаны результаты отслеживания клеток с мышами Yac128, обработанными посредством PBS, CBA-mir-HTT-6433 или U6-mir-HTT-6433. Время, потраченное на передвижение по периметру клетки, регистрировали в течение 24-27 часов. Среднее время в час рассчитывали путем деления общего времени на количество часов регистрации.
На фиг. 7А-7В показано, что долгосрочная экспрессия mir-HTT-6433 с промотора U6 вызывает уменьшение массы стриатума. На фиг. 7А показаны репрезентативные изображения окрашивания DARPP-32 на стороне с инъекцией у мышей Yac128 через 1 (вверху) и 6 (внизу) месяцев после инъекции. На фиг. 7B показаны результаты количественной оценки DARPP-32-положительной площади через 6 месяцев после инъекции.
На фиг. 8A-8D показано, что долгосрочная экспрессия mir-HTT-6433 с промотора U6 вызывает постоянную активацию микроглии. На фиг. 8А показаны репрезентативные изображения окрашивания Iba1 на стороне с инъекцией у мышей Yac128 через 1 (вверху) и
6 (внизу) месяцев после инъекции. Изображения были сделаны на месте инъекции. Количественная оценка общей (фиг. 8B), активированной (фиг. 8C) и находящейся в состоянии покоя (фиг. 8D) микроглии через 6 месяцев после инъекции.
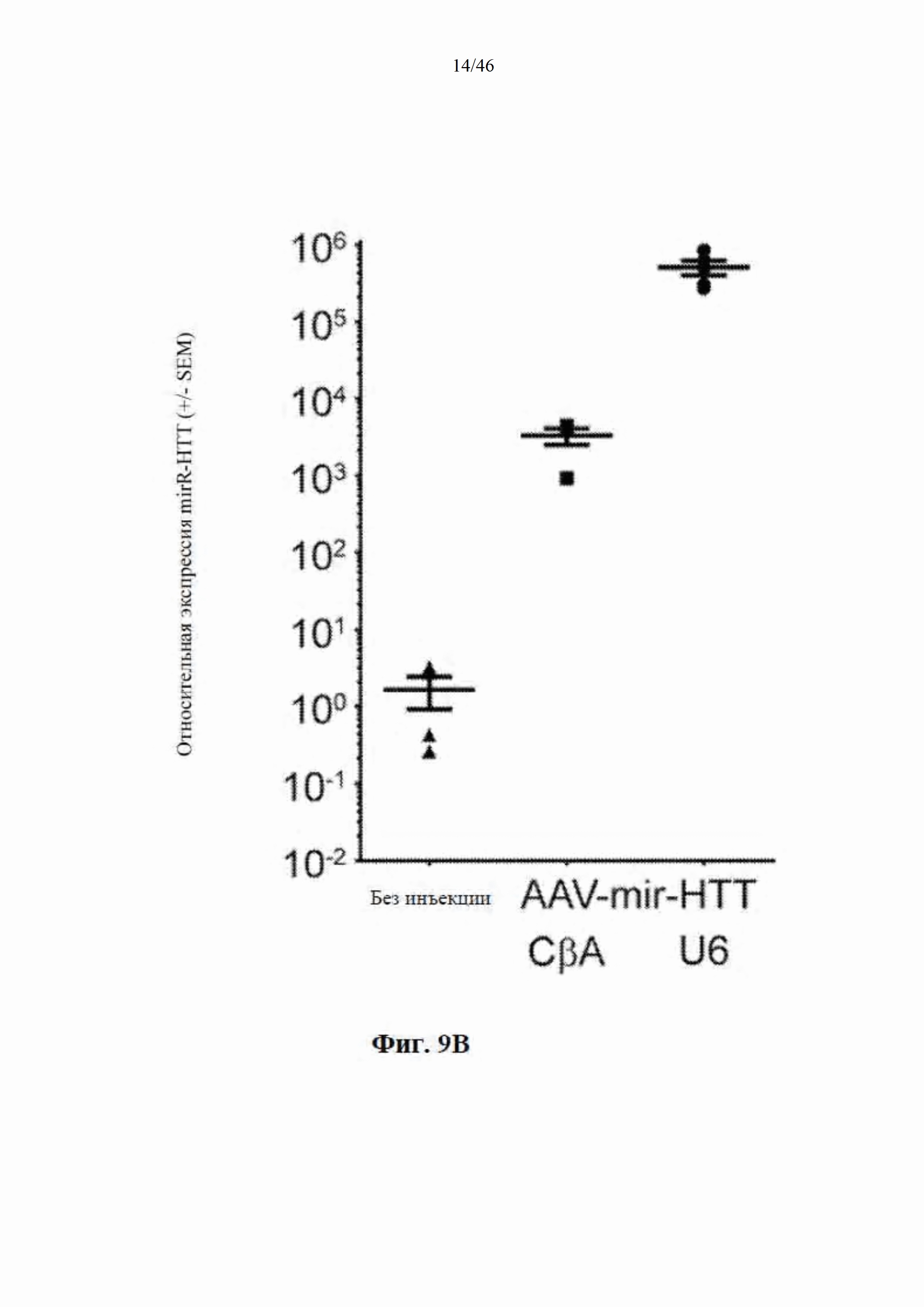
На фиг. 9А-9С показано, что экспрессия искусственной микроРНК на основе mir155 с промотора U6 приводит к сверхэкспрессии нацеленной на гентингтин направляющей цепи и других последовательностей. На фиг. 9А показаны начальные положения считывания при картировании относительно шпильки искусственной микроРНК, нацеленной на гентингтин (с остовом mir-155). Положения приведены относительно зрелой цепи, а результаты считывания нормализованы к общему количеству картированной эндогенной микроРНК в каждом образце. Горизонтальная линия представляет собой фоновые уровни искусственной микроРНК, обнаруженной в контрольных образцах. На фиг. 9В показаны результаты относительной количественной оценки зрелой miR-HTT (с остова mir-155) с помощью количественной RT-PCR. На фиг. 9С показаны начальные части считывания при картировании относительно нацеленной на гентингтин искусственной микроРНК, встроенной в остов mir-30 и экспрессируемой с промотора U6.
На фиг. 10А-10В показано, что экспрессия mir-HTT-6433 преимущественно уменьшает уровни мРНК с целевыми сайтами. На фиг. 10A показано, что мРНК разделялась на молекулы, которые содержали каноническую микроРНК, которая связывалась соответственно с сайтами искусственной микроРНК (легенда), и молекулы, которые не содержали их. В группе мышей с введенной инъекцией AAV-CbA-mir-HTT-6433 отсутствует различие между мРНК с такими сайтами и без них. На фиг. 10B, напротив, показано, что в группе AAV-U6-mir-HTT-6433 имеет место сдвиг в направлении репрессии мРНК с идеальными 8-нуклеотидными сайтами.
На фиг. 11А-11С показано, что снижение дозы вектора приводит к снижению распространения и нокдауну в стриатуме мыши. На фиг. 11А показано окрашивание GFP в стриатуме мышей, которым был введен инъекцией вектор, кодирующий нацеленную на гентингтин искусственную микроРНК и EGFP. Для измерения процента стриатума, который был GFP-положительным, использовали ImageJ. На фиг. 11B показаны результаты количественной RT-PCR с целью измерения мРНК гентингтина человека в стриатуме у мышей Yac128. На фиг. 11С показаны репрезентативные фотографии мышей, которым был введен инъекцией вектор, кодирующий нацеленную на гентингтин микроРНК и EGFP, в трех различных дозах. Данные свидетельствуют о том, что уменьшение дозы вектора приводит к снижению распространения и нокдауну.
На фиг. 12А-12В показаны данные, свидетельствующие, что у мышей Yac128 наблюдали снижение способности проходить по балке после инъекции нацеленной на гентингтин искусственной микроРНК под управлением промотора U6. На фиг. 12А видно, что у мышей, которым была введена инъекция, через 2-3 месяца наблюдали явное увеличение времени для прохождения по балке, и некоторые из них не могли пройти всю балку. На фиг. 12B видно, что у мышей Yac128, которым были введены инъекцией PBS или CBA-mir-HTT-6433, в возрасте 7 месяцев наблюдали возрастное снижение реакции на балке. Инъекция посредством U6-mir-HTT-6433 (красные точки) ускоряет такое снижение.
На фиг. 13А-13В показаны мыши C57BL/6, у которых наблюдали начальное ухудшение реакции на балке после инъекции нацеленной на гентингтин искусственной микроРНК под управлением промотора U6. На фиг. 13А показано время, необходимое для прохождения по балке для контрольных (интактных) мышей и мышей, которым инъекцией были введены AAV-U6-mir-HTT-6433 и AAV-CbA-mir-HTT-6433. На фиг. 13А показаны результаты количественной оценки DARPP-32-положительной площади стриатума у контрольных (интактных) мышей и мышей, которым инъекцией были введены AAV-U6- mir-HTT-6433 и AAV-CbA-mir-HTT-6433.
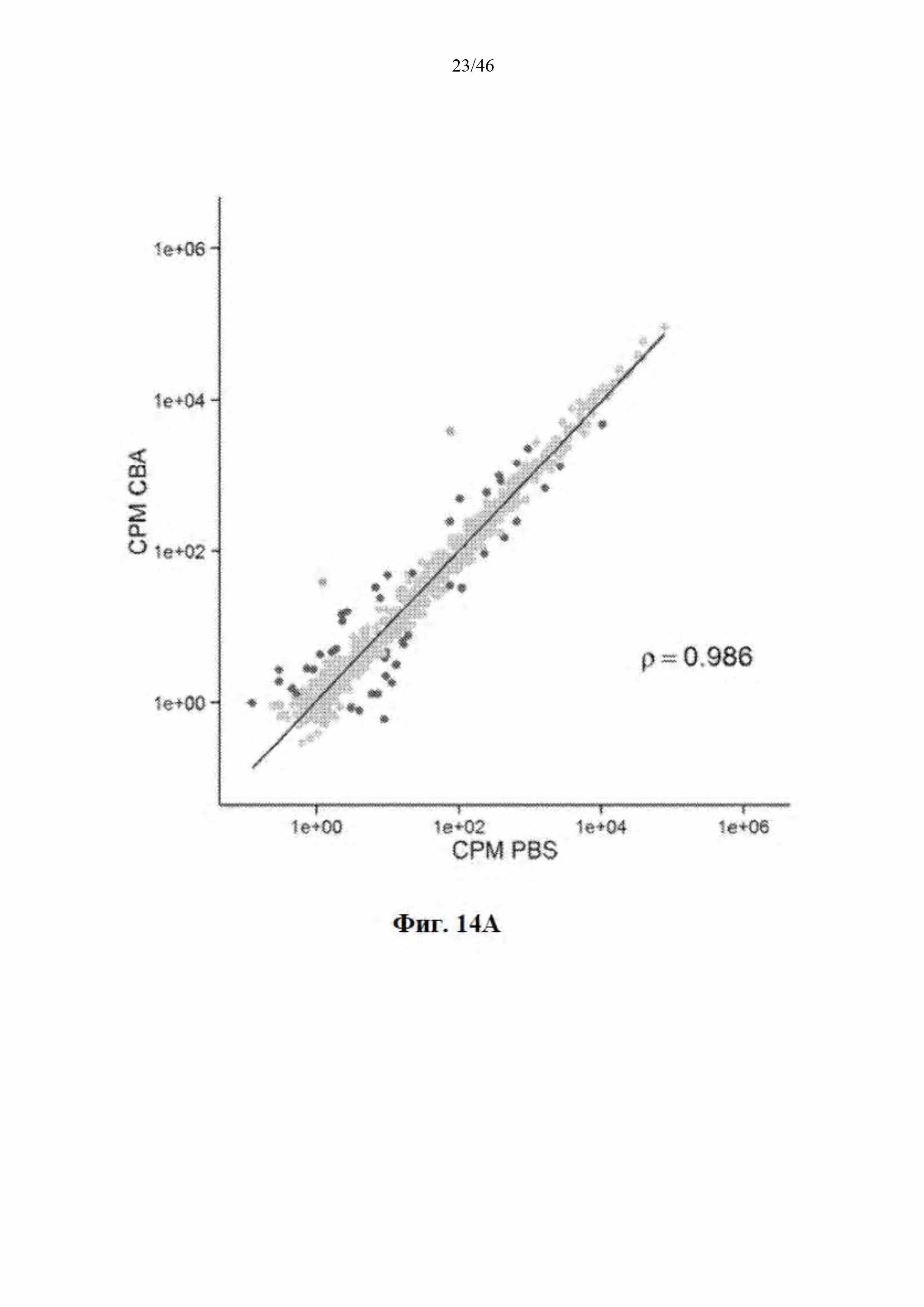
На фиг. 14А-14B показано, что распределение эндогенных микроРНК практически не изменяется после инъекции mir-HTT-6433. На фиг. 14А показано распределение у мышей, которым инъекцией была введена AAV-CbA-mir-HTT-6433; уровни направляющей и сопровождающей цепей mir-HTT-6433 показаны зеленым, красным показаны все виды эндогенной микроРНК, где видны значимые изменения у мышей, которым инъекцией была введена AAV-CbA-mir-HTT-6433. На фиг. 14В показано распределение у мышей, которым инъекцией была введена AAV-U6-mir-HTT-6433.
На фиг. 15А-15С показаны профили мРНК у мышей, обработанных посредством mir-HTT-6433. На фиг. 15А показано, что у мышей, которым инъекцией была введена AAV- CbA-mir-HTT-6433, наблюдали незначительные изменения в экспрессии мРНК; зеленым цветом обозначены все гены, у которых наблюдали значимые р-значения, а синим показаны гены, которые остаются значимыми после поправки на множественное сравнение. На фиг. 15B показано, что у мышей, которым инъекцией была введена AAV-U6- mir-HTT-6433, наблюдали больше изменений в экспрессии мРНК по сравнению с CBA. На фиг. 15C показаны профили мРНК у мышей, обработанных посредством mir-HTT-6433; 7 РНК значимо различались по экспрессии среди групп, обработанных посредством U6 и CbA.
На фиг. 16 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) в средней части хвостатого ядра модельной овцы с болезнью Гентингтона через один месяц после интрастриатальной инъекции либо scAAV9 CBA-mir-HTT («промотор CBA»), либо scAAV9 U6-mir-HTT («промотор U6»), либо пустого контрольного вектора scAAV9. Также приведены данные об уровне экспрессии htt у контрольных овец без инъекции. Относительные уровни экспрессии htt были нормализованы к калнексину овцы. Примечание: в каждой из конструкций CBA и U6 использовали остов mir155.
На фиг. 17 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) в средней части скорлупы головного мозга модельной овцы с болезнью Гентингтона через один месяц после интрастриатальной инъекции либо scAAV9 CBA-mir-HTT («промотор CBA»), либо scAAV9 U6-mir -HTT («промотор U6»), либо пустого контрольного вектора scAAV9. Также приведены данные об уровне экспрессии у контрольных овец без инъекции. Относительные уровни экспрессии htt были нормализованы к калнексину овцы.
На фиг. 18 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) на медиальной стороне средней части хвостатого ядра модельной овцы с болезнью Гентингтона через шесть месяцев после интрастриатальной инъекции либо scAAV9 CBA-mir-HTT («промотор CBA»), либо пустого контрольного вектора scAAV9. Приведены данные по уровню экспрессии в стороне без инъекции и в стороне с инъекцией. Относительные уровни экспрессии htt были нормализованы к калнексину овцы.
На фиг. 19 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) на латеральной стороне средней части хвостатого ядра модельной овцы с болезнью Гентингтона через шесть месяцев после интрастриатальной инъекции либо scAAV9 CBA-mir-HTT («промотор CBA»), либо пустого контрольного вектора scAAV9. Приведены данные по уровню экспрессии в стороне без инъекции и в стороне с инъекцией. Относительные уровни экспрессии htt были нормализованы к калнексину овцы.
На фиг. 20 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) в средней части хвостатого ядра модельной овцы с болезнью Гентингтона через шесть месяцев после интрастриатальной инъекции либо scAAV9 CBA-mir-HTT («промотор CBA»), либо scAAV9 U6-mir -HTT («промотор U6»), либо пустого контрольного вектора scAAV9. Также приведены данные об уровне экспрессии htt у контрольных овец без инъекции. Относительные уровни экспрессии htt были нормализованы к калнексину овцы.
На фиг. 21 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) на латеральной стороне средней части скорлупы головного мозга модельной овцы с болезнью Гентингтона через шесть месяцев после интрастриатальной инъекции либо scAAV9 CBA-mir-HTT («промотор CBA»), либо пустого контрольного вектора scAAV9. Приведены данные по уровню экспрессии в стороне без инъекции и в стороне с инъекцией. Относительные уровни экспрессии htt были нормализованы к калнексину овцы.
На фиг. 22 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) на медиальной стороне средней части скорлупы головного мозга модельной овцы с болезнью Гентингтона через шесть месяцев после интрастриатальной инъекции либо scAAV9 CBA-mir-HTT («промотор CBA»), либо пустого контрольного вектора scAAV9. Приведены данные по уровню экспрессии в стороне без инъекции и в стороне с инъекцией. Относительные уровни экспрессии htt были нормализованы к калнексину овцы.
На фиг. 23 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) в средней части скорлупы головного мозга модельной овцы с болезнью Гентингтона через шесть месяцев после интрастриатальной инъекции либо scAAV9 CBA-mir-HTT («промотор CBA»), либо scAAV9 U6-mir -HTT («промотор U6»), либо пустого контрольного вектора scAAV9. Также приведены данные об уровне экспрессии htt у контрольных овец без инъекции. Относительные уровни экспрессии htt были нормализованы к калнексину овцы.
На фиг. 24 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) в переднем стриатуме модельной овцы с болезнью Гентингтона через шесть месяцев после интрастриатальной инъекции либо scAAV9 CBA- mir-HTT («промотор CBA»), либо scAAV9 U6-mir -HTT («промотор U6»), либо пустого контрольного вектора scAAV9. Также приведены данные об уровне экспрессии htt у контрольных овец без инъекции. Относительные уровни экспрессии htt были нормализованы к калнексину овцы.
На фиг. 25А-25В показаны прогнозируемые структуры типа «шпилька» искусственной микроРНК, нацеленной на гентингтин человека. На фиг. 25A показана прогнозируемая структура типа «шпилька» у mir-155-6433 (SEQ ID NO: 23). На фиг. 25B показана прогнозируемая структура типа «шпилька» у mir-30-6433 (SEQ ID NO: 24).
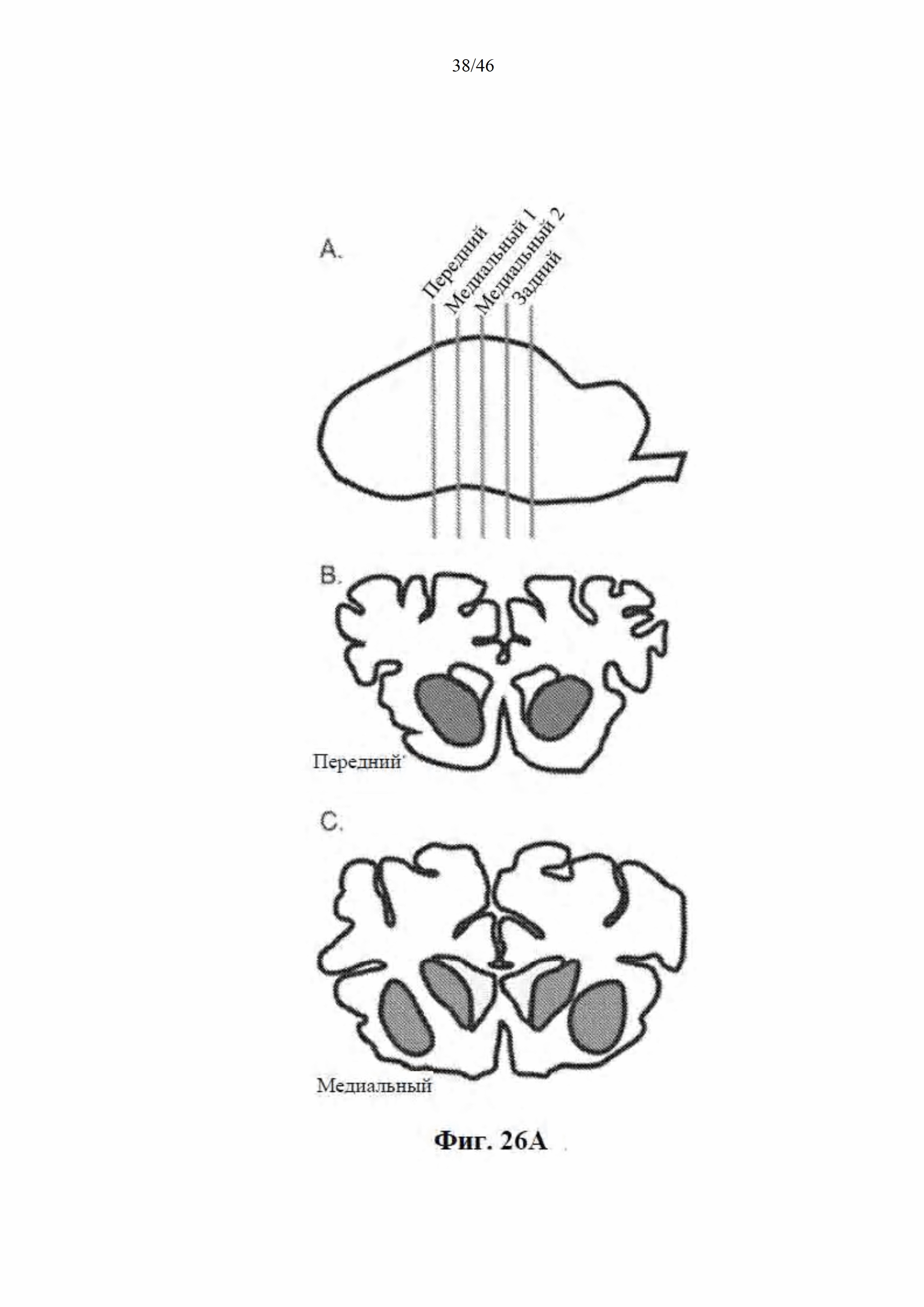
На фиг. 26A-26B показана доставка AAV-векторов в головной мозг овцы. На фиг. 26А показан схематический вид головного мозга овцы, рассеченного в коронарной плоскости (сверху), так чтобы весь стриатум умещался в 4 блока по 6 мм. Передний блок содержит переднюю часть стриатума, которая не разделена внутренней капсулой (посередине). Внизу показаны медиальные блоки, которые являются целью инъекции и имеют определенную скорлупу и хвостатое ядро. На фиг. 26B показаны AAV-векторные геномы у контрольных (AAV9) и обработанных (AAV9miRHTT) животных. Векторные геномы измеряли с помощью цифровой капельной ПЦР с использованием геномной HPRT в качестве референсного гена. Значения изображены в виде графика на логарифмической шкале.
На фиг. 27 показано, что искусственная направляющая цепь микроРНК была количественно определена с помощью цифровой капельной ПЦР. Относительные уровни микроРНК рассчитывали путем нормализации к let-7e*, и это значение откладывали на график на логарифмической шкале. Образцы с RQN <5 были исключены. Указанное количество представляет собой общее количество образцов, которые пережили этот порог качества, и их использовали в анализе микроРНК. P-значения рассчитывали с использованием двухфакторного дисперсионного анализа с поправкой Тьюки для множественного тестирования.
На фиг. 28 показано, что scAAV9-anti-HTT-6433 уменьшает количество мРНК мутантного гентингтина человека в стриатуме. Приведенные данные относятся к сигналу от мРНК HTT, нормализованного к калнексину овцы. Звездочками указаны значимые различия в средних значениях между группами обработки (AAV9 или AAV9miRHTT) при p=0,03 или менее с непарными t-критериями. Искусственная микроРНК под управлением промотора U6 значимо снижает мРНК мутантного HTT человека в хвостатом ядре и скорлупе головного мозга через 1 месяц после инъекции и в скорлупе головного мозга через 6 месяцев после инъекции. Искусственная микроРНК под управлением промотора CBA снижает мРНК HTT в хвостатом ядре, скорлупе головного мозга и переднем стриатуме через 1 месяц после инъекции и в хвостатом ядре и скорлупе головного мозга через 6 месяцев после инъекции. При анализе исследовали медиальный участок хвостатого ядра, латеральной скорлупы головного мозга и переднего стриатума.
На фиг. 29A-29B показаны уровни эндогенной мРНК htt овцы и белка у овец, обработанных посредством AAV9 и AAV9miRHTT. На фиг. 29A показаны уровни мРНК htt овцы, которые были определены так, как описано в способах, и выражены относительно калнексина овец (Canx). Показаны результаты исследования 2. Между группами, обработанными посредством AAV9 и AAV9miRHTT, отсутствовало различие в уровнях эндогенной мРНК htt овцы. На фиг. 29В показаны уровни эндогенного гентингтина овцы и белка mHTT человека, детектированные с помощью антитела к htt1-17 (Ab1) в скорлупе головного мозга по результатам исследования 2 через 6 месяцев после инъекции. По результатам вестерн-блоттинга образца виден сигнал для htt wt (обозначен стрелкой) и мутантного htt человека (стрелкой) для сторон с инъекцией и без инъекции головного мозга у 4 различных овец, которым на одной стороне была введена инъекцией AAV9miRHTT. На графике показаны средние значения htt овцы wt и mHTT человека, определенные по результатам денситометрии, в виде процента стороны с инъекцией от стороны без инъекции. Следует отметить, что обработка посредством AAV9miRHTT не оказывает влияния на уровни эндогенного белка гентингтина овец, но значимо уменьшает уровни mHTT человека. Звездочкой обозначено p=0,005 с непарным t-критерием.
На фиг. 30 показано, что AAV9-miRHTT уменьшает количество мутантного белка гентингтина человека в стриатуме. По результатам вестерн-блоттинга образцов скорлупы головного мозга из исследований 1 и 2 виден мутантный HTT, детектируемый с помощью антитела 3B5H10, и актин в качестве контрольной загрузки (сверху). На графике видно распределение отдельных значений и среднее значение (горизонтальная полоска) для овец, обработанных посредством либо AAV9 (контроль), либо AAV9-miRHTT (внизу). Показаны результаты для различных участков стриатума (хвостатого ядра, скорлупы головного мозга и переднего стриатума) в исследованиях 1 и 2 и через 1 и 6 месяцев после инъекции. В исследовании 2 через 6 месяцев после инъекции в каждом участке были исследованы две площади (площади 1 и 2). Звездочками указано значимое различие на стороне с инъекцией между AAV9 и AAV9-miRHTT при p <0,05 или менее на основе непарных t-критериев.
На фиг. 31 показаны уровни мутантного HTT человека, детектированного с помощью MSD-анализа, через 1 и 6 месяцев после инъекции в исследовании 1 (промотор U6) и исследовании 2 (промотор CBA). На графике видно распределение отдельных значений и средних значений (горизонтальные полоски) для овец, обработанных посредством либо AAV9 (контроль), либо AAV9-miRHTT. Показаны результаты для различных участков стриатума (хвостатого ядра, скорлупы головного мозга и переднего стриатума). Звездочками * указано значимое различие на стороне с инъекцией между AAV9 и AAV9-miRHTT при p <0,05 или менее на основе непарных t-критериев.
На фиг. 32A-32B показано, что уровни mHTT не изменяются в ипсилатеральной коре головного мозга и контралатеральном хвостатом ядре и скорлупе головного мозга стриатума овец, которым была инъекцией введена miRHTT. На фиг. 32А показан график, на котором указаны средние уровни mHTT, нормализованные к актину, в коре головного мозга, ипсилатеральной стриатуму с инъекцией miRHTT. Данные приведены из исследования 1 через 1 и 6 месяцев после инъекции NS на основе непарного t-критерия. На фиг. 32B показана столбчатая диаграмма, на которой указаны уровни mHTT, нормализованные к актину, в хвостатом ядре и скорлупе головного мозга, контрлатеральных стриатуму с инъекцией miRHTT. Данные приведены из исследования 1 через 1 и 6 месяцев после инъекции NS на основе непарного t-критерия.
Подробное раскрытие настоящего изобретения
Аспекты настоящего изобретения относятся к определенным интерферирующим РНК (например, микроРНК, таким как искусственные микроРНК), которые при доставке субъекту эффективны для уменьшения экспрессии патогенного белка гентингтина (HTT) у субъекта. Следовательно, описанные настоящим раскрытием способы и композиции пригодны, в соответствии с некоторыми вариантами осуществления, для лечения болезни Гентингтона.
Способы лечения болезни Гентингтона
Настоящее раскрытие относится к способам доставки трансгена (например, ингибирующей РНК, такой как микроРНК) субъекту. Способы обычно предусматривают введение субъекту эффективного количества выделенной нуклеиновой кислоты, кодирующей интерферирующую РНК, способную уменьшать экспрессию белка гентингтина (htt), или rAAV, содержащего нуклеиновую кислоту для экспрессии ингибирующей РНК, способной уменьшать экспрессию белка гентингтина.
Согласно некоторым аспектам, настоящее раскрытие относится к ингибирующей микроРНК, которая специфически связывается (например, гибридизируется) по меньшей мере с двумя (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более) смежными основаниями гентингтина человека (например, SEQ ID NO: 1). Применяемый в контексте настоящего документа термин «смежные основания» относится к двум или более нуклеотидным основаниям, которые ковалентно связаны (например, одной или несколькими фосфодиэфирными связями и т. д.) друг с другом (например, как часть молекулы нуклеиновой кислоты). В соответствии с некоторыми вариантами осуществления, по меньшей мере одна микроРНК приблизительно на 50%, приблизительно на 60%, приблизительно на 70% приблизительно на 80%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или приблизительно на 100% идентична двум или более (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более) смежным нуклеотидным основаниям из SEQ ID NO: 1. В соответствии с некоторыми вариантами осуществления, ингибирующая РНК представляет собой микроРНК, которая содержит последовательность, изложенную под любым из SEQ ID NO: 2-10, или кодируется ею.
Применяемый в контексте настоящего документа термин «болезнь Гентингтона» или «HD» относится к нейродегенеративному заболеванию, характеризующемуся прогрессирующим ухудшением движений, когнитивными и поведенческими изменениями, вызванными увеличением количества тринуклеотидного повтора (например, CAG, который транслируется в полиглутаминовый или поли-Q участок) в гене HTT, что приводит к выработке патогенного мутантного белка гентингтина (HTT или mHTT). В соответствии с некоторыми вариантами осуществления, мутантный белок гентингтин увеличивает скорость гибели нейронов в определенных участках головного мозга. Как правило, тяжесть HD коррелирует с размером увеличения количества тринуклеотидного повтора у субъекта. Например, субъекта, имеющего участок повторов CAG, содержащий от 36 до 39 повторов, характеризуют как имеющего HD с «уменьшенным проявлением», тогда как субъекта, имеющего более 40 повторов, характеризуют как имеющего HD с «полным проявлением». Таким образом, в соответствии с некоторыми вариантами осуществления, субъект, имеющий HD или имеющий риск развития HD, имеет ген HTT, содержащий от приблизительно 36 до приблизительно 39 повторов CAG (например, 36, 37, 38 или 39 повторов). В соответствии с некоторыми вариантами осуществления, субъект, имеющий HD или имеющий риск развития HD, имеет ген HTT, содержащий 40 или более (например, 40, 45, 50, 60, 70, 80, 90, 100, 200 или более) повторов CAG. В соответствии с некоторыми вариантами осуществления, у субъекта, имеющего ген HTT, содержащий более 100 повторов CAG, HD развивается раньше, чем у субъекта, имеющего менее 100 повторов CAG. В соответствии с некоторыми вариантами осуществления, у субъекта, имеющего ген HTT, содержащий более 100 повторов CAG, симптомы HD могут развиться до достижения возраста приблизительно 20 лет, и их называют ювенильной HD (также называемой акинетически-ригидной HD или вестфальским вариантом HD). Количество повторов CAG в аллеле гена HTT субъекта можно определить с помощью любого подходящего способа, известного в настоящей области техники. Например, нуклеиновые кислоты (например, ДНК) можно выделить из биологического образца (например, крови) субъекта, а количество повторов CAG в аллеле HTT можно определить гибридизационным способом, таким как ПЦР или секвенирование нуклеиновых кислот (например, секвенирование Illumina, секвенирование по Сенгеру, секвенирование SMRT и т. д.).
«Эффективное количество» вещества представляет собой количество, достаточное для достижения требуемого эффекта. В соответствии с некоторыми вариантами осуществления, эффективное количество выделенной нуклеиновой кислоты представляет собой количество, достаточное для трансфицирования (или инфицирования в контексте rAAV-опосредованной доставки), достаточного количества целевых клеток целевой ткани субъекта. В соответствии с некоторыми вариантами осуществления, целевая ткань представляет собой ткань центральной нервной системы (ЦНС) (например, ткань головного мозга, ткань спинного мозга, спинномозговую жидкость (CSF) и т. д.). В соответствии с некоторыми вариантами осуществления, эффективное количество выделенной нуклеиновой кислоты (например, которое может быть доставлено с помощью rAAV) может представлять собой количество, достаточное для получения терапевтического эффекта у субъекта, например, для уменьшения экспрессии патогенного гена или белка (например, HTT), для увеличения продолжительности жизни субъекта, для улучшения у субъекта одного или нескольких симптомов заболевания (например, симптома болезни Гентингтона) и т. д. Эффективное количество будет зависеть от множества факторов, таких как, например, вид, возраст, вес, состояние здоровья субъекта и ткани, на которую необходимо оказать целенаправленное воздействие, и, таким образом, может варьировать в зависимости от субъекта и ткани, как описано в других разделах настоящего раскрытия.
Выделенные нуклеиновые кислоты
Согласно некоторым аспектам, настоящее раскрытие относится к выделенным нуклеиновым кислотам, которые пригодны для уменьшения (например, ингибирования) экспрессии гентингтина человека (HTT). Последовательность «нуклеиновой кислоты» обозначает последовательность ДНК или РНК. В соответствии с некоторыми вариантами осуществления, белки и нуклеиновые кислоты по настоящему изобретению являются выделенными. Применяемый в контексте настоящего документа термин «выделенный» означает искусственно полученный. Применяемый в настоящем документе в отношении нуклеиновых кислот термин «выделенный» означает: (i) амплифицированный in vitro, например, с помощью полимеразной цепной реакции (ПЦР); (ii) рекомбинантно полученный с помощью клонирования; (iii) очищенный, например, путем расщепления и разделения в геле; или (iv) синтезированный, например, с помощью химического синтеза. Выделенная нуклеиновая кислота представляет собой нуклеиновую кислоту, с которой легко совершать манипуляции методиками рекомбинантной ДНК, которые хорошо известны в настоящей области техники. Таким образом, нуклеотидную последовательность, содержащуюся в векторе, в котором известны 5' и 3' сайты рестрикции или для которого были раскрыты последовательности праймеров полимеразной цепной реакции (ПЦР), считают выделенной, а последовательность нуклеиновой кислоты, существующую в своем нативном состоянии в своем естественном хозяине, - нет. Выделенная нуклеиновая кислота может быть практически очищенной, но это необязательно. Например, нуклеиновая кислота, которая выделена в векторе клонирования или экспрессии, не является чистой, поскольку она может составлять лишь малый процент материала в клетке, в которой она находится. Тем не менее, такая нуклеиновая кислота является выделенной в том смысле, как данный термин применяют в контексте настоящего документа, поскольку она легко поддается манипуляции стандартными методиками, известными специалистам в настоящей области техники. Применяемый в контексте настоящего документа в отношении белков или пептидов термин «выделенный» относится к белку или пептиду, который был выделен из его естественной среды или был искусственно получен (например, с помощью химического синтеза, технологии рекомбинантной ДНК и т. д.).
Специалист в настоящей области также поймет, что для получения функционально эквивалентных вариантов или гомологов капсидных белков можно произвести консервативные аминокислотные замены. Согласно некоторым аспектам, настоящее раскрытие охватывает изменения последовательности, которые приводят в результате к консервативным аминокислотным заменам. Применяемый в контексте настоящего документа термин «консервативная аминокислотная замена» относится к аминокислотной замене, которая не изменяет характеристики относительного заряда или размера белка, в котором производят такую аминокислотную замену. Варианты можно получить в соответствии со способами изменения полипептидной последовательности, известными специалисту в настоящей области, такими как те, которые можно найти в публикациях, которые представляют собой сборники описания таких способов, например, Molecular Cloning: A Laboratory Manual, J. Sambrook, et al., eds., Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989, или Current Protocols in Molecular Biology, F.M. Ausubel, et al., eds., John Wiley & Sons, Inc., New York. Консервативные замены аминокислот включают замены, производимые среди аминокислот в следующих группах: (a) M, I, L, V; (b) F, Y, W; (c) K, R, H; (d) A, G; (e) S, T; (f) Q, N; и (g) E, D. Таким образом, специалист может произвести консервативные аминокислотные замены в аминокислотной последовательности раскрываемых в настоящем документе белков и полипептидов.
Выделенные нуклеиновые кислоты по настоящему изобретению могут представлять собой рекомбинантные векторы на основе аденоассоциированного вируса (AAV) (rAAV-векторы). В соответствии с некоторыми вариантами осуществления, выделенная нуклеиновая кислота, которая описана настоящим раскрытием, содержит участок (например, первый участок) содержащий первый инвертированный концевой повтор (ITR) аденоассоциированного вируса (AAV) или его вариант. Выделенная нуклеиновая кислота (например, рекомбинантный AAV-вектор) может быть упакована в капсидный белок и введена субъекту и/или доставлена в выбранную целевую клетку. «Рекомбинантные AAV (rAAV)-векторы» обычно состоят, как минимум, из трансгена и его регуляторных последовательностей и 5' и 3' инвертированных концевых повторов AAV (ITR). Трансген может содержать, как раскрыто в других разделах настоящего документа, один или несколько участков, которые кодируют одну или несколько ингибирующих РНК (например, микроРНК), содержащих нуклеиновую кислоту, которая нацелена на эндогенную мРНК субъекта. Трансген может также содержать участок, кодирующий, например, белок и/или последовательность для контроля экспрессии (например, поли-А хвост), как раскрыто в других разделах настоящего раскрытия.
Как правило, последовательности ITR имеют длину приблизительно 145 п. о. Предпочтительно, в молекуле применяются практически полные последовательности, кодирующие ITR, хотя допустима некоторая степень незначительной модификации этих последовательностей. Способность изменять эти последовательности ITR находится в пределах компетенции специалиста в настоящей области техники. (См., например, такие публикации, как Sambrook et al., "Molecular Cloning. A Laboratory Manual", 2d ed., Cold Spring Harbor Laboratory, New York (1989); и K. Fisher et al., J Virol., 70:520 532 (1996)). Примером такой молекулы, используемой в настоящем изобретении, является «цис- действующая» плазмида, содержащая трансген, в котором выбранная последовательность трансгена и связанные с ней регуляторные элементы фланкированы 5' и 3' последовательностями ITR AAV. Последовательности ITR AAV можно получить из любого известного AAV, включая выявленные к настоящему времени типы AAV млекопитающих. В соответствии с некоторыми вариантами осуществления, выделенная нуклеиновая кислота (например, rAAV-вектор) содержит по меньшей мере один ITR, имеющий серотип, выбранный из AAV1, AAV2, AAV5, AAV6, AAV6.2, AAV7, AAV8, AAV9, AAV10, AAV11 и их вариантов. В соответствии с некоторыми вариантами осуществления, выделенная нуклеиновая кислота содержит участок (например, первый участок), кодирующий ITR AAV2.
В соответствии с некоторыми вариантами осуществления, выделенная нуклеиновая кислота дополнительно содержит участок (например, второй участок, третий участок, четвертый участок и т. д.), содержащий второй ITR AAV. В соответствии с некоторыми вариантами осуществления, второй ITR AAV имеет серотип выбранный из AAV1, AAV2, AAV5, AAV6, AAV6.2, AAV7, AAV8, AAV9, AAV10, AAV11 и их вариантов. В соответствии с некоторыми вариантами осуществления, второй ITR является мутантным ITR, в котором отсутствует функциональный сайт концевого разрешения (TRS). Термин «отсутствие сайта концевого разрешения» может относиться к ITR AAV, который содержит мутацию (например, смысловую мутацию, такую как несинонимичная мутация или миссенс-мутация), которая нивелирует функцию сайта концевого разрешения (TRS) ITR, или к укороченному ITR AAV, в котором отсутствует последовательность нуклеиновой кислоты, кодирующая функциональный TRS (например, ITR ΔTRS). Без привязки к какой-либо конкретной теории, rAAV-вектор, содержащий ITR без функционального TRS, производит самокомплементарный rAAV-вектор, например, как описано в публикации McCarthy (2008) Molecular Therapy 16(10):1648-1656.
В дополнение к основным элементам, указанным выше для рекомбинантного AAV- вектора, вектор также включает традиционные регуляторные элементы, которые функционально связаны с элементами трансгена таким образом, чтобы обеспечивалась транскрипция, трансляция и/или экспрессия в клетке, трансфицированной таким вектором или инфицированной вирусом, получаемым с помощью настоящего изобретения. В контексте настоящего документа к «функционально связанным» последовательностям относятся как регулирующие экспрессию последовательности, которые находятся рядом с представляющим интерес геном, так и регулирующие экспрессию последовательности, которые действуют в транс-положении или на расстоянии, регулируя представляющий интерес ген. К регулирующим экспрессию последовательностям относятся соответствующие последовательности инициации, окончания транскрипции, промоторные и энхансерные последовательности; эффективные сигналы процессирования РНК, такие как сигналы сплайсинга и полиаденилирования (поли-А); последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (т.е. консенсусная последовательность Козака); последовательности, которые повышают стабильность белка; и, при необходимости, последовательности, которые усиливают секрецию кодируемого продукта. В настоящей области техники известен ряд регулирующих экспрессию последовательностей, в том числе промоторы, которые являются нативными, конститутивными, индуцируемыми и/или тканеспецифическими, и их можно использовать.
В контексте настоящего документа последовательность нуклеиновой кислоты (например, кодирующая последовательность) и регуляторные последовательности считаются функционально связанными, когда они ковалентно связаны таким образом, чтобы поместить экспрессию или транскрипцию последовательности нуклеиновой кислоты под влияние или контроль регуляторных последовательностей. Если необходимо, чтобы последовательности нуклеиновой кислоты транслировались в функциональный белок, считается, что две последовательности ДНК функционально связаны, если индукция промотора в 5'-регуляторных последовательностях приводит к транскрипции кодирующей последовательности, и если природа связи между двумя такими последовательностями ДНК (1) не приводит к введению мутации со сдвигом рамки, (2) не препятствует способности промоторного участка управлять транскрипцией кодирующих последовательностей или (3) не препятствует способности соответствующего РНК- транскрипта транслироваться в белок. Таким образом, промоторный участок будет функционально связан с последовательностью нуклеиновой кислоты, если промоторный участок будет способен осуществлять транскрипцию такой последовательности ДНК так, чтобы получаемый в результате транскрипт мог транслироваться в необходимый белок или полипептид. Аналогично, два или более кодирующих участков являются функционально связанными, когда они связаны таким образом, чтобы их транскрипция с общего промотора приводила к экспрессии двух или более белков, транслированных в рамке. В соответствии с некоторыми вариантами осуществления, функционально связанные кодирующие последовательности дают на выходе слитый белок. В соответствии с некоторыми вариантами осуществления, функционально связанные кодирующие последовательности дают на выходе функциональную РНК (например, микроРНК).
Согласно некоторым аспектам, настоящее раскрытие относится к выделенной нуклеиновой кислоте, содержащей трансген, причем трансген содержит последовательность нуклеиновой кислоты, кодирующую одну или несколько микроРНК. «МикроРНК» представляет собой малую некодирующую молекулу РНК, способную опосредовать транскрипционный или посттрансляционный сайленсинг генов. Как правило, микроРНК транскрибируется в виде дуплексной структуры по типу «шпильки» или «петли-на-стебле» (например, обладающий самокомплементарностью, одноцепочечный остов), называемой первичной микроРНК (pri-микроРНК), которая подвергается ферментативному процессингу (например, посредством Drosha, DGCR8, Pasha и т. д.) в pre-микроРНК. Длина pri-микроРНК может варьировать. В соответствии с некоторыми вариантами осуществления, pri-микроРНК варьирует в диапазоне от приблизительно 100 до приблизительно 5000 пар оснований (например, приблизительно 100, приблизительно 200, приблизительно 500, приблизительно 1000, приблизительно 1200, приблизительно 1500, приблизительно 1800 или приблизительно 2000 пар оснований) в длину. В соответствии с некоторыми вариантами осуществления, pri- микроРНК составляет более 200 пар оснований, например, 2500, 5000, 7000, 9000 или более пар оснований в длину.
Pre-микроРНК, которая также характеризуется дуплексной структурой по типу «шпильки» или «петли-на-стебле», также может варьировать по длине. В соответствии с некоторыми вариантами осуществления, pre-микроРНК варьирует по размеру от приблизительно 40 пар оснований в длину до приблизительно 500 пар оснований в длину. В соответствии с некоторыми вариантами осуществления, pre-микроРНК варьирует по размеру от приблизительно 50 до 100 пар оснований в длину. В соответствии с некоторыми вариантами осуществления, pre-микроРНК варьирует по размеру от приблизительно 50 до приблизительно 90 пар оснований в длину (например, приблизительно 50, приблизительно 52, приблизительно 54, приблизительно 56, приблизительно 58, приблизительно 60, приблизительно 62, приблизительно 64, приблизительно 66, приблизительно 68, приблизительно 70, приблизительно 72, приблизительно 74, приблизительно 76, приблизительно 78, приблизительно 80, приблизительно 82, приблизительно 84, приблизительно 86, приблизительно 88 или приблизительно 90 пар оснований в длину).
Обычно pre-микроРНК экспортируется в цитоплазму и ферментативно процессируется посредством Dicer с образованием сначала несовершенного дуплекса микроРНК/микроРНК*, а затем одноцепочечной зрелой молекулы микроРНК, которая затем загружается в индуцированный РНК комплекс сайленсинга (RISC). Как правило, зрелая молекула микроРНК варьирует по размеру от приблизительно 19 до приблизительно 30 пар оснований в длину. В соответствии с некоторыми вариантами осуществления, зрелая молекула микроРНК составляет приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23, приблизительно 24, приблизительно 25, приблизительно 26, приблизительно 27, приблизительно 28, приблизительно 29 или 30 пар оснований в длину. В соответствии с некоторыми вариантами осуществления, выделенная нуклеиновая кислота по настоящему раскрытию содержит последовательность, кодирующую pri-микроРНК, pre-микроРНК или зрелую микроРНК, содержащую последовательность, указанную под любым из SEQ ID NO: 2-10 или 21-22.
Следует понимать, что выделенная нуклеиновая кислота или вектор (например, rAAV-вектор), в соответствии с некоторыми вариантами осуществления, содержит последовательность нуклеиновой кислоты, кодирующую более одной (например, множество, к примеру, 2, 3, 4, 5, 10 или более) микроРНК. В соответствии с некоторыми вариантами осуществления, каждая из более чем одной микроРНК нацелена (например, гибридизируется или специфически связывается с ним) на один и тот же целевой ген (например, выделенная нуклеиновая кислота, кодирующая три уникальные микроРНК, причем каждая микроРНК нацелена на ген HTT). В соответствии с некоторыми вариантами осуществления, каждая из более чем одной микроРНК нацелена (например, гибридизуется или специфически связывается с ним) на другой целевой ген.
Согласно некоторым аспектам, настоящее раскрытие относится к выделенным нуклеиновым кислотам и векторам (например, rAAV-векторам), которые кодируют одну или несколько искусственных микроРНК. В контексте настоящего документа «искусственная микроРНК» или «amiRNA» относится к эндогенной pri-микроРНК или pre-микроРНК (например, остову микроРНК, который является предшественником микроРНК, способным производить функциональную зрелую микроРНК), в которой последовательности микроРНК и микроРНК* (например, «сопровождающая» цепь дуплекса микроРНК) были заменены соответствующими последовательностями amiRNA/amiRNA*, которые управляют высокоэффективным РНК-сайленсингом целевого гена, например, как описано в публикации Eamens et al. (2014), Methods Mol. Biol. 1062:211-224. Например, в соответствии с некоторыми вариантами осуществления, искусственная микроРНК содержит остов pri-микроРНК miR-155, в который была вставлена последовательность, кодирующая зрелую HTT-специфическую микроРНК (например, любую из SEQ ID NO: 2-10), вместо эндогенной последовательности, кодирующей зрелую микроРНК miR-155. В соответствии с некоторыми вариантами осуществления, микроРНК (например, искусственная микроРНК), которая описана настоящим раскрытием, содержит остовную последовательность miR-155, остовную последовательность miR-30, остовную последовательность mir-64 или остовную последовательность miR-122.
Участок, содержащий трансген (например, второй участок, третий участок, четвертый участок и т. д.), может быть расположен в любом подходящем местоположении выделенной нуклеиновой кислоты. Участок может быть расположен в любой нетранслируемой части нуклеиновой кислоты, включая, например, интрон, 5' или 3' нетранслируемый участок и т. д.
В некоторых случаях может быть необходимо размещение участка (например, второго участка, третьего участка, четвертого участка и т. д.) выше первого кодона последовательности нуклеиновой кислоты, кодирующей белок (например, кодирующей белок последовательности). Например, участок может быть расположен между первым кодоном кодирующей белок последовательности и 2000 нуклеотидами выше первого кодона. Участок может быть расположен между первым кодоном кодирующей белок последовательности и 1000 нуклеотидами выше первого кодона. Участок может быть расположен между первым кодоном кодирующей белок последовательности и 500 нуклеотидами выше первого кодона. Участок может быть расположен между первым кодоном кодирующей белок последовательности и 250 нуклеотидами выше первого кодона. Участок может быть расположен между первым кодоном кодирующей белок последовательности и 150 нуклеотидами выше первого кодона.
В некоторых случаях (например, когда трансген не содержит кодирующей белок последовательности) может быть необходимо расположить участок (например, второй участок, третий участок, четвертый участок и т. д.) выше поли-А хвоста трансгена. Например, участок может быть расположен между первым основанием поли-А хвоста и 2000 нуклеотидами выше первого основания. Участок может быть расположен между первым основанием поли-А хвоста и 1000 нуклеотидами выше первого основания. Участок может быть расположен между первым основанием поли-А хвоста и 500 нуклеотидами выше первого основания. Участок может быть расположен между первым основанием поли-А хвоста и 250 нуклеотидами выше первого основания. Участок может быть расположен между первым основанием поли-А хвоста и 150 нуклеотидами выше первого основания. Участок может быть расположен между первым основанием поли-А хвоста и 100 нуклеотидами выше первого основания. Участок может быть расположен между первым основанием поли-А хвоста и 50 нуклеотидами выше первого основания. Участок может быть расположен между первым основанием поли-А хвоста и 20 нуклеотидами выше первого основания. В соответствии с некоторыми вариантами осуществления, участок расположен между последним нуклеотидным основанием промоторной последовательности и первым нуклеотидным основанием последовательности поли-А хвоста.
В некоторых случаях участок может быть расположен ниже последнего основания поли-А хвоста трансгена. Участок может находиться между последним основанием поли- А хвоста и положением 2000 нуклеотидов ниже последнего основания. Участок может находиться между последним основанием поли-А хвоста и положением 1000 нуклеотидов ниже последнего основания. Участок может находиться между последним основанием поли-А хвоста и положением 500 нуклеотидов ниже последнего основания. Участок может находиться между последним основанием поли-А хвоста и положением 250 нуклеотидов ниже последнего основания. Участок может находиться между последним основанием поли-А хвоста и положением 150 нуклеотидов ниже последнего основания.
Следует понимать, что в случаях, когда трансген кодируется более одной микроРНК, каждая микроРНК может быть расположена в любом подходящем местоположении в пределах трансгена. Например, нуклеиновая кислота, кодирующая первую микроРНК, может быть расположена в интроне трансгена, а последовательность нуклеиновой кислоты, кодирующая вторую микроРНК, может быть расположена в другом нетранслируемом участке (например, между последним кодоном кодирующей белок последовательности и первым основанием поли-А хвоста трансгена).
В соответствии с некоторыми вариантами осуществления, трансген дополнительно содержит последовательность нуклеиновой кислоты, кодирующую одну или несколько регулирующих экспрессию последовательностей (например, промотор и т. д.). К регулирующим экспрессию последовательностям относятся соответствующие последовательности инициации, окончания транскрипции, промоторные и энхансерные последовательности; эффективные сигналы процессирования РНК, такие как сигналы сплайсинга и полиаденилирования (поли-А); последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (т. е. консенсусная последовательность Козака); последовательности, которые повышают стабильность белка; и, при необходимости, последовательности, которые усиливают секрецию кодируемого продукта. В настоящей области техники известно огромное количество регулирующих экспрессию последовательностей, в том числе промоторы, которые являются нативными, конститутивными, индуцируемыми и/или тканеспецифическими, и их можно использовать.
«Промотор» обозначает последовательность ДНК, распознаваемую синтезирующим механизмом клетки или введенным синтезирующим механизмом, и такая последовательность необходима для инициации специфической транскрипции гена. Фразы «функционально расположенные», «под контролем» или «под транскрипционным контролем» означают, что промотор находится в правильном местоположении и правильной ориентации по отношению к нуклеиновой кислоте для контроля инициации РНК-полимеразы и экспрессии гена.
В случае нуклеиновых кислот, кодирующих белки, последовательность полиаденилирования обычно вставляют после трансгенных последовательностей и перед 3' последовательностью ITR AAV. Пригодная в настоящем раскрытии rAAV-конструкция также может содержать интрон, желательно расположенный между промоторной/энхансерной последовательностью и трансгеном. Одной возможной интронной последовательностью является последовательность, которая получена от SV-40 и называется T-интронной последовательностью SV-40. Другим векторным элементом, который можно применять, является участок внутренней посадки рибосомы (IRES). Последовательность IRES применяют для получения более одного полипептида с одного транскрипта гена. Последовательность IRES можно будет применять для получения белка, который содержит более одной полипептидной цепи. Выбор этих и других традиционных векторных элементов является общеизвестным, и многие такие последовательности доступны [см., например, публикацию Sambrook et al., и упомянутые в ней ссылки, например, на страницах 3.18, 3.26 и 16.17, 16.27 и публикацию Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, 1989]. В соответствии с некоторыми вариантами осуществления, в полипротеин включена последовательность вируса ящура 2А, это небольшой пептид (длиной примерно 18 аминокислот), который, как было показано, опосредует расщепление полипротеинов (Ryan, M D et al., EMBO, 1994; 4: 928-933; Mattion, N M et al., J Virology, November 1996; p. 8124-8127; Furler, S et al., Gene Therapy, 2001; 8: 864-873; и Halpin, C et al., The Plant Journal, 1999; 4: 453-459). Расщепляющая активность последовательности 2А ранее была продемонстрирована в искусственных системах, в том числе плазмидах и векторах для генной терапии (AAV и ретровирусах) (Ryan, M D et al., EMBO, 1994; 4: 928-933; Mattion, N M et al., J Virology, November 1996; p. 8124-8127; Furler, S et al., Gene Therapy, 2001; 8: 864-873; и Halpin, C et al., The Plant Journal, 1999; 4: 453-459; de Felipe, P et al., Gene Therapy, 1999; 6: 198-208; de Felipe, P et al., Human Gene Therapy, 2000; 11: 1921-1931.; и Klump, H et al., Gene Therapy, 2001; 8: 811-817).
Примеры конститутивных промоторов включают без ограничения промотор LTR ретровирусного вируса саркомы Рауса (RSV) (необязательно с энхансером RSV), промотор цитомегаловируса (CMV) (необязательно с энхансером CMV) [см., например, публикацию Boshart et al., Cell, 41:521-530 (1985)], промотор SV40, промотор гена дигидрофолатредуктазы, промотор гена β-актина, промотор гена фосфоглицеринкиназы (PGK) и промотор гена EF1α [Invitrogen]. В соответствии с некоторыми вариантами осуществления, промотор представляет собой усиленный промотор гена куриного β- актина. В соответствии с некоторыми вариантами осуществления, промотор представляет собой промотор U6.
Индуцируемые промоторы позволяют регулировать экспрессию генов, и их можно регулировать экзогенно вводимыми соединениями, факторами окружающей среды, такими как температура, или наличием конкретного физиологического состояния, например, острой фазы, определенной стадии дифференцировки клетки или только в реплицирующихся клетках. Индуцируемые промоторы и индуцируемые системы доступны от различных коммерческих источников, включая без ограничения Invitrogen, Clontech и Ariad. Были описаны и многие другие системы, и они могут быть легко подобраны специалистом в настоящей области техники. Примеры индуцируемых промоторов, регулируемых экзогенно вводимыми соединениями, включают индуцируемый цинком промотор гена овечьего металлотионина (MT), индуцируемый дексаметазоном (Dex) промотор вируса опухоли молочной железы мыши (MMTV), промоторную систему полимеразы T7 (WO 98/10088); экдизоновый промотор насекомых (No et al., Proc. Natl. Acad. Sci. USA, 93:3346-3351 (1996)), тетрациклин-репрессируемую систему (Gossen et al., Proc. Natl. Acad. Sci. USA, 89:5547-5551 (1992)), тетрациклин- индуцируемую систему (Gossen et al., Science, 268:1766-1769 (1995), см. также публикацию Harvey et al., Curr. Opin. Chem. Biol., 2:512-518 (1998)), RU486-индуцируемую систему (Wang et al., Nat. Biotech., 15:239-243 (1997) и Wang et al., Gene Ther., 4:432-441 (1997)) и рапамицин-индуцируемую систему (Magari et al., J. Clin. Invest., 100:2865-2872 (1997)). Другими типами индуцируемых промоторов, которые могут быть пригодны в этом контексте, являются промоторы, которые регулируются конкретным физиологическим состоянием, например, температурой, острой фазой, определенной стадией дифференцировки клетки или только в реплицирующихся клетках.
В соответствии с другим вариантом осуществления, будут применять нативный для трансгена промотор. Нативный промотор может быть предпочтительным, когда необходимо, чтобы экспрессия трансгена имитировала нативную экспрессию. Нативный промотор можно применять, когда экспрессия трансгена должна регулироваться в зависимости от времени, или в зависимости от стадии развитии, или тканеспецифическим образом, или в ответ на конкретные транскрипционные стимулы. В соответствии с дополнительным вариантом осуществления, для имитации нативной экспрессии также можно применять другие нативные регулирующие экспрессию элементы, такие как энхансерные элементы, сайты полиаденилирования или консенсусные последовательности Козака.
В соответствии с некоторыми вариантами осуществления, регуляторные последовательности дают возможность тканеспецифической экспрессии генов. В некоторых случаях тканеспецифические регуляторные последовательности связывают тканеспецифические факторы транскрипции, которые индуцируют транскрипцию тканеспецифическим образом. Такие тканеспецифические регуляторные последовательности (например, промоторы, энхансеры и т. д.) хорошо известны в настоящей области техники. К типичным тканеспецифическим регуляторным последовательностям относятся без ограничения следующие тканеспецифические промоторы: специфический для печени промотор гена тироксинсвязывающего глобулина (TBG), промотор гена инсулина, промотор гена глюкагона, промотор гена соматостатина, промотор гена панкреатического полипептида (PPY), промотор гена синапсина-1 (Syn), промотор гена креатинкиназы (MCK), промотор гена десмина (DES) млекопитающего, промотор гена тяжелой цепи α-миозина (a-MHC) или промотор гена сердечного тропонина T (cTnT). К другим типичным промоторам относятся промотор гена бета- актина, коровый промотор вируса гепатита B, Sandig et al., Gene Ther., 3:1002-9 (1996); промотор гена альфа-фетопротеина (AFP), Arbuthnot et al., Hum. Gene Ther., 7:1503-14 (1996)), промотор гена остеокальцина костей (Stein et al., Mol. Biol. Rep., 24:185-96 (1997)); промотор гена сиалопротеина костей (Chen et al., J. Bone Miner. Res., 11:654-64 (1996)), промотор CD2 (Hansal et al., J. Immunol., 161:1063-8 (1998); промотор гена тяжелой цепи иммуноглобулина; промотор гена α-цепи рецептора Т-клеток, нейронный, такой как промотор гена нейрон-специфический енолазы (NSE) (Andersen et al., Cell. Mol. Neurobiol., 13:503-15 (1993)), промотор гена легкой цепи нейрофиламента (Piccioli et al., Proc. Natl. Acad. Sci. USA, 88:5611-5 (1991)) и нейрон-специфический промотор гена vgf (Piccioli et al., Neuron, 15:373-84 (1995)), среди прочего, что будет очевидно для специалиста в настоящей области техники.
Аспекты настоящего раскрытия относятся к выделенной нуклеиновой кислоте, содержащей более одного промотора (например, 2, 3, 4, 5 или более промоторов). Например, в контексте конструкции, имеющей трансген, содержащий первый участок, кодирующий белок, и второй участок, кодирующий ингибирующую РНК (например, микроРНК), может быть необходимо управлять экспрессией кодирующего белок участка с помощью первой промоторной последовательности (например, первой промоторной последовательности, функционально связанной с кодирующим белок участком) и управлять экспрессией участка, кодирующего ингибирующую РНК, второй промоторной последовательностью (например, второй промоторной последовательностью, функционально связанной с участком, кодирующим ингибирующую РНК). Как правило, первая промоторная последовательность и вторая промоторная последовательность могут быть одной и той же промоторной последовательностью или разными промоторными последовательностями. В соответствии с некоторыми вариантами осуществления, первая промоторная последовательность (например, промотор, управляющий экспрессией кодирующего белок участка) представляет собой промоторную последовательность гена РНК-полимеразы III (polIII). Неограничивающие примеры промоторных последовательностей polIII включают промоторные последовательности U6 и H1. В соответствии с некоторыми вариантами осуществления, вторая промоторная последовательность промотора (например, промоторная последовательность, управляющая экспрессией ингибирующей РНК) представляет собой промоторную последовательность гена РНК-полимеразы II (polII). Неограничивающие примеры промоторных последовательностей polII включают промоторные последовательности T7, T3, SP6, RSV и цитомегаловируса. В соответствии с некоторыми вариантами осуществления, промоторная последовательность polIII управляет экспрессией участка, кодирующего ингибирующую РНК (например, микроРНК). В соответствии с некоторыми вариантами осуществления, промоторная последовательность polII управляет экспрессией кодирующего белок участка.
В соответствии с некоторыми вариантами осуществления, нуклеиновая кислота содержит трансген, который кодирует белок. Белок может представлять собой терапевтический белок (например, пептид, белок или полипептид, пригодный для лечения или предупреждения развития болезненных состояний у субъекта-млекопитающего) или репортерный белок. В соответствии с некоторыми вариантами осуществления, терапевтический белок пригоден для лечения или предупреждения развития болезни Гентингтона, например, полиглутамин-связывающий пептид 1 (QBP1), PTD-QBP1, ED11, интраантитело C4, интраантитело VL12,3, интраантитело MW7, антитела Happ1, антитела Happ3, интраантитело mEM48, некоторые моноклональные антитела (например, 11C2) и пептид P42 и их варианты, которые описаны в публикации Marelli et al. (2016) Orphanet Journal of Rare Disease 11:24; doi:10.1186/s13023-016-0405-3. В соответствии с некоторыми вариантами осуществления, терапевтический белок представляет собой белок гентингтин дикого типа (например, белок гентингтин, имеющий участок повторов поли-Q, содержащий менее 36 повторов).
Без привязки к какой-либо конкретной теории, аллель-специфический сайленсинг мутантного гентингтина (HTT) может обеспечивать улучшенный профиль безопасности у субъекта в сравнении с аллель-неспецифическим сайленсингом (например, сайленсинг как аллелей дикого типа, так и мутантных аллелей HTT), поскольку в клетках сохраняется экспрессия и функция HTT дикого типа. Аспекты настоящего изобретения относятся к признанию и принятию авторами изобретения того факта, что выделенные нуклеиновые кислоты и векторы, которые включают одну или несколько последовательностей ингибирующей РНК (например, микроРНК), нацеленных на ген HTT аллель- неспецифическим образом, при этом управляющих экспрессией защищенного гена HTT дикого типа (гена HTT дикого типа, который не является мишенью для микроРНК), способны обеспечивать сопутствующий нокдаун мутантного HTT, например, в ткани ЦНС, с повышенной экспрессией HTT дикого типа. Как правило, последовательность нуклеиновой кислоты, кодирующая эндогенные мРНК HTT дикого типа и мутантного HTT, и нуклеиновая кислота трансгена, кодирующая «защищенную» мРНК HTT дикого типа, достаточно различаются с тем, чтобы «защищенная» мРНК трансгена HTT дикого типа не была мишенью для одной или нескольких ингибирующих РНК (например, микроРНК). Это может быть достигнуто, например, путем введения одной или нескольких молчащих мутаций в последовательность трансгена HTT так, чтобы он кодировал тот же белок, что и эндогенный ген HTT дикого типа, но имел другую последовательность нуклеиновой кислоты. В этом случае экзогенную мРНК можно назвать «защищенной». Альтернативно, ингибирующая РНК (например, микроРНК) может быть нацелена на 5' и/или 3' нетранслируемые участки эндогенной мРНК HTT дикого типа. Эти 5' и/или 3' участки затем можно удалить или заменить в трансгенной мРНК так, чтобы трансгенная мРНК не была мишенью для одной или нескольких ингибирующих РНК.
Репортерные последовательности (например, последовательности нуклеиновой кислоты, кодирующие репортерный белок), которые могут быть представлены в трансгене, включают без ограничения последовательности ДНК, кодирующие β-лактамазу, β-галактозидазу (LacZ), щелочную фосфатазу, тимидинкиназу, зеленый флуоресцентный белок (GFP), хлорамфениколацетилтрансферазу (CAT), люциферазу и другие хорошо известные в настоящей области техники. При связывании с регуляторными элементами, которые управляют их экспрессией, репортерные последовательности производят сигналы, детектируемые общепринятыми способами, включая ферментативный, рентгенографический, колориметрический, флуоресцентный или другие спектрографические анализы, анализы на основе сортировки флуоресцентно- активированных клеток и иммунологические анализы, включая твердофазный иммуноферментный анализ (ИФА), радиоиммуноанализ (РИА) и иммуногистохимию. Например, если маркерная последовательность представляет собой ген LacZ, присутствие вектора, несущего сигнал, детектируют с помощью анализов на β-галактозидазную активность. Если трансген представляет собой зеленый флуоресцентный белок или люциферазу, вектор, несущий сигнал, можно измерить визуально по цвету или выработке света в люминометре. Такие репортеры могут быть, например, пригодны при проверке способности тканеспецифического нацеливания и тканеспецифической промоторной регуляторной активности у нуклеиновой кислоты.
Рекомбинантные аденоассоциированные вирусы (rAAV)
Согласно некоторым аспектам, настоящее раскрытие относится к выделенным AAV. Применяемый в контексте настоящего документа в отношении AAV, термин «выделенный» относится к AAV, который был искусственно произведен или получен. Выделенные AAV можно получить с помощью рекомбинантных способов. Такие AAV в настоящем документе называются «рекомбинантными AAV». Рекомбинантные AAV (rAAV) предпочтительно обладают способностями тканеспецифического нацеливания с тем, чтобы нуклеаза и/или трансген rAAV доставлялись конкретно в одну или несколько заранее определенных тканей. Капсид AAV является важным элементом в определении этих способностей тканеспецифического нацеливания. Таким образом, можно выбрать rAAV, имеющий капсид, подходящий для ткани, на которую производят нацеливание.
Способы получения рекомбинантных AAV, имеющих необходимый капсидный белок, хорошо известны в настоящей области техники. (См., например, US 2003/0138772), содержание которого включено в настоящий документ посредством ссылки в полном его объеме). Как правило, способы предусматривают культивирование клетки-хозяина, которая содержит последовательность нуклеиновой кислоты, кодирующую капсидный белок AAV; функциональный ген rep; рекомбинантный вектор AAV, состоящий из инвертированных концевых повторов (ITR) AAV и трансгена; и достаточные вспомогательные функциональные элементы, позволяющие упаковывать рекомбинантный AAV-вектор в капсидные белки AAV. В соответствии с некоторыми вариантами осуществления, капсидные белки представляют собой структурные белки, кодируемые геном cap AAV. AAV содержат три капсидных белка, вирионные белки 1-3 (под названием VP1, VP2 и VP3), причем все они транскрибируются с одного гена cap посредством альтернативного сплайсинга. В соответствии с некоторыми вариантами осуществления, молекулярные массы VP1, VP2 и VP3 составляют соответственно приблизительно 87 кДа, приблизительно 72 кДа и приблизительно 62 кДа. В соответствии с некоторыми вариантами осуществления, при трансляции капсидные белки образуют сферическую 60-мерную белковую оболочку вокруг вирусного генома. В соответствии с некоторыми вариантами осуществления, функции капсидных белков заключаются в защите вирусного генома, доставке генома и взаимодействии с хозяином. Согласно некоторым аспектам, капсидные белки доставляют вирусный геном хозяину тканеспецифическим образом.
В соответствии с некоторыми вариантами осуществления, капсидный белок AAV относится к серотипу AAV, выбранному из группы, состоящей из AAV2, AAV3, AAV4, AAV5, AAV6, AAV8, AAVrh8, AAV9 и AAV10. В соответствии с некоторыми вариантами осуществления, капсидный белок AAV относится к серотипу, происходящему от не относящегося к человеку примата, например, серотипу AAVrh8. В соответствии с некоторыми вариантами осуществления, капсидный белок AAV относится к серотипу AAV9. В соответствии с некоторыми вариантами осуществления, капсидный белок AAV содержит последовательность, изложенную под SEQ ID NO: 20.
Компоненты, которые должны культивироваться в клетке-хозяине для упаковки rAAV-вектора в капсид AAV, можно ввести в клетку-хозяина в транс-положении. Альтернативно, любой один или несколько требуемых компонентов (например, рекомбинантный AAV-вектор, последовательности rep, последовательности cap и/или вспомогательные функциональные элементы) могут обеспечиваться стабильной клеткой- хозяином, которая была сконструирована методами инженерии так, чтобы она содержала один или несколько требуемых компонентов, с помощью способов, известных специалистам в настоящей области техники. Наиболее целесообразно, чтобы такая стабильная клетка-хозяин содержала требуемый компонент(-ы) под контролем индуцируемого промотора. Тем не менее, требуемый компонент(-ы) может находиться под контролем конститутивного промотора. Примеры подходящих индуцируемых и конститутивных промоторов представлены в настоящем документе при рассмотрении регуляторных элементов, подходящих для применения с трансгеном. В качестве еще одной альтернативы, выбранная стабильная клетка-хозяин может содержать выбранный(- ые) компонент(-ы) под контролем конститутивного промотора и другой(-ие) выбранный(- ые) компонент(-ы) под контролем одного или нескольких индуцируемых промоторов. Например, можно получить стабильную клетку-хозяина, которая происходит из клеток линии 293 (которые содержат вспомогательные функциональные элементы E1 под контролем конститутивного промотора), но которые содержат белки rep и/или cap под контролем индуцируемых промоторов. Специалист в настоящей области техники может создать и другие стабильные клетки-хозяева.
В соответствии с некоторыми вариантами осуществления, настоящее раскрытие относится к клетке-хозяину, содержащей нуклеиновую кислоту, которая содержит кодирующую последовательность, которая кодирует белок (например, белок гентингтина дикого типа, необязательно «защищенный» белок гентингтина дикого типа). В соответствии с некоторыми вариантами осуществления, настоящее раскрытие относится к композиции, содержащей описанную выше клетку-хозяина. В соответствии с некоторыми вариантами осуществления, композиция, содержащая вышеуказанную клетку-хозяина, дополнительно содержит криоконсервант.
Рекомбинантный AAV-вектор, последовательности rep, последовательности cap и вспомогательные функциональные элементы, необходимые для получения rAAV по настоящему изобретению, можно доставить в упаковывающую клетку-хозяина с помощью любого подходящего генетического элемента (вектора). Выбранный генетический элемент можно доставить любым подходящим способом, в том числе способами, которые описаны в настоящем документе. Способы, применяемые для конструирования любого варианта осуществления настоящего раскрытия, известны специалистам в области работы с нуклеиновыми кислотами и включают генную инженерию, рекомбинантную инженерию и методики синтеза. См., например, публикацию Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. Аналогично, хорошо известны способы получения вирионов rAAV, и выбор подходящего способа не является ограничением настоящего раскрытия. См, например, публикацию K. Fisher et al., J. Virol., 70:520-532 (1993), и патент США № 5478745.
В соответствии с некоторыми вариантами осуществления, рекомбинантные AAV можно получить с помощью способа тройной трансфекции (который подробно описан в патенте США № 6001650). Как правило, рекомбинантные AAV получают путем трансфекции клетки-хозяина рекомбинантным AAV-вектором (содержащим трансген), подлежащим упаковке в частицы AAV, вспомогательным функциональным AAV- вектором и дополнительным функциональным вектором. Вспомогательный функциональный AAV-вектор кодирует последовательности «вспомогательного функционального элемента AAV» (т. е. rep и cap), которые функционирует в транс- положении для продуктивной репликации и инкапсулирования AAV. Предпочтительно, вектор вспомогательного функционального элемента AAV поддерживает эффективное продуцирование вектора AAV без образования каких-либо детектируемых вирионов AAV дикого типа (т. е. вирионов AAV, содержащих функциональные гены rep и cap). Неограничивающие примеры векторов, подходящих для применения с настоящим раскрытием, включают pHLP19, описанный в патенте США № 6001650, и вектор pRep6cap6, описанный в патенте США № 6156303, оба из которых включены в настоящий документ посредством ссылки. Дополнительный функциональный вектор кодирует нуклеотидные последовательности не происходящих от AAV вирусных и/или клеточных функциональных элементов, от которых зависит репликация AAV (т. е. «дополнительные функциональные элементы»). К дополнительным функциональным элементам относятся функциональные элементы, необходимые для репликации AAV, включая без ограничения, такие элементы, которые вовлечены в активацию транскрипции гена AAV, стадиеспецифический сплайсинг мРНК AAV, репликацию ДНК AAV, синтез продуктов экспрессии cap и сборку капсида AAV. Вирусные дополнительные функциональные элементы могут происходить от любого из известных вирусов-помощников, таких как аденовирус, вирус герпеса (кроме вируса простого герпеса 1-го типа) и вирус коровьей оспы.
Согласно некоторым аспектам, настоящее раскрытие относится к трансфицированным клеткам-хозяевам. Термин «трансфекция» применяют для обозначения поглощения чужеродной ДНК клеткой, и клетка была «трансфицирована», если экзогенная ДНК была введена внутрь клеточной мембраны. В настоящей области техники общеизвестен ряд методик трансфекции. См., например, публикации Graham et al. (1973) Virology, 52:456, Sambrook et al. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York, Davis et al. (1986) Basic Methods in Molecular Biology, Elsevier, and Chu et al. (1981) Gene 13:197. Такие методики можно применять для введения в подходящие клетки-хозяева одной или нескольких экзогенных нуклеиновых кислот, таких как вектор для встраивания нуклеотидов и другие молекулы нуклеиновой кислоты.
«Клетка-хозяин» обозначает любую клетку, которая содержит или способна содержать представляющее интерес вещество. Зачастую клетка-хозяин является клеткой млекопитающего. Клетку-хозяина можно применять в качестве реципиента вспомогательной конструкции AAV, минигенной плазмиды AAV, дополнительного функционального вектора или другой трансферной ДНК, связанной с выработкой рекомбинантных AAV. Термин включает потомство исходной клетки, которая была подвергнута трансфекции. Таким образом, «клетка-хозяин» в контексте настоящего документа может обозначать клетку, которая была трансфицирована экзогенной последовательностью ДНК. Понятно, что потомство одной родительской клетки не всегда может быть полностью идентичным по морфологии или геномной или общей комплементарной цепи ДНК с исходным родителем вследствие естественной, случайной или преднамеренной мутации.
Применяемый в контексте настоящего документа термин «клеточная линия» обозначает популяцию клеток, способных к непрерывному или длительному росту и делению in vitro. Зачастую клеточные линии представляют собой клональные популяции, полученные из одной клетки-предшественника. Кроме того, в настоящей области техники известно, что во время хранения или переноса таких клональных популяций в кариотипе могут происходить спонтанные или индуцированные изменения. Следовательно, клетки, полученные из упомянутой клеточной линии, могут не быть абсолютно идентичными предковым клеткам или культурам, и упомянутая клеточная линия включает такие варианты.
Применяемый в контексте настоящего документа термин «рекомбинантная клетка» обозначает клетку, в которую был включен экзогенный сегмент ДНК, такой как сегмент ДНК, который приводит к транскрипции биологически активного полипептида или к выработке биологически активной нуклеиновой кислоты, такой как РНК.
Применяемый в контексте настоящего документа термин «вектор» включает любой генетический элемент, такой как плазмида, фаг, транспозон, космида, хромосома, искусственная хромосома, вирус, вирион и т. д., который способен к репликации, когда он связан с соответствующими регулирующими элементами и который может переносить генные последовательности от клетки к клетке. Таким образом, данный термин включает «проводники» для клонирования и экспрессии, а также вирусные векторы. В соответствии с некоторыми вариантами осуществления, пригодными векторами считаются такие векторы, в которых сегмент нуклеиновой кислоты, который должен быть транскрибирован, расположен под транскрипционным контролем промотора. «Промотор» обозначает последовательность ДНК, распознаваемую синтезирующим механизмом клетки или введенным синтезирующим механизмом, и такая последовательность необходима для инициации специфической транскрипции гена. Фразы «функционально расположенные», «под контролем» или «под транскрипционным контролем» означают, что промотор находится в правильном местоположении и правильной ориентации по отношению к нуклеиновой кислоте для контроля инициации РНК-полимеразы и экспрессии гена. Термин «вектор или конструкция экспрессии» означает любой тип генетической конструкции, содержащей нуклеиновую кислоту, в которой способна транскрибироваться часть или вся кодирующая последовательность нуклеиновой кислоты. В соответствии с некоторыми вариантами осуществления, экспрессия включает транскрипцию нуклеиновой кислоты, например, с образованием биологически активного полипептидного продукта или функциональной РНК (например, направляющей РНК) с транскрибированного гена.
Вышеуказанные способы упаковки рекомбинантных векторов в требуемые капсиды AAV для получения rAAV по настоящему изобретению не подразумеваются как ограничивающие, и для специалистов в настоящей области техники будут очевидны другие подходящие способы.
В соответствии с некоторыми вариантами осуществления, любой один или несколько тимидиновых (T) нуклеотидов или уридиновых (U) нуклеотидов в представленной в настоящем документе последовательности, включая последовательность, представленную в перечне последовательностей, можно заменить любым другим нуклеотидом, подходящим для образования пары оснований (например, согласно принципу образования пар оснований Уотсона - Крика) с аденозиновым нуклеотидом. Любой один или несколько тимидиновых (T) нуклеотидов в последовательности, представленной в настоящем документе, включая последовательность, представленную в перечне последовательностей, можно соответствующим образом заменить уридиновым (U) нуклеотидом или наоборот.
Пути введения
RAAV по настоящему раскрытию можно доставлять субъекту в композициях в соответствии с любыми подходящими способами, известными в настоящей области техники. Например, rAAV, предпочтительно суспендированный в физиологически совместимом носителе (т. е. в композиции), можно вводить субъекту, т. е. животному- хозяину, такому как человек, мышь, крыса, кошка, собака, овца, кролик, лошадь, корова, коза, свинья, морская свинка, хомяк, курица, индейка, или не относящемуся к человеку примату (например, макаку). В соответствии с некоторыми вариантами осуществления, понятие «животное-хозяин» не включает человека.
Доставку rAAV субъекту-млекопитающему можно осуществлять, например, посредством внутримышечной инъекции или посредством введения в кровоток субъекта- млекопитающего. Введение в кровоток можно осуществлять посредством инъекции в вену, артерию или любой другой сосудистый канал. В соответствии с некоторыми вариантами осуществления, rAAV вводят в кровоток посредством изолированной перфузии конечностей, методики, хорошо известной в области хирургии, причем такой способ фактически позволяет специалисту изолировать конечность от системного кровотока перед введением вирионов rAAV. Вариант методики перфузии изолированных конечностей, описанный в патенте США № 6177403, также может быть использован специалистом для введения вирионов в сосудистую сеть изолированной конечности для потенциального усиления трансдукции в мышечных клетках или ткани. Более того, в некоторых случаях может быть необходима доставка вирионов в ЦНС субъекта. Под «ЦНС» подразумевают все клетки и ткань головного и спинного мозга позвоночных. Таким образом, данный термин включает без ограничения нейроны, глиальные клетки, астроциты, спинномозговую жидкость (CSF), интерстициальные пространства, кость, хрящ и тому подобное. Рекомбинантные AAV можно доставлять непосредственно в ЦНС или головной мозг путем инъекции, например, в область желудочка, а также в стриатум (например, хвостатое ядро или скорлупа стриатума), в спинной мозг и нервно-мышечное соединение, или в мозжечковые доли посредством иглы, катетера или аналогичного устройства с помощью нейрохирургических методик, известных в настоящей области техники, такие как стереотаксическая инъекция (см., например, публикации Stein et al., J Virol 73:3424-3429, 1999; Davidson et al., PNAS 97:3428-3432, 2000; Davidson et al., Nat. Genet. 3:219-223, 1993; и Alisky and Davidson, Hum. Gene Ther. 11:2315-2329, 2000). В соответствии с некоторыми вариантами осуществления, описываемые в настоящем раскрытии rAAV вводят путем внутривенной инъекции. В соответствии с некоторыми вариантами осуществления, rAAV вводят путем внутримозговой инъекции. В соответствии с некоторыми вариантами осуществления, rAAV вводят путем интратекальной инъекции. В соответствии с некоторыми вариантами осуществления, rAAV вводят путем интрастриатальной инъекции. В соответствии с некоторыми вариантами осуществления, rAAV доставляют путем внутричерепной инъекции. В соответствии с некоторыми вариантами осуществления, rAAV доставляют путем инъекции в мостомозжечковую цистерну. В соответствии с некоторыми вариантами осуществления, rAAV доставляют путем инъекции в латеральный желудочек головного мозга.
Аспекты настоящего раскрытия относятся к композициям, содержащим рекомбинантный AAV, содержащий капсидный белок и нуклеиновую кислоту, кодирующую трансген, причем трансген содержит последовательность нуклеиновой кислоты, кодирующую одну или несколько микроРНК. В соответствии с некоторыми вариантами осуществления, каждая микроРНК содержит последовательность, изложенную под любым из SEQ ID NO: 2-10. В соответствии с некоторыми вариантами осуществления, нуклеиновая кислота дополнительно содержит несколько ITR AAV. В соответствии с некоторыми вариантами осуществления, rAAV содержит rAAV-вектор, представленный последовательностью, изложенной под любым из SEQ ID NO: 16-19, или ее частью. В соответствии с некоторыми вариантами осуществления, композиция дополнительно содержит фармацевтически приемлемый носитель.
Композиции по настоящему раскрытию могут содержать один rAAV или в комбинации с одним или несколькими другими вирусами (например, второй rAAV, имеющий один или несколько различных трансгенов). В соответствии с некоторыми вариантами осуществления, композиция содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более различных rAAV, каждый из которых имеет один или несколько различных трансгенов.
Подходящие носители без труда может подобрать специалист в настоящей области техники с учетом указания, для которого предназначен rAAV. Например, один подходящий носитель включает солевой раствор, который может быть составлен с различными буферными растворами (например, фосфатно-солевым буферным раствором). Другие иллюстративные носители включают стерильный солевой раствор, лактозу, сахарозу, фосфат кальция, желатин, декстран, агар, пектин, арахисовое масло, кунжутное масло и воду. Выбор носителя не является ограничением настоящего раскрытия.
Необязательно, композиции по настоящему раскрытию могут содержать, помимо rAAV и носителя(-ей), другие традиционные фармацевтические ингредиенты, такие как консерванты или химические стабилизаторы. К подходящим иллюстративным консервантам относятся хлорбутанол, сорбат калия, сорбиновая кислота, диоксид серы, пропилгаллат, парабены, этилванилин, глицерин, фенол и парахлорфенол. К подходящим химическим стабилизаторам относятся желатин и альбумин.
RAAV вводят в количествах, достаточных для трансфекции клеток требуемой ткани и для обеспечения достаточных уровней переноса и экспрессии генов без нежелательных побочных эффектов. Традиционные и фармацевтически приемлемые пути введения включают без ограничения прямую доставку в выбранный орган (например, внутрипортальную доставку в печень), пероральный, ингаляционный (включая интраназальную и интратрахеальную доставку), внутриглазной, внутривенный, внутримышечный, подкожный, внутрикожный, внутриопухолевый и другие парентеральные пути введения. При необходимости, пути введения можно сочетать.
Доза вирионов rAAV, необходимая для достижения определенного «терапевтического эффекта», например, единицы дозы в копиях генома/килограмм массы тела (КГ/кг), будет варьировать в зависимости от нескольких факторов, включая без ограничения путь введения вириона rAAV, уровень экспрессии гена или РНК, необходимый для достижения терапевтического эффекта, конкретное заболевание или нарушение, которое лечат, и стабильность продукта гена или РНК. Специалист в настоящей области без труда может определить диапазон доз вириона rAAV для лечения пациента, имеющего конкретное заболевание или нарушение, на основе вышеупомянутых факторов, а также других факторов, которые хорошо известны в настоящей области техники.
Эффективное количество rAAV представляет собой количество, достаточное для целенаправленного инфицирования животного, целенаправленного воздействия на необходимую ткань. В соответствии с некоторыми вариантами осуществления, эффективное количество rAAV представляет собой количество, достаточное для получения стабильного соматического трансгенного модельного животного. Эффективное количество будет зависеть преимущественно от таких факторов, как вид, возраст, масса тела, состояние здоровья субъекта и ткань, на которую нужно оказать целенаправленное воздействие, и, следовательно, может варьировать в зависимости от животного и ткани. Например, эффективное количество rAAV обычно находится в диапазоне от приблизительно 1 мл до приблизительно 100 мл раствора, содержащего от приблизительно 109 до 1016 копий генома. В некоторых случаях дозировка составляет от приблизительно 1011 до 1013 копий генома rAAV. В соответствии с определенными вариантами осуществления, эффективным для целенаправленного воздействия на ткань ЦНС является 1012 или 1013 копий генома rAAV. В некоторых случаях стабильных трансгенных животных получают с помощью многократных доз rAAV.
В соответствии с некоторыми вариантами осуществления, дозу rAAV вводят субъекту не чаще одного раза в течение календарного дня (например, за 24-часовой период). В соответствии с некоторыми вариантами осуществления, дозу rAAV вводят субъекту не чаще одного раза в 2, 3, 4, 5, 6 или 7 календарных дней. В соответствии с некоторыми вариантами осуществления, дозу rAAV вводят субъекту не чаще одного раза в календарную неделю (например, 7 календарных дней). В соответствии с некоторыми вариантами осуществления, дозу rAAV вводят субъекту не чаще двух раз в неделю (например, один раз за период в две календарные недели). В соответствии с некоторыми вариантами осуществления, дозу rAAV вводят субъекту не чаще одного раза в календарный месяц (например, один раз в 30 календарных дней). В соответствии с некоторыми вариантами осуществления, дозу rAAV вводят субъекту не чаще одного раза в шесть календарных месяцев. В соответствии с некоторыми вариантами осуществления, дозу rAAV вводят субъекту не чаще одного раза в календарный год (например, 365 дней или 366 дней в високосный год).
В соответствии с некоторыми вариантами осуществления, композиции rAAV составлены для уменьшения агрегации частиц AAV в композиции, особенно там, где присутствуют высокие концентрации rAAV (например, ~1013 КГ/мл или более). Способы уменьшения агрегации rAAV хорошо известны в настоящей области техники и предусматривают, например, добавление поверхностно-активных веществ, регулирование рН, регулирования концентрации соли и т. д. (См., например, публикацию Wright FR, et al., Molecular Therapy (2005) 12, 171-178, содержание которой включено в настоящий документ посредством ссылки.)
Состав фармацевтически приемлемых вспомогательных средств и растворов- носителей хорошо известен специалистам в настоящей области, как и разработка подходящих режимов дозирования и лечения для применения описанных в настоящем документе конкретных композиций в различных режимах лечения.
Как правило, эти составы могут содержать по меньшей мере приблизительно 0,1% активного соединения или более, хотя процентное содержание активного(-ых) ингредиента(-ов) может, конечно, варьировать и обычно может составлять от приблизительно 1 или 2% до приблизительно 70% или 80% или более от массы или объема всего состава. Естественно, количество активного соединения в каждой терапевтически пригодной композиции можно приготовить таким образом, чтобы получить подходящую дозировку в любой заданной однократной дозе соединения. Такие факторы, как растворимость, биодоступность, биологический период полувыведения, путь введения, срок годности продукта, а также другие фармакологические факторы будут учитываться специалистом в области приготовления таких фармацевтических составов, и, в связи с этим, могут быть необходимы различные дозировки и режимы лечения.
При определенных обстоятельствах будет необходимо доставлять rAAV- терапевтические конструкции в соответствующим образом составленных фармацевтических композициях, которые раскрыты в настоящем документе, либо подкожно, либо внутрь поджелудочной железы, либо интраназально, либо парентерально, либо внутривенно, либо внутримышечно, либо интратекально либо перорально, внутрибрюшинно или путем ингаляции. В соответствии с некоторыми вариантами осуществления, для доставки rAAV можно применять способы введения, которые описаны в патентах США №№ 5543158, 5641515 и 5399363 (каждый из которых специально включен в настоящий документ посредством ссылки во всем своем объеме). В соответствии с некоторыми вариантами осуществления, предпочтительным способом введения является путем инъекции в портальную вену.
К фармацевтическим формам, подходящим для инъекционного применения, относятся стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий для немедленного приема. Дисперсии также можно приготовить в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. В обычных условиях хранения и применения эти препараты содержат консервант для предупреждения роста микроорганизмов. Во многих случаях такая форма является стерильной и жидкой до такой степени, чтобы была возможность без труда ввести ее с помощью шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т. п.), их подходящие смеси и/или растительные масла. Надлежащую текучесть можно поддерживать, например, с помощью покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и с помощью поверхностно-активных веществ. Предупреждения действия микроорганизмов можно достичь с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т. п. Во многих случаях будет предпочтительным включить придающие изотоничность средства, например, различные сахара или хлорид натрия. Пролонгированную абсорбцию инъекционных композиций можно достичь в композициях с помощью средств, замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Для введения инъекционного водного раствора, например, раствор можно подходящим образом забуферизировать, если это необходимо, а жидкий разбавитель сначала сделать изотоническим посредством достаточного количества солевого раствора или глюкозы. Эти конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В этой связи стерильная водная среда, которую можно использовать, будет известна специалистам в настоящей области техники. Например, одну дозу можно растворить в 1 мл придающего изотоничность раствора NaCl и либо добавить в 1000 мл жидкости для гиподермоклиза, либо ввести инъекцией в предлагаемом месте инфузии (см., например, публикацию "Remington's Pharmaceutical Sciences" 15th Edition, страницы 1035-1038 и 1570-1580). Некоторое варьирование дозы обязательно будет иметь место в зависимости от состояния реципиента. Лицо, ответственное за введение, в любом случае будет определять подходящую дозу для индивидуального реципиента.
Стерильные инъекционные растворы готовят путем включения активного rAAV в необходимом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными в настоящем документе, при необходимости, с последующей стерилизацией фильтрацией. Обычно дисперсии готовят путем включения различных стерилизованных активных ингредиентов в стерильный наполнитель лекарственной формы, который содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами приготовления являются методики вакуумной сушки и лиофильной сушки, которые дают порошок активного ингредиента плюс любой дополнительный требуемый ингредиент из его раствора, предварительно подвергнутого стерилизующему фильтрованию.
Раскрытые в настоящем документе композиции с rAAV также можно составить в нейтральной или солевой форме. Фармацевтически приемлемые соли включают соли присоединения кислоты (образованные со свободными аминогруппами белка) и соли, которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная, миндальная и т. п. Соли, образованные со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, гистидин, прокаин и т. п. После составления растворы будут вводить способом, совместимым с дозированным составом, и в таком количестве, которое является терапевтически эффективным. Составы можно легко вводить в виде различных лекарственных форм, таких как инъекционные растворы, капсулы с различным высвобождением лекарственного средства и т. п.
Применяемый в контексте настоящего документа термин «носитель» включает все возможные растворители, дисперсионные среды, наполнители лекарственной формы, покрытия, разбавители, антибактериальные и противогрибковые средства, придающие изотоничность и замедляющие абсорбцию средства, буферы, растворы носителей, суспензии, коллоиды и т. п. Применение таких сред и средств для фармацевтически активных веществ хорошо известно в настоящей области техники. В композиции также можно включить дополнительные активные ингредиенты. Фраза «фармацевтически приемлемый» относится к молекулярным частицам и композициям, которые не вызывают аллергическую или аналогичную неблагоприятную реакцию при введении реципиенту.
Для введения композиций по настоящему изобретению в подходящие клетки- хозяева можно применять средства доставки, такие как липосомы, нанокапсулы, микрочастицы, микросферы, липидные частицы, везикулы и т. п. В частности, доставляемые rAAV-вектором трансгены можно составить для доставки инкапсулированными либо в липидной частице, либо в липосоме, либо в везикуле, либо в наносфере, либо в наночастице или т. п.
Такие составы могут быть предпочтительными для введения фармацевтически приемлемых составов раскрываемых в настоящем документе нуклеиновых кислот или rAAV-конструкций. Составление и применение липосом в целом известно специалистам в настоящей области техники. Недавно были разработаны липосомы с улучшенной стабильностью в сыворотке и увеличенными периодами полужизни в кровотоке (патент США № 5741516). Кроме того, были описаны различные способы получения липосомных и липосомоподобных препаратов в качестве потенциальных носителей лекарственных средств (патенты США №№ 5567434, 5552157, 5565213, 5738868 и 5795587).
Липосомы успешно применяют с рядом типов клеток, которые обычно устойчивы к трансфекции при использовании других процедур. Кроме того, липосомы не имеют ограничений по длине ДНК, которые типичны для вирусных систем доставки. Липосомы эффективно применяют для введения генов, лекарственных средств, радиотерапевтических средств, вирусов, транскрипционных факторов и аллостерических эффекторов в различные культивируемые клеточные линии и в различных животных. Кроме того, было завешено несколько успешных клинических испытаний, посвященных изучению эффективности опосредованной липосомами доставки лекарственных средств.
Липосомы получают из фосфолипидов, которые диспергированы в водной среде и самопроизвольно образуют мультиламеллярные концентрические двухслойные везикулы (также называемые мультиламеллярными везикулами (MLV)). MLV обычно имеют диаметр от 25 нм до 4 мкм. Обработка MLV ультразвуком приводит в результате к образованию небольших моноламеллярных везикул (SUV) диаметром от 200 до 500

Альтернативно, можно применять нанокапсульные составы rAAV. Нанокапсулы обычно могут захватывать вещества стабильным и воспроизводимым образом. Чтобы избежать побочных эффектов из-за внутриклеточной перегрузки полимерами, такие ультрамелкие частицы (размером около 0,1 мкм) следует конструировать с применением полимеров, способных разлагаться in vivo. Для применения предусмотрены биоразлагаемые полиалкилцианоакрилатные наночастицы, которые соответствуют этим требованиям.
В дополнение к описанным выше способам доставки в качестве альтернативных способов доставки композиций с rAAV реципиенту также предусмотрены следующие методики. Сонофорез (т. е. ультразвук) был использован и описан в патенте США №5656016 в качестве устройства для повышения скорости и эффективности проникновения лекарственного средства в кровеносную систему и по ней. Другими предусмотренными альтернативами доставки лекарственных средств являются внутрикостная инъекция (патент США № 5779708), устройства с микрочипом (патент США № 5797898), офтальмологические составы (Bourlais et al., 1998), трансдермальные матрицы (патент США №№ 5770219 и 5783208) и доставка с контролируемой обратной связью (патент США № 5697899).
Наборы и родственные композиции
Описанные в настоящем документе лекарственные средства, в соответствии с некоторыми вариантами осуществления, могут быть собраны в фармацевтические, или диагностические, или исследовательские наборы для облегчения их применения в терапевтических, диагностических или исследовательских задачах. Набор может включать одну или несколько емкостей, в которых размещены компоненты по настоящему раскрытию и инструкции по применению. В частности, такие наборы могут включать одно или несколько описанных в настоящем документе средств вместе с инструкциями, описывающими предназначение и надлежащее применение таких средств. В соответствии с определенными вариантами осуществления, средства в наборе могут быть представлены в фармацевтической композиции и дозировке, подходящей для конкретной задачи и для способа введения таких средств. Наборы для исследовательских целей могут содержать компоненты в соответствующих концентрациях или количествах для проведения различных экспериментов.
В соответствии с некоторыми вариантами осуществления, настоящее раскрытие относится к набору для получения rAAV, причем этот набор содержит емкость, содержащую выделенную нуклеиновую кислоту, содержащую микроРНК, содержащую или кодируемую последовательностью, изложенной под любым из SEQ ID NO: 2-10. В соответствии с некоторыми вариантами осуществления, набор дополнительно содержит емкость, содержащую выделенную нуклеиновую кислоту, кодирующую капсидный белок AAV, например, капсидный белок AAV9.
Набор может быть разработан для облегчения применения описанных в настоящем документе способов исследователями и может быть представлен в различных формах. Каждая из композиций набора, где это применимо, может быть представлена в жидкой форме (например, в растворе) или в твердой форме, (например, в виде сухого порошка). В некоторых случаях некоторые из композиций можно совмещать или иным образом обрабатывать (например, до активной формы), например, путем добавления подходящего растворителя или других веществ (например, воды или среды для культивирования клеток), которые могут поставляться или не поставляться с набором. В контексте настоящего документа «инструкции» могут обозначать компонент инструкции и/или рекламного материала и обычно включают письменные инструкции на упаковке или в сочетании с упаковкой по настоящему раскрытию. Инструкции также могут включать любые устные или электронные инструкции, представленные любым способом так, чтобы пользователь четко понял, что инструкции должны быть связаны с набором, например, аудиовизуальные (например, видеокассета, DVD и т. д.), интернет- и/или веб-сообщения и т. д. Письменные инструкции могут быть представлены в форме, предписанной государственным органом, регулирующим производство, применение или продажу фармацевтических препаратов или биологических продуктов, причем эти инструкции также могут отражать одобрение органом применения или продажи для применения на животных.
Набор может содержать любой один или несколько из описанных в настоящем документе компонентов в одной или нескольких емкостях. В качестве примера, в соответствии с одним вариантом осуществления, набор может включать инструкции по смешиванию одного или нескольких компонентов из набора и/или выделению и смешиванию образца и применения на субъекте. Набор может включать емкость, содержащую описанные в настоящем документе средства. Средства могут быть представлены в форме жидкости, геля или твердого вещества (порошка). Средства могут быть приготовлены стерильными, упакованы в шприц и поставляться в холодильнике. В качестве альтернативы, оно может содержаться во флаконе или другой емкости для хранения. Во второй емкости могут быть приготовлены стерильными другие средства. В качестве альтернативы, набор может включать активные средства, предварительно смешанные и поставляемые в шприце, флаконе, пробирке или другой емкости.
Иллюстративные варианты осуществления настоящего изобретения будут описаны более подробно с помощью приведенных далее примеров. Эти варианты осуществления являются иллюстративными для настоящего изобретения, которое, как поймет специалист в настоящей области, не ограничено такими иллюстративными вариантами осуществления.
Примеры
Пример 1
Материалы и способы
Клеточная культура и скрининговые анализы
Клетки HeLa содержали в DMEM с высоким содержанием глюкозы и с 10% термоинактивированным FBS и 1% пенициллина и стрептомицина (ThermoFisher). За двадцать четыре часа до трансфекции клетки высевали на 6-луночные планшеты в количестве 0,8-1,0×106 клеток/лунка. В день трансфекции ростовую среду заменяли на 1,6 мл среды Opti-MEM (ThermoFisher). Плазмиды трансфицировали, используя 2 мкл/лунка DharmaFECT Duo (Dharmacon). В каждую лунку вносили 0,6 мкг плазмидной ДНК. Через сорок восемь часов после трансфекции собирали клетки и экстрагировали общую РНК с помощью набора для выделения РНК MirVana. Получали кДНК с помощью 1 мкг РНК/реакционный объем с применением олиго-dT и Superscript III (Invitrogen). Измеряли мРНК гентингтина с помощью аналитического набора TaqMan (ThermoFisher). Относительные уровни мРНК гентингтина рассчитывали с помощью ΔΔC(T) способа с гипоксантин-гуанинфосфорибозилтрансферазой (HPRT) человека в качестве конститутивного гена.
Размещение мышей, инъекции и содержание
Получали мышей YAC128 и FVB дикого типа. Мышей разводили на фоне FVB путем скрещивания самцов мышей дикого типа с самками YAC128. Полученных в результате гетерозиготных по YAC128 и дикого типа мышей содержали в световом режиме 12:12 и давали им неограниченный доступ к пище и воде. Генотипы подтверждали с помощью ПЦР ДНК, экстрагированной из срезов хвоста или ушей. Мышам вводили инъекцией выбранный AAV непосредственно в стриатум посредством стереотаксического устройства для небольших животных SAS-4100 (ASI Instruments, Уоррен, Мичиган), оснащенного микроинъекторами UMPC3 или UMPC4 (World Precision Instruments, Сарасота, Флорида). Мышей анестезировали посредством 284 мг/кг трибромэтанола и помещали в стереотаксическое устройство. Хирургическую операцию проводили с использованием брегмы в качестве нулевой точки, отмеряя переднюю на 1,0 мм, боковую на 2,0 мм и нижнюю иглу 33 калибра на 3,0 мм в стриатум. Помпы устанавливал на подачу 3,0 мкл со скоростью 125 нл/мин. После инъекций мышам позволяли восстановиться на согревающей подушке, а затем помещали обратно в их клетки в области содержания.
Экстракция тканей
В соответствующий момент времени мышей умерщвляли и экстрагировали ткани для анализа РНК или иммуногистохимии. Для экстракции РНК мышей анестезировали и убивали смещением шейных позвонков. Удаляли головной мозг и иссекали стриатум. По возможности использовали экспрессию GFP для направления иссечения с тем, чтобы подвергнуть анализу только GFP-положительную ткань. Ткань сразу помещали в стабилизирующий раствор RNALater (Ambion). После этого их хранили замороженными при -80°С. В конце эксперимента мышей, предназначенных для иммуноцитохимии, подвергали сильной анестезии и вводили перфузией внутрисердечно физиологический раствор с последующим добавлением 4% параформальдегида. Образцы подвергали последующей фиксации в течение ночи в холодном 2% параформальдегиде, а затем хранили в фосфатно-солевом буферном растворе при 4°С. Корональные срезы получали путем среза 40-микронных срезов на вибратоме Leica VT1000s.
Поведение мышей
Прохождение по балке: мышей обучали проходить по балке (балке определенного размера). После обучения регистрировали, когда мыши проходили по балке от одного края до другого. Регистрировали три испытания на каждую мышь. Исходя из результатов регистрации, измеряли количество времени, которое потребовалось мышам для перехода от метки на одном краю балки к другому.
Активность в клетке проживания: Мышей помещали отдельно в автоматизированную сканирующую систему для фенотипирования в клетке проживания (Clever Sys, Inc., Рестон, Виргиния) на период 26 часов. Для расчета среднего времени активности в час из данных удаляли первый час, в течение которого мышь адаптируется к новым окружающим условиям, затем рассчитывали общее время, проведенное в процессе хождения, от общего зарегистрированного времени, минус один час.
Иммуногистохимия и количественная оценка
Срезы фиксированной ткани блокировали 3% перекисью водорода в течение трех минут, а затем инкубировали с 0,5% Triton x в течение 20 минут. Иммуноцитохимию проводили с применением реагентов из набора Vector Laboratories Elite ABC к кроличьим или мышиным антителам к DARPP32 (Abcam ab40801; разведение 1:10000), Iba1 (Wako
019-19741; разведение 1:1000), GFP (Life Technologies G10362; разведение 1:1000) и NeuN (EMD Millipore MAB377; разведение 1:1000). Срезы окрашивали в течение 2 минут диаминобензидином с применением набора Metal Enhanced DAB Substrate Kit (Pierce).
Клонирование и анализ библиотеки малых РНК
Общую РНК экстрагировали с применением набора MirVana для выделения РНК. Выбор размера РНК из 18-30 нуклеотидов проводили с применением 5 мкг общей РНК на 15% денатурирующем полиакриламидном геле. После выбора размера малые РНК осаждали этанолом и лигировали с предварительно аденилированным 3'-адаптером (5'-rAppTGGAATTCTCGGGTGCCAAGG/ddC/-3'; SEQ ID NO: 11). Лигированные продукты гибридизировали с праймером для RT (обратной транскрипции) (5'- CCTTGGCACCCGAGAATTCCA-3'; SEQ ID NO: 12) и лигировали с 5'-адаптером (РНК: 5'-GUUCAGAGUUCUACAGUCCGACGAUC-3'; SEQ ID NO: 13). Обратную транскрипцию проводили с применением смеси обратной транскриптазы AMV (NEB) и амплифицировали в ПЦР с применением ДНК-полимеразы Pfx AccuPrime (Invitrogen) с одним универсальным праймером (5'-AATGATACGGCGACCACCGAGATCTACACGTTCAGAGTTCTACAGTCCGA-3'; SEQ ID NO: 14) и одним баркодированным праймером (5'-CAAGCAGAAGACGGCATACGAGATNNNNNNGTGACTGGAGTTCCTTGGCACCCGAG AATTCCA-3'; SEQ ID NO: 15). Библиотеки секвенировали и картировали относительно генома mm9 и в генома AAV. Разновидности микроРНК классифицировали по положению, полученному при 5'-концевом картировании, на микроРНК-шпильке, поэтому каждая разновидность состояла из всех небольших РНК с общими затравочными последовательностями. 3'-конец не рассматривали при отнесении к разновидностям. Дифференциальную экспрессию эндогенных микроРНК анализировали с помощью пакета edgeR.
Клонирование и анализ библиотеки мРНК
РНК экстрагировали так, как указано выше. Библиотеки создавали при помощи стандартных способов. Результаты считывания картировали с помощью topHat2, а дифференциальную экспрессию рассчитывали с помощью пакета deseq2.
Эксперименты на овцах
Модельным трансгенным овцам с болезнью Гентингтона (например, трансгенной овце, экспрессирующей патогенный белок гентингтин человека) вводили инъекцией либо scAAV9-CBA-mir-HTT (содержащую микроРНК 6433 в остове mir-155), либо scAAV-U6- mir-HTT (содержащую микроРНК 6433 в остове mir-155), либо пустой контрольный вектор scAAV9. Овец умерщвляли либо через один, либо через шесть месяцев после инъекции. Получали образцы тканей и нуклеиновых кислот и анализировали их с помощью количественной ПЦР и иммуногистохимии.
Пример 2
Эксперименты in vivo на мышах
Разработка схемы и отбор нацеленных на гентингтин искусственных микроРНК
Тестировали девять последовательностей, нацеленных на мРНК гентингтина человека (таблица 1, фиг. 1). Схематическое изображение местоположений девяти целевых последовательностей представлено на фиг. 4A. Две копии искусственной микроРНК клонировали тандемно в остов, в основе которого лежала эндогенная miR-155 или miR-30, и всю искусственную микроРНК вставляли в 3'-UTR последовательности EGFP (фиг. 5A, верхняя часть). Структуры спрогнозированных шпилек искусственной микроРНК к HTT на основе mir-155 и mir-30 показаны соответственно на фиг. 25A-25B. Полученные в результате плазмиды подвергали трансфекции в клетки Hela. Спустя сорок восемь часов клетки собирали и измеряли уровни мРНК эндогенного гентингтина с помощью количественной RT-PCR (qRT-ПЦР). Три из девяти искусственных микроРНК снижали уровень гентингтина более чем на 50% (фиг. 1-2 и 4B-4C).

Для экспериментов in vivo из первоначального скрининга были отобраны три последовательности. Также тестировали искусственную микроРНК на основе известной миРНК (E1.4). Последовательности-кандидаты упаковывали в самокомплементарный вектор AAV9 и вводили инъекцией непосредственно в стриатум трансгенных мышей, у которых экспрессируется гентингтин человека с участком примерно в 128 повторов, кодирующих полиглутамин (мыши Yac128). Спустя один месяц оценивали распределение AAV9 и экспрессию репортера GFP для трех различных доз. В случае наиболее высокой дозы окрашивание GFP присутствовало по всему стриатуму (фиг. 11A), а уровень мРНК гентингтина человека значительно снижался у мышей, которых обрабатывали посредством либо AAV9-CβA-anti-HTT-6433 (p=0,006), либо AAV9-CβA-anti-HTT-5155 (p=0,013, фиг. 4C; при этом в качестве остова использовали mir-155). Снижение дозы вектора приводило к снижению экспрессии GFP (фиг. 11А), а при разведении 1:10 значимого снижения уровня мРНК к гентингтину человека не достигали (фиг. 11B). На фиг. 11С представлены репрезентативные фотографии мышей, которым был введен инъекцией вектор, кодирующий нацеленную на гентингтин микроРНК и EGFP, в трех различных дозах.
Экспрессия искусственной микроРНК с промотора U6 не улучшала сайленсинг гентингтина
Одну копию наиболее активной микроРНК (HTT-6433) клонировали в вектор AAV9 под контролем промотора U6 (фиг. 5A, нижняя часть). Мышам вводили односторонней инъекцией либо первоначальную двухкопийную AAV9-CBA-anti-HTT-6433 (содержащую SEQ ID NO: XX), либо AAV9-CBA-anti-HTT-5155, либо AAV9-U6- anti-HTT-6433 (содержащую SEQ ID NO: XX, либо AAV9-U6-anti-HTT-5155. Спустя один месяц собирали стриатум и подтверждали экспрессию GFP, а уровень мРНК гентингтина измеряли с помощью qRT-PCR. Независимо от последовательности искусственной микроРНК, не наблюдали значимого отличия нокдауна среди мышей, обработанных посредством AAV9-U6-anti-HTT и AAV9-CBA-anti-HTT. У обеих мышей, которых обрабатывали посредством AAV9-U6-anti-HTT-6433 и AAV9-CBA-anti-HTT-6433, количество мРНК гентингтина на стороне с инъекцией составляло примерно 50% от количества на стороне без инъекции (фиг. 5B). Следует отметить, что использование контрлатеральной стороны (без инъекции) в качестве контроля для каждого животного снижало варьирование среди животных. У мышей, которым односторонней инъекцией вводили AAV9-GFP, иногда наблюдали небольшое количество GFP-положительных нейронов на контрлатеральной стороне, что свидетельствовало о том, что некоторая часть вируса распространялась на сторону без инъекции. Поэтому использование контрлатеральной стороны в качестве контроля может приводить к недооценке нокдауна. Для исключения возможных искажающих эффектов от использования контрлатеральной стороны в качестве контроля эксперимент повторяли с использованием группы животных, которым вводили инъекцией только PBS в качестве контроля. Данные свидетельствовали, что как AAV9-U6-anti-HTT-6433, так и AAV9-CBA-mir-HTT-6433 снижали уровень мРНК гентингтина примерно на 50% (фиг. 5C).
Долгосрочная экспрессия в стриатуме mir-HTT-6433 с промотора U6 токсична для мышей
AAV9-U6-anti-HTT-6433 или AAV9-CBA-anti-HTT-6433 вводили односторонней инъекцией непосредственно в стриатум мышей Yac128. Спустя шесть месяцев после инъекции наблюдали, что мыши, которым инъекцией вводили AAV9-U6-anti-HTT-6433, не обустраивали гнезда, а у некоторых проявлялся гиперактивный фенотип. Для того, чтобы задокументировать эти аномалии, в каждой клетке заменяли материалы для гнезд. Двадцать четыре часа спустя новые материалы для гнезд у мышей AAV9-U6-anti-HTT-6433 оставались неиспользованными, тогда как мыши, которым инъекцией вводили PBS и AAV9-CBA-anti-HTT-6433, обустраивали гнезда, как и ожидалось (фиг. 6A). С помощью системы для отслеживания клетки проживания мышей регистрировали в течение двадцати четырех часов. Мыши, обработанные посредством AAV9-U6-anti-HTT-6433, проводили значимо больше времени, перемещаясь вокруг их клетки проживания, нежели мыши, обработанные посредством PBS или посредством AAV9-CBA-anti-HTT-6433 (фиг. 6B). Также измеряли среднее время, необходимое мышам для прохождения по балке. Для этого теста мышам необходимо было трижды завершить прохождение по балке. В среднем, мыши, обработанные посредством AAV9-CBA-anti-HTT-6433, имели тенденцию проходить быстрее, чем мыши, которые получали только инъекцию PBS (фиг. 3 и 12A). Из четырех оставшихся мышей в группе AAV9-U6-anti-HTT-6433 две не были способны успешно пройти, спрыгнув либо упав с балки (фиг. 12A). Во втором эксперименте, проведенном на мышах Yac128 более зрелого возраста (7 месяцев), наблюдали возрастное увеличение времени прохождения по балке. Такое увеличение имело место как у интактных мышей, так и у мышей, обработанных посредством AAV9-CBA-anti-HTT-6433, и оно ускорялось у мышей, обработанных посредством AAV9-U6-anti-HTT-6433 (фиг. 12B).
Нейропатологические данные коррелировали с описанными выше поведенческими результатами. На стороне мыши AAV9-U6-anti-HTT-6433, в которую была сделана инъекция, наблюдали увеличение желудочка, утрату DARPP-32-положительных нейронов и уменьшение массы стриатума (фиг. 7A-7B). В остальной части стриатума наблюдали повышенное окрашивание по Iba1 (фиг. 8А, нижняя часть), увеличение общей и активированной микроглии и уменьшение количества покоящейся микроглии (фиг. 8B-8D). Мышам C57Bl/6 дикого типа и мышам FVB вводили инъекцией одни и те же векторы и оценивали последствия miR под управлением U6 с целью определения, зависит ли токсичность от наличия мутантного гена болезни Гентингтона в этом контексте. У мышей FVB эффект был аналогичным таковому у мышей Yac128 с быстрым ухудшением в тесте на балке и сильно увеличенными желудочками. Однако у мышей C57BL6 данный эффект хотя и присутствовал, но был менее выраженным. Несмотря на то, что в группе U6 было начальное увеличение времени прохождения по балке, в конечной точке исследования не было значимого различия между группами (фиг. 13A). Уменьшение массы стриатума также было не таким сильным у мышей C57BL6 (фиг. 13B).
Экспрессия искусственной нацеленной на гентингтин микроРНК с промотора U6 приводила к сверхэкспрессии нацеленной на гентингтин малой РНК
Группам мышей вводили односторонней инъекцией векторы scAAV9, экспрессирующие искусственную микроРНК 6433 с промоторов U6 и CβA. Клонировали и секвенировали малые РНК, полученные спустя две недели после инъекции. В обеих группах девяносто шесть процентов последовательностей были расположены на карте генома AAV, который был картирован относительно получаемой малой РНК, и лишь небольшой процент давал неточное расщепление посредством Dicer или Drosha. В группе, которой вводили инъекцией искусственную микроРНК под управлением промотора U6, нацеленная на гентингтин последовательность преобладала в результатах секвенирования, составляя половину (50%) всех картируемых последовательностей, тогда как у мышей, которым был инъекцией введен вектор CBA, лишь 5% последовательностей соответствовали кодируемой вектором малой РНК (фиг. 9A). Таким образом, потенциально малые РНК с альтернативными затравочными последовательностями, включая смысловые цепи и продукты «проскальзывания», могут присутствовать на уровнях, сравнимых с уровнями функциональных эндогенных микроРНК (фиг. 9A). Для подтверждения сверхэкспрессии нацеленной на гентингтин последовательности относительное количество нацеленной на гентингтин малой РНК измеряли с помощью qPCR. Наблюдали, что экспрессия малой РНК была в 150-250 раз выше у мышей, которым была введена инъекцией конструкция под контролем промотора U6 (фиг. 9B).
В качестве остова для искусственной микроРНК обычно используют эндогенные последовательности микроРНК 30 обычно используют. Для определения, являются ли профили изоформ miR, полученные из этого остова, более благоприятными, встраивали последовательность anti-HTT-6433 в остов miR-30 и вводили ее инъекцией 10-недельным мышам Yac128 (фиг. 9C). Остов mir-30 давал уровни зрелой искусственной микроРНК, которые сравнимы с уровнями, получаемыми с промотором CβA (фиг. 9А), и снижал уровень гентингтина человека почти на 50%. В отличие от остова mir-155, остов mir-30 давал зрелую смысловую (сопровождающую) цепь на уровнях, сравнимых с уровнями антисмысловой (направляющей) цепи. Комбинация промотора CβA с остовом mir-155 давала лишь задуманную антисмысловую цепь, превышающую фоновый уровень (фиг. 9A).
Хотя более половины считываний в образце можно сопоставить на карте относительно закодированной в AAV искусственной микроРНК, сверхэкспрессия искусственной нацеленной на гентингтин микроРНК, оказывала минимальное влияние на распределение эндогенных микроРНК (фиг. 14A-14B). Фактически, наибольшие различия наблюдали, когда группы, которым была сделана инъекция, сравнивали с (контрлатеральной) стороной без инъекции, что свидетельствовало о том, что сама инъекция вызывала локальное изменение в профилях микроРНК. Это могло отражать местную воспалительную реакцию на травму, которая могла со временем исчезнуть.
Экспрессия искусственной нацеленной на гентингтин микроРНК с промотора U6 нарушала экспрессию многих мРНК
Проводили анализ секвенирования РНК стриатума мышей, обработанных либо AAV9-U6-anti-HTT-6433, либо AAV9-CBA-anti-HTT-6433, для изучения последствий сверхэкспрессии нацеленной на гентингтин микроРНК. Через две недели после инъекции сравнивали профили мРНК стриатума на сторонах с инъекцией и без инъекции. Данные свидетельствовали о том, что у мышей, которых обрабатывали посредством CBA-mirHTT-6433, было несколько значимых различий (фиг. 14A). У мышей, которых обрабатывали посредством AAV9-U6-anti-HTT-6433, наблюдали как увеличение уровней мРНК, так и их уменьшение в ответ на обработку (фиг. 14B). При сравнении профилей AAV9-U6-anti- HTT-6433 и AAV9-CBA-anti-HTT-6433 спустя две недели было обнаружено, что только 8 мРНК экспрессировались со значимым различием среди этих двух групп. РНК сортировали в соответствии с наличием или отсутствием прогнозируемых целевых сайтов для искусственной микроРНК и наносили на график кумулятивное распределение изменений у мРНК в случае наличия или отсутствия целевых сайтов. У мышей, которым инъекцией вводили AAV-U6-6433, наблюдали небольшой сдвиг в сторону даунрегуляции генов, содержащихся в их 3'-UTR, были обнаружены идеальные целевые сайты из 8 нуклеотидов, соответствующие наиболее многочисленным разновидностям происходящих из AAV малых РНК (фиг. 10B). Этот сдвиг не был виден у мышей, которым вводили инъекцией AAV-CBA-6433 (фиг. 10A), как и не был виден у мышей с любой другой разновидностью происходящих из AAV малых РНК (фиг. 15A-15C).
Пример 3
Эксперименты in vivo на овцах
В этом примере была использована модель болезни Гентингтона на овцах. Вкратце: получали трансгенных овец, у которых присутствует экспрессия человеческого белка гентингтин (htt человека). Овцам вводили интрастриатальной инъекцией либо scAAV9 CBA-mir-HTT («промотор CBA»), либо scAAV9 U6-mir-HTT («промотор U6»), либо пустой контрольный вектор scAAV9. Каждая конструкция содержала одну копию последовательности mir-6433 к гентингтину (SEQ ID NO: 7), вставленную в остов mir-155, расположенный внутри интрона, который находился соответственно между промотором CBA или промотором U6 и последовательностью полиаденилирования β-глобулина. Конструкции, применяемые для получения rAAV, которые вводили в этом эксперименте, приведены под SEQ ID NO: 18 (scAAV9 CBA-mir-HTT) и 19 (scAAV9 U6-mir-HTT).
Овец умерщвляли либо через один, либо через шесть месяцев после инъекции. Получали образцы тканей и нуклеиновых кислот и анализировали их с помощью количественной ПЦР и иммуногистохимии.
Данные свидетельствовали о том, что на момент времени один месяц инъекция mir- HTT, экспрессируемой под контролем промотора U6, приводила к снижению экспрессии htt как в средней части хвостатого ядра, так и в средней части скорлупы головного мозга овец по сравнению с контрольными мышами без инъекции и с инъекцией пустым scAAV9. На фиг. 16 приведены данные, относящиеся к снижению экспрессии htt человека в средней части хвостатого ядра овцы через месяц после введения scAAV9 U6-mir-HTT. На фиг. 17 приведены данные, относящиеся к снижению экспрессии гентингтина человека в средней части скорлупы головного мозга модельной овцы через месяц после введения scAAV9 U6- mir-HTT. Следует отметить, что в отличие от мышиной модели, описанной в предыдущем примере, mir-HTT, экспрессируемая с промотора U6, не была токсичным в овечьей модели болезни Гентингтона.
Данные свидетельствовали о том, что на момент времени шесть месяцев инъекция mir-HTT, экспрессируемой под контролем промотора CBA, приводила в результате к снижению экспрессии htt как в средней части хвостатого ядра, так и в средней части скорлупы головного мозга овец по сравнению с контрольными мышами без инъекции и с инъекцией пустым scAAV9.
На фиг. 18 и 19 приведены данные, относящиеся к уменьшению экспрессии htt человека в медиальной (фиг. 18) и латеральной (FIG. 19) сторонах средней части хвостатого ядра овцы. Данные свидетельствовали о том, что mir-HTT, экспрессируемая с промотора CBA, вызывала снижение экспрессии htt человека в стороне головного мозга, в которую была сделана инъекция, по сравнению со стороной головного мозга без инъекции и с контрольными мышами, которым была сделана инъекция пустого scAAV9. Эффекты экспрессии mir-HTT с промоторов CBA и U6 на сайленсинг htt в средней части хвостатого ядра также сравнивали через шесть месяцев после инъекции. Данные свидетельствовали о том, что mir-HTT, экспрессируемая либо с промотора U6, либо с промотора CBA, приводила к снижению экспрессии htt человека в средней части хвостатого ядра по сравнению с контрольными животными без инъекций и инъекцией пустого scAAV9 (фиг. 20).
На фиг. 21 и 22 приведены данные, относящиеся к уменьшению экспрессии htt человека в латеральной (фиг. 21) и медиальной (фиг. 22) сторонах средней части скорлупы головного мозга овец через шесть месяцев после инъекции. Данные свидетельствовали о том, что mir-HTT, экспрессируемая с промотора CBA, вызывала снижение экспрессии htt человека в стороне головного мозга, в которую была сделана инъекция, по сравнению со стороной головного мозга без инъекции и с контрольными мышами, которым была сделана инъекция пустого scAAV9. Эффекты экспрессии mir-HTT с промоторов CBA и U6 на сайленсинг htt в средней части хвостатого ядра также сравнивали через шесть месяцев после инъекции. Данные свидетельствовали о том, что mir-HTT, экспрессируемая либо с промотора U6, либо с промотора CBA, приводила к снижению экспрессии htt человека в средней части скорлупы головного мозга по сравнению с контрольными животными без инъекций и инъекцией пустого scAAV9 (фиг. 23).
На фиг. 24 приведены данные, относящиеся к относительной экспрессии РНК гентингтина человека (htt человека) в переднем стриатуме модельной овцы с болезнью Гентингтона через шесть месяцев после интрастриатальной инъекции либо scAAV9 CBA- mir-HTT («промотор CBA»), либо scAAV9 U6-mir -HTT («промотор U6»), либо пустого контрольного вектора scAAV9.
Пример 4
Искусственные микроРНК уменьшают уровень мутантного гентингтина человека по всему стриатуму у трансгенной модельной овцы с болезнью Гентингтона
Животные и процедуры на животных
В этом примере были использованы мериносовые овцы. Перед введением анестетика животным ночью не давали пищи в течение примерно 8 часов. Животные проходили предоперационное физикальное обследование, включая измерение сердечного ритма, частоты дыхания, температуры и веса. Собирали исходные образцы сыворотки (5 мл) и CSF.
Исследование проводили двумя частями с двумя различными группами овец. Для первого исследования сорок одному трансгенному животному (21 валуху, 20 овцам) возрастом примерно 8 месяцев вводили односторонней инъекцией 300 мкл самокомплементарного вектора AAV9 (scAAV9) с титром 1×1013 мкг/мл в общей сложности 3×1012 копий генома. Для второго исследования четырнадцати животным возрастом 14 месяцев вводили инъекцией этот вектор и четырнадцати - контрольный вектор. В состав с вектором добавляли гадолиний для обеспечения возможности послеоперационной визуализации распределения инъекции. Животных переводили в операционную и готовили к хирургической операции. Их укладывали в положении сфинкса на пенопластовой подушке на сложенных конечностях или со свисающими конечностями. Для удержания головы животного на месте использовали стереотаксическую рамку (Kopf, для крупных животных). Спинномозговую жидкость собирали с помощью люмбальной пункции с применением канюли 19 калибра для спинномозговой пункции. rAAV доставляли непосредственно в стриатум, направляя во внутреннюю капсулу. Брили голову животного, предварительно обработанную бетадином, и покрывали прозрачным пластиком. С помощью скальпеля №15 производили криволинейный разрез, обнажая брегму. После выявления брегмы с помощью электрической дрели производили 3-4 мм трепанационное отверстие, расположенное рострально на расстоянии 10 мм от брегмы и латерально на расстоянии 11 мм от средней линии. Канюлю для конвекционной доставки (CED) (MRI Interventions, Ирвин, Калифорния) закрепляли в манипуляторе и заполняли подлежащим введению средством для удаления воздуха из линии. Вскрывали твердую мозговую оболочку с помощью 1,5 мм разреза посредством скальпеля № 11 и вводили канюлю для CED на 25 мм от поверхности твердой мозговой оболочки до целевой глубины. Наружная часть канюли (1,65 мм) закрывала разрез твердой мозговой оболочки для предупреждения утечки CSF во время инфузии. Инфузию начинали через 5 минут после введения канюли, позволяя стабилизироваться ткани вокруг кончика. Скорость инфузии устанавливали на уровне 3,33 мкл/мин до введения общего объема 300 мкл. Через десять минут после завершения инфузии канюлю медленно извлекали и использовали пробку из костного воска для восстановления черепа и предупреждения утечки CSF. Рану промывали солевым раствором и закрывали с использованием 3.0 викрилового шва. После этого проводили стандартную процедуру пробуждения от анестезии и восстановления. Проводили послеоперационную МРТ для определения распространения гадолиния. Одно животное из первого исследования было исключено после хирургической операции, поскольку гадолиний не был виден при визуализации, а второе животное из второго исследования было исключено, поскольку гадолиний, по всей видимости, находился преимущественно в желудочке. После хирургической операции животных держали под наблюдением в течение трех дней и содержали в закрытом помещении в течение 5 дней. Затем их переводили на улицу и размещали в загонах на оставшуюся часть исследования. На протяжении всего исследования животных отслеживали визуально на наличие признаков дистресса и изменений в поведении. Двое животных пострадали от осложнений после хирургического вмешательства, что привело к частичному параличу конечностей. Полагали, что это связано с положением животных под анестезией. Одно животное рано анестезировали, а другое было переведено из шестимесячной в месячную группу. Животных периодически взвешивали в течение периода после инъекции, брали образцы спинномозговой жидкости, крови и сыворотки и хранили их для дальнейшего анализа.
Для подсчета клеток и определения лейкоцитарной формулы собирали кровь через венопункцию яремной вены в пробирку для забора крови с калиевой солью ЭДТА (с лавандовым верхом; LT) и проводили полный анализ крови с определением лейкоцитарной формулы (CBE с лейкоцитарной формулой). Для клинической химии собирали кровь посредством венопункции яремной вены в пробирку для сбора сыворотки (с красным верхом; RT). Образцы подвергали биохимическому анализу по множественным показателям (МВА).
Через один и шесть месяцев после инъекции собирали животных, причем животных использовали либо для гистологического, либо для биохимического анализа. Животных переносили на операционный стол и помещали в лежачее положение на брюхе, при этом собирали примерно 6 мл CSF. Животное переводили в положении лежа на спине. Обнажали сонные артерии и вводили в них канюлю на глубину 4 см от кончика канюли. Обнажали яремные вены и в яремную вену вводили инъекцией 200-500 ед. гепарина/кг. Через пять минут после введения гепарина овец умерщвляли путем внутривенной инъекции летабарба (325 мг пентабарбитона натрия/мл) в количестве 1 мл/2 кг массы тела. Инфузионную помпу заполняли холодным 9% NaCl и соединяли с канюлями в сонных артериях. Животному вводили перфузией примерно 8 л холодного 9% раствора NaCl с давлением 500 мм рт. ст. Для гистологии инфузию переключали на 8 л 4% параформальдегида с давлением 500 мм рт. ст. Извлекали головной мозг и печень. Ткани подвергали последующей фиксации в 4% параформальдегиде в течение 24 часов при температуре 4°С и переносили в 30% сахарозу в 1× фосфатно-солевом буферном растворе минимум на 14 дней при температуре 4°С.
Для анализа РНК, белка и ДНК овцам вводили перфузией холодный 9% NaCl так, как описано выше. Сбор периферической ткани проводили в следующем порядке: печень, надпочечник, яичники (если это было уместно), мышцу и сердце. Перекрестное загрязнение предотвращали за счет использования различных инструментов и мытья поверхностей для вскрытия 10% отбеливателем и 70% этанолом. Орган извлекали из тела и для сбора образцов использовали 3 мм дерматом. В общей сложности из каждого органа собирали десять образцов, два образца подвергали мгновенной заморозке в жидком азоте, а восемь образцов хранили в стабилизационном растворе RNALater при температуре 4°С в течение 24 часов (300 мкл стабилизационного раствора RNALater для образцов печени, мышц и сердца, 500 мкл стабилизационного раствора RNALater для образцов надпочечников и яичников).
Из черепа извлекали головной мозг с помощью циркулярной пилы и щипцов для костей. После извлечения головной мозг взвешивали и помещали вентрально в специально изготовленную из плексигласа матрицу для головного мозга. В головном мозге производили девять разрезов так, чтобы весь стриатум содержался в 4 блоках размером 6 мм. Первый разрез производили постериально от места прикрепления обонятельной луковицы (примерно 18 мм от начала матрицы), а последующие четыре разреза производили с интервалами 6 мм. Стриатум разделяли на четыре блока по 6 мм от постериальной к антериальной части: 2p (постериальный), 2m1 (медиальный 1), 2m2 (медиальный 2) и 2a (антериальный). Рассечение стриатума проводили в следующем порядке: 2p, 2m1, 2a. Стриатум в правом (без инъекции) полушарии рассекали первым во всех блоках, а между полушариями заменяли лезвие скальпеля. Рассечение производили в чашке Петри на сухом льду и старались удалять из ткани стриатума как можно больше белого вещества. После отсечения части стриатума (хвостатого ядра и скорлупы) разделяли пополам, при этом медиальную часть (наиболее близкую к срединной линии блока) хранили в 1 мл стабилизирующего раствора RNALater при температуре 4°С, а боковую часть подвергали мгновенной заморозке в жидком азоте. Рассечение стриатума в случае 6-месячной группы в исследовании с CBA производили таким образом, чтобы получить четыре образца стриатума как из хвостатого ядра, так и из скорлупы. Дорсальные срезы (как медиальные, так и латеральные) подвергали мгновенной заморозке в жидком азоте, а вентральные срезы (как медиальные, так и латеральные) хранили в 1 мл стабилизирующего раствора RNALater при температуре 4°С. Стабилизирующий раствор RNALater удаляли через двадцать четыре часа и образцы хранили при температуре -80°С.
Блок 2m2 обильно покрывали OCT и замораживали в бане с 2-метилбутаном и сухим льдом. Остальные блоки 2a, 2m1 и 2p замораживали аналогичным образом. Из каждого блока брали десять образцов коры в дорсально-вентральном направлении, два из них подвергали мгновенной заморозке в жидком азоте, а восемь хранили в 1 мл стабилизирующего раствора RNALater при температуре 4°С.
Разрез ткани для гистологического анализа
Перед разрезанием ткани для гистологического анализа стриатум выделяли из головного мозга, обильно покрывали OCT и хранили при температуре -20°С в течение двадцати четырех часов. Коронарные срезы толщиной 40 мкм нарезали с помощью санного микротома (санный микротом Reichert-Jung Tetrander) по всему стриатуму. Срезы хранили в 0,01% азиде натрия в 1× фосфатно-солевом буферном растворе при температуре 4°С.
Клонирование вектора и получение rAAV9
Для первого исследования тестируемый вектор содержал промотор U6, управляющий искусственной микроРНК, на базе эндогенного остова mir155 (AAV9-U6-miRHTT). Искусственная микроРНК нацелена на гентингтин человека, но не овцы. Для улучшения упаковки AAV был включен химерный цитомегаловирусный энхансер/куриный промотор гена β-актина (CBA), управляющий химерным интроном. Контрольный вектор (AAV9) содержал только пустой промотор CBA и интрон. Для второго исследования тестируемый вектор содержал энхансер CMV и промотор CBA, интрон и искусственную микроРНК на основе микроРНК-155 (AAV9-CBA-miRHTT).
Для упаковки векторную плазмиду rAAV, упаковывающую плазмиду и плазмиду- помощник аденовируса совместно трансфицировали в клетки HEK 293. Упаковывающая плазмида экспрессировала регуляторные белки и капсидные белки AAV9, что приводило к вырезанию, репликации и упаковке рекомбинантного генома из векторной плазмиды rAAV в вирионы AAV. Рекомбинантные вирусы очищали с помощью стандартной методики седиментации в градиенте CsCl и обессоливали посредством диализа.
Анализ уровней мРНК гентингтина
Уровни РНК в образцах, которые хранились в стабилизирующем растворе RNALater, анализировали с помощью анализа с использованием разветвленных зондов ДНК (bDNA). Образцы обрабатывали в соответствии с рекомендациями производителя по приготовлению гомогенатов тканей из тканей, хранившихся в стабилизирующем растворе RNALater (Affymetrix eBioscience, набор Quantigene® Sample Processing Kit). Гомогенизированные образцы анализировали в соответствии с руководствами производителя для анализа bDNA (QuantiGene® 2.0 Reagent System). Образцы анализировали с помощью зонда для детекции гентингтина человека (Human HD, SA-50339 от Quantigene), овечьего гентингтина (Sheep Huntingtin, SF-10586 от Quantigene) и овечьего калнексина в качестве конститутивного гена (Sheep Calnexin, SF-10622 от Quantigene). Результаты анализа измеряли с помощью люминометра Tecan Infinite M1000 PRO (время для аккумулирования заряда светодиодом установлено на 200 мс).
Анализ уровней miR-Htt
Образцы биопсии (2 мм) брали из латеральной части хвостатого ядра и медиальной части скорлупы из замороженных блоков. Экстракции РНК производили с использованием рекомендаций производителя TRIzol (Ambion) с некоторыми внесенными модификациями. После разделения фаз при экстракции TRIzol водную фазу переносили в колонку RNA Clean & Concentrator (Zymo) и следовали данному протоколу. РНК хранили при температуре -80°С до анализа. Качество и концентрацию РНК определяли на анализаторе фрагментов (Advanced Analytical Technologies Inc.). Непосредственно перед анализом РНК разводили до 20 нг/мкл. Направляющие цепи искусственной микроРНК подвергали обратной транскрипции с использованием набора для обратной транскрипции микроРНК TaqMan MicroRNA Reverse Transcription Kit (кат. № 4366596, Thermo Scientific), 2 мкл РНК и праймеров по типу «стебель-петля», специфичных к направляющим цепям (специфический аналитический реагент от ThermoFisher, нацеленный на UAAGCAUGGAGCUAGCAGGCU (SEQ ID NO: 25) или аналитический реагент под номером 002407, let7e*) в соответствии с инструкциями производителя. Реакции ddPCR проводили с использованием 5 мкл RT-продуктов, 1× концентрации аналитического реагента miR-Htt и 0,3× концентрации аналитического реагента let-7e* для обеспечения возможности мультиплексирования. Капли создавали с помощью генератора капель QX200 (кат. № 1864002, Biorad) и отслеживали их на наличие положительного сигнала после амплификации ПЦР в конечной точке (40 циклов). Относительную экспрессию miRHTT определяли путем расчета соотношения между абсолютными концентрациями miRHTT и let-7e*.
Распределение вектора по геному
Геномную ДНК экстрагировали из образцов, которые перед этим были подвергнуты мгновенной заморозке в жидком азоте, с использованием набора Gentra Puregene Tissue (Qiagen). Концентрации геномной ДНК измеряли с помощью спектрофотометра NanoDrop ONEc. Цифровую капельную ПЦР (ddPCR, Biorad) проводили в соответствии с рекомендациями производителя с использованием 50 нг ДНК в качестве вводного материала и аналитических реагентов TaqMan, детектирующих вектор-специфический промотор CB и U6 и референсный ген HPRT. Результаты выражали в виде генома вектора на диплоидный геном (гв/дг).
Анализ уровней белка гентингтина - мезомасштабный анализ на детектирование (MSD) mHTT
Образцы стриатума гомогенизировали в буфере, состоящем из 10 мМ HEPES, 250 мМ сахарозы, 1 мМ ЭДТА и ингибиторов протеазы (Roche), и обрабатывали ультразвуком в течение 10 секунд с амплитудой 10%. Концентрацию белка измеряли с помощью анализа по методу Бредфорда. 96-луночный стандартный планшет QuicPlex (MSD) покрывали кроличьим моноклональным антителом к пролиновому участку 1220 HTT (D7F7, Cell Signaling, 1:250) в PBS в течение ночи при температуре 4°C. Планшет промывали 3×10 минут посредством PBST (PBS + 0,05% Tween20) и блокировали 3% бычьим сывороточным альбумином (BSA) в PBS в течение 2 часов при комнатной температуре. После промывания 3×10 мин посредством PBST технические дубликаты образцов с 20 мкг белка в 25 мкл буфера для гомогенизации или холостые пробы (буфер для гомогенизации) распределяли в планшет и инкубировали в течение ночи при температуре 4°C на орбитальном шейкере. Планшет промывали 3×10 мин в PBST и инкубировали в смеси вторичных/детектирующих антител следующим образом: Для детекции mHTT мышиное моноклональное антитело MW1 (DSHB) к полиQ смешивали с конъюгированным с люминофором SulfoTag детектирующим антителом к мышиным антителам (MSD) в концентрации 1 мкг/мл каждого антитела в 1% BSA в PBS. В каждую лунку вносили 30 мкл смеси детектирующих антител и инкубировали в течение 3 часов при комнатной температуре на орбитальном шейкере. Планшет промывали 3×10 мин в PBST и в каждую лунку вносили 150 мкл 2× буфера для считывания результатов (MSD) непосредственно перед считыванием на ридере QuickPlex SQ120 (MSD).
Вестерн-блоттинг
Небольшие кусочки ткани удаляли из замороженных блоков и гомогенизировали на льду в 200 мкл 10 мМ HEPES, pH 7,2, 250 мМ сахарозы, 1 мМ ЭДТА + таблетки ингибитора протеаз (мини, полная, без ЭДТА, Roche № 11836170001). Образцы обрабатывали ультразвуком в течение 10 секунд, а концентрацию белка определяли с помощью метода Бредфорда (BioRad, № 500-0006). Равные концентрации белка (25 мкг) разделяли с помощью SDS-PAGE на 3-8% трис-ацетатных гелях (Life Technologies, № EA03785BOX) и переносили на нитроцеллюлозу с помощью системы TransBlot Turbo (BioRad). Блоты блокировали в 5% обезжиренном сухом молоке в забуференном посредством трис солевом растворе + 0,1% Tween-20 (TBST) в течение 1 часа и инкубировали в течение ночи в первичном антителе при температуре 4°C, разведенном в блокирующем растворе. В качестве первичных антител использовали следующие: антитела к поли-Q (MW1, Coriell, 1:500 или 3B5H10, Sigma, 1:1000), антитела к гентингтину (MAB2166, EMD Millipore, 1:1000 или Ab1, DiFiglia et al., 1995, 1:1000), антитела к DARPP32 (№ ab40801, Abcam, 1:10000), антитела к актину (A4700, Sigma, 1:1000) и антитела к спектрину (MAB1622, EMD Milliopore, 1:4000). Блоты промывали в TBST, инкубировали в меченных пероксидазой вторичных антителах, разведенных до 1:5000 в блокирующем растворе, в течение 1 часа при комнатной температуре, промывали в TBST и инкубировали в хемилюминесцентном субстрате SuperSignal West Pico (Pierce, №34080). Изображения получали с помощью ПЗС-системы визуализации (Alpha Innotech) и Hyperfilm ECL (GE Healthcare). Денситометрию осуществляли на цифровых изображениях с использованием программного обеспечения ImageJ (NIH). Статистический анализ проводили с помощью непарных t-критериев, а результаты выражали как среднее значение для стороны, в которую была введена инъекция.
Иммуногистохимия для DARPP32, NeuN и Iba1
Для количественной оценки DARPP32-положительных клеток каждый двадцатый срез инкубировали в течение трех минут в 3% перекиси водорода в 1× PBS, в течение двадцати минут в 0,5% Triton-X-100, а затем в течение четырех часов в 1,5% нормальной козьей сыворотке (Vector Labs, S-1000) в 1× PBS. Срезы инкубировали в антителах к DARPP32 (AbCam, ab40801, разведение 1:1000) в 1,5% нормальной козьей сыворотке в течение ночи при температуре 4°С. Затем срезы инкубировали в биотинилированном козьем антителе к IgG кролика (Vector Labs, AP-1000, разведение 1:200) в 1× PBS в течение 10 минут. Срезы инкубировали с 2% реагентом Elite A и 2% Elite B из набора Vectastain Elite ABC (Vector Labs, PK-6100) в 1× PBS в течение пяти минут. Для визуализации DARPP32-положительных клеток использовали набор Metal Enhanced DAB (ThermoFisher Scientific, 34065). Срезы инкубировали в 1× 3,3'-диаминобензидине в стабильном пероксидном буфере.
Для количественной оценки NeuN-положительных клеток каждый двадцатый срез инкубировали в течение трех минут в 3% перекиси водорода в 1× PBS, в течение двадцати минут в 0,5% Triton-X-100, а затем в течение ночи в 1,5% нормальной козьей сыворотке (Vector Labs, S-1000) в 1× PBS при температуре 4°С в течение ночи. Срезы инкубировали в антителах к NeuN (Chemicon, MAB377, разведение 1:1000) в 1,5% нормальной козьей сыворотке в течение одного часа при температуре 4°С. Затем срезы инкубировали в течение 40 минут с конъюгированным с флуоресцентным красителем AF594 козьим антителом к мышиному IgG (ThermoFisher Scientific, A-11005, разведение 1:2000) для визуализации NeuN-положительных клеток.
Для количественного определения Iba1-положительных клеток каждый двадцатый срез инкубировали в течение одного часа в растворе 5% нормальной козьей сыворотки (Vector Labs, S-1000), 1% бычьего сывороточного альбумина (Sigma, A-3059), 0,2% Triton- Х-100 и 0,03% перекиси водорода в 1× PBS. Срезы инкубировали в антителе к Iba1 (Wako Chemicals, 019-19741, разведение 1:1000) в 5% нормальной козьей сыворотке (Vector Labs, S-1000) и 1% бычьем сывороточном альбумине (Sigma, A-3059) при 4 С в течение ночи. Срезы инкубировали с биотинилированным козьим антителом к IgG кролика (Vector Labs, AP-1000, разведение 1:200) в 1× PBS в течение десяти минут. Срезы инкубировали с 2% реагентом Elite A и 2% Elite B из набора Vectastain Elite ABC (Vector Labs, PK-6100) в 1× PBS в течение пяти минут. Для визуализации реакции использовали набор Metal Dhanced DAB (ThermoFisher Scientific, 34605) путем инкубации среза в 1× 3',3-диаминобензидине в стабильном пероксидном буфере.
Количественную оценку DARPP32- и Iba1-положительных клеток в левом и правом полушарии головного мозга проводили путем получения изображений (20× в случае DARPP32 и 40× в случае Iba1) каждого среза с помощью микроскопа Nikon Eclipse E600. Для последовательного захвата изображения среди различных срезов первое изображение захватывали в медиальном, дорсальном крае стриатума, а затем предметный столик перемещали на 0,5 см к вентральному краю. После достижения вентрального края предметный столик сдвигали на 0,5 см в латеральном направлении и на 0,5 см в дорсальном направления, пока не были получены десять изображений. Каждому изображению присваивали случайные номера, чтобы устранить систематическую ошибку при количественной оценке клеток. Клетки подсчитывали с помощью программного обеспечения ImageJ (NIH).
Количественную оценку NeuN-положительных клеток проводили с использованием Nikon Eclipse E600 со 100-ватной лампой Chiu Technical Corporation Mercury при 60× увеличении. Для количественной оценки NeuN-положительных клеток также использовали стереологический способ, применяемый для захвата изображений с DARPP32 и Iba1.
Площадь стриатума, хвостатого ядра и скорлупы для каждого среза измеряли путем ручного обведения окрашенных участков с DARPP32 с помощью программного обеспечения ImageJ (NIH) на сторонах с инъекцией и без нее каждого 20-го среза по стриатуму (29-35 срезов на сторону для каждого животного). Экспериментатор не был знаком с условиями проведения эксперимента. Общий объем для каждого участка определяли путем умножения площади на толщину среза (40 микрон) на количество срезов между покровными стеклами (20) и их сложения для каждого животного. Статистический анализ проводили с использованием Microsoft Excel, парных и непарных t-критериев, N=3 или 4 животных на группу.
Распределение векторного генома и микроРНК после инъекции
Был обнаружен сайленсинг большого количества мышиного гентингтина в нокин- модели HD и трансгенной мРНК mHTT человека в трансгенной мышиной модели HD. В этом примере двум группам овец с HD (исследование 1 и исследование 2) вводили односторонней инъекцией в стриатум. В исследовании 1 овцам возрастом 8-9 месяцев вводили инъекцией scAAV9-U6-miRHTT (AAV9miRHTT) или scAAV9-CBA-empty (AAV9), где была вставлена некодирующая промежуточная последовательность между промотором и сигналом поли-А. В исследовании 2 овцам возрастом 14 месяцев вводили инъекцией scAAV9-CBA-miRHTT или scAAV9-CBA-empty (AAV9). Головной мозг собирали через один и шесть месяцев после введения AAV9-miRHTT.
Определяли количество копий генома в подмножестве областей (фиг. 26A) с помощью капельной цифровой ПЦР (ddPCR, фиг. 26B). Количество копий генома были наиболее высокими в хвостатом ядре и скорлупе на стороне с инъекцией в сравнении со стороной без инъекции и имели наиболее высокие уровни в группах обработки посредством scAAV9-U6-miRHTT через 1 и 6 месяцев после инъекции. Небольшие количества векторного генома присутствовали в коре и печени, но не поддавались детекции в надпочечниках (фиг. 26B).
Качество РНК измеряли с помощью анализатора фрагментов, который выдает оценку, называемую показателем качества РНК (RQN). RQN получали путем анализа электроферограммы, и он включает в себя ряд различных параметров целостности РНК, таких как соотношение между остротой рибосомальных пиков 28S и 18S и базовой линией. Оценки обычно варьируют от 0 (полностью разложилась) до 10. Образцы с оценками, превышающими 5, использовали для анализа уровней направляющей цепи искусственной miR. Два животных из исследования 1 и два из исследования 2 были исключены из анализа из-за низких оценок RQN. Уровни направляющих цепей искусственных микроРНК измеряли с использованием ddPCR и нормализовали к эндогенному let7e* (фиг. 27). Относительное количество антисмысловой цепи искусственной miR было в 3,5-1000 раз выше на стороне с инъекцией, чем на стороне без инъекции, и выше через один месяц по сравнению с шестью месяцами после инъекции. Низкие уровни направляющих цепей микроРНК были детектированы на стороне, контрлатеральной относительно инъекции AAV9-miRHTT.
Однократное введение scAAV9-miRHTT долгосрочно снижало количество мРНК мутантного гентингтина человека в хвостатом ядре и скорлупе головного мозга
мРНК HTT в переднем и медиальном стриатуме измеряли с помощью анализа с использованием разветвленных зондов ДНК (bDNA), который специфически распознает мРНК HTT человека, но не овцы. Для этого анализа не требуется выделение РНК, и все образцы были включены в анализ. Через один месяц после инъекции, ближайшей к инъекции в медиальный блок, scAAV9-U6-miRHTT (исследование 1) снижал уровень мРНК HTT человека более чем на 50% как в хвостатом ядре, так и в скорлупе головного мозга (фиг. 28). Не было обнаружено значимого сайленсинга в переднем стриатуме, который был дальше от места инъекции (фиг. 28). Через шесть месяцев после инъекции сайленсинг мРНК был четко выражен в хвостатом ядре (фиг. 28). В группе scAAV9-CβA-miRHTT (исследование 2) заметный сайленсинг мРНК HTT имел место в медиальной скорлупе, медиальном хвостатом ядре и переднем стриатуме (фиг. 28) через один месяц и в медиальном хвостатом ядре и части медиальной скорлупы (фиг. 28) через шесть месяцев после инъекции. В переднем стриатуме не наблюдали значимого снижения через шесть месяцев. Отсутствовал значимый сайленсинг эндогенной мРНК HTT овцы (фиг. 29A).
Из результатов вестерн-блоттинга и электрохемилюминесценции (MSD-анализа) видно, что scAAV9-miRHTT снижал уровень мутантного белка гентингтина человека в хвостатом ядре и скорлупе головного мозга
Белок HTT детектировали с помощью вестерн-блоттинга (фиг. 30) и электрохемилюминесценции (Meso Scale Discovery (MSD, фиг. 30) в одних и тех же препаратах образцов. В исследовании 1 антитело 3BH510, с помощью которого преимущественно детектируют mHTT (мутантный HTT) относительно HTT дикого типа, использовали для детекции белка mHTT с помощью вестерн-блоттинга (фиг. 30). Через один месяц после обработки посредством scAAV9-U6-miRHTT наблюдали значимое снижение белка mHTT в хвостатом ядре, скорлупе головного мозга и переднем стриатуме и в скорлупе головного мозга через шесть месяцев после обработки в сравнении с обработкой посредством AAV9 без miRHTT. В исследовании 2 (фиг. 30, нижняя часть) обработка посредством scAAV9-CβA-miRHTT значимо подавляла выработку mHTT через один месяц после инъекции в скорлупе головного мозга и через шесть месяцев после инъекции в хвостатом ядре, скорлупе головного мозга и переднем стриатуме.
Из результатов MSD-анализа с применением MW1 для детекции было видно, что обработка посредством scAAV9-U6-miRHTT (исследование 1) значимо снижала уровни белка mHTT в хвостатом ядре, скорлупе головного мозга и переднем стриатуме через один и шесть месяцев после обработки. scAAV9-CBA- miRHTT заметно подавлял выработку белка mHTT в хвостатом ядре через один месяц после инъекции и в хвостатом ядре, скорлупе головного мозга и переднем стриатуме через 6 месяцев после обработки (фиг. 31). Эти результаты свидетельствовали, что имело место значительное сходство между результатами, полученными с помощью MSD-анализа (фиг. 31), и результатами, полученными с помощью вестерн-блоттинга (фиг. 30).
Таблица 2: средний процент снижения мутантного белка гентингтина с помощью вестерн-блоттинга и MSD-анализа в исследованиях 1 и 2. Мутантный белок гентингтина человека измеряли с помощью вестерн-блоттинга с антителом 3B5H10 к поли-Q htt в исследовании 1 и антителами 3B5H10, MAB2166 (антителами к HTT443-456), которые не распознают HTT овец (Reid et al., 2013), и моноклональным антителом MW1 к поли-Q в исследовании 2. В MSD-анализах в качестве детектирующего антитела использовали MW1. В этой таблице представлен средний процент снижения mHTT для хвостатого ядра, скорлупы головного мозга и переднего стриатума. Процент понижения рассчитывали путем деления среднего сигнала для стороны с инъекцией у обработанных посредством AAV9miRHTT овец на средний сигнал для стороны с инъекцией у животных, обработанных только AAV9.

Поскольку антитела, которые детектируют mHTT, могут иметь различную чувствительность, в исследование 2 (таблица 2) были включены два других антитела для детектирования белка mHTT человека с помощью вестерн-блоттинга, MAB2166 и MW1. У трансгенных овец с HD MAB2166 распознает только гентингтин человека, но не HTT овец. MW1 преимущественно распознает расширенный полиглутаминовый участок в HTT, и его также использовали для детекции mHTT в MSD-анализе. В таблице 2 приведены результаты сравнения среднего процента снижения уровня mHTT, детектированного вестерн-блоттингом с тремя антителами к mHTT (3B5H10, 2166 и MW1) и MSD-анализом, с MW1 в исследованиях 1 и 2. Все три антитела в вестерн-блоттинге детектировали значительное снижение уровня mHTT во множественных участках неостриатума в исследовании 2 (от 49% до 81%). Результаты снижения уровня mHTT, полученные с помощью MSD-анализа, согласовывались при анализе в исследовании 2 двух образцов из одного и того же участка стриатума. Также заслуживает внимания сравнение результатов, полученных с помощью вестерн-блоттинга и MSD-анализов, с MW1 в исследовании 2. Имело место значительное сходство между этими двумя различными способами детекции mHTT по величине снижения mHTT.
Согласно результатам, вестерн-блоттинга, в коре головного мозга, покрывающей стриатум с инъекцией AAV9-miRHTT, не наблюдали снижения уровней белка mHTT в сравнении с корой головного мозга с инъекцией AAV9 (фиг. 32A). Низкий уровень направляющей цепи мРНК был детектирован в хвостатом ядре и скорлупе головного мозга на стороне, контрлатеральной стриатуму с инъекцией AAV9-miRHTT. В этих участках не наблюдали пониженных уровней белка mHTT по результатам вестерн-блоттинга (фиг. 32B).
Для того, чтобы исследовать, влияла ли обработка посредством AAV9-miRHTT против гена HD человека на уровни эндогенного HTT овцы, уровни трансгенного mHTT человека с уровнями эндогенного HTT овцы сравнивали напрямую с помощью вестерн- блоттинга с использованием различий в миграции двух белков на SDS PAGE (фиг. 29B). Из результатов вестерн-блоттинга с антителом Ab1, которое распознает htt1-17, было видно, что в отличие от mHTT человека, эндогенный HTT овец не снижался при обработке посредством miRHTT (фиг. 29B).
Обработка посредством микроРНК не оказывала влияния на DARPP32-меченые нейроны и объем стриатума
Для изучения безопасности инъекции векторами AAV проводили иммуногистохимию по DARPP32, маркеру средних шипиковых нейронов, и подсчитывали количество DARPP32-положительных клеток. Отсутствовало значимое различие между количеством клеток в группах с обработкой посредством AAV9-miRHTT и AAV9 (таблица 3), как и отсутствовало значимое различие между группами обработок в количестве клеток, окрашенных по NeuN, маркеру нейронов. Определяли объемы стриатума с помощью измерений площади поперечного сечения стриатума в DARPP32-меченых срезах, и было обнаружено, что после обработки посредством микроРНК они не изменялись в сравнении с контролем (таблица 4).



Временное увеличение активированной микроглии происходило после прямой инъекции scAAV9
Изучали иммуногистохимическую локализацию Iba1, белка, который локализуется в микроглии и активируется при их активации. Меченые клетки выявляли по морфологии как покоящуюся или активированную микроглию (таблица 5). Инъекция scAAV9-U6- miRHTT или соответствующего контрольного вектора увеличивала количество активированной микроглии на стороне с инъекцией через один месяц после инъекции, но через шесть месяцев после инъекции стороны с инъекцией и без инъекции были неразличимы. Во втором исследовании реакцию микроглии изучали только в конечной точке исследования (через 6 месяцев), т. е. в тот момент, когда между группами не было значимого различия. Полученные результаты свидетельствовали о том, что временное увеличение активированной микроглии не зависело от груза AAV и могло иметь место с любым вектором или лишь с хирургическим вмешательством.
Таблица 5. Количество и классификация по морфологии IBA1-положительных клеток. Статистический анализ проводили с помощью парного t-критерия (сторона с инъекцией и сторона без инъекции). Значимое увеличение активированной микроглии на стороне с инъекцией по сравнению со стороной без инъекции было обнаружено у овец с HD, которым была инъекцией введена AAV9-U6-miRHTT (1p=0,01), и у овец WT, которым был инъекцией введен AAV9 (2p=0,006), через шесть месяцев. Значимое уменьшение количества микроглии в состоянии покоя было обнаружено через один месяц у овец с HD, которым инъекцией вводили как AAV9 (3р = 0,05), так и AAV9-U6-miRHTT (4р=0,04), и значимое увеличение общей микроглии было обнаружено у овец с HD, которым был инъекцией введен AAV9, через шесть месяцев в исследовании 2 (4р=0,04). Все анализы проводили с помощью парного t-критерия, сравнивая сторону с инъекцией относительно стороны без инъекции.

Обработка посредством scAAV9-miRHTT не оказывала влияния на результаты анализа крови, электролиты или функцию печени и почек.
Образцы крови отбирали четыре раза: на исходном уровне (до обработки), через 28 (или 30) дней, через 90 дней и через 180 дней после обработки. Проводили общий анализ крови, измеряли электролиты и проводили функциональные исследования печени и почек (таблица 6). Никаких изменений ни в одном из этих измерений не было обнаружено между овцами, которым инъекцией была введена AAV9-miRHTT, и контрольной группой. Кроме того, не наблюдали каких-либо изменений массы.


ПОСЛЕДОВАТЕЛЬНОСТИ
>SEQ ID NO: 1 Huntingtin mRNA; NCBI Ref. Seq NM_002111.8)
GCTGCCGGGACGGGTCCAAGATGGACGGCCGCTCAGGTTCTGCTTTTACCTGCGGCC CAGAGCCCCATTCATTGCCCCGGTGCTGAGCGGCGCCGCGAGTCGGCCCGAGGCCT CCGGGGACTGCCGTGCCGGGCGGGAGACCGCCATGGCGACCCTGGAAAAGCTGATG AAGGCCTTCGAGTCCCTCAAGTCCTTCCAGCAGCAGCAGCAGCAGCAGCAGCAGCA GCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAACAGCCGCCACCGCCGCCG CCGCCGCCGCCGCCTCCTCAGCTTCCTCAGCCGCCGCCGCAGGCACAGCCGCTGCTG CCTCAGCCGCAGCCGCCCCCGCCGCCGCCCCCGCCGCCACCCGGCCCGGCTGTGGCT GAGGAGCCGCTGCACCGACCAAAGAAAGAACTTTCAGCTACCAAGAAAGACCGTGT GAATCATTGTCTGACAATATGTGAAAACATAGTGGCACAGTCTGTCAGAAATTCTCC AGAATTTCAGAAACTTCTGGGCATCGCTATGGAACTTTTTCTGCTGTGCAGTGATGA CGCAGAGTCAGATGTCAGGATGGTGGCTGACGAATGCCTCAACAAAGTTATCAAAG CTTTGATGGATTCTAATCTTCCAAGGTTACAGCTCGAGCTCTATAAGGAAATTAAAA AGAATGGTGCCCCTCGGAGTTTGCGTGCTGCCCTGTGGAGGTTTGCTGAGCTGGCTC ACCTGGTTCGGCCTCAGAAATGCAGGCCTTACCTGGTGAACCTTCTGCCGTGCCTGA CTCGAACAAGCAAGAGACCCGAAGAATCAGTCCAGGAGACCTTGGCTGCAGCTGTT CCCAAAATTATGGCTTCTTTTGGCAATTTTGCAAATGACAATGAAATTAAGGTTTTG TTAAAGGCCTTCATAGCGAACCTGAAGTCAAGCTCCCCCACCATTCGGCGGACAGC GGCTGGATCAGCAGTGAGCATCTGCCAGCACTCAAGAAGGACACAATATTTCTATA GTTGGCTACTAAATGTGCTCTTAGGCTTACTCGTTCCTGTCGAGGATGAACACTCCA CTCTGCTGATTCTTGGCGTGCTGCTCACCCTGAGGTATTTGGTGCCCTTGCTGCAGCA GCAGGTCAAGGACACAAGCCTGAAAGGCAGCTTCGGAGTGACAAGGAAAGAAATG GAAGTCTCTCCTTCTGCAGAGCAGCTTGTCCAGGTTTATGAACTGACGTTACATCAT ACACAGCACCAAGACCACAATGTTGTGACCGGAGCCCTGGAGCTGTTGCAGCAGCT CTTCAGAACGCCTCCACCCGAGCTTCTGCAAACCCTGACCGCAGTCGGGGGCATTGG GCAGCTCACCGCTGCTAAGGAGGAGTCTGGTGGCCGAAGCCGTAGTGGGAGTATTG TGGAACTTATAGCTGGAGGGGGTTCCTCATGCAGCCCTGTCCTTTCAAGAAAACAAA AAGGCAAAGTGCTCTTAGGAGAAGAAGAAGCCTTGGAGGATGACTCTGAATCGAGA TCGGATGTCAGCAGCTCTGCCTTAACAGCCTCAGTGAAGGATGAGATCAGTGGAGA GCTGGCTGCTTCTTCAGGGGTTTCCACTCCAGGGTCAGCAGGTCATGACATCATCAC AGAACAGCCACGGTCACAGCACACACTGCAGGCGGACTCAGTGGATCTGGCCAGCT GTGACTTGACAAGCTCTGCCACTGATGGGGATGAGGAGGATATCTTGAGCCACAGC TCCAGCCAGGTCAGCGCCGTCCCATCTGACCCTGCCATGGACCTGAATGATGGGACC
CAGGCCTCGTCGCCCATCAGCGACAGCTCCCAGACCACCACCGAAGGGCCTGATTC AGCTGTTACCCCTTCAGACAGTTCTGAAATTGTGTTAGACGGTACCGACAACCAGTA TTTGGGCCTGCAGATTGGACAGCCCCAGGATGAAGATGAGGAAGCCACAGGTATTC TTCCTGATGAAGCCTCGGAGGCCTTCAGGAACTCTTCCATGGCCCTTCAACAGGCAC ATTTATTGAAAAACATGAGTCACTGCAGGCAGCCTTCTGACAGCAGTGTTGATAAAT TTGTGTTGAGAGATGAAGCTACTGAACCGGGTGATCAAGAAAACAAGCCTTGCCGC ATCAAAGGTGACATTGGACAGTCCACTGATGATGACTCTGCACCTCTTGTCCATTGT GTCCGCCTTTTATCTGCTTCGTTTTTGCTAACAGGGGGAAAAAATGTGCTGGTTCCG GACAGGGATGTGAGGGTCAGCGTGAAGGCCCTGGCCCTCAGCTGTGTGGGAGCAGC TGTGGCCCTCCACCCGGAATCTTTCTTCAGCAAACTCTATAAAGTTCCTCTTGACACC ACGGAATACCCTGAGGAACAGTATGTCTCAGACATCTTGAACTACATCGATCATGG AGACCCACAGGTTCGAGGAGCCACTGCCATTCTCTGTGGGACCCTCATCTGCTCCAT CCTCAGCAGGTCCCGCTTCCACGTGGGAGATTGGATGGGCACCATTAGAACCCTCAC AGGAAATACATTTTCTTTGGCGGATTGCATTCCTTTGCTGCGGAAAACACTGAAGGA TGAGTCTTCTGTTACTTGCAAGTTAGCTTGTACAGCTGTGAGGAACTGTGTCATGAG TCTCTGCAGCAGCAGCTACAGTGAGTTAGGACTGCAGCTGATCATCGATGTGCTGAC TCTGAGGAACAGTTCCTATTGGCTGGTGAGGACAGAGCTTCTGGAAACCCTTGCAGA GATTGACTTCAGGCTGGTGAGCTTTTTGGAGGCAAAAGCAGAAAACTTACACAGAG GGGCTCATCATTATACAGGGCTTTTAAAACTGCAAGAACGAGTGCTCAATAATGTTG TCATCCATTTGCTTGGAGATGAAGACCCCAGGGTGCGACATGTTGCCGCAGCATCAC TAATTAGGCTTGTCCCAAAGCTGTTTTATAAATGTGACCAAGGACAAGCTGATCCAG TAGTGGCCGTGGCAAGAGATCAAAGCAGTGTTTACCTGAAACTTCTCATGCATGAG ACGCAGCCTCCATCTCATTTCTCCGTCAGCACAATAACCAGAATATATAGAGGCTAT AACCTACTACCAAGCATAACAGACGTCACTATGGAAAATAACCTTTCAAGAGTTATT GCAGCAGTTTCTCATGAACTAATCACATCAACCACCAGAGCACTCACATTTGGATGC TGTGAAGCTTTGTGTCTTCTTTCCACTGCCTTCCCAGTTTGCATTTGGAGTTTAGGTT GGCACTGTGGAGTGCCTCCACTGAGTGCCTCAGATGAGTCTAGGAAGAGCTGTACC GTTGGGATGGCCACAATGATTCTGACCCTGCTCTCGTCAGCTTGGTTCCCATTGGAT CTCTCAGCCCATCAAGATGCTTTGATTTTGGCCGGAAACTTGCTTGCAGCCAGTGCT CCCAAATCTCTGAGAAGTTCATGGGCCTCTGAAGAAGAAGCCAACCCAGCAGCCAC CAAGCAAGAGGAGGTCTGGCCAGCCCTGGGGGACCGGGCCCTGGTGCCCATGGTGG AGCAGCTCTTCTCTCACCTGCTGAAGGTGATTAACATTTGTGCCCACGTCCTGGATG ACGTGGCTCCTGGACCCGCAATAAAGGCAGCCTTGCCTTCTCTAACAAACCCCCCTT CTCTAAGTCCCATCCGACGAAAGGGGAAGGAGAAAGAACCAGGAGAACAAGCATC TGTACCGTTGAGTCCCAAGAAAGGCAGTGAGGCCAGTGCAGCTTCTAGACAATCTG
ATACCTCAGGTCCTGTTACAACAAGTAAATCCTCATCACTGGGGAGTTTCTATCATC TTCCTTCATACCTCAAACTGCATGATGTCCTGAAAGCTACACACGCTAACTACAAGG TCACGCTGGATCTTCAGAACAGCACGGAAAAGTTTGGAGGGTTTCTCCGCTCAGCCT TGGATGTTCTTTCTCAGATACTAGAGCTGGCCACACTGCAGGACATTGGGAAGTGTG TTGAAGAGATCCTAGGATACCTGAAATCCTGCTTTAGTCGAGAACCAATGATGGCA ACTGTTTGTGTTCAACAATTGTTGAAGACTCTCTTTGGCACAAACTTGGCCTCCCAGT TTGATGGCTTATCTTCCAACCCCAGCAAGTCACAAGGCCGAGCACAGCGCCTTGGCT CCTCCAGTGTGAGGCCAGGCTTGTACCACTACTGCTTCATGGCCCCGTACACCCACT TCACCCAGGCCCTCGCTGACGCCAGCCTGAGGAACATGGTGCAGGCGGAGCAGGAG AACGACACCTCGGGATGGTTTGATGTCCTCCAGAAAGTGTCTACCCAGTTGAAGACA AACCTCACGAGTGTCACAAAGAACCGTGCAGATAAGAATGCTATTCATAATCACAT TCGTTTGTTTGAACCTCTTGTTATAAAAGCTTTAAAACAGTACACGACTACAACATG TGTGCAGTTACAGAAGCAGGTTTTAGATTTGCTGGCGCAGCTGGTTCAGTTACGGGT TAATTACTGTCTTCTGGATTCAGATCAGGTGTTTATTGGCTTTGTATTGAAACAGTTT GAATACATTGAAGTGGGCCAGTTCAGGGAATCAGAGGCAATCATTCCAAACATCTT TTTCTTCTTGGTATTACTATCTTATGAACGCTATCATTCAAAACAGATCATTGGAATT CCTAAAATCATTCAGCTCTGTGATGGCATCATGGCCAGTGGAAGGAAGGCTGTGAC ACATGCCATACCGGCTCTGCAGCCCATAGTCCACGACCTCTTTGTATTAAGAGGAAC AAATAAAGCTGATGCAGGAAAAGAGCTTGAAACCCAAAAAGAGGTGGTGGTGTCA ATGTTACTGAGACTCATCCAGTACCATCAGGTGTTGGAGATGTTCATTCTTGTCCTGC AGCAGTGCCACAAGGAGAATGAAGACAAGTGGAAGCGACTGTCTCGACAGATAGCT GACATCATCCTCCCAATGTTAGCCAAACAGCAGATGCACATTGACTCTCATGAAGCC CTTGGAGTGTTAAATACATTATTTGAGATTTTGGCCCCTTCCTCCCTCCGTCCGGTAG ACATGCTTTTACGGAGTATGTTCGTCACTCCAAACACAATGGCGTCCGTGAGCACTG TTCAACTGTGGATATCGGGAATTCTGGCCATTTTGAGGGTTCTGATTTCCCAGTCAA CTGAAGATATTGTTCTTTCTCGTATTCAGGAGCTCTCCTTCTCTCCGTATTTAATCTCC TGTACAGTAATTAATAGGTTAAGAGATGGGGACAGTACTTCAACGCTAGAAGAACA CAGTGAAGGGAAACAAATAAAGAATTTGCCAGAAGAAACATTTTCAAGGTTTCTAT TACAACTGGTTGGTATTCTTTTAGAAGACATTGTTACAAAACAGCTGAAGGTGGAAA TGAGTGAGCAGCAACATACTTTCTATTGCCAGGAACTAGGCACACTGCTAATGTGTC TGATCCACATCTTCAAGTCTGGAATGTTCCGGAGAATCACAGCAGCTGCCACTAGGC TGTTCCGCAGTGATGGCTGTGGCGGCAGTTTCTACACCCTGGACAGCTTGAACTTGC GGGCTCGTTCCATGATCACCACCCACCCGGCCCTGGTGCTGCTCTGGTGTCAGATAC TGCTGCTTGTCAACCACACCGACTACCGCTGGTGGGCAGAAGTGCAGCAGACCCCG AAAAGACACAGTCTGTCCAGCACAAAGTTACTTAGTCCCCAGATGTCTGGAGAAGA
GGAGGATTCTGACTTGGCAGCCAAACTTGGAATGTGCAATAGAGAAATAGTACGAA GAGGGGCTCTCATTCTCTTCTGTGATTATGTCTGTCAGAACCTCCATGACTCCGAGC ACTTAACGTGGCTCATTGTAAATCACATTCAAGATCTGATCAGCCTTTCCCACGAGC CTCCAGTACAGGACTTCATCAGTGCCGTTCATCGGAACTCTGCTGCCAGCGGCCTGT TCATCCAGGCAATTCAGTCTCGTTGTGAAAACCTTTCAACTCCAACCATGCTGAAGA AAACTCTTCAGTGCTTGGAGGGGATCCATCTCAGCCAGTCGGGAGCTGTGCTCACGC TGTATGTGGACAGGCTTCTGTGCACCCCTTTCCGTGTGCTGGCTCGCATGGTCGACA TCCTTGCTTGTCGCCGGGTAGAAATGCTTCTGGCTGCAAATTTACAGAGCAGCATGG CCCAGTTGCCAATGGAAGAACTCAACAGAATCCAGGAATACCTTCAGAGCAGCGGG CTCGCTCAGAGACACCAAAGGCTCTATTCCCTGCTGGACAGGTTTCGTCTCTCCACC ATGCAAGACTCACTTAGTCCCTCTCCTCCAGTCTCTTCCCACCCGCTGGACGGGGAT GGGCACGTGTCACTGGAAACAGTGAGTCCGGACAAAGACTGGTACGTTCATCTTGT CAAATCCCAGTGTTGGACCAGGTCAGATTCTGCACTGCTGGAAGGTGCAGAGCTGG TGAATCGGATTCCTGCTGAAGATATGAATGCCTTCATGATGAACTCGGAGTTCAACC TAAGCCTGCTAGCTCCATGCTTAAGCCTAGGGATGAGTGAAATTTCTGGTGGCCAGA AGAGTGCCCTTTTTGAAGCAGCCCGTGAGGTGACTCTGGCCCGTGTGAGCGGCACCG TGCAGCAGCTCCCTGCTGTCCATCATGTCTTCCAGCCCGAGCTGCCTGCAGAGCCGG CGGCCTACTGGAGCAAGTTGAATGATCTGTTTGGGGATGCTGCACTGTATCAGTCCC TGCCCACTCTGGCCCGGGCCCTGGCACAGTACCTGGTGGTGGTCTCCAAACTGCCCA GTCATTTGCACCTTCCTCCTGAGAAAGAGAAGGACATTGTGAAATTCGTGGTGGCAA CCCTTGAGGCCCTGTCCTGGCATTTGATCCATGAGCAGATCCCGCTGAGTCTGGATC TCCAGGCAGGGCTGGACTGCTGCTGCCTGGCCCTGCAGCTGCCTGGCCTCTGGAGCG TGGTCTCCTCCACAGAGTTTGTGACCCACGCCTGCTCCCTCATCTACTGTGTGCACTT CATCCTGGAGGCCGTTGCAGTGCAGCCTGGAGAGCAGCTTCTTAGTCCAGAAAGAA GGACAAATACCCCAAAAGCCATCAGCGAGGAGGAGGAGGAAGTAGATCCAAACAC ACAGAATCCTAAGTATATCACTGCAGCCTGTGAGATGGTGGCAGAAATGGTGGAGT CTCTGCAGTCGGTGTTGGCCTTGGGTCATAAAAGGAATAGCGGCGTGCCGGCGTTTC TCACGCCATTGCTAAGGAACATCATCATCAGCCTGGCCCGCCTGCCCCTTGTCAACA GCTACACACGTGTGCCCCCACTGGTGTGGAAGCTTGGATGGTCACCCAAACCGGGA GGGGATTTTGGCACAGCATTCCCTGAGATCCCCGTGGAGTTCCTCCAGGAAAAGGA AGTCTTTAAGGAGTTCATCTACCGCATCAACACACTAGGCTGGACCAGTCGTACTCA GTTTGAAGAAACTTGGGCCACCCTCCTTGGTGTCCTGGTGACGCAGCCCCTCGTGAT GGAGCAGGAGGAGAGCCCACCAGAAGAAGACACAGAGAGGACCCAGATCAACGTC CTGGCCGTGCAGGCCATCACCTCACTGGTGCTCAGTGCAATGACTGTGCCTGTGGCC GGCAACCCAGCTGTAAGCTGCTTGGAGCAGCAGCCCCGGAACAAGCCTCTGAAAGC
TCTCGACACCAGGTTTGGGAGGAAGCTGAGCATTATCAGAGGGATTGTGGAGCAAG AGATTCAAGCAATGGTTTCAAAGAGAGAGAATATTGCCACCCATCATTTATATCAGG CATGGGATCCTGTCCCTTCTCTGTCTCCGGCTACTACAGGTGCCCTCATCAGCCACG AGAAGCTGCTGCTACAGATCAACCCCGAGCGGGAGCTGGGGAGCATGAGCTACAAA CTCGGCCAGGTGTCCATACACTCCGTGTGGCTGGGGAACAGCATCACACCCCTGAG GGAGGAGGAATGGGACGAGGAAGAGGAGGAGGAGGCCGACGCCCCTGCACCTTCG TCACCACCCACGTCTCCAGTCAACTCCAGGAAACACCGGGCTGGAGTTGACATCCAC TCCTGTTCGCAGTTTTTGCTTGAGTTGTACAGCCGCTGGATCCTGCCGTCCAGCTCAG CCAGGAGGACCCCGGCCATCCTGATCAGTGAGGTGGTCAGATCCCTTCTAGTGGTCT CAGACTTGTTCACCGAGCGCAACCAGTTTGAGCTGATGTATGTGACGCTGACAGAAC TGCGAAGGGTGCACCCTTCAGAAGACGAGATCCTCGCTCAGTACCTGGTGCCTGCCA CCTGCAAGGCAGCTGCCGTCCTTGGGATGGACAAGGCCGTGGCGGAGCCTGTCAGC CGCCTGCTGGAGAGCACGCTCAGGAGCAGCCACCTGCCCAGCAGGGTTGGAGCCCT GCACGGCGTCCTCTATGTGCTGGAGTGCGACCTGCTGGACGACACTGCCAAGCAGCT CATCCCGGTCATCAGCGACTATCTCCTCTCCAACCTGAAAGGGATCGCCCACTGCGT GAACATTCACAGCCAGCAGCACGTACTGGTCATGTGTGCCACTGCGTTTTACCTCAT TGAGAACTATCCTCTGGACGTAGGGCCGGAATTTTCAGCATCAATAATACAGATGTG TGGGGTGATGCTGTCTGGAAGTGAGGAGTCCACCCCCTCCATCATTTACCACTGTGC CCTCAGAGGCCTGGAGCGCCTCCTGCTCTCTGAGCAGCTCTCCCGCCTGGATGCAGA ATCGCTGGTCAAGCTGAGTGTGGACAGAGTGAACGTGCACAGCCCGCACCGGGCCA TGGCGGCTCTGGGCCTGATGCTCACCTGCATGTACACAGGAAAGGAGAAAGTCAGT CCGGGTAGAACTTCAGACCCTAATCCTGCAGCCCCCGACAGCGAGTCAGTGATTGTT GCTATGGAGCGGGTATCTGTTCTTTTTGATAGGATCAGGAAAGGCTTTCCTTGTGAA GCCAGAGTGGTGGCCAGGATCCTGCCCCAGTTTCTAGACGACTTCTTCCCACCCCAG GACATCATGAACAAAGTCATCGGAGAGTTTCTGTCCAACCAGCAGCCATACCCCCA GTTCATGGCCACCGTGGTGTATAAGGTGTTTCAGACTCTGCACAGCACCGGGCAGTC GTCCATGGTCCGGGACTGGGTCATGCTGTCCCTCTCCAACTTCACGCAGAGGGCCCC GGTCGCCATGGCCACGTGGAGCCTCTCCTGCTTCTTTGTCAGCGCGTCCACCAGCCC GTGGGTCGCGGCGATCCTCCCACATGTCATCAGCAGGATGGGCAAGCTGGAGCAGG TGGACGTGAACCTTTTCTGCCTGGTCGCCACAGACTTCTACAGACACCAGATAGAGG AGGAGCTCGACCGCAGGGCCTTCCAGTCTGTGCTTGAGGTGGTTGCAGCCCCAGGA AGCCCATATCACCGGCTGCTGACTTGTTTACGAAATGTCCACAAGGTCACCACCTGC TGAGCGCCATGGTGGGAGAGACTGTGAGGCGGCAGCTGGGGCCGGAGCCTTTGGAA GTCTGCGCCCTTGTGCCCTGCCTCCACCGAGCCAGCTTGGTCCCTATGGGCTTCCGC ACATGCCGCGGGCGGCCAGGCAACGTGCGTGTCTCTGCCATGTGGCAGAAGTGCTC
TTTGTGGCAGTGGCCAGGCAGGGAGTGTCTGCAGTCCTGGTGGGGCTGAGCCTGAG GCCTTCCAGAAAGCAGGAGCAGCTGTGCTGCACCCCATGTGGGTGACCAGGTCCTTT CTCCTGATAGTCACCTGCTGGTTGTTGCCAGGTTGCAGCTGCTCTTGCATCTGGGCCA GAAGTCCTCCCTCCTGCAGGCTGGCTGTTGGCCCCTCTGCTGTCCTGCAGTAGAAGG TGCCGTGAGCAGGCTTTGGGAACACTGGCCTGGGTCTCCCTGGTGGGGTGTGCATGC CACGCCCCGTGTCTGGATGCACAGATGCCATGGCCTGTGCTGGGCCAGTGGCTGGG GGTGCTAGACACCCGGCACCATTCTCCCTTCTCTCTTTTCTTCTCAGGATTTAAAATT TAATTATATCAGTAAAGAGATTAATTTTAACGTAACTCTTTCTATGCCCGTGTAAAG TATGTGAATCGCAAGGCCTGTGCTGCATGCGACAGCGTCCGGGGTGGTGGACAGGG CCCCCGGCCACGCTCCCTCTCCTGTAGCCACTGGCATAGCCCTCCTGAGCACCCGCT GACATTTCCGTTGTACATGTTCCTGTTTATGCATTCACAAGGTGACTGGGATGTAGA GAGGCGTTAGTGGGCAGGTGGCCACAGCAGGACTGAGGACAGGCCCCCATTATCCT AGGGGTGCGCTCACCTGCAGCCCCTCCTCCTCGGGCACAGACGACTGTCGTTCTCCA CCCACCAGTCAGGGACAGCAGCCTCCCTGTCACTCAGCTGAGAAGGCCAGCCCTCC CTGGCTGTGAGCAGCCTCCACTGTGTCCAGAGACATGGGCCTCCCACTCCTGTTCCT TGCTAGCCCTGGGGTGGCGTCTGCCTAGGAGCTGGCTGGCAGGTGTTGGGACCTGCT GCTCCATGGATGCATGCCCTAAGAGTGTCACTGAGCTGTGTTTTGTCTGAGCCTCTCT CGGTCAACAGCAAAGCTTGGTGTCTTGGCACTGTTAGTGACAGAGCCCAGCATCCCT TCTGCCCCCGTTCCAGCTGACATCTTGCACGGTGACCCCTTTTAGTCAGGAGAGTGC AGATCTGTGCTCATCGGAGACTGCCCCACGGCCCTGTCAGAGCCGCCACTCCTATCC CCAGGCCAGGTCCCTGGACCAGCCTCCTGTTTGCAGGCCCAGAGGAGCCAAGTCATT AAAATGGAAGTGGATTCTGGATGGCCGGGCTGCTGCTGATGTAGGAGCTGGATTTG GGAGCTCTGCTTGCCGACTGGCTGTGAGACGAGGCAGGGGCTCTGCTTCCTCAGCCC TAGAGGCGAGCCAGGCAAGGTTGGCGACTGTCATGTGGCTTGGTTTGGTCATGCCCG TCGATGTTTTGGGTATTGAATGTGGTAAGTGGAGGAAATGTTGGAACTCTGTGCAGG TGCTGCCTTGAGACCCCCAAGCTTCCACCTGTCCCTCTCCTATGTGGCAGCTGGGGA GCAGCTGAGATGTGGACTTGTATGCTGCCCACATACGTGAGGGGGAGCTGAAAGGG AGCCCCTCCTCTGAGCAGCCTCTGCCAGGCCTGTATGAGGCTTTTCCCACCAGCTCC CAACAGAGGCCTCCCCCAGCCAGGACCACCTCGTCCTCGTGGCGGGGCAGCAGGAG CGGTAGAAAGGGGTCCGATGTTTGAGGAGGCCCTTAAGGGAAGCTACTGAATTATA ACACGTAAGAAAATCACCATTCCGTATTGGTTGGGGGCTCCTGTTTCTCATCCTAGC TTTTTCCTGGAAAGCCCGCTAGAAGGTTTGGGAACGAGGGGAAAGTTCTCAGAACT GTTGGCTGCTCCCCACCCGCCTCCCGCCTCCCCCGCAGGTTATGTCAGCAGCTCTGA GACAGCAGTATCACAGGCCAGATGTTGTTCCTGGCTAGATGTTTACATTTGTAAGAA ATAACACTGTGAATGTAAAACAGAGCCATTCCCTTGGAATGCATATCGCTGGGCTCA
ACATAGAGTTTGTCTTCCTCTTGTTTACGACGTGATCTAAACCAGTCCTTAGCAAGG GGCTCAGAACACCCCGCTCTGGCAGTAGGTGTCCCCCACCCCCAAAGACCTGCCTGT GTGCTCCGGAGATGAATATGAGCTCATTAGTAAAAATGACTTCACCCACGCATATAC ATAAAGTATCCATGCATGTGCATATAGACACATCTATAATTTTACACACACACCTCT CAAGACGGAGATGCATGGCCTCTAAGAGTGCCCGTGTCGGTTCTTCCTGGAAGTTGA CTTTCCTTAGACCCGCCAGGTCAAGTTAGCCGCGTGACGGACATCCAGGCGTGGGAC GTGGTCAGGGCAGGGCTCATTCATTGCCCACTAGGATCCCACTGGCGAAGATGGTCT CCATATCAGCTCTCTGCAGAAGGGAGGAAGACTTTATCATGTTCCTAAAAATCTGTG GCAAGCACCCATCGTATTATCCAAATTTTGTTGCAAATGTGATTAATTTGGTTGTCA AGTTTTGGGGGTGGGCTGTGGGGAGATTGCTTTTGTTTTCCTGCTGGTAATATCGGG AAAGATTTTAATGAAACCAGGGTAGAATTGTTTGGCAATGCACTGAAGCGTGTTTCT TTCCCAAAATGTGCCTCCCTTCCGCTGCGGGCCCAGCTGAGTCTATGTAGGTGATGT TTCCAGCTGCCAAGTGCTCTTTGTTACTGTCCACCCTCATTTCTGCCAGCGCATGTGT CCTTTCAAGGGGAAAATGTGAAGCTGAACCCCCTCCAGACACCCAGAATGTAGCAT CTGAGAAGGCCCTGTGCCCTAAAGGACACCCCTCGCCCCCATCTTCATGGAGGGGGT CATTTCAGAGCCCTCGGAGCCAATGAACAGCTCCTCCTCTTGGAGCTGAGATGAGCC CCACGTGGAGCTCGGGACGGATAGTAGACAGCAATAACTCGGTGTGTGGCCGCCTG GCAGGTGGAACTTCCTCCCGTTGCGGGGTGGAGTGAGGTTAGTTCTGTGTGTCTGGT GGGTGGAGTCAGGCTTCTCTTGCTACCTGTGAGCATCCTTCCCAGCAGACATCCTCA TCGGGCTTTGTCCCTCCCCCGCTTCCTCCCTCTGCGGGGAGGACCCGGGACCACAGC TGCTGGCCAGGGTAGACTTGGAGCTGTCCTCCAGAGGGGTCACGTGTAGGAGTGAG AAGAAGGAAGATCTTGAGAGCTGCTGAGGGACCTTGGAGAGCTCAGGATGGCTCAG ACGAGGACACTCGCTTGCCGGGCCTGGGCCTCCTGGGAAGGAGGGAGCTGCTCAGA ATGCCGCATGACAACTGAAGGCAACCTGGAAGGTTCAGGGGCCGCTCTTCCCCCAT GTGCCTGTCACGCTCTGGTGCAGTCAAAGGAACGCCTTCCCCTCAGTTGTTTCTAAG AGCAGAGTCTCCCGCTGCAATCTGGGTGGTAACTGCCAGCCTTGGAGGATCGTGGCC AACGTGGACCTGCCTACGGAGGGTGGGCTCTGACCCAAGTGGGGCCTCCTTGTCCA GGTCTCACTGCTTTGCACCGTGGTCAGAGGGACTGTCAGCTGAGCTTGAGCTCCCCT GGAGCCAGCAGGGCTGTGATGGGCGAGTCCCGGAGCCCCACCCAGACCTGAATGCT TCTGAGAGCAAAGGGAAGGACTGACGAGAGATGTATATTTAATTTTTTAACTGCTGC AAACATTGTACATCCAAATTAAAGGAAAAAAATGGAAACCATCAAAAAAAAAAAA AAAAAA
>SEQ ID NO: 2
TAAATGTGCCTGTTGAAGGGC
>SEQ ID NO: 3
AAGAGGTGCAGAGTCATCATC
>SEQ ID NO: 4
TTCTGGAGGACATCAAACCAT
>SEQ ID NO: 5
TGAACTGGCCCACTTCAATGT
>SEQ ID NO: 6
TTCCATTGGCAACTGGGCCAT
>SEQ ID NO: 7
TAAGCATGGAGCTAGCAGGCT
>SEQ ID NO: 8
TAGCGTTGAAGTACTGTCCCC
SEQ ID NO: 9
TTGAGGCAGCAGCGGCTGTGC
>SEQ ID NO: 10
TTCATCAGCTTTTCCAGGGTC
>SEQ ID NO: 11
TGGAATTCTCGGGTGCCAAGG
>SEQ ID NO: 12
CCTTGGCACCCGAGAATTCCA
>SEQ ID NO: 13
GUUCAGAGUUCUACAGUCCGACGAUC
>SEQ ID NO: 14
AATGATACGGCGACCACCGAGATCTACACGTTCAGAGTTCTACAGTCCGA
>SEQ ID NO: 15
CAAGCAGAAGACGGCATACGAGATNNNNNNGTGACTGGAGTTCCTTGGCACCCGAG AATTCCA
>SEQ ID NO: 16
LOCUS dsCB-GFP-mir155- 5483 bp DNA circular SYN 11-OCT-2012
DEFINITION Ligation of 6433 into dsCB-GFP-mirFlank-ployA* ACCESSION dsCB-GFP-mir155-
KEYWORDS . SOURCE Unknown. ORGANISM Unknown
Unclassified.
REFERENCE 1 (bases 1 to 5483) AUTHORS Self
JOURNAL Unpublished.
COMMENT SECID/File created by SciEd Central, Scientific & Educational Software
COMMENT SECNOTES|Vector molecule: dsCB-GFP-mirFlank-ployA* Fragment ends: BsmBI
Fragment size: 5419
Insert molecule: 6433
Fragment ends: Fragment size: 64
FEATURES Location/Qualifiers misc_feature 662..767
/gene="mutated ITR"
/SECDrawAs="Region" misc_feature 814..1093
/gene="CMV enhancer"
/SECDrawAs="Region" misc_feature 870..899
/gene="tentative for"
/SECDrawAs="Region" misc_feature 1100..1126
/gene="Probe"
/SECDrawAs="Region" misc_feature 1100..1369
/gene="B-Actin promoter"
/product="Chicken"
/SECDrawAs="Region" misc_feature complement (1168..1190)
/gene="rev"
/SECDrawAs="Region" misc_feature 1435..1465
/gene="SV40_late_19s_int"
/SECDrawAs="Region" misc_feature 1435..1531
/gene="modSV40_late_16s_int"
/SECDrawAs="Region" CDS 1605..2314
/gene="GFP'"
/SECDrawAs="Gene" misc_feature 2341..2357
/gene="'MCS"
/SECDrawAs="Region" misc_feature 2372..2395
/gene="5'miR Flank'"
/SECDrawAs="Region" misc_feature 2460..2504
/gene="3'miR Flank"
/SECDrawAs="Region" misc_feature 2573..2699
/gene="Poly A signal"
/product="Rabbit globin poly A"
/SECDrawAs="Region" misc_feature complement (2788..2917)
/gene="3' ITR"
/SECDrawAs="Region" CDS 3680..4537
ORIGIN
/gene="Amp(R)"
/SECDrawAs="Gene"
1 gcccaatacg caaaccgcct ctccccgcgc gttggccgat tcattaatgc agctgattct
61 aacgaggaaa gcacgttata cgtgctcgtc aaagcaacca tagtacgcgc cctgtagcgg
121 cgcattaagc gcggcgggtg tggtggttac gcgcagcgtg accgctacac ttgccagcgc
181 cctagcgccc gctcctttcg ctttcttccc ttcctttctc gccacgttcg ccggctttcc
241 ccgtcaagct ctaaatcggg ggctcccttt agggttccga tttagtgctt tacggcacct
301 cgaccccaaa aaacttgatt agggtgatgg ttcacgtagt gggccatcgc cctgatagac
361 ggtttttcgc cctttgacgt tggagtccac gttctttaat agtggactct tgttccaaac
421 tggaacaaca ctcaacccta tctcggtcta ttcttttgat ttataaggga ttttgccgat
481 ttcggcctat tggttaaaaa atgagctgat ttaacaaaaa tttaacgcga attttaacaa
541 aatattaacg cttacaattt aaatatttgc ttatacaatc ttcctgtttt tggggctttt
601 ctgattatca accggggtac atatgattga catgctagtt ttacgattac cgttcatcgc
661 cctgcgcgct cgctcgctca ctgaggccgc ccgggcaaag cccgggcgtc gggcgacctt
721 tggtcgcccg gcctcagtga gcgagcgagc gcgcagagag ggagtggaat tcacgcgtgg
781 atctgaattc aattcacgcg tggtacctct ggtcgttaca taacttacgg taaatggccc
841 gcctggctga ccgcccaacg acccccgccc attgacgtca ataatgacgt atgttcccat
901 agtaacgcca atagggactt tccattgacg tcaatgggtg gagtatttac ggtaaactgc
961 ccacttggca gtacatcaag tgtatcatat gccaagtacg ccccctattg acgtcaatga
1021 cggtaaatgg cccgcctggc attatgccca gtacatgacc ttatgggact ttcctacttg
1081 gcagtacatc tactcgaggc cacgttctgc ttcactctcc ccatctcccc cccctcccca
1141 cccccaattt tgtatttatt tattttttaa ttattttgtg cagcgatggg ggcggggggg
1201 gggggggggc gcgcgccagg cggggcgggg cggggcgagg ggcggggcgg ggcgaggcgg
1261 agaggtgcgg cggcagccaa tcagagcggc gcgctccgaa agtttccttt tatggcgagg
1321 cggcggcggc ggcggcccta taaaaagcga agcgcgcggc gggcgggagc gggatcagcc
1381 accgcggtgg cggcctagag tcgacgagga actgaaaaac cagaaagtta actggtaagt
1441 ttagtctttt tgtcttttat ttcaggtccc ggatccggtg gtggtgcaaa tcaaagaact
1501 gctcctcagt ggatgttgcc tttacttcta ggcctgtacg gaagtgttac ttctgctcta
1561 aaagctgcgg aattgtaccc gcggccgatc caccggtcgc caccatggtg agcaagggcg
1621 aggagctgtt caccggggtg gtgcccatcc tggtcgagct ggacggcgac gtaaacggcc
1681 acaagttcag cgtgtccggc gagggcgagg gcgatgccac ctacggcaag ctgaccctga
1741 agttcatctg caccaccggc aagctgcccg tgccctggcc caccctcgtg accaccctga
1801 cctacggcgt gcagtgcttc agccgctacc ccgaccacat gaagcagcac gacttcttca
1861 agtccgccat gcccgaaggc tacgtccagg agcgcaccat cttcttcaag gacgacggca
1921 actacaagac ccgcgccgag gtgaagttcg agggcgacac cctggtgaac cgcatcgagc
1981 tgaagggcat cgacttcaag gaggacggca acatcctggg gcacaagctg gagtacaact
2041 acaacagcca caacgtctat atcatggccg acaagcagaa gaacggcatc aaggtgaact
2101 tcaagatccg ccacaacatc gaggacggca gcgtgcagct cgccgaccac taccagcaga
2161 acacccccat cggcgacggc cccgtgctgc tgcccgacaa ccactacctg agcacccagt
2221 ccgccctgag caaagacccc aacgagaagc gcgatcacat ggtcctgctg gagttcgtga
2281 ccgccgccgg gatcactctc ggcatggacg agctgtacaa gtaaagcggc cctagcgttt
2341 ccggcgacgg tgctagcgtc gaccagtgga tcctggaggc ttgctgaagg ctgtatgctg
2401 taagcatgga gctagcaggc tgttttggcc actgactgac agcctgctct ccatgcttac
2461 aggacacaag gcctgttact agcactcaca tggaacaaat ggcccagatc tggccgcact
2521 cgaaaacggg ccctctagac tcgaggacgg ggtgaactac gcctgaggat ccgatctttt
2581 tccctctgcc aaaaattatg gggacatcat gaagcccctt gagcatctga cttctggcta
2641 ataaaggaaa tttattttca ttgcaatagt gtgttggaat tttttgtgtc tctcactcgg
2701 aagcaattcg ttgatctgaa tttcgaccac ccataatacc cattaccctg gtagataagt
2761 agcatggcgg gttaatcatt aactacaagg aacccctagt gatggagttg gccactccct
2821 ctctgcgcgc tcgctcgctc actgaggccg ggcgaccaaa ggtcgcccga cgcccgggct
2881 ttgcccgggc ggcctcagtg agcgagcgag cgcgcagcct taattaacct aattcactgg
2941 ccgtcgtttt acaacgtcgt gactgggaaa accctggcgt tacccaactt aatcgccttg
3001 cagcacatcc ccctttcgcc agctggcgta atagcgaaga ggcccgcacc gatcgccctt
3061 cccaacagtt gcgcagcctg aatggcgaat gggacgcgcc ctgtagcggc gcattaagcg
3121 cggcgggtgt ggtggttacg cgcagcgtga ccgctacact tgccagcgcc ctagcgcccg
3181 ctcctttcgc tttcttccct tcctttctcg ccacgttcgc cggctttccc cgtcaagctc
3241 taaatcgggg gctcccttta gggttccgat ttagtgcttt acggcacctc gaccccaaaa
3301 aacttgatta gggtgatggt tcacgtagtg ggccatcgcc ctgatagacg gtttttcgcc
3361 ctttgacgtt ggagtccacg ttctttaata gtggactctt gttccaaact ggaacaacac
3421 tcaaccctat ctcggtctat tcttttgatt tataagggat tttgccgatt tcggcctatt
3481 ggttaaaaaa tgagctgatt taacaaaaat ttaacgcgaa ttttaacaaa atattaacgc
3541 ttacaattta ggtggcactt ttcggggaaa tgtgcgcgga acccctattt gtttattttt
3601 ctaaatacat tcaaatatgt atccgctcat gagacaataa ccctgataaa tgcttcaata
3661 atattgaaaa aggaagagta tgagtattca acatttccgt gtcgccctta ttcccttttt
3721 tgcggcattt tgccttcctg tttttgctca cccagaaacg ctggtgaaag taaaagatgc
3781 tgaagatcag ttgggtgcac gagtgggtta catcgaactg gatctcaaca gcggtaagat
3841 ccttgagagt tttcgccccg aagaacgttt tccaatgatg agcactttta aagttctgct
3901 atgtggcgcg gtattatccc gtattgacgc cgggcaagag caactcggtc gccgcataca
3961 ctattctcag aatgacttgg ttgagtactc accagtcaca gaaaagcatc ttacggatgg
4021 catgacagta agagaattat gcagtgctgc cataaccatg agtgataaca ctgcggccaa
4081 cttacttctg acaacgatcg gaggaccgaa ggagctaacc gcttttttgc acaacatggg
4141 ggatcatgta actcgccttg atcgttggga accggagctg aatgaagcca taccaaacga
4201 cgagcgtgac accacgatgc ctgtagcaat ggcaacaacg ttgcgcaaac tattaactgg
4261 cgaactactt actctagctt cccggcaaca attaatagac tggatggagg cggataaagt
4321 tgcaggacca cttctgcgct cggcccttcc ggctggctgg tttattgctg ataaatctgg
4381 agccggtgag cgtgggtctc gcggtatcat tgcagcactg gggccagatg gtaagccctc
4441 ccgtatcgta gttatctaca cgacggggag tcaggcaact atggatgaac gaaatagaca
4501 gatcgctgag ataggtgcct cactgattaa gcattggtaa ctgtcagacc aagtttactc
4561 atatatactt tagattgatt taaaacttca tttttaattt aaaaggatct aggtgaagat
4621 cctttttgat aatctcatga ccaaaatccc ttaacgtgag ttttcgttcc actgagcgtc
4681 agaccccgta gaaaagatca aaggatcttc ttgagatcct ttttttctgc gcgtaatctg
4741 ctgcttgcaa acaaaaaaac caccgctacc agcggtggtt tgtttgccgg atcaagagct
4801 accaactctt tttccgaagg taactggctt cagcagagcg cagataccaa atactgttct
4861 tctagtgtag ccgtagttag gccaccactt caagaactct gtagcaccgc ctacatacct
4921 cgctctgcta atcctgttac cagtggctgc tgccagtggc gataagtcgt gtcttaccgg
4981 gttggactca agacgatagt taccggataa ggcgcagcgg tcgggctgaa cggggggttc
5041 gtgcacacag cccagcttgg agcgaacgac ctacaccgaa ctgagatacc tacagcgtga
5101 gctatgagaa agcgccacgc ttcccgaagg gagaaaggcg gacaggtatc cggtaagcgg
5161 cagggtcgga acaggagagc gcacgaggga gcttccaggg ggaaacgcct ggtatcttta
5221 tagtcctgtc gggtttcgcc acctctgact tgagcgtcga tttttgtgat gctcgtcagg
5281 ggggcggagc ctatggaaaa acgccagcaa cgcggccttt ttacggttcc tggccttttg
5341 ctggcctttt gctcacatgt tctttcctgc gttatcccct gattctgtgg ataaccgtat
5401 taccgccttt gagtgagctg ataccgctcg ccgcagccga acgaccgagc gcagcgagtc
5461 agtgagcgag gaagcggaag agc
>SEQ ID NO: 17
//LOCUS pdsU6-Mir-htt-64 5686 bp DNA circular SYN 17-SEP-2013
DEFINITION Ligation of 6433 into pU6-miRNAFlank-GFP* ACCESSION pdsU6-Mir-htt-64
KEYWORDS . SOURCE Unknown. ORGANISM Unknown
Unclassified.
REFERENCE 1 (bases 1 to 5686)
AUTHORS Self
JOURNAL Unpublished.
COMMENT SECID/File created by SciEd Central, Scientific & Educational Software
COMMENT SECNOTES|Vector molecule: pU6-miRNAFlank-GFP* Fragment ends: BsmBI
Fragment size: 5622
Insert molecule: 6433
Fragment ends: Fragment size: 64
FEATURES Location/Qualifiers misc_feature 662..767
/gene="mutated ITR"
/SECDrawAs="Region" misc_feature 777..1041
/gene="U6 promoter"
/SECDrawAs="Region" misc_signal 1041..1041
/gene="Pol III Start"
/product="Transcriptional Start "
/SECDrawAs="Label" CDS 1042..1065
/gene="5' miR Flank'"
/SECDrawAs="Gene" CDS 1130..1175
/gene="miR 3' Flank"
/SECDrawAs="Gene" misc_signal 1176..1181
/gene="Pol III term"
/product="pol III terminator"
/SECDrawAs="Label" misc_feature 1199..1478
/gene="CMV enhancer"
/SECDrawAs="Region" misc_feature 1255..1284
/gene="tentative for"
/SECDrawAs="Region" misc_feature 1485..1754
/gene="B-Actin promoter"
/product="Chicken"
/SECDrawAs="Region" misc_feature 1485..1511
/gene="Probe"
/SECDrawAs="Region" misc_feature complement (1553..1575)
/gene="rev"
/SECDrawAs="Region" misc_feature 1820..1916
/gene="modSV40_late_16s_int"
/SECDrawAs="Region" misc_feature 1820..1850
/gene="SV40_late_19s_int"
/SECDrawAs="Region" CDS 1990..2699
/gene="GFP'"
/SECDrawAs="Gene" misc_feature 2726..2737
/gene="'MCS'"
/SECDrawAs="Region" misc_feature 2776..2902
/gene="Poly A signal"
/product="Rabbit globin poly A"
/SECDrawAs="Region" misc_feature complement (2991..3120)
/gene="3' ITR"
/SECDrawAs="Region" CDS 3883..4740
/gene="Amp(R)"
/SECDrawAs="Gene"
ORIGIN
1 gcccaatacg caaaccgcct ctccccgcgc gttggccgat tcattaatgc agctgattct
61 aacgaggaaa gcacgttata cgtgctcgtc aaagcaacca tagtacgcgc cctgtagcgg
121 cgcattaagc gcggcgggtg tggtggttac gcgcagcgtg accgctacac ttgccagcgc
181 cctagcgccc gctcctttcg ctttcttccc ttcctttctc gccacgttcg ccggctttcc
241 ccgtcaagct ctaaatcggg ggctcccttt agggttccga tttagtgctt tacggcacct
301 cgaccccaaa aaacttgatt agggtgatgg ttcacgtagt gggccatcgc cctgatagac
361 ggtttttcgc cctttgacgt tggagtccac gttctttaat agtggactct tgttccaaac
421 tggaacaaca ctcaacccta tctcggtcta ttcttttgat ttataaggga ttttgccgat
481 ttcggcctat tggttaaaaa atgagctgat ttaacaaaaa tttaacgcga attttaacaa
541 aatattaacg cttacaattt aaatatttgc ttatacaatc ttcctgtttt tggggctttt
601 ctgattatca accggggtac atatgattga catgctagtt ttacgattac cgttcatcgc
661 cctgcgcgct cgctcgctca ctgaggccgc ccgggcaaag cccgggcgtc gggcgacctt
721 tggtcgcccg gcctcagtga gcgagcgagc gcgcagagag ggagtggaat tctataaagg
781 tcgggcagga agagggccta tttcccatga ttccttcata tttgcatata cgatacaagg
841 ctgttagaga gataattaga attaatttga ctgtaaacac aaagatatta gtacaaaata
901 cgtgacgtag aaagtaataa tttcttgggt agtttgcagt tttaaaatta tgttttaaaa
961 tggactatca tatgcttacc gtaacttgaa agtatttcga tttcttggct ttatatatct
1021 tgtggaaagg acgaaacacc gcctggaggc ttgctgaagg ctgtatgctg taagcatgga
1081 gctagcaggc tgttttggcc actgactgac agcctgctct ccatgcttac aggacacaag
1141 gcctgttact agcactcaca tggaacaaat ggcccttttt tctagtggta cctctggtcg
1201 ttacataact tacggtaaat ggcccgcctg gctgaccgcc caacgacccc cgcccattga
1261 cgtcaataat gacgtatgtt cccatagtaa cgccaatagg gactttccat tgacgtcaat
1321 gggtggagta tttacggtaa actgcccact tggcagtaca tcaagtgtat catatgccaa
1381 gtacgccccc tattgacgtc aatgacggta aatggcccgc ctggcattat gcccagtaca
1441 tgaccttatg ggactttcct acttggcagt acatctactc gaggccacgt tctgcttcac
1501 tctccccatc tcccccccct ccccaccccc aattttgtat ttatttattt tttaattatt
1561 ttgtgcagcg atgggggcgg gggggggggg ggggcgcgcg ccaggcgggg cggggcgggg
1621 cgaggggcgg ggcggggcga ggcggagagg tgcggcggca gccaatcaga gcggcgcgct
1681 ccgaaagttt ccttttatgg cgaggcggcg gcggcggcgg ccctataaaa agcgaagcgc
1741 gcggcgggcg ggagcgggat cagccaccgc ggtggcggcc tagagtcgac gaggaactga
1801 aaaaccagaa agttaactgg taagtttagt ctttttgtct tttatttcag gtcccggatc
1861 cggtggtggt gcaaatcaaa gaactgctcc tcagtggatg ttgcctttac ttctaggcct
1921 gtacggaagt gttacttctg ctctaaaagc tgcggaattg tacccgcggc cgatccaccg
1981 gtcgccacca tggtgagcaa gggcgaggag ctgttcaccg gggtggtgcc catcctggtc
2041 gagctggacg gcgacgtaaa cggccacaag ttcagcgtgt ccggcgaggg cgagggcgat
2101 gccacctacg gcaagctgac cctgaagttc atctgcacca ccggcaagct gcccgtgccc
2161 tggcccaccc tcgtgaccac cctgacctac ggcgtgcagt gcttcagccg ctaccccgac
2221 cacatgaagc agcacgactt cttcaagtcc gccatgcccg aaggctacgt ccaggagcgc
2281 accatcttct tcaaggacga cggcaactac aagacccgcg ccgaggtgaa gttcgagggc
2341 gacaccctgg tgaaccgcat cgagctgaag ggcatcgact tcaaggagga cggcaacatc
2401 ctggggcaca agctggagta caactacaac agccacaacg tctatatcat ggccgacaag
2461 cagaagaacg gcatcaaggt gaacttcaag atccgccaca acatcgagga cggcagcgtg
2521 cagctcgccg accactacca gcagaacacc cccatcggcg acggccccgt gctgctgccc
2581 gacaaccact acctgagcac ccagtccgcc ctgagcaaag accccaacga gaagcgcgat
2641 cacatggtcc tgctggagtt cgtgaccgcc gccgggatca ctctcggcat ggacgagctg
2701 tacaagtaaa gcggccctag cgtttccggc gacggtgcta gactcgagga cggggtgaac
2761 tacgcctgag gatccgatct ttttccctct gccaaaaatt atggggacat catgaagccc
2821 cttgagcatc tgacttctgg ctaataaagg aaatttattt tcattgcaat agtgtgttgg
2881 aattttttgt gtctctcact cggaagcaat tcgttgatct gaatttcgac cacccataat
2941 acccattacc ctggtagata agtagcatgg cgggttaatc attaactaca aggaacccct
3001 agtgatggag ttggccactc cctctctgcg cgctcgctcg ctcactgagg ccgggcgacc
3061 aaaggtcgcc cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc gagcgcgcag
3121 ccttaattaa cctaattcac tggccgtcgt tttacaacgt cgtgactggg aaaaccctgg
3181 cgttacccaa cttaatcgcc ttgcagcaca tccccctttc gccagctggc gtaatagcga
3241 agaggcccgc accgatcgcc cttcccaaca gttgcgcagc ctgaatggcg aatgggacgc
3301 gccctgtagc ggcgcattaa gcgcggcggg tgtggtggtt acgcgcagcg tgaccgctac
3361 acttgccagc gccctagcgc ccgctccttt cgctttcttc ccttcctttc tcgccacgtt
3421 cgccggcttt ccccgtcaag ctctaaatcg ggggctccct ttagggttcc gatttagtgc
3481 tttacggcac ctcgacccca aaaaacttga ttagggtgat ggttcacgta gtgggccatc
3541 gccctgatag acggtttttc gccctttgac gttggagtcc acgttcttta atagtggact
3601 cttgttccaa actggaacaa cactcaaccc tatctcggtc tattcttttg atttataagg
3661 gattttgccg atttcggcct attggttaaa aaatgagctg atttaacaaa aatttaacgc
3721 gaattttaac aaaatattaa cgcttacaat ttaggtggca cttttcgggg aaatgtgcgc
3781 ggaaccccta tttgtttatt tttctaaata cattcaaata tgtatccgct catgagacaa
3841 taaccctgat aaatgcttca ataatattga aaaaggaaga gtatgagtat tcaacatttc
3901 cgtgtcgccc ttattccctt ttttgcggca ttttgccttc ctgtttttgc tcacccagaa
3961 acgctggtga aagtaaaaga tgctgaagat cagttgggtg cacgagtggg ttacatcgaa
4021 ctggatctca acagcggtaa gatccttgag agttttcgcc ccgaagaacg ttttccaatg
4081 atgagcactt ttaaagttct gctatgtggc gcggtattat cccgtattga cgccgggcaa
4141 gagcaactcg gtcgccgcat acactattct cagaatgact tggttgagta ctcaccagtc
4201 acagaaaagc atcttacgga tggcatgaca gtaagagaat tatgcagtgc tgccataacc
4261 atgagtgata acactgcggc caacttactt ctgacaacga tcggaggacc gaaggagcta
4321 accgcttttt tgcacaacat gggggatcat gtaactcgcc ttgatcgttg ggaaccggag
4381 ctgaatgaag ccataccaaa cgacgagcgt gacaccacga tgcctgtagc aatggcaaca
4441 acgttgcgca aactattaac tggcgaacta cttactctag cttcccggca acaattaata
4501 gactggatgg aggcggataa agttgcagga ccacttctgc gctcggccct tccggctggc
4561 tggtttattg ctgataaatc tggagccggt gagcgtgggt ctcgcggtat cattgcagca
4621 ctggggccag atggtaagcc ctcccgtatc gtagttatct acacgacggg gagtcaggca
4681 actatggatg aacgaaatag acagatcgct gagataggtg cctcactgat taagcattgg
4741 taactgtcag accaagttta ctcatatata ctttagattg atttaaaact tcatttttaa
4801 tttaaaagga tctaggtgaa gatccttttt gataatctca tgaccaaaat cccttaacgt
4861 gagttttcgt tccactgagc gtcagacccc gtagaaaaga tcaaaggatc ttcttgagat
4921 cctttttttc tgcgcgtaat ctgctgcttg caaacaaaaa aaccaccgct accagcggtg
4981 gtttgtttgc cggatcaaga gctaccaact ctttttccga aggtaactgg cttcagcaga
5041 gcgcagatac caaatactgt tcttctagtg tagccgtagt taggccacca cttcaagaac
5101 tctgtagcac cgcctacata cctcgctctg ctaatcctgt taccagtggc tgctgccagt
5161 ggcgataagt cgtgtcttac cgggttggac tcaagacgat agttaccgga taaggcgcag
5221 cggtcgggct gaacgggggg ttcgtgcaca cagcccagct tggagcgaac gacctacacc
5281 gaactgagat acctacagcg tgagctatga gaaagcgcca cgcttcccga agggagaaag
5341 gcggacaggt atccggtaag cggcagggtc ggaacaggag agcgcacgag ggagcttcca
5401 gggggaaacg cctggtatct ttatagtcct gtcgggtttc gccacctctg acttgagcgt
5461 cgatttttgt gatgctcgtc aggggggcgg agcctatgga aaaacgccag caacgcggcc
5521 tttttacggt tcctggcctt ttgctggcct tttgctcaca tgttctttcc tgcgttatcc
5581 cctgattctg tggataaccg tattaccgcc tttgagtgag ctgataccgc tcgccgcagc
5641 cgaacgaccg agcgcagcga gtcagtgagc gaggaagcgg aagagc
>SEQ ID NO: 18
LOCUS pCVscAsaq+-mir64 5155 bp DNA circular SYN 17-SEP-2013
DEFINITION Ligation of 6433 into pCVscAsaq+-mirFlank* ACCESSION pCVscAsaq+-mir64
KEYWORDS . SOURCE Unknown. ORGANISM Unknown
Unclassified.
REFERENCE 1 (bases 1 to 5155) AUTHORS Self
JOURNAL Unpublished.
COMMENT SECID/File created by SciEd Central, Scientific & Educational Software
COMMENT SECNOTES|Vector molecule: pCVscAsaq+-mirFlank* Fragment ends: BsmBI
Fragment size: 5090
Insert molecule: 6433
Fragment ends: Fragment size: 64
FEATURES Location/Qualifiers misc_feature 1..105
/gene="ITR"
/SECDrawAs="Region" misc_feature 182..449
/gene="CMV"
/product="CMV Enhancer"
/SECDrawAs="Region" CDS 448..753
/gene="CB promoter"
/product="Promoter Eukaryotic"
/SECDrawAs="Gene" CDS 754..1819
/gene="Intron"
/product="Intron"
/SECDrawAs="Gene" CDS 1820..1839
/gene="MCS"
/SECDrawAs="Gene" misc_feature 1843..1847
/gene="''MCS"
/SECDrawAs="Region" misc_feature 1862..1885
/gene="5'miR Flank'"
/SECDrawAs="Region" misc_feature 1950..1994
/gene="3'miR Flank"
/SECDrawAs="Region" CDS 2002..2128
/gene="RBG pA"
/product="PolyA Signal"
/SECDrawAs="Gene" misc_feature complement (2002..2128)
/gene="RBG\pA"
/SECDrawAs="Info only" misc_feature 2139..2281
/gene="3'ITR"
/SECDrawAs="Region" CDS 2317..2509
/gene="lacZ"
/SECDrawAs="Gene" CDS 2510..2965
/gene="f1 ori"
/SECDrawAs="Gene" misc_feature 3097..3957
/gene="bla-AmpR"
/SECDrawAs="Region" misc_feature 4117..4731
/gene="rep-pMB1"
/SECDrawAs="Region"
ORIGIN
1 ctgcgcgctc gctcgctcac tgaggccgcc cgggcaaagc ccgggcgtcg ggcgaccttt
61 ggtcgcccgg cctcagtgag cgagcgagcg cgcagagagg gagtgtagcc atgctctagg
121 aagatcaatt caattcacgc gtcgacattg attattgact agctctggtc gttacataac
181 ttacggtaaa tggcccgcct ggctgaccgc ccaacgaccc ccgcccattg acgtcaataa
241 tgacgtatgt tcccatagta acgccaatag ggactttcca ttgacgtcaa tgggtggagt
301 atttacggta aactgcccac ttggcagtac atcaagtgta tcatatgcca agtccgcccc
361 ctattgacgt caatgacggt aaatggcccg cctggcatta tgcccagtac atgaccttac
421 gggactttcc tacttggcag tacatctacg tattagtcat cgctattacc atggtcgagg
481 tgagccccac gttctgcttc actctcccca tctccccccc ctccccaccc ccaattttgt
541 atttatttat tttttaatta ttttgtgcag cgatgggggc gggggggggg ggggggcgcg
601 cgccaggcgg ggcggggcgg ggcgaggggc ggggcggggc gaggcggaga ggtgcggcgg
661 cagccaatca gagcggcgcg ctccgaaagt ttccttttat ggcgaggcgg cggcggcggc
721 ggccctataa aaagcgaagc gcgcggcggg cgggagtcgc tgcgcgctgc cttcgccccg
781 tgccccgctc cgccgccgcc tcgcgccgcc cgccccggct ctgactgacc gcgttactcc
841 cacaggtgag cgggcgggac ggcccttctc ctccgggctg taattagcgc ttggtttaat
901 gacggcttgt ttcttttctg tggctgcgtg aaagccttga ggggctccgg gagggccctt
961 tgtgcggggg ggagcggctc ggggggtgcg tgcgtgtgtg tgtgcgtggg gagcgccgcg
1021 tgcggctccg cgctgcccgg cggctgtgag cgctgcgggc gcggcgcggg gctttgtgcg
1081 ctccgcagtg tgcgcgaggg gagcgcggcc gggggcggtg ccccgcggtg cggggggggc
1141 tgcgagggga acaaaggctg cgtgcggggt gtgtgcgtgg gggggtgagc agggggtgtg
1201 ggcgcgtcgg tcgggctgca accccccctg cacccccctc cccgagttgc tgagcacggc
1261 ccggcttcgg gtgcggggct ccgtacgggg cgtggcgcgg ggctcgccgt gccgggcggg
1321 gggtggcggc aggtgggggt gccgggcggg gcggggccgc ctcgggccgg ggagggctcg
1381 ggggaggggc gcggcggccc ccggagcgcc ggcggctgtc gaggcgcggc gagccgcagc
1441 cattgccttt tatggtaatc gtgcgagagg gcgcagggac ttcctttgtc ccaaatctgt
1501 gcggagccga aatctgggag gcgccgccgc accccctcta gcgggcgcgg ggcgaagcgg
1561 tgcggcgccg gcaggaagga aatgggcggg gagggccttc gtgcgtcgcc gcgccgccgt
1621 ccccttctcc ctctccagcc tcggggctgt ccgcgggggg acggctgcct tcggggggga
1681 cggggcaggg cggggttcgg cttctggcgt gtgaccggcg gctctagagc ctctgctaac
1741 catgttcatg ccttcttctt tttcctacag ctcctgggca acgtgctggt tattgtgctg
1801 tctcatcatt ttggcaaaga attcatcgat accgtcgacg atctagcgtc gaccagtgga
1861 tcctggaggc ttgctgaagg ctgtatgctg taagcatgga gctagcaggc tgttttggcc
1921 actgactgac agcctgctct ccatgcttac aggacacaag gcctgttact agcactcaca
1981 tggaacaaat ggcccagatc cgatcttttt ccctctgcca aaaattatgg ggacatcatg
2041 aagccccttg agcatctgac ttctggctaa taaaggaaat ttattttcat tgcaatagtg
2101 tgttggaatt ttttgtgtct ctcactcgat cagatctgag gaacccctag tgatggagtt
2161 ggccactccc tctctgcgcg ctcgctcgct cactgaggcc gcccgggcaa agcccgggcg
2221 tcgggcgacc tttggtcgcc cggcctcagt gagcgagcga gcgcgcagag agggagtggc
2281 cccccccccc ccccccccct gcattctaga gagctccaat tcgccctata gtgagtcgta
2341 ttacgcgcgc tcactggccg tcgttttaca acgtcgtgac tgggaaaacc ctggcgttac
2401 ccaacttaat cgccttgcag cacatccccc tttcgccagc tggcgtaata gcgaagaggc
2461 ccgcaccgat cgcccttccc aacagttgcg cagcctgaat ggcgaatgga aattgtaagc
2521 gttaatattt tgttaaaatt cgcgttaaat ttttgttaaa tcagctcatt ttttaaccaa
2581 taggccgaaa tcggcaaaat cccttataaa tcaaaagaat agaccgagat agggttgagt
2641 gttgttccag tttggaacaa gagtccacta ttaaagaacg tggactccaa cgtcaaaggg
2701 cgaaaaaccg tctatcaggg cgatggccca ctacgtgaac catcacccta atcaagtttt
2761 ttggggtcga ggtgccgtaa agcactaaat cggaacccta aagggagccc ccgatttaga
2821 gcttgacggg gaaagccggc gaacgtggcg agaaaggaag ggaagaaagc gaaaggagcg
2881 ggcgctaggg cgctggcaag tgtagcggtc acgctgcgcg taaccaccac acccgccgcg
2941 cttaatgcgc cgctacaggg cgcgtcaggt ggcacttttc ggggaaatgt gcgcggaacc
3001 cctatttgtt tatttttcta aatacattca aatatgtatc cgctcatgag acaataaccc
3061 tgataaatgc ttcaataata ttgaaaaagg aagagtatga gtattcaaca tttccgtgtc
3121 gcccttattc ccttttttgc ggcattttgc cttcctgttt ttgctcaccc agaaacgctg
3181 gtgaaagtaa aagatgctga agatcagttg ggtgcacgag tgggttacat cgaactggat
3241 ctcaacagcg gtaagatcct tgagagtttt cgccccgaag aacgttttcc aatgatgagc
3301 acttttaaag ttctgctatg tggcgcggta ttatcccgta ttgacgccgg gcaagagcaa
3361 ctcggtcgcc gcatacacta ttctcagaat gacttggttg agtactcacc agtcacagaa
3421 aagcatctta cggatggcat gacagtaaga gaattatgca gtgctgccat aaccatgagt
3481 gataacactg cggccaactt acttctgaca acgatcggag gaccgaagga gctaaccgct
3541 tttttgcaca acatggggga tcatgtaact cgccttgatc gttgggaacc ggagctgaat
3601 gaagccatac caaacgacga gcgtgacacc acgatgcctg tagcaatggc aacaacgttg
3661 cgcaaactat taactggcga actacttact ctagcttccc ggcaacaatt aatagactgg
3721 atggaggcgg ataaagttgc aggaccactt ctgcgctcgg cccttccggc tggctggttt
3781 attgctgata aatctggagc cggtgagcgt gggtctcgcg gtatcattgc agcactgggg
3841 ccagatggta agccctcccg tatcgtagtt atctacacga cggggagtca ggcaactatg
3901 gatgaacgaa atagacagat cgctgagata ggtgcctcac tgattaagca ttggtaactg
3961 tcagaccaag tttactcata tatactttag attgatttaa aacttcattt ttaatttaaa
4021 aggatctagg tgaagatcct ttttgataat ctcatgacca aaatccctta acgtgagttt
4081 tcgttccact gagcgtcaga ccccgtagaa aagatcaaag gatcttcttg agatcctttt
4141 tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac cgctaccagc ggtggtttgt
4201 ttgccggatc aagagctacc aactcttttt ccgaaggtaa ctggcttcag cagagcgcag
4261 ataccaaata ctgtccttct agtgtagccg tagttaggcc accacttcaa gaactctgta
4321 gcaccgccta catacctcgc tctgctaatc ctgttaccag tggctgctgc cagtggcgat
4381 aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac cggataaggc gcagcggtcg
4441 ggctgaacgg ggggttcgtg cacacagccc agcttggagc gaacgaccta caccgaactg
4501 agatacctac agcgtgagct atgagaaagc gccacgcttc ccgaagggag aaaggcggac
4561 aggtatccgg taagcggcag ggtcggaaca ggagagcgca cgagggagct tccaggggga
4621 aacgcctggt atctttatag tcctgtcggg tttcgccacc tctgacttga gcgtcgattt
4681 ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg ccagcaacgc ggccttttta
4741 cggttcctgg ccttttgctg gccttttgct cacatgttct ttcctgcgtt atcccctgat
4801 tctgtggata accgtattac cgcctttgag tgagctgata ccgctcgccg cagccgaacg
4861 accgagcgca gcgagtcagt gagcgaggaa gcggaagagc gcccaatacg caaaccgcct
4921 ctccccgcgc gttggccgat tcattaatgc agctggcacg acaggtttcc cgactggaaa
4981 gcgggcagtg agcgcaacgc aattaatgtg agttagctca ctcattaggc accccaggct
5041 ttacacttta tgcttccggc tcgtatgttg tgtggaattg tgagcggata acaatttcac
5101 acaggaaaca gctatgacca tgattacgcc agatttaatt aaggccttaa ttagg
>SEQ ID NO: 19
LOCUS U6-mir6433-BGHpA 5223 bp DNA circular SYN 12-SEP-2013
DEFINITION Ligation of dsAAV CB MCS** into U6-MiRBA-6433-GFP** ACCESSION U6-mir6433-BGHpA
KEYWORDS . SOURCE Unknown. ORGANISM Unknown
Unclassified.
REFERENCE 1 (bases 1 to 5223) AUTHORS Self
JOURNAL Unpublished.
COMMENT SECID/File created by SciEd Central, Scientific & Educational Software
COMMENT SECNOTES|Vector molecule: U6-MiRBA-6433-GFP** Fragment ends: blunt and EagI
Fragment size: 4954
Insert molecule: dsAAV CB MCS** Fragment ends: EagI and blunt Fragment size: 269
FEATURES Location/Qualifiers misc_feature 662..767
/gene="mutated ITR"
/SECDrawAs="Region" misc_feature 777..1041
/gene="U6 promoter"
/SECDrawAs="Region" misc_signal 1041..1041
/gene="Pol III Start"
/product="Transcriptional Start "
/SECDrawAs="Label"
CDS 1042..1065
/gene="5' miR Flank'"
/SECDrawAs="Gene" CDS 1130..1175
/gene="miR 3' Flank"
/SECDrawAs="Gene" misc_signal 1176..1181
/gene="Pol III term"
/product="pol III terminator"
/SECDrawAs="Label" misc_feature 1199..1478
/gene="CMV enhancer"
/SECDrawAs="Region" misc_feature 1255..1284
/gene="tentative for"
/SECDrawAs="Region" misc_feature 1485..1511
/gene="Probe"
/SECDrawAs="Region" misc_feature 1485..1754
/gene="B-Actin promoter"
/product="Chicken"
/SECDrawAs="Region" misc_feature complement (1553..1575)
/gene="rev"
/SECDrawAs="Region" misc_feature 1820..1850
/gene="SV40_late_19s_int"
/SECDrawAs="Region" misc_feature 1820..1916
/gene="modSV40_late_16s_int"
/SECDrawAs="Region" misc_feature 2034..2230
/gene="BGHpA"
/SECDrawAs="Region"
misc_feature 2263..2274
/gene="'MCS'"
/SECDrawAs="Region" misc_feature 2313..2439
/gene="Poly A signal"
/product="Rabbit globin poly A"
/SECDrawAs="Region" misc_feature complement (2528..2657)
/gene="3' ITR"
/SECDrawAs="Region" CDS 3420..4277
/gene="Amp(R)"
/SECDrawAs="Gene"
ORIGIN
1 gcccaatacg caaaccgcct ctccccgcgc gttggccgat tcattaatgc agctgattct
61 aacgaggaaa gcacgttata cgtgctcgtc aaagcaacca tagtacgcgc cctgtagcgg
121 cgcattaagc gcggcgggtg tggtggttac gcgcagcgtg accgctacac ttgccagcgc
181 cctagcgccc gctcctttcg ctttcttccc ttcctttctc gccacgttcg ccggctttcc
241 ccgtcaagct ctaaatcggg ggctcccttt agggttccga tttagtgctt tacggcacct
301 cgaccccaaa aaacttgatt agggtgatgg ttcacgtagt gggccatcgc cctgatagac
361 ggtttttcgc cctttgacgt tggagtccac gttctttaat agtggactct tgttccaaac
421 tggaacaaca ctcaacccta tctcggtcta ttcttttgat ttataaggga ttttgccgat
481 ttcggcctat tggttaaaaa atgagctgat ttaacaaaaa tttaacgcga attttaacaa
541 aatattaacg cttacaattt aaatatttgc ttatacaatc ttcctgtttt tggggctttt
601 ctgattatca accggggtac atatgattga catgctagtt ttacgattac cgttcatcgc
661 cctgcgcgct cgctcgctca ctgaggccgc ccgggcaaag cccgggcgtc gggcgacctt
721 tggtcgcccg gcctcagtga gcgagcgagc gcgcagagag ggagtggaat tctataaagg
781 tcgggcagga agagggccta tttcccatga ttccttcata tttgcatata cgatacaagg
841 ctgttagaga gataattaga attaatttga ctgtaaacac aaagatatta gtacaaaata
901 cgtgacgtag aaagtaataa tttcttgggt agtttgcagt tttaaaatta tgttttaaaa
961 tggactatca tatgcttacc gtaacttgaa agtatttcga tttcttggct ttatatatct
1021 tgtggaaagg acgaaacacc gcctggaggc ttgctgaagg ctgtatgctg taagcatgga
1081 gctagcaggc tgttttggcc actgactgac agcctgctct ccatgcttac aggacacaag
1141 gcctgttact agcactcaca tggaacaaat ggcccttttt tctagtggta cctctggtcg
1201 ttacataact tacggtaaat ggcccgcctg gctgaccgcc caacgacccc cgcccattga
1261 cgtcaataat gacgtatgtt cccatagtaa cgccaatagg gactttccat tgacgtcaat
1321 gggtggagta tttacggtaa actgcccact tggcagtaca tcaagtgtat catatgccaa
1381 gtacgccccc tattgacgtc aatgacggta aatggcccgc ctggcattat gcccagtaca
1441 tgaccttatg ggactttcct acttggcagt acatctactc gaggccacgt tctgcttcac
1501 tctccccatc tcccccccct ccccaccccc aattttgtat ttatttattt tttaattatt
1561 ttgtgcagcg atgggggcgg gggggggggg ggggcgcgcg ccaggcgggg cggggcgggg
1621 cgaggggcgg ggcggggcga ggcggagagg tgcggcggca gccaatcaga gcggcgcgct
1681 ccgaaagttt ccttttatgg cgaggcggcg gcggcggcgg ccctataaaa agcgaagcgc
1741 gcggcgggcg ggagcgggat cagccaccgc ggtggcggcc tagagtcgac gaggaactga
1801 aaaaccagaa agttaactgg taagtttagt ctttttgtct tttatttcag gtcccggatc
1861 cggtggtggt gcaaatcaaa gaactgctcc tcagtggatg ttgcctttac ttctaggcct
1921 gtacggaagt gttacttctg ctctaaaagc tgcggaattg tacccgcggc cgcgtttaaa
1981 ccctgcaggt ctagaaagct tatcgatacc gtcgactaga gctcgctgat cagcctcgac
2041 tgtgccttct agttgccagc catctgttgt ttgcccctcc cccgtgcctt ccttgaccct
2101 ggaaggtgcc actcccactg tcctttccta ataaaatgag gaaattgcat cgcattgtct
2161 gagtaggtgt cattctattc tggggggtgg ggtggggcag gacagcaagg gggaggattg
2221 ggaagacaat agcagggtac aagtaaagcg gccctagcgt ttccggcgac ggtgctagac
2281 tcgaggacgg ggtgaactac gcctgaggat ccgatctttt tccctctgcc aaaaattatg
2341 gggacatcat gaagcccctt gagcatctga cttctggcta ataaaggaaa tttattttca
2401 ttgcaatagt gtgttggaat tttttgtgtc tctcactcgg aagcaattcg ttgatctgaa
2461 tttcgaccac ccataatacc cattaccctg gtagataagt agcatggcgg gttaatcatt
2521 aactacaagg aacccctagt gatggagttg gccactccct ctctgcgcgc tcgctcgctc
2581 actgaggccg ggcgaccaaa ggtcgcccga cgcccgggct ttgcccgggc ggcctcagtg
2641 agcgagcgag cgcgcagcct taattaacct aattcactgg ccgtcgtttt acaacgtcgt
2701 gactgggaaa accctggcgt tacccaactt aatcgccttg cagcacatcc ccctttcgcc
2761 agctggcgta atagcgaaga ggcccgcacc gatcgccctt cccaacagtt gcgcagcctg
2821 aatggcgaat gggacgcgcc ctgtagcggc gcattaagcg cggcgggtgt ggtggttacg
2881 cgcagcgtga ccgctacact tgccagcgcc ctagcgcccg ctcctttcgc tttcttccct
2941 tcctttctcg ccacgttcgc cggctttccc cgtcaagctc taaatcgggg gctcccttta
3001 gggttccgat ttagtgcttt acggcacctc gaccccaaaa aacttgatta gggtgatggt
3061 tcacgtagtg ggccatcgcc ctgatagacg gtttttcgcc ctttgacgtt ggagtccacg
3121 ttctttaata gtggactctt gttccaaact ggaacaacac tcaaccctat ctcggtctat
3181 tcttttgatt tataagggat tttgccgatt tcggcctatt ggttaaaaaa tgagctgatt
3241 taacaaaaat ttaacgcgaa ttttaacaaa atattaacgc ttacaattta ggtggcactt
3301 ttcggggaaa tgtgcgcgga acccctattt gtttattttt ctaaatacat tcaaatatgt
3361 atccgctcat gagacaataa ccctgataaa tgcttcaata atattgaaaa aggaagagta
3421 tgagtattca acatttccgt gtcgccctta ttcccttttt tgcggcattt tgccttcctg
3481 tttttgctca cccagaaacg ctggtgaaag taaaagatgc tgaagatcag ttgggtgcac
3541 gagtgggtta catcgaactg gatctcaaca gcggtaagat ccttgagagt tttcgccccg
3601 aagaacgttt tccaatgatg agcactttta aagttctgct atgtggcgcg gtattatccc
3661 gtattgacgc cgggcaagag caactcggtc gccgcataca ctattctcag aatgacttgg
3721 ttgagtactc accagtcaca gaaaagcatc ttacggatgg catgacagta agagaattat
3781 gcagtgctgc cataaccatg agtgataaca ctgcggccaa cttacttctg acaacgatcg
3841 gaggaccgaa ggagctaacc gcttttttgc acaacatggg ggatcatgta actcgccttg
3901 atcgttggga accggagctg aatgaagcca taccaaacga cgagcgtgac accacgatgc
3961 ctgtagcaat ggcaacaacg ttgcgcaaac tattaactgg cgaactactt actctagctt
4021 cccggcaaca attaatagac tggatggagg cggataaagt tgcaggacca cttctgcgct
4081 cggcccttcc ggctggctgg tttattgctg ataaatctgg agccggtgag cgtgggtctc
4141 gcggtatcat tgcagcactg gggccagatg gtaagccctc ccgtatcgta gttatctaca
4201 cgacggggag tcaggcaact atggatgaac gaaatagaca gatcgctgag ataggtgcct
4261 cactgattaa gcattggtaa ctgtcagacc aagtttactc atatatactt tagattgatt
4321 taaaacttca tttttaattt aaaaggatct aggtgaagat cctttttgat aatctcatga
4381 ccaaaatccc ttaacgtgag ttttcgttcc actgagcgtc agaccccgta gaaaagatca
4441 aaggatcttc ttgagatcct ttttttctgc gcgtaatctg ctgcttgcaa acaaaaaaac
4501 caccgctacc agcggtggtt tgtttgccgg atcaagagct accaactctt tttccgaagg
4561 taactggctt cagcagagcg cagataccaa atactgttct tctagtgtag ccgtagttag
4621 gccaccactt caagaactct gtagcaccgc ctacatacct cgctctgcta atcctgttac
4681 cagtggctgc tgccagtggc gataagtcgt gtcttaccgg gttggactca agacgatagt
4741 taccggataa ggcgcagcgg tcgggctgaa cggggggttc gtgcacacag cccagcttgg
4801 agcgaacgac ctacaccgaa ctgagatacc tacagcgtga gctatgagaa agcgccacgc
4861 ttcccgaagg gagaaaggcg gacaggtatc cggtaagcgg cagggtcgga acaggagagc
4921 gcacgaggga gcttccaggg ggaaacgcct ggtatcttta tagtcctgtc gggtttcgcc
4981 acctctgact tgagcgtcga tttttgtgat gctcgtcagg ggggcggagc ctatggaaaa
5041 acgccagcaa cgcggccttt ttacggttcc tggccttttg ctggcctttt gctcacatgt
5101 tctttcctgc gttatcccct gattctgtgg ataaccgtat taccgccttt gagtgagctg
5161 ataccgctcg ccgcagccga acgaccgagc gcagcgagtc agtgagcgag gaagcggaag
5221 agc
>SEQ ID NO: 20 AAV9 Capsid Protein
MAADGYLPDWLEDNLSEGIREWWALKPGAPQPKANQQHQDNARGLVLPGYKYLGPG NGLDKGEPVNAADAAALEHDKAYDQQLKAGDNPYLKYNHADAEFQERLKEDTSFGG NLGRAVFQAKKRLLEPLGLVEEAAKTAPGKKRPVEQSPQEPDSSAGIGKSGAQPAKKRL NFGQTGDTESVPDPQPIGEPPAAPSGVGSLTMASGGGAPVADNNEGADGVGSSSGNWH CDSQWLGDRVITTSTRTWALPTYNNHLYKQISNSTSGGSSNDNAYFGYSTPWGYFDFN RFHCHFSPRDWQRLINNNWGFRPKRLNFKLFNIQVKEVTDNNGVKTIANNLTSTVQVFT DSDYQLPYVLGSAHEGCLPPFPADVFMIPQYGYLTLNDGSQAVGRSSFYCLEYFPSQML RTGNNFQFSYEFENVPFHSSYAHSQSLDRLMNPLIDQYLYYLSKTINGSGQNQQTLKFSV AGPSNMAVQGRNYIPGPSYRQQRVSTTVTQNNNSEFAWPGASSWALNGRNSLMNPGP AMASHKEGEDRFFPLSGSLIFGKQGTGRDNVDADKVMITNEEEIKTTNPVATESYGQVA TNHQSAQAQAQTGWVQNQGILPGMVWQDRDVYLQGPIWAKIPHTDGNFHPSPLMGGF GMKHPPPQILIKNTPVPADPPTAFNKDKLNSFITQYSTGQVSVEIEWELQKENSKRWNPE IQYTSNYYKSNNVEFAVNTEGVYSEPRPIGTRYLTRNL
>SEQ ID NO: 21
GCCTGGAGGCTTGCTGAAGGCTGTATGCTGTAAGCATGGAGCTAGCAGGCTGTTTTG GCCACTGACTGACAGCCTGCTCTCCTAGCTTACAGGACACAAGGCCTGTTACTAGCA CTCACATAACAAATGGCCCTTTT
>SEQ ID NO: 22
GCTCGAGTGAGCGCAGCCTGCTAGCTCCATGCTTACTGTAAAGCCACCAGATGGGTA AGCATGGAGCTAGCAGGCTTCGCCTACTAGTTTT
Реферат
Изобретение относится к биотехнологии. Предложена выделенная нуклеиновая кислота для снижения экспрессии патогенного белка гентингтина. Выделенная нуклеиновая кислота содержит трансген, кодирующий одну или более зрелую одноцепочечную микроРНК, в которой нуклеотидная последовательность трансгена, кодирующего каждую зрелую одноцепочечную микроРНК, содержит последовательность, указанную под SEQ ID NO: 7, и фланкирована гетерологичной остовной последовательностью микроРНК. Вектор для снижения экспрессии патогенного белка гентингтина, который содержит выделенную нуклеиновую кислоту. Рекомбинантный AAV (rAAV) для снижения экспрессии патогенного белка гентингтина (НТТ), где указанный rAAV содержит (i) капсидный белок и (ii) выделенную нуклеиновую кислоту. Изобретение позволяет снизить экспрессии патогенного белка гентингтина у пациентов с болезнью Гентингтона. 3 н. и 19 з.п. ф-лы, 55 ил., 6 табл., 4 пр.

Комментарии