Реагенты для лечения окулофарингеальной мышечной дистрофии (opmd) и их применение - RU2755544C2
Код документа: RU2755544C2
Чертежи














Описание
Данные о родственных заявках
Настоящая заявка испрашивает приоритет предварительной заявки на патент США №62/322745, поданной 14 апреля 2016 года, полное содержание которой включено в данный документ посредством ссылки.
Область техники
Настоящее изобретение относится к реагентам для РНК-интерференции (RNAi) для лечения окулофарингеальной мышечной дистрофии (OPMD), композициям, содержащим их, и их применению для лечения индивидуумов, страдающих OPMD, или предрасположенных к ее развитию.
Предпосылки изобретения
OPMD представляет собой медленно прогрессирующее дегенеративное мышечное нарушение с поздним началом с аутосомно-доминантным типом наследования. Заболевание в основном характеризуется прогрессирующим опущением век (птоз) и затруднением глотания (дисфагия). Глоточные и перстнеглоточная мышцы являются специфическими мишенями при OPMD. Слабость проксимальных отделов конечностей имеет тенденцию к появлению на более поздней стадии прогрессирования заболевания. Мутация, которая вызывает заболевание, представляет собой аномальную экспансию тринуклеотидного повтора (GCN)n в кодирующей области гена ядерного поли(А)-связывающего белка 1 (PABPN1). Эта экспансия приводит к удлинению полиаланинового тракта на N-конце белка PABPN1: 10 аланинов, присутствующих в нормальном белке, удлиняются до 11-18 аланинов в мутантной форме (expPABPN1). Основным патологическим признаком заболевания являются ядерные агрегаты expPABPN1. Неправильное сворачивание удлиненного PABPN1 приводит к накоплению нерастворимых полимерных фибриллярных агрегатов внутри ядер пораженных клеток. PABPN1 представляет собой склонный к агрегации белок, и мутантный аланин-удлиненный PABPN1 при OPMD имеет более высокую скорость агрегации, чем нормальный белок дикого типа. Однако до сих пор неясно, имеют ли ядерные агрегаты при OPMD патологическую функцию или защитную роль как следствие клеточного механизма защиты.
В настоящее время для OPMD нет фармакологического или какого-либо иного лечения. Симптоматические хирургические вмешательства могут частично исправить птоз и улучшить глотание у умеренно и более тяжело пораженных индивидуумов. Например, перстнеглоточная миотомия в настоящее время является единственно возможным лечением, доступным для улучшения глотания у этих пациентов. Однако это не корректирует прогрессирующую деградацию глоточной мускулатуры, которая часто приводит к смерти в результате затруднения глотания и асфиксии.
Соответственно, остается потребность в терапевтических средствах для лечения OPMD у пациентов, страдающих от нее и/или предрасположенных к ее развитию.
Краткое описание
Настоящее изобретение основано, частично, на осознании авторами настоящего изобретения того факта, что на данный момент не существует терапевтических средств для лечения OPMD. Таким образом, настоящее изобретенные предусматривает реагенты для RNAi, целенаправленно воздействующие на области транскрипта mRNA PABPN1, который является причиной OPMD. Авторы настоящего изобретения показали, что эти реагенты для RNAi эффективны для посттранскрипционного подавления транскриптов mRNA PABPN1, в том числе вариантов транскриптов, которые в противном случае были бы транслированы в мутантный белок PABPN1, вызывающий OPMD, т.е. те белки PABPN1, которые содержат удлиненный полиаланиновый тракт. Например, было показано, что иллюстративные реагенты для RNAi по настоящему изобретению подавляют или снижают экспрессию белка PABPN1 на моделях OPMD как in vitro, так и in vivo. Кроме того, настоящее изобретение предусматривает реагенты для экспрессии белка PABPN1 человека дикого типа, характеризующегося транскриптом мРНК, на который реагенты для RNAi по настоящему изобретению (далее в данном документе "реагенты для замещения PABPN1" не оказывают целенаправленного воздействия). Авторы настоящего изобретения показали, что при введении в сочетании с реагентами для RNAi по настоящему изобретению реагенты для замещения PABPN1 способны экспрессировать белок PABPN1, характеризующийся транскриптом, который устойчив к реагентам для RNAi и который является функциональным. Эти результаты авторов настоящего изобретения обеспечивают реагенты, которые могут иметь терапевтические применения при лечении OPMD.
Соответственно, настоящее изобретение предусматривает РНК, содержащую эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под любым из SEQ ID NO: 1-3. Предпочтительно, эффекторная последовательность будет иметь длину менее 30 нуклеотидов. Например, подходящая эффекторная последовательность может находиться в диапазоне 17-29 нуклеотидов в длину.
Эффекторная последовательность может содержать 6 ошибочных спариваний пар оснований относительно последовательности, приведенной под любым из SEQ ID NO: 1-3, к которой эффекторная последовательность является по существу комплементарной. В другом примере эффекторная последовательность может содержать 5 ошибочных спариваний пар оснований относительно последовательности, приведенной под любым из SEQ ID NO: 1-3, к которой эффекторная последовательность является по существу комплементарной. В другом примере эффекторная последовательность может содержать 4 ошибочных спариваний пар оснований относительно последовательности, приведенной под любым из SEQ ID NO: 1-3, к которой эффекторная последовательность является по существу комплементарной. В другом примере эффекторная последовательность содержит 3 ошибочных спаривания пар оснований относительно последовательности, приведенной под любым из SEQ ID NO: 1-3, к которой эффекторная последовательность является по существу комплементарной. В другом примере эффекторная последовательность содержит 2 ошибочных спаривания пар оснований относительно последовательности, приведенной под любым из SEQ ID NO: 1-3, к которой эффекторная последовательность является по существу комплементарной. В другом примере эффекторная последовательность содержит 1 ошибочное спаривание пары оснований относительно последовательности, приведенной под любым из SEQ ID NO: 1-3, к которой эффекторная последовательность является по существу комплементарной. В еще одном примере эффекторная последовательность на 100% комплементарна области эквивалентной длины в пределах последовательности, приведенной под любым из SEQ ID NO: 1-3.
РНК по настоящему изобретению может представлять собой однонитевую молекулу РНК. Например, однонитевую РНК можно выбрать из группы, состоящей из РНК, содержащей эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 5, за исключением 1, 2, 3, 4, 5 или 6 ошибочных спариваний оснований, при условии, что эффекторная последовательность способна образовывать дуплекс с последовательностью, приведенной под SEQ ID NO: 5;
РНК, содержащей эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 7, за исключением 1, 2, 3, 4, 5 или 6 ошибочных спариваний оснований, при условии, что эффекторная последовательность способна образовывать дуплекс с последовательностью, приведенной под SEQ ID NO: 7; и
РНК, содержащей эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 9, за исключением 1, 2, 3, 4, 5 или 6 ошибочных спариваний оснований, при условии, что эффекторная последовательность способна образовывать дуплекс с последовательностью, приведенной под SEQ ID NO: 9.
Например, однонитевую РНК может содержать эффекторную последовательность, выбранную из последовательностей, приведенных под SEQ ID NO: 4, 6 или 8.
В другом примере РНК может дополнительно содержать последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна эффекторной последовательности.
Например, РНК по настоящему изобретению можно выбрать из группы, состоящей из
РНК, содержащей (i) эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 5, за исключением 1, 2, 3, 4, 5 или 6 ошибочных спариваний оснований, при условии, что эффекторная последовательность способна образовывать дуплекс с последовательностью, приведенной под SEQ ID NO: 5, и (ii) последовательность, комплементарную эффекторной последовательности, содержащую последовательность, которая по существу комплементарна эффекторной последовательности;
РНК, содержащей (i) эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 7, за исключением 1, 2, 3, 4, 5 или 6 ошибочных спариваний оснований, при условии, что эффекторная последовательность способна образовывать дуплекс с последовательностью, приведенной под SEQ ID NO: 7, и (ii) последовательность, комплементарную эффекторной последовательности, содержащую последовательность, которая по существу комплементарна эффекторной последовательности; и
РНК, содержащей (i) эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 9, за исключением 1, 2, 3, 4, 5 или 6 ошибочных спариваний оснований, при условии, что эффекторная последовательность способна образовывать дуплекс с последовательностью, приведенной под SEQ ID NO: 9, и (ii) последовательность, комплементарную эффекторной последовательности, содержащую последовательность, которая по существу комплементарна эффекторной последовательности.
В другом примере РНК по настоящему изобретению можно выбрать из группы, состоящей из
РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 4, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 4;
РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 6, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 6; и
РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 8, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 8.
Например, последовательность, комплементарную эффекторной последовательности из РНК по настоящему изобретению может содержать 1, 2, 3, 4, 5 или 6 ошибочных спариваний относительно соответствующей эффекторной последовательности, при условии, что родственные эффекторные последовательности и последовательности, комплементарные эффекторным последовательностям, способны образовывать дуплекс.
В другом примере РНК по настоящему изобретению выбрана из группы, состоящей из
РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 4, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 5;
РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 6, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 7; и
РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 8, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 9.
Поэтому следует понимать, что РНК по настоящему изобретению может быть предоставлена в виде дуплекса малой интерферирующей РНК (siRNA) или двухнитевой РНК (dsRNA).
В качестве альтернативы, РНК по настоящему изобретению может быть предоставлена в виде короткой шпилечной РНК (shRNA). РНК по настоящему изобретению, когда предоставляется в виде shRNA, может содержать последовательность петли, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности. Подходящие последовательности петли можно выбрать из известных из уровня техники. Например, shRNA в соответствии с настоящим изобретением может содержать любую комбинацию эффекторных последовательностей и последовательностей, комплементарных эффекторным последовательностям, описанных в данном документе, с последовательностью стебель-петля, расположенной между ними.
В одном примере РНК по настоящему изобретению выбрана из группы, состоящей из
shRNA, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 10, (ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 10, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности;
shRNA, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 12, (ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 12, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности; и
shRNA, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 14, (ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 14, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности.
В одном примере РНК по настоящему изобретению выбрана из группы, состоящей из
shRNA, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 10, (ii) последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 11, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности;
shRNA, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 12, (ii) последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 13, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности; и
shRNA, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 14, (ii) последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 15, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности.
Например, shRNA в соответствии с настоящим изобретением может содержать последовательность, приведенную под любым из SEQ ID NO: 16-21.
Специалисту в данной области техники будет понятно, что РНК в соответствии с настоящим изобретением можно объединять или применять в сочетании с другими терапевтическими средствами для лечения OPMD. Соответственно, настоящее изобретение предусматривает РНК, описанную в данном документе, в комбинации с одним или несколькими другими средствами для лечения OPMD. В одном примере предусмотрено множество РНК, предусматривающее
(a) по меньшей мере одну РНК, описанную в данном документе; и
(b) по меньшей мере одну РНК, выбранную из
(i) РНК, описанной в данном документе; или
(ii) РНК, содержащей эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, который является причиной OPMD;
где РНК в (а) и РНК в (b) содержат различные эффекторные последовательности.
В одном примере РНК в (b) представляет собой РНК, описанную в данном документе.
В одном примере множество РНК по настоящему изобретению предусматривает по меньшей мере две РНК, выбранные из (а) первой РНК, содержащей эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, как описано в данном документе;
(b) второй РНК, содержащей эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, как описано в данном документе; и
(c) третьей РНК, содержащей эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 3, как описано в данном документе.
В одном примере по меньшей мере одна или каждая из РНК во множестве представляет собой ssRNA, выбранную из описанных в данном документе ssRNA. Например, множество РНК по настоящему изобретению может предусматривать по меньшей мере две ssRNA, выбранные из группы, состоящей из
(a) первой РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 4;
(b) второй РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 6; и
(c) третьей РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 8.
В одном примере по меньшей мере одна или каждая из РНК во множестве представляет собой dsRNA, выбранную из описанных в данном документе dsRNA. Например, множество РНК по настоящему изобретению может предусматривать по меньшей мере две dsRNA, выбранные из группы, состоящей из
(a) первой РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 4, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 4, например, последовательность, приведенную под SEQ ID NO: 5;
(b) второй РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 6, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 6, например, последовательность, приведенную под SEQ ID NO: 7; и
(с) третьей РНК, содержащей эффекторную последовательность, приведенную под SEQ ID NO: 8, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 8, например, последовательность, приведенную под SEQ ID NO: 9.
В другом примере по меньшей мере одна или каждая из РНК во множестве РНК, описанных в данном документе, может присутствовать в форме shRNA. Как описано в данном документе, каждая shRNA из множества будет содержать последовательность стебель-петля, расположенную между соответствующей эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности, так что shRNA образует единую непрерывную последовательность. Например, множество shRNA по настоящему изобретению может предусматривать по меньшей мере две РНК, выбранные из группы, состоящей из
(a) первой РНК, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 10, (ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 10, например, последовательность, приведенную под SEQ ID NO: 11, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности;
(b) второй РНК, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 12, (ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 12, например, последовательность, приведенную под SEQ ID NO: 13, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности; и
(c) третьей РНК, содержащей (i) эффекторную последовательность, приведенную под SEQ ID NO: 14, (ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 14, например, последовательность, приведенную под SEQ ID NO: 15, и (iii) последовательность стебель-петля, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности.
Как описано в данном документе, множество РНК по настоящему изобретению может предусматривать первую РНК и вторую РНК, как описано в данном документе. В другом примере множество РНК по настоящему изобретению предусматривает первую РНК и третью РНК, как описано в данном документе. В другом примере множество РНК по настоящему изобретению предусматривает вторую РНК и третью РНК, как описано в данном документе. В еще одном примере множество РНК по настоящему изобретению предусматривает первую РНК, вторую РНК и третью РНК, как описано в данном документе.
Множество РНК в соответствии с настоящим изобретением может предусматривать не более 10 РНК, например, две РНК, или три РНК, или четыре РНК, или пять РНК, или шесть РНК, или семь РНК, или восемь РНК, или девять РНК, или десять РНК. В одном примере множество РНК предусматривает две из описанных в данном документе РНК. В другом примере множество РНК предусматривает три из описанных в данном документе РНК.
В соответствии с одним примером настоящего изобретения, в котором предусмотрено множество shRNA, данное множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18.
В соответствии с одним примером настоящего изобретения, в котором предусмотрено множество shRNA, данное множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В соответствии с одним примером настоящего изобретения, в котором предусмотрено множество shRNA, данное множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В соответствии с одним примером настоящего изобретения, в котором предусмотрено множество shRNA, данное множество предусматривает или состоит из (i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16;
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18; и
(iii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В одном примере множество описанных в данном документе РНК может быть предоставлено вместе в виде единой композиции.
В одном примере множество описанных в данном документе РНК может быть предоставлено в виде нескольких композиций. Например, каждая из РНК множества может быть предоставлена отдельно. В качестве альтернативы, по меньшей мере одна РНК из множества может быть предоставлена отдельно и две или более из множества предоставлены вместе в композиции.
РНК или каждая РНК по настоящему изобретению может представлять собой ДНК-направленную РНК (ddRNA), которая может быть транскрибирована из нуклеиновой кислоты. Соответственно, настоящее изобретение также предусматривает конструкцию для ДНК-направленной RNAi (ddRNAi), содержащую нуклеиновую кислоту, которая содержит последовательность ДНК, кодирующую РНК по настоящему изобретению, например, где РНК представляет собой shRNA, описанную в данном документе.
Последовательность ДНК, кодирующая shRNA, может содержать последовательность ДНК, кодирующую последовательность петли, расположенную между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности. Например, последовательность ДНК, кодирующую shRNA по настоящему изобретению, можно выбрать из группы, состоящей из последовательности, приведенной под любым из SEQ ID NO: 16-21. В одном примере последовательность ДНК, кодирующая shRNA по настоящему изобретению, может также содержать последовательность терминатора с 3'-конца.
В другом примере настоящее изобретение предусматривает конструкцию для ddRNAi, способную экспрессировать множество shRNA. Например, конструкция для ddRNAi по настоящему изобретению может содержать нуклеиновую кислоту, содержащую одну или несколько последовательностей ДНК, кодирующих множество РНК по настоящему изобретению, например, где каждая из РНК представляет собой shRNA, описанную в данном документе.
В одном примере конструкция для ddRNAi может содержать по меньшей мере две нуклеиновые кислоты, выбранные из группы, состоящей из
(a) первой нуклеиновой кислоты, содержащей последовательность ДНК, кодирующую последовательность shRNA, содержащую
(i) эффекторную последовательность, содержащую область из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности PABPN1, приведенной под SEQ ID NO: 1; и
(ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна эффекторной последовательности;
(b) второй нуклеиновой кислоты, содержащей последовательность ДНК, кодирующую последовательность shRNA, содержащую
(i) эффекторную последовательность, содержащую область из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности PABPN1, приведенной под SEQ ID NO: 2; и
(ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна эффекторной последовательности; и
(c) третьей нуклеиновой кислоты, содержащей последовательность ДНК, кодирующую последовательность shRNA, содержащую
(i) эффекторную последовательность, содержащую область из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности PABPN1, приведенной под SEQ ID NO: 3; и
(ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна эффекторной последовательности.
В одном примере последовательность ДНК, содержащаяся в первой нуклеиновой кислоте, кодирует последовательность shRNA, содержащую эффекторную последовательность, приведенную под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 11.
В одном примере последовательность ДНК, содержащаяся во второй нуклеиновой кислоте, кодирует последовательность shRNA, содержащую эффекторную последовательность, приведенную под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 13.
В одном примере последовательность ДНК, содержащаяся в третьей нуклеиновой кислоте, кодирует последовательность shRNA, содержащую эффекторную последовательность, приведенную под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 15.
Каждая нуклеиновая кислота, содержащая последовательность ДНК, кодирующую shRNA, описанную в данном документе, может содержать последовательность ДНК, кодирующую последовательность петли, расположенную между родственной эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности.
В одном примере первая нуклеиновая кислота содержит последовательность ДНК, кодирующую последовательность shRNA, приведенную под SEQ ID NO: 16 или 17.
В одном примере вторая нуклеиновая кислота содержит последовательность ДНК, кодирующую последовательность shRNA, приведенную под SEQ ID NO: 18 или 19.
В одном примере третья нуклеиновая кислота содержит последовательность ДНК, кодирующую последовательность shRNA, приведенную под SEQ ID NO: 20 или 21.
Каждая из описанных в данном документе shRNA может необязательно дополнительно содержать два смежных урацила (UU) с 3'-конца shRNA, например, в результате терминации транскрипции с промотора RNA Pol III.
Каждая нуклеиновая кислота может также содержать последовательность терминатора с 3'-конца последовательности ДНК, кодирующей shRNA.
В одном примере конструкция для ddRNAi, способная экспрессировать множество РНК, содержит первую нуклеиновую кислоту, описанную в данном документе, и вторую нуклеиновую кислоту, описанную в данном документе. В одном примере конструкция для ddRNAi, способная экспрессировать множество РНК, содержит первую нуклеиновую кислоту, описанную в данном документе, и третью нуклеиновую кислоту, описанную в данном документе. В одном примере конструкция для ddRNAi, способная экспрессировать множество РНК, содержит вторую нуклеиновую кислоту, описанную в данном документе, и третью нуклеиновую кислоту, описанную в данном документе. В одном примере конструкция для ddRNAi, способная экспрессировать множество РНК, содержит первую нуклеиновую кислоту, описанную в данном документе, вторую нуклеиновую кислоту, описанную в данном документе, и третью нуклеиновую кислоту, описанную в данном документе.
Иллюстративная конструкция для ddRNAi, способная экспрессировать три shRNA по настоящему изобретению, содержит
первую нуклеиновую кислоту, содержащую последовательность ДНК, кодирующую последовательность shRNA, приведенную под SEQ ID NO: 16;
вторую нуклеиновую кислоту, содержащую последовательность ДНК, кодирующую последовательность shRNA, приведенную под 18; и
третью нуклеиновую кислоту, содержащую последовательность ДНК, кодирующую последовательность shRNA, приведенную под SEQ ID NO: 20.
Каждая из описанных в данном документе shRNA может необязательно дополнительно содержать два смежных урацила (UU) с 3'-конца shRNA, например, в результате терминации транскрипции с промотора RNA Pol III.
В одном примере конструкция для ddRNAi, описанная в данном документе, содержит один промотор, который функционально связан с нуклеиновой кислотой или каждой нуклеиновой кислотой, кодирующей shRNA по настоящему изобретению.
В другом примере каждая нуклеиновая кислота, кодирующая shRNA по настоящему изобретению, функционально связана с отдельным промотором. Например, промотор(промоторы) находится(находятся) выше соответствующей(соответствующих) последовательности(последовательностей) ДНК, кодирующей shRNA. В конструкции для ddRNAi, содержащей несколько промоторов, промоторы могут быть одинаковыми или различными. Иллюстративными промоторами являются промоторы RNA pol III, такие как, например, промоторы U6 и H1.
В соответствии с примером конструкции для ddRNAi, которая способна экспрессировать три shRNA по настоящему изобретению, конструкция для ddRNAi может содержать
(a) промотор U6-1 выше первой нуклеиновой кислоты, содержащей последовательность ДНК, кодирующую последовательность shRNA, приведенную под SEQ ID NO: 16;
(b) промотор U6-9 выше второй нуклеиновой кислоты, содержащей последовательность ДНК, кодирующую последовательность shRNA, приведенную под SEQ ID NO: 18; и
(c) промотор HI выше третьей нуклеиновой кислоты, содержащей последовательность ДНК, кодирующую последовательность shRNA, приведенную под SEQ ID NO: 20.
В одном примере конструкция для ddRNAi, которая способна экспрессировать три shRNA по настоящему изобретению, содержит последовательность, приведенную под SEQ ID NO: 22. В одном примере конструкция для ddRNAi, которая способна экспрессировать три shRNA по настоящему изобретению, содержит последовательность, приведенную под SEQ ID NO: 23.
В еще одном примере настоящее изобретение предусматривает множество конструкций для ddRNAi, где каждая конструкция для ddRNAi способна экспрессировать по меньшей мере одну shRNA, описанную в данном документе. Множество конструкций для ddRNAi может предусматривать по меньшей мере две конструкции для ddRNAi, выбранные из группы, состоящей из (а) первой конструкции для ddRNAi, которая содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, содержащую
(i) эффекторную последовательность, содержащую область из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности PABPN1, приведенной под SEQ ID NO: 1; и
(ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна эффекторной последовательности;
(b) второй конструкции для ddRNAi, которая содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, содержащую
(i) эффекторную последовательность, содержащую область из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности PABPN1, приведенной под SEQ ID NO: 2; и
(ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна эффекторной последовательности; и
(c) третьей конструкции для ddRNAi, которая содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, содержащую
(i) эффекторную последовательность, содержащую область из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности PABPN1, приведенной под SEQ ID NO: 3; и
(ii) последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна эффекторной последовательности.
В одном примере первая конструкция для ddRNAi содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует эффекторную последовательность, приведенную под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 11.
В одном примере вторая конструкция для ddRNAi содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует эффекторную последовательность, приведенную под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 13.
В одном примере третья конструкция для ddRNAi содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует эффекторную последовательность, приведенную под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, приведенную под SEQ ID NO: 15.
В каждой из конструкций для ddRNAi в данном множестве последовательность ДНК, кодирующая соответствующие shRNA, может содержать последовательность ДНК, кодирующую последовательность петли, расположенную между соответствующей эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности.
В одном примере первая конструкция для ddRNAi содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, приведенную под SEQ ID NO: 16 или 17.
В одном примере вторая конструкция для ddRNAi содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, приведенную под SEQ ID NO: 18 или 19.
В одном примере третья конструкция для ddRNAi содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, приведенную под SEQ ID NO: 20 или 21.
В каждой из конструкций для ddRNAi нуклеиновая кислота или каждая нуклеиновая кислота может также содержать последовательность терминатора с 3'-конца последовательности ДНК, кодирующей shRNA.
Каждая из shRNA, экспрессируемых из конструкции для ddRNAi, может также необязательно дополнительно содержать два смежных урацила (UU) с 3'-конца shRNA, например, в результате терминации транскрипции с промотора RNA Pol III.
В одном примере множество конструкций для ddRNAi предусматривает первую конструкцию для ddRNAi, описанную в данном документе, и вторую конструкцию для ddRNAi, описанную в данном документе. В одном примере множество конструкций для ddRNAi предусматривает первую конструкцию для ddRNAi, описанную в данном документе, и третью конструкцию для ddRNAi, описанную в данном документе. В одном примере множество конструкций для ddRNAi предусматривает вторую конструкцию для ddRNAi, описанную в данном документе, и третью конструкцию для ddRNAi, описанную в данном документе. В одном примере множество конструкций для ddRNAi предусматривает первую конструкцию для ddRNAi, описанную в данном документе, вторую конструкцию для ddRNAi, описанную в данном документе, и третью конструкцию для ddRNAi, описанную в данном документе.
Иллюстративное множество конструкций для ddRNAi предусматривает
первую конструкцию для ddRNAi, которая содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, приведенную под SEQ ID NO: 16;
вторую конструкцию для ddRNAi, которая содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, приведенную под SEQ ID NO: 18; и
третью конструкцию для ddRNAi, которая содержит нуклеиновую кислоту, содержащую последовательность ДНК, которая кодирует последовательность shRNA, приведенную под SEQ ID NO: 20.
Каждая конструкция для ddRNAi в данном множестве конструкций для ddRNAi может содержать промотор, который функционально связан с нуклеиновой кислотой или каждой нуклеиновой кислотой, кодирующей shRNA по настоящему изобретению.
В соответствии с примером, в котором одна или несколько конструкций для ddRNAi из множества способны экспрессировать более одной shRNA, каждая нуклеиновая кислота, кодирующая shRNA, может быть функционально связана с отдельным промотором. Например, промотор(промоторы) находится(находятся) выше соответствующей(соответствующих) последовательности(последовательностей) ДНК, кодирующей shRNA. В конструкции для ddRNAi, содержащей несколько промоторов, промоторы могут быть одинаковыми или различными. Иллюстративными промоторами являются промоторы RNA pol III, такие как, например, промоторы U6 и H1.
Конструкция для ddRNAi или каждая конструкция для ddRNAi, как описано в данном документе, может быть включена в вектор экспрессии.
В соответствии с примером, в котором присутствует множество конструкций для ddRNAi, может быть предусмотрено множество векторов экспрессии, содержащих ddRNAi. В одном примере один или более из множества векторов экспрессии содержит множество конструкций для ddRNAi, раскрытых в данном документе. В другом примере каждая из конструкций для ddRNAi в данном множестве содержится в отдельном векторе экспрессии. В любом из вышеперечисленных способов в этом параграфе множество векторов экспрессии могут совместно экспрессировать множество shRNA в соответствии с настоящим изобретением.
Настоящее изобретение также предусматривает композицию, содержащую конструкцию для ddRNAi, множество конструкций для ddRNAi, вектор экспрессии и/или множество векторов экспрессии, как описано в данном документе. В одном примере композиция может также содержать один или несколько фармацевтически приемлемых носителей и/или разбавителей.
В одном примере композиция по настоящему изобретению дополнительно содержит нуклеиновую кислоту, кодирующую функциональный белок PABPN1, которая характеризуется транскриптом mRNA, на который shRNA или каждая shRNA, кодируемая конструкцией(конструкциями) для ddRNAi в композиции, не оказывает целенаправленного воздействия. Например, функциональный белок PABPN1 представляет собой белок PABPN1 человека дикого типа, например, имеющий последовательность, приведенную под SEQ ID NO: 25.
В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, является кодон-оптимизированной, так что на mRNA, транскрибируемую с нее, не оказывает целенаправленного воздействия shRNA или каждая shRNA, кодируемая конструкцией(конструкциями) для ddRNAi в композиции. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, содержит последовательность, приведенную под SEQ ID NO: 24. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, может также содержать последовательность Козака с 5'-конца.
Нуклеиновая кислота, кодирующая функциональный белок PABPN1, раскрытый в данном документе, будет содержаться в векторе экспрессии.
В соответствии с примером, в котором конструкция для ddRNAi или каждая конструкция для ddRNAi содержится в пределах одного вектора экспрессии, конструкция(конструкции) для ddRNAi и нуклеиновая кислота, кодирующая функциональный белок PABPN1, могут содержаться в пределах одного вектора экспрессии. В качестве альтернативы, конструкция(конструкции) для ddRNAi и нуклеиновая кислота, кодирующая функциональный белок PABPN1, могут содержаться в различных векторах экспрессии.
В соответствии с примером, в котором множество конструкций для ddRNAi по настоящему изобретению содержится во множестве векторов экспрессии, каждая конструкция для ddRNAi может содержаться в различном векторе экспрессии, а нуклеиновая кислота, кодирующая функциональный белок PABPN1, может содержаться по меньшей мере в одном из векторов экспрессии, содержащих конструкцию для ddRNAi.
В одном примере вектор экспрессии или каждый вектор экспрессии представляет собой плазмиду или миникольцо.
В одном примере плазмида или миникольцо или вектор экспрессии или конструкция для ddRNAi или каждые плазмида или миникольцо или вектор экспрессии или конструкция для ddRNAi образуют комплекс с катионным ДНК-связывающим полимером, например, полиэтиленимином.
В другом примере вектор экспрессии или каждый вектор экспрессии представляет собой вирусный вектор. Например, вирусный вектор выбран из группы, состоящей из вектора на основе аденоассоциированного вируса (AAV), ретровирусного вектора, аденовирусного вектора (AdV) и лентивирусного вектора (LV).
Настоящее изобретение также предусматривает нуклеиновую кислоту, кодирующую функциональный белок PABPN1, имеющий транскрипт mRNA, на который не оказывает целенаправленного воздействия одна или несколько РНК, например, shRNA, описанные в данном документе как целенаправленно воздействующие на транскрипт mRNA дикого типа белка PABPN1. В одном примере функциональный белок PABPN1, кодируемый нуклеиновой кислотой по настоящему изобретению, может иметь такую же аминокислотную последовательность, как у белка PABPN1 человека дикого типа, например, последовательность, представленную под SEQ ID NO: 25. Нуклеиновая кислота по настоящему изобретению, которая кодирует функциональный белок PABPN1, может быть кодон-оптимизирована так, что на mRNA, транскрибируемую с нее, не оказывает целенаправленного воздействия одна или несколько РНК, например, shRNA, описанные в данном документе как целенаправленно воздействующие на транскрипт mRNA дикого типа белка PABPN1. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, содержит последовательность, приведенную под SEQ ID NO: 24. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, может также содержать последовательность Козака с 5'-конца. Нуклеиновая кислота, кодирующая функциональный белок PABPN1, раскрытый в данном документе, может содержаться в векторе экспрессии. Вектор экспрессии может быть любым вектором экспрессии, как описано в данном документе выше относительно конструкций для ddRNAi по настоящему изобретению. Как также описано в данном документе выше, вектор экспрессии, содержащий нуклеиновую кислоту, кодирующую функциональный белок PABPN1, может также содержать одну или несколько конструкций для ddRNAi по настоящему изобретению.
Нуклеиновая кислота, кодирующая функциональный белок PABPN1 по настоящему изобретению, может быть пригодна для лечения OPMD в комбинации с РНК, множеством РНК, конструкцией для ddRNAi, множеством конструкций для ddRNAi, вектором экспрессии, множеством векторов экспрессии и/или композицией, описанной в данном документе, или у субъекта, который уже получил лечение с помощью них.
Настоящее изобретение также предусматривает способ подавления экспрессии белка PABPN1, который является причиной OPMD у субъекта, при этом способ включает введение субъекту РНК, множества РНК, конструкции для ddRNAi, множества конструкций для ddRNAi, вектора экспрессии, множества векторов экспрессии и/или композиции, описанной в данном документе.
Настоящее изобретение также предусматривает способ лечения OPMD у субъекта, страдающего от нее, при этом способ включает введение субъекту РНК, множества РНК, конструкции для ddRNAi, множества конструкций для ddRNAi, вектора экспрессии, множества векторов экспрессии и/или композиции, описанных в данном документе. Способ лечения OPMD может дополнительно включать введение субъекту нуклеиновой кислоты, кодирующей функциональный белок PABPN1, описанный в данном документе.
Настоящее изобретение также предусматривает способ лечения OPMD у субъекта, страдающего от нее, при этом способ включает введение субъекту нуклеиновой кислоты, кодирующей функциональный белок PABPN1 по настоящему изобретению, где субъекту ранее вводили РНК, множество РНК, конструкцию для ddRNAi, множество конструкций для ddRNAi, вектор экспрессии, множество векторов экспрессии и/или композицию, описанные в данном документе. Настоящее изобретение также предусматривает способ лечения OPMD у субъекта, страдающего от нее, при этом способ включает введение субъекту
(a) одного или нескольких средств для подавления экспрессии белка PABPN1, который является причиной OPMD, где указанное средство(средства) выбрано(выбраны) из (i) РНК, множества РНК, конструкции для ddRNAi, множества конструкций для ddRNAi, вектора экспрессии, множества векторов экспрессии и/или композиции, описанных в данном документе; и
(b) вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую функциональный белок PABPN1, которая характеризуется транскриптом mRNA, на который не оказывает целенаправленного воздействия средство из (а).
В одном примере функциональный белок PABPN1 содержит аминокислотную последовательность белка PABPN1 человека дикого типа, например, последовательность, представленную под SEQ ID NO: 25.
В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, является кодон-оптимизированной так, что на mRNA, транскрибируемую с нее, не оказывает целенаправленного воздействия средство из (а), которое действует через RNAi. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, содержит последовательность, приведенную под SEQ ID NO: 24. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, может также содержать последовательность Козака с 5'-конца.
В одном примере средство(средства) из (а) и вектор экспрессии из (b) вводят субъекту совместно. В одном примере средство(средства) из (а) и вектор экспрессии из (b) вводят субъекту раздельно, но одновременно. В одном примере средство(средства) из (а) и вектор экспрессии из (b) вводят субъекту последовательно.
(а) Настоящее изобретение также предусматривает набор, содержащий одного или нескольких средств для подавления экспрессии белка PABPN1, который является причиной OPMD, где указанное средство(средства) выбрано(выбраны) из (i) РНК, множества РНК, конструкции для ddRNAi, множества конструкций для ddRNAi, вектора экспрессии, множества векторов экспрессии и/или композиции, описанных в данном документе; и
(b) вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую функциональный белок PABPN1, которая характеризуется транскриптом mRNA, на который не оказывает целенаправленного воздействия средство из (а).
В одном примере функциональный белок PABPN1 представляет собой белок PABPN1 человека дикого типа, например, имеющий последовательность, приведенную под SEQ ID NO: 25.
В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, является кодон-оптимизированной так, что на mRNA, транскрибируемую с нее, не оказывает целенаправленного воздействия средство из (а), которое действует через RNAi. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, содержит последовательность, приведенную под SEQ ID NO: 24. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, может также содержать последовательность Козака с 5'-конца.
В одном примере набор дополнительно содержит инструкции для применения в способе по настоящему изобретению.
Настоящее изобретение также предусматривает применение РНК, множества РНК, конструкции для ddRNAi, множества конструкций для ddRNAi, вектора экспрессии, множества векторов экспрессии и/или композиции, описанных в данном документе, при получении лекарственного препарата для лечения или предупреждения OPMD у субъекта.
Настоящее изобретение также предусматривает применение нуклеиновой кислоты, кодирующей функциональный белок PABPN1, описанный в данном документе, при получении лекарственного препарата для лечения или предупреждения OPMD у субъекта. Лечение OPMD в соответствии с этим примером может включать введение лекарственного препарата субъекту в комбинации со средством, действующим через RNAi, которое выбрано из РНК, множества РНК, конструкции для ddRNAi, множества конструкций для ddRNAi, вектора экспрессии, множества векторов экспрессии и/или композиции, описанных в данном документе, где нуклеиновая кислота, кодирующая функциональный белок PABPN1, характеризуется транскриптом mRNA, на который не оказывает целенаправленного воздействия средство, которое действует через RNAi. В соответствии с другим примером лечение OPMD может включать введение лекарственного препарата субъекту, которому уже вводили средство, действующее через RNAi, которое выбрано из РНК, множества РНК, конструкции для ddRNAi, множества конструкций для ddRNAi, вектора экспрессии, множества векторов экспрессии и/или композиции, описанных в данном документе, где нуклеиновая кислота, кодирующая функциональный белок PABPN1, характеризуется транскриптом mRNA, на который не оказывает целенаправленного воздействия средство, которое действует через RNAi.
Настоящее изобретение также предусматривает применение вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую функциональный белок PABPN1, при получении лекарственного препарата для лечения или предупреждения OPMD у субъекта, где лекарственный препарат содержит средство, действующее через RNAi, которое выбрано из РНК, множества РНК, конструкции для ddRNAi, множества конструкций для ddRNAi, вектора экспрессии, множества векторов экспрессии и/или композиции, описанных в данном документе, и где функциональный белок PABPN1 имеет транскрипт mRNA, на который не оказывает целенаправленного воздействия данное средство.
В одном примере функциональный белок PABPN1 имеет аминокислотную последовательность белка PABPN1 человека дикого типа, например, последовательность, представленную под SEQ ID NO: 25.
В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, является кодон-оптимизированной так, что на mRNA, транскрибируемую с нее, не оказывает целенаправленного воздействия средство. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, содержит последовательность, приведенную под SEQ ID NO: 24. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, может также содержать последовательность Козака с 5'-конца.
В каждом из вышеприведенных примеров субъект, подлежащий лечению, может страдать OPMD или может быть генетически предрасположен к OPMD.
Настоящее изобретение также предусматривает РНК, множество РНК, конструкцию для ddRNAi, множество конструкций для ddRNAi, вектор экспрессии, множество векторов экспрессии, композицию и/или набор, описанные в данном документе, для применения в терапии. Например, РНК, множество РНК, конструкцию для ddRNAi, множество конструкций для ddRNAi, вектор экспрессии, множество векторов экспрессии, композицию и/или набор можно применять в лечении OPMD у субъекта и/или в способе, раскрытом в данном документе.
Настоящее изобретение также предусматривает нуклеиновую кислоту, кодирующую функциональный белок PABPN1, описанный в данном документе, для применения в терапии. Например, нуклеиновую кислоту, кодирующую функциональный белок PABPN1, можно применять в лечении OPMD у субъекта и/или в способе, раскрытом в данном документе.
Лечение OPMD в соответствии с любым примером, описанным в данном документе, может включать одно или несколько из снижения или подавления экспрессии белка PABPN1, который является причиной OPMD, т.е. белка PABPN1, имеющего удлиненный полиаланиновый тракт, у субъекта. В качестве альтернативы или дополнительно, лечение OPMD в соответствии с любым примером, описанным в данном документе, может включать замещение белка PABPN1 у субъекта с использованием нуклеиновой кислоты, кодирующей функциональный белок PABPN1, описанный в данном документе. Например, белок PABPN1 для замещения может содержать аминокислотную последовательность белка PABPN1 дикого типа. В одном примере лечение снижает или подавляет экспрессию белка PABPN1, который является причиной OPMD, и замещает функциональный белок PABPN1, имеющий нормальную длину полиаланиновых остатков у субъекта.
Краткое описание графических материалов
На фигуре 1 показан уровень экспрессии PABPN1 человека в здоровых (LHCNM2) или пораженных OPMD (КМОР6/4) миобластах человека после трансфекции с помощью последовательностей-кандидатов dsRNA (dsRNA1, dsRNA2 и dsRNA3).
На фигуре 2 проиллюстрирована эффективность нокдауна PABPN1 в клетках HEK293T после трансфекции с помощью плазмид на основе AAV, экспрессирующих одинарную и трицистронную shRNA в отношении mRNA PABPN1. Экспрессию PABPN1 выражали относительно экспрессии GAPDH (*р<0,05, ***р<0,005).
Фигура 3(А) представляет собой вестерн-блоттинг, показывающий уровень белка PABPN1 относительно белка GAPDH, экспрессированного в клетках HEK293T, трансфицированных с помощью (A) pAAV-HBVpol, (В) pAAV-shRNAx3-long, (С) pAAV mut-PABPN1-FLAG или (D) pAAV Opt-hPABPN1-MYC.
На фигуре 3(В) проиллюстрирована, слева направо, средняя экспрессия PABPN1, нормированная по экспрессии PABPN1 в нетрансфицированных клетках HEK293T, в (i) нетрансфицированных контрольных клетках HEK293T, (ii) клетках HEK293T, трансфицированных с помощью pAAV-HBVpol, (iii) клетках HEK293T, трансфицированных с помощью pAAV-shRNA5, (iv) клетках HEK293T, трансфицированных с помощью pAAV-shRNA5 и pAAV mut-PABPN1-FLAG, (v) клетках HEK293T, трансфицированных с помощью pAAV-shRNA5 и pAAV Opt-hPABPN1-MYC, (vi) клетках HEK293T, трансфицированных с помощью pAAV-shRNAx3-short, (vii) клетках HEK293T, трансфицированных с помощью pAAV-shRNAx3-short и pAAV mut-PABPN1-FLAG, (viii) клетках HEK293T, трансфицированных с помощью pAAV-shRNAx3-short и pAAV Opt-hPABPN1-MYC, (ix) клетках HEK293T, трансфицированных с помощью pAAV-shRNAx3-long, (х) клетках HEK293T, трансфицированных с помощью pAAV-shRNAx3-long и pAAV mut-PABPN1-FLAG, и (xi) клетках HEK293T, трансфицированных с помощью pAAV-shRNAx3-long и pAAV Opt-hPABPN1-MYC (**р<0,01, ***р<0,005).
Фигура 3(С) представляет собой вестерн-блоттинг, показывающий уровни Мус-меченого белка PABPN1 относительно белка GAPDH, экспрессированного в клетках HEK293T, трансфицированных с помощью, слева направо, (i) pAAV-HBVpol, (ii) pAAV mut-PABPN1-FLAG и pAAV-HBVpol, (iii) pAAV Opt-hPABPN1-MYC и pAAV-HBVpol, (iv) pAAV-shRNAx3-long, (v) pAAV mut-PABPN1-FLAG и pAAV-shRNAx3-long, или (vi) pAAV Opt-hPABPN1-MYC и pAAV-shRNAx3-long.
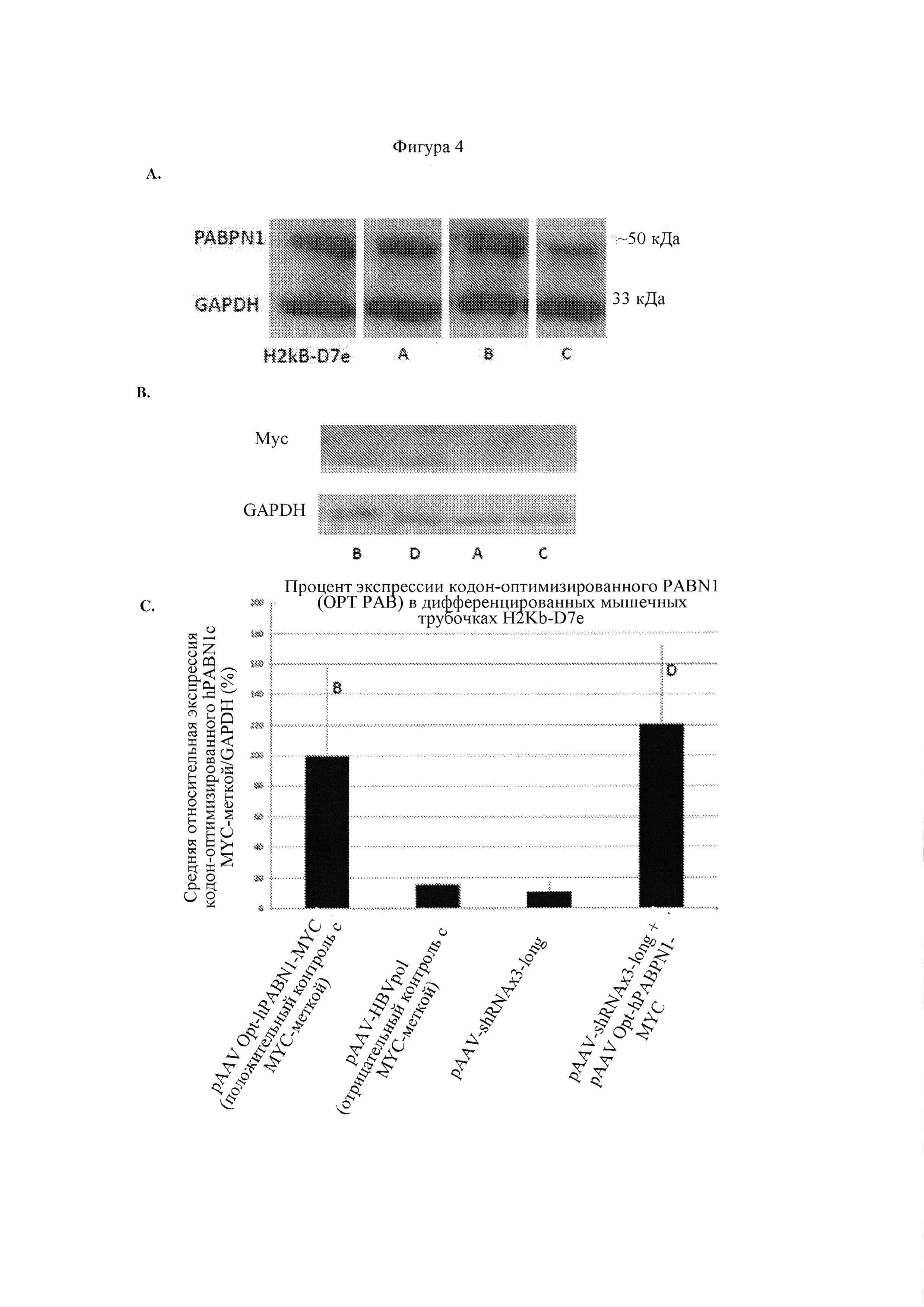
Фигура 4(А) представляет собой вестерн-блоттинг, показывающий уровни белка PABPN1 относительно белка GAPDH в контрольных клетках H2kB-D7e и в клетках H2kB-D7e, трансфицированных с помощью (А) pAAV-HBVpol, (В) pAAV-shRNAx3-long или (С) pAAV mut-PABPN1-FLAG и pAAV-shRNAx3-long.
Фигура 4(В) представляет собой вестерн-блоттинг, показывающий уровни Мус-меченого белка PABPN1 относительно белка GAPDH в клетках H2kB-D7e, трансфицированных с помощью (В) pAAV-shRNAx3-long, (D) pAAV Opt-hPABPN1-MYC и pAAV-shRNAx3-long, (A) pAAV-HBVpol или (С) pAAV mut-PABPN1-FLAG и pAAV-shRNAx3-long.
На фигуре 4(С) проиллюстрирован средний уровень экспрессии Мус-меченого кодон-оптимизированного PABPN1 относительно экспрессии GAPDH (выражено в процентах) в клетках H2kB-D7e, трансфицированных с помощью (i) pAAV Opt-hPABPN1-MYC, (ii) pAAV-HBVpol, (iii) pAAV-shRNAx3-long, и (iv) pAAV-shRNAx3-long и pAAV Opt-hPABPN1-MYC.
Фигура 4(D) представляет собой вестерн-блоттинг, показывающий уровень FLAG-меченого мутантного белка PABPN1 (содержащего удлиненный полиаланиновый тракт) относительно белка GAPDH в клетках H2kB-D7e, трансфицированных с помощью (А) pAAV-HBVpol, (С) pAAV mut-PABPN1-FLAG и pAAV-shRNAx3-long, (В) pAAV-shRNAx3-long или (D) pAAV Opt-hPABPN1-MYC и pAAV-shRNAx3-long.
На фигуре 4(Е) проиллюстрирован средний уровень FLAG-меченого мутантного белка PABPN1 (содержащего удлиненный полиаланиновый тракт) относительно экспрессии GAPDH (выражено в процентах) в клетках H2kB-D7e, трансфицированных с помощью, слева направо, (А) pAAV-HBVpol, (В) pAAV-shRNAx3-long, (С) pAAV-shRNAx3-long, или (D) pAAV-shRNAx3-long и pAAV-shRNAx3-long.
На фигуре 5 показан (А) вес, (В) удельная сила и (С) изометрическая максимальная сила. of Tibialis anterior (ТА) muscles excised from (i) A17 mice treated with saline, (ii) FvB mice treated with saline, (iii) A17 treated with scAAV8-shRNAx3-long, (iv) A17 treated with ssAAV9 Opt-hPABPN1-MYC and (v) A17 treated with scAAV8-shRNAx3-long and ssAAV9 Opt-hPABPN1-MYC. Все измерения мышц проводили через 18 недель после инъекции.
Фигура 6(А) представляет собой вестерн-блоттинг, показывающий средний уровень экспрессии белка PABPN1 относительно экспрессии белка винкулина в мышцах Tibialis anterior (ТА) у (i) мышей А17, обработанных солевым раствором, (ii) мышей FvB, обработанных солевым раствором, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC.
На фигуре 6(В) проиллюстрирован уровень экспрессии белка PABPN1 в мышцах Tibialis anterior (ТА) у (i) мышей A17, обработанных солевым раствором, (ii) мышей FvB, обработанных солевым раствором, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC, как определено с помощью денситометрического анализа вестерн-блоттинга на фигуре 6(А).
Фигура 6(С) представляет собой вестерн-блоттинг, показывающий средний уровень экспрессии белка MYC относительно экспрессии белка винкулина в мышцах Tibialis anterior (ТА) у (i) мышей A17, обработанных солевым раствором, (ii) мышей FvB, обработанных солевым раствором, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC. Этот вестерн-блоттинг иллюстрирует, что myc-эпитоп обнаружен во всех мышцах, обработанных ssAAV9 Opt-hPABPN1-MYC отдельно или в комбинации с scAAV8-shRNAx3-long. Стрелка показывает выявленную полосу с правильной молекулярной массой.
На фигуре 6(D) проиллюстрирован уровень Мус-метки, выявленной в мышцах Tibialis anterior (ТА) у мышей A17 через 18 недель после инъекции с ssAAV9 Opt-hPABPN1-MYC отдельно или в комбинации с scAAV8-shRNAx3-long, как определено с помощью денситометрического анализа вестерн-блоттинга на фигуре 6(С). На этом графике показано, что scAAV8-shRNAx3-long не влияет на количество белка optPABPN1 при совместной экспрессии в мышцах с инъекцией как scAAV8-shRNAx3-long, так и ssAAV9 Opt-hPABPN1-MYC.
На фигуре 7А показана иммунофлуоресцентная гистохимия для выявления PABPN1 и ламинина на срезах мышц Tibialis anterior (ТА) у (i) мышей A17, обработанных солевым раствором, (ii) мышей FvB, обработанных солевым раствором, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC. Срезы предварительно обрабатывали 1М KCl, чтобы удалить весь растворимый PABPN1 из ткани. Количество PABPN1-положительных внутриядерных включений (INI) значительно снижено в обработанных scAAV8-shRNAx3-long мышцах. Все мышечные срезы брали через 18 недель после инъекции.
На фигуре 7В проиллюстрирован уровень ядер, содержащих INI, (выраженный в процентах) на срезах мышц Tibialis anterior (ТА) у (i) мышей A17, обработанных солевым раствором, (ii) мышей FvB, обработанных солевым раствором, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC. На этом графике проиллюстрировано, что обработка с помощью либо scAAV8-shRNAx3-long, либо как scAAV8-shRNAx3-long, так и ssAAV9 Opt-hPABPN1-MYC снижает количество INI до приблизительно 10% и 5%, соответственно, по сравнению с мышцами A17 с инъекцией солевого раствора (CNF=35%) (однофакторный дисперсионный анализ с ретроспективным критерием Бонферрони, ***р<0,001).
На фигуре 8А показаны изображения окрашенных гематоксилин-эозином (Н&Е) срезов мышцы Tibialis anterior (ТА), вырезанной у (i) мышей A17 с инъекцией солевого раствора, (ii) мышей FvB с инъекцией солевого раствора, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC. Эти изображения показывают, что истощение эндогенного PABPN1 в мышцах A17 увеличивает количество волокон с центрально расположенными ядрами, тогда как совместная инъекция ssAAV9-opthPABPN1-MYC сохраняла количество волокон с центральными ядрами на том же уровне, который наблюдался в мышцах A17 с инъекцией солевого раствора, указывая на то, что совместная экспрессия кодон-оптимизированного hPABPN1 предупреждает дегенерацию мышц. Все мышечные срезы брали через 18 недель после инъекции.
На фигуре 8В представлены типичные изображения иммунологического окрашивания на коллаген VI на срезах мышцы Tibialis anterior (ТА), вырезанной у (i) мышей A17 с инъекцией солевого раствора, (ii) мышей FvB с инъекцией солевого раствора, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC. Все мышечные срезы брали через 18 недель после инъекции.
На фигуре 8С проиллюстрирован процент волокон с центрально расположенными ядрами (CN) на срезах мышцы Tibialis anterior (ТА), вырезанной у (i) мышей A17 с инъекцией солевого раствора, (ii) мышей FvB с инъекцией солевого раствора, (iii) А17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC. Все мышечные срезы брали через 18 недель после инъекции.
На фигуре 8D проиллюстрирован процент коллаген VI-положительной области на срезах мышцы Tibialis anterior (ТА), вырезанной у (i) мышей A17 с инъекцией солевого раствора, (ii) мышей FvB с инъекцией солевого раствора, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC. На этом графике показано значительное уменьшение фиброза в мышцах, обработанных с помощью scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC.
На фигуре 8Е проиллюстрирован средний размер мышечных волокон в группе и показано, что мышечные волокна мышц, обработанных с помощью ssAAV9-opt hPABPN1-MYC отдельно или в комбинации с scAAV8-shRNAx3-long, больше, чем мышечные волокна, обработанные солевым раствором (среднее значение ± SEM n=5-8, однофакторный дисперсионный анализ с ретроспективным критерием Бонферрони или анализ Хи-квадрат, *р<0,05, ***р<0,001, ns: не достоверно).
На фигуре 8F проиллюстрировано распределение площади поперечного сечения (CSA) мышечных волокон на срезах мышцы Tibialis anterior (ТА), вырезанной у (i) мышей A17 с инъекцией солевого раствора, (ii) мышей FvB с инъекцией солевого раствора, (iii) A17, обработанных scAAV8-shRNAx3-long, (iv) A17, обработанных ssAAV9 Opt-hPABPN1-MYC, и (v) A17, обработанных scAAV8-shRNAx3-long и ssAAV9 Opt-hPABPN1-MYC. Сравнение различных групп с помощью анализа Хи-квадрат указывает на изменения в распределении мышечных волокон для мышц, обработанных с использованием scAAV8-shRNAx3-long отдельно и в комбинации с ssAAV9 Opt-hPABPN1-MYC, по сравнению с животными, которым вводили только солевой раствор.
Ключ к перечню последовательностей
SEQ ID NO: 1: Последовательность РНК для области в пределах транскрипта mRNA, соответствующей белку PABPN1, обозначенная как область ImRNA PABPN1.
SEQ ID NO: 2: Последовательность РНК для области в пределах транскрипта mRNA, соответствующей белку PABPN1, обозначенная как область 2 mRNA PABPN1.
SEQ ID NO: 3: Последовательность РНК для области в пределах транскрипта mRNA, соответствующей белку PABPN1, обозначенная как область 3 mRNA PABPN1.
SEQ ID NO: 4: Эффекторная последовательность РНК для ssRNA и dsRNA, обозначенная как ssRNA 1 и dsRNA 1, соответственно.
SEQ ID NO: 5: Последовательность, комплементарная эффекторной последовательности РНК для dsRNA, обозначенная как dsRNA1.
SEQ ID NO: 6: Эффекторная последовательность РНК для ssRNA и dsRNA, обозначенная как ssRNA2 и dsRNA2, соответственно.
SEQ ID NO: 7: Последовательность, комплементарная эффекторной последовательности РНК для dsRNA, обозначенная как dsRNA2.
SEQ ID NO: 8: Эффекторная последовательность РНК для ssRNA и dsRNA, обозначенная как ssRNA3 и dsRNA3, соответственно.
SEQ ID NO: 9: Последовательность, комплементарная эффекторной последовательности РНК для dsRNA, обозначенная как dsRNA3.
SEQ ID NO: 10: Эффекторная последовательность РНК для shRNA, обозначенная как shRNA1 и shRNA2.
SEQ ID NO: 11: Последовательность, комплементарная эффекторной последовательности РНК для shRNA, обозначенная как shRNA1 и shRNA2.
SEQ ID NO: 12: Эффекторная последовательность РНК для shRNA, обозначенная как shRNA3 и shRNA4.
SEQ ID NO: 13: Последовательность, комплементарная эффекторной последовательности РНК для shRNA, обозначенная как shRNA3 и shRNA4.
SEQ ID NO: 14: Эффекторная последовательность РНК для shRNA, обозначенная как shRNA5 и shRNA6.
SEQ ID NO: 15: Последовательность, комплементарная эффекторной последовательности РНК для shRNA, обозначенная как shRNA5 и shRNA6.
SEQ ID NO: 16: Последовательность РНК для shRNA, обозначенная как shRNA1. SEQ ID NO: 17: Последовательность РНК для shRNA, обозначенная как shRNA2.
SEQ ID NO: 18: Последовательность РНК для shRNA, обозначенная как shRNA3.
SEQ ID NO: 19: Последовательность РНК для shRNA, обозначенная как shRNA4.
SEQ ID NO: 20: Последовательность РНК для shRNA, обозначенная как shRNA5.
SEQ ID NO: 21: Последовательность РНК для shRNA, обозначенная как shRNA6.
SEQ ID NO: 22: Последовательность ДНК для OPMD Тройная короткая конструкция.
SEQ ID NO: 23: Последовательность ДНК для OPMD Тройная длинная конструкция.
SEQ ID NO: 24: Последовательность ДНК для кодон-оптимизированной последовательности cDNA PABPN1 человека.
SEQ ID NO: 25: Аминокислотная последовательность для кодон-оптимизированного белка PABPN1 человека.
SEQ ID NO: 26: Последовательность ДНК для кодон-оптимизированной последовательности cDNA PABPN1 человека (с Мус-меткой).
SEQ ID NO: 27: Аминокислотная последовательность для кодон-оптимизированного белка PABPN1 человека (с Мус-меткой).
SEQ ID NO: 28: Последовательность cDNA для мутантного белка PABPN1 человека (с FLAG-меткой).
SEQ ID NO: 29: Аминокислотная последовательность для мутантного белка PABPN1 человека (с FLAG-меткой).
Подробное описание изобретения
Общая информация
По всему настоящему описанию, если конкретно не указано иное или контекст не требует иного, ссылку на одну стадию, признак, химическое соединение, группу стадий или группу признаков или химических соединений следует учитывать с охватом одного и множества (т.е. одного или нескольких) таких стадий, признаков, химических соединений, групп стадий или групп признаков или химических соединений.
Специалистам в данной области техники будет понятно, что настоящее изобретение допускает различные варианты и модификации, отличные от тех, которые конкретно описаны. Следует понимать, что настоящее изобретение включает все такие варианты и модификации. Настоящее изобретение также включает все стадии, признаки, композиции и соединения, упомянутые или указанные в настоящем описании индивидуально или совместно, и любые возможные комбинации или любые два или более из указанных стадий или признаков.
Настоящее изобретение не должно ограничиваться объемом конкретных примеров, описанных в данном документе, которые предназначены только для иллюстративных целей. Функционально эквивалентные продукты, композиции и способы явно входят в объем настоящего изобретения.
Любой пример настоящего изобретения в данном документе должен применяться mutatis mutandis к любому другому примеру настоящего изобретения, если конкретно не указано иное.
Если конкретно не определено иначе, все технические и научные термины, используемые в данном документе, должны принимать то значение, которое обычно понимается специалистом в данной области техники (например, в культивировании клеток, молекулярной генетике, иммунологии, иммуногистохимии, химии белка и биохимии).
Если не указано иное, рекомбинантная ДНК, рекомбинантный белок, культивирование клеток и иммунологические методики, используемые в настоящем раскрытии, являются стандартными процедурами, хорошо известными специалистам в данной области техники. Такие методики описаны и объясняются в литературе в таких источниках, как J. Perbal, A Practical Guide to Molecular Cloning, John Wiley and Sons (1984), J. Sambrook et al. Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989), T.A. Brown (editor). Essential Molecular Biology: A Practical Approach, Volumes 1 and 2, IRL Press (1991), D.M. Glover and B.D. Hames (editors), DNA Cloning: A Practical Approach, Volumes 1-4, IRL Press (1995 and 1996) и F.M. Ausubel et al. (editors). Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience (1988, включая все редакции до настоящего времени), Ed Harlow and David Lane (editors) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, (1988) и J.E. Coligan et al. (editors) Current Protocols in Immunology, John Wiley & Sons (включая все редакции до настоящего времени).
По всему настоящему описанию, если контекст не требует иного, слово "содержать" или варианты, такие как "содержит" и "содержащий", будут пониматься как подразумевающие включение заявленной стадии или элемента или целого числа или группы стадий или элементов или целых чисел, но не исключение любой другой стадии или элемента или целого числа или группы элементов или целых чисел.
Термин "и/или", например, "X и/или Y" следует понимать как "X и Y" или "X или Y" и следует принимать для обеспечения явной поддержки обоих значений или любого из значений.
Отдельные определения
Под "РНК" понимают молекулу, содержащую по меньшей мере один рибонуклеотидный остаток. Под "рибонуклеотидом" понимают нуклеотид с гидроксильной группой в 2'-положении β-D-рибофуранозного фрагмента. Термины включают двухнитевую РНК, однонитевую РНК, выделенную РНК, такую как частично очищенная РНК, по существу чистая РНК, синтетическая РНК, рекомбинантно продуцируемая РНК, а также измененная РНК, которая отличается от встречающейся в природе РНК добавлением, делецией, заменой и/или изменением одного или нескольких нуклеотидов. Такие изменения могут включать добавление материала, отличного от нуклеотидного, например, к концу(концам) РНК или внутрь, например, к одному или нескольким нуклеотидам РНК. Нуклеотиды в молекулах РНК по настоящему изобретению могут также содержать нестандартные нуклеотиды, такие как невстречающиеся в природе нуклеотиды или химически синтезированные нуклеотиды или дезоксинуклеотиды. Эти измененные РНК можно назвать аналогами или аналогами встречающейся в природе РНК.
Используемый в данном документе термин "реагент для RNAi" относится к РНК, которая способна вызывать "РНК-интерференцию" или "RNAi".
Термин "РНК-интерференция" или "RNAi" в целом относится к РНК-зависимому сайленсингу экспрессии генов, инициированному молекулами двухнитевой РНК (dsRNA) и молекулами однонитевой малой интерферирующей РНК (ss-siRNA) в цитоплазме клетки. Молекула dsRNA или молекула ss-siRNA снижает или подавляет продукты транскрипции целевой последовательности нуклеиновой кислоты, за счет этого обеспечивая сайленсинг гена.
Используемый в данном документе термин "двухнитевая РНК" или "dsRNA" относится к молекуле РНК, имеющей структуру дуплекса и содержащую эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, которые имеют схожую длину друг с другом. Эффекторная последовательность и последовательность, комплементарная эффекторной последовательности, могут находиться в одной нити РНК или в отдельных нитях РНК. "Эффекторная последовательность" (часто называемая "направляющей нитью") по существу комплементарна целевой последовательности, которая в данном случае представляет собой область транскрипта mRNA PABPN1. "Эффекторная последовательность" также может упоминаться как "антисмысловая последовательность". "Последовательность, комплементарная эффекторной последовательности" будет достаточно комплементарной эффекторной последовательности, так что ее можно отжечь с эффекторной последовательностью с образованием дуплекса. В этом отношении последовательность, комплементарная эффекторной последовательности, будет по существу гомологична области целевой последовательности. Как будет очевидно специалисту в данной области техники, термин "последовательность, комплементарная эффекторной последовательности" также может упоминаться как "комплемент эффекторной последовательности", или смысловая последовательность, или последовательность сопровождающей нити.
Используемый в данном документе термин "дуплекс" относится к областям в двух комплементарных или по существу комплементарных нуклеиновых кислотах (например, РНК), или в двух комплементарных или по существу комплементарных областях однонитевой нуклеиновой кислоты (например, РНК), которые образуют пары оснований друг с другом либо путем спаривания оснований по Уотсону-Крику, либо любым другим способом, который обеспечивает стабилизированный дуплекс между нуклеотидными последовательностями, которые являются комплементарными или по существу комплементарными. Специалисту в данной области техники должно быть понятно, что в области дуплекса 100%-ная комплементарность не требуется; допустима существенная комплементарность. Существенная комплементарность может включать 69%-ную комплементарность или более. Например, одно ошибочное спаривание в области дуплекса, состоящей из 19 пар оснований (т.е. 18 пар оснований и одного ошибочного спаривания), приводит в результате к комплементарности 94,7%, что делает область дуплекса по существу комплементарной. В другом примере два ошибочных спаривания в области дуплекса, состоящей из 19 пар оснований (т.е. 17 пар оснований и двух ошибочных спариваний), приводят в результате к комплементарности 89,5%, что делает область дуплекса по существу комплементарной. В еще одном примере три ошибочных спаривания в области дуплекса, состоящей из 19 пар оснований (т.е. 16 пар оснований и трех ошибочных спариваний), приводят в результате к комплементарности 84,2%, что делает область дуплекса по существу комплементарной и т.д.
dsRNA может быть предоставлена в виде структуры шпильки или стебель-петля с областью дуплекса, состоящей из эффекторной последовательности и последовательности, комплементарной эффекторной последовательности, связанной последовательностью из по меньшей мере 2 нуклеотидов, которая называется стебель-петля. Когда dsRNA предоставлена в виде структуры шпильки или стебель-петля, ее можно называть "шпилечная РНК" или "короткое шпилечное средство для RNAi" или "shRNA". Другие молекулы dsRNA, представленные в виде структуры шпильки или стебель-петля, или которые приводят к их образованию, включают первичные транскрипты miRNA (pri-miRNA) и предшественники microRNA (pre-miRNA). Pre-miRNA shRNA могут быть естественным образом получены из pri-miRNA под действием ферментов Drosha и Pasha, которые распознают и удаляют области первичного транскрипта miRNA, которые образуют структуру стебель-петля. В качестве альтернативы, транскрипт pri-miRNA можно сконструировать таким образом, чтобы заменить природную структуру стебель-петля искусственной/рекомбинантной структурой стебель-петля. В этом случае Drosha и Pasha распознают и удаляют искусственную shRNA. Молекулы dsRNA, полученные с использованием этого подхода, известны как "shmiRNA", "shmiR" или "microRNA-каркасы shRNA".
Используемый в данном документе термин "однонитевая малая интерферирующая РНК", "ss-siRNA", "однонитевая РНК", "ssRNA" или аналогичный относится к молекуле РНК, имеющей однонитевую структуру и содержащей эффекторную последовательность. Как описано в данном документе для молекул dsRNA, "эффекторная последовательность" (часто называемая "антисмысловой последовательностью" или "направляющей нитью") по существу комплементарна целевой последовательности, которая в данном случае представляет собой область транскрипта mRNA PABPN1. Однако, в отличие от реагентов для RNAi, имеющих структуру дуплекса, ssRNA не содержат последовательность, комплементарную эффекторной последовательности.
Используемый в данном документе термин "комплементарный" в отношении последовательности относится к комплементу последовательности при спаривании оснований по Уотсону-Крику, согласно которому гуанин (G) образует пару с цитозином (С) и аденин (А) образует пару либо с урацилом (U), либо с тимином (Т). Последовательность может быть комплементарной всей длине другой последовательности или может быть комплементарной определенной части или длине другой последовательности. Специалисту в данной области техники будет понятно, что U может присутствовать в РНК и что Т может присутствовать в ДНК. Следовательно, А в пределах последовательности РНК или ДНК может образовывать пару с U в последовательности РНК или Т в последовательности ДНК.
Используемый в данном документе термин "по существу комплементарный" используется для обозначения достаточной степени комплементарности или точного спаривания, так что происходит стабильное и специфическое связывание между последовательностями нуклеиновой кислоты, например, между эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности, или между эффекторной последовательностью и целевой последовательностью. Понятно, что последовательность нуклеиновой кислоты не обязательно должна быть на 100% комплементарной последовательности ее мишени или комплемента. Этот термин охватывает последовательность, комплементарную другой последовательности за исключением липкого конца. В некоторых случаях последовательность комплементарна другой последовательности за исключением 1-2 ошибочных спариваний. В некоторых случаях последовательности являются комплементарными за исключением 1 ошибочного спаривания. В некоторых случаях последовательности являются комплементарными за исключением 2 ошибочных спариваний. В других случаях последовательности являются комплементарными за исключением 3 ошибочных спариваний. В других случаях последовательности являются комплементарными за исключением 4 ошибочных спариваний.
Термин "кодированный" или "кодирующий", используемый в контексте РНК по настоящему изобретению, следует понимать как означающий то, что РНК способна транскрибироваться с матрицы ДНК. Соответственно, нуклеиновая кислота, которая кодирует или предназначена для РНК по настоящему изобретению, будет содержать последовательность ДНК, которая служит в качестве матрицы для транскрипции соответствующей РНК.
Термин "конструкция для ДНК-направленной RNAi" или "конструкция для ddRNAi" относится к нуклеиновой кислоте, содержащей последовательность ДНК, которая при транскрибировании продуцирует молекулу РНК, вызывающую RNAi. Конструкция для ddRNAi может содержать нуклеиновую кислоту, которая транскрибируется как единичная РНК, которая способна к самоотжигу в структуру шпильки с областью дуплекса, связанной с помощью стебля-петли из по меньшей мере 2 нуклеотидов, т.е. shRNA, или как единичная РНК с множеством shRNA, или как множество транскриптов РНК, каждый из которых способен сворачиваться как единичная shRNA, соответственно. Конструкция для ddRNAi может находиться внутри вектора экспрессии, т.е. "экспрессирующая конструкция для ddRNAi", например, функционально связанная с промотором.
Используемый в данном документе термин "функционально связанный" или "функциональная связь" (или аналогичный) означает, что кодирующая последовательность нуклеиновой кислоты связана с регуляторной последовательностью, например, промотором, или находится в ассоциации с ней способом, который облегчает экспрессию кодирующей последовательности. Регуляторные последовательности включают промоторы, энхансеры и другие элементы контроля экспрессии, которые признаны в данной области техники и выбраны для управления экспрессией кодирующей последовательности.
Под "вектором" понимают среду-носитель для введения нуклеиновой кислоты в клетку. Векторы включают без ограничения плазмиды, фагмиды, вирусы, бактерии и среды-носители, полученные из вирусных или бактериальных источников. "Плазмида" представляет собой кольцевую двухнитевую молекулу ДНК. Пригодным типом вектора для применения в соответствии с настоящим изобретением является вирусный вектор, где гетерологичные последовательности ДНК вставляют в вирусный геном, который можно модифицировать для удаления одного или нескольких вирусных генов или их частей. Определенные векторы способны к автономной репликации в клетке-хозяине (например, векторы с точкой начала репликации, которая функционирует в клетке-хозяине). Другие векторы могут быть стабильно интегрированы в геном клетки-хозяина и, таким образом, реплицируются вместе с геномом хозяина. Другие векторы сохраняются во внехромосомном состоянии без интеграции в геном клетки-хозяина. Используемый в данном документе термин "вектор экспрессии" будет пониматься в значении вектора, способного экспрессировать молекулу РНК по настоящему изобретению.
"Функциональный белок PABPN1" следует понимать как белок PABPN1, обладающий функциональными свойствами белка PABPN1 дикого типа, например, способностью контролировать сайт полиаденилирования mRNA и/или сплайсинг интронов в клетке млекопитающего. Соответственно, "функциональный белок PABPN1" будет пониматься как белок PABPN1, который не является причиной OPMD при экспрессии или присутствии у субъекта. В одном примере ссылка в данном документе на "функциональный белок PABPN1" является ссылкой на белок PABPN1 человека дикого типа. Последовательность белка PABPN1 человека дикого типа приведена в NCBI RefSeq NP_004634. Соответственно, функциональный белок PABPN1 человека может обладать in vivo функциональными свойствами белка PABPN1 человека, указанного в NCBI RefSeq NP_004634.
Используемые в данном документе термины "осуществление лечения", "лечить" или "лечение" и их варианты относятся к клиническому вмешательству, предназначенному для изменения естественного поведения индивидуума или клетки, подвергающихся лечению, в ходе клинической патологии. Желательные эффекты лечения включают снижение скорости прогрессирования заболевания, улучшение или ослабление болезненного состояния, ремиссию или улучшение прогноза. Из этого следует, что лечение OPMD включает снижение или подавление экспрессии белка PABPN1, который является причиной OPMD у субъекта, и/или экспрессию у субъекта белка PABPN1, имеющего нормальную длину полиаланиновых остатков. Предпочтительно, лечение OPMD включает снижение или подавление экспрессии белка PABPN1, который является причиной OPMD у субъекта, и экспрессию у субъекта белка PABPN1, имеющего нормальную длину полиаланиновых остатков. Индивидуум является успешно "вылеченным", например, если достигается один или несколько из вышеуказанных результатов лечения.
"Терапевтически эффективное количество" представляет собой по меньшей мере минимальную концентрацию или количество, необходимые для достижения измеримого улучшения состояния OPMD, такого как измеримое улучшение одного или нескольких симптомов OPMD, например, включая без ограничения птоз, дисфагию и слабость мышц у субъекта. Терапевтически эффективное количество в данном документе может варьироваться в зависимости от таких факторов, как стадия заболевания, возраст, пол и вес пациента, а также способность РНК, ddRNAi или экспрессирующей конструкции вызывать желаемый ответ у индивидуума и/или способность вектора экспрессии экспрессировать функциональный белок PABPN1 у субъекта. Терапевтически эффективное количество также является таким количеством, при котором любые токсичные или вредные эффекты РНК, конструкции для ddRNAi или экспрессирующего вектора перевешиваются терапевтически благоприятными эффектами РНК, конструкции для ddRNAi или экспрессирующего вектора по ингибированию, подавлению или снижению экспрессии белка PABPN1, являющегося причиной OPMD, рассматриваемыми отдельно или в комбинации с терапевтически благоприятными эффектами экспрессии функционального белка PABPN1 у субъекта.
Используемый в данном документе термин "субъект" или "пациент" может быть человеком или животным, отличным от человека, страдающим OPMD или генетически предрасположенным к ней, т.е. иметь вариант гена PABPN1, который является причиной OPMD. "Животное, отличное от человека" может быть приматом, сельскохозяйственным животным (например, овцы, лошади, крупный рогатый скот, свиньи, ослы), животным-компаньоном (например, домашние животные, такие как собаки и кошки), лабораторным животным для испытаний (например, мыши, кролики, крысы, свиньи, дрозофилы, С. elegans, рыбки данио), животным-исполнителем (например, скаковые лошади, верблюды, борзые) или содержащимся в неволе диким животным. В одном примере субъект или пациент является млекопитающим. В одном примере субъект или пациент является человеком.
Термины "сниженная экспрессия", "снижение экспрессии" или аналогичные, относятся к отсутствию или наблюдаемому снижению уровня белка и/или продукта mRNA с целевого гена, например, гена PABPN1. Снижение не должно быть абсолютным, но может быть частичным снижением, достаточным для того, чтобы было выявляемое или наблюдаемое изменение в результате RNAi, осуществляемой с помощью РНК по настоящему изобретению. Снижение можно измерить путем определения снижения уровня mRNA и/или белкового продукта целевой нуклеиновой кислоты относительно клетки, не содержащей РНК, конструкцию ddRNAi или вектор экспрессии, и может составлять всего лишь 1%, 5% или 10%, или может быть абсолютным, т.е. 100% подавлением. Эффекты снижения можно определить путем изучения внешних свойств, т.е. количественного и/или качественного фенотипа клетки или организма, а также могут включать выявление присутствия или изменения количества ядерных агрегатов expPABPN1 в клетке или организме после введения РНК, конструкции для ddRNAi или вектора экспрессии по настоящему изобретению.
Средства для RNAi
В одном примере настоящее изобретение предусматривает РНК, т.е. способную вызывать RNAi, где РНК содержит эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под любым из SEQ ID NO: 1-3. Предпочтительно, РНК по настоящему изобретению будет содержать эффекторную последовательность, которая имеет длину менее 30 нуклеотидов. Например, подходящие эффекторные последовательности могут находиться в диапазоне 17-29 нуклеотидов в длину.
В одном примере эффекторная последовательность по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под SEQ ID NO: 1. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и содержать 6 ошибочно спаренных оснований относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и содержать 5 ошибочно спаренных оснований относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и содержать 4 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и содержать 3 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и содержать 2 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и содержать 1 ошибочно спаренное основание относительно нее. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 1.
В одном примере эффекторная последовательность по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под SEQ ID NO: 2. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, и содержать 6 ошибочно спаренных оснований относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, и содержать 5 ошибочно спаренных оснований относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, и содержать 4 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, и содержать 3 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, и содержать 2 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, и содержать 1 ошибочно спаренное основание относительно нее. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 2.
В одном примере эффекторная последовательность по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под SEQ ID NO: 3. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 3, и содержать 6 ошибочно спаренных оснований относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 3, и содержать 5 ошибочно спаренных оснований относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 3, и содержать 4 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 3, и содержать 3 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 3, и содержать 2 ошибочно спаренных основания относительно нее. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 3, и содержать 1 ошибочно спаренное основание относительно нее. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 3.
В одном примере РНК по настоящему изобретению представляет собой однонитевую РНК (ssRNA).
ssRNA в соответствии с настоящим изобретением может содержать эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под любым из SEQ ID NO: 1-3. Например, ssRNA по настоящему изобретению может содержать эффекторную последовательность, содержащую или состоящую из последовательности, которая по существу идентична последовательности, приведенной под SEQ ID NO: 4, 6 или 8.
В одном примере ssRNA по настоящему изобретению может содержать эффекторную последовательность, содержащую или состоящую из последовательности, которая по существу идентична последовательности, приведенной под SEQ ID NO: 4. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 4, и содержать 6 оснований, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 4, и содержать 5 оснований, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 4, и содержать 4 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 4, и содержать 3 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 4, и содержать 2 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 4, и содержать 1 основание, которое изменено относительно нее. Например, эффекторная последовательность может быть на 100% идентична последовательности, приведенной под SEQ ID NO: 4
В одном примере ssRNA по настоящему изобретению может содержать эффекторную последовательность, содержащую или состоящую из последовательности, которая по существу идентична последовательности, приведенной под SEQ ID NO: 6. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 6, и содержать 6 оснований, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 6, и содержать 5 оснований, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 6, и содержать 4 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 6, и содержать 3 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 6, и содержать 2 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 6, и содержать 1 основание, которое изменено относительно нее. Например, эффекторная последовательность может быть на 100% идентична последовательности, приведенной под SEQ ID NO: 6
В одном примере ssRNA по настоящему изобретению может содержать эффекторную последовательность, содержащую или состоящую из последовательности, которая по существу идентична последовательности, приведенной под SEQ ID NO: 8. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 8, и содержать 6 оснований, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 8, и содержать 5 оснований, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 8, и содержать 4 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 8, и содержать 3 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 8, и содержать 2 основания, которые изменены относительно нее. Например, эффекторная последовательность может быть по существу идентична последовательности, приведенной под SEQ ID NO: 8, и содержать 1 основание, которое изменено относительно нее. Например, эффекторная последовательность может быть на 100% идентична последовательности, приведенной под SEQ ID NO: 8.
В одном примере РНК по настоящему изобретению, которая способна вызывать RNAi, представляет собой двухнитевую РНК (dsRNA). dsRNA в соответствии с настоящим изобретением будет содержать эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность содержит по меньшей мере 17 смежных нуклеотидов, которые по существу комплементарны области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под любым из SEQ ID NO: 1-3.
Иллюстративные dsRNA в соответствии с настоящим изобретением содержат эффекторную последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 3, т.е. SEQ ID NO: 5, 7 и 9.
В одном примере настоящее изобретение предусматривает dsRNA, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 5. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 5, за исключением 6 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 5, за исключением 5 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 5, за исключением 4 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 5, за исключением 3 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 5, за исключением 2 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 5, за исключением одного ошибочно спаренного основания. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 5.
В одном примере настоящее изобретение предусматривает dsRNA, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 7. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 7, за исключением 6 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 7, за исключением 5 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 7, за исключением 4 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 7, за исключением 3 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 7, за исключением 2 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 7, за исключением одного ошибочно спаренного основания. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 7.
В одном примере настоящее изобретение предусматривает dsRNA, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 9. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 9, за исключением 6 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 9, за исключением 5 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 9, за исключением 4 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 9, за исключением 3 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 9, за исключением 2 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 9, за исключением одного ошибочно спаренного основания. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 9.
Если dsRNA по настоящему изобретению содержит эффекторную последовательность, которая по существу комплементарна последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 3, за исключением 1, 2, 3, 4, 5 или 6 ошибочных спариваний (как описано в данном документе), эффекторная последовательность будет по-прежнему иметь возможность образовывать дуплекс с соответствующей последовательностью, комплементарной эффекторной последовательности в таблице 3.
В одном примере настоящее изобретение предусматривает dsRNA, содержащую эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность представляет собой последовательность, описанную в колонке, обозначенной "Эффекторная последовательность", в таблице 3, т.е. выбранную из SEQ ID NO: 4, 6 и 8, и последовательность, комплементарная эффекторной последовательности, из dsRNA по существу комплементарна ее эффекторной последовательности. Например, последовательность, комплементарная эффекторной последовательности, из РНК может содержать 1, 2, 3, 4, 5 или 6 ошибочных спариваний относительно родственной эффекторной последовательности, но все еще способна образовывать с ней дуплекс.
В одном примере dsRNA может содержать эффекторную последовательность, приведенную под SEQ ID NO: 4, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна ей за исключением 1, 2, 3, 4, 5 или 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 4, за исключением 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 4, за исключением 5 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 4, за исключением 4 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 4, за исключением 3 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 4, за исключением 2 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 4, за исключением одного ошибочно спаренного основания. Например, последовательность, комплементарная эффекторной последовательности, может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 4.
В одном примере dsRNA может содержать эффекторную последовательность, приведенную под SEQ ID NO: 6, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна ей за исключением 1, 2, 3, 4, 5 или 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 6, за исключением 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 6, за исключением 5 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 6, за исключением 4 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 6, за исключением 3 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 6, за исключением 2 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 6, за исключением одного ошибочно спаренного основания. Например, последовательность, комплементарная эффекторной последовательности, может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 6.
В одном примере dsRNA может содержать эффекторную последовательность, приведенную под SEQ ID NO: 8, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна ей за исключением 1, 2, 3, 4, 5 или 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 8, за исключением 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 8, за исключением 5 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 8, за исключением 4 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 8, за исключением 3 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 8, за исключением 2 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 8, за исключением одного ошибочно спаренного основания. Например, последовательность, комплементарная эффекторной последовательности, может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 8.
Иллюстративные dsRNA в соответствии с настоящим изобретением содержат соответствующие эффекторные последовательности и последовательности, комплементарные эффекторным последовательностям, как описано в колонках таблицы 3, обозначенных "Эффекторная последовательность" и "Последовательность, комплементарная эффекторной последовательности", соответственно. В одном примере соответствующие эффекторные последовательности и последовательности, комплементарные эффекторным последовательностям, из dsRNA могут быть предусмотрены в виде отдельных нуклеиновых кислот, которые образуют дуплекс, например, путем спаривания оснований по Уотсону-Крику.
Иллюстративная РНК по настоящему изобретению, которая представляет собой dsRNA, содержит эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 4, и последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 5.
Иллюстративная РНК по настоящему изобретению, которая представляет собой dsRNA, содержит эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 6, и последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 7.
Иллюстративная РНК по настоящему изобретению, которая представляет собой dsRNA, содержит эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 8, и последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 9.
РНК по настоящему изобретению, которая способна вызывать RNAi, также может быть предусмотрена в виде короткой шпилечной РНК (shRNA). shRNA в соответствии с данным примером настоящего изобретения будет содержать эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность содержит по меньшей мере 17 смежных нуклеотидов, которые по существу комплементарны области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под любым из SEQ ID NO: 1-3.
Иллюстративная shRNA в соответствии с настоящим изобретением содержит эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность по существу комплементарна последовательности, комплементарной эффекторной последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, т.е. SEQ ID NO: 11, 13 и 15.
В одном примере настоящее изобретение предусматривает shRNA, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 11. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 11, за исключением 6 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 11, за исключением 5 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 11, за исключением 4 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 11, за исключением 3 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 11, за исключением 2 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 11, за исключением одного ошибочно спаренного основания. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 11.
В одном примере настоящее изобретение предусматривает shRNA, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 13. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 13, за исключением 6 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 13, за исключением 5 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 13, за исключением 4 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 13, за исключением 3 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 13, за исключением 2 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 13, за исключением одного ошибочно спаренного основания. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 13.
В одном примере настоящее изобретение предусматривает shRNA, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под SEQ ID NO: 15. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 15, за исключением 6 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 15, за исключением 5 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 15, за исключением 4 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 15, за исключением 3 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 15, за исключением 2 ошибочно спаренных оснований. Например, эффекторная последовательность может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 15, за исключением одного ошибочно спаренного основания. Например, эффекторная последовательность может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 15.
Если shRNA по настоящему изобретению содержит эффекторную последовательность, которая по существу комплементарна последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, за исключением 1, 2, 3, 4, 5 или 6 ошибочных спариваний (как описано в данном документе), эффекторная последовательность будет по-прежнему иметь возможность образовывать область дуплекса с соответствующей последовательностью, комплементарной эффекторной последовательности, в таблице 4.
В другом примере настоящее изобретение предусматривает shRNA, содержащую эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность представляет собой последовательность, описанную в колонке, обозначенной "Эффекторная последовательность", в таблице 4, т.е. выбранную из SEQ ID NO: 10, 12 и 14, и последовательность, комплементарная эффекторной последовательности, из shRNA по существу комплементарна ее эффекторной последовательности. Например, последовательность, комплементарная эффекторной последовательности, из shRNA может содержать 1, 2, 3, 4, 5 или 6 ошибочных спариваний относительно родственной эффекторной последовательности, но все еще способна образовывать с ней дуплекс.
В одном примере shRNA может содержать эффекторную последовательность, приведенную под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна ей за исключением 1, 2, 3, 4, 5 или 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 10, за исключением 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 10, за исключением 5 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 10, за исключением 4 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 10, за исключением 3 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 10, за исключением 2 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 10, за исключением одного ошибочно спаренного основания. Например, последовательность, комплементарная эффекторной последовательности, может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 10.
В одном примере shRNA может содержать эффекторную последовательность, приведенную под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна ей за исключением 1, 2, 3, 4, 5 или 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 12, за исключением 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 12, за исключением 5 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 12, за исключением 4 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 12, за исключением 3 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 12, за исключением 2 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 12, за исключением одного ошибочно спаренного основания. Например, последовательность, комплементарная эффекторной последовательности, может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 12.
В одном примере shRNA может содержать эффекторную последовательность, приведенную под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна ей за исключением 1, 2, 3, 4, 5 или 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 14, за исключением 6 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 14, за исключением 5 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 14, за исключением 4 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 14, за исключением 3 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 14, за исключением 2 ошибочно спаренных оснований. Например, последовательность, комплементарная эффекторной последовательности, может быть по существу комплементарна последовательности, приведенной под SEQ ID NO: 14, за исключением одного ошибочно спаренного основания. Например, последовательность, комплементарная эффекторной последовательности, может быть на 100% комплементарна последовательности, приведенной под SEQ ID NO: 14.
Если РНК по настоящему изобретению предусмотрена в виде shRNA, последовательность стебель-петля будет располагаться между соответствующей эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности, так что соответствующая РНК образует единую непрерывную последовательность. Последовательность стебель-петля имеет достаточную длину, чтобы позволить эффекторной последовательности и последовательности, комплементарной эффекторной последовательности, отжигаться друг с другом, т.е. образовывать область дуплекса путем спаривания оснований по Уотсону-Крику. Подходящие последовательности стебель-петля можно, например, выбрать из известных из уровня техники.
Иллюстративные shRNA в соответствии с настоящим изобретением содержат соответствующие эффекторные последовательности и последовательности, комплементарные эффекторным последовательностям, как описано в колонках таблицы 4, обозначенных "Эффекторная последовательность" и "Последовательность, комплементарная эффекторной последовательности", соответственно. Такие иллюстративные shRNA могут содержать последовательность, приведенную в таблице 5, необязательно модифицированную, как описано в данном документе.
Иллюстративная РНК по настоящему изобретению, которая представляет собой shRNA, содержит эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 11. shRNA в соответствии с этим примером может содержать или состоять из последовательности, приведенной под SEQ ID NO: 16. В качестве альтернативы, shRNA в соответствии с этим примером может содержать или состоять из последовательности, приведенной под SEQ ID NO: 17.
Иллюстративная РНК по настоящему изобретению, которая представляет собой shRNA, содержит эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 13. shRNA в соответствии с этим примером может содержать или состоять из последовательности, приведенной под SEQ ID NO: 18. В качестве альтернативы, shRNA в соответствии с этим примером может содержать или состоять из последовательности, приведенной под SEQ ID NO: 19.
Иллюстративная РНК по настоящему изобретению, которая представляет собой shRNA, содержит эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 15. shRNA в соответствии с этим примером может содержать или состоять из последовательности, приведенной под SEQ ID NO: 20. В качестве альтернативы, shRNA в соответствии с этим примером может содержать или состоять из последовательности, приведенной под SEQ ID NO: 21.
Каждая из описанных в данном документе shRNA может необязательно дополнительно содержать два смежных урацила (UU) с 3'-конца shRNA, например, в результате терминации транскрипции с промотора RNA Pol III.
Настоящее изобретение также предусматривает множество РНК, т.е. способных вызывать RNAi, где каждая из РНК содержит эффекторную последовательность по меньшей мере из 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, который является причиной OPMD, и по меньшей мере одна РНК из множества представляет собой РНК, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под любым из SEQ ID NO: 1-3, как описано в данном документе. Предпочтительно, каждая РНК из множества содержит эффекторную последовательность, которая имеет длину менее 30 нуклеотидов. Например, подходящие эффекторные последовательности могут находиться в диапазоне 17-29 нуклеотидов в длину.
Иллюстративные РНК, включая ssRNA, dsRNA и shRNA, содержащие эффекторную последовательность, которая по существу комплементарна последовательности, приведенной под любым из SEQ ID NO: 1-3, были описаны и должны применяться mutatis mutandis к этому примеру настоящего изобретения.
Множество РНК в соответствии с настоящим изобретением может предусматривать две РНК, описанные в данном документе. В другом примере множество РНК в соответствии с настоящим изобретением может предусматривать три из РНК, описанных в данном документе.
Таким образом, множество РНК в соответствии с настоящим изобретением может предусматривать одну или несколько из описанных в данном документе РНК, содержащих эффекторную последовательность, имеющую по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, который является причиной OPMD, как приведено в таблице 1.
В одном примере эффекторная последовательность по меньшей мере одной РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 1.
В одном примере эффекторная последовательность по меньшей мере одной РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 2.
В одном примере эффекторная последовательность по меньшей мере одной РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 3.
В одном примере эффекторная последовательность по меньшей мере одной РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и эффекторная последовательность другой РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 2.
В одном примере эффекторная последовательность по меньшей мере одной РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и эффекторная последовательность другой РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 3.
В одном примере эффекторная последовательность по меньшей мере одной РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, и эффекторная последовательность другой РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 3.
В одном примере эффекторная последовательность по меньшей мере одной РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 1, и эффекторная последовательность другой РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 2, и эффекторная последовательность еще одной РНК во множестве по существу комплементарна последовательности, приведенной под SEQ ID NO: 3.
Иллюстративные РНК, включая ssRNA, dsRNA, shRNA и shmiRNA, которые содержат эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна последовательности, приведенной в одном из SEQ ID NO: 1-3, описаны в данном документе.
В одном примере настоящее изобретение предусматривает множество РНК, которые представляют собой ssRNA, каждая из которых содержит эффекторную последовательность, по существу идентичную эффекторной последовательности, приведенной в колонке, обозначенной "Эффекторная последовательность", в таблице 2.
Иллюстративное множество ssRNA по настоящему изобретению предусматривает
(i) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 4; и
(ii) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 6.
Иллюстративное множество ssRNA по настоящему изобретению предусматривает
(i) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 4; и
(ii) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 8.
Иллюстративное множество ssRNA по настоящему изобретению предусматривает
(i) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 6; и
(ii) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 8.
Иллюстративное множество ssRNA по настоящему изобретению предусматривает
(i) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 4;
(ii) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 6; и
(iii) ssRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 8.
В одном примере настоящее изобретение предусматривает множество РНК, которые представляют собой dsRNA, каждая из которых содержит эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность каждой РНК по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 3. Например, эффекторная последовательность каждой dsRNA может содержать или состоит из последовательности, приведенной в колонке, обозначенной "Эффектор", в таблице 3. Родственная последовательность, комплементарная эффекторной последовательности, может содержать или состоять из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 3.
Иллюстративные dsRNA, содержащие эффекторную последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 3, описаны в данном документе.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 4, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 5; и
(ii) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 6, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 7.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 4, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 5; и
(ii) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 8, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 9.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 6, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 7; и
(ii) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 8, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 9.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 4, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 5;
(ii) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 6, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 7; и
(iii) dsRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 8, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 9.
В другом примере множество РНК по настоящему изобретению предусмотрено в виде множества shRNA, где эффекторная последовательность каждой shRNA по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. Например, эффекторная последовательность каждой shRNA может содержать или состоит из последовательности, приведенной в колонке, обозначенной "Эффектор", в таблице 4. Родственная последовательность, комплементарная эффекторной последовательности, может содержать или состоять из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4.
Иллюстративные shRNA, содержащие эффекторную последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, описаны в данном документе.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(ii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11;
(ii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(iii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Как описано в данном документе, каждая shRNA из множества будет содержать последовательность стебель-петля, расположенную между соответствующей эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности, так что shRNA образует единую непрерывную последовательность. Иллюстративные shRNA описаны в данном документе, например, в таблице 5.
В одном примере настоящее изобретение предусматривает множество РНК, где множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18.
В одном примере настоящее изобретение предусматривает множество РНК, где множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В одном примере настоящее изобретение предусматривает множество РНК, где множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В одном примере настоящее изобретение предусматривает множество РНК, где множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16;
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18; и
(iii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
Каждая из описанных в данном документе shRNA может необязательно дополнительно содержать два смежных урацила (UU) с 3'-конца shRNA, например, в результате терминации транскрипции с промотора RNA Pol III.
В другом примере множество РНК по настоящему изобретению предусмотрено в виде множества shmiRNA, где эффекторная последовательность каждой shmiRNA по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. Например, эффекторная последовательность каждой shmiRNA может содержать или состоит из последовательности, приведенной в колонке, обозначенной "Эффектор", в таблице 4. Родственная последовательность, комплементарная эффекторной последовательности, может содержать или состоять из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4.
Иллюстративные shmiRNA, содержащие эффекторную последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, описаны в данном документе.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(ii) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративное множество РНК по настоящему изобретению предусматривает
(i) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11;
(ii) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(iii) shmiRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Как описано в данном документе, каждая shmiRNA из множества будет содержать последовательность стебель-петля, расположенную между соответствующей эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности, так что shmiRNA образует единую непрерывную последовательность. Иллюстративные shmiRNA описаны в данном документе, например, в таблице 5.
В одном примере настоящее изобретение предусматривает множество РНК, где множество предусматривает или состоит из
(i) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16; и
(ii) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18.
В одном примере настоящее изобретение предусматривает множество РНК, где множество предусматривает или состоит из
(i) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16; и
(ii) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В одном примере настоящее изобретение предусматривает множество РНК, где множество предусматривает или состоит из
(i) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18; и
(ii) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В одном примере настоящее изобретение предусматривает множество РНК, где множество предусматривает или состоит из
(i) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16;
(ii) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18; и
(iii) shmiRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
Каждая из описанных в данном документе shmiRNA может необязательно дополнительно содержать два смежных урацила (UU) с 3'-конца shmiRNA, например, в результате терминации транскрипции с промотора RNA Pol III.
В соответствии с одним примером множество описанных в данном документе РНК может быть предоставлено вместе в виде единой композиции.
В соответствии с другим примером множество описанных в данном документе РНК может быть предоставлено в виде нескольких композиций. Например, каждая из РНК множества может быть предоставлена отдельно. В качестве альтернативы, по меньшей мере одна РНК из множества может быть предоставлена отдельно и две или более из множества предоставлены вместе в композиции.
РНК или множество РНК по настоящему изобретению могут предусматривать синтетические РНК или ДНК-направленные РНК (ddRNA). Синтетические РНК могут быть изготовлены способами, известными из уровня техники, такими как обычный синтез олигонуклеотидов, и могут включать химические модификации для увеличения периода полувыведения и/или эффективности средства на основе siRNA и/или для обеспечения состава для более надежной доставки. Многие химические модификации олигонуклеотидов известны и хорошо описаны в данной области техники.
В одном примере по существу все нуклеотиды РНК по настоящему изобретению являются модифицированными. В другом примере все нуклеотиды РНК по настоящему изобретению являются модифицированными. РНК по настоящему изобретению, в которых "по сути все нуклеотиды модифицированы", являются в основном, но не полностью модифицированными и могут включать не более чем 5, 4, 3, 2 или 1 немодифицированный нуклеотид.
В одном примере РНК по настоящему изобретению содержит одну или несколько выступающих областей и/или кэпирующих групп на 3'-конце, 5'-конце или на обоих концах одной или обеих нитях дуплекса. Длина выступающих областей может составлять 1-6 нуклеотидов, например, 2-6 нуклеотидов, 1-5 нуклеотидов, 2-5 нуклеотидов, 1-4 нуклеотида, 2-4 нуклеотида, 1-3 нуклеотида, 2-3 нуклеотида или 1-2 нуклеотида. Наличие выступающих концов может быть обусловлено тем, что одна нить длиннее другой, или может быть обусловлено тем, что две нити одинаковой длины расположены со сдвигом. Выступающий конец может образовывать ошибочное спаривание с целевой mRNA или он может быть комплементарным целевым последовательностям генов или может иметь другую последовательность. Первая и вторая нити также могут быть соединены, например, дополнительными основаниями с образованием "шпильки" или с помощью других линкеров, отличных от основания.
В одном примере каждый из нуклеотидов в выступающей области РНК независимо является модифицированным или немодифицированным нуклеотидом, в том числе без ограничения с сахаром с 2'-модификацией, таким как 2-F, 2'-O-метил, тимидин (Т), дезокситимидин (dT), 2'-O-метоксиэтил-5-метилуридин (Тео), 2'-O-метоксиэтиладенозин (Аео), 2'-O-метоксиэтил-5-метилцитидин (m5Ceo) и любые их комбинации. Например, последовательность выступающего конца на обоих концах каждой нити может представлять собой dTdT. Выступающий конец может образовывать ошибочное спаривание с целевой mRNA или он может быть комплементарным целевым последовательностям генов или может иметь другую последовательность.
5'- или 3'-выступающие концы смысловой нити, антисмысловой нити или обеих нитей РНК могут быть фосфорилированными. В некоторых примерах выступающий(выступающие) область(области) содержит(содержат) два нуклеотида с фосфотиоатом между двумя нуклеотидами, при этом два нуклеотида могут быть одинаковыми или различными.
В одном примере РНК по настоящему изобретению содержит только один выступающий конец, который может повышать интерферирующую активность РНК без воздействия на ее общую стабильность. Например, однонитевой выступающий конец может быть расположен с 3'-конца эффекторной последовательности или в качестве альтернативы с 3'-конца последовательности, комплементарной эффекторной последовательности. В одном примере РНК также содержит тупой конец, расположенный с 5'-конца последовательности, комплементарной эффекторной последовательности (или с 3'-конца эффекторной последовательности), или vice versa.
Модификации предусматривают, например, концевые модификации, например, модификации 5'-конца (фосфорилирование, конъюгирование, инвертированные связи) или модификации 3'-конца (конъюгирование, нуклеотиды ДНК, инвертированные связи и т.д.); модификации оснований, например, замену стабилизирующими основаниями, дестабилизирующими основаниями или основаниями, которые образуют пару оснований с расширенным репертуаром партнеров, удаление оснований (нуклеотиды с удаленным азотистым основанием) или конъюгирование оснований; модификации сахаров (например, в 2'-положении или 4'-положении) или замену сахара и/или модификации остова, в том числе модификацию или замену фосфодиэфирных связей. Конкретные примеры РНК, пригодных в настоящем изобретении, включают без ограничения РНК, содержащие модифицированные остовы или не встречающиеся в природе межнуклеозидные связи. РНК с модифицированными остовами включают, среди прочего, такие, которые не содержат атом фосфора в остове. Для целей настоящего описания и как иногда упоминается в данной области, модифицированные РНК, не содержащие атом фосфора в своем межнуклеозидном остове, также могут считаться олигонуклеозидами. В некоторых примерах модифицированная РНК будет содержать атом фосфора в своем межнуклеозидном остове. Иллюстративные патенты США, в которых изложена идея получения фосфорсодержащих связей, включают без ограничения патенты США №№7015315; 7041816; 7273933; 7321029 и патент США RE 39464.
Модифицированные остовы РНК, которые не содержат атом фосфора в своем составе, представляют собой остовы, образованные короткоцепочечными алкильными или циклоалкильными межнуклеозидными связями, смешанными гетероатомными и алкильными или циклоалкильными межнуклеозидными связями или одной или несколькими короткоцепочечными гетероатомными или гетероциклическими межнуклеозидными связями. Они включают остовы с морфолиновыми связями (частично образованные из сахарной части нуклеозида); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетильные и тиоформацетильные остовы; метиленформацетильные и тиоформацетильные остовы; алкенсодержащие остовы; сульфаматные остовы; метилениминовые и метиленгидразиновые остовы; сульфонатные и сульфонамидные остовы; амидные остовы и другие, содержащие смесь составляющих частей N, О, S и СН2. Иллюстративные патенты США, в которых изложена идея иллюстративных форм этих олигонуклеотидов, включают без ограничения патенты США №№5663312; 5633360; 5677437 и 5677439.
В других примерах РНК по настоящему изобретению включают или представляют собой миметик РНК, например, остов, в котором структурные единицы нуклеотида заменены новыми группами. Структурные единицы в виде оснований сохраняются для гибридизации с соответствующим целевым соединением нуклеиновой кислоты. Одно такое олигомерное соединение, миметик РНК, который, как было показано, обладает превосходными свойствами гибридизации, называется пептидной нуклеиновой кислотой (PNA). В соединениях PNA сахарный остов РНК заменен амидсодержащим остовом, в частности аминоэтилглициновым остовом. Нуклеотидные основания сохраняются и связываются непосредственно или опосредованно с атомами азота азагруппы амидной части остова. Иллюстративные патенты США, в которых изложена идея получения соединений PNA, включают без ограничения патенты США №№5539082; 5714331 и 5719262.
Модифицированные РНК также могут содержать один или несколько замещенных сахарных фрагментов. РНК, например, dsRNA, представленные в данном документе, могут содержать одно из следующего в 2'-положении: ОН; F; О-, S- или N-алкил; О-, S- или N-алкенил; О-, S- или N-алкинил или О-алкил-О-алкил, где алкил, алкенил и алкинил могут быть замещенными или незамещенными C1-С10алкилом или С2-С10алкенилом и алкинилом. Иллюстративные подходящие модификации включают O[(CH2)nO]mCH3, O(СН2)nOCH3, O(CH1)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(СН2)nON[(СН2)nCH3)]2, где n и m составляют от 1 до приблизительно 10.
РНК по настоящему изобретению также может содержать модификации или замещения нуклеотидного основания (часто называемого в данной области техники просто как "основание"). Используемые в данном документе "немодифицированные" или "встречающиеся в природе" нуклеотидные основания включают пуриновые основания: аденин (А) и гуанин (G), и пиримидиновые основания: тимин (Т), цитозин (С) и урацил (U). Модифицированные нуклеотидные основания включают другие синтетические и встречающиеся в природе нуклеотидные основания, такие как дезокситимин (dT), 5-метилцитозин (5-me-С), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил- и другие алкил-производные аденина и гуанина, 2-пропил- и другие алкил-производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и -цитозин, 5-пропинилурацил и -цитозин, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил-, 8-гидроксил- и другие 8-замещенные аденины и гуанины, 5-галоген-, в частности 5-бром-, 5-трифторметил- и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин, а также 3-деазагуанин и 3-деазааденин.
РНК по настоящему изобретению также может быть модифицирована таким образом, чтобы она содержала одну или несколько запертых нуклеиновых кислот (LNA). Запертая нуклеиновая кислота представляет собой нуклеотид, содержащий модифицированный рибозный фрагмент, где рибозный фрагмент содержит дополнительный мостик, соединяющий 2'- и 4'-атомы углерода. Эта структура эффективно "запирает" рибозу в структурной конформации 3'-эндо. Было показано, что добавление запертых нуклеиновых кислот в siRNA повышает стабильность siRNA в сыворотке крови и снижает нецелевые эффекты (Elmen, J. et al., (2005) Nucleic Acids Research 33(1):439-447).
Потенциально стабилизирующие модификации на концах РНК могут включать N-(ацетиламинокапроил)-4-гидроксипролинол (Нур-С6-NHAc), N-капроил-4-гидроксипролинол (Нур-С6), N-ацетил-4-гидроксипролинол (Hyp-NHAc), тимидин-2'-0-дезокситимидин (простой эфир), N-(аминокапроил)-4-гидроксипролинол (Нур-С6-амино), 2-докозаноилуридин-3''-фосфат, инвертированное основание dT (idT) и другие. Раскрытие этой модификации можно найти в публикации согласно РСТ № WO 2011/005861.
В одном примере РНК по настоящему изобретению является химически синтезированной. Олигонуклеотиды (например, определенные модифицированные нуклеотиды или части олигонуклеотидов, лишенные рибонуклеотидов) синтезируют с использованием протоколов, известных из уровня техники, например, описанных в Caruthers et al., (1992), Methods in Enzymology 211, 3-19, WO 99/54459, Wincott et al., (1995), Nucleic Acids Res. 23, 2677-2684, Wincott et al., (1997), Methods Mol. Bio., 74, 59, Brennan et al., (1998), Biotechnol Bioeng., 61, 33-45, и Brennan, патенте США №6001311. При синтезе олигонуклеотидов находят применение обычные группы защиты и связывания нуклеиновых кислот, такие как диметокситритил с 5'-конца и фосфорамидиты с 3'-конца.
РНК без модификаций синтезируют с использованием процедур, описанных в Usman et al., (1987), J. Am. Chem. Soc., 109, 7845; Scaringe et al., (1990), Nucleic Acids Res., 18, 5433. В этих синтезах находят применение общие группы защиты и связывания нуклеиновых кислот, такие как диметокситритил с 5'-конца, и фосфорамидиты с 3'-конца, которые могут быть использованы для определенных РНК по настоящему изобретению.
В определенных примерах РНК по настоящему изобретению синтезируют, удаляют защитные группы и анализируют в соответствии со способами, описанными в патентах США №№6995259, 6686463, 6673918, 6649751 и/или 6989442.
В альтернативном примере РНК по настоящему изобретению синтезируют в виде дискретных компонентов и объединяют вместе после синтеза, например, путем лигирования (Moore et al., (1992), Science 256, 9923 или WO 93/23569), или путем гибридизации после синтеза и/или удаления защитных групп.
ddRNAi
РНК по настоящему изобретению, которая представляет собой shRNA или shmiRNA, может быть транскрибирована из нуклеиновой кислоты. Соответственно, в одном примере настоящее изобретение предусматривает нуклеиновую кислоту, кодирующую РНК по настоящему изобретению.
В одном примере нуклеиновая кислота представляет собой ДНК.
В другом примере настоящее изобретение предусматривает нуклеиновую кислоту, кодирующую множество РНК по настоящему изобретению.
В другом примере настоящее изобретение предусматривает множество нуклеиновых кислот, кодирующих множество РНК по настоящему изобретению. Например, каждая нуклеиновая кислота из множества может кодировать одну РНК, описанную в данном документе. В другом примере одна или несколько нуклеиновых кислот кодируют множество РНК, например, одна нуклеиновая кислота из множества кодирует две или более РНК по настоящему изобретению и другая нуклеиновая кислота из множества кодирует одну или несколько РНК по настоящему изобретению.
В одном примере множество описанных в данном документе нуклеиновых кислот предоставлены вместе, например, в единой композиции.
В другом примере множество описанных в данном документе нуклеиновых кислот предоставлены в виде нескольких компонентов, например, нескольких композиций. Например, каждая из нуклеиновых кислот множества может быть предоставлена отдельно. В качестве альтернативы, в примере, в котором представлены по меньшей мере три нуклеиновых кислоты по настоящему изобретению, по меньшей мере одна из нуклеиновых кислот может быть предоставлена отдельно и две или более из множества предоставлены вместе.
В некоторых примерах нуклеиновая кислота по настоящему изобретению содержит один или несколько дополнительных элементов, например, для облегчения транскрипции РНК. Например, нуклеиновая кислота может содержать промотор, функционально связанный с последовательностью, кодирующей РНК по настоящему изобретению. Другие элементы, например, терминаторы транскрипции, известны из уровня техники и/или описаны в данном документе.
В одном примере нуклеиновая кислота представляет собой ДНК-направленную конструкцию для RNAi (ddRNAi).
В одном примере конструкция для ddRNAi содержит последовательность, кодирующую РНК по настоящему изобретению, функционально связанную с промотором.
В одном примере конструкция для ddRNAi содержит последовательность, кодирующую РНК, которая содержит эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, по настоящему изобретению. Как описано в данном документе, РНК по настоящему изобретению будет содержать эффекторную последовательность, содержащую по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под любым из SEQ ID NO: 1-3. Иллюстративные эффекторные последовательности и последовательности, комплементарной эффекторной последовательности, приведены в таблице 4.
Например, последовательности могут быть функционально связаны с промотором, например, U6 или H1. В одном примере обе последовательности могут быть функционально связаны с одним и тем же промотором. В одном примере обе последовательности могут быть функционально связаны с различными промоторами.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую эффекторную последовательность, и последовательность, кодирующую последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность по существу комплементарна последовательности, комплементарной эффекторной последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. Например, эффекторная последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, может содержать 0, 1, 2, 3 или 4 ошибочных спаривания при образовании дуплекса с соответствующей последовательностью, комплементарной эффекторной последовательности, в таблице 4.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую эффекторную последовательность, которая по существу комплементарна последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, за исключением 4 ошибочно спаренных оснований.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую эффекторную последовательность, которая по существу комплементарна последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, за исключением 3 ошибочно спаренных оснований.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую эффекторную последовательность, которая по существу комплементарна последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, за исключением 2 ошибочно спаренных оснований.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую эффекторную последовательность, которая по существу комплементарна последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, за исключением одного ошибочно спаренного основания.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность на 100% комплементарна последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. В одном примере конструкция для ddRNAi содержит последовательность, кодирующую последовательность, комплементарную эффекторной последовательности, которая по существу комплементарна эффекторной последовательности, кодируемой конструкцией для ddRNAi.
Иллюстративные конструкции для ddRNAi по настоящему изобретению содержат последовательности, кодирующие соответствующие эффекторные последовательности и последовательности, комплементарные эффекторным последовательностям, как описано в таблице 4.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, которая кодирует эффекторную последовательность, и последовательность, кодирующую последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность состоит из последовательности, приведенной в колонке, обозначенной "Эффекторная последовательность", в таблице 4. В одном примере последовательность, комплементарная эффекторной последовательности, состоит из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4.
Иллюстративная конструкция для ddRNAi по настоящему изобретению содержит последовательность, кодирующую эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, кодирующую последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 11.
Другая иллюстративная конструкция для ddRNAi по настоящему изобретению содержит последовательность, кодирующую эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, кодирующую последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 13.
Дополнительная иллюстративная конструкция для ddRNAi по настоящему изобретению содержит последовательность, кодирующую эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, кодирующую последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 15.
В другом примере настоящее изобретение предусматривает конструкцию для ddRNAi, кодирующую множество РНК по настоящему изобретению, или содержащую последовательность, кодирующую РНК по настоящему изобретению и по меньшей мере еще одну РНК, способную вызывать RNAi.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, кодирующую множество РНК по настоящему изобретению, где каждая РНК содержит эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность по меньшей мере одной (или каждой) РНК по существу комплементарна последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. Иллюстративные РНК по настоящему изобретению, содержащие эффекторную последовательность, которая является "по существу комплементарной" последовательности, описанной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, были описаны и должны применяться mutatis mutandis к этому примеру настоящего изобретения. Однако в одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, кодирующую множество РНК по настоящему изобретению, где каждая РНК содержит эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность по меньшей мере одной (или каждой) РНК состоит из последовательности, приведенной в колонке, обозначенной "Эффекторная последовательность", в таблице 4. В одном примере последовательность, комплементарная эффекторной последовательности, по меньшей мере одной (или каждой) РНК состоит из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, кодирующую множество РНК по настоящему изобретению, каждая из которых способна вызывать RNAi, где
(i) по меньшей мере одна РНК содержит эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность РНК состоит из последовательности, приведенной в колонке, обозначенной "Эффекторная последовательность", в таблице 4 (в одном примере последовательность, комплементарную эффекторной последовательности каждой РНК состоит из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4); и
(ii) по меньшей мере одна РНК содержит эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, где эффекторная последовательность РНК состоит из последовательности из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, который является причиной OPMD;
Например, по меньшей мере одна РНК в (ii) может отличаться от РНК в (i), но состоит из последовательности, приведенной в колонке, обозначенной "Эффекторная последовательность", в таблице 4 (в одном примере последовательность, комплементарная эффекторной последовательности, каждой РНК состоит из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4).
Иллюстративная конструкция для ddRNAi по настоящему изобретению включает
(i) последовательность, кодирующую РНК, содержащую эффекторную последовательность, состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) последовательность, кодирующую РНК, содержащую эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13.
Иллюстративная конструкция для ddRNAi по настоящему изобретению включает
(i) последовательность, кодирующую РНК, содержащую эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) последовательность, кодирующую РНК, содержащую эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративная конструкция для ddRNAi по настоящему изобретению включает
(i) последовательность, кодирующую РНК, содержащую эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(ii) последовательность, кодирующую РНК, содержащую эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Другая иллюстративная ddRNAi по настоящему изобретению включает
(i) последовательность, кодирующую РНК, содержащую эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11;
(ii) последовательность, кодирующую РНК, содержащую эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(iii) последовательность, кодирующую РНК, содержащую эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Как описано в данном документе, каждая shRNA и/или shmiRNA по настоящему изобретению будет содержать последовательность стебель-петля, расположенную между соответствующей эффекторной последовательностью и последовательностью, комплементарной эффекторной последовательности, так что соответствующая РНК образует единую непрерывную последовательность. Соответственно, ddRNAi по настоящему изобретению может содержать последовательность, кодирующую стебель-петлю, расположенную между последовательностями, кодирующими соответствующую эффекторную последовательность и последовательность, комплементарную эффекторной последовательности, соответственно.
В одном примере конструкция для ddRNAi содержит последовательность, кодирующую shRNA по настоящему изобретению, функционально связанную с промотором. Например, конструкция для ddRNAi по настоящему изобретению содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной в таблице 5, функционально связанной с промотором, например, промотором U6 или H1.
Иллюстративная конструкция для ddRNAi может содержать последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16 или 17. В одном примере конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16. В одном примере конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 17.
Иллюстративная конструкция для ddRNAi может содержать последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18 или 19. В одном примере конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18. В одном примере конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 19.
Иллюстративная конструкция для ddRNAi может содержать последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20 или 21. В одном примере конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20. В одном примере конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 21.
Настоящее изобретение также предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, содержащих по меньшей мере одну shRNA по настоящему изобретению.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где каждая shRNA содержит эффекторную последовательность, содержащую или состоящую из последовательности из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, который является причиной OPMD, и где по меньшей мере одна shRNA содержит эффекторную последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. Иллюстративные эффекторные последовательности, которые по существу комплементарны последовательностям, комплементарным эффекторным последовательностям, приведенным в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, были описаны и должны применяться mutatis mutandis к этому примеру настоящего изобретения. Например, эффекторная последовательность по меньшей мере одной shRNA во множестве, кодируемая конструкцией для ddRNAi, может содержать или состоять из последовательности, приведенной в колонке, обозначенной "Эффекторная последовательность", в таблице 4 (например, родственная последовательность, комплементарная эффекторной последовательности, может содержать или состоять из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4).
В другом примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где эффекторная последовательность каждой shRNA предусматривает или состоит из эффекторной последовательности, приведенной в колонке, обозначенной "Эффектор", в таблице 4. Родственная последовательность, комплементарная эффекторной последовательности, соответствующих shRNA может содержать или состоять из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. Иллюстративные shRNA, содержащие эффекторную последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, описаны в данном документе.
Иллюстративная конструкция для ddRNAi по настоящему изобретению может содержать последовательность, кодирующую множество shRNA, при этом множество предусматривает
(i) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13.
Иллюстративная конструкция для ddRNAi по настоящему изобретению может содержать последовательность, кодирующую множество shRNA, при этом множество предусматривает
(i) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративная конструкция для ddRNAi по настоящему изобретению может содержать последовательность, кодирующую множество shRNA, при этом множество предусматривает
(i) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(ii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративная конструкция для ddRNAi по настоящему изобретению может содержать последовательность, кодирующую множество shRNA, при этом множество предусматривает
(i) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11;
(ii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(iii) shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративные shRNA по настоящему изобретению описаны в таблице 5. Соответственно, конструкция для ddRNAi по настоящему изобретению может содержать последовательность, кодирующую множество shRNA, описанных в таблице 5.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18; и
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где множество предусматривает или состоит из
(i) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 16;
(ii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 18; и
(iii) shRNA, содержащей или состоящей из последовательности, приведенной под SEQ ID NO: 20.
Настоящее изобретение также предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество РНК, при этом множество предусматривает shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, и по меньшей мере еще одну shRNA по настоящему изобретению.
Настоящее изобретение также предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество РНК, при этом множество предусматривает shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, и по меньшей мере еще одну shRNA по настоящему изобретению.
Настоящее изобретение также предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество РНК, при этом множество предусматривает shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, и по меньшей мере еще одну shRNA по настоящему изобретению.
В другом примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую shmiRNA, функционально связанную с промотором. Например, конструкция для ddRNAi по настоящему изобретению содержит последовательность, кодирующую shmiRNA, содержащую или состоящую из последовательности, приведенной в таблице 5, функционально связанной с промотором, например, промотором RNA pol II. Иллюстративные комбинации эффекторных последовательностей и последовательностей, комплементарных эффекторным последовательностям, были описаны в контексте конструкций для ddRNAi, содержащих последовательности, кодирующие shRNA по настоящему изобретению, и должны применяться mutatis mutandis к этому примеру, описывающему конструкции для ddRNAi, содержащие последовательности, кодирующие shmiRNA.
Как обсуждалось выше, конструкция для ddRNAi обычно содержит последовательность, кодирующую РНК по настоящему изобретению (например, shRNA или shmiRNA по настоящему изобретению), функционально связанную с промотором. Например, конструкция для ddRNAi, содержащая последовательность, кодирующую shRNA или shmiRNA по настоящему изобретению, может быть функционально связана с промотором RNA pol III, например, промотором U6 или H1. В качестве альтернативы, конструкция для ddRNAi, содержащая последовательность, кодирующую shRNA или shmiRNA по настоящему изобретению, может быть функционально связана с промотором RNA pol II, например, промотором UbC, CMV или PGK. Если конструкция для ddRNAi кодирует множество shRNA, каждая из последовательностей, кодирующих одну из множества shRNA, может быть функционально связана с промотором, например, промотором U6 или H1. В качестве альтернативы, если конструкция для ddRNAi кодирует множество shRNA, каждая из последовательностей, кодирующих множество shRNA, может быть функционально связана с одним и тем же промотором. Например, промотор Pol II, например, промотор UbC, CMV или PGK, может быть особенно пригоден для направления экспрессии более длинной конструкции, содержащей последовательность, кодирующую множество shRNA или shmiRNA.
Часто конструкция для ddRNAi находится в векторе, например, плазмиде, или миниплазмиде, или вирусном векторе.
В одном примере последовательности, кодирующие множество РНК по настоящему изобретению (например, shRNA или shmiRNA) в конструкции для ddRNAi, функционально связаны с одним и тем же промотором. Например, конструкция может содержать несколько копий одного и того же промотора с каждой копией, функционально связанной с последовательностью, кодирующей другую shRNA или shmiRNA по настоящему изобретению.
В другом примере каждый промотор, функционально связанный с последовательностью, кодирующей shRNA или shmiRNA по настоящему изобретению, отличается. Например, в конструкции для ddRNAi, кодирующей три shRNA по настоящему изобретению, каждая из трех последовательностей, кодирующих соответствующие shRNA, функционально связана с другим промотором. Аналогично, в конструкции для ddRNAi, кодирующей три shmiRNA по настоящему изобретению, каждая из трех последовательностей, кодирующих соответствующие shmiRNA, функционально связана с другим промотором.
В дополнительном примере в конструкции для ddRNAi, кодирующей три или более shRNA, две (или более) последовательности, кодирующие shRNA или shmiRNA, связаны с одним и тем же промотором, и одна (или более) последовательность, кодирующая РНК, связана с другим промотором.
В одном примере промотор представляет собой конститутивный промотор. Термин "конститутивный" при упоминании промотора означает, что промотор способен направлять транскрипцию функционально связанной последовательности нуклеиновой кислоты в отсутствие специфического стимула (например, теплового шока, химических веществ, света и т.д.). Как правило, конститутивные промоторы способны направлять экспрессию кодирующей последовательности по существу в любой клетке и любой ткани. Промоторы, используемые для транскрипции РНК по настоящему изобретению, включают промотор для убиквитина, CMV, β-актина, гистона Н4, генов EF-1α или pgk, контролируемые РНК-полимеразой II, или промоторные элементы, контролируемые РНК-полимеразой I.
В одном примере используют промотор Pol II, такой как промотор для CMV, SV40, U1, β-актина, или гибридный промотор Pol II. Другие подходящие промоторы Pol II известны из уровня техники и могут использоваться в соответствии с этим примером настоящего изобретения. Например, система промоторов Pol II может быть предпочтительной в конструкции для ddRNAi по настоящему изобретению, экспрессирующей pri-miRNA, которая под действием ферментов Drosha и Pasha обрабатывается до одной или нескольких shmiRNA. Система промоторов Pol II также может быть предпочтительной в конструкции для ddRNAi по настоящему изобретению, содержащей последовательность, кодирующую множество shRNA или shmiRNA под контролем одного промотора. Система промоторов Pol II также может быть предпочтительной, если желательна тканевая специфичность.
В другом примере используют промотор, контролируемый РНК-полимеразой III, такой как промотор U6 (U6-1, U6-8, U6-9), промотор H1, промотор 7SL, промотор Y человека (hY1, hY3, hY4 (см., например, Maraia, et al., (1994) Nucleic Acids Res 22(15):3045-52) и hY5 (см. Maraia, et al., (1994) Nucleic Acids Res 24(18):3552-59), промотор MRP-7-2 человека, промотор аденовируса VA1, промотор tRNA человека или промотор рибосомальной 5s-РНК. Промоторы Pol III могут быть предпочтительными в конструкциях для ddRNAi по настоящему изобретению, которые экспрессируют shRNA.
Подходящие промоторы для применения в конструкции для ddRNAi по настоящему изобретению описаны в патенте США №8008468 и патенте США №8129510.
В одном примере промотор представляет собой промотор RNA pol III. Например, промотор представляет собой промотор U6. В другом примере промотор представляет собой промотор H1.
Если промотором в конструкции является промотор U6, он может быть промотором U6-1, промотором U6-8 или промотором U6-9 (см., например, Domitrovich, et al., (2003) Nucleic Acids Res, 31:2344-2352). Например, промотором в конструкции является промотор U6-1. Например, промотором в конструкции является промотор U6-8. Например, промотором в конструкции является промотор U6-9.
В случае, если конструкция для ddRNAi кодирует множество shRNA по настоящему изобретению, последовательность, кодирующая по меньшей мере одну из shRNA, функционально связана с промотором U6, а последовательность, кодирующая по меньшей мере еще одну РНК, функционально связана с промотором H1.
В случае, если конструкция для ddRNAi кодирует три shRNA по настоящему изобретению, каждая из последовательностей, кодирующих две shRNA, функционально связана с промотором U6, а последовательность, кодирующая оставшиеся РНК, функционально связана с промотором H1. Например, если рассматривать в направлении от 5' к 3', каждая из первой и второй последовательности функционально связана с промотором U6, а третья последовательность функционально связана с промотором H1. Например, если рассматривать в направлении от 5' к 3', первая последовательность может быть функционально связана с промотором U6-1, вторая последовательность может быть функционально связана с промотором U6-9 и третья последовательность может быть функционально связана с промотором H1.
В другом примере каждая из последовательностей, кодирующих две shRNA, функционально связана с промотором H1, а последовательность, кодирующая оставшиеся РНК, функционально связана с промотором U6.
В некоторых примерах используют промоторы различной силы. Например, применение двух или более сильных промоторов (таких как промотор типа Pol III) может перенапрячь клетку путем, например, истощения пула доступных нуклеотидов или других клеточных компонентов, необходимых для транскрипции. Дополнительно или в качестве альтернативы, применение нескольких сильных промоторов может вызвать токсический уровень экспрессии средств для RNAi в клетке. Таким образом, в некоторых примерах один или несколько промоторов в полипромоторной конструкции для ddRNAi слабее других промоторов в конструкции, или все промоторы в конструкции могут экспрессировать shRNA с меньшей скоростью, чем максимальная. Промоторы также можно модифицировать с использованием различных молекулярных методик или иным образом, например, путем модификации различных регуляторных элементов, для достижения более слабых уровней или более сильных уровней транскрипции. Одним из способов достижения сниженной транскрипции является модификация элементов последовательности в промоторах, которые, как известно, контролируют активность промотора. Например, известно, что проксимальный элемент последовательности (PSE) влияет на активность промоторов U6 человека (см., например, Domitrovich, et al., (2003) Nucleic Acids Res 31: 2344-2352). Замена элементов PSE, присутствующих в сильных промоторах, таких как промоторы U6-1, U6-8 или U6-9 человека, элементом из слабого промотора, такого как промотор U6-7 человека, снижает активность гибридных промоторов U6-1, U6-8 или U6-9.
Промоторы, пригодные в некоторых примерах настоящего изобретения, могут быть тканеспецифическими или клеточноспецифическими. Термин "тканеспецифический" при применении в отношении промотора относится к промотору, который способен направлять селективную транскрипцию представляющей интерес нуклеиновой кислоты в ткани конкретного типа (например, ткани глаза или мышцы) при относительном отсутствии экспрессии той же представляющей интерес нуклеотидной последовательности в ткани другого типа (например, печени). Термин "клеточноспецифический" при применении в отношении промотора относится к промотору, который способен направлять селективную транскрипцию представляющей интерес нуклеиновой кислоты в клетке конкретного типа при относительном отсутствии экспрессии той же представляющей интерес нуклеотидной последовательности в клетке другого типа в той же ткани.
В одном примере конструкция для ddRNAi по настоящему изобретению может дополнительно содержать один или несколько энхансеров для повышения экспрессии shRNA или shmiRNA по настоящему изобретению. Энхансеры, подходящие для применения в примерах по настоящему изобретению, включают энхансер из CMV (Xia et al., (2003) Nucleic Acids Res 31(17):е100) и другие энхансеры, известные специалистам в данной области техники.
В дополнительном примере конструкция для ddRNAi по настоящему изобретению может содержать терминатор транскрипции, связанный с нуклеиновой кислотой, кодирующей shRNA или shmiRNA по настоящему изобретению. В случае, если конструкция для ddRNAi кодирует несколько shRNA или несколько shmiRNA, терминаторы, связанные с каждой нуклеиновой кислотой, могут быть одинаковыми или различными. В одном примере терминатор представляет собой непрерывный участок из 4 или более, или 5 или более, или 6 или более остатков Т, например, таких как в случае конструкции для ddRNAi, кодирующей shRNA под управлением одного или нескольких промоторов pol III.
В некоторых примерах, где используют различные промоторы, терминаторы могут быть различными и соответствовать промотору от гена, из которого получен терминатор. К таким терминаторам относятся терминатор poly A SV40, терминатор гена VA1 AdV, терминатор гена рибосомальной 5S-PHK и терминаторы тРНК человека. Кроме того, промоторы и терминаторы могут быть смешанными и подобранными, как это обычно делается с промоторами и терминаторами RNA pol II.
В одном примере промотор и терминатор в каждом компоненте промотор/РНК-кодирующая последовательность/терминатор в конструкции для ddRNAi, кодирующей несколько РНК, являются различными для снижения вероятности событий рекомбинации ДНК между компонентами.
В одном примере конструкция для ddRNAi по настоящему изобретению содержит последовательность, кодирующую shRNA по настоящему изобретению, функционально связанную с промотором U6 и связанную с терминатором, содержащим по меньшей мере четыре остатка тимидина, например, 4, или 5, или 6 остатков тимидина. Необязательно последовательность, кодирующая shRNA, также может быть связана с инициатором транскрипции, содержащим один гуанин.
В одном примере конструкция для ddRNAi по настоящему изобретению содержит последовательность, кодирующую shRNA, состоящую из последовательности, приведенной в таблице 5, функционально связанной с промотором, например, промотором U6 или H1. В одном примере последовательность, кодирующая shRNA, связана с терминатором, например, содержащим по меньшей мере четыре остатка тимидина, таких как 4, или 5, или 6 остатков тимидина.
Одна иллюстративная конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, функционально связанной с промотором U6, например, промотором U6-1, и последовательностью терминатора, содержащей шесть смежных остатков тимидина.
Другая иллюстративная конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, функционально связанной с промотором U6, например, промотором U6-9, и терминатором, содержащим шесть смежных остатков тимидина.
Другая иллюстративная конструкция для ddRNAi содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, функционально связанной с промотором H1 и терминатором, содержащим пять смежных остатков тимидина.
В другом примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где конструкция для ddRNAi содержит (i) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной в таблице 5, функционально связанной с промотором, например, промотором U6 или H1, и (ii) последовательность, кодирующую по меньшей мере еще одну shRNA по настоящему изобретению, функционально связанную с промотором. В одном примере последовательность в (i) связана с терминатором, например, содержащим по меньшей мере пять остатков тимидина. В одном примере последовательность в (ii) связана с терминатором, например, содержащим по меньшей мере пять остатков тимидина. В одном примере каждая из последовательностей в (i) и (ii) связана с терминатором, например, содержащим по меньшей мере пять остатков тимидина.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где конструкция для ddRNAi содержит (i) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, функционально связанной с промотором U6, например, промотором U6-1, и терминатором, содержащим шесть смежных остатков тимидина; и (ii) последовательность, кодирующую по меньшей мере еще одну shRNA по настоящему изобретению, функционально связанную с промотором и терминатором, содержащим по меньшей мере четыре остатка тимидина.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где конструкция для ddRNAi содержит (i) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, функционально связанной с промотором U6, например, промотором U6-9, и терминатором, содержащим шесть смежных остатков тимидина; и (ii)
последовательность, кодирующую по меньшей мере еще одну shRNA по настоящему изобретению, функционально связанную с промотором и терминатором, содержащим по меньшей мере четыре остатка тимидина.
В одном примере настоящее изобретение предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где конструкция для ddRNAi содержит (i) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, функционально связанной с промотором H1 и терминатором, содержащим шесть смежных остатков тимидина; и (ii) последовательность, кодирующую по меньшей мере еще одну shRNA по настоящему изобретению, функционально связанную с промотором и терминатором, содержащим по меньшей мере четыре остатка тимидина.
Настоящее изобретение также предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где конструкция для ddRNAi содержит
(i) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, функционально связанной с промотором U6, например, промотором U6-1, и терминатором, содержащим шесть смежных остатков тимидина; и
(ii) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, функционально связанной с промотором U6, например, промотором U6-9, и терминатором, содержащим шесть смежных остатков тимидина.
Настоящее изобретение также предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где конструкция для ddRNAi содержит
(i) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, функционально связанной с промотором U6, например, промотором U6-1, и терминатором, содержащим шесть смежных остатков тимидина; и
(ii) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, функционально связанной с промотором H1 и терминатором, содержащим пять смежных остатков тимидина.
Настоящее изобретение также предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где конструкция для ddRNAi содержит
(i) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, функционально связанной с промотором U6, например, промотором U6-1, и терминатором, содержащим шесть смежных остатков тимидина; и
(ii) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, функционально связанной с промотором H1 и терминатором, содержащим пять смежных остатков тимидина.
Настоящее изобретение также предусматривает конструкцию для ddRNAi, содержащую последовательность, кодирующую множество shRNA, где конструкция для ddRNAi содержит
(i) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, функционально связанной с промотором U6, например, промотором U6-1, и терминатором, содержащим шесть смежных остатков тимидина;
(ii) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, функционально связанной с промотором U6, например, промотором U6-9, и терминатором, содержащим шесть смежных остатков тимидина; и
(iii) последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, функционально связанной с промотором H1 и терминатором, содержащим пять смежных остатков тимидина.
В другом примере настоящее изобретение предусматривает множество конструкций для ddRNAi, каждая из которых кодирует shRNA, где по меньшей мере одна из конструкций для ddRNAi во множестве представляет собой конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA по настоящему изобретению. Иллюстративные shRNA по настоящему изобретению были описаны и должны применяться mutatis mutandis к этому примеру.
В одном примере настоящее изобретение предусматривает множество конструкций для ddRNAi, каждая из которых содержит последовательность, кодирующую shRNA, где по меньшей мере одна из конструкций для ddRNAi во множестве представляет собой конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. Иллюстративные эффекторные последовательности, которые по существу комплементарны последовательностям, комплементарным эффекторным последовательностям, приведенным в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, были описаны и должны применяться mutatis mutandis к этому примеру настоящего изобретения. Например, эффекторная последовательность shRNA, кодируемая по меньшей мере одной конструкцией для ddRNAi, может содержать или состоять из последовательности, приведенной в колонке, обозначенной "Эффекторная последовательность", в таблице 4 (родственная последовательность, комплементарная эффекторной последовательности, из shRNA, кодируемая по меньшей мере одной конструкцией для ddRNAi, может, например, содержать или состоять из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4).
В другом примере настоящее изобретение предусматривает множество конструкций для ddRNAi, каждая из которых содержит последовательность, кодирующую shRNA, где каждая из конструкций для ddRNAi содержит последовательность, кодирующую shRNA, которая содержит или состоит из эффекторной последовательности, приведенной в колонке, обозначенной "Эффектор", в таблице 4. Родственная последовательность, комплементарная эффекторной последовательности, соответствующих shRNA может содержать или состоять из последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4. Иллюстративные конструкции для ddRNAi во множестве конструкций для ddRNAi содержат последовательность, кодирующую shRNA, содержащую эффекторную последовательность, которая по существу комплементарна последовательности, комплементарной эффекторной последовательности, приведенной в колонке, обозначенной "Последовательность, комплементарная эффекторной последовательности", в таблице 4, описаны в данном документе.
Иллюстративное множество конструкций для ddRNAi по настоящему изобретению предусматривает
(i) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13.
Иллюстративное множество конструкций для ddRNAi по настоящему изобретению предусматривает
(i) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11; и
(ii) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративное множество конструкций для ddRNAi по настоящему изобретению предусматривает
(i) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(ii) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
Иллюстративное множество конструкций для ddRNAi по настоящему изобретению предусматривает
(i) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 10, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 11;
(ii) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 12, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 13; и
(iii) конструкцию для ddRNAi, содержащую последовательность, кодирующую shRNA, которая содержит эффекторную последовательность, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 14, и последовательность, комплементарную эффекторной последовательности, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 15.
В соответствии с примерами, описанными в данном документе, по меньшей мере одна конструкция для ddRNAi из множества может содержать последовательность, кодирующую shRNA, описанную в таблице 5. Последовательность, кодирующая shRNA, описанную в таблице 5, может быть функционально связана с промотором, например, промотором U6 или H1. Каждая из описанных в таблице 5 shRNA может необязательно дополнительно содержать два смежных урацила (UU) с 3'-конца shRNA, например, в результате терминации транскрипции с промотора RNA Pol III.
В одном примере настоящее изобретение предусматривает множество конструкций для ddRNAi, предусматривающих две или более конструкции для ddRNAi, каждая из которых содержит последовательность, кодирующую shRNA по настоящему изобретению. Например, каждая конструкция для ddRNAi из множества может содержать последовательность, кодирующую shRNA, описанную в таблице 5, функционально связанную с промотором, например, промотором U6 или H1.
В одном примере множество конструкций для ddRNA предусматривает
(i) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, функционально связанной с промотором U6, например, промотором U6-1, и последовательностью терминатора, содержащей шесть смежных остатков тимидина; и
(ii) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, функционально связанной с промотором U6, например, промотором U6-9, и последовательностью терминатора, содержащей шесть смежных остатков тимидина.
В одном примере множество конструкций для ddRNA предусматривает
(i) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, функционально связанной с промотором U6, например, промотором U6-1, и последовательностью терминатора, содержащей шесть смежных остатков тимидина; и
(ii) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, функционально связанной с промотором H1 и последовательностью терминатора, содержащей пять смежных остатков тимидина.
В одном примере множество конструкций для ddRNA предусматривает
(i) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, функционально связанной с промотором U6, например, промотором U6-9, и последовательностью терминатора, содержащей шесть смежных остатков тимидина; и
(ii) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, функционально связанной с промотором H1 и последовательностью терминатора, содержащей пять смежных остатков тимидина.
В одном примере множество конструкций для ddRNA предусматривает
(i) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 16, функционально связанной с промотором U6, например, промотором U6-1, и последовательностью терминатора, содержащей шесть смежных остатков тимидина;
(ii) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 18, функционально связанной с промотором U6, например, промотором U6-9, и последовательностью терминатора, содержащей шесть смежных остатков тимидина; и
(iii) конструкцию для ddRNAi, которая содержит последовательность, кодирующую shRNA, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 20, функционально связанной с промотором H1 и последовательностью терминатора, содержащей пять смежных остатков тимидина.
Кроме того, конструкция для ddRNAi или каждая конструкция для ddRNAi может содержать один или несколько сайтов множественного клонирования и/или уникальных сайтов рестрикции, которые расположены стратегически, так что промотор, кодирующую shRNA последовательность и/или элементы терминатора легко удалить или заменить. Конструкцию для ddRNAi или каждую конструкцию для ddRNAi можно собрать из меньших олигонуклеотидных компонентов, используя стратегически расположенные сайты рестрикции и/или комплементарные "липкие" концы. Базовый вектор для одного подхода в соответствии с настоящим изобретением включает плазмиды с полилинкером, в котором все сайты являются уникальными (хотя это не является абсолютным требованием). Каждый промотор последовательно вставляют между его обозначенными уникальными сайтами, получая основную кассету с одним или несколькими промоторами, все из которых могут иметь переменную ориентацию. Последовательно, опять, отожженные пары праймеров вставляют в уникальные сайты после каждого из отдельных промоторов, получая конструкцию кассеты с одиночной, двойной или множественной экспрессией. Вставку можно перемещать, например, в остов AVV с использованием двух уникальных сайтов для рестрикционного фермента (одинаковых или различных), которые фланкируют вставку кассеты с одиночной, двойной или множественной экспрессией.
Образование конструкции или каждой конструкции можно выполнить с использованием любых подходящих методик генной инженерии, хорошо известных из уровня техники, включая, без ограничения, стандартные методики ПЦР, синтез олигонуклеотидов, расщепление рестрикционной эндонуклеазой, лигирование, трансформацию, очистку плазмид и секвенирование ДНК. Если конструкция или каждая конструкция представляет собой вирусную конструкцию, эта конструкция содержит, например, последовательности, необходимые для упаковки конструкции для ddRNAi в вирусные частицы, и/или последовательности, которые позволяют интегрировать конструкцию для ddRNAi в геном клетки-мишени. В некоторых примерах вирусная конструкция или каждая вирусная конструкция дополнительно содержит гены, которые обеспечивают репликацию и размножение вируса, однако такие гены будут поставляться как транс-действующие. Кроме того, шаблон вирусной конструкции или каждый шаблон вирусной конструкции содержит гены или генетические последовательности из генома любого известного организма, включенные в нативной или модифицированной форме. Например, вирусная конструкция может содержать последовательности, пригодные для репликации конструкции в бактериях.
Конструкция или каждая конструкция также может содержать дополнительные генетические элементы. Типы элементов, которые можно включить в конструкцию, никоим образом не ограничены и могут быть выбраны специалистом в данной области техники. Например, дополнительные генетические элементы могут включать репортерный ген, такой как один или несколько генов для флуоресцентного маркерного белка, такого как GFP или RFP; легко анализируемого фермента, такого как бета-галактозидаза, люцифераза, бета-глюкуронидаза, хлорамфеникол-ацетилтрансфераза или секретируемая эмбриональная щелочная фосфатаза; или белков, для которых легко доступны иммунологические анализы, такие как гормоны или цитокины.
Другие генетические элементы, которые можно использовать в вариантах осуществления настоящего изобретения, включают те, которые кодируют белки, придающие клеткам преимущество селективного роста, такие как аденозиндезаминаза, аминогликозид-фосфотрансфераза, дигидрофолатредуктаза, гигромицин-В-фосфотрансфераза, устойчивость к лекарственному средству, или гены, кодирующие белки, которые обеспечивают биосинтетическую способность, отсутствующую у ауксотрофа. Если репортерный ген включают вместе с конструкцией или каждой конструкцией, может быть включена последовательность внутреннего сайта связывания рибосомы (IRES). В одном примере дополнительные генетические элементы функционально связаны с независимым промотором/энхансером и контролируются им. Кроме того, можно использовать подходящую точку начала репликации для размножения конструкции в бактериальной или клеточной культуре. Последовательность точки начала репликации обычно отделена от конструкции для ddRNAi и других генетических последовательностей. Такие точки начала репликации известны из уровня техники и включают точки начала репликации из pUC, ColE1, 2-micron или SV40.
Экспрессирующие конструкции
В одном примере конструкция для ddRNAi по настоящему изобретению включена в экспрессирующую конструкцию.
В одном примере экспрессирующая конструкция представляет собой вектор экспрессии.
В одном примере вектор экспрессии представляет собой плазмиду, например, известную из уровня техники. В одном примере подходящим плазмидным вектором экспрессии является вектор pAAV, например, самокомплементарный плазмидный вектор pAAV (pscAAV) или однонитевой плазмидный вектор pAAV (pssAAV). Как описано в данном документе, плазмида может содержать один или несколько промоторов RNA pol III, например, для управления экспрессией одной или нескольких РНК по настоящему изобретению. Подходящие промоторы RNA pol III для включения в вектор экспрессии были описаны в данном документе.
В одном примере вектор экспрессии представляет собой миникольцевую ДНК. Миникольцевая ДНК описана в публикации патента США №2004/0214329. Миникольцевая ДНК пригодна для постоянно высоких уровней транскрипции нуклеиновой кислоты. Кольцевые векторы характеризуются отсутствием бактериальных последовательностей для подавления экспрессии. Например, миникольцевые векторы отличаются от бактериальных плазмидных векторов тем, что они лишены точки начала репликации и не имеют маркеров для селекции с лекарственным средством, обычно встречающихся в бактериальных плазмидах, например, β-лактамазу, tet и тому подобного. Следовательно, миникольцевая ДНК становится меньше по размеру, что обеспечивает более эффективную доставку.
В одном примере вектор экспрессии представляет собой вирусный вектор.
Вирусный вектор, основанный на любом подходящем вирусе, можно использовать для доставки ddRNAi по настоящему изобретению. Кроме того, можно использовать гибридные вирусные системы. Выбор вирусной системы доставки будет зависеть от различных параметров, таких как ткань, предназначенная для доставки, эффективность трансдукции системы, патогенность, иммунологические проблемы и проблемы с токсичностью и тому подобное.
Традиционно используемые классы вирусных систем, пригодных в генной терапии, можно разделить на две группы в зависимости от того, интегрируют ли их геномы в хроматин клетки-хозяина (ретровирусы и лентивирусы), или сохраняются в ядре клетки преимущественно в виде внехромосомных эписом (аденоассоциированный вирус, аденовирусы и герпесвирусы). В одном примере вирусный вектор по настоящему изобретению интегрируется в хроматин клетки-хозяина. В другом примере вирусный вектор по настоящему изобретению сохраняется в ядре клетки-хозяина в виде внехромосомной эписомы.
В одном примере вирусный вектор принадлежит к семейству Parvoviridae. Parvoviridae представляет собой семейство небольших однонитевых, безоболочечных ДНК-вирусов с геномами длиной приблизительно 5000 нуклеотидов. В члены семейства входит аденоассоциированный вирус (AAV). В одном примере вирусным вектором по настоящему изобретению является AAV. AAV является зависимым парвовирусом, который обычно требует совместного инфицирования с другим вирусом (как правило, аденовирусом или герпесвирусом) для инициации и поддержания продуктивного инфекционного цикла. В отсутствие такого вируса-помощника AAV все еще способен инфицировать или трансфицировать клетку-мишень путем опосредованного рецептором связывания и интернализации, проникая в ядро как не делящихся, так и делящихся клеток. Поскольку потомство вируса при AAV-инфекции в отсутствие вируса-помощника не продуцируется, степень трансдукции ограничивается только исходными клетками, инфицированными вирусом. Именно эта особенность делает AAV желательным вектором для настоящего изобретения. Кроме того, в отличие от ретровируса, аденовируса и вируса простого герпеса, AAV, по-видимому, не обладает патогенностью и токсичностью у человека (Kay, et al., (2003) Nature. 424: 251). Поскольку данный геном обычно кодирует только два гена, нет ничего удивительного в том, что в качестве среды-носителя для доставки AAV ограничен упаковочной емкостью 4,5 тысячи однонитевых нуклеотидов (т.о.). Однако, хотя это ограничение по размеру способно ограничивать гены, которые можно доставить для заместительной генной терапии, это не оказывает отрицательного влияния на упаковку и экспрессию более коротких последовательностей, таких как shRNA.
В одном примере вирусным вектором является аденовирусный вектор (AdV). Аденовирусы представляют собой двухнитевые безоболочечные ДНК-вирусы среднего размера с линейными геномами в диапазоне 26-48 т.о. Аденовирусы проникают в клетку-мишень путем опосредованного рецептором связывания и интернализации, проникая в ядро как не делящихся, так и делящихся клеток. Аденовирусы для выживания и репликации в значительной степени зависят от клетки-хозяина и способны реплицироваться в ядре клеток позвоночных, используя механизм репликации хозяина.
Другая вирусная система доставки, пригодная для конструкций для ddRNAi по настоящему изобретению, представляет собой систему, основанную на вирусах семейства Retroviridae. Ретровирусы представляют собой однонитевые РНК-вирусы животных, которые характеризуются двумя уникальными особенностями. Во-первых, геном ретровируса является диплоидным, состоящим из двух копий РНК. Во-вторых, эта РНК транскрибируется вирион-ассоциированным ферментом обратной транскриптазой в двухнитевую ДНК. Эта двухнитевая ДНК или провирус могут затем интегрироваться в геном хозяина и передаваться от родительской клетки к клеткам потомства в виде стабильно-интегрированного компонента генома хозяина.
В некоторых примерах вирусным вектором является лентивирус. Векторы на основе лентивируса часто псевдотипированы гликопротеином вируса везикулярного стоматита (VSV-G) и получены из вируса иммунодефицита человека (HIV); висна-маэди, который вызывает энцефалит (висну) или пневмонию у овец; вируса инфекционной анемии лошадей (EIAV), который вызывает аутоиммунную гемолитическую анемию и энцефалопатию у лошадей; вируса кошачьего иммунодефицита (FIV), который вызывает иммунную недостаточность у кошек; вируса бычьего иммунодефицита (BIV), который вызывает лимфаденопатию и лимфоцитоз у крупного рогатого скота; и вируса иммунодефицита обезьян (SIV), который вызывает иммунную недостаточность и энцефалопатию у нечеловекообразных приматов. Векторы, которые основаны на HIV, обычно сохраняют <5% родительского генома, и <25% генома включены в упаковочные конструкции, что сводит к минимуму возможность получения способного к обратной репликации HIV. Биологическая безопасность была дополнительно увеличена за счет разработки самоинактивирующихся векторов, которые содержат делеции регуляторных элементов в нижерасположенной последовательности длинных концевых повторов, исключая транскрипцию упаковочного сигнала, который необходим для мобилизации вектора. Одним из основных преимуществ применения векторов на основе лентивируса является то, что перенос гена является постоянным в большинстве тканей или типов клеток, даже после клеточного деления трансфицированной клетки.
Конструкция на основе лентивируса, используемая для экспрессии РНК по настоящему изобретению, содержит последовательности из 5' и 3' длинных концевых повторов (LTR) лентивируса. В одном примере вирусная конструкция содержит инактивированный или самоинактивирующийся 3'-LTR из лентивируса. 3'-LTR можно выполнить самоинактивирующийся любым способом, известным из уровня техники. Например, элемент U3 из 3'-LTR содержит делецию его энхансерной последовательности, например, сайтов ТАТА-бокс, Sp1 и NF-каппа В. В результате самоинактивации 3'-LTR провирус, который интегрирован в геном хозяина, будет содержать инактивированный 5'-LTR. Последовательности LTR могут представлять собой последовательности LTR из любого лентивируса любого вида. Конструкция на основе лентивируса также может включать последовательности для генов MMLV или MSCV, RSV или млекопитающих. Кроме того, последовательность U3 из лентивирусного 5'-LTR можно заменить промоторной последовательностью в вирусной конструкции. Это может увеличить титр вируса, полученного из пакующей клеточной линии. Также может быть включена энхансерная последовательность.
Другие вирусные или невирусные системы, известные специалистам в данной области техники, можно использовать для доставки ddRNAi или нуклеиновой кислоты по настоящему изобретению в клетки, представляющие интерес, включая без ограничения векторы на основе транспозона аденовируса с удалением гена (см. Yant, et al., (2002) Nature Biotech. 20:999-1004); системы, полученные из вируса Синдбис или вируса леса Семлики (см. Perri, et al., (2002) J. Virol. 74(20):9802-9807); системы, полученные из вируса болезни Ньюкасла или вируса Сендай.
Тестирование РНК или конструкции для ddRNAi по настоящему изобретению
Модели клеточных культур
Примером линии клеток, пригодной в качестве модели клеточной культуры для OPMD, является линия клеток HEK293T (HEK293T, АТСС, Манассас, США), описанная в примере 3, которая трансфицирована вектором, экспрессирующим нормальный Ala10-humanPABPN1-FLAG (Ala10) или мутантный Ala17-humanPABPN1-FLAG (Ala17), последний из которых является отличительной чертой OPMD.
Другим примером линии клеток, пригодной в качестве модели клеточной культуры для OPMD, является первичная линия клеток мышиных миобластов (IM2), стабильно трансфицированная для экспрессии нормального Ala10-humanPABPN1-FLAG (Ala10) или мутантного Ala17-humanPABPN1-FLAG (Ala17). Иллюстративной линией клеток, полученной из IM2, которая стабильно экспрессирует мутантный Ala17-humanPABPN1-FLAG (Ala17), является линия клеток H2kB-D7e, описанная в примере 3. Линия клеток H2kB-D7e также описана в Raz et al., (2011) American Journal of Pathology, 179(4):1988-2000.
Другие линии клеток, подходящие для моделей клеточных культур OPMD, известны из уровня техники, такие как описанные в Fan et al., (2001) Human Molecular Genetics, 10:2341-2351, Bao et al., (2002) The Journal of Biological Chemistry, 277:12263-12269 и Abu-Baker et al, (2003) Human Molecular Genetics, 12:2609-2623.
Как проиллюстрировано в данном документе, активность РНК или конструкции для ddRNAi по настоящему изобретению определяют при введении РНК или конструкции для ddRNAi в клетку и последующем измерении уровня экспрессии РНК или белка, кодируемого геном PABPN1. Например, внутриклеточную экспрессию гена PABPN1 можно оценить с помощью одного или более из RT-PCR, количественной ПЦР, полуколичественной ПЦР или гибридизации in-situ в жестких условиях с использованием одного или нескольких зондов или праймеров, которые специфичны для PABPN1. Внеклеточный PABPN1 можно также проанализировать либо с помощью ПЦР с использованием одного или нескольких зондов или праймеров, которые специфичны для ДНК PABPN1, или ELISA для белка PABPN1.
Полинуклеотиды, которые можно использовать в методиках RT-PCR, количественной ПЦР или полуколичественной ПЦР для выявления экспрессии PABPN1, известны и коммерчески доступны (Thermo Fisher). Однако полинуклеотиды, пригодные для способов выявления на основе ПЦР, можно сконструировать на основе информации о последовательности, доступной для PABPN1, с использованием способа и/или программного обеспечения, известного из уровня техники. В одном примере присутствие или отсутствие mRNA PABPN1 можно выявить с помощью RT-PCR с использованием стандартных методик, известных из уровня техники. В одном примере присутствие или отсутствие или относительное количество полипептида или белка PABPN1 можно выявить с использованием любого одного или более из вестерн-блоттинга, ELISA или других стандартных количественных или полуколичественных методик, доступных в данной области техники, или комбинации таких методик. Методики, основанные на распознавании PABPN1 с помощью антител, рассматриваются и описаны в данном документе, например, в примерах 3-5. В одном примере присутствие или отсутствие или относительное содержание полипептида PABPN1 можно обнаружить с помощью методик, которые включают захват антителами полипептидов PABPN1 в комбинации с электрофоретическим разделением захваченных полипептидов PABPN1, например, с использованием анализа Isonostic™ (Target Discovery, Inc.). Антитела для белка PABPN1 являются коммерчески доступными.
Различные средства для нормализации различий в эффективности трансфекции или трансдукции и получения образца известны из уровня техники.
РНК или конструкция для ddRNAi по настоящему изобретению, которая снижает экспрессию mRNA или белка, кодируемого PABPN1, или которая снижает присутствие ядерных агрегатов белка PABPN1 относительно уровня экспрессии mRNA или белка, кодируемого PABPN1, или количества ядерных агрегатов белка PABPN1 в отсутствие РНК по настоящему изобретению, считается пригодной для применений в терапевтических целях, например, таких как лечение OPMD путем снижения экспрессии эндогенного PABPN1 и замены части или всего эндогенного PABPN1 белком PABPN1, который не является причиной OPMD, как описано в данном документе.
Модели на животных
Для изучения OPMD доступно несколько моделей на небольших животных, примеры которых описаны в Uyama et al., (2005) Acta Myologica, 24(2):84-88 и Chattier and Simonelig (2013) Drug Discovery Today: technologies, 10:e103-107. Иллюстративной моделью на животных является модель транс генной мыши А17.1, описанная в примерах 4 и 5 в данном документе, и которая была описана ранее в Davies et al., (2005) Nature Medicine, 11:672-677 и Trollet et al., (2010) Human Molecular Genetics, 19(11):2191-2207.
Любую из вышеперечисленных моделей на животных можно использовать для определения эффективности РНК или конструкции для ddRNAi по настоящему изобретению для нокдауна, снижения или подавления экспрессии РНК или белка, кодируемых геном PABPN1.
Способы анализа внутриклеточной и внеклеточной экспрессии гена PABPN1 были описаны в данном документе в отношении клеточных моделей и должны применяться mutatis mutandis к этому примеру настоящего изобретения.
Средства замещения для функционального PABPN1
В одном примере настоящее изобретение предусматривает средство замещения для функционального белка PABPN1, например, в клетке или животном. Функциональный белок PABPN1 не будет являться причиной OPMD и он не будет кодироваться транскриптом mRNA, на который целенаправленно воздействует (воздействуют) РНК по настоящему изобретению.
В одном примере средство замещения для функционального белка PABPN1 в клетке или животном представляет собой нуклеиновую кислоту, например, такую как ДНК, или cDNA, кодирующую функциональный белок PABPN1. Например, нуклеиновая кислота, кодирующая функциональный белок PABPN1, может быть кодон-оптимизированной, например, содержать одно или несколько вырожденных или неоднозначных оснований относительно нуклеиновой кислоты PABPN1 дикого типа, но которая кодирует идентичные аминокислоты, так что соответствующая последовательность mRNA, кодирующая функциональный белок PABPN1, не распознается РНК по настоящему изобретению. Например, кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1, может содержать одно или несколько вырожденных или неоднозначных оснований относительно нуклеиновой кислоты PABPN1 дикого типа в области, на которую целенаправленно воздействует РНК по настоящему изобретению. В одном примере одно или несколько вырожденных или неоднозначных оснований находятся в затравочной области РНК по настоящему изобретению.
В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, является кодон-оптимизированной таким образом, что ее соответствующая последовательность mRNA не распознается РНК по настоящему изобретению. Например, функциональный белок PABPN1, кодируемый кодон-оптимизированной последовательностью нуклеиновой кислоты, может содержать аминокислотную последовательность, приведенную под SEQ ID NO: 25, т.е. аминокислотную последовательность белка PABPN1 человека дикого типа. В одном примере средство замещения для функционального белка PABPN1, например, белка PABPN1 с аминокислотной последовательностью, приведенной под SEQ ID NO: 25, представляет собой нуклеиновую кислоту, содержащую последовательность, приведенную под SEQ ID NO: 24. В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, может также содержать последовательность Козака.
В одном примере функциональный белок PABPN1 присоединен к эпитопной метке, например, Мус-метке, или содержит ее. Например, функциональный белок PABPN1, содержащий Мус-метку, может содержать аминокислотную последовательность, приведенную под SEQ ID NO: 27. В соответствии с этим примером средство замещения для функционального белка PABPN1 может представлять собой нуклеиновую кислоту, содержащую последовательность, приведенную под SEQ ID NO: 26.
В одном примере кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1, функционально связана с промотором, подходящим для экспрессии функционального белка PABPN1. Одним из иллюстративных промоторов, подходящих для применения с нуклеиновой кислотой, кодирующей функциональный белок PABPN1, является промотор SpC512. Однако можно использовать любой подходящий промотор, известный из уровня техники. Например, другие подходящие промоторы для применения с нуклеиновой кислотой, кодирующей функциональный белок PABPN1, описаны в US 20110212529 A1.
Как описано в данном документе, промоторы, пригодные в некоторых примерах настоящего изобретения, могут быть тканеспецифическими или клеточноспецифическими.
В одном примере кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1 по настоящему изобретению, может дополнительно содержать один или несколько энхансеров для увеличения экспрессии функционального белка PABPN1 и его соответствующего транскрипта mRNA. Специалистам в данной области техники будут известны энхансеры, подходящие для применения в этом примере настоящего изобретения.
Нуклеиновая кислота, кодирующая функциональный белок PABPN1, может содержаться в векторе экспрессии. Иллюстративные векторы экспрессии были описаны в контексте РНК и конструкций для ddRNAi по настоящему изобретению и должны применяться mutatis mutandis к этому примеру.
Соответственно, в одном примере средство замещения для функционального белка PABPN1 в клетке или животном может представлять собой вектор экспрессии, содержащий кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1. Например, вектор экспрессии по настоящему изобретению может содержать кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1, например, последовательность, приведенную под SEQ ID NO: 24, и промотор для ее экспрессии, например, промотор SpC512. В одном примере кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1, может также содержать последовательность Козака. Таким образом, вектор экспрессии по настоящему изобретению может содержать последовательность, приведенную под SEQ ID NO: 24, с последовательностью Козака на ее 5'-конце.
В одном примере средство замещения для функционального белка PABPN1, например, с последовательностью, приведенной под SEQ ID NO: 25, представляет собой кодон-оптимизированную нуклеиновую кислоту, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 24. В одном примере кодон-оптимизированная нуклеиновая кислота дополнительно содержит последовательность Козака. Таким образом, средство замещения для функционального белка PABPN1 может представлять собой нуклеиновую кислоту, содержащую или состоящую из последовательности, приведенной под SEQ ID NO: 24, с последовательностью Козака на ее 5'-конце.
В одном примере нуклеиновая кислота, кодирующая функциональный белок PABPN1, как описано в данном документе, может содержаться в плазмидном векторе экспрессии. Подходящие плазмидные векторы экспрессии описаны в данном документе и будут известны из уровня техники. В одном примере подходящим плазмидным вектором экспрессии является вектор pAAV, например, плазмидный вектор pscAAV или плазмидный вектор pssAAV.
В одном примере вектор экспрессии представляет собой миникольцевую ДНК. Векторы в виде миникольцевой ДНК были описаны в данном документе.
В одном примере вектор экспрессии представляет собой вирусный вектор. Например, вирусный вектор, основанный на любом подходящем вирусе, можно использовать для доставки кодон-оптимизированной нуклеиновой кислоты, кодирующей функциональный белок PABPN1 по настоящему изобретению. Кроме того, можно использовать гибридные вирусные системы. Выбор вирусной системы доставки будет зависеть от различных параметров, таких как ткань, предназначенная для доставки, эффективность трансдукции системы, патогенность, иммунологические проблемы и проблемы с токсичностью и тому подобное.
Иллюстративные вирусные системы для доставки генетического материала в клетку или животное были описаны в контексте РНК и конструкций для ddRNAi по настоящему изобретению и должны применяться mutatis mutandis к этому примеру.
В одном примере вирусным вектором является AAV.
В одном примере вирусным вектором является вектор на основе AdV.
В одном примере вирусным вектором является лентивирус.
Другие вирусные или невирусные системы, известные специалистам в данной области техники, можно использовать для доставки кодон-оптимизированной нуклеиновой кислоты, кодирующей функциональный белок PABPN1 по настоящему изобретению, в представляющие интерес клетки, включая без ограничения векторы на основе транспозона аденовируса с удалением гена (см. Yant, et al., (2002) Nature Biotech. 20:999-1004); системы, полученные из вируса Синдбис или вируса леса Семлики (см. Perri, et al, (2002) J. Virol. 74(20):9802-07); системы, полученные из вируса болезни Ньюкасла или вируса Сендай.
В соответствии с примером, в котором кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1, как описано в данном документе, предоставляется с конструкцией для ddRNAi по настоящему изобретению, кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1, может быть включена в тот же вирус экспрессии, что и конструкция для ddRNAi.
В альтернативном примере, в котором кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1 по настоящему изобретению, и конструкция для ddRNAi по настоящему изобретению должны предоставляться вместе, при этом кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1, и конструкция для ddRNAi могут быть включены в различные векторы экспрессии. Если кодон-оптимизированная нуклеиновая кислота, кодирующая функциональный белок PABPN1, и конструкция для ddRNAi включены в различные векторы экспрессии, соответствующие векторы экспрессии могут быть векторами одного типа или векторами различных типов.
Тестирование функционального PABPN1
Модели клеточных культур
Иллюстративные модели клеточных культур OPMD были описаны в данном документе и описаны в примере 3. Такие модели клеточных культур OPMD можно использовать для оценки способности средства по настоящему изобретению заменить функциональный белок PABPN1 в присутствии одной или нескольких РНК по настоящему изобретению, целенаправленно воздействующих на эндогенный PABPN1.
Иллюстративные способы выявления присутствия или отсутствия или относительного количества белка PABPN1 также описаны и применимы mutatis mutandis к этому примеру. Например, присутствие или отсутствие или относительное количество белка PABPN1 можно выявить с использованием любого одного или более из вестерн-блоттинга, ELISA или других стандартных количественных или полуколичественных методик, доступных в данной области техники, или комбинации таких методик. Методики, основанные на распознавании PABPN1 с помощью антител, рассматриваются и описаны в данном документе (например, в примере 3).
Мутантные и функциональные белки PABPN1 можно экспрессировать с соответствующими белковыми метками, например, метками туе или flag, для облегчения дифференциального выявления мутантных и функциональных белков PABPN1 с использованием подходящих антител, которые являются коммерчески доступными. Например, мутантный белок PABPN1 человека может экспрессироваться с меткой FLAG и содержать аминокислотную последовательность, приведенную под SEQ ID NO: 29. Таким образом, присутствие или отсутствие или относительное количество как мутантного, так и функционального белка PABPN1 можно независимо выявить в клетке после трансфекции или трансдукции клетки с РНК по настоящему изобретению и средства для замещения функционального белка PABPN1 по настоящему изобретению.
В одном примере присутствие или отсутствие или относительное содержание полипептида PABPN1 можно обнаружить с помощью методик, которые включают захват антителами полипептидов PABPN1 в комбинации с электрофоретическим разделением захваченных полипептидов PABPN1, например, с использованием анализа Isonostic™ (Target Discovery, Inc.). Антитела для белка PABPN1 являются коммерчески доступными.
Средство по настоящему изобретению, которое экспрессирует белок PABPN1, не являющийся причиной OPMD, в клетке в присутствии РНК по настоящему изобретению (т.е. в присутствии реагента для RNAi, описанного в данном документе), считается пригодным для лечения OPMD.
Модели на животных
Были описаны иллюстративные модели на животных для изучения OPMD. Иллюстративные модели на животных для изучения OPMD также описаны в примерах 4 и 5.
Любую из вышеперечисленных моделей на животных можно использовать для определения эффективности средства по настоящему изобретению для замены функционального белка PABPN1 in vivo в присутствии РНК или конструкции для ddRNAi по настоящему изобретению.
Способы анализа внутриклеточной и внеклеточной экспрессии PABPN1 были описаны в данном документе в отношении клеточных моделей и должны применяться mutatis mutandis к этому примеру настоящего изобретения.
В одном примере гистологические и морфологические анализы, описанные в примере 5, можно использовать для определения эффективности средства по настоящему изобретению для замены функционального белка PABPN1 in vivo в присутствии РНК или конструкции для ddRNAi по настоящему изобретению. Дополнительные анализы, которые можно использовать для определения эффективности средства по настоящему изобретению для замены функционального белка PABPN1 in vivo, описаны в Trollet et al., (2010) Human Molecular Genetics, 19(11): 2191-2207.
Композиции и носители
В некоторых примерах в композиции предусмотрена РНК, или конструкция для ddRNAi, или вектор экспрессии по настоящему изобретению. В некоторых примерах в композиции предусмотрена нуклеиновая кислота, кодирующая функциональный белок PABPN1 по настоящему изобретению. В некоторых примерах в композиции предусмотрена РНК, или конструкция для ddRNAi, или вектор экспрессии по настоящему изобретению вместе с нуклеиновой кислотой, кодирующей функциональный белок PABPN1 по настоящему изобретению.
Как описано в данном документе, вектор экспрессии может содержать конструкцию для ddRNAi по настоящему изобретению отдельно или в комбинации с кодон-оптимизированной нуклеиновой кислотой, кодирующей функциональный белок PABPN1 по настоящему изобретению. Таким образом, в данном документе ссылку на вектор экспрессии и/или композицию, содержащую его, следует понимать с охватом (i) вектора экспрессии, содержащего конструкцию для ddRNAi по настоящему изобретению, или композиции, содержащей его; (ii) вектора экспрессии, содержащего конструкцию для ddRNAi по настоящему изобретению, и кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1 по настоящему изобретению, или композиции, содержащей его; или (iii) вектора экспрессии, содержащего кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1 по настоящему изобретению, или композиции, содержащей его.
Согласно одному примеру композиция по настоящему изобретению может содержать (i) вектор экспрессии, содержащий конструкцию для ddRNAi по настоящему изобретению, и (ii) вектор экспрессии, содержащий кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1 по настоящему изобретению.
В качестве альтернативы, композиция по настоящему изобретению может содержать вектор экспрессии, содержащий конструкцию для ddRNAi по настоящему изобретению, и кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1 по настоящему изобретению.
В еще одном примере вектор экспрессии, содержащий конструкцию для ddRNAi по настоящему изобретению, может предоставляться в одной композиции, а вектор экспрессии, содержащий кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1 по настоящему изобретению, может предоставляться в другой композиции, например, которые упакованы вместе.
Композиция по настоящему изобретению может также содержать один или несколько фармацевтически приемлемых носителей или разбавителей. Например, композиция может содержать носитель, подходящий для доставки РНК, или конструкции для ddRNAi, или вектора экспрессии по настоящему изобретению в мышцу субъекта после введения в нее.
В некоторых примерах носителем является носитель на основе липидов, катионный липид или комплекс липосомы и нуклеиновой кислоты, липосома, мицелла, виросома, липидная наночастица или их смесь.
В некоторых примерах носителем является биоразлагаемый носитель на основе полимера, так что образуется комплекс катионного полимера и нуклеиновой кислоты. Например, носителем может быть катионная полимерная микрочастица, подходящая для доставки РНК, или конструкции для ddRNAi, или вектора экспрессии по настоящему изобретению в мышечные клетки. Применение катионных полимеров для доставки композиций в клетки известно из уровня техники, например, описано в Judge et al. (2005) Nature 25: 457-462, содержание которой включено в данный документ посредством ссылки. Иллюстративным катионным носителем на основе полимера является катионный ДНК-связывающий полимер, такой как полиэтиленимин. Другие катионные полимеры, подходящие для комплексообразования и доставки РНК или конструкций для ddRNAi или векторов экспрессии по настоящему изобретению, включают поли(L-лизин) (PLL), хитозан, РАМАМ-дендримеры и поли(2-диметиламино)этилметакрилат (pDMAEMA). Эти и другие подходящие катионные полимеры известны из уровня техники и описаны в Mastrobattista and Hennink, (2012) Nature Materials, 77:10-12, WO/2003/097107 и WO/2006/041617, полное содержание которых включено в данный документ посредством ссылки. Такие составы носителей были разработаны для различных путей доставки, включая парентеральную подкожную инъекцию, внутривенную инъекцию и ингаляцию.
В дополнительном примере носителем является носитель на основе циклодекстрина, такой как комплекс полимера циклодекстрина и нуклеиновой кислоты.
В дополнительном примере носителем является носитель на основе белка, такой как комплекс катионного пептида и нуклеиновой кислоты.
В другом примере носителем является липидная наночастица. Иллюстративные наночастицы описаны, например, в US 7514099.
В некоторых примерах РНК, или ddRNAi, или экспрессирующую конструкцию по настоящему изобретению составляют с композицией липидных наночастиц, содержащей смесь катионный липид/холестерин/PEG-C-DMA/DSPC (например, в соотношении 40/48/2/10), катионный липид/холестерин/PEG-DMG/DSPC (например, в соотношении 40/48/2/10), или катионный липид/холестерин/PEG-DMG (например, в соотношении 60/38/2). В некоторых примерах катионный липид представляет собой Octyl CL в DMA, DL в DMA, L-278, DLinKC2DMA или МС3.
В другом примере РНК, или ddRNAi, или экспрессирующую конструкцию по настоящему изобретению составляют с любым из составов на основе катионных липидов, описанных в WO 2010/021865; WO 2010/080724; WO 2010/042877; WO 2010/105209 или WO 2011/022460.
В другом примере РНК, или ddRNAi, или экспрессирующую конструкцию по настоящему изобретению конъюгируют или образуют комплекс с другим соединением, например, для облегчения доставки РНК, или ddRNAi, или экспрессирующей конструкции. Неограничивающие примеры таких конъюгатов описаны в US 2008/0152661 и US 2004/0162260 (например, CDM-LBA, CDM-Pip-LBA, CDM-PEG, CDM-NAG и т.д.).
В другом примере полиэтиленгликоль (PEG) ковалентно присоединяют к РНК, или ddRNAi, или вектору экспрессии по настоящему изобретению. Прикрепленный PEG может быть с любой молекулярной массой, например, от приблизительно 100 до приблизительно 50000 дальтон (Да).
В еще одном примере РНК, или конструкцию для ddRNAi, или вектор экспрессии по настоящему изобретению составляют с носителем, содержащим поверхностно-модифицированные липосомы, содержащие поли(этиленгликоль)-липиды (PEG-модифицированные, или длительно циркулирующие липосомы или липосомы-невидимки), такие как раскрытые, например, в WO 96/10391; WO 96/10390 или WO 96/10392.
В некоторых примерах РНК, или конструкцию для ddRNAi, или вектор экспрессии по настоящему изобретению можно также составить или объединять в комплекс с полиэтиленимином или его производным, таким как производные полиэтиленимин-полиэтиленгликоль-N-ацетилгалактозамина (PEI-PEG-GAL) или полиэтиленимин-полиэтиленгликоль-три-N-ацетилгалактозамина (PEI-PEG-triGAL).
В других примерах РНК, или конструкция для ddRNAi, или вектор экспрессии по настоящему изобретению образует комплекс со средствами, разрушающими мембрану, такими как описанные в публикации заявки на патент США №2001/0007666.
Другие носители включают циклодекстрины (см., например, Gonzalez et al., (1999), Bioconjugate Chem., 10, 1068-1074; или WO 03/46185), сополимер молочной и гликолевой кислоты (PLGA) и микросферы PLCA (см., например, US 2002130430).
Композиции, желательно, включают материалы, которые повышают биологическую стабильность РНК, или конструкции для ddRNAi, или вектора экспрессии по настоящему изобретению, и/или материалы, которые увеличивают способность композиций избирательно локализоваться в мышечных клетках и/или проникать в них. Терапевтические композиции по настоящему изобретению можно вводить в фармацевтически приемлемых носителях (например, физиологическом солевом растворе), которые выбирают на основе способа и пути введения и стандартной фармацевтической практики. Специалист в данной области техники может легко составить фармацевтическую композицию, которая содержит РНК, или конструкцию для ddRNAi, или вектор экспрессии по настоящему изобретению. В некоторых случаях используют изотонический состав. Как правило, добавки для изотоничности могут включать хлорид натрия, декстрозу, маннит, сорбит и лактозу. В некоторых случаях предпочтительными являются изотонические растворы, такие как забуференный фосфатом солевой раствор. Стабилизаторы включают желатин и альбумин. В некоторых примерах к составу добавляют сосудосуживающее средство. Композиции в соответствии с настоящим изобретением предоставляются стерильными и апирогенными. Подходящие фармацевтические носители, а также необходимые фармацевтические компоненты для применения в фармацевтических составах описаны в Remington: The Science and Practice of Pharmacy (ранее Remington's Pharmaceutical Sciences), Mack Publishing Co., стандартном справочном тексте в данной области и в USP/NF.
Объем, концентрацию и состав фармацевтической композиции, а также схему лечения можно специально разработать для увеличения до максимума доставки в клетки при сведении к минимуму токсичности, такой как воспалительный ответ, например, при необходимости можно использовать относительно большие объемы (5, 10, 20, 50 мл или более) с соответствующими низкими концентрациями активных ингредиентов, а также включение противовоспалительного соединения, такого как кортикостероид.
Композиции по настоящему изобретению можно составить для введения любым подходящим путем. Например, пути введения включают без ограничения внутримышечный, внутрибрюшинный, внутрикожный, подкожный, внутривенный, внутриартериальный, внутриглазной и пероральный, а также трансдермальный или путем ингаляции или суппозитория. Иллюстративные пути введения включают внутривенное (IV), внутримышечное (IM), пероральное, внутрибрюшинное, внутрикожное, внутриартериальное и подкожное введение. В одном примере композиция по настоящему изобретению составлена для IM-введения. Такие композиции пригодны для фармацевтических применений и могут быть легко составлены в подходящем стерильном апирогенном носителе, например, забуференном солевом растворе для инъекций, для парентерального введения, например, IM, внутривенного (включая внутривенную инфузию), SC и для внутрибрюшинного введения. Некоторые пути введения, такие как IM, IV-инъекция или инфузия, могут обеспечить эффективную доставку в мышечную ткань и трансфекцию конструкций для ddRNAi и/или кодон-оптимизированных нуклеиновых кислот, кодирующих PABPN1 по настоящему изобретению, и экспрессию в ней РНК и/или кодон-оптимизированной нуклеиновой кислоты.
Способы лечения
В одном примере РНК, или конструкцию для ddRNAi, или вектор экспрессии, или композицию по настоящему изобретению можно использовать для подавления экспрессии эндогенного белка PABPN1, включая белок PABPN1, который является причиной OPMD, у субъекта.
В одном примере РНК, или конструкцию для ddRNAi, или вектор экспрессии, или композицию по настоящему изобретению можно использовать для лечения OPMD у пациента, страдающего от нее. Аналогично, РНК, или конструкцию для ddRNAi, или вектор экспрессии, или композицию по настоящему изобретению можно использовать для предупреждения развития или прогрессирования одного или нескольких симптомов OPMD у субъекта, страдающего от нее или предрасположенного к ней.
В каждом из вышеприведенных примеров вектор экспрессии и/или композиция по настоящему изобретению могут содержать как конструкцию для ddRNAi по настоящему изобретению, так и кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1 по настоящему изобретению. Соответственно, введение вектора экспрессии или композиции может быть эффективным для (i) подавления, снижения или нокдауна экспрессии эндогенного PABPN1, в том числе белка PABPN1, содержащего удлиненный полиаланиновый тракт, который является причиной OPMD, и (ii) обеспечивает экспрессию функционального белка PABPN1, на который не оказывают целенаправленного воздействия РНК, вызывающие подавление, снижение или нокдаун экспрессии эндогенного PABPN1. Таким образом, композиция по настоящему изобретению может восстанавливать функцию белка PABPN1, например, посттранскрипционную обработку РНК, в клетке или животном, которым ее вводят.
В другом примере лечение OPMD может включать введение субъекту отдельно (i) одного или нескольких средств для подавления экспрессии белка PABPN1, который является причиной OPMD, и (ii) вектора экспрессии, содержащего кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1 по настоящему изобретению, или композиции, содержащей его. Как описано в данном документе, одним или несколькими средствами для подавления экспрессии белка PABPN1, который является причиной OPMD, может быть РНК, или конструкция для ddRNAi, или вектор экспрессии, или композиция по настоящему изобретению. Субъекту можно вводить компоненты (i) и (ii) совместно, одновременно или последовательно.
Например, лечение OPMD может включать введение субъекту кодон-оптимизированной нуклеиновой кислоты, кодирующей функциональный белок PABPN1 по настоящему изобретению, где субъекту ранее вводили одно или более средство для подавления экспрессии белка PABPN1, который является причиной OPMD, но которое не подавляет экспрессию кодон-оптимизированной нуклеиновой кислоты. Например, субъекту возможно ранее вводили РНК, множество РНК, конструкцию для ddRNAi, множество конструкций для ddRNAi, вектор экспрессии, множество векторов экспрессии и/или композицию по настоящему изобретению.
Как обсуждалось выше, пути введения включают без ограничения внутримышечный, внутрибрюшинный, внутрикожный, подкожный, внутривенный, внутриартериальный, внутриглазной и пероральный, а также трансдермальный или путем ингаляции или суппозитория. Иллюстративные пути введения включают внутривенное (IV), внутримышечное (IM), пероральное, внутрибрюшинное, внутрикожное, внутриартериальное и подкожное введение. Некоторые пути введения, такие как IM, IV-инъекция или инфузия, могут обеспечить эффективную доставку в мышечную ткань и трансфекцию конструкций для ddRNAi и/или кодон-оптимизированных нуклеиновых кислот, кодирующих PABPN1 по настоящему изобретению, и экспрессию в ней РНК и/или кодон-оптимизированной нуклеиновой кислоты.
Специалист в данной области техники сможет путем обычного экспериментирования определить эффективное нетоксичное количество РНК или конструкции для ddRNAi или вектора(векторов) экспрессии или композиции(композиций) по настоящему изобретению, которое потребуется для лечения субъекта, страдающего от OPMD. Терапевтически эффективный уровень дозы для любого конкретного пациента будет зависеть от множества факторов, включая используемую композицию; возраст, вес тела, общее состояние здоровья, пол и рацион пациента; время введения; путь введения; скорость разрушения РНК или конструкции для ddRNAi или вектора(векторов) экспрессии или композиции(композиций) по настоящему изобретению; продолжительность лечения, а также другие связанные с этим факторы, хорошо известные в медицине.
Эффективность РНК или конструкции для ddRNAi или вектора(векторов) экспрессии или композиции(композиций) по настоящему изобретению в отношении уменьшения или подавления экспрессии белка PABPN1, вызывающего OPMD, и в отношении экспрессии функционального белка PABPN1, который не является причиной OPMD, в количестве, достаточном для восстановления функции PABPN1, можно определить путем оценки сократимости мышц и/или затруднения глотания у субъекта, лечение которого осуществляют. Способы тестирования способности к глотанию и сократимости мышц известны из уровня техники. Например, затруднение глотания можно оценить, используя видеофлуороскопию, UGI-эндоскопию или тестирование эзофагальной манометрии и импеданса. Другие способы оценки клинических признаков OPMD описаны в

Наборы
Настоящее изобретение также предусматривает РНК, или конструкцию для ddRNAi, или вектор(векторы) экспрессии, или композицию(композиции) по настоящему изобретению в наборе. Набор может содержать контейнер. Набор обычно содержит РНК или конструкцию для ddRNAi, или вектор (векторы) экспрессии, или композицию(композиции) по настоящему изобретению с инструкциями по их введению. В некоторых примерах набор содержит более одной РНК, или ddRNAi, или вектора экспрессии, или композиции по настоящему изобретению. В одном примере набор содержит (i) РНК, или конструкцию для ddRNAi, или вектор(векторы) экспрессии, или композицию(композиции) по настоящему изобретению в качестве первого компонента набора и (ii) вектор экспрессии, содержащий кодон-оптимизированную нуклеиновую кислоту, кодирующую функциональный белок PABPN1 по настоящему изобретению, или композицию, содержащую его, в качестве второго компонента набора. Первый и второй компоненты набора могут быть упакованы в наборе вместе.




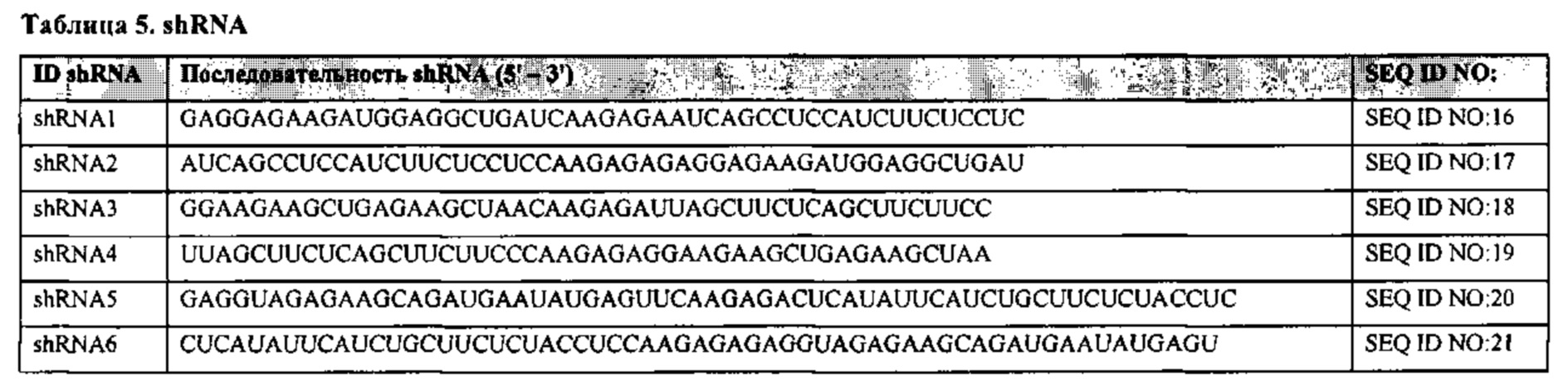
Примеры
Пример 1. Конструирование dsRNA и shRNA, целенаправленно воздействующих на PABPN1
Последовательности, представляющие собой потенциальные мишени для конструирования конструкций для ddRNAi, идентифицировали в последовательности mRNA PABPN1 с использованием общедоступных алгоритмов конструирования siRNA (включая Ambion, Promega, Invitrogen, Origene и MWG), выбирали последовательности, консервативные у человека, быка и мыши. siRNA синтезировали и тестировали in vitro на вышеуказанных и отбирали три активные siRNA для преобразования в конструкции для ddRNAi. В таблице 1 представлены транскрипты mRNA, соответствующие областям, выбранным в качестве мишеней для конструирования двухнитевых РНК (dsRNA) и коротких шпилечных РНК (shRNA).
dsRNA, содержащие эффекторные последовательности, по существу комплементарные целевым областям, описанным в таблице 1, конструировали и подтверждали (таблица 3). Скрининг последовательностей siRNA в отношении снижения активности PABPN1 человека проводили в клетках HeLa, где конститутивно экспрессируется эндогенный PABPN1 человека. Трансфекцию siRNA проводили с использованием олигофектамина (Life Technologies). Вкратце, в день трансфекции среду в 12-луночном планшете заменяли на 400 мкл бессывороточной среды без антибиотика и 100 мкл комплекса олигофектамин-siRNA. В 100 мкл комплекса олигофектамин-siRNA 3 мкл олигофектамина в 7 мкл Opti-Mem (Gibco) и 60 пмоль siRNA в 87 мкл Opti-Mem смешивали вместе до конечного объема 100 мкл. Смесь инкубировали при комнатной температуре в течение 20 мин. Через 4 часа после трансфекции в каждую лунку добавляли 250 мкл среды с 30% FBS. Конечная концентрация siRNA составляла 80 нМ. Выделение РНК проводили через 48 часов после трансфекции. - Все последовательности siRNA, протестированные в отношении целевых областей, приведенных в таблице 1, показали существенный нокдаун PABPN1 в клетках HeLa. Из протестированных siRNA три последовательности показывают различную степень эффективности (dsRNA 1, 2 и 3 в таблице 3). Их также оценили в человеческих миобластах от здоровых или пораженных OPMD индивидуумов. Вкратце, человеческие миобласты от здоровых или пораженных OPMD индивидуумов трансфицировали посредством dsRNA1, dsRNA2 или dsRNA3 в соответствии со способом, описанным выше. Затем проводили количественную RT-PCR и показали значительный уровень нокдауна для каждой из dsRNA (фигура 1).
Конструировали shRNA, соответствующие dsRNA 1-3, содержащие эффекторные последовательности, которые по существу комплементарны целевым областям, описанным в таблице 1, и они представлены в таблице 4. Полные последовательности для shRNA в таблице 4, включая эффекторные последовательности, последовательности стебель-петля и последовательности, комплементарные эффекторной последовательности, соответственно (в ориентации 5'-3'), представлены в таблице 5.
Пример 2. Создание самокомплементарных конструкций плазмиды на основе AAV и вирусов, экспрессирующих shRNA, целенаправленно воздействующие на PABPN1
Самокомплементарные плазмиды на основе аденоассоциированного вируса типа 2 (scAAV2), экспрессирующие одну или три из shRNA, целенаправленно воздействующих на PABPN1 (как представлено в таблице 5), создавали путем субклонирования одной или трех shRNA, целенаправленно воздействующих на PABPN1, в остов scAAV2.
Вкратце, одну конструкцию shRNA, содержащую ДНК, кодирующую shRNA5 (SEQ ID NO: 20) под контролем промотора H1, клонировали в остов вектора pAAV2 (pAAV-shRNA5). Также получали две тройные конструкции shRNA, содержащие ДНК, кодирующую shRNA1 (SEQ ID NO: 16), shRNA3 (SEQ ID NO: 18) и shRNA5 (SEQ ID NO: 20) под контролем промоторов РНК-полимеразы III U61, U69 и H1, соответственно, клонированные в остов вектора pAAV2. Эти тройные конструкции представляли собой pAAV-shRNAx3-short (SEQ ID NO: 22) и pAAV-shRNAx3-long (SEQ ID NO: 23). Оба варианта включали описанную конструкцию трицистронной shRNA, однако конструкция в pAAV-shRNAx3-long также включала спейсерную последовательность ДНК с целью создания оптимального размера вставки для упаковки AAV. Аналогично, конструировали вирусную плазмиду на основе AAV, экспрессирующую shRNA в отношении гена полимеразы HBV (pAAV-HBVpol), для применения в качестве контроля.
Дополнительно получали еще две плазмиды: одну, кодирующую FLAG-меченый мутантный PABPN1 человека, включая удлинение на 7 аланинов (pAAV mut-PABPN1-FLAG; SEQ ID NO: 27), и другую, содержащую кодон-оптимизированную последовательность, кодирующую PABPN1 человека дикого типа с MYC-меткой (pAAV Opt-hPABPN1-MYC; SEQ ID NO: 26).
Каждый из векторов на основе AAV получали посредством псевдотипирования в капсиде AAV8.
Затем получали исходный раствор рекомбинантного псевдотипированного вектора на основе AAV. Вкратце, клетки HEK293T культивировали во вращающихся флаконах с модифицированной по Дульбекко средой Игла, дополненной 10% FBS, и инкубировали при 37°С и 5% CO2. Каждую из вирусных плазмид pAAV-shRNA, описанных в данном примере, и плазмиду pAAVhelpercap8 (pDP8r) или плазмиду pAAVhelpercap9 (pDP9rs) объединяли в комплекс с полиэтиленимином (PEI) в соответствии с инструкциями производителя. Затем выполняли двойную трансфекцию с одной из pAAV-shRNA5, pAAV-shRNAx3-short или pAAV-shRNAx3-long и pDP8r (или pDP9rs) в клетках HEK293T. Клетки HEK293T культивировали в течение 72 часов при 37°С и 5% CO2, после чего клетки лизировали и scAAV shRNA-экспрессирующие частицы для каждой из вирусных плазмид очищали с помощью ультрацентрифугирования в ступенчатом градиенте иодиксанола (Sigma-Aldrich). Число векторных геномов определяли количественно с помощью дот-блот-гибридизации и количественной полимеразной цепной реакции (Q-PCR).
Для вирусных плазмид, обозначенных pAAV-shRNA5, pAAV-shRNAx3-short, pAAV-shRNAx3-long, pAAV-HBVpol, pAAV mut-PABPN1-FLAG и pAAV Opt-hPABPN1-MYC, соответствующие вирусные препараты scAAV8 обозначили scAAV8-shRNA5, scAAV8-shRNAx3-short, scAAV8-shRNAx3-long, scAAV8-HBVpol, ssAAV8 mut-PABPN1-FLAG и ssAAV9-Opt-hPABPN1-MYC, соответственно.
Пример 3. Сайленсинг гена PABPN1 in vitro
Этот пример демонстрирует способность плазмид pAAV-shRNA PABPN1, полученных в примере 2, к нокдауну экспрессии PABPN1 in vitro.
Клетки
Эмбриональные клетки почки человека (HEK293T, АТСС, Манассас, США) выращивали в модифицированной по Дульбекко среде Игла (DMEM), содержащей 20 мМ HEPES, 10% фетальной бычьей сыворотки (FBS) и 2 мМ глутамина (РАА laboratories, Йовил, Великобритания).
Первичные мышиные миобласты (клон IM2), иммортализованные с помощью трансгена чувствительного к температуре большого Т-антигена SV40 (tsA58) и полученные из Immorto-Mouse H2kB-IM2 (исходная линия клеток), H2kB-WTA (кодирующая PABPN1 человека дикого типа) и H2kB-D7e (кодирующая PABPN1 с удлинением на 7 аланинов) предоставлены доктором Michael Antoniou, Королевский колледж Лондона. Клетки IM2 выращивали в DMEM, содержащей 20 мМ HEPES, 2 мМ глутамина и дополненной 20% FBS, 0,5% экстракта куриного эмбриона, 100 Ед./мл пенициллин-стрептомицина, 2 ммоль/л L-глутамина и 20 Ед./мл интерферона-γ.
Обрамотка
Вкратце, клетки HEK293T высевали при 3×105 клеток/лунку и трансфицировали на следующий день одной из pAAV-shRNA5, pAAV-shRNAx3-short или pAAV-shRNAx3-long (4 мкг/лунку) с плазмидами на основе AAV, экспрессирующими мутантный hPABPN1-FLAG (pAAV mut-PABPN1-FLAG) (4 мкг/лунку) (SEQ ID NO: 27) или кодон-оптимизированный PABPN1 (pAAV Opt-hPABPN1-MYC) (4 мкг/лунку) (SEQ ID NO: 26), или без них. В качестве контроля клетки HEK293T трансфицировали плазмидой pAAV-HBVpol, экспрессирующей shRNA в отношении гена полимеразы HBV (4 мкг/лунку). Клетки HEK293T инкубировали при 33°С в DMEM 10% FCS в отсутствие антибиотиков в течение 48 часов, после чего клетки собирали и получали клеточные лизаты для анализа с помощью вестерн-блоттинга.
Аналогично, мышечные миобласты H2kB-D7e (106 клеток/лунку) трансфицировали посредством нуклеофекции pAAV-HBVpol, AAV-shRNAx3-short или pAAV-shRNAx3-long с плазмидами на основе AAV, экспрессирующими мутантный hPABPN1-FLAG или Opt-hPABPN1-MYC (1 мкг/лунку), или без них. Затем мышиные миобласты H2kB-D7e инкубировали при 33°С в DMEM 10% FCS в отсутствие антибиотиков в течение 48 часов и затем переключали на дифференцировку путем инкубации в DMEM/5% лошадиной сыворотке в течение еще 72 часов. Через 5 дней после трансфекции собирали мышечные трубочки и получали клеточные лизаты для анализа с помощью вестерн-блоттинга.
Вестерн-блот-анализ
Клеточные лизаты получали посредством гомогенизации клеток в буфере RIPA, содержащем NaCl 0,15 М, 0,1% SDS, 50 мМ Tris (рН 8), 2 мМ EDTA и 10% Triton-X-100 со смесью ингибиторов протеаз (Complete, Roche Diagnostics).
Белки разделяли на 4-12% геле Bis-Tris (Invitrogen) и переносили на нитроцеллюлозную мембрану (мембрана Hybond ECL, Amersham Biosciences), которую блокировали посредством инкубации в 5% молоке в 0,1 М PBS, 0,1% Tween-20. Нитроцеллюлозную мембрану окрашивали первичными антителами, образованными к PABPN1 (Abcam, 1/10000) и GAPDH человека (Abcam, 1/10000) или GAPDH мыши (Abcam, 1/2500) в качестве контроля аутореакции.
Для выявления удлиненного мутантного белка PABPN1, экспрессированного вектором pAAV mut-PABPN1-FLAG, и кодон-оптимизированного белка PABPN1, экспрессированного вектором pAAV opt-hPABPN1-MYC, нитроцеллюлозную мембрану окрашивали антителом к FLAG (Sigma, 1/10000) и антителом к cMYC (Abcam, 1/10000), соответственно.
Нитроцеллюлозную мембрану дополнительно инкубировали с HRP-конъюгированными вторичными антителами к антителу кролика и к антителу мыши (Sigma, 1/2000 и 1/1000, соответственно). Иммунореактивные полосы выявляли с использованием реагента усиленной хемилюминесценции (ECL, Amersham Biosciences) и визуализировали путем воздействия на мембрану с помощью ECL Hyperfilm (Amersham Biosciences).
Количественная оценка общего нокдауна для PABPN1 относительно GAPDH с использованием ImageJ показана на фигуре 2. Как видно на фигуре 2, средние значения 40%, 90% и 95% нокдауна экспрессии PABPN1 достигались с помощью одинарного вектора shRNA (pAAV-shRNA5), трицистронного короткого вектора (pAAV-shRNAx3-short) и трицистронного длинного вектора (pAAV-shRNAx3-long), соответственно. Как короткая (размер вставки ~1 т.о.), так и длинная (размер вставки ~1,5 т.о.) трицистронная конструкция shRNA приводила к аналогичной степени нокдауна PABPN1 из-за сходства в композициях последовательностей, направленных в отношении одних и тех же мишеней в гене PABPN1. В связи с этим добавление спейсерной последовательности к конструкции pAAV-shRNAx3-long отрицательно не сказывалось на эффективности нокдауна PABPN1, а скорее приводило к чуть более выраженному нокдауну.
Одинарный вектор shRNA (pAAV-shRNA5) и оба трицистронных вектора (pAAV-shRNAx3-short и pAAV-shRNAx3-long) были способны к нокдауну PABPN1 дикого и мутантного типов в клетках HEK293, совместно трансфицированных pAAV mut-PABPN1-FLAG, экспрессиирующим мутантный PABPN1, но общий нокдаун был более статистически значимым для конструкций с тройной shRNA, чем для конструкции с одинарной shRNA. С другой стороны, в клетках HEK293, совместно трансфицированных вектором pAAV mut-PABPN1-FLAG, экспрессирующим мутантный PABPN1, и контрольным вектором pAAV-HBV-pol, целенаправленно воздействующим на ген полимеразы HBV (фигуры 3а и 3b), не наблюдалось никакого нокдауна.
Кроме того, по сравнению с клетками HEK293, совместно трансфицированными вектором pAAV mut-PABPN1-FLAG, экспрессирующим удлиненный мутантный белок PABPN1, клетки, совместно трансфицированные вектором pAAV Opt-hPABPN1-MYC, экспрессирующим кодон-оптимизированный PABPN1, показали хорошие уровни белка PABPN1. Эти данные показывают, что кодон-оптимизированный белок PABPN1 является устойчивым к разрушению с помощью shRNA, экспрессируемых одинарной и трицистронными конструкциями shRNA (фигуры 3а и 3b). Чтобы подтвердить это наблюдение, для выявления экспрессии кодон-оптимизированного белка PABPN1, содержащего пептидную метку cMYC, использовали антитело к cMYC (фигура 3с).
Аналогичные результаты получили на мышиных миобластах H2kB-D7e, трансфицированных либо (i) контрольным вектором pAAV-HBV-pol, (ii) вектором pAAV Opt-hPABPN1-MYC, экспрессирующим кодон-оптимизированный PABPN1, (iii) вектором pAAV-shRNAx3-long, либо (iv) вектором pAAV Opt-hPABPN1-MYC и вектором pAAV-shRNAx3-long. Как видно на фигурах 4а-4е, вектор pAAV-shRNAx3-long способен к нокдауну мутантного удлиненного белка PABPN1, экспрессируемого дифференцированными мышиными миобластами H2kB-D7e, тогда как кодон-оптимизированный белок PABPN1 был устойчив к разрушению с помощью shRNA, экспрессируемых трицистронной конструкцией shRNA.
Все данные представлены в виде среднего значения ± стандартная ошибка среднего. Все статистические анализы проводили с использованием t-критерия Стьюдента или ANOVA. Различие считалась значимым при *Р<0,05, **Р<0,01 или ***Р<0,001.
Исходя из этих данных конструкция pAAV8-shRNAx3-long была выбрана для получения вируса и дальнейшей оценки.
Пример 4. Сайленсинг гена эндогенного PABPN1 и замещение кодон-оптимизированным PABPN1 in vivo
Этот пример демонстрирует способность рекомбинантного вируса scAAV8-shRNAx3-long, полученного в примере 2, к нокдауну экспрессии эндогенного PABPN1 in vivo и его замещению кодон-оптимизированным PABPN1 человека. Также продемонстрированы физиологические последствия нокдауна мутантного PABPN1 и замещения не мутантной формой гена.
Обработка
Ранее были описаны трансгенные мыши А17.1 (Davies, Wang et al., 2005, Trollet, Anvar et al., 2010). Мышей A17.1 и контрольных WT FvB получили путем скрещивания гетерозиготных носителей линии А17.1 (Davies, Wang et al., 2005) с мышами с фоновым генотипом FvB. Мышей генотипировали по бычьему PABPN1 через 4 недели после рождения и содержали в помещениях с минимальной заболеваемостью (Колледж Ройял-Холлоуэй Лондонского университета (Royal Holloway-University of London)) с доступом к пище и воде ad libitum.
Вкратце, мышей Al7 возрастом 10-12 недель помещали в группы обработки 1-4 ниже (n=5 на группу обработки). Мышей WT FvB, также возрастом 10-12 недель, использовали в качестве здорового контроля и помещали в группу 5 (n=5). Всех мышей анестезировали с помощью 2-4% изофлурана и обрабатывали следующим образом:
Группа 1 (А17): однократный болюс 50 мкл солевого раствора, содержащего 2,5Е+10 вирусных частиц scAAV8-shRNAx3-long, в обе мышцы ТА путем IM-инъекции.
Группа 2 (А17): однократный болюс 50 мкл солевого раствора, содержащего 1,3Е+11 вирусных частиц ssAAV9-Opt-hPABPN1 (экспрессирующих кодон-оптимизированный hPABPN1), в обе мышцы ТА путем IM-инъекции.
Группа 3 (А17): однократный болюс 50 мкл солевого раствора, содержащего 2,5Е+10 вирусных частиц scAAV8-shRNAx3-long и 1,3Е+11 вирусных частиц ssAAV9-Opt-hPABPN1, в обе мышцы ТА путем IM-инъекции.
Группа 4 (А17): однократный болюс 50 мкл только солевого раствора.
Группа 5 (FvB): однократный болюс 50 мкл только солевого раствора.
Сократимость мыши
Измерения сократимости мышц ТА, включая изометрическую максимальную и удельную силу, проводили через 18 недель после инъекции с использованием методики, описанной ранее в Trollet et al., (2010) Human Molecular Genetics, 19(11): 2191-2207. Эти данные представлены на фигуре 4.
Затем мышей умерщвляли посредством передозировки анестетика, после чего мышцы ТА вырезали от сухожилия до сухожилия, взвешивали и быстро замораживали в охлажденном жидким азотом изопентане для дальнейшего гистологического и молекулярного анализа.
Экспрессия mRNA PABPN1
Общую РНК выделяли из образцов скелетных мышц с использованием Trizol (Invitrogen) в соответствии с инструкциями производителя. Образцы РНК определяли количественно с использованием спектрофотометра NanoDrop ND-1000 (NanoDrop Technologies). РНК (50-250 нг для биопсии мышц, 1-3 мкг для клеточного осадка) подвергали обратной транскрипции с использованием обратной транскриптазы М-MLV (Invitrogen) в соответствии с инструкциями производителя. cDNA использовали для количественной реакции ПЦР с использованием смеси буфера SYBR green (LightCycler® 480 Sybr green I Master) в общем объеме реакции 9 мкл. Реакцию ПЦР проводили следующим образом: 8 минут при 95°С, а затем 50 циклов: 15 секунд при 95°С, 15 секунд при 60°С и 15 секунд при 72°С. Специфичность продуктов ПЦР проверяли при анализе кривой плавления с использованием следующей программы: 65°С, увеличивая на 0,11°С/секунду до 97°С.
Уровень экспрессии каждой mRNA нормализовали до уровня экспрессии mRNA мышиного RPLP0 (большой рибосомальный белок, субъединица Р0). Уровни экспрессии рассчитывали в соответствии со способом ΔΔCt.
Последовательности праймеров, используемых для RT-PCR и RT-PCR в реальном времени, являлись следующими:
Иммуногистохимия
Иммуногистохимию проводили на срезах мышц ТА (10 мкм), вырезанных у мышей для выявления присутствия ядерных агрегатов белка PABPN1. Вкратце, срезы мышцы ТА инкубировали в 1 М KCl, 30 мМ HEPES, 65 мМ PIPES, 10 мМ EDTA, 2 мМ MgCl2 (рН 6,9) в течение 1 часа для удаления любых растворимых белков. Затем срезы блокировали 1% нормальной козьей сывороткой в 0,1 М PBS, 0,1% Triton X100 и инкубировали в течение ночи при 4°С с первичным антителом к PABPN1, разведенным до 1:200 в том же буфере. Затем срезы дополнительно инкубировали с антителом к ламинину в течение 1 ч. при RT, а потом с вторичными антителами в течение 1 ч. при комнатной температуре. Наконец, срезы окрашивали с помощью Hoechst для визуализации ядер.
Гистологические и морфологические анализы
Окрашивание проводили на поперечных серийных криосрезах мышц ТА (10 мкм). Мышцы ТА рассекали на 10-12 различных интервалов вдоль длины мышцы, что позволяет определить максимальную площадь поперечного сечения (CSA). Для оценки морфологии тканей и визуализации фиброза и соединительной ткани окрашивали поперечные срезы мышц, соответственно, Н&Е и коллагеном VI для дальнейшего изучения при флуоресцентном свете. Для оценки центрального расположения ядра в каждом срезе оценивали пять случайных областей. Изображения визуализировали с использованием микроскопа Olympus ВХ60 (Olympus Optical, Гамбург, Германия), оцифрованного с использованием CCD-камеры (Photometries CoolSNAP fx; Roper Scientific, Тусон, Аризона, США), и анализировали с использованием системы анализа изображений MetaView (Universal Imaging, Даунингтаун, Пенсильвания, США). Подсчитывали общее количество волокон в этих областях и количество волокон с центрально расположенными ядрами выражали в процентах от общего количества волокон (фигура 5).
Вестерн-блот-анализ
Затем проводили вестерн-блот-анализ на тканях для выявления PABPN1. Вкратце, лизаты мышц получали гомогенизацией ткани в растворе RIPA (0,15 М NaCl, 0,05 М HEPES, 1% NP-40, 0,5% дезоксихолат натрия, 0,10% SDS, 0,01 М EDTA) со смесью ингибиторов протеаз. Белки разделяли на 4-12% геле Bis-Tris (Invitrogen) и переносили на нитроцеллюлозную мембрану (мембрана Hybond ECL, Amersham Biosciences), которую блокировали посредством инкубации в 5% молоке в 0,1 М PBS, 0,1% Tween-20. Нитроцеллюлозную мембрану окрашивали первичными антителами, образованными к PABPN1 (Abcam, 1/10000) или винкулину мыши (Sigma, 1/10000) в качестве контроля аутореакции. Нитроцеллюлозную мембрану дополнительно инкубировали с HRP-конъюгированными вторичными антителами к антителу кролика и к антителу мыши (Sigma, 1/2000 и 1/1000, соответственно). Иммунореактивные полосы выявляли с использованием реагента усиленной хемилюминесценции (ECL, Amersham Biosciences) и визуализировали путем воздействия на мембрану с помощью ECL Hyperfilm (Amersham Biosciences).
Все данные представлены в виде среднего значения ± стандартная ошибка среднего (SEM) (размер когорты указан на эксперимент). Все статистические анализы проводили с использованием Г-критерия Стьюдента. Различие считалась значимым при *Р<0,05, **Р<0,01 или ***Р<0,001.
Результаты
Установили, что в то время, как мышечная масса (фигура 5В) не восстанавливалась в течение 4 месяцев обработки, было показано, что улучшается общая сила мышц (фигура 5А) и удельная сила мышц (фигура 5С), нормированная для мышей в группе 3, которым вводили (i) вирусные частицы scAAV8-shRNAx3-long, экспрессирующие три shRNA, целенаправленно воздействующие на эндогенный PABPN1, и (ii) вирусные частицы ssAAV8 Opt-hPABPN1, экспрессирующие замещенный кодон-оптимизированный PABN1 человека, на который не оказывают целенаправленного воздействия shRNA (фигура 5).
Как видно из данных вестерн-блоттинга, представленных на фигуре 6, мыши А17, которым вводили scAAV8-shRNAx3-long отдельно и в комбинации с ssAAV9 opt hPABPN1-myc, показали значительно сниженные уровни мутантного удлиненного белка PABPN1 относительно мышей, которым вводили только солевой раствор, демонстрируя способность вирусных частиц scAAV-shRNAx3-long подавлять экспрессию эндогенного мутантного белка PABPN1 in vivo. Кроме того, Мус-метка одинаково экспрессировалась у мышей, обработанных ssAAV9-optPABPN1-myc, или комбинацией scAAV8-shRNAx3-long и ssAAV9-opt hPABPN1-myc.
С помощью количественной ПЦР подтверждали эти результаты, показав, что scAAV8-shRNAx3-long приводила к 80% нокдауну экспрессии PABPN1 по сравнению с мышами, которым вводили только солевой раствор, и scAAV8-shRNAx3-long при введении в комбинации с ssAAV9 opt hPABPN1-myc приводила к 90% нокдауну экспрессии PABPN1 по сравнению с мышами, которым вводили только солевой раствор.
Гистологический и молекулярный анализ показал, что сайленсинг эндогенного PABPN1 почти устраняет ядерные агрегаты (фигура 7А-В) и индуцирует разрушение мышц, как показано с помощью увеличения количества волокон с центрально расположенным ядром (фигура 8А, С). В связи с этим, ядерные агрегаты были обнаружены в 35% мышечных ядер у мышей А17, в то время как мышечные ядра у мышей FvB практически не содержали агрегатов. Хотя экспрессия optPABPN1 не изменяла образование нерастворимых агрегатов в мышцах мышей А17, обработка с помощью scAAV8-shRNAx3-long уменьшала количество мышечных ядер, содержащих агрегаты, до 10%. Количество мышечных ядер, содержащих агрегаты, уменьшалось до всего лишь 5%, когда scAAV8-shRNAx3-long вводили совместно с ssAAV9-opthPABPN1-myc, экспрессирующей кодон-оптимизированный PABPN1. Тем не менее было показано, что разрушение мышц обращалось вспять при совместной экспрессии кодон-оптимизированного PABPN1 человека.
В мышцах мышей А17, обработанных комбинацией scAAV8-shRNAx3-long и ssAAV9 opt hPABPN1-myc, наблюдали значительное уменьшение фиброзной ткани по сравнению с мышцами мышей А17, которым вводили солевой раствор (фигура 8В, D). Наконец, анализ площади поперечного сечения (CSA) мышечных волокон показал, что, хотя инъекция scAAV-shRNAx3-long сама по себе не изменяла CSA мышечных волокон, обработка с помощью ssAAV9 Opt-hPABPN1-myc отдельно или в комбинации с scAAV-shRNAx3-long заметно увеличивала CSA мышечных волокон (фигура 8E-F).
В совокупности эти данные показывают, что конструкция shRNAx3-long, доставленная с помощью AAV, эффективно снижает PABPN1 in vivo и значительно уменьшает образование ядерных агрегатов. Важно отметить, что также было показано, что PABPN1 с оптимизированной последовательностью может экспрессироваться с помощью rAAV in vivo с получением транскрипта, который устойчив к разрушению и который восстанавливает функцию мышц. В совокупности эти данные in vivo демонстрируют, что подавление и заместительная терапия эффективны для восстановления мышечных функций при OPMD.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Benitec Biopharma Limited
<120> Реагенты для лечения окулофарингеальной мышечной дистрофии (OPMD) и их применение
<130> 177475
<150> US 62/322,745
<151> 2016-04-14
<160> 29
<170> PatentIn версия 3.5
<210> 1
<211> 23
<212> РНК
<213> Homo sapiens
<400> 1
uugaggagaa gauggaggcu gau 23
<210> 2
<211> 21
<212> РНК
<213> Homo sapiens
<400> 2
aggaagaagc ugagaagcua a 21
<210> 3
<211> 27
<212> РНК
<213> Homo sapiens
<400> 3
gagguagaga agcagaugaa uaugagu 27
<210> 4
<211> 23
<212> РНК
<213> Искусственная последовательность
<220>
<223> Эффекторная последовательность для ssRNA1 и dsRNA1
<400> 4
aucagccucc aucuucuccu caa 23
<210> 5
<211> 23
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность, комплементарная эффекторной последовательности для dsRNA1
<400> 5
uugaggagaa gauggaggcu gau 23
<210> 6
<211> 21
<212> РНК
<213> Искусственная последовательность
<220>
<223> Эффекторная последовательность для ssRNA2 и dsRNA2
<400> 6
uuagcuucuc agcuucuucc u 21
<210> 7
<211> 21
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность, комплементарная эффекторной последовательности для dsRNA2
<400> 7
aggaagaagc ugagaagcua a 21
<210> 8
<211> 27
<212> РНК
<213> Искусственная последовательность
<220>
<223> Эффекторная последовательность для ssRNA3 и dsRNA3
<400> 8
acucauauuc aucugcuucu cuaccuc 27
<210> 9
<211> 27
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность, комплементарная эффекторной последовательности для dsRNA3
<400> 9
gagguagaga agcagaugaa uaugagu 27
<210> 10
<211> 23
<212> РНК
<213> Искусственная последовательность
<220>
<223> Эффекторная последовательность для shRNA1 и shRNA2
<400> 10
aucagccucc aucuucuccu caa 23
<210> 11
<211> 23
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность, комплементарная эффекторной последовательности для shRNA1 и shRNA2
<400> 11
uugaggagaa gauggaggcu gau 23
<210> 12
<211> 21
<212> РНК
<213> Искусственная последовательность
<220>
<223> Эффекторная последовательность для shRNA3 и shRNA4
<400> 12
uuagcuucuc agcuucuucc u 21
<210> 13
<211> 21
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность, комплементарная эффекторной последовательности для shRNA3 и shRNA4
<400> 13
aggaagaagc ugagaagcua a 21
<210> 14
<211> 27
<212> РНК
<213> Искусственная последовательность
<220>
<223> Эффекторная последовательность для shRNA5 и shRNA6
<400> 14
acucauauuc aucugcuucu cuaccuc 27
<210> 15
<211> 27
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность, комплементарная эффекторной последовательности для shRNA5 и shRNA6
<400> 15
gagguagaga agcagaugaa uaugagu 27
<210> 16
<211> 49
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность shRNA1
<400> 16
gaggagaaga uggaggcuga ucaagagaau cagccuccau cuucuccuc 49
<210> 17
<211> 49
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность shRNA2
<400> 17
aucagccucc aucuucuccu ccaagagaga ggagaagaug gaggcugau 49
<210> 18
<211> 47
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность shRNA3
<400> 18
ggaagaagcu gagaagcuaa caagagauua gcuucucagc uucuucc 47
<210> 19
<211> 47
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность shRNA4
<400> 19
uuagcuucuc agcuucuucc caagagagga agaagcugag aagcuaa 47
<210> 20
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность shRNA5
<400> 20
gagguagaga agcagaugaa uaugagucaa gagacucaua uucaucugcu ucucuaccuc 60
<210> 21
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<223> Последовательность shRNA6
<400> 21
cucauauuca ucugcuucuc uaccuccaag agagagguag agaagcagau gaauaugagu 60
<210> 22
<211> 1068
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тройная короткая конструкция OPMD
<400> 22
ctcgagacgc gtggtaccga gctcgctagc agcgcttacg tatttaaatg gcaggaagag 60
ggcctatttc ccatgattcc ttcatatttg catatacgat acaaggctgt tagagagata 120
attagaatta atttgactgt aaacacaaag atattagtac aaaatacgtg acgtagaaag 180
taataatttc ttgggtagtt tgcagtttta aaattatgtt ttaaaatgga ctatcatatg 240
cttaccgtaa cttgaaagta tttcgatttc ttggctttat atatcttgtg gaaaggacga 300
aacaccgagg agaagatgga ggctgatcaa gagaatcagc ctccatcttc tcctcttttt 360
tatgcgcacg tttaaacagg gcggtgcggc tcaggctctg ccccgcctcc ggggctattt 420
gcatacgacc atttccagta attcccagca gccaccgtag ctatatttgg tagaacaacg 480
agcactttct caactccagt caataactac gttagttgca ttacacattg ggctaatata 540
aatagaggtt aaatctctag gtcatttaag agaagtcggc ctatgtgtac agacatttgt 600
tccaggggct ttaaatagct ggtggtggaa ctcaatattc ggaagaagct gagaagctaa 660
caagagatta gcttctcagc ttcttccttt tttgtatacg atacctatca attcgaacgc 720
tgacgtcatc aacccgctcc aaggaatcgc gggcccagtg tcactaggcg ggaacaccca 780
gcgcgcgtgc gccctggcag gaagatggct gtgagggaca ggggagtggc gccctgcaat 840
atttgcatgt cgctatgtgt tctgggaaat caccataaac gtgaaatgtc tttggatttg 900
ggaatcttat aagttctgta tgagaccaca gatccccgag gtagagaagc agatgaatat 960
gagttcaaga gactcatatt catctgcttc tctacctctt tttgacacac gtcctgcagc 1020
gttaaccaat tgccacgggg ttggggtacc acgcgtgagc tcctcgag 1068
<210> 23
<211> 1527
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тройная длинная конструкция OPMD
<400> 23
ctcgagacgc gtggtaccga gctcgctagc agcgcttacg tatttaaatg gcaggaagag 60
ggcctatttc ccatgattcc ttcatatttg catatacgat acaaggctgt tagagagata 120
attagaatta atttgactgt aaacacaaag atattagtac aaaatacgtg acgtagaaag 180
taataatttc ttgggtagtt tgcagtttta aaattatgtt ttaaaatgga ctatcatata 240
agatgggctt accgtaactt gaaagtattt cgatttcttg gctttatata tcttgtggaa 300
aggacgaaac accgaggaga agatggaggc tgatcaagag aatcagcctc catcttctcc 360
tcttttttac atcaggttgt ttttctgttt ttacatcagg ttgtttttct gtttggtttt 420
ttttttacac cacgtttata cgccggtgca cggtttacca ctgaaaacac ctttcatcta 480
caggtgatat cttttaacac aaataaaatg tagtagtcca tgcgcacgtt taaacaaggg 540
cggtgcggct caggctctgc cccgcctccg gggctatttg catacgacca tttccagtaa 600
ttcccagcag ccaccgtagc tatatttggt agaacaacga gcactttctc aactccagtc 660
aataactacg ttagttgcat tacacattgg gctaatataa atagaggtta aatctctagg 720
tcatttaaga gaagtcggcc tatgtgtaca gacatttgtt ccaggggctt taaatagctg 780
gtggtggaac tcaatattcg gaagaagctg agaagctaac aagagattag cttctcagct 840
tcttcctttt ttccattttc cctcccagaa acggaatctt gctctgttgc ccaggctgga 900
atgcaatggc gcgatcttag cttgttgcaa cctccgcctc ccgggttgaa gcgattctcc 960
tgcctcagcc tcccgagtag ctgggattat aaacatgcgc cagtatacga tacctatcaa 1020
ttcgaacgct gacgtcatca acccgctcca aggaatcgcg ggcccagtgt cactaggcgg 1080
gaacacccag cgcgcgtgcg ccctggcagg aagatggctg tgagggacag gggagtggcg 1140
ccctgcaata tttgcatgtc gctatgtgtt ctgggaaatc accataaacg tgaaatgtct 1200
ttggatttgg gaatcttata agttctgtat gagaccacag atccccgagg tagagaagca 1260
gatgaatatg agttcaagag actcatattc atctgcttct ctacctcttt ttaaacaaaa 1320
cgaaaccggg ccgggcgcgg tggttcacgc ctataatccc tgcactttgg gaggccgagg 1380
cgggcggatc acaaggtcag gaggtcgaga ccatccaggc taacacggtg aaaccccccc 1440
ccatctctac taaaaaaaaa aagacacacg tcctgcagcg ttaaccaatt gccacggggt 1500
tggggtacca cgcgtgagct cctcgag 1527
<210> 24
<211> 950
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Кодон-оптимизированная последовательность cDNA PABPN1 человека (с последовательностью Козака, но без myc-метки)
<400> 24
ccgctgccgc cgctgctgct gccgcagccg gcgctgccgg cggaagaggc agcggccctg 60
gcagacggcg gcatctggtc cctggcgccg gaggggaggc cggcgaaggc gcccctggcg 120
gagccggcga ctacggcaac ggcctggaaa gcgaggaact ggaacccgag gaactgctgc 180
tggaacctga gcccgagcca gagcccgagg aagagccccc taggccaaga gccccccctg 240
gcgccccagg accaggacca ggctctgggg caccaggctc tcaggaagag gaagaagagc 300
ccggcctcgt cgagggagac ccaggcgatg gcgctatcga agatcccgag ctggaagcca 360
tcaaggccag agtgcgggag atggaagagg aggccgaaaa attgaaagag ctgcagaacg 420
aagtcgaaaa acaaatgaac atgtcccccc ctcctggaaa tgctggccct gtgatcatga 480
gcatcgagga aaagatggaa gccgacgccc ggtctatcta cgtgggcaac gtggactacg 540
gcgccaccgc cgaagaactg gaagcccact ttcacggctg tggcagcgtg aaccgggtga 600
ccatcctgtg cgacaagttc agcggccacc ccaagggctt cgcctacatc gagttcagcg 660
acaaagaaag cgtgcggacc tctctggctc tcgacgagtc tctgttcagg ggaaggcaga 720
tcaaggtcat ccccaagcgg accaacaggc ccggcatcag caccaccgac agaggcttcc 780
ctagggctag gtacagagcc cggaccacca actacaacag cagcagaagc cggttctaca 840
gcggcttcaa ttctcggcct agaggcagag tgtaccgggg cagggccagg gccacctcct 900
ggtacagccc ctactgaacc tcctggtaca gcccctactg atgagatatc 950
<210> 25
<211> 306
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность кодон-оптимизированного PABpN1 человека (без Myc-метки)
<400> 25
Met Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Gly Ala Ala Gly Gly
1 5 10 15
Arg Gly Ser Gly Pro Gly Arg Arg Arg His Leu Val Pro Gly Ala Gly
20 25 30
Gly Glu Ala Gly Glu Gly Ala Pro Gly Gly Ala Gly Asp Tyr Gly Asn
35 40 45
Gly Leu Glu Ser Glu Glu Leu Glu Pro Glu Glu Leu Leu Leu Glu Pro
50 55 60
Glu Pro Glu Pro Glu Pro Glu Glu Glu Pro Pro Arg Pro Arg Ala Pro
65 70 75 80
Pro Gly Ala Pro Gly Pro Gly Pro Gly Ser Gly Ala Pro Gly Ser Gln
85 90 95
Glu Glu Glu Glu Glu Pro Gly Leu Val Glu Gly Asp Pro Gly Asp Gly
100 105 110
Ala Ile Glu Asp Pro Glu Leu Glu Ala Ile Lys Ala Arg Val Arg Glu
115 120 125
Met Glu Glu Glu Ala Glu Lys Leu Lys Glu Leu Gln Asn Glu Val Glu
130 135 140
Lys Gln Met Asn Met Ser Pro Pro Pro Gly Asn Ala Gly Pro Val Ile
145 150 155 160
Met Ser Ile Glu Glu Lys Met Glu Ala Asp Ala Arg Ser Ile Tyr Val
165 170 175
Gly Asn Val Asp Tyr Gly Ala Thr Ala Glu Glu Leu Glu Ala His Phe
180 185 190
His Gly Cys Gly Ser Val Asn Arg Val Thr Ile Leu Cys Asp Lys Phe
195 200 205
Ser Gly His Pro Lys Gly Phe Ala Tyr Ile Glu Phe Ser Asp Lys Glu
210 215 220
Ser Val Arg Thr Ser Leu Ala Leu Asp Glu Ser Leu Phe Arg Gly Arg
225 230 235 240
Gln Ile Lys Val Ile Pro Lys Arg Thr Asn Arg Pro Gly Ile Ser Thr
245 250 255
Thr Asp Arg Gly Phe Pro Arg Ala Arg Tyr Arg Ala Arg Thr Thr Asn
260 265 270
Tyr Asn Ser Ser Arg Ser Arg Phe Tyr Ser Gly Phe Asn Ser Arg Pro
275 280 285
Arg Gly Arg Val Tyr Arg Gly Arg Ala Arg Ala Thr Ser Trp Tyr Ser
290 295 300
Pro Tyr
305
<210> 26
<211> 947
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Кодон-оптимизированная последовательность cDNA PABpN1 человека (с последовательностью Козака и Myc-меткой)
<400> 26
ccgctgccgc cgctgctgct gccgcagccg gcgctgccgg cggaagaggc agcggccctg 60
gcagacggcg gcatctggtc cctggcgccg gaggggaggc cggcgaaggc gcccctggcg 120
gagccggcga ctacggcaac ggcctggaaa gcgaggaact ggaacccgag gaactgctgc 180
tggaacctga gcccgagcca gagcccgagg aagagccccc taggccaaga gccccccctg 240
gcgccccagg accaggacca ggctctgggg caccaggctc tcaggaagag gaagaagagc 300
ccggcctcgt cgagggagac ccaggcgatg gcgctatcga agatcccgag ctggaagcca 360
tcaaggccag agtgcgggag atggaagagg aggccgaaaa attgaaagag ctgcagaacg 420
aagtcgaaaa acaaatgaac atgtcccccc ctcctggaaa tgctggccct gtgatcatga 480
gcatcgagga aaagatggaa gccgacgccc ggtctatcta cgtgggcaac gtggactacg 540
gcgccaccgc cgaagaactg gaagcccact ttcacggctg tggcagcgtg aaccgggtga 600
ccatcctgtg cgacaagttc agcggccacc ccaagggctt cgcctacatc gagttcagcg 660
acaaagaaag cgtgcggacc tctctggctc tcgacgagtc tctgttcagg ggaaggcaga 720
tcaaggtcat ccccaagcgg accaacaggc ccggcatcag caccaccgac agaggcttcc 780
ctagggctag gtacagagcc cggaccacca actacaacag cagcagaagc cggttctaca 840
gcggcttcaa ttctcggcct agaggcagag tgtaccgggg cagggccagg gccacctcct 900
ggtacagccc ctacgaacag aagctgatca gcgaggaaga tctgtga 947
<210> 27
<211> 316
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность кодон-оптимизированного PABpN1 человека (с Myc-меткой)
<400> 27
Met Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Gly Ala Ala Gly Gly
1 5 10 15
Arg Gly Ser Gly Pro Gly Arg Arg Arg His Leu Val Pro Gly Ala Gly
20 25 30
Gly Glu Ala Gly Glu Gly Ala Pro Gly Gly Ala Gly Asp Tyr Gly Asn
35 40 45
Gly Leu Glu Ser Glu Glu Leu Glu Pro Glu Glu Leu Leu Leu Glu Pro
50 55 60
Glu Pro Glu Pro Glu Pro Glu Glu Glu Pro Pro Arg Pro Arg Ala Pro
65 70 75 80
Pro Gly Ala Pro Gly Pro Gly Pro Gly Ser Gly Ala Pro Gly Ser Gln
85 90 95
Glu Glu Glu Glu Glu Pro Gly Leu Val Glu Gly Asp Pro Gly Asp Gly
100 105 110
Ala Ile Glu Asp Pro Glu Leu Glu Ala Ile Lys Ala Arg Val Arg Glu
115 120 125
Met Glu Glu Glu Ala Glu Lys Leu Lys Glu Leu Gln Asn Glu Val Glu
130 135 140
Lys Gln Met Asn Met Ser Pro Pro Pro Gly Asn Ala Gly Pro Val Ile
145 150 155 160
Met Ser Ile Glu Glu Lys Met Glu Ala Asp Ala Arg Ser Ile Tyr Val
165 170 175
Gly Asn Val Asp Tyr Gly Ala Thr Ala Glu Glu Leu Glu Ala His Phe
180 185 190
His Gly Cys Gly Ser Val Asn Arg Val Thr Ile Leu Cys Asp Lys Phe
195 200 205
Ser Gly His Pro Lys Gly Phe Ala Tyr Ile Glu Phe Ser Asp Lys Glu
210 215 220
Ser Val Arg Thr Ser Leu Ala Leu Asp Glu Ser Leu Phe Arg Gly Arg
225 230 235 240
Gln Ile Lys Val Ile Pro Lys Arg Thr Asn Arg Pro Gly Ile Ser Thr
245 250 255
Thr Asp Arg Gly Phe Pro Arg Ala Arg Tyr Arg Ala Arg Thr Thr Asn
260 265 270
Tyr Asn Ser Ser Arg Ser Arg Phe Tyr Ser Gly Phe Asn Ser Arg Pro
275 280 285
Arg Gly Arg Val Tyr Arg Gly Arg Ala Arg Ala Thr Ser Trp Tyr Ser
290 295 300
Pro Tyr Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu
305 310 315
<210> 28
<211> 945
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность cDNA мутантного PABpN1 человека (с FLAG-меткой)
<400> 28
atggcggcgg cggcggcggc ggcagcagca gcgggggctg cgggcggtcg gggctccggg 60
ccggggcggc ggcgccatct tgtgcccggg gccggtgggg aggccgggga gggggccccg 120
gggggcgcag gggactacgg gaacggcctg gagtctgagg aactggagcc tgaggagctg 180
ctgctggagc ccgagccgga gcccgagccc gaagaggagc cgccccggcc ccgcgccccc 240
ccgggagctc cgggccctgg gcctggttcg ggagcccccg gcagccaaga ggaggaggag 300
gagccgggac tggtcgaggg tgacccgggg gacggcgcca ttgaggaccc ggagctggaa 360
gctatcaaag ctcgagtcag ggagatggag gaagaagctg agaagctaaa ggagctacag 420
aacgaggtag agaagcagat gaatatgagt ccacctccag gcaatgctgg cccggtgatc 480
atgtccattg aggagaagat ggaggctgat gcccgttcca tctatgttgg caatgtggac 540
tatggtgcaa cagcagaaga gctggaagct cactttcatg gctgtggttc agtcaaccgt 600
gttaccatac tgtgtgacaa atttagtggc catcccaaag ggtttgcgta tatagagttc 660
tcagacaaag agtcagtgag gacttccttg gccttagatg agtccctatt tagaggaagg 720
caaatcaagg tgatcccaaa acgaaccaac agaccaggca tcagcacaac agaccggggt 780
tttccacgag cccgctaccg cgcccggacc accaactaca acagctcccg ctctcgattc 840
tacagtggtt ttaacagcag gccccggggt cgcgtctaca ggggccgggc tagagcgaca 900
tcatggtatt ccccttacga ctacaaggac gacgatgaca agtga 945
<210> 29
<211> 314
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность мутантного PABpN1 человека (с FLAG-меткой)
<400> 29
Met Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Gly Ala Ala Gly Gly
1 5 10 15
Arg Gly Ser Gly Pro Gly Arg Arg Arg His Leu Val Pro Gly Ala Gly
20 25 30
Gly Glu Ala Gly Glu Gly Ala Pro Gly Gly Ala Gly Asp Tyr Gly Asn
35 40 45
Gly Leu Glu Ser Glu Glu Leu Glu Pro Glu Glu Leu Leu Leu Glu Pro
50 55 60
Glu Pro Glu Pro Glu Pro Glu Glu Glu Pro Pro Arg Pro Arg Ala Pro
65 70 75 80
Pro Gly Ala Pro Gly Pro Gly Pro Gly Ser Gly Ala Pro Gly Ser Gln
85 90 95
Glu Glu Glu Glu Glu Pro Gly Leu Val Glu Gly Asp Pro Gly Asp Gly
100 105 110
Ala Ile Glu Asp Pro Glu Leu Glu Ala Ile Lys Ala Arg Val Arg Glu
115 120 125
Met Glu Glu Glu Ala Glu Lys Leu Lys Glu Leu Gln Asn Glu Val Glu
130 135 140
Lys Gln Met Asn Met Ser Pro Pro Pro Gly Asn Ala Gly Pro Val Ile
145 150 155 160
Met Ser Ile Glu Glu Lys Met Glu Ala Asp Ala Arg Ser Ile Tyr Val
165 170 175
Gly Asn Val Asp Tyr Gly Ala Thr Ala Glu Glu Leu Glu Ala His Phe
180 185 190
His Gly Cys Gly Ser Val Asn Arg Val Thr Ile Leu Cys Asp Lys Phe
195 200 205
Ser Gly His Pro Lys Gly Phe Ala Tyr Ile Glu Phe Ser Asp Lys Glu
210 215 220
Ser Val Arg Thr Ser Leu Ala Leu Asp Glu Ser Leu Phe Arg Gly Arg
225 230 235 240
Gln Ile Lys Val Ile Pro Lys Arg Thr Asn Arg Pro Gly Ile Ser Thr
245 250 255
Thr Asp Arg Gly Phe Pro Arg Ala Arg Tyr Arg Ala Arg Thr Thr Asn
260 265 270
Tyr Asn Ser Ser Arg Ser Arg Phe Tyr Ser Gly Phe Asn Ser Arg Pro
275 280 285
Arg Gly Arg Val Tyr Arg Gly Arg Ala Arg Ala Thr Ser Trp Tyr Ser
290 295 300
Pro Tyr Asp Tyr Lys Asp Asp Asp Asp Lys
305 310
<---
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая конструкцию для ДНК-направленной РНК-интерференции (ddRNAi), вектор экспрессии, содержащий вышеуказанную конструкцию, композицию для ингибирования экспрессии белка PABPN1, который является причиной окулофарингеальной мышечной дистрофии (OPMD), способ подавления экспрессии белка PABPN1, способ лечения окулофарингеальной мышечной дистрофии (варианты) и набор для лечения окулофарингеальной мышечной дистрофии. В одном из вариантов реализации изобретения конструкция ddRNAi содержит в себе последовательность ДНК, кодирующую шпилечную РНК, содержащую эффекторную последовательность из по меньшей мере 17 смежных нуклеотидов, которая по существу комплементарна области транскрипта РНК, соответствующей белку PABPN1, где область транскрипта РНК приведена под любым из SEQ ID NO: 1-3. Изобретение расширяет арсенал средств для ДНК-направленной РНК-интерференции. 7 н. и 26 з.п. ф-лы, 8 ил., 5 табл., 4 пр.





Комментарии