Способ получения 2'-фтор-2'-алкилзамещенных или других замещенных рибофуранозилпиримидинов и пуринов и их производных - RU2433124C2
Код документа: RU2433124C2
Описание
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение предусматривает (i) способы получения 2-дезокси-2-фтор-2-метил-D-рибонолактоновых производных, (ii) способы превращения промежуточных лактонов в нуклеозиды с высокой активностью по отношению к вирусу гепатита С (HCV) и их аналогов и (iii) способы получения нуклеозидов с активностью по отношению к HCV, содержащих 2′-дезокси-2′-фтор-2′-С-метил-β-D-рибофуранозилнуклеозиды, из предварительно полученного предпочтительно природного нуклеозида.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Инфекция, вызванная HCV, по всему миру достигала эпидемических уровней и имеет трагические последствия для инфицированных пациентов. В настоящее время не существует эффективных методов лечения этой инфекции, и единственными лекарствами, доступными для лечения хронического гепатита С, являются различные формы альфа-интерферона (IFN-α) или сами по себе, или в сочетании с рибавирином. Однако терапевтическое значение этих методов было значительно уменьшено из-за вредного действия, что подчеркивает необходимость создания дополнительных возможностей для лечения.
Вирус гепатита С является малым вирусом в оболочке семейства Flaviviridae с геномом положительно-нитевой РНК ~9,6 кб внутри нуклеокапсида. Геном содержит одну открытую рамку считывания (ORF), кодирующую полибелок из более чем 3000 аминокислот, который расщепляется с образованием зрелого структурного и неструктурного вирусных белков. ORF фланкируется 5′- и 3′-нетранслированными участками (NTRs) нескольких сотен нуклеотидов по длине, которые являются важными для РНК (NTRs) нескольких сотен нуклеотидов по длине, которые имеют значение для трансляции и репликации РНК. Транслированный полибелок содержит структурное ядро (С) и белки в оболочке (E1, E2, р7) на N-конце, за ними следуют неструктурные белки (NS2, NS3, NS4A, NS4B, NS5A, NS5B). Зрелые структурные белки генерируются при расщеплении сигнальной пептидазы хозяина. Место соединения между NS2 и NS3 автокаталитически расщепляется NS2/NS3 протеазой, в то время как оставшиеся четыре места соединения расщепляются доменом N-концевой серинпротеазы NS3, образовашего комплекс с NS4A. Белок NS3 также обладает NTP-зависимой активностью геликазы, которая раскручивает дуплексную РНК во время репликации. Белок NS5B обладает активностью РНК-зависимой РНК полимеразы (RDRP), которая существенна для репликации вирусов. В отличие от HBV или HIV в репликации HCV ДНК не участвует.
В заявке США на патент (US 2005/0009737 А1) указано, что 1-(2-дезокси-2-фтор-2-С-метил-β-D)-рибофуранозил)цитозин (14) является сильнодействующим и селективным агентом в отношении HCV. Известные ранее методы (Схемы 1-3) получения этого соединения совсем не эффективны, приводят к получению очень низких выходов и не осуществляются в промышленном масштабе.



Ранее известные способы получения (2′R)-2′-дезокси-2′-фтор-2′-С-метилнуклеозидов и их аналогов из D-ксилозы, цитидина или уридина использовали DAST или Deoxofluor® для ключевой реакции фторирования. Однако DAST и Deoxofluor являются дорогими, опасными для промышленного синтеза и часто дают ненадежные результаты. Следовательно, эти алкиламиносеросодержащие трифториды не подходят для промышленного производства.
При разработке лучших условий фторирования было установлено, что раскрытие циклического сульфата фторирующими агентами, не являющимися алкиламиносеросодержащими трифторидами, представляет собой превосходный способ синтеза нуклеозида с анти-HCV-активностью, (2′R)-2′-дезокси-2′-фтор-2′-С-метилцитидина. Кроме того, было обнаружено, что этот новый способ синтеза может быть применен и для других нуклеозидов, включая нуклеозид, обладающий активностью против HCV, D-2-дезокси-2-фторцитидин (Devos et al., патент США №6660721), нуклеозиды с активностью против HBV, D- и L-2′,3′-дидегидро-2′,3′-дидезокси-2'-фторнуклеозиды (Schinazi et al., патент США №6348587) (I и II, Фигура 3), а также другие 2′-замещенные нуклеозиды, такие как D- и L-FMAU (Su et al., J. Med. Chem., 1986, 29, 151-154; Chu et al., патент США №6512107).
Существует необходимость в создании нового и экономичного способа синтеза 2-С-алкил-2-дезокси-2-замещенных D-рибопиранозилнуклеозидов, которые обладают активностью против HCV.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описанное в данной заявке изобретение относится к различным промежуточным продуктам и способам синтеза соединений общих формул [I] и [II]


где Х обозначает галоген (F, Cl, Br);
Y обозначает N или СН,
Z обозначает галоген, ОН, OR', SH, SR′, NH2, NHR′ или R′,
R2 обозначает C1-С3алкил, винил или этинил,
R3' и R5' могут быть одинаковыми или разными Н, алкилом, аралкилом, ацилом, циклическим ацеталем, таким как 2′, 3′-O-изопропилиден или 2′,3′-O-бензилиден, или 2′,3′-циклическим карбонатом.
R2, R4 и R5 независимо обозначают Н, галоген, включая F, Cl, Br, I, ОН, OR′, SH, SR′, N3, NH2, NHR′, NR′2, NHC(O)OR′, низший C1-С6алкил, галогенированный (F, Cl, Br, I) низший C1-С6алкил, такой как CF3 и СН2СH2F, низший С2-С6алкенил, такой как СН=CH2, галогенированный (F, Cl, Br, I) низший С2-С6алкенил, такой как СН=СНСl, СН=СНВr и СН=CHI, низший С2-С6 алкинил, такой как СН≡СН, галогенированный (F, Cl, Br, I) низший С2-С6-алкинил, низший C1-С6алкокси, такой как СН2ОН или СН2СН2OН, галогенированный (F, Cl, Br, I) низший C1-С6алкокси, СО2Н, CO2R', CONH2, CONHR', CONR'2, СН=СНСO2Н, СН=CHCO2R' и
R' обозначает возможно замещенный C1-С12алкил или -ацил (особенно когда алкил является остатком аминокислоты), циклоалкил, возможно замещенный С2-С6алкинил, возможно замещенный С2-С6 алкенил или возможно замещенный ацил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящее время нет доступных средств профилактики против Flaviviridae, включая вирус гепатита С (HCV), вирус Денге (DENV), западнонильский вирус (WNV) или вирус желтой лихорадки (YFV). Единственными одобренными способами лечения инфекции HCV является лечение одним альфа-интерфероном или его сочетанием с нуклеозидом рибавирином, но терапевтическое значение этих способов было сильно снижено из-за вредных последствий. Недавно было обнаружено, что группа нуклеозидов, включая 2′-дезокси-2′-фтор-2′-С-метилцитидин, обладает высокой и селективной активностью в отношении репликации HCV в системе репликонов. Однако трудности при химическом синтезе этого и аналогичных нуклеозидов препятствуют дальнейшим биофизическому, биохимическому, фармакологическому изучению лекарств в клинике для лечения инфекции флавивирусами (Flaviviridae).
Данное изобретение предусматривает эффективное получение нуклеозидов и промежуточных продуктов, содержащи× 2-дезокси-2-фтор-2-С-метил-D-рибофуранозильные фрагменты.
Определения
Термин "независимо", используемый в данной заявке, означает, что переменная, которая применяется независимо, меняется независимо от применения к применению. Так, в соединении, таком как RaXYRa, где Ra "независимо обозначает углерод или азот", оба заместителя Ra могут обозначать азот или один Ra может быть углеродом, а другой Ra- азотом.
Применяемые термины "энантиомерно чистый" или "энантиомерно обогащенный" относятся к композиции нуклеозида, которая содержит по меньшей мере около 95% и предпочтительно около 97%, 98%, 99% и 100% одного энантиомера этого нуклеозида.
Используемый термин "практически не содержащий" или "практически в отсутствие" относится к композиции нуклеозида, которая включает по меньшей мере 85 или 90% по весу, предпочтительно от 95 до 98% по весу и даже более предпочтительно 99-100% по весу указанного энантиомера этого нуклеозида. По предпочтительному варианту в способах и в соединениях по изобретению соединения практически не содержат энантиомеров.
Термин "алкил", если не оговорено иное, относится к насыщенной линейной или разветвленной углеводородной цепи, обычно C1-С10, и конкретно охватывает метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил, циклогексил, циклогексилметил, 3-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил и т.п. Термин включает замещенные и незамеченные алкильные группы. Алкильные группы могут быть замещены одним или более заместителями, выбранными из группы, охватывающей гидроксил, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфокислотную группу, сульфат, группу фосфиновой кислоты, фосфат или фосфонат. Один или более атомов водорода, присоединенных к атому углерода в алкиле, может быть замещен одним или несколькими атомами галогена, например атомом фтора или хлора, или обоими этими атомами, это могут быть трифторметил, дифторметил, фторхлорметил и т.п. Углеводородная цепь может также прерываться гетероатомом, таким как N, О или S.
Термин "низший алкил", если иное не оговорено, относится к C1-С4насыщенной линейной или разветвленной алкильной группе, включая как замещенные, так и незамещенные группы, указанные выше. Если в данной заявке не оговорено иное, когда подходящей группой является алкил, предпочтительным является низший алкил. Точно так же, когда имеют в виду алкил или низший алкил, предпочтительным является незамещенный алкил или низший алкил.
Термин "циклоалкил", если не оговорено иное, относится к насыщенному углеводородному кольцу, содержащему 3-8 атомов углерода, предпочтительно 3-6 атомов углерода, такому как циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкильная группа также может быть замещена в кольце или в алкильной группе, например циклопропилметил и т.п.
Термины "алкиламино" или "ариламино" относятся к аминогруппе, которая содержит один или два алкильных или арильных заместителя соответственно.
Термин "защищенная", если не оговорено иное, относится к группе, которая присоединена к атому кислорода, азота или фосфора для предотвращения его реакции или для других целей. Специалистам в области органического синтеза хорошо известны многочисленные защитные группы для кислорода и азота. Неограничивающие примеры включают С(O)-алкил, C(O)Ph, С(O)-арил, СН3, CH2-алкил, СН2-алкенил, CH2Ph, CH2-арил, СН2О-алкил, CH2O-арил, SO2-алкил, SO2-арил, трет-бутилдиметилсилил, трет-бутилдифенилсилил и 1,3-(1,1,3,3-тетраизопропилдисилоксанилиден).
Термин "арил", если не оговорено иное, относится к фенилу, дифенилу или нафтилу, предпочтительно к фенилу. Термин включает как замещенные, так и незамещенные группы. Арильная группа может быть замещена одним или несколькими заместителями, включая, без ограничения, гидроксил, галоген, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфокислоту, сульфат, фосфоновую кислоту или фосфонат, незащищенные или защищенные, если это необходимо и как известно специалистам, например, из T.W. Greene and P.G.M. Wuts "Protective Groups in Organic Synthesis", 3rd edition, John Wiley and Sons, 1999.
Термин "алкарил" или "алкиларил" относятся к алкильной группе с арильным заместителем. Термины "аралкил" или "арилалкил" относятся к арильной группе с алкильным заместителем, например к бензилу.
Термин "галоген" включает хлор, бром, иод и фтор.
Термин "ацилэфир" или "О - связанный сложный эфир" относится к эфиру карбоновой кислоты формулы C(O)R′, в которой некарбонильная часть сложноэфирной группы R′, обозначает линейный или разветвленный алкил, циклоалкил или низший алкил, алкоксиалкил, включая метоксиметил, аралкил, включая бензил, арилоксиалкил, такой как феноксиметил, арил, включая фенил, возможно замещенный галогеном (F, Cl, Br, I), C1-C4алкил или C1-C4алкокси, эфиры сульфокислоты, такие как алкил- или аралкилсульфонил, включая метансульфонил, моно-, ди- или трифосфат, тритил или монометокситритил, замещенный бензил, триалкилсилил (например, диметил - третбутилсилил) или дифенилметилсилил. Арильные группы в сложных эфирах оптимально включают фенильные группы.
Термин "ацил" относится к группе формулы R′′C(O), где R′′ обозначает линейный или разветвленный алкил, циклоалкил, аминокислоту, арил, включая фенил, алкиларил, аралкил, включая бензил, алкоксиалкил, включая метоксиметил, арилоксиалкил, такой как феноксиметил, или замещенный алкил (включая низший алкил), арил, включая фенил, возможно замещенный хлором, бромом, фтором, иодом, C1-С4алкилом или C1-С4алкокси, сульфонаты, такие как алкил- или арилсульфонил, включая метансульфонил, моно-, ди- или трифосфат, тритил или монометокситритил, замещенный бензил, алкарил, аралкил, включая бензил, алкоксиалкил, включая метоксиметил, арилоксиалкил, такой как феноксиметил. Арильные группы в сложных эфирах оптимально включают фенильные группы. В частности, ацильные группы включают ацетил, трифторацетил, метилацетил, циклопропилацетил, циклопропилкарбокси, пропионил, бутирил, изобутирил, гексаноил, гептаноил, октаноил, неогептаноил, фенилацетил, 2-ацетокси-2 фенилацетил, дифенилацетил, α-метокси-α-трифторметилфенилацетил, бромацетил, 3-нитробензолацетил, 4-хлорбензолацетил, 2-хлор-2,2-дифенилацетил, 2-хлор-2-фенилацетил, триметилацетил, хлордифторацетил, перфторацетил, фторацетил, бромдифторацетил, метоксиацетил, 2-тиофенацетил, хлорсульфонилацетил, 3-метоксифенилацетил, феноксиацетил, трет-бутилацетил, трихлорацетил, монохлорацетил, дихлорацетил, 7Н-додекафторгептаноил, перфторгептаноил, 7Н-додекафторгептаноил, 7-хлордодекафторгептаноил, 7-хлордодекафторгептаноил, 7Н-додекафторгептаноил, 7Н-додекафторгептаноил, нонафтор-3,6-диоксагептаноил, нонафтор-3,6-диоксагептаноил, перфторгептаноил, метоксибензоил, метил-3-амино-5-фенилтиофен-2-карбоксил, 3,6-дихлор-2-метоксибензоил, 4-(1,1,2,2-тетрафторэтокси-бензоил, 2-бромпропионил, омега-аминокаприл, деканоил, н-пентадеканоил, стеарил, 3-циклопентилпропионил, 1-бензолкарбоксил, O-ацетилманделил, пивалоилацетил, 1-адамантанкарбоксил, циклогексанкарбонил, 2,6-пиридинкарбоксил, циклопропанкарбоксил, циклобутанкарбоксил, перфторциклогексилкарбоксил, 4-метилбензоил, хлорметилизоксазолил-карбонил, перфторциклогексилкарбоксил, кротонил, 1-метил-1H-индазол-3-карбонил, 2-пропенил, изовалерил, 1-пирролидинкарбонил, 4-фенилбензоил. Когда применяется термин "ацил", он означает, конкретно и независимо, ацетил, трифторацетил, метилацетил, циклопропилацетил, пропионил, бутирил, изобутирил, гексаноил, гептаноил, октаноил, неогептаноил, фенилацетил, дифенилацетил, трифторметил - фенилацетил, бромацетил, 4- хлорбензолацетил, 2-хлор-2,2-дифенилацетил, 2-хлор-2- фенилацетил, триметилацетил, хлордифторацетил, перфторацетил, фторацетил, бромдифторацетил, 2-тиофенацетил, хлорсульфонилацетил, 3-метоксифенилацетил, феноксиацетил, трет-бутилацетил, трихлорацетил, монохлорацетил, дихлорацетил, метоксибензоил, 2-бромпропионил, деканоил, н-пентадеканоил, стеарил, 3-циклопентилпропионил, 1-бензолкарбоксил, пивалоилацетил, 1-адамантан-карбоксил, пиклогексан - карбоксил, 2,6-пиридин-карбоксил, циклопропан - карбоксил, циклобутан - карбоксил, 4-метилбензоил, кротонил, 1-метил-1H-индазол-3-карбонил, 2-пропенил, изовалерил, 4-фенилбензоил.
Термин "низший ацил" относится к ацильной группе, в которой R", определенный выше, обозначает низший алкил.
Термин "природное нуклеиновое основание" или "модифицированное нуклеиновое основание" относится к "пуриновому" или "пиримидиновому" основаниям, определение которых дано ниже.
Термин "пуриновое" или "пиримидиновое" основание включает, но без ограничения, аденин, N6-алкилпурины, N6-ацилпурины (где ацил обозначает С(O) (алкил, арил, алкиларил или арилалкил), N6-бензилпурин N6-галопурин, N6-винилпурин, N6-ацетиленпурин, N6-гидроксиалкилпурин, N6-аллиламинопурин, N6-тиоаллилпурин, N2-алкилпурины, N2 -алкил-6-тиопурины, тимин, цитозин, 5-фторцитозин, 5-метилцитозин, 6-азапиримидин, включая 6-азацитозин, 2- и/или 4-меркалтопиримидин, урацил, 5-галоурацил, включая 5-фторурацил, С5-алкилпиримидины, С5-бензилпиримидины, С5-галопиримидины, С5-винилпиримидин, С5-ацетиленпиримидн, С5-ацилпиримидин, N4-ацетилцитозин, N4-бензоилцитозин, N4-алкилпиримидин, С5-гидроксиалкилпурин, С5-амидопиримидин, С5-цианпиримидин, С5-иодпиримидин, С6-иодпиримидин, С5-Br-винилпиримидин, С6-Br-винилпиримидин, С5-нитропиримидин, С5-аминопиримидин, N2-алкилпурины, N2-алкил-6-тиопурины, 5-азацитидинил, 5-азаурацилил, триазолпиридинил, имидазолпиридинил, пирролпиримидинил и пиразолпиримидинил. Пуриновые основания включают, но без ограничения, гуанин, аденин, гипоксантин, 2,6-диаминопурин, 6-хлорпурин. Функциональные кислород- и азотсодержащие группы основания могут быть защищены, если это необходимо или желательно. Подходящие защитные группы хорошо известны специалистам и включают триметилсилил, диметилгексилсилил, трет-бутилдиметилсилил и трет-бутилдифенилсилил, тритил, алкильные и ацильные группы, такие как ацетил и пропионил, метансульфонил и п-толуолсульфонил.
Термин "аминокислота" включает природные и синтетические α, β, γ или δ-аминокислоты, в том числе, но без ограничения, аминокислоты, имеющиеся в белках, а именно глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин, серин, треонин, цистеин, тирозин, аспарагин, глутамин, аспартат, глутамат, лизин, аргинин и гистидин. По предпочтительному варианту аминокислота имеет L-конфигурацию. Или же аминокислота может быть производным аланила, валинила, лейцинила, изолейцинила, пролинила, фенилаланинила, триптофанила, метионинила, глицинила, серинила, треонинила, цистеинила, тирозинила, аспарагинила, глутаминила, аспартоила, глутароила, лизинила, аргининила, гистидинила, β-аланила, β-валинила, β-лейцинила, β-изолейцинила, β-пролинила, β-фенилаланинила, β-триптофанила, β-метионинила, β-глицинила, β-серинила, β-треонинила, β-цистеинила, β-тирозинила, β-аспарагинила, β-глутаминила, β-аспартоила, β-глутароила, β-лизинила, β-аргининила или β-гистидинила. Когда применяется термин "аминокислота", то считается, что он обозначает конкретное и независимое указание каждого из эфиров α, β, γ или δ-глицина, аланина, валина, лейцина, изолейцина, метионина, фенилаланина, триптофана, пролина, серина, треонина, цистеина, тирозина, аспарагина, глутамина, аспартата, глутамата, лизина, аргинина и гистидина в D- и L-конфигурациях.
Термин "фармацевтически приемлемая соль или пролекарство" применяется в описании для указания любой фармацевтически приемлемой формы (такой как эфир, фосфатный эфир, соль эфира или родственная группа) соединения, которая после введения пациенту приводит к образованию активного соединения. Фармацевтически приемлемые соли включают соли, полученные из фармацевтически приемлемых неорганических или органических оснований и кислот. Подходящие соли включают соли, полученные на основе щелочных металлов, таких как калий и натрий, щелочноземельных металлов, таких как кальций и магний, и различных кислот, хорошо известных в фармацевтике. Фармацевтически приемлемые соли могут быть также кислыми солями присоединения, когда получаются с атомом азота. Такие соли получают из фармацевтически приемлемых неорганических и органических кислот, таких как соляная, серная, фосфорная, уксусная, лимонная, винная и т.п. Фармацевтически приемлемые пролекарства обозначают соединение, которое подвергается метаболизму, например гидролизуется или окисляется, в организме хозяина с образованием соединения по данному изобретению. Типичные примеры пролекарств включают соединения, которые содержат биологически лабильные защитные группы в функциональной части активного соединения. Пролекарства включают соединения, которые могут быть окислены, восстановлены, аминированы, деаминированы, гидроксилированы, дегидроксилированы, гидролизованы, дегидролизованы, алкилированы, деалкилированы, ацилированы, деацилированы, фосфорилированы, дефосфорилированы с образованием активного соединения.
Заявители создали новый, практичный и эффективный способ синтеза 2-С-алкил-2-дезокси-2-замещенных производных D-рибофуранозы, являющихся ключевыми промежуточными продуктами для соединения 14 (Схема 1) и их производных и аналогов с применением хиральных катализаторов или без них. Ключевой стадией процесса синтеза 14 является асимметричная конверсия соединения 41 в соединение 42 при помощи хиральных катализаторов (Схема 4). Ранее описанный способ синтеза 42 требовал применения катализаторов Sharpless AD, таких как дигидрохинидин (DHQD) и его производные. Данное изобретение относится к стереоселективному получению соединения 42 из 41 с применением осмия, осмата или перманганата без хиральных катализаторов. Заявители также разработали практичный и эффективный способ синтеза соединения 49 из соединения 42 с применением нуклеофильного раскрытия циклического сульфата 50 (Схема 6) высокостереоспецифическим и региоселективным образом. Реакции, показанные на Схемах 4, 5 и 6, представляют собой пример выбора способа получения соединения 14 и его производных.

Реагент: (a) CH2Cl2, комн. t, 12 ч; (b) AD - смесь β, 1:1, трет- BuOH - H2O, MeSO2NH2, 0°C, 24 ч, или (b′) стереоселективное дигидроксилирование без хиральных катализаторов; (с) BzCl/Ру, комн. t; (d) DAST/TYF, комн. t; (е) MeCN/Н2O/ СF3СO2Н, 80-90°С, азеотропная перегонка; (g) BzCl/Ру/СН2Сl2, комн. t.

Реагент: (а) НСl/EtOH (b) BzCl/Py (с) DAST.

Реагент: (a) SOCl2, Et3N, CH2Cl2; (b) TEMPO - NaOCl; (c) TEAF; (d) НСl; (e) АсОН или Dowex - H+; (f) BzCl/Py; (g) LiAl (OBu - трет)3Н; (h) Ac2O; (i) силилированные основания/условие Vorbruggen; (j) NH3/MeOH.
I. ПОЛУЧЕНИЕ СОЕДИНЕНИЙ
(i) Синтез циклического сульфита (IIIа) и циклического сульфата (IIIb)
Данное изобретение относится к способу получения 2′-F-нуклеозидов и других 2′-замещенных нуклеозидов общих формул IB и IB-L при помощи нуклеофильного раскрытия циклического сульфита, IIIа (X=SO), сульфата IIIb (X=SO2) формулы III в условиях высокостереоспецифического и региоселективного синтеза через лактоны формулы IV.




Радикалы в формулах IB, IB-L, III, IV имеют следующие значения:
R1 независимо обозначает низший алкил C1-С6, включая, но без ограничения, метил, этил, возможно замещенный фенил, возможно замещенный бензил, или же R1является частью циклического алкилена, включая этилен (-CH2CH2-) или триметилен (-СН2СН2СН2-), образуя циклопентил или циклогексанил;
R2 и R3 независимо обозначают водород, низший алкил (C1-С6), включая, но без ограничения, метил, гидроксиметил, метоксиметил, галометил, включая, но без ограничения, фторметил, этил, пропил, возможно замещенный этенил, включая, но без ограничения, винил, галоидвинил (F-СН=С), возможно замещенный этинил, включая, но без ограничения, галоэтинил (F-С=С), возможно замещенный аллил, включая, но без ограничения, галоидаллил (FHC=СН-СН2-);
R4 независимо обозначает водород, арил, включая, но без ограничения, фенил, арилалкил, включая, но без ограничения, бензил, низший алкил, включая, но без ограничения, метил, этил, пропил. Nu обозначает галоген (F, Cl, Br), N3, CN, NO3, CF3, OR или NR2, где R обозначает ацил, включая, но без ограничения, ацетил, бензоил, арилалкил, включая, но без ограничения, бензил, низший алкил, включая, но без ограничения, метил, этил, пропил, CH2R, где R обозначает водород, низший алкил, включая, но без ограничения, метил, этил, пропил;
Х обозначает SO2, SO или СО и
В обозначает природное или модифицированное нуклеиновое основание. По одному из вариантов соединение IB обозначает


где R2 и R3 независимо обозначают водород, низший алкил (C1-С6), включая, но без ограничения, метил, гидроксиметил, метоксиметил, галометил, включая, но без ограничения, фторметил, этил, пропил, возможно замещенный этенил, включая, но без ограничения, винил, галоидвинил (F-СН=С), возможно замещенный этинил, включая, но без ограничения, галоэтинил (F-С=С), возможно замещенный аллил, включая, но без ограничения, галоидаллил (FHC=СН-CH2-);
В обозначает природное или модифицированное нуклеиновое основание.
Данное изобретение относится также к способам синтеза соединения, эфира 2-алкил-4,5-ди-O-защищенный 2,3-дигидроксипентановой кислоты общей формулы 42В, который является ценным промежуточным продуктом при синтезе нуклеозидов общих формул [I] и [II] (ниже) с активностью против HCV.

где R′, R′′ обозначают изопропилиден, бензилиден или циклогексилиден или т.н., или часть циклической группы, включающей этилен (-СН2СН2-) или триметилен (-СН2СН2СН2-), образуя циклопентил или циклогексанил соответственно; R′ и R′′ могут независимо обозначать низший алкил C1-С6 или арил С6-С20, бензил или возможно замещенный бензил триалкилсилил, трет-бутилдиалкилсилил, трет-бутилдифенилсилил, TIPDS, ТНР, MOM, MEM и другие группы, возможно защищающие простой эфир; или Н, ацетил, бензоил и другой возможно замещенный ацил (R′ и R′′ обозначают -C(O)-R, где R может обозначать низший алкил C1-С6 или арил С6-С20, бензил или возможно замещенный бензил);
R1 и R2 независимо обозначают водород, арил (С6-С20) и низший алкил (C1-С6), включая метил, гидроксиметил, метоксиметил, галометил, включая фторметил, этил, пропил, возможно замещенный этенил, включая винил, галоидвинил (F-СН=С), возможно замещенный этинил, включая галоэтинил (F-С=С), возможно замещенный аллил, включая галоидаллил (FHC=СН-CH2-);
R3 независимо обозначает водород, арил, включая, но без ограничения, фенил, арилалкил, включая, но без ограничения, бензил, низший алкил (C1-С6), включая метил, этил, пропил.
Изобретение относится также к способам получения соединений общей формулы 49В, которые синтезируют из производных эфира 2-алкил-4,5-ди-O-защищенной 2,3-дигидроксипентановой кислоты общей формулы [42В].

где R3 и R5 могут независимо обозначать Н, СН3, Ac, Bz, пивалоил или 4-нитробензоил, 3-нитробензоил, 2-нитробензоил, 4-хлорбензоил, 3-хлорбензоил, 2-хлорбензоил, 4-метилбензоил, 3-метилбензоил, 2-метилбензоил, п-фенилбензоил, другой возможно замещенный ацил (R3 и R5 обозначают -C(O)-R, R может обозначать низший алкил C1-С6 или арил С6-С20, бензил или возможно замещенный бензил), тритил, триалкилсилил, трет-бутилдиалкилсилил, трет-бутилдифенилсилил, TIPDS, ТНР, MOM, MEM и другие группы, возможно защищающие простой эфир (R3 и R5 могут независимо обозначать алкил C1-С10) или R3 и R5 связаны через - SiR2-O-SiR2 или -SiR2-, где R обозначает низший алкил, такой как Me, Et, н-Pr или изо-Pr.
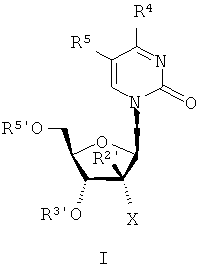

где Х обозначает галоген (F, Cl, Br);
Y обозначает N или СН,
Z обозначает галоген, ОН, OR′, SH, SR′, NH2, NHR′ или R′, R2' обозначает C1-С3 алкил, винил или этинил,
R3' и R5' могут быть одинаковыми или разными Н, алкилом, аралкилом, ацилом, циклическим ацеталем, таким как 2′,3′-O-изопропилиден или 2',3'-O-бензилиден, или 2′,3′-циклическим карбонатом.
R2, R4 и R5 независимо обозначают Н, галоген, включая F, Cl, Br, I, ОН, OR', SH, SR′, N3, NH2, NHR′, NR′2, NHC(O)OR′, низший C1-С6 алкил, галогенированный (F, Cl, Br, I) низший C1-С6 алкил, такой как CF3 и CH2CH2F, низший C2-С6 алкенил, такой как СН=CH2, галогенированный (F, Cl, Br, I) низший C1-С6 алкенил, такой как СН=СНСl, СН=СНВr и СН=CHI, низший C2-С6 алкинил, такой как СН≡СН, галогенированный (F, Cl, Br, I) низший C2-С6-алкинил, низший C1-С6 алкокси, такой как СН3ОН или СН2СН2ОН, галогенированный (F, Cl, Br, I) низший C1-С6 алкокси, СO2Н, CO2R′, CONH2, CONHR', CONR'2, СН=СНСO2Н, СН=CHCO2R' и
R' и R" одинаковые или разные и обозначает возможно замещенный C1-С12 алкил или -ацил (особенно когда алкил является остатком аминокислоты), циклоалкил, возможно замещенный С2-С6 алкинил, возможно замещенный С2-С6 алкенил или возможно замещенный ацил.
Реакция циклического сульфата 50 (Схема 6) с тетраэтиламмонийфторидом или тетраметиламмонийфторидом 51 (Схема 6) приводит к количественному получению фторированного сульфата высокостереоспецифическим и региоселективным образом. Последующая циклизация, катализируемая кислотой, позволила получить 2'-фтор-2-С-метил-γ-рибонолактон 53 с высоким выходом.
Данное изобретение основано на обнаружении этого факта и предусматривает способ получения 2′-дезокси-2′-замещенных нуклеозидов, I и II с применением описанных реакций.
(2S,3R,4R)-4,5-O-Алкилиден-2-диметил-2,3,4,5-тeтрагидpoкси-2-метилпентановой кислоты этиловый эфир (42В) может быть получен путем асимметричного дигидроксилирования (AD) или стереоселективного дигидроксилирования продукта Виттига 41 в присутствии хиральных катализаторов или без них. Продукт Виттига 41 в свою очередь может быть получен легко из защищенного (R), глицеральдегида (Схемы 7, 8), где R1 независимо обозначает низший алкил C1-С6, включая, но без ограничения, метил, этил, возможно замещенный фенил, возможно замещенный бензил. Или же R' является частью циклической группы, включая этилен (-СН2СН2-) или триметилен (-СН2СН2СН2-), образуя циклопентил или циклогексанил соответственно; R2, R3независимо обозначают водород, низший алкил (С1-С6), включая, но без ограничения, метил, гидроксиметил, метоксиметил, галометил, включая, но без ограничения, фторметил, этил, пропил, возможно замещенный этенил, включая, но без ограничения, винил, галоидвинил (F-СН≡С), возможно замещенный этинил, включая, но без ограничения, галоэтинил (F-С=С), возможно замещенный аллил, включая, но без ограничения, галоидаллил (FHC=СН-СН2-); R4 независимо обозначает ацил, включая, но без ограничения, ацетил, бензоил, арилалкил, включая, но без ограничения, бензил, низший алкил C1-С10, включая, но без ограничения, метил, этил, пропил, CH2R, где R обозначает водород, низший алкил C1-С10, включая, но без ограничения, метил, этил, пропил.

Диол (42В) может быть превращен в циклический сульфит (IIIа) путем обработки тионилхлоридом (SOCl2) в присутствии алкиламина, такого как триэтиламин, диизопропилэтиламин, или пиридина, который затем может быть окислен при помощи окислителей, выбранных из первой группы, включающей RuCl2, KMnO4 и TEMPO или сочетания соединения первой группы и соединения из второй группы, состоящей из NaIO4, KIO4, HIO4, mCPBA, NaOCl и оксона. Растворитель на этой стадии выбирают из одного или нескольких соединений из группы, состоящей из хлороформа, метиленхлорида, 1,2-дихлорэтана, диэтилового эфира, тетрагидрофурана, бензола и толуола, растворитель может быть сам по себе или в сочетании с водой (GaO Y. et al. J. Am. Chem. Soc. 1988, 110, 7538-7539, Beeridge et al. J. Org. Chem. 1990, 55, 1211-1217). Возможно так же осуществить прямое превращение диола в циклический сульфат (Vb) путем обработки сульфурилхлоридом или сульфурилдиимидазолом. С другой стороны, диол 42В можно превратить в циклический карбонат (IIIс) путем обработки карбонилдиимидазолом или карбонилдиметоксидом (Схема 8) (Chang et al., Tetrahedron Lett. 1996, 37, 3219-3222).

(ii) Синтез замещенного 2-дезокси-D)-рибоно-γ-лактона, 53В
Циклический сульфат (IIIb, Схема 8) можно превратить во фторированный эфир серной кислоты формулы 51В (Схема 9) с высоким выходом и с высокими региоселективностью и стереоспецифичностью путем обработки тетраалкиламмоний фторидом, включая, но без ограничения, тетраметиламмонийфторид (TMAF), тетраэтиламмонийфторид (TEAF) или тетрабутиламмонийфторид (TBAF) или трис(диметиламино)серы (триметилсилил)дифторид (TAS-F) (Fuentes J. et al. Tetrahedron Lett. 1998, 39, 7149-7152), в протонном полярном растворителе, таком как ацетон, тетрагидрофуран, N,N-диметилформамид или ацетонитрил (Схема 9). Фториды металлов, такие как фторид серебра (AgF), фторид калия (RF), фторид цезия (CsF) или фторид рубидия (RbF) могут быть применены в отдельности или с каталитическим количеством тетраалкиламмонийфторида, краун-эфира, диглима или полиэтиленгликоля или другого катализатора переноса фаз.
Циклический сульфат (IIIb) может быть превращен в другие 2-замещенные сульфаты формулы 51В путем обработки NaBH4, тетраалкиламмонийхлоридом, тетраалкиламмонийбромидом, NaN3 или LiN3, NH4OR, NH4SCN, СF3I-тетракис(диметиламино)этиленом (TDAE) и тетраалкиламмонийнитратом (GaO Y. et al. J. Am. Chem. Soc. 1988, 110, 7538-7539), KCN, LiCu(R)2, где R обозначает метил, этил, этиленил или этинил. Точно также циклический сульфит (IIIа) может быть превращен в замещенный эфир 52В (Chang et al. Tetrahedron Lett. 1996, 37, 3219-3222). Затем соединения формул 51В и 52В могут быть превращены в замещенные лактоны формулы 53В путем обработки кислотой в содержащем воду органическом растворителе, таком как метанол, этанол или ацетонитрил.
В формуле 53В R2, R3 независимо обозначают водород, низший алкил (C1-С6), включая, но без ограничения, метил, гидроксиметил, метоксиметил, галометил, включая, но без ограничения, фторметил, этил, пропил, возможно замещенный этенил, включая, но без ограничения, винил, галоидвинил (F-CH=C), возможно замещенный этинил, включая, но без ограничения, галоэтинил (F-C≡С), возможно замещенный аллил, включая, но без ограничения, галоидаллил (FHC=CH-CH2-). Nu обозначает галоген (F, Cl, Br), N3, CN, NO3, CF3, OR или NR2, где R обозначает ацил, включая, но без ограничения, ацетил, бензоил, арилалкил, включая, но без ограничения, бензил, низший алкил (C1-С10), включая, но без ограничения, метил, этил, пропил, CH2R, где R обозначает водород, низший алкил, включая, но без ограничения, метил, этил, пропил.

(iii) Защита D-рибоно-γ-лактона, 53В
Соединение 53В может быть селективно защищено соответствующими агентами с получением 5-защищенных лактонов формулы 53С в присутствии подходящего основания в подходящем растворителе. Защитные группы включают, но без ограничения, тритил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, бензилоксиметил, бензоил, толуоил, 4-фенилбензоил, 2-, 3- или 4-нитробензоил, 2-, 3- или 4-хлорбензоил, другой замещенный бензоил. Основание может представлять собой, без ограничения, имидазол, пиридин, 4-(диметиламино)пиридин, триэтиламин, диизопропилэтиламин, 1,4-диазабицикло-[2,2,2]-октан. Растворитель включает, но без ограничения, пиридин, дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран.
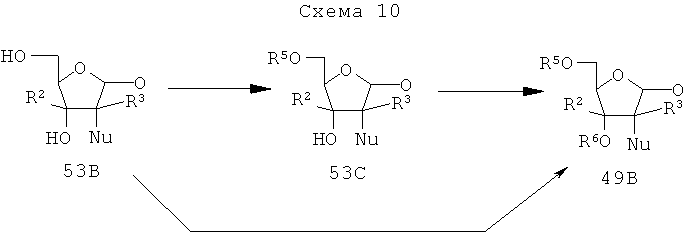
Иначе лактон 53В может быть защищен соответствующими защитными агентами в присутствии соответствующего основания в среде подходящего растворителя. Защитные группы (R5, R6) включают, но без ограничения, метоксиметил, метоксиэтил, бензилоксиметил, этоксиметил, тритилтриэтилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, ацил, включая ацетил, пивалоил, бензоил, толуоил, 4-фенилбензоил, 2-, 3- или 4-нитробензоил, 2-, 3- или 4-хлорбензоил, другой замещенный бензоил. Основание может представлять собой, без ограничения, имидазол, пиридин, 4-(диметиламино)пиридин, триэтиламин, диизопропилэтиламин, 1,4-диазабицикло-[2,2,2]-октан. Растворитель включает, но без ограничения, пиридин, дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран (Схема 10).
(iv) β-Гликозилирование, приводящее к комплексообразованию

Сочетание 2-дезокси-2-фтор-2-С -метилрибофуранозида (54: Nu=F, R3=Me, R5=R6=пивaлoил) с силилированным N4 -бензилцитозином в присутствии триметилсилилтрифторметансульфоната (TMSOTf) в СНС1з привело к образованию смеси α/β-аномеров с отношением 2/1 в сторону α-изомера. Однако β-аномер получался как основной продукт (α/β=4,9) по той же реакции, катализируемой SnCl4 в похожих условиях. Возможные механизмы предложены на Схеме 10А (R5 и R6 обозначают O-защитные группы, которые могут быть ацилом или силилом, или алкилом, или аралкилом C1-C20). Обработка 54 силилированным N4 - бензоилцитозином в присутствии TMSOTf в среде СНСl3 привела к образованию оксониевого промежуточного продукта 54-I. Силилированное основание "атакует" 54-I с верхней стороны с образованием β-аномера 55В или снизу с получением α-аномера 55В - альфа. Вследствие стереопрепятствия с верхней стороны, вызванного 2 - метилом, силилированное основание "атаковало" 54-1 в основном снизу (менее стереозатрудненная сторона), при этом образовалась смесь α/β -аномеров с отношением 2/1 с преимуществом α-аномера. Обработка 54 силилированным N4-бензоилцистеином в присутствии SnCl4 привела к образованию комплекса 54-II вместо оксониевого соединения 54-1. Силилированный N4-бензоилцистеин "атаковал" 54-II с менее стереозатрудненной верхней стороны с образованием смеси α/β-аномеров с отношением 1/5 с преимуществом β-аномера.
Соединение 54 может быть получено из защищенного лактона формулы 49В, который может быть восстановлен DIBAL-H или три - трет-бутоксиалюминийгидридом лития и другим гидридом в качестве восстановителя до лактола, который затем можно превратить или в ацилат путем ацилирования ацилгалогенидом или ангиридом ацила в присутствии подходящего основания в подходящем растворителе. Галоидангидрид или ангидрид ацила включают, но без ограничения, хлорангидрид уксусной кислоты, возможно замещенный бензоилхлорид, уксусный ангидрид, возможно замещенный ангидрид бензойной кислоты. Основание может представлять собой, без ограничения, имидазол, пиридин, 4-(диметиламино) пиридин, триэтиламин, диизопропилэтиламин, 1,4-диазабицикло-[2,2,2]-октан. Растворитель включает, но без ограничения, пиридин, дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран.
(v) Синтез L-нуклеозидов, IB-L
Способы для D-ряда соединений формул I и II можно применять для получения L-нуклеозидов формулы IB-L из (S)-глицеральдегидов (Схема 11).

(vi) Синтез 2-алкил-4,5-ди-О-защищенной 2,3-дигидроксипентановой кислоты
В настоящее время наиболее предпочтительным способом синтеза нуклеозидов общих формул I и II является получение производного 2-дезокси-2-фтор-2-С-метил-D-рибофуранозила I и II, как показано на Схеме 4, Схеме 5 и Схеме 6 выше, через (i) синтез промежуточного соединения, производных эфира 2-алкил-4,5-ди-O-защищенной 2,3-дигидроксипентановой кислоты общей формулы I, (ii) превращение 42В в 3,5-защищенный 2-дезокси-2-фтор-2-С-метил-D-рибоно-γ-лактона общей формулы 49В и (iii) конверсию 49В в пуриновые и пиримидиновые нуклеозиды общих формул I и II. Ключевой стадией на Схеме 4 является стереоселективное катализируемое осмием дигидроксилирование олефинового промежуточного продукта 41 с получением соединения 42 в присутствии дорогостоящего катализатора Sharpless AD. Без катализатора Sharpless, в случае применения других хиральных соединений, таких как L-хинидин, реакция также протекает ровно с образованием желательного соединения 42. Kishi et al. предположили, что при дигидроксилировании производных аллилового спрта (сложных эфиров, простых эфиров, ацеталей или кеталей) в присутствии OsO4 основная реакция будет протекать на поверхности олефиновой связи, которая противоположна поверхности ранее существовавших гидроксильной или алкоксильной групп (Tetrahedron Lett. 1983, 24, 3947). В каждом случае основной продукт образовывался при добавлении OsO4 с анти-стороны кислорода у соседнего вторичного атома углерода. Однако стереоселективность является недостаточной для препаративного синтеза.
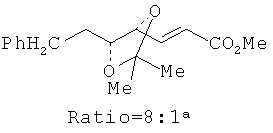



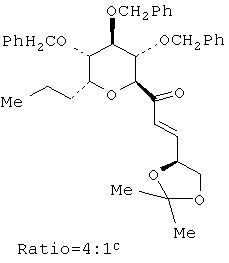


Следуя правилу Kishi, гласящему, что стереохимия возникает из предпочтительного подхода тетраокиси осмия к поверхности олефиновой связи, противоположной поверхности ранее бывших гидроксильной или алкоксильной группы, осуществляли дигидроксилирование 41 в первоначальных условиях, но без хиральных катализаторов, включающих катализатор Sharpless AD. Дигидроксилирование соединения 41 с применением системы Kе3Fе(CN)6/K2OsO2(OH)4/К2СО3 без хиральных катализаторов приводит к выходу, равному 77%, этот продукт представляет собой смесь 5:1 изомеров, причем предпочтительным изомером является желательное соединение 42. Реакция олефина 41 с OsO4 в присутствии N-окиси N-метилморфолина (NMO) в качестве окислителя без хиральных катализаторов обеспечивает получение 5:1 смеси соединения 42 и его изомера с выходом, равным 79%. Наиболее неожиданно то, что когда в качестве окислителя применяется трет-бутилгидроперекись (ТВНР) в присутствии каталитического количества OsO4 в ацетоне и в присутствии ацетата аммония в качестве буфера (комбинация реагентов применялась при синтезе алдитолов Masamune и Sharpless (J. Org. Chem. 1982, 47, 1373)), выделяется кристаллический продукт, представляющий собой по существу чистое желаемое соединение 42. Этот метод поэтому превосходит методы с применением OsO4/NMO и Fe(CN)6-3. При наличии 10 ммоль желательный диол 42 образуется исключительно с выходом, равным 87%. В этом продукте не было примеси другого изомера, как показали анализы методом1H ЯМР.
Хорошо известно, что при окислении OSO4 промежуточным продуктом является циклический осмат V (ниже) (Criegee, Liebigs Ann. Chem., 1936, 522, 75). цис-Дигидроксилирование олефинов в присутствии перманганата калия в щелочной среде известно уже некоторое время (Robinson and Robinson, J. Chem. Soc. 1925, 127, 1628) и эта реакция протекает через образование циклического эфира VI. Так были осуществлены реакции дигироксилирования в присутствии перманганата.


Ранние сообщения показали, что дигидроксилирование олефинов в присутствии перманганата в кислых или нейтральных условиях вызывает переокисление исходных диолов с сопутствующим получением кетонов и карбоксилатов. Дальнейшее окисление диолов может быть замедлено только в щелочных условиях. Поскольку соединение 41 является эфиром карбоновой кислоты, реакцию нельзя осуществить в среде водной щелочи. Hazra et al. (J. Chem. Soc. Perkin Trans. I, 1994, 1667) описывает успешное дигидроксилирование высокозамещенных олефинов с получением соответствующих диолов с применением перманганата тетрадецилтриметиламмония (TDTAP) в смеси трет-BuOH, дихлорметана и воды в присутствии 0,1 экв. КОН. Применение этого метода для дигидроксилирования соединения 41 приводит к быстрому образованию (в течение 10 мин при комнатной температуре) смеси соединения 42 и его диастереомера в отношении 8:1, которую выделяют с выходом 71%. Окисление происходит гораздо быстрее в похожих условиях без КОН, но выход соединения 42 не возрастает.
Mukaiyama et al. (Chem. Lett. 1983, 173) описали дигидроксилирование олефинов с применением KMnO4 и 18-краун-6-эфира в дихлорметане при температуре -40°С. Попытка провести дигидроксилирование соединения 41 при условиях Mukaiyama, но при разных температурах привела к образованию 6:1 смеси соединения 41 и его диастереомера с выходом 50% при температуре -40°С и с выходом 94% при температуре -10°С.
Неожиданно, в противоположность известным методам, которые описывают, что окисление двойной связи KMnO4 протекет через образование диола, который быстро затем окисляется без наличия основания, было обнаружено, что диол 42 выделяется, когда соответствующее соединение 41 обрабатывают KMnO4 без добавления щелочи и краун-эфира. В среде чистого третбутанола окисление не происходит даже при комнатной температуре в течение 2 дней. Добавление воды к этой смеси ускоряет реакцию. Установлено, что чем больше воды в реакционной среде, тем быстрее протекает реакция с низкой селективностью в отношении образования соединения 42; чем меньше воды, тем медленнее реакция, но селективность повышается. В любом случае выход является довольно небольшим из-за дальнейшего окисления.
Наиболее удивительно и что противоречит известным фактам, то, что обработка соединения 41 KMnO4 в ацетоне приводит к получению 10:1 смеси с количественным выходом и основным компонентом является соединение 42. Обнаружено, что стереоселективность повышается при проведении реакции в смеси ацетона и пиридина.
Нижеследующие примеры способствуют лучшему пониманию изобретения. Этот раздел не должен рассматриваться как ограничивающий каким-либо образом данное изобретение, изложенное в следующей ниже формуле изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Этиловый эфир (2S, 3R, 4R)-4,5-O-изопропилиден-2,3-O-сульфурил-2,3,4,5-твтрагидрокси-2-метилпентановой кислоты (IIIb, R1=СН3, R2=Н, R3=СН3)
К раствору этилового эфира (2S, 3R, 4R)-4,5-O-изопропилиден-2,3,4,5-тетрагидрокси-2-метилпентановой кислоты (R1=СН3, R2=Н, R3=СН3) (2,0 г, 8,06 ммоль) в безводном метиленхлориде (40 мл), содержащему триэтиламин (3,4 мл) при температуре 0°С добавляют тионилхлорид (0,88 мл, 12,08 ммоль) по каплям в течение 10 мин. Полученную реакционную смесь перемешивают при 0°С в течение 10 мин, разбавляют холодным эфиром (100 мл), промывают водой (50 мл × 2) и рассолом (50 мл × 2), высушивают над сульфатом натрия и концентрируют с получением остатка (IIIа, R1=СН3, R2=Н, R3=СН3), который растворяют в смеси ацетонитрил - тетрахлорметан (10: 10 мл). К полученному раствору последовательно добавляют при комнатной температуре периодат натрия (2,58 г, 12,06 ммоль), трихлорид рутения (16 мг, 0,077 ммоль) и воду (14 мл). Полученную реакционную смесь перемешивают при комнатной температуре в течение 10 мин, разбавляют эфиром (100 мл), промывают водой (50 мл × 2), насыщенным раствором бикарбоната натрия (50 мл × 2) и рассолом (50 мл × 2), высушивают над сульфатом натрия, концентрируют и выпаривают вместе с толуолом (30 мл × 3) с получением сиропообразного остатка сульфата IIIb (2,23 г, 89%), который используют без очистки для следующей реакции.1Н-ЯМР (СDСl3) δ (ppm) : 5.04 (d, 1H, J=9.6 Hz, H-3). 4.37 (m, 1H, H-4), 4.29 (q, 2H, J=7,6 Hz, СН2СН3), 4.17 (dd, 1H, J=5.6, 9.6 Hz, H-5), 4.05 (dd, 1H, J=3.2. 9.6 Hz, H-5'), 1.8 (s, 3Н, СН3-2), 1.38 (s, 3H, (СН3)2С), 1.32 (t, 3H, J=6.8 Hz, СН2СН3), 1.31 (s, 3Н, (СН3)2С).
ПРИМЕР 2
Тетрабутиламмониевая соль этилового эфира 2-фтор-4,5-O-изопропилиден-2-метил-3-сульфоокси-3,4,5-тригидроксипентановой кислоты (51В, R1=СН3, R2=H, R3=СН3, Nu=F, М+= тетрабутиламмоний)
Метод 1. К раствору сульфата IIIb из примера 1 (628 мг, 2,02 ммоль) в безводном тетрагидрофуране при температуре 0°С добавляют тетрабутиламмонийфторид (1 М в тетрагидрофуране, высушен при помощи молекулярных сит 4 Å) по каплям в течение 5 мин. Полученную реакционную смесь перемешивают в течение 20 мин при температуре 0°С, добавляют еще 2 мл тетрабутиламмоний фторида (1 М в тетрагидрофуране, высушен при помощи молекулярных сит 4 Å, 3 мл) и затем реакционную смесь перемешивают при температуре 0°С в течение 2 ч, затем концентрируют и очищают методом хроматографии на колонке с силикагелем (EtOAc) с получением фторированного сульфата в виде сиропа (350 мг, 38%).1Н-ЯМР (СDСl3) δ (ppm) : 4.66 (d, 1H, J=9.6, 25.6 Hz, H-3), 4.48 (dd, 1H, J=5.2, 8.8 Hz, H-4), 4.20, 4.07 (2m, 4H, Н-5, ОСН2СН3), 3.21 (m, 8H, N(СН2СН2СН2СН3)4), 1.69 (d, 3H, J=22.4 Hz, СН3-2), 1.59 (m, 8H, N(СН2СН2СН2СН3)4), 1.39 (m, 8H, СН2СН2СН2СН3)4), 1.27-1.25 (m, 9H, ОСН2СН3, (СН3)2С), 0.96 (t, 12H, J=6.8 Hz, СН2СН2СН2СН3)4).
Метод 2. К раствору циклического сульфата IIIb (480 мг, 1,55 ммоль) в безводном тетрагидрофуране при температуре 0°С добавляют по каплям тетрабутиламмонийфторид (1 М в тетрагидрофуране, нейтрализован HF-пиридином, 3,1 мл) в течение 5 мин. Полученную реакционную смесь перемешивают в течение 39 ч, концентрируют и очищают методом хроматографии на силикагеле (CH2Cl2: МеОН=10: 1) с получением фторированного сульфата в виде сиропа (280 мг, 39%).
ПРИМЕР 3
2-Дезокси-2-фтор-2-С-метил-D-рибоно-γ-лактон
(53В, R2=H, R3=СН3, Nu=F)
Смесь продукта из примера 2 (170 мг, 0,370 ммоль), трифторуксусной кислоты (0,8 мл) и воды (2 мл) в ацетонитриле (10 мл) нагревают при 80°С в течение 1,5 ч, разбавляют этилацетатом (15 мл), промывают водой (10 мл) и насыщенным раствором бикарбоната натрия (10 мл). Водный слой насыщают NaCl и подвергают экстракции этилацетатом (10 мл). Соединенные органические слои высушивают при помощи сульфата натрия, фильтруют и концентрируют с получением остатка, который очищают хроматографией на силикагеле (от гексаны:этилацетат = 1:1 до СН2Сl2:МеОН=20:1) с получением нужного соединения в виде твердого продукта белого цвета (60 мг, 100%).1Н-ЯМР (СDСl3) δ (ppm) : 6.06 (d, 1H, J=6.8 Hz, HO-3), 5.16 (t, 1H, J=4.8 Hz, HO-5), 4.26 (m, 1H, H-4), 3.98 (ddd, 1H, J=7.2, 8.0, 23.2 Hz, H-3), 3.78 (ddd, 1H, J=2.0, 5.2, 12.8 Hz, H-5), 3.55 (ddd, 1H, J=4.4, 5.6, 12.4 Hz, H-5'), 1.48 (d, 3H, J=24 Hz, СН3-2);13C ЯМР (CDCl3) 5 (ppm) : 171.2 (d, J=21.2 Hz, C-1), 92.5 (d, J=177.5 Hz, C-2), 83.37 (C-4), 70.2 (d, J=15.9 Hz, C-3), 59.0 (C-5), 17.1 (d, J=25.0 Hz, СН3-С-2).
ПРИМЕР 4
3,5-Ди-O-бензоил -2- дезокси-2-фтор-2-метил-В-рибоно-γ-лактон (49В, R2=Н, R3=СН3, R5=Bz, R6=Bz, Nu=F)
Соединение из пример 3 (60 мг, 0,16 ммоль) растворяют в безводном пиридине (1 мл) и добавляют бензоилхлорид (0,3 мл). Полученную реакционную смесь перемешивают при комнатной температуре в течение 20 мин, добавляют воду (1 мл), перемешивают в течение 20 мин, разбавляют этилацетатом (5 мл), промывают водой (2 мл) и 1 M HCl (2 мл × 3) и высушивают при помощи сульфата натрия. После фильтрации и концентрирования остаток очищают хроматографией на силикагеле (гексаны:этилацетат = 10:1) с получением 3,5-ди-O-6ензоил-2-дезокси-2-фтор-D)-рибоно-γ-лактона в виде твердого продукта белого цвета (118 мг, 87%).1Н-ЯМР (CDCl3) δ (ppm) : 8.08 (m, 2H, аром.), 7.99 (m, 2H, аром.), 7.63 (m, 1H, аром.), 7.58 (m, 1H, аром.), 7.49 (m, 2H, аром.), 7.43 (m, 2H, аром.), 5.51 (dd, 1H, J=7.2, 17.6 Hz, H-3), 5.00 (m, 1H, H-4), 4.78 (dd, 1H, J=3.6, 12.8 Hz, H-5), 4.59 (dd, 1H, J=5.2,12.8 Hz, H-5'), 1.75 (d, 3H, J=23.6 Hz, СН3-2).
ПРИМЕР 5
Тетраэтиламмониевая соль этилового эфира (2R, 3S, 4R)-4,5-дигидрокси-2-фтор-4,5-O-изопропилиден-2-метил-3-сульфоксипентоновой кислоты (51В, R1=СН3, R2=Н, R3=СН3, Nu=F, М+= тетраэтиламмоний)
Метод 1. К раствору сульфата IIIb (Схема 9) (1,96 г, 6,32 ммоль) в безводном N,N-диметилформамиде (20 мл) при температуре 0°С одной порцией добавляют гидрат тетраэтиламмонийфторида (1,39 г, 9,13 ммоль). Полученную реакционную смесь перемешивают в течение 30 мин, концентрируют и испаряют вместе с толуолом с получением полутвердого продукта (51b) (3,35 г, сырой, ЯМР показал наличие одного продукта).1H - ЯМР (CDCl3) 6 (ppm) : 4.61 (dd, 1H, J=9.2, 25.6 Hz, H-3), 4.51 (dd, 1H, J=5.2, 9.2 Hz, H-4), 4.23-4.05 (m, 4H, H-5, ОСН2СН3), 3.32 (q, 8H, J=7.2 Hz, N(СН2СН3)4), 1.69 (d, 3H, J=23.2 Hz, СН3-2), 1.31-1.24 (m, 21H, ОСН2СН3, (СН3)2С, N(CH2СН3)4. Метод 2. К раствору сульфата IIIb (148 мг, 0,477 молль) в безводном ацетонитриле (2 мл) при температуре 0°С одной порцией добавляют гидрат тетраэтиламмонийфторида (107 мг, 0,717 ммоль). Полученную реакционную смесь перемешивают в течение 24 ч и выпаривают вместе с толуолом с получением полутвердого продукта (257 мг, сырой, протонный ЯМР показал наличие одного продукта).
ПРИМЕР 6
Получение 1-(2-дезокси-2-фтор-2-метил-3,5-0-3,5-дипивалоилрибофуранозил)-N4-бензоилцитозина (IIb, R5=R6=пивалоил, R2=Н, R3=Me)
К раствору соединения 49В (Схема 6) (Nu=F, R2=Н, R3=Me, R5=R6=пивалоил, 3,44 г, 10,36 ммоль) в ТГФ (70 мл) добавляют LiAl (трет-BuО)3Н (13,47 ммоль, 1 М в ТГФ, 13,47 мл) при температуре от -20°С до -10°С и полученный раствор перемешивают при температуре -10°C÷-15°C в течение 2 ч. К раствору снова добавляют LiAl (трет-BuO)3Н (1,35 мл, 1,35 ммоль) и перемешивают раствор при -10°С в течение 1 ч. Добавляют ледяную воду (50 мл). Смесь экстрагируют EtOAc (200 мл), органический слой промывают водой, рассолом и сушат (Na2SO4). Растворитель удаляют и получают сырой лактол, который растворяют в СН2Сl2 (50 мл). К раствору добавляют Et3N (31,08 ммоль, 4,24 мл), 4-диметиламинопиридин (1 ммоль, 122 мг) и триметилацетилхлорид (20,7 ммоль, 2,55 мл) и перемешивают смесь 16 ч при комнатной температуре. Добавляют воду (20 мл) и перемешивают полученную смесь в течение 10 мин при комнатной температуре. Добавляют EtOAc (200 мл), промывают органический слой водой, рассолом и высушивают (Na2SO4). Растворитель удаляют и остаток выпаривают вместе с толуолом (2×20 мл) с получением сырого промежуточного продукта (5, 6,74 г) для следующей реакции сочетания без очистки.
Суспензию N4-бензоилцитозина (6,06 ммоль, 1,30 г) и (NH4)2SO4 (30 мг) в HMDS (16,7 мл) нагревают с обратным холодильником в течение 5 ч и концентрируют прозрачный раствор досуха при пониженном давлении. Остаток растворяют в 1,2-дихлорэтане (50 мл). К раствору добавляют сырое соединение 54 (1,96 г Схема 6) и SnCl4(1,42 мл, 12,12 ммоль) при комнатной температуре. Раствор нагревают с обратным холодильником в течение 24 ч и охлаждают до 0°С. К раствору добавляют NаНСО3 (6,11 г, 72,72 ммоль) и EtOAc (50 мл). К смеси медленно добавляют воду (2 мл) и перемешивают полученную смесь при комнатной температуре 20 мин. Твердый продукт удаляют путем фильтрации. Органический раствор промывают водой, рассолом и высушивают (Na2SO4). Растворитель удаляют, получая сироп сырой смеси β/α - аномеров с отношением 4/1 с преимуществом β-изомера. Сырой продукт растворяют в МеОН (1 мл) при температуре 50°С. К раствору добавляют гексаны (10 мл). Смесь оставляют на 1 ч при комнатной температуре, затем при 0°С на 2 ч. Кристаллы собирают на фильтре, промывают гексанами, получая продукт 55 (Схема 6) (323 мг, 20,3% в расчете на 49). Маточник концентрируют досуха и очищают хроматографическим методом на колонке (20-50% EtOAc) в гексанах) с получением второй порции 55.1Н-ЯМР (CDCl3): δ 8.82 (br s, 1H, NH), 8.10, 7.89, 7.62, 7.52 (m, 7H, Н-5, Н-6, 5Ph-H), 6.41 (d, J=18.4 Hz, 1H, Н-1'), 5.10 (m, 1H, H-3'), 4.45 (d, J=9.6 Hz, 1H, H-4'), 4.36 (t, J=2.8 Hz, 2H, Н-5'), 1.35 (d, J=22.0 Hz, 3H, Me), 1.29, 1.23 [ss, 18H, С(Ме)3].
ПРИМЕР 7
(2S,3R)-3-[(4R)-2,2-диметил-[1,3]-диоксолан-4-ил]-2,3-дигидрокси-2-метил-пропионовой кислоты этиловый эфир (42)
К перемешиваемому раствору 41 (214 мг, 0,1 ммоль) в трет-Bu-ОН в атмосфере аргона добавляют раствор N-окси 4-метилморфолина (0,47 мл, 50 вес.%-ный раствор в воде) и воду (0,2 мл). Затем добавляют 2,5%-ный (вес) раствор тетраокиси осмия в трет-бутиловом спирте (0,51 мл) и перемешивают смесь в течение 5 ч при комнатной температуре на водяной бане. Смесь выпаривают под вакуумом до получения сиропа, который подвергают азеотропной перегонке с водой (3×10 мл) для удаления 4-метилморфолина. Остаток высушивают путем добавления и выпаривания этилового спирта (2×10 мл) с получением остатка, который очищают методом хроматографии на силикагеле с применением 20% EtOAc в смеси гексанов с получением желательного продукта и его изомера (196 мг, 96%) в виде твердого продукта. Протонный ЯМР показывает, что отношение нужного продукта к его изомеру равно примерно 5:1. Перекристаллизацией из смеси гексаны/этилацетат получают чистый продукт (91 мг, 37,4% в расчете на исходное вещество) в виде кристаллов.1H-ЯМР (DMSO-d6) δ : 1.18 (t, J=7.2 Hz, 3H, -ОСН2СН3), 1.24 (s. 3H, СН3), 1.28 (s, 3H, 2-СН3), 3.67 (t, J=7.2 Hz, 1H), 3.85, 4.06 и 4.12 (m, 4H), 4.97 (s, 1H, 2-OH, D2O обмен), 5.14 (d, J=7.6 Hz, 2-OH, D2O обмен).
ПРИМЕР 8
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Ферроцианид калия в качестве окислителя с осмиевым катализатором
В круглодонную колбу объемом 100 мл, снабженную магнитной мешалкой, загружают 5 мл трет-бутилового спирта, 5 мл воды и смесь К2Fe(CN)6 (0,98 г), К2СО3(0,41 г) и K2OsO2(OH)4 (3,2 мг). Перемешивание при комнатной температуре приводит к образованию двух прозрачных фаз, нижняя водная фаза оказывается желтой. В этот момент добавляют метансульфонамид (95 мг). Смесь охлаждают до 0°С, при этом некоторая часть солей осаждается, сразу же добавляют 214 мг (1 ммоль) соединения 41 и энергично перемешивают гетерогенную суспензию при температуре 0°С в течение 24 ч. К этой смеси добавляют твердый сульфит натрия (1,5 г), перемешивая при температуре 0°С, затем дают смеси нагреться до комнатной температуры и перемешивают 30-60 мин. Добавляют этилацетат (10 мл) и после разделения слоев водную фазу экстрагируют EtOAc. Органический слой высушивают над Na2SO4 и концентрируют досуха. Остаток очищают методом хроматографии на силикагеле с применением 20% EtOAc в смеси гексанов, получая нужный продукт (190 мг, 77%) в виде твердого продукта. Протонный ЯМР показал, что отношение нужного продукта к его изомеру составляет примерно 5:1. Перекристаллизацией смеси при помощи гексанов/этилацетата получают чистый диол (102 мг, 41% в расчете на исходное вещество) в виде кристаллов. Спектр1Н ЯМР этого продукта идентичен спектру аутентичного образца.
ПРИМЕР 9
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Гидроперекись третичного бутила в качестве окислителя при комнатной температуре с осмиевым катализатором
В колбу объемом 50 мл, снабженную магнитной мешалкой, загружают 2 мл ацетона, 214 мг (1 ммоль) соединения 41, 65 мг Еt4МОАс × 4H2O и 0,3 мл гидроперекиси третичного бутила (5~6 М в декане). После перемешивания при комнатной температуре до получения прозрачного раствора Et4NOAc полученный раствор охлаждают на ледяной бане и одной порцией добавляют 5 мл OsO4 (2,5 вес.%) в трет-BuOH). Раствор сразу же становится коричневато-пурпурным. Через 1 ч ледяную баню удаляют, дают реакционной смеси нагреться до комнатной температуры и перемешивают в течение 14 ч. Остальное проводят, как описано выше. После очистки методом флэш-хроматографии получают 178 мг (72%) твердого продукта. На спектре1Н ЯМР при δ 1,26 наблюдается крошечный пик, что указывает на наличие изомера в количестве менее 4%.
ПРИМЕР 10
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Гидроперекись третичного бутила в качестве окислителя при температуре 0°С с осмиевым катализатором
В колбу объемом 250 мл, снабженную магнитной мешалкой, загружают 20 мл ацетона, 2,14 г (10 ммоль) соединения 41, 650 мг Et4NOAc × 4H2O и 3 мл гидроперекиси трет-бутила (5~6 М в декане). После перемешивания при комнатной температуре до получения прозрачного раствора Et4NOAc полученный раствор охлаждают на ледяной бане и одной порцией добавляют 5 мл OsO4 (2,5 вес.%) в трет-BuОН). Раствор сразу же становится коричневато-пурпурным. Затем реакционную смесь перемешивают при температуре 0°С в течение 6,5 ч (мониторинг при помощи ТСХ, гексаны:этилацетат = 4:1, Rf=0,18). При 0°С добавляют эфир (40 мл) и полученную смесь обрабатывают 5 мл свежеприготовленного 10%-ного раствора NaHCO3, добавляемого одной порцией. Ледяную баню удаляют и перемешивание продолжают в течение 1 ч. К смеси добавляют ЕtOАс (100 мл) и Н2О (50 мл). После разделения слоев водную фазу экстрагируют EtOAc. Органический слой промывают рассолом, сушат (MgSO4) и концентрируют. Остаток очищают флэш-хроматографией при помощи 20% ЕtOАс в гексанах с получением нужного продукта (2,16 г, 87%).1Н ЯМР не показывает примеси изомера.
ПРИМЕР 11
(2S,3R)-3-[(4R)-2,2-диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Перманганат тетрадецилтриметиламмония (TDTAP) в качестве окислителя
К перемешиваемому раствору соединения 41 (214 мг, 1 ммоль) в трет-BuOH (10 мл) и CH2Cl2 (2 мл) при комнатной температуре небольшими порциями добавляют раствор КОН (6 мг, 0,1 ммоль) в воде и затем TDTAP (0,420 г, 1,12 ммоль) в течение 5 мин. Через 5 мин ТСХ показывает, что реакция завершена. Раствор резко охлаждают 10 мл насыщенного раствора бисульфита натрия. Реакционную смесь концентрируют под вакуумом и экстрагируют остаток этилацетатом (3×15 мл), сушат (Na2SO4), выпаривают до получения твердого продукта белого цвета, который затем растворяют в 5 мл СН2Сl2, пропускают через силикагель с нанесенным целлитом, промывают этилацетатом (50 мл).
Фильтрат высушивают под вакуумом с получением вязкого масла (174 мг, выход 71%) в виде смеси 8:1, в которой преобладающим изомером является соединение, указанное в заготовке.
ПРИМЕР 12
(2S,3R)-3-[(4R)-2,2-диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Перманганат калия в качестве окислителя вместе с 18-краун-6-эфиром-А (при температуре -40°С)
К раствору соединения 41 (214 мг, 1 ммоль) в CH2Cl2 (10 мл) и 18-краун-6-эфира (37,5 мг, 0,1 ммоль) добавляют KMnO4 (158 мг, 1 ммоль) частями при температуре -40°С, смесь перемешивают в течение 2 ч при той же температуре. В это время реакционная смесь становится темно-коричневой. После завершения реакции смесь резко охлаждают насыщенным раствором бисульфита натрия (10 мл). Полученную бесцветную смесь фильтруют через фритту и экстрагируют фильтрат этилацетатом (2×25 мл), сушат (Na2SO4) и концентрируют с получением вязкого масла, содержащего 10-20% исходного непрореагировавшего олефина вместе с желательными диолами и его изомером в отношении 6:1 (1Н ЯМР). Исходный олефин может быть удален пропусканием через силикагель с использованием смеси 5% этилацетата - гексана. 6:1 смесь желательных диолов элюируют на колонке при помощи смеси 20% этилацетата/гексана и получают белый твердый продукт (200 мг, ~80%) после испарения растворителя.
ПРИМЕР 13
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Перманганат калия в качестве окислителя вместе с 18-краун-6-эфиром-В (при -10°С)
К раствору соединения 41 (214 мг, 1 ммоль) в CH2Cl2 (10 мл) добавляют 37,5 мг (0,1 ммоль) 18-краун-6-эфира и охлаждают смесь при -10°С. Частями добавляют КМnO4 (237 мг, 1,5 ммоль) и перемешивают смесь при -10°С в течение 2 ч. В это время реакционная смесь становится темно-коричневой, ее обрабатывают насыщенным раствором бисульфита натрия (10 мл). Полученную смесь фильтруют через фритту, фильтрат экстрагируют этилацетатом (2×25 мл), сушат (Na2SO4) и выпаривают с получением белого твердого продукта (240 мг, 94,4%), состоящего из желательного продукта и его изомера в отношении 6:1.
ПРИМЕР 14
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Перманганат калия в качестве окислителя в 1:9 смеси Н2О/трет-BuОН
К раствору соединения 41 (214 мг, 1 ммоль) в трет-BuOH (9 мл) и Н2О (1 мл) при температуре 0°С частями добавляют КМnO4 (237 мг, 1,5 ммоль) и смесь перемешивают при указанной температуре в течение 2 ч. Загружают дополнительное количество (79 мг, 0,5 ммоль) КМnO4 и перемешивают смесь еще в течение 30 мин. После обработки, как описано выше, получают 128 мг (50%) смеси изомеров в отношении 8:1 в виде белого твердого продукта, основным компонентом которого является желаемый продукт.
ПРИМЕР 15
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Перманганат калия в качестве окислителя в 1:9 смеси Н2О/трет-BuOH
К раствору соединения 41 (214 мг, 1 ммоль) в Н2О (9 мл) и трет-BuOH (1 мл) при 0°С добавляют частями KMnO4 (237 мг, 1,5 ммоль) и смесь перемешивают при указанной температуре в течение 30 мин. В это время реакционная смесь становится темно-коричневой, ее обрабатывают насыщенным раствором бисульфита натрия (10 мл). Полученную смесь фильтруют через фритту, фильтрат экстрагируют этилацетатом (3×25 мл), сушат (Na2SO4) и концентрируют с получением 4:1 смеси изомеров диола в виде белого твердого продукта (128 мг, 50%), основным компонентом которого является соединение 42.
ПРИМЕР 16
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Перманганат калия в качестве окислителя в воде при температуре 0°С
Раствор КМnO4 (158 мг, 1,0 ммоль) в воде (10 мл) добавляют к соединению 41 (214 мг, 1 ммоль) и перемешивают смесь при температуре 0°С в течение 1 ч. Реакционную смесь быстро охлаждают насыщенным раствором бисульфита натрия 910 мл) и обрабатывают, как описано выше. Твердый продукт белого цвета (80 мг, 32%) получается в виде 4:1 смеси изомеров диола, в которой преобладающим компонентом является целевое соединение.
ПРИМЕР 17
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Перманганат калия в качестве окислителя в ацетоне
К раствору соединения 41 (214 мг, 1 ммоль) в ацетоне (10 мл) добавляют 37,5 мг (0,1 ммоль) и охлаждают реакционную смесь до 0°С. К этому холодному раствору частями добавляют КМnO4 (237 мг, 1,5 ммоль) и перемешивают реакционную смесь в течение 2 ч при той же температуре. В это время реакционная смесь становится темно-коричневой. Реакционную смесь быстро охлаждают насыщенным раствором бисульфита натрия (10 мл), при этом раствор становится бесцветным. Реакционную смесь экстрагируют этилацетатом (3×25 мл), сушат и выпаривают смесь с получением твердого продукта белого цвета (245 мг, 96,4%) с отношением 10:1.
ПРИМЕР 18
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42)
Перманганат калия в качестве окислителя в смеси ацетона и пиридина
К раствору соединения 41 (214 мг, 1 ммоль) в смеси ацетона (9 мл) и пиридина (1 мл) при 0°С добавляют КМnO4 (158 мг, 1,0 ммоль) и перемешивают смесь при указанной температуре в течение 1 ч. После обработки реакционной смеси, как указано выше, получают 164 мг (67%) белого твердого практически чистого продукта. Данные1Н ЯМР показывают, что этот сырой продукт содержит около 6% диастереомера соединения (42).
ПРИМЕР 19
(2S,3R)-3-[(4R)-2,2-Диметил-[1,3-диоксолан-4-ил]-2,3-дигидрокси-2-метилпропионовой кислоты этиловый эфир (42) в системе RuCl3/CeCl3/NaIO4
В круглодонную колбу объемом 50 мл, снабженную магнитной мешалкой, загружают смесь NaIO4 (321 мг, 1,5 ммоль) и СеСl3·7Н2O (37 мг, 0,1 ммоль) в 0,45 мл воды, перемешивают и осторожно нагревают до образования суспензии ярко-желтого цвета. После охлаждения до 0°С добавляют ЕtOАс (1,25 мл) и ацетонитрил (1,5 мл) и перемешивают суспензию в течение 2 мин. Добавляют 0,1 М водный раствор RuCl3 (25 мкл) и перемешивают смесь в течение 2 мин. Одной порцией добавляют раствор соединения 41 (214 мг, 1 ммоль) в ЕtOАс (0,25 мл) и полученную суспензию перемешивают при температуре 0°С в течение 1 ч. Добавляют твердый Na2SO4 и затем ЕtOАс (3 мл). Твердый продукт отфильтровывают, остаток на фильтре несколько раз промывают EtOAc. Затем фильтрат промывают насыщенным раствором Na2SO3, органический слой высушивают (Na2SO4) и концентрируют досуха. Остаток очищают хроматографией на силикагеле с применением 20% EtOAc в гексанах, получают сироп (150 мг, 60%).1H ЯМР показывает, что отношение целевого продукта к его изомеру составляет около 1,6:1.
ПРИМЕР 20
Восстановление и ацилирование соединения 49
К раствору 3,5-дибензоил-2-фтор-2-дезокси-2-метил-D-рибонолактона (49,23 г, 61,77 ммоль. Схема 6) в безводном ТГФ (400 мл) добавляют LiAl (O-трет-Bu)3H (75 мл, 1 М в ТГФ, 75 ммоль) в течение 15 мин при температуре от -20°С до -10°С и перемешивают полученный раствор при указанной температуре до исчерпания всего исходного продукта. Через 5 ч остается около 10-20%
исходного соединения, поэтому добавляют еще 10 мл LiAl (O-трет-Bu)3H (10 ммоль) при той же температуре и перемешивают в течение 1 ч, пока ТСХ не покажет, что весь исходный материал исчерпан. К этой реакционной смеси добавляют DMAP (7,5 г) и Ас2O (58,2 г, 616 ммоль) и перемешивают раствор при -10°С в течение примерно 2-3 ч. После завершения реакции (по данным ТСХ) смесь разбавляют этилацетатом (400 мл) и 200 мл воды. Органический слой отделяют, а водный слой промывают этилацетатом (2×100 мл). Объединенные органические слои промывают водой (3×150 мл), рассолом и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении и выпаривают вместе с толуолом (2×100 мл), получают сырой ацетат в виде прозрачного коричневого масла. Это масло пропускают через силикагель (50 г) и промывают смесью 20% этилацетата/гексанов, пока не выделится весь ацетат. Растворитель выпаривают при пониженном давлении, получая нужный ацетат (54, 32 г) в виде бесцветного масла.
ПРИМЕР 21
1-(2-Дезокси-2-фтор-2-метил-3-5-O-дибензоил-β-D-рибофуранозил)-N4-бензоилцитозин (55)
К суспензии N4-бензоилцитозина (20,39 г, 94,74 ммоль) в 400 мл HMDS добавляют (NH4)2SO4 (250 мг) и нагревают с обратным холодильником в течение 4 ч. Избыток HMDS удаляют при пониженном давлении. Маслянистый остаток растворяют в хлорбензоле (1 л). К этому раствору добавляют раствор ацетата (25 г) в хлорбензоле (250 мл) и SnCl4 (190,4 ммоль, 49 г) и смесь перемешивают при комнатной температуре в течение 2 ч с последующим нагреванием при температуре около 65°С в течение 16 ч. Реакционную смесь охлаждают до 0°С, затем добавляют NaHCO3 (96 г, 1,14 ммоль) и этилацетат (500 мл) с последующим осторожным введением воды (20 мл). Эту смесь перемешивают при комнатной температуре в течение 30 мин. Смесь фильтруют под вакуумом, остаток промывают этилацетатом. Органический слой промывают водой, рассолом (2×250 мл) и сушат над безводным Na2SO4. Растворитель удаляют при пониженном давлении, получая бледно-желто-коричневый продукт. Его растворяют в МеОН (250 мл), нагревают с обратным холодильником в течение 30 мин, охлаждают до комнатной температуры и фильтруют, получая целевой продукт (55, 8,0 г) в виде почти белого твердого продукта.
ПРИМЕР 22
1-(2-Дезокси-2-фтор-2-С-метил-β-D-рибофуранозш) цитозин (14)
Суспензию 55 из примера 21 (16,7 г, 30,8 ммоль. Схема 6) обрабатывают метанольным раствором аммиака (750 мл, 7 М в МеОН), перемешивают при комнатной температуре в течение 12 ч и концентрируют досуха при пониженном давлении с получением бледно-желтого твердого продукта. К этому продукту добавляют ТГФ (400 мл), нагревают с обратным холодильником в течение 30 мин и охлаждают до комнатной температуры. Образуется твердый продукт, который собирают на фильтре и промывают ТГФ с получением соединения 14 (6,7 г, 88%) в виде почти белого порошка.
Реферат
Данное изобретение относится к способам получения производных 2′-дезокси,2′-фтор-2′-метил-D-рибонолактона ! из исходных соединений или . Получаемые таким образом производные 2′-дезокси,2′-фтор-2′-метил-D-рибонолактона могут быть использованы для получения нуклеозидов, содержащих 2′-дезокси-2′-фтор-2′-С-метил-β-D-рибофуранозилнуклеозиды и обладающих сильной активностью против HCV. 3 н. и 5 з.п. ф-лы.
Формула

где R1 обозначает метил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает этил; и
Nu обозначает F; и
М+ обозначает тетраалкиламмоний, включая тетраэтиламмоний.

где R1 обозначает метил;
R2 обозначает водород;
R3 обозначает метил;
R4 обозначает этил; и
Nu обозначает F.

включающий
(a) обработку соединения формулы 51В или 52В


кислотой в среде по меньшей мере одного растворителя,
(b) последующую азеотропную перегонку в среде бензола или толуола в присутствии кислоты для получения соединеия 53В

(c) защиту соединения формулы 53 В защитным агентом в присутствии основания в среде растворителя.

защищено защитным агентом, выбранным из одного или более соединений группы, включающей метоксиметилхлорид, метоксиэтилхлорид, бензилоксиметилхлорид, этоксиметилхлорид, тритилхлорид, триэтилсилилхлорид, трет.бутилдиметилсилилхлорид, трет.бутилдифенилсилилхлорид, ацетилхлорид, ацетил ангидрид, бензоилангидрид, бензоилхлорид, толуоилхлорид, 4-фенилбензоилхлорид, 2-, 3- или 4-нитробензоилхлорид, 2-, 3- или 4-хлорбензоилхлорид; в присутствии основания в среде растворителя, и в котором R2 и R3 определены выше.

Комментарии