Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение - RU2731385C1
Код документа: RU2731385C1
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к макрогетероциклическим нуклеозидным производным и их аналогам, получению и применению. Эти соединения являются пролекарствами для лечения вирусных и раковых заболеваний и представляют собой ингибиторы полимеразы NS5B ВГС, ДНК-полимеразы ВГВ и обратной транскриптазы (RT) ВИЧ-1.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Нуклеозиды и нуклеотиды (нуклеоз(т)иды) используются в клинической практике в течение примерно 50 лет и стали краеугольными камнями при лечении пациентов с вирусными инфекциями или раком. Регистрация ряда новых препаратов за последнее десятилетие показывает, что этот класс соединений по-прежнему обладает большим потенциалом. Так, нуклеоз(т)иды представляют большой интерес в качестве перспективных химиотерапевтических агентов, в том числе: 2'-дезокси-L-уридин (CAS №31501-19-6), 2'-дезокси-D-уридин (CAS №951-78-0), телбивудин (CAS №3424-98-4), зидовудин (AZT, CAS №30516-87-1), трифлуридин (CAS №70-00-8), клевудин (CAS №163252-36-6), PSI-6206 (CAS №863329-66-2), 2'-(S)-2'-хлор-2'-дезокси-2'-фторуридин (CAS №1673560-41-2), ND06954 (CAS №114248-23-6), ставудин (CAS №3056-17-5), 5-этинилтавудин (фестинавир, CAS №634907-30-5), торцитабин (CAS №40093-94-5), (-)-бета-D-(2R,4R)-диоксолан-тимин (DOT, 1-((2R,4R)-2-(гидроксиметил)-1,3-диоксолан-4-ил)-5-метил-2,4(1Н,3Н)-пиримидиндион, CAS No. 127658-07-5), 2-(6-амино-пурин-9-ил)-этанол (CAS №707-99-3), 2'-С-метилцитидин (CAS №20724-73-6), PSI-6130 (CAS №817204-33-4), гемцитабин (CAS №95058-81-4), 2'-хлор-2'-дезокси-2'-фторцитидин (CAS №1786426-19-4), 2',2'-дихлор-2'-дезоксицитидин (CAS №1703785-65-2), 2'-С-метилцитидин (CAS №20724-73-6), PSI-6130 (CAS №817204-33-4), ламивудин (3ТС, CAS №134678-17-4), эмтрицитабин (CAS №143491-57-0), 2'-дезоксиаденозин (CAS №958-09-8), 2'-дезокси-β-L-аденозин (CAS №14365-45-8), 2'-дезокси-4'-С-этинил-2-фтораденозин (CAS №865363-93-5), диданозин (CAS №69655-05-6), энтекавир (CAS №209216-23-9), FMCA (CAS №1307273-70-6), диоксолан-G (DOG, CAS №145514-01-8), β-D-2'-дезокси-2'-(R)-фтор-2'-β-С-метил (CAS №817204-45-8), абакавир (ABC, CAS №136470-78-5), диоксолан-А (DOA, CAS # 145514-02-9), [(2R,4R)-4-(6-циклопропиламино-пурин-9-ил)-[1,3]диоксолан-2-ил]-метанол (CAS №1446751-04-7), амдоксовир (AMDX, CAS №145514-04-1), (R)-1-(6-амино-пурин-9-ил)-пропан-2-ол (CAS №14047-28-0) и [(2S,5R)-5-(6-амино-пурин-9-ил)-4-фтор-2,5-дигидро-фуран-2-ил]-метанол [M.J. Sofia. Nucleosides и Nucleotides for the treatment of viral diseases. In Annual Reports in Medicinal Chemistry 2014, Volume 49, Editor-in-Chief M.C. Desai, p 221-247. L.P. Jordheim et al. Advances in the development of nucleoside и nucleotide analogues for cancer и viral diseases. Nat. Rev. Drug. Discov. 2013, 12(6), 447-464.].
В настоящее время нуклеоз(т)иды являются предпочтительным вариантом и стандартом лечения пациентов, инфицированных вирусом гепатита В (ВГВ), и становятся ключевым компонентом методов лечения пациентов, инфицированных вирусом гепатита С (ВГС). Они также играют центральную роль при лечении других вирусных инфекций, вызванных вирусами герпеса (HSV-1 и HSV-2), вирусом ветряной оспы, вирусом Эпштейна-Барра и цитомегаловирусом [Е. De Clercq. Ed. Antiviral Agents 2013, Vol. 67: Academic Press: New York. 2013. L.P. Jordheim et al. Advances in the development of nucleoside и nucleotide analogues for cancer и viral diseases. Nal. Rev. 2013, 12, 447-464.]. Привлекательность нуклеоз(т)идной стратегии при разработке терапевтических средств для лечения заболеваний с высоким риском смертельного исхода обусловлена тем, что для всех вирусов требуется полимераза для репликации как ДНК, так и РНК.
Другой фактор, который необходимо учитывать при разработке нуклеоз(т)идного ингибитора, относится к нуклеоз(т)идной метаболической активации. Это нуклеотидный аналог трифосфата, служащий функциональным субстратом для вирусной полимеразы, которая включается в растущую цепь РНК или ДНК, что обычно приводит к обрыву цепи и в конечном итоге к прекращению вирусной репликации. Следовательно, эффективность, с которой нуклеоз(т)ид преобразуется в активный трифосфат, а также концентрация и период полураспада трифосфата внутри клетки являются важными факторами, определяющими эффективность нуклеоз(т)ида как ингибитора вирусной репликации. Как правило, первая из трех стадий фосфорилирования, необходимых для создания активного трифосфата, является определяющей. В тех случаях, когда сам нуклеозид не является хорошим субстратом для киназы, участвующей в начальной стадии фосфорилирования, желательна доставка монофосфата, но это обычно требует использования пролекарственной технологии, чтобы замаскировать неблагоприятные характеристики фосфатной группы и облегчить проницаемость. По этой причине нуклеотидные пролекарственные стратегии получили широкое использование в разработке нуклеотидов для лечения вирусных и раковых заболеваний.
Пролекарство уридинового нуклеотида Совальди® (софосбувир, PSI-7977; GS-7977) [М.J. Sofia et al. Discovery of a β-D-20-Deoxy-20-r-fluoro-20-β-C-methyluridine Nucleotide Prodrug (PSI-7977) for the Treatment of Hepatitis С Virus. J. Med. Chem. 2010, 53, 7202-7218. M.J. Sofia et al. Nucleoside phosphoramidate prodrugs. US 7964580 (2011).] стало первым нуклеоз(т)идом, одобренным регулирующими органами FDA и ЕС для лечения больных гепатитом С, инфицированных генотипами (gT) 1, 2, 3 и 4 вируса гепатита С, и в клинических испытаниях оно также показало эффективность в отношении всех соответствующих генотипов ВГС (gT1-gT6) [I.M. Jacobson et al. Sofosbuvir for hepatitis С genotype 2 or 3 in patients without treatment options. Engl. J. Med. 2013, 368, 1867-1877. E. Lewirz et al. Sofosbuvir for previously untreated chronic hepatitis С infection. Engl. J. Med. 2013, 368, 1878-1887]. Его одобрение положило начало применению полностью пероральной безинтерфероновой схемы лечения пациентов, страдающих ВГС.
Другие известные химиотерапевтические средства для лечения гепатита С содержат фосфорамидатные фрагменты, среди них AVI-4201 [A.V. Ivachtchenko et al. Alkyl 2-{[(2r,3s,5r)-5-(amino-2-oxo-2n-pyrimidin-1-yl)-3-hydroxy-tetrarhydro-furan-2-yl-methoxy]-phenoxy-phosphorуl-amino}-propionates, nucleoside inhibitors of HCV NS5B RNA-polymerase, and methods for producing and use thereof. WO 2014148949, 2014], AVI-4203 [A.V. Ivachtchenko et al. Substituted (S)-(2R,3R,5R)-3-hydroxy-(5-pyrimidin-1-yl)-tetrahydrofuran-2-ylmethyl aryl phosphoramidate. Pat US 8889701, 2014] or CC-1845 [D.L Mayers. Development of Potent Novel Oral Pan-genotypic HCV Nucleotide, NS5A, NS5B non-nucleoside, and Helicase Inhibitors. 2015. https://www.informedhorizons.com/hepdart2015/pdf/Presentations/Mayers.pdf].

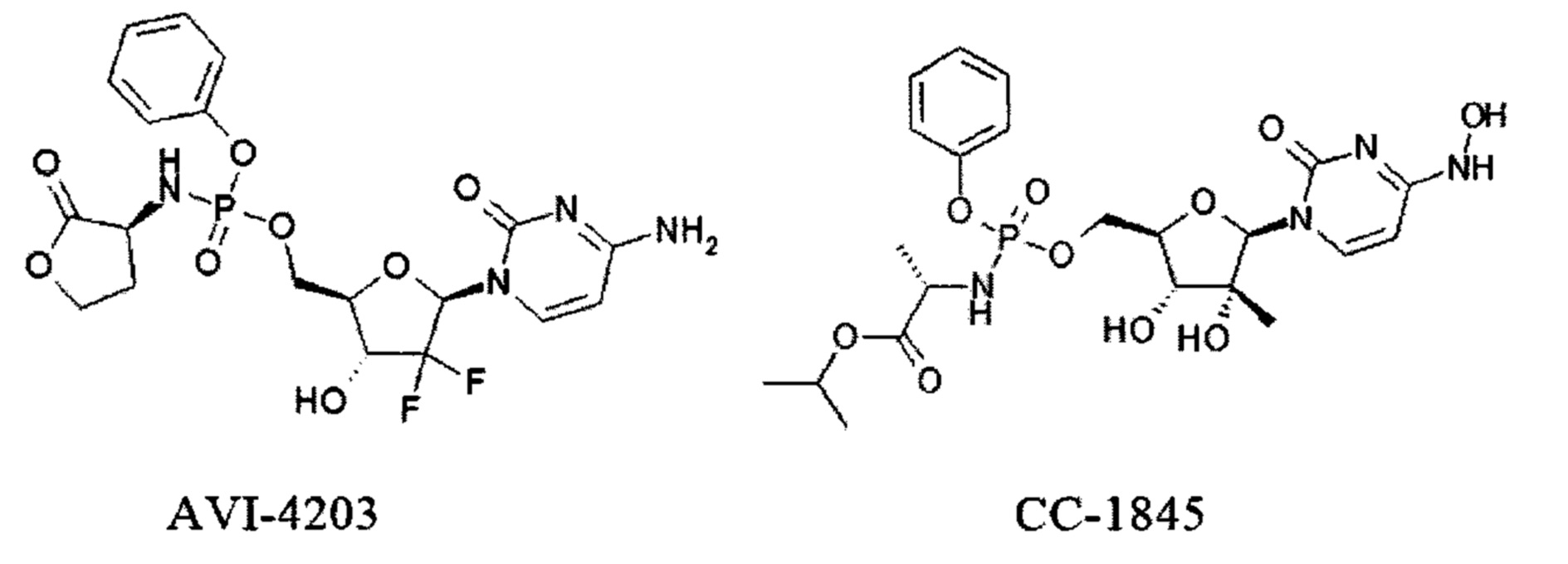
Следует отметить, что в этом случае ингибиторная активность фосфорамидатных ингибиторов РНК-полимеразы NS5b ВГС Sovaldi®, AVI-4201, AVI-4203 и СС-1845 на порядки величины выше, чем у соответствующих нуклеозидов: PSI-6206, Гемцитабина и 2'-С-Метилцитидина.
Исследованы и другие гуанозиновые нуклеотидные пролекарства, в которых также используется фрагмент фосфорамидатного пролекарства для усиления целенаправленного воздействия на печень. Так, PSI-353661 продемонстрировал высокую ингибирующую активность в анализе репликонов (ЕС90=0,008 μМ - >1000-кратное увеличение активности по сравнению с аналогом гуанозина - β-D-2'-дезокси-2'-R-фтор-2'-β-С-метилгуанозином (Таблица 1)) и новый профиль резистентности, аналогичный PSI-352938, но дело так и не дошло до клинических исследований [W. Clung et al. Discovery of PSI-353661, a Novel Purine Nucleotide. ACS Med. Chem. Lett. 2011. 2. 130-135.]. Структурно-родственные пролекарства IDX-184 (EC50=0,4 мкМ) [X.-J. Zhou, et al. Safety и Pharmacokinetics of IDX184, a Liver-Targeted Nucleotide Polymerase Inhibitor of Hepatitis С Virus, in Healthy Subjects. Antimicrob. Agents Chemother. 2011, 55, 76-81. J. Lalezari, et al. Short-Term Monotherapy with IDX184, a Liver-Targeted Nucleotide Polymerase Inhibitor, in Patients with Chronic Hepatitis С Virus Infection. Antimicrob. Agents Chemother. 2012. 56, 6372-6378.] и INX-08189 (BMS-986094, EC50=0.010 μM) [C. McGuigan et al. Phosphorodiamidates as a Promising New Phosphate Prodrug Motif for Antiviral Drug Discovery: Application to Anti-ВГС Agents. J. Med. Chem. 2011, 54, 8632-8645. J.H. Vernachio et al. INX-08189, a phosphoramidate prodrug of 6-O-methyl-2'-C-methyl guanosine, is a potent inhibitor of hepatitis С virus replication with excellent pharmacokinetic and pharmacodynamic properties. Antimicrob. Agents Chemother. 2011. 55, 1843-1851.], образующие аналогичные трифосфаты, дошли до стадии клинических исследований, но из-за высокой сердечно-сосудистой токсичности, вызываемой INX-08189, были прекращены разработки обоих соединений [J.J. Arnold et al. Sensitivity of Mitochondrial Transcription and Resistance of RNA Polymerase II Dependent Nuclear Transcription to Antiviral Ribonucleosides. PLOS Pathog. 2012. 8, DOI: 10.1371/journal.ppat. 1003030.]. Судя по всему, высокая сердечнососудистая токсичность, наблюдаемая у INX-08189, снизила интерес к разработке гуанозинового нуклеозида для лечения пациентов, инфицированных вирусом гепатита С.


ВГВ представляет собой ДНК-содержащий вирус семейства гепаднавирусов. По оценкам, во всем мире 400 миллионов человек заражены ВГВ. В настоящее время стандарт лечения ВГВ - длительная нуклеоз(т)идная терапия. Нуклеоз(т)иды, одобренные для лечения ВГВ-инфекции, включают ламивудин, адефовир дипивоксил, энтекавир, телбивудин и тенофовира дизопроксил фумарат (TDF). Из них наиболее широко применяются энтекавир и TDF. Длительное применение энтекавира приводит к резистентности у значительной популяции пациентов, a TDF вызывает нефротоксичность и остеопороз [D. Grimm et al. HBV life cycle and novel drug targets. Hepatol. Int. 2011. 5. 644-653. G. Borgia, I. Gentile. Treating chronic hepatitis B: today and tomorrow. Curr. Med. Chem. 2006. 13. 2839-2855.]. Однако продолжительная нуклеоз(т)идная терапия приводит к уменьшению фиброза печени, свидетельствуя о том, что подавление репликации вируса имеет положительный эффект при длительном лечении [Т.Т. Chang et al. Long-term entecavir therapy results in the reversal of fibrosis/cirrhosis and continued histological improvement in patients with chronic hepatitis B. Hepatology 2010. 52, 886-893. P. Marcellin et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet 2013, 381, 468-475.].
Несмотря на успехи нуклеоз(т)идной ВГВ терапии, продолжается работа по выявлению новых ингибиторов, которые могут обеспечить дополнительные преимущества по сравнению с существующими агентами, и некоторые из упомянутых выше анти-ВИЧ агентов также были исследованы для лечения ВГВ-инфекции [С.А. Geng et al. Small-molecule inhibitors for the treatment of hepatitis В virus documented in patents. Mini Rev. Med. Chem. 2013. 13, 749-776.].
В последнее время получен 2'-фтор-6'-метилен-карбоциклический аденозин (FMCA) (ЕС50=0,55 мкМ) с 6'-метилен-карбоциклическим ядром, позаимствованным у энтекавира, который оказался сильным ингибитором репликации ВГВ и обладал активностью в отношении ламивудин-энтекавир резистентного клона (L180M+M204V+S202G) [R.K. Rawal et al. 2'-Fluoro-6'-methylene-carbocyclic adenosine phosphoramidate (FMCAP) prodrug: In vitro anti-HBV activity against the lamivudine-entecavir resistant triple mutant and its mechanism of action. Bioorg. Med. Chem. Lett. 2013. 23, 503-506.]. Кроме того, получение соответствующего 5'-фосфорамидата FMCA привело к созданию соединения, которое оказалось в 10 раз мощнее FMCA в отношении как немутантного типа (ЕС50=0,62 мкМ), так и резистентного мутанта (EC50=0,054 мкМ) [R.K. Rawal et al. 2'-Fluoro-6'-methylene-carbocyclic adenosine phosphoramidate (FMCAP) prodrug: In vitro anti-HBV activity against the lamivudine-entecavir resistant triple mutant and its mechanism of action. Bioorg. Med. Chem. Lett. 2013.25, 503-506.].
Известно также, что фосфорамидатные конъюгаты клевудина (EIDD-02173) сохранили высокую анти-ВГВ активность в моделях клеточных культур инфекции. Фосфорамидатный фрагмент успешно доставляет клевудин-5'-монофосфат в печень и одновременно значительно снижает воздействие на другие органы. Селективная направленная доставка в печень потенциально могла бы привести к побочному воздействию клевудина на организм человека. [G.R. Bluemling et al. Targeted Delivery of Clevudine-5'-Monophosphate to the Liver after Oral Administration of a Clevudine-5'-phosphoramidate Conjugate to Rats for the Treatment of HBV Infections. Global Antiviral Journal 2015, 11, Suppl. 3: HEP DART 2015: Abstr. 104, Р. 97].
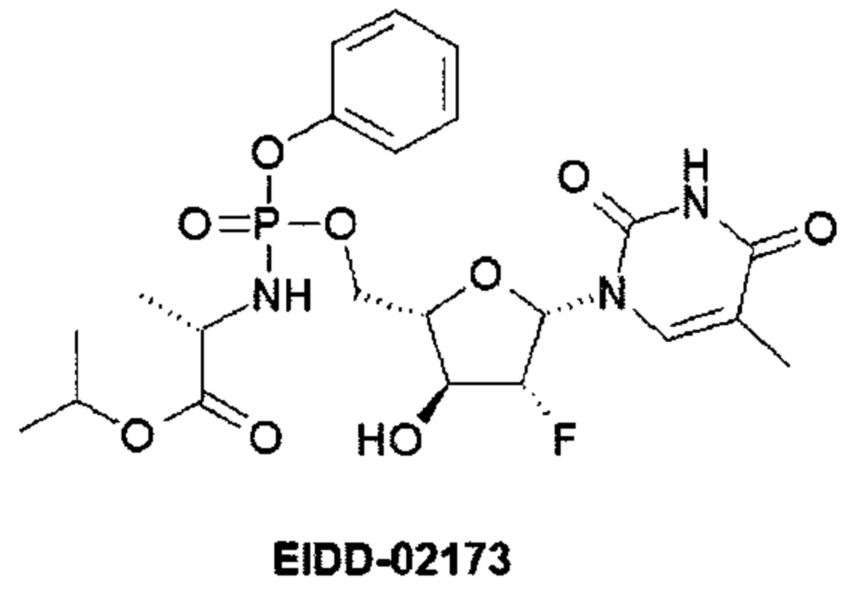
Гемцитабин-5'-фосфорамидат (NUC-1031) [M. Slusarczyk et al. Application of ProTide Technology to Gemcitabine: A Successful Approach to Overcome the Key Cancer Resistance Mechanisms Leads to a New Agent (NUC-1031) in Clinical Development. J. Med. Chem. 2014, 57, 1531-1542] показал высокую противораковую активность. В частности, NUC-1031 значительно снижает объем опухоли in vivo в ксенографтных моделях рака поджелудочной железы человека. Важно отметить, что активация NUC-1031 гораздо меньше зависит от нуклеозидных транспортеров и дезоксицитидина, чем гемцитабин. Кроме того, NUC-1031, в отличие от гемцитабина, устойчив к цитидиндезаминазной деградации.

Следует отметить, что структура фосфорамидатного фрагмента оказывает существенное влияние на стабильность фосфорамидатных нуклеозидов в различных средах, на их фармакокинетику, биодоступность, распределение в органах тела и избирательность действия [М.J. Sofia et al. 2010. P. Wang et al. Phosphoramidate prodrugs of (-)-β-D-(2R,4R)-dioxolane-thymine (DOT) as potent anti-HIV agents. Antiviral Chem. Chemotherapy 2012, 22, 217-238. L. Bondada et al. Adenosine Dioxolane Nucleoside Phosphoramidates as Antiviral Agents for Human Immunodeficiency and Hepatitis В Viruses. ACS Med. Chem. Lett. 2013, 4, 747-751. M. Slusarczyk et al. Application of ProTide Technology to Gemcitabine: A Successful Approach to Overcome the Key Cancer Resistance Mechanisms Leads to a New Agent (NUC-1031) in Clinical Development. J. Med. Chem. 2014, 57, 1531-1542.].
На сегодняшний день синтез новых фосфорамидатных нуклеозидных пролекарств и их применение в качестве химиотерапевтических средств для лечения вирусных и раковых заболеваний являются весьма актуальными проблемами.
Важно также отметить, что до настоящего времени нуклеозид-содержащие макрогетероциклические фосфорамидаты и их применение для лечения вирусных и раковых болезней не были известны.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым макрогетероциклическим нуклеозидным производным и их аналогам, представленным соединениями общей формулы 1, общей формулы 2, их стереоизомеру, изотопно-обогащенному аналогу, фармацевтически приемлемой соли, гидрату, сольвату и кристаллической или полиморфной форме, которые предназначены для лечения вирусных и раковых заболеваний у млекопитающих.

где:
Ar представляет собой арил или гетарил;
R1 и R2 необязательно являются одинаковыми заместителями, выбранными из Н, F, Cl, СН3, ОН;
R3 представляет собой Н или СН3;
X представляет собой кислород или этандиил-1, 1 (С=СН2);
Y представляет собой CH(R4)(CH2)k, CH(R4)(CH2)mC(O)O(CH2)n;
R4 представляет собой Н или СН3;
k имеет значение от нуля до шести;
m имеет значение от нуля до двух;
n имеет значение от единицы до четырех;
Q представляет собой радикал, выбранный из Q1-Q4;

где: R5 представляет собой заместитель, выбранный из Н, F, Cl, СН3, ОН;
стрелка (→) обозначает место присоединения Q1-Q4.
ОПРЕДЕЛЕНИЯ
Ниже приведены определения различных терминов, использованных в описании данного изобретения. Эти определения относятся к терминам, используемым по всему тексту описания и формулы настоящего изобретения, кроме особо оговоренных случаев, как по отдельности, так и в составе большей группы.
Термин «арил», используемый здесь, если не оговорено иначе, относится к замещенному или незамещенному фенилу (Ph), бифенилу или нафтилу; предпочтительно термин «арил» относится к замещенному или незамещенному фенилу. Арильная группа может быть замещена одним или несколькими фрагментами, выбранными из гидроксила, F, Cl, Br, I, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфокислоты, сульфата, фосфоновой кислоты, фосфата и фосфоната, при необходимости защищенными или нет, известные специалистам в данной области, например, ими могут быть описанные в книге Грин Т.В. и Ватса П.Г.М. «Защитные группы в органических синтезах» (Т.W. Greene и P.G.М. Wuts, "Protective Groups in Organic Synthesis," 3rd ed., John Wiley & Sons, 1999).
Термин «гетероарил», используемый здесь, относится к моно- или полициклическому ароматическому радикалу, у которого один или несколько атомов кольца выбираются из S, О и N, а остальные атомы кольца - углеродные. Гетероарил включает среди прочего пиридинил, пиразинил, пиримидинил, хинолинил, изохинолинил, бензимидазолил, бензооксазолил или хиноксалинил.
Термин «алкил», используемый здесь, относится к насыщенным, линейным или разветвленным углеводородным радикалам, содержащим от одного до шести атомов углерода. Примеры C1-С6 алкильных радикалов включают среди прочего метил, этил, пропил, изопропил, н-бутил и трет-бутил.
«Низший алкил» означает неразветвленную или разветвленную цепь, содержащую 1-4 атомов углерода.
Термин «алкокси» означает -О-алкильную группу или -О-циклоалкильную группу, где алкил и циклоалкил соответствуют вышеприведенному определению. Примеры -О-алкильных групп включают среди прочего метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, трет-бутилокси. Термин «низший алкокси», используемый здесь, означает алкокси-группу с «низшей алкильной» группой, определенной выше. «С1-10 алкокси» означает:
-О-алкил, где алкил представляет собой С1-10. Примеры -О-циклоалкильных групп включают среди прочего
-О-циклопропил, -О-циклобутил, -О-циклопентил и -О-циклогексил.
Термин «циклоалкил», используемый здесь, относится к карбоциклической кольцевой системе, содержащей от 3 до шести атомов углерода. Примеры С3-С6 циклоалкильных радикалов включают среди прочего циклопропил, циклобутил, циклопентил, циклогексил.
Термин «необязательно замещенный» означает, что указанная группа может быть замещена в одном или нескольких положениях любым одним радикалом или любой комбинацией радикалов.
Термин «N- и О-защитная группа» или «защитная группа» относится к группам, способным защитить амино- или гидроксильную группу от нежелательных реакций. Общераспространенные защитные группы описаны в книге Грин и Вуттса «Защитные группы в химическом синтезе» (Greene and Wuts, Protecting groups in chemical synthesis (3rd ed., John Wiley & Sons, NY (1999)). Неограничивающие примеры N-защитных групп включают ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, бензоил, 4-хлорбензоил, 4-бромбензоил или 4-нитробензоил; сульфонильные группы, такие как бензолсульфонил или п-толуолсульфонил; сульфенильные группы, такие как фенилсульфенил (фенил-S-) или трифенилметилсульфенил (тритил-S-); сульфинильные группы, такие как п-метилфенилсульфинил (п-метилфенил-S(O)-) или трет-бутилсульфинил (t-Bu-S(O)-); карбамат-образующие группы, такие как бензилоксикарбонил, р-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтоксикарбонил, диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлор-этокси-карбонил, феноксикарбонил, 4-нитро-феноксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил или фенилтиокарбонил; алкильные группы, такие как бензил, п-метоксибензил, фенилметил, или бензилоксиметил; п-метоксифенил; и силильные группы, такие как триметилсилил. Предпочтительные N-зашитные группы включают формил, ацетил, бензоил, пивалоил, трет-бутилацетил, фенилсульфонил, бензил, трет-бутилоксикарбонил (Boc) и бензилоксикарбонил (Cbz).
Термин «активный компонент» (действующее вещество) означает физиологически активное соединение синтетического или иного (биотехнологического, растительного, животного, бактерицидного и т.д.) происхождения, которое проявляет фармакологическую активность и является активным ингредиентом фармацевтической композиции, используемой в производстве.
«Лекарственное средство» означает соединение (или смесь соединений в виде фармацевтической композиции) и лекарственный препарат в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенных для восстановления, улучшения или изменения физиологических функций у людей и животных, а также для лечения и профилактики заболеваний, для диагностики, анестезии, контрацепции, в косметологии и т.д.
«Терапевтический коктейль» означает одновременно вводимую комбинацию из двух и более лекарственных средств, проявляющих различный механизм фармакологического действия и направленных на различные биомишени, принимающие участие в патологическом процессе.
«Фармацевтическая композиция» означает композицию, включающую соединение общей формулы 2 и как минимум один компонент, который выбирается из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных средств, распределителей и вспомогательных веществ, средств доставки, таких как консерванты, стабилизаторы, наполнители, разрыхлители, увлажнители, эмульгаторы, суспендирующие средства, загустители, подсластители, корригенты вкуса, ароматизаторы, антибактериальные средства, фунгициды, смазывающие вещества и регуляторы пролонгированной доставки, выбор и соответствующие пропорции которых зависят от характера и способа введения и дозировки. Примерами подходящих суспендирующих веществ являются этоксилированный изостеариловый спирт, полиоксиэтен, сорбитол и сорбитоловый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также их смеси.
Защита от микроорганизмов может быть обеспечена различными антибактериальными и противогрибковыми средствами, такими как, например, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может также содержать изотонические агенты, такие как, например, сахар, хлорид натрия, и подобные им соединения. Пролонгированный эффект композиции достигается с помощью агентов, замедляющих абсорбцию действующего вещества, например, моностеарат алюминия или желатин. Примеры подходящих носителей, растворителей, разбавителей и средств доставки: вода, этанол, полиспирты и их смеси, натуральные масла (такие как оливковое масло) и органические сложные эфиры (такие как этилолеат). Примеры наполнителей: лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция, и т.п. Примеры разрыхлителей и распределителей: крахмал, альгиновая кислота и ее соли, а также силикаты.
Примеры подходящих лубрикантов: стеарат магния, лаурилсульфат натрия, тальк и высокомолекулярный полиэтиленгликоль. Фармацевтическую композицию для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного и местного или ректального способов введения действующего вещества, как одну, так и в комбинации с другим активным соединением, можно вводить людям и животным в стандартной лекарственной форме или в смеси с традиционными фармацевтическими носителями. Подходящие стандартные лекарственные формы включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы и суспензии; сублингвальная и трансбуккальная лекарственные формы; аэрозоли; импланты; локальная, трансдермальная, подкожная, внутримышечная, внутривенная, интраназальная и интраокулярная формы, а также ректальные лекарственные формы.
Соединения или соли по настоящему изобретению могут также применяться в виде пролекарств.
Соединения по настоящему изобретению могут содержать несимметрично замещенные атомы углерода и фосфора, известные как хиральные центры. Эти соединения могут существовать, в частности, в виде отдельных стереоизомеров или рацемических смесей. Соединения, названные здесь отдельными стереоизомерами, означают соединения, практически не содержащие других стереоизомеров (например, практически не содержащие других энантиомеров или диастереомеров). «Практически не содержащий» означает, что указанный стереоизомер составляет минимум 80% соединения в композиции; предпочтительно, чтобы указанный стереоизомер составлял минимум 90% соединения в композиции; и еще более предпочтительно, чтобы указанный стереоизомер составлял минимум 95%, 96%, 97%, 98% или 99% соединения в композиции. Если в химической структуре соединения не указана стереохимия хирального углерода, то считается, что данная химическая структура включает в себя соединения, содержащие любой из стереомеров хирального центра. Индивидуальные стереоизомеры соединений по настоящему изобретению могут быть получены разнообразными способами, известными в данной области техники. Эти способы включают среди прочего стереоспецифический синтез, хроматографическое разделение диастереомеров, хроматографическое разделение энантиомеров, превращение энантиомеров из энантиомерной смеси в диастереомеры с последующим хроматографическим разделением диастереомеров и регенерацией индивидуальных энантиомеров и ферментативное разделение.
При стереоспецифическом синтезе обычно применяют соответствующие оптически чистые (энантиомерно чистые) или существенно оптически чистые материалы и реакции синтеза, которые не вызывают рацемизацию или инверсию стереохимии при хиральных центрах. Смеси стереоизомеров соединений, включая рацемические смеси, полученные в результате реакции синтеза, могут быть разделены, например, хроматографическим и способами, которыми владеют обычные специалисты в данной области техники. Хроматографическое разделение энантиомеров можно осуществлять с помощью смол, применяемых в хиральной хроматографии, многие из которых доступны коммерчески. В неограничивающем примере рацемат помещают в раствор и загружают на колонку, содержащую хиральную неподвижную фазу. Затем энантиомеры можно разделить методом ВЭЖХ. Разделение энантиомеров можно оптимизировать путем преобразования энантиомеров, входящих в состав смеси, в диастереомеры взаимодействием с хиральными вспомогательными реагентами. Полученные диастереомеры можно разделить хроматографированием на колонке или путем кристаллизации/пере кристаллизации. Этот способ целесообразно применять, когда разделяемые соединения содержат карбоксильную группу, аминогруппу или гидроксильную группу, которая образует соль или ковалентную связь с хиральным вспомогательным реагентом. Неограничивающие примеры подходящих хиральных вспомогательных реагентов включают хирально чистые аминокислоты, органические карбоновые кислоты или органосульфоновые кислоты. После разделения диастереомеров хроматографическими методами можно производить регенерацию индивидуальных энантиомеров. Часто хиральный вспомогательный реагент подлежит восстановлению и повторному использованию.
При разделении производных энантиомеров в энантиомерной смеси полезную роль могут сыграть ферменты, например, эстеразы, фосфатазы или липазы. Например, сложноэфирное производное карбоксильной группы в разделяемых соединениях можно обработать ферментом, который селективно гидролизует только один из энантиомеров в смеси. Полученную энантиомерно чистую кислоту можно затем отделить от негидролизованного сложного эфира.
В альтернативном варианте соли энантиомеров в смеси получают любым подходящим способом, известным в данной области техники, включая обработку карбоновой кислоты соответствующим оптически чистым основанием, таким как алкалоиды или фенилэтиламин, с последующим осаждением или кристаллизацией/перекристаллизацией энантиомерно чистых солей. Способы, подходящие для расщепления/разделения смеси стереоизомеров, включая рацемические смеси, описаны в книге «Энантиомеры, рацематы и расщепления» (Enantiomers, Racemates, and Resolutions, Jacques et al., 1981, John Wiley and Sons, New York, NY).
Кроме того, если соединение существует в различных таутомерных формах, предполагается, что указанное соединение не ограничивается каким-либо одним конкретным таутомером, а охватывает все таутомерные формы. Соединения по данному изобретению могут существовать в различных стабильных конформационных формах, которые можно разделять. Торсионная асимметрия, обусловленная ограниченными вращениями вокруг асиметричной одинарной связи, например, вследствие стерического затруднения или напряжения кольца, может способствовать разделению различных конформеров. Данное изобретение распространяется на все конформационные изомеры указанных соединений и их смеси.
Соединения, представленные в настоящем изобретении, описываются в основном с помощью стандартной терминологии. Следует понимать, что настоящее изобретение охватывает все стереоизомеры описываемого соединения с асимметричным центром (асимметричными центрами) и их смеси, если не указано иначе. Неограничивающие примеры стереоизомеров включают энантиомеры, диастереомеры, и цис-транс-изомеры. Предполагается, что если описываемое соединение существует в различных таутомерных формах, то это соединение охватывает все таутомерные формы.
Число атомов углерода в углеводородном фрагменте указывается префиксом «Сх-Су», где х обозначает минимальное, а у - максимальное число атомов углерода во фрагменте. Так, например, «C1-С6-алкил» относится к алкильному заместителю, содержащему от 1 до 6 атомов углерода. Если в качестве связующего элемента в описываемой структуре выступает химическая связь, то элемент слева от связующего элемента присоединяется непосредственно к элементу справа от связующего элемента, образуя ковалентную связь. Если два или несколько смежных связующих элементов в описываемой структуре представляют собой химические связи, то элемент слева от этих связующих элементов присоединяется непосредственно к элементу справа от этих связующих элементов, образуя ковалентную связь.
При описании фрагмента химической формулой дефисами (одним или несколькими), обозначают часть фрагмента, имеющую свободную валентность (одну или более). Если фрагмент называется «необязательно замещенным», то этот фрагмент может быть либо замещенным, либо незамещенным. Если фрагмент называется необязательно замещенным неводородными радикалами в указанном максимальном количестве, то такой фрагмент может быть либо незамещенным, либо замещенным неводородными радикалами в указанном максимальном количестве или в количестве, соответствующем максимальному числу замещаемых позиций на фрагменте, в зависимости от того, что меньше. Так, например, если фрагмент описывается как гетероцикл, необязательно замещенный тремя, но не более, неводородными радикалами, то любой гетероцикл, имеющий менее трех замещаемых позиций, будет необязательно замещенным неводородными радикалами в количестве, соответствующем числу замещаемых позиций в данном гетероцикле.
Термин «фармацевтически приемлемый» используется как прилагательное, означающее, что определяемый им объект пригоден для применения в качестве фармацевтического продукта или в составе фармацевтического продукта.
Термин «терапевтически эффективное количество» относится к общему количеству каждого действующего вещества, достаточного для принесения пациенту значимой пользы, например, снижение вирусной нагрузки.
Термин «пролекарство» относится к производным соединений по данному изобретению, которые содержат химически или метаболически отщепляемые группы и превращаются в результате реакции сольволиза или изменения физиологических условий в соединения по данному изобретению, которые проявляют фармацевтическую активность in vivo. Пролекарство соединения можно создать традиционным способом путем реакции функциональной группы соединения (такой как аминогруппа, гидроксигруппа или карбоксигруппа). Пролекарства часто имеют преимущества с точки зрения растворимости, тканевой совместимости или отсроченного высвобождения у млекопитающих (см. Bungard, Н., Design of products, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают кислотные производные, хорошо известные практикующим специалистам в данной области техники, такие как, например, сложные эфиры, полученные взаимодействием исходного кислотного соединения с подходящим спиртом, или амиды, полученные взаимодействием исходного кислотного соединения с подходящим амином. Примеры пролекарств включают среди прочего ацетат, формиат, бензоат и другие ацилированные производные спиртовых или аминных функциональных групп в соединениях по данному изобретению.
Термин «сольват» относится к физической ассоциации соединения по настоящему изобретению с одной или более молекулами органического или неорганического растворителя. Такая физическая ассоциация часто связана с образованием водородных связей. В определенных случаях сольват можно выделить, например, когда кристаллическая решетка кристаллического твердого тела содержит одну или несколько молекул растворителя. Термин «сольват» включает в себя как сольваты в жидкой фазе, так и выделяемые сольваты. Примеры сольватов включают среди прочего гидраты, этанолаты и метанолаты.
Настоящее изобретение далее будет описано в связи с определенными вариантами осуществления, но не ограничивается ими. Напротив, настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем формулы изобретения. Таким образом, следующие примеры, которые включают в себя 10 конкретных вариантов осуществления, иллюстрируют одно практическое применение настоящего изобретения, при этом понимается, что данные примеры предназначены для целей иллюстрации некоторых вариантов осуществления изобретения и, по мнению авторов, представляют собой наиболее целесообразное и доступное для понимания описание его методик и концептуальных аспектов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Одним из примеров реализации настоящего изобретения является новое макрогетероциклическое нуклеозидное производное и его аналоги общей формулы 1 или общей формулы 2, их стереоизомер, изотопно-обогащенный аналог, фармацевтически приемлемая соль, гидрат, сольват и кристаллическая или полиморфная форма,

где:
Ar представляет собой арил или гетарил;
R1 и R2 являются необязательно идентичными заместителями, выбранными из Н, F, Cl, СН3, ОН;
R3 представляет собой Н или СН3;
X представляет собой кислород или этандиил-1, 1 (С=СН2);
Y представляет собой CH(R4)(CH2)k, CH(R4)(CH2)mC(O)O(CH2)n;
R4 представляет собой Н или СН3;
k имеет значение от нуля до шести;
m имеет значение от нуля до двух;
n имеет значение от единицы до четырех;
Q представляет собой радикал, выбранный из Q1-Q4;

где: R5 является заместителем, выбранным из Н, F, Cl, СН3, ОН;
стрелка (→) обозначает место присоединения Q1-Q4.
Более предпочтительными макрогетероциклическими нуклеозидными производными и их аналогами являются (2R,3aS,6S,9S,13aR)-2-(2,4-диохо-3,4-дигидро-2H-пиримидин-1-ил)-6,9-диметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(1/2)), (2R,3aS,6S,9S,11S,13aR)-2-(2,4-диохо-3,4-дигидро-2Н-пиримидин-1-ил)-6,9-диметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(1)), (2R,3aS,6S,9S,11R,13aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-6,9-диметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(2)), (2R,3R,3aR,6S,9S,13aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,6,9-триметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(3/4)), (2R,3R,3aR,6S,9S,11S,13aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,6,9-триметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(3)), (2R,3R,3aR,6S,9S,11R,13aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,6,9-триметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(4)), (2R,3R,3aR,10S,14aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,10-диметил-12-оксо-12-фенокси-октагидро-1,4,8,13-тетраокса-11-аза-12-фосфа-циклопентациклотридецен-5,9-дион (1(5/6)), (2R,3R,3aR,10S,12S,14aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,10-диметил-12-оксо-12-фенокси-октагидро-1,4,8,13-тетраокса-11-аза-12-фосфа-циклопентациклотридецен-5,9-дион (1(5)), (2R,3R,3aR,10S,12R,14aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,10-диметил-12-оксо-12-фенокси-октагидро-1,4,8,13-тетраокса-11-аза-12-фосфа-циклопентациклотридецен-5,9-дион (1(6)), (2S,3aS,11S,15aR)-2-(2-амино-6-оксо-1,6-дигидро-пурин-9-ил)-11-метил-1-метилен-13-оксо-13-фенокси-декагидро-4,9,14-триокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(7/8)), (2S,3aS,11S,13S,15aR)-2-(2-амино-6-оксо-1,6-дигидро-пурин-9-ил)-11-метил-1-метилен-13-оксо-13-фенокси-декагидро-4,9,14-триокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(7)), (2S,3S,3aS,11S,13R,15aR)-2-(6-амино-пурин-9-ил)-3,11-диметил-1-метилен-13-оксо-13-фенокси-декагидро-4,9,14-триокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(8)), (2R,3aS,11S,15aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(9/10)), (2R,3aS,11S,13S,15aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(9)), (2S,3aR,11S,13R,15aS)-11-метил-2-(5-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(10)), (2R,3aS,11S,15aR)-2-(2,4-диоксо-5-трифторметил-3,4-дигидро-2Н-пиримидин-1-ил)-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(11/12)), (2R,3aS,11S,13S,15aR)-2-(2,4-диоксо-5-трифторметил-3,4-дигидро-2H-пиримидин-1-ил)-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(11)), (2S,3R,3aS,11S,13R,15aS)-3-фтор-11-метил-2-(5-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(12)), (2R,3R,3aR,11S,5aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,11-диметил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(13/14)), 2R,3R,3aR,11S,13S,15aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,11-диметил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(13)), (2R,3R,3aR,11S,13R,15aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,11-диметил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(14)), (2R,3aR,11S,15aR)-2-(4-амино-2-оксо-2H-пиримидин-1-ил)-3,3-дифтор-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(15/16)), (2R,3aR,11S,13S,15aR)-2-(4-амино-2-оксо-2Н-пиримидин-1-ил)-3,3-дифтор-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(15)), (2R,3aR,11S,13R,15aR)-2-(4-амино-2-оксо-2H-пиримидин-1-ил)-3,3-дифтор-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(16)), (2R,3R,3aR,12S,16aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,12-диметил-14-оксо-14-фенокси-декагидро-1,4,10,15-тетраокса-13-аза-14-фосфа-циклопентациклопентадецен-5,11-дион (1(17/18)), (2R,3R,3aR,12S,14S,16aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,12-диметил-14-оксо-14-фенокси-декагидро-1,4,10,15-тетраокса-13-аза-14-фосфа-циклопентациклопентадецен-5,11-дион (1(17)), (2R,3R,3aR,12S,14R,16aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3фтор-3,12-диметил-14-оксо-14-фенокси-декагидро-1,4,10,15-тетраокса-13-аза-14-фосфа-циклопентациклопентадецен-5,11-дион (1(18)), (2R,3R,3aR,13S,15S,17aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,13-диметил-15-оксо-15-фенокси-декагидро-1,4,11,16-тетраокса-14-аза-15-фосфа-циклопентациклогексадецен-5,12-дион (1(19/20)), (2R,3R,3aR,13S,15S,17aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,13-диметил-15-оксо-15-фенокси-декагидро-1,4,11,16-тетраокса-14-аза-15-фосфа-циклопентациклогексадецен-5,12-дион (1(19)), (2R,3R,3aR,13S,15R,17aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,13-диметил-15-оксо-15-фенокси-декагидро-1,4,11,16-тетраокса-14-аза-15-фосфа-циклопентациклогексадецен-5,12-дион (1(20)), (2R,3R,3aR,14S,16S,18aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,14-диметил-16-оксо-16-фенокси-додекагидро-1,4,12,17-тетраокса-15-аза-16-фосфа-циклопентациклогептадецен-5,13-дион (1(21/22)), (2R,3R,3aR,14S,16S,18aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,14-диметил-16-оксо-16-фенокси-додекагидро-1,4,12,17-тетраокса-15-аза-16-фосфа-циклопентациклогептадецен-5,13-дион (1(21)), (2R,3R,3aR,14S,16R,18aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,14-диметил-16-оксо-16-фенокси-додекагидро-1,4,12,17-тетраокса-15-аза-16-фосфа-циклопентациклогептадецен-5,13-дион (1(22)), (2R,3R,3aR,15S,17S,19aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,15-диметил-17-оксо-17-фенокси-додекагидро-1,4,13,18-тетраокса-16-аза-17-фосфа-циклопентациклооктадецен-5,14-дион (1(23/24)), (2R,3R,3aR,15S,17S,19aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,15-диметил-17-оксо-17-фенокси-додекагидро-1,4,13,18-тетраокса-16-аза-17-фосфа-циклопентациклооктадецен-5,14-дион (1(23)), (2R,3R,3aR,15S,17R,19aR)-2-(2,4-диосо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,15-диметил-17-оксо-17-фенокси-додекагидро-1,4,13,18-тетраокса-16-аза-17-фосфа-циклопентациклооктадецен-5,14-дион (1(24)), (2R,3R,3aR,12S,15S,17S,19aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,12,15-триметил-17-оксо-17-фенокси-декагидро-1,4,9,13,18-пентаокса-16-аза-17-фосфа-циклопентациклооктадецен-5,10,14-трион (1(25/26)), (2R,3R,3aR,12S,15S,17S,19aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,12,15-триметил-17-оксо-17-фенокси-декагидро-1,4,9,13,18-пентаокса-16-аза-17-фосфа-циклопентациклооктадецен-5,10,14-трион (1(25)), (2R,3R,3aR,15S,17R,19aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,15-диметил-17-оксо-17-фенокси-декагидро-1,4,8,13,18-пентаокса-16-аза-17-фосфа-циклопентациклооктадецен-5,9,14-трион (1(26)), (2R,3R,3aR,9S,11S,13aR,15R,16R,16aR,22S,24S,26aR)-2,15-бис(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3,16-дифтор-3,9,16,22-тетраметил-11,24-дифеноксидодекагидро-2Н,13Н-дифторо[3,2-j:3',2'-v][1,6,9,13,18,21,3,15,2,14]гексаоксадиазадифосфациклотетракозин-5,8,18,21(6Н,9Н,19Н,22Н)-тетрон 11,24-диоксид (1(27)), (2R,3R,3aR,11S,13S,15aR,17R,18R,18aR,26S,28S,30aR)-2,17-бис(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3,18-дифтор-3,11,18,26-тетраметил-13,28-дифеноксигексадекагидро-2Н,15Н-дифторо[3,2-l:3',2'-z][1,6,11,15,20,25,3,17,2,16]гексаоксадиазадифосфациклооктакозин-5,10,20,25(6Н,11Н,21Н,26Н)-тетрон 13,28-диоксид (1(28)), или их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы.






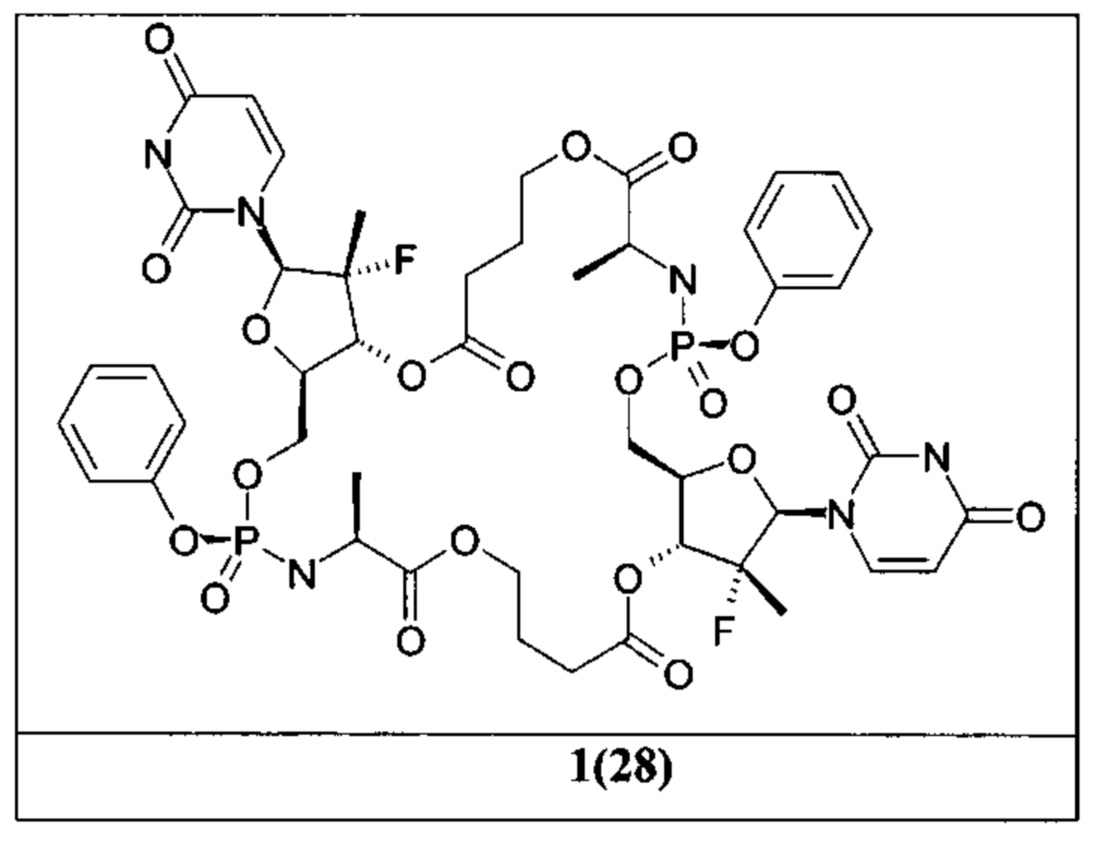
Новые макрогетероциклические нуклеозидные производные и их аналоги общей формулы 1 или общей формулы 2, несомненно, представляют интерес, в частности, как потенциальные лекарственные препараты для лечения гепатита С. Например, макрогетероцикл 1(13) более устойчив (Т1/2>24 ч) в искусственном желудочном соке (SFG) и фракции S9 печени человека (Т1/2>12,4 ч) по сравнению с Совальди®, у которого Т1/2=15 ч в SGF и Т1/2>1,8 ч во фракции S9 печени человека.
Макрогетероцикл 1(13) также обеспечивает более высокое значение Cmax=341 нг/мл метаболита PSI-352707 [Е. Murakami et al. Mechanism of activation of PSI-7851 and its diastereoisomer PSI-7977. J. Biol. Chem. 2010, 285 (45), 34337-34347] в плазме крыс (крысы линии Спрег-Доули, 10 мг/кг перорально), чем препарат Совальди® в тех же условиях, у которого Cmax=154 нг/мл метаболита PSI-352707 при одинаковом времени (1 ч) достижения сопоставимого значения Cmax и имеет значения Т1\2=1,80 ч и Т1/2=1,75 ч соответственно для макрогетероцикла 1(13) и Sovaldi®. В печени крыс величина Cmax у PSI-352707 сопоставима со значениями макрогетероцикла 1(13) и Совальди®: соответственно, Cmax=1578 нг/мл и Cmax=1702 нг/мл. При этом, макрогетероцикл 1(13) имеет более приемлемое значение Tmax=0,25 ч и Т1/2=1,9 ч по сравнению с Совальди®, у которого Tmax=0,50 ч и Т1/2=1,3 ч.
Дозировка, введение и применение
Предметом настоящего изобретения является фармацевтическая композиция, содержащая одно или несколько макрогетероциклических нуклеозидных производных общей формулы 1 или общей формулы 2, а также их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты, и кристаллические или полиморфные формы, необязательно в комбинации с фармацевтически приемлемым вспомогательным веществом, носителем, добавкой, разбавителем и соответствующей средой для лечения вирусных инфекций и/или опухолевых заболеваний у млекопитающих.
Соединения общей формулы 1 или 2 могут быть приготовлены в виде самых разнообразных перорально вводимых лекарственных форм и носителей, пероральное введение может быть в форме таблеток, таблеток с покрытием, твердых и мягких желатиновых капсул, растворов, эмульсий, сиропов или суспензий. Наряду с другими путями введения, соединения по настоящему изобретению эффективны при введении в виде суппозитория. Наиболее удобным способом введения обычно является пероральный с использованием подходящей суточной схемы приема лекарственных доз, которую можно регулировать в зависимости от тяжести заболевания и реакции пациента на противовирусное и противоопухолевое лекарство.
Макрогетероциклические нуклеозидные производные общей формулы 1 или общей формулы 2, их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы вместе с одним или несколькими обычными вспомогательными веществами, носителями или разбавителями могут быть представлены в виде фармацевтических композиций и единичных лекарственных форм. Фармацевтические композиции и единичные лекарственные формы могут состоять из обычных ингредиентов в обычных пропорциях, как с дополнительными активными соединениями, так и без них, а единичные лекарственные формы могут содержать любое соответствующее эффективное количество активного ингредиента, соразмерное с предполагаемым суточным диапазоном доз. Фармацевтические композиции могут быть использованы в виде твердых веществ, таких как таблетки или заполненные капсулы, в виде мягких лекарственных форм, порошков, препаратов с замедленным высвобождением или жидкостей, таких как суспензии, эмульсии или заполненные капсулы для перорального применения; или в форме суппозиториев для ректального или вагинального введения. Типичный препарат будет содержать примерно от 5 до 95 весовых процентов активного соединения или соединений. Термин «препарат» или «лекарственная форма» включает в себя как твердые, так и жидкие лекарственные формы активного соединения, и специалисту в данной области техники будет понятно, что активный ингредиент может существовать в различных препаратах в зависимости от требуемой дозы и фармакокинетических параметров.
Термин «вспомогательное вещество», используемый в данном описании, относится к соединению, которое используют для получения фармацевтической композиции, и которое, как правило, является безопасным, нетоксичным, ни биологически, ни иным образом нежелательным, и включает в себя вспомогательные вещества, приемлемые для применения в ветеринарии, а также фармакологически приемлемые для человека. Соединения по данному изобретению могут вводиться отдельно, но обычно их вводят в смеси с одним или несколькими фармацевтически приемлемыми вспомогательными веществами, разбавителями или носителями, выбранными с учетом предполагаемого пути введения и стандартной фармацевтической практики.
Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые могут также действовать как разбавители, корригенты вкуса, солюбилизаторы, смазывающие вещества, суспендирующие агенты, связывающие вещества, консерванты, дезинтегрирующие таблетки агенты или инкапсулирующий материал. В порошках носитель обычно представляет собой тонкоизмельченное твердое вещество, которое представляет собой смесь с тонко измельченным активным компонентом. В таблетках активный компонент обычно смешивают с носителем, имеющим необходимую связывающую способность, в подходящих пропорциях и спрессовывают в форму желаемого размера. Подходящие носители включают, но не ограничиваются ими, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, натрийкарбоксиметилцеллюлозу, легкоплавкий воск, масло какао и тому подобное. Препараты в твердой форме могут содержать в дополнение к активному компоненту красители, ароматизаторы, стабилизаторы, буферы, искусственные и природные подсластители, диспергаторы, загустители, солюбилизирующие агенты и тому подобное.
Жидкие лекарственные формы также пригодны для перорального введения. Жидкие лекарственные формы представляют собой эмульсии, сиропы, эликсиры и водные суспензии. Они включают твердые формы препаратов, которые предназначены для превращения в жидкие препараты непосредственно перед использованием. Эмульсии могут быть приготовлены в растворах, например, в водных растворах пропиленгликоля или могут содержать эмульгаторы, такие как лецитин, моноолеат сорбита или гуммиарабик. Водные суспензии могут быть приготовлены диспергированием тонкоизмельченного активного компонента в воде с вязкими материалами, такими как природные или синтетические камеди, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другими хорошо известными суспендирующими агентами.
Макрогетероциклическое нуклеозидное производное общей формулы 1 или общей формулы 2, его стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы могут быть приготовлены для введения в виде суппозиториев. Низкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, сначала расплавляют и активный компонент гомогенно диспергируют, например, перемешиванием. Расплавленную гомогенную смесь затем выливают в формы удобного размера, дают остыть и затвердеть.
Макрогетероциклическое нуклеозидное производное общей формулы 1 или общей формулы 2, его стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы могут быть приготовлены для вагинального введения. Уместно применение пессариев, тампонов, кремов, гелей, паст, пен или спреев, содержащих помимо активного ингредиента известные в данной области техники носители.
Предметом настоящего изобретения является использование макрогетероциклического нуклеозидного производного общей формулы 1 или общей формулы 2, его стереоизомеров, изотопно-обогащенных аналогов, фармацевтически приемлемых солей, гидратов, сольватов и кристаллических или полиморфных форм в производстве лекарственного средства для лечения вирусных и раковых заболеваний. Предполагается, что описываемое здесь макрогетероциклическое нуклеозидное производное, представленное формулой 1 или общей формулой 2 и используемое в производстве лекарственного средства для лечения любого противовирусного и противоракового заболевания, может представлять собой любое из соединений формул 1(1)-1(26), 2(1) и 2(2), а также их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы, по отдельности или в сочетании с другим соединением по настоящему изобретению. Лекарственное средство включает среди прочего любое из соединений, предусматриваемых по настоящему изобретению.
Термин «лекарственное средство» означает вещество, применяемое для лечения и/или профилактики субъекта, нуждающегося в этом, причем вещество включает среди прочего лекарственную композицию, препарат, лекарственную форму и т.п., содержащие фосфорамидатный макрогетероцикл формулы 1 или общей формулы 2.
Предметом настоящего изобретения является метод лечения и/или профилактики субъекта, нуждающегося в этом, причем указанный метод включает введение субъекту терапевтически эффективного количества макрогетероциклического нуклеозидного производного, представленного формулой 1 или формулой 2, его стереоизомера, изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата и кристаллической или полиморфной формы.
Предметом настоящего изобретения также является метод лечения и/или профилактики субъекта, нуждающегося в этом, причем указанный метод включает введение субъекту терапевтически эффективного количества минимум двух или более различных макрогетероциклических нуклеозидных производных, соответствующих соединению, представленному формулой 1 или общей формулой 2, его стереоизомера, изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата и кристаллической или полиморфной формы.
Предметом настоящего изобретения также является метод лечения и/или профилактики субъекта, нуждающегося в этом, причем указанный метод включает одновременное или последовательное введение субъекту терапевтически эффективного количества минимум двух макрогетероциклических нуклеозидных производных, соответствующих соединению, представленному формулой 1 или общей формулой 2, его стереоизомера, изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата и кристаллической или полиморфной формы.
Термин «субъект» означает млекопитающее, которое среди прочего включает крупный рогатый скот, свиней, овец, куриц, индеек, буйволов, лам, страусов, собак, кошек и человека, предпочтительным субъектом является человек. Предполагается, что в методе лечения субъекта в шестом варианте осуществления изобретения может быть любое из соединений, предусмотренных в любом из аспектов первого, второго и третьего вариантов осуществления изобретения, или соединений, конкретно указанных в вышеприведенных таблицах, по отдельности или в комбинации с другим соединением по настоящему изобретению.
Термин «терапевтически эффективное количество», используемый здесь, означает количество, необходимое для уменьшения симптомов заболевания у индивидуума. В каждом конкретном случае доза регулируется в соответствии с индивидуальными потребностями. Эта доза может варьироваться в широких пределах в зависимости от многочисленных факторов, таких как тяжесть заболевания, подлежащего лечению, возраст и общее состояние здоровья пациента, других лекарственных средств, используемых для лечения пациента, путей и форм введения, а также предпочтений и опыта лечащего врача. Для перорального введения суточная доза составляет приблизительно от 0,1 до 10 г, включая все значения между ними, в монотерапии и/или в комбинированной терапии. Предпочтительная суточная доза составляет примерно от 0,1 до 7 г в день, более предпочтительная суточная доза составляет 0,2 и около 5,0 г. Как правило, для быстрого уменьшения или устранения вируса лечение начинают с большой начальной «нагрузочной дозы», которую затем снижают до уровня, достаточного для предотвращения всплеска инфекции. Обычный специалист в области лечения указанных здесь болезней сумеет, без неоправданного экспериментирования и, полагаясь на личные знания, опыт и описание настоящей патентной заявки, установить терапевтически эффективное количество соединений по настоящему изобретению для данной болезни и данного пациента.
Предметом настоящего изобретения является метод лечения и/или профилактики субъекта, нуждающегося в этом, причем указанный метод включает одновременное или последовательное введение субъекту терапевтически эффективного количества соединения, представленного формулой 1 или общей формулой 2, его стереоизомера, изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата и кристаллической или полиморфной формы и терапевтически эффективного количества другого противовирусного агента. Понимается, что временной интервал между последовательными приемами может варьироваться в пределах 1-24 часов, включая любой промежуточный поддиапазон.
Примеры «других противовирусных агентов» включают среди прочего: ингибиторы NS3-протеазы ВГС, ингибиторы NS4 ВГС (см. US 20140296136, US 8,987,195, US 7973040, US 2012214783); ингибиторы NS4 ВГС (см. ЕР 1497282); ингибиторы NS3/NS4 ВГС (ЕР 2364984); ингибиторы NS5A ВГС (Shingo Nakamoto et al. Hepatitis С virus NS5A inhibitors and drug resistance mutations. World J Gastroenterol. 2014 Mar 21; 20(11): 2902-2912 (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3961994/); A.V. Ivachtchenko et al. Discovery of Novel Highly Potent Hepatitis С Virus NS5A Inhibitor (AV4025). J. Med. Chem. 2014, 57, 7716-7730; Pat. Appl. US 14/845,333); агонисты толл-подобных рецепторов (см. WO 2015023958, WO 2012097012); и другие ингибиторы (см. WO 2014106019, WO 2014033176, WO 2014033170, WO 2014033167, WO 2013006394, US 20090163545).
Наиболее предпочтительной является фармацевтическая композиция, которая наряду с новым макрогетероциклическим нуклеозидным производным, представленным формулой 1 или общей формулой 2, его стереоизомером, изотопно-обогащенным аналогом, фармацевтически приемлемой солью, гидратом, сольватом и кристаллической или полиморфной формой содержит противовирусное или противораковое лекарство в терапевтически эффективных количествах.
Наиболее предпочтительной является фармацевтическая композиция, которая наряду с макрогетероциклическим нуклеозидным производным, представленным формулой 1 и общей формулой 2, его стереоизомером, изотопно-обогащенным аналогом, фармацевтически приемлемой солью, гидратом, сольватом и кристаллической или полиморфной формой содержит терапевтически эффективное количество ингибитора NS5A ВГС, выбранного из группы, состоящей из Даклатасвира (Daclatasvir, Daklinza, BMS790052) [Belema, М. et al. J. Med. Chem. 57, 1643-1672, 2014, WO 2008/021927, WO 2008/021928, WO-2008/021936. https://en.wikipedia.org/wiki/Daclatasvir;], Омбитасвира (Ombitasvir, ABT-267) [DeGoey, et al. J. Med. Chem. 57, 2047-2057, 2014, WO 2010/144646], GS-5885, Велпатасвира (Velpatasvir, GS-5816) [Everson G.T. et al. Sofosbuvir with Velpatasvir in Treatment-Naive Noncirrhotic Patients with Genotype 1 to 6 Hepatitis С Virus Infection: A Randomized Trial. Ann. Intern. Med. 2015, 163(11), 818-826. doi: 10.7326/M15-1000. Epub 2015 Nov 10. www.medkoo.com/products/9855], Одаласвира (Odalasvir, ACH-3102) [US 8,809,313. http://en.wikipedia.org/wiki/Odalasvir] и Элбасвира (Elbasvir, MK-8742) [Coburn, C. A. et al. ChemMedChem. 8, 1930-1940, 2013, WO 2012/040923, WO 2012/041014], Гепавивира (Hepavivir, AV-4025) [Ivachtchenko, A. V. et al. J. Med. Chem. 57, 7716-7730, 2014, WO 2012/074437, http://allachem.com/wp-content/uploads/2013/08/hcv-AV4025-082413.doc], AV-4067, AV-4084, AVI-4056 и AVI-4058 [Pat. Appl. US 15221613].


Предметом настоящего изобретения является метод лечения вирусных и раковых заболеваний у субъекта, нуждающегося в этом, причем указанный метод включает последовательное или одновременное введение субъекту терапевтически эффективного количества соединения, представленного общей формулой 1 или общей формулой 2, его стереоизомера, изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата и кристаллической или полиморфной формы и другого противовирусного или противоракового агента. Понимается, что временной интервал между последовательными приемами может варьироваться в пределах 1-24 часов, включая любой промежуточный поддиапазон.
Предметом настоящего изобретения является метод лечения и/или профилактики субъекта, нуждающегося в этом, причем указанный метод включает одновременное или последовательное введение субъекту терапевтически эффективного количества как минимум одного соединения, представленного общей формулой 1 или общей формулой 2, его стереоизомера, изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата и кристаллической или полиморфной формы и терапевтически эффективного количества другого противовирусного или противоракового агента. Понимается, что временной интервал между последовательными приемами может варьироваться в пределах 1-24 часов, включая любой промежуточный поддиапазон.
Предполагается, что другой противовирусный агент представляет собой среди прочего интерферон-альфа, интерферон-бета, пегилированный интерферон-альфа, рибавирин, левовирин, вирамидин, другой нуклеозидный ингибитор полимеразы ВГС, ненуклеозидный ингибитор полимеразы ВГС, ингибитор протеазы ВГС, ингибитор геликазы ВГС, ингибитор сплавления ВГС, ингибитор ДНК-полимеразы ВГВ и ингибитор обратной транскриптазы (RT) ВИЧ-1. Введение активного соединения или его производного или соли в комбинации с другим противовирусным или противораковым агентом приводит к повышению активности по сравнению с исходным соединением. При комбинированной терапии введение препаратов может быть одновременным или последовательным по отношению к соединению, представленному общей формулой 1 или общей формулой 2, его стереоизомеру, изотопно-обогащенному аналогу, фармацевтически приемлемой соли, гидрату, сольвату и кристаллической или полиморфной форме. Таким образом, используемое здесь понятие «одновременное введение» включает в себя введение агентов в одно и то же или в разное время. Одновременное введение двух или более агентов может осуществляться как с использованием одной препаративной формы, содержащей два или более активных ингредиентов, так и с использованием двух или более лекарственных форм с одним активным агентом.
Понимается, что приводимые в настоящем описании ссылки на лечение распространяются как на профилактику, так и на лечение существующих заболеваний. Кроме того, используемый здесь термин «лечение» вирусной инфекции включает также лечение или профилактику заболевания или состояния, связанного с опосредованной вирусной инфекцией или ее клиническими симптомами.
Процесс производства
Предметом настоящего изобретения является процесс производства макрогетероциклического нуклеозидного производного, представленного общей формулой 1 и общей формулой 2, путем циклизации кислоты общей формулы 3 (Схема 1) и, при необходимости, разделением последней на стереоизомеры.
Схема 1

где 1-3 и их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы; Ar, R1, R2, R3, R4, X, Y, и Q определены выше.
Кислоты общей формулы 3 получают (Схема 2) взаимодействием соответствующего хлорфосфориламинного производного общей формулы 8, его стереоизомера, изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата и кристаллической или полиморфной формы с соединением общей формулы 12, его стереоизомером, изотопно-обогащенным аналогом, фармацевтически приемлемой солью, гидратом, сольватом и кристаллической или полиморфной формой с последующим отщеплением бензила и Cbz-группы каталитическим гидрированием полученных бензиловых эфиров общей формулы 13, их стереоизомера, изотопно-обогащенного аналога, фармацевтически приемлемой соли, гидрата, сольвата и кристаллической или полиморфной формы и, при необходимости, разделением последних на стереоизомеры.
Схема 2


где 3-13 и их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы; Ar, R1, R2, R3, X, Y, и Q определены выше.
Макрогетероциклическое нуклеозидное производное, представленной общей формулой 1 или общей формулой 2, можно получить исходя из кислоты общей формулы 16, которую при необходимости разделяют на стереоизомеры. Кислоту общей формулы 16, ее стереоизомер, изотопно-обогащенный аналог, фармацевтически приемлемую соль, гидрат, сольват и кристаллическую или полиморфную форму можно получить исходя из нуклеозида общей формулы 14 (Схема 3).
Схема 3

где 14-16 и их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы; Ar, R1, R2, R3, X, Y, и Q определены выше.
Для получения (S) и (R) фосфорных энантиомеров макроциклов 1 и 2 (1(P(S)), 2(P(S)), 1(P(R)), 2(P(R))) используются подходящие (S) и (R) фосфорные энантиомеры соответствующих кислот общей формулы 19(P(S)) или 19(P(R)) (Схема 4).

Где 1(P(S-)), 2(P(S-)), 1(P(R-)), 2(P(R-)) и их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы; Ar, R1, R2, R3, X, Y, и Q определены выше.
Кислоты 19(P(S)), 19(P(R)) получают взаимодействием хлоридов 8 с пентафторфенолом (Схема 4). Полученные реакционные смеси фосфорных энантиомеров 17 разделяются на отдельные фосфорные энантиомеры 17(P(S)) и 17(P(R)) путем кристаллизации из подходящего растворителя или хроматографически. В результате реакции последних соединений с нуклеозидами 12 образуются соединения 18(P(S)), 18(P(R)), которые подвергаются каталитическому гидрированию с образованием кислот 19(P(S)), 19(P(R)).
Схема 4

где: 1(P(S-)), 2(P(S-)), 1(P(R-)), и 2(P(R-)), 8, 17, 17(P(S-)), 17(P(R)), 18(P(S-)), 18(P(R)), 19(P(S-)), 19(P(R)), и их стереоизомеры, изотопно-обогащенные аналоги, фармацевтически приемлемые соли, гидраты, сольваты и кристаллические или полиморфные формы; Ar, R1, R2, R3, X, Y, и Q определены выше.
Настоящее изобретение далее будет описано в связи с определенными вариантами осуществления, которые не предназначены для ограничения его объема. Напротив, настоящее изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем формулы изобретения. Так, следующие примеры, которые включают в себя конкретные варианты осуществления, иллюстрируют одно практическое применение настоящего изобретения, при этом понимается, что данные примеры предназначены для целей иллюстрации некоторых вариантов осуществления изобретения и, по мнению авторов, представляют собой наиболее целесообразное и доступное для понимания описание его методик и концептуальных аспектов.
ПРИМЕРЫ
Пример 1. Общая методика получения трет-бутоксикарбониламино)-пропаноатов 6 a-g

К раствору 2,606 г (14,5 ммол) бензил L-лактата (4) и 2,764 г (14,6 ммол) N-Boc-L-аланина (5а) в 100 мл ДХМ при 0°С добавляли ДМАП (0,353 г, 2,9 ммол) и ДЦК (3,044 г, 14,7 ммол). Реакционную смесь перемешивали в течение 15 ч при комнатной температуре и фильтровали. Осадок промывали эфиром, объединенный фильтрат выпаривали на роторном испарителе, очищали методом колоночной хроматографии на силикагеле (гексан: EtOAc 4:1) и получали 4,7 г (92%) S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-(трет-бутоксикарбониламино)пропаноата (6а) в виде вязкого бесцветного масла.1Н ЯМР (ДМСО-d6, 400) δ: 7,36 (m, 6Н), 5,15 (s, 2Н), 5,12 (m, 1Н), 4,04 (m, 1H), 1,43 (d, J=7,2 Гц, 3H), 1,37 (s, 9H), 1,23 (t, J=7,2 Гц, 3H).
Аналогично получали (S)-3-(бензилокси)-3-оксопропил 2-(трет-бутоксикарбониламино)пропаноат (6b) с выходом 97%,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 7,36 (m, 5Н), 7,24 (d, J=7,6 Гц, 1Н), 5,12 (s, 2Н), 4,32 (р, J=6,0 Гц, 1Н), 4,22 (р, J=6,0 Гц, 1Н), 3,95 (р, J=7,2 Гц, 0,9Н), 3,87 (m, 0,1Н), 2,73 (t, J=6,0 Гц, 2Н), 1,37 (s, 8Н), 1,32 (br. s, 1H), 1,17 (d, J=7,2 Гц, 3Н); (S)-бензил 4-(2-(трет-бутоксикарбониламино)пропаноилокси)бутаноат (3с) с выходом 96%,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 7,36 (m, 5Н), 7,26 (d, J=7,6 Гц, 1H), 5,09 (s, 2H), 4,06 (m, 2H), 3,97 (m, 1H), 2,45 (t, J=7,6 Гц, 2H), 1,84 (p, J=6,8 Гц, 2H), 1,36 (s, 8H), 1,31 (br. s, 1H), 1,22 (d, J=7,2 Гц, 3Н); (S)-бензил 5-(2-(трет-бутоксикарбониламино)пропаноилокси)пентаноат (3d) с выходом 99%,1Н ЯМР (ДМСО-d6, 400 МГц) δ 7,36 (m, 5Н), 7,23 (d, J=7,2 Гц, 1Н), 5,08 (s, 2Н), 4,01 (m, 3Н), 2,39 (m, 2Н), 1,59 (m, 4Н), 1,37 (s, 8Н), 1,32 (br. s, 1H), 1,22 (d, J=7,2 Гц, 3Н); (S)-бензил 6-(2-(трет-бутоксикарбониламино)пропаноилокси)гексаноат (3е) с выходом 99%,1Н ЯМР (CDCl3, 400 МГц) δ: 7,37 (m, 5Н), 5,13 (s, 2Н), 5,05 (br. s, 1Н), 4,30 (m, 1Н), 4,13 (m, 2Н), 2,39 (t, J=7,2 Гц, 2Н), 1,68 (m, 4Н), 1,46 (s, 8,4Н), 1,44 (br. s, 0,6Н), 1,40 (m, 2Н), 1,38 (d, J=7,2 Гц, 3Н); (S)-бензил 7-(2-(трет-бутоксикарбониламино)пропаноилокси)гептаноат (3f) с выходом 99%,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 7,35 (m, 5Н), 7,23 (d, J=7,6 Гц, 1Н), 5,08 (s, 2Н), 4,00 (m, 3Н), 2,34 (t, J=7,2 Гц, 2Н), 1,54 (m, 4Н), 1,37 (s, 8Н), 1,33 (br. s, 1Н), 1,28 (m, 4Н), 1,22 (d, J=7,2 Гц, 3Н). (S)-бензил 8-(2-(трет-бутоксикарбониламино)пропаноилокси)октаноат (3 г) с выходом 99%,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 7,36 (m, 5Н), 7,23 (d, J=7,2 Гц, 1H), 5,08 (s, 2Н), 4,00 (m, 3Н), 2,34 (t, J=7,2 Гц, 2Н), 1,53 (m, 4Н), 1,37 (s, 8Н), 1,33 (br. s, 1Н), 1,26 (m, 6Н), 1,22 (d, J=7,2 Гц, 3Н).
Пример 2. Общая методика получения 2-аминопропаноат гидрохлоридов 7a-g

К раствору 4,7 г (13,4 ммол) (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-(трет-бутоксикарбониламино)пропаноата (6а) в 40 мл диоксана добавляли 40 мл 3N HCl в диоксане. Раствор перемешивали 15 ч при комнатной температуре, выпаривали на роторном испарителе и получали (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-аминопропаноат гидрохлорид (7а) в количественном соотношении в виде вязкого бесцветного масла, которое медленно кристаллизуется. ЖХ-МС (ИЭР) 252 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 8,63 (br. s, 3Н), 7,38 (m, 5Н), 5,26 (q, J=7,2 Гц, 1Н), 5,19 (m, 2H), 4,15 (q, J=7,2 Гц, 1H), 1,48 (d, J=7,2 Гц, 3Н), 1,42 (d, J=7,2 Гц, 3Н).
Аналогично получали (S)-3-(бензилокси)-3-оксопропил 2-аминопропаноат гидрохлорид (7b) - ЖХ-МС (ИЭР) 252 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 8,56 (br. s, 3Н), 7,37 (m, 5Н), 5,13 (s, 2Н), 4,43 (m, 1Н), 4,33 (m, 1H), 4,01 (m, 1H), 2,80 (t, J=6,0 Гц, 2H), 1,34 (d, J=7,2 Гц, 3Н); (S)-бензил 4-(2-аминопропаноилокси)бутаноат гидрохлорид (7с) -ЖХ-МС (ИЭР) 266 (М+Н)+; (S)-бензил 5-(2-аминопропаноилокси)пентаноат гидрохлорид (7d) - ЖХ-МС (ИЭР) 280 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 8,60 (br. s, 3Н), 7,36 (m, 5Н), 5,09 (s, 2Н), 4,15 (m, 2Н), 4,04 (m, 1H), 2,41 (m, 2Н), 1,63 (m, 4Н), 1,41 (d, J=7,2 Гц, 3Н); (S)-бензил 6-(2-аминопропаноилокси)гексаноат гидрохлорид (7е) - ЖХ-МС (ИЭР) 294 (М+Н)+; (S)-бензил 7-(2-аминопропаноилокси)гептаноат гидрохлорид (7f) - ЖХ-МС (ИЭР) 308 (М+Н)+,1Н ЯМР (D2O, 400 МГц) δ: 7,27 (m, 5Н), 5,00 (s, 2Н), 4,11 (m, 3Н), 2,25 (t, J=7,2 Гц, 2Н), 1,51 (m, 4Н), 1,48 (d, J=7,6 Гц, 3Н), 1,19 (m, 4Н); (S)-бензил 8-(2-аминопропаноилокси)октаноат гидрохлорид (7 г) - ЖХ-МС (ИЭР) 322 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 8,54 (br. s, 3Н), 7,36 (m, 5Н), 5,08 (s, 2Н), 4,14 (m, 2Н), 4,05 (m, 1H), 2,35 (t, J=7,2 Гц, 2Н), 1,56 (m, 4Н), 1,41 (d, J=7,2 Гц, 3Н), 1,28 (m, 6Н).
Пример 3. Общая методика получения 2-хлор(фенокси)фосфориламино)-пропаноатов 8a-g

Раствор 3,035 г (10,5 ммол) (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-аминопропаноат гидрохлорида (7а) и фенил дихлорфосфата (1,575 мл, 10,5 ммол) растворяли в 40 мл ДХМ и охлаждали до -78°С. К раствору добавили по каплям раствор триэтиламина (2,86 мл, 21 ммол) в 10 мл ДХМ и полученную смесь перемешивали 1 ч при -78°С, после чего давали нагреться до комнатной температуры. Смесь выпаривали на роторном испарителе, остаток обрабатывали бензолом. Осадок отфильтровывали, фильтрат очищали с помощью сухой флэш-хроматографии на сухом силикагеле (промытом MeCN, EtOAc, толуолом, гексаном), используя в качестве элюента гексан: EtOAc 2:1 и получали 3,8 г (85%) S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-(хлор(фенокси)фосфориламино)пропаноата (8а) в виде бесцветного масла.1Н ЯМР (CDCl3, 400 МГц) δ 7,37 (m, 7Н), 7,27 (m, 3Н), 5,24 (m, 1Н), 5,19 (m, 2Н), 4,25 (m, 2Н), 1,55 (m, 6Н).
Аналогично получали (2S)-3-(бензилокси)-3-оксопропил 2-(хлор(фенокси)фосфориламино)-пропаноат (8b) с выходом 65%,1Н ЯМР (CDCl3, 400 МГц) δ: 7,37 (m, 7Н), 7,26 (m, 3Н), 5,16, 5,17 (2s, 2Н), 4,49 (m, 2Н), 4,20 (m, 2Н), 2,75 (q, J=5,6 Гц, 2Н), 1,45, 1,46 (2d, J=7,2 Гц, 3Н); бензил 4-((S)-2-(хлор(фенокси)фосфориламино)пропаноилокси)бутаноат (8с) с выходом 49%,1Н ЯМР (CDCl3, 400 МГц) δ: 7,37 (m, 7Н), 7,27 (m, 3Н), 5,15 (2s, 2Н), 4,32 (m, 1H), 4,24 (q, J=6,4 Гц, 2Н), 4,18 (m, 1Н), 2,48 (m, 2Н), 2,05 (m, 2Н), 1,51 (2d, J=7,2 Гц, 3Н); бензил 5-((S)-2-(хлор(фенокси)фосфориламино)пропаноилокси)пентаноат (8d) с выходом 61%,1Н ЯМР (CDCl3, 400 МГц) δ: 7,37 (m, 7Н), 7,27 (m, 3Н), 5,14 (2s, 2Н), 4,34 (m, 1H), 4,20 (m, 2Н), 4,16 (m, 1Н), 2,42 (m, 2Н), 1,74 (m, 4Н), 1,51, 1,52 (2d, J=7,2 Гц, 3Н); бензил 6-((S)-2-(хлор(фенокси)фосфориламино)пропаноилокси)гексаноат (8е) с выходом 22%,1Н ЯМР (CDCl3, 400 МГц) δ: 7,37 (m, 7Н), 7,28 (m, 3Н), 5,13 (2s, 2Н), 4,31 (m, 1H), 4,21 (m, 1Н), 4,18 (q, J=6,8 Гц, 2Н), 2,38 (m, 2Н), 1,70 (m, 4Н), 1,51, 1,52 (2d, J=7,2 Гц, 3Н), 1,42 (m, 2Н); бензил 7-((S)-2-(хлор(фенокси)фосфориламино)пропаноилокси)гептаноат (8f) с выходом 75%,1Н ЯМР (CDCl3, 400 МГц) δ: 7,37 (m, 7Н), 7,27 (m, 3Н), 5,13 (s, 2Н), 4,33 (m, 1Н), 4,17 (m, 3Н), 2,37, 2,38 (2t, J=7,4 Гц, 2Н), 1,67 (m, 4Н), 1,52, 1,53 (2d, J=7,2 Гц, 3Н), 1.37 (m, 4Н); бензил 8-((S)-2-(хлор(фенокси)фосфориламино)пропаноилокси)октаноат (8g) с выходом 72%;1Н ЯМР (CDCl3, 400 МГц) δ: 7,37 (m, 7Н), 7,27 (m, 3Н), 5,13 (s, 2Н), 4,31 (m, 1H), 4,19 (m, 3Н), 2,36, 2,37 (2t, J=7,4 Гц, 2Н), 1,65 (m, 4Н), 1,52, 1,53 (2d, J=7,2 Гц, 3Н), 1,34 (m, 6Н).
Пример 4. Общая методика получения 1-((2R,3R,4R,5R)-5-((трет-бутилдиметилсилилокси)метил)-4-гидрокси-тетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-дионов (10а,b)

К раствору 1,3 г (5 ммол) 1-((2R,3R,4R,5R)-3-фтор-4-гидрокси-5-(гидроксиметил)-3-метил-тетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-диона (9а) в 10 мл пиридина прибавляли трет-бутилхлордиметилсилан (866 мг, 5,75 ммол) при 0-5°С, после чего добавляли 1-метилимидазол (0,399 мл, 5 ммол). Смесь перемешивали 3 ч, затем добавляли 3 мл метанола и перемешивали еще 1 ч. Смесь выпаривали на роторном испарителе, растворяли в ДХМ, промывали 5% раствором лимонной кислоты, рассолом, сушили над Na2SO4, выпаривали на роторном испарителе и получали 1-((2R,3R,4R,5R)-5-((трет-бутилдиметилсилилокси)метил)-3-фтор-4-гидрокси-3-метил-тетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-дион (10а) с количественным выходом. ЖХ-МС (ИЭР) 375 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 11,51 (s, 1Н), 7,82 (d, J=8,0 Гц, 1Н), 6,00 (d, J=18,8 Гц, 1Н), 5,73 (d, J=6,8 Гц, 1H), 5,54 (dd, J1=8,0 Гц, J2=2,4 Гц, 1H), 4,02 (dd, J1=12,0 Гц, J2=1,2 Гц, 1H), 3,89 (m, 1Н), 3,80 (m, 2Н), 1,27 (d, J=22,4 Гц, 3Н), 0,90 (s, 9Н), 0,10 (d, J=2,4 Гц, 6Н).
Аналогично получали 1-((2R,4S,5R)-5-((трет-бутилдиметилсилилокси)метил)-4-гидрокси-тетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-дион (10b) исходя из 2'-дезоксиуридина. ЖХ-МС (ИЭР) 343 (М+Н)+.1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,31 (s, 1Н), 7,75 (d, J=8,0 Гц, 1Н), 6,14 (t, J=6,8 Гц, 1H), 5,57 (dd, J1=8,0 Гц, J2=2,0 Гц, 1H), 5,29 (d, J=4,4 Гц, 1H), 4,20 (m, 1Н), 3,77 (m, 3Н), 2,15 (m, 1Н), 2,05 (m, 1H), 0,87 (s, 9Н), 0,07 (s, 6Н).
Пример 5. Общая методика получения бензил (2R,3R,4R,5R)-2-((трет-бутилдиметилсилилокси)метил)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-тетрагидрофуран-3-ил карбонатов (11а,b)

К раствору 1,935 г (5,17 ммол) 1-((2R,3R,4R,5R)-5-(трет-бутилдиметилсилилокси)метил)-3-фтор-4-гидрокси-3-метил-тетрагидрофуран-2-ил)пиримидин-2,4(1H,3H)-диона (10а) и ДМАП (1,263 г, 10,34 ммол) в 50 мл ДХМ добавляли по каплям бензил хлорформиат (1,107 мл, 7,75 ммол) при 0-5°С. Реакционную смесь нагревали до комнатной температуры и оставляли перемешиваться на ночь, затем промывали 5% раствором лимонной кислоты и рассолом. После сушки над Na2SO4 и выпаривания на роторном испарителе бензил (2R,3R,4R,5R)-2-((трет-бутилдиметилсилилокси)метил)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-3-ил карбонат (11а) использовали на следующей стадии без дополнительной очистки. Выход количественный. ЖХ-МС (ИЭР) δ, 09 (М+Н)+.1Н ЯМР (ДМСО-d6, 400 МГц) δ: 11,56 (s, 1Н), 7,82 (d, J=8,0 Гц, 1Н), 7,39 (m, 5Н), 6,04 (d, J=18,8 Гц, 1Н), 5,62 (d, J=8,0 Гц, 1H), 5,21 (s, 2H), 5,14 (m, 1H), 4,18 (d, J=9,2 Гц, 1H), 4,18 (dd, J1=12,0 Гц, J2=2,4 Гц, 1H), 3,77 (dd, J1=12,0 Гц, J2=3,2 Гц, 1H), 1,33 (d, J=22,8 Гц, 3Н), 0,86 (s, 9H), 0,08 (d, J=3,2 Гц, 6H).
Аналогично получали бензил (2R,3S,5R)-2-((трет-бутилдиметилсилилокси)метил)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-тетрагидрофуран-3-ил карбонат (11b) - ЖХ-МС (ИЭР) 477 (М+Н)+,1Н ЯМР (ДМСО-d6), 400 МГц) δ: 11,37 (s, 1Н), 7,72 (d, J=8,0 Гц, 1Н), 7,39 (m, 5Н), 6,13 (dd, J1=8,0 Гц, J2=6,0 Гц, 1Н), 5,63 (dd, J1=8,0 Гц, J2=2,0 Гц, 1Н), 5,17 (s, 2Н), 5,14 (m, 1Н), 4,14 (m, 1Н), 3,80 (m, 2Н), 2,43 (m, 1H), 2,27 (m, 1H), 0,87 (s, 9Н), 0,07 (s, 6Н).
Пример 6. Общая методика получения бензил (2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-(гидроксиметил)-тетрагидрофуран-3-ил карбонатов (12а,b)

К раствору 2,62 г (5,15 ммол) бензил (2R,3R,4R,5R)-2-((трет-бутилдиметилсилилокси)метил)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-3-ил карбоната (11a) в 50 мл ДХМ добавляли Et3N⋅3HF (4,21 мл, 25,75 ммол), и смесь перемешивали 24 ч. Смесь промывали водой, сушили над Na2SO4, разбавляли 50 мл толуола и выпаривали на роторном испарителе, доводя объем приблизительно до 30 мл. Осадок отфильтровывали, промывали гексаном и высушивали. Выход бензил (2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-2-(гидроксиметил)-4-метил-тетрагидрофуран-3-ил карбоната (12а) составил 1,715 г (84%). ЖХ-МС (ИЭР) 395 (М+Н)+.1Н ЯМР (ДМСО-d6, 400 МГц) δ: 11.53 (s, 1H), 7,94 (d, J=8,0 Гц, 1Н), 7,40 (m, 5Н), 6,05 (d, J=19,2 Гц, 1H), 5,72 (d, J=8,0 Гц, 1Н), 5,36 (br. s, 1H), 5,22 (m, 2Н), 5,12 (dd, J1=20,0 Гц, J2=8,4 Гц, 1Н), 4,12 (m, 1Н), 3,80 (m, 1Н), 3,61 (m, 1Н), 1,33 (d, J=23,2 Гц, 3Н).
Аналогично получали бензил (2R,3S,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-(гидроксиметил)-тетрагидрофуран-3-ил карбонат (12b). Выход 80%. ЖХ-МС (ИЭР) 363 (М+Н)+.1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,34 (s, 1Н), 7,86 (d, J=8,0 Гц, 1Н), 7,39 (m, 5Н), 6,15 (dd, J1=8,8 Гц, J2=6,0 Гц, 1Н), 5,67 (dd, J1=8,0 Гц, J2=2,0 Гц, 1Н), 5,19 (m, 2Н), 5,17 (s, 2Н), 4,07 (m, 1H), 3,62 (m, 2Н), 2,37 (m, 1Н), 2,29 (m, 1Н).
Пример 7. Общая методика получения (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил)2-((((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноатов (13а-i)

К раствору 197 мг (0,5 ммоль) бензил (2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-2-(гидроксиметил)-4-метил-тетрагидрофуран-3-ил карбоната (8а) и 330 мг (0,75 ммоль) (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-(хлор(фенокси)фосфориламино)-пропаноата (12а) в 10 мл ацетонитрила добавляли N-метилимидазол (0,159 мл, 1 ммоль) и перемешивали смесь 18 ч, после чего останавливали реакцию добавлением 0,2 мл метанола. Растворитель выпаривали на роторном испарителе, остаток растворяли в ДХМ, промывали 3% лимонной кислотой и рассолом, сушили над Na2SO4, выпаривали на роторном испарителе, очищали методом колоночной хроматографии на силикагеле (гексан : EtOAc 2:3) и получали 364 мг (93%) (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-((((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноата (13а) в виде бесцветного твердого стекловидного вещества. ЖХ-МС (ИЭР) 784 (М+Н)+.
Аналогично получали (S)-3-(бензилокси)-3-оксопропил 2-((((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноат (13b) с выходом 88%, ЖХ-МС (ИЭР) 784 (М+Н)+; бензил 4-((S)-2-((((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси) бутаноат (13с) с выходом 81%, ЖХ-МС (ИЭР) 798 (М+Н)+; бензил 5-((S)-2-((((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)пентаноат (13d) с выходом 84%, ЖХ-МС (ИЭР) 812 (М+Н)+; бензил 6-((S)-2-((((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)гексаноат (9е) с выходом 85%, ЖХ-МС (ИЭР) 826 (М+Н)+; бензил 7-((S)-2-((((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)гептаноат (9f) с выходом 80%, ЖХ-МС (ИЭР) 840 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 11,57 (s, 1H), 7,66 (d, J=8,0 Гц, 1Н), 7,36 (m, 12Н), 7,18 (m, 3Н), 6,07 (m, 2Н), 5,63 (t, J=8,6 Гц, 1Н), 5,20 (m, 3Н), 5,07 (s, 2Н), 4,31 (m, 3Н), 3,97 (m, 2Н), 3,84 (m, 1H), 2,31, 2,32 (2t, J=7,2 Гц, 2Н), 1,49 (m, 4Н), 1,34 (d, J=22,8 Гц, 3Н), 1,23 (m, 7Н); бензил 8-((S)-2-((((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)-фосфориламино)пропаноилокси)октаноат (13g) с выходом 83%), ЖХ-МС (ИЭР) 854 (М+Н)+; (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-((((2R,3S,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноат (13h) с выходом 70%, ЖХ-МС (ИЭР) 752 (М+Н)+,1Н ЯМР (400 МГц, ДМСО-d6) δ: 11,38 (s, 1H), 7,59, 7,62 (2d, J=8,4 Гц, 1Н), 7,37 (m, 12Н), 7,19 (m, 3Н), 6,15 (m, 2Н), 5,57 (m, 1Н), 5,18 (m, 1Н), 5,17 (s, 2Н), 5,15 (s, 2Н), 5,07 (m, 1Н), 4,24 (m, 3Н), 3,94 (m, 1H), 2,36 (m, 1H), 2,23 (m, 1H), 1,40, 1,41 (2d, J=6,8 Гц, 3Н), 1,23, 1,25 (2d, J=7,2 Гц, 3Н); бензил 4-((S)-2-((((2R,3S,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)бутаноат (13i) с выходом 81%, ЖХ-МС (ИЭР) 766 (М+Н)+,1Н ЯМР (400 МГц, ДМСО-d6) δ: 11,39 (s, 1Н), 7,59 (t, J=7,6 Гц, 1H), 7,36 (m, 12Н), 7,18 (m, 3Н), 6,12 (m, 2Н), 5,54, 5,61 (2dd, J1=8,0 Гц, J2=2,0 Гц, 1Н), 5,18 (m, 1Н), 5,17 (s, 2Н), 5,07, 5,08 (2s, 2Н), 4,24 (m, 3Н), 4,03 (m, 2Н), 3,86 (m, 1Н), 2,43 (t, J=7,2 Гц, 2Н).
Пример 8. Общая методика получения S)-2-((S)-2-((((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-3-гидрокси-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)пропионовой кислоты (3а-i)
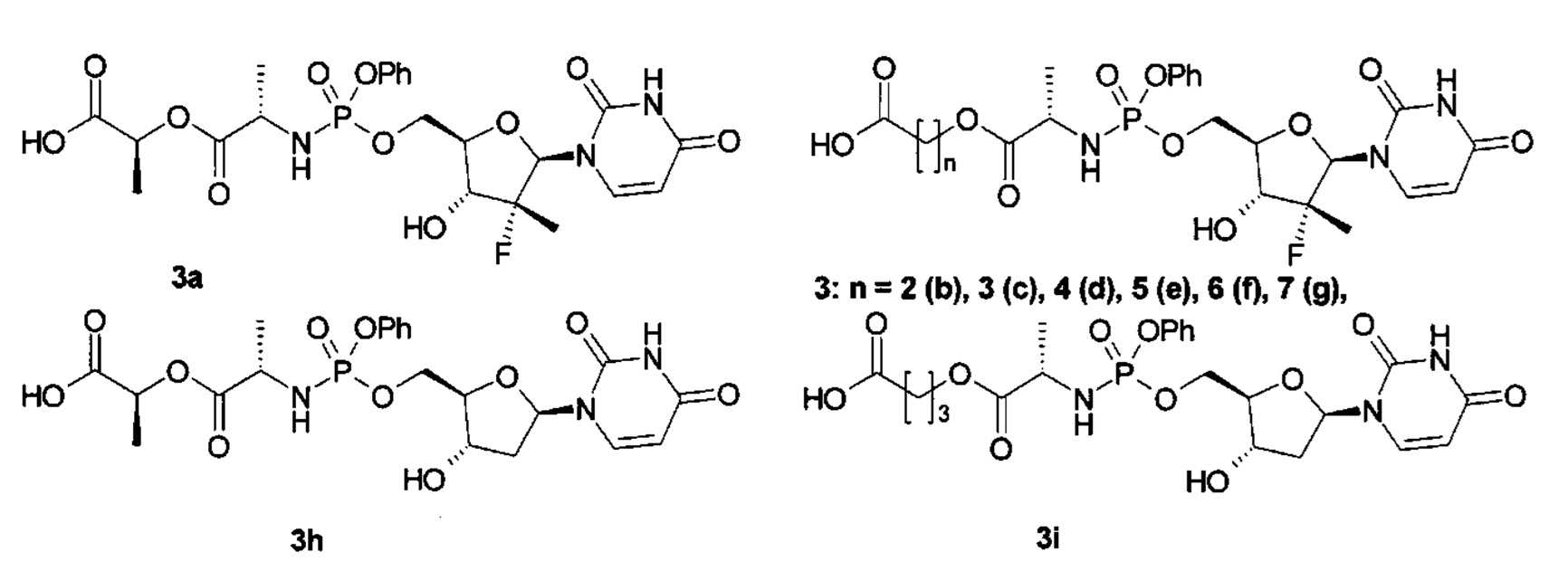
Раствор 364 мг (0,46 ммол) соединения 13а в 20 мл EtOAc перемешивали с 40 мг 10% Pd/C в атмосфере водорода в течение 12 ч. Полученный раствор фильтровали через селит, выпаривали на роторном испарителе и получали 260 мг (100%) of S)-2-((S)-2-((((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)пропионовой кислоты (3а). ЖХ-МС (ИЭР) 560 (М+Н)+.1Н ЯМР (ДМСО-d6, 400 МГц) δ: 13,00 (br. s, 1H), 11,51 (s, 1H), 7,55 (d, J=8,0 Гц, 1H), 7,38 (m, 2H), 7,21 (m, 3H), 6,14 (m, 1H), 6,03 (m, 1H), 5,55 (m, 1H), 4,89 (m, 1H), 4,40 (m, 1H), 4,25 (m, 1H), 4,02 (m, 1H), 3,87 (m, 2H), 1,37, 1,38 (2d, J=7,2 Гц, 3Н), 1,26 (m, 6H).
Аналогично получали 3-((5)-2-((((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)пропионовую кислоту (3b) - ЖХ-МС (ИЭР) 560 (М+Н)+; 4-((S)-2-((((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)бутановую кислоту (3с) - ЖХ-МС (ИЭР) 574 (М+Н)+; 5-((S)-2-((((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)пентановую кислоту (3d) - ЖХ-МС (ИЭР) 588 (М+Н)+; 6-((S)-2-((((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино) пропаноилокси)-гексановую кислоту (3е) - ЖХ-МС (ИЭР) 602 (М+Н)+; 7-((S)-2-((((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)гептановую кислоту (3f) - ЖХ-МС (ИЭР) 616 (М+Н)+; 7-((S)-2-((((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)-октановую кислоту (3g) - ЖХ-МС (ИЭР) 630 (М+Н)+; (S)-2-((S)-2-((((2R,3S,5R)-3-гидрокси-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)пропионовую кислоту (3h) - ЖХ-МС (ИЭР) 542 (М+Н)+; 4-((S)-2-((((2R,3S,5R)-3-гидрокси-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)бутановую кислоту (3i). ЖХ-МС (ИЭР) 556 (М+Н)+.
Пример 9. Методика получения (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-((S)-(перфторфенокси)(фенокси)фосфориламино)пропаноата (17а)

К раствору 6,247 г (14,7 ммол) (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-(хлор(фенокси)фосфориламино)пропаноата (8а) в 70 мл безводного ДХМ добавляли по каплям раствор 2,7 г (14,7 ммол) пентафторфенола и триэтиламина (1,99 мл, 14,7 ммол) в 20 мл ДХМ при 0°С. Смесь перемешивали 15 ч при комнатной температуре и выпаривали на роторном испарителе. Остаток обрабатывали 150 мл толуола, раствор фильтровали и снова выпаривали на роторном испарителе. Остаток обрабатывали 100 мл смеси гексан/EtOAc (4:1). Спустя 1 ч осадок фильтровали, промывали гексаном, перекристаллизовывали из 100 мл смеси гексан/EtOAc (4:1) и получали 2,766 г (33%) (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-((S)-(перфторфенокси)(фенокси)фосфориламино)пропаноата (17а) в виде твердого белого вещества. ЖХ-МС (ИЭР) 574 (М+Н)+,1Н ЯМР (CDCl3, 400 МГц) δ: 7,36 (m, 7Н), 7,25 (m, 3Н), 5,19 (m, 3Н), 4,27 (m, 1Н), 3,89 (m, 1Н), 1,54 (d, J=7,2 Гц, 3Н), 1,49 (d, J=7,2 Гц, 3Н).
Пример 10. Методика получения бензил 4-((S)-2-((S)-(перфторфенокси)(фенокси)фосфориламино)пропаноилокси)бутаноата (17b)
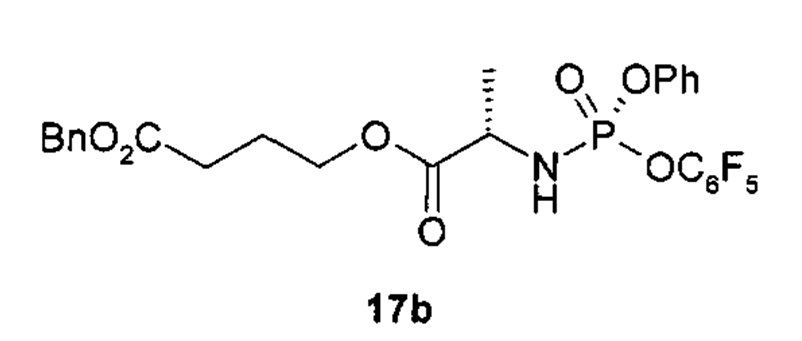
К раствору 5,8 г (13,2 ммол) бензил 4-((S)-2-(хлор(фенокси)фосфориламино)пропаноилокси)бутаноата (8b) в 70 мл безводного ДХМ добавляли раствор 2,43 г (13,2 ммол) пентафторфенола и триэтиламина (1,84 мл, 13,2 ммол) в 10 мл дихлорметана при 0°С. Смесь перемешивали 15 ч при комнатной температуре и выпаривали на роторном испарителе. Остаток обрабатывали 150 мл толуола, раствор фильтровали и снова выпаривали на роторном испарителе. Остаток обрабатывали 100 мл гексана. Через 1 ч полученный осадок фильтровали, промывали гексаном и сушили на воздухе. Продукт промывали водой и сушили на воздухе. Бензил 4-((S)-2-((S)-(перфторфенокси)(фенокси)фосфориламино)пропаноилокси)бутаноат (17b) получали в виде твердого белого вещества с выходом 5,8 г (75%). ЖХ-МС (ИЭР) 588 (М+Н)+.1Н ЯМР (CDCl3, 400 МГц) δ: 7.36 (m, 7Н), 7.24 (m, 3Н), 5.14 (s, 2Н), 4.19 (m, 3Н), 3.97 (m, 1Н), 2.45 (t, J=7.2 Гц, 2Н), 2.02 (m, 2Н), 1.47 (d, J=6.8 Гц, 3Н).
Пример 11. Общая методика получения соединений 18aP(S), 18cP(S) и 18iP(S)
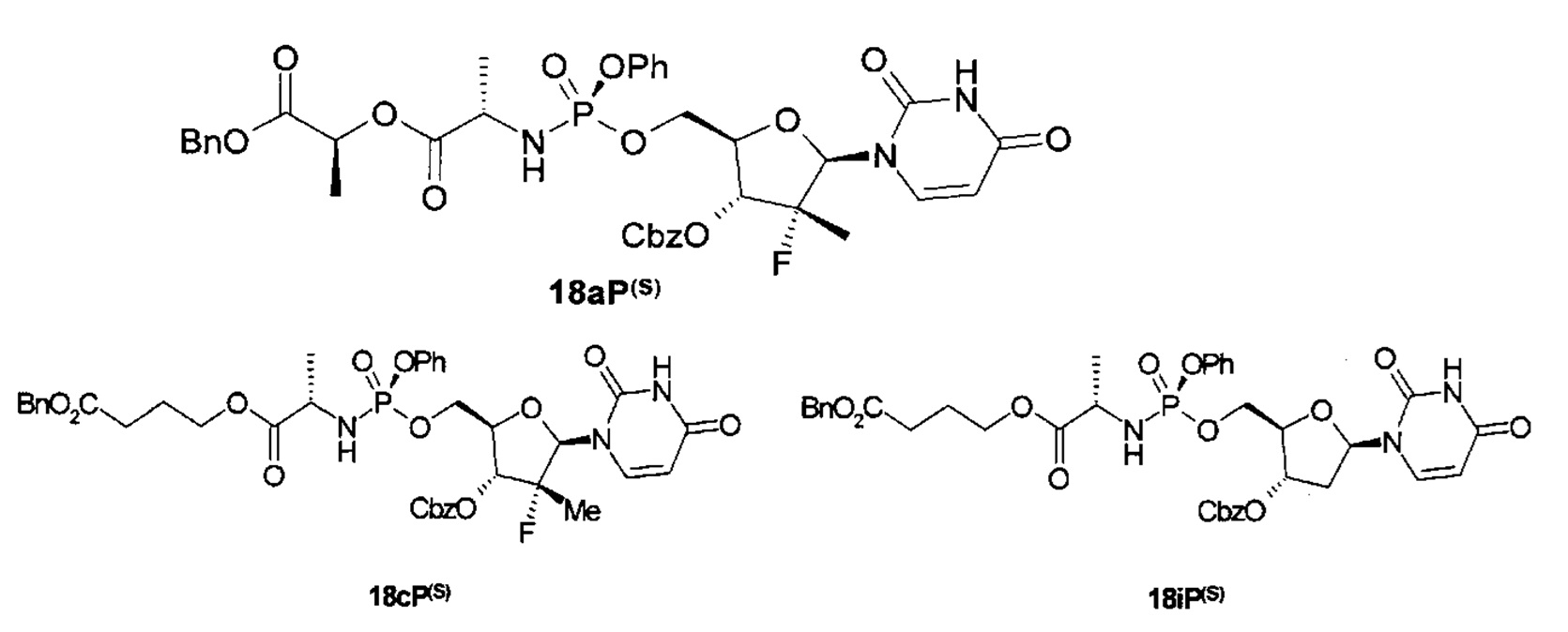
К раствору 789 мг (2 ммол) бензил (2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-2-(гидроксиметил)-4-метил-тетрагидрофуран-3-ил карбоната (12а) в 40 мл ТГФ в атмосфере аргона добавляли 1М раствор трет-бутилмагний хлорида в ТГФ (4,2 мл, 4,2 ммол) и перемешивали смесь 0,5 ч при комнатной температуре. С помощью шприца добавляли раствор 0,63 г (1,1 ммол) (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-((S)-(перфторфенокси)(фенокси)фосфориламино)пропаноата (17а) в 5 мл ТГФ, и смесь оставляли перемешиваться на ночь при комнатной температуре в атмосфере аргона. Реакцию останавливали добавлением 1 мл метанола, выпаривали на роторном испарителе, остаток растворяли в ДХМ, промывали 5% лимонной кислотой, насыщенным NaHCO3, рассолом, сушили над Na2SO4 и выпаривали на роторном испарителе. Требуемый продукт выделяли методом колоночной хроматографии на силикагеле (гексан: EtOAc 1:1, 1:2, 0:1). Выход (S)-((S)-1-(бензилокси)-1-оксопропан-2-ил) 2-((S)-(((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси) фосфориламино)пропаноата (18aP(S)) составил 700 мг (44%). ЖХ-МС (ИЭР) 784 (М+Н)+.
Аналогично получали бензил 4-((S)-2-((S)-(((2R,3R,4R,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)бутаноат (18cP(S)) с выходом 69%, ЖХ-МС (ИЭР) 798 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 11,55 (s, 1Н), 7,66 (d, J=8,0 Гц, 1H), 7,37 (m, 12Н), 7,17 (m, 3Н), 6,08 (dd, J1=12,8 Гц, J2=10,4 Гц, 1H), 6,01 (m, 1H), 5,62 (d, J=8,0 Гц, 1Н), 5,20 (m, 3Н), 5,08 (s, 2Н), 4,34 (m, 1Н), 4,27 (m, 2Н), 4,03 (m, 2Н), 3,86 (m, 1Н), 2,42 (t, J=7,6 Гц, 2Н), 1,82 (р, J=6,8 Гц, 2Н), 1,34 (d, J=23,2 Гц, 3Н), 1,22 (d, J=7,2 Гц, 3Н); бензил 4-((S)-2-((((2R,3S,5R)-3-(бензилоксикарбонилокси)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)бутаноат (18iP(S)) с выходом 94%, ЖХ-МС (ИЭР) 766 (М+Н)+.
Пример 12. Общая методика получения соединений 19aP(S), 19cP(S) и 19iP(S)


Раствор 700 мг (0,9 ммол) соединения 18aP(S) в 25 мл EtOAc перемешивали с 70 мг 10% Pd/C в атмосфере водорода в течение 12 ч. Полученный раствор фильтровали через селит, выпаривали на роторном испарителе и получали 499 мг (100%) (S)-2-((S)-2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)пропионовой кислоты (19aP(S)). ЖХ-МС (ИЭР) 560 (М+Н)+.
Аналогично получали 4-((S)-2-((S)-(((2R,3R,4R,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-4-фтор-3-гидрокси-4-метил-тетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)бутановую кислоту (19cP(S)) - ЖХ-МС (ИЭР) 574 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ: 12,11 (s, 1Н), 11,50 (s, 1H), 7,56 (d, J=8,0 Гц, 1Н), 7,37 (m, 2Н), 7,30 (m, 3Н), 6,07 (dd, J1=12,8 Гц, J2=10,4 Гц, 1Н), 6,01 (m, 1Н), 5,83 (d, J=8,0 Гц, 1H), 5,54 (dd, J1=8,0 Гц, J2=2,0 Гц, 1Н), 4,37 (m, 1Н), 4,24 (m, 1H), 4,02 (m, 3Н), 3,86 (m, 2Н), 2,27 (t, J-7,2 Гц, 2Н), 1,77 (р, J=6,8 Гц, 2Н), 1,25 (d, J=22,4 Гц, 3Н), 1,25 (d, J=7,2 Гц, 3Н); 4-((S)-2-((((2R,3S,5R)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-3-гидрокситетрагидрофуран-2-ил)метокси)(фенокси)фосфориламино)пропаноилокси)бутановую кислоту (19iP(S)) - ЖХ-МС (ИЭР) 542 (М+Н)+.
Пример 13. Общая методика получения макрогетероциклического нуклеозидного производного и его аналогов общей формулы (1) или (2).
Циклизация кислот 10a-i, 19aP(S), 19cP(S) и 19iP(S) (общая методика). К раствору 0,5 ммоль кислоты 10a-i, 19aP(S), 19cP(S), или 19iP(S) и HATU (209 мг, 0,55 ммоль) в 10 мл сухого ацето нитрила добавляли диизопропилэтиламин (DIPEA) (0,218 мл, 1,25 ммол) и перемешивали смесь в течение 24 ч. Раствор выпаривали на роторном испарителе, растворяли в ДХМ, промывали 5% раствором лимонной кислоты, рассолом, выпаривали на роторном испарителе и очищали методом колоночной хроматографии на силикагеле (гексан: EtOAc 1:3 - 1:4). Соответствующее макрогетероциклическое нуклеозидное производное и их аналог общей формулы 1 или 2 готовят в виде смесей или индивидуальных энантиомеров. Смеси энантиомеров 1 и 2 разделяли методом кристаллизации из подходящего растворителя или хроматографическим методом. (2R,3aS,6S,9S,13aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-6,9-диметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(1/2)), ЖХ-МС (ИЭР) 510 (М+Н)+. (2R,3aS,6S,9S,11S,13aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-6,9-диметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(1)), ЖХ-МС (ИЭР) 510 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,33 (s, 1Н), 7,72 (d, J=8.0 Гц, 1Н), 7.38 (m, 2Н), 7.22 (m, 2Н), 7.19 (m, 1Н), 6.16 (m, 2Н), 5.62 (d, J=8.0 Гц, 1Н), 5.06 (m, 1Н), 4.92 (q, J=7.0 Гц, 1H), 4.26 (m, 1Н), 4.16 (m, 2Н), 3.88 (m, 1H), 2.62 (m, 1Н), 2.36 (m, 1Н), 1.47 (d, J=7.2 Гц, 3Н), 1.32 (d, J=7.2 Гц, 3Н). (2R,3aS,6S,9S,11R,13aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-6,9-диметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(2)), ЖХ-МС (ИЭР) 510 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,32 (s, 1H), 7,66 (d, J=8,0 Гц, 1Н), 7,40 (m, 2Н), 7,22 (m, 3Н), 6,34 (dd, J1=15,2 Гц, J2=9,6 Гц, 1H), 6,13 (dd, J1=8,0 Гц, J2=2,8 Гц, 1Н), 5,59 (d, J=8,0 Гц, 1H), 5,02 (q, J=8,0 Гц, 1Н), 4,92 (q, J=6,8 Гц, 1H), 4,44 (m, 1Н), 4,05 (m, 1Н), 3,91 (m, 1Н), 3,75 (m, 1Н), 2,66 (m, 1H), 2,37 (m, 1H), 1,47 (d, J=6,8 Гц, 3Н), 1,24 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,6S,9S,13aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,6,9-триметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(3/4)), ЖХ-МС (ИЭР) 542 (М+Н)+. (2R,3R,3aR,6S,9S,11S,13aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,6,9-триметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(3)), ЖХ-МС (ИЭР) 542 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,56 (s, 1H), 7,73 (d, J=8,0 Гц, 1H), 7,41 (m, 2Н), 7,22 (m, 3Н), 6,42 (dd, J1=14,8 Гц, J2=9,2 Гц, 1Н), 6,16 (br. s, 0,5Н), 5,67 (d, J=8,0 Гц, 1Н), 5,29 (br. s, 0,5Н), 4,98 (q, J=6,8 Гц, 1H), 4,44 (m, 1H), 4,24 (m, 2Н), 3,78 (m, 1Н), 1,52 (d, J=6,8 Гц, 3Н), 1,36 (d, J=24,0 Гц, 3Н), 1,27 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,6S,9S,11R,13aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,6,9-триметил-11-оксо-11-фенокси-гексагидро-1,4,7,12-тетраокса-10-аза-11-фосфа-циклопентациклододецен-5,8-дион (1(4)), ЖХ-МС (ИЭР) 542 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,47 (s, 1Н), 7,46 (s, 1Н), 7,36 (m, 2Н), 7,22 (m, 2Н), 7,18 (m, 1Н), 6,18 (m, 2Н), 6,05 (d, J=4,8 Гц, 1Н), 5,11 (m, 0,5Н), 4,98 (m, 0,5Н), 4,91 (m, 2Н), 4,22 (m, 3Н), 3,99 (m, 1Н), 3,91 (m, 1H), 1,52 (d, J=6,8 Гц, 3Н), 1,36 (d, J=24,0 Гц, 3Н), 1,27 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,10S, 14aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,10-диметил-12-оксо-12-фенокси-октагидро-1,4,8,13-тетраокса-11-аза-12-фосфа-циклопентациклотридецен-5,9-дион (1(5/6)), ЖХ-МС (ИЭР) 542 (М+Н)+. (2R,3R,3aR,10S,12S, 14aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,10-диметил-12-оксо-12-фенокси-октагидро-1,4,8,13-тетраокса-11-аза-12-фосфа-циклопентациклотридецен-5,9-дион (1(5)), ЖХ-МС (ИЭР) 542 (М+Н)+. (2S,3aS,11S,15aR)-2-(2-амино-6-оксо-1,6-дигидро-пурин-9-ил)-11-метил-1-метилен-13-оксо-13-фенокси-декагидро-4,9,14-триокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1 (7/8)), ЖХ-МС (ИЭР) 556 (М+Н)+.
(2S,3aS,11S,13S,15aR)-2-(2-амино-6-оксо-1,6-дигидро-пурин-9-ил)-11-метил-1-метилен-13-оксо-13-фенокси-декагидро-4,9,14-триокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(7)), ЖХ-МС (ИЭР) 556 (М+Н)+,1Н ЯМР (ДМСО-d4, 400 МГц) δ 11,53 (s, 1H), 7,40 (m, 3Н), 7,27 (m, 2Н), 7,20 (m, 1Н), 6,27 (dd, J1=14,8 Гц, J2=11,6 Гц, 1Н), 6,08 (d, J=20,0 Гц, 1Н), 5,26 (br. s, 1H), 5,10 (br. s, 1H), 4,40 (m, 2H), 4,29 (m, 1H), 4,20 (m, 2H), 3,65 (m, 1H), 2,57 (m, 2H), 2,05 (m, 1H), 1,96 (m, 1H), 1,29 (d, J=22,8 Гц, 3Н), 1,21 (d, J=7,2 Гц, 3Н). (2S,3S,3aS,11S,13R,15aR)-2-(6-амино-пурин-9-ил)-3,11-диметил-1-метилен-13-оксо-13-фенокси-декагидро-4,9,14-триокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(8)), ЖХ-МС (ИЭР) 556 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,56 (s, 1Н), 7,72 (d, J=8,0 Гц, 1Н), 7,39 (m, 2Н), 7,21 (m, 3Н), 6,17 (t, J=7,2 Гц, 1Н), 6,08 (d, J=20,0 Гц, 1Н), 5,62 (d, J=8,0 Гц, 1Н), 5,40 (m, 1Н), 4,35 (m, 3Н), 4,20 (m, 2Н), 3,80 (m, 1H), 2,62 (m, 2Н), 2,07 (m, 1Н), 1,90 (m, 1Н), 1,30 (d, J=22,8 Гц, 3Н), 1,18 (d, J=7,2 Гц, 3Н). (2R,3aS,11S,15aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(9/10)), ЖХ-МС (ИЭР) 524 (М+Н)+. (2R,3aS,11S,13S,15aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-11-метил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(9)), ЖХ-МС (ИЭР) 524 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,32 (s, 1Н), 7,55 (d, J=8,0 Гц, 1H), 7,38 (m, 2Н), 7,24 (m, 2Н), 7,19 (m, 1Н), 6,19 (dd, J1=14,4 Гц, J2=11,2 Гц, 1Н), 6,13 (dd, J1=6,8 Гц, J2=6,0 Гц, 1H), 5,43 (d, J=8,0 Гц, 1Н), 5,30 (m, 1Н), 4,38 (m, 1H), 4,14 (m, 3Н), 4,03 (m, 1Н), 3,64 (m, 1H), 2,55 (m, 1H), 2,44 (m, 2Н), 2,29 (m, 1Н), 1,99 (m, 2Н), 1,21 (d, J=6,8 Гц, 3Н). (2S,3aR,11S,13R,15aS)-11-метил-2-(5-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(10)), ЖХ-МС (ИЭР) 524 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,36 (s, 1H), 7,73 (d, J=8,0 Гц, 1Н), 7,38 (m, 2H), 7,20 (m, 3H), 6,14 (t, J=6,8 Гц, 1H), 6,05 (t, J=10,8 Гц, 1H), 5,64 (d, J=8,0 Гц, 1H), 5,33 (m, 1H), 4,35 (m, 1H), 4,21 (m, 2H), 4,11 (m, 2H), 3,80 (m, 1H), 2,47 (m, 3H), 2,29 (m, 1H), 2,02 (m, 1H), 1,89 (m, 2H), 1,13 (d, J=6,8 Гц, 3H). (2R,3R,3aR,11S,5aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,11-диметил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(13/14)), ЖХ-МС (ИЭР) 556 (М+Н)+. (2R,3R,3aR,11S,13S,15aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,11-диметил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(13)), ЖХ-МС (ИЭР) 556 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,53 (s, 1Н), 7,40 (m, 3Н), 7,27 (m, 2Н), 7,20 (m, 1H), 6,27 (dd, J1=14,8 Гц, J2=11,6 Гц, 1Н), 6,08 (d, J=20,0 Гц, 1Н), 5,26 (br. s, 1Н), 5,10 (br. s, 1Н), 4,40 (m, 2Н), 4,29 (m, 1Н), 4,20 (m, 2Н), 3,65 (m, 1Н), 2,57 (m, 2Н), 2,05 (m, 1Н), 1,96 (m, 1Н), 1,29 (d, J=22,8 Гц, 3Н), 1,21 (d, J=7,2 Гц, 3Н).
(2R,3R,3aR,11S,13R,15aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,11-диметил-13-оксо-13-фенокси-октагидро-1,4,9,14-тетраокса-12-аза-13-фосфа-циклопентациклотетрадецен-5,10-дион (1(14)), ЖХ-МС (ИЭР) 556 (М+Н)+.1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,56 (s, 1H), 7,72 (d, J=8,0 Гц, 1Н), 7,39 (m, 2Н), 7,21 (m, 3Н), 6,17 (t, J=7,2 Гц, 1H), 6,08 (d, J=20,0 Гц, 1Н), 5,62 (d, J=8,0 Гц, 1H), 5,40 (m, 1Н), 4,35 (m, 3Н), 4,20 (m, 2Н), 3,80 (m, 1H), 2,62 (m, 2Н), 2,07 (m, 1Н), 1,90 (m, 1Н), 1,30 (d, J=22,8 Гц, 3Н), 1,18 (d, J=7,2 Гц, 3Н). (2R,3R,3aR,12S,16aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,12-диметил-14-оксо-14-фенокси-декагидро-1,4,10,15-тетраокса-13-аза-14-фосфа-циклопентациклопентадецен-5,11-дион (1(17/18)), ЖХ-МС (ИЭР) 560 (М+Н)+. (2R,3R,3aR,12S,14S,16aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,12-диметил-14-оксо-14-фенокси-декагидро-1,4,10,15-тетраокса-13-аза-14-фосфа-циклопентациклопентадецен-5,11-дион (1(17)), ЖХ-МС (ИЭР) 560 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,55 (s, 1Н), 7,54 (br. s, 1H), 7,40 (m, 2H), 7,22 (m, 3Н), 6,21 (dd, J1=14,4 Гц, J2=10,4 Гц, 1H), 6,05 (br. s, 1H), 5,43 (br. s, 1H), 5,28 (br. s, 1H), 4,48 (m, 1H), 4,39 (m, 1H), 4,17 (m, 2H), 4,09 (m, 1H), 3,80 (m, 1H), 2,58 (m, 1H), 2,42 (m, 1H), 1,83 (m, 1H), 1,72 (m, 1H), 1,65 (m, 2H), 1,29 (d, J=22,8 Гц, 3Н), 1,20 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,12S,14R,16aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,12-диметил-14-оксо-14-фенокси-декагидро-1,4,10,15-тетраокса-13-аза-14-фосфа-циклопентациклопентадецен-5,11-дион (1(18)), ЖХ-МС (ИЭР) 560 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,55 (s, 1H), 7,74 (d, J=8,0 Гц, 1H), 7,38 (m, 2H), 7,19 (m, 3Н), 6,11 (br. s, 1H), 6,01 (m, 1H), 5,69 (d, J=8,0 Гц, 1H), 5,21 (br. s, 1H), 4,43 (m, 1H), 4,28 (m, 2H), 4,09 (m, 2H), 3,86 (m, 1H), 2,66 (m, 1H), 2,30 (m, 1H), 1,85 (m, 1H), 1,69 (m, 2H), 1,51 (m, 1H), 1,32 (d, J=22,8 Гц, 3Н), 1,14 (d, J=7,2 Гц, 3Н). (2R,3R,3aR,13S,15S,17aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,13-диметил-15-оксо-15-фенокси-декагидро-1,4,11,16-тетраокса-14-аза-15-фосфа-циклопентациклогексадецен-5,12-дион (1(19/20)), ЖХ-МС (ИЭР) 584 (М+Н)+. (2R,3R,3aR,13S,15S,17aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,13-диметил-15-оксо-15-фенокси-декагидро-1,4,11,16-тетраокса-14-аза-15-фосфа-циклопентациклогексадецен-5,12-дион (1(19)), ЖХ-МС (ИЭР) 584 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,56 (s, 1Н), 7,66 (d, J=8,0 Гц, 1Н), 7,37 (m, 2Н), 7,19 (m, 3Н), 6,05 (m, 2Н), 5,58 (d, J=8,0 Гц, 1Н), 5,28 (br. s, 1Н), 4,35 (m, 1H), 4,26 (m, 2Н), 4,19 (m, 1Н), 4,01 (m, 1H), 3,86 (m, 1Н), 2,47 (m, 2Н), 1,61 (m, 4Н), 1,35 (m, 2Н), 1,30 (d, J=22,8 Гц, 3Н), 1,11 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,13S,15R,17aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-3-фтор-3,13-диметил-15-оксо-15-фенокси-декагидро-1,4,11,16-тетраокса-14-аза-15-фосфа-циклопентациклогексадецен-5,12-дион (1(20)), ЖХ-МС (ИЭР) 584 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,55 (s, 1H), 7,49 (d, J=6,8 Гц, 1H), 7,41 (m, 2Н), 7,28 (m, 2Н), 7,21 (m, 1Н), 6,19 (dd, J1=15,2 Гц, J2=10,4 Гц, 1H), 6,08 (d, J=19,6 Гц, 1H), 5,31 (d, J=6,8 Гц, 1H), 5,17 (br. s, 1Н), 4,50 (m, 1Н), 4,38 (m, 2Н), 3,95 (m, 2Н), 3,82 (m, 1H), 2,48 (m, 2Н), 1,61 (m, 4Н), 1,27 (d, J=19,2 Гц, 3Н), 1,24 (m, 2Н), 1,14 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,14S,16S,18aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,14-диметил-16-оксо-16-фенокси-додекагидро-1,4,12,17-тетраокса-15-аза-16-фосфа-циклопентациклогептадецен-5,13-дион (1(21/22)) ЖХ-МС (ИЭР) 598 (М+Н)+. (2R,3R,3aR,14S,16S,18aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,14-диметил-16-оксо-16-фенокси-додекагидро-1,4,12,17-тетраокса-15-аза-16-фосфа-циклопентациклогептадецен-5,13-дион (1(21)), ЖХ-МС (ИЭР) 598 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,55 (s, 1Н), 7,69 (d, J=8,0 Гц, 1H), 7,37 (m, 2Н), 7,17 (m, 3Н), 6,04 (m, 2Н), 5,63 (d, J=8,0 Гц, 1Н), 5,31 (br. s, 1H), 4,36 (m, 1Н), 4,29 (m, 2Н), 4,18 (m, 1Н), 4,00 (m, 1Н), 3,84 (m, 1Н), 2,45 (t, J=6,0 Гц, 2Н), 1,70 (m, 1Н), 1,57 (m, 3Н), 1,34 (m, 4Н), 1,31 (d, J=22,8 Гц, 3Н), 1,17 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,14S,16R,18aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,14-диметил-16-оксо-16-фенокси-додекагидро-1,4,12,17-тетраокса-15-аза-16-фосфа-циклопентациклогептадецен-5,13-дион (1(22)), ЖХ-МС (ИЭР) 598 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,54 (s, 1Н), 7,59 (d, J=7,6 Гц, 1Н), 7,39 (m, 2Н), 7,24 (m, 2Н), 7,19 (m, 1H), 6,16 (dd, J1=14,4 Гц, J2=10,0 Гц, 1H), 6,05 (m, 1H), 5,47 (d, J=7,6 Гц, 1H), 5,29 (br. s, 1H), 4,39 (m, 1H), 4,33 (m, 1H), 4,19 (m, 1H), 4,13 (m, 1H), 4,01 (m, 1H), 3,78 (m, 1H), 2,47 (m, 2H), 1,68 (m, 1H), 1,62 (m, 3H), 1,34 (m, 4H), 1,28 (d, J=22,8 Гц, 3Н), 1,19 (d, J=6,8 Гц, 3Н).
(2R,3R,3aR,15S,17S,19aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,15-диметил-17-оксо-17-фенокси-додекагидро-1,4,13,18-тетраокса-16-аза-17-фосфа-циклопентациклооктадецен-5,14-дион (1(23/24)), ЖХ-МС (ИЭР) 612 (М+Н)+. (2R,3R,3aR,15S,17S,19aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,15-диметил-17-оксо-17-фенокси-додекагидро-1,4,13,18-тетраокса-16-аза-17-фосфа-циклопентациклооктадецен-5,14-дион (1(23)), ЖХ-МС (ИЭР) 612 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,55 (s, 1H), 7,56 (d, J=8,0 Гц, 1H), 7,36 (m, 2Н), 7,19 (m, 3Н), 6,05 (m, 2Н), 5,48 (d, J=8,0 Гц, 1Н), 5,25 (br. s, 1Н), 4,33 (m, 4Н), 3,92 (m, 1Н), 3,84 (m, 1Н), 2,44 (m, 2Н), 1,58 (m, 4Н), 1,30 (m, 6Н), 1,28 (d, J=22,8 Гц, 3Н), 1,19 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,15S,17R,19aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-3-фтор-3,15-диметил-17-оксо-17-фенокси-додекагидро-1,4,13,18-тетраокса-16-аза-17-фосфа-циклопентациклооктадецен-5,14-дион (1(24)), ЖХ-МС (ИЭР) 612 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,54 (s, 1H), 7,65 (d, J=8,0 Гц, 1Н), 7,38 (m, 2Н), 7,21 (m, 3Н), 6,10 (dd, J1=14,4 Гц, J2=9,6 Гц, 1Н), 6,04 (m, 1Н), 5,52 (d, J=8,0 Гц, 1Н), 5,24 (br. s, 1Н), 4,32 (m, 2Н), 4,23 (m, 2Н), 3,96 (m, 1Н), 3,80 (m, 1Н), 2,44 (m, 2Н), 1,59 (m, 4Н), 1,31 (m, 6Н), 1,28 (d, J=22,8 Гц, 3Н), 1,21 (d, J=6,8 Гц, 3Н). (2R,3R,3aR,9S,11S,13aR,15R,16R,16aR,22S,24S,26aR)-2,15-бис(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3,16-дифтор-3,9,16,22-тетраметил-11,24-дифеноксидодекагидро-2Н,13Н-дифторо[3,2-j:3',2'-v][1,6,9,13,18,21,3,15,2,14]гексаоксадиазадифосфациклотетракозин-5,8,18,21(6Н,9Н,19Н,22Н)-тетрон 11,24-диоксид (2(1)), ЖХ-МС (ИЭР) 1055. (2R,3R,3aR,11S,13S,15aR,17R,18R,18aR,26S,28S,30aR)-2,17-бис(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3,18-дифтор-3,11,18,26-тетраметил-13,28-дифеноксигексадекагидро-2Н,15Н-дифторо[3,2-l:3',2'-z][1,6,11,15,20,25,3,17,2,16]гексаоксадиазадифосфациклооктакозин-5,10,20,25(6Н,11Н,21Н,26Н)-тетрон 13,28-диоксид (2(2)), ЖХ-МС (ИЭР) 1111 (М+Н)+,1Н ЯМР (ДМСО-d6, 400 МГц) δ 11,55 (s, 2Н), 7,65 (d, J=8,0 Гц, 2Н), 7,38 (m, 4Н), 7,22 (m, 4Н), 7,19 (m, 2Н), 6,15 (dd, J1=14,0 Гц, J2=10,0 Гц, 2Н), 6,03 (m, 2Н), 5,57 (d, J=8,0 Гц, 2Н), 5,28 (br. s, 2Н), 4,37 (m, 2Н), 4,28 (m, 2Н), 4,17 (m, 4Н), 4,07 (m, 2Н), 3,85 (m, 2Н), 2,53 (m, 4Н), 1,88 (m, 4Н), 1,30 (d, J=22,8 Гц, 6Н), 1,23 (d, J=7,2 Гц, 6Н).
Пример 14. Получение фармацевтической композиции в виде таблетки. Крахмал (1600 мг), молотую лактозу (1600 мг), тальк (400 мг), и (2R,3R,3aR,11S,13S,15aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-циклопентациклотетрадецен-5,10-дион (1(13)) (1000 мг) смешивали и прессовали в брусок. Полученный брусок измельчали в гранулы, просеивали через сито и собирали гранулы размером 14-16 меш. Полученные таким образом гранулы сформировали в таблетки подходящей формы весом 100-300 мг каждая.
Пример 15. Получение фармацевтической композиции в виде капсул. (2R,3R,3aR,11S,13S,15aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-циклопентациклотетрадецен-5,10-дион (1(13)) тщательно смешивали с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывали в желатиновые капсулы подходящего размера по 450 мг или 600 мг в каждой капсуле.
Пример 16. Получение фармацевтической композиции в виде капсул. (2R,3R,3aR,11S,13S,15aR)-2-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-циклопентациклотетрадецен-5,10-дион (1(13)) и AV-4047 или AV-4056, или AV-4058 и порошок лактозы тщательно перемешивали в соотношении 4:(0,5÷1):2. Полученную порошкообразную смесь упаковывали в желатиновые капсулы подходящего размера по 350 мг или 700 мг в каждой капсуле.
Пример 17. Получение фармацевтической композиции в виде капсул. (2R,3R,3aR,11S,13S,15aR)-2-(2,4-диоксо-3,4-дигидро-2H-пиримидин-циклопентациклотетрадецен-5,10-дион (1(13)), Daclatasvir (Daklinza, BMS790052) и порошок лактозы тщательно перемешивали в соотношении 4:1:2. Полученную порошкообразную смесь упаковывали в желатиновые капсулы подходящего размера по 700 мг в каждой капсуле.
Пример 18. Анти-ВГС активность (ЕС50) и цитотоксичность (СС50) пролекарств общей формулы 1. Для определения противовирусной активности химиотерапевтических агентов общей формулы 1 (тестируемых соединений) применялся анализ репликонов ВГС. В качестве референтного препарата использовали Sovaldi (PSI-7977). При анализе репликонов ВГС использовалась клеточная линия гепатоцеллюлярной карциномы человека Huh7, содержащая репликоны ВГС и приобретенная у стороннего производителя. В 96-луночные планшеты высевали клетки плотностью 7,5×103 клеток на лунку в 50 мкл питательной среды. Использовался свежеприготовленный маточный раствор соединения двойной концентрации в питательной среде (DMEM IX, Cellgro; кат. # 10-013-CV). Всего из маточного раствора двойной концентрации в питательной среде приготовили 11 3-кратных серийных разведений испытуемых соединений с конечной концентрацией от 20 нМ до 0,2 пМ. Не менее чем через 4 часа после посадки клеток начинали обработку соединений путем добавления в планшеты 50 мкл разведенного соединения. Таким образом, конечные концентрации соединения после разбавления 1:1 в культуральной среде варьировались от 10 нМ до 0,1 пМ. Конечная концентрация ДМСО составляа 0,5%. Клетки и ингибиторы инкубировали в течение 3 дней при 37°С/5% СО2. Среду удаляли из планшетов легким постукиванием. Клетки фиксировали 100 мкл смеси ацетона-метанола (1:1) в течение 1 минуты, промывали 3 раза фосфатным буфером (PBS) и затем блокировали 10% бычьей фетальной сывороткой (FBS) в PBS (150 мкл/лунку) в течение часа при комнатной температуре. Далее клетки трижды промывали буфером PBS и инкубировали в течение 2 часов при 37°С с моноклональными антителами к Core-антигену вируса гепатита С (100 мкл/лунку) (Affinity Bioreagents; кат. # MA1-080, 1 мг/мл маточного раствора разбавленного 1:4000 в 10% FBS-PBS). Затем клетки трижды промывали PBS и инкубировали в течение часа при 37°С с козьими антимышиными антителами, конъюгированными с пероксидазой хрена (100 мкл/лунку) (разбавл. 1:3500 в 10% FBS-PBS). Клетки трижды промывали PBS и проявляли раствором OPD по 100 мкл/лунку (1 таблетка OPD + 12 мл цитрат/фосфатного буфера + 5 мкл 30% Н2О2 на планшет) в течение 30 минут в темноте при комнатной температуре. Реакцию останавливали добавлением 2N H2SO4 (100 мкл/лунку) и измеряли оптическую плотность при А490 X при помощи многоканального спектрофотометра Victor3 V 1420 (Perkin Elmer). Значения ЕС50 тестируемых соединений рассчитывали на основе уравнений наилучшего приближения, полученных при помощи программы Xlfit.
Цитотоксичность тестируемых соединений изучалась параллельно на той же клеточной линии Huh7. Жизнеспособность клеток определяли с помощью набора ATPLite Kit (Perkin Elmer, Бостон, США) в соответствии с инструкциями производителя. Клетки высевали в черные 96-луночные планшеты с прозрачным дном (7,5×103 клеток на лунку) в 50 мкл среды. Через 18 часов начинали обработку соединений добавлением в планшеты 50 мкл разведенных соединений. Каждое разведенное соединение тестировали в трех повторах. Затем клетки и ингибиторы инкубировали в течение 96 часов при 37°С/5% СО2. Планшеты дважды промывали PBS (0,2 мл/лунку) и затем лизировали добавлением лизирующего буфера (0,05 мл/лунку) (все реагенты включены в набор ATPLite Kit). После 5-минутного выдерживания на вращающейся платформе добавляли субстратный буфер (0,05 мл/лунку). Планшеты инкубировали еще 5 минут, затем вырерживали в темноте в течение 10 минут и измеряли люминесценцию на приборе TopCount NXT (Packard, Perkin Elmer). Значения CC50 для всех тестируемых соединений определяли при помощи программы XLfit 4.1.
Пример 19
Метаболическая стабильность макрогетероциклического нуклеозидного производного, представленным формулой 1 и 2, и Sovaldi в S9 фракции микросом печени человека. Исходные растворы тестируемых соединений и PSI-352707 (10 мМ) готовили в ДМСО и хранили при -20°С. Десятикратные стандартные растворы PSI-352707 (10, 8, 5, 2 и 1 мкМ) готовили разведением исходного раствора смесью вода-ацетонитрил (1/1, об. %). Общий объем приготовленной реакционной смеси составил 350,5 мкЛ, включая 0,1 М калий-фосфатного буфера (рН 7,4), 1 мМ НАДФН (NADPH), 7 мМ G6P, 1,5 ед./мл G6PDH, 3,3 мМ MgCl2, 5 мМ УДФГК (UDPGA), 122 мкЛ деионизированной воды и 1 мкМ тестируемого соединения. Реакционную смесь предварительно инкубировали при 400 об/мин, 37°С. Реакцию начинали добавлением в реакционную смесь 1 мг/мл S9 фракции печени человека и проводили инкубацию при 400 об/мин, 37°С. В заданные временные точки (0, 0,25, 0,5, 1, 2, 4, 6 8, 24 ч), брали аликвоты объемом 30 мкЛ и останавливали реакцию добавлением 180 мкл ацетонитрила, содержащего 200 нг/мл внутреннего стандарта (IS, толбутамид). Осаждение проводилось на льду в холодильнике при +4°С в течение 15 мин. Затем образцы центрифугировались в течение 10 мин при 3000 об/мин. 150 мкл супернатанта отбирали для ЖХ-МС/МС анализа. Для приготовления калибровочных образцов PSI-352707 смешивали 148 мкл супернатанта после инкубации без испытуемого соединения с 2,1 мкл соответствующего десятикратного стандартного раствора десятикратной концентрации PSI-352707.
ЖХ-МС/МС анализ производили с использованием системы QTrap 5500 System (АВ Sciex) в сочетании с системой 1290 UPLC System (Agilent). Разделение проводилось на колонке BioBasic АХ (50×2,1 мм, 5 мк, Thermo Scientific). Подвижная фаза состояла из растворителя А (10 мМ формиата аммония в смеси вода-ацетонитрил (7/3, об. %), рН 5,.6) и растворителя В (1 мМ формиата аммония в смеси вода-ацетонитрил (7/3, об. %), рН 9,8). Элюирование проводили со ступенчатым градиентом (0-0,4 мин 80%В. 0,8-2,0 мин 40%В, 2,2-3,0 мин 80%В).
Источник ABSciex QTrap 5500 (TurbolonSpray) работал в режиме отрицательной ионизации (температура источника составляла 650°С, давление газа 1 и газа 2 соответственно составляло 65 и 40 psi (фунтов на кв. дюйм)). PSI-352707 и IS (толбутамид) были обнаружены в режиме MRM по переходам при отношении массы к заряду от 410 до 150 для PSI-352707 (энергия соударения -30 кВ) и 269/170 для толбутамида (энергия соударения -25 kV). Скорость потока составляла 0,5 мл/мин, объем впрыска - 1 мкл. Анализ и количественное определение данных производили при помощи программы Analyst (АВ Sciex).
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Изобретение может быть использовано в медицине, ветеринарии, биохимии.
Реферат
Настоящее изобретение относится к применимому в медицине производному, композиции на его основе и его получению. Предложено производное формулы 1 или 2, их стереоизомергде Ar представляет собой фенил; Rи Rвыбраны из Н, F, Cl, СН, ОН; Rпредставляет собой Н или СН; X представляет собой кислород или этандиил-1,1(С=СН); Y представляет собой CH(R)(CH), CH(R)(CH)C(O)O(CH); Rпредставляет собой Н или СН; k имеет значение от нуля до шести; m имеет значение от нуля до двух; n имеет значение от единицы до четырех; Q представляет собой радикал, выбранный из Q1-Q4;где Rявляется заместителем, выбранным из Н, F, Cl, СН, ОН; стрелка (→) обозначает место присоединения Q1-Q4. Предложенный процесс для получения соединений по п. 1 или 2 включает циклизацию кислоты формулы 3 или 16где Ar, R, R, R, X, Y и Q определены выше. Предложены новое эффективное для лечения гепатита С производное и эффективный процесс его получения, а также фармацевтическая композиция на его основе. Предложенное производное является пролекарством для лечения вирусных заболеваний и является ингибитором полимеразы HCV NS5B, полимеразы HBV DNA и обратной транскриптазы HIV-1. 4 н. и 6 з.п. ф-лы, 19 пр.
Формула

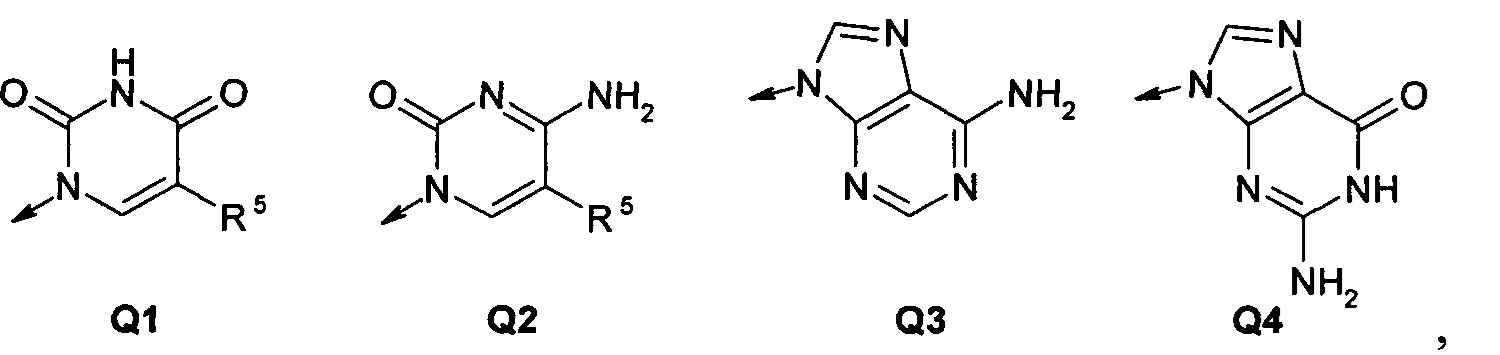
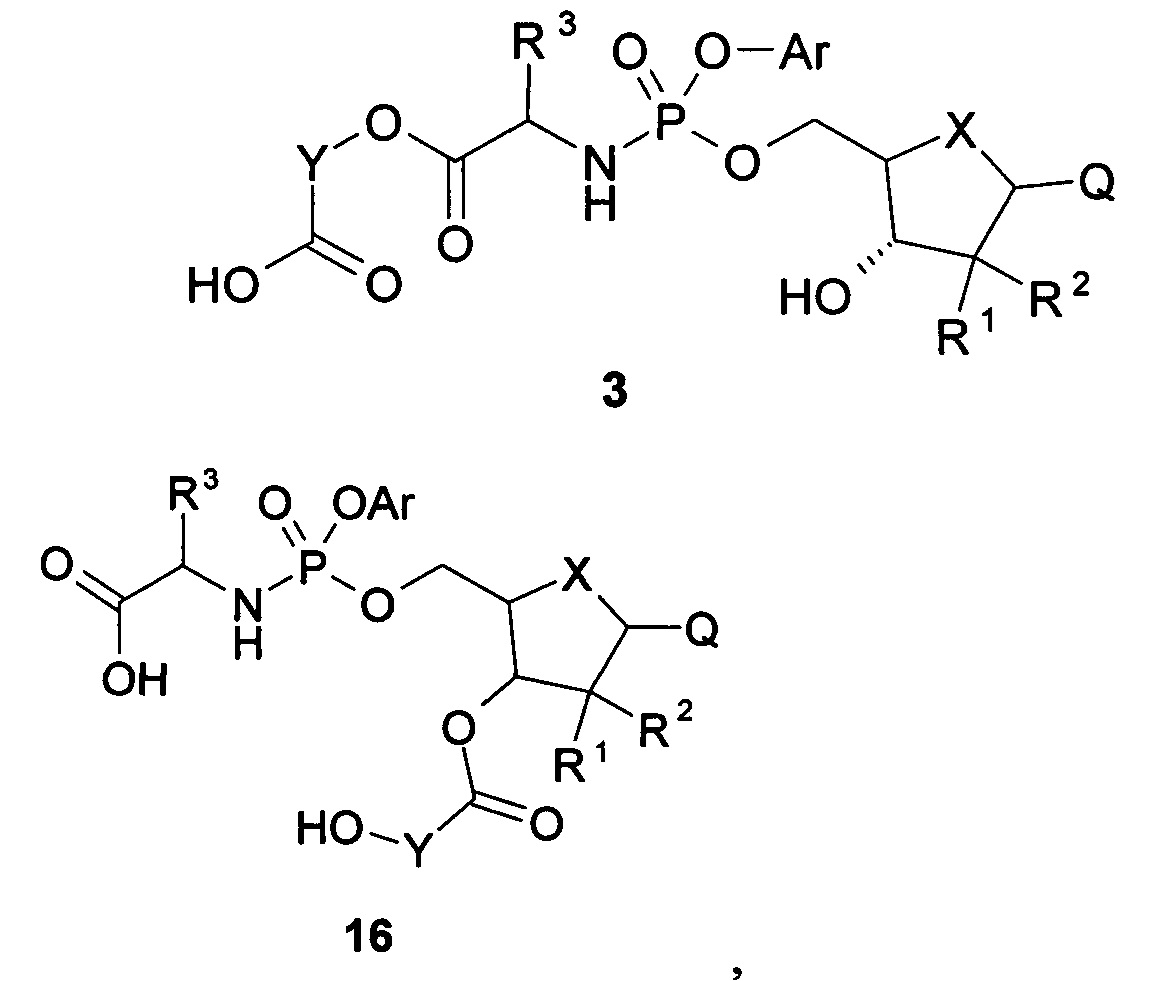

Комментарии