Производные глюкопиранозилоксипиразола и их применение в лекарственных средствах - RU2317302C2
Код документа: RU2317302C2
Описание
Область техники
Данное изобретение относится к производным глюкопиранозилоксипиразола или их фармацевтически приемлемым солям, которые полезны в качестве лекарственных средств, и их фармацевтическим применениям.
Более конкретно, данное изобретение относится к производным глюкопиранозилоксипиразола, представленным общей формулой
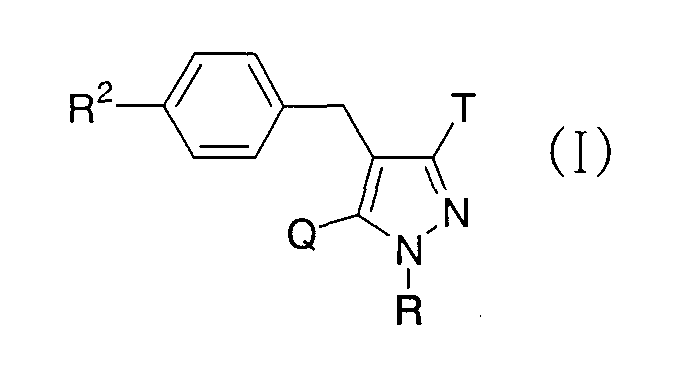
где R представляет атом водорода, низшую алкильную группу или группу, образующую пролекарство; один из Q и Т представляет группу, представленную общей формулой
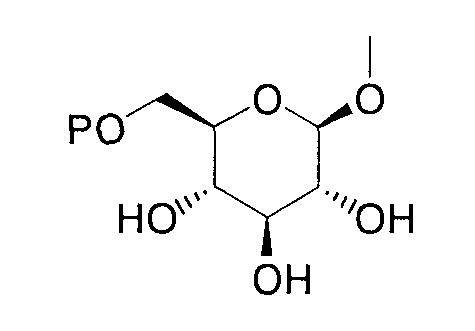
(где Р представляет атом водорода или группу, образующую пролекарство), тогда как другой представляет низшую алкильную группу или группу галоген(низший алкил); R2 представляет атом водорода, низшую алкильную группу, низшую алкоксигруппу, низшую алкилтиогруппу, группу галоген(низший алкил) или атом галогена; и при условии, что Р не представляет атом водорода, когда R представляет атом водорода или низшую алкильную группу, или их фармацевтически приемлемым солям, которые полезны в качестве агентов для предупреждения или лечения заболевания, связанного с гипергликемией, такого как диабет, осложнения, связанные с диабетом или ожирение, из которых производные глюкопиранозилоксипиразола, которые имеют ингибирующую активность в отношении SGLT2 человека, представленные общей формулой

где R0 представляет атом водорода или низшую алкильную группу; один из Q0 и Т0 представляет группу, представленную общей формулой
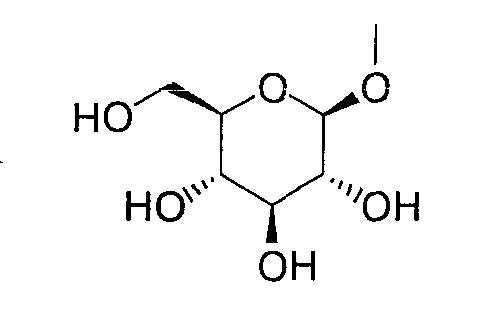
тогда как другой представляет низшую алкильную группу или группу галоген(низший алкил); и R2 представляет атом водорода, низшую алкильную группу, низшую алкоксигруппу, низшую алкилтиогруппу, группу галоген(низший алкил) или атом галогена, являются активными формами, и к их фармацевтическим применениям.
Предпосылки создания изобретения
Диабет является одним из заболеваний, связанных с образом жизни, и имеющим в основе изменение привычек питания и отсутствие физической нагрузки. Таким образом, в отношении пациентов с диабетом проводят терапию с использованием диеты и физических упражнений. Кроме того, в тех случаях, когда достаточный контроль и непрерывное проведение этой терапии являются затруднительными, проводят одновременно медикаментозное лечение. В настоящее время в качестве антидиабетических агентов используют бигуаниды, сульфонилмочевины и усилители чувствительности к инсулину. Однако, бигуаниды и сульфонилмочевины обнаруживают иногда побочные действия, такие как молочнокислый ацидоз и гипогликемия соответственно. В случае применения усилителей чувствительности к инсулину наблюдают иногда вредные побочные действия, такие как отек, и необходимо также проявлять внимание в отношении прогрессирования ожирения. Таким образом, для решения этих проблем было желательным развитие антидиабетических агентов, имеющих новый механизм действия.
В последние годы прогрессировало развитие антидиабетических агентов нового типа, которые стимулируют экскрецию глюкозы с мочой и низкий уровень глюкозы в крови предотвращением избыточной реабсорбции глюкозы в почке (J. Clin. Invest., Vol. 79, pp. 1510-1515 (1987)). Кроме того, сообщается, что SGLT2 (Na+/глюкоза-котранспортер 2) присутствует в сегменте S1 проксимального почечного канальца и участвует в основном в реабсорбции глюкозы, фильтруемой через клубочки почки (J. Clin. Invest., Vol. 93, pp. 397-404 (1994)). Таким образом, ингибирование активности SGLT2 человека предотвращает реабсорбцию избыточной глюкозы в почке и вследствие этого стимулирует экскрецию избыточной глюкозы через мочу и нормализует уровень глюкозы в крови. Таким образом, желательным было быстрое развитие антидиабетических агентов, которые имеют сильную ингибирующую активность в отношении SGLT2 человека и имеют новый механизм действия. Кроме того, поскольку такие агенты стимулируют экскрецию избыточной глюкозы через мочу и в результате уменьшается накопление глюкозы в теле, ожидается также, что они обладают предупреждающим или ослабляющим действием на ожирение и мочегонным действием. Кроме того, предполагается, что эти агенты являются полезными для разнообразных родственных заболеваний, которые имеют место при прогрессировании диабета или ожирения вследствие гипергликемии.
Что касается соединений, имеющих пиразольную часть, описано, что WAY-123783 увеличивает количество экскретируемой глюкозы у здоровых мышей. Однако его действия на человека вообще не были описаны (J. Med. Chem., Vol. 39, pp. 3920-3928 (1996)).
Описание изобретения
Авторы данного изобретения провели обстоятельное исследование для нахождения соединений, имеющих ингибирующую активность в отношении SGLT2 человека. В результате было обнаружено, что соединения, представленные приведенной выше формулой (I), превращаются в производные глюкопиранозилоксипиразола, представленные приведенной выше формулой (II), в качестве их активных форм in vivo и обнаруживают превосходную ингибирующую активность в отношении SGLT2 человека, как упоминается ниже, составляя, таким образом, основу данного изобретения.
Данное изобретение относится к следующим производным глюкопиранозилоксипиразола или их фармацевтически приемлемым солям, которые проявляют ингибирующую активность в отношении SGLT2 человека in vivo и обнаруживают превосходное гипогликемическое действие посредством экскреции избыточной глюкозы с мочой, предотвращая реабсорбцию глюкозы в почке, и обеспечивает их фармацевтические применения.
Таким образом, данное изобретение относится к производному глюкопиранозилоксипиразола, представленному общей формулой

где R представляет атом водорода, низшую алкильную группу или группу, образующую пролекарство; один из Q и Т представляет группу, представленную общей формулой

(где Р представляет атом водорода или группу, образующую пролекарство), тогда как другой представляет низшую алкильную группу или группу галоген(низший алкил); R2 представляет атом водорода, низшую алкильную группу, низшую алкоксигруппу, низшую алкилтиогруппу, группу галоген(низший алкил) или атом галогена; и при условии, что Р не представляет атом водорода, когда R представляет атом водорода или низшую алкильную группу, или его фармацевтически приемлемой соли.
Данное изобретение относится также к фармацевтической композиции, ингибитору SGLT2 человека и агенту для предотвращения или лечения заболевания, связанного с гипергликемией, которая содержит в качестве активного ингредиента производное глюкопиранозилоксипиразола, представленное приведенной выше общей формулой (I), или его фармацевтически приемлемую соль.
Данное изобретение относится к способу для предотвращения или лечения заболевания, связанного с гипергликемией, который включает введение эффективного количества производного глюкопиранозилоксипиразола, представленного приведенной выше общей формулой (I), или его фармацевтически приемлемой соли.
Данное изобретение относится к применению производного глюкопиранозилоксипиразола, представленного приведенной выше общей формулой (I), или его фармацевтически приемлемой соли для производства фармацевтической композиции для предотвращения или лечения заболевания, связанного с гипергликемией.
Кроме того, данное изобретение относится к фармацевтической комбинации, которая содержит (А) производное глюкопиранозилоксипиразола, представленное приведенной выше общей формулой (I), или его фармацевтически приемлемую соль и (В) по меньшей мере одно вещество, выбранное из группы, состоящей из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, усилителя секреции инсулина, препарата инсулина, антагониста рецептора глюкагона, стимулятора рецепторной киназы инсулина, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеинтирозинфосфатазы-1В, ингибитора гликогенфосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозобисфосфатазы, ингибитора пируватдегидрогеназы, ингибитора глюконеогенеза печени, D-хироинозита, ингибитора гликогенсинтазы-киназы-3, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов прогрессирующего гликозилирования, ингибитора протеинкиназы С, антагониста рецептора γ-аминомасляной кислоты, антагониста натриевого канала, ингибитора фактора транскрипции NF-κ В, ингибитора липидпероксидазы, ингибитора дипептидазы N-ацетилированной-α-связанной кислоты, инсулин-подобного фактора роста I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервов, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, ингибитора гидроксиметилглутарил-кофермента А-редуктазы, производного фибриновой кислоты, агониста β3-адреноцептора, ингибитора ацил-кофермента А-холестерин-ацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора белка-переносчика микросомного триглицерида, ингибитора липоксигеназы, ингибитора карнитинпальмитоил-трансферазы, ингибитора скваленсинтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, вещества, усиливающего экскрецию желчной кислоты, ингибитора котранспортера натрия/желчной кислоты, ингибитора белка-переносчика сложных эфиров холестерина, супрессанта аппетита, ингибитора ангиотензинпревращающего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелинпревращающего фермента, антагониста рецептора эндотелина, диуретического агента, антагониста кальция, вазодилатирующего антигипертензивного агента, агента, блокирующего симпатическую нервную систему, антигипертензивного агента, действующего на центральную нервную систему, агониста α2-адреноцептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, агента, способствующего выведению мочевой кислоты, и подщелачивающего мочу агента.
Данное изобретение относится к способу предупреждения или лечения заболевания, связанного с гипергликемией, включающему введение эффективного количества (А) производного глюкопиранозилоксипиразола, представленного приведенной выше общей формулой (I), или его фармацевтически приемлемой соли, в комбинации с (В) по меньшей мере одним веществом, выбранным из группы, состоящей из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, усилителя секреции инсулина, препарата инсулина, антагониста рецептора глюкагона, стимулятора рецепторной киназы инсулина, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеинтирозинфосфатазы-1В, ингибитора гликогенфосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозобисфосфатазы, ингибитора пируватдегидрогеназы, ингибитора глюконеогенеза печени, D-хироинозита, ингибитора гликогенсинтазы-киназы-3, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов прогрессирующего гликозилирования, ингибитора протеинкиназы С, антагониста рецептора γ -аминомасляной кислоты, антагониста натриевого канала, ингибитора фактора транскрипции NF-κВ, ингибитора липидпероксидазы, ингибитора дипептидазы N-ацетилированной-α-связанной кислоты, инсулин-подобного фактора роста I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервов, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, ингибитора гидроксиметилглутарил-кофермента А-редуктазы, производного фибриновой кислоты, агониста β3 -адреноцептора, ингибитора ацил-кофермента А-холестерин-ацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора белка-переносчика микросомного триглицерида, ингибитора липоксигеназы, ингибитора карнитинпальмитоил-трансферазы, ингибитора скваленсинтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, вещества, усиливающего экскрецию желчной кислоты, ингибитора котранспортера натрия/желчной кислоты, ингибитора белка-переносчика сложных эфиров холестерина, супрессанта аппетита, ингибитора ангиотензинпревращающего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелинпревращающего фермента, антагониста рецептора эндотелина, диуретического агента, антагониста кальция, вазодилатирующего антигипертензивного агента, агента, блокирующего симпатическую нервную систему, антигипертензивного агента, действующего на центральную нервную систему, агониста α2-адреноцептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, агента, способствующего выведению мочевой кислоты, и подщелачивающего мочу агента.
Данное изобретение относится к применению (А) производного глюкопиранозилоксипиразола, представленного приведенной выше общей формулой (I), или его фармацевтически приемлемой соли и (В) по меньшей мере одного вещества, выбранного из группы, состоящей из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, усилителя секреции инсулина, препарата инсулина, антагониста рецептора глюкагона, стимулятора рецепторной киназы инсулина, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеинтирозинфосфатазы-1В, ингибитора гликогенфосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозобисфосфатазы, ингибитора пируватдегидрогеназы, ингибитора глюконеогенеза печени, D-хироинозита, ингибитора гликогенсинтазы-киназы-3, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов прогрессирующего гликозилирования, ингибитора протеинкиназы С, антагониста рецептора γ-аминомасляной кислоты, антагониста натриевого канала, ингибитора фактора транскрипции NF-κВ, ингибитора липидпероксидазы, ингибитора дипептидазы N-ацетилированной-α-связанной кислоты, инсулин-подобного фактора роста I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервов, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, ингибитора гидроксиметилглутарил-кофермента А-редуктазы, производного фибриновой кислоты, агониста β3-адреноцептора, ингибитора ацил-кофермента А-холестерин-ацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора белка-переносчика микросомного триглицерида, ингибитора липоксигеназы, ингибитора карнитинпальмитоил-трансферазы, ингибитора скваленсинтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, вещества, усиливающего экскрецию желчной кислоты, ингибитора котранспортера натрия/желчной кислоты, ингибитора белка-переносчика сложных эфиров холестерина, супрессанта аппетита, ингибитора ангиотензинпревращающего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелинпревращающего фермента, антагониста рецептора эндотелина, диуретического агента, антагониста кальция, вазодилатирующего антигипертензивного агента, агента, блокирующего симпатическую нервную систему, антигипертензивного агента, действующего на центральную нервную систему, агониста α2-адреноцептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, агента, способствующего выведению мочевой кислоты, и подщелачивающего мочу агента, для производства фармацевтической композиции для предупреждения или лечения заболевания, связанного с гипергликемией.
В данном изобретении термин "пролекарство" означает соединение, которое превращается в производное глюкопиранозилоксипиразола, представленное приведенной выше общей формулой (II), в виде его активной формы in vivo. В качестве примеров групп, образующих пролекарства, в случаях, когда такие группы локализованы при гидроксигруппе, иллюстрируются гидроксизащитная группа, используемая обычно в качестве пролекарства, такая как низшая ацильная группа, (низший алкокси)замещенная низшая ацильная группа, (низший алкокси)карбонилзамещенная низшая ацильная группа, низшая алкоксикарбонильная группа и (низший алкоксикарбонил)замещенная низшая алкоксикарбонильная группа, а в случаях, когда такие группы локализованы при атоме азота, аминозащитная группа, используемая обычно в качестве пролекарства, такая как низшая ацильная группа, низшая алкоксикарбонильная группа, низшая ацилоксиметильная группа и низшая алкоксикарбонилоксиметильная группа.
В качестве примеров производных глюкопиранозилоксипиразола, представленных приведенной выше общей формулой (I), представлены, например, соединения, представленные общей формулой
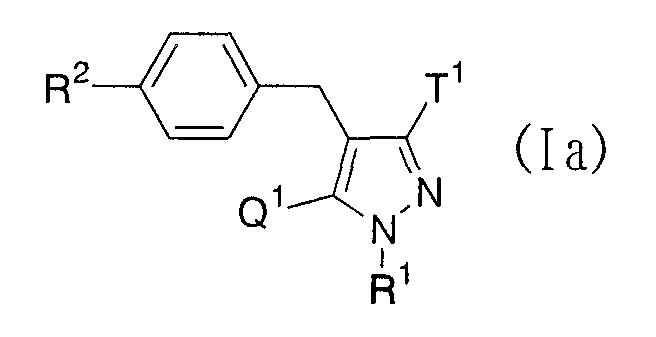
где R1 представляет атом водорода, низшую алкильную группу, низшую ацильную группу, низшую алкоксикарбонильную группу, низшую ацилоксиметильную группу или низшую алкоксикарбонилоксиметильную группу; один из Q1 и Т1 представляет группу, представленную общей формулой

(где Р1 представляет атом водорода, низшую ацильную группу, (низший алкокси)замещенную низшую ацильную группу, (низший алкокси)карбонилзамещенную низшую ацильную группу, низшую алкоксикарбонильную группу и (низший алкокси)замещенную низшую алкоксикарбонильную группу, тогда как другой представляет низшую алкильную группу или группу галоген(низший алкил); R2 представляет атом водорода, низшую алкильную группу, низшую алкоксигруппу, низшую алкилтиогруппу, группу галоген(низший алкил) или атом галогена; и при условии, что Р1 не представляет атом водорода, когда R1 представляет атом водорода или низшую алкильную группу.
В данном изобретении термин "низшая алкильная группа" означает алкильную группу с прямой или разветвленной цепью, имеющую 1-6 атомов углерода, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или подобные; термин "низшая алкоксигруппа" означает алкоксигруппу с прямой или разветвленной цепью, имеющую 1-6 атомов углерода, такую как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, изопентилоксигруппа, неопентилоксигруппа, трет-пентилоксигруппа, гексилоксигруппа или подобные; и термин "низшая алкилтиогруппа" означает алкилтиогруппу с прямой или разветвленной цепью, имеющую 1-6 атомов углерода, такую как метилтиогруппа, этилтиогруппа, пропилтиогруппа, изопропилтиогруппа, бутилтиогруппа, изобутилтиогруппа, втор-бутилтиогруппа, трет-бутилтиогруппа, пентилтиогруппа, изопентилтиогруппа, неопентилтиогруппа, трет-пентилтиогруппа, гексилтиогруппа или подобные. Термин "атом галогена" означает атом фтора, атом хлора, атом брома или атом йода; и термин "группа галоген(низший алкил)" означает вышеупомянутую низшую алкильную группу, замещенную различными или одинаковыми 1-3 атомами галогена, определенными выше. Термин "низшая ацильная группа" означает прямую, разветвленную или циклическую ацильную группу, имеющую 2-7 атомов углерода, такую как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, пивалоильная группа, гексаноильная группа и циклогексилкарбонильная группа; и термин "(низший алкокси)замещенная низшая ацильная группа" означает вышеупомянутую низшую ацильную группу, замещенную вышеупомянутой низшей алкоксигруппой. Термин "низшая алкоксикарбонильная группа" означает прямую, разветвленную или циклическую алкоксикарбонильную группу, имеющую 2-7 атомов углерода, такую как метоксикарбонильная группа, этоксикарбонильная группа, изопропилоксикарбонильная группа, изобутилоксикарбонильная группа и циклогексилоксикарбонильная группа; термин "(низший алкоксикарбонил)замещенная низшая ацильная группа" означает вышеупомянутую низшую ацильную группу, замещенную вышеупомянутой низшей алкоксикарбонильной группой, такую как 3-(этоксикарбонил)пропионильная группа; и термин "(низший алкокси)замещенная низшая алкоксикарбонильная группа означает вышеупомянутую низшую алкоксикарбонильную группу, замещенную вышеупомянутой алкоксигруппой, такую как 2-мтоксиэтоксикарбонильная группа. Кроме того, термин "низшая ацилоксиметильная группа" означает гидроксиметильную группу, О-замещенную вышеупомянутой низшей ацильной группой; а термин "низшая алкоксикарбонилоксиметильная группа" означает гидроксиметильную группу, О-замещенную вышеупомянутой низшей алкоксикарбонильной группой.
В заместителе R предпочтительными являются атом водорода или алкильная группа с прямой или разветвленной цепью, имеющая 1-3 атома углерода; более предпочтительными являются атом водорода, этильная группа, пропильная группа или изопропильная группа; и наиболее предпочтительной является изопропильная группа вследствие метаболической стабильности во фракции S9 печени человека. В заместителе R2 алкильная группа с прямой или разветвленной цепью, имеющая 1-4 атома углерода, алкоксигруппа с прямой или разветвленной цепью, имеющая 1-3 атома углерода, или алкилтиогруппа с прямой или разветвленной цепью, имеющая 1-3 атома углерода, являются предпочтительными; и этильная группа, этоксигруппа, изопропоксигруппа, метоксигруппа или метилтиогруппа являются более предпочтительными. В заместителях Q и Т предпочтительно, чтобы заместитель Q был низшей алкильной группой или группой галоген(низший алкил). Среди них предпочтительной является низшая алкильная группа; более предпочтительной является алкильная группа с прямой или разветвленной цепью, имеющая 1-3 атома углерода; и наиболее предпочтительной является метильная группа. В заместителе Р предпочтительными являются низшая ацильная группа и низшая алкоксикарбонильная группа; более предпочтительной является низшая алкоксикарбонильная группа; и наиболее предпочтительной является алкоксикарбонильная группа с прямой или разветвленной цепью, имеющая 2-5 атомов углерода. Конкретно, предпочтительными являются метоксикарбонильная группа, этоксикарбонильная группа, изопропоксикарбонильная группа или изобутоксикарбонильная группа.
В качестве соединений данного изобретения предпочтительными являются
4-[(4-изопропоксифенил)метил]-1-изопропил-3-(6-О-метоксикарбонил-β -D-глюкопиранозилокси)-5-метилпиразол,
3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол,
3-(6-О-изопропоксикарбонил-β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол,
3-(6-О-изобутоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол,
4-[(4-этилфенил)метил]-1-изопропил-3-(6-О-метоксикарбонил-β-D-глюкопиранозилокси)-5-метилпиразол,
3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-4-[(4-этилфенил)метил]-1-изопропил-5-метилпиразол,
4-[(4-этилфенил)метил]-3-(6-О-изопропоксикарбонил-β -D-глюкопиранозилокси)-1-изопропил-5-метилпиразол,
4-[(4-этилфенил)метил]-3-(6-О-изобутоксикарбонил-β-D-глюкопиранозилокси)-1-изопропил-5-метилпиразол,
4-[(4-этоксифенил)метил]-1-изопропил-3-(6-О-метоксикарбонил-β-D-глюкопиранозилокси)-5-метилпиразол,
3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-этоксифенил)метил]-1-изопропил-5-метилпиразол,
4-[(4-этоксифенил)метил]-3-(6-О-изопропоксикарбонил-β-D-глюкопиранозилокси)-1-изопропил-5-метилпиразол,
4-[(4-этоксифенил)метил]-3-(6-О-изобутоксикарбонил-β-D-глюкопиранозилокси)-1-изопропил-5-метилпиразол,
1-изопропил-3-(6-О-метоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-метоксифенил)метил]-5-метилпиразол,
3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-1-изопропил-4-[(4-метоксифенил)метил]-5-метилпиразол,
3-(6-О-изопропоксикарбонил-β-D-глюкопиранозилокси)-1-изопропил-4-[(4-метоксифенил)метил]-5-метилпиразол,
3-(6-О-изобутоксикарбонил-β -D-глюкопиранозилокси)-1-изопропил-4-[(4-метоксифенил)метил]-5-метилпиразол,
1-изопропил-3-(6-О-метоксикарбонил-β-D-глюкопиранозилокси)-5-метил-4-[(4-метилтиофенил)метил]пиразол,
3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-1-изопропил-5-метил-4-[(4-метилтиофенил)метил]пиразол,
3-(6-О-изопропоксикарбонил-β -D-глюкопиранозилокси)-1-изопропил-5-метил-4-[(4-метилтиофенил)метил]пиразол,
3-(6-О-изобутоксикарбонил-β -D-глюкопиранозилокси)-1-изопропил-5-метил-4-[(4-метилтиофенил)метил]пиразол и подобные.
Более предпочтительными являются
4-[(4-изопропоксифенил)метил]-1-изопропил-3-(6-О-метоксикарбонил-β-D-глюкопиранозилокси)-5-метилпиразол,
3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол,
3-(6-О-изопропоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол,
3-(6-О-изобутоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол; и
наиболее предпочтительными являются
3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол и подобные.
Соединения, представленные приведенной выше общей формулой (I) данного изобретения, могут быть получены введением гидрокси- и/или аминозащитных групп, которые могут быть использованы в качестве пролекарства, в гидроксигруппу и/или к атому азота производного глюкопиранозилоксипиразола, представленного приведенной выше формулой (II), обычным путем.
Например, соединения данного изобретения могут быть получены с использованием производного глюкопиранозилоксипиразола, представленного приведенной выше формулой (II), в соответствии со следующей методикой или аналогичными методиками:

Где Р0 представляет гидроксизащитную группу, такую как низшая ацильная группа, низший алкокси-замещенная низшая ацильная группа, низший алкоксикарбонил-замещенная низшая ацильная группа, низшая алкоксикарбонильная группа, низший алкокси-замещенная низшая алкоксикарбонильная группа или бензилоксикарбонильная группа; Р3 представляет низшую ацильную группу или низшую алкоксикарбонильную группу; Р4 представляет низшую ацильную группу; Р5 представляет низшую алкоксикарбонильную группу; R13 представляет низшую ацильную группу или низшую алкоксикарбонильную группу; R14 представляет низшую ацилоксиметильную группу или низшую алкоксикарбонилоксиметильную группу; R15 представляет аминозащитную группу, такую как низшая алкильная группа, низшая ацильная группа, низший алкокси-замещенная низшая ацильная группа, низший алкоксикарбонил-замещенная низшая ацильная группа, низшая алкоксикарбонильная группа, низший алкокси-замещенная низшая алкоксикарбонильная группа или бензилоксикарбонильная группа; один из Q6 и Т6 представляет группу, представленную общей формулой:

(где Р0 имеет указанное выше значение), тогда как другой представляет низшую алкильную группу или группу галоген(низший алкил); один из Q7 и Т7 представляет группу, представленную общей формулой:

(где Р3 имеет указанное выше значение), тогда как другой представляет низшую алкильную группу или группу галоген(низший алкил); Х1 и Х2 представляют уходящую группу, такую как атом брома или атом хлора; и R0, R2, Q0 и Т0 имеют определенные выше значения.
Способ 1
Пролекарство, представленное приведенной выше общей формулой (Ib), может быть получено защитой атома азота производного глюкопиранозилоксипиразола, представленного приведенной выше формулой (II), ангидридом алифатической кислоты, представленным приведенной выше формулой (III), в алифатической кислоте, такой как уксусная кислота, обычно при температуре от 0°С до температуры кипения обычно в течение от 30 минут до 1 дня, или, альтернативно, защитой атома азота производного глюкопиранозилоксипиразола, представленного приведенной выше общей формулой (II), производным сукцинимида, представленным приведенной выше формулой (IV), в инертном растворителе, таком как тетрагидрофуран, обычно при температуре от комнатной температуры до температуры кипения обычно в течение от 1 часа до 1 дня. Время реакции может подходящим образом варьироваться в зависимости от используемых исходного материала, растворителя и температуры реакции.
Способ 2
Соединение, представленное приведенной выше формулой (V), может быть получено введением гидроксиметильной группы к атому азота производного глюкопиранозилоксипиразола, представленного приведенной выше общей формулой (II), с использованием формальдегида в различных растворителях. Примерами растворителя, используемого в этой реакции, могут быть вода, метанол, этанол, тетрагидрофуран, дихлорметан, этилацетат, N,N-диметилформамид, ацетонитрил, смесь из данных растворителей и подобные. Температура реакции равна обычно от 0°С до температуры кипения, и время реакции равно обычно от 30 минут до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции.
Способ 3
Пролекарство, представленное приведенной выше общей формулой (Ic), может быть получено защитой гидроксиметильной группы соединения, представленного приведенной выше общей формулой (V), реагентом для защиты, представленным приведенной выше общей формулой (VI), в присутствии основания, такого как пиридин, триэтиламин, N,N-диизопропилэтиламин, пиколин, лутидин, коллидин, хинуклидин, 1,2,2,6,6-пентаметилпиперидин или 1,4-диазабицикло[2.2.2]октан, в инертном растворителе или без растворителя. Примерами инертного растворителя, используемого в этой реакции, могут быть дихлорметан, ацетонитрил, этилацетат, диизопропиловый эфир, хлороформ, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, ацетон, трет-бутанол, смесь указанных растворителей и подобные. Температура реакции равна обычно от -40°С до температуры кипени, и время реакции равно обычно от 30 минут до 2 дней с варьированием в зависимости от исходного материала, растворителя и температуры реакции.
Способ 4
Пролекарство, представленное приведенной выше общей формулой (Id), может быть получено защитой гидроксиметильной группы или атома азота и гидроксиметильной группы производного глюкопиранозилоксипиразола, представленного приведенной выше общей формулой (II), реагентом для защиты, представленным приведенной выше общей формулой (VII), в присутствии основания, такого как пиридин, триэтиламин, N,N-диизопропилэтиламин, пиколин, лутидин, коллидин, хинуклидин, 1,2,2,6,6-пентаметилпиперидин или 1,4-диазабицикло[2.2.2]октан, в инертном растворителе или без растворителя. Примерами инертного растворителя, используемого в этой реакции, могут быть дихлорметан, ацетонитрил, этилацетат, диизопропиловый эфир, хлороформ, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, ацетон, трет-бутанол, смесь данных растворителей и подобные. Температура реакции равна обычно от -40°С до температуры кипения, и время реакции равно обычно от 30 минут до 2 дней с варьированием в зависимости от исходного материала, растворителя и температуры реакции.
Способ 5
Пролекарство, представленное приведенной выше общей формулой (Ie), может быть получено дистилляцией соединения, представленного приведенной выше общей формулой (Id), в присутствии слабого основания, такого как гидрокарбонат натрия, карбонат натрия или карбонат калия, в спиртовом растворителе, таком как метанол или этанол. Температура реакции равна обычно от 0°С до температуры кипения, и время реакции равно обычно от 15 минут до 1 дня с варьированием в зависимости от исходного материала, растворителя и температуры реакции.
Способ 6
Пролекарство, представленное приведенной выше общей формулой (If), или аналогичные соединения могут быть получены защитой атома азота производного глюкопиранозилоксипиразола, представленного приведенной выше общей формулой (Ie), ангидридом алифатической кислоты, представленным приведенной выше общей формулой (III), в алифатической кислоте, такой как уксусная кислота, обычно при температуре от 0°С до температуры кипения обычно в течение от 30 минут до 1 дня, альтернативно, производным сукцинимида, представленным приведенной выше общей формулой (IV), в инертном растворителе, таком как тетрагидрофуран, обычно при температуре от комнатной температуры до температуры кипения в течение от 1 часа до 1 дня и далее, альтернативно, реагентом для защиты, представленным приведенной выше общей формулой (VI), в присутствии основания, такого как пиридин, триэтиламин, N,N-диизопропилэтиламин, пиколин, лутидин, коллидин, хинуклидин, 1,2,2,6,6-пентаметилпиперидин или 1,4-диазабицикло[2.2.2]октан, в инертном растворителе или без растворителя обычно при температуре от -40°С до температуры кипения, и время реакции равно обычно от 30 минут до 2 дней с варьированием в зависимости от исходного материала, растворителя и температуры реакции.
Способ 7
Соединение, представленное приведенной выше общей формулой (VIII), может быть получено введением гидроксиметильной группы к атому азота соединения, представленного приведенной выше общей формулой (Ie), с использованием формальдегида в различных растворителях. Примерами растворителя, используемого в этой реакции, могут быть вода, метанол, этанол, тетрагидрофуран, дихлорметан, N,N-диметилформамид, ацетонитрил и смесь указанных растворителей и подобные. Температура реакции равна обычно от 0°С до температуры кипения, и время реакции равно обычно от 30 минут до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции.
Способ 8
Пролекарство, представленное приведенной выше общей формулой (Ig), может быть получено защитой гидроксиметильной группы соединения, представленного приведенной выше общей формулой (VIII), реагентом для защиты, представленным приведенной выше общей формулой (VI), в присутствии основания, такого как пиридин, триэтиламин, N,N-диизопропилэтиламин, пиколин, лутидин, коллидин, хинуклидин, 1,2,2,6,6-пентаметилпиперидин или 1,4-диазабицикло[2.2.2]октан, в инертном растворителе или без растворителя. Примерами инертного растворителя, используемого в этой реакции, могут быть дихлорметан, ацетонитрил, этилацетат, диизопропиловый эфир, хлороформ, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, ацетон, трет-бутанол, смесь указанных растворителей и подобные. Температура реакции равна обычно от -40°С до температуры кипения, и время реакции равно обычно от 30 минут до 2 дней с варьированием в зависимости от исходного материала, растворителя и температуры реакции.
Способ 9
Пролекарство, представленное приведенной выше общей формулой (Ih), может быть получено снятием защиты у соединения, представленного приведенной выше общей формулой (Ig), снятию защиты каталитическим гидрированием в присутствии палладиевого катализатора, такого как палладий на угле, в инертном растворителе. Примерами инертного растворителя, используемого в этой реакции, могут быть метанол, этанол, тетрагидрофуран, этилацетат, смесь указанных растворителей и подобные. Температура реакции равна обычно от 0°С до температуры кипения, и время реакции равно обычно от 30 минут до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции.
Например, соединения, представленные приведенной выше общей формулой (II), которые используют в качестве исходных материалов в вышеупомянутом способе получения, могут быть получены согласно следующей методике:

где Х3 и Y представляют уходящую группу, такую как атом галогена, мезилоксигруппа или тозилоксигруппа; R3 представляет низшую алкильную группу или группу галоген(низший алкил); R4 представляет метильную группу или этильную группу; R5 представляет низшую алкильную группу; один из Q8 и Т8 представляет 2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилоксигруппу, тогда как другой представляет низшую алкильную группу или группу галоген(низший алкил); и R0, R2, Q0 и Т0 имеют определенные выше значения.
Способ А
Соединение, представленное приведенной выше общей формулой (XI), может быть получено конденсацией бензилпроизводного, представленного приведенной выше общей формулой (IX), с кетоацетатом, представленным приведенной выше общей формулой (Х), в присутствии основания, такого как гидрид натрия или трет-бутоксид калия, в инертном растворителе. Примерами инертного растворителя, используемого в этой реакции, могут быть 1,2-диметоксиэтан, тетрагидрофуран, N,N-диметилформамид, смесь указанных растворителей и подобные. Температура реакции равна обычно от комнатной температуры до температуры кипения, и время реакции равно обычно от 1 часа до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции.
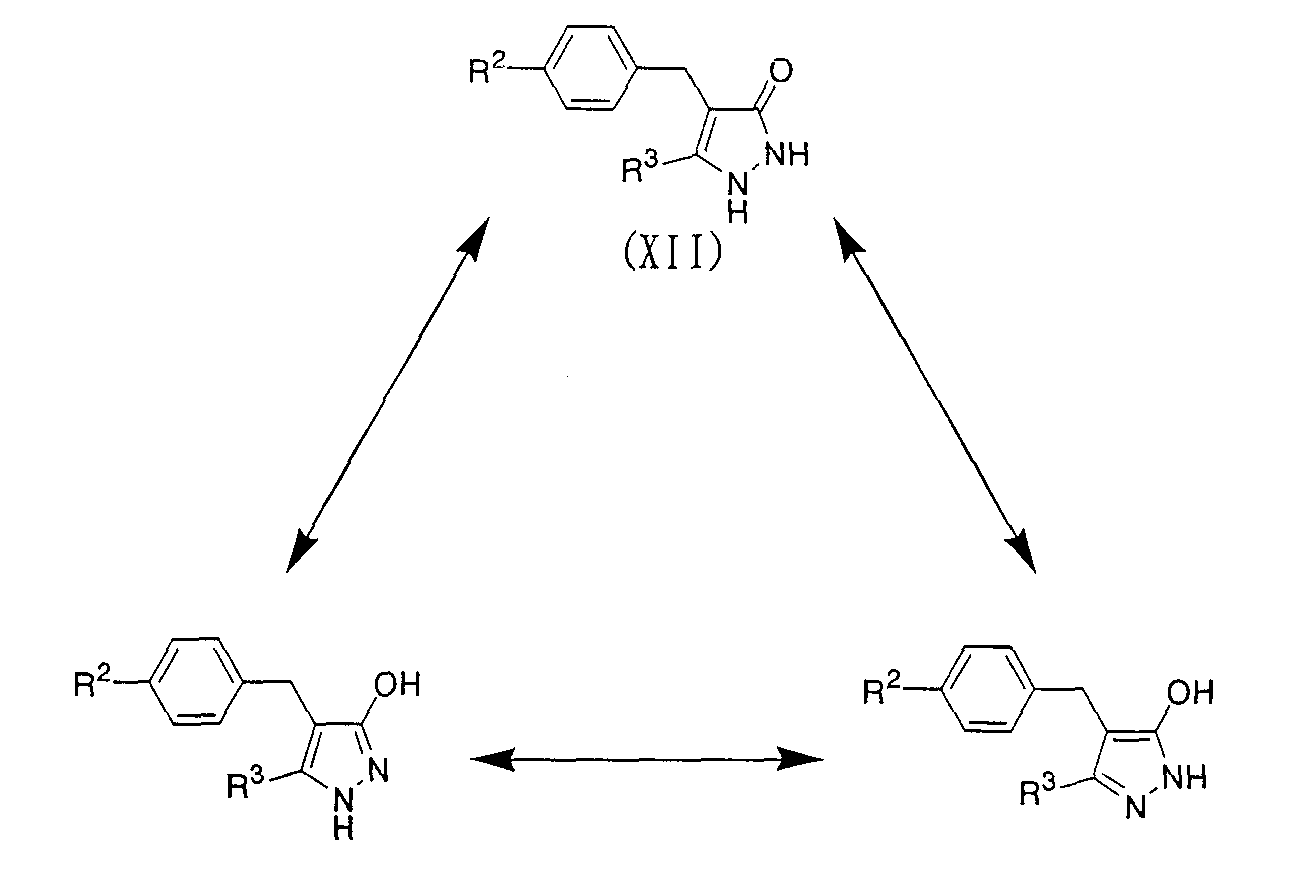
Способ В
Производное пиразолона, представленное приведенной выше общей формулой (XII), может быть получено конденсацией соединения, представленного приведенной выше общей формулой (XI), с гидразином или моногидратом гидразина в инертном растворителе. Примерами инертного растворителя, используемого в этой реакции, могут быть толуол, тетрагидрофуран, хлороформ, смесь указанных растворителей и подобные. Температура реакции равна обычно от комнатной температуры до температуры кипения, и время реакции равно обычно от 1 часа до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции. Полученное производное пиразолона, представленное приведенной выше общей формулой (XII), может быть также использовано в способе С после превращения его в соль обычным путем.
Способ С
В случае производных пиразолона, представленных приведенной выше общей формулой (XII), где R3 обозначает низшую алкильную группу, соответствующее соединение, представленное приведенной выше общей формулой (XIV), может быть получено гликозидированием соответствующего производного пиразолона, представленного приведенной выше общей формулой (XII), с использованием ацетобром-α-D-глюкозы в присутствии основания, такого как карбонат серебра, в инертном растворителе и N-алкилированием полученного соединения с использованием алкилирующего агента, представленного приведенной выше общей формулой (XIII), в присутствии основания, такого как карбонат калия, в инертном растворителе по мере необходимости. Примерами растворителя, используемого в реакции гликозидирования, могут быть тетрагидрофуран и подобные. Температура реакции равна обычно от комнатной температуры до температуры кипения, и время реакции равно обычно от 1 часа до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции. Примерами растворителя, используемого в реакции N-алкилирования, могут быть ацетонитрил, N,N-диметилформамид, тетрагидрофуран, смесь указанных растворителей и подобные. Температура реакции равна обычно от комнатной температуры до температуры кипения, и время реакции равно обычно от 1 часа до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции.
В случае производных пиразолона, представленных приведенной выше общей формулой (XII), где R3 обозначает группу галоген(низший алкил), соответствующее соединение, представленное приведенной выше общей формулой (XIV), может быть получено гликозидированием соответствующего производного пиразолона, представленного приведенной выше общей формулой (XII), с использованием ацетобром-α-D-глюкозы в присутствии основания, такого как карбонат калия, в инертном растворителе и N-алкилированием полученного соединения с использованием алкилирующего агента, представленного приведенной выше общей формулой (XIII), в присутствии основания, такого как карбонат калия, в инертном растворителе по мере необходимости. Примерами растворителя, используемого в реакции гликозидирования, могут быть ацетонитрил, тетрагидрофуран и подобные. Температура реакции равна обычно от комнатной температуры до температуры кипения, и время реакции равно обычно от 1 часа до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции. Примерами растворителя, используемого в реакции N-алкилирования, могут быть ацетонитрил, N,N-диметилформамид, тетрагидрофуран, смесь указанных растворителей и подобные. Температура реакции равна обычно от комнатной температуры до температуры кипения, и время реакции равно обычно от 1 часа до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции.
В соединении, представленном приведенной выше общей формулой (XII), в качестве исходных материалов имеются следующие три таутомера, варьирующиеся в зависимости от изменения условий реакции:
где R2 и R3 имеют определенные выше значения.
Полученные соединения, представленные приведенной выше общей формулой (XIV), могут быть также использованы в способе D после превращения в соль обычным путем.
Способ D
Глюкопиранозилоксипиразол, представленный приведенной выше общей формулой (II), может быть получен гидролизом соединения, представленного приведенной выше общей формулой (XIV). Примерами растворителя, используемого в этой реакции, могут быть метанол, этанол, тетрагидрофуран, вода, смесь указанных растворителей и подобные, и используемым основанием являются гидроксид натрия, этоксид натрия и подобные. Температура реакции равна обычно от 0°С до комнатной температуры, и время реакции равно обычно от 30 минут до 6 часов с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции.
Из соединений, представленных приведенной выше общей формулой (II), которые также используют в качестве исходных материалов в вышеупомянутом способе получения, могут быть также получены соединения, в которых R0 обозначает низшую алкильную группу, согласно следующей методике:

где R2, R5 , Q0, Т0 и Х3 имеют определенные выше значения.
Способ Е
Соединение, представленное приведенной выше общей формулой (IIb), могут быть получены N-алкилированием соединения, представленного приведенной выше общей формулой (IIa), с использованием N-алкилирующего агента, представленного приведенной выше общей формулой (XIII), в присутствии основания, такого как карбонат калия или карбонат цезия, и необязательно каталитического количества иодида натрия в инертном растворителе. Примерами инертного растворителя, используемого в этой реакции, могут быть N,N-диметилформамид, 1,2-диметоксиэтан, диметилсульфоксид, тетрагидрофуран, этанол, смесь указанных растворителей и подобные. Температура реакции равна обычно от комнатной температуры до температуры кипения, и время реакции равно обычно от 10 минут до 1 дня с варьированием в зависимости от используемых исходного материала, растворителя и температуры реакции.
Соединения, представленные приведенной выше общей формулой (I) данного изобретения, полученные приведенными выше способами получения, могут быть выделены и очищены общепринятыми способами разделения, такими как фракционная перекристаллизация, очистка с использованием хроматографии, экстракция растворителями и экстракция с использованием твердой фазы.
Производные глюкопиранозилоксипиразола, представленные приведенной выше общей формулой (I) данного изобретения, могут быть превращены в их фармацевтически приемлемые соли обычным образом. Примеры таких солей включают кислотно-аддитивные соли с минеральными кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные, кислотно-аддитивные соли с органическими кислотами, такими как муравьиная кислота, уксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, пропионовая кислота, лимонная кислота, янтарная кислота, винная кислота, фумаровая кислота, масляная кислота, щавелевая кислота, малоновая кислота, малеиновая кислота, молочная кислота, яблочная кислота, угольная кислота, глутаминовая кислота, аспарагиновая кислота, адипиновая кислота, олеиновая кислота, стеариновая кислота и подобные, и соли с неорганическими основаниями, такие как соль натрия, соль калия, соль кальция, соль магния и подобные.
Пролекарства, представленные приведенной выше общей формулой (I) данного изобретения, включают их сольваты с фармацевтически приемлемыми растворителями, такими как этанол и вода.
У соединений, представленных приведенной выше общей формулой (I) данного изобретения, существуют два оптических изомера, R-изомер и S-изомер, причем каждое соединение имеет асимметричный атом углерода, за исключением глюкопиранозилоксигруппы. В данном изобретении может быть использован либо R-изомер, либо S-изомер, и может быть использована также смесь обоих изомеров.
Пролекарства, представленные приведенной выше общей формулой (I) данного изобретения, превращаются в производные глюкопиранозилоксипиразола, представленные приведенной выше общей формулой (II), в виде их активных форм in vivo и проявляют превосходную ингибирующую активность в отношении SGLT2 человека. С другой стороны, поскольку WAY-123783 имеет крайне слабую ингибирующую активность в отношении SGLT2 человека, нельзя ожидать, что он проявляет достаточное действие в качестве ингибитора SGLT2 человека. Кроме того, пролекарства, представленные приведенной выше общей формулой (I) данного изобретения, имеют улучшенную абсорбцию при пероральном введении, и фармацевтические композиции, содержащие в качестве активного ингредиента это пролекарство, имеют высокую полезность в качестве пероральных препаративных форм. Таким образом, пролекарства данного изобретения являются чрезвычайно полезными в качестве агентов для предупреждения или лечения заболевания, связанного с гипергликемией, такого как диабет, осложнения, связанные с диабетом (например, ретинопатия, невропатия, нефропатия, язва, макроангиопатия), ожирение, гиперинсулинемия, нарушение метаболизма глюкозы, гиперлипидемия, гиперхолестеринемия, гипертриглицеридемия, нарушения липидного метаболизма, атеросклероз, гипертензия, застойная сердечная недостаточность, отек, гиперурикемия, подагра или подобные.
Кроме того, соединения данного изобретения могут быть выгодным образом использованы в комбинации по меньшей мере с одним веществом, выбранным из лекарственных средств, отличных от ингибиторов SGLT2. Примеры лекарственных средств, которые могут быть использованы в комбинации с соединениями данного изобретения, включают усилитель чувствительности к инсулину, ингибитор абсорбции глюкозы, бигуанид, усилитель секреции инсулина, препарат инсулина, антагонист рецептора глюкагона, стимулятор рецепторной киназы инсулина, ингибитор трипептидилпептидазы (II), ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1В, ингибитор гликогенфосфорилазы, ингибитор глюкозо-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза печени, D-хироинозита, ингибитор гликогенсинтазы-киназы-3, глюкагон-подобный пептид-1, аналог глюкагон-подобного пептида-1, агонист глюкагон-подобного пептида-1, амилин, аналог амилина, агонист амилина, ингибитор альдозоредуктазы, ингибитор образования конечных продуктов прогрессирующего гликозилирования, ингибитор протеинкиназы С, антагонист рецептора γ-аминомасляной кислоты, антагонист натриевого канала, ингибитор фактора транскрипции NF-κВ, ингибитор липидпероксидазы, ингибитор дипептидазы N-ацетилированной-α-связанной кислоты, инсулин-подобный фактора роста I, тромбоцитарный фактора роста (PDGF), аналог тромбоцитарного фактора роста (PDGF), (например, PDGF-AA, PDGF-BB, PDGF-AB), эпидермальный фактор роста (EGF), фактор роста нервов, производное карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128, ингибитор гидроксиметилглутарил-кофермента А-редуктазы, производное фибриновой кислоты, агонист β3-адреноцептора, ингибитор ацил-кофермента А-холестерин-ацилтрансферазы, пробкол, агонист рецептора тиреоидного гормона, ингибитор абсорбции холестерина, ингибитор липазы, ингибитор белка-переносчика микросомного триглицерида, ингибитор липоксигеназы, ингибитор карнитинпальмитоил-трансферазы, ингибитор скваленсинтазы, стимулятор рецептора липопротеина низкой плотности, производное никотиновой кислоты, вещество, усиливающее экскрецию желчной кислоты, ингибитор котранспортера натрия/желчной кислоты, ингибитор белка-переносчика сложных эфиров холестерина, супрессанта аппетита, ингибитор ангиотензинпревращающего фермента, ингибитор нейтральной эндопептидазы, антагонист рецептора ангиотензина II, ингибитор эндотелинпревращающего фермента, антагонист рецептора эндотелина, диуретический агент, антагонист кальция, вазодилатирующий антигипертензивный агент, агент, блокирующий симпатическую нервную систему, антигипертензивный агент, действующий на центральную нервную систему, агонист α2-адреноцептора, антитромбоцитарный агент, ингибитор синтеза мочевой кислоты, агент, способствующий выведению мочевой кислоты, и подщелачивающий мочу агент.
В случае применений соединения данного изобретения в комбинации с вышеупомянутыми одним или несколькими лекарственными средствами данное изобретение включают либо дозированные формы для одновременного введения в виде единой препаративной формы, либо раздельные препараты, вводимые одним и тем же способом или различными способами, и введение при различных интервалах доз в виде раздельных препаратов одним и тем же или различными способами введения. Фармацевтическая композиция, содержащая соединение данного изобретения и одно или несколько из вышеупомянутых лекарственных средств, включает как дозированные формы в виде единой препаративной формы, так и раздельные препараты для комбинирования, как указано выше.
Соединения данного изобретения могут вызывать более выгодные эффекты, чем аддитивные эффекты, в предупреждении или лечении указанных выше заболеваний при использовании подходящим образом в комбинации с вышеупомянутыми лекарственными средствами. Кроме того, доза введения может быть уменьшена в сравнении с введением любого одного лекарственного средства как такового, или можно избежать или уменьшить побочные вредные действия одновременно вводимых лекарственных средств, отличных от ингибиторов SGLT2.
Конкретные соединения в качестве вышеупомянутых лекарственных средств, используемые для комбинации, и подходящие заболевания, подлежащие лечению, приведены в качестве примеров далее. Однако данное изобретение не ограничивается ими, и, например, эти конкретные соединения включают их свободные соединения и их фармацевтически приемлемые соли.
Примерами усилителей чувствительности к инсулину являются агонисты активируемого пероксисомным пролифератором рецептора-γ, такие как троглитазон, гидрохлорид пиоглитазона, малеат розиглитазона, натрий-дарглитазон, GI-262570, изаглитазон, LG-100641, NC-2100, T-174, DRF-2189, CLX-0921, CS-011, GW-1929, циглитазон, натрий-энглитазон и NIP-221, агонисты активируемого пероксисомным пролифератором рецептора-α, такие как GW-9578 и ВМ-170744, агонисты активируемого пероксисомным пролифератором рецептора-α/γ, такие как GW-409544, KRP-297, NN-622, CLX-0940, LR-90, SB-219994, DRF-4158 и DRF-MDX8, агонисты рецептора ретиноида Х, такие как ALRT-268, AGN-4204, MX-6054, AGN-194204, LG-100754 и бексаротен, и другие усилители чувствительности к инсулину, такие как регликсан, ONO-5816, MBX-102, CRE-1625, FK-614, CLX-0901, CRE-1633, NN-2344, BM-13125, BM-501050, HQL-975, CLX-0900, MBX-668, MBX-675, S-15261, GW-544, AZ-242, LY-510929, AR-H049020 и GW-501516. Усилители чувствительности к инсулину используют предпочтительно при диабете, осложнениях, связанных с диабетом, ожирении, гиперинсулинемии, нарушении метаболизма глюкозы, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушении липидного метаболизма, атеросклерозе и более предпочтительно при диабете, гиперинсулинемии или нарушении метаболизма глюкозы, вследствие улучшения нарушения трансдукции сигнала инсулина в периферических тканях и увеличения поглощения глюкозы в тканях из крови, приводящих к снижению уровня глюкозы в крови.
Примерами ингибиторов абсорбции глюкозы являются ингибиторы α-глюкозидазы, такие как акарбоза, воглибоза, миглитол, CKD-711, эмиглитат, MDL-25,637, камиглибоза и MDL-73,945, и ингибиторы α-амилазы, такие как AZM-127. Ингибиторы абсорбции глюкозы применяют предпочтительно при диабете, осложнениях, связанных с диабетом, ожирении, гиперинсулинемии или нарушении метаболизма глюкозы и более предпочтительно при диабете или нарушении метаболизма глюкозы вследствие ингибирования желудочно-кишечного ферментативного расщепления углеводов, содержащихся в пищевых продуктах, и ингибирования или задержки абсорбции глюкозы в тело.
Примерами бигуанидов являются фенформин, гидрохлорид фенформина, гидрохлорид метформина или подобные. Бигуаниды используют предпочтительно при диабете, осложнениях, связанных с диабетом, ожирении, гиперинсулинемии или нарушении метаболизма глюкозы и более предпочтительно при диабете, гиперинсулинемии или нарушении метаболизма глюкозы вследствие снижения уровня глюкозы крови ингибирующими действиями на глюконеогенез печени, усиливающим действием на анаэробный гликолиз в тканях или улучшающими действием на инсулинорезистентность в периферических тканях.
Примерами усилителей секреции инсулина являются толбутамид, хлорпропамид, толазамид, ацетогексамид, гликлопирамид, глибурид (глибенкламид), гликлазид, 1-бутил-3-метанилилмочевина, карбутамид, глиборнурид, глипизид, глихидон, глисоксапид, глибутиазол, глибузол, глигексамид, натрий-глимидин, глипинамид, фенбутамид, толцикламид, глимепирид, натеглинид, митиглинид кальций-гидрат, репаглинид или подобные. Усилители секреции инсулина используют предпочтительно при диабете, осложнениях, связанных с диабетом, или нарушении метаболизма глюкозы и более предпочтительно при диабете и нарушении метаболизма глюкозы вследствие снижения уровня глюкозы в крови действием на панкреатические β-клетки и усилением секреции инсулина.
Примерами препаратов инсулина являются инсулин человека, аналоги инсулина человека, полученный из животных инсулин или подобные. Препараты инсулина используют предпочтительно при диабете, осложнениях, связанных с диабетом, или нарушении метаболизма глюкозы и более предпочтительно при диабете и нарушении метаболизма глюкозы.
Примерами антагонистов рецептора глюкозы являются BAY-27-9955, NNC-92-1687 или подобные; примерами стимуляторов рецепторной киназы инсулина являются TER-17411, L-783281, KRX-613 или подобные; примерами ингибиторов трипептидилпептидазы II являются UCL-1397 или подобные; примерами ингибиторов дипептидилпептидазы IV являются NVP-DPP728A, TSL-225, P-32/98 или подобные; примерами ингибиторов протеинтирозинфосфатазы 1В являются РТР-112, ОС-86839, PNU-177496 или подобные; примерами ингибиторов гликогенфосфорилазы являются NN-4201, CP-368296 или подобные; примерами ингибиторов фруктозобисфосфатазы являются R-132917 или подобные; примерами ингибиторов пируватдегидрогеназы являются AZD-7545 или подобные; примерами ингибиторов глюконеогенеза печени являются FR-225659 или подобные; примерами аналогов глюкагон-подобного пептида-1 являются эксендин-4, CJC-1131 или подобные; примерами агонистов глюкагон-подобного пептида-1 являются AZM-134, LY-315902 или подобные; примерами амилина являются аналоги амилина или агонисты амилина, ацетат прамлинтида или подобные. Эти лекарственные средства, ингибиторы глюкозо-6-фосфатазы, D-хироинозит, ингибиторы гликогенсинтазы-киназы, глюкагон-подобный пептид-1, используются предпочтительно при диабете, осложнениях, связанных с диабетом, гиперинсулинемии или нарушении метаболизма глюкозы и, более предпочтительно, при диабете или нарушении метаболизма глюкозы.
Примерами ингибиторов альдозоредуктазы являются аскорбилгамоленат, толрестат, эпалрестат, ADN-138, BAL-ARI8, ZD-5522, ADN-311, GP-1447, IDD-598, фидарестат, сорбинил, поналрестат, ризарестат, зенарестат, миналрестат, метосорбинил, AL-1567, имирестат, М-16209, ТАТ, AD-5467, зополрестат, AS-3201, NZ-314, SG-210, JTT-811, линдолрестат или подобные. Ингибиторы альдозоредуктазы используют предпочтительно при осложнениях, связанных с диабетом, вследствие ингибирования альдозоредуктазы и снижения избыточного внутриклеточного накопления сорбита при ускоренном пути полиолов, которые имеют место при непрерывном гипергликемическом состоянии в тканях при осложнениях, связанных с диабетом.
Примерами ингибиторов образования конечных продуктов прогрессирующего гликозилирования являются пиридоксамин, ОРВ-9195, ALT-946, ALT-711, гидрохлорид пимагедина или подобные. Ингибиторы образования конечных продуктов прогрессирующего гликозилирования предпочтительно используют при осложнениях, связанных с диабетом, вследствие ингибирования образования конечных продуктов прогрессирующего гликозилирования, которое ускоряется при непрерывном гипергликемическом состоянии при диабете, и уменьшения клеточного повреждения.
Примерами ингибиторов протеинкиназы С являются LY-333531, мидостаурин или подобные. Ингибиторы протеинкиназы С предпочтительно используют при осложнениях, связанных с диабетом, вследствие ингибирования активности протеинкиназы С, которая усиливается при непрерывном гипергликемическом состоянии при диабете.
Примерами антагонистов рецептора γ-аминомасляной кислоты являются топирамат или подобные; примерами антагонистов натриевых каналов являются гидрохлорид мексилетина, окскарбазепин или подобные; примерами ингибиторов фактора транскрипции NF-κВ являются декслипотам или подобные; примерами ингибиторов пероксидазы являются тирилазадмезилат или подобные; примерами ингибиторов дипептидазы N-ацетилированной α-связанной кислоты являются GPI-5693 или подобные, примерами производных карнитина являются карнитин, гидрохлорид левацекарнина, хлорид левокарнитина, левокарнитин, ST-261 или подобные. Эти лекарственные средства, инсулин-подобный фактор роста I, тромбоцитарный фактор роста, аналоги тромбоцитарного фактора роста, эпидермальный фактор роста, фактор роста нервов, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид и Y-128, используют предпочтительно при осложнениях, связанных с диабетом.
Примерами ингибиторов гидроксиметилглутарил-кофермента А-редуктазы являются натрий-церивастатин, натрий-правастатин, ловастатин, симвастатин, натрий-флувастатин, гидрат кальций-аторвастатина, SC-45355, SQ-33600, CP-83101, BB-476, L-669262, S-2468, DMP-565, U-20685, BAY-x-2678, BAY-10-2987, кальций-питавастатин, кальций-росувастатин, колестолон, далвастатин, ацитемат, мевастатин, крилвастатин, BMS-180431, BMY-21950, гленвастатин, карвастатин, BMY-22089, бервастатин или подобные. Ингибиторы гидроксиметилглутарил-кофермента А-редуктазы используют предпочтительно при гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушении липидного метаболизма или атеросклерозе и, более предпочтительно, при гиперлипидемии, гиперхолестеринемии или атеросклерозе вследствие снижения уровня холестерина в крови ингибированием гидроксиметилглутарил-кофермента А-редуктазы.
Примерами производных фибриновой кислоты являются безафибрат, беклобрат, бинифибрат, ципрофибрат, клинофибрат, клофибрат, алюминий-клофибрат, клофибриновая кислота, этофибрат, фенофибрат, гемфиброзил, никофибрат, пирифибрат, ронифибрат, симфибрат, теофибрат, AHL-157 или подобные. Производные фибриновой кислоты используют предпочтительно при гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гиперглицеридемии, нарушении липидного метаболизма или атеросклерозе и, более предпочтительно, при гиперлипидемии, гипертриглицеридемии или атеросклерозе вследствие активации липопротеинлипазы печени и усиления окисления жирных кислот, приводящего к снижению уровня триглицеридов в крови.
Примерами агонистов β3-адреноцептора являются BRL-28410, SR-58611A, ICI-198157, ZD-2079, BMS-194449, BRL-37344, CP-331679, CP-114271, L-750355, BMS-187413, SR-59062A, BMS-210285, LY-377604, SWR-0342SA, AZ-40140, SB-226552, D-7114, BRL-35135, FR-149175, BRL-26830A, CL-316243, AJ-9677, GW-427353, N-5984, GW-2696 или подобные. Агонисты β3-адреноцептора используют предпочтительно при ожирении, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии или нарушении липидного метаболизма и, более предпочтительно, при ожирении или гиперинсулинемии вследствие стимуляции β3 -адреноцептора в адипозной ткани и усиления окисления жирных кислот, приводящего к индукции потребления энергии.
Примерами ингибиторов ацил-кофермента А-холестерин-ацилтрансферазы являются NTE-122, MCC-147, PD-132301-2, DUP-129, U-73482, U-76807, RP-70676, P-06139, CP-113818, RP-73163, FR-129169, FY-038, EAB-309, KY-455, LS-3115, FR-145237, T-2591, J-104127, R-755, FCE-28654, YIC-C8-434, авасимибе, CI-976, RP-64477, F-1394, элдасимибе, CS-505, CL-283546, YM-17E, лецимибиде, 447С88, YM-750, E-5324, KW-3033, HL-004, эфлуцимибе или подобные. Ингибиторы ацил-кофермента А-холестерин-ацилтрансферазы используют при гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии или нарушении липидного метаболизма и, более предпочтительно, при гиперлипидемии или гиперхолестеринемии вследствие снижения уровня холестерина в крови ингибированием ацил-кофермента А-холестерин-ацилтрансферазы.
Примерами агонистов рецептора тиреоидного гормона являются натрий-лиотиронин, натрий-левотироксин, КВ-2611 или подобные; примерами ингибиторов абсорбции холестерина являются эзетимибе, SCH-48461 или подобные; примерами ингибиторов липазы являются орлистат, ATL-962, AZM-131, RED-103004 или подобные; примерами ингибиторов карнитин-пальмитоилтрансферазы являются этомоксир или подобные; примерами ингибиторов скваленсинтазы являются SDZ-268-198, BMS-188494, A-87049, RPR-101821, ZD-9720, RPR-107393, ER-27856 или подобные; примерами производных никотиновой кислоты являются никотиновая кислота, никотинамид, никомол, ницеритрол, аципимокс, никорандил или подобные; примерами веществ, усиливающих экскрецию желчной кислоты, являются колестирамин, колестилан, гидрохлорид колесевелама, GT-102-279 или подобные; примерами ингибиторов котранспортеров натрия/желчной кислоты являются 264W94, S-8921, SD-5613 или подобные; и примерами ингибиторов белков-переносчиков эфиров холестерина являются PNU-107368E, SC-795, JTT-705, CP-529414 или подобные. Эти лекарственные средства, пробкол, ингибиторы белка-переносчика микросомного триглицерида, ингибиторы липоксигеназы и усилители рецептора липопротеина низкой плотности используются предпочтительно при гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии или нарушении липидного метаболизма.
Примерами супрессантов аппетита являются ингибиторы повторного поглощения моноамина, ингибиторы повторного поглощения серотонина, стимуляторы высвобождения серотонина, агонисты серотонина (в частности, агонисты 5НТ2С), ингибиторы повторного поглощения норадреналина, стимуляторы высвобождения норадреналина, агонисты α1-адреноцептора, агонисты β2-адреноцептора, агонисты допамина, антагонисты рецептора каннабиноида, антагонисты рецептора γ-аминомасляной кислоты, антагонисты Н3-гистамина, L-гистидин, лептин, аналоги лептина, агонисты рецептора лептина, агонисты рецептора меланокортина (в частности, агонисты МС3-R, агонисты МС4-R), стимулирующий α-меланоциты гормон, регулируемый кокаином и амфетамином транскрипт, белок махагониевого дерева, агонисты энтеростатина, кальцитонин, белок, родственный гену кальцитонина, бомбезин, агонисты холецистокинина (в частности, агонисты ССК-А), кортикотропинвысвобождающий гормон, аналоги кортикотропинвысвобождающего гормона, агонисты кортикотропинвысвобождающего гормона, урокортин, соматостатин, аналоги соматостатина, агонисты рецептора соматостатина, пептид, активирующий аденилатциклазу гипофиза, полученный из головного мозга нейротрофический фактор, цилиарный нейротрофический фактор, тиротропинвысвобождающий гормон, нейротензин, саувагин, антагонисты нейропептида Y, антагонисты опиоидных пептидов, антагонисты галанина, антагонисты меланинконцентрирующего гормона, ингибиторы связанного с подагрой белка и антагонисты рецептора орексина. Конкретно, примерами ингибиторов повторного поглощения моноамина являются мазиндол или подобные; примерами ингибиторов повторного поглощения серотонина являются гидрохлорид дексфенфлурамина, фенфлурамин, гидрохлорид сибутрамина, малеат флувоксамина, гидрохлорид сертралина или подобные; примерами агонистов серотонина являются инотриптан, (+)-норфенфлурамин или подобные; примерами ингибиторов повторного поглощения норадреналина являются бупропион, GW-320659 или подобные; примерами стимуляторов высвобождения норадреналина являются ролипрам, YM-992 или подобные; примерами агонистов β2-адреноцептора являются амфетамин, декстроамфетамин, фентермин, бензфетамин, метамфетамин, фендиметразин, фенметразин, диэтилпропион, фенилпропаноламин, клобензорекс или подобные; примерами агонистов допамина являются ER-230, допрексин, мезилат бромкриптина или подобные; примерами антагонистов рецептора каннабиноида являются римонабант или подобные; примерами антагонистов рецептора γ-аминомасляной кислоты являются топирамид или подобные; примерами антагонистов Н3-гистамина являются GT-2394 или подобные; примерами лептина являются аналоги лептина или агонисты рецептора лептина, LY-355101 или подобные; примерами агонистов холецистокинина (в частности, агонистов ССК-А) являются SR-146131, SSR-125180, BP-3.200, A-71623, FPL-15849, GI-248573, GW-7178, GI-181771, GW-7854, A-71378 или подобные, примерами антагонистов нейропептида Y являются SR-120819-A, PD-160170, NGD-95-1, BIBP-3226, 1229-U-91, CGP-71683, BIBO-3304, CP-671906-01, J-115814 или подобные. Супрессанты аппетита используют предпочтительно при диабете, осложнениях, связанных с диабетом, ожирении, нарушении метаболизма глюкозы, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушении липидного метаболизма, атеросклероза, гипертензии, застойной сердечной недостаточности, отека, гиперурикемии или подагры и, более предпочтительно, при ожирении вследствие стимуляции или ингибирования активностей интрацеребральных моноаминов или биологически активных пептидов в центральной системе, регулирующей аппетит, и подавления (уменьшения) аппетита, приводящих к уменьшению поглощения энергии.
Примерами ингибиторов ангиотензинпревращающего фермента являются каптоприл, малеат эналаприла, алацеприл, гидрохлорид делаприла, рамиприл, лизиноприл, гидрохлорид имидаприла, гидрохлорид беназеприла, моногидрат церонаприла, цилазаприл, натрий-фозиноприл, периндоприл-эрбумин, кальций-мовелтриприл, гидрохлорид хинаприла, гидрохлорид спираприла, гидрохлорид темокаприла, трандолаприл, кальций-зофеноприл, гидрохлорид моэксиприла, рентиаприл или подобные. Ингибиторы ангиотензинпревращающего фермента предпочтительно используют при осложнениях, связанных с диабетом, или гипертензии.
Примерами ингибиторов нейтральной эндопептидазы являются омапатрилат, MDL-100240, фазидотрил, сампатрилат, GW-660511X, миксанприл, SA-7060, E-4030, SLV-306, экадотрил и подобные. Ингибиторы нейтральной эндопептидазы предпочтительно используют при осложнениях, связанных с диабетом, или гипертензии.
Примерами антагонистов рецептора ангиотензина II являются кандесартан-цилексетил, кандесартан-цилексетил/гидрохлортиазид, калий-лосартан, мезилат эпросартана, валсартан, телмисартан, ирбесартан, EXP-3174, L-158809, EXP-3312, олмесартан, тазосартан, КТ-3-671, GA-0113, RU-64276, EMD-90423, BR-9701 или подобные. Антагонисты рецептора ангиотензина II предпочтительно используют при осложнениях, связанных с диабетом, или гипертензии.
Примерами ингибиторов эндотелинпревращающего фермента являются CGS-31447, CGS-35066, SM-19712 или подобные; примерами антагонистов рецептора эндотелина являются L-749805, TBC-3214, BMS-182874, BQ-610, TA-0201, SB-215355, PD-180988, натрий-ситакссентан, BMS-193884, дарусентан, ТВС-3711, босентан, натрий-тезосентан, J-104132, YM-598, S-0139, SB-234551, RPR-118031A, ATZ-1993, RO-61-1790, ABT-546, энласентан, BMS-207940 или подобные. Эти лекарственные средства предпочтительно используют при осложнениях, связанных с диабетом, или гипертензии и, более предпочтительно, при гипертензии.
Примерами диуретических агентов являются хлорталидон, метолазон, циклопентиазид, трихлорметиазид, гидрохлортиазид, гидрофлуметиазид, бензилгидрохлортиазид, пенфлутизид, метиклотиазид, индапамид, трипамид, мефрусид, азосемид, этакриновая кислота, торасемид, пиретанид, фуросемид, буметанид, метикран, канреноат калия, спиронолактон, триамтерен, аминофиллин, гидрохлорид циклетанина, LLU-α, PNU-80873A, изосорбид, D-маннит, D-сорбит, фруктоза, глицерин, ацетазоламид, метазоламид, FR-179544, OPC-31260, ликсиваптан, гидрохлорид кониваптана или подобные. Диуретические лекарственные средства предпочтительно используют при осложнениях, связанных с диабетом, гипертензии, застойной сердечной недостаточности или отеке и, более предпочтительно, при гипертензии, застойной сердечной недостаточности или отеке вследствие уменьшения кровяного давления или ослабления отека увеличением экскреции мочи.
Примерами антагонистов кальция являются аранидипин, гидрохлорид эфонидипина, гидрохлорид никадипина, гидрохлорид барнидипина, гидрохлорид бенидипина, гидрохлорид манидипина, цилнидипин, нисолдипин, нитрендипин, нифедипин, нилвадипин, фелодипин, бесилат амлодипина, пранидипин, гидрохлорид лерканидипина, исрадипин, элгодипин, азелнидипин, лацидипин, гидрохлорид ватанидипина, лемилдипин, гидрохлорид дилтиазема, малеат клентиазема, гидрохлорид верапамила, S-верапамил, гидрохлорид фасудила, гидрохлорид бепридила, гидрохлорид галлопамила или подобные; примерами вазодилатирующих антигипертензивных агентов являются индапамид, гидрохлорид тодралазина, гидрохлорид гидралазина, кадралазин, будралазин или подобные; примерами агентов, блокирующих симпатическую нервную систему, являются гидрохлорид амосулалола, гидрохлорид теразосина, гидрохлорид буназосина, гидрохлорид празосина, мезилат доксазосина, гидрохлорид пропанолола, атенолол, тартрат метопролола, карведилол, нипрадилол, гидрохлорид целипролола, небиволол, гидрохлорид бетаксолола, пиндолол, гидрохлорид тертатолола, гидрохлорид бевантолола, малеат тимолола, гидрохлорид картеолола, гемифумарат бисопролола, малонат бопиндолола, нипрадилол, сульфат пенбутолола, гидрохлорид ацебутолола, гидрохлорид тилизолола, надолол, урапидил, индорамин или подобные; примерами антигипертензивных агентов, действующих на центральную нервную систему, являются резерпин или подобные, и примерами агонистов α2-адреноцептора являются гидрохлорид клонидина, метилдопа, CHF-1035, гуанабензацетат, гидрохлорид гуанфасина, моксонидин, лофекседин, гидрохлорид талипексола или подобные. Эти лекарственные средства предпочтительно используют при гипертензии.
Примерами антитромбоцитарных агентов являются гидрохлорид тиклопидина, дипиридамол, цилостазол, этилэйкозапентат, гидрохлорид сарпогрелата, дигидрохлорид дилазепа, трапидил, натрий-берапрост, аспирин или подобные. Антитромбоцитарные агенты предпочтительно используют при атеросклерозе или застойной сердечной недостаточности.
Примерами ингибиторов синтеза мочевой кислоты являются аллопуринол, оксипуринол или подобные; примерами агентов, способствующих выведению мочевой кислоты, являются бензбромарон, пробенесид или подобные; примерами подщелачивающих мочу агентов являются гидрокарбонат натрия, цитрат калия, цитрат натрия или подобные. Эти лекарственные средства предпочтительно используют при гиперурикемии или подагре.
В случае применения в комбинации с лекарственными средствами, отличными от ингибиторов SGLT2, например в применении при диабете, предпочтительной является комбинация по меньшей мере с одним веществом из группы, включающей усилитель чувствительности к инсулину, ингибитор абсорбции глюкозы, бигуанид, усилитель секреции инсулина, препарат инсулина, антагонист рецептора глюкагона, стимулятор рецепторной киназы инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1В, ингибитор гликогенфосфорилазы, ингибитор глюкозо-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза печени, D-хироинозит, ингибитор гликогенсинтазы-киназы-3, глюкагон-подобный пептид-1, аналог глюкагон-подобного пептида-1, агонист глюкагон-подобного пептида-1, амилин, аналог амилина, агонист амилина и супрессор аппетита; более предпочтительной является комбинация по меньшей мере с одним веществом из группы, включающей усилитель чувствительности к инсулину, ингибитор абсорбции глюкозы, бигуанид, усилитель секреции инсулина, препарат инсулина, антагонист рецептора глюкагона, стимулятор рецепторной киназы инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1В, ингибитор гликогенфосфорилазы, ингибитор глюкозо-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза печени, D-хироинозит, ингибитор гликогенсинтазы-киназы-3, глюкагон-подобный пептид-1, аналог глюкагон-подобного пептида-1, агонист глюкагон-подобного пептида-1, амилин, аналог амилина и агонист амилина; и наиболее предпочтительной является комбинация по меньшей мере с одним веществом из группы, включающей усилитель чувствительности к инсулину, ингибитор абсорбции глюкозы, бигуанид, усилитель секреции инсулина и препарат инсулина. Подобным образом, в применении при осложнениях, связанных с диабетом, предпочтительной является комбинация по меньшей мере с одним веществом из группы, включающей усилитель чувствительности к инсулину, ингибитор абсорбции глюкозы, бигуанид, усилитель секреции инсулина, препарат инсулина, антагонист рецептора глюкагона, стимулятор рецепторной киназы инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1В, ингибитор гликогенфосфорилазы, ингибитор глюкозо-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза печени, D-хироинозит, ингибитор гликогенсинтазы-киназы-3, глюкагон-подобный пептид-1, аналог глюкагон-подобного пептида-1, агонист глюкагон-подобного пептида-1, амилин, аналог амилина, агонист амилина, ингибитор альдозоредуктазы, ингибитор образования конечных продуктов прогрессирующего гликозилирования, ингибитор протеинкиназы С, антагонист рецептора γ-аминомасляной кислоты, антагонист натриевого канала, ингибитор фактора транскрипции NF-κВ, ингибитор липидпероксидазы, ингибитор дипептидазы N-ацетилированной-α -связанной кислоты, инсулин-подобный фактора роста I, тромбоцитарный фактор роста, аналог тромбоцитарного фактора роста, эпидермальный фактор роста, фактор роста нервов, производное карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128, ингибитор ангиотензинпревращающего фермента, ингибитор нейтральной эндопептидазы, антагонист рецептора ангиотензина II, ингибитор эндотелинпревращающего фермента, антагонист рецептора эндотелина и диуретический агент; и более предпочтительной является комбинация по меньшей мере с одним веществом из группы, включающей ингибитор альдозоредуктазы, ингибитор ангиотензинпревращающего фермента, ингибитор нейтральной эндопептидазы и антагонист рецептора ангиотензина II. Кроме того, в применении при лечении ожирения предпочтительной является комбинация по меньшей мере с одним веществом из группы, включающей усилитель чувствительности к инсулину, ингибитор абсорбции глюкозы, бигуанид, усилитель секреции инсулина, препарат инсулина, антагонист рецептора глюкагона, стимулятор рецепторной киназы инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1В, ингибитор гликогенфосфорилазы, ингибитор глюкозо-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза печени, D-хироинозит, ингибитор гликогенсинтазы-киназы-3, глюкагон-подобный пептид-1, аналог глюкагон-подобного пептида-1, агонист глюкагон-подобного пептида-1, амилин, аналог амилина, агонист амилина, агонист β3 -адреноцептора и супрессант аппетита; и более предпочтительной является комбинация по меньшей мере с одним веществом из группы, включающей агонист β3-адреноцептора и супрессант аппетита.
При применении фармацевтических композиций данного изобретения в практическом лечении используют различные дозированные формы в зависимости от их применений. Примерами дозированных форм являются порошки, гранулы, мелкие гранулы, сухие сиропы, таблетки, капсулы, инъекционные растворы, растворы, мази, суппозитории, припарки и подобные, которые вводят перорально или парентерально.
Эти фармацевтические композиции могут быть приготовлены смешиванием, или разбавлением, или разведением с подходящей фармацевтической добавкой, такой как эксципиенты, разрыхлители, связывающие вещества, смазывающие вещества, разбавители, буферы, агенты изотоничности, антисептики, увлажнители, эмульгаторы, диспергирующие агенты, стабилизирующие агенты, солюбилизирующие лобавки и подобные, и приготовлением смеси согласно общепринятым способам. В случае применения соединения данного изобретения в комбинации с лекарственными средствами, отличными от ингибиторов SGLT2, они могут быть приготовлены формулированием каждого активного ингредиента вместе или индивидуально.
При применении фармацевтических композиций данного изобретения в практическом лечении доза соединения, представленного приведенной выше общей формулой (I), или его фармацевтически приемлемой соли в качестве активного ингредиента определяется в зависимости от возраста, пола, веса тела и степени тяжести симптомов и лечения каждого пациента, и эта доза находится приблизительно в диапазоне от 0,1 до 1000 мг в день для взрослого человека в случае перорального введения и приблизительно в диапазоне от 0,01 до 300 мг в день для взрослого человека в случае парентерального введения, и эта суточная доза может быть разделена на одну-несколько доз в день и вводиться подходящим образом. Также и в случае применения соединения данного изобретения в комбинации с лекарственными средствами, отличными от ингибиторов SGLT2, доза соединения данного изобретения может быть уменьшена подходящим образом и необязательно зависит от дозы лекарственных средств, отличных от ингибиторов SGLT2.
Далее, данное изобретение иллюстрируется подробно следующими Ссылочными примерами, Примерами и Тест-примерами. Однако данное изобретение не ограничивается ими.
Ссылочный пример 1
1, 2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-он
К раствору 4-иопропоксибензилового спирта (0,34 г) в тетрагидрофуране (6 мл) добавляли триэтиламин (0,28 мл) и метансульфонилхлорид (0,16 мл) и эту смесь перемешивали при комнатной температуре в течение 30 минут. Полученный нерастворимый материал удаляли фильтрованием. Полученный раствор 4-иопропоксибензилметансульфоната в тетрагидрофуране добавляли в суспензию гидрида натрия (60%, 81 мг) и метилацетоацетата (0,20 мл) в 1,2-диметоксиэтане (10 мл) и смесь перемешивали при 80°С в течение ночи. Реакционную смесь выливали в насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток растворяли в толуоле (5 мл). К раствору добавляли безводный гидразин (0,19 мл) и смесь перемешивали в течение ночи при 80оС. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 1, 2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она (95 мг).
1H-ЯМР (ДМСО-d6) δ м.д.:
1,22 (6H, д, J=6,0 Гц), 1,99 (3H, с), 3, 45 (2H, с), 4,40-4,60 (1H, м), 6,65-6,80 (2H, м), 6,95-7,10 (2H, м)
Ссылочный пример 2
1, 2-дигидро-5-метил-4-[(4-пропилфенил)метил]-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-попилбензилового спирта вместо 4-иопропоксибензилового спирта.
1H-ЯМР (ДМСО-d6) δ м.д.:
0,75-0,95 (3H, м), 1,45-1,65 (2H, м), 1,99 (3H, с), 2,40-2,55 (2H, м), 3,32 (2H, с), 6,95-7,10 (4H, м)
Ссылочный пример 3
1,2-дигидро-4-[(4-изобутилфенил)метил]-5-метил-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-иобутилбензилового спирта вместо 4-иопропоксибензилового спирта.
1H-ЯМР (ДМСО-d6) δ м.д.:
0,83 (6H, д, J=6,6 Гц), 1,70-1,85 (1H, м), 1,99 (3H, с), 2,30-2,45 (2H, м), 3,50 (2H, с), 6,90-7,10 (4H, м)
Ссылочный пример 4
1,2-дигидро-5-метил-4-[(4-пропоксифенил)метил]-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-попоксибензилового спирта вместо 4-иопропоксибензилового спирта.
1H-ЯМР (ДМСО-d6) δ м.д.:
0,95 (3Н, т, J=7,4 Гц), 1,60-1,75 (2H, м), 1,98 (3H, с), 3,46 (2H, с), 3,75-3,90 (2H, м), 6,70-6,85 (2H, м), 6,95-7,10 (2H, м)
Ссылочный пример 5
4-[(4-этоксифенил)метил]-1, 2-дигидро-5-метил-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-эоксибензилового спирта вместо 4-иопропоксибензилового спирта.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,20-1,35 (3H, м), 1,98 (3H, с), 3,46 (2H, с), 3,85-4,05 (2H, м), 6,70-6,85 (2H, м), 6,95-7,10 (2H, м)
Ссылочный пример 6
1,2-дигидро-5-метил-4-[(4-трифторметилфенил)метил]-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-тифторметилбензилового спирта вместо 4-иопропоксибензилового спирта.
1H-ЯМР (ДМСО-d6) δ м.д.:
2,02 (3H, с), 3,64 (2H, с), 7,30-7,45 (2H, м), 7,55-7,70 (2H, м)
Ссылочный пример 7
4-[(4-трет-бутилфенил)метил]-1, 2-дигидро-5-метил-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-тет-бутилбензилового спирта вместо 4-иопропоксибензилового спирта.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,24 (9H, с), 2,01 (3H, с), 3,49 (2H, с), 7,00-7,15 (2H, м), 7,15-7,30 (2H, м)
Ссылочный пример 8
4-[(4-бутоксифенил)метил]-1,2-дигидро-5-метил-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-бтоксибензилового спирта вместо 4-иопропоксибензилового спирта.
1H-ЯМР (ДМСО-d6) δ м.д.:
0,91 (3H, т, J=7,4 Гц), 1,30-1,50 (2H, м), 1,55-1,75 (2H, м), 1,98 (3H, с), 3,46 (2H, с), 3,80-3,95 (2H, м), 6,70-6,85 (2H, м), 6,95-7,10 (2H, м)
Ссылочный пример 9
1,2-дигидро-5-метил-4-[(4-метилтиофенил)метил]-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-(метилтио)бензилового спирта вместо 4-иопропоксибензилового спирта.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,99 (3H, с), 2,42 (3H, с), 3,50 (2H, с), 7, 05-7,20 (4H, м)
Ссылочный пример 10
5-этил-1,2-дигидро-4-[(4-метилтиофенил)метил]-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 1, с использованием 4-(метилтио)бензилового спирта вместо 4-иопропоксибензилового спирта и с использованием метил-3-оксопентаноата вместо метилацетоацетата.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,02 (3H, т, J=7,6 Гц), 2,39 (2H, кв, J=7,6 Гц), 2,42 (3H, с), 3,51 (2H, с), 7,05-7,20 (4H, м)
Ссылочный пример 11
1,2-дигидро-4-[(4-изопропилфенил)метил]-5-метил-3Н-пиразол-3-он
К суспензии гидрида натрия (60%, 40 мг) в 1, 2-диметоксиэтане (1 мл) добавляли метилацетоацетат (0,11 мл), 4-иопропилбензилхлорид (0,17 г) и каталитическое количество иодида натрия и эту смесь перемешивали при 80°С в течение ночи. Реакционную смесь выливали в насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток растворяли в толуоле (1 мл). К раствору добавляли безводный гидразин (0,094 мл) и смесь перемешивали в течение ночи при 80°С. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 1, 2-дигидро-4-[(4-изопропилфенил)метил]-5-метил-3Н-пиразол-3-она (0,12 г).
1H-ЯМР (ДМСО-d6) δ м.д.:
1,16 (6H, д, J=6,9 Гц), 2,01 (3H, с), 2, 70-2,90 (1H, м), 3,49 (2H, с), 6,95-7,20 (4H, м)
Ссылочный пример 12
4-[(4-этилфенил)метил]-1,2-дигидро-5-метил-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 11, с использованием 4-эилбензилхлорида вместо 4-иопропилбензилхлорида.
1H-ЯМР (ДМСО-d6 ) δ м.д.:
1,13 (3H, т, J=7,6 Гц), 2,00 (3H, с), 2,45-2,60 (2H, м), 3,49 (2H, с), 7,00-7,15 (4H, м)
Ссылочный пример 13
1, 2-дигидро-5-метил-4-[(4-метилфенил)метил]-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 11, с использованием 4-мтилбензилбромида вместо 4-иопропилбензилхлорида.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,98 (3H, с), 2,23 (3H, с), 3,48 (2H, с), 6,95-7,10 (4H, м)
Ссылочный пример 14
4-бензил-1,2-дигидро-5-трифторметил-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 11, с использованием этилтрифторацетоацетата вместо метилацетоацетата и с использованием бензилбромида вместо 4-иопропилбензилхлорида.
1H-ЯМР (ДМСО-d6) δ м.д.:
3,73 (2H, с), 7,05-7,35 (5H, м), 12,50-13,10 (1H, ушир.с)
Ссылочный пример 15
1, 2-дигидро-4-[(4-метоксифенил)метил]-5-метил-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 11, с использованием 4-мтоксибензилбромида вместо 4-иопропилбензилхлорида.
1H-ЯМР (ДМСО-d6) δ м.д.:
1,99 (3H, с), 3,47 (2H, с), 3,69 (3H, с), 6,75-6,85 (2H, м),
7,00-7,10 (2H, м), 8,70-11,70 (2H, ушир.)
Ссылочный пример 16
4-бензил-1,2-дигидро-5-метил-3Н-пиразол-3-он
Указанное в заголовке соединение получали, как описано в Ссылочном Примере 11, с использованием бензилбромида вместо 4-иопропилбензилхлорида.
1H-ЯМР (ДМСО-d6) δ м.д.:
2,00 (3H, с), 3,54 (2H, с), 7,05-7,30 (5H, с)
Ссылочный пример 17
4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразол
К суспензии 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она (46 мг), ацетобром-α-D-глюкозы (99 мг) и молекулярных сит 4Å в тетрагидрофуране (3 мл) добавляли карбонат серебра (66 мг) и смесь перемешивали при облучении светом при 65°С в течение ночи. Реакционную смесь очищали колоночной хроматографией на аминопропилсиликагеле (элюент: тетрагидрофуран). Последующая очистка препаративной тонкослойной хроматографией на силикагеле (проявляющий растворитель: этилацетат:гексан = 2/1) давала 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол (42 мг).
1H-ЯМР (CDC13) δ м.д.:
1, 25-1,35 (6H, м), 1,88 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,10 (3H, с), 3,45-3,65 (2H, м), 3,80-3,90 (1H, м), 4,13 (1H, дд, J=2,3, 12,4 Гц), 4,31 (1H, дд, J=4,0, 12,4 Гц), 4,40-4,55 (1Н, м), 5,15-5,35 (3H, м), 5,50-5,60 (1H, м), 6,70-6,80 (2H, м), 6,95-7,05 (2H, м)
Ссылочный пример 18
5-метил-4-[(4-пропилфенил)метил]-3-(2,3,4, 6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 1, 2-дигидро-5-метил-4-[(4-пропилфенил)метил]-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
0,91 (3H, т, J=7,3 Гц), 1,50-1,65 (2H, м), 1,86 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,10 (3H, с), 2,45-2,55 (2H, м), 3,55 (1H, д, J=15,8 Гц), 3,63 (1H, д, J=15,8 Гц), 3,80-3,90 (1H, м), 4,13 (1H, дд, J=2,3, 12,4 Гц), 4,30 (1H, дд, J=3,9, 12,4 Гц), 5,15-5,35 (3H, м), 5,50-5,60 (1H, м), 7,00-7,20 (4H, м)
Ссылочный пример 19
4-[(4-изобутилфенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 1,2-дигидро-4-[(4-изобутилфенил)метил]-5-метил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
0,87 (6H, д, J=6,6 Гц), 1,70-1,85 (1H, м), 1,87 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,10 (3H, с), 2,40 (2H, д, J=7,2 Гц), 3,56 (1H, д, J=15,8 Гц), 3,63 (1H, д, J=15,8 Гц), 3,80-3,90 (1H, м), 4,14 (1H, дд, J=2,3, 12,4 Гц), 4,31 (1H, дд, J=4,0, 12,4 Гц), 5,15-5,35 (3H, м), 5,50-5,60 (1H, м), 6,95-7,10 (4H, м)
Ссылочный пример 20
5-метил-4-[(4-пропоксифенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 1,2-дигидро-5-метил-4-[(4-пропоксифенил)метил]-3Н-пиразол-3-она вместо 1, 2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,01 (3H, т, J=7,4 Гц), 1,70-1,85 (2H, м), 1,89 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,10 (3H, с), 3,53 (1H, д, J=15,7 Гц), 3,59 (1H, д, J=15,7 Гц), 3,80-3,95 (3H, м), 4,14 (1H, дд, J=2,3, 12,4 Гц), 4,31 (1H, дд, J=4,0, 12,4 Гц), 5, 15-5,35 (3H, м), 5,50-5,60 (1H, м), 6,70-6,80 (2H, м), 6,95-7,10 (2H, м).
Ссылочный пример 21
4-[(4-этоксифенил)метил]-5-метил-3-(2,3,4, 6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 4-[(4-этоксифенил)метил]-1, 2-дигидро-5-метил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,38 (3H, т, J=7,0 Гц), 1,89 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,10 (3H, с), 3,53 (1H, д, J=15,8 Гц), 3,59 (1H, д, J=15,8 Гц), 3,80-3,90 (1H, м), 3,98 (2H, кв, J=7,0 Гц), 4,13 (1H, дд, J=2, 3, 12,4 Гц), 4,31 (1H, дд, J=4,0, 12,4), 5,15-5,30 (3H, м), 5,50-5,60 (1H, м), 6,70-6,80 (2H, м), 6,95-7,10 (2H, м)
Ссылочный пример 22
5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-4-[(4-трифторметилфенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 1,2-дигидро-5-метил-4-[(4-трифторметилфенил)метил]-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,85 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,14 (3H, с), 3,65 (1H, д, J=15,9 Гц), 3,71 (1H, д, J=15,9 Гц), 3,80-3,90 (1H, м), 4,14 (1H, дд, J=2,4, 12,4 Гц), 4,31 (1H, дд, J=4,0, 12,4 Гц), 5,15-5,40 (3H, м), 5,55-5,65 (1H, м), 7,20-7,30 (2H, м), 7,45-7,55 (2H, м)
Ссылочный пример 23
4-[(4-трет-бутилфенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 4-[(4-трет-бутилфенил)метил]-1,2-дигидро-5-метил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,27 (9H, с), 1,84 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,14 (3H, с), 3,56 (1H, д, J=15,8 Гц), 3,64 (1H, д, J=15,8 Гц), 3,80-3,90 (1H, м), 4,13 (1H, дд, J=2,3, 12,4 Гц), 4,31 (1H, дд, J=4,0, 12,4 Гц), 5,15-5,30 (3H, м), 5,50-5,60 (1H, м), 7,00-7,10 (2H, м), 7,20-7,30 (2H, м)
Ссылочный пример 24
4-[(4-бутоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 4-[(4-бутоксифенил)метил]-1,2-дигидро-5-метил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
0,96 (3H, т, J=7,4 Гц), 1,40-1,55 (2H, м), 1,65-1,80 (2H, м), 1,88 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,10 (3H, с), 3,52 (1H, д, J=15,8 Гц), 3,59 (1H, д, J=15,8 Гц), 3,80-3,90 (1H, м), 3,91 (2H, т, J=6,5 Гц), 4,13 (1H, дд, J=2,3, 12,4 Гц), 4,31 (1H, дд, J=4,0, 12,4 Гц), 5,15-5,30 (3H, м), 5,50-5,60 (1H, м), 6,70-6,80 (2H, м), 6,95-7,10 (2H, м)
Ссылочный пример 25
5-метил-4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 1, 2-дигидро-5-метил-4-[(4-метилтиофенил)метил]-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,88 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,07 (3H, с), 2,12 (3H, с), 2,44 (3H, с), 3,50-3,65 (2H, м), 3,80-3,90 (1H, м), 4,13 (1H, дд, J=2,4, 12,4 Гц), 4,31 (1H, дд, J=4,1, 12,4 Гц), 5,15-5,30 (3H, м), 5,55-5,65 (1Н,м), 7,00-7,10 (2H, м), 7,10-7,20 (2H, м), 8,65-8,85 (1H, ушир.с)
Ссылочный пример 26
5-этил-4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 5-этил-1,2-дигидро-4-[(4-метилтиофенил)метил]-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,13 (3H, т, J=7,6 Гц), 1,88 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,44 (3H, с), 2,45-2,55 (2H, м), 3,50-3,70 (2H, м), 3,80-3,90 (1H, м), 4,05-4,20 (1H, м), 4,31 (1H, дд, J=4,0, 12,4 Гц), 5,15-5,35 (3H, м), 5,55-5,65 (1H, м), 7,00-7,10 (2H, м), 7,10-7,20 (2H, м), 8,80-9,20 (1H, ушир.с)
Ссылочный пример 27
4-[(4-изопропилфенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 1,2-дигидро-4-[(4-изопропилфенил)метил]-5-метил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1 H-ЯМР (CDC13) δ м.д.:
1,20 (6H, д, J=6,9 Гц), 1,85 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,13 (3H, с), 2,75-2,90 (1H, м), 3,56 (1H, д, J=15,8 Гц), 3,63 (1H, д, J=15,8 Гц), 3,80-3,90 (1H, м), 4,05-4,20 (1H, м), 4,31 (1H, дд, J=4,0, 12,4 Гц), 5,15-5,35 (3H, м), 5,50-5,60 (1H, м), 7,00-7,15 (4H, м), 8,70-9,30 (1H, ушир.с)
Ссылочный пример 28
4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол
К раствору 1, 2-дигидро-4-[(4-метилтиофенил)метил]-5-трифторметил-3Н-пиразол-3-она (2,0 г) в ацетонитриле (100 мл) добавляли ацетобром-α-D-глюкозу (3,1 г) и карбонат калия (11,1 г) и эту смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором и солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/1) с получением 4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола (2,0 г).
1H-ЯМР (CDC13) δ м.д.:
1,91 (3H, с), 2,03 (3H, с), 2,04 (3H, с), 2,09 (3H, с), 2,45 (3H, с), 3,73 (2H, с), 3,75-3,90 (1H, м), 4,15-4,35 (2H, м), 5,15-5,65 (4H, м), 7,00-7,20 (4H, м)
Ссылочный пример 29
4-бензил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 28, с использованием 4-бензил-1,2-дигидро-5-трифторметил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-метилтиофенил)метил]-5-трифторметил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,89 (3H, с), 2,02 (3H, с), 2,04 (3H, с), 2,08 (3H, с), 3,70-3,90 (3H, м), 4,15-4,30 (2H, м), 5,10-5,50 (4H, м), 7,10-7,30 (5H, м)
Ссылочный пример 30
4-[(4-метоксифенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 28, с использованием 1,2-дигидро-4-[(4-метоксифенил)метил]-5-трифторметил-3Н-пиразол-3-она вместо 1, 2-дигидро-4-[(4-метилтиофенил)метил]-5-трифторметил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,93 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,09 (3H, с), 3,65-3,75 (2H, м), 3,77 (3H, с), 3,75-3,90 (1H, м), 4,15-4,35 (2H, м), 5,10-5,45 (4H, м), 6,75-6,85 (2H, м), 7,00-7,15 (2H, м)
Ссылочный пример 31
4-[(4-метоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 1,2-дигидро-4-[(4-метоксифенил)метил]-5-метил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,89 (3H, с), 2,02 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,10 (3H, с), 3,45-3,65 (2H, м), 3,76 (3H, с), 3,80-3,90 (1H, м), 4,11 (1H, дд, J=2,2, 12,4 Гц), 4,30 (1H, дд, J=4,0, 12,4 Гц), 5,15-5,35 (3H, м), 5,50-5,60 (1Н, м), 6,70-6,85 (2H, м), 7,00-7,10 (2H, м)
Ссылочный пример 32
4-бензил-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 17, с использованием 4-бензил-1,2-дигидро-5-метил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она.
1H-ЯМР (CDC13) δ м.д.:
1,86 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,11 (3H, с), 3,59 (1H, д, J=15,8 Гц), 3,66 (1H, д, J=15,8 Гц), 3,80-3,90 (1H, м), 4,11 (1H, дд, J=2,3, 12,4 Гц), 4,30 (1H, дд, J=4,0, 12,4 Гц), 5,15-5,30 (3H, м), 5,50-5,65 (1H, м), 7,05-7,30 (5H, м), 8,75-9,55 (1H, ушир.с)
Ссылочный пример 33
4-[(4-метоксифенил)метил]-1, 5-диметил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)пиразол
Суспензию 4-[(4-метоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола (18 г), карбоната калия (14 мг) и иодметана (4,7 мг) в ацетонитриле (2 мл) перемешивали при 75°С в течение ночи. Реакционную смесь фильтровали через Celite® и растворитель фильтрата удаляли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией на силикагеле (проявляющий растворитель: бензол/ацетон = 2/1) с получением 4-[(4-метоксифенил)метил]-1,5-диметил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)пиразола (4 мг).
1H-ЯМР (CDC13) δ м.д.:
1,90 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,07 (3H, с), 3,45-3,60 (2H, м), 3,60 (3H, с), 3,76 (3H, с), 3,80-3,90 (1H, м), 4,13(1H, дд, J=2,4, 12,4 Гц), 4,29 (1H, дд, J=4,1, 12, 4 Гц), 5,15-5,30 (3H, м), 5,50-5,60 (1H, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Ссылочный пример 34
1-метил-4-[(4-метилтиофенил)метил]-3-(2,3,4, 6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифтотрметилпиразол
Суспензию 4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола (30 мг), карбоната калия (8,0 мг) и иодметана (8,2 мг) в тетрагидрофуране (1 мл) перемешивали при 75°С в течение ночи. Реакционную смесь фильтровали через Celite® и растворитель фильтрата удаляли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией на силикагеле (проявляющий растворитель: дихлорметан/этилацетат = 5/1) с получением 1-метил-4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифтотрметилпиразола (13 мг).
1 H-ЯМР (CDC13) δ м.д.:
1,89 (3H, с), 2,02 (3H, с), 2,04 (3H, с), 2,07 (3H, с), 2,44 (3H, с), 3,65-3,95 (6H, м), 4,14 (1H, дд, J=2,3, 12,4 Гц), 4,29 (1H, дд, J=4,3, 12, 4 Гц), 5,15-5,35 (3H, м), 5,50-5,65 (1H, м), 7,00-7,20 (4H, м)
Ссылочный пример 35
1-этил-4-[(4-метилтиофенил)метил]-3-(2,3,4, 6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифтотрметилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 34, с использованием иодэтана вместо иодметана.
1H-ЯМР (CDC13) δ м.д.:
1,40 (3H, т, J=7,2 Гц), 1,90 (3H, с), 2,02 (3H, с), 2,04 (3H, с), 2,06 (3H, с), 2,44 (3H, с), 3,72 (2H, с), 3,80-3,90 (1H, м), 4,05-4,20 (3H, м), 4,27 (1H, дд, J=4,5, 12,4 Гц), 5,10-5,35 (3H, м), 5,55-5,65 (1H, м), 7,00-7,10 (2H, м), 7,10-7,20 (2H, м)
Ссылочный пример 36
4-[(4-метилтиофенил)метил]-1-пропил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 34, с использованием 1-иодпропана вместо иодметана.
1H-ЯМР (CDC13) δ м.д.:
0,92 (3H, т, J=7,4 Гц), 1,75-1,90 (2H, м), 1,89 (3H, с), 2,02 (3H, с), 2,04 (3H, с), 2,06 (3H, с), 2,44 (3H, с), 3,72 (2H, с), 3,80-3,90 (1H, м), 3,90-4,05 (2H, м), 4,12 (1H, дд, J=2,3, 12,4 Гц), 4,27 (1H, дд, J=4,5, 12,4 Гц), 5,10-5, 35 (3H, м), 5,55-5,65 (1H, м), 7,00-7,10 (2H, м), 7,10-7,20 (2H, м)
Ссылочный пример 37
3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразол
К раствору 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола (61 мг) в этаноле (3 мл) добавляли 1 моль/л водного раствора гидроксида натрия (0,53 мл) и эту смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывающий растворитель: дистиллированная вода, элюент: метанол) с получением 3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола (39 мг).
1H-ЯМР (CD3OD) δ м.д.:
1,26 (6H, д, J=5,9 Гц), 2,05 ( 3H, с), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,75-3,90 (1H, м), 4,45-4,60 (1H, м), 5,00-5,10 (1H, м), 6,70-6,80 (2H, м), 7,00-7,15 (2H, м)
Ссылочный пример 38
3-(β-D-глюкопиранозилокси)-5-метил-4-[(4-пропилфенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 5-метил-4-[(4-пропилфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
0,91 (3H, т, J=7,5 Гц), 1,50-1,65 (2H, м), 2,05 (3H, с), 2,45-2,60 (2H, м), 3, 25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,83 (1H, д, J=11,9 Гц), 5,00-5,10 (1H, м), 7,00-7,15 (4H, м)
Ссылочный пример 39
3-(β -D-глюкопиранозилокси)-4-[(4-изобутилфенил)метил]-5-метил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-изобутилфенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
0,87 (6H, д, J=6,6 Гц), 1,70-1,90 (1H, м), 2,04 (3H, с), 2,41 (2H, д, J=7,1 Гц), 3,25-3,45 (4H, м), 3,55-3,90 (4H, м), 5,00-5,10 (1H, м), 6,95-7,15 (4H, м)
Ссылочный пример 40
3-(β -D-глюкопиранозилокси)-5-метил-4-[(4-пропоксифенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 5-метил-4-[(4-пропоксифенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,02 (3H, т, J=7,4 Гц), 1,65-1,80 (2H, м), 2,05 (3H, с), 3,25-3,45 (4H, м), 3, 60-3,75 (3H, м), 3,80-3,90 (3H, м), 5,00-5,10 (1H, м), 6,70-6,85 (2H, м), 7,05-7,15 (2H, м)
Ссылочный пример 41
4-[(4-этоксифенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-этоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,34 (3H, т, J=7,0 Гц), 2,05 (3H, с), 3,25-3,45 (4H,м), 3,60-3,75 (3H, м), 3, 80-3,90 (1H, м), 3,97 (2H, кв, J=7,0 Гц), 5,00-5,10 (1H, м), 6,70-6,85 (2H, м), 7,05-7,15 (2H, м)
Ссылочный пример 42
3-(β -D-глюкопиранозилокси)-5-метил-4-[(4-трифторметилфенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 5-метил-3-(2,3, 4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-4-[(4-трифторметилфенил)метил]-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2,08 (3H, с), 3,20-3,40 (4H, м), 3,67 (1H, дд, J=5,0, 11,9 Гц), 3,75-3,90 (3H, м), 5,00-5,10 (1H, м), 7,30-7,45 (2H, м), 7,45-7,60 (2H, м)
Ссылочный пример 43
4-[(4-трет-бутилфенил)метил]-3-(β -D-глюкопиранозилокси)-5-метил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-трет-бутилфенил)метил]-5-метил-3-(2,3,4, 6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,28 (9H, с), 2,06 (3H, с), 3,25-3,45 (4H, м), 3,60-3,90 (4H, м), 5,00-5,10 (1H, м), 7,05-7,15 (2H, м), 7,20-7,30 (2H, м)
Ссылочный пример 44
4-[(4-бутоксифенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-бутоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
0,97 (3H, т, J=7,4 Гц), 1,40-1,55 (2H, м), 1,65-1,80 (2H, м), 2,05 (3H, с), 3,30-3,45 (4H, м), 3,60-3,75 (3H, м), 3,83 (1H, д, J=12,0 Гц), 3,91 (2H, т, J=6,4 Гц), 5,00-5,10 (1H, м), 6,70-6,85 (2H, м), 7,05-7, 15 (2H, м)
Ссылочный пример 45
3-(β-D-глюкопиранозилокси)-5-метил-4-[(4-метилтиофенил)метил]-1-Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 5-метил-4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2,06 (3H, с), 2,42 (3H, с), 3,20-3,45 (4H, м), 3,55-3,75 (3H, м), 3,80-3,90 (1H, м), 5,00-5,10 (1H, м), 7,05-7,20 (4H, м)
Ссылочный пример 46
5-этил-3-(β-D-глюкопиранозилокси)-4-[(4-метилтиофенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 5-этил-4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,06 (3H, т, J=7,6 Гц), 2,42 (3H, с), 2,47 (2H, кв, J=7,6 Гц), 3,25-3,45 (4H, м), 3,60-3,80 (3H, м), 3,80-3,90 (1H, м), 5,00-5,10 (1H, м), 7,10-7,20 (4H, м)
Ссылочный пример 47
3-(β -D-глюкопиранозилокси)-4-[(4-изопропилфенил)метил]-5-метил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-изопропилфенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,20 (6H, д, J=6,9 Гц), 2,05 (3H, с), 2,75-2,90 (1H, м), 3,25-3,45 (4H, м), 3, 55-3,90 (4H, м), 5,00-5,10 (1H, м), 7,00-7,15 (4H, м)
Ссылочный пример 48
3-(β -D-глюкопиранозилокси)-4-[(4-метилтиофенил)метил]-5-трифторметил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2,42 (3H, с), 3,25-3,50 (4H, м), 3,69 (1H, дд, J=4,9, 12,0 Гц), 3,75-3,90 (3H, м), 4,90-5,10 (1H, м), 7,10-7,20 (4H, м)
Ссылочный пример 49
4-бензил-3-(β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-бензил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
3,25-3, 45 (4H, м), 3,67 (1H, дд, J=5,3, 12,0 Гц), 3,80-3,95 (3H, м), 4,97 (1H, д, J=7,4 Гц), 7,05-7,25 (5H, м)
Ссылочный пример 50
3-(β -D-глюкопиранозилокси)-4-[(4-метоксифенил)метил]-5-трифторметил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-метоксифенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
3,25-3,45 (4H, м), 3,67 (1H, д, J=5,4, 12,1 Гц), 3,73 (3H, с), 3,75-3,90 (3H, м), 4,90-5,00 (1H, м), 6,70-6,85 (2H, м), 7,05-7,15 (2H, м)
Ссылочный пример 51
3-(β -D-глюкопиранозилокси)-4-[(4-метоксифенил)метил]-5-метил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-метоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2,04 (3H, с), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,73 (3H, с), 3,80-3,90 (1H, м), 5,00-5,10 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м)
Ссылочный пример 52
4-бензил-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-бензил-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2, 05 (3H, с), 3,25-3,45 (4H, м), 3,60-3,90 (4H, м), 5,00-5,10 (1H, м), 7,05-7,25 (5H, м)
Ссылочный пример 53
3-(β -D-глюкопиранозилокси)-4-[(4-метоксифенил)метил]-1,5-диметилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-метоксифенил)метил]-1,5-диметил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2,06 (3H, с), 3,25-3,45 (4H, м), 3,55-3,70 (6H, м), 3,73 (3H, с), 3,75-3,90 (1H, м), 5,00-5,10 (1H, м), 6,70-6,80 (2H, м), 7,05-7,15 (2H, м)
Ссылочный пример 54
3-(β -D-глюкопиранозилокси)-1-метил-4-[(4-метилтиофенил)метил]-5-трифторметилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 1-метил-4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметилпиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2,42 (3H, с), 3,30-3,50 (4H, м), 3,69 (1H, дд, J=4,7, 12,0 Гц), 3,75-3,90 (6H, м), 5,25-5,35 (1H, м), 7,05-7,20 (4H, м)
Ссылочный пример 55
1-этил-3-(β -D-глюкопиранозилокси)-4-[(4-метилтиофенил)метил]-5-трифторметилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 1-этил-4-[(4-метилтиофенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметилпиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,38 (3H, т, J=7,1 Гц), 2,42 (3H, с), 3,30-3,50 (4H, м), 3,60-3,75 (1H, м), 3, 75-3,90 (3H, м), 4,14 (2H, кв, J=7,1 Гц), 5,25-5,35 (1H, м), 7,05-7,20 (4H, м)
Ссылочный пример 56
3-(β -D-глюкопиранозилокси)-4-[(4-метилтиофенил)метил]-1-пропил-5-трифторметилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-метилтиофенил)метил]-1-пропил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметилпиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
0,90 (3H, т, J=7,4 Гц), 1,75-1,90 (2H, м), 2,42 (3H, с), 3,30-3,50 (4H, м), 3,69 (1H, дд, J=4,9, 12,0 Гц), 3,75-3,90 (3H, м), 4,00-4,10 (2H, м), 5,25-5,35 (1H, м), 7,05-7,20 (4H, м)
Ссылочный пример 57
3-(β -D-глюкопиранозилокси)-5-метил-4-[(4-метилфенил)метил]-1Н-пиразол
5-метил-4-[(4-метилфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол получали, как описано в Ссылочном примере 17, с использованием 1,2-дигидро-5-метил-4-[(4-метилфенил)метил]-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она. Затем указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 5-метил-4-[(4-метилфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2,04 (3H, с), 2,26 (3H, с), 3,25-3,45 (4H, м), 3,55-3,90 (4H, м), 5,00-5,10 (1H, м), 6,95-7,15 (4H, м)
Ссылочный пример 58
4-[(4-этилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразол
4-[(4-этилфенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол получали, как описано в Ссылочном примере 17, с использованием 4-[(4-этилфенил)метил]-1,2-дигидро-5-метил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-изопропоксифенил)метил]-5-метил-3Н-пиразол-3-она. Затем указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-этилфенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1, 18 (3H, т, J=7,6 Гц), 2,04 (3H, с), 2,57 (2H, кв, J=7,6 Гц), 3,25-3,45 (4H, м), 3,55-3,90 (4H, м), 5,00-5,10 (1H, м), 6,95-7,20 (4H, м)
Ссылочный пример 59
3-(β-D-глюкопиранозилокси)-4-[(4-метилфенил)метил]-5-трифторметил-1Н-пиразол
4-[(4-метилфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол получали, как описано в Ссылочном примере 28, с использованием 1,2-дигидро-4-[(4-метилфенил)метил]-5-трифторметил-3Н-пиразол-3-она вместо 1, 2-дигидро-4-[(4-метилтиофенил)метил]-5-трифторметил-3Н-пиразол-3-она. Затем указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-метилфенил)метил]-3-(2, 3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
2,25 (3H, с), 3,20-3,45 (4H, м), 3,55-3,70 (1H, м), 3,70-3,90 (3H, м), 4,80-4,95 (1H, м), 6,90-7,15 (4H, м)
Ссылочный пример 60
4-[(4-этилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол
4-[(4-этилфенил)метил]-3-(2,3,4, 6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол получали, как описано в Ссылочном примере 28, с использованием 4-[(4-этилфенил)метил]-1, 2-дигидро-5-трифторметил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-метилтиофенил)метил]-5-трифторметил-3Н-пиразол-3-она. Затем указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-этилфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4, 6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,18 (3H, т, J=7,6 Гц), 2,50-2,60 (2H, м), 3,15-3,40 (4H, м), 3,55-3,65 (1H, м), 3,70-3,90 (3H, м), 4,80-4,95 (1H, м), 6,95-7,15 (4H, м)
Ссылочный пример 61
3-(β -D-глюкопиранозилокси)-4-[(4-изопропилфенил)метил]-5-трифторметил-1Н-пиразол
4-[(4-изопропилфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол получали, как описано в Ссылочном примере 28, с использованием 1,2-дигидро-4-[(4-изопропилфенил)метил]-5-трифторметил-3Н-пиразол-3-она вместо 1, 2-дигидро-4-[(4-метилтиофенил)метил]-5-трифторметил-3Н-пиразол-3-она. Затем указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-изопропилфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,20 (6H, д, J=6,9 Гц), 2,75-2,85 (1H, м), 3,15-3,40 (4H, м), 3,55-3,65 (1H, м), 3,70-3,90 (3H, м), 4,80-4,95 (1H, м), 7,00-7,15 (4H, м)
Ссылочный пример 62
4-[(4-хлорфенил)метил]-3-(β -D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол
4-[(4-хлорфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразол получали, как описано в Ссылочном примере 28, с использованием 4-[(4-хлорфенил)метил]-1,2-дигидро-5-трифторметил-3Н-пиразол-3-она вместо 1,2-дигидро-4-[(4-метилтиофенил)метил]-5-трифторметил-3Н-пиразол-3-она. Затем указанное в заголовке соединение получали, как описано в Ссылочном примере 37, с использованием 4-[(4-хлорфенил)метил]-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-5-трифторметил-1Н-пиразола вместо 4-[(4-изопропоксифенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
3,20-3, 40 (4H, м), 3,55-3,70 (1H, м), 3,75-3,90 (3H, м), 4,80-4,95 (1Н, м), 7,10-7,25 (4H, м)
Ссылочный пример 63
3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1-пропилпиразол
К суспензии 3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола (50 мг) и карбоната цезия (0,20 г) в N,N-диметилформамиде (1 мл) добавляли 1-иодпропан (0,036 мл) при 50°С и эту смесь перемешивали в течение ночи. К реакционной смеси добавляли воду и полученную смесь очищали твердофазной экстракцией на ODS (промывающий растворитель: дистиллированная вода, элюент: метанол). Полученный полуочищенный материал очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 8/1) с получением 3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1-пропилпиразола (28 мг).
1H-ЯМР (CD3OD) δ м.д.:
0,87 (3H, т, J=7,4 Гц), 1,26 (6H, д, J=6,0 Гц), 1,65-1,80 (2H, м), 2,07 (3H, с), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,75-3,95 (3H, м), 4,40-4,60 (1H, м), 5,00-5,10 (1H, м), 6, 70-6,80 (2H, м), 7,00-7,10 (2H, м)
Ссылочный пример 64
1-этил-3-(β-D-глюкопиранозилокси)-4-[(4-изопропилфенил)метил]-5-метилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием иодэтана вместо 1-иодпропана.
1H-ЯМР (CD3OD) δ м.д.:
1,26 (6H, д, J=6,0 Гц), 1,29 (3H, т, J=7,2 Гц), 2,08 (3H, с), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,75-3,90 (1H, м), 3,96 (2H, кв, J=7,2 Гц), 4,40-4,60 (1H, м), 5,00-5,10 (1Н, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Ссылочный пример 65
1-этил-3-(β-D-глюкопиранозилокси)-4-[(4-метоксифенил)метил]-5-метилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием 3-(β-D-глюкопиранозилокси)-4-[(4-метоксифенил)метил]-5-метил-1Н-пиразола вместо 3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола и с использованием иодэтана вместо 1-иодпропана.
1H-ЯМР (CD3OD) δ м.д.:
1,29 (3H, т, J=7,1 Гц), 2,07 (3H, с), 3,20-3,45 (4H, м), 3,55-3,75 (6H, м), 3,82 (1H, дд, J=2,0, 12,0 Гц), 3,90-4,05 (2H, м), 5,00-5,10 (1H, м), 6,70-6,85 (2H, м), 7,05-7,15 (2H, м)
Ссылочный пример 66
3-(β-D-глюкопиранозилокси)-4-[(4-метоксифенил)метил]-5-метил-1-пропилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием 3-(β-D-глюкопиранозилокси)-4-[(4-метоксифенил)метил]-5-метил-1Н-пиразола вместо 3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
0,87 (3H, т, J=7,5 Гц), 1,65-1,80 (2H, м), 2,07 (3H, с), 3,35-3,45 (4H, м), 3,60-3,75 (3H, м), 3,73 (3H, с), 3,75-3,85 (1H, м), 3,85-3,95 (2H, м), 5,00-5,10 (1H, м), 6,70-6,85 (2H, м), 7,00-7,15 (2H, м)
Ссылочный пример 67
1-этил-4-[(4-этоксифенил)метил]-3-(β-D-глюкопиранозилокси)-5-метилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием 4-[(4-этоксифенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразола вместо 3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола и с использованием иодэтана вместо 1-иодпропана.
1H-ЯМР (CD3OD) δ м.д.:
1,28 (3H, т, J=7,4 Гц), 1,34 (3H, т, J=7,2 Гц), 2,07 (3H, с), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 3,90-4,00 (4H, м), 5,00-5,10 (1H, м), 6,70-6,85 (2H, м), 7,00-7,15 (2H, м)
Ссылочный пример 68
4-[(4-этоксифенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1-пропилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием 4-[(4-этоксифенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразола вместо 3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
0,87 (3H, т, J=7,6 Гц), 1,34 (3H, т, J=7,1 Гц), 1,65-1,80 (2H, м), 2,07 (3H, с), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,81 (1H, дд, J=2,1, 12,1 Гц), 3,85-4,05 (4H, м), 5,00-5,10 (1H, м), 6,70-6,85 (2H, м), 7,00-7,15 (2H, м)
Ссылочный пример 69
1-этил-4-[(4-этилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-метилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием 4-[(4-этилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразола вместо 3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола и с использованием иодэтана вместо 1-иодпропана.
1H-ЯМР (CD3OD) δ м.д.:
1,17 (3H, т, J=7,6 Гц), 1,28 (3H, т, J=7,2 Гц), 2,06 (3H, с), 2,56 (2H, кв, J=7,6 Гц), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 3,90-4,00 (2H, м), 5,00-5,10 (1H, м), 7,00-7, 15(4H,м)
Ссылочный пример 70
4-[(4-этилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1-пропилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием 4-[(4-этилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразола вместо 3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола.
1H-ЯМР (CD3OD) δ м.д.:
0,87 (3H, т, J=7,4 Гц), 1,17 (3H, т, J=7,6 Гц), 1,65-1,80 (2H, м), 2,06 (3H, с), 2,56 (2H, кв, J=7,6 Гц), 3,25-3,45 (4H, м), 3,60-3,95 (6H, м), 5,00-5,10 (1H, м), 7,00-7,15 (4H, м)
Ссылочный пример 71
1-бутил-3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием 1-бромбутана вместо 1-иодпропана.
1H-ЯМР (CD3OD) δ м.д.:
0,92 (3H, т, J=7,4 Гц), 1,20-1,40 (8H, м), 1,60-1,75 (2H, м), 2,07 (3H, с), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,81 (1H, дд, J=2,1, 12,0 Гц), 3,91 (2H, т, J=7,2 Гц), 4,45-4,55 (1H, м), 5,00-5,10 (1H, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Ссылочный пример 72
3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 63, с использованием 2-бомпропана вместо 1-иодпропана.
1H-ЯМР (CD3OD) δ м.д.:
1,26 (6H, д, J=6,0 Гц), 1,30-1,40 (6H, м), 2,08 (3H, с), 3,15-3,45 (4H, м), 3,55-3,75 (3H, м), 3,78 (1H, дд, J=2,3, 12,0 Гц), 4,35-4,45 (1H, м), 4,45- 4,55 (1H, м), 5,00-5,10 (1H, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Ссылочный пример 73
4-[(4-этилтиофенил)метил]-1,2-дигидро-5-метил-3Н-пиразол-3-он
К раствору 4-эилтиобензилового спирта (8,3 г) и триэтиламина (6,9 мл) в тетрагидрофуране (200 мл) добавляли метансульфонилхлорид (3,8 мл) при 0°С и эту смесь перемешивали в течение 1 часа. Нерастворимое вещество удаляли фильтрованием. Полученный раствор 4-эилтиобензилметансульфоната в тетрагидрофуране добавляли к суспензии гидрида натрия (60%, 2,2 г) и метилацетоацетата (5,3 мл) в 1,2-диметоксиэтане (200 мл) и эту смесь перемешивали при 80°С в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали солевым раствором, сушили над безводным сульфатом магния и растворитель удаляли при пониженном давлении. К раствору остатка в толуоле (150 мл) добавляли моногидрат гидразина (7,2 мл) и эту смесь перемешивали при 80°С в течение 1 часа. Реакционную смесь охлаждали до 0°С и перемешивали еще в течение 1 часа. Полученные осадки собирали фильтрованием и промывали водой и гексаном с получением 4-[(4-этилтиофенил)метил]-1,2-дигидро-5-метил-3Н-пиразол-3-она (1,5 г).
1H-ЯМР (CD3OD) δ м.д.:
1,19 (3H, т, J=7,3 Гц), 2,00 (3H, с), 2,90 (2H, кв, J=7,3 Гц), 3,51 (2H, с), 7,05-7,15 (2H, м), 7,15-7,25 (2H, м)
Ссылочный пример 74
4-[(4-этилтиофенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразол
К суспензии 4-[(4-этилтиофенил)метил]-1,2-дигидро-5-метил-3Н-пиразол-3-она (1,6 г) и ацетобром-α-D-глюкозы (2,9 г) в тетрагидрофуране (30 мл) добавляли карбонат серебра (2,1 г) и смесь перемешивали при экранировании света при 60°С в течение ночи. Реакционную смесь очищали колоночной хроматографией на аминопропилсиликагеле (элюент: тетрагидрофуран) и дополнительно колоночной хроматографией на силикагеле (элюент: гексан/этилацетат = 1/3) с получением 4-[(4-этилтиофенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилокси)-1Н-пиразола (1,4 г).
1H-ЯМР (CD3OD) δ м.д.:
1,28 (3H, т, J=7,4 Гц), 1,88 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,11 (3H, с), 2,89 (2H, кв, J=7,4 Гц), 3,56 (1H, д, J=15,9 Гц), 3,62 (1H, д, J=15,9 Гц), 3,80-3,90 (1H, м), 4,13 (1H, дд, J=2, 3, 12,6 Гц), 4,31 (1H, дд, J=3,9, 12,6 Гц), 5,15-5,35 (3H, м), 5,55-5,65 (1H, м), 7,00-7,10 (2H, м), 7,15-7,25 (2H, м), 8,79 (1H, ушир.с)
Ссылочный пример 75
4-[(4-этилтиофенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразол
К раствору 4-[(4-этилтиофенил)метил]-5-метил-3-(2,3,4,6-тетра-О-ацетил-β -D-глюкопиранозилокси)-1Н-пиразола (1,3 г) в метаноле (10 мл) добавляли метоксид натрия (28% раствор в метаноле, 0,13 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 5/1) с получением 4-[(4-этилтиофенил)метил]-3-(β -D-глюкопиранозилокси)-5-метил-1Н-пиразола (0,87 г).
1H-ЯМР (CD3OD) δ м.д.:
1,24 (3H, т, J=7,3 Гц), 2,06 (3H, с), 2,88 (2H, кв, J=7,3 Гц), 3,30-3,45 (4H, м), 3,60-3,80 (3H, м), 3,80-3,90 (1H, м), 5,00-5,10 (1H, м), 7,10-7,30 (4H, м)
Ссылочный пример 76
1-(бензилоксикарбонил)-3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метилпиразол
К раствору 3-(β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола (1,3 г) в тетрагидрофуране (30 мл) добавляли N-(бензилоксикарбонилокси)сукцинимид (1,6 г) и эту смесь перемешивали с обратным холодильником при кипячении в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 1-(бензилоксикарбонил)-3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метилпиразола (1,3 г).
1H-ЯМР (CD3OD) δ м.д.:
1,27 (6H, д, J=6,3 Гц), 2,35 (3H, с), 3,45-3,70 (6H, м), 3,76 (1H, дд, J=4,5, 12,0 Гц), 3,85 (1H, дд, J=2,8, 12,0 Гц), 4,40-4,50 (1H, м), 5,30-5,40 (2H, м), 5,48 (1H, д, J=8,0 Гц), 6,70-6,80 (2H, м), 6,95-7,05 (2H, м), 7,25-7,50 (5H, м)
Ссылочный пример 77
1-(бензилоксикарбонил)-3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метилпиразол
К раствору 1-(бензилоксикарбонил)-3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метилпиразола (0, 20 г) в 2,4,6-триметилпиридине (4 мл) добавляли этилхлорформиат (0,092 мл) и эту смесь перемешивали при комнатной температуре в течение 1 дня. К реакционной смеси добавляли воду и моногидрат лимонной кислоты и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом магния и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 1-(бензилоксикарбонил)-3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метилпиразола (0,17 г).
1H-ЯМР (CD3OD) δ м.д.:
1,19 (3H, т, J=7,1 Гц), 1,26 (6H, д, J=6,0 Гц), 2,36 (3H, с), 3,30-3,50 (3H, м), 3,50-3,75 (3H, м), 4,10 (2H, кв, J=7,1 Гц), 4,25-4,35 (1H, м), 4,35-4,45 (1H, м), 4,45-4,60 (1H, м), 5,35-5,45 (2H, м), 5,45-5,60 (1H, м), 6,70-6,85 (2H, м), 7,00-7,15 (2H, м), 7,30-7,55 (5H, м)
Ссылочный пример 78
1-(бензилоксикарбонил)-4-[(4-изопропоксифенил)метил]-3-(6-О-метоксикарбонил-β -D-глюкопиранозилокси)-5-метилпиразол
Указанное в заголовке соединение получали, как описано в Ссылочном примере 77, с использованием метилхлорформиата вместо этилхлорформиата.
1H-ЯМР (CDC13) δ м.д.:
1,30 (6H, д, J=6,4 Гц), 2,43 (3H, с), 3,45-3,70 (6H, м), 3,78 (3H, с), 4,39 (1H, дд, J=2,2, 11,8 Гц), 4,40-4,55 (2H, м), 5, 38 (2H, с), 5,40-5,50 (1H, м), 6,70-6,85 (2H, м), 7,00-7,10 (2H, м), 7,30-7,50 (5H, м)
Пример 1
3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол
К раствору 3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразола (0,10 г) в 2,4,6-триметилпиридине (1 мл) добавляли этилхлорформиат (0,072 г) и эту смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли моногидрат лимонной кислоты (3,3 г) и воду и полученную смесь очищали ODS-твердофазной экстракцией (промывающий растворитель: дистиллированная вода, элюент: метанол). Дополнительная очистка колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) и перекристаллизация (растворитель для перекристаллизации: этилацетат/гексан = 1/3) давали 3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол (0,084 г).
1H-ЯМР (CD3OD) δ м.д.:
1,23 (3H, т, J=7,0 Гц), 1, 26 (6H, д, J=5,8 Гц), 1,30-1,40 (6H, м), 2,07 (3H, с), 3,25-3,45 (4H, м), 3,60-3,70 (2H, м), 4,12 (2H, кв, J=7,0 Гц), 4,21(1H, дд, J=5,4, 11,6 Гц), 4,34 (1H, дд, J=1,7, 11,6 Гц), 4,35-4,45 (1H, м), 4, 45-4,55 (1H, м), 5,00-5,10 (1H, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Примеры 2-14
Соединения, перечисленные в таблице 1, получали из соответствующего исходного материала, как описано в примере 1.
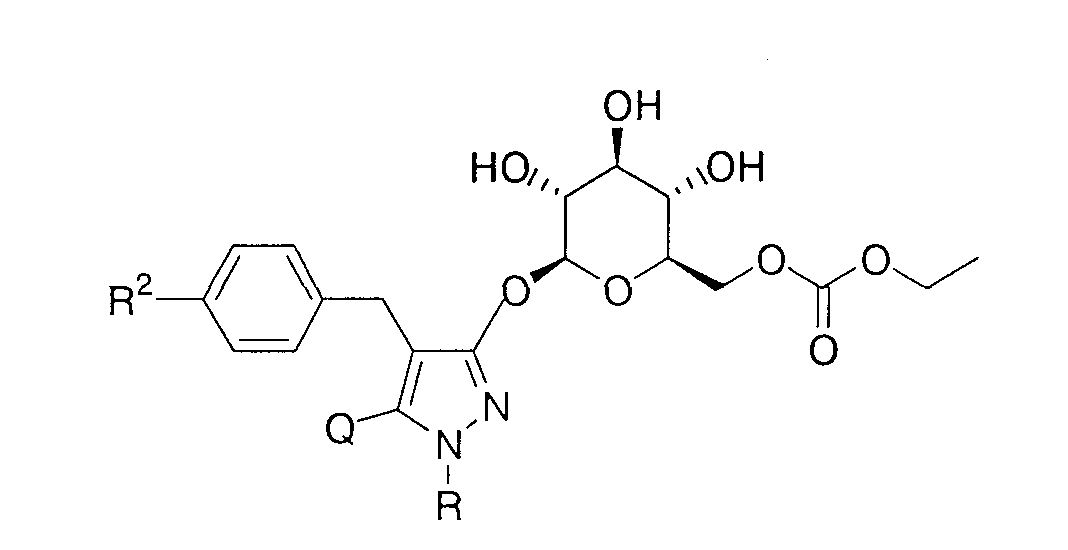
Пример 15
4-[(4-изопропоксифенил)метил]-1-изопропил-3-(6-О-метоксикарбонил-β-D-глюкопиранозилокси)-5-метилпиразол
Указанное в заголовке соединение получали, как описано в примере 1, с использованием метилхлорформиата вместо этилхлорформиата.
1H-ЯМР (CD3OD) δ м.д.:
1,26 (6H, д, J=6,1 Гц), 1,30-1,40 (6H,м), 2,07 (3H, с), 3,25-3,45 (4H, м), 3,60-3,70 (2H, м), 3,71 (3H, с), 4,22 (1H, дд, J=5,2, 11,7 Гц), 4,35 (1H, дд, J=2,1, 11,7 Гц), 4,35-4, 45 (1H, м), 4,45-4,60 (1Н, м), 5,00-5,10 (1Н, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Пример 16
3-(6-О-изобутилоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол
Указанное в заголовке соединение получали, как описано в примере 1, с использованием изобутилхлорформиата вместо этилхлорформиата.
1H-ЯМР (CD3OD) δ м.д.:
0,90 (6H, д, J=6,7 Гц), 1,26 (6H, д, J=5,9 Гц), 1,30-1,40 (6H, м), 1, 80-2,00 (1H, м), 2,07 (3H, с), 3,25-3,50 (4H, м), 3,60-3,70 (2H, м), 3,80-3,90 (2H, м), 4,21 (1H, дд, J=5,2, 11,5 Гц), 4,36 (1H, дд, J=1,8, 11,5 Гц), 4,35-4,45 (1H, м), 4,45-4,55 (1H, м), 5,00-5,10 (1H, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Пример 17
4-[(4-изопропоксифенил)метил]-1-изопропил-5-метил-3-(6-О-пропионил-β -D-глюкопиранозилокси)пиразол
К раствору 3-(β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразола (0,10 г) в 2,4,6-триметилпиридине (1 мл) добавляли пропионилхлорид (0,072 г) при 0°С и эту смесь перемешивали в течение 5 часов. К реакционной смеси добавляли моногидрат лимонной кислоты (3,3 г) и воду и полученную смесь очищали ODS-твердофазной экстракцией (промывающий растворитель: дистиллированная вода, элюент: метанол). Дополнительная очистка колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) давала 4-[(4-изопропоксифенил)метил]-1-изопропил-5-метил-3-(6-О-пропионил-β-D-глюкопиранозилокси)пиразол (0,074 г).
1H-ЯМР (CD3OD) δ м.д.:
1,05 (3H, т, J=7,5 Гц), 1,26 (6H, д, J=5,9 Гц), 1,30-1,40 (6H, м), 2,07 (3H, с), 2,27 (2H, кв, J=7,5 Гц), 3,25-3,45 (4H, м), 3,60-3,70 (2H, м), 4,18 (1H, дд, J=5,6, 11,5 Гц), 4,30 (1H, дд, J=2,2, 11,5 Гц), 4,35-4,45 (1Н, м), 4,45-4,55 (1H, м), 5,00-5,10 (1H, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Пример 18
3-(6-О-ацетил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол
Указанное в заголовке соединение получали, как описано в примере 17, с использованием ацетилхлорида вместо пропионилхлорида.
1H-ЯМР (CD3OD) δ м.д.:
1,26 (6H, д, J=6,4 Гц), 1,30-1,40 (6H, м), 1,98 (3H, с), 2,08 (3H, с), 3,25-3,45 (4H, м), 3, 60-3,70 (2H, м), 4,16 (1H, дд, J=5,6, 11,8 Гц), 4,29 (1H, дд, J=2,0, 11,5 Гц), 4,35-4,55 (2H, м), 5,00-5,10 (1H, м), 6,70-7,80 (2H, м), 7,00-7,10 (2H, м)
Пример 19
3-(6-О-бутирил-β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-1-изопропил-5-метилпиразол
Указанное в заголовке соединение получали, как описано в примере 17, с использованием бутирилхлорида вместо пропионилхлорида.
1H-ЯМР (CD3OD) δ м.д.:
0,88 (3H, т, J=7,4 Гц), 1,26 (6H, д, J=6,0 Гц), 1,30-1, 40 (6H, м), 1,50-1,65 (2H, м), 2,07 (3H, с), 2,15-2,30 (2H, м), 3,25-3,50 (4H, м), 3,60-3,70 (2H, м), 4,17 (1H, дд, J=5,7, 11,9 Гц), 4,31 (1H, дд, J=2,0, 11,9 Гц), 4,30-4,55 (2H, м), 5,00-5,10 (1H, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Пример 20
4-[(4-изопропоксифенил)метил]-1-изопропил-5-метил-3-(6-О-пивалоил-β -D-глюкопиранозилокси)пиразол
Указанное в заголовке соединение получали, как описано в примере 17, с использованием пивалоилхлорида вместо пропионилхлорида.
1 H-ЯМР (CD3OD) δ м.д.:
1,10 (9H, с), 1,26 (6H, д, J=6,1 Гц), 1,30-1,40 (6H, м), 2,06 (3H, с), 3,30-3,45 (4H, м), 3,60-3,70 (2H, м), 4,16 (1H, дд, J=5,8, 11,7 Гц), 4,30 (1H, дд, J=2,0, 11,7 Гц), 4,30-4,55 (2H, м), 5,05-5,15 (1H, м), 6,70-6,80 (2H, м), 7,00-7,10 (2H, м)
Пример 21
1-этоксикарбонил-3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-4-[(4-этилтиофенил)метил]-5-метилпиразол
К раствору 4-[(4-этилтиофенил)метил]-3-(β -D-глюкопиранозилокси)-5-метил-1Н-пиразола (0,03 г) в 2,4,6-триметилпиридине (0,5 мл) добавляли этилхлорформиат (0,021 мл) и эту смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 10% водный раствор лимонной кислоты и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и растворитель удаляли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 1-этоксикарбонил-3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-этилтиофенил)метил]-5-метилпиразола (0,023 г).
1H-ЯМР (CD3OD) δ м.д.:
1,15-1,30 (6H, м), 1,39 (3H, т, J=7,1 Гц), 2,37 (3H, с), 2,87 (2H, кв, J=7,3 Гц), 3,35-3,50 (3H, м), 3,60-3,80 (3H, м), 4,12 (2H, кв, J=7,1 Гц), 4,29 (1H, дд, J=5,3, 11,9 Гц), 4,35-4,50 (3H, м), 5,50-5,60 (1H, м), 7,10-7,25 (4H, м)
Примеры 22-43
Соединения, перечисленные в таблице 2, получали из соответствующего исходного материала, как описано в примере 21.

Пример 44
3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-1-(этоксикарбонилоксиметил)-4-[(4-метилтиофенил)метил]-5-метилпиразол
К раствору 3-(β-D-глюкопиранозилокси)-5-метил-4-[(4-метилтиофенил)метил]-1Н-пиразола (0,11 г) в воде (0,5 мл) и этаноле (0,1 мл) добавляли формальдегид (37% водный раствор, 0,068 мл) и эту смесь перемешивали при 40°С в течение 3 дней. К реакционной смеси добавляли тетрагидрофуран и безводный сульфат магния и полученный нерастворимый материал удаляли фильтрованием. Растворитель фильтрата удаляли при пониженном давлении. Остаток растворяли в 2,4, 6-триметилпиридине (1 мл). К этому раствору добавляли этилхлорформиат (0,009 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли моногидрат лимонной кислоты (4 г) и воду и полученную смесь очищали ODS-твердофазной экстракцией (промывающий растворитель: 10% водный раствор лимонной кислоты, дистиллированная вода, элюент: метанол). Дополнительная очистка колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 15/1) давала 3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-1-(этоксикарбонилоксиметил)-4-[(4-метилтиофенил)метил]-5-метилпиразол (0,058 г).
1H-ЯМР (CD3OD) δ м.д.:
1,23 (3H, т, J=7,1 Гц), 1,26 (3H, т, J=7,1 Гц), 2,18 (3H, с), 2,42 (3H, с), 3,30-3,45 (3H, м), 3,50-3,60 (1H, м), 3,63 (1H, д, J=16,0 Гц), 3,70 (1H, д, J=16,0 Гц), 4,13 (2H, кв, J=7,1 Гц), 4,18 (2H, кв, J=7,1 Гц), 4,28 (1Н, дд, J=4,8, 11,7 Гц), 4,39 (1H, дд, J=2,0, 11,7 Гц), 5,25-5,35 (1H, м), 5,80-5,95 (2H, м), 7,10-7,20 (4H, м)
Пример 45
1-ацетил-4-[(4-этилтиофенил)метил]-3-(β-D-глюкопиранозилокси)-5-метилпиразол
К раствору 4-[(4-этилтиофенил)метил]-3-(β-D-глюкопиранозилокси)-5-метил-1Н-пиразола (0,41 г) в тетрагидрофуране (10 мл) добавляли уксусную кислоту (0,11 мл) и уксусный ангидрид (0,18 мл) и эту смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли диэтиловый эфир. Полученные осажденные кристаллы собирали фильтрованием с получением 1-ацетил-4-[(4-этилтиофенил)метил]-3-(β -D-глюкопиранозилокси)-5-метилпиразола (0,36 г).
1H-ЯМР (CD3OD) δ м.д.:
1,24 (3H, т, J=7,3 Гц), 2,43 (3H, с), 2,54 (3H, с), 2,89 (2H, кв, J=7,3 Гц), 3,30-3,50 (4H, м), 3,60-3,75 (3H, м), 3,80-3,90 (1H, м), 5,45-5,55 (1H, м), 7,10-7,30 (4H, м)
Пример 46
1-ацетил-3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-4-[(4-этилтиофенил)метил]-5-метилпиразол
К раствору 1-ацетил-4-[(4-этилтиофенил)метил]-3-(β -D-глюкопиранозилокси)-5-метилпиразола (0,03 г) в 2,4,6-триметилпиридине (0,5 мл) добавляли этилхлорформиат (0,012 мл) и эту смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (5 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Полученный осадок собирали фильтрованием и промывали 10% водным раствором лимонной кислоты и водой с получением 1-ацетил-3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-4-[(4-этилтиофенил)метил]-5-метилпиразола (0,020 г).
1H-ЯМР (CD3OD) δ м.д.:
1,20 (3H, т, J=7,2 Гц), 1,24 (3H, т, J=7,4 Гц), 2,41 (3H, с), 2,55 (3H, с), 2,88 (2H, кв, J=7,4 Гц), 3,30-3,40 (1H, м), 3,40-3,50 (2H, м), 3,50-3,65 (1H, м), 3,65 (1H, д, J=15,8 Гц), 3,72 (1H, д, J=15,8 Гц), 4,05-4,15 (2H, м), 4,27 (1H, дд, J=6,3, 11,7 Гц), 4,42 (1H, дд, J=2,0, 11,7 Гц), 5,40-5,55 (1H, м), 7,10-7,30 (4H, м)
Пример 47
3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразол
К раствору 1-(бензилоксикарбонил)-3-(6-О-этоксикарбонил-β-D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метилпиразола (0,17 г) в тетрагидрофуране (4 мл) добавляли порошок 10% палладия на угле и эту смесь перемешивали в атмосфере водорода при комнатной температуре в течение 3 часов. Полученный нерастворимый материал удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол = 10/1) с получением 3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метил-1Н-пиразола (0,10 г).
1H-ЯМР (CD3OD) δ м.д.:
1,23 (3H, т, J=7,1 Гц), 1,26 (6H, д, J=6,0 Гц), 2,04 (3H, с), 3,30-3,55 (4H, м), 3,61 (1H, д, J=15,9 Гц), 3,67 (1H, д, J=15,9 Гц), 4,12 (2H, кв, J=7,1 Гц), 4,27 (1H, дд, J=4,9, 11,7 Гц), 4,38 (1H, дд, J=2,0, 11,7 Гц), 4,45-4,60 (1H, м), 5,10-5,20 (1H, м), 6,70-6,80 (2H, м), 7,00-7,15 (2H, м)
Пример 48
4-[(4-изопропоксифенил)метил]-3-(6-О-метоксикарбонил-β -D-глюкопиранозилокси)-5-метил-1Н-пиразол
Указанное в заголовке соединение получали, как описано в примере 47, с использованием 1-(бензилоксикарбонил)-4-[(4-изопропоксифенил)метил]-3-(6-О-метоксикарбонил-β-D-глюкопиранозилокси)-5-метилпиразола вместо 1-(бензилоксикарбонил)-3-(6-О-этоксикарбонил-β -D-глюкопиранозилокси)-4-[(4-изопропоксифенил)метил]-5-метилпиразола.
1H-ЯМР (CD3OD) δ м.д.:
1,26 (6H, д, J=5,9 Гц), 2,04 (3H, с), 3,30-3, 55 (4H, м), 3,61 (1H, д, J=15,9 Гц), 3,67 (1H, д, J=15,9 Гц), 3,72 (3H, с), 4,28 (1H, дд, J=5,2, 11,7 Гц), 4,39 (1H, дд, J=1,8, 11,7 Гц), 4,45-4,55 (1H, м), 5,05-5,15 (1H, м), 6,70-6,80 (2H, м), 7, 00-7,15 (2H, м)
Тест-пример 1
Анализ на ингибирующее действие в отношении активности SGLT2 человека
1) Конструирование плазмидного вектора, экспрессирующего SGLT2 человека
Получение кДНК-библиотеки для ПЦР-амплификации выполняли обратной транскрипцией тотальной РНК, выделенной из почки человека (ген Ori) с олиго-dT в качестве праймера с использованием системы предварительной амплификации SUPERSCRIPT (Gibco-BRL: LIFE TECHNOLOGIES). ДНК-фрагмент, кодирующий SGLT2 человека, амплифицировали ПЦР-реакцией, в которой кДНК-библиотеку почки человека, описанную выше, использовали в качестве матрицы, и следующие олигонуклеотиды 0702F и 0712R, представленные последовательностями с номерами 1 и 2 соответственно, использовали в качестве праймеров. Амплифицированный ДНК-фрагмент лигировали в pCR-Blunt (Invitrogen), вектор для клонирования, в соответствии со стандартным способом этого набора. Escherichia coli НВ101 трансформировали в соответствии с обычным способом и затем выполняли отбор трансформантов на среде с LB-агаром, содержащим 50 мкг/мл канамицина. После экстрагирования плазмидной ДНК и очистки ее из одного из трансформантов выполняли амплификацию ДНК-фрагмента, кодирующего SGLT2 человека, при помощи ПЦР-реакции, в которой в качестве праймеров использовали следующие олигонуклеотиды 0714F и 0715R, представленные последовательностями с номерами 3 и 4 соответственно. Амплифицированный ДНК-фрагмент расщепляли ферментами рестрикции Xho I и Hind III и затем очищали с использованием системы очистки Wizard (Promega). Очищенный ДНК-фрагмент встраивали в соответствующие сайты рестрикции pcDNA3.1 (-) Myc/His - В (Invitrogen) вектора для экспрессии слитого белка. Escherichia coli НВ101 трансформировали в соответствии с обычным способом и затем выполняли отбор трансформанта на среде с LB-агаром, содержащим 100 мкг/мл ампициллина. После экстрагирования плазмидной ДНК и очистки ее из этого трансформанта анализировали последовательность оснований этого ДНК-фрагмента, встроенную в сайты множественного клонирования вектора pcDNA3.1 (-) Myc/His - В. Этот клон имел замену одного основания (АТС, который кодирует изолейцин-433, был заменен GTC) в сравнении с SGLT2 человека, описанным Wells et al. (Am. J. Physiol., Vol. 263, pp. 459-465 (1992)). В результате получали клон, в котором изолейцин-433 заменен валином. Этот плазмидный вектор, экспрессирующий SGLT2 человека, в котором пептид, представленный последовательностью с номером 5, слит с карбоксил-концевым остатком аланина, был назван KL29.
Последовательность № 1 ATGGAGGAGCACACAGAGGC
Последовательность № 2 GGCATAGAAGCCCCAGAGGA
Последовательность № 3 AACCTCGAGATGGAGGAGCACACAGAGGC
Последовательность № 4 AACAAGCTTGGCATAGAAGCCCCAGAGGA
Последовательность № 5 KLGPEQKLISEEDLNSAVDHHHHHH
2) Получение клеток, временно экспрессирующих SGLT2 человека
KL29, плазмиду, кодирующую SGLT2 человека, трансфицировали в клетки COS-7 (RIKEN CELL BANK RCB0539) электропорацией. Электропорацию выполняли с генератором «импульсов генов» GENE PULCER II (Bio-Rad Laboratories) в условиях: 0,290 кВ, 975 мкФ, 2×106 клеток COS-7 и 20 мкг KL29 в 500 мкл среды OPTI-MEM I (Gibco-BRL: LIFE TECHNOLOGIES) в кювете типа 0,4 см. После переноса генов эти клетки собирали центрифугированием и ресуспендировали со средой OPTI-MEM I (1 мл на кювету). В каждую лунку в 96-луночном планшете добавляли 125 мкл этой суспензии клеток. После культивирования в течение ночи при 37°С в атмосфере 5% СО2 в каждую лунку добавляли 125 мкл среды DMEM, которая содержала 10% фетальную бычью сыворотку (Sanko Jyunyaku), 100 единиц/мл натрий-пенициллина G (Gibco-BRL: LIFE TECHNOLOGIES), 100 мкг/мл стрептомицин-сульфата (Gibco-BRL: LIFE TECHNOLOGIES). Эти клетки культивировали до следующего дня и затем их использовали для измерения ингибирующей активности против поглощения метил-α-D-глюкопиранозида.
3) Измерение ингибирующей активности против поглощения метил-α-D-глюкопиранозида
После растворения тест-соединений в диметилсульфоксиде и разбавления буфером для поглощения (буфером с рН 7,4, содержащим 140 мМ хлорид натрия, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 5 мМ метил-α-D-глюкопиранозида, 10 мМ 2-[(4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и 5 мМ трис(гидроксиметил)аминометана) каждый растворитель использовали в качестве тест-пробы для измерения ингибирующей активности. После удаления среды клеток COS-7, экспрессирующих временно SGLT2 человека, в каждую лунку добавляли 200 мкл буфера для предварительной обработки (буфера с рН 7,4, содержащего 140 мМ хлорида натрия, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ 2-[(4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и 5 мМ трис(гидроксиметил)аминометана) и эти клетки инкубировали при 37°С в течение 10 минут. После удаления буфера для предварительной обработки добавляли 200 мкл того же самого буфера и клетки инкубировали при 37°С в течение 10 минут. Буфер для измерения готовили добавлением 7 мкл метил-α -D-(U-14C)-глюкопиранозида (Amersham Pharmacia Biotech) к 525 мкл приготовленной тест-пробы. Для контроля буфер для измерения готовили без тест-соединения. Для оценки фонового поглощения в отсутствие тест-соединения и натрия готовили подобным образом буфер для измерения фонового поглощения, который содержал 140 мМ холинхлорида вместо хлорида натрия. После удаления буфера для предварительной обработки в каждую лунку добавляли 75 мкл каждого буфера для измерения, клетки инкубировали при 37°С в течение 2 часов. После удаления буфера для измерения в каждую лунку добавляли 200 мкл промывочного буфера (буфера с рН 7,4, содержащего 140 мМ холинхлорида, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ метил-α-D-глюкопиранозида, 10 мМ 2-[(4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и 5 мМ трис(гидроксиметил)аминометана) и сразу же удаляли. После двух дополнительных промывок клетки солюбилизировали добавлением 75 мкл 0, 2 моль/л гидроксида натрия в каждую лунку. После перенесения клеточных лизатов в планшет PicoPlate (Packard) и добавления 150 мкл сцинтиллятора MicroScint-40 (Packard) в каждую лунку радиоактивность измеряли сцинтилляционным счетчиком для микропланшетов TopCount (Packard). Различие в поглощении получали в виде величины 100% вычитанием радиоактивности в фоновом поглощении из радиоактивности в контроле, после чего концентрации, при которых 50% поглощения ингибировались (IC50), рассчитывали из кривой зависимости ингибирования от концентрации, полученной с использованием метода наименьших квадратов. Результаты показаны в следующей таблице 3.
Тест-пример 2
Анализ абсорбционной способности при пероральном введении
1) Приготовление проб для измерения концентрации лекарственного средства после внутривенной инъекции в хвостовую вену
В качестве экспериментального животного использовали голодавших в течение ночи крыс SD (CLEA JAPAN, INC., самцов, в возрасте 5 недель, 140-170 г). Шестьдесят мг тест-соединения растворяли добавлением 1,8 мл этанола, 7,2 мл полиэтиленгликоля 400 и 9 мл солевого раствора и затем готовили раствор 3,3 мг/мл. Измеряли вес тела крыс и раствор тест-соединения вводили внутривенно в хвостовую вену неанестезированных крыс в дозе 3 мл/кг (10 мг/кг). Внутривенную инъекцию в хвостовую вену выполняли с использованием иглы для инъекции 26 G (калибра) и шприца на 1 мл. Временными точками для сбора крови были 2, 5, 10, 20, 30, 60 и 120 минут после внутривенной инъекции в хвост. Кровь центрифугировали и плазму использовали в качестве пробы для измерения концентрации лекарственного средства в плазме.
2) Приготовление проб для измерения концентрации лекарственного средства после перорального введения
В качестве экспериментального животного использовали голодавших в течение ночи крыс SD (CLEA JAPAN, INC., самцов, в возрасте 5 недель, 140-170 г). Тест-соединение суспендировали или растворяли в 0,5% растворе натрий-карбоксиметилцеллюлозы в концентрации 1 мг/мл активной формы. Если в этих условиях не получали гомогенной суспензии, тест-соединение растворяли в этаноле при концентрации 100 мг/мл активной формы и затем суспензию получали добавлением этого раствора к 99 объемам раствора 0,5% натрий-карбоксиметилцеллюлозы. После измерения веса тела крыс жидкость, содержащую описанное выше тест-соединение, вводили перорально при дозе 10 мл/кг (10 мг/кг в виде активной формы). Пероральное введение выполняли с использованием желудочной трубки для крыс и шприца на 2,5 мл. Временные точки для сбора крови были 15, 30, 60, 120 и 240 минут после перорального введения. Кровь центрифугировали и плазму использовали в качестве пробы для измерения концентрации лекарственного средства в плазме.
3) Измерение концентрации лекарственного средства
Способ А
К 0,1 мл плазмы, полученной в 1) и 2), как описано выше, добавляли адекватное количество адекватного материала внутреннего стандарта в соответствии с обычным способом и затем выполняли депротеинизацию добавлением 1 мл метанола. После центрифугрования метанольную фазу выпаривали досуха под током азота. Остаток растворяли в 300 мкл подвижной фазы и аликвоту 30 мкл этого раствора впрыскивали в колонку ВЭЖХ. Концентрацию лекарственного средства в плазме измеряли с использованием ВЭЖХ-способа в следующих условиях. К 0,1 мл контрольной плазмы добавляли адекватный внутренний стандарт и добавляли адекватно различные концентрации соответствующей активной формы тест-соединения в соответствии с обычным способом, производили описанные выше действия и затем получали стандартную кривую.
Колонка: Develosil ODS-UG-5 (4,6×250 мм)
Подвижная фаза: ацетонитрил/10 мМ фосфатный буфер (рН 3,0) = 22:78 (об./об.)
Температура колонки: 50°С
Скорость тока: 1,0 мл/мин
Длина волны для измерения: УФ 232 нм
Способ В
К 50 мкл плазмы, полученной в 1) и 2), как описано выше, добавляли адекватное количество адекватного материала внутреннего стандарта в соответствии с обычным способом и добавляли 100 мкл дистиллированной воды и затем выполняли экстракцию добавлением 1 мл диэтилового эфира. После центрифугирования фазу диэтилового эфира выпаривали досуха под током азота. Остаток растворяли в 200 мкл подвижной фазы и аликвоту 10 мкл этого раствора впрыскивали в колонку LC-MS/MS. Концентрацию лекарственного средства в плазме измеряли с использованием способа LC-MS/MS при следующих условиях. К 50 мкл контрольной плазмы добавляли адекватный внутренний стандарт и добавляли адекватно различные концентрации соответствующей активной формы тест-соединения в соответствии с обычным способом, производили описанные выше действия и затем получали стандартную кривую.
LC (жидкостная хроматография)
Колонка: Symmetry C8 (2,1×20 мм)
Подвижная фаза: ацетонитрил/0,1% раствор уксусной кислоты = 65:35 (об./об.)
Температура колонки: 40°С
Скорость тока: 0,2 мл/мин
MS/MS
Ионизационный способ: ESI (Turbo Ion Spray), режим детектирования положительного иона
Напряжение распыления ионов: 5000 В
Температура газа нагревателя: 450°С
Энергия столкновения: 17,5 В
Напряжение усилителя: 2300 В
Скорость тока газа турбораспыления ионов: 7000 мл/мин
Газ распылителя: 11 BIT
Газ завесы: 11 BIT
Газ столкновения: 4 BIT
Каждую площадь под кривой зависимости концентрации в плазме от времени при внутривенной инъекции в хвостовую вену и пероральном введении тест-соединения определяли, используя стандарт WinNonlin Standard, производимый корпорацией Pharsight, из концентрации в плазме в каждой временной точке, полученной из способа А и способа В, и затем рассчитывали биодоступность (%) на основе следующей формулы. Результаты показаны в следующей таблице 4.
Биодоступность (%) = (Площадь под кривой зависимости концентрации в плазме от времени при пероральном введении/Площадь под кривой зависимости концентрации плазмы от времени при внутривенной инъекции в хвостовую вену) х 100
Тест-пример 3
Анализ на необязательное действие в отношении экскреции глюкозы с мочой
В качестве экспериментального животного использовали голодавших в течение ночи крыс SD (JAPAN, SLC. Inc., самцов, в возрасте 7 недель, 202-221 г). Тест-соединение суспендировали в 0,5% растворе натрий-карбоксиметилцеллюлозы в концентрации 2 мг/мл. Если в этих условиях не получали гомогенной суспензии, тест-соединение растворяли в этаноле при концентрации 200 мг/мл активной формы и затем суспензию 2 мг/мл получали добавлением этого раствора к 99 объемам 0,5% раствора натрий-карбоксиметилцеллюлозы. Часть этой суспензии разбавляли 0,5% раствором натрий-карбокстметилцеллюлозы и затем готовили суспензии 0,6 и 0,2 мг/мл. После измерения веса тела крыс эту тест-суспензию вводили перорально при дозе 5 мг/кг (1,3 и 10 мг/кг). В качестве контроля перорально вводили только 0,5% раствор натрий-карбоксиметилцеллюлозы в дозе 5 мл/кг. Сразу же после этого перорального введения вводили перорально раствор глюкозы 400 г/л в дозе 5 мл/кг (2 г/кг). Пероральное введение выполняли с использованием желудочной трубки для крыс и шприца на 2,5 мл. Число животных в одной группе составляло 3. Сбор мочи выполняли в клетке для исследования метаболизма (метаболической клетке) после окончания введения глюкозы. Взятие проб мочи производили спустя 24 часа после введения глюкозы. После завершения сбора мочи объем мочи регистрировали и измеряли концентрацию глюкозы в моче. Концентрацию глюкозы измеряли с использованием набора для лабораторного испытания: Glucose B-test WAKO (Waco Pure Chemical Industries, Ltd.). Количество экскреции глюкозы с мочой за 24 часа на 200 г веса тела рассчитывали из объема мочи, концентрации глюкозы в моче и веса тела. Результаты показаны в следующей таблице 5.
Тест-пример 4
Тест на острую токсичность
После голодания в течение 4 часов 4-недельным самцам мышей ICR (Japan SLC. Inc., 20-25 г, 5 животных в каждой группе) перорально вводили суспензии (200 мг/мл), приготовленные добавлением 0,5% раствора натрий-карбоксиметилцеллюлозы к тест-соединению, при дозе 10 мл/кг (2000 мг/кг). Наблюдение выполняли до 24 часов после введения. Результаты показаны в следующей таблице 6.
Промышленная применимость
Производные глюкопиранозилоксипиразола, представленные приведенной выше общей формулой (I) данного изобретения, или их фармацевтически приемлемые соли имеют улучшенную абсобцию при пероральном введении. Кроме того, они имеют превосходное гипогликемическое действие посредством экскреции избыточной глюкозы с мочой, предотвращая реабсорбцию глюкозы в почках, поскольку они превращаются в производные глюкопиранозилоксипиразола, представленные приведенной выше общей формулой (II), в виде их активных форм in vivo и проявляют сильную ингибирующую активность в отношении SGLT2 человека. Таким образом, данное изобретение может обеспечивать агенты для предупреждения или лечения заболевания, связанного с гипергликемией, такого как диабет, осложнения, связанные с диабетом, ожирение или подобные, причем эти агенты являются также полезными в качестве препаративных форм для перорального введения.
[ОТДЕЛЬНЫЙ ТЕКСТ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ]
Последовательность номер 1: Синтетический ДНК-праймер
Последовательность номер 2: Синтетический ДНК-праймер
Последовательность номер 3: Синтетический ДНК-праймер
Последовательность номер 4: Синтетический ДНК-праймер
Последовательность номер 5: Пептид, слитый с карбоксил-концевым остатком аланина SGLT2 человека
Реферат
Данное изобретение относится к новым производным глюкопиранозилоксипиразола общей формулы

где R - водород, низшие алкил, ацил, алкоксикарбонил, ацилоксиметил или алкоксикарбонилоксиметил; один из Q и Т представляет группу общей формулы

(где Р - водород, низшие ацил или алкоксикарбонил); тогда как другой - низший алкил или галоген(низший алкил); R2 - водород, низшие алкил, алкокси, алкилтио, галоген(низший алкил) или галоген; и при условии, что Р не представляет водород, когда R - водород или низший алкил, их фармацевтически приемлемым солям, фармацевтическим композициям для предотвращения реабсорбции глюкозы в почке и проявляющим ингибиторную активность в отношении SGLT2 человека, фармацевтическим комбинациям, которые используются для предотвращения или лечения заболеваний, связанных с гипергликемией. 9 н. и 27 з.п. ф-лы, 6 табл.
Формула
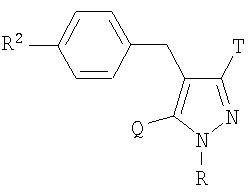


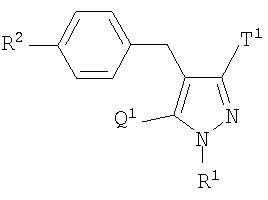









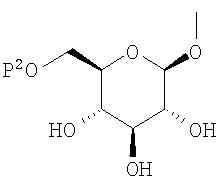





Комментарии