Селективные ингибиторы гликозидазы и их применение - RU2625308C2
Код документа: RU2625308C2
Описание
Область техники
Настоящая заявка относится к соединениям, которые селективно ингибируют гликозидазы, и к их применению.
Уровень техники
Широкий спектр клеточных белков, как ядерных, так и цитоплазматических, посттрансляционно модифицируют путем добавления моносахарида 2-ацетамидо-2-деокси-β-D-глюкопиранозида (β-N-ацетилглюкозамин), который присоединяют посредством О-гликозидной связи1. Такую модификацию обычно называют О-связанным N-ацетилглюкозамином или О-GlcNAc. Ферментом, ответственным за посттрансляционное связывание β-N-ацетилглюкозамина (GlcNAc) с конкретными остатками серина и треонина многочисленных ядерно-цитоплазматических белков, является О-GlcNAc трансфераза (OGT)2-5. Второй фермент, известный как гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазы (O-GlcNAcase)6,7, удаляет такую посттрансляционную модификацию с высвобождением белка, делая O-GlcNAc-модификацию динамическим циклом, возникающим несколько раз во время продолжительности жизни белка8.
О-GlcNAc-модифицированные белки регулируют широкий спектр жизненно важных клеточных функций, включая, например, транскрипцию9-12, протеасомальную деградацию13 и клеточную связь14. О-GlcNAc также найден на многих структурных белках15-17. Например, он найден на ряде белков цитоскелета, включая белки нейрофиламентов18,19, синапсины6,20, синапсин-специфическую клатриновую сборку белка АР-37 и анкиринG14. О-GlcNAc-модификация, как установлено, является широко распространенной в головном мозге21,22. Она также найдена на белках, однозначно вовлеченных в этиологию серьезных заболеваний, включая болезнь Альцгеймера (БА (AD)) и рак.
Например, хорошо показано, что БА и ряд близких таупатий, включая синдром Дауна, болезнь Пика, болезнь Ниманна-Пика типа С и боковой амиотрофический склероз (БАС (ALS)), характеризуются, отчасти, развитием нейрофибриллярных клубков (НФК (NFT)). Такие НФК представляют собой агрегаты спаренных спиральных филаментов (PHF) и состоят из атипичной формы цитоскелетного белка «тау». Обычно тау стабилизирует ключевую клеточную сеть микротрубочек, которая является существенной для распределения белков и питательных веществ внутри нейронов. У больных БА, однако, тау становится гиперфосфорилированным, что нарушает его нормальные функции, образует PHF и, в конечном итоге, агрегирует с образованием НФК. У больных БА все шесть изоформ тау найдены в НФК, и все сильно гиперфосфорилированы23,24. Тау в ткани здорового головного мозга несут только 2 или 3 фосфатные группы, тогда как тау, найденные в головном мозге больных БА, несут в среднем 8 фосфатных групп25,26. Четкая параллель между уровнем НФК в головном мозге у больных БА и серьезностью деменции подтверждает ключевую роль дисфункции тау при БА27-29. Точные причины этого гиперфосфорилирования тау остаются трудными для понимания. Соответственно, значительные усилия были предприняты в направлении: а) выявления молекулярной физиологической основы гиперфосфорилирования тау30; и b) определения стратегий, которые могли бы ограничить гиперфосфорилирование тау в надежде, что это могло бы остановить или даже развернуть в обратную сторону развитие болезни Альцгеймера31-34. К настоящему времени несколько линий доказательств подтверждают, что положительная регуляция ряда киназ может быть вовлечена в гиперфосфорилирование тау21,35,36, хотя совсем недавно была выдвинута альтернативная основа для такого гиперфосфорилирования21.
В частности, выяснено, что фосфатные уровни тау регулируют с помощью уровней O-GlcNAc на тау. Присутствие O-GlcNAc на тау стимулировало исследования, которые устанавливают соотношения уровней O-GlcNAc с уровнями фосфорилирования тау. Интерес в этой области вытекает из наблюдения, что O-GlcNAc модификация, как установлено, присутствует на многих белках у аминокислотных остатков, которые также, как известно, фосфорилированы37-39. C учетом этого наблюдения было найдено, что повышение уровней фосфорилирования приводит к снижению уровней O-GlcNAc и, наоборот, повышенные уровни O-GlcNAc коррелируют с пониженными уровнями фосфорилирования40. Такое обратное соотношение между O-GlcNAc и фосфорилированием названо «инь-ян гипотезой»41 и получило прочное биохимическое подтверждение в результате открытия, что фермент OGT4 образует функциональный комплекс с фосфатазами, которые действуют, удаляя фосфатные группы из белков42. Подобно фосфорилированию, O-GlcNAc является динамической модификацией, которая может быть удалена и вновь установлена несколько раз за время продолжительности жизни белка. Возможно, ген, кодирующий O-GlcNAс, проецирует к хромосомному локусу, который связан с БА7,43. Гиперфосфорилированный тау в головном мозге человека с БА имеет значительно более низкие уровни O-GlcNAc, чем найдено в головном мозге здорового человека21. Показано, что уровни O-GlcNAc растворимого тау-белка из головного мозга человека, подверженного БА, значительно ниже, чем уровни из здорового головного мозга. Кроме того, PHF из больного головного мозга подтверждает полностью отсутствие какой-либо O-GlcNAc модификации любого рода21. Молекулярная основа такого гипогликозилирования тау не известна, хотя оно может вытекать из повышенной активности киназ и/или дисфункции одного из ферментов, вовлеченных в обработку O-GlcNAc.
В доказательство этой последней точки зрения как в PC-12 нейронных клетках, так и в срезах ткани головного мозга мышей неселективный ингибитор N-ацетилглюкозаминидазы был использован для повышения уровней тау O-GlcNAc, при этом наблюдали, что уровни фосфорилирования упали21. Смысл таких обобщенных результатов состоит в том, что путем поддержания уровней O-GlcNAc у больных БА, например, путем ингибирования действия O-GlcNAcase, можно иметь возможность блокировать гиперфосфорилирование тау и все из сопутствующих эффектов гиперфосфорилирования тау, включая образование НФК и последующие эффекты. Однако, поскольку соответствующее функционирование β-гексозаминидаз является критическим, любое потенциальное терапевтическое воздействие для лечения БА, которое блокирует действие O-GlcNAcазы, должно бы исключать сопутствующее ингибирование обеих гексозаминидаз А и В.
Нейроны не запасают глюкозу и поэтому головной мозг питается глюкозой, поставляемой кровью, чтобы поддерживать свои существенные метаболические функции. В частности, показано, что в пределах головного мозга поглощение глюкозы и метаболизм падают с возрастом44. В пределах головного мозга больных БА встречаются значительные снижения в потреблении глюкозы и, как полагают, являются потенциальной причиной нейродегенерации45. Основание для такой пониженной поставки глюкозы в головной мозг при БА46-48, как считают, вытекает из любого пониженного транспорта глюкозы49,50, поврежденной передачи инсулинового сигнала51,52 и пониженного кровотока53.
Учитывая такой поврежденный глюкозный метаболизм, следует отметить, что из всей глюкозы, поступающей в клетки, 2-5% переходит в биосинтетический путь гексозамина, в результате регулируя клеточные концентрации конечного продукта этого пути, уридин-дифосфат-N-ацетилглюкозамина (UDP-GlcNAc)54. UDP-GlcNAc представляет собой субстрат ядерно-цитоплазматического фермента О-GlcNAc трансферазы (OGT)2-5, который действует, посттрансляционно присоединяя GlcNAc к специфическим сериновым и треониновым остаткам многочисленных ядерно-цитоплазматических белков. ОGT распознает большое число из его субстратов55,56 и партнеров связывания42,57 через домены тетратрикопептидного повтора (TPR)58,59. Как описано выше, О-GlcNAcазe6,7 снимает такую посттрансляционную модификацию, высвобождая белки, делающие О-GlcNAc-модификацию динамическим циклом, встречающимся несколько раз за время продолжительности жизни белка8. О-GlcNAc найден в нескольких белках на известных сайтах фосфорилирования10,38,39,60, включая тау и нейрофиламенты61. Кроме того, OGT проявляет необычное кинетическое поведение, делающее ее тонко чувствительной к внутриклеточным концентрациям субстрата UDP-GlcNAc и, следовательно, к поступлению глюкозы42.
С учетом известных свойств биосинтетического пути гексозамина, ферментативных свойств OGT и двухсторонней зависимости между О-GlcNAc и фосфорилированием показано, что пониженная доступность глюкозы в головном мозге приводит к гиперфосфорилированию тау45. Таким образом, постепенное нарушение глюкозного транспорта и метаболизма, независимо от их причин, приводит к пониженным О-GlcNAc и гиперфосфорилированию тау (и других белков). Кроме того, ингибирование О-GlcNAcазе будет компенсировать связанное с возрастом нарушение глюкозного метаболизма в пределах головного мозга здорового индивидуума, а также больных, страдающих БА или близкими нейродегенеративными заболеваниями.
Эти результаты подтверждают, что нарушение функций в механизме регулирования уровней О-GlcNAc тау может быть жизненно важным при образовании НФК и сопутствующей нейродегенерации. Хорошее обоснование для блокирования гиперфосфорилирования тау в качестве терапевтически полезного вмешательства62 вытекает из последних исследований, показывающих, что когда трансгенных мышей, содержащих тау человека, обрабатывают ингибиторами киназы, они не проявляют типичные двигательные дефекты34, и в другом случае33, показывают пониженные уровни нерастворимого тау. Эти исследования показывают четкую связь между понижением уровней фосфорилирования тау и смягчением БА-подобных поведенческих симптомов в мышиной модели этого заболевания. Действительно, фармакологическая модуляция гиперфосфорилирования тау широко признана в качестве важной терапевтической стратегии лечения БА и других нейродегенеративных нарушений63.
Маломолекулярные ингибиторы О-GlcNAcase для ограничения гиперфосфорилирования тау рассмотрены для лечения БА и родственных таупатий64. Точнее, ингибитор О-GlcNAcase thiamet-G вовлечен в снижение фосфорилирования тау в культивируемых РС-12 клетках у патологически значимых сайтов64. Более того, пероральное введение thiamet-G здоровым крысам Sparague-Dawley вовлечено в пониженное фосфорилирование тау при Thr231, Ser396 и Ser422 как в коре головного мозга, так и в гиппокампе крысы.
Также существуют многочисленные доказательства, показывающие, что повышенные уровни О-GlcNAc белковой модификации обеспечивают защиту против патогенных эффектов стресса в сердечной ткани, включая стресс, вызванный ишемией, кровоизлиянием, гиперволемическим шоком и кальциевым парадоксом. Например, показана активация биосинтетического пути гексозамина (БПГ (НВР)) путем введения глюкозамина, чтобы вызвать защитный эффект в животных моделях ишемии/реперфузии65-71, травматического кровоизлияния72-74, гиперволемического шока75 и кальциевого парадокса65,76. Более того, убедительное доказательство показывает, что такие кардиозащитные эффекты опосредованы повышенными уровнями О-GlcNAc-модификации белка65,66,68,71,73,76-79. Также есть доказательство, что О-GlcNAc-модификация играет роль в ряде нейродегенеративных заболеваний, включая болезнь Паркинсона и болезнь Хантингтона80.
У людей есть три гена, кодирующих ферменты, которые отщепляют концевые β-N-ацетилглюкозаминные остатки от гликоконъюгатов. Первый их них кодирует О-GlcNAcase. О-GlcNAcase является представителем 84 семейства гликозидгидролаз, которое включает ферменты из организмов, таких же многообразных, как прокариотические патогены для людей (классификацию семейства гликозидгидролаз см. Coutinho P.M. and Henrissat B. (1999), Carbohydrate-Active Enzymes server at URL: http://afmb.cnrs-mrs.fr/CAZY/81,82. О-GlcNAcase действует, гидролизуя О-GlcNAc от сериновых и треониновых остатков посттрансляционно модифицированных белков1,6,7,83,84. С учетом присутствия О-GlcNAc на многих внутриклеточных белках фермент О-GlcNAcase, как оказывается, имеет значение в этиологии некоторых заболеваний, включая диабет II типа14,85, БА16,21,86 и рак22,87. Хотя О-GlcNAcase, вероятно, выделен очень рано18,19, прошло приблизительно 20 лет до того, как была понята6 его биохимическая роль в действии по отщеплению О-GlcNAc от сериновых и треониновых остатков белков. Совсем недавно фермент О-GlcNAcase был клонирован7, частично охарактеризован20, и было подтверждено, что он имеет дополнительную активность в качестве гистоновой ацетилтрасферазы20. Однако о каталитическом механизме этого фермента известно немного.
Два других гена, НЕХА и НЕХВ, кодируют ферменты, катализирующие гидролитическое отщепление концевых β-N-ацетилгликозаминных остатков от гликоконъюгатов. Продукты генов НЕХА и НЕХВ преимущественно дают два димерных изозима, гексозаминидазу А и гексозаминидазу В, соответственно. Гексозаминидаза А (αβ), гетеродимерный изозим, состоит из α- и β-субъединиц. Гексозаминидаза В (ββ), гомодимерный изозим, состоит из двух β-субъединиц. Две субъединицы, α- и β-, несут высокий уровень идентичности последовательности. Оба из этих ферментов классифицированы как представители 20 семейства гликозидгидролаз и обычно локализованы в пределах лизосом. Соответствующее функционирование таких лизосомальных β-гексозаминидаз является критическим для развития человека, факт, который подчеркивают катастрофические генетические заболевания, болезнь Тау-Сакса и болезнь Сандхоффа, которые вытекают из дисфункции, соответственно, гексозаминидазы А и гексозаминидазы В88. Такая ферментная недостаточность вызывает накопление гликолипидов и гликоконъюгатов в лизосомах, приводя к неврологическим повреждениям и деформациям. Вредные воздействия накопления ганглиозидов на организменном уровне еще раскрываются.89
По причине биологической важности таких β-N-ацетил-глюкозаминидаз маломолекулярные ингибиторы гликозидаз90-93 получили большое внимание94 как в качестве инструмента для оценки роли таких ферментов в биологических процессах, так и при разработке потенциальных терапевтических областей применения. Контроль функции гликозидазы с использованием небольших молекул обеспечивает несколько преимуществ в сравнении с исследованиями генного нокаута, в том числе способность быстро менять дозы или полностью отменять лечение.
Однако главной проблемой при разработке ингибиторов для блокирования функции гликозидазы млекопитающих, включая О-GlcNAcase, является большое число функционально родственных ферментов, присутствующих в тканях более высоких эукариотов. Соответственно, использование неселективных ингибиторов при изучении клеточной и организменной физиологической роли одного конкретного фермента затруднено, так как сложные фенотипы возникают из сопутствующего ингибирования таких функционально родственных ферментов. В случае β-N-ацетилглюкозаминидаз многие соединения, которые действуют, блокируя функцию О-GlcNAcase, являются неспецифическими и потенциально действуют, ингибируя лизосомальные β-гексозаминидазы.
Небольшое число лучше охарактеризованных ингибиторов β-N-ацетилглюкозаминидаз, которые были использованы в исследованиях О-GlcNAc посттрансляционных модификаций в пределах как клеток, так и тканей, представляют собой стрептозотоцин (СТЦ (STZ)), 2’-метил-α-D-глюкопирано[2,1-d]-Δ2’-тиазолин (NAG-тиазолин) и О-(2-ацетамидо-2-деокси-D-глюкопиранозилиден)амино-N-фенилкарбамат (PUGNAc)14,95-98.
СТЦ (STZ) долго использовали в качестве диабетогенного соединения, так как оно оказывает особенно вредное действие на β-инсулярные клетки99. СТЦ проявляет свои цитотоксические эффекты посредством как алкилирования клеточной ДНК99,100, так и также генерирования радикальных образцов, включая оксид азота101. Получающийся разрыв нитей ДНК стимулирует активацию поли(АДФ-рибоза)полимеразы (PARP)102 с конечным результатом истощения уровней клеточной NAD+ и, в конечном счете, приводя к гибели клетки103,104. Другие исследователи, наоборот, предположили, что токсичность СТЦ является следствием необратимого ингибирования О-GlcNAcase, которая является высоко экспрессирующей в пределах β-инсулярных клеток95,105. Эта гипотеза, однако, была поставлена под сомнение двумя независимыми группами исследователей106,107. Так как уровни клеточного О-GlcNAc на белках растут в ответ на многие формы клеточного стресса108, кажется возможным, что СТЦ приводит к увеличению уровней О-GlcNAc-модификации на белках путем индуцирования клеточного стресса, а не посредством какого-либо специфического и прямого действия на О-GlcNAcase. Действительно, Honover с соавторами показал, что СТЦ функционирует как плохой и иногда селективный ингибитор О-GlcNAcase109, и хотя другими было предположено, что СТЦ необратимо ингибирует О-GlcNAcase110, четкая демонстрация такого способа действия отсутствует. Недавно было показано, что СТЦ не ингибирует необратимо О-GlcNAcase111.
NAG-Тиазолин, как установлено, является потенциальным ингибитором 20 семейства гексозаминидаз93,112, и, совсем недавно, 84 семейства О-GlcNAcase111. Несмотря на его эффективность, оборотной стороной использования NAG-тиазолина в сложном биологическом контексте является то, что он лишен селективности и, следовательно, вносит помехи во множество клеточных процессов.
PUGNAc представляет собой другое соединение, которое испытывает те же проблемы отсутствия селективности, и уже получило применение в качестве ингибитора как О-GlcNAcase человека6,113, так и 20 семейства человеческих β-гексозаминидаз114. Эта молекула, разработанная Vasella с сотрудниками, как найдено, является потенциальным конкурентным ингибитором β-N-ацетилглюкозаминидаз из Canavalia ensiformis, Mucor rouxii и β-гексозаминидазы из бычьей почки91. Продемонстрировано, что введение PUGNAc в крысиную модель травматического кровоизлияния снижает циркулирующие уровни провоспалительных цитокинов TNF-α и IL-6115. Также показано, что введение PUGNAc в клеточную модель активации лимфоцитов снижает продуцирование цитокина IL-2116. Последующие исследования показали, что соединение PUGNAc может быть использовано в животных моделях, чтобы уменьшить размер инфаркта миокарда после закупорки левой коронарной артерии117. Особенное значение имеет тот факт, что повышение уровней О-GlcNAc путем введения PUGNAc, ингибитора О-GlcNAcase,в крысиной модели травматического кровоизлияния улучшает сердечную функцию115,118. Кроме того, повышение уровней О-GlcNAc путем обработки PUGNAc в клеточной модели ишемии/(реперфузионного повреждения) с использованием миоцитов желудочков новорожденных крыс улучшает жизнеспособность клеток и снижает некроз и апоптоз в сравнении с необработанными клетками119.
Совсем недавно было подтверждено, что селективный ингибитор О-GlcNAcase, NButGT, проявляет защитную активность в клеточной модели ишемии/реперфузии и клеточных стрессов, включая окислительный стресс120. Это исследование поддерживает применение ингибиторов О-GlcNAcase для повышения уровней белкового О-GlcNAc и предупреждения в результате патогенных эффектов стресса в сердечной ткани.
Международные патентные заявки: PCТ/СА 2006/000300, направленная на рассмотрение 1 марта 2006 г., опубликованная под № WO 2006/092049 8 сентября 2006 г.; PCТ/СА 2007/001554, направленная на рассмотрение 31 августа 2007 г., опубликованная под № WO 2008/025170 6 марта 2008 г.; PCТ/СА 2009/001087, направленная на рассмотрение 31 июля 2009 г., опубликованная под № WO 2010/012106 4 февраля 2010 г.; PCТ/СА 2009/001088, направленная на рассмотрение 31 июля 2009 г., опубликованная под № WO 2010/012107 4 февраля 2010 г.; PCТ/СА 2009/001302, направленная на рассмотрение 16 сентября 2009 г., опубликованная под № WO 2010/037207 8 апреля 2010 г.; PCТ/СА 2011/000548, направленная на рассмотрение 10 мая 2011 г., опубликованная под № WO 2011/140640 17 ноября 2011 г.; PCТ/СА 2011/001241, направленная на рассмотрение 8 ноября 2011 г., опубликованная под № WO 2012/061927 18 мая 2012 г.; и PCТ/US 2011/059668, направленная на рассмотрение 8 ноября 2011 г., опубликованная под № WO 2012/064680 18 мая 2012 г.; описывают селективные ингибиторы О-GlcNAcase.
Суть изобретения
Изобретение предлагает, помимо всего прочего, соединения для селективного ингибирования гликозидаз, пролекарства соединений, варианты применения соединений и пролекарств, фармацевтические композиции, включающие соединения или пролекарства соединений, и способы лечения заболеваний и нарушений, связанных с дефицитом или сверхэкспрессией О-GlcNAcase и/или с накоплением или дефицитом О-GlcNAc.
В одном аспекте настоящее изобретение предлагает соединение формулы (I) или его фармацевтически приемлемую соль:
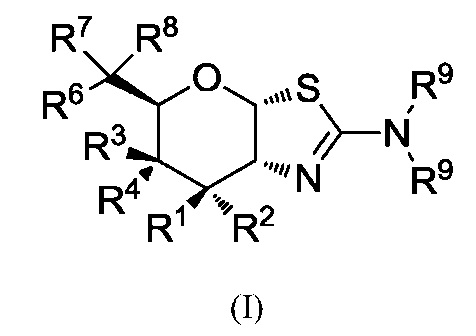
где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (I) или его фармацевтически приемлемую соль:
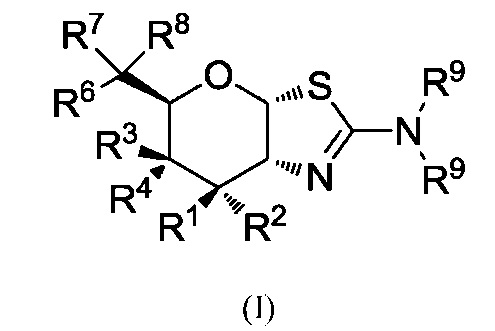
где R1 может представлять собой Н и R2 может представлять собой F, или R1 может представлять собой F и R2 может представлять собой Н; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Iа) или его фармацевтически приемлемую соль:

где R1 может представлять собой Н и R2 может представлять собой F, или R1 может представлять собой F и R2 может представлять собой Н; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими F или ОН; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Ib) или его фармацевтически приемлемую соль:
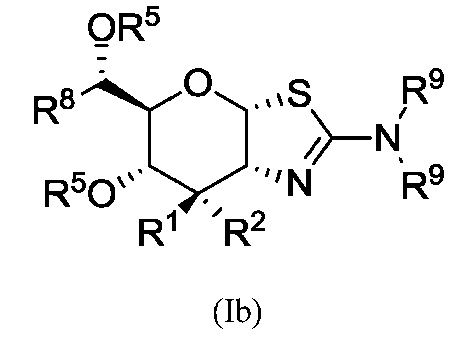
где R1 и R2 независимо могут представлять собой Н или F; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Iс) или его фармацевтически приемлемую соль:

где каждый из R5 независимо может представлять собой Н или С1-6-ацил; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Id) или его фармацевтически приемлемую соль:

где каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими F или ОН; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (Iе) или его фармацевтически приемлемую соль:

где каждый R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8- алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления изобретение предлагает соединение формулы (I) или его фармацевтически приемлемую соль:

где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода, необязательно замещен от одного и до максимального числа заместителей атомами фтора или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей атомами фтора или ОН-группами; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила или С1-6-алкоксигруппы, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца; где, когда R6 представляет собой OR5, то R7 не является F.
В альтернативных вариантах осуществления соединение может представлять собой пролекарство; соединение может селективно ингибировать О-гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазу (О-GlcNAcase); соединение может селективно связывать О-GlcNAcase (например, О-GlcNAcase млекопитающего); соединение может селективно ингибировать отщепление 2-ацетамидо-2-деокси-β-D-глюкопиранозидазу (О-GlcNAc); соединение может по существу не ингибировать β-гексозаминидазу млекопитающего.
В альтернативных вариантах осуществления соединение в соответствии с формулой (I), формулой (Iа), формулой (Ib), формулой (Ic), формулой (Id) или формулой (Iе) может иметь повышенную проницаемость.
В альтернативных аспектах настоящее изобретение предлагает фармацевтическую композицию, включающую соединение в соответствии с изобретением в комбинации с фармацевтически приемлемым носителем.
В альтернативных аспектах изобретение предлагает способы селективного ингибирования О-GlcNAcase, или ингибирования О-GlcNAcase у субъекта, нуждающегося в нем, или повышения уровня О-GlcNAc, или лечения нейродегенеративного заболевания, таупатии, рака или стресса у субъекта, нуждающегося в этом, путем введения субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли:

где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F. Состоянием может быть болезнь Альцгеймера, боковой амиотрофический склероз (ALS), боковой амиотрофический склероз с когнитивным нарушением (ALSci), деменция аргирофильных гранул, Bluit disease, кортико-базальная дегенерация (CBD), деменция боксеров, диффузные нейрофибриллярные клубки с кальцификацией, синдром Дауна, семейная британская деменция, семейная датская деменция, лобно-височная деменция с паркинсонизмом, связанным с хромосомой 17 (FTDP-17), болезнь Герстмана-Штраусслера-Шейнкера, паркинсонизм Гваделупы, болезнь Галлервордена-Шпатца (нейродегенерация с накоплением в головном мозге железа I типа), множественная системная атрофия, миотоническая дистрофия, болезнь Ниманна-Пика (тип С), паллидо-понто-нигральная дегенерация, комплекс паркинсонизм-деменция Гуама, болезнь Пика (PiD), постэнцефалитический паркинсонизм (РЕР), прионные болезни (включая болезнь Крейтцфельда-Якоба (CJD), разновидность болезни Крейтцфельда-Якоба (vCJD), спорадическую фатальную инсомнию и куру), прогрессивный субкортикальный глиоз, прогрессирующий надъядерный паралич (PSP), синдром Ричардсона, подострый склерозирующий панэнцефалит, старческое слабоумие только с клубков, болезнь Хантингтона, болезнь Паркинсона, шизофрения, легкое когнитивное нарушение (MCI), невропатия (включая периферическую невропатию, вегетативную невропатию, неврит и диабетическую невропатию) или глаукома. Стресс может представлять собой нарушение сердечной деятельности, например, ишемию, кровоизлияние, гиповолемический шок, инфаркт миокарда, интервенционную кардиологию, кардиошунтиование, фибринолитическую терапию, ангиопластику или размещение стента.
В альтернативных аспектах изобретение предлагает способ лечения О-GlcNAcase-опосредуемого состояния, которое устраняет нейродегенеративное заболевание, таупатию, рак или стресс, у субъекта, нуждающегося в лечении, путем введения субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли:

где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из С1-8-алкила, С2-8-алкенила С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть соединены вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F. В некоторых вариантах осуществления состояние может быть воспалительным или аллергическим заболеванием, таким как астма, аллергический ринит, состояние гиперчувствительности легких, пневмонит гиперчувствительности, эозинофильная пневмония, гиперчувствительность замедленного типа, атеросклероз, интерстициальная болезнь легких (ILD) (например, идиопатический легочный фиброз, или ILD, связанная с ревматоидным артритом, системной красной волчанкой, анкилозирующим спондилоартритом, системным склерозом, синдромом Шегрена, полимиозитом или дерматомиозитом); общая анафилактическая реакция или реакция гиперчувствительности, лекарственная аллергия, аллергическая реакция на укус насекомого; аутоиммунные заболевания, такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, синдром Гийена-Барре, системная красная волчанка, миастения гравис, гломерулонефрит, аутоиммунный тиреоидит, отторжение трансплантата, включая отторжение аллотрансплантата и болезнь «трансплантат против хозяина»; воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит; спондилоартропатия; склеродермия; псориаз (включая опосредуемый Т-клетками псориаз) и воспалительные дерматозы, такие как дерматит, экзема, атопический дерматит, аллергический контактный дерматит, уртикарная сыпь; васкулит (например, некротический, кожный и сверхчувствительный васкулит); эозинофильный миозит, эозинофильный фасциит; отторжение трансплантата, в особенности, но без ограничения, трансплантатов паренхиматозных органов, таких как сердце, легкие, печень, почки и трансплантат поджелудочной железы (например, аллотрансплантатов почки и легкого); эпилепсия; болевые ощущения; фибромиалгия; нарушение мозгового кровообращения, например, нейропротекция после нарушения мозгового кровообращения.
В альтернативных вариантах осуществления R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F. Введение может повышать уровень O-GlcNAc у субъекта. Субъектом может быть человек.
В альтернативных аспектах изобретение предлагает применение соединения в эффективном количестве соединения формулы (I) или его фармацевтически приемлемой соли:

где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами F или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F, при получении лекарственного средства. Лекарственное средство может быть предназначено для селективного ингибирования O-GlcNAcase, для повышения уровня O-GlcNAc, для лечения состояния, опосредуемого O-GlcNAcase, для лечения нейродегенеративного заболевания, таупатии, рака или стресса.
В альтернативных аспектах изобретение предлагает способ скрининга селективного ингибитора O-GlcNAcase путем: а) контактирования первого образца с испытуемым соединением; b) контактирования второго образца с соединением формулы (I):

где R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом; где, когда R6 представляет собой OR5, то R7 не является F; с) определения уровня ингибирования O-GlcNAcase в первом и втором образцах, где испытуемое соединение представляет собой селективный ингибитор O-GlcNAcase, если испытуемое соединение проявляет такое же или более высокое ингибирование O-GlcNAcase при сравнении с соединением формулы (I).
Приведенная суть изобретения необязательно описывает все признаки настоящего изобретения.
Подробное описание
Изобретение предлагает, в частности, новые соединения, которые способны ингибировать О-гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазу (O-GlcNAcase). В некоторых вариантах осуществления O-GlcNAcase представляет собой O-GlcNAcase млекопитающего, такого как крыса, мышь, или O-GlcNAcase человека.
В некоторых вариантах осуществления одно или несколько соединений в соответствии с изобретением проявляют повышенную проницаемость. Проницаемость может быть оценена с использованием ряда стандартных экспериментальных методик, включая, но без ограничения, in situ перфузию, ex vivo диффузию в тканях, in vitro клеточные монослои (например, клеток Caco-2, клеток MDCK, клеток LLC-PK1) и искусственные клеточные мембраны (например, оценка проницаемости искусственных параллельных мембран, PAMPA); подходящие методики измерения эффективной проницаемости (Пэфф (Рeff)) или кажущейся проницаемости (Пкаж (Papp)) рассмотрены, например, Volpe в публикации The AAPS Journal, 2010, 12(4), 670-678. В некоторых вариантах осуществления одно или несколько соединений в соответствии с настоящим изобретением показывают повышенную проницаемость при испытании в одном или нескольких таких методах оценки для определения Пэфф и Пкаж (Peff и Papp). В некоторых вариантах осуществления соединение, которое проявляет повышенную проницаемость, показывает более высокое пероральное поглощение. В некоторых вариантах осуществления соединение, которое проявляет повышенную проницаемость, показывает более высокую пенетрантность головного мозга при введении in vivo. В некоторых вариантах осуществления соединение, которое проявляет повышенную проницаемость, достигает более высоких концентраций в головном мозге при введении in vivo. В некоторых вариантах осуществления соединение, которое проявляет повышенную проницаемость, показывает более высокое соотношение концентраций (головной мозг)/плазма при введении in vivo. В некоторых вариантах осуществления «повышенная проницаемость» означает повышение измеренных значений Пэфф или Пкаж на любое значение между 10% и 100%, или любое целое значение между 10% и 100%, например, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или свыше 100%, или повышение в 1 раз, 2 раза или 3 раза или больше в сравнении с подходящим справочным соединением, описанным, например, в публикациях WO 2006/092049 или WO 2008/025170. Подходящее справочное соединение, например, может представлять собой (3аR,5R,6S,7R,7aR)-5-(гидроксиметил)-2-пропил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диол, или (3аR,5R,6S,7R,7aR)-2-(этиламино)-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диол, или (3аR,5R,6S,7R,7aR)-2-(диметиламино)-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диол. В некоторых вариантах осуществления «повышенная проницаемость» означает поддающееся измерению значение Пкаж (то есть, значение больше чем ноль) при оценке, описанной ниже для определения Пкаж в клетках LLC-PK1. В некоторых вариантах осуществления «повышенная проницаемость» означает значение Пкаж больше чем 2×10-6 см/сек при оценке, описанной ниже для определения Пкаж в клетках LLC-PK1. В альтернативных вариантах осуществления «повышенная проницаемость» означает значением Пкаж в интервале от 2×10-6 см/сек до 35×10-6 см/сек при оценке, описанной ниже для определения Пкаж в клетках LLC-PK1.
В некоторых вариантах осуществления соединение в соответствии с изобретением проявляет превосходную селективность при ингибировании O-GlcNAcase. В некоторых вариантах осуществления одно или несколько соединений в соответствии с изобретением являются более селективными для O-GlcNAcase в сравнении с β-гексозаминидазой. В некоторых вариантах осуществления одно или несколько соединений селективно ингибируют активность O-GlcNAcase млекопитающих в сравнении с β-гексозаминидазой млекопитающих. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase по существу не ингибирует β-гексозаминидазу. В некоторых вариантах осуществления β-гексозаминидаза представляет собой β-гексозаминидазу млекопитающих, такую как β-гексозаминидаза крысы, мыши или человека. Соединение, которое «селективно» ингибирует O-GlcNAcase, представляет собой соединение, которое ингибирует активность или биологическую функцию O-GlcNAcase, но по существу не ингибирует активность или биологическую функцию β-гексозаминидазы. Например, в некоторых вариантах осуществления селективный ингибитор O-GlcNAcase селективно ингибирует отщепление 2-ацетамидо-2-деокси-β-D-глюкопиранозида (O-GlcNAc) от полипептидов. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase селективно связывается с O-GlcNAcase. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase ингибирует гиперфосфорилирование тау белка и/или ингибирует образование НФК. Определения «ингибирует», «ингибирование» или «угнетение» означают снижение на любое значение между 10% и 90%, или любое целое значение между 30% и 60%, или свыше 100%, или снижение в 1 раз, 2 раза, 5 раз, 10 раз или более. Следует понимать, что угнетение не требует полного ингибирования. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase поднимает или повышает уровни O-GlcNAc, например, уровни O-GlcNAc-модифицированного полипептида или белка, в клетках, тканях или органах (например, в головном мозге, в мускулах или сердце (сердечных тканях)) и у животных. Под выражением «поднятие» или «повышение» понимают повышение на любое значение между 10% и 90%, или любое целое значение между 30% и 60%, или свыше 100%, или увеличение в 1 раз, 2 раза, 5 раз, 10 раз, 15 раз, 25 раз, 50 раз, 100 раз или более. В некоторых вариантах осуществления селективный ингибитор O-GlcNAcase показывает соотношение селективности, которое описано в изобретении, в интервале от 10 до 100000, или в интервале от 100 до 100000, или в интервале от 1000 до 100000, или, по меньшей мере 10, 20, 50, 100, 200, 500, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 6000, 7000, 10000, 25000, 50000, 75000 или любое значение в пределах или около описанного интервала.
Одно или несколько соединений настоящего изобретения поднимают уровни O-GlcNAc на O-GlcNAc-модифицированных полипептидах или белках in vivo особенно через взаимодействие с ферментом O-GlcNAcase и являются эффективными при лечении состояний, которые требуют или реагируют на ингибирование активности O-GlcNAcase.
В некоторых вариантах осуществления одно или несколько соединений настоящего изобретения полезны в качестве агентов, которые продуцируют снижение фосфорилирования тау и образования НФК. В некоторых вариантах осуществления одно или несколько соединений, таким образом, полезны для лечения болезни Альцгеймера и родственных таупатий. В некоторых вариантах осуществления одно или несколько соединений, следовательно, способны лечить болезнь Альцгеймера и родственные таупатии за счет понижения фосфорилирования тау и снижения образования НФК как результат повышения уровней тау O-GlcNAc. В некоторых вариантах осуществления одно или несколько соединений продуцируют повышение уровней O-GlcNAc-модификации на O-GlcNAc-модифицированных полипептидах или белках, и, следовательно, полезны при лечении нарушений, восприимчивых к таким повышениям O-GlcNAc-модификации; такие нарушения включают, но без ограничения, нейродегенеративные, воспалительные, сердечно-сосудистые и иммунорегуляторные заболевания. В некоторых вариантах осуществления соединение также является полезным в результате других видов биологической активности, связанных с их способностью ингибировать активность ферментов гликозидазы. В альтернативных вариантах осуществления одно или несколько соединений изобретения являются ценными инструментами при изучении физиологической роли O-GlcNAc на клеточном и организменном уровне.
В альтернативных вариантах осуществления изобретение предлагает способы поднятия или повышения уровней O-GlcNAc модификации белков у животных, таких как ветеринарные животные, и у людей. В альтернативных вариантах осуществления изобретение предлагает способы селективного ингибирования фермента O-GlcNAcase у животных, таких как ветеринарные животные, и у людей. В альтернативных вариантах осуществления изобретение предлагает способы ингибирования фосфорилирования тау полипептидов или ингибирования образования НФК у животных, таких как ветеринарные животные, и у людей.
В конкретных вариантах осуществления изобретение предлагает соединения, описываемые в целом формулой (I), и его соли, пролекарства и энантиомерные формы:

Как представлено в формуле (I): R1 и R2 независимо могут представлять собой Н или F; R3 может представлять собой ОR5 и R4 может представлять собой Н, или R3 может представлять собой Н и R4 может представлять собой ОR5; каждый из R5 независимо может представлять собой Н или С1-6-ацил; R6 может представлять собой Н, F или ОR5; R7 может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода и F, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; R8 может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами; или R7 и R8 и атом углерода, к которому они присоединены, могут вместе образовывать винил; и каждый R9 может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом, или две группы R9 могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группой или метилом; где, когда R6 представляет собой OR5, то R7 не является F.
В некоторых вариантах осуществления R1, как показано в формуле (I), может представлять собой Н или F. В некоторых вариантах осуществления R1 может представлять собой F.
В некоторых вариантах осуществления R2, как показано в формуле (I), может представлять собой Н или F. В некоторых вариантах осуществления R2 может представлять собой F.
В некоторых вариантах осуществления R3, как показано в формуле (I), может представлять собой Н, ОН или OC(O)R10, где R10 может представлять собой Н, С1-6-алкил или С3-6-циклоалкил. В некоторых вариантах осуществления R3 может представлять собой Н или ОН. В некоторых вариантах R3 может представлять собой Н.
В некоторых вариантах осуществления R4, как показано в формуле (I), может представлять собой Н, ОН или OC(O)R10, где R10 может представлять собой Н, С1-6-алкил или С3-6-циклоалкил. В некоторых вариантах осуществления R4 может представлять собой Н или ОН. В некоторых вариантах R4 может представлять собой ОН.
В некоторых вариантах осуществления R6, как показано в формуле (I), может представлять собой Н, F, ОН или OC(O)R10, где R10 может представлять собой Н, С1-6-алкил или С3-6-циклоалкил. В некоторых вариантах R6 может представлять собой Н или ОН.
В некоторых вариантах осуществления R7, как показано в формуле (I), может быть выбран из группы, состоящей из: Н, F, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, причем каждый, за исключением водорода, необязательно замещен от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами. В некоторых вариантах осуществления R7 может представлять собой Н или СН3.
В некоторых вариантах осуществления R8, как показано в формуле (I), может быть выбран из группы, состоящей из: С1-8-алкила, С2-8-алкенила, С2-8-алкинила, С3-6-циклоалкила, арила и гетероарила, необязательно замещенных от одного и до максимального числа заместителей одним или несколькими атомами фтора или ОН-группами. В некоторых вариантах R8 может представлять собой СН3 или CF3.
В некоторых вариантах осуществления R7 и R8 и атом углерода, к которому они присоединены, как показано в формуле (I), могут вместе образовывать винил.
В некоторых вариантах осуществления каждый R9, как показано в формуле (I), может быть независимо выбран из группы, состоящей из: Н, С1-6-алкила, С3-6-алкенила, С3-6-алкинила и С1-6-алкоксигруппы, где С1-6-алкил, С3-6-алкенил, С3-6-алкинил или С1-6-алкоксигруппа необязательно могут быть замещены от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом. В некоторых вариантах осуществления каждый R9 независимо может представлять собой Н, СН3 или СН2СН3.
В некоторых вариантах осуществления две группы R9, как показано в формуле (I), могут быть связаны вместе с атомом азота, к которому они присоединены, с образованием кольца, причем указанное кольцо необязательно независимо замещено от одного и до максимального числа заместителей одним или несколькими атомами фтора, ОН-группами или метилом.
В некоторых вариантах осуществления NR92, как показано в формуле (I), могут представлять собой необязательно замещенный:



В конкретных вариантах осуществления изобретения соединения в соответствии с формулой (I) включают соединения, описанные в таблице 1.
Как будет понятно специалисту в данной области техники, приведенная выше формула (I) также может быть представлена следующим образом:

Как используется в данном случае, формы единственного числа включают множество объектов, если содержание ясно не указывает на другое. Например, «соединение» относится к одному или нескольким таким соединениям, тогда как «фермент» указывает на конкретный фермент, а также на другие члены семейства и их эквиваленты, которые известны специалистам в данной области техники.
По всей данной заявке подразумевается, что определение «соединение» или «соединения» относится к соединениям, рассмотренным в описании, и включает предшественники и производные соединений, в том числе ацил-защищенные производные, и фармацевтически приемлемые соли соединения, предшественников и производных. Изобретение также включает пролекарства соединений, фармацевтические композиции, включающие соединения и фармацевтически приемлемый носитель, и фармацевтические композиции, включающие пролекарства соединений и фармацевтически приемлемый носитель.
Соединения настоящего изобретения могут содержать один или несколько асимметрических центров и, таким образом, могут существовать в виде рацематов и рацемических смесей, единственного энантиомера, диастереомерных смесей и индивидуальных диастереомеров. Могут присутствовать дополнительные асимметрические центры в зависимости от природы разнообразных заместителей на молекуле. Каждый такой асимметрический центр независимо будет давать два оптических изомера, и подразумевается, что все возможные оптические изомеры и диастереомеры в смеси и в виде чистых или частично очищенных соединений включены в рамки объема настоящего изобретения. Любые формулы, структуры или названия соединений, приведенные в данном описании, которые не определяют конкретную стереохимию, как подразумевают, охватывают любые или все существующие изомеры, описанные выше, и их смеси в любой пропорции. Когда стереохимия определена, изобретение, как подразумевается, охватывает этот конкретный изомер в чистой форме или как часть смеси с другими изомерами в любой пропорции.
Определение «алкил» относится к неразветвленной или разветвленной углеводородной группе, содержащей только атомы углерода и водорода, не содержащей ненасыщенность и включающей, например, от одного до десяти атомов углерода, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода, и которая присоединена к остатку молекулы простой связью. В альтернативных вариантах осуществления алкильная группа может содержать от одного до восьми атомов углерода, например, 1, 2, 3, 4, 5, 6, 7 или 8 атомов углерода. В альтернативных вариантах осуществления алкильная группа может содержать от одного до шести атомов углерода, например, 1, 2, 3, 4, 5 или 6 атомов углерода. Если в описании конкретно не указано другое, алкильная группа необязательно может быть замещена одним или несколькими заместителями, описанными в изобретении. Если в описании конкретно не указано другое, следует понимать, что замещение может находиться на любом атоме углерода алкильной группы.
Определение «алкенил» относится к неразветвленной или разветвленной углеводородной группе, содержащей только атомы углерода и водорода, содержащей, по меньшей мере одну двойную связь и включающей, например, от двух до десяти атомов углерода, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода, и которая присоединена к остатку молекулы простой связью или двойной связью. В альтернативных вариантах осуществления алкенильная группа может содержать от двух до восьми атомов углерода, например, 2, 3, 4, 5, 6, 7 или 8 атомов углерода. В альтернативных вариантах осуществления алкенильная группа может содержать от трех до шести атомов углерода, например, 3, 4, 5 или 6 атомов углерода. Если в описании конкретно не указано другое, алкенильная группа необязательно может быть замещена одним или несколькими заместителями, описанными в изобретении. Если в описании конкретно не указано другое, следует понимать, что замещение может находиться на любом атоме углерода алкенильной группы.
Определение «алкинил» относится к неразветвленной или разветвленной углеводородной группе, содержащей только атомы углерода и водорода, содержащей, по меньшей мере одну тройную связь и включающей, например, от двух до десяти атомов углерода. В альтернативных вариантах осуществления алкинильная группа может содержать от двух до восьми атомов углерода, например, 2, 3, 4, 5, 6, 7 или 8 атомов углерода. В альтернативных вариантах осуществления алкинильная группа может содержать от трех до шести атомов углерода, например, 3, 4, 5 или 6 атомов углерода. Если в описании конкретно не указано другое, алкинильная группа необязательно может быть замещена одним или несколькими заместителями, описанными в изобретении.
Определение «арил» относится к фенильной группе, ароматическому кольцу, содержащему 6 атомов углерода. Если в описании конкретно не указано другое, определение «арил», как подразумевается, включает арильные группы, необязательно замещенные одним или несколькими заместителями, описанными в изобретении.
Определение «гетероарил» относится к одной ароматической кольцевой группе, содержащей один или несколько гетероатомов в кольце, например, атомы N, O, S, включая, например, 5-6-членные, такие как 5- или 6-членные. Примеры гетероарильных групп включают фуран, тиофен, пиррол, оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, 1,2,3-оксадиазол, 1,2,3-триазол, 1,2,4-триазол, 1,3,4-тиадиазол, тетразол, пиридин, пиридазин, пиримидин, пиразин, 1,3,5-триазин, имидазол. Если в описании конкретно не указано другое, определение «гетероарил», как подразумевается, включает гетероарильные группы, необязательно замещенные одним или несколькими заместителями, описанными в изобретении.
Определение «ацил» относится к группе формулы -С(О)Ra, где Ra представляет собой С1-10-алкильную, или С1-6-алкильную группу, или С3-15-циклоалкильную группу, которые описаны в изобретении. Алкильная(ые) или циклоалкильная(ые) группа(ы) необязательно может(гут) быть замещена(ы), как описано в изобретении.
Определение «алкоксигруппа» относится к группе формулы -ORb, где Rb представляет собой С1-10-алкильную или С1-6-алкильную группу, описанную в изобретении. Алкильная(ые) группа(ы) необязательно может(гут) быть замещена(ы), как описано в изобретении.
Определение «циклоалкил» относится к стабильной, одновалентной, моноциклической, бициклической или трициклической углеводородной группе, содержащей только атомы углерода и водорода, имеющей, например, от 3 до 15 атомов углерода, и которая является насыщенной и прикреплена к остатку молекулы простой связью. В альтернативных вариантах осуществления циклоалкильная группа может содержать от трех до шести атомов углерода, например, 3, 4, 5 или 6 атомов углерода. Если в описании конкретно не указано другое, определение «циклоалкил», как подразумевается, включает циклоалкильные группы, которые необязательно замещены, как описано в изобретении.
В некоторых вариантах осуществления две группы R9, как показано в формуле (I), могут быть связаны вместе с атомом азота, к которому они прикреплены, с образованием кольца. В таких вариантах осуществления «кольцо» относится к стабильной азотсодержащей моноциклической группе, имеющей от 3 до 6 членов, которое может быть насыщенным или мононенасыщенным. В альтернативных вариантах осуществления кольцо может включать атомы С, Н и N. В других вариантах осуществления кольцо может включать гетероатомы, например, О и S. Примеры кольца в таких вариантах осуществления включают 1-азиридинил, 1-азетидинил, 1-пирролидинил, 2,5-дигидро-1Н-пиррол-1-ил, 1-пиперидинил, 1,2,3,6-тетрагидропиридин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, 1-пиперизинил, азетидин-2-он-1-ил, пирролидин-2-он-1-ил, пиперид-2-он-1-ил, 1,2-оксазетидин-2-ил, изоксазолидин-2-ил и 1,2-оксазинан-2-ил. Кольцо в этих вариантах осуществления необязательно может быть замещено, как описано выше.
Определения «необязательный» или «необязательно» означает, что в последствии описанное событие или случаи могут иметь место или не иметь место и что описание включает случаи, где указанные событие или случай встречаются один или несколько раз, и случаи, в которых это не происходит. Например, «необязательно замещенный алкил» означает, что алкильная группа может быть замещена или может быть не замещена и что описание включает как замещенные алкильные группы, так и алкильные группы, которые не имеют замещения, и что указанные алкильные группы могут быть замещены один или несколько раз. Примеры необязательно замещенных алкильных групп включают, но без ограничения, метил, этил, пропил и др., и в том числе циклоалкилы, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и др.; примеры необязательно замещенных алкенильных групп включают аллил, кротил, 2-пентенил, 3-гексенил, 2-циклопентенил, 2-циклогексенил, 2-циклопентенилметил, 2-циклогексенилметил и др. В некоторых вариантах необязательно замещенные алкильные и алкенильные группы включают С1-6-алкилы или алкенилы.
Показания к применению
Изобретение предлагает способы лечения состояний, которые опосредуются, прямо или косвенно, с помощью фермента O-GlcNAcase или уровнями O-GlcNAc-модифицированного белка, например, состояния, которое получает положительный результат при ингибировании фермента O-GlcNAcase или при повышении уровней O-GlcNAc-модифицированного белка. Такие состояния включают, но без ограничения, глаукому, шизофрению, таупатии, такие как болезнь Альцгеймера, нейродегенеративные заболевания, сердечно-сосудистые заболевания, заболевания, связанные с воспалением, заболевания, связанные с иммуносупрессией, и рак. Одно или несколько соединений настоящего изобретения также пригодны при лечении заболеваний и нарушений, связанных с дефицитом или сверхэкспрессией O-GlcNAcase или с накоплением или истощением O-GlcNAc, или любого заболевания или нарушения, восприимчивого к терапии ингибированием глюкозидазы. Такие заболевания и нарушения включают, но не ограничены ими, глаукому, шизофрению, нейродегенеративные нарушения, такие как болезнь Альцгеймера (БА (AD)) или рак. Такие заболевания и нарушения также могут включать заболевания или нарушения, связанные с накоплением или дефицитом фермента OGT. Также включен способ защиты или лечения целевых клеток, экспрессирующих белки, которые модифицированы остатками O-GlcNAc, дисрегуляция модификации которых приводит к заболеванию или патологии. Определение «лечение», которое используют в данном случае, включает лечение, предупреждение и ослабление симптомов.
В альтернативных вариантах осуществления изобретение предлагает способы повышения или поднятия уровней O-GlcNAc-модификации белка у животных, таких как ветеринарные животные, и у людей. Такое повышение уровней O-GlcNAc может быть полезным при предупреждении или лечении болезни Альцгеймера; предупреждении или лечении других нейродегенеративных заболеваний (например, болезни Паркинсона, болезни Хантингтона); обеспечении нейрозащитных эффектов; предупреждении поражения сердечной ткани; и при лечении заболеваний, связанных с воспалением или иммуносупрессией.
В альтернативных вариантах осуществления изобретение предлагает способы селективного ингибирования фермента O-GlcNAcase у животных, таких как ветеринарные животные, и людей.
В альтернативных вариантах осуществления изобретение предлагает способы ингибирования фосфорилирования тау полипептидов, или ингибирования образования НФК у животных, таких как ветеринарные животные, и у людей. Соответственно, соединение изобретения может быть использовано для изучения и лечения БА и других таупатий.
В общем случае способы настоящего изобретения реализуют путем введения соединения в соответствии с изобретением субъекту, нуждающемуся в этом, или путем введения в контакт клеток или образца с соединением в соответствии с изобретением, например, фармацевтической композицией, содержащей терапевтически эффективное количество соединения формулы (I). Точнее, соединения могут быть приемлемы при лечении нарушений, в которые вовлечено регулирование O-GlcNAc белковой модификации, или любого состояния, которые описано в данном случае. Интерес представляют болезнь Альцгеймера (БА) и близкие нейродегенеративные таупатии, при которых аномальное гиперфосфорилирование тау белка, связанного с микротрубочками, вовлечено в патогенез заболевания. В некоторых вариантах осуществления соединение может быть использовано для блокирования гиперфосфорилирования тау путем поддержания повышенных уровней O-GlcNAc на тау, в результате чего обеспечивая положительный терапевтический эффект.
Эффективность соединения при лечении патологии, связанной с накоплением токсичных тау образцов (например, болезни Альцгеймера и других таупатий), может быть подтверждена путем оценки способности соединения блокировать образование токсичных тау образцов в достоверных клеточных121-123 и/или трансгенных животных моделях заболевания33,34.
Таупатии, которые можно лечить с помощью соединения настоящего изобретения, включают: болезнь Альцгеймера, боковой амиотрофический склероз (ALS), боковой амиотрофический склероз с когнитивным нарушением (ALSci), деменцию аргирофильных гранул, Bluit disease, кортико-базальную дегенерацию (CBD), деменцию боксеров, диффузные нейрофибриллярные клубки с кальцификацией, синдром Дауна, семейную британскую деменцию, семейную датскую деменцию, лобно-височную деменцию с паркинсонизмом, связанным с хромосомой 17 (FTDP-17), болезнь Герстмана-Штраусслера-Шейнкера, паркинсонизм Гваделупы, болезнь Галлервордена-Шпатца (нейродегенерация с накоплением в головном мозге железа I типа), множественную системную атрофию, миотоническую дистрофию, болезнь Ниманна-Пика (тип С), паллидо-понто-нигральную дегенерацию, комплекс паркинсонизм-деменция Гуама, болезнь Пика (PiD), постэнцефалитический паркинсонизм (РЕР), прионные болезни (включая болезнь Крейтцфельда-Якоба (CJD), разновидность болезни Крейтцфельда-Якоба (vCJD), спорадическую фатальную инсомнию и куру), прогрессивный субкортикальный глиоз, прогрессирующий надъядерный паралич (PSP), синдром Ричардсона, подострый склерозирующий панэнцефалит, старческое слабоумие только с клубков и глаукому.
Одно или несколько соединений настоящего изобретения также полезны при лечении состояний, связанных с повреждением или стрессом тканей, стимулирующим клетки или активирующим дифференциацию клеток. Соответственно, в некоторых вариантах осуществления соединение настоящего изобретения может быть использовано для обеспечения положительного терапевтического эффекта в ряде состояний или медицинских процедур, включающих стресс сердечной ткани, в том числе, но без ограничения: ишемию, кровоизлияние, гиповолемический шок, инфаркт миокарда, интервенционную кардиологию, кардиошунтирование, фибринолитическую терапию, ангиопластику или размещение стента.
Эффективность соединения при лечении патологии, связанной с клеточным стрессом (включая ишемию, кровоизлияние, гиповолемический шок, инфаркт миокарда и другие сердечно-сосудистые нарушения), может быть подтверждена путем испытания способности соединения предупреждать клеточное повреждение в достоверных методах оценки клеточного стресса108,119,120 и предупреждать повреждение ткани и стимулировать функциональное восстановление в животных моделях ишемии-реперфузии71,117 и травматического кровоизлияния73,115,118.
Соединения, которые селективно ингибируют активность GlcNAcase, могут быть использованы для лечения заболеваний, которые связаны с воспалением, включая, но без ограничения, воспалительные и аллергические заболевания, такие как астма, аллергический ринит, состояние гиперчувствительности легких, пневмонит гиперчувствительности, эозинофильная пневмония, гиперчувствительность замедленного типа, атеросклероз, интерстициальная болезнь легких (ILD) (например, идиопатический легочный фиброз, или ILD, связанная с ревматоидным артритом, системной красной волчанкой, анкилозирующим спондилоартритом, системным склерозом, синдромом Шегрена, полимиозитом или дерматомиозитом); общую анафилактическую реакцию или реакцию гиперчувствительности, лекарственную аллергию; аллергию от укусов насекомых, аутоиммунные заболевания, такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, синдром Гийена-Барре, системная красная волчанка, миастения гравис, гломерулонефрит, аутоиммунный тиреоидит, отторжение трансплантата, включая отторжение аллотрансплантата и болезнь «трансплантат против хозяина»; воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит; спондилоартропатию; склеродермию; псориаз (включая опосредуемый Т-клетками псориаз) и воспалительные дерматозы, такие как дерматит, экзема, атопический дерматит, аллергический контактный дерматит, уртикарную сыпь; васкулит (например, некротический, кожный и сверхчувствительный васкулит); эозинофильный миозит, эозинофильный фасциит; и рак.
Кроме того, соединения, которые воздействуют на уровни GlcNAc-модификации белка, могут быть использованы для лечения заболеваний, связанных с иммуносупрессией, например, у индивидуумов, подвергающихся химиотерапии, радиационной терапии, усиленному заживлению ран и лечению ожогов, лечению аутоиммунного заболевания или другой лекарственной терапии (например, кортикостероидной терапии) или комбинации обычных лекарств, используемых при лечении аутоиммунных заболеваний и (отторжения трансплантата)/трансплантации, которые вызывают иммуносупрессию; или иммуносупрессии вследствие наследственного дефекта в рецепторной функции или других причин.
Одно или несколько соединений изобретения могут быть использованы для лечения нейродегенеративного заболевания, включая болезнь Паркинсона и болезнь Хантингтона. Другие состояния, которые можно лечить, представляют собой состояния, которые запускаются, подвергаются воздействию или любым другим способом коррелируют с уровнем О-GlcNAc посттрансляционной белковой модификацией. Ожидается, что одно или несколько соединений настоящего изобретения могут быть приемлемы для лечения таких состояний и в особенности, но без ограничения, состояний, для которых доказана ассоциация с уровнями О-GlcNAc: отторжение трансплантата, в особенности, но без ограничения, трансплантатов паренхиматозных органов, таких как сердце, легкие, печень, почки и трансплантат поджелудочной железы (например, аллотрансплантат почки и легкого); рак, в особенности, но без ограничения, рак молочной железы, легкого, простаты, поджелудочной железы, толстой кишки, прямой кишки, мочевого пузыря, почки, яичника; а также неходжкинская лимфома и меланома; эпилепсия; болевые ощущения; фибромиалгия или нарушение мозгового кровообращения, например, для нейропротекции после нарушения мозгового кровообращения.
Фармацевтические и ветеринарные композиции, дозировки и введение
Фармацевтические композиции, включающие соединения в соответствии с изобретением, или для применения в соответствии с изобретением, как подразумевают, находятся в рамках объема изобретения. В некоторых вариантах осуществления предложены фармацевтические композиции, включающие эффективное количество соединения формулы (I).
Соединения формулы (I) и их фармацевтически приемлемые соли, энантиомеры, сольваты и производные являются полезными, так как они обладают фармакологической активностью в животных, включая людей. В некоторых вариантах осуществления одно или несколько соединений в соответствии с изобретением стабильны в плазме при введении субъекту.
В некоторых вариантах осуществления соединение в соответствии с изобретением или для применения в соответствии с изобретением может быть представлено в комбинации с любыми другими активными средствами или фармацевтическими композициями, где такая комбинированная терапия приемлема для модуляции активности GlcNAcase, например, для лечения нейродегенеративных, воспалительных, сердечно-сосудистых или иммунорегуляторных заболеваний или любого описанного в изобретении состояния. В некоторых вариантах осуществления соединение в соответствии с изобретением и для применения в соответствии с изобретением может быть представлено в комбинации с одним или несколькими средствами, полезными для предупреждения или лечения болезни Альцгеймера. Примеры таких агентов включают, но без ограничения:
- ингибиторы ацетилхолинэстеразы (AChEI), такие как Арисепт® (Допенезил), Экселон® (Ривастигмин), Разадин® (Разадин ER®, Реминил®, Нивалин®, Галантамин), Когнекс® (Такрин), Димебон, Гуперзин А, Фенсерин, Дебио-9902 SR (ZT-1 SR), Занапезил (ТАК0147), Ганстигмин, NP7557 и др.;
- антагонисты NMDA рецептора, такие как Наменда® (Аксура®, Акатинол®, Эбикса®, Мемантин), Димебон, SGS-742, Нерамексан, Дебио-9902 SR (ZT-1 SR) и др.;
- ингибиторы и/или модуляторы гамма-секретазы, такие как ФлуризанТМ (Таренфлурбил, МРС-7869, R-флурбипрофен), LY450139, MK 0752, E2101, BMS-289948, BMS-299897, BMS-433796, LY-411575, GSI- 136 и др.;
- ингибиторы бета-секретазы, такие как ATG-Z1, CTS-21166, MK-8931 и др.;
- активаторы альфа-секретазы, такие как NGX267 и др.;
- ингибиторы агрегации и/или фибриллизации амилоида-β, такие как Альцгемед™ (3APS, Трамипрозат, 3-амино-1-пропан-сульфоновая кислота), AL-108, AL-208, AZD-103, PBT2, Цереакт, ONO-2506PO, PPI-558 и др.;
- ингибиторы тау агрегации, такие как метиленовый голубой и др.;
- стабилизаторы микротрубочек, такие как AL-108, AL-208, паклитаксел и др.;
- ингибиторы RAGE, такие как ТТР488 и др.;
- антагонисты 5-НТ1а рецептора, такие как Ксалипроден, Лекозотан и др.;
- антагонисты 5-НТ4 рецептора, такие как PRX-03410 и др.;
- ингибиторы киназы, такие как SRN-003-556, амфуриндамид (amfurindamide), LiCl, AZD1080, NP031112, SAR-502250 и др.;
- гуманизированные моноклональные анти-Аβ-антитела, такие как Бапинеузумаб (ААВ-001), LY2062430, RN1219, ACU-5A5 и др.;
- амилоидные вакцины, такие как AN-1792, ACC-001 и др.;
- нейропротекторные агенты, такие как Церебролизин, AL-108, AL-208, Гуперзин А и др.;
- антагонисты кальциевого канала L-типа, такие как МЕМ-1003 и др.;
- антагонисты никотинового рецептора, такие как AZD3480, GTS-21 и др.;
- агонисты никотинового рецептора, такие как МЕМ 3454, Нефирацетам и др.;
- агонисты гамма-рецептора, активируемого пролифератором пероксисом (PPAR), такие как Авандия® (Росглитазон) и др.;
- ингибиторы фосфодиэстеразы IV(PDE4), такие как MK-0952 и др.;
- заместительная гомональная терапия, например, эстрогеном (Премарин) и др.;
- ингибиторы моноаминоксидазы (МАО), такие как NS2330, Разагилин (Азилект®), TVP-1012 и др.;
- модуляторы АМРА рецептора, такие как Ампалекс (СХ 516) и др.;
- потенциаторы фактора роста нервов или NGF, такие как CERE-110 (AAV-NGF), T-588, T-817MA и др.;
- агенты, которые предупреждают высвобождение лютеинизирующего гормона (ЛГ (LH)) питуитарной железой, такие как лейопролид (VP-4896) и др.;
- модуляторы рецептора GABA, такие как АС-3933, NGD 97-1, CP-457920 и др.;
- обратные агонисты бензодиазепинового рецептора, такие как SB-737552 (S-8510), AC-3933 и др.;
- норадреналин-высвобождающие агенты, такие как Т-588, Т-817МА и др.
Следует понимать, что комбинация соединений в соответствии с изобретением или для применения в соответствии с изобретением со средствами для лечения болезни Альцгеймера не ограничена описанными выше примерами, а включает комбинацию с любыми средствами, приемлемыми для лечения болезни Альцгеймера. Комбинация соединений в соответствии с изобретением или для применения в соответствии с изобретением и другие средства для лечения болезни Альцгеймера могут быть введены по отдельности или в сочетании. Введение одного агента может быть проведено до, одновременно или после введения другого(их) агента(ов).
В альтернативных вариантах осуществления соединение может быть представлено в виде «пролекарства» или защищенных форм, которые высвобождают соединение после введения субъекту. Например, соединение может нести защитную группу, которая отщепляется путем гидролиза в жидкостях организма, например, в токе крови, высвобождая в результате активное соединение, или окисляется или восстанавливается в жидкостях организма, высвобождая соединение. Соответственно, определение «пролекарство», как подразумевают, указывает на соединение, которое может быть превращено при физиологических условиях или путем сольволиза в биологически активное соединение настоящего изобретения. Таким образом, определение «пролекарство» относится к метаболическому предшественнику соединения изобретения, который является фармацевтически приемлемым. Пролекарство может быть неактивным при введении субъекту, нуждающемуся в этом, но превращается in vivo в активное соединение настоящего изобретения. Пролекарства обычно легко преобразуются in vivo, давая исходное соединение изобретения, например, за счет гидролиза в крови. Пролекарственное соединение часто обеспечивает преимущество растворимости, совместимости с тканями или замедленного высвобождения в субъекте.
Определение «пролекарство», также, как подразумевается, включает любые ковалентно связанные носители, которые высвобождают активное соединение настоящего изобретения in vivo, когда такое пролекарство вводят субъекту. Пролекарства соединения настоящего изобретения могут быть получены путем модификации функциональных групп, присутствующих в соединении настоящего изобретения таким путем, что модификации могут быть расщеплены или рутинной манипуляцией, или in vivo до исходного соединения настоящего изобретения. Пролекарства включают соединения настоящего изобретения, где гидрокси-, амино- или меркаптогруппа связана с любой группой, которая, когда пролекарство соединения настоящего изобретения вводят млекопитающему, расщепляется с образованием свободной гидрокси-, свободной амино- или свободной меркаптогруппы, соответственно. Примеры пролекарств включают, но без ограничения, ацетатные, формиатные и бензоатные производные спирта и ацетамида, формамидные и бензамидные производные аминных функциональных групп в одном или нескольких соединениях настоящего изобретения и т.д.
Обсуждение пролекарств может быть найдено в публикациях «Smith and Williams’ Introduction to Principles of Drug Design», H.J. Smith, Wright, Second Edition, London (1988); Bundgard H., Design of Prodrugs (1985), pp. 7-9, 21-24 (Elsevier, Amsterdam); The Practice of Medicinal Chemistry, Camille G. Wermuth et al., Ch. 31 (Academic Press, 1996); A Textbook of Drug Design and Development, P. Krogsgaard-Larson and H. Bundgaard, eds. Ch. 5, pp. 113, 191 (Harwood Academic Publishers, 1991); Higuchi T., et al., «Pro-drugs as Novel Delivery Systems», A.C.S. Symposium Series, Vol. 14; или Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987; которые все включены полностью посредством ссылки.
Подходящие пролекарственные формы одного или нескольких соединений настоящего изобретения включают варианты осуществления, в которых один или несколько заместителей R5, которые представлены в формуле (I), представляют собой C(O)R, где R представляет собой необязательно замещенный алкил, алкенил, алкинил, арил или гетероарил. В этих случаях сложноэфирная группа может быть гидролизована in vivo (например, в физиологических жидкостях), высвобождая активные соединения, в которых каждый заместитель R5 представляет собой Н. Предпочтительные пролекарственные варианты осуществления изобретения включают соединения формулы (I), где один или несколько заместителей R5 представляют собой С(О)СН3.
Соединения в соответствии с изобретением или для применения в соответствии с изобретением могут быть представлены по отдельности или в комбинации с другими соединениями в присутствии липосомы, адъюванта или любого фармацевтически приемлемого носителя, разбавителя или наполнителя, в форме, приемлемой для введения субъекту, такому как млекопитающее, например, люди, крупный рогатый скот, овцы и т.д. При необходимости лечение с помощью соединения в соответствии с изобретением может быть объединено с одной или несколькими традиционными и существующими терапиями при показаниях к применению, описанных в данном случае. Соединения в соответствии с изобретением можно принимать постоянно или периодически. «Постоянное» введение относится к введению соединения(ий) по непрерывной схеме в отличие от схемы острого введения так, чтобы поддерживать начальный терапевтический эффект (активность) в течение длительного периода времени. «Периодическое» введение означает лечение, которое проводится не последовательно без перерыва, а скорее является циклическим по природе. Определения «введение», «вводимое» или «применение», которые используют в данном случае, как следует понимать, означают снабжение соединением настоящего изобретения субъекта, нуждающегося в нем.
«Фармацевтически приемлемый носитель, разбавитель или наполнитель» включает, но без ограничения, любой адъювант, носитель, наполнитель, вещество, способствующее скольжению, подслащивающее средство, разбавитель, консервант, краситель/(красящее вещество), усилитель вкуса и запаха, поверхностно-активное вещество, смачивающий агент, диспергирующий агент, суспендирующий агент, стабилизатор, изотонический агент, растворитель или эмульгатор, которые были одобрены, например, управлением по контролю за продуктами и лекарствами Соединенных Штатов или другим правительственным учреждением как приемлемые к применению для человека или домашних животных.
Соединение настоящего изобретения может быть введено в форме фармацевтически приемлемой соли. В таких случаях фармацевтические композиции в соответствии с настоящим изобретением могут содержать соль такого соединения, предпочтительно физиологически приемлемую соль, что известно в данной области техники. В некоторых вариантах осуществления определение «фармацевтически приемлемая соль», как это используется в данном случае, означает активный ингредиент, содержащий соединение формулы (I), используемое в форме его соли, особенно, где солевая форма придает активному ингредиенту улучшенные фармакокинетические свойства в сравнении со свободной формой активного ингредиента, или другой ранее рассмотренной солевой форме.
«Фармацевтически приемлемая соль» включает как кислотные, так основные аддитивные соли. «Фармацевтически приемлемая кислотная аддитивная соль» относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом неприемлемыми и которые образованы с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные кислоты, и с органическими кислотами, такими как уксусная кислота, трифторуксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и подобные кислоты.
«Фармацевтически приемлемая основная аддитивная соль» относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом неприемлемыми. Такие соли готовят путем присоединения неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают, но не ограничиваются ими, натриевые, калиевые, литиевые, аммонийные, кальциевые, магниевые, железные, цинковые, медные, марганцевые, алюминиевые соли и подобные им соли. Предпочтительными неорганическими солями являются аммонийные, натриевые, калиевые, кальциевые и магниевые соли. Соли, полученные из органических оснований, включают, но не ограничиваются ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая существующие в природе замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминные смолы и подобные соединения. Особенно предпочтительными органическими основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин.
Таким образом, определение «фармацевтически приемлемая соль» охватывает все приемлемые соли, в том числе, но без ограничения, ацетат, лактобионат, бензолсульфонат, лаурат, бензоат, малат, бикарбонат, малеат, бисульфат, манделат, битартрат, мезилат, борат, метилбромид, бромид, метилнитрит, эдетат кальция, метилсульфат, камсилат, мукат, карбонат, напсилат, хлорид, нитрат, клавуланат, N-метилглюкамин, цитрат, аммонийную соль, дигидрохлорид, олеат, эдетат, оксалат, эдисилат, памоат (эмбонат), эстолат, пальмитат, эзилат, пантотенат, фумарат, фосфат/дифосфат, глюцептат, полигалактуронат, глюконат, салицилат, глютам, стеарат, гликоллиларсанилат, сульфат, гексилрезорцинат, субацетат, гидрадамин, сукцинат, гидробромид, таннат, гидрохлорид, тартрат, гидроксинафтоат, теоклат, иодид, тозилат, изотионат, триэтиодид, лактат, паноат, валерат и подобные соли.
Фармацевтически приемлемые соли соединения настоящего изобретения могут быть использованы в дозировках для модифицирования характеристик растворимости или гидролиза, или могут быть использованы в препаратах с постепенным высвобождением или в пролекарственных рецептурах. Кроме того, фармацевтически приемлемые соли соединения настоящего изобретения могут включать соли, образованные из катионов, таких как натрий, калий, алюминий, кальций, литий, магний, цинк, и из оснований, таких как аммиак, этилендиамин, N-метилглютамин, лизин, аргинин, орнитин, холин, N,N’-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенетиламин, диэтиламин, пиперазин, три(гидроксиметил)-аминометан и гидроксид тетраметиламмония.
Фармацевтические рецептуры обычно будут включать один или несколько носителей, приемлемых для схемы введения препарата, будь то путем инъекции, ингаляции, топикального введения, орошением, или другими схемами, приемлемыми для выбранного лечения. Подходящими носителями являются носители, известные в данной области техники для таких схем введения.
Подходящие фармацевтические композиции могут быть приготовлены с помощью средств, известных в данной области техники, и их схема введения и доза могут быть определены практикующим врачом. В случае парентерального введения соединение может быть растворено в стерильной воде или физиологическом растворе, или в фармацевтически приемлемом растворителе в случае введения нерастворимых в воде соединений, таких как растворители, используемые для витамина К. В случае тонкокишечного введения соединение может быть введено в таблетке, капсуле или растворенным в жидкой форме. Таблетка или капсула могут быть кишечнорастворимыми, или могут находиться в рецептуре для постепенного высвобождения. Известно большое число подходящих рецептур, включая полимерные или белковые микрочастицы, инкапсулирующие соединение, которое должно быть высвобождено, мази, гели, гидрогели или растворы, которые могут быть использованы топикально или локально, чтобы ввести соединение. Пластырь с постепенным высвобождением или имплантат могут быть использованы, чтобы обеспечить высвобождение в течение длительного периода времени. Большое число методик, известных практикующим врачам, описано в публикации: Remington: the Science & Practice of Pharmacy, Alfonso Gennaro, 20-th ed., Williams & Wilkins (2000). Рецептуры для парентерального введения, например, могут содержать наполнители, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения, или гидрированные нафталины. Биосовместимый, биоразлагающийся лактидный полимер, сополимер лактид/гликолид или полиоксиэтилен-полиоксипропиленовые сополимеры могут быть использованы для контроля высвобождения соединения. Другие потенциально приемлемые парентеральные системы доставки для модуляторных соединений включают частицы этилен/винилацетатного сополимера, осмотические насосы, имплантируемые инфузионные системы и липосомы. Рецептуры для ингаляции могут содержать, например, лактозу, или могут представлять собой водные растворы, содержащие, например, полиоксиэтилен-9-лауриловый эфир, гликохолат и деоксихолат, или могут представлять собой масляные растворы для введения в форме назальных капель, или находиться в виде геля.
Соединение или фармацевтическая композиция в соответствии с настоящим изобретением может быть введена перорально или не перорально, например, внутримышечно, внутрибрюшинно, внутривенно, интрацистернальными инъекцией или вливанием, подкожной инъекцией, трансдермальным или чрезслизистым путями. В некоторых вариантах осуществления соединение или фармацевтическая композиция в соответствии с изобретением или для применения в соответствии с настоящим изобретением может быть введена посредством медицинского устройства или приспособления, такого как имплантат, трансплантат, протез, стент и др. Могут быть разработаны имплантаты, которые, как предполагается, содержат и высвобождают такие соединения или композиции. Например, возможен имплантат, изготовленный из полимерного материала, приспособленного для высвобождения соединения в течение некоторого периода времени. Соединение может быть введено отдельно или в виде смеси с фармацевтически приемлемым носителем, например, в виде твердых рецептур, таких как таблетки, капсулы, гранулы, порошки и т.д.; жидких рецептур, таких как сиропы, инъекции и др.; инъекций, капель, свечей, пессарий. В некоторых вариантах осуществления соединения или фармацевтические композиции в соответствии с настоящим изобретением или для применения в соответствии с настоящим изобретением могут быть введены с помощью спрея для ингаляций, назальным, вагинальным, ректальным, подъязычным или топикальным путями, и могут быть приготовлены отдельно или вместе в подходящих дозированных лекарственных формах, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и растворители, соответствующие каждому пути введения.
Соединение настоящего изобретения может быть использовано для лечения животных, включая мышей, крыс, лошадей, крупный рогатый скот, овец, собак, кошек и обезьян. Однако соединение изобретения также может быть использовано в других организмах, таких как пернатые (например, куры). Одно или несколько соединений настоящего изобретения также могут быть эффективны при применении в человеке. Определение «субъект» или, с другой стороны, называемый в данном случае «пациент», как подразумевают, должно относится к животному, предпочтительно млекопитающему, наиболее предпочтительно к человеку, который является объектом лечения, наблюдения или эксперимента. Однако одно или несколько соединений, способов и фармацевтических композиций настоящего изобретения могут быть использованы для лечения животных. Соответственно, как используется в данном случае, «субъектом» может быть человек, нечеловекообразный примат, крыса, мышь, корова, лошадь, свинья, овца, коза, собака, кошка и т.д. Субъект может рассматриваться как имеющий состояние или находящийся в зоне риска появления состояния, требующего модуляции активности O-GlcNAcase.
«Эффективное количество» соединения в соответствии с изобретением включает терапевтически эффективное количество или профилактически эффективное количество. «Терапевтически эффективное количество» означает количество, эффективное при дозировках и в течение периода времени, необходимых для достижения желаемого терапевтического результата, такого как ингибирование O-GlcNAcase, поднятие уровней O-GlcNAc, ингибирование фосфорилирования тау или любого состояния, описанного в изобретении. Терапевтически эффективное количество соединения может меняться в соответствии с факторами, такими как состояние болезни, возраст, пол и вес индивидуума, а также способность соединения вызывать желаемую реакцию индивидуума. Схема приема лекарственного средства может быть подобрана так, чтобы обеспечить оптимальную терапевтическую реакцию. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты соединения перевешиваются терапевтически полезными эффектами. «Профилактически эффективное количество» означает количество, эффективное при дозировках и в течение периода времени, необходимых для достижения желаемого профилактического результата, такого как ингибирование O-GlcNAcase, поднятие уровней O-GlcNAc, ингибирование фосфорилирования тау или любого состояния, описанного в изобретении. Как правило, профилактическую дозу используют в субъекте до или на ранней стадии заболевания, поэтому профилактически эффективное количество может быть меньше терапевтически эффективного количества. Подходящий интервал терапевтически или профилактически эффективного количества соединения может представлять собой любое целое число от 0,1 нМ до 0,1 М, от 0,1 нМ до 0,05 М, от 0,05 нМ до 15 мкМ или 0,01 нМ до 10 мкМ.
В альтернативных вариантах осуществления при лечении или предупреждении состояний, которые требуют модуляции активности O-GlcNAcase, подходящий уровень дозировки обычно будет составлять приблизительно от 0,01 до 500 мг на кг веса тела субъекта в день, и может быть введен в разовых или многократных дозах. В некоторых вариантах осуществления уровень доз будет составлять приблизительно от 0,1 до 250 мг/кг в день. Следует понимать, что конкретный уровень доз и частота дозирования для любого конкретного пациента может быть изменена и будет зависеть от ряда факторов, включающих активность конкретного используемого соединения, метаболическую стабильность и продолжительность действия этого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, схему и время введения, скорость выведения, лекарственную комбинацию, серьезность конкретного состояния и пациента, подвергающегося лечению.
Следует отметить, что величины дозировок могут меняться с серьезностью состояния, которое должно быть облегчено. Для любого конкретного субъекта конкретная схема дозирования может быть подогнана со временем в соответствии с индивидуальной потребностью и профессиональным заключением лица, назначающего или контролирующего введение композиций. Интервалы дозировок, представленные в данном случае, являются только примерными и не ограничивают интервал дозировок, которые могут быть выбраны практикующим врачом. Количество активного(ых) соединения(й) в композиции может меняться в зависимости от таких факторов, как состояние заболевания, возраст, пол и вес субъекта. Схемы дозирования могут быть подогнаны так, чтобы обеспечить оптимальную терапевтическую реакцию. Например, может быть введена одна ударная доза, несколько поделенных доз может быть введено в течение времени, или доза может быть пропорционально уменьшена или увеличена по показаниям потребности терапевтической ситуации. Может быть полезным готовить парентеральные композиции в дозированной стандартной лекарственной форме для простоты введения и равномерности дозирования. В общем случае соединения изобретения должны быть использованы так, чтобы они не вызывали существенной токсичности, и, как описано в данном случае, одно или несколько соединений проявляют приемлемый профиль безопасности для терапевтического применения. Токсичность соединения настоящего изобретения может быть определена с использованием стандартных методик, например, путем тестирования на культурах клеток или подопытных животных и определения терапевтического индекса, то есть, соотношения между LD50 (доза, смертельная для 50% популяции) и LD100 (доза, смертельная для 100% популяции). В некоторых случаях, однако, например, при сильных болезненных состояниях, может быть необходимо введение значительных избытков композиций.
В соединениях общей формулы (I) атомы могут проявлять свои природные изотопные составы, либо один или несколько атомов могут быть искусственно обогащены конкретным изотопом, имеющим такой же атомный номер, но атомную массу или массовый номер, отличные от атомной массы или атомного номера, преимущественно найденного в природе. Настоящее изобретение, как подразумевают, включает все приемлемые изотопные разновидности соединений общей формулы (I). Например, разные изотопные формы водорода (Н) включают протий (1Н), дейтерий (2Н) и тритий (3Н). Протий является основным изотопом водорода, находящимся в природе. Обогащение дейтерием может обеспечить некоторые терапевтические преимущества, такие как повышение in vivo периода полувыведения или снижения требований по дозировке, или может давать соединение, полезное в качестве стандарта для описания биологических образцов. Изотопно-обогащенные соединения в пределах общей формулы (I) могут быть получены без уникальных экспериментов с помощью обычных методик, также известных специалистам в данной области техники, или с помощью способов, аналогичных способам, описанным в схемах и примерах, с использованием соответствующих изотопно-обогащенных реагентов и/или промежуточных соединений.
Другие варианты применения и методы оценки
Соединение формулы (I) может быть использовано при скрининговых исследованиях соединений, которые модулируют активность гликозидазных ферментов, предпочтительно ферментов O-GlcNAcase. Способность испытуемого соединения ингибировать O-GlcNAcase-зависимое отщепление O-GlcNAc от модельного субстрата может быть измерена с использованием любого метода оценки, который описан в данном случае или известен специалисту в данной области техники. Например, может быть использован метод оценки на основе флуоресценции или УФ, известный в данной области техники. «Испытуемое соединение» представляет собой любое существующее в природе или искусственно полученное химическое соединение. Испытуемое соединение может включать, но без ограничения, пептиды, полипептиды, синтезированные органические молекулы, существующие в природе органические молекулы и молекулы нуклеиновой кислоты. Испытуемое соединение может «конкурировать» с известным соединением, таким как соединение формулы (I), например, вмешиваясь в ингибирование O-GlcNAcase-зависимое отщепление O-GlcNAc или вмешиваясь в любую биологическую реакцию, индуцированную соединением формулы (I).
Обычно испытуемое соединение может показывать любое значение между 10% и 200%, или свыше 500% модуляции, при сравнении с соединением формулы (I) или с другим справочным соединением. Например, испытуемое соединение может показывать по меньшей мере любое положительное или отрицательное целое число от 10% до 200% модуляции, или по меньшей мере любое положительное или отрицательное целое число от 30% до 150% модуляции, или по меньшей мере любое положительное или отрицательное целое число от 60% до 100% модуляции, или любое положительное или отрицательное целое число свыше 100% модуляции. Соединение, которое является отрицательным модулятором будет в целом снижать уровень модуляции относительно известного соединения, тогда как соединение, которое является положительным модулятором, будет в целом повышать уровень модуляции относительно известного соединения.
В общем случае испытуемые соединения идентифицируют из больших каталогов природных продуктов и синтетических (или полусинтетических) экстрактов или химических каталогов в соответствии со способами, известными в данной области техники. Специалисту в области поиска и разработки лекарств будет понятно, что точный источник испытуемых экстрактов или соединений не является критическим для способа(ов) изобретения. Соответственно, фактически любое число химических экстрактов или соединений может быть проверено с использованием типичных способов, описанных в изобретении. Примеры таких экстрактов или соединений включают, но не ограничиваются ими, растительные, грибные, прокариотические или животные экстракты, ферментационные бульоны и синтетические соединения, а также модификации существующих соединений. Также доступны многочисленные методы разработки случайного или прямого синтеза (например, полусинтеза или тотального синтеза) любого числа химических соединений, включая, но без ограничения, соединения на основе сахаридов, липидов, пептидов и нуклеиновых кислот. Каталоги синтетических соединений коммерчески доступны. С другой стороны, каталоги природных соединений в форме бактериальных, грибных, растительных и животных экстрактов коммерчески доступны из ряда источников, включая Biotics (Sussex, UK), Xenova (Slough, UK), Harbor Branch Oceanographic Institute (Ft. Pierce, FL, USA) и PharmaMar, MA, USA. Кроме того, природные или синтетически произведенные каталоги получают при необходимости в соответствии со способами, известными в данной области техники, например, путем стандартных методов экстракции или фракционирования. Более того, при необходимости любой каталог или соединение легко модифицируют с использованием стандартных химических, физических или биохимических методов.
Когда сырой экстракт, как установлено, модулирует ингибирование O-GlcNAcase-зависимое отщепление O-GlcNAc или любую биохимическую реакцию, индуцированную соединением формулы (I), дополнительное фракционирование давшего положительный результат экстракта необходимо, чтобы выделить химические составляющие, ответственные за наблюдаемый результат. Таким образом, цель процесса экстракции, фракционирования и очистки состоит в тщательном описании и идентификации химической структурной единицы в сыром экстракте, обладающей O-GlcNAcase-ингибирующей активностью. Такие же методы оценки, как и описанные в данном случае для определения активных компонентов в смесях соединений, могут быть использованы для очистки активного компонента и для испытания его производных. Методы фракционирования и очистки таких гетерогенных экстрактов известны в данной области техники. При необходимости соединения, показавшие, что являются полезными средствами лечения, химически модифицируют в соответствии со способами, известными в данной области техники. Соединения, идентифицированные как имеющие терапевтическое, профилактическое, диагностическое или другое значение, могут быть затем проанализированы с использованием подходящих животных моделей, как это описано в данном случае при рассмотрении известного уровня техники.
В некоторых вариантах осуществления одно или несколько соединений полезны при разработке животных моделей для изучения заболеваний или нарушений, связанных с дефицитом O-GlcNAcase, сверхэкспрессией O-GlcNAcase, накоплением O-GlcNAc, истощением O-GlcNAc, и для изучения лечения заболеваний и нарушений, связанных с дефицитом или срехэкспрессией O-GlcNAcase или с накоплением или истощением O-GlcNAc. Такие заболевания и нарушения включают нейродегенеративные заболевания, в том числе болезнь Альцгеймера, и рак.
Различные альтернативные варианты осуществления и примеры изобретения описаны в настоящем изобретении. Такие варианты осуществления и примеры являются иллюстративными и не должны рассматриваться как ограничивающие объем изобретения.
ПРИМЕРЫ
Приведенные ниже примеры предназначены для иллюстрации вариантов осуществления изобретения и их не следует истолковывать ограничивающим образом.
Сокращения:
ABCN = 1,1’-азобис(циклогексанкарбонитрил)
AcCl = ацетилхлорид
AIBN = азобисизобутиронитрил
BCl3 = трихлорид бора
BnBr = бензилбромид
Bu4NI = иодид тетра-н-бутиламмония
Вос2О = ди-трет-бутилдикарбонат
BzCl = бензоилхлорид
DAST = трифторид диэтиламиносеры
DCM (ДХМ) = дихлорметан
DIPEA = диизопропилэтиламин
DMAP = 4-диметиламинопиридин
(DMF) ДМФА = N,N-диметилформамид
DMP = периодинан Десса-Мартина
(DMSO) ДМСО = диметилсульфоксид
Et3N = триэтиламин
Et2О = диэтиловый эфир
РМВ = пентаметилбензол
TBDMSCl = трет-бутилдиметилсилилхлорид
TBAF = фторид тетра-н-бутиламмония
TMSCF3 = (трифторметил)триметилсилан
TFA (ТФУК) = 2,2,2-трифторуксусная кислота
THF (ТГФ) = тетрагидрофуран
Тио-CDI = 1,1’-тиокарбонилдиимидазол.
Примеры 1 и 2
(3aR,5R,6R,7R,7aR)-7-фтор-5-((S)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5R,6R,7R,7aR)-7-фтор-5-((R)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К суспензии (3aR,5R,6S,7R,7aR)-2-(метиламино)-5- гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диола (8,50 г, 37,0 ммоль) в ДМФА (60 мл) добавляют DIPEA (2,0 мл), Вос2О (23,0 г, 105 ммоль) и МеОН (2,0 мл). Смесь перемешивают при комнатной температуре в течение 3 часов и затем добавляют МеОН (50 мл). Реакционную смесь концентрируют при пониженном давлении при ~35°С. Остаток очищают на силикагеле колоночной флэш-хроматографией (МеОН/ДХМ, 1:8), затем перекристаллизовывают из смеси EtOAc/гексаны, получают трет-бутил-((3aR,5R,6S,7R,7aR)-6,7-дигидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде твердого вещества белого цвета (11,8 г, 96%).
1H ЯМР (400 MГц, CDCl3) δ 6,14 (д, J=6,9 Гц, 1H), 4,20 (д, J=6,4 Гц, 1H), 4,11 (д, J=5,6 Гц, 1H), 3,85-3,70 (м, 2H), 3,63-3,55 (м, 1H), 3,31 (c, 3H), 1,53 (c, 9H).
К раствору описанного выше материала (11,7 г, 35,1 ммоль), DIPEA (10,3 г, 80,0 ммоль) и DMAP (0,040 г, 0,33 ммоль) в ДХМ (180 мл) при 0°С медленно добавляют BzCl (10,1 г, 72,0 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 5 часов. Добавляют насыщенный водный раствор NH4Cl (100 мл) и собирают органический слой. Водный слой дополнительно экстрагируют ДХМ (3×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток разделяют на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:4 до 1:1), получают ((3aR,5R,6S,7R,7aR)-6-(бензоилокси)-2-((трет-бутоксикарбонил)(метил)амино)-7-гидрокси-5,6,7,7а- тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоат в виде твердого вещества белого цвета (4,20 г, 22%).
1H ЯМР (400 MГц, CDCl3) δ 8,01-7,99 (м, 4H), 7,60-7,55 (м, 1H), 7,54-7,50 (м, 1H), 7,45-7,41 (м, 2H), 7,37-7,35 (м, 2H), 6,21 (д, J=7,1 Гц, 1H), 5,23-5,20 (м, 1H), 4,55-4,51 (м, 2H), 4,48-4,42 (м, 2H), 4,15-4,07 (м, 2H), 3,36 (c, 3H), 1,56 (c, 9H).
К раствору описанного выше материала (7,91 г, 14,6 ммоль) в безводном ДХМ (100 мл) при -78°С в атмосфере N2 добавляют DAST (11,8 г, 73,0 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 72 часов. Реакционную смесь затем охлаждают при -78°С, разбавляют ДХМ (100 мл) и затем гасят насыщенным водным раствором NaHCO3 (150 мл). Органический слой собирают, и водный слой экстрагируют ДХМ (2×100 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:4), получают ((3aR,5R,6R,7R,7aR)-6-(бензоилокси)-2-((трет-бутоксикарбонил)(метил)амино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоат в виде твердого вещества белого цвета (6,10 г, 77%).
1H ЯМР (400 MГц, CDCl3) δ 8,01-7,98 (м, 4H), 7,60-7,56 (м, 1H), 7,56-7,52 (м, 1H), 7,45-7,41 (м, 2H), 7,38-7,35 (м, 2H), 6,19 (д, J=7,2 Гц, 1H), 5,52-5,46 (м, 1H), 5,40-5,28 (м, 1H), 4,61-4,56 (м, 1H), 4,52 (дд, J=3,6, 12,0 Гц, 1H), 4,43 (дд, J=5,7, 12,0 Гц, 1H), 4,03-3,99 (м, 1H), 3,36 (c, 3H), 1,56 (c, 9H).
Смесь описанного выше материала (6,10 г, 11,2 ммоль) и К2СО3 (1,00 г, 7,25 ммоль) в безводном МеОН (50 мл) перемешивают при комнатной температуре в течение 3 часов. Добавляют сухой лед и растворитель удаляют при пониженном давлении. Остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (EtOAc/гексаны, от 1:1 до 10:1), получают трет-бутил-((3aR,5R,6R,7R,7aR)-7-фтор-6-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)(метил)карбамат в виде твердого вещества белого цвета (3,25 г, 86%).
1H ЯМР (400 MГц, CDCl3) δ 6,06 (д, J=6,8 Гц, 1H), 5,15 (ддд, J=2,4, 4,4, 45,7 Гц, 1H), 4,46-4,41 (м, 1H), 3,96-3,89 (м, 1H), 3,83 (дд, J=3,2, 11,8 Гц, 1H), 3,73 (дд, J=5,4, 11,8 Гц, 1H), 3,46-3,42 (м, 1H), 3,32 (c, 3H), 1,54 (c, 9H).
При 0°С к раствору описанного выше материала (0,880 г, 2,61 ммоль) и имидазола (0,354 г, 5,20 ммоль) в безводном ДМФА (15 мл) добавляют TBDMSCl (0,452 г, 3,00 ммоль). Смесь перемешивают при комнатной температуре в течение 72 часов и разбавляют Et2O (100 мл) и насыщенным раствором соли (100 мл). Органический слой собирают, и водный слой экстрагируют Et2O (50 мл). Объединенный экстракт промывают Н2О (50 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:3), получают трет-бутил-((3aR,5R,6R,7R,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-6-гидрокси-5,6,7,7а- тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены белого цвета (1,10 г, 93%).
1H ЯМР (400 MГц, CDCl3) δ 6,06 (д, J=6,8 Гц, 1H), 5,19-5,02 (м, 1H), 4,43-4,38 (м, 1H), 3,98-3,93 (м, 1H), 3,85 (дд, J=5,0, 10,6 Гц, 1H), 3,73 (дд, J=5,2, 10,6 Гц, 1H), 3,45-3,43 (м, 1H), 3,34 (c, 3H), 1,54 (c, 9H), 0,89 (c, 9H), 0,08 (c, 6H).
При 0°С к раствору описанного выше материала (1,06 г, 2,25 ммоль) и Bu4NI (0,087 г, 0,24 ммоль) в безводном ДМФА (15 мл) добавляют NaH (60% в минеральном масле, 0,118 г, 2,94 ммоль). После добавления NaH к реакционной смеси добавляют BnBr (0,703 г, 4,11 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов и разбавляют Et2O (60 мл) и насыщенным NH4Cl (50 мл). Органический слой собирают, и водный слой экстрагируют Et2O (2×30 мл). Объединенный экстракт промывают насыщенным раствором соли (40 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:4), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде липкого масла (1,22 г, 96%).
1H ЯМР (400 MГц, CDCl3) δ 7,37-7,27 (м, 5H), 6,10 (д, J=7,0 Гц, 1H), 5,30-5,16 (м, 1H), 4,80 (д, J=11,0 Гц, 1H), 4,55 (д, J=11,0 Гц, 1H), 4,48-4,42 (м, 1H), 3,88-3,80 (м, 1H), 3,78-3,69 (м, 2H), 3,46-3,44 (м, 1H), 3,31 (c, 3H), 1,53 (c, 9H), 0,89 (c, 9H), 0,04 (c, 6H).
При 0°С к раствору описанного выше материала (1,22 г, 2,25 ммоль) в ТГФ (15 мл) добавляют TBAF (1,0 М в ТГФ, 5,0 мл, 5,0 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 часов и разбавляют EtOAc (20 мл) и насыщенным раствором соли (50 мл). Органический слой собирают и водный слой экстрагируют EtOAc (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 1:2), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде твердого вещества белого цвета (0,96 г, 100%).
1H ЯМР (400 MГц, CDCl3) δ 7,37-7,29 (м, 5H), 6,09 (д, J=6,7 Гц, 1H), 5,32 (ддд, J=1,8, 3,6, 45,4 Гц, 1H), 4,80 (д, J=11,6 Гц, 1H), 4,55 (д, J=11,6 Гц, 1H), 4,53-4,48 (м, 1H), 3,81-3,72 (м, 2H), 3,61-3,55 (м, 1H), 3,49-3,45 (м, 1H), 3,31 (c, 3H), 1,53 (c, 9H).
К раствору описанного выше материала (1,50 г, 3,52 ммоль) в ДХМ (40 мл) добавляют DMP (2,20 г, 5,20 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь разбавляют Et2O (20 мл) и затем концентрируют досуха. Добавляют насыщенный водный раствор NaHCO3 (30 мл) с Na2S2O3 (2 г) и смесь экстрагируют EtOAc (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 1:2), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде твердого вещества белого цвета (1,02 г, 68%).
1H ЯМР (400 MГц, CDCl3) δ 9,60 (c, 1H), 7,35-7,29 (м, 5H), 6,12 (д, J=7,0 Гц, 1H), 5,39-5,27 (м, 1H), 4,78 (д, J=11,4 Гц, 1H), 4,66 (д, J=11,4 Гц, 1H), 4,57-4,51 (м, 1H), 4,00-3,95 (м, 2H), 3,31 (c, 3H), 1,53 (c, 9H).
К раствору описанного выше материала (0,150 г, 0,350 ммоль) в безводном ТГФ (10 мл) в атмосфере N2 добавляют MеMgBr (1,4М в смеси ТГФ/толуол, 0,60 мл, 0,84 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 2 часов. Реакцию гасят насыщенным водным раствором NH4Cl (10 мл) и затем смесь экстрагируют EtOAc (3×15 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5((R и S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены не совсем белого цвета (0,115 г, 75%) с диастереомерным соотношением 1:3,2 по данным1Н ЯМР.
К описанному выше материалу (0,115 г, 0,260 ммоль) и РМВ (0,115 г, 0,777 ммоль) в безводном ДХМ (4 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 0,8 мл, 0,8 ммоль). Смесь перемешивают в течение ~3 часов, при этом температура охлаждающей бани поднимается до 0°С. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:12), получают смесь названных соединений в виде твердого вещества бледно-желтого цвета (0,055 г, 85%). Смесь затем разделяют на Agilent 1200 с помощью препаративной ВЭЖХ (колонка, С18, 19×50 мм, 5 мкм; подвижная фаза - вода с 0,03% NH4OH и CH3CN (от 3% до 100% за 15 минут); детектор, 220 нм), получают (3aR,5R,6R,7R,7aR)-7-фтор-5-((S)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (19 мг) и (3aR,5R,6R,7R,7aR)-7-фтор-5-((R)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (5,5 мг), оба в виде твердых веществ белого цвета.
Пример 1:1H ЯМР (400 MГц, CD3OD) δ 6,34 (д, J=6,6 Гц, 1H), 4,83 (тд, J=4,2 Гц, 45,4 Гц, 1H), 4,37-4,31 (м, 1H), 4,00-3,91 (м, 2H), 3,31-3,28 (м, 1H), 2,84 (c, 3H), 1,22 (д, J=6,6 Гц, 1H);13C ЯМР (100 MГц, CD3OD) δ 164,52 (д, J=1,6 Гц), 96,10 (д, J=177,3 Гц), 90,82 (д, J=3,0 Гц), 77,11 (д, J=3,0 Гц), 73,90 (д, J=25,3 Гц), 69,06 (д, J=23,5 Гц), 62,61, 30,63, 19,90; MS, (ES, m/z) [M+H]+ 251,1. Пример 2:1H ЯМР (400 MГц, D2O) δ 6,29 (д, J=6,9 Гц, 1H), 4,83 (тд, J=4,2, 45,4 Гц, 1H), 4,44-4,29 (м, 1H), 4,08-3,91 (м, 1H), 3,89-3,78 (м, 1H), 3,61-3,50 (м, 1H), 2,76 (c, 3H), 1,10 (д, J=6,6 Гц, 3H); MS, (ES, m/z) [M+H]+ 251,1.
Примеры 3 и 4
(3aR,5R,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5R,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К суспензии (3aR,5R,6S,7R,7aR)-2-(этиламино)-5-гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диола (35,0 г, 141 ммоль) в ДМФА (300 мл), охлажденной до 15°С, добавляют DIPEA (6,0 мл), Вос2О (61,5 г, 282 ммоль) и МеОН (6,0 мл). Смесь перемешивают при комнатной температуре в течение 16 часов и затем добавляют МеОН (50 мл). Реакционную смесь концентрируют при пониженном давлении при ~35°С. Остаток очищают на силикагеле колоночной флэш-хроматографией (EtOAc/гексаны, 1:1, затем МеОН/ДХМ, 1:5), затем перекристаллизовывают из смеси EtOAc/гексаны, получают трет-бутил-((3aR,5R,6S,7R,7aR)-6,7-дигидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде твердого вещества белого цвета (31,5 г, выход 64%).
1H ЯМР (400 MГц, CDCl3) δ 6,12 (д, J=6,8 Гц, 1H), 4,23-4,22 (м, 1H), 4,17-4,14 (м, 1H), 3,91-3,86 (м, 2H), 3,81-3,77 (м, 3H), 3,59-3,55 (м, 1H), 3,17-3,16 (м, 1H, OH), 1,53 (c, 9H), 1,16 (т, J=7,0 Гц, 3H).
К раствору описанного выше материала (1,64 г, 4,73 ммоль), DIPEA (1,34 г, 10,4 ммоль) и DMAP (0,010 г, 0,082 ммоль) в ДХМ (50 мл) при 0°С медленно добавляют BzCl (1,33 г, 9,50 ммоль). После добавления смесь перемешивают при комнатной температуре в течение ночи. Добавляют насыщенный водный раствор NH4Cl (50 мл) и собирают органический слой. Водный слой дополнительно экстрагируют ДХМ (2×40 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток разделяют на силикагеле с помощью колоночной флэш-хроматографии (EtOAc/гексаны, от 1:4 до 1:2), получают ((3aR,5R,6S,7R,7aR)-6-(бензоилокси)-2-((трет-бутоксикарбонил)(этил)амино)-7-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоат в виде твердого вещества белого цвета (0,67 г, 26%).
1H ЯМР (400 MГц, CDCl3) δ 8,08 (д, J=8,1 Гц, 4H), 7,57-7,35 (м, 6H), 6,19 (д, J=7,1 Гц, 1H), 5,21 (дд, J=2,8, 9,2 Гц, 1H), 4,56-4,51 (м, 2H), 4,47-4,42 (м, 2H), 4,14-4,10 (м, 1H), 3,99-3,92 (м, 2H), 1,55 (c, 9H), 1,19 (т, J=7,2 Гц, 3H).
К раствору описанного выше материала (3,00 г, 5,39 ммоль) в безводном ДХМ (30 мл) при -78°С в атмосфере N2 добавляют DAST (5,44 г, 33,8 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 48 часов. Реакционную смесь затем охлаждают при -78°С, разбавляют ДХМ (50 мл) и затем гасят насыщенным водным раствором NaHCO3 (70 мл). Органический слой собирают, и водный слой экстрагируют ДХМ (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:4), получают ((3aR,5R,6R,7R,7aR)-6-(бензоилокси)-2-((трет-бутоксикарбонил)(этил)амино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоат в виде твердого вещества белого цвета (2,15 г, 71%).
1H ЯМР (400 MГц, CDCl3) δ 8,00-7,98 (м, 4H), 7,59-7,57 (м, 1H), 7,52-7,48 (м, 1H), 7,43-7,39 (м, 2H), 7,37-7,33 (м, 2H), 6,15 (д, J=7,2 Гц, 1H), 5,51-5,43 (м, 1H), 5,38-5,26 (м, 1H), 4,59-4,55 (м, 1H), 4,50 (дд, J=3,6, 12,0 Гц, 1H), 4,41 (дд, J=5,7, 12,0 Гц, 1H), 4,02-3,92 (м, 3H), 1,56 (c, 9H), 1,19 (т, J=7,0 Гц, 3H).
Смесь описанного выше материала (2,15 г, 3,85 ммоль) и К2СО3 (0,531 г, 3,85 ммоль) в безводном МеОН (40 мл) перемешивают при комнатной температуре в течение 3 часов. Добавляют сухой лед и растворитель удаляют при пониженном давлении. Остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (EtOAc/гексаны, 1:1, затем 10:1), получают трет-бутил-((3aR,5R,6R,7R,7aR)-7-фтор-6-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)(этил)карбамат в виде твердого вещества белого цвета (1,25 г, 93%).
1H ЯМР (400 MГц, CDCl3) δ 6,05 (д, J=6,8 Гц, 1H), 5,24-5,12 (м, 1H), 4,48-4,43 (м, 1H), 3,99-3,82 (м, 4H), 3,73 (дд, J=5,5, 11,4 Гц, 1H), 3,45-3,41 (м, 1H), 1,54 (c, 9H), 1,18 (т, J=7,0 Гц, 3H).
При 0°С к раствору описанного выше материала (1,25 г, 3,58 ммоль) и имидазола (0,488 г, 7,16 ммоль) в безводном ДМФА (25 мл) добавляют TBDMSCl (0,583 г, 3,87 ммоль). Смесь перемешивают при комнатной температуре в течение 72 часов и разбавляют Et2O (100 мл) и насыщенным раствором соли (100 мл). Органический слой собирают и водный слой экстрагируют Et2O (50 мл). Объединенный экстракт промывают Н2О (50 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:3), получают трет-бутил-((3aR,5R,6R,7R,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде бесцветного липкого масла (1,66 г, 100%).
1H ЯМР (500 MГц, CDCl3) δ 6,03 (д, J=6,8 Гц, 1H), 5,10 (ддд, J=2,8, 4,2, 45,5 Гц), 4,43-4,40 (м, 1H), 3,99-3,88 (м, 3H), 3,85 (дд, J=5,0, 10,5 Гц, 1H), 3,71 (дд, J=5,6, 10,5 Гц, 1H), 3,41-3,38 (м, 1H), 2,39 (д, J=5,6 Гц, 1H), 1,54 (c, 9H), 1,17 (т, J=7,0 Гц, 3H), 0,89 (c, 9H), 0,080 (c, 3H), 0,078 (c, 3H).
При 0°С к раствору описанного выше материала (1,63 г, 3,51 ммоль) и Bu4NI (0,13 г, 0,35 ммоль) в безводном ДМФА (15 мл) добавляют NaH (60% в минеральном масле, 0,182 г, 4,56 ммоль). После добавления NaH к реакционной смеси добавляют BnBr (1,20 г, 7,00 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов и разбавляют Et2O (60 мл) и насыщенным NH4Cl (50 мл). Органический слой собирают, и водный слой экстрагируют Et2O (2×30 мл). Органический экстракт промывают насыщенным раствором соли (40 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:4), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде липкого масла (1,90 г, 98%).
1H ЯМР (400 MГц, CDCl3) δ 7,36-7,27 (м, 5H), 6,08 (д, J=7,0 Гц, 1H), 5,31-5,18 (м, 1H), 4,79 (д, J=11,5 Гц, 1H), 4,55 (д, J=11,5 Гц, 1H), 4,49-4,43 (м, 1H), 3,92-3,78 (м, 3H), 3,75 (дд, J=2,2, 11,5 Гц, 1H), 3,70 (дд, J=4,5, 11,5 Гц, 1H), 3,41-3,38 (м, 1H), 1,52 (c, 9H), 1,12 (т, J=7,0 Гц, 3H), 0,88 (c, 9H), 0,038 (c, 3H), 0,036 (c, 3H).
При 0°С к раствору описанного выше материала (1,89 г, 3,41 ммоль) в ТГФ (20 мл) добавляют TBAF (1,0 М в ТГФ, 5,0 мл, 5,0 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 часов и разбавляют EtOAc (20 мл) и насыщенным раствором соли (50 мл). Органический слой собирают и водный слой экстрагируют EtOAc (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 1:2), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5- (гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде твердого вещества белого цвета (1,43 г, 95%).
1H ЯМР (400 MГц, CDCl3) δ 7,38-7,28 (м, 5H), 6,06 (д, J=7,1 Гц, 1H), 5,32 (ддд, J=1,3, 3,1, 45,2 Гц, 1H), 4,79 (д, J=11,6 Гц, 1H), 4,55 (д, J=11,6 Гц, 1H), 4,53-4,48 (м, 1H), 3,91-3,85 (м, 2H), 3,81-3,73 (м, 2H), 3,59-3,55 (м, 1H), 3,46-3,41 (м, 1H), 1,53 (c, 9H), 1,12 (т, J=7,0 Гц, 3H).
К раствору описанного выше материала (0,441 г, 1,00 ммоль) в ДХМ (10 мл) добавляют DMP (0,630 г, 1,49 ммоль). После перемешивания при комнатной температуре в течение 1,5 часа реакционную смесь разбавляют Et2O (20 мл) и затем концентрируют досуха. Добавляют насыщенный водный раствор NaHCO3 (20 мл) с Na2S2O3 (2 г) и смесь экстрагируют EtOAc (2×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 1:2), получают трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде твердого вещества белого цвета (0,36 г, 81%).
1H ЯМР (400 MГц, CDCl3) δ 9,60 (c, 1H), 7,36-7,27 (м, 5H), 6,11 (д, J=7,0 Гц, 1H), 5,39-5,26 (м, 1H), 4,76 (д, J=11,4 Гц, 1H), 4,66 (д, J=11,4 Гц, 1H), 4,57-4,51 (м, 1H), 3,99-3,93 (м, 1H), 3,93-3,91 (м, 1H), 3,89-3,83 (м, 2H), 1,52 (c, 9H), 1,08 (т, J=7,0 Гц, 3H).
К раствору описанного выше материала (0,357 г, 0,85 ммоль) в безводном ТГФ (10 мл) в атмосфере N2 добавляют MеMgBr (1,4М в смеси ТГФ/толуол, 1,4 мл, 2,0 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 2 часов. Реакцию гасят насыщенным водным раствором NH4Cl (10 мл) и затем смесь экстрагируют EtOAc (3×15 мл). Объединенный экстракт сушат над безводным Na2SO4. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 2:3), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((R и S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде пены белого цвета (0,22 г, 60%) с диастереомерным соотношением 1:2,2 по данным1Н ЯМР.
К описанному выше материалу (0,215 г, 0,473 ммоль) и РМВ (0,115 г, 0,777 ммоль) в безводном ДХМ (4 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 0,8 мл, 0,8 ммоль). Смесь перемешивают в течение ~3 часов, при этом температура охлаждающей бани поднимается до 0°С. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. После очистки на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:15) получают смесь названных соединений в виде твердого вещества белого цвета (0,110 г, 88%). Смесь затем разделяют на Agilent 1200 с помощью препаративной ВЭЖХ (колонка, С18, 19×50 мм, 5 мкм; подвижная фаза - вода с 0,03% NH4OH и CH3CN (от 10% до 45% за 10 минут); детектор, 220 нм), получают (3aR,5R,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (45 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, D2O) δ 6,25 (д, J=6,6 Гц, 1H), 4,80 (тд, J=4,2, 45,4 Гц, 1H), 4,43-4,35 (м, 1H), 4,94-3,83 (м, 2H), 3,27 (дд, J=3,9, 9,3 Гц, 1H), 3,19-3,11 (м, 2H), 1,12 (д, J=6,6 Гц, 3H), 1,07 (т, J=7,2 Гц, 3H); MS, (ES, m/z) [M+H]+ 265,0.
Также выделяют (3aR,5R,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (30 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, D2O) δ 6,28 (д, J=6,6 Гц, 1H), 4,80 (тд, J=4,2, 45,4 Гц, 1H), 4,44-4,36 (м, 1H), 4,03-4,00 (м, 1H), 3,98-3,82 (м, 1H), 3,52 (дд, J=3,0, 12,3 Гц, 1H), 3,13-3,20 (м, 2H), 1,11 (д, J=6,9 Гц, 3H), 1,07 (т, J=7,2 Гц, 3H); MS, (ES, m/z) [M+H]+ 265,0.
Примеры 5 и 6
(3aR,5R,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5R,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

При 0°С к раствору (3aR,5R,6S,7R,7aR)-2-(диметиламино)-5-гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диола (5,20 г, 21,0 ммоль) и имидазола (8,0 г, 117 ммоль) в безводном ДМФА (65 мл) добавляют TBDMSCl (10,0 г, 66,3 ммоль). Смесь перемешивают при комнатной температуре в течение 24 часов и разбавляют Et2O (100 мл) и насыщенным раствором соли (100 мл). Органический слой собирают и водный слой экстрагируют Et2O (100 мл). Объединенный экстракт промывают Н2О (100 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 1:1), получают (3aR,5R,6R,7R,7aR)-7-((трет-бутилдиметилсилил)окси)-5-(((трет-бутилдиметилсилил)окси)метил)-2-(диметиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде бесцветного липкого масла (5,95 г, 60%).
1H ЯМР (500 MГц, CDCl3) δ 6,15 (д, J=5,9 Гц, 1H), 4,34-4,33 (м, 1H), 4,21-4,19 (м, 1H), 3,80-3,72 (м, 2H), 3,48-3,47 (м, 1H), 3,01 (c, 6H), 0,897 (c, 9H), 0,893 (c, 9H), 0,124 (c, 3H), 0,120 (c, 3H), 0,068 (c, 6H).
При 0°С к раствору описанного выше материала (5,95 г, 12,5 ммоль) и DMAP (0,10 г, 0,81 ммоль) в пиридине (50 мл) добавляют BzCl (3,00 г, 21,3 ммоль). Смесь перемешивают при комнатной температуре в течение 24 часов и разбавляют EtOAc (100 мл) и насыщенным водным NaHCO3 (100 мл). Органический слой собирают и водный слой экстрагируют EtOAc (100 мл). Объединенный экстракт промывают Н2О (100 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают с гексанами при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:4), получают (3aR,5R,6R,7R,7aR)-7-((трет-бутил-диметилсилил)окси)-5-(((трет-бутилдиметилсилил)окси)метил)-2- (диметиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-илбензоат в виде твердого вещества белого цвета (6,85 г, 88%).
1H ЯМР (400 MГц, CDCl3) δ 8,05-8,02 (м, 2H), 7,56-7,52 (м, 1H), 7,43-7,39 (м, 2H), 6,27 (д, J=6,3 Гц, 1H), 5,06-5,03 (м, 1H), 4,40 (дд, J=2,2, 3,8 Гц, 1H), 4,32-4,30 (м, 1H), 3,82-3,79 (м, 1H), 3,71 (д, J=4,8 Гц, 2H), 3,03 (c, 6H), 0,89 (c, 9H), 0,85 (c, 9H), 0,17 (c, 3H), 0,13 (c, 3H), 0,02 (c, 3H), 0,00 (3H).
В раствор описанного выше материала (9,30 г, 16,0 ммоль) в МеОН (100 мл) барборитуют HCl (газ) в течение 2 минут. Реакционную смесь затем перемешивают при комнатной температуре в течение 2 часов. Растворитель удаляют и остаток нейтрализуют насыщенным водным раствором NаHCO3 (150 мл). Водный слой экстрагируют EtOAс (6×80 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении, получают (3aR,5R,6S,7R,7aR)-2-(диметиламино)-7-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-илбензоат в виде твердого вещества белого цвета (5,4 г, 96%).
1H ЯМР (400 MГц, CDCl3) δ 8,03-8,01 (м, 2H), 7,56-7,53 (м, 1H), 7,44-7,39 (м, 2H), 6,37 (д, J=4,5 Гц, 1H), 5,12-5,09 (м, 1H), 4,41-4,37 (м, 2H), 3,92-3,89 (м, 1H), 3,78-3,73 (м, 1H), 3,69-3,65 (м, 1H), 3,00 (c, 6H).
При 0°С к раствору описанного выше материала (5,35 г, 15,2 ммоль) и DMAP (0,050 г, 0,41 ммоль) в пиридине (50 мл) добавляют BzCl (2,88 г, 15,8 ммоль). Смесь перемешивают при комнатной температуре в течение 4 часов и разбавляют EtOAс (100 мл) и насыщенным водным раствором NaHCO3 (100 мл). Органический слой собирают и водный слой экстрагируют EtOAс (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают с гексанами при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 10:1), получают ((3aR,5R,6S,7R,7aR)-6-(бензоилокси)-2-(диметиламино)-7-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоат в виде твердого вещества белого цвета (4,20 г, 67%).
1H ЯМР (400 MГц, CDCl3) δ 8,04-8,00 (м, 4H), 7,58-7,50 (м, 2H), 7,44-7,37 (м, 4H), 6,38 (д, J=6,6 Гц, 1H), 5,23-5,20 (м, 1H), 4,56 (дд, J=3,2, 12,0 Гц, 1H), 4,48-4,41 (м, 3H), 4,27-4,22 (м, 1H), 3,03 (c, 6H).
Описанный выше материал (0,410 г, 0,898 ммоль) превращают в соответствующий фторид посредством обработки DAST с использованием методики, описанной в примере 3. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:3 до 1:2), получают ((3aR,5R,6R,7R,7aR)-6-(бензоилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоат в виде пены белого цвета (0,380 г, 92%).
1H ЯМР (500 MГц, CDCl3) δ 8,03-8,00 (м, 4H), 7,58-7,55 (м, 1H), 7,44-7,41 (м, 1H), 7,44-7,41 (м, 2H), 7,39-7,36 (м, 2H), 6,36 (д, J=6,8 Гц, 1H), 5,51-5,45 (м, 1H), 5,28-5,19 (м, 1H), 4,69-4,67 (м, 1H), 4,51 (дд, J=3,4, 12,0 Гц, 1H), 4,40 (дд, J=5,9, 12,0 Гц, 1H), 4,13-4,10 (м, 1H), 3,05 (c, 6H).
Описанный выше материал (0,375 г, 0,818 ммоль) подвергают реакции снятия защитной группы с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:12), получают (3aR,5R,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,190 г, 93%).
1H ЯМР (400 MГц, CD3OD) δ 6,35 (д, J=6,7 Гц, 1H), 4,78 (тд, J=5,0 Гц, 48,1 Гц, 1H), 4,34-4,28 (м, 1H), 3,79 (дд, J=2,0, 12,0 Гц, 1H), 3,77-3,64 (м, 2H), 3,61-3,57 (м, 1H), 3,01 (c, 6H).
Описанный выше материал (1,30 г, 5,19 ммоль) превращают в соответствующий простой силильный эфир с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:1), получают (3aR,5R,6R,7R,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (1,84 г, 97%).
1H ЯМР (400 MГц, CDCl3) δ 6,22 (д, J=6,3 Гц, 1H), 5,07 (ддд, J=2,2, 4,2, 45,8 Гц, 1H), 4,52-4,49 (м, 1H), 3,86-3,81 (м, 1H), 3,78 (д, J=4,8 Гц, 2H), 3,50-3,46 (м, 1H), 3,02 (c, 6H), 0,089 (c, 9H), 0,07 (c, 6H).
Описанный выше материал (1,80 г, 4,94 ммоль) защищают бензильной группой, затем простой силильный эфир расщепляют с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 2:3 до 5:1), получают ((3aR,5R,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метанол в виде твердого вещества белого цвета (2,02 г, 91% по двум стадиям).
1H ЯМР (400 MГц, CDCl3) δ 7,37-7,28 (м, 5H), 6,27 (д, J=6,7 Гц, 1H), 5,21 (ддд, J=2,5, 3,9, 46,1 Гц, 1H), 4,82 (д, J=11,6 Гц, 1H), 4,59-4,53 (м, 1H), 3,77-3,69 (м, 2H), 3,66-3,57 (м, 2H), 3,00 (c, 6H).
К раствору ДМСО (0,172 г, 2,20 ммоль) в безводном ДХМ (10 мл) при -78°С в атмосфере N2 медленно добавляют оксалилхлорид (0,261 г, 2,06 ммоль), и смесь перемешивают при ~30°С в течение 45 минут. Смесь затем охлаждают при -78°С и медленно добавляют раствор описанного выше материала (0,290 г, 0,852 ммоль) в безводном ДХМ (5 мл). После перемешивания при ~30°С в течение 2 часов реакционную смесь снова охлаждают при -78°С и добавляют Et2N (0,334 г, 3,31 ммоль). Смесь перемешивают при ~30°С в течение еще 30 минут и затем гасят Н2О (20 мл). Органический слой собирают и водный слой экстрагируют ДХМ (2×10 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении, получают сырой (3aR,5S,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-карбальдегид в виде пены бледно-желтого цвета. В атмосфере N2 полученный альдегид растворяют в безводном ТГФ (20 мл) и добавляют MeMgBr (1,4М в смеси ТГФ/толуол, 1,5 мл, 2,1 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 2 часов. Реакцию гасят насыщенным водным раствором NaHCO3 (20 мл) и затем экстрагируют EtOAc (3×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 2:3 до 5:1), получают смешанные (R и S)-1-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)этанол в виде твердого вещества бледно-желтого цвета (0,24 г, 79%) с диастереомерным соотношением 1:4 по данным1Н ЯМР.
Описанный выше материал (0,240 г, 0,677 ммоль) подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 3. После очистки на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:12) получают смесь названных соединений в виде твердого вещества белого цвета (0,161 г, 90%). Смесь затем разделяют с помощью препаративной, хиральной ВЭЖХ (колонка Chiralpak IC (SFC), 2×25 см, 5 мкм; Chiral-P(IC)002S09IC00CJ-MI001; подвижная фаза, фаза А, гексан; фаза В, этанол с 0,1% DEA (10% этанола, 30 минут); детектор, 220 нм), получают (3aR,5R,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (68 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, D2O) δ 6,24 (д, J=6,9 Гц, 1H), 4,79 (тд, J=4,2, 45,4 Гц, 1H), 4,41-4,36 (м, 1H), 3,93-3,83 (м, 2H), 3,29-3,24 (м, 1H), 2,90 (c, 6H), 1,13 (д, J=6,6 Гц, 3H); MS, (ES, m/z) [M+H]+ 265,0.
Также выделяют (3aR,5R,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (22 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, D2O) δ 6,26 (д, J=6,9 Гц, 1H), 4,78 (тд, J=4,2, 45,4 Гц, 1H), 4,42-4,34 (м, 1H), 3,99-3,95 (м, 1H), 3,89-3,80 (м, 1H), 3,54-3,50 (м, 1H), 2,91 (c, 6H), 1,14 (д, J=6,6 Гц, 3H). MS, (ES, m/z) [M+H]+ 265,0.
Примеры 7 и 8
(3aR,5S,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамата (0,410 г, 0,936 ммоль) и TMSCF3 (0,266 г, 1,87 ммоль) в безводном ТГФ (8 мл) добавляют TBAF (1,0 М в ТГФ, 0,040 мл, 0,040 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют еще одну порцию TBAF (1,0 М в ТГФ, 1,5 мл, 1,5 ммоль) и смесь перемешивают при комнатной температуре еще 16 часов. Реакционный раствор затем разбавляют EtOAc (20 мл) и насыщенным раствором соли (30 мл). Органический слой собирают, и водный слой экстрагируют EtOAc (20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:3), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((R и S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде масла бледно-желтого цвета (0,355 г, 75%) с диастереомерным соотношением 1:1,05 по данным1Н ЯМР.
Описанный выше материал (0,350 г, 0,688 ммоль) подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 3. Очистка и разделение на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:15) дают (3aR,5S,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (0,082 г, 37%) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, CD3OD) δ 6,34 (д, J=6,6 Гц, 1H), 4,93-4,78 (м, 1H), 4,39-4,33 (м, 1H), 4,26-4,20 (м, 1H), 4,07-4,00 (м, 1H), 3,79 (д, J=9,6 Гц, 1H), 3,34-3,23 (м, 2H), 1,18 (т, J=7,2 Гц, 3H);13C ЯМР (100 MГц, CD3OD) δ 163,67, 126,42 (кв, J=281,0 Гц), 96,08 (д, J=777,7 Гц), 90,22 (д, J=1,3 Гц), 73,66 (д, J=25,4 Гц), 71,74-71,67 (м), 69,08 (кв, J=30,3 Гц), 68,00 (д, J=24,1 Гц), 39,77, 14,87; MS, (ES, m/z) [M+H]+ 319,1.
Также выделяют (3aR,5S,6R,7R,7aR)-2-(этиламино)-7-фтор-5- ((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (0,074 г, 34%) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, CD3OD) δ 6,28 (д, J=6,6 Гц, 1H), 4,98-4,84 (м, 1H), 4,49-4,43 (м, 1H), 4,12-4,04 (м, 2H), 3,75 (дд, J=5,4, 8,8 Гц, 1H), 3,34-3,23 (м, 2H), 1,18 (т, J=7,2 Гц, 3H);13C ЯМР (100 MГц, CD3OD) δ 163,43, 126,14 (кв, J=280,8 Гц), 94,24 (д, J=176,5 Гц), 89,42 (д, J=1,4 Гц), 73,84 (д, J=26,3 Гц), 72,91-72,88 (м), 72,10 (кв, J=29,9 Гц), 69,74 (д, J=24,7 Гц), 39,87, 14,93; MS, (ES, m/z) [M+H]+ 319,1.
Приведенные ниже примеры синтезированы в соответствии с методиками, аналогичными методикам, описанным в примерах 7 и 8.
Примеры 11 и 12
(3aR,5S,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

(3aR,5R,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метанол (0,290 г, 0,852 ммоль) подвергают окислению по Сверну, как описано в примере 5, получают сырой (3aR,5S,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-карбальдегид, который обрабатывают TMSCF3, как описано в примере 9. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 2:3 до 4:1), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((R и S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(диметил)карбамат в виде твердого вещества бледно-желтого цвета (0,230 г, 66%) с диастереомерным соотношением 1,4:1 по данным1Н ЯМР.
Описанный выше материал (0,230 г, 0,563 ммоль) подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 3. Очистка и разделение на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:16) дает (3aR,5S,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (0,060 г, 33%) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, CD3OD) δ 6,36 (д, J=6,6 Гц, 1H), 4,84 (тд, J=4,8, 47,8 Гц, 1H), 4,45 (тд, J=4,5, 14,0 Гц, 1H), 4,25-4,19 (м, 1H), 4,05-3,97 (м, 1H), 3,76 (д, J=9,6 Гц, 1H), 3,01 (c, 6H);13C ЯМР (100 MГц, CD3OD) δ 166,08, 126,42 (кв, J=281,1 Гц), 96,22 (д, J=177,9 Гц), 91,23 (д, J=3,5 Гц), 74,13 (д, J=25,3 Гц), 71,87-71,80 (м), 69,04 (кв, J=30,3 Гц), 67,97 (д, J=24,1 Гц), 40,38; MS, (ES, m/z) [M+H]+ 319,1.
Также выделяют (3aR,5S,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (0,074 г, 41%) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, CD3OD) δ 6,32 (д, J=6,4 Гц, 1H), 4,90 (ддд, J=3,2, 4,3, 46,2 Гц, 1H), 4,51-4,45 (м, 1H), 4,14-4,04 (м, 2H), 3,74 (дд, J=4,9, 8,8 Гц, 1H), 3,04 (c, 6H);13C ЯМР (100 MГц, CD3OD) δ 165,93 (д, J=2,7 Гц), 126,13 (кв, J=280,8 Гц), 94,28 (д, J=176,7 Гц), 90,28 (д, J=1,6 Гц), 74,07 (д, J=26,3 Гц), 73,09-73,05 (м), 71,97 (кв, J=29,9 Гц), 69,63 (д, J=24,9 Гц), 40,50; MS, (ES, m/z) [M+H]+319,1.
Примеры 13 и 14
(3aR,5R,6S,7aR)-2-(этиламино)-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5R,6S,7aR)-2-(этиламино)-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол
Смесь ((3aR,5R,6S,7R,7aR)-6-(бензоилокси)-2-((трет-бутоксикарбонил)(этил)амино)-7-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоата (2,60 г, 4,68 ммоль) и тио-CDI (90%, техн., 2,0 г, 10,0 ммоль) в толуоле (60 мл) перемешивают при 95°С в течение 16 часов. После охлаждения растворитель удаляют при пониженном давлении и остаток очищают с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:3 до 2:3), получают (3aR,5R,6S,7R,7aR)-7-((1Н-имидазол-1-карбонотиоил)окси)-5-((бензоилокси)метил)-2-((трет-бутоксикарбонил)(этил)амино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-илбензоат в виде твердого вещества желтого цвета (3,00 г, 96%).
1H ЯМР (400 MГц, CDCl3) δ 8,76 (c, 1H), 8,08-7,94 (м, 4H), 7,70 (c, 1H), 7,57-7,37 (м, 6H), 7,18 (c, 1H), 6,36 (дд, J=1,9, 3,7 Гц, 1H), 6,17 (д, J=7,1 Гц, 1H), 5,54 (тд, J=1,2, 9,2 Гц, 1H), 4,70-4,67 (м, 1H), 4,60 (дд, J=3,2, 12,1 Гц, 1H), 4,42 (дд, J=5,1, 12,1 Гц, 1H), 4,11-4,08 (м, 1H), 4,05-3,97 (м, 2H), 1,56 (c, 9H), 1,22 (т, J=7,2 Гц, 3H).
Смесь описанного выше материала (3,00 г, 4,50 ммоль), гидрида трибутилолова (2,91 г, 10,0 ммоль) и ABCN (0,085 мг, 0,35 ммоль) в смешанной безводной смеси толуол/ТГФ (30/40 мл) перемешивают при кипении с обратным холодильником в течение 4 часов. После охлаждения растворитель удаляют при пониженном давлении и остаток очищают с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:3), получают ((3aR,5R,6S,7aR)-6-(бензоилокси)-2-((трет-бутоксикарбонил)-(этил)амино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоат в виде твердого вещества белого цвета (1,60 г, 66%).
1H ЯМР (400 MГц, CDCl3) δ 8,03-7,94 (м, 4H), 7,57-7,52 (м, 2H), 7,44-7,35 (м, 4H), 6,07 (д, J=7,2 Гц, 1H), 5,44-5,40 (м, 1H), 4,52-4,41 (м, 3H), 4,06-3,96 (м, 3H), 2,70-2,64 (м, 1H), 2,47-2,40 (м, 1H), 1,56 (c, 9H), 1,18 (т, J=7,2 Гц, 3H).
Описанный выше материал (1,6 г, 3,0 ммоль) подвергают реакции снятия бензоильной защитной группы с помощью К2СО3 с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью колоночной флэш-хроматографии (МеОН/ДХМ, 1:20), получают трет-бутил-этил-((3aR,5R,6S,7aR)-6-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)карбамат (0,86 г, 87%) в виде твердого вещества белого цвета.
Описанный выше материал (0,820 г, 2,48 ммоль) защищают с помощью моно-TBDMS с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (ЕtOAc/гексаны, от 1:5 до 1:2) получают трет-бутил-((3aR,5R,6S,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат (0,71 г, 64%) в виде твердого вещества белого цвета.
Описанный выше материал (0,710 г, 2,24 ммоль) защищают бензильной группой с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (ЕtOAc/гексаны, от 1:10 до 1:4) получают трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-(((трет-бутилдиметилсилил)окси)метил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат (0,77 г, 64%) в виде бесцветного липкого масла.
Описанный выше материал (0,770 г, 1,43 ммоль) подвергают реакции снятия защитной силильной группы с помощью TBAF с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (ЕtOAc/гексаны, от 1:5 до 1:1) получают трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде бесцветной липкой пены (0,61 г, 100%).
1H ЯМР (400 MГц, CDCl3) δ 7,33-7,25 (м, 5H), 5,97 (д, J=7,2 Гц, 1H), 4,66 (д, J=11,6 Гц, 1H), 4,38 (д, J=11,6 Гц, 1H), 4,36-4,33 (м, 1H), 3,86 (кв, J=7,0 Гц, 2H), 3,75-3,71 (м, 2H), 3,60-3,56 (м, 1H), 3,60-3,50 (м, 1H), 2,53-2,49 (м, 1H), 2,06-2,01 (м, 1H), 1,90 (т, J=6,7 Гц, 1H), 1,52 (c, 9H), 1,10 (т, J=7,0 Гц, 3H).
При 0°С к смеси описанного выше материала (0,098 г, 0,24 ммоль), бромида тетрабутиламмония (ТВАВ) (5,3 мг, 0,017 ммоль), 2,2,6,6-тетраметилпиперидин-N-оксида (ТЕМРО) (2,6 мг, 0,017 ммоль), NaHCO3 (0,12 г, 1,2 ммоль) в смеси Н2О/ДХМ (3/5 мл) добавляют N-бромсукцинимид (NBS) (0,054 г, 0,30 ммоль). Смесь перемешивают при ~12°С в течение 30 минут и экстрагируют ДХМ (2×10 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:1), получают трет-бутил-((3aR,5S,6S,7aR)-6-(бензилокси)-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде пены не совсем белого цвета (0,075 г, 75%).
1H ЯМР (400 MГц, CDCl3) δ 9,61 (c, 1H), 7,35-7,26 (м, 5H), 6,00 (д, J=7,2 Гц, 1H), 4,67 (д, J=11,6 Гц, 1H), 4,49 (д, J=11,6 Гц, 1H), 4,40-4,37 (м, 1H), 4,01-3,98 (м, 2H), 3,85 (кв, J=7,0 Гц, 2H), 2,62-2,59 (м, 1H), 2,05-2,01 (м, 1H), 1,52 (c, 9H), 1,08(т, J=7,0 Гц, 3H).
Описанный выше материал (0,065 г, 0,15 ммоль) обрабатывают MeMgBr с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 2:3) получают трет- бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-((R и S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде пены белого цвета (0,046 г, 70%) с диастереомерным соотношением 1:1,3 по данным1Н ЯМР.
Описанный выше материал (0,170 г, 0,389 ммоль) подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 3. После очистки на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:14) получают смесь названных соединений в виде твердого вещества белого цвета (0,084 г, 88%). Смесь затем разделяют на Agilent 1200 с помощью препаративной ВЭЖХ (колонка, С18, 19 х 50 мм, 5 мкм; подвижная фаза - вода с 0,03% NH4OH и CH3CN (от 10% до 70% за 8 минут); детектор, 220 нм), получают (3aR,5R,6S,7aR)-2-(этиламино)-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (26 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, D2O) δ 6,20 (д, J=6,3 Гц, 1H), 4,33-4,28 (м, 1H), 3,93-3,85 (м, 2H), 3,40 (дд, J=3,9, 7,8 Гц, 1H), 3,33-3,20 (м, 2H), 2,14-2,04 (м, 2H), 1,20 (д, J=6,6 Гц, 3H), 1,17 (т, J=7,2 Гц, 3H); MS, (ES, m/z) [M+H]+ 247,0.
Также выделяют (3aR,5R,6S,7aR)-2-(этиламино)-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (22 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 MГц, D2O) δ 6,20 (д, J=6,3 Гц, 1H), 4,33-4,31 (м, 1H), 3,95-3,87 (м, 2H), 3,33-3,32 (м, 1H), 3,31-3,19 (м, 2H), 2,12 (т, J=4,8 Гц, 2H), 1,20 (д, J=6,6 Гц, 3H), 1,17 (т, J=7,2 Гц, 3H); MS, (ES, m/z) [M+H]+ 247,0.
Пример 15
(3aR,5R,6R,7R,7aR)-5-этил-7-фтор-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

Диастереомерную смесь трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((R и S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,560 г, 1,27 ммоль), полученную в примере 1, и тио-CDI (90% техн., 0,60 г, 3,3 ммоль) в безводном ДМФА (20 мл) перемешивают при 95°С в течение 5 часов. После охлаждения растворитель удаляют при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:3 до 1:1), получают бледно-желтое липкое масло. Смесь липкого масла, Bu3SnH (0,873 г, 3,00 ммоль) и ABCN (0,030 г, 0,12 ммоль) в безводном ТГФ (20 мл) перемешивают при кипении с обратным холодильником в течение 4 часов. После охлаждения растворитель удаляют при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:4), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-5-этил-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде бесцветного масла (0,28 г, 52%).
1H ЯМР (400 MГц, CDCl3) δ 7,35-7,27 (м, 5H), 6,09 (д, J=7,3 Гц, 1H), 5,32-5,19 (м, 1H), 4,79 (д, J=11,5 Гц, 1H), 4,52 (д, J=11,5 Гц, 1H), 4,50-4,46 (м, 1H), 3,54-3,47 (м, 1H), 3,31 (c, 3H), 3,30-3,26 (м, 1H), 1,76-1,70 (м, 1H), 1,53 (c, 9H), 1,45-1,37 (м, 1H), 0,89 (т, J=7,4 Гц, 3H).
К раствору описанного выше материала (0,280 г, 0,660 ммоль) и PMB (0,30 г, 2,0 ммоль) в безводном ДХМ (10 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 2,5 мл, 2,5 ммоль). Смесь перемешивают в течение ~3 часов, при этом температура охлаждающей бани поднимается до 0°С. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:15) получают (3aR,5R,6R,7R,7aR)-5-этил-7-фтор-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,099 г, 64%).
1H ЯМР (400 MГц, CD3OD) δ 6,30 (д, J=6,6 Гц, 1H), 4,72 (дт, J=4,9, 48,0 Гц, 1H), 4,32-4,25 (м, 1H), 3,57-3,49 (м, 1H), 3,42 (дт, J=2,8, 8,8 Гц, 1H), 2,84 (c, 3H), 1,89-1,82 (м, 1H), 1,50-1,42 (м, 1H), 0,94 (т, J=7,4 Гц, 3H);13C ЯМР (100 MГц, CD3OD) δ 164,64 (д, J=1,3 Гц), 96,39 (д, J=177,2 Гц), 91,16 (д, J=3,7 Гц), 75,20 (д, J=4,7 Гц), 73,79 (д, J=24,7 Гц), 72,94 (д, J=22,3 Гц), 30,53, 26,30, 10,11; MS, (ES, m/z) [M+H]+ 235,1.
Примеры 16 и 17
(3aR,5R,6S,7aR)-5-((S)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5R,6S,7aR)-5-((R)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-
тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

Описанный выше материал, 1-((3aR,5R,6S,7aR)-6-(бензилокси)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)этанол (0,180 г, 0,558 ммоль), подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 20. После очистки на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:12) получают (3aR,5R,6S,7aR)-5-((S)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,105 г, 81%) и в виде смеси диастереомеров.
Диастереомерную смесь, описанную выше, (95 мг, 0,41 ммоль) разделяют препаративной ВЭЖХ при следующих условиях: [(Agilent 1200): Колонка, X-Bridge C18; подвижная фаза, 50 ммоль/л NH4HCO3 в воде с 0,05% NH4OH и CH3CN (CH3CN от 5% и до 20% за 10 минут) детектор, 220 нм, УФ], получают:
(3aR,5R,6S,7aR)-5-((S)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (изомер, элюирующий быстрее, 33,8 мг) в виде твердого вещества белого цвета;
1H ЯМР (300 MГц, D2O) δ 6,12 (д, J=6,6 Гц, 1H), 4,34-4,39 (м, 1H), 3,88-3,94 (м, 1H), 3,77-3,85 (м, 1H), 3,12-3,16 (м, 1H), 2,76 (c, 3H), 2,04-2,08 (м, 2H), 1,12 (д, J=6,6 Гц, 3H).
(3aR,5R,6S,7aR)-5-((R)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (изомер, элюирующий медленнее, 21,7 мг) в виде твердого вещества белого цвета;
1H ЯМР (300 MГц, D2O) δ 6,15 (д, J=6,6 Гц, 1H), 4,36-4,40 (м, 1H), 3,90-3,99 (м, 2H), 3,35-3,39 (м, 1H), 2,78 (c, 3H), 2,01-2,09 (м, 2H), 1,09 (д, J=6,6 Гц, 3H).
Примеры 18 и 19
(3aR,5R,6S,7aR)-2-(диметиламино)-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5R,6S,7aR)-2-(диметиламино)-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол
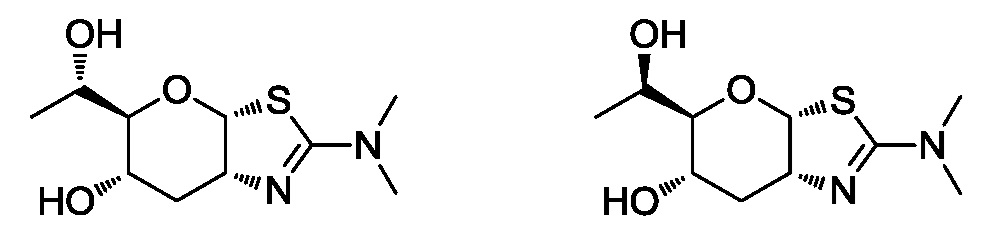
К раствору (3aR,5S,6S,7aR)-6-(бензилокси)-2-(диметиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-карбальдегида (1,04 г) в безводном ТГФ (30 мл) при 0°С добавляют по каплям раствор MeMgBr (1,4М в смеси ТГФ/толуол, 1:3, 5,80 мл, 8,13 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 20 часов. Смесь разбавляют Н2О (50 мл), экстрагируют EtOAс (2×40 мл). Объединенный экстракт сушат над безводным Na2SO4. Растворители упаривают при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, элюируют с помощью 2%-5% 2М NH3 раствора в МеОН в ДХМ, получают 1-((3aR,5R,6S,7aR)-6-(бензилокси)-2-(диметиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)этанол (0,840 г, 77%) в виде пены бледно-желтого цвета. МС m/z: 337,2 (М+1, 100%); Данные спектра1Н ЯМР (400 МГц, CDCl3) показывают, что продукт представляет собой смесь двух диастереомеров с соотношением ~60:40.
К раствору описанного выше материала (0,260 г, 0,774 ммоль) в ДХМ (5 мл) при -78°С добавляют раствор BCl3 в ДХМ (1,0 М, 1,55 мл, 1,55 ммоль). Смесь медленно нагревают до комнатной температуры и перемешивают 17 часов. Реакционную смесь снова охлаждают до -78°С и по каплям добавляют смесь МеОН/ДХМ, 1:1 (2 мл), чтобы погасить реакцию. Растворители упаривают, и остаток обрабатывают три раза МеОН. Сырой продукт очищают колоночной хроматографией на силикагеле, элюируют с помощью 2%-5% 2М раствора NH3 в МеОН в ДХМ, получают (3aR,5R,6S,7aR)-2-(диметиламино)-5-(1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (0,086 г, 45%) в виде твердого вещества белого цвета. МС m/z: 247,1 (М+1, 100%). Данные спектра1Н ЯМР (400 МГц, МеОD) показывают, что продукт представляет собой смесь двух диастереомеров с соотношением ~60:40.
Описанную выше смесь (77,3 мг) разделяют с помощью препаративной ВЭЖХ при следующих условиях: [(Agilent 1200, препаративная ВЭЖХ); Колонка: Sun Fire Prep C18; 19×50 мм, 5 мкм; подвижная фаза: вода с 0,03% NH4OН и CH3CN (5% CH3CN и до 35% за 10 минут) детектор: 220 нм, УФ], получают:
(3aR,5R,6S,7aR)-2-(диметиламино)-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (изомер, элюирующий быстрее) в виде твердого вещества белого цвета (26,3 мг); [M+H]+ 247,1;
1H ЯМР (300 MГц, D2O) δ 6,22 (д, J=6,9 Гц, 1H), 4,43-4,48 (м, 1H), 3,93-3,97 (м, 1H), 3,80-3,85 (м, 1H), 3,16-3,20 (м, 1H), 3,04 (c, 6H), 2,05-2,12 (м, 2H), 1,13 (д, J=6,6 Гц, 3H).
(3aR,5R,6S,7aR)-2-(диметиламино)-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (изомер, элюирующий медленнее) в виде твердого вещества белого цвета 18 мг); [M+H]+ 247,1;
1H ЯМР (300 MГц, D2O) δ 6,23 (д, J=6,9 Гц, 1H), 4,47-4,49 (м, 1H), 3,95-4,05 (м, 1H), 3,91-3,94 (м, 1H), 3,38-3,41 (м, 1H), 3,06 (c, 6H), 1,97-2,12 (м, 2H), 1,08 (д, J=6,3 Гц, 3H).
Примеры 20 и 21
(3aR,5S,6S,7aR)-2-(метиламино)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6S,7aR)-2-(метиламино)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол
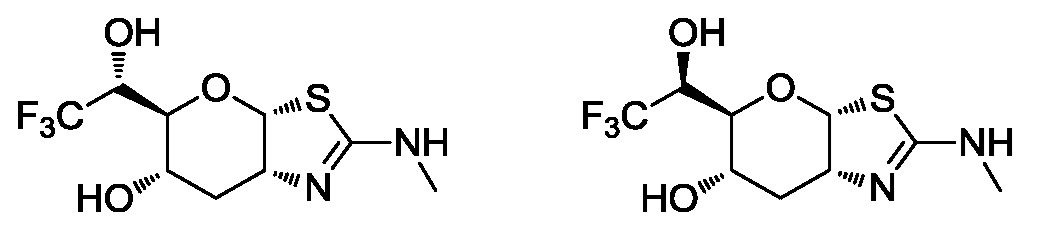
Смесь ((3aR,5R,6S,7R,7aR)-6-(бензоилокси)-2-((трет-бутоксикарбонил)(метил)амино)-7-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоата (5,00 г, 9,21 ммоль) и тио-CDI (90%, техн., 3,40 г, 19,1 ммоль) в безводном ДМФА (30 мл) перемешивают при 95°С в течение 4 часов. После охлаждения растворитель удаляют при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 2:3), получают (3aR,5R,6S,7R,7aR)-7-((1Н-имидазол-1-карбонотиоил)-окси)-5-((бензоилокси)метил)-2-((трет-бутоксикарбонил)-(метил)амино)- 5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-илбензоат в виде твердого вещества бледно-желтого цвета (5,60 г, 93%).
1H ЯМР (400 MГц, CDCl3) δ 8,76 (c, 1H), 8,03-8,01 (м, 2H), 7,97-7,95 (м, 2H), 7,64-7,60 (м, 1H), 7,54-7,50 (м, 1H), 7,45 (т, J=1,1 Гц, 2H), 7,34 (т, J=7,7 Гц, 2H), 7,02 (c, 1H), 6,38-6,37 (м, 1H), 6,15 (д, J=7,1 Гц, 1H), 5,56 (тд, J=1,2, 9,2 Гц, 1H), 4,70-4,67 (м, 1H), 4,58 (дд, J=3,2, 12,1 Гц, 1H), 4,42 (дд, J=5,1, 12,1 Гц, 1H), 4,08-4,03 (м, 1H), 3,43 (c, 3H), 1,56 (c, 9H).
Смесь описанного выше материала (5,60 г, 8,58 ммоль), Bu3SnH (5,84 г, 17,0 ммоль) и ABCN (0,15 г, 0,60 ммоль) в смешанной безводной смеси толуол/ТГФ (50/50 мл) перемешивают при 90°С в течение 16 часов. После охлаждения растворитель удаляют при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают ((3aR,5R,6S,7aR)-6-(бензоилокси)-2-((трет-бутоксикарбонил)-(метил)амино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метилбензоат в виде твердого вещества белого цвета (3,20 г, 71%).
1H ЯМР (400 MГц, CDCl3) δ 8,03-7,98 (м, 4H), 7,58-7,49 (м, 2H), 7,44-7,40 (м, 4H), 6,08 (д, J=7,3 Гц, 1H), 5,44-5,40 (м, 1H), 4,49-4,40 (м, 3H), 4,07-4,03 (м, 1H), 3,35 (c, 3H), 2,64-2,59 (м, 1H), 2,44-2,37 (м, 1H), 1,56 (c, 9H).
Смесь описанного выше материала (3,20 г, 6,08 ммоль) и К2СО3 (0,840 г, 6,08 ммоль) в безводном МеОН (40 мл) перемешивают при комнатной температуре в течение 3 часов. Добавляют сухой лед и растворитель удаляют при пониженном давлении. Остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (МеОН/ДХМ, от 1:50 до 1:20), получают трет-бутил-((3aR,5R,6S,7aR)-6-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде твердого вещества белого цвета (1,82 г, 94%).
1H ЯМР (400 MГц, CDCl3) δ 5,91 (д, J=6,9 Гц, 1H), 4,36-4,32 (м, 1H), 3,89-3,85 (м, 1H), 3,81-3,75 (м, 1H), 3,65-3,59 (м, 1H), 3,38-3,34 (м, 1H), 3,33 (c, 3H), 2,48-2,43 (м, 1H), 2,32 (д, J=10,7 Гц, 1H), 2,17-2,11 (м, 1H), 1,84 (т, J=6,3 Гц, 1H), 1,54 (c, 9H).
При 0°С к раствору описанного выше материала (1,82 г, 5,72 ммоль) и имидазола (1,17 г, 17,2 ммоль) в безводном ДМФА (30 мл) добавляют TBDMSCl (0,952 г, 6,32 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов и разбавляют Et2O (100 мл) и насыщенным раствором соли (100 мл). Органический слой собирают, и водный слой экстрагируют Et2O (50 мл). Объединенный экстракт промывают Н2О (50 мл) сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-((3aR,5R,6S,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде бесцветного липкого масла (2,30 г, 93%).
1H ЯМР (400 MГц, CDCl3) δ 5,92 (д, J=6,8 Гц, 1H), 4,31-4,28 (м, 1H), 3,92-3,90 (м, 1H), 3,73 (д, J=4,6 Гц, 2H), 3,35-3,31 (м, 1H), 3,33 (c, 3H), 2,41 (д, J=9,4 Гц, 1H), 2,41-2,36 (м, 1H), 2,18-2,12 (м, 1H), 1,54 (c, 9H), 0,89 (c, 9H), 0,06 (c, 6H).
При 0°С к раствору описанного выше материала (2,78 г, 6,45 ммоль) и Bu4NI (0,238 г, 0,645 ммоль) в безводном ДМФА (25 мл) добавляют NaH (60% в минеральном масле, 0,335 г, 8,38 ммоль). После добавления NaH к реакционной смеси добавляют BnBr (1,93 г, 11,3 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов и разбавляют Et2O (100 мл) и насыщенным NH4Cl (100 мл). Органический слой собирают и водный слой экстрагируют Et2O (2х40 мл). Объединенный экстракт промывают насыщенным раствором соли (80 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:4), получают трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-(((трет-бутилдиметилсилил)окси)метил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде бесцветного липкого масла (2,76 г, 82%).
1H ЯМР (400 MГц, CDCl3) δ 7,36-7,27 (м, 5H), 6,02 (д, J=7,1 Гц, 1H), 4,67 (д, J=11,6 Гц, 1H), 4,40 (д, J=11,6 Гц, 1H), 4,34-4,30 (м, 1H), 3,83-3,78 (м, 1H), 3,77-3,69 (м, 2H), 3,53-3,50 (м, 1H), 3,29 (c, 3H), 2,44-2,39 (м, 1H), 2,14-2,08 (м, 1H), 1,52 (c, 9H), 0,88 (c, 9H), 0,04 (c, 6H).
При 0°С к раствору описанного выше материала (2,7 г, 5,2 ммоль) в ТГФ (20 мл) добавляют TBAF (1,0 М в ТГФ, 12,0 мл, 12,0 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 часов и разбавляют EtOAc (40 мл) и насыщенным раствором соли (80 мл). Органический слой собирают и водный слой экстрагируют EtOAc (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 1:1), получают трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде бесцветной липкой пены (2,0 г, 94%).
1H ЯМР (400 MГц, CDCl3) δ 7,37-7,27 (м, 5H), 6,01 (д, J=7,2 Гц, 1H), 4,69 (д, J=11,6 Гц, 1H), 4,40 (д, J=11,6 Гц, 1H), 4,36-4,34 (м, 1H), 3,77-3,72 (м, 2H), 3,62-3,54 (м, 2H), 3,30 (c, 3H), 2,53-2,48 (м, 1H), 2,09-2,02 (м, 1H), 1,71 (т, J=6,3 Гц, 1H), 1,53 (c, 9H).
При 0°С к раствору описанного выше материала (0,663 г, 1,62 ммоль) в ДХМ (20 мл) добавляют DMP (1,17 г, 2,76 ммоль). После перемешивания при комнатной температуре в течение 1,5 часа реакционную смесь разбавляют Et2O (30 мл) и затем концентрируют досуха. Добавляют насыщенный водный раствор NaHCO3 (30 мл) с Na2S2O3 (2 г) и смесь экстрагируют EtOAc (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш- хроматографии (EtOAc/гексаны, от 1:10 до 2:3), получают трет-бутил-((3aR,5S,6S,7aR)-6-(бензилокси)-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены белого цвета (0,57 г, 86%).
1H ЯМР (500 MГц, CDCl3) δ 9,63 (c, 1H), 7,36-7,27 (м, 5H), 6,04 (д, J=7,2 Гц, 1H), 4,69 (д, J=11,5 Гц, 1H), 4,50 (д, J=11,5 Гц, 1H), 4,43-4,39 (м, 1H), 4,07 (д, J=8,0 Гц), 4,02-3,99 (м, 1H), 3,29 (c, 3H), 2,64-2,59 (м, 1H), 2,10-2,03 (м, 1H), 1,53 (c, 9H).
К раствору описанного выше материала (0,17 г, 0,42 ммоль) и TMSCF3 (0,12 г, 0,84 ммоль) в безводном ТГФ (6 мл) добавляют TBAF (1,0 М в ТГФ, 0,020 мл, 0,020 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют еще одну порцию TBAF (1,0 М в ТГФ, 0,60 мл, 0,60 ммоль) и смесь перемешивают при комнатной температуре еще 16 часов. Реакционный раствор затем разбавляют EtOAc (20 мл) и насыщенным раствором соли (30 мл). Органический слой собирают и водный слой экстрагируют EtOAc (20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:4 до 1:1), получают трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,060 г, 30%) в виде масла бледно-желтого цвета.
1H ЯМР (400 MГц, CDCl3) δ 7,33-7,27 (м, 5H), 6,01 (д, J=7,4 Гц, 1H), 4,69 (д, J=11,0 Гц, 1H), 4,43-4,35 (м, 2H), 4,08-3,99 (м, 2H), 3,75 (дд, J=5,6, 7,9 Гц, 1H), 3,26 (c, 3H), 2,63-2,57 (м, 1H), 2,09-2,03 (м, 1H), 1,52 (c, 9H).
Также выделяют трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,052 г, 26%) в виде масла бледно-желтого цвета.
1H ЯМР (400 MГц, CDCl3) δ 7,36-7,27 (м, 5H), 6,05 (д, J=7,2 Гц, 1H), 4,79 (д, J=11,5 Гц, 1H), 4,41 (д, J=11,5 Гц, 1H), 4,35-4,31 (м, 1H), 4,03-3,98 (м, 1H), 3,93-3,89 (м, 1H), 3,77 (д, J=8,6 Гц, 1H), 3,29 (c, 3H), 2,45-2,39 (м, 1H), 2,15-2,09 (м, 1H), 1,52 (c, 9H).
К трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,052 г, 0,11 ммоль) и РМВ (0,10 г, 0,67 ммоль) в безводном ДХМ (5 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 0,60 мл, 0,60 ммоль). Смесь перемешивают в течение ~3 часов, при этом температура охлаждающей бани поднимается до 0°С. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:12) получают (3aR,5S,6S,7aR)-2-(метиламино)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,023 г, 74%).
1H ЯМР (400 MГц, CD3OD) δ 6,21 (д, J=6,4 Гц, 1H), 4,29-4,24 (м, 1H), 4,21-4,15 (м, 1H), 4,01-3,96 (м, 1H), 3,70 (д, J=8,8 Гц, 1H), 2,83 (c, 3H), 2,22-2,16 (м, 1H), 2,08-2,01 (м, 1H);13C ЯМР (100 MГц, CD3OD) δ 163,69, 126,47 (кв, J=281,2 Гц), 91,73, 73,5 (шир.), 69,62 (кв, J=30,1 Гц), 69,34, 64,60, 35,16, 30,60; MS, (ES, m/z) [M+H]+ 287,1.
К трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,060 г, 0,13 ммоль) и РМВ (0,10 г, 0,67 ммоль) в безводном ДХМ (4 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 0,60 мл, 0,60 ммоль). Смесь перемешивают в течение ~3 часов, при этом температура охлаждающей бани поднимается до 0°С. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:12), получают (3aR,5S,6S,7aR)-2-(метиламино)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,030 г, 82%).
1H ЯМР (400 MГц, CD3OD) δ 6,15 (д, J=6,5 Гц, 1H), 4,38-4,34 (м, 1H), 4,11-4,07 (м, 1H), 4,05-3,98 (м, 1H), 3,68 (дд, J=5,6, 7,1 Гц), 2,84 (c, 3H), 2,20-2,09 (м, 2H);13C ЯМР (100 MГц, CD3OD) δ 163,99, 126,24 (кв, J=280,7 Гц), 91,08, 75,0 (шир.), 72,12 (кв, J=29,7 Гц), 70,17, 67,00, 33,65, 30,80; MS, (ES, m/z) [M+H]+ 287,1.
Примеры 22 и 23
(3aR,5S,6S,7aR)-2-(диметиламино)-5-((R)-2,2,2-трифтор-1- гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6S,7aR)-2-(диметиламино)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору (3aR,5S,6S,7aR)-6-(бензилокси)-2-(диметиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-карбальдегида (0,650 г) в безводном ТГФ (15 мл) при комнатной температуре добавляют TMSCF3 (0,750 г, 5,08 ммоль), затем TBAF (1,0 М в ТГФ, 0,10 мл, 0,10 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют еще 2,50 мл TBAF (1,0 М в ТГФ) и смесь перемешивают при комнатной температуре в течение 18 часов. Раствор затем разбавляют насыщенным водным NaHCO3 (30 мл), экстрагируют EtOAc (2×20 мл). Объединенный экстракт сушат над безводным Na2SO4. Растворитель упаривают при пониженном давлении и остаток очищают на силикагеле колоночной хроматографией, элюируют с помощью 1%-3% 1М раствора NH3 в МеОН в ДХМ, получают 1-((3aR,5R,6S,7aR)-6-(бензилокси)-2-(диметиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)-2,2,2-трифторэтанол (0,274 г, 35%) в виде пены бледно-желтого цвета. МС m/z: 391,1 (М+1, 100%). Расчетное соотношение двух диастереомеров составляет 70:30 по данным спектра1Н ЯМР (400 МГц, CDCl3).
К раствору описанного выше материала (0,260 г, 0,774 ммоль) в ДХМ (5 мл) при -78°С добавляют раствор BCl3 в ДХМ (1,0 М, 1,34 мл, 1,34 ммоль). Смесь медленно нагревают до комнатной температуры и перемешивают 17 часов. Реакционную смесь снова охлаждают до -78°С и по каплям добавляют смесь МеОН/ДХМ, 1:1 (2 мл), чтобы погасить реакцию. Растворители упаривают и остаток обрабатывают три раза МеОН. Сырой продукт очищают колоночной хроматографией на силикагеле, элюируют с помощью 2%-5% 2М раствора NH3 в МеОН в ДХМ, получают (3aR,5S,6S,7aR)-2-(диметиламино)-5-(2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (0,044 г, 22%) в виде пены бледно-желтого цвета. МС m/z: 301,1 (М+1, 100%). По данным спектра1Н ЯМР (400 МГц, МеОD) расчетное соотношение двух диастереомеров составляет 70:30.
Примеры 24 и 25
(3aR,5S,6R,7R,7aR)-7-фтор-2-(метиламино)-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6R,7R,7aR)-7-фтор-2-(метиламино)-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол
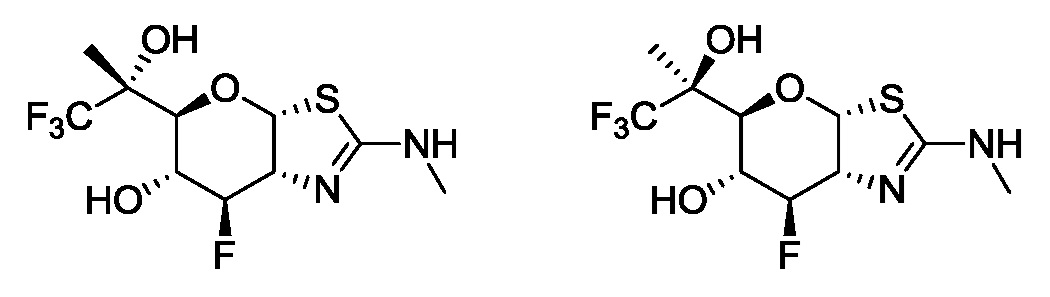
К раствору трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,930 г, 2,19 ммоль) в безводном ТГФ (15 мл) при 0°С в атмосфере N2 добавляют MeMgBr (1,4М в смеси ТГФ/толуол, 3,0 мл, 5,2 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 3 часов. Реакцию гасят с помощью насыщенного водного раствора NaHCO3 (30 мл) и затем экстрагируют EtOAс (3×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворители упаривают при пониженном давлении, остаток растворяют в ДХМ (40 мл) и добавляют Вос2О (2,0 г, 92 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов. После концентрирования остаток очищают с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-(1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены не совсем белого цвета (0,767 г, 80%), которая содержит смесь двух диастереомеров.
Описанный выше материал (0,767 г, 1,74 ммоль) окисляют с помощью DMP с использованием методики, описанной в примере 29. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2) получают трет-бутил-((3aR,5S,6R,7R,7aR)-5-ацетил-6-(бензилокси)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены белого цвета (0,39 г, 51%).
1H ЯМР (400 МГц, CDCl3) δ 7,36-7,27 (м, 5H), 6,14 (д, J=7,2 Гц, 1H), 5,37-5,25 (м, 1H), 4,76 (д, J=11,2 Гц, 1H), 4,65 (д, J=11,2 Гц, 1H), 4,57-4,55 (м, 1H), 4,07-4,00 (м, 1H), 3,86 (д, J=8,5 Гц, 1H), 3,26 (c, 3H), 2,19 (c, 3H), 1,53 (c, 9H).
К описанному выше материалу (0,375 г, 0,856 ммоль) добавляют TMSCF3, как описано в примере 29. Полученную смесь очищают и разделяют на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:20 до 1:4), получают трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,13 г, 30%) в виде пены белого цвета.
1H ЯМР (400 MГц, CDCl3) δ 7,38-7,29 (м, 5H), 6,18 (д, J=7,3 Гц, 1H), 5,55-5,44 (м, 1H), 4,84 (д, J=10,6 Гц, 1H), 4,65-4,62 (м, 1H), 4,49 (д, J=10,6 Гц, 1H), 4,08-4,01 (м, 1H), 3,63 (д, J=8,5 Гц, 1H), 3,32 (c, 3H), 3,14 (c, 1H), 1,53 (c, 9H), 1,32 (c, 3H).
Также выделяют трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,20 г, 46%) в виде пены белого цвета.
1H ЯМР (400 MГц, CDCl3) δ 7,38-7,30 (м, 5H), 6,15 (д, J=7,2 Гц, 1H), 5,57-5,46 (м, 1H), 4,83 (д, J=10,6 Гц, 1H), 4,64-4,62 (м, 1H), 4,52 (д, J=10,6 Гц, 1H), 4,08-4,01 (м, 1H), 3,64 (д, J=8,6 Гц, 1H), 3,34 (c, 3H), 3,00 (c, 1H), 1,54 (c, 9H), 1,34 (c, 3H).
Описанный выше материал, трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,130 г, 0,256 ммоль) подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 20. После очистки на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:15) получают (3aR,5S,6R,7R,7aR)-7-фтор-2-(метиламино)-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,073 г, 90%).
1H ЯМР (400 MГц, CD3OD) δ 6,32 (д, J=6,8 Гц, 1H), 5,04-4,91 (м, 1H), 4,55-4,50 (м, 1H), 4,20-4,13 (м, 1H), 3,61 (д, J=8,5 Гц, 1H), 2,86 (c, 3H), 1,36 (c, 3H);13C ЯМР (100 MГц, CD3OD) δ 164,36 (д, J=2,5 Гц), 127,43 (кв, J=285,3 Гц), 93,67 (д, J=177,4 Гц), 89,21, 75,77 (кв, J=27,0 Гц), 74,71 (д, J=1,4 Гц), 73,70 (д, J=26,7 Гц), 68,14 (д, J=25,0 Гц), 30,90, 18,90 (кв, J=2,1 Гц); MS, (ES, m/z) [M+H]+318,1.
Описанный выше материал, трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,200 г, 0,394 ммоль) подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 20. После очистки на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:15) получают (3aR,5S,6R,7R,7aR)-7-фтор-2-(метиламино)-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,114 г, 91%).
1H ЯМР (400 MГц, CD3OD) δ 6,29 (д, J=6,8 Гц, 1H), 5,05-4,93 (м, 1H), 4,55-4,51 (м, 1H), 4,15-4,08 (м, 1H), 3,73 (д, J=8,6 Гц, 1H), 2,85 (c, 3H), 1,34 (c, 3H);13C ЯМР (100 MГц, CD3OD) δ 164,35 (д, J=2,7 Гц), 127,35 (кв, J=284,3 Гц), 93,14 (д, J=175,8 Гц), 89,65, 75,73 (кв, J=27,3 Гц), 73,40 (д, J=27,2 Гц), 72,90, 68,88 (д, J=25,6 Гц), 30,85, 16,75 (кв, J=1,3 Гц); MS, (ES, m/z) [M+H]+ 318,1.
Примеры 26 и 27
(3aR,5S,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К альдегиду трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамату (0,42 г, 0,96 ммоль) добавляют MeMgBr, как описано в примере 24. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAс/гексаны, от 1:10 до 2:3) получают трет-бутил-(3aR,5R,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-(1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде пены белого цвета (0,30 г, 69%), которая содержит два диастереомера.
Описанный выше материал (0,30 г, 0,66 ммоль) окисляют с помощью DMP с использованием методики, описанной в примере 29. После очистки на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-((3aR,5S,6R,7R,7aR)-5-ацетил-6-(бензилокси)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде прозрачного масла (0,20 г, 67%).
1H ЯМР (400 MГц, CDCl3) δ 7,37-7,27 (м, 5H), 6,14 (д, J=7,2 Гц, 1H), 5,43-5,32 (м, 1H), 4,77 (д, J=11,1 Гц, 1H), 4,65 (д, J=11,1 Гц, 1H), 4,60-4,55 (м, 1H), 4,07-4,00 (м, 1H), 3,92-3,85 (м, 2H), 3,84 (д, J=8,3 Гц, 1H), 2,19 (c, 3H), 1,53 (c, 9H), 1,08 (т, J=7,0 Гц, 3H).
К описанному материалу (0,200 г, 0,442 ммоль) добавляют TMSCF3, как описано в примере 29. Полученную смесь очищают и разделяют на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:20 до 1:4), получают трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат (0,057 г, 25%) в виде пены белого цвета.
1H ЯМР (400 MГц, CDCl3) δ 7,38-7,28 (м, 5H), 6,13 (д, J=7,4 Гц, 1H), 5,45-5,33 (м, 1H), 4,77 (д, J=10,9 Гц, 1H), 4,62-4,58 (м, 1H), 4,52 (д, J=10,9 Гц, 1H), 4,05-3,98 (м, 1H), 3,86-3,81 (м, 2H), 3,58 (д, J=8,7 Гц, 1H), 3,20 (c, 1H), 1,53 (c, 9H), 1,32 (c, 3H), 1,05 (т, J=7,0 Гц, 3H).
Также выделяют трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат (0,10 г, 43%) в виде пены белого цвета.
1H ЯМР (400 MГц, CDCl3) δ 7,36-7,29 (м, 5H), 6,09 (д, J=7,4 Гц, 1H), 5,46-5,34 (м, 1H), 4,78 (д, J=10,9 Гц, 1H), 4,62-4,57 (м, 1H), 4,53 (д, J=10,9 Гц, 1H), 4,06-3,99 (м, 1H), 3,91-3,79 (м, 2H), 3,57 (д, J=8,9 Гц, 1H), 3,15 (c, 1H), 1,53 (c, 9H), 1,34 (c, 3H), 1,06 (т, J=7,0 Гц, 3H).
Описанный выше материал, трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)- 5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат (0,057 г, 0,11 ммоль) подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 20. После очистки на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:17) получают (3aR,5S,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,031 г, 85%).
1H ЯМР (400 MГц, CD3OD) δ 6,30 (д, J=6,8 Гц, 1H), 5,03-4,90 (м, 1H), 4,54-4,49 (м, 1H), 4,20-4,13 (м, 1H), 3,61 (д, J=8,5 Гц, 1H), 3,30-3,22 (м, 2H), 1,36 (c, 3H), 1,17 (т, J=7,2 Гц, 3H);13C ЯМР (100 MГц, CD3OD) δ 163,48 (д, J=1,7 Гц), 127,48 (кв, J=285,5 Гц), 93,70 (д, J=177,4 Гц), 88,94, 75,79 (кв, J=27,0 Гц), 74,76 (д, J=1,4 Гц), 73,79 (д, J=26,7 Гц), 68,15 (д, J=25,1 Гц), 40,02, 18,92 (кв, J=2,2 Гц), 14,95; MS, (ES, m/z) [M+H]+ 333,1.
Описанный выше материал, трет-бутил-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-7-фтор-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат (0,100 г, 0,191 ммоль) подвергают реакции снятия защитной группы с помощью BCl3 с использованием методики, описанной в примере 20. После очистки на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:17) получают (3aR,5S,6R,7R,7aR)-2-(этиламино)-7-фтор-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,053 г, 84%).
1H ЯМР (400 MГц, CD3OD) δ 6,26 (д, J=6,8 Гц,1H), 5,04-4,92 (м, 1H), 4,54-4,50 (м, 1H), 4,15-4,07 (м, 1H), 3,73 (д, J=8,6 Гц, 1H), 3,34-3,21 (м, 2H), 1,33 (c, 3H), 1,17 (т, J=7,2 Гц, 3H);13C ЯМР (100 MГц, CD3OD) δ 163,47 (д, J=2,2 Гц), 127,40 (кв, J=284,2 Гц), 93,11 (д, J=175,6 Гц), 89,36, 75,75 (кв, J=27,3 Гц), 73,50 (д, J=27,2 Гц), 72,90, 68,94 (д, J=25,7 Гц), 39,95, 16,72 (кв, J=1,5 Гц), 14,98; MS, (ES, m/z) [M+H]+ 333,1.
Пример 28
(3aR,5S,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-(1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору ДМСО (0,275 г, 3,50 ммоль) в безводном ДХМ (5 мл) при -78°С в атмосфере N2 по каплям добавляют оксалилхлорид (0,422 г, 3,32 ммоль). Смесь перемешивают при ~30°С в течение 30 минут и снова охлаждают при -78°С. Добавляют раствор (3aR,5R,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)метанола (0,465 г, 1,37 ммоль) в безводном ДХМ (5 мл). После перемешивания при ~30°С в течение 2 часов реакционную смесь снова охлаждают при -78°С и добавляют Et2N (0,624 г, 6,18 ммоль). Смесь перемешивают при ~30°С в течение еще 30 минут и затем гасят Н2О (20 мл). Органический слой собирают, и водный слой экстрагируют ДХМ (2×10 мл). Объединенные экстракты сушат над безводным Na2SO4. Растворитель упаривают при пониженном давлении, получают сырой альдегид. Альдегид очищают на силикагеле с помощью колоночной хроматографии, элюируют с помощью 30%-60% EtOAc в гексанах, получают (3aR,5S,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-карбальдегид (0,190 г, 41%) в виде пены бледно-желтого цвета. МС m/z: 339,1 (М+1, 100%).
К раствору описанного выше альдегида (0,170 г, 0,503 ммоль) в безводном ТГФ (5 мл) при 0°С по каплям добавляют раствор MeMgBr (1,4М в смеси ТГФ/толуол, 1:3, 0,90 мл, 1,26 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Смесь разбавляют Н2О (10 мл) и экстрагируют EtOAc (2×10 мл). Объединенные экстракты сушат над безводным Na2SO4. Растворители упаривают при пониженном давлении и остаток очищают на силикагеле с помощью колоночной хроматографии, элюируют с помощью 1%-2% 2М раствора NH3 в МеОН в ДХМ, получают 1-((3aR,5R,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)этанол (0,115 г, 65%) в виде пены бледно-желтого цвета. МС m/z: 355,2 (М+1, 100%). Данные спектра1Н ЯМР (400 МГц, СDCl3) показывают, что продукт является смесью двух диастереомеров с соотношением ~4:1.
К раствору описанного выше материала (0,110 г, 0,311 ммоль) в сухом ДХМ (3 мл) при 0°С добавляют DMP (0,198 г, 0,467 ммоль). Затем смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь разбавляют насыщенным водным раствором NaHCO3 (10 мл) и 1М Na2S2O3 (3 мл) и экстрагируют ДХМ (2×10 мл). Экстракты сушат над Na2SO4 и растворитель упаривают, получают сырой продукт. Продукт очищают колоночной хроматографией на силикагеле, элюируют с помощью 1% NH4OH в смеси гексаны/EtOAc, 1:1, получают 1-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)этанон (0,0786 г, 72%) в виде пены белого цвета. Этот материал используют непосредственно на следующей стадии без очистки. МС m/z: 353,1 (М+1, 100%).
1H ЯМР (400 MГц, CDCl3) δ 7,28-7,38 (м, 2H), 6,32 (д, J=6,7 Гц, 1H), 5,29 (д, J=44,3 Гц, 1H), 4,81 (д, J=11,3 Гц, 1H), 4,66 (м, 1H), 4,64 (д, J=11,3 Гц, 1H), 3,95-4,03 (м, 2H), 3,01 (c, 6H), 2,16 (c, 3H).
К раствору описанного выше материала (0,074 г, 0,21 ммоль) в безводном ТГФ (4 мл) при комнатной температуре добавляют TMSCF3 (0,075 г, 0,53 ммоль), затем TBAF (1,0 М в ТГФ, 0,03 мл, 0,03 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют еще 0,24 мл TBAF (1,0 М в ТГФ) и смесь перемешивают при комнатной температуре в течение 5 часов. Раствор затем разбавляют насыщенным водным раствором NaHCO3 (10 мл), экстрагируют EtOAc (2×10 мл). Объединенный экстракт сушат над безводным Na2SO4. Растворитель упаривают при пониженном давлении, и остаток очищают на силикагеле колоночной хроматографией, элюируют с помощью 30% EtOAc в гексанах, получают 2-((3aR,5S,6R,7R,7aR)-6-(бензилокси)-2-(диметиламино)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)-1,1,1-трифторпропан-2-ол (0,055 г, 62%) в виде сиропа бледно-желтого цвета. МС m/z: 423,1 (М+1, 100%). Данные спектров1Н ЯМР (400 МГц, CDCl3) показывают, что продукт является смесью двух диастереомеров с соотношением ~56:44.
К раствору описанного выше материала (0,055 г, 0,13 ммоль) в ДХМ (2 мл) при -78°С добавляют раствор BCl3 в ДХМ (1,0 М, 0,16 мл, 0,16 ммоль). Смесь медленно нагревают до комнатной температуры и перемешивают 5 часов. Реакционную смесь снова охлаждают до -78°С и по каплям добавляют смесь МеОН/ДХМ, 1:1 (1 мл), чтобы погасить реакцию. Растворители упаривают, и остаток обрабатывают три раза МеОН. Сырой продукт очищают колоночной хроматографией на силикагеле, элюируют с помощью 30%-100% EtOAc в гексанах, получают (3aR,5S,6R,7R,7aR)-2-(диметиламино)-7-фтор-5-(1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (0,0344 г, 80%) в виде твердого вещества белого цвета. МС m/z: 333,1 (М+1, 100%). Данные спектра1Н ЯМР (400 МГц, МеОD) показывают, что продукт является смесью двух диастереомеров с соотношением ~56:44.
Примеры 29 и 30
(3aR,5S,6S,7aR)-2-(метиламино)-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6S,7aR)-2-(метиламино)-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-((3aR,5S,6S,7aR)-6-(бензилокси)-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)- (метил)карбамата (0,920 г, 2,26 ммоль) в безводном ТГФ (20 мл) при 15°С по каплям добавляют раствор MeMgBr (1,4М в смеси ТГФ/толуол, 4,1 мл, 5,7 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, и затем реакцию гасят с помощью насыщенного водного раствора NaHCO3 (30 мл). Смесь экстрагируют EtOAс (2×30 мл) и объединенные экстракты сушат над безводным Na2SO4. После фильтрования растворители упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (МеОН/ДХМ, от 0:4 до 1:4), получают трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-(1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,350 г, 37%) в виде пены белого цвета. Спектр1Н ЯМР (400 МГц, CDCl3) для данного материала показывает, что он содержит два диастереомера в соотношении 1:2. Также выделяют незащищенный побочный продукт 1-((3aR,5R,6S,7aR)-6-(бензилокси)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-5-ил)этанол (0,300 г, 41%) в виде твердого вещества белого цвета. Спектр1Н ЯМР (400 МГц, CDCl3) данного материала показывает, что он содержит два диастереомера в соотношении 1:1,4.
К раствору трет-бутил-((3aR,5R,6S,7aR)-6-(бензилокси)-5-(1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,406 г, 0,961 ммоль) в сухом ДХМ (20 мл) добавляют DMP (0,615 г, 1,45 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем концентрируют. Остаток разбавляют насыщенным водным раствором NaHCO3 (20 мл) и 1М водным раствором Na2S2O3 (5 мл) и экстрагируют EtOAc (2×20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAс/гексаны, от 1:4 до 2:3), получают трет-бутил-(3aR,5S,6S,7aR)-5-ацетил-6-(бензилокси)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,32 г), который содержит примеси и используется на следующей стадии без дополнительной очистки.
К раствору описанного выше материала и TMSCF3 (0,251 г, 1,77 ммоль) в безводном ТГФ (15 мл) добавляют TBAF (1,0 М в ТГФ, 0,030 мл, 0,030 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют еще одну порцию TBAF (1,0 М в ТГФ, 1,2 мл, 1,2 ммоль) и смесь перемешивают при комнатной температуре еще в течение 3 часов. Реакционный раствор затем разбавляют EtOAc (20 мл) и насыщенным раствором соли (30 мл). Органический слой собирают, и водный слой экстрагируют EtOAc (20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:4 до 1:1), получают трет-бутил-((3aR,5S,6S,7aR)-6-(бензилокси)-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,11 г, 23% по двум стадиям) в виде масла бледно-желтого цвета.
1H ЯМР (400 MГц, CDCl3) δ 7,35-7,27 (м, 5H), 6,06 (д, J=7,7 Гц, 1H), 4,70 (д, J=10,8 Гц, 1H), 4,46-4,42 (м, 1H), 4,32 (д, J=10,8 Гц, 1H), 4,08-4,05 (м, 1H), 3,67 (д, J=7,8 Гц, 1H), 3,26 (c, 3H), 2,70-2,66 (м, 1H), 1,98-1,92 (м, 1H), 1,52 (c, 9H), 1,31 (c, 3H).
Также выделяют трет-бутил-((3aR,5S,6S,7aR)-6-(бензилокси)-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,16 г, 34% по двум стадиям) в виде масла бледно-желтого цвета.
1H ЯМР (400 MГц, CDCl3) δ 7,34-7,27 (м, 5H), 6,05 (д, J=7,6 Гц, 1H), 4,71 (д, J=10,8 Гц, 1H), 4,45-4,42 (м, 1H), 4,35 (д, J=10,8 Гц, 1H), 4,08-4,05 (м, 1H), 3,69 (д, J=8,0 Гц, 1H), 3,27 (c, 3H), 2,71-2,67 (м, 1H), 2,03-1,98 (м, 1H), 1,53 (c, 9H), 1,32 (c, 3H).
Защищенный материал, трет-бутил-((3aR,5S,6S,7aR)-6-(бензилокси)-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,105 г, 0,214 ммоль) подвергают реакции снятия защиты с использованием BCl3, как описано в примере 20. После очистки на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:12) получают (3aR,5S,6S,7aR)-2-(метиламино)-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,051 г, 79%).
1H ЯМР (400 MГц, CD3OD) δ 6,18 (д, J=6,8 Гц, 1H), 4,46-4,42 (м, 1H), 4,20-4,17 (м, 1H), 3,53 (д, J=7,2 Гц, 1H), 2,85 (c, 3H), 2,32-2,27 (м, 1H), 2,09-2,02 (м, 1H), 1,33 (c, 3H);13C ЯМР (100 MГц, CD3OD) δ 164,34, 127,46 (кв, J=285,3 Гц), 91,10, 77,04, 75,83 (кв, J=26,9 Гц), 70,56, 66,52, 33,66, 30,94, 18,67 (кв, J=2,2 Гц); MS, (ES, m/z) [M+H]+ 301,1.
Защищенный материал, трет-бутил-((3aR,5S,6S,7aR)-6-(бензилокси)-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,160 г, 0,326 ммоль) подвергают реакции снятия защиты с использованием BCl3, как описано в примере 20. После очистки на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:12) получают (3aR,5S,6S,7aR)-2-(метиламино)-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,072 г, 73%).
1H ЯМР (400 MГц, CD3OD) δ 6,18 (д, J=6,8 Гц, 1H), 4,44-4,41 (м, 1H), 4,19-4,15 (м, 1H), 3,67 (д, J=7,4 Гц, 1H), 2,85 (c, 3H), 2,29-2,24 (м, 1H), 2,09-2,03 (м, 1H), 1,31 (c, 3H);13C ЯМР (100 MГц, CD3OD) δ 164,14, 127,51 (кв, J=284,3 Гц), 91,42, 75,71 (кв, J=27,0 Гц), 75,53, 70,18, 66,58, 33,47, 30,89, 16,96 (кв, J=1,5 Гц); MS, (ES, m/z) [M+H]+ 301,1.
Приведенные ниже примеры синтезированы в соответствии с методиками, аналогичными схемам и примерам, рассмотренным выше.
Пример 33
(3aR,5R,6R,7R,7aR)-2-амино-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К суспензии гидрохлорида (2S,3R,4R,5S,6R)-6-(ацетоксиметил)-3-аминотетрагидро-2Н-пиран-2,4,5-триилтриацетата (14,0 г, 36,5 ммоль) в MeCN (160 мл) добавляют DIPEA (5,16 г, 40,0 ммоль) и аллилизотиоцианат (7,92 г, 79,9 ммоль). После перемешивания смеси при 80°С в течение 3 часов растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:2 до 2:1), получают белую пену (16,7 г). Пену белого цвета растворяют в ДХМ (120 мл) и добавляют ТФУК (8,5 мл). Смесь перемешивают при комнатной температуре в течение 16 часов и затем концентрируют при пониженном давлении. Остаток разбавляют ДХМ (60 мл) и промывают насыщенным водным раствором NaHCO3 (60 мл). Органический слой собирают и водный слой экстрагируют ДХМ один раз (40 мл). Объединенный органический экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают досуха при пониженном давлении. Остаток растворяют в ДХМ (160 мл) и добавляют Вос2О (21,8 г, 100 ммоль), а также DIPEA (3,0 мл). Смесь перемешивают при комнатной температуре в течение 16 часов. Растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 2:3), получают пену белого цвета. Пену белого цвета растворяют в сухом МеОН (150 мл), куда барботируют NH3 (газ) в течение 5 минут. После перемешивания при комнатной температуре в течение 3 часов смесь концентрируют и остаток очищают перекристаллизацией из смеси МеОН/EtOAc, получают трет-бутил-аллил((3aR,5R,6S,7R,7aR)-6,7-дигидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)карбамат в виде твердого вещества белого цвета (9,02 г, 69% по четырем стадиям).
1H ЯМР (400 MГц, CD3OD) δ 6,12 (д, J=6,2 Гц, 1H), 5,88-5,79 (м, 1H), 5,18-5,12 (м, 2H), 4,54-4,41 (м, 2H), 4,30-4,26 (м, 2H), 3,84 (дд, J=2,8, 11,9 Гц, 1H), 3,74-3,67 (м, 2H), 3,50-3,46 (м, 1H), 2,37 (шир.c, 1H), 2,22 (шир.c, 1H), 2,00 (шир.c, 1H), 1,53 (c, 9H).
К раствору описанного выше материала (7,02 г, 19,4 ммоль), DIPEA (6,29 г, 48,7 ммоль) и DMAP (0,040 г, 0,33 ммоль) в ДХМ (150 мл) при 15°С медленно добавляют BzCl (6,03 г, 42,9 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 5 часов. Добавляют насыщенный водный раствор NH4Cl (40 мл) и органический слой собирают. Экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток разделяют на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 2:3), получают (3aR,5R,6S,7R,7aR)-2-(аллил(трет-бутоксикарбонил)амино)-5-((бензоилокси)метил)-7-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ил)бензоат в виде твердого вещества белого цвета (2,80 г, 25%).
1H ЯМР (400 MГц, CDCl3) δ 8,01-7,99 (м, 4H), 7,59-7,56 (м, 1H), 7,54-7,50 (м, 1H), 7,44-7,40 (м, 2H), 7,39-7,35 (м, 2H), 6,20 (д, J=7,0 Гц, 1H), 5,88-5,81 (м, 1H), 5,17-5,07 (м, 3H), 4,54-4,48 (м, 4H), 4,45-4,40 (м, 2H), 4,12-4,06 (м, 1H), 2,70 (д, J=6,4 Гц, 1H), 1,53 (c, 9H).
К раствору описанного выше материала (2,40 г, 4,22 ммоль) в безводном ДХМ (30 мл) при -78°С в атмосфере N2 добавляют DAST (4,32 г, 2,68 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 2 дней. При -78°С реакционную смесь разбавляют ДХМ (20 мл) и затем реакцию гасят путем добавления по каплям насыщенного водного раствора NaHCO3. Органический слой собирают и водный слой экстрагируют ДХМ (2×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:20 до 1:4), получают (3aR,5R,6R,7R,7aR)-2-(аллил(трет-бутоксикарбонил)-амино)-5-((бензоилокси)метил)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ил)бензоат в виде твердого вещества белого цвета (1,70 г, 70%).
1H ЯМР (400 MГц, CDCl3) δ 8,00-7,98 (м, 4H), 7,60-7,56 (м, 1H), 7,53-7,50 (м, 1H), 7,44-7,40 (м, 2H), 7,38-7,34 (м, 2H), 6,17 (д, J=7,1 Гц, 1H), 5,92-5,82 (м, 1H), 5,46 (дд, J=9,4, 21,3 Гц, 1H), 5,36-5,25 (м, 1H), 5,16-5,08 (м, 2H), 4,59-4,44 (м, 4H), 4,40 (дд, J=6,0, 12,0 Гц, 1H), 3,99-3,95 (м, 1H), 1,53 (c, 9H).
Смесь описанного выше материала (1,70 г, 2,98 ммоль) и К2СО3 (0,40 г, 2,9 ммоль) в безводном МеОН (30 мл) перемешивают при комнатной температуре в течение 3 часов. Добавляют сухой лед и растворитель удаляют при пониженном давлении. Остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (МеОН/ДХМ, 1:20), получают трет-бутил-аллил-((3aR,5R,6R,7R,7aR)-7-фтор-6-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)карбамат в виде твердого вещества белого цвета (1,07 г, 99%).
1H ЯМР (400 MГц, CD3OD) δ 6,12 (д, J=6,6 Гц, 1H), 5,95-5,85 (м, 1H), 5,16-5,10 (м, 2H), 5,00-4,86 (м, 1H), 4,54-4,37 (м) 3H), 3,81-3,73 (м, 2H), 3,60 (д, J=6,0, 12,1 Гц, 1H), 3,39-3,34 (м, 1H), 1,51 (c, 9H).
При 0°С к раствору описанного выше материала (1,06 г, 2,94 ммоль) и имидазола (0,600 г, 8,82 ммоль) в безводном ДМФА (15 мл) добавляют TBDMSCl (0,478 г, 3,17 ммоль). Смесь перемешивают при комнатной температуре в течение 5 часов и разбавляют Et2O (100 мл) и насыщенным раствором соли (100 мл). Органический слой собирают и водный слой экстрагируют Et2O (50 мл). Объединенный экстракт промывают Н2О (50 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-аллил-((3aR,5R,6R,7R,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)карбамат в виде твердого вещества белого цвета (1,36 г, 97%).
1H ЯМР (400 MГц, CDCl3) δ 6,05 (д, J=6,8 Гц, 1H), 5,90-5,80 (м, 1H), 5,18-5,04 (м, 3H), 4,51-4,39 (м, 3H), 3,93-3,84 (м, 1H), 3,81-3,72 (м, 2H), 3,31-3,26 (м, 1H), 2,14 (д, J=8,1 Гц, 1H), 1,53 (c, 9H), 0,89 (c, 9H), 0,07 (c, 6H).
При 0°С к раствору описанного выше материала (0,720 г, 1,51 ммоль) и Bu4NI (0,056 г, 0,151 ммоль) в безводном ДМФА (8 мл) добавляют NaH (60% в минеральном масле, 0,078 г, 1,96 ммоль), а затем добавляют аллилбромид (0,365 г, 3,02 ммоль). Смесь перемешивают при комнатной температуре в течение 5 часов, разбавляют Et2O (50 мл) и промывают насыщенным раствором NаНСО3 (50 мл). Органический слой собирают и водный слой экстрагируют Et2O (30 мл). Органический экстракт промывают насыщенным раствором соли (50 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:20 до 1:4), получают трет-бутил-аллил-((3aR,5R,6R,7R,7aR)-6-(аллилокси)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)карбамат в виде бледно-желтого липкого масла (0,675 г, 87%).
1H ЯМР (400 MГц, CDCl3) δ 6,08 (д, J=7,0 Гц, 1H), 5,93-5,82 (м, 2H), 5,30-5,08 (м, 5H), 4,46-4,40 (м, 3H), 4,22 (дд, J=5,3, 12,6 Гц, 1H), 4,03 (дд, J=5,8, 12,6 Гц, 1H), 3,80-3,70 (м, 3H), 3,39-3,35 (м, 1H), 1,51 (c, 9H), 0,89 (c, 9H), 0,05 (c, 6H).
При 0°С к раствору описанного выше материала (0,675 г, 1,31 ммоль) в ТГФ (10 мл) добавляют TBAF (1,0 М в ТГФ, 2,5 мл, 2,5 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 часов и разбавляют EtOAc (30 мл) и насыщенным раствором соли (30 мл). Органический слой собирают и водный слой экстрагируют EtOAc (20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 1:2), получают трет-бутил-аллил-((3aR,5R,6R,7R,7aR)-6-(аллилокси)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2- ил)карбамат в виде бесцветного масла (0,53 г, 100%).
1H ЯМР (400 MГц, CDCl3) δ 6,07 (д, J=7,1 Гц, 1H), 5,92-5,82 (м, 2H), 5,31-5,10 (м, 5H), 4,52-4,40 (м, 3H), 4,22 (дд, J=5,2, 12,6 Гц, 1H), 4,03 (дд, J=5,9, 12,6 Гц, 1H), 3,82-3,77 (м, 1H), 3,74-3,61 (м, 2H), 3,42-3,38 (м, 1H), 1,52 (c, 9H).
При 0°С к раствору описанного выше материала (0,53 г, 1,3 ммоль) в ДХМ (25 мл) добавляют DMP (0,81 г, 1,9 ммоль). После перемешивания при комнатной температуре в течение 1,5 часа реакционную смесь разбавляют Et2O (30 мл) и затем концентрируют досуха. Добавляют насыщенный водный раствор NaHCO3 (30 мл) с Na2S2O3 (2 г) и смесь экстрагируют EtOAc (2×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:4 до 2:3), получают соответствующий альдегид в виде бесцветного масла (0,47 г). К этому материалу в безводном ТГФ (15 мл) при 0°С добавляют раствор MeMgBr (1,4М в смеси ТГФ/толуол, 2,5 мл, 3,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем реакцию гасят с помощью насыщенного раствора NaHCO3 (30 мл). Смесь экстрагируют EtOAс (2×30 мл) и объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворители упаривают при пониженном давлении и остаток очищают с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-аллил-((3aR,5R,6R,7R,7aR)-6-(аллилокси)-7-фтор-5-(1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН- пирано[3,2-d]тиазол-2-ил)карбамат (0,29 г, 53%) в виде смеси двух диастереомеров в соотношении 2,6:1, как показывают данные1Н ЯМР.
В атмосфере Ar к описанному выше материалу (0,168 г, 0,403 ммоль) в 1,4-диоксане (10 мл) добавляют Et3N (0,164 г, 1,62 ммоль), НСООН (0,118 г, 2,43 ммоль). В раствор барботируют Ar в течение 30 секунд и добавляют Pd(PPh3)4 (0,187 г, 0,162 ммоль). После перемешивания при 60°С в течение 16 часов реакционную смесь концентрируют и остаток очищают с помощью автоматической колоночной флэш-хроматографии (МеОН/ДХМ, от 1:40 до 1:20), получают трет-бутил-((3aR,5R,6R,7R,7aR)-7-фтор-6-гидрокси-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)карбамат в виде твердого вещества не совсем белого цвета (0,083 г, 85%).
1H ЯМР (400 MГц, CD3OD) δ 6,21 (д, J=7,1 Гц, 1H), 4,90 (тд, J=3,8, 46,7 Гц, 1H), 4,35-4,31 (м, 1H), 4,01-3,90 (м, 2H), 3,14 (дд, J=3,0, 9,6 Гц, 1H), 1,49 (c, 9H), 1,22 (д, J=6,6 Гц, 1H);13C ЯМР (100 MГц, CD3OD) δ 162,83, 155,73, 94,85 (д, J=177,4 Гц), 87,24 (д, J=1,4 Гц), 82,88, 77,22 (д, J=3,3 Гц), 69,29 (д, J=27,8 Гц), 68,92 (д, J=24,1 Гц), 67,08, 28,54, 19,77; MS, (ES, m/z) [M+Na]+ 359,1.
В раствор описанного выше материала (0,0562 г, 0,167 ммоль) в сухом МеОН (5 мл) барботируют HCl (газ) в течение 30 секунд. После перемешивания при комнатной температуре в течение 5 часов реакционную смесь концентрируют досуха. Остаток нейтрализуют с помощью 1,0 М раствора NH3 в МеОН и очищают на силикагеле с помощью колоночной флэш-хроматографии (1,0 М раствор NH3 в смеси МеОН/ДХМ, 1:5), получают (3aR,5R,6R,7R,7aR)-2-амино-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде почти белого твердого вещества (0,0387 г, 98%).
1H ЯМР (400 MГц, CD3OD) δ 6,36 (д, J=7,0 Гц, 1H), 4,85 (тд, J=4,2, 47,1 Гц, 1H), 4,38-4,32 (м, 1H), 4,00-3,92 (м, 2H), 3,28 (дд, J=2,7, 9,3 Гц, 1H), 1,21 (д, J=6,6 Гц, 1H);13C ЯМР (100 MГц, CD3OD) δ 165,10 (д, J=2,3 Гц), 95,64 (д, J=177,3 Гц), 91,13 (д, J=2,5 Гц), 77,17 (д, J=3,8 Гц), 73,41 (д, J=26,0 Гц), 69,02 (д, J=23,8 Гц), 66,73, 19,88; MS, (ES, m/z) [M+H]+ 237,1.
Пример 34
(3aR,5R,6R,7S,7aR)-7-фтор-5-((S)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол
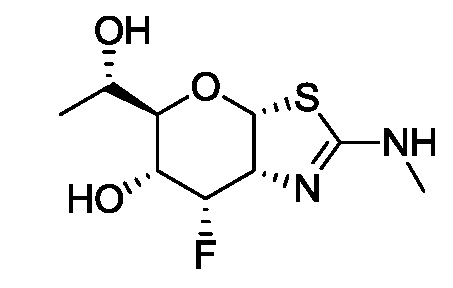
При 0°С к раствору трет-бутил-((3aR,5R,6R,7R,7aR)-7-фтор-6-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (9,00 г, 26,8 ммоль) и имидазола (9,09 г, 133 ммоль) в безводном ДМФА (60 мл) добавляют TBDMSCl (14,1 г, 93,5 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов, разбавляют Et2O (200 мл) и насыщенным раствором соли (2×100 мл). Органический слой собирают и водный слой экстрагируют Et2O (2×00 мл). Объединенный экстракт промывают насыщенным раствором соли (100 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 0 до 1:6), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-((трет-бутилдиметилсилил)окси)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде бесцветного масла (16,0 г, 100%).
1H ЯМР (400 MГц, CDCl3) δ 6,10 (д, J=6,9 Гц, 1H), 4,89 (тд, J=4,3, 47,3 Гц, 1H), 4,38-4,31 (м, 1H), 4,01-3,93 (м, 1H), 3,81-3,70 (м, 2H), 3,41-3,37 (м, 1H), 3,32 (c, 3H), 1,53 (c, 9H), 0,89 (c, 18H), 0,144 (c, 3H), 0,087 (c, 3H), 0,048 (c, 6H).
При 0°С к раствору описанного выше материала (16,0 г) в смешанных ДХМ/МеОН (100 мл, 1:4) добавляют AcCl (0,32 г, 4,1 ммоль). После перемешивания смеси при комнатной температуре в течение 24 часов добавляют порошок NaHCO3 (1 г) и суспензию перемешивают 30 минут. Затем упаривают растворитель при пониженном давлении и остаток растворяют в ДХМ (100 мл) и промывают насыщенным водным раствором NaHCO3 (50 мл). Органический слой собирают и водный слой экстрагируют ДХМ (2×80 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования фильтрат обрабатывают Вос2О (4,0 г, 18 ммоль) в течение 3 часов. Затем растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:3), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-((трет-бутилдиметилсилил)окси)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены белого цвета (11,6 г, 96%).
1H ЯМР (400 MГц, CDCl3) δ 6,10 (д, J=7,1 Гц, 1H), 4,99 (ддд, J=2,7, 4,1, 46,0 Гц, 1H), 4,46-4,40 (м, 1H), 3,96-3,88 (м, 1H), 3,78 (дд, J=2,3, 11,8 Гц, 1H), 3,62 (дд, J=5,2, 11,8 Гц, 1H), 3,46-3,41 (м, 1H), 3,32 (c, 3H), 1,54 (c, 9H), 0,89 (c, 9H), 0,16 (c, 3H), 0,09 (c, 3H).
К раствору описанного выше материала (11,3 г, 25,1 ммоль) в ДХМ (200 мл) при 0°С добавляют DMP (14,8 г, 34,9 ммоль). После перемешивания при комнатной температуре в течение 2 часов реакционный раствор концентрируют при комнатной температуре приблизительно до 100 мл и затем разбавляют Et2O (300 мл). Полученную суспензию фильтруют через слой целита и фильтрат концентрируют досуха при комнатной температуре. Остаток экстрагируют Et2O (200 мл) и твердое вещество отфильтровывают. Эфирный раствор промывают насыщенным водным раствором NaHCO3 (200 мл) и водный слой экстрагируют Et2O (2×50 мл). Объединенный экстракт сушат над безводным MgSO4. После фильтрования растворитель упаривают при пониженном давлении, получают сырой трет-бутил-((3aR,5R,6R,7R,7aR)-6-((трет-бутилдиметилсилил)окси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (11,8 г). Этот сырой материал используют на следующей стадии без дополнительной очистки.
К раствору описанного выше материала (11,8 г) в безводном ТГФ (200 мл) в атмосфере N2 при 0°С добавляют MеMgBr (1,4М в смеси ТГФ/толуол, 42,0 мл, 58,8 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 2 часов. Реакцию гасят насыщенным водным раствором NаHCO3 (200 мл) и реакционную смесь экстрагируют EtOAc (200 мл) и ДХМ (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении. Остаток растворяют в ДХМ (100 мл) и обрабатывают Вос2О (3 г) в течение 3 часов. Растворитель затем упаривают при пониженном давлении и остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (EtOAc/гексаны, от 0 до 1:4), получают трет-бутил-((3aR,5R,6R,7R,7aR)-6-((трет-бутилдиметилсилил)окси)-7-фтор-5-(1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде смеси двух диастереомеров (6,60 г, 57% по двум стадиям).
К раствору описанного выше материала (6,60 г, 14,2 ммоль) в безводном ТГФ (80 мл) при 0°С добавляют TBAF (1,0 М в ТГФ, 28,0 мл, 28,0 ммоль). Смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь разбавляют насыщенным раствором соли (100 мл) и затем экстрагируют EtOAc (3×80 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью колоночной хроматографии (EtOAc/гексан/25% ДХМ, от 1:2 до 1:1), получают трет-бутил-((3aR,5R,6R,7R,7aR)-7-фтор-6-гидрокси-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (3,77 г, 76%).
1H ЯМР (400 MГц, CDCl3) δ 6,09 (д, J=6,9 Гц, 1H), 5,24-5,12 (м, 1H), 4,48-4,43 (м, 1H), 3,97-3,87 (м, 2H), 3,34 (c, 3H), 3,15 (дд, J=5,0, 8,0 Гц, 1H), 2,12 (шир.c, 2H, (OH)), 1,55 (c, 9H), 1,26 (д, J=6,5 Гц, 3H).
При 0°С к раствору описанного выше материала (0,930 г, 2,65 ммоль) и имидазола (0,726 г, 10,7 ммоль) в безводном ДМФА (20 мл) добавляют TBDMSCl (0,502 г, 3,33 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов, разбавляют Et2O (100 мл) и промывают насыщенным раствором соли (2×100 мл). Органический слой собирают и водный слой экстрагируют Et2O (50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 0 до 1:3), получают трет-бутил-((3aR,5S,6R,7R,7aR)-5-((S)-1-((трет-бутилдиметилсилил)окси)этил)-7-фтор-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены белого цвета (0,919 г, 75%).
1H ЯМР (500 MГц, CDCl3) δ 6,09 (д, J=6,9 Гц, 1H), 5,04 (тд, J=4,0, 46,8 Гц, 1H), 4,41-4,36 (м, 1H), 4,08-4,03 (м, 2H), 3,32 (c, 3H), 3,32-3,30 (м, 1H), 2,64 (шир.c, 1H, (OH)), 1,54 (c, 9H), 1,20 (д, J=6,4 Гц, 3H), 0,89 (c, 9H), 0,087 (c, 3H), 0,083 (c, 3H).
К раствору описанного выше материала (0,900 г, 1,94 ммоль) в ДХМ (30 мл) добавляют DMP (1,23 г, 2,91 ммоль). После перемешивания при комнатной температуре в течение 45 минут реакционную смесь разбавляют Et2O (100 мл). Полученную суспензию фильтруют через слой целита и фильтрат концентрируют досуха при комнатной температуре. Остаток загружают на слой силикагеля и продукт элюируют с помощью смеси EtOAc/гексаны, 1:4, получают трет-бутил-((3aR,5R,6R,7R,7aR)-5-((S)-1-((трет-бутилдиметилсилил)окси)этил)-7-фтор-6-оксо-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены белого цвета (0,90 г, 100%).
1H ЯМР (400 MГц, CDCl3) δ 6,47 (д, J=6,9 Гц, 1H), 5,11 (дд, J=5,5, 48,4 Гц, 1H), 4,68-4,61 (м, 1H), 4,54-4,49 (м, 1H), 3,90-3,89 (м, 1H), 3,32 (c, 3H), 1,54 (c, 9H), 1,26 (д, J=6,5 Гц, 3H), 0,84 (c, 9H), 0,074 (c, 3H), 0,043 (c, 3H).
К раствору описанного выше материала (0,900 г, 1,94 ммоль) в сухом МеОН (25 мл) добавляют NaH (60% в минеральном масле, 0,0155 г, 0,388 ммоль) и смесь перемешивают при комнатной температуре в течение 10 минут (контроль с помощью ТСХ). Реакционную смесь затем охлаждают при 0°С и добавляют NaBH4 (0,140 г, 3,70 ммоль). После перемешивания смеси при 0°С в течение 20 минут добавляют крошку сухого льда и растворитель упаривают. Остаток растворяют в ДХМ (50 мл) и промывают насыщенным водным раствором NH4Cl (50 мл). Органический слой собирают, и водный слой экстрагируют ДХМ (2×20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 2:5), получают трет-бутил-((3aR,5S,6R,7S,7aR)-5-((S)-1-((трет-бутилдиметилсилил)окси)-этил)-7-фтор-6-гидрокси-5,6,7,7а- тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены белого цвета (0,793 г, 88%).
1H ЯМР (500 MГц, CDCl3) δ 6,11 (д, J=6,9 Гц, 1H), 4,99 (тд, J=4,3, 47,2 Гц, 1H), 4,48-4,42 (м, 1H), 4,15-4,09 (м, 1H), 4,02-3,96 (м, 1H), 3,48-3,45 (м, 1H), 3,37 (c, 3H), 2,80 (шир.c, 1H, (OH)), 1,55 (c, 9H), 1,22 (д, J=6,4 Гц, 3H), 0,89 (c, 9H), 0,084 (c, 3H), 0,075 (c, 3H).
В раствор описанного выше материала (0,780 г, 1,68 ммоль) в сухом МеОН (20 мл) барботируют HCl (газ) в течение 30 секунд. Смесь перемешивают при комнатной температуре в течение 6 часов. После упаривания растворителя при пониженном давлении остаток нейтрализуют с помощью 1,0 М раствора NH3 в МеОН и очищают на силикагеле с помощью колоночной флэш-хроматографии (1,0 М раствор NH3 в смеси МеОН/ДХМ, 1:10), получают (3aR,5R,6R,7S,7aR)-7-фтор-5-((S)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,410 г, 98%).
1H ЯМР (500 MГц, CD3OD) δ 6,41 (д, J=6,7 Гц, 1H), 4,84 (тд, J=3,6 Гц, 50,1 Гц, 1H), 4,40-4,34 (м, 1H), 4,04-3,93 (м, 2H), 3,60 (дд, J=2,7, 8,6 Гц, 1H), 2,86 (c, 3H), 1,22 (д, J=6,6 Гц, 1H);13C ЯМР (100 MГц, CD3OD) δ 165,56, 91,07 (д, J=183,5 Гц), 90,92 (д, J=4,4 Гц), 76,33 (д, J=3,2 Гц), 71,56 (д, J=16,2 Гц), 67,39 (д, J=17,2 Гц), 66,88, 30,58, 19,70; MS, (ES, m/z) [M+H]+ 251,1.
Пример 35
(3aR,5R,6R,7S,7aR)-7-фтор-5-((R)-1-гидроксиэтил)-2- (метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-((3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,35 г, 0,83 ммоль) в безводном ТГФ (15 мл) при 0°С и в атмосфере N2 добавляют MeMgBr (1,4М в смеси ТГФ/толуол, 3,0 мл, 4,2 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 2 часов. Реакцию гасят с помощью насыщенного водного раствора NaHCO3 (30 мл) и затем экстрагируют EtOAс (30 мл) и ДХМ (3×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворители упаривают при пониженном давлении и остаток сушат при высоком вакууме. К остатку и PMB (0,50 г, 3,4 ммоль) в сухом ДХМ (8 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 3,0 мл, 3,0 ммоль). Смесь перемешивают в течение ~3 часов, при этом температуру охлаждающей бани медленно повышают до комнатной температуры. Реакционную смесь охлаждают до -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (1,0 М NH3 в МеОН/ДХМ, 1:10), получают (3aR,5R,6R,7S,7aR)-7-фтор-5-((R)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,039 г, 19%).
1H ЯМР (400 MГц, CD3OD) δ 6,40 (д, J=6,7 Гц, 1H), 4,78 (тд, J=3,6, 49,3 Гц, 1H), 4,40 (ддд, J=3,6, 6,6, 18,0 Гц, 1H), 4,00-3,89 (м, 2H), 3,79 (дд, J=3,2, 8,0 Гц, 1H), 2,86 (c, 3H), 1,19 (д, J=6,6 Гц, 1H);13C ЯМР (100 MГц, CD3OD) δ 165,99, 91,11 (д, J=5,31 Гц), 90,74 (д, J=184,1 Гц), 76,85 (кв, J=3,7 Гц), 71,64 (д, J=16,4 Гц), 68,64, 68,22 (д, J=16,9 Гц), 30,55, 17,74; MS, (ES, m/z) [M+H]+ 251,1.
Примеры 36 и 37
(3aR,5R,6R,7S,7aR)-2-(этиламино)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5R,6R,7S,7aR)-2-(этиламино)-7-фтор-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-((3aR,5R,6R,7S,7aR)-6-(трет-бутилдиметилсилилокси)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамата (600 мг, 1,3 ммоль) в ДХМ (30 мл) добавляют DMP (806 мг, 1,9 ммоль) при 0°С. После перемешивания при комнатной температуре в течение 2 часов реакцию гасят смешанным насыщенным водным раствором NaHCO3 (20 мл) и Na2S2O3 (20 мл). Полученный раствор экстрагируют ДХМ (3х30 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, получают сырой альдегид. Альдегид растворяют в ТГФ (30 мл), обрабатывают MeMgCl (3М в ТГФ, 1,1 мл, 3,3 ммоль) при 0 - ~25°С в течение 3 часов. Затем реакцию гасят Н2О (50 мл) и экстрагируют EtOAc (3×40 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают на колонке силикагеля, элюируют 3%-30% EtOAc в петролейном эфире, получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(трет-бутилдиметилсилилокси)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамата в виде масла желтого цвета (355 мг, 57% по двум стадиям).
(ES, m/z) [M+H]+ 479,0;1H ЯМР (300 MГц, CDCl3) δ 6,20-6,14 (м, 1H), 4,95-4,65 (м, 1H), 4,44-4,25 (м, 2H), 4,08-3,79 (м, 4H), 1,51 (c, 9H), 1,25-1,14 (м, 6H), 0,87 (c, 9H), 0,12-0,06 (м, 6H).
Раствор описанного выше материала (350 мг, 0,73 ммоль) в МеОН (насыщен НСl-газом) (10 мл) перемешивают в течение 3 часов при комнатной температуре. Летучие компоненты отгоняют, получают остаток, который растворяют в МеОН (5 мл). Значение рН раствора доводят до 9 насыщенным водным раствором К2СО3. Полученный раствор экстрагируют ТГФ (3×10 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Сырой продукт очищают с помощью препаративной ВЭЖХ при следующих условиях: [(Agilent 1200): Колонка, X-Bridge Prep-C18; подвижная фаза, вода с 0,05% аммиака и от 3% ацетонитрила и до 13% ацетонитрила за 10 минут; детектор, 220, 254 нм], получают:
(3aR,5R,6R,7S,7aR)-2-(этиламино)-7-фтор-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (63 мг, 32%).
(ES, m/z): [M+H]+ 265,0;
1H ЯМР (300 MГц, D2O) δ 6,25 (д, J=6,6 Гц, 1H), 4,78 (тд, J=3,9, 48,3 Гц, 1H), 4,42-4,33 (м, 1H), 4,00-3,91 (м, 2H), 3,71-3,68 (м, 1H), 3,22-3,05 (м, 2H), 1,07 (д, J=6,6 Гц, 3H), 1,02 (д, J=7,2 Гц, 3H); и
(3aR,5R,6R,7S,7aR)-2-(этиламино)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (77 мг, 39%).
(ES, m/z): [M+H]+ 265,0;
1H ЯМР (300 MГц, D2O) δ 6,20 (д, J=6,6 Гц, 1H), 4,85 (тд, J=3,6, 49,2 Гц, 1H), 4,41-4,31 (м, 1H), 3,98-3,89 (м, 2H), 3,47-3,43 (м, 1H), 3,17-3,09 (м, 2H), 1,10 (д, J=6,6 Гц, 3H), 1,02 (д, J=7,2 Гц, 3H).
Пример 38
(3aR,5S,6R,7S,7aR)-7-фтор-2-(метиламино)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-((3aR,5R,6R,7R,7aR)-5-(трет-бутилдиметилсилил)окси)метил)-7-фтор-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (9,28 г, 20,6 ммоль) в ДХМ (150 мл) добавляют DMP (13,1 г, 30,9 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь разбавляют Et2О (400 мл). Полученную суспензию фильтруют через слой целита и фильтрат концентрируют досуха при комнатной температуре. Остаток загружают на слоистую вставку NaHCO3/силикагель и продукт элюируют (EtOAc/гексаны, 1:4), получают трет-бутил-((3aR,5R,6R,7R,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-6-оксо-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата в виде белого кристаллического твердого вещества (8,96 г, 97 ммоль).
1H ЯМР (400 MГц, CDCl3) δ 6,29 (д, J=7,0 Гц, 1H), 5,09 (дд, J=4,7, 48,4 Гц, 1H), 4,75-4,69 (м, 1H), 4,12-4,05 (м, 2H), 3,96-3,93 (м, 1H), 3,28 (c, 3H), 1,54 (c, 9H), 0,86 (c, 9H), 0,056 (c, 3H), 0,050 (c, 3H).
К раствору описанного выше материала (8,96 г, 20,0 ммоль) в сухом МеОН (250 мл) добавляют NaH (60% в минеральном масле, 0,158 г, 3,95 ммоль) и смесь перемешивают при комнатной температуре в течение 15 минут (контроль с помощью ТСХ). Реакционную смесь затем охлаждают при 0°С и добавляют NaBH4 (1,32 г, 34,9 ммоль). После перемешивания смеси при 0°С в течение 20 минут добавляют крошку сухого льда и растворитель упаривают. Остаток растворяют в ДХМ (100 мл) и промывают насыщенным водным раствором NH4Cl (100 мл). Органический слой собирают и водный слой экстрагируют ДХМ (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 2:5), получают трет-бутил-((3aR,5R,6R,7S,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены белого цвета (6,84 г, 76%).
1H ЯМР (400 MГц, CDCl3) δ 6,06 (д, J=6,7 Гц, 1H), 5,01 (тд, J=4,3, 46,8 Гц, 1H), 4,49-4,44 (м, 1H), 4,17-4,13 (м, 1H), 3,80-3,79 (м, 2H), 3,66-3,63 (м, 1H), 3,38 (c, 3H), 2,72 (шир.c, 1H, (OH)), 1,54 (c, 9H), 0,89 (c, 9H), 0,062 (c, 3H), 0,057 (c, 3H).
При 0°С к раствору описанного выше материала (1,30 г, 2,89 ммоль) и Bu4NI (0,107 г, 0,290 ммоль) в безводном ДМФА (12 мл) добавляют NaH (60% в минеральном масле, 0,145 г, 3,63 ммоль). После добавления NaH добавляют BnBr (0,989 г, 5,78 ммоль). После перемешивания при 0°С в течение 30 минут и затем при комнатной температуре в течение ночи смесь разбавляют Et2O (100 мл). Смесь промывают насыщенным водным раствором NH4Cl (2×50 мл). Водный слой экстрагируют Et2O (2×40 мл). Объединенный экстракт промывают насыщенным раствором соли (50 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:20 до 1:4), получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде липкого масла (1,44 г, 92%).
1H ЯМР (400 MГц, CDCl3) δ 7,36-7,27 (м, 5H), 6,21 (д, J=7,2 Гц, 1H), 5,30-5,16 (м, 1H), 4,80 (д, J=11,4 Гц, 1H), 4,56 (д, J=11,4 Гц, 1H), 4,50-4,42 (м, 1H), 3,95-3,78 (м, 4H), 3,44 (c, 3H), 1,54 (c, 9H), 0,89 (c, 9H), 0,049 (c, 6H).
При 0°С к раствору описанного выше материала (1,44 г, 2,66 ммоль) в ТГФ (25 мл) добавляют TBAF (1,0 М в ТГФ, 3,5 мл, 3,5 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 часов и разбавляют насыщенным раствором соли (50 мл). Смесь экстрагируют EtOAc (2×40 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:2 до 1:1), получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)-(метил)карбамат в виде твердого вещества белого цвета (1,08 г, 95%).
1H ЯМР (400 MГц, CDCl3) δ 7,37-7,27 (м, 5H), 6,18 (д, J=7,4 Гц, 1H), 5,17-5,04 (м, 1H), 4,84 (д, J=11,6 Гц, 1H), 4,55 (д, J=11,6 Гц, 1H), 4,50-4,43 (м, 1H), 3,95-3,91 (м, 1H), 3,88-3,82 (м, 1H), 3,79-3,75 (м, 1H), 3,71-3,67 (м, 1H), 3,37 (c, 3H), 1,53 (c, 9H).
К раствору описанного выше материала (2,57 г, 6,03 ммоль) в ДХМ (60 мл) при 0°С добавляют DMP (3,82 г, 9,00 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь разбавляют Et2O (100 мл). Полученную суспензию фильтруют через слой целита, и фильтрат концентрируют досуха при комнатной температуре. Остаток экстрагируют EtOAc (3×50 мл) и твердое вещество отфильтровывают. Экстракт промывают смешанными насыщенными водными растворами NaHCO3 (30 мл) и Na2S2O3 (5 мл). Экстракт собирают и сушат над безводным MgSO4. После фильтрования растворитель упаривают при пониженном давлении, получают сырой трет-бутил-((3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат. Сырой материал используют на следующей стадии без дополнительной очистки.
1H ЯМР(400 MГц, CDCl3) δ 9,65 (c, 1H), 7,39-7,29 (м, 5H), 6,04 (д, J=7,0 Гц, 1H), 5,08 (тд, J=4,2, 46,7 Гц, 1H), 4,84 (д, J=11,4 Гц, 1H), 4,64 (д, J=11,4 Гц, 1H), 4,55-4,49 (м, 1H), 4,31 (д, J=7,5 Гц, 1H), 4,19-4,15 (м, 1H), 3,30 (c, 3H), 1,52 (c, 9H).
К раствору описанного выше материала (1,94 г, 4,57 ммоль) и TMSCF3 (1,80 г, 12,7 ммоль) в безводном ТГФ (50 мл) добавляют TBAF (1,0 М в ТГФ, 0,75 мл, 0,75 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь охлаждают при 0°С и добавляют еще одну порцию TBAF (1,0 М в ТГФ, 11,0 мл, 11,0 ммоль). Смесь перемешивают при комнатной температуре в течение еще 2 часов и затем разбавляют EtOAc (100 мл) и насыщенным раствором соли (100 мл). Органический слой собирают и водный слой экстрагируют EtOAc (50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 2:3), получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде твердого вещества бледно-желтого цвета (0,761 г, 34%).
1H ЯМР (400 MГц, CDCl3) δ 7,36-7,28 (м, 5H), 6,20 (д, J=7,5 Гц, 1H), 5,06 (тд, J=3,5, 49,5 Гц, 1H), 4,80 (д, J=11,6 Гц, 1H), 4,57 (д, J=11,6 Гц, 1H), 4,38-4,30 (м, 1H), 4,23 (д, J=8,8 Гц, 1H), 4,15-4,10 (м, 1H), 3,91-3,84 (м, 1H), 3,32 (c, 3H), 2,96 (д, J=10,1 Гц, 1H (OH)), 1,52 (c, 9H).
К раствору описанного выше материала (0,760 г, 1,54 ммоль) и РМВ (0,70 г, 4,7 ммоль) в безводном ДХМ (10 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 10,0 мл, 10,0 ммоль). Смесь перемешивают ~5 часов, при этом температура охлаждающей бани поднимается до комнатной температуры. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:8), получают (3aR,5S,6R,7S,7aR)-7-фтор-2-(метиламино)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества не совсем белого цвета (0,373 г, 80%).
1H ЯМР (400 MГц, CD3OD) δ 6,43 (д, J=6,7 Гц, 1H), 4,86 (ддд, J=2,9, 3,6, 51,5 Гц, 1H), 4,34-4,26 (м, 2H), 4,17 (д, J=9,3 Гц, 1H), 3,99-3,90 (м, 1H), 2,85 (c, 3H);13C ЯМР (100 MГц, CD3OD) δ 165,65, 126,48 (кв, J=281,2 Гц), 91,27 (д, J=183,2 Гц), 90,42 (д, J=2,2 Гц), 70,54 (д, J=16,2 Гц), 69,70-69,65 (м), 69,20 (д, J=30,4 Гц), 65,91 (д, J=17,6 Гц), 30,37; MS, m/z=305,1 (M+1).
Пример 39
(3aR,5S,6R,7S,7aR)-7-фтор-2-(метиламино)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-(3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил((метил)карбамата (0,352 г, 0,829 ммоль) и TMSCF3 (0,290 г, 2,04 ммоль) в безводном ТГФ (15 мл) добавляют TBAF (1,0 М в ТГФ, 0,050 мл, 0,050 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь охлаждают при 0°С и добавляют еще одну порцию TBAF (1,0 М в ТГФ, 1,5 г, 1,5 ммоль). Смесь перемешивают при комнатной температуре в течение 2 часов и затем разбавляют EtOAc (20 мл) и насыщенным раствором соли (50 мл). Органический слой собирают и водный слой экстрагируют EtOAc (20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной хроматографии (EtOAc/гексаны, от 1:10 до 2:3), получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде твердого вещества светло-желтого цвета (0,141 г, 34%).
1H ЯМР (400 MГц, CDCl3) δ 7,37-7,28 (м, 5H), 6,14 (д, J=7,5 Гц, 1H), 5,09 (тд, J=4,1, 46,4 Гц, 1H), 4,87 (д, J=10,8 Гц, 1H), 4,38-4,30 (м, 1H), 4,50 (д, J=10,8 Гц, 1H), 4,25-4,22 (м, 1H), 4,10-4,06 (м, 2H), 3,27 (c, 3H), 1,52 (c, 9H).
К раствору описанного выше материала (0,141 г, 0,285 ммоль) и РМВ (0,20 г, 1,3 ммоль) в безводном ДХМ (6 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 2,5 мл, 2,5 ммоль). Смесь перемешивают в течение ~4 часов, при этом температура охлаждающей бани поднимается до комнатной температуры. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. После очистки на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:10) получают (3aR,5S,6R,7S,7aR)-7-фтор-2-(метиламино)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,076 г, 78%).
1H ЯМР (400 MГц, CD3OD) δ 6,34 (д, J=6,6 Гц, 1H), 4,85 (тд, J=3,8, 48,2 Гц, 1H), 4,52-4,46 (м, 1H), 4,20-4,14 (м, 2H), 4,02 (дд, J=4,3, 7,5 Гц, 1H), 2,87 (c, 3H);13C ЯМР (100 MГц, CD3OD) δ 166,00, 126,09 (кв, J=280,7 Гц), 90,39 (д, J=6,2 Гц), 89,99 (д, J=185,0 Гц), 74,54 (д, J=4,7 Гц), 72,12 (д, J=16,6 Гц), 71,40 (кв, J=30,0 Гц), 67,57 (д, J=17,0 Гц), 30,72; MS, m/z=305,1 (M+1).
Примеры 40 и 41
(3aR,5S,6R,7S,7aR)-2-(этиламино)-7-фтор-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6R,7S,7aR)-2-(этиламино)-7-фтор-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К суспензии (3aR,5R,6S,7R,7aR)-2-(этиламино)-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диола (88 г, 358 ммоль) в МеОН (500 мл) добавляют последовательно при 25°С Et3N (48,9 г, 484 ммоль) и Вос2О (139 г, 637 ммоль). После перемешивания в течение 10 часов летучие компоненты отгоняют, получают остаток, который очищают с помощью колонки с силикагелем, элюируют с помощью 1%~3% МеОН в ДХМ, получают сырой продукт в виде сиропа. Сироп перекристаллизовывают из смеси EtOAc/петролейный эфир (1:3), получают трет-бутил-(3aR,5R,6S,7R,7aR)-6,7-дигидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде твердого вещества белого цвета (90 г, 73%).
(ES, m/z): [M+H]+ 349,0;
1H ЯМР (300 MГц, CDCl3) δ 6,13 (д, J=6,6 Гц, 1H), 4,23-4,22 (м, 1H), 4,17-4,14 (м, 1H), 3,91-3,86 (м, 2H), 3,81-3,77 (м, 3H), 3,59-3,55 (м, 1H), 3,16-3,17 (м, 1H, OH), 1,53 (c, 9H), 1,15 (т, J=7,5 Гц, 3H).
Раствор описанного выше материала (80 г, 230 ммоль) и имидазола (62,5 г, 919 ммоль) в ДМФА (300 мл) обрабатывают TBDMSCl (76 г, 506 ммоль) в течение 3 часов при 50°С. Реакцию гасят насыщенным водным раствором NaHCO3 (1 л) и экстрагируют EtOAс (3×200 мл). Объединенный органический слой промывают насыщенным раствором соли (3×300 мл), сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают с помощью колонки с силикагелем, элюируют 3%-10% EtOAc в петролейном эфире, получают трет-бутил-(3aR,5R,6R,7R,7aR)-7-(трет-бутилдиметилсилилокси)-5-((трет-бутилдиметилсилилокси)метил))-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде масла желтого цвета (78 г, 59%).
(ES, m/z): [M+H]+ 577,0;
1H ЯМР (300 MГц, CDCl3) δ 5,95 (д, J=6,0 Гц, 1H), 4,25-4,21 (м, 1H), 4,01-4,09 (м, 1H), 3,98-3,83 (м, 2H), 3,81-3,65 (м, 3H), 3,45-3,35 (м, 1H), 1,50 (c, 9H), 1,15 (т, J=7,5 Гц, 3H), 0,92 (c, 9H), 0,89 (c, 9H), 0,15 (c, 6H), 0,08 (c, 6H).
К раствору описанного выше материала (75 г, 130 ммоль) в пиридине (200 мл) при 0°С добавляют DMAP (1,6 г, 13 ммоль) и BzCl (36,5 г, 261 ммоль). Смесь перемешивают при 25°С в течение 6 часов, реакцию гасят насыщенным водным раствором NaHCO3 (600 мл) и экстрагируют EtOAc (3×200 мл). Объединенный органический слой промывают насыщенным раствором соли (3×200 мл), сушат над безводным Na2SO4 и концентрируют в вакууме. Сырой остаток очищают с помощью колонки с силикагелем, элюируют 1%-5% EtOAc в петролейном эфире, получают (3aR,5R,6R,7R,7aR)-2-(трет-бутоксикарбонил)-7-(трет-бутилдиметилсилилокси)-5-(((трет-бутилдиметилсилил)окси)метил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-илбензоат в виде масла желтого цвета (80 г, 90%).
(ES, m/z): [M+H]+ 681,0;
1H ЯМР (300 MГц, CDCl3) δ 8,03 (д, J=6,0 Гц, 2H), 7,57-7,54 (м, 1H), 7,44-7,39 (м, 2H), 6,06 (д, J=4,8 Гц, 1H), 5,17 (д, J=6,9 Гц, 1H), 4,49 (c, 1H), 4,19-4,16 (м, 1H), 3,95 (кв, J=4,8 Гц, 2H), 3,74-3,73 (м, 1H), 3,71-3,68 (м, 2H), 1,55 (c, 9H), 1,15 (т, J=4,8 Гц, 3H), 0,92 (c, 9H), 0,87 (c, 9H), 0,20 (c, 3H), 0,16 (c, 3H), 0,03 (c, 6H).
Описанный выше материал (80 г, 117 ммоль) обрабатывают 1,5М раствором HCl (газ) в МеОН (300 мл) при комнатной температуре в течение 12 часов. Растворитель удаляют при комнатной температуре в вакууме, получают остаток, который растворяют в МеОН (500 мл), затем добавляют Et3N (23,5 г, 232 ммоль) и Вос2О (50,8 г, 233 ммоль) при комнатной температуре. Через 10 часов после добавления летучие компоненты отгоняют, получают остаток, который очищают с помощью колонки с силикагелем, элюируют 10%-20% EtOAc в ДХМ, получают трет-бутил-((3aR,5R,6S,7R,7aR)-2-(трет-бутоксикарбонил)-7-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-илбензоат в виде масла желтого цвета (47 г, 88%).
(ES, m/z): [M+H]+ 453,0;
1H ЯМР (300 MГц, CDCl3) δ 8,03 (д, J=6,0 Гц, 2H), 7,57-7,54 (м, 1H), 7,44-7,39 (м, 2H), 6,17 (д, J=7,2 Гц, 1H), 5,13 (д, J=8,4 Гц, 1H), 4,56-4,55 (м, 1H), 4,39-4,37 (м, 1H), 3,95 (кв, J=4,8 Гц, 2H), 3,80-3,60 (м, 3H), 1,55 (c, 9H), 1,15 (т, J=4,8 Гц, 3H).
К раствору описанного выше материала (47 г, 104 ммоль) и DMAP (0,6 г, 4,9 ммоль) в пиридине (300 мл) при -10°С добавляют BzCl (11,6 г, 82 ммоль). После перемешивания 12 часов при комнатной температуре реакцию гасят насыщенным водным раствором NaHCO3 (800 мл) и экстрагируют EtOAc (3×500 мл). Объединенный органический слой промывают насыщенным раствором соли (3×300 мл), сушат над безводным Na2SO4 и концентрируют в вакууме. Сырой остаток очищают с помощью колонки с силикагелем, элюируют 10%-20% EtOAc в петролейном эфире, получают [(3aR,5R,6S,7R,7aR)-6-(бензоилокси)-2-{[(трет-бутокси)карбонил](этил)амино}-7-гидрокси-3аН,5Н,6Н,7Н,7аН-пирано[3,2-d][1,3]тиазол-5-ил]метилбензоат в виде масла желтого цвета (35 г, 61%).
(ES, m/z): [M+H]+ 557,0;
1H ЯМР (300 MГц, CDCl3) δ 8,03-8,01 (м, 4H), 7,61-7,52 (м, 2H), 7,45-7,37 (м, 4H), 6,20 (д, J=5,4 Гц, 1H), 5,19-5,17 (м, 1H), 4,57-4,53 (м, 2H), 4,48-4,43 (м, 2H), 4,17-4,13 (м, 1H), 4,00-3,90 (м, 2H), 1,57 (c, 9H), 1,19 (т, J=5,4 Гц, 3H).
Раствор описанного выше материала (20 г, 36 ммоль) в ДХМ (200 мл) обрабатывают DAST (23,2 г, 144 ммоль) при -78°С. После перемешивания 36 часов при 25°С реакцию гасят насыщенным раствором NaHCO3 (400 мл) и экстрагируют ДХМ (3×200 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Сырой остаток очищают с помощью колонки с силикагелем, элюируют 1%-5% EtOAc в петролейном эфире, получают [(3aR,5R,6R,7R,7aR)-6-(бензоилокси)-2-{[(трет-бутокси)карбонил](этил)амино}-7-фтор-3аН,5Н,6Н,7Н,7аН-пирано[3,2-d][1,3]тиазол-5-ил]метилбензоат в виде масла желтого цвета (14 г, 70%).
(ES, m/z): [M+H]+ 559,0;
1H ЯМР (300 MГц, CDCl3) δ 8,02-8,00 (м, 4H), 7,61-7,51 (м, 2H), 7,45-7,36 (м, 4H), 6,18 (д, J=5,4 Гц, 1H), 5,54-5,40 (м, 1H), 5,35 (д, J=36 Гц, 1H), 4,61-4,59 (м, 1H), 4,57-4,41 (м, 2H), 4,03-3,94 (м, 3H), 1,57 (c, 9H), 1,21 (т, J=5,1 Гц, 3H).
Раствор описанного выше материала (26 г, 46,5 ммоль) в МеОН (200 мл) обрабатывают К2CO3 (0,7 г, 5 ммоль) в течение 3 часов при 25°C. Полученный раствор нейтрализуют уксусной кислотой и растворитель удаляют при комнатной температуре в вакууме. Сырой остаток очищают на колонке с силикагелем, элюируют 1%-3% МеОН в ДХМ, получают трет-бутил-этил-((3aR,5R,6R,7R,7aR)-7-фтор-6-гидрокси-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)карбамат в виде твердого вещества белого цвета (15 г, 92%).
(ES, m/z): [M+H]+ 351,0;
1H ЯМР (300 MГц, CDCl3) δ 6,10 (д, J=5,1 Гц, 1H), 4,95 (тд, J=4,3, 45 Гц, 1H), 4,43-4,37 (м, 1Н), 3,96-3,87 (м, 2H), 3,80-3,73 (м, 2H), 3,62-3,57 (м, 1H), 3,38-3,35 (м, 1H), 1,53 (c, 9H), 1,13 (т, J=5,1 Гц, 3H).
К раствору описанного выше материала (3 г, 8,5 ммоль) в ДХМ (50 мл) добавляют Et3N (1,3 г, 13 ммоль), DMAP (0,2 г, 1,7 ммоль) и TBDMSCl (1,93 г, 12,7 ммоль) при комнатной температуре. После перемешивания в течение 10 часов реакцию гасят насыщенным водным раствором NaHCO3 (50 мл) и экстрагируют ДХМ (2×30 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают с помощью колонки с силикагелем, элюируют 10%-20% EtOAc в петролейном эфире, получают трет-бутил-((3aR,5R,6R,7R,7aR)-5-((трет-бутилдиметилсилилокси)метил)-7-фтор-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил(этил)карбамат в виде масла желтого цвета (3,6 г, 90%).
(ES, m/z): [M+H]+ 465,0;
1H ЯМР (300 MГц, CDCl3) δ 5,98 (д, J=6,6 Гц, 1H), 4,96 (тд, J=4,9, 48 Гц, 1H), 4,45-4,37 (м, 2H), 3,96-3,87 (м, 2H), 3,88-3,75 (м, 1H), 3,64-3,55 (м, 1H), 3,38-3,35 (м, 1H), 1,51 (c, 9H), 1,15 (т, J=5,1 Гц, 3H), 0,85 (c, 9H), 0,02 (c, 6H).
К раствору описанного выше материала (2,2 г, 4,7 ммоль) в ДХМ (40 мл) при 0°С добавляют DMP (3 г, 7,1 ммоль). После перемешивания при комнатной температуре в течение 2 часов реакцию гасят смешанными насыщенными водными растворами NaHCO3 (20 мл) и Na2S2O3 (20 мл). Полученный раствор экстрагируют ДХМ (3×30 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают на колонке с силикагелем, элюируют с помощью 2%-15% EtOAc в петролейном эфире, получают трет-бутил-((3aR,5R,7R,7aR)-5-((трет-бутил-диметилсилилокси)метил)-7-фтор-6-оксо-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде твердого вещества желтого цвета (1,9 г, 89%).
(ES, m/z): [M+H]+ 463,0;
1H ЯМР (300 MГц, CDCl3) δ 6,24 (д, J=6,9 Гц, 1H), 5,05 (дд, J=4,5, 48,6 Гц, 1H), 4,75-4,68 (м, 1H), 4,11-4,06 (м, 1H), 4,04-3,99 (м, 1H), 3,93-3,79 (м, 3H), 1,51 (c, 9H), 1,07 (т, J=6,9 Гц, 3H), 0,84 (c, 9H), 0,03 (c, 6H).
К раствору описанного выше материала (1,8 г, 3,9 ммоль) в МеОН (30 мл) добавляют NaH (70% в минеральном масле, 11 мг, 0,3 ммоль). После перемешивания при комнатной температуре в течение 40 минут реакционную смесь затем охлаждают при 0°С и добавляют NaBH4 (296 мг, 7,8 ммоль). Еще через 1 час реакцию гасят смесью лед-вода (30 мл) и экстрагируют ДХМ (3×30 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают на колонке с силикагелем, элюируют с помощью 3%-20% EtOAc в петролейном эфире, получают трет-бутил-((3aR,5R,6R,7S,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде твердого вещества желтого цвета (1,2 г, 67%).
(ES, m/z): [M+H]+ 465,0;
1H ЯМР (300 MГц, CDCl3) δ 6,01 (д, J=6,6 Гц, 1H), 4,93 (тд, J=4,3, 46,8 Гц, 1H), 4,44-4,35 (м, 2H), 4,17-4,08 (м, 1H), 3,96-3,87 (м, 1H), 3,86-3,77 (м, 1H), 3,56-3,47 (м, 1H), 3,42-3,37 (м, 1H), 1,51 (c, 9H), 1,13 (т, J=5,1 Гц, 3H), 0,85 (c, 9H), 0,02 (c, 6H).
К раствору описанного выше материала (2,6 г, 5,6 ммоль) в ДХМ (50 мл) при комнатной температуре добавляют имидазол (816 мг, 12 ммоль) и TBDMSCl (1,3 г, 8,4 ммоль). После перемешивания в течение 16 часов реакцию гасят насыщенным водным раствором NaHCO3 (50 мл) и экстрагируют ДХМ (3×30 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают на короткой колонке с силикагелем, элюируют с помощью 1%-20% EtOAc в петролейном эфире, получают сырой трет-бутил-((3aR,5R,6R,7S,7aR)-6-(трет-бутилдиметилсилилокси)-5-(((трет-бутилдиметилсилилокси)метил)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде масла желтого цвета, которое напрямую используют на следующей стадии; (ES, m/z): [M+H]+ 579,1.
К раствору описанного выше сырого материала в ДХМ (10 мл) и МеОН (20 мл) при 0°С медленно добавляют AcCl (2 мл). После перемешивания 30 минут при 20°С (контроль ТСХ) значение рН раствора доводят до 8-9 с помощью Et3N. Растворитель удаляют при комнатной температуре в вакууме. Остаток очищают с помощью колонки с силикагелем, элюируют с помощью 3%-20% EtOAc в петролейном эфире, получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(трет-бутилдиметилсилилокси)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(этил)карбамат в виде масла желтого цвета (1,3 г, 50% по двум стадиям).
(ES, m/z): [M+H]+ 465,1;
1H ЯМР (300 MГц, CDCl3) δ 6,17 (д, J=6,3 Гц, 1H), 4,99-4,82 (м, 1H), 4,22-4,13 (м, 1H), 4,09-4,03 (м, 1H), 3,88-3,75 (м, 2H), 3,73-3,67 (м, 1H), 3,55-3,41 (м, 1H), 3,38-3,35 (м, 1H), 1,55 (c, 9H), 1,17 (т, J=5,1 Гц, 3H), 0,91 (c, 9H), 0,09 (c, 6H).
К раствору описанного выше материала (1,3 г, 2,8 ммоль) в ДХМ (30 мл) добавляют DMP (1,8 г, 4,2 ммоль). После перемешивания при комнатной температуре в течение 2 часов реакцию гасят с помощью смешанных насыщенных водных растворов NaHCO3 (20 мл) с Na2S2O3 (20 мл). Полученный раствор экстрагируют ДХМ (3×30 мл). Объединенный органический слой сушат над безводным Na2SO4, концентрируют в вакууме, получают сырой альдегид. Альдегид растворяют в ТГФ (30 мл), обрабатывают TMSCF3 (2 г, 14 ммоль) и TBAF (350 мг, 1,1 ммоль) и 4А молекулярными ситами при 0°С ~ 25°С в течениет 12 часов, затем добавляют еще TBAF (1,3 г, 4,2 ммоль). Еще через 2 часа реакционную смесь разбавляют Н2О (50 мл) и экстрагируют EtOAc (3×40 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают с помощью колонки с силикагелем, элюируют с помощью 3%-30% EtOAc в петролейном эфире, получают трет-бутил-этил-((3aR,5S,6R,7S,7aR)-7-фтор-6-гидрокси-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)карбамат в виде масла желтого цвета (970 мг, 39% по двум стадиям).
(ES, m/z): [M+H]+ 419,1;
1H ЯМР (300 MГц, CDCl3) δ 6,26-6,13 (м, 1H), 5,01-4,80 (м, 1H), 4,39-4,23 (м, 2H), 4,21-3,99 (м, 2H), 3,68-3,52 (м, 2H), 1,55 (c, 9H), 1,19-1,13 (м, 3H).
К раствору описанного выше материала (380 мг, 0,9 ммоль) в ДХМ (20 мл) добавляют ТФУК (4 мл). Через 2 часа при комнатной температуре летучие компоненты отгоняют, получают остаток, который растворяют в МеОН (3 мл) и нейтрализуют концентрированным аммиаком. После концентрирования в вакууме сырую смесь очищают с помощью препаративной ВЭЖХ при следующих условиях: [(Agilent 1200): Колонка, X-Bridge Prep-C18; подвижная фаза, вода с 0,05% аммиака и от 10% ацетонитрила до 22% ацетонитрила за 10 минут; детектор, 220, 254 нм], получают:
(3aR,5S,6R,7S,7aR)-2-(этиламино)-7-фтор-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (70,3 мг, 24%).
(ES, m/z): [M+H]+
319,0;1H ЯМР (300 MГц, D2O) δ 6,15 (д, J=6,6 Гц, 1H), 4,89 (тд, J=4,2, 44,1 Гц, 1H), 4,48-4,39 (м, 1H), 4,32-4,16 (м, 2H), 3,95-3,90 (м, 1H), 3,20-3,10 (м, 2H), 1,02 (т, J=7,5 Гц, 3H);
и (3aR,5S,6R,7S,7aR)-2-(этиламино)-7-фтор-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (81,9 мг, 28%).
(ES, m/z): [M+H]+ 319,0;
1H ЯМР (300 MГц, D2O) δ 6,24 (д, J=6,6 Гц, 1H), 4,92 (ддд, J=2,7, 4,2, 50,7 Гц, 1H), 4,37-4,26 (м, 2H), 4,09-3,97 (м, 2H), 3,19-3,07 (м, 2H), 1,02 (т, J=7,2 Гц, 3H).
Пример 42
(3aR,5R,6R,7S,7aR)-5-этил-7-фтор-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2- d]тиазол-2-ил)(метил)карбамата (500 мг, 1,17 ммоль) в сухом ДХМ (20 мл) при 0°С добавляют DMP (746 мг, 1,76 ммоль). После перемешивания при комнатной температуре в течение 2 часов реакцию гасят с помощью смешанных насыщенных водных растворов NaHCO3 (10 мл) и Na2S2O3 (10 мл). Полученный раствор экстрагируют ДХМ (3×30 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме, получают сырой альдегид трет-бутил-(3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат. Этот сырой альдегид используют на следующей стадии без дополнительной очистки.
1H ЯМР (400 MГц, CDCl3) δ 9,65 (c, 1H), 7,39-7,29 (м, 5H), 6,04 (д, J=7,0 Гц, 1H), 5,08 (тд, J=4,2, 46,7 Гц, 1H), 4,84 (д, J=11,4 Гц, 1H), 4,64 (д, J=11,4 Гц, 1H), 4,55-4,49 (м, 1H), 4,31 (д, J=7,5 Гц, 1H), 4,19-4,15 (м, 1H), 3,30 (c, 3H), 1,52 (c, 9H).
Раствор описанного выше сырого материала (1,17 ммоль) в ТГФ (20 мл) обрабатывают MeMgCl (1М, 2,34 мл, 2,34 ммоль) в течение 3 часов при 10°С. Затем реакцию гасят Н2О (20 мл) и экстрагируют EtOAc (3×30 мл). Объединенный органический слой промывают насыщенным раствором соли (2×20 мл), сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают с помощью колонки с силикагелем, элюируют с помощью 5%-20% EtOAc в петролейном эфире, получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде легкого масла желтого цвета (273 мг, 53% по 2 стадиям).
(ES, m/z) [M+H]+ 441,1;
1H ЯМР (300 MГц, CDCl3) δ 7,40-7,31 (м, 5H), 6,21-6,03 (м, 1H), 5,12-4,93 (м, 2H), 4,65-4,42 (м, 2H), 4,35-4,15 (м, 2H), 3,96-3,65 (м, 1H), 3,38-3,29 (м, 3H), 1,57-1,54 (м, 9H), 1,34-1,29 (м, 3H).
К раствору описанного выше материала (150 мг, 0,34 ммоль) в ДХМ (15 мл) медленно при 0°С добавляют пиридин (107 мг, 1,36 ммоль) и О-фенилкарбонохлоридотиоат (248 мг, 1,45 ммоль). После перемешивания при комнатной температуре в течение 24 часов реакцию гасят насыщенным водным раствором NaHCO3 (20 мл). Полученный раствор экстрагируют ДХМ (3×50 мл). Объединенный органический слой сушат над безводным Na2SO4 и концентрируют в вакууме. Остаток очищают с помощью колонки с силикагелем, элюируют с помощью 2%-5% EtOAc в петролейном эфире, получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-((S)-1-(феноксикарбонотиоилокси)этил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде масла желтого цвета (116 мг, 59%).
(ES, m/z) [M+H]+ 577,0;
1H ЯМР (300 MГц, CDCl3) δ 7,46-7,29 (м, 8H), 7,20-7,10 (м, 2H), 6,23 (д, J=7,5 Гц, 1H), 5,58-5,52 (м, 1H), 5,19-5,00 (м, 1H), 4,93 (д, J=11,1 Гц, 1H), 4,68-4,60 (м, 1H), 4,57 (д, J=11,1 Гц, 1H), 4,10-3,98 (м, 2H), 3,29 (c, 3H), 1,55 (c, 9H), 1,38-1,34 (м, 3H).
К раствору описанного выше материала (110 мг, 0,19 ммоль) в толуоле (10 мл) добавляют SnBu3H (277 мг, 0,95 ммоль), AIBN (31 мг, 0,19 ммоль). После перемешивания в течение 2 часов при 80°С растворитель отгоняют, получают остаток, который очищают на колонке с силикагелем, элюируют с помощью 2%-10% EtOAc в петролейном эфире, получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-5-этил-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде легкого масла желтого цвета (57 мг, 70%).
(ES, m/z) [M+H]+ 425,0;1H ЯМР (300 MГц, CDCl3) δ 7,38-7,31 (м, 5H), 6,12 (д, J=7,5 Гц, 1H), 5,19-5,01 (м, 1H), 4,88 (д, J=11,1 Гц, 1H), 4,54 (д, J=11,4 Гц, 1H), 4,50-4,44 (м, 1H), 3,73-3,64 (м, 2H), 3,33 (c, 3H), 1,58-1,49 (м, 2H), 1,51 (c, 9H), 0,93 (т, J=7,5 Гц, 3H).
Раствор описанного выше материала (110 мг, 0,26 ммоль) в ДХМ (10 мл) обрабатывают BCl3 (1М, 1,3 мл, 1,3 ммоль) при -78°С ~ -30°С в течение 2 часов. Затем реакцию гасят с помощью МеОН (10 мл). Летучие компоненты отгоняют, получают остаток, который растворяют в МеОН (3 мл) и нейтрализуют концентрированным аммиаком. После концентрирования в вакууме сырой продукт очищают с помощью препаративной ВЭЖХ при следующих условиях: [(Agilent 1200): Колонка, X-Bridge Prep-C18; подвижная фаза, вода с 0,05% аммиака и от 18% ацетонитрила до 38% ацетонитрила за 8 минут; детектор, 220 нм, 254 нм], получают (3aR,5R,6R,7S,7aR)-5-этил-7-фтор-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (60,9 мг, 55%).
(ES, m/z): [M+H]+ 235,0;1H ЯМР (300 MГц, D2O) δ 6,19 (д, J=6,3 Гц, 1H), 4,89 (тд, J=3,3, 53,4 Гц, 1H), 4,40-4,31 (м, 1H), 3,83-3,70 (м, 2H), 2,78 (c, 3H), 1,74-1,65 (м, 1H), 1,60-1,49 (м, 1H), 0,85 (т, J=7,5 Гц, 3H).
Пример 43
(3aR,5S,6R,7S,7aR)-7-фтор-5-(2-гидроксипропан-2-ил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол
К раствору трет-бутил-((3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (2,0 г, 4,7 ммоль) в безводном ТГФ (40 мл) при 0°С и в атмосфере N2 добавляют MeMgBr (1,4М в смеси ТГФ/толуол, 8,0 мл, 11,2 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 3 часов. Остаток разбавляют Et2O (50 мл) и затем гасят насыщенным водным раствором NaHCO3 (50 мл). Органический слой собирают и водный слой экстрагируют ДХМ (3×40 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток растворяют в ДХМ (40 мл) и добавляют Вос2О (2,0 г, 9,2 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов. После концентрирования остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:2 до 3:2), получают трет-бутил-((3aR,5R,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-(1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (1,0 г, 48%) в виде смеси диастереомеров.
К раствору описанного выше материала (1,0 г, 2,3 ммоль) в ДХМ (20 мл) добавляют DMP (1,2 г, 2,8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 часа и затем разбавляют Et2O (80 мл). После фильтрования через слой целита фильтрат промывают насыщенным водным раствором NaHCO3 (30 мл) и собирают. Водный слой экстрагируют EtOAc (2×40 мл). Объединенный экстракт сушат над Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:8 до 1:2), получают трет-бутил-((3aR,5S,6R,7S,7aR)-5-ацетил-6-(бензилокси)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,49 г, 49%) в виде твердого вещества белого цвета.
1H ЯМР (500 MГц, CDCl3) δ 7,39-7,37 (м, 2H), 7,34-7,31 (м, 2H), 7,31-7,29 (м, 1H), 6,02 (д, J=7,1 Гц, 1H), 5,15-5,04 (м, 1H), 4,84 (д, J=11,1 Гц, 1H), 4,62 (д, J=11,1 Гц, 1H), 4,54-4,51 (м, 1H), 4,25-4,20 (м, 2H), 3,33 (c, 3H), 2,23 (c, 3H), 1,54 (c, 9H).
К раствору описанного выше материала (0,153 г, 0,348 ммоль) в безводном ТГФ (10 мл) в атмосфере N2 добавляют MeMgBr (1,4М в смеси ТГФ/толуол, 0,50 мл, 0,70 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 3 часов. Реакцию гасят насыщенным водным раствором NaHCO3 (20 мл) и затем экстрагируют ДХМ (2×20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток сушат в высоком вакууме. К раствору остатка и РМВ (0,15 г, 1,0 ммоль) в сухом ДХМ (4 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 2,6 мл, 2,6 ммоль). Смесь перемешивают ~5 часов, при этом температура охлаждающей бани медленно повышается до комнатной температуры. Реакционную смесь охлаждают до -78°С, гасят смешанными МеОН/ДХМ, и затем концентрируют досуха. Остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:12), получают (3aR,5S,6R,7S,7aR)-7-фтор-5-(2-гидроксипропан-2-ил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,073 г, 79%).
1H ЯМР (400 MГц, CD3OD) δ 6,15 (д, J=6,5 Гц, 1H), 4,38-4,34 (м, 1H), 4,11-4,07 (м, 1H), 4,05-3,98 (м, 1H), 3,68 (дд, J=5,6, 7,1 Гц), 2,84 (c, 3H), 2,20-2,09 (м, 2H);13C ЯМР (100 MГц, CD3OD) δ 163,99, 126,24 (кв, J=280,7 Гц), 91,08, 75,0 (шир.), 72,12 (кв, J=29,7 Гц), 70,17, 67,00, 33,65, 30,80; MS, (ES, m/z) [M+H]+ 265,1.
Примеры 44 и 45
(3aR,5S,6R,7S,7aR)-7-фтор-2-(метиламино)-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6R,7S,7aR)-7-фтор-2-(метиламино)-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-((3aR,5S,6R,7S,7aR)-5-ацетил-6- (бензилокси)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,310 г, 0,704 ммоль) и TMSCF3 (0,299 г, 2,10 ммоль) в безводном ТГФ (12 мл) добавляют TBAF (1,0 М в ТГФ, 0,040 мл, 0,040 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют еще одну порцию TBAF (1,0 М в ТГФ, 1,2 мл, 1,2 ммоль) и смесь перемешивают при комнатной температуре в течение еще 2 часов. Реакционный раствор затем разбавляют насыщенным раствором соли (50 мл) и EtOAc (2×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают и разделяют на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-((3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,178 г, 50%) в виде пены белого цвета;
1H ЯМР (основной изомер) (400 MГц, CDCl3) δ 7,37-7,28 (м, 5H), 6,18 (д, J=7,7 Гц, 1H), 5,08 (тд, J=4,3, 45,6 Гц, 1H), 4,92 (д, J=10,7 Гц, 1H), 4,67-4,60 (м, 1H), 4,49 (д, J=10,7 Гц, 1H), 4,27-4,22 (м, 1H), 3,66-3,92 (м, 1H), 3,28 (c, 3H), 3,05 (шир.c, 1H), 1,54 (c, 9H), 1,38 (c, 3H);
и трет-бутил-((3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,136 г, 38%) в виде пены белого цвета.
1H ЯМР (минорный изомер) (400 MГц, CDCl3) δ 7,37-7,28 (м, 5H), 6,19 (д, J=1,1 Гц, 1H), 5,05 (тд, J=4,3, 45,7 Гц, 1H), 4,94 (д, J=10,7 Гц, 1H), 4,64-4,60 (м, 1H), 4,49 (д, J=10,7 Гц, 1H), 4,26-4,24 (м, 1H), 3,90 (д, J =7,5 Гц, 1H), 3,29 (c, 3H), 3,25 (шир.c, 1H), 1,54 (c, 9H), 1,37 (c, 3H).
Стереохимия каждого изомера произвольна.
К раствору трет-бутил-((3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (основной изомер со стадии добавления TMSCF3) (0,18 г, 0,35 ммоль) и РМВ (0,15 г, 1,0 ммоль) в сухом ДХМ (5 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 2,0 мл, 2,0 ммоль). Смесь перемешивают в течение ~4 часов, при этом температура охлаждающей бани медленно поднимается до комнатной температуры. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:13), получают (3aR,5S,6R,7S,7aR)-7-фтор-2-(метиламино)-5-((R)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,086 г, 77%).
1H ЯМР (600 MГц, CD3OD) δ 6,37 (д, J=6,7 Гц, 1H), 4,83 (ддд, J=3,5, 4,6, 46,7 Гц, 1H), 4,61-4,57 (м, 1H), 4,33-4,30 (м, 1H), 3,90 (д, J=6,9 Гц), 2,88 (c, 3H), 1,34 (c, 3H);13C ЯМР (150,9 MГц, CD3OD) δ 165,55, 127,29 (кв, J=286,0 Гц), 90,86 (д, J=8,4 Гц), 89,66 (д, J=186,5 Гц), 76,23 (д, J=4,0 Гц), 75,41 (кв, J=27,4 Гц), 72,65 (д, J=16,6 Гц), 67,79 (д, J=16,6 Гц), 30,84, 17,28; MS, (ES, m/z) [M+H]+ 319,1.
К раствору трет-бутил-((3aR,5S,6R,7S,7aR)-6-(бензилокси)-7-фтор-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (минорный изомер со стадии добавления TMSCF3) (0,136 г, 0,277 ммоль) и РМВ (0,10 г, 0,68 ммоль) в сухом ДХМ (5 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 2,0 мл, 2,0 ммоль). Смесь перемешивают в течение ~4 часов, при этом температура охлаждающей бани медленно повышается до комнатной температуры. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (1,0 М NH3 в смеси МеОН/ДХМ, 1:13), получают (3aR,5S,6R,7S,7aR)-7-фтор-2-(метиламино)-5-((S)-1,1,1-трифтор-2-гидроксипропан-2-ил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,081 г, 92%).
1H ЯМР (600 MГц, CD3OD) δ 6,34 (д, J=6,7 Гц, 1H), 4,84 (ддд, J=3,5, 5,0, 46,3 Гц, 1H), 4,63-4,60 (м, 1H), 4,36-4,33 (м, 1H), 3,75 (д, J=6,9 Гц), 2,88 (c, 3H), 1,35 (c, 3H);13C ЯМР (150,9 MГц, CD3OD) δ 165,25, 127,26 (кв, J=287,0 Гц), 90,46 (д, J=9,1 Гц), 89,55 (д, J=186,4 Гц), 79,12 (д, J=4,0 Гц), 75,77 (кв, J=27,3 Гц), 73,26 (д, J=16,6 Гц), 67,35 (д, J=16,9 Гц), 30,96, 18,72; MS, (ES, m/z) [M+H]+ 319,1.
Примеры 46 и 47
(3aR,5R,6S,7R,7aR)-7-фтор-5-((S)-1-гидроксиэтил)-2- (метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5R,6S,7R,7aR)-7-фтор-5-((R)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол
К раствору трет-бутил-((3aR,5R,7R,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-6-оксо-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (2,57 г, 5,72 ммоль) в сухом МеОН (50 мл) при 0°С добавляют NaВH4 (0,295 г, 7,80 ммоль). После перемешивания смеси при 0°С в течение 20 минут добавляют крошку сухого льда и растворитель упаривают. Остаток растворяют в ДХМ (50 мл) и промывают насыщенным водным раствором NаHCO3 (50 мл). Органический слой собирают и водный слой экстрагируют ДХМ (2×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:3), получают трет-бутил-((3aR,5R,6S,7R,7aR)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-6-гидрокси-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,95 г, 37%) в виде липкого масла.
1H ЯМР (400 MГц, CDCl3) δ 6,11 (д, J=6,7 Гц, 1H), 4,84 (ддд, J=3,2, 6,7, 48,2 Гц, 1H), 4,45 (тд, J=6,7, 16,6 Гц, 1H), 4,32-4,29 (м, 1H), 4,00-3,93 (м, 2H), 3,90-3,86 (м, 1H), 3,36 (c, 3H), 3,19 (шир.c, 1H, (OH)), 1,53 (c, 9H), 0,90 (c, 9H), 0,093 (c, 3H), 0,087 (c, 3H).
При 0°С к раствору описанного выше материала (0,852 г, 1,89 ммоль) и Bu4NI (0,070 г, 0,189 ммоль) в безводном ДМФА (8 мл) добавляют NaH (60% в минеральном масле, 0,945 г, 2,36 ммоль). После добавления NaH к реакционной смеси добавляют BnBr (0,646 г, 3,78 ммоль). После перемешивания при комнатной температуре в течение 16 часов смесь разбавляют насыщенным раствором соли (60 мл) и экстрагируют Et2O (2×60 мл). Объединенный экстракт промывают насыщенным раствором соли (60 мл) и сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:5), получают трет-бутил-((3aR,5R,6S,7R,7aR)-6-(бензилокси)-5-(((трет-бутилдиметилсилил)окси)метил)-7-фтор-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде бесцветного липкого масла (0,980 г, 95%).
1H ЯМР (500 MГц, CDCl3) δ 7,38-7,29 (м, 5H), 5,98 (д, J=6,0 Гц, 1H), 4,89 (ддд, J=2,1, 7,1, 48,6 Гц, 1H), 4,87 (д, J=11,8 Гц, 1H), 4,64 (д, J=11,8 Гц, 1H), 4,43 (тд, J=6,6, 18,1 Гц, 1H), 4,17-4,10 (м, 1H), 4,01-3,98 (м, 1H), 3,81 (дд, J=7,0, 10,5 Гц, 1H), 3,77-3,73 (м, 1H), 3,36 (c, 3H), 1,52 (c, 9H), 0,88 (c, 9H), 0,05 (c, 6H).
При 0°С к раствору описанного выше материала (0,980 г, 1,81 ммоль) в ТГФ (10 мл) добавляют TBAF (1,0 М в ТГФ, 3,0 мл, 3,0 ммоль). После перемешивания при комнатной температуре в течение 2 часов реакционную смесь разбавляют насыщенным раствором соли (50 мл) и экстрагируют EtOAc (2×50 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 2:3), получают трет-бутил-((3aR,5R,6S,7R,7aR)-6-(бензилокси)-7-фтор-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде твердого вещества белого цвета (0,79 г, 100%).
1H ЯМР (400 MГц, CDCl3) δ 7,39-7,32 (м, 5H), 5,98 (д, J=5,88 Гц, 1H), 5,11 (ддд, J=2,9, 6,2, 48,6 Гц, 1H), 4,88 (д, J=11,6 Гц, 1H), 4,61 (д, J=11,6 Гц, 1H), 4,45 (тд, J=6,0, 15,9 Гц, 1H), 4,08-3,98 (м, 2H), 3,92-3,88 (м, 1H), 3,70 (дд, J=4,6, 11,6 Гц, 1H), 1,51 (c, 9H).
К раствору описанного выше материала (0,790 г, 1,85 ммоль) в ДХМ (10 мл) добавляют DMP (1,14 г, 2,69 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь разбавляют Et2O (100 мл) и фильтруют через слой целита. Фильтрат концентрируют при пониженном давлении и остаток очищают на силикагеле с помощью колоночной флэш-хроматографии (EtOAc/гексаны, от 1:5 до 1:2), получают трет-бутил-((3aR,5S,6S,7R,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде твердого вещества белого цвета (0,73 г, 93%).
1H ЯМР (400 MГц, CDCl3) δ 9,76 (д, J=3,1 Гц, 1H), 7,39-7,31 (м, 5H), 5,93 (д, J=4,3 Гц, 1H), 5,39 (ддд, J=1,8, 4,5, 48,7 Гц, 1H), 4,85 (д, J=11,6 Гц, 1H), 4,66 (д, J=11,6 Гц, 1H), 4,28-4,20 (м, 3H), 3,33 (c, 3H), 1,53 (c, 9H).
К раствору описанного выше материала (0,390 г, 0,919 ммоль) в безводном ТГФ (8 мл) в атмосфере N2 добавляют MeMgBr (1,4М в смеси ТГФ/толуол, 3,0 мл, 4,2 ммоль). После добавления смесь перемешивают при комнатной температуре в течение 2 часов. Реакцию гасят с помощью насыщенного водного раствора NaHCO3 (30 мл) и затем экстрагируют EtOAс (40 мл) и ДХМ (2×30 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворители упаривают при пониженном давлении, остаток растворяют в ДХМ (5 мл). Добавляют Вос2О (0,38 г, 1,7 ммоль) и смесь перемешивают при комнатной температуре в течение 16 часов. Растворитель удаляют при пониженном давлении и остаток очищают на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-((3aR,5R,6S,7R,7aR)-6-(бензилокси)-7-фтор-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)-(метил)карбамат (0,116 г, 29%) в виде твердого вещества белого цвета.
1H ЯМР (500 MГц, CDCl3) δ 7,39-7,33 (м, 5H), 6,00 (д, J=6,2 Гц, 1H), 5,00 (ддд, J=2,8, 6,2, 48,4 Гц, 1H), 4,94 (д, J=11,5 Гц, 1H), 4,65 (д, J=11,5 Гц, 1H), 4,48 (тд, J=6,6, 16,7 Гц, 1H), 4,26-4,22 (м, 1H), 4,08-4,04 (м, 1H), 3,56 (дд, J=3,1, 8,3 Гц, 1H), 3,36 (c, 3H), 1,51 (c, 9H), 1,20 (д, J=6,3 Гц, 3H);
также выделяют трет-бутил-((3aR,5R,6S,7R,7aR)-6-(бензилокси)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат (0,186 г, 46%) в виде твердого вещества белого цвета.
1H ЯМР (500 MГц, CDCl3) δ 7,38-7,30 (м, 5H), 6,12 (д, J=6,3 Гц, 1H), 5,10-4,99 (м, 1H), 4,96 (д, J=11,8 Гц, 1H), 4,61 (д, J=11,8 Гц, 1H), 4,54 (тд, J=6,6, 17,2 Гц, 1H), 4,15-4,07 (м, 2H), 3,60 (дд, J=3,1, 6,3 Гц, 1H), 3,48 (c, 3H), 1,54 (c, 9H), 1,08 (д, J=6,3 Гц, 3H).
К раствору трет-бутил-((3aR,5R,6S,7R,7aR)-6-(бензилокси)-7-фтор-5-((R)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,116 г, 0,264 ммоль) и РМВ (0,20 г, 1,3 ммоль) в безводном ДХМ (6 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 1,2 мл, 1,2 ммоль). Смесь перемешивают в течение ~3 часов, при этом температура охлаждающей бани поднимается до комнатной температуры. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:10), получают (3aR,5R,6S,7R,7aR)-7-фтор-5-((R)-1-гидроксиэтил)-2-(метилмино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,064 г, 97%).
1H ЯМР (400 MГц, CDCl3) δ 6,43 (дд, J=1,4, 6,5 Гц, 1H), 4,51 (ддд, J=3,2, 8,2, 48,2 Гц, 1H), 4,35-4,32 (м, 1H), 4,30-4,22 (м, 1H), 4,03-3,96 (м, 1H), 3,57 (д, J=8,2 Гц, 1H), 2,86 (c, 3H), 1,20 (д, J=6,3 Гц, 3H);13C ЯМР (100 MГц, CD3OD) δ 164,40, 95,50 (д, J=183,3 Гц), 92,85 (д, J=8,6 Гц), 78,33 (д, J=6,2 Гц), 69,39 (д, J=20,8 Гц), 66,14 (д, J=16,5 Гц), 65,95 (д, J=8,4 Гц), 30,23, 20,71; MS, (ES, m/z) [M+H]+ 251,1).
К раствору трет-бутил-((3aR,5R,6S,7R,7aR)-6-(бензилокси)-7-фтор-5-((S)-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,180 г, 0,409 ммоль) и РМВ (0,20 г, 1,3 ммоль) в безводном ДХМ (6 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 2,0 мл, 2,0 ммоль). Смесь перемешивают в течение ~3 часов, при этом температура охлаждающей бани поднимается до комнатной температуры. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:10), получают (3aR,5R,6S,7R,7aR)-7-фтор-5-((S)-1-гидроксиэтил)-2-(метиламино)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,092 г, 90%).
1H ЯМР (400 MГц, CDCl3) δ 6,45 (дд, J=1,1, 6,4 Гц, 1H), 4,59 (ддд, J=3,2, 8,1, 48,0 Гц, 1H), 4,30-4,22 (м, 1H), 4,18-4,14 (м, 1H), 4,08-4,02 (м, 1H), 3,66 (д, J=7,4 Гц, 1H), 2,83 (c, 3H), 1,22 (д, J=6,8 Гц, 3H);13C ЯМР (100 MГц, CD3OD) δ 164,73, 95,14 (д, J=183,0 Гц), 92,31 (д, J=8,7 Гц), 79,15 (д, J=6,2 Гц), 69,62 (д, J=20,7 Гц), 67,98 (д, J=2,9 Гц), 67,56 (д, J=16,7 Гц), 30,28, 18,92; MS, (ES, m/z) [M+H]+ 251,1.
Примеры 48 и 49
(3aR,5S,6S,7R,7aR)-7-фтор-2-(метиламино)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол и (3aR,5S,6S,7R,7aR)-7-фтор-2-(метиламино)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол

К раствору трет-бутил-((3aR,5S,6S,7R,7aR)-6-(бензилокси)-7-фтор-5-формил-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамата (0,320 г, 0,754 ммоль) и TMSCF3 (0,208 г, 1,46 ммоль) в безводном ТГФ (8 мл) добавляют TBAF (1,0 М в ТГФ, 0,030 мл, 0,030 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют еще одну порцию TBAF (1,0 М в ТГФ, 1,0 мл, 1,0 ммоль) и смесь перемешивают при комнатной температуре в течение еще 2 часов. Реакционный раствор затем разбавляют EtOAc (20 мл) и насыщенным раствором соли (30 мл). Органический слой собирают и водный слой экстрагируют EtOAc (20 мл). Объединенный экстракт сушат над безводным Na2SO4. После фильтрования растворитель упаривают при пониженном давлении и остаток очищают и разделяют на силикагеле с помощью автоматической колоночной флэш-хроматографии (EtOAc/гексаны, от 1:10 до 1:2), получают трет-бутил-((3aR,5R,6S,7R,7aR)-6-(бензилокси)-7-фтор-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-2-ил)(метил)карбамат в виде пены бледно-желтого цвета с соотношением диастереомеров 6,8:1 по данным1Н ЯМР. К раствору пены желтого цвета и РМВ (0,20 г, 1,3 ммоль) в безводном ДХМ (6 мл) при -78°С в атмосфере N2 добавляют BCl3 (1,0 М в ДХМ, 2,0 мл, 2,0 ммоль). Смесь перемешивают в течение ~3 часов, при этом температура охлаждающей бани поднимается до комнатной температуры. Реакционную смесь охлаждают при -78°С, гасят смешанными МеОН/ДХМ и затем концентрируют досуха. Остаток очищают на силикагеле колоночной флэш-хроматографией (1,0 М NH3 в смеси МеОН/ДХМ, 1:10), получают (3aR,5S,6S,7R,7aR)-7-фтор-2-(метиламино)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол в виде твердого вещества белого цвета (0,118 г, 77%) с диастереомерным соотношением 6,8:1 по данным1Н ЯМР. Смесь разделяют препаративной ВЭЖХ при следующих условиях: [Колонка, X-Bridge Prep-C18; 19×150 мм; подвижная фаза, вода с 0,05% NH4OH и CH3CN (от 5% и до 25% за 10 минут) детектор, 220 нм], получают: (3aR,5S,6S,7R,7aR)-7-фтор-2-(метиламино)-5-((S)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (изомер, элюирующий быстрее) в виде твердого вещества белого цвета (65 мг, общий выход 28%).
1H ЯМР (300 MГц, CD3OD) δ 6,46 (д, J=6,3 Гц, 1H), 4,66 (тд, J=3,0, 48,3 Гц, 1H), 4,44-4,42 (м, 3H), 4,12 (д, J=6,0 Гц, 1H), 2,85 (c, 3H), MS, (ES, m/z) [M+H]+ 305,0;
и (3aR,5S,6S,7R,7aR)-7-фтор-2-(метиламино)-5-((R)-2,2,2-трифтор-1-гидроксиэтил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6-ол (изомер, элюирующий медленнее) (6,5 мг, общий выход 2,8%);
1H ЯМР (300 MГц, CD3OD) 5 6,41 (д, J=6,3 Гц, 1H), 4,63 (тд, J=3,3, 48,0 Гц, 1H), 4,36-4,19 (м, 3H), 4,08-4,05 (м, 1H), 2,85 (c, 3H), (ES, m/z) [M+H]+ 305,0.
Приведенные ниже примеры могут быть синтезированы в соответствии с методиками, аналогичными схемам и примерам, рассмотренным выше.
Биологическая активность
Метод оценки для определения значений КI для ингибирования активности O-GlcNAcase
Экспериментальная методика для кинетических анализов: Ферментативные реакции проводят в реакционной смеси, содержащей 50 мМ NaH2PO4, 100 мМ NaCl и 0,1% BSA (рН 7,0), с использованием 2 мМ дигидрата 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминида (Sigma M2133), растворенного в ddH2O, в качестве субстрата. Количество очищенного человеческого фермента O-GlcNAcase, используемого в реакции, составляет 0,7 нМ. Испытуемое соединение переменных концентраций добавляют к ферменту перед инициированием реакции. Реакцию проводят при комнатной температуре в 96-луночном планшете и инициируют добавлением субстрата. Продуцирование флуоресцентного продукта измеряют каждые 60 секунд в течение 45 минут с помощью планшет-ридера Tecan Infinite M200 с возбуждением при 355 нМ и эмиссией, определяемой при 460 нМ, с 4-метилумбеллифероном (Sigma M1381), используемом для получения стандартной кривой. Наклон кривой продуцирования продукта определяют для каждой концентрации испытанного соединения и наносят на график, используя стандартный алгоритм аппроксимации кривой для S-образной кривой зависимости «доза-реакция». Определяют значения для соответствия четырех-параметровой S-обратной кривой данных.
Значения КI определяют с использованием уравнение Ченга-Прусоффа; Km субстрата O-GlcNAcase составляет 0,2 мМ.
Примеры 1-49 испытывают в описанном выше методе оценки и показывают значения КI для ингибирования O-GlcNAcase в интервале 0,1 нМ-10 мкМ.
Метод оценки для определения значений КI для ингибирования активности β-гексозаминидазы
Экспериментальная методика для кинетических анализов: Ферментативные реакции проводят в реакционной смеси, содержащей 50 мМ NaH2PO4, 100 мМ NaCl и 0,1% BSA (рН 7,0), с использованием 2 мМ дигидрата 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминида (Sigma M2133), растворенного в ddH2O, в качестве субстрата. Количество очищенного человеческого фермента β-гексозаминидазы, используемого в реакции, составляет 24 нМ. Испытуемое соединение переменных концентраций добавляют к ферменту перед инициированием реакции. Реакцию проводят при комнатной температуре в 96-луночном планшете и инициируют добавлением субстрата. Продуцирование флуоресцентного продукта измеряют каждые 60 секунд в течение 45 минут с помощью планшет-ридера Tecan Infinite M200 с возбуждением при 355 нМ и эмиссией, определяемой при 460 нМ, с 4-метилумбеллифероном (Sigma M1381), используемом для получения стандартной кривой. Наклон кривой продуцирования продукта определяют для каждой концентрации испытанного соединения и наносят на график, используя стандартный алгоритм аппроксимации кривой для S-образной кривой зависимости «доза-реакция». Определяют значения соответствия для четырех-параметровой S-образной кривой данных.
Значения КI определяют с использованием уравнение Ченга-Прусоффа.
При испытании в этом методе оценки многие соединения, описанные в данном изобретении, показывают значения КI для ингибирования β-гексозаминидазы в интервале от 10 нМ до больше чем 100 мкМ.
Отношение селективности для ингибирования O-GlcNAcase в сравнении с β-гексозаминидазой определяют в данном случае как:
КI(β-гексозаминидазы)/КI(O-GlcNAcase).
В общем случае соединения, описанные в данном изобретении, проявляют отношение селективности в интервале приблизительно от 10 до 100000. Таким образом, соединения настоящего изобретения проявляют высокую селективность для ингибирования O-GlcNAcase в сравнении с β-гексозаминидазой.
Метод оценки для определения клеточной активности соединений, которые ингибируют активность O-GlcNAcase
Ингибирование O-GlcNAcase, которая удаляет O-GlcNAc с клеточных белков, приводит к повышению уровня O-GlcNAc-модифицированного белка в клетках. Увеличение O-GlcNAc-модифицированного белка может быть измерено с помощью антитела, такого как RL-2, которое связывает O-GlcNAc-модифицированный белок. Величина взаимодействия (O-GlcNAc-модифицированный белок):(RL2 антитело) может быть измерена с помощью твердофазного иммуноферментного анализа (ELISA).
Может быть использован ряд линий культивируемых клеток, экспрессирующих эндогенные уровни O-GlcNAcase; примеры включают клетки PC-12 крыс и клетки U-87 или SK-N-SH человека. В этом методе оценки клетки РС-12 крыс размещают в 96-луночных планшетах из расчета приблизительно 10000 клеток/лунка. Соединения, которые должны быть испытаны, растворяют в ДМСО, или 2 или 10 мМ исходного раствора, и затем разбавляют ДМСО и водой в двухступенчатом процессе с использованием рабочего места Tecan. Клетки обрабатывают разбавленными соединениями в течение 24 часов (5,4 мкл в 200 мкл объема 1 лунки), чтобы получить конечную концентрацию ингибитора, необходимую для измерения зависящей от концентрации соединения реакции, как правило, десять 3-кратных стадий разбавления, начиная при 10 мкМ, используемых для определения кривой «концентрация-реакция». Для получения лизата клеток среду из обработанных соединением клеток удаляют, клетки промывают один раз фосфатно-солевым буфером (ФСБ) и затем лизируют в течение 5 минут при комнатной температуре в 50 мкл реагента Phosphosate (Novagen Inc., Madison, WI) с помощью ингибиторов протеазы и PMSF. Клеточный лизат собирают и переносят в новый планшет, который затем или покрывают аналитическими планшетами сразу же, или замораживают при -80°С до использования в методике ELISA. При необходимости суммарную концентрацию белка образцов определяют с использованием 20 мкл образца с использованием метода ВСА.
Часть метода оценки ELISA проводят в черном 96-луночном планшете Maxisorp, который нагружен на ночь при 4°С 100 мкл/лунка клеточного лизата (разбавление 1:10 лизата с помощью ФСБ, содержащего ингибиторы протеазы, ингибиторы фосфатазы и PMSF). На следующий день лунки промывают 3 раза из расчета 300 мкл/лунка промывочным буфером (Трис-забуференный физиологический раствор с 0,1% Tween 20). Лунки блокируют с помощью 100 мкл/лунка блокирующего буфера (Трис-забуференный физиологический раствор/0,05% Tween 20 и 2,5% бычьего сывороточного альбумина). Каждую лунку затем промывают два раза из расчета 300 мкл/лунку промывочным буфером. Анти-O-GlcNAc-антитело PL-2 (Abcam, Cambridge, MA), разбавленное 1:1000 в блокирующем буфере, добавляют из расчета 100 мкл/лунка. Планшет запечатывают и инкубируют при 37°С в течение 2 часов при мягком встряхивании. Лунки затем промывают 3 раза из расчета 300 мкл/лунка промывочным буфером. Для определения количества RL-2, связанного с пероксидазой хрена (HRP), конъюгированного с вторичным антителом козы против мыши (разбавленного 1:3000 в блокирующем буфере), добавляют из расчета 100 мкл/лунка. Планшет инкубируют 60 мин при 37°С при мягком встряхивании. Каждую лунку затем промывают 3 раза с помощью 300 мкл/лунка промывочным буфером. Добавляют определяющий реагент, 100 мкл/лунка реагента Amplex Ultra RED (полученного путем добавления 30 мкл 10 мМ исходного раствора Amplex Ultra RED к 10 мл ФСБ с 18 мкл 3%-ного пероксида водорода, Н2О2). Определяющую реакцию выдерживают 15 минут при комнатной температуре и затем считывают возбуждение при 530 нМ и эмиссию при 590 нм.
Количество O-GlcNAc-модифицированного белка, определенное с помощью ELISA, наносят на график для каждой концентрации испытуемого соединения с использованием стандартного алгоритма аппроксимации кривой для S-образных кривых «доза-ответ». Определяют значения соответствия для четырех-параметровой S-образной кривой данных с точкой перегиба кривой, являющейся значением эффективности испытуемого соединения.
Метод оценки для определения кажущейся проницаемости (Пкаж)
Двунаправленный перенос оценивают в клетках LLC-PK1, чтобы определить кажущуюся проницаемость (Пкаж). Клетки LLC-PK1 могут образовывать плотный монослой и, следовательно, могут быть использованы для оценки векторного переноса соединений от базально-латерального к апикальному (В→А) и от апикального к базально-латеральному (А→В).
Чтобы определить Пкаж, клетки LLC-PK1 культивируют в 96-луночных культуральных планшетах с вкладышами (transwell) (Millipore). Растворы, содержащие испытуемые соединения (1 мкМ), готовят в сбалансированном солевом растворе Хенкса с 10 мМ HEPES. Субстратный раствор (150 мкл) добавляют или в апикальную (А), или в базально-латеральную (В) камеру культурального планшета, и добавляют буфер (150 мкл) в камеру, напротив камеры, содержащей соединение. При t=3 часа удаляют 50 мкл с обеих сторон монослоев, содержащих дозу испытуемого соединения, помещают в 96-луночные планшеты, добавляют сцинтиллятор (200 мкл) или внутренний стандарт (100 мкл лабетолола 1 мкМ) к образцам, и концентрацию определяют с помощью метода жидкостно-сцинтилляционного счета в сцинтилляционном счетчике MicroBeta Wallac Trilux (Perkin Elmer Life Sciences, Boston, MA) или с помощью сочетания ЖХ-МС/МС (Applied Biosystems SCIEX API 5000, тройной квадрупольный масс-спектрометр). В качестве позитивного контроля используют [3H]-Верапамил (1 мкМ). Опыты проводят три раза.
Кажущуюся проницаемость, Пкаж, рассчитывают по следующей формуле для образцов, полученных при t=3 часа:

где: объем рецепторной камеры составляет 0,15 мл; площадь мембраны составляет 0,11 см2; начальная концентрация представляет собой сумму концентрации, измеренной в отдающей камере, и концентрации, измеренной в приемной камере, при t=3 часа; Δ в концентрации представляет собой концентрацию в приемной камере через 3 часа; и Δ во времени представляет собой время инкубации (3×60×60=10800 сек). Пкаж выражают в виде 10-6 см/сек. Пкаж (клетки LLC-PK1) представляют собой среднее значение Пкаж для переноса от А к В и Пкаж для переноса от В к А при t=3 часа:

Репрезентативные данные из связывания, на клеточной основе, и оценок проницаемости, описанных выше, показаны в приведенной ниже таблице. Некоторые соединения изобретения проявляют превосходную эффективность или проницаемость в одном или нескольких из этих методов оценки. Для сравнения первые выходные данные таблицы показывают данные для соединений (3aR,5R,6S,7R,7aR)-2-(этиламино)-5-(гидроксиметил)-5,6,7,7а- тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диола и (3aR,5R,6S,7R,7aR)-2-(диметиламино)-5-(гидроксиметил)-5,6,7,7а-тетрагидро-3аН-пирано[3,2-d]тиазол-6,7-диола, которые описаны в публикации WO 2008/025170.

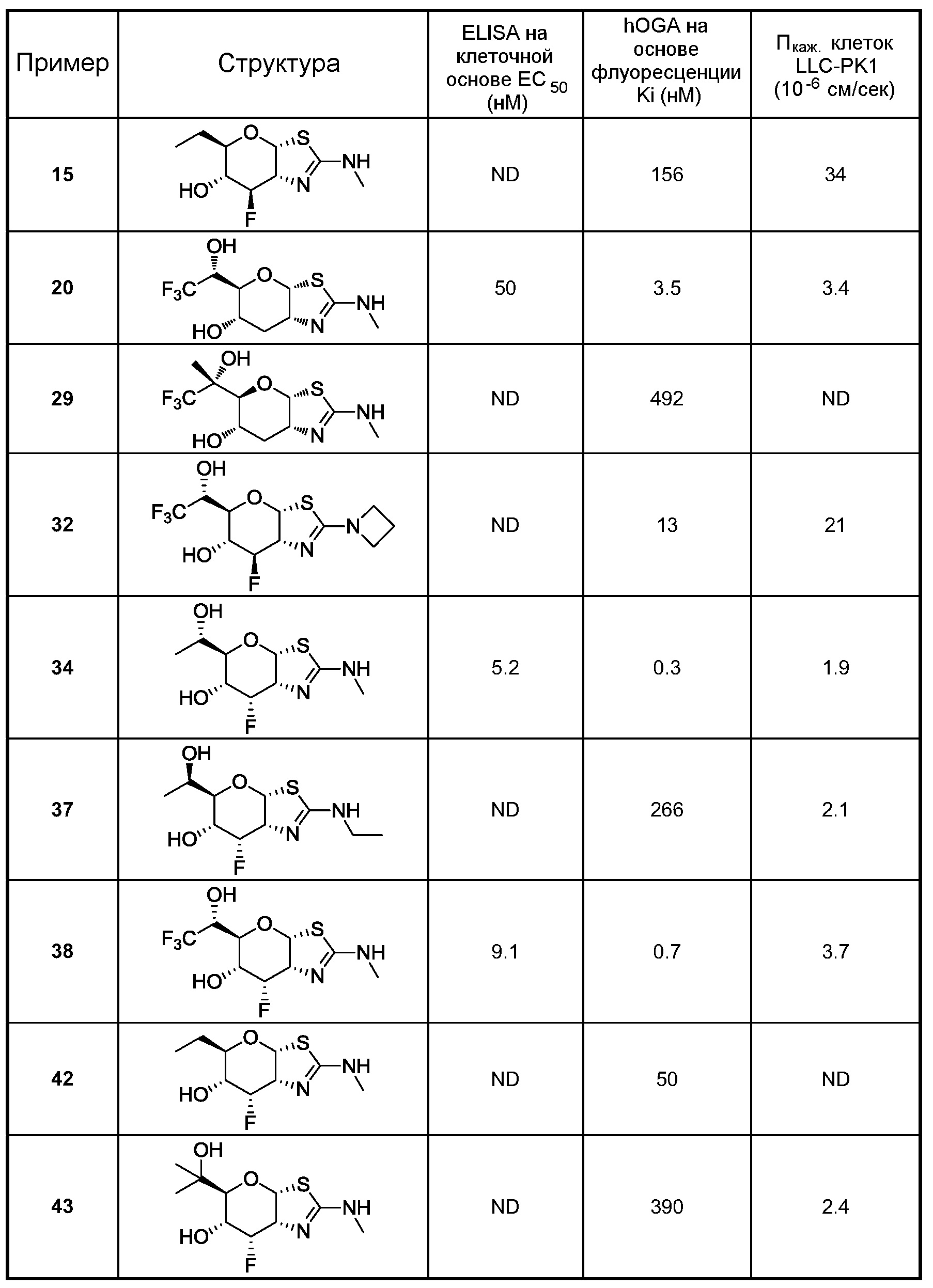
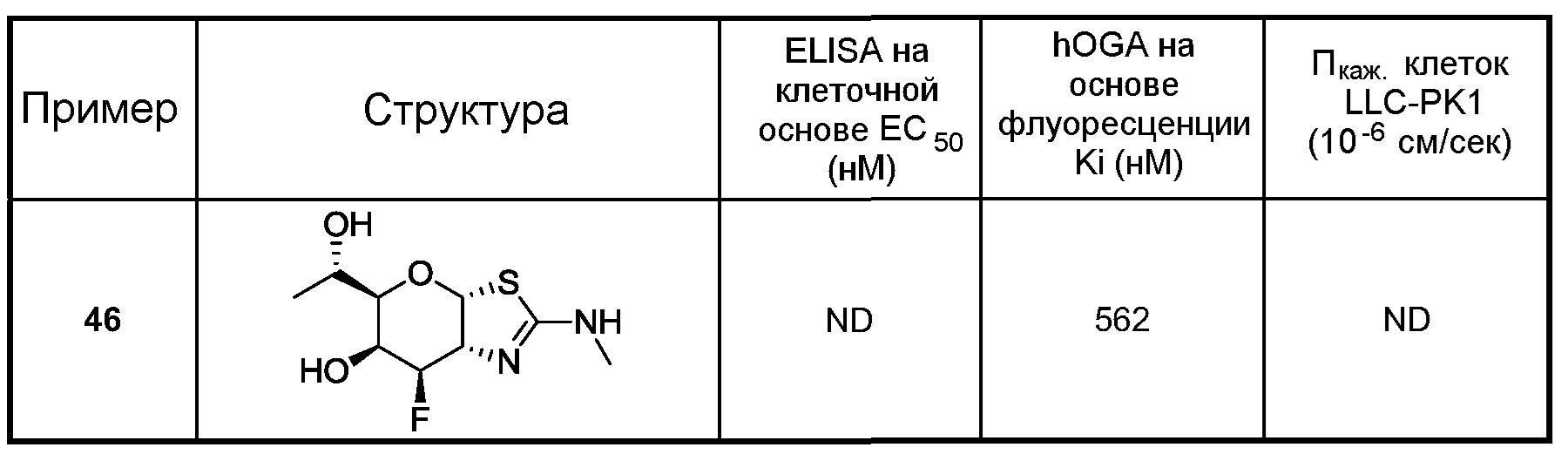
Настоящее изобретение описано применительно к одному или нескольким вариантам осуществления. Однако специалисту в данной области техники будет очевидно, что ряд вариантов и модификаций может быть выполнен без отступления от объема изобретения, который определен в формуле изобретения.
Ссылки



Реферат
Изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где Rи Rнезависимо представляют собой Н или F; Rпредставляет собой ORи Rпредставляет собой Н, или Rпредставляет собой Н и Rпредставляет собой OR; каждый из Rпредставляет собой Н; Rпредставляет собой Н или OR; Rвыбирают из группы, состоящей из Н и C-алкила; Rвыбирают из группы, состоящей из C-алкила, необязательно замещенного 1-3 атомами фтора; и каждый Rнезависимо выбирают из группы, состоящей из Н, C-алкила, или две группы Rсвязаны вместе с атомом азота, к которому они присоединены, с образованием 4-членного кольца, содержащего 3 атома углерода. Соединения формулы (I) предназначены для изготовления лекарственного средства или фармацевтической композиции, обладающих ингибирующей активностью в отношении гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазы (O-GlcNAcase). Также изобретение относится к способу селективного ингибирования гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазы (O-GlcNAcase) у субъекта, нуждающегося в этом, включающему введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Соединения формулы (I) применяются для лечения заболеваний, опосредованных ингибированием гликопротеин 2-ацетамидо-2-деокси-β-D-глюкопиранозидазы (O-GlcNAcase). Технический результат – селективные ингибиторы гликозидазы. 7 н. и 15 з.п. ф-лы, 5 табл., 49 пр.
Формула
























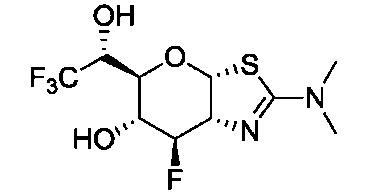

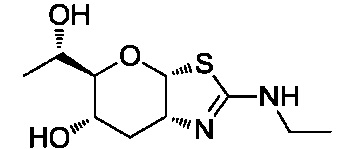

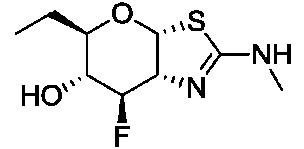
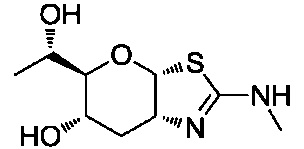
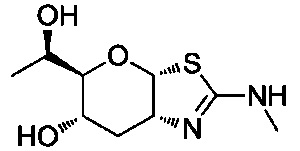



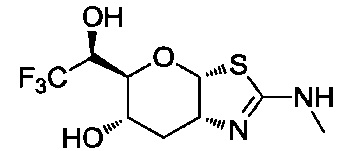

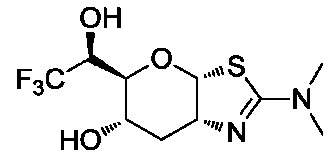
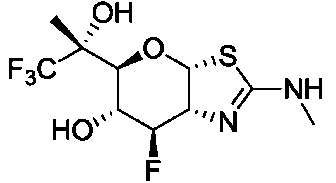













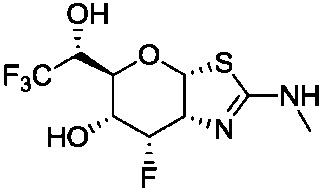











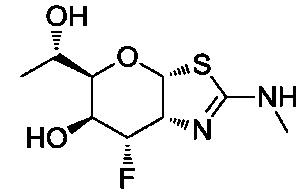

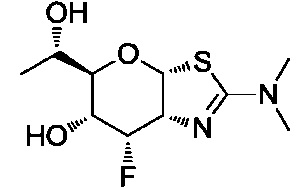



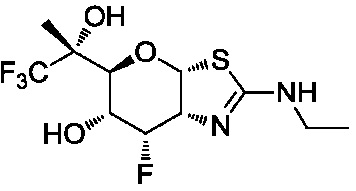
























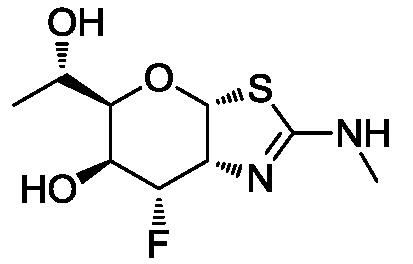
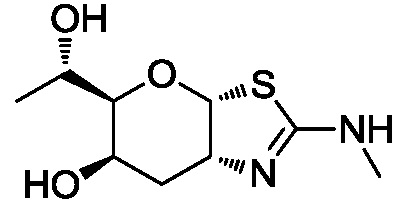

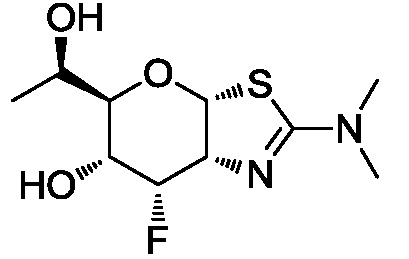




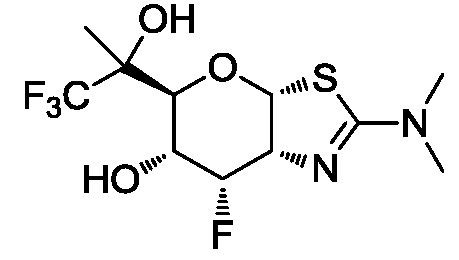
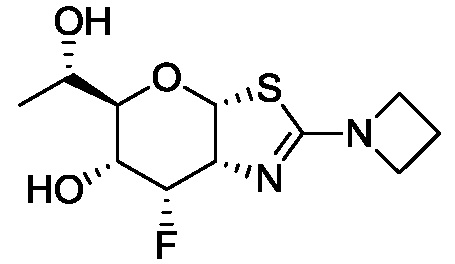
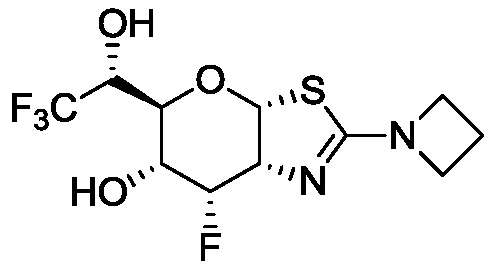
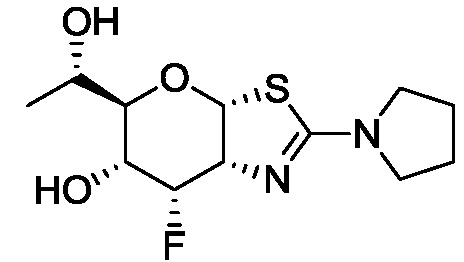

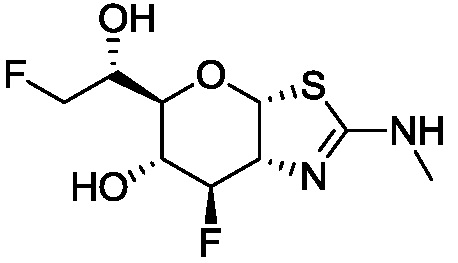

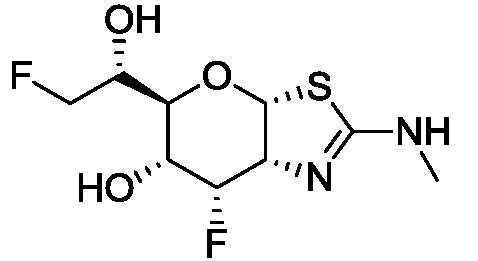




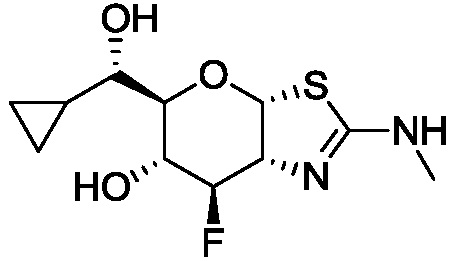











Комментарии