Высокомолекулярный конъюгат подофиллотоксинов - RU2447095C2
Код документа: RU2447095C2
Чертежи
Описание
Область техники, к которой относится изобретение
Изобретение относится к высокомолекулярному конъюгату подофиллотоксинов, в котором карбоксильная группа полимера, имеющего фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, связана сложноэфирной связью с гидроксильной группой подофиллотоксинов, способу его получения и его применения.
Уровень техники
Подофиллотоксин является физиологически активным веществом, содержащимся в водном экстракте корней и стеблей американского подофилла, который является многолетним растением рода Podophyllum, и известно, что подофиллотоксин и его производные обладают противораковой активностью. Однако многие из этих соединений плохо растворимы в воде, и поэтому проводили исследование на водорастворимых высокомолекулярных производных подофиллотоксинов и т.п. с целью дальнейшего улучшения эффективности.
Например, в Патентном Документе 1 описано высокомолекулярное производное подофиллотоксинов, конъюгированное с полиэтиленгликолем. Однако в этих высокомолекулярных производных подофиллотоксинов только от одной до двух молекул подофиллотоксина может быть связано с одной молекулой полиэтиленгликоля из-за его структуры, и поэтому для введения эффективного количества лекарственного средства требуется большое количество полимера.
В Патентном Документе 2 описана молекула, в которой лекарственное средство связано с блок-сополимером полиэтиленгликоля и полиаспарагиновой кислоты, которая образует мицеллы и обладает растворимостью в воде. В Патентном Документе 3 описан полимерный носитель, в котором гидрофобное вещество связано с карбоксильной группой в боковой цепи блок-сополимера полиэтиленгликоля и полимера кислотной аминокислоты и который действует как полимерный носитель лекарственного средства. В Патентном Документе 4 описано высокомолекулярное производное камптотецина, в котором карбоксильная группа в боковой цепи блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты связана с фенольной гидроксильной группой камптотецина. Однако в Патентных Документах 2-4 не описаны конъюгаты подофиллотоксинов.
[Патентный Документ 1] выложенная японская патентная заявка (KOHYO) № 10-513187
[Патентный Документ 2] японский патент № 2694923
[Патентный Документ 3] японский патент № 3268913
[Патентный Документ 4] публикация международной патентной заявки № WO 2004/39869
Раскрытие изобретения
Проблемы, решаемые изобретением
Связь между фрагментом полиэтиленгликоля и лекарственным средством, описанная в Патентном Документе 1, в организме расщепляется гидролизующими ферментами, которые могут контролировать доставку и высвобождение лекарственного средства. Однако считается, что гидролизующие ферменты в организме значительно различаются как у различных видов, так и у особей одного вида. Поэтому имеется опасение, что эффект высвобожденного лекарственного средства будет сильно различаться между особями, если расщепление связи с лекарственным средством зависит от гидролизующих ферментов.
В случае конъюгата адриамицина, описанного в Патентном Документе 2, в котором блок-сополимер связан с адриамицином амидной связью, эффективность является сомнительной, поскольку высвобождение лекарственного средства посредством гидролиза является медленным из-за амидной связи, химически стабильной связывающей формы.
Подофиллотоксины, такие как этопозид и тенипозид, являются противораковыми агентами, и, таким образом, имеется потребность в новых производных, которые являются водорастворимыми и имеют превосходную противораковую активность.
Способы решения проблем
В результате интенсивного изучения проблем, описанных выше, авторы настоящего изобретения обнаружили феномен, что если соединение, имеющее гидроксильную группу, связано сложноэфирной связью со свободной карбоновой кислотой моноамида янтарной кислоты, то это соединение, имеющее гидроксильную группу, легко высвобождается, так как структура моноамида янтарной кислоты преобразуется в циклическую структуру (имид янтарной кислоты). На основании этого авторы настоящего изобретения получили высокомолекулярный конъюгат подофиллотоксинов, в котором полимер, имеющий фрагмент полиэтиленгликоля и фрагменты моноамида янтарной кислоты, связан сложноэфирной связью с гидроксильной группой подофиллотоксинов, и обнаружили, что высокомолекулярный конъюгат, полученный таким образом, высвобождает подофиллотоксины независимо от гидролизующих ферментов, придя, таким образом, к созданию настоящего изобретения.
В частности, настоящее изобретение относится к следующему (1)-(10).
(1) Высокомолекулярный конъюгат подофиллотоксинов, в котором карбоксильная группа полимера, имеющего фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, связана сложноэфирной связью с гидроксильной группой подофиллотоксинов.
(2) Высокомолекулярный конъюгат подофиллотоксинов согласно п. (1) выше, где полимер, имеющий фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, является блок-сополимером.
(3) Высокомолекулярный конъюгат подофиллотоксинов согласно п. (2) выше, где два или более фрагментов моноамида янтарной кислоты образуют полиаспарагиновую кислоту.
(4) Высокомолекулярный конъюгат подофиллотоксинов согласно п. (3) выше, представленный формулой (I):
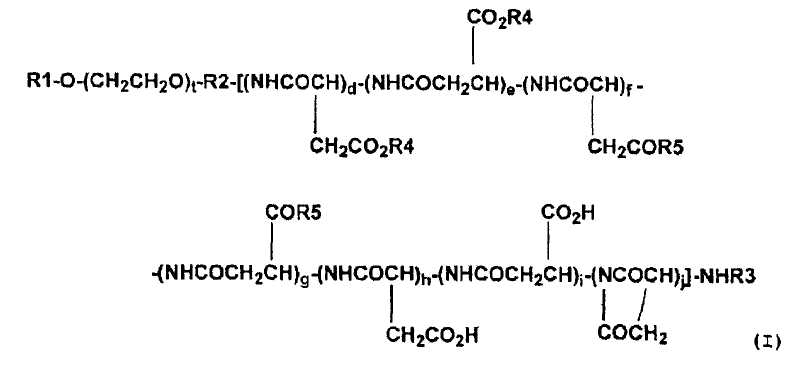
где R1 обозначает атом водорода или (C1-C6)-алкильную группу; R2 обозначает связывающую группу; R3 обозначает атом водорода или (C1-C6)-ацильную группу; R4 обозначает остаток гидроксильной группы подофиллотоксинов; R5 обозначает группу, выбранную из группы, состоящей из (C1-C30)-алкоксигруппы, (C7-C30)-аралкилоксигруппы, (C1-C30)-алкиламиногруппы, ди-(C1-C30)-алкиламиногруппы, аминокислоты с защищенной карбоксильной группой и -N(R6)CONH(R7), где каждый R6 и R7, которые могут быть одинаковыми или разными, обозначает циклическую (C3-C6)-алкильную группу или (C1-C5)-алкильную группу, необязательно замещенную третичной аминогруппой; t означает целое число от 5 до 11500; каждое d, e, f, g, h, i и j независимо означает целое число от 0 до 200, при условии, что d+e означает целое число от 1 до 200, и d+e+f+g+h+i+j означает целое число от 3 до 200, и что соответствующие составляющие единицы полиаспарагиновой кислоты являются связанными в любом порядке.
(5) Высокомолекулярный конъюгат подофиллотоксинов согласно п. (4) выше, где R1 является (C1-C6)-алкильной группой; R2 является (C2-C6)-алкиленовой группой; R3 является (C1-C6)-ацильной группой; t является целым числом от 8 до 2300; и каждое d, e, f, g, h, i и j независимо является целым числом от 0 до 100, при условии, что d+e является целым числом от 1 до 100 и d+e+f+g+h+i+j является целым числом от 6 до 100.
(6) Высокомолекулярный конъюгат подофиллотоксинов согласно п. (5) выше, где R1 является (C1-C3)-алкильной группой; R2 является (C2-C4)-алкиленовой группой; R3 является (C1-C3)-ацильной группой; t является целым числом от 100 до 300; и каждое d, e, f, g, h, i и j независимо является целым числом от 0 до 90, при условии, что d+e является целым числом от 1 до 90 и d+e+f+g+h+i+j является целым числом от 15 до 90.
(7) Высокомолекулярный конъюгат подофиллотоксинов согласно любому из (1)-(6) выше, где подофиллотоксины являются подофиллотоксином, этопозидом или тенипозидом.
(8) Высокомолекулярный конъюгат подофиллотоксинов, полученный сложноэфирным связыванием карбоксильной группы полимера, имеющего фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, с гидроксильной группой подофиллотоксинов с использованием дегидратирующего конденсирующего агента в органическом растворителе.
(9) Способ получения высокомолекулярного конъюгата подофиллотоксинов согласно любому из (1)-(7) выше, включающий сложноэфирное связывание карбоксильной группы полимера, имеющего фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, с гидроксильной группой подофиллотоксинов с использованием дегидратирующего конденсирующего агента в органическом растворителе.
(10) Противораковый агент, содержащий высокомолекулярный конъюгат подофиллотоксинов согласно любому из (1)-(8) выше в качестве активного ингредиента.
Эффекты изобретения
Высокомолекулярный конъюгат подофиллотоксинов согласно настоящему изобретению способен высвобождать лекарственное средство независимо от гидролизующих ферментов в организме, почти не подвержен влиянию индивидуальных различий и, предположительно, может обладать эффективным терапевтическим действием.
Лучший вариант осуществления изобретения
Высокомолекулярный конъюгат подофиллотоксинов согласно настоящему изобретению характеризуется тем, что карбоксильная группа полимера, имеющего фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, связана сложноэфирной связью с гидроксильной группой подофиллотоксинов.
Согласно настоящему изобретению, термин «фрагмент моноамида янтарной кислоты» означает структуру -HNCO-C-C-CO2H, и примеры включают моноамид янтарной кислоты (-HNCO-CH2-CH2-CO2H), структуру, в которой одна или две карбоксильные группы в аспарагиновой кислоте являются амидированными (-HNCO-CH(-NH-)-CH2CO2H или -HNCO-CH2-CH(-NH-)-CO2H) и т.п. Эти фрагменты моноамида янтарной кислоты могут составлять полимерную главную цепь, например, как в случае полиаспарагиновой кислоты, или могут быть связаны с функциональными группами главной полимерной цепи, составленной многоатомным спиртом, таким как декстран, полиамином, таким как полилизин, или поликарбоновой кислотой, отличной от полиаспарагиновой кислоты (например, полимолочной кислотой и т.п.).
Примеры полимера, имеющего фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, включают полимер привитого типа, в котором фрагмент полиэтиленгликоля и фрагменты моноамида янтарной кислоты гребнеобразно ответвляются от основной полимерной цепи, и полимер блочного типа (блок-сополимер), в котором полимер, имеющий фрагмент полиэтиленгликоля и фрагменты моноамида янтарной кислоты, расположены последовательно на одной линии, и т.п.
Когда два или более фрагментов моноамида янтарной кислоты образуют полиаспарагиновую кислоту, полимер привитого типа также включает в себя полимер, в котором фрагмент полиэтиленгликоля частично связан с главной цепью полиаспарагиновой кислоты, и т.п., тогда как полимер блочного типа включает в себя полимер, в котором концевая группа полиаспарагиновой кислоты связана с концевой группой полиэтиленгликолевого фрагмента, и т.п.
Фрагмент полиэтиленгликоля в полимере высокомолекулярного конъюгата подофиллотоксинов согласно настоящему изобретению включает в себя полиэтиленгликоль, в котором обе концевые группы или одна концевая группа модифицированы. Когда модифицированы обе концевые группы, модифицирующие группы могут быть одинаковыми или разными. Примеры модифицирующих групп включают (C1-C6)-алкильную группу, необязательно имеющую заместитель. Примеры (C1-C6)-алкильной группы, необязательно имеющей заместитель, включают следующие алкильные группы и, предпочтительно, являются (C1-C4)-алкильной группой, включающей, например, метильную группу, этильную группу, н-пропильную группу, н-бутильную группу и т.п. Примеры заместителя в (C1-C6)-алкильной группе, необязательно имеющей заместитель, включают, например, аминогруппу, метиламиногруппу, диметиламиногруппу, этиламиногруппу, диэтиламиногруппу и т.п.
Молекулярная масса фрагмента полиэтиленгликоля составляет примерно 300-500000, предпочтительно, примерно 500-100000, более предпочтительно, примерно 1000-50000.
Молекулярная масса полимера, имеющего фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, согласно настоящему изобретению, составляет примерно 500-600000, предпочтительно, примерно 600-110000, и более предпочтительно, примерно 800-80000.
Согласно настоящему изобретению, термин «молекулярная масса» относится к средневзвешенной молекулярной массе, определенной способом GPC (gel permeation chromatography - гельпроникающей хроматографии).
В высокомолекулярном конъюгате подофиллотоксинов согласно настоящему изобретению количество подофиллотоксинов, связанных с полимером, имеющим фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, составляет 1-100%, предпочтительно, 1-90%, более предпочтительно, 2-60%, в расчете на общее число карбоксильных групп.
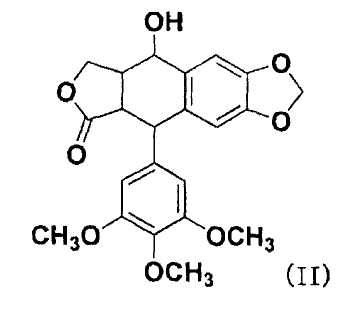
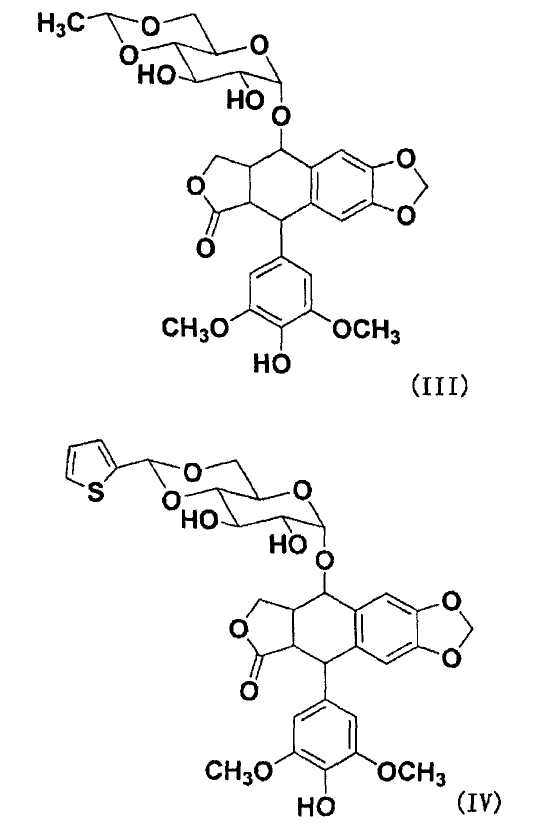
Согласно настоящему изобретению, на подофиллотоксины не накладывают конкретных ограничений, при условии, что они являются подофиллотоксинами, имеющими гидроксильную группу и противораковую активность. Примеры подофиллотоксинов включают подофиллотоксин, представленный следующей формулой (II), этопозид, представленный следующей формулой (III), тенипозид, представленный следующей формулой(IV), и т.п. Примеры гидроксильной группы подофиллотоксинов включают, например, спиртовую гидроксильную группу следующей формулы (II), спиртовую гидроксильную группу на фрагменте сахара или фенольную гидроксильную группу на бензольном кольце следующей формулы (III) или следующей формулы (IV), и положение заместителя гидроксильной группы не ограничено.
Высокомолекулярный конъюгат подофиллотоксинов согласно настоящему изобретению может включать конъюгат, образованный либо через спиртовую гидроксильную группу подофиллотоксинов, либо через фенольную гидроксильную группу подофиллотоксинов, либо через их смесь. В качестве альтернативы, можно также применять высокомолекулярный конъюгат, в котором на одной молекуле могут быть смешаны подофиллотоксины, связанные через спиртовую гидроксильную группу, и подофиллотоксины, связанные через фенольную кислотную группу.
В качестве двух или более фрагментов моноамида янтарной кислоты согласно настоящему изобретению предпочтительной является полиаспарагиновая кислота.
Предпочтительные высокомолекулярные конъюгаты подофиллотоксинов согласно настоящему изобретению включают соединение, представленное выше общей формулой (I), где R1 обозначает атом водорода или (С1-С6)-алкильную группу; R2 обозначает связывающую группу; R3 обозначает атом водорода или (C1-C6)-ацильную группу; R4 обозначает остаток гидроксильной группы подофиллотоксинов; R5 обозначает группу, выбранную из группы, состоящей из (C1-C30)-алкоксигруппы, (C7-C30)-аралкилоксигруппы, (C1-C30)-алкиламиногруппы, ди-(C1-C30)-алкиламиногруппы, аминокислоты с защищенной карбоксильной группой и -N(R6)CONH(R7), где каждый R6 и R7, которые могут быть одинаковыми или разными, обозначает циклическую (C3-C6)-алкильную группу или (C1-C5)-алкильную группу, необязательно замещенную третичной аминогруппой; t означает целое число от 5 до 11500; и каждое d, e, f, g, h, i и j независимо означает целое число от 0 до 200, при условии, что d+e означает целое число от 1 до 200 и d+e+f+g+h+i+j означает целое число от 3 до 200, и что соответствующие составляющие единицы полиаспарагиновой кислоты связаны в любом порядке.
Примеры (C1-C6)-алкильной группы для R1 в общей формуле (I) включают (C1-C6)-алкильную группу с прямой или разветвленной цепью, включая, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, н-гексильную группу и т.п., и предпочтительной является (С1-С4)-алкильная группа с прямой или разветвленной цепью, и особо предпочтительной является (С1-С3)-алкильная группа с прямой или разветвленной цепью, включая, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, и более особо предпочтительной является метильная группа.
Примеры связывающей группы, обозначенной как R2 в общей формуле (I), включают, но не ограничиваются конкретно ими, (C2-C6)-алкиленовую группу. Предпочтительной является (C2-C4)-алкиленовая группа, включая, например, этиленовую группу, триметиленовую группу, бутиленовую группу и т.п., и особо предпочтительной является триметиленовая группа.
Примеры (C1-C6)-ацильной группы для R3 в общей формуле (I) включают, но не ограничиваются конкретно ими, формильную группу, ацетильную группу, пропионильную группу, пивалоильную (триметилацетильную) группу и т.п. Предпочтительной является (C1-C3)-ацильная группа, и особо предпочтительна ацетильная группа.
В отношении остатка гидроксильной группы подофиллотоксинов для R4 в общей формуле (I), примеры подофиллотоксинов включают указанные подофиллотоксины и на них не накладываются конкретные ограничения, при условии, что подофиллотоксины имеют гидроксильную группу, способную связываться с фрагментом карбоновой кислоты полимера через сложноэфирную связь с использованием дегидратирующего конденсирующего агента, и имеют противораковую активность. Примеры подофиллотоксинов включают подофиллотоксин, представленный указанной формулой (II), этопозид, представленный указанной формулой (III), тенипозид, представленный указанной формулой (IV), и т.п.
R5 в общей формуле (I) обозначает группу, выбранную из группы, состоящей из (C1-C30)-алкоксигруппы, (C7-C30)-аралкилоксигруппы, (C1-C30)-алкиламиногруппы, ди-(C1-C30)-алкиламиногруппы, аминокислоты с защищенной карбоксильной группой и -N(R6)CONH(R7), где каждый R6 и R7, которые могут быть одинаковыми или разными, являются (C3-C6)-циклоалкильной группой или (C1-C5)-алкильной группой, необязательно замещенной третичной аминогруппой. R5 в общей формуле (I) могут быть одинаковыми или разными в одной молекуле, и полимер в высокомолекулярном конъюгате подофиллотоксинов может включать один тип или комбинированный тип R5.
Примеры (C1-C30)-алкоксигруппы включают (C1-C30)-алкоксигруппу с прямой или разветвленной цепью, и предпочтительной является (С1-С10)-алкоксигруппа с прямой или разветвленной цепью, включая, например, метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, трет-бутоксигруппу и т.п. Примеры (C7-C30)-аралкилоксигруппы включают (С7-С12)-аралкилоксигруппу с прямой или разветвленной цепью, и предпочтительной является (С1-С10)-аралкилоксигруппа с прямой или разветвленной цепью, включая, например, 4-фенилбутоксигруппу и т.п.
Примеры (C1-C30)-алкиламиногруппы или ди-(C1-C30)-алкиламиногруппы включают (C1-C30)-алкиламиногруппу с прямой или разветвленной цепью или ди-(С1-С30)-алкиламиногруппу с прямой или разветвленной цепью, и предпочтительной является (С1-С20)-алкиламиногруппа или ди-(С1-С20)-алкиламиногруппа с прямой или разветвленной цепью, включая, например, метиламиногруппу, этиламиногруппу, н-пропиламиногруппу, изопропиламиногруппу, н-бутиламиногруппу, трет-бутиламиногруппу, диметиламиногруппу, диэтиламиногруппу, ди-(н-бутил)-аминогруппу и т.п.
Примеры аминокислоты с защищенной карбоксильной группой включают аминокислоту, обычно используемую в пептидном синтезе, в которой карбоксильная группа является защищенной, включая, например бензиловый эфир фенилаланина и т.п.
Примеры группы -N(R6)CONH(R7), где R6 и R7, которые могут быть одинаковыми или разными, являются (C3-C6)-циклоалкильной группой или (C1-C5)-алкильной группой, необязательно замещенной третичной аминогруппой, включают, но не ограничиваются конкретно ими, например, циклогексиламинокарбонилциклогексиламиногруппу, изопропиламинокарбонилизопропиламиногруппу и т.п.
Полиаспарагиновая кислота, которая составлена из двух или более фрагментов моноамида янтарной кислоты в высокомолекулярном конъюгате подофиллотоксинов, представленном общей формулой (I) согласно настоящему изобретению, включает составляющие единицы α-аминокислотного типа, β-аминокислотного типа, циклизированного типа и т.п. Эти составляющие единицы связаны в любом порядке и могут быть связаны так, чтобы образовывать форму блочного типа или форму произвольного типа.
Общее число остатков аспарагиновой кислоты в полиаспарагиновой кислоте высокомолекулярного конъюгата подофиллотоксинов, представленного общей формулой (I), представлено выражением «d+e+f+g+h+i+j» и может быть определено из количества производного аспарагиновой кислоты, использованного для получения блок-сополимера. Число остатков аспарагиновой кислоты (d+e+f+g+h+i+j) равно примерно 3-200, предпочтительно, примерно 6-100, особо предпочтительно, 15-90.
Отношение числа остатков аспарагиновой кислоты, связанных с подофиллотоксинами (d+e), к общему числу остатков аспарагиновой кислоты (d+e+f+g+h+i+j) равно 1-100%, предпочтительно, 3-90%, более предпочтительно, 4-60%. Кроме того, число остатков аспарагиновой кислоты (d+e) равно примерно 1-200, предпочтительно, примерно 1-100, особо предпочтительно, примерно 1-90.
Количество остатков аспарагиновой кислоты, с которыми связаны подофиллотоксины (d+e), можно определить, например, из количества не прореагировавших подофиллотоксинов, оставшихся в реакционной жидкости после проведения реакции дегидратационной конденсации для связывания подофиллотоксинов сложноэфирной связью в органическом растворителе, как показано в последующих примерах.
Отношение α-аминокислотного типа (d+f+h) к общему числу остатков аспарагиновой кислоты (d+e+f+g+h+i+j) равно 10-100%, предпочтительно, 20-100%. Отношение β-аминокислотного типа (e+g+i) равно 0-90%, предпочтительно, 0-80%. Отношение можно изменять соответствующим образом, например, подходящим образом выбирая условия снятия защиты для защитной группы в полиаспарагиновой кислоте и т.п.
В общей формуле (I) t означает целое число от примерно 5 до 11500, предпочтительно, целое число от примерно 8 до 2300, более предпочтительно, целое число от примерно 100 до 300.
Высокомолекулярный конъюгат подофиллотоксинов согласно настоящему изобретению может образовывать мицеллы с фрагментами полиэтиленгликоля в качестве внешней оболочки в воде.
Высокомолекулярный конъюгат подофиллотоксинов согласно настоящему изобретению получают сложноэфирным связыванием карбоксильной группы полимера, имеющего фрагмент полиэтиленгликоля и два или более фрагментов моноамида янтарной кислоты, с гидроксильной группой подофиллотоксинов, применяя дегидратирующий конденсирующий агент в органическом растворителе, и настоящее изобретение также включает способ получения; т.е. способ получения, по которому, например, блок-сополимер полиэтиленгликолевого фрагмента с полиаспарагиновой кислотой, полученный способом, описанным в Патентном Документе 2, и подофиллотоксины, в которых, при необходимости, защищены функциональные группы, отличные от реагирующей группы, подвергают реакции с применением дегидратирующего конденсирующего агента, такого как дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIPC), гидрохлорид 1-этил-3-(3-диметиламинопропил)-карбодиимида (WSC) или 1-этоксикарбонил-2-этокси-1,2-дигидроксихинолинон (EEDQ), при температуре 0-180°C, предпочтительно, при 5-50ºC, в органическом растворителе, в котором растворяют оба вещества, предпочтительно, в апротонном полярном растворителе, таком как N,N-диметилформамид (DMF), 1,3-диметил-2-имидазолидинон (DMI) или N-метилпирролидон (NMP). Кроме того, в реакции конденсации можно также применять вспомогательное реакционное средство, такое как N,N-диметиламинопиридин (DMAP). После реакции конденсации, при необходимости, проводят снятие защиты и применяют традиционные операции разделения, очистки и т.п. для получения высокомолекулярного конъюгата подофиллотоксинов.
Кроме того, высокомолекулярный конъюгат подофиллотоксинов, в котором R5 является группой -N(R6)CONH(R7), (где каждый R6 и R7, которые могут быть одинаковыми или разными, является (C3-C6)-циклоалкильной группой или (C1-C5)-алкильной группой, необязательно замещенной третичной аминогруппой), может также быть получен по реакции, использующей указанные карбодиимиды в качестве конденсирующего агента.
В качестве способа введения (C1-C30)-алкоксигруппы, (C7-C30)-аралкилоксигруппы, (C1-C30)-алкиламиногруппы, ди-(С1-С30)-алкиламиногруппы или аминокислоты с защищенной карбоксильной группой в качестве R5 в соединение общей формулы (I) можно указать способ, в котором карбоксильную группу полимера сначала активируют, а затем подвергают реакции с соответствующим спиртом, соответствующим амином или аминокислотой с защищенной карбоксильной группой и т.п. в количестве, вводимом в оснòвных (щелочных) условиях; способ, в котором соответствующий спирт, соответствующий амин, аминокислоту с защищенной карбоксильной группой и т.п. сначала активируют, а затем подвергают реакции с полимером, и т.п. После очистки полимера можно той же самой реакцией реактивировать любые не прореагировавшие карбоксильные группы полимера и реактивированные карбоксильные группы можно сконденсировать с гидроксильной группой подофиллотоксинов. В качестве альтернативы, можно повторно (неоднократно) провести реакции с другими спиртами, аминами и т.п. для синтеза смеси полимеров, имеющих разные заместители в качестве R5, с которыми затем можно сконденсировать подофиллотоксины. Кроме того, после конденсации полимера с подофиллотоксинами можно ввести (C1-C30)-алкоксигруппу, (C7-C30)-аралкилоксигруппу, (C1-C30)-алкиламиногруппу, ди-(C1-C30)-алкиламиногруппу, аминокислоту с защищенной карбоксильной группой и т.п.
Способ получения высокомолекулярного конъюгата подофиллотоксинов согласно настоящему изобретению не предназначен для ограничения указанными способами.
Настоящее изобретение также включает противораковые средства, содержащие высокомолекулярный конъюгат подофиллотоксинов согласно настоящему изобретению в качестве активного ингредиента. Высокомолекулярный конъюгат можно применять в дозированной форме, которую применяют традиционно, включая, например, инъекции, таблетки, порошки и т.п. Для получения лекарственной формы можно применять фармацевтически приемлемые традиционно применяемые носители, например, связующие, смазывающие средства, дезинтеграторы, растворители, эксципиенты, солюбилизаторы, диспергенты, стабилизаторы, суспендирующие средства, консерванты, смягчающие средства, красители, отдушки и т.п. Из них предпочтительным является применение в качестве инъекции, и обычно применяют, например, воду, физиологический раствор соли, 5% раствор глюкозы или маннита, водорастворимые органические растворители (например, глицерин, этанол, диметилсульфоксид, N-метилпирролидон, полиэтиленгликоль, кремофор и т.п. и их смеси), смеси воды и водорастворимых органических растворителей и т.п.
Разумеется, доза высокомолекулярного конъюгата подофиллотоксинов согласно настоящему изобретению может варьировать в зависимости от пола, возраста, физиологических условий (состояний), (природы) патологии и т.п. у пациентов, и высокомолекулярный конъюгат вводят парентерально, обычно в дозе 0,01-500 мг/м2, предпочтительно, 0,1-250 мг/м2, в качестве активного ингредиента в день для взрослого. Введение посредством инъекции проводят внутривенно, внутриартериально, в пораженное место (место опухоли) и т.п.
Примеры
Далее в настоящем описании настоящее изобретение будет проиллюстрировано более конкретно со ссылкой на Примеры, что не предполагает ограничения этими примерами.
Пример 1
Синтез соединения 1 (конъюгат этопозида и блок-сополимера фрагмента метоксиполиэтиленгликоля, имеющего молекулярную массу 12000, и фрагмента полиаспарагиновой кислоты, имеющего степень полимеризации 35: общая формула (I), в которой R1=Me (метильная группа), R2=триметиленовая группа, R3=Ac (ацетильная группа), R4=остаток этопозида, R5=изопропиламинокарбонилизопропиламиногруппа, d+e+f+g+h+i+j=35, t=273)
Блок-сополимер метоксиполиэтиленгликоля с полиаспарагиновой кислотой (степень полимеризации аспарагиновой кислоты: 35, 1,80 г), полученный согласно способу, описанному в Патентном Документе 3, и коммерчески доступный этопозид (700 мг) растворяли в DMF (70 мл) и добавляли DMAP (72 мг) и DIPC (1,25 мл). Смесь перемешивали в течение 20 часов при 25°C. К реакционной жидкости добавляли этанол (105 мл), этилацетат (105 мл) и диизопропиловый эфир (840 мл) и смесь перемешивали в течение 120 минут при комнатной температуре. После этого осадок собирали фильтрованием и промывали смесью этанола с диизопропиловым эфиром (1/4 (по объему), 100 мл). Полученный осадок растворяли в смеси ацетонитрила с водой (1/1 (по объему), 210 мл) и затем раствор пропускали через колонку ионообменной смолы (Dowex 50 (H+), произведенной Dow Chemical Company, 15 мл) и элюировали смесью ацетонитрила с водой (1/1 (по объему), 30 мл). После добавления воды (140 мл) к полученной таким образом элюированной фракции отгоняли ацетонитрил при пониженном давлении и затем остаток высушивали из замороженного состояния, получая соединение 1 (2,06 г).
На основании количества не прореагировавшего этопозида в реакционной жидкости, определенного HPLC (high performance liquid chromatography - высокоэффективной жидкостной хроматографией), содержание этопозида в соединении 1 было определено равным 16,5% (по массе) и отношение (d+e) к (d+e+f+g+h+i+j) было определено равным 15%. В соединении 1 свободный этопозид не был детектирован.
Согласно этому способу, в качестве R5 может быть добавлена изопропиламинокарбонилизопропиламиногруппа, и с помощью1Н-ЯМР (спектр водородного ядерного магнитного резонанса) было определено относительное содержание данной группы с использованием соединения 1, растворенного в смеси дейтероксида натрия, оксида дейтерия и дейтерированного ацетонитрила. Отношение изопропиламинокарбонилизопропиламиногруппы к полиаспарагиновой кислоте соединения 1, т.е. отношение (f+g) к (d+e+f+g+h+i+j) составляло 19,6%. Остальные остатки аспарагиновой кислоты были в форме свободной карбоновой кислоты (h+i) или циклической структуры (j).
Пример 2
Синтез соединения 2 (конъюгат подофиллотоксина и блок-сополимера фрагмента метоксиполиэтиленгликоля, имеющего молекулярную массу 12000, и фрагмента полиаспарагиновой кислоты, имеющего степень полимеризации 35: общая формула (I), в которой R1=Me (метильная группа), R2=триметиленовая группа, R3=Ac (ацетильная группа), R4=остаток подофиллотоксина, R5=изопропиламинокарбонилизопропиламиногруппа, d+e+f+g+h+i+j=35, t=273)
Блок-сополимер метоксиполиэтиленгликоля с полиаспарагиновой кислотой (степень полимеризации аспарагиновой кислоты: 35, 226 мг), полученный согласно способу, описанному в Патентном Документе 3, и коммерчески доступный подофиллотоксин (106 мг) растворяли в DMF (5 мл) и добавляли DMAP (12 мг) и DIPC (0,16 мл). Смесь перемешивали в течение 20 часов при 25ºC. К реакционной жидкости добавляли этанол (15 мл) и диизопропиловый эфир (60 мл) и смесь перемешивали в течение 120 минут при комнатной температуре. Затем осадок собирали фильтрованием и промывали смесью этанола с диизопропиловым эфиром (1/4 (по объему), 10 мл). Полученный осадок растворяли в смеси ацетонитрила с водой (1/1 (по объему), 10 мл) и затем раствор пропускали через колонку ионообменной смолы (Dowex 50 (H+), произведенной Dow Chemical Company, 2,5 мл) и элюировали смесью ацетонитрила с водой (1/1 (по объему), 5 мл). После добавления воды (10 мл) к полученной таким образом элюированной фракции отгоняли ацетонитрил при пониженном давлении. Затем остаток высушивали из замороженного состояния, получая соединение 2 (220 мг).
На основании количества не прореагировавшего подофиллотоксина в реакционной жидкости, определенного HPLC (high performance liquid chromatography - высокоэффективной жидкостной хроматографией), содержание подофиллотоксина в соединении 2 было определено равным 10,6% (по массе) и отношение (d+e) к (d+e+f+g+h+i+j) было определено равным 13,1%. В соединении 2 свободный подофиллотоксин не был детектирован.
Согласно этому способу, в качестве R5 может быть добавлена изопропиламинокарбонилизопропиламиногруппа, и с помощью1Н-ЯМР было определено относительное содержание данной группы с использованием соединения 2, растворенного в смеси дейтероксида натрия, оксида дейтерия и дейтерированного ацетонитрила. Отношение изопропиламинокарбонилизопропиламиногруппы к полиаспарагиновой кислоте соединения 2, т.е. отношение (f+g) к (d+e+f+g+h+i+j) составляло 15,2%. Остальные остатки аспарагиновой кислоты были в форме свободной карбоновой кислоты (h+i) или циклической структуры (j).
Пример 3
Синтез соединения 3 (конъюгат подофиллотоксина и блок-сополимера фрагмента метоксиполиэтиленгликоля, имеющего молекулярную массу 12000, и фрагмента полиаспарагиновой кислоты, имеющего степень полимеризации 33: общая формула (I), в которой R1=Me (метильная группа), R2=триметиленовая группа, R3=Ac (ацетильная группа), R4=остаток подофиллотоксина, R5=изопропиламинокарбонилизопропиламиногруппа или О-бензилфенилаланильная группа, d+e+f+g+h+i+j=33, t=273)
Блок-сополимер метоксиполиэтиленгликоля с полиаспарагиновой кислотой (степень полимеризации аспарагиновой кислоты: 33, 464,4 мг), полученный согласно способу, описанному в Патентном Документе 3, и коммерчески доступный подофиллотоксин (100 мг) растворяли в DMF (6 мл) и добавляли DMAP (12 мг) и DIPC (0,09 мл). Смесь перемешивали в течение 20 часов при 15ºC. После этого добавляли гидрохлорид бензилового сложного эфира фенилаланина (36,8 мг), триэтиламин (0,02 мл) и DIPC (0,23 мл) и затем перемешивали в течение следующих 4 часов при 25ºС. К реакционной жидкости добавляли этилацетат (10 мл), этанол (10 мл) и диизопропиловый эфир (80 мл) и смесь перемешивали в течение 30 минут при комнатной температуре. Затем осадок собирали фильтрованием и промывали смесью этанола с диизопропиловым эфиром (1/4 (по объему), 20 мл). Полученный осадок растворяли в смеси ацетонитрила с водой (1/1 (по объему), 20 мл) и затем раствор пропускали через колонку ионообменной смолы (Dowex 50 (H+), произведенной Dow Chemical Company, 3 мл) и элюировали смесью ацетонитрила с водой (1/1 (по объему), 20 мл). После добавления воды (25 мл) к полученной таким образом элюированной фракции отгоняли ацетонитрил при пониженном давлении и затем остаток высушивали из замороженного состояния, получая соединение 3 (580 мг).
На основании количества не прореагировавшего подофиллотоксина в реакционной жидкости, определенного HPLC (high performance liquid chromatography - высокоэффективной жидкостной хроматографией), содержание подофиллотоксина в соединении 3 было определено равным 13,7% (по массе) и отношение (d+e) к (d+e+f+g+h+i+j) было определено равным 19%. В соединении 3 свободный подофиллотоксин не был детектирован.
О-бензилфенилаланильная группа, введенная в качестве одного из R5, была определена анализом количества бензилового спирта, высвобождаемого гидролизом соединения 3 в растворе гидроксида натрия в смеси ацетонитрила с водой при 40ºС в течение 6 часов. Отношение О-бензилфенилаланильной группы, связанной с (f+g), к (d+e+f+g+h+i+j) составляло 13%.
Кроме того, в качестве R5 может быть также добавлена изопропиламинокарбонилизопропиламиногруппа, и с помощью1Н-ЯМР (спектра водородного ядерного магнитного резонанса) было определено относительное содержание данной группы с использованием соединения 3, растворенного в смеси дейтероксида натрия, оксида дейтерия и дейтерированного ацетонитрила. Отношение изопропиламинокарбонилизопропиламиногруппы к полиаспарагиновой кислоте, т.е. отношение изопропиламинокарбонилизопропиламиногруппы, связанной с (f+g), к (d+e+f+g+h+i+j) составляло 15%. В результате, отношение общего количества R5 к полиаспарагиновой кислоте, т.е. отношение (f+g) к (d+e+f+g+h+i+j) составляло 28%. Остальные остатки аспарагиновой кислоты были в форме свободной карбоновой кислоты (h+i) или циклической структуры (j).
Сравнительный Пример 1
Синтез сравнительного соединения 1 (конъюгат этопозида и блок-сополимера фрагмента метоксиполиэтиленгликоля, имеющего молекулярную массу 12000, и фрагмента полиглутаминовой кислоты, имеющего степень полимеризации 23)
Блок-сополимер метоксиполиэтиленгликоля с полиглутаминовой кислотой (21 мг), полученный согласно способу, описанному в выложенной японской патентной заявке (KOKAI) № 5-955, и коммерчески доступный этопозид (9,6 мг) растворяли в DMF (1 мл) и добавляли DMAP (0,6 мг) и DIPC (0,01 мл). Смесь перемешивали в течение 20 часов при 25ºC. К реакционной жидкости добавляли этанол (1,5 мл), этилацетат (1,5 мл) и диизопропиловый эфир (12 мл) и смесь перемешивали в течение 30 минут при комнатной температуре. Затем осадок собирали фильтрованием и промывали смесью этанола с диизопропиловым эфиром (1/4 (по объему), 2 мл). Полученный осадок растворяли в смеси ацетонитрила с водой (1/1 (по объему), 3 мл) и затем раствор пропускали через колонку ионообменной смолы (Dowex 50 (H+), произведенной Dow Chemical Company, 0,2 мл) и элюировали смесью ацетонитрила с водой (1/1 (по объему), 1 мл). После добавления воды (1 мл) к полученной таким образом элюированной фракции отгоняли ацетонитрил при пониженном давлении и затем остаток высушивали из замороженного состояния (лиофилизовывали), получая сравнительное соединение 1 (28,0 мг).
На основании количества не прореагировавшего этопозида в реакционной жидкости, определенного HPLC, содержание этопозида в сравнительном соединении 1 было определено равным 23,8% (по массе). В сравнительном соединении 1 свободный этопозид не был детектирован.
Сравнительный Пример 2
Синтез сравнительного соединения 2 (конъюгат подофиллотоксина и блок-сополимера фрагмента метоксиполиэтиленгликоля, имеющего молекулярную массу 12000, и фрагмента полиглутаминовой кислоты, имеющего степень полимеризации 23)
Блок-сополимер метоксиполиэтиленгликоля с полиглутаминовой кислотой (52 мг), полученный согласно способу, описанному в выложенной японской патентной заявке (KOKAI) № 5-955, и коммерчески доступный подофиллотоксин (10 мг) растворяли в DMF (1 мл) и добавляли DMAP (2 мг) и DIPC (0,03 мл). Смесь перемешивали в течение 20 часов при 25ºC. К реакционной жидкости добавляли этанол (3 мл) и диизопропиловый эфир (12 мл) и смесь перемешивали в течение 30 минут при комнатной температуре. Затем осадок собирали фильтрованием и промывали смесью этанола с диизопропиловым эфиром (1/4 (по объему), 2 мл). Полученный осадок растворяли в смеси ацетонитрила с водой (1/1 (по объему), 3 мл) и затем раствор пропускали через колонку ионообменной смолы (Dowex 50 (H+), произведенной Dow Chemical Company, 0,2 мл) и элюировали смесью ацетонитрила с водой (1/1 (по объему), 1 мл). После добавления воды (1 мл) к полученной таким образом элюированной фракции отгоняли ацетонитрил при пониженном давлении. После этого остаток высушивали из замороженного состояния, получая сравнительное соединение 2 (64,3 мг).
На основании количества не прореагировавшего подофиллотоксина в реакционной жидкости, определенного HPLC, содержание подофиллотоксина в сравнительном соединении 2 составляло 16,0% (по массе). В сравнительном соединении 2 свободный подофиллотоксин не был детектирован.
Тестовый Пример 1
Высвобождение лекарственного средства из соединения 1 в отсутствие ферментов
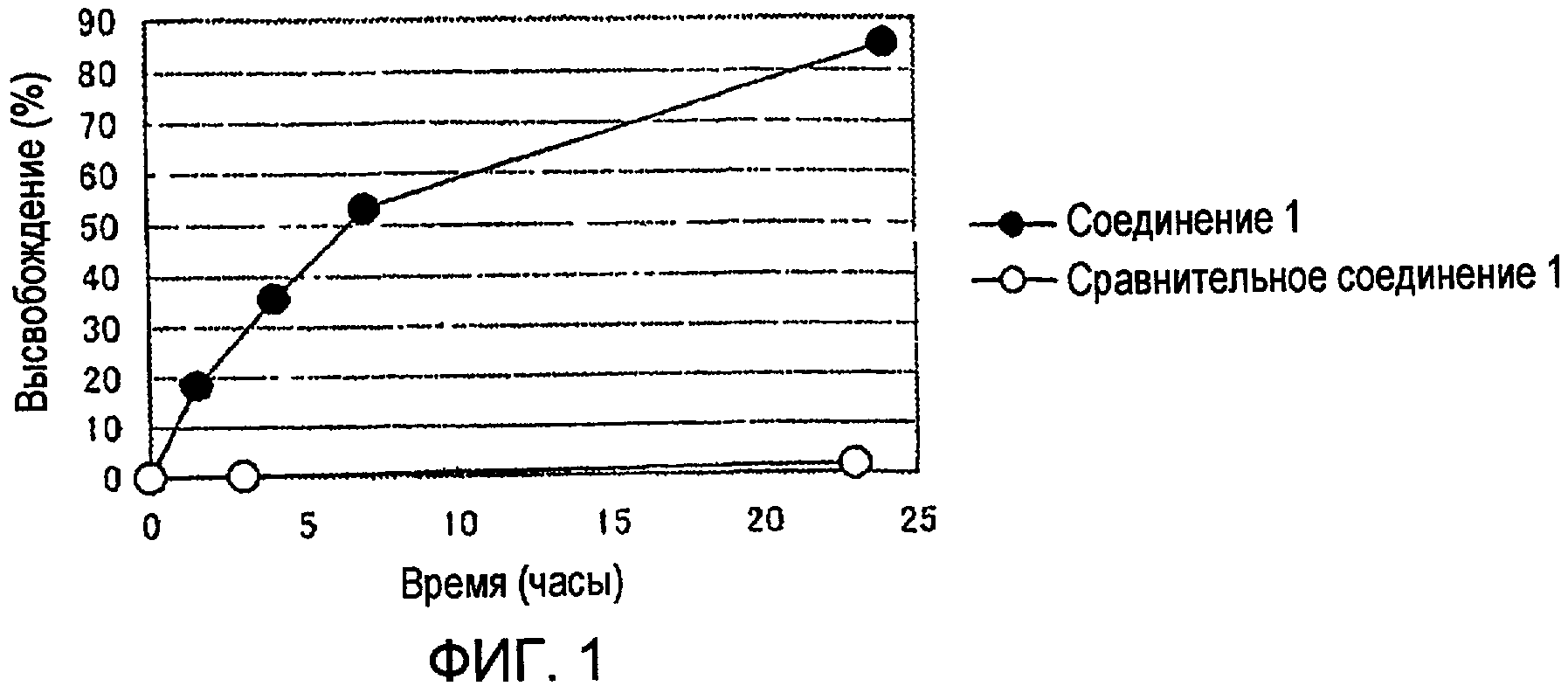
Соединение 1 или сравнительное соединение 1 растворяли в PBS (физиологическом растворе соли с фосфатным буфером, рН 7,1) до концентрации полимера, равной 1 мг/мл, и раствор инкубировали при 37ºС. Этопозид, высвободившийся из высокомолекулярного конъюгата, отделяли и количественно определяли с помощью HPLC в сравнении со стандартной кривой. Отношение определенной величины к общему количеству лекарственного средства, определенному из содержания лекарственного средства в высокомолекулярном конъюгате, показано на Фиг. 1.
Как видно из Фиг. 1, высокомолекулярный конъюгат согласно настоящему изобретению (соединение 1) высвобождает 85% или более этопозида за 24 часа в отсутствие гидролизующих ферментов, тогда как сравнительное соединение 1, не имеющее фрагмента моноамида янтарной кислоты, практически не высвобождает этопозид в течение 24 часов. Этот результат демонстрирует превосходную эффективность высвобождения лекарственного средства высокомолекулярного конъюгата этопозида согласно настоящему изобретению в отсутствие ферментов.
Тестовый Пример 2
Высвобождение лекарственного средства из соединений 2 и 3 в отсутствие ферментов
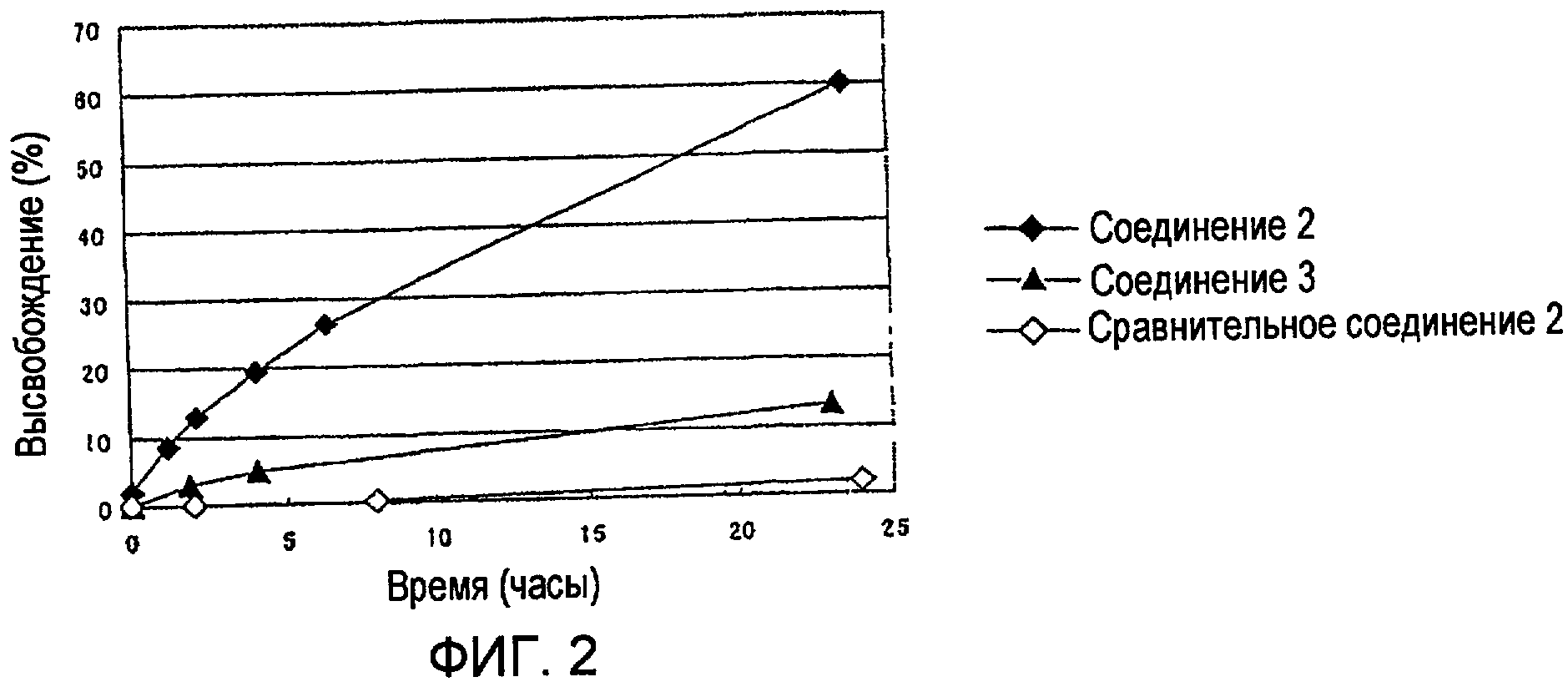
Соединения 2 и 3 или сравнительное соединение 2 растворяли в PBS (физиологическом растворе соли с фосфатным буфером, рН 7,1) до концентрации полимера, равной 1 мг/мл, и раствор инкубировали при 37ºС. Подофиллотоксин, высвободившийся из высокомолекулярного конъюгата, отделяли и количественно определяли с помощью HPLC в сравнении со стандартной кривой. Отношение определенной величины к общему количеству лекарственного средства, определенному из содержания лекарственного средства высокомолекулярного конъюгата, показано на Фиг. 2.
Как видно из Фиг. 2, высокомолекулярный конъюгат согласно настоящему изобретению (соединения 2 и 3) высвобождали 10-60% или более подофиллотоксина за 24 часа в отсутствие гидролизующих ферментов, тогда как сравнительное соединение 2, не имеющее фрагмента моноамида янтарной кислоты, практически не высвобождало подофиллотоксин в течение 24 часов. Этот результат демонстрирует превосходную эффективность высвобождения лекарственного средства высокомолекулярного конъюгата подофиллотоксина согласно настоящему изобретению в отсутствие ферментов. Кроме того, было показано, что эффективность высвобождения лекарственного средства можно легко контролировать.
Тестовый Пример 3
Противоопухолевый эффект соединения 1
Рак толстой кишки мыши, Colon 26, поддерживаемый серийными подкожными субкультурами в мышах, разрезали на квадратные фрагменты размером примерно 2 мм и эти фрагменты троакаром трансплантировали под кожу спины самкам мышей CDF1. Через семь дней после трансплантации опухоли в хвостовую вену мыши внутривенно однократно вводили высокомолекулярный конъюгат согласно настоящему изобретению (соединение 1) или контрольное лекарственное средство (этопозид, ЕТР). Контрольная группа означает группу, в которой лекарственное средство не вводили. Соединение 1 растворяли в 5% растворе глюкозы для инъекции и применяли. Препарат ЕТР, Rastet injection (произведенный Nippon Kayaku Co., Ltd.) разбавляли 5% раствором глюкозы для инъекции и применяли. После введения большую ось (L, мм) и малую ось (W, мм) опухоли измеряли штангенциркулем и рассчитывали объем опухоли по формуле: (L×W2)/2. Таблица 1 показывает отношение объема опухоли к объему опухоли в день введения. Изменения массы тела в течение этого периода времени также показаны в Таблице 1 как отношение массы тела к массе тела в день введения.
Таблица 1 демонстрирует, что высокомолекулярный конъюгат согласно настоящему изобретению обладает большей противораковой активностью, чем ЕТР, в дозе (450 мг/кг), вызывающей снижение массы тела в той же степени, что и доза ЕТР (90 мг/кг), и поэтому может служить противораковым средством.
Тестовый Пример 4: Противоопухолевое действие соединений 2 и 3
Рак толстой кишки мыши, Colon 26, поддерживаемый серийными подкожными субкультурами в мышах, разрезали на квадратные фрагменты размером примерно 2 мм и эти фрагменты троакаром трансплантировали под кожу спины самкам мышей CDF1. Через семь дней после трансплантации опухоли (в Таблице 2 - день начала введения) в хвостовую вену мыши внутривенно вводили высокомолекулярный конъюгат согласно настоящему изобретению (соединение 2 и соединение 3) или контрольное лекарственное средство (подофиллотоксин, POD). Соединение 2 и соединение 3 растворяли в 5% растворе глюкозы для инъекции и вводили однократно. Контрольная группа означает группу, в которой лекарственное средство не вводили. Препарат POD, закупленный у Sigma-Aldrich Company, разбавляли 5% раствором глюкозы для инъекции и вводили в течение 5 последовательных дней со дня начала введения. После введения большую ось (L, мм) и малую ось (W, мм) опухоли измеряли штангенциркулем и рассчитывали объем опухоли по формуле: (L×W2)/2. Таблица 2 показывает отношение объема опухоли к объему опухоли в день начала введения. Изменения массы тела в течение этого периода времени также показаны в Таблице 2 как отношение массы тела к массе тела в день введения.
Таблица 2 демонстрирует, что высокомолекулярные конъюгаты согласно настоящему изобретению обладают большей противораковой активностью, чем POD, при введенном количестве (75 мг/кг), вызывающем снижение массы тела в той же степени, что и POD (15 мг/кг в день, введенный в течение 5 последовательных дней), несмотря на однократное введение, и поэтому могут служить противораковым средством.
Краткое описание чертежей
Фиг. 1 показывает отношение количества этопозида, высвобожденного из соединения 1 (высокомолекулярного производного, в котором этопозид связан с полиаспарагиновой кислотой блок-сополимера) или сравнительного соединения 1 (высокомолекулярного производного, в котором этопозид связан с полиглутаминовой кислотой блок-сополимера) в растворах PBS (рН 7,1, 37ºС), к общему количеству связанного этопозида. На Фиг. 1 -●- обозначает процентную долю количества, высвобожденного из соединения 1 согласно настоящему изобретению, и -○- обозначает процентную долю количества, высвобожденного из сравнительного соединения 1.
Фиг. 2 показывает отношение количества подофиллотоксина, высвобожденного из соединения 2 или соединения 3 согласно настоящему изобретению (высокомолекулярных производных, в которых подофиллотоксин связан с полиаспарагиновой кислотой блок-сополимера) или сравнительного соединения 2 (высокомолекулярного производного, в котором подофиллотоксин связан с полиглутаминовой кислотой блок-сополимера) в растворах PBS (pH 7,1, 37ºC), к общему связывающему количеству подофиллотоксина. На Фиг. 2 -♦- обозначает процентную долю количества, высвобожденного из соединения 2 согласно настоящему изобретению, -▲- обозначает процентную долю количества, высвобожденного из соединения 3, и -◊- обозначает процентную долю количества, высвобожденного из сравнительного соединения 2.
Реферат
Изобретение относится к противораковым агентам, содержащим высокомолекулярный конъюгат подофиллотоксинов. Предложен противораковый агент, содержащий высокомолекулярный конъюгат подофиллотоксинов, представленный формулой (I), где R1 - водород или (С1-С6)-алкильная группа; R2 - связывающая группа; R3 - водород или (С1-С6)-ацильная группа; R4 - остаток гидроксильной группы подофиллотоксинов; R5 выбран из (С1-С30)-алкоксигруппы, (С7-С30)-аралкилоксигруппы, (С1-С30)-алкиламиногруппы, ди-(С1-С30)-алкиламиногруппы, аминокислоты с защищенной карбоксильной группой и -N(R6)CONH(R7), где каждый R6 и R7, которые могут быть одинаковыми или разными, обозначает циклическую (С3-С6)-алкильную группу или (С1-С5)-алкильную группу, необязательно замещенную третичной аминогруппой; t=5-11500; каждое d, е, f, g, h, i и j независимо - целое число от 0 до 200, при условии, что d+e - целое число от 1 до 200, и d+e+f+g+h+i+j - целое число от 3 до 200, и что соответствующие составляющие единицы полиаспарагиновой кислоты являются связанными в любом порядке. Технический результат - предложенный противораковый агент растворим в воде и имеет высокую терапевтическую активность. 3 з.п. ф-лы, 2 ил., 2 табл., 3 пр.
Формула
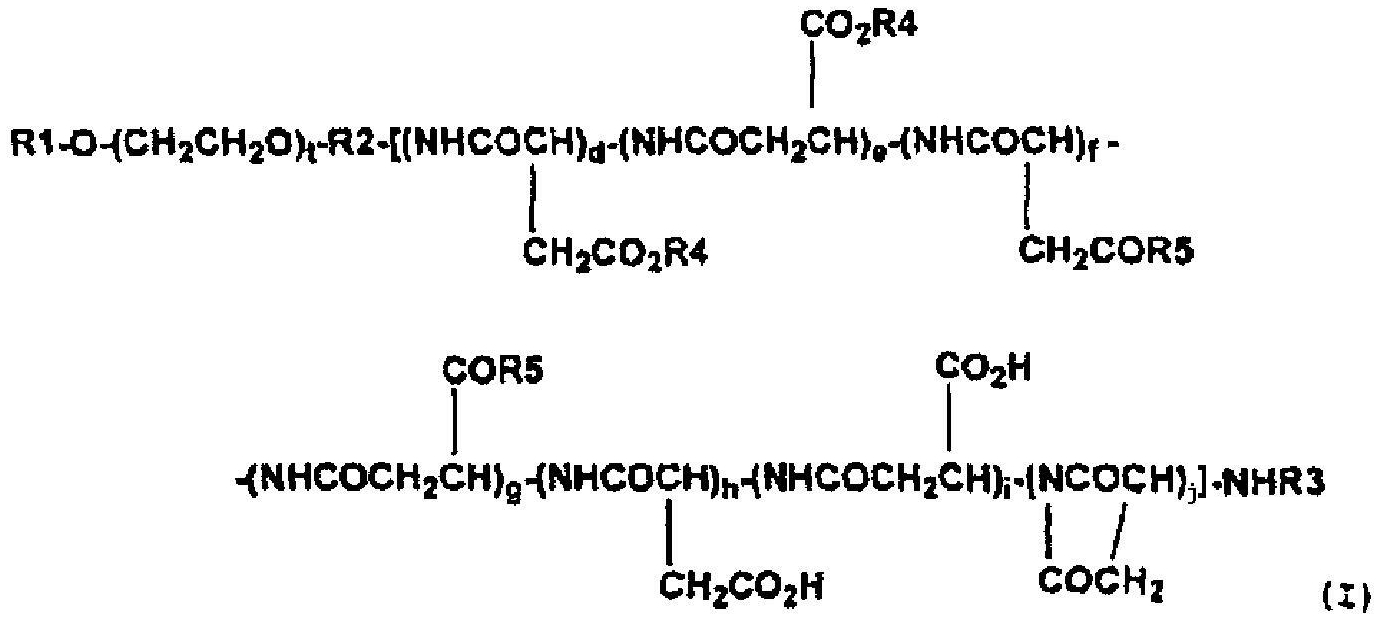
где R1 обозначает атом водорода или (С1-С6)-алкильную группу; R2 обозначает связывающую группу; R3 обозначает атом водорода или (С1-С6)-ацильную группу; R4 обозначает остаток гидроксильной группы подофиллотоксинов; R5 обозначает группу, выбранную из группы, состоящей из (С1-С30)-алкоксигруппы, (С7-С30)-аралкилоксигруппы, (С1-С30)-алкиламиногруппы, ди-(С1-С30)-алкиламиногруппы, аминокислоты с защищенной карбоксильной группой и -N(R6)CONH(R7), где каждый R6 и R7, которые могут быть одинаковыми или разными, обозначает циклическую (С3-С6)-алкильную группу или (С1-С5)-алкильную группу, необязательно замещенную третичной аминогруппой; t означает целое число от 5 до 11500; каждое d, е, f, g, h, i и j независимо означает целое число от 0 до 200, при условии, что d+e означает целое число от 1 до 200, и d+e+f+g+h+i+j означает целое число от 3 до 200, и что соответствующие составляющие единицы полиаспарагиновой кислоты являются связанными в любом порядке.
Документы, цитированные в отчёте о поиске
Композиции, включающие биологический агент

Комментарии