Аминный сольват ингибитора натрий-глюкозного котранспортера и способ его получения и его применение - RU2710230C1
Код документа: RU2710230C1
Чертежи






Описание
Область техники
Настоящее изобретение относится к области разработки лекарственных средств и, в частности относится к аминному сольвату ингибитора натрий-зависимого глюкозного котранспортера и способу его получения и его применению.
Предшествующий уровень техники
Диабет представляет собой нарушение обмена веществ с рецидивирующей или стойкой гипергликемией. Ненормальные уровни глюкозы в крови могут приводить к серьезным и хроническим осложнениям, включая сердечно-сосудистое заболевание, хроническую почечную недостаточность, повреждение сетчатки, поражение нервов, микрососудистое повреждение и ожирение.
На ранней стадии лечения диабета контроль диеты и лечебная физкультура представляют собой предпочтительный способ контроля уровня глюкозы в крови. Когда данными способами трудно достичь контроля уровня глюкозы в крови, для лечения нужен инсулин или пероральные гипогликемические лекарственные средства. Существует множество гипогликемических лекарственных средств, используемых в настоящее время в клиническом лечении, включая соединения бигуаниды, соединения сульфонилмочевины, агенты, улучшающие инсулинорезистентность, ингибиторы α-глюкозидазы и тому подобное. Однако данные лекарственные средства не способны удовлетворять требованиям длительного лечения вследствие разных токсичных эффектов. Например, соединения бигуаниды могут вызывать лактатацидоз; соединения сульфонилмочевины могут приводить к гипогликемии; агенты, улучшающие инсулинорезистентность, могут вызывать эдему и сердечную недостаточность; и ингибиторы α-глюкозидазы могут вызывать симптомы, такие как боли в области живота, вздутие, диарея и тому подобное. При рассмотрении указанной выше ситуации необходимо разработать более безопасные и более эффективные новые противодиабетические лекарственные средства для удовлетворения требованиям лечения диабета.
Обнаружено, что регуляция транспорта глюкозы в клетках главным образом достигается двумя главными членами семейства белков транспортеров глюкозы (GLUT) (пассивный транспорт) и натрий-зависимых глюкозных котранспортеров (SGLT) (активный транспорт). Члены семейства SGLT с функцией транспорта глюкозы главным образом расположены в кишечнике и проксимальном канальце почки и тому подобное. Соответственно, можно сделать вывод о том, что члены семейства SGLT играют ключевую роль во всасывании глюкозы в кишечнике и обратном захвате глюкозы в почке, и они стали одной из идеальных потенциальных мишеней в отношении лечения диабета.
В частности, член семейства белок SGLT-1 главным образом расположен в клетках слизистой кишечника тонкой кишки, с меньшим уровнем экспрессии в сердечной мышце и почке. Главным образом, он совместно действует с белком GLUT для регуляции всасывания глюкозы в кишечнике. Другой член семейства белок SGLT-2 главным образом является ответственным за регуляцию обратного захвата глюкозы в почках благодаря его высокому уровню экспрессии в почках, то есть когда глюкоза в моче проходит через клубочек, она может активно присоединяться к эпителиальным клеткам почечного канальца и транспортироваться в клетки посредством SGLT-2 и повторно циркулировать. Во время данного процесса SGLT-2 отвечает за 90% обратного всасывания и остающиеся 10% обратного всасывания осуществляется SGLT-1. Теория о SGLT-2, как главном белке-транспортере, была дополнительно подтверждена в испытаниях на животных. Уровень мРНК SGLT-2 в клетках коркового вещества почки крысы снижается специфичными антисмысловыми олигонуклеотидами SGLT-2, таким образом, значительно подавляя обратный захват глюкозы в почке крысы. На основе данных результатов можно сделать вывод о том, что если разработать ингибитор SGLT (SGLT-1/SGLT-2), через регуляцию его функции транспорта глюкозы, возможно, с одной стороны, контролировать всасывание глюкозы в кишечнике и, с другой стороны, ингибировать обратный захват глюкозы в почке и усиливать выделение глюкозы из мочи, достигая, таким образом, более систематичного гипогликемического эффекта и становясь идеальным лекарственным средством для лечения диабета.
Кроме того, также обнаружили, что ингибитор SGLT может быть полезным в лечении осложнений, связанных с диабетом, таких как ретинопатия, нейропатия, нефропатия, инсулинорезистентность, вызванная нарушениями метаболизма глюкозы, гиперинсулинемия, гиперлипидемия, ожирение и тому подобное. Ингибитор SGLT также можно объединять с существующими терапевтическими агентами, такими как сульфонамиды, тиазолидиндионы, метформин, инсулин и тому подобное, которые могут снижать дозировку лекарственных средств, не воздействуя на эффективность, так чтобы избегать или уменьшать возникновение вредных эффектов и улучшать соблюдение пациентами данного лечения.
Кратко, в качестве нового лекарственного средства лечения диабета ингибитор SGLT имеет хорошие перспективы развития. Таким образом, существует срочная необходимость в разработке эффективного соединения, которое было бы безопасным и обладало бы хорошими фармакокинетическими свойствами для лечения диабета и связанных нарушений обмена веществ. В патентной заявке WO2015/032272A1, поданной Jiangsu Hansoh Pharmaceuticals Co., Ltd. в 2015 году, описана серия соединений, которые ингибируют SGLT, где наиболее репрезентативное соединение формулы (I) выглядит следующим образом:

Его химическим названием является: (1S,2S,3S,4R,5S)-5-(3-((2,3- дигидробензо[b][1,4]диоксин-6-ил)метил)-4-этилфенил)-1-(гидроксиметил)-6,8-диоксабицикло[3.2.1]октан-2,3,4-триол. Данное соединение оказывает очень значительное ингибирующее действие на SGLT2 и также оказывает значительное ингибирующее действие на SGLT1, вследствие этого, предполагается его разрабатывать в качестве одиночного ингибитора SGLT2 или двойного ингибитора SGLT2/SGLT1. Однако данная серия соединений обычно представлена в форме масла или пенистого твердого вещества вследствие свойства их структуры, и специалист в данной области не мог получить соответствующее состояние агрегации во время процесса разработки лекарственного средства. В Примере 9 патентной заявки WO2015/032272A1 описывается только лишь соединение формулы (I) в аморфной форме, его рентгеновская порошковая дифрактограмма показана на Фиг. 8. Содержащиеся там примеси также сложно удалить посредством очистки. Таким образом, существует срочная необходимость в разработке формы агрегации, подходящей для разработки лекарственного средства, так чтобы удовлетворять требованиям фармацевтической композиции для клинического исследования и маркетинга.
Краткое описание изобретения
Для устранения дефекта предшествующего уровня техники, после глубокого исследования автор изобретения обнаружил, что соединение формулы (I) (1S,2S,3S,4R,5S)-5-(3-((2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-4-этилфенил)-1-(гидроксиметил)-6,8-диоксабицикло[3.2.1]октан-2,3,4-триол можно объединять с аминным реагентом, получая, таким образом, аминный сольват соединения формулы (I) в твердой форме, особенно сольват амина соединения формулы (I) в кристаллической форме. Полученный аминный сольват соединения формулы (I) может удовлетворять требованиям дальнейшей разработки лекарственного средства. Он имеет очень важное значение клинического применения и, как ожидается, разрабатывается в новое поколение ингибитора SGLT.
В одном аспекте настоящее изобретение предлагает аминный сольват соединения формулы (I) (1S,2S,3S,4R,5S)-5-(3-((2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-4-этилфенил)-1-(гидроксиметил)-6,8-диоксабицикло[3.2.1]октан-2,3,4-триол, амин выбран из группы, состоящей из метиламина, диметиламина, этиламина, диэтиламина, пропиламина, дипропиламина, трипропиламина, 1,2-диметилпропиламина, циклопропиламина, диизопропиламина, триэтиламина, н-бутиламина, изобутиламина, трет-бутиламина, втор-бутиламина, диизобутиламина, гексиламина, дициклогексиламина, дециламина, додециламина, триэтаноламина, аллиламина, этаноламина, 3-пропаноламина, изопропаноламина, диизопропаноламина, триизопропаноламина, диметилэтаноламина, диэтилэтаноламина, этилендиамина, 1,3-пропандиамина, 1,4-бутандиамина, 1,5-пентандиамина, 1,6-гександиамина, морфолина и пиперазина.
В другом предпочтительном воплощении амин выбран из группы, состоящей из диэтиламина, диизопропиламина, триэтаноламина, триизопропаноламина, этилендиамина и 1,3-пропандиамина.
В другом предпочтительном воплощении аминный сольват соединения формулы (I) представляет собой твердое соединение.
В другом более предпочтительном воплощении аминный сольват соединения формулы (I) представляет собой кристаллическое соединение.
В другом предпочтительном воплощении аминный сольват соединения формулы (I) представляет собой диэтиламинны сольват соединения формулы (I).
Рентгеновская порошковая дифрактограмма диэтиламинного сольвата соединения формулы (I) содержит пики при угле дифракции (2θ) 13,78±0,2°, 17,02±0,2°, 16,48±0,2° и 12,46±0,2°.
В другом предпочтительном воплощении рентгеновская порошковая дифрактограмма диэтиламинного сольвата соединения формулы (I) дополнительно содержит пики при угле дифракции (2θ) 23,94±0,2°, 18,74±0,2°, 18,76±0,2°, 15,72±0,2° и 20,68±0,2°.
В другом более предпочтительном воплощении рентгеновская порошковая дифрактограмма диэтиламинного сольвата соединения формулы (I) дополнительно содержит пики при угле дифракции (2θ) 10,82±0,2°, 21,58±0,2°, 23,26±0,2°, 25,16±0,2°, 25,58±0,2° и 24,26±0,2°.
В наиболее предпочтительном воплощении рентгеновская порошковая дифрактограмма диэтиламинного сольвата соединения формулы (I) содержит по существу те же пики при углах дифракции (2θ), как показано в Таблице 1.
Таблица 1
В другом более предпочтительном воплощении элементарная ячейка диэтиламинного сольвата соединения формулы (I) представляет собой ортогональную систему, пространственная группа, P212121, a равно 8,2642 (4) Å, b равно 8,3582 (4) Å, c равно 39,994 (2) Å и объем элементарной ячейки 2762,5 (2) Å3.
В другом аспекте настоящее изобретение предлагает способ получения аминного сольвата соединения формулы (I), включающий следующие стадии:
Стадия 1): приведение соединения формулы (I) в контакт с подходящим аминным реагентом;
Стадия 2): добавление соответствующего количества антирастворителя до помутнения раствора, или добавление затравочного кристалла или их комбинации, затем продолжение осаждения кристалла; и
Стадия 3): разделение твердой и жидкой фазы с получением аминного сольвата соединения формулы (I).
В другом предпочтительном воплощении аминный реагент на стадии 1) способа получения аминного сольвата соединения формулы (I) представляет собой чистый жидкий аминный реагент, водный аминный реагент или смесь аминного реагента и органического растворителя, и аминный реагент выбран из группы, состоящей из метиламина, диметиламина, этиламина, диэтиламина, пропиламина, дипропиламина, трипропиламина, 1,2-диметилпропиламина, циклопропиламина, диизопропиламина, триэтиламина, н-бутиламина, изобутиламина, трет-бутиламина, втор-бутиламина, диизобутиламина, гексиламина, дициклогексиламина, дециламина, додециламина, триэтаноламина, аллиламина, этаноламина, 3-пропаноламина, изопропаноламина, диизопропаноламина, триизопропаноламина, диметилэтаноламина, диэтилэтаноламина, этилендиамина, 1,3-пропандиамина, 1,4-бутандиамина, 1,5-пентандиамина, 1,6-гександиамина, морфолина и пиперазина.
В другом предпочтительном воплощении контакт соединения формулы (I) с подходящим аминным реагентом на стадии 1) может быть осуществлен посредством растворения соединения формулы (I) в подходящем аминном реагенте или растворения соединения формулы (I) в подходящем органическом растворителе с последующим добавлением подходящего аминного реагента.
Растворение относится к традиционной операции, известной специалистам в данной области. Можно постепенно проводить нагревание должным образом или увеличение количества растворителя для растворения вещества или для того, чтобы сделать раствор прозрачным. Подразумевается, что модификации или эквивалентные замены технических решений включены в объем настоящего изобретения.
В другом предпочтительном воплощении антирастворитель на стадии 2) содержит воду, н-гептан, н-гексан, изооктан, пентан, циклогексан, циклопентан, диэтиловай эфир или их смесь, но не ограничивается ими.
В другом более предпочтительном воплощении органический растворитель, используемый в способе получения аминного сольвата соединения формулы (I), содержит метанол, этанол, н-пропанол, изопропанол, н-бутанол, ацетонитрил, ацетон, метилэтилкетон, тетрагидрофуран, диоксан, N, N-диметилформамид, диметилсульфоксид, этилацетат, изопропилацетат, дихлорметан, трихлорэтан, четырёххлористый углерод, метил-трет-бутиловый эфир, диизопропиловый эфир, бензол, толуол, ксилол или их смесь, но не ограничивается ими.
В другом аспекте настоящее изобретение предлагает фармацевтическая композиция, содержащая терапевтически эффективное количество аминного сольвата соединения формулы (I) и фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к применению упомянутого выше аминного сольвата соединения формулы (I) или фармацевтической композиции, содержащей тот же аминный сольват соединения формулы (I), в получении лекарственного средства для ингибирования натрий-зависимых глюкозных котранспортеров (SGLT).
В другом аспекте настоящее изобретение относится к применению указанного выше аминного сольвата соединения формулы (I) или фармацевтической композиции, содержащей тот же аминный сольват соединения формулы (I), в получении лекарственного средства для ингибирования белка SGLT-1, лекарственного средства для ингибирования белка SGLT-2 или лекарственного средства для двойного ингибирования белка SGLT-1 и белка SGLT-2.
В другом аспекте настоящее изобретение относится к применению аминного сольвата соединения формулы (I) или фармацевтической композиции, содержащей тот же аминный сольват соединения формулы (I), в получении лекарственного средства для лечения или задержки развития или приступа заболевания, выбранного из группы, состоящей из диабета, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии, инсулинорезистентности, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот или глицерина, гиперлипидемии, ожирения, гипертриглицеридемии, метаболического синдрома, осложнений диабета, атеросклероза и гипертензии.
Настоящее изобретение также относится к упомянутому выше аминному сольвату соединения формулы (I) или фармацевтической композиции, содержащей тот же аминный сольват соединения формулы (I), для применения в качестве ингибитора SGLT, особенно ингибитора SGLT-1, ингибитора SGLT-2, двойного ингибитора SGLT-1 и SGLT-2.
Настоящее изобретение также относится к упомянутому выше аминному сольвату соединения формулы (I) или фармацевтической композиции, содержащей тот же аминный сольват соединения формулы (I), для применения в лечении или задержке развития или приступа диабета, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии, инсулинорезистентности, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот или глицерина, гиперлипидемии, ожирения, гипертриглицеридемии, метаболического синдрома, осложнений диабета, атеросклероза или гипертензии.
В другом аспекте настоящее изобретение предлагает способ ингибирования SGLT, включающий введение терапевтически эффективного количества аминного сольвата соединения формулы (I) или фармацевтической композиции, содержащей тот же аминный сольват соединения формулы (I), нуждающемуся в этом пациенту.
В другом аспекте настоящее изобретение предлагает способ лечения диабета, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии, инсулинорезистентности, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот или глицерина, гиперлипидемии, ожирения, гипертриглицеридемии, метаболического синдрома, осложнений диабета, атеросклероза и гипертензии, включающий введение терапевтически эффективного количества указанного выше аминного сольвата соединения формулы (I) или фармацевтической композиции, содержащей тот же аминный сольват соединения формулы (I), нуждающемуся в этом пациенту.
Описание графических материалов
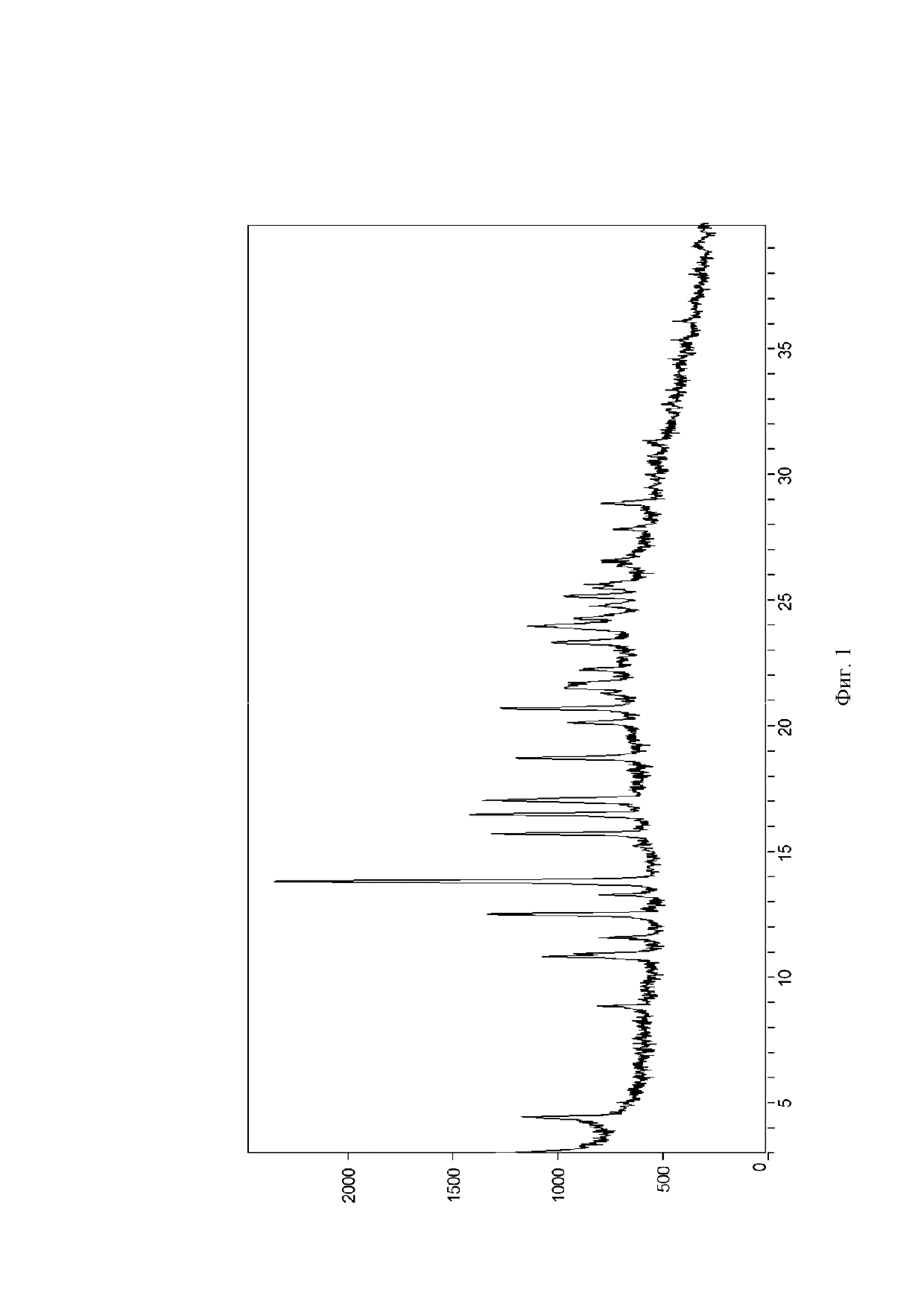
На Фиг. 1 показана рентгеновская порошковая дифрактограмма кристаллической формы I; на оси X представлен угол дифракционного пика 2θ(°), на оси Y представлена интенсивность пика.
На Фиг. 2 показана картина дифференциальной сканирующей калориметрии кристаллической формы I; на оси X представлена температура (°C), на оси Y представлен тепловой поток (W/G).
На Фиг. 3 показана картина термогравиметрического анализа кристаллической формы I; на оси X представлена температура (°C), на оси Y представлена выраженная в процентах потеря массы (%).
На Фиг. 4 показана рентгеновская порошковая дифрактограмма кристаллической формы I перед (верхняя кривая) и после (нижняя кривая) динамического испытания поглощения влаги. На оси X представлен угол дифракционного пика 2θ(°), на оси Y представлена интенсивность пика.
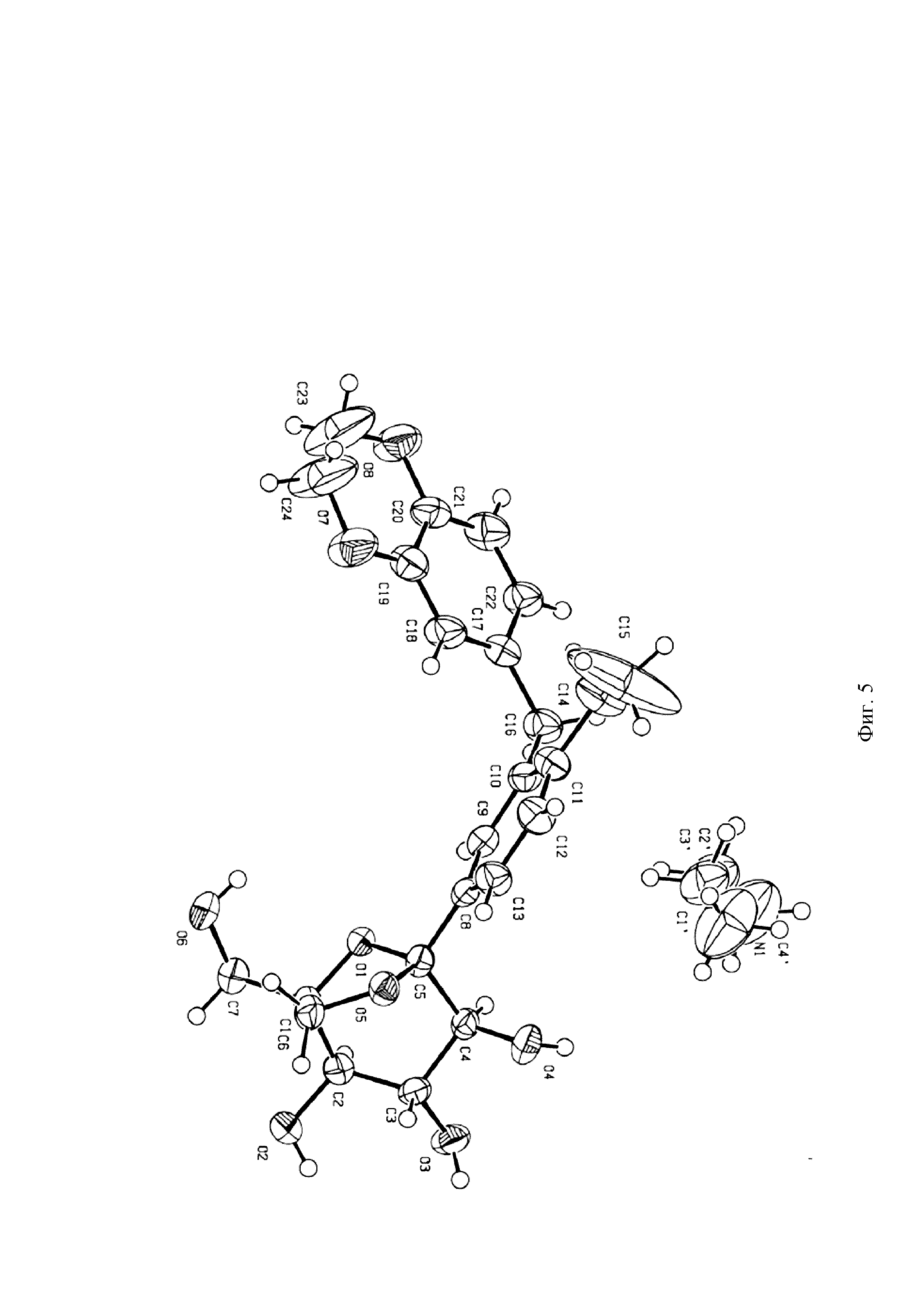
На Фиг. 5 показана схема монокристаллической структуры кристаллической формы I.
На Фиг. 6 показана схема упаковки элементарной ячейки кристаллической формы I.
На Фиг. 7 показана диаграмма сравнения смоделированной порошковой дифрактограммы монокристалла (нижняя кривая) и измеренной порошковой дифрактограммы кристаллической формы I (верхняя кривая). На оси X представлен угол дифракционного пика 2θ(°), на оси Y представлена интенсивность пика.
На Фиг. 8 показана рентгеновская порошковая дифрактограмма аморфного соединения формулы (I;) на оси X представлен угол дифракционного пика 2θ(°), на оси Y представлена интенсивность пика.
Подробное описание изобретения
1. Термины
Термин «фармацевтически приемлемый», в том виде, в котором он используется в данном документе, относится к тем соединениям, веществам, композициям и/или лекарственным формам, которые, согласно обоснованному врачебному решению, подходят для контакта с тканями человека и животных без избыточной токсичности, раздражения, аллергической реакции или других проблематичных осложнений в соответствии с разумным отношением польза/риск. В определенных предпочтительных воплощениях кристаллические структуры соединения по настоящему изобретению находятся по существу в чистой форме.
Термин «по существу чистый», в том виде, в котором он используется в данном документе, обозначает соединение, обладающее чистотой, приблизительно 90% и более, включая, например, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% и приблизительно 100%.
Термин «полиморф», в том виде, в котором он используется в данном документе, относится к кристаллическим формам, имеющим одинаковый химический состав, но разное пространственное расположение молекул, атомов и/или ионов, образующих кристалл. Несмотря на то, что полиморфы имеют одинаковый химический состав, они различаются по упаковке и геометрическому расположению, и могут демонстрировать разные физические свойства, такие как температура плавления, форма, цвет, плотность, твердость, способность деформироваться, стабильность, растворимость, скорость растворения и похожие свойства. В зависимости от их взаимосвязи температура-стабильность, два полиморфа могут быть либо монотропными, либо энантиотропными. Для монотропной системы относительная стабильность у двух твердых фаз остается неизменной при изменении температуры. Напротив, в энантиотропной системе существует температура перехода, при которой стабильность двух фаз меняется ((Theory and Origin of Polymorphism in “Polymorphism in Pharmaceutical Solids” (1999) ISBN:)-8247-0237). Явление соединения, существующего в разных кристаллических структурах, называется явлением полиморфизма лекарственного средства.
Образцы кристаллических структур по настоящему изобретению могут быть предоставлены по существу однородностью чистой фазы, указывая на наличие доминирующего количества монокристаллической структуры и необязательно небольших количеств одной или более чем одной кристаллической структуры. Наличие более чем одной кристаллической структуры настоящего изобретения в образце можно определять методиками, такими как рентгеновская порошковая дифракция (XRPD) или спектроскопия ядерного магнитного резонанса твердого тела (SSNMR). Например, при сравнении экспериментально измеренного спектра XRPD (наблюдаемого) со смоделированным спектром XRPD (рассчитанным) наличие лишних пиков может указывать на более чем одну кристаллическую структуру в образце. Смоделированную XRPD можно рассчитать на основе данных рентгеновского анализа монокристаллов (см. Smith, D. K., «A FORTRAN Program for Calculating X-Ray Powder Diffraction Patterns», Lawrence Radiation Laboratory, Livermore, California, UCRL-7196, April 1963; также см. Yin. S., Scaringe, R. P., DiMarco, J., Galella, M. and Gougoutas, J.Z., American Pharmaceutical Review, 2003, 6, 2, 80). Предпочтительно, кристаллическая структура обладает по существу однородностью чистой фазы, как указано, меньше чем 10%, предпочтительно меньше чем 5% и более предпочтительно меньше чем 2% от общей площади пиков в экспериментально измеренном спектре XRPD возникающих лишних пиков, которые отсутствуют в смоделированном спектре XRPD. Наиболее предпочтительной является кристаллическая структура по настоящему изобретению, обладающая по существу однородностью чистой фазы меньше чем 1% от общей площади пиков в экспериментально измеренном спектре XRPD возникающих лишних пиков, которые отсутствуют в смоделированном спектре XRPD.
Разные кристаллические структуры по настоящему изобретению можно различать между собой посредством применения разных аналитических методик, известных специалистам в данной области. Такие методики включают рентгеновскую порошковую дифракцию (XRPD), дифференциальную сканирующую калориметрию (DSC) и термогравиметрический анализ (TGA), но не ограничиваются ими.
Кристаллические структуры настоящего изобретения можно получать разными способами, включая, например, кристаллизацию или перекристаллизацию из подходящего растворителя, сублимацию, рост из расплава, трансформацию твердого тела из другой фазы, кристаллизацию из сверхкритической жидкости и струйное распыление. Методики кристаллизации или перекристаллизации кристаллических структур из смеси растворителей включают, например, выпаривание растворителя, снижение температуры смеси растворителей, затравливание кристалла в перенасыщенной смеси растворителей молекулы и/или соли, лиофилизацию смеси растворителей и добавление антирастворителя (противорастворителя) к смеси растворителей. Методики кристаллизации с высокой пропускной способностью можно использовать для получения кристаллических структур, включая полиморфы. Кристаллы лекарственных средств, включая полиморфы, способы получения и характеристика кристаллов лекарственных средств описаны в Химии твердого состояния лекарственных средств S. R. Byrn, R. R. Pfeiffer, and J. G. Stowell, 2nd Edition, SSCI, West Lafayette, Indiana, 1999.
Затравочные кристаллы могут быть добавлены к любой смеси кристаллизации для стимуляции кристаллизации. Как очевидно специалисту в данной области, затравочный кристалл используют в качестве средства контролирования роста определенной кристаллической структуры или в качестве средства контролирования распределения размера частиц кристаллического продукта. Соответственно, расчет требуемого количества затравочного кристалла зависит от размера доступного затравочного кристалла и желаемого размера средней частицы продукта, как описано в «Programmed cooling of batch crystallizers,» J. W. Mullin and J. Nyvlt, Chemical Engineering Science, 1971, 26, 369-377. В основном, частицы малого размера нужны для эффективного контроля роста кристаллов в партии. Затравочные кристаллы малого размера могут быть получены посредством просеивания, перемалывания или тонкого измельчения кристаллов большего размера или посредством микрокристаллизации раствора. Следует отметить, что размалывание или тонкое измельчение кристаллов не приводит к какому-либо изменению в кристалличности желаемой кристаллической структуры (то есть превращению в аморфный или другой полиморф).
Термин «комнатная температура» или «КТ» в том виде, в котором он используется в данном документе, относится к температуре окружающей среды от 20 до 25°C (68-77°F).
Кристаллические структуры, эквивалентные кристаллическим структурам, описанным ниже и заявленным в данном документе, могут демонстрировать похожие, но не идентичные аналитические характеристики в пределах разумного диапазона ошибки, в зависимости от условия испытаний, чистоты, оборудования и других общепринятых переменных, известных специалистам в данной области. Соответственно, специалистам в данной области будет очевидно, что в настоящем изобретении могут быть сделаны разные модификации и варианты, не отклоняясь от объема и сущности настоящего изобретения. Другие воплощения настоящего изобретения станут очевидными специалистам в данной области из рассмотрения описания настоящего изобретения, описанного в данном документе, и из практики. Заявители предполагают, чтобы описание и примеры рассматривались в качестве иллюстративных, а не в качестве ограничивающих его объем.
2. Экспериментальные материалы
Реактивы, используемые в примерах настоящего изобретения, представляют собой имеющиеся в продаже реактивы промышленной степени чистоты или аналитической степени чистоты. Соединение получено согласно Примеру 9 патентной заявки WO2015032272A1, поданной Jiangsu Hansoh Pharmaceuticals Co., Ltd., и чистота составляет 95,1%, определенная посредством жидкостной хроматографии.
3. Методы анализа
3.1. Рентгеновская порошковая дифракция
Специалисты в данной области признают, что рентгеновский порошковый дифракционный спектр может быть получен с ошибкой измерения, которая зависит от используемых условий измерения. В частности, общеизвестно, что интенсивность в рентгеновской порошковой дифрактограмме может колебаться в зависимости от используемых условий измерения. Также следует понимать, что относительная интенсивность может также варьировать в зависимости от экспериментальных условий и, соответственно, не следует принимать во внимание точную интенсивность. Кроме того, ошибка измерения общепринятого угла рентгеновской порошковой дифракции обычно составляет примерно 5% или меньше, и такую степень ошибки измерения следует рассматривать как принадлежащую упомянутым выше углам дифракции. Следовательно, следует понимать, что кристаллические структуры по настоящему изобретению не ограничены кристаллическими структурами, которые обеспечивают точно такую же рентгеновскую порошковую дифрактограмму, как рентгеновская порошковая дифрактограмма, изображенная на Фигурах, описанных в данном документе. Любые кристаллические структуры, которые обеспечивают такую же рентгеновскую порошковую дифрактограмму, как рентгеновские порошковые дифрактограммы, описанные в графических материалах, попадают в объем настоящего изобретения. Способность определять значительную степень идентичности рентгеновской порошковой дифрактограммы находится в компетенции специалистов в данной области. Другие подходящие стандартные калибровки известны специалистам в данной области. Относительные интенсивности, однако, могут варьировать в зависимости от размера и формы кристалла.
Кристаллические формы соединения по настоящему изобретению характеризовали их рентгеновской порошковой дифрактограммой. Таким образом, рентгеновскую порошковую дифрактограмму соли собирали с помощью рентгеновского порошкового дифрактометра Bruker D8 Discover с GADDS (общая система дифракции с площадным детектором) CS с использованием Cu-Kα-излучения (1,54 Å) в режиме работы в отражённом свете. Напряжение на лампе и сила тока во время сканирования устанавливали на уровне 40кВ и 40мА, соответственно. В интервале 2θ от 3,0° до 40° образец сканировали в течение 60 секунд. Для положения пика, представленного 2θ, использовали стандарт корунд для калибровки дифрактометра. Весь анализ обычно проводили при 20°C-30°C. Данные собирали и интегрировали посредством GADDS с использованием версии 4.1.14T программы WNT. Дифрактограмму анализировали с помощью программы DiffracPlus с версией 9.0.0.2 Eva, которая была опубликована в 2003. Образец XRPD получали следующим образом: образец помещали на монокристаллическую кремниевую подложку, затем порошок образца находился под нажимом с помощью покровного стекла или эквивалента для обеспечения того, чтобы поверхность образца была ровной и обладала подходящей высотой. Затем, держатель образца помещали в прибор Bruker XRPD, и рентгеновскую порошковую дифрактограмму собирали с использованием параметров прибора, описанных выше. Измеренную разницу, связанную с результатом анализа рентгеновской порошковой дифрактограммы, получали посредством разных факторов, включая: (а) ошибку при подготовке образца (например, высота образца), (б) ошибку прибора, (в) ошибку калибровки, (г) ошибку оператора (включая те ошибки, которые встречаются при определении положений пиков) и (д) свойства вещества (например, ошибка предпочтительной ориентации). Ошибка калибровки и ошибка высоты образца приводит к сдвигам всех пиков в одном и том же направлении. В основном, калибровочный коэффициент согласует измеренные положения пиков с ожидаемыми положениями пиков и в диапазоне ожидаемых значений 2θ±0,2°.
3.2. Дифференциальная сканирующая калориметрия (DSC)
Испытания с использованием дифференциальной сканирующей калориметрии (DSC) проводили на TA InstrumentsTM, модель Q2000. Образец (приблизительно 1-6 мг) взвешивали в алюминиевую чашку и аккуратно записывали как сотню миллиграмма и переносили на прибор DSC. Прибор продували азотом при 50 мл/мин. Данные собирали при температуре от комнатной температуры до 350°C при скорости нагревания 10°C/мин. Рисунок был нанесен на график, когда эндотермические пики были направлены вниз. Однако специалисты в данной области отметят, что в измерении DSC измеренная исходная температура и максимальная температура варьируют в определенной степени в зависимости от скорости нагревания, формы кристаллов, чистоты и других измеренных параметров.
3.3. Термогравиметрический анализ (TGA)
Испытания с использованием термогравиметрического анализа (TGA) проводили на TA InstrumentsTM, модель Q500. Образец (приблизительно 10-30 мг) помещали в предварительно взвешенную алюминиевую чашку. Образец аккуратно взвешивали с помощью прибора и записывали как тысячу миллиграмма. Печь продували азотом при 100 мл/мин. Данные собирали при температуре от комнатной температуры до 300°C при скорости нагревания 10°C/мин.
Настоящее изобретение дополнительно описано посредством графических материалов и следующих примеров, которые предназначены для иллюстрирования конкретных воплощений настоящего изобретения и не должны толковаться как каким-либо образом ограничивающие объем настоящего изобретения.
Пример 1
20 мг соединения формулы (I) помещали в 4,0 мл стеклянный флакон, затем 1 мл диэтиламина добавляли в качестве позитивного растворителя, и смесь перемешивали для того, чтобы сделать ее прозрачной. 4,0 мл воды медленно добавляли в качестве антирастворителя, и смесь перемешивали посредством магнитной мешалки при комнатной температуре (20-25°C) в течение 24 часов. Кристаллический диэтиламинный сольват соединения формулы (I) (называемый кристаллической формой I в данном документе) получали посредством разделения на твердую и жидкую фазу. Рентгеновская порошковая дифрактограмма кристаллической формы показана на Фиг. 1.
Пример 2
50 мг соединения формулы (I) помещали в 10,0 мл стеклянный флакон, затем 5 мл диэтиламина добавляли в качестве позитивного растворителя, и смесь перемешивали для того, чтобы сделать ее прозрачной. Добавляли 5 мг кристалла, полученного в Примере 1, и смесь перемешивали посредством магнитной мешалки при комнатной температуре (20-25°C) в течение 24 часов. Кристаллический диэтиламинный сольват соединения формулы (I) получали посредством разделения на твердую и жидкую фазу. Рентгеновская порошковая дифрактограмма кристаллической формы по существу является такой же, как на Фиг. 1.
Пример 3
500 мг соединения формулы (I) помещали в 100,0 мл круглодонную колбу, затем 25 мл диэтиламина добавляли в качестве позитивного растворителя, и смесь перемешивали для того, чтобы сделать ее прозрачной. В качестве антирастворителя медленно добавляли 50 мл воды с последующим добавлением 20 мг кристалла, полученного в Примере 1. Затем, еще 50 мл воды медленно добавляли в качестве антирастворителя, и смесь перемешивали посредством магнитной мешалки при комнатной температуре (20-25°C) в течение 24 часов. Кристаллический диэтиламинный сольват соединения формулы (I) получали посредством разделения на твердую и жидкую фазу. Рентгеновская порошковая дифрактограмма кристаллической формы по существу является такой же, как на Фиг. 1.
Чистота полученного образца составляет 99,5%, определенная посредством высокоэффективной жидкостной хроматографии, которая существенно улучшена, по сравнению с чистотой (95,1%, определенной посредством жидкостной хроматографии) вещества для кристаллизации (получено согласно Примеру 9 патентной заявки WO2015032272A1, поданной Jiangsu Hansoh Pharmaceuticals Co., Ltd.). Это может удовлетворять требованиям клинической разработки и устранять технический дефект предшествующего уровня техники, где растворение аморфного твердого вещества и удаление растворителя проводят неоднократно, а все равно получают аморфное твердое вещество с низкой чистотой. Видно, что получение диэтиламинного сольвата из аморфного вещества в настоящем изобретении может не только предоставлять соединение в твердой форме, особенно в кристаллической форме, но также значительно улучшать чистоту образца, которая достигает уровня для клинического применения.
Результаты DSC анализа кристаллической формы I, полученной в Примерах 1-3, показали, что существует характеристический эндотермический пик при 102,8±2°C, как показано на Фиг. 2.
Результаты TGA анализа кристаллической формы I, полученной в Примерах 1-3, показали, что когда образец нагревают до 93,5°C, потеря массы составляла 1,02%, как показано на Фиг. 3. Предварительное исследование показало, что это было поверхностное поглощение воды, которым можно пренебречь.
Согласно динамическому испытанию поглощения влаги на образце кристаллической формы I, количество поглощенной воды увеличивается вместе с повышением влажности от 0% RH (относительная влажность) до 80% RH в условиях 25°C, и изменение массы составляет 0,286%. В соответствии с руководством по испытанию гигроскопичности лекарственных средств, описанному в «Pharmacopoeia of the People's Republic of China (2010 edition)», данный образец является слабогигроскопичным. В нормальных условиях хранения (то есть 25°C, 60% влажность) количество поглощенной воды составляло примерно 0%; в условиях ускоренных испытаний (то есть 75% влажность) количество поглощенной воды составляло примерно 0,191%; и в экстремальных условиях (то есть 90% влажность) количество поглощенной воды составляло 1,049%. На Фиг. 4 показана диаграмма сравнения дифрактограмм XRPD перед и после динамического испытания поглощения влаги. Видно, что кристаллическая форма образца остается неизменной перед и после динамического испытания поглощения влаги.
Пример 4
5 мг соединения формулы (I) помещали в 2,0 мл стеклянный флакон, затем в качестве позитивного растворителя добавляли 0,2 мл диэтиламина, и смесь перемешивали для того, чтобы сделать ее прозрачной. 1,0 мл воды медленно добавляли в качестве антирастворителя, и смеси давали постоять при комнатной температуре (20-25°C) в течение 1 недели. Монокристалл диэтиламинного сольвата соединения формулы (I) получали посредством разделения на твердую и жидкую фазу.
Данные по монокристаллу собирали в системе тестирования монокристаллов Bruker Apex II посредством использования Mokα-излучения (λ=0,71073Å). Индексирование и обработку измеренных данных по интенсивности проводили на Collect program button пакета программ HKL2000. Температура составляла 296K вовремя процесса сбора данных по кристаллам.
На Фиг. 5 показана структурная схема кристаллической формы I, и на Фиг. 6 показана структурная схема упаковки кристаллической формы I. На Фиг. 7 показана диаграмма сравнения смоделированной порошковой дифрактограммы монокристалла и измеренной порошковой дифрактограммы кристаллической формы I. Эксперименты показали, что порошковый кристалл, полученный в Примере 1, является по существу чистым. Параметры элементарной ячейки кристаллической формы I показаны в Таблице 2:
Таблица 2
Пример 5
Проводили исследование физической стабильности и химической стабильности диэтиламинного сольвата соединения формулы (I) и аморфного соединения формулы (I) в утяжеленном режиме. Диэтиламинный сольват соединения формулы (I), полученный в Примере 3, и аморфное соединение формулы (I) помещали в стеклянные флаконы соответственно в двухкратной повторности, примерно 10 мг каждого образца. Данные образцы для испытания стабильности помещали в инкубатор при 80°C на одну неделю. После помещения на одну неделю один образец использовали для анализа химической чистоты посредством способа ВЭЖХ (высокоэффективная жидкостная хроматография). Другой образец использовали для характеристики кристалла посредством XRPD. Физическая стабильность и химическая стабильность данных двух твердых веществ показаны в Таблице 3.
Таблица 3
Согласно указанным выше испытаниям стабильности в утяжеленном режиме диэтиламинный сольват соединения формулы (I) имел очевидные преимущества в физической стабильности и химической стабильности по сравнению с аморфным соединением формулы (I). Образец диэтиламинного сольвата соединения формулы (I) не разрушался при высокой температуре, химическая чистота по существу оставалась неизменной, и кристаллическая форма также оставалась по существу такой же. Однако аморфное соединение формулы (I) изменялось и сразу же распадалось после размещения при высокой температуре, делая сложным обеспечение качества продукта. Известно, что в области разработки лекарственных средств физическая стабильность и химическая стабильность соединения являются крайне важными для получения, хранения, транспортировки, способа изготовления, срока годности лекарственного средства и тому подобное. Вследствие этого, по сравнению с аморфным соединением формулы (I), диэтиламинный сольват соединения формулы (I), разработанный настоящим изобретением, более согласуется с потребностями клинического исследования и более предпочтителен для фармацевтической разработки.
Вкратце, аминный сольват соединения формулы (I), разработанный настоящим изобретением, обладает более высокой физической стабильностью и химической стабильностью по сравнению с аморфным агрегатным состоянием. В частности, продукт кристаллической формы I, полученный в Примерах, обладает высокой чистотой, высокой стабильностью и низкой гигроскопичностью, что облегчает получение, транспортировку и хранение лекарственного средства. Элементарные операции во время процесса, такие как очистка, обесцвечивание, фильтрация и тому подобное, также являются простыми и нетрудными для выполнения, так что он обладает очевидными преимуществами. Таким образом, аминный сольват соединения формулы (I) по настоящему изобретению имеет значительные улучшения по сравнению с ранее описанным аморфным соединением формулы (I) и удовлетворяет требованиям клинической разработки лекарственных средств.
Наконец, следует отметить, что упомянутые выше примеры используют только для иллюстрации технического решения настоящего изобретения, но не предназначены для ограничения объема настоящего изобретения. Несмотря на то, что настоящее изобретение было подробно описано со ссылкой на предпочтительные примеры, специалист в данной области поймет, что техническое решение настоящего изобретения может быть модифицировано или эквивалентно изменено без отклонения от сущности и объема настоящего изобретения, и такие модификации и изменения должны быть включены в формулу изобретения настоящего изобретения.
Реферат
Изобретение относится к применимому в медицине и фармацевтической промышленности диэтиламинному сольвату соединения формулы (I):,имеющему одну молекулу диэтиламина на одну молекулу соединения формулы (I), композиции на его основе, способу его получения и ингибированию натрий-зависимых глюкозных котранспортеров (SGLT) с его использованием для лечения заболеваний. Предложенный способ получения включает приведение соединения формулы (I) в контакт с диэтиламином, добавление антирастворителя до помутнения раствора, или добавление затравочного кристалла, или их комбинации, затем продолжение осаждения кристалла, разделение твердой и жидкой фаз с получением диэтиламинного сольвата соединения формулы (I). Предложен новый твердый сольват, ингибитор SGLT, эффективный для получения лекарственного средства для лечения или задержки развития диабета, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии, инсулинорезистентности, гипергликемии, гиперинсулинемии, повышенных уровней жирных кислот или глицерина, гиперлипидемии, ожирения, гипертриглицеридемии, метаболического синдрома, осложнений диабета, атеросклероза и гипертензии. 8 н. и 13 з.п. ф-лы, 5 пр., 3 табл., 8 ил.
Формула


Комментарии