Композиции, способы и медицинские композиции для лечения и поддержания здоровья печени - RU2755478C2
Код документа: RU2755478C2
Чертежи
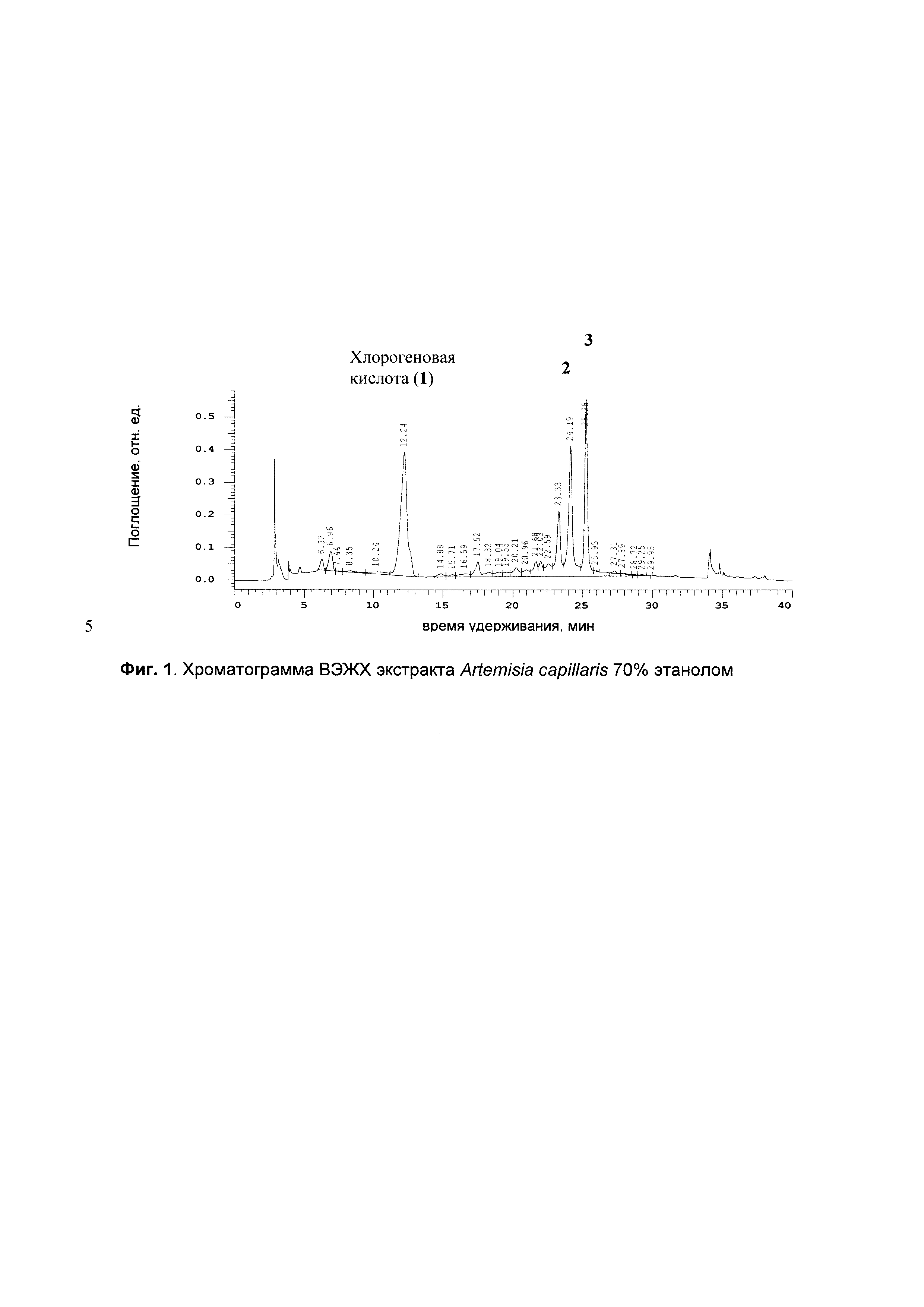
Описание
Настоящая заявка, поданная в соответствии с Договором о патентной кооперации, истребует приоритет Предварительной патентной заявки США №62192711, поданной 15 июля 2015 г. под названием "Композиции и способы для здоровья печени", и Патентной заявки США №15208075, поданной 12 июля 2016 г. под названием "Композиции, способы и медицинские композиции для лечения и поддержания здоровья печени", у которых общий заявитель и которые полностью включены в настоящее описание посредством ссылки.
Область техники
Областью техники настоящего изобретения являются соединения и композиции, пригодные для поддержания здоровья печени, включая стереоизомеры, фармацевтически или нутрицевтически приемлемые соли, таутомеры, гликозиды и пролекарства соединений, композиций и относящиеся к ним способы улучшения и поддержания здоровья печени.
Уровень техники
Печень является жизненно важным органом, который играет главную роль в метаболизме и детоксикации различных эндогенных и экзогенных вредных веществ. Считается, что в печени происходит более 500 химических реакций. Известно, что различные ксенобиотики или чужеродные химические вещества вызывают гепатотоксичность, среди которых ацетаминофен (н-ацетил-п-аминофенол или АРАР) и четыреххлористый углерод (CCl4) обычно используются в исследованиях модели на животных, которая имитирует токсичность печени человеческого типа с аналогичными механизмами действий. Большой диапазон биомаркеров из гомогенатов сыворотки или печени были использованы для контроля и/или анализа состояния здоровья печени, где смещение от нормального диапазона считается признаком повреждения органа. Среди этих биомаркеров наиболее часто используются: ALT (аланинаминотрансфераза), AST (аспартатаминотрансфераза), MDA (малондиальдегид), GSH (глутатион), SOD (супероксиддисмутаза), N-концевая киназа c-Jun (JNK), GSH-Px (глутатионпероксидаза), CAT (каталаза) и TNF-α (фактор некроза опухоли-альфа). Печеночные панели, такие как AST, ALT, общий билирубин, конъюгированный и неконъюгированный билирубин, желчная кислота, общий белок, альбумин, глобулин и щелочная фосфатаза, использовались в качестве стандартного метода анализа здоровья печени. В то время как ALT и AST признаны неспецифичными маркерами при поражении печени, ALT показала относительную специфичность к печени. Например, AST имеет исходный коэффициент в печени (9000: 1) против мышц (5200: 1); в сравнении ALT имеет исходный коэффициент в печени (7600: 1) против мышц (750: 1). Период полувыведения общего AST и ALT составляет 17±5 часов и 47±10 часов, соответственно. ALT стабилен в течение 3 дней при комнатной температуре, 3 недели в холодильнике, 24 часа в цельной крови; однако свойства ALT быстро ухудшаются при повторном замораживании и оттаивании. Сыворотка ALT использовалась для скрининга экстракта растений в наших исследованиях.
АРАР является очень безопасным и эффективным обезболивающим и жаропонижающим препаратом в терапевтической дозировке. Это самая частая причина острой жизненной недостаточности в Соединенных Штатах. Индуцированная АРАР печеночная токсичность является клинически значимой, хорошо изученной, может быть быстро индуцирована in vivo с помощью единичной дозы, и она стала традиционной моделью для оценки потенциальных гепатопротекторных эффектов фитотерапии.
Индуцированная АРАР гибель клеток не вызвана одним трагическим событием, прекращающим жизненно важную функцию клеток, вместо этого он вызывает ряд событий, начинающихся с формирования реактивного метаболита и инициирования митохондриальной дисфункции, которая усиливается через путь JNK, что в конечном итоге приводит к появлению нефункциональных митохондрий и массивной деградации ДНК, приводящей к некрозу клеток.
Токсичность АРАР проявляется в очень сложных путях механизмов действий. Как было установлено ранее, внутриклеточные сигнальные механизмы индуцированной АРАР клеточной гибели инициируются метаболизмом небольшой фракции вводимой дозы ферментами Р450, главным образом Сур 2е1 и 1а2 (Zaher и др., 1998), до н-ацетил-п-бензохинонимин (NAPQI). В нормальных условиях этот высокореактивный метаболит детоксифицируется с помощью GSH, что приводит к сильному истощению GSH печени (Mitchell и др., 197), которое становится критическим во время передозировки. Одновременно возрастающее количество NAPQI приводит к реакции с сульфгидрильными группами белков, вызывая ковалентное связывание клеточных белков (Jollow и др., 1973). Интересно, что исследования показали, что полное связывание белка в клетке не так важно, как образование аддуктов в митохондриях (Tirmenstein и Nelson, 1989; Qiu и др., 2001). Связывание белков митохондрий вызывает митохондриальный окислительный стресс (Jaeschke, 1990), который вызывает активацию сигнально-регулирующей киназы апоптоза 1 (Nakagawa и др., 2008) и N-терминальной киназы c-Jun (JNK) (Hanawa и др., 2008), а также усиление митохондриального окислительного стресса и образования пероксинитрита с помощью митохондриальной транслокации JNK (Saito и др., 2010а). Огромный окислительный стресс, наконец, вызывает в митохондриях открытие пор с изменением проницаемости мембраны (МРТ) с коллапсом мембранного потенциала (Kon и др., 2004; Masubuchi и др., 2005; Ramachandran и др., 2011а; Loguidice и Boelsterli, 2011) с последующим высвобождением межмембранных белков, таких как эндонуклеаза G и апоптоз-индуцирующий фактор (AIF), из митохондрий (Kon и др., 2004; Bajt и др., 2008). Обе эндонуклеазы G и AIF транслоцируются в ядро и вызывают фрагментацию ДНК (Cover и др., 2005; Bajt и др., 2006, 2011), что в конечном итоге приводит к гибели клеток. Коллапс митохондриального мембранного потенциала с истощением АТФ и деградацией ядер являются ключевыми событиями, приводящими к клеточному некрозу. Следовательно, при разработке терапевтического вмешательства для защиты печени существует множество точек воздействия, где эти механизмы могут быть прерваны.
Знание хронологии патологического процесса модели дает ориентиры для терапевтического вмешательства. В то время как окислительный стресс и асептические воспаления играют значительную роль в токсичности АРАР, патофизиология модели характеризуется рядом событий, включающих метаболическую активацию между 0 и 2 ч, истощение GSH в течение первых 30 минут, внутриклеточные механизмы гибели клеток между 2 и 12 ч, воспалительный ответ на временном интервале 6-24 ч и регенерацию в течение 24-72 ч после токсичности АРАР (Jaeschke и др., 2012а).
Как уже упоминалось, передозировка АРАР может вызвать сильную печеночную токсичность у людей, характеризующуюся образованием белка-аддукта (Davern и др., 2006; James and др., 2009), повреждением митохондрий и фрагментацией ядерной ДНК (McGill и др., 2012а), что приводит к смерти клетки. Поэтому желательно использовать модели на животных, которые могут иметь сходные патофизиологические особенности при исследовании растительных экстрактов для защиты печени. Таким образом, для экспериментов in vivo мышь является предпочтительной моделью, так как ее повреждение наиболее сильно напоминает патофизиологию человека как по механизму, так и по зависимости от дозы. Фактически, некоторые полагают, что основной существенной разницей в гепатотоксичности АРАР между мышами и людьми является более поздняя токсичность у людей, которая проявляется в пике ALT в интервале 24-48 ч после воздействия по сравнению с мышами, у которых ALT достигает максимума в интервале 6-12 ч (Larson, 2007). Это различие может быть частично объяснено различиями в адсорбции между двумя этими видами. В противоположность этому, крыса, хотя и является популярной моделью для тестирования натуральных продуктов, является плохой моделью, поскольку большинство штаммов крыс в значительной степени нечувствительны к токсичности АРАР (Mitchell и др., 1973; McGill и др., 2012b). Даже при высокой дозе ≥1 г/кг, АРАР в основном не вызывает соответствующего повреждения печени (Jaeschke и др., 2013). И в то время как истощение GSH и протеиновые аддукты могут быть измерены, низкие концентрации аддуктов в митохондриях печени крыс по сравнению с мышами оказываются недостаточными для инициирования достаточной митохондриальной дисфункции и последующих событий амплификации, приводящих к гибели некротических клеток (McGill и др., 2012b). Эти фундаментальные различия между двумя видами были отражены во время оценки фитотерапии. Например, в исследовании на крысах, доза АРАР 3 г/кг приводила к увеличению уровней ALT в плазме примерно в 3 раза по сравнению с исходным уровнем, а фитотерапевтическое вещество ослабляло эту умеренную травму печень на 33% (Ajith и др., 2007). Любые гистологические изменения в этой модели крысы были минимальными и трудными для обнаружения. С другой стороны, в исследовании на мышах увеличение ALT составляло более в 60 раз после введения дозы 300 мг/кг АРАР, а его снижение под действием фитотерапевтического вещества составило 75% (Wan и др., 2012). Гистологические изменения, вызванные токсичностью АРАР и защитным эффектом препарата, были легкими для обнаружения.
CCl4, галоидированный алкановый промышленный химикат с ограничениями по использованию, является широко известным гепатотоксином, который широко используется для индукции острой токсической травмы печени у широкого круга лабораторных животных. Люди подвергаются воздействию CCl4, в профессиональной среде и от загрязнения окружающей среды, например, загрязненной питьевой воды. Тем не менее, указанное химическое вещество в настоящее время по-прежнему выступает в роли важного ингредиента в качестве модельного соединения для выяснения механизмов действия гепатотоксических эффектов, таких как жировая дегенерация, фиброз, гепатоцеллюлярная смерть и канцерогенность (Slater 1981; Renner Н. 1985, Reynolds, 1963). Оно считается одним из классических веществ, используемых в химически индуцированных печеночных токсичных моделях на животных, в первую очередь связанных с образованием свободных радикалов и перекисного окисления липидов.
Как и АРАР, токсичность CCl4 инициируется цитохромом P450s, главным образом (CYP)2E1, CYP2B1 или CYP2B2 (Nelson and Harrison, 1987), с получением реакционноспособных метаболических продуктов трихлорметильных свободных радикалов (CCl3-), которые могут инициировать перекисное окисление липидов и в конечном итоге приводят к перепроизводству активных форм кислорода (ROS) и гепатоцитов (Poyer и др., 1980; Albano и др., 1982). При этом эти радикалы могут связываться с клеточными молекулами (нуклеиновая кислота, белок и липид), нарушая важнейшие клеточные процессы, такие как липидный обмен, с таким потенциальным результатом, как жировой дегенерации (стеатоз), и прямым повреждением этих макромолекул (Weddle and др., 1976). Эти радикалы также могут реагировать с кислородом с образованием трихлорметилперокси-радикала CCl3OO-, высокореакционноспособной частицы. После образования он инициирует цепную реакцию перекисного окисления липидов, атакуя и разрушая полиненасыщенные жирные кислоты, в частности те, которые связаны с фосфолипидами. Это влияет на проницаемость митохондриального, эндоплазматического ретикулума и плазматических мембран, что приводит к потере клеточного связывания кальция и гомеостаза, что может в значительной степени способствовать последующему повреждению клеток. Поэтому антиоксиданты и ловушки радикалов были использованы для изучения механизма токсичности CCl4, а также для защиты клеток печени от индуцированного CCl4 повреждения путем подавления цепной реакции перекисного окисления липидов (Cheeseman и др., 1987). На молекулярном уровне CCl4 активирует TNF-α (Czaja и др., 1995), оксид азота (NO) (Chamulitrat и др., 1994, 1995) и трансформирующие факторы роста (TGF) (Luckey и др., 2001) в клетке, процессы, которые, по-видимому, направляют клетку в первую очередь на разрушение или фиброз. На этом основании предполагается, что растительные экстракты с противовоспалительной активностью могут иметь потенциальное применение при защите печени. В то время как острое введение большой дозы CCl4 вызывает тяжелый некроз, хроническое введение более низких доз часто используется для индукции фиброза печени.
Окислительный стресс представляет собой дисбаланс между производством свободных радикалов и присущей способностью организма противодействовать или нейтрализовать их вредные эффекты за счет взаимодействия с различными восстанавливающими и секвестрирующими эндогенными сетями антиоксидантной защиты. Когда отсутствует необходимая адаптация системы антиоксидантной защиты организма, накопление активных форм кислорода приводит к активации чувствительных к стрессу внутриклеточных сигнальных путей, которые, в свою очередь, вызывают повреждение клеток, приводящее к некрозу. В то время как повреждения от окислительного стресса влияют на все тело как на систему, такое воздействие становится более пагубным, когда оно затрагивает жизненно важные органы, такие как печень, где происходит первичная детоксикация, необходимая для удаления и метаболизма вредных токсинов, таких как алкоголь. В результате печень восприимчива к вызванной алкоголем травме, так как и спирт, и его первичный метаболит ацетальдегид продуцируют реакционноспособные активные формы кислорода (ROS) и гидроксильные радикалы (ОН), воздействуя на систему антиоксидантной защиты печени. Наиболее распространенные патологические состояния, такие как жирная печень, гепатит, фиброз и цирроз, наблюдаются в связанных с алкоголем расстройствах печени в результате повторного воздействия алкоголя. Эти результаты в сочетании с окислением клеточных липидов, белков и ДНК были продемонстрированы у нескольких экспериментальных животных (Wu и Cederbaum, 2003). В настоящей работе мы использовали наиболее часто используемую модель животных с практическими клиническими проявлениями, такими как АРАР, и подтвердили результаты классической модели гепатотоксичности, индуцированной CCl4. Независимо от химических агентов, используемых для индукции гепатотоксичности, обе модели АРАР и CCl4 имеют общую критическую стадию окислительного стресса, вызванного активными формами кислорода, генерируемыми избыточными промежуточными метаболитами, что приводит к окислению белков, перекисному окислению липидов и повреждению ДНК.
С учетом вышесказанного, существует необходимость в разработке, изготовлении и использовании композиции, лекарственной композиции и связанных с ней способов, которые предназначены для лечения и поддержания здоровья печени. Идеальные соединения, лекарственные композиции и композиции, которые были бы пригодными для лечения, должны включать любое одно или более из следующих свойств: (1) лечение или предотвращение повреждения клеток печени у млекопитающих; (2) улучшение здоровья печени; (3) сохранение ферментов печени, ответственных за детоксикацию и антиокислительные процессы, у млекопитающих; (4) увеличение способности печени млекопитающего к детоксикации; (5) лечение или предотвращение заболеваний печени у млекопитающих; (6) модификация воспаления печени у млекопитающего; и (7) улучшение функции обновления печень. Идеальные соединения и композиции могут быть получены из по меньшей мере одного растительного экстракта или содержат по меньшей мере один растительный экстракт, при этом указанный растительный экстракт может или не может быть обогащен. В рамках этой разработки было бы идеальным использовать часто используемые и приемлемые модели для тестирования рассматриваемых соединений и композиций. Было бы также желательно разработать надежное терапевтическое вмешательство для улучшения здоровья печени путем воздействия на определенные точки в механизмах деградации печени и изучения этих результатов.
Краткое описание настоящего изобретения
Описаны композиции и способы для лечения и поддержания здоровья печени, содержащие смесь экстрактов растений, при этом указанные экстракты растений содержат по меньшей мере один экстракт Artemisia, по меньшей мере один гелевый порошок Aloe, и по меньшей мере один экстракт Schizandra.
Описаны композиции и способы для лечения и поддержания здоровья печени, которые содержат смесь растительных экстрактов, при этом указанные растительные экстракты содержат по меньшей мере один экстракт Artemisia обогащенный по меньшей мере одним полимером или биополимером, по меньшей мере один гелевый порошок Aloe, обогащенный по меньшей мере одним хромоном, и по меньшей мере один экстракт Schizandra, обогащенный по меньшей мере одним лигнаном и органической кислотой.
Описаны медицинские композиции и способы для поддержания функции печени, минимизации повреждения клеток печени, стимуляции здоровой печени, защиты антиокислительной целостности печени, нейтрализации токсинов, уменьшения действия свободных радикалов которые влияют на здоровья печени, удаления активных форм кислорода, снижения оксидативного стресса, предотвращения образования токсичных метаболитов, улучшения способности и/или функции печени к детоксикации, очистки печени, восстановления структуры печени, защиты клеток печени от токсинов, помощи протеканию и циркуляции крови в печени, поддержки функции печени, укрепления и успокоения печени, успокоения и тонизирования печени, облегчения боли в печени, очистки от вредных химических соединений и организмов, поддержания метаболических процессов печени, облегчения дискомфорта печени, облегчения синдрома жирной печени, улучшения способности печени к детоксикации, снижения уровней ферментов печени, обеспечения природных окислителей, увеличения уровня SOD, увеличения уровня GSH, снижения уровня пероксидирования клеток печени, снижения уровня накопления жирных кислот, поддержания уровня здоровых противовоспалительных процессов, улучшения иммунной функции печени, стимулирования регенерации клеток печени, улучшения восстановительной функции печени, стимулирования высвобождения желчи, стимулирования здорового потока желчи, омоложения печени, или подобного у млекопитающего, при этом указанная медицинская композиция содержит упомянутые композиции в качестве активного ингредиента.
Краткое описание фигур
На Фиг. 1 приведена хроматограмма ВЭЖХ экстракта Artemisia capillaris 70% этанолом.
Подробное описание настоящего изобретения
Вкратце, настоящее описание относится к соединениям и композициям, полезных для управления здоровьем печени, включая стереоизомеры, фармацевтически или нутрицевтически приемлемые соли, таутомеры, гликозиды и пролекарства описанных соединения, и к соответствующим способам улучшения здоровья печени.
Рассматриваемые соединения и композиции получены из по меньшей мере одного растительного экстракта или содержат его, при этом указанный растительный экстракт может быть обогащен или может быть не обогащен. В рамках этой разработки часто используемые и приемлемые модели использовались для тестирования рассматриваемых соединений и композиций. Кроме того, терапевтическое вмешательство для здоровья печени было предложено с целью воздействия на точки в механизмах деградации печень и изучения этих результатов. Рассматриваемые соединения, медицинские композиции и композиции являлись пригодными для эффективного лечения любого одного или более из следующего: (1) лечения или предотвращения повреждения клеток печень млекопитающего; (2) стимуляции здоровья печени; (3) сохранения ферментов детоксикации и антиокисления печени у млекопитающего; (4) повышения способности печени к детоксикации у млекопитающего; (5) лечения или предотвращения заболеваний печени у млекопитающего; (6) модификации воспаления печени у млекопитающего; и (7) улучшения восстановительной функции печени.
В частности, описаны композиции, соединения и способы для лечения и поддержания здоровья печени, которые содержат смесь растительных экстрактов, при этом указанные растительные экстракты содержат по меньшей мере один экстракт Artemisia, по меньшей мере один гелевый порошок Aloe, и по меньшей мере один экстракт Schizandra.
В дополнение, описаны композиции, соединения и способы для лечения и поддержания здоровья печени, которые содержат смесь растительных экстрактов, при этом указанные растительные экстракты содержат по меньшей мере один экстракт Artemisia, обогащенный по меньшей мере одним полимером или биополимером, по меньшей мере один гелевый порошок Aloe, обогащенный по меньшей мере одним хромоном, и по меньшей мере один экстракт Schizandra, обогащенный по меньшей мере одним лигнаном и органической кислотой.
Также описаны медицинские композиции и способы для поддержания функции печени, минимизации повреждения клеток печени, стимуляции здоровой печени, защиты антиокислительной целостности печени, нейтрализации токсинов, уменьшения действия свободных радикалов которые влияют на здоровья печени, удаления активных форм кислорода, снижения оксидативного стресса, предотвращения образования токсичных метаболитов, улучшения способности и/или функции печени к детоксикации, очистки печени, восстановления структуры печени, защиты клеток печени от токсинов, помощи протеканию и циркуляции крови в печени, поддержки функции печени, укрепления и успокоения печени, успокоения и тонизирования печени, облегчения боли в печени, очистки от вредных химических соединений и организмов, поддержания метаболических процессов печени, облегчения дискомфорта печени, облегчения синдрома жирной печени, улучшения способности печени к детоксикации, снижения уровней ферментов печени, обеспечения природных окислителей, увеличения уровня SOD, увеличения уровня GSH, снижения уровня пероксидирования клеток печени, снижения уровня накопления жирных кислот, поддержания уровня здоровых противовоспалительных процессов, улучшения иммунной функции печени, стимулирования регенерации клеток печени, улучшения восстановительной функции печени, стимулирования высвобождения желчи, стимулирования здорового потока желчи, омоложения печени, или подобного у млекопитающего, при этом указанная медицинская композиция содержит рассматриваемые композиции в качестве активного ингредиента.
Разработана концепция обнаружения уникальной смеси соединений и экстрактов с повышенной эффективностью для защиты печень от повторяющихся воздействий оксидативного стресса, также имея в виду травму печени, индуцированную употреблением спирта, генерализованную усталость и истощение. Сообщается, что некоторые ботанические препараты, богатые фенольными соединениями, связаны с антиоксидантными действиями в биологических системах, действуя как ловушки синглетного кислорода и свободных радикалов, что приводит к их использованию в фитотерапии. Представляется, что объединение таких растительных материалов, имеющих понятную эффективность и данные по безопасности, было бы выгодно для общего здоровья печени. Таким образом, модели АРАР и CCl4 использовались для скрининга различных растительных экстрактов. В результате некоторые растительные экстракты показали снижение уровня ALT в сыворотке только в одной модели, но критерии, которые следует учитывать, показали эффективность в обеих моделях.
Из 38 тестируемых растительных материалов, Schisandra, Artemisia и N931 были единственными материалами, которые продемонстрировали свою эффективность в обеих моделях. N931 представляет собой композицию, содержащую уникальную комбинацию 1-4% алоэзина и 96-99% 200:1 порошка полисахаридов из внутренней части листа Aloe vera. Как раскрыто в настоящем описании, рассматриваемые композиции, как правило, содержат смесь растительных экстрактов из экстракта Artemisia, обогащенного одним или более биополимером, гелевый порошок Алоэ, обогащенный одним или более хромоном, и экстракт Schisandra, обогащенный одним или более лигнаном и органическими кислотами.
Степени ингибирования, наблюдаемые для этих материалов, не были одинаковыми между моделями. Например, в то время как экстракты из Schizandra, казалось демонстрировали более высокую защиту повреждения печени, вызванного АРАР (до 48,9% при дозе 500 мг/кг), при той же дозе указанный экстракт показал только 22,8% ингибирования в модели гепатотоксичности, вызванной CCl4. С другой стороны, экстракт Artemisia, такой как Artemisia capillaris, показал снижение уровня ALT в сыворотке крови на 48,0% при дозе 400 мг/кг в модели гепатотоксичности, вызванной CCl4; напротив, ингибирование, наблюдаемое в модели, вызванной АРАР, было только 24,0% при этом же уровне дозы по сравнению с контролем с носителем. Учитывая эти сильные индивидуальные характеристики, наблюдаемые в отдельной модели для каждого растения, идея объединения этих растительных экстракты для получения лучшего результата в обеих моделях получила лучшее подкрепление. N931 показал умеренную защиту печени в обеих моделях. Как описано выше, продолжительные и глубокие исследования подтвердили антиоксидантную активность Schizandra, Artemisia и N931 с различной степенью защиты печени. Тем не менее, они никогда не объединялись вместе при определенных соотношениях, чтобы получить рассматриваемые и раскрытые композиции, включая SAL, что обычно понимается как уникальная комбинация Schizandra, Artemisia и N931.
Интересное открытие заключалось в том, что когда Schizandra смешивали с Artemisia capellaris в соотношениях 4:1, 2:1, 1:1, 1:2 и 1:4 в дозировке 400 мг/кг, только соотношение 2:1 (вдвое больше Schizandra, чем Artemisia capillaris) в модели АРАР и соотношение 1:2 (вдвое больше Artemisia capellaris, чем Schizandra) в модели CCL4 показали 48,0% и 40,6% снижение уровней ALT в сыворотке, соответственно, по сравнению с контролем с носителем с травмой. Не получилось продемонстрировать ожидаемую эффективность в обеих моделях при одном соотношении, что указывает на необходимость того, чтобы композиции была дополнена третьим компонентом. Предположили, что N931 является этим компонентом, поскольку он показал умеренное ингибирование в обеих моделях. Добавление N931 к этим двум перспективным смесям показало активность защиты печеней в обеих моделях с примерно одинаковой величиной: то есть 52,5% и 46,3% в обеих моделях соответственно, что считалось дополнительным вкладом третьего компонента композиции или соединения в полученный результат. Когда была проверена целесообразность комбинации этих трех растительных материалов, наблюдалась неожиданная синергия из комбинации этих трех растительных материалов, которая превышала предсказанный результат, основываясь только на суммировании эффектов, наблюдаемых для каждого из его составляющих при данном соотношении и в дозе 400 мг/кг.
На самом деле, ни один из компонентов не показал активность по защите печени в степени, эквивалентной той, которая показана для рассматриваемого соединения или композиции, содержащей Schizandra, Artemisia и N931. Более того, данные из панели печени, которые содержат ACT, ALT, желчную кислоту, общий белок, общий билирубин, конъюгированный билирубин, альбумин и общий белок, показали, что рассматриваемые композиции обладают защитной активностью печени по сравнению с животными с травмой, обработанными носителем. Как показывают данные, полученные на гомогенатах печени, рассматриваемые композиции, в том числе SAL, также восполняли истощенный глутатион печени в сочетании с повышением активности супероксиддисмутазы печени. Рассматриваемое уникальное соотношение 4S:8A:3L обеспечивает показанную активность защиты печени на нескольких моделях животных в сочетании с постоянными уровнями нескольких специфических биомаркеров оксидативного стресса.
Как раскрыто в настоящем описании, экстракт Artemisia и экстракт Schizandra можно смешивать в весовом соотношении от 4:1 до 1:4. В некоторых рассмотренных вариантах осуществления, гелевый порошок Aloe можно дополнительно смешивать со смесью экстрактов Artemisia и Schizandra в весовом процентном соотношении от примерно 5% до примерно 50%. В других рассматриваемых вариантах осуществления смесь Artemisia, Schizandra и гелевого порошка листьев Aloe может быть представлена в соотношении 8:4:3, соответственно.
Экстракт Schizandra является рассматриваемым компонентом или составляющей, которая может быть использована как часть целевого соединения или композиции. Экстракт Schizandra может быть получен из подходящего источника, включая Schisandra chinensis, Schisandra elongate, Schisandra glabra, Schisandra glaucescens, Schisandra henryi, Schisandra incarnate, Schisandra lancifolia, Schisandra neglecta, Schisandra nigra, Schisandra propinqua, Schisandra pubescens, Schisandra repanda, Schisandra rubriflora, Schisandra rubrifolia, Schisandra sinensis, Schisandra sphaerandra, Schisandra sphenanthera, Schisandra tomentella, Schisandra tuberculata, Schisandra vestita, Schisandra viridis, Schisandra wilsoniana или их комбинаций.
Экстракт Schizandra может быть обогащенным одним или более лигнанами и органическими кислотами, как рассматривается в настоящем описании. Рассматриваемыми лигнанами, выделенными из экстракта Schizandra являются шизандрин, дезоксишизандрин, γ-шизандрин, псевдо-γ-шизандрин, wuweizisu В, wuweizisu С, изошизандрин, прегомизин, эошизандрин, шизандрол, шизандрол А, шизандрол В, шизантерин А, В, С, D, Е, рубшизантерин, шизанхенол ацетат, шизанхенол В, шизанхенол, гомизин А, В, С, D, Е, F, G, Н, J, N, О, R, S, Т, U, эпигомизин О, ангелоилгомизин Н, О, Q, Т, иглоилгомизин Н, Р, ангелоилизогомизин О, бензиолгомизин Н, О, Р, Q, бензоилизогомизин или их комбинация. Рассматриваемые органические кислоты, выделенные из экстракта Schizandra, включают яблочную кислоту, лимонную кислоту, шикимовую кислоту или их комбинации.
Экстракт Artemisia является рассматриваемым компонентом или составляющей, которая может быть использована как часть целевого соединения или композиции. Экстракт Artemisia может быть получен из подходящего источника, включая Artemisia absinthium, Artemisia abrotanum L, Artemisia afra, Artemisia annua L, Artemisia arborescens, Artemisia asiatica, Artemisia campestris, Artemisia deserti, Artemisia iwayomogi, Artemisia ludoviciana, Artemisia vulgaris, Artemisia oelandica, Artemisia princeps Pamp, Artemisia sacrorum, Artemisia scoparia, Artemisia stelleriana, Artemisia frigida Willd, Artemisia anethoides Mattf., Artemisia anethifolia Weber., Artemisia faurier Nakai, Origanum vulgare, Siphenostegia chinensis или их любой комбинации.
Экстракт Artemisia может быть обогащен одним или более биополимерами, рассматриваемыми в настоящем описании. Рассматриваемыми полимерами и биополимерами, выделенными из экстракта Artemisia, являются указанные соединения, эктрагированные любым подходящим растворителем, включая воду, метанол, этанол, спирт, смешивающийся с водой растворитель или их комбинация. В рассматриваемых вариантах осуществления, указанный экстракт Artemisia содержит примерно от 0,01% до примерно 99,9% биополимеров с индивидуальным или средним молекулярным весом более примерно 500 г/моль. В некоторых рассматриваемых вариантах осуществления, указанный экстракт Artemisia содержит примерно от 0,01% до примерно 99,9% биополимеров с индивидуальным или средним молекулярным весом более примерно 750 г/моль. В других рассматриваемых вариантах осуществления, указанный экстракт Artemisia содержит от примерно 0,01% до примерно 99,9% биополимеров с индивидуальным или средним молекулярным весом более примерно 1000 г/моль.
Гелевый порошок Aloe является еще одним рассматриваемым компонентом или составляющей и может быть получен из любого подходящего источника, включая Aloe arborescens, Aloe barbadensis, Aloe cremnophila, Aloe ferox, Aloe saponaria, Aloe vera, Aloe vera var. chinensis или их комбинации.
Гелевый порошок Aloe может быть обогащен один или более хромонами, рассматриваемыми в настоящем описании. Рассматриваемые хромоны содержат или выбраны из алоэзина, алоэзинола, алоэрезина А, алоэрезина В, алоэрезина С, алоэрезина D, алоэрезина Е или их любую комбинации. В рассматриваемых вариантах осуществления, указанная композиция с по меньшей мере одним хромоном может содержать от примерно 0,01% до примерно 100% одного или более хромонов. В некоторых рассматриваемых вариантах осуществления, указанная композиция с хромоном содержит от примерно 1% до примерно 4% алоэзина, при этом указанная композиция по существу свободна от антрохинонов и при этом указанный гель Aloe выделен из растения, выбранного из Aloe barbadensis или Aloe vera; и при этом указанный по меньшей мере один хромон выделен из Aloe vera или Aloe ferox или их любую комбинации.
Рассматриваемые соединения, медицинские композиции и композиции могут содержать или дополнительно содержат или включают по меньшей мере один гепатопротектор. В некоторых вариантах осуществления по меньшей мере один гепатопротектор может содержать или состоит из порошка растения или растительного экстракта расторопши, куркумы, володушки, лакричника, шалфея, шелковицы, говении, репейника, кудрании, люцеума, цитрусовых, сливы, желтого японского абрикоса, корейских морских водорослей, одуванчика, винограда, виноградных косточек, малины, камелии, зеленого чая, масло криля, дрожжи, соевые бобы; выделенные и обогащенные силимарины, флавоноиды, фосфолипиды, серосодержащие соединения, пикногенолы, желатины, соевый лецитин, панкреатические ферменты; природный или синтетический N-ацетилсерин, таурин, рибофлавин, ниацин, пиридоксин, фолиевую кислоту, каротены, витамин А, витамин В2, В6, В16, витамин С, витамин Е, глутатион, разветвленные аминокислоты, селен, медь, цинк, марганец, коэнзим Q10, L-аргинин, L-глутамин, фосфатидилхолин или подобного вещества или их комбинации.
Также рассматриваемыми в настоящем описании являются in vivo метаболические продукты описанных соединений. Такие продукты могут образовываться посредством, например, окисления, восстановления, гидролиза, амидирования, этерификации и подобных реакций, протекающих с введенным соединением, преимущественно в ходе ферментативных процессов. Соответственно, рассматриваемыми соединениями являются соединения, полученные в ходе процессов, включающих введение рассматриваемого соединения или композиция млекопитающему на период времени, достаточный для получения его метаболического продукта. Такие продукты обычно идентифицируют посредством введения радиоактивно меченного соединения согласно настоящему описанию в детектируемой дозе такому животному, как крыса, мышь, морская свинка, собака, кошка, свинья, овца, лошадь, обезьяна или человек, предоставляя время, достаточное для осуществления его метаболизма, и последующего выделения продуктов конверсии из мочи, кровы или других биологических образцов.
Использующиеся в настоящем описании фразы "стабильное соединение" и "стабильная структура" используются взаимозаменяемо и предназначены для обозначения соединения, которое является достаточно устойчивым для того, чтобы пережить выделение для приемлемой степени чистоты из реакционной смеси и для того, чтобы остаться неизменным в процессе приготовления эффективного терапевтического агента.
Использующийся в настоящем описании термин "млекопитающее" включает людей и одомашненных животных, таких как лабораторные животные или домашние животные (например, крыса, мышь, морская свинка, кошки, собаки, свиньи, крупный рогатый скот, овцы, козы, лошади, кролики, приматы) и не домашние животные, такие как животные дикой природы или подобные.
Использующиеся в настоящем описании термины "необязательный" или "необязательно" могут быть использованы взаимозаменяемо и означают, что последующий описанный элемент, компонент, событие или условия могут происходить или могут не происходить, и включает примеры, где указанный элемент, компонент, событие или условие происходит и примеры, в которых они не происходят. Например, "необязательно замещенный арил" означает, что указанный арильный радикал может быть замещен или может быть незамещен - другими словами, указанное описание включает как замещенные радикалы арила, так и радикалы арила без заместителей.
Рассматриваемые соединения, медицинские композиции и композиции могут содержать или дополнительно содержат или состоят из по меньшей мере одного фармацевтически или нутрицевтически приемлемого носителя, разбавителя или вспомогательного вещества. Использующаяся в настоящем описании фраза "фармацевтически или нутрицевтически приемлемый носитель, разбавитель или вспомогательное вещество" включает в себя любой адъювант, носитель, вспомогательное вещество, смазывающий агент, подсластитель, разбавитель, консервант, краску/краситель, усилитель вкуса, поверхностно-активное вещество, смачивающий агент, диспергирующий агент, суспендирующий агент, стабилизатор, изотонический агент, растворитель или эмульгатор, которые были одобрены Управлением по контролю за продуктами и лекарствами США как пригодные для использования у людей или домашних животных.
Рассматриваемые соединения, медицинские композиции и композиции могут содержать или дополнительно содержат или состоят из по меньшей мере одной фармацевтически или нутрицевтически приемлемой соли. Использующаяся в настоящем описании фраза "фармацевтически или нутрицевтически приемлемая соль" включает как соль присоединения кислоты, так и соль присоединения основания.
Использующаяся в настоящем описании фраза "фармацевтически или нутрицевтически приемлема соль присоединения кислоты "относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом нежелательными и которые образуются с помощью неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота кислоты и подобные, и органических кислот, такой как уксусная кислота, 2,2-дихлоруксусная кислота, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10-сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламиновая кислота, додецилсульфоновая кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксоглутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислота, изомасляная кислота, молочная кислота, лактобионовая кислота, лауриновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, муциновая кислота, нафталин-1,5-дисульфоновая кислота, нафталин-2-сульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглутаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, ундециленовая кислота или подобные.
Использующаяся в настоящем описании фраза "фармацевтически или нутрицевтически приемлемая соль присоединения основания" относится к солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом нежелательными. Такие соли образуются путем добавления неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований включают соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и подобные им. В определенных вариантах осуществления, указанными неорганическими солями являются соли аммония, натрия, калия, кальция или магния. Соли, полученные с помощью органических оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклические амины, и основные ионы ионообменных смол, такие как аммоний, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дихлоргексиламин, лизин, аргинин, гистидин, новокаин, гидрабамин, холин, бетаин, бенетамин, бензатин, этилендиамин, глюкозамин, метилглюкамин, теобромин, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и подобные им. Наиболее приемлемые органические основания включают изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин или кафеин.
Кристаллизация часто приводит к образованию сольватов рассматриваемых соединений, которые также включены в понятие "рассматриваемые соединения". Использующийся в настоящем описании термин "сольват" относится к агрегату, который содержит одну или более молекул рассматриваемых соединений, медицинскую композицию или композицию с одной или более молекул растворителя. Указанным растворителем может быть вода, и в этом случае указанный сольват может быть гидратом. В качестве альтернативы, указанным растворителем может быть органический растворитель. Таким образом, указанные рассматриваемые соединения, медицинские композиции или композиции могут существовать в виде гидрата, включая моногидрат, дигидрат, полугидрат, полуторного гидрата, тригидрата, тетрагидрата и подобный им, а также в виде соответствующих сольватированных форм. Рассматриваемое соединение, медицинская композиция или композиция может быть чистым сольватом, хотя в других случаях рассматриваемое соединение, медицинская композиция или композиция могут просто содержать дополнительную воду или смесь воды плюс какого-либо дополнительного растворителя.
Термин "фармацевтическая композиция" или "нутрицевтическая композиция" относится к смеси рассматриваемого соединения, медицинской композиция или композиция и среды, обычно используемой в уровне техники для доставки указанного биологического соединения млекопитающим, например, людям. Например, рассматриваемое фармацевтическое соединение, медицинская композиция или композиция может быть изготовлена в форме самостоятельной композиции или может быть использована в форме самостоятельной композиции, или являться компонентом предписанного лекарственного средства, безрецептурного медицинского средства, лекарственного средства растительного происхождения, фитотерапевтического лекарственного средства, гомеопатического агента или любой другой формы продукта здравоохранения, исследованного и разрешенного к применению государственным органом. Примерами рассматриваемой нутрицевтической композиции может быть композиция, изготовленная в форме самостоятельной композиции или использованная в форме самостоятельной композиции или в качестве пищевого или биоактивного компонента в пище, в новых продуктах питания, в функциональных продуктах питания, напитках, батончиках, пищевых красителях, пищевых добавках, в медицинских продуктах питания, диетических добавках или продуктах растительного происхождения. Среда, обычно используемая в уровне техники, включает любые фармацевтически или нутрицевтически приемлемые носители, разбавители или вспомогательные вещества.
Использующаяся в настоящем описании фраза "обогащенный" относится к растительному экстракту или другому составу, имеющему по меньшей мере от примерно двукратно до примерно 1000-кратно повышенного количества или активности одного или более активных соединений по сравнению с количеством или активностью одного или более активных соединений, обнаруженных в массе растительного материала или другого источника перед экстракцией или другим процессом обработки. В определенных вариантах осуществления, указанная масса растительного материала или другого источника перед экстракцией или другом процессом обработки может быть сухой массой, влажной массой или их комбинацией.
Использующаяся в настоящем описании фраза "основной активный ингредиент" или "основной активный компонент" относится к одному или более активному рассматриваемому соединению, обнаруженному в растительном экстракте или другом препарате, или обогащенному растительному экстракту или другому препарату, обладающему по меньшей мере одной биологической активностью. В определенных вариантах осуществления, основным активным ингредиентом обогащенного экстракта будет одно или более активное соединение, которое присутствует в обогащенном виде в таком экстракте. Обычно, один или более основной активный компонент будет ответственным, прямо или косвенно, за большую часть (например, более чем 50%) одной или более измеряемой биологической активностями или эффектами по сравнению с другими компонентами экстракта. В определенных вариантах осуществления, основной активный ингредиент может быть неосновным компонентом по весовому процентному составу экстракта (например, менее примерно 50%, 25%, 20%, 15%, 10%, 5%, или 1% компонентов, содержащихся в экстракте), но при этом обеспечивать большую часть желаемой биологической активности. Любая рассматриваемая композиция, содержащая основной активный ингредиент, также может содержать неосновные активные ингредиенты, которые могут или не могут вносить вклад в фармацевтическую или нутрицевтическую активность обогащенной композиции, но не на уровне основного активного компонента, и неосновной активный компонент сам по себе может быть неэффективным в отсутствие основного активного ингредиента.
Использующиеся в настоящем описании фразы "эффективное количество" или "терапевтически эффективное количество" относятся к такому количеству рассматриваемого соединения, медицинской композиции или композиции, которое, будучи введенным млекопитающему, такому как человека, которое будет достаточно для эффективного лечения, включая одно или более из следующего: (1) лечения или предотвращения повреждения клеток печени у млекопитающего; (2) стимуляции здоровья печени; (3) сохранения ферментов детоксикации и анти-окисления печени у млекопитающего; (4) повышения способности печени к детоксикации у млекопитающего; (5) лечения или предотвращения заболеваний печени у млекопитающего; (6) модификации воспаления печени у млекопитающего; и (7) улучшения восстановительной функции печени. Указанное количество рассматриваемого соединения, медицинской композиции или композиции, которое представляет собой "терапевтически эффективное количество", может варьировать в зависимости от указанного соединения, условий лечения и его интенсивности, способа введения, продолжительности лечения или веса тела и возраста субъекта, нуждающегося в лечении, и может быть определено специалистом в уровне техники в соответствии с его собственными знаниями и в соответствии с настоящим описанием.
Термин "добавки", использующийся в настоящем описании относится к продукту, соединению и/или композиции, которая улучшает, способствует, поддерживает, повышает, регулирует, управляет, контролирует, поддерживает, оптимизирует, модифицирует, снижает, ингибирует или предотвращает конкретное состояние, структуру или функцию, ассоциированную с природным состоянием или биологическим процессом (например, не используется для диагностики, лечения, смягчения, излечивания или предотвращения заболевания). В определенных вариантах осуществления, добавкой является диетическая добавка. Например, что касается условий, связанных с здоровьем печени, диетические добавки могут быть использованы для поддержания функции печени, минимизации повреждения клеток печени, стимуляции здоровой печени, защиты антиокислительной целостности печени, нейтрализации токсинов, уменьшения действия свободных радикалов, которые влияют на здоровье печени, удаления активных форм кислорода, снижения оксидативного стресса, предотвращения образования токсичных метаболитов, улучшения способности и/или функции печени к детоксикации, очистки печени, восстановления структуры печени, защиты клеток печень от токсинов, помощи потоку и циркуляции крови в печени, поддержки функции печени, защиты и успокоения печени, успокоения и тонизирования печени, облегчения боли в печени, очистки от вредных химических соединений и организмов, поддержания метаболических процессов печени, облегчения дискомфорта печени, облегчения синдрома жирной печени, улучшения способности печени к детоксикации, снижения уровней ферментов печени, обеспечения природных окислителей, увеличения уровня SOD, увеличения уровня GSH, снижения уровня пероксидирования клеток печени, снижения уровня накопления жирных кислот, поддержания уровня здоровых противовоспалительных процессов, улучшения иммунной функции печени, стимулирования регенерации клеток печени, улучшения восстановительной функции печени, стимулирования высвобождения желчи, стимулирования здорового потока желчи, омоложения печени, или подобного у млекопитающего. В определенных вариантах осуществления, диетические добавки являются особой категорией диетических продуктов, пищевых продуктов или обоих и не являются лекарственным средством.
Термины "лечение" или "улучшение" могут быть использованы взаимозаменяемо и относятся либо к терапевтическому лечению или профилактическому/превентивному лечению рассматриваемого заболевания или состояния у млекопитающего, такого как человек, имеющего рассматриваемое заболевание или состояние, или у которого подозревается наличие рассматриваемого заболевания или состояния, и включает: (i) предотвращение появления указанного заболевания или состояния у млекопитающего, в частности, когда у такого млекопитающего существует предрасположенность к указанному состоянию, но оно еще не было у него диагностировано; (ii) ингибирования указанного заболевания или состояния, например, остановки его развития; (iii) ослабления указанного заболевания или состояния, то есть, достижения регресса указанного заболевания или состояния; или (iv) ослабления симптомов, вызванных указанным заболеванием или состоянием (например, облегчения боли, снижения воспаления, снижения утраты способности к детоксикации), без воздействия на заболевание или состояние, вызвавшие их.
Использующиеся в настоящем описании термины "заболевание" и "состояние" могут быть использованы взаимозаменяемо или могут быть различными, поскольку конкретное расстройство или состояние могут не иметь известного агента, являющегося причиной (то есть этиология еще не была исследована), и, в связи с этим, не признается заболеванием в настоящем описании, а только нежелательным состоянием или синдромом с более или менее специфическим набором симптомов, идентифицированных лечащими врачами. В определенных вариантах осуществления, рассматриваемые соединения, медицинские композиции, композиции и способы используются для лечения, например, гепатита, заболеваний печени, вызванных употреблением алкоголя, цирроза или обоих.
Использующийся в настоящем описании термин "статистически значимый" относится к значению р=0,050 или менее, рассчитанному с использованием t-теста Стьюдента, и означает, что маловероятно, что конкретное событие или измеренный результат, был получен случайно.
Протокол химического наименования и любые структурные диаграммы, используемые в настоящем описании, являются модифицированной формой номенклатурной системы ИЮПАК, использующей программное обеспечение ACD/Name версии 9,07 или программное обеспечение для наименований ChemDraw Ultra версии 11,0 (CambridgeSoft), при этом рассматриваемые соединения в настоящем описании называют в виде производных центральной структуры ядра, например, имидазопиридиновой структуры. Для сложных химических названий, используемых в настоящем описании, группа заместителей указана перед группой, к которой она прикрепляется. Например, циклопропилэтил содержит этильный скелет с циклопропильным заместителем.
В определенных вариантах осуществления, рассматриваемые соединения и композиции (например, фармацевтическая, нутрицевтическая) могут вводиться в количестве, достаточном для способствования здоровью печени; улучшения здоровья печени; сохранения здоровья печени; лечения или управления здоровьем печени; поддержания здоровья печени; поддержания нормального и комфортного уровня функции детоксикации печени; улучшения способности печени к удалению свободных радикалов; снижения повреждения от вредных свободных радикалов, получаемых из химических соединений, лекарств, метаболитов и биологических токсинов; сохранения ферментов, которые влияют на здоровье печени, защищают от хронического оксидативного стресса, вызванного повреждением печени вследствие вирусной инфекции гепатита В/С, потребления алкоголя, метаболических нарушений, болезни жирной печени, не вызванной алкоголем (NAFLD), стеатогепатита, не вызванного алкоголем (NASH), заболевания печени, вызванного употреблением алкоголя, энцефалопатией печени, фибропролиферативным заболеванием печени (фиброз печени), повреждения гепатоцитов в ходе гипоксии/повторного окисления, или их любой комбинации; или любым другим связанным проявлением, описанным в настоящем описании, и в общем случае с приемлемой токсичностью для пациента.
В некоторых других вариантах осуществления, рассматриваемые соединения и композиции (например, фармацевтическая, нутрицевтическая) могут вводится в количестве, достаточном для лечения нарушения печени или заболевания, включающего вирусный гепатит, гепатит, вызванный употреблением алкоголя, аутоиммунный гепатит, заболевание печени, вызванное употреблением алкоголя, болезнь жирной печени, стеатоз, стеатогепатит, болезнь жирной печени, не вызванная употреблением алкоголя, болезнь печени, вызванная употреблением лекарственных препаратов, цирроз, фиброз, печеночная недостаточность, печеночная недостаточность, вызванная употреблением лекарственных препаратов, метаболический синдром, гепатоклеточная карцинома, холангиокарцинома, первичный бириарный цирроз, желчные канальцы, синдром Жильбера, желтуха, или любое другое состояние печени, ассоциированное с токсичностью или их комбинация, и в общем случае с приемлемой токсичностью для пациента.
Введение рассматриваемых соединений, медицинских композиций или композиций, или их фармацевтически или нутрицевтически приемлемых солей, в чистой форме или в виде подходящей фармацевтической или нутрицевтической композиции, может осуществляться посредством любого приемлемого пути введения агентов, использующихся для обслуживания сходных целей. Рассматриваемые фармацевтическая или нутрицевтическая композиции могут быть получены путем комбинации рассматриваемого соединения с подходящим фармацевтически или нутрицевтически приемлемым носителем, разбавителем или вспомогательным веществом, и может быть получено в форме препарата в твердом виде, полутвердом виде, жидкой или газообразной формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, препараты для инъекций, вещества для ингаляции, гели, микросферы и аэрозоли. Обычные пути введения такой фармацевтической или нутрицевтической композиции включают оральное, местное, чрезкожное, ингаляционное, парентеральное, сублингвальное, буккальное, ректальное, вагинальное или интраназальное введения.
Термин «парентеральный», использующийся в настоящем описании включает подкожные инъекции, внутривенную, внутримышечную, внутриструнную инъекцию или инфузионную методики. Рассматриваемые фармацевтическая или нутрицевтическая композиции получены в такой форме, чтобы обеспечить активным ингредиентам, содержащимся в настоящем описании, биодоступность в момент введения композиции пациенту или вскоре после него. В некоторых вариантах осуществления, рассматриваемые композиции и соединения могут быть разработаны или в такой форме, чтобы они могли быть высвобождаться в течение некоторого времени после введения.
В определенных вариантах осуществления, рассматриваемые композиции вводят субъекту или пациенту в форме одной или более единицы дозировки, где, например, таблетки могут быть единичной дозировкой, а контейнер с рассматриваемыми соединениями в форме аэрозоля может содержать множество единичных доз. Действительные способы получения таких дозированных форм известны или очевидны специалисту в данной области техники; например, см. Remington: The Science и Practice of Pharmacy, 20th Edition (Philadelphia College of Pharmacy and Science, 2000). Рассматриваемые композиции, предназначенные для введения, в любом случае содержат терапевтически эффективное количество рассматриваемого соединения или его фармацевтически или нутрицевтически приемлемой соли для лечения интересующего заболевания или состояния в соответствии с методиками, раскрытыми в настоящем описании.
Рассматриваемая фармацевтическая или нутрицевтическая композиция может быть в твердой форме или в форме жидкости. В одном аспекте, носитель(и) может быть в форме порошка, так что указанные композиции представлены, например, в форме таблетки или порошка. Указанный носитель(и) может быть в форме жидкости, так что указанная композиция может быть, например, сиропом для орального применения, жидкостью для инъекции или аэрозолем, который пригоден, например, при введении путем ингаляции.
Указанная фармацевтическая или нутрицевтическая композиция, предназначенная для орального введения, может быть либо в форме твердого вещества или жидкости, при этом полутвердая форма, полужидкая форма, суспензия и гель включены в формы, рассматриваемые в настоящем описании либо как твердые вещества, либо как жидкости.
В качестве композиции для орального введения могут быть получены фармацевтическая или нутрицевтическая композиции в форме порошка, гранулы, прессованной таблетки, пилюли, капсулы, жевательной резники, облатки, батончика или подобной формы. Такая твердая композиция обычно содержит один или более инертный разбавитель или съедобный носитель. В дополнение, одно или более из следующих веществ могут присутствовать: связующие, такие как карбоксиметилцеллюлоза, этилцеллюлоза, циклодекстрин, микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательные вещества, такие как крахмал, лактоза или декстрины, дезинтегрирующие агенты, такие как альгиновая кислота, альгинат натрия, Primojel®, кукурузный крахмал и подобные; смазывающие вещества, такие как стеарат магния или Sterotex®; глиданты, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин; ароматизатор, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор; и краситель.
Когда фармацевтическая или нутрицевтическая композиция присутствует в форме, например, желатиновой капсулы, она может содержать, в дополнение к материалам перечисленных выше типов, жидкий носитель, такой как полиэтиленгликоль или масло.
Рассматриваемая фармацевтическая или нутрицетическая композиция может быть в форме жидкости, например, эликсиром, сиропом, гелем, раствором, эмульсией или суспензией. Указанные жидкости могут быть предназначены для орального введения или для введения путем инъекции, в виде двух примеров. Указанная полезная композиция, предназначенная для орального введения, содержит, в дополнение к настоящим соединениям, один или более из следующего: подсластитель, консерванты, красители и усилители вкуса. В композицию, предназначенную для введения путем инъекции, может быть включено одно или более поверхностно-активное вещество, консервант, смачивающий агент, диспергирующий агент, суспендирующий агент, буфер, стабилизатор и изотонический агент.
Рассматриваемые жидкие фармацевтическая или нутрицевтическая композиции, будь то растворы, суспензии или другая подобная форма, могут включать один или более из следующих адъювантов: стерильные разбавители, такие как вода для инъекций, солевой раствор, такой как физиологический раствор, раствор Рингера, изотонический натрий хлорид, фиксированные масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или многоразовые флаконы из стекла или пластика. Физиологический солевой раствор является обычно используемым адъювантом. Инъекционная фармацевтическая или нутрицевтическая композиция является стерильной.
Рассматриваемая жидкая фармацевтическая или нутрицевтическая композиция, предназначенная для парентерального или перорального введения, должна содержать некоторое количество рассматриваемого соединения, медицинской композиции или композиции, чтобы была получена подходящая доза.
Рассматриваемая фармацевтическая или нутрицевтическая композиция может быть предназначена для местного применения, и в этом случае носитель может подходящим образом включать раствор, эмульсию, крем, лосьон, мазь или гель. Основание, например, может содержать одно или более из следующего: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавитель, такой как вода и спирт, и эмульгаторы и стабилизаторы. Сгущающие агенты могут присутствовать в фармацевтической или нутрицевтической композиции для местного применения. Композиция, предназначенная для трансдермального введения, может включать в себя трансдермальный патч или устройство для ионтофореза.
Рассматриваемая фармацевтическая или нутрицевтическая композиция может быть предназначена для ректального введения, в виде, например, суппозитория, который расплавляется в прямой кишке и высвобождает лекарство. Композиция для ректального введения может содержать маслянистую основу в качестве подходящего ненасыщенного вспомогательного вещества. Такие основания включают ланолин, масло какао и полиэтиленгликоль.
Рассматриваемая фармацевтическая или нутрицевтическая композиция может включать в себя различные материалы, которые изменяют физическую форму твердой или жидкой дозированной единицы. Например, композиция может включать материалы, которые образуют оболочку покрытия вокруг активных ингредиентов. Материалы, которые образуют оболочку покрытия, обычно являются инертными, и могут быть выбраны из, например, сахара, шеллака и других энтеросолюбильных покрывающих агентов. В качестве альтернативы, активные ингредиенты могут быть помещены в желатиновую капсулу.
Рассматриваемая фармацевтическая или нутрицевтическая композиция в твердой или жидкой форме может включать агент, который связывается с рассматриваемым соединением и тем самым помогает в доставке соединения. Подходящие агенты, которые могут содействовать этой способности, включают моноклональное или поликлональное антитело, белок или липосому.
Рассматриваемая фармацевтическая или нутрицевтическая композиция в твердой или жидкой форме может включать частицы уменьшенного размера, например, для улучшения биодоступности. Размер частицы порошка, гранулы, частицы, микросферы или подобного в композиции, с вспомогательным веществом или без него, может быть макроразмера (например, видимым для глаза или размером не менее 100 мкм), микроразмера (например, может варьироваться от примерно 100 мкм до примерно 100 нм), наноразмера (например, может иметь размер не более 100 нм) и любой размер между ними или их любой комбинацией для улучшения размера и объемной плотности.
Рассматриваемая фармацевтическая или нутрицевтическая композиция может содержать или состоять из единицы дозы, которая может быть введена в в виде аэрозоля. Термин аэрозоль используют для обозначения ряда систем, начиная с систем коллоидной природы и до систем, состоящих из прессованных упаковок. Доставка может быть обеспечена посредством сжиженного или сжатого газа или посредством подходящей системы с насосом, которые диспергируют активные ингредиенты. Аэрозоли соединения согласно настоящему изобретению могут быть представлены в виде однофазной, двухфазной или трехфазной систем для доставки указанных активных ингредиентов. Средство доставки аэрозоля включает необходимый контейнер, активаторы, клапана, субконтейнеры и подобные детали, которые вместе могут образовывать набор. Специалист в данной области техники может выбрать наиболее подходящий аэрозоль без проведения каких-либо экспериментов.
Рассматриваемая фармацевтическая или нутрицевтическая композиция может быть получена по методологии, хорошо известной в фармацевтической или нутрицевтической области техники. Например, фармацевтическая или нутрицевтическая композиция, предназначенная для введения путем инъекции, может быть получена путем объединения рассматриваемого соединения со стерильной дистиллированной водой для образования раствора. Поверхностно-активное вещество может быть добавлено для облегчения образования гомогенного раствора или суспензии. Поверхностно-активные вещества представляют собой соединения, которые нековалентно взаимодействуют с рассматриваемым соединением, чтобы способствовать растворению или образованию гомогенной суспензии соединения в водной дисперсии.
Рассматриваемые соединения, композиции и медицинские композиции, или их фармацевтически или нутрицевтически приемлемые соли вводятся в терапевтически эффективном количества, которое варьируется в зависимости от множества факторов, включающих активность конкретного используемого соединения; метаболическую стабильность и длительность действия соединения; возраст, вес тела, общее состояние здоровья, пол и диету пациента; режим и время введения; скорость выделения; сочетание лекарств; тяжесть конкретного расстройства или состояния; и субъекта, в отношении которого осуществляют терапию.
Рассматриваемые соединения, композиции и медицинские композиции, или их фармацевтически или нутрицевтически приемлемые производные, также могут вводиться одновременно с введением одного или более других терапевтических агентов или после него. Такая комбинированная терапия включает введение одной фармацевтической или нутрицевтической лекарственной формы, которая содержит рассматриваемое соединение, и одного или более дополнительного активного агента, а также введение рассматриваемого соединения и каждого активного агента в его отдельной фармацевтической или нутрицевтической лекарственной форме. Например, рассматриваемое соединение и другой активный агент можно вводить пациенту вместе в виде единой композиции для перорального введения, такой как таблетка или капсула, или каждый агент можно вводить в отдельных пероральных лекарственных формах. В тех случаях, когда используются отдельные лекарственные формы, рассматриваемые соединения и один или более дополнительный активный агент можно вводить по существу в одно и то же время, то есть, одновременно или в отдельные периоды, следующие друг за другом, то есть, последовательно; под комбинированной терапией понимают все эти схемы.
Следует понимать, что в настоящем описании, комбинации заместителей или варьирующихся частей изображенной формулы допускаются только если такие комбинации приводя к образованию стабильного соединения.
Специалистам в данной области также понятно, что в описанном в настоящем описании способе функциональные группы промежуточных соединений могут нуждаться в защите подходящими защитными группами. Такие функциональные группы включают гидрокси, амино, меркапто и карбоновую кислоту. Подходящие защитные группы для гидроксигруппы включают триалкилсилил или диарилалкилсилил (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), тетрагидропиранил, бензил и подобные им. Подходящие защитные группы для амино, амидино и гуанидино групп включают трет-бутоксикарбонил, бензилоксикарбонил и подобные им. Подходящие защитные группы для меркаптогруппы включают C(O)R'' (где R'' представляет собой алкил, арил или арилалкил), п-метоксибензил, тритил и подобные им. Подходящие защитные группы для карбоновой кислоты включают алкильные, арильные или арилалкиловые эфиры. Защитные группы могут быть добавлены или удалены в соответствии со стандартными методами, которые известны специалистам в данной области техники и как описано в настоящем описании. Использование защитных групп подробно описано в Green, T.W. и P.G.M. Wutz, Protective Groups in Organic Synthesis (1999), 3-е изд., Wiley, которое полностью включено в настоящее описание посредством ссылки. Как понятно специалисту в данной области, защитная группа также может быть полимерной смолой, такой как смола Ванга, смола Ринка или смола 2-хлортритил-хлорид.
Специалистам в данной области также понятно, что, хотя такие защищенные производные рассматриваемых соединений могут не обладать фармакологической активностью как таковой, они могут быть введены млекопитающему и затем метаболизированы в организме с образованием соединений, которые являются фармакологически активными. Поэтому такие производные можно описать как «пролекарства». Все пролекарства рассматриваемых соединений включены в объем настоящего раскрытия.
Более того, рассматриваемые соединения, которые существуют в свободной основной или в кислой форме, могут быть превращены в их фармацевтически или нутрицевтически приемлемые соли путем обработки соответствующим неорганическим или органическим основанием или кислотой способами, известными специалисту в данной области. Соли рассматриваемых соединений могут быть превращены в их свободную основную или кислую форму стандартными методами.
В некоторых вариантах осуществления, рассматриваемые соединения, композиции и/или медицинские композиции могут быть выделены из растительных источников, например, из растений, приведенных в Примерах и где-либо еще в настоящем описании. Подходящие части растений для выделения рассматриваемых экстрактов и соединений включают листья, кору, ствол, кору ствола, стебли, кору стеблей, прутики, ветки, корни, кору корней, поверхность коры (такую как перидерма или полидерма, которые могут включать феллему, феллоген, феллодерм или их любую комбинацию), молодые побеги, корневища, семена, фрукты, андроцей, гинецей, чашечки, тычинки, лепестки, чашелистики, плодолистики (пестики), цветки или их любые комбинации. Рассматриваемые растительные экстракты получены из по меньшей мере одной части растения, выбранного из группы, включающей стебли, кору стеблей, стволы, кору стволов, прутики, ветки, корни, кору корней, молодые побеги, семена, корневища, цветки и другие репродуктивные органы, листья, другие надземные части или их комбинацией. В некоторых связанных вариантах осуществления, рассматриваемые соединения выделены из растительных источников и синтетически модифицированы для того, чтобы содержать любой из процитированных выше заместителей. В этом отношении, синтетическая модификация рассматриваемых соединений, выделенных из растений, может быть выполнена с использованием любой из множества методик, известных из уровня техники и хорошо известных специалистам в данной области техники.
Примеры
Пример 1: Животные
Целевые разведенные мыши в возрасте 7-8 недель с массой тела 25-30 г были приобретены у Charles River Laboratories (Уилмингтон, Массачусетс). Животных акклиматизировали по прибытии в течение недели, прежде чем их взвешивали и назначали случайным образом в их соответствующие группы. Мышей ICR (5 на клетку) помещали в полипропиленовую клетку и индивидуально идентифицировали по номерам на их хвосте. Каждая клетка была накрыта крышкой из проволочной сетки и фильтрующей верхней частью (Аллентаун, Нью-Джерси). Каждая отдельная клетка была идентифицирована посредством карточки клетки, указывающей номер проекта, исследуемое соединение, уровень дозировки, группу и номер животного. Использовались мягкие постельные принадлежности Harlan Т7087 и менялись не реже двух раз в неделю. Животным был обеспечен свободный доступ к пресной воде и диете для кормления грызунов # Т2018 (Harlan Teklad, 370W, Кент, Вашингтон) и их размещали в комнате с контролируемой температурой (22,2°С) в 12-часовом светло-темном цикле. Все эксперименты на животных проводились в соответствии с институциональными руководящими принципами, соответствующими руководству по уходу и использованию лабораторных животных.
Пример 2: Модели повреждения печени у животных, вызванных ацетаминофеном (АРАР) или тетрахлоруглеродом (CCL4)
Был разработан сбалансированный терапевтический график и оптимизирован для профилактики и вмешательства следующим образом: для АРАР-индуцированной модели гепатотоксичности АРАР (Лот № MKBQ8028V от Sigma) в дозе 400 мг/кг, растворенный в теплом солевом растворе (лот №132908 от G- Biosciences, лот №720729 от Quality Biological) (нагретый до 60°С и охлажденный до температуры окружающей среды), вводили перорально мышам ICR/CD-1 после ночи голодания для индукции токсичности. Для модели гепатотоксичности, индуцированной CCl4, CCl4 (лот № SHBD5351V от Sigma) в дозе 25 мкл/кг, растворенный в кукурузном масле, вводили внутрибрюшинно после ночи голодания мышам ICR/CD-1, чтобы вызвать токсичность. Для обеих моделей материалы вводили за 48 ч, 24 ч, 2 ч до введения АРАР или CCl4 и через 6 ч после индукции. В общей сложности мыши получали 3 дозы до химической индукции и дозу после химической индукции. 10% Твин-20 (лот № 0134С141 от Amresco), 1% CMC (лот № NH0454 от Spectra) или 1% МС (лот № SLBK4357V) использовали в качестве носителя для всех материалов. Мыши контрольной группы без АРАР или CCl4 получали только носитель. ALT в сыворотке определяли на Т24 (Phoenix Laboratories, Эверетт, Вашингтон).
Пример 3: Получение растительных экстрактов
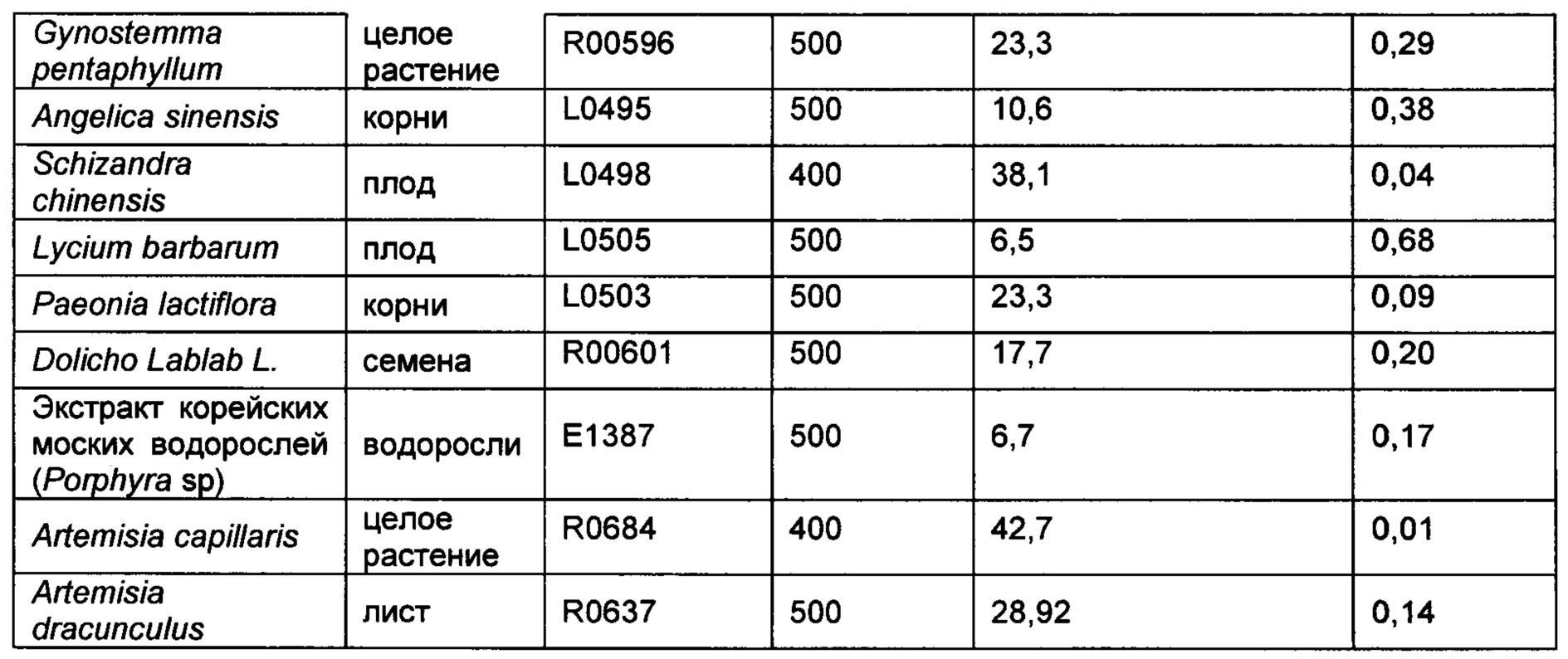
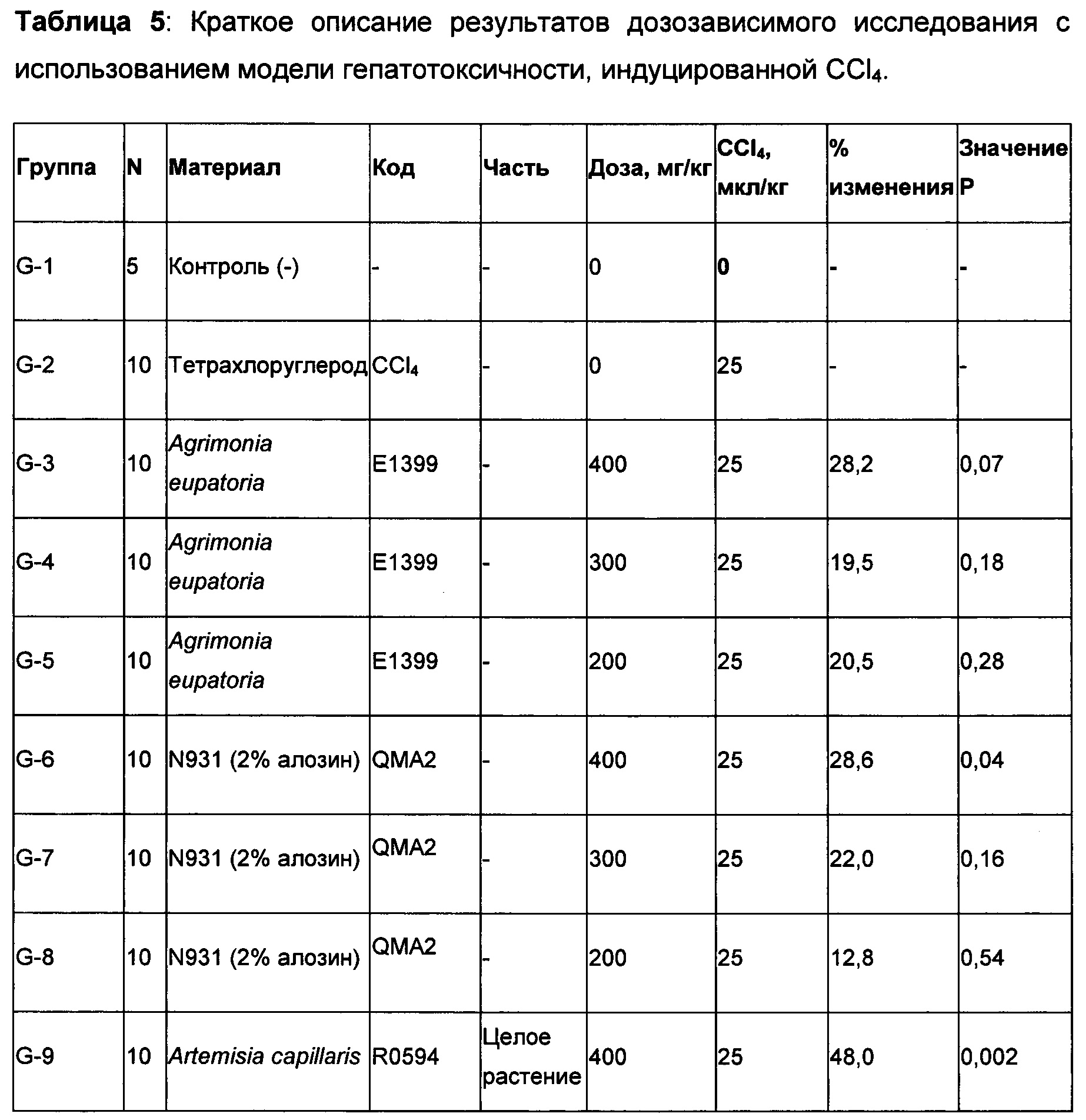
Растения собирали и обрабатывали различными растворителями в зависимости от свойств активных соединений и скринировали в наших моделях гепатотоксичности животных у мышей. Следующие 19 растений, указанных в Таблице 1, включая различные части из 16 видов, показали ингибирование ALT в сыворотке на разных уровнях либо в модели, индуцированной ацетаминофеном, либо на модели, индуцированной CCl4 у мышей. Для дополнительных исследований будут выбраны только растения с эффективностью в обеих моделях.
Экстракты расторопши получали как экстракты 80% этанолом / 20% воды семян Silybum marianum с коэффициентом экстракции 40-50:1. Почвенное семя экстрагировали 80% этанолом / 20% воды, а затем осадок отделяли от надосадочной жидкости фильтрованием. Указанный растворитель удаляли под вакуумом с получением мягкого экстракта, который смешивали с мальтодекстрином и дополнительно сушили с помощью распылительной сушилки. Экстракты расторопши стандартизировали для соответствия требованиям не менее 50% общего количества силимарины и не менее 30% силибинина. Силимарин состоит из смеси флавонолигнанов силибинина, силидианина и силикамина. Силибинин является основной активной составляющей силимарина. Стандартизованный экстракт семян расторопши является коммерчески доступным.
Как описано выше, N931 представляет собой композицию, содержащую уникальную комбинацию 1-4% алоэзина и 96-99% 200:1 гелевый порошок полисахаридов внутреннего слоя листа Aloe vera, смешанную обычным способом. Гелевый порошок полисахаридов внутреннего слоя листа Aloe vera поставлялся компанией Aloecorp в форме лиофилизата. Кору удаляли вручную со свежих очищенных листьев растения Aloe barbadensis, и затем сок алоэ собирали и обрабатывали целлюлазой для дезактивации фермента. Активированный уголь использовался для удаления цвета во время дезактивации фермента. Обесцвеченный фильтрат дополнительно переносили в лиофилизационные ловушки, чтобы получить гелевый порошок внутреннего листа Aloe vera, который смешивали с 1-4% алоэзина для получения N931.
Пример 4: Гепатопротекторная активность растительных экстрактов в в моделях гепатотоксичности, вызванных АРАР и CCL4
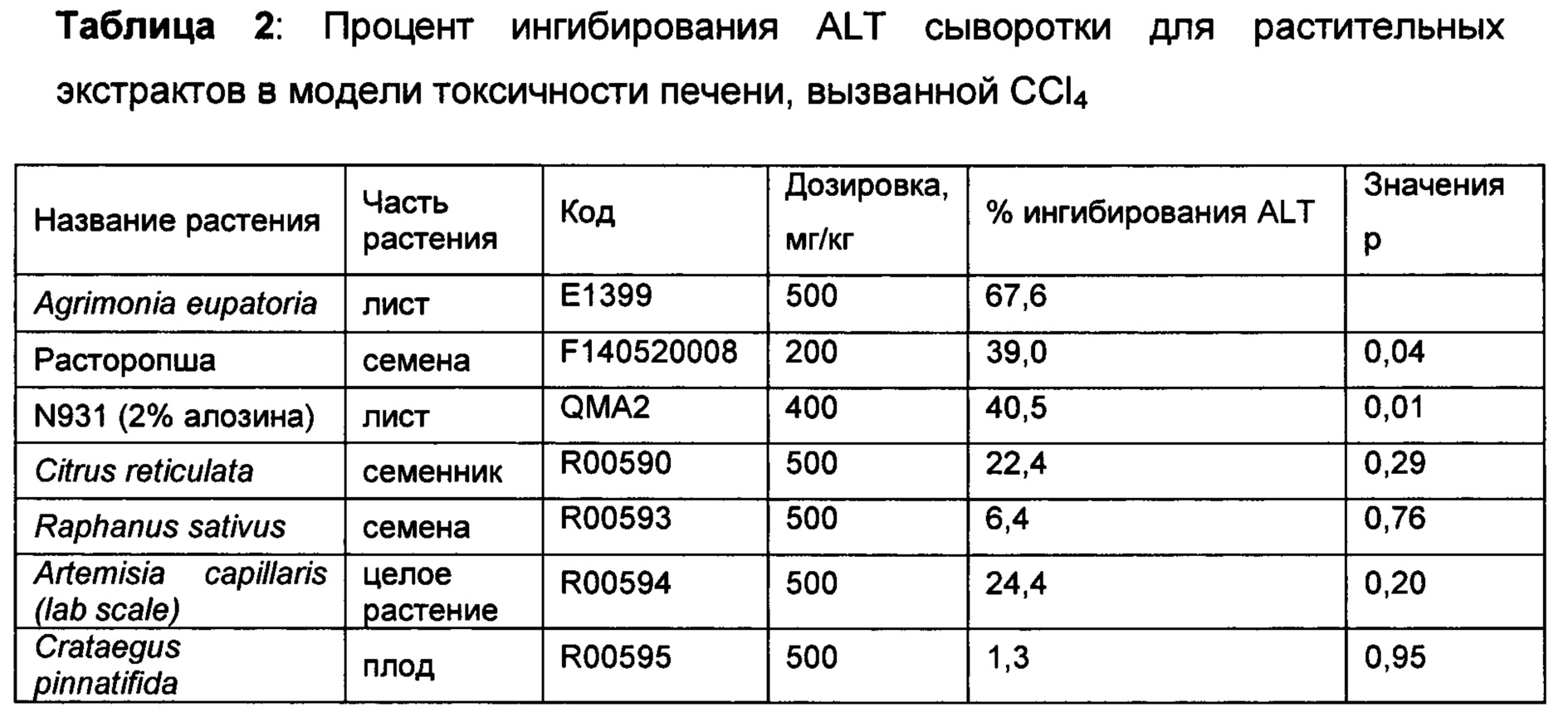
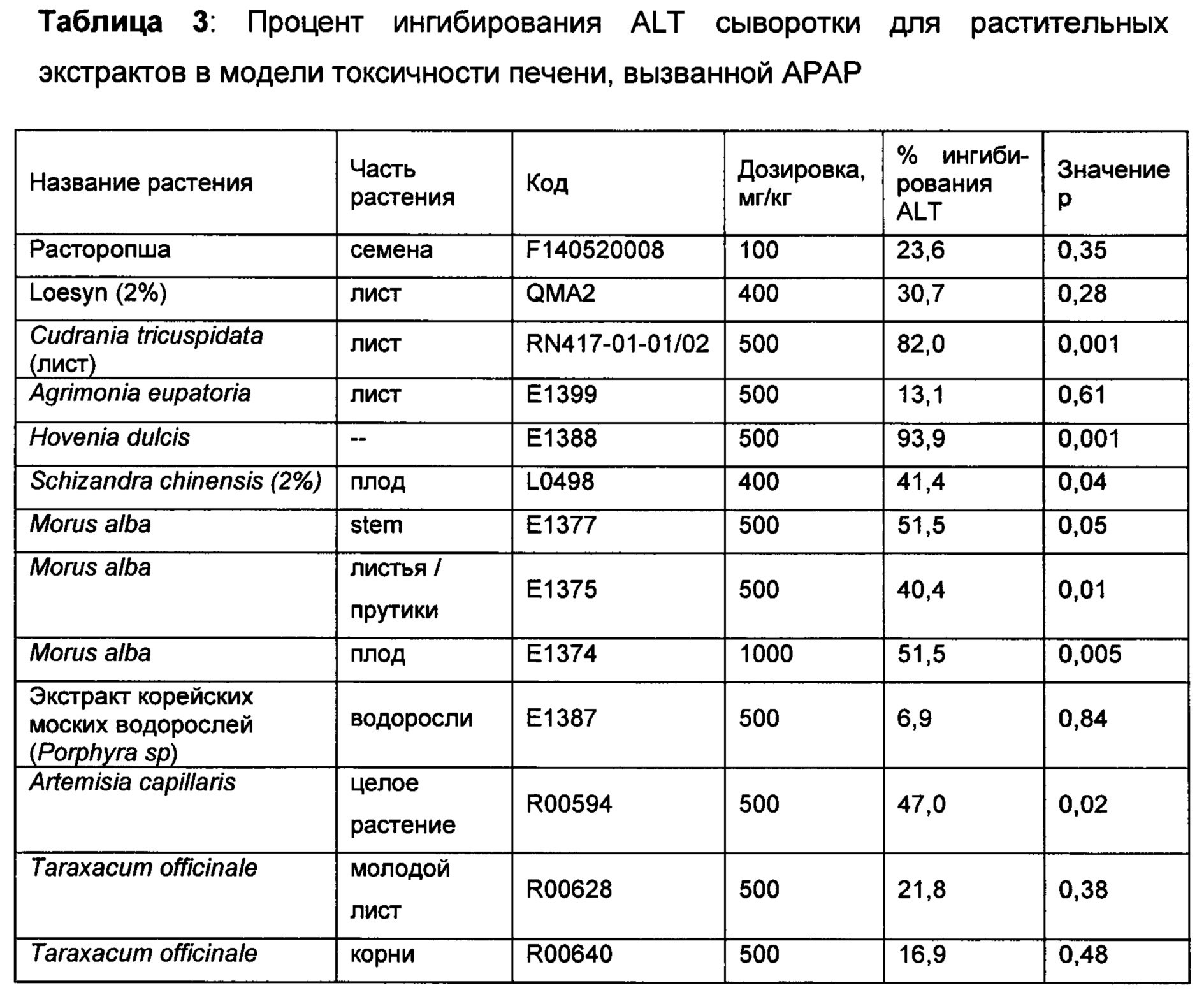
Растительные материалы из обычно используемых растений, собранные на основе их исторического использования по защите и обновлению печени, экстрагировали с использованием 70% этанола и скринированы на предмет их эффективности при токсичности печени, вызванной как АРАР, так и CCl4. Материалы вводили животным перорально в дозировке, указанной в Таблицах 2-3. В то время как большинство растительных экстрактов демонстрировали ингибирование ALT в сыворотке в одной модели, несколько растений продемонстрировали свою эффективность в обеих моделях. Среди них Schizandra chinensis, Artemisia capillaris, расторопша и Loesyn были отобраны для дополнительных исследований.
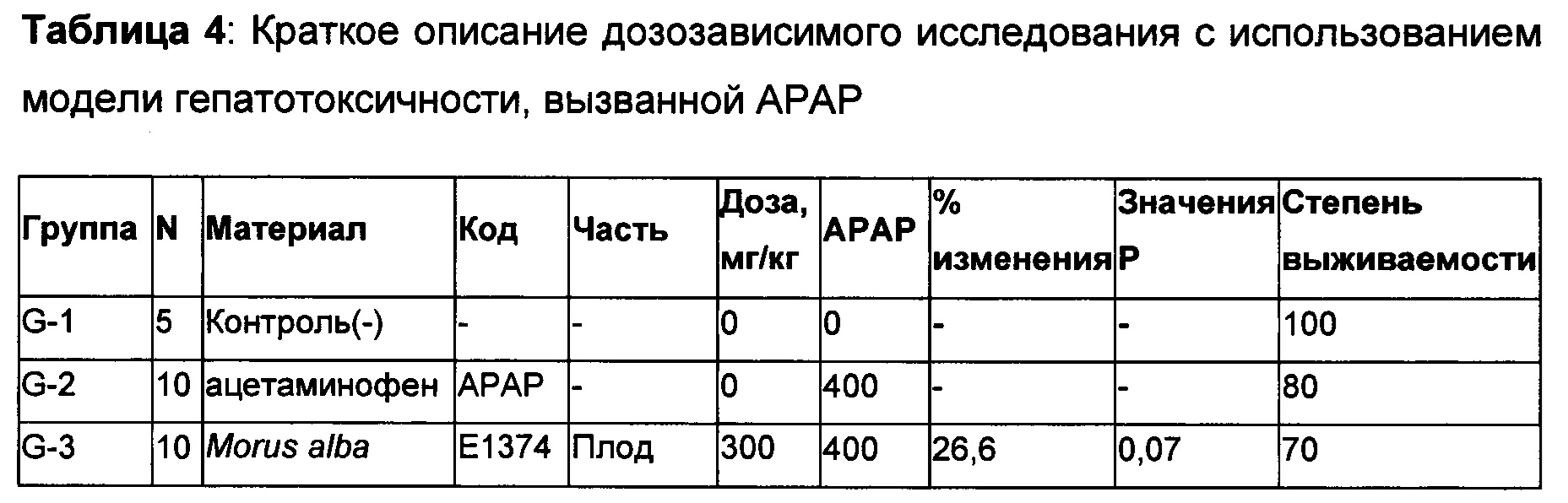
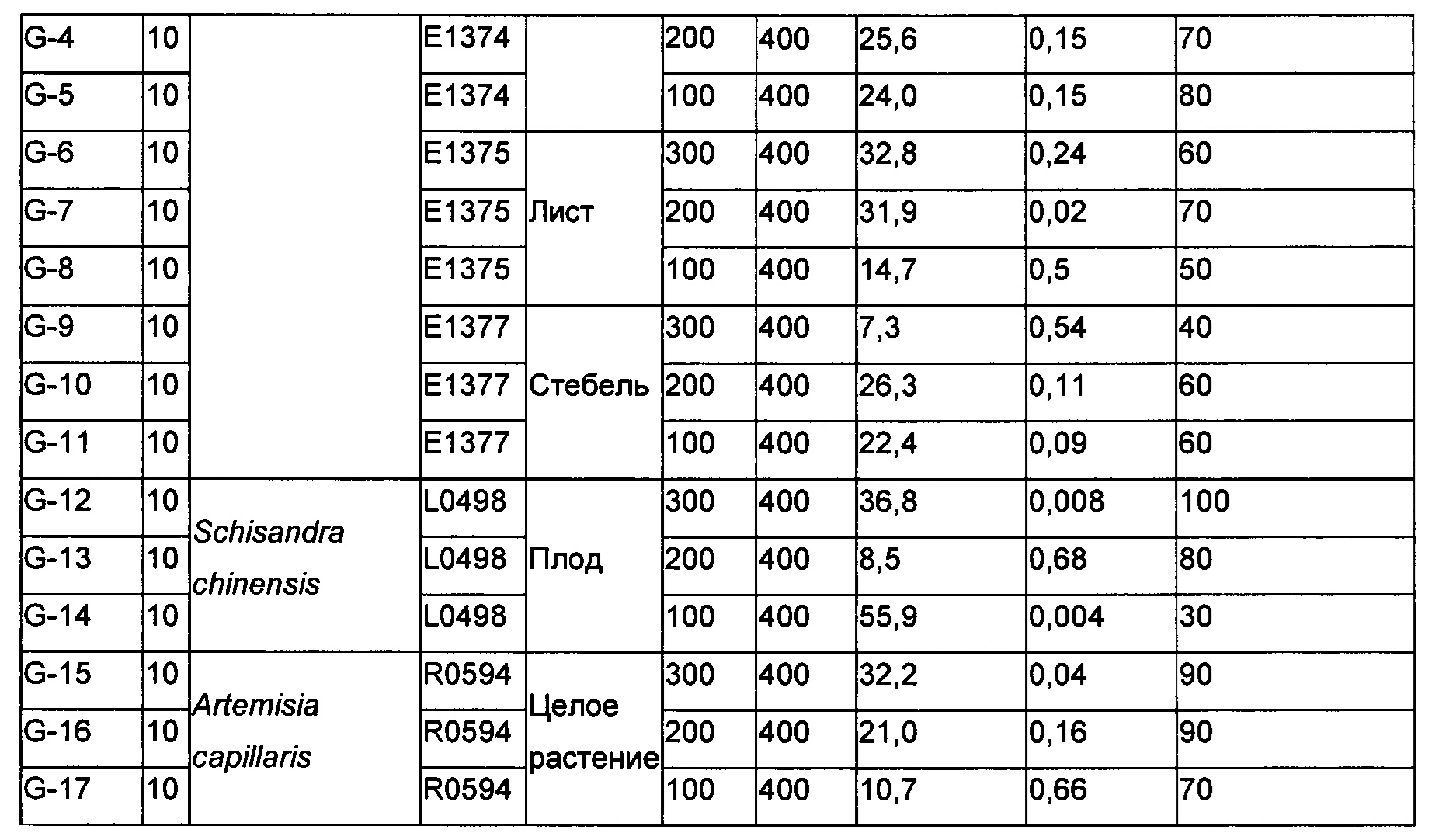
Пример 5: Дозозависимый эффект выбранных растительных экстрактов в модели АРАР
Лист шелковицы (Morus) (Е1375), плод шелковицы (Е1374), стебель шелковицы (Е1377), Artemisia capillaris (R0594) и Schizandra chinensis (2%) (L0498) тестировали в дозировках 100, 200 и 300 мг/кг в модели гепатотоксичности, вызванной АРАР, как в способе, описанном выше. 10% Твин-20 использовали в качестве носителя для всех материалов. Контрольная группа мышей без АРАР получала только носитель (10% Твин-20). ALT сыворотки определяли через 24 ч. Как видно из Таблицы 4, приведенной ниже, два растительных материала, такие как Schizandra chinensis (2%) (L0498) и Artemisia capillaris (R0594) продемонстрировали 36,8% и 32,2% ингибирования уровня ALT сыворотки, соответственно, при дозировке 300 мг/кг. Указанные снижения были статистически значимыми. Хотя L0498 продемонстрировал 100% степень выживаемости при дозировке 300 мг/кг, R0594 продемонстрировал только 90% степень выживаемости. При наименьшей дозировке (100 мг/кг), L0498 продемонстрировал только 30% степень выживаемости. Тогда как, R0594 продемонстрировал 70% степень выживаемости при этой дозировке. Вне зависимости от дозировки, степени выживаемости для всех экстрактов шелковицы были ниже 40. Такие высокие значения смертности приводили к неубедительным процентам снижения уровней ALT сыворотки. Поэтому, Schizandra chinensis (2%) (L0498) и Artemisia capillaris (R0594) могут быть рассмотрены в качестве настоящей удачи в этой модели с оптимальной эффективностью при примерно 300 мг/кг.
Пример 6: Дозозависимый эффект выбранных растительных экстрактов в модели CCl4
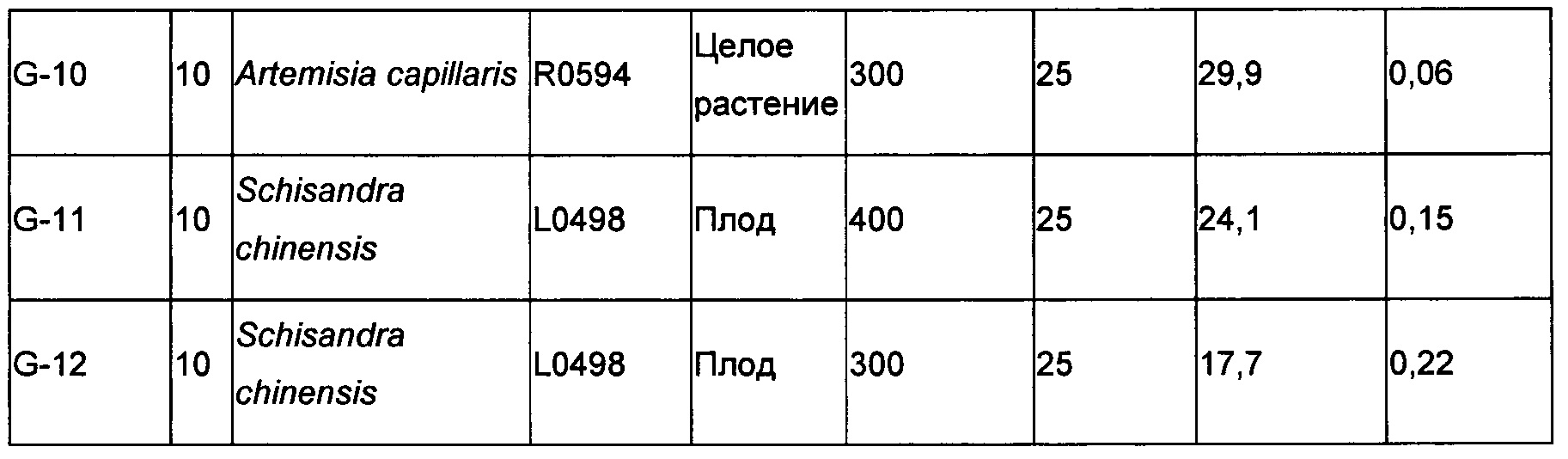
Agrimonia eupatoria (Е1399) и Loesyn (QMA2) в дозировке 400 мг/кг, 300 мг/кг и 200 мг/кг; Artemisia capillaris (R0594), и Schizandra chinensis (2%) (L0498) в дозировке 400 мг/кг и 300 мг/кг тестировали в модели гепатотоксичности, вызванной CCl4, как описано выше. 10% Твин-20 использовали в качестве носителя для всех материалов. Мыши контрольной группы без CCl4 получали только носитель (10% Твин-20). ALT сыворотки определяли через 24 ч.
Как видно из Таблицы 5 ниже, почти для всех указанных экстрактов наблюдалось снижение уровней ALT в сыворотке, коррелировавшее с дозировкой. Наибольшие снижения уровней ALT в сыворотке наблюдались у мышей, обработанных 400 мг/кг Artemisia capillaris (R0594) (48,0%) с последующей обработкой дозой 300 мг/кг того же растительного материала (29,9%). Указанные снижения были статистически значимыми. При дозе 400 мг/кг, как Agrimonia, так и Loesyn продемонстрировали очень схожий уровень снижения уровня ALT (а именно 28%) с значением Р, равным 0,07 и 0,04, соответственно. При этом наблюдался 100% уровень выживаемости для всех групп, включая контрольную группу, обработанную носителем. По крайней мере эта партия Artemisia capillaris (R0594) продемонстрировала превосходные свойства в ингибировании уровня ALT в сыворотке, чем все остальные исследованные перспективные соединения.
Пример 7: Получение органических экстрактов Artemisia capillaris
Высушенные надземные части Artemisia capillaris (2,5 кг) нарезали, измельчали и затем экстрагировали примерно 15-кратным объемом (37,5 л) 70% этилового спирта в воде (об./об.). Указанную экстракцию осуществляли при 85°С в течение 3 часов. После фильтрации, полученный этанольный раствор концентрировали на роторном испарителе под вакуумом при 40°С. Указанную процедуру экстракции и концентрирования повторяли два раза с 10-кратным объемом (25 л) 70% этилового спирта в воде (об./об.) в течение 2 часов. Полученный раствор концентрированного экстракта упаривали досуха под вакуумом в сухой печи с получением 480 г порошка 70% EtOH экстракта Artemisia capillaris (лот № RN367-3-60M) с выходом экстракции 19,2%.
Высушенные измельченные растения Artemisia capillaris (180,4 г) экстрагировали 70% этанолом в воде три раза с обратным холодильником в течение одного часа каждый раз. Органические растворы объединяли и упаривали под вакуумом с получением 70% этанольного экстракта (R594-70EE) весом 37,7 г с выходом 20,9%. Схожие результаты получали с использованием такой же процедуры, но органический растворитель был заменен метанолом или этанолом с получением метанольного экстракта (ME) или этанольного экстракта (ЕЕ), этанол : H2O (7:3) экстракта, этанол : H2O (1:1) экстракта, этанол : H2O (3:7) экстракта с водой, соответственно. Процесс экстракции указанными растворителями суммирован в Таблице 6.
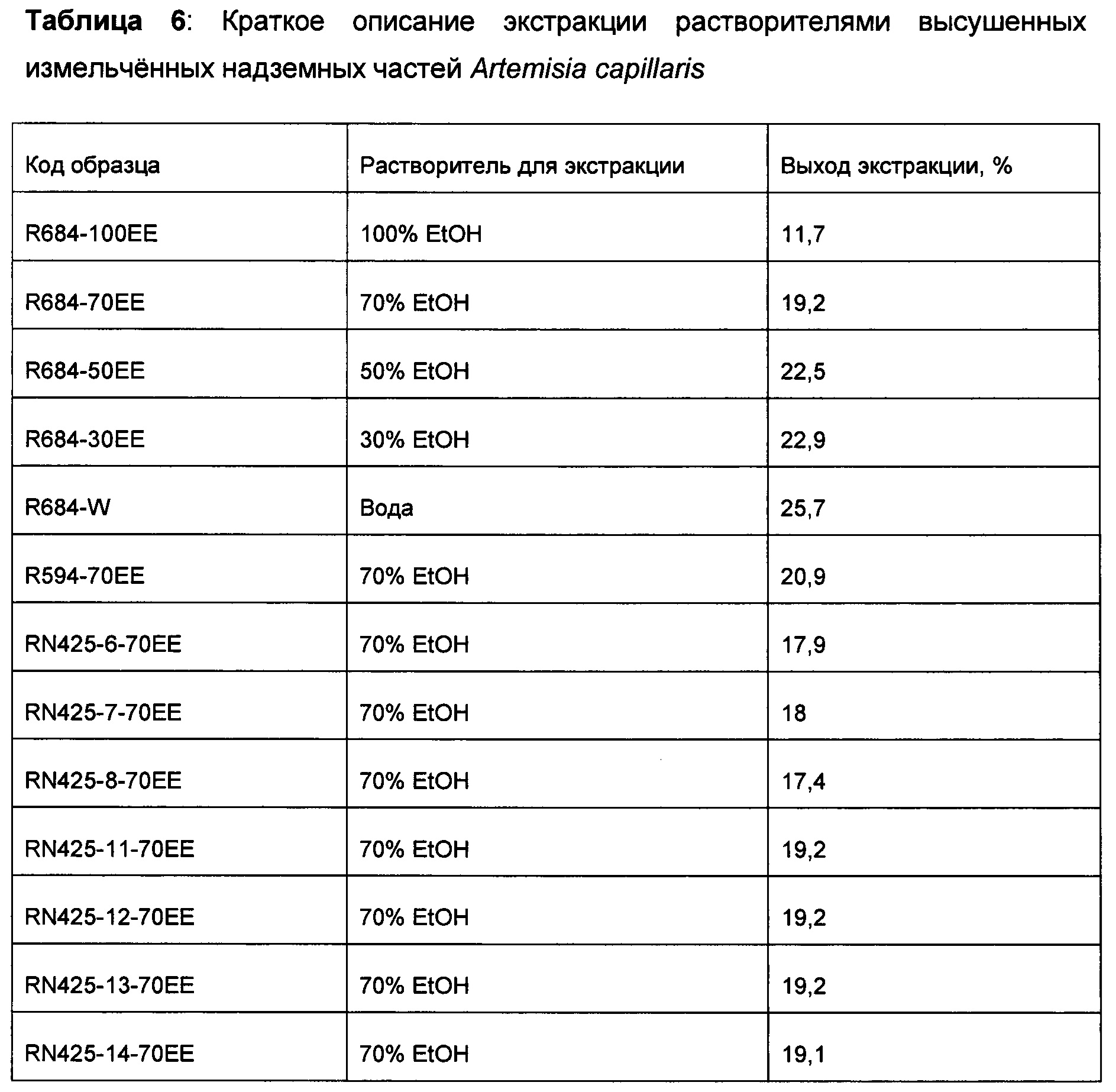
Пример 8: Фракционирование экстрактов Artemisia capillaris с помощью биологических проб
70% этанольный экстракт Artemisia capillaris (RN425-7-70EE, 20 г) разделяли между гексанами (200 мл) и водой (250 мл) три раза. Из объединенных гексановых растворов удаляли растворитель под вакуумом с получением гексанового экстракта (НЕ) весом 1,43 г. Водный слой экстрагировали этилацетатом (200 мл) три раза. Объединенные слои этилацетата осушали под вакуумом с получением этилацетатного экстракта (ЕА) 2,29 г. Водный слой дополнительно экстрагировали бутанолом (200 мл) три раза с получением бутанольного экстракта (BU) 3,70 г. Оставшийся водный слой подвергали лиофильной сушке с получением водного экстракта (WA) 15,3 г. Указанные экстракты 70% ЕЕ, НЕ, ЕА, BU и WA тестировали в модели гепатотоксичности, индуцированной CCl4, на мышах. Экстракты НЕ, ЕА, BU были неактивными, в то время как 70% ЕЕ продемонстрировал 25,27% ингибирование ALT при 400 мг/кг, a WA фракция продемонстрировала 37,49% ингибирование при 300 мг/кг с Р≤0,05.
Активную фракцию WA дополнительно фракционировали с использованием HP20SS хроматографии. WA (4,4 г) растворяли в 20% растворе EtOH в воде и загружали на колонку HP20SS (Diaion, Mitsubishi Chemical Corporation, Япония, 160 г), предварительно стабилизированную 20% EtOH в воде. Указанную колонку элюировали 800 мл 20% EtOH в воде, 600 мл 40% EtOH в воде, 400 мл 60% EtOH, 200 мл 80% EtOH, и наконец промывали 200 мл EtOH и 200 мл ацетона. Две основные фракции НР-01 (3,67 г, 83,4%) и НР-02 (305,7 мг, 6,95%) собирали и тестировали в модели гепатотоксичности, индуцированной CCl4, на мышах. Главными компонентами фракции НР-01 являются олигосахариды и полисахариды. Фракция НР-02 содержит главным образом полифенолы. НР-01 продемонстрировала уровень ингибирования ALT, сравнимый с WA, с 32,86% ингибированием при 300 мг/кг. НР-02 являлась неактивной в той же модели, что указывает на то, что полифенолы не вносят вклад в активность указанного растения.
Активную фракцию НР-01 дополнительно фракционировали с помощью открытой LH-20 колонки. НР-01 (1,06 г) растворяли в воде и загружали на одну колонку LH-20, предварительно стабилизированную в воде, и с помощью градиентной элюции МеОН/H2O получали 4 фракции, LH-01 (43,4 мг, 4,26%), LH-02 (799,6 мг, 78,5%), хлорогеновую кислоту (LH-03, 45,4 мг, 4,5%) и LH-04 (23,1 мг, 2,27%). Только основную фракцию LH-02 проверяли в исследовании in vivo ввиду ограниченного количества образцов. LH-02, 78,5% фракции НР-01, не продемонстрировала какой-либо активности в модели гепатотоксичности, индуцированной CCl4, на животных при дозировке 300 мг/кг. Хлорогеновая кислота (С3878, Sigma-Aldrich, США), составляющая фракции НР-01 в количестве примерно 4,5%, не продемонстрировала какого-либо ингибирования в опыте при дозировке 200 мг/кг. Указанные данные эксперимента in vivo четко продемонстрировали, что указанные водорастворимые компоненты, кроме хлорогеновой кислоты и полифенолов, являются ответственными за гепатопротекторную активность экстракта Artemisia. Содержание активных полисахаридов было менее 10% фракции WA. Указанная информация суммирована в Таблице 7.
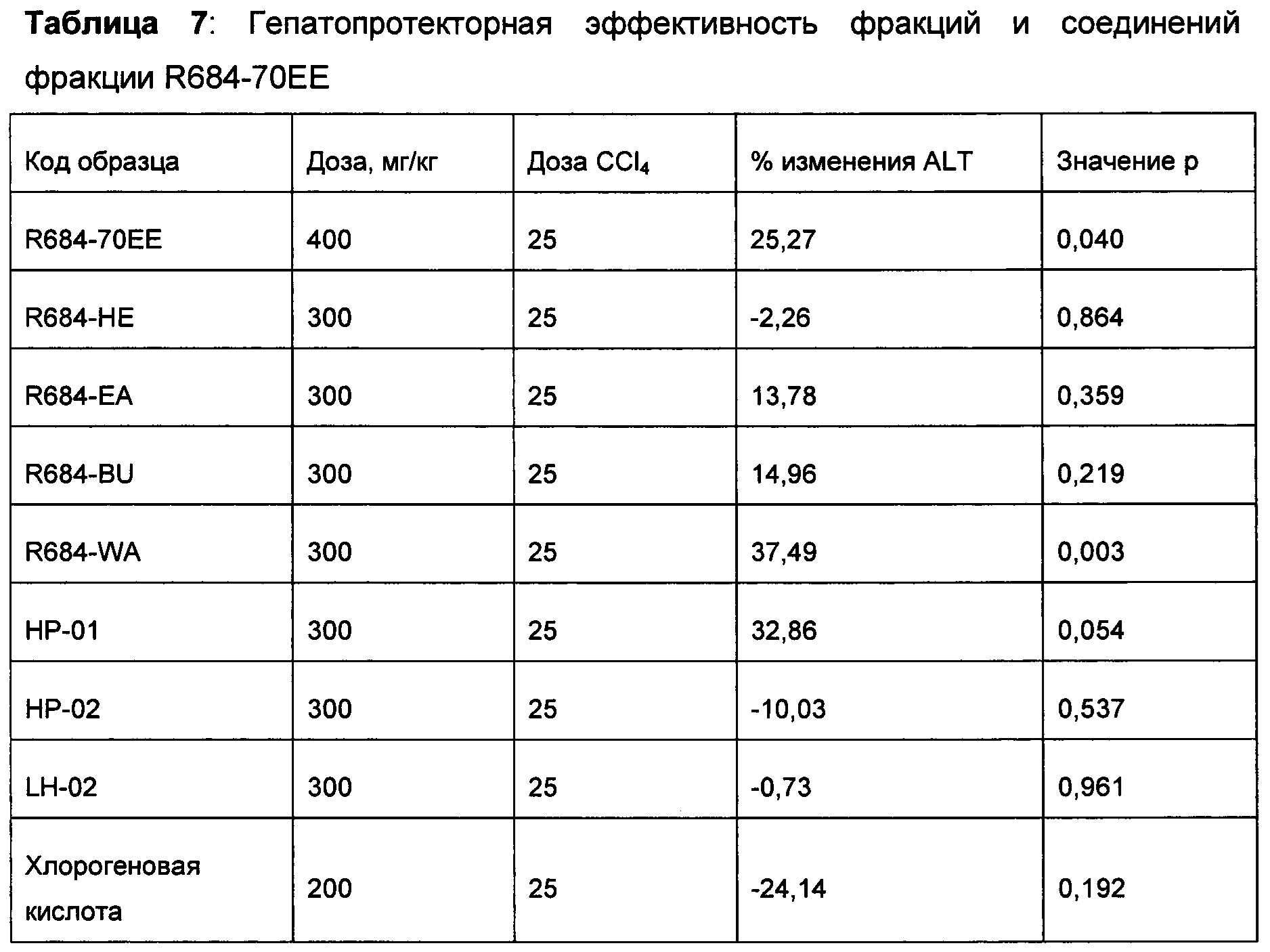
Пример 9: Фракционирование активного образца НР-1 с помощью мембранного диализа
Фракцию с гепатопротекторной активностью, НР-01 как показано в Примере 8 и Таблице 7, из Artemisia capillaris растворяли в подходящем объеме дистиллированной воды и диализировали в пробирках с мембраной для диализа против дистиллированной воды (отсечка по MW 2000) 3 раза в течение 3 часов каждый раз. Как оставшийся раствор, так и объединенные диализные растворы высушивали посредством лиофильной сушки с получением двух образцов DA-1 (MW>2000, 13,79%) и DA-2 (MW<2000, 84,54%). Фракцию DA-2 дополнительно диализировали с отсечкой по молекулярной массе 500 с последующей процедурой, идентичной процедуре в предыдущем диализе. Собирали фракции DA-3 (500
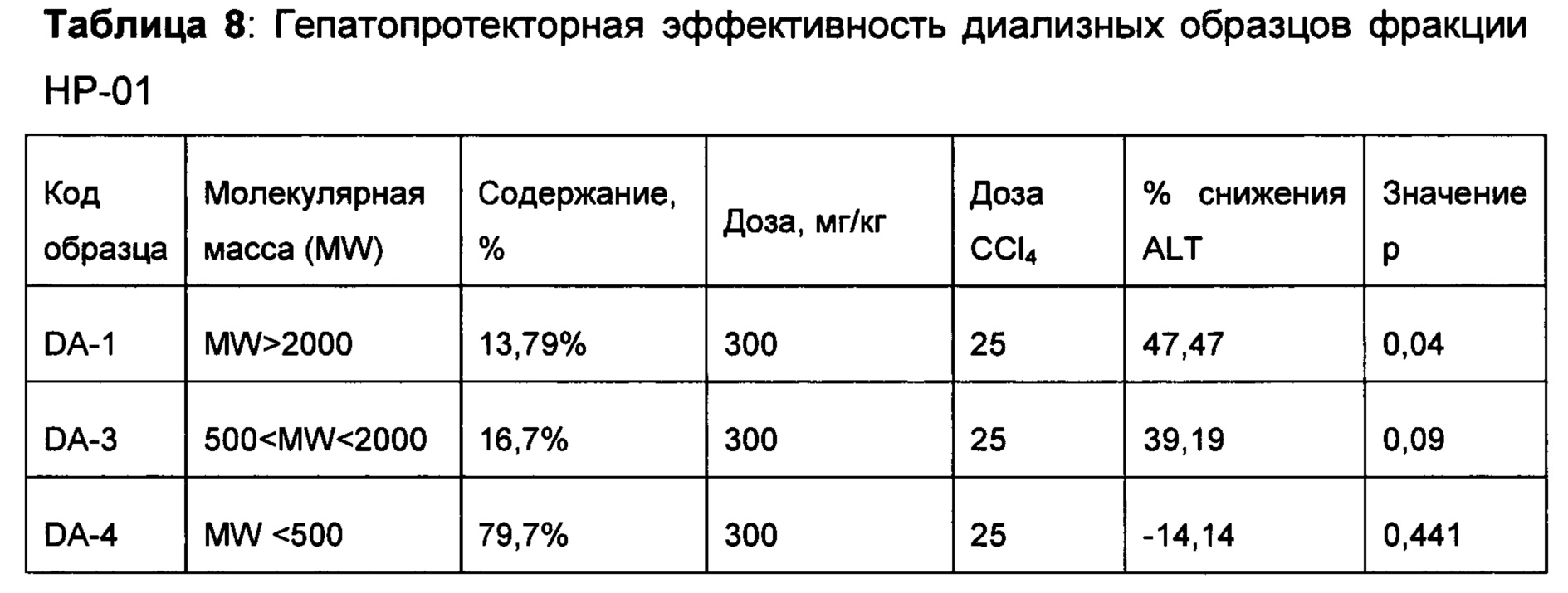
Пример 10: Анализ с помощью ВЭЖХ и количественная оценка экстрактов Artemisia capillaris
Маркерные соединения хлорогеновой кислоты (1, С3878, Sigma-Aldrich, США), и дикаффеоильных кислот (2-3) в экстрактах Artemisia capillaris идентифицировали на основании анализа LCMS и литературных отчетах, а их количество определяли в помощью колонки С18 с обращенной фазой (Phenomenex, Luna С18, 10 мкм, 250 мм × 4,6 мм) в системе ВЭЖХ Hitachi с УФ-детекцией при длине волны 320 нм. Указанную колонку элюировали бинарным градиентом 0,1% трифторуксусной кислоты (TFA) в воде и ацетонитрилом со скоростью потока 1 мл/в минуту. Количества соединений 1-3 рассчитывали на основании референсного соединения хлорогеновой кислоты. Содержание хлорогеновой кислоты в 70% ЕЕ экстракте Artemisia capillaris, полученного из различных источников, варьировало в диапазоне 1,5-4,8% (об./об.), рассчитанном по площади пика. Эта информация суммирована в Таблицах 9-10.
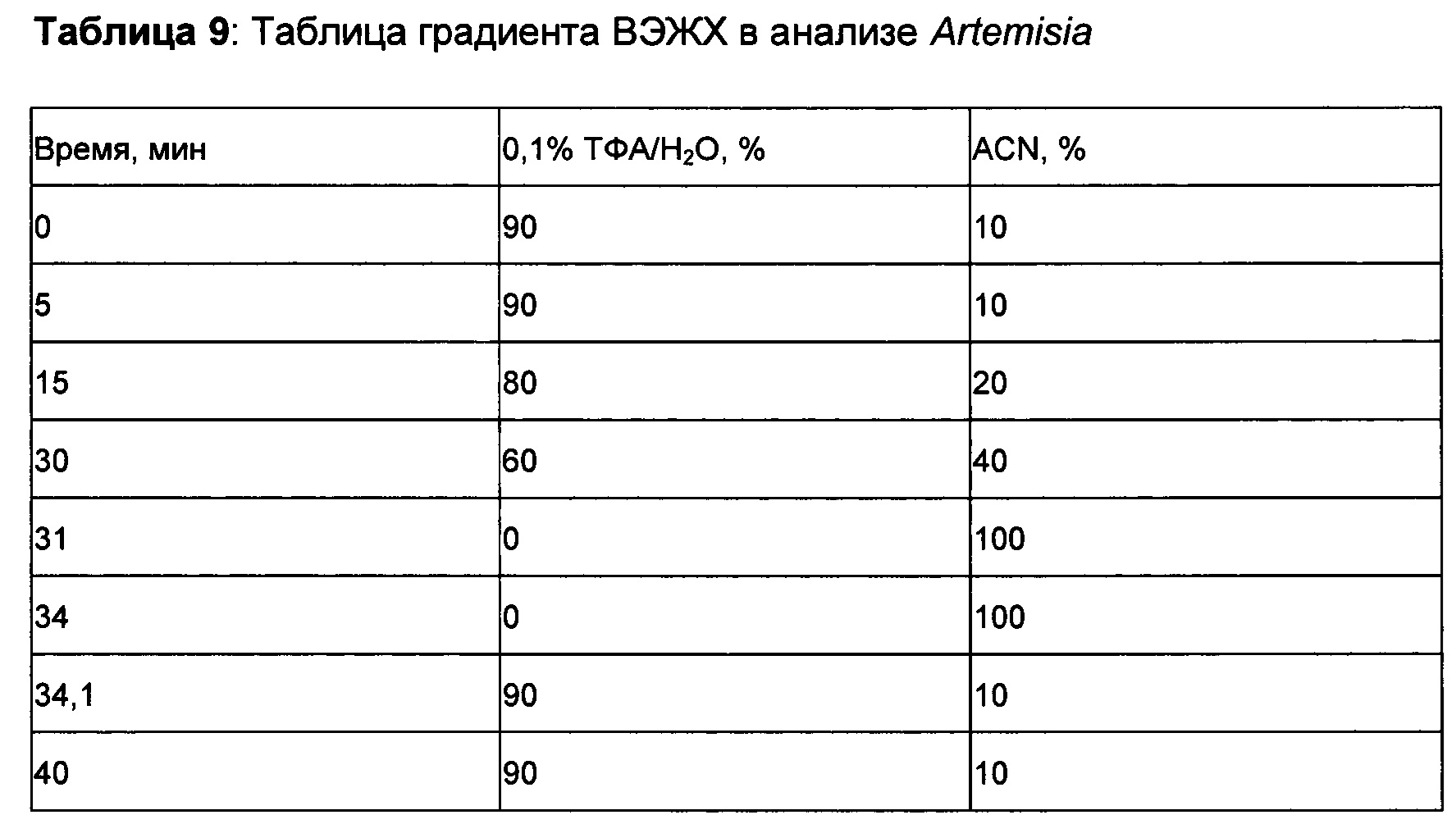
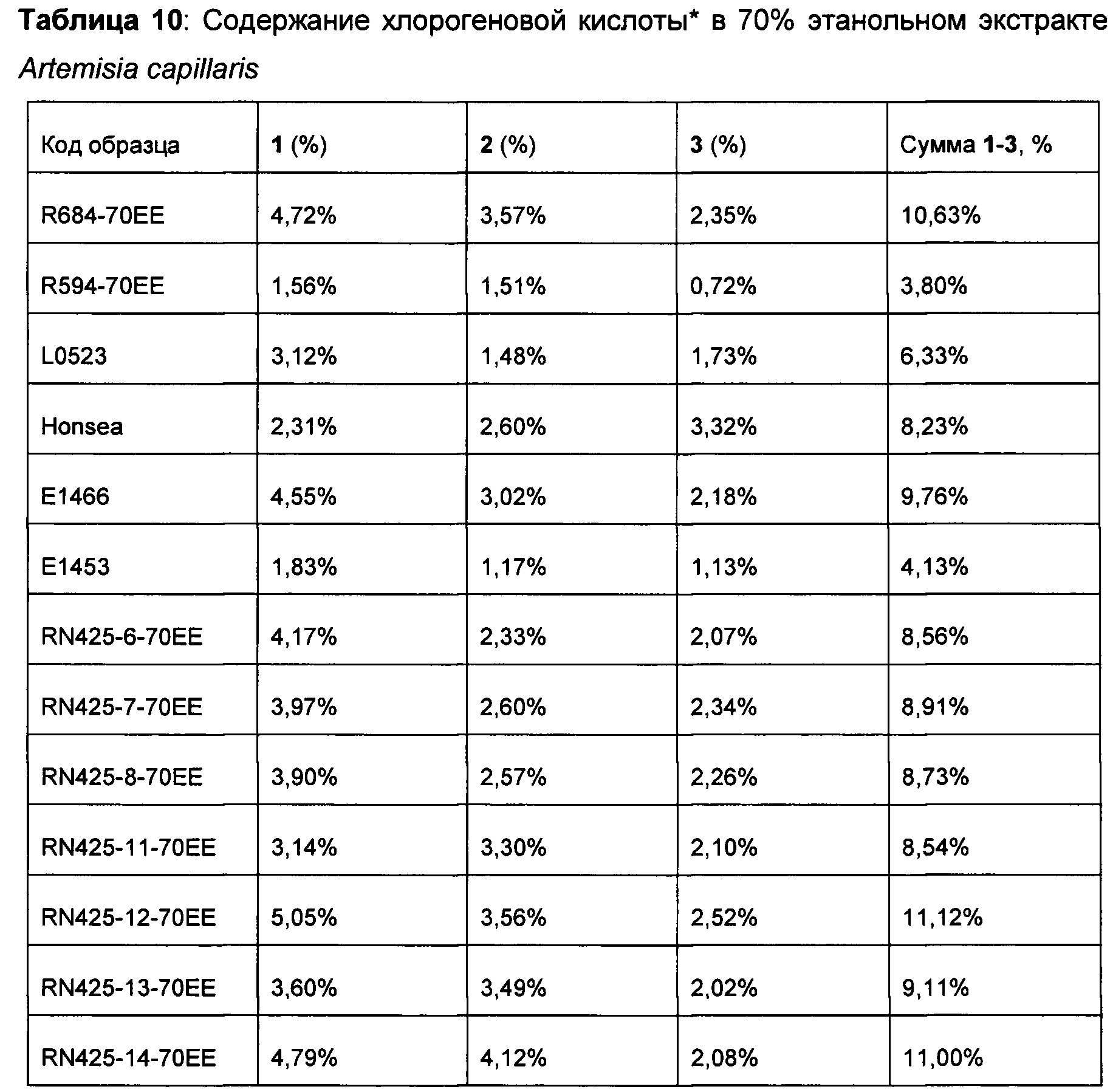
*Хлорогеновую кислоту использовали в качестве стандартного соединения для количественной оценки всех трех пиков (1-3)
Пример 11: Количественная оценка катехинов в экстрактах Artemisia capillaris
Количество катехинов в водной фракции (WA) экстрактов Artemisia capillaris оценивали посредством ВЭЖХ. Для детекции катехинов использовали систему Hitachi ВЭЖХ/ФДА с колонкой С18 с обращенной фазой (Phenomenex, США, Luna 5 мкм, 250 мм × 4,6 мм) и количество оценивали при скорости потока 1,0 мл/мин при температуре колонки 35°С при длине волны УФ 275 нм. Эпикатехин (Е1753, Sigma-Aldrich, США) не был обнаружен во всех образцах Artemisia, и только небольшое количество катехина было обнаружено и его количество оценено на основании стандарта катехина (С1251, Sigma-Aldrich, США). Содержание катехина во фракции WA экстракта Artemisia capillaris, в диапазоне 0,02-0,32%, не являлось релевантным гепатопротекторным свойствам экстракта Artemisia, обнаруженным в нашем исследовании in vivo. Эта информация суммирована в Таблицах 11-12.
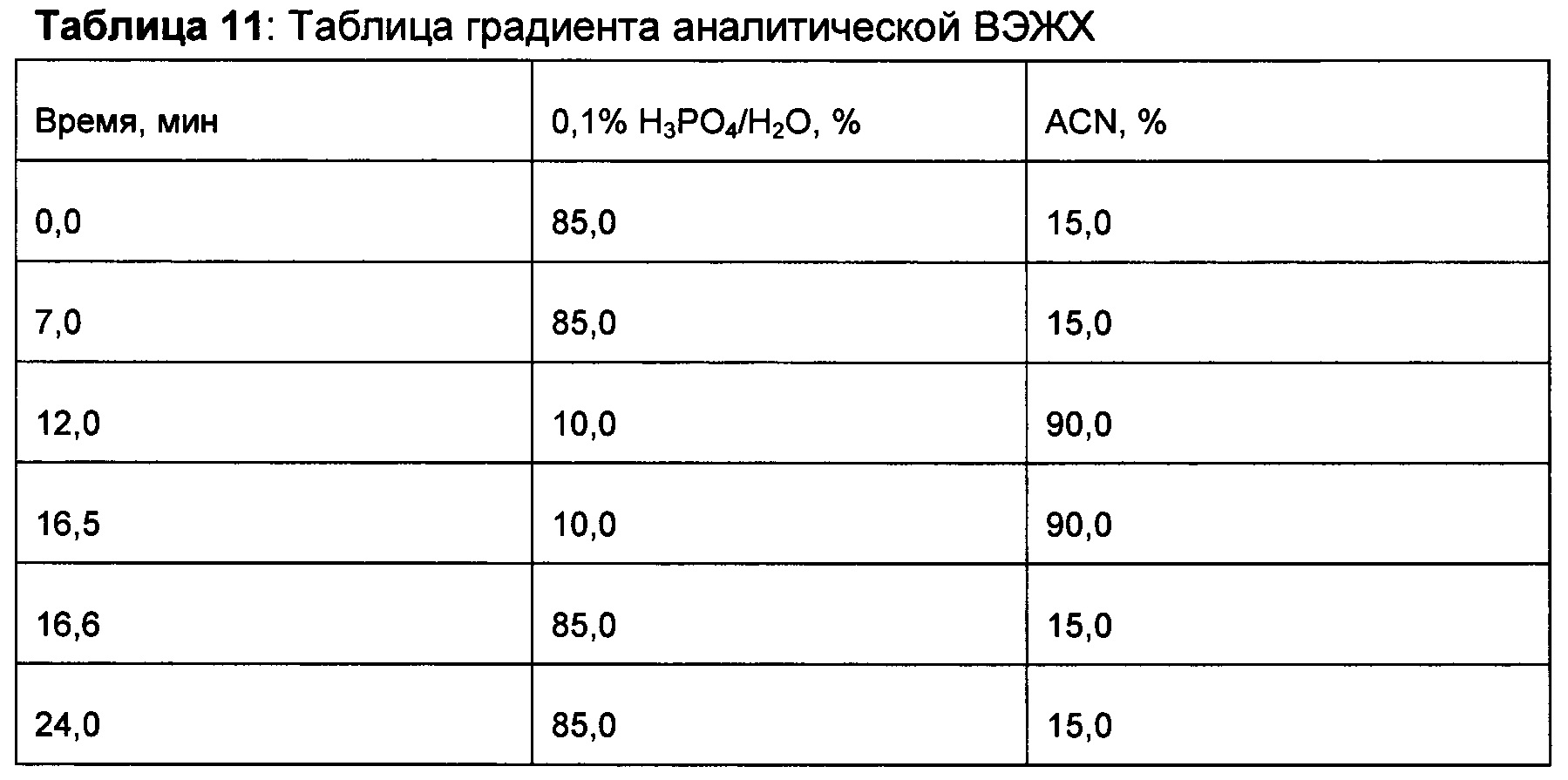


нд: нет данных
Пример 12: Разделение полисахаридов с помощью мембранного диализа
Необработанные полисахариды фракции НР-01 из Artemisia capillaris растворяли в подходящем объеме дистиллированной воды и диализировали в пробирках с мембраной для диализа против дистиллированной воды (отсечка по MW 2000) 3 раза в течение 3 часов каждый раз. Как оставшийся раствор, так и объединенные диализные растворы высушивали посредством лиофильной сушки с получением двух образцов DA-1 (MW>2000, 13,79%) и DA-2 (MW<2000, 84,54%). Оба образца тестировали в модели гепатотоксичности, индуцированной CCl4, на мышах.
Пример 13: Анализ полисахаридов и оценка их количества посредством гель-фильтрации
Активную фракцию WA экстрактов Artemisia capillaris также анализировали посредством гель-фильтрации, которая является хорошо разработанным способом для оценки распределения молекулярных масс полисахаридов. Полисахариды Artemisia capillaris анализировали на колонке PolySep-SEC-P5000 (колонка Phenomenex, ООН-3145KO, 300 мм × 7,8 мм) с помощью системы ВЭЖХ Hitachi с датчиком показателя преломления. Мобильная фаза представляла собой 0,1 М NaCl при скорости потока 0,7 мл/мин в течение 25 мин. Вводили 20 мкл каждого образца в концентрации 10 мг/мл. Полисахариды определяли количественно в семи диапазонах, разделенных на >2000, 2000-1000, 100-500, 500-200, 200-50, 50-10, <10 кДа на основе шести стандартов молекулярной массы декстрана (американские полимерные стандарты). Молекулярно-массовое распределение образцов водной фракции различных экстрактов варьировалось. Защитная активность в отношении печени связана с более высоким молекулярным распределением. Хотя общее содержание полисахаридов является сходным, распределение по массе значительно различалось среди образцов Artemisia capillaris. Чем было выше содержание более крупных полисахаридов, тем лучшей была эффективность Artemisia capillaris. Распределение молекулярной массы показано в Таблице 13.
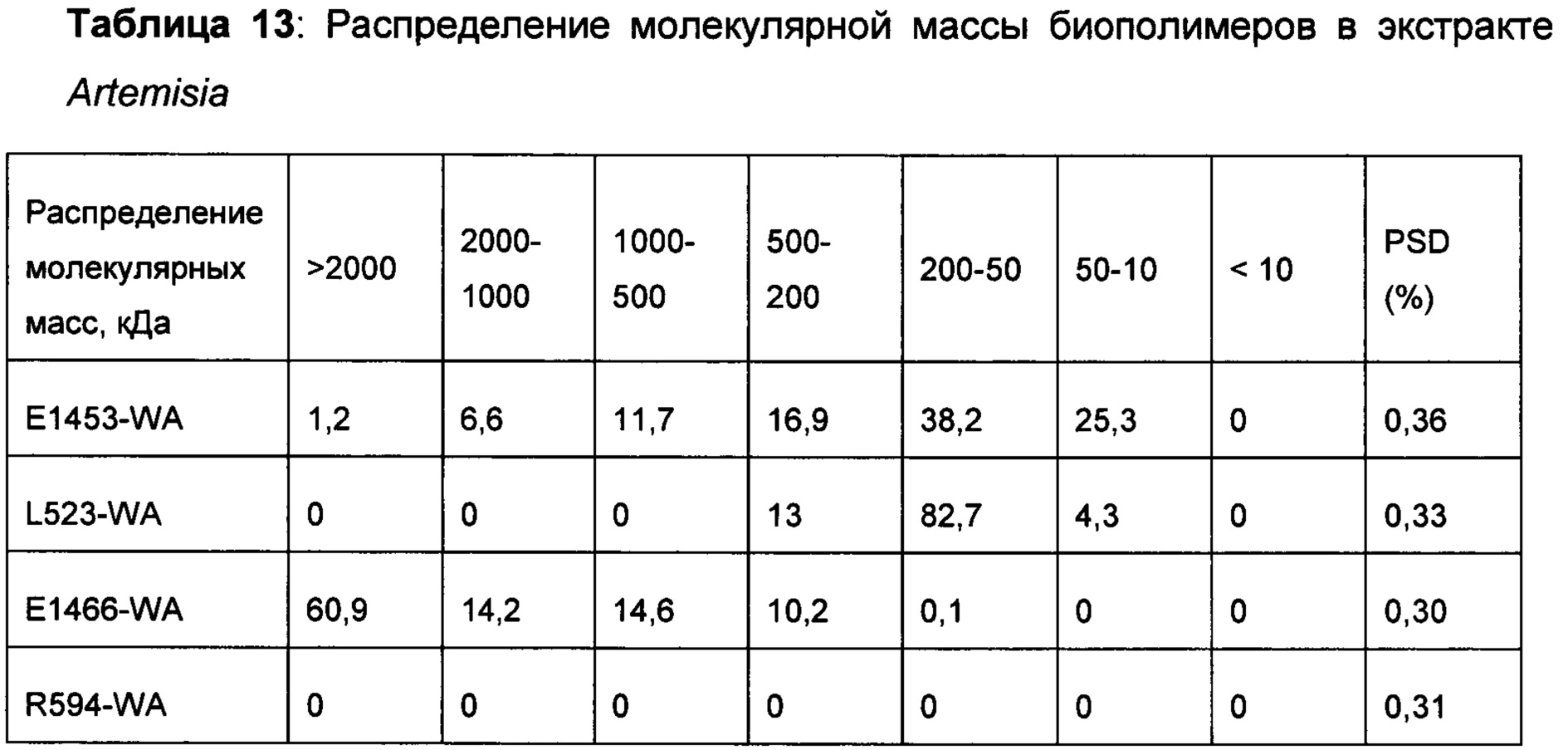
Пример 14: Гепатопротекторная активность фракций Artemisia capillaris в модели CCl4
Модель гепатотоксичности, вызванной CCl4, использовали для оценки гепатопротекторной активности фракций Artemisia capillaris в гексане (НЕ), этилацетате (ЕА), бутаноле (BU) и воде. Мыши контрольной группы получали только 10% Твин-20. Уровень ALT в сыворотке определяли через 24 часа. Хотя фракции Artemisia вводили в дозировке 300 мг/кг, исходные материалы вводили в дозировке 400 мг/кг.
Как видно из Таблицы 14, наиболее сильное ингибирование ALT в сыворотке наблюдалось у мышей, обработанных водной фракцией Artemisia в дозировке 300 мг/кг, что указывало на возможность присутствия активного маркера в этой фракции. Однако, это не исключало существование других активных маркеров в других фракциях. Исходный материал (R684) имел постоянную активность при дозировке 400 мг/кг. Наблюдался 100% уровень выживаемости во всех группах этой модели.
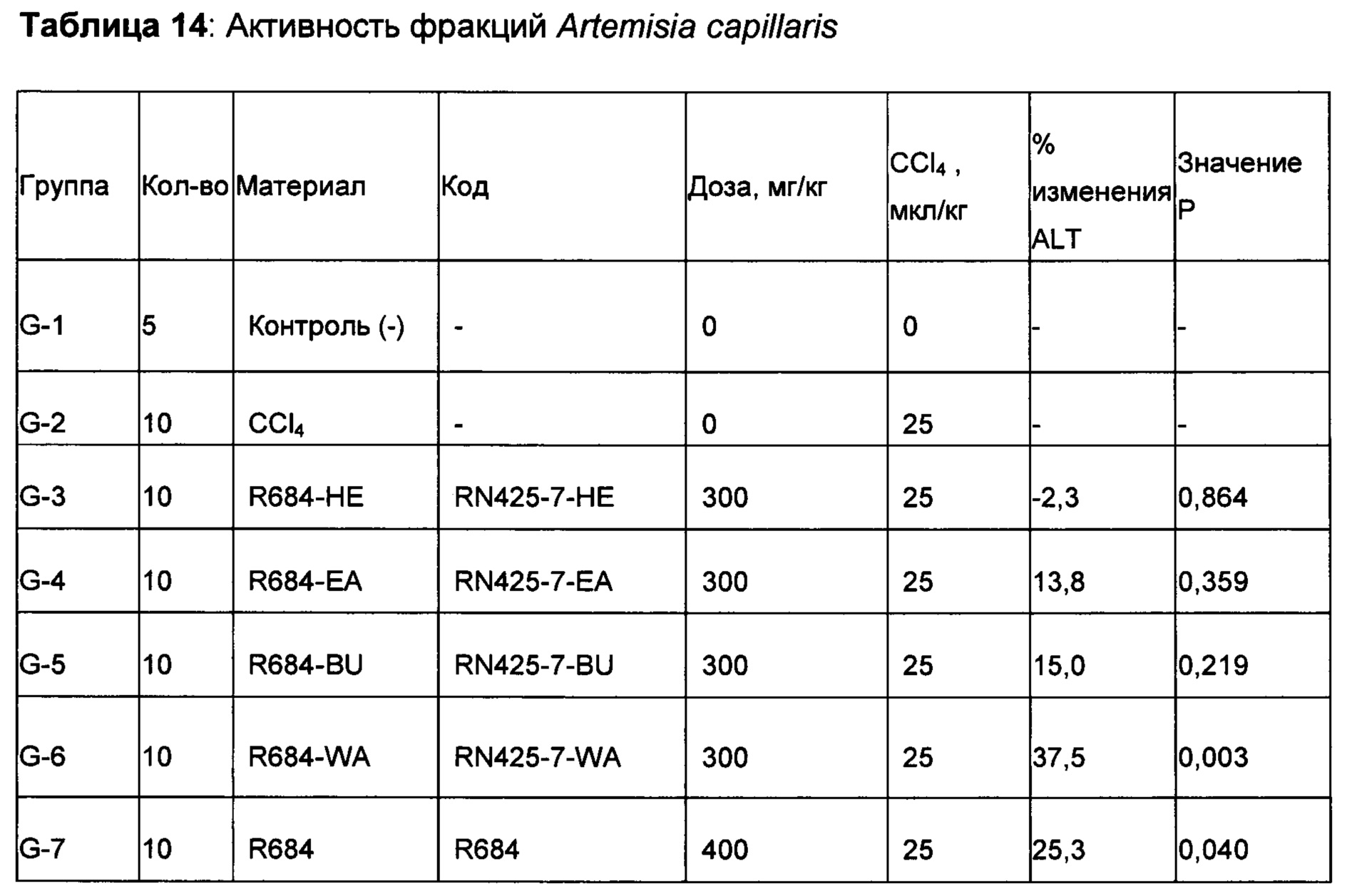
Пример 15. Получение органических экстрактов из плодов Schisandra chinensis
В общей сложности 20 г высушенных плодов Schisandra chinensis помещали в две пробирки их нержавеющей стали объемом 100 мл и дважды экстрагировали органическим 70% EtOH в воде с использованием автоматического экстрактора ASE 300 при 80 градусах и давлении 1500 фунтов на квадратный дюйм. Указанный раствор экстракта автоматически отфильтровывался и собирался. Объединенный раствор упаривали досуха на роторном испарителе с получением сырого 70% EtOH экстракта (9,65 г, 49,5%).
Схожие результаты были получены с использованием такой же процедуры, но с заменой органического растворителя на метанол или этанол с получением метанольного экстракта (ME) или этанольного экстракта (ЕЕ), экстракта этанол : H2O (7:3), экстракта этанол : H2O (1:1), экстракта этанол : H2O (3:7) и водного экстракта, соответственно.
Экстракты Schisandra chinensis получали посредством экстракции высушенных плодов с помощью смеси 70% этанол / 30% вода (об./об.). Указанный экстракт дополнительно обрабатывали с получением экстракта в форме порошка (Лот №) с общим содержанием шизандринов не менее 2%, включая шизандрин, шизантерин А, шизандрин А (дезоксишизандрин), и шизандрин В.
Пример 16: Анализ ВЭЖХ и определение количественного состава экстрактов Schisandra chinensis
Четыре активных маркерных соединения, шизандрин (лот №110857, Национальный институт пищевых продуктов и контроля, Китай), шизантерин А (лот №11529-200503, Национальный институт пищевых продуктов и контроля, Китай), шизандрин А (дезоксишизандрин, лот №110764-200107, Национальный институт пищевых продуктов и контроля, Китай), и шизандрин В (лот №110765-200508, Национальный институт пищевых продуктов и контроля, Китай), были идентифицированы в экстрактах Schisandra chinensis и подтверждено их присутствие с помощью референсных стандартных материалов Schisandra chinensis (лот №140217, Национальный институт пищевых продуктов и контроля, Китай).
Количество активных маркерных соединений определяли с помощью ВЭЖХ с использованием колонки С18 с обращенной фазой (Phenomenex, Luna С18, 10 мкм, 250 мм × 4,6 мм) в системе ВЭЖХ Hitachi с длиной волны УФ-детекции 250 нм путем сравнения с референсными стандартными материалами. Колонку элюировали водой и ацетонитрилом при скорости потока 1 мл/мин. Профиль градиента для этого Примера приведен в в Таблице 15. Каждый индивидуальный пик идентифицировали и обсчитывали, а затем общее содержание четырех соединений, включающих шизандрины, шизантерин А, шизандрин А и шизандрин В, рассчитывали на основании среднеквадратичного значения. Эта информация приведена в Таблице 16.
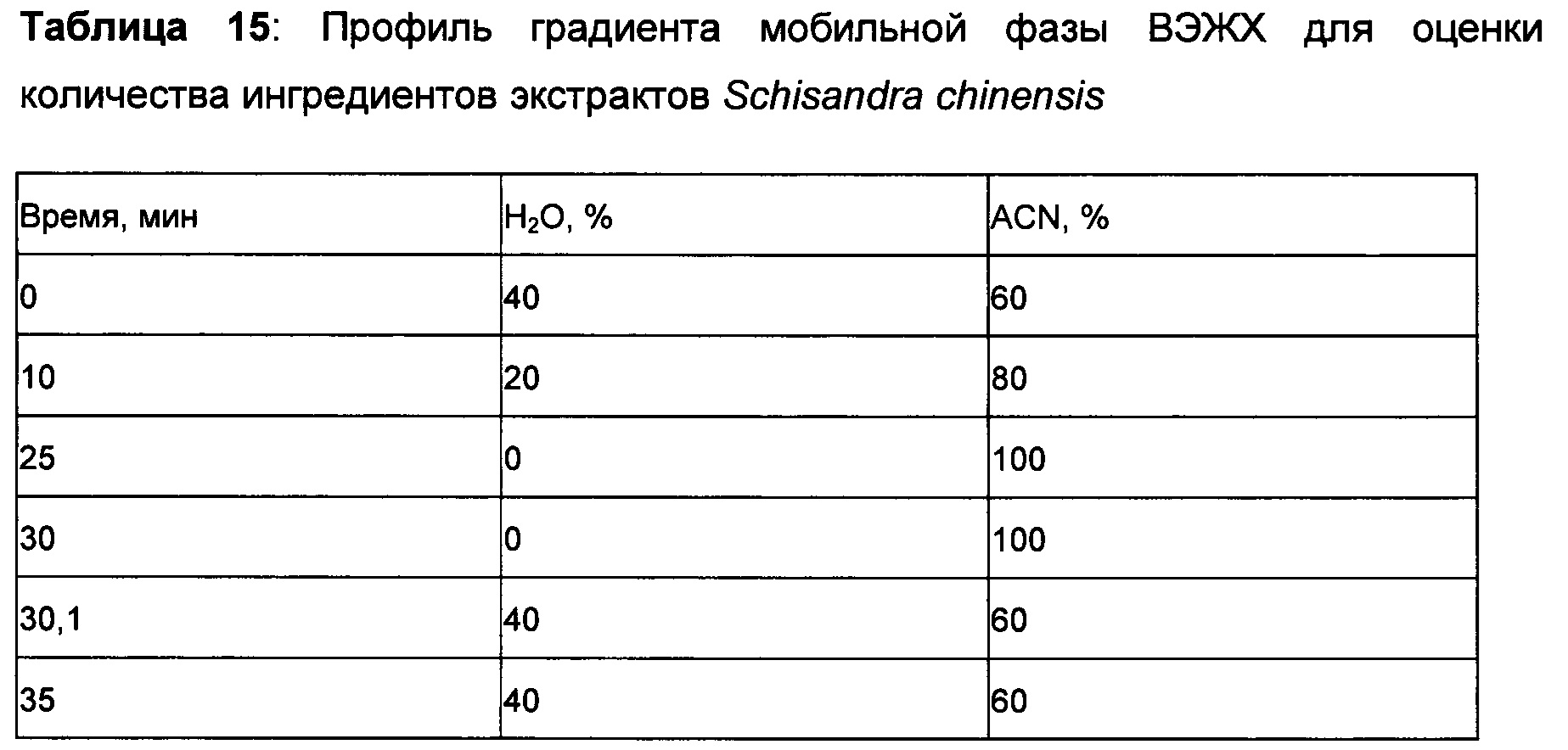
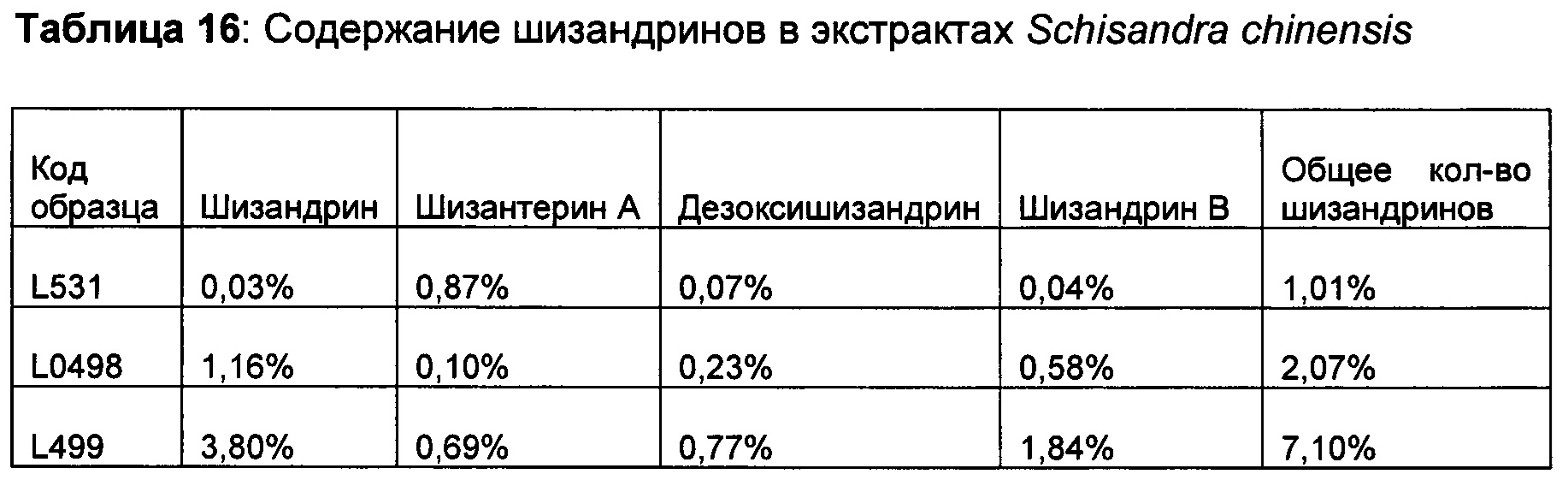
Пример 17: Определение количества органических кислотой методом ВЭЖХ в экстрактах плодов Schisandra
Присутствие яблочной кислоты, шикимовой кислоты и лимонной кислоты в 70% EtOH экстракте, полученном самостоятельно из различных сборов, было подтверждено, как указано в Таблице 17. Количества указанных органических кислот определяли с помощью ВЭЖХ с использованием колонки Hypersil GOLD aQ (4,6×250 мм, 5 мкм) в изократических условиях в течение 20 минут при 5°C с помощью 50 мМ раствора дигидрофосфата калия (рН 2,8 установлен с помощью H3PO4) качестве мобильной фазы при скорости потока 0,7 мл/мин. Указанные органические кислоты детектировали с использованием УФ-детектора с длиной волны 205 нм и идентифицировали на основании времени удерживания по сравнению со стандартами органических кислот.
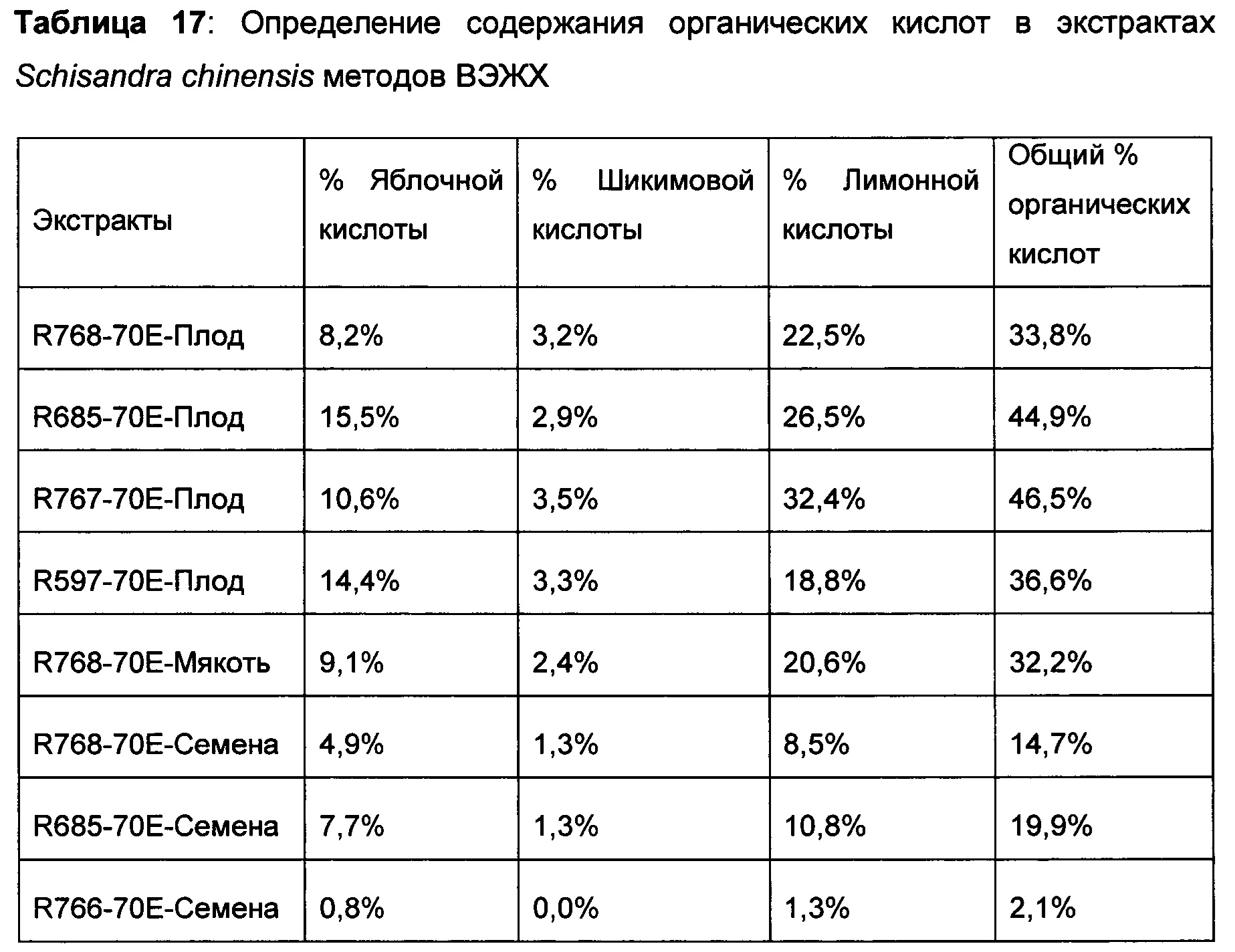
Пример 18: Экстракты Artemisia и Schisandra в различных комбинациях в гепатопротекторных моделях АРАР и CCl4
Поскольку ведущие растения, такие как Artemisia capillaris и Schisandra chinensis, были выбраны, их эффективность в защите печени оценивали в различных комбинациях в соотношениях 4:1, 2:1, 1:1, 1:2 и 1:4 в моделях гепатотоксичности, вызванных АРАР и CCl4. Комбинации двух растений обозначали как "SA" с использованием первых букв каждого растения, то есть "S" для Schisandra chinensis и "А" для Artemisia capillaris. Как видно из Таблицы 18 ниже, хотя все смеси продемонстрировали тот же вид защиты печени, наибольшую степень защиты со статистически значимым 48,0% снижением измеренного уровня ALT в сыворотке наблюдали, когда мышей обрабатывали смесью Schizandra и Artemisia в соотношении 2:1 с общей дозировкой 400 мг/кг. Аналогично, в модели CCl4, наибольшую степень защиты печени со статистически значимым 40,6% снижением измеренного уровня ALT в сыворотке наблюдали, когда мышей обрабатывали смесью Schizandra и Artemisia в соотношении 1:2 с общей дозировкой 400 мг/кг. Наблюдали 100% степень выживаемости в обеих моделях для этого соотношения.
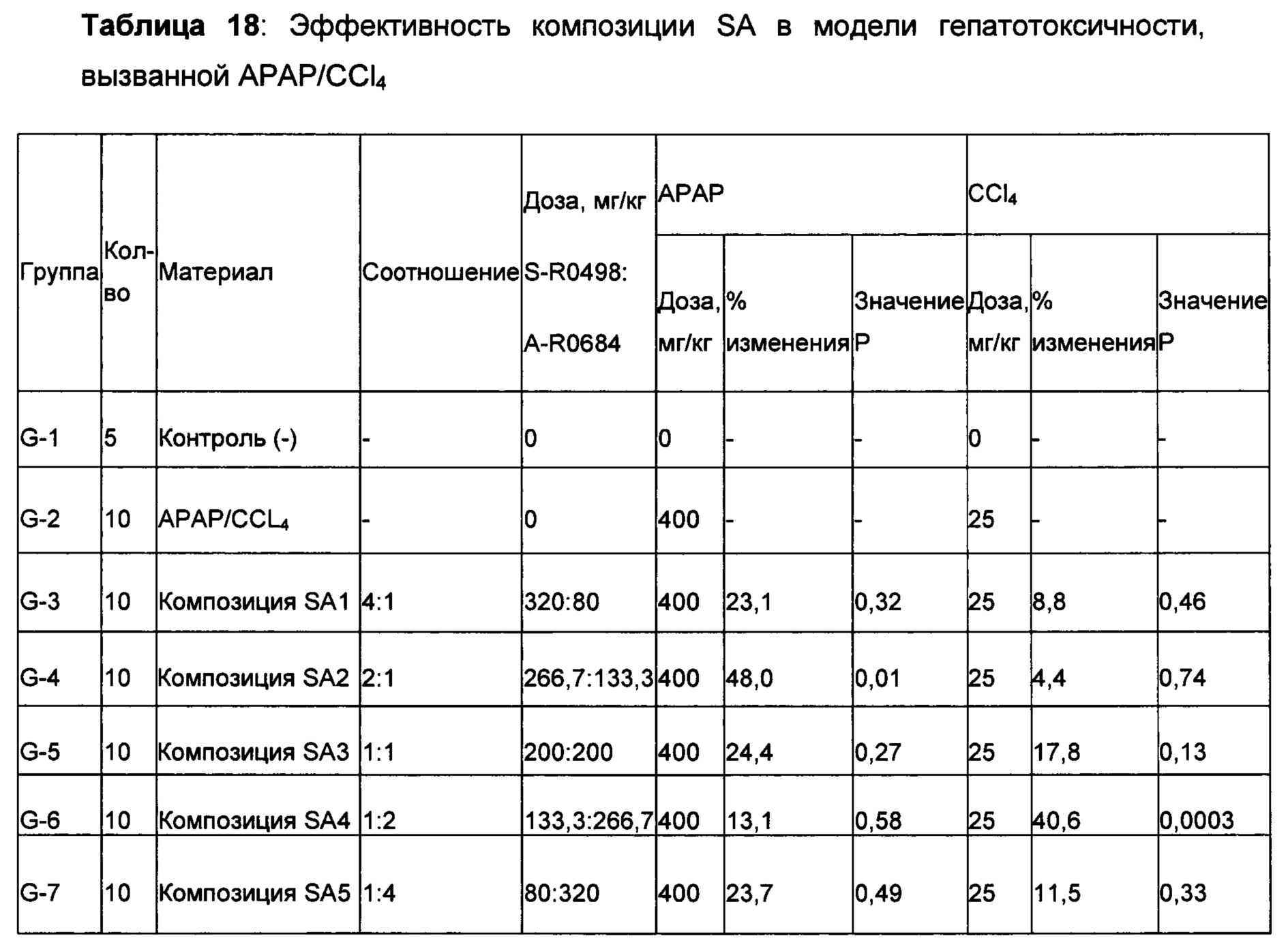
Наибольшую эффективность по защите печени наблюдали, когда Schisandra и Artemisia были смешаны в соотношении 2S:1A (модель АРАР) и 1S:2A (модель CCl4). В результате, указанные соотношения были приняты как наилучшие.
Пример 19: Получение композиции комбинацией SAL
Рассматриваемые композиции комбинации SAL (лот № RN425-1501) получали смешиванием 320 г экстракта Schisandra (лот № Е1458), 263 г экстракта Artemisia (лот № RN425-13), 377 г экстракта Artemisia (лот № RN425-14) и 240 г N931(E1459 с 2% Алоэзина) в смесителе Ribbon (Hankook P.M. EMG, Корея) при 30 об/мин в течение 1 ч с получением 1,17 кг комбинации SAL (лот № RN425-1501) в соотношении Schisandra : Artemisia: N931=4:8:3 по весу.
Пример 20: Оценка гепатопротекторной активности смесей Schisandra Chinensis. Artemisia capillaris и N931 в моделях APAP/CCl4
Два наилучших соотношения смеси Schisandra chinensis и Artemisia capillaris 2S:1A (в модели АРАР) и 1S:2A (в модели CCl4) были выбраны для дополнительного изучения гепатопротекторной активности путем добавления третьего компонента, показавшего наилучшую активность, (Loesyn) и с получением смеси, обозначенной как SAL. "L" означает Loesyn. N931 добавляли в соотношении 10, 20 и 30% по отношению к весу комбинации 2S:1A и 10, 20 и 25% по отношению к весу комбинации 1S:2A. Эту композицию исследовали в модели гепатотоксичности, вызванной АРАР/CCl4. Мышей обрабатывали с помощью композиции SAL при дозировке 400 мг/кг. Хотя все композиции при различных соотношениях продемонстрировали определенную степень гепатопротекторной активности, как видно из Таблицы 19, наибольшее снижение содержания ALT в сыворотке (51,9%, Р=0,01) и наибольшее гепатопротекторное действие наблюдалось, когда мышей обрабатывали с помощью SAL в дозировке 400 мг/кг при соотношении 106,7/213,3/80, соответственно. При этом наблюдалась 100% степень выживаемости для этого конкретного соотношения в этой модели.
Подобным образом, хотя все композиции при различных соотношениях продемонстрировали определенную степень гепатопротекторной активности, как видно из Таблицы 19, наибольшее снижение содержания ALT в сыворотке (42,3%, Р=0,01) наблюдалось, когда мышей обрабатывали с помощью SAL в дозировке 400 мг/кг при соотношении 106,7/213,3/80, соответственно. При этом наблюдалась 100% степень выживаемости для этого конкретного соотношения в этой модели.
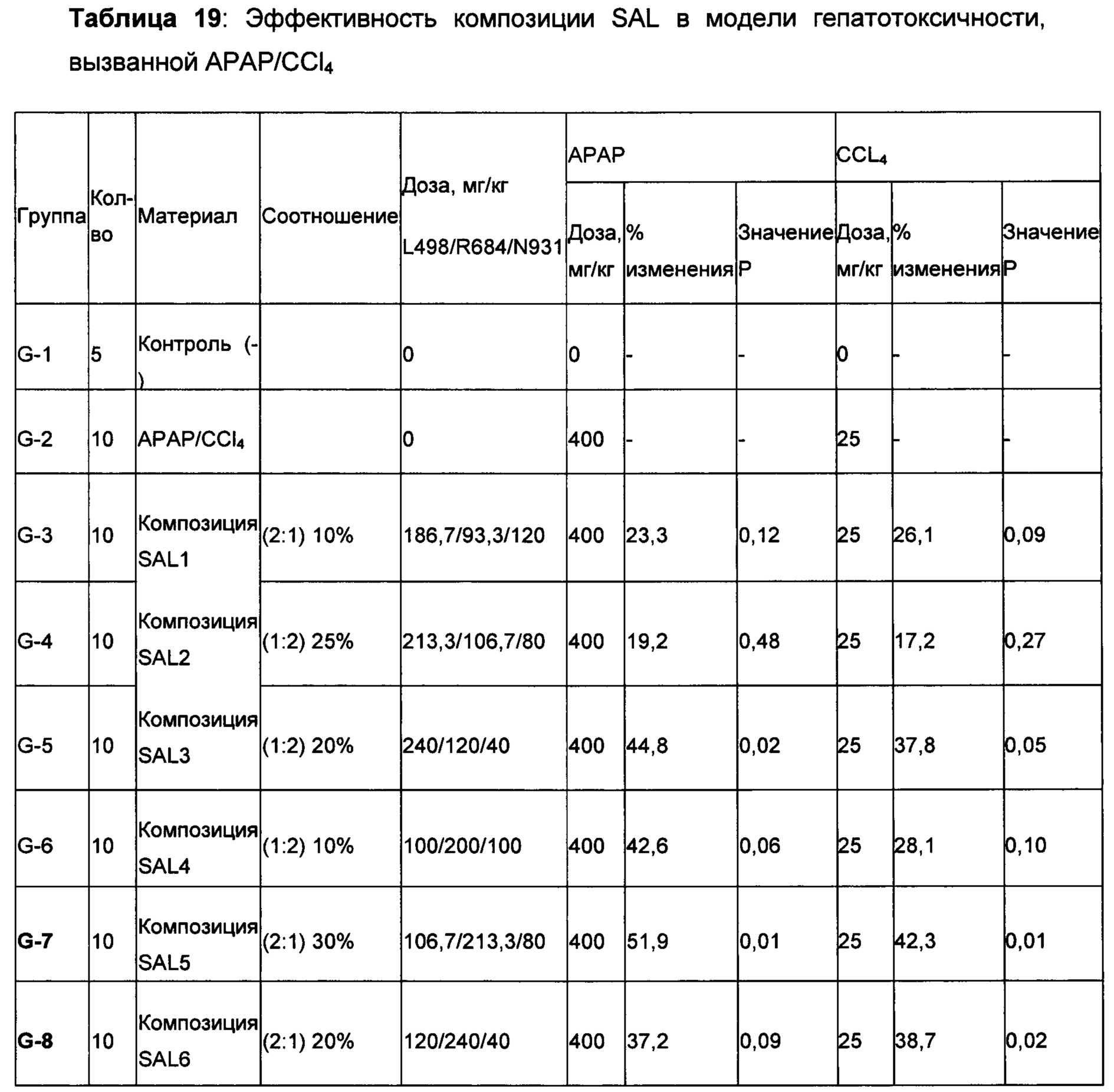
Хотя множество композиций продемонстрировали эффективность в защите печени, наибольшая защита наблюдалась, когда 20% Loesyn по весу добавляли к смеси 1S:2A в обеих моделях с получением конечного соотношения 4S:8A:3L для указанной композиции SAL. В результате, указанное соотношение, 4S:8A:3L, было принято в качестве наилучшей композиции.
Пример 21: Дозозависимый эффект композиции, содержащей Schisandra Chinensis, Artemisia capillaris и N931 в модели гепатотоксичности, вызванной АРАР и CCl4
Оптимальную дозировку композиции SAL, которая бы приводила к существенной защите печени, определяли в моделях гепатотоксичности, вызванной АРАР и CCl4. Мышам скармливали орально указанную композицию SAL при дозировках 400 мг/кг, 325 мг/кг и 250 мг/кг, суспендированную в 10% Твин-20. Контрольная группа получала только раствор носителя. Как видно из Таблицы 20, в группе АРАР для указанной композиции наблюдалось коррелирующее с дозой ингибирование уровня ALT в сыворотке. 52,5% (р=0,001), 48,5% (р=0,012) и 34,6% (р=0,079) ингибирования наблюдались для мышей, обработанных дозировками 400 мг/кг, 325 мг/кг и 250 мг/кг SAL, соответственно. Аналогично, в группе CCl4 для указанной композиции наблюдалось коррелирующее с дозой ингибирование уровня ALT в сыворотке. 46,3% (р=0,003), 39,5% (р=0,007) и 29,9% (р=0,036) ингибирования наблюдались для мышей, обработанных дозировками 400 мг/кг, 325 мг/кг и 250 мг/кг SAL, соответственно. Наблюдалась 100% степень выживаемости для всех групп в обеих моделях. Указанная композиция SAL обеспечивала статистически значимую (CCL4) защиту повреждений печени при таком низком уровне дозировок как 250 мг/кг для 1S:2A с 20% L.
Также мы исследовали эффективность индивидуальных растений, таких как Schisandra, Artemisia и Loesyn в дозировках, эквивалентных для каждого из соотношения растений в композиции SAL, которые присутствуют в 4S:8A:3L при наибольшей исследованной дозировке (400 мг/кг). Как видно из Таблицы 20, в среднем 20% ингибирование с 70-80% степенью выживаемости наблюдалось для этих растений в приведенной дозировке.
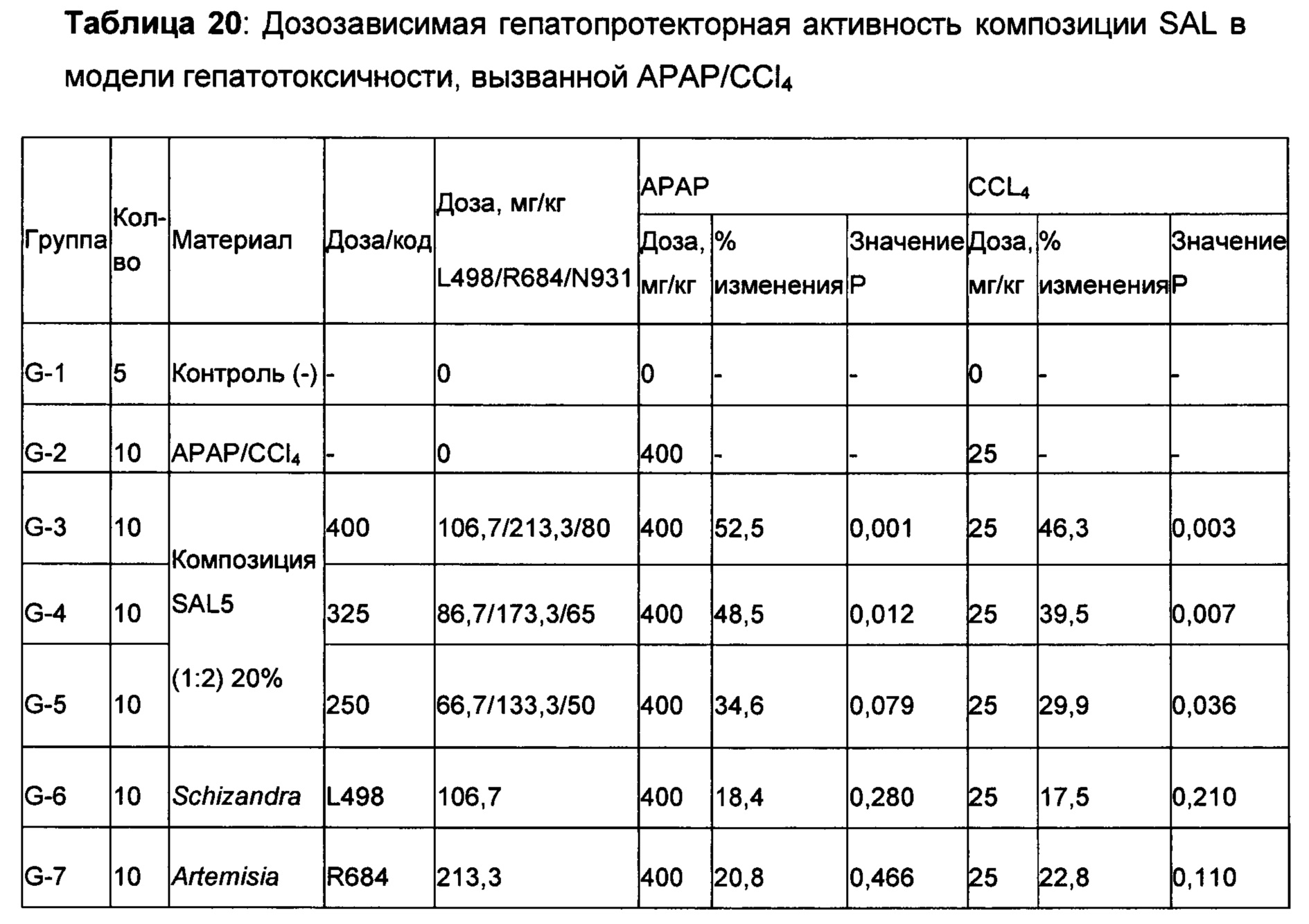
Пример 22: Оценка синергии для указанной композиции SAL
Для оценки преимущества объединения Schizandra chinensis, Artemisia capillaris и N931 в обеих моделях АРАР и CCL4 использовали уравнение Колби (Colby, 1967). Как видно из Таблицы 21, приведенной ниже, наблюдаемые значения были выше, чем ожидаемые гипотетические значения (А+В-С) в обеих моделях, что указывало на наличие синергии при объединении трех ингредиентов в специфическом соотношении, присутствующем в SAL. Преимущество объединения Schizandra, Artemisia и N931 было подтверждения посредством их синергической защиты печени от повреждений, вызванных АРАР и CCl4.
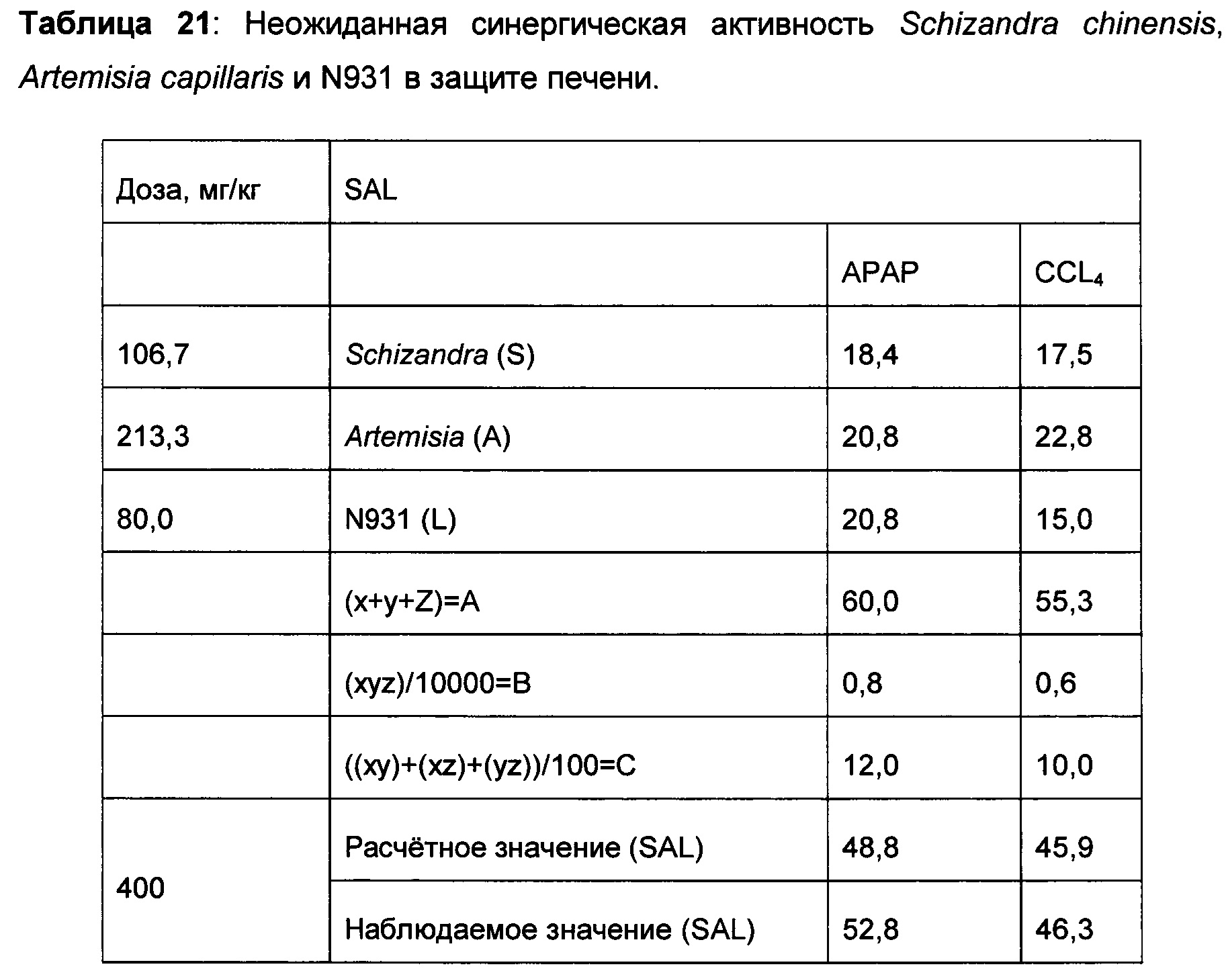
Пример 23: Гепатопротекторная активность композиции SAL в сравнении с ее индивидуальными компонентами при дозировке 300 мг/кг
Обе модели гепатотоксичности, вызванной АРАР и CCl4, использовали для сравнения гепатопротекторной активности композиции SAL в сравнении с индивидуальными компонентами в дозировке 300 мг/кг, используя снижение уровня ALT в сыворотке как меру эффективности. 10% Твин-20 использовали в качестве носителя для всех материалов. Контрольная группа мышей получала только Твин-20. Кроме уровня ALT в сыворотке, для контроля получали данные для панели, такой как общий белок, общий билирудин, альбумин, AST и желчная кислота, через 24 часа после АРАР/CCl4, SAL.
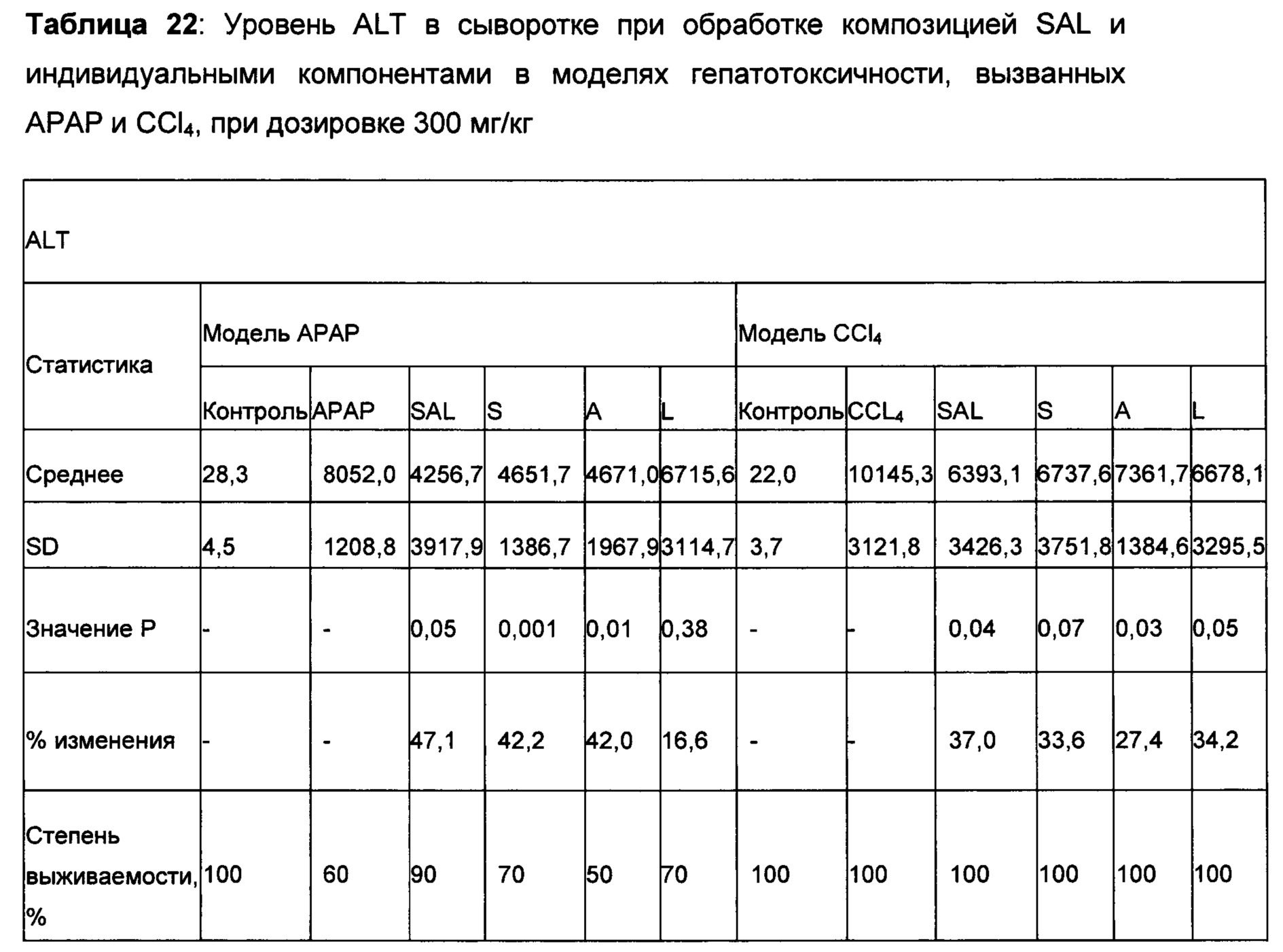
Как видно из Таблиц 23 и 24, для AST как меры эффективности, указанная композиция (SAL) продемонстрировала увеличенную степень защиты печени от повреждения, чем носитель в модели АРАР (а именно 60,6%). Статистически значимые снижения 47,1, 42,2, 42,0, и 16,6% уровней ALT в сыворотке наблюдали для мышей, обработанных SAL, S (Schisandra), А (Artemisia) и L (N931) по сравнению с группой, обработанной носителем, соответственно. Наименьшую степень выживаемости (50%) наблюдали для мышей, обработанных Artemisia.
Подтверждая результаты, полученные на модели АРАР, указанная композиция SAL продемонстрировала большую гепатопротекторную активность, чем каждый индивидуальный компонент при дозировке 300 мг/кг в модели CCl4 с использованием уровня ALT в сыворотке в качестве меры эффективности. В дополнение, использование AST в качестве меры эффективности показало, что указанная композиция (SAL) продемонстрировала повышенную защиту от повреждений, чем носитель (а именно 32,5%). Наблюдался 100% уровень выживаемости для всех групп в этой модели.
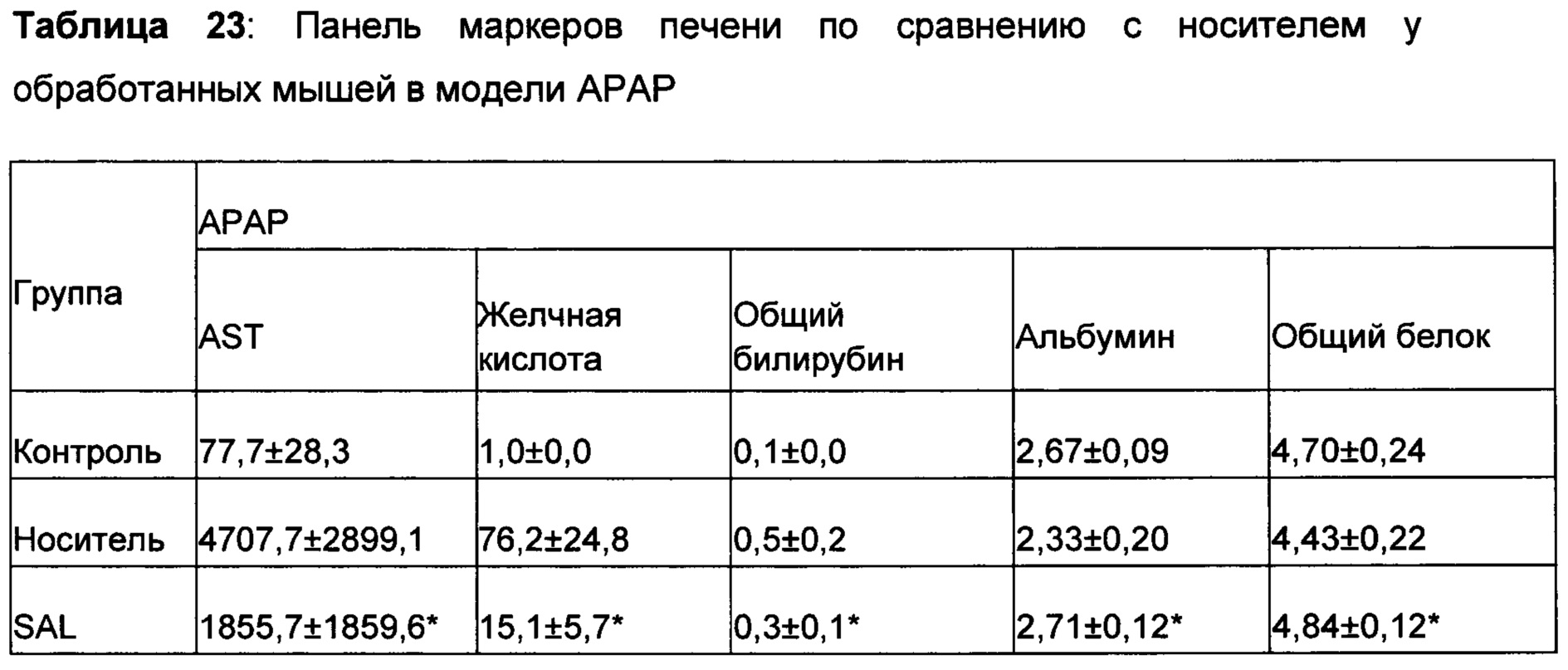
Как видно из Таблицы 24, указанная композиция SAL показала улучшенный результат по биомаркерам, ассоциированных с печенью, таким как желчная кислота, общий билирубин и общий белок в модели АРАР по сравнению с мышами в модели АРАР, обработанных носителем. Аналогично, статистически значимое различие в уровнях желчной кислоты наблюдали для мышей, обработанных композицией SAL в модели CCl4, по сравнению с контрольной группой с носителем.
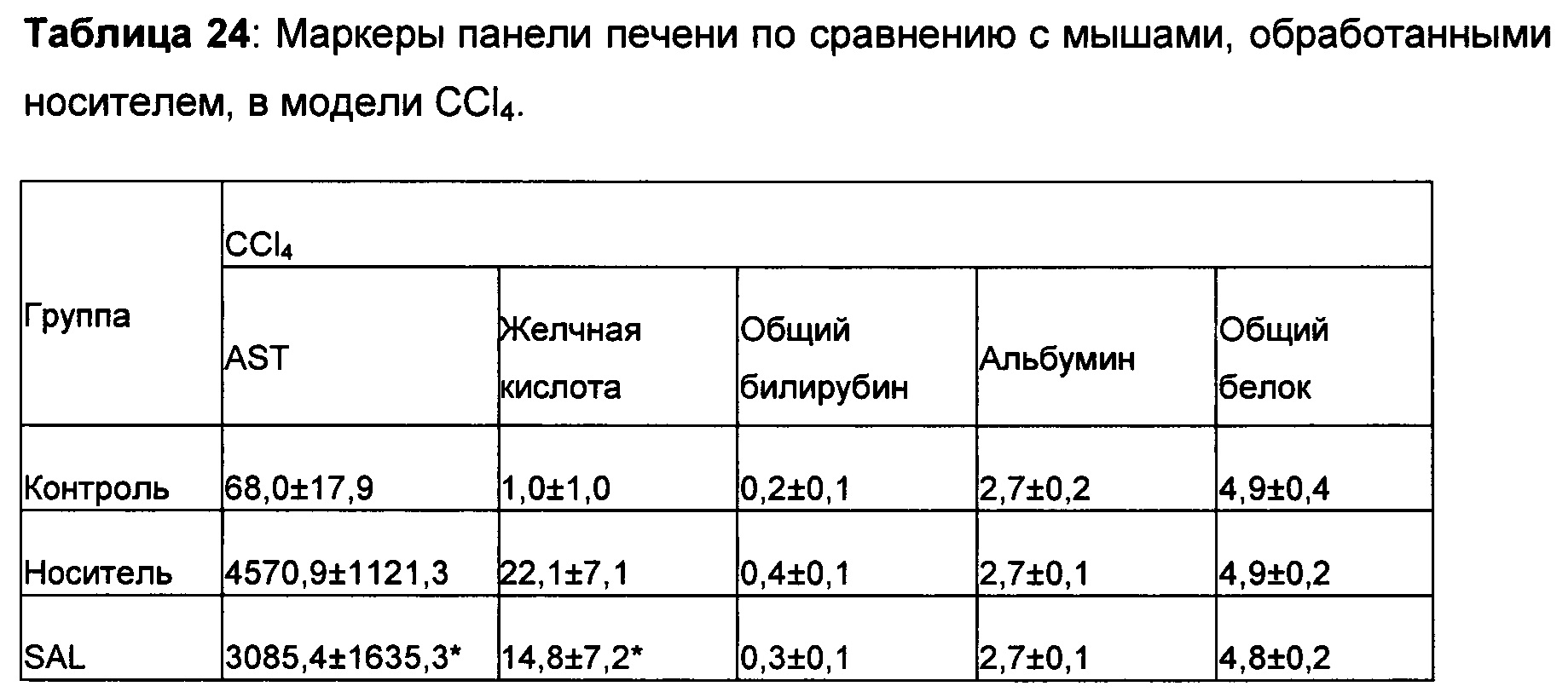
Пример 24: Исследование, подтверждающее эффективность композиции SAL в моделях гепатотоксичности, вызванной АРАР и CCL4
Для документального подтверждения превосходной гепатопротекторной активности композиции SAL проводили подтверждающее исследование с использованием обеих моделей гепатотоксичности, вызванных АРАР и CCl4. Мышам скармливали указанную композицию SAL в дозировке 400 мг/кг орально. 10% Твин-20 использовали в качестве носителя для всех материалом. Мыши контрольной группы получали только Твин-20. Кроме оценки уровня ALT в сыворотке, измеряли уровни в панели печени, такой как общий белок, общий билирубин, прямой и непрямой билирубин, альбумин, глобулин, AST, желчная кислота и ALP, через 24 часа для контроля, АРАР/CCl4, SAL.
Как видно из Таблиц 25 и 26, приведенных ниже, статистически значимые ингибирования уровней ALT, AST в сыворотке, конъюгированного билирубина и желчной кислоты наблюдали у мышей, обработанных указанной композицией SAL. Эти уровни ингибирования оставляли 34,0%, 44,5%, 60,0% и 26,7% снижения по сравнению с группой, обработанной носителем. Аналогично, композиция SAL продемонстрировала статистически значимые снижения уровня ALT (снижения на 44,0%) и сильный тренд в снижении AST (снижения на 35,9%) по сравнению с мышами, обработанными носителем. В общем, композиция SAL обеспечивала высокую степень защиты печени от повреждений во множестве часто используемых моделей на мышах, что показано в Таблице 27.
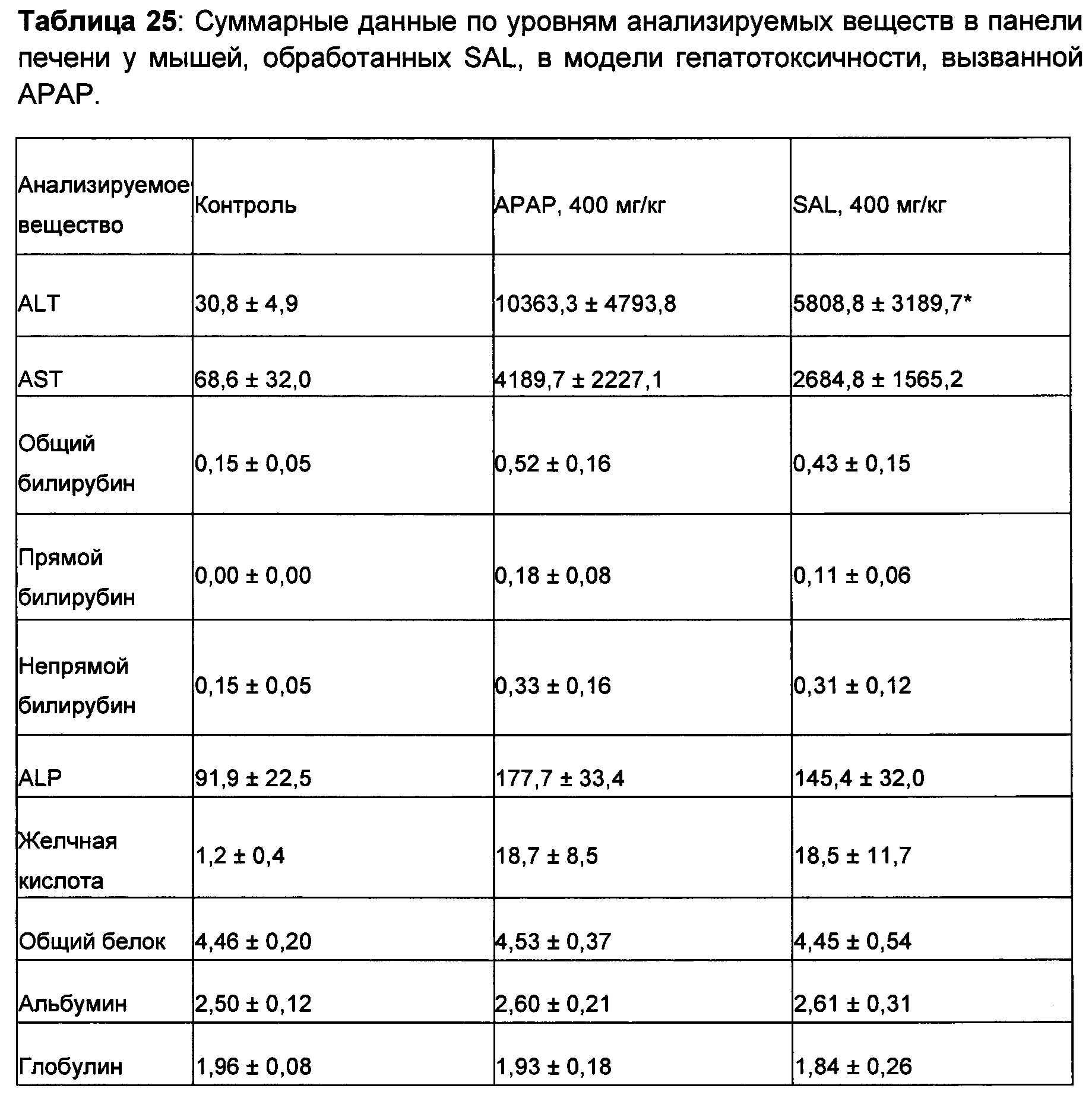
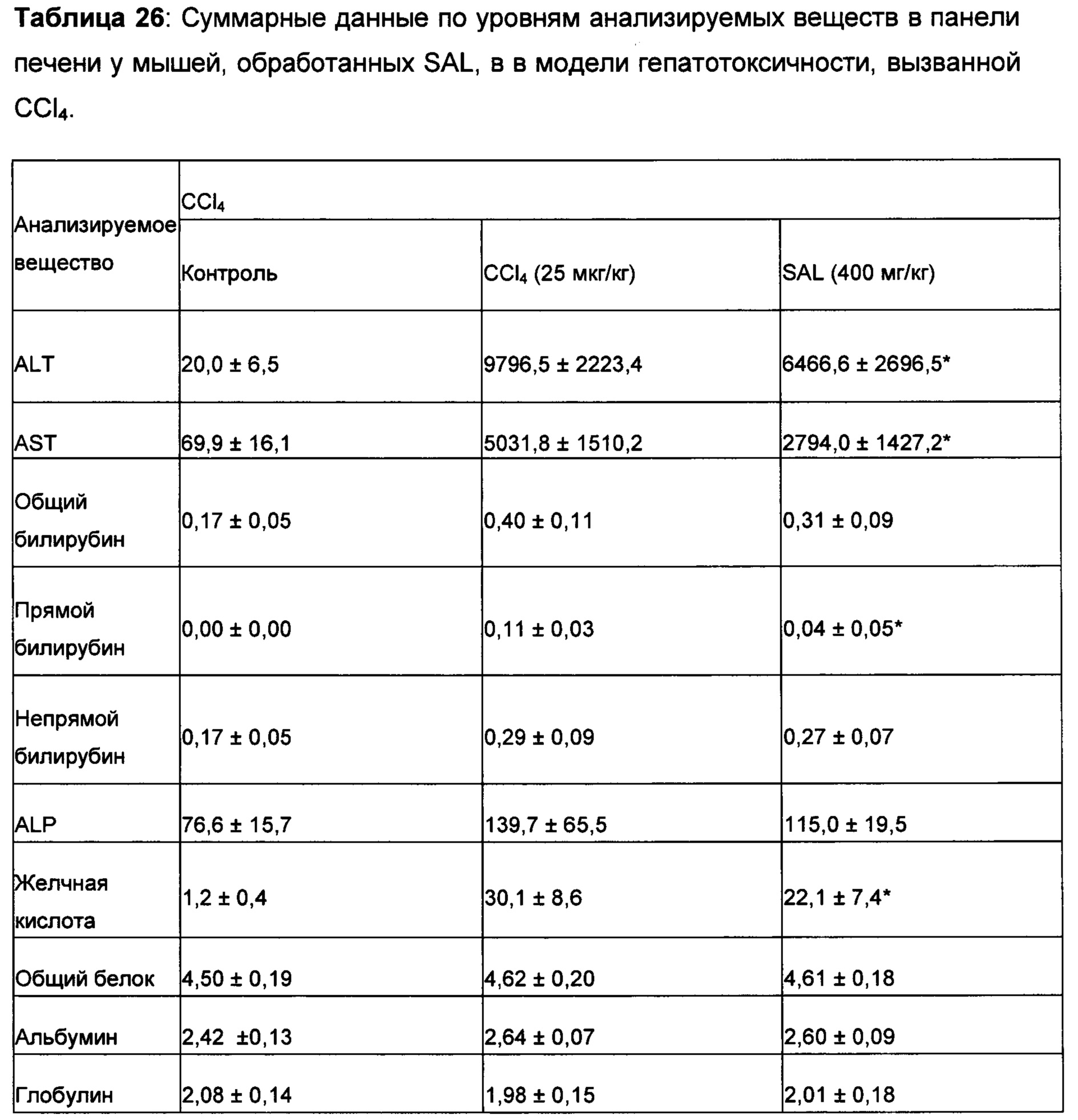
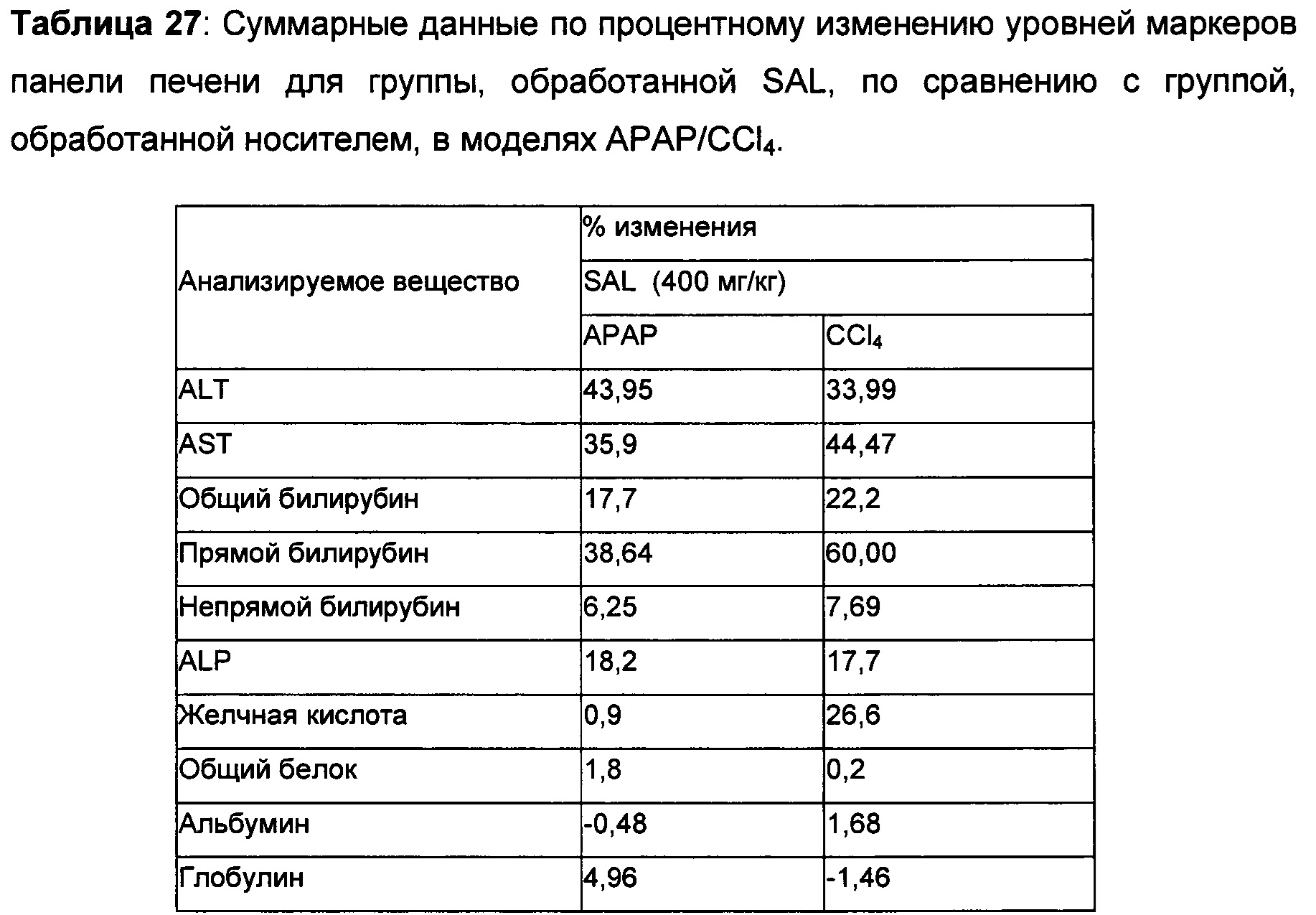
(+): ↓ Снижение по сравнению с группой АРАР/CCl4 (+), обработанной носителем
(-): ↑ Повышение по сравнению с группой АРАР/CCl4 (+), обработанной носителем
Пример 25: Влияние композиции SAL на уровни биомаркеров оксидативного стресса в печени гомогенатов, полученных в моделях гепатотоксичности, вызванной CCl4
Дополнительные подтверждающие исследования осуществляли для оценки влияния композиции SAL в защите печени с использованием модели гепатотоксичности, вызванной CCl4. Мышам скармливали композицию SAL в дозировке 400 мг/кг орально. 10% Твин-20 использовали в качестве носителя. Мыши контрольной группы получали только Твин-20. Ткани печени получали сразу же после некропсии и хранили на сухом льду до переноса в -80°С. Затем материалы пересылали в лабораторию, работающую по контракту (Brunswick Laboratories, 200 Turnpike Rd, MA 01772, США), в сухом льду для финальной обработки образцов и анализа биомаркеров. Оценивали уровни глутатиона (GSH) и супероксиддисмутаз (SODs) печени.
Глутатион (GSH) является ключевым внутриклеточным трипептидным тиолом, который помогает защищать клетки от повреждений свободными радикалами, обеспечивая восстановительные эквиваленты для восстановления гидропероксидов жиров. В ходе этого процесса в качестве продукта реакции образуется окисленный глутатион (GSSG). Уровень GSH использовали в качестве индикативного биомаркера уровня окислителей in vivo и уровня оксидативного стресса в клетках и тканях. В этом анализе, сульфгидрильная группа GSH реагирует с DTNB (5,5'-дитио-бис-2-(нитробензойная кислота)) с получением окрашенного желтого продукта 5-тио-2-нитробензойная кислота (TNB). Количество GSH в биологических образцах определяли путем измерения поглощения TNB при 410 нм.
Супероксиддисмутазы (SODs) являются ферментами, содержащими ионы металлов, которые катализируют реакцию диспропорционирования супероксидного аниона в молекулярный кислород и пероксид водорода. SOD считаются одними из наиболее важных антиоксидативных ферментов in vivo. Тест на SOD является колориметрическим исследованием, в котором используют соли тетразолия для измерения диспропорционирования супероксидных радикалов, которые образовались посредством ксантиноксидазы и ксантина, и активность SOD в указанных образцах рассчитывают по стандартной кривой, полученной с использованием стандартов SOD. Одна единица SOD определяется как количество фермента, необходимое для осуществления 50% диспропорционирования супероксидных радикалов.
Как видно из Таблицы 28 ниже, взятая на грамм уровня белка каждого испытанного биомаркера, применение композиции SAL позволило пополнить обедненный глутатион печени в сочетании с повышением уровня супероксиддисмутазы печени. Эти данные в сочетании с ранее описанными данными панелей печени убедительно свидетельствуют о том, что композиция SAL обладает гепатопротекторной активностью от оксидативного стресса, вызванного повреждениями печени, вызванными CCL4.
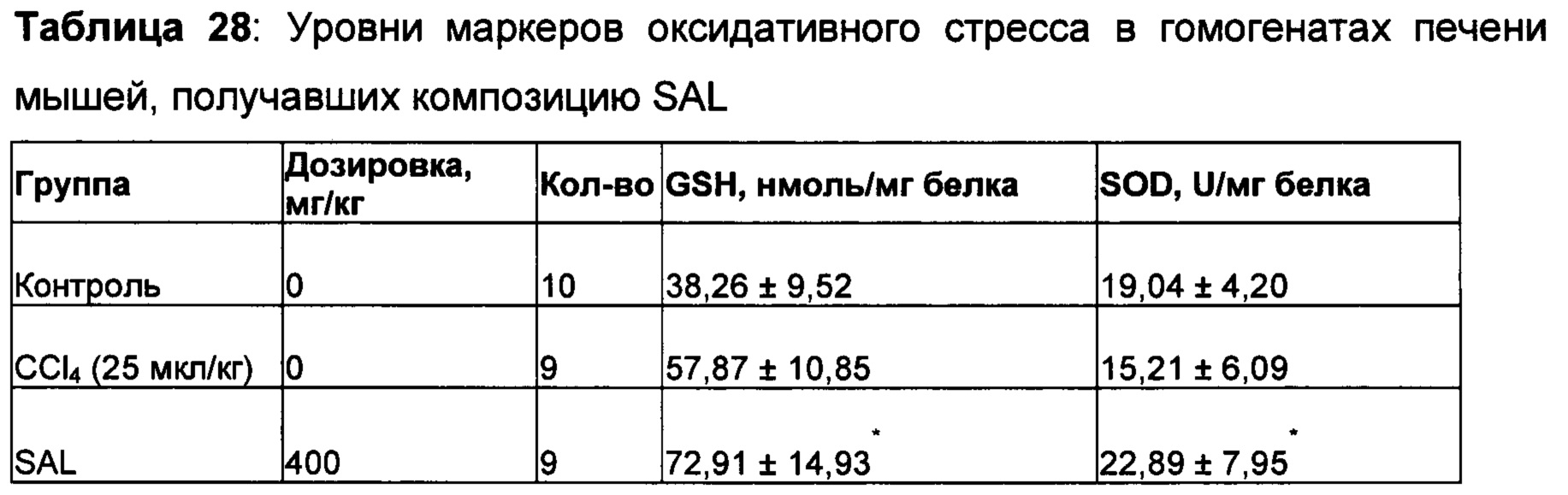
*Р<0,05
Пример 26: Оценка гепатопротекторной активности смесей Astragalus membranous, Schisandra chinensis и Artemisia capillaris в конкретных соотношениях в модели гепатотоксичности, вызванной CCl4
Гепатопротекторную активность комбинации, содержащей два дополнительных перспективных растительных экстракта, также оценивали в модели гепатотоксичности, вызванной CCl4, на мышах. Astragalus membranous комбинировали с Schisandra chinensis или Artemisia capillaris в соотношениях 1:1, 1:2, 2:1, 1:4 и 4:1. Как видно из Таблицы 29, когда Astragalus смешивали с Schisandra, только одно соотношение, а именно 1:4, показало статистически незначимое снижение (34,1%) уровня ALT в сыворотке по сравнению с мышами, получавшими носитель. В противоположность этому, большие уровни защиты печени наблюдались, когда Astragalus смешивали с Artemisia. Статистически значимые уровни 46,3% и 57,7% ингибирования ALT в сыворотке наблюдали для соотношений 2:1 и 4:1 Astragalus: Artemisia, соответственно. Наблюдали 100% уровень выживаемости для всех соотношений, протестированных в этой модели.
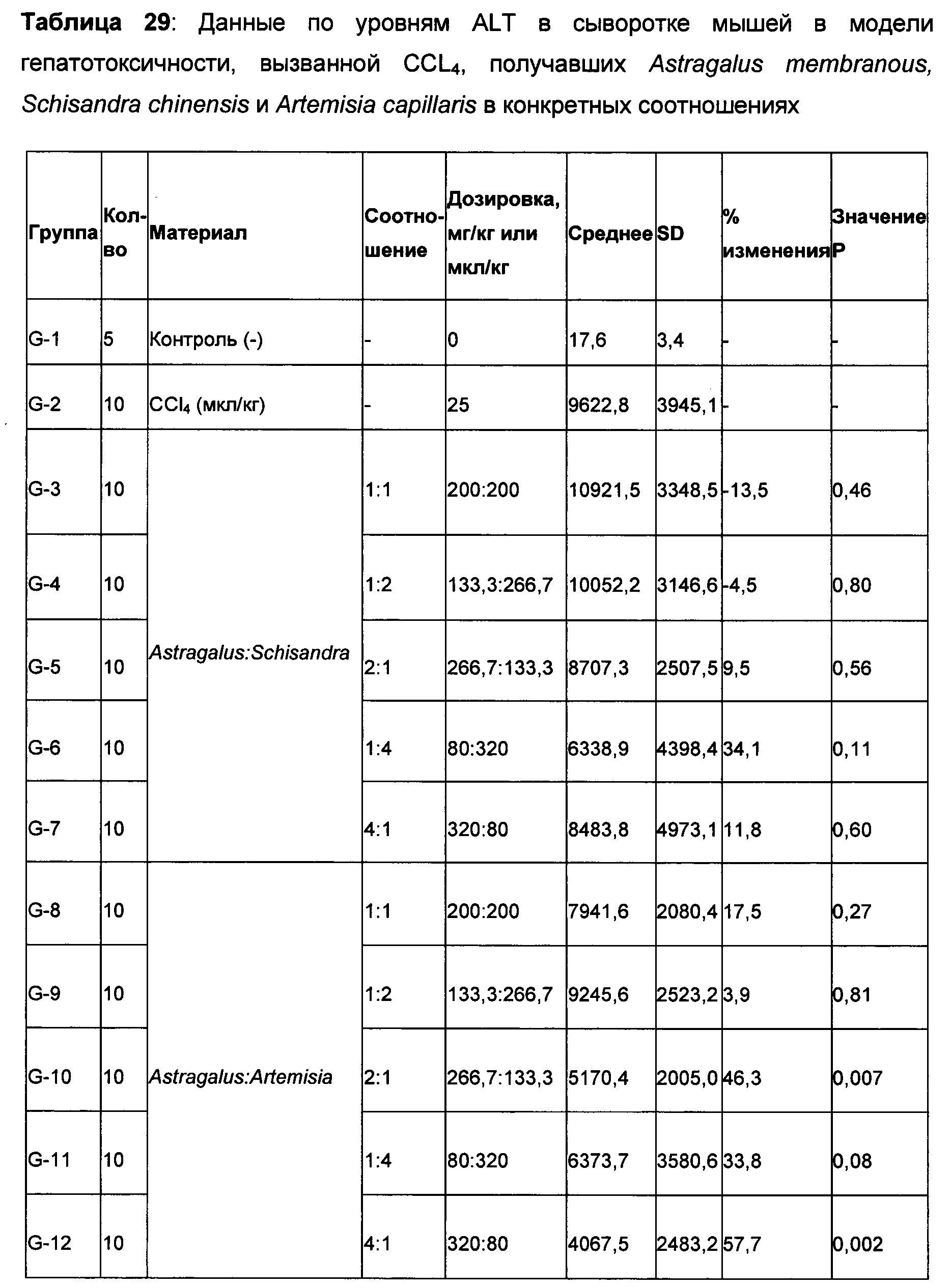
Таким образом, раскрыты конкретные варианты осуществления и способы получения соединений и композиций, полезных для управлением здоровья печени, включающие стереоизомеры, фармацевтически или нутрицевтически приемлемые соли, таутомеры, гликозиды и пролекарства описанных соединений, вместе с соответствующими способами улучшения и поддержания здоровья печени. При этом, однако, специалисту в данной области техники понятно, что возможно гораздо большее количество модификаций помимо уже описанных, которые не выходят за рамки концепции изобретения, раскрытого в настоящем описании. Следовательно, предмет изобретения не должен ограничиваться ничем, кроме как сутью настоящего описания. Более того, при интерпретации описания и формулы изобретения все термины должны интерпретироваться максимально широко, в соответствии с контекстом. В частности, термины «содержит» и «содержащая» следует интерпретировать как относящуюся к элементам, компонентам или шагам неисключительным образом, указывая, что ссылочные элементы, компоненты или этапы могут быть представлены или использованы или объединены с другим элементами, компонентами или шагами, на которые прямо не ссылаются.
СПИСОК ЛИТЕРАТУРЫ
Каждая из нижеприведенных ссылок является ссылкой на полноразмерный источник информации, включенный в настоящее описание. Следует отметить, что каждый из этих источников полностью включен в настоящее описание посредством ссылки.
1. Ajith ТА, Hema U, Aswathy MS. Zingiber officinale Roscoe prevents acetaminophen-induced acute hepatotoxicity by enhancing hepatic antioxidant status. Food Chem. Toxicol. 2007; 45: 2267-2272.
2. Albano E., Lott A.K., Slater T.F., Stier A., Symons M.C.R., and Tomasi A. (1982) Spin trapping studies on the free radical products formed by metabolic activation of carbon tetrachloride in rat liver microsomal fractions, isolated hepatocytes and in vivo. Biochem. J. 204: 593-603.
3. Amat N, Upur H,

4. An RB, Sohn DH, Kim YC. Hepatoprotective compounds of the roots of Cudrania tricuspidata on tacrine-induced cytotoxicity in Hep G2 cells. Biol Pharm Bull. 2006; 29(4): 838-40.
5. Bajt МЛ, Cover C, Lemasters JJ, Jaeschke H. Nuclear translocation of endonuclease G and apoptosisinducing factor during acetaminophen-induced liver cell injury. Toxicol. Sci. 2006; 94: 217-225.
6. Bajt МЛ, Farhood A, Lemasters JJ, Jaeschke H. Mitochondrial bax translocation accelerates DNA fragmentation and cell necrosis in a murine model of acetaminophen hepatotoxicity. J. Pharmacol. Exp. Ther. 2008; 324: 8-14.
7. Bajt МЛ, Ramachandran A, Yan HM, Lebofsky M, Farhood A, Lemasters JJ, Jaeschke H. Apoptosisinducing factor modulates mitochondrial oxidant stress in acetaminophen hepatotoxicity. Toxicol. Sci. 2011; 122: 598-605.
8. Cha JD, Moon SE, Kim HY, Lee JC, Lee KY. The essential oil isolated from Artemisia Capillaris prevents LPS-induced production of NO and PGE(2) by inhibiting MAPK-mediated pathways in RAW 264,7 macrophages. Immunol Invest. 2009; 38: 483-97.
9. Chamulitrat W., Blazka M.E., Jordan S.J., Luster M.I., and Mason R.P. (1995) Tumor necrosis factor-alpha and nitric oxide production in endotoxin-primed rats administered carbon tetrachloride. Life Sci. 57: 2273-2280.
10. Chamulitrat W., Jordan S.J., and Mason R.P. (1994) Nitric oxide production during endotoxic shock in carbon tetrachloride-treated rats. Mol. Pharmacol. 46: 391-397.
11. Cheeseman K.H., Davies M.J., Emery S., Maddix S.P., and Slater T.F. (1987) Effects of alpha-tocopherol on carbon tetrachloride metabolism in rat liver microsomes. Free Radic. Res. Commun. 3: 325-330.
12. Choi JH, Kim DW, Yun N, Choi JS, Islam MN, Kim YS, et al. Protective effects of hyperoside against carbon tetrachloride-induced liver damage in mice. J Nat Prod. 2011; 74: 1055-60.
13. Choi MK, Han JM, Kim HG, Lee JS, Lee JS, Wang JH, Son SW, Park HJ, Son CG. Aqueous extract of Artemisia capillaris exerts hepatoprotective action in alcohol-pyrazole-fed rat model. J Ethnopharmacol. 2013; 147(3): 662-70
14. Chu CY, Tseng TH, Hwang JM, Chou FP, Wang CJ. Protective effects of capillarisin on tert-butylhydroperoxide-induced oxidative damage in rat primary hepatocytes. Arch Toxicol. 1999; 73: 263-8.
15. Colby, SR. Calculating Synergistic and Antagonistic Responses of Herbicide combinations. Weeds, Vol. 15, No. 1 (Jan., 1967), pp. 20-22.
16. Cover C, Mansouri A, Knight TR, Bajt МЛ, Lemasters JJ, Pessayre D, Jaeschke H. Peroxynitriteinduced mitochondrial and endonuclease-mediated nuclear DNA damage in acetaminophen hepatotoxicity. J. Pharmacol. Exp. Ther. 2005; 315: 879-887.
17. Czaja M.J., Xu J., and Alt E. (1995) Prevention of carbon tetrachloride-induced rat liver injury by soluble tumor necrosis factor receptor. Gastroenterology 108: 1849-1854.
18. Davern TJ 2nd, James LP, Hinson JA, Poison J, Larson AM, Fontana RJ, Lalani E, Munoz S, Shakil AO, Lee WM, Acute Liver Failure Study Group. Measurement of serum acetaminophen-protein adducts in patients with acute liver failure. Gastroenterology. 2006; 130: 687-694.
19. Feng G, Wang X, You C, Cheng X, Han Z, Zong L, Zhou C, Zhang M. Antiproliferative potential of Artemisia capillaris polysaccharide against human nasopharyngeal carcinoma cells. Carbohydr Polym. 2013; 15; 92(2): 1040-5.
20. Han KH, Jeon YJ, Athukorala Y, Choi KD, Kim CJ, Cho JK, et al. A water extract of Artemisia Capillaris prevents 2,2'-azobis(2-amidinopropane) dihydrochloride-induced liver damage in rats. J Med Food. 2006; 9:342-7.
21. Hanawa N, Shinohara M, Saberi B, Gaarde WA, Han D, Kaplowitz N. Role of JNK translocation to mitochondria leading to inhibition of mitochondria bioenergetics in acetaminophen-induced liver injury. J. Biol. Chem. 2008; 283: 13565-13577.
22. He CS, Yue HY, Xu J, Xue F, Liu J, Li YY, Jing HE. Protective effects of capillary artemisia polysaccharide on oxidative injury to the liver in rats with obstructive jaundice. Exp Ther Med. 2012; 4(4): 645-648.
23. Hogade MG, Patil ks, Wadkar GH, Mathapati SS, Dhumal P. Hepatoprotective activity of Morus alba (Linn.) leaves extract against carbon tetrachloride induced hepatotoxicity in rats. African Journal of Pharmacy and Pharmacology 2010; Vol. 4(10), pp. 731-734,
24. Hong JH, Lee IS. Cytoprotective effect of Artemisia Capillaris fractions on oxidative stress-induced apoptosis in V79 cells. Biofactors. 2009; 35:380-8.
25. Hong SH, Seo SH, Lee JH, Choi ВТ. The aqueous extract from Artemisia capillaris Thunb. Inhibits lipopolysaccharide-induced inflammatory response through preventing NF-kappaB activation in human hepatoma cell line and rat liver. Int J Mol Med. 2004; 13(5)717-20.
26. Hu YQ, Tan RX, Chu MY, Zhou J. Apoptosis in human hepatoma cell line SMMC-7721 induced by water-soluble macromolecular components of Artemisia capillaris Thunberg. Jpn J Cancer Res. 2000; 91(1): 113-7.
27. Hung HY, SC. Recent Studies and Progression of Yin Chen Hao

28. Jaeschke H, McGill MR, Ramachandran A. Oxidant stress, mitochondria, and cell death mechanisms in drug-induced liver injury: lessons learned from acetaminophen hepatotoxicity. Drug Metab. Rev. 2012a; 44: 88-106.
29. Jaeschke H, Williams CD, McGill MR, Xie Y, Ramachandran A. Models of drug-induced liver injury for evaluation of phytotherapeutics and other natural products. Food Chem Toxicol. 2013 May; 55: 279-89.
30. Jaeschke H. Glutathione disulfide formation and oxidant stress during acetaminophen-induced hepatotoxicity in mice in vivo: the protective effect of allopurinol. J. Pharmacol. Exp. Ther. 1990; 255: 935-941.
31. James LP, Letzig L, Simpson PM, Capparelli E, Roberts DW, Hinson JA, Davern TJ, Lee WM. Pharmacokinetics of acetaminophen-protein adducts in adults with acetaminophen overdose and acute liver failure. Drug Metab. Dispos. 2009; 37: 1779-1784.
32. Jollow DJ, Mitchell JR, Potter WZ, Davis DC, Gillette JR, Brodie BB. Acetaminophen-induced hepatic necrosis. II. Role of covalent binding in vivo. J. Pharmacol. Exp. Ther. 1973; 187: 195-202.
33. Jung HA, Park JJ, Islam MN, Jin SE, Min BS, Lee JH, et al. Inhibitory activity of coumarins from Artemisia Capillaris against advanced glycation end product formation. Arch Pharm Res. 2012; 35: 1021-35.
34. Kim DW, Cho HI, Kim KM, Kim SJ, Choi JS, Kim YS, et al. lsorhamnetin-3-O-galactoside protects against CCl4-lnduced hepatic injury in mice. Biomol Ther. 2012; 20: 406-12.
35. Kim EK, Kwon KB, Han MJ, Song MY, Lee JH, Lv N, et al. Inhibitory effect of Artemisia Capillaris extract on cytokine-induced nitric oxide formation and cytotoxicity of RINm5F cells. Int J Mol Med. 2007; 19: 535-40.
36. Kim SW, Kim HW, Woo MH, Lee JH, Choi JS, Min BS. Quantitative determination of bioactive compounds В некоторых Artemisia capillaris by high-performance liquid chromatography. Nat Prod Sci. 2010; 16(4): 233-238.
37. Коп K, Kim JS, Jaeschke H, Lemasters JJ. Mitochondrial permeability transition in acetaminopheninduced necrosis and apoptosis of cultured mouse hepatocytes. Hepatology. 2004; 40: 1170-1179.
38. Koo HN, Hong SH, Jeong HJ, Lee EH, Kim NG, Choi SD, et al. Inhibitory effect of Artemisia Capillaris on ethanol-induced cytokines (TNF-α, IL-1α) secretion in Hep G2 cells. Immunopharmacol Immunotoxicol. 2002; 24: 441-53.
39. Kwon OS, Choi JS, Islam MN, Kim YS, Kim HP. Ингибирование of 5-lipoxygenase and skin inflammation by the aerial parts of Artemisia Capillaris and its constituents. Arch Pharm Res. 2011; 34: 1561-9.
40. Larson AM. Acetaminophen hepatotoxicity. Clin. Liver Dis. 2007; 11: 525-548.
41. Lee HI, Seo КО, Yun KW, Kim MJ, Lee MK. Comparative study of the hepatoprotective efficacy of Artemisia iwayomogi and Artemisia capillaris on ethanol-administered mice. J Food Sci. 2011; 76(9): T207-11.
42. Loguidice A, Boelsterli UA. Acetaminophen overdose-induced liver injury in mice is mediated by peroxynitrite independently of the cyclophilin D-regulated permeability transition. Hepatology. 2011; 54: 969-978.
43. Luckey S.W. and Petersen D.R. (2001) Activation of Kupffer cells during the course of carbon tetrachloride-induced liver injury and fibrosis in rats. Exp. Mol. Pathol. 71: 226-240.
44. Masubuchi Y, Suda C, Horie T. Involvement of mitochondrial permeability transition in acetaminophen-induced liver injury in mice. J. Hepatol. 2005; 42: 110-116.
45. McGill MR, Sharpe MR, Williams CD, Taha M, Curry SC, Jaeschke H. The mechanism underlying acetaminophen-induced hepatotoxicity in humans and mice involves mitochondrial damage and nuclear DNA fragmentation. J. Clin. Invest. 2012a; 122: 1574-1583.
46. McGill MR, Williams CD, Xie Y, Ramachandran A, Jaeschke H. Acetaminophen-induced liver injury in rats and mice: Comparison of protein adducts, mitochondrial dysfunction, and oxidative stress in the mechanism of toxicity. Toxicol. Appl. Pharmacol. 2012b; 264: 387-394.
47. Mitchell JR, Jollow DJ, Potter WZ, Davis DC, Gillette JR, Brodie BB. Acetaminophen-induced hepatic necrosis. I. Role of drug metabolism. J. Pharmacol. Exp. Ther. 1973; 187: 185-194.
48. Nakagawa H, Maeda S, Hikiba Y, Ohmae T, Shibata W, Yanai A, Sakamoto K, Ogura K, Noguchi T, Karin M, Ichijo H, Omata M. Deletion of apoptosis signal-regulating kinase 1 attenuates acetaminophen-induced liver injury by inhibiting c-Jun N-terminal kinase activation. Gastroenterology. 2008; 135: 1311-21.
49. Nelson S.D. and Harrison P.J. (1987) Roles of cytochrome P450 in chemically induced cytotoxicity. In: Guengrich F.P. (Ed.), Mammalian Cytochromes P450, CRC Press, Boca Raton, pp. 19-80.
50. Panossian A, Wikman G. Pharmacology of Schisandra chinensis Bail.: an overview of Russian research and uses in medicine. J Ethnopharmacol. 2008; 118(2): 183-212.
51. Park KM, Li Y, Kim B, Zhang H, Hwangbo K, Piao DG, Chi MJ, Woo MH, Choi JS, Lee JH, Moon DC, Chang HW, Kim JR, Son JK. High-performance liquid chromatographic analysis for quantitation of marker compounds of Artemisia capillaris Thunb. Arch Pharm Res. 2012; 35(12): 2153-2162.
52. Poyer J.L, McCay P.B., Lai E.K., Janzen E.G., and Davis E.R. (1980) Confirmation of assignment of trichloromethyl radical spin adduct detected by spin trapping during 13C carbon tetrachloride metabolism in vitro and in vivo. Biochem. Biophys. Res. Commun. 94: 1154-1160.
53. Qiu Y, Benet LZ, Burlingame AL. Identification of hepatic protein targets of the reactive metabolites of the non-hepatotoxic regioisomer of acetaminophen, 3'-hydroxyacetanilide, in the mouse in vivo using two-dimensional gel electrophoresis and mass spectrometry. Adv. Exp. Med. Biol. 2001; 500: 663-673.
54. Ramachandran A, Lebofsky M, Baines CP, Lemasters JJ, Jaeschke H. Cyclophilin D deficiency protects against acetaminophen-induced oxidant stress and liver injury. Free Radic. Res. 2011a; 45: 156-164.
55. Renner H. (1985) The limited relevance of models used for testing human hepatic diseases and their prevention. In: Keppler E., Popper H., Bianchi L, and Reutter W. (Eds.), Mechanisms of Hepatocyte Injury and Death, MTP Press Ltd., Lancaster, pp. 311-320.
56. Reynolds E.S. (1963) Liver parenchymal cell injury. I. Initial alterations of the cell following poisoning with carbon tetrachloride. J. Cell Biol. 19: 139-157.
57. Saito C, Lemasters JJ, Jaeschke H. c-Jun N-terminal kinase modulates oxidant stress and peroxynitrite formation independent of inducible nitric oxide synthase in acetaminophen hepatotoxicity. Toxicol. Appl. Pharmacol. 2010a; 246: 8-17.
58. Singab AN, Ayoub NA, AN EN, Mostafa NM. Antioxidant and hepatoprotective activities of Egyptian moraceous plants against carbon tetrachloride-induced oxidative stress and liver damage in rats. Pharm Biol. 2010; 48(11): 1255-64.
59. Slater T.F. (1981) Activation of carbon tetrachloride:chemical principles and biological significance. In: McBrien D.C.H., Slater T.F. (Eds.), Free Radicals, Lipid Peroxidation and Cancer, Academic Press, London, pp. 243-270.
60. Tien YC, Liao JC, Chiu CS, Huang TH, Huang CY, Chang WT, et al. Esculetin ameliorates carbon tetrachloride-mediated hepatic apoptosis in rats. Int J Mol Sci. 2011; 12: 4053-67.
61. Tirmenstein MA, Nelson SD. Subcellular binding and effects on calcium homeostasis produced by acetaminophen and a nonhepatotoxic regioisomer, 3'-hydroxyacetanilide, in mouse liver. J. Biol. Chem. 1989; 264: 9814-9819.
62. Wan Y, Wu YL, Lian LH, Nan JX. Protective effect of Ornithogalum saundersiae Ait (Liliaceae) against acetaminophen-induced acute liver injury via CYP2E1 and HIF-1α. Chin. J. Nat. Med. 2012; 10: 177-184.
63. Wang JH, Choi MK, Shin JW, Hwang SY, Son CG. Antifibrotic effects of Artemisia capillaris and Artemisia iwayomogi in a carbon tetrachloride-induced chronic hepatic fibrosis animal model. J Ethnopharmacol. 2012;140(1): 179-85.
64. Weddle CC, Hornbrook KR, McCay PB. Lipid peroxidation and alteration of membrane lipids in isolated hepatocutes exposed to carbon tetrachloride. J. Biol. Chem. 1976; 251: 4973-4978.
65. Yang CC, Fang JY, Hong TL, Wang TC, Zhou YE, Lin TC. Potential antioxidant properties and hepatoprotective effects of an aqueous extract formula derived from three Chinese medicinal herbs against CCl(4)-induced liver injury in rats. Int Immunopharmacol. 2013; 15(1): 106-13.
66. Zaher H, Buters JT, Ward JM, Bruno MK, Lucas AM, Stern ST, Cohen SD, Gonzalez FJ. Protection against acetaminophen toxicity in CYP1A2 and CYP2E1 double-null mice. Toxicol. Appl. Pharmacol. 1998; 152: 193-199.
67. Zhao Y, Geng CA, Ma YB, Huang XY, Chen H, Cao TW, He K, Wang H, Zhang XM, Chen JJ. UFLC/MS-IT-TOF guided isolation of anti-HBV active chlorogenic acid analogues from Artemisia capillaris as a traditional Chinese herb for the treatment of hepatitis. J Ethnopharmacol. 2014; 156: 147-54.
Реферат
Группа изобретений относится к фармацевтической промышленности, а именно к композиции, обладающей гепатопротекторной активностью, и к медицинской композиции. Предложена композиция, содержащая смесь обогащенных растительных экстрактов, при этом указанные обогащенные растительные экстракты содержат экстракт Artemisia, обогащенный по меньшей мере одним полимером или биополимером, выделенным из Artemisia, гелевый порошок Aloe, обогащенный по меньшей мере одним хромоном, выделенным из Aloe, и экстракт Schizandra, обогащенный по меньшей мере одним лигнаном и органической кислотой, выделенными из Schizandra, отличающаяся тем, что указанная смесь Artemisia, Schizandra и гелевого порошка листьев Aloe представляет собой смесь в соотношении 8:4:3. Предложена также медицинская композиция, восстанавливающая функции печени путем, выбранным из нейтрализации токсинов, уменьшения действия свободных радикалов, которые влияют на здоровье печени, удаления активных форм кислорода, снижения оксидативного стресса, предотвращения образования токсичных метаболитов, улучшения способности и/или функции печени к детоксикации, очистки печени, восстановления структуры печени, защиты клеток печени от токсинов, помощи протеканию и циркуляции крови в печени, поддержки функции печени, облегчения боли в печени, очистки от вредных химических соединений, поддержания метаболических процессов печени, облегчения дискомфорта печени, облегчения синдрома жирной печени, улучшения способности печени к детоксикации, снижения уровней ферментов печени, увеличения уровня SOD, увеличения уровня GSH, снижения уровня пероксидирования клеток печени, снижения уровня накопления жирных кислот, стимулирования регенерации клеток печени, улучшения восстановительной функции печени, стимулирования высвобождения желчи, стимулирования здорового потока желчи, омоложения печени, при этом указанная медицинская композиция содержит вышеописанную композицию в качестве активного ингредиента. Вышеописанные композиции обладают синергетической гепатопротекторной активностью, восстанавливают функции печени. 2 н. и 17 з.п. ф-лы, 1 ил., 29 табл., 26 пр.

Комментарии