Полиацилированные производные 20(r)-гинзенозида rg3, их получение и применение - RU2673885C1
Код документа: RU2673885C1
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармацевтической химии, и, в частности, настоящее изобретение относится к полиацилированному производному 20(R)-гинзенозида Rg3 и способу его получения, а также к противоопухолевому фармакологическому действию указанных производных.
Предпосылки создания изобретения
20(R)-Гинзенозид Rg3 представляет собой тетрациклический тритерпеноидный мономер гинзенозида сапонина, выделенный из красного женьшеня (красный женьшень представляет собой продукт обработки Panax ginseng С.А. Меу). Он был выделен из корейского женьшеня японским исследователем Kitagawa Hoon в 1980, его молекулярная формула представляет собой С42Н72О13, относительный молекулярный вес - 784,3. 20(R)-Гинзенозид Rg3 эффективен при синергетической детоксикации, оказывает положительное влияние при дефиците ци, усиливает иммунитет человеческого организма и т.д. Кроме того, исследования показали, что гинзенозид Rg3 участвует в подавлении пролиферации, инфильтрации и метастазирования опухолевых клеток, может индуцировать апоптоз раковых клеток печени, раковых клеток предстательной железы, раковых клеток при лейкемии, раковых клеток шейки матки.

Из-за большого размера молекулы 20(R)-гинзенозид Rg3 нерастворим в воде и других высокополярных растворителях, а также нерастворим в петролейном эфире, хлороформе и других низкополярных или неполярных растворителях; 20(R)-гинзенозид Rg3 хорошо растворим в пиридине, растворе этанола (50-70%), водных растворах сильных кислот (рН<2) и сильнощелочных растворах (рН>10). Он принадлежит к IV классу лекарственных средств согласно Системе Биофармацевтической Классификации (Biopharmaceutics Classification System, BCS), и вследствие низкой растворимости и трансмембранной проницаемости, а также низкой биодоступности, фармакологическое действие 20(R)-гинзенозида Rg3 ограничено.
За последние годы многие исследователи провели тщательные исследования полиацилирования природных соединений, например Liu Jikai с соавторами синтезировали пентаацетат бергенина путем катализа твердой кислотой, что описано в Патентной Заявке CN 200510010970.0 (Kunming Institute of Botany, Chinese Academy of Sciences). По сравнению с исходным бергенином, в экспериментах на животных было показано, что пентаацетат бергенина обладает выраженным синергетическим фармакологическим действием и может эффективно преодолевать ограничения, характерные для бергенина, такие как слабое противокашлевое и противоастматическое действие, а также низкую оральную абсорбцию.
Пентаацетат мангиферина, мангиферин гептаноил и мангиферин гексабутаноил были синтезированы с применением серной кислоты в качестве катализатора исследовательской группой под руководством Deng Jia Gang в Guangxi University of Medical Sciences. (Experiment Traditional Medical Formulae Vol 18, No 24, page 185-189); Фармакологические эксперименты с пентаацетатом мангиферина, мангиферин пропионил гептаацетатом и мангиферин бутирил гексаакрилатом, полученными каталитическим синтезом с серной кислотой (исследовательская группа под руководством Deng Jiagang et al., Guangxi Medical University), показали, что три указанные производные мангиферина могут оказывать фармакологическое действие, схожее с мангиферином, при дозировке 1/4 от дозировки мангиферина, что указывает на более сильное противовоспалительное действие ацилированных производных по сравнению с мангиферином (Chinese Journal of Experiment Traditional Medical Formulae Vol 18, No 24, page 185-189). Фармакологическое исследование эпигаллокатехин галлата октаацетата, полученного в результате полиацилирующей модификации эпигаллокатехин галлата (исследовательская группа под руководством Таk Hang Chan, Hong Kong Polytechnic University), показало, что данное производное обладает улучшенной стабильностью и более высокой противораковой эффективностью (Bioorg & Medicinal Chemistry 12 (2004) 5587-5593). Суммируя вышесказанное, сложноэфирные производные лекарственных средств, полученные посредством сложноэфирной модификации, имеют повышенную липорастворимость и более высокий коэффициент распределения в системе масло/вода, что повышает их трансмембранную проницаемость, приводя к улучшенной трансмембранной абсорбции, биодоступности лекарственных средств и повышенной эффективности лекарственных средств. Однако, таких исследований в отношении 20(R)-гинзенозида Rg3 не проводилось, поэтому авторы настоящего изобретения разработали и синтезировали полиацилированные производные 20(R)-гинзенозида Rg3 путем щелочного катализа и провели их фармакологическое исследование.
Краткое описание сути изобретения
Технической проблемой, на решение которой направлено настоящее изобретение, является получение полиацилированных производных 20(R)-гинзенозида Rg3 методами химического синтеза. В настоящем изобретении описано синтетическое полиацилированное производное 20(R)-гинзенозида Rg3, полученное ацилированием с использованием 20(R)-гинзенозида Rg3 в качестве исходного соединения.
Гидроксильные группы 20(R)-гинзенозида Rg3 блокируют для повышения липофильности и изменения коэффициента распределения в системе масло\вода, тем самым увеличивая всасываемость в кишечнике и повышая эффективность. Кроме того, в настоящем изобретении описан также способ получения полиацилированных производных 20(R)-гинзенозида Rg3, в котором используются мягкие условия проведения реакции и который пригоден для массового промышленного применения.
Прежде всего, в настоящем изобретении описаны полиацилированные производные 20(R)-гинзенозида Rg3 (т.е. мультиацилированные производные 20(R)-гинзенозида Rg3), имеющие формулу (I),

где R=CH3(CH2)nCO, n=0-5,
где R=CH3(CH2)nCO, n=2-4,
Также, в настоящем изобретении описана фармацевтическая композиция, содержащая полиацилированное производное 20(R)-гинзенозида Rg3 по настоящему изобретению и фармацевтически приемлемое вспомогательное вещество.
К фармацевтически приемлемым вспомогательным веществам, описанным в настоящем документе, относятся нетоксичные твердые, полутвердые или жидкие наполнители, разбавители, носители, регуляторы уровня рН, модификаторы ионной силы, агенты для обеспечения замедленного высвобождения и контролируемого высвобождения, средства для создания покрытия и другие фармацевтические вспомогательные вещества. Применяющиеся вспомогательные вещества можно адаптировать к подходящей форме введения и можно создавать составы, известные квалифицированным специалистам в данной области, представляющие собой препараты для инъекций, лиофилизованные порошки для инъекций, спреи, растворы для перорального введения, суспензии для перорального введения, таблетки, капсулы, таблетки с кишечно-растворимой оболочкой, пилюли, порошки, гранулы, препараты с замедленным высвобождением и контролируемым высвобождением.
Полиацилированные производные 20(R)-гинзенозида Rg3 по первому аспекту настоящего изобретения можно вводить инъекционно или через желудочно-кишечный тракт, поэтому фармацевтическая композиция по настоящему изобретению предпочтительно представляет собой препарат для инъекций или препарат для введения через желудочно-кишечный тракт, другими словами - особенно предпочтительны вспомогательные вещества, подходящие для введения посредством инъекции и через желудочно-кишечный тракт.
Термин "введение через желудочно-кишечный тракт" в настоящем документе относится к форме введения через желудочно-кишечный тракт пациентов, включая пероральное введение, введение в виде принудительного питания и введение посредством клизмы, предпочтительно пероральное введение, например с применением вспомогательных веществ, известных квалифицированным специалистам в данной области, растворов для перорального введения, суспензий для перорального введения, таблеток, капсул, таблеток с кишечно-растворимой оболочкой, пилюль, порошков, гранул и препаратов с замедленным высвобождением и контролируемым высвобождением, а препараты для введения посредством инъекций включают инъецируемые растворы и порошки для приготовления инъецируемых растворов.
Также, в другом аспекте настоящего изобретения описан способ получения полиацилированных производных 20(R)-гинзенозида Rg3, включающий следующие стадии:
1) растворение 20(R)-гинзенозида Rg3 в органическом растворителе с получением раствора 20(R)-гинзенозида Rg3,
2) добавление ацилирующего агента для этерификации,
3) добавление воды для остановки реакции и доведение рН раствора до 7 с использованием основания, и
4) затем фильтрацию и перекристаллизацию с получением конечного продукта.
Органический растворитель на стадии 1) выбран из триэтиламина или безводного пиридина, предпочтительно безводного пиридина, а ацилирующий агент на стадии 2) представляет собой ацилхлорид или ангидрид кислоты.
В частности, ацилхлорид выбран из ацетил хлорида, пропионил хлорида, бутирил хлорида, валерил хлорида или гексаноил хлорида; и ангидрид кислоты выбран из уксусного ангидрида, пропионового ангидрида, масляного ангидрида, валерианового ангидрида или капронового ангидрида.
Температура реакции этерификации на стадии 2) составляет 80-100°С.
В частности, время этерификации составляет 2-5 часов.
В частности, ацилирующий агент добавляют в раствор 20(R)-гинзенозида Rg3 при комнатной температуре.
В частности, комнатная температура равна 15-35°С.
Основание на стадии 3) выбрано из неорганических оснований.
В частности, неорганическое основание выбирают из карбоната натрия, карбоната калия, бикарбоната натрия или гидрокарбоната калия, предпочтительно бикарбоната натрия.
В частности, вода, добавляемая на стадии 3), представляет собой ледяную воду, т.е. воду с температурой 0°С, для завершения процесса этерификации.
Перекристаллизацию полиацилированного производного 20(R)-гинзенозида Rg3 на стадии 4) осуществляют с использованием системы вода/метанол.
В другом аспекте настоящего изобретения описано применение полиацилированных производных 20(R)-гинзенозида Rg3 для приготовления противоопухолевых и противораковых лекарственных средств.
В настоящем изобретении описано также применение полиацилированных производных 20(R)-гинзенозида Rg3 в производстве лекарственных средств для борьбы с различными солидными опухолями у животных, раком легких у человека, раком груди, раком желудка, раком кишечника и гепатокарциномой.
Настоящее изобретение обеспечивает преимущества, заключающиеся в том, что способ получения полиацилированных производных 20(R)-гинзенозида Rg3 по настоящему изобретению легко контролируется, увеличивает суммарный выход продуктов и подходит для массового промышленного производства.
Подробное описание изобретения
Далее настоящее изобретение будет описано на приводимых ниже вариантах осуществления, и приведенные варианты осуществления следует во всех отношениях рассматривать как иллюстративные, а не ограничивающие объем настоящего изобретения. Все реагенты и материалы, применяющиеся в описанных вариантах осуществления, коммерчески доступны, а в случае недостатка коммерческих источников следует обратиться к Guidebook to Organic Synthesis, руководствам от регулирующих органов в области лекарственных средств и инструкциям производителей к соответствующим приборам и реагентам.
Пример 1
1) 20(R)-Гинзенозид Rg3 (4 г, 5,09 ммоль) добавляли в 180 мл сухого безводного пиридина и перемешивали для растворения, получая раствор 20(R)-гинзенозида Rg3.
2) При комнатной температуре (15-35°С) добавляли ацетил хлорид (0,71 мл, около 10 ммоль) в раствор 20(R)-гинзенозида Rg3.
3) Реакционную смесь нагревали при перемешивании и выдерживали при 80°С для проведения этерификации.
4) После выдерживания реакционной смеси при температуре 80°С в течение 5 часов реакционный раствор выливали в ледяную воду и добавляли насыщенный водный раствор бикарбоната натрия до значения рН 7, что приводило к выпадению большого количества белого твердого осадка.
5) Фильтрация давала белое твердое вещество, которое промывали большим количеством воды и перекристаллизовывали из смеси вода/метанол, с получением белого порошка.
20(R)-гинзенозид Rg3 октаацетат (3 г) в виде белого твердого порошка растворим в воде, этаноле. После проявления ТСХ-пластины (раствор для хроматографирования: хлороформ/метанол 50:1, Rf=0,4) и опрыскивания реагентом 10% Н2SO4-этанол, проявляется фиолетовым цветом. В спектре ESI-MS, m/z[M+Na]=1143,6, и молекулярная масса составляет 1121.
1H-ЯМР и13С-ЯМР параметры для 20(R)-гинзенозид Rg3 октоацетата приведены ниже:
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.): 5,301-5,255 (т, 1H, J=9,2 Гц), 5,192-5,146 (т, 1H, J=9,2 Гц), 5,062 (с, 1H), 4,891-4,721 (м, 4Н), 4,629 (с, 2Н), 4,182-4,067 (м, 3Н), 3,973-3,911 (м, 3Н), 3,630-3,592 (т, 1H, J=1,2 Гц), 3,512 (с, 1H), 3,054-3,053 (д, 1H, J=7,6 Гц), 2,088 (с, 2Н), 1,984-1,902 (м, 22Н), 1,738 (с, 3Н), 1,626-1,210 (м, 18Н), 0,992-0,889 (м, 12Н), 0,794 (с, 3Н), 0,721 (с, 5Н);
13С-ЯМР (100 МГц, Пиридин-d5) δ (м.д.): 171,88, 171,81, 171,72, 171,61, 171,51, 171,31, 171,19, 171,15 (С=O), 132,05 (С-25), 127,30 (С-24), 104,92 (С-1''), 102,35 (С-1'), 91,57 (С-3), 79,27 (С-2'), 76,78 (С-5''), 74,96 (С-5'), 74,71 (С-2''), 74,71 (С-20), 73,56 (С-3''), 73,25 (С-3'), 72,98 (С-12), 70,79 (С-4''), 70,39 (С-4'), 63,95 (С-6''&6'), 57,54 (С-5), 53,76 (С-14), 51,56 (С-17), 51,47 (С-9), 47,40 (С-13), 44,35 (С-22), 41,17 (С-4), 40,85 (С-8), 40,04 (С-1), 38,18 (С-10), 36,06 (С-7), 32,75 (С-11), 30,09 (С-15), 27,22 (С-28), 25,64 (С-16), 24,96 (С-2), 24,83 (С-26), 22,39 (С-21), 21,93 (С-23), 21,71-21,79 (СН3СО), 18,29 (С-6), 17,65 (С-30), 17,26 (С-27), 16,17 (С-29), 16,13 (С-19), 16,90 (С-18).
На основе данных спектров ESI-MS,1H-ЯМР и13С-ЯМР, можно заключить, что структурная формула 20(R)-гинзенозид Rg3 октоацетата имеет следующий вид:

Пример 2
1) 20(R)-Гинзенозид Rg3 (4 г, 5,09 ммоль) добавляли в 180 мл сухого безводного пиридина и перемешивали для растворения, получая раствор 20(R)-гинзенозида Rg3.
2) При комнатной температуре (20-25°С) добавляли н-масляный ангидрид (3,07 мл, около 10 ммоль) в раствор 20(R)-гинзенозида Rg3.
3) Реакционную смесь нагревали при перемешивании и выдерживали при 100°С для проведения этерификации.
4) После выдерживания реакционной смеси при температуре 100°С в течение 5 часов реакционный раствор выливали в ледяную воду и добавляли насыщенный водный раствор бикарбоната натрия до значения рН 7, что приводило к выпадению большого количества белого твердого осадка.
5) Фильтрация давала белое твердое вещество, которое промывали большим количеством воды и перекристаллизовывали из смеси вода/метанол, с получением белого порошка.
20(R)-гинзенозид Rg3 окто-н-бутират (3 г) в виде белого твердого порошка растворим в воде и этаноле. После проявления ТСХ-пластины (раствор для хроматографирования: петролейный эфир/этилацетат 3:1, Rf=0,5) и опрыскивания реагентом 10% Н2SO4-этанол, проявляется фиолетовым цветом. В спектре ESI-MS, m/z[M+Na]=1368,27, и молекулярная масса составляет 1345.
1H-ЯМР и13С-ЯМР параметры для 20(R)-гинзенозид Rg3 окто-н-бутирата приведены ниже:
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.): 5,301-5,255 (т, 1H, J=9,2 Гц), 5,192-5,146 (т, 1H, J=9,2 Гц), 5,062 (с, 1H), 4,891-4,721 (м, 4Н), 4,629 (с, 2Н), 4,182-4,067 (м, 3Н), 3,973-3,911 (м, 3Н), 3,630-3,592 (т, 1H, J=1,2 Гц), 3,512 (с, 1H), 3,054-3,053 (д, 1H, J=7,6 Гц), 2,35 (м, 12Н), 2,32 (с, 2Н), 1,984-1,902 (м, 22Н), 1,801-1,793 (м, 16Н), 1,738 (с, 3Н), 0,992-0,889 (м, 16Н), 0,794 (с, 3Н), 0,721 (с, 5Н).
13С-ЯМР (100 МГц, Пиридин-d5) δ (м.д.): 172,96, 172,89, 172,62, 172,51, 172,47, 172,28, 172,26, 172,06 (С=O), 130,55 (С-25), 125,81 (С-24), 103,44 (С-1''), 100,82 (С-1'), 90,01 (С-3), 77,41 (С-2'), 77,11 (С-5''), 76,68 (С-5'), 75,47 (С-2''), 72,04 (С-20), 74,43 (С-3''), 73,91 (С-3'), 71,64 (С-12), 69,14 (С-4''), 68,74 (С-4'), 63,30 (С-6'), 63,35 (С-6''), 56,34 (С-5), 51,39 (С-14), 50,16 (С-17), 49,99 (С-9), 48,73 (С-13), 42,59 (С-22), 40,25 (С-4), 40,04 (С-8), 39,25 (С-1), 36,85 (С-10), 35,59-35,90 (СН3СН2 СН2СО), 35,01 (С-7), 31,59 (С-11), 31,16 (С-15), 27,22 (С-28), 25,64 (С-16), 24,96 (С-2), 24,83 (С-26), 22,39 (С-21), 21,93 (С-23), 18,42 (С-6), 18,17-18,34 (СН3СН2СН2СО), 17,65 (С-30), 17,26 (С-27), 16,12 (С-29), 16,02 (С-19), 15.40 (С-18), 13,64 (СН3СН2СН2СО).
На основе данных спектров ESI-MS,1H-ЯМР и13С-ЯМР, можно заключить, что структурная формула 20(R)-гинзенозид Rg3 окто-н-бутирата имеет следующий вид:

Пример 3
1) 20(R)-Гинзенозид Rg3 (4 г, 5,09 ммоль) добавляли в 180 мл сухого безводного пиридина и перемешивали для растворения, получая раствор 20(R)-гинзенозида Rg3.
2) При комнатной температуре (15-25°С) добавляли н-пропионовый ангидрид (3,07 мл, около 10 ммоль) в раствор 20(R)-гинзенозида Rg3.
3) Реакционную смесь нагревали при перемешивании и выдерживали при 80°С для проведения этерификации.
4) После выдерживания реакционной смеси при температуре 80°С в течение 5 часов реакционный раствор выливали в ледяную воду и добавляли насыщенный водный раствор бикарбоната натрия до значения рН 7, что приводило к выпадению большого количества белого твердого осадка.
5) Фильтрация давала белое твердое вещество, которое промывали большим количеством воды и перекристаллизовывали из смеси вода/метанол, с получением белого порошка.
20(R)-гинзенозид Rg3 окто-н-пропионат (3 г) в виде белого твердого порошка растворим в воде и этаноле.
После проявления ТСХ-пластины (раствор для хроматографирования: петролейный эфир/этилацетат 3:1, Rf=0,4) и опрыскивания реагентом 10% Н2SO4-этанол, проявляется фиолетовым цветом. В спектре ESI-MS, m/z[M+Na]=1255,71, и молекулярная масса составляет 1233.
1H-ЯМР и13С-ЯМР параметры для 20(R)-гинзенозид Rg3 окто-н-пропионата приведены ниже:
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.): 5,301-5,255 (т, 1H, J=9,2 Гц), 5,192-5,146 (т, 1H, J=9,2 Гц), 5,062 (с, 1H), 4,891-4,721 (м, 4Н), 4,629 (с, 2Н), 4,182-4,067 (м, 3Н), 3,973-3,911 (м, 3Н), 3,630-3,592 (т, 1H, J=1,2 Гц), 3,512 (с, 1H), 3,054-3,053 (д, 1H, J=7,6 Гц), 2,29-2,27 (м, 16Н), 2,088 (с, 2Н), 1,14-1,12 (м, 24Н), 1,738 (с, 3Н), 0,992-0,889 (м, 16Н), 0,794 (с, 3Н), 0,721 (с, 5Н);
13С-ЯМР (100 МГц, Пиридин-d5) δ (м.д.): 175,27, 175,20, 175,04, 174,97, 174,87, 174,70, 174,68, 174,52 (С=O), 132,06 (С-25), 127,31 (С-24), 104,96 (С-1''), 102,38 (С-1'), 91,53 (С-3), 79,14 (С-2'), 77,11 (С-5''), 76,68 (С-5'), 75,47 (С-2''), 72,46 (С-20), 74,43 (С-3''), 73,91 (С-3'), 70,18 (С-12), 70,86 (С-4''), 70,36 (С-4'), 63,81 (С-6''&6'), 57,57 (С-5), 53,86 (С-14), 51,53 (С-17), 51,49 (С-9), 7,40 (С-13), 44,29 (С-22), 41,20 (С-4), 40,87 (С-8), 40,07 (С-1), 38,20 (С-10), 36,09 (С-7), 32,87 (С-11), 30,13 (С-15), 29,54-29,98 (СН3СН2СО), 29,10 (СН3СН2СО), 28,82-28,98 (СН3СН2СО), 27,08 (С-28), 24,24 (С-16), 24,96 (С-2), 24,83 (С-26), 22,39 (С-21), 21,93 (С-23), 19,65 (С-6), 18,97 (С-30), 18,96 (С-27), 17,53 (С-29), 17,50 (С-19), 16,90 (С-18), 10,45-10,58 (СН3СН2СО).
На основе данных спектров ESI-MS,1H-ЯМР и13С-ЯМР, можно заключить, что структурная формула 20(R)-гинзенозид Rg3 окто-н-пропионата имеет следующий вид:

Пример 4
1) 20(R)-Гинзенозид Rg3 (4 г, 5,09 ммоль) добавляли в 180 мл сухого безводного пиридина и перемешивали для растворения, получая раствор 20(R)-гинзенозида Rg3.
2) При комнатной температуре (15-35°С) добавляли гексаноил хлорид (1,387 мл, около 10 ммоль) в раствор 20(R)-гинзенозида Rg3.
3) Реакционную смесь нагревали при перемешивании и выдерживали при 80°С для проведения этерификации.
4) После выдерживания реакционной смеси при температуре 80°С в течение 5 часов реакционный раствор выливали в ледяную воду и добавляли насыщенный водный раствор бикарбоната натрия до значения рН 7, что приводило к выпадению большого количества белого твердого осадка.
5) Фильтрация давала белое твердое вещество, которое промывали большим количеством воды и перекристаллизовывали из смеси вода/метанол, с получением белого порошка.
20(R)-гинзенозид Rg3 окто-н-гексаноат (3 г) в виде белого твердого порошка растворим в воде и этаноле. После проявления ТСХ-пластины (раствор для хроматографирования: хлороформ/метанол 5:1, Rf=0,4) и опрыскивания реагентом 10% Н2SO4-этанол, проявляется фиолетовым цветом. В спектре ESI-MS, m/z[M+Na]=1602,2, и молекулярная масса составляет 1570.
1H-ЯМР и13С-ЯМР параметры для 20(R)-гинзенозид Rg3 окто-н-гексаноата приведены ниже:
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.): 5,301-5,255 (т, 1H, J=9,2 Гц), 5,192-5,146, (т, 1H, J=9,2 Гц), 5,062 (с, 1H), 4,891-4,721 (м, 4Н), 4,629 (с, 2Н), 4,182-4,067 (м, 3Н), 3,973-3,911 (м, 3Н), 3,630-3,592 (т, 1H, J=1,2 Гц), 3,512 (с, 1H), 3,054-3,053 (д, 1H, J=7,6 Гц), 2,29-2,27 (м, 16Н), 2,088 (с, 2Н), 1,14-1,12 (м, 24Н), 1,738 (с, 3Н), 0,992-0,889 (м, 16Н), 0,794 (с, 3Н), 0,721 (с, 5Н).
13С-ЯМР (100 МГц, Пиридин-d5) δ (м.д.): 173,27, 173,20, 173,04, 172,98, 172,82, 172,70, 172,67, 172,52 (С=O), 132,06 (С-25), 127,31 (С-24), 104,96 (С-1''), 102,38 (С-1'), 91,53 (С-3), 79,14 (С-2'), 77,11 (С-5''), 76,68 (С-5'), 75,47 (С-2''), 72,46 (С-20), 74,43 (С-3''), 73,91 (С-3'), 70,18 (С-12), 70,86 (С-4''), 70,36 (С-4'), 63,81 (С-6''&6'), 57,57 (С-5), 53,86 (С-14), 51,53 (С-17), 51,49 (С-9), 7,40 (С-13), 44,29 (С-22), 41,20 (С-4), 40,87 (С-8), 40,07 (С-1), 38,20 (С-10), 36,09 (С-7), 33,14-34,28 (СН3СН2СН2СН2СН2СО), 32,87 (С-11), 28,82-28,98 (СН3СН2СН2СН2СН2СО), 30,13 (С-15), 27,08 (С-28), 24,24 (С-16), 24,96 (С-2), 24,83 (С-26), 22,39 (С-21), 22,48-22,10 (СН3СН2СН2СН2СН2СО), 21,93 (С-23), 19,65 (С-6), 18,97 (С-30), 18,96 (С-27), 17,53 (С-29), 17,50 (С-19), 16,90 (С-18), 14,41-14,67 (СН3СН2СН2СН2СН2СО).
На основе данных спектров ESI-MS,1H-ЯМР и13С-ЯМР, можно заключить, что структурная формула 20(R)-гинзенозид Rg3 окто-н-гексаноата имеет следующий вид:

Экспериментальный пример. Влияние полиацилированных производных 20(R)-гинзенозида Rg3 на подавление роста опухоли
1. Протестированные лекарственные средства
Полиацилированные производные 20(R)-гинзенозида Rg3:
20(R)-гинзенозид Rg3 окто-ацетат, 20(R)-гинзенозид Rg3 окто-н-бутират и 20(R)-гинзенозид Rg3 окто-н-пропионат, предоставленные компанией Dalian Fusheng natural drug development Co. Ltd., детектировали методом нормализации площадей с применением ВЭЖХ с УФ-детектором и испарительным детектором светорассеяния, их чистота была определена как равная 99,6%, 99,2% и 99,1%, соответственно.
Способ получения
Точно отмеряли количество полиацилированных производных 20(R)-гинзенозида Rg3, добавляли 5% CMC-Na для получения целевой концентрации суспензии. Объем введения составлял 0,5 мл/мышь.
2. Материалы для эксперимента
Лекарственные средства для положительного контроля:
Циклофосфамид (СТХ) для инъекций, от Shanghai Hualian Pharmaceuticals Group, введение один раз в день, в течение семи дней подряд;
5Fu раствор для инъекций, от Shanghai Xudonghaipu Pharmaceuticals Co., ltd.; митомицин (MMC) для инъекций, от Kyowa Hakko Kogyo Co. Ltd.
Опухоли:
модель рака груди человека Всар-37, модель рака легких человека А549, модель рака кишечника человека LOVO, модель рака желудка человека MGC и модель рака печени человека QGY, причем линии опухолевых клеток принадлежали ко второму или более поколению, линия клеток мышиной В16 меланомы, мышиная модель карциномы легких Льюиса, мышиная модель саркомы s180 - все перечисленные культуры пересевались и сохранялись в Фармакологическом Подразделении Шанхайского Института Фармацевтической Промышленности.
3. Животные для экспериментов
Происхождение:
Голые мыши, возраст 6 недель, вес 18-22 г/мышь, от Центра Лабораторных Животных Китайской Академии Наук, Шанхайское отделение, сертификат No,2001 А032.
Мыши C57BL/6 и Куныминские мыши, 18-22 г/мышь, от Центра Лабораторных Животных Китайской Академии Наук, Шанхайское отделение, сертификат SYXK (Шанхай) 2004-0015.
Пол: самцы или самки, одинаковый половой состав для каждого повтора эксперимента
Число животных: 10 мышей и 10 голых мышей для каждой из групп положительного контроля и тестовых групп в эксперименте, и 20 для группы отрицательного контроля
4. Условия эксперимента
Дозировка:
Дозировки для 20(R)-гинзенозид Rg3 окто-ацетата, 20(R)-гинзенозид Rg3 окто-н-бутирата и 20(R)-гинзенозид Rg3 окто-н-пропионата были установлены на уровне группы с высокой дозой (0,3 мг/кг/с), группы со средней дозой (0,06 мг/кг/с) и группы с низкой дозой (0,012 мг/кг/с).
Режим дозировки: пероральное введение, два раза в сутки.
Модель опухоли человека и клеточная мышиная модель: ро × 14bid (ро -перорально; bid - 2 раза в сутки);
Мышиная модель опухоли: po × l0bid.
Контрольные эксперименты:
Группа отрицательного контроля: получала такой же объем 5%-ного CMC-Na, как тестовая группа, в таком же режиме дозирования, как тестовая группа.
Группа положительного контроля: Циклофосфамид СТХ 30 мг/кг, ММС 2 мг/кг и 5Fu 30 мг/кг интраперитонеально или внутривенно, один раз в сутки, в течение семи дней подряд.
5. Методика эксперимента и основные стадии
5.1 Противоопухолевое тестирование
5.1.1 Модель подкожного инокулирования
Опухолевые клетки в фазе быстрого роста отбирали в стерильных условиях и готовили суспензии клеток с концентрацией примерно 2×107/мл путем гомогенизации, полученные суспензии вводили мышам-хозяевам подкожно в объеме 0,2 мл/мышь и повторяли на следующий день согласно дизайну эксперимента, животных из каждой группы забивали примерно через три недели, отбирали и взвешивали опухоли, и вычисляли степень подавления опухоли по следующей формуле:
степень подавления опухоли % = [(средний вес опухоли в контрольной группе -средний вес опухоли в тестовой группе)/средний вес опухоли в контрольной группе] × 100%
Те же самые операции повторяли в модели ксенотрансплантанта опухоли человека, за исключением того, что корм, упаковку, клетку и контактирующие инструменты стерилизовали при высоком давлении перед использованием, и голых мышей кормили в подставке с ламинарным течением. Опухоли и вес животных с опухолями измеряли в динамике (размер опухоли измеряли штангенциркулем: длинный диаметр/а, короткий диаметр/b, и объем опухоли = а × b2/2).
5.1.2 Модель желудочного инокулирования in situ
Два пересева in vivo клеток рака желудка MGC в фазе быстрого роста отбирали в стерильных условиях и готовили суспензии клеток с концентрацией примерно 1-2×107/мл путем гомогенизации; полученные суспензии клеток (0,05 мл) хирургическим путем вводили голым мышам в большую кривизну желудка и повторяли на следующий день согласно дизайну эксперимента, и вычисляли степень увеличения продолжительности жизни животных с опухолью по следующей формуле:
Степень увеличения продолжительности жизни % = среднее число суток выживаемости в тестируемой группе/ среднее число суток выживаемости в контрольной группе × 100%
5.2 Тестирование в отношении метастазов опухолей
5.2.1 Модель инокулирования в хвостовую вену
Клетки мышиной меланомы В16 в фазе логарифмического роста отбирали в стерильных условиях и готовили суспензии клеток с концентрацией примерно 2,5×105/мл; полученные суспензии клеток вводили в дозировке 0,2 мл/мышь в хвостовую вену мышам C57BL/6 и повторяли на следующий день согласно дизайну эксперимента, животных забивали примерно через три недели, отбирали и взвешивали легкие в каждой группе, подсчитывали колонии метастазирующих раковых клеток в легких на одну мышь и среднее число колоний опухолевых клеток в каждой группе, и вычисляли степень подавления опухоли по следующей формуле:
степень подавления опухоли % = [(среднее число колоний в контрольной группе -среднее число колоний в тестовой группе)/ среднее число колоний в контрольной группе] × 100%
5.2.2 Модель метастазов в печени с инокулированием в селезенку
Клетки рака кишечника LOVO (выращивали in vitro) в фазе логарифмического роста отбирали в стерильных условиях и готовили суспензии клеток с концентрацией примерно 1,8×107/мл, используя культуральную среду RPMI1640 как разбавитель. Голых мышей подвергали общему наркозу и разрезали живот после обычной дезинфекции кожи на животе, вынимали селезенку и вводили суспензии клеток рака кишечника LOVO (0,05 мл/мышь), затем возвращали селезенку на место, зашивали разрезы, и мышей помещали в клетки с подставкой с ламинарным течением. На следующий день мышам вводили препараты согласно дизайну эксперимента, наблюдали и регистрировали уровень смертности в каждой группе, и вычисляли степень увеличения продолжительности жизни в сравнении с группой отрицательного контроля.
5.2.3 Модель инокулирования в печень in situ
В стерильных условиях, из пересева in vivo второго поколения источника опухоли QGY в фазе быстрого роста готовили суспензии клеток с концентрацией примерно 1-2×107/мл путем гомогенизации (1:6), и полученные гомогенаты подготавливали к применению, фильтруя через сетки из нержавеющей стали 100 меш. Голым мышам обычным образом проводили дезинфекцию и анестезию, разрезали от мечевидного отростка грудины по середине брюшной полости, обнажая печень, инъецировали подготовленные суспензии клеток (0,05 мл) в паренхиму печени с помощью импортных 28ga 1/2 мл шприцов, брюшную полость закрывали и затем зашивали слой за слоем. Голых мышей кормили в подставке с ламинарным течением, при этом стерилизуя под высоким давлением весь корм, упаковку, клетку и контактирующие инструменты перед использованием. На следующий день мышам вводили препараты согласно дизайну эксперимента, наблюдали и регистрировали время выживания в период 45 дней в каждой группе, и вычисляли время выживания в сравнении с группой отрицательного контроля и степень увеличения продолжительности жизни.
6. Результаты
6.1 Результаты противоопухолевого теста полиацилированных производных Rg3 в опухолевых моделях
Результаты противоопухолевого теста 20(R)-гинзенозид Rg3 окто-н-пропионата, 20(R)-гинзенозид Rg3 окто-н-бутирата и 20(R)-гинзенозид Rg3 окто-ацетата в мышиных и человеческих опухолевых моделях приведены в Таблице 1 и Таблице 2.

В сравнении с группой отрицательного контроля, *** значение р<0,01

В сравнении с группой отрицательного контроля, ***р<0,01
Из Таблицы 1 и Таблицы 2 видно, что 20(R)-гинзенозид Rg3 окто-н-пропионат, 20(R)-гинзенозид Rg3 окто-н-бутират и 20(R)-гинзенозид Rg3 окто-ацетат оказывают подавляющее действие на мышиные и человеческие опухолевые модели, и оптимальная степень подавления опухоли в тестируемых группах превышает 70%, демонстрируя существенное отличие в сравнении с группой отрицательного контроля (р<0,01).
6.2 Результаты тестирования полиацилированных производных Rg3 (а именно Rg3 мульти-ацилированных производных) в моделях метастазов опухолей
Результаты тестирования в отношении метастазов опухолей для 20(R)-гинзенозид Rg3 окто-н-пропионата, 20(R)-гинзенозид Rg3 окто-н-бутирата и 20(R)-гинзeнoзид Rg3 окто-ацетата в моделях метастазов мышиной меланомы В16, S180 и карциномы легких Льюиса, а также в модели метастазов рака легких человека, приведены в Таблице 3-6.


В сравнении с группой отрицательного контроля, ***значение р<0,01



В сравнении с группой отрицательного контроля, *** значение р<0,01
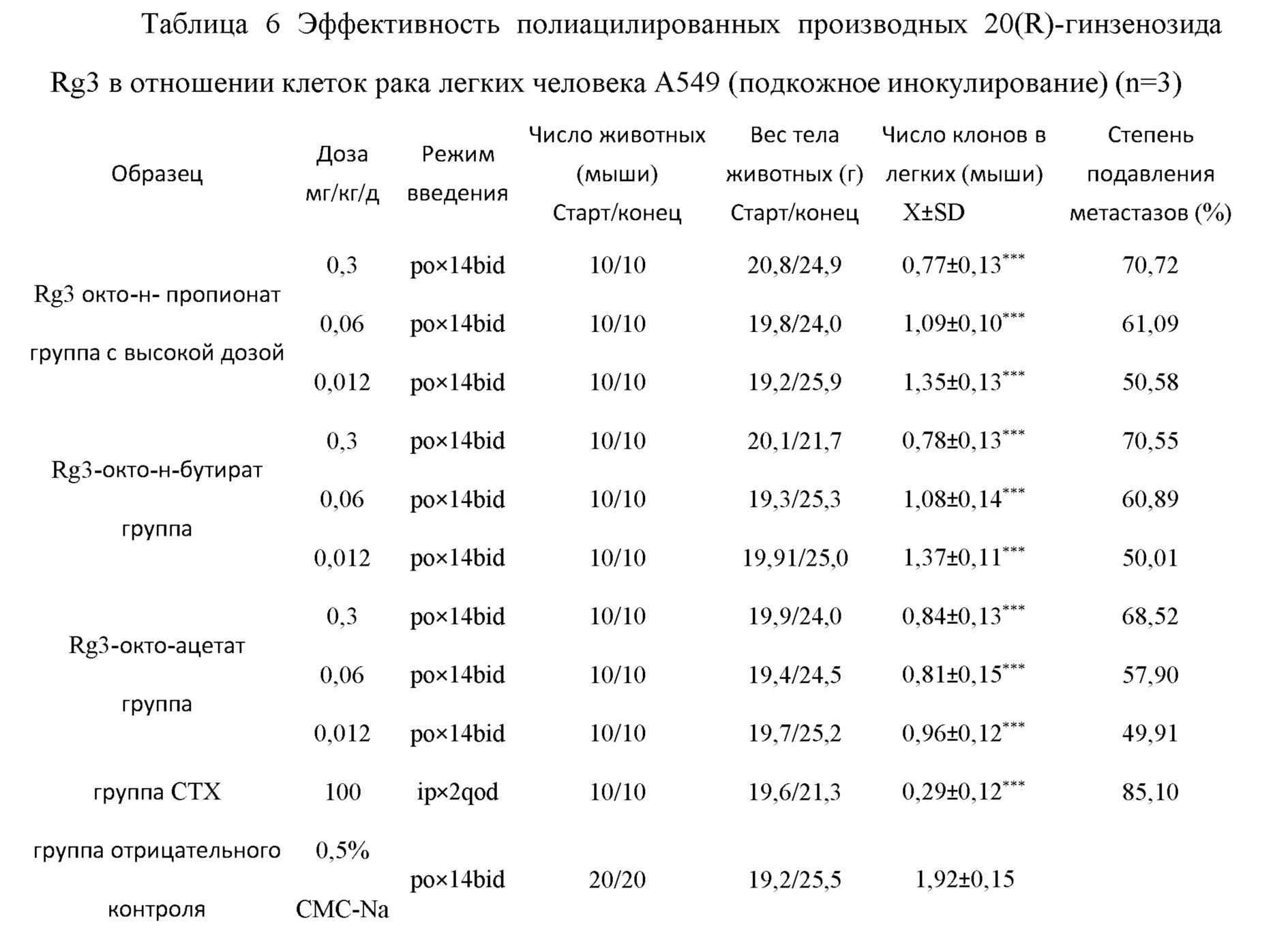
В сравнении с группой отрицательного контроля, *** значение р<0,01 Из Таблиц 3-6 видно, что степени подавления раковых метастазов в случае 20(R)-гинзенозид Rg3 окто-н-пропионата, 20(R)-гинзенозид Rg3 окто-н-бутирата и 20(R)-гинзенозид Rg3 окто-ацетата в моделях метастазов мышиной меланомы В16, S180 и карциномы легких Льюиса, а также в модели метастазов рака легких человека, достигают 70-80%.
6.3 Степень увеличения продолжительности жизни по результатам противоопухолевого тестирования полиацилированных производных Rg3 в моделях метастазов опухолей
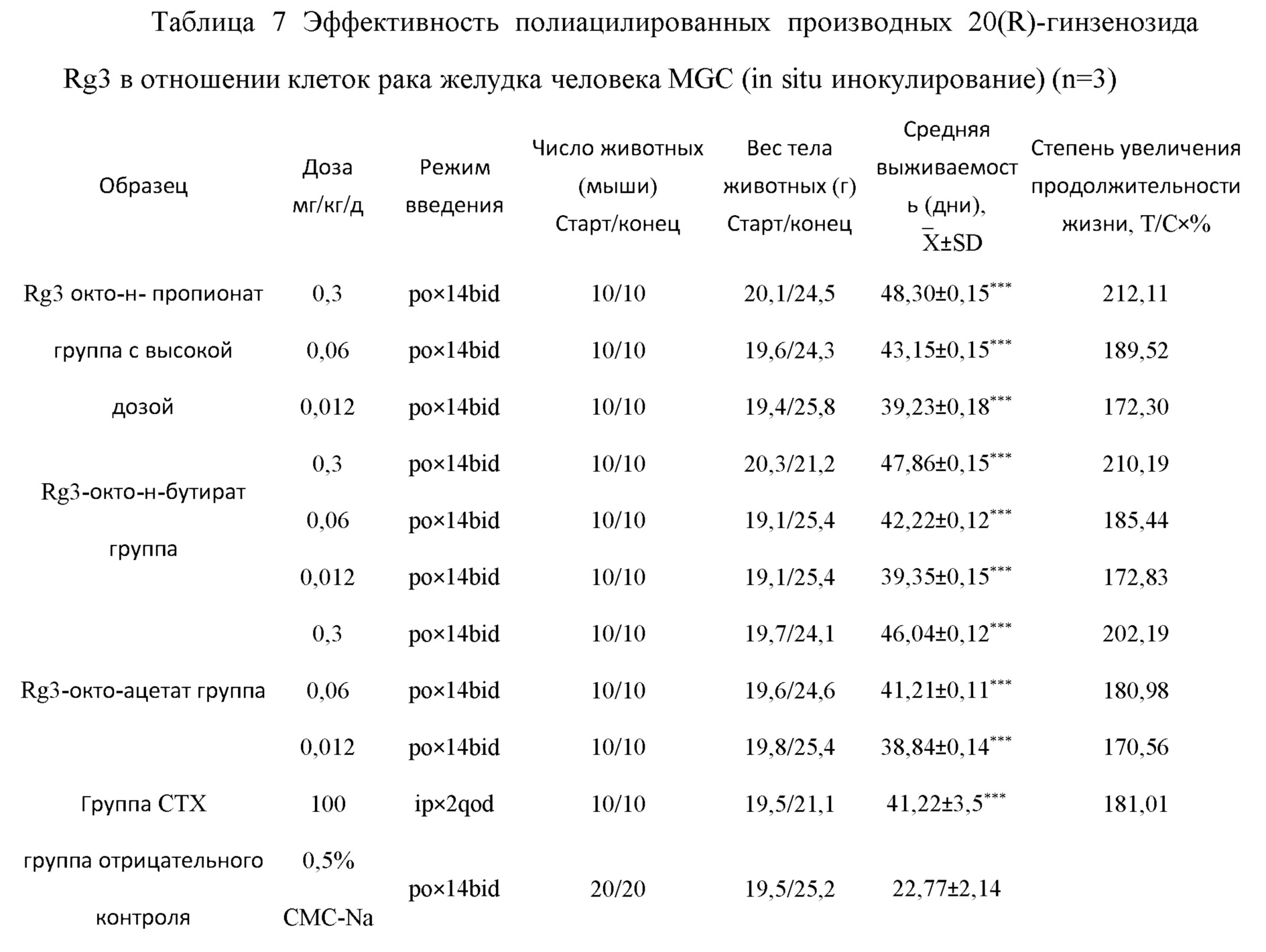
Степень увеличения продолжительности жизни по результатам противоопухолевого тестирования гинзенозид Rg3 окто-н-пропионата, гинзенозид Rg3 окто-н-бутирата и гинзенозид Rg3 окто-ацетата в моделях метастазов рака желудка человека, метастазов рака кишечника человека, метастазов рака печени человека приведена в Таблицах 7-9.
В сравнении с группой отрицательного контроля, *** значение р<0,01


В сравнении с группой отрицательного контроля, *** значение р<0,01

В сравнении с группой отрицательного контроля, *** значение р<0,01 Из Таблиц 7-9 видно, что 20(R)-гинзенозид Rg3 окто-н-пропионат, 20(R)-гинзенозид Rg3 окто-н-бутират и 20(R)-гинзенозид Rg3 окто-ацетат могут существенно увеличить время выживаемости в моделях рака желудка человека, рака кишечника человека и рака печени человека, с очевидным эффектом увеличения продолжительности жизни. Среди всех групп, группы с высокой дозой 20(R)-гинзенозид Rg3 окто-н-пропионата, 20(R)-гинзенозид Rg3 окто-н-бутирата и 20(R)-гинзенозид Rg3 окто-ацетата продемонстрировали очевидный эффект увеличения продолжительности жизни при раке желудка человека, раке кишечника человека и раке печени человека, во всех случаях более сильный, чем в группе положительного контроля; а группы с низкими дозами продемонстрировали эффект увеличения продолжительности жизни, аналогичный группе положительного контроля.
Реферат
Изобретение относится к применению полиацилированного производного 20(R)-гинзенозида Rg3, имеющего формулу (I), для получения противоопухолевого или противоракового лекарственного средства, в которой R=CH(CH)nCO, n=1-5. Технический результат: получены полиацилированные производные 20(R)-гинзенозида Rg3, имеющего формулу (I), которые применяют для получения противоопухолевого или противоракового лекарственного средства, в том числе для борьбы с солидной опухолью у животного, рака легких, рака груди, рака желудка, рака кишечника и рака печени у людей. 3 з.п. ф-лы, 9 табл., 4 пр.
Формула

Документы, цитированные в отчёте о поиске
Противоопухолевое средство

Комментарии