Липидный бислойный носитель для лекарственных средств и визуализирующих агентов - RU2577291C2
Код документа: RU2577291C2
Чертежи







Описание
Область техники, к которой относится изобретение
Изобретение относится к носителям, включающим липидную бислойную оболочку, заключающую в себе полость, в особенности к липосомам, и к их применению для высвобождения лекарственных средств или в качестве визуализирующего агента. В частности, изобретение относится к носителям, таким как липосомы, которые подходят для высвобождения содержащихся в них веществ в ответ на температуру, и к направленной доставке лекарственных средств и/или визуализирующих агентов с помощью носителей с зависимым от температуры высвобождением.
Известный уровень техники
Многие заболевания, которые локализованы главным образом в определенной ткани, лечат с помощью вводимых системно лекарственных средств. Хорошо известным примером является стандартное лечение рака с помощью системной химиотерапии, сопровождающейся существенными побочными эффектами для больного, обусловленными нежелательным биораспределением и токсичностью. Терапевтическое окно для этих лекарственных средств обычно определяется, с одной стороны, минимальной требуемой терапевтической концентрацией в пораженной ткани и, с другой стороны, токсическими эффектами в органах-немишенях, например, в печени, селезенке.
Локализованное лечение, например, с помощью местного высвобождения цитостатиков из наноносителей, дает надежду на более эффективное лечение и более широкое терапевтическое окно по сравнению со стандартной терапией. Местная доставка лекарственных средств важна также, если другие терапевтические возможности, такие как хирургическое вмешательство, являются слишком рискованными, как это часто бывает в случае злокачественных заболеваний печени. Местная доставка лекарственных средств может также стать предпочтительным вариантом лечения по многим показаниям при сердечно-сосудистом заболевании (CVD), таком как атеросклероз коронарных артерий.
Технология медицинской визуализации, такая как визуализация с помощью магнитного резонанса (MRI) или ультразвуковая визуализация, может быть использована не только для планирования лечения, но также для контроля местной доставки лекарственного средства, руководствуясь визуализацией. Фокусированный ультразвуковой метод представляет собой метод выбора для индукции местной доставки лекарственных средств, так как он дает ряд преимуществ. Этот способ является неинвазивным, может быть сделана фокусировка на пораженной ткани, и при его использовании наблюдаются только очень ограниченные неблагоприятные воздействия на окружающую ткань. С помощью ультразвука может быть предоставлено два типа запуска доставки лекарственных средств. Во-первых, ткань может быть нагрета контролируемым образом с точностью приблизительно в половину градуса по Цельсию в диапазоне температур от температуры тела до 100°С. Во-вторых, ультразвуковые волны создают сильные осцилляции давления, что дает стимул для доставки лекарственных средств на основе механических сил.
Специалист в данной области техники сталкивается с несколькими проблемами при предоставлении систем носителей для высвобождения веществ, таких как лекарственные средства или визуализирующие компоненты. Так, например, систему носителей необходимо создать так, чтобы она могла быть нагружена существенным количеством указанных веществ. В частности, если вещества для высвобождения включают лекарственные средства, система носителей должна быть чувствительна к внешнему стимулу, такому как (местные) изменения температуры или давления, которые позволяют быстро и локально высвободить лекарственное средство. Более того, процесс доставки лекарственного средства нуждается во всестороннем контроле, т.е. высвобождение лекарственного средства в месте лечения должно быть измеряемым in vivo, количество и скорость высвобождения лекарственного средства должны служить в качестве входного параметра для определения приложения последующего стимула, следовательно, доставка лекарственного средства может контролироваться системой обратной связи, руководствуясь визуализацией.
Существенное улучшение эффективности лечения лекарственными средствами в составе липосом может быть получено с помощью запуска высвобождения лекарственных средств посредством внешнего стимула. Одним подходом к запуску высвобождения инкапсулированных молекул является использование чувствительных к температуре липосом. В этом случае высвобождение лекарственного средства происходит при температуре выше температуры фазового перехода плавления (Tm) мембраны липосомы. При Tm происходят структурные изменения в липидной мембране, так как она переходит из гелеобразного состояния в фазу жидкого состояния. Этот переход ведет к отчетливому повышению проницаемости мембраны для растворенных веществ и воды. Включение фосфатидилхолинов, таких как лизо-PC, ацетилированного MPPC и фактора активации тромбоцитов (PAF) в бислой липосом оказывает выраженный эффект на свойства липосом. В 1988 г. Bratton et al. показали, что эти липиды могут быть использованы для снижения Tm липосом на основе дипальмитоилфосфатидилхолина (DPPC). Needham et al. создали липосомы, чувствительные к низкой температуре (LTSL), состоящие из лизо-PC/DPPC/DPPE-PEG2000, которые высвобождают инкапсулированный доксорубицин (ThermoDox®) в течение приблизительно секунд в ответ на мягкие гипертермические условия (39-42°C). DPPC представляет собой дипальмитоилфосфатидилхолин, PEG2000 представляет собой пропиленгликоль со средней молекулярной массой приблизительно 2000 дальтон. Быстрое высвобождение растворенных в воде веществ из внутренней части этих чувствительных к температуре систем при температурах, близких к Tm, было приписано образованию временных пор. Эти поры являются термодинамически стабильными в присутствии формирующих мицеллы фосфолипидов, таких как лизо-PC и пэгилированные фосфолипиды. Более того, образование временных пор приписывают аккумуляции лизолипидов в результате латеральной диффузии в пределах липидного бислоя. Доклинические эксперименты с LTSL на основе лизо-PC, нагруженными доксорубицином, в сочетании с применением внешнего местного повышения температуры четко продемонстрировали улучшенную эффективность доставки лекарственного средства, индуцируемую температурой. Вместо надежды на аккумуляцию липосом в опухоли, гипертермию применяли в течение первого часа после введения чувствительного к температуре липосомного состава доксорубицина. Это цитостатическое лекарственное средство быстро высвобождалось в микроциркуляторную сеть опухоли и затем захватывалось опухолевыми клетками. Хотя LTSL на основе лизо-PC, нагруженные доксорубицином, успешно применялись для доставки лекарственного средства в сочетании с игольной RF абляцией, стабильность липосомного состава в плазме при 37°С была субоптимальной, демонстрируя до 40% высвобождения доксорубицина в 1 час.
В патенте EP 331504 раскрываются чувствительные к температуре липосомы, приготовленные из фосфолипидов, несущих две алифатические группы, которые могут быть небольшими в отношении длины алифатического хвоста, например, одна имеет по меньшей мере 8 углеродных атомов, а другая имеет по меньшей мере 10 углеродных атомов. Предпочтительно обе алифатические группы имеют 12-18 углеродных атомов. Эта ссылка отражает раннюю попытку, сделанную более двадцати лет назад, и в ней не дано доказательств предоставления чувствительных к температуре липосом, которые соответствуют текущим требованиям применения в современных системах визуализации и лечения. Эти требования относятся к предоставлению улучшенных температурных переходов per se, а также, например, к предоставлению лучшего увеличения контрастности при доставке лекарственного средства под контролем MRI, и к свойствам, таким как улучшенные коэффициенты обмена воды через липидную оболочку. Последнее является важным для MR визуализации, когда желательно иметь сильное увеличение контрастности между интактным носителем и высвобождаемым MR контрастирующим агентом. Это увеличение контрастности является высоким в случае относительно низкой скорости трансмембранного обмена воды.
Таким образом, требуется, чтобы системы носителей для локализованной доставки лекарственных средств могли быть оптимизированы с точки зрения применения доставки лекарственного средства под контролем MRI. В частности, желательно предоставить носители, которые способны достичь лучшего увеличения контрастности при этих вариантах применения.
Краткое описание сущности изобретения
Для лучшей адресации указанных выше пожеланий, в одном аспекте, в изобретении представлен чувствительный к температуре носитель, включающий липидную бислойную оболочку, где липидный бислой включает фосфолипид, имеющий две концевые алкильные цепи, причем одна представляет собой короткую цепь, имеющую длину цепи самое большее семь углеродных атомов, другая является длинной цепью, имеющей длину цепи по меньшей мере пятнадцать углеродных атомов.
В другом аспекте в изобретении предлагается применение фосфолипида, имеющего две концевые алкильные цепи, причем одна представляет собой короткую цепь, имеющую длину цепи самое большее семь углеродных атомов, другая является длинной цепью, имеющей длину цепи по меньшей мере пятнадцать углеродных атомов, в качестве компонента термочувствительных носителей, в частности липосом.
В еще одном аспекте изобретение обеспечивает систему, включающую лекарственное вещество и чувствительный к температуре носитель для указанного лекарственного вещества, где носитель включает липидный бислой, который включает лекарственное вещество, где указанный липидный бислой включает фосфолипид, имеющий две концевые алкильные цепи, причем одна представляет собой короткую цепь, имеющую длину цепи самое большее семь углеродных атомов, другая является длинной цепью, имеющей длину цепи по меньшей мере пятнадцать углеродных атомов.
В дополнительном аспекте изобретению принадлежит система, включающая вещество для MRI, и носитель, включающий полупроницаемый липидный бислой, который заключает в себе полость, включающую воду, где указанный липидный бислой включает фосфолипид, имеющий две концевые алкильные цепи, причем одна представляет собой короткую цепь, имеющую длину цепи самое большее семь углеродных атомов, другая является длинной цепью, имеющей длину цепи по меньшей мере пятнадцать углеродных атомов.
В еще одном аспекте изобретение относится к любому из указанных выше носителей, предназначенных для высвобождения содержащихся в них веществ in vivo, для способов лечения и визуализации, соответственно, включающих введение любого из указанных выше носителей животному, предпочтительно человеку, и индукции высвобождения содержащегося в нем вещества in vivo.
Подробное описание изобретения
Должно быть понятно, что изобретение не ограничивается вариантами осуществления и формулировками, описанными в настоящем документе выше. Также должно быть понятно, что в формуле изобретения слово «включающий» не исключает другие элементы или стадии.
Настоящее изобретение относится к носителям, включающим липидную бислойную оболочку. В частности, такие оболочки включают в себя полость и являются полупроницаемыми, обычно включающими фосфолипиды. Носители включают микроносители, имеющие размер частиц с диаметром порядка от нескольких до десятков микрон, и наноносители, имеющие размер частиц с диаметром порядка от десятков до сотен нанометров. В контексте изобретения носители в дальнейшем обозначаются как липосомы.
Липосомы обычно представляют собой сферические везикулы, включающие бислойную мембрану, включающую в себя полость (просвет). Бислой может быть создан из по меньшей мере одного фосфолипида и может включать или не включать холестерин. Липосомы могут быть составлены из природных фосфолипидов со смешанными липидными цепями (как у фосфатидилэтаноламина яйца) или из чистых компонентов поверхностно-активных веществ как у диолеоилфосфатидилэтаноламина (DOPE). Термин липосомы при использовании в описании настоящего изобретения включает липидные сферы, обычно называемые мицеллами.
Типичный пример полупроницаемой оболочки встречается также в полупроницаемых мембранах, включающих фосфолипидный бислой. Фосфолипидный бислой является наиболее проницаемым для маленьких, незаряженных растворенных веществ. Липосомы могут быть созданы на основе фосфолипидного бислоя. В широком смысле изобретение основано на выборе смешанных короткоцепочечных/длинноцепочечных фосфолипидов в качестве компонента липидного бислоя липосом. Под короткими в настоящем описании подразумеваются имеющие самое большее семь углеродных атомов и под длинными в настоящем описании подразумеваются имеющие длину цепи по меньшей мере пятнадцать углеродных атомов. Таким образом, предоставляются две концевые алкильные цепи регулируемой длины, и в результате обнаружения того, что одна из этих цепей должна быть короткой, а другая должна быть длинной, авторы изобретения считают (не желая быть связанными теорией), что тем самым достигается ряд неожиданных благоприятных эффектов.
Таким образом, смешанные короткоцепочечные/длинноцепочечные фосфолипиды позволяют настраивать свойства оболочки носителя, которые относятся к высвобождению лекарственного средства. В результате этого носители по изобретению вносят вклад в достижение быстрого высвобождения лекарственного средства при предварительно определенной температуре. В изобретении предлагается также возможность настройки коэффициента обмена воды через оболочку носителя, что может быть использовано для доведения до максимума усиления контрастности MR в интервале между температурой тела и гипертермией. Последнее важно для области доставки лекарственных средств под контролем MR визуализации посредством высвобождения лекарственных средств в результате ответа на температуру.
Смешанные короткоцепочечные/длинноцепочечные фосфолипиды
В широком смысле изобретение применимо к любым фосфолипидам, которые могут быть включены в липидный бислой липосомы. Главное требование заключается в том, что присутствуют короткая и длинная алкильные цепи. Возможно, чтобы длинная алкильная цепь включала двойную связь, но предпочтительны насыщенные цепи. В соответствии с изобретением длины этих цепей могут варьироваться для настройки свойств липидного бислоя.
Должно быть понятно, что термины «короткая» и «длинная» в их наиболее широком смысле являются относительными. Т.е., если короткая цепь имеет два углеродных атома, цепь, имеющая больше шести углеродных атомов, может рассматриваться как длинная. С другой стороны, если длинная цепь имеет пятнадцать углеродных атомов, цепь, имеющая десять углеродных атомов, может рассматриваться как короткая. В целом различие в длине между короткой цепью и длинной цепью должно составлять по меньшей мере десять углеродных атомов, предпочтительно между одиннадцатью и шестнадцатью углеродными атомами.
Короткая цепь предпочтительно имеет в длину самое большее пять углеродных атомов. В более предпочтительных вариантах осуществления короткая цепь имеет в длину два, три или четыре углеродных атома. Длинная цепь предпочтительно имеет длину цепи по меньшей мере пятнадцать углеродных атомов. Верхний предел длины длинной цепи предпочтительно составляет тридцать углеродных атомов, более предпочтительно двадцать углеродных атомов. В предпочтительных вариантах осуществления длинная цепь имеет пятнадцать, шестнадцать, семнадцать или восемнадцать углеродных атомов.
Фосфолипиды известны и обычно относятся к фосфатидилхолину, фосфатидилэтаноламину, фосфатидилсерину и фосфатидилинозитолу. В изобретении предпочтительно применять фосфатидилхолин.
В дополнительном предпочтительном варианте осуществления смешанные короткоцепочечные/длинноцепочечные фосфолипиды удовлетворяют следующим формулам, либо (I), либо (II):
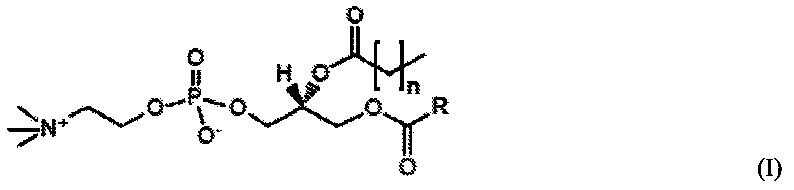
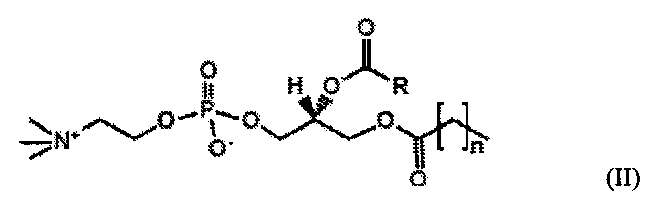
В формулах R представляет собой алкильную цепь из от пятнадцати до тридцати углеродных атомов и предпочтительно представляет собой C15H31 или C17H35; n является целым числом от 1 до 6, предпочтительно от 1 до 4 и более предпочтительно 2-3.
Эти соединения могут быть синтезированы путем этерификации лизо-РС соответствующими ангидридами. Пример схемы реакций приведен на схеме 1 ниже:
Схема 1

На схеме DMAP обозначает 4-диметиламинопиридин, и DCM обозначает дихлорметан. Указание на 1n,R относится к соединению формулы (I) выше.
В другом аспекте изобретение относится к применению любого из смешанных короткоцепочечных/длинноцепочечных фосфолипидов, как описано выше, в качестве компонента липосом, чувствительных к температуре, особенно с целью настройки высвобождающих свойств липосом.
Чувствительные к температуре носители
Изобретение относится к носителям, которые являются чувствительными к температуре. Это означает, что физическое или химическое состояние носителя зависит от его температуры.
Может быть использован любой чувствительный к температуре носитель, который может вмещать интересующую молекулу и который является интактным при температуре тела (т.е. при 37°С), но разрушается при любой другой температуре, отличающейся от температуры тела, и который может переноситься индивидуумом. Носители по изобретению включают, но не ограничиваются этим, чувствительные к температуре микро- и наночастицы, чувствительные к температуре липосомы, чувствительные к температуре нановезикулы и чувствительные к температуре наносферы.
Специалисту в данной области техники должно быть ясно, что термочувствительная природа носителя должна быть понятна из контекста его введения in vivo, предпочтительно людям. Т.е. температуры, при которых в носителе должны наступать структурные изменения так, чтобы высвобождалось его содержимое (например, путем открытия липидного бислоя чувствительной к температуре липосомы), находятся обычно в пределах уровня, который может переноситься индивидуумом, т.е. как правило, ниже 50°С, и предпочтительно на 1-5°С выше температуры тела.
Чувствительные к температуре носители для применения по изобретению идеально сохраняют свою структуру при приблизительно 37°С, но разрушаются при более высокой температуре, предпочтительно только слегка повышенной относительно температуры тела человека, и также предпочтительно выше повышенной температуры тела. Обычно температура около 42°С (умеренная гипертермия) является крайне пригодной для индуцируемой температуры (местной) доставки лекарственного средства. Может быть применено нагревание любым физиологически приемлемым путем, предпочтительно путем использования фокусируемого источника энергии, способного индуцировать строго локализованную гипертермию. Снабжение энергией может быть осуществлено, например, через микроволны, ультразвук, магнитную индукцию, инфракрасную энергию или энергию света.
Чувствительные к температуре нановезикулы обычно имеют диаметр до 100 нм. В контексте настоящего изобретения везикулы более крупные, чем 100 нм, обычно до 5000 нм, рассматриваются как микровезикулы. Слово везикула описывает любой тип микро- или нановезикулы. Везикулы, такие как липосомные везикулы, обычно включают полость, которая может содержать любое интересующее вещество. В настоящем изобретении это предпочтительно, как подчеркивалось выше.
Чувствительные к температуре липосомы включают, но не ограничиваются этим, любую липосому, включая липосомы, имеющие пролонгированный период полужизни, например, пэгилированные липосомы.
Чувствительные к температуре липосомы известны в данной области техники. Липосомы по настоящему изобретению могут быть получены любым из разнообразных методов, которые известны в данной области техники. См., например, патент США № 4235871; опубликованные патентные заявки PCT WO 96/14057; New RRC, Liposomes: A practical approach, IRL Press, Oxford (1990), pages 33-104; Lasic, D.D., Liposomes from physics to applications, Elsevier Science Publishers, Amsterdam, 1993; Liposomes, Marcel Dekker, Inc., New York (1983).
Захват лекарственного средства или другого вещества внутрь липосом по настоящему изобретению также может быть осуществлен с использованием традиционного метода в данной области техники. При получении композиций липосом по настоящему изобретению стабилизаторы, такие как антиоксиданты, и другие добавки могут быть использованы до тех пор, пока они существенно не мешают цели изобретения.
Оболочка должна обычно быть полупроницаемой. Термин «полупроницаемый» вполне ясен в данной области техники. В целом он относится к свойству мембраны, такой как оболочка, быть избирательно проницаемой, иногда также обозначаемому как частично проницаемая или дифференциально проницаемая мембрана. В этом смысле оболочка указывает на структуру, которая по существу закрыта, в том смысле, что она является не полностью открытой стенкой и предпочтительно главным образом закрытой стенкой (в этом случае оболочка заключает в себе полость), которая позволяет определенным молекулам или ионам проходить через нее путем диффузии.
В настоящем описании полупроницаемость оболочки обычно относится к ее способности позволять анализируемому при MR веществу проходить через нее путем диффузии. Следовательно, если сочетание анализируемых веществ (таких как вода или другие малые молекулы, включающие протоны) и оболочки (такой как липидный бислой) таково, что анализируемое вещество способно проходить через оболочку путем диффузии, оболочка рассматривается как полупроницаемая.
Ссылки на чувствительные к температуре носители, обладающие полупроницаемой оболочкой, есть, например, в патентах США US 6726925, US 2006/0057192, US 2007/0077230A1 и патенте JP 2006-306794.
В другом аспекте изобретению принадлежит система доставки лекарственного средства, включающая носитель по любому из вариантов осуществления, как описано выше, и по меньшей мере одно лекарственное вещество.
В дополнительном аспекте изобретению принадлежит система визуализации, включающая носитель по любому из вариантов осуществления, как описано выше, и по меньшей мере одно вещество, усиливающее контрастность MRI.
В еще одном аспекте изобретение относится к системе, включающей носитель по любому из вариантов осуществления, как описано выше, лекарственное вещество и вещество, усиливающее контрастность MRI.
В еще одном аспекте в изобретении представлена комбинированная система для доставки лекарственного средства с визуализацией, включающая носитель по любому из вариантов осуществления, как описано выше, по меньшей мере одно лекарственное вещество и по меньшей мере одно вещество, усиливающее контрастность MRI.
В другом аспекте изобретение относится к любому из указанных выше носителей для применения с целью высвобождения содержащегося в нем вещества in vivo, для способов лечения и визуализации, соответственно, включающих введение любого из указанных выше носителей животному, предпочтительно человеку, и индукции высвобождения содержащегося в нем вещества in vivo.
В еще одном аспекте в изобретении предлагается способ доставки лекарственного средства индивидууму под контролем MRI, включающий введение указанному индивидууму носителя по любому из вариантов осуществления, описанных выше, предлагаемого с лекарственным средством и с веществом, усиливающим контрастность MRI, позволяющий носителю высвобождать лекарственное средство и вещество, усиливающее контрастность MRI, и осуществляющий визуализацию MR изображения с использованием контраста, предоставляемого веществом, усиливающим контрастность.
Носители лекарственных средств
В одном аспекте изобретение относится к носителю, подходящему для локализованной доставки биологически активного агента, такого как лекарственное средство. В настоящем описании далее термин «биологически активный агент» должен рассматриваться вкратце как «лекарственное средство» и носитель как «носитель лекарственного средства». Носитель лекарственного средства в контексте настоящего изобретения относится к любому материалу, в котором может содержаться или на котором может находиться биологически активный агент, так чтобы обладать способностью высвобождаться в организм индивидуума.
Носитель лекарственного средства подлежит введению в организм индивидуума, подвергаемого MRI. Это может происходить, например, с помощью введения в системный кровоток или с помощью других методов введения носителя в жидкости организма.
Лекарственное средство представляет собой химическое вещество, используемое для терапии, лечения, профилактики или диагностики заболевания или нарушения, или используемое для улучшения состояния физического или психического здоровья другим способом. Контролируемая доставка, прогнозируемая настоящим изобретением, должна быть главным образом пригодна для терапевтических агентов (т.е. лекарственных средств в строгом смысле, предназначенных для терапии или профилактики заболеваний или нарушений), но также и для агентов, которые вводят в диагностических целях. Хотя другие биологически активные агенты, т.е. такие агенты, которые не являются терапевтическими или диагностическими, такие как ингредиенты нутрицевтиков, не должны обычно подвергаться контролируемой и/или отслеживаемой доставке, это может быть сделано, если это желательно, с использованием настоящего изобретения.
Наиболее оптимальное применение изобретения достигается в случае терапевтических агентов с направленной доставкой, так как такая доставка должна быть наиболее выгодной по природе, благодаря мониторингу, ставшему доступным с помощью изобретения. Это свойственно, например, агентам для лечения опухолей, которые необходимо доставить к их местонахождению, агентам для лечения или профилактики сердечно-сосудистых нарушений, таких как атеросклероз коронарных артерий, или антитромботическим агентам (например, местно растворяющим сгустки крови), или агентам, для которых требуется прохождение через гематоэнцефалический барьер, таких как нейромодуляторы, что может быть использовано для лечения заболеваний нервной системы, таких как эпилепсия, болезнь Альцгеймера, болезнь Паркинсона или удар. Преимущества контролирования и мониторинга направленной доставки лекарственных средств используются также для направленной доставки диагностических агентов. Сходно с направленной доставкой терапевтических агентов, и в данном случае рак также является областью, в которой может быть важна сайт-специфичная доставка.
Биологически активные агенты, пригодные для использования в настоящем изобретении, включают биологически активные агенты, включающие терапевтические лекарственные средства, эндогенные молекулы и фармакологически активные агенты, включая антитела; пищевые вещества; косметические агенты; диагностические агенты; и дополнительные контрастирующие агенты для визуализации. При применении в настоящем описании активный агент включает фармацевтически приемлемые соли активных агентов.
Носители лекарственных средств по настоящему изобретению могут включать либо гидрофильные, либо гидрофобные биологически активные агенты. Гидрофильный биологически активный агент может быть инкапсулирован в водный компартмент носителя, в то время как гидрофобные биологически активные агенты могут быть включены в гидрофобные домены носителя, например, в липидный бислой липосом. Нуклеиновые кислоты, углеводы и, в целом, белки и пептиды являются растворимыми в воде или гидрофильными. Например, предусматриваются также биологически активные агенты, которые представляют собой небольшие молекулы, липиды, липополисахариды, полинуклеотиды и антисмысловые нуклеотиды (агенты для генной терапии). Такие биологически активные агенты, которые могут быть включены, таким образом, включают непептидные и небелковые лекарственные средства. В пределах объема настоящего изобретения можно включать лекарственные средства полимерной природы, но также можно включать лекарственные средства относительно небольшой молекулярной массы, менее 1500 г/моль или даже менее 500 г/моль.
Соответственно, соединения, предусмотренные для использования в качестве биологически активных агентов в контексте настоящего изобретения, включают любое соединение с терапевтическими или профилактическими эффектами. Это может быть соединение, которое влияет на тканевой рост, рост клеток, дифференцировку клеток или участвует в этих процессах, соединение, которое способно вызывать биологическое действие, такое как иммунный ответ, или соединение, которое может играть любую другую роль в одном или более биологическом процессе. Неограничивающее перечисление примеров включает противомикробные агенты (включая антибактериальные, противовирусные агенты и противогрибковые агенты), противовирусные агенты, противоопухолевые агенты, ингибиторы тромбина, противотромботические агенты, тромболитические агенты, фибринолитические агенты, ингибиторы вазоспазма, блокаторы кальциевых каналов, вазодилятаторы, антигипертензивные агенты, противомикробные агенты, антибиотики, ингибиторы гликопротеидных рецепторов клеточной поверхности, антитромбоцитарные агенты, антимитотические агенты, ингибиторы микротрубочек, антисекреторные агенты, ингибиторы актина, ингибиторы ремоделирования, антиметаболиты, антипролиферативные агенты (включая антиангиогенные агенты), противораковые химиотерапевтические агенты, противовоспалительные агенты стероидной или нестероидной природы, иммуносупрессорные агенты, антагонисты гормона роста, факторы роста, агонисты дофамина, радиотерапевтические агенты, компоненты внеклеточного матрикса, ингибиторы ACE, ловушки для свободных радикалов, хелаторы, антиоксиданты, антиполимеразы и агенты для фотодинамической терапии.
Относительно небольшие пептиды могут быть обозначены по количеству аминокислот (например, ди-, три-, тетрапептиды). Пептид с относительно небольшим количеством амидных связей может также называться олигопептидом (до 50 аминокислот), в то время как пептид с относительно большим количеством (более 50 аминокислот) может называться полипептидом или белком. Кроме того, что они являются полимерами аминокислотных остатков, определенные белки могут дополнительно быть охарактеризованы по так называемой четвертичной структуре, конгломерату ряда полипептидов, которые необязательно соединены химически амидными связями, но соединены с помощью сил, обычно известных специалисту в данной области техники, таких как электростатические силы и силы Ван дер Ваальса. Термины пептиды, белки или их смеси при применении в настоящем описании предназначены для включения всех указанных выше возможностей.
Другие примеры пептидов или белков или объектов, включающих пептиды или белки, которые могут преимущественно включаться в носитель, включают, но не ограничиваются этим, иммуногенные пептиды или иммуногенные белки, которые включают, но не ограничиваются этим, следующее:
Токсины, такие как дифтерийный токсин и токсин столбняка.
Антигены поверхности вирусов или частей вирусов, таких как аденовирусы, вирус Эпштейна-Барра, вирус гепатита A, вирус гепатита B, вирусы герпеса, ВИЧ-1, ВИЧ-2, HTLV-III, вирусы гриппа, вирус японского энцефалита, вирус кори, вирусы папилломы, парамиксовирусы, полиовирус, вирус бешенства, вирус краснухи, вирусы коровьей оспы (натуральной оспы) и вирус желтой лихорадки. Антигены поверхности бактерий или частей бактерий, таких как Bordetella pertussis, Helicobacter pylori, Clostridium tetani, Corynebacterium diphtheria, Escherichia coli, Haemophilus influenza, Klebsiella species, Legionella pneumophila, Mycobacterium bovis, Mycobacterium leprae, Mycrobacterium tuberculosis, Neisseria gonorrhoeae, Neisseria meningitidis, Proteus species, Pseudomonas aeruginosa, Salmonella species, Shigella species, Staphylococcus aureus, Streptococcus pyogenes, Vibrio cholera и Yersinia pestis. Антигены поверхности паразитов, вызывающие заболевания, или частей паразитов, таких как Plasmodium vivax (малярия), Plasmodium falciparum (малярия), Plasmodium ovale (малярия), Plasmodium malariae (малярия), Leishmania tropica (лейшманиоз), Leishmania donovani (лейшманиоз), Leishmania branziliensis (лейшманиоз), Trypanosoma rhodescense (сонная болезнь), Trypanosoma gambiense (сонная болезнь), Trypanosoma cruzi (болезнь Шагаса), Schistosoma mansoni (шистосомоз), Schistosomoma haematobium (шистосомоз), Schistosoma japonicum (шистосомоз), Trichinella spiralis (трихинеллез), Stronglyloides duodenale (анкилостомоз), Ancyclostoma duodenale (анкилостомоз), Necator americanus (анкилостомоз), Wucheria bancrofti (филяриоз), Brugia malaya (филяриоз), Loa loa (филяриоз), Dipetalonema perstaris (филяриоз), Dracuncula medinensis (филяриоз) и Onchocerca volvulus (филяриоз).
Иммуноглобулины, такие как IgG, IgA, IgM, иммуноглобулин против бешенства и иммуноглобулин против коровьей оспы.
Антитоксины, такие как антитоксин против ботулизма, антитоксин против дифтерии, антитоксин против газовой гангрены, антитоксин против столбняка.
Антигены, которые вызывают иммунный ответ против заболеваний ног и ротовой полости.
Гормоны и факторы роста, такие как фолликулостимулирующий гормон, пролактин, ангиогенин, эпидермальный фактор роста, кальцитонин, эритропоэтин, тиреотропин-рилизинг гормон, инсулин, гормоны роста, инсулиноподобные факторы роста 1 и 2, фактор роста скелета, хорионический гонадотропин человека, лютеинизирующий гормон, фактор роста нервов, адренокортикотропный гормон (АКТГ), рилизинг-гормон лютеинизирующего гормона (LHRH), паратиреоидный гормон (ПТГ), тиреотропин-рилизинг гормон (TRH), вазопрессин, холецистокинин и кортикотропин-рилизинг гормон; цитокины, такие как интерфероны, интерлейкины, колониестимулирующие факторы и факторы некроза опухолей; фибринолитические ферменты, такие как урокиназа, активатор почечного плазминогена; и факторы свертывания, такие как протеин C, фактор VIII, фактор IX, фактор VII и антитромбин III.
Примерами других белков или пептидов являются альбумин, предсердный нарийуретический фактор, ренин, супероксиддисмутаза, альфа-1-антитрипсин, белки сурфактанта легких, бацитрацин, бестатин, цидоспорин, дельта-пептид сна (DSIP), эндорфины, глюкагон, грамицидин, меланоцитингибирующие факторы, нейротензин, окситоцин, сомостатин, терпротид, сывороточный фактор тимуса, тимозин, DDAVP, дерморфин, мет-энкефалин, пептидогликан, сатиетин, тимопентин, продукт разрушения фибрина, дез-энкефалин-альфа-эндорфин, гонадотропин-рилизинг гормон, лейпролид, альфа-МСГ и меткефамид.
Противоопухолевые агенты, такие как алтретамин, фторурацил, амсакрин, гидроксикарбамид, аспарагиназа, ифосфамид, блеомицин, ломустин, бусульфан, мелфалан, хлорамбуцил, меркаптопурин, хлорметин, метотрексат, цисплатин, митомицин, циклофосфамид, прокарбазин, цитарабин, тенипозид, дакарбазин, тиотепа, дактиномицин, тиогуанин, даунорубицин, треосульфан, доксорубицин, тиофосфамид, эстрамуцин, винбластин, этоглуцид, винкристин, этопозид, виндезин и паклитаксел.
Противомикробные агенты, включающие:
Антибиотики, такие как ампициллин, нафциллин, амоксициллин, оксациллин, азлоциллин, пенициллин G, карбенициллин, пенициллин V, диклоксациллин, фенетициллин, флоксациллин, пиперациллин, мециллинам, сулбенициллин, метициллин, тикарциллин, мезлоциллин, цефалоспорины: цефаклор, цефалотин, цефадроксил, цефапирин, цефамандол, цефрадин, цефатризин, цефсулодин, цефазолин, цефтазидим, цефоранид, цефтриаксон, цефокситин, цефуроксим, цефацетрил, латамоксеф и цефалексин. Аминогликозиды, такие как амикацин, неомицин, дибекацин, канамицин, гентамицин, нетилмицин, тобрамицин. Макролиды, такие как амфотерицин B, новобиоцин, бацитрацин, нистатин, клиндамицин, полимиксины, колистин, ровамицин, эритромицин, спектиномицин, линкомицин, ванкомицин. Тетрациклины, такие как хлортетрациклин, окситетрациклин, демеклоциклин, ролитетрациклин, доксициклин, тетрациклин и миноциклин. Другие антибиотики, такие как хлорамфеникол, рифамицин, рифампицин и тиамфеникол.
Химиотерапевтические агенты, такие как сульфонамиды, сульфадиазин, сульфаметизол, сульфадиметоксин, сульфаметоксазол, сульфадимидин, сульфаметоксипиридазин, сульфафуразол, сульфафеназол, сульфален, сульфизомидин, сульфамеразин, сульфизоксазол и триметоприм с сульфаметоксазолом или сульфаметролом.
Антисептики мочевых путей, такие как метанамин, хинолоны (норфлоксацин, циноксацин), налидиксовая кислота, нитросоединения (нитрофурантоин, нифуртоинол) и оксолиновая кислота.
Лекарственное средство для анаэробных инфекций, такое как метронидазол.
Лекарственные средства для лечения туберкулеза, такие как аминосалициловая кислота, изониазид, циклосерин, рифампицин, этамбутол, тиокарлид, этионамид и виомицин.
Лекарственные средства для лечения проказы, такие как амитиозон, рифампицин, клофазимин, сульфоксон натрия и диаминодифенилсульфон (DDS, дапсон).
Противогрибковые агенты, такие как амфотерицин B, кетоконазол, клотримазол, миконазол, эконазол, натамицин, флуцитозин, нистатин и гризеофулвин.
Противовирусные агенты, такие как ацикловир, идоксуридин, амантидин, метизазон, цитарабин, видарабин и ганцикловир.
Химиотерапевтические агенты против амебиаза, такие как хлорохин, йодхинол, клиохинол, метронидазол, дегидроэметин, паромомицин, дилоксанид, фуроатетинидазол и эметин.
Противомалярийные агенты, такие как хлорохин, пириметамин, гидроксихлорохин, хинин, мефлохин, сульфадоксин/пириметамин, пентамидин, сурамин натрия, примахин, триметоприм и прогуанил.
Противогельминтозные агенты, такие как антимонил-тартрат калия, ниридазол, антимонил-димеркаптосукцинат натрия, оксамнихин, бефений, пиперазин, дихлорофен, празиквантел, диэтилкарбамазин, пирантелпамоат, гикантон, пиривия памоат, левамизол, стибофен, мебендазол, тетрамизол, метрифонат, тиобендазол и никлозамид.
Противовоспалительные агенты, такие как ацетилсалициловая кислота, мефенамовая кислота, аклофенак, напроксен, азопропанон, нифлумовая кислота, бензидамин, оксифенбутазон, диклофенак, пироксикам, фенопрофен, пирпрофен, флурбипрофен, салицилат натрия, ибупрофенсулиндак, индометацин, тиапрофеновая кислота, кетопрофен и толметин.
Средства против подагры, такие как колхицин и аллопурин.
Анальгетики (опиоидные) центрального действия, такие как алфентанил, метадон, безитрамид, морфин, бупренорфин, никоморфин, буторфанол, пентазоцин, кодеин, петидин, декстроморамид, пиритранид, декстропропоксифен, суфентанил и фентанил.
Местные анестетики, такие как артикаин, мепивакаин, бупивакаин, прилокаин, этидокаин, прокаин, лидокаин и тетракаин.
Лекарственные средства для болезни Паркинсона, такие как амантидин, дифенгидрамин, апоморфин, этопропазин, бензтропина мезилат, лерготрил, бипериден, леводофа, бромокриптин, лизурид, карбидофа, метиксен, хлорфеноксамин, орфенадрин, цикримин, проциклидин, дексетимид и тригексифенидил.
Мышечные релаксанты центрального действия, такие как баклофен, каризопродол, хлормезанон, хлорзоксазон, циклобензаприн, дантролен, диазепам, фебарбамат, мефеноксалон, мефенезин, метоксалон, метокарбамол и толперизон.
Кортикостероиды, включающие:
Минералокортикоиды, такие как кортизол, дезоксикортикостерон и фторгидрокортизон.
Глюкокортикоиды, такие как беклометазон, бетаметазон, кортизон, дексаметазон, флуоцинолон, флуоцинонид, флуокортолон, флуорометолон, флупреднизолон, флурандренолид, галцинонид, гидрокортизон, медризон, метилпреднизолон, параметазон, преднизолон, преднизон и триамцинолон (ацетонид).
Андрогены, включающие:
Андрогенные стероиды, используемые для терапии, такие как даназол, флуоксиместерон, местеролон, метилтестостерон, тестостерон и их соли.
Анаболические стероиды, используемые для терапии, такие как калустерон, нандролон и их соли, дромостанолон, оксандролон, этилэстренол, оксиметолон, метандриол, станозолол, метандростенолон и тестолактон.
Антиандрогены, такие как ципротерона ацетат.
Эстрогены, включающие эстрогенные стероиды, используемые для терапии, такие как диэтилстильбэстрол, эстрадиол, эстриол, этинилэстрадиол, местранол и хинэстрол.
Антиэстрогены, такие как хлоротрианисен, кломифен, этамокситрифетол, нафоксидин и тамоксифен.
Прогестины, такие как аллилэстренол, дезогестрел, диметистерон, дидрогестерон, этинилэстренол, этистерон, этинадиола диацетат, этинодиол, гидроксипрогестерон, левоноргестрел, линэстренол, медроксипрогестерон, мегэстрола ацетат, норэтиндрон, норэтистерон, норэтинодрел, норгестрел и прогестерон.
Тиреоидные лекарственные средства, включающие:
Тиреоидные лекарственные средства, используемые для терапии, такие как левотиронин и лиотиронин.
Антитиреоидные лекарственные средства, используемые для терапии, такие как карбимазол, метимазол, метилтиоурацил и пропилтиоурацил.
Кроме биологически активных водорастворимых агентов могут быть включены другие водорастворимые соединения, такие как антиоксиданты, ионы, хелатирующие агенты, красители, визуализирующие соединения.
Предпочтительные терапевтические агенты относятся к области рака (например, противоопухолевые агенты) и сердечно-сосудистого заболевания.
Методы получения липофильных производных лекарственных средств, которые пригодны для составления с наночастицами или липосомами, известны в данной области техники (см., например, патент США 5534499, описывающий ковалентное присоединение терапевтических агентов к цепи жирной кислоты фосфолипида). Лекарственными средствами в настоящем изобретении могут быть также пролекарства.
Лекарственное средство может находиться внутри, снаружи или в обоих компартментах носителя, например, в полости или оболочке липосомы. Распределение лекарственного средства не зависит от распределения других агентов, включенных в носитель, таких как реагент парамагнитного химического сдвига или парамагнитный агент. Может быть использовано сочетание лекарственных средств, и любое из этих лекарственных средств может находиться внутри, снаружи или в обоих компартментах носителя лекарственного средства, например, в полости или оболочке липосомы.
Визуализирующие агенты
В другом аспекте изобретение относится к носителям, которые пригодны в качестве визуализирующих агентов, предпочтительно для MRI. Для этой цели носитель включает (в полости, оболочке или на ее поверхности) вещество, способное повышать контрастность. Такие вещества включают усилители контрастности T1 и/или T2, а также усилители контрастности CEST MRI.
Почти все современные сканеры MRI основываются на изображении скоплений молекул воды, которые находятся в очень высокой концентрации по всему организму во всех тканях. Если контраст между разными тканями недостаточен для получения клинической информации, вводят контрастирующие MRI агенты (CA), такие как низкомолекулярные комплексы гадолиния. Эти парамагнитные комплексы снижают время продольной (T1) и поперечной (T2) релаксации протонов молекул воды. В качестве T1 контрастирующего агента действует также марганец. Носитель может включать усилители контрастности для1H MRI, для19F MRI или обоих. В изобретении также может быть реализована концепция «все в одном» сочетанием19F MRI с T1, T2 и предпочтительно еще и в сочетании с контрастированием CEST в1H MRI.
CEST MRI
В предпочтительном осуществлении изобретение также относится к усилению контрастности CEST MRI. Этот метод служит для создания контрастности изображения с помощью зависимого от химического обмена переноса насыщения (CEST) от отобранных, предварительно магнитно насыщенных протонов на скопления молекул воды, выявляемые с помощью MRI.
Если используется CEST MRI, то предпочтительные носители по изобретению, т.е. чувствительные к температуре носители, имеющие полупроницаемую оболочку, окружающую полость, способствуют достижению оптимального усиления контрастности CEST. Преимущество этих носителей заключается в том, что усиление контрастности CEST может быть осуществлено на основе агента парамагнитного химического сдвига, находящегося в полости, при взаимодействии с пулом протонов или других выявляемых MRI веществ, также находящихся в полости.
Хотя изобретение в его предпочтительном варианте осуществления относится к применению усиления контрастности CEST любого типа для чувствительного к температуре высвобождения лекарственного средства, предпочтительно использование более совершенных методов CEST по мере их появления.
CEST в сочетании с реагентом парамагнитного химического сдвига (ParaCEST) представляет собой метод, при котором намагничивание пула протонов с парамагнитным сдвигом контрастирующего агента CEST избирательно насыщается путем применения облучения в частотном диапазоне радиоволн (RF). Перенос этого насыщения на скопление молекул воды путем обмена протонов ведет к снижению количества возбудимых протонов воды вокруг контрастирующего агента CEST. Это снижение интенсивности сигнала скопления воды фиксируется и может быть использовано для усиления негативного контраста в изображениях MRI.
Подход к достижению высокой эффективности CEST основывается на использовании большого количества молекул воды в растворе, содержащем реагент парамагнитного сдвига (например, Na[Tm(dotma)(H2O)]), где "H4dotma" обозначает α,α',α'',α'''-тетраметил-1,4,7,10-тетрауксусную кислоту, а dotma представляет собой соответствующую четырежды депротонированную тетраанионную форму лиганда, для получения пула протонов с химическим сдвигом, которые в результате могут быть избирательно насыщены импульсом RF. Если эту систему заключают в носитель, например, липосому, магнитное насыщение может быть перенесено на скопление молекул воды снаружи носителей, которые не имеют химического сдвига (LipoCEST). Уровень переноса намагниченности и, следовательно, степень усиления контрастности определяются скоростью диффузии воды через оболочку носителя, например, фосфолипидную мембрану, а также количеством воды внутри носителя.
Оптимальная скорость обмена воды прямо коррелирует с разницей в химическом сдвиге между пулом протонов внутри носителя и скоплением воды снаружи носителя. Парамагнитный сдвиг, который индуцируется на молекулах воды внутри липосом, состоит из двух основных компонентов: химического сдвига, возникающего в результате диполярного взаимодействия между молекулами воды и реагентом сдвига (δdip), и химического сдвига, вызываемого эффектом объемной магнитной восприимчивости (δbms). Суммарный парамагнитный сдвиг представляет собой сумму этих двух компонентов:
δ=δdip+δbms (1)
δbms равен нулю для сферических частиц, но он может быть значительным для анизотропных частиц. Несферические частицы испытывают воздействие силы в магнитном поле, что заставляет их располагаться вдоль силовых линий магнитного поля. В случае липосом эффект дополнительно возрастает, если они несут парамагнитные молекулы, связанные с фосфолипидной мембраной.
Ссылкой на CEST с использованием несферических липосом служит Terreno, E. et al. Angew. Chem. Int. Ed. 46, 966-968 (2007).
В изобретении реагент химического сдвига может быть включен любым способом внутрь или снаружи носителя. Предпочтительно, чтобы реагент сдвига в достаточной мере взаимодействовал с пулом протонов путем заключения как реагента, так и пула протонов в полость носителя.
Реагент или реагенты парамагнитного химического сдвига может быть по существу любым парамагнитным агентом, способным переносить относительно большое количество молекул воды раствора или дисперсии, в котором он находится, в пул протонов с химическим сдвигом в плане их MR резонансной частоты по сравнению с окружающими протонами скопления молекул воды. Поскольку липосомы содержат оболочку, которая в принципе обеспечивает обмен протонов с их непосредственным окружением, насыщение, вызываемое избирательным импульсом RF, должно переноситься на окружение нагруженных чувствительных к температуре носителей лекарственного средства. Таким образом, после проведения магниторезонансной визуализации непосредственное окружение термочувствительных носителей лекарственного средства должно проявлять пониженную интенсивность сигнала относительно других скоплений молекул воды и тем самым обеспечивать обнаружение непосредственного окружения контрастирующих агентов благодаря пониженной интенсивности сигнала. Реагент парамагнитного химического сдвига включает парамагнитное соединение, т.е. любое соединение, обладающее парамагнитными свойствами. Предпочтительно парамагнитное соединение включает парамагнитные ионы металла, например, ионы металла в комплексе с хелатирующими лигандами. Парамагнитные ионы металла известны специалистам в данной области техники и не требуют разъяснений в настоящем описании. Например, ранние и поздние переходные металлы, конкретно включающие хром, марганец, железо, а также лантаниды, такие как гадолиний, европий, диспрозий, голмий, эрбий, тулий, иттербий.
Реагент парамагнитного химического сдвига включает хелатирующую структуру, способную сильно связывать парамагнитный металл и обеспечивающую возможность взаимодействия металла с водой или другим подходящим источником протонов. В отношении подходящих хелатирующих структур делается ссылка на P. Caravan et al., Chem. Rev., 99, 2293-2352 (1999). Предпочтительно, вода, по меньшей мере временно, координирована с металлом парамагнитного реагента. В отношении механизмов парамагнитного сдвига делается ссылка на J. A. Peters et al., Prog. Nucl. Magn. Reson. Spectr., 28, 283-350 (1999). В одном варианте осуществления сама хелатирующая структура также включает обмениваемые протоны, например, протоны гидроксила, амина или амида. Соответственно, реагент парамагнитного химического сдвига включает ион лантанида, координированный с хелатирующей структурой, например, макроциклическими хелатами лантанида (III), берущими начало от 1,4,7,10-тетраазациклододекан-l,4,7,10-тетрауксусной кислоты (H4dota), 1,4,7,10-тетраазациклододекан-a,a',a'',a'''-тетраметил-l,4,7,10-тетрауксусной кислоты (H4dotma) и родственных соединений, обеспечивающей продольную координацию молекулы воды в парамагнитном реагенте. В отношении этого аспекта делается ссылка на Aime et al., Angew. Chem. Int. Ed., 44, 5513-5515 (2005). Ряд одинаковых, сходных или разных хелатирующих единиц может быть объединен в дендримерной или полимерной структуре с получением разветвленных или полимерных реагентов химического сдвига. Общее преимущество использования разветвленных или полимерных парамагнитных соединений заключается в возможности достижения высоких эффективных концентраций комплекса парамагнитного металла без такого же увеличения осмолярности раствора, которое имело бы место в случае использования мононуклеарных парамагнитных соединений. В этой связи в настоящем описании дается ссылка на E. Terreno, A. Barge, L. Beltrami, G. Cravotto, D. D. Castelli, F. Fedeli, B. Jebasingh, S. Aime, Chemical Communications, 2008, 600-602.
Предпочтительно реагент парамагнитного химического сдвига является водорастворимым. Подходящие реагенты химического сдвига известны специалистам в данной области техники. Для контрастирующих агентов CEST не требуются какие-либо специальные реагенты химического сдвига, пока реагент сдвига и пул протонов взаимодействуют в той мере, которая достаточна для получения пула протонов с химическим сдвигом.
Предпочтительно, чтобы реагент парамагнитного сдвига представлял собой комплекс металла, включающий ион металла и лиганд на основе многозубчатого хелатирующего лиганда. Более предпочтительно, чтобы взаимодействие реагента химического сдвига с пулом протонов происходило в форме координации. Таким образом, предпочтительно, чтобы комплекс металла содержал по меньшей мере один сайт координации металла при сохранении открытым сайта координации по меньшей мере одной молекулы воды.
Примерами подходящих водорастворимых реагентов химического сдвига служат [Ln(hpdo3a)(H2O)] (1), [Ln(dota)(H2O)]- (2), [Ln(dotma)(H2O)]- (3), [Ln(dotam)(H2O)]3+ (4) и [Ln(dtpa)(H2O)]2- (5), включая их производные и родственные соединения, при этом Ln представляет собой ион лантанида.
Предпочтительно реагент парамагнитного химического сдвига представляет собой комплекс лантанида, такой, как представленный в формулах 1-5 ниже:


где лантанид представляет собой Eu3+, Dy3+, Ho3+, Er3+, Tm3+, Yb3+, и предпочтительно Tm3+ или Dy3+. Реагент парамагнитного химического сдвига обычно включают в агент в количестве от 1 мМ до 2000 мМ, предпочтительно от 10 мМ до 1000 мМ, и более предпочтительно от 50 мМ до 200 мМ.
Упомянутые выше содержащие металл соединения могут быть растворены, эмульгированы, суспендированы или любым другим образом распределены равномерно или неравномерно в полости, т.е. во внутреннем компартменте липосомы. Альтернативно они могут быть присоединены к внешнему компартменту липосомы посредством по меньшей мере одной ковалентной или нековалентной связи или любого их сочетания. Более того, то же самое или по меньшей мере одно другое содержащее металл соединение может находиться одновременно в любом из компартментов.
Можно предусмотреть случай, когда парамагнитный агент и лекарственное средство представляют собой одно и то же, если само лекарственное средство содержит подходящий металл.
Дополнительные повышающие контрастность агенты
Контрастирующие агенты по изобретению могут включать T1, T2 или T2* снижающие агенты. В этом отношении дается ссылка на Aime et al., Journal of the American Chemical Society, 2007, 129, 2430-2431. Также может быть реализована концепция все в одном с T1, T2 или T2* и контрастирующими агентами CEST.
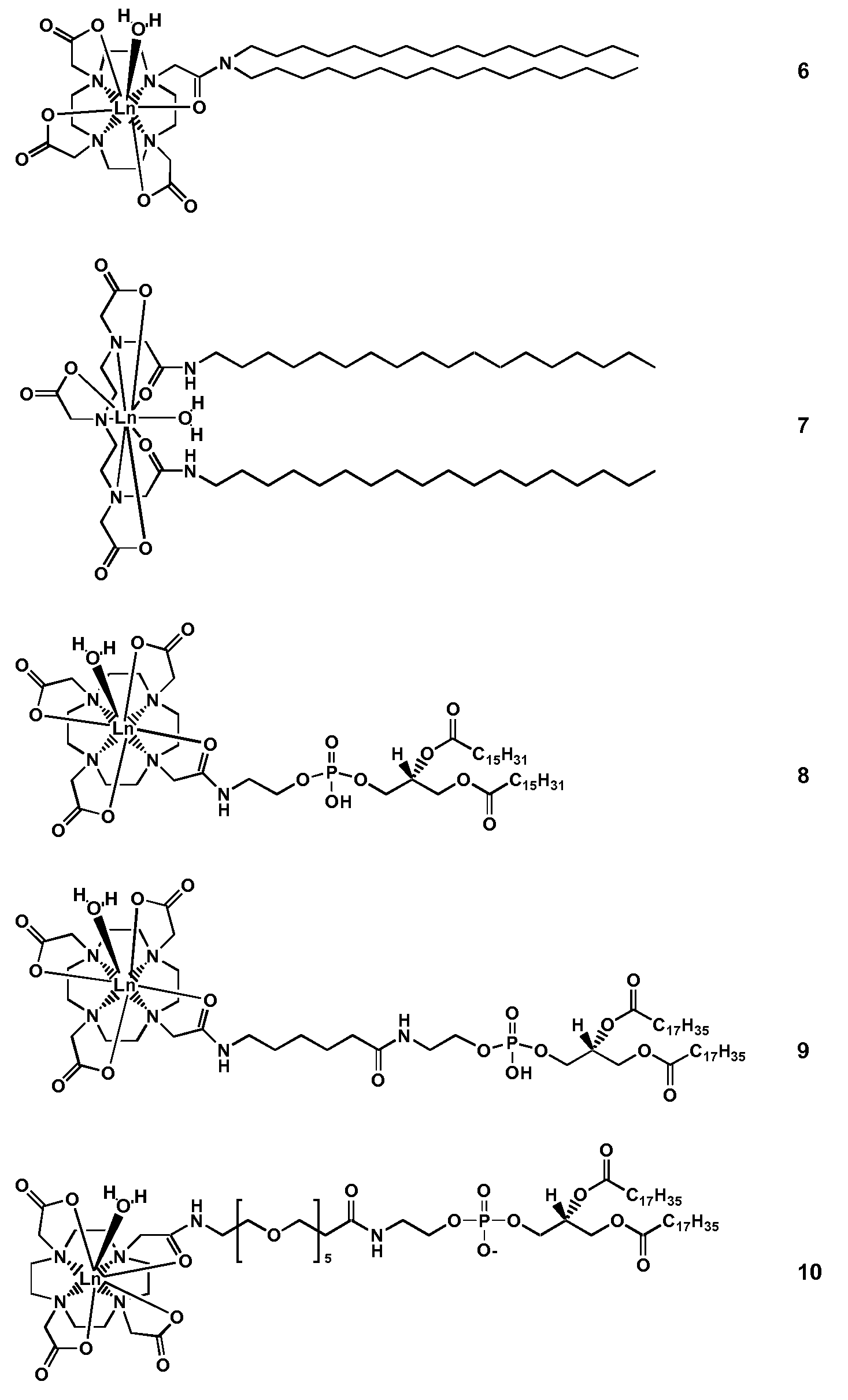
Разница в химическом сдвиге между протонами внутри чувствительных к температуре носителей лекарственного средства и протонами скопления воды может быть дополнительно увеличена введением мембраны чувствительных к температуре носителей лекарственного средства с дополнительным парамагнитным агентом, который не является необходимым для реагента химического сдвига. В результате ориентация отличного от сферы носителя в магнитном поле меняется, и отмеченный выше эффект чувствительности скопления увеличивается. Дополнительный парамагнитный агент предпочтительно представляет собой амфифильное соединение, включающее комплекс лантанида (на более поляризованной стороне амфифильного соединения) и содержащее неполярный хвост, который обладает склонностью к предпочтительному включению в липидный бислой и встраиванию в него на поверхности чувствительного к температуре носителя лекарственного средства на основе гидрофобных взаимодействий молекул.
Эти амфифильные парамагнитные комплексы могут представлять собой:

Комбинированное усиление контрастности19F и1H MR
По изобретению подходящее сочетание19F и1H MR может быть реализовано разными путями.
Так, может быть получен MR контраст с двойной или множественной меткой путем использования механизма CEST и/или19F MR. Альтернативно, множественные контрасты могут быть получены посредством модификации времени продольной релаксации (T1) или времени поперечной релаксации (T2) визуализируемого соединения (обычно протонов воды) с помощью содержащего металл соединения, находящегося в носителе. Любые из этих усиливающих контрастность механизмов могут быть дополнительно использованы при любом их сочетании.
MR контраст с двойной или множественной меткой в зависимости от физического состояния носителя отслеживают либо в последовательном, либо чередующемся режиме с помощью обычного оборудования MR или одновременно при использовании сочетаний последовательности на спектрометрических системах с двойным резонансом, например, при резонансных частотах1H и19F MR.
В этой связи изобретение также относится к использованию одновременной двуядерной MR визуализации при отслеживании и/или управлении доставкой лекарственного средства.
Сочетание CEST и контрастирующего19F агента в термочувствительной липосоме дает благоприятную возможность отслеживать процесс высвобождения лекарственного средства независимо и одновременно с помощью CEST и19F MRI. Одновременный мониторинг двух разных сигналов MR опосредуется соответствующими методами MR с двойной меткой. Этот подход ведет к нескольким возможным преимуществам. Так, пространственное распределение нагруженных лекарственным средством частиц может быть оценено до высвобождения лекарственного средства с помощью CEST MRI; сигналы1H CEST и19F MR увеличиваются с увеличением количества высвобожденного лекарственного средства, что обеспечивает количественный контроль дозы высвобожденного лекарственного средства in vivo при использовании контура обратной связи; высвобождение лекарственных средств из носителя в месте повреждения может быть индуцировано местным стимулом, таким как нагревание в случае термочувствительных липосом, с помощью, например, RF или ультразвука; усиление контрастности CEST MR может быть по желанию включено или выключено.
Контрастирующие агенты19F MRI
19F, выявляемый MR, в естественных условиях отсутствует в организме, т.е.19F MRI неизбежно должна основываться на использовании добавленных контрастирующих19F агентов.
Контрастирующие агенты для19F MRI предпочтительно содержат большое количество магнитно эквивалентных групп фтора (чувствительность растет пропорционально количеству магнитно эквивалентных атомов F на молекулу). С целью получения желаемого сочетания с CEST MRI используемые контрастирующие агенты19F MR являются предпочтительно водорастворимыми и особенно предпочтительно заряженными молекулами с тем, чтобы они обладали как можно более высокой растворимостью в воде. Для цели применения в фосфолипидных оболочках предпочтительные контрастирующие агенты19F не связываются значительно или не ассоциируют значительно с фосфолипидами. Для цели их высвобождения в организме человека или животного контрастирующие агенты19F предпочтительно обладают низкой токсичностью и высокой биосовместимостью.
Предпочтительными контрастирующими агентами19F являются заряженные пер-F аналоги алифатических углеводородов.
Примеры и графические иллюстрации
Изобретение будет проиллюстрировано с помощью следующих неограничивающих примеров и сопровождающих их неограничивающих графических иллюстраций (фигуры 1-9).
Описание графических иллюстраций
На фиг.1 представлена столбчатая диаграмма, показывающая температуры фазового перехода плавления чувствительных к температуре липосом (TSL), содержащих либо 10% моль-% лизо-PC, либо 10 моль-% 1n,Rв липидном бислое и 250 мМ ProHance и доксорубицина в их водном просвете.
На фиг.2 и 3 показаны результаты флуоресценции и продольной релаксации для TSL, содержащих 10% моль-% ацетилированных PC (1n,R:n=0, R=C15H31 или C17H35) в липидном бислое и 250 мМ ProHance и доксорубицина в их водном просвете.
Изображены флуоресценция и продольная релаксация во время линейного повышения температуры (0,5 K/мин (0,5˚С/мин)) от 300 K (27˚С) до 323 K (50˚С) для LTSL, содержащих: 10,R (R=C15H31, наверху слева) и 10,R (R=C17H35, наверху справа) в HBS. Высвобождение доксорубицина как функция температуры для LTSL, содержащих: 10,R (R=C15H31, внизу слева) и 10,R (R=C17H35, внизу справа) в HBS.
На фиг.4 и 5 показаны флуоресценция и продольная релаксация во время линейного повышения температуры (0,5 K/мин (0,5˚С/мин)) от 300 K (27˚С) до 323 K (50˚С) для LTSL, содержащих: 13,R (R=C15H31, наверху слева) и 13,R (R=C17H35, наверху справа) в HBS. Высвобождение доксорубицина как функция температуры для LTSL, содержащих: 13,R (R=C15H31, внизу слева) и 13,R (R=C17H35, внизу справа) в HBS.
На фиг.6 показано высвобождение доксорубицина как функция температуры для LTSL, содержащих DPPC:DPPE-PEG2000, демонстрирующее отсутствие количественного высвобождения доксорубицина.
На фиг.7 показана продольная релаксация (rl) чувствительных к температуре липосом, содержащих ProHance и доксорубицин, во время линейного повышения температуры (0,5 K/мин (0,5˚С/мин)). При 310 K (37˚С) продольная релаксация парамагнитных липосом, содержащих 10,R (n=0 и R=C17H35) дает наименьшую величину. Для ясности на фигуре представлена надпись.
На фиг.8 показана продольная релаксация липосом (TTSL и NTSL), содержащих доксорубицин и 250 мМ [Gd(hpdo3a)(H2O)]. Для ясности на фигуре представлена надпись.
На фиг. 9 показана разница в продольной релаксации между 310 К (37°C) и 315 К (42°C) для липосом, заключающих в себе 250 мМ PtoHance и доксорубицина. Были проведены контрольные эксперименты с нечувствительными к температуре липосомами (NTSL; HSPC: Chol: DPPE-PEG2000 = 75:20:3) и обычными чувствительными к температуре липосомами (TTSL; DPPC: HSPC: Chol: DPPE-PEG2000 = 50:25:15:3).
Пример 1
Соединение указанного выше типа 1n,R с n=0 и R=C17H35, т.е. 1(n=0, R=C17H35), получали следующим образом. Раствор 4-диметиламинопиридина (149,1 мг, 1,22 ммоль) в дихлорметане (8 мл), высушенный на молекулярных ситах, добавляли к 1-миристоил-2-стеароил-sn-глицеро-3-фосфохолину, обозначаемому как MSPC (211,8 мг, 0,404 ммоль). Затем добавляли уксусный ангидрид (115 мкл, 1,23 ммоль), и смесь перемешивали в течение 30 часов при комнатной температуре в атмосфере азота с получением бесцветного раствора. Добавляли метанол (8 мл), и растворитель удаляли при комнатной температуре при пониженном давлении. Сырую смесь растворяли в хлороформе (8 мл), и органический слой трижды экстрагировали раствором МеОН (8 мл) и 0,1 М HCl (8 мл). Смесь центрифугировали (30 минут, 4000 об/мин) для обеспечения быстрого разделения фаз. Оставшийся органический слой фильтровали и затем концентрировали на роторном испарителе при комнатной температуре при пониженном давлении. Сырой продукт растворяли в ацетоне (30 мл), и раствор охлаждали до -20˚С для стимулирования осаждения. Для получения твердого вещества смесь центрифугировали (30 минут, 4000 об/мин, -19˚С), и растворитель декантировали. Полученный продукт промывали ацетоном, центрифугировали (30 минут, 4000 об/мин, -19˚С) и сушили с помощью струи азота с получением 1(n=0, R=C17H35) (0,132 г) с выходом 58%. Продукт анализировали с помощью1H- и13C ЯМР-спектроскопии.
Пример 2
Соединение 1(n=3, R=C17H35) получали аналогично получению 1 (n=0, R=C17H35) примера 1 с выходом 70% (0,172 г). Вместо уксусного ангидрида использовали валериановый ангидрид (240 мкл, 1,22 ммоль). Этот продукт не растворялся полностью в ацетоне, и поэтому очистку проводили путем перемешивания сырого продукта в ацетоне до охлаждения до -20˚С. Продукт анализировали с помощью1H- и13C ЯМР-спектроскопии.
Пример 3
Липосомы формировали методом гидрирования липидной пленки, совмещенным с последовательной экструзией. Фосфолипиды растворяли в растворе CHCl3/MeOH (4:1 об./об.). Растворители осторожно удаляли при пониженном давлении и получали тонкую липидную пленку. Липидную пленку гидратировали в растворе 250 мМ [Gd(hpdo3a)(H2O)] в 120 мМ буфере ацетата аммония. Дисперсию несколько раз последовательно продавливали через поликарбонатные мембранные фильтры с диаметрами пор 400, 200 и 100 нм. После экструзии буфер вне липосом заменяли забуференным HEPES физиологическим раствором (HBS), pH 7,4 (20 мМ HEPES, 137 мМ NaCl) с помощью гель-фильтрации через колонку PD-10 (GE Healthcare). Затем к липосомам добавляли раствор доксорубицина в HBS (5 мг/мл) при массовом соотношении фосфолипида к доксорубицину 20:1 и инкубировали в течение 90 мин при 37˚С. Наконец, липосомы пропускали через другую колонку PD-10 для удаления следов неинкапсулированного доксорубицина и свободного [Gd(hpdo3a)(H2O)].
Состав фосфолипидного бислоя представлен в таблице 1 ниже.
Пример 4
Липосомы примера 3 нагружали доксорубицином и 250 мМ [Gd(hpdo3a)(H2O)]. Tm и гидродинамический диаметр липосом (составы A-E) определяли с помощью дифференциальной сканирующей калориметрии (DSC) и динамического светорассеяния (DLS), соответственно. Как показано в таблице 2 и на фигуре 1, Tm фосфолипидного бислоя можно модулировать включением 1n,R.
Пример 5
Высвобождение доксорубицина и [Gd(hpdo3a)(H2O)] из водного просвета липосом исследовали как функцию температуры путем измерения флуоресценции при 590 нм и продольной релаксации (rl), соответственно (фигуры 2-8).
Во всех исследованных системах флуоресценция инкапсулированных кристаллов доксорубицина гасится при 300 K (27˚С). Однако при температурах, близких к Tm, и после высвобождения из липосомы наблюдается резкое увеличение флуоресцентного сигнала. Пока агент MRI остается внутри липосомы, продольная релаксация ограничена скоростью трансмембранного обмена воды. При повышении температуры агент высвобождается, и наблюдается усиление контрастности MR. Включение в бислой PC со смешанными короткими и длинными цепями обеспечивает возможность настройки свойств мембраны, связанных с высвобождением лекарственного средства и скоростью трансмембранного обмена воды, и тем самым усилением контрастности MR (фигуры 7-9). Путем настройки скорости трансмембранного обмена воды свойства термочувствительных липосом могут быть оптимизированы для применения в доставке лекарственных средств под контролем визуализации MR. Более того, совместное инкапсулирование доксорубицина и T1-агента в термочувствительной липосоме, состоящей из PC со смешанными короткими и длинными цепями, создает благоприятную возможность отслеживать процесс высвобождения лекарственного средства.
Реферат
Раскрыты носители лекарственных средств и/или агентов визуализации MR, имеющие липидную бислойную оболочку, включающую фосфолипид, имеющий две концевые алкильные цепи, причем одна представляет собой короткую цепь, имеющую длину цепи самое большее семь углеродных атомов, другая является длинной цепью, имеющей длину цепи, составляющую пятнадцать-тридцать углеродных атомов. Смешанные длинноцепочечные/короткоцепочечные фосфолипиды служат для настройки высвобождающих свойств носителя. Предпочтительными фосфолипидами являются фосфатидилхолины. 6 н. и 7 з.п. ф-лы, 9 ил., 2 табл., 5 пр.
Формула


где R представляет собой алкильную цепь из от пятнадцати до тридцати углеродных атомов и n является целым числом от 1 до 6.



Комментарии