Способ получения натрий моносиалового ганглиозида и нейропротекторное средство на его основе - RU2632710C2
Код документа: RU2632710C2
Описание
Изобретение относится к области химико-фармацевтической промышленности и касается препаратов ганглиозида GM1 в инъекционной форме.
Ганглиозиды, представляющие собой гликосфинголипиды, содержащие сиаловую кислоту, присутствуют в клеточной мембране млекопитающих, особенно в мембранах нервных клеток.
Ганглиозиды играют существенную роль в развитии нервной клетки, росте, дифференцировании, репарации нерва.
Натрий моносиаловый ганглиозид (моносиалотетрагексозилганглиозид натрия, GM1, monosialotetrahexosylganglioside) является одним из самых важных ганглиозидов. Он играет значительную роль в лечении заболеваний центральной нервной системы. GM1 при введении в организм может включаться в структуру нейрональных мембран и вызывать динамические перестройки в эндогенных ганглиозидах. Известно, что GM1 при введении животным с ишемическими, травматическими и токсическими повреждениями мозга предохраняют его нервные клетки от гибели, повышает жизнеспособность нейронов и клеток нейрональных линий при действии на них глутамата и других токсинов.
GM1 способствуют лечению различных нарушений функционирования ЦНС и является нейропротекторным средством (Neuroprotective effects of monosialotetrahexosylganglioside, Ai-ping Xi. et al., Neural Regen Res. 2015 Aug; 10(8): 1343-1344). Включается механизм «ремоделирования нейропластичности нерва» (состоит из выживания нервных клеток, роста аксонов, синаптического роста). Моносиалотетрагексозилганглиозид оказывает защитное воздействие на вторичный дегенеративный нерв после травм. А также положительно воздействует на параметры церебральной гемодинамики и травмы, ведущие к отеку мозга. Ганглиозид снимает отек нервных клеток с помощью повышения активности ферментов клеточной мембраны. Эксперименты на животных показали, что ганглиозид помогает при расстройствах поведения, вызванных болезнью Паркинсона.
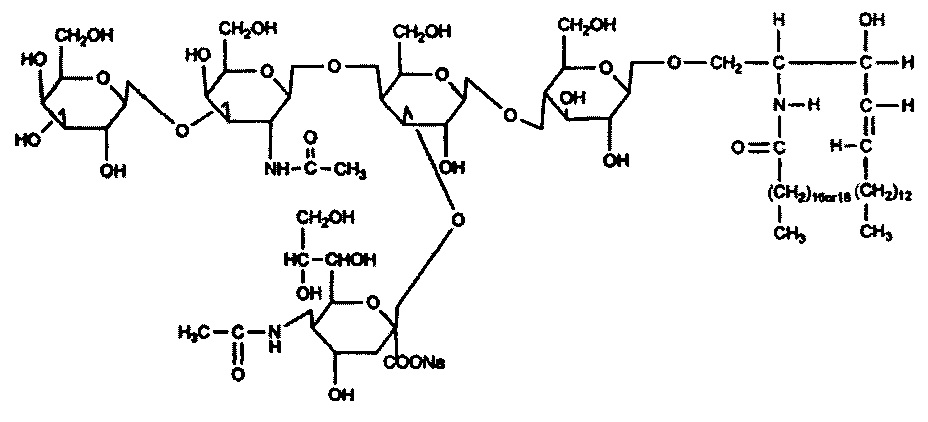
Моносиалотетрагексозилганглиозид натрия (GM1)
Как правило, для использования в медицинской практике к препаратам природного происхождения предъявляются высокие требования к степени их очистки. Поэтому исследователями были предприняты многочисленные попытки разработки подходящих способов получения ганглиозидов.
Например, известен патент RU 2483736 (С2), опубл. 2013-06-10, который относится к способу получения и очистки моносиалоганглиозида в форме его натриевой соли и включает а) отделение GM1 от Фукозил GM1 в липидной смеси, содержащей моносиалоганглиозид GM1 в качестве основного ганглиозидного компонента, с помощью колоночной ионообменной хроматографии с использованием элюента, содержащего ионы калия или цезия, (б) извлечение растворенного вещества из элюированного раствора, (в) диафильтрацию водного раствора извлеченного растворенного вещества стадии (б), (г) добавление натриевой соли и диафильтрацию полученного водного раствора, (д) извлечение GM1 в форме его натриевой соли.
CN101108868 (A) - 2008-01-23 раскрывает метод получения GM1 с высокой чистотой, который включает стадии: (1) свежую мозговую ткань licestock используют для приготовления ацетонового порошка; (2) порошок, подготовленный на стадии(1), растворяют раствором для извлечения и перемешивают 4-5 часов, отделяют центрифугированием и собирают супернатант, супернатант очищают LV хроматографической колонкой для получения ганглиозида; (3) весь ганглиозид, подготовленный на стадии (2), отделяют колоночной хроматографией MonoQ для получения ганглиозида GM1 с чистотой 90-95%; (4) GM1, подготовленный на стадии (3), отделяют гидрофобной хроматографией для получения ганглиозида GM1 с чистотой больше чем 98%; (5) водный раствор GM1, подготовленный на стадии (4), фильтруют через мембрану гиперфильтрации с 50 000-100 000 MWCO, и полученный фильтрат переводят в GM1 сухой порошок посредством замораживания и высыхания. Метод может улучшить выработку GM1 и избежать загрязнения другими фосфолипидами.
Патент US 5532141, опубл. 1996-07-02, раскрывает способ получения молекулы липида ганглиозида, включающей контакт образца мозговой невральной ткани, полученной из животного, с агентом извлечения, таким как хлороформ, метанол, вода при условиях, обеспечивающих извлечение молекул липида ганглиозида из указанной невральной ткани и удаление извлеченных молекул липида ганглиозида из указанного агента извлечения.
CN 104151372 А -2014-11-19 описывает способ приготовления моносиалотетрагексил ганглиозида натрия. Способ включает следующие шаги: а) берут замороженный свиной мозг, размораживают, моют, гомогенизируют, добавляют жидкий раствор в концентрированную соляную кислоту, перемешивают и затем центрифугируют для получения отделенного мозгового протеина; b)осажденный протеин добавляют в метанол, гомогенизируют, перемешивают и центрифугируют для получения спиртового экстракта; с) концентрируют; d) гидролизуют концентрат, полученный ранее, затем отделяют центрифугированием и собирают жидкость супернатанта для получения продукта гидролиза; е) проводят ультрафильтрацию продуктагидролиза многократно, отделяя вещества с молекулярными массами выше 1 600 дальтон для получения предварительного чистого продукта GM1, далее проводят ультрафильтрацию предварительно очищенного продукта GM1 и удаляют вещества с молекулярными массами ниже 1500 дальтон для получения чистого раствора GM1; f) высушивают раствор GM1 и получают моносиалотетрагексил ганглиозид натрия.
Известен способ выделения и очистки GM1 из мозга свиньи. Метод состоит из экстракции смесью вода- метанол- хлороформ и двухступенчатого хроматографического отделения с помощью DEAE-сефарозной ионно-обменной средой и Sephacryl S-100 средой. Очищенный GM1 был гомогенным и имел чистоту >98,0%. Молекулярная масса, измеренная методом высокоэффективной вытеснительной хроматографии, была 30.0 kDa и 1546.9 Da при масс-спектроскопическом измерении ионизацией распылением в электрическом поле (Liujiao Bian, Isolation and purification of monosialotetrahexosylgangliosides from pig brain by extraction and liquid chromatography, Biomedical Chromatography, Volume 29, Issue 10, pages 1604-1611, October 2015). Данное решение может быть указано в качестве ближайшего аналога.
Задачей настоящего изобретения является получение непирогенной субстанции с высокой степенью чистоты, пригодной для производства эффективных инъекционных форм ганглиозида.
Задача решается новым способом получения моносиалотетрагексозилганглиозида натрия (GM1) и инъекционного раствора на его основе.
Способ заключается в том, что свиные мозги экстрагируют смесью трихлорметан-метиловый спирт, добавляют гидроксид натрия, отделяют раствор от осадка центрифугированием, медленно нагревают до расщепления, адсорбируют на макроретикулярной ионообменной смоле с последующей десорбцией и промыванием водой, десорбированную жидкость помешивают, повышая температуру нагрева, кристаллизовавшуюся смесь пропускают через центрифугу, осадок промывают ацетоном и этанолом, просушивают, полученную ганглизиодную смесь переводят в водный раствор, тщательно размешивают, добавляют соляную кислоту, для регуляции уровня рН=3.0-3.2, нагревают до 75-85°С в течение 1.5-2 ч, добавляют ацетон для выпадения осадка, отделяют осадок центрифугированием и промывают его ацетоном, высушивают, проводят хроматографическое разделение смеси на ионообменной колонне, собирают фракцию моносиалотетрагексозиловых ганглиозидов (GM-1), определенную тонкослойной хроматографией, концентрируют до выпадения GM-1 осадка, растворяют его в смеси трихлорметана, метилового спирта и очищенной воды, затем раствор пропускают через ионообменную смоляную колонну, получившуюся жидкость концентрируют, добавляют ацетон для получения осадка, фильтруют, высушивают, разбавляют в воде, добавляют активированный уголь, размешивают, фильтруют и пропускают через катионообменную смоляную колонну, получившуюся жидкость повторно фильтруют и концертируют, добавляют ацетон, охлаждают, получившийся осадок вновь фильтруют, высушивают с получением конечного продукта.
Продукт: моносиалотетрагексозилганглиозид натрия из свиного мозга. Содержание моносиалотетрагексозилганглиозида натрия (C73H130N3NaO31 или C75H134N3NaO31) не менее 98%.
В качестве макроретикулярной ионообменной смолы могут быть использованы такие, как смолы на основе дивинилбензола или на основе полистирола, которые выпускаются, в частности, под торговыми названиями «Dowex» (фирма «Dow Chemical Со») и «Amberlyte» (фирма «Rohm and Haas»).
В качестве катионообменной смолы могут быть использованы, например, сефароза SP, сефароза CM, Trisacryl М SP, DOWEX МАС-3, Fractogel EMD Amberlite и др.
Предпочтительно в качестве ионообменных смол используют смолы марки GUDU, в частности гель сильной кислоты с катионообменной смолой 001*7, например катионообменной смолой на основе полистиролсульфоната, сшитой приблизительно с дивинилбензолом (http://www.sxresin.com/en/display.asp?id=51), смолу сильноосновного анионита 1-го (гель) типа 201*4 (http://www.sxresin/com/en/display.asp?id=90).
Полученная субстанция ганглиозида используется для приготовления нейропротекторного средства в форме раствора для инъекций, который затем подвергается стерилизующей фильтрации и производится наполнение ампул стеклянных.
Раствор для инъекций содержит, мг/мл:
Возможность осуществления изобретения может быть продемонстрирована ниже представленными примерами.
Пример 1
(1) Приготовление экстракта:
Помещают трихлорметан, метиловый спирт и свиной мозг в экстрактную емкость в соответствии с соотношением (2.5-2.6):5:1, после перемешивания дают смеси отстояться в течение 2 часов, пока верхний слой жидкости в емкости не станет прозрачным. Верхний слой жидкости смешивают с 1.5% раствором гидроксида натрия в объемном соотношении 5:1. Проводят расщепление (гидролиз) путем медленного нагревания; когда жидкость выливается наружу, регулируют паровой клапан, чтобы стабилизировать выливание жидкости. Температура контролируется, чтобы не превысила 80°С до момента полного расщепления и забора образца верхнего слоя расщепленной жидкости. (Промежуточный продукт I).
(2) Абсорбция на макроретикулярной ионообменной смоле и десорбция образца верхнего слоя жидкого экстракта;
При абсорбции жидкого экстракта контролируют скорость течения в пределах 5.00 л/мин. После адсорбции и сатурации промывают смолу питьевой водой, пока не будет вытекать прозрачная жидкость и контролируют скорость течения в пределах 8.00 л/мин. Растворяют и десорбируют раствором Гидроксида Натрия в метиловом спирте с рН 11.50-11.80; контролируя скорость потока в пределах 3.5 л/мин.; температуру 28-30°С; и собирают десорбированный раствор в пропорции более чем 95%.
Перемещают десорбированную жидкость в концентрирующую емкость; перемешивают и нагревают, контролируя температуру, чтобы не превышала 30°С; и концентрируют до 1-3% от начального объема. Отстаивают концентрированный раствор более 8 часов для кристаллизации и разделения под действием центробежных сил. Осадок на фильтре промывают ацетоном и этиловым спиртом; после высыхания получают предварительно преобразованную ганглиозидную смесь.
Из предварительно преобразованной ганглиозидной смеси готовят водный раствор; после смешивания до полного растворения добавляют соляную кислоту до рН 3.00-3.20. Нагревают до 75-85°С и подвергают трансформации в течение 1.5-2 ч. После трансформации добавляют ацетон в 10-15-кратном объеме; равномерно перемешивают, отстаивают и оставляют. Центрифугируют, промывают осадок на фильтре ацетоном и получают ганглиозидную смесь (Промежуточный продукт III).
(3) Разделение ганглиозидной смеси:
Смешивают Промежуточный Продукт III и проточную фазу (Трихлорметан, Метиловый спирт и очищенная вода в соотношении 55:40:4) в соответствии с соотношением объемов 1:3, после сорбции ионообменную хроматографическую колонну промывают проточной фазой (Трихлорметан, Метиловый спирт и очищенная вода в соотношении 55:40:4); элюируют и детектируют собираемый раствор в соответствии с методом тонкослойной хроматографии и затем собирают раствор в соответствии с результатом определения соответственно. После того как вытекающая жидкость, соответствующая требованиям, декомпрессируется и концентрируется при условиях 0.06-0.1МРа вакуумной степени и температуре, не превышающей 35°С, регулируют значение РН до 7-8 насыщенным раствором Гидроксида Натрия; отстаивают, центрифугируют и добавляют ацетон и после сушки получают сырьевой продукт (Промежуточный продукт IV).
(4) Отделение Моносиалотетрагексозиловых ганглиозидов сырьевого продукта:
Смешивают Промежуточный Продукт IV и промывочную фазу (Трихлорметан, Метиловый спирт и очищенная вода в соотношении объемов 60:40:4) в соответствии с соотношением объемов 1:3, пропускают через ионную хроматографическую колонну, промывают. Собирают элюат в соответствии с результатом тонкослойной хроматографии (TLC). Из раствора, с результатом измерения TLC которого получен Промежуточный Продукт V, требуется забор образцов собранной жидкости из каждой емкости. После подготовки образец подвергается HPLC детекции с максимальной единичной примесью ≤0.5%; концентрируют и отстаивают образцы с примесями ≤3.0%; удаляют супернатант, чтобы получить моносиалотетрагексогиловый ганглиозный сырьевой продукт (GM-1 сырьевой продукт).
(5) Очистка, сушка и упаковка GM-1:
Растворяют сырьевой продукт GM-1 проточной фазой (Трихлорметан, Метиловый спирт и очищенная вода в соотношении объемов 70:35:4.1). Раствор пропускают через ионно-обменные смолы при скорости течения 10 л/ч. После регулирования значения рН вытекающей жидкости до 4.50-5.50 насыщенным раствором гидроксида натрия, декомпрессии, концентрирования и добавления ацетона для получения осадка; фильтрации и сушки воздухом, получают очищенный сырьевой продукт GM-1.
Очищенный сырьевой продукт GM-1 готовят в виде 15% водного раствора; добавляют активированный уголь массой 20% от массы очищенного сырьевого продукта GM-1 и затем раствор фильтруют; фильтрат проходит через катионно-обменные смолы со скоростью течения 5 л/ч; вытекающую жидкость собирают и значение рН доводят до 4.70-4.80 насыщенным раствором гидроксида натрия и затем фильтруют. После дистилляции при 70-75°С к охлажденному отфильтрованному раствору добавляется в два раза больший по объему концентрированный ацетон; температуру снижают не ниже 0°С; раствор отстаивают и фильтруют; осадок подвергают аэрации и затем вакуумной сушке 24 ч при 0.08 МПа вакуума и при 49°С-51°С для получения GM-1. Высушенный конечный продукт дробят до получения порошка в течение 30-40 минут, пакуют, маркируют и помещают в место хранения.
Пример 2
Исследование чистоты полученной субстанции
К 0,2 мл раствора для испытания с содержанием установленного количества элемента добавляют 2 мл воды, затем 2 мл раствора резорцин-соляной кислоты (0,2 г резорцина смешивают с 10 мл воды, добавляют 90 мл соляной кислоты, затем 0,25 мл 0,1 моль/л сульфата меди), подогревают в теплой ванне 15 минут, цвет раствора сине-фиолетовый; извлекают 5 мл н-амилового спирта, слой н-амилового спирта синий.
Берут около 20 мг продукта, добавляют 1 мл ледяной уксусной кислоты, нагревают в кипящей воде до полного растворения, после чего добавляют 1 каплю раствора трихлорида железа и в кипящей ванне медленно вливают 1 мл серной кислоты, что повлечет разделение раствора на 2 слоя, цвет 2-х слоев должен быть коричневый.
Данный продукт представляет собой дифференциальную реакцию натриевой соли (Приложение IV С Китайской Фармакопеи (2010 версия) том II).
В зафиксированной хроматограмме с содержанием установленного элемента, максимальное время содержания раствора для испытания равняется максимальному времени содержания эталонного раствора.
Инфракрасный спектр поглощения данного продукта такой же, как и у эталонного продукта.
Ясность и цвет раствора. Продукт разбавляют водой так, чтобы на 1 мл приходилось 20 мг раствора, получается бесцветный раствор. Сиаловая кислота. Продукт разбавляют водой так, чтобы на 1 мл приходилось 0,25 мг раствора, в качестве раствора для испытаний. Отдельно берут эталон сиаловой кислоты, разбавляют водой так, чтобы на 1 мл приходилось 50 μg раствора, это будет эталонный раствор. Точно отмеряют по 2 мл эталонного раствора и раствора для испытаний, в каждый добавляют по 2 мл резорцин-соляной кислоты, перемешивают, опускают получившиеся растворы в ванну на 15 минут, затем охлаждают. В каждый раствор добавляют по 5 мл н-амилового спирта, трясут 1 минуту. Помещают растворы в ледяную ванну на 15 минут с центрифугой 2000 об/мин на 5 минут. Извлекают из верхнего слоя н-амиловый спирт в соответствии с УФ методом спектрофотометрии (Приложение IV А Китайской Фармакопеи (2010 версия) том II) и определяют степень поглощения при длине волны 585 нм; раствор для испытаний заменивают на воду и проводят исследование по такому же методу. Исходя из того, что это сухой продукт, он содержит 19.0%-21.0% сиаловой кислоты. Протеин определяют по реагентному методу Фолина (Приложение VII М Китайской Фармакопеи (2010 версия) том II). Из расчета на сухой продукт, содержание протеина не более 1.0%.
Примеси с высоким молекулярным весом определяются по методу молекулярной эксклюзионной хроматографии (Приложение V Н Китайской Фармакопеи (2010 версия) том II).
Хроматографические условия и пригодность системы тестирования
Используют гидрофильный модифицированный силикагель в качестве наполнителя хроматографической колонки (например, TSK GEL 2000 SW×1, 300 nm ×7.8 mm, 5 μm; или с подобной эффективностью); трифторуксусную кислоту - ацетонитрил - воду (0.05:40:60) в качестве подвижной фазы, скорость потока 0,7 мл/мин; длина волны 214 нм. Число теоретических тарелок в соответствии с рибонуклеазой пика А не менее 5000, степень разделения между смежными пиками не менее 3.0, исходя из соотношения высоты пика и высоты долины.
Подготовка стандартной кривой. Берут рибонуклеазу А (молекулярный вес 13700), инсулин человека (молекулярный вес 5808), тимозин α1 (молекулярный вес 3108) и соматостатин (молекулярная масса 1638), по отдельности добавляют подвижную фазу для растворения и получения раствора 1 мг/мл в качестве стандартного молекулярного раствора. Отмеряют 20 μ1 вышеуказанного раствора, по отдельности вливают в жидкий хроматограф, записывают хроматограмму, повторите 5 раз, относительное стандартное отклонение времени удерживания должно быть не больше 2.0%. Принимают время удерживания каждого пика за абсциссу, логарифм молекулярного веса за ординату, проводят линейную регрессию, коэффициент корреляции менее 0.99.
Метод определения. Согласно методу нормализации, в хроматографии раствора для испытаний площадь пика примесей с молекулярным весом более 5000 дальтон менее 1.00%.
Влажность. Измеряют с помощью метода определения влажности (Приложение VIII М статья А Китайской Фармакопеи (2010 версия) том II), содержание воды не превышает 4,5%.
Тяжелые металлы. Измеряют в соответствии с Приложением VIII Н Китайской Фармакопеи (2010 версия) том II, содержание тяжелых металлов не превышает 12%.
Аномальная токсичность. Проверяют в соответствии с Приложением XI С Китайской Фармакопеи (2010 версия) том II, лекарство, согласно методу внутривенных инъекций, соответствует требованиям.
Пироген. Определяют на основе Приложения XI D Китайской Фармакопеи (2010 версия) том II; на 1 кг веса домашней кошки вводят 2 мл, соответствует требованиям - не содержит пирогенов.
Определение содержания с помощью метода высокоэффективной жидкостной хроматографии.
Количество теоретических тарелок исчисляется пиком моносиалотетрагексозилганглиозида натрия и не менее 1000, степень разделения между моносиалотетрагексозилганглиозидом натрия и соседними пиками примесей соответствовует требованиям.
Нейропротекторный агент.
Пример 3. Схема и описание производственного процесса получения раствора инъекций натрий моносиалового ганглиозида
Описание производственного процесса
1. Стерилизация и промывка ампул:
Ампулы закладываются на конвейер ультразвуковой моющей машины, после чего автоматически попадают в моющий шкаф, который при помощи ультразвука промывает ампулы. Дальнейшая схема промывки ампул: циркуляционная вода - циркуляционная вода - сжатый воздух -дистиллированная вода - вода для инъекций - сжатый воздух, после этого ампулы по закрытому конвейеру автоматически переправляются в сушильный тоннель. Частота промывки моющей машины не должна превышать 50 Hz, температура в сушильном тоннеле не должны быть ниже 280°.
2. Приготовление
2.1 В реактор заливается вода для инъекций объемом 105-110% от общего водного объема. Включается мешалка, скорость которой должна быть не менее 360 оборотов в минуту.
2.2 В соответствии с общим количеством воды и общими пропорциями, гидрофосфат натрия, натрия дигидрофосфат и хлористый натрий добавляется в воду для инъекций, перемешивается в течение 5 минут до полного растворения. После этого, соленую воду в баке охлаждают до 40-45°С, производят ультратонкую фильтрацию, взвешивают соленую воду и проверяют рецептуру (включая указанное в рецептуре общее количество воды и соли). После этого соленую воду заливают в отдельный реактор.
2.3 В порошок активного компонента добавляют прошедшую ультратонкую фильтрацию соленую воду, размешивают в течение 20 минут до полного растворения.
2.4 Проверка получившейся жидкости
Используя 10 mol/L NaOH регулируют уровень рН (необходимый уровень 7.3-7.7), размешивая раствор в течение 5 минут.
2.5 Заливают 50± мл жидкости в колбу, проводим визуальную проверку цвета и прозрачности, проверяем уровень рН.
Описание: получившаяся жидкость бесцветная и прозрачная.
Цвет: ≤колориметрического раствора желтого цвета №1
Прозрачность:≤стандартного нефелометрического раствора №2
Уровень рН: 7.3-7.7
2.6 Связующий трубопровод проходит через реактор → насос санитарной системы → фильтр → сборник. После включения насоса санитарной системы начинается фильтрация, продолжительность фильтрации должны быть не более 1-го часа. Давление предварительного фильтра: ≤0.15 Мра, необходимо протоколировать уровень давления в начале, середине и в конце процесса фильтрации.
3. Порядок наполнения ампул и герметизация:
Перед началом расфасовки лекарственный раствор пропускают через фильтр, диаметр ячеек которого должен быть - 0,22 мм, также необходимо до и после проведения фильтрации проверить фильтрующий наконечник, стандарт ≥50 psi или в соответствии с требованиями инструкции.
Отфильтрованный лекарственный раствор разливают по помытым и стерилизованным ампулам, запаивают при помощи и направляют дальше по конвейерной линии в отсек стерилизации. В процессе расфасовки, оператор каждые полчаса проверяет объем расфасовки и попадание кислорода, стандартом является: 2 мл :20 мг : 2.1240g : 2.2337g 2 мл : 40 мг : 2.1340 г - 2.2363 г
Остаток кислорода ≤2.5%
Время от растворения порошка до расфасовки и герметизации: не более 12 часов.
4. Стерилизация и проверка герметичности
Операторы отдела стерилизации при выходе ампул из конвейерного туннеля собирают герметично запаянные ампулы в бокс из нержавеющей стали, после заполнения бокса, его устанавливают в стерилизатор, и проводят стерилизацию.
Параметры стерилизации: стерилизовать в течение 20 минут при температуре 121° и при разреженном вакууме: 0,08 МРа три минуты. Также необходимо, чтобы герметично упакованный полуфабрикат прошел 6-часовую стерилизацию.
5. Визуальная проверка
При проведении визуальной проверки ампулы следует установить в проверочный желоб, провести проверку, отсеянные ампулы с дефектами (пропускающие воздух, вспузырившиеся, карбонизированные) уложить в бокс из нержавеющей стали. После завершения механической проверки ампулы по конвейеру переходят в отсек полностью автоматической проверки на наличие дефектов. Ампулы без дефектов и отбракованные укладываются на разные конвейерные линии. Ампулы с дефектами укладываются в отдельный бокс из нержавеющей стали.
6. Упаковка
ПВХ блистер устанавливают на конвейере, после расфасовки ампул в ПВХ блистер проверяется их количество, в случае лишней или недостающей ампулы необходимо доложить или убрать ампулу. Также во время упаковки необходимо следить за качеством и четкостью маркировки и ее соответствию требованиям. После этого сверху блистера укладывается инструкция, а сам блистер укладывается в коробку и запечатывается.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к способу выделения моносиалотетрагексозилганглиозида натрия (GM1). Способ выделения GM1 заключается в том, что готовят экстракт свиного мозга с использованием смеси трихлорметана, метилового спирта, проводят абсорбцию на макроретикулярной ионообменной смоле и десорбцию жидкого экстракта, разделение ганглиозидной смеси, отделение моносиалотетрагексозиловых ганглиозидов сырьевого продукта с его последующей очисткой, сушкой и упаковкой при определенных условиях. Нейропротекторное средство в форме раствора для инъекций. Вышеописанный способ позволяет получить субстанцию высокой чистоты, пригодную для получения инъекционных препаратов. 2 н.п. ф-лы, 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ получения чистого моносиалоганглиозида gm1 для применения в медицине

Комментарии