Способы ингибирования фукозилирования белков in vivo с использованием аналогов фукозы - RU2625768C2
Код документа: RU2625768C2
Чертежи







Описание
Перекрестная ссылка на родственные заявки
Данная заявка заявляет приоритет предварительной заявки на патент США 61/371116, поданной 5 августа 2010 г., раскрытие которой включено в данный документ для сведения.
Уровень техники
L-фукоза, также относящаяся к 6-дезокси-L-галактозе, представляет собой моносахарид, который является компонентом некоторых N- и О-связанных гликанов и гликолипидов у животных (см. Becker and Lowe, Glycobiology, 13:41R-51R, 2003). Как правило, фукоза добавляется в качестве концевых модификаций гликанов, включая гликаны, соединенные с антигенами группы крови, селектины и антитела. Фукоза может присоединяться к гликанам посредством α(1,2)-, α(1,3)-, α(1,4)- и α(1,6)-связей под действием специфических фукозилтрансфераз. Как правило, α(1,2)-фукозидные связи ассоциированы с антигенами группы Н-крови. α(1,3)- и α(1,4)-фукозидные связи ассоциированы с модификацией антигенов LewisX. α(1,6)-фукозидные связи ассоциированы с молекулами N-связанных GlcNAc, которые находятся на антителах.
Полагается, что фукозилирование белков играет роль в развитии млекопитающих. У мышей, гомозиготных по нацеленной мутации гена FX, имеют место многочисленные аномалии развития, включая летальный фенотип. Также сообщалось о пониженной рождаемости мышей от гетерозиготных гибридов (Becker et al., Mammalian Genome, 14:130-139, 2003). Было высказано предположение о том, что аберрантное фукозилирование ассоциировано с заболеваниями человека, включая положительную регуляцию сиалил-LewisX и сиалил-LewisYпри раке. Эти гликаны являются лигандами молекул Е- и Р-селектина. Предполагается, что повышение уровня гликанов в сиалил-LewisX и сиалил-LewisY в раковых клетках приводит к усилению распространения метастазов за счет взаимодействия Е- и Р-селектинов в эндотелии. Гликаны с высокой степенью фукозилирования также были обнаружены у пациентов с ревматоидным артритом. Однако в настоящее время отсутствуют разрешенные для применения терапевтические подходы, нацеленные на степень фукозилирования белков.
Сущность изобретения
Способы и композиции, описанные в данном документе, частично основываются на неожиданных результатах, представленных в разделе «Примеры», показывающих, что у животных, которым ввели аналог фукозы, имеется пониженный уровень фукозилирования белков. Фукозилирование антител и других белков можно модулировать с использованием аналогов фукозы, описанных в данном документе.
В одном аспекте изобретение относится к способам и композициям для продукции in vivo дефукозилированных белков. У животных, таких как млекопитающие, которым ввели аналог фукозы (формул I, II, II, IV, V или VI), продуцируются белки, такие как поверхностные клеточные белки, имеющие пониженный уровень фукозилирования. Снижение фукозилирования оценивается относительно животных, не обработанных аналогами фукозы соответственно формул I, II, II, IV, V или VI.
В близком аспекте изобретение относится к продукции in vivo антител и производных антител с пониженным фукозилированием кора. У животных, которым ввели аналог фукозы (формул I, II, II, IV, V или VI), продуцируются антитела и производные антител, имеющие пониженный уровень фукозилирования кора (т.е. пониженный уровень фукозилирования N-ацетилглюкозамина сложных N-гликозид-связанных сахарных цепей, соединенных с F-областью через N-ацетилглюкозамин редуцирующего конца сахарных цепей). Снижение фукозилирования кора оценивается относительно животных, не обработанных аналогами фукозы соответственно формул I, II, II, IV, V или VI.
Еще в одном аспекте изобретение относится к фармацевтическим композициям, содержащим аналоги фукозы и формулированным для введения целевому животному. Аналоги фукозы можно формулировать для введения животному для ингибирования или снижения фукозилирования в условиях in vivo.
Данные и другие аспекты настоящего изобретения можно полнее понять при обращении к последующему подробному описанию, неограничивающим примерам конкретных вариантов осуществления и прилагаемым фигурам.
Краткое описание чертежей
На фигуре 1 приведены результаты влияния введения аналогов фукозы (внутрибрюшинной инъекцией) на фукозилирование антител. Дот-блоты показаны на левой панели, и график приведен на правой панели. Уровни нагрузки белками дот-блотов (вверху слева) и фукоза-специфическая биолюминесценция (внизу слева) для стандартов антитела сАС10 (нижний дот-блот, левый наиболее заштрихованный прямоугольник и соответствующие колонки верхнего дот-блота), необработанного контроля (нижний дот-блот, второй заштрихованный прямоугольник слева и соответствующая колонка верхнего дот-блота) и алкинилфукозы (SGD-1887; нижний дот-блот, средний заштрихованный прямоугольник и соответствующая колонка верхнего дот-блота), перацетата алкинилфукозы (SGD-1890; нижний дот-блот, второй заштрихованный прямоугольник справа и соответствующая колонка верхнего дот-блота) и 2-фторфукозы (SGD-2083; нижний дот-блот, правый наиболее заштрихованный прямоугольник и соответствующая колонка верхнего дот-блота). После корректировки на уровень нагрузки на графике справа показан % фукозилирования.
На фигуре 2 показано влияние на фукозилирование кора антитела введения аналогов фукозы с питьевой водой. На графиках показан % фукозилирования антител по данным газовой хроматографии (ГХ): на панелях А и В приведены уровни фукозилирования анти-KLH-антител (Ab), выделенных от животных обработанных групп, в то время как на панелях С и D показаны уровни фукозилирования остальных (не-KLH-специфических) IgG антител. На панелях А и С показан процент фукозилирования для каждого животного с использованием калибровочной кривой с очищенным антителом (0-100% фукозилирование). На панелях В и D показан уровень фукозилирования у обработанных животных в виде процента от среднего значения для животных в необработанной контрольной группе.
На фигуре 3 показано влияние введения аналогов фукозы с питьевой водой на фукозилирование кора антител. На данной фигуре приведены уровни фукозилирования неспецифических-KLH-антител. Уровни нагрузки белками дот-блотов (вверху слева) и фукоза-специфическая биолюминесценция (внизу слева) для стандартов антитела сАС10 (верхний и нижний дот-блоты, левый наиболее заштрихованные прямоугольники), необработанного контроля (верхний и нижний дот-блоты, второй левый (верхний) и правый прямоугольники) и 2-фторфукозы (верхний и нижний дот-блоты, второй слева (нижний) и второй справа прямоугольники (верхний и нижний)). После корректировки на уровень нагрузки на графике справа показан % фукозилирования.
На фигуре 4 показано влияние введения 2-фторфукозы в различных дозах с питьевой водой на фукозилирование кора антител. Дот-блоты показывают уровни нагрузки белками (слева) и фукоза-специфическую биолюминесценцию (в середине) для необработанного контроля и 1; 10 и 100 мМ SGD-2083 (как указано). На графике справа показан % фукозилирования по сравнению с необработанным контролем.
На фигуре 5 показано влияние введения 2-фторфукозы на циркулирующие лейкоциты и нейтрофилы. Панель А. От отдельных мышей отбирали пробы крови и определяли количество лейкоцитов на гемоцитометре с использованием раствора Тюрка для отделения эритроцитов. Панель В. Для подсчета числа нейтрофилов определяли процент лейкоцитов, которые были Gr-1+ проточной цитометрией и относили к общему определенному количеству клеток (А). Панель С. Отбирали пул лимфатических узлов от отдельных мышей, готовили суспензии отдельных клеток и на гемоцитометре подсчитывали количество клеток. Условные обозначения представляют отдельных мышей (n=3 в группе; ромбы, необработанные животные; прямоугольники, 1 мМ 2-фторфукозы (SGD-2083); треугольники, 10 мМ 2-фторфукозы; кружки, 100 мМ 2-фторфукозы.
На фигуре 6 показано влияние введения 2-фторфукозы на связывание Е-селектина с нейтрофилами. Панель А. Пример идентификации нейрофилов проточной цитометрией. Клетки гейтировали в прямом и боковом светорассеивании для включения живых лейкоцитов и затем применяли к гистограмме, отражающей Gr-1-окрашивание для идентификации нейтрофилов. Позитивные клетки гейтировали, подсчитывали процент позитивных клеток (использованных для определения числа клеток, приведенного на фигуре 5В), и гейтирование применяли к гистограммам на (В). Панель В. Примеры связывания Е-селектина с нейтрофилами от необработанного животного (слева) и животного, обработанного перорально 2-фторфукозой (SGD-2083) в дозе 100 мМ (справа). Серые гистограммы показывают связывание Е-селектина, и точечные линии показывают связывание одного вторичного реагента. Определяли геометрические средние значение интенсивности флуоресценции для связывания Е-селектина. Панель С. Определяли геометрические средние значения интенсивности флуоресценции для связывания Е-селектина для каждого животного (В) и сравнивали между группами (n=3 на группу; ошибки в виде коротких отрезков представляют стандартное отклонение).
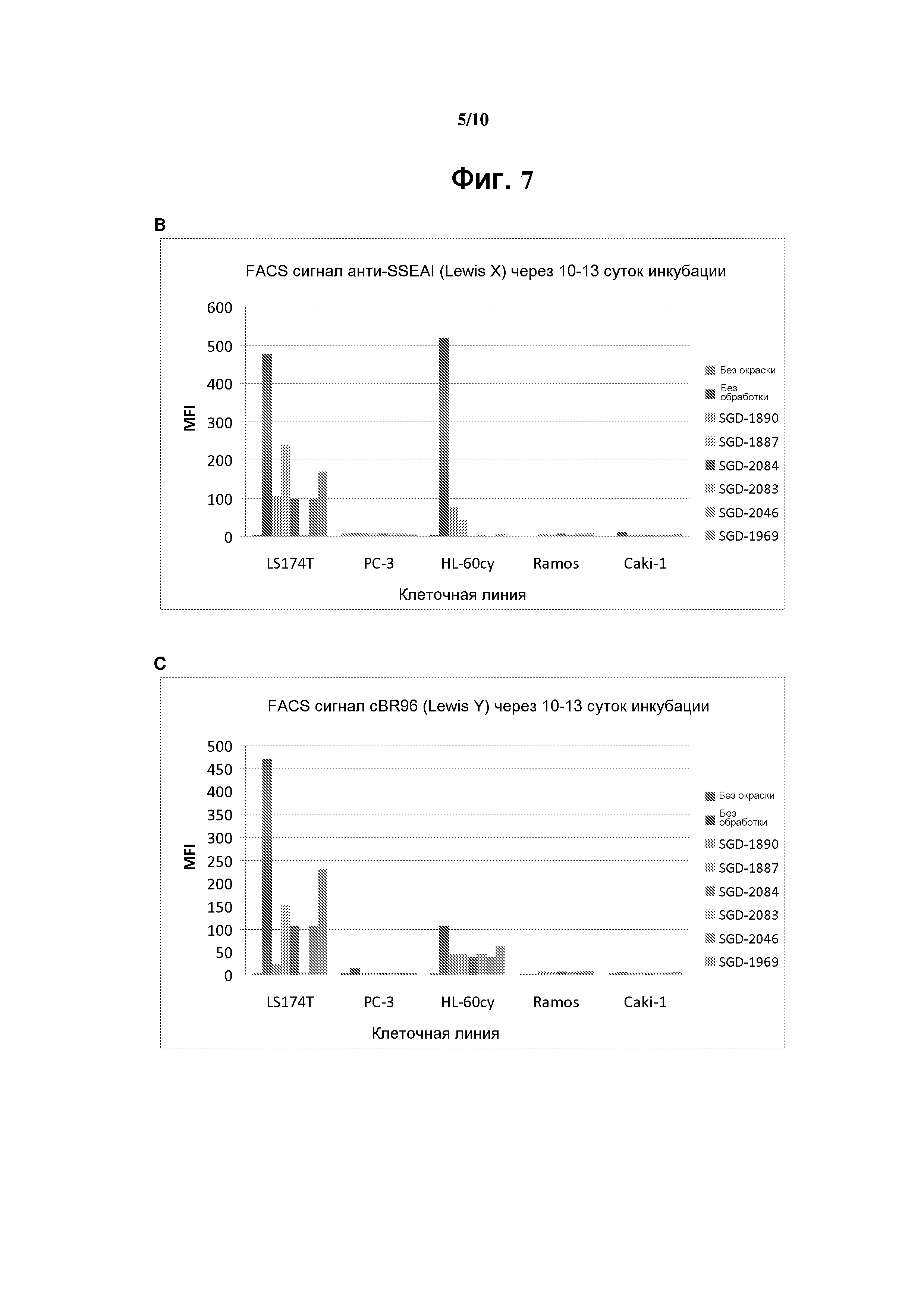
На фигуре 7 показано влияние на фукозилирование белков клеточных линий, культивированных с некоторыми аналогами фукозы. Исследовали клеточные линии LS174T, PC-3, Ramos, HL-60cy и Caki-1.
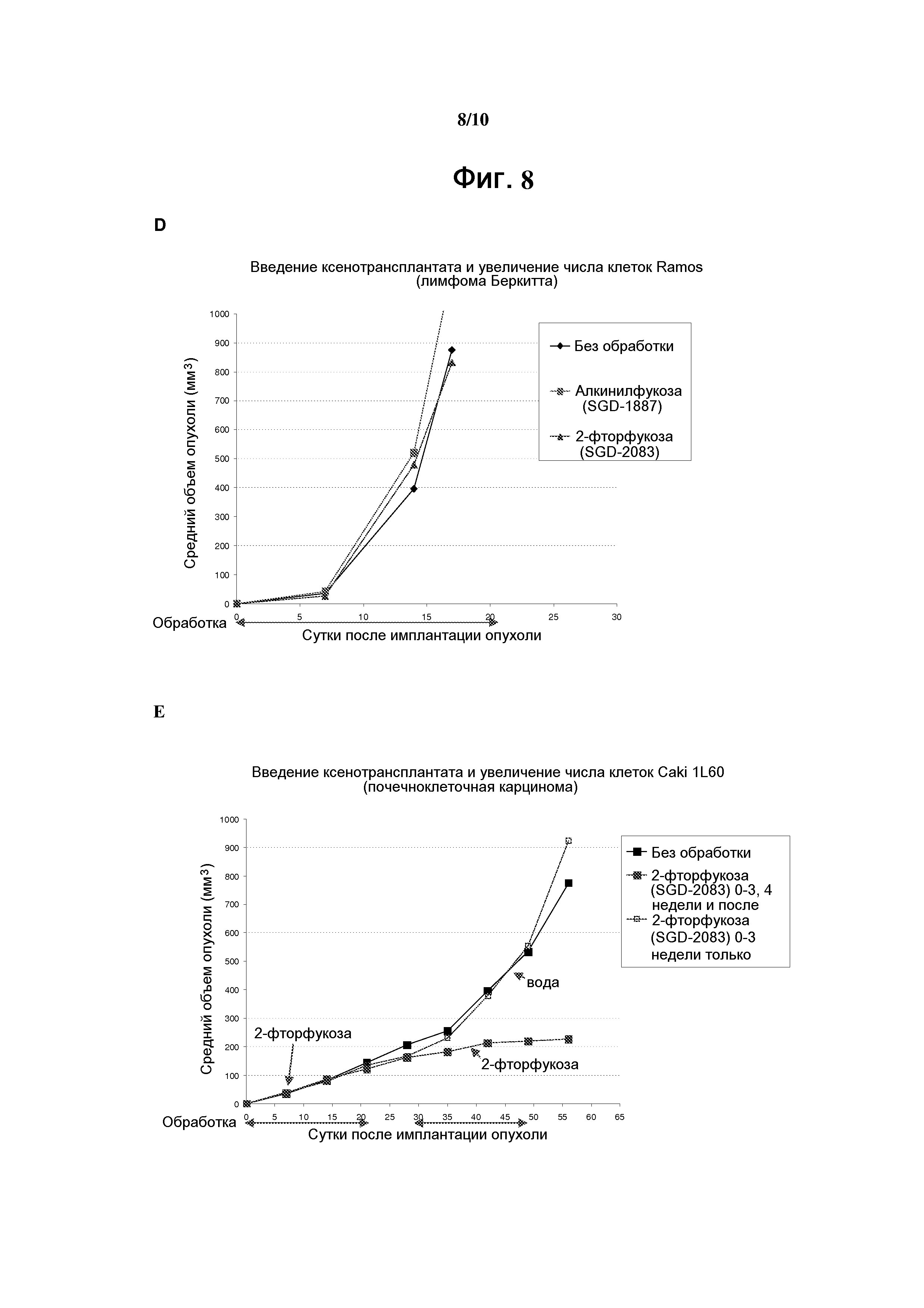
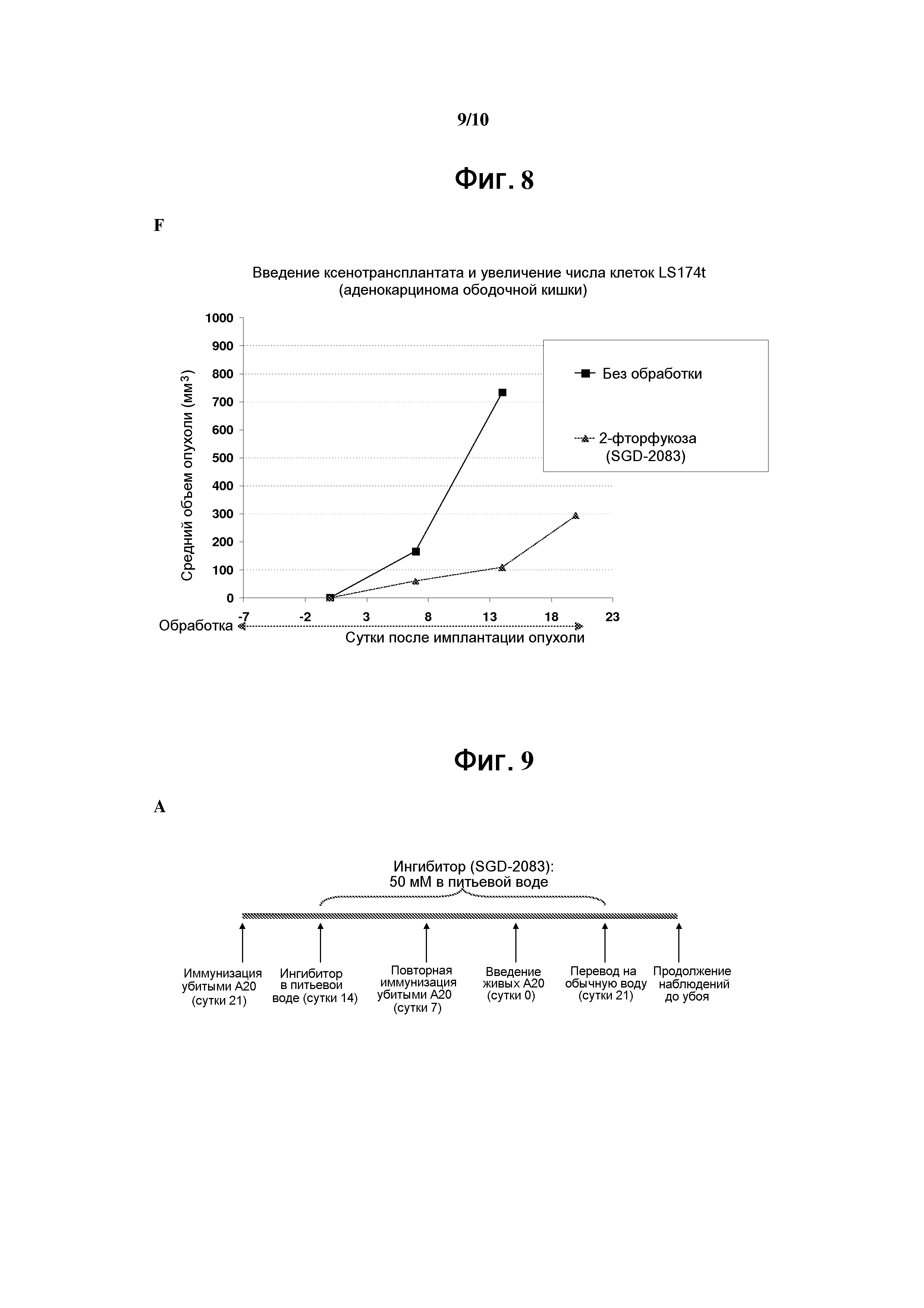
На фигуре 8 показаны эффекты аналогов фукозы на моделях опухолевых ксенотрансплантатов на мышах. Результаты, полученные на моделях ксенотрансплантатов на мышах с клеточными линиями LS174T, PC-3, Ramos, HL-60 и Caki-1 (предварительно обработанными 2-фторфукозой (SGD-2083)), приведены соответственно на панелях А-Е. Результаты на модели ксенотрансплантатов на мышах с необработанными клеточными линиями LS174T показаны на панели F.
На фигуре 9 приведен дизайн опыта (панель А) и результаты (панель В) с моделью опухолевой вакцины, основанной на предварительной иммунизации убитыми клетками мышиной лимфомы А20 с последующим введением живых клеток лимфомы А20 с или без введения аналога фукозы (2-фторфукозы).
Подробное описание изобретения
Определения
Термин «антитело» относится к (а) иммуноглобулиновым полипептидам и иммунологически активным фрагментам иммуноглобулиновых полипептидов, т.е. полипептидам семейства иммуноглобулинов или их фрагментам, которые содержат антигенсвязывающий сайт(ы), который иммуноспецифически связывается с определенным антигеном и содержит Fc-домен, содержащий сложную N-гликозид-связанную сахарную цепь(и), или (b) консервативно замещенным производным таких иммуноглобулиновых полипептидов или фрагментов, которые иммуноспецифически связываются с антигеном. В общем, антитела описаны, например, Harlow&Lane, Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1988).
«Производное антитела» означает антитело, имеющее значения, определенные выше (включая фрагмент антитела), или Fc-домен или область антитела, содержащее сложную N-гликозид-связанную сахарную цепь(и), которое модифицировано ковалентным присоединением гетерологичной молекулы, например, присоединением гетерологичного полипептида (например, лиганд-связывающего домена гетерологичного белка) или гликозилированием (иным чем фукозилирование кора), дегликозилированием (иным чем фукозилирование нон-кора), ацетилированием, фосфорилированием или другой модификацией, обычно не ассоциированной с антителом или Fc-доменом или Fc-областью.
Термин «моноклональное антитело» относится к антителу, которое получено из одного клеточного клона, включая клон любых эукариотических или прокариотически клеток, или фаговый клон, и независимо от метода, которым он получен. Таким образом, термин «моноклональное антитело» не ограничивается антителами, продуцированными гибридомной технологией.
Термин «Fc-область» относится к константной области антитела, например, CH1-шарнирный участок-CH2-CH3 домен, необязательно содержащей CH4 домен, или консервативно замещенному производному такой Fc-области.
Термин «Fc-домен» относится к константному домену области антитела, например, CH1, шарнирный участок, CH2, CH3, CH4 домен, или консервативно замещенному производному такого Fc-домена.
Термин «антиген» является молекулой, с которой специфически связывается антитело или производное антитела.
Термины «специфическое связывание» и «специфически связывается» означает, что антитело или производное антитела будет связываться высокоселективным образом с его соответствующим антигеном-мишенью, а не с множеством других антигенов. Как правило, антитело или производное антитела связывается с аффинностью, составляющей, по меньшей мере, 1⋅10-7 М и предпочтительно от 10-8 М до 10-9 М, 10-10 М, 10-11 М или 10-12 М, и связывается с заранее определенным антигеном с аффинностью, которая, по меньшей мере, в два раза выше по сравнению с его аффинностью связывания с неспецифическим антигеном (например, BSA, казеин) иным, чем заранее определенный антиген или близко связанный антиген.
Термины «ингибировать» или «ингибирование» означает снижение на определяемое количество или полное предупреждение.
В том смысле, в котором в данном документе используется термин «перацетат алкинилфукозы», он относится к любой или всем формам алкинилфукозы (5-этиниларабинозы) с ацетатными группами в положениях R1-4 (см. формулы I и II ниже), включая 6-этинилтетрагидро-2Н-пиран-2,3,4,5-тетраилтетраацетат, в том числе, изомеры (2S,3S,4R,5R,6S) и (2R,3S,4R,5R,6S), и 5-((S)-1-гидроксипроп-2-инил)тетрагидрофуран-2,3,4-триилтетраацетат, включая изомеры (2S,3S,4R,5R) и (2R,3S,4R,5R), и альдозную форму, если по контексту не указано иначе. Термины «триацетат алкинилфукозы», «диацетат алкинилфукозы» и «моноацетат алкинилфукозы» относятся соответственно к указанным три-, ди- и моноацетатам алкинилфукозы.
Если по контексту не указано иначе, термин «алкил» относится к незамещенному насыщенному углеводороду с прямой или разветвленной цепью, содержащему 1-20 атомов углерода (и все комбинации и субкомбинации пределов и конкретных чисел атомов углерода), если не указано иначе. Предпочтительной является алкильная группа из 1-3, 1-8 или 1-10 атомов углерода. Примерами алкильных групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 2-пентил, 3-пентил, 2-метил-2-бутил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, 3-метил-2-бутил, 3-метил-1-бутил, 2-метил-1-бутил, 1-гексил, 2-гексил, 3-гексил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 3-метил-3-пентил, 2-метил-3-пентил, 2,3-диметил-2-бутил и 3,3-диметил-2-бутил.
Алкильные группы, в виде заместителя или в виде части другой замещающей группы, в том случае, когда они замещены, могут быть замещены одной или более группами, предпочтительно 1-3 группами (и любыми дополнительными заместителями, выбранными из атомов галогена), включая, не ограничиваясь этим, атом галогена, -О-(С1-С8 алкил), -О-(С2-С8 алкенил), -О-(С2-С8 алкинил), арил, -С(О)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбран из -Н, -С1-С8 алкила, -С2-С8 алкенила, -С2-С8 алкинила или арила.
Если по контексту не указано иначе, то термины «алкенил» и «алкинил» относятся к незамещенным или необязательно замещенным (указаны) прямым или разветвленным углеводородным цепям, содержащим 2-20 атомов углерода (и все комбинации и субкомбинации пределов и конкретных чисел атомов углерода), притом что 2-3, 2-4, 2-8 или 2-10 атомов углерода являются предпочтительными. Алкенильная цепь содержит, по меньшей мере, одну двойную связь в цепи, и алкинильная цепь имеет, по меньшей мере, одну тройную связь в цепи. Примеры алкенильных групп включают, не ограничиваясь этим, этилен или винил, аллил, 1-бутенил, 2-бутенил, изобутеленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2-бутенил и 2,3-диметил-2-бутенил. Примеры алкинильных групп включают, не ограничиваясь этим, ацетиленовую группу, пропаргил, ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил и 3-метил-1-бутинил.
Алкенильные и алкинильные группы, в виде заместителя или в виде части другой замещающей группы, в том случае, когда они замещены, могут быть замещены одной или более группами, предпочтительно 1-3 группами (и любыми дополнительными заместителями, выбранными из атомов галогена), включая, не ограничиваясь этим, атом галогена, -О-(С1-С8 алкил), -О-(С2-С8 алкенил), -О-(С2-С8 алкинил), арил, -С(О)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбран из -Н, -С1-С8 алкила, -С2-С8 алкенила, -С2-С8 алкинила или арила.
Если по контексту не указано иначе, то термин «алкилен» относится к незамещенному насыщенному углеводородному радикалу с прямой или разветвленной цепью, содержащему 1-20 атомов углерода (и все комбинации и субкомбинации пределов и конкретных чисел атомов углерода), притом что 1-8 или 1-10 атомов углерода являются предпочтительными, и имеющему два одновалентных радикальных центра, образовавшихся в результате удаления двух атомов водорода от одного и того же или двух различных атомов углерода исходного алкана. Типичные алкилены включают, не ограничиваясь этим, метилен, этилен, пропилен, бутилен, пентилен, гексилен, гептилен, октилен, нонилен, декален, 1,4-циклогексилен и тому подобное.
Алкиленовые группы, в виде заместителя или в виде части другой замещающей группы, в том случае, когда они замещены, могут быть замещены одной или более группами, предпочтительно 1-3 группами (и любыми дополнительными заместителями, выбранными из атомов галогена), включая, не ограничиваясь этим, атом галогена, -О-(С1-С8 алкил), -О-(С2-С8 алкенил), -О-(С2-С8 алкинил), арил, -С(О)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбран из -Н, -С1-С8 алкила, -С2-С8 алкенила, -С2-С8 алкинила или арила.
Термин «алкенилен» относится к ненасыщенному углеводородному радикалу с разветвленной или прямой цепью или циклическому углеводородному радикалу алкенильной группы (как описано выше), имеющему два одновалентных радикальных центра, образовавшихся в результате удаления двух атомов водорода от одного и того же или двух различных атомов углерода исходного алкена. «Алкенилен» может быть незамещенным или необязательно замещенным (указано), как описано выше для алкенильных групп. В некоторых вариантах осуществления «алкенилен» является незамещенным.
Термин «алкинилен» относится к ненасыщенному углеводородному радикалу с разветвленной или прямой цепью или циклическому углеводородному радикалу алкинильной группы (как описано выше), и имеющему два одновалентных радикальных центра, образовавшихся в результате удаления двух атомов водорода от одного и того же и двух различных атомов углерода исходного алкина. «Алкинилен» может быть незамещенным или необязательно замещенным (указано), как описано выше для алкинильных групп. В некоторых вариантах осуществления «алкинилен» является незамещенным.
Если не указано иначе по контексту, то термин «арил» относится к замещенному или незамещенному одновалентному ароматическому углеводородному радикалу из 6-20 атомов углерода (и все комбинации и субкомбинации пределов и конкретных чисел атомов углерода), полученному удалением одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Некоторые арильные группы обозначаются в приводимых в качестве примера структурах как «Ar». Типичные арильные группы включают, не ограничиваясь этим, радикалы, полученные из бензола, замещенного бензола, фенила, нафталена, антрацена, бифенила и тому подобное.
Арильная группа, в виде заместителя или в виде части другой замещающей группы, может быть необязательно замещена одной или более группами, предпочтительно 1-5, или даже 1-2 группами, включая, не ограничиваясь этим, атом галогена, С1-С8 алкил, С2-С8 алкенил, С2-С8 алкинил, -О-(С1-С8 алкил), -О-(С2-С8 алкенил), -О-(С2-С8 алкинил), арил, -С(О)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, -NO2, -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбран из -Н, -С1-С8 алкила, -С2-С8 алкенила, -С2-С8 алкинила или арила.
Если не указано иначе по контексту, то термин «гетероцикл» относится к замещенной или незамещенной моноциклической кольцевой системе, содержащей 3-7 или 3-10 кольцевых атомов (также относящихся к членам кольца), в которой, по меньшей мере, один кольцевой атом представляет гетероатом, выбранный из N, O, P или S (и все комбинации и субкомбинации пределов и конкретных чисел атомов углерода и гетероатомов). Гетероцикл может содержать 1-4 кольцевых гетероатомов независимо выбранных из N, O, P или S. Один или более атомов N, O или S в гетероцикле могут быть окисленными. Моноциклический гетероцикл предпочтительно содержит 3-7 членов кольца (например, 2-6 атомов углерода и 1-3 гетероатомов, независимо выбранных из N, O, P или S). Кольцо, которое содержит гетероатом, может быть ароматическим или неароматическим. Если не указано иначе, то гетероцикл, соединен с его боковой группой по любому гетероатому или атому углерода, что приводит к обеспечению стабильной структуры.
Гетероциклы описаны Paquette, «Principles of Modern Heterocyclic Chemistry» (W.A. Benjamin, New York, 1968), в частности главы 1, 3, 4, 6, 7 и 9; «The Chemistry of Heterocyclic Compounds, A series of Monographs» (John Wiley & Sons, New York, 1950 до настоящего времени), в частности тома 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. 82:5566 (1960). Примеры «гетероциклических» групп включают, в качестве примера и без ограничения, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, фукозил, азиридинил, азетидинил, оксиранил, оксетанил и тетрагидрофуранил.
Гетероциклическая группа, в виде заместителя или в виде части другой замещающей группы, в том случае, когда она замещена, может быть замещена одной или более группами, предпочтительно 1-2 группами, включая, не ограничиваясь этим, -С1-С8 алкил, -С2-С8 алкенил, -С2-С8 алкинил, атом галогена, -О-(С1-С8 алкил), -О-(С2-С8 алкенил), -О-(С2-С8 алкинил), арил, -С(О)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбран из -Н, -С1-С8 алкила, -С2-С8 алкенила, -С2-С8 алкинила или арила.
В качестве примера и без ограничения связанные с углеродом гетероциклы, могут быть соединены в следующих положениях: положение 2, 3, 4, 5 или 6 пиридина; положение 3, 4, 5 или 6 пиридазина; положение 2, 4, 5 или 6 пиримидина; положение 2, 3, 5 или 6 пиразина; положение 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола; положение 2, 4 или 5 оксазола, имидазола или тиазола; положение 3, 4 или 5 изоксазола, пиразола или изотиазола; положение 2 или 3 азиридина; или положение 2, 3 или 4 азетидина. Приведенные в качестве примера связанные с углеродом гетероциклы могут включать 2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3-пиразинил, 5-пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил.
В качестве примера и без ограничения связанные с азотом гетероциклы, могут быть соединены в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина или 1Н-индазола; положении 2 изоиндола или изоиндолина, и положении 4 морфолина. Еще более типичные, связанные с азотом гетероциклы могут включать 1-азиридил, 1-азетидил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1-пиперидинил.
Если не указано иначе, то термин «карбоцикл» относится к замещенной или незамещенной, насыщенной или ненасыщенной неароматической моноциклической кольцевой системе, содержащей 3-6 кольцевых атомов (и все комбинации и субкомбинации пределов и конкретных чисел атомов углерода), где все кольцевые атомы являются атомами углерода.
Карбоциклические группы, в виде заместителя или в виде части другой замещающей группы, в том случае, когда они замещены, могут быть замещены, например, одной или более группами, предпочтительно 1 или 2 группами (и любыми дополнительными заместителями, выбранными из атомов галогена), включая, не ограничиваясь этим, атом галогена, -С1-С8 алкил, -С2-С8 алкенил, -С2-С8 алкинил, -О-(С1-С8 алкил), -О-(С2-С8 алкенил), -О-(С2-С8 алкинил), арил, -С(О)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -NH2, -NH(R’), -N(R’)2 и -CN, где каждый R’ независимо выбран из -Н, -С1-С8 алкила, -С2-С8 алкенила, -С2-С8 алкинила или арила.
Примеры моноциклических карбоциклических заместителей включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогептил, циклооктил, 1,3-циклогексадиенил, 1,4-циклогексадиенил, 1,3-циклогептадиенил, 1,3,5-циклогептатриенил и циклооктадиенил.
В том случае, если переменная имеется более чем один раз в любом заместителе или в любой формуле, то его определение в каждом случае является независимым по отношению к определению в каждом другом случае. Комбинации заместителей и/или переменных допустимы только, если такие комбинации приводят к стабильным соединениям.
Если не указано иначе по контексту, то термин «гифен»(-) означает точку присоединения к боковой молекуле. Следовательно, термин «-(С1-С10 алкилен)арил» или «-С1-С10 алкилен(арил)» относится к С1-С10 алкиленовому радикалу, имеющему значения, определенные выше, где алкиленовый радикал соединен с боковой молекулой по любому из атомов углерода алкиленового радикала, и один из атомов водорода, соединенный с атомом углерода алкиленового радикала, замещен арильным радикалом, имеющим значения, определенные выше.
В тех случаях, когда определенная группа «замещена», то группа может иметь один или более заместителей, предпочтительно от одного до пяти заместителей, более предпочтительно от одного до трех заместителей, наиболее предпочтительно от одного до двух заместителей, независимо выбранных из приведенного перечня заместителей. Однако, в общем, группа имеет любое число заместителей, выбранных из атома галогена.
Подразумевается, что определение любого заместителя или переменной в определенном положении в молекуле не зависит от его определений в другом месте в этой молекуле. Очевидно, понятно, что заместители и характер замещения в соединениях по данному изобретению могут быть выбраны специалистами в данной области для получения соединений, которые являются активными и химически стабильными, которые можно легко синтезировать методами, известными в данной области, а также способами, приведенными в данном документе.
Термин «фармацевтически приемлемый» означает разрешенный регулирующим органом федерального или правительственного значения, или входящий в Фармакопею США, или другую широко признанную фармакопею, для применения у животных и, в частности, у людей. Термин «фармацевтически совместимый ингредиент» относится к фармацевтически приемлемому разбавителю, адъюванту, наполнителю или носителю, с которым вводят аналог фукозы.
Выражение «небольшие электроноакцепторные группы» относится к любому заместителю, который имеет более высокую электроотрицательность в месте присоединения заместителя, чем, например, атом водорода или гидроксильная группа, или по сравнению с заместителем, находящимся в фукозе в этом месте. В общем небольшая электроноакцепторная группа содержит 10 или менее атомов (других чем атом водорода) и включает группы, такие как нитро; циано и цианоалкил (например, -CH2CH2CN); галогены; ацетилен или другие алкины или галогеналкины (например, -C≡CCF3); алкены или галогеналкены; аллены; карбоновые кислоты, сложные эфиры, амиды и их галогензамещенные формы; сульфоновая и фосфорная кислоты, сложные эфиры и амиды; и их галогензамещенные формы; галогеналкильные группы (например, -CF3, -CHF2, -CH2CF3), ацил и галогенацил (например, -С(О)СН3 и -C(O)CF3); алкилсульфонил и галогеналкилсульфонил (например, -S(O)2алкил и -S(O)2галогеналкил); арилокси (например, фенокси и замещенный фенокси); аралкилокси (например, бензилокси и замещенный бензилокси) и оксираны. Предпочтительные электроноакцепторные группы представляют группы, содержащие 8, 7 или 6, или менее атомов (других, чем атом водорода).
Как правило, аналоги фукозы представляют по существу чистые соединения, не содержащие нежелательных примесей. Это означает, что аналог обычно имеет чистоту, по меньшей мере, 50% мас./мас. (масса/масса), а также в основном не содержит интерферирующих белков и других примесей. В некоторых случаях агенты имеют чистоту, по меньшей мере, 80% мас./мас., более предпочтительно 90% или примерно 95% мас./мас. С использованием обычных методов очистки можно получить гомогенный продукт с чистотой, по меньшей мере, 99%.
Общая информация
Изобретение относится к способам и композициям для снижения фукозилирования белка у животных. Способы частично основаны на неожиданных результатах, представленных в разделе «Примеры», которые показывают, что введение аналога фукозы субъекту (например, млекопитающему) приводит к синтезу антитела или производного антитела, имеющего пониженное фукозилирование кора, и другие белки также имеют пониженный уровень фукозилирования. Выражение «пониженное фукозилирование» по отношению к белкам, в общем, относится к пониженному присоединению фукозы к гликанам через α(1,2)-, α(1,3)-, α(1,4)- и α(1,6)-связи. «Фукозилирование кора» по отношению к антителу относится к присоединению фукозы («фукозилированию») к N-ацетилглюкозамину («GlcNAc») в редуцирующем конце N-связанного гликана антитела. «Пониженное фукозилирование кора» по отношению к антителу относится к уменьшению количества фукозы, связанной с N-ацетилглюкозамином («GlcNAc») в редуцирующем конце N-связанного гликана антитела по сравнению с необработанным животным.
В различных аспектах, описанных в данном документе, животное, которому вводят аналог фукозы, как правило, представляет собой млекопитающее и предпочтительно является человеком. Следовательно, изобретение также относится к способам и композициям для снижения фукозилирования белка у млекопитающего, такого как человек.
В других аспектах изобретение относится к фармацевтическим композициям аналогов фукозы и фармацевтических наполнителей, в которых эффективное количество аналога(в) фукозы находится в смеси с наполнителями, подходящими для введения животному. В некоторых вариантах осуществления аналог фукозы находится в сухой форме (например, лиофилизированной), необязательно со стабилизаторами, которые повышают стабильность композиции при длительном хранении. В некоторых вариантах осуществления фармацевтическую композицию аналогов фукозы и фармацевтических наполнителей формулируют для введения млекопитающему. В некоторых дополнительных вариантах осуществления фармацевтические композиции аналогов фукозы и фармацевтических наполнителей формулируют для введения человеку.
В некоторых вариантах осуществления фукозилирование сложных N-гликозид-связанных сахарных цепей, связанных с Fc-областью (или доменом) антитела, снижается. В том смысле, в котором в данном документе используется это выражение, «сложная N-гликозид-связанная сахарная цепь», как правило, связана с аспарагином 297 (согласно системе нумерации Kabat), хотя, сложная N-гликозид-связанная сахарная цепь может быть связана с другими остатками аспарагина. В том смысле, в котором в данном документе используется это выражение «сложная N-гликозид-связанная сахарная цепь» имеет биантенную составную сахарную цепь, в основном имеющую следующую структуру:
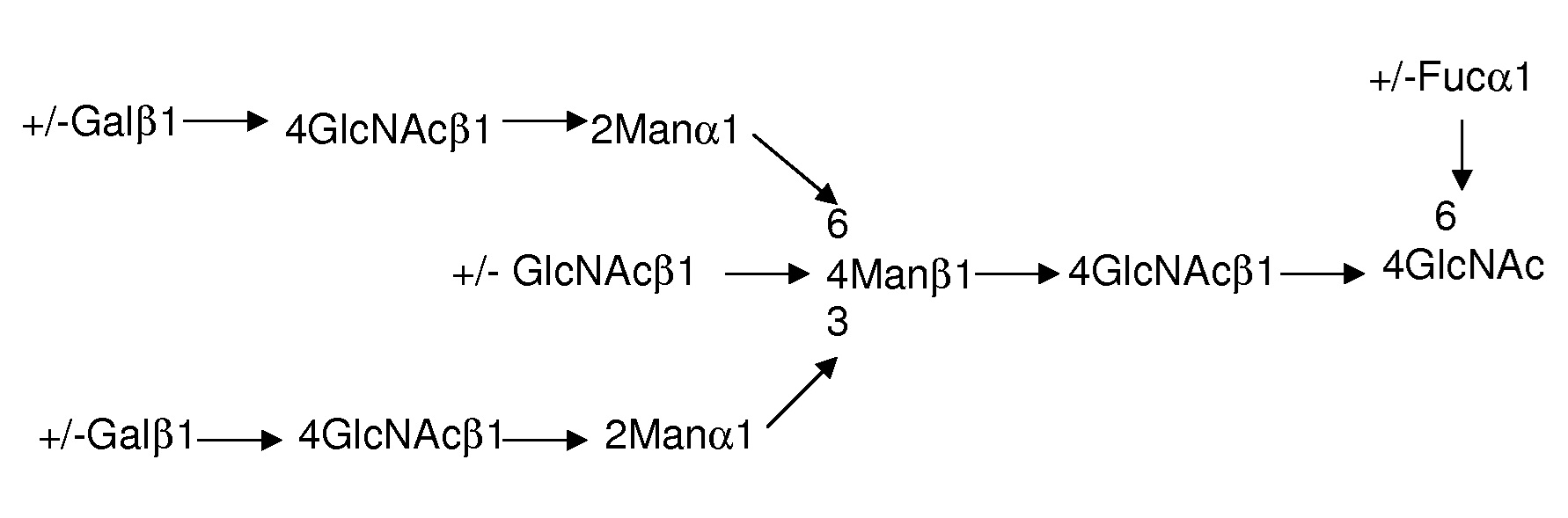
где ± указывает, что молекула сахара может присутствовать или отсутствовать, и число указывает положение связей между молекулами сахара. В приведенной выше структуре конец сахарной цепи, который связан с аспарагином, называется редуцирующим концом (справа), и противоположная сторона называется нередуцирующим концом. Фукоза обычно связана с N-ацетилглюкозамином («GlcNAc») редуцирующего конца, обычно α-1,6-связью (положение 6 GlcNAc связано с положением 1 фукозы). Сокращенное обозначение «Gal» относится к галактозе, и «Man» относится к маннозе.
«Сложная N-гликозид-связанная сахарная цепь» исключает высокоманнозный тип сахарной цепи, в котором только манноза включается в нередуцирующий конец структуры кора, но она включает 1) сложный тип, в котором сторона нередуцирующего конца структуры кора имеет одно или более разветвлений галактоза-N-ацетилглюкозамина (также относящегося к «gal-GlcNAc»), и сторона нередуцирующего конца Gal-GlcNAc необязательно содержит сиаловую кислоту, двурассекающую N-ацетилглюкозамин или тому подобное, или 2) гибридный тип, в котором сторона нередуцирующего конца структуры кора имеет разветвления высокоманнозной N-гликозид-связанной сахарной цепи и сложную N-гликозид-связанную сахарную цепь.
В некоторых вариантах осуществления «сложная N-гликозид-связанная сахарная цепь» включает сложный тип, в котором сторона нередуцирующего конца структуры кора имеет ноль, одно или более разветвлений галактоза-N-ацетилглюкозамина (также относящегося к «gal-GlcNAc»), и сторона нередуцирующего конца Gal-GlcNAc необязательно дополнительно содержит структуру, такую как сиаловая кислота, двурассекающую N-ацетилглюкозамин или тому подобное, но исключает цепи с высокоманнозным компонентом.
Согласно настоящему изобретению, как правило, только небольшое количество фукозы включается в сахарную цепь(и) (например, в гликан или сложные N-гликозид-связанные сахарные цепи) после введения аналога фукозы. Например, в различных вариантах осуществления менее чем примерно 60%, менее чем примерно 50%, менее чем примерно 40%, менее чем примерно 30%, менее чем примерно 20%, менее чем примерно 15%, менее чем примерно 10%, менее чем примерно 5% или менее чем примерно 1% антител в сыворотке крови животного (например, млекопитающего, такого как человек) являются фукозилированными в коре по сравнению с животным, не получившим аналог фукозы. В некоторых вариантах осуществления по существу отсутствуют (т.е. менее 0,5%) антитела в сыворотке крови животного, которые фукозилированы в коре, по сравнению с животным, не получавшим аналог фукозы.
В некоторых вариантах осуществления фукозилирование белков снижено примерно на 60%, примерно на 50%, примерно на 40%, примерно на 30%, примерно на 20%, примерно на 15%, примерно на 10%, примерно на 5% или примерно на 1%, для клеточных поверхностных белков у животного (например, млекопитающего, такого как человек), которые фукозилируются, по сравнению с животным, не получавшим аналог фукозы. В некоторых вариантах осуществления фукозилирование белков через α(1,2)-связь снижено примерно на 60%, примерно на 50%, примерно на 40%, примерно на 30%, примерно на 20%, примерно на 15%, примерно на 10%, примерно на 5% или примерно на 1%, для клеточных поверхностных белков у животного (например, млекопитающего, такого как человек), которые фукозилируются, по сравнению с животным, не получавшим аналог фукозы.
В некоторых вариантах осуществления фукозилирование белков через α(1,3)-связь снижено примерно на 60%, примерно на 50%, примерно на 40%, примерно на 30%, примерно на 20%, примерно на 15%, примерно на 10%, примерно на 5% или примерно на 1%, для клеточных поверхностных белков у животного (например, млекопитающего, такого как человек), которые фукозилируются, по сравнению с животным, не получавшим аналог фукозы. В некоторых вариантах осуществления фукозилирование белков через α(1,4)-связь снижено примерно на 60%, примерно на 50%, примерно на 40%, примерно на 30%, примерно на 20%, примерно на 15%, примерно на 10%, примерно на 5% или примерно на 1%, для клеточных поверхностных белков у животного (например, млекопитающего, такого как человек), которые фукозилируются, по сравнению с животным, не получавшим аналог фукозы.
В некоторых вариантах осуществления фукозилирование белков через α(1,6)-связь снижено примерно на 60%, примерно на 50%, примерно на 40%, примерно на 30%, примерно на 20%, примерно на 15%, примерно на 10%, примерно на 5% или примерно на 1%, для клеточных поверхностных белков у животного (например, млекопитающего, такого как человек), которые фукозилируются, по сравнению с животным, не получавшим аналог фукозы.
В некоторых вариантах осуществления фукозилирование лейкоцитов в сыворотке крови животного (например, млекопитающего, такого как человек) снижено, по меньшей мере, примерно на 60%, по меньшей мере, примерно на 50%, по меньшей мере, примерно на 40%, по меньшей мере, примерно на 30%, по меньшей мере, примерно на 20%, по меньшей мере, примерно на 15%, по меньшей мере, примерно на 10% или, по меньшей мере, примерно на 5% по сравнению с животным, не получавшим аналог фукозы. В некоторых вариантах осуществления фукозилирование через α(1,3)-связь лейкоцитов в сыворотке крови животного (например, млекопитающего, такого как человек) снижено, по меньшей мере, примерно на 60%, по меньшей мере, примерно на 50%, по меньшей мере, примерно на 40%, по меньшей мере, примерно на 30%, по меньшей мере, примерно на 20%, по меньшей мере, примерно на 15%, по меньшей мере, примерно на 10% или, по меньшей мере, примерно на 5% по сравнению с животным, не получавшим аналог фукозы. В некоторых вариантах осуществления фукозилирование через α(1,4)-связь лейкоцитов в сыворотке крови животного (например, млекопитающего, такого как человек) снижено, по меньшей мере, примерно на 60%, по меньшей мере, примерно на 50%, по меньшей мере, примерно на 40%, по меньшей мере, примерно на 30%, по меньшей мере, примерно на 20%, по меньшей мере, примерно на 15%, по меньшей мере, примерно на 10% или, по меньшей мере, примерно на 5% по сравнению с животным, не получавшим аналог фукозы.
В некоторых вариантах осуществления фукозилирование антител в сыворотке крови животного (например, млекопитающего, такого как человек) снижено, по меньшей мере, примерно на 60%, по меньшей мере, примерно на 50%, по меньшей мере, примерно на 40%, по меньшей мере, примерно на 30%, по меньшей мере, примерно на 20%, по меньшей мере, примерно на 15%, по меньшей мере, примерно на 10% или, по меньшей мере, примерно на 5% по сравнению с животным, не получавшим аналог фукозы.
В некоторых вариантах осуществления только небольшое количество аналога фукозы (или метаболита или продукта аналога фукозы) включается в гликаны (например, в сложную N-гликозид-связанную сахарную цепь(и)) антитела, производного антитела или другие гликаны белков. Например, в различных вариантах осуществления менее чем примерно 60%, менее чем примерно 40%, менее чем примерно 30%, менее чем примерно 20%, менее чем примерно 15%, менее чем примерно 10%, менее чем примерно 5% или менее чем примерно 1% аналога фукозы (или метаболита или продукта аналога фукозы) включается в гликаны антител в сыворотке крови животного по сравнению с животным, не получавшим аналог фукозы. В некоторых вариантах осуществления менее чем примерно 60%, менее чем примерно 40%, менее чем примерно 30%, менее чем примерно 20%, менее чем примерно 15%, менее чем примерно 10%, менее чем примерно 5% или менее чем примерно 1% аналога фукозы (или метаболита или продукта аналога фукозы) включается в гликаны клеточных поверхностных белков животного по сравнению с животным, не получавшим аналог фукозы.
В некоторых вариантах осуществления менее чем примерно 60%, менее чем примерно 40%, менее чем примерно 30%, менее чем примерно 20%, менее чем примерно 15%, менее чем примерно 10%, менее чем примерно 5% или менее чем примерно 1% аналога фукозы (или метаболита или продукта аналога фукозы) включается в гликаны лейкоцитов в сыворотке крови животного по сравнению с животным, не получавшим аналог фукозы.
Аналоги фукозы
Подходящие аналоги фукозы для способов по настоящему изобретению (определенные ниже в виде формул I, II, II, IV, V или VI) представляют собой такие соединения, которые можно безопасно вводить млекопитающему в количестве, эффективном для ингибирования фукозилирования кора сложных N-гликозид-связанных сахарных цепей антител или производных антител. Аналоги фукозы описаны в опубликованной заявке на патент США 2009-0317869, которые снижают включение фукозы в сложные N-гликозид-связанные сахарные цепи антител или производных антител, продуцированных клетками-хозяевами в условиях in vitro. Аналог фукозы можно вводить животному-субъекту (например, млекопитающему) парентеральным, пероральным или другим подходящим путем введения.
В некоторых вариантах осуществления аналог фукозы (или внутриклеточный метаболит или продукт аналога фукозы) ингибирует фермент(ы) на пути утилизации фукозы. (В том смысле, в котором в данном документе используется термин «внутриклеточный метаболит», он представляет, например, GDP-модифицированный аналог или полностью или частично деэтерифицированный аналог. Продукт может представлять, например, полностью или частично деэтерифицированный аналог.) Например, аналог фукозы (или внутриклеточный метаболит или продукт аналога фукозы) может ингибировать активность фукокиназы или GDP-фукозопирофосфорилазы. В некоторых вариантах осуществления аналог фукозы (или внутриклеточный метаболит или продукт аналога фукозы) ингибирует фукозилтрансферазу (такую, как 1,2-фукозилтрансфераза, 1,3-фукозилтрансфераза, 1,4-фукозилтрансфераза или 1,6-фукозилтрансфераза (например, белок FUT8)). В некоторых вариантах осуществления аналог фукозы (или внутриклеточный метаболит или продукт аналога фукозы) может ингибировать активность фермента на синтетическом пути de novo для фукозы. Например, аналог фукозы (или внутриклеточный метаболит или продукт аналога фукозы) может ингибировать активность GDP-манноза-4,6-дегидратазы и/или GDP-фукозосинтетазы. В некоторых вариантах осуществления аналог фукозы (или внутриклеточный метаболит или продукт аналога фукозы) может ингибировать транспортер фукозы (например, транспортер GDP-фукозы).
В некоторых вариантах осуществления аналог фукозы имеет следующую формулу (I) или (II):
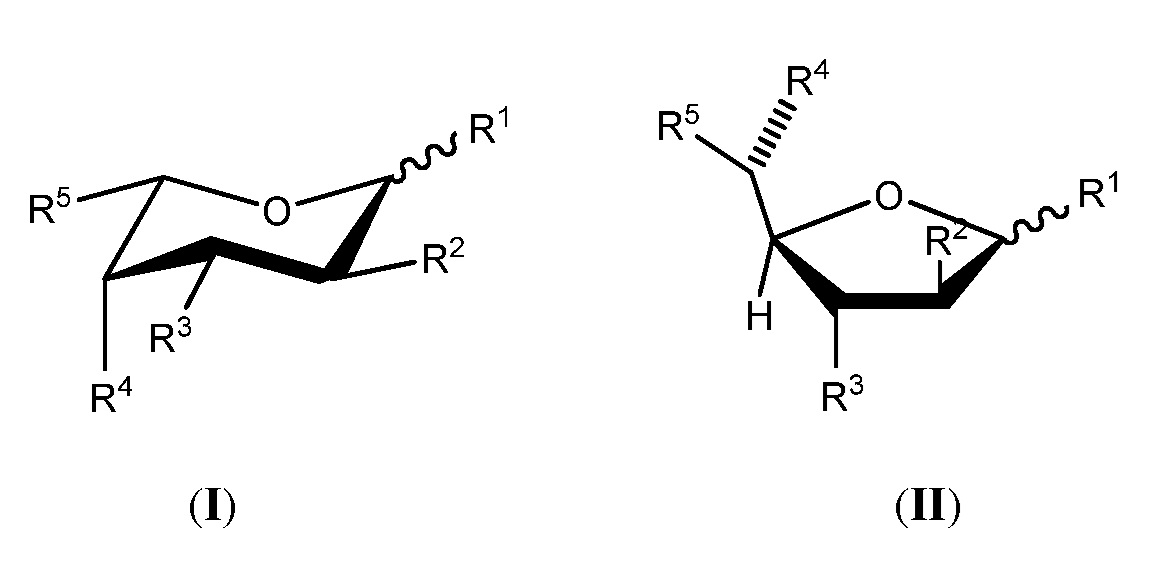
или биологически приемлемая соль или сольват аналога, где каждая из формул (I) или (II) может представлять альфа- или бета-аномер, или соответствующую альдозную форму. В приведенных выше формулах каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О)арила, -ОС(О)гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла), -ОС(О)С2-С10 алкинилен(гетероцикла), -ОС(О)СН2О(СН2СН2О)nCH3, -ОС(О)СН2СН2О(СН2СН2О)nCH3, -О-три-С1-С3 алкилсилила, -ОС1-С10 алкила, -ОСН2ОС(О) алкила, -ОСН2ОС(О) алкенила, -ОСН2ОС(О) алкинила, -ОСН2ОС(О) арила, -ОСН2ОС(О) гетероцикла, -ОСН2ОС(О)О алкила, -ОСН2ОС(О)О алкенила, -ОСН2ОС(О)О алкинила, -ОСН2ОС(О)О арила и -ОСН2ОС(О)О гетероцикла, где каждый n представляет целое число, независимо выбранное из 0-5; и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH2C≡CH, -C(O)OCH3, -CH(OAc)CH3, -CN, -CH2CN, -CH2X (где Х представляет F, Br, Cl или I), -CHX2 (где каждый Х представляет F, Br, Cl или I) и метоксирана.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой: каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О) арила, -ОС(О)гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)СН2О(СН2СН2О)nCH3, -ОС(О)СН2СН2О(СН2СН2О)nCH3, -О-три-С1-С3 силила, -ОС1-С10 алкила, -ОСН2ОС(О) алкила, -ОСН2ОС(О)О алкила, -ОСН2ОС(О) арила и -ОСН2ОС(О)О арила, где каждый n представляет целое число, независимо выбранное из 0-5; и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH2C≡CH, -C(O)OCH3, -CH(OAc)CH3, -CN, -CH2CN, -CH2X (где Х представляет F, Br, Cl или I), -CHX2 (где каждый Х представляет F, Br, Cl или I) и метоксирана.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С1-С10 алкенилен(гетероцикла) и -ОС(О)С2-С10 алкинилен(гетероцикла); и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH2C≡CH, -C(O)OCH3, -CH(OAc)CH3, -CN, -CH2CN, -CH2X (где Х представляет F, Br, Cl или I), -CHX2 (где каждый Х представляет F, Br, Cl или I) и метоксирана.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -О-три-С1-С3силила и -ОС1-С10 алкила; и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH2C≡CH, -C(O)OCH3, -CH(OAc)CH3, -CN, -CH2CN, -CH2X (где Х представляет F, Br, Cl или I) и метоксирана.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОСН2ОС(О)алкила, -ОСН2ОС(О)алкенила, -ОСН2ОС(О)алкинила, -ОСН2ОС(О)арила, -ОСН2ОС(О)гетероцикла, -ОСН2ОС(О)О алкила, -ОСН2ОС(О)О алкенила, -ОСН2ОС(О)О алкинила, -ОСН2ОС(О)О арила и -ОСН2ОС(О)О гетероцикла; и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH2C≡CH, -C(O)OCH3, -CH(OAc)CH3, -CN, -CH2CN, -CH2X (где Х представляет F, Br, Cl или I), -CHX2 (где каждый Х представляет F, Br, Cl или I) и метоксирана.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла) и -ОС(О)С2-С10 алкинилен(гетероцикла); и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH2C≡CH, -C(O)OCH3, -CH(OAc)CH3, -CN, -CH2CN и метоксирана.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О)арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла) и -ОС(О)С2-С10 алкинилен(гетероцикла); и R5 выбран из группы, состоящей из -CH2F,-CH2I, CH2Br и -CH2Cl.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла) и -ОС(О)С2-С10 алкинилен(гетероцикла); и R5 выбран из группы, состоящей из -CHF2, CHBr2 и -CHCl2.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла) и -ОС(О)С2-С10 алкинилен(гетероцикла); и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3 и -CH2C≡CH.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла) и -ОС(О)С2-С10 алкинилен(гетероцикла); и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -(CH2)n(CN) (где n=0 или 1) и -СО(О)СН3.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла) и -ОС(О)С2-С10 алкинилен(гетероцикла); и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH2CN и -СО(О)СН3.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла) и -ОС(О)С2-С10 алкинилен(гетероцикла); и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH(OAc)CH3, -CH2CN и -СО(О)СН3.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой R5 имеет значения, определенные выше, и каждый из R1-R4представляет гидроксил или -ОС(О)С1-С10алкил.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой R5 имеет значения, определенные выше, и каждый из R1-R4представляет гидроксил или -ОАс.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН и -ОС(О)С1-С10 алкила; и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH(OAc)CH3, -CH2CN, -СО(О)СН3, -CH2F и -CHF2.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН и -ОАс; и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH(OAc)CH3, -CH2CN, -СО(О)СН3, -CH2F и -CHF2.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН и -ОС(О)С1-С10 алкила; и R5 выбран из группы, состоящей из -C≡CH, -CH2F и -CHF2.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН и -ОАс; и R5 выбран из группы, состоящей из -C≡CH, -CH2F и -CHF2.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН и -ОС(О)С1-С10 алкила; и R5 представляет -C≡CH.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН и -ОАс; и R5 представляет -C≡CH.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН и -ОС(О)С1-С10 алкила; и R5 представляет -CHF2.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН и -ОАс; и R5 представляет -CHF2.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН или сложного эфира, выбранного из группы, состоящей из -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла), -ОС(О)С2-С10 алкинилен(гетероцикла), -ОС(О)СН2О(СН2СН2О)nCH3 (где n равен 0-5) и -ОС(О)СН2СН2О(СН2СН2О)nCH3 (где n равен 0-5); и R5 выбран из группы, состоящей из -C≡CH, -C≡CCH3, -CH2C≡СН, -С(О)ОСН3, -CH(OAc)CH3, -CN, -CH2CN, -CH2X (где Х представляет F, Br, Cl или I) и -СНХ2 (где каждый Х представляет F, Br, Cl или I) и метоксирана.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН или -ОС(О)С1-С10 алкила; и R5 представляет -СН2Х (где Х представляет F, Br, Cl или I).
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН или -ОАс; и R5 представляет -СН2Х (где Х представляет F, Br, Cl или I).
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН или -ОС(О)С1-С10 алкила; и R5 представляет -CH2Br.
В некоторых вариантах осуществления аналог фукозы имеет формулу (I) или (II), в которой каждый из R1-R4 независимо выбран из группы, состоящей из -ОН или -ОАс; и R5 представляет -CH2Br.
В некоторых вариантах осуществления аналог фукозы имеет молекулярную массу менее чем 2000 дальтон. В других вариантах осуществления аналог фукозы имеет молекулярную массу менее чем 1000 дальтон.
В некоторых вариантах осуществления R5 является незамещенным.
В некоторых вариантах осуществления каждый из R1-R4является незамещенным.
В некоторых вариантах осуществления R5 не является кетоном (-С(О)алкилом).
В некоторых вариантах осуществления R5 не является -СН(СН3)ОАс.
В некоторых вариантах осуществления R5 не является -СН(СН3)ОАс, когда каждый из R1-R4 представляет -ОАс.
В некоторых вариантах осуществления R5 не является -С≡СН.
В некоторых вариантах осуществления R5 не является -С≡СН, когда любой из R1-R4 представляет -ОАс.
В некоторых вариантах осуществления R5 не является -С≡СН, когда любой из R1-R4 представляет -ОС(О)алкил.
В некоторых вариантах осуществления R5 не является -С≡СН, когда каждый из R1-R4 представляет -ОС(О)алкил.
В некоторых вариантах осуществления R5 не является -С≡СН3, когда каждый из R1-R4 представляет ОН.
В некоторых вариантах осуществления аналог фукозы представляет собой перацетат алкинилфукозы. В некоторых вариантах осуществления аналог фукозы представляет собой триацетат алкинилфукозы. В некоторых вариантах осуществления аналог фукозы представляет собой диацетат алкинилфукозы. В некоторых вариантах осуществления аналог фукозы представляет собой смесь перацетата алкинилфукозы, триацетата алкинилфукозы и диацетата алкинилфукозы.
В некоторых вариантах осуществления аналог фукозы представляет собой смесь перацетата алкинилфукозы, триацетата алкинилфукозы, диацетата алкинилфукозы и моноацетата алкинилфукозы.
В любом из различных вариантов осуществления аналог фукозы не является фукозой. В некоторых вариантах осуществления аналог фукозы не является перацетатом алкинилфукозы. В некоторых вариантах осуществления аналог фукозы не является галактозой или L-галактозой.
В другой группе вариантов осуществления аналог фукозы имеет следующую формулу (III) или (IV):

или его биологически приемлемая соль или сольват, где каждая из формул (III) или (IV) может представлять альфа- или бета-аномер, или соответствующую альдозную форму; и где:
каждый из R1-R4 независимо выбран из группы, состоящей из атомов фтора, хлора, -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинил(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла), -ОС(О)С2-С10 алкинилен(гетероцикла), -ОСН2ОС(О)алкила, -ОСН2ОС(О)О алкила, -ОСН2ОС(О)арила, -ОСН2ОС(О)О арила, -OC(O)CH2O(CH2CH2O)nCH3, -OC(O)CH2CH2O(CH2CH2O)nCH3, -О-три-С1-С3 алкилсилила и -ОС1-С10 алкила, где каждый n представляет целое число, независимо выбранное из 0-5; и
каждый из R2a и R3a независимо выбран из группы, состоящей из H, F и Cl;
R5 выбран из группы, состоящей из -СН3, -CHF2, -CH=C=H2, -C≡CH, -C≡CCH3, -CH2C≡CH, -C(O)OCH3, -CH(OAc)CH3, -CN, -CH2CN, -CH2X (где Х представляет F, Br, Cl или I) и метоксирана.
где, когда R5 является другим, чем -CH=С=CH2, -CH2F или -CHF2, то тогда, по меньшей мере, один из R1, R2, R3, R2a и R3a является атомом фтора или хлора.
В некоторых вариантах осуществления формул (III) или (IV), R1 является F.
В некоторых вариантах осуществления формул (III) или (IV), R2 является F.
В некоторых вариантах осуществления формул (III) или (IV), R3 является F.
В некоторых вариантах осуществления формул (III) или (IV), R1 и R2каждый представляет F.
В некоторых вариантах осуществления формул (III) или (IV), R2 и R2a каждый представляет F.
В некоторых вариантах осуществления формул (III) или (IV), R1, R3 и R4каждый независимо выбран из -ОН и -ОС(О)С1-С10 алкила; R2представляет F; и R5является -СН3.
В некоторых вариантах осуществления формул (III) или (IV), R1, R3 и R4каждый независимо выбран из -ОН и -ОАс; R2представляет F; и R5является -СН3.
В некоторых вариантах осуществления формул (III) или (IV), R1, R3 и R4каждый независимо выбран из -ОН и -ОС(О)С1-С10 алкила; R2представляет F; и R2a и R3a каждый является Н; и R5представляет -СН3.
В некоторых вариантах осуществления формул (III) или (IV), R1, R3 и R4каждый независимо выбран из -ОН и -ОАс; R2представляет F; и R2a и R3a каждый является Н; и R5представляет -СН3.
В некоторых вариантах осуществления формул (III) или (IV), R1, R2, R3 и R4каждый независимо выбран из -ОН и -ОС(О)С1-С10 алкила; R2a и R3a каждый является Н; и R5представляет -CHF2.
В некоторых вариантах осуществления формул (III) или (IV), R1, R2, R3 и R4каждый независимо выбран из -ОН и -ОАс; R2a и R3a каждый является Н; и R5представляет - CHF2.
В некоторых вариантах осуществления формул (III) или (IV), R1, R2, R3 и R4каждый независимо выбран из -ОН и -ОС(О)С1-С10 алкила; R2a и R3a каждый является Н; и R5представляет -CH2F.
В некоторых вариантах осуществления формул (III) или (IV), R1, R2, R3 и R4каждый независимо выбран из -ОН и -ОАс; R2a и R3a каждый является Н; и R5представляет -CH2F.
В другой группе вариантов осуществления аналог фукозы имеет следующую формулу (V) или (VI):
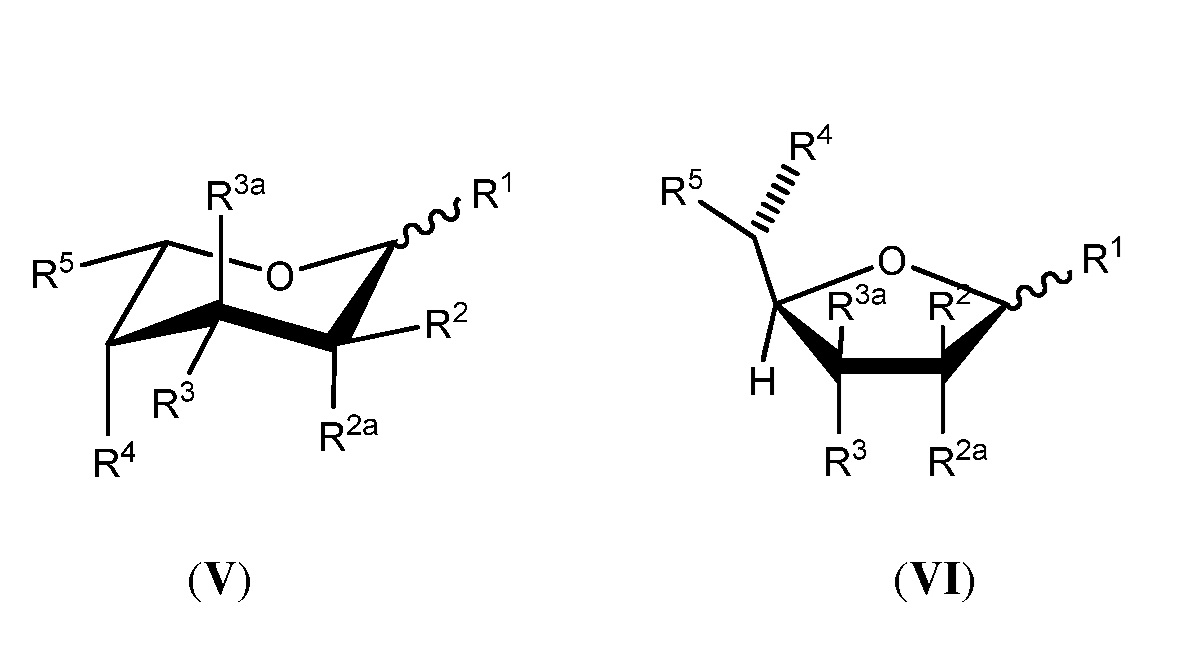
или его биологически приемлемая соль или сольват, где каждая из формул (III) или (IV) может представлять альфа- или бета-аномер или соответствующую альдозную форму; и где:
каждый из R1, R2, R2a, R3, R3a и R4 независимо выбран из группы, состоящей из -ОН, -ОС(О)Н, -ОС(О)С1-С10 алкила, -ОС(О)С2-С10 алкенила, -ОС(О)С2-С10 алкинила, -ОС(О) арила, -ОС(О) гетероцикла, -ОС(О)С1-С10 алкилен(арила), -ОС(О)С2-С10 алкенилен(арила), -ОС(О)С2-С10 алкинилен(арила), -ОС(О)С1-С10 алкилен(гетероцикла), -ОС(О)С2-С10 алкенилен(гетероцикла), -ОС(О)С2-С10 алкинилен(гетероцикла), -ОСН2ОС(О) алкила, -ОСН2ОС(О)О алкила, -ОСН2ОС(О) арила, -ОСН2ОС(О)О арила, -OC(O)CH2O(CH2CH2O)nCH3, -OC(O)CH2CH2O(CH2CH2O)nCH3, -О-три-С1-С3 алкилсилила, -ОС1-С10 алкила и небольшой электроноакцепторной группы, где каждый n представляет целое число, независимо выбранное из 0-5;
R5 представляет член, выбранный из группы, состоящей из -СН3, -СНХ2, -СН2Х, -СН(Х’)-С1-С4 алкила, незамещенного или замещенного атомом галогена, -СН(Х’)-С2-С4 алкена, незамещенного или замещенного атомом галогена, -СН(Х’)-С2-С4 алкина, незамещенного или замещенного атомом галогена, -СН=С(R10)(R11), -C(CH3)=C(R12)(R13), -C(R14)=C=C(R15)(R16), -C3-карбоцикла, незамещенного или замещенного метилом или атомом галогена, -CH(X’)-C3карбоцикла, незамещенного или замещенного метилом или атомом галогена, -C3-гетероцикла, незамещенного или замещенного метилом или атомом галогена, -CH(X’)-C3гетероцикла, незамещенного или замещенного метилом или атомом галогена, -CH2N3, -CH2CH2N3 и бензилоксиметила, или R5 является небольшой электроноакцепторной группой; где R10представляет атом водорода или С1-С3 алкил, незамещенный или замещенный атомом галогена; R11представляет С1-С3 алкил, незамещенный или замещенный атомом галогена; R12представляет атом водорода, атом галогена или С1-С3 алкил, незамещенный или замещенный атомом галогена; R13представляет атом водорода или С1-С3 алкил, незамещенный или замещенный атомом галогена; R14представляет атом водорода или метил; R15и R16независимо выбраны из атома водорода, метила и атома галогена; Х представляет атом галогена; X’ представляет атом галогена или атом водорода; и
дополнительно каждый из R1, R2, R2a, R3 и R3a необязательно представляет атом водорода; необязательно два из R1, R2, R2a, R3 и R3a объединяются по смежным атомам углерода с образованием двойной связи между указанными смежными атомами углерода; и
при условии что, по меньшей мере, один из R1, R2, R2a, R3, R3a, R4 и R5 является небольшой электроноакцепторной группой, или R5содержит атом галогена, ненасыщенную связь, карбоцикл, гетероцикл или азид, за исключением, когда (i) R2и R2a оба являются атомами водорода, (ii) R3и R3a оба являются атомами водорода, (iii) R1является атомом водорода, (iv) имеется двойная связь между указанными смежными атомами углерода или (v) R5представляет бензилоксиметил; и
где белок, антитело или производное антитела, продуцированные в условиях in vivo, имеют пониженное фукозилирование по сравнению с белком, антителом или производным антитела, продуцируемым в условиях in vivo, в отсутствии аналога фукозы.
В некоторых вариантах осуществления формул (V) или (VI), R2aи R3a каждый представляет атом водорода.
В некоторых вариантах осуществления формул (V) или (VI), R5выбран из группы, состоящей из -CH3, -CH2CH3, -CH2C≡CH, -CH=CHCH3, циклопропила, оксирана, оксирана, замещенного метилом, -CH2F, -CH2Cl, -CH2Br, -CH2I, -CHF2, -CH=C=CH2, -CH2N3 и -CH2CH2N3.
В некоторых вариантах осуществления формул (V) или (VI), небольшая электроноакцепторная группавыбрана из атомов фтора, хлора, брома, -CHF2, -CH=C=CH2, -С≡СН, -С≡ССН3, -CH2C≡CH, -СО2Н, -С(О)ОС1-С4 алкила, -СН(ОАс)СН3, -CN, -CH2CN, -CH2X (где X представляет Br, Cl или I) и метоксирана.
В некоторых вариантах осуществления формул (V) или (VI), R5выбран из группы, состоящей из -CH3, -С≡СН, -CH2F, -CH2Br и -CHF2. В некоторых дополнительных вариантах осуществления каждый из R1, R2, R2a, R3, R3a и R4независимо выбран из группы, состоящей из -ОН, -ОС(О)Н и -ОС(О)С1-С10 алкила.
В некоторых вариантах осуществления формул (V) или (VI), небольшая электроноакцепторная группавыбрана из атомов фтора, хлора, брома, -CHF2, -CH=C=CH2, -С≡СН, -С≡ССН3, -CH2C≡CH, -СО2Н, -С(О)ОС1-С4 алкила, -СН(ОАс)СН3, -CN, -CH2CN, -CH2X (где X представляет Br, Cl или I) и метоксирана.
В некоторых вариантах осуществления формул (V) или (VI), по меньшей мере, два из R1, R2, R2a, R3, R3a и R4независимо выбраны из небольших электроноакцепторных групп.
В некоторых вариантах осуществления формул (V) или (VI), аналог фукозы выбран из соединений, приведенных в таблицах 1, 2 или 3.
Фармацевтические композиции
Аналоги фукозы формул I, II, III, IV, V и VI (далее относится к «аналогам фукозы») можно формулировать для терапевтических применений. Аналоги фукозы можно формулировать в виде фармацевтических композиций, содержащих терапевтически или профилактически эффективное количество аналога фукозы и один или более фармацевтически совместимых (приемлемых) ингредиентов. Например, фармацевтическая или нефармацевтическая композиция, как правило, включает один или более носителей (например, стерильные жидкости, такие как вода и масла, включающие продукты нефтепереработки, а также животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное). Вода является более типичным носителем, когда фармацевтическую композицию вводят внутривенно. Также можно использовать солевые растворы и водные растворы декстрозы и глицерина в качестве жидких носителей, в частности, для инъекционных растворов. Подходящие наполнители включают, например, аминокислоты, крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, глицеролмоностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и тому подобное. Если требуется, то композиция может также содержать небольшие количества смачивающих или эмульгирующих агентов или рН забуферивающих веществ. Такие композиции могут находиться в форме растворов, суспензий, эмульсии, таблеток, пилюль, капсул, порошков, композиций с замедленным высвобождением и тому подобное. Примеры подходящих фармацевтических носителей описаны в «Remington’s Pharmaceutical Sciences», E. W. Martin. Как правило, такие композиции будут содержать терапевтически эффективное количество аналога фукозы, обычно в очищенной форме, вместе с соответствующим количеством носителя для получения формы для правильного введения пациенту. Композиции соответствуют способу введения.
Фармацевтические композиции, описанные в данном документе, могут находиться в любой форме, которая позволяет вводить композицию животному (например, млекопитающему). Фармацевтические композиции, описанные в данном документе, могут находиться в любой форме, которая позволяет вводить композицию млекопитающему. Фармацевтические композиции, описанные в данном документе, могут находиться в любой форме, которая позволяет вводить композицию человеку.
Композиции могут находиться в твердой или жидкой форме. Типичные пути введения включают, без ограничения, пероральный, парентеральный, сублингвальный и внутриглазной пути введения. Парентеральные пути включают подкожные инъекции, внутривенную, внутримышечную, интрастернальную инъекцию или инфузии. Предпочтительно композиции вводятся парентерально или перорально. Данные фармацевтические композиции можно формулировать таким образом, чтобы аналог фукозы был биодоступным при введении композиции животному. Композиции также могут иметь форму одной или более разовых лекарственных форм, где, например, таблетка может представлять разовую лекарственную форму, и контейнер с аналогом фукозы в твердой форме может содержать множество разовых лекарственных форм.
Вещества, используемые в фармацевтических композициях, должны быть нетоксичными в используемых количествах. Специалистам в данной области, очевидно, понятно, что оптимальная доза активного ингредиента(в) в фармацевтической композиции будет зависеть от различных факторов. Соответствующие факторы включают, без ограничения, тип животного (например, человек), конкретную форму аналога фукозы, способ введения, используемую композицию и тяжесть заболевания или расстройство, которое подвергается лечению.
Фармацевтически приемлемый носитель или растворитель может находиться в виде частиц, так, что композиции представляют, например, таблеточную или порошковую форму. Носитель(и) может быть жидким для композиций, например, представляющих собой сироп для приема внутрь или жидкость для инъекций.
При пероральном введении композиция предпочтительно находится в твердой или жидкой форме, куда включаются полутвердые, полужидкие формы, суспензии и гели, рассматриваемые здесь как твердые или жидкие.
В качестве композиции для перорального введения композицию можно формулировать в виде порошка, гранулы, прессованной таблетки, пилюли, капсулы, жевательной резинки, облатки или подобной формы. Как правило, такая твердая композиция содержит один или более инертных разбавителей. Кроме того, может присутствовать одно или более из следующих веществ: связующие вещества, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза или желатин; наполнители, такие как крахмал, лактоза или декстрины, разрыхлители, такие как альгиновая кислота, альгинат натрия, примогель, кукурузный крахмал и тому подобное; скользящие вещества, такие как стеарат магния или стеротекс; смазывающие вещества, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин, вкусовое вещество, такое как мята, метилсалицилат или вкусовое вещество со вкусом и запахом апельсина и краситель.
В том случае, когда композиция находится в виде капсулы, например, желатиновой капсулы, то она может содержать в дополнении к веществам, указанным выше, жидкий носитель, такой как полиэтиленгликоль, циклодекстрин или жирное (нелетучее) масло.
Композиция может находиться в форме жидкости, например, эликсира, сиропа, раствора, эмульсии или суспензии. Жидкость может быть пригодной для перорального введения или для введения с помощью инъекции. В том случае, когда она предназначается для перорального введения, то композиция может содержать одно или более из подсластителя, консервантов, красящего вещества/красителя и усилителя вкуса. В композиции для введения инъекцией (как описано выше) также может быть включено одно или более из поверхностно-активного вещества, консерванта, смачивающего вещества, диспергирующего вещества, суспендирующего вещества, буфера, стабилизатора и изотонического агента.
Жидкие композиции, независимо от того являются ли они растворами, суспензиями или подобной формой, также могут включать одно или более из следующих веществ: стерильные разбавители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический раствор, раствор Рингера, изотонический раствор хлорида натрия, жирные масла, такие как синтетические моно- и диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, циклодекстрин, пропиленгликоль или другие растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для доведения изотоничности, такие как хлорид натрия или декстроза. Физиологический раствор является предпочтительным адъювантом. Инъекционная композиция предпочтительно является стерильной.
Как указывалось выше, количество аналога фукозы, которое является эффективным в лечении конкретного заболевания или расстройства, будет зависеть от природы заболевания или расстройства, и его можно определить обычными клиническими методами. Кроме того, можно необязательно использовать тесты in vitro или in vivo для идентификации пределов оптимальных дозировок. Точная дозировка для использования в композициях также будет зависеть от пути введения, и тяжести заболевания или расстройства, и в конечном счете будет решаться на основе мнения лечащего врача и обстоятельств, характерных для каждого пациента.
Композиции содержат эффективное количество аналога фукозы так, что будет обеспечена подходящая дозировка. Как правило, такое количество составляет, по меньшей мере, примерно 0,01% аналога фукозы к массе композиции. При пероральном введении такое количество варьирует в пределах примерно от 0,1% до примерно 80% к массе композиции. Предпочтительные композиции для перорального введения содержат примерно от 4% до примерно 50% аналога фукозы к массе композиции. Предпочтительные композиции по настоящему изобретению готовят таким образом, чтобы разовая лекарственная форма для парентерального введения содержала примерно от 0,01% мас. до примерно 2% мас. аналога фукозы.
Для внутривенного введения композиция может содержать примерно от 1 до примерно 250 мг аналога фукозы на кг массы тела животного. В некоторых вариантах осуществления количество для введения будет находиться в пределах примерно от 1 до 25 мг/кг массы тела аналога фукозы. Предпочтительно вводимое количество будет составлять примерно от 4 до примерно 25 мг/кг массы тела аналога фукозы.
В общем, доза аналога фукозы, вводимая животному, как правило, составляет примерно от 0,1 мг/кг до примерно 250 мг/кг массы тела животного. Предпочтительно доза, предназначенная для введения животному, находится в пределах примерно от 0,1 мг/кг до примерно 20 мг/кг массы тела животного, более предпочтительно примерно от 1 мг/кг до примерно 10 мг/кг массы тела животного.
Композиции содержат эффективное количество аналога фукозы таким образом, чтобы обеспечивалась соответствующая дозировка. Как правило, такое количество составляет, по меньшей мере, 0,01% аналога фукозы к массе композиции. При пероральном введении такое количество варьирует в пределах примерно от 0,1% до примерно 80% к массе композиции. Предпочтительные композиции для перорального введения содержат примерно от 4% до примерно 50% аналога фукозы к массе композиции. Предпочтительные композиции по настоящему изобретению готовят таким образом, чтобы разовая лекарственная форма для парентерального введения содержала примерно от 0,01% мас. до примерно 2% мас. аналога фукозы.
Для внутривенного введения композиция может содержать примерно от 1 до 250 мг аналога фукозы на кг массы тела животного. В некоторых вариантах осуществления вводимое количество будет находиться в пределах примерно от 1 до примерно 25 мг/кг массы тела аналога фукозы. Предпочтительно вводимое количество будет составлять примерно от 4 до примерно 25 мг/кг массы тела аналога фукозы.
Обычно аналог фукозы или его фармацевтическую композицию можно вводить по схеме, основанной на ежедневном введении, введении раз в неделю, раз в две недели и раз в месяц согласно требуемому эффекту. Аналог фукозы или его фармацевтическую композицию можно вводить примерно от 1 до примерно 5, примерно от 1 до примерно 10, примерно от 1 до примерно 15 или более циклов, где каждый цикл по продолжительности составляет месяц. В каждом цикле дозы можно вводить ежедневно, через день, два раза в неделю, раз в неделю, раз в две недели, один раз каждые три недели или раз в месяц. Цикл может необязательно включать период отдыха от препарата, во время которого фукозилирование белков (например, антител или других белков) повышается. Альтернативно период отдыха можно включить между циклами. Такой период отдыха может позволить восстановить фукозилирование белков, принимающих участие в обеспечении жизненно важных функций.
Решение о предпочтительном способе введения аналога фукозы или его фармацевтически приемлемой композиции остается за лечащим врачом, и частично будет зависеть от медицинского состояния (такого как локализация злокачественной опухоли или аутоиммунного заболевания). В одном варианте осуществления аналог фукозы или композиции вводятся парентерально. Еще в одном варианте осуществления аналог фукозы или композиции вводят перорально.
В конкретных вариантах осуществления может быть желательным вводить один или более аналогов фукозы или композиций локально в область, которая нуждается в лечении. Этого можно достичь, например, и не в качестве ограничения, локальной инфузией во время хирургической операции; местной аппликацией; инъекцией или с помощью импланта, где имплант изготовлен из пористого, непористого или гелеобразного материала, включая мембраны, такие как сиаластичные мембраны, или волокна. В одном варианте осуществления введение можно проводить прямой инъекцией в область (или первоначальную область) локализации злокачественной опухоли, опухоли или неопластической, или пренеопластической ткани.
Еще в одном варианте осуществления введение можно проводить прямой инъекцией в область (или первоначальную область) проявления аутоиммуного заболевания.
Еще в одном варианте осуществления аналоги фукозы можно вводить в носителе, в частности, липосоме (см. Langer, Science, 249:1527-1533, 1990; Treat et al., в «Liposomes in the Therapy of Infectious Disease and Cancer», Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365, 1989; Lopez-Berestein, ibid., pp. 317-327; см. в общем ibid).
Еще в одном варианте осуществления аналоги фукозы или композиции можно доставлять в системе с контролируемым высвобождением. В одном варианте осуществления можно использовать насос (см. Langer, выше; Sefton, CRC Crit. Ref. Biomed. Eng., 14:201, 1987; Buchwald et al., Surgery, 88:507, 1980; Saudek et al., N. Engl. J. Med., 321:574, 1989). Еще в одном варианте осуществления можно использовать полимерные материалы (см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla., 1974; Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York, 1984; Ranger and Peppas, J. Macromol. Sci. Rev. Macromol. Chem., 23:61, 1983; см. также Levy et al., Science, 228:190, 1985; During et al., Ann. Neurol., 25:351, 1989; Howard et al., J. Neurosurg., 71:105, 1989). Другие системы с контролируемым высвобождением обсуждаются в обзоре Langer (Science, 249:1527-1533, 1990).
Термин «носитель» относится к разбавителю, адъюванту или наполнителю, с которыми вводится аналог фукозы. Такие фармацевтические носители могут представлять жидкости, такие как вода и масла, включающие продукты нефтепереработки, а также животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Носители также могут представлять солевой раствор, аравийскую камедь, желатин, крахмальную пасту, тальк, кератин, коллоидный диоксид кремния, мочевину и тому подобное. Кроме того, можно использовать вспомогательные вещества, стабилизаторы, загустители, скользящие вещества и красители. В одном варианте осуществления при введении животному аналоги фукозы или композиции, и фармацевтически приемлемые носители являются стерильными. Вода является предпочтительным носителем, когда аналоги фукозы вводят внутривенно. Также можно использовать солевые растворы и водные растворы декстрозы и глицерина в качестве жидких носителей, в частности, для инъекционных растворов. Подходящие фармацевтические носители также включают наполнители, такие как крахмал, глюкоза, сахароза, желатин, солод, рис, мел, силикагель, стеарат натрия, глицеролмоностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, вода, этанол и тому подобное. Если требуется, то композиции по настоящему изобретению также могут содержать небольшие количества смачивающих или эмульгирующих агентов, или рН забуферивающих агентов.
Терапевтические способы с применением аналогов фукозы для снижения фукозилирования антител и других белков в условиях in vivo
Изобретение относится к аналогам фукозы формул I, II, III, IV, V или VI (далее относятся к «аналогам фукозы»), которые пригодны для лечения рака, аиутоиммуного заболевания или инфекционного заболевания у животного.
Лечение рака
Аналоги фукозы являются пригодными для лечения рака у пациентов. Введение аналога фукозы животному (например, млекопитающему, такому как человек), нуждающемуся в этом, может приводить к ингибированию размножения опухолевой клетки(ок) или раковой клетки(ок), или лечению рака у животного (например, человека-пациента). Следовательно, аналоги фукозы можно использовать в различных областях для лечения рака у животных.
Аналоги фукозы также являются пригодными для повышения в условиях in vivo продукции антител без фукозилирования кора. Увеличении доли таких антител против раковых мишеней у пациента может привести к ингибированию размножения опухолевой клетки(ок) или раковой клетки(ок), или лечению рака у животного (например, человека-пациента). Следовательно, аналоги фукозы могут использоваться в различных областях для лечения рака у животных.
Конкретные типы рака, которые можно лечить аналогами фукозы, включают солидные опухоли и злокачественные заболевания крови. Такие виды рака включают, не ограничиваясь этим: (1) солидные опухоли, включающие, не ограничиваясь этим, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, рак ободочной кишки, колоректальный рак, рак почек, рак поджелудочной железы, рак костей, рак молочной железы, рак яичника, рак предстательной железы, рак пищевода, рак желудка, рак ротовой полости, рак носовой полости, рак горла, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, рак потовых желез, рак сальных желез, папиллярную карциному, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, бронхогенный рак, почечноклеточный рак, гепатому, карциному желчных протоков, хориокарциному, семиному, тератокарциному, опухоль Вильма, рак шейки матки, рак тела матки, рак яичка, мелкоклеточный рак легких, рак мочевого пузыря, рак легких, эпителиальную карциному, глиому, глиобластому, мульформную астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, невриному слухового нерва, олигодендроглиому, менингиому, рак кожи, меланому, нейробластому или ретинобластому; (2) злокачественные заболевания крови, включая, не ограничиваясь этим, острый лимфобластный лейкоз «ALL», острый лимфобластный В-клеточный лейкоз, острый лимфобластный Т-клеточный лейкоз, острый миелобластный лейкоз «AML», острый промиелоцитарный лейкоз «APL», острый монобластный лейкоз, острый эритролейкемический лейкоз, острый мегакариобластный лейкоз, острый миеломоноцитарный лейкоз, острый нелимфоцитарный лейкоз, острый недифференцированный лейкоз, хронический миелоцитарный лейкоз «CML», хронический лимфоцитарный лейкоз «CLL», волосистоклеточный лейкоз, множественную миелому, острые и хронические лейкемии, например, лимфобластную миелогенную лейкемию и лимфоцитарную миелоцитарную лейкемию, и (3) лимфомы, такие как болезнь Ходжкина, неходжкинская лимфома, множественная миелома, макроглобулинемия Вальденстрема, болезнь тяжелых цепей и полицитемия истинная.
Мультимодальное лечение рака
Рак, включая, не ограничиваясь этим, опухоль, метастаз или любое заболевание или расстройство, характеризующееся неконтролируемым ростом клеток, можно лечить или профилактировать введением аналога фукозы любой из формул I, II, III, IV, V или VI, представленной выше, животному (например, млекопитающему, такому как человек), нуждающемуся в этом. В некоторых вариантах осуществления изобретение относится к способам лечения или профилактики рака, включающим введение животному, нуждающемуся в этом, эффективного количества аналога фукозы и необязательно химиотерапевтического препарата. В одном варианте осуществления химиотерапевтический препарат представляет препарат, лечение которым было признано неэффективным. В другом варианте осуществления химиотерапевтический препарат представляет препарат, лечение которым было признано эффективным. Аналоги фукозы можно вводить животному, которое также подверглось хирургической операции в качестве лечения рака.
В одном варианте осуществления дополнительным способом лечения рака является лучевая терапия.
В конкретном варианте осуществления аналог фукозы вводится совместно с химиотерапевтическим препаратом или лучевой терапией. В другом конкретном варианте осуществления химиотерапевтический препарат или лучевую терапию назначают до или после введения аналога фукозы, предпочтительно, по меньшей мере, с интервалом час, пять часов, 12 часов, сутки, неделю, две недели, три недели, месяц или несколько месяцев (например, до трех месяцев) до или после введения аналога фукозы.
Химиотерапевтический препарат можно вводить в течение серии циклов, и он может представлять собой один препарат или комбинацию химиотерапевтических препаратов, описанных в данном документе. В отношении облучения, то можно использовать любой протокол лучевой терапии в зависимости от типа рака, который подвергается лечению. Например, не ограничиваясь этим, можно применять облучение рентгеновскими лучами, в частности, высокоэнергетический мегавольтаж (излучение с энергией свыше 1 МэВ) может применяться для глубоко расположенных опухолей, и рентгеновское облучение в виде электронного пучка или ортовольтаж при раке кожи. Также можно вводить радиоизотопы, испускающие гамма-лучи, такие как радиоактивные изотопы радия, кобальта и других элементов.
Кроме того, изобретение относится к способам лечения рака с аналогом фукозы в качестве альтернативы к химиотерапии или лучевой терапии, в тех случаях, когда было доказано или может быть доказано, что химиотерапия или лучевая терапия являются слишком токсичными, например, они приводят к неприемлемым или непереносимым побочным эффектам у субъекта, который лечится. Животное, которое подвергается лечению, необязательно можно лечить другой противораковой терапией, такой как хирургическая операция, лучевая терапия или химиотерапия, в зависимости от того, какое лечение является приемлемым или переносимым.
Мультилекарственная терапия рака
Настоящее изобретение включает способы лечения рака, включающие введение животному, нуждающемуся в этом, эффективного количества аналога фукозы и терапевтического агента, который является противораковым препаратом. Подходящие противораковые препараты включают, не ограничиваясь этим, метотрексат, таксол, L-аспарагиназу, меркаптопурин, тиогуанин, гидроксимочевину, цитарабин, циклофосфамид, ифосфамид, нитрозомочевины, цисплатин, карбоплатин, митомицин, дакарбазин, прокарбизин, топотекан, азотистые иприты, цитоксан, этопозид, 5-фторурацил, BCNU, иринотекан, камптотецин, блеомицин, доксорубицин, идарубицин, даунорубицин, дактиномицин, пликамицин, митоксантрон, аспарагиназу, винбластин, винкристин, винорелбин, паклитаксел и доцетаксел. В предпочтительном варианте осуществления противораковый препарат включает, не ограничиваясь этим, алкилирующие агенты, азотистые иприты (циклофосфамид, ифосфамид, трофосфамид, хлорамбуцил), нитрозомочевины (кармустин (BCNU), ломустин (CCNU)), алкилсульфонаты (бусульфан, треосульфан), триазены (дакарбазин), препараты, содержащие платину (цисплатин, оксалиплатин, карбоплатин), растительные алкалоиды (алкалоиды барвинка - винкристин, винбластин, виндезин, винорелбин), таксоиды (паклитаксел, доцетаксел), ингибиторы ДНК-топоизомеразы, эпиподофиллины (этопозид, тенипозид, топотекан, 9-аминокамптотецин, камптотецин), криснатол, митомицины (митомицин С); антиметаболиты, такие как антифолаты: ингибиторы DHFR: метотрексат, триметрексат; ингибиторы IMP-дегидрогеназы: микофеноловая кислота, тиазофурин, рибавирин, EICAR; ингибиторы рибонуклеотидредуктазы: гидроксимочевина, дефероксамин; аналоги пиримидинов: аналоги урацила: 5-фторурацил, флоксуридин, доксифлуридин, ратитрексед; аналоги цитозина: цитарабин (ара С), арабинозид цитозина, флударабин; аналоги пуринов: меркаптопурин, тиогуанин; гормональные препараты: антагонисты рецепторов: антиэстрогены: тамоксифен, ралоксифен, мегестрол, агонисты LHRH: госкрелин, лейпролид ацетат; антиандрогены: флутамид, бикалутамид; ретиноиды/дельтоиды: аналоги витамина D3: ЕВ 1089, СВ 1093, КН 1060; фотодинамическую терапию: вертопорфин (BPD-MA), фталоцианин, фотосенсибилизатор Pc4, деметоксигипокреллин А (2BA-2-DMHA); цитокины: интерферон-альфа, интерферон-гамма; фактор некроза опухолей; другие: ингибиторы изопренилирования: ловастатин; дофаминергические нейротоксины: ион 1-метил-4-фенилпиридиния; ингибиторы клеточного цикла: стауроспорин; актиномицины: актиномицин D, дактиномицин; блеомицины: блеомицин А2, блеомицин В2, пепломицин; антрациклины: даунорубицин, доксорубицин (адриамицин), идарубицин, эпирубицин, пирарубицин, зорубицин, митоксантрон; ингибиторы MDR: верапамил и ингибиторы Ca2+-АТФазы: тапсигаргин.
Адъювантная терапия рака
Аналоги фукозы можно использовать в качестве адъюванта в комбинации с вакциной против рака. В том смысле, в котором в данном документе используется термин «вакцина против рака», он означает соединение, которое избирательно повреждает опухолевые клетки, индуцируя и/или усиливая специфический иммунный ответ против опухолевых клеток. Вакцина против рака, например, может представлять собой лекарственный препарат, содержащий пептид, полипептид или белок TAA или TSA, и фармацевтические композиции, содержащие пептид, полипептид или белок TAA или TSA. В том смысле, в котором в данном документе используется термин «TSA», он относится к «опухоль-специфическому антигену», и TAA относится к «опухоль-ассоциированному антигену». TSA представляют молекулы, уникальные для опухолевых клеток. TAA являются общими молекулами, но которые по разному экспрессируются в раковых клетках и нормальных клетках.
Дозу вакцины против рака можно определить с соответствующими модификациями согласно степени стимуляции иммунного ответа против вакцины. В общем, она находится в пределах от 0,01 до 100 мг/сутки/взрослого человека или предпочтительно от 0,1 до 10 мг/сутки/взрослого человека по активному веществу. Вакцину против рака можно вводить от одного раза в несколько дней до одного раза в несколько месяцев. Введение можно проводить согласно широко известным способам введения пептида, полипептида или белка, предназначенного для медицинского применения, таким как подкожное, внутривенное или внутримышечное введение. Для индукции и/или усиления иммунного ответа во время введения пептид, полипептид или белок можно использовать в присутствии или отсутствии соответствующего адъюванта, с или без связывания с носителем. Носитель не ограничивается при условии, что он сам по себе не оказывает токсического действия на организм человека и способен усиливать антигенность; в качестве примера носителей можно привести целлюлозу, полимерные аминокислоты, альбумин и тому подобное. Адъюванты могут представлять вещества, которые обычно применяются для введения пептидной вакцины, и в качестве примера можно привести неполный адъювант Фрейнда (FIA), алюминиевый адъювант (ALUM), вакцину против Bordetella pertussis, минеральное масло и тому подобное. Кроме того, состав композиции можно соответственно выбрать с учетом хорошо известного способа формуляции пептида, полипептида или белка.
Иначе эффективную вакцину против рака можно получить также, получением фракции мононуклеарных клеток из периферической крови пациента, их инкубацией с пептидом, полипептидом или белком по настоящему изобретению, и затем обратным введением фракции мононуклеарных клеток, в которых наблюдали индукцию CTL и/или активацию CTL, в кровь пациента. Аналог фукозы можно вводить совместно во время или после повторного введения мононуклеарных клеток. Условия культивирования, такие как концентрация мононуклеарных клеток, концентрация пептида, полипептида или белка, время культивирования и тому подобное, можно определить просто повторением опытов. Во время культивирования можно добавить вещество, обладающее способностью повышать рост лимфоцитов, такое как интерлейкин-2.
Лечение аутоиммунных заболеваний
Аналоги фукозы пригодны для модуляции аутоиммунного заболевания или для лечения аутоиммунного заболевания, таким образом, для ослабления симптомов и/или аутоиммунного ответа. Аналоги фукозы можно использовать в различных областях для лечения аутоиммунного заболевания у животного.
В одном варианте осуществления аналоги фукозы отрицательно регулируют или отрицательно модулируют аутоиммунное антитело, ассоциированное с конкретным аутоиммунным заболеванием.
Конкретные типы аутоиммунных заболеваний, которые можно лечить аналогами фукозы, включают, не ограничиваясь этим, связанные с Th2-лифоцитами расстройства (например, атопический дерматит, атопическая астма, риноконъюнктивит, аллергический ринит, синдром Оменна, системный склероз и синдром трансплантат против хозяина); связанные с Th1-лифоцитами расстройства (например, ревматоидный артрит, рассеянный склероз, псориаз, синдром Шегрена, тиреоидит Хашимото, болезнь Граве, первичный билиарный цирроз, гранулематоз Вегенера и туберкулез); связанные с активированными В-лимфоцитами расстройства (например, системная красная волчанка, синдром Гудпасчера, ревматоидный артрит и диабет типа I) и приведенные ниже.
Активный хронический гепатит, болезнь Аддисона, аллергический альвеолит, аллергическая реакция, аллергический ринит, синдром Альпорта, анафилаксия, анкилозирующий спондилит, антифосфолипидный синдром, артрит, аскаридоз, аспергиллез, атопическая аллергия, атопический дерматит, атопический ринит, болезнь Бехчета, легкое «любителя птиц», бронхиальная астма, синдром Каплана, кардиомиопатия, глютеновая болезнь, болезнь Чагаса, хронический гломерулонефрит, синдром Когана, болезнь холодовых агглютининов, синдром врожденной краснухи, CREST-синдром, болезнь Крона, криоглобулинемия, синдром Кушинга, дерматомиозит, дискоидная красная волчанка, синдром Дресслера, синдром Итона-Ламберта, эховирусная инфекция, энцефаломиелит, эндокринная офтальмопатия, инфекция, вызванная вирусом Эпштейна-Барра, эмфизема легких у лошадей, эритематоз, синдром Эванса, синдром Фелти, фибромиалгия, синдром Фукса, атрофия желудка, желудочно-кишечная аллергия, гигантоклеточный артериит, гломерулонефрит, синдром Гудпасчера, синдром трансплантат против хозяина, болезнь Граве, болезнь Гуллиана-Барра, тиреоидит Хашимото, гемолитическая анемия, болезнь Шенлейн-Геноха, идиопатическая пурпура, атрофия надпочечников, идиопатический фиброз легких, IgA-нефропатия, воспалительные заболевания кишечника, инсулинзависимый сахарный диабет, юношеский артрит, юношеский сахарный диабет (типа I), синдром Ламберта-Итона, ламинит, красный плоский лишай, волчаночный гепатит, лимфопения при красной волчанке, болезнь Меньера, смешанное соединительнотканное заболевание, рассеянный склероз, тяжелая миастения, пернициозная анемия, полигландулярный синдром, пресенильная деменция, первичная агаммаглобулинемия, первичный билиарный цирроз, псориаз, псориатический артрит, феномен Рейно, рецидивирующая угроза прерывания беременности, синдром Рейтера, ревматическая лихорадка, ревматоидный артрит, синдром Самптера, шистосомоз, синдром Шмидта, склеродерма, синдром Шульмана, синдром Шегрена, синдром «ригидного человека», симпатическая офтальмия, системная красная волчанка, артериит Такаясу, темпоральный артериит, тиреоидит, тромбоцитопения, тиреотоксикоз, токсический эпидермальный некролиз типа В, резистентность к инсулину, сахарный диабет типа I, язвенный колит, витилиго, макроглобулинемия Вальдстрема и грануломатоз Вегенера.
Мультилекарственная терапия аутоиммунных заболеваний
Настоящее изобретение также относится к способам лечения аутоиммунного заболевания, включающим введение животному (например, млекопитающему) эффективного количества аналога фукозы и необязательно терапевтического агента, о котором известно, что он используется для лечения аутоиммунного заболевания. В одном варианте осуществления препараты против аутоиммунного заболевания включают, не ограничиваясь этим, циклоспорин, циклоспорин А, микофенилата мофетил, сиролимус, такролимус, энанерцепт, преднизон, азатиоприн, метотрексат, циклофосфамид, преднизон, аминокапроновую кислоту, хлорквин, гидроксихлорквин, гидрокортизон, дексаметазон, хлорамбуцил, DHEA, даназол, бромкриптин, мелоксикам или инфликсимаб.
Лечение инфекционных заболеваний
Аналоги фукозы являются пригодными для усиления иммунного ответа, что приводит к повышенному киллингу или ингибированию размножения клетки, которая является причиной инфекционного заболевания, или другими словами для лечения инфекционного заболевания. Следовательно, аналоги фукозы можно использовать в различных областях для лечения инфекционного заболевания у животного.
В одном варианте осуществления аналоги фукозы повышают иммунный ответ, приводя к киллингу или ингибированию, или повышенному киллингу или ингибированию размножения клеток, которые являются причиной конкретного инфекционного заболевания.
Конкретные типы инфекционных заболеваний, которые можно лечить аналогами фукозы, включают, не ограничиваясь этим, (1) бактериальные болезни: дифтерия, коклюш, оккультная бактериемия, инфекция мочевых путей, гастроэнтерит, целлюлит, эпиглоттит, трахеит, гипертрофия аденоидов, ретрофарингеальный абсцесс, импетиго, эктима, пневмония, эндокардит, септический артрит, пневмококковый перитонит, бактериальный менингит, острый гнойный менингит, уретрит, цервицит шейки матки, проктит, фарингит, сальпингит, эпидидимит, гонорея, сифилис, листериоз, сибирская язва, нокардиоз, сальмонеллез, тифоидная лихорадка, дизентерия, конъюнктивит, синусит, бруцеллез, туляремия, холера, бубонная чума, столбняк, некротизирующий энтерит, актиномикоз, смешанные анаэробные инфекции, сифилис, рецидивирующая лихорадка, лептоспироз, болезнь Лима, лихорадка после укусов крыс, туберкулез, лимфаденит, проказа, хламидиоз, пневмония, вызванная хламидиями, трахома, конъюнктивит с включениями, системный; (2) грибковые заболевания: гистоплазмоз, кокцидиоидомикоз, бластомикоз, споротрихоз, криптококкоз, системный кандидоз, аспергиллез, мукормикоз, мицетома, хромомикоз; (3) заболевания, вызванные рикетсиями: тиф, пятнистая лихорадка Скалистых Гор, эрлихиоз, восточные клещевые риккетсиозы, риккетсиозная оспа, Q-лихорадка и бартонеллез; (4) паразитарные заболевания: малярия, бабезиоз, африканская сонная болезнь, болезнь Чагаса, лейшманиоз, лихорадка дум-дум, токсоплазмоз, менингоэнцефалит, кератит, энтамебиаз, гиардиаз, криптоспоридиоз, изоспороз, циклоспороз, микроспороз, аскаридоз, трихоцефалез, анкилостомоз, энтеробиоз, синдром мигрирующей личинки, трихинеллез, дракункулез, лимфатический филяриатоз, лоаоз, онхоцеркоз, филяриоз собак, шистосомоз, водный кожный зуд, парагонимоз, клонорхоз, фасциолез, описторхоз, цестодозные инвазии, эхинококкоз, альвеококкоз; (5) вирусные заболевания: корь, подострый склерозирующий панэнцефалит, обычная простуда, свинка, краснуха, розеола, пятая венерическая болезнь, ветряная оспа, респираторно-синцитиальная вирусная инфекция, круп, бронхиолит, инфекционный мононуклеоз, полимиелит, герпангина, ящур, болезнь Борнхольма, генитальный герпес, генитальные бородавки, асептический менингит, миокардит, перикардит, гастроэнтерит, синдром приобретенного иммунодефицита (СПИД), синдром Рея, синдром Кавасаки, грипп, бронхит, вирусная «перенесенная на ногах» пневмония, острое фебрильное респираторное заболевание, острая фарингоконъюнктивальная лихорадка, эпидемический кератоконъюнктивит, вирус герпеса простого типа 1 (HSV-1), вирус герпеса простого типа 2 (HSV-2), опоясывающий лишай, инклюзионная цитомегалия, бешенство, прогрессирующая мультифокальная лейкоэнцефалопатия, болезнь Куру, фатальная семейная бессонница, болезнь Крейтцфельдта-Якоба, синдром Герстмана-Штраусслера-Шейнкера, тропический спастический парапарез, западный энцефалит лошадей, калифорнийский энцефалит, энцефалит Сент-Луис, желтая лихорадка, лихорадка Денге, лимфоцитарный хориоменингит, лихорадка Ласса, геморрагическая лихорадка, инфекция, вызванная хантавирусами, пульмонарный синдром, лихорадка Марбург, лихорадка Эбола и оспа натуральная.
Мультилекарственная терапия инфекционных заболеваний
Настоящее изобретение также относится к способам лечения инфекционного заболевания, включающим введение животному (например, млекопитающему), нуждающемуся в этом, аналога фукозы и необязательно терапевтического агента, который представляет собой противоинфекционный агент. В одном варианте осуществления противоинфекционный агент представляет, не ограничиваясь этим: (1) антибактериальные агенты: β-лактамные антибиотики: пенициллин G, пенициллин V, клоксациллин, диклоксациллин, метициллин, нафциллин, оксациллин, ампициллин, амоксициллин, бакампициллин, азлоциллин, карбенициллин, мезлоциллин, пиперациллин, тикарциллин; аминогликозиды: амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин; макролиды: азитромицин, кларитромицин, эритромицин, линкомицин, клиндамицин; тетрациклины: демеклоциклин, доксициклин, миноциклин, окситетрациклин, тетрациклин; хинолоны: циноксацин, налидиксовая кислота, фторхинолоны: ципрофлоксацин, эноксацин, грепафлоксацин, левофлоксацин, ломефлоксацин, норфлоксацин, офлоксацин, спарфлоксацин, тровафлоксицин; полипептиды: бацитрацин, колистин, полимиксин В; сульфонамиды: сульфисоксазол, сульфаметоксазол, сульфадиазин, сульфаметизол, сульфацетамид; разные антибактериальные агенты: триметоприм, сульфаметазол, хлорамфеникол, ванкомицин, метронидазол, квинупристин, далфопристин, рифампин, спектиномицин, нитрофурантоин; противовирусные препараты: общие противовирусные препараты: идоксурадин, видарабин, трифлуридин, ацикловир, фамцицикловир, пенцикловир, валацикловир, ганцицикловир, фоскарнет, рибавирин, амантадин, римантадин, сидофовир; антисмысловые олигонуклеотиды; иммуноглобулины; интерфероны; препараты для лечения ВИЧ-инфекции: зидовудин, диданозин, залцитабин, ставудин, ламивудин, невирапин, делвирдин, саквинавир, ритонавир, индинавир и нелфинавир.
Другие терапевтические агенты
Настоящие способы могут дополнительно включать введение аналога фукозы и терапевтического агента или его фармацевтически приемлемых солей или сольватов. Аналог фукозы и терапевтический агент могут функционировать аддитивно или более предпочтительно синергетически. В предпочтительном варианте осуществления композицию, содержащую аналог фукозы, вводят совместно с введением одного или более терапевтических агентов, которые могут представлять часть той же композиции, или находиться в другой композиции, чем та, которая содержит аналог фукозы. Еще в одном варианте осуществления аналог фукозы вводится до или после введения терапевтического агента(в).
В настоящих способах лечения рака, аутоиммунного заболевания или инфекционного заболевания терапевтический агент также может представлять собой противорвотное средство. Подходящие противорвотные препараты включают, не ограничиваясь этим, метоклопромид, домперидон, проклоперазин, прометазин, хлорпромазин, триметобензамид, ондасетрон, гранисетрон, гидроксизин, ацетиллейцин, моноэтаноламин, ализаприд, азасетрон, бензквинамид, биетанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенилод, доласетрон, меклизин, металлатал, метопимазин, набилон, оксипемдил, пипамазин, скополамин, сульпирид, тетрагидроканнабинолы, тиэтилперазин, тиопроперазин и трописетрон.
Еще в одном варианте осуществления терапевтический агент может представлять гематопоэтический колониестимулирующий фактор. Подходящие гематопоэтические колониестимулирующие факторы включают, не ограничиваясь этим, филграстим, сарграмостин, молгограмостим и эритропоэтин альфа.
Еще в одном варианте осуществления терапевтический агент может представлять собой опиоидный или неопиоидный анальгетический препарат. Подходящие опиоидные анальгетические агенты включают, не ограничиваясь этим, морфин, героин, гидроморфон, гидрокодон, оксиморфон, оксикодон, метопон, апоморфин, норморфин, эторфин, бупренорфин, меперидин, лопермид, анилеридин, этогептазин, пиминидин, бетапродин, дифеноксилат, фентанил, суфентанил, алфентанил, ремифентанил, леворфанол, декстрометорфан, феназоцин, пентазоцин, циклазоцин, метадон, изометадон и пропоксифен. Подходящие неопиоидные анальгетические агенты включают, не ограничиваясь этим, аспирин, целекоксиб, рофекоксиб, диклофенак, дифлузинал, этодолак, фенопруфен, флурбипруфен, ибупруфен, кетопруфен, индометацин, кеторолак, меклофенамат, мефенамовую кислоту, набуметон, напроксен, пироксикам и сулиндак.
Изобретение дополнительно описывается в последующих примерах, которые не предназначаются для ограничения объема изобретения.
Примеры
Пример 1: продукция нефукозилированных антител в условиях in vivo
Методы
Мышей-самок BALB/c иммунизировали гемоцианином морского моллюска (KLH) за 30-60 суток до начала опыта. Для первого опыта мышам вводили внутрибрюшинно во всех случаях в дозе 150 мг/кг алкинилфукозу (SGD-1887), перацетат алкинилфукозы (SGD-1890), 2-фторфукозу (SGD-2083) или триацетат 2-фторфукозы (SGD-2084) ежедневно в течение 7 суток или оставляли без обработки. На сутки 2 мышам также повторно иммунизировали KLH. Через одни сутки после последнего внутрибрюшинного введения мышей убивали, отбирали кровь и готовили сыворотку крови. Во втором опыте мышам вводили 100 мМ триацетата 2-фторфукозы (SGD-2083) в питьевой воде или оставляли без обработки в течение 7 суток, повторно иммунизировали KLH и продолжали спаивать питьевую воду, содержащую 100 мМ 2-фторфукозы, или оставляли без обработки еще в течение 7 суток перед убоем. Затем получали сыворотку. Ни одна мышь не пала в опыте. Для обоих опытов сыворотку пропускали через промышленно доступную колонку для аффинной хроматографии с анти-KLH-антителом для получения KLH-специфических поликлональных антител. Элюент с колонки для аффинной хроматографии с анти-KLH-антителом пропускали через промышленно доступную колонку с протеином А с получением остальных антител.
Дот-блоты: 0,5 мкг каждого из антител от необработанных и обработанных животных, а также стандарты антитела сАС10 с известной степенью фукозилирования кора (от 0 до 100% фукозы) переносили на нитроцеллюлозную мембрану. Визуализировали уровни белка окрашиванием Ponceau. Блот гибридизовали биотинилированным L-фукоза-специфическим лектином Aspergillus oryzae (AOL) (который связывается с фукозилированными антителами) и развивали со стрептавидином HRP и ECL. Определяли нагрузку на гель (визуально) и сигналы фукозы (биолюминесценцией) с использованием камеры Alpha Innotech и определяли количественно с использованием автоматической программы.
Газовая хроматография (ГХ): 40 мкг каждого из антител от необработанных и обработанных животных, которые диализовали против воды, подвергали метанолизу в метанольном растворе HCl. Аналогичным образом обрабатывали контрольные образцы антитела сАС10 с 0-100% фукозы. Полученные метилгликозиды дериватизовали триметилсилилированием спиртов моносахарида с использованием промышленно доступной смеси Tri-Sil. Полученные триметилсилильные производные метилгликозидов анализировали на газовом хроматографе Hewlet Packard с пламенно-ионизационным детектором с использованием температурного градиента на колонке Agilent J&W DB-1. Идентифицировали соответствующие пики по времени удерживания в сравнении со стандартами сахаров, дериватизированных параллельно с образцами Ab. Определяли площадь пиков с использованием программного обеспечения ГХ. Соотношения площадей пиков фукозы/маннозы использовали для определения состояния фукозилирования антител.
Результаты
Опыт 1: на фигуре 1 показан дот-блот (слева) с антителами, которые не связывались с KLH, а были извлечены с колонки с протеином А. Результаты приведены для стандартов сАС10 (нижний дот-блот, самый заштрихованный прямоугольник слева и соответствующая колонка верхнего дот-блота), необработанного контроля (нижний дот-блот, второй заштрихованный прямоугольник слева и соответствующая колонка верхнего дот-блота) и алкинилфукозы (SGD-1887; нижний дот-блот, средний заштрихованный прямоугольник и соответствующая колонка верхнего дот-блота), перацетата алкинилфукозы (SGD-1890, нижний дот-блот, второй заштрихованный прямоугольник справа и соответствующая колонка верхнего дот-блота) и 2-фторфукозы (SGD-2083; нижний дот-блот, правый самый заштрихованный прямоугольник и соответствующая колонка верхнего дот-блота). После нормализации уровня нагрузки также представлен процент фукозилирования на графике справа. В среднем уровни фукозилирования были ниже примерно на одну треть по сравнению с необработанными контрольными животными.
На фигуре 2 показаны уровни фукозилирования обоих анти-KLH-антител (панели А и В) и остальных молекул сывороточных IgG, выделенных от животных обработанных групп (панели С и D). Уровни фукозилирования показаны в виде процента фукозилирования на основе стандартов антитела cAC10 (панели А и С) и среднего значения для обработанных групп в виде процента от среднего значения для группы необработанного контроля (панели С и D). В среднем степень фукозилирования анти-KLH-антител была ниже примерно вполовину в результате обработки тремя аналогами фукозы. Фукозилирование кора остальных собранных антител также было ниже примерно на четверть. В данном опыте общее количество антител (KLH-специфических и неспецифических) повышалось у мышей после воздействия KLH. В результате большинство антител синтезировалось вновь во время периодов обработки. Результаты данных наблюдений указывают, что у вновь синтезированных антител имело место пониженное фукозилирование кора после введения аналога фукозы.
Опыт 2: в данном опыте исследовали влияние перорального введения аналогов фукозы. На фигуре 3 приведены результаты обработки мышей пероральным введением аналогов фукозы. Определенные уровни фукозилирования антител представляли показатели для антител, которые не связывались с KLH, а были извлечены с колонки с протеином А. Результаты приведены для стандартов сАС10 (верхний и нижний дот-блоты, самый левый прямоугольник), необработанного контроля (верхний и нижний дот-блоты, второй слева (верхний) и правый прямоугольники) и 2-фторфукозы (верхний и нижний дот-блоты, второй слева (нижний) и второй справа прямоугольники (верхний и нижний)). После нормализации уровня нагрузки также представлен процент фукозилирования на графике справа. Фукозилирование кора антител от обработанных животных практически отсутствовало: в среднем уровни фукозилирования составляли соответственно 7% у обработанных и 81% у необработанных животных. Данные результаты указывают на то, что пероральное введение аналогов фукозы является эффективным способом для снижения фукозилирования антител.
Пример 2: активность аналогов фукозы в условиях in vitro в клеточной культуре
Аналоги фукозы оценивали на их влияние на фукозилирование кора антител в концентрациях 50 мкМ и 1 мМ, как, в общем, описано в опубликованной заявке на патент США 2009-0317869. Вкратце протокол был следующим: клетки линии A CHO DG44, продуцирующие гуманизированное моноклональное IgG1 анти-CD70-антитело, h1F6 (см. публикацию международной заявки WO 06/113909), культивировали при титре 7,5⋅105 клеток на мл в 2 мл культуральной среды СНО при 37°С, 5% СО2 и встряхивании со скоростью 100 об/мин в 6-луночном планшете для культивирования тканей. В среду добавляли инсулинподобный фактор (IGF), пенициллин, стрептомицин и аналог фукозы в концентрации 1 мМ или 50 мкМ. Через 5 суток после инокуляции культуру центрифугировали при 13000 об/мин в течение 5 мин для осаждения клеток; затем из супернатанта выделяли антитела.
Выделение антител проводили нанесением кондиционной среды на смолу с протеином А, предварительно уравновешенную 1Х забуференным фосфатом физиологическим раствором (PBS), рН 7,4. После промывания смолы 20 объемами слоя смолы 1Х PBS антитела элюировали 5 объемами слоя смолы буфером для элюирования Immunopure IgG (Pierce Biotechnology, Rockford, IL). Добавляли 10% объем 1 М Трис буфера рН 8,0 для нейтрализации элюированной фракции. Результаты приведены в следующих таблицах.
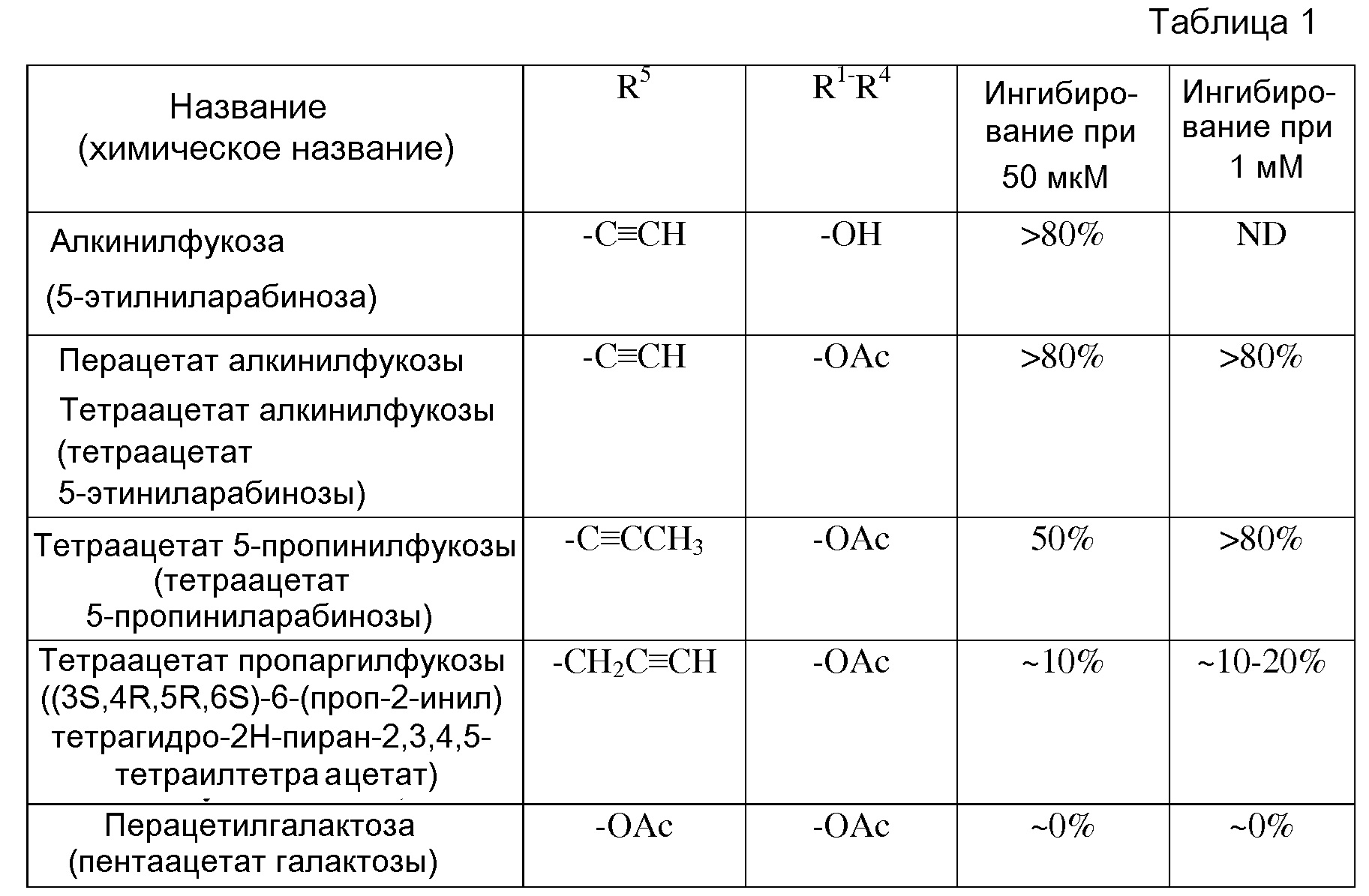
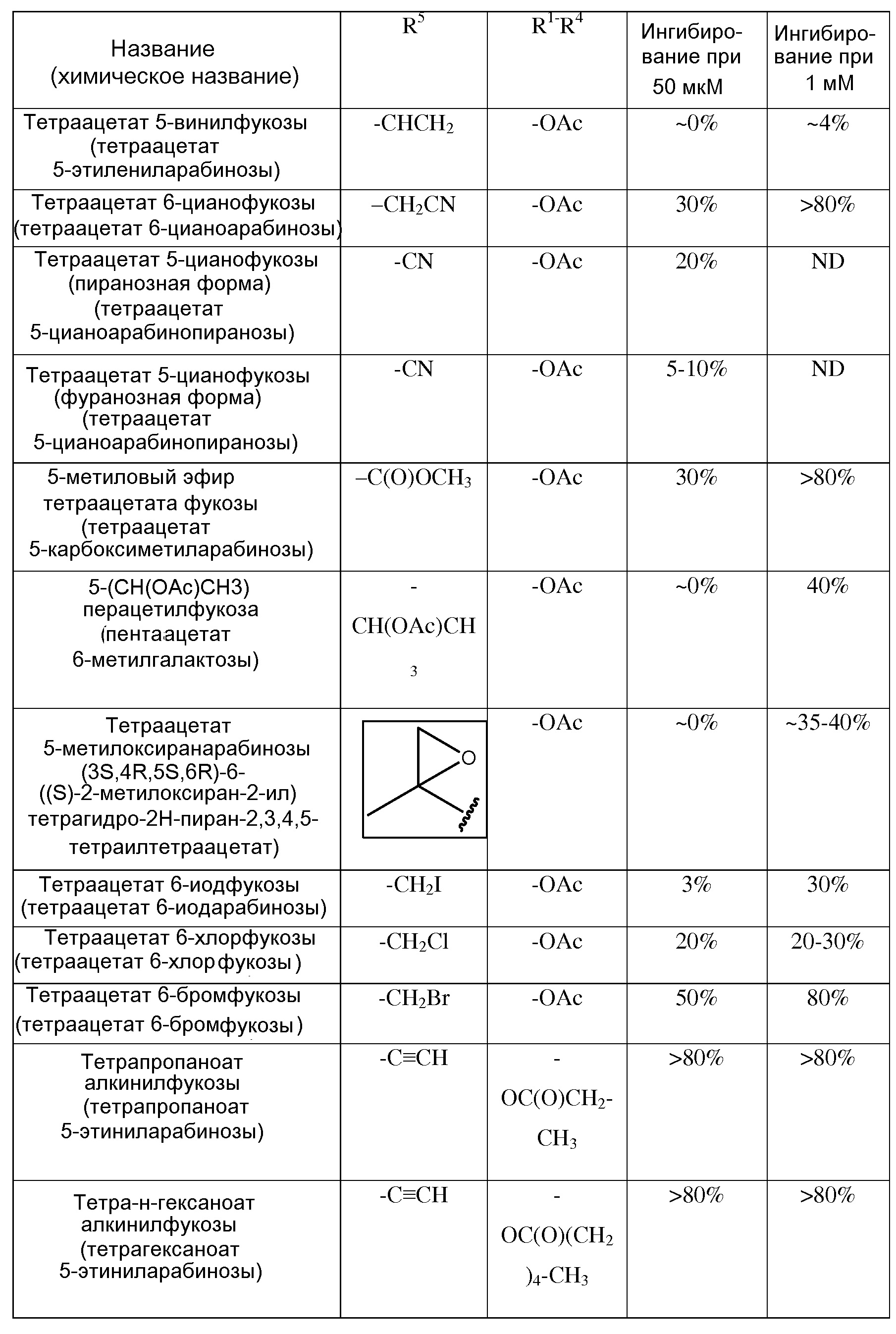

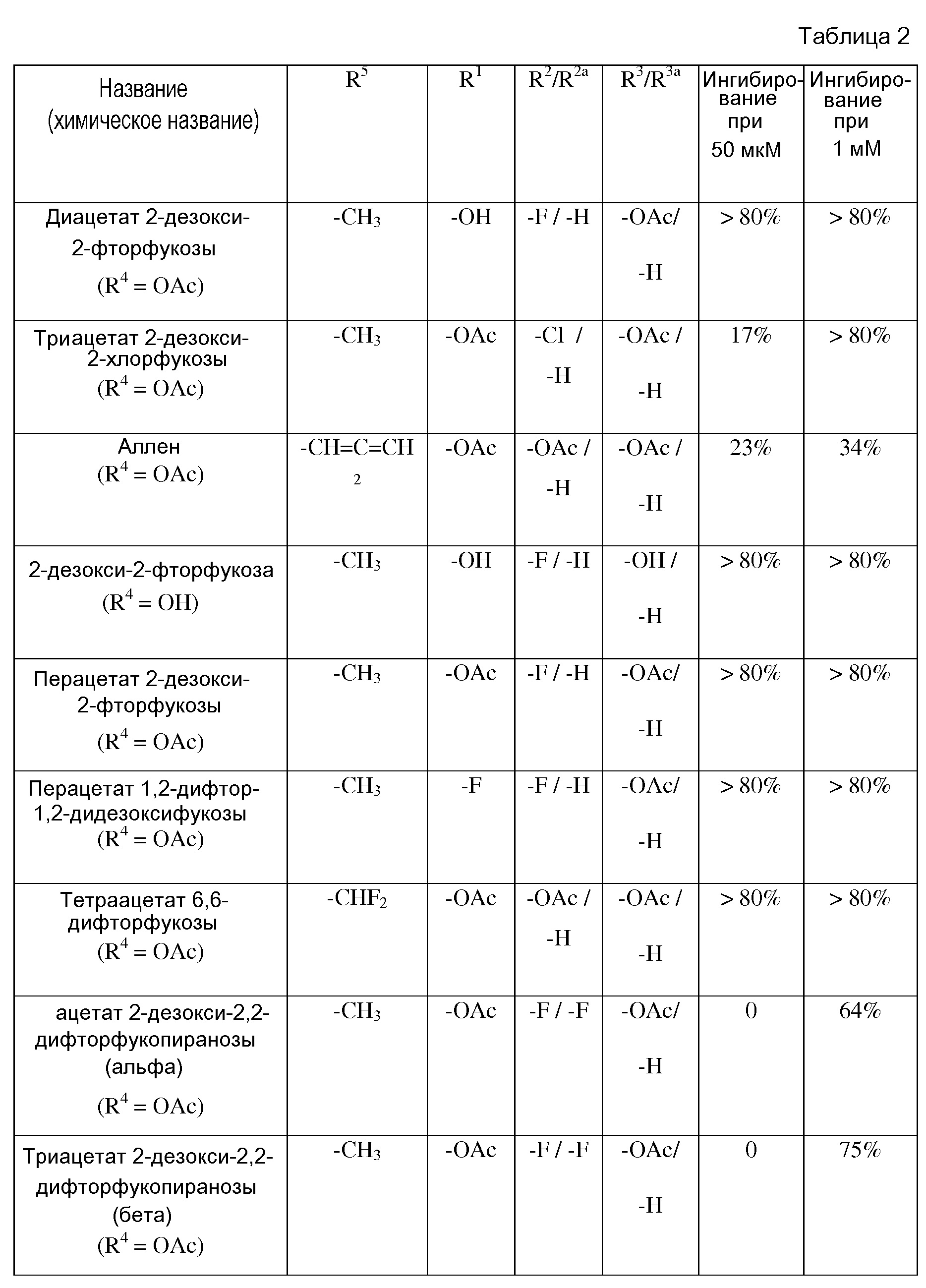

Некоторые аналоги фукозы тестировали на их способность включаться в антитела. Такие аналоги фукозы тестировали в концентрациях 50 мкМ и 1 мМ с использованием методологии, описанной выше. Результаты приведены в последующей таблице.
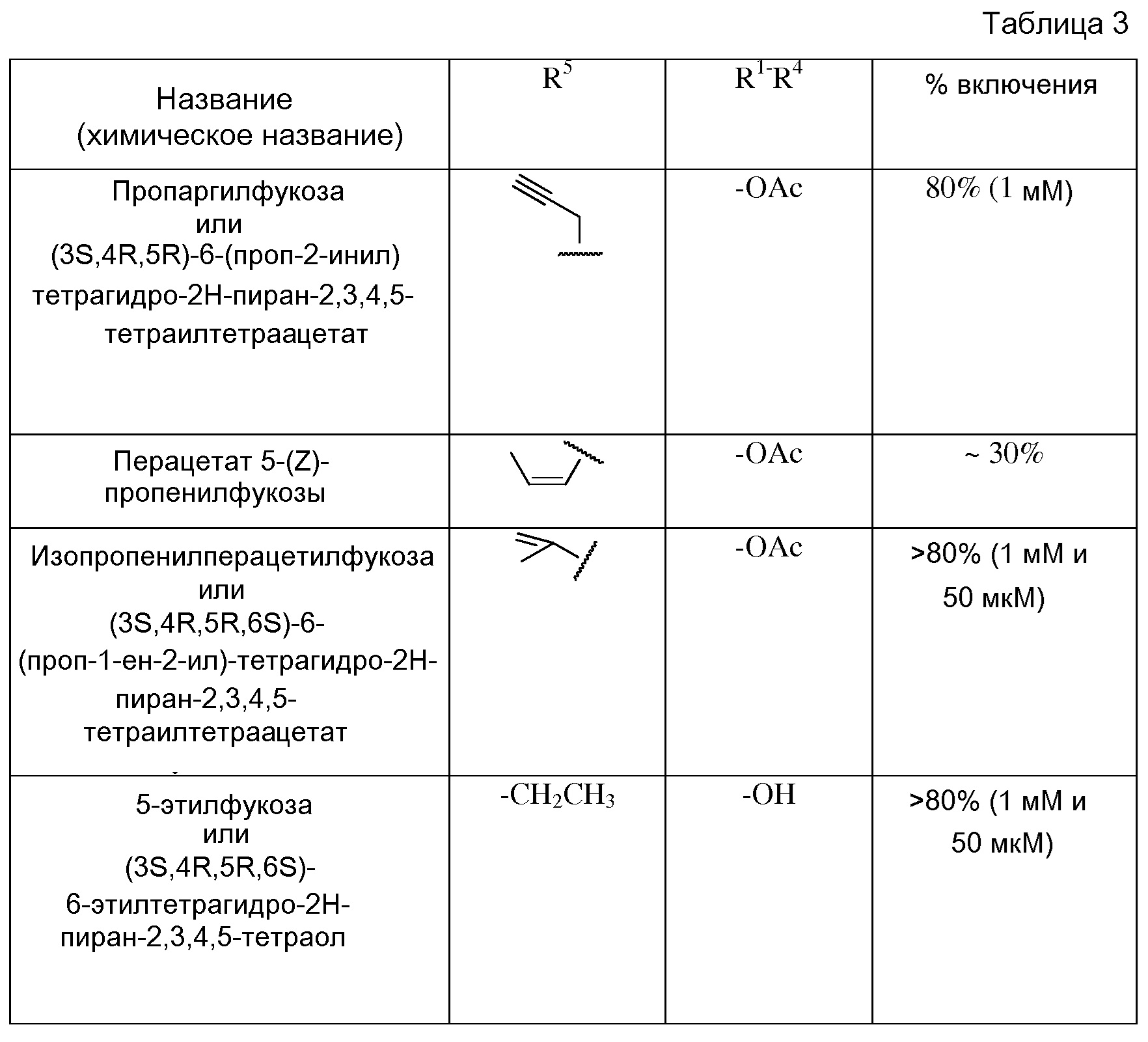

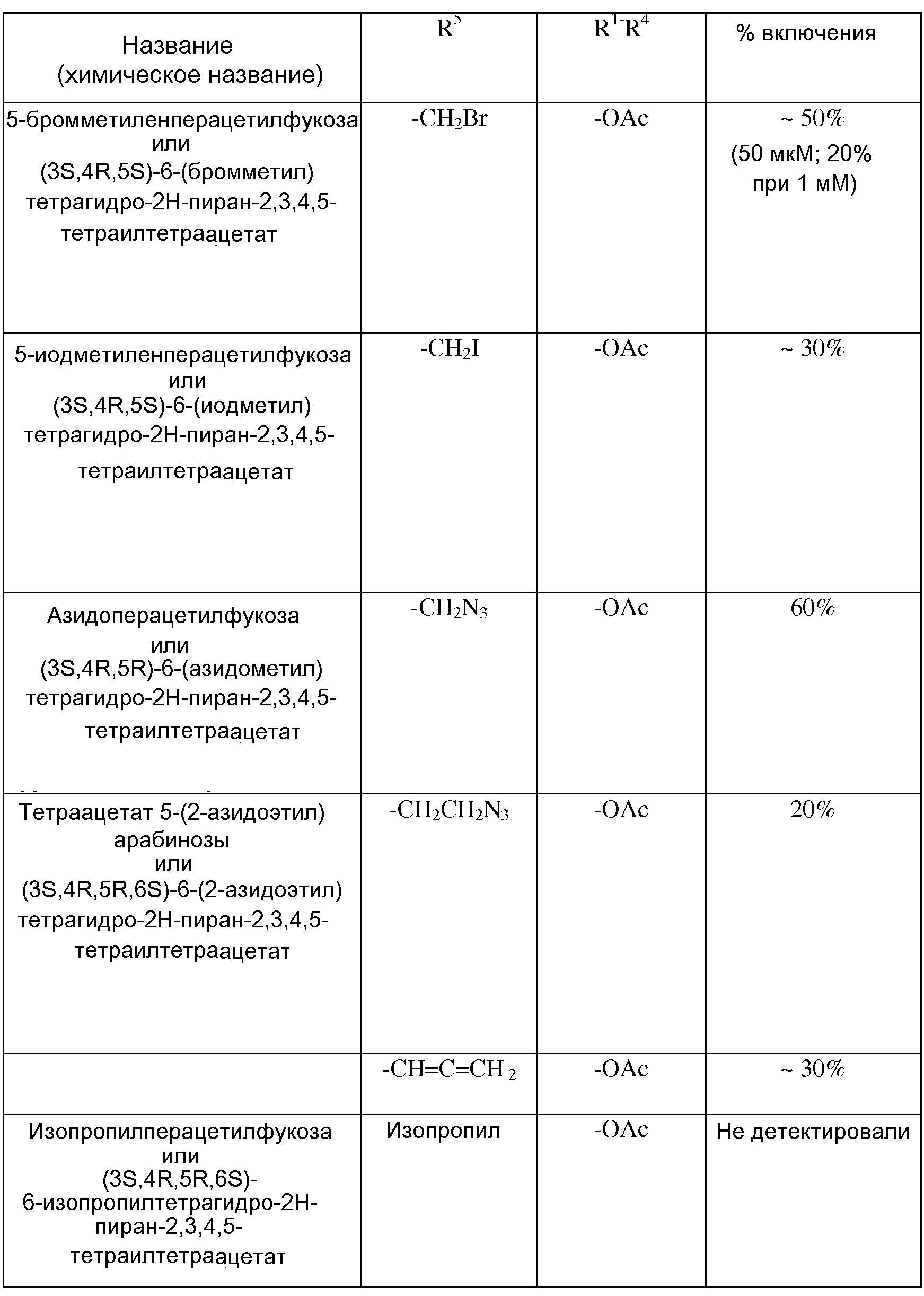
С использованием данных тестов были идентифицированы соединения-кандидаты для ингибирования фукозилирования кора антитела у млекопитающих.
Пример 3: продукция нефукозилированных антител в условиях in vivo после перорального введения
В данном опыте дополнительно исследовали влияние перорального введения аналога фукозы 2-фторфукозы (SGD-2083). Мышам-самкам BALC/c спаивали питьевую воду с 1, 10 и 100 мМ 2-фторфукозы в течение 14 суток. Мышей иммунизировали TiterMAX Classic и еще в течение 7 суток спаивали питьевую воду, содержащую 1, 10 и 100 мМ 2-фторфукозы. Затем мышей подвергали эвтаназии, отбирали пробы крови и получали сыворотку крови. Эндогенные антитела выделяли пропусканием сыворотки крови через колонку с протеином А.
Собранные антитела оценивали на степень фукозилирования дот-блотом следующим образом. Антитела от необработанных и обработанных животных (0,5 мкг каждого), а также стандарты сАС10 с 0-100% фукозы (только опыт 1) переносили на нитроцеллюлозную мембрану. Визуализировали уровни белка окрашиванием Ponceau S. Блот гибридизовали биотинилированным лектином AOL и развивали со стрептавидином HRP и ECL (как описано выше). Определяли нагрузку на гель (визуально) и сигналы фукозы (биолюминесценцией) с использованием камеры Alpha Innotech и определяли количественно с использованием автоматической программы.
Результаты
Имело место дозозависимое снижение уровня фукозилирования антител для трех концентраций 2-фторфукозы (SGD-2083). Рассматривая фигуру 4, можно отметить, что уровни фукозилирования были наиболее высокими у необработанных контрольных животных и в группах с 1 мМ 2-фторфукозы (левая и средняя панели, верхние два прямоугольника). Антитела при средней концентрации 2-фторфукозы были практически без фукозы, как и с концентрацией 100 мМ 2-фторфукозы. Данные результаты подтверждают, что введение 2-фторфукозы мышам может ингибировать фукозилирование кора антитела.
Пример 4: влияние аналогов фукозы на человеческие клетки
Исследовали способность различных аналогов фукозы ингибировать фукозилирование IgG антител, продуцированных миеломными клетками человека, а также фукозилирование поверхностных белков клеток раковых клеточных линий человека. В первом опыте исследовали способность аналогов фукозы ингибировать фукозилирование IgG, продуцированного клеточной линией LP-1, клеточной линией множественной миеломы человека. Было подтверждено, что продуцированные антитела и обнаруженные в культуральной среде необработанных клеток LP-1, представляют собой тип IgG с использованием вестерн-блоттинга с детектированием антител против человеческого IgG (данные не приводятся). Это получали культивированием 20 мл клеток LP-1 в колбе для культивирования Т-75 (250000 клеток/мл) в течение 5 суток при 37°С во влажной атмосфере 5% СО2 в IgG-истощенной среде для культивирования тканей (90% RPMI c 10% IgG-истощенной инактивированной нагреванием FBS). Клетки осаждали центрифугированием (200g, 4°С, 5 мин) и собирали культуральную среду. Среду фильтровали через фильтр 0,22 мкм и затем инкубировали с 1 мл 50% суспензии смолы с протеином А MabSelectTM в PBS при 4°С с вращением в течение ночи для захвата IgG. Суспензии смолы давали осадиться и большую часть среды удаляли. Суспензию смолы примерно с 0,5 мл среды переносили в две пробирки с фильтром из ацетата целлюлозы для спин-центрифугирования и центрифугировали при 5000g в течение 1 мин. Затем слой смолы промывали 3 раза 0,5 мл PBS. IgG элюировали 700 мкл буфера для элюирования Pierce IgG (в который добавляли 52 мкл 9 М Трис буфера, рН 9,5 для доведения рН после элюирования). Полученный элюент переносили в центрифужный концентратор с пределом отсечения по молекулярной массе 10000 и образец концентрировали до примерно 20 мкл. 1 мкл концентрированного образца наносили на полиакриламидный гель SDS для разделения с последующим переносом на нитроцеллюлозную мембрану. Окрашивание блота на общий белок проводили Ponceau S и для изотип идентифицировали с антителом против человеческого IgG. Как и предполагалось, окрашивание на общий белок показывало полосы, соответствующие молекулярным массам тяжелой и легкой цепей IgG, и окрашивание анти-человеческим IgG показывало реакцию с полосой белка, соответствующей молекулярной массе тяжелой цепи.
Фукозилирование антитела также можно оценить с использованием биотин-меченного L-фукоза-специфического лектина Aspergillus oryzae (AOL), который специфически связывается с α-1,6-связанной фукозой антитела. Данный способ определения фукозы функционирует как для блотированного белка, который разделили электрофорезом SDS-PAGE, так и для белка, который наносился на нитроцеллюлозу без разделения. Флуоресцентный сигнал, генерированный с использованием конъюгата AOL-биотин со связыванием стрептавидин-HRP и ECL детектированием, можно количественно определить с использованием системы Alpha Innotech FlourChem® Q. Как и предполагалось, IgG, выделенный из культуры LP-1, давал AOL-зависимый сигнал в полосе, соответствующей молекулярной массе тяжелой цепи (данные не приводятся). Аналоги 2-фторфукоза (SGD-2083) и перацетат 2-фторфукозы (SGD-2084) не ингибировали фукозилирование антитела, но перацетат алкинилфукозы (SGD-1890) - ингибировал.
Для дополнительной оценки активности различных аналогов фукозы 48 различных аналогов фукозы и других четырех ингибиторов гликозилирования тестировали на их способность оказывать влияние на фукозилирование IgG, продуцированного клетками LP-1. Клетки LP-1 (250000 клеток/мл, 3 мл на соединение в 6-луночных планшетах) инкубировали с 100 мкМ каждого аналога фукозы в течение 5 суток при 37°С во влажной атмосфере 5% СО2 в IgG-истощенной среде для культивирования тканей (90% RPMI c 10% IgG-истощенной инактивированной нагреванием FBS). IgG выделяли, как описано выше, с использованием только 0,5 мл суспензии смолы с протеином А MabSelectTM и одной пробирки для спин-центрифугирования на образец с 400 мкл буфера для элюирования IgG в 25 мкл 9 М Трис буфера, рН 9. Элюаты концентрировали до 10-20 мкл на образец и 2 мкл каждого из концентрированных образцов переносили на нитроцеллюлозную мембрану и окрашивали Ponceau S для установления и доведения нагрузки образцов при окрашивании AOL. С учетом данных определения общего белка в каждом образце примерно 0,5 мкг каждого образца наносили на мембрану, высушивали на воздухе и окрашивали Ponceau S. Изображение данной окрашенной мембраны регистрировали с использованием системы Alpha Innotech FlourChem® Q. Затем мембрану блокировали 5% бычьим сывороточным альбумином (BSA) в забуференном Трис физиологическом растворе (TBS) в течение 1 ч, промывали TBS (TBS с Тритоном) 3 раза и затем инкубировали с 5 мкг/мл биотинилированного-AOL в течение 1 ч. Мембрану вновь промывали TBST 3 раза с последующим инкубированием со стрептавидином-HRP в течение 30 мин и конечным промыванием TBST 3 раза. Биолюминесцентный сигнал определяли с использованием реагентов для хемилюминесценции (ECL) и анализировали с использованием системы Alpha Innotech FlourChem® Q и программного обеспечения Alphaview®. Результаты приведены в последующей таблице. Для некоторых аналогов анализировали много образцов, как показано в таблице.


Три аналога фукозы были выбраны на основе результатов полного анализа SDS-PAGE/вестерн-блоттинга для демонстрации того, что изменения сигнала фукозы в тяжелой цепи можно детектировать данным методом. Выбранные три аналога использовали в концентрации 50 мкМ. При проведении анализов сравнивали активность 2-фторфукозы (SGD-2083), перацетата 2-фторфукозы (SGD-2084) и перцетата алкинилфукозы (SGD-1890) с антителом из необработанных клеток. Применение IgG, продуцированного с перацетатом алкинилфукозы, который не проявлял реактивности с биотинилированным AOL, подтверждало, что изменения сигнала AOL можно детектировать данным методом, в то время как 2-фторфукоза (SGD-2083) и перацетат 2-фторфукоза (SGD-2084) не показывали очевидного изменения сигнала AOL. Эти результаты в целом совпадают с данными по этим соединениям в таблице 4.
Оказалось, что многие тестированные аналоги фукозы, приведенные в таблице 4, снижают фукозилирование антитела, продуцированного человеческими миеломными клетками. Дот-блоты соединений показывали, что 10 из них были потенциально сильными ингибиторами фукозилирования IgG в человеческих клетках, о чем судили по снижению сигнала AOL в качестве показателя ингибирования. Данные аналоги фукозы представляют перцетат алкинилфукозы (SGD-1890), тетрапропионат алкинилфукозы (SGD-2010), триацетат 1-метилфукозы (SGD-2039), тетраацетат 5-этилфукозы (SGD-1989), тетрацетат 6-фторфукозы (SGD-1988), тетраацетат 6-бромфукозы (SGD-1969), тетраацетат 6’,6-дифторфторфукозы (SGD-2046), тетраацетат 6-кето-6-этилфукозы (SGD-2067), тетраацетат 5-эпоксифукозы (SGD-2020) и тетраацетат 5-метилкетофукозы (SGD-1964).
Для дополнительного определения результатов с AOL дот-блотов выделяли образцы IgG, продуцированного клетками, обработанными следующими аналогами фукозы (которые давали от среднего до сильного снижения сигнала AOL дот-блота) и исследовали по снижению PLRP-MS для подтверждения статуса фукозилирования с использованием молекулярной массы тяжелой цепи: перацетат алкинилфукозы; тетраацетат 5-винилфукозы; тетраацетат 5-метилкетофукозы; тетраацетат 6-бромфукозы; тетраацетат 6-фторфукозы; тетраацетат 5-этилфукозы; тетраацетат 5-эпоксифукозы; тетраацетат 6’,6-дифторфукозы, тетраацетат 6-кето-6-этилфукозы и перацетат 2-фторфукозы.
Образцы клеток LP-1 в объеме 40 мл (250000 клеток/мл) обрабатывали 100 мкМ аналога фукозы в течение 5 суток, как описано выше, и выделяли IgG, как описано выше, с использованием смолы с протеином А. Выхода устанавливали УФ-спектроскопией, приняв коэффициент экстинкции, равный 1,4 единиц оптической плотности/(мг/мл). Семь из десяти соединений давали достаточное количество IgG для постановки анализа (соединения SGD-2067, SGD-1964 и SGD-2020 давали <10 мкг IgG, вероятно, за счет токсичности этих аналогов для клеток). Остальные IgG восстанавливали 10 мМ DTT при 37°С в течение 15 мин и разделяли на PLRP с последующим определением молекулярной массы с использованием масс-спектрометра QTOF. Исследовали полученные пики тяжелой цепи и сравнивали с IgG, продуцированным необработанными клетками.
Результаты масс-спектрометрии приведены в таблице 5 (ниже). Масс-спектрометрические сигналы оценивали сравнением высоты пика тяжелой цепи против тяжелой цепи минус фукоза и тяжелая цепь минус фукоза плюс масса аналога фукозы (которая будет увеличиваться, если имело место включение аналога в углеводный фрагмент антитела). Четыре из десяти тестированных соединений были полными или частичными ингибиторами 1,6-фукозилирования в антителе. Перацетат алкинилфукозы (SGD-1890) обеспечивал полное ингибирование, в то время как перацетат 2-фторфукозы (SGD-2084) был следующим по наилучшей эффективности с 70% ингибированием, за которой следовали тетраацетат 6’,6-дифторфукозы (SGD-2046) и тетраацетат 6-бромфукозы (SGD-1969) примерно с 33 и 20% ингибированием, связанным с включением аналога в углевод.
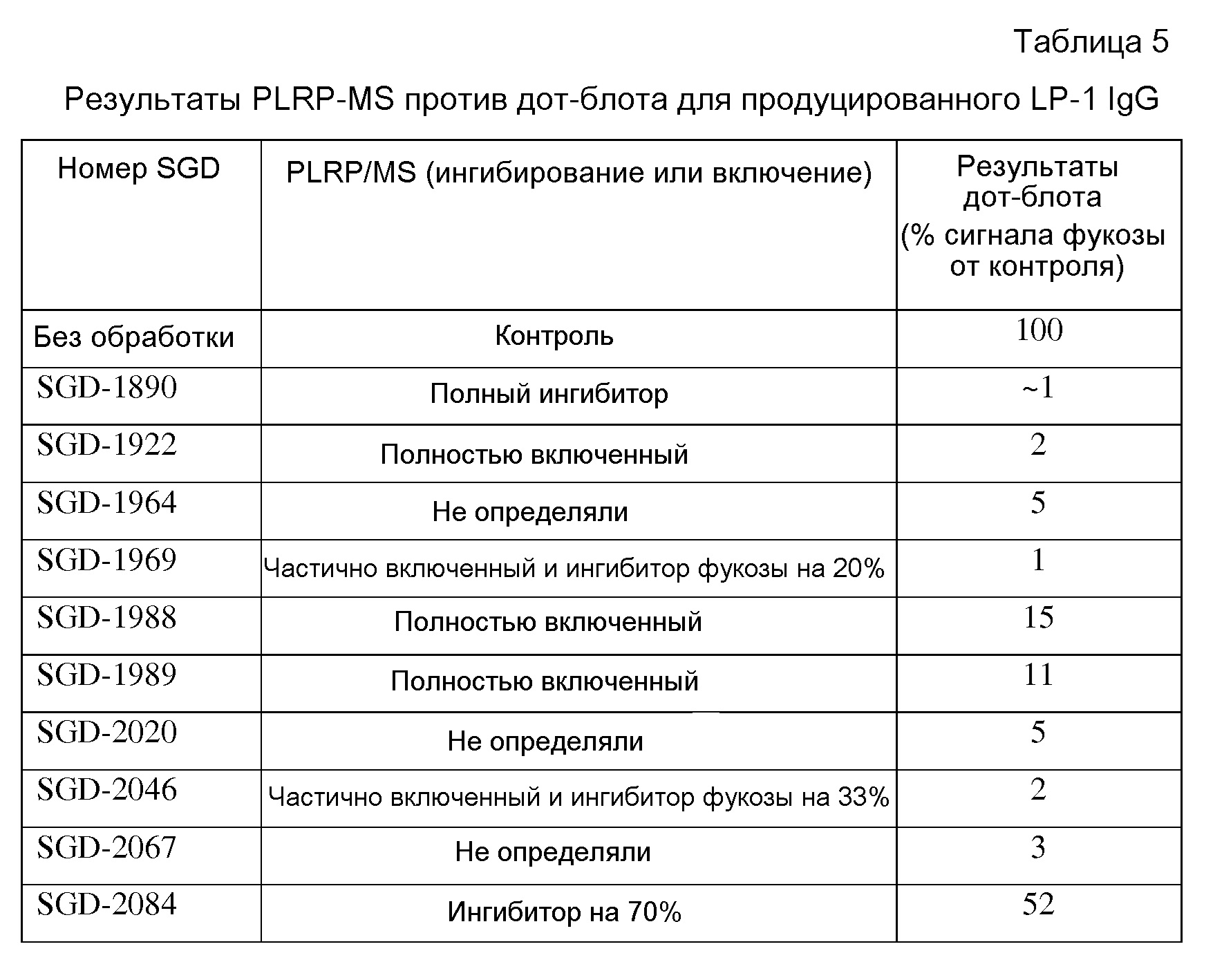
Пример 5: влияние аналогов фукозы на фукозилирование белка
Исследовали влияние четырех частичных и полных ингибиторов, перцетата алкинилфукозы (SGD-1890), перацетата 2-фторфукозы (SGD-2084), тетраацетата 6’,6-дифторфукозы (SGD-2046) и тетраацетата 6-бромфукозы (SGD-1969), на фукозилирование поверхностных клеточных белков раковых клеток человека при инкубации клеток пяти различных раковых линий человека (Caki-1, PC-3, Ramos, LS174t и HL60cy). 100 мкМ каждого ингибитора использовали в стандартных условиях культивирования примерно в течение 1-2 недель с регулярной заменой культуральной среды, включая добавление свежего ингибитора. После инкубационного периода клетки анализировали FACS с использованием четырех различных реагентов для детектирования: биотинилированный-Lens culimaris агглютинин-А (LCA), анти-Lewisx-антитело(анти-SSEA1), анти-Lewisy-антитело(cBR96) и рекомбинантный слитый белок человеческий Р-селектин/CD62P/Fc. Протокол включал отмывку клеток буфером для FACS (PBS+10% бычьего сывороточного альбумина+0,02% азида натрия) 3 раза с последующей инкубацией с первичным детектирующим реагентом в течении 1 ч при 4°С с последующим промыванием 3 раза буфером для FACS и затем инкубацией со вторичным детектирующим реагентом в течении 1 ч при 4°С. Наконец, клетки промывали буфером для FACS 3 раза и ресуспендировали в буфере для FACS, и анализировали на проточном цитометре BD FACScan. Реагент LCA узнает последовательности, содержащие α-связанные остатки маннозы, и его аффинность заметно повышается под действием α-связанных остатков фукозы, соединенных с фрагментом N-ацетилхитобиозой олигосахаридного кора. Слитый белок с Р-селектином детектирует лиганд Р-селектина, находящийся на поверхности клеток, взаимодействие, которое включает сиалил-Lewisx-эпитоп, представляющий лиганд Р-селектина.
Все исследуемые клеточные линии показывали окрашивание реагентом LCA, который узнает последовательности, содержащие α-связанные остатки маннозы, аффинность которого заметно повышается под действием α-связанных остатков фукозы, соединенных с фрагментом N-ацетилхитобиозой олигосахаридного кора. LCA-детектирование данного эпитопа сахара снижалось при обработке клеток всеми ингибиторами (100 мкМ). На основании этого можно предположить, что на присутствие фукозы на клеточной поверхности оказывает влияние обработка шестью тестированными аналогами фукозы.
На фигуре 7 приведены результаты этих опытов. В отношении Lewisx, то из тестированных клеточных линий только необработанные LS1745t и HL60cy имели существенное количество Lewisxна клеточной поверхности (анти-SSEAI-окрашивание) (фигура 7А). Детектирование анти-SSEAI данной структуры достоверно снижалось при обработке клеток всеми аналогами фукозы (100 мкМ).
В отношении Lewisy, то из тестированных клеточных линий только необработанные LS1745t и HL60cy имели существенное количество LewisY, детектированноена клеточной поверхности (окрашивание cBR96) (фигура 7В). Детектирование cBR96 данной структуры достоверно снижалось при обработке клеток всеми аналогами фукозы (100 мкМ).
В отношении Р-селектина, тоизтестированных клеточных линий только необработанная линия HL60cy имела существенное количество лиганда Р-селектинана клеточной поверхности. Детектирование этого лиганда несколько снижалось при обработке клеток всеми аналогами фукозы, за исключением перацетата алкинилфукозы (SGD-1890) (100 мкМ) (фигура 7С). Необработанные клетки Ramos показывали небольшое количество лиганда Р-селектина; однако при обработке аналогами фукозы сигнал для данного лиганда усиливался. Это является неожиданным результатом, и ранее он не наблюдался с предыдущей обработкой этих клеток 2-фторфукозой (SGD-2083) или алкинилфукозой (SGD-1887).
На основании этих результатов можно предположить, что обработка данными аналогами фукозы может оказать влияние на присутствие фукозы на клеточной поверхности, в общем, и также, в частности, на фукозилирование модификаций LewisХ и LewisY на клеточной поверхности и сиалил-LewisХ, присутствующего в лиганде Р-селектина.
Пример 6: лейкоцитоз и снижение связывания Е-селектина после перорального введения 2-фторфукозы
Исследовали влияние аналога фукозы на лейкоцитоз и связывание Е-селектина у мышей. Мышам-самкам Balb/c вводили перорально 2-фторфукозу (SGD-2083) с питьевой водой или оставляли без обработки. У мышей отбирали пробы крови до введения и затем каждую неделю в течение трех недель для определения циркулирующего числа клеток и их способности связываться с Е-селектином. В одном опыте 2-фторфукозу формулировали в концентрациях 1 мМ, 10 мМ или 100 мМ в питьевой воде (n=3 в группе). На 14 сутки мышей обрабатывали адъювантом TiterMAX® Classic (Sigma) для стимуляции продукции поликлональных, антиген-неспецифических антител В-клетками, и животных оставляли на воде, содержащей 2-фторфукозу до 21 суток. Во втором опыте мышам вводили 2-фторфукозу, формулированную для перорального введения с питьевой водой в концентрации 10 мМ и 100 мМ в течение трех недельбез каких-либо других обработок(n=6 в группе).На 21 сутки пул лимфатических узлов (подмышечных, плечевых, паховых и брыжеечных) от каждого из трех животных исследовали в дополнении к анализу крови. Лимфатические узлы гомогенизировали в суспензии отдельных клеток и определяли общее число клеток на гемоцитометре с использованием трипанового синего, для исключения погибших клеток. Для определения общего числа лейкоцитов/мкл крови образцы крови от отдельных животных анализировали на гемоцитометре с использованием раствора Тюрка (0,01% генциановый фиолетовый в 3% уксусной кислоте) для исключения эритроцитов (RBC). RBC удаляли из остатка крови осмотическим лизисом для анализа проточной цитометрией. Клетки инкубировали с анти-Gr-1-FITC-антителами (BD Biosciences) для идентификации нейтрофилов и рекомбинантного слитого белка Е-селектин-человеческая Fc. Клетки отмывали и затем инкубировали с PE-меченным козьим вторичным антителом против человеческой IgG-Fc (Jackson Immunoresearch) для детектирования связанного Е-селектина. Образцы собирали в проточном цитометре FACSCalibur и анализировали с использованием программного обеспечения CellQuest. Определяли процент Gr-1+ клеток и рассчитывали абсолютное количество нейтрофилов с использованием общего числа лейкоцитов по данным подсчета клеток на гемоцитометре. В дополнении проточные клетки гейтировали в режиме по Gr-1+ клеткам для оценки связывания Е-селектина с нейтрофилами анализом гистограммы. Определяли геометрическое среднее значение флуоресцентного сигнала Е-селектина из гистограммы.
Результаты
Результаты, приведенные на фигурах 5А и 5В, показывают, что пероральное введение 2-фторфукозы (SGD-2083) приводило к повышению циркулирующих лейкоцитов и нейтрофилов в зависимости от дозы. 2-фторфукоза, введенная в концентрации 1 мМ, оказывала очень незначительное воздействие, в то время как эффект усиливался с повышением доз 2-фторфукозы до 10 мМ и 100 мМ. Данные, приведенные на фигурах 5А и 5В, отражают результаты первого опыта, сутки 14. Аналогичные результаты были получены на сутки 7 и 21 в первом опыте, а также на сутки 14 и 21 во втором опыте (данные не приводятся). Во втором опыте на сутки 21 также исследовали лимфатические узлы, и на фигуре 5С показано, что пероральное введение 2-фторфукозы приводит к заметному снижению клеточности лимфатических узлов. Эффект был более выраженным в концентрации 100 мМ по сравнению с 10 мМ.
Пероральное введение 2-фторфукозы также приводит к пониженному связыванию Е-селектина с нейтрофилами (фигура 6). Эффекты аналогов фукозы также были дозозависимыми, притом что концентрация, составляющая 1 мМ, оказывала незначительный эффект, и 10 мМ и 100 мМ имели возрастающее действие (фигуры 5В и 5С).
Наблюдаемое повышение циркулирующих лейкоцитов и нейтрофилов (лейкоцитоз) согласуется с ингибированием связывания нейтрофилами Е-селектина. Е-селектин опосредует выход лейкоцитов в периферические сосуды и лимфатические узлы, и ингибирование связывания Е-селектина (посредством ингибирования фукозилирования) будет также снижать выход и приводить к накоплению лейкоцитов в крови. На основании данных результатов можно предположить, что аналоги фукозы, которые ингибируют фукозилирование белков, и в частности, фукозилирование Е-селектина, могут подавлять аутоиммунитет.
Пример 7: ингибирование роста опухолей введением аналогов фукозы
Опыт 1
Человеческие клеточные линии оценивали на их чувствительность к аналогу фукозы 2-фторфукозе в условиях in vitro. Исследуемыми клеточными линиями были: аденокарцинома ободочной кишки LS174T, аденокарцинома ободочной кишки PC-3, острый миелогенный лейкоз HL-60, лимфома Беркитта Ramos и почечноклеточная карцинома Caki-1. Клетки указанных линий культивировали в присутствии 100 мкМ 2-фторфукозы (SGD-2083) в культуральной среде, 100 мкМ алкинилфукозы (SGD-1887) в культуральной среде или в контрольной культуральной среде (без аналога фукозы) в течение двух недель. Культуральными средами были: среда Игла МЕМ с 10% FBS (LS174T), 50:50 F12 и RPMI с 10% FBS (PC-3), RPMI с 10% FBS (HL-60), IMDM с 10% FBS (Ramos) и McCoy с 10% FBS (PC-3). Клетки оценивали на фукозилирование белков клеточной поверхности FACS с использованием антитела cBR96 для детектирования Lewis Y, антитела SSEA-1 для детектирования Lewis X, лиганда Р-селектина для детектирования Р-селектина и лектина AOL для детектирования общего уровня фукозилирования.
Результаты
Результаты анализа FACS выявили различные уровни фукозилированных клеточных поверхностных белков в клетках различных линий (данные не приводятся). В целом 2-фторфукоза (SGD-2083) была более хорошим ингибитором фукозилирования белков по сравнению с алкинилфукозой (SGD-1887).
Опыт 2
Для дальнейшей оценки активности данных аналогов фукозы проводили дополнительные опыты в условиях in vivo с использованием опухолевых клеток, которые предварительно были обработаны культивированием в присутствии аналога фукозы или с использованием необработанных опухолевых клеток. Опухолевые клетки имплантировали 10 мышам на группу следующим образом. Для клеточных линий LS174T, PC-3 и Caki-1 5⋅105 клеток в 25% матригеле имплантировали подкожно нуд мышам-самкам. Для клеточных линий HL-60 и Ramos 5⋅106 клеток имплантировали подкожно мышам-самкам SCID. Мыши, которым имплантировали необработанные клетки, получали обычную питьевую воду. Мышам, которым имплантировали опухолевые клетки, предварительно обработанные 2-фторфукозой (SGD-2083), спаивали питьевую воду с добавлением 20 мМ 2-фторфукозы (SGD-2083). Мышам, которым имплантировали опухолевые клетки, предварительно обработанные алкинилфукозой (SGD-1887), спаивали обычную питьевую воду. Мыши не получали питьевую воду, содержащую алкинилфукозу.
После получения в течение 3 недель питьевой воды, содержащей 2-фторфукозу, мышей переводили на обычную питьевую воду, за исключением мышей с опухолями Caki-1. Последних мышей переводили на обычную питьевую воду в течение одной недели. Через неделю получения обычной воды мышей рандомизировали на две группы по 5 животных в каждой для получения питьевой воды с добавлением 20 мМ 2-фторфукозы или обычной питьевой воды. Мышей убивали, когда размеры опухолей достигали объема примерно 1000 мм3.
При анализе фигур 8А-Е можно отметить ингибирование роста опухолей для клеток LS174T, PC-3 и Caki-1, обработанных 2-фторфукозой (SGD-2083). Изменения в росте опухолей не наблюдали для клеток HL-60 и Ramos. Для Caki-1 не наблюдали ингибирования роста опухолей во время первого периода обработки, но данный эффект отмечали после того, как мышей возвращали к обработке 2-фторфукозой. Для других клеточных линий оказалось, что ингибирование роста опухолей начиналось, когда размер опухолей достигал 150 мм3. За счет более медленного роста опухоли Caki-1 не достигали этой точки до второго периода обработки 2-фторфукозой (SGD-2083). Эти результаты указывают на то, что обработка аналогами фукозы может ингибировать рост опухолей.
Опыт 3
В третьем опыте опухолевые клетки имплантировали без предварительной обработки аналогом фукозы. Клетки аденокарциномы ободочной кишки LS174T (5⋅105 клеток в 25% матригеле) имплантировали подкожно нуд мышам-самкам. Мышам спаивали питьевую воду, содержащую 50 мМ 2-фторфукозы (SGD-2083), начиная за 7 суток до имплантации до 21 суток после имплантации, или животных содержали на обычной питьевой воде.
Результаты
При рассмотрении фигуры 8F становится очевидным, у мышей, которым спаивали питьевую воду с 50 мМ 2-фторфукозы (SGD-2083), имело место подавление роста опухолей, которые достигали размера 110 мм3 против 734 мм3у мышей, которые получали обычную питьевую воду. В целом данные результаты дают основание предположить, что при введении аналога фукозы можно достичь подавления роста опухолей.
Пример 8: модель противоопухолевой вакцины
Мышей-самок Balb/c иммунизировали подкожной имплантацией 1 млн клеток мышиной лимфомы А20 (убитых облучением) на сутки 21 и сутки 7. Другую группу мышей не иммунизировали. На сутки 0 всем мышам вводили внутривенно 1,5 или 5 млн живых клеток А20. На сутки -14 до +21 мышей содержали на питьевой воде с 50 мМ 2-фторфукозы (SGD-2083) или спаивали обычную питьевую воду. В опыте было 8 следующих опытных групп:
1. Без иммунизации, 1,5 млн живых клеток А20, обычная питьевая вода.
2. Без иммунизации, 5 млн живых клеток А20, обычная питьевая вода.
3. Без иммунизации, 1,5 млн живых клеток А20, 50 мМ SGD-2083 в питьевой воде.
4. Без иммунизации, 5 млн живых клеток А20, 50 мМ SGD-2083 в питьевой воде.
5. Иммунизированные, 1,5 млн живых клеток А20, обычная питьевая вода.
6. Иммунизированные, 5 млн живых клеток А20, обычная питьевая вода.
7. Иммунизированные, 1,5 млн живых клеток А20, 50 мМ SGD-2083 в питьевой воде.
8. Иммунизированные, 5 млн живых клеток А20, 50 мМ SGD-2083 в питьевой воде.
Результаты
На фигуре 9А показан дизайн исследования. При рассмотрении фигуры 9В становится очевидным, что мыши, которых не иммунизировали, пали в ответ на введение живых клеток А20 на 22-35 сутки. Мыши, получавшие 2-фторфукозу (SGD-2083), выживали на несколько суток дольше по сравнению с мышами, получавшими обычную питьевую воду. Две мыши, иммунизированные 5 млн убитых клеток А20 и получавшие обычную питьевую воду, погибли в результате введения живых А20. Все мыши, получавшие иммунизацию и 2-фторфукозу (SGD-2083) с питьевой водой, были по-прежнему живы на момент получения данных.
Настоящее изобретение не ограничивается в объеме конкретными вариантами осуществления, описанными в данном документе. Различные модификации изобретения в дополнении к описанным в данном документе, станут очевидными для специалистов в данной области из приведенного описания и прилагающихся фигур. Предполагается, что такие модификации попадают в объем прилагаемой формулы изобретения. Если не указано иначе по контексту, то любую стадию, элемент, вариант осуществления, признак или аспект изобретения можно использовать в комбинации с любыми другими. Все патентные заявки и научные публикации, инвентарные номера и тому подобное, относящиеся к данной заявке, включены в полном объеме для сведения для всех целей до той степени, как если бы они были включены по отдельности.
Реферат
Группа изобретений относится к медицине и может быть использована для ингибирования фукозилирования белков у млекопитающего. Для этого указанному млекопитающему вводят эффективное количество аналога фукозы, выбранного из группы, состоящей из одной из следующих струпных формул (V) или (VI). Также предложена фармацевтическая композиция для ингибирования фукозилирования белков у млекопитающего. Группа изобретений обеспечивает ингибирование фукозилирования белков, в частности фукозилирование Е-селектина, что способствует подавлению аутоиммунитета. 2 н. и 9 з.п. ф-лы, 9 ил., 5 табл., 8 пр.
Формула
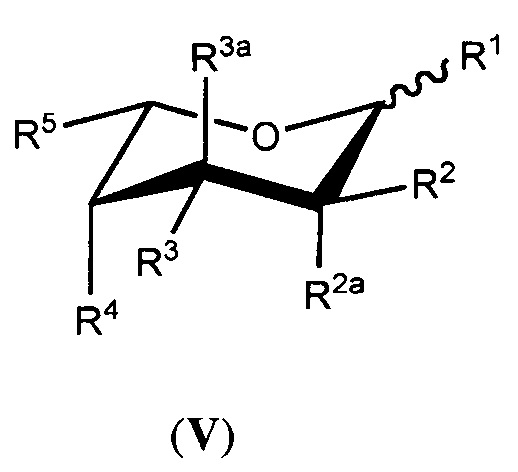
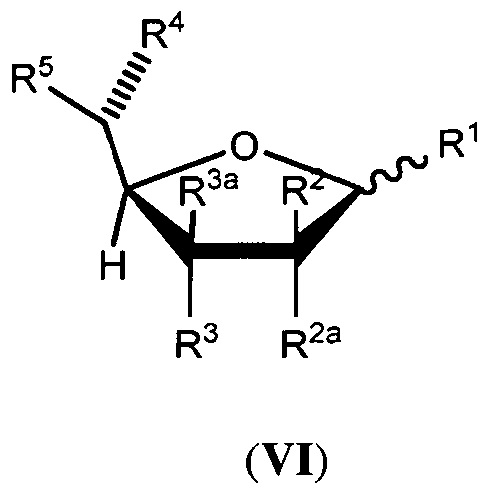
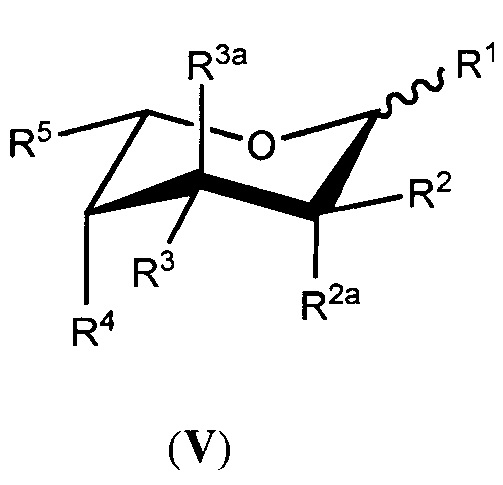
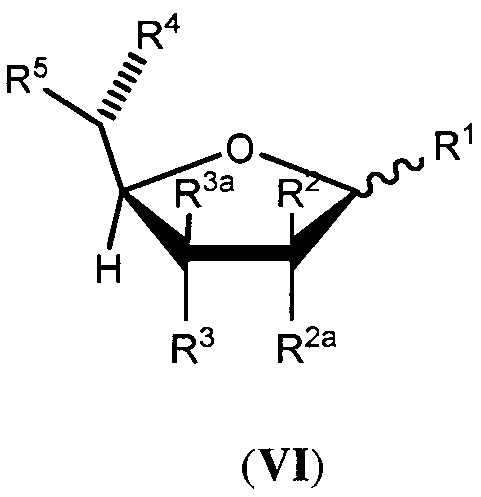

Комментарии