N-метил-n-( α,d -глюкопиранозил) аммония-2-(акридон-9-он-10-ил)ацетат(циклоферон), обладающий интерфероногенной, противовирусной, в том числе антивич, антипаразитарной, антипромоторной и радиопротективной активностью - RU2036198C1
Код документа: RU2036198C1
Чертежи





Описание
Изобретение относится к медицине, а именно к биологически активным веществам, получаемым химическим путем. Изобретение относится к
новым производным
акриданонов общей формулы
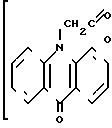

(I), обладающим широким спектром биологической активности: интерфероногенной, противовирусной, в том числе антиВИЧ, антипаразитарной, антипромоторной, радиопротективной.
Известны соединения, относящиеся к классу акриданонов природного происхождения и модифицированные на их основе путем химического синтеза, проявляющие противоопухолевую и противовирусную активность (патент Японии N 64-40426, кл. А 61 К 31/47, 1989, патент Японии N 63-310826, кл. А 61 К 31/435, 1988), а также ряд природных соединений этого же класса, обладающих антипротозойной и противогерпетической активностью (патент США N 4244954, кл. А 61 К 31/47, 1978, патент ЕПВ N 110298, кл. А 61 К, 1984).
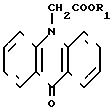
Известен структурный аналог циклоферона, а именно хлоргидрат диметиламинэтилового эфира 10-карбоксиметил-9-акри- дона общей формулы

(II), где R водород, обладающий интерфероногенной активностью и отличающийся от циклоферона заместителем в положении 10 акридонового цикла (патент Польши N 139805, кл. С 07 D 219/16, 1987). Указанное вещество обладает меньшей интерфероногенной активностью по сравнению с заявляемым объектом при одинаковом уровне токсичности.
Задача изобретения получение нового производного акриданонового класса, обладающего широким спектром биологической активности, низкой токсичностью, высоким химиотерапевтическим индексом.
Решение поставленной задачи достигается соединением общей формулы (1), получаемым взаимодействием соединения общей формулы
(III), где R1 водород, алкильная группа, катион металла или аммония, с производным α, D-глюкопиранозиламина общей формулы

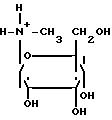
(IV), где R2 метильная группа.
П р и м е р 1. 99,6 г N-метил-N-(αD-глюкопиранозиламина) растворяют в 200 мл дистиллированной воды и прибавляют порциями при перемешивании 125 г тщательно измельченной 2-(акридон-9-он-10-ил)уксусной кислоты, продолжают перемешивание при комнатной температуре до полного растворения и прибавляют 1000 мл этилового спирта. Выпавший осадок отфильтровывают, промывают на фильтре 100 мл этилового спирта и сушат при 60оС в течении 1 ч. В форме желтых кристаллов получают 224 г (100%) N-метил-N-(αD-глюкопиранозил)-аммония-2-(акридон-9-он-10-ил) ацетата (циклоферона), который после перекристаллизации из низших спиртов имеет т.пл. 129-132оС.
Вычислено, C 58,74, H 5,83, N 6,73
C22H26N2
O8
Найдено, C 58,52, H 5,64, N 6,81.
П р и м е р 2. 276 г натрия 2-(акридон-9-он-10-ил)-ацетата растворяют при перемешивании в 400 мл дистиллированной воды, прибавляют концентрированную соляную кислоту до рН 3, выпавший осадок 2-(акридон-9-он-10-ил)уксусной кислоты отфильтровывают, промывают на фильтре 100 мл дистиллированной воды и перекристаллизовывают из смеси диметилформалид-вода (3: 1). Осадок 2-(акридон-9-он-10-ил)уксусной кислоты сушат при 105оС в течение 3 ч и далее действуют аналогично примеру 1. Получают 398 г (89%) N-метил-N-(αD-глюкопиранозил)аммония-2(акридон-9-он-10-ил) ацетата (циклоферона), который после перекристаллизации из ниших спиртов имеет т.пл. 129-132оС.
П р и м е р 3. 282 г 2-этил-(акридон-9-он-10-ил)-ацетата суспендируют в 500 мл 20%-ного водного раствора едкого натра, нагревают до кипения и перемешивают при кипении до полного растворения осадка, затем реакционную массу охлаждают до комнатной температуры, подкисляют концентрированной соляной кислотой до рН 3,0. Выпавший осадок 2-(акридон-9-он-10-ил) уксусной кислоты отфильтровывают, промывают на фильтре 300 мл воды и перекристаллизовывают аналогично примеру 2. Далее действуют аналогично примеру 1.
Получают 381 г (86%) N-метил-N(α D-глюкопиранозил)аммония-2- (акридон-9-он-10-ил)ацетата(циклоферона), который после перекристаллизации из низших спиртов имеет т.пл. 129-132оС.
Физико-химические свойства циклоферона представлены в табл.1.
Мутагенным, терратогенным, эмбриотоксическим и аллергенным действием N-метил-N-(α, D-глюкопиранозил)аммония-2-(ак- ридон-9- он-10-ил)ацетат(циклоферон) не обладает.
Изучение медико-биологических свойств N-метил-N-(α D-глюкопиранозил)аммония-2-(акридон-9-он-10-ил)ацетата (циклоферона) проведено в эксперименте на животных, при этом выявлен широкий спектр биологической активности заявляемого вещества, сочетающийся с его низкой токсичностью, хорошей переносимостью и высоким индексом терапевтической эффективности.
Опыт А. Острая токсичность циклоферона изучена на беспородных белых мышах линии ристал массой 18-20 г.
Препарат вводили внутривенно и внутримышечно в различных дозах от 2000 мг/кг и ниже с двухкратным шагом. Срок наблюдения 14 дней. Летальную дозу (ЛД50 ) рассчитывали по методу Кербера. Данные по изучению острой токсичности представлены в табл.2.
Опыт Б. Интерфероногенная активность.
Известна способность низкомолекулярного соединения из класса флуоренонов тилорона индуцировать выработку интерферона. Интерфероноиндуцирующим действием обладают низкомолекулярные соединения класса акриданонов, например хлоргидрат диметиламиноэтилового эфира 10-карбоксиметил-9-акридона.
Интерфероноиндуцирующую активность циклоферона изучали на мышах и в культуре клеток животного и человеческого происхождения.
Мышам линии СВА массой 10-12 г вводили однократно подкожно циклоферон в дозе 200 мг/кг и тилорон в дозе 50 мг/кг. Через определенные интервалы времени определяли титры интерферона в крови стандартным методом на гомологических клетках L-929, выращенных в 96-луночных планшетах в термостате с СО2. Тест-вирусом служил вирус энцефаломиокардита. Сравнительные данные интерфероноиндуцирующей активности циклоферона, тилорона и структурного прототипа циклоферона хлоргидрата диметиламиноэтилового эфира 10-карбоксиметил-9-акридона приведены в табл.3.
Как видно из представленных данных, циклоферон индуцирует продукцию раннего (2-8 ч) интерферона в высоких титрах. Пик продукции интерферона в случае циклоферона превышает уровень интерферона в сыворотке мышей в ответ на введение тилорона в 1000 раз, структурного прототипа в 640 раз. Высокая интерфероноиндуцирующая активность циклоферона подтверждена также на культуре клеток.
Из мышей линии СВА выделяли лимфоциты селезенки и лимфоциты периферической крови и индуцировали их циклофероном и тилореном. Посадочная концентрация лимфоцитов составляла 5х106 кл/мл. Исследовали динамику накопления интерферона в культуральной жидкости лимфоцитов, выращенных на пластиковых панелях в присутствии СО2.
Титры интерферона в спленоцитах и клетках крови после введения циклоферона и тилорона представлены в табл.4.
Результаты, представленные в табл.4, демонстрируют, что циклоферон индуцирует существенно более высокие уровни интерферона в смешанной культуре лимфоцитов селезенки и периферической крови, чем тилорон.
Подтверждена интерфероногенная активность циклоферона при действии в культуре клеток человека. С этой целью лимфоциты периферической крови человека получали путем разделения лейкоцитарной массы донорской крови. Посадочная концентрация лимфоцитов составляла 2х106 кл/мл. Клетки выращивали в 24-луночных пластиковых панелях. Индукцию лимфоцитов осуществляли циклофероном и тилороном в концентрации 600 и 200 мг/мл соответственно. Интерферон в культуральной жидкости определяли титрованием на диплоидных человеческих клетках М-19. Тест-вирусом служил вирус везикулярного стоматита. Пробы интерферона нейтрализовали стандартными антисыворотками к α -9 и β -9 человеческого интерферона, контролем служили международные стандарты человеческого интерферона.
Данные индукции интерферона в лимфоцитах человека приведены в табл.5.
Как следует из данных табл.5, циклоферон индуцирует продукцию интерферона в лимфоцитарных культурах периферической крови человека в 90 раз выше, чем тилорон.
Опыт В. Противовирусная активность циклоферона.
1. В. Установлена высокая активность N-метил-N-(α, D-глюкопиранозил)аммония-2-(ак- ридон-9-он-10-ил)ацетата (циклоферона) при экспериментальной инфекции мышей, зараженных вирусом клещевого энцефалита (КЭ).
В настоящее время для борьбы с этой инфекцией используется только инактивированная вакцина, обладающая весьма низкой эффективностью и требующая ежегодных прививок в связи с быстрым снижением резистентности к этой инфекции. Других средств защиты от КЭ практическая медицина не имеет.
Для установления эффективности циклоферона в отношении КЭ использовали вирус КЭ штамм АБСЕТТАРОВ. Титр вируса при внутримозговом заражении составил 7,0-8,0 lg LD50, при подкожном заражении 5,0 lg LD50. Эксперимент проводили на нелинейных белых мышах массой 12-14 г. Заражение животных осуществляли введением вируса КЭ подкожно. Циклоферон растворяли в физрастворе и вводили опытной группе мышей подкожно. Контрольной группе мышей вводили подкожно физраствор. Наблюдение за экспериментальными животными проводилось в течение 21 дня. Критериями оценки эффективности циклоферона служили выживаемость и средняя продолжительность жизни животных опытной группы по сравнению с контрольной. Результаты проведенного эксперимента представлены в табл.6.
Представленные данные свидетельствуют о выраженном защитном действии препарата. Кроме того, специально проведенные исследования показали, что на 4 и 7 сутки после заражения вирус КЭ в мозгу мышей, получавших циклоферон, не был обнаружен, в то время как в контрольной группе животных вирус репродуцировался в высоких титрах.
2. В. Установлена активность циклоферона в отношении вируса иммунодефицита человека (ВИЧ). В настоящее время известен единственный препарат, разрешенный для применения в медицинской практике как средство для лечения синдрома приобретенного иммунодефицита (СПИД). Это нуклеозидной природы азидотимидин (ретровир, зидовудин), существенными недостатками которого являются высокая токсичность, быстрое формирование устойчивости к нему штаммов вируса. Кроме того, препарат не обеспечивает выживаемости, а только пролонгирует продолжительность жизни больных СПИД.
Для оценки эффективности циклоферона на репродукцию ВИЧ использовали культуру клеток моноцитов линии И-937. Клетки выращивали в пробирках на среде RPMI-1640 с 20%-й фетальной телячьей сывороткой в конечной концентрации 0,5-0,7х106 кл/мл. Перед внесением препаратов в состав поддерживающей среды суспензию клеток инфицировали концентратом культуральной жидкости, питая полученные из клеток линии НТА-41, продуцирующих ВИЧ. Затем клетки инкубировали при 37о С в течение 3-4 суток с последующей сменой питательной среды. На 5 и 7 дни после инфицирования определяли наличие вирусспецифического антигена в реакции непрямой иммунофлуоресценции с использованием иммуноглобулинов к ВИЧ.
Результаты оценки ингибирующего действия циклоферона на эспрессию антигенов ВИЧ в клетках моноцитов линии И-937, индуцирующих ВИЧ, в сравнении с азидотимидин представлены в табл.7.
Таким образом, циклоферон в концентрациях, почти в 1000 раз меньших, чем азидотимидин, оказывает равный эффект на экспрессию антигенов ВИЧ в культуре клеток моноцитов.
Опыт Г. Антипаразитарная активность циклоферона изучена на модели экспериментального хламидиоза в сравнении с гидрохлоридом тетрациклина, являющегося традиционным средством лечения этого вида инфекционной патологии человека. Ранее индукторы интерферона при лечении хламидиозных инфекций не использовались. Лечение хламидиозных инфекций антибиотиками тетерациклинового ряда требует длительного курса лечения, ограничено токсичностью антибиотика и быстрым развитием устойчивых форм возбудителей.
В работе использовали возбудитель C. trachomatis нелинейных белых мышей массой 16-18 г, заражаемых суспензией инфицированного материала. В опытных группах животным вводили циклоферон спустя 24 ч после заражения однократно в дозе 60 мг/кг и двукратно с интервалом 96 ч.
Тетрациклин гидрохлорид вводили по общепринятой схеме однократно в течении 5 дн в дозе 100 мг/кг.
Контрольной группе животных вводили физраствор.
Индекс эффективности учитывали цитископически при окраске мазков-отпечатков лимфатических узлов и легкого, где происходит размножение возбудителя.
Сравнительные данные по эффективности лечения хламидиоза циклофероном и тетрациклином представлены в табл.8.
Полученные сравнительные данные свидетельствуют о том, что циклоферон оказывает более выраженный лечебный эффект, увеличивая в 2-4 раза индекс эффективности по сравнению с группой животных, которых лечили тетрациклином.
Опыт Д. Антипромоторная активность.
Известно, что развитие опухолей является многостадийным процессом, включающим инициацию, промоцию, прогрессию. Первые две стадии вызывают в процессе канцерогенеза возникновение первичной опухоли, прогрессия означает процесс дальнейшей эволюции опухоли. Вещества, обнаруживающие антипромоторную активность, можно рассматривать как потенциальные противоопухолевые средства. Изучение проводили на мышах линии СВА, самках массой 25 г. В качестве препарата сравнения использовали тилорон-синтетический препарат из класса флуоренонов.
Препараты вводили животным в оптимальных дозах ежедневно в течение 6 сут. Через 6 ч после последней инъекции животных забивали, вырезали часть легкого и печени, погружали их в среду 199 и производили измерение силы сцепления клеток. Контрольной партии мышей вводили физраствор.
Измерение силы сцепления клеток проводили с помощью микроманипулятора по методу Кумана в модификации Е.А.Модяновой. Для каждой экспериментальной точки измеряли силу сцепления клеток у 4-5 мышей. От каждой мыши исследовали по одному сегменту, в котором определяли сцепление у 10-30 клеток.
Результаты оценки антипромоторной активности циклоферона представлены в табл.9 и 10.
Таким образом, при введении циклоферона величина силы сцепления гепатоцитов возрастает в 2 раза, в то время как в случае тилорона показатели не отличаются от контроля.
Как видно из данных табл.10, циклоферон повышает силу сцепления клеток альвеол легких в 1,2 раза по сравнению с тилороном и контролем.
Изучение антипромоторной активности циклоферона показало, что циклоферон ведет себя как классический адгезионный фактор, который увеличивает силу сцепления клеток в печени в 2 раза, в альвеолах легких в 1,5 раза.
Опыт Е. Радиопротективная активность.
Радиопротективную активность циклоферона изучали на мышах линии СВА/1 массой в среднем 26,7 ±1,84 г. Мышей облучали60Со в диапазоне 7,5-9,0 Гр. Циклоферон вводили в дозе 300 мг/кг однократно, подкожно за 2 ч до облучения. Контрольной группе животных вводили физраствор. Наблюдение проводили в течение 14 дн.
Критерием эффективности препарата служили показатели выживаемости мышей.
Результаты эксперимента представлены в табл.11.
Таким образом, однократное подкожное введение циклоферона за 2 ч до облучения обеспечивает защиту 70% мышей от воздействия60Со в дозе 8,7 Гр и 50-60% от 8,0-8,5 Гр, а 40% от максимальной дозы 9,0 Гр, что свидетельствует о высоком радиопротективном эффекте циклоферона.
Таким образом, из вышеизложенного следует, что разработчикам удалось получить новое соединение акриданонового класса, обладающие широким спектром биологической активности, в том числе активностью неизвестной ранее для данного класса соединений (антипаразитарная, радиопротективная). В виду низкой токсичности соединения целесообразна разработка на его основе лекарственных препаратов для парентерального, перорального и наружного применения.
Реферат
Использование: в медицине, в частности, в качестве интерфероногенного, противовирусного (в том числе антиВИЧ), антипаразитарного, антипромоторного и радиопротективного средства. Сущность изобретения: продукт - N-метил-N-( α, D- глюкопиранозил) аммония-2- (акридон -9- он-10-ил) ацетат C22H26N2O8, т. пл. 129 - 132°С, выход 100%. Реагент 1 : N-метил -N-( α, D-глюкопиранозиламин). Реагент 2 : 2-(акридон -9- он-10-ил) уксусная кислота. Условия реакции: в среде этанола при комнатной температуре. Структура продукта приведена в описании. 11 табл.
Формула
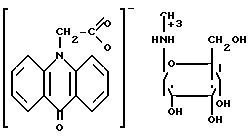
обладающий интерфероногенной, противовирусной, в том числе антиВИЧ, антипаразитарной, антипромоторной и радиопротективной активностью.

Комментарии