Производные пантотената для лечения неврологических заболеваний - RU2653497C2
Код документа: RU2653497C2
Чертежи


Описание
По настоящей заявке испрашивается приоритет предварительной патентной заявки №61/639602, поданной 27 апреля 2012, полное содержание которой включено в настоящее изобретение с помощью ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к производным пантотената для лечения неврологических заболеваний (таких как нейродегенерация, связанная с пантотенаткиназой), фармацевтическим композициям, содержащим данные соединения, и их применению в лечении неврологических заболеваний.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Нейродегенерация, связанная с пантотенаткиназой (PKAN), представляет собой форму, предположительно ответственную за половину нейродегенераций с накоплением железа в мозге (NBIA), которая вызывает экстрапирамидную дисфункцию (например, дистонию, оцепенелость, хореоатетоз) (A.M. Gregory and S.J. Hayflick, "Neurodegeneration With Brain Iron Accumulation", Orphanet Encyclopedia, сентябрь 2004). Считается, что PKAN является генетическим заболеванием, являющимся результатом недостатка фермента пантотенаткиназы, который является ответственным за превращение пантотената (витамина B-5) в 4'-фосфопантотенат. Затем, 4'-фосфопантотенат превращается в кофермент A (CoA) (как показано ниже) (R. Leonardi, Y.-M. Zhang, C.O. Rock and S. Jackowski, "Coenzyme A: Back In Action", Progress in Lipid Research, 2005, 44, 125-153).
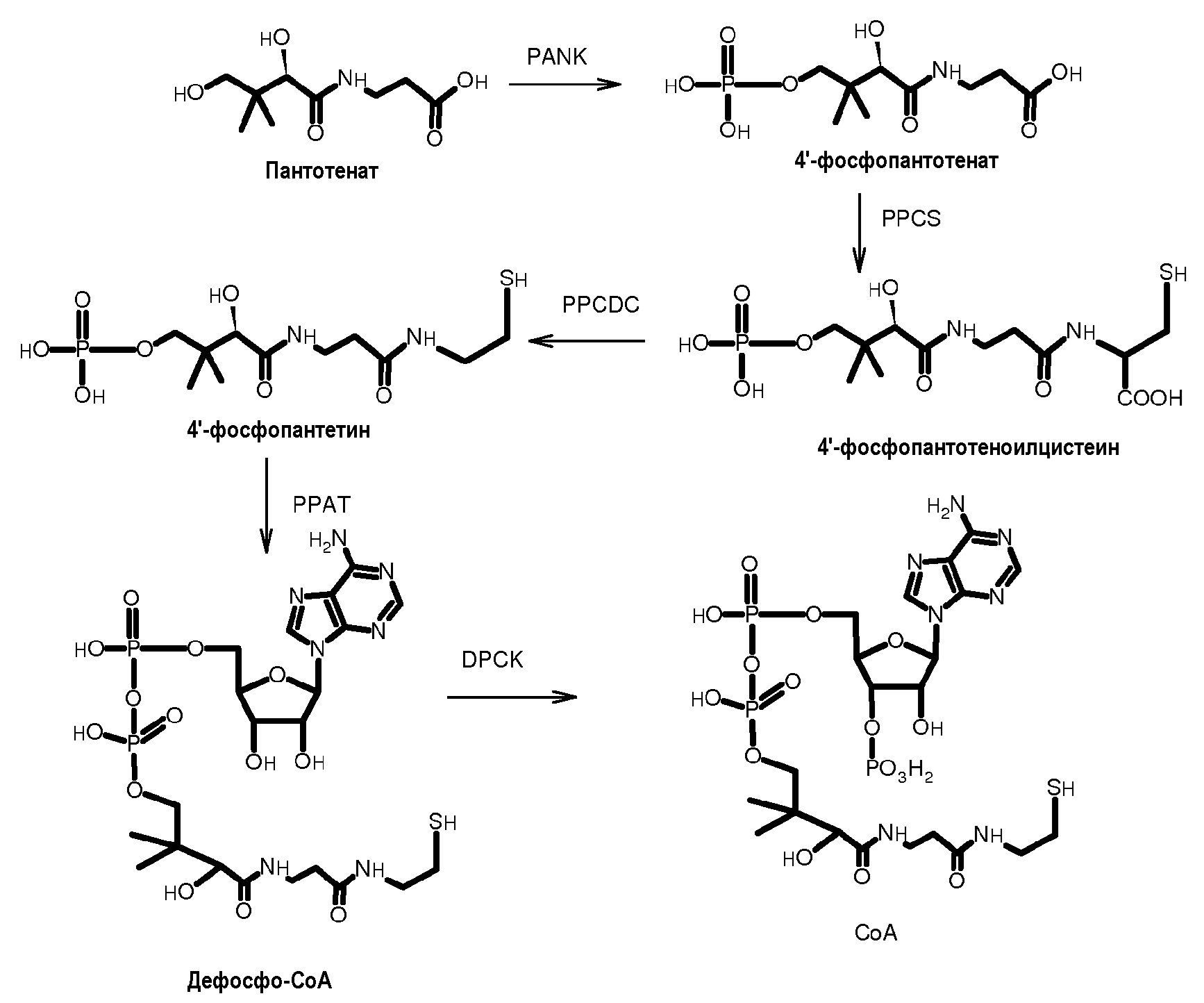
В частности, пантотенат превращается в 4'-фосфопантотенат с помощью фермента пантотенаткиназы (PANK), который превращается в 4'-фосфопантотеноилцистеин с помощью фермента 4'-фосфопантотеноилцистеинсинтазы (PPCS), и затем подвергается декарбоксилированию до 4'-фосфопантетина с помощью 4'- фосфопантотеноилцистеиндекарбоксилазы (PPCDC). Затем 4'-фосфопантетин присоединяется к аденозину под действием фосфопантетинаденилтрансферазы (PPAT), давая дефосфо-CoA, который, наконец, превращается в кофермент A (CoA) с помощью дефосфо-CoA-киназы (DPCK).
Классическая PKAN обычно присутствует у детей в возрасте 10-15 лет, хотя существует также атипичная форма, которая может возникать вплоть до 40 лет. PKAN представляет собой прогрессирующее дегенеративное заболевание, которое приводит к потери скелетно-мышечной функции с разрушительным действием на качество жизни.
Один подход к лечению PKAN может заключаться в применении продукта ферментативной реакции, а именно 4'-фосфопантотената. Данный подход упоминался в литературе, но является признанным тот факт, что высокозаряженная молекула не будет способна проникать через липофильную клеточную мембрану (C.J. Balibar, M.F. Hollis-Symynkywicz, and J. Tao, "Pantethine Rescues Phosphopantothenoylcystein Synthetase and Phosphopantothenoylcystein Decarboxylase Deficiency In Escherichia Coli But Not In Pseudomonas Aeruginosa", J. Bacteriol., 2011, 193, 3304-3312).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к пролекарствам 4'-фосфопантотената или заменителю 4'-фосфопантотената. Данные пролекарства обладают большей клеточной проницаемостью, чем 4'-фосфопантотенат. Не желая быть связанными любой конкретной теорией, считают, что замещение 4'-фосфопантотената или применение его заменителя будет обеспечивать материал для получения CoA или его активного варианта. Таким образом, данные пролекарства являются пригодными для лечения заболеваний, являющихся результатом недостатка 4'-фосфопантотената и/или CoA.
Один вариант осуществления настоящего изобретения представляет собой пролекарство 4'-фосфопантотената, (3-{[(2R)-2-гидрокси-3,3-диметил-4-(фосфоноокси)бутаноил]амино}пропановую кислоту). Пролекарство может содержать одну или более пролекарственных групп, присоединенных к 4'-фосфопантотенату. Предпочтительно, данные пролекарственные группы снижают заряд соединения, посредством этого увеличивая его клеточную проницаемость. В одном варианте осуществления одна или более пролекарственных групп присоединены к карбоксильной группе и/или фосфоногруппе 4'-фосфопантотената. В предпочтительном варианте осуществления пролекарство содержит одну пролекарственную группу, соединенную с карбоксильной группой, и две пролекарственные группы, соединенные с фосфоногруппой. В одном более предпочтительном варианте осуществления, атом водорода в одной гидроксильной группе фосфоногруппы замещен пролекарственной группой, и другая гидроксильная группа фосфоногруппы замещена аминогруппой (например, аминокислотой, присоединенной через ее аминогруппу к атому фосфора).
В одном варианте осуществления настоящее изобретение относится к пролекарству 4'-фосфопантотената или другому соединению настоящего изобретения, которое не образует ион при физиологическом pH (например, при pH от приблизительно 7,3 до приблизительно 7,5, таком как при pH от приблизительно 7,3 до приблизительно 7,4, таком как при pH приблизительно 7,4 или при pH приблизительно 7,365).
В другом варианте осуществления настоящее изобретение относится к пролекарству 4'-фосфопантотената или другому соединению настоящего изобретения, имеющему величину pKa приблизительно 7.
Другой вариант осуществления настоящего изобретения представляет собой соединение, имеющее формулу

или его фармацевтически приемлемую соль, где
X представляет собой гидрокси, галоген, -OR6 или -SR6 (где R6 представляет собой C1-C6 алкил, C2-C6 алкенил или C2-C6 алкинил, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил);
Q представляет собой карбоновую кислоту (-COOH), сульфиновую кислоту (-SOOH), сульфокислоту (SOOOH) или их эфир (т.е. -COOR1, -SOOR1, -SOOOR1);
R1 выбран из замещенного или незамещенного C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C2-C6 алкинила, замещенного или незамещенного C3-C8 циклоалкила, замещенного или незамещенного C3-C8 циклоалкенила, замещенного или незамещенного C3-C8 циклоалкил(C1-C6 алкила), замещенного или незамещенного C3-C8 циклоалкенил(C1-C6 алкила), замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного гетероарила, замещенного и незамещенного гетероциклилалкила и замещенного и незамещенного гетероарилалкила;
(a) Z представляет собой фосфонат (-CH2P(O)OR2), фосфат (-OP(O)OR3R4), тиофосфонат (-CH2P(S)OR2), тиофосфат (-OP(S)OR3R4),

R2, R3 и R4 независимо выбраны из замещенного или незамещенного C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C2-C6 алкинила, замещенного или незамещенного C3-C8 циклоалкила, замещенного или незамещенного C3-C8 циклоалкенила, замещенного или незамещенного C3-C8 циклоалкил(C1-C6 алкила), замещенного или незамещенного C3-C8 циклоалкенил(C1-C6 алкила), замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного гетероарила, замещенного и незамещенного гетероциклилалкила и замещенного и незамещенного гетероарилалкила;
R5 выбран из замещенного или незамещенного C1-C6 алкила (такого как незамещенный C1-C6 алкил), замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C2-C6 алкинила, замещенного или незамещенного C3-C8 циклоалкила, замещенного или незамещенного C3-C8 циклоалкенила, замещенного или незамещенного C3-C8 циклоалкил(C1-C6 алкила), замещенного или незамещенного C3-C8 циклоалкенил(C1-C6 алкила), замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного гетероарила, замещенного и незамещенного гетероциклилалкила и замещенного и незамещенного гетероарилалкила;
Y представляет собой эфир природной или неприродной аминокислоты формулы

R7 выбран из замещенного или незамещенного C1-C6 алкила (такого как незамещенный C1-C6 алкил), замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C2-C6 алкинила, замещенного или незамещенного C3-C8 циклоалкила, замещенного или незамещенного C3-C8 циклоалкенила, замещенного или незамещенного C3-C8 циклоалкил(C1-C6 алкила), замещенного или незамещенного C3-C8 циклоалкенил(C1-C6 алкила), замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного гетероарила, замещенного и незамещенного гетероциклилалкила и замещенного и незамещенного гетероарилалкила;
R8 и R9 независимо выбраны из водорода, боковых цепей аминокислот, C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C2-C6 алкинила, замещенного или незамещенного C3-C8 циклоалкила, замещенного или незамещенного C3-C8 циклоалкенила, замещенного или незамещенного C3-C8 циклоалкил(C1-C6 алкила), замещенного или незамещенного C3-C8 циклоалкенил(C1-C6 алкила), замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного гетероарила, замещенного и незамещенного гетероциклилалкила и замещенного и незамещенного гетероарилалкила;
при условии, что оба R8 и R9 не являются водородом.
В одном предпочтительном варианте осуществления боковая цепь аминокислоты в определении R8 и R9 представляет собой боковую цепь природной аминокислоты (например, L-аминокислоты). В формуле F R8 и R9 могут быть соединены с атомом углерода, обозначенным так, чтобы данный атом углерода имел R или S абсолютную конфигурацию (D или L относительную конфигурацию). В более предпочтительном варианте осуществления одна из R8 и R9 представляет собой водород, и другая представляет собой боковую цепь аминокислоты (предпочтительно, боковую цепь аминокислоты природной L-аминокислоты, такой как протеиногенная аминокислота).
Другой вариант осуществления представляет собой соединение формулы
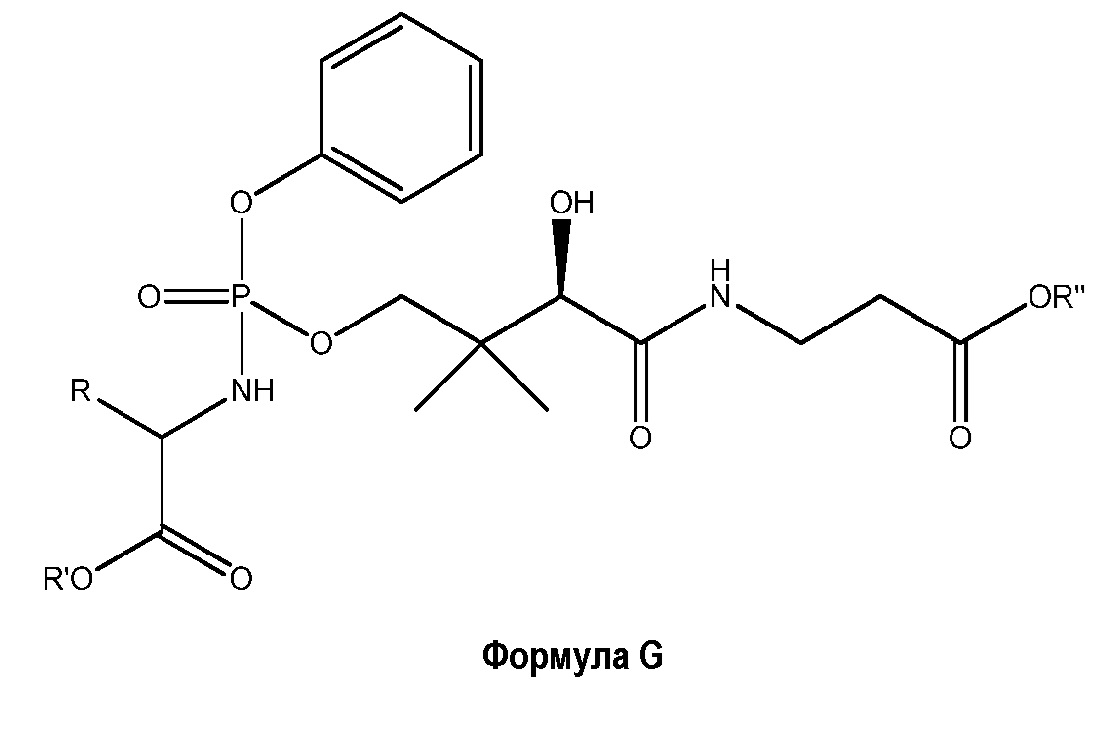
или его фармацевтически приемлемую соль, где
R представляет собой боковую цепь аминокислоты;
R' выбран из C1-C6 алкила, замещенного или незамещенного C1-C6 алкила (такого как незамещенный C1-C6 алкил), замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C2-C6 алкинила, замещенного или незамещенного C3-C8 циклоалкила, замещенного или незамещенного C3-C8 циклоалкенила, замещенного или незамещенного C3-C8 циклоалкил(C1-C6 алкила), замещенного или незамещенного C3-C8 циклоалкенил(C1-C6 алкила), замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного гетероарила, замещенного и незамещенного гетероциклилалкила и замещенного и незамещенного гетероарилалкила; и
R" выбран из замещенного или незамещенного C1-C6 алкила, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенного C2-C6 алкинила, замещенного или незамещенного C3-C8 циклоалкила, замещенного или незамещенного C3-C8 циклоалкенила, замещенного или незамещенного C3-C8 циклоалкил(C1-C6 алкила), замещенного или незамещенного C3-C8 циклоалкенил(C1-C6 алкила), замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного гетероарила, замещенного и незамещенного гетероциклилалкила и замещенного и незамещенного гетероарилалкила.
В одном предпочтительном варианте осуществления боковая цепь аминокислоты в определении R представляет собой боковую цепь природной аминокислоты (например, природной L-аминокислоты). R может быть соединен с атомом углерода, показанным так, чтобы атом углерода имел R или S абсолютную конфигурацию (D или L относительную конфигурацию). В более предпочтительном варианте осуществления R представляет собой боковую цепь протеиногенной аминокислоты. В одном предпочтительном варианте осуществления стереохимия группы R является такой, что молекула имеет следующую стереохимию:

В одном варианте осуществления соединения формулы G, R' представляет собой C1-C6 алкил (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил), бензил, циклогексил и метилциклопропил.
В одном варианте осуществления соединения формулы G, R" представляет собой C1-C6 алкил (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил), бензил, циклогексил, и метилциклопропил.
Другой вариант осуществления представляет собой соединение формулы

или его фармацевтически приемлемую соль, где
R представляет собой боковую цепь аминокислоты;
X представляет собой галоген (например, F);
n равно 0, 1, 2, 3, 4 или 5 (например, 0, 1 или 2);
R' выбран из C1-C6 алкила, C2-C6 алкенила, C2-C6 алкинила, C3-C8 циклоалкила, C3-C8 циклоалкенила, C3-C8 циклоалкил(C1-C6 алкила), C3-C8 циклоалкенил(C1-C6 алкила), арила, арилалкила, гетероциклила, гетероарила, гетероциклилалкила и гетероарилалкила; каждый из которых необязательно замещен одним или более галогенами (например, фтором); и
R" выбран из C1-C6 алкила, C2-C6 алкенила, C2-C6 алкинила, C3-C8 циклоалкила, C3-C8 циклоалкенила, C3-C8 циклоалкил(C1-C6 алкила), C3-C8 циклоалкенил(C1-C6 алкила), арила, арилалкила, гетероциклила, гетероарила, гетероциклилалкила и гетероарилалкила; каждый из которых необязательно замещен одним или более галогенами (например, фтором).
В одном предпочтительном варианте осуществления n равно 0. В другом предпочтительном варианте осуществления n равно 1.
В одном предпочтительном варианте осуществления боковая цепь аминокислоты в определении R представляет собой боковую цепь природной аминокислоты (например, природной L-аминокислоты). R может быть соединена с атомом углерода, показанным так, чтобы атом углерода имел R или S абсолютную конфигурацию (D или L относительную конфигурацию). В более предпочтительном варианте осуществления R представляет собой боковую цепь протеиногенной аминокислоты. В одном предпочтительном варианте осуществления стереохимия группы R является такой, что молекула имеет следующую стереохимию:
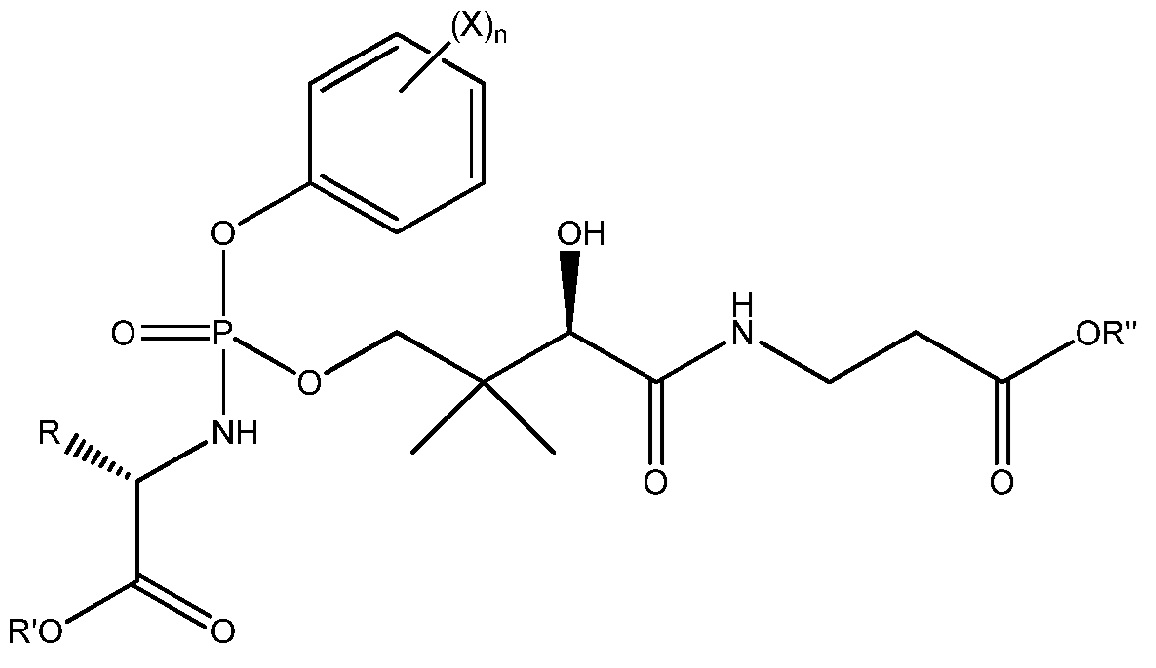
В одном варианте осуществления соединения формулы H, R' представляет собой C1-C6 алкил (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил или трет-бутил), бензил, циклогексил или метилциклопропил, каждый из которых необязательно замещен одним или более галогенами (например, фтором).
В одном варианте осуществления соединения формулы H, R" представляет собой C1-C6 алкил (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил или трет-бутил), бензил, циклогексил или метилциклопропил, каждый из которых необязательно замещен одним или более галогенами (например, фтором).
Предпочтительные соединения настоящего изобретения включают соединения формулы

или их фармацевтически приемлемую соль, где

(где Bn представляет собой бензил, Cy представляет собой циклогексил, Et представляет собой этил, hex представляет собой гексил, iBu представляет собой изобутил, iPr представляет собой изопропил, Me представляет собой метил, MeCyPr представляет собой метилциклопропил (т.е. -CH2-циклопропил), и MeIndole представляет собой (1H-индол-3-ил)метил). В одном варианте осуществления, соединения, приведенные выше, имеют следующую стереохимию:

Еще другой вариант осуществления представляет собой фармацевтическую композицию, содержащую соединение настоящего изобретения и фармацевтически приемлемое вспомогательное вещество. В одном варианте осуществления фармацевтическая композиция содержит эффективное количество соединения для лечения неврологического заболевания. Фармацевтическая композиция может представлять собой лекарственную форму, такую как таблетка или капсула.
Еще другой вариант осуществления представляет собой способ лечения заболевания, связанного с недостатком пантотенаткиназы, 4'-фосфопантотената или кофермента A у субъекта. Способ включает введение субъекту эффективного количества соединения настоящего изобретения.
Еще другой вариант осуществления представляет собой способ лечения нейродегенерации, связанной с пантотенаткиназой, у субъекта. Способ включает введение субъекту эффективного количества соединения настоящего изобретения. Субъект может страдать от нейродегенерации с накоплением в мозге железа.
Еще другой вариант осуществления представляет собой способ лечения болезни Паркинсона у субъекта. Способ включает введение субъекту эффективного количества соединения настоящего изобретения.
Еще другой вариант осуществления представляет собой способ обработки клеток или ткани, вовлеченных в патологию, характеризующуюся нарушенной нейронной функцией у субъекта. Способ включает введение субъекту эффективного количества соединения настоящего изобретения. Патологию можно выбрать из дистонии, экстрапирамидальных эффектов, дисфагии, оцепенелости и/или негибкости конечностей, хореоатетоза, тремора, деменции, спастичности, мышечной слабости и судорог.
Еще другой вариант осуществления представляет собой способ обработки клеток или ткани, вовлеченных в патологию, характеризующуюся нарушением нейронов, вызванным нарушенной регуляцией гена, связанного с ферментом пантотенкиназой. Способ включает введение субъекту эффективного количества соединения настоящего изобретения.
Еще другой вариант осуществления представляет собой способ лечения патологии, характеризующейся нарушением нейронов, вызванным нарушенной регуляцией гена, связанного с ферментом пантотенкиназой, у субъекта. Способ включает введение субъекту эффективного количества соединения настоящего изобретения.
Еще другой вариант осуществления представляет собой способ обработки клеток или ткани, вовлеченных в патологию, характеризующуюся нарушением нейронов, вызванным нарушенной регуляцией экспрессии гена, связанного с ферментом пантотенкиназой. Способ включает введение субъекту эффективного количества соединения настоящего изобретения.
Еще другой вариант осуществления представляет собой способ лечения патологии, характеризующейся нарушением нейронов, вызванным нарушением экспрессии гена, связанного с ферментом пантотенкиназой, у субъекта. Причем способ включает введение субъекту эффективного количества соединения настоящего изобретения.
Еще другой вариант осуществления представляет собой способ лечения субъекта, имеющего нейроны с чрезмерным накоплением железа. Способ включает введение субъекту эффективного количества соединения настоящего изобретения.
В приведенных выше способах субъект может представлять собой ребенка (например, 10-15 лет) или взрослого.
Еще другой вариант осуществления представляет собой способ получения соединения формулы G или H:
(a) защитой обеих гидроксильных групп пантотеновой кислоты;
(b) этерификацией кислотной группы защищенной пантотеновой кислоты, получая соединение формулы

где каждая Pg независимо представляет собой защитную группу, и R" определен выше относительно формулы G или H;
(c) деблокированием гидроксильных групп;
(d) фосфорилированием деблокированного соединения соединением формулы

где L представляет собой уходящую группу (например, галоген, такой как хлор), и R и R' определены выше относительно формулы G или H; и
(e) необязательно получением соли соединения, полученного на стадии (d).
Еще другой вариант осуществления представляет собой способ получения соединения формулы G или H:
(a) этерификацией пантотеновой кислоты со спиртом формулы R"OH, получая соединение формулы

где R" определен выше относительно формулы G или H;
(b) фосфорилированием этерифицированного соединения соединением формулы

где L представляет собой уходящую группу (например, галоген), и R и R' определены выше относительно формулы G или H; и
(c) необязательно получением соли соединения, полученного на стадии (b). Этерификацию на стадии (a) можно проводить воздействием на пантотеновую кислоту условиями этерификации по Фишеру.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1 представляет собой диаграмму, показывающую концентрацию ацетил CoA в HEK 293T клетках человека, как измерено масс-спектрометрией, после обработки соединениями примеров 2, 5, 7 и 12.
Фигура 2 представляет собой диаграмму, показывающую концентрацию mBBr CoA у необработанных Pank1+/+ мышей (WT), необработанных Pank1-/- нокаутных мышей (pank1KO) и PANK нокаутных мышей после введения соединения примера 2 (Pank KO + пример 2).
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Определения
Как применяют в настоящем изобретении, определенные термины могут иметь следующие значения.
Как применяют в описании и формуле изобретения, формы единственного лица включают множественные референты, если контекст ясно не предписывает иначе. Например, термин "клетка" включает множество клеток, включая их смеси. Аналогично, применение "соединения" для лечения или получения лекарственных препаратов, как определено в настоящем изобретении, предполагает применение одного или более соединений настоящего изобретения для данного лечения или получения.
Как применяют в настоящем изобретении, предполагается, что термин "включая", обозначает то, что композиции и способы включают перечисленные элементы, но не исключает другие. Таким образом, композиция, состоящая по существу из элементов, как определено в настоящем изобретении, не будет исключать микропримеси после способа выделения и очистки и фармацевтически приемлемые носители, такие как фосфатно-солевой буферный раствор, консерванты и подобные. "Состоящий из" следует понимать как исключающий больше чем микропримеси других ингредиентов и последующие стадии способа для введения композиции настоящего изобретения. Варианты осуществления, определенные каждым из временных терминов, включены в объем настоящего изобретения.
Термин "алкил" относится к радикалу с нормальной или разветвленной углеводородной цепью, состоящему только из атомов углерода и водорода, несодержащему ненасыщенности. Если не указано иначе, термин "алкил" относится к группе, содержащей от одного до восьми атомов углерода (например, от одного до шести атомов углерода или от одного до четырех атомов углерода) и которая соединена с остатком молекулы единичной связью. Примеры алкильных групп включают, но не ограничиваются, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, втор-бутил, н-пентил и втор-пентил.
Термин "алкенил" относится к алифатической углеводородной группе, содержащей углерод-углеродную двойную связь и которая может иметь нормальную или разветвленную цепь. Если не указано иначе, термин "алкенил" относится к группе, содержащей от 2 до приблизительно 10 атомов углерода, например, этенил, 1-пропенил, 2-пропенил (аллил), изопропенил, 2-метил-1-пропенил, 1-бутенил и 2-бутенил.
Термин "алкинил" относится к радикалу с нормальной или разветвленной углеводородной цепью, содержащему, по меньшей мере, одну углерод-углеродную тройную связь. Если не указано иначе, термин "алкинил" относится к группе, содержащей в диапазоне от 2 вплоть до приблизительно 12 атомов углерода (например, 2-10 атомов углерода), например, этинил, пропинил и бутинил.
Термин "циклоалкил" обозначает неароматическую моно- или полициклическую кольцевую систему из приблизительно 3-12 атомов углерода, такую как циклопропил, циклобутил, циклопентил и циклогексил.
Термин "циклоалкилалкил" относится к радикалу, содержащему циклическое кольцо, содержащему в диапазоне от приблизительно 3 вплоть до 8 атомов углерода, непосредственно соединенному с алкильной группой, которая затем соединена с основной структурой при любом атоме углерода в алкильной группе, что приводит в результате к образованию стабильной структуры, такой как циклопропилметил, циклобутилэтил и циклопентилэтил.
Термин "арил" относится к моно- или полициклическому ароматическому радикалу, содержащему в диапазоне от 6 вплоть до 20 атомов углерода, такому как фенил, нафтил, тетрагидронафтил, инданил и бифенил.
Термин "арилалкил" относится к арильной группе, как определено выше, непосредственно соединенной с алкильной группой, как определено выше, например, -CH2C6H5 и -C2H5C6H5.
Термин "гетероциклил" относится к неароматическому 3-15-членному кольцевому радикалу, который состоит из атомов углерода и, по меньшей мере, одного гетероатома, выбранного из азота, фосфора, кислорода и серы. Гетероциклический кольцевой радикал может представлять собой моно-, би-, три- или тетрациклическую кольцевую систему, которая может содержать конденсированные, мостиковые или спирокольцевые системы, и атомы азота, фосфора, углерода, кислорода или серы в гетероциклическом кольцевом радикале могут быть необязательно окислены до различных окисленных состояний. Кроме того, атом азота может быть необязательно кватернизирован.
Термин "гетероциклилалкил" относится к гетероциклильной группе, как определено выше, непосредственно соединенной с алкильной группой, как определено выше.
Термин "гетероарил" относится к необязательно замещенному 5-14-членному ароматическому кольцу, содержащему один или более гетероатомов, выбранных из N, O и S в качестве кольцевых атомов. Гетероарил может представлять собой моно-, би- или трициклическую кольцевую систему. Примеры данных гетероарильных кольцевых радикалов включают, но не ограничиваются, оксазолил, тиазолил имидазолил, пирролил, фуранил, пиридинил, пиримидинил, пиразинил, бензофуранил, индолил, бензотиазолил, бензоксазолил, карбазолил, хинолил и изохинолил.
Термин "гетероарилалкил" относится к гетероарильной группе, как определено выше, непосредственно соединенной с алкильной группой, как определено выше, например, -CH2C6H4N и -C2H5C6H4N.
Термин "галоген" включает F, Cl, Br и I.
Термин "боковая цепь аминокислоты" относится к боковой цепи R альфа-аминокислоты формулы H2N-CH(R)-COOH. Например, боковая цепь аланина представляет собой метил, боковая цепь глицина представляет собой водород, боковая цепь валина представляет собой изопропил, и боковая цепь триптофана представляет собой (1H-индол-3-ил)метил. Подходящие боковые цепи аминокислот в соединениях настоящего изобретения включают боковые цепи природных аминокислот, включая протеиногенные аминокислоты. Неограничивающие примеры природных аминокислот включают стандартные аминокислоты или протеиногенные аминокислоты включают, но не ограничиваются, аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глютаминовую кислоту, глютамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, пирролизин, селеноцистеин, серин, треонин, триптофан, тирозин и валин.
Термин "замещенный", если не указано иначе, относится к замещению одним или любой комбинацией следующих заместителей: водород, гидрокси, галоген, карбоксил, циано, нитро, оксо (=O), тио(=S), алкил, алкокси, алкенил, алкинил, арил, арилалкил, циклоалкил, циклоалкенил, арил, гетероциклил, гетероарил, -COORx, -C(O)Rx, -C(S)RX, -C(O)NRxRy, -C(O)ONRxRy, -NRyRz, -NRxCONRyRz, -N(Rx)SORy, -N(Rx)SО2Ry, -(=N-N(Rx)Ry), -NRX C(O)ORy, -NRxRy, -NRxC(O)Ry-, -NRxC(S)Ry -NRxC(S)NRyRz, -SONRxRy-, -SO2NRxRy-, -ORx, -ORxC(O)NRyRz, -ORxC(O)ORy-, -OC(O)Rx, -OC(O)NRxRy, -RxNRyC(O)Rz, -RxORy, -RxC(O)ORy, -RxC(O)NRyRz, -RxC(O)Rx, -RxOC(O)Ry, -SRX, -SORx, -SO2Rx и -ONO2, где Rx, Ry и Rz в каждой из приведенных выше групп могут представлять собой атом водорода, алкил, алкокси, алкенил, алкинил, арил, арилалкил, циклоалкил, циклоалкенил, амино, арил, гетероарил, гетероциклил, или любые два из Rx, Ry и Rz могут быть соединены, образуя насыщенное или ненасыщенное 3-10-членное кольцо, которое может необязательно содержать гетероатомы, которые могут быть одинаковыми или различными и которые выбраны из O, NH или S. В одном варианте осуществления термин замещенный относится к замещению одним или более галогенами (например, фтором).
Термин "субъект" относится к млекопитающему, такому как домашнее животное (например, собака или кошка) или человек. Предпочтительно, субъект представляет собой человека.
Фраза "эффективное количество" относится к количеству, которое, при введении субъекту или пациенту для лечения заболевания, является достаточным для осуществления данного лечения заболевания.
"Лечение" включает (1) ингибирование заболевания у субъекта или пациента, подвергающегося или проявляющего патологию или симптоматологию заболевания (например, остановку дальнейшего развития патологии и/или симптоматологии), (2) облегчение заболевания у субъекта или пациента, который подвергается или проявляет патологию или симптоматологию заболевания (например, обращение патологии и/или симптоматологии) и/или (3) осуществление любого измеряемого ослабления заболевания у субъекта или пациента, который подвергается или проявляет патологию или симптоматологию заболевания.
Фармацевтические составы и пути введения
Соединения настоящего изобретения можно вводить рядом путей, включая перорально и инъекцией (например, подкожно, внутривенно и внутрибрюшинно).
Соединения можно вводить перорально в виде твердой или жидкой лекарственной формы. При обеих формах введения соединение можно покрывать материалом, защищающим его от действия кислот и других естественных условий, которые могут дезактивировать соединение. Соединения можно формулировать в виде водных растворов, жидких дисперсий, проглатываемых таблеток, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов и капсул-имплантатов. Пероральные лекарственные формы могут содержать вспомогательные вещества, известные в данной области техники, такие как связующие, разрыхлители, ароматизаторы, антиоксиданты и консерванты. Жидкие лекарственные формы могут содержать разбавители, такие как соляной раствор или водный буфер.
Соединения можно также вводить инъекцией. Составы, подходящие для инъекции, могут включать стерильные водные растворы (при растворимости в воде) или дисперсии и стерильные порошки для немедленного получения стерильных инъецируемых растворов или дисперсий. Композиция может быть стерильной и текучей до степени, чтобы ее можно было легко вводить шприцом. Она может быть стабильной в условиях получения и хранения и может быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Носитель может представлять собой растворитель или диспергирующую среду, включающую, например, воду, этанол, полиол (такой как глицерин, пропиленгликоль и жидкий полиэтиленгликоль), подходящие их смеси и растительные масла. Подходящую текучесть можно поддерживать, например, применяя покрытие, такое как лецитин, поддержанием требуемого размера частиц в случае дисперсии и применением поверхностно-активных веществ. Предотвращение действия микроорганизмов можно осуществлять различными антибактериальными и противогрибковыми агентами, например, парабенами, хлорбутанолом, фенолом и аскорбиновой кислотой. Во многих случаях предпочтительно включать в композицию изотонические агенты, например, сахара, хлорид натрия или полиспирты, такие как маннитол и сорбитол. Длительное поглощение инъецируемых композиций можно осуществлять включением в композицию агента, который замедляет поглощение, например, моностеарата алюминия или желатина.
Стерильные инъецируемые растворы можно получить включением терапевтического соединения в требуемом количестве в подходящий растворитель с одним или комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей фильтровальной стерилизацией. Обычно дисперсии получают введением терапевтического соединения в стерильный носитель, который содержит основную диспергирующую среду и другие требуемые ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, способы получения включают вакуумную сушку и лиофилизацию, которая дает порошок активного ингредиента (т.е. терапевтическое соединение) плюс любой дополнительный требуемый ингредиент из его предварительно стерилизованного фильтрованием раствора.
Фактическое количество дозы соединения, вводимого субъекту, может определяться физическими и физиологическими факторами, такими как возраст, пол, вес тела, тяжесть заболевания, тип заболевания, которое лечат, предшествующее или сопутствующее терапевтическое воздействие, идиопатия субъекта и путь введения. Данные факторы может определить специалист в данной области техники. Практикующий врач, ответственный за введение, будет обычно определять концентрацию активного ингредиента (ингредиентов) в композиции и подходящую дозу (дозы) для конкретного субъекта.
В одном варианте осуществления субъекту, являющемуся человеком, вводят дневные дозы от приблизительно 0,01 мг/кг до приблизительно 100 мг/кг.
Предполагаются единичные или многократные дозы соединений. Требуемые интервалы времени для доставки многократных доз может определить специалист в данной области техники, применяя не более чем стандартные эксперименты. В качестве примера, субъектам можно вводить две дозы в день при приблизительно 12-часовых интервалах. В некоторых вариантах осуществления соединение вводят один раз в день.
Соединения можно вводить по стандартному режиму. Как применяют в настоящем изобретении, стандартный режим относится к предварительно определенному назначенному периоду времени. Стандартный режим может включать периоды времени, которые являются одинаковыми или отличными по длине, при условии, что режим определен заранее. Например, стандартный режим может включать введение дважды в день, каждый день, один раз в два дня, один раз в три дня, один раз в четыре дня, один раз в пять дней, один раз в шесть дней, один раз в неделю, один раз в месяц или любой количеством дней или недель в данных диапазонах. Альтернативно, предварительно определенный стандартный режим может включать введение дважды в день в течение первой недели, с последующим раз в день в течение нескольких месяцев. В других вариантах осуществления настоящее изобретение обеспечивает то, что агент (агенты) можно вводить перорально и то, что время введения зависит или не зависит от приема пищи. Таким образом, например, агент можно вводить каждое утро и/или каждый вечер, независимо от того, ел ли субъект или будет есть.
Комбинационная терапия
В добавление к применению в виде монотерапии, соединения можно также применять в комбинационных терапиях. Эффективную комбинационную терапию можно осуществлять одной композицией или фармакологическим составом, который содержит оба агента, или двумя различными композициями или составами, вводимыми одновременно, где одна композиция содержит соединение настоящего изобретения, и другая содержит второй агент (агенты). Альтернативно, терапия может предшествовать или следовать после лечения другим агентом через интервалы в диапазоне от минут до месяцев.
Дополнительный агент или агенты можно выбрать из любого агента или агентов, пригодных для лечения неврологического заболевания, например, любого агента или агентов, пригодных для лечения недостатка пантотенаткиназы, 4'-фосфопантотената или кофермента. В одном варианте осуществления дополнительный агент или агенты являются пригодными в улучшении когнитивной функции, например, ингибитор ацетилхолинэстеразы, такой как физостигмин, неостигмин, иридостигмин, амбеноний, демаркарий, ривастигмин, галантамин, донепезил и их комбинации. В другом варианте осуществления дополнительный агент или агенты представляет собой железохелатирующий агент, такой как деферипрон, дефероксамин, деферасирокс и их комбинации.
Получение фосфопантотенатных производных
Соединения настоящего изобретения можно получить из пантотеновой кислоты (витамина B5), которая является легко доступной. Получение пантотеновой кислоты описано, например, в патентах США №2676976 и 2870188.
Следующий способ получения соединений формулы G можно приспособить для получения других соединений настоящего изобретения, таких как соединения формулы H. Соединение формулы G можно получить (a) защитой обеих гидроксильных групп пантотеновой кислоты, (b) этерификацией кислотной группы защищенной пантотеновой кислоты, получая соединение формулы

где каждая Pg независимо представляет собой защитную группу, и R" определен выше относительно формулы G, (c) деблокированием гидроксильных групп, (d) фосфорилированием деблокированного соединения соединением формулы

где L представляет собой уходящую группу (например, галоген), и R и R' определены выше относительно формулы G; и (e) необязательно получением соли соединения, полученного на стадии (d). Данная схема реакций показана ниже (где L представляет собой Cl)

(примечание: R1 на последней стадии может представлять собой водород).
Стадию защиты (a) можно проводить обработкой пантотеновой кислоты бензальдегидом и хлоридом цинка, получая соответствующий ацеталь (T.W. Green and P.G.M. Wuts, Protective Groups in Organic Synthesis, Wiley-Interscience, New York, 1999, 217-224, 716-719). Пантотеновую кислоту можно также защищать обработкой пантотеновой кислоты ацетоном и толуолсульфокислотой (M. Carmack and C.J. Kelley, "Synthesis of optically active Cleland's reagent [(-)-1,4-дитио-L-треит]", J. Org. Chem., 1968, 33, 2171-2173), получая соответствующий ацеталь. В другом примере, пантотеновую кислоту обрабатывают гидридом натрия, с последующей обработкой бензилбромидом, получая ди-O-бензилированную пантотеновую кислоту (T.W. Green et al., выше).
После деблокирования гидроксильных групп получение эфира (R") можно осуществлять, например, взаимодействием деблокированной пантотеновой кислоты с подходящим спиртом и дициклогексилдикарбодиимидом (DCC) или диэтилазодикарбоксилатом (DEAD) и трифенилфосфином (реакция Мицунобу). Альтернативно, деблокированную пантотеновую кислоту можно превратить в соответствующий хлорангидрид кислоты (например, тионилхлоридом или оксалилхлорид), с последующей обработкой соответствующим спиртом.
Деблокирование можно проводить любым способом, известным в данной области техники, таким как описанный в T.W. Green et al., выше.
В качестве альтернативы стадиям (a)-(c), пантотеновую кислоту можно этерифицировать спиртом формулы R"OH, например, воздействием на пантотеновую кислоту условиями этерификации по Фишеру (т.е. избытком спирта и каталитическим количеством кислоты при кипячении с обратным холодильником).
Первичную гидроксильную группу в соединении, полученном на стадии (c), можно селективно фосфорилировать. См. J.D. Patrone, J. Yao, N.E. Scott, и G.D. Dotson, "Selective Inhibitors of Bacterial Phosphopantothenoylcysteine Synthetase", J. Am. Chem. Soc, 2009, 131, 16340-16341). Условия, описанные в D.M. Lehsten, D.N. Baehr, T.J. Lobl, и A.R. Vaino, "An Improved Procedure for the Synthesis of Nucleoside Phosphoramidates", Organic Process Research & Development, 2002, 6, 819-822, можно применять для данной реакции.
Данный способ показан ниже со способом получения фосфорилирующего реагента.

Необязательно, оптически чистый продукт можно получить проведением хирального разделения конечного продукта или одного из промежуточных соединений стадий при получении.
Альтернативно, соединения настоящего изобретения можно получить путем, описанным в B.S. Ross, P.G. Reddy, H.-R. Zhang, S. Rachakonda, and M, J. Sofia, "Synthesis of Diastereomerically Pure Nucleotide Phosphoramidates", J. Org. Chem., 2011, 76, 8311-8319. Данным путем можно получить оптически чистый продукт без проведения конечной стадии хирального разделения.
ПРИМЕРЫ
Пример 1
Получение этил 3-((2R)-4-(((((S)-1-этокси-1-оксопропан-2-ил)амино)(фенокси)фосфорил)окси)-2-гидрокси-3,3-диметилбутанамидо)пропаноата

Гидрохлорид этилового эфира L-аланина (0,50 г, 3,25 ммоль) суспендировали в 10 мл CH2Cl2 и обрабатывали фенилфосфордихлоридатом (0,50 мл, 3,35 ммоль) при -10°C и в атмосфере азота. Затем хорошо перемешиваемую смесь обрабатывали по каплям N-метилимидазолом (1,0 мл, 12,5 ммоль). Через 1 час и при -10°C медленно добавляли этилпантотенат (0,70 г, 2,8 ммоль) в 3 мл CH2Cl2. Данную смесь нагревали до комнатной температуры и через 3 часа добавляли 2 мл метанола. Экстракцию осуществляли последовательно 1 M HCl, водой, 5% NaHCO3 и солевым раствором. Органическую фазу сушили (Na2SO4) и растворитель упаривали, получая 1,11 г прозрачного бесцветного сиропа. Данный материал очищали колоночной флэш-хроматографией, применяя 30 г силикагеля и элюируя смесью 1:1 EtOAc/гексан, содержащей 5% EtOH. Способ повторяли до тех пор, пока не получали 1,1 г фосфорамидата. ВЭЖХ показала продукт в виде смеси 1:1 диастереомеров, имеющей чистоту 97%.1Н-ЯМР (CDCl3) δ: 1,08 (c, 3H, CH3), 1,21 (д, 3H, J=2,7 Гц, CH3), 1,27 (м, 6H, CH3), 1,35 (т, 3H, J=6,9 Гц, CH3), 2,53 (кв, 2H, J=4,2 Гц, CH2), 3,50 (м, 2H, CH2), 3,60 (м, 1H, CH), 3,78 (д, J=7,5 Гц, CH), 3,9 (м, 2H, CH2), 4,10 (м, 6H, CH2), 4,79 (т, 1H, J=6,5 Гц, CH), 7,15 и 7,40 (2Мc, 5H, Ph). Ожидаемая молекулярная масса 502,21, наблюдаемая молекулярная масса 503,09 [M+H+].
Пример 2
Получение метил 3-((2R)-2-гидрокси-4-(((((S)-1-метокси-1-оксопропан-2-ил)амино)(фенокси)фосфорил)окси)-3,3-диметилбутанамидо)пропаноата

Гидрохлорид метилового эфира L-аланина (1,35 г, 9,65 ммоль) суспендировали в дихлорметане (20 мл) и обрабатывали фенилфосфодихлоридатом (1,51 мл, 10,15 ммоль) при -78°C в атмосфере аргона. Добавляли по каплям диизопропилэтиламин (2,6 мл, 20,27 ммоль). Смесь перемешивали при -78°C в течение 30 минут, затем нагревали до комнатной температуры в течение 1 часа. Смесь охлаждали до -5°C и добавляли по каплям метилпантотенат (1,6 мл, 20,27 ммоль) в дихлорметане. Добавляли N-метилимидазол (1,6 мл, 20,27 ммоль) и после перемешивания при -5°C в течение 30 минут и при комнатной температуре в течение 1 часа добавляли 2 мл метанола. Смесь промывали последовательно водой (30 мл), 5% лимонной кислотой (30 мл) и солевым раствором (10 мл). Органическую фазу сушили (Na2SO4) и растворитель удаляли при пониженном давлении. Очистку осуществляли смесью 1:1 EtOAc:гексан, получая продукт в виде прозрачного бесцветного масла (1,1 г, 24% выход). ВЭЖХ показала продукт в виде смеси 1:1 диастереомеров, имеющей чистоту 97%.1Н-ЯМР (CDCl3) δ: 1,11 (c, 3H, CH3), 1,27, 1,39 и 1,40 (2 Сc, 3H, CH3), 1,41 (совмещение д, 3H, J=1,2 Гц, CRCH3), 3,55 (м, 2H, CH2), 3,60 (м, 1H, CH2), 3,63 (м, 1H, CH), 3,66 и 3,68 (2 Cc, 3H, COCH3), 3,70 и 3,74 (2 Сc, 3H, COCH3), 3,78 (м, 1H, CH), 4,03 (м, 1H, CH), 4,17 (м, 1H, CH), 7,16 и 7,35 и 7,40 (2 Мc, 5H, Ph). Ожидаемая молекулярная масса 474,18, наблюдаемая молекулярная масса 475,03 (M+H+].
Примеры 3-14
Соединения, показанные в таблице ниже, получали согласно способам получения, приведенным в примерах 1 и 2, применяя подходящие исходные соединения.

Пример 15
Бактериальное испытание in vitro
SJ16 представляет собой штамм Escherichia coli, который требует добавления пантотеновой кислоты для пролиферации (т.е. он содержит такую мутацию, что пантотеновая кислота является дезактивированной). Таким образом, он служит в качестве подходящего анализа для определения, может ли соединение спасти организм от недостатка PANK, причины PKAN. Соединения настоящего изобретения испытывали на токсичность и на способность способствовать росту штамма SJ16 Escherichia coli K-12 (см., например, Jackowski et ah, J. Bacteriol., 148, 926-932, 1981) и DWO (см., например, Vallari et al, J. Bacteriol, 169, 5795-5800, 1987) в пермиссивных и непермиссивных условиях. Испытуемое соединение в растворителе (диметилсульфоксид, DMSO) добавляли к ростовой среде при конечной концентрации 8 мкМ. Только растворитель (ДМСО) добавляли к ростовой среде при конечной концентрации <0,1% в качестве контроля.
Штамм SJ16 выращивали при 37°C в течение 18 часов на плотной питательной среде, содержащей агар (1,5%), M9 минимальные питательные соли (см., Miller, Experiments in Molecular Genetics. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1972), глюкозу (0,4%), метионин (50 мкг/мл) и с (пермиссивный) или без (непермиссивный) пантотената кальция (1 мкМ). Отсутствие роста при добавлении пантотената кальция указывало на токсичность. Рост без добавления пантотената кальция указывал на способность бактерий метаболизировать соединение, получая пантотенат или β-аланин.
Штамм DV70 выращивали при 30°C (пермиссивные) или 42°C (непермиссивные) в течение 18 часов на плотной питательной среде, содержащей агар (1,5%), M9 минимальные питательные соли, глюкозу (0,4%), метионин (50 мкг/мл) и пантотенат кальция (1 мкМ). Отсутствие роста при 30°C указывало на токсичность. Рост при 42°C указывал на метаболизм соединения и последующее превращение в кофермент A бактериями.
Результаты выделения SJ16 для соединений примеров 2, 5, 7 и 12 показаны в таблице ниже. Результат “да” указывает на то, что бактерии были живы через 18 часов. Соединения примеров 2, 5, 7 и 12 не приводили в результате к выделению штамма DV70.
Пример 16
Соединения примеров 2, 5, 7 и 12 испытывали на иммортализованных человеческих клетках (HEK 293T). Количество ацетил-CoA (расположенный далее в цепочке продукт PANK) после введения соединений примеров 2, 5, 7 и 12 измеряли масс-спектрометрией. Результаты показаны на фигуре 1.
Как видно из фигуры 1, обработка HEK 293T клеток 200 мкМ соединения примера 2 давала 42% повышение ацетил CoA по сравнению с исходной величиной (p<0,0005). Обработка HEK 293T клеток 20 мкМ соединения примера 7 давала 38% повышение ацетил CoA по сравнению с исходной величиной (p<0,005).
Пример 17
Испытания in vivo
Соединения настоящего изобретения испытывали на эффективность на Pankl-/- мышах (штамм 129SvJ×C57BL/6J базис), которые сравнивали с Pankl+/+ (штамм 129SvJ×C57BL/6J) однопометными животными подходящего возраста, в возрасте 8-12 недель. Каждую мышь идентифицировали закодированной ушной биркой и взвешивали в первый день испытания. Каждое соединение вводили 4-5 мышам внутрибрюшинным введением при дозе 1,2 мкмоль/г веса тела в 5 мкл диметилсульфоксида один раз в день в течение 5 дней, и затем мышей выдерживали натощак в течение ночи, взвешивали и подвергали эвтаназии. Необработанные мыши получали 5 мкл диметилсульфоксида раз в день в течение 5 дней и затем их выдерживали натощак перед взвешиванием и эвтаназии. Печень извлекали из каждой мыши, аликвоты быстро замораживали в жидком азоте и хранили при -80°C. В пределах 7 дней образцы печени размораживали на льду, взвешивали и анализировали на содержание кофермента A, как описано ниже. Эффективность определяли статистически значимым увеличением в печени количества кофермента A на мышах Pankl-/-, по сравнению с печенью из необработанных мышей Pankl-/-и эквивалентно по сравнению с количеством кофермента A в необработанных мышах Pankl+/+.
CoA измерения: извлечение фибробластов и печени и дериватизация кофермента A перед высокоэффективной жидкостной хроматографией (ВЭЖХ)
Извлечение фибробластов или печени осуществляли модификацией способа, описанного ранее (см., Minkler et ah, Anal. Biochem., 376, 275-276, 2008). Дериватизацию кофермента A осуществляли модификацией способа, описанного ранее (см. Shimada et al, J. Chromatogr. B Biomed. AppL, 659, 227-241, 1994).
Печень (20-50 мг) гомогенизировали в 2 мл 1 мМ KOH и pH доводили до 12 0,25 M KOH. Фибробласты соскабливали с чашки для культивирования и собирали в 1 мл воды, которую переносили к 200 мкл 0,25 M NaOH. Затем гомогенат печени выдерживали при 55°C в течение 2 часов и фибробласты выдерживали в течение 1 часа при 55°C. pH доводили до pH 8 1 M Trizma-HCl и добавляли 10 мкл 100 мМ монобромобимана (mBBr, Life Technologies, NY) в течение 2 часов в темноте. Реакционную смесь подкисляли уксусной кислотой и центрифугировали при 500×g в течение 15 минут. Затем кондиционированную среду добавляли к 2-(2-пиридил)этиловой колонке (Supelco), которую уравновешивали 1 мл смесью 50% метанол/2% уксусная кислота. Колонку промывали 2×1 мл смесью 50% метанол/2% уксусная кислота и 1 мл воды. Образцы элюировали 2×1 мл 50 мМ формиатом аммония в 95% этаноле. Образцы упаривали в потоке азота и суспендировали в 300 мкл воды. Образцы центрифугировали в Spin-X Centrifuge Tube Filter (0,22 мкм ацетат целлюлозы, Costar), удаляя любые осадки перед ВЭЖХ.
Количественное определение кофермента A ВЭЖХ
mBBr производное кофермента A разделяли обращено-фазовой ВЭЖХ, применяя Gemini C18 3 мкм колонку (150×4,60 мм) фирмы Phenomenex (Torrance, CA). Применяемая хроматографическая система представляла собой Waters e2695 модуль для разделения с детектором в УФ/видимом спектре, и она контролировалась Empower 3 программным обеспечением. Растворитель A представлял собой 50 мМ фосфат калия pH 4,6, и растворитель B представлял собой 100% ацетонитрил. 20 мкл образца вводили в колонку, и скорость потока составляла 0,5 мл/мин. ВЭЖХ программа была следующей: начиная со смеси растворителей 90% A/10% B, 0-2 минута изократический 10% B, 2-9 минута линейный градиент 10% B - 25% B, 9-23 минута логарифмический градиент 25% B - 40% B, 23-25 минута линейный градиент 40-10% и 25-30 минута изократический 10% B. Детектор устанавливали на λ393 нм. Площадь под пиком кофермента A, дериватизированного mBBr, интегрировали и сравнивали со стандартной кривой концентраций mBBr-кофермент A, полученного из имеющегося в продаже кофермента A.
Фигура 2 показывает количества mBBr CoA у PANK нокаутных мышей после введения соединения примера 2. Как можно видеть из фигуры 2, соединение примера 2 восстанавливало количество CoA до количества, наблюдаемого у нормальных мышей. Это также показано в таблице ниже.
Все публикации, патенты и патентные заявки, приведенные в настоящем изобретении, включены в настоящее изобретение с помощью ссылки.
Реферат
Настоящее изобретение относится к пригодным в медицине соединению формулыили его фармацевтически приемлемым солям, гдеПредложены новые соединения и фармацевтические композиции, эффективные для лечения патологий, связанных с недостатком пантотенаткиназы, 4'-фосфопантотената или кофермента A, включая неврологические заболевания. 8 н. и 12 з.п. ф-лы, 17 пр., 3 табл., 2 ил.
Формула



Комментарии