Не мышиное анти-m-csf-антитело (варианты), его получение и использование - RU2401277C2
Код документа: RU2401277C2
Чертежи
































































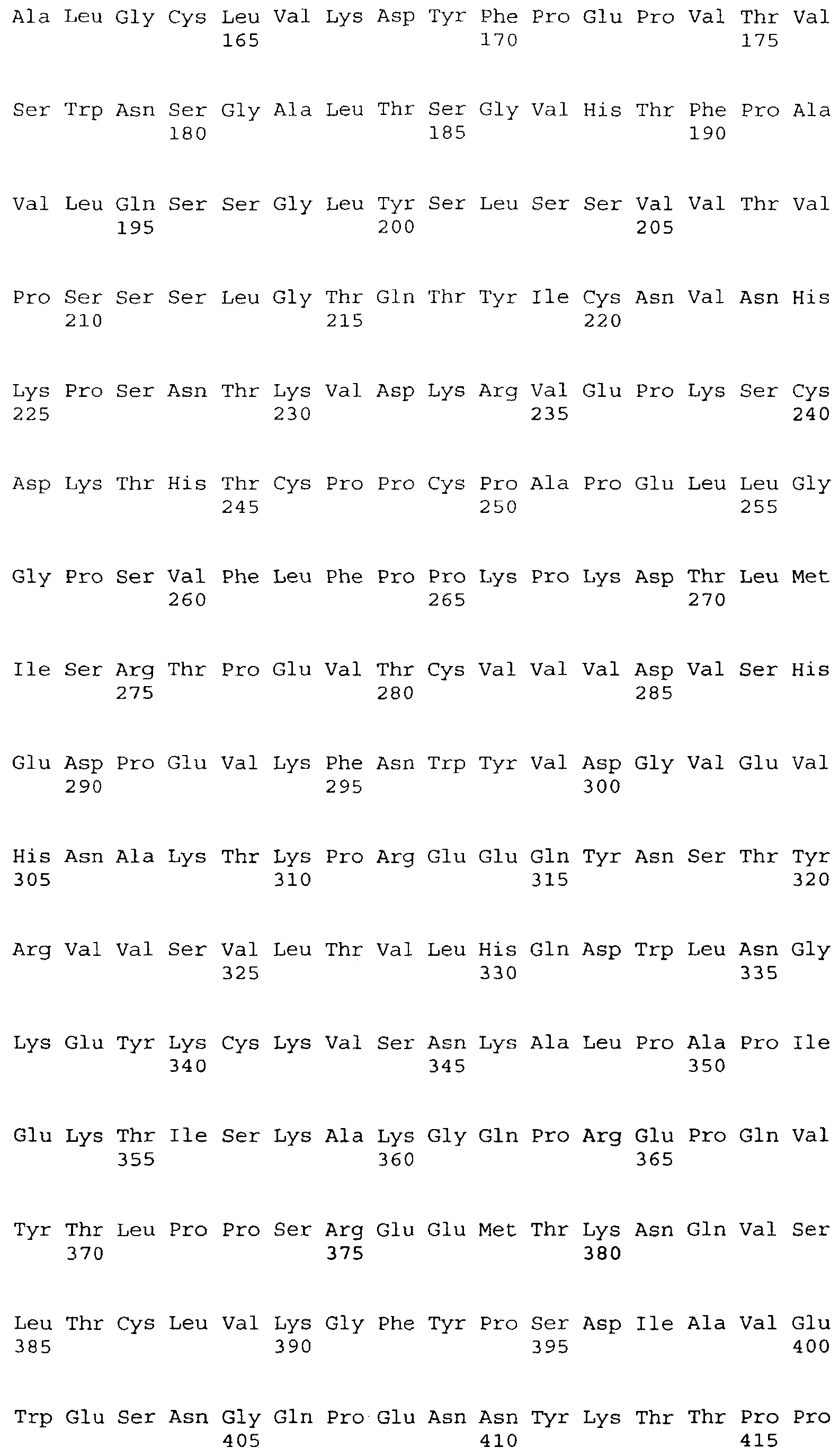














































































Описание
В настоящей заявке испрашивается приоритет предварительной заявки США №60/535181, поданной 7 января 2004, и предварительной заявки США №60/576417, поданной 2 июня 2004, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к способам предупреждения и лечения остеолиза, рака с метастазами и остеопороза, ассоциированного с метастазами рака, путем введения M-CSF-специфического антитела индивидууму.
Предшествующий уровень техники
Метастазы рака являются главной причиной постоперационных или посттерапевтических рецидивов рака у пациентов. Несмотря на интенсивные попытки разработать методику лечения рака, метастазы рака, в основном, не поддаются лечению. Кость является одной из самых распространенных участков, в которые метастазирует раковые опухоли человека различных типов (например, рак молочной железы, легкого, предстательной железы и щитовидной железы). Появление метастазов, вызывающих остеолиз кости, является причиной развития серьезных заболеваний, проявляющихся постоянной болью, высоким риском переломов, сдавлением нервов и гиперкальцемией. Несмотря на серьезность этих клинических симптомов, имеется очень немного способов лечения остеопороза, ассоциированного с метастазами рака.
Остеокласты опосредуют реадсорбцию кости. Остеокласты представляют собой многоядерные клетки, дифференцирующиеся из гемопоэтических клеток. Обычно принято считать, что остеокласты образуются в результате слияния мононуклеарных предшественников, происходящих от гемопоэтических стволовых клеток костного мозга, но не в результате неполного деления клеток (Chambers, Bone and Mineral Research, 6:1-25, 1989; Göthling et al., Clin. Orthop. Relat R. 120:201-228, 1976; Kahn et al., Nature 258:325-327, 1975, Suda et al., Endocr. Rev. 13:66-80, 1992; Walker, Science 180:875, 1973; Walker, Science 190:785-787, 1975; Walker, Science 190:784-785, 1975). Эти клетки происходят от тех же самых стволовых клеток, что и клетки линии дифференцировки моноцитов-макрофагов (Ash et al., Nature 283:669-670, 1980, Kerby et al., J. Bone Miner.Res. 7:353-62, 1992). Для дифференцировки предшественников остеокластов в зрелые многоядерные остеокласты требуется присутствие различных факторов, включая гормональные и локальные раздражители (Athanasou et al., Bone Miner. 3:317-333, 1988; Feldman et al., Endocrinology 107:1137-1143, 1980; Walker, Science 190:784-785, 1975; Zheng et al., Histochem. J.23:180-188, 1991), и было показано, что жизнеспособная костная ткань и костные клетки играют решающую роль в развитии остеокластов (Hagenaars et al., Bone Miner 6:179-189, 1989). Для дифференцировки остеокластов также требуется присутствие остеобластов или клеток стромы костного мозга. Одним из факторов, продуцируемых клетками, способствующими образованию остеобластов, является макрофагальный колониестимулирующий фактор, M-CSF (Wictor-Jedrzejczak et al., Proc. Natl. Acad. Sci. USA 87:4828-4823, 1990; Yoshida et al., Nature 345:442-444, 1990). Другим сигналом (Suda et al. Endocr. Rev. 13:66-80, 1992) является активатор рецептора для лиганда NF-kB (RANKL, также известный как TRANCE, ODF и OPGL), посредством которого остеобластные/стромальные клетки стимулируют образование и резорбцию остеокластов, а именно рецептора RANK (TRANCER), локализованного на остеокластах и предшественниках остеокластов (Lacey et al., Cell 93:165-176, 1998; Tsuda et al., Biochem Biophys Res. Co.234:137-142, 1997; Wong et al., J. Exp. Med. 186:2075-2080, 1997; Wong et al., J. Biol. Chem. 272:25190-25194, 1997; Yasuda et al., Endocrinology 139:1329-1337, 1998; Yasuda et al., Proc. Natl. Acad. Sci. US 95:3597-3602, 1998). Остеобласты также секретируют белок, который является сильным ингибитором образования остеокластов и называется остеопротегерином (OPG, также известный как OCIF), который действует как рецептор-“ловушка” для RANKL, то есть ингибирует позитивный сигнал между остеокластами и остеобластами посредством RANK и RANKL.
Остеокласты ответственны за растворение как минерального, так и органического костного матрикса (Blair et al., J. Cell Biol. 1164-1172, 1986). Остеокласты представляют собой клетки терминальной дифференцировки, имеющие уникальную поляризованную морфологию со специализированными мембранными областями и несколько мембранных и цитоплазматических маркеров, таких как резистентная к тартрату кислая фосфотаза (TRAP)(Anderson et al. 1979), (угольная кислота)-ангидраза II (Väänänen et al., Histochemistry 78:481-485, 1983), рецептор кальцитонина (Warshafsky et al., Bone 6:179-185, 1985) и рецептор витронектина (Davies et al., J. Cell. Biol. 109:1817-1826, 1989). Многоядерные остеокласты обычно содержат менее 10 ядер, но они могут содержать и до 100 ядер, диаметр которых составляет от 10 до 100 мкм (Göthling et al., Clin. Orthop. Relat. R. 120:201-228, 1976). Это позволяет относительно легко идентифицировать такие клетки под оптическим микроскопом. Указанные клетки, в их активном состоянии, являются в высокой степени вакуолизированными, а также содержат много митохондрий, что указывает на их высокую скорость метаболизма (Mundy, in Primer on the metabolic bone diseases and disorders of mineral metabolism, pages 18-22, 1990). Поскольку остеокласты играют главную роль в остеолизе, ассоциированном с метастазами кости, то необходимо выявить новые средства и разработать методы стимуляции и функционирования остеокластов.
Таким образом, необходимость в идентификации новых средств и в разработке способов профилактики или лечения остеолиза или метастазов рака, включая метастазы, вызывающие остеолиз кости, остается крайне актуальной.
Описание сущности изобретения
Материалы и способы согласно изобретению удовлетворяют вышеупомянутым и другим требованиям, относящимся к данной области. В одном из своих вариантов настоящее изобретение относится к не мышиному моноклональному антителу, включающему функциональный фрагмент, который специфически связывается с таким же эпитопом M-CSF, как и любое одно из мышиных моноклональных антител RX1, MC1 или МС3, имеющих аминокислотные последовательности, представленные на фигурах 4, 14 и 15 соответственно. В своем родственном варианте настоящее изобретение относится к вышеупомянутому антителу, выбранному из группы, состоящей из поликлонального антитела; моноклонального антитела, включая антитело Human Engineered™ (человеческое сконструированное антитело); гуманизированного антитела; человеческого антитела; химерного антитела; фрагментов антитела: Fab, F(ab')2, Fv, ScFv или SCA; диатела; линейного антитела или мутеина любого из указанных антител, где указанное антитело предпочтительно сохраняет аффинность связывания, равную, по меньшей мере, 10-7, 10-8 или 10-9 или выше. В настоящем изобретении также рассматривается не мышиное моноклональное антитело, включая его функциональный фрагмент, которые на более чем 75% конкурируют с моноклональными антителами RX1, MC1 и/или МС3, имеющими аминокислотную последовательность, представленную на фигуре 4, за связывание с M-CSF.
В другом своем варианте настоящее изобретение относится к не мышиному моноклональному антителу, включая его функциональный фрагмент, где указанное не мышиное моноклональное антитело или его функциональный фрагмент связывается с эпитопом M-CSF, который включает, по меньшей мере, 4, 5, 6, 7 или 8 смежных аминокислотных остатков 98-105 последовательности на фигуре 12.
В другом своем варианте настоящее изобретение относится к не мышиному моноклональному антителу, включая его функциональный фрагмент, где указанное не мышиное моноклональное антитело или его функциональный фрагмент связывается с эпитопом M-CSF, который включает, по меньшей мере, 4, 5, 6, 7 или 8 смежных аминокислотных остатков в положениях 65-73 или 138-144 последовательности, представленной на фигуре 12 (соответствующих эпитопам M-CSF, распознаваемым антителами 5Н5 или МС3).
В еще одном своем варианте настоящее изобретение относится к вышеупомянутому антителу или к его фрагменту, который связывается с эпитопом M-CSF, включающим аминокислоты 98-105, указанные на фигуре 12. В своем родственном варианте настоящее изобретение относится к вышеупомянутому антителу, содержащему область CDR3, показанную на фигуре 4А. В другом своем варианте настоящее изобретение относится к антителу, содержащему, по меньшей мере, 1, 2, 3, 4, 5 или 6 областей CDR мышиного антитела RX1, представленных на фигуре 4А. Такое антитело, содержащее, по меньшей мере, 1, 2, 3, 4 или 5 из 6 областей CDR мышиного антитела RX1, может также содержать, по меньшей мере, любые 1, 2, 3, 4 или 5 из 6 областей CDR антитела 5Н4, представленных на фигуре 16А-В. Альтернативно, антитело, которое содержит, по меньшей мере, 1, 2, 3, 4 или 5 областей CDR мышиного антитела RX1, может также содержать, по меньшей мере, любые 1, 2, 3, 4 или 5 из 6 областей CDR антитела МС1, представленных на фигуре 16А-В. В еще одном альтернативном варианте вышеупомянутое антитело может также содержать любые, по меньшей мере, 1, 2, 3, 4 или 5 из 6 областей CDR антитела МС3, представленных на фигуре 16А-В. В своем родственном варианте настоящее изобретение относится к антителу, которое содержит, по меньшей мере, 1, 2, 3, 4 или 5 областей CDR мышиного антитела RX1 и которое может содержать, по меньшей мере, 1, 2, 3, 4 или 5 областей консенсусной последовательности CDR, представленной на фигуре 16А-В. В еще одном родственном варианте изобретения один или несколько остатков в консенсусной последовательности областей CDR в вышеупомянутом антителе заменены соответствующим остатком любого из CDR мышиного антитела RX1, 5Н4, МС1 или МС3. При этом желательная аффинность связывания может сохраняться, даже если одна или несколько аминокислот в данном антителе являются мутированными, например, в результате консервативных замен в CDR, и/или консервативных или неконсервативных замен в остатках низкого и умеренного риска.
В другом своем варианте настоящее изобретение относится к вариантам вышеупомянутого антитела, содержащего аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, представленной на фигурах 4А, 13, 14 или 15. В родственном варианте изобретения указанное антитело содержит аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, представленной на фигурах 4А, 13, 14 или 15.
В еще одном варианте изобретения указанное антитело содержит константную область и один или несколько вариабельных каркасных областей тяжелой и легкой цепей последовательности человеческого антитела. В родственном варианте изобретения указанное антитело содержит модифицированную или немодифицированную константную область человеческого иммуноглобулина IgG1, IgG2, IgG3 или IgG4. В предпочтительном варианте изобретения константной областью является человеческий IgG1 или IgG4, который может быть, но необязательно, модифицирован в целях усиления или ослабления некоторых свойств этого антитела. В случае IgG1, модификации, внесенные в константную область, а в частности в шарнирную область или в СН2-область, могут усиливать или ослаблять эффекторную функцию, включая ADCC- и/или CDC-активность. В других вариантах изобретения константная область IgG2 модифицирована в целях снижения уровня образования комплекса “антитело-антиген”. В случае IgG4, модификации в константной области, а в частности в шарнирной области, могут приводить к снижению уровня образования полуантител.
В еще одном варианте изобретения вышеупомянутое антитело является производным, или получено на основе, или содержит часть человеческой консенсусной последовательности, последовательности человеческой зародышевой линии, консенсусной последовательности человеческой зародышевой линии, или любой одной из последовательностей человеческого антитела, представленных в базах данных Kabat, NCB1 Ig Blast, http://www.ndci.nlm.nih.gov/igblast/showGermline.cgi, в базах данных Kabat http://www.bioinf.org.uk/abs/seqtest.htlm, на FTP-сайте для версии Kabat Release 5.0 (1992) ftp:/ftp.ndci.nih.gov/repository/kabat/Rel5.0, в базе данных ImMunoGeneTics (Montpellier France), http://imgt.cnusc.fr:8104/, V-Base http://www.mrc-cpe.cam.ac.uk/LIST.php?menu=901, Zurich University http://www.unizh.ch/~antibody/Sequences/index.html, The Therapeutic Antibody Human Homology Project (TAHHP) http://www.path.cam.ac.uk/~mrc7/humanisation/TAHHP.html, Protein Sequences and Structure Analysis of Antibody Domains http://how to/AnalyseAntibody/, Humanisation by design, http://people.cryst.bbk.ac.uk/~ubcg07s/, Antibody Resources http://www.antibodyresource.com/education.html, Antibody Engineering (by TT Wu), Humana Press.
В предпочтительном аспекте настоящего изобретения вышеупомянутое антитело представляет собой антитело Human Engineered™. Так, например, последовательность антитела Human Engineered™ представляет собой любую из последовательностей, указанных на фигурах 23-24. Рассматриваются также и другие антитела Human Engineered™ или их варианты.
Так, например, в одном из своих вариантов настоящее изобретение относится к вышеупомянутому антителу, полученному на основе антитела RX1, где вариабельная область тяжелой цепи этого антитела содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту. В своем родственном варианте настоящее изобретение относится к антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту.
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту. В своем родственном варианте настоящее изобретение относится к антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту. В другом своем варианте настоящее изобретение относится к антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность

В другом своем варианте настоящее изобретение относится к антителу, в котором вариабельная область тяжелой цепи содержит аминокислотную последовательность

В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту. В своем родственном варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту. В еще одном своем варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту.
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту. В своем родственном варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность

где Х представляет собой любую аминокислоту. В другом своем варианте настоящее изобретение относится к антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность

В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором вариабельная область легкой цепи содержит аминокислотную последовательность


В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, в котором, по меньшей мере, один Х представляет собой соответствующую аминокислоту в аминокислотной последовательности, представленной на фигуре 4А. В своем родственном варианте настоящее изобретение относится к антителу, в котором, по меньшей мере, один Х представляет собой консервативную замену (в соответствии с таблицей 1) соответствующей аминокислоты в аминокислотной последовательности, представленной на фигуре 4А. В другом родственном варианте настоящее изобретение относится к антителу, в котором, по меньшей мере, один Х представляет собой не консервативную замену (в соответствии с таблицей 1) соответствующей аминокислоты в аминокислотной последовательности, представленной на фигуре 4А. В еще одном своем варианте настоящее изобретение относится к антителу, в котором, по меньшей мере, один Х представляет собой соответствующую аминокислоту в последовательности человеческого антитела.
Вышеупомянутое антитело Human Engineered™ является производным, или получено на основе, или содержит часть консенсусной последовательности человеческого антитела, последовательности человеческой зародышевой линии, консенсусной последовательности человеческой зародышевой линии, или любой одной из последовательностей человеческого антитела, представленных в базе данных Kabat, NCB1 Ig Blast, http://www.ndci.nlm.nih.nih.gov/igblast/showGermline.cgi, в базе данных Kabat http://www.bioinf.org.uk/abs/seqtest.htlm, на FTP-сайте для версии Kabat Release 5.0/ (1992) ftp:/ftp.ncbi.nih.gov/repository/kabat/Rel5.0/, в базе данных ImMunoGeneTics (Montpellier France), http://imgt.cnusc.fr:8104/, V-Base http://www.mrc-cpe.cam.ac.uk/LIST.php?menu=901, Zurich University http://www.unizh.ch/~antibody/Sequences/index.htlm, The Therapeutic Antibody Human Homology Project (TAHHP) http://www.path.cam.ac.uk/~mrc7/humanisation/TAHHP.html, Protein Sequence and Structure Analysis of Antibody Domains http://how to/AnalyseAntibodies/, Humanisation by design, http://people.cryst.bbk.ac.uk/~ubcg07s/, Antibody Resources http://www.antibodyresource.com/educational.html, Antibody Engineering (by TT Wu), Humana Press.
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу Human Engineered™, последовательность которого представляет собой одну из последовательностей, указанных на фигурах 23-24 или 29-30. В другом варианте изобретения вышеуказанное антитело содержит аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична одной из аминокислотных последовательностей, представленных на фигуре 19В. В другом варианте изобретения указанное антитело содержит аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92 93, 94, 95, 96, 97, 98 или 99% идентична одной из аминокислотных последовательностей легкой цепи, представленных на фигурах 20В-22В.
В еще одном варианте изобретения вышеупомянутое антитело, такое как 5Н4, МС1 или МС3, имеющее последовательности, указанные на одной из фигур 24С-24Е, представляет собой антитело Human Engineered™, полученное методами, описанными в патенте США №5766886, Studnicka et al., и в примере 4A настоящего изобретения, и эти последовательности пронумерованы согласно нумерации Кэбата, как показано на фигурах 24С-24Е, с идентификацией остатков с заменами низкого, умеренного или высокого риска. В своем родственном варианте настоящее изобретение относится к вышеупомянутому антителу, где все остатки низкого риска в тяжелой или легкой цепи или в обеих цепях были модифицированы, если это необходимо, так, чтобы эти остатки были идентичны остаткам исходной последовательности человеческого иммуноглобулина. Аналогичным образом, в другом своем варианте, настоящее изобретение относится к вышеупомянутому антителу, где все остатки низкого + умеренного риска в тяжелой или легкой цепи или в обеих цепях были модифицированы, если это необходимо, так, чтобы эти остатки были идентичны остаткам исходной последовательности человеческого иммуноглобулина. Тяжелая цепь, где все остатки низкого риска являются модифицированными, могут быть объединены с легкой цепью, где все остатки низкого и умеренного риска являются модифицированными, и наоборот. Аналогичным образом, легкая цепь и тяжелая цепь вышеупомянутого антитела Human Engineered™ могут быть объединены с легкой или тяжелой цепью гуманизированного антитела или химерного антитела.
В другом варианте изобретения указанное антитело содержит аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична одной из аминокислотных последовательностей тяжелой цепи вышеописанного антитела Human Engineered™, полученного в соответствии с методом Studnicka et al. В еще одном варианте изобретения указанное антитело содержит аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична одной из аминокислотных последовательностей легкой цепи вышеописанного антитела Human Engineered™, полученного в соответствии с методом Studnicka et al.
В другом своем варианте настоящее изобретение относится к антителу, содержащему тяжелую цепь, описанную выше, и легкую цепь, описанную выше.
В еще одном варианте изобретения вышеупомянутое антитело имеет аффинность Kd, равную по меньшей мере 10-7. В родственном варианте изобретения, указанное антитело имеет аффинность Kd, равную по меньшей мере 10-9.
В другом своем варианте настоящее изобретение относится к вышеупомянутому антителу, которое представляет собой поликлональное антитело; моноклональное антитело, включая антитело Human Engineered™; гуманизированное антитело; человеческое антитело; химерное антитело; фрагменты антитела: Fab, F(ab')2, Fv, ScFv или SCA; диатело; линейное антитело или мутеин любого из указанных антител. В родственном варианте изобретения моноклональное антитело представляет собой выделенное антитело.
В еще одном своем варианте настоящее изобретение относится к выделенной нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую легкую цепь вышеупомянутого антитела. В родственном варианте изобретения указанная выделенная нуклеиновая кислота содержит нуклеотидную последовательность тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична нуклеотидной последовательности тяжелой цепи, представленной на фигурах 4А, 13, 14 или 15. В другом родственном варианте изобретения указанная выделенная нуклеиновая кислота содержит нуклеотидную последовательность легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентична нуклеотидной последовательности легкой цепи, представленной на фигурах 4А, 13, 14 или 15.
В другом своем варианте настоящее изобретение относится к вектору, содержащему вышеупомянутую выделенную нуклеиновую кислоту. В родственном варианте настоящее изобретение относится к вышеупомянутому вектору, в котором указанная выделенная нуклеиновая кислота функционально связана с регуляторной последовательностью. В другом своем варианте настоящее изобретение относится к клетке-хозяину, содержащему вышеупомянутый вектор.
В данной заявке рассматриваются несколько способов осуществления настоящего изобретения. Так, например, в настоящем изобретении рассматривается способ продуцирования вышеупомянутого антитела, включающий культивирование вышеупомянутой клетки-хозяина, так, чтобы экспрессируемая в этой клетке выделенная нуклеиновая кислота продуцировала данное антитело. В родственном варианте настоящее изобретение также относится к способу, включающему стадию выделения антитела из культуры клетки-хозяина. В родственном варианте настоящее изобретение также относится к выделенному антителу, продуцированному вышеупомянутым способом.
Настоящее изобретение также относится к гибридоме, которая секретирует вышеупомянутое антитело согласно изобретению. Кроме того, настоящее изобретение относится к вышеупомянутому антителу, конъюгированному с токсином.
В другом своем варианте настоящее изобретение относится к фармацевтической композиции, содержащей одно из вышеупомянутых антител и фармацевтически приемлемый носитель, наполнитель или разбавитель. В родственном варианте изобретения указанная фармацевтическая композиция дополнительно содержит второе терапевтическое средство. В другом своем родственном варианте настоящее изобретение относится к фармацевтической композиции, где указанным вторым терапевтическим средством является противораковое химиотерапевтическое средство. В еще одном родственном варианте настоящее изобретение относится к фармацевтической композиции, в которой указанным вторым терапевтическим средством является бифосфонат. В другом варианте изобретения указанным вторым терапевтическим средством является другое антитело.
В настоящем изобретении рассматриваются антитела, которые обладают рядом желательных свойств, эффективных для лечения заболеваний и расстройств. В одном из своих вариантов настоящее изобретение относится к любому из вышеупомянутых антител, которое связывается с M-CSF и может быть использовано для предотвращения у пациента заболевания, вызывающего или стимулирующего развитие остеолиза, и которое способствует значительному ослаблению тяжести остеопороза, ассоциированного с указанным заболеванием. Аналогичным образом, настоящее изобретение относится к любому из вышеупомянутых антител, которое связывается с M-CSF и которое может быть использовано для лечения пациента, страдающего заболеванием, вызывающим или стимулирующим развитие остеолиза, где указанное антитело способствует значительному ослаблению тяжести остеопороза, ассоциированного с указанным заболеванием.
В настоящем изобретении рассматривается ряд заболеваний и расстройств, которые могут поддаваться лечению с использованием антитела в соответствии с изобретением. В одном из своих вариантов настоящее изобретение относится к вышеупомянутому антителу, которое может быть использовано для лечения заболевания, выбранного из группы, состоящей из метаболических болезней кости, ассоциированных с относительно повышенной активностью остеокластов, включая эндокринопатии (включая гиперкортицизм, гипогонадизм, первичный или вторичный гиперпаратиреоз, гипертиреоз), гиперкальцемию, дефицитные состояния (включая рахит/остеомаляцию, цингу, нарушение питания), хронические заболевания (включая синдромы малабсорбции, хроническую почечную недостаточность (включая остеодистрофию почек)), хроническое заболевание печени (включая остеодистрофию печени)), заболевания, ассоциированные с приемом лекарственных средств (включая глюкокортикоиды (индуцированный глюкокортикоидами остеопороз), гепарин, алкоголь), наследственные заболевания (несовершенный остеогенез, гомоцистинурию), рак, остеопороз, остеопетроз, воспаление кости, ассоциированное с артритом и ревматоидным артритом, периодонтальное заболевание, фиброзную дисплазию и/или болезнь Педжета.
В своем родственном варианте настоящее изобретение относится к вышеупомянутому антителу, которое связывается с M-CSF и которое может быть использовано для профилактики или лечения рака с метастазами в кости, где указанным метастазирующим раком является рак молочной железы, рак легкого, рак почек, множественная миелома, рак щитовидной железы, рак предстательной железы, аденокарцинома, злокачественные заболевания клеток крови, включая лейкоз и лимфому; рак головы и шеи; рак желудочно-кишечного тракта, включая рак пищевода, рак желудка, рак толстой кишки, рак тонкой кишки, рак ободочной кишки, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчных протоков или желчного пузыря; злокачественные заболевания женских половых органов, включая карциному яичника, рак эндометрия, рак влагалища и рак шейки матки; рак мочевого пузыря; рак головного мозга, включая нейробластому; саркома, остеосаркома; и рак кожи, включая злокачественную меланому или плоскоклеточный рак.
В другом своем варианте настоящее изобретение относится к способу скрининга на M-CSF-специфическое антитело, включающему стадии контактирования среды метастатических опухолевых клеток, остеокластов и антитела-кандидата; детекции образования остеокластов, пролиферации и/или дифференцировки остеокластов и идентификацию указанного антитела-кандидата как M-CSF-специфического антитела, если было обнаружено снижение уровня образования, пролиферации и/или дифференцировки остеокластов. Аналогичным образом, настоящее изобретение относится к вышеупомянутому способу, в котором указанная среда метастатических опухолевых клеток включает опухолевые клетки.
В другом своем варианте настоящее изобретение относится к вышеупомянутому способу, где указанная стадия контактирования (а) протекает in vivo; указанная стадия детекции (b) включает детекцию размера и/или числа метастазов в кости, а антитело-кандидат идентифицируют как M-CSF-специфическое антитело, если было обнаружено уменьшение размера и/или числа метастазов в кости. В своем родственном варианте настоящее изобретение относится к вышеупомянутому способу, дополнительно предусматривающему стадию определения наличия связывания антитела-кандидата с M-CSF. Аналогичным образом, в другом своем варианте настоящее изобретение относится к вышеупомянутому способу, который дополнительно предусматривает стадию определения факта ингибирования взаимодействия указанного антитела-кандидата с M-CSF и его рецептором M-CSFR.
В другом своем варианте настоящее изобретение относится к способу идентификации M-CSF-специфического антитела, которое может способствовать профилактике или лечению метастазов рака кости, где указанный способ предусматривает стадии: (а) детекции связывания антитела-кандидата с эпитопом M-CSF, включающим, по меньшей мере, 4 смежных аминокислотных остатка 98-105, указанных на фигуре 12; и (b) анализа способности указанного антитела-кандидата к профилактике или лечению метастазов рака в кости in vitro или in vivo.
В другом своем варианте настоящее изобретение относится к способу идентификации M-CSF-специфического антитела, которое может способствовать профилактике или лечению метастазов рака в кости, где указанный способ предусматривает стадии: (а) детекции связывания антитела-кандидата с эпитопом M-CSF, включающим, по меньшей мере, 4 смежных аминокислотных остатка 65-73 или 138-144, указанных на фигуре 12 (соответствующих эпитопам M-CSF, распознаваемым антителом 5Н4 или МС3); и (b) анализа способности указанного антитела-кандидата к профилактике или лечению метастазов рака в кости in vitro или in vivo.
В еще одном своем варианте настоящее изобретение относится к способу модификации CDR антитела, которое связывается с эпитопом M-CSF, включающим аминокислоты 98-105, представленные на фигуре 12, где указанный способ предусматривает: модификацию аминокислот в CDR аминокислотной последовательности, представленной на фигуре 4А, и отбор антитела, которое связывается с M-CSF с аффинностью Ка, составляющей по меньшей мере, 10-7. В другом своем варианте настоящее изобретение относится к способу системной модификации вплоть до 60% аминокислотной последовательности тяжелой цепи, представленной на фигуре 4А, где указанный способ предусматривает модификацию любых остатков Х1-Х52 в аминокислотной последовательности:

В своем родственном варианте настоящее изобретение относится к способу системной модификации вплоть до 60% аминокислотной последовательности легкой цепи, представленной на фигуре 4А, где указанный способ предусматривает модификацию любых остатков Х1-Х52 в аминокислотной последовательности:

В еще одном своем варианте настоящее изобретение относится к способу модификации CDR антитела, которое связывается с эпитопом M-CSF, включающим аминокислоты 65-73 или 138-144, указанные на фигуре 12 (соответствующие эпитопам M-CSF, распознаваемым антителом 5Н4 или МС3), где указанный способ включает модификацию аминокислот в аминокислотной последовательности области CDR, представленной на одной из фигур 13, 14 и 15, и отбор антитела, которое связывается с M-CSF с аффинностью Ка, составляющей, по меньшей мере, 10-7. В другом своем варианте настоящее изобретение относится к способу системной модификации до 60% аминокислотной последовательности тяжелой цепи, представленной на одной из фигур 13, 14 и 15, где указанный способ включает модификацию вышеупомянутых последовательностей, полученных методами, описанными в патенте США №5766886, Studnicka et al., и в примере 4А настоящей заявки, и пронумерованных в соответствии с нумерацией по Кэбату, как показано на фигурах 24С-24Е; и тестирование антитела, содержащего модифицированную аминокислотную последовательность, на связывание с эпитопом M-CSF, включающим аминокислоты 65-73 или 138-144, указанные на фигуре 12 (соответствующие эпитопам M-CSF, распознаваемым антителом 5Н4 или МС3). В родственном варианте изобретения все остатки низкого риска являются модифицированными. Аналогичным образом, в другом варианте изобретения все остатки низкого и умеренного риска являются модифицированными. В еще одном варианте изобретения все остатки низкого и умеренного риска, за исключением пролина, являются модифицированными.
В другом своем варианте настоящее изобретение относится к способу экспрессии антитела, имеющего области CDR, сконструированные вышеупомянутым способом. В другом своем варианте настоящее изобретение относится к фармацевтической композиции, содержащей антитело, связывающееся с M-CSF, где указанное антитело получают вышеупомянутым способом.
В еще одном своем варианте настоящее изобретение относится к способу профилактики или ослабления остеопороза, включающему введение индивидууму, страдающему заболеванием, вызывающим или стимулирующим развитие остеолиза, терапевтически эффективного количества любого из вышеупомянутых антител, которое предупреждает или ослабляет остерпороз, ассоциированный с указанным заболеванием. В своем родственном варианте настоящее изобретение относится к способу лечения индивидуума, страдающего заболеванием, вызывающим или стимулирующим развитие остеолиза, где указанный способ предусматривает введение указанному индивидууму терапевтически эффективного количества любого из вышеупомянутых антител, ослабляющего тяжесть остерпороза, ассоциированного с указанным заболеванием.
В своем родственном варианте настоящее изобретение относится к вышеупомянутому способу, в котором указанное заболевание выбрано из группы, состоящей из метаболических болезней кости, ассоциированных с относительно повышенной активностью остеокластов, включая эндокринопатии (включая гиперкортицизм, гипогонадизм, первичный или вторичный гиперпаратиреоз, гипертиреоз), гиперкальцемию, дефицитные состояния (включая рахит/остеомаляцию, цингу, нарушение питания), хронические заболевания (включая синдромы малабсорбции, хроническую почечную недостаточность (включая остеодистрофию почек)), хроническое заболевание печени (остеодистрофию печени)), заболевания, ассоциированные с приемом лекарственных средств (включая глюкокортикоиды (включая индуцированный глюкокортикоидами остеопороз), гепарин, алкоголь), наследственные заболевания (включая несовершенный остеогенез, гомоцистинурию), рак, остеопороз, остеопетроз, воспаление кости, ассоциированное с артритом и ревматоидным артритом, периодонтальное заболевание, фиброзную дисплазию и/или болезнь Педжета.
В еще одном своем варианте настоящее изобретение относится к способу профилактики или лечения метастазов рака в кости, включающему введение индивидууму, страдающему метастазами рака, терапевтически эффективного количества любого из вышеупомянутых антител. В своем родственном варианте настоящее изобретение относится к способу, в котором указанным метастазирующим раком является рак молочной железы, рак легкого, рак почек, множественная миелома, рак щитовидной железы, рак предстательной железы, аденокарцинома, злокачественные заболевания клеток крови, включая лейкоз и лимфому; рак головы и шеи; рак желудочно-кишечного тракта, включая рак пищевода, рак желудка, рак толстой кишки, рак тонкой кишки, рак ободочной кишки, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчных протоков или желчного пузыря; злокачественные заболевания женских половых органов, включая карциному яичника, рак эндометрия, рак влагалища и рак шейки матки; рак мочевого пузыря; рак головного мозга, включая нейробластому; саркома, остеосаркома; и рак кожи, включая злокачественную меланому или плоскоклеточный рак.
В еще одном своем варианте настоящее изобретение относится к способу профилактики остеопороза и роста опухоли, где указанный способ предусматривает введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества любого из вышеупомянутых антител. В родственном варианте изобретения указанный способ также предусматривает введение второго терапевтического средства. В другом родственном варианте настоящее изобретение относится к способу, в котором вторым терапевтическим средством является противораковое химиотерапевтическое средство или бифосфонат. В еще одном родственном варианте настоящее изобретение относится к способу, в котором указанным бифосфонатом является зеледронат, памидронат, клодронат, этидронат, тилундронат, алендронат или ибандронат. В еще одном родственном варианте настоящее изобретение относится к вышеупомянутым способам, в которых указанным терапевтическим средством является цитотоксическое химиотерапевтическое средство. В другом своем варианте настоящее изобретение относится к вышеупомянутому способу, в котором указанный индивидуум не проходил лечения бифосфонатом.
В еще одном родственном варианте настоящее изобретение относится к вышеупомянутому способу, в котором указанное антитело является эффективным для снижения дозы второго терапевтического средства, необходимого для достижения терапевтического эффекта. В другом варианте изобретения указанным терапевтическом средством является другой, не-M-CSF, колониестимулирующий фактор, например колониестимулирующий фактор G-CSF, или антитело против RANKL, или растворимый рецептор RANKL.
В другом своем варианте настоящее изобретение относится к вышеупомянутым способам, в которых указанным индивидуумом является млекопитающее. В родственном варианте изобретения указанным млекопитающим является человек.
В другом своем варианте настоящее изобретение относится к вышеупомянутым способам, в которых указанное антитело ингибирует взаимодействие M-CSF с его рецептором (M-CSFR). В другом родственном варианте изобретения указанное антитело ингибирует пролиферацию и/или дифференцировку остеокластов, индуцированную опухолевыми клетками. В еще одном своем варианте настоящее изобретение относится к вышеупомянутым способам, в которых указанное антитело вводят в дозе, составляющей примерно от 2 мкг/кг до 30 мг/кг, от 0,1 мг/кг до 30 мг/кг или от 0,1 мг/кг до 10 мг/кг массы тела.
В другом варианте изобретения рассматривается использование антитела для изготовления лекарственного средства в количестве, эффективном для профилактики или ослабления остеопороза у пациента с симптомами остеолиза, и для изготовления лекарственного средства для лечения пациента, страдающего заболеванием, вызывающим или стимулирующим развитие остеолиза. Кроме того, вышеупомянутое антитело может быть использовано для лечения заболевания, выбранного из группы, состоящей из метаболических болезней кости, ассоциированных с относительно повышенной активностью остеокластов, включая эндокринопатии (включая, гиперкортицизм, гипогонадизм, первичный или вторичный гиперпаратиреоз, гипертиреоз), гиперкальцемию, дефицитные состояния (включая, рахит/остеомаляцию, цингу, нарушение питания), хронические заболевания (включая, синдромы малабсорбции, хроническую почечную недостаточность (включая, остеодистрофию почек), хроническое заболевание печени (включая, остеодистрофию печени)), заболевания, ассоциированные с приемом лекарственных средств (включая глюкокортикоиды (индуцированный глюкокортикоидами остеопороз), гепарин, алкоголь), наследственные заболевания (включая, несовершенный остеогенез, гомоцистинурию), рак, остеопороз, остеопетроз, воспаление кости, ассоциированное с артритом и ревматоидным артритом, периодонтальное заболевание, фиброзную дисплазию и/или болезнь Педжета.
В другом варианте изобретения рассматривается использование антитела для изготовления лекарственного средства для профилактики или лечения метастазов рака кости у пациента, страдающего метастазами рака. В родственном варианте изобретения указанным метастазирующим раком является рак молочной железы, рак легкого, рак почек, множественная миелома, рак щитовидной железы, рак предстательной железы, аденокарцинома, злокачественные заболевания клеток крови, включая лейкоз и лимфому; рак головы и шеи; рак желудочно-кишечного тракта, включая рак пищевода, рак желудка, рак толстой кишки, рак тонкой кишки, рак ободочной кишки, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчных протоков или желчного пузыря; злокачественные заболевания женских половых органов, включая карциному яичника, рак эндометрия, рак влагалища и рак шейки матки; рак мочевого пузыря; рак головного мозга, включая нейробластому; саркома, остеосаркома; или рак кожи, включая злокачественную меланому или плоскоклеточный рак.
В еще одном варианте рассматривается использование антитела согласно изобретению для изготовления лекарственного средства для лечения пациента, страдающего раком.
В любом из вышеупомянутых вариантов лечение указанным лекарственным средством комбинируют с лечением вторым терапевтическим средством. В родственном варианте изобретения указанным вторым терапевтическом средством является противораковое химиотерапевтическое средство. В родственных вариантах изобретения указанным вторым терапевтическим средством является другой, не-M-CSF, колониестимулирующий фактор, или антитело против RANKL, или растворимый рецептор RANKL, или бифосфонат. В родственном варианте изобретения указанным бифосфонатом является зеледронат, памидронат, клодронат, этидронат, тилундронат, алендронат или ибандронат.
В еще одном варианте изобретения рассматривается любое из вышеуказанных применений, в которых указанный пациент не проходил лечение бифосфонатом, и/или в которых указанный пациент проходил предварительное лечение вторым терапевтическим средством. В родственном варианте изобретения указанным вторым терапевтическом средством является противораковое химиотерапевтическое средство, другой, не-M-CSF, колониестимулирующий фактор, или антитело против RANKL, или растворимый рецептор RANKL, или бифосфонат. В еще одном родственном варианте изобретения указанным бифосфонатом является зеледронат, памидронат, клодронат, этидронат, тилундронат, алендронат или ибандронат. В еще одном родственном варианте изобретения указанный пациент не подвергался лечению бифосфонатом.
В другом варианте изобретения рассматривается использование синергической комбинации антитела согласно изобретению для получения лекарственного средства для лечения пациента с симптомами остеолиза, где применение указанного лекарственного средства координируют с лечением вторым терапевтическим средством. В родственном варианте изобретения указанным вторым терапевтическом средством является противораковое химиотерапевтическое средство, другой, не-M-CSF, колониестимулирующий фактор, или антитело против RANKL, или растворимый рецептор RANKL, или бифосфонат. В родственном варианте изобретения указанным бифосфонатом является зеледронат, памидронат, клодронат, этидронат, тилундронат, алендронат или ибандронат. В еще одном родственном варианте изобретения указанный пациент не подвергался лечению бифосфонатом.
Рассматриваются варианты любого из вышеупомянутых применений, где в указанном лекарственном средстве антитело присутствует в количестве, эффективном для снижения дозы второго терапевтического средства, необходимой для достижения терапевтического эффекта. В любом из вышеупомянутых вариантов, относящихся к остеопорозу, ассоциированному с раком, количество антитела в лекарственном средстве является предпочтительно эффективным для ингибирования пролиферации и/или дифференцировки остеокластов, индуцируемых опухолевыми клетками.
В любом из вышеупомянутых лекарственных средств количество антитела может составлять дозу примерно от 2 мкг/кг до 30 мг/кг массы тела. В родственном варианте изобретения количество антитела в лекарственном средстве составляет дозу примерно от 0,1 мг/кг до 30 мг/кг массы тела. В еще одном варианте изобретения количество антитела в лекарственном средстве составляет дозу примерно от 0,1 мг/кг до 10 мг/кг массы тела.
В настоящем изобретении также рассматриваются наборы. В одном из своих вариантов настоящее изобретение относится к набору, содержащему терапевтически эффективное количество антитела согласно изобретению, упакованное в контейнере, таком как сосуд или флакон, и, кроме того, содержащему этикетку, приклеенную к указанному контейнеру или вложенную в этот контейнер, где указанная этикетка включает описание содержимого данного контейнера, показания и/или инструкции по использованию содержимого данного контейнера для профилактики или ослабления остеопороза.
В другом своем варианте настоящее изобретение относится к набору, содержащему терапевтически эффективное количество антитела согласно изобретению, упакованное в контейнере, таком как сосуд или флакон, и, кроме того, содержащему этикетку, приклеенную к указанному контейнеру или вложенную в контейнер, где указанная этикетка включает описание содержимого данного контейнера, показания и/или инструкции по использованию содержимого данного контейнера для лечения пациента, страдающего заболеванием, вызывающим или стимулирующим остеолиз.
В своем родственном варианте настоящее изобретение относится к набору, используемому для лечения заболевания, выбранного из группы, состоящей из метаболических болезней кости, ассоциированных с относительно повышенной активностью остеокластов, включая эндокринопатии (включая гиперкортицизм, гипогонадизм, первичный или вторичный гиперпаратиреоз, гипертиреоз), гиперкальцемию, дефицитные состояния (включая рахит/остеомаляцию, цингу, нарушение питания), хронические заболевания (включая синдромы малабсорбции, хроническую почечную недостаточность (включая остеодистрофию почек), хроническое заболевание печени (включая остеодистрофию печени)), заболевания, ассоциированные с приемом лекарственных средств (включая глюкокортикоиды (индуцированный глюкокортикоидами остеопороз), гепарин, алкоголь), наследственные заболевания (включая несовершенный остеогенез, гомоцистинурию), рак, остеопороз, остеопетроз, воспаление кости, ассоциированное с артритом и ревматоидным артритом, периодонтальное заболевание, фиброзную дисплазию и/или болезнь Педжета.
В другом своем варианте настоящее изобретение относится к набору, содержащему терапевтически эффективное количество антитела согласно изобретению, упакованное в контейнере, таком как сосуд или флакон, и, кроме того, содержащему этикетку, приклеенную к указанному контейнеру или вложенную в этот контейнер, где указанная этикетка включает описание содержимого данного контейнера, показания и/или инструкции по использованию содержимого данного контейнера для предупреждения или лечения метастазов рака в кости. В родственном варианте изобретения указанным метастазирующим раком является рак молочной железы, рак легкого, рак почек, множественная миелома, рак щитовидной железы, рак предстательной железы, аденокарцинома, злокачественные заболевания клеток крови, включая лейкоз и лимфому; рак головы и шеи; рак желудочно-кишечного тракта, включая рак пищевода, рак желудка, рак толстой кишки, рак тонкой кишки, рак ободочной кишки, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчных протоков или желчного пузыря; злокачественные заболевания женских половых органов, включая карциному яичника, рак эндометрия, рак влагалища и рак шейки матки; рак мочевого пузыря; рак головного мозга, включая нейробластому; саркома, остеосаркома; или рак кожи, включая злокачественную меланому или плоскоклеточный рак.
В еще одном своем варианте настоящее изобретение относится к набору, содержащему терапевтически эффективное количество антитела согласно изобретению, упакованное в контейнере, таком как сосуд или флакон, и, кроме того, содержащему этикетку, приклеенную к указанному контейнеру или вложенную в этот контейнер, где указанная этикетка включает описание содержимого данного контейнера, показания и/или инструкции по использованию содержимого данного контейнера для лечения рака.
В другом варианте изобретения указанный набор также содержит второе терапевтическое средство. В родственном варианте изобретения указанным вторым терапевтическом средством является противораковое химиотерапевтическое средство, другой, не-M-CSF, колониестимулирующий фактор, или антитело против RANKL, или растворимый рецептор RANKL, или бифосфонат. В родственном варианте изобретения указанным бифосфонатом является зеледронат, памидронат, клодронат, этидронат, тилундронат, алендронат или ибандронат. В еще одном варианте изобретения указанный набор включает инструкции по его использованию для лечения пациента, который не проходил лечение бифосфонатом.
В другом своем варианте настоящее изобретение относится к вышеупомянутому набору, содержащему дозу антитела, эффективную для снижения дозы второго терапевтического средства, необходимой для достижения терапевтического эффекта. В другом варианте изобретения указанный набор содержит синергическую дозу антитела. В еще одном варианте изобретения указанный набор содержат дозу антитела, эффективную для ингибирования пролиферации и/или дифференцировки остеокластов, индуцированных опухолевыми клетками.
В еще одном варианте изобретения вышеупомянутый набор содержит дозу антитела, составляющую примерно от 2 мкг/кг до 30 мг/кг массы тела. В другом варианте изобретения указанный набор содержит дозу антитела, составляющую примерно от 0,1 мг/кг до 30 мг/кг массы тела. В еще одном варианте изобретения указанный набор содержит дозу антитела, составляющую примерно от 0,1 мг/кг до 10 мг/кг массы тела.
В другом своем варианте настоящее изобретение относится к упаковке, сосуду или контейнеру, включающим лекарственное средство, содержащее одно или несколько вышеупомянутых антител, и инструкцию, в которой указано, что данное лекарственное средство должно быть использовано в комбинации с хирургической операцией или с лучевой терапией. В другом своем варианте настоящее изобретение относится к способу предупреждения или лечения метастазов рака в кости, включающему стадии введения любого из вышеупомянутых антител индивидууму и проведения индивидууму хирургической операции или лучевой терапии. В другом своем варианте настоящее изобретение относится к способу направленной обработки опухолевых клеток, экспрессирующих на своей поверхности мембраносвязанный M-CSF, где указанный способ предусматривает стадию введения любого из вышеупомянутых антител, где указанное антитело конъюгировано с радионуклидом или с другим токсином. В другом своем варианте настоящее изобретение относится к способу лечения индивидуума, страдающего раком, где указанный способ предусматривает введение указанному индивидууму терапевтически эффективного количества любого из вышеупомянутых антител.
В еще одном своем варианте настоящее изобретение относится к способу профилактики остеопороза, включающему введение индивидууму, страдающему заболеванием, вызывающим или стимулирующим остеолиз, любого из вышеупомянутых антител в количестве, эффективном для нейтрализации M-CSF, продуцируемого клетками данного индивидуума, где указанное количество превышает количество, эффективное для нейтрализации M-CSF, продуцируемого раковыми клетками. В родственном варианте настоящее изобретение относится к способу лечения индивидуума, страдающего заболеванием, вызывающим или стимулирующим остеолиз, любого из вышеупомянутых антител в количестве, эффективном для нейтрализации M-CSF, продуцируемого клетками данного индивидуума, где указанное количество превышает количество, эффективное для нейтрализации M-CSF, продуцируемого раковыми клетками.
В одном из вариантов изобретения настоящее изобретение относится к фармацевтической композиции, содержащей антитело RX1, 5Н4, MC1 и/или МС3, или не мышиное антитело, происходящее от антитела RX1, 5Н4, MC1 и/или МС3, или антитело, конкурирующее с антителом RX1, 5Н4, MC1 и/или МС3, и противораковое терапевтическое средство. В другом своем варианте настоящее изобретение относится к упаковке, сосуду или контейнеру, включающим лекарственное средство, содержащее антитело RX1, 5Н4, MC1 и/или МС3, или не-мышиное антитело, происходящее от антитела RX1, 5Н4, MC1 и/или МС3, или антитело, конкурирующее с антителом RX1, 5Н4, MC1 и/или МС3, и инструкцию, в которой указано, что данное лекарственное средство должно быть использовано в комбинации с хирургической операцией или с лучевой терапией.
В еще одном своем варианте настоящее изобретение относится к способу лечения индивидуума, страдающего раком, при котором раковые клетки на секретируют M-CSF, где указанный способ предусматривает стадию введения любого из вышеупомянутых антител.
Краткое описание графического материала
На фигуре 1 представлена топологическая диаграмма, где указаны дисульфидные связи в усеченном димерном M-CSF.
На фигуре 2 представлена стереодиаграмма С-альфа-остова M-CSF, где помечен каждый десятый остаток и где некристаллографическая ось симметрии указана пунктирной линией.
На фигуре 3 проиллюстрировано сравнение остеокласт-индуцирующей активности очищенного M-CSF и кондиционированной среды (CM) от клеток MDA 231 и MCF7.
На фигуре 4А представлена аминокислотная последовательность M-CSF-специфического мышиного антитела RX1 (SEQ ID NO: 2 и 4) (кодируемая кДНК-вставкой плазмиды, депонированной в Американской коллекции типовых культур, Manassas, VA, USA, и в АТСС под номером депозита РТА-6113) и соответствующая последовательность нуклеиновой кислоты (SEQ ID NO: 1 и 3). Области CDR пронумерованы и помечены жирным шрифтом.
На фигурах 4В и 4С представлены аминокислотные последовательности легкой (SEQ ID NO: 5) и тяжелой (SEQ ID NO: 6) цепей M-CSF-специфического мышиного антитела RX1, соответственно, с остатками высокого риска (выделены жирным шрифтом), умеренного риска (подчеркнуты) и низкого риска, идентифицированными методом Studnicka et al., WO 93/11794.
На фигуре 5А показано, что анти-M-CSF антитела RX1 и 5А1 являются видоспецифическими. На фигуре 5В показана M-CSF-нейтрализующая активность антител МС1 и МС3.
На фигуре 6 показано, что антитело RX1 эффективно ингибирует остеолиз в модели человеческого ксенотрансплантата при концентрации 5 мг/кг.
На фигуре 7 показано, что число метастазов снижается при введении антитела RX1 “голым” мышам, несущим раковые клетки человеческой молочной железы MDA-MB-231 при концентрации 5 мг/кг.
На фигуре 8А и 8В показано, что M-CSF-специфическое антитело связывается с клеточной линией рака молочной железы MDA-MB-231 и с раковой клеточной линией множественной миеломы ARH77.
На фигуре 9 показано, что M-CSF преобладает на поверхности ряда раковых клеток.
На фигуре 10 представлена аминокислотная последовательность M-CSFα (SEQ ID NO: 7).
На фигуре 11 представлена аминокислотная последовательность M-CSFβ (SEQ ID NO: 8).
На фигуре 12 представлена аминокислотная последовательность M-CSFγ (SEQ ID NO: 9). Различного рода полиморфизм в ДНК-последовательности может приводить к модификации аминокислот. Так, например, широко распространенный полиморфизм приводит к замене Pro на Ala в положении 104.
На фигурах 13, 14 и 15 представлены аминокислотные последовательности M-CSF-специфических мышиных антител 5Н4 (SEQ ID NO: 10 и 11), МС1 (SEQ ID NO: 12 и 13) (продуцируемого гибридомой, депонированной в АТСС под номером депозита РТА-6263) и МС3 (SEQ ID NO: 14 и 15) (продуцируемого гибридомой, депонированной в АТСС под номером депозита РТА-6264), соответственно.
На фигурах 16А и В проиллюстрировано выравнивание аминокислотных последовательностей CDR-областей тяжелой и легкой цепей человеческих M-CSF-специфических мышиных антител RX1, 5Н4, МС1 и МС3 (SEQ ID NO: 16-38).
На фигуре 17 показана нейтрализующая активность интактного антитела RX1 или его Fab-фрагмента по сравнению с нейтрализующей активностью интактного антитела 5Н4 или его Fab-фрагмента.
На фигуре 18 показана структура M-CSF с эпитопами (светлыми) для антител RX1, 5Н4 и МС3 (SEQ ID NO: 120, 122 и 123).
На фигуре 19А показаны (а) области риска (Н = высокий риск, М = умеренный риск, L = низкий риск) для тяжелой цепи мышиного RX1; (b) аминокислотная последовательность тяжелой цепи антитела RX1 (SEQ ID NO: 6); (с) аминокислотная последовательность наиболее родственной человеческой консенсусной последовательности, то есть консенсусной последовательности Vh2 Kabat, выровненной с последовательностью RX1 (SEQ ID NO: 39), и (d) замены, которые были сделаны для продуцирования двух репрезентативных последовательностей антитела Human Engineered™ (SEQ ID NO: 41 и 43). На фигуре 19В показаны репрезентативные аминокислотные последовательности двух тяжелых цепей антитела Human Engineered™ (SEQ ID NO: 41 и 43), называемые “областями низкого риска” и “областями низкого + умеренного риска”, а также соответствующие последовательности нуклеиновой кислоты (SEQ ID NO: 40 и 42).
На фигуре 20А показаны (а) области риска (Н = высокий риск, М = умеренный риск, L = низкий риск) для легкой цепи мышиного RX1; (b) аминокислотная последовательность легкой цепи антитела RX1 (SEQ ID NO: 5); (с) аминокислотная последовательность наиболее родственной человеческой консенсусной последовательности, то есть консенсусной последовательности Vk3 Kabat, выровненной с последовательностью RX1 (SEQ ID NO: 49), и (d) замены, которые были сделаны для продуцирования двух репрезентативных последовательностей антитела Human Engineered™ (SEQ ID NO: 45 и 47). На фигуре 20В показаны репрезентативные аминокислотные последовательности двух легких цепей антитела Human Engineered™ (SEQ ID NO: 45 и 47), называемые “областями низкого риска” и “областями низкого + умеренного риска”, а также соответствующие последовательности нуклеиновой кислоты (SEQ ID NO: 44 и 46).
На фигуре 21А показаны (а) области риска (Н = высокий риск, М = умеренный риск, L = низкий риск) для легкой цепи мышиного RX1; (b) аминокислотная последовательность легкой цепи антитела RX1 (SEQ ID NO: 5); (с) аминокислотная последовательность наиболее родственной человеческой консенсусной последовательности, то есть консенсусной последовательности Vk3 Kabat, выровненной с последовательностью RX1 (SEQ ID NO: 49), и (d) альтернативная репрезентативная аминокислотная последовательность, в которой остатки в положениях 54-56 являются немодифицированными (то есть представляют собой остатки мышиной последовательности) (SEQ ID NO: 48). На фигуре 21В представлены репрезентативные аминокислотные последовательности двух альтернативных легких цепей антитела Human Engineered™ (SEQ ID NO: 48 и 136), а также соответствующие последовательности нуклеиновой кислоты (SEQ ID NO: 137 и 135).
На фигуре 22А показаны (а) области риска (Н = высокий риск, М = умеренный риск, L = низкий риск) для легкой цепи мышиного RX1; (b) аминокислотная последовательность легкой цепи антитела RX1 (SEQ ID NO: 5); (с) аминокислотная последовательность наиболее родственной консенсусной последовательности человеческой зародышевой линии, Vk6 подгруппы 2-1-(1) А14, выровненной с последовательностью RX1 (SEQ ID NO: 50), и (d) замены, которые были сделаны для продуцирования двух репрезентативных последовательностей антитела Human Engineered™ (SEQ ID NO: 51 и 53). На фигуре 22В показаны репрезентативные аминокислотные последовательности двух легких цепей антитела Human Engineered™ (SEQ ID NO: 51 и 53), называемые “областями низкого риска” и “областями низкого + умеренного риска”, а также соответствующая последовательность нуклеиновой кислоты (SEQ ID NO: 52).
На фигурах 23А и 23В показано выравнивание аминокислотной последовательности легкой цепи мышиного RX1 (SEQ ID NO: 54) с различными человеческими консенсусными последовательностями и консенсусными последовательностями человеческой зародышевой линии, проводимое в соответствии с системой нумерации по Кэбату (нумерация аминокислот указана в строке, обозначенной “POS”) (SEQ ID NO: 55-82).
На фигурах 24А и 24В показано выравнивание аминокислотной последовательности тяжелой цепи мышиного RX1 (SEQ ID NO: 83) с различными человеческими консенсусными последовательностями и консенсусными последовательностями человеческой зародышевой линии, проводимое в соответствии с системой нумерации по Кэбату (нумерация аминокислот указана в строке, обозначенной “POS”) (SEQ ID NO: 84-112). На фигурах 24С-24Е проиллюстрировано соответствие аминокислотных остатков антител 5Н4, МС1 и МС3 по системе нумерации Кэбата (SEQ ID NO: 10 и 11; SEQ ID NO: 12 и 13; SEQ ID NO: 14 и 15, соответственно).
На фигуре 25 проиллюстрирована сравнительная нейтрализация рекомбинантного человеческого M-CSF рекомбинантным мышиным антителом RX1, обозначенным rmRX1, и тремя вариантами антитела Human Engineered™, RX1-1 (в которых были сделаны все замены низкого риска), каждый из которых имеет различные константные области (IgG1, IgG2 или IgG4), обозначенные heRX1-1.G1, heRX1-1.G2 и heRX1-1.G4.
На фигуре 26 проиллюстрирована сравнительная нейтрализация человеческой сыворотки рекомбинантным мышиным антителом RX1, обозначенным rmRX1, и несколькими различными вариантами heRX1-1 (в которых были сделаны все замены низкого риска), каждый из которых имеет различные константные области (IgG1, IgG2 или IgG4), обозначенные RX2, RX1-1-IgG2, RX1-1-IgG1, RX1-1-IgG1, RX1-1-IgG4, RX1-a-IgG4.
На фигуре 27 проиллюстрирована сравнительная нейтрализация среды MDA231 (клеточной линии рака молочной железы) рекомбинантным мышиным антителом RX1, обозначенным rmRX1, и несколькими различными вариантами heRX1-1 (в которых были сделаны все замены низкого риска), каждый из которых имеет различные константные области (IgG1, IgG2 или IgG4), обозначенные RX2, RX1-1-IgG2, RX1-1-IgG1, RX1-1-IgG1, RX1-1-IgG4, RX1-a-IgG4.
На фигуре 28 проиллюстрировано действие на остеокластогенез (измеряемое по TRAP-активности) рекомбинантного мышиного антитела RX1, обозначенного rmRX1, и двух различных вариантов heRX1-1.G1, каждый из которых имеет различные константные области (IgG1 или IgG2), обозначенные heRX1-1.IgG1 и heRX1-1.IgG2.
На фигуре 29А показана аминокислотная последовательность (SEQ ID NO: 114) и нуклеотидная последовательность (SEQ ID NO: 113) для heRX1-1.IgG1 с аминокислотными модификациями низкого риска. На фигуре 29В показана аминокислотная последовательность (SEQ ID NO: 116) и нуклеотидная последовательность (SEQ ID NO: 115) для heRX1-1.IgG1 с аминокислотными модификациями низкого + умеренного риска.
На фигуре 30 показана аминокислотная последовательность (SEQ ID NO: 119) и нуклеотидная последовательность (кДНК (SEQ ID NO: 118) и геномная ДНК (SEQ ID NO: 117)) для heRX1-1.IgG4 с аминокислотными модификациями низкого риска.
Подробное описание изобретения
Способность к метастазированию является характерной особенностью рака. Метастазами называют распространение раковых клеток на другие участки организма или состояние, вызываемое такими распространением раковых клеток. Образование метастазов представляет собой сложный многостадийный процесс, который включает изменение генетического материала клетки, неконтролируемую пролиферацию модифицированной клетки с образованием первичной опухоли, развитие новой кровеносной системы для кровоснабжения указанной первичной опухоли, инвазию указанной кровеносной системы клетками первичной опухоли, распространение небольших агрегатов клеток первичных опухолей на другие участки организма и рост вторичных опухолей на этих участках.
Кость является одним из самых распространенных участков метастазирования раковых опухолей молочной железы, легких, предстательной железы и щитовидной железы человека, а также других раковых опухолей, и при аутопсии было обнаружено, что почти у 60% пациентов с раком наблюдались метастазы в кости. Образование метастазов, вызывающих остеолиз кости, включает уникальную стадию остеокластной резорбции кости, которая не наблюдается при метастазах в других органах. Разрежение кости, ассоциированное с метастазами рака, опосредуется остеокластами (многоядерными гигантскими клетками, обладающими способностью к резорбции минерализованной ткани), которые, очевидно, активируются опухолевыми продуктами.
Было обнаружено, что колониестимулирующий фактор (CSF-1), также известный как макрофагальный колониестимулирующий фактор (M-CSF), играет решающую роль в образовании остеокластов. Кроме того, было показано, что M-CSF, в кооперации с другими растворимыми факторами, модулирует функции зрелых остеокластов, их миграцию и жизнеспособность, а также межклеточные взаимодействия, опосредуемые остеобластами и фибробластами (Fixe & Praloran, Cytokine 10:3-7, 1998; Martin et al., Critical Rev. in Eukariotic Gene Expression 8:107-23 (1998)).
Полноразмерная мРНК человеческого M-CSF кодирует белок-предшественник, состоящий из 554 аминокислот. В результате альтернативного сплайсинга мРНК и дифференциального посттрансляционного протеолитического процессинга, M-CSF может либо секретироваться в кровоток в виде гликопротеина или протеогликана, содержащего сульфат хондроитина, либо экспрессироваться в виде трансмембранного гликопротеина на поверхности M-CSF-продуцирующих клеток. Трехмерная структура экспрессируемых в бактериях 150 амино-концевых аминокислот человеческого M-CSF, то есть минимальной последовательности, необходимой для обеспечения полной биологической активности in vitro, указывает на то, что этот белок представляет собой дисульфидный димер, каждый мономер которого состоит из четырех альфа-спиральных пучков и антипараллельной бета-складки (Pandit et al., Science 258:1358-62 (1992)). В результате альтернативного сплайсинга мРНК продуцируются три различных вида M-CSF. Такими тремя полипептидными предшественниками являются: M-CSFα, состоящий из 256 аминокислот, M-CSFβ, состоящий из 554 аминокислот, и M-CSFγ, состоящий из 438 аминокислот. M-CSFβ представляет собой секретированный белок, который не встречается в мембраносвязанной форме. M-CSFα экспрессируется в виде интегрального мембранного белка, который медленно высвобождается посредством протеолитического отщепления. M-CSFα отщепляется у аминокислот 191-197 последовательности, представленной на фигуре 10. Мембраносвязанная форма M-CSF может взаимодействовать с рецепторами на соседних клетках, а поэтому она может опосредовать специфические межклеточные контакты. Термин “M-CSF” может также включать аминокислоты 36-436, представленные на фигуре 12.
Различные формы M-CSF действуют путем связывания со своим рецептором M-CSFR на клетках-мишенях. M-CSFR представляет собой трансмембранную молекулу с пятью внеклеточными иммуноглобулино-подобными доменами, трансмембранным доменом и с внутриклеточным прерывающимся Src-родственным тирозинкиназным доменом. M-CSFR кодируется прото-онкогеном с-fms. Связывание M-CSF с внеклеточным доменом M-CSFR приводит к димеризации рецептора и тем самым активирует цитоплазматический киназный домен с последующим аутофосфорилированием и фосфорилированием других клеточных белков (Hamilton J.A. J. Leukoc. Biol., 62(2):145-55 (1997); Hamilton J, A. Immuno Today., 18(7):313-7(1997).
Фосфорилированные клеточные белки индуцируют каскад биохимических событий, приводящих к таким клеточным ответам, как митоз, секреция цитокинов, активное перемещение в мембране и регуляция транскрипции своего собственного рецептора (Fixe & Praloran, Cytokine 10:32-37 (1998)).
M-CSF экспрессируются в стромальных клетках, остеобластах и в других клетках. Он также экспрессируется в опухолевых клетках молочной железы, матки и яичника. Уровень экспрессии в этих опухолях коррелирует с высокой злокачественностью опухоли и плохим прогнозом (Kacinski Ann. Med. 27:79-85 (1995); Smith et al., Clin. Cancer. Res. 1:313-25 (1995)). В карциномах молочной железы экспрессия M-CSF преобладает в инвазивных опухолевых клетках, а не во внутрипротоковых (пре-инвазивных) раковых клетках (Scholl et al., J. Natl. Cancer. Inst. 86:120-6 (1994)). Кроме того, было показано, что M-CSF стимулирует прогрессирование опухолей молочной железы с образованием злокачественных опухолей (Lin et al., J. Exp. Med. 93:727-39 (2001). Что касается рака молочной железы и яичника, то продуцирование M-CSF, очевидно, приводит к рекрутингу макрофагов в опухоль.
Как показано в настоящей заявке, M-CSF-специфическое антитело, такое как антитело RX1, 5Н4, МС1 или МС3, нейтрализует индуцирование остеокластов метастатическими раковыми клетками и/или снижает число метастазов в кость у животных с моделью рака. Так, например, настоящее изобретение относится к композициям и к способам лечения или профилактики рака, метастазов рака и остеопороза, ассоциированного с метастазами рака.
Предпочтительное мышиное анти-M-CSF антитело RX1 было модифицировано так, чтобы оно было менее иммуногенным для человека, методом Studnicka et al. на основе антитела Human Engineered™. В предпочтительном варианте изобретения 8-12 поверхностных аминокислотных остатков вариабельной области тяжелой цепи и 16-19 поверхностных остатков в области легкой цепи были заменены человеческими остатками в положениях, которые, как было определено, по всей вероятности, не оказывают негативного влияния на связывание с антигеном или на укладку белка, но, при этом, снижают его иммуногенность для человека. Были сконструированы синтетические гены, содержащие модифицированные вариабельные области тяжелой и/или легкой цепи, и эти гены были присоединены к константным областям человеческой тяжелой цепи γ и/или легкой цепи каппа. Любые константные области человеческой тяжелой и легкой цепей могут быть использованы в комбинации с вариабельными областями антитела Human Engineered™. Гены человеческих тяжелой и легкой цепей были введены в клетки млекопитающих, после чего были получены и охарактеризованы рекомбинантные продукты иммуноглобулина. Другими репрезентативными анти-M-CSF антителами, такими как 5Н4, МС1 и МС3, также являются антитела Human Engineered™.
Термин “антитело, происходящее от RX1” включает любое из следующих вариантов антител:
1) аминокислотный вариант мышиного антитела RX1, имеющий аминокислотную последовательность, представленную на фигуре 4, включая варианты, содержащие аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, представленной на фигуре 4, и/или содержащие аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, представленной на фигуре 4, с учетом аналогичных аминокислот для определения гомологии;
2) M-CSF-связывающие полипептиды (за исключением мышиного антитела RX1), содержащие одну или несколько гипервариабельных областей (комплементарность-определяющих областей, CDR) мышиного антитела RX1, имеющих аминокислотную последовательность, представленную на фигуре 4, предпочтительно состоящую, по меньшей мере, из CDR3 тяжелой цепи RX1, а более предпочтительно содержащую две или более, либо три или более, либо четыре или более, либо пять или более, либо все шесть CDR;
3) антитела Human Engineered™, имеющие аминокислотные последовательности тяжелой и легкой цепей, представленные на фигурах 19В-22В, или их варианты, имеющие аминокислотные последовательности тяжелой и легкой цепей, где указанные аминокислотные последовательности, по меньшей мере, на 60% идентичны аминокислотной последовательности тяжелой или легкой цепи исходного антитела Human Engineered™, представленной на фигурах 19В-22В, более предпочтительно, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 85%, еще более предпочтительно, по меньшей мере, на 90%, и наиболее предпочтительно, по меньшей мере, на 95%, например, на 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и 100%;
4) M-CSF-связывающие полипептиды (за исключением мышиного антитела RX1), содержащие остатки высокого риска одной или нескольких CDR антител Human Engineered™, представленных на фигурах 19В-22В, а предпочтительно содержащие остатки высокого риска двух или более, либо трех или более, либо четырех или более, либо пяти или более, либо всех шести CDR;
5) Антитела Human Engineered™ или их варианты, сохраняющие аминокислотные остатки высокого риска, представленные на фигуре 4В и содержащие одну или несколько модификаций остатков низкого или умеренного риска, представленных на фигуре 4В;
например, содержащие одну или несколько модификаций в остатках низкого риска и консервативных замен остатков умеренного риска, представленных на фигуре 4В, или,
например, сохраняющие аминокислотные остатки умеренного и высокого риска, представленные на фигуре 4В, и содержащие одну или несколько модификаций в остатках низкого риска,
где указанные модификации включают инсерции, делеции или замены, и могут включать консервативные замены, либо могут приводить к продуцированию рекомбинантного антитела, которое имеет последовательность, наиболее сходную с последовательностью человеческой легкой или тяжелой цепи, с последовательностью легкой цепи или тяжелой цепи человеческой зародышевой линии, с консенсусной последовательностью человеческой легкой цепи или тяжелой цепи, или с консенсусной последовательностью легкой цепи или тяжелой цепи человеческой зародышевой линии; где указанные антитела сохраняют способность связываться с M-CSF.
Указанные антитела предпочтительно связываются с M-CSF с аффинностью, составляющей, по меньшей мере, 10-7, 10-8 или 10-9 или выше, и предпочтительно нейтрализуют остеокластогенез-индуцирующую активность M-CSF.
Аналогично, термин “антитело, происходящее от МС3” включает любое из следующих вариантов антител:
1) аминокислотный вариант мышиного антитела МС3, имеющий аминокислотную последовательность, представленную на фигуре 15, включая варианты, содержащие аминокислотную последовательность вариабельной области тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, представленной на фигуре 15, и/или содержащие аминокислотную последовательность вариабельной области легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, представленной на фигуре 15, с учетом аналогичных аминокислот для определения гомологии;
2) M-CSF-связывающие полипептиды (необязательно включая или исключая мышиное антитело МС3), содержащие одну или несколько гипервариабельных областей (CDR) мышиного антитела МС3, имеющих аминокислотную последовательность, представленную на фигуре 15, предпочтительно состоящую, по меньшей мере, из CDR3 тяжелой цепи МС3, а более предпочтительно содержащую две или более, либо три или более, либо четыре или более, либо пять или более, либо все шесть CDR;
3) антитела Human Engineered™, продуцированные посредством модификации мышиной последовательности методами, описанными в патенте США №5766886, Studnicka et al., и в примере 4 А данной заявки, и пронумерованными в соответствии с нумерацией по Кэбату, как показано на фигурах 24С-24Е, для идентификации остатков низкого, умеренного и высокого риска; где указанные антитела включают, по меньшей мере, одну из нижеследующих тяжелых цепей и, по меньшей мере, одну из нижеследующих легких цепей, а именно: (а) тяжелую цепь, в которой, если это необходимо, все остатки низкого риска были модифицированы так, чтобы эти остатки были идентичны соответствующим остаткам последовательности исходного человеческого иммуноглобулина, или (b) тяжелую цепь, в которой, если это необходимо, все остатки низкого и умеренного риска были модифицированы так, чтобы эти остатки были аналогичны остаткам этой последовательности исходного человеческого иммуноглобулина, (с) легкую цепь, в которой, если это необходимо, все остатки низкого риска были модифицированы так, чтобы эти остатки были идентичны соответствующим остаткам последовательности исходного человеческого иммуноглобулина, или (d) легкую цепь, в которой, если это необходимо, все остатки низкого и умеренного риска были модифицированы так, чтобы эти остатки были идентичны соответствующим остаткам последовательности исходного человеческого иммуноглобулина,
4) варианты антител, упомянутых в предыдущем параграфе (3), содержащие аминокислотные последовательности тяжелой и легкой цепей, которые, по меньшей мере, на 60% идентичны аминокислотной последовательности тяжелой или легкой цепи исходного антитела Human Engineered™, более предпочтительно, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 85%, еще более предпочтительно, по меньшей мере, на 90%, и наиболее предпочтительно, по меньшей мере, на 95%, например, на 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и 100%;
5) M-CSF-связывающие полипептиды (необязательно включая или исключая мышиное антитело МС3), содержащие остатки высокого риска одной или нескольких CDR мышиного антитела МС3, представленного на фигуре 15, а предпочтительно содержащие остатки высокого риска двух или более, либо трех или более, либо четырех или более, либо пяти или более, либо всех шести CDR;
6) антитела Human Engineered™ или их варианты, сохраняющие аминокислотные остатки высокого риска мышиного антитела МС3 и содержащие одну или несколько модификаций остатков низкого или умеренного риска;
например, содержащие одну или несколько модификаций в остатках низкого риска и консервативных замен остатков умеренного риска или,
например, сохраняющие аминокислотные остатки умеренного и высокого риска и содержащие одну или несколько модификаций в остатках низкого риска,
где указанные модификации включают инсерции, делеции или замен и могут включать консервативные замены, либо могут приводить к продуцированию рекомбинантного антитела, которое имеет последовательность, наиболее сходную с последовательностью человеческой легкой или тяжелой цепи, с последовательностью легкой цепи или тяжелой цепи человеческой зародышевой линии, с консенсусной последовательностью человеческой легкой цепи или тяжелой цепи, или с консенсусной последовательностью легкой цепи или тяжелой цепи человеческой зародышевой линии; где указанные антитела сохраняют способность связываться с M-CSF.
Указанные антитела предпочтительно связываются с M-CSF с аффинностью, соответствующей, по меньшей мере, 10-7, 10-8 или 10-9 или выше, и предпочтительно нейтрализуют остеокластогенез-индуцирующую активность M-CSF.
Термины “антитело, происходящее от 5Н4” или “антитело, происходящее от МС1” имеют значения, аналогичные значениям терминов, определенных выше.
Как подробно описано в настоящей заявке, антитела, происходящие от антител RX1, 5Н4, МС1 или МС3, включая антитела Human Engineered™ или их варианты, могут представлять собой антитела различных изотипов, таких как IgG, IgA, IgM или IgE. Антитела класса IgG могут включать различные константные области, например, антитело IgG2 может быть модифицировано так, чтобы оно содержало константную область IgG1 или IgG4. В своих предпочтительных вариантах настоящее изобретение относится к антителам Human Engineered™ или к их вариантам, содержащим модифицированную или немодифицированную константную область IgG1 или IgG4. В случае IgG1, модификации, внесенные в константную область, а в частности в шарнирную область или в СН2-область, могут усиливать или ослаблять эффекторную функцию, включая ADCC- или CDC-активность. В других вариантах изобретения константная область IgG2 модифицирована в целях снижения уровня образования комплекса “антитело-антиген”. В случае IgG4, модификации в константной области, а в частности в шарнирной области, могут приводить к подавлению образования полуантител. В своем конкретном варианте настоящее изобретение относится к продуцированию мутаций в шарнирной последовательности IgG4 Cys-Pro-Ser-Cys с получением шарнирной последовательности Cys-Pro-Pro-Cys, характерной для IgG1.
В настоящей заявке показано, что антитела Human Engineered™, содержащие константные области IgG1 или IgG4, обладают улучшенными свойствами по сравнению с антителами Human Engineered™, содержащими константные области IgG2. Выбор Fc-области IgG1 или IgG4 позволяет повысить аффинность связывания, M-CSF-нейтрализующую активность и активность, направленную против остеокластов. Кроме того, выбор Fc-области IgG1 или IgG4 позволяет получить комплексы антиген-антитело, которые имеют наибольшее сходство с комплексами, образуемыми родительским мышиным антителом.
Таким образом, очевидно, что подвижность шарнирной области заметно влияет на связывание антитела с димерным антигеном M-CSF, а также на нейтрализующую активность антитела. В настоящем изобретении, в общих чертах, предполагается, что получение антител, содержащих тяжелую цепь, включающую модифицированную или немодифицированную константную область IgG1 или IgG4, а в частности шарнирную область и домен СН2, или предпочтительно, по меньшей мере, шарнирные области, позволит повысить аффинность связывания антитела и/или замедлять диссоциацию антитела от димерных антигенов.
Термин “антитело, конкурирующее с RX1” включает:
1) не мышиное моноклональное антитело или моноклональное антитело, не являющееся антителом грызунов, которое связывается с тем же эпитопом M-CSF, что и мышиное RX1, имеющее полноразмерные последовательности легкой и тяжелой цепей, представленные на фигуре 4;
2) не мышиное моноклональное антитело или моноклональное антитело, не являющееся антителом грызунов, которое связывается, по меньшей мере, с 4 смежными аминокислотами 98-105 последовательности M-CSF, представленной на фигуре 12; и
3) не мышиное моноклональное антитело или моноклональное антитело, не являющееся антителом грызунов, которое более чем на 75%, более чем на 80% или более чем на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% или 95% конкурирует с мышиным антителом RX1, имеющим полноразмерную последовательность, представленную на фигуре 4, за связывание с M-CSF. Указанные антитела предпочтительно связываются с M-CSF с аффинностью, равной по меньшей мере 10-7, 10-8 или 10-9 или выше, и предпочтительно нейтрализуют остеокластогенез-индуцирующую активность M-CSF.
Термины “антитело, конкурирующее с МС1” или “антитело, конкурирующее с МС3” или “антитело, конкурирующее с 5Н4” аналогичным образом определяются как антитела, связывающиеся с тем же эпитопом M-CSF, с которым связываются мышиные антитела МС1, МС3 или 5Н4, имеющие полноразмерные последовательности легкой и тяжелой цепей, представленные на фигурах 13, 14 или 15, соответственно, и который имеет аминокислоты 65-73 или 138-144, представленные на фигуре 12 (соответствующие эпитопам M-CSF, распознаваемым антителами 5Н4 или МС3).
Любое химерное, человеческое или гуманизированное антитело против M-CSF, описанное до подачи настоящей заявки, или описанное в заявке, поданной до даты подачи настоящей заявки, исключается, но необязательно, из объема настоящего изобретения.
“Моноклональное антитело, не являющееся антителом грызунов” представляет собой любое антитело, определенное здесь в широком смысле, которое не является полноразмерным интактным моноклональным антителом грызунов, генерированным гибридомой грызунов. Таким образом, более конкретно, антитела, не являющееся антителами грызунов, включают, но не ограничиваются ими, варианты антител грызунов, фрагменты антител грызунов, линейные антитела, химерные антитела, гуманизированные антитела, антитела Human Engineered™ и человеческие антитела, включая человеческие антитела, вырабатываемые у трансгенных животных или продуцируемые методом фагового представления. Аналогичным образом, не-мышиными антителами являются, но не ограничиваются ими, варианты мышиных антител, фрагменты мышиных антител, линейные антитела, химерные антитела, гуманизированные антитела, антитела Human Engineered™ и человеческие антитела.
Используемый здесь термин “опухоль” означает все растущие и пролиферирующиеся неопластические клетки, независимо от того, являются ли они злокачественными или доброкачественными, и все предраковые и раковые клетки и ткани.
Термины “рак” и “раковый” означают или описывают физиологическое состояние млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примерами рака являются, но не ограничиваются ими, карцинома, лимфома, бластома, саркома и лейкоз. Более конкретными примерами такого рака являются рак молочной железы, рак предстательной железы, рак толстой кишки, плоскоклеточный рак, мелкоклеточный рак легких, не мелкоклеточный рак легких, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак ободочной кишки, карцинома эндометрия, карцинома слюнных желез, рак почек, рак печени, рак вульвы, рак щитовидной железы, карцинома печени и рак головы и шеи различных типов.
Термин “лечение” означает вмешательство, осуществляемое в целях предупреждения развития заболевания или воздействия на патологический процесс заболевания. В соответствии с этим термин “лечение” означает терапевтическое лечение и профилактические или превентивные меры. Индивидуумами, которым требуется лечение, являются индивидуумы, уже страдающие данным заболеванием, а также индивидуумы, которые нуждаются в предотвращении такого заболевания. При лечении опухолевого заболевания (например, рака) терапевтическое средство может непосредственно ослаблять патологические процессы опухолевых клеток, или сообщать этим опухолевым клеткам большую восприимчивость к лечению другими терапевтическими средствами, например лучевой терапией и/или химиотерапией. Лечение пациентов, страдающих клиническими, биохимическими, радиологическими или субъективными симптомами заболевания, такого как остеолиз, может включать ослабление некоторых или всех указанных симптомов или снижение предрасположенности к данному заболеванию. Термин “патология” рака включает все процессы, которые негативно влияют на самочувствие пациента. Этот термин включает, но не ограничивается ими, аномальный или неконтролируемый рост клеток, метастазы, негативное влияние на нормальное функционирование соседних клеток, высвобождение цитокинов или других продуктов секреции на аномальных уровнях, подавление или усиление воспалительного или иммунного ответа и т.п. Таким образом, положительная динамика заболевания после лечения может проявляться в уменьшении размера опухоли, снижении скорости роста опухоли, разрушении имеющихся опухолевых клеток или метастатических клеток, и/или в уменьшении размера или числа метастазов.
Термин “млекопитающее”, подвергаемое лечению, означает любое животное, принадлежащее к классу млекопитающих, включая человека, домашних животных и сельскохозяйственных животных, а также животных, живущих в зоопарках, животных, участвующих в спортивных состязаниях, или домашних питомцев, таких как собаки, лошади, кошки, коровы и т.п. При этом предпочтительным млекопитающим является человек.
Используемый здесь термин “метастазирующий рак” означает рак, который может распространяться на другие участки организма, а в частности на кость. Метастазировать в кость может рак различных видов, но наиболее распространенными видами рака, дающими метастазы в кость, являются рак молочной железы, рак легких, рак почек, множественная миелома, рак щитовидной железы и рак предстательной железы. Так, например, другими видами рака, которые могут метастазировать в кость, являются, но не ограничиваются ими, аденокарцинома, злокачественные заболевания клеток крови, включая лейкоз и лимфому; рак головы и шеи; рак желудочно-кишечного тракта, включая рак пищевода, рак желудка, рак толстой кишки, рак тонкой кишки, рак ободочной кишки, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчных протоков или желчного пузыря; злокачественные заболевания женских половых органов, включая карциному яичника, рак эндометрия, рак влагалища и рак шейки матки; рак мочевого пузыря; рак головного мозга, включая нейробластому; саркома, остеосаркома; и рак кожи, включая злокачественную меланому и плоскоклеточный рак. В настоящем изобретении, в частности, рассматривается предупреждение и лечение остеолитических поражений костей, индуцированных опухолью.
Используемый здесь термин “терапевтически эффективное количество” означает терапевтическое или профилактическое количество антитела против M-CSF, подходящее для осуществления настоящего изобретения и вырабатывающее нужный терапевтический или профилактический эффект или ответ при его введении в соответствии с нужной схемой лечения.
Используемый здесь термин “человеческий M-CSF” означает человеческий полипептид, имеющий, по существу, ту же аминокислотную последовательность, что и зрелые человеческие полипептиды M-CSFα, M-CSFβ или M-CSFγ, описанные в публикации Kawasaki et al., Science 230:291 (1985), Cerretti et al., Molecular Immunology, 25:761 (1988) или Ladner et al., EMBO Journal 6:2693 (1987), каждая из которых вводится в настоящее описание посредством ссылки. Такая терминология отражает тот факт, что три зрелых M-CSF имеют различные аминокислотные последовательности, описанные выше, и что активная форма M-CSF представляет собой дисульфидный димер, а поэтому, если термин “M-CSF” относится к биологически активной форме, то под этим подразумевается также и его димерная форма. Термин “димер M-CSF” означает два полипептидных мономера M-CSF, которые являются димеризованными и включают как гомодимеры (состоящие из двух мономеров M-CSF одного и того же типа), так и гетеродимеры (состоящие из двух различных мономеров). Мономеры M-CSF могут быть превращены в димеры M-CSF in vitro, как описано в патенте США №4929700, который вводится в настоящее описание посредством ссылки.
Анти-M-CSF антитела
Настоящее изобретение относится к M-CSF-специфическому антителу, такому как RX1, 5H4, MC1 и/или МС3; к фармацевтическим композициям, включающим M-CSF-специфическое антитело, такое как антитело RX1, 5H4, MC1 и/или МС3; к способам получения указанных фармацевтических композиций и к способам лечения пациентов указанными фармацевтическими композициями и соединениями. Термин “антитело” используется в настоящей заявке в самом широком смысле и включает полноразмерные антитела, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), фрагменты антител, которые могут связываться с антигеном (например, Fab', F(ab')2, Fv, одноцепочечные антитела, диатела) и рекомбинантные пептиды, составляющие вышеуказанные антитела, при условии, что они обладают нужной биологической активностью.
Используемый здесь термин “моноклональное антитело” означает антитело, полученное из популяции, в основном, гомогенных антител, то есть отдельных антител, составляющих такую популяцию, которые являются идентичными, если не учитывать возможные природные мутации, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются в высокой степени специфическими и направлены против одного антигенного сайта. Кроме того, в отличие от стандартных препаратов (поликлональных) антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Моноклональные антитела, помимо своей специфичности, обладают тем преимуществом, что они синтезируются гомогенной культурой, не содержащей других иммуноглобулинов с различными специфичностями и свойствами.
Определение “моноклональный” указывает на тип антитела, полученного, в основном, из гомогенной популяции антител, но при этом подразумевается, что такое антитело необязательно должно быть продуцировано каким-либо конкретным методом. Так, например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature, 256:495 [1975], или они могут быть получены методами рекомбинантных ДНК (см., например, патент США №4816567). “Моноклональные антитела” могут быть также выделены из фаговых библиотек антител методами, описанными, например, в публикации Clackson et al., Nature, 352:624628[1991] и Marks et al., J. Mol. Biol., 222:581-597 (1991).
Иммуноглобулины, в зависимости от аминокислотной последовательности константного домена их тяжелых цепей, могут быть отнесены к различным классам. Существует пять основных классов, IgA, IgD, IgE, IgG и IgM, и несколько из этих классов могут быть дополнительно подразделены на подклассы или изотипы, например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации иммуноглобулинов различных классов хорошо известны специалистам. Иммуноглобулины различных изотипов обладают различными эффекторными функциями, например изотипы IgG1 и IgG3 обладают ADCC-активностью.
“Фрагменты антител” содержат часть интактного полноразмерного антитела, предпочтительно антигенсвязывающую или вариабельную область интактного антитела. Примерами фрагментов антител являются Fab-, Fab'-, F(ab')2- и Fv-фрагменты; диатела; линейные антитела (Zapata et al., Protein Eng., 8(10):1057-1062 (1995)); одноцепочечные молекулы антитела и мультиспецифические антитела, образованные из фрагментов антител. Гидролиз антител папаином приводит к продуцированию двух идентичных антигенсвязывающих фрагментов, называемых “Fab”-фрагментами, каждый из которых имеет один антигенсвязывающий сайт, и остаточного “Fc”-фрагмента, название которого отражает его способность легко кристаллизоваться. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который состоит из двух “одноцепочечных Fv-фрагментов” или “scFv”-фрагментов антитела, содержащих VH- и VL-домены антитела, где указанные домены присутствуют в одной полипептидной цепи. Предпочтительно Fv-полипептид дополнительно содержит полипептидный линкер между VH- и VL-доменами, что приводит к образованию структуры, необходимой для связывания с антигеном. Описание sFv можно найти в публикации Pluckthun in The Pharmacology of Monoclonal Antibodies, vol.113, Rosenburg & Moore eds., Springer-Verlag, New York, pp.269-315 (1994).
Термин “гипервариабельная область” означает аминокислотные остатки антитела, которые ответственны за связывание с антигеном. Гипервариабельные области содержат аминокислотные остатки, происходящие от комплементарность-определяющей области или CDR [то есть остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и остатки 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи, описанные Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)], и/или остатки, происходящие от гипервариабельной петли [то есть остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и остатки 26-32 (Н2), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи, описанные в публикации Chothia et al., J. Mol. Biol. 196:901-917 (1987)].
“Каркасные или FR-остатки” представляют собой остатки вариабельной области, но не являются остатками гипервариабельной области.
Термин “диатела” означает небольшие фрагменты антител с двумя антигенсвязывающими сайтами, где указанные фрагменты содержат вариабельную область тяжелой цепи (VH), соединенную с вариабельной областью легкой цепи (VL) в одной и той же полипептидной цепи (VH VL). Если линкер является слишком коротким для образования пары между двумя доменами на одной и той же цепи, то домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих сайта. Диатела более подробно описаны, например, в ЕР 404097; в WO 93/11161 и в работе Hollinger et al. Proc. Natl. Acad. Sci., USA, 90:6444-6448 (1993).
В некоторых вариантах изобретения может оказаться желательным генерировать мультиспецифические (например, биспецифические) моноклональные антитела, включая моноклональное антитело, человеческое антитело, гуманизированное антитело, антитело Human Engineered™ или варианты анти-M-CSF антител, обладающих специфичностью связывания, по меньшей мере, с двумя различными эпитопами. Репрезентативные биспецифические антитела могут связываться с двумя различными эпитопами M-CSF. Альтернативно, ветвь анти-M-CSF антитела может быть объединена с ветвью, которая связывается со стимулирующей молекулой на лейкоцитах, такой как молекула Т-клеточного рецептора (например, CD2 или CD3), или Fc-рецепторы для IgG (FcγR), такие как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), так, чтобы клеточные защитные механизмы были сфокусированы в клетках, экспрессирующих M-CSF. Биспецифические антитела могут быть также использованы для определения локализации цитотоксических агентов в клетках, экспрессирующих M-CSF. Эти антитела имеют M-CSF-связывающую ветвь и ветвь, которая связывается с цитотоксическим агентом (например, с сапорином, антиинтерфероном 60, винкаалкалоидом, цепью рицина А, метотрексатом или гаптеном, меченным радиоактивным изотопом). Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, F(ab')2-фрагментов биспецифических антител).
В соответствии с другим способом продуцирования биспецифических антител может быть сконструирована граница между парой молекул антитела для максимизации процента гетеродимеров, выделенных из рекомбинантной клеточной культуры. Такая граница предпочтительно содержит, по меньшей мере, часть домена СН3 константной области антитела. В этом способе боковые цепи одной или нескольких небольших аминокислот в пограничной области первой молекулы антитела заменяют боковыми цепями более крупных аминокислот (например, тирозина или триптофана). В пограничной области второй молекулы антитела создают компенсирующие “полости”, имеющие размер, идентичный или аналогичный размеру более крупной(ых) боковой(ых) цепи(ей), путем замены боковых цепей крупных аминокислот боковыми цепями более мелких аминокислот (например, аланина или треонина). Это позволяет увеличить выход гетеродимеров по отношению к другим нежелательным конечным продуктам, таким как гомодимеры. См. заявку WO 96/27011, опубликованную 6 сентября 1996.
Биспецифическими антителами являются перекрестносшитые или “гетероконъюгированные” антитела. Так, например, одно из антител в таком гетероконъюгате может быть присоединено к авидину, а другое к биотину. Гетероконъюгированные антитела могут быть получены любым стандартным методом перекрестного сшивания. Подходящие перекрестносшивающие агенты, а также ряд методов перекрестного сшивания хорошо известны специалистам и описаны в патенте США №4676980.
Методы продуцирования биспецифических антител из фрагментов антител были также описаны в литературе. Так, например, биспецифические антитела могут быть получены путем химического связывания. В работе Brennan et al., Science, 229:81 (1985) описана процедура, в которой интактные антитела подвергают протеолитическому расщеплению с образованием F(ab')2-фрагментов. Эти фрагменты восстанавливают в присутствии агента, образующего дитиоловый комплекс, такого как арсенит натрия, для стабилизации соседних дитиолов и предотвращения образования межмолекулярной дисульфидной связи. Затем полученные Fab'-фрагменты превращают в производные тионитробензоата (TNB). После этого одно из производных Fab'-TNB снова превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB, в результате чего получают биспецифическое антитело. Полученные биспецифические антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов. В еще одном варианте изобретения Fab'-SH-фрагменты, непосредственно выделенные из E.coli, могут быть химически связаны in vitro с образованием биспецифических антител (Shalaby et al., J. Exp. Med. 175:217-225 (1992)).
В публикации Shalaby et al., J. Exp. Med. 175:217-225 (1992) описано продуцирование полностью гуманизированной молекулы F(ab')2 биспецифического антитела. Каждый Fab'-фрагмент был отдельно секретирован из E.coli и подвергнут прямому химическому связыванию in vitro с образованием биспецифического антитела. Полученное таким образом биспецифическое антитело обладает способностью связываться с клетками, сверхэкспрессирующими рецептор HER2, и с нормальными человеческими Т-клетками, а также стимулировать литическую активность человеческих цитотоксических лимфоцитов, направленную против клеток-мишеней опухолей человеческой молочной железы.
Были также описаны различные методы получения и выделения фрагментов биспецифических антител непосредственно из рекомбинантной клеточной культуры. Так, например, биспецифические антитела были продуцированы с использованием “лейциновых молний” (Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)). Пептиды лейциновой молнии, происходящие от белков Fos и Jun, были присоединены к Fab'-частям двух других антител путем лигирования генов. Гомодимеры антитела были восстановлены в шарнирной области с образованием мономеров, а затем снова окислены с образованием гетеродимеров антитела. Этот метод может быть также использован для продуцирования гомодимеров антитела. Технология “диател”, описанная Hollinger et al., Proc. Natl. Acad. Sci., USA, 90:6444-6448 (1993), обеспечивает альтернативный механизм получения фрагментов биспецифического антитела.
Эти фрагменты содержат вариабельную область тяжелой цепи (VH), соединенную с вариабельной областью легкой цепи (VL) посредством линкера, который является слишком коротким для создания пары между двумя доменами одной и той же цепи. В соответствии с этим, VH- и VL-домены одного фрагмента вынуждены спариваться с комплементарными VL- и VH-доменами другого фрагмента, образуя тем самым два антигенсвязывающих сайта. Также была описана другая стратегия получения фрагментов биспецифического антитела с использованием одноцепочечных Fv(sFv)-димеров. См. Gruber et al., J. Immunol., 152:5368 (1994).
Альтернативно, биспецифическим антителом может быть “линейное антитело”, продуцированное, как описано в публикации Zapata et al., Protein Eng., 8(10):1057-1062 (1995). Короче говоря, эти антитела содержат пару тандемных Fd-сегментов (VH-CH1-VH-CH1), которые образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Рассматриваются также антитела с более чем двумя валентностями. Так, например, могут быть получены и триспецифические антитела (Tutt et al., J. Immunol. 147:60 (1991)).
В некоторых вариантах изобретения моноклональное антитело, человеческое антитело, гуманизированное антитело, антитело Human Engineered™ или вариант анти-M-CSF антитела представляют собой фрагмент антитела, такой как фрагмент антитела RX1, 5Н4, МС1 или МС3. Для получения фрагментов антител были разработаны различные методы. Традиционно, эти фрагменты образуются в результате протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты могут продуцироваться непосредственно рекомбинантными клетками-хозяевами. В работе Better et al., Science 240: 1041-1043 (1998) описана секреция функциональных фрагментов антитела бактериями (см., например, Better et al., Skerra et al., Science 240: 1041-1043 (1998)). Так, например, Fab'-SH-фрагменты могут быть непосредственно выделены из E.coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В другом варианте изобретения F(ab')2-фрагменты получают с использованием “лейциновой молнии” GCN4 для стимуляции сборки F(ab')2-молекулы. В соответствии с другим подходом Fv-, Fab- или F(ab')2-фрагменты могут быть непосредственно выделены из культуры рекомбинантной клетки-хозяина. Специалистам известны и другие методы получения фрагментов антител.
“Выделенное” антитело представляет собой антитело, которое было идентифицировано и выделено из компонентов его природного окружения. Контаминирующими компонентами его природного окружения являются вещества, негативно влияющие на диагностическую или терапевтическую эффективность антитела, и такими компонентами могут быть ферменты, гормоны и другие белковые или не белковые растворенные вещества. В предпочтительных вариантах изобретения указанное антитело может быть очищено (1) до степени более чем 95% по массе антитела, как может быть определено методом Лаури, а более предпочтительно более чем на 99% по массе антитела, или (2) до степени, достаточной для введения, по меньшей мере, 15 остатков у N-концевой или внутренней части аминокислотной последовательности, с использованием секвенатора, снабженного центрифужным сосудом, или (3) до гомогенности с помощью электрофореза в ДСН-ПААГ в восстанавливающих или невосстанавливающих условиях с окрашиванием кумасси синим или предпочтительно серебром. Термин “выделенное антитело” включает антитело in situ в рекомбинантных клетках, если отсутствует, по меньшей мере, один природный компонент этого антитела. Однако, обычно, выделенное антитело может быть получено, по меньшей мере, в одной стадии очистки.
Подробное описание структуры и генерирования антител можно найти в публикациях Roth D.B. и Craig N.L., Cell 94:411-414 (1998) и в патенте США №6255458, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Вкратце, процесс генерирования ДНК, кодирующей гены тяжелой и легкой цепей иммуноглобулина, происходит, главным образом, в развивающихся В-клетках. Перед реаранжировкой и присоединением различных сегментов гена иммуноглобулина, сегменты генов областей V, D, J и константной области (С) находятся, в основном, в относительной близости друг от друга на одной хромосоме. В процессе дифференцировки В-клеток, каждый из членов соответствующего семейства генных сегментов V, D, J (или только V и J, в случае генов легкой цепи) подвергается рекомбинации с образованием функционально реаранжированных генов тяжелой и легкой цепей иммуноглобулина. Этот процесс реаранжировки генных сегментов, очевидно, является последовательным. То есть сначала образуются D-J-области тяжелой цепи, а затем образуются V-DJ-области тяжелой цепи и V-J-области легкой цепи.
Рекомбинация генных сегментов вариабельной области с образованием функциональных вариабельных областей тяжелой и легкой цепей опосредуется рекомбинацией сигнальных последовательностей (RSS), которые фланкируют рекомбинантно компетентные сегменты V, D и J. RSS, необходимые и достаточные для прямой рекомбинации, содержат диадо-симметричный гептамер, АТ-богатый нонамер и интронную спейсерную область, состоящую из 12 или из 23 пар нуклеотидов. Эти сигналы являются консервативными среди различных локусов и видов, в которых осуществляется рекомбинация D-J (или V-J), и функционально взаимозаменяемыми. См. Oettinger et al. (1990), Science, 248, 1517-1523 и цитируемые там работы. Этот гептамер содержит последовательность CACAGTG или ее аналог, за которой следует спейсерная область неконсервативной последовательности, а затем нонамер, имеющий последовательность АСАААААСС или ее аналог. Эти последовательности находятся в J-области или в расположенной ниже области каждого генного сегмента V и D. Непосредственно перед D- и J-сегментами зародышевой линии также присутствуют две рекомбинантные сигнальные последовательности, сначала нонамер, а затем снова гептамер, разделенный неконсервативной последовательностью. Гептамерные и нонамерные последовательности, расположенные за VL-, VH- или D-сегментом, комплементарны последовательностям, расположенным перед JL-, D или JH-сегментами, с которыми они рекомбинируют. Спейсеры, расположенные между гептамерными и нонамерными последовательностями, имеют длину либо в 12 пар нуклеотидов, либо в 22-24 пары нуклеотидов.
Помимо реаранжировки V-, D- и J-сегментов другая вариабельность генерируется в первичном репертуаре тяжелой и легкой цепей иммуноглобулина путем вариабельной рекомбинации в положениях, в которых соединены V- и J-сегменты легкой цепи и в которых соединены D- и J-сегменты тяжелой цепи. Такая вариабельность в легкой цепи обычно имеет место в последнем кодоне гена V-сегмента и в первом кодоне J-сегмента. Аналогичное несоответствие в областях стыка наблюдается и на хромосоме тяжелой цепи между D- и JH-сегментами и может распространяться максимум на 10 нуклеотидов. Кроме того, несколько нуклеотидов могут быть встроены между D- и JH-сегментами и между VH- и D-сегментами, которые не кодируются геномной ДНК. Присоединение этих нуклеотидов известно как N-концевая вариабельность.
Суммарный эффект таких реаранжировок в генных сегментах вариабельной области и вариабельной рекомбинации, которая может происходить в процессе такого присоединения, заключается в продуцировании первичного репертуара антител.
“Fv” представляет собой минимальный фрагмент антитела, содержащий полноразмерный антигенраспознающий сайт и антигенсвязывающий сайт. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, жестко связанных друг с другом нековалентной связью. Указанная область имеет такую конфигурацию, при которой три CDR каждого вариабельного домена взаимодействуют друг с другом таким образом, что они образуют антигенсвязывающий сайт на поверхности димера VH-VL. В целом, шесть CDR сообщают антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать антиген и связываться с ним, хотя и с меньшей аффинностью, чем весь сайт связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab-фрагменты отличаются от Fab'-фрагментов тем, что они имеют несколько дополнительных остатков у карбокси-конца СН1-домена тяжелой цепи, включая один или несколько цистеинов, происходящих от шарнирной области антитела. Используемое здесь обозначение Fab'-SH означает Fab', в котором цистеиновый(е) остаток(ки) константных доменов имеет(ют) свободную тиоловую группу. F(ab')2-фрагменты антитела, по своей природе, продуцируются как пары Fab'-фрагментов, между которыми расположены цистеины шарнирной области.
Термин “нейтрализующее антитело” означает молекулу антитела, способную элиминировать или значительно ослаблять эффекторную функцию антигена-мишени, с которым она связывается. В соответствии с этим, “нейтрализующее антитело” против мишени обладает способностью элиминировать или значительно ослаблять эффекторную функцию, такую как: ферментативная активность, связывание с лигандом или передача внутриклеточного сигнала.
Как описано в настоящей заявке, для достижения нужных эффектов, в композициях и способах лечения метастазов рака и/или остеопороза, ассоциированного с метастазами рака, может быть использовано одно или несколько антител, взятых отдельно или в комбинации с другими терапевтическими средствами. Антитела согласно изобретению могут быть выделены у животного, у которого вырабатывается данное антитело в результате либо непосредственного контакта с антигеном окружающей среды, либо иммунизации таким антигеном. Альтернативно, антитела могут быть продуцированы методами рекомбинантных ДНК с использованием одной из систем экспрессии антител, хорошо известных специалистам (см., например, Harlow & Lane Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, (1988)). Такие антитела могут включать рекомбинантные IgG, химерные гибридные белки, имеющие последовательности, происходящие от иммуноглобулина, или антитела Human Engineered™, и все эти антитела могут быть использованы для лечения метастазов рака и/или остеопороза, ассоциированного с метастазами рака согласно изобретению. Термин “антитело”, помимо интактных полноразмерных молекул, также означает их фрагменты (такие как, например, scFv-, Fv-, Fd-, Fab-, Fab'- и F(ab')2-фрагменты) или мультимеры или агрегаты интактных молекул и/или фрагментов, которые связываются с M-CSF (или M-CSFR). Эти фрагменты антител связываются с антигеном и могут быть дериватизированы так, чтобы они обладали структурными признаками, облегчающими их выведение и поглощение, например, путем введения галактозных остатков.
В одном из вариантов настоящего изобретения моноклональные антитела против M-CSF могут быть получены, в основном, как описано в патенте США №5491065 (1997), Halenbeck et al., который вводится в настоящее описание посредством ссылки. Репрезентативными моноклональными антителами против M-CSF являются антитела, которые связываются с кажущимся конформационным эпитопом, ассоциированным с рекомбинантным или нативным димерным M-CSF, и одновременно нейтрализуют его биологическую активность. Эти антитела, по существу, не реагируют с биологически неактивными формами M-CSF, включая мономерный и химически дериватизированный димерный M-CSF.
В других своих вариантах настоящее изобретение относится к моноклональным анти-M-CSF антителам Human Engineered™. Термин “антитело Human Engineered™” означает антитело, происходящее от не человеческого антитела, обычно от мышиного моноклонального антитела. Альтернативно, антитело Human Engineered™ может происходить от химерного антитела, которое сохраняет или, по существу, сохраняет антигенсвязывающие свойства родительского не человеческого антитела, но которое, при его введении человеку, обладает меньшей иммуногенностью по сравнению с указанным родительским антителом. Используемый здесь термин “химерное антитело” означает антитело, содержащее последовательность, полученную от двух различных антител (см., например, патент США №4816567), которые обычно происходят от различных видов. Чаще всего, химерные антитела содержат фрагменты человеческих и мышиных антител, а обычно, константные области человеческого антитела и вариабельные области мышиного антитела.
Термин “комплементарность-определяющая область” или термин “CDR” означает аминокислотные последовательности, которые, взятые вместе, определяют аффинность связывания и специфичность природной Fv-области сайта связывания нативного иммуноглобулина (см., например, Chothia et al., J. Mol. Biol. 196:901-917 (1987); Kabat et al., U.S. Dept. of Health and Human Services NIH Publication No. 91 3242 (1991)). Термин “константная область” означает часть молекулы антитела, которая сообщает эффекторные функции. В настоящем изобретении константные области мышиного антитела предпочтительно заменены константными областями человеческого антитела. Константные области рассматриваемых антител происходят от человеческих иммуноглобулинов. Константная область тяжелой цепи может быть выбрана из пяти изотипов: альфа, дельта, эпсилон, гамма или мю.
Антитела согласно изобретению считаются иммуноспецифическими или специфически связывающимися антителами, если они связываются с антигеном с Ка, превышающим или составляющим примерно 106 М-1, предпочтительно превышающим или составляющим примерно 107 М-1, более предпочтительно превышающим или составляющим примерно 108 М-1, а наиболее предпочтительно превышающим или составляющим примерно 109 М-1, 1010 М-1, 1011 М-1 или 1012 М-1. Анти-M-CSF антитела могут связываться с различными природными формами M-CSF, включая формы, экспрессируемые тканями хозяина/индивидуума, а также формы, экспрессируемые опухолью. Описанные здесь моноклональные антитела, такие как антитела RX1, 5Н4, МС1 или МС3, обладают аффинностью по отношению к M-CSF и характеризуются константой равновесной диссоциации (Kd), составляющей, по меньшей мере, 10-4 М, предпочтительно, по меньшей мере, примерно 10-7 М - 10-8 М, а более предпочтительно, по меньшей мере, примерно 10-8 М, 10-10 М, 10-11 М, 10-12 М. Такая аффинность может быть легко определена стандартными методами, такими как равновесный диализ, анализ с использованием устройства BIAcore 2000 в соответствии с общими процедурами, описанными производителем; радиоиммуноанализ с использованием125I-меченного M-CSF, или другим методом, известным специалистам. Данные аффинности могут быть проанализированы, например, методом Scatchard et al., Ann. N.Y. Acad. Sci., 51:660 (1949). Таким образом, очевидно, что предпочтительные антитела против M-CSF будут обладать высокой степенью специфичности к M-CSF и будут связываться с другими молекулами, в основном, с более низкой аффинностью. Предпочтительные антитела связываются с M-CSF с аффинностью, аналогичной аффинности связывания мышиного RX1, представленного на фигуре 4, с M-CSF, обладают низкой иммуногенностью и ингибируют метастазы раковых клеток, как было определено при тестировании животных с моделью метастазирующего заболевания. Другие репрезентативные антитела связываются с M-CSF с аффинностью, аналогичной аффинности связывания с M-CSF мышиных антител 5Н4, МС1 или МС3, представленных на фигурах 13, 14 или 15 соответственно.
Антиген, используемый для продуцирования антител, может представлять собой, например, интактный M-CSF или фрагмент M-CSF, который сохраняет нужный эпитоп и который необязательно присоединен к другому полипептиду, что позволяет отображать данный эпитоп в его нативной конформации. Альтернативно, клетки, экспрессирующие M-CSF на своей поверхности, могут быть использованы для продуцирования антител. Эти клетки могут быть трансформированы так, чтобы они экспрессировали M-CSF, либо могут быть использованы другие природные клетки, экспрессирующие M-CSF. Другие формы M-CSF, подходящие для генерирования антител, известны специалистам в данной области.
Поликлональные антитела
Поликлональные антитела предпочтительно вырабатываются у животных после многократных подкожных (s.c.) или внутрибрюшинных (i.p.) инъекций соответствующего антигена и адъюванта. Усиленный гуморальный ответ может быть достигнут путем конъюгирования соответствующего антигена с белком, который является иммуногенным для видов, подвергаемых иммунизации, например с гемоцианином лимфы улитки, сывороточным альбумином, бычьим тироглобулином или соевым ингибитором трипсина с использованием бифункционального или дериватизирующего агента, например малеимидобензоилсульфосукцинимидоэфира (конъюгированного посредством цистеиновых остатков), N-гидроксисукцинимида (посредством лизиновых остатков), глутаральдегида, ангидрида янтарной кислоты или других известных агентов.
Животных иммунизируют антигеном, иммуногенными конъюгатами или дериватами путем объединения, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и путем подкожной инъекции раствора в несколько участков. Через месяц животных повторно иммунизируют во множество участков путем подкожной инъекции фракции 1/5-1/10 от первоначального количества пептида или конъюгата в полном адъюванте Фрейнда. Через 7-14 дней после повторной инъекции у животных берут кровь и анализируют сыворотку на титр антител. Затем животных повторно иммунизируют до достижения плато титра. Повторную иммунизацию животных предпочтительно осуществляют путем инъекции конъюгата того же самого антигена, но конъюгированного с другим белком, и/или посредством другого перекрестносшивающего реагента. Конъюгаты могут быть также получены в рекомбинантной клеточной культуре в виде гибридных белков. Кроме того, для усиления иммунного ответа могут быть также использованы агрегирующие агенты, такие как квасцы.
Моноклональные антитела
Моноклональные антитела могут быть получены с применением гибридомной технологии, впервые описанной Kohler et al. Nature, 256:495 (1975), либо они могут быть получены методами рекомбинантных ДНК.
В методе получения гибридом мышь или другое подходящее животное-хозяин, такое как хомячок или макак, иммунизируют, как описано выше, для вырабатывания у них лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающиеся с белком, используемым для иммунизации. Альтернативно, лимфоциты могут быть иммунизованы in vitro. Затем лимфоциты подвергают слиянию с миеломными клетками с использованием подходящего агента для слияния, такого как полиэтиленгликоль, в результате чего образуются гибридомные клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и культивируют в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание не слитых родительских миеломных клеток. Так, например, если родительские миеломные клетки не содержат фермента гипоксантин-гуанин-фосфорибозилтрансферазы (HGPRT или HPRT), то культуральная среда для получения гибридом обычно включает гипоксантин, аминоптерин и тимидин (среда НАТ), то есть вещества, предупреждающие рост HGPRT-дефицитных клеток.
Предпочтительными миеломными клетками являются клетки, которые способны подвергаться эффективному слиянию, поддерживать стабильное продуцирование высоких уровней антител выбранными антитело-продуцирующими клетками и являются чувствительными к среде. Для продуцирования человеческих моноклональных антител также используются человеческие миеломные клеточные линии и гетеромиеломные клеточные линии “мышь-человек” (Kozbor J. Immunol., 133:3001 (1984) & Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)). Примерами мышиных миеломных линий являются линии, происходящие от клеток мышиных опухолей МОР-21 и М.С.-11, имеющихся в институте Salk Institute Cell Distribution Center, San Diego, California USA, и клеток SP-2 или Х63-Ag8-653, депонированных в Американской коллекции типовых культур, Rockville, Md. USA.
Культуральную среду для роста гибридомных клеток анализируют на продуцирование моноклональных антител против данного антигена. Специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют предпочтительно путем иммунопреципитации или путем проведения in vitro анализа на связывание, такого как радиоиммуноанализ (РИА) или твердофазный иммунноферментный анализ (ELISA). Аффинность связывания моноклонального антитела может быть, например, определена с помощью анализа Скэтчарда (Munson et al., Anal. Biochem., 107:220 (1980)).
После идентификации гибридомных клеток, которые продуцируют антитела с нужной специфичностью, аффинностью и/или активностью, данные клоны могут быть субклонированы с помощью процедур лимитирующего разведения и культивированы стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящей культуральной средой, предназначенной для достижения данной цели, является, например, среда D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут быть культивирования in vivo в качестве асцитных опухолей у животных. Моноклональные антитела, секретированные субклонами, соответствующим образом выделяют из культуральной среды, асцитной жидкости или сыворотки путем проведения стандартных процедур очистки иммуноглобулинов, таких как, например, хроматография на белке А - сефарозе, хроматография на гидроксиапатитах, гель-электрофорез, диализ или аффинная хроматография.
Продуцирование рекомбинантных антител
ДНК, кодирующая моноклональные антитела, может быть выделена и секвенирована из гибридомных клеток в соответствии со стандартными процедурами (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Для определения последовательности обычно необходимо выделение, по меньшей мере, части нужного гена или кДНК. Обычно для этого требуется клонирование ДНК или предпочтительно мРНК (то есть кДНК), кодирующей моноклональные антитела. Клонирование осуществляют стандартными методами (см., например, руководство Sambrook et al., (1989) Molecular Cloning: A Laboratory Guide, Vols 1-3, Cold Spring Harbor Press, которое вводится в настоящее описание посредством ссылки). Так, например, библиотека кДНК может быть сконструирована путем обратной транскрипции polyA + мРНК, а предпочтительно мембраносвязанной мРНК, и эта библиотека может быть скринирована с использованием зондов, специфичных к последовательностям генов полипептидов человеческого иммуноглобулина. Однако, в предпочтительном варианте изобретения, для амплификации кДНК (или частей полноразмерных кДНК), кодирующих представляющий интерес сегмент гена иммуноглобулина (например, сегмент вариабельной области легкой цепи), используется полимеразная цепная реакция (ПЦР). Амплифицированные последовательности могут быть легко клонированы в любой подходящий вектор, например экспрессионные векторы, минигенные векторы или векторы фагового представления. Следует отметить, что конкретный метод клонирования не имеет решающего значения, если может быть определена последовательность какой-либо части представляющего интерес полипептида иммуноглобулина. Используемый здесь термин “выделенная молекула нуклеиновой кислоты” или “выделенная последовательность нуклеиновой кислоты” означает молекулу нуклеиновой кислоты, которая либо (1) идентифицирована и отделена, по меньшей мере, от одной примесной молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике нуклеиновой кислоты, либо (2) клонирована, амплифицирована, помечена, или как-либо иначе идентифицирована от фоновых нуклеиновых кислот, так, чтобы можно было определить последовательность представляющей интерес нуклеиновой кислоты. Выделенная молекула нуклеиновой кислоты имеет форму или окружение, в которых она не встречается в природе. Поэтому выделенные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, присутствующей в природных клетках. Однако выделенная молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, присутствующую в клетках, которые обычно экспрессируют указанное антитело, где, например, указанная молекула нуклеиновой кислоты находится в хромосоме в положении, отличающемся от положения, в котором она присутствует в природных клетках.
Одним из источников РНК, используемой для клонирования и секвенирования, является гибридома, продуцированная путем выделения В-клеток из трансгенных мышей и слияния этих В-клеток с иммортализованными клетками. Преимущество использования гибридом заключается в том, что они могут быть легко скринированы, в результате чего может быть выбрана гибридома, продуцирующая представляющее интерес человеческое моноклональное антитело. Альтернативно, РНК может быть выделена из В-клеток (или целой селезенки) иммунизованного животного. Если используемыми источниками не являются гибридомы, то может оказаться желательным проведение скрининга на последовательности, кодирующие иммуноглобулины или полипептиды иммуноглобулинов, обладающих способностью к специфическому связыванию. Одним из методов такого скрининга является применение техники фагового представления. Фаговое представление описано, например, в публикациях Dower et al., WO 91/17271, McCafferty et al., WO 92/01407 и Caton & Koprowski, Proc. Natl. Acad. Sci., USA, 87:6450-6454 (1990), которые вводятся в настоящее описание посредством ссылки. В одном из вариантов изобретения, в котором применяется метод фагового представления, у иммунизованной трансгенной мыши выделяют кДНК (например, полноразмерную кДНК селезенки) и проводят полимеразную цепную реакцию для амплификации кДНК-последовательностей, кодирующих часть полипептида иммуноглобулина, например области CDR, а затем амплифицированные последовательности встраивают в фаговый вектор. кДНК, кодирующие представляющие интерес пептиды, например пептиды вариабельных областей с нужными свойствами связывания, идентифицируют стандартными методами, такими как “пэннинг”.
Затем определяют последовательность амплифицированной или клонированной нуклеиновой кислоты. Обычно определяют последовательность, кодирующую полноразмерную вариабельную область полипептида иммуноглобулина, однако иногда достаточно секвенировать только часть вариабельной области, например CDR-кодирующую часть. Обычно, секвенированная часть имеет длину, по меньшей мере, в 30 нуклеотидов, но чаще всего секвенируют последовательность, кодирующую, по меньшей мере, примерно одну треть или, по меньшей мере, половину вариабельной области.
Секвенирование может быть осуществлено на клонах, выделенных из библиотеки кДНК, или, при проведении ПЦР, оно может быть осуществлено после субклонирования амплифицированной последовательности или путем прямого ПЦР-секвенирования указанного амплифицированного сегмента. Секвенирование осуществляют стандартными методами (см., например, руководство Sambrook et al., (1989) Molecular Cloning: A Laboratory Guide, Vols 1-3, Cold Spring Harbor Press, и Sanger F. et al. (1977) Proc. Natl. Acad. Sci., USA, 74:5463-5467, которое вводится в настоящее описание посредством ссылки). Путем сравнения последовательности клонированной нуклеиновой кислоты с известными последовательностями генов и кДНК человеческого иммуноглобулина специалист в данной области может легко определить, в зависимости от секвенируемой области, (i) встречаемость данных сегментов полипептида иммуноглобулина гибридомной зародышевой линии (включая изотип тяжелой цепи) и (ii) последовательность вариабельных областей тяжелой и легкой цепей, включая последовательности, образованные в результате присоединения N-концевой области и процесса соматической мутации. Одним из источников получения информации о последовательностях генов иммуноглобулина является National Center for Biotechnology Information, National Library of Medicine, National Institutes of Health, Bethesda, Md.
После выделения эта ДНК может быть встроена в экспрессионные векторы, которые затем трансфецируют в клетки-хозяева, такие как клетки E.coli, обезьяньи клетки COS, клетки почек человеческого эмбриона 293 (например, клетки 293Е), клетки яичника китайского хомячка (СНО) или миеломные клетки, которые продуцируют только белок иммуноглобулина, в результате чего в этих рекомбинантных клетках-хозяевах синтезируются моноклональные антитела. Продуцирование рекомбинантных антител хорошо известно специалистам.
Последовательности регуляции экспрессии представляют собой ДНК-последовательности, необходимые для экспрессии функционально присоединенной кодирующей последовательности в данном организме-хозяине. Регуляторными последовательностями, подходящими для прокариотов, являются, например, промоторная и, необязательно, операторная последовательность; и сайт связывания с рибосомой. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является “функционально присоединенной”, если она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Так, например, ДНК, кодирующая препоследовательность или секреторную лидерную последовательность, функционально присоединена к ДНК, кодирующей полипептид, если он экспрессируется в форме белка-предшественника, который участвует в секреции полипептида; либо промотор или энхансер функционально присоединен к кодирующей последовательности, если он влияет на транскрипцию последовательности; либо сайт связывания с рибосомой функционально присоединен к кодирующей последовательности, если положение этого сайта облегчает трансляцию. В общих чертах, термин “функционально присоединенный” означает, что связанные ДНК-последовательности являются смежными, а в случае секреторной лидерной последовательности они являются смежными и находятся в одной и той же рамке считывания. Однако энхансеры необязательно должны быть смежными с присоединяемой последовательностью. Присоединение может быть осуществлено путем лигирования в подходящих рестрикционных сайтах. Если такие сайты отсутствуют, то в соответствии со стандартной практикой могут быть использованы синтетические олигонуклеотидные адаптеры или линкеры.
Используемые здесь термины “клетка”, “клеточная линия” и “клеточная культура” являются взаимозаменяемыми, и все они включают потомство этих клеток. Так, например, термины “трансформанты” и “трансформированные клетки” включают первичные клетки индивидуума и происходящие от них культуры независимо от числа пересевов. Следует отметить, что все потомство не может быть абсолютно идентичным по составу ДНК, что обусловлено искусственно введенными или самопроизвольными мутациями. Эти термины также включают мутантное потомство, которое имеет такую же функцию или биологическую активность, которая была установлена при скрининге исходной трансформированной клетки. Более точное определение этих терминов будет понятно из контекста нижеследующего описания.
В альтернативном варианте аминокислотная последовательность представляющего интерес иммуноглобулина может быть определена путем прямого секвенирования белка. Подходящие кодирующие нуклеотидные последовательности могут быть сконструированы в соответствии с таблицей универсальных кодонов.
Варианты аминокислотной последовательности нужного антитела могут быть получены путем введения соответствующих нуклеотидных модификаций в кодирующую ДНК или путем пептидного синтеза. Такими вариантами являются, например, делеции и/или инсерции и/или замены остатков в аминокислотных последовательностях антител. Для получения конечной конструкции может быть использована любая комбинация делеций, инсерций и замен, при условии, что такая конечная конструкция будет обладать нужными свойствами. Аминокислотные модификации могут также приводить к изменению посттрансляционных процессов в моноклональном антителе, человеческом антителе, гуманизированном антителе, антителе Human Engineered™ или его варианта, например к изменению числа или положений сайтов гликозилирования.
Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотной последовательности данного антитела, получают различными методами, известными специалистам. Такими методами являются, но не ограничиваются ими, выделение из природного источника (в случае природных вариантов аминокислотной последовательности) или проведение олигонуклеотид-опосредуемого (или сайт-направленного) мутагенеза, ПЦР-мутагенеза и кластерного мутагенеза ранее полученного варианта или немодифицированного варианта антитела.
Настоящее изобретение также относится к выделенной нуклеиновой кислоте, кодирующей антитело согласно изобретению и функционально присоединенной к регуляторным последовательностям, распознаваемым клеткой-хозяином; к векторами и клеткам-хозяевам, содержащим указанные нуклеиновой кислоты; и к способам рекомбинантного продуцирования антител, которые могут включать культивирование клетки-хозяина для экспрессии нуклеиновой кислоты и, необязательно, выделение указанного антитела из культуры или культуральной среды клетки-хозяина.
Для продуцирования рекомбинантного антитела нуклеиновую кислоту, кодирующую такое антитело, выделяют и встраивают в реплицирующийся вектор для последующего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующая моноклональное антитело, может быть легко выделена и секвенирована стандартными методами (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи данного антитела). Существует множество доступных векторов. Компонентами таких векторов обычно являются, но не ограничиваются ими, один или несколько из таких компонентов, как: сигнальная последовательность, ориджин репликации, один или несколько селективных маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(1) Компонент - сигнальная последовательность
Антитело согласно изобретению может быть рекомбинантно продуцировано не только прямым методом, но также и в форме гибрида данного полипептида с гетерологичным полипептидом, который предпочтительно представляет собой сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления у N-конца зрелого белка или полипептида. Выбранной сигнальной последовательностью предпочтительно является последовательность, которая распознается и процессируется (то есть отщепляется сигнальной пептидазой) в клетке-хозяине. Если прокариотические клетки-хозяева не распознают и не процессируют сигнальную последовательность нативного антитела, то такая сигнальная последовательность может быть заменена сигнальной последовательностью, выбранной, например, из группы, состоящей из лидерных последовательностей пектат-лиазы (например, pelB), щелочной фосфатазы, пенициллиназы, lpp, или термостабильного эндотоксина II. Для секреции в дрожжах нативная сигнальная последовательность может быть заменена, например, лидерной последовательностью инвертазы дрожжей, лидерной последовательностью α-фактора (включая лидерные последовательности α-фактора Saccharomyces и Kluyveromyces), или лидерной последовательностью кислой фосфатазы, лидерной последовательностью глюкоамилазы C. albicans или сигнальной последовательностью, описанной в WO 90/13646. Для экспрессии в клетках млекопитающих используются сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например сигнальная последовательность gD вируса простого герпеса.
ДНК для такой области предшественника лигируют с антитело-кодирующей ДНК с сохранением рамки считывания.
(2) Компонент - ориджин репликации
Экспрессионные и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая способствует репликации данного вектора в одной или нескольких выбранных клетках-хозяевах. Обычно, в клонирующих векторах, такой последовательностью является последовательность, которая позволяет данному вектору реплицироваться независимо от ДНК хромосомы хозяина и которая включает ориджины репликации или автономно реплицирующиеся последовательности. Такие последовательности для различных бактерий, дрожжей и вирусов хорошо известны. Ориджин репликации, происходящий от плазмиды pBR322, является подходящим для большинства грамотрицательных бактерий, а именно ориджин плазмиды 2 µ является подходящим для дрожжей, а различные вирусные ориджины могут быть использованы для клонирования векторов в клетках млекопитающих. Обычно, ориджин репликации не является необходимым для векторов, экспрессирующихся в клетках млекопитающих (ориджин SV40 обычно используется в тех случаях, когда он содержит ранний промотор).
(3) Компонент - селективный маркер
Экспрессионный и клонирующий векторы могут содержать селективный ген, также называемый селективным маркером. Обычно, селективные гены кодируют белки, которые (а) сообщают резистентность к антибиотикам или к другим токсинам, например к ампициллину, неомицину, метотрексату, тетрациклину, G418, генетицину, гистидину или микофеноловой кислоте, (b) комплементируют дефицит, обусловленный ауксотрофией, и (с) обеспечивают поступление важных питательных веществ, которые не поступают из комплексных сред, например ген, кодирующий D-аланин-рацемазу Bacillus.
Одним из примеров схемы отбора является использование лекарственного средства, прекращающего рост клетки-хозяина. Клетки, которые были успешно трансформированы гетерологичным геном, продуцируют белок, сообщающий резистентность к лекарственному средству и, тем самым, способствующий выживанию этих клеток в селективной среде. Для такого доминантного отбора могут быть использованы, например, такие лекарственные средства, как метотрексат, неомицин, гистидин, пуромицин, микофеноловая кислота и гигромицин.
Другими примерами подходящих селективных маркеров для клеток млекопитающих являются маркеры, которые позволяют идентифицировать клетки, способные встраивать в свой геном антитело-кодирующую нуклеиновую кислоту, например такие маркеры, как DHFR, тимидинкиназа, металлотионеин-I и II, а предпочтительно гены, кодирующие металлотионеин приматов, аденозин-дезаминазу, орнитин-декарбоксилазу и т.п.
Так, например, клетки, трансформированные селективным геном DHFR, сначала идентифицируют путем культивирования всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. При использовании DHFR дикого типа подходящей клеткой-хозяином является клеточная линия яичника китайского хомячка (СНО), дефицитная по DHFR-активности.
Альтернативно, клетки-хозяева (в частности, хозяева дикого типа, содержащие эндогенный DHFR), трансформированные или ко-трансформированные ДНК-последовательностями, кодирующими антитело согласно изобретению, белок DHFR дикого типа и другой селективный маркер, такой как аминогликозид-3'-фосфотрансфераза (АРН), могут быть отобраны путем культивирования клеток в среде, содержащей агент для отбора, проводимого с использованием селективного маркера, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418. См. патент США №4965199.
Подходящим селективным геном для использования в дрожжах является ген trp1, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282:39 (1979)). Ген trp1 представляет собой селективный маркер для мутантного штамма дрожжей, который не способен расти в присутствии триптофана, например штамма, депонированного в ATCC №44076 или РЕР4-1. Jones, Genetics, 85:12 (1977). Присутствие мутации в гене trp1 в геноме дрожжевой клетки-хозяина позволяет эффективно осуществлять детекцию трансформации путем культивирования в отсутствии триптофана. Аналогичным образом, Leu2-дефицитные дрожжевые штаммы (ATCC 20622 или 38626) комплементировали известными плазмидами, несущими ген Leu2. Ura3-дефицитные дрожжевые штаммы комплементировали плазмидами, несущими ген ura3.
Кроме того, векторы, происходящие от кольцевой 1,6 мкм-плазмиды pKD1, могут быть использованы для трансформации дрожжей Kluyveromyces. Альтернативно, экспрессионная система для крупномасштабного продуцирования рекомбинантного телячьего химозина была описана для K.lactis. Van den Berg, Bio/Technology, 8:135 (1990). Были также описаны стабильные многокопийные экспрессионные векторы для секреции зрелого рекомбинантного человеческого сывороточного альбумина промышленными штаммами Kluyveromyces. Fleer et al., Bio/Technology, 9:968-975 (1991).
(4) Компонент - промотор
Экспрессионные и клонирующие векторы обычно содержат промотор, распознаваемый организмом-хозяином и функционально присоединенный к антитело-кодирующей нуклеиновой кислоте. Промоторами, подходящими для использования в прокариотических хозяевах, являются промотор арабинозы (например, araB), промотор phoA, промоторные системы β-лактамазы и лактозы, промоторные системы щелочных фосфатаз и триптофана (trp), и гибридные промоторы, такие как промотор tac. Однако подходящими также являются и другие известные бактериальные промоторы. Промоторы, используемые в бактериальных системах, также содержат последовательность Шайна-Дальгарно (S.D.), функционально присоединенную к ДНК, кодирующей антитело согласно изобретению.
Промоторные последовательности, подходящие для эукариотов, известны специалистам. Фактически, все гены эукариотов имеют АТ-богатую область, локализованную приблизительно в области, расположенной на 25-30 нуклеотидов выше от сайта инициации транскрипции. Другой такой последовательностью, локализованной приблизительно в области, расположенной на 70-80 нуклеотидов выше от сайта инициации транскрипции многих генов, является область CNCAAT, где N может означать любой нуклеотид. У 3'-конца большинства эукариотических генов расположена последовательность ААТААА, которая может служить сигналом для присоединения poly A-хвоста к 3'-концу кодирующей последовательности. Все указанные последовательности могут быть соответствующим образом встроены в эукариотические экспрессионные векторы.
Примерами промоторных последовательностей, подходящих для использования в дрожжевых клетках-хозяевах, являются промоторы 3-фосфоглицерат-киназы или других гликолитических ферментов, таких как энолаза, глицеральдегид-3-фосфат-дегидрогеназа, гексокиназа, пируват-декарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфат-изомераза, 3-фосфоглицерат-мутаза, пируваткиназа, тритиофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другими дрожжевыми промоторами, которые представляют собой индуцибельные промоторы, имеющие дополнительное преимущество, заключающееся в их способности регулировать транскрипцию в определенных условиях культивирования, являются промоторные области генов алкоголь-дегидрогеназы 2, изоцитохрома С, кислой фосфатазы, гидролитических ферментов, ассоциированных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфат-дегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Векторы и промоторы, подходящие для экспрессии в дрожжах, также описаны в ЕР 73657. Наряду с дрожжевыми промоторами также преимущественно используются дрожжевые энхансеры.
Транскрипция антител из векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов таких вирусов, как вирус лейкоза Абельсона, полиомавирус, вирус оспы домашней птицы, аденовирус (такой как аденовирус 2), вирус коровьей папиломы, вирус саркомы птиц, а наиболее предпочтительно цитомегаловирус, ретровирус, вирус гепатита В, обезьяний вирус 40 (SV40); гетерологичными промоторами млекопитающих, например промотором актина или промотором иммуноглобулина; и промоторами белков теплового шока, при условии, что такие промоторы являются совместимыми с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 обычно получают в виде рестрикционного фрагмента SV40, который также содержит ориджин репликации вируса SV40. Предранний промотор человеческого цитомегаловируса обычно получают в виде рестрикционного HindIII-фрагмента Е. Система экспрессии ДНК в клетках-хозяевах млекопитающих, полученная на основе коровьего папиломавируса, используемого в качестве вектора, описана в патенте США №4419446. Модификация этой системы для экспрессии кДНК человеческого β-интерферона в мышиных клетках под контролем промотора тимидинкиназы вируса простого герпеса описана в патенте США №4601878. См. также Reyes et al., Nature 297:598-601 (1982). Альтернативно, в качестве промотора может быть использован вирус саркомы Рауса, имеющий длинный концевой повтор.
(5) Компонент - энхансерный элемент
Транскрипция ДНК, кодирующей антитело согласно изобретению в высших эукариотах, часто усиливается при встраивании в вектор энхансерной последовательности. В настоящее время известно много энхансерных последовательностей, происходящих от генов млекопитающих (генов глобина, эластазы, альбумина, альфа-фетопротеина и инсулина). Однако обычно используется энхансер от вируса эукариотической клетки. Примерами является энхансер вируса SV40, локализованный в поздней области ориджина репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомавируса, локализованный в поздней области ориджина репликации, и энхансеры адновируса. См. также публикацию Yaniv, Nature 297:17-18 (1982), в которой описаны энхансерные элементы для активации эукариотических промоторов. Энхансер может быть встроен в вектор в 5'- или 3'-положеннии по отношению к антитело-кодирующей последовательности, но предпочтительно, чтобы он находился в 5'-положении от промотора.
(6) Компонент - сайт терминации транскрипции
Экспрессионные векторы, используемые в эукариотических клетках-хозяевах (в дрожжах, грибах, насекомых, растений, животных, человека или в ядросодержащих клетках, происходящих от других многоклеточных организмов), также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно расположены со стороны 5'-конца, а иногда, 3'-конца от нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибированные в виде полиаденилированных фрагментов в нетранслированной части мРНК, кодирующей антитело. Одним из подходящих компонентов терминации транскрипции является область полиаденилирования коровьего гормона роста. См. описание экспрессионных векторов в WO 94/11026 и в настоящей заявке. Другим компонентом терминации транскрипции является терминатор транскрипции легкой цепи мышиного иммуноглобулина.
(7) Отбор и трансформация клеток-хозяев
Клетками-хозяевами, подходящими для клонирования или экспрессии ДНК в описанных здесь векторах, являются клетки прокариотов, дрожжей или высших эукариотов, описанные выше. Прокариотами, подходящими для этой цели, являются eubacteria, такие как грамотрицательные или грамположительные микроорганизмы, например Enterobacteriaceae, такие как Escherichia, например E.coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans и Shigella, а также Bacillus, такие как B.subtilis и B.licheniformis (например, B.licheniformis 41Р, описанные в патенте DD 266710, опубликованном 12 апреля 1989), Pseudomonas, такие как P.aeruginosa и Streptomyces. Предпочтительным клонирующим хозяином E.coli является E.coli 294 (АТСС 31446), хотя могут быть использованы и другие штаммы, такие как E.coli В, E.coli Х1776 (АТСС 31537) и E.coli W3110 (АТСС 27325). Эти примеры приводятся лишь для иллюстрации и не ограничивают объема изобретения.
Помимо прокариотов подходящими хозяевами для клонирования или экспрессии антитело-кодирующих векторов являются эукариотические микробы, такие как гифомицеты или дрожжи. Из низших эукариотических микроорганизмов-хозяев наиболее часто используются Saccharomyces cerevisiae или стандартные пекарские дрожжи. Однако в данном случае могут быть использованы и другие часто применяемые и доступные микроорганизмы других видов и штаммов, таких как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K.lactis, K.fragilis (АТСС 12424), K.bulgaricus (АТСС 16045), K.wickeramii (АТСС 24178), K.waltii (АТСС 56500), K.drosophilarum (АТСС 36906), K.thermotolerans и K.marxianus; yarrowia (ЕР 402226); Pichia pastoris (ЕР 183070); Candida; Trichodermareesia (ЕР 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomycesoccidentalis; и гифомицеты, такие как, например, микроорганизмы-хозяева Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как Aspergillus nidulans и Aspergillus niger.
Клетками-хозяевами, подходящими для экспрессии гликозилированного антитела, являются многоклеточные организмы. Примерами клеток беспозвоночных являются клетки растений и насекомых. Были идентифицированы различные бакуловирусные штаммы и варианты, а также соответствующие пермиссивные клетки-хозяева насекомых, таких как Spodoptera frugiperda (гусеница совки), Aedes aegypti (желтолихорадочный комар), Aedes albopictus (белопятнистый комар), Drosophilamelanogaster (плодовая мушка) и Bombyx mori (тутовый шелкопряд). В настоящее время имеется ряд доступных штаммов, которые могут быть использованы для трансфекции, например вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в настоящем изобретении, а в частности для трансфекции клеток Spodoptera frugiperda.
В качестве клеток-хозяев могут быть также использованы клетки растительных культур хлопчатника, кукурузы, картофеля, сои, петуньи, томатов, табака, ряски и клетки других растений.
Однако самый большой интерес представляют клетки позвоночных, и размножение клеток позвоночных (тканевой культуры) становится рутинной процедурой. Примерами обычно используемых линий клеток-хозяев млекопитающих являются клетки яичника китайского хомячка, включая клетки СНОK1 (АТСС CCL61), DXB-11, DG-44 и клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клеточную линию CV1 почек обезьяны, трансформированную SV40 (COS-7, ATCC CRL 1651); клеточную линию почек человеческого эмбриона (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре [Graham et al., J. Gen. Virol. 36:59 (1977)]; клетки почек детеныша хомячка (ВНК, АТСС CCL 10); мышиные клетки Сертоли (™4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почек обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почек собак (MDCK, ATCC CCL 34); клетки печени лабораторной крысы Buffalo (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (HepG2, HB 8065); опухолевые клетки мышиной молочной железы (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annal N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC5; клетки FS4 и клеточную линию человеческой гепатомы (HepG2).
Клетки-хозяева трансформируют или трансфецируют вышеописанными экспрессионными или клонирующими векторами для продуцирования антитела и культивируют в подходящих питательных средах, модифицированных, если это необходимо, для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности. Кроме того, новые векторы и трансфецированные клеточные линии со множеством копий транскрипционных единиц, разделенных селективным маркером, являются особенно подходящими и предпочтительными для экспрессии антител против M-CSF.
(8) Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования антитела согласно изобретению, могут быть культивированы в различных средах. Средами, подходящими для культивирования клеток-хозяев, являются коммерчески доступные среды, такие как среда Хэмса F10 (Sigma), минимальная поддерживающая среда ((МЕМ) (Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла (DMEM), Sigma). Кроме того, в качестве культуральной среды для культивирования клеток-хозяев может быть использована любая среда, описанная в публикации Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), в патентах США №№4767704, 4657866, 4927762, 4560655 или 5122469; в WO 90103430; в WO 87/00195 или в патенте США Re. №30985. В любую из этих сред могут быть добавлены, если это необходимо, гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия и фосфат кальция и магния), буферы (такие как HEPES), нуклеотиды (такие как аднозин и тимидин), антибиотики (такие как лекарственное средство гентамицин™), микроэлементы (определенные как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярных дозах), и глюкоза или эквивалентный источник энергии. Могут быть также включены любые другие необходимые добавки в соответствующих концентрациях, известные специалистам в данной области. Условия культивирования, такие как температура, рН и т.п., аналогичны условиям, используемым для экспрессии выбранных клеток-хозяев, и известны среднему специалисту в данной области.
(9) Очистка антитела
C применением техники рекомбинантных ДНК антитело может быть продуцировано внутри клеток или в периплазматическом пространстве, либо оно может быть непосредственно секретировано в среду, включая среду от микробных культур. Если в первой стадии антитело продуцируется внутри клеток, то затем клеточный дебрис или клетки-хозяева или их лизированные фрагменты удаляют, например, путем центрифугирования или ультрафильтрации. В публикации Better et al., Science 240: 1041-1043 (1998); ICSU Shot Reports 10: 105 (1990); и Proc. Natl. Acad. Sci., USA, 90: 457-461 (1993) описана процедура выделения антител, которые секретируются в периплазматическое пространство E.coli (см. также Carter et al., Bio/Technology 10:163-167 (1992)).
Композиция антитела, полученная из микробных клеток или клеток млекопитающих, может быть очищена, например, с помощью хроматографии на гидроксилапатитах, катионо- или анионообменной хроматографии и аффинной хроматографии, при этом предпочтительным методом очистки является аффинная хроматография. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа Fc-домена иммуноглобулина, присутствующего в данном антителе. Белок А может быть использован для очистки антител, содержащих тяжелые цепи γ1, γ2 или γ4 человеческого иммуноглобулина (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Для всех мышиных изотипов и для γ3 человеческого иммуноглобулина рекомендуется белок G (Guss et al., EMBO J. 5:15671575 (1986)). В качестве матрицы, с которой связывается аффинный лиганд, наиболее часто используется агароза, но могут быть использованы и другие матрицы. Механически стабильные матрицы, такие как стекло с регулируемым размером пор или поли(стиролдивинил)бензол, обеспечивают более быструю скорость потока и более короткое время обработки, чем это может быть достигнуто с использованием агарозы. Если антитело содержит домен СН3, то для очистки может быть использована смола Bakerbond ABX™ (J.T. Baker, Phillipsburg, N.J.). В зависимости от выделяемого антитела могут быть также применены и другие методы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на двуокиси кремния, хроматография на гепарин-сефарозеТМ, хроматография на анионо- или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, электрофорез в ДСН-ПААГ и преципитация сульфатом аммония.
Химерные и гуманизированные антитела
Поскольку химерные или гуманизированные антитела являются менее иммуногенными для человека, чем родительские мышиные моноклональные антитела, они могут быть использованы для лечения человека с гораздо меньшим риском развития анафилаксии. Таким образом, эти антитела могут оказаться предпочтительными для введения in vivo человеку в терапевтических целях.
Химерные моноклональные антитела, в которых вариабельные домены Ig мышиного моноклонального антитела присоединены к константным доменам человеческого Ig, могут быть продуцированы стандартными методами, известными специалистам (см. Morrison S.L. et al. (1984) Chimeric Human Antibody, Holtcnles; Mouse Antigen Binding Domains with Human Constant Region Domains, Proc. Natl. Acad. Sci. USA 81, 6841-6855 и Boulianne, G.L. et al., Nature 312, 643-646 (1984)). Хотя было подтверждено, что некоторые химерные моноклональные антитела являются менее иммуногенными для человека, однако известно, что вариабельные домены мышиного Ig все же могут вызывать значительный ответ у человека против мышиных антител.
Гуманизированные антитела могут быть получены различными методами, включая, например, (1) введение не человеческих гипервариабельных областей (CDR) в человеческую каркасную и константную область (этот способ известен как “гуманизация посредством “CDR-трансплантации”), или альтернативно, (2) трансплантацию полноразмерных не человеческих вариабельных доменов и их “покрытием” поверхностью, подобной поверхности последовательности человеческого антитела (этот способ известен как “маскировка”). В настоящем изобретении термин “гуманизированные антитела” включает как “гуманизированные”, так и “маскированные” антитела. Эти методы описаны в публикациях, например, Jones et al., Nature 321:522-525 (1986); Morrison et al. Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984); Morrison & Oi, Adv. Immunol., 44:65-92 (1988); Verhoeyer et al., Science 239:1534-1536 (1988)); Padlan, Molec. Immun. 28:489-498 (1991); Padlan, Molec. Immunol. 31(3):169-217 (1994) и Kettleborough C.A. et al., Protein Eng. 4(7):773-83 (1991), которые вводятся в настоящее описание посредством ссылки.
В частности, после повторного введения антитела грызунов человеку in vivo либо отдельно, либо в виде конъюгата, у реципиента будет вырабатываться иммунный ответ против антитела грызунов, так называемый НАМА-ответ (человеческое антимышиное антитело). Если требуется повторное введение доз, то этот НАМА-ответ может ограничивать эффективность данного фармацевтического средства. Иммуногенность антитела может быть ослаблена посредством химической модификации указанного антитела гидрофильным полимером, таким как полиэтиленгликоль, или посредством генной инженерии путем создания антитела со связывающей структурой, более сходной со структурой человеческого антитела. Так, например, генные последовательности вариабельных доменов антитела грызунов, которые связываются с СЕА, могут быть заменены вариабельными доменами человеческого миеломного белка с получением рекомбинантного химерного антитела. Эти процедуры подробно описаны в ЕР 194276, ЕР 0120694, ЕР 0125023, ЕР 0171496, ЕР 0173494 и WO 86/01533. Альтернативно, генные последовательности CDR антитела грызунов могут быть выделены или синтезированы и заменены соответствующими областями последовательности гомологичного гена человеческого антитела с получением человеческого антитела со специфичностью исходного антитела грызунов. Эти процедуры описаны в ЕР 023940, в WO 90/07861 и WO 91/09967. Альтернативно, большое число остатков поверхности вариабельного домена антитела грызунов может быть заменено остатками, обычно присутствующими в гомологичном человеческом антителе с получением антитела грызуна, которое имеет “замаскированную” внешнюю поверхность и которое, поэтому, будет распознаваться организмом человека как “свое”. Этот подход был продемонстрирован в работе Padlan et al. (1991) Mol. Immunol. 28, 489.
CDR-трансплантация включает введение одного или нескольких из шести CDR, происходящих от вариабельных доменов тяжелой и легкой цепей мышиного Ig, в соответствующие четыре каркасных области вариабельных доменов человеческого Ig, и такая трансплантация также называется “CDR-прививкой”. В этом методе (Riechmann L. et al., Nature 332, 323 (1988)) используются консервативные каркасные области (FR1-FR4) в качестве основы для сохранения CDR-петлей, которые, в основном, контактируют с антигеном. Однако недостаток CDR-трансплантации заключается в том, что полученное в результате такой трансплантации гуманизированное антитело имеет, по существу, более низкую аффинность связывания, чем исходное мышиное антитело, поскольку аминокислоты каркасных областей могут играть важную роль в связывании с антигеном и поскольку аминокислоты петель CDR могут влиять на ассоциацию двух вариабельных доменов Ig. Для сохранения аффинности гуманизированного моноклонального антитела метод CDR-трансплантации может быть усовершенствован путем выбора человеческих каркасных областей, наиболее сходных с каркасными областями исходного мышиного антитела, и путем сайт-направленного мутагенеза одиночных аминокислот в каркасных областях или в CDR с помощью компьютерного моделирования антигенсвязывающего сайта (см., например, Co, M.S. et al. (1994) J. Immunol. 152, 2968-2976).
Один из методов гуманизации антител включает выравнивание не человеческих последовательностей тяжелой и легкой цепей с человеческими последовательностями тяжелой и легкой цепей, отбор и замену не человеческой каркасной области человеческой каркасной областью на основе такого выравнивания; молекулярное моделирование для предсказания конформации гуманизированной последовательности и ее сравнение с конформацией родительского антитела. После этого осуществляют повторную обратную мутацию остатков в CDR-области, нарушающую структуру CDR, до тех пор, пока предсказанная конформация модели гуманизированной последовательности не будет наиболее приближенной к конформации не человеческих CDR родительского не человеческого антитела. Такие гуманизированные антитела могут быть дополнительно дериватизированы для облегчения их захвата и очистки, например, посредством рецепторов Ashwell (см., например, патенты США №№5530101 и 5585089, которые вводятся в настоящее описание посредством ссылки).
Различные методы гуманизации мышиных моноклональных антител путем рационального конструирования описаны в литературе (см., например, заявку 20020091240, опубликованную 11 июля 2002, WO 92/11018 и патенты США №№5693762 и 5766866).
Варианты аминокислотных последовательностей
Метод, применяемый для идентификации некоторых остатков или областей антитела, которые имеют предпочтительную локализацию для мутагенеза, называется “аланин-сканирующим мутагенезом” и описан Cunningham & Wells, Science 244:1081-1085 (1989). В этом методе остаток или группу нужных остатков идентифицируют (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно аланином или полиаланином) для влияния на взаимодействие этих аминокислот с антигеном. Затем локализацию аминокислот, проявляющих функциональную чувствительность к таким заменам, уточняют путем введения дополнительных или других модификаций в положении замены или на некотором расстоянии от данной замены. Так, например, положение введения аминокислотной замены может быть определено заранее, тогда как природа мутации per se необязательно должна быть определена заранее. Так, например, для анализа эффективности мутации в данном сайте Ala-сканирующий или неспецифический мутагенез осуществляют в нужном кодоне или в нужной области и варианты экспрессированного антитела скринируют на нужную активность.
Вставками в аминокислотные последовательности являются вставки у амино- и/или карбокси-концов, образующие гибриды, имеющие длину от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности, состоящие из одного или множества аминокислотных остатков. Примерами концевых инсерций является антитело с N-концевым метионильным остатком или антитело (включая фрагмент антитела), присоединенное к эпитопной метке или к эпитопу, связывающемуся с рецептором спасения. Другими инсерционными вариантами молекулы антитела являются гибриды, например, N- или С-концов антитела с полипептидом, который увеличивает время полужизни антитела в сыворотке.
Термин “меченный эпитопом” относится к антителу, присоединенному к эпитопной метке. Полипептид эпитопной метки имеет достаточное количество остатков для образования эпитопа, против которого может быть создано антитело, но при этом он является достаточно коротким, чтобы не препятствовать активности антитела. Предпочтительно эпитопная метка должна быть достаточно уникальной для того, чтобы данное антитело, по существу, не вступало в перекрестную реакцию с другими эпитопами. Подходящие полипептиды метки обычно имеют, по меньшей мере, 6 аминокислотных остатков, а чаще примерно 8-50 аминокислотных остатков (предпочтительно примерно 9-30 остатков). Примерами являются полипептид метки гемагглютинина (ГА) гриппа и вырабатываемое против него антитело 12СА5 [Field et al., Mol. Cell. Biol. 8:2159-2165 (1988)]; полипептид метки с-myc и вырабатываемое против него антитело 8F9, 3C7, 6E10, G4, B7 и 9Е10 [Evan et al., Mol. Cell. Biol. 5(12):3610-3616 (1985)], гликопротеин D вируса простого герпеса (gD) и вырабатываемое против него антитело [Paborsky et al., Protein Engineering 3(6):547-553 (1990)]. Другой репрезентативной меткой является полигистидиновая последовательность, обычно содержащая примерно шесть гистидиновых остатков и позволяющая выделять меченное таким образом соединение с использованием агента, образующего хелатный комплекс с никелем. Другие метки, такие как метка FLAG® (Eastman Kodak, Rochester, NY), хорошо известные специалистам и описанные в литературе, входят в объем настоящего изобретения.
Используемый здесь термин “рецептор-связыващий эпитоп спасения” означает эпитоп Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который ответственен за увеличение времени полужизни молекулы IgG в сыворотке in vivo.
Вариантом другого типа является вариант с заменой аминокислоты. Эти варианты имеют, по меньшей мере, один удаленный аминокислотный остаток в молекуле антитела и вместо него встроенный другой остаток. Предусматривается, что мутагенез с заменами может быть проведен в любой гипервариабельной области или в CDR-областях или в каркасных областях. Консервативные замены представлены в таблице 1. Наиболее консервативные замены указаны в столбце под заголовком “Предпочтительные замены”. Если такие замены не приводят к изменению биологической активности, то могут быть введены дополнительные основные замены, названные в таблице 1 “репрезентативными заменами”, или замены, дополнительно описанные ниже при описании классов аминокислот, и может быть проведен скрининг продуктов.
Значительные изменения биологических свойств антитела могут быть достигнуты путем выбора замен, которые значительно отличаются по своему влиянию (а) на структуру полипептидного остова в области замены, например складчатую и спиральную конформацию, (b) на заряд или гидрофобность молекулы в нужном сайте, или (с) объем боковой цепи. По общим свойствам своих боковых цепей природные остатки подразделяются на нижеследующие группы:
(1) гидрофобные остатки: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные остатки: Cys, Ser, Thr;
(3) кислотные остатки: Asp, Glu;
(4) основные остатки: Asn, Gln, His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro; и
(6) ароматические остатки: Trp, Tyr, Phe.
Консервативные замены предусматривают замены аминокислоты одного класса другой аминокислотой того же самого класса. Не консервативные замены предусматривают замены аминокислоты одного класса другой аминокислотой другого класса.
Для повышения окислительной стабильности молекулы и предупреждения нежелательного перекрестного связывания любой цистеиновый остаток, не участвующий в поддержании правильной конформации моноклонального антитела, человеческого антитела, гуманизированного антитела, антитела Human Engineered™ или варианта такого антитела, может быть также заменен, обычно, серином. И наоборот, в антитело, для повышения его стабильности (в частности, если указанным антителом является фрагмент антитела, такой как Fv-фрагмент), может быть введена цистеиновая(ые) связь(и).
Созревание аффинности предусматривает получение и скрининг вариантов антител, которые имеют замены в CDR родительского антитела, а также отбор вариантов, обладающих улучшенными биологическими свойствами, такими как аффинность связывания, по сравнению с родительским антителом. Стандартный способ генерирования таких вариантов с заменами предусматривает созревание аффинности с применением метода фагового представления. Для этого несколько положений гипервариабельной области (например, 6-7 положений) подвергают мутации для влияния всех возможных аминокислотных замен в каждом положении. Генерированные таким образом варианты антитела будут представлены как моновалентные молекулы на частицах нитчатого фага в виде гибридов с продуктом гена III, упакованных в каждой частице фага М13. Затем варианты, представленные на фаге, скринируют на их биологическую активность (например, аффинность связывания).
Для идентификации остатков гипервариабельной области, которые играют существенную роль в связывании с антигеном, может быть осуществлен аланин-сканирующий мутагенез. Альтернативно или дополнительно, может оказаться полезным проанализировать кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Такие контактные остатки и соседние остатки являются кандидатами на замену, осуществляемую в соответствии с разработанными здесь способами. После генерирования таких вариантов панель этих вариантов подвергают скринингу, описанному в настоящей заявке, и антитела, обнаруживающие превосходные свойства в одном или нескольких релевантных анализах, могут быть выбраны для дальнейшего исследования.
Могут быть также продуцированы варианты антител, которые имеют модифицированный характер гликозилирования, по сравнению с родительским антителом, например, путем делеции одной или нескольких углеводных групп, присутствующих в антителе, и/или добавления одного или нескольких сайтов гликозилирования, отсутствующих в антителе.
Гликозилирование антител обычно является либо N-связанным, либо О-связанным. N-связанное гликозилирование означает присоединение углеводной группы к боковой цепи аспарагинового остатка. Трипептидные последовательности “аспарагин-Х-серин” и “аспарагин-Х-треонин”, где Х означает любую аминокислоту, за исключением пролина, представляют собой последовательности распознавания для ферментативного присоединения углеводной части к боковой цепи аспарагина. Присутствие любой из этих трипептидных последовательностей в полипептиде способствует созданию потенциального сайта гликозилирования. Таким образом, сайты N-связанного гликозилирования могут быть добавлены в антитело путем такой модификации аминокислотной последовательности, при которой она будет содержать одну или несколько указанных трипептидных последовательностей. О-связанное гликозилирование означает присоединение одного из сахаров, таких как N-ацетилгалактозамин, галактоза или ксилоза к гидроксиаминокислоте, главным образом, к серину или треонину, хотя ими могут быть также 5-гидроксипролин или 5-гидроксилизин. Сайты О-связанного гликозилирования могут быть добавлены в антитело путем инсерции или замены одного или нескольких сериновых или треониновых остатков в последовательности исходного антитела. Например, аминокислоты RX1 в положениях 41-43 на фигуре 4А (NGS) могут быть сохранены. Альтернативно, могут быть сохранены только аминокислоты 41 и 42 (NG).
В основном, варианты аминокислотной последовательности антитела Human Engineered™ имеют аминокислотную последовательность, которая, по меньшей мере, на 60% идентична исходной аминокислотной последовательности тяжелой или легкой цепи антитела Human Engineered™ (например, как показано на фигурах 19В-22В), предпочтительно, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 85%, еще более предпочтительно, по меньшей мере, на 90%, и наиболее предпочтительно, по меньшей мере, на 95%, например, на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и 100%. Термины “идентичность” или “гомология”, относящиеся к этой последовательности, определены в настоящей заявке как процент аминокислотных остатков в последовательности-кандидате, идентичных остаткам антитела Human Engineered™, после выравнивания этих последовательностей и введения пробелов, если это необходимо для получения максимального процента идентичности последовательностей, без учета каких-либо консервативных замен (как указано выше в таблице 1), которые рассматриваются как часть идентичности последовательностей. Ни одна из таких модификаций, как N-концевые, С-концевые или внутренние удлинения, делеции или инсерции в последовательности антитела, не должна негативно влиять на идентичность или гомологию последовательностей. Таким образом, идентичность последовательностей может быть определена стандартными методами, обычно применяемыми для определения сходства аминокислот в данном положении двух полипептидов. С использованием компьютерной программы, такой как BLAST или FASTA, два полипептида выравнивают на оптимальное соответствие их аминокислот (либо по всей длине одной или обеих последовательностей, либо по длине предварительно определенной части одной или обеих последовательностей). Эти программы имеют параметры по умолчанию, такие как штраф за пропуск символа и штраф за пробел, и оценочная матрица, такая как РАМ 250 [стандартная оценочная матрица; см. Dayhoff et al. Atlas of Protein Sequence and Structure, vol.5, supp.3 (1978)], которые могут быть использованы вместе с компьютерной программой. Так, например, процент идентичности может быть вычислен следующим образом: общее число идентичных соответствий умножают на 100, а затем делят на сумму длины более длинной последовательности в данном участке соответствия и числа пробелов, введенных в более длинные последовательности для выравнивания двух последовательностей.
Могут также рассматриваться и другие модификации антител. Так, например, может оказаться желательным модифицировать антитело согласно изобретению с точки зрения его эффекторной функции в целях повышения эффективности данного антитела для лечения, например, рака. Так, например, в Fc-область может(могут) быть введен(ы) цистеиновый(е) остаток(ки), что будет способствовать образованию межцепьевой дисульфидной связи в этой области. Генерированное таким образом гомодимерное антитело может обладать повышенной способностью к интернализации и/или повышенной комплемент-зависимой цитолитической активностью и повышенной антитело-зависимой цитотоксичностью (ADCC). См. Caron et al. J. Exp. Med. 176:1191-1195 (1992) и Shopes, B.J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью могут быть также получены с использованием гетеробифункциональных перекрестносшивающих линкеров, описанных Wolff et al. Cancer Research 53:2560-2565 (1993). Альтернативно, может быть сконструировано антитело, которое имеет две Fc-области, а поэтому оно может обладать повышенной комплемент-зависимой цитолитической активностью и повышенной ADCC. См. Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989). Кроме того, было показано, что последовательности в CDR могут стимулировать связывание антитела с МНС класса II и запускать нежелательный ответ путем продуцирования хелперных Т-клеток. Консервативная замена допускает сохранение связывающей активности антитела, но при этом она может приводить к утрате способности запускать нежелательный Т-клеточный ответ. См. также публикацию Steplewski et al., Proc. Natl. Acad. Sci., USA, 1988; 85(13):4852-6, которая вводится в настоящее описание посредством ссылки и в которой описаны химерные антитела, в которых мышиные вариабельные области соединены с человеческими константными областями гамма-1, гамма-2, гамма-3 и гамма-4.
В некоторых вариантах изобретения для повышения проницаемости опухоли может, например, оказаться желательным использование не интактного антитела, а фрагмента антитела. В этом случае для увеличения времени его полужизни в сыворотке может оказаться желательной модификация такого фрагмента антитела, например, путем присоединения молекул, таких как ПЭГ или другие водорастворимые полимеры, включая полисахаридные полимеры, к фрагментам антитела. Это может быть достигнуто, например, путем включения эпитопа, связывающегося с рецептором спасения, во фрагмент антитела (например, путем мутации соответствующей области в данном фрагменте антитела или путем включения данного эпитопа в пептидную метку, которую затем присоединяют к фрагменту антитела либо у конца, либо в середине последовательности, например, путем ДНК-синтеза или пептидного синтеза) (см., например, WO 96/32478).
Эпитоп, связывающийся с рецептором спасения, предпочтительно содержит область, в которой один или несколько аминокислотных остатков, происходящих от одной или двух петель Fc-домена, перенесены в аналогичное положение фрагмента антитела. Еще более предпочтительно, чтобы были перенесены три или более остатка от одной или двух петель Fc-домена. Еще более предпочтительно, чтобы данный эпитоп был выделен из домена СН2 Fc-области (например, IgG) и перенесен в область СН1, СН3 или VH указанного антитела или в более чем одну такую область. Альтернативно, эпитоп выделяют из домена СН2 Fc-области и переносят в область CL или VL или в обе эти области фрагмента антитела. См. также Международные заявки WO 97/34631 и WO 96/32478, в которых описаны Fc-варианты и их взаимодействие с рецептором спасения.
Таким образом, антитела согласно изобретению могут содержать человеческую Fc-часть, человеческую консенсусную Fc-часть или ее вариант, который сохраняет способность взаимодействовать с Fc-рецептором спасения, включая варианты, в которых цистеины, участвующие в образовании дисульфидной связи, были модифицированы или делетированы, и/или в которых в N-конец был добавлен Met и/или были удалены одна или несколько из 20 N-концевых аминокислот, и/или были удалены области, которые взаимодействуют с комплементом, таким как сайт связывания с C1q, и/или был удален ADCC-сайт [см., например, Molec. Immunol. 29 (5): 633-9 (1992)].
В предшествующих исследованиях был картирован сайт связывания человеческого и мышиного IgG на FcR, главным образом, до нижней части шарнирной области, состоящей из остатков 233-239 IgG. В других исследованиях были представлены дополнительные более широкие сегменты, например Gly316-Lys338 для человеческого Fc-рецептора I, Lys274-Arg301 и Tyr407-Arg416 для человеческого Fc-рецептора III, или несколько специфических остатков, находящихся за пределами нижней части шарнирной области, например в Asn297 и Glu318 для мышиного IgG2b, взаимодействующего с мышиным Fc-рецептором II. В описании 3,2 Е кристаллической структуры Fc-фрагмента человеческого IgG1 вместе с человеческим Fc-рецептором IIIA указаны остатки Leu234-Ser239, Asp265-Glu269, Asn297-Thr299 и Ala327-Ile332 IgG1, участвующие в связывании с Fc-рецептором IIIA. Исходя из анализа кристаллической структуры было высказано предположение, что остатки, находящиеся в петлях FG СН2-домена IgG (остатки 326-330), при их введении в нижнюю часть шарнирной области (Leu234-Gly237), и BC (остатки 265-271), могут играть определенную роль в связывании с Fc-рецептором IIA. См. публикацию Shields et al., J. Biol.Chem., 276(9):6591-6604(2001), которая во всей своей полноте вводится в настоящее описание посредством ссылки. Мутация остатков в сайтах связывания с Fc-рецептором может приводить к изменению эффекторной функции, например к изменению ADCC- или CDC-активности или к изменению времени полужизни. Как описано выше, возможными мутациями являются инсерции, делеции или замены одного или нескольких остатков, включая замену аланином, консервативную замену, неконсервативную замену или замену соответствующим аминокислотным остатком другого подкласса IgG в том же самом положении антитела (например, замену остатка IgG1 соответствующим остатком IgG2 в этом же положении).
Shield и др. сообщали, что остатки IgG1, участвующие в связывании со всеми человеческими Fc-рецепторми, находятся в СН2-домене, присутствующим в непосредственной близости от шарнирной области, и подразделяются на две следующие категории: 1) остатки, которые могут взаимодействовать непосредственно со всеми FcR, а именно Leu234-Pro238, Ala327 и Pro329 (и возможно Asp265); и 2) остатки, которые влияют на углеводную природу или положение, а именно Asp265 и Asn297. Другими остатками IgG1, которые влияют на связывание с Fc-рецептором II, являются следующие остатки (наибольший эффект): Arg225, Thr256, Glu258, Ser267, Asp270, Glu272, Asp280, Arg292, Ser298 и следующие остатки (меньший эффект): His268, Asn276, His285, Asn286, Lys290, Gln295, Arg301, Thr307, Leu309, Asn315, Lys322, Lys326, Pro331, Ser337, Ala339, Ala378 и Lys414. A327Q, A327S, P329A, D265A и D270A снижают уровень связывания. Помимо остатков, идентифицированных выше для всех FcR, другими остатками IgG1, которые снижают уровень связывания с Fc-рецептором IIIA на 40% или более, являются следующие остатки: Ser239, Ser267 (только Gly), His268, Glu293, Gln295, Tyr296, Arg301, Val303, Lys338 и Asp376. Вариантами, которые повышают уровень связывания с FcRIIIA, являются Т256А, K290A, S298A, E333A, K334A и А339Т. Lys414 дает 40% снижение уровня связывания с FcRIIA и FcRIIB, Arg416 дает 30% снижение уровня связывания с FcRIIA и FcRIIIA, Gln419 дает 30% снижение уровня связывания с FcRIIA и 40% снижение уровня связывания с FcRIIB, а Lys360 дает 23% увеличение уровня связывания с FcRIIIA. См. также Presta et al., Biochem. Soc. Trans. (2001) 30, 487-490.
Так, например, в патенте США №6194551, который во всей своей полноте вводится в настоящее описание посредством ссылки, описаны варианты, имеющие измененную эффекторную функцию и содержащие мутации в Fc-области человеческого IgG в положениях аминокислот 329, 331 или 322 (по нумерации Кэбата), и некоторые из этих вариантов обладают пониженной C1q-связывающей активностью или CDC-активностью. Так, например, патент США №6737056, который во всей своей полноте вводится в настоящее описание посредством ссылки, описаны варианты, имеющие измененную эффекторную функцию или измененную функцию связывания с рецептором Fc-гамма, то есть содержащие мутации в Fc-области человеческого IgG в положениях аминокислот 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 или 439 (по нумерации Кэбата), и некоторые из этих вариантов имеют профили связывания с рецептором, ассоциированные с пониженной ADCC- или CDC-активностью. При этом было установлено, что из указанных мутаций, что мутации в положении аминокислот 238, 265, 269, 270, 327 или 329 приводят к снижению уровня связывания с FcRI, а также было установлено, что мутации в положениях аминокислот 238, 265, 269, 270, 292, 294, 295, 298, 303, 324, 327, 329, 333, 335, 338, 373, 376, 414, 416, 419, 435, 438 или 439 приводят к снижению уровня связывания с FcRII, а мутации в положениях аминокислот 238, 239, 248, 249, 252, 254, 265, 269, 270, 272, 278, 289, 293, 294, 295, 296, 301, 303, 322, 327, 329, 338, 340, 373, 376, 382, 388, 389, 416, 434, 435 или 437 приводят к снижению уровня связывания с FcRIII.
В патенте США №5624821, который во всей своей полноте вводится в настоящее описание посредством ссылки, сообщается, что C1q-связывающая активность мышиного антитела может быть изменена путем введения мутаций в положения аминокислотных остатков 318, 320 или 322 тяжелой цепи, а также сообщается, что замена остатка 297 (Asn) приводит к потере литической активности.
В публикации заявки США №20040132101, которая во всей своей полноте вводятся в настоящее описание посредством ссылки, описаны варианты, имеющие мутации в положениях аминокислот 240, 244, 245, 247, 262, 263, 266, 299, 313, 325, 328 или 332 (по нумерации Кэбата) или в положениях аминокислот 234, 235, 239, 240, 241, 243, 244, 245, 247, 262, 263, 264, 265, 266, 267, 269, 296, 297, 298, 299, 313, 325, 327, 328, 329, 330 или 332 (по нумерации Кэбата), где мутации в положениях 234, 235, 239, 240, 241, 243, 244, 245, 247, 262, 263, 264, 265, 266, 267, 269, 296, 297, 298, 299, 313, 325, 327, 328, 329, 330 или 332 могут приводить к снижению ADCC-активности или к снижению уровня связывания с рецептором Fc-гамма.
В публикации Chappel et al., Proc. Natl. Acad. Sci., USA, 1991; 88(20):9036-40, которая во всей своей полноте вводится в настоящее описание посредством ссылки, сообщается, что цитофильная активность IgG1 является свойством, присущим его СН2-домену тяжелой цепи. Одиночные точковые мутации в любом из аминокислотных остатков 234-237 IgG1 приводят к значительному снижению или к потере его активности. Для полного восстановления связывающей активности необходима замена всех остатков IgG1 в положениях 234-237 (LLGG) на соответствующие остатки IgG2 и IgG4. Было обнаружено, что антитело IgG2, содержащее полноразмерную последовательность ELLGGP (остатки 233-238), было более активным, чем IgG1 дикого типа.
В публикации Isaacs et al., J. Immunol. 1998; 161(8):3862-9, которая во всей своей полноте вводится в настоящее описание посредством ссылки, сообщается, что мутации в мотиве, играющем решающую роль в связывании с FcR-гамма (где глутамат 233 заменен пролином, лейцин/фенилаланин 234 заменен валином, а лейцин 235 заменен аланином), полностью предотвращают истощение клеток-мишеней. Замена глутамата 318 аланином приводит к элиминации эффекторной функции мышиного IgG2b, а также к снижению активности человеческого IgG4.
В публикации Armour et al., Mol. Immunol. 2003; 40(9):585-93, которая во всей своей полноте вводится в настоящее описание посредством ссылки, были идентифицированы варианты IgG1, которые реагируют с активирующим рецептором, FcR-гамма IIa, по меньшей мере, в 10 раз менее эффективно, чем IgG1 дикого типа, однако их уровень связывания с ингибирующим рецептором FcR-гамма IIb был ниже только в четыре раза. Были сделаны мутации в области аминокислот 233-236 и/или в положениях аминокислот 327, 330 и 331. См. также заявку WO 99/58572, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
В публикации Xu et al., J. Biol. Chem. 1994;269(5):3469-74, которая во всей своей полноте вводится в настоящее описание посредством ссылки, сообщается, что в IgG1 замена Pro331 на Ser приводит к заметному снижению C1q-связывающей активности и фактически к элиминации литической активности. В противоположность этому, замена Ser331 на Pro в IgG4 сообщает варианту Pro331-IgG4 частичную литическую активность (40%).
В публикации Schuurman et al., Mol. Immunol. 2001; 38(1):1-8, которая во всей своей полноте вводится в настоящее описание посредством ссылки, сообщается, что замена одного из шарнирных цистеинов, участвующего в образовании связи между тяжелыми цепями, Cys226, на серин приводит к образованию более стабильной связи между тяжелыми цепями. Замена последовательности Cys-Pro-Ser-Cys шарнирной области IgG4 на последовательность Cys-Pro-Pro-Cys шарнирной области IgG1 также приводит к значительной стабилизации ковалентной связи между тяжелыми цепями.
В публикации Angal et al., Mol. Immunol. 1993; 30(1):105-8, которая во всей своей полноте вводится в настоящее описание посредством ссылки, сообщается, что замена серина в положении аминокислоты 241 в IgG4 на пролин (присутствующий в этом же положении в IgG1 и IgG2) приводит к продуцированию гомогенного антитела, а также к увеличению времени полужизни в сыворотке и к улучшению его распределения в ткани, по сравнению с исходным химерным IgG4.
Человеческое антитело и антитело Human Engineered™
Human Engineered™
В работе Studnicka [см., например, Studnicka et al., патент США №5766886; Studnicka et al., Protein Engineering 7:805-814 (1994)] был описан метод получения вариабельных доменов антитела Human Engineered™ для снижения иммуногенности при одновременном сохранении связывающей активности молекул антител. В соответствии с этим методом, каждой аминокислоте вариабельной области была установлена степень риска такой замены. Аминокислотные замены были подразделены на три категории риска: (1) замены низкого риска, при которых существует наиболее высокая вероятность снижения иммуногенности с наименьшим шансом нарушения связывания с антигеном; (2) замены умеренного риска, которые также приводят к снижению иммуногенности, но к повышению шанса нарушения связывания с антигеном или укладки белка; (3) замены высокого риска, которые имеют важное значение для связывания или для сохранения структуры антитела и создают наиболее высокий риск негативного воздействия на связывание с антигеном или укладку белка. В целом, считается, что из-за трехмерной структурной конфигурации пролинов модификации в положениях пролинов будут приводить к заменам, по меньшей мере, умеренного риска, даже если замена в таком положении обычно считается заменой низкого риска.
Вариабельные области легкой и тяжелой цепей антитела грызунов, представляющие собой Human Engineered™, были получены путем замены человеческих аминокислот в положениях, в которых, как было определено, вероятность негативного воздействия таких замен на связывание с антигеном или на укладку белка очень низка, а вероятность, что такие замены будут приводить к снижению иммуногенности в организме человека, достаточно велика. Аминокислотные остатки, которые находятся в положениях “низкого риска” и которые являются кандидатами на модификацию в соответствии с этим методом, были идентифицированы путем выравнивания аминокислотных последовательностей вариабельных области грызунов с последовательностью человеческой вариабельной области. При этом может быть использована любая человеческая вариабельная область, включая отдельную последовательность VH или VL или консенсусную человеческую последовательность VH или VL, либо отдельную или консенсусную последовательность человеческой зародышевой линии. Могут быть модифицированы аминокислотные остатки в любом положении “низкого риска” или во всех положениях “низкого риска”. Так, например, в каждое положение “низкого риска”, в котором аминокислотные остатки выровненных мышиной и человеческой последовательностей отличаются друг от друга, вводят аминокислотную модификацию, то есть аминокислотный остаток последовательности грызуна заменяют человеческим остатком. Альтернативно, могут быть внесены модификации в аминокислотные остатки во всех положениях “низкого риска” и в любом положении “умеренного риска”. В идеальном случае, для достижения наименьшей иммуногенности, во всех положениях низкого и умеренного риска, аминокислотные остатки грызунов заменяют остатками человеческой последовательности.
Были сконструированы синтетические гены, содержащие модифицированные вариабельные области тяжелой и/или легкой цепей, и эти гены были присоединены к константным областям тяжелой цепи γ и/или легкой цепи каппа человеческого иммуноглобулина. Любая из константных областей тяжелой и легкой цепей человеческого иммуноглобулина может быть использована в комбинации с вариабельными областями антитела Human Engineered™, включая IgA (любого подкласса, такого как IgA1 или IgA2), IgD, IgE, IgG (любого подкласса, такого как IgG1, IgG2, IgG3 или IgG4) или IgM. Гены тяжелой и легкой цепей человеческого иммуноглобулина вводят в клетки-хозяева, такие как клетки млекопитающих, а затем получают и охарактеризовывают рекомбинантные продукты иммуноглобулина.
Человеческие антитела от трансгенных животных
Человеческие антитела против M-CSF могут быть также продуцированы у трансгенных животных, у которых не продуцируется эндогенный иммуноглобулин, и сконструированы так, чтобы они содержали локус человеческого иммуноглобулина. Так, например, в WO 98/24893 описаны трансгенные животные, имеющие локус человеческого Ig, где у указанных животных не продуцировались функциональные эндогенные иммуноглобулины вследствие инактивации эндогенных локусов тяжелой и легкой цепей. В WO 91/741 также описаны трансгенные млекопитающие-хозяева, не относящиеся к приматам и способные вырабатывать иммунный ответ к иммуногену, где антитела имеют константные и/или вариабельные области приматов и где генные локусы, кодирующие эндогенный иммуноглобулин, были заменены или инактивированы. В WO 96/30498 описано использование системы Cre/Lox для модификации локуса иммуноглобулина у млекопитающего, так, чтобы были замены все или часть константных или вариабельных областей с образованием модифицированной молекулы антитела. В WO 94/02602 описаны не относящиеся к человеку млекопитающие-хозяева, имеющие инактивированные эндогенные локусы Ig и функциональные человеческие локусы Ig. В патенте США №5939598 описаны методы создания трансгенных мышей, у которых отсутствуют эндогенные тяжелые цепи и у которых экспрессируется экзогенный локус иммуноглобулина, содержащий одну или несколько ксеногенных константных областей.
С использованием вышеописанных трансгенных животных может быть продуцирован иммунный ответ к выбранной антигенной молекуле, и у этих животных могут быть взяты антитело-продуцирующие клетки, которые могут быть использованы для продуцирования гибридом, секретирующих человеческие моноклональные антитела. Протоколы иммунизации, адъюванты и т.п. известны специалистам и применяются для иммунизации, например, трансгенных мышей, как описано в WO 96/33735. В этой публикации описаны моноклональные антитела против различных антигенных молекул, включая IL-6, IL-8, TNFα, человеческий CD4, L-селектин, gp39 и столбнячный токсин. Моноклональные антитела могут быть протестированы на их способность ингибировать или нейтрализовать биологическую активность или физиологический эффект соответствующего белка. В WO 96/33735 описано, что моноклональные антитела против IL-8, происходящие от иммунных клеток трансгенных мышей, иммунизованных IL-8, блокируют IL-8-индуцированные функции нейтрофилов. Человеческие моноклональные антитела со специфичностью к данному антигену, используемому для иммунизации трансгенных животных, также описаны в WO 96/34096, в заявке на патент США №20030194404 и в заявке на патент США №20030031667.
См. также, например, Jakobovits et al., Proc. Natl. Acad. Sci., USA, 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggerman et al., Year in Immuno, 7:33 (1993) и патенты США №№5591669, 5589369 и 5545807, и заявку на патент США №20020199213. В заявке на патент США №20030092125 описаны методы изменения иммунного ответа у животного к нужному эпитопу. Человеческие антитела могут также продуцироваться in vitro активированными В-клетками (см. патенты США №№5567610 и 5229275).
Человеческие антитела, полученные методом фагового представления
Разработка способов получения наборов рекомбинантных генов человеческого антитела и представление кодированных фрагментов антитела на поверхности нитчатого бактериофага дают возможность непосредственно продуцировать человеческие антитела. Антитела, продуцированные фаговым методом, получают в виде антиген-связывающих фрагментов, обычно, Fv- или Fab-фрагментов в бактериях, и эти фрагменты не обладают эффекторными функциями. Эффекторные функции могут быть созданы по одной из двух стратегий, например, фрагменты могут быть сконструированы либо в виде полноразмерных антител для экспрессии в клетках млекопитающих, либо в виде фрагментов биспецифических антител, имеющих второй сайт связывания, способный стимулировать эффекторную функцию.
Обычно, Fd-фрагмент (VH-СН1) и легкую цепь (VL-CL) антител отдельно клонируют с помощью ПЦР и подвергают произвольной рекомбинации в комбинаторных библиотеках фагового представления, которые затем могут быть отобраны на связывание с конкретным антигеном. Fab-фрагменты экспрессируются на поверхности фага, то есть физически присоединяются к генам, которые их кодируют. Так, например, отбор Fab путем связывания с антигеном проводят одновременно с отбором на Fab-кодирующие последовательности, которые могут быть затем амплифицированы. Несколько раундов связывания с антигеном и повторной амплификации, то есть процедуры, называемой “пэннингом”, приводят к обогащению Fab-фрагментом, специфичным к антигену, после чего этот фрагмент выделяют.
В 1994 году был описан метод гуманизации антител, называемый “направленным отбором”. В направленном отборе используется эффективный метод фагового представления, который дает возможность осуществлять гуманизацию мышиного моноклонального антитела (см. Jespers L.S. et al., Bio/Technology 12, 899/903 (1994)). Для этого Fd-фрагмент мышиного моноклонального антитела может быть представлен в комбинации с библиотекой легких цепей человеческого антитела и полученная библиотека Fab-гибридов может быть затем отобрана с использованием антигена. Таким образом, мышиный Fd-фрагмент может быть затем использован в качестве матрицы для направленного отбора. После этого отобранные человеческие легкие цепи комбинируют с библиотекой человеческих Fd-фрагментов. Отбор полученной библиотеки приводит к получению полноразмерного человеческого Fab.
Были описаны различные процедуры выделения человеческих антител из библиотек фагового представления (см., например, Hoogenboom et al., J. Mol. Biol. 227:381 (1991); Marks et al., J. Mol. Biol. 222:581-597 (1991), патент США №5565332 и 5573905; Clackson T. & Wells, J.A. TIBTECH 12, 173-184 (1994)). В частности, in vitro отбор и выделение антител из библиотек фагового представления становятся в последнее время самым эффективным методом (см. Burton D.R. & Barbas III, C.F., Adv. Immunol. 57, 191-280 (1994) & Winter G. et al., Annu. Rev. Immunol. 12, 433-455 (1994), заявку на патент США №20020004215 и WO 92/01047, заявку на патент США №20030190317, опубликованную 9 октября 2003, патент США №6054287 и патент США №5877293).
В публикации Watkins “Screening of Phage-Expressed Antibody Libraries by Capture Lift”, Methods in Molecular Biology, Antibody Phage Display: Methods and Protocols 178:187-193, и в заявке на патент США №200120030044772, опубликованной 6 марта 2003, описаны методы скрининга экспрессированных фагом библиотек антител или других связывающих молекул путем “захвата”, то есть метода, предусматривающего иммобилизацию молекул, связывающихся с кандидатом, на твердом носителе.
Продукты антител могут быть скринированы на активность и на возможность их применения в способах лечения согласно изобретению с помощью анализов, описанных в настоящей заявке в разделе, озаглавленном “Методы скрининга”, или с помощью любых подходящих анализов, известных специалистам.
Другие ковалентные модификации
Ковалентные модификации антитела также входят в объем настоящего изобретения. Такие модификации могут быть внесены путем химического синтеза или ферментативного или химического расщепления антитела, если это необходимо. В молекулу антитела могут быть внесены ковалентные модификации других типов путем взаимодействия выбранных аминокислотных остатков антитела с органическим дериватизирующим агентом, способным реагировать с выбранными боковыми цепями или с N- или С-концевыми остатками.
Цистеинильные остатки чаще всего подвергают взаимодействию с α-галогенацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, с получением карбоксиметиловых или карбоксиамидометиловых производных. Цистеинильные остатки также дериватизируют путем взаимодействия с бромтрифторацетоном, альфа-бром-β-(5-имидазоил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, бензоатом п-хлорртути, 2-хлорртуть-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом.
Гистидильные остатки дериватизируют путем взаимодействия с диэтилпирокарбонатом при рН 5,5-7,0, поскольку этот агент является относительно специфичным для гистидильной боковой цепи. Также может быть использован пара-бромфенацилбромид, и такую реакцию предпочтительно проводят в 0,1 М какодилате натрия при рН 6,0.
Лизинильные и амино-концевые остатки подвергают взаимодействию с ангидридами янтарной кислоты или других карбоновых кислот. Дериватизация этими агентами приводит к изменению заряда лизинильных остатков. Другими подходящими реагентами для дериватизации альфа-аминосодержащих остатков являются имидоэфиры, такие как метилпиколинимидат, фосфат пиридоксаля, пиридоксаль, хлорборгидрид, тринитробензолсульфоновая кислота, О-метилизомочевина, 2,4-пентандион и глиоксилат, участвующий в катализируемой трансаминазой реакции.
Аргинильные остатки модифицируют посредством взаимодействия с одним или несколькими стандартными реагентами, например с фенилглиоксалем, 2,3-бутандионом, 1,2-циклогександионом и нингидрином. Для дериватизации аргининовых остатков необходимо, чтобы такая реакция была проведена в щелочных условиях, поскольку гуанидиновая функциональная группа имеет высокий рКа. Кроме того, эти реагенты могут взаимодействовать с лизиновыми группами, а также с эпсилон-аминогруппой аргинина.
Специфическая модификация тирозильных остатков может быть осуществлена путем введения представляющих интерес спектральных меток в тирозильные остатки посредством взаимодействия с ароматическими диазониевыми соединениями или тетранитрометаном. В большинстве случаев используется N-ацетилимидазол и тетранитрометан, в результате чего образуются О-ацетилтирозильные группы и 3-нитропроизводные, соответственно. Тирозильные остатки подвергают иодированию с использованием125I или131I с получением меченых белков для их использования в радиоиммуноанализе.
Карбоксильные боковые группы (аспартил или глутамил) селективно модифицируют путем взаимодействия с карбодиимидами (RN=C=NR'), где R и R' представляют собой различные алкильные группы, такими как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азоний-4,4-диметилпентил)карбодиимид. Кроме того, аспартильные и глутамильные остатки превращают в аспарагинильные и глутаминильные остатки посредством взаимодействия с ионами аммония.
Глутаминильные и аспарагинильные остатки часто подвергают реакции деамидирования с образованием глутамильных и аспартильных остатков, соответственно. Эти остатки подвергают деамидированию в нейтральных или основных условиях. Деамидированная форма этих остатков входит в объем настоящего изобретения.
Другими модификациями являются гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильных или треонильных остатков, метилирование альфа-аминогрупп боковых цепей лизина, аргинина и гистидина (T.E.Creighton, Proteins: Structure and Molecular Properties, W.H.Freeman & Co., San Francisco, pp.79-86 (1983)), ацетилирование N-концевого амина и амидирование любой С-концевой карбоксильной группы.
Ковалентная модификация другого типа предусматривает химическое или ферментативное присоединение гликозидов к антителу. Эти процедуры имеют то преимущество, что для их проведения не требуется продуцирования антитела в клетке-хозяине, которое обладает способностью к N- или О-связанному гликозилированию. В зависимости от применяемого метода присоединения, сахар(сахара) может(могут) быть присоединен(ы) (а) к аргинину и гистидину, (b) к свободным карбоксильным группам, (с) к свободным сульфгидрильным группам, таким как группы цистеина, (d) к свободным гидроксильным группам, таким как группы серина, треонина или гидроксипролина, (е) к ароматическим остаткам, таким как фенилаланин, тирозин или триптофан, или (f) к амидной группе глутамина. Эти методы описаны в заявке WO 87/05330, опубликованной 11 сентября 1987, и в публикации Aplin & Wriston, CRC Crit. Rev. Biochem., pp.259-306 (1981).
Удаление любых углеводных групп, присутствующих на антителе, может быть осуществлено химическим или ферментативным методом. Для химического дегликозилирования, антитело должно быть обработано соединением трифторметансульфоновой кислоты или эквивалентным соединением. Такая обработка приводит к отщеплению большей части или всех сахаров, за исключением линкерных сахаров (N-ацетилглюкозамина или N-ацетилгалактозамина), но при этом антитело остается интактным. Химическое дегликозилирование описано в публикации Hakimuddin et al., Arch. Biochem. Biophys. 259:52 (1987) и Edge et al. Anal. Biochem. 118:131 (1981). Ферментативное отщепление углеводных групп может быть достигнуто под действием различных эндо- и экзогликозидаз, описанных в публикации Thotakura et al., Meth. Enzymol. 138:350 (1987).
Другой тип ковалентной модификации антитела включает присоединение данного антитела к одному из различных не белковых полимеров, например к полиэтиленгликолю, полипропиленгликолю, полиоксиэтилированным полиолам, полиоксиэтилированному сорбиту, полиоксиэтилированной глюкозе, полиоксиэтилированному глицерину, полиоксиалкиленам или к полисахаридным полимерам, таким как декстран. Такие методы известны специалистам и описаны, например, в патентах США №№4640835, 4496689, 4301144, 4670417, 4791192, 4179337, 4766106, 4179337, 4495285, 4609546 или в ЕР 315456.
Генная терапия
Доставка терапевтического антитела в соответствующие клетки может быть осуществлена посредством генной терапии ex vivo, in situ или in vitro любым подходящим методом, известным специалистам, включая физический перенос ДНК (например, с использованием липосом или химических агентов) или использование вирусных векторов (например, аденовируса, адено-ассоциированного вируса или ретровируса). Так, например, при in vivo терапии нуклеиновая кислота, кодирующая нужное антитело и взятая либо отдельно, либо в комбинации с вектором, липосомой или преципитатом, может быть непосредственно введена индивидууму, а в некоторых вариантах изобретения, она может быть введена в участок организма, в котором желательна экспрессия данного антитела. При ex vivo-терапии у индивидуума берут клетки и в эти клетки вводят нуклеиновую кислоту, а затем эти модифицированные клетки снова вводят индивидууму либо прямым способом, либо, например, путем инкапсуляции в пористые мембраны, которые затем имплантируют пациенту. См., например, патенты США №№4892538 и 5283187. Для введения нуклеиновых кислот в жизнеспособные клетки существуют различные методы. Эти методы варьируются в зависимости от того, переносят ли данную нуклеиновую кислоту в культивированные клетки in vitro или в клетки нужного хозяина in vivo. Методами, подходящими для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, являются использование липосом, электропорация, микроинжекция, слияние клеток, опосредуемая DEAE-декстраном трансфекция и преципитация фосфатом кальция. Вектором, наиболее часто используемым для ex vivo доставки нуклеиновой кислоты, является ретровирус.
Другими методами переноса нуклеиновой кислоты in vivo является трансфекция с использованием вирусных векторов (таких как аденовирус, вирус простого герпеса I или адено-ассоциированный вирус) и липидных систем. Нуклеиновая кислота и трансфецирующий агент ассоциируются, но необязательно, с микрочастицами. Примерами трансфецирующих агентов являются агенты, обеспечивающие ко-преципитацию фосфата кальция или хлорида кальция; агенты, обеспечивающие опосредуемую DEAE-декстраном трансфекцию; бромид амфифильного четвертичного аммония DO™A ((диолеоилоксипропил)-триметиламмония, имеющийся в продаже под названием Липофектин, GIBCO-BRL) (Felgner et al. (1987) Proc. Natl. Acad. Sci., USA, 84, 7413-7417; Malone et al. (1989) Proc. Natl. Acad. Sci., USA, 86:6077-6081); липофильные диэфиры глутаминовой кислоты с верхними боковыми триметиламмониевыми группами (Ito et al. (1990) Biochem. Biophys. Acta 1023, 124-132); метаболизируемые исходные липиды, такие как катионные липиды: диоктадециламиноглицилспермин (DOGS, Transfectam, Promega) и дипальмитоилфосфатидилэтаноламилспермин (DPPES) (J.P.Behr (1986) Tetrahedron Lett. 27, 5861-5864, J.P.Behr et al. (1989) Proc. Natl. Acad. Sci., USA, 86, 6982-6986); метаболизируемые соли четвертичного аммония (DOTB, метилсульфат N-(1-[2,3-диолеоилокси]пропил)-N,N,N-триметиламмония (DOTAP) (Boehringer Mannheim); полиэтиленимин (ПЭИ), диолеоиловые эфиры, ChoTB, ChoSC, DOSC) (Leventis et al. (1990) Biochim. Inter. 22, 235-241); 3-бета-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (DC-Chol), диолеоилфосфатидилэтаноламин (DOPE)/3-бета-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (DC-Chol) в смеси в отношении 1:1 (Gao et al. (1991) Biochim. Biophys. Acta. 1065, 8-14), спермин, спермидин, липополиамины (Behr et al., Bioconjugate Chem. 1994, 5:382-389), липофильные полилизины (LPLL) (Zhou et al. (1991) Biochim. Biophys. Acta. 939, 8-18), гидроксид [[(1,1,3,3-тетраметилбутил)крезокси]этокси]этил]диметилбензиламмония (гидроксид DEBDA) с избытком фосфатидилхолина/холестерина (Ballas et al. (1988) Biochim. Biophys. Acta 939, 8-18), смеси бромида цетилтриметиламмония (СТАВ)/DOPE (Pinnaduwage et al., (1989) Biochim. Biohys. Acta. 985, 33-37), липофильный диэфир глутаминовой кислоты (™AG) с DOPE, CTAB, DEBDA, бромидом дидодециламмония (DDAB) и стеариламином в смеси с фосфатидилэтаноламином (Rose et al. (1991) Biotechnique 10, 520-525), DDAB/DOPE (TransfectACE, GIBCO BRL) и липиды, несущие олигогалактозу. Примерами агентов-усилителей трансфекции, которые повышают эффективность трансфекции, являются, например, DEAE-декстран, полибрен, пептид, разрушающий лизосому (Ohmori N.I. et al., Biochem. Biophys. Res. Commun. Jun. 27, 1997; 235(3):726-9), протеогликаны на основе хондроитана, сульфатированные протеогликаны, полиэтиленимин, полилизин (Pollard H. et al., J. Biol. Chem. 1998, 273(13):7507-11), связывающийся с интегрином пептид CYGGRGDTP, линейный декстран-содержащий нонасахарид, глицерин, холестерильные группы, связанные с олигонуклеотидом у 3'-конца межнуклеозидной связью (Letsinger R.L. 1989, Proc. Natl. Acad. Sci., USA, 86:(17):6553-6), лизофосфатид, лизофосфатидилхолин, лизофосфатидилэтаноламин и 1-олеоиллизофосфатидилхолин.
В некоторых случаях может оказаться желательным вводить нуклеиновую кислоту посредством агента, который осуществляет направленную доставку вектора, содержащего нуклеиновую кислоту, в клетки-мишени. Такими “нацеливающими” молекулами являются антитела, специфичные к мембранному белку поверхности клетки-мишени, или лиганд для рецептора на клетке-мишени. В случае липосом, для направленной доставки и/или для облегчения внедрения в клетку могут быть использованы белки, которые связываются с мембранным белком клеточной поверхности, ассоциированным с эндоцитозом. Примерами таких белков являются капсидные белки и их фрагменты, нацеленные на клетки конкретного типа, антитела против белков, которые подвергаются интернализации в кровотоке, и белки, которые определяют внутриклеточную локализацию и увеличивают время полужизни внутри клеток. В других вариантах изобретения может быть использован опосредуемый рецептором эндоцитоз. Такие методы описаны, например, в публикации Wu et al., 1987 или Wagner et al., 1990. Описание известных способов мечения генов и протоколов генной терапии имеется в публикации Anderson 1992. См. также заявку WO 93/25673 и цитируемые там работы. Более подробное описание метода генной терапии можно найти в публикации Friedmann, Science, 244:1275-1281 (1989); Anderson, Nature, supplement to vol. 392, no 6679, pp.25-30 (1998); Verma, Scientific American:64-84 (1990) и Miller, Nature, 357:455-460 (1992).
Методы скрининга
Проведение эффективной терапии зависит от идентификации эффективных агентов, не обладающих какой-либо заметной токсичностью. Антитела могут быть скринированы на аффинность связывания известными методами. Так, например, для этого могут быть проведены анализы на подвижность в геле, Вестерн-блот-анализ, конкурентный анализ с применением радиоактивного мечения, ко-фракционирование с помощью хроматографии, ко-преципитация, перекрестное связывание, ELISA и т.п., описанные, например, в руководстве Current Protocols in Molecular Biology (1999) John Wiley & Sons, N.Y., которое во всей своей полноте вводится в настоящее описание посредством ссылки.
Для предварительного скрининга на антитела, которые связываются с нужным эпитопом на M-CSF (например, которые блокируют связывание антител RX1, 5Н4, МС1 и/или МС3 с M-CSF), может быть проведен рутинный анализ на перекрестное блокирование, например анализ, описанный в публикации Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed. Harlow & David Lane (1988). Могут быть также проведены рутинные анализы на конкурентное связывание, в которых неизвестное антитело охарактеризовывают по его способности ингибировать связывание M-CSF с M-CSF-специфическим антителом согласно изобретению. При этом может быть использован интактный M-CSF, его фрагменты или линейные эпитопы, такие как эпитопы, представленные аминокислотами 98-105 M-CSF на фигуре 12, либо аминокислоты 65-73 или 138-144 на фигуре 12 (соответствующие эпитопам M-CSF, распознаваемым антителами 5Н4 или МС3). Картирование эпитопов описано в работе Champe et al., J. Biol.Chem., 270:1388-1394 (1995).
Также подразумевается, что эти антитела должны быть протестированы на их воздействие на остеокластогенез, а затем введены животным. Соединения, которые могут быть использованы для профилактики или лечения остеопороза, ассоциированного с метастазами рака, могут быть скринированы с помощью различных анализов. Так, например, антагонист-кандидат может быть сначала охарактеризован в культуральной клеточной системе для определения его способности нейтрализовать M-CSF, индуцирующий остеокластогенез. Такая система может включать совместное культивирование мышиных остеобластов свода черепа и клеток селезенки (Suda et al., Modulation of osteoclast differentiation. Endocr. Rev. 13:6680, 1982; Martin & Udagawa, Trends Endocrinol. Metab. 9:6-12, 1998), совместное культивирование мышиных стромальных клеточных линий (например, МС3Т3-G2/PA6 и ST2) и клеток мышиной селезенки (Udagawa et al., Endocrinology 125:1805 13, 1989) и совместное культивирование клеток ST2 и клеток костного мозга, мононуклеарных клеток периферической крови или альвеолярных макрофагов (Udagawa et al., Proc. Natl. Acad. Sci., USA, 87:7260 4, 1990; Sasaki et al., Cancer Res. 58:462 7, 1998; Mancino et al., J. Surg. Res. 100:18-24, 2001). В отсутствие любого антагониста M-CSF многоядерные клетки, полученные при таком совместном культивировании, удовлетворяют основным критериям остеокластов, таким как тартрат-резистентная кислофосфатазная активность (TRAP, маркерный фермент для остеокластов), присутствие кальцитонинового рецептора, p60C-STC и витронектинового рецептора, а также способность образовывать участки резорбции на кости и дентиновом слое. Присутствие эффективного антагониста M-CSF приводит к ингибированию образования таких многоядерных клеток.
Помимо вышеуказанных систем совместного культивирования способность анти-M-CSF антитела-кандидата ингибировать остеокластогенез может быть оценена в системе, не содержащей стромальных клеток или остеобластов. M-CSF, необходимый для остеокластогенеза, может быть продуцирован путем совместного культивирования с метастатическими раковыми клетками (например, MDA 231) или в кондиционированной среде, полученной от этих раковых клеток (Mancino et al., J. Surg. Res. 0:18-24, 2001), или путем добавления очищенного M-CSF.
Эффективность данного антитела против M-CSF в отношении профилактики или лечения остеопороза, ассоциированного с метастазами рака, может быть также оценена у любого животного с моделью метастазов в кости, известной специалистам. Такими модельными системами являются системы, предусматривающие прямую инъекцию опухолевых клеток в костномозговую полость (Ingall, Proc. Soc. Exp. Biol. Med., 117:819-22, 1964; Falasko, Clin. Orthop. 169:207, 1982), в брюшную аорту крыс (Powles et al., Br. J. Cancer 28:31621, 1973), в боковую хвостовую вену или в левый желудочек мышей (Auguello et al., Cancer Res. 48: 687681, 1988). В отсутствие эффективного антагониста M-CSF остеолитические метастазы в кости, образованные после инъекции опухолевых клеток, могут быть выявлены с помощью радиографии (участков остеолитического поражения кости) или с помощью гистологического и иммуногистохимического анализа (кости и мягких тканей). См. Sasaki et al., Cancer Res. 55:3551 7, 1995; Yoneda et al., J. Clin. Invest. 99:2509 17, 1997. Clohisy & Ramnaraine, Orthop. Res. 16:660 6, 1998, Yin et al., J. Clin. Invest. 103:197 206, 1999. Присутствие эффективного антитела против M-CSF может способствовать предотвращению образования остеолитических метастазов в кости или ингибированию метастазов путем снижения их количества и/или их размера.
Анти-M-CSF антитела согласно изобретению могут быть также использованы для профилактики или лечения метастазов рака. Эффективность анти-M-CSF антитела-кандидата в профилактике или лечении метастазов рака может быть оценена с использованием модели инвазии через базальную мембрану человеческого амниона, описанной в работе Filderman et al., Cancer Res. 52:36616, 1992. Кроме того, может быть также использована любая система животного с моделью метастазов рака различных типов. Такими системами-моделями являются, но не ограничиваются ими, системы, описанные в публикациях Wenger et al., Clin. Exp. Metastasis 19:169 73, 2002; Yi et al., Cancer Res. 62:917 23, 2002; Tsutsumi et al., Cancer Lett. 169:77-85, 2001; Tsingotjidou et al., Anticancer Res. 21:971 8, 2001; Wakabayashi et al., Oncology 59:75 80, 2000; Culp & Kogerman, Front Biosci. 3:D67283, 1998; Runge et al., Invest Radiol. 32:212 7; Shioda et al., J. Surg. Oncol. 64:122 6, 1997; Ma et al., Invest Ophthalmol Vis. Sci. 37:2293 301, 1996; Kuruppu et al., J. Gastroenterol. Hepatol. 11:26 32, 1996. Присутствие эффективного антитела против M-CSF может способствовать предотвращению метастазов рака или ингибированию метастазов путем снижения их количества и/или их размера.
Противоопухолевая активность конкретного антитела против M-CSF или комбинации антител против M-CSF может быть оценена in vivo с использованием подходящего животного-модели. Так, например, моделями для ксеногенной злокачественной лимфомы, которым вводят клетки человеческой лимфомы, являются животные с иммунодефицитом, такие как “голые” мыши или мыши SCID. Эффективность антитела может быть предсказана с помощью анализов, в которых оценивают ингибирование образование опухоли, регрессию опухоли или метастазов и т.п.
В одном из вариантов, относящихся к in vitro анализу, настоящее изобретение относится к способу, предусматривающему стадии (а) контактирования иммобилизованного M-CSF с антителом-кандидатом и (b) детекции связывания антитела-кандидата с M-CSF. В альтернативном варианте изобретения антитело-кандидат подвергают иммобилизации и детектируют связывание с M-CSF. Иммобилизацию осуществляют любым методом, хорошо известным специалистам, включая ковалентное связывание с носителем, со сферами или с хроматографической смолой, а также не ковалентное высокоаффинное взаимодействие, такое как связывание с антителом или связывание со стрептавидином/биотином, где указанное иммобилизованное соединение включает биотиновую молекулу. Детекция связывания может быть осуществлена (i) с использованием радиоактивной метки на неиммобилизованном соединении, (ii) с использованием флуоресцентной метки на неиммобилизованном соединении, (iii) с использованием антитела, иммуноспецифичного к неиммобилизованному соединению, (iv) с использованием метки на неиммобилизованном соединении, возбуждающем флуоресцентный носитель, к которому присоединено иммобилизованное соединение, а также другими методами, хорошо известными и применяемыми на практике.
Антитела, которые модулируют (например, повышают, снижают или блокируют) активность или экспрессию M-CSF, могут быть идентифицированы путем инкубирования предполагаемого модулятора с клеткой, экспрессирующей M-CSF, и определения влияния указанного предполагаемого модулятора на активность или экспрессию M-CSF. Селективность антитела, модулирующего активность полипептида или полинуклеотида M-CSF, может быть оценена путем сравнения его влияния на полипептид или полинуклеотид M-CSF с его влиянием на другие родственные соединения. Селективными модуляторами могут быть, например, антитела и другие белки, пептиды или органические молекулы, которые специфически связываются с полипептидами M-CSF или с нуклеиновой кислотой, кодирующей полипептид M-CSF. Модуляторы активности M-CSF являются терапевтически эффективными для лечения заболеваний и физиологических состояний, развитие которых вызывается нормальной или аберрантной активностью полипептида M-CSF.
В настоящем изобретении также рассматриваются анализы путем высокоэффективного скрининга (HTS) для идентификации антител, которые взаимодействуют с полипептидом M-CSF или ингибируют его биологическую активность (то есть ингибируют ферментативную активность, активность связывания и т.п.). HTS-анализы позволяют осуществлять эффективный скрининг большого числа соединений. Для исследования взаимодействия между полипептидами M-CSF и их партнеров по связыванию применяются клеточные HTS-системы. HTS-анализы были разработаны в целях идентификации “наилучших соединений” (“хитов”) или “преимущественных соединений”, обладающих желательными свойствами, в которые могут быть внесены модификации для улучшения этих желательных свойств. Химические модификации этих “хитов” или “преимущественных соединений” часто основаны на идентифицируемой взаимосвязи структуры/активности между “хитами” и полипептидами M-CSF.
В другом своем аспекте настоящее изобретение относится к способам идентификации антител, которые модулируют (то есть снижают) активность M-CSF, где указанный способ предусматривает контактирование M-CSF с антителом и определение способности данного антитела модифицировать активность M-CSF. Активность в присутствии тестируемого антитела сравнивают с активностью в отсутствие тестируемого антитела. Если активность в образце, содержащем тестируемое антитело, меньше, чем активность в образце, не содержащем тестируемого антитела, то такое антитело будет ингибировать активность M-CSF.
Для функциональной экспрессии рекомбинантных полипептидов существует ряд гетерологичных систем, хорошо известных специалистам. Такими системами являются бактерии (Strosberg et al., Trends in Pharmacological Sciences (1992) 13:95-98), дрожжи (Pausch, Trends in Biotechnology (1997) 15:487-494), клетки насекомых нескольких видов (Vanden Broeck, Int. Rev. Cytology (1996) 164:189-268), клетки амфибий (Jayawickreme et al., Current Opinion in Biotechnology (1997) 8:629-634) и некоторые клеточные линии млекопитающих (СНО, HEK293, COS и т.п.; см. Gerhardt et al., Eur. J. Pharmacology (1997) 334:1-23). Эти примеры не исключают применения других возможных систем клеточной экспрессии, включая клеточные линии, полученные из нематод (заявка РСТ WO 98/37177).
В одном из вариантов изобретения способы скрининга на антитела, модулирующие активность M-CSF, предусматривают контактирование тестируемых антител с полипептидом M-CSF и анализ на присутствие комплекса указанного антитела и M-CSF. В таких анализах, лиганд обычно является меченым. После соответствующего инкубирования свободные лиганды отделяются от лигандов, присутствующих в связанной форме, и количество свободной или несвязанной метки является показателем способности данного антитела связываться с полипептидом M-CSF или M-CSFR.
В другом варианте изобретения используется высокоэффективный скрининг на фрагменты антител или CDR, обладающие подходящей аффинностью связывания с полипептидом M-CSF. Вкратце, большое число различных небольших пептидных тестируемых соединений синтезируют на твердом субстрате. Затем пептидные тестируемые антитела подвергают контакту с полипептидом M-CSF и промывают. Связанные полипептиды M-CSF детектируют методами, хорошо известными специалистам. Очищенные полипептиды согласно изобретению могут быть также нанесены непосредственно на планшеты для их использования в вышеупомянутых методах поиска лекарственных средств. Кроме того, не нейтрализующие антитела могут быть использованы для захвата белка и его иммобилизации на твердом носителе.
Комбинированная терапия
Для повышения эффективности лечения метастазов рака и/или остеопороза, ассоциированного с метастазами рака, при идентификации более чем одного анти-M-CSF антитела, которое является эффективным у животного-модели, может также оказаться предпочтительным использовать смесь двух или более указанных анти-M-CSF антител. Композиции, содержащие одно или несколько анти-M-CSF антител, могут быть введены человеку или млекопитающему, страдающему метастазами рака и/или остеропорозом, ассоциированным с такими метастазами рака, или имеющему предрасположенность к указанным заболеваниям. Для одновременного введения двух терапевтических средств необязательно, чтобы такие средства были введены в одно и то же время или одним и тем же способом, при условии, что это время будет совпадать с периодом времени, в течение которого указанные средства обладают терапевтическим действием. При этом предусматривается одновременное или поочередное введение, например введение в различные дни или недели.
Хотя терапия анти-M-CSF антителом может применяться на всех стадиях рака, однако, такая терапия может быть особенно подходящей при запущенном раке или при метастазах рака. Комбинирование терапии антителом с курсом химиотерапии или лучевой терапии может оказаться предпочтительным для пациентов, которые не проходили химиотерапию, тогда как терапия антителом может быть показана для пациентов, которые проходили один или несколько курсов химиотерапии. Кроме того, терапия антителом позволяет также снижать дозы сопутствующей химиотерапии, особенно у пациентов, которые не очень хорошо переносят токсическое действие химиотерапевтического средства.
Способ согласно изобретению предусматривает введение анти-M-CSF антитела, взятого отдельно, а также в комбинации с другими антителами или с “коктейлем” из других антител. Такие “коктейли” антител могут иметь некоторые преимущества, поскольку они содержат антитела, которые действуют в соответствии с различными эффекторными механизмами, или содержат комбинацию непосредственно действующих цитотоксических антител с антителами, действие которых основано на присущей им иммунной эффекторной функции. Такие антитела, взятые в комбинации друг с другом, могут обладать синергическим терапевтическим действием.
Комбинация антитела RX1 или его производного, антитела Human Engineered™, с другими терапевтическими средствами может оказывать определенное действие на пациента, страдающего опосредованным остеокластами заболеванием, и/или на рост опухоли или метастазы. Так, например, антитело RX1 может быть использовано в целях приготовления лекарственного средства для лечения пациента, страдающего остеолитическим заболеванием, где лечение указанным лекарственным средством комбинируют с лечением антителом против RANKL, растворимым рецептором RANKL, другими ингибиторами RANKL или бисфосфонатами (например, Aredia; Zometa; Clodronate). Альтернативно, антитело против RANKL или бисфосфонат могут быть использованы в целях приготовления лекарственного средства для лечения пациента, страдающего остеолитическим заболеванием, где лечение указанным лекарственным средством комбинируют с лечением антителом RX1 или сконструированным производным человеческого антитела RX1. Такая комбинация может также давать синергический эффект при лечении пациента. Антитело RX1 и другое терапевтическое средство необязательно должны быть введены одновременно. RX1 или сконструированный человеческий вариант и другое терапевтическое средство могут быть введены через 1 день, 1 неделю, 2 недели, 4 недели, 2 месяца, 3 месяца, 6 месяцев, 1 год или через 2 года.
В настоящем изобретении также рассматривается использование RX1 или его производного Human Engineered™ в целях приготовления лекарственного средства для лечения пациента, страдающего остеолитическим заболеванием, где указанное лекарственное средство используется для лечения пациента, который уже проходил курс лечения антителом против RANKL или бисфосфонатами. Термин “предварительное лечение” означает, что данный пациент уже проходил курс лечения за 2 года, 1 год, 6 месяцев, 3 месяца, 2 месяца, 1 месяц, 2 недели, 1 неделю или, по меньшей мере, за один день до лечения антителом RX1 или его вариантом Human Engineered™.
Антитело RX1 или его варианты Human Engineered™ могут быть использованы в комбинации с другими противораковыми терапевтическими средствами. Так, например, антитело RX1 или его сконструированные человеческие варианты могут быть использованы в целях приготовления лекарственного средства для лечения пациента, страдающего раковым заболеванием, где указанное лечение лекарственным средством комбинируют с лечением другими терапевтическими средствами и/или с лечением другими методами, включая, но не ограничиваясь ими, лечение различными химиотерапевтическими средствами, блокаторами андрогена и иммуномодуляторами (например, IL-2, GM-CSF, SLC) или бисфосфонатами (например, Aredia; Zometa; Clodronate); хирургическую операцию; лучевую терапию; химиотерапию цитотоксическими средствами; гормональную терапию (например, тамоксифеном; противоандрогенную терапию); терапию антителом (например, нейтрализующими антителами против RANKL/RANK; нейтрализующим антителом против PTHrP, антителом против Her2, антителом против CD20, антителом против CD40, антителом против CD22, антителом против VEGF, антителом против IGFR-1, антителом против EphA2, антителом против НААН, антителом против ™EFF2 и антителом против CAIX); терапию терапевтическим белком (например, растворимым рецептором RANKL; OPG и ингибиторами PDGF и ММР); терапию низкомолекулярным лекарственным средством (например, ингибитором Src-киназы); терапию киназными ингибиторами рецепторов факторов роста или ингибиторами RANKL; терапию олигонуклеотидами (например, антисмысловой последовательностью RANKL, RANK или PTHrP); генную терапию (например, ингибиторами RANKL или RANK); терапию пептидами (например, мутеинами RANKL), а также описанными здесь белками, пептидами, соединениями и небольшими молекулами.
Антитело RX1 и его варианты Human Engineered™ могут быть использованы в целях изготовления лекарственного средства для лечения пациентов, которые проходили курс лечения вышеупомянутыми терапевтическими средствами.
Термин “цитотоксическое средство” означает вещество, которое ингибирует или предотвращает функцию клеток и/или вызывает деструкцию этих клеток. Этот термин включает радиоактивные изотопы (например,131I,125I,90Y и186Re), химиотерапевтические средства и токсины, такие как ферментативно активные токсины, происходящие от бактерий, грибов, растений или животных, или синтетические токсины или их фрагменты. Термин “нецитотоксический агент” означает вещество, которое не ингибирует или не предотвращает функции клеток и/или не вызывает деструкцию клеток. Термин “нецитотоксический агент” может также включать агент, который, после его активации, может стать цитотоксическим. Нецитотоксическими агентами могут быть сферы, липосомы, матрицы или частицы (см., например, публикации заявок на патент США 2003/0028071 и 2003/0032995, которые вводятся в настоящее описание посредством ссылки). Такие агенты могут быть конъюгированы, связаны, присоединены или ассоциированы с антителом согласно изобретению.
Термин “противораковые химиотерапевтические средства” включает, но не ограничивается ими, алкилирующие агенты, такие как карбоплатин и цисплатин; алкилирующие агенты, содержащие азотный аналог горчичного газа, нитрозомочевинные алкилирующие агенты, такие как кармустин (BCNU); антиметаболиты, такие как метотрексат; фолиновую кислоту; антиметаболиты на основе пуриновых аналогов, меркаптопурин; антиметаболиты на основе пиримидиновых аналогов, такие как фторурацил (5-FU) и гемцитабин (Gemzar®); гормональные антибластомные средства, такие как гозерелин, лейпролид и тамоксифен; природные антибластомные средства, такие как альдеслейкин, интерлейкин-2, доцетаксел, этопозид (VP-16), интерферон-альфа, паклитаксел (Taxol®) и третиноин (ATRA); природные антибластомные антибиотики, такие как блеомицин, дактиномицин, даунорубицин, доксорубицин, дауномицин и митомицины, включая митомицин С; и винкаалкалоидные природные антибластомные средства, такие как винбластин, винкристин, виндезин; гидроксимочевину; ацеглатон, адриамицин, ифосфамид, эноцитабин, эпитиостанол, акларубицин, анцитабин, нимустин, гидрохлорид прокарбазина, карбоквон, карбоплатин, кармофур, хромомицин А3, противоопухолевые полисахариды, противоопухолевые тромбоцитарные факторы, циклофосфамид (Cytoxin®), шизофиллан, цитарабин (арабинозид цитозина), дакарбазин, тиоинозин, тиотепу, тегафур, доластатины, аналоги доластатина, такие как ауристатин, СРТ-11 (иринотекан), митозантрон, винорелбин, тенипозид, аминоптерин, карминомицин, эсперамицины (см., например, патент США №4675187), неокарзиностатин, OK-432, блеомицин, фуртулон, броксуридин, бусульфан, хонван, пепломицин, бестатин (Ubenimex®), интерферон-β, мепитиостан, митобронитол, мелфалан, ламининовые пептиды, лентинан, экстракт Coriolus versicolor, тегафур/урацил, эстрамустин (эстроген/мехлоретамин).
Кроме того, другими агентами, используемыми в качестве терапевтических средств для лечения пациентов с раковым заболеванием, являются ЕРО, G-CSF, ганцикловир; антибиотики, лейпролид; меперидин; зидовудин (AZT); интерлейкины 1-18, включая их мутанты и аналоги; интерфероны или цитокины, такие как интерфероны α, β и γ; гормоны, такие как лютеинизирующий релизинг-гормон (LHRH) и их аналоги, и гонадотропин релизинг-гормон (GnRH); факторы роста, такие как трансформирующий фактор роста -β (TGF-β), фактор роста фибробластов (FGF), факторы роста нервных тканей (NGF); релизинг-фактор гормона роста (GHRF), эпидермальный фактор роста (EGF), гомологический фактор, активирующий фактор роста фибробластов (FGFHF); фактор роста гепатоцитов (HGF) и инсулиноподобный фактор роста (IGF); фактор некроза опухоли -α и -β (TNF-α и -β); ингибирующий инвазию фактор-2 (IIF-2); белки морфогенеза кости 1-7 (ВМР 1-7); соматостатин; тимозин-α-1; γ-глобулин; супероксиддисмутаза (SOD); факторы комплемента; антиангиогенные факторы; антигенные вещества; и пролекарства.
Термин “пролекарство” означает предшественник или производное фармацевтически активного вещества, которое, по сравнению с родительским лекарственным средством, обладает меньшей цитотоксичностью или вообще не обладает нецитотоксичностью по отношению к опухолевым клеткам и способны ферментативно или гидролитически активироваться или превращаться в более активную зрелую форму. См., например, Wilman, “Prodrugs in Cancer Chemotherapy” Biochemical Society Transactions, 14, pp.375-382, 615th Meeting Belfast (1986) и Stella et al. “Prodrugs: A Chemical Approach to Targeted Drug Delivery”, Directed Drug Delivery, Borchardt et al., (ed.), pp.247-267, Humana Press (1985). Пролекарствами являются, но не ограничиваются ими, фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, пролекарства, модифицированные D-аминокислотой, гликозилированные пролекарства, β-лактам-содержащие пролекарства; пролекарства, необязательно содержащие замещенный феноксиацетамид, или пролекарства, необязательно содержащие замещенный фенилацетамид; 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примерами цитотоксических лекарственных средств, которые могут быть дериватизированы с получением пролекарственной формы для ее использования в настоящем изобретении, являются, но не ограничиваются ими, химиотерапевтические агенты, описанные выше.
Введение и получение
Анти-M-CSF антитела, используемые для практического осуществления способа согласно изобретению, могут быть приготовлены в виде фармацевтических композиций, содержащих носитель, подходящий для осуществления доставки нужного лекарственного средства. Подходящими носителями являются любые вещества, которые, при их объединении с анти-M-CSF антителами, сохраняют противоопухолевую функцию антитела и не реагируют с иммунной системой индивидуума. Примерами являются, но не ограничиваются ими, любые различные стандартные фармацевтические носители, такие как стерильные забуференные фосфатом физиологические растворы, бактериостатическая вода и т.п. Могут быть использованы различные водные носители, например вода, забуференная вода, 0,4% физиологический раствор, 0,3% глицин и т.п., и эти носители могут включать другие белки, повышающие стабильность, такие как альбумин, липопротеин, глобулин и т.п., подвергаемые слабой химической модификации или т.п.
Терапевтические препараты антитела приготавливают путем смешивания антитела, имеющего нужную степень чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed.(1980)) для их хранения в форме лиофилизованных препаратов или водных растворов. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; фениловый, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (содержащие примерно менее чем 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы с металлами (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как Твин™, Плюроники™ или полиэтиленгликоль.
Рассматриваемый здесь препарат может также содержать более чем одно активное соединение, показанное для данной терапии, предпочтительно соединение с комплементарной активностью, которое не оказывает негативного влияния на другое соединение. Так, например, может оказаться желательным использовать иммунодепрессант. Такие молекулы являются подходящими для их использования в комбинации с другими средствами в количестве, эффективном для достижения нужного эффекта.
Активные ингредиенты могут быть также заключены в микрокапсулу, полученную, например методами коацервации или межфазной полимеризации, например микрокапсулу, содержащую гидроксиметилцеллюлозу или желатин, и полиметилметакрилатную микрокапсулу, соответственно, в коллоидных системах для доставки лекарственных средств (например, в липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методы описаны в руководстве Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed.(1980).
Препараты, предназначенные для in vivo введения, должны быть стерильными. Это может быть легко достигнуто путем фильтрации через стерильные фильтрующие мембраны.
Антитело вводят любым подходящим методом, включая парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное введение, и если это необходимо, оно может быть введено местно или в пораженный участок. Парентеральные способы введения включают внутривенное, внутриартериальное, внутрибрюшинное, внутримышечное, чрезкожное или подкожное введение. Кроме того, указанное антитело может быть введено путем периодического вливания, а в частности, со снижением доз антитела. Предпочтительно, чтобы такая доза была введена путем инъекции, а наиболее предпочтительно путем внутривенных или подкожных инъекций, в зависимости от того, является ли такое введение кратковременным или продолжительным. Рассматриваются и другие методы введения, включая местное введение, а в частности чрезкожное введение, введение через слизистую, ректальное введение, пероральное введение или введение в определенный участок, например, с помощью катетера, помещенного вблизи от нужного участка.
Композиции согласно изобретению могут быть приготовлены в виде, например, гранул, порошков, таблеток, капсул, сиропов, суппозиториев, инъекций, эмульсий, эликсиров, суспензий или растворов. Композиции согласно изобретению могут быть предназначены для различных путей введения, например для перорального введения, интраназального введения, ректального введения, подкожной инъекции, внутривенной инъекции, внутримышечных инъекций или внутрибрюшинной инъекции. Нижеследующие лекарственные формы приводятся лишь в иллюстративных целях и не должны рассматриваться как ограничение настоящего изобретения.
Приемлемыми твердыми лекарственными формами для перорального, трансбуккального и подъязычного введения являются порошки, суспензии, гранулы, таблетки, драже, капсулы, гелевые капсулы и миникапсулы. Эти препараты могут быть получены, например, путем смешивания одного или нескольких соединений согласно изобретению и фармацевтически приемлемых солей или их таутомеров, и, по меньшей мере, одной добавкой, такой как крахмал или другая добавка. Подходящими добавками являются сахароза, лактоза, целлюлоза, сахар, маннит, мальтит, декстран, крахмал, агар, альгинаты, хитины, хитозаны, пектины, трагакантовая камедь, аравийская камедь, желатины, коллагены, казеин, альбумин, синтетические или полусинтетические полимеры или глицериды. Для облегчения введения пероральные формы могут содержать, но необязательно, и другие ингредиенты, такие как неактивный разбавитель или замасливатели, такие как стеарат магния, консерванты, такие как парабен или сорбиновая кислота, антиоксиданты, такие как аскорбиновая кислота, токоферол или цистеин, дезинтегрирующие агенты, связующие вещества, загустители, буферы, подсластители, отдушки или ароматизирующие агенты. Таблетки или драже могут также иметь подходящее покрытие из известных материалов.
Жидкие препараты для перорального введения могут быть приготовлены в форме фармацевтически приемлемых эмульсий, сиропов, эликсиров, суспензий и растворов, которые могут содержать неактивный разбавитель, такой как вода. Фармацевтические композиции и лекарственные средства могут быть получены в виде жидких суспензий или растворов с использованием стерильных жидкостей, таких как, но не ограничивающихся ими, масло, вода, спирт и их комбинации. В композиции для перорального или парентерального введения могут быть добавлены фармацевтически приемлемые поверхностно-активные вещества, суспендирующие агенты и эмульгирующие агенты.
Как указывалось выше, суспензии могут включать масла. Такими маслами являются, но не ограничиваются ими, арахисовое масло, кунжутное масло, масло семян хлопчатника, кукурузное масло и оливковое масло. Препарат типа суспензии может также содержать сложные эфиры жирных кислот, такие как этилолеат, изопропилмиристат, глицериды жирных кислот и ацетилированные глицериды жирных кислот. Препараты типа суспензий могут также содержать спирты, такие как, но не ограничивающиеся ими, этанол, изопропиловый спирт, гексадециловый спирт, глицерин, и пропиленгликоль. Такие суспензии могут также содержать эфиры, такие как, но не ограничивающиеся ими, полиэтиленгликоль, углеводороды нефти, такие как минеральное масло и вазелиновое масло, а также воду.
Фармацевтические препараты и лекарственные средства для интраназального введения могут быть приготовлены в виде спрея или аэрозоля, содержащего соответствующий(ие) растворитель(и), и необязательно, другие соединения, такие как, но не ограничивающиеся ими, стабилизаторы, противомикробные агенты, антиоксиданты, рН-модификаторы, поверхностно-активные вещества, модификаторы биологической доступности и их комбинации. Пропеллент для аэрозольной композиции может включать сжатый воздух, азот, двуокись углерода или углеводородный низкопипящий растворитель.
Формы для введения путем инъекции обычно включают водные суспензии или масляные суспензии, которые могут быть получены с использованием подходящего диспергирующего или смачивающего агента и суспендирующего агента. Лекарственные формы для инъекций могут быть получены в жидкой фазе или в форме суспензии, приготовленной с использованием растворителя или разбавителя. Приемлемыми растворителями или носителями являются стерилизованная вода, раствор Рингера, или изотонический водный солевой раствор. Альтернативно, в качестве растворителей или суспендирующих агентов могут быть использованы стерильные масла. Предпочтительными являются нелетучие масла или жирные кислоты, включая натуральные или синтетические масла, жирные кислоты, моно-, ди- или триглицериды.
Фармацевтические препараты и лекарственные средства для инъекций могут быть приготовлены в виде порошков, подходящих для последующего их разведения соответствующим раствором, описанным выше. Примерами таких порошков являются, но не ограничиваются ими, порошки, осушенные вымораживанием, вихревым размешиванием или распылением, аморфные порошки, гранулы, преципитаты или частицы. Препараты для инъекции могут, но необязательно, содержать стабилизаторы, рН-модификаторы, поверхностно-активные вещества, модификаторы биологической доступности и их комбинации.
Фармацевтические препараты и лекарственные средства для ректального введения могут быть приготовлены в форме суппозиториев, мази, клизм, таблеток или кремов для высвобождения данного соединения в тонкий кишечник, сигмовидный изгиб ободочной кишки и/или в прямую кишку. Суппозитории для ректального введения получают путем смешивания одного или нескольких соединений согласно изобретению или фармацевтически приемлемых солей или таутомеров этих соединений с фармацевтически приемлемыми наполнителями, например с маслом какао или полиэтилегликолем, которые находятся в твердой фазе при нормальной температуре хранения, и в жидкой фазе при температуре, подходящей для высвобождения лекарственного средства во внутрь организма, например в прямую кишку. Для приготовления композиции типа мягких желатиновых капсул или суппозиториев могут быть также использованы масла. Для приготовления препаратов типа суспензий могут быть использованы вода, физиологический раствор, водная декстроза, растворы других родственных сахаров и глицерины, и такие суспензии могут дополнительно содержать суспендирующие агенты, такие как пектины, карбомеры, метилцеллюлоза, гидроксипропилцеллюлоза или карбоксиметилцеллюлоза, а также буферы и консерванты.
Могут быть получены препараты для пролонгированного высвобождения. Подходящими примерами препаратов для пролонгированного высвобождения могут служить полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, где указанные матрицы могут быть получены в виде формованных изделий, например пленок или микрокапсул. Примерами матриц для препаратов пролонгированного высвобождения являются сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт, полилактиды (патент США №3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, неразлагаемый сополимер этилена и винилацетата, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как Lupron Depot™ (микросферы для инъекции, состоящие от сополимера молочной кислоты и гликолевой кислоты и из ацетата лейпролида), и поли-D-(-)3-гидроксимасляная кислота. Полимеры, такие как сополимеры этилена и винилацетата и сополимеры молочной кислоты и гликолевой кислоты, способны высвобождать молекулы в течение более 100 дней, тогда как гидрогели высвобождают белки за более короткие периоды времени. Хотя инкапсулированные антитела присутствуют в организме в течение длительного периода времени, однако, они могут денатурироваться или агрегироваться в условиях влажности при 37°С, что приводит к потере их биологической активности и возможному изменению их иммуногенности. Для стабилизации этих антител, в зависимости от конкретного механизма их действия, могут быть разработаны рациональные стратегии. Так, например, если механизмом агрегации является образование межмолекулярной S-S-связи посредством тио-дисульфидного обмена, то стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотного раствора, регуляции влажности, применения соответствующих добавок и разработки соответствующих составов полимерных матриц.
В соответствии с настоящим изобретением могут быть получены быстродействующие композиции, композиции немедленного высвобождения, композиции длительного действия или композиции пролонгированного высвобождения, описанные в настоящей заявке. Таким образом, могут быть также приготовлены фармацевтические композиции с регулируемым высвобождением или замедленным высвобождением лекарственного средства.
Композиции согласно изобретению могут быть также включены, например, в мицеллы или липосомы или в другие инкапсулированные формы и могут быть введены в виде формы с замедленным высвобождением, что позволяет обеспечить их длительное хранение и/или пролонгированную доставку. Поэтому такие фармацевтические препараты и лекарственные средства могут быть спрессованы в гранулы или цилиндрические формы и имплантированы внутримышечно или подкожно в качестве “депо”-препарата для инъекций или в качестве имплантатов, таких как стенты. В этих трансплантатах могут быть использованы известные инертные материалы, такие как силиконы или биологически разлагаемые полимеры.
Помимо вышеописанных репрезентативных унифицированных лекарственных форм в настоящем изобретении рассматриваются фармацевтически приемлемые наполнители или носители, которые, по существу, известны специалистам в данной области. Такие наполнители и носители описаны, например, в руководстве “Remingtons Pharmaceutical Sciences”, Mack Pub. Co., New Jersy (1991), которое вводится в настоящее описание посредством ссылки.
Конкретные дозы лекарственного средства могут быть скорректированы в зависимости от тяжести заболевания, возраста, массы тела, общего состояния здоровья пациента, его пола и режима питания, а также от интервалов между введениями доз, способа введения, скорости выведения лекарственного средства и комбинации используемых лекарственных средств. Любые из вышеуказанных лекарственных форм, содержащих эффективные количества лекарственного средства, могут быть получены путем рутинного экспериментирования, а поэтому они входят в объем настоящего изобретения.
Анти-M-CSF антитела, используемые в качестве терапевтических средств для лечения метастазов рака или остеопороза, ассоциированного с метастазами рака, обычно получают, по существу, в свободной форме, то есть не содержащей других природных иммуноглобулинов или других биологических молекул. Предпочтительные анти-M-CSF антитела также имеют минимальную токсичность при их введении млекопитающему, страдающему метастазами рака и/или остеопорозом, ассоциированным с метастазами рака, или имеющему предрасположенность к таким заболеваниям.
Композиции согласно изобретению могут быть стерилизованы стандартными хорошо известными методами. Полученные растворы могут быть упакованы для непосредственного применения, или отфильтрованы в асептических условиях и лиофилизованы, и такие лиофилизованные препараты, перед их введением, смешивают со стерильным растворителем. Указанные композиции могут содержать фармацевтически приемлемые вспомогательные добавки, необходимые для создания условий, близких к физиологическим условиям, такие как агенты для коррекции рН или забуферивающие агенты, агенты, придающие изотоничность и т.п., например ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция и стабилизаторы (например, 20% мальтоза и т.п.).
Анти-M-CSF антитела согласно изобретению могут быть также введены с помощью липосом, которые представляют собой небольшие везикулы, состоящие из липидов различных типов, фосфолипидов и/или поверхностно-активного вещества, которые могут быть использованы для доставки лекарственного средства (например, описанных здесь антител и, необязательно, химиотерапевтических агентов). Липосомы включают эмульсии, пены, мицеллы, нерастворимые монослои, фосфолипидные дисперсии, ламеллярные слои и т.п. и могут служить в качестве везикул для доставки анти-M-CSF антител в конкретную ткань, а также для увеличения времени полужизни данной композиции. Различные методы получения липосом описаны, например, в патентах США №№4837028 и 5019369, которые вводятся в настоящее описание посредством ссылки.
Липосомы, содержащие антитела, могут быть получены известными методами, такими как методы, описанные в публикациях Thstein et al., Proc. Natl. Acad. Sci., USA, 82: 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci., USA, 77: 4030 (1980); и в патентах США №№4485045 и 4544545. Липосомы с продолжительным временем циркуляции в кровотоке описаны в патенте США №5013556. Особенно эффективные липосомы могут быть приготовлены методом выпаривания с обращенной фазой, с получением липидной композиции, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизированный фосфатидилэтаноламин (ПЭГ-ФЭ). Липосомы подвергают экструзии через фильтры с определенным размером пор, в результате чего получают липосомы нужного диаметра. Fab'-фрагменты антитела согласно изобретению могут быть конъюгированы с липосомами, как описано в работе Martin et al., J. Biol.Chem. 257: 286-288 (1982), посредством реакции дисульфидного обмена. Такая липосома может содержать, но необязательно, химиотерапевтический агент (такой как доксорубицин) [см., например, Gabizon et al., J. National Cancer Inst. 81(19):1484 (1989)].
Концентрация анти-M-CSF антитела в данной композиции может широко варьироваться, то есть она может составлять примерно менее чем 10%, обычно, по меньшей мере, около 25%, и примерно до 75% или 90% по массе композиции, и может быть скорректирована, главным образом, по объему жидкости, вязкости и т.п. в соответствии с конкретно выбранным способом введения. Существующие методы получения композиций для перорального, местного и парентерального введения хорошо известны или очевидны специалистам и подробно описаны, например, в руководстве Remington's Pharmaceutical Sciences, Mack Publishing. Co., Easton, PA (1995), которое вводится в настоящее описание посредством ссылки.
Определение эффективного количества композиции согласно изобретению для лечения метастазов рака и/или остеопороза, ассоциированного в метастазами рака, у пациента может быть осуществлено стандартными эмпирическими методами, хорошо известными специалистам. Так, например, in vivo нейтрализующая активность сыворотки, взятой от пациента, которому была введена доза анти-M-CSF антитела, может быть оценена с помощью анализа, в котором может быть определена in vitro способность этой сыворотки блокировать M-CSF-индуцированную пролиферацию и жизнеспособность мышиных моноцитов (CD11b+-клеток, то есть субпопуляции CD11-клеток, которые экспрессируют высокие уровни рецептора для M-CSF), как описано в работе Cenci et al., J.Clin. Invest. 1055: 1279-87, 2000.
Композиции согласно изобретению вводят млекопитающему, который уже страдает от метастазов рака или от остеопороза, ассоциированного с метастазами рака, или имеет предрасположенность к таким заболеваниям, в количестве, достаточном для предупреждения или, по меньшей мере, для прекращения развития метастазов рака или остеопороза, ассоциированного с метастазами рака. Количество, необходимое для достижения этих целей, называется “терапевтически эффективным количеством”. Эффективные количества анти-M-CSF антитела могут варьироваться и зависят от тяжести заболевания, от массы тела и общего состояния здоровья пациента, подвергаемого лечению, но обычно, такие количества составляют в пределах примерно от 1,0 мкг/кг до 100 мг/кг массы тела, или примерно от 10 мкг/кг до 30 мг/кг, но чаще всего используются дозы примерно от 1,0 мкг/кг до 10 мг/кг или примерно от 1 мкг/кг до 10 мг/кг. Так, например, начальная доза антитела-кандидата, которая может быть введена пациенту один раз или несколько раз или путем непрерывной инфузии, составляет примерно от 10 мкг/кг до 5 мг/кг, или от 30 мкг/кг до 1 мг/кг. Указанные дозы могут быть введены ежедневно или через день, еженедельно или менее часто, в зависимости от восприимчивости данного заболевания или переносимости этой дозы пациентом. При этом может оказаться необходимым поддержание уровня доз в течение более длительного периода времени, такого как 4, 5, 6, 7, 8, 10 или 12 недель или более до тех пор, пока не будет достигнуто нужное ослабление симптомов заболевания, и если необходимо, эти дозы могут быть скорректированы. Преимущество такой терапии заключается в том, что она легко поддается мониторингу с применением стандартных методов и анализов.
Разовое или многократное введение композиций может быть осуществлено с использованием доз и режима их введения, выбранного лечащим врачом. Соответствующая доза антитела, используемая для профилактики или лечения заболевания, будет зависеть от типа заболевания, подвергаемого лечению и определенного выше, от тяжести и течения данного заболевания, независимо от того, вводится ли это антитело в превентивных или в терапевтических целях, от предшествующей терапии, от клинической истории болезни пациента и его восприимчивости к данному антителу и от назначения врача. Указанное антитело соответствующим образом вводят пациенту в течение одного курса лечения или в течение нескольких курсов лечения.
В любом случае, данные композиции должны содержать определенное количество анти-M-CSF антитела, обеспечивающего доставку этого антитела в период времени, достаточный для эффективного предупреждения или минимизации тяжести метастизирующего ракового заболевания и/или остеопороза, ассоциированного с метастазами рака. Композиции согласно изобретению могут быть введены отдельно или в виде комплексной терапии в сочетании с другим известным терапевтическим средством, обычно используемым специалистами для лечения метастазов рака и/или остеопороза, ассоциированного с метастазами рака.
Композиция антитела может быть приготовлена, разделена на дозы и введена в соответствии с хорошо разработанной стандартной медицинской практикой. Для осуществления этих целей учитываются такие факторы, как конкретное расстройство, подвергаемое лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного пациента, этиология данного расстройства, участок, в который необходимо введение лекарственного средства, способ введения, схема введения и другие факторы, известные специалистам-медикам. Терапевтически эффективное количество вводимого антитела может быть определено с учетом вышеуказанных факторов и является минимальным количеством, необходимым для предупреждения, улучшения динамики или лечения M-CSF-опосредованного заболевания, состояния или расстройства, а в частности для уничтожения раковых клеток, а более конкретно, для лечения метастазирующего опухолевого заболевания. Такое количество должно быть предпочтительно более низким, чем то количество, которое оказывает токсическое действие на хозяина или сообщает хозяину значительно большую восприимчивость к инфекциям.
Данное антитело может быть, но необязательно, приготовлено в комбинации с одним или несколькими веществами, обычно используемыми для предупреждения или лечения рассматриваемого расстройства. Так, например, при раке указанное антитело может быть введено в комбинации с химиотерапевтическим средством или в системе ADEPT, описанной выше. Эффективное количество таких веществ зависит от количества антитела, присутствующего в данной композиции, от типа заболевания, состояния или расстройства или применяемого лечения, и других обсуждаемых выше факторов. Эти вещества обычно используются в тех же самых дозах и в соответствии с теми же способами введения, которые были описаны выше, или примерно в дозах, составляющих от 1 до 99% от обычно используемых доз.
В другом своем варианте настоящее изобретение относится к промышленному изделию, содержащему вещества, используемые для лечения заболеваний, расстройств или состояний, описанных выше, включая лечение рака. Такое промышленное изделие содержит контейнер и вкладыш. Подходящими контейнерами являются, например, флаконы, сосуды, шприцы и тест-пробирки. Эти контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Указанный контейнер содержит композицию, которая является эффективной для лечения указанного состояния, и может иметь стерильный доступ (например, такой контейнер может представлять собой мешок с раствором для внутривенного введения или сосуд с пробкой, протыкаемой иглой для подкожных инъекций). Активным агентом в указанной композиции является антитело согласно изобретению. На этикетке, наклеенной на контейнер, или в инструкции, прилагаемой к этому контейнеру, указано, что такая композиция используется для лечения данного конкретного заболевания. Указанное промышленное изделие может дополнительно содержать второй контейнер, включающий фармацевтически приемлемый буфер, такой как забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать и другие материалы, необходимые для коммерческого производства и для потребителя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку, содержащие инструкции по применению.
Иммунотерапия
Анти-M-CSF антителами, используемыми для лечения пациентов, страдающих раком, являются антитела, способные инициировать сильный иммунный ответ против опухоли, и антитела, способные регулировать цитотоксичность. В соответствии с этим, анти-M-CSF антитела могут вызывать лизис опухолевых клеток по механизмам комплемент-опосредуемой или антитело-зависимой клеточной цитотоксичности (ADCC), и для осуществления этих механизмов необходимо взаимодействие интактной Fc-части молекулы иммуноглобулина с сайтами Fc-рецептора эффекторных клеток или белков комплемента. Кроме того, анти-M-CSF антитела, которые оказывают прямое биологическое действие на рост опухоли, могут быть использованы для осуществления настоящего изобретения. Возможными механизмами, благодаря которым могут осуществляться прямые функции таких цитотоксических антител, являются ингибирование клеточного роста, модуляция дифференцировки клеток, модуляция профилей действия факторов ангиогенеза опухоли и индуцирования апоптоза. Механизм, благодаря которому конкретное анти-M-CSF антитело оказывает противоопухолевое действие, может быть определен с помощью любого из ряда in vitro анализов, разработанных для определения ADCC, ADMMC, комплемент-опосредуемого клеточного лизиса и т.п. и, по существу, известных специалистам.
В одном из вариантов изобретения иммунотерапию осуществляют с использованием антител, которые имеют более высокую аффинность по отношению к мембраносвязанной форме M-CSF (M-CSFα), чем выбранные формы M-CSF. Так, например, могут быть получены антитела, которые специфически связываются в сайте отщепления M-CSFα или в близлежащем сайте, или с частью M-CSFα, смежной с мембраной. Такие антитела могут также эффективно ингибировать отщепление и высвобождение растворимой активной части M-CSFα.
Указанные анти-M-CSF антитела могут быть введены в их “оголенной” форме или в неконъюгированной форме, либо они могут быть конъюгированы с терапевтическими средствами. В одном из вариантов изобретения анти-M-CSF антитела конъюгированы с радиосенсибилизирующими агентами. Используемый здесь термин “радиосенсибилизатор” означает молекулу, а предпочтительно молекулу с низкой молекулярной массой, которую вводят животным в терапевтически эффективных количествах в целях повышения восприимчивости радиосенсибилизируемых клеток этих животных к электромагнитному излучению и/или в целях повышения восприимчивости этих животных к лечению заболеваний, проводимому с применением электромагнитного излучения. Заболеваниями, которые могут быть подвергнуты лечению электромагнитным излучением, являются неопластические заболевания, доброкачественные и злокачественные опухоли и раковые клетки.
Используемые здесь термины “электромагнитное излучение” и “излучение” включают, но не ограничиваются ими, излучение на длине волны от 10-20 до 100 метров. В предпочтительных вариантах настоящего изобретения применяется гамма-излучение (10-20-10-13 м), рентгеновское излучение (10-12-10-9 м), ультрафиолетовое излучение (10-400 нм), излучение в диапазоне видимого света (400 нм-700 нм), инфракрасное излучение (700 нм-1,0 мм) и микроволновое излучение (1 мм-30 см).
Известно, что радиосенсибилизаторы повышают чувствительность раковых клеток к токсическому действию электромагнитного излучения. В настоящее время, радиосенсибилизаторы, активированные электромагнитным рентгеновским излучением, применяются во многих схемах лечения рака. Примерами активированных рентгеновским излучением радиосенсибилизаторов являются, но не ограничиваются ими, метронидазол, мизонидазол, дезметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин С, RSU 1069, SR 4233, EO9, RB6145, никотинамид, 5-бромдезоксиуридин (BUdR), 5-иоддезоксиуридин (IUdR), бромдезоксицитидин, фтордезоксиуридин (FUdR), гидроксимочевина, цисплатин и их терапевтически эффективные аналоги и производные.
Фотодинамическая терапия (PDT) рака предусматривает облучение видимым светом, где в качестве активатора видимого света используется сенсибилизирующий агент. Примерами фотодинамических радиосенсибилизаторов являются, но не ограничиваются ими, производные гематопорфирина, Photofrin(r), производные бензопорфирина, NPe6, олово-содержащий этиопорфирин (SnET2), феоборбид-α, бактериохлорофилл-α, нафталоцианины, фталоцианины, цинк-содержащий фталоцианин и их терапевтически эффективные аналоги и производные.
В другом варианте изобретения указанное антитело может быть конъюгировано с рецептором (таким как стрептавидин) в целях его использования для предварительной доставки в опухоль, где указанный конъюгат “антитело-рецептор” вводят пациенту, после чего несвязанный конъюгат удаляют из кровотока под действием очищающего агента, а затем вводят лиганд (например, авидин), конъюгированный с цитотоксическим средством (например, радионуклидом).
Настоящее изобретение также относится к вышеописанным антителам в детектируемо меченной форме. Антитела могут быть детектируемо помечены с использованием радиоизотопов, аффинных меток (таких как биотин, авидин и т.п.), ферментативных меток (таких как пероксидаза хрена, щелочная фосфатаза и т.п.), флуоресцентных, люминесцентных или биолюминесцентных меток (таких как ФИТЦ или родамин и т.п.), атомов парамагнетиков и т.п. Процедуры осуществления такого мечения хорошо известны специалистам, см., например, Sternberg L.A. et al., J. Histochem. Cytochem. 18:315 (1970); Bayer E.A. et al., Meth. Enzym. 62:308 (1979); Engval E. et al., Immunol. 109:129 (1972); Goding J.W. J. Immunol. Meth. 13:215 (1976)).
Термин “метка” означает детектируемое соединение или детектируемую композицию, прямо или опосредованно конъюгированные с антителом. Такая метка сама по себе может быть детектируемой (например, радиоизотопные метки или флуоресцентные метки), или, в случае ферментативной метки, она может катализировать химическую модификацию детектируемого субстратного соединения или композиции. Альтернативно, сама метка может быть недетектируемой, но может представлять собой элемент, связанный с другим детектируемым агентом (например, с эпитопной меткой или с одним из пары партнеров по связыванию, такой как биотин-авидин и т.п.). Таким образом, антитело может содержать метку или детектируемый агент, который облегчает выделение этого антитела, и способы идентификации антител согласно изобретению включают стадию выделения M-CSF/антитела посредством взаимодействия с меткой или с детектируемым агентом.
Репрезентативные терапевтические иммуноконъюгаты содержат описанное здесь антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагменты), или радиоактивный изотоп (то есть радиоактивный конъюгат). Гибридные белки более подробно описаны ниже.
Получение иммуноконъюгатов описано в патенте США №6306393. Иммуноконъюгаты могут быть получены путем непрямого конъюгирования терапевтического средства с компонентом-антителом. Общие методы описаны у Shih et al., Int. J. Cancer 41:832-839 (1988); Shih et al., Int. J. Cancer. 46:1101-1106 (1990) и Shih et al., в патенте США №5057313. Такой общий метод включает взаимодействие компонента-антитела, имеющего окисленную углеводную часть, с полимером-носителем, который имеет, по меньшей мере, одну свободную функциональную аминогруппу, и к которому присоединены различные вещества, такие как лекарственное средство, токсин, хелатообразующее вещество, борный компонент или другое лекарственное средство. Указанное взаимодействие сначала приводит к образованию связи шиффова основания (имина), которая может быть стабилизирована путем восстановления до вторичного амина с образованием конечного конъюгата.
Полимером-носителем предпочтительно является аминодекстран или полипептид, имеющий, по меньшей мере, 50 аминокислотных остатков, хотя могут быть также использованы и другие, по существу, эквивалентные полимеры-носители. В целях облегчения введения и доставки лекарственного средства для эффективной терапии предпочтительно, чтобы конечный иммуноконъюгат растворялся в водном растворе, таком как сыворотка млекопитающего. Так, например, солюбилизирующие функциональные группы на полимере-носителе будут улучшать растворимость конечного иммуноконъюгата в сыворотке. В частности, предпочтительным носителем является аминодекстран.
Процедуру получения иммуноконъюгата с аминодекстрановым носителем обычно начинают с декстранового полимера, а предпочтительно декстрана, имеющего среднюю молекулярную массу примерно 10000-100000. Этот декстран подвергают реакции взаимодействия с окислителем в целях осуществления регулируемого окисления части его углеводных колец для образования альдегидных групп. Такое окисление обычно проводят с использованием гликолитических химических реагентов, таких как NaIO4, в соответствии со стандартными процедурами.
Затем окисленный декстран подвергают взаимодействию с полиамином, предпочтительно с диамином, а более предпочтительно с моно- или полигидроксидиамином. Подходящими аминами являются этилендиамин, пропилендиамин или другие подобные полиметилендиамины, диэтилентриамин или подобные полиамины, 1,3-диамино-2-гидроксипропан или другие подобные гидроксилированные диамины или полиамины и т.п. Для гарантии, по существу, полного превращения альдегидных функциональных групп в группы шиффовых оснований используют избыток амина по отношению к альдегидным группам декстрана.
Для осуществления восстановительной стабилизации полученного промежуточного шиффова основания используют восстановитель, такой как NaBH4, NaBH3, CN или т.п. Полученный аддукт может быть очищен путем его пропускания через колонку стандартных размеров для удаления перекрестносшитых декстранов.
Для введения функциональных аминогрупп могут быть также применены и другие стандартные методы дериватизации, например реакция взаимодействия с бромцианом, а затем с диамином.
После этого аминодекстран подвергают реакции взаимодействия с вводимым производным конкретного лекарственного средства, токсином, хелатообразующим веществом, иммуномодулятором, борным компонентом или другим терапевтическим средством в активированной форме, предпочтительно с карбоксил-активированным производным, полученным стандартным способом, например, с использованием дициклогексилкарбодиимида (DCC) или его водорастворимого варианта, в результате чего получают промежуточный аддукт.
Альтернативно, полипептидные токсины, такие как противовирусный белок фитолакки или А-цепь рицина и т.п., могут быть присоединены к аминодекстрану путем глутаральдегидной конденсации или посредством реакции взаимодействия активированных карбоксильных групп на белке с аминами на аминодекстране.
Хелатообразующие агенты для радиоактивных металлов или усилители магнитного резонанса хорошо известны специалистам. Типичными агентами являются производные этиледиаминтетрауксусной кислоты (EDTA) и диэтилентриаминпентауксусной кислоты (DTPA). Обычно, эти хелатообразующие агенты имеют на своей боковой цепи группы, посредством которых такой хелатообразующий агент может присоединяться к носителю. Такими группами являются, например, бензилизотиоцианат, посредством которого DTPA или EDTA могут быть присоединены к аминогруппе носителя. Альтернативно, карбоксильные группы или аминогруппы на хелатообразующем агенте могут быть присоединены к носителю посредством активации или дериватизации с последующим присоединением в соответствии с методами, хорошо известными специалистам.
Борные компоненты, такие как карбораны, могут быть присоединены к компонентам-антителам стандартными методами. Так, например, карбораны могут быть получены с использованием карбоксильных функциональных групп, находящихся на боковых цепях, методами, хорошо известными специалистам. Присоединение таких карборанов к носителю, например к аминодекстрану, может быть осуществлено посредством активации карбоксильных групп карборанов и конденсации с аминами на носителе с получением промежуточного конъюгата. Затем такие промежуточные конъюгаты присоединяют к компонентам-антителам с получением терапевтически приемлемых иммуноконъюгатов методом, описанным ниже.
Вместо аминодекстрана может быть использован полипептид-носитель, однако такой полипептид-носитель должен иметь, по меньшей мере, 50 аминокислотных остатков в цепи, а предпочтительно 100-5000 аминокислотных остатков. По меньшей мере, некоторыми из аминокислотных остатков должны быть лизиновые остатки, либо глутаматные или аспартатные остатки. Для присоединения лекарственного средства, токсина, иммуномодулятора, хелатообразующего агента, борного компонента или другого терапевтического средства обычно используются боковые амины лизиновых остатков и боковые карбоксилаты глутамина и аспартата. Примерами полипептидных носителей, подходящих для придания полученному нагруженному носителю и иммуноконъюгату нужной растворимости, являются полилизин, полиглутаминовая кислота, полиаспарагиновая кислота, их сополимеры и смешанные полимеры этих аминокислот и т.п., например серинов.
Конъюгирование промежуточного конъюгата с компонентом-антителом осуществляют путем окисления углеводной части указанного компонента-антитела и взаимодействия карбонилов полученного альдегида (и кетона) с аминогруппами, оставшимися на носителе после присоединения лекарственного средства, токсина, хелатообразующего агента, иммуномодулятора, борного компонента или другого терапевтического средства. Альтернативно, промежуточный конъюгат может быть присоединен к окисленному компоненту-антителу посредством аминовых групп, которые были введены в указанный промежуточный конъюгат после присоединения терапевтического средства. Окисление обычно осуществляют либо химически, например с использованием NaIO4 или другого глиголитического реагента, либо ферментативно, например, с использованием нейраминидазы и галактозидазы. В случае использования аминодекстранового носителя обычно не все амины аминодекстрана используются для связывания с терапевтическим средством. Остальные амины аминодекстрана конденсируются с окисленным компонентом-антителом с образованием продуктов присоединения шиффова основания, которые затем подвергают реакции восстановительной стабилизации, обычно, в присутствии борогидридного восстановителя.
Аналогичные процедуры проводят для получения других иммуноконъюгатов согласно изобретению. Нагруженные полипептидные носители предпочтительно имеют свободные лизиновые остатки для конденсации с окисленной углеводной частью компонента-антитела. Карбоксилы на полипептидном носителе могут быть, если это необходимо, превращены в амины, например, посредством DCC-активации и взаимодействия с избытком диамина.
Полученный иммуноконъюгат очищают стандартными методами, такими как эксклюзионная хроматография на сефакриле S-300 или аффинная хроматография с использованием одного или нескольких эпитопов CD84Hy.
Альтернативно, иммуноконъюгаты могут быть получены путем прямого конъюгирования компонента-антитела с терапевтическим средством. Общая процедура аналогична непрямому методу конъюгирования, за исключением того, что терапевтическое средство непосредственно присоединяют к окисленному компоненту-антителу.
Следует отметить, что описанные здесь хелатообразующие агенты могут быть заменены другими терапевтическими средствами. Специалист в данной области может самостоятельно разработать такие схемы конъюгирования без излишнего экспериментирования.
В качестве дополнительной иллюстрации можно отметить, что терапевтическое средство может быть присоединено к шарнирной области восстановленного компонента-антитела посредством образования дисульфидной связи. Так, например, пептиды столбнячного токсоида могут быть сконструированы посредством одного цистеинового остатка, который используют для присоединения пептида к компоненту-антителу. Альтернативно, такие пептиды могут быть присоединены к указанному компоненту-антителу с использованием гетеробифункционального перекрестносшивающего линкера, такого как N-сукцинил-3-(2-пиридилдитио)пропионат (SPDP). Yu et al., Int. J. Cancer 56:244 (1994). Общие методы такого конъюгирования хорошо известны специалистам. См., например, Wong, Chemistry Of Protein Conjugation and Cross-Linking (CRC Press 1991); Upeslacis et al., “Modification of Antibodies by Chemical Methods” in Monoclonal Antibodies: Principles and Applications, Birch et al. (eds.), pages 187-230 (Wiley-Liss, Inc. 1995); Price, “Production and Characterization of Synthetic Peptide-Derived Antibodies” in Monoclonal Antibodies: Production, Engineering and Clinical Application, Ritter et al. (eds.), pages 60-84 (Cambridge University Press 1995).
Конъюгаты антитела и цитотоксического агента получают с использованием различных бифункциональных связывающихся с белком агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо-соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуоил-2,6-диизоцианат) и активные бис-замещенные соединения (такие как 1,5-дифтор-2,4-динитробензол). Так, например, иммунотоксин рицин может быть получен, как описано в публикации Vitetta et al., Science 238:1098 (1987). Репрезентативным хелатообразующим агентом для конъюгирования радионуклида с антителом является 1-изотиоцианатобензил-3-метилдиэтилентриаминопента-уксусная кислота, меченная углеводом-14 (МХ-DTPA) (см., например, WO 94/11026).
Как указывалось выше, углеводные части Fc-области антитела могут быть использованы для конъюгирования с терапевтическим средством. Однако Fc-область может отсутствовать, если в качестве компонента-антитела иммуноконъюгата используется фрагмент антитела. Тем не менее, можно ввести углеводную часть в вариабельную область легкой цепи антитела или фрагмента антитела. См., например, Leung et al., J. Immunol. 154:5919 (1995); Hansen et al., патент США №5443953. Затем сконструированная углеводная часть может быть использована для присоединения к терапевтическому средству.
Кроме того, специалисту в данной области известны различные возможные варианты методов конъюгирования. Так, например, углеводная часть может быть использована в целях присоединения полиэтиленгликоля для увеличения времени полужизни интактного антитела или его антигенсвязывающего фрагмента в крови, лимфе или в других внеклеточных жидкостях. Кроме того, может быть сконструирован “двухвалентный иммуноконъюгат” путем присоединения терапевтических средств к углеводной части и к свободной сульфгидрильной группе. Такая свободная сульфгидрильная группа может присутствовать в шарнирной области компонента-антитела.
Гибридные белки анти-M-CSF антител
В настоящем изобретении рассматривается использование гибридных белков, содержащих одну или несколько молекул анти-M-CSF антитела и молекулу иммуномодулятора или токсина. Методы получения гибридных белков антител хорошо известны специалистам. См., например, патент США №6306393. Гибридные белки антител, содержащие молекулу интерлейкина-2, описаны у Boleti et al., Ann. Oncol. 6:945 (1995), Nicolet et al., Cancer Gene Ther. 2:161 (1995), Becker et al., Proc. Natl. Acad. Sci., USA, 93:7826 (1996), Hank et al., Clin. Cancer. Res. 2:1951 (1996) и Hu et al., Cancer Res. 56:4998 (1996). Кроме того, в публикации Yang et al., Hum. Antibodies Hybridomas 6:129 (1995) описан гибридный белок, включающий F(ab')2-фрагмент и молекулу фактора некроза опухоли-альфа.
Методы получения гибридных белков “антитело-токсин”, в которых рекомбинантная молекула содержит один или несколько компонентов-антител и токсин или химиотерапевтическое средство, также известны специалистам. Так, например, гибридные белки “антитело-эндотоксин А Pseudomonas” были описаны у Chaudhary et al., Nature 339:394 (1989), Brinkmann et al., Proc. Nat'l. Acad. Sci., USA, 88:8616 (1991), Batra et al., Proc. Nat'l. Acad. Sci., USA, 89:5867 (1992), Friedman et al., J. Immunol. 150:3054 (1993), Wels et al., Int. J. Can. 60:137 (1995), Fominaya et al., J. Biol. Chem. 271:10560 (1996), Kuan et al., Biochemistry 35:2872 (1996) и Schmidt et al., Int. J. Can. 65:538 (1996). Гибридные белки “антитело-токсин”, содержащие молекулу дифтерийного токсина, были описаны Kreitman et al., Leukemia 7:553 (1993), Nicholls et al., J. Biol. Chem. 268:5302 (1993), Thompson et al., J. Biol. Chem. 270:28037 (1995) и Vallera et al., Blood 88:2342 (1996). В публикации Deonarain et al., Tumor Targeting 1:177 (1995) описан гибридный белок “антитело-токсин”, содержащий молекулу РНКазы, а в публикации Linardou et al., Cell Biophys. 24-25:243 (1994) описан гибридный белок “антитело-токсин”, содержащий такой компонент, как ДНКаза I. В гибридном белке “антитело-токсин” в качестве токсиновой части присутствовал гелонин, см. публикацию Wang et al., Abstracts of the 209th ACS National Meeting, Anaheim, Calif., Apr. 2-6, 1995, Part 1, BIOT005. Кроме того, в публикации Dohlsten et al., Proc. Natl. Acad. Sci., USA, 91:8945 (1994) описан гибридный белок “антитело-токсин”, содержащий стафилококковый энтеротоксин-А.
Репрезентативными токсинами, которые обычно используются для получения таких конъюгатов, являются рицин, абрин, рибонуклеаза, ДНКаза I, стафилококковый энтеротоксин-А, противовирусный белок фитолакки, гелонин, дифтерийный токсин, экзотоксин Pseudomonas и эндотоксин Pseudomonas. См., например, Pastan et al., Cell 47:641 (1986) и Goldenberg, CA-A Cancer Journal for Clinicians 44:43 (1994). Специалистам известны и другие подходящие токсины.
Антитела согласно изобретению могут быть использованы в методе ADEPT, включающем конъюгирование указанного антитела с пролекарство-активирующим ферментом, который превращает пролекарство (например, пептидильное химиотерапевтическое средство, см. WO 81/01145) в активное противораковое лекарственное средство. См., например, WO 88/07378 и патент США №4975278.
Ферментный компонент иммуноконъюгата, используемого в ADEPT, включает любой фермент, способный воздействовать на пролекарство таким образом, что под его действием это пролекарство превращается в более активную цитотоксическую форму.
Ферментами, которые могут быть использованы в способе согласно изобретению, являются, но не ограничиваются ими, щелочная фосфатаза, используемая для превращения фосфат-содержащих пролекарств в свободные лекарственные средства; арилсульфатаза, используемая для превращения сульфат-содержащих пролекарств в свободные лекарственные средства; цитозиндезаминаза, используемая для превращения нетоксичного 5-фторцитозина в противораковое лекарственное средство, 5-фторурацил; протеазы, такие как протеаза Serratia, термолизин; субтилизин; карбоксипептидазы и катепсины (такие как катепсины В и L), которые используются для превращения пептид-содержащих лекарственных средств в свободные лекарственные средства; D-аланилкарбоксипептидазы, используемые для превращения пролекарств, содержащих D-аминокислотные заместители; углевод-отщепляющие ферменты, такие как β-галактозидаза и нейраминидаза, используемые для превращения гликозилированных пролекарств в свободные лекарственные средства; β-лактамаза, используемая для превращения лекарственных средств, дериватизированных β-лактамами, в свободные лекарственные средства; и пенициллин-амидазы, такие как пенициллин-V-амидаза или пенициллин-G-амидаза, используемые для превращения лекарственных средств, дериватизированных у атомов азота аминогруппы феноксиацетильными или фенилацетильными группами, соответственно, в свободные лекарственные средства. Альтернативно, антитела с ферментативной активностью, также известные специалистам как абзимы, могут быть использованы для превращения пролекарств согласно изобретению в свободные активные лекарственные средства (см., например, Massey, Nature 328: 457-458 (1987)). Конъюгаты “антитело-абзим” могут быть получены в соответствии с настоящим описанием для доставки абзима в популяцию опухолевых клеток.
Ферменты согласно изобретению могут быть ковалентно связаны с антителами методами, хорошо известными специалистам, такими как использование гетеробифункциональных перекрестносшивающих агентов, обсуждаемых выше. Альтернативно, гибридные белки, содержащие, по меньшей мере, антигенсвязывающую область антитела согласно изобретению, присоединенную, по меньшей мере, к функционально активной части фермента согласно изобретению, могут быть сконструированы методами рекомбинантных ДНК, хорошо известными специалистам (см., например, Neuberger et al., Nature 312: 604-608 (1984)).
Нетерапевтическое применение
Антитела согласно изобретению могут быть использованы в качестве агентов для аффинной очистки M-CSF или в диагностических анализах белка M-CSF, например для детекции его экспрессии в специфических клетках, тканях или в сыворотке. Такие антитела могут быть также использованы в диагностических анализах in vivo. Обычно, для этих целей, антитело метят радионуклидом (таким как111In,99Tc,14С,131I,125I,3Н,32Р или35S) так, чтобы локализацию данной опухоли можно было определить с помощью иммуносцинтиграфии.
Антитела согласно изобретению могут быть использованы в любом известном аналитическом методе, таком как анализы на конкурентное связывание, прямые и непрямые “сэндвич”-анализы, такие как ELISA и анализы путем иммунопреципитации. Zola, Monoclonal Antibodes: A Manual Techniques, pp 147-158 (CRC Press, Inc. 1987). Эти антитела могут быть также использованы в целях проведения иммуногистохимического анализа для мечения образцов опухоли методами, известными специалистам.
Для удобства антитело согласно изобретению может быть включено в набор, содержащий упакованную комбинацию реагентов в заранее определенных количествах вместе с инструкциями по проведению диагностического анализа. Если антитело помечено ферментом, то такой набор будет включать субстраты и кофакторы, необходимые для этого фермента (например, субстрат-предшественник, который представляет собой детектируемый хромофор или флуорофор). Кроме того, могут быть включены и другие вспомогательные компоненты, такие как стабилизаторы, буферы (например, блокирующий буфер или буфер для лизиса) и т.п. Относительные количества различных реагентов могут широко варьироваться для достижения такой концентрации реагентов в растворе, которая, по существу, оптимизирует чувствительность данного анализа. В частности, указанные реагенты могут быть приготовлены в виде сухих, обычно лиофилизованных, порошков, включающих наполнители, которые после растворения, позволяют получить раствор реагента, имеющего соответствующую концентрацию.
Настоящее изобретение проиллюстрировано на нижеследующих примерах, которые не должны рассматриваться как ограничение настоящего изобретения.
ПРИМЕРЫ
Пример 1
В этом примере показано, что анти-M-CSF антитела RX1 и 5А1 являются видоспецифическими, и что антитела RX1, МС1 и МС3 нейтрализуют активность человеческого M-CSF. RX1 представляет собой коммерчески доступное антитело, поступившее в продажу более чем год назад еще до подачи настоящей заявки. Репрезентативными коммерчески доступными источниками являются, но не ограничиваются ими, клоны 116, 692 и 21 мышиного моноклонального антитела против человеческого M-CSF (Anogen); клоны 21113.131, 26730 и 26786 антитела против человеческого M-CSF (R & D Systems, Inc.) и клон М16 антитела против человеческого M-CSF (Antigenix America, Inc.).
Для оценки нейтрализующей активности RX1 и 5А1 проводили анализ на пролиферацию клеточной линии М-NFS-60 (депонированной в Американской коллекции типовых культур рег. № CRL-1838, АТСС, Rockville, MD, USA, и происходящей от линии миелогенного лейкоза, индуцированного мышиным эктопическим ретровирусом дикого типа Cas-Br-MuLV и отвечающего на интерлейкин-3 и M-CSF и содержащим усеченный прото-онкоген с-myb, образованный в результате интеграции ретровируса). Для пролиферации М-NFS-60 необходимо присутствие M-CSF в зависимости от дозы. В этом анализе, клетки М-NFS-60 промывали и высевали в среду RPMI 1640, содержащую 10% FBS и 3000 ед./мл M-CSF и 1% Pen/Strep. Рекомбинантный человеческий M-CSF (в конечной концентрации 10 нг/мл) и антитело против человеческого или мышиного M-CSF в различных концентрациях инкубировали в инкубаторе в течение 1 часа при 37°С в 5% СО2. После инкубирования смесь добавляли к клеточной культуре М-NFS-60 в 96-луночные микротитрационные планшеты. Общий объем для анализа в каждой лунке составлял 100 мкл, при этом концентрация M-CSF составляла 10 нг/мл, а концентрация антитела указана на фигуре 5. Клетки инкубировали при 37°С в 5% СО2 в течение 72 часов, а затем число клеток определяли с помощью анализа CellTiter Glo (Promega). Вышеупомянутый анализ повторяли для антител МС3 и МС1.
Как показано на фигуре 5, антитела RX1 и 5А1 против M-CSF являются видоспецифическими. Пролиферацию клеток оценивали в анализе CellTiter Glo путем регистрации интенсивности флуоресцентного излучения, которое линейно коррелировало с числом клеток. Видоспецифическую нейтрализующую активность антител RX1 и 5А1 оценивали по их способности ингибировать М-NFS-60 в присутствии либо человеческого, либо мышиного M-CSF. И наконец, как показано на фигуре 5В, антитела МС3 и МС1 также являются эффективными ингибиторами активности M-CSF.
Пример 2
В этом примере показано, что антитело RX1 в дозе 5 мг/кг эффективно ингибирует остеолиз в модели человеческого ксенотрансплатата. В этом исследовании использовали самок “голых” мышей в возрасте 4-7 недель со средней массой ~20 г. Опухолевые клетки (MDA-МВ-231, 3×105), суспендированные в 10 мкл физиологического раствора, инъецировали в полость костного мозга правой большеберцовой кости. Рентгенограммы задних конечностей получали через один день после инокуляции опухолью для получения фоновой картины и для выявления разрушения кости, вызванного инъекцией. Мышей произвольно распределяли по группам обработки по 10 мышей на группу, включая группу, которой i.p. вводили PBS, и группу, которой i.p. вводили RX1 в дозе 5 мг/кг, один раз в неделю в течение 6 недель. По окончании исследований снова получали рентгенограммы задних конечностей и сравнивали их с фоновой картиной повреждения кости. Степень повреждения кости, вызываемого опухолью, определяли, как показано на фигуре 6. У группы животных, обработанных антителом RX1 в дозе 5 мг/кг, наблюдалась статистически значимая устойчивость кости к индуцируемому опухолью повреждению.
Пример 3
В этом примере показано, что число метастазов снижается при введении антитела RX1 “голой” мыши, несущей раковые клетки MDA-МВ-231 человеческой молочной железы, в концентрации 5 мг/кг.
В этом исследовании использовали самок “голых” мышей в возрасте 4-7 недель со средней массой ~20 г. Опухолевые клетки (MDA-МВ-231, 3×105), суспендированные в 10 мкл физиологического раствора, инъецировали в полость костного мозга правой большеберцовой кости. Рентгенограммы задних конечностей получали через один день после инокуляции опухолью для получения фоновой картины и для выявления разрушения кости, вызванного инъекцией. Мышей произвольно распределяли по группам обработки, включая группу, которой i.p. вводили PBS, и группу, которой i.p. вводили RX1 в дозе 5 мг/кг, один раз в неделю в течение 6 недель. По окончании исследований у мышей каждой группы обработки брали легкие и фиксировали в растворе Боуинса для подсчета метастатических узлов в легких.
Как показано на фигуре 7, число метастазов снижалось при введении антитела RX1 в концентрации 5 мг/кг “голой” мыши, несущей раковые клетки MDA-МВ-231 человеческой молочной железы.
Пример 4
В этом примере описана процедура гуманизации антитела RX1. Антитела 5Н4, МС1 и МС3 были гуманизированы в соответствии с аналогичными процедурами.
Конструирование генов для легких и тяжелых цепей гуманизированного RX1
Нуклеотидные и аминокислотные последовательности для мышиного RX1 представлены на фигуре 4В. Для конструирования каркасной области гуманизированного антитела использовали последовательность человеческого антитела, идентифицированную с помощью базы данных для идентификации белков, имеющейся в Национальном фонде медико-биологических исследований, или с помощью аналогичной базы данных. Для отбора последовательности гуманизированной тяжелой цепи последовательность тяжелой цепи мышиного RX1 выравнивали с последовательностью тяжелой цепи человеческого антитела. В каждом положении, для гуманизированной последовательности выбирали аминокислоту человеческого антитела, однако, если это положение не подпадало под одну из четырех определенных ниже категорий, то выбирали аминокислоту мышиного RX1, а именно, если:
(1) это положение находится в гипервариабельной области (CDR), как было определено по Кэбату (Kabat, J. Immunol., 125, 961-969 (1980));
(2) эта аминокислота человеческого антитела редко встречается в человеческих тяжелых цепях в данном положении, а аминокислота мышиного RX1 является наиболее распространенной в человеческих тяжелых цепях в данном положении;
(3) это положение находится в непосредственной близости к CDR в аминокислотной последовательности тяжелой цепи мышиного RX1; или
(4) 3-мерное моделирование мышиного антитела RX1 позволяет предположить, что указанная аминокислота находится в физической близости к антигенсвязывающей области.
Для отбора последовательности гуманизированной легкой цепи последовательность легкой цепи мышиного RX1 выравнивали с последовательностью легкой цепи человеческого антитела. В каждом положении, для гуманизированной последовательности отбирали аминокислоту человеческого антитела, если только это положение также не подпадало под одну из описанных выше категорий, а именно:
(1) если оно находится в CDR;
(2) если данная аминокислота в этом положении является более типичной для мышиного RX1, чем для человеческого антитела;
(3) если оно находится вблизи от CDR; или
(4) если имеется вероятность, что в трехмерном пространстве, это положение находится в непосредственной близости от связывающей области.
Фактически, были отобраны следующие нуклеотидные последовательности генов тяжелой и легкой цепей:
(1) нуклеотидные последовательности, кодирующие аминокислотные последовательности, выбранные, как описано выше;
(2) 5'-область этих кодирующих последовательностей, то есть нуклеотидных последовательностей, кодирующих лидерную (сигнальную) последовательность. Эти лидерные последовательности были отобраны как типичные последовательности антител;
(3) 3'-область кодирующих последовательностей, то есть нуклеотидных последовательностей, которые соответствуют J5-сегменту мышиной легкой цепи и J2-сегменту мышиной тяжелой цепи, которые являются частью мышиной последовательности RX1. Эти последовательности были включены потому, что они содержат донорные сигналы сплайсинга; и
(4) каждая из концевых последовательностей, которая представляет собой XbaI-сайт, обеспечивающий расщепление ферментом XbaI и клонирование вектора в XbaI-сайт.
Конструирование генов гуманизированной легкой и тяжелой цепей
Для синтеза тяжелой цепи были получены четыре олигонуклеотида на ДНК-синтезаторе Applied Biosystems 380B. Два из этих нуклеотида представляют собой часть каждой нити тяжелой цепи, и каждый олигонуклеотид перекрывается с последующим олигонуклеотидом примерно на 20 нуклеотидов, что облегчает отжиг. Эти олигонуклеотиды, взятые вместе, покрывают всю вариабельную область гуманизированной тяжелой цепи с несколькими дополнительными нуклеотидами у каждого конца, что способствует рестрикции в XbaI-сайтах. Эти олигонуклеотиды очищали из полиакридамидных гелей.
Каждый олигонуклеотид фосфорилировали с использованием АТФ и полинуклеотид-киназы Т4 в соответствии со стандартными процедурами (Maniatis et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. (1989)). Для отжига фосфорилированных олигонуклеотидов эти олигонуклеотиды суспендировали вместе в 40 мкл ТА (33 мМ трис-ацетата, рН 7,9, 66 мМ ацетата калия, 10 мМ ацетата магния) при концентрации примерно 3,75 мкМ каждого, а затем нагревали до 95°С в течение 4 минут и медленно охлаждали до 4°С. Для получения полноразмерного гена из этих олигонуклеотидов путем синтеза противоположной цепи каждого олигонуклеотида добавляли нижеследующие компоненты в конечном объеме 100 мкл:
Смесь инкубировали при 37°С в течение 30 минут. Затем добавляли 10 мкл ДНК-лигазы Т4 и проводили инкубирование в течение 30 минут при 37°С. Полимеразу и лигазу инактивировали путем инкубирования реакционной смеси при 70°С в течение 15 минут. Для расщепления гена ферментом XbaI в реакционную смесь добавляли 50 мкл 2 × ТА, содержащих BSA при 200 мкг/мл, и DTT при 1 мМ, 43 мкл воды и 50 мкл XbaI в 5 мкл. Реакционную смесь инкубировали в течение 3 часов при 37°С, а затем очищали на геле. Затем XbaI-фрагмент выделяли из геля и клонировали в XbaI-сайт плазмиды pUC19 стандартными методами. Плазмиды очищали стандартными методами и секвенировали дидезокси-методом.
Конструирование плазмид для экспрессии гуманизированных легких и тяжелых цепей проводили путем выделения XbaI-фрагментов легкой и тяжелой цепей из плазмиды pUC19, в которую они были встроены, с последующим их введением в XbaI-сайт соответствующего экспрессионного вектора, который будет экспрессировать высокие уровни полноразмерной тяжелой цепи при его трансфекции в подходящую клетку-хозяина.
Синтез и аффинность гуманизированного антитела
Экспрессионные векторы трансфецировали в мышиные клетки Sp2/0 и клетки, которые интегрировались в плазмиды, отбирали по селективному(ым) маркеру(ам), присутствующему(им) в экспрессионных векторах, стандартными методами. Для подтверждения способности указанных клеток секретировать антитело, связывающееся с M-CSF, супернатант от этих клеток инкубировали с клетками, которые, как известно, экспрессируют M-CSF. После промывки клетки инкубировали с козьим античеловеческим антителом, конъюгированным с флуоресцеином, промывали и анализировали по флуоресценции на цитофлуориметре FACSCAN.
В следующем эксперимент, клетки, продуцирующие гуманизированное антитело, инъецировали мышам и полученную асцитную жидкость собирали. Гуманизированное антитело очищали из указанных асцитов, в основном, до гомогенного состояния путем пропускания через аффинную колонку с козьим антителом против человеческого иммуноглобулина, приготовленную на носителе Affigel-10 (Bio-Rad Laboratories Inc., Richmond, Calif.) в соответствии со стандартными процедурами. Для определения аффинности гуманизированного антитела по сравнению с аффинностью исходного мышиного антитела RX1 проводили эксперимент по конкурентному связыванию методами, известными специалистам.
Пример 4А
В этом примере описаны клонирование и экспрессия антител RX1 Human Engineered™, а также очистка таких антител и их тестирование на связывающую активность. Антитела Human Engineered™, 5Н4, МС1 и МС3 были получены аналогичными методами.
Конструирование последовательностей Human Engineered™
Получение вариабельных доменов антитела Human Engineered™ было описано в работе Studnicka [см., например, Studnicka et al., патент №5766886; Studnicka et al., Protein Engineering 7:805-814 (1994)] как способ снижения иммуногенности при одновременном сохранении связывающей активности молекул антител. В соответствии с этим способом каждой аминокислоте вариабельной области была установлена степень риска замены. Аминокислотные замены были подразделены на три категории риска: (1) замены низкого риска, при которых существует наиболее высокая вероятность снижения иммуногенности с наименьшей вероятностью нарушения связывания с антигеном; (2) замены умеренного риска, которые также приводят к снижению иммуногенности, но к увеличению вероятности нарушения связывания с антигеном или укладки белка; (3) замены остатков высокого риска, имеющих важное значение для связывания или для сохранения структуры антитела, которые создают наиболее высокий риск негативного воздействия на связывание с антигеном или укладку белка. Обычно считается, что из-за трехмерной структурной конфигурации пролинов модификации пролинов будут приводить к заменам, по меньшей мере, умеренного риска, даже если замена в таком положении обычно считается заменой низкого риска. Предпочтительными модификациями являются замены, но могут быть также внесены инсерции и делеции. На фигурах 4В и 4С показаны степени риска, приписываемые каждому аминокислотному остатку легкой и тяжелой цепей мышиного RX1, соответственно, и подразделяемые на категории модификаций высокого, умеренного или низкого риска.
Вариабельные области легкой и тяжелой цепей мышиного антитела RX1 представляют собой области Human Engineered™, полученные с применением этого метода. Аминокислотные остатки, которые являются кандидатами на модификацию в соответствии с этим методом и которые находятся в положениях “низкого риска”, были идентифицированы путем выравнивания аминокислотных последовательностей мышиных вариабельных областей с последовательностью человеческой вариабельной области. При этом может быть использована любая человеческая вариабельная область, включая отдельную последовательность VH или VL или консенсусную человеческую последовательность VH или VL. Аминокислотные остатки могут быть модифицированы в любом положении “низкого риска” или во всех положениях “низкого риска”. Для последовательностей тяжелой цепи Human Engineered™ “низкого риска”, представленных на фигурах 19А-В, в качестве матрицы использовали человеческую консенсусную последовательность Vh2 (по Кэбату), и в каждое положение “низкого риска”, в котором мышиные и человеческие аминокислотные остатки отличались друг от друга, вводили аминокислотную модификацию, а именно мышиный остаток заменяли человеческим остатком. Для последовательностей легкой цепи Human Engineered™ “низкого риска”, представленных на фигурах 20А-В, в качестве матрицы использовали человеческую консенсусную последовательность каппа-3 (по Кэбату), и в каждое положение “низкого риска”, в котором мышиные и человеческие аминокислотные остатки отличались друг от друга, вводили аминокислотную модификацию, а именно мышиный остаток заменяли человеческим остатком. Всего было сделано 16 аминокислотных модификаций низкого риска в легкой цепи и 8 модификаций низкого риска в тяжелой цепи.
Аналогичным образом, аминокислотные остатки, которые являются кандидатами на модификацию в соответствии с этим методом и которые находятся во всех положениях “низкого и умеренного риска”, были идентифицированы путем выравнивания аминокислотных последовательностей мышиных вариабельных областей с последовательностью человеческой вариабельной области. Аминокислотные остатки могут быть модифицированы в любом положении “низкого или умеренного риска” или во всех положениях “низкого и умеренного риска”. Для последовательности тяжелой цепи Human Engineered™, представленной на фигурах 19А-В, в качестве матрицы использовали человеческую консенсусную последовательность Vh2 (по Кэбату), и в каждое положение низкого или умеренного риска, в котором мышиные и человеческие аминокислотные остатки отличались друг от друга, вводили аминокислотную модификацию, а именно мышиный остаток заменяли человеческим остатком. Для последовательности легкой цепи Human Engineered™, представленной на фигурах 20А-В, в качестве матрицы использовали человеческую консенсусную последовательность каппа-3 (по Кэбату), и в каждое положение низкого или умеренного риска, в котором мышиные и человеческие аминокислотные остатки отличались друг от друга, вводили аминокислотную модификацию, а именно мышиный остаток заменяли человеческим остатком. Всего было сделано 19 аминокислотных модификаций низкого и умеренного риска в легкой цепи и 12 модификаций низкого и умеренного риска в тяжелой цепи.
Как показано на фигурах 21А-В, была также получена последовательность легкой цепи “альтернативного низкого риска”, в которой модификацию в положении 54 снова восстанавливали путем замены на мышиный остаток. Как показано на фигурах 21А-В, была также получена последовательность легкой цепи “альтернативного низкого + умеренного риска”, в которой модификации в положениях 54-56 снова восстанавливали путем замены на мышиные остатки.
И наконец, последовательность V-области легкой цепи Human Engineered™ “низкого + умеренного риска” также получали с использованием последовательности VK6 человеческой зародышевой линии подгруппы 2-1-(1) А14 в качестве матрицы, как показано на фигурах 22А-В.
В настоящем изобретении также рассматриваются остальные аминокислоты 41-43 (NGS), показаны на фигуре 4А, которые представляют собой сайт гликозилирования. Альтернативно, могут быть сохранены лишь одна или две из аминокислот 41-43 (например, NG).
Получение экспрессионных векторов для перманентного роста клеточной линии
ДНК-фрагменты, кодирующие каждую из вышеописанных последовательностей V-области тяжелой и легкой цепи, вместе с происходящими от антитела сигнальными последовательностями, конструировали методами нуклеотидного синтеза. ДНК, кодирующую каждую из вышеописанных аминокислотных последовательностей V-области легкой цепи, встраивали в вектор рМХР10, содержащий человеческую константную область легкой цепи каппа. ДНК, кодирующую каждую из вышеописанных аминокислотных последовательностей V-области тяжелой цепи, встраивали в вектор рМХР6, содержащий человеческую константную область тяжелой цепи гамма-2. Были сконструированы дополнительные векторы, содержащие аминокислотные последовательности V-области тяжелой цепи, присоединенные к человеческим константным областям гамма-1 (кДНК) и гамма-4 (геномная и кДНК), имеющим последовательности, представленные на фигурах 29А, 29b и 30. Все указанные векторы содержат промотор hCMV и 3'-нетранслируемую область мышиной легкой цепи каппа, а также селективные маркерные гены, такие как neo или his для отбора на трансфектанты, резистентные к G418 или к гистидину, соответственно. Векторы, содержащие легкую и тяжелую цепи, описаны в таблицах 2 и 3, соответственно.
Затем были сконструированы векторы, содержащие нужные гены легкой + тяжелой цепи Human Engineered™ (гамма-1, гамма-2 и гамма-4). Эти “состоящие из 2 генов” векторы содержат гены, кодирующие каждую цепь антитела, то есть тяжелую и легкую цепь, и находящиеся под контролем промотора hCMV, донора сплайсинга CMV, акцептора сплайсинга 16S SV40 и 3'-нетранслируемой ДНК мышиной легкой цепи каппа, включая polyA-сайт. Эти векторы также содержат селективный маркерный ген, такой как neo или his, и ген резистентности к ампициллину. Векторы, содержащие гены тяжелой и легкой цепи, описаны в таблице 4. Могут быть также сконструированы векторы, содержащие две копии генов легкой и тяжелой цепи (векторов из четырех генов).
Получение экспрессионных векторов для временной экспрессии
Векторы, содержащие гены легкой или тяжелой цепи, описанные выше, были также сконструированы для временной трансфекции. Эти векторы были аналогичны описанным выше векторам для перманентной трансфекции, за исключением того, что вместо генов neo или his они содержат ген oriP вируса Эпштейна-Барра для репликации в клетках HEK293, которые экспрессируют ядерный антиген вируса Эпштейна-Барра. Указанные векторы для временной трансфекции описаны в таблицах 5 и 6.
Временная экспрессия RX1 Human Engineered™ в клетках НЕK293Е
Отдельные векторы, каждый из которых содержит ген oriP вируса Эпштейна-Барра и гены легкой или тяжелой цепи, описанные выше, подвергали временной трансфекции в клетки НЕK293Е. Клетки, подвергнутые временной трансфекции, оставляли для инкубирования в течение периода времени до 10 дней, после чего супернатант выделяли и антитело очищали хроматографией на белке А. Белки, полученные посредством временной трансфекции клеток 293Е, описаны ниже в таблице 7.
Культивирование перманентно трансфецированных клеток СНО-К1
Описанные выше векторы (таблица 4), содержащие одну копию каждого из вместе взятых генов легкой и тяжелой цепей, трансфецировали в Ех-Cell-302-адаптированные клетки СНО-К1. Клетки СНО-К1, адаптированные для роста суспензионной культуры в среде Ех-Cell 302, обычно подвергали электропорации 40 мкг линеаризованного вектора. Альтернативно, линеаризованная ДНК может быть конъюгирована с линейным полиэтиленимином (ПЭИ) и использована для трансфекции. Клетки высевали в 96-луночные планшеты, содержащие среду Ех-Cell 302, в которую были добавлены 1% FBS и G418. Клоны скринировали в 96-луночных планшетах и лучшие из клонов, ~10% от каждой трансфекции, переносили в 24-луночные планшеты, содержащие среду Ех-Cell 302.
Тест на продуктивность осуществляли в 24-луночных планшетах в среде Ех-Cell 302 для культур, выращенных в течение 7 и 14 дней, и по истечении этого времени супернатанты культур тестировали на уровни секретированного антитела в ELISA-анализе иммуноглобулина IgG.
Лучшие из клонов переносили в шейкерные колбы, содержащие среду Ех-Cell 302. Поскольку клетки были адаптированы для роста суспензионной культуры, то тестирование этих клонов в шейкерных колбах осуществляли в среде Ех-Cell 302. Эти клетки культивировали в течение периода времени до 10 дней в 125-мл колбах Эрленмейера, содержащих 25 мл среды. В течение периода инкубирования колбы открывали, по меньшей мере, через день для газового обмена и по окончании периода инкубирования уровни полипептида иммуноглобулина в культуральной среде определяли с помощью ELISA-анализа IgG. После проведения множества последовательных трансфекций одной и той же клеточной линии двумя или тремя многокомпонентными транскрипционными векторами получали клоны и клеточные линии, у которых наблюдалось дополнительное увеличение уровней продуцирования иммуноглобулина, предпочтительно, до 300 мкг/мл или более.
Очистка
Может быть разработан способ выделения полипептидов иммуноглобулина из векторов и всех клеточных линий согласно изобретению. В соответствии с методами, хорошо известными специалистам, клетки удаляют путем фильтрации после завершения культивирования. Фильтрат загружают на колонку с белком А (со множеством пропусканий через колонку, если это необходимо). Затем колонку промывают и экспрессированные и секретированные полипептиды иммуноглобулина элюируют с колонки. Для получения продукта антитела, пул белка А выдерживают при низком рН (рН 3, минимум 30 минут и максимум один час) для проведения стадии инактивации вируса. Затем для дополнительной очистки продукта проводят стадию абсорбционного катионного обмена. Элюат из абсорбционной делительной колонки пропускают через фильтр Зейца (фильтр, отфильтровывающий вирус) для дополнительной очистки от возможно присутствующих вирусных частиц. Затем фильтрат дополнительно очищают путем пропускания через анионообменную колонку, с которой данный продукт не связывается. И наконец, процедуру очистки завершают путем переноса продукта в буфер для препаратов посредством диафильтрации. Ретентат доводят до концентрации белка, по меньшей мере, 1 мг/мл и добавляют стабилизатор.
Активность связывания
Оценивали M-CSF-связывающую активность рекомбинантных антител Human Engineered™. Белок выделяли из супернатантов культуры в шейкерных колбах путем пропускания через колонку с белком А с последующим определением концентрации по А280. Анализы на связывание проводили, как описано выше в примере 1, или как описано ниже в примере 12. Планшеты Immulon II предварительно сенсибилизировали антигеном sM-CSF, который был предварительно разведен в сенсибилизирующем растворе PBS для его иммобилизации на микропланшете. Затем добавляли различные тестируемые концентрации M-CSF, составляющие от 0,25 до 20 мкг/мл в объеме 50 мкл/лунку, и инкубировали при 4°С в течение ночи. Затем планшеты три раза промывали PBS-0,05% твином. Блокирование осуществляли путем добавления раствора 1% BSA в PBS-0,05% твине с последующим 30-минутным инкубированием при 37°С. Разведения полипептидов иммуноглобулина приготавливали в растворе 1% BSA в PBS-0,05% твине. В результате получали 2- или 3-кратные серийные разведения и добавляли в лунки (100 мкл/лунку) с двумя или тремя повторениями. После 90-минутного инкубирования при 37°С микропланшет 3 раза промывали PBS-0,05% твином. Для проявления сигнала в каждую лунку добавляли “второе” козье антитело против человеческого IgG (гамма- или Fc-специфическое), конъюгированное с пероксидазой, и инкубировали в течение 60 минут при 37°С, с последующим добавлением OPD при 0,4 мг/мл в цитратном буфере + 0,012% H2O2. После проведения анализа в течение 5-10 минут при комнатной температуре его прекращали добавлением 100 мкл 1М H2SO4 и планшеты считывали при 490 нм. Были использованы козье антитело против человеческого IgG (гамма-специфическое) и козье антитело против человеческого IgG (Fc-специфическое).
Пример 5
В нижеследующем примере описан способ лечения человека с использованием M-CSF-специфического антитела, такого как антитело, происходящее от RX1 или конкурирующее с RX1, включая происходящее от RX1 антитело Human Engineered™ с модифицированной или немодифицированной константной областью IgG1 или IgG4. Аналогичная процедура может быть также осуществлена для антитела, происходящего от MC1 или МС3, или антитела, конкурирующего с МС1 или МС3. Ожидаемые эффективные дозы составляют в пределах от 2 мкг/кг до 10 мг/кг. Эта оценка была сделана из нижеследующих соображений, подкрепленных экспериментальными данными.
Измеренный уровень M-CSF в человеческой плазме (у здорового пациента и у пациента с раком молочной железы) составлял примерно 1 нг/мл. M-CSF-нейтрализующее антитело RX1 имело измеренную концентрацию EC50, равную 2 нг/мл для 1 нг/мл человеческого M-CSF. В соответствии с этим, было предположено, что эффективная концентрация антитела в человеческой плазме в 10-50000 раз превышает его EC50, то есть составляет от 20 нг/мл до 100 мкг/мл антитела в человеческой плазме. Исходя из РК-исследований, для достижения этой концентрации у человека-пациента, а именно для достижения концентрации антитела 20 нг/мл-100 мкг/мл в плазме, требуется доза 2 мкг/кг-10 мг/кг.
Пример 6
В этом примере описана процедура оценки противораковой активности моноклонального анти-M-CSF антитела в модели подкожно имплантированной опухоли. В вышеописанном примере 2 было показано, что обработка моноклональным анти-M-CSF антителом приводит к значительному ингибированию роста опухоли в костном мозге. Это исследование ставит своей целью определить, может ли такое антитело также ингибировать рост опухоли в мягкой ткани.
В данном исследовании были использованы самки мышей nu/nu в возрасте 10 недель со средней массой ~20 г. Перед началом исследования мышей оставляли, по меньшей мере, на 7 дней для акклиматизации. На день 0, в правый бок “голой” мыши подкожно инъецировали клетки SW620 рака толстой кишки человека в количестве 5×106 клеток/мышь в 100 мкл. Когда объем опухоли достигал 100-200 мм3 (обычно через 1 неделю после инокуляции опухолью), мышей произвольно разделяли на 5 групп по 10 мышей на группу, которым вводили:
1) PBS
2) RX1
3) 5А1
4) контрольное Ab изотипов mIgG1 + rIgG1
5) 5А1+RX1
Мышам внутривенно вводили указанные антитела при 10 мг/кг один раз в неделю в течение 4 недель. Когда объем опухоли достигал 2000 мм3, исследование завершали. Альтернативно, животных также умерщвляли в тех случаях, если изъязвление поверхности опухоли превышало 30% от всей площади поверхности опухоли, наблюдалось значительное снижение массы тела (>20%), наблюдалось обезвоживание и болезненное состояние. У всех мышей брали цельную кровь и популяцию моноцитов анализировали как потенциальный суррогатный маркер. Рост/размер опухоли определяли в 2-факторном анализе. Объем опухоли вычисляли по измеренной ширине и длине опухоли. Как и предполагалось, рост опухоли в мягкой ткани ингибировался, на что указывал результат вышеописанного эксперимента.
Пример 7
В нижеследующем примере описана процедура оценки эффективности комбинированной терапии, проводимой для лечения и профилактики тяжелого остеолитического заболевания, ассоциированного с метастазами рака.
План эксперимента. Исследование, описанное выше в примере 5, проводили, по существу, аналогичным образом, но с нижеследующими исключениями. Помимо антитела или комбинации антител, используемых для введения группам обработки, описанным ниже, животных подвергали одной из нижеследующих дополнительных обработок, таких как:
1. Обработка бисфосфонатом (например, Aredia; Zometa; Clodronate).
2. Хирургическая операция.
3. Лучевая терапия.
4. Химиотерапия.
5. Гормональная терапия (например, тамоксифеном; терапия антиандрогеном).
6. Терапия антителами (например, RANKL/RANK-нейтрализующими антителами; PTHrP-нейтрализующим антителом).
7. Терапия терапевтическим белком (например, растворимым рецептором RANKL; OPG и ингибиторами PDGF и ММР).
8. Терапия низкомолекулярным лекарственным средством (например, ингибитором Src-киназы).
9. Терапия олигонуклеотидами (например, антисмысловыми последовательностями RANKL, RANK или PTHrP).
10. Генная терапия (например, ингибиторами RANKL или RANK).
11. Терапия пептидами (например, мутеинами RANKL).
Группы обработки представлены ниже. Вышеуказанная дополнительная обработка приводится ниже как “плюс терапия Х”:
1. Только PBS.
2. Только терапия Х.
3. Обработка крысиным IgG1 контрольного изотипа.
4. Обработка мышиным IgG1 контрольного изотипа.
5. Обработка только антителом RX1 против человеческого M-CSF.
6. Обработка только крысиным IgG1 5А1 против мышиного M-CSF.
7. Обработка комбинацией крысиного IgG1 и мышиного IgG1 контрольных изотипов.
8. Обработка комбинацией RX1 и 5А1.
9. Обработка крысиным IgG1 контрольного изотипа + терапия Х.
10. Обработка мышиным IgG1 контрольного изотипа + терапия Х.
11. Обработка антителом RX1 против человеческого M-CSF + терапия Х.
12. Обработка крысиным IgG1 5А1 против мышиного M-CSF + терапия Х.
13. Обработка комбинацией крысиного IgG1 и мышиного IgG1 контрольных изотипов + терапия Х.
14. Обработка комбинацией RX1 и 5А1 + терапия Х.
Введение дозы: каждому животному вводили 0,1-30 мг/кг каждого антитела. Предпочтительная доза составляет 10 мг/кг. Введение может быть осуществлено внутривенно (i.v.), внутрибрюшинно (i.p.) или подкожно (s.c.). Предпочтительным является внутрибрюшинное введение. Обработку начинают со дня после инъекции опухолевых клеток, как описано выше в примере 5.
Измерения: Для оценки тяжести остеолиза у различных групп обработки, для каждой мыши, со дня после инъекции опухолевых клеток, получали базовые сцинтиграммы на Faxitron. Сцинтиграфию на Faxitron проводили также в конце исследования (через 8 недель). Одновременно измеряли рост опухолей с использованием системы Xenogen, поскольку опухолевые клетки стабильно экспрессируют люциферазу. Как и ожидалось, комбинированная терапия, проводимая для лечения и предупреждения тяжелого остеолитического заболевания, ассоциированного с метастазами рака, давала лучший результат по сравнению с терапией, проводимой с использованием лишь одного антитела.
Пример 8
В нижеследующем примере описан протокол оценки способности M-CSF-специфического антитела связываться, например, с клетками рака молочной железы (клеточной линией MDA231) или раковыми клетками множественной миеломы (клеточной линией ARH77) на клеточном сортере с активацией флуоресценции.
Сначала клетки два раза промывали PBS (без Ca2+, Mg2+). В каждый 10-см планшет добавляли 2 мл 3 мМ EDTA и планшеты инкубировали при 37°С в течение 2-3 минут до тех пор, пока клетки не приобретали круглую форму и не начинали отделяться от планшета. Затем добавляли 10 мл буфера А (PBS + 5% FBS) и содержимое перемешивали. После этого клетки осаждали и ресуспендировали примерно при 5×106 клеток/мл в PBS + 5% FBS, а затем помещали в пробирки при 100 мкл/образец.
На этой стадии добавляли 0,1-10 мкг/мл “первого” антитела (антитела против M-CSF или контрольного антитела в указанной концентрации). Разведение, если необходимо, проводили в 5% FBS/PBS. Затем смесь инкубировали в течение 30 минут при 4°С. После инкубирования клетки 3 раза промывали путем центрифугирования при 400 g в течение 5 минут и ресуспендировали в PBS.
ФИТЦ- или ФЭ-меченное анти-IgG антитело (0,25 мкг/образец) разводили в 1% BSA/PBS при оптимальном разведении и клетки ресуспендировали в этом растворе и инкубировали в течение 30 минут при 4°С. Затем клетки 3 раза промывали, как описано выше. После промывки клеток эти клетки ресуспендировали с 0,5 мл/образец PI-PBS (если это было необходимо для идентификации погибших клеток от живых клеток). Эти клетки могут быть также фиксированы для последующего анализа (клетки, если они фиксированы в 0,1% формальдегиде, могут храниться примерно в течение 3 дней). Затем эти клетки были проанализированы посредством FACS с активацией флуоресценции в соответствии со стандартными процедурами.
Как показано на фигурах 8А и 8В, M-CSF-специфическое антитело RX1 связывалось с клеточной линией рака молочной железы MDA231 или с раковой клеточной линией множественной миеломы ARH77 при различных указанных концентрациях антитела.
Пример 9
В нижеследующем примере показано, что M-CSF преобладает на поверхностях ряда раковых клеток. Иммуногистохимическое окрашивание M-CSF проводили с использованием M-CSF-специфического антитела RX1 следующим образом:
В начале эксперимента предметные стекла нагревали в печи при 55-60°С в течение 1 часа и оставляли для охлаждения на 2-3 минуты. При этом были использованы следующие параметры депарафинизации и повторной гидратации:
Перед осуществлением стадии блокирования пероксидом проводили восстановление антигена с использованием реагента 1 × Biogenex Citra Plus. Раствор сначала нагревали в микроволновой печи при полной мощности до кипения. После закипания раствора режим работы микроволновой печи быстро устанавливали на уровень мощности 2 и в этом режиме раствор выдерживали еще 13 минут, а затем его оставляли для охлаждения перед обработкой. Стадию блокирования пероксидом проводили, как описано ниже. Предметные стекла погружали в 3% H2O2 (25 мл 30% - 250 мл деионизованной H2O) и оставляли на 10 минут при комнатной температуре. Затем предметные стекла 2 раза промывали деионизованной H2O и промывали 1 × PBS, 2×2 минуты.
Процедуру блокирования авидином/биотином осуществляли следующим образом. Предметные стекла помещали в металлическую стойку в горизонтальном положении. Для маркировки тканей использовали синий карандаш РАР (гидрофобный маркер для предметных стекол). Затем добавляли 2 капли авидина Zymed (реагент А), достаточных для покрытия ткани, и эти предметные стекла инкубировали при комнатной температуре в течение 10 минут. После инкубирования предметные стекла промывали следующим образом:
2×3 минуты промывали в 1 × PBS;
добавляли 2 капли биотина Zymed (реагента В) при комнатной температуре в течение 10 минут;
2×3 минуты промывали в 1 × PBS.
Процедуру блокирования белка осуществляли следующим образом. Сначала добавляли 10% сыворотку [до конечной концентрация 2%], содержащую “второе” антитело. Затем концентрированный блокирующий раствор (Power Block) BioGenex разводили 1 × деионизованной H2O. Стойку с предметными стеклами на 8 минут погружали в блокирующий раствор Power Block при комнатной температуре и предметные стекла промывали 2 раза в 1Х PBS.
Для добавления “первого” антитела (RX1) предметные стекла помещали в металлическую стойку в горизонтальном положении. Затем добавляли антитело для покрытия каждого среза (~350 мкл), и это антитело наносили кончиком пипетки (если это необходимо), не затрагивая ткань. Затем предметные стекла инкубировали в течение 1 часа при комнатной температуре. После инкубирования предметные стекла 3 раза промывали 1 × PBS, каждый раз по 3-5 минут. На этой стадии на срезы наносили реагент BioGenex Multi-Link и смесь инкубировали в течение 10-11 минут при комнатной температуре. После этого срезы промывали 3 минуты, каждый раз.
Мечение осуществляли путем нанесения ПХ-метки BioGenex на срезы, которые затем инкубировали при комнатной температуре в течение 10-11 минут и 3 раза промывали 1 × PBS, по 3 минуты. Затем к этим срезам добавляли субстрат H2O2 BioGenex (1 каплю АЕС на каждые 2,5 мл H2O2), а затем инкубировали при комнатной температуре в течение 10 минут. После этого срезы несколько раз промывали деионозиванной H2O. Стадию контрастного окрашивания осуществляли следующим образом. Срезы окрашивали гематоксилином в течение 1 минуты при комнатной температуре. Затем срезы два раза промывали H2O и инкубировали в 1 х PBS в течение 1 минуты. После этого срезы тщательно промывали H2O для удаления PBS. Срезы препаратов на предметных стеклах приготавливали путем нанесения на них капли реагента Super Mount BioGenex, а затем сушили воздухом в течение ночи при комнатной температуре.
Как показано на фигуре 9, M-CSF преобладал на поверхностях ряда раковых клеток. Срезы для раковых клеток указанных типов оценивали по следующей балльной системе.
Пример 10
В нижеследующем примере описана процедура получения антител МС1 и МС3. МС1 и МС3 представляют собой два моноклональных мышиных антитела, которые нейтрализуют человеческое анти-M-CSF антитело и связываются с человеческим M-CSF. Аминокислотные последовательности этих антител представлены на фигурах 14 и 15, соответственно. Эти последовательности были идентифицированы в несколько стадий, включая а) иммунизацию мышей Balb/С рекомбинантным человеческим M-CSF; b) скрининг на позитивные клоны, продуцирующие антитела, связывающиеся с человеческим M-CSF в формате ELISA; с) субклонирование позитивных клонов для генерирования стабильных гибридомных клонов; d) увеличение масштаба культивирования клеток для продуцирования большого количества антител; е) очистку и характеризацию антител в анализах на аффинность, на связывание с клетками и на нейтрализующую активность, как описано в предыдущих примерах.
На фигурах 16А и 16В показано выравнивание последовательностей CDR тяжелой и легкой цепей, соответственно, для антител RX1, 5Н4, МС1 и МС3.
Гуманизированные варианты и варианты Human Engineered™ получали, как описано выше в примерах.
Пример 11
В этом примере показано, что анти-M-CSF антитела RX1 и 5Н4, а также их Fab-фрагменты обладают различными нейтрализующими активностями. В нижеследующем примере также показано, что антитела RX1, 5Н4 и МС3 обладают различными аффинностями связывания с M-CSF. В этом примере также продемонстрировано, что аффинности вышеупомянутых интактных антител превышают аффинности Fab-фрагментов вышеупомянутых антител.
Нейтрализующие активности интактных антител RX1 и 5Н4 по сравнению с активностями Fab-фрагментов RX1 и 5Н4 определяли путем оценки M-CSF-зависимой клеточной пролиферации в присутствии различных концентраций антитела. Пролиферацию клеток оценивали с использованием хемилюминесцентного красителя. Как показано на фигуре 17, интактное RX1 обладало самой высокой активностью, а активность Fab-фрагмента RX1 снижалась и была аналогична активности антитела 5Н4 и Fab-фрагмента 5Н4.
Связывающие свойства вышеупомянутых антител анализировали с помощью анализов BIAcore. Для определения относительных аффинностей связывания антител RX1, 5Н4 и МС3 с M-CSF, Fc-фрагмент кроличьего антимышиного антитела иммобилизовали на биосенсорном чипе СМ5 путем связывания с амином. Затем вышеупомянутые антитела иммобилизовали на биосенсорном чипе СМ5 с антимышиным Fc-фрагментом при концентрации 1,5 мкг/мл в течение 3 минут при 2 мкл/мин. M-CSF наносили на модифицированную биосенсорную поверхность при различных концентрациях (Rmax ~ 15). Тестируемые антитела и антиген разводили в 0,01М HEPES, рН 7,4, 0,15М NaCl, 3 мМ EDTA, 0,005% поверхностно-активного вещества Р20 (HBS-ЕР). Все эксперименты проводили при 25°С. Кинетические константы и константы аффинности определяли с помощью компьютерной программы Biaevaluation (Biacore) с подбором модели взаимодействия/общего соответствия, 1:1. Как показано ниже в таблице 8, RX1 связывался с M-CSF с наиболее высокой аффинностью по сравнению с 5Н4 и МС3.
Для определения относительных различий между аффинностью связывания интактного mAb и Fab-фрагментов RX1, 5Н4 и МС3 была использована альтернативная конфигурация анализов Biacore. Более конкретно, M-CSF иммобилизовали на биосенсорном чипе СМ5 путем связывания с амином. 0,5 мкг/мл M-CSF в 10 мМ ацетата натрия, рН 4,0, инъецировали при 1 мкл/мин в течение 5 минут до достижения RL=6-12 RU. Тестируемое антитело (или Fab-фрагмент) наносили на модифицированную биосенсорную поверхность при различных концентрациях. Тестируемые антитела разводили в 0,01М HEPES, рН 7,4, 0,15М NaCl, 3 мМ EDTA, 0,005% поверхностно-активного вещества Р20 (HBS-ЕР) и все эксперименты проводили при 25°С. Кинетические константы и константы аффинности определяли с помощью компьютерной программы Biaevaluation (Biacore) с подбором модели взаимодействия/общего соответствия, 1:1. Как показано ниже в таблице 9, RX1 связывался с M-CSF с наиболее высокой аффинностью по сравнению с другими тестируемыми антителами. Fab-фрагмент RX1 связывался с M-CSF со значительно более низкой аффинностью, чем голопротеин RX1.
Данные аффинности связывания и нейтрализации показали, что нейтрализующая активность антитела RX1 обусловлена, главным образом, его очень высокой аффинностью по отношению к M-CSF, и что такая высокая аффинность может быть, по меньшей мере, частично обусловлена способностью обеих ветвей указанного антитела одновременно связываться с димером M-CSF.
Пример 12
В нижеследующем примере был выявлен линейный эпитоп (то есть аминокислотная последовательность) на M-CSF, распознаваемый антителами RX1, 5Н4 и МС3.
Сначала была разработана стратегия картирования эпитопов для того, чтобы определить, какие из эпитопов на M-CSF, т.е. линейные или конформационнные, распознаются антителами RX1, 5Н4 и МС3. В соответствии с этим, анти-M-CSF антитела против M-CSF тестировали с использованием 0,1 мкг M-CSF в восстанавливающих, а также в невосстанавливающих условиях. Каждое из антител распознавало только невосстановленную форму M-CSF, что позволяет предположить, что распознаваемые эпитопы по своей природе являются эпитопами прерывистого типа.
Затем, для каждого антитела был определен линейный эпитоп M-CSF. В частности, были получены мембраны SPOT (Sigma Genosys), где представляющую интерес последовательность фрагмента M-CSF, перекрывающуюся с 10-мерными пептидами, синтезированными со сдвигом в одну аминокислоту, загружали на целлюлозный мембранный носитель. Затем эти мембраны зондировали вышеуказанными антителами и идентифицировали реактивные SPOT. После этого пептидную последовательность идентифицировали по ее соответствующей локализации на мембране и перекрывающиеся аминокислоты в позитивно реагирующих пептидах идентифицировали как эпитоп. Как показано на фигуре 18, антитело RX1 связывается с другим линейным эпитопом, то есть не с тем эпитопом, с которым связываются 5Н4 и МС3, причем картирование этого эпитопа указывало на другое его расположение на M-CSF. RX1 связывается с линейным эпитопом, имеющим последовательность RFRDNTPN (SEQ ID NO: 120) или RFRDNTAN (SEQ ID NO: 121), аминокислоты 98-105 M-CSF на фигуре 12. 5Н4 связывается с линейным эпитопом, имеющим последовательность ITFEFVDQE (SEQ ID NO: 122), аминокислоты 65-73 M-CSF на фигуре 12. МС3 связывается с двумя линейными эпитопами, имеющими последовательности (1) ITFEFVDQE (SEQ ID NO: 122), аминокислоты 65-73 M-CSF на фигуре 12 и (2) FYETPLQ (SEQ ID NO: 123), аминокислоты 138-144 M-CSF на фигуре 12.
Пример 13
Была определена аффинность связывания вариантов Human Engineered™ антител RX1, полученных, как описано выше в примере 4А. В этом примере показано, что варианты Human Engineered™ антитела RX1 с константными областями различных подклассов IgG связываются с M-CSF с различными аффинностями in vitro. Для определения относительных различий между аффинностями связывания интактных антител с помощью анализа Biacore, M-CSF иммобилизовали на биосенсорном чипе СМ5 путем связывания с амином. 0,5 мкг/мл M-CSF в 10 мМ ацетата натрия, рН 4,0, инъецировали при 1 мкл/мин в течение 5 минут до достижения RL=6-12 RU. Тестируемое антитело или его Fab-фрагменты наносили на модифицированную биосенсорную поверхность при различных концентрациях, варьирующихся в пределах от 100 нМ до 1,5 нМ, при 2-кратных разведениях. Тестируемые антитела разводили в 0,01М HEPES, рН 7,4, 0,15М NaCl, 3 мМ EDTA, 0,005% поверхностно-активного вещества Р20 (HBS-ЕР) и все эксперименты проводили при 25°С. Эксперименты с каждой концентрацией и буфером-контролем проводили с тремя повторениями и данные собирали в течение 3 минут ассоциации и 8 минут диссоциации. Кинетические константы и константы аффинности определяли с помощью компьютерной программы Biaevaluation (Biacore) с подбором модели взаимодействия/общего соответствия, 1:1. Как показано ниже в таблице 10, heRX1-1.G1 и heRX1-1.G4 связывались с M-CSF с аффинностью, которая была почти аналогична аффинности связывания мышиного RX1 с M-CSF.
В отличие от этого, в таблице 11 показано, что хотя и имеется несколько отклонений в аффинности связывания, однако, все конструкции гамма-2 обнаруживали, по меньшей мере, 7-кратное снижение аффинности связывания по сравнению с аффинностью родительского мышиного антитела.
Пример 14
В этом примере показано, что варианты Human Engineered™ антител RX1 с константными областями различных подклассов IgG обладают различными нейтрализующими активностями in vitro. Для оценки нейтрализующей активности анти-M-CSF антител проводили анализ на пролиферацию клеточной линии М-NFS-60 (депонированной в Американской коллекции типовых культур рег. № CRL-1838, АТСС, Rockville, MD, USA, и происходящей от линии миелогенного лейкоза, индуцированного мышиным эктопическим ретровирусом дикого типа Cas-Br-MuLV. Эта клеточная линия отвечает на интерлейкин-3 и M-CSF и содержит усеченный протоонкоген с-myb, образованный в результате интеграции ретровируса). Для пролиферации М-NFS-60 необходимо присутствие M-CSF в зависимости от дозы. В этом анализе, клетки М-NFS-60 промывали и высевали в среду RPIM 1640, содержащую 10% FBS и 1% Pen/Strep. Рекомбинантный человеческий M-CSF (в конечной концентрации 10 нг/мл, эквивалентной 3000 ед/мл M-CSF-активности) инкубировали при различных концентрациях антител в пределах от 1 мкг/мл до 0,5 нг/мл (при серийном 2-кратном разведении) в инкубаторе в течение 1 часа при 37°С в 5% СО2. После инкубирования смесь добавляли к клеточной культуре М-NFS-60 в 96-луночные микротитрационные планшеты. Общий объем для анализа в каждой лунке составлял 100 мкл, при этом концентрация M-CSF составляла 10 нг/мл, а концентрация антитела указана ниже. Клетки инкубировали при 37°С в 5% СО2 в течение 72 часов, а затем число клеток определяли с помощью анализа CellTiter Glo (Promega). Каждое антитело тестировали с тремя повторениями и этот тест повторяли на следующий день (для всех шести анализов на каждое антитело). IC50 каждого антитела анализировали путем построения кривой.
Этот анализ повторяли с использованием человеческого M-CSF в сыворотке, в MDA231-кондиционированной среде (содержащей M-CSF), а также с использованием M-CSF собакоподобной обезьяны в сыворотке и рекомбинантного M-CSF собакоподобной обезьяны. Результаты представлены на фигуре 25 (рекомбинантный M-CSF), на фигуре 26 (человеческий M-CSF в сыворотке) и на фигуре 27 (MDA231-кондиционированная среда) и были получены путем считывания интенсивности флуоресценции в анализе CellTiter Glo, и эти результаты линейно коррелировали с числом клеток. Нейтрализующая активность этих антител представлена как степень ингибирования пролиферации клеток М-NFS-60.
Эти результаты показали, что концентрация IC50 для heRX1-1-IgG1 и heRX1-1-IgG4 была почти аналогичной концентрации IC50 рекомбинантного родительского мышиного антитела RX1, а IC50 heRX1-1-IgG2 была в 2 или в 4 раза выше.
В нижеследующей таблице 12 показана относительная концентрация IC50 (выраженная как кратность снижения IC50) для различных конструкций IgG2, полученных, как описано выше в примере 4А. Из этих конструкций наименьшее снижение IC50 обнаруживали конструкции heRX1-1.G2 и heRX1-10.G2.
Пример 15
В этом примере показано, что варианты Human Engineered™ антител RX1 с константными областями различных подклассов IgG обладают различными ТРАР-активностями в in vitro анализе на остеокластогенез.
CD34+-клетки человеческого костного мозга (Biowhittaker, catalog №2М-101А, 3×105 клеток/сосуд) индуцировали для дифференцировки в остеокласты в описанных здесь экспериментальных условиях. На день 1, CD34+-клетки оттаивали из одного замороженного сосуда в 10 мл среды (альфа-МЕМ с 10% FCS, 1 × Pen/Strep и 1 × фунгизон). Эти клетки один раз промывали и ресуспендировали в 2 мл среды, а затем помещали в 96-луночный планшет при 100 мкл/лунку. На 2-й день, не удаляя исходную среду, в каждую лунку добавляли 50 мкл 4 × CSF-1 до конечной концентрации 30 нг/мл и 50 мкл 4 × RANKL (sRANKL, Chemicon catalog # GF091, 10 мкг/упаковку) до конечной концентрации 100 нг/мл. На 7-й день в каждую лунку добавляли 50 мкл 5 × RANKL до конечной концентрации 100 нг/мл. На 17-й день клетки окрашивали на ТРАР-активность (набор для окрашивания на ТРАР-активность, содержащий кислую фосфатазу лейкоцитов, Sigma catalog # 387-A) и оценивали под микроскопом.
На 2-й день анализа добавляли M-CSF-нейтрализующие антитела. Эти антитела ингибировали дифференцировку остеокластов в зависимости от дозы, как показано на фигуре 28. Ингибирующую активность антител в анализе на дифференцировку остеокластов выражали как отсутствие видимых остеокластов на 17-й день анализа.
Пример 16
Были дополнительно охарактеризованы антитела Human Engineered™ RX1 с константными областями различных подклассов IgG.
Комплексы “антиген-антитело”, которые представляли собой комплексы различных вариантов Human Engineered™ антитела RX1 с M-CSF, исследовали путем объединения M-CSF и антитела в буфере в равных молярных отношениях с последующей оценкой размера комплекса антиген-антитело с помощью эксклюзионной хроматографии или методом рассеяния света. Полученные результаты показали, что мышиное родительское RX1 образует 1:1-комплексы с M-CSF размером примерно 200 кДа. Антитела heRX1-9.G2 или heRX1-10.G2 образуют 2:1 или 2:2-комплексы с M-CSF размером примерно 400 кДа. heRX1-10.G2 образует большие агрегаты с решетчатой структурой с M-CSF размером более чем 2×106 Да. Конструкции IgG1 и IgG4 образовывали небольшие комплексы, аналогичные комплексам, образуемым мышиным родительским RX1.
Электрофорез в денатурирующем восстанавливающем и невосстанавливающем ПААГ с ДСН, проводимый для heRX1-1.G4, показал, что вариант IgG4, как и ожидалось, образовывал полуантитела.
Все вышеуказанные патенты США, публикации заявок на патент США, заявки на патент США, иностранные патенты, иностранные патентные заявки и непатентные публикации, цитируемые в настоящей заявке и/или перечисленные в начале настоящей заявки, во всей своей полноте вводятся в настоящее описание посредством ссылки.
Исходя из вышеуказанного очевидно, что, хотя настоящее изобретение описано на конкретных вариантах его осуществления, представленных в целях иллюстрации, однако, в него могут быть внесены различные модификации, не выходящие за пределы существа и объема изобретения.
Реферат
Изобретение относится к анти-М-СSF-специфическим антителам, полученным на основе RX1 или происходящим от RX1, и которые более чем на 75% конкурируют с моноклональными антителами RX1, МС1 и/или МС3 за связывание с M-CSF (макрофагальному колониестимулирующему фактору). Не мышиное антитело является двухцепочечным, содержит определенную аминокислотную последовательность (приведенную в формуле изобретения и перечне последовательностей) и сохраняет высокую аффинность по отношению к M-CSF. Изобретение раскрывает выделенную нуклеиновую кислоту, кодирующую указанное антитело, вектор экспрессии, клетку-хозяина и способ получения анти-M-CSF-антитела с использованием клетки-хозяина или гибридомы, в частности гибридомы АТСС РТА-6263 или АТСС РТА-6264. Изобретение описывает фармацевтическую композицию, содержащую указанные антитела, наборы, содержащие фармацевтические композиции, и способы профилактики и лечения остеопороза у индивидуума, страдающего остеолитическим заболеванием. Полученные по изобретению антитела способны ингибировать дифференцировку остеокластов, что позволяет использовать их как высокоэффективные препараты для лечения остеолиза, рака с метастазами и остеопороза, ассоциированного с метастазами рака. 34 н. и 97 з.п. ф-лы, 30 ил., 12 табл.
Формула
a)
XVXLXEXGXXXXXXXXXLXLXCXVXDYSITSDYAWNW1XQXXXXXLXWMGYIS
YSGSTSXNXXLXXXIXIXRXXXXXXFXLXLXXVXXXDXAXYYCASFDYAHAMDY
WGXGTXVXVXX,
b)
DVXLXEXGPXXVXPXXXLXLXCXVTDYSITSDYAWNWIRQXPXXKLEWMGYIS
YSSYNPSLKXRIXIXRXTXXNXFXLXLXXVXXXDXATYYCASFDYAHAMDYWGX
GTXVXVXX,
c)
XVQLQESGPGLVKPSQXLSLTCTVXDYSITSDYAWNWIRQFPGXXLEWMGYISY
SGSTSYNPSLKSMXIXRDTSKNQFXLQLNSVTXXDTAXYYCASFDYAHAMDYW
GQGTXVTVSS,
и d)
DVQLQESGPGLVKPSQXLSLTCTVTDYSITSDYAWNWIRQFPGXKLEWMGYISY
SGSTSYNPSLKSRIX1XRDTSKNQFXLQLNSVTXXDTATYYCASFDYAIIAMDYW
GQGTXVTVSS,
где X представляет собой любую аминокислоту, и где указанное антитело сохраняет Kd аффинности (константу равновесной диссоциации) по отношению к M-CSF (SEQ ID NO: 9), равную по меньшей мере 10-8 М, или большую аффинность.
DVQLQESGPGLVKPSQTLSLTCTVTDYSITSDYAWNWIRQFPGKKLEWMGYISY
SGSTSYNPSLKSRITISRDTSKNQFSLQLNSVTAADTATYYCASFDYAJiEAMDYW
GQGTTVTVSS,
и где указанное антитело сохраняет Kd аффинности (константу равновесной диссоциации) по отношению к M-CSF (SEQ ID NO: 9), равную по меньшей мере 10-8 М, или большую аффинность.
QVQLQESGPGLVKPSQTLSLTCTVSDYSITSDYAWNWIRQFPGKGLEWMGYISY
SGSTSYNPSLKSRITISPvDTSKNQFSLQLNSVTAADTAVYYCASFDYAHAMDYW
GQGTTVTVSS,
и где указанное антитело сохраняет Kd аффинности (константу
равновесной диссоциации) по отношению к M-CSF (SEQ ID NO: 9), равную по меньшей мере 10-8 М, или большую аффинность.
a) XIXLXQXXXXXXVXXXXXVXFXCXAXQSIGTSIHWYXQXXXXXPXLL1KYASEX
XXXIXXXFXGXGXGXXFXLXIXXVXXXDXADYYCQQINSWPTTFGXGTXLXXXX
X,
b)
XIXLXQXPXXLXVXPXXXVXFXCXASQSIGTSIHWYQQXTXXSPRLLIKYASEXIS
XI PXRFXGXGXGXXFXLXIXXVXXXDXADYYCQQINSWPTTFGXGTXLXXXXX,
c)
XIXLTQSPXXLSVSPGERVXFSCRASQSIGTSIHWYQQXTXXXPRLLIKYASEXXX
GIP XRFSGSGSGTDFTLXIXXVESEDXADYYCQQINSWPTTFGXGTKLEIKRX,
d)
XIXLTQSPXXLSVSPGERVXFSCRASQSIGTSIHWYQQXTXXSPRLLIKYASEXISG
IPX RFSGSGSGTDFTLXIXXVESEDXADYYCQQINSWPTTFGXGTKLEIKRX, и
e)
XIXLTQSPXXLSVSPGERVXFSCRASQSIGTSIHWYQQXTXXXPRLLIKYASESISG
IPX RFSGSGSGTDFTLXIXXVESEDXADYYCQQINSWPTTFGXGTKLEIKRX,
где Х представляет собой любую аминокислоту, и где указанное антитело сохраняет Kd аффинности (константу равновесной диссоциации) по отношению к M-CSF (SEQ ID NO: 9), равную по меньшей мере 10-8 М, или большую аффинность.
EIVLTQSPGTLSVSPGERVTFSCPvASQSIGTSIHWYQQKTGQAPRLLIKYASESIS
GIPD RFSGSGSGTDFTLTISRVESEDFADYYCQQINSWPTTFGQGTKLEIJCRT,
и где указанное антитело сохраняет Kd аффинности (константу равновесной диссоциации) по отношению к M-CSF (SEQ ID NO: 9), равную по меньшей мере 10-8 М, или большую аффинность.
EIVLTQSPGTLSVSPGERVTFSCRASQSIGTSIHWYQQKTGQAPRLLIKYASERAT
GIP DRFSGSGSGTDFTLTISRVESEDFADYYCQQINSWPTTFGQGTKLEIKRT,
и где указанное антитело сохраняет Kd аффинности (константу равновесной диссоциации) по отношению к M-CSF (SEQ ID NO: 9), равную по меньшей мере 10-8 М, или большую аффинность.
EIVLTQSPGTLSVSPGERVTFSCRASQSIGTSIHWYQQKTGQSPRLLIKYASERISG
IPD RFSGSGSGTDFTLTISRVESEDFADYYCQQINSWPTTFGQGTKLEIKRT,
и где указанное антитело сохраняет Kd аффинности (константу равновесной диссоциации) по отношению к M-CSF (SEQ ID NO: 9), равную по меньшей мере 10-8 М, или большую аффинность.

Комментарии