Средства и способы лечения и/или предотвращения рака, зависимого от природного лиганда ahr - RU2640913C2
Код документа: RU2640913C2
Чертежи
























Описание
Настоящее изобретение относится к области противораковых лекарственных средств и лечения рака. В частности, настоящее изобретение относится к способу лечения и/или предотвращения рака, зависимого от природного лиганда арилгидрокарбонового рецептора (AHR), включающему введение субъекту, страдающему указанным раком, терапевтически эффективного количества ингибитора AHR. Кроме этого, предусмотрен ингибитор AHR для применения в лечении и/или предотвращении рака, зависимого от природного лиганда AHR.
Микроокружение опухоли представляет особую проблему для эффективной терапии опухолей, поскольку она имеет множество аспектов влияния на злокачественность опухоли (Tennant 2010, Nat Rev Cancer 10, 267).
Метаболизм триптофана (Тгр) является примером большого значения, которое имеет микроокружение опухоли. Была продемонстрирована его функциональная значимость в качестве центрального эндогенного механизма ограничения иммунного ответа в моделях у животных (Munn 2007, J Clin Invest 117, 1147).
В частности, активация метаболизма Trp коррелирует с заболеваниями и нарушениями иммунной системы, такими как иммунитет к опухоли, аутоиммунность, инфекционные заболевания и поддержание иммунной привилегии (Opitz 2007, Cell Mol Life Sci 64, 2452). Деградация Trp под действием индоламин-2,3-диоксигеназ 1 и 2 (IDO1/2) в опухолях и дренирующих опухоль лимфатических узлах ингибирует противоопухолевые иммунные ответы и связана с неблагоприятным прогнозом при различных злокачественных опухолях (Lob 2009, Nat Rev Cancer 9 (6): 445). Ингибирование IDO1/2 подавляет образование опухоли в животных моделях, и в настоящее время его тестируют в клинических исследованиях I/II фазы у пациентов, страдающих раком (Muller 2005, Nat Med 11(3): 312, Uyttenhove 2003, Nat Med 9(10), 1269; DiPuccio 2010, Expert Opin Ther Pat 20, 229; Ball 2007, Gene 396(1), 203; Metz 2007, Cancer Res 67(15), 7082).
Другой фермент, который, как известно, вовлечен в метаболизм Trp в нейронах и гепатоцитах, представляет собой триптофан-2,3-диоксигеназу (TDO), также обеспечивающую первый этап распада Trp (Thackray 2008, Biochem Soc Trans 36, 1120). Также сообщалось о TDO как о потенциальной мишени для противоопухолевых лекарственных средств (WO 2010/008427). Однако значимость катаболизма Trp для образования и прогрессирования опухоли человека остается неясной.
Кинуренин (Куп) представляет собой метаболит Trp, имеющий иммуносупрессивные функции. Однако его молекулярные мишени и механизм оказания указанного действия еще не известны. Существуют данные о том, что экзогенный Kyn, среди прочего, активирует фактор транскрипции, представляющий собой арилгидрокарбоновый рецептор (AHR), в дендритных клетках и Т-клетках (Mezrich 2010, J Immunol 185, 3190; Nguyen 2010, Proc Natl. Acad Sci, USA, 107, 19961).
AHR представляет собой фактор транскрипции семейства «основная область-спираль-петля-спираль» (basic helix-loop-helix, bHLH)/Per-Arnt-Sim (PAS), активируемый ксенобиотиками, такими как бензапирен и 2,3,7,8-тетрахлордибензодиоксин (TCDD). В ядре AHR образует гетеродимер с ядерным транслокатором AHR (ARNT), который взаимодействует с коровым связывающим мотивом диоксин-чувствительных элементов (DRE), расположенных в регуляторных областях целевых генов AHR (Reyes 1992, Science 256, 5060; Abel 2010, Biol Chem 391, 1235).
Известно, что AHR вовлечен в химический канцерогенез, вызываемый, например, галогенированными ароматическими углеводородами. Кроме того, существуют данные о том, что экстракты зеленого чая могут выступать в качестве антагонистов AHR и, таким образом, могут предотвращать вредное воздействие таких галогенированных ароматических углеводородов (Palermo 2003, Chem Res Toxicol 16, 865). Более того, известно, что конститутивная экспрессия гена AHR вовлечена в клеточную выживаемость в клетках глиобластомы (Gramatzki 2009, Oncogene 28, 2593).
С учетом вышеизложенного, средства и способы для эффективного лечения опухолей, злокачественность которых зависит от метаболических процессов, таких как катаболизм Trp, пока не предложены, но, тем не менее, были бы крайне востребованными.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения и/или предотвращения рака, зависимого от природного лиганда AHR, включающему введение субъекту, страдающему указанным раком, терапевтически эффективного количества ингибитора AHR.
В предпочтительном варианте реализации способа согласно настоящему изобретению указанный рак выбран из группы, состоящей из: опухолей головного мозга, предпочтительно глиомы, меланомы, аденокарциномы толстой и прямой кишки, карциномы толстой кишки, почечно-клеточной карциномы, немелкоклеточного рака легкого (НМРЛ), рака молочной железы, печеночно-клеточной карциномы, карциномы яичников, карциномы головы и шеи, рака мочевого пузыря, аденокарциномы поджелудочной железы, мезотелиомы и мелкоклеточного рака легкого (МРЛ).
В предпочтительном варианте реализации способа согласно настоящему изобретению указанный ингибитор AHR представляет собой низкомолекулярное соединение.
В более предпочтительном варианте реализации способа согласно настоящему изобретению указанное низкомолекулярное соединение представляет собой соединение растительного происхождения или его производное.
В более предпочтительном варианте реализации способа согласно настоящему изобретению указанное соединение растительного происхождения или его производное представляет собой флавон или его производное. Наиболее предпочтительно, указанный флавон или его производное представляет собой 3,4-диметоксифлавон, 3'-метокси-4'-нитрофлавон, 4',5,7-тригидроксифлавон (апигенин) или 1-метил-N-[2-метил-4-[2-(2-метилфенил)диазенил]фенил-1Н-пиразол-5-карбоксамид (СН223191; номер CAS 301326-22-7).
В другом более предпочтительном варианте реализации способа согласно настоящему изобретению указанное соединение растительного происхождения или его производное представляет собой ресвератрол или его производное, эпигаллокатехин или эпигаллокатехингаллат.
В другом предпочтительном варианте реализации способа согласно настоящему изобретению указанное низкомолекулярное соединение представляет собой соединение, характеризующееся следующей общей формулой (I):

где
(i) R1 и R2 независимо друг от друга представляют собой водород или С1-С12 алкил,
(ii) R3 - R11 независимо друг от друга представляют собой водород, С1-С12 алкил, гидроксил или С1-С12 алкокси, и
(iii) пунктирная линия представляет собой либо двойную связь, либо два атома водорода.
В другом предпочтительном варианте реализации способа согласно настоящему изобретению указанный ингибитор AHR представляет собой антитело, которое специфично связывается с белком AHR и ингибирует его.
В другом предпочтительном варианте реализации способа согласно настоящему изобретению указанный ингибитор AHR представляет собой белок-репрессор AHR или неактивный ядерный транслокатор AHR (ARNT).
В другом предпочтительном варианте реализации способа согласно настоящему изобретению указанный ингибитор AHR представляет собой ингибитор, являющийся нуклеиновой кислотой.
В другом более предпочтительном варианте реализации способа согласно настоящему изобретению указанный репрессор, являющийся нуклеиновой кислотой, специфично связывается с полинуклеотидом, кодирующим AHR, и выбран из группы, состоящей из: рибозима, антисмысловой молекулы, ингибирующего олигонуклеотида, микроРНК и малой интерферирующей РНК (siPHK).
Более того, согласно настоящему изобретению предусмотрен ингибитор AHR для применения в лечении и/или предотвращении рака, зависимого от природного лиганда AHR.
ЧЕРТЕЖИ
На Фиг. 1 показано, что TDO вызывает деградацию Trp до Kyn в опухолях головного мозга человека: а - Содержание Trp (слева) и Kyn (справа) в надосадочных жидкостях астроцитов человека (hAs), линий клеток глиомы и клеток, инициирующих глиому (GIC) (Т323), культивированных в течение 72 часов, и измеренное путем ВЭЖХ (n=4); b - Корреляция между мРНК TDO и высвобождением Kyn клетками глиомы человека, измеренным путем количественной ОТ-ПЦР и ВЭЖХ (n=4); с - Концентрации Kyn в надосадочных жидкостях клеток глиомы U87, культивированных в течение 48 часов в присутствии ингибитора TDO 680С91 (черные столбики) или его растворителя (белые столбики, n=4, Р=0,005, 0,002 и 0,0009 для 1, 5 и 10 мкМ TDOI соответственно); d - Высвобождение Kyn клетками глиомы после нокдауна TDO (черные столбики, Ρ=0,000007, 0,0007 и 0,00006 соответственно), IDO1 (темно-серые столбики) или ID02 (светло-серые столбики) siPHK (п=3); е - Слабая нейронная экспрессия TDO в здоровой ткани головного мозга (верхнее изображение). Экспрессия TDO в глиобластоме (IV степень согласно ВОЗ, нижнее изображение); красный: окрашивание TDO; * некроз; острия стрелок: граница с инфильтрованной тканью головного мозга. Изображение-вставка: отдельные клетки опухоли (стрелки), инфильтрирующие прилегающую ткань головного мозга. Увеличение: 40х, изображения-вставки 400х (верхнее изображение), 100x (нижнее изображение); f - График экспрессии TDO [показатель H-score] в опухолях головного мозга увеличивающейся злокачественности (II-IV степень согласно ВОЗ; II степень, n=18, III степень, n=15, IV степень, n=35); g - Корреляция пролиферативного индекса Ki-67 с Η-score TDO в глиомах разных степеней согласно ВОЗ (n=42); h - Концентрации Trp (слева) и Kyn (справа) в сыворотках крови 24 пациентов с глиобластомой и 24 здоровых контролей в соответствующей возрастной и половой группе, измеренные путем ВЭЖХ; i - Количественная оценка окрашивания хинолиновой кислоты в здоровой ткани головного мозга человека (белый столбик, n=5) и ткани глиобластомы (черный столбик, b=5). Распределение данных на (f) и (g) представлено в виде ящичковых диаграмм, демонстрирующих 25 и 75 процентиль вместе с медианой, усы представляют собой 10 и 90 процентиль соответственно.
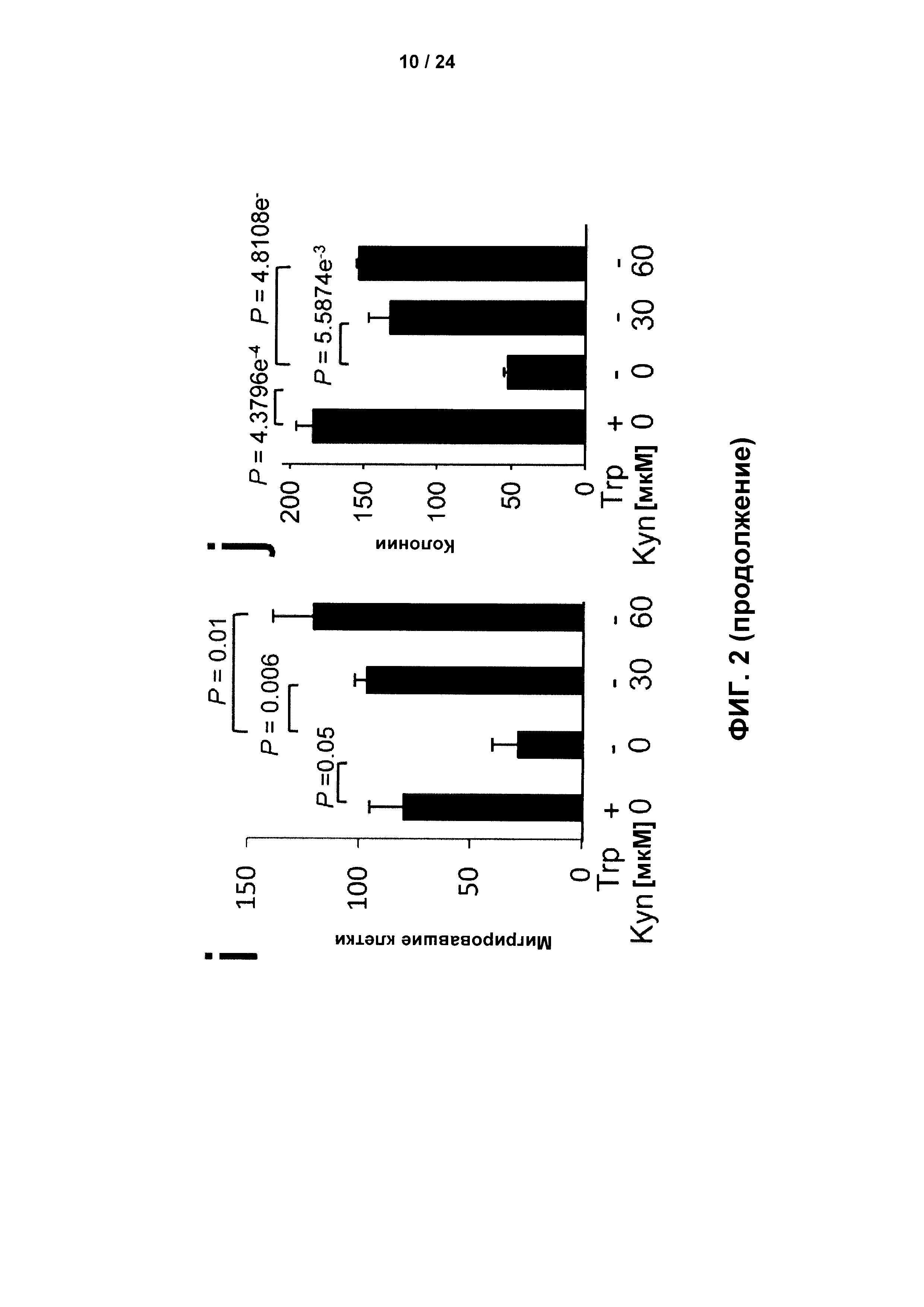
На Фиг. 2 показаны паракринные эффекты опосредованного TDO высвобождения Kyn,клетками глиомы в отношении иммуноцитов: а - Корреляция аллогенной пролиферации мононуклеарных клеток периферической крови (МКПК), культивированных совместно с различными линиями клеток глиомы, с высвобождением Kyn клетками глиомы (n=3); b - Аллогенная пролиферация МКПК, культивированных совместно с контрольными клетками глиомы U87 (sh-c), экспрессирующими TDO, по сравнению с клетками глиомы U87 со стабильным нокдауном TDO, опосредованным короткой шпилечной РНК (sh-TDO), с или без 100 мкМ Kyn (черные столбики), по сравнению с одними только МКПК с или без 100 мкМ Kyn (белые столбики, n=3); с - Количественное определение (LCA)+ клеток (левый график) и CD8+ клеток (правый график), окрашенных на срезах глиомы человека с низкой экспрессией TDO (H-score <150, белый столбик, n=12 для LCA, n=10 для CD8) и на срезах глиомы человека с высокой экспрессией TDO (H-score ≥ 150, черный столбик, n=17 для LCA и n=10 для CD8); d - Рост Τdo-дефицитных клеток глиомы GL261 мышей, стабильно трансфицированных Tdo (заштрихованные кружки) или пустым вектором (незаштрихованные кружки), введенных подкожно путем инъекции в бок мышей C57BL/6N, контролировали с использованием измерительных штангенциркулей (n=6). Массу опухоли рассчитывали с использованием уравнения: масса опухоли (r) = (длина (см) × ширина (см)2) × 0,5; е - Высвобождение IFN-γ Т-клетками мышей с подкожными опухолями, экспрессирующими Tdo (черный столбик), по сравнению с Т-клетками мышей с Tdo-дефицитными опухолями (белый столбик) после повторной стимуляции лизатами глиомы, измеренное методом иммуноферментных пятен (ELISpot) (n=3); f - Лизис клеток глиомы GL261 мышей клетками селезенки мышей с опухолями GL261, экспрессирующими Tdo, по сравнению с мышами с подкожными Tdo-дефицитными опухолями GL261, измеренный по высвобождению хрома (n=4); g - Количественное определение расстояний миграции клеток sh-c (незаштрихованные квадраты) и sh-TDO (заштрихованные кружки) в коллагеновую матрицу (n=3, Р=0,004, 0,0005 и 0,01 для 24, 48 и 72 часов соответственно); h - Клоногенная выживаемость клеток U87 sh-c (белый столбик) и sh-TDO (черный столбик) (n=3); i - Анализ с использованием камеры Бойдена с матригелем клеток глиомы U87 в отсутствие или присутствии 70 мкМ Trp без или с 30 мкМ или 60 мкМ Kyn,(n=3); j - Клоногенная выживаемость клеток глиомы LN-18 в отсутствие или присутствии 70 мкМ Trp без или с 30 мкМ или 60 мкМ Kyn (n=3); k - Типичные изображения МРТ головы, окрашивание гематоксилином и эозином (Н&Е), и нестином мышей CD1 пи/пи с имплантированными клетками глиомы U87 sh-c (верхние изображения) или sh-TDO (нижние изображения). Изображения характерны для двух независимых экспериментов (n=6); l - Масса опухоли клеток глиомы U87 sh-c (белые столбики) и sh-TDO (черные столбики), введенных подкожно путем инъекции в бок мышей CD1 nu/nu, которых лечили либо антителом против несиалированной формы GM1 (ASIALO) для истощения NK-клеток, или контрольным IgG (IgG) (n=8).
На Фиг. 3 показано, что Kyn активирует AHR: а - Связь 25 генов, наиболее сильно индуцированных обработкой Kyn в клетках U87 через 8 часов, с передачей сигнала AHR (красный: повышающая регуляция, зеленый: понижающая регуляция); b - Транслокация AHR, меченого зеленым флуоресцентным белком (GFP), в ядро клеток гепатомы мыши, которые не вызывают распад Trp, после 3-часовой обработки 50 мкм Kyn, 50 мкм Trp или 1 нМ тетрахлородибензо-п-диоксином (TCDD) (отрицательный контроль: среда); с - Соотношения интенсивности флуоресценции в ядре и интенсивности флуоресценции в цитоплазме в клетках с AHR, меченым GFP, после 3 часов указанной обработки (отрицательный контроль: среда, положительный контроль: 1 нМ TCDD, 50 мкМ Kyn). Распределение данных представлено ящичковыми диаграммами, демонстрирующими 25 и 75 процентиль вместе с медианой, усы представляют собой 10 и 90 процентиль соответственно (Р<0,001, однофакторный ранговый дисперсионный анализ (ANOVA) с последующим методом Данна (Dunn)); d - Вестерн-блоттинг AHR двух разных ядерных и цитоплазматических фракций контрольных (1, 2), обработанных Kyn (3, 4) и обработанных TCDD (5, 6) клеток глиомы LN-229 человека каждая; е - Диоксин-чувствительный элемент (DRE) активировал экспрессию гена люциферазы в клетках глиомы U87, обработанных указанными концентрациями Kyn (n=2); f - Радиолигандный анализ связывания с указанными концентрациями L-3Н-Kyn с использованием цитозоля печени мыши от Ahr-компетентных и Ahr-дефицитных мышей. Специфическое связывание рассчитывали путем вычитания радиоактивности, измеренной в Ahr-дефицитном цитозоле, из радиоактивности Ahr-компетентного цитозоля (n=4); g - Экспрессия мРНК CYP1A1 в клетках глиомы LN-308 sh-AHR (черные столбики) по сравнению с контрольными клетками (sh-c, белые столбики), обработанными 100 мкМ Kyn, 1 нМ TCDD или контролями (n=4); h - Экспрессия мРНК целевых генов AHR в клетках глиомы U87 sh-TDO (черные столбики) по сравнению с sh-c (белые столбики, n=4).
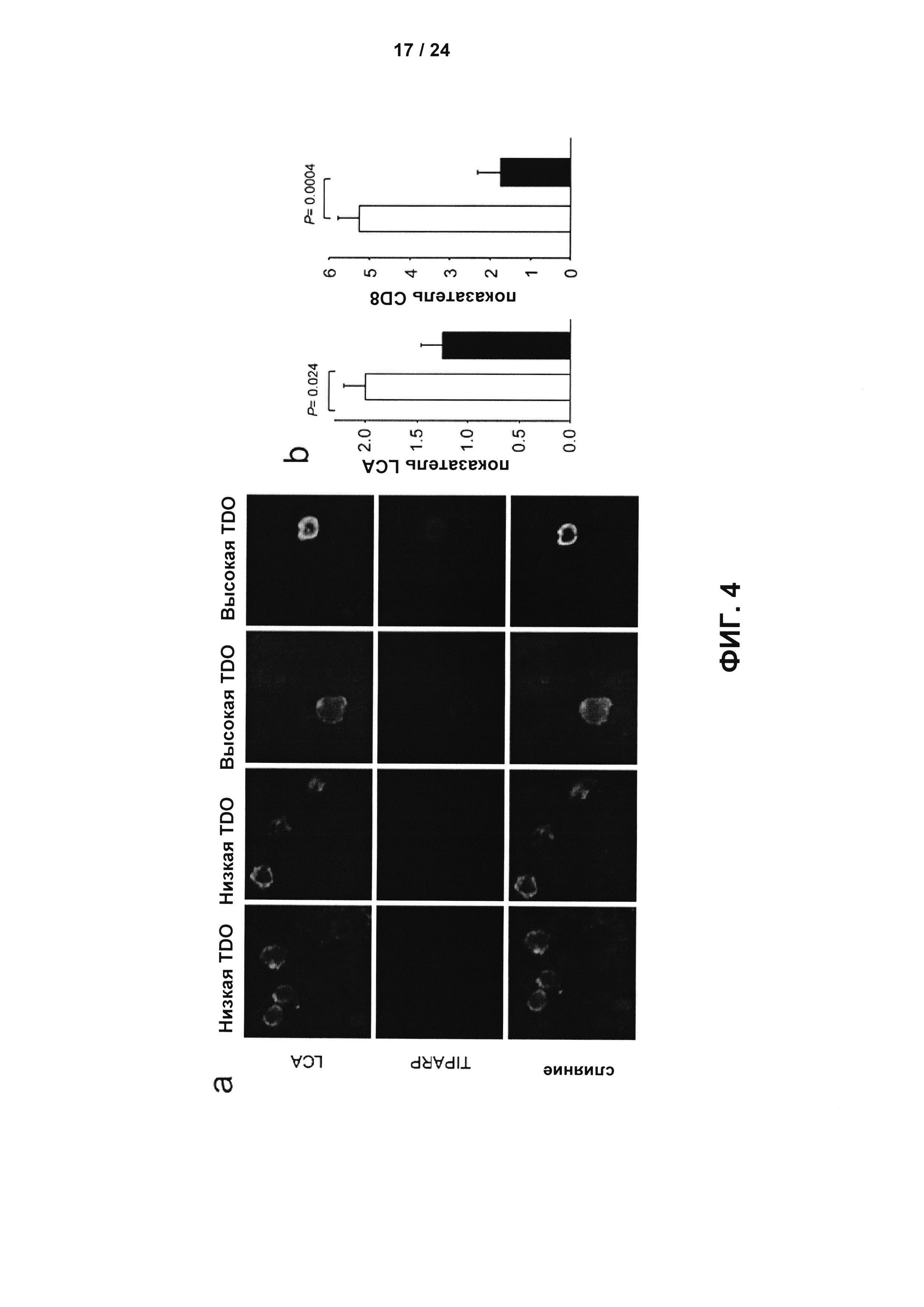
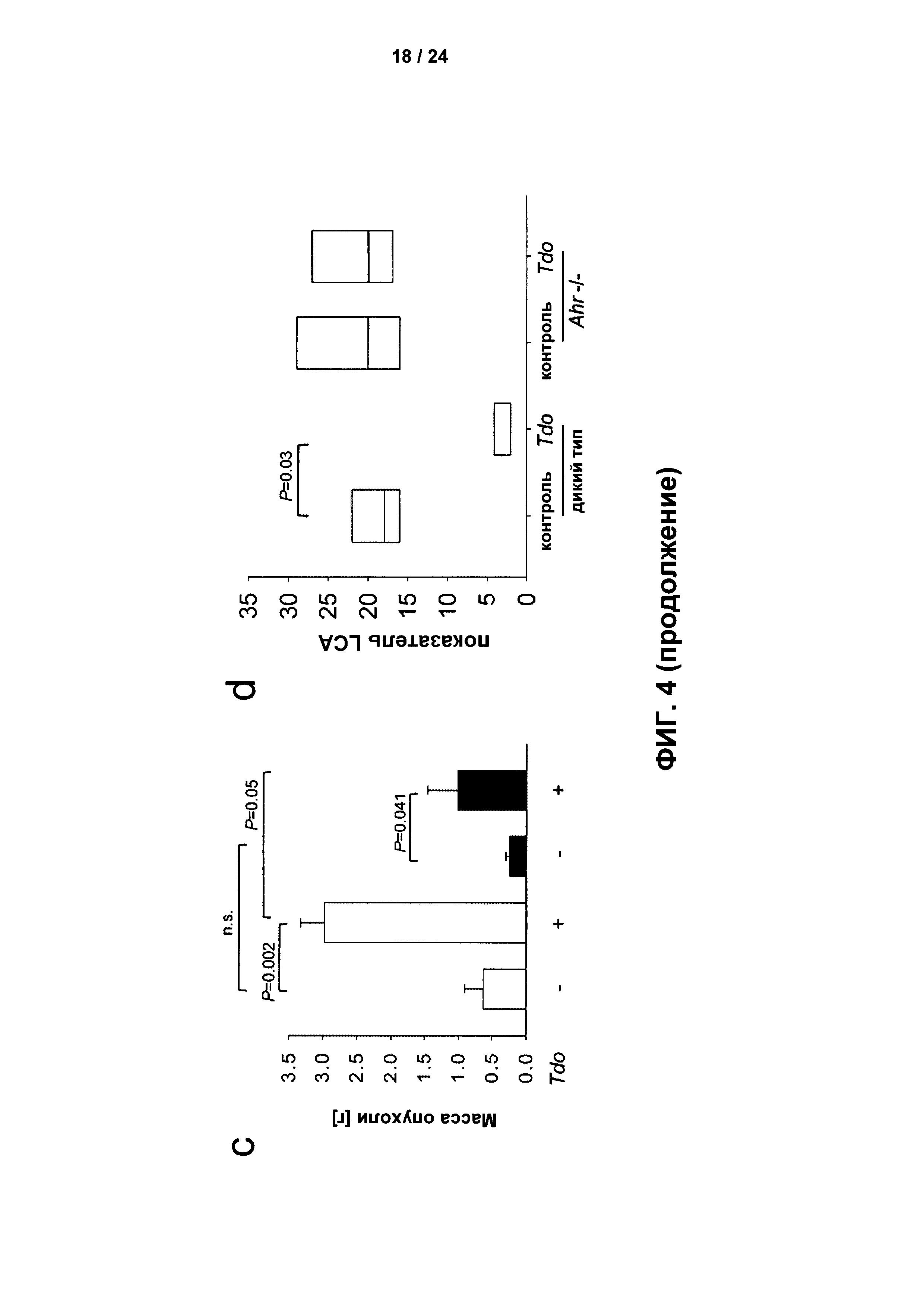
На Фиг. 4 показано, что аутокринные и паракринные эффекты Kyn, получаемого под действием TDO, опосредованы AHR: а - Иммунофлуоресцентное окрашивание LCA и TIPARP на срезах глиомы человека с низкой или высокой экспрессией TDO. Увеличение: 40x; b - Количественное определение LCA+ клеток (слева) и CD8+ клеток (справа), окрашенных на срезах глиомы человека с низкой экспрессией AHR (Histoscore <150, белый столбик, n=10 для LCA и n=8 для CD8) и на срезах глиомы человека с высокой экспрессией AHR (Histoscore ≥ 150, черный столбик, n=12 для LCA и n=12 для CD8); с - Масса опухоли, измеренная через 15 дней после подкожной инъекции клеток глиомы GL261 мышей с и без экспрессии Tdo в бок Ahr-компетентных (белые столбики) или Ahr-дефицитных мышей (черные столбики, n=6); d - Количественное определение LCA+ иммуноцитов, окрашенных в подкожных Tdo-компетентных и Tdo-дефицитных опухолях GL261 у Ahr-компетентных и Ahr-дефицитных мышей, представлено в виде ящичковых диаграмм, демонстрирующих 25 и 75 процентиль, и медиану (n=4); е - Миграция клеток глиомы LN-308 sh-c (белые столбики) и клеток глиомы LN-308 с нокдауном AHR двумя разными shPHK (sh-AHR1, серые столбики и sh-AHR2, черные столбики) в присутствии или в отсутствие 100 мкМ Kyn (n=4); f - Клоногенность клеток глиомы LN-308 sh-c (белые столбики) и sh-AHR (черные столбики) с или без 100 мкМ Kyn (n=3); g - Рост AHR-компетентных (заштрихованные кружки) и AHR-дефицитных (незаштрихованные кружки) клеток глиомы LN-308 человека, введенных подкожно путем инъекции в бок мышей CD1nu/nu, контролировали с использованием измерительных штангенциркулей (n=7). Массу опухоли рассчитывали с использованием уравнения масса опухоли (г) = (длина (см) × ширина (см)2) × 0,5.
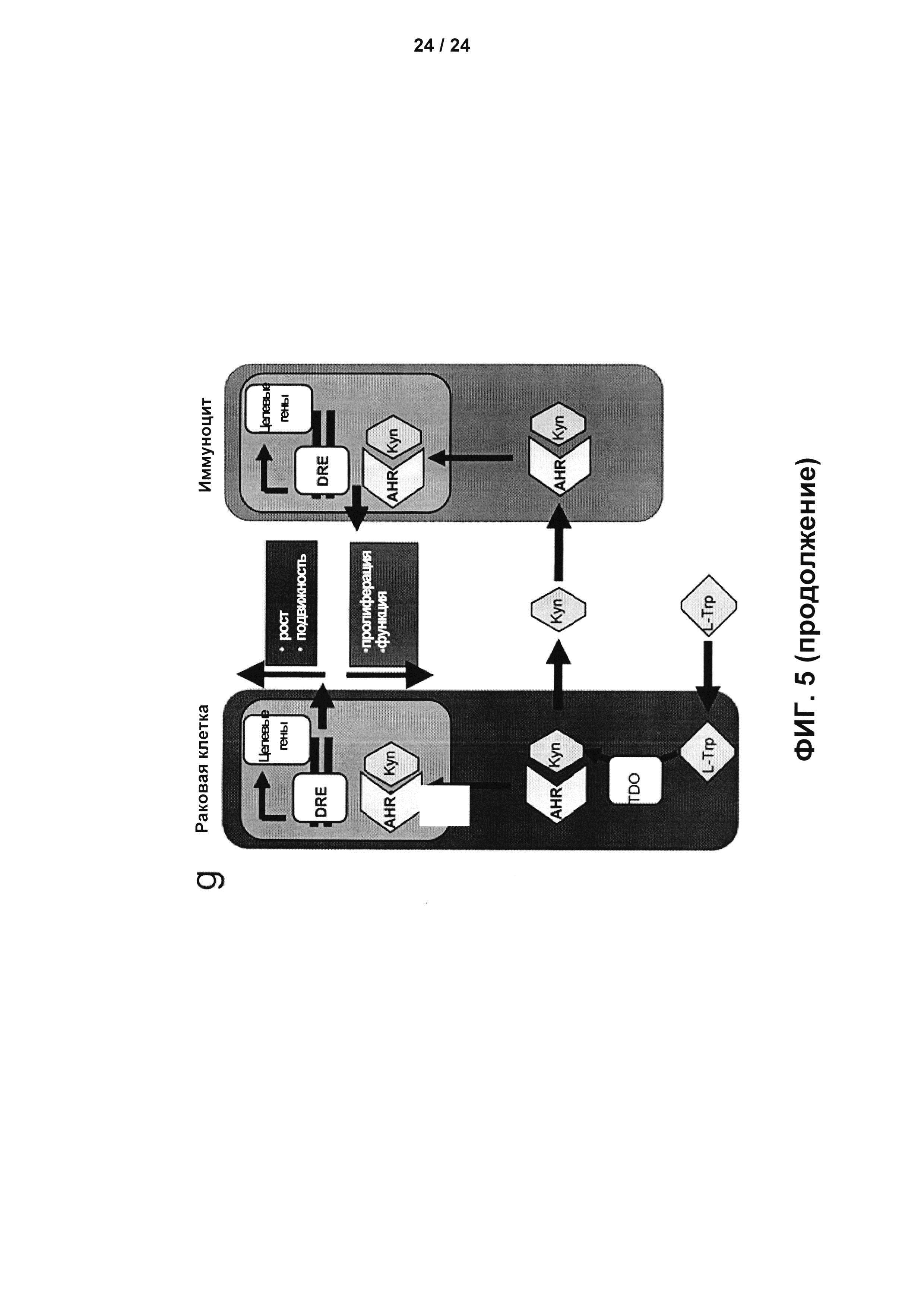
На Фиг. 5 показано, что Kyn, получаемый под действием TDO, активирует AHR в различных раковых опухолях человека, и активация AHR позволяет прогнозировать выживаемость среди пациентов с глиомой: а - Корреляция экспрессии TDO (красный) и экспрессии AHR (коричневый) в последовательных срезах ткани глиобластомы человека. Стрелки показывают сосуды для ориентировки. Увеличение: 40х, изображения-вставки 200x; b - Корреляция между экспрессией TDO и AHR в ткани глиомы человека на основе Η-score TDO и AHR, рассчитанная с использованием ранговой корреляции Спирмена (n=26); с - Корреляция между экспрессией TDO и CYP1B1 в данных микроматриц глиобластомы человека (n=396), проанализированная с помощью ранговой корреляции Спирмена; d - Корреляция между экспрессией TDO и CYP1B1 в данных микроматриц рака мочевого пузыря человека (слева, n=58), рака легкого человека (в центре, n=122) и карциномы яичников человека (справа, n=91), проанализированная с помощью ранговой корреляции Спирмена; е - Вероятность выживания пациентов с глиомой (II-IV степень согласно ВОЗ) с высокой экспрессией (красный) TDO или AHR по сравнению с пациентами со средней (синий) или низкой (зеленый) экспрессией данных генов, полученная из базы данных REMBRANDT. Для статистического анализа см. Дополнительные сведения 21; f - Вероятность выживания пациентов с глиобластомой с высокой экспрессией (красный) целевого гена CYP1B1 AHR по сравнению с пациентами с низкой (зеленый) экспрессией CYP1B1, полученная из набора данных по глиобластоме сети Атласа Ракового Генома (The Cancer Genome Atlas, TCGA) (n=362); g - Сводная фигура, подчеркивающая аутокринные и паракринные эффекты Kyn, получаемого под действием TDO, в отношении раковых клеток и иммуноцитов через AHR.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения и/или предотвращения рака, зависимого от природных лигандов AHR, включающему введение субъекту, страдающему указанным раком, терапевтически эффективного количества ингибитора AHR.
В настоящем описании термин «лечение» относится к любой положительной динамике при раке, наблюдаемой у субъекта, получающего лечение, по сравнению с субъектом, не получающим лечение. Такая положительная динамика может представлять собой предотвращение ухудшения или прогрессирования рака. Более того, указанная положительная динамика также может представлять собой уменьшение интенсивности или вылечивание рака, или сопровождающих его симптомов. Очевидно, что лечение может не быть успешным для 100% субъектов, которых лечат. Однако данный термин требует, чтобы лечение было успешным для статистически значимой части субъектов (например, когорты в когортном исследовании). То, является ли часть статистически значимой, может быть незамедлительно определено специалистом в данной области техники с использованием различных хорошо известных инструментов статистической оценки, например, определения доверительных интервалов, определения p-значения, t-критерия Стьюдента, критерия Манна-Уитни и т.д. Подробное описание можно найти в Dowdy and Wearden, Statistics for Research, John Wiley & Sons, New York 1983. Предпочтительные доверительные интервалы представляют собой по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%. p-значения предпочтительно представляют собой 0,05, 0,01, 0,005 или 0,0001.
В настоящем описании термин «предотвращение» относится к недопущению возникновения рака, указанного в настоящем описании, или сопровождающих его синдромов. Очевидно, что термин «предотвращение» относится к недопущению возникновения рака в пределах определенного временного промежутка в будущем. Указанный временной промежуток предпочтительно должен начинаться после введения соединения согласно настоящему изобретению и продолжаться в течение по меньшей мере 1 месяца, по меньшей мере 6 месяцев, по меньшей мере 9 месяцев, по меньшей мере 1 года, по меньшей мере 2 лет, по меньшей мере 5 лет, по меньшей мере 10 лет или даже в течение оставшегося физиологического времени жизни субъекта. Очевидно, что предотвращение может не быть успешным для 100% субъектов, которых лечат. Однако данный термин требует, чтобы предотвращение было успешным для статистически значимой части субъектов (например, когорты в когортном исследовании). То, является ли часть статистически значимой, может быть незамедлительно определено специалистом в данной области техники с использованием различных хорошо известных инструментов статистической оценки, также подробно рассмотренных в иных местах настоящего документа.
В настоящем описании термин «рак, зависимый от природного лиганда AHR», относится к любому злокачественному новообразованию, которое зависит от конститутивной активации AHR, вызываемой природным лигандом AHR. Предпочтительно, указанный природный лиганд AHR представляет собой кинуренин (Kyn). Кинуренин предпочтительно образуется в результате распада триптофана вследствие повышенной экспрессии ферментов, вызывающих распад триптофана. Более предпочтительно, рак согласно настоящему изобретению, таким образом, представляет собой рак, связанный с повышенной активностью триптофан-2,3-диоксигеназы (TDO). Активность TDO, указанную в настоящем описании, предпочтительно можно оценить путем измерения концентраций кинуренина и/или триптофана, присутствующих в ткани раковой опухоли или раковых клетках. Более того, повышенную активность TDO также можно оценить путем определения количества фермента TDO или транскриптов, кодирующих указанный фермент TDO, в ткани раковой опухоли или раковых клетках. Количество фермента TDO может быть определено методами на основе антител, такими как твердофазный иммуноферментный анализ (ELISA), тогда как количество транскриптов может быть определено методами на основе гибридизации нуклеиновых кислот, такими как нозерн-блоттинг, или методами амплификации нуклеиновых кислот, такими как ОТ-ПЦР. Наиболее предпочтительные методы определения того, присутствует ли повышенная TDO, связанная с раком, описаны в прилагаемых Примерах ниже или описаны в WO 2010/008427, соответствующее содержание которого включено в настоящее описание посредством ссылки. Предпочтительно, указанный выше рак выбран из группы, состоящей из: опухолей головного мозга, предпочтительно глиомы, меланомы, аденокарциномы толстой и прямой кишки, карциномы толстой кишки, почечно-клеточной карциномы, немелкоклеточного рака легкого (НМРЛ), рака молочной железы, печеночно-клеточной карциномы, карциномы яичников, карциномы головы и шеи, рака мочевого пузыря, аденокарциномы поджелудочной железы, мезотелиомы и мелкоклеточного рака легкого (МРЛ). В качестве альтернативы, а также более предпочтительно, рак согласно настоящему изобретению, таким образом, представляет собой рак, связанный с повышенной активностью индоламин-2,3-диоксигеназы 1 или 2 (IDO1 или 2). Предпочтительные раковые опухоли, рассматриваемые в этом контексте, хорошо известны в данной области техники; см., например, Lob 2009, Nat Rev Cancer 9(6), 445, соответствующее содержание которого включено в настоящее описание посредством ссылки.
«Ингибитор AHR» согласно настоящему изобретению представляет собой соединение, способное ингибировать либо напрямую, либо опосредованно активность полипептида, представляющего собой арилгидрокарбоновый рецептор (AHR). Полипептид AHR согласно настоящему изобретению является членом семейства факторов транскрипции «основная область-спираль-петля-спираль». Он представляет собой цитозольный фактор транскрипции, который обычно неактивен и присутствует в комплексе с несколькими шаперонами. Уже были описаны некоторые лиганды, которые могут активировать или ингибировать AHR, в том числе искусственные или встречающиеся в природе лиганды. Первые обнаруженные лиганды были синтетическими и являлись членами семейства галогенированных ароматических углеводородов (полихлорированные дибензодиоксины, такие как 2,3,7,8-тетрахлордибензо-n-диоксин (TCDD), дибензофураны и бифенилы) и полициклических ароматических углеводородов (3-метилхолантрен, бензо(а)пирен, бензантрацены и бензофлавоны). Встречающиеся в природе соединения, которые были идентифицированы в качестве лигандов AHR, включают производные триптофана, такие как кинуренин, индиго и индирубин, тетрапирролы, такие как билирубин, метаболиты арахидоновой кислоты, такие как липоксин A4 и простагландин G, модифицированный липопротеин низкой плотности, несколько пищевых каротиноидов и 7-кетохолестерол. После связывания лиганда шапероны отделяются, что приводит к транслокации AHR в ядро и димеризации с ARNT (ядерный транслокатор AHR). Комплекс AHR и ARNT влияет на транскрипцию генов.
Полипептид AHR содержит несколько доменов, имеющих критическое значение для функции, и классифицируется как член семейства факторов транскрипции «основная область-спираль-петля-спираль» /Per-Arnt-Sim (bHLH/PAS). Его мотив bHLH расположен в N-конце белка. Члены суперсемейства bHLH содержат два отличных по функции и высококонсервативных домена. Первый представляет собой основную область, вовлеченную в связывание указанного фактора транскрипции с ДНК. Второй представляет собой область «спираль-петля-спираль (HLH)», облегчающую взаимодействия белок-белок AHR также содержит два домена PAS, PAS-Α и PAS-B, которые представляют собой участки из 200-350 аминокислот, демонстрирующие высокую гомологию последовательностей с доменами белка, обнаруженными в генах дрозофилы (Drosophila) period (Per) и single-minded (Sim). Более того, схожие домены присутствуют в ARNT. Домены PAS поддерживают специфические вторичные взаимодействия с другими белками, содержащими домены PAS, так же как и ARNT, так, что могут образовываться гетерозиготные и гомозиготные белковые комплексы. Сайт связывания с лигандом AHR содержится в домене PAS-B и содержит несколько консервативных остатков, имеющих критическое значение для связывания лиганда. В частности, аминокислоты Tyr310, Phe324, His326 и/или Arg352, по-видимому, вовлечены в связывание лиганда. Наконец, домен, богатый Q, расположен в C-концевой области белка и вовлечен в набор коактиваторов и трансактивацию.
Предпочтительно, полипептид AHR представляет собой AHR человека и более предпочтительно AHR человека, кодируемый полинуклеотидом, представленным под номером доступа Genbank: NM_001621.4 (GI: 229577137), или содержит аминокислотную последовательность, представленную под данным номером доступа. Более того, согласно настоящему изобретению предусмотрены варианты полипептида AHR, указанные выше. Варианты вышеуказанных полинуклеотидов содержат одну или более замен, делеций и/или добавлений нуклеотидов, и предпочтительно приводят к кодированной аминокислоте, содержащей одну или более замен, делеций и/или добавлений аминокислоты, т.е. варианту полипептида согласно настоящему изобретению. Вариантный полинуклеотид предпочтительно должен содержать последовательность нуклеиновых кислот, на по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичную конкретным последовательностям нуклеиновых кислот, указанным выше. Более того, вариантный полинуклеотид предпочтительно может содержать последовательность нуклеиновых кислот, кодирующую аминокислотную последовательность, на по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичную аминокислотным последовательностям, указанным выше. В настоящем описании термин «идентичный» относится к идентичности последовательностей, охарактеризованной путем определения количества идентичных аминокислот между двумя последовательностями нуклеиновых кислот или аминокислотными последовательностями, при этом указанные последовательности выравнивают так, чтобы получить самое высокое совпадение порядка. Ее можно рассчитать с использованием опубликованных технологий или методов, систематизированных в компьютерных программах, таких как, например, BLASTP, BLASTN или FASTA (Altschul 1990, J Mol Biol 215, 403). В соответствии с одним из аспектов, значения идентичности в процентах рассчитаны по всей аминокислотной последовательности или по меньшей мере по 50% нуклеотидов более длинной последовательности. Для сравнения разных последовательностей специалисту доступна серия программ на основе различных алгоритмов. В данном контексте алгоритмы Нидлемана (Needleman) и Вунша (Wunsch) или Смита (Smith) и Уотермана (Waterman) дают наиболее надежные результаты. Для осуществления выравнивания последовательностей можно использовать программу PileUp (Higgins 1989, CABIOS 5, 151) или программы Gap и Bestfit (Needleman 1970, J Mol Biol 48; 443, Smith 1981, Adv Appl Math 2, 482), которые являются частью пакета программного обеспечения GCG (Genetics Computer Group 1991, 575 Science Drive, Madison, Wisconsin, USA 53711). В соответствии с другим аспектом настоящего изобретения значения идентичности последовательностей, указанные выше в процентах (%), следует определять с использованием программы GAP по всей области последовательностей со следующими параметрами: Штраф за внесение разрыва «гэпа» (Gap Weight): 50, Штраф за продолжение гэпа (Length Weight): 3, Среднее совпадение (Average Match): 10,000 и Среднее несовпадение (Average Mismatch): 0,000, которые, если не указано иное, всегда должны использоваться в качестве стандартных параметров для выравнивания последовательностей. Очевидно, что вышеуказанные варианты по-прежнему должны демонстрировать по существу такую же биологическую активность, что указана для AHR выше.
Соединение, напрямую ингибирующее активность AHR, предпочтительно представляет собой соединение, которое способно физически взаимодействовать с полипептидом AHR и, тем самым, ингибировать его активность. Такое ингибирование может происходить, если соединение связывается с доменом взаимодействия AHR или его лигандсвязывающим доменом и, таким образом, ингибирует биологическую функцию AHR, указанную в иных местах настоящего документа. Предпочтительно, ингибитор блокирует лигандсвязывающий домен для кинуренина, т.е. взаимодействует с лигандсвязывающим доменом домена PAS-B или лигандсвязывающим доменом, образованным Tyr310, Phe324, His326 и Arg352 (положения аминокислот, соответствующие AHR человека). В качестве альтернативы, соединение может вызывать аллостерический эффект в отношении полипептида AHR, также приводящий к ингибированию биологической функции. Опосредованное ингибирование может быть вызвано соединением, уменьшающим или предотвращающим транскрипцию и/или трансляцию полипептидов AHR и, таким образом, количество доступных полипептидов AHR в клетке. Ингибитор AHR должен по меньшей мере уменьшать активность AHR в статистически значимой степени. Конечно, предпочтительно, ингибитор будет уменьшать активность AHR до уровня ниже пределов обнаружения. Качественное и/или количественное определение ингибирования активности AHR можно проводить с помощью анализов, хорошо известных в данной области техники, и предпочтительно анализов, описанных в прилагаемых Примерах ниже. Активность AHR можно детектировать путем определения индукции экспрессии его эндогенного целевого гена CYP1A1 с помощью анализа с использованием этоксирезоруфин-О-деэтилазы (EROD).
В качестве альтернативы, активность AHR можно детектировать путем использования анализа с геном-репортером, в котором экспрессию гена-репортера контролируют диоксин-чувствительный элемент (DRE)-зависимым промотором. Наиболее предпочтительные анализы для определения активности AHR подробно описаны в прилагаемых Примерах.
Предпочтительно, ингибитор AHR представляет собой низкомолекулярное соединение.
«Низкомолекулярное соединение» (small molecule compound) согласно настоящему изобретению представляет собой органическую молекулу, имеющую молекулярную массу менее 10 кДа, менее 5 кДа, менее 2 кДа, менее 1 кДа или менее 500 Да. Предпочтительно низкомолекулярное соединение не представляет собой полимер. Предпочтительно низкомолекулярное соединение согласно настоящему изобретению может проникать в клетки и может диффундировать в цитоплазму для связывания с полипептидом AHR. Низкомолекулярные соединения, указанные в настоящем описании, могут быть искусственно синтезированы и могут содержаться в библиотеках химических соединений для скрининга на предмет потенциальных ингибиторов AHR. В качестве альтернативы, низкомолекулярные соединения могут быть получены из природных источников, таких как ткани, клетки или целые организмы, путем экстракции. Подходящие источники представляют собой, в частности, растения, растительную ткань или микроорганизмы. Однако также могут быть предусмотрены другие источники низкомолекулярных соединений - ингибиторов для AHR. Например, 7-кетохолестерол, по-видимому, представляет собой конкурентный ингибитор AHR у людей (Savouret 2001, J. Biol. Chem. 276 (5): 3054-9).
В предпочтительном варианте реализации способа согласно настоящему изобретению указанное низкомолекулярное соединение представляет собой соединение растительного происхождения или его производное.
В настоящем описании «соединение растительного происхождения или его производное» представляет собой низкомолекулярное соединение, получаемое путем экстракции из растения, растительной ткани или растительной клетки. Как правило, низкомолекулярные соединения растительного происхождения представляют собой метаболиты, такие как первичные или наиболее предпочтительно вторичные метаболиты растений. В более предпочтительном варианте реализации способа согласно настоящему изобретению указанное соединение растительного происхождения или его производное представляет собой флавон или его производное. Наиболее предпочтительно, указанный флавон или его производное представляет собой 3,4-диметоксифлавон, 3'-метокси-4'-нитрофлавон, 4',5,7-тригидроксифлавон (апигенин) или 1-метил-N-[2-метил-4-[2-(2-метилфенил)диазенил]фенил-1Н-пиразол-5-карбоксамид. В другом более предпочтительном варианте реализации способа согласно настоящему изобретению указанное соединение растительного происхождения или его производное представляет собой ресвератрол (транс-3,5,4'-тригидроксистильбен) или его производное, эпигаллокатехин или эпигаллокатехингаллат.
В другом предпочтительном варианте реализации способа согласно настоящему изобретению указанное низкомолекулярное соединение представляет собой соединение, характеризующееся следующей общей формулой (I):

где
(i) R1 и R2 независимо друг от друга представляют собой водород или С1-С12 алкил,
(ii) R3 - R11 независимо друг от друга представляют собой водород, C1-C12 алкил, гидроксил или С1-С12 алкокси, и
(iii) пунктирная линия представляет собой либо двойную связь, либо два атома водорода.
В частности, более предпочтительным является соединение, имеющее любую из следующих формул (II)-(V)


Другие более предпочтительные соединения и способы их получения описаны в WO 2007/128723, соответствующее содержание которого включено в настоящее описание посредством ссылки.
В другом предпочтительном варианте реализации способа согласно настоящему изобретению указанный ингибитор AHR представляет собой антитело, которое специфично связывается с белком AHR и ингибирует его.
Термин «антитело», употребляемый в данном контексте, относится ко всем видам антител, которые специфично связываются с полипептидом AHR и которые ингибируют активность AHR, как указано в иных местах настоящего документа. Предпочтительно, такое ингибирующее антитело согласно настоящему изобретению должно специфично связываться с эпитопом в пределах полипептида AHR, который расположен в лигандсвязывающем домене. В качестве альтернативы, связывание с эпитопом, за счет которого антитело должно ингибировать активность AHR, может происходить в ДНК-связывающем домене AHR или в доменах, ответственных за взаимодействие с полипептидом ARNT. Подходящие домены подробно рассмотрены в иных местах настоящего документа. Предпочтительно, антитело согласно настоящему изобретению представляет собой моноклональное антитело, поликлональное антитело, одноцепочечное антитело, химерное антитело или любой фрагмент, или производное указанных антител. Такие фрагменты и производные, включенные в термин «антитело», употребляемый в настоящем описании, включают биспецифическое антитело, синтетическое антитело, фрагмент Fab, F(ab)2 Fv или scFv, или химически модифицированное производное любого из данных антител. В контексте антитела согласно настоящему изобретению термин «специфическое связывание» означает, что антитело не дает перекрестную реакцию с другими полипептидами. Специфическое связывание может быть протестировано различными хорошо известными методами.
Антитела или их фрагменты, в целом, могут быть получены путем использования способов, описанных, например, в Harlow and Lane "Antibodies, A Laboratory Manual", CSH Press, Cold Spring Harbor, 1988. Моноклональные антитела могут быть получены методами, включающими слияние клеток миеломы мыши с клетками селезенки, полученными от иммунизированных млекопитающих и предпочтительно иммунизированных мышей (Kohler 1975, Nature 256, 495, and Galfré 1981, Meth. Enzymol. 73, 3). Предпочтительно, иммуногенный пептид, содержащий эпитоп, указанный выше, вводят млекопитающему. В зависимости от вида хозяина могут быть использованы различные адъюванты для повышения иммунного ответа. Такие адъюванты предпочтительно включают адъювант Фрейнда, минеральные гели, например гидроксид алюминия, и поверхностно-активные вещества, например лизолецитин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин фиссуреллы и динитрофенол.
В другом предпочтительном варианте реализации способа согласно настоящему изобретению указанный ингибитор AHR представляет собой белок-репрессор AHR или неактивный ядерный транслокатор AHR (ARNT).
В настоящем описании термин «репрессор AHR (AHRR)» относится к предполагаемому гену-супрессору опухоли, который отрицательно регулирует активность AHR и комплекса AHR/ARNT. Предпочтительно, полинуклеотид, кодирующий полипептид AHRR, а также аминокислотная последовательность для самого полипептида AHRR, указанного в настоящем описании, представлены под номером доступа Genbank: ВС151852 (GI: 156229770). Более того, полипептид AHRR согласно настоящему изобретению может представлять собой вариант вышеуказанных конкретных полинуклеотидов или полипептидов. Варианты вышеуказанных полинуклеотидов содержат одну или более замен, делеций и/или добавлений нуклеотидов, и предпочтительно приводят к кодированной аминокислоте, содержащей одну или более замен, делеций и/или добавлений аминокислоты, т.е. варианту полипептида согласно настоящему изобретению. Вариантный полинуклеотид предпочтительно должен содержать последовательность нуклеиновых кислот, на по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичную конкретным последовательностям нуклеиновых кислот, указанным выше. Более того, вариантный полинуклеотид предпочтительно может содержать последовательность нуклеиновых кислот, кодирующую аминокислотную последовательность, на по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичную аминокислотным последовательностям, указанным выше. То, как можно рассчитать идентичность последовательностей между двумя конкретными последовательностями, подробно описано в иных местах настоящего документа.
Как рассмотрено ранее, неактивные варианты полипептида ARNT могут быть незамедлительно получены специалистом в данной области техники на основе вышеуказанных конкретных полинуклеотидных или аминокислотных последовательностей, или их вариантов. Более того, данные неактивные полипептиды ARNT или полинуклеотиды, их кодирующие, можно вводить в раковые клетки, которые лечат, способами, хорошо известными в данной области техники. В частности, перенос генов посредством вирусных систем экспрессии предусмотрен согласно настоящему изобретению в качестве системы доставки полинуклеотидов, кодирующих неактивный ARNT. Подходящие технологии хорошо известны в данной области техники (см. выше).
В настоящем описании термин «ядерный транслокатор AHR (ARNT)» относится к связывающему белку для фактора транскрипции AHR. Подробное описание можно найти в настоящем документе ранее. Полипептид ARNT, называемый в настоящем описании ингибитором AHR, представляет собой полипептид, который по-прежнему способен взаимодействовать с AHR, но который предотвращает ядерную транслокацию или который направляет комплекс AHR/ARNT в «аппарат» клетки для расщепления белка. То, как такие модифицированные ингибирующие полипептиды ARNT могут быть получены, хорошо известно специалисту в данной области техники. Предпочтительно, полинуклеотид, кодирующий (немодифицированный) полипептид ARNT, указанный в настоящем описании, представлен под номером доступа Genbank: NM_001197325.1 (GI: 309747070). Предпочтительно, указанный полинуклеотид кодирует полипептид, содержащий аминокислотную последовательность, представленную под номером доступа Genbank: (белок) NP_001184254.1 (GI: 309747071). Более того, полипептид ARNT согласно настоящему изобретению может представлять собой вариант вышеуказанных конкретных полинуклеотидов или полипептидов ARNT. Варианты вышеуказанных полинуклеотидов содержат одну или более замен, делеций и/или добавлений нуклеотидов, и предпочтительно приводят к кодированной аминокислоте, содержащей одну или более замен, делеций и/или добавлений аминокислоты, т.е. варианту полипептида согласно настоящему изобретению. Вариантный полинуклеотид предпочтительно должен содержать последовательность нуклеиновых кислот, на по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичную конкретным последовательностям нуклеиновых кислот, указанным выше. Более того, вариантный полинуклеотид предпочтительно может содержать последовательность нуклеиновых кислот, кодирующую аминокислотную последовательность, на по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичную аминокислотным последовательностям, указанным выше. То, как можно рассчитать идентичность последовательностей между двумя конкретными последовательностями, подробно описано в иных местах настоящего документа.
Полипептиды AHRR или полинуклеотиды, их кодирующие, можно вводить в раковые клетки, которые лечат, способами, хорошо известными в данной области техники. В частности, перенос генов посредством вирусных систем экспрессии предусмотрен согласно настоящему изобретению в качестве системы доставки полинуклеотидов, кодирующих неактивный ARNT. Подходящие технологии хорошо известны в данной области техники и описаны, например, в Gardlík 2005, Med Sci Monit. 11 (4): RA110-21; Salmons 1993, Hum Gene Ther. 4(2): 129-41.
В другом предпочтительном варианте реализации способа согласно настоящему изобретению указанный ингибитор AHR представляет собой ингибитор, являющийся нуклеиновой кислотой.
В настоящем описании «ингибитор, являющийся нуклеиновой кислотой» представляет собой молекулу нуклеиновой кислоты, такую как аптамер, которая ингибирует активность полипептида AHR путем связывания с указанным полипептидом подобным образом, что описан для антител выше, или молекулу нуклеиновой кислоты, которая из-за комплементарности полинуклеотиду, кодирующему полипептид AHR, связывается с указанным полинуклеотидом и ингибирует его транскрипцию или трансляцию. Например, ингибирующая нуклеиновая кислота может выступать в виде олигонуклеотида, образующего тройную спираль, путем нарушения правильной транскрипции гена AHR. Более того, ингибирующая нуклеиновая кислота может представлять собой рибозим, который специфично связывается и вызывает распад транскриптов AHR. В качестве альтернативы, она может быть антисмысловой, представлять собой siPHK или микроРНК, способную связываться с транскриптом и вызывать его распад или по меньшей мере ингибировать его эффективную трансляцию. Последний тип ингибирующих нуклеиновых кислот характеризуется тем, что они обычно содержат последовательность нуклеиновых кислот, комплементарную последовательности в транскриптах AHR. Такая комплементарная последовательность должна быть достаточной длины и должна содержать достаточное количество соответствующих нуклеотидов для обеспечения специфической гибридизации с транскриптом в клетке. Такие ингибиторы, являющиеся нуклеиновыми кислотами, могут быть экспрессированы в раковой клетке после доставки системой для переноса генов, указанной в иных местах настоящего документа. Ингибирующие нуклеиновые кислоты предпочтительно можно экспрессировать под контролем последовательности, контролирующей экспрессию. Таким образом, опосредование РНК-интерференции (PHKi) для ингибирования экспрессии целевого гена можно модулировать с помощью последовательности, контролирующей экспрессию, которую можно регулировать экзогенным стимулом, таким как tet-оператор, активность которого можно регулировать тетрациклином или индуцируемыми теплом промоторами, или под контролем опухолеспецифичного или тканеспецифичного промотора. Однако ингибиторы, являющиеся нуклеиновыми кислотами, также могут быть доставлены с помощью систем доставки на основе липосом.
Таким образом, в другом более предпочтительном варианте реализации способа согласно настоящему изобретению указанный ингибитор, являющийся нуклеиновой кислотой, выбран из группы, состоящей из: рибозима, антисмысловой молекулы, ингибирующего олигонуклеотида, аптамера, микроРНК и siPHK.
«Рибозим» согласно настоящему изобретению представляет собой молекулу РНК, содержащую последовательность, комплементарную транскрипту AHR. Более того, рибозим содержит последовательность нуклеиновых кислот, способную вызывать гидролиз фосфодиэфирных связей в пределах транскрипта AHR. Рибозимы согласно настоящему изобретению могут представлять собой так называемые рибозимы типа «головка молотка», рибозимы типа «шпилька» или сателлитные рибозимы Варкуда (VS ribozymes). Технология рибозимов хорошо известна в данной области техники, и подходящий рибозим может быть незамедлительно получен и использован специалистом в данной области техники; см., например, Khan 2006, Clin. Chim. Acta 367 (1-2): 20-27; Kalota 2004, Cancer Biology & Therapy 3:1 4-12.
В настоящем описании термин «антисмысловая молекула» относится к терапевтической антисмысловой РНК, комплементарной транскрипту AHR или морфолино-олигонуклеотиду, способному связывать транскрипт AHR. Технология антисмысловых молекул, включая использование морфолино-олигонуклеотидов, хорошо известна в данной области техники; см., например, Kalota 2004, Cancer Biology & Therapy 3:1 4-12; Morcos 2007, Biochem Biophys Res Commun 358 (2): 521-7.
В настоящем описании термин «ингибирующие олигонуклеотиды» предпочтительно относится к малым молекулам двухцепочечных ДНК, которые способны связываться с конкретными областями целевой геномной ДНК, посредством чего достигается сайленсинг гена (так называемые олигонуклеотиды, образующие тройную спираль), или к олигонуклеотидам, которые выступают в качестве приманок для изолирования фактора транскрипции, особенно необходимого для транскрипции целевого гена. Данные технологии также успешно использовали in vivo, а также они уже в некоторой степени позволили получить лекарственные средства (также см. Kalota 2004, Cancer Biology & Therapy 3:1 4-12.).
В настоящем описании термин «аптамер» относится к аптамерам нуклеиновых кислот, которые специфично связываются с полипептидом AHR. Пул аптамеров может быть получен путем использования, например, метода систематической эволюции лигандов экспоненциальным обогащением (SELEX). Этап отбора может быть проведен для тех аптамеров, которые специфично связываются с полипептидом AHR. Среди специфично связывающихся аптамеров могут быть идентифицированы либо те, которые блокируют связывание с лигандом, либо те, которые блокируют домены взаимодействия и, таким образом, являются подходящими ингибиторами согласно настоящему изобретению. Технология получения аптамеров хорошо известна в данной области техники; см., например, Tuerk 1990, Science. Aug 3; 249(4968):505-510; or Ellington 1990, Nature. Aug 30; 346(6287):818-822.
Термин «микроРНК» согласно настоящему изобретению относится к молекуле одноцепочечной РНК, которая по меньшей мере частично комплементарна последовательности нуклеиновых кислот, содержащейся в транскрипте AHR. микроРНК обычно имеют длину от примерно 19 до 26 нуклеотидов. микроРНК синтезируют в виде предшественника, так называемой первичной микроРНК (pri-microRNA), содержащей шпилечную структуру и две дополнительные самокомплементарные области, образующие стержень шпильки. Одна из самокомплементарных последовательностей нуклеиновых кислот представляет собой микроРНК. Первичная микроРНК имеет длину примерно 70 нуклеотидов и процессируется в клетке-мишени в зрелую микроРНК. Зрелая микроРНК способна понижающе регулировать экспрессию генов путем влияния либо на трансляцию, либо на стабильность транскрибируемой мРНК после гибридизации с ней. То, как получить микроРНК и ее предшественника, первичную микроРНК, хорошо известно специалисту в данной области техники. В частности, самокомплементарные области эндогенной молекулы первичной микроРНК заменяют парой самокомплементарных областей, включающих одну самокомплементарную область, по меньшей мере частично комплементарную транскрипту AHR. Технология микроРНК описана, например, в Bartel 2009, Cell 136 (2): 215-33, Trang 2008, Oncogene 27 Suppl 2: S52-7 or Li 2009, The AAPS journal 11 (4): 747-57.
«Короткая шпилечная РНК (shPHK)» согласно настоящему изобретению имеет схожую структуру, что описана для первичных микроРНК выше. Однако shPHK, как правило, короче по длине. Более предпочтительно, shPHK, указанная согласно настоящему изобретению в качестве ингибитора AHR, представляет собой молекулу нуклеиновой кислоты, содержащую или по существу состоящую из последовательности нуклеиновых кислот, представленной в любой из SEQ ID NO: с 1 по 4. Получение и использование shPHK хорошо известно в данной области техники и описано, например, в Mclntyre 2006, ВМС Biotechnol. 6: 1 or Cao 2005, J Appl Genet. 46 (2): 217-25.
Термин «малая интерферирующая РНК (siPHK)» относится к молекуле нуклеиновой кислоты, которая представляет собой агент, являющийся двухцепочечной РНК, который комплементарен и может образовывать пары оснований с частью транскрипта AHR. siPHK действует таким образом, чтобы специфично направлять ферменты в клетке-хозяине на расщепление целевой РНК. В силу специфичности последовательности siPHK и ее гомологии с целевой РНК, siPHK может вызывать расщепление цепи целевой РНК, таким образом, инактивируя целевую молекулу РНК. Предпочтительно, siPHK, которая является достаточной для опосредования PHKi, содержит последовательность нуклеиновых кислот, содержащую фрагмент инвертированного повтора целевого гена и кодирующую область представляющего интерес гена (или ее часть). Комплементарные области siPHK обеспечивают достаточную гибридизацию siPHK с целевой РНК и, таким образом, опосредуют PHKi. В клетках млекопитающих siPHK являются приблизительно 19-25 нуклеотидов в длину. Необходимо, чтобы последовательность siPHK была достаточной длины для сведения вместе siPHK и целевой РНК за счет взаимодействий спаривания комплементарных оснований. Длина siPHK предпочтительно больше или равна десяти нуклеотидам и является достаточной для стабильного взаимодействия с целевой РНК; в частности 15-30 нуклеотидов; более конкретно любое целое число от 15 до 30 нуклеотидов, наиболее предпочтительно 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 и 30. Под достаточной длиной понимается олигонуклеотид из 15 или больше нуклеотидов, т.е. достаточно большой длины для обеспечения предусмотренной функции в предполагаемых условиях. Под стабильным взаимодействием понимается взаимодействие малых интерферирующих РНК с целевой нуклеиновой кислотой (например, путем образования водородных связей с комплементарными нуклеотидами в мишени в физиологических условиях). Как правило, такая степень комплементарности составляет 100% между siPHK и целевой РНК, но при необходимости может быть меньше, предпочтительно 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%. Например, 19 оснований из 21 основания могут образовывать пары оснований. В некоторых случаях, когда необходим выбор между различными аллельными вариантами, требуется 100% комплементарность целевому гену для того, что эффективно отличить целевую последовательность от другой аллельной последовательности. В данной области техники известны способы, относящиеся к применению PHKi для сайленсинга генов в организмах, включающих нематоду (С. elegans), дрозофилу (Drosophila), растения и млекопитающих (см., например, Fire 1998, Nature 391:806-811; Fire 1999, Trends Genet. 15, 358-363; WO 2001/29058; WO 2009/932619).
Наконец, согласно настоящему изобретению, в целом, предусмотрен ингибитор AHR предпочтительно такой, как определен выше, для применения в лечении и/или предотвращении рака, связанного с повышенной активностью триптофан-2,3-диоксигеназы (TDO).
Связанную с раком иммуносупрессию за счет деградации Trp до сих пор объясняли, главным образом, ферментативной активностью IDO в раковых клетках и дренирующих опухоль лимфатических узлах. Таким образом, ингибирование IDO в настоящее время оценивают в клинических исследованиях как терапевтическую стратегию для лечения рака несмотря на некоторые нецелевые эффекты в отношении раковых клеток человека. В исследованиях, лежащих в основе настоящего изобретения, было показано, что TDO сильно экспрессирована в раковой опухоли и в равной степени способна продуцировать иммуносупрессивный Kyn. В IDO-отрицательных клетках глиомы TDO, по-видимому, является единственным определяющим фактором конститутивного распада Trp, что указывает на то, что TDO представляет собой новую мишень для терапевтического воздействия в терапии глиомы. В действительности, недавно был разработан ингибитор TDO, доступный в форме для перорального введения. Ингибирование TDO может не только восстанавливать противоопухолевые иммунные ответы, но и действовать на внутренний злокачественный фенотип клеток опухоли, так как авторы настоящего изобретения очертили важное значение конститутивного распада Trp для поддержания злокачественного фенотипа рака путем воздействия на сами клетки опухоли. Появляющиеся данные указывают на способствующую возникновению опухоли роль AHR. Активация AHR способствует клоногенности и инвазивности раковых клеток. У трансгенных мышей с конститутивно активным AHR спонтанно развиваются опухоли, и репрессор AHR (AHRR) представляет собой ген-супрессор опухоли в многочисленных раковых опухолях человека. Аберрантный фенотип Ahr-дефицитных мышей указывает на существование эндогенных лигандов AHR. Тогда как было показано, что различные эндогенно образуемые метаболиты, такие как метаболиты арахидоновой кислоты, билирубин, цАМФ, триптамин и 6-формилиндоло[3,2-b]карбазол (FICZ), являются агонистами AHR, их функции не были убедительно продемонстрированы в контексте патофизиологии, таком как рак или иммуноактивация. Поэтому, поиск эндогенных лигандов AHR продолжается.
Согласно настоящему изобретению это два важных пути, вносящие вклад в прогрессирование рака, демонстрируя, что катаболизм Trp приводит к активации AHR, и они подтверждают патофизиологическое состояние человека, связанное с выработкой достаточных количеств функционально значимого эндогенного лиганда AHR. Результаты исследований, лежащих в основе настоящего изобретения, показывают дифференцированный ответ первичных иммуноцитов и трансформированных раковых клеток на сигналы, опосредованные AHR, что согласуется с различными токсикологическими исследованиями с использованием классических экзогенных лигандов AHR, TCDD и 3-метилхолантрена (3-МС). Воздействие данных ксенобиотиков приводит к сильному подавлению клеточного и гуморального иммунного ответа и в то же время способствует канцерогенезу и индуцирует рост опухоли. Данные специфичные к клеткам различия эффектов AHR, вероятно, зависят от экспрессии факторов, дифференциально регулирующих передачу сигнала AHR, таких как AHRR, а также специфичного к клеткам взаимовлияния (crosstalk) факторов транскрипции, формирующего ответ на активацию AHR. Вероятно, что активация AHR, опосредованная Kyn, является значимой не только при раке. Например, активация AHR мыши и человека агонистическими лигандами индуцирует регуляторные Т-клетки. Интересно то, что Ahr-дефицитные мыши страдают обострением аутоиммунитета ЦНС в отсутствие экзогенного лиганда, тогда как катаболиты Trp подавляют аутоиммунитет ЦНС, что позволяет предположить, что активация катаболизма Trp представляет собой эндогенную петлю обратной связи для ограничения воспаления через AHR. В действительности, экзогенный Kyn,вовлечен в регуляцию иммуноцитов у мышей через AHR. Концентрации Kyn, достаточные для активации AHR, также образуются IDO в ответ на воспалительные стимулы. В более широком контексте, значительное число злокачественных опухолей возникает из областей главным образом хронической инфекции и воспаления, в которых катаболизм Trp в микроокружении опухоли активируется и поддерживает подавление локального иммунного ответа. Активация AHR кинуренином, образованным в ответ на воспалительные стимулы, таким образом, может представлять собой ранее неизвестный путь, связывающий воспаление и канцерогенез.
Полное содержание и содержание, специально упомянутое в настоящем описании, всех источников, указанных в настоящем описании, включено в настоящее описание посредством ссылки.
ПРИМЕРЫ
Далее настоящее изобретение будет описано с помощью следующих примеров, которые, однако, не следует рассматривать как ограничивающие объем настоящего изобретения.
Пример 1: Материалы и общие методы
Клетки и реагенты
Происхождение и условия культивирования линий клеток подробно описаны в Дополнительных методах. Все клетки, инициирующие глиому (GIC), получали из свежеиссеченных опухолей и использовали при первых пересевах. Все клетки тестировали стандартным способом на предмет бактериального загрязнения. RPMI 1640, не содержащую Trp (Promocell), и диализированную FBS (Invitrogen) использовали для культивирования клеток в условиях без Trp. L-Trp и L-Kyn получали от Sigma-Aldrich. Интерферон-γ (IFN-γ) получали от Immunotools (Фризойте, Германия). TCDD и 3-метилхолантрен (3-МС) получали от Sigma-Aldrich и 3,4-диметоксифлавон (3,4-DMF) получали от Alfa Aesar (Карлсруэ, Германия). Ингибитор TDO ((Е)-6-фтор-3-[2-(3-пиридил)винил]-1Н-индол) 680С91 синтезировали путем конденсации 6-фториндол-3-карбоксальдегида с пиридин-3-уксусной кислотой в присутствии пиперидина.
Мыши
Мышей C57BL/6N и CD-1 nu/nu приобретали у Charles River (Зульцфельд, Германия). Ahr-дефицитные мыши (В6.129-AHRtm1Bra/J) были любезно предоставлены Charlotte Esser (Дюссельдорф, Германия). Мышей C57BL/6N, которые были соответствующего возраста с Ahr-дефицитными мышами, получали от Harlan Laboratories (Росдорф, Германия).
Анализ экспрессии TDO
Экспрессию TDO анализировали с помощью иммуногистохимии в опухолях человека. Ее значимость для распада Trp определяли с использованием генетического нокдауна или сверхэкспрессии TDO. Trp и Kyn измеряли в надосадочных жидкостях культур клеток, сыворотках человека и ткани ксенотрансплантата путем ВЭЖХ. Для оценки влияния активности TDO на иммунный ответ использовали реакции смешанной культуры лейкоцитов, высвобождение хрома, ELISpot и окрашивание иммуноцитов в тканях опухолей. Анализ клеточного цикла, анализы с использованием Матригеля и анализы инвазии сфероидов, анализы методом зарастания царапины, анализы образования сферы и анализы клоногенности использовали для анализа аутокринных эффектов активности TDO. Все процедуры у животных выполняли согласно принципам проведения исследований на лабораторных животных и были разрешены правительством. Ортотопическую имплантацию клеток глиомы человека со стабильным нокдауном TDO и без него мышам CD1nu/nu, подкожную инъекцию данных клеток мышам CD1nu/nu с истощением NK-клеток или дикого типа, и подкожную инъекцию Tdo-компетентных и Tdo-дефицитных клеток GL261 мышей сингенным мышам C57BL/6N осуществляли для анализа аутокринных и паракринных эффектов активности TDO in vivo. Анализ клеток глиомы человека, обработанных Kyn, с использованием микроматриц проводили для идентификации путей передачи сигнала, активируемых Kyn. Анализ транслокации AHR, анализы DRE-люциферазы и радиолигандные анализы связывания подтвердили активацию AHR кинуренином. Фармакологическое ингибирование и стабильный нокдаун AHR (in vitro и in vivo) подтвердили, что эффекты Kyn зависят от AHR. Инъекцию Tdo-компетентных и Tdo-дефицитных клеток опухоли мышам Ahr+/+ и Ahr-/- использовали для исследования вклада эффектов хозяина в опосредуемое TDO способствование возникновению рака. Наконец, окрашивания, данные микроматриц и клинические данные тканей опухолей человека использовали для анализа того, активирует ли TDO AHR в раковых опухолях человека и как это влияет на выживаемость.
Анализ концентраций Trp и Kyn путем высокоэффективной жидкостной хроматографии (ВЭЖХ)
Анализ методом ВЭЖХ проводили с использованием ВЭЖХ Beckman с детектированием на фотодиодной матрице (PDA) и колонки Lichrosorb RP-18 (250 мм × 4 мм (внутренний диаметр), 5 мкм, Merck, Дармштадт, Германия). Концентрации Kyn и Trp измеряли в среде 3×105 клеток. Получали сыворотку крови человека у 24 пациентов с глиобластомой (10 женщин, 14 мужчин, средний возраст 54,5 лет) и 24 здоровых контролей в соответствующей возрастной и половой группе (10 женщин, 14 мужчин, средний возраст 53,5 лет) после информированного согласия и анализировали на предмет концентраций Trp и Kyn. Для измерения концентраций Kyn в ксенотрансплантатах U87 опухоли U87 иссекали, определяли их массу, сразу же замораживали в жидком азоте и обрабатывали.
Количественная (к) ОТ-ПЦР
Тотальную РНК выделяли с помощью набора RNeasy Qiagen и кДНК синтезировали с помощью набора для обратной транскрипции Applied Biosystems (Фостер Сити, Калифорния, США). Количественную ОТ-ПЦР осуществляли в термоциклере ABI 7000 с SYBR Green PCR Mastermix (оба от Applied Biosystems). Все праймеры отделяли по меньшей мере одним интроном на геномной ДНК для исключения амплификации геномной ДНК. Реакции ПЦР контролировали путем включения контролей, не содержащих обратной транскриптазы, путем пропуска матриц и путем как анализов кривой плавления, так и анализов с использованием геля. Для каждого гена получали стандартные кривые. Относительное количественное определение экспрессии генов проводили путем сравнения пороговых значений. Все результаты приводили к глицеральдегид-3-фосфатдегидрогеназе (ГАФД).
Эксперименты с siPHK
Для нокдауна IDO1 (INDO), IDO2 и TDO (TDO2) использовали siPHK SMART-pool от Dharmacon RNA Technologies (Лафайет, Колорадо, США). Целевые последовательности были следующими:
INDO человека (номер доступа Genbank NM_002164):
5'-UCACCAAAUCCACGAUCAUUU-3' (SEQ ID NO: 5);
5'-UUUCAGUGUUCUUCGCAUAUU-3' (SEQ ID NO: 6);
5'-GUAUGAAGGGUUCUGGGAAUU-3' (SEQ ID NO: 7);
5'-GAACGGGACACUUUGCUAAUU-3' (SEQ ID NO: 8)
IDO2 человека (номер доступа Genbank NM_194294):
5'-CAAACUUCCUCAAUUGAUU-3' (SEQ ID NO: 9);
5'-UUGGAAAGCUAUCACAUAU-3' (SEQ ID NO: 10);
5'-GAGUAUGGCUUUCUUCUUC-3' (SEQ ID NO: 11);
5'-GCACCCAGUUGAAGUUUAA-3' (SEQ ID NO: 12)
TDO2 человека (номер доступа Genbank NM_005651):
5'-UCAUAAGGAUUCAGGCUAA-3' (SEQ ID NO: 13);
5'-AGUGAUAGGUACAAGGUAU-3' (SEQ ID NO: 14);
5'-GGAUUUAACUUCUGGGGAA-3' (SEQ ID NO: 15);
5'-GCGAAGAAGACAAAUCACA-3' (SEQ ID NO: 16)
Смысловая shPHK TDOA:
5'-GGAAAGAACTCCAGGTTTATTCAAGAGATAAACCTGGAGTTCTTTCC-3' (SEQ ID NO: 17)
Антисмысловая shPHK TDOA:
5'-CCTTTCTTGAGGTCCAAATAAGTTCTCTATTTGGACCTCAAGAAAGG-3' (SEQ ID NO: 18)
Смысловая shPHK TDOB:
5'-TCATAAGGATTCAGGCTAATTCAAGAGATTAGCCTGAATCCTTATGA-3' (SEQ ID NO: 19)
Антисмысловая shPHK TDOB:
5'-AGTATTCCTAAGTCCGATTAAGTTCTCTAATCGGACTTAGGAATACT-3' (SEQ ID NO: 20)
Нецелевой пул ON-TARGETplus siCONTROL (D-001810-10-05, Dharmacon) и трансфекцию без siPHK использовали в качестве отрицательных контролей. Клетки трансфицировали с использованием липофектамина RNAiMAX от Invitrogen. Эффективность нокдауна анализировали путем количественной ОТ-ПЦР.
Клетки со стабильным нокдауном
Клетки глиомы U87 человека трансфицировали плазмидой pSUPER.puro (OligoEngine, Сиэтл, Вашингтон, США), экспрессирующей sh-TDO, или скремблированным контролем (scrambled control), с использованием реагента для трансфекции FUGENE HD (Roche, Мангейм, Германия). Через 72 часа после трансфекции среду заменяли на DMEM, содержащую 5 мкг/мл пуромицина (AppliChem GmbH). Если не указано иное, использовали sh-7DOA. Для нокдауна AHR в клетках глиомы LN308 вектор pSingle-tTS-shRNA приобретали у Clontech (Калифорния, США). Соединенные двухцепочечные олигонуклеотиды, кодирующие желаемые последовательности shPHK с липкими концами XhoI/HindIII, клонировали в вектор с использованием сайтов клонирования XhoI/HindIII. Короткие шпилечные последовательности для сайленсинга контроля/AHR или shPHK TDO, содержащие липкие концы XhoI/HindIII, были следующими:
Скремблированная антисмысловая shPHK, олигонуклеотид:
5'-AGCTTGGATCCAAAAAAGTACTTCCACCTCAGTTGGCTCTCTTGAAGCCAACTGAGGTGGAAGTACC-3' (SEQ ID No: 21),
Скремблированная смысловая shPHK, олигонуклеотид:
5'-TCGAGGTACTTCCACCTCAGTTGGCTTCAAGAGAGCCAACTGAGGTGGAAGTACTTTTTTGGATCCA-3' (SEQ ID NO: 22),
Антисмысловая shPHK AHR, олигонуклеотид:
5'-AGCTTGGATCCAAAAAAGCGTTTACCTTCAAACTTTATCTCTTGAATAAAGTTTGAAGGTAAACGCC-3' (SEQ ID NO: 1),
Смысловая shPHK AHR, олигонуклеотид:
5'-TCGAGGCGTTTACCTTCAAACTTTATTCAAGAGATAAAGTTTGAAGGTAAACGCTTTTTTGGATCCA-3' (SEQ ID NO: 2),
Антисмысловая shPHK AHR, олигонуклеотид (Dharmacon siPHK #6 из Smart pool siPHK AHRAHR):
5'-AGCTTGGATCCAAAAAAGGAACTCAAGCTGTATGGTATCTCTTGAATACCATACAGCTTGAGTTCCC-3' (SEQ ID NO: 3),
Смысловая shPHK AHR, олигонуклеотид (Dharmacon):
5'-TCGAGGGAACTCAAGCTGTATGGTATTCAAGAGATACCATACAGCTTGAGTTCCTTTTTTGGATCCA-3' (SEQ ID NO: 4).
Рекомбинантный вектор трансфицировали в клетки глиомы LN-308 и LN-18, и клональные трансформанты отбирали с помощью 1 мг/мл неомицина (Sigma-Aldrich). Нокдаун индуцировали с использованием 2 мкг/мл доксициклина (Sigma-Aldrich), клетки анализировали через 72 часа после индукции. Если не указано иное, использовали sh-AHR1.
Стабильная сверхэкспрессия
Клетки GL261 трансфицировали либо pcDNA3.1 (-) (Invitrogen), экспрессирующим кДНК Tdo (NM_019911), либо пустым вектором с использованием реагента FuGENE HD (Roche). Клональные трансформанты отбирали с использованием 1 мг/мл неомицина (Sigma-Aldrich).
Препараты ткани и иммуногистохимия
Срезы, уменьшенные до 3 мкм, инкубировали и обрабатывали соответствующим антителом с использованием устройства для иммунного окрашивания Ventana BenchMark XT® (Ventana). Для количественного анализа окрашивания TDO оценивали процент окрашенных клеток опухоли и интенсивность окрашивания в характерных областях увеличения (200х) на срезах тканей с использованием оптической микроскопии (Olympus ВХ51).
Иммунофлуоресцентное окрашивание
Для иммунофлуоресценции срезы глиом с низкой экспрессией TDO и глиом с высокой экспрессией TDO инкубировали совместно с антителами анти-TIPARP кролика (1:50) и анти-LCA мыши (1:50) в течение ночи при 4°C после 30 минут теплового демаскирования антигенов в растворе для демаскировки антигенов 1 Ventana. Затем вносили вторичные антитела осла к IgG кролика AlexaFluor 568 (1:500, Invitrogen) и осла к IgG мыши DyLight 488 (1:100, Jackson ImmunoResearch, Вест Гров Пенсильвания, США) на 5 часов. Микрофотографии делали на микроскопе Olympus ВХ-50 (Olympus GmbH, Гамбург, Германия) с использованием Axiocam MRm Zeiss (Zeiss, Йена, Германия).
Реакция смешанной культуры лейкоцитов (MLR)
Клетки глиомы высевали в 96-луночные планшеты в RPMI 1640, содержащей 10% FBS, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина. Через 24 часа после высевания добавляли 2×105 облученных (30 Гр) МКПК в качестве стимуляторов и 2×105 МКПК от неродственных доноров в качестве клеток-респондеров. Проводили MLR в течение шести дней и культуры подвергали импульсному мечению [3Н]-метилтимидином (PerkinElmer, Уолтем, Массачусетс, США) в течение последних 18 часов. Клетки собирали и поглощение радионуклидов измеряли путем счета сцинтилляций. Эксперименты повторяли с шестью неродственными донорами МКПК.
Анализ по гену-репортеру
Двойной анализ с применением люциферазы/renilla проводили, как подробно описано в Дополнительных методах. Для анализа активности гена-репортера, регулируемого DRE, в ответ на различные метаболиты Trp использовали экспрессионную плазмиду pGL3 с промотором и контрольную плазмиду pRL-SV40, экспрессирующую люциферазу renilla (Promega, Гейдельберг, Германия).
Анализы инвазии
В анализах с использованием матригеля инвазию клеток оценивали путем подсчета количества клеток, которые мигрировали через мембрану, в 5 независимых полях зрения микроскопа под большим увеличением и выражали в виде процента инвазивности по сравнению с контролем с использованием Microgrid. В анализах сфероидов получаемые с помощью микроскопа фотографии площади, покрытой каждым сфероидом, делали через 0, 24, 48 и 72 часа после имплантации. Для количественного определения среднюю площадь, покрытую проникшими клетками глиомы в указанный момент времени, измеряли с интервалами 24 часа и сравнивали с площадью в 0 часов с помощью ImageJ.
Анализ высвобождения хрома
Ингибирование цитотоксичности иммуноцитов оценивали с использованием стандартизированного анализа высвобождения51 Cr (Дополнительные методы). Специфический лизис в процентах рассчитывали следующим образом: [Экспериментальное высвобождение51Cr - Минимальное высвобождение] / [Максимальное высвобождение - Минимальное высвобождение] × 100. Данный эксперимент проводили по меньшей мере с 4 разными донорами МКПК.
Анализ методом иммуноферментных пятен (ELISpot)
Дендритные клетки (ДК) выделяли из костного мозга здоровых мышей C57BL/6N и культивировали в RPMI 1640, содержащей 20 нг/мл гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) (Immunotools), в течение 5 дней. Извлекали селезенки у мышей с опухолями и «протирали» через 40 мкм клеточный фильтр. Лизировали эритроциты и выделяли Т-клетки с помощью MACS с использованием набора для выделения Т-клеток Pan Τ cell isolation kit (Miltenyi GmbH). Высевали 2×105 ДК в планшет ELISpot (Millipore), покрытый антителом анти-IFNγ (Mabtech АВ, Nacka Strand, Швеция), и активировали 10 мкг лизата GL261 - полученного в ФБР путем повторных циклов замораживания и оттаивания - в течение 4 часов перед добавлением 1×105 Т-клеток. Через 36 часов детектировали Т-клетки, продуцирующие IFNγ, с помощью биотинилированного антитела анти-ΙΡΝγ, стрептавидин-ALP и BCIP/NBTPLUS (Mabtech) и количественно определяли с использованием анализатора ImmunoSpot (Cellular Technology Limited, Шейкер Хайте, Огайо, США).
Детектирование транслокации AHR
Для детектирования транслокации AHR 7000 клеток Tao BpRc1c с AHR, меченым GFP, на лунку подвергали воздействию 50 мкМ Kyn,или 50 мкМ Trp, фиксировали в 3,7% формальдегиде в ФБР, пермеабилизировали в 0,1% Тритоне (Triton) X100, инкубировали совместно с 1 мкг/мл Hoechst 33342 (Invitrogen) и получали изображения на устройстве Imager 855 BD Pathway™ в неконфокальном режиме с использованием объектива 20х U-Аро 340 (Olympus, NA 0,75). Дальнейший анализ интенсивности флуоресценции проводили с использованием программного обеспечения Attovision (BD Biosciences). Кроме того, сравнивали содержание белка AHR в ядерной и цитоплазматической фракциях клеток глиомы LN-229 путем иммуноблоттинга.
Радиолигандный анализ связывания с использованием 3Н-меченого Kyn
L-3Н-Kyn с удельной активностью 11 Ки/ммоль получали от Quotient Bioresearch (Radiochemicals) Ltd (Кардифф, Великобритания). Проводили анализы связывания с L-3H-Kyn с использованием цитозоля печени мыши от Ahr-компетентных и Ahr-дефицитных мышей. Специфическое связывание определяли как разницу радиоактивности между Ahr-компетентным и Ahr-дефицитным цитозолем.
Эксперименты на животных
Все процедуры у животных выполняли согласно принципам проведения исследований на лабораторных животных и были разрешены правительством. Клетки глиомы человека либо вводили подкожно путем инъекции, либо стереотаксически имплантировали в правое полосатое тело шести 6-12-недельных бестимусных мышей (CD1nu/nu) и контролировали. Истощение NK-клеток осуществляли путем интраперитонеальной инъекции антитела кролика анти-asialo GM1 (Wako Chemicals, Дюссельдорф, Германия) один раз в две недели, начиная за 2 дня до инъекции клеток опухоли. Контролям вводили IgG кролика путем инъекции (Calbiochem, Дармштадт, Германия). Для индукции нокдауна AHR in vivo мышам вводили доксициклин в концентрации 2 мг/мл в питьевой воде, содержащей сахарозу. Клетки глиомы мыши вводили подкожно путем инъекции в правый бок 6-12-недельных мышей C57BL6/N дикого типа или AHR-/- мышей C57/BL6.
Магнитно-резонансная томография (МРТ)
Изображения МРТ, представленные на Фиг. 3g, получали с использованием специально разработанной катушки приема/передачи для маленьких животных в традиционном сканере МРТ всего тела 1,5 Тл (Symphony, Siemens, Эрланген, Германия).
Микроматрица
Клетки глиомы U87 обрабатывали 100 мкМ Kyn в течение 8 часов или 24 часов, после чего клетки собирали и выделяли РНК с использованием набора RNAeasy (Qiagen). РНК подвергали анализам с использованием микроматриц, подробно описанным в Дополнительных методах. Для каждой из четырех обработок (8 часов, 24 часа, обработанные Kyn, необработанные) гибридизовали две матрицы и рассчитывали средние соотношения log2 экспрессии генов в образцах, обработанных Kyn, по сравнению с необработанными образцами. Дальнейший анализ данных подробно описан в Дополнительных методах. Для клинических образцов данные микроматриц и клинические данные получали из базы молекулярных данных неоплазии головного мозга (REpository for Molecular BRAin Neoplasia DaTa, REMBRANDT) (Дополнительные методы). Анализ выживаемости в рамках набора данных по нелеченной первичной глиобластоме (n=362) сети Атласа Ракового Генома (TCGA) проводили с использованием модуля «анализ Каплана-Мейера» анализа с использованием микроматриц R2 и платформы визуализации (http://r2.amc.nl).
Статистический анализ
Данные выражены в виде среднего значения ± стандартная ошибка среднего. Анализ значимости проводили с использованием t-критерия Стьюдента (SigmaPlot). Значения Ρ<0,05 считались значимыми. Корреляцию Ki67 и TDO анализировали с помощью ранговой корреляции Спирмена (SPSS, IBM, Сомерс, Нью-Йорк, США). Корреляцию между TDO и AHR (Фиг. 6с), а также между TDO и CYP1B1 (Фиг. 6d) анализировали с помощью ранговой корреляции Спирмена (SigmaPlot). Интенсивность ядерной флуоресценции анализировали с использованием однофакторного рангового ANOVA (p=<0,001) с последующим методом Данна (p<0,05).
Пример 2: Аутокринные и паракринные эффекты Kyn, образованного под действием TDO
В соответствии с исследованиями, лежащими в основе настоящего изобретения, скрининг линий раковых клеток человека выявил конститутивный распад Trp и высвобождение высоких микромолярных количеств Kyn в клетках опухоли головного мозга, а именно линиях клеток глиомы и клетках, инициирующих глиому (GIC), но не в астроцитах человека (Фиг. 1а). Удивительно то, что IDO1 и IDO2 не объясняли конститутивный катаболизм Trp в опухолях головного мозга. Вместо этого, триптофан-2,3-диоксигеназа (TDO), которая преимущественно экспрессируется в печени, и которая, как полагают, регулирует системные концентрации Trp, была сильно экспрессирована в клетках глиомы человека и коррелировала с высвобождением Kyn (Фиг. 1b). Фармакологическое ингибирование или нокдаун TDO блокировали высвобождение Kyn клетками глиомы, тогда как нокдаун IDO1 и IDO2 не оказывал влияния (Фиг. 1c, d), что таким образом подтверждает, что TDO является центральным ферментом, вызывающим распад Trp, в клетках глиомы человека. В образцах опухоли головного мозга человека уровни белка TDO увеличивались по мере увеличения злокачественности и коррелировали с индексом пролиферации (Фиг. 1e-g). Как описано ранее (Miller 2004, Neurobiol Dis 15(3), 618), головной мозг здорового человека демонстрировал лишь слабое окрашивание TDO в нейронах (Фиг. 1e). Экспрессия TDO не ограничивалась глиомами и ее также обнаруживали в других типах рака, указанных в иных местах настоящего документа, включая печеночно-клеточную карциному, карциному толстой кишки, рак молочной железы, НМРЛ, карциному яичников, злокачественную меланому (метастазы в головном мозге) и почечно-клеточную карциному.
Уменьшенные концентрации Trp измеряли в сыворотках крови пациентов с глиомой (Фиг. 1h). Они, вероятно, не преобразовывались в повышенные уровни Kyn (Фиг. 1h), т.к. Kyn поглощается другими клетками и метаболизируется в хинолиновую кислоту. Действительно, накопление хинолиновой кислоты обнаруживали в ткани глиобластомы, экспрессирующей TDO (Фиг. 1i). Kyn подавляет аллогенную пролиферацию Т-клеток. Аллогенная пролиферация Т-клеток обратно коррелировала с образованием Kyn под действием TDO, образованной в глиоме (Фиг. 2а). Нокдаун TOO в клетках глиомы (Дополнительная Фиг. 4c, d; Дополнительные сведения 9) восстанавливал аллогенную пролиферацию Т-клеток, тогда как добавление Kyn к клеткам с нокдауном TDO предотвращало восстановление пролиферации Т-клеток (Фиг. 2b). Kyn зависимым от концентрации образом ингибировал пролиферацию CD4+ и CD8+ Т-клеток, стимулированных рецепторами Т-клеток (Дополнительная Фиг. 4е). Кроме того, нокдаун TDO приводил к повышенному лизису клеток глиомы аллореактивными МКПК (Дополнительная Фиг. 4f). Наконец, сниженную инфильтрацию общий лейкоцитарный антиген (LCA)-положительными и CD8+ иммуноцитами наблюдали на срезах глиомы человека с высокой экспрессией TDO по сравнению со срезами с низкой экспрессией TDO (Фиг. 2с), что указывает на то, что образование Kyn под действием TDO может подавлять противоопухолевые иммунные ответы. Эксперименты in vivo у иммунокомпетентных мышей показали, что опухоли, экспрессирующие TDO, росли быстрее и демонстрировали более высокий индекс пролиферации, чем контрольные TDO-дефицитные опухоли (Фиг. 2d). Активность TDO в опухолях подавляла противоопухолевые иммунные ответы in vivo, о чем свидетельствует уменьшение высвобождения интерферона-γ (IFN-γ) опухолеспецифичными Т-клетками, и лизис клеток опухоли клетках селезенки мышей с опухолями, экспрессирующими TDO, по сравнению с мышами с TDO-дефицитными опухолями (Фиг. 2e, f).
Затем оценивали аутокринные эффекты Kyn в отношении клеток глиомы. Тогда как отличий в развитии клеточного цикла между контролями и клетками глиомы с нокдауном TDO не обнаруживали, нокдаун TDO уменьшал подвижность и клоногенную выживаемость (Фиг. 2g, h). Это было опосредовано Kyn, т.к. экзогенное добавление Kyn восстанавливало подвижность и клоногенную выживаемость в отсутствии Trp (Фиг. 2i, j), что позволяет предположить, что Kyn увеличивает подвижность злокачественных клеток глиомы. В GIC образование сфер увеличивалось в ответ на Kyn. Наконец, происходило нарушение образования опухоли, когда опухоли с нокдауном TDO ортотопически имплантировали в головной мозг бестимусных мышей, лишенных функциональных Т-клеток (Фиг. 2k).
Пример 3: Ингибирование NK-клеток, опосредованное TDO
Для анализа того, может ли ингибирование противоопухолевых ответов NK-клеток, опосредованное TDO, которые являются функциональными у бестимусных мышей, объяснить нарушение образования опухолей с нокдауном TDO, рост подкожных опухолей сравнивали в присутствии или в отсутствие NK-клеток. Истощение NK-клеток усиливало рост как контрольных опухолей, так и опухолей с нокаутом TDO, но не восстанавливало рост опухолей с нокаутом TDO до роста контролей (Фиг. 2l), что позволяет предположить, что Kyn, образуемый за счет конститутивной активности TDO, усиливает злокачественный фенотип глиом человека аутокринным образом в отсутствиt функциональных противоопухолевых ответов Т-клеток и NK-клеток.
Пример 4: Молекулярный механизм активности Kyn через AHR
Для лучшего понимания молекулярных механизмов, лежащих в основе аутокринных эффектов Kyn в отношении клеток глиомы, проводили анализы обработанных Kyn клеток глиомы с использованием микроматриц, выявляющие обширную индукцию генов ответа AHR кинуренином (Фиг. 3а). Анализы путей показали, что 25 генов, которые были наиболее сильно индуцированы обработкой Kyn в клетках U87 через 8 часов и через 24 часа, напрямую или опосредованно регулировались AHR (Фиг. 3а).
Злокачественные линии клеток глиомы, а также GIC конститутивно экспрессируют AHR и повышающую регуляцию целевых генов AHR кинуренином подтверждали в двух разных линиях клеток глиомы. Kyn приводил к транслокации AHR в ядро через 1 час, что таким образом демонстрирует немедленный эффект Kyn в отношении AHR (Фиг. 3b, с). Соответственно, анализ клеток опухоли, активированных Kyn, методом вестерн-блоттинга показал уменьшение цитоплазматической локализации, происходящее параллельно с увеличением накопления AHR в ядре, сопоставимое с индуцируемым TCDD (Фиг. 3d).
Kyn зависимым от концентрации образом индуцировал активность DRE-люциферазы в клетках глиомы с ЕС50, составляющей 36,6 мкМ (Фиг. 3е). Активация AHR была свойственна только Kyn в группе катаболитов Trp. Анализ с использованием этоксирезоруфин-О-деэтилазы (EROD) подтвердил индукцию функционального целевого гена AHR цитохрома Р450, семейства 1, подсемейства А, полипептида 1 (CYP1A1) с ЕС50, составляющей 12,3 мкМ для Kyn. Радиолигандные анализы связывания с использованием цитозоля печени мыши от Ahr-компетентных и Ahr-дефицитных мышей показали, что Kyn связывается с AHR с KD (приблизительно) ≈ 4 мкМ (Фиг. 3f). Активацию AHR и повышающую регуляцию экспрессии генов, регулируемых AHR, в ответ на Kyn ингибировали антагонистом AHR 3,4-DMF или путем нокдауна AHR (Фиг. 3g), что указывает на то, что Kyn является специфическим агонистом AHR. Вовлеченность таких же или схожих остатков AHR в связывание с Kyn, TCDD и 3-метилхолантреном (3-МС) подтверждал тот факт, что 3,4-DMF ингибировал активацию AHR всеми тремя лигандами. Важно то, что эндогенная выработка Kyn клетками глиомы была достаточной для активации AHR, т.к. нокдаун TDO уменьшал экспрессию генов, регулируемых AHR (Фиг. 3h). Поскольку средние концентрации Kyn, составляющие 37,01+/- 13,4 мкМ, измеряли в ксенотрансплантатах U87 (n=6), концентраций Kyn, достаточных для активации AHR, также достигали in vivo. В соответствии с активацией AHR кинуренином, полученным под действием TDO, экспрессию целевого гена AHR TIPARP в LCA+ иммуноцитах наблюдали только на срезах глиомы человека, экспрессирующих TDO (Фиг. 4а).
Для определения того, влияет ли TDO на противоопухолевые иммунные ответы через AHR, анализировали инфильтрацию иммуноцитов на срезах глиомы человека в зависимости от экспрессии AHR. Действительно, инфильтрация LCA+ и CD8+ иммуноцитами была снижена на срезах глиом человека с высокой AHR сравнению со срезами с низкой экспрессией AHR (Фиг. 4b). Для анализа вклада экспрессии AHR хозяина в рост опухоли, сравнивали рост опухолей мышей с экспрессией и без экспрессии Tdo у Ahr-дефицитных и Ahr-компетентных мышей. Рост опухолей, экспрессирующих Tdo, был ослаблен у Ahr-дефицитных мышей по сравнению с Ahr-компетентными мышами (Фиг. 4с), что указывает на то, что эффекты хозяина, опосредуемые AHR, усиливают рост опухоли. Окрашивание LCA+ иммуноцитов в опухолях выявило, что экспрессия TDO уменьшала инфильтрацию LCA+ иммуноцитами у Ahr-компетентных мышей, но не у Ahr-дефицитных мышей (Фиг. 4d), что позволяет предположить, что опосредованное TDO подавление противоопухолевых иммунных ответов через AHR вносит вклад в эффекты хозяина, усиливающие рост опухолей, экспрессирующих Tdo. Кроме того, тогда как экспрессия Tdo у Ahr-компетентных мышей сильно усиливала рост опухоли по сравнению с опухолями, не экспрессирующими Tdo, тот же эффект наблюдали у Ahr-дефицитных мышей хотя и в гораздо меньшей степени (Фиг. 4с). Поскольку клетки глиомы мыши экспрессируют функциональный AHR, данные результаты позволяют предположить, что увеличение роста опухоли, опосредованное TDO, у Ahr-дефицитных мышей обусловлено аутокринными эффектами TDO в отношении самих клеток опухоли. Эту идею подтверждает тот факт, что Kyn не индуцировал подвижность клеток глиомы человека после нокдауна AHR (Фиг. 4е). К тому же увеличение клоногенной выживаемости в ответ на Kyn прекращалось в клетках глиомы с нокдауном AHR (Фиг. 4f). Наконец, эксперименты in vivo показали, что индуцированный нокдаун AHR в клетках глиомы человека ингибировал рост опухоли у мышей с ослабленным иммунитетом (Фиг. 4g), что подчеркивает важное значение передачи сигнала AHR для аутокринных эффектов распада Trp.
Затем исследовали, активирует ли Kyn, образующийся под действием TDO, AHR в ткани опухоли головного мозга человека. Действительно, экспрессия TDO коррелировала с экспрессией AHR и целевых генов AHR в ткани глиомы человека (Фиг. 5a, b, c), что указывает на то, что конститутивная экспрессия TDO в клетках глиомы вырабатывала уровни Kyn, достаточные для активации AHR. Для исследования того, активируется ли путь передачи сигнала TDO-Kyn-AHR также в раковых опухолях, отличных от глиомы, авторы настоящего изобретения анализировали данные микроматриц различных опухолей человека. Интересно то, что экспрессия TDO коррелировала с экспрессией целевого гена AHR CYP1B1 не только в глиоме (Фиг. 5с), но также и в B-клеточной лимфоме, саркоме Юинга, карциноме мочевого пузыря, карциноме шейки матки, карциноме толстой и прямой кишки, карциноме легкого и карциноме яичников (Фиг. 5d). Данное обнаружение указывает на то, что путь TDO-Kyn-AHR не ограничивается опухолями головного мозга, а, по-видимому, является общей особенностью раковых опухолей. Анализ базы данных Rembrandt выявил, что общая выживаемость пациентов с глиомой (II-IV степень согласно ВОЗ) с высокой экспрессией TDO, AHR или целевого гена AHR CYP1B1 была снижена по сравнению с пациентами со средней или низкой экспрессией данных генов (Фиг. 5е). Наконец, было обнаружено, что у пациентов с глиобластомой (IV степень согласно ВОЗ) экспрессия целевых генов AHR CYP1B1, IL1B, IL6 и IL8, регулируемых Kyn, получаемым под действием TDO, в клетках глиомы (Фиг. 3h) позволяет прогнозировать выживаемость даже вне зависимости от степени согласно ВОЗ (Фиг. 5f), что таким образом дополнительно подчеркивает важное значение активации AHR для злокачественного фенотипа глиом. Таким образом, эти данные позволяют предположить, что эндогенный Kyn опухолевого происхождения активирует AHR аутокринным/паракринным образом и тем самым способствует прогрессированию опухоли (Фиг. 5g).
Реферат
Группа изобретений относится к медицине, а именно к онкологии, и касается лечения и/или предотвращения рака, зависимого от природного лиганда AHR. Для этого вводят терапевтически эффективное количество ингибитора арилгидрокарбонового рецептора (AHR). Это обеспечивает возможность эффективного лечения и/или предотвращения опухоли головного мозга, патогенез которой обусловлен несбалансированной выработкой кинуренина. 2 н. и 13 з.п. ф-лы, 24 ил., 4 пр.
Формула


Комментарии