Иммунотерапевтические композиции на основе дрожжей-muc1 и способы их применения - RU2642300C2
Код документа: RU2642300C2
Чертежи




































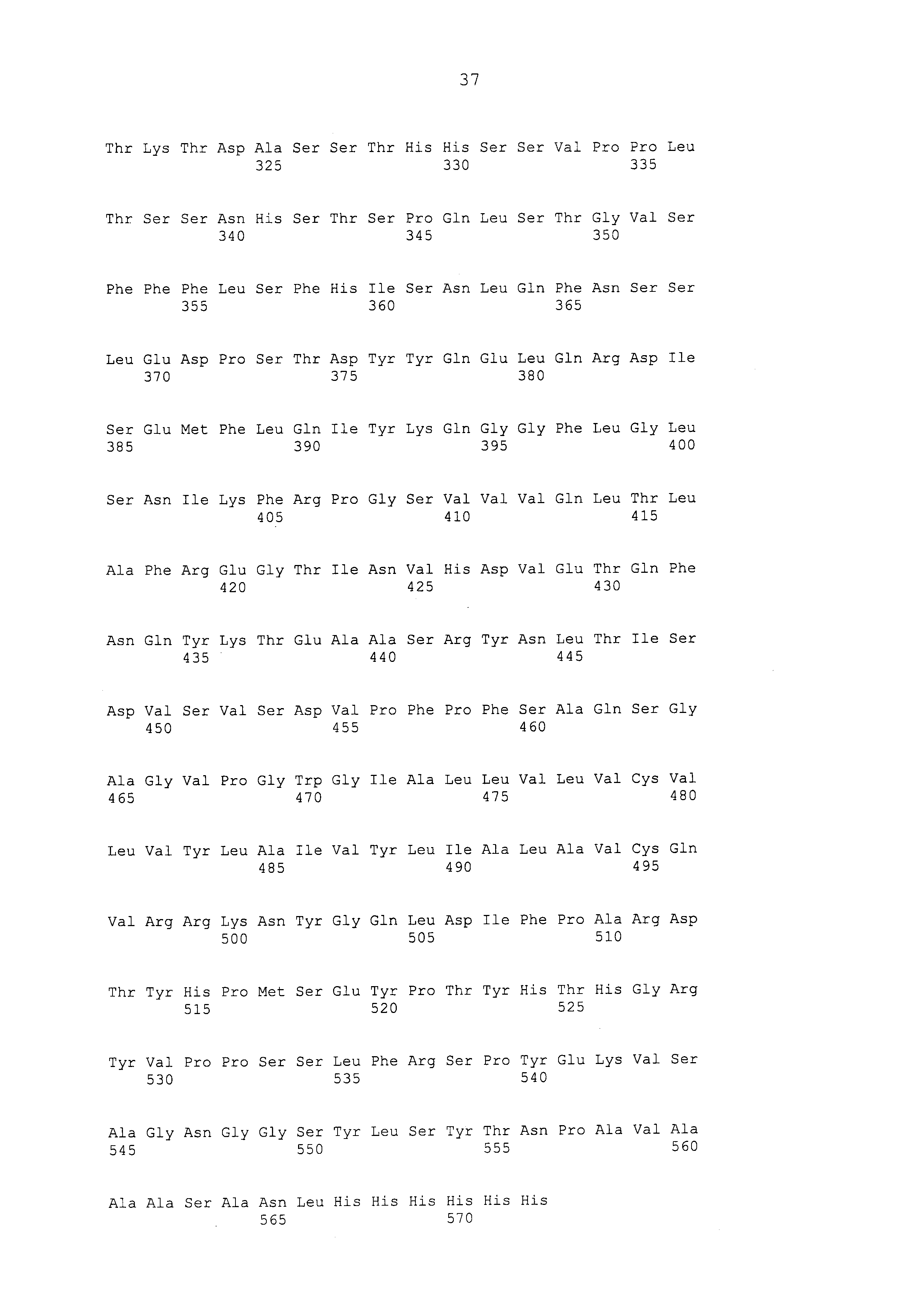



Описание
Права государства на изобретение
Настоящее изобретение было создано в соответствии с Соглашением о сотрудничестве в исследованиях и разработках Национального института здравоохранения и Департамента здравоохранения и социальных служб. Правительство Соединенных Штатов имеет определенные права на это изобретение.
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается преимущество приоритета предварительной заявки на патент США №61/524407, поданной 17 августа 2011 г., в соответствии со ст. 35 Кодекса законов США (CFR) § 119(e). Полное описание предварительной заявки на патент США №61/524407 вводится в настоящее описание посредством ссылки.
Документ по Договору о совместных исследованиях
Настоящее изобретение было создано заинтересованными сторонами или по поручению заинтересованных сторон Договора о сотрудничестве по исследованиям и разработкам от 8 мая 2008 г. Сторонами Договора о сотрудничестве по исследованиям и разработкам являются: GlobeImmune, Inc. и Департамент здравоохранения и социальных служб США при Национальном институте рака, Научно-исследовательском центре здравоохранения или отделении Национального института здравоохранения.
Ссылка на список последовательностей
Настоящая заявка содержит список последовательностей, поданный в электронном виде как текстовой файл EFS-Web. Текстовой файл под именем «3923-40-PCT_ST25» имеет размер 89 килобайт (кб) и был зарегистрирован 16 августа 2012 г. Информация, содержащаяся в данном текстовом файле, во всей своей полноте вводится в настоящее описание посредством ссылки согласно ст. 37 Кодекса законов США (CFR) § 1.52(e)(5).
Область, к которой относится изобретения
В общих чертах, настоящее изобретение относится к дрожжевой иммунотерапевтической композиции и к способам лечения и/или предупреждения рака, характеризующегося экспрессией и сверхэкспрессией муцина-1 (MUC1).
Предшествующий уровень техники
Рак является лидирующей причиной смертности людей во всем мире, и разработка эффективных способов лечения рака представляет собой одну из наиболее важных сфер исследований и разработки лекарственных препаратов. Хотя уже было предложено несколько инновационных подходов для лечения и предупреждения рака, однако, многие раковые заболевания до сих пор остаются причиной высокой смертности среди населения, что обусловлено трудностями, связанными с лечением этих заболеваний стандартными методами, или их относительной невосприимчивостью к таким методам лечения.
Большое число человеческих карцином и злокачественных заболеваний крови характеризуются, по меньшей мере частично, аберрантной сверхэкспрессией белка, известного как муцин-1 (MUC1), и нормальная функция этого белка заключается в защите эпителиальных клеток от токсинов, микроорганизмов и других стрессов, возникающих под действием окружающей среды (Kufe et al., Hybridoma 1984; 3:223-32). MUC1 представляет собой гетеродимерный белок, образующийся в результате нековалентного связывания двух субъединиц, кодируемых одним транскриптом, и последующего посттрансляционного процессинга в субъединицы, известные как MUC1-N и MUC1-C. MUC1 обычно присутствует в апикальных пограничных областях секреторных эпителиальных клеток, и если эти клетки теряют свою полярность в ответ на стресс, что является обратимым процессом для нормальных клеток, то MUC1 может взаимодействовать с молекулами, которые обычно локализуются в базолатеральных пограничных областях. Кроме того, в ответ на стрессовое воздействие окружающей среды, субъединица MUC1-N, то есть крупный белок, содержащий варьирующееся число тандемных повторов (VNTR), которые интенсивно гликозилируются под действием О-связанных гликанов, может слущиваться. Другая субъединица MUC1, известная как MUC1-C, имеет внеклеточный домен, трансмембранный домен и цитоплазматический хвост и может связываться с лигандом, ответственным за физическую ассоциацию MUC1 с рецептором эпидермального фактора роста (EGFR) (Li et al., J. Biol. Chem. 2001; 276:35239-42; Schroeder et al., J. Biol. Chem. 2001; 276:13057-64), а также с другими тирозинкиназными рецепторами, такими как ErbB2-4,20 FGFR321 и PDGFR (Li et al., Mol. Cancer Res. 2003; 1:765-75; Ren et al., Mol. Cancer Res. 2006; 4:873-83; Singh et al., Cancer Res. 2007; 67:5201-10). Кроме того, MUC1-C связывается с различными компонентами путей передачи сигнала, которыми являются рецепторы ErbB, c-Src, β-катенин, факторы транскрипции (p53, ERa) и другие эффекторы, такие Grb2/SOS (Pandey et al., Cancer Res. 1995; 55:4000-3; Kinlough et al., J. Biol. Chem. 2004; 279:53071-7).
В трансформированных эпителиальных клетках полярность мембраны является необратимой, а экспрессия MUC1 активируется на всей поверхности клеток карциномы (Kufe et al., 1984, см. выше). Сверхэкспрессия MUC1 ассоциируется с пониженным уровнем О-гликозилирования MUC1-N и с высокими уровнями MUC1-N на клеточной поверхности, достигаемыми посредством стерических взаимодействий комплексов «клетка-клетка» и «клетка-внеклеточная мембрана», которые ассоциируются со злокачественными фенотипами (Ligtenberg et al., Cancer Res. 1992; 52:223-32; van de Wiel-van Kemenade et al., J. Immunol. 1993; 151:767-76; Wesseling et al., Mol. Biol. Cell 1996; 7:565-77). Поскольку субъединица MUC1-C участвует в различных путях передачи сигналов, ассоциированных с канцерогенезом, то в настоящее время она рассматривается как онкопротеин, и было показано, что сверхэкспрессия этой субъединицы участвует в блокировании индуцирования апоптоза в ответ на повреждение ДНК (Ren et al., Cancer Cell 2004; 5:163-75; Raina et al., J. Biol. Chem. 2004; 279:20607-12), в ответ на окислительный стресс (Yin and Kufe, J. Biol. Chem. 2003; 278:35458-64; Yin et al., J. Biol. Chem. 2004; 279:45721-7) и гипоксию (Yin et al., J. Biol. Chem. 2007; 282:257-66), а также способствует субстрат-независимому росту опухолей и канцерогенезу (Li et al., Oncogene 2003; 22:6107-10; Huang et al., Cancer Biol. Ther. 2003; 2:702-6; Huang et al., Cancer Res. 2005; 65:10413-22; Schroeder et al., Oncogene 2004; 23:5739-47).
Как обсуждалось выше, данные, полученные в различных лабораториях, показали, что MUC1-N (α-субъединица) играет определенную роль в развитии рака путем сообщения клетке соответствующих свойств, которые способствуют ее «ускользанию» от иммунного надзора и, потенциально, распространению метастазов. MUC1-C (β-субъединица) участвует в путях передачи сигнала, ответственных за развитие и прогрессирование опухоли. Эти двойные функции MUC1 можно объяснить тем, что этот антиген играет различные роли в различных раковых заболеваниях. Так, например, MUC1, очевидно, представляет собой ранний маркер ракового заболевания, такого как рак молочной железы и рак толстой кишки (см., например, Kretschmer et al., Mol. Cancer. 2011 Feb 11; 10(1):15; Mukhopadhyay et al., Biochim Biophys Acta. 2011 Apr; 1815(2):224-40; Saeki et al., Gastroenterology. 2011 Mar; 140(3):892-902), причем MUC1 ассоциируется с путями эпителиально-мезенхимальной транзиции (EMT) и метастазированием рака, такого как рак поджелудочной железы и рак пищевода (см., например, Xu et al., Life Sci. 2011 Jun 6; 88(23-24):1063-9; Besmer et al., Cancer Res. 2011 Jul 1; 71(13):4432-42; Roy et al., Oncogene 2011 Mar 24; 30(12):1449-59; Ye et al., Lab Invest. 2011 May; 91(5):778-87), и предупреждает терминальную дифференцировку раковых клеток под действием молекул активного кислорода при остром миелоидном лейкозе (ОМЛ) (см., например, Yin et al., Blood. 2011 May 5; 117(18):4863-70; Fatrai et al., Exp Hematol. 2008 Oct; 36(10):1254-65), что приводит к неограниченному самообновлению этих клеток.
Принимая во внимание очевидную роль MUC1 в сообщении раковым клеткам злокачественного фенотипа, MUC1, в частности, MUC1-N, можно сказать, что MUC1 является главным объектом противораковой терапии. Действительно, большинство терапевтических подходов направлено на MUC1-N, то есть на внеклеточную часть гетеродимера MUC1. Однако такие подходы, направленные на MUC1-N, пока оказались безуспешными при их клиническом применении, что, вероятно, обусловлено проблемами, связанными со слущиванием MUC1-N с клеток. В совсем недавно проведенных исследованиях, для нацеливания на субъединицу MUC1-C было предложено использовать антитела против этого внеклеточного домена или их пептиды; пептиды, конъюгированные с углеводным полимером и с небольшими молекулами; препараты опухолевых клеток, экспрессирующих MUC1; и гибриды дендритная клетка/опухолевая клетка. Однако в настоящее время не было получено разрешения на проведение противораковой терапии, специфически нацеленной на MUC1. В соответствии с этим, необходимо разработать новые продукты, которые были бы эффективными для лечения и/или предупреждения рака, ассоциирующегося с экспрессией или сверхэкспрессией MUC1.
Описание сущности изобретения
В одном из своих вариантов настоящее изобретение относится к иммунотерапевтической композиции на основе дрожжей-MUC1, содержащей: (a) дрожжевой носитель; и (b) гибридный белок, экспрессирующийся дрожжевым носителем и содержащий по меньшей мере один антиген MUC1. В одном из аспектов изобретения антиген MUC1 состоит, в направлении от N-конца к C-концу, из: SEA/внеклеточного домена (ED) MUC1, где SEA/ED-домен MUC1 включает ED MUC1, фланкированный у N-конца одной или более аминокислотами, происходящими от не-ED части SEA-домена MUC1; по меньшей мере двух доменов с варьирующимся числом тандемных повторов (VNTR); трансмембранного домена (TM) MUC1; и цитоплазматического домена (СD) MUC1.
В одном из аспектов изобретения антиген включает два домена VNTR. В одном из аспектов изобретения домен VNTR имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности в положениях 126-145 SEQ ID NO: 11; любым смежным 20 аминокислотам в положениях 61-1020 SEQ ID NO: 11; любым смежным 20 аминокислотам в положениях 126-965 SEQ ID NO: 11; SEQ ID NO: 12; любым смежным 20 аминокислотам в положениях 90-130 SEQ ID NO: 14; любым смежным 20 аминокислотам в положениях 60-100 SEQ ID NO: 15; и соответствующей последовательности, происходящей от другого человеческого белка MUC1. В одном из аспектов изобретения домен VNTR имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична любым смежным 20 аминокислотам в положениях 90-130 SEQ ID NO: 14 или любым смежным 20 аминокислотам в положениях 60-100 SEQ ID NO: 15. В одном из аспектов изобретения гибридный белок имеет два домена VNTR, и аминокислотная последовательность этих двух доменов VNTR находится в положениях 90 и 130 SEQ ID NO: 14 или в положениях 60 и 100 SEQ ID NO: 15.
В одном из аспектов изобретения ED MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности, выбранной из аминокислотной последовательности в положениях 116-173 SEQ ID NO: 2; в положениях 107-164 SEQ ID NO: 4; в положениях 107-164 SEQ ID NO: 6; в положениях 98-155 SEQ ID NO: 8; в положениях 1098-1155 SEQ ID NO: 11; в положениях 32-89 SEQ ID NO: 14; в положениях 2-59 SEQ ID NO: 15; и соответствующей последовательности, происходящей от другого человеческого белка MUC1. В одном из аспектов изобретения ED MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности в положениях 32-89 SEQ ID NO: 14 или в положениях 2-59 SEQ ID NO: 15. В одном из аспектов изобретения ED MUC1 имеет аминокислотную последовательность в положениях 32-89 SEQ ID NO: 14 или в положениях 2-59 SEQ ID NO: 15. В одном из аспектов изобретения SEA/ED MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности, выбранной из аминокислотной последовательности в положениях 115-173 SEQ ID NO: 2; в положениях 106-164 SEQ ID NO: 4; в положениях 106-164 SEQ ID NO: 6; в положениях 97-155 SEQ ID NO: 8; в положениях 1097-1155 SEQ ID NO: 11; в положениях 31-89 SEQ ID NO: 14; в положениях 1-59 SEQ ID NO: 15; и соответствующей последовательности, происходящей от другого человеческого белка MUC1. В одном из аспектов изобретения SEA/ED MUC1 имеет аминокислотную последовательность в положениях 31-89 SEQ ID NO: 14 или в положениях 1-59 SEQ ID NO: 15.
В одном из аспектов изобретения ТМ-домен MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности, выбранной из аминокислотной последовательности в положениях 174-201 SEQ ID NO: 2, в положениях 165-192 SEQ ID NO: 4, в положениях 165-192 SEQ ID NO: 6, в положениях 156-183 SEQ ID NO: 8, в положениях 1156-1183 SEQ ID NO: 11, в положениях 131-158 SEQ ID NO: 14, в положениях 101-128 SEQ ID NO: 15, и соответствующей последовательности, происходящей от другого человеческого белка MUC1. В одном из аспектов изобретения ТМ-домен MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности в положениях 131-158 SEQ ID NO: 14 или в положениях 101-128 SEQ ID NO: 15. В одном из аспектов изобретения ТМ-домен MUC1 имеет аминокислотную последовательность в положениях 131-158 SEQ ID NO: 14 или в положениях 101-128 SEQ ID NO: 15.
В одном из аспектов изобретения СD-домен MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности, выбранной из аминокислотной последовательности в положениях 202-273 SEQ ID NO: 2, в положениях 193-264 SEQ ID NO: 4, в положениях 193-264 SEQ ID NO: 6, в положениях 184-255 SEQ ID NO: 8, в положениях 1184-1255 SEQ ID NO: 11, в положениях 159-230 SEQ ID NO: 14, в положениях 129-200 SEQ ID NO: 15, в положениях 7-78 SEQ ID NO: 17, в положениях 79-150 SEQ ID NO: 17, в положениях 151-222 SEQ ID NO: 17; в положениях 1-72 SEQ ID NO: 18, в положениях 73-144 SEQ ID NO: 18, в положениях 145-216 SEQ ID NO: 18, и соответствующей последовательности, происходящей от другого человеческого белка MUC1. В одном из аспектов изобретения CD-домен MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности в положениях 159-230 SEQ ID NO: 14 или в положениях 129-200 SEQ ID NO: 15. В одном из аспектов изобретения СD-домен MUC1 имеет аминокислотную последовательность в положениях 159-230 SEQ ID NO: 14 или в положениях 129-200 SEQ ID NO: 15.
В одном из аспектов этого варианта осуществления изобретения, антиген MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97% или 98% идентична последовательности SEQ ID NO: 15. В одном из аспектов изобретения антиген MUC1 содержит SEQ ID NO: 15 или аминокислотную последовательность, которая по меньшей мере на 99% идентична последовательности SEQ ID NO: 15. В одном из аспектов изобретения антиген MUC1 имеет аминокислотную последовательность SEQ ID NO: 15.
В одном из аспектов этого варианта осуществления изобретения, гибридный белок дополнительно содержит сигнальную последовательность MUC1, присоединенную к N-концу SEA/ED MUC1. В одном из аспектов изобретения сигнальная последовательность MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности, выбранной из последовательностей в положениях 1-27 SEQ ID NO: 2, в положениях 1-32 SEQ ID NO: 4, в положениях 1-32 SEQ ID NO: 6, в положениях 1-27 SEQ ID NO: 8, в положениях 1-23 SEQ ID NO: 11, в положениях 1-30 SEQ ID NO: 14, и соответствующей последовательности, происходящей от другого человеческого белка MUC1. В одном из аспектов изобретения сигнальная последовательность MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности в положениях 1-30 SEQ ID NO: 14. В одном из аспектов изобретения сигнальная последовательность MUC1 имеет аминокислотную последовательность в положениях 1-30 SEQ ID NO: 14. В одном из аспектов изобретения гибридный белок имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97% или 98% идентична последовательности SEQ ID NO: 14. В одном из аспектов изобретения гибридный белок содержит SEQ ID NO: 14 или аминокислотную последовательность, которая по меньшей мере на 99% идентична последовательности SEQ ID NO: 14. В одном из аспектов изобретения гибридный белок имеет аминокислотную последовательность SEQ ID NO: 14.
В одном из аспектов этого варианта осуществления изобретения, антиген MUC1, по сравнению с последовательностью MUC1 дикого типа, содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или более аминокислотных замен, вводимых для создания 1-11 эпитопов-агонистов в антигене MUC1, также называемом здесь антигеном-агонистом MUC1. В одном из аспектов этого варианта осуществления изобретения, аминокислотные замены выбраны из A96Y, P97L, G104V, S105Y, T106L, A147Y, C161V, T199L, D200F, S215Y и T239L, которые были введены в часть антигена MUC1, имеющего последовательность SEQ ID NO: 14 или SEQ ID NO: 15. В одном из аспектов изобретения антиген-агонист MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97% или 98% идентична SEQ ID NO: 23. В одном из аспектов изобретения антиген MUC1 содержит SEQ ID NO: 23 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 23. В одном из аспектов изобретения антиген MUC1 имеет аминокислотную последовательность SEQ ID NO: 23. Иммунотерапевтическая композиция на основе дрожжей-MUC1 заявлена в п. 1 формулы изобретения, где антиген MUC1 содержит от 1 до 11 аминокислотных замен, введенных для создания антигена-агониста MUC1.
В другом своем варианте настоящее изобретение относится к иммунотерапевтической композиции на основе дрожжей-MUC1, содержащей: (a) дрожжевой носитель; и (b) гибридный белок, экспрессирующийся дрожжевым носителем и содержащий по меньшей мере один антиген MUC1. Антиген MUC1 состоит из двух или более цитоплазматических доменов (CD) MUC1. В одном из аспектов изобретения антиген MUC1 состоит из трех цитоплазматических доменов (CD) MUC1. В одном из аспектов изобретения три CD происходят от одного и того же белка MUC1. В одном из аспектов изобретения каждый CD-домен содержит аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности, выбранной из аминокислотной последовательности в положениях 202-273 SEQ ID NO: 2, в положениях 193-264 SEQ ID NO: 4, в положениях 193-264 SEQ ID NO: 6, в положениях 184-255 SEQ ID NO: 8, в положениях 1184-1255 SEQ ID NO: 11, в положениях 159-230 SEQ ID NO: 14, в положениях 129-200 SEQ ID NO: 15, в положениях 7-78 SEQ ID NO: 17, в положениях 79-150 SEQ ID NO: 17, в положениях 151-222 SEQ ID NO: 17; в положениях 1-72 SEQ ID NO: 18, в положениях 73-144 SEQ ID NO: 18, в положениях 145-216 SEQ ID NO: 18, и соответствующей последовательности, происходящей от другого человеческого белка MUC1. В одном из аспектов изобретения каждый CD-домен содержит аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности, выбранной из аминокислотной последовательности в положениях 129-200 SEQ ID NO: 15, в положениях 7-78 SEQ ID NO: 17, в положениях 79-150 SEQ ID NO: 17, в положениях 151-222 SEQ ID NO: 17; в положениях 1-72 SEQ ID NO: 18, в положениях 73-144 SEQ ID NO: 18, и в положениях 145-216 SEQ ID NO: 18.
В одном из аспектов этого варианта осуществления изобретения, антиген MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97% или 98% идентична SEQ ID NO: 18. В одном из аспектов изобретения антиген MUC1 имеет аминокислотную последовательность SEQ ID NO: 18 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 18. В одном из аспектов изобретения антиген MUC1 имеет аминокислотную последовательность SEQ ID NO: 18. В одном из аспектов изобретения гибридный белок имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97% или 98% идентична SEQ ID NO: 17. В одном из аспектов изобретения гибридный белок имеет аминокислотную последовательность SEQ ID NO: 17 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 17. В одном из аспектов изобретения гибридный белок имеет аминокислотную последовательность SEQ ID NO: 17.
В другом своем варианте настоящее изобретение относится к иммунотерапевтической композиции на основе дрожжей-MUC1, содержащей: (a) дрожжевой носитель; и (b) гибридный белок, экспрессирующийся дрожжевым носителем и содержащий по меньшей мере один антиген-агонист MUC1. В одном из аспектов этого варианта осуществления изобретения, антиген-агонист MUC1, по сравнению с последовательностью MUC1 дикого типа, содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или более аминокислотных замен, вводимых для создания 1-11 эпитопов-агонистов в антигене MUC1, также называемом здесь антигеном-агонистом MUC1. В одном из аспектов изобретения антиген-агонист MUC1 имеет аминокислотную последовательность, которая по меньшей мере на 95%, 96%, 97% или 98% идентична SEQ ID NO: 23 или SEQ ID NO: 25. В одном из аспектов изобретения антиген MUC1 содержит SEQ ID NO: 23 или SEQ ID NO: 25 или аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 23 или SEQ ID NO: 25. В одном из аспектов изобретения антиген MUC1 имеет аминокислотную последовательность SEQ ID NO: 23 или SEQ ID NO: 25.
В другом своем варианте настоящее изобретение относится к способу снижения опухолевой нагрузки, ингибирования роста опухоли и/или увеличения продолжительности жизни индивидуума, имеющего раковую опухоль, экспрессирующую MUC1. Этот способ включает стадию введения индивидууму иммунотерапевтической композиции на основе дрожжей-MUC1, описанной в настоящей заявке. В одном из аспектов изобретения экспрессию MUC1 в раковой опухоли индивидуума детектируют на момент первого введения композиции. В одном из аспектов изобретения индивидуум страдает раковым заболеванием на стадии I. В одном из аспектов изобретения индивидуум страдает раковым заболеванием на стадии II. В одном из аспектов изобретения индивидуум страдает раковым заболеванием на стадии III. В одном из аспектов изобретения индивидуум страдает раковым заболеванием на стадии IV.
В другом своем варианте настоящее изобретение относится к применению любой из описанных здесь иммунотерапевтических композиций на основе дрожжей-MUC1 для лечения заболевания. В одном из аспектов изобретения указанным заболеванием является рак.
В другом своем варианте настоящее изобретение относится к применению любой из описанных здесь иммунотерапевтических композиций на основе дрожжей-MUC1 для замедления, прекращения, обратного развития или предупреждения метастатического прогрессирования рака у индивидуума, страдающего раком.
В другом своем варианте настоящее изобретение относится к применению любой из описанных здесь иммунотерапевтических композиций на основе дрожжей-MUC1 для предупреждения или для отсрочки начала развития MUC1-экспрессирующей раковой опухоли.
В другом своем варианте настоящее изобретение относится к применению комбинации иммунотерапевтических композиций для лечения рака, где указанные иммунотерапевтические композиции содержат: (a) первую композицию, которая представляет собой любую из описанных здесь иммунотерапевтических композиций на основе дрожжей-MUC1; и (b) по меньшей мере одну дополнительную иммунотерапевтическую композицию, содержащую дрожжевой носитель и антиген, не являющийся антигеном MUC1. В одном из аспектов изобретения антиген, не являющийся антигеном MUC1, выбран из мутированного Ras, карциноэмбрионального антигена (CEA) и/или антигена Brachyury.
В одном из аспектов любого из своих вариантов, настоящее изобретение относится к способу, осуществляемому с использованием описанной здесь иммунотерапевтической композиции на основе дрожжей-MUC1, или к применению указанной композиции, где указанный индивидуум проходит или проходил другую терапию рака, которая может включать, но не ограничивается ею, химиотерапию, направленную противораковую терапию, лучевую терапию, адоптивный Т-клеточный перенос, хирургическое удаление опухоли у индивидуума и/или введение одной или более дополнительных иммунотерапевтических композиций. В одном из аспектов изобретения дополнительные иммунотерапевтические композиции содержат второй раковый антиген, который представляет собой антиген MUC1 или раковый антиген, не являющийся антигеном MUC1. В одном из аспектов изобретения дополнительные иммунотерапевтические композиции содержат дрожжевой носитель и второй раковый антиген, который не включает антиген MUC1. В одном из аспектов изобретения дополнительные иммунотерапевтические композиции содержат второй раковый антиген, которым являются, но не ограничиваются ими, мутированный Ras, карциноэмбриональный антиген (CEA), антиген Brachyury, EGFR, BCR-Abl, MART-1, MAGE-1, MAGE-3, GAGE, GP-100, MUC-2, PSMA, тирозиназа, TRP-1 (gp75), NY-ESO-1, TRP-2, TAG72, KSA, CA-125, PSA, HER-2/neu/c-erb/B2, hTERT, p73, B-RAF, антиген, вызывающий аденоматозный кишечный полипоз (APC), Myc, белок фон Хиппеля-Линдау (VHL), Rb-1, Rb-2, андрогенный рецептор (AR), Smad4, MDR1, Flt-3, BRCA-1, BRCA-2, pax3-fkhr, ews-fli-1, HERV-H, HERV-K, TWIST, мезотелин и/или NGEP. В одном из аспектов изобретения второй раковый антиген выбран из группы, состоящей из мутированного Ras, карциноэмбрионального антигена (CEA) и антигена Brachyury. В одном из аспектов изобретения дополнительной иммунотерапевтической композицией является вакцина на основе вирусного вектора. В одном из аспектов изобретения дополнительной иммунотерапевтической композицией является гибрид дендритная клетка/опухолевая клетка.
В другом своем варианте настоящее изобретение относится к способу предупреждения или отсрочки начала развития MUC1-экспрессирующей раковой опухоли. Этот способ включает стадию введения индивидууму любой из описанных здесь иммунотерапевтических композиций на основе дрожжей-MUC1. В одном из аспектов изобретения рак не был диагностирован у индивидуума. В одном из аспектов изобретения у индивидуума имеется высокий риск развития рака. В одном из аспектов изобретения, указанный индивидуум имеет предраковое поражение. В одном из аспектов изобретения указанный индивидуум имеет раковую опухоль, однако, в этой опухоли не были обнаружены MUC1-экспрессирующие раковые клетки.
В одном из аспектов изобретения, относящихся к способам, осуществляемым с использованием описанной здесь иммунотерапевтической композиции на основе дрожжей-MUC1, или к применению указанной композиции, указанная раковая опухоль ассоциируется с поражением эпителиальных клеток. В одном из аспектов изобретения указанными раковыми заболеваниями являются, но не ограничиваются ими, рак молочной железы, рак тонкого кишечника, рак желудка, рак поджелудочной железы, рак почек, рак мочевого пузыря, рак матки, рак яичника, рак яичек, рак легких, рак толстой кишки, рак предстательной железы, меланома, множественный миелогенный лейкоз (MMЛ), хронический лимфоцитарный лейкоз (ХЛЛ), острый миелоидный лейкоз (ОМЛ), лимфома Беркитта, ходжкинская лимфома, раковые опухоли секреторных тканей и их метастазы. В одном из аспектов изобретения рак выбран из рака молочной железы и рака толстой кишки. В одном из аспектов изобретения рак выбран из рака молочной железы, рака толстой кишки, рака поджелудочной железы, рака яичника, рака пищевода и ОМЛ. В одном из аспектов изобретения, где раком является ОМЛ, иммунотерапевтическую композицию на основе дрожжей-MUC1 вводят донору и реципиенту, подвергаемому терапии путем трансплантации костного мозга (ТКС). В одном из аспектов изобретения, где раком является ОМЛ, иммунотерапевтическую композицию на основе дрожжей-MUC1 вводят индивидууму в комбинации с терапией цитарабином и антрациклином.
В одном из аспектов любого из описанных здесь вариантов осуществления изобретения, указанным дрожжевым носителем являются цельные дрожжи. В одном из аспектов изобретения указанный дрожжевой носитель является термоинактивированным. В одном из аспектов изобретения указанный дрожжевой носитель происходит от мутированного дрожжевого штамма, который, в отличие от дрожжевого штамма дикого типа, продуцирует частично гликозилированные белки. В одном из аспектов изобретения антиген MUC1 экспрессируется на клеточной стенке дрожжевого носителя. В одном из аспектов изобретения антиген MUC1 экспрессируется в периплазме или цитоплазме дрожжевого носителя. В одном из аспектов изобретения дрожжевой носитель происходит от Saccharomyces. В одном из аспектов изобретения, дрожжевой носитель происходит от Saccharomyces cerevisiae.
В одном из аспектов любого из описанных здесь вариантов осуществления изобретения, иммунотерапевтическую композицию получают путем культивирования цельных дрожжей, экспрессирующих антиген MUC1, в среде, которую поддерживают при рН 5,5-8. В одном из аспектов изобретения указанная среда была забуферена буферным агентом. В одном из аспектов изобретения дрожжи культивируют в среде, которую поддерживают при рН 6-8.
В одном из аспектов любого из описанных здесь вариантов осуществления изобретения, указанная композиция также содержит по меньшей мере один модификатор биологического ответа.
В одном из аспектов любого из описанных здесь вариантов осуществления изобретения, указанная композиция также содержит фармацевтически приемлемый наполнитель.
В одном из аспектов любого из описанных здесь вариантов осуществления изобретения, указанную композицию приготавливают для инъекции.
Краткое описание графического материала
На фиг. 1A схематически представлена структура полноразмерного белка MUC1.
На фиг. 1B схематически представлена структура гибридного белка, экспрессируемого в иммунотерапевтической композиции на основе дрожжей, известной как GI-6101.
На фиг. 1C схематически представлена структура гибридного белка, экспрессируемого в иммунотерапевтической композиции на основе дрожжей, известной как GI-6104.
На фиг. 2A представлено цифровое изображение, иллюстрирующее экспрессию гибридного белка MUC1 в композиции GI-6101.
На фиг. 2B представлено цифровое изображение, иллюстрирующее экспрессию гибридных белков MUC1 в композиции GI-6101 и 6104 до и после дегликозилирования.
На фиг. 2C представлено цифровое изображение, иллюстрирующее экспрессию гибридного белка MUC1 в композиции GI-6104.
На фиг. 3 представлено цифровое изображение, иллюстрирующее экспрессию гибридного белка MUC1 в композиции GI-6105.
Подробное описание изобретения
В общих чертах, настоящее изобретение относится к иммунотерапевтическим композициям на основе дрожжей и к способам предупреждения и/или лечения раковых опухолей, экспрессирующих или сверхэкспрессирующих муцин-1 (который обычно обозначается здесь «MUC1», и который также известен или был известен под названием «антиген DF3» или «HMFG»). Настоящее изобретение включает применение иммунотерапевтической композиции на основе дрожжей (также называемой композицией или продуктом на основе дрожжей, применяемыми в иммунотерапии), содержащей дрожжевой носитель и новые антигены MUC1 (указанная композиция также называется здесь «композицией на основе дрожжей-MUC1, применяемой в иммунотерапии», «продуктом на основе дрожжей-MUC1, применяемым в иммунотерапии» или «иммунотерапевтическими композициями на основе дрожжей-MUC1»). В настоящей заявке авторами описаны конструирование и продуцирование новых иммунотерапевтических продуктов на основе дрожжей-MUC1, и ими было продемонстрировано, что иммунотерапия с применением дрожжей-MUC1 приводит к созреванию человеческих клеток (ДК), к повышению уровня продуцирования цитокинов дендритными клетками (ДК), ассоциирующемуся с иммунными ответами, которые, как предполагается, являются эффективными для лечения опухолей, и к активации MUC1-специфических Т-клеточных линий. В целом, представленные здесь данные указывают на то, что иммунотерапия с применением дрожжей-MUC1 может быть эффективной для вырабатывания MUC1-специфических клеточных иммунных ответов (CD4+ и CD8+), и что иммунотерапия с применением дрожжей-MUC1, как и предполагалось, является эффективной для предупреждения и лечения MUC1-экспрессирующих опухолей.
Иммунотерапия с применением дрожжей-MUC1 может быть легко адаптирована для использования дополнительных опухолевых антигенов в одной и той же дрожжевой композиции или для использования в комбинации с другими иммунотерапевтическими композициями на основе дрожжей (последовательно или одновременно), которые нацелены на другие опухолевые антигены, или в комбинации с другими иммунотерапевтическими средствами и курсами лечения/терапии рака. В соответствии с этим, иммунотерапия с применением дрожжей-MUC1 для лечения рака определенного типа, на определенной стадии и с определенной степенью злокачественности, может быть адаптирована к определенным антигенам, экспрессируемым данной опухолью, и к общему состоянию здоровья индивидуума (то есть, такая терапия может быть легко персонифицирована), а для индивидуума, который уже страдает раком, такая терапия может быть модифицирована по мере прогрессирования раковой опухоли у индивидуума в целях достижения максимальной эффективности на различных стадиях развития опухоли. Иммунотерапия с применением дрожжей-MUC1 дает возможность проводить универсальное профилактическое и/или терапевтическое лечение рака различных типов.
Действительно, иммунотерапия с применением дрожжей-MUC1 может быть легко адаптирована для лечения различных MUC1-положительных раковых заболеваний путем разработки иммунотерапии с применением дрожжей-MUC1 в зависимости от роли, которую играет данный антиген в развитии ракового заболевания каждого типа. Так, например, поскольку MUC1 был описан как ранний маркер рака, такого как рак молочной железы или рак толстой кишки, то иммунотерапия с применением дрожжей может быть проведена в профилактических целях у пациентов с MUC1-положительной предзлокачественной гиперплазией молочной железы или с кишечными полипами. Поскольку MUC1 ассоциируется с путями эпителиальной-мезинхимальной транзиции (EMT) и распространением метастазов рака, такого как рак поджелудочной железы, рак яичника и рак пищевода, то, в другом примере, иммунотерапия с применением дрожжей-MUC1 может быть проведена как терапевтическая вспомогательная терапия в дополнение к стандартной терапии указанных раковых опухолей для стимуляции прекращения распространения метастазов MUC1-положительных раковых опухолей поджелудочной железы, яичника и пищевода на стадии 3. Поскольку было обнаружено, что MUC1 блокирует терминальную дифференцировку клеток посредством молекул активного кислорода при остром миелоидном лейкозе (ОМЛ) и способствует неограниченному самообновлению этих раковых клеток, то, в еще одном примере, иммунотерапия с применением дрожжей-MUC1 может быть осуществлена в качестве вспомогательной терапии в дополнение к стандартной терапии MUC1-положительного ОМЛ в целях стимуляции апоптоза и предотвращения неограниченного самообновления злокачественных клеток. Клиническое испытание иммунотерапии с применением дрожжей-MUC1 у пациентов с ОМЛ описано в примерах.
Описанные здесь композиции на основе дрожжей-MUC1 индуцируют природные иммунные ответы, а также адаптивные иммунные ответы на антиген-мишень (MUC1), включая CD4-зависимые TH17- и TH1-T-клеточные ответы и антиген-специфические CD8+-T-клеточные ответы, которыми являются цитотоксические Т-лимфоцитарные (CTL) ответы, и все эти композиции используют без экзогенных адъювантов, цитокинов или других иммуностимулирующих молекул, многие из которых являются токсичными. Кроме того, иммунотерапевтические композиции на основе дрожжей-MUC1 снижают число и/или функциональность регуляторных Т-клеток (Treg), что приводит к усилению ответа эффекторных Т-клеток, которые обычно могут подавляться, например, в результате присутствия опухоли. Более того, по сравнению с иммунотерапевтическими композициями, которые индуцируют иммунный ответ посредством вырабатывания гуморальных ответов, антиген-специфические универсальные и сильные клеточные иммунные ответы, вырабатываемые иммунотерапевтическими композициями на основе дрожжей-MUC1, очевидно, являются особенно эффективными для уничтожения опухолевых клеток. Действительно, многочисленные исследования показали, что иммунотерапевтические способы являются более эффективными, если на опухолевые клетки были нацелены CD8+-CTL, которые распознают опухолевые пептиды в присутствии молекул MHC класса I. Иммунотерапия с применением дрожжей-MUC1 обладает высокой способностью к активации антигенпрезентирующих клеток и дает уникальную возможность индуцировать перекрестный иммунный ответ с продуцированием CD8+-CTL-ответов, которые обычно обладают эффективным действием, направленным против опухолей, даже в присутствии какого-либо окружения, оказывающего ингибирующее действие. Поскольку при иммунотерапии такого типа используется природная способность антигенпрезентирующей клетки представлять релевантные иммуногены, то для получения эффективного иммунотерапевтического препарата согласно изобретению, совсем необязательно знать, являются ли эпитопы CTL или эпитопы МНС класса II точно идентичными MUC1. Фактически, множество CD4+- и CD8+-T-клеточных эпитопов могут быть введены в одну иммунотерапевтическую композицию на основе дрожжей-MUC1, и, таким образом, иммунотерапевтические композиции на основе дрожжей-MUC1 согласно изобретению не ограничиваются применением коротких пептидов. Действительно, применение более длинных полипептидов и гибридных белков, содержащих множество доменов антигена-мишени в этих композициях, является эффективным. В соответствии с этим, при проведении иммунотерапии с применением дрожжей-MUC1, для идентификации предполагаемых Т-клеточных эпитопов не требуется использование алгоритмов и сложных формул.
Дрожжи-MUC1 могут быть с успехом использованы в соответствии с протоколом для иммунизации (профилактической или терапевтической) без экзогенных адъювантов, иммуностимулирующих агентов или молекул, костимулирующих молекул или цитокинов, хотя, при необходимости, такие агенты все же могут быть использованы. Кроме того, иммунотерапия с применением дрожжей-MUC1 может быть проведена повторно с той же эффективностью, что может быть проблематичным при проведении иммунотерапии других типов.
Композиции согласно изобретению
В одном из своих вариантов настоящее изобретение относится к иммунотерапевтической композиции на основе дрожжей, которая может быть использована для предупреждения и/или лечения рака, характеризующегося экспрессией или сверхэкспрессией MUC1 (включая раковые опухоли, которые на ранней стадии могут не содержать клетки, экспрессирующие детектируемый MUC1, но которые могут или будут содержать клетки, экспрессирующие MUC1 на более поздних стадиях развития рака). Указанной композицией является иммунотерапевтическая композиция на основе дрожжей-MUC1, содержащая: (a) дрожжевой носитель; и (b) раковый антиген, содержащий один или более антигенов MUC1 и/или их иммуногенных доменов. Антиген MUC1 или его иммуногенный домен, в основном, экспрессируется в виде рекомбинантного белка дрожжевым носителем (например, интактными дрожжами или дрожжевыми сферопластами, которые могут затем, но необязательно, процессироваться в дрожжевые цитопласты, «тени» дрожжевых клеток или дрожжевой мембранный экстракт или его фракцию), хотя в одном из вариантов осуществления изобретения один или более антигенов MUC1 загружают в дрожжевой носитель или как-либо иначе комбинируют с описанным здесь дрожжевым носителем с образованием комплексов, а затем присоединяют к указанному носителю, смешивают с этим носителем или вводят вместе с этим носителем с получением композиции согласно изобретению.
Термин «иммунотерапевтическая композиция на основе дрожжей-MUC1» означает «иммунотерапевтическую композицию на основе дрожжей» конкретного типа, которая содержит по меньшей мере один антиген MUC1 или его иммуногенный домен. Термин «иммунотерапевтическая композиция на основе дрожжей» может быть синонимом терминам «иммунотерапевтический продукт на основе дрожжей», «композиция на основе дрожжей для иммунотерапии», «композиция на основе дрожжей», «иммунотерапевтическое средство на основе дрожжей», «вакцина на основе дрожжей» или термины, образованные от указанных словосочетаний. «Иммунотерапевтическая композиция» представляет собой композицию, которая продуцирует иммунный ответ, достаточный для достижения по меньшей мере одного терапевтического эффекта у индивидуума. Используемый здесь термин «иммунотерапевтическая композиция на основе дрожжей» означает композицию, которая включает компонент «дрожжевой носитель» и которая продуцирует иммунный ответ, достаточный для достижения по меньшей мере одного терапевтического эффекта у индивидуума. Более конкретно, иммунотерапевтической композицией на основе дрожжей является композиция, которая включает компонент дрожжевой носитель и обычно антигенный компонент и которая может вырабатывать или индуцировать иммунный ответ, такой как клеточный иммунный ответ, включая, но не ограничиваясь ими, Т-клеточно-опосредуемый иммунный ответ. В одном из аспектов изобретения иммунотерапевтическая композиция на основе дрожжей, используемая в настоящем изобретении, способна индуцировать CD8+- и/или CD4+-T-клеточно-опосредуемый иммунный ответ, а в одном из аспектов изобретения CD8+- и CD4+-T-клеточно-опосредуемый иммунный ответ, в частности, ответ на антиген-мишень (например, раковый антиген). CD4+-иммунный ответ может включать иммунные TH1-ответы, иммунные TH2-ответы, иммунные TH17-ответы или любые комбинации вышеуказанных ответов. Иммунотерапевтические композиции на основе дрожжей способны, в частности, вырабатывать TH1- и TH17-ответы. CD8+-иммунный ответ может включать цитотоксический T-лимфоцитарный (CTL) ответ, и иммунотерапевтические композиции на основе дрожжей способны продуцировать такие ответы. В одном из аспектов изобретения иммунотерапевтическая композиция на основе дрожжей модулирует число и/или функциональность регуляторных Т-клеток (Treg) у индивидуума. Иммунотерапия с применением дрожжей может быть также модифицирована в целях стимуляции ответа преимущественно одного типа, например, путем добавления цитокинов и антител, и/или модуляции метода получения дрожжей. Иммунотерапевтическая композиция на основе дрожжей может, но необязательно, вырабатывать гуморальный иммунный ответ.
Иммунотерапевтические композиции на основе дрожжей-MUC1 согласно изобретению могут быть «профилактическими» или «терапевтическими». Если композиции согласно изобретению являются профилактическими, то эти композиции вводят еще до начала развития или обнаружения раковой опухоли, экспрессирующей MUC1, в целях предупреждения, ингибирования или замедления развития MUC1-экспрессирующих опухолей и/или в целях предупреждения, ингибирования или замедления развития метастазов таких опухолей и/или, в основном, в целях предупреждения или ингибирования прогрессирования рака у индивидуума. Как обсуждается в настоящей заявке, MUC1 экспрессируется в некоторых раковых опухолях. Поэтому профилактические композиции могут быть введены индивидуумам, у которых очевидно отсутствует раковая опухоль (у здоровых или нормальных индивидуумов), индивидуумам с предраковым заболеванием (предзлокачественными поражениями), а также индивидуумам, которые страдают раком, но у которых MUC1 пока еще не был детектирован (то есть, до экспрессии MUC1 опухолевыми клетками в раковой опухоли). Индивидуумы с высоким риском развития рака, в частности рака, который обычно ассоциируется с экспрессией MUC1 и/или с развитием метастазов, могут быть подвергнуты профилактическому лечению композицией согласно изобретению. Если иммунотерапевтические композиции согласно изобретению являются терапевтическими, то эти композиции вводят индивидууму с MUC1-экспрессирующей раковой опухолью в целях ослабления симптомов рака, например, снижения опухолевой нагрузки у индивидуума, ингибирования роста опухоли у индивидуума, увеличения продолжительности жизни индивидуума и/или для предупреждения и ингибирования прогрессирования рака, для обратного развития рака или для замедления прогрессирования рака у индивидуума.
Обычно иммунотерапевтическая композиция на основе дрожжей-MUC1 включает дрожжевой носитель и по меньшей мере один раковый антиген, содержащий антиген MUC1 или его иммуногенный домен, где указанный раковый антиген экспрессируется дрожжевым носителем, присоединяется к дрожжевому носителю, загружается в этот носитель или смешивается с ним. В некоторых вариантах осуществления изобретения раковый антиген, антиген MUC1 или его иммуногенный домен представляют собой гибридный белок. Некоторые белки MUC1 и гибридные белки MUC1, которые могут быть использованы в композициях и способах согласно изобретению, описаны ниже. В некоторых вариантах осуществления изобретения раковый антиген и антиген MUC1 представляют собой один и тот же элемент. В некоторых вариантах осуществления изобретения раковый антиген включает, помимо антигена MUC1, другие антигены, например, другие раковые антигены. В одном из аспектов изобретения гибридный белок, используемый в качестве ракового антигена, может включать два или более антигенов, например, антиген MUC1 и другой раковый антиген, не являющийся антигеном MUC1, или два различных антигена MUC1. В одном из аспектов изобретения гибридный белок может включать два или более иммуногенных доменов одного или более антигенов, такие как два или более иммуногенных доменов антигена MUC1 или два или более эпитопов одного или более антигенов, таких как два или более эпитопов антигена MUC1.
В соответствии с настоящим изобретением дрожжевой носитель, используемый в иммунотерапевтической композиции на основе дрожжей-MUC1, представляет собой любую дрожжевую клетку (например, целую или интактную клетку) или ее производное (см. ниже), которые могут быть использованы в комбинации с одним или более антигенами, их иммуногенными доменами или их эпитопами в композиции согласно изобретению (например, в терапевтической или профилактической композиции). Следовательно, такими дрожжевыми носителями могут быть, но не ограничиваются ими, живой интактный (целый) дрожжевой микроорганизм (то есть, дрожжевые клетки, имеющие все ее компоненты, включая клеточную стенку), «убитый» (инактивированный) или инактивированный интактный дрожжевой микроорганизм или производные интактных дрожжевых клеток, включая дрожжевые сферопласты (то есть, дрожжевые клетки без клеточной стенки), дрожжевые цитопласты (то есть, дрожжевые клетки без клеточной стенки и ядра), дрожжевая «тень» (то есть, дрожжевые клетки без клеточной стенки, ядра и цитоплазмы), субклеточные дрожжевые мембранные экстракты или их фракции (также называемые здесь дрожжевой мембранной частицей, а ранее называемые субклеточной дрожжевой частицей), любые другие дрожжевые частицы или препараты, содержащие дрожжевые клеточные стенки.
Дрожжевые сферопласты обычно получают путем ферментативного расщепления дрожжевой клеточной стенки. Такой метод описан, например, в публикации Franzusoff et al., 1991, Meth. Enzymol. 194, 662-674, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Дрожжевые цитопласты обычно получают путем удаления ядра из дрожжевых клеток. Такой метод описан, например, в публикации Coon, 1978, Natl. Cancer Inst. Monogr. 48, 45-55, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Дрожжевые «тени» обычно получают путем лигирования проницаемых или лизированных клеток после гидролиза, и такие «тени» могут, но необязательно, содержать по меньшей мере некоторые из органелл этих клеток. Такой метод описан, например, в публикациях Franzusoff et al., 1983, J. Biol. Chem. 258, 3608-3614, и Bussey et al., 1979, Biochim. Biophys. Acta 553, 185-196, каждая из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Дрожжевая мембранная частица (субклеточный дрожжевой мембранный экстракт или его фракция) представляет собой дрожжевую мембрану, в которой отсутствует природное ядро или природная цитоплазма. Такая частица может иметь любой размер, включая размер, например, в пределах от размера природной дрожжевой мембраны до размера микрочастиц, продуцируемых путем обработки ультразвуком или другими известными методами разрушения мембраны с последующим лигированием после гидролиза. Метод продуцирования субклеточных дрожжевых мембранных экстрактов описан, например, в публикации Franzusoff et al., 1991, Meth. Enzymol. 194, 662-674. Можно также использовать фракции дрожжевых мембранных частиц, содержащих дрожжевые мембранные части, в том случае, если антиген или другой белок рекомбинантно экспрессируется дрожжами до получения дрожжевых мембранных частиц, антигена или другого представляющего интерес белка. Антигены или другие представляющие интерес белки или их комбинации могут присутствовать внутри мембраны и на любой поверхности мембраны (то есть, эти белки могут присутствовать внутри и снаружи мембраны и/или по всей мембране дрожжевой мембранной частицы). В одном из вариантов осуществления изобретения дрожжевая мембранная частица представляет собой рекомбинантную дрожжевую мембранную частицу, которой может быть интактная, поврежденная или разрушенная и лигированная после гидролиза дрожжевая мембрана, включающая по меньшей мере один нужный антиген или другой представляющий интерес белок, присутствующий на поверхности мембраны или по меньшей мере частично внутри этой мембраны.
Примером препарата дрожжевой клеточной стенки является препарат, полученный из выделенных дрожжевых клеточных стенок, несущих антиген, находящийся на поверхности клеточной стенки или, по меньшей мере частично, внутри клеточной стенки, и такой препарат дрожжевой клеточной стенки, при его введении животному, стимулирует нужный иммунный ответ против рассматриваемого заболевания.
Для получения дрожжевого носителя согласно изобретению может быть использован любой дрожжевой штамм. Дрожжи представляют собой одноклеточные микроорганизмы, принадлежащие к одному из трех классов: Ascomycetes, Basidiomycetes и Fungi Imperfecti. Одним из аргументов при выборе типа дрожжей, используемых в качестве иммунного модулятора, является патогенность дрожжей. В одном из вариантов осуществления изобретения дрожжами является непатогенный штамм, такой как Saccharomyces cerevisiae. Выбор непатогенного дрожжевого штамма позволяет минимизировать какие-либо побочные эффекты у индивидуума, которому был введен дрожжевой носитель. Однако могут быть использованы и патогенные дрожжи, если патогенность этих дрожжей может быть устранена любыми способами, известными специалистам (например, путем получения мутантных штаммов). В соответствии с одним из аспектов настоящего изобретения были использованы непатогенные дрожжевые штаммы.
Дрожжевые штаммы, которые могут быть использованы в настоящем изобретении, принадлежат к роду, включая, но не ограничиваясь ими, Saccharomyces, Candida (которые могут быть патогенными), Cryptococcus, Hansenula, Kluyveromyces, Pichia, Rhodotorula, Schizosaccharomyces и Yarrowia. В одном из аспектов изобретения дрожжи выбирают из дрожжей рода Saccharomyces, Candida, Hansenula, Pichia или Schizosaccharomyces, а в одном из аспектов изобретения используют дрожжи Saccharomyces. Видами дрожжевых штаммов, которые могут быть использованы в настоящем изобретении, являются, но не ограничиваются ими, Saccharomyces cerevisiae, Saccharomyces carlsbergensis, Candida albicans, Candida kefyr, Candida tropicalis, Cryptococcus laurentii, Cryptococcus neoformans, Hansenula anomala, Hansenula polymorpha, Kluyveromyces fragilis, Kluyveromyces lactis, Kluyveromyces marxianus var. lactis, Pichia pastoris, Rhodotorula rubra, Schizosaccharomyces pombe и Yarrowia lipolytica. При этом следует отметить, что некоторые из этих видов включают ряд подвидов, типов, подтипов и т.п., которые, как предполагается, принадлежат к вышеупомянутым видам. В одном из аспектов изобретения видами дрожжей, используемых в настоящем изобретении, являются S. cerevisiae, C. albicans, H. polymorpha, P. pastoris и S. pombe. Наиболее подходящими являются дрожжи S. cerevisiae, поскольку они относительно легко поддаются манипуляциям и «по существу, известны как безопасные», или сокращенно «GRAS», а поэтому используются в качестве пищевых добавок (GRAS, в соответствии с Положением FDA 62FR18938, 17 апреля, 1997 г.). Одним из вариантов осуществления настоящего изобретения является дрожжевой штамм, в котором могут реплицироваться плазмиды с образованием очень большого числа копий, например, штамм S. cerevisiae cir°. Одним из таких штаммов является штамм S. cerevisiae, который способен встраивать экспрессионные векторы, что позволяет одному или более антигенам-мишеням и/или антигенным гибридным белкам и/или другим белкам экспрессироваться на высоком уровне. Другим дрожжевым штаммом, используемым в настоящем изобретении, является W303α Saccharomyces cerevisiae. Кроме того, в настоящем изобретении могут быть использованы любые мутантные дрожжевые штаммы, включая штаммы, которые обнаруживают пониженный уровень посттрансляционных модификаций, экспрессируемых антигенов-мишеней или других белков, например, таких модификаций, как мутации в ферментах, которые повышают уровень N-связанного гликозилирования. В одном из аспектов изобретения иммунотерапевтическую композицию на основе дрожжей-MUC1 получают с использованием мутантного дрожжевого штамма, который продуцирует антиген MUC1, где указанный антиген, в отличие от того же самого антигена, продуцируемого штаммом дикого типа (с нормальным уровнем гликозилирования), представляет собой белок, имеющий пониженный уровень гликозилирования. Такой антиген MUC1 может иметь большее сходство с антигенами MUС1, экспрессируемыми опухолевыми клетками, и эти антигены впоследствии могут процессироваться в уникальные Т-клеточные эпитопы антигенпрезентирующими клетками, что приводит к усилению специфического противоопухолевого ответа.
Иммунотерапевтическая композиция на основе дрожжей-MUC1 согласно изобретению включает по меньшей мере один раковый антиген, содержащий антиген MUC1. В соответствии с настоящим изобретением термин «антиген» по существу означает: любую часть белка (например, пептид, неполный белок, полноразмерный белок), где указанный белок является природным белком или белком, полученным или сконструированным путем синтеза; клеточную композицию (целую клетку, клеточный лизат или разрушенные клетки); организм (целый организм, лизат или разрушенные клетки этого организма) или углевод или другую молекулу или ее часть. Антиген может вырабатывать антигенспецифический иммунный ответ (например, гуморальный и/или клеточно-опосредуемый иммунный ответ) против одного и того же антигена или подобных антигенов, которые взаимодействуют in vitro, in vivo или ex vivo с элементом иммунной системы (например, с Т-клетками, антителами).
Антиген может представлять собой небольшую молекулу, например, один эпитоп, один иммуногенный домен или более крупную молекулу, и может включать множество эпитопов или иммуногенных доменов. Антиген в основном может быть небольшим, то есть его размер может составлять приблизительно 8-11 аминокислот (то есть, он может представлять собой пептид), и быть более крупным, то есть он может представлять собой домен белка, полноразмерный белок, мультимер, гибридный белок, химерный белок, целую клетку, целый микроорганизм или любые их части (например, фрагменты белка (полипептиды), лизаты целых клеток или экстракты микроорганизмов). Антигенами, используемыми в иммунотерапевтических композициях на основе дрожжей-MUC1 согласно изобретению, являются пептиды, полипептиды, домен(ы) белка, белковые субъединицы, полноразмерные белки, мультимеры, гибридные белки и химерные белки. Кроме того, антигенами могут быть углеводы, которые могут быть включены в дрожжевой носитель или в композицию согласно изобретению. Следует отметить, что в некоторых вариантах осуществления изобретения (например, если антиген экспрессируется дрожжевым носителем из рекомбинантной молекулы нуклеиновой кислоты) антигеном является белок (включая фрагменты, домены, субъединицы и полноразмерные белки), гибридный белок, химерный белок или их фрагменты, но не целая клетка или целый микроорганизм. В одном из вариантов осуществления изобретения антиген для экспрессии в дрожжах имеет минимальный размер, позволяющий ему рекомбинантно экспрессироваться в дрожжах, если этот антиген представляет собой полноразмерный белок, экспрессирующийся в дрожжах (другими словами, белок, который экспрессируется в дрожжах и который может включать антиген или состоять из антигена, предпочтительно имеет длину по меньшей мере в 25 аминокислот), но обычно такой антиген имеет длину по меньшей мере или более чем 25 аминокислот, по меньшей мере или более чем 26 аминокислот, по меньшей мере или более чем 27 аминокислот, по меньшей мере или более чем 28 аминокислот, по меньшей мере или более чем 29 аминокислот, по меньшей мере или более чем 30 аминокислот, по меньшей мере или более чем 31 аминокислоту, по меньшей мере или более чем 32 аминокислоты, по меньшей мере или более чем 33 аминокислоты, по меньшей мере или более чем 34 аминокислоты, по меньшей мере или более чем 35 аминокислот, по меньшей мере или более чем 36 аминокислот, по меньшей мере или более чем 37 аминокислот, по меньшей мере или более чем 38 аминокислот, по меньшей мере или более чем 39 аминокислот, по меньшей мере или более чем 40 аминокислот, по меньшей мере или более чем 41 аминокислоту, по меньшей мере или более чем 42 аминокислоты, по меньшей мере или более чем 43 аминокислоты, по меньшей мере или более чем 44 аминокислоты, по меньшей мере или более чем 45 аминокислот, по меньшей мере или более чем 46 аминокислот, по меньшей мере или более чем 47 аминокислот, по меньшей мере или более чем 48 аминокислот, по меньшей мере или более чем 49 аминокислот, по меньшей мере или более чем 50 аминокислот, или по меньшей мере 25-50 аминокислот, по меньшей мере 30-50 аминокислот, по меньшей мере 35-50 аминокислот, по меньшей мере 40-50 аминокислот или по меньшей мере 45-50 аминокислот, хотя могут экспрессироваться и белки меньшего размера, но в основном экспрессируются более крупные белки (например, белки длиной в сто аминокислот или даже в несколько тысяч аминокислот). В соответствии с одним из аспектов изобретения может экспрессироваться полноразмерный белок или домен белка, в котором отсутствуют 1-20 аминокислот, расположенных у N- и/или C-конца. Гибридными белками и химерными белками, которые могут быть экспрессированы в соответствии с настоящим изобретением, также являются антигены. Термин «антиген-мишень» означает антиген, на который специфически нацелена иммунотерапевтическая композиция согласно изобретению (то есть, антиген, обычно нативный антиген, против которого желательно вырабатывание иммунного ответа). Термин «раковый антиген» означает антиген, содержащий по меньшей мере один антиген, который ассоциируется с раковой опухолью, например, антиген, экспрессируемый опухолевыми клетками, и поэтому нацеливание на такой антиген равнозначно нацеливанию на опухолевую клетку и/или раковую клетку. Раковый антиген может включать один или более антигенов, происходящих от одного или более белков, включая один или более опухолеассоциированных белков. Термин «антиген MUC1» означает антиген, происходящий от белка MUC1, сконструированный из белка MUC1 или продуцированный из белка MUC1 (включая MUC1-N, MUC1-C или оба MUC1-N и MUC1-C).
Термин «иммуноген», если он относится к стимуляции иммунного ответа, означает подмножество значений термина «антиген», а поэтому, в некоторых случаях, этот термин может употребляться как синоним термина «антиген». Используемый здесь термин «иммуноген» означает антиген, который вырабатывает гуморальный и/или клеточно-опосредуемый иммунный (то есть, иммуногенный) ответ, и поэтому введение такого иммуногена индивидууму приводит к вырабатыванию антигенспецифического иммунного ответа против одного и того же или аналогичных антигенов, взаимодействующих с иммунной системой индивидуума. В одном из вариантов осуществления изобретения иммуноген вырабатывает клеточно-опосредуемый иммунный ответ, включая CD4+-T-клеточный ответ (например, TH1, TH2 и/или TH17) и/или CD8+-T-клеточный ответ (например, CTL-ответ).
Термины «иммуногенный домен» или «иммунологический домен» данного антигена могут означать любые части, фрагменты или эпитопы антигена (например, пептидный фрагмент или субъединицу или эпитоп для антитела или другой конформационный эпитоп), содержащие по меньшей мере один эпитоп, который, при его введении животному, может действовать как иммуноген. Поэтому иммуногенный домен является более крупным, чем одна аминокислота, и имеет размер, достаточный для того, чтобы он содержал по меньшей мере один эпитоп, который может действовать как иммуноген. Так, например, один белок может содержать множество различных иммуногенных доменов. Иммуногенные домены необязательно должны представлять собой линейные последовательности в белке, например, в случае гуморального иммунного ответа рассматриваются конформационные домены.
Эпитоп определен здесь как один иммуногенный сайт в данном антигене, который является достаточным для вырабатывания иммунного ответа иммунной системой в присутствии соответствующих костимулирующих сигналов и/или активированных клеток иммунной системы. Другими словами, эпитопом является часть антигена, которая распознается компонентами иммунной системы, и такой эпитоп может также называться антигенной детерминантой. Для специалистов в данной области очевидно, что Т-клеточные эпитопы отличаются по размеру и составу от В-клеточных эпитопов или эпитопов для антител, а эпитопы, презентированные молекулами МНС класса I в путях клеточных взаимодействий, отличаются по размеру и структурным свойствам от эпитопов, презентированных молекулами МНС класса II в путях клеточных взаимодействий. Так, например, Т-клеточные эпитопы, презентированные молекулами MHC класса I, обычно имеют длину от 8 до 11 аминокислот, тогда как эпитопы, презентированные молекулами MHC класса II, менее ограничены по своей длине и могут содержать до 25 аминокислот или более. Кроме того, Т-клеточные эпитопы имеют предсказанные структурные свойства, зависящие от специфических молекул MHC, связанных с эпитопом. Эпитопами могут быть эпитопы с линейными последовательностями или конформационные эпитопы (консервативные связывающие области). Большинство антител распознают конформационные эпитопы.
MUC1 (который может также называться «муцином-1», а также «антигеном DF3» или «HMFG1») представляет собой крупный гликопротеин, экспрессируемый большинством эпителиальных секреторных тканей злокачественных эпителиальных клеток на базальных уровнях и на высоких уровнях. В большинстве случаев MUC1 представляет собой полиморфный трансмембранный белок типа I с крупным внеклеточным доменом (также называемым субъединицей MUC1-N), включающим варьирующееся число тандемных повторов (VNTR; обычно от 20-125 повторов), которые имеют высокий уровень О-связанного гликозилирования. Белок MUC1 кодируется как один транскрипт, а затем он посттрансляционно процессируется в субъединицы, известные как MUC1-N и MUC1-C, или в β-субъединицы, соответственно, которые впоследствии образуют гетеродимерный белок посредством сильного нековалентного взаимодействия двух субъединиц. MUC1 расщепляется на N- и C-субъединицы в домене «белка спермы морского ежа, белка энтерокиназы и белка агрина» (SEA), то есть в домене высококонсервативного белка, который был назван по его первоначальной идентификации в белке спермы, в белке энтерокиназы и в белке агрине, и который присутствует в ряде высокогликозилированных муцин-подобных белков, обычно связанных с мембраной. Белок MUC1 расщепляется между остатками глицина и серина, присутствующими в последовательности GSVVV (например, в положениях 1097-1101 SEQ ID NO: 11) в домене SEA (Lillehoj et al., 2003, Biochem. Biophys. Res. Commun. 307:743-749; Parry et al., 2001, Biochem. Biophys. Res. Commun. 283:715-720; Wreschner et al., 2002, Protein Sci. 11:698-706).
Субъединица MUC1-C включает внеклеточный домен (ED), который является гликозилированным и связывается с лигандом галектином-3, который, в свою очередь, служит в качестве моста для физического связывания MUC1 с рецептором эпидермального фактора роста (EGFR) и, вероятно, с другими тирозинкиназными рецепторами. MUC1-C также включает трансмембранный (TM) домен и цитоплазматический домен (CD), содержащий несколько тирозиновых остатков, которые, при их фосфорилировании, могут действовать как связывающие мотивы для белков с SH2-доменами (подробное обсуждение белка MUC1 и его известных и предполагаемых функций см. публикацию Kufe, 2008, Cancer Biol. & Ther. 7:81-84). Варианты альтернативного сплайсинга MUC1 (известные как, например, MUC1/Y и MUC1/X) представляют собой «короткие» варианты MUC1, которые не содержат большинство из MUC1-N, включая большую область VNTR, но содержат домен ED, TM-домен и CD-области, а также домен SEA и часть N-концевой области сигнальной последовательности. В этих коротких вариантах может не наблюдаться расщепление в домене SEA.
Выделение и секвенирование ДНК и кДНК, кодирующей человеческий MUC1, описано в литературе (см., например, Siddiqui et al., 1998, PNAS 85:2320-2323; Abe and Kufe, 1993, PNAS 90:282-286; Hareuveni et al., 1990, Eur. J. Biochem. 189(3):475-486; Gendler et al., 1990, J. Biol. Chem. 265(25):15286-15293; Lan et al., 1990, J. Biol. Chem 265(25):15294-15299; Tsarfaty et al., 1990, Gene 93(2):313-318; Lancaster, 1990, Biochem. Biophys. Res. Commun. 173(3):1019-1029). Репрезентативный белок-предшественник полноразмерного человеческого MUC1, содержащего области MUC1-N и MUC1-C, описан в SwissProt, регистрационный номер P15941.3 (GI296439295), и представлен в настоящем описании последовательностью SEQ ID NO: 11. Из гена, кодирующего SEQ ID NO: 11, может быть создано 10 различных изоформ MUC1 посредством альтернативного сплайсинга транскрипта. Так, например, изоформа, известная как MUC1/Y, не содержит аминокислот в положениях 54-1053 последовательности SEQ ID NO: 11. Различные другие изоформы представлены в базе данных, в которой имеется описание этого белка.
Для иллюстрации идентификации доменов в белке MUC1, которая может быть применена к любому человеческому белку MUC1, а также к белкам MUC1 других млекопитающих, было показано, что нижеследующие домены могут быть легко идентифицированы в последовательности SEQ ID NO: 11. Сигнальная последовательность MUC1, также называемая здесь лидерной последовательностью, расположена приблизительно в положениях 1-23 SEQ ID NO: 11 (сигнальная последовательность MUC1 идентифицирована как более длинная последовательность в некоторых вариантах MUC1, и она может включать дополнительные аминокислоты, например, в положениях 1-32). Субъединица MUC1-N или α-субъединица включает приблизительно аминокислоты в положениях 24-1097 SEQ ID NO: 11, а субъединица MUC1-C или β-субъединица включает приблизительно аминокислоты в положениях 1098-1255 SEQ ID NO: 11.
В субъединице MUC1-N может находиться домен VNTR (с варьирующимся числом тамдемных повторов), содержащий множество повторов в этом конкретном белке, включая приблизительно область в положениях 126-965, содержащую 42 повтора из 20 аминокислот в последовательности PAPGSTAPPAHGVTSAPDTR (например, в положениях 126-145 SEQ ID NO: 11), которая обычно представляет собой распознаваемую последовательность VNTR (см. также SEQ ID NO: 12, представленную ниже, которая определяет общий полиморфизм в этой последовательности). Поскольку эти последовательности являются повторяющимися последовательностями, то за начало отсчета можно принять любую одну из 20 аминокислот в одной VNTR, а затем снова начинать отсчет с повтора этой первой аминокислоты. Более конкретно, поскольку один домен VNTR представляет собой последовательность приблизительно из 20 аминокислот, перед которой и/или после которой присутствует другая идентичная, почти идентичная или гомологичная последовательность из 20 аминокислот, и которая может входить в ряд большого числа таких повторяющихся последовательностей, то для описания одного VNTR в области повторов VNTR «положение 1» данного VNTR можно рассматривать как любую одну из 20 аминокислот в VNTR, а затем фланкирующие ее аминокислоты слева и справа могут быть соответственно пронумерованы так, что аминокислота, которая находится выше (до) положения 1, является либо последней аминокислотой (в положении 20) предшествующего VNTR, либо последней аминокислотой последовательности, присоединенной к VNTR (если такая предшествующая последовательность не является также последовательностью VNTR), а аминокислота, которая находится ниже положения 1, присутствует в положении 2 VNTR, положении 3 и т.п., вплоть до последовательности повтора со следующим VNTR.
Положения 61-1120 SEQ ID NO: 11 включают область VNTR, обсуждаемую выше, плюс дополнительные области, называемые «повторяющимися областями». Так, например, аминокислоты в положениях 81-100, в положениях 101-120, в положениях 121-140, в положениях 141-160, в положениях 161-180, в положениях 181-200, в положениях 201-220, в положениях 221-240, в положениях 241-260, в положениях 261-180, в положениях 281-300 и т.д., с приращениями в 20 аминокислот по всем положениям 1001-1120 последовательности SEQ ID NO: 11, представляют собой повторяющиеся области в этом белке.
В полноразмерном белке MUC1, представленном SEQ ID NO: 11 (до расщепления на субъединицы), домен SEA находится в положениях 1034-1152 SEQ ID NO: 11. Расщепление домена SEA между аминокислотами 1097 и 1098 SEQ ID NO: 11 приводит к образованию домена MUC1-C. В домене MUC1-C внеклеточный домен (ED) присутствует приблизительно в положениях 1098-1155 SEQ ID NO: 11; трансмембранный (TM) домен присутствует приблизительно в положениях 1156-1183 SEQ ID NO: 11, а цитоплазматический домен (CD, также называемый цитоплазматическим хвостом) присутствует приблизительно в положениях 1184-1255 SEQ ID NO: 11.
Число VNTR в данной субъединице MUC1-N является в высокой степени полиморфным и может варьироваться, например, от 20 до 125 повторов. Тандемно повторяющийся икоза-пептид обычно имеет полиморфизм в одном или более из трех положений (в положениях 9, 18 и 19 SEQ ID NO: 12): PAPGSTAP[P/A/Q/T]AHGVTSAP[DT/ES]R (SEQ ID NO: 12, области в скобках означают часто встречающиеся полиморфизмы), где полиморфизм в положениях 18 и 19 SEQ ID NO: 12 возникает преимущественно при заменах DT>ES, и где одна замена в положении 9 происходит по следующей предпочтительности: P>A, P>Q и P>T. Наиболее часто встречающаяся замена, DT>ES, наблюдается в 50% повторов.
Известны различные варианты транскрипта MUC1, и субъединицы, домены или области MUC1, описанные выше на примере последовательности SEQ ID NO: 11, могут быть легко идентифицированы в этих вариантах, а поэтому антиген MUC1, используемый в настоящем изобретении, может быть сконструирован или продуцирован на основе данной последовательности MUC1 или соответствующей последовательности, происходящей от другого белка MUC1. Так, например, одна нуклеотидная последовательность, кодирующая человеческий белок MUC1, представлена здесь как SEQ ID NO: l, которая имеется в GENBANK® под регистрационным номером NM_002456.4 (GI: 65301116). Последовательность SEQ ID NO: 1 кодирует человеческий белок MUC1 из 273 аминокислот (вариант транскрипта 1, также известный как MUC1/ZD), аминокислотная последовательность которого представлена здесь как SEQ ID NO: 2 (также имеющаяся в GENBANK® под регистрационным номером NP_002447.4; GL65301117). В SEQ ID NO: 2 присутствуют нижеследующие домены: сигнальная последовательность (в положениях 1-27 SEQ ID NO: 2); домен SEA (в положениях 55-170 SEQ ID NO: 2); ED (в положениях 116-173 SEQ ID NO: 2); TM-домен (в положениях 174-201 SEQ ID NO: 2); и CD (в положениях 202-273 SEQ ID NO: 2). Сайт протеолитического расщепления в домене SEA, который отделяет ED-домен от N-концевой области домена SEA, находится в положениях 115 и 116 SEQ ID NO: 2. Этот вариант транскрипта не содержит области VNTR, как показано в SEQ ID NO: 11.
Другая нуклеотидная последовательность, кодирующая другой человеческий белок MUC1, представлена здесь как SEQ ID NO: 3, которая имеется в GENBANK® под регистрационным номером NM_001018016.1 (GI67189006). SEQ ID NO: 3 кодирует человеческий белок MUC1 из 264 аминокислот (вариант транскрипта 2, также известный как «MUC1/Y»), аминокислотная последовательность которого представлена здесь как SEQ ID NO: 4 (также имеющаяся в GENBANK® под регистрационным номером NP_001018016.1; GI67189007). В SEQ ID NO: 4 присутствуют нижеследующие домены: сигнальная последовательность (в положениях 1-32 SEQ ID NO: 4); домен SEA (в положениях 45-161 SEQ ID NO: 4); ED (в положениях 107-164 SEQ ID NO: 4); TM-домен (в положениях 165-192 SEQ ID NO: 4); и CD (в положениях 193-264 SEQ ID NO: 4). Сайт протеолитического расщепления в домене SEA, который отделяет ED-домен от N-концевой области домена SEA, находится в положениях 106 и 107 SEQ ID NO: 4. Этот вариант транскрипта не содержит области VNTR, как показано в SEQ ID NO: 11.
Другая нуклеотидная последовательность, кодирующая другой человеческий белок MUC1, представлена здесь как SEQ ID NO: 5, которая имеется в GENBANK® под регистрационным номером AY327587.1 (GI:33150003). SEQ ID NO: 5 кодирует человеческий белок MUC1 из 264 аминокислот (вариант транскрипта 2, также известный как «MUC1/Y»), аминокислотная последовательность которого представлена здесь как SEQ ID NO: 6 (также имеющаяся в GENBANK® под регистрационным номером AAP97018.1 (GI:33150004). В SEQ ID NO: 6 присутствуют нижеследующие домены: сигнальная последовательность (в положениях 1-32 SEQ ID NO: 6); домен SEA (в положениях 45-161 SEQ ID NO: 6); ED (в положениях 107-164 SEQ ID NO: 6); TM-домен (в положениях 165-192 SEQ ID NO: 6); и CD (в положениях 193-264 SEQ ID NO: 6). Сайт протеолитического расщепления в домене SEA, который отделяет ED-домен от N-концевой области домена SEA, находится в положениях 106 и 107 SEQ ID NO: 6. Этот вариант транскрипта не содержит области VNTR, как показано в SEQ ID NO: 11. SEQ ID NO: 6 на 99% идентична SEQ ID NO: 4, что указывает на высокую степень гомологии между последовательностями MUC1, происходящими от различных источников.
Другая нуклеотидная последовательность, кодирующая другой человеческий белок MUC1, представлена здесь как SEQ ID NO: 7, которая имеется в GENBANK® под регистрационным номером NM_001018017 (GI324120954). SEQ ID NO: 7 кодирует человеческий белок MUC1 из 255 аминокислот (вариант транскрипта 3), аминокислотная последовательность которого представлена здесь как SEQ ID NO: 8 (также имеющаяся в GENBANK® под регистрационным номером NP_001018017.1; GI67189069). В SEQ ID NO: 8 присутствуют нижеследующие домены: сигнальная последовательность (в положениях 1-27 SEQ ID NO: 8); домен SEA (в положениях 36-152 SEQ ID NO: 8); ED (в положениях 98-155 SEQ ID NO: 8); TM-домен (в положениях 156-183 SEQ ID NO: 8); и CD (в положениях 184-255 SEQ ID NO: 8). Сайт протеолитического расщепления в домене SEA, который отделяет ED-домен от N-концевой области домена SEA, находится в положениях 97 и 98 SEQ ID NO: 6. Этот вариант транскрипта не содержит области VNTR, как показано в SEQ ID NO: 11.
Человеческий MUC1 в высокой степени гомологичен белку MUC1 животных других видов, поэтому можно предположить, что домены в данном белке MUC1 можно идентифицировать путем сравнения этих последовательностей. Кроме того, некоторые последовательности MUC1 животных других видов, в частности млекопитающих, могут быть использованы для получения иммунотерапевтических композиций на основе дрожжей-MUC1 согласно изобретению, в случае, если эти последовательности являются идентичными или по существу гомологичными, и если эти последовательности вырабатывают эффективный иммунный ответ против антигена-мишени (например, нативного MUC1, экспрессируемого опухолевой клеткой). Так, например, мышиный белок MUC1 представлен здесь как аминокислотная последовательность SEQ ID NO: 9. SEQ ID NO: 9 имеется в GENBANK® под регистрационным номером NM_013605 (GI7305292). SEQ ID NO: 9 кодирует мышиный белок MUC1 из 631 аминокислоты, аминокислотная последовательность которого представлена здесь как SEQ ID NO: 10 (также имеющаяся в GENBANK® под регистрационным номером NP_038633; GI7305293). В SEQ ID NO: 10 присутствуют следующие домены: сигнальная последовательность (приблизительно в положениях 1-20 SEQ ID NO: 10); VNTR (идентифицируемый в положениях 21-425 SEQ ID NO: 10); домен SEA (в положениях 426-528 SEQ ID NO: 10); ED (в положениях 475-536 SEQ ID NO: 10); TM-домен (в положениях 531-559 SEQ ID NO: 10); и CD (в положениях 560-631 SEQ ID NO: 10). Сайт протеолитического расщепления в домене SEA, который отделяет ED-домен от N-концевой области домена SEA, находится в положениях 474 и 475 SEQ ID NO: 10. Для иллюстрации уровня консервативности последовательности MUC1 в доменах, можно отметить, что мышиный домен SEA MUC1 SEQ ID NO: 10 на 62% идентичен и на 68% гомологичен или точно соответствует (как было определено с помощью программы BLAST) домену SEA человеческого MUC1 SEQ ID NO: 11. Последовательность SEQ ID NO: 10 ED мышиного MUC1 на 56% идентична и на 73% гомологична последовательности SEQ ID NO: 11 ED человеческого MUC1. Последовательность ТМ-домена мышиного MUC1 SEQ ID NO: 10 на 89% идентична и на 93% гомологична последовательности ТМ-домена человеческого MUC1 SEQ ID NO: 11. Последовательность CD мышиного MUC1 SEQ ID NO: 10 на 88% идентична и на 88% гомологична последовательности CD человеческого MUC1 SEQ ID NO: 11.
Человеческий MUC1, включая описанные здесь человеческие белки MUC1 и антигены MUC1, содержат различные CD4+- и CD8+-T-клеточные эпитопы. Такие T-клеточные эпитопы описаны, например, в патенте США №6546643; в патенте США №7118738; в патенте США №7342094; в патенте США №7696306; и в публикации заявки на патент США №2008/0063653.
В одном из вариантов осуществления изобретения антиген MUC1 содержит гибридный белок, включающий множество доменов белка MUC1, или состоит из этого гибридного белка. В одном из вариантов осуществления изобретения антиген MUC1 происходит от частей или сконструирован из частей субъединицы MUC1-C. В одном из вариантов осуществления изобретения антиген MUC1 происходит от частей или сконструирован из частей субъединицы MUC1-N. В одном из вариантов осуществления изобретения антиген MUC1 происходит от частей или сконструирован из частей обеих субъединиц MUC1-C и MUC1-N.
В одном из вариантов осуществления изобретения гибридный белок, используемый в иммунотерапевтических композициях на основе дрожжей-MUC1, включает по меньшей мере два, по меньшей мере три, по меньшей мере четыре или по меньшей мере пять нижеследующих антигенов MUC1, расположенных в гибридном белке в любом порядке, где любой из этих антигенов может повторяться в этом гибридном белке один или несколько раз (например, в виде комбинации из двух или более CD-сегментов), а именно, гибридный белок включает: (1) сигнальную последовательность MUC1; (2) по меньшей мере одну часть домена SEA MUC1 и/или по меньшей мере одну часть внеклеточного домена (ED) MUC1 или его иммуногенного домена, который, в одном из аспектов изобретения, может включать большую часть ED или весь ЕD помимо одной или более фланкирующих аминокислот домена SEA; (3) по меньшей мере два домена VNTR; (4) по меньшей мере один трансмембранный домен MUC1 или его иммуногенный домен; и (5) по меньшей мере один цитоплазматический (CD) домен MUC1 или его иммуногенный домен. Такой гибридный белок не является полноразмерным белком MUC1 и не содержит полноразмерного белка MUC1 (то есть, он не включает полноразмерную субъединицу MUC1-N и полноразмерную субъединицу MUC1-C), при этом такой гибридный белок не включает полноразмерную субъединицу MUC1-N. В одном из аспектов изобретения указанный гибридный белок не включает полноразмерную субъединицу MUC1-C. В одном из аспектов изобретения сегменты гибридного белка (например, белков или доменов MUC1, включая иммуногенные домены) расположены в другом порядке, отличающемся от порядка расположения сегментов в нативном белке MUC1 или в белке MUC1 дикого типа.
Сигнальная последовательность MUC1 (или лидерная последовательность), используемая в описанном здесь гибридном белке, может представлять собой сигнальную последовательность, происходящую от любого белка MUC1, а в одном из аспектов изобретения от человеческого белка MUC1. В одном из аспектов изобретения сигнальная последовательность MUC1, используемая в гибридном белке согласно изобретению, имеет аминокислотную последовательность, включающую аминокислотную последовательность или состоящую из аминокислотной последовательности, выбранной из последовательностей в положениях 1-27 SEQ ID NO: 2, в положениях 1-32 SEQ ID NO: 4, в положениях 1-32 SEQ ID NO: 6, в положениях 1-27 SEQ ID NO: 8, в положениях 1-23 SEQ ID NO: 11, в положениях 1-30 SEQ ID NO: 14, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей. В одном из аспектов изобретения сигнальная последовательность MUC1 расположена у N-конца гибридного белка, используемого в настоящем изобретении. В одном из аспектов изобретения в гибридном белке согласно изобретению, вместо сигнальной последовательности MUC1 (то есть, для ее замены) используется последовательность, не являющаяся последовательностью MUC1, например, такая как последовательность любого из описанных ниже N-концевых синтетических и дрожжевых пептидов.
Домен MUC1 белка спермы морского ежа, белка энтерокиназы и белка агрина (SEA), используемый в описанном здесь гибридном белке, может представлять собой домен SEA или его часть, которая включает по меньшей мере один иммуногенный домен, происходящий от любого белка MUC1, а в одном из аспектов изобретения от человеческого белка MUC1. В одном из аспектов изобретения часть домена SEA MUC1, используемая в гибридном белке согласно изобретению, включает по меньшей мере аминокислотную последовательность, происходящую от внеклеточного домена (ED) MUC1, но может не включать последовательность, расположенную выше ED-домена. В одном из аспектов изобретения домен SEA MUC1, используемый в гибридном белке согласно изобретению, имеет аминокислотную последовательность, включающую аминокислотную последовательность или состоящую из аминокислотной последовательности, выбранной из последовательностей в положениях 55-170 или в положениях 116-170 SEQ ID NO: 2 или по меньшей мере в одном ее иммуногенном домене; в положениях 45-161 или в положениях 107-161 SEQ ID NO: 4 или по меньшей мере в одном ее иммуногенном домене, в положениях 45-161 или в положениях 107-161 SEQ ID NO: 6 или по меньшей мере в одном ее иммуногенном домене, в положениях 36-152 или в положениях 98-152 SEQ ID NO: 8 или по меньшей мере в одном ее иммуногенном домене, в положениях 1034-1152 или в положениях 1098-1152 SEQ ID NO: 11 или по меньшей мере в одном ее иммуногенном домене, в положениях 31-86 SEQ ID NO: 14 или по меньшей мере в одном ее иммуногенном домене, в положениях 1-56 SEQ ID NO: 15 или по меньшей мере в одном ее иммуногенном домене, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей.
Внеклеточный домен (ED) MUC1, используемый в описанном здесь гибридном белке, может представлять собой ED или его часть, которая включает по меньшей мере один иммуногенный домен, происходящий от любого белка MUC1, а в одном из аспектов изобретения от человеческого белка MUC1. В одном из аспектов изобретения ED MUC1, используемый в гибридном белке согласно изобретению, имеет аминокислотную последовательность, включающую аминокислотную последовательность или состоящую из аминокислотной последовательности, выбранной из последовательностей в положениях 116-173 SEQ ID NO: 2 или по меньшей мере в одном ее иммуногенном домене, в положениях 107-164 SEQ ID NO: 4 или по меньшей мере в одном ее иммуногенном домене, в положениях 107-164 SEQ ID NO: 6 или по меньшей мере в одном ее иммуногенном домене, в положениях 98-155 SEQ ID NO: 8 или по меньшей мере в одном ее иммуногенном домене, в положениях 1098-1155 SEQ ID NO: 11 или по меньшей мере в одном ее иммуногенном домене, в положениях 32-89 SEQ ID NO: 14 или по меньшей мере в одном ее иммуногенном домене, в положениях 2-59 SEQ ID NO: 15 или по меньшей мере в одном ее иммуногенном домене, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей.
Один домен MUC1 с варьирующимся числом тандемных повторов (VNTR), используемый в описанном здесь гибридном белке, может представлять собой домен MUC1, происходящий от любого белка MUC1, а в одном из аспектов изобретения, от человеческого белка MUC1. В одном из аспектов изобретения, домен VNTR MUC1, используемый в гибридном белке согласно изобретению, имеет аминокислотную последовательность, включающую аминокислотную последовательность или состоящую из аминокислотной последовательности, выбранной из последовательностей в положениях 126-145 SEQ ID NO: 11, любых смежных 20 аминокислот в положениях 61-1020 SEQ ID NO: 11 или любых смежных 20 аминокислот в положениях 126-965 SEQ ID NO: 11; SEQ ID NO: 12 (включая любой полиморфизм в SEQ ID NO: 12, как описано выше), любых смежных 20 аминокислот в положениях 90-130 SEQ ID NO: 14, любых смежных 20 аминокислот в положениях 60-100 SEQ ID NO: 15, или соответствующей последовательности VNTR, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей.
Трансмембранный (TM) домен MUC1, используемый в описанном здесь гибридном белке, может представлять собой ТМ-домен или его часть, которая включает по меньшей мере один иммуногенный домен, происходящий от любого белка MUC1, а в одном из аспектов изобретения от человеческого белка MUC1. В одном из аспектов изобретения ТМ-домен MUC1, используемый в гибридном белке согласно изобретению, имеет аминокислотную последовательность, включающую аминокислотную последовательность или состоящую из аминокислотной последовательности, выбранной из последовательностей в положениях 174-201 SEQ ID NO: 2 или по меньшей мере в одном ее иммуногенном домене, в положениях 165-192 SEQ ID NO: 4 или по меньшей мере в одном ее иммуногенном домене, в положениях 165-192 SEQ ID NO: 6 или по меньшей мере в одном ее иммуногенном домене, в положениях 156-183 SEQ ID NO: 8 или по меньшей мере в одном ее иммуногенном домене, в положениях 1156-1183 SEQ ID NO: 11 или по меньшей мере в одном ее иммуногенном домене, в положениях 131-158 SEQ ID NO: 14 или по меньшей мере в одном ее иммуногенном домене, в положениях 101-128 SEQ ID NO: 15 или по меньшей мере в одном ее иммуногенном домене, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей.
Цитоплазматический (CD) домен MUC1, используемый в описанном здесь гибридном белке, может представлять собой СD или его часть, которая включает по меньшей мере один иммуногенный домен, происходящий от любого белка MUC1, а в одном из аспектов изобретения от человеческого белка MUC1. В одном из аспектов изобретения СD MUC1, используемый в гибридном белке согласно изобретению, имеет аминокислотную последовательность, включающую аминокислотную последовательность или состоящую из аминокислотной последовательности, выбранной из последовательностей в положениях 202-273 SEQ ID NO: 2 или по меньшей мере в одном ее иммуногенном домене, в положениях 193-264 SEQ ID NO: 4 или по меньшей мере в одном ее иммуногенном домене, в положениях 193-264 SEQ ID NO: 6 или по меньшей мере в одном ее иммуногенном домене, в положениях 184-255 SEQ ID NO: 8 или по меньшей мере в одном ее иммуногенном домене, в положениях 1184-1255 SEQ ID NO: 11 или по меньшей мере в одном ее иммуногенном домене, в положениях 159-230 SEQ ID NO: 14 или по меньшей мере в одном ее иммуногенном домене, в положениях 129-200 SEQ ID NO: 15 или по меньшей мере в одном ее иммуногенном домене, в положениях 7-78 или в положениях 79-150 или в положениях 151-222 SEQ ID NO: 17 или по меньшей мере в одном ее иммуногенном домене; в положениях 1-72 или в положениях 73-144 или в положениях 145-216 SEQ ID NO: 18 или в ее иммуногенном домене, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей.
В одном из вариантов осуществления изобретения гибридный белок, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, включает нижеследующие антигены MUC1 в соответствующем порядке от N-конца до C-конца: (1) часть домена SEA MUC1 и внеклеточный домен (ED) MUC1, который содержит большую часть или весь ED MUC1; (2) по меньшей мере два домена VNTR; (3) трансмембранный домен MUC1; и (4) цитоплазматический (CD) домен MUC1. В одном из вариантов осуществления изобретения гибридный белок включает нижеследующие антигены MUC1 в соответствующем порядке от N-конца до C-конца: (1) сигнальную последовательность MUC1; (2) часть домена SEA MUC1 и внеклеточный домен (ED) MUC1, который содержит большую часть или весь ED MUC1; (3) по меньшей мере два домена VNTR; (4) трансмембранный домен MUC1; и (5) цитоплазматический (CD) домен MUC1. Гибридный белок согласно изобретению может включать дополнительные или альтернативные элементы, а именно, N-концевые и/или C-концевые пептиды, которые повышают уровень экспрессии или стабильность или способствуют экспрессии или стабильности гибридного белка и/или коротких промежуточных линкерных последовательностей (например, пептидов, состоящих из 1, 2, 3, 4, или 5 аминокислот), расположенных между сегментами гибридного белка, и/или позволяют идентифицировать и/или осуществлять очистку указанных гибридных белков или указанных линкерных последовательностей, которые могут быть использованы для введения сайтов рестриктирующих ферментов в целях облегчения клонирования, то есть сайтов расщепления для фагосомных протеаз хозяина, в целях ускорения процессинга белка или антигена и для последующих манипуляций с этими конструкциями. Такие элементы подробно описаны ниже.
В одном из примеров такой гибридный белок, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, содержит или включает нижеследующие антигены MUC1 в соответствующем порядке от N- до C-конца:
(1) внеклеточный домен (ED) MUC1, который может быть присоединен у N-конца на расстоянии от одной, двух, трех, четырех, пяти или более фланкирующих аминокислот от части, не являющейся ED домена SEA, который расположен выше ED в белке дикого типа, где указанный ED-сегмент включает аминокислотную последовательность или состоит из этой аминокислотной последовательности, выбранной из последовательности в положениях 116-173 SEQ ID NO: 2; в положениях 107-164 SEQ ID NO: 4; в положениях 107-164 SEQ ID NO: 6; в положениях 98-155 SEQ ID NO: 8; в положениях 1098-1155 SEQ ID NO: 11; в положениях 32-89 SEQ ID NO: 14; в положениях 2-59 SEQ ID NO: 15; или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей;
(2) по меньшей мере два домена VNTR, где каждый домен VNTR содержит аминокислотную последовательность или состоит из аминокислотной последовательности, выбранной из последовательности в положениях 126-145 SEQ ID NO: 11, любых смежных 20 аминокислот в положениях 61-1020 SEQ ID NO: 11 или любых смежных 20 аминокислот в положениях 126-965 SEQ ID NO: 11; SEQ ID NO: 12 (включая любой полиморфизм в SEQ ID NO: 12, как описано выше), любых смежных 20 аминокислот в положениях 90-130 SEQ ID NO: 14, любых смежных 20 аминокислот в положениях 60-100 SEQ ID NO: 15, или соответствующей последовательности VNTR, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей;
(3) трансмембранный домен (TM) MUC1, где ТМ-домен содержит аминокислотную последовательность или состоит из этой аминокислотной последовательности, выбранной из последовательности в положениях 174-201 SEQ ID NO: 2, в положениях 165-192 SEQ ID NO: 4, в положениях 165-192 SEQ ID NO: 6, в положениях 156-183 SEQ ID NO: 8, в положениях 1156-1183 SEQ ID NO: 11, в положениях 131-158 SEQ ID NO: 14, в положениях 101-128 SEQ ID NO: 15, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей; и
(4) цитоплазматический (CD) домен MUC1, где CD содержит аминокислотную последовательность или состоит из аминокислотной последовательности, выбранной из последовательности в положениях 202-273 SEQ ID NO: 2, в положениях 193-264 SEQ ID NO: 4, в положениях 193-264 SEQ ID NO: 6, в положениях 184-255 SEQ ID NO: 8, в положениях 1184-1255 SEQ ID NO: 11, в положениях 159-230 SEQ ID NO: 14, в положениях 129-200 SEQ ID NO: 15, в положениях 7-78 или в положениях 79-150 или в положениях 151-222 SEQ ID NO: 17; в положениях 1-72 или в положениях 73-144 или в положениях 145-216 SEQ ID NO: 18, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей.
В одном из аспектов этого варианта осуществления изобретения, гибридный белок, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, содержит аминокислотную последовательность SEQ ID NO: 14 или SEQ ID NO: 15 или состоит из этих последовательностей. SEQ ID NO: 14 включает нижеследующие антигены MUC1 в следующем порядке от N-конца до C-конца: (1) сигнальную последовательность MUC1 (в положениях 1-30 SEQ ID NO: 14); (2) сегмент SEA/ED MUC1 (в положениях 31-89 SEQ ID NO: 14); (3) сегмент VNTR, содержащий два домена VNTR (в положениях 90-130 SEQ ID NO: 14); (4) TM-домен MUC1 (в положениях 131-158 SEQ ID NO: 14); (5) CD MUC1 (в положениях 159-230 SEQ ID NO: 14); и (6) гексапептидную гистидиновую метку (в положениях 231-236 SEQ ID NO: 14). SEQ ID NO: 14 кодируется нуклеотидной последовательностью, представленной SEQ ID NO: 13. SEQ ID NO: 15 включает нижеследующие антигены MUC1 в следующем порядке от N-конца до C-конца: (1) сегмент SEA/ED MUC1 (в положениях 1-59 SEQ ID NO: 15); (2) сегмент VNTR, содержащий два домена VNTR (в положениях 60-100 SEQ ID NO: 15); (3) ТМ-домен MUC1 (в положениях 101-128 SEQ ID NO: 15); и (4) CD MUC1 (в положениях 129-200 SEQ ID NO: 15). Гибридный белок SEQ ID NO: 14 или SEQ ID NO: 15 включает, но необязательно, N-концевой пептид, который представляет собой синтетический N-концевой пептид, сконструированный для сообщения резистентности к расщеплению протеосомой и стабилизации экспрессии гибридного белка, представленного SEQ ID NO: 21, или N-концевой пептид, происходящий от дрожжевой лидерной последовательности альфа, такой как SEQ ID NO: 19 или SEQ ID NO: 20, или другой N-концевой пептид, который может быть использован в описанной здесь иммунотерапевтической композиции на основе дрожжей. Кроме того, один или более линкерных пептидов, состоящих из одной, двух, трех или более аминокислот, таких как линкер, состоящий из двух аминокислот Thr-Ser, могут быть, но необязательно, встроены между сегментами гибридного белка. Гексагистидиновая метка у C-конца гибридного белка также является необязательной.
В одном из вариантов осуществления изобретения гибридный белок, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, включает указанные ниже антигены MUC1 в следующем порядке от N-конца до C-конца: (1) по меньшей мере два домена VNTR; и (2) часть домена SEA MUC1 и внеклеточный домен (ED) MUC1, который включает большую часть или весь ED MUC1. Такой гибридный белок может включать дополнительные части области MUC1-N, фланкирующие домены VNTR. Такой гибридный белок не содержит полноразмерной субъединицы MUC1-N.
В другом варианте осуществления изобретения гибридный белок, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, включает указанные ниже антигены MUC1 в следующем порядке от N-конца до C-конца: (1) первый цитоплазматический домен (CD) MUC1; (2) второй цитоплазматический домен (CD) MUC1; и (3) третий цитоплазматический домен (CD) MUC1. В одном из вариантов осуществления изобретения указанный гибридный белок может включать дополнительные цитоплазматические домены MUC1. В одном из вариантов осуществления изобретения по меньшей мере один из СD MUC1 происходят от источника, отличающегося от источника, от которого происходят другие СD MUC1 (например, один СD MUC1 происходит от первого человеческого белка MUC1, а другой СD MUC1 происходит от второго белка MUC1, где последовательности первого и второго СD MUC1 могут отличаться друг от друга). В одном из вариантов осуществления изобретения этот гибридный белок присоединен к N-концу с сигнальной последовательностью MUC1. В другом варианте осуществления изобретения этот гибридный белок может включать N-концевые и/или C-концевые пептиды, которые повышают уровень экспрессии или стабильность, либо способствуют повышению экспрессии или стабильности гибридного белка и/или коротких промежуточных линкерных последовательностей (например, пептидов, состоящих из 1, 2, 3, 4, или 5 аминокислот), расположенных между сегментами гибридного белка, и/или позволяют идентифицировать и/или осуществлять очистку указанных гибридных белков или указанных линкерных последовательностей, которые могут быть использованы для введения сайтов рестриктирующих ферментов в целях облегчения клонирования, то есть сайтов расщепления для фагосомных протеаз хозяина, в целях ускорения процессинга белка или антигена и для последующих манипуляций с этими конструкциями.
В одном из примеров такой гибридный белок, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, содержит или включает нижеследующие антигены MUC1 в соответствующем порядке от N- до C-конца:
(1) первый цитоплазматический (CD) домен MUC1, где CD содержит аминокислотную последовательность или состоит из аминокислотной последовательности, выбранной из последовательности в положениях 202-273 SEQ ID NO: 2, в положениях 193-264 SEQ ID NO: 4, в положениях 193-264 SEQ ID NO: 6, в положениях 184-255 SEQ ID NO: 8, в положениях 1184-1255 SEQ ID NO: 11, в положениях 159-230 SEQ ID NO: 14, в положениях 129-200 SEQ ID NO: 15, в положениях 7-78 или в положениях 79-150 или в положениях 151-222 SEQ ID NO: 17; в положениях 1-72 или в положениях 73-144 или в положениях 145-216 SEQ ID NO: 18, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей;
(2) второй цитоплазматический (CD) домен MUC1, где CD содержит аминокислотную последовательность или состоит из аминокислотной последовательности, выбранной из последовательности в положениях 202-273 SEQ ID NO: 2, в положениях 193-264 SEQ ID NO: 4, в положениях 193-264 SEQ ID NO: 6, в положениях 184-255 SEQ ID NO: 8, в положениях 1184-1255 SEQ ID NO: 11, в положениях 159-230 SEQ ID NO: 14, в положениях 129-200 SEQ ID NO: 15, в положениях 7-78 или в положениях 79-150 или в положениях 151-222 SEQ ID NO: 17; в положениях 1-72 или в положениях 73-144 или в положениях 145-216 SEQ ID NO: 18, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей;
(3) третий цитоплазматический (CD) домен MUC1, где CD содержит аминокислотную последовательность или состоит из аминокислотной последовательности, выбранной из последовательности в положениях 202-273 SEQ ID NO: 2, в положениях 193-264 SEQ ID NO: 4, в положениях 193-264 SEQ ID NO: 6, в положениях 184-255 SEQ ID NO: 8, в положениях 1184-1255 SEQ ID NO: 11, в положениях 159-230 SEQ ID NO: 14, в положениях 129-200 SEQ ID NO: 15, в положениях 7-78 или в положениях 79-150 или в положениях 151-222 SEQ ID NO: 17; в положениях 1-72 или в положениях 73-144 или в положениях 145-216 SEQ ID NO: 18, или соответствующей последовательности, происходящей от другого белка MUC1, такого как другой человеческий белок MUC1, или из аминокислотной последовательности, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из этих аминокислотных последовательностей.
В одном из аспектов этого варианта осуществления изобретения, гибридный белок, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, включает аминокислотную последовательность SEQ ID NO: 17 или SEQ ID NO: 18 или состоит из указанных последовательностей. SEQ ID NO: 17 включает нижеследующие антигены MUC1 в соответствующем порядке от N- до C-конца: (1) синтетический пептид, представленный SEQ ID NO: 21 (в положениях 1-6 SEQ ID NO: 17); (2) первый СD MUC1 (в положениях 7-78 SEQ ID NO: 17); (3) второй СD MUC1 (в положениях 79-150 SEQ ID NO: 17); (4) третий СD MUC1 (в положениях 151-222 SEQ ID NO: 17); и (5) гексагистидиновую метку (в положениях 223-228 SEQ ID NO: 17). SEQ ID NO: 17 кодируется нуклеотидной последовательностью, представленной SEQ ID NO: 16. SEQ ID NO: 18 включает нижеследующие антигены MUC1 в соответствующем порядке от N- до C-конца: (1) первый СD MUC1 (в положениях 1-72 SEQ ID NO: 18); (2) второй СD MUC1 (в положениях 73-144 SEQ ID NO: 18); (3) третий СD MUC1 (в положениях 145-216 SEQ ID NO: 18). Гибридный белок SEQ ID NO: 17 или SEQ ID NO: 18 включает, но необязательно, N-концевой пептид, который представляет собой синтетический N-концевой пептид, сконструированный для сообщения резистентности к расщеплению протеосомой и стабилизации экспрессии гибридного белка, представленного SEQ ID NO: 21, или N-концевой пептид, происходящий от дрожжевой лидерной последовательности альфа, такой как SEQ ID NO: 19 или SEQ ID NO: 20, или другой N-концевой пептид, который может быть использован в описанной здесь иммунотерапевтической композиции на основе дрожжей. Кроме того, один или более линкерных пептидов, состоящих из 1-3 или более аминокислотных линкерных последовательностей, состоящих из одной, двух, трех или более аминокислот, таких как линкер, состоящий из двух аминокислот Thr-Ser, могут быть, но необязательно, встроены между сегментами гибридного белка. Гексагистидиновая метка у C-конца гибридного белка также является необязательной.
Антиген MUC1, используемый в настоящем изобретении, также включает белки, имеющие аминокислотную последовательность, которая по меньшей мере на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности любого из описанных здесь белков, доменов, гибридных белков или антигенов MUC1 по всей длине белка или по отношению к его определенному фрагменту или домену (например, иммунологическому домену или функциональному домену (домену по меньшей мере с одной биологической активностью)), который образует часть белка. Так, например, домен описанного здесь белка MUC1 включает сигнальную последовательность, домен VNTR, домен SEA, внеклеточный домен (ED), TM-домен и/или цитоплазматический домен (CD). Иммунологический домен подробно описан выше. Описанными здесь гибридными белками MUC1 являются белки, представленные SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 17 и SEQ ID NO: 18. В соответствии с этим, антиген MUC1, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, включает антиген MUC1, содержащий аминокислотную последовательность или состоящий из аминокислотной последовательности, такой как любая из SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 17 и SEQ ID NO: 18; аминокислотная последовательность, которая по меньшей мере приблизительно на 95%, 96%, 97%, 98% или 99% идентична любой из из последовательностей SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 17 и SEQ ID NO: 18, и/или соответствующая последовательность, происходящая от другого белка MUC1 (например, гибридного белка, в котором один или более сегментов гибрида происходят от соответствующих последовательностей другого белка MUC1 или от последовательности белка-агониста MUC1, где различия между описанными здесь последовательностями могут быть незначительными).
Соответствующие части любого из белков или доменов MUC1, происходящих или продуцированных из последовательности или источников, отличающихся от описанных здесь источников, в частности, из последовательностей или источников, присутствующих у животных одного и того же вида, могут быть непосредственно использованы для создания гибридных белков, имеющих структуру, аналогичную структуре описанных здесь гибридных белков, или ту же самую структуру. Так, например, соответствующая последовательность в указанном человеческом белке MUC1, происходящем от любого источника, который соответствует положениям 1034-1152 SEQ ID NO: 11, может быть легко идентифицирована с применением простых средств или способов выравнивания последовательностей. Поэтому последовательности с небольшими и/или консервативными отличиями от описанных здесь последовательностей полностью входят в объем настоящего изобретения.
В некоторых аспектах изобретения в белок дикого типа или в эталонный белок MUC1 могут быть внесены одна, две, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать или более аминокислотных инсерций, делеций и/или замен, при условии, что полученный белок MUC1, если он используется в качестве антигена в иммунотерапевтической композиции на основе дрожжей-MUC1 согласно изобретению, будет вырабатывать иммунный ответ против нативного белка MUC1, то есть белка MUC1 дикого типа или эталонного белка MUC1, где указанный ответ может быть усиленным, ослабленным иммунным ответом или, в основном, аналогичным иммунным ответом. Так, например, настоящее изобретение включает применение антигенов-агонистов MUC1, которые могут содержать один или более Т-клеточных эпитопов, в которые были внесены мутации для усиления Т-клеточного ответа на агонист MUC1, например, благодаря повышению авидности или аффинности эпитопа по отношению к молекуле MHC или к Т-клеточному рецептору, который распознает эпитоп при условии МНС-рестриктированной презентации. Следовательно, агонисты MUC1 могут повышать активность или эффективность Т-клеточного ответа на нативный MUC1, экспрессируемый опухолевыми клетками. Различные Т-клеточные эпитопы MUC1, включая эпитопы-агонисты, описаны в патенте США №6546643; в патенте США №7118738; в патенте США №7342094; в патенте США №7696306; и в публикации заявки на патент США №2008/0063653, и любой один или более из этих эпитопов могут быть введены в антиген MUC1 согласно изобретению, например, путем добавления, делеции или замены одной или более аминокислот в описанной здесь последовательности для приведения этой последовательности в соответствие с известной последовательностью эпитопа в этом(этих) положении(ях).
Примеры антигенов-агонистов MUC1 описаны в настоящей заявке (см. примеры 3 и 4). В одном из вариантов осуществления изобретения антиген-агонист MUC1, используемый в настоящем изобретении, содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или все 11 нижеследующих замен, где положения замен соответствуют положениям MUC1 дикого типа, представленным под регистрационным номером NP_001191214 (хотя те же самые или эквивалентные положения могут быть легко идентифицированы в любой другой последовательности MUC1 дикого типа): T93, A161, P162, G169, S170, T171, A392, C406, T444, D445 или S460. В одном из вариантов осуществления изобретения антиген-агонист MUC1, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, содержит аминокислотную последовательность SEQ ID NO: 23 или SEQ ID NO: 25 или состоит из этих аминокислотных последовательностей. SEQ ID NO: 23 включает нижеследующие антигены MUC1 в соответствующем порядке от N- до C-конца: (1) сигнальную последовательность MUC1 (в положениях 1-30 SEQ ID NO: 23); (2) сегмент SEA/ED MUC1 (в положениях 31-89 SEQ ID NO: 23); (3) сегмент VNTR, содержащий два домена VNTR (в положениях 90-130 SEQ ID NO: 23); (4) TM-домен MUC1 (в положениях 131-158 SEQ ID NO: 23); (5) CD MUC1 (в положениях 159-230 SEQ ID NO: 23); (6) эпитоп-агонист MUC1 (в положениях 231-246 SEQ ID NO: 23) и (7) гексапептидную гистидиновую метку (в положениях 247-252 SEQ ID NO: 23). SEQ ID NO: 23 кодируется нуклеотидной последовательностью, представленной SEQ ID NO: 22 (оптимизированной по кодонам для экспрессии в дрожжах). Сигнальная последовательность MUC1 (в положениях 1-30 SEQ ID NO: 23) может быть заменена другой N-концевой последовательностью, сконструированной в целях сообщения резистентности к разложению протеосомой и/или в целях стабилизации экспрессии, например, пептидом, представленным SEQ ID NO: 21, или N-концевым пептидом, происходящим от лидерной дрожжевой последовательности альфа, такой как SEQ ID NO: 19 или SEQ ID NO: 20. Гексагистидиновая С-концевая метка является необязательной, но она облегчает идентификацию и/или очистку белка. SEQ ID NO: 23, по сравнению с антигеном MUC1 в SEQ ID NO: 14 или SEQ ID NO: 15, содержит нижеследующие аминокислотные замены, введенные для создания ряда эпитопов-агонистов (замены в положениях SEQ ID NO: 23 даны в соответствии с положениями в последовательности MUC1 дикого типа, представленной под регистрационным номером NP 001191214): A96Y (положение 161 в MUC1 дикого типа), P97L (положение 162 в MUC1 дикого типа), G104V (положение 169 в MUC1 дикого типа), S105Y (положение 170 в MUC1 дикого типа), T106L (положение 171 в MUC1 дикого типа), A147Y (положение 392 в MUC1 дикого типа), C161V (положение 406 в MUC1 дикого типа), T199L (положение 444 в MUC1 дикого типа), D200F (положение 445 в MUC1 дикого типа), S215Y (положение 460 в MUC1 дикого типа) и T239L (положение 93 в MUC1 дикого типа).
SEQ ID NO: 25 включает нижеследующие антигены MUC1 в соответствующем порядке от N- до C-конца: (1) лидерную последовательность альфа-фактора, представленную здесь как SEQ ID NО:19 (в положениях 1-89 SEQ ID NO: 25); (2) линкерную последовательность Thr-Ser (в положениях 90-91 SEQ ID NO: 25); (3) полноразмерный белок-агонист MUC1, соответствующий белку дикого типа, за исключением введенных 11 эпитопов-агонистов (в положениях 92-566 SEQ ID NO: 25); и (7) гексапептидную гистидиновую метку (в положениях 567-572 SEQ ID NO: 25). SEQ ID NO: 25 кодируется нуклеотидной последовательностью, представленной SEQ ID NO: 24 (оптимизированной по кодонам для экспрессии в дрожжах). Лидерная последовательность альфа (в положениях 1-89 SEQ ID NO: 25) может быть заменена другой N-концевой последовательностью, сконструированной в целях сообщения резистентности к разложению протеосомой и/или в целях стабилизации экспрессии, например, пептидом, представленным SEQ ID NO: 21, или N-концевым пептидом, происходящим от другой лидерной дрожжевой последовательности альфа, такой как SEQ ID NO: 20, или сигнальной последовательностью MUC1. Гексагистидиновая С-концевая метка является необязательной, но она облегчает идентификацию и/или очистку белка. Последовательность в GI-6106, по сравнению с белком MUC1 дикого типа, используемым в качестве матрицы, содержит нижеследующие аминокислотные замены, введенные для создания ряда эпитопов-агонистов (замены в положениях SEQ ID NO: 25 даны в соответствии с положениями в последовательности MUC1 дикого типа, представленной под регистрационным номером NP_001191214): T184L (положение 93 в MUC1 дикого типа), A232Y (положение 161 в MUC1 дикого типа), P233L (положение 162 в MUC1 дикого типа), G240V (положение 169 в MUC1 дикого типа), S241Y (положение 170 в MUC1 дикого типа), T242L (положение 171 в MUC1 дикого типа), A483Y (положение 392 в MUC1 дикого типа), C497V (положение 406 в MUC1 дикого типа), T535L (положение 444 в MUC1 дикого типа), D536F (положение 445 в MUC1 дикого типа) и S551Y (положение 460 в MUC1 дикого типа).
В соответствии с этим антиген-агонист MUC1, используемый в иммунотерапевтической композиции на основе дрожжей согласно изобретению, включает антиген MUC1, содержащий нижеследующие последовательности или состоящий из этих последовательностей, таких как SEQ ID NO: 23 или SEQ ID NO: 25, или MUC1-специфические последовательности в этих более крупных гибридных белках, или аминокислотная последовательность, которая по меньшей мере приблизительно на 95%, 96%, 97%, 98% или 99% идентична любой из последовательностей SEQ ID NO: 23, SEQ ID NO: 25 или MUC1-специфической последовательности в этих более крупных гибридных белках, и/или соответствующая последовательность, происходящая от другого белка MUC1 (например, гибридного белка, в котором один или более сегментов гибрида происходят от соответствующих последовательностей другого белка MUC1, где различия между описанными здесь последовательностями могут быть незначительными).
Как обсуждалось выше, N-концевые экспрессионные последовательности и С-концевые метки, например, описанные выше для гибридных белков SEQ ID NO: 14, SEQ ID NO: 17, SEQ ID NO: 23 или SEQ ID NO: 25, являются необязательными, но они могут быть выбраны из нескольких описанных здесь других последовательностей, в целях повышения уровня экспрессии, повышения стабильности и/или для идентификации и/или очистки белка. Кроме того, многие различные промоторы, используемые в дрожжах, известны специалистам. Кроме того, по различным соображениям, между частями гибридного белка, содержащего антиген MUC1, могут быть введены короткие промежуточные линкерные последовательности (например, пептиды, состоящие из 1, 2, 3, 4 или 5 аминокислот), включая сайты рестриктирующих ферментов для облегчения клонирования, то есть, сайты расщепления для фагосомных протеаз хозяина, например, для ускорения процессинга белка или антигена и для последующих манипуляций с этими конструкциямии.
Белки, включая гибридные белки, которые используются в качестве компонента иммунотерапевтической композиции на основе дрожжей-MUC1 согласно изобретению, получают, но необязательно, с использованием антигенных конструкций, которые являются особенно подходящими для повышения уровня экспрессии или стабилизации экспрессии гетерологичных антигенов в дрожжах. В одном из вариантов осуществления изобретения нужный(е) антигенный(е) белок (белки) или пептид(ы) присоединяют у их амино-конца: (a) к специфическому синтетическому пептиду, который стабилизирует экспрессию гибридного белка в дрожжевом носителе или предотвращает посттрансляционную модификацию экспрессированного гибридного белка (такие пептиды подробно описаны, например, в публикации заявки на патент США №2004-0156858 Al, опубликованной 12 августа 2004 г., которая во всей своей полноте вводится в настоящее описание посредством ссылки); (b) по меньшей мере к части эндогенного дрожжевого белка, где указанный партнер по связыванию способствует повышению стабильности экспрессии белка в дрожжах и/или предотвращает посттрансляционную модификацию белков дрожжевыми клетками (такие белки также подробно описаны, например, в публикации заявки на патент США №2004-0156858 Al, см. выше); и/или (c) по меньшей мере к части дрожжевого белка, которая индуцирует экспрессию гибридного белка на поверхности дрожжей (например, белка Aga, более подробно описанного ниже). Кроме того, настоящее изобретение включает, но необязательно, применение пептидов, присоединенных к С-концу антиген-кодирующей конструкции, в частности, для отбора и идентификации белка. Такими пептидами являются, но не ограничиваются ими, любой синтетический или природный пептид, такой как пептидная метка (например, 6×His или гексапептид) или любая другая короткая эпитопная метка. Могут быть использованы пептиды, присоединенные к С-концу антигена согласно изобретению, с добавлением или без добавления N-концевых пептидов, обсуждаемых выше, и наоборот.
В одном из вариантов осуществления изобретения синтетический пептид, используемый в гибридном белке, экспрессируемом в дрожжах, присоединен к N-концу антигена, где указанный пептид, состоящий по меньшей мере из двух аминокислот в положениях, гетерологичных по отношению к указанному антигену, стабилизирует экспрессию гибридного белка в дрожжевом носителе или предупреждает посттрансляционную модификацию экспрессированного гибридного белка. Синтетический пептид и N-концевая часть антигена, взятые вместе, образуют гибридный белок, в котором: (1) аминокислотным остатком в положении 1 гибридного белка является метионин (то есть, первой аминокислотой в синтетическом пептиде является метионин); (2) аминокислотный остаток в положении 2 гибридного белка не является глицином или пролином (то есть, вторая аминокислота в синтетическом пептиде не является глицином или пролином); (3) ни одна из аминокислот в положениях 2-6 гибридного белка не является метионином (то есть, аминокислоты в положениях 2-6 части синтетического пептида или белка, в том случае, если синтетический пептид имеет длину менее чем 6 аминокислот, не являются метионином); и (4) ни одна из аминокислот в положениях 2-6 гибридного белка не является лизином или аргинином (то есть, аминокислоты в положениях 2-6 части синтетического пептида или белка, в том случае, если синтетический пептид имеет длину менее чем 5 аминокислот, не являются лизином или аргинином). Синтетический пептид может иметь длину до 2 аминокислот, но в одном из аспектов изобретения, он имеет длину 2-6 аминокислот (включая 3, 4, 5 аминокислот) и может иметь длину, в целых числах, более чем 6 аминокислот и приблизительно до 200 аминокислот, 300 аминокислот, 400 аминокислот, 500 аминокислот или более.
В одном из вариантов осуществления изобретения гибридный белок содержит аминокислотную последовательность M-X2-X3-X4-X5-X6, где M представляет собой метионин; X2 представляет собой любую аминокислоту, кроме глицина, пролина, лизина или аргинина; X3 представляет собой любую аминокислоту, кроме метионина, лизина или аргинина; X4 представляет собой любую аминокислоту, кроме метионина, лизина или аргинина; X5 представляет собой любую аминокислоту, кроме метионина, лизина или аргинина; и X6 представляет собой любую аминокислоту, кроме метионина, лизина или аргинина. В одном из вариантов осуществления изобретения остаток X6 является пролином. Репрезентативная синтетическая последовательность, которая повышает стабильность экспрессии антигена в дрожжевых клетках и/или предупреждает посттрансляционную модификацию белка в дрожжах, включает последовательность M-A-D-E-A-P (представленную здесь как SEQ ID NO: 21). Этот партнер по связыванию, помимо того, что он повышает стабильность экспрессируемого белка, очевидно, не оказывает негативного влияния на иммунный ответ против иммунизирующего антигена в данной конструкции. Кроме того, синтетические гибридные пептиды могут быть сконструированы так, чтобы они содержали эпитоп, который может распознаваться селективным агентом, таким как антитело.
В одном из вариантов осуществления изобретения антиген MUC1 присоединен у N-конца к дрожжевому белку, такому как препро-последовательность альфа-фактора (также называемую здесь сигнальной лидерной последовательностью альфа-фактора, аминокислотная последовательность которой представлена здесь последовательностью SEQ ID NO: 19 или SEQ ID NO: 20). Специалистам известны и другие препро-последовательности альфа-фактора дрожжей, и применение этих последовательностей входит в объем настоящего изобретения.
В одном из аспектов изобретения дрожжевой носитель модифицируют для экспрессии антигена или для обеспечения доставки или транслокации экспрессированного белкового продукта, частично или полностью, на поверхность дрожжевого носителя (внеклеточная экспрессия). Одним из способов для достижения цели настоящего изобретения в соответствии с этим его аспектом является использование спейсера для локализации одного или более белков на поверхности дрожжевого носителя. Так, например, этот спейсер можно использовать для создания гибрида белка антигена(ов) или другого представляющего интерес белка с белком, который доставляет антиген(ы) или другой представляющий интерес белок к клеточной стенке дрожжей. Так, например, один из таких белков, который может быть использован для доставки других белков, представляет собой дрожжевой белок (например, белок клеточной стенки 2 (cwp2), Aga2, Pir4 или Flo1), который обеспечивает доставку антигена(ов) или другого представляющего интерес белка к клеточной стенке дрожжей так, чтобы такой антиген или другой белок локализовался на поверхности дрожжей. Для получения спейсера могут быть использованы белки, не являющиеся дрожжевыми белками, однако, для получения спейсера именно от такого белка, наиболее предпочтительно, чтобы вырабатываемый иммуногенный ответ был направлен против антигена-мишени, а не против спейсерного белка. Так, например, если для получения спейсера используются другие белки, то такой белок не должен вырабатывать сильный иммунный ответ на сам спейсерный белок, то есть он не должен подавлять иммунный ответ на антиген(ы)-мишень(и). Специалист должен сделать так, чтобы иммунный ответ на спейсерный белок был незначительным по сравнению с иммунным ответом на антиген(ы)-мишень(и). Спейсеры могут быть сконструированы так, чтобы они содержали сайты расщепления (например, сайты расщепления протеазой), что позволит легко удалить антиген или выделить его из дрожжей, если это необходимо. При этом может быть применен любой известный метод определения степени иммунных ответов (например, продуцирование антител, анализы на лизис клеток и т.п.), и такие методы хорошо известны специалистам.
Другим способом позиционирования антигена(ов)-мишени(ей) или других белков на поверхности дрожжей является использование сигнальных последовательностей, таких как гликозилфосфатидилинозит (GPI) для заякоривания мишени на стенке дрожжевой клетки. Альтернативно, такое позиционирование может быть осуществлено путем присоединения сигнальных последовательностей, которые направляют антиген(ы) или другие представляющие интерес белки на секреторный путь посредством их транслокации в эндоплазматический ретикулум (ER), так, чтобы этот антиген связывался с белком, связанным с клеточной стенкой (например, cwp).
В одном из аспектов изобретения спейсерный белок представляет собой дрожжевой белок. Дрожжевой белок может состоять приблизительно из 2-800 аминокислот. В одном из вариантов осуществления изобретения дрожжевой белок состоит приблизительно из 10-700 аминокислот. В другом варианте осуществления изобретения дрожжевой белок состоит приблизительно из 40-600 аминокислот. В другом своем варианте настоящее изобретение включает дрожжевой белок, имеющий длину по меньшей мере в 250 аминокислот, по меньшей мере в 300 аминокислот, по меньшей мере в 350 аминокислот, по меньшей мере в 400 аминокислот, по меньшей мере в 450 аминокислот, по меньшей мере в 500 аминокислот, по меньшей мере в 550 аминокислот, по меньшей мере в 600 аминокислот или по меньшей мере в 650 аминокислот. В одном из вариантов осуществления изобретения дрожжевой белок имеет длину по меньшей мере в 450 аминокислот. Для оптимизации экспрессии антигена на поверхности, если это необходимо, следует также принять во внимание, должна ли комбинация антигена и спейсера экспрессироваться в виде мономера, димера или тримера, или даже в виде большего числа субъединиц, соединенных вместе. Использование мономеров, димеров, тримеров и т.п. позволяет достичь соответствующего пространственного расположения или укладки антигена, которые способствовали бы к такому размещению определенной части антигена, если не всего антигена, на поверхности дрожжевого носителя, которое сообщало бы этому носителю большую иммуногенность.
Использование дрожжевых белков может приводить к стабилизации экспрессии гибридных белков в дрожжевом носителе, к предупреждению посттрансляционной модификации экспрессируемого гибридного белка и/или к доставке гибридного белка в конкретный компартмент дрожжей (например, для экспрессии на поверхности дрожжевых клеток). Для направления на дрожжевой секреторный путь используются репрезентативные дрожжевые белки, которыми являются, но не ограничиваются ими: Aga (включая, но не ограничиваясь ими, Aga1 и/или Aga2); SUC2 (дрожжевая инвертаза); сигнальная лидерная последовательность альфа-фактора; CPY; Cwp2p для локализации и удерживания белков в клеточной стенке; гены BUD для локализации на почкующейся дрожжевой клетке во время начальной фазы образования дочерней клетки; Flo1p; Pir2p и Pir4p.
Для доставки белка в другие части дрожжевого носителя, или для его удерживания и/или стабилизации в этих других частях дрожжевого носителя, например, в цитозоле, в митохондриях, в эндоплазматическом ретикулуме или в ядре, могут быть использованы и другие последовательности. Примерами подходящих дрожжевых белков, которые могут быть использованы в любых описанных выше вариантах осуществления изобретения, являются, но не ограничиваются ими, TK, AF, SEC7; фосфоенолпируваткарбоксикиназа PCK1, фосфоглицерокиназа PGK и триозофосфатизомераза ТPI, генные продукты, необходимые для репрессируемой экспрессии этих белков в присутствии глюкозы и для локализации в цитозоле; белки теплового шока SSA1, SSA3, SSA4, SSC1, экспрессия которых индуцируется после тепловой обработки клеток и которые становятся более термостабильными после такой обработки; митохондриальный белок CYC1 для доставки в митрохондрии; ACT1.
В настоящем изобретении рассматриваются способы продуцирования дрожжевых носителей и экспрессии, объединения и/или ассоциации дрожжевых носителей с антигенами и/или с другими белками и/или с агентами, представляющими интерес с точки зрения получения иммунотерапевтических композиций на основе дрожжей.
В соответствии с настоящим изобретением используемый здесь термин «комплекс дрожжевой носитель-антиген» или «комплекс дрожжи-антиген», по существу относится к любой ассоциации дрожжевого носителя с антигеном, и этот термин может употребляться как синоним термина «иммунотерапевтическая композиция на основе дрожжей», если такая композиция используется для вырабатывания иммунного ответа, описанного выше. Такая ассоциация включает экспрессию антигена дрожжами (рекомбинантными дрожжами), введение антигена в дрожжи, физическое присоединение антигена к дрожжам и смешивание дрожжей и антигена вместе, например, в буфере или в другом растворе или препарате. Комплексы такого типа подробно описаны ниже.
В одном из вариантов осуществления изобретения дрожжевые клетки, используемые для получения дрожжевого носителя, трансфицируют гетерологичной молекулой нуклеиновой кислоты, кодирующей белок (например, антиген) так, чтобы такой белок экспрессировался дрожжевой клеткой. Такие дрожжи также называются здесь рекомбинантными дрожжами или рекомбинантным дрожжевым носителем. Кроме того, дрожжевые клетки могут быть получены с использованием фармацевтически приемлемого наполнителя и введены непосредственно пациенту, и могут быть сохранены для последующего введения, либо они могут быть загружены в дендритные клетки в виде интактных клеток. Дрожжевыми клетками могут быть также «убитые» клетки, либо эти клетки могут быть дериватизированы, например, посредством образования дрожжевых сферопластов, цитопластов, «теней» или субклеточных частиц, и любые из этих производных могут быть сохранены, введены пациенту или загружены в дендритные клетки. Дрожжевые сферопласты могут быть также непосредственно трансфицированы рекомбинантной молекулой нуклеиновой кислоты (например, сначала сферопласт продуцируют из цельных дрожжей, а затем трансфицируют) для получения рекомбинантного сферопласта, экспрессирующего антиген. Дрожжевые клетки или дрожжевые сферопласты, которые рекомбинантно экспрессируют антиген(ы), могут быть использованы для продуцирования дрожжевого носителя, содержащего дрожжевые цитопласты, дрожжевые «тени» или дрожжевые мембранные частицы или частицы дрожжевых клеточных стенок или их фракции.
В общих чертах, дрожжевой носитель и антиген(ы) и/или другие агенты могут быть ассоциированы друг с другом любым описанным здесь методом. В одном из аспектов изобретения дрожжевой носитель загружают вовнутрь клетки вместе с антигеном(ами) и/или агентом(ами). В другом аспекте изобретения антиген(ы) и/или агент(ы) ковалентно или нековалентно связан(ы) с дрожжевым носителем. В другом аспекте изобретения дрожжевой носитель и антиген(ы) и/или агент(ы) были ассоциированы друг с другом путем смешивания. В другом аспекте изобретения, и в одном из вариантов осуществления изобретения, антиген(ы) и/или агент(ы) рекомбинантно экспрессируются дрожжевым носителем или дрожжевыми клетками или дрожжевыми сферопластами, от которых происходит дрожжевой носитель.
Число антигенов и/или других белков, продуцируемых дрожжевым носителем согласно изобретению, представляет собой любое число антигенов и/или других белков, которое может быть фактически продуцировано дрожжевым носителем, и обычно такое число составляет по меньшей мере от 1 и приблизительно до 6 или более антигенов и/или других белков, включая приблизительно от 2 до 6 таких антигенов и/или других белков.
Экспрессия антигена или другого белка в дрожжевом носителе согласно изобретению может быть достигнута методами, известными специалистам. Вкратце, молекулу нуклеиновой кислоты, кодирующую по меньшей мере один нужный антиген иди другой белок, встраивают в экспрессионный вектор так, чтобы молекула нуклеиновой кислоты была функционально присоединена к последовательности регуляции транскрипции для осуществления конститутивной или регулируемой экспрессии этой молекулы нуклеиновой кислоты при ее трансформации в дрожжевую клетку-хозяина. Молекулы нуклеиновой кислоты, кодирующие один или более антигенов и/или других белков, могут присутствовать в одном или более экспрессионных векторах, функционально присоединенных к одной или более последовательностям регуляции экспрессии. Особенно ценными последовательностями регуляции экспрессии являются последовательности, которые регулируют инициацию транскрипции, такие как промотор или вышерасположенные последовательности активации. В настоящем изобретении могут быть использованы любые подходящие дрожжевые промоторы, и ряд таких промоторов известен специалистам. Промоторами для экспрессии в Saccharomyces cerevisiae являются, но не ограничиваются ими, промоторы генов, кодирующих нижеследующие дрожжевые белки: алкоголь-дегидрогеназу I (ADH1) или II (ADH2), CUP1, фосфоглицераткиназу (PGK), триозофосфатизомеразу (TPI), трансляционный фактор элонгации EF-1 альфа (TEF2), глицеральдегид-3-фосфатдегидрогеназу (GAPDH; также называемую TDH3 для триозофосфатдегидрогеназы), галактокиназу (GAL1), галактозо-1-фосфат-уридил-трансферазу (GAL7), UDP-галактозо-эпимеразу (GAL 10), цитохром cl (CYC1), белок Sec7 (SEC7) и кислую фосфатазу (PHО5), включая гибридные промоторы, такие как промоторы ADH2/GAPDH и CYC1/GAL10, и промотор ADH2/GAPDH, который индуцируется при низких концентрациях глюкозы в клетках (например, приблизительно от 0,1 до 0,2 процента), а также промотор CUP1 и промотор TEF2. Аналогичным образом, известен ряд вышерасположенных последовательностей активации (UAS), также называемых энхансерами. Вышерасположенными последовательностями активации экспрессии в Saccharomyces cerevisiae являются, но не ограничиваются ими, UAS генов, кодирующих нижеследующие белки: PCK1, TPI, TDH3, CYC1, ADH1, ADH2, SUC2, GAL1, GAL7 и GAL10, а также другие UAS, активируемые генным продуктом GAL4, а в одном из аспектов изобретения используются UAS ADH2. Поскольку UAS ADH2 активируется генным продуктом ADR1, то она может быть более предпочтительной для сверхэкспрессии гена ADR1, если гетерологичный ген функционально присоединен к UAS ADH2. Последовательностями терминации транскрипции для экспрессии в Saccharomyces cerevisiae являются последовательности терминации транскрипции генов α-фактора, GAPDH и CYC1.
Последовательностями регуляции транскрипции для экспрессии генов в метилтрофных дрожжах являются области регуляции транскрипции генов, кодирующих алкоголь-оксидазу и формиат-дегидрогеназу.
Трансфекция молекулы нуклеиновой кислоты в дрожжевую клетку согласно изобретению может быть осуществлена любым методом, используемым для введения молекулы нуклеиновой кислоты в клетку, и такими методами являются, но не ограничиваются ими, диффузия, активный транспорт, обработка в ультразвуковой бане, электропорация, микроинжекция, липофекция, адсорбция и слияние протопластов. Трансфицированные молекулы нуклеиновой кислоты могут быть интегрированы в дрожжевую хромосому или сохранены на внехромосомных векторах с применением методов, известных специалистам. Примеры дрожжевых носителей, несущих такие молекулы нуклеиновой кислоты, подробно описаны в настоящей заявке. Как обсуждалось выше, дрожжевые цитопласты, дрожжевые «тени» и дрожжевые мембранные частицы или препараты клеточных стенок могут быть также получены рекомбинантным методом путем трансфекции интактных дрожжевых микроорганизмов или дрожжевых сферопластов нужными молекулами нуклеиновой кислоты для продуцирования в них антигена, с последующей модификацией этих микроорганизмов или сферопластов известными методами, обычно применяемыми для продуцирования цитопластов, дрожжевых «теней» или субклеточного мембранного экстракта дрожжей или их фракций, содержащих нужные антигены или другие белки.
Условиями для эффективного продуцирования рекомбинантных дрожжевых носителей и экспрессии антигена и/или другого белка дрожжевым носителем является среда, благоприятная для культивирования дрожжевого штамма. Такой благоприятной средой обычно является водная среда, содержащая усвояемые источники углевода, азота и фосфата, а также соответствующие соли, минералы, металлы и другие микроэлементы, такие как витамины и факторы роста. Такая среда может содержать комплексы питательных веществ, либо она может представлять собой минимальную среду определенного состава. Дрожжевые штаммы согласно изобретению могут быть культивированы в различных контейнерах, включая, но не ограничиваясь ими, биореакторы, колбы Эрленмейера, тест-пробирки, микротитрационные планшеты и чашки Петри. Культивирование осуществляют при температуре, рН и содержании кислорода, подходящих для данного дрожжевого штамма. Такие условия культивирования хорошо известны среднему специалисту в данной области (см., например, Guthrie et al. (eds.), 1991, Methods in Enzymology, vol. 194, Academic Press, San Diego). Так, например, в соответствии с одним из протоколов, жидкие культуры, содержащие подходящую среду, могут быть инокулированы культурами сбраживающих микроорганизмов, полученными из планшетов, и/или культурами сбраживающих микроорганизмов, содержащих иммунотерапевтические композиции на основе дрожжей-MUC1, а затем эти культуры могут быть культивированы приблизительно в течение 20 часов при 30°C, с перемешиванием при 250 об/мин. Затем первичные культуры могут быть размножены, если это необходимо, с получением более крупных культур. Экспрессия белка из векторов, которыми были трансформированы дрожжи (например, экспрессия MUC1), может быть конститутивной, если используемым промотором является конститутивный промотор, либо она может быть индуцирована путем добавления соответствующих компонентов в целях создания благоприятных условий для промотора, если используемым промотором является индуцибельный промотор (например, добавления сульфата меди в случае промотора CUP1). В случае индуцибельного промотора, индуцирование экспрессии белка может быть инициировано после выращивания культуры до соответствующей клеточной плотности, которая может составлять приблизительно 0,2 Y.U./мл или более.
Одним из неограничивающих примеров среды, подходящей для культивирования иммунотерапевтической композиции на основе дрожжей-MUC1 согласно изобретению, является среда U2. Среда U2 содержит следующие компоненты: 15 г/л глюкозы, 6,7 г/л азотистого основания дрожжей, содержащего сульфат аммония, и 0,04 мг/мл (каждого) гистидина, триптофана и аденина, а также 0,06 мг/мл лейцина. Другим неограничивающим примером среды, подходящей для культивирования иммунотерапевтической композиции на основе дрожжей-MUC1 согласно изобретению, является среда UL2. Среда UL2 содержит следующие компоненты: 15 г/л глюкозы, 6,7 г/л азотистого основания дрожжей, содержащего сульфат аммония, и 0,04 мг/мл (каждого) гистидина, триптофана и аденина.
В некоторых вариантах осуществления изобретения дрожжи культивируют в условиях с нейтральным pH. Используемый здесь общий термин «нейтральный pH» означает pH в пределах приблизительно от pH 5,5 до pH 8, а в одном из аспектов изобретения приблизительно от pH 6 до 8. Специалисту в данной области известно, что при измерении рН на рН-метре допустимы небольшие отклонения (например, в пределах десятых или сотых долей). Так, например, культивирование дрожжевых клеток при нейтральном рН означает, что эти дрожжевые клетки культивируют при нейтральном рН в течение большего периода времени их нахождения в культуре. В одном из вариантов осуществления изобретения дрожжи культивируют в среде, поддерживаемой при pH по меньшей мере 5,5 (то есть, pH культуральной среды не должен снижаться до значения ниже 5,5). В другом аспекте изобретения дрожжи культивируют в среде, поддерживаемой при pH приблизительно 6, 6,5, 7, 7,5 или 8. В одном из аспектов изобретения нейтральный pH поддерживают с использованием буфера, подходящего для получения забуференной культуры или культуральной среды. Культивирование дрожжей при нейтральном pH стимулирует некоторые биологические процессы, которые являются желательными при использовании дрожжей в качестве носителей для иммуномодуляции. Так, например, культивирование дрожжей при нейтральном pH обеспечивает хороший рост дрожжей без какого-либо негативного влияния на время образования клеток (например, не вызывает замедления времени удвоения клеток). Дрожжи могут продолжать свой рост до высокой плотности, не теряя при этом пластичности клеточных стенок. Культивирование при нейтральном pH позволяет получать дрожжи с пластичными клеточными стенками и/или дрожжи, которые являются более чувствительными к ферментам, гидролизующим клеточные стенки (например, к глюканазе) при всех значениях плотности клеток в культуре. Это свойство является желательным, поскольку дрожжи с гибкими клеточными стенками могут индуцировать различные другие или усиленные иммунные ответы по сравнению с дрожжами, которые были культивированы в более кислотных условиях, что обусловлено, например, стимуляцией секреции цитокинов антигенпрезентирующими клетками, которые обеспечивают фагоцитоз дрожжей (например, цитокинов TH1-типа, включая, но не ограничиваясь ими, IFN-γ, интерлейкин-12 (IL-12) и IL-2, а также провоспалительных цитокинов, таких как IL-6). Кроме того, с применением таких методов культивирования достигается лучшая доступность к антигенам, локализованным в клеточной стенке. В другом аспекте изобретения культивирование при нейтральном pH для некоторых антигенов позволяет высвобождать связанный с дисульфидом антиген при обработке дитиотреитолом (DTT), что было бы невозможно в случае культивирования антиген-экспрессирующих дрожжей в среде с более низким рН (например, pH 5). В одном из неограничивающих примеров условий культивирования дрожжей при нейтральном pH в соответствии с настоящим изобретением, описанная выше среда UL2 является забуференной, например, 4,2 г/л бис-трисом.
Авторами настоящего изобретения было продемонстрировано, что иммунотерапевтические композиции на основе дрожжей-MUC1 согласно изобретению, культивированные в условиях при нейтральном рН, являются более сильными активаторами дендритных клеток, а также активируют MUC1-специфические Т-клетки и продуцируют более высокие уровни IFN-γ, чем те же самые иммунотерапевтические композиции на основе дрожжей-MUC1, культивированные в стандартных условиях (при которых не поддерживается нейтральный pH) (см. примеры).
В одном из вариантов осуществления изобретения регуляция уровня гликозилирования дрожжей применяется для регуляции экспрессии антигенов в дрожжах, в частности, на их поверхности. Уровень гликозилирования дрожжей может влиять на иммуногенность и антигенность антигена, в частности, если он экспрессируется на поверхности, поскольку сахарные группы имеют тенденцию к увеличению объема. Так, например, присутствие сахарных групп на поверхности дрожжей и их влияние на трехмерное пространство вокруг антигена(ов)-мишени(ей) должно рассматриваться как модуляция дрожжей согласно изобретению. Если это необходимо, то для снижения или повышения уровня гликозилирования может быть применен любой метод. Так, например, можно использовать отобранный дрожжевой мутантный штамм, который имеет низкий уровень гликозилирования (например, мутанты mnnl, ochl и mnn9), либо такое гликозилирование может быть элиминировано путем мутации в последовательностях акцептора гликозилирования на антигене-мишени. Альтернативно, могут быть использованы дрожжи с пониженным уровнем гликозилирования, например, дрожжи Pichia. Дрожжи могут быть также обработаны методами, которые позволяют снижать уровень гликозилирования или изменять характер гликозилирования.
В одном из вариантов осуществления изобретения, в качестве альтернативы рекомбинантной экспрессии антигена или другого белка в дрожжевом носителе, этот дрожжевой носитель внутриклеточно нагружают белком или пептидом, либо углеводами или другими молекулами, которые служат в качестве антигена и/или иммуномодулирующих агентов или модификаторов биологического ответа согласно изобретению. Затем дрожжевой носитель, который в своих клетках уже содержит антиген и/или другие белки, может быть введен индивидууму или загружен в носитель, такой как дендритная клетка. Пептиды и белки могут быть введены непосредственно в дрожжевые носители согласно изобретению известными методами, такими как диффузия, активный транспорт, слияние липосом, электропорация, фагоцитоз, циклы замораживания-оттаивания и обработка в ультразвуковой бане. Дрожжевыми носителями, в которые могут быть непосредственно введены пептиды, белки, углеводы или другие молекулы, являются интактные дрожжи, а также сферопласты, «тени» или цитопласты, в которые могут быть введены антигены и другие агенты после их получения. Альтернативно, в интактные дрожжи могут быть введены антиген и/или агент, а затем из этих дрожжей могут быть получены сферопласты, «тени», цитопласты или субклеточные частицы. В дрожжевой носитель может быть введено любое число антигенов и/или других агентов, и в этом варианте изобретения может быть введено по меньшей мере 1, 2, 3, 4 или любое целое число до сотен или тысяч антигенов и/или других агентов, например, таких, которые должны обеспечивать загрузку микроорганизма или его частей.
В другом варианте осуществления изобретения антиген и/или другой агент физически присоединяют к дрожжевому носителю. Физическое присоединение антигена и/или другого агента к дрожжевому носителю может быть осуществлено любыми подходящими методами, например, методами ковалентного и нековалентного связывания, которые включают, но не ограничиваются ими, химическое перекрестное связывание антигена и/или другого агента с внешней поверхностью дрожжевого носителя или биологическое связывание антигена и/или другого агента с внешней поверхностью дрожжевого носителя, например, с использованием антитела или другого партнера по связыванию. Химическое перекрестное связывание может быть осуществлено, например, методами, включающими связывание посредством глутаральдегида, фотоаффинное мечение, обработку карбодиимидами, обработку химическими соединениями, способными образовывать дисульфидные связи, и обработку другими стандартными перекрестно сшивающими агентами, известными специалистам. Альтернативно, химическое соединение может быть подвергнуто контакту с дрожжевым носителем, что будет приводить к изменению заряда липидного бислоя дрожжевой мембраны или состава клеточной стенки, так, чтобы внешняя поверхность дрожжей была легко доступна для присоединения антигенов и/или других агентов, имеющих конкретные зарядные свойства, или для связывания с этими антигенами и/или другими агентами. Нацеливающие агенты, такие как антитела, связывающие пептиды, растворимые рецепторы и другие лиганды, могут быть также введены в антиген в виде гибридного белка, либо они могут быть как-либо иначе ассоциированы с антигеном для связывания этого антигена с дрожжевым носителем.
Если антиген или другой белок экспрессируется на поверхности дрожжей или физически связывается с такой поверхностью, то в одном из аспектов изобретения, для оптимизации экспрессии антигена или другого белка на поверхности дрожжей или для оптимизации их содержания на этой поверхности, могут быть тщательно подобраны спейсеры. Размер спейсера(ов) может зависеть от количества антигена или другого белка, которое необходимо для его связывания на поверхности дрожжей. Таким образом, в зависимости от используемого(ых) антигена(ов) или другого(их) белка(ов), специалист может самостоятельно выбрать спейсер, который будет создавать соответствующее пространство для положения данного антигена или другого белка на поверхности дрожжей. В одном из вариантов осуществления изобретения спейсер представляет собой дрожжевой белок длиной по меньшей мере в 450 аминокислот. Такие спейсеры подробно обсуждались выше.
В еще одном варианте осуществления изобретения дрожжевой носитель и антиген или другой белок ассоциируются друг с другом по более пассивному неспецифическому или нековалентному механизму связывания, такому как легкое помешивание дрожжевого носителя и антигена или другого белка вместе в буфере или в другой подходящей композиции (например, в смеси).
В одном из вариантов осуществления изобретения интактные дрожжи (с экспрессируемыми гетерологичными антигенами или другими белками или без них) могут быть культивированы или обработаны в целях получения препаратов дрожжевых клеточных стенок, мембранных дрожжевых частиц или фрагментов дрожжей (то есть, неинтактных дрожжей), и в некоторых вариантах осуществления изобретения такие дрожжевые фрагменты могут быть получены или введены с другими композициями, которые включают антигены (например, ДНК-вакцины, вакцины на основе белковых субъединиц, «убитых» или инактивированных патогенов, и вакцины на основе вирусных векторов), для усиления иммунных ответов. Так, например, для разделения дрожжей на части, которые могут быть использованы в качестве адъюванта, эти дрожжи могут быть подвергнуты ферментативной обработке, химической обработке или физическому воздействию (например, механическому фрагментированию или обработке ультразвуком).
В одном из вариантов осуществления изобретения дрожжевыми носителями, используемыми в настоящем изобретении, являются «убитые» или инактивированные дрожжевые носители. Цитолиз или инактивация дрожжей могут быть осуществлены любым из подходящих методов, известных специалистам. Так, например, стандартным методом инактивации дрожжей является термоинактивация, и если это необходимо, то специалист в данной области может провести мониторинг структурных изменений антигена-мишени в дрожжах стандартными методами. Альтернативно, могут быть применены и другие методы инактивации дрожжей, такие как методы химической обработки и методы воздействия электрическим током, радиоактивным излучением или УФ-излучением. См., например, методику, описанную в стандартном руководстве по культивированию дрожжей, таком как Methods of Enzymology, Vol. 194, Cold Spring Harbor Publishing (1990). Любые стратегии инактивации дрожжей должны проводиться с учетом вторичной, третичной или четвертичной структуры антигена-мишени для сохранения такой структуры в целях оптимизации его иммуногенности.
Дрожжевые носители могут быть использованы для получения иммунотерапевтических композиций или продуктов на основе дрожжей-MUC1 согласно изобретению с применением технологии, известной специалистам. Так, например, дрожжевые носители могут быть осушены путем лиофилизации. Препараты, содержащие дрожжевые носители, могут быть также получены путем упаковки дрожжей в виде брикета или таблетки, которые обычно используются в хлебопекарном производстве или в пивоварении. Кроме того, дрожжевой носитель может быть смешан с фармацевтически приемлемыми наполнителями, такими так изотонический буфер, который может быть введен хозяину или в клетку хозяина. Примерами таких наполнителей являются вода, физиологический раствор, раствор Рингера, раствор декстрозы, раствор Хэнкса и другие физиологически сбалансированные водно-солевые растворы. Могут быть также использованы и безводные носители, такие как жирные масла, кунжутное масло, этилолеат или триглицериды. Другими подходящими препаратами являются суспензии, содержащие агенты, повышающие вязкость, такие как натрий-содержащая карбоксиметилцеллюлоза, сорбит, глицерин или декстран. Наполнители могут также содержать небольшое количество добавок, таких как вещества, повышающие изотоничность и химическую стабильность. Примерами буферов являются фосфатный буфер, бикарбонатный буфер и трис-буфер, а примерами консервантов являются тимерозал, м- или o-крезол, формалин и бензиловый спирт. Стандартные препараты могут представлять собой жидкие препараты для инъекций или твердые вещества, которые могут распределяться в соответствующей жидкости с образованием суспензии или раствора для инъекций. Таким образом, в нежидком препарате, наполнитель может содержать, например, декстрозу, альбумин человеческой сыворотки и/или консерванты, к которым до их введения могут быть добавлены стерильная вода или физиологический раствор.
В одном из вариантов осуществления изобретения композиция может включать дополнительные агенты, которые могут также представлять собой соединения-модификаторы биологического ответа, либо они могут образовывать такие агенты/модификаторы. Так, например, дрожжевой носитель может быть трансфицирован или загружен по меньшей мере одним антигеном и по меньшей мере одним агентом/модификатором биологического ответа, либо композиция согласно изобретению может быть введена в комбинации по меньшей мере с одним агентом/модификатором биологического ответа. Модификаторами биологического ответа являются адъюванты и другие соединения, которые могут модулировать иммунные ответы и которые могут называться иммуномодулирующими соединениями, а также соединения, модифицирующие биологическую активность другого соединения или агента, например, иммунотерапевтические композиции на основе дрожжей, причем такая биологическая активность не ограничивается системными иммунными эффектами. Некоторые иммуномодулирующие соединения могут стимулировать протективный иммунный ответ, а некоторые соединения могут подавлять неблагоприятный иммунный ответ, и выбор иммуномодулирующего соединения, используемого в комбинации с данной иммунотерапевтической композицией на основе дрожжей, может зависеть, по меньшей мере частично, от заболевания или патологического состояния, подвергаемого лечению или предупреждению, и/или от конкретного индивидуума, подвергаемого лечению. Некоторые модификаторы биологического ответа преимущественно усиливают клеточно-опосредуемый иммунный ответ, а некоторые из них преимущественно усиливают гуморальный иммунный ответ (то есть, могут стимулировать иммунный ответ, при котором наблюдается повышение клеточно-опосредуемого иммунитета по сравнению с гуморальным иммунитетом, или наоборот). Некоторые модификаторы биологического ответа обладают одним или несколькими общими свойствами с иммунотерапевтическими композициями на основе дрожжей, либо усиливают или дополняют биологические свойства иммунотерапевтических композиций на основе дрожжей. Специалистам известен ряд методов, которые могут быть применены для оценки уровня стимуляции или подавления иммунных ответов, для дифференциации клеточно-опосредуемых иммунных ответов от гуморальных иммунных ответов, а также для дифференциации клеточно-опосредуемого ответа одного типа от клеточно-опосредуемого ответа другого типа (например, TH17-ответа от TH1-ответа).
Агентами/модификаторами биологического ответа, используемыми в настоящем изобретении, могут быть, но не ограничиваются ими, цитокины, хемокины, гормоны, производные липидов, пептиды, белки, полисахариды, низкомолекулярные лекарственные средства, антитела и их антигенсвязывающие фрагменты (включая, но не ограничиваясь ими, антитела против цитокинов, антитела против рецепторов цитокинов, антитела против хемокинов), витамины, полинуклеотиды, молекулы, связывающиеся с нуклеиновой кислотой, аптамеры и модуляторы роста. Некоторыми подходящими агентами являются, но не ограничиваются ими, IL-1 или агонисты IL-1 или IL-1R, анти-IL-1 антитела или другие антагонисты IL-1; IL-6 или агонисты IL-6 или IL-6R, анти-IL-6 антитела или другие антагонисты IL-6; IL-12 или агонисты IL-12 или IL-12R, анти-IL-12 антитела или другие антагонисты IL-12; IL-17 или агонисты IL-17 или IL-17R, анти-IL-17 антитела или другие антагонисты IL-17; IL-21 или агонисты IL-21 или IL-21R, анти-IL-21 антитела или другие антагонисты IL-21; IL-22 или агонисты IL-22 или IL-22R, анти-IL-22 антитела или другие антагонисты IL-22; IL-23 или агонисты IL-23 или IL-23R, анти-IL-23 антитела или другие антагонисты IL-23; IL-25 или агонисты IL-25 или IL-25R, анти-IL-25 антитела или другие антагонисты IL-25; IL-27 или агонисты IL-27 или IL-27R, анти-IL-27 антитела или другие антагонисты IL-27; интерферон типа 1 (включая IFN-α) или агонисты или антагонисты интерферона типа I или его рецептора; интерферон типа II (включая IFN-γ) или агонисты или антагонисты интерферона типа II или его рецептора; анти-CD40 антитело, CD40L, белок, кодируемый геном активации лимфоцитов 3 (LAG3), и/или IMP321 (T-клеточный иммуностимулирующий фактор, происходящий от растворимой формы LAG3), анти-CTLA-4 антитело (например, для высвобождения анергических T-клеток); Т-клеточные костимуляторы (например, анти-CD137 антитело, анти-CD28 антитело, анти-CD40 антитело); алемтузумаб (например, CamPath®), денилейкин-дифтитокс (например, ONTAK®); анти-CD4 антитело; анти-CD25 антитело; анти-PD-1 антитело, анти-PD-L1 антитело, анти-PD-L2 антитело; агенты, блокирующие FOXP3 (например, блокирующие активность/уничтожающие регуляторные CD4+/CD25+-T-клетки); лиганд Flt3, имихимод (Aldara™), гранулоцитарный-макрофагальный колониестимулирующий фактор (GM-CSF); гранулоцитарный колониестимулирующий фактор (G-CSF), сарграмостим (Leukine®); гормоны, включая, но не ограничиваясь ими, пролактин и гормон роста; агонисты Toll-подобных рецепторов (TLR), включая, но не ограничиваясь ими, агонисты TLR-2, агонисты TLR-4, агонисты TLR-7 и агонисты TLR-9; антагонисты TLR, включая, но не ограничиваясь ими, антагонисты TLR-2, антагонисты TLR-4, антагонисты TLR-7 и антагонисты TLR-9; противовоспалительные средства и иммуномодуляторы, включая, но не ограничиваясь ими, ингибиторы COX-2 (например, Celecoxib, NSAIDS), глюкокортикоиды, статины и талидомид и его аналоги, включая IMiD™ (которые являются структурными и функциональными аналогами талидомида (например, REVLIMID® (леналидомид), ACTIMID® (помалидомид)); провоспалительные агенты, такие как грибковые или бактериальные компоненты или любые провоспалительные цитокины или хемокины; иммунотерапевтические вакцины, включая, но не ограничиваясь ими, вакцины на основе вирусов, вакцины на основе бактерий или вакцины на основе антител; и любые другие иммуномодуляторы, усилители иммунного ответа, провоспалительные средства, провоспалительные агенты и любые агенты, которые модулируют число, уровень активации и/или выживаемость антигенпрезентирующих клеток или TH17-клеток, TH1-клеток и/или клеток Treg. В настоящем изобретении рассматривается любая комбинация таких агентов, и любые указанные агенты, объединенные с иммунотерапевтической композиции на основе дрожжей или вводимые вместе с указанной композицией в соответствии с протоколом (например, одновременно, последовательно или в каком-либо другом формате), представляют собой композицию, входящую в объем настоящего изобретения. Такие агенты хорошо известны специалистам. Эти агенты могут быть использованы отдельно или в комбинации с другими описанными здесь агентами.
Агентами могут быть агонисты и антагонисты указанного белка, пептида или их доменов. Используемый здесь термин «агонист» означает любое соединение или агент, включая, но не ограничиваясь ими, небольшие молекулы, белки, пептиды, антитела, агенты, связывающиеся с нуклеиновой кислотой, и другие агенты, которые связываются с рецептором или с лигандом и продуцируют или стимулируют ответ, а также агенты, имитирующие или усиливающие действие природного вещества, связывающегося с указанным рецептором или лигандом. Термин «антагонист» означает любое соединение или агент, включая, но не ограничиваясь ими, небольшие молекулы, белки, пептиды, антитела, агенты, связывающиеся с нуклеиновой кислотой, и другие агенты, которые блокируют, ингибируют или ослабляют действие агониста.
Композиции согласно изобретению могут дополнительно включать любые другие агенты или композиции, либо они могут быть введены вместе с указанными агентами или композициями (например, одновременно, последовательно или периодически) согласно протоколу, используемыми в целях предупреждения или лечения рака, либо они могут включать любые соединения или они могут введены вместе с указанными соединениями, используемыми в целях лечения или ослабления любого симптома рака, в частности, раковых заболеваний, ассоциированных с экспрессией или со сверхэкспрессией MUC1. Кроме того, композиции согласно изобретению могут быть использованы вместе с другими иммунотерапевтическими композициями, включая иммунотерапевтические композиции для профилактики и/или терапии. Дополнительными агентами, композициями или протоколами (например, протоколами терапии), которые могут быть использованы для лечения рака, являются, но не ограничиваются ими, химиотерапия, хирургическое удаление опухоли, лучевая терапия, трансплантация аллогенных или аутологичных стволовых клеток, Т-клеточный адоптивный перенос, иммунотерапия других типов, включая иммунотерапию на основе вирусного вектора и иммунотерапию с использованием гибрида «дендритные клетки/опухолевые клетки» и/или направленная противораковая терапия (например, терапия с использованием низкомолекулярных лекарственных средств, биологических средств или моноклональных антител, которые специфически нацелены на молекулы, участвующие в росте и прогрессировании опухоли, включая, но не ограничиваясь ими, селективные модуляторы эстрогеновых рецепторов (SERM), ингибиторы ароматазы, ингибиторы тирозинкиназы, ингибиторы серин/треонинкиназы, ингибиторы гистон-деацетилазы (HDAC), активаторы ретиноидного рецептора, стимуляторы апоптоза, ингибиторы ангиогенеза, ингибиторы поли(ADP-рибозо)полимеразы (PARP) или иммуностимуляторы). Любые из указанных дополнительных терапевтических средств могут быть введены, в соответствии с протоколом, до, во время, поочередно или после введения иммунотерапевтических композиций согласно изобретению или в различные периоды времени. Так, например, если указанную композицию вводят индивидууму в комбинации с химиотерапией или направленной противораковой терапией, то может оказаться желательным введение иммунотерапевтических композиций на основе дрожжей-MUC1 в «перерывы» между введением доз химиотерапевтических средств или средств для нацеленной противораковой терапии в целях достижения максимальной эффективности иммунотерапевтических композиций. Хирургическое удаление опухоли обычно проводят до введения иммунотерапевтической композиции на основе дрожжей-MUC1, однако, дополнительная или первичная хирургическая операция может быть осуществлена во время или после введения иммунотерапевтической композиции на основе дрожжей-MUC1.
Настоящее изобретение также включает набор, содержащий любые из описанных здесь композиций или любой из отдельных компонентов описанных здесь композиций. Наборы могут включать дополнительные реагенты и текстовые инструкции или указания по применению любой из композиций согласно изобретению для предупреждения или лечения рака, ассоциированного с экспрессией или сверхэкспрессией MUC1, или характеризующегося такой экспрессией или сверхэкспрессией.
Способы введения или применения композиций согласно изобретению
Иммунотерапевтические композиции на основе дрожжей-MUC1 согласно изобретению предназначены для предупреждения или лечения рака, ассоциированного с экспрессией или сверхэкспрессией MUC1, или характеризующегося такой экспрессией или сверхэкспрессией, включая предупреждение развития таких раковых заболеваний, прекращение их прогрессирования или излечение таких раковых заболеваний. Более конкретно, иммунотерапевтические композиции на основе дрожжей-MUC1 могут быть использованы для предупреждения, ингибирования или замедления развития MUC1-экспрессирующих опухолей и/или для предупреждения, ингибирования или замедления миграции опухолей и/или инвазии опухоли в другие ткани (метастазов) и/или, по существу, предупреждения или ингибирования прогрессирования рака у индивидуума. Иммунотерапевтические композиции на основе дрожжей-MUC1 могут быть также использованы для ослабления по меньшей мере одного симптома рака, например, уменьшения опухолевой нагрузки у индивидуума; ингибирования роста опухоли у индивидуума; увеличения продолжительности жизни индивидуума; и/или предупреждения и ингибирования прогрессирования рака, обратного развития раковой опухоли или замедления прогрессирования раковой опухоли у индивидуума.
Раковыми заболеваниями, которые поддаются лечению с применением композиций и способов согласно изобретению, являются любые раковые опухоли, которые экспрессируют или могут экспрессировать MUC1, или раковые опухоли, находящиеся поблизости от раковых опухолей, которые экспрессируют или могут экспрессировать MUC1, включая раковые опухоли эпителиальных тканей, и такими раковыми заболеваниями являются, но не ограничиваются ими, рак молочной железы, рак тонкого кишечника, рак желудка, рак почек, рак мочевого пузыря, рак матки, рак яичника, рак яичек, рак легких, рак толстой кишки, рак поджелудочной железы, рак предстательной железы, рак яичек и их метастазы. Кроме того, MUC1 экспрессируется или может экспрессироваться в раковых опухолях крови, таких как лимфома, лейкоз и миелома, включая, но не ограничиваясь ими, хронический лимфоцитарный лейкоз (ХЛЛ), множественную миелогенную лимфому (MMЛ), острый миелоидный лейкоз (ОМЛ), В-клетки, трансформированные вирусом Эпштейна-Барра (EBV), лимфому Беркитта и ходжкинскую лимфому.
В одном из аспектов изобретения MUC1 не детектируется в раковой опухоли индивидуума при первом введении композиции. Если MUC1 не детектируется в раковой опухоли индивидуума, то данный индивидуум может иметь раковое заболевание на ранней стадии, при котором экспрессия MUC1 еще не проявляется (например, на стадии I или на стадии II), или при котором экспрессия MUC1 еще не детектируется ни в одном случае (то есть, MUC1 может экспрессироваться на низком уровне, а может и не экспрессироваться, либо он может экспрессироваться в небольшом количестве опухолевых клеток, но пока еще не может быть обнаружен стандартными методами детектирования). Альтернативно, у индивидуума могут наблюдаться предраковые поражения или опухоли, либо у него может быть предрасположенность к развитию рака (например, определенная из анамнеза, по генетическим маркерам и т.п.). В этих аспектах изобретения развитие MUC1-экспрессирующих опухолевых клеток может быть предотвращено, замедлено или ингибировано с использованием иммунотерапевтической композиции на основе дрожжей-MUC1.
В другом аспекте изобретения экспрессия MUC1 детектируется или может детектироваться в раковой опухоли индивидуума при первом введении композиции. В этом аспекте изобретения у индивидуума может наблюдаться рак на стадии I, стадии II, стадии III или стадии IV. В этом аспекте изобретения использование иммунотерапевтической композиции на основе дрожжей-MUC1 приводит к снижению роста опухолей, к удалению опухолей, либо к замедлению или к прекращению роста опухолей, экспрессирующих MUC1, а также может приводить к уменьшению опухолевой нагрузки у индивидуума, к ингибированию роста MUC1-экспрессирующей опухоли и/или к увеличению продолжительности жизни индивидуума.
В другом своем варианте настоящее изобретение относится к способу лечения рака, в частности, MUC1-экспрессирующей раковой опухоли. Указанный способ включает введение индивидууму с MUC1-экспрессирующей раковой опухолью описанной здесь иммунотерапевтической композиции на основе дрожжей-MUC1, где указанная композиция включает: (a) дрожжевой носитель; и (b) раковый антиген, содержащий по меньшей мере один антиген MUC1. В одном из аспектов изобретения указанный способ позволяет снижать опухолевую нагрузку у пациента. В одном из аспектов изобретения указанный способ способствует увеличению продолжительности жизни пациента. В одном из аспектов изобретения указанный способ способствует ингибированию роста опухоли у индивидуума.
В одном из аспектов изобретения индивидууму дополнительно вводят по меньшей мере одно другое терапевтическое соединение или проводят соответствующий курс лечения рака в соответствии с протоколом. Такие терапевтические средства и протоколы подробно обсуждаются в описании настоящей заявки. Так, например, в одном из аспектов любого варианта осуществления изобретения, относящегося к описанным здесь способам согласно изобретению, если указанный индивидуум страдает раковым заболеванием (независимо от уровня детектируемой экспрессии MUC1 в опухолевых клетках), то такой индивидуум подвергается или был подвергнут другой противораковой терапии. Такая терапия может включать любую из схем терапевтического лечения или использование любого терапевтического соединения или агента, описанного выше, включая, но не ограничиваясь ими, химиотерапию, лучевую терапию, направленную противораковую терапию, хирургическое удаление опухоли, перенос стволовых клеток, терапию цитокинами, Т-клеточный адоптивный перенос и/или введение второй иммунотерапевтической композиции. В случае введения второй иммунотерапевтической композиции, такими композициями могут быть, но не ограничиваются ими, дополнительная иммунотерапевтическая композиция, применяемая в иммунотерапии с использованием дрожжей, в иммунотерапии с использованием рекомбинантного вируса (вирусных векторов, см., например, публикацию PCT № WO/00/34494), в терапии с использованием цитокинов, в терапии с использованием иммуностимуляторов (включая химиотерапию с использованием соединений, обладающих иммуностимулирующими свойствами), в терапии с использованием ДНК-вакцин, в иммунотерапии с использованием гибрида «дендритные клетки/опухолевые клетки» (см., например, публикацию PCT № WO/2009/062001), и другие иммунотерапевтические композиции.
В одном из аспектов изобретения вторая иммунотерапевтическая композиция содержит второй раковый антиген, который не является антигеном MUC1. Так, например, вторая иммунотерапевтическая композиция, используемая в комбинации с иммунотерапевтической композицией на основе дрожжей-MUC1, представляет собой иммунотерапевтическую композицию на основе дрожжей, содержащую второй раковый антиген, экспрессирующийся в опухоли одного и того же типа или в других опухолях у индивидуума, имеющего такую опухоль, или у индивидуума с риском развития такой опухоли. Такими раковыми антигенами являются, но не ограничиваются ими, один или более из таких антигенов, как карциноэмбриональный антиген (CEA), онкопротеин Ras с точковой мутацией, антиген Brachyury, EGFR, BCR-Abl, MART-1, MAGE-1, MAGE-3, GAGE, GP-100, MUC-2, обычные онкопротеины р53 и онкопротеины р53 с точковой мутацией, PSMA, тирозиназа, TRP-1 (gp75), NY-ESO-1, TRP-2, TAG72, KSA, CA-125, PSA, HER-2/neu/c-erb/B2, hTERT, p73, B-RAF, антиген, вызывающий аденоматозный кишечный полипоз (APC), Myc, белок фон Хиппеля-Линдау (VHL), Rb-1, Rb-2, андрогенный рецептор (AR), Smad4, MDR1, Flt-3, BRCA-1, BRCA-2, pax3-fkhr, ews-fli-1, HERV-H, HERV-K, TWIST, мезотелин, NGEP, модификации таких антигенов, варианты сплайсинга таких антигенов и агонисты эпитопов таких антигенов, а также комбинации таких антигенов и/или их иммуногенных доменов, модификаций, вариантов и/или агонистов эпитопов.
Используемый здесь термин «лечение рака» или любые производные (пермутации) этого словосочетания (например, «рак, подвергаемый лечению» и т.п.) обычно относится к введению композиции согласно изобретению после появления рака (например, после диагностики или обнаружения рака у индивидуума), где по меньшей мере одной целью терапевтического лечения (по сравнению с отсутствием такого лечения) является: снижение опухолевой нагрузки; ингибирование роста опухоли; увеличение продолжительности жизни индивидуума; замедление, ингибирование, прекращение или предупреждение начала развития метастазов рака (например, замедление, ингибирование, прекращение или предупреждение начала развития опухоли, миграции опухоли и/или инвазии опухоли в ткани, расположенные за пределами первичной раковой опухоли и/или других процессов, ассоциированных с метастатическим прогрессированием рака); замедление или прекращение прогрессирования первичной раковой опухоли; усиление иммунных ответов против опухоли; развитие стойких иммунных ответов против опухолевых антигенов; и/или улучшение общего состояния здоровья у индивидуума. Термин «предупреждать рак» или «предотвращать рак» или любые производные этих словосочетаний (например, «предупреждение рака» и т.п.) обычно относится к введению композиции согласно изобретению до возникновения рака, в случае детектирования предраковых клеток, или до возникновения рака на конкретной стадии или до обнаружения экспрессии опухолевого антигена в раковой опухоли (например, до детектирования экспрессии MUC1 в раковой опухоли), где по меньшей мере одной целью лечения (по сравнению с отсутствием такого лечения) является: предупреждение или замедление начала развития раковой опухоли, или, в случае возникновения рака после лечения, по меньшей мере ослабление тяжести ракового заболевания (например, снижение уровня роста опухоли, прекращение прогрессирования раковой опухоли, усиление иммунных ответов против раковой опухоли, ингибирование метастатических процессов и т.п.) или улучшение показателей состояния здоровья у индивидуума (например, увеличение продолжительности жизни индивидуума).
Настоящее изобретение включает доставку (введение, иммунизацию, вакцинацию) иммунотерапевтической композиции на основе дрожжей-MUC1 согласно изобретению пациенту или индивидууму. Способ введения может быть осуществлен ex vivo или in vivo, но обычно его проводят in vivo. Введение ex vivo означает осуществление отдельной стадии, проводимой в лаборатории без участия пациента, такой как введение композиции согласно изобретению в популяцию клеток (дендритных клеток), взятых у пациента в соответствующих условиях, так чтобы дрожжевой носитель, антиген(ы) и любые другие агенты или композиции были загружены в клетки; и возвращение этих клеток обратно в организм пациента. Терапевтическая композиция согласно изобретению может быть затем возвращена пациенту или введена пациенту любым подходящим способом введения.
Введение композиции может быть системным, в слизистую и/или в область, близкую к локализации сайта-мишени (например, в область локализации опухоли). Подходящие способы введения могут быть выбраны самим специалистом в зависимости от типа раковой опухоли или популяции клеток-мишеней или ткани. Различными приемлемыми способами введения являются, но не ограничиваются ими, внутривенное введение, внутрибрюшинное введение, внутримышечное введение, интранодальное введение, введение в коронарную артерию, внутриартериальное введение (например, в сонную артерию), подкожное введение, чрескожное введение, интратрахеальное введение, внутрисуставное введение, интравентрикулярное введение, ингаляция (например, аэрозоля), внутричерепное введение, интраспинальное введение, внутриглазное введение, внутриушное введение, интраназальное введение, пероральное введение, введение в легкие, введение через катетер и введение непосредственно в ткань. В одном из аспектов изобретения способами введения являются: внутривенное введение, внутрибрюшинное введение, подкожное введение, внутрикожное введение, интранодальное введение, внутримышечное введение, чрескожное введение, ингаляция, интраназальное введение, пероральное введение, внутриглазное введение, внутрисуставное введение, внутричерепное введение и интраспинальное введение. Парентеральное введение может включать внутрикожное введение, внутримышечное введение, внутрибрюшинное введение, интраплевральное введение, введение в легкие, внутривенное введение, подкожное введение, введение путем катетеризации предсердия и введение путем катетеризации вены. Внутриушное введение может включать закапывание в ухо; интраназальное введение может включать закапывание в нос или интразазальную инъекцию, а внутриглазное введение может включать закапывание в глаза. Аэрозольное введение (ингаляция) может быть также осуществлено стандартными методами (см., например, Stribling et al., Proc. Natl. Acad. Sci. USA 189:11277-11281, 1992). В одном из аспектов изобретения иммунотерапевтическую композицию на основе дрожжей-MUC1 согласно изобретению вводят подкожно. В одном из аспектов изобретения иммунотерапевтическую композицию на основе дрожжей-MUC1 согласно изобретению вводят непосредственно в ткань, окружающую опухоль.
В общих чертах, подходящая разовая доза иммунотерапевтической композиции на основе дрожжей-MUC1 представляет собой дозу, обеспечивающую эффективную доставку дрожжевого носителя и антигена MUC1 в клетки определенного типа, в ткани или в определенный участок тела пациента в количестве, эффективном для вырабатывания антигенспецифического иммунного ответа против одного или более антигенов или эпитопов MUC1 при введении указанной композиции один или несколько раз в течение соответствующего периода времени. Так, например, в одном из вариантов осуществления изобретения, разовая доза композиции на основе дрожжей-MUC1 согласно изобретению составляет приблизительно от 1×105 до 5×107 эквивалентов дрожжевых клеток на килограмм массы тела организма, в который вводят указанную композицию. Одна дрожжевая единица (Y.U.) составляет 1×107 дрожжевых клеток или эквивалентов дрожжевых клеток. В одном из аспектов изобретения разовая доза дрожжевого носителя согласно изобретению составляет приблизительно от 0,1 Y.U. (1×106 дрожжевых клеток или эквивалентов дрожжевых клеток) до приблизительно 100 Y.U. (1×109 клеток) на дозу (то есть, на организм), включая любую промежуточную дозу, с приращением 0,1×106 клеток (то есть, 1,1×106, 1,2×106, 1,3×106…). В одном из вариантов осуществления изобретения подходящая доза составляет от 1 Y.U. до 40 Y.U., а в одном из аспектов изобретения от 10 Y.U. до 40 Y.U. или от 10 Y.U. до 80 Y.U. В одном из вариантов осуществления изобретения дозы вводят в различные участки тела индивидуума, но в одно и то же время. Так, например, доза 40 Y.U. может быть введена путем инъекции доз 10 Y.U. в четыре различных участка тела индивидуума в одно и то же время. Настоящее изобретение включает введение определенного количества иммунотерапевтической композиции на основе дрожжей-MUC1 (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 Y.U. или более) в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более различных участков тела индивидуума в виде разовой дозы.
«Бустер-дозы» или «высокие дозы» терапевтической композиции вводят, например, в случае, если иммунный ответ против антигена является низким, или если необходимо вырабатывание иммунного ответа или индуцирования стойкого иммунного ответа против конкретного антигена или конкретных антигенов. Бустер-дозы могут быть введены приблизительно с перерывом в 1, 2, 3, 4, 5, 6, 7 или 8 недель или раз в месяц, раз в два месяца, раз в квартал, раз в год и/или с увеличением перерывов на небольшое время или на несколько лет после первого введения, в зависимости от состояния здоровья индивидуума, подвергаемого терапии, и цели терапии на данный период времени введения (например, профилактика, активная терапия, поддерживающая терапия). В одном из вариантов осуществления изобретения схема введения представляет собой схему, при которой дозы иммунотерапевтической композиции на основе дрожжей-MUC1 вводят по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более раз в течение определенного периода времени, составляющего несколько недель, месяцев или лет. В одном из вариантов осуществления изобретения дозы вводят еженедельно или раз в две недели всего 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более доз, а затем раз в две недели или раз в месяц, если это необходимо для достижения желаемого профилактического или терапевтического лечения рака. Дополнительные бустер-дозы могут быть затем введены с аналогичными или более длительными интервалами (месяцы или годы) в качестве поддерживающей терапии или терапии во время ремиссии, если это необходимо.
В одном из аспектов изобретения введение иммунотерапевтической композиции на основе дрожжей-MUC1 осуществляют последовательно и/или одновременно с введением одного или нескольких дополнительных терапевтических средств или с проведением дополнительной терапии, например, хирургической операции по удалению опухоли, химиотерапии, лучевой терапии, введения другой иммунотерапевтической композиции или проведения курса лечения, включая терапию с использованием вирусного вектора и терапию с использованием гибрида «дендритные клетки/опухолевые клетки»; терапию цитокинами, адоптивного Т-клеточного переноса (включая адоптивный перенос Т-клеток, которые были стимулированы ex vivo антигеном и/или иммунотерапевтической композицией) или трансплантацию стволовых клеток. В одном из примеров иммунотерапию на основе дрожжей-MUC1 проводят в комбинации с иммунотерапией на основе вирусного вектора, например, как описано в публикации PCT № WO/00/34494. В другом примере иммунотерапию на основе дрожжей-MUC1 проводят в комбинации с терапией на основе гибрида «дендритные клетки/опухолевые клетки» или с использованием клеток иммунной системы (например, Т-клеток), стимулированных указанными гибридами «дендритные клетки/опухолевые клетки», например, как описано в публикации PCT №WO/2009062001. В таких вариантах осуществления изобретения иммунотерапия, проводимая без использования дрожжей, может быть направлена на MUC1 или другой опухолевый антиген, и такая терапия может включать дополнительное введение других агентов, таких как цитокины, антитела или другие агенты.
В одном из аспектов изобретения один или более курсов терапии рака (включая любые курсы терапии, описанные в настоящей заявке или известные специалистам) могут быть проведены или осуществлены до введения или после введения первой дозы иммунотерапевтической композиции на основе дрожжей-MUC1. В одном из вариантов осуществления изобретения один или более курсов лечения могут быть проведены или осуществлены поочередно с введением доз иммунотерапевтической композиции на основе дрожжей-MUC1, например, по схеме, в которой композицию на основе дрожжей-MUC1 вводят в определенные интервалы между последовательным введением одной или более доз химиотерапии или какой-либо другой терапии. В одном из вариантов осуществления изобретения иммунотерапевтическую композицию на основе дрожжей-MUC1 вводят в одной или более дозах в течение определенного периода времени до начала проведения дополнительной терапии. Другими словами, иммунотерапевтическую композицию на основе дрожжей-MUC1 вводят в качестве монотерапии в течение определенного периода времени, а затем проводят дополнительную терапию (например, химиотерапию) либо одновременно с введением новых доз иммунотерапевтической композиции на основе дрожжей-MUC1, либо поочередно с проведением иммунотерапии с использованием дрожжей-MUC1. Альтернативно или дополнительно, другая терапия может быть осуществлена в течение определенного периода времени до начала введения иммунотерапевтической композиции на основе дрожжей-MUC1, и указанные концепции терапии могут быть объединены (например, сначала проводят хирургическую операцию по удалению опухоли, а затем монотерапию с использованием иммунотерапевтической композиции на основе дрожжей-MUC1 в течение нескольких недель, после чего поочередно вводят дозы химиотерапии и иммунотерапевтической композиции на основе дрожжей-MUC1 в течение недель или месяцев и/или проводят другую терапию, либо проводят комбинированную терапию по новой схеме, которая предусматривает последовательное, одновременное или чередующееся введение указанных терапевтических средств). В настоящем изобретении рассматриваются различные схемы лечения рака с использованием иммунотерапевтической композиции на основе дрожжей-MUC1, и эти примеры следует рассматривать как неограничивающие примеры различных возможных схем лечения.
Иммунотерапевтическая композиция на основе вирусов обычно включает вирусный вектор, содержащий вирусный геном или его части (например, рекомбинантный вирус) и последовательность нуклеиновой кислоты, кодирующую по меньшей мере один антиген, происходящий от агента, вызывающего заболевание или патологическое состояние (например, раковый(ые) антиген(ы); антиген(ы), вызывающий(ие) инфекционное заболевание, и/или по меньшей мере один из их иммуногенных доменов). В некоторых вариантах изобретения иммунотерапевтическая композиция на основе вирусов также включает по меньшей мере один вирусный вектор, содержащий одну или более последовательностей нуклеиновой кислоты, кодирующих одну или более иммуностимулирующих молекул. В некоторых вариантах осуществления изобретения гены, кодирующие иммуностимулирующие молекулы и антигены, встраивают в один и тот же вирусный вектор (в один и тот же рекомбинантный вирус).
Иммунотерапевтические композиции, содержащие гибрид «дендритные клетки/опухолевые клетки», получают путем слияния дендритных клеток с недендритными клетками, которые экспрессируют опухолевые антигены, включая опухолевые клетки, методами слияния, известными специалистам. Эти гибридные клетки имеют свойства дендритных клеток, а также экспрессируют и презентируют опухолевые антигены на опухолевых клетках. Эти композиции могут быть введены индивидууму или использованы для стимуляции Т-клеток ex vivo в методах переноса Т-клеток.
В одном из аспектов изобретения иммунотерапевтическая композиция на основе дрожжей может быть также нацелена, помимо MUC1, на дополнительные антигены, не являющиеся MUC1. Такие дополнительные антигены-мишени и антигены MUC1 могут быть включены в тот же самый дрожжевой носитель, либо могут быть получены дополнительные иммунотерапевтические композиции на основе дрожжей, нацеленные на другие антигены, с последующим их объединением, если это необходимо, в зависимости от индивидуума, подвергаемого лечению, от антигенов, экспрессируемых раковой опухолью конкретного типа или конкретной опухолью индивидуума, и/или в зависимости от стадии развития рака у индивидуума или от периода лечения индивидуума. Так, например, может быть выбрана комбинация антигенов, которая включает: (1) антигены, участвующие в основных событиях развития рака, такие как мутированный Ras, (2) антигены, участвующие в нарушении регуляции клеточных процессов или ассоциированные с указанными процессами, такие как CEA или MUC1, и (3) антигены Brachyury, участвующие процессах метастазирования. Так, например, одна или более других иммунотерапевтических композиций на основе дрожжей могут экспрессировать один или более антигенов, включая, но не ограничиваясь ими, карциноэмбриональный антиген (CEA), онкопротеин Ras с точковой мутацией, антиген Brachyury, EGFR, BCR-Abl, MART-1, MAGE-1, MAGE-3, GAGE, GP-100, MUC-2, обычные онкопротеины р53 и онкопротеины р53 с точковой мутацией, PSMA, тирозиназу, TRP-1 (gp75), NY-ESO-1, TRP-2, TAG72, KSA, CA-125, PSA, HER-2/neu/c-erb/B2, hTERT, p73, B-RAF, антиген, вызывающий аденоматозный кишечный полипоз (APC), Myc, белок фон Хиппеля-Линдау (VHL), Rb-1, Rb-2, андрогенный рецептор (AR), Smad4, MDR1, Flt-3, BRCA-1, BRCA-2, pax3-fkhr, ews-fli-1, HERV-H, HERV-K, TWIST, мезотелин, NGEP, модификации таких антигенов, варианты сплайсинга таких антигенов и агонисты эпитопов таких антигенов, а также комбинации таких антигенов и/или их иммуногенных доменов, модификаций, вариантов и/или агонистов эпитопов. Одна, две, три или более указанных иммунотерапевтических композиций на основе дрожжей могут быть введены до, одновременно, поочередно или после введения индивидууму иммунотерапевтической композиции на основе дрожжей-MUC1 в целях оптимизации нацеливания на антигены опухоли индивидуума. Как указывалось выше, в эти протоколы может быть также включена дополнительная терапия (например, хирургическое удаление опухоли, химиотерапия, направленная противораковая терапия, лучевая терапия и т.п.).
В одном из своих вариантов настоящее изобретение относится к способу лечения рака. Указанный способ включает следующие стадии: (a) введение индивидууму с раковой или предраковой опухолью первой иммунотерапевтической композиции на основе дрожжей-MUC1, содержащей дрожжевой носитель и антиген MUC1, описанные в настоящей заявке, и (b) введение индивидууму одной или более дополнительных иммунотерапевтических композиций до, во время или после введения первой иммунотерапевтической композиции, где каждая из этих композиций содержит дрожжевой носитель и другой раковый антиген, не являющийся антигеном MUC1. Дополнительным раковым антигеном может быть любой раковый антиген, известный специалистам или описанный в настоящей заявке, включая, но не ограничиваясь ими, мутированный Ras, карциноэмбриональный антиген (CEA), антиген Brachyury, EGFR и т.п. Стадии могут быть проведены повторно, если это необходимо для лечения рака у конкретного индивидуума, а раковые антигены могут быть модифицированы до или во время лечения для специфического нацеливания на раковую опухоль конкретного типа у индивидуума.
В способе согласно изобретению композиции и терапевтические композиции могут быть введены любому животному, включая любых позвоночных, в частности, животных, принадлежащих к классу позвоночных, млекопитающих, включая, но не ограничиваясь ими, приматов, грызунов, сельскохозяйственных животных и домашних питомцев. Сельскохозяйственными животными являются млекопитающие, выращиваемые для производства продуктов питания и продуктов народного потребления (например, овцы для производства шерсти). Млекопитающими, которые могут быть подвергнуты лечению или профилактике способами согласно изобретению, являются люди, приматы, не являющиеся человеком, собаки, кошки, мыши, крысы, козы, овцы, крупный рогатый скот, лошади и свиньи.
Термин «индивидуум» относится к позвоночным, таким как млекопитающие, включая, но не ограничиваясь им, человека. Млекопитающими являются, но не ограничиваются ими, сельскохозяйственные животные, животные, участвующие в спортивных состязаниях, домашние питомцы, приматы, мыши и крысы. Термин «индивидуум» может быть синонимом терминов «животное», «субъект» или «пациент».
Общие методы, применяемые в соответствии с настоящим изобретением
На практике настоящее изобретение может быть осуществлено, если это не оговорено особо, с применением стандартных методов молекулярной биологии (включая методы рекомбинантных ДНК), микробиологии, биологии клетки, биохимии, химии нуклеиновых кислот и иммунологии, хорошо известных специалистам. Такие методы подробно описаны в литературе, например, в публикациях Methods of Enzvmology, Vol. 194, Guthrie et al., eds., Cold Spring Harbor Laboratory Press (1990); Biology and activities of yeasts, Skinner, et al., eds., Academic Press (1980); Methods in yeast genetics: a laboratory course manual. Rose et al., Cold Spring Harbor Laboratory Press (1990); The Yeast Saccharomyces: Cell Cycle and Cell Biology, Pringle et al., eds., Cold Spring Harbor Laboratory Press (1997); The Yeast Saccharomyces: Gene Expression, Jones et al., eds., Cold Spring Harbor Laboratory Press (1993); The Yeast Saccharomyces: Genome Dynamics, Protein Synthesis, and Energetics, Broach et al., eds., Cold Spring Harbor Laboratory Press (1992); Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) и Molecular Cloning: A Laboratory Manual, third edition (Sambrook and Russel, 2001) (в целом называемые здесь «Sambrook»); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987, включая дополнения на 2001); PCR: The Polymerase Chain Reaction (Mullis et al., eds., 1994); Harlow and Lane (1988), Antibodies, A Laboratory Manual, Cold Spring Harbor Publications, New York; Harlow and Lane (1999) Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (в целом называемые здесь «Harlow and Lane»), Beaucage et al. eds., Current Protocols in Nucleic Acid Chemistry, John Wiley & Sons, Inc., New York, 2000); Casarett and Doullʹs Toxicology The Basic Science of Poisons, C. Klaassen, ed., 6th edition (2001), и Vaccines, S. Plotkin, W. Orenstein, and P. Offit, eds., Fifth Edition (2008).
Общие определения
"TARMOGEN®" (GlobeImmune, Inc., Louisville, Colorado) в общих чертах означает дрожжевой носитель, экспрессирующий один или более гетерологичных антигенов во внеклеточном пространстве (на их поверхности), во внутриклеточном пространстве (внутри клетки или в цитозоле) или во внеклеточном пространстве и внутриклеточном пространстве. TARMOGEN® в общих чертах описан в литературе (см., например, патент США №5830463). Некоторые иммунотерапевтические композиции на основе дрожжей и методы их получения и их общее применение также подробно описаны в патенте США №5830463, в патенте США №7083787, в патенте США №7736642, в публикациях Stubbs et al., Nat. Med. 7:625-629 (2001), Lu et al., Cancer Research 64:5084-5088 (2004) и в публикации Bernstein et al., Vaccine 2008 Jan 24; 26(4):509-21, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Используемый здесь термин «аналог» означает химическое соединение, которое по своей структуре аналогично другому соединению, но слегка отличается от него по своему составу (что обусловлено заменой атома одного элемента на атом другого элемента, или присутствием конкретной функциональной группы, или заменой одной функциональной группы на другую функциональную группу). Таким образом, аналогом является соединение, которое имеет функции или внешний вид, аналогичные функциям или внешнему виду исходного соединения или сравнимые с функциям или внешним видом исходного соединения, но имеют структуру или происхождение, отличающиеся от структуры или происхождения исходного соединения.
Используемые здесь термины «замещенный», «замещенное производное» и «производное», если они относятся к соединению, означают, что по меньшей мере один атом водорода, связанный с незамещенным соединением, заменен другим атомом или другой химической группой.
Хотя производное имеет физическую структуру, сходную со структурой родительского соединения, однако, оно может обладать химическими и/или биологическими свойствами, отличающимися от химических и/или биологических свойств родительского соединения. Такими свойствами могут быть, но не ограничиваются ими, повышенная или пониженная активность родительского соединения, новая активность родительского соединения, повышенная или пониженная биологическая доступность, повышенная или пониженная эффективность, повышенная или пониженная стабильность in vitro и/или in vivo, и/или повышенная или пониженная способность к абсорбции.
В основном, термин «биологически активный» означает, что соединение (включая белок или пептид) обладает по меньшей мере одной детектируемой активностью, которая влияет на метаболические, физиологические, химические или другие процессы в клетках, тканях или в организме, как было измерено или определено in vivo (то есть, в обычных физиологических условиях) или in vitro (то есть, в лабораторных условиях).
В соответствии с настоящим изобретением термин «модулировать» может употребляться как синоним термина «регулировать» и обычно относится к увеличению или снижению конкретной активности. Используемый здесь термин «активация» обычно употребляется для описания конкретной активности и означает индуцирование, инициацию, повышение, увеличение, интенсификацию, улучшение, усиление, амплификацию, стимуляцию или обеспечение такой активности. Аналогичным образом, используемый здесь термин «подавление» обычно употребляется для описания конкретной активности и означает уменьшение, снижение, ингибирование, нейтрализация, ослабление, сокращение, блокирование или предотвращение такой активности.
В одном из вариантов осуществления изобретения любая из описанных здесь аминокислотных последовательностей может быть получена из последовательности, содержащей по меньшей мере одну и приблизительно до 20 дополнительных гетерологичных аминокислот, фланкирующих каждый из C- и/или N-концов конкретной аминокислотной последовательности. Полученный белок или полипептид может «по существу состоять из» конкретной аминокислотной последовательности. В соответствии с настоящим изобретением гетерологичные аминокислоты представляют собой последовательность аминокислот, не являющуюся природной (то есть, не обнаруженную в природе in vivo), которая фланкирует конкретную аминокислотную последовательность, или не обладает функцией конкретной аминокислотной последовательности, или не кодируется нуклеотидами, которые фланкируют природную последовательность нуклеиновой кислоты, кодирующую конкретную аминокислотную последовательность, присутствующую в этом гене, если такие нуклеотиды в природной последовательности были транслированы с использованием стандартных кодонов, встречающихся в организме, от которого происходит данная аминокислотная последовательность. Аналогичным образом, словосочетание «по существу состоит из», если оно относится к описанной здесь последовательности нуклеиновой кислоты, означает, что последовательность нуклеиновой кислоты, кодирующая конкретную аминокислотную последовательность, может быть фланкирована приблизительно по меньшей мере одним и приблизительно до 60 дополнительными гетерологичными нуклеотидами у каждого 5ʹ- и/или 3ʹ-конца последовательности нуклеиновой кислоты, кодирующей конкретную аминокислотную последовательность. Эти гетерологичные нуклеотиды не являются природными (то есть, не обнаружены в природе in vivo) и фланкируют последовательность нуклеиновой кислоты, кодирующую конкретную аминокислотную последовательность, если эта нуклеиновая кислота присутствует в природном гене, либо эти гетерологичные нуклеотиды не кодируют белок, который сообщает какую-либо дополнительную функцию белку, имеющему конкретную аминокислотную последовательность, или изменяет такую функцию.
В соответствии с настоящим изобретением словосочетание «селективно связывается с» относится к способности антитела, антигенсвязывающего фрагмента или партнера по связыванию согласно изобретению преимущественно связываться со специфическими белками. Более конкретно, словосочетание «селективно связывается» относится к специфическому связыванию одного белка с другим (например, антитела, его фрагмента или партнера по связыванию с антигеном), где уровень связывания, измеряемый в любом стандартном анализе (например, в иммуноанализе), является статистически значимо более высоким, чем уровень связывания, измеренный в анализе на контрольное связывание. Так, например, при осуществлении иммуноанализа, контрольное связывание обычно включает реакцию связывания в лунке/пробирке, которая содержит антитело или один антигенсвязывающий фрагмент (то есть, в отсутствие антигена), где уровень реактивности (например, неспецифического связывания с лункой) антитела или его антигенсвязывающего фрагмента в отсутствие антигена рассматривается как фоновое связывание. Связывание может быть измерено различными стандартными методами, включая ферментативные иммуноанализы (например, ELISA, иммуно-блот-анализы и т.п.).
Общие понятия «белок или полипептид» используемые в настоящем изобретении включают полноразмерные белки или любой их фрагмент, домен (структурный, функциональный или иммуногенный), конформационный эпитоп, либо гомолог или вариант данного белка. В общих чертах, гибридный белок может означать белок или полипептид. Выделенный белок согласно изобретению представляет собой белок (включая полипептид или пептид), который был удален из его природной среды (то есть, который был модифицирован человеком), и таким белком могут быть, например, очищенные белки, частично очищенные белки, рекомбинантно продуцированные белки и синтетически продуцированные белки. Так, например, термин «выделенный» не указывает на степень очистки данного белка. При этом предпочтительно, чтобы выделенный белок согласно изобретению был продуцирован рекомбинантно. В соответствии с настоящим изобретением термины «модификация» и «мутация» являются синонимами, в частности, если они относятся к модификациям/мутациям аминокислотных последовательностей белка или их частей (или последовательностей нуклеиновой кислоты).
Используемый здесь термин «гомолог» или «вариант» означает белок или пептид, которые отличаются от исходного белка или пептида (то есть, от «прототипа» или белка «дикого типа) небольшими модификациями по сравнению с исходным белком или пептидом, но которые сохраняют структуру остова белка и структуру боковой цепи белка в его природной форме. Такими изменениями являются, но не ограничиваются ими, замены одной или нескольких аминокислот боковой цепи; замены одной или нескольких аминокислот, включая делеции (например, усеченный вариант белка или пептида), инсерции и/или замены; изменения стереохимической структуры одного или нескольких атомов; и/или небольшие дериватизации, включая, но не ограничиваясь ими, метилирование, гликозилирование, фосфорилирование, ацетилирование, миристоилирование, пренилирование, пальмитилирование, амидирование и/или присоединение гликозилфосфатидилинозита. Гомолог или вариант, по сравнению с исходным белком или пептидом, могут обладать повышенной, пониженной или, в основном, аналогичной активностью. Гомолог или вариант может включать агонист белка или антагонист белка. Гомологи или варианты могут быть получены методами, известными специалистам в области синтеза белков, и такими методами являются, но не ограничиваются ими, прямые модификации выделенного исходного белка, прямой синтез белка, или модификации в последовательности нуклеиновой кислоты, кодирующей белок, например, классическими методами или методами рекомбинантных ДНК в целях достижения неспецифического или направленного мутагенеза, с получением последовательности, кодирующей вариант белка. Кроме того, могут присутствовать природные варианты исходного белка (например, изоформы, аллельные варианты или другие природные варианты, которые могут передаваться от индивидууму к индивидууму), и такие варианты могут быть выделены, продуцированы и/или использованы в соответствии с настоящим изобретением.
Гомолог или вариант данного белка может включать аминокислотную последовательность или, в основном, состоять из или состоять из указанной аминокислотной последовательности, которая по меньшей мере приблизительно на 45%, или по меньшей мере приблизительно на 50%, или по меньшей мере приблизительно на 55%, или по меньшей мере приблизительно на 60%, или по меньшей мере приблизительно на 65%, или по меньшей мере приблизительно на 70%, или по меньшей мере приблизительно на 75%, или по меньшей мере приблизительно на 80%, или по меньшей мере приблизительно на 85%, или по меньшей мере приблизительно на 86%, или по меньшей мере приблизительно на 87%, или по меньшей мере приблизительно на 88%, или по меньшей мере приблизительно на 89%, или по меньшей мере приблизительно на 90%, или по меньшей мере приблизительно на 91%, или по меньшей мере приблизительно на 92%, или по меньшей мере приблизительно на 93%, или по меньшей мере приблизительно на 94%, или по меньшей мере приблизительно на 95%, или по меньшей мере приблизительно на 96%, или по меньшей мере приблизительно на 97%, или по меньшей мере приблизительно на 98%, или по меньшей мере приблизительно на 99% (или на любой другой процент, составляющий от 45% до 99%, с увеличением на целое число) идентична аминокислотной последовательности исходного белка (например, определенной здесь аминокислотной последовательности или аминокислотной последовательности определенного здесь белка). В одном из вариантов осуществления изобретения указанный гомолог или вариант включает аминокислотную последовательность или, в основном, состоит из или состоит из указанной аминокислотной последовательности, которая менее чем на 100%, приблизительно менее чем на 99%, приблизительно менее чем на 98%, приблизительно менее чем на 97%, приблизительно менее чем на 96%, приблизительно менее чем на 95% и т.п. со снижением на 1%, приблизительно до менее чем на 70% идентична аминокислотной последовательности исходного белка.
Используемый здесь термин «процент (%) идентичности», если это не оговорено особо, означает оценку степени гомологии, которую осуществляют с применением: (1) программы поиска базовой гомологии Basic Local Alignment Search Tool (BLAST) с использованием программы blastp для поиска аминокислот и программы blastn для поиска нуклеиновых кислот со стандартными параметрами по умолчанию, где запрашиваемую последовательность отфильтровывают по областям с наименее сложной структурой с использованием параметров по умолчанию (как описано в руководстве Altschul, S.F., Madden, T.L., Schaaffer, A.A., Zhang, J., Zhang, Z., Miller, W. & Lipman, D.J. (1997) «Gapped BLAST and PSI-BLAST: a new generation of protein database search programs» Nucleic Acids Res. 25:3389-3402, которое во всей своей полноте вводится в настоящее описание посредством ссылки); (2) программы BLAST для выравнивания двух последовательностей (например, с использованием параметров, описанных ниже); (3) и/или программы PSI-BLAST со стандартными параметрами по умолчанию (программа с положение-специфическими итерациями BLAST). Следует отметить, что из-за небольших различий между стандартными параметрами в программах Basic BLAST и BLAST для двух последовательностей, при использовании программы BLAST, две конкретные последовательности могут распознаваться как последовательности, имеющие значимую гомологию, тогда как при поиске, осуществляемом в программе Basic BLAST с использованием одной из последовательностей в качестве запрашиваемой последовательности, вторая последовательность не может быть идентифицирована с наибольшими соответствиями. Кроме того, программа PSI-BLAST представляет собой автоматизированную универсальную версию поиска «профиля», который является чувствительным способом поиска гомологии последовательностей. В этой программе впервые осуществляют поиск в базе данных программы BLAST с введением пробелов. В программе PSI-BLAST используется информация, полученная по любым значимым выравниваниям с возвратом для создания положение-специфической оценочной матрицы, которая заменяет запрашиваемую последовательность в следующем раунде поиска в базе данных. Поэтому, совершенно очевидно, что процент идентичности может быть определен с использованием одной из этих программ.
Две конкретные последовательности могут сравниваться друг с другом путем выравнивания с помощью программы BLAST. как описано в публикации Tatusova and Madden, (1999) «Blast 2 sequences - a new tool for comparing protein and nucleotide sequences», FEMS Microbiol Lett. 174:247-250, которая во всей своей полноте вводится в настоящее описание посредством ссылки. Такое выравнивание последовательностей осуществляют в программах blastp или blastn с использованием алгоритма BLAST 2.0 для проведения поиска соответствия между двумя последовательностями с использованием программы Gapped BLAST (BLAST 2.0) с введением «пробелов» (делеций и инсерций) в выравниваемых последовательностях. Для ясности можно отметить, что выравнивание двух последовательностей с помощью программы BLAST осуществляют с использованием стандартных параметров по умолчанию, как описано ниже.
Для blastn использовали матрицу 0 BLOSUM62:
«Премия» за соответствие =1
«Штраф» за несоответствие =-2
Штрафы за «пробел-пропуск» (5) и за «пробел-удлинение» (2)
Пробел х пропуск (gap x_dropoff) (50); ожидание (expect)
(10); размер слова (11); фильтр (включение)
Для blastp использовали матрицу 0 BLOSUM62:
Штрафы за «пробел-пропуск» (11) и за «пробел-удлинение» (1)
Пробел х пропуск (gap x_dropoff) (50); ожидание (expect)
(10); размер слова (3); фильтр (включение).
Выделенной молекулой нуклеиновой кислоты является молекула нуклеиновой кислоты, которая была удалена из его природной среды (то есть, которая была модифицирована человеком), и такой природной средой является геном или хромосома, в которых присутствует природная молекула нуклеиновой кислоты. Так, например, термин «выделенный» не указывает на степень очистки молекулы нуклеиновой кислоты, а означает, что такая молекула не включает полноразмерный геном или всю хромосому или сегмент генома, содержащего более чем один ген, в котором присутствует природная молекула нуклеиновой кислоты. Выделенная молекула нуклеиновой кислоты может включать полноразмерный ген. Выделенная молекула нуклеиновой кислоты, которая содержит ген, не является фрагментом хромосомы, включающим такой ген, а точнее включает кодирующую область и регуляторные области, ассоциированные с данным геном, но не дополнительные гены, которые обычно присутствуют на той же самой хромосоме. Выделенная молекула нуклеиновой кислоты может также включать части гена. Выделенная молекула нуклеиновой кислоты может также включать конкретную последовательность нуклеиновой кислоты, фланкированную (то есть, у 5ʹ- и/или 3ʹ-конца последовательности) дополнительными нуклеиновыми кислотами, которые по своей природе обычно не фланкируют конкретную последовательность нуклеиновой кислоты (то есть, гетерологичные последовательности). Выделенной молекулой нуклеиновой кислоты могут быть ДНК, РНК (например, мРНК) или производные ДНК или РНК (например, кДНК). Хотя термин «молекула нуклеиновой кислоты» означает, главным образом, физическую молекулу нуклеиновой кислоты, а термин «последовательность нуклеиновой кислоты» означает, главным образом, нуклеотидную последовательность молекулы нуклеиновой кислоты, однако, эти два термина могут употребляться как синонимы, особенно, если они используются по отношению к молекуле нуклеиновой кислоты или к последовательности нуклеиновой кислоты, кодирующим белок или домен белка.
Рекомбинантной молекулой нуклеиновой кислоты является молекула, которая может включать по меньшей мере одну из последовательностей нуклеиновой кислоты, кодирующих любые один или более описанных здесь белков и функционально присоединенных по меньшей мере к одной из последовательностей регуляции транскрипции, способных эффективно регулировать экспрессию молекулы (молекул) нуклеиновой кислоты в трансфицированной клетке. Хотя термин «молекула нуклеиновой кислоты» означает, главным образом, физическую молекулу нуклеиновой кислоты, а термин «последовательность нуклеиновой кислоты» означает, главным образом, нуклеотидную последовательность молекулы нуклеиновой кислоты, однако, эти два термина могут употребляться как синонимы, особенно, если они используются по отношению к молекуле нуклеиновой кислоты или к последовательности нуклеиновой кислоты, кодирующей белок. Кроме того, термин «рекомбинантная молекула», главным образом, означает молекулу нуклеиновой кислоты, функционально присоединенную к последовательности регуляции транскрипции, и такой термин может употребляться как синоним термина «молекула нуклеиновой кислоты, вводимая животному».
Рекомбинантная молекула нуклеиновой кислоты включает рекомбинантный вектор, представляющий собой любую последовательность нуклеиновой кислоты, обычно гетерологичную последовательность, которая функционально присоединена к выделенной молекуле нуклеиновой кислоты, кодирующей гибридный белок согласно изобретению, и которая обладает способностью рекомбинантно продуцировать гибридный белок и доставлять молекулу нуклеиновой кислоты в клетку-хозяина согласно изобретению. Такой вектор может содержать последовательности нуклеиновой кислоты, которые, по своей природе, обычно не являются смежными с выделенными молекулами нуклеиновой кислоты, встроенными в вектор. Вектором может быть прокариотическая или эукариотическая РНК или ДНК, а в настоящем изобретении таким вектором предпочтительно является плазмида, используемая для трансфицирования дрожжей. Рекомбинантные векторы могут быть использованы для клонирования, секвенирования и/или какой-либо другой модификации молекул нуклеиновой кислоты, а также для доставки таких молекул (например, в виде ДНК-композиции или композиции на основе вирусного вектора). Рекомбинантные векторы предпочтительно используют для экспрессии молекул нуклеиновой кислоты, и такие векторы могут также называться экспрессионными векторами. Предпочтительные рекомбинантные векторы могут экспрессироваться в трансфицированных клетках-хозяевах, таких как дрожжи.
В рекомбинантной молекуле согласно изобретению молекулы нуклеиновой кислоты функционально присоединены к экспрессионным векторам, содержащим регуляторные последовательности, такие как последовательности регуляции транскрипции, последовательности регуляции трансляции, ориджины репликации и другие регуляторные последовательности, которые являются совместимыми с клеткой-хозяином и могут регулировать экспрессию молекул нуклеиновой кислоты согласно изобретению. В частности, рекомбинантные молекулы согласно изобретению включают молекулы нуклеиновой кислоты, функционально присоединенные к одной или более последовательностям регуляции экспрессии. Термин «функционально присоединенный» относится к связыванию молекул нуклеиновой кислоты с последовательностью регуляции экспрессии, которое обеспечивает экспрессию указанной молекулы при ее переносе (то есть, трансформации, трансдукции или трансфекции) в клетку-хозяина.
В соответствии с настоящим изобретением используемый здесь термин «трансфекция» означает любой метод, посредством которого экзогенная молекула нуклеиновой кислоты (то есть, рекомбинантная молекула нуклеиновой кислоты) может быть встроена в клетку. Термин «трансформация» может использоваться здесь как синоним термина «трансфекция», если он означает введение молекул нуклеиновой кислоты в микробные клетки, такие как клетки водорослей, бактерий и дрожжей. Термин «трансформация», если он употребляется по отношению к микробным системам, означает наследуемое изменение, обусловленное приобретением микроорганизмом экзогенных нуклеиновых кислот, и этот термин по существу является синонимом термина «трансфекция». Поэтому методами трансфекции являются, но не ограничиваются ими, трансформация, химическая обработка клеток, бомбардировка частицами, электропорация, микроинжекция, липофекция, адсорбция, инфицирование и слияние протопластов.
Нижеследующие результаты экспериментов приводятся в целях иллюстрации осуществления изобретения и не должны рассматриваться как ограничение объема изобретения.
ПРИМЕРЫ
Пример 1
В нижеследующем примере описано продуцирование иммунотерапевтической композиции на основе дрожжей-MUC1, известной как GI-6101.
В этом эксперименте были сконструированы дрожжи (Saccharomyces cerevisiae), экспрессирующие человеческий антиген MUC1 под контролем промотора, индуцируемого атомом меди, CUP1, или конститутивного промотора, TEF2, и продуцирующие иммунотерапевтические композиции на основе дрожжей-MUC1. В каждом случае гибридный белок, содержащий антиген MUC1, был продуцирован в виде одного полипептида, содержащего нижеследующие элементы последовательности, присоединенные, с сохранением рамки считывания, от N- до C-конца, и представленного SEQ ID NO: 15: (1) сегмент SEA/ED MUC1 (в положениях 1-59 SEQ ID NO: 15); (2) сегмент VNTR, содержащий два домена VNTR (в положениях 60-100 SEQ ID NO: 15); (3) TM-домен MUC1 (в положениях 101-128 SEQ ID NO: 15); и (4) CD MUC1 (в положениях 129-200 SEQ ID NO: 15). Этот гибридный белок также включает сигнальную последовательность MUC1 (в положениях 1-30 SEQ ID NO: 14), которая может быть заменена другой N-концевой последовательностью, сконструированной в целях сообщения резистентности к разложению протеосомой и/или стабилизации экспрессии, такой как пептид, представленный SEQ ID NO: 21, или N-концевой пептид, происходящий от дрожжевой лидерной последовательности альфа, такой как SEQ ID NO: 19 или SEQ ID NO: 20. Полноразмерный гибридный белок, включающий N-концевую сигнальную последовательность MUC1 и гексагистидиновую C-концевую метку, вводимую для облегчения идентификации и/или очистки белка, представляет собой один полипептид, содержащий нижеследующие элементы последовательности SEQ ID NO: 14, присоединенные, с сохранением рамки считывания, от N- до C-конца: (1) сигнальную последовательность MUC1 (в положениях 1-30 SEQ ID NO: 14); (2) сегмент SEA/ED MUC1 (в положениях 31-89 SEQ ID NO: 14); (3) сегмент VNTR, содержащий два домена VNTR (в положениях 90-130 SEQ ID NO: 14); (4) TM-домен MUC1 (в положениях 131-158 SEQ ID NO: 14); (5) CD MUC1 (в положениях 159-230 SEQ ID NO: 14); и (6) гексапептидную гистидиновую метку (в положениях 231-236 SEQ ID NO: 14). SEQ ID NO: 14 кодируется нуклеотидной последовательностью, представленной SEQ ID NO: 13 (оптимизированной по кодонам для экспрессии в дрожжах).
Вкратце, была синтезирована ДНК, кодирующая антигены MUC1, и эта ДНК была встроена в клонирующие EcoRI- и NotI-сайты за промотором CUP1 (в векторе pGI-100) или за промотором TEF2 (в векторе plu011) в дрожжевых экспрессионных 2-мкм векторах. Нуклеотидные последовательности, кодирующие C-концевой гексагистидиновый пептид, были присоединены к плазмидному вектору для получения последовательности, кодирующей полноразмерный гибридный белок, представленный SEQ ID NO: 14. Полученные плазмиды переносили в DH5α для сохранения плазмиды и в W303α Saccharomyces cerevisiae для продуцирования иммунотерапевтических композиций на основе дрожжей-MUC1.
Перенос в Saccharomyces cerevisiae осуществляли путем трансфекции ацетатом лития/полиэтиленгликолем, и первичные трансфектанты отбирали на планшетах с твердой минимальной средой, не содержащей урацила (UDM; средой, не содержащей уридина). Колонии отбирали путем культивирования в U2 (в среде, не содержащей уридина) или в среде UL2 (в среде, не содержащей уридина и лейцина) при 30°C.
Иммунотерапевтическая композиция на основе дрожжей-MUC1, содержащая полинуклеотид, кодирующий человеческий гибридный белок MUC1, представленный SEQ ID NO: 14, под контролем промотора TEF2, также обозначается здесь GI-6101.
Жидкие культуры, не содержащие уридина (U2) или не содержащие уридина и лейцина (UL2), инокулировали с использованием планшетов и культур для инициации ферментации, описанных выше, и культивировали приблизительно в течение 24 часов при 30°C с перемешиванием при 250 об/мин. pH-забуференную среду UL2, содержащую 4,2 г/л бис-трис (BT-UL2), также инокулировали дрожжами, взятыми из банка замороженных дрожжевых клеток, для анализа иммунотерапевтических композиций на основе дрожжей-MUC1, полученных в условиях их продуцирования с нейтральным рН (данные не приводятся). При культивировании в pH-забуференной среде UL2 было обнаружено присутствие β-глюканов на дрожжевой клеточной стенке и, очевидно, приводило к модификации клеточных иммунных ответов, индуцированных дрожжами в результате модификации взаимодействий с дектиновыми рецепторами на антигенпрезентирующих клетках. Остальные культуры выращивали в аналогичных условиях, независимо от того, была ли использована среда U2, UL2 или BT-UL2. Первичные культуры использовали для инокуляции конечных культур с тем же самым составом.
Рецепт приготовления жидкой среды U2:
15 г/л глюкозы
6,7 г/л азотистого основания дрожжей, содержащих сульфат аммония
0,04 г/л каждого из таких компонентов, как гистидин, триптофан, аденин, и 0,06 г/л лейцина
Рецепт приготовления жидкой среды UL2:
15 г/л глюкозы
6,7 г/л азотистого основания дрожжей, содержащих сульфат аммония
0,04 г/л каждого из таких компонентов, как гистидин, триптофан и аденин
В предварительных экспериментах по сравнению иммунотерапевтических композиций на основе дрожжей-MUC1, продуцируемых под контролем различных промоторов, CUP1-запускаемую (индуцибельную) экспрессию дрожжей-MUC1 осуществляли путем культивирования в 2 или 3 стадии, и после того как культура для инициации ферментации или промежуточная культура достигала полулогарифмической фазы роста (mid-log) (1,5-4 Y.U./мл), экспрессию инициировали добавлением 0,375 мМ сульфата меди до тех пор, пока разведение культуры не достигало 0,1 или 0,2 Y.U./мл от промежуточной культуры, а затем культивирование продолжали до достижения плотности культуры 1,5-3 Y.U. TEF2-запускаемая экспрессия дрожжей-MUC1 является конститутивной, а поэтому культивирование этих клеток продолжали до тех пор, пока плотность культур не достигала 1,1-4,0 Y.U./мл. Клетки от каждой культуры собирали, промывали и термоинактивировали при 56°C в течение 1 часа в PBS.
После термоинактивации культур клетки три раза промывали в PBS. Экспрессию всего белка оценивали в анализе на TCA- преципитацию/связывание с нитроцеллюлозой и в вестерн-блот-анализе с использованием моноклонального антитела против his-метки и анти-MUC1 (VNTR) антитела (sc-7313, Santa Cruz). Содержание белка количественно оценивали с применением полуколичественных методов получения цифровых изображений. GI-6101, как и ожидалось, экспрессирует гибридный белок MUC1 в виде мембраноассоциированного белка размером приблизительно 25 кДа.
На фиг. 2A проиллюстрирована экспрессия антигена MUC1 в GI-6101 с использованием анти-MUC1 (VNTR) антитела и анти-His антител для детектирования. Полученные результаты выявили хороший уровень экспрессии белка MUC1. На фиг. 2B представлен антиген MUC1 GI-6101 после дегликозилирования ферментами EdoH или PNGaseF. На этой фигуре показано, что гибридный белок GI-6101 экспрессируется как гликозилированный продукт, так как размер этого гибридного белка был выше размера этого белка до дегликозилирования, но ниже размера, который, как предполагается, должен составлять 25 кДа после дегликозилирования ферментами EdoH или PNGaseF.
Количественный уровень экспрессии антигена в GI-6101, который был культивирован в стандартных условиях культивирования, сравнивали с уровнем экспрессии антигена GI-6101, культивированного в условиях нейтрального pH, как описано выше. Уровни экспрессии антигена, проводимой любыми способами (данные не приводятся), были приблизительно одинаковыми, что указывает на то, что способ, осуществляемый при нейтральном pH, не влиял на уровень экспрессии антигена MUC1 в дрожжах.
Пример 2
В нижеследующем примере описано продуцирование иммунотерапевтической композиции на основе дрожжей-MUC1, известной как GI-6104.
В этом эксперименте были сконструированы дрожжи (Saccharomyces cerevisiae), экспрессирующие человеческий антиген MUC1 под контролем промотора, индуцируемого атомом меди, CUP1, или конститутивным промотором, TEF2, и продуцирующие иммунотерапевтические композиции на основе дрожжей-MUC1. В каждом случае гибридный белок, содержащий антиген MUC1, был продуцирован в виде одного полипептида, содержащего нижеследующие элементы последовательности, присоединенные, с сохранением рамки считывания, от N- до C-конца, и представленного SEQ ID NO: 18. SEQ ID NO: 18 включает нижеследующие антигены MUC1, расположенные в соответствующем порядке от N- до C-конца: (1) первый CD MUC1 (в положениях 1-72 SEQ ID NO: 18); (2) второй CD MUC1 (в положениях 73-144 SEQ ID NO: 18); и (3) третий CD MUC1 (в положениях 145-216 SEQ ID NO: 18). Этот гибридный белок дополнительно включает N-концевую последовательность, сконструированную в целях сообщения резистентности к разложению протеосомой и/или стабилизации экспрессии (представленную в этом гибридном белке как SEQ ID NO: 21). Этот гибридный белок может быть альтернативно сконструирован с использованием сигнальной последовательности MUC1 (например, в положениях 1-30 SEQ ID NO: 14), другого синтетического N-концевого пептида, описанного в настоящей заявке, или N-концевого пептида, происходящего от дрожжевой лидерной последовательности альфа, такой как SEQ ID NO: 19 или SEQ ID NO: 20. Полноразмерный гибридный белок, включающий N-концевой пептид и гексагистидиновую C-концевую метку, вводимую для облегчения идентификации и/или очистки белка, представляет собой один полипептид, содержащий нижеследующие элементы последовательности SEQ ID NO: 17, присоединенные, с сохранением рамки считывания, от N- до C-конца: (1) синтетический пептид, представленный SEQ ID NO: 21 (в положениях 1-6 SEQ ID NO: 17); (2) первый CD MUC1 (в положениях 7-78 SEQ ID NO: 17); (3) второй CD MUC1 (в положениях 79-150 SEQ ID NO: 17); (4) третий CD MUC1 (в положениях 151-222 SEQ ID NO: 17); и (5) гексагистидиновую метку (в положениях 223-228 SEQ ID NO: 17). SEQ ID NO: 17 кодируется нуклеотидной последовательностью, представленой SEQ ID NO: 16 (оптимизированной по кодонам для экспрессии в дрожжах).
Вкратце, была синтезирована ДНК, кодирующая антигены MUC1, и эта ДНК была встроена в клонирующие EcoRI- и NotI-сайты за промотором CUP1 (в векторе pGI-100) или за промотором TEF2 (в векторе plu011) в дрожжевых экспрессионных 2-мкм векторах. Нуклеотидные последовательности, кодирующие C-концевой гексагистидиновый пептид, были присоединены к плазмидному вектору для получения последовательности, кодирующей полноразмерный гибридный белок, представленный SEQ ID NO: 17. Полученные плазмиды переносили в DH5α для сохранения плазмиды и в W303α Saccharomyces cerevisiae для продуцирования иммунотерапевтических композиций на основе дрожжей-MUC1.
Перенос в Saccharomyces cerevisiae осуществляли путем трансфекции ацетатом лития/полиэтиленгликолем, и первичные трансфектанты отбирали на планшетах с твердой минимальной средой, не содержащей урацила (UDM; средой, не содержащей уридина). Колонии отбирали путем культивирования в U2 (в среде, не содержащей уридина) или в среде UL2 (в среде, не содержащей уридина и лейцина) при 30°C.
Иммунотерапевтическая композиция на основе дрожжей-MUC1, содержащая полинуклеотид, кодирующий человеческий гибридный белок MUC1, представленный SEQ ID NO: 17, под контролем промотора CUP1, также обозначается здесь GI-6104.
Жидкие культуры, не содержащие уридина (U2) или не содержащие уридина и лейцина (UL2) (рецепты приготовления сред приводятся в примере 1), были инокулированы с использованием планшетов и культур для инициации ферментации, описанных выше, и культивированы приблизительно в течение 24 часов при 30°C с перемешиванием при 250 об/мин. pH-забуференную среду UL2, содержащую 4,2 г/л бис-трис (BT-UL2), также инокулировали дрожжами, взятыми из банка замороженных дрожжевых клеток, для анализа иммунотерапевтических композиций на основе дрожжей-MUC1, полученных в условиях их продуцирования с нейтральным рН (данные не приводятся). Культивирование в pH-забуференной среде UL2 выявило присутствие β-глюканов на дрожжевой клеточной стенке и, очевидно, приводило к модификации клеточных иммунных ответов, индуцированных дрожжами в результате модификации взаимодействий с дектиновыми рецепторами на антигенпрезентирующих клетках. Остальные культуры выращивали в аналогичных условиях, независимо от того, была ли использована среда UL2 или BT-UL2. Первичные культуры использовали для инокуляции конечных культур с тем же самым составом.
В предварительных экспериментах по сравнению иммунотерапевтических композиций на основе дрожжей-MUC1, продуцируемых под контролем различных промоторов, CUP1-запускаемую (индуцибельную) экспрессию дрожжей-MUC1 осуществляли путем культивирования в 2 или 3 стадии, и после того как культура для инициации ферментации или промежуточная культура достигала полулогарифмической фазы роста (1,5-4 Y.U./мл), экспрессию антигена инициировали добавлением 0,375 мМ сульфата меди до тех пор, пока разведение культуры не достигало 0,1 или 0,2 Y.U./мл от промежуточной культуры, а затем культивирование продолжали до достижения плотности культуры 1,5-3 Y.U. CUP1-запускаемая (индуцибельная) экспрессия дрожжей-MUC1 была также инициирована добавлением 0,375 мМ сульфата меди до тех пор, пока плотность культуры дрожжей-MUC1 не достигала приблизительно 2 Y.U./мл, и такое индуцирование продолжали в течение 4-6 часов. TEF2-запускаемая экспрессия дрожжей-MUC1 является конститутивной, а поэтому культивирование этих клеток продолжали до тех пор, пока плотность культур не достигала 1,1-4,0 Y.U./мл. Клетки от каждой культуры собирали, промывали и подвергали термоинактивации при 56°C в течение 1 часа в PBS.
После термоинактивации культур клетки три раза промывали в PBS. Экспрессию всего белка оценивали в анализе на TCA- преципитацию/связывание с нитроцеллюлозой и в вестерн-блот-анализе с использованием моноклонального антитела против his-метки и анти-MUC1 (С-концевого) антитела (sc-6827, Santa Cruz). Содержание белка количественно оценивали с применением полуколичественных методов получения цифровых изображений. GI-6104, как и ожидалось, экспрессирует гибридный белок MUC1 в виде цитозольного белка размером приблизительно 25 кДа.
На фиг. 2С проиллюстрирована экспрессия антигена MUC1 в GI-6104 с использованием анти-MUC1 (С-концевого) антитела и анти-His антител для детектирования. Полученные результаты выявили хороший уровень экспрессии белка MUC1. На фиг. 2B представлен антиген MUC1 GI-6104 после дегликозилирования ферментом EdoH. На этой фигуре показано, что гибридный белок GI-6104 не экспрессируется как гликозилированный продукт, поскольку размер этого гибридного белка был аналогичен размеру данного белка до и после дегликозилирования ферментом EdoH.
Количественный уровень экспрессии антигена в GI-6104, который был культивирован в стандартных условиях культивирования, сравнивали с уровнем экспрессии антигена в GI-6104, культивированного в условиях нейтрального pH, как описано выше. Уровни экспрессии антигена, проводимой любыми способами (данные не приводятся), были приблизительно одинаковыми, что указывает на то, что способ, осуществляемый при нейтральном pH, не влиял на уровень экспрессии антигена MUC1 в дрожжах.
Пример 3
В нижеследующем примере описано продуцирование иммунотерапевтической композиции на основе дрожжей-агониста MUC1, известной как GI-6105.
В этом эксперименте были сконструированы дрожжи (Saccharomyces cerevisiae), экспрессирующие человеческий антиген-агонист MUC1 под контролем промотора, индуцируемого атомом меди, CUP1, и продуцирующие иммунотерапевтическую композицию на основе дрожжей-агониста MUC1. Антиген-агонист MUC1 был сконструирован с использованием антигена, происходящего от иммунотерапевтической композиции на основе дрожжей-MUC1 GI-6101 (см. пример 1) в качестве матрицы. Вкратце, гибридный белок, содержащий антиген-агонист MUC1, был продуцирован в виде одного полипептида, содержащего нижеследующие элементы последовательности, присоединенные, с сохранением рамки считывания, от N- до C-конца, и представленного SEQ ID NO: 23: (1) сигнальная последовательность MUC1 (в положениях 1-30 SEQ ID NO: 23); (2) сегмент SEA/ED MUC1 (в положениях 31-89 SEQ ID NO: 23); (3) сегмент VNTR, содержащий два домена VNTR (в положениях 90-130 SEQ ID NO: 23); (4) TM-домен MUC1 (в положениях 131-158 SEQ ID NO: 23); (5) CD MUC1 (в положениях 159-230 SEQ ID NO: 23); (6) эпитоп-агонист MUC1 (в положениях 231-246 SEQ ID NO: 23) и (7) гексапептидная гистидиновая метка (в положениях 247-252 SEQ ID NO: 23). SEQ ID NO: 23 кодируется нуклеотидной последовательностью, представленной SEQ ID NO: 22 (оптимизированной по кодонам для экспрессии в дрожжах). Сигнальная последовательность MUC1 (в положениях 1-30 SEQ ID NO: 23) может быть заменена другой N-концевой последовательностью, сконструированной для сообщения резистентности к разложению протеосомой и/или стабилизации экспрессии, такой как пептид, представленный SEQ ID NO: 21, или N-концевым пептидом от дрожжевой лидерной последовательности альфа, такой как SEQ ID NO: 19 или SEQ ID NO: 20. Гексагистидиновая С-концевая метка является необязательной, но используется для облегчения идентификации и/или очистки белка. По сравнению с антигеном в GI-6101 (например, SEQ ID NO: 14 или 15), последовательность в GI-6105 содержит нижеследующие аминокислотные замены, введенные для создания ряда эпитопов-агонистов (замены в положениях SEQ ID NO: 23 даны в соответствии с положениями в последовательности MUC1 дикого типа, представленной под регистрационным номером NP_001191214): A96Y (положение 161 в MUC1 дикого типа), P97L (положение 162 в MUC1 дикого типа), G104V (положение 169 в MUC1 дикого типа), S105Y (положение 170 в MUC1 дикого типа), T106L (положение 171 в MUC1 дикого типа), A147Y (положение 392 в MUC1 дикого типа), C161V (положение 406 в MUC1 дикого типа), T199L (положение 444 в MUC1 дикого типа), D200F (положение 445 в MUC1 дикого типа), S215Y (положение 460 в MUC1 дикого типа) и T239L (положение 93 в MUC1 дикого типа).
Плазмиду, содержащую антиген-агонист MUC1 для GI-6105 (SEQ ID NO: 23), переносили в дрожжи W303α, и трансформанты отбирали после 3-дневного культивирования при 30°C на агаре, не содержащем уридина (UDA). Моноколонии повторно наносили полосами на планшеты с агаром, не содержащим уридина и лейцина (ULDA), и инкубировали при 30°C еше 4 дня для отбора клеток с повышенным числом плазмидных копий.
Моноколонию GI-6105 выделяли из планшета с ULDA и использовали для инокуляции 25 мл жидкой среды UL2 (культуры для инициации ферментации). Культуру для инициации ферментации инкубировали со встряхиванием при 30°C до плотности 3,7 YU/мл, а затем эту культуру использовали для инокуляции промежуточной культуры до плотности 0,3 YU/мл. Промежуточную культуру культивировали до плотности 3,0 YU/мл, а затем использовали для инокуляции конечной культуры до плотности 0,04 YU/мл. Конечную культуру культивировали до плотности 3,6 YU/мл, а затем обрабатывали 0,5 мМ сульфата меди в течение 3 часов при 30°C для индуцирования экспрессии антигена-агониста MUC1 v1.0.
Индуцированные клетки один раз промывали PBS, подвергали термоинактивации при 56°C в течение 1 часа, а затем три раза промывали в PBS. Общее содержание белка в термоинактивированных клетках измеряли с помощью анализа Amidoschwarz, и количество антигена определяли с помощью вестерн-блот-анализа с использованием моноклонального антитела, распознающего С-концевую гексагистидиновую эпитопную метку. Количество антигена оценивали путем интерполяции по стандартной кривой, построенной для his-меченного белка NS3 HCV. Как показано на фиг. 3, указанный антиген экспрессировался в дрожжах, а количество антигена в GI-6105, как было оценено, составляло приблизительно 2801 нг/YU.
Пример 4
В нижеследующем примере описано продуцирование иммунотерапевтической композиции на основе дрожжей-агониста MUC1, известной как GI-6106.
В этом эксперименте были сконструированы дрожжи (Saccharomyces cerevisiae), экспрессирующие человеческий антиген-агонист MUC1 под контролем промотора, индуцируемого атомом меди, CUP1, и продуцирующие иммунотерапевтическую композицию на основе дрожжей-агониста MUC1. Антиген-агонист MUC1 был сконструирован с использованием полноразмерного антигена MUC1 дикого типа, представленного под регистрационным номером NP_001191214, хотя для конструирования аналогичных агонистов могут быть использованы и другие белки MUC1 дикого типа. Вкратце, гибридный белок, содержащий антиген-агонист MUC1, был продуцирован в виде одного полипептида, содержащего нижеследующие элементы последовательности, присоединенные с сохранением рамки считывания от N- до C-конца, и представленного SEQ ID NO: 25: (1) лидерная последовательность альфа-фактора, представленную здесь последовательностью SEQ ID NO: 19 (в положениях 1-89 SEQ ID NO: 25); (2) линкерная последовательность Thr-Ser (в положениях 90-91 SEQ ID NO: 25); (3) полноразмерный белок-агонист MUC1, соответствующий белку дикого типа, за исключением введенных 11 эпитопов-агонистов (в положениях 92-566 SEQ ID NO: 25) и (4) гексапептидная гистидиновая метка (в положениях 567-572 SEQ ID NO: 25). SEQ ID NO: 25 кодируется нуклеотидной последовательностью, представленной SEQ ID NO: 24 (оптимизированной по кодонам для экспрессии в дрожжах). Лидерная последовательность альфа (в положениях 1-89 SEQ ID NO: 25) может быть заменена другой N-концевой последовательностью, сконструированной в целях сообщения резистентности к разложению протеосомы и/или в целях стабилизации экспрессии, например, пептидом, представленным SEQ ID NO: 21, или N-концевым пептидом, происходящим от другой лидерной дрожжевой последовательности альфа, такой как SEQ ID NO: 20, или сигнальной последовательностью MUC1. Гексагистидиновая С-концевая метка является необязательной, но она облегчает идентификацию и/или очистку белка. Последовательность в GI-6106, по сравнению с белком MUC1 дикого типа, используемым в качестве матрицы, содержит нижеследующие аминокислотные замены, введенные для создания ряда эпитопов-агонистов (замены в положениях SEQ ID NO: 25 даны в соответствии с положениями в последовательности MUC1 дикого типа, представленной под регистрационным номером NP_001191214): T184L (положение 93 в MUC1 дикого типа), A232Y (положение 161 в MUC1 дикого типа), P233L (положение 162 в MUC1 дикого типа), G240V (положение 169 в MUC1 дикого типа), S241Y (положение 170 в MUC1 дикого типа), T242L (положение 171 в MUC1 дикого типа), A483Y (положение 392 в MUC1 дикого типа), C497V (положение 406 в MUC1 дикого типа), T535L (положение 444 в MUC1 дикого типа), D536F (положение 445 в MUC1 дикого типа) и S551Y (положение 460 в MUC1 дикого типа).
Плазмиду, содержащую антиген-агонист MUC1 для GI-6106, переносили в дрожжи W303α, и трансформанты отбирали после 3-дневного культивирования при 30°C на агаре, не содержащем уридина (UDA). Моноколонии повторно наносили полосами на планшеты с агаром, не содержащим уридина и лейцина (ULDA), и инкубировали при 30°C еше 4 дня для отбора клеток с повышенным числом плазмидных копий.
Моноколонию GI-6106 выделяли из планшета с ULDA и использовали для инокуляции 25 мл жидкой среды UL2 (культуры для инициации ферментации). Культуру для инициации ферментации инкубировали со встряхиванием при 30°C до плотности ~3 YU/мл, а затем эту культуру использовали для инокуляции промежуточной культуры до плотности 0,3 YU/мл. Промежуточную культуру культивировали до плотности 3 YU/мл, а затем использовали для инокуляции конечной культуры до плотности 0,04 YU/мл. Конечную культуру культивировали до плотности 3 YU/мл, а затем обрабатывали 0,5 мМ сульфата меди в течение 3 часов при 30°C для индуцирования экспрессии антигена-агониста MUC1 v2.0.
Индуцированные клетки один раз промывали PBS, подвергали термоинактивации при 56°C в течение 1 часа, а затем три раза промывали в PBS. Общее содержание белка в термоинактивированных клетках измеряли с помощью анализа Amidoschwarz, и количество антигена-агониста определяли с помощью вестерн-блот-анализа с использованием моноклонального антитела, распознающего С-концевую гексагистидиновую эпитопную метку. Количество антигена оценивали путем интерполяции по стандартной кривой, построенной для his-меченного белка NS3 HCV. Результаты показали, что дрожжи GI-6106 экспрессируют антиген (данные не приводятся), а количество антигена в GI-6106, как было оценено, составляло приблизительно 2940 нг/YU.
Пример 5
В нижеследующем примере описан фенотипический и функциональный анализ, в котором оценивали влияние иммунотерапевтических композиций, содержащих дрожжи-MUC1, на человеческие дендритные клетки.
Для оценки влияния иммунотерапевтических композиций, содержащих дрожжи-MUC1 и описанных в примерах 1 и 2, на фенотип и функцию дендритных клеток, проводили нижеследующие эксперименты.
В первом эксперименте человеческие дендритные клетки (ДК) культивировали в течение 48 часов: (1) только со средой (необработанной), (2) с CD40L (1 мкг/мл) плюс энхансер для лигандов (1 мкг/мл), используемый в качестве позитивного контроля; (3) с контрольными дрожжами (контрольные дрожжи; дрожжи, содержащие пустой вектор (без вставки антигена MUC1)); (4) с иммунотерапевтической композиций на основе дрожжей-MUC1, известной как GI-6101 и культивированной в стандартных условиях, описанных в примере 1 (GI-6101); (5) с иммунотерапевтической композиций на основе дрожжей-MUC1, известной как GI-6101 и культивированной в условиях с нейтральным рН, как описано в примере 1 (GI-6101 (DEC)); (6) с иммунотерапевтической композиций на основе дрожжей-MUC1, известной как GI-6104 (GI-6104) и культивированной в стандартных условиях, описанных в примере 2; или (7) с иммунотерапевтической композиций на основе дрожжей-MUC1, известной как GI-6104 и культивированной в условиях с нейтральным рН, как описано в примере 2 (GI-6104 (DEC)). Дендритные клетки и дрожжи объединяли в соотношении 1:10 (ДК:дрожжи). ДК собирали и анализировали на экспрессию поверхностного маркера ДК с помощью проточной цитометрии. Результаты представлены ниже в таблице 1 как процент позитивных клеток и MFI (СКП, среднекратный прирост) (в скобках).
Полученные результаты показали, что дрожжи (контрольные дрожжи и дрожжи, экспрессирующие антигены MUC1), независимо от способа их культивирования, активировали экспрессию СD80 и CD83 на дендритных клетках по сравнению с необработанными клетками. CD80 или B7.1 представляют собой костимулирующую молекулу, необходимую для активации и выживания Т-клеток, которые активируются на активированных дендритных клетках. CD83 представляет собой маркер созревания дендритных клеток. В соответствии с этим, в данном эксперименте было показано, что иммунотерапевтические композиции на основе дрожжей-MUC1 могут активировать маркеры созревания ДК.
Во втором эксперименте продуцирование цитокинов и хемокинов дендритными клетками оценивали после их культивирования с иммунотерапевтическими композициями на основе дрожжей-MUC1. Вкратце, человеческие ДК, взятые у здорового донора (донора, который, как считается, не страдает раком), культивировали в течение 5 дней с гранулоцитарным-макрофагальным колониестимулирующим фактором (GM-CSF) и интерлейкином-4 (IL-4), либо обрабатывали CD40L (1 мкг/мл, Enzo Life Sciences) плюс энхансер для лигандов (1 мкг/мл, Enzo Life Sciences) в течение 24 часов, или контрольными дрожжами (пустой вектор), GI-6101, культивированной в стандартных условиях (GI-6101); GI-6101 культивированной в условиях с нейтральным pH (GI-6101 (DEC)), GI-6104, культивированной в стандартных условиях (GI-6104), или GI-6104, культивированной в условиях с нейтральным pH (GI-6104 (DEC)) в течение 48 часов (отношение ДК:дрожжи = 1:10). Культивированные супернатанты собирали и скринировали на продуцирование цитокинов и хемокинов с использованием мультиплексного набора цитокинов/хемокинов. Результаты выражены в пг/мл и представлены в таблице 2.
Результаты, представленные в таблице 2, показали, что обработка дендритных клеток, взятых у здорового донора, иммунотерапевтическими композициями на основе дрожжей-MUC1, описанными в примерах 1 и 2, приводила к увеличению уровня продуцирования цитокинов и хемокинов этими клетками. Было замечено, что уровень продуцирования интерферона-γ (IFN-γ) повышался после обработки иммунотерапевтическими композициями на основе дрожжей-MUC1 в условиях с нейтральным pH, при которых, как и ожидалось, наблюдалось усиление TH1- и CD8+-T-клеточных ответов. Кроме того, иммунотерапевтические композиции на основе дрожжей-MUC1, культивированные в условиях с нейтральным pH, индуцировали увеличение уровня продуцирования цитокинов и хемокинов дендритными клетками (ДК), причем иммунотерапевтическая композиция на основе дрожжей-MUC1, известная как GI-6101 (нейтральный pH), стимулировала самый высокий уровень продуцирования цитокинов и хемокинов дендритными клетками (ДК). Цифры, выделенные жирным шрифтом, означают индуцирование цитокинов/хемокинов, которое статистически было более значимым по сравнению с необработанным контролем (данные не приводятся).
Эксперимент, проиллюстрированный в таблице 2, повторяли с использованием дендритных клеток, выделенных у другого здорового донора. Полученные результаты (данные не приводятся) сравнивали с результатами, представленными в таблице 2, и было подтверждено, что иммунотерапевтические композиции на основе дрожжей-MUC1 индуцировали продуцирование цитокинов и хемокинов дендритными клетками, и что композиция на основе дрожжей-MUC1, известная как GI-6101 и культивированная в условиях с нейтральным рН, из двух указанных композиций, культивированных в таких условиях, индуцировала продуцирование цитокинов и хемокинов дендритными клетками на самом высоком уровне.
В целом, полученные результаты показали, что иммунотерапевтические композиции на основе дрожжей-MUC1 могут активировать дендритные клетки и индуцировать продуцирование цитокинов и хемокинов, которое ассоциируется с вырабатыванием иммунного ответа.
Пример 6
В этом примере показано, что иммунотерапевтические композиции на основе дрожжей-MUC1 согласно изобретению могут активировать MUC1-специфические Т-клетки.
T-3-P93L представляет собой MUC1-специфическую Т-клеточную линию, которая специфически распознает пептид-агонист MUC1, обозначенный P93L, в присутствии HLA-A2. P93L представляет собой пептид, расположенный в положениях 92-101 полноразмерного белка MUC1 (например, ATWGQDVTSV; в положениях 92-101 SEQ ID NO: 11), за исключением того, что треонин в положении 2 этого пептида (положение 93 в фрагменте 92-101 SEQ ID NO: 11) был заменен лейцином, в результате чего был образован пептид-агонист. P93L связывается с HLA-A2 на более высоком уровне, чем нативный пептид (дикого типа), и является более активным индуктором MUC1-специфических Т-клеток, чем нативный пептид (более высокий уровень продуцирования цитокинов TH1-клетками (см. публикацию заявки на патент США №2008/0063653)). T-клеточная линия T-3-P93L может специфически лизировать HLA-A2-позитивные, MUC1-позитивные опухолевые мишени in vitro (данные не приводятся). Эта T-клеточная линия является специфичной для части MUC1, которая находится в субъединице MUC1-N.
В этом эксперименте ДК, взятые у здорового донора и приготовленные, как описано в примере 5, обрабатывали иммунотерапевтическими композициями на основе дрожжей, описанными в примерах 1 и 2, либо контрольными дрожжами (пустой вектор) или CD40L (позитивный контроль), либо вообще не обрабатывали (негативный контроль), в условиях, описанных выше в примере 5. ДК, обработанные контрольными дрожжами или CD40L, подвергали импульсному мечению пептидом P93L (P93L использовали в концентрации 10 мкг/мл), либо не подвергали такому мечению. Затем обработанные ДК использовали в качестве антигенпрезентирующих клеток (АПК) для оценки их способности стимулировать MUC1-специфическую Т-клеточную линию T-3-P93L (соотношение T-клетки:ДК = 10:1). Супернатанты 24-часовой культуры собирали и скринировали на секрецию интерферона-γ (IFN-γ). Полученные результаты представлены в таблице 3, где они выражены как количество IFN-γ, продуцированное Т-клетками в пг/мл.
Результаты показали, что дендритные клетки, обработанные GI-6101, продуцированные в стандартных условиях и в условиях с нейтральным pH и экспрессирующие домены VNTR субъединицы MUC1-N, обладали способностью стимулировать MUC1-N-специфические Т-клетки с образованием большого количества IFN-γ. GI-6104, которая не экспрессировала антиген белка MUC1-N (GI-6104 экспрессирует только антиген MUC1, происходящий от цитоплазматического домена (CD)), также не стимулировала MUC1-N-специфические Т-клетки.
Во втором эксперименте MUC1-C-специфическую Т-клеточную линию, обозначенную T-15-P1240(1Y), стимулировали ДК, обработанными, как описано в вышеупомянутом эксперименте, для того чтобы определить, могут ли иммунотерапевтические композиции на основе дрожжей-MUC1 согласно изобретению стимулировать эти Т-клетки. Клеточная линия T-15-P1240(1Y) представляет собой MUC1-C-специфическую Т-клеточную линию, которая специфически распознает пептид-агонист MUC1, обозначенный P1240(1Y) и представляющий собой пептид MUC1-C, в присутствии HLA-A2. P1240(1Y) представляет собой пептид, расположенный в положениях 1240-1248 полноразмерного белка MUC1 (например, SLSYTNPAV; в положениях 1240-1248 SEQ ID NO: 11), за исключением того, что серин в положении 1 этого пептида (в положении 1240 во фрагменте 1240-1248 SEQ ID NO: 11) заменен лизином, в результате чего образуется пептид-агонист. P1240(1Y) связывается с HLA-A2 также хорошо или даже лучше, чем нативный пептид (дикого типа), и является более активным индуктором MUC1-специфических Т-клеток, чем нативный пептид (более высокий уровень продуцирования цитокинов TH1-клетками). T-клеточная линия T-15-P1240(1Y) может специфически лизировать HLA-A2-позитивные, MUC1-позитивные опухолевые мишени in vitro (данные не приводятся). Эта T-клеточная линия является специфичной для части MUC1, которая находится в субъединице MUC1-С, в частности, в цитоплазматическом домене (СD).
В этом эксперименте ДК были получены из МКПК здорового HLA-A2-положительного донора и были приготовлены, как описано в примере 5. ДК обрабатывали иммунотерапевтическими композициями на основе дрожжей, описанными в примерах 1 и 2, или CD40L (позитивный контроль), либо вообще не обрабатывали (негативный контроль), в условиях, описанных выше в примере 5. ДК, обработанные CD40L, подвергали импульсному мечению пептидом P1240(1Y) (этот пептид использовали в концентрации 10 мкг/мл), либо не подвергали такому мечению. Затем обработанные ДК использовали в качестве антигенпрезентирующих клеток (АПК) для оценки их способности стимулировать MUC1-специфическую Т-клеточную линию T-15-P1240(1Y) (соотношение T-клетки:ДК=10:1). Супернатанты 24-часовой культуры собирали и скринировали на секрецию интерферона-γ (IFN-γ). Полученные результаты представлены в таблице 4, где они выражены как количество IFN-γ, продуцированное Т-клетками в пг/мл.
Результаты показали, что GI-6101 и GI-6104, культивированные в стандартных условиях или в условиях с нейтральным pH, обладали способностью стимулировать MUC1-С-специфические Т-клетки с образованием большого количества IFN-γ. Иммунотерапевтические композиции на основе дрожжей-MUC1, культивированные в условиях с нейтральным pH (обе GI-6101 и GI-6104), стимулировали продуцирование IFN-γ Т-клетками на более высоких уровнях, чем иммунотерапевтические композиции на основе дрожжей-MUC1, культивированные в стандартных условиях.
Третий эксперимент повторял эксперимент, описанный выше в таблице 4, за исключением того, что в данном эксперименте использовали другое соотношение ДК:Т-клетки, где ДК были обработаны иммунотерапевтическими композициями на основе дрожжей-MUC1, GI-6101 и GI-6104. Результаты представлены ниже в таблице 5.
Результаты снова показали, что GI-6101 и GI-6104, культивированные в стандартных условиях или в условиях с нейтральным pH, обладали способностью стимулировать MUC1-С-специфические Т-клетки с образованием большого количества IFN-γ, и что указанные композиции, культивированные в условиях с нейтральным pH, стимулировали продуцирование IFN-γ Т-клетками на более высоких уровнях, чем иммунотерапевтические композиции на основе дрожжей-MUC1, культивированные в стандартных условиях. Полученные результаты также показали, что дозозависимый ответ повышается по мере увеличения числа ДК по отношению к числу Т-клеток.
В целом, полученные результаты показали, что иммунотерапевтические композиции на основе дрожжей-MUC1 могут антигенспецифически активировать MUC1-специфические Т-клетки, как было проиллюстрировано по высвобождению IFN-γ из Т-клеток, стимулированных ДК, обработанных иммунотерапевтическими композициями на основе дрожжей-MUC1. Эти результаты также показали преимущество в продуцировании IFN-γ Т-клетками с использованием иммунотерапевтических композиций на основе дрожжей-MUC1, культивированных в условиях с нейтральным рН.
Пример 7
В нижеследующем примере продемонстрировано, что композиции на основе дрожжей-MUC1 согласно изобретению могут способствовать размножению и стимуляции MUC1-специфических Т-клеток у раковых пациентов.
В этом эксперименте ДК получали из МКПК раковых пациентов (после противораковой терапии, которая может включать химиотерапию, введение вирусной вакцины и/или предварительную терапию). ДК получали путем 5-дневного культивирования в присутствии GM-CSF и IL-4 и последующего инкубирования в присутствии дрожжей (GI-6101 и/или GI-6104, культивированных в стандартных условиях или в условиях с нейтральным рН). После 48-часового совместного культивирования, ДК использовали в качестве АПК для стимуляции аутологичных Т-клеток при оценке уровня продуцирования цитокинов и/или пролиферации CD4+-T-клеток. Как и ожидалось, иммунотерапевтические композиции на основе дрожжей-MUC1 могут способствовать размножению и активации Т-клеток у раковых пациентов.
Во втором эксперименте ДК получали из МКПК раковых пациентов (после противораковой терапии, которая может включать химиотерапию, введение вирусной вакцины и/или предварительную терапию). ДК получали путем 5-дневного культивирования в присутствии GM-CSF и IL-4 и последующего инкубирования в присутствии дрожжей (GI-6101 и/или GI-6104, культивированных в стандартных условиях или в условиях с нейтральным рН). После 48-часового совместного культивирования, ДК использовали в качестве АПК для стимуляции аутологичных Т-клеток. Каждый цикл стимуляции in vitro (IVS) проводили 3 дня в отсутствие IL-2, а затем еще 4 дня в присутствии 20 ед./мл рекомбинантного IL-2. Тетрамеры, специфичные к пептиду MUC1, использовали для определения процента CD8+-T-клеток, которые были размножены после обработки иммунотерапевтическими композициями на основе дрожжей-MUC1. Как и ожидалось, иммунотерапевтические композиции на основе дрожжей-MUC1 могут способствовать размножению и активации Т-клеток у раковых пациентов.
В третьем эксперименте иммунотерапевтические композиции на основе дрожжей-MUC1 использовали для продуцирования MUC1-специфических CTL из МКПК, которые лизируют MUC1-экспрессирующие мишени. В этом эксперименте MUC1-специфические Т-клетки, взятые у здоровых доноров и/или у раковых пациентов (после противораковой терапии, которая может включать химиотерапию, введение вирусной вакцины и/или предварительную терапию), размножали in vitro с использованием ДК, инкубированных с иммунотерапевтическими композициями на основе дрожжей-MUC1 (GI-6101 или GI-6104) за 2 цикла стимуляции in vitro (IVS). На день 5 CD8+-T-клетки выделяли и использовали в ночном анализе на действие CTL против опухолевых клеток, экспрессирующих MUC1. Эти эксперименты, как и ожидалось, продемонстрировали, что иммунотерапевтические композиции на основе дрожжей-MUC1 могут генерировать MUC1-специфические CTL, способные уничтожать MUC1-экспрессирующие опухолевые клетки.
Пример 8
В нижеследующем примере продемонстрировано, что иммунизация иммунотерапевтической композицией на основе дрожжей-MUC1 приводит к снижению размера MUC1-экспрессирующих опухолей in vivo.
В этом эксперименте мышам в хвостовую вену (на день 0) имплантировали опухолевые клетки, экспрессирующие рекомбинантный человеческий белок MUC1. Через четыре дня после имплантации опухоли, животных еженедельно вакцинировали контрольными дрожжами (YVEC или дрожжами с пустым вектором) и композицией на основе дрожжей-MUC1 (GI-6101 или GI-6104), которые вводили в четыре различных участка в дозе 1 YU на участок (всего 4 YU на дозу). На день 40 после имплантации опухоли животных умерщвляли и оценивали число опухолевых узлов в легких. Как и ожидалось, иммунотерапевтические композиции на основе дрожжей-MUC1 способствовали снижению размера MUC1-экспрессирующих опухолей у мышей по сравнению с опухолями у мышей, которым вводили только дрожжи (без антигена MUC1).
Пример 9
В нижеследующем примере описано клиническое испытание фазы 1, в котором участвовали индивидуумы с MUC1-положительной раковой опухолью.
Клиническое испытание фазы 1 с открытой меткой и с эскалацией доз проводили с использованием иммунотерапевтической композиции на основе дрожжей-MUC1, известной как GI-6101 и описанной в примере 1, или GI-6104, описанной в примере 2 (культивированных в стандартных условиях культивирования или в условиях культивирования с нейтральным рН). 12-24 индивидуумам с MUC1-положительной опухолью подкожно вводили иммунотерапевтическую композицию на основе дрожжей-MUC1 в соответствии с протоколом последовательной эскалации доз в интервалах 4 Y.U. (1 Y.U. × 4 участка), 16 Y.U. (4 Y.U × 4 участка) и 40 Y.U. (10 Y.U. × 4 участка). Иммунотерапевтическую композицию на основе дрожжей-MUC1 вводили с двухнедельными интервалами в течение 3 месяцев, а затем ежемесячно. Для дополнительного исследования отбирали группу пациентов, которая участвовала в клиническом испытании с эскалацией доз (n=10), и этим пациентам вводили максимально допустимую дозу (MTD) или наблюдаемую наилучшую дозу. В качестве первичной конечной точки служили результаты мониторинга на безопасность, а в качестве вторичных конечных точек - антигенспецифические Т-клеточные ответы (например, MUC1-специфические CD8+-T-клетки, которые появлялись или размножались после лечения), а также клиническая активность.
Как и ожидалось, GI-6101 и GI-6104 были безопасными и хорошо переносились пациентами без какой-либо явной токсичности. Кроме того, как и ожидалось, GI-6101 или GI-6104 продуцировали вырабатываемые после лечения MUC1-специфические T-клеточные ответы или усиливали уже существующие MUC1-специфические базовые T-клеточные ответы у статистически значимого числа пациентов. У некоторых пациентов также наблюдалась ожидаемая стабилизация заболевания.
Пример 10
В нижеследующем примере описано клиническое испытание (P1/P2), проводимое с использованием иммунотерапевтических композиций на основе дрожжей-MUC1.
Повышенная экспрессия MUC1 наблюдалась в ~70% случаев острого миелоидного лейкоза (ОМЛ), что позволяет предположить, что повышенные уровни MUC1 могут быть ответственны за регуляцию пролиферативного потенциала незрелого компартмента лейкозных клеток.
В первом клиническом испытании иммунотерапевтическое средство первого ряда на основе дрожжей, известное как GI-6101 (см. пример 1), использовали в клиническом отделении для больных с MUC1-положительным ОМЛ (этот протокол испытания может быть также применим и к другим иммунотерапевтическим композициям на основе дрожжей-MUC1, таким как GI-6104). Применение GI-6101 планировалось как вспомогательная терапия к уже существующим схемам лечения стандартными цитотоксическими средствами, такими как цитарабин и антрациклин (например, даунорубицин), то есть как дополнительный способ стимуляции иммунного цитолиза MUC1-положительных лейкозных клеток, а также элиминации MUC1-положительных лейкозных клеток, которые могут «ускользать» от путей терминальной дифференцировки (апоптоза). Конечной точкой этого испытания является стимуляция ремиссии, а также увеличение общей продолжительности жизни (до и после трансплантации).
Во втором испытании GI-6101 использовали в клиническом отделении по трансплантации костного мозга (ТКМ) для предупреждения рецидивов ОМЛ у пациентов с MUC1-положительным заболеванием (этот протокол испытания может быть также применим и к другим иммунотерапевтическим композициям на основе дрожжей-MUC1, таким как GI-6104). Клинические стратегии по оценке вакцинации доноров костного мозга (адоптивный перенос) и/или вакцинации реципиентов костного мозга в период после трансплантации применяли для снижения частоты рецидивов после ТКМ.
(A) Протокол клинических испытаний с участием пациентов с MUC1-положительным ОМЛ, подвергаемых терапии первого ряда с использованием GI-6101 плюс цитарибина и даунорубицина, и стандартной терапии.
Пациентам проводили стартовую химиотерапию, заключающуюся в непрерывном внутривенном вливании цитарабина (арабинозида цитозина) в дозе 100-200 мг/м2 в день × 7 дней и внутривенном введении даунорубицина (или дауномицина (дауномицина-церубидина)) в дозе 45 мг/м2 на дни 1, 2 и 3 терапии цитарабином, или проводили такую схему лечения с допустимыми модификациями, с последующим введением GI-6101 (или плацебо) через 14 дней после завершения стартового цикла химиотерапии. Затем, через 14 дней после рестартовой терапии или через 14 дней после каждого последующего цикла консолидирующей химиотерапии, вводили GI-6101 (или плацебо). После стартовой, рестартовой и консолидирующей терапии вводили GI-6101 (или плацебо) каждый месяц в течение 3 лет, и первичной целью такой терапии было предупреждение рецидивов.
Как и ожидалось, введение GI-6101 приводило к увеличению частоты ремиссий у пациентов по сравнению с пациентами, получавшими плацебо.
(B) Протокол клинических испытаний с участием пациентов с MUC1-положительным ОМЛ, подвергаемых пост-ТКМ-терапии с использованием GI-6101 и плацебо.
Для лечения пациентов с MUC1-положительным ОМЛ, которым требовалась миело-абляционня терапия с последующей трансплантацией костного мозга, GI-6101 (или плацебо) вводили донорам костного мозга за 7-14 дней до взятия костного мозга, а реципиентам, которым трансплантировали костный мозг, GI-6101 (или плацебо) вводили через месяц и в течение 3 лет после трансплантации костного мозга. Первичной целью такого испытания является снижение частоты рецидивов ОМЛ.
Как и ожидалось, введение GI-6101 приводило к снижению частоты рецидивов ОМЛ у пациентов по сравнению с пациентами, получавшими плацебо.
ХОТЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ ПОДРОБНО ОПИСАНО НА РАЗЛИЧНЫХ ВАРИАНТАХ ЕГО ОСУЩЕСТВЛЕНИЯ, ОДНАКО, СЛЕДУЕТ ОТМЕТИТЬ, ЧТО В НЕГО МОГУТ БЫТЬ ВКЛЮЧЕНЫ МОДИФИКАЦИИ И ИЗМЕНЕНИЯ, ОЧЕВИДНЫЕ ДЛЯ СПЕЦИАЛИСТА В ДЕННОЙ ОБЛАСТИ. ПРИ ЭТОМ НЕСОМНЕННО, ЧТО ТАКИЕ МОДИФИКАЦИИ И ИЗМЕНЕНИЯ ВХОДЯТ В ОБЪЕМ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ, ИЗЛОЖЕННЫЙ В ПРЕДСТАВЛЕННОЙ НИЖЕ ФОРМУЛЕ ИЗОБРЕТЕНИЯ.
Реферат
Изобретение относится к области биотехнологии, конкретно к получению иммунотерапевтических композиций на основе дрожжей, содержащих муцин-1 (MUC1), что может быть использовано в медицине. Получают гибридный белок, который содержит антиген MUC1, имеющий аминокислотную последовательность, которая по меньшей мере на 85% идентична последовательности SEQ ID NO: 25 или по меньшей мере на 95% идентична положениям 92-566 последовательности SEQ ID NO: 25, и где MUC1 антиген содержит 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 из следующих аминокислот L184, Y232, L233, V240, V241, L242, Y483, V497, L335, F536 и Y551. Изобретение позволяет эффективно лечить экспрессирующие муцин-1 раковые опухоли, а также предупреждать их метастатическое прогрессирование. 7 н. и 7 з.п. ф-лы, 3 ил., 5 табл., 10 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ усиления иммунного ответа млекопитающего на антиген

Комментарии