Кристаллические формы динатриевой соли n-(5-хлорсалицилоил)-8-аминокаприловой кислоты - RU2507196C2
Код документа: RU2507196C2
Чертежи


Описание
Область изобретения
[1] Настоящее изобретение относится к кристаллическим формам динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты (далее "5-CNAC"), фармацевтическим составам, содержащим указанные кристаллические формы, способам получения указанных кристаллических форм, а также к способам доставки активных агентов, содержащих указанные кристаллические формы.
Уровень техники
[2] В патенте США №5773647 описаны 193 соединения, в качестве средств доставки, включая N-(5-хлорсалицилоил)-8-аминокаприловую кислоту ("5-CNAC"). Данные соединения повышают биологическую доступность широкого спектра биологически активных агентов, в частности, биологически активных агентов, обычно не подходящих для перорального введения. В опубликованных заявках на патент США №№2006/0078622 и 2006/0078623 описаны микрочастицы или наночастицы соединений, выступающих в качестве агентов доставки, включая 5-CNAC. В опубликованной заявке на патент США №2005/0054557 описаны фармацевтические составы, содержащие гормон паращитовидной железы, кальцитонин и 5-CNAC. В международной публикации WO 00/59863 описана динатриевая соль N-(5-хлорсалицилоил)-8-аминокаприловой кислоты.
[3] В опубликованной международной заявке на патент WO 2005/01403 описано применение кальцитонина и 5-CNAC для лечения остеоартрита. В опубликованной заявке на патент США №2006/0106110 предложен способ ингибирования агрегации тромбоцитов у млекопитающих, включающий введение млекопитающему модифицированной аминокислоты, в том числе 5-CNAC. В опубликованной международной заявке на патент №03/015822 описано применение 5-CNAC в качестве средства пероральной доставки фрагментов гормона паращитовидной железы. В опубликованной международной заявке на патент WO 02/45754 описаныфармацевтические составы, содержащие фармакологически активные агенты, кросповидон или повидон и средство доставки (например, 5-CNAC).
Краткое описание изобретения
[4] Настоящее изобретение относится к четырем кристаллическим формам динатриевой соли М-(5-хлорсалицилоил)-8-аминокаприловой кислоты ("5-CNAC") (которые обозначены далее как формы I-IV), включая октагидрат 5-CNAC.
[5] Согласно одному из вариантов реализации настоящего изобретения предложен фармацевтический состав, содержащий (A) (i) одну или более форм I-IV 5-CNAC, и (В) активный агент, в частности, кальцитонин (например, кальцитонин лосося) или гормон роста человека (например, рекомбинантный гормон роста человека). Согласно предпочтительному варианту реализации изобретения указанный фармацевтический состав содержит по меньшей мере примерно 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98, 99, 99,1, 99,2, 99,3, 99,4, 99,5, 99,6, 99,7, 99,8 или 99,9% масс, одной из форм I-IV 5-CNAC относительно 100% общей массы 5-CNAC в фармацевтическом составе. Согласно другому предпочтительному варианту реализации изобретения фармацевтический состав содержит по меньшей мере примерно 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98, 99, 99,1, 99,2, 99,3, 99,4, 99,5, 99,6, 99,7, 99,8 или 99,9% масс, одной из форм I-IV 5-CNAC относительно 100% общей массы кристаллической 5-CNAC в указанном фармацевтическом составе.
[6] Согласно другому варианту реализации в настоящем изобретении предложен фармацевтический состав, например, в виде таблетки, содержащий по меньшей мере одну из форм I-IV 5-CNAC и по меньшей мере один активный агент и/или фармацевтически приемлемую добавку (в частности, из числа описанных ниже). Предпочтительно активный агент представляет собой кальцитонин. Еще одним предпочтительным активным агентом является терапевтическая смесь кальцитонина и гормона паращитовидной железы (в частности, РТН[1-34]). Другим предпочтительным активным агентом является инсулин. Еще один предпочтительный активный агент представляет собой гормон роста (в частности, рекомбинантный гормон роста человека).
[7] Согласно еще одному варианту реализации в настоящем изобретении предложен способ введения или доставки активного агента животному (в частности, человеку) путем введения фармацевтического состава согласно настоящему изобретению.
[8] Согласно другому варианту реализации в настоящем изобретении предложен способ лечения болезни Педжета или гиперкальциемии, или лечения или предотвращения остеопороза у млекопитающего (в частности, у человека), нуждающегося в таком лечении или предотвращении, путем перорального введения эффективного количества фармацевтического состава согласно настоящему изобретению (например, фармацевтического состава, содержащего формы I, II, III и/или IV 5-CNAC и (i) кальцитонин (например, кальцитонин лосося) или (ii) комбинацию кальцитонина и гормона паращитовидной железы или его фрагмента (в частности, РТН[1-34]). Другие заболевания или состояния, которые можно лечить, или физиологические эффекты, которые могут быть обеспечены путем перорального введения эффективного количества фармацевтического состава согласно настоящему изобретению, например, фармацевтического состава, содержащего формы I, II, III и/или IV 5-CNAC и (i) кальцитонин (например, кальцитонин лосося) или (ii) комбинацию кальцитонина и гормона паращитовидной железы или его фрагмента (в частности, РТН[1-34]), включают заболевания костей, боль в костях (включая боль, связанную с остеопорозом или раком), остеоартрит, патологическую резорбцию и ремоделирование субхондральной кости, сохранение и/или стимулирование хряща, ингибирование активности фосфолипазы А2 и/или коллагеназы, стимулирование синтеза гликозаминогликана и/или протеогликана, стимулирование остеогенеза, воздействие на неоднорость плотности или жесткости субхондральной кости, воздействие на воспалительный процесс, приводящее к облегчению боли при движении и связанных с этим симптомов, уменьшение дегенеративных изменений в суставах пациента.
[9] Согласно еще одному варианту реализации в настоящем изобретении предложен способ получения формы I 5-CNAC, включающий (а) растворение моноэтанолсольвата 5-CNAC в смеси ацетонитрила и воды, и (б) охлаждение раствора, полученного на операции (а), при эффективной температуре (в частности, примерно от 5°C до примерно 15°C) с образованием формы I 5-CNAC.
[10] Согласно другому варианту реализации в настоящем изобретении предложен способ получения формы I 5-CNAC путем (а) нагревания водного раствора 5-CNAC (в частности, до температуры от примерно 40°C до примерно 70°C) и (б) удаления воды из полученного раствора с образованием формы I 5-CNAC (например, при помощи роторного испарителя и/или вакуум-сушильного шкафа).
[11] Согласно следующему варианту реализации в настоящем изобретении предложен способ получения моноэтанолсольвата 5-CNAC (в частности, формы II) путем (а) добавления гидроксида натрия к раствору N-(5-хлорсалицилоил)-8-аминокаприловой кислоты и этанола и (б) осаждения формы II 5-CNAC из раствора. Предпочтительно молярное отношение гидроксида натрия к N-(5-хлорсалицилоил)-8-аминокаприловой кислоте составляет примерно 2:1.
[12] Согласно другому варианту реализации в настоящем изобретении предложен способ получения октагидрата 5-CNAC (в частности, формы III) путем выдержки (i) моногидрата 5-CNAC (в частности, формы I, IV или их смеси), (ii) моноэтанолсольвата 5-CNAC (в частности, формы II) или (iii) смеси указанных форм при относительной влажности по меньшей мере примерно 75% в течение времени, достаточного для образования октагидрата. Согласно одному из вариантов реализации изобретения октагидрат получают при комнатной температуре или при температуре в пределах от примерно 22°C до примерно 40°C или примерно 50°C.
[13] Согласно еще одному варианту реализации в настоящем изобретении предложен способ получения формы IV 5-CNAC путем (а) растворения 5-CNAC в метилэтилкетоне при повышенной температуре (в частности, от примерно 30°C до примерно 70°C) и (б) охлаждения раствора метилэтилкетона, полученного на операции (а), с образованием формы IV 5-CNAC.
[14] Согласно следующему варианту реализации в настоящем изобретении предложен способ получения смеси форм I и IV 5-CNAC путем охлаждения раствора 5-CNAC и ацетона в течение времени, достаточного для образования смеси форм I и IV. Указанный раствор может дополнительно содержать воду.
[15] Кристаллы, полученные согласно любому из вышеописанных способов, могут быть выделены любым из способов, известных из уровня техники.
Краткое описание фигур
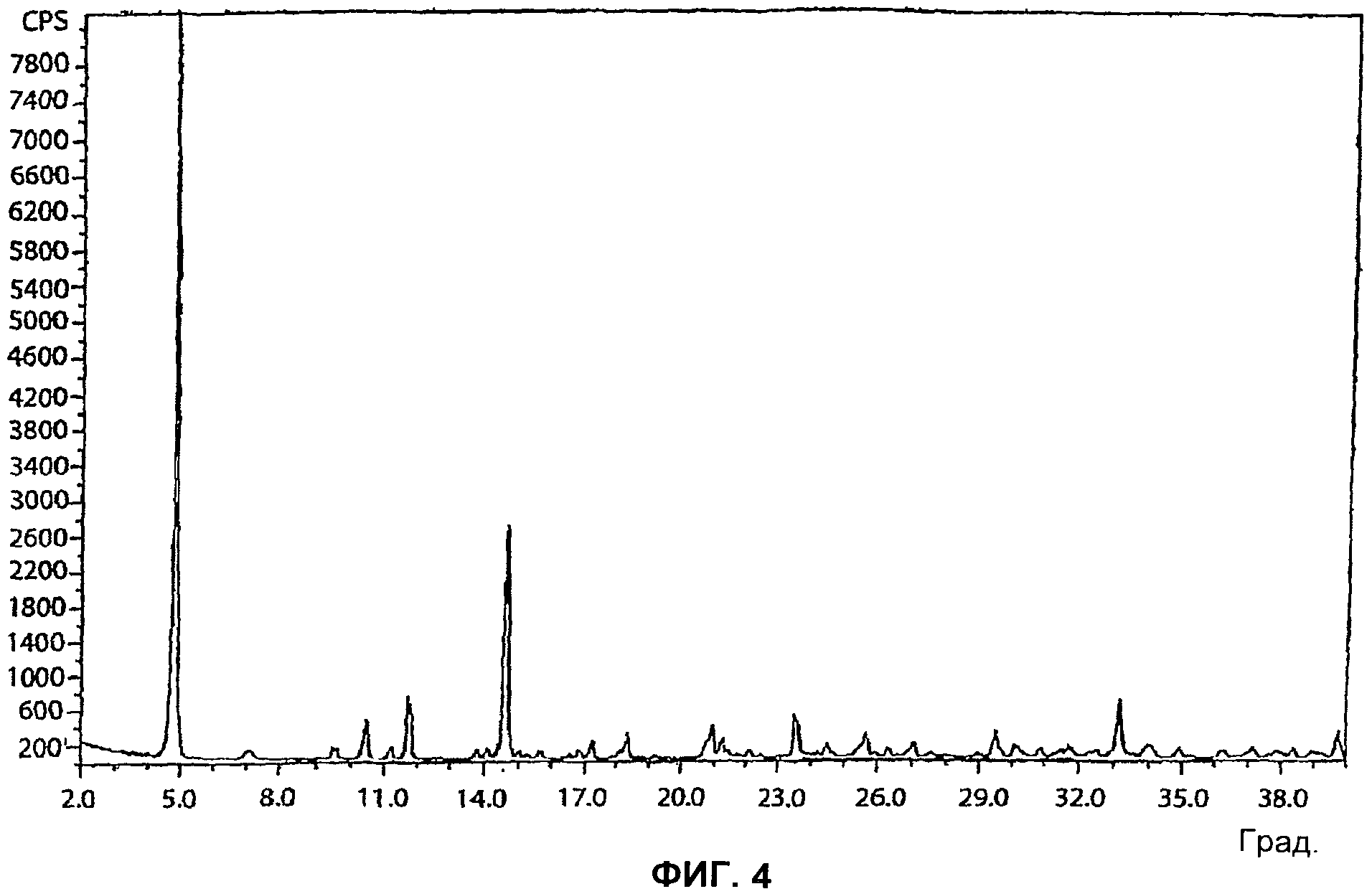
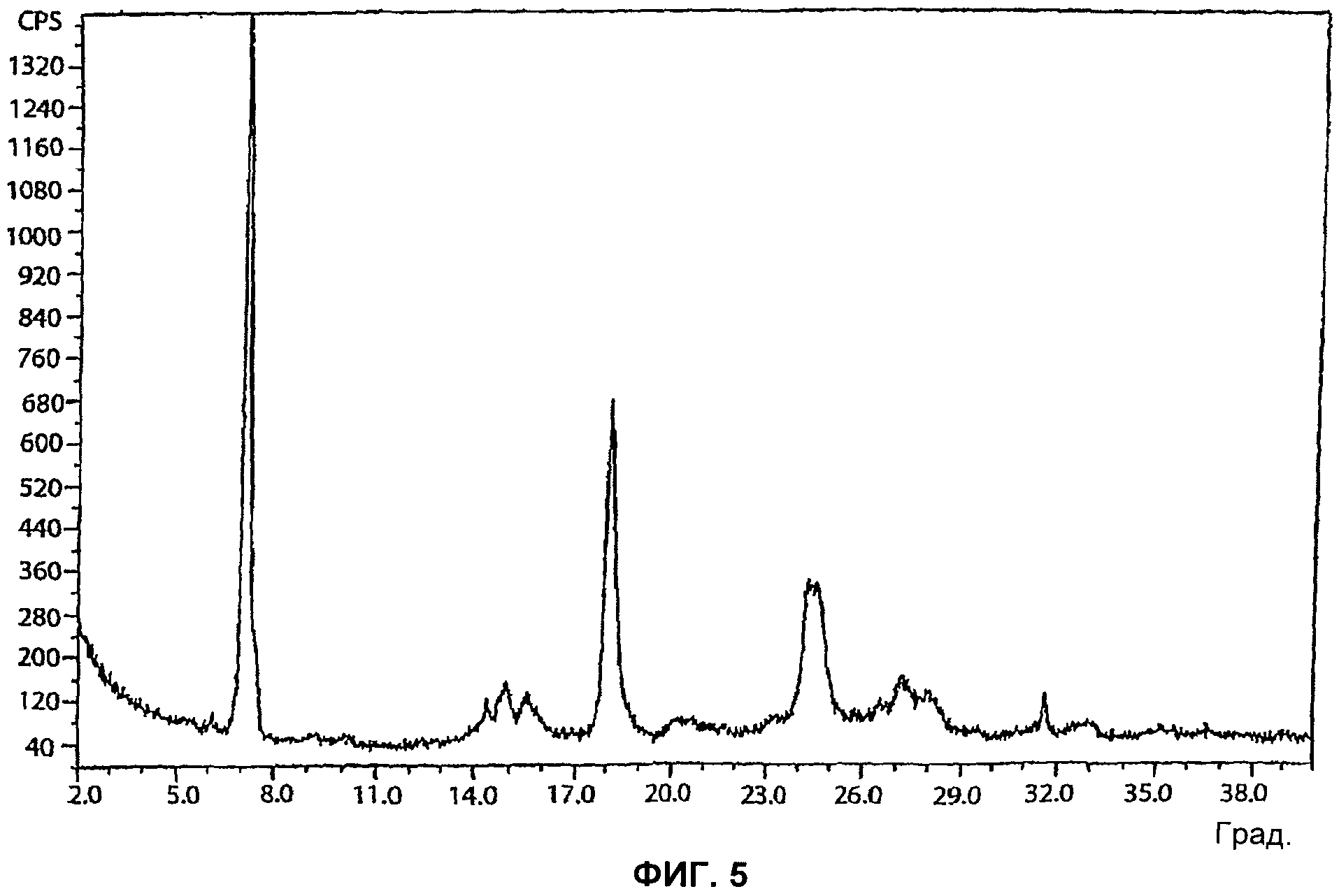
[16] Фигуры 1, 3, 4 и 5 представляют собой порошковые рентгенограммы (X-ray powder diffractogram, XRPD) форм I-IV 5-CNAC, соответственно, полученных в примерах 1-4 (верхние спектры на фигуре 3 - спектры формы II).
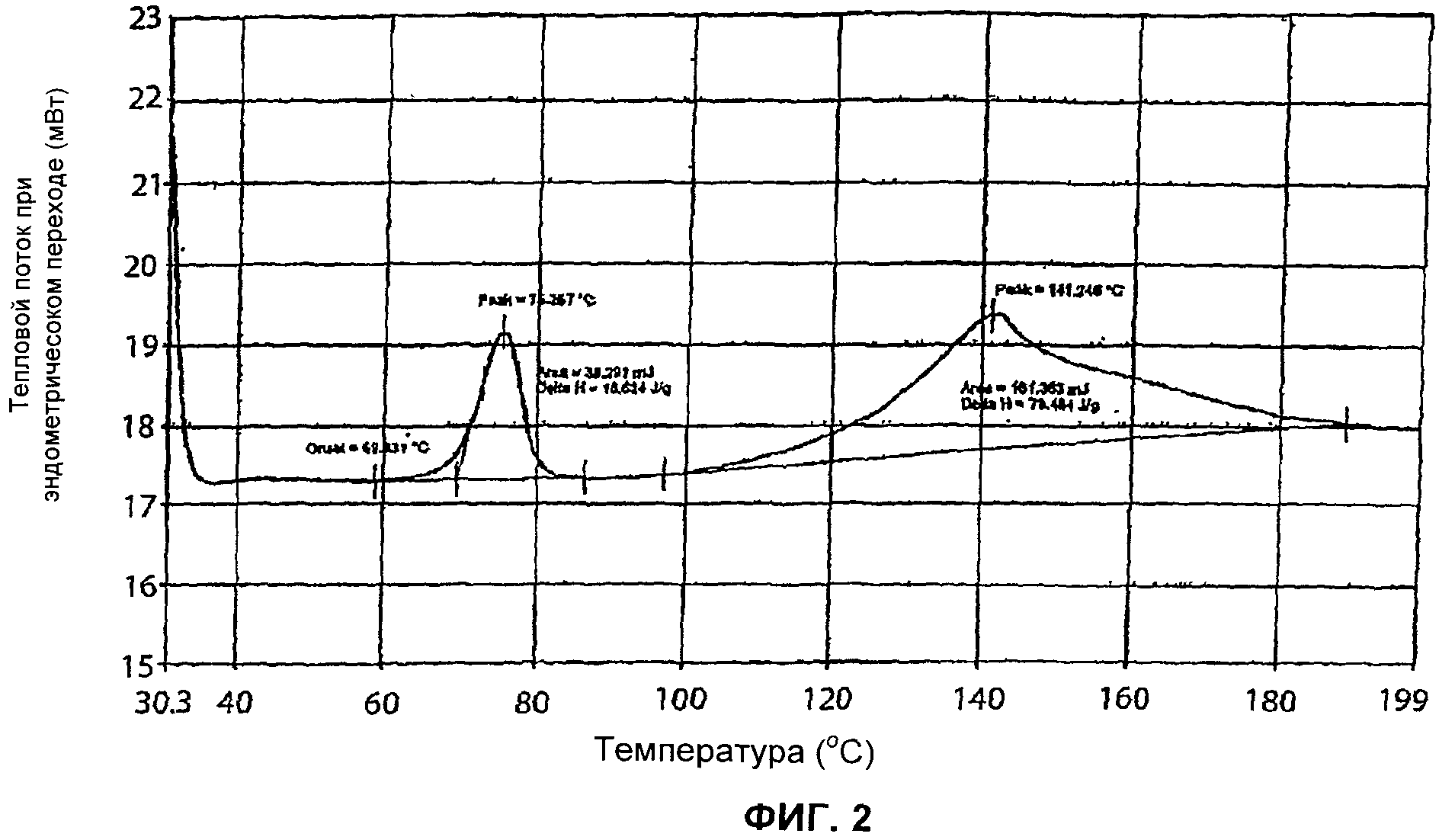
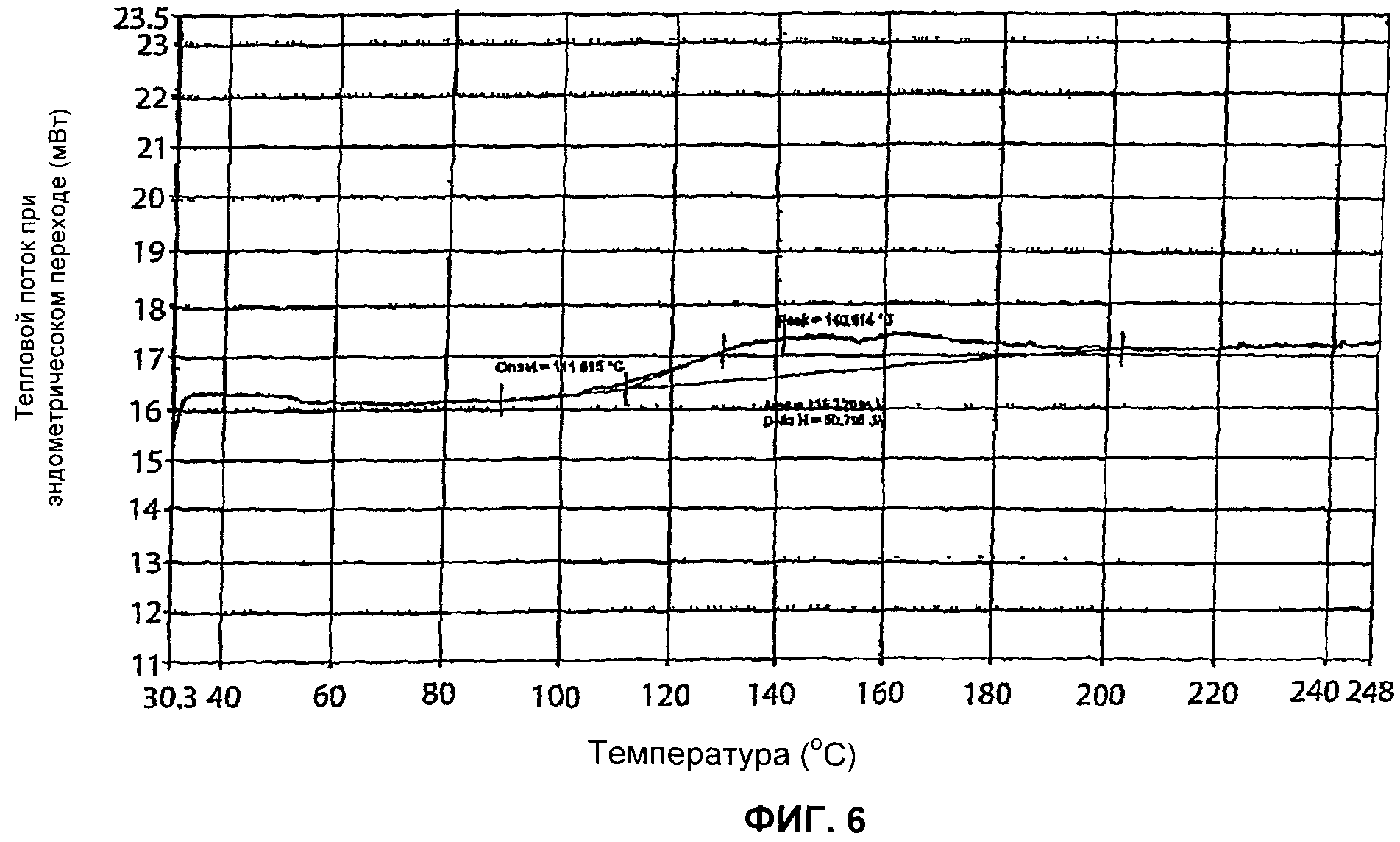
[17] На Фигурах 2 и 6 представлены результаты анализа методом дифференциальной сканирующей калориметрии (differential scanning calorimetry, DSC) для форм I и IV 5-CNAC, соответственно, полученных в примерах 1 и 4.
Подробное описание изобретения
Определения
[18] Термин "полиморф" относится к различным кристаллическим формам одного вещества.
[19] Термин "гидрат", используемый в настоящем описании, включает без ограничения кристаллическое вещество, содержащее одну или более молекул воды в определенном отношении в качестве составной части кристалла, или кристаллический материал, содержащий свободную воду.
[20] Термин "5-CNAC", используемый в настоящем описании, относится к динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты. Если не указано иное, термин "5-CNAC" в настоящем описании относится ко всем полиморфам 5-CNAC.
[21] Термин "моногидрат 5-CNAC", используемый в настоящем описании, относится к кристаллической форме 5-CNAC, в которой с каждой молекулой 5-CNAC связана одна молекула воды.
[22] Термин "октагидрат 5-CNAC", используемый в настоящем описании, относится к кристаллической форме 5-CNAC, в которой с каждой молекулой 5-CNAC связано восемь молекул воды.
[23] Термин "сольват", используемый в настоящем описании, включает без ограничения молекулярный или ионный комплекс молекул или ионов растворителя с молекулами или ионами 5-CNAC. Термин "со-сольват" используемый в настоящем описании, включает без ограничения молекулярный или ионный комплекс молекул или ионов двух или более растворителей с молекулами или ионами 5-CNAC.
[24] Термин "средство доставки", используемый в настоящем описании, относится к 5-CNAC, включая ее кристаллические формы.
[25] "Эффективное количество лекарственного препарата" представляет собой количество активного агента (например, гепарина, кальцитонина, гормона паращитовидной железы или рекомбинантного гормона роста человека), которое является эффективным для лечения или предотвращения состояния у живого организма, которому вводят указанный активный агент, в течение некоторого периода времени. Так, например, эффективное количество лекарственного препарата обеспечивает терапевтический эффект в течение заданного интервала между приемами лекарственного средства. Как известно специалистам в данной области техники, эффективные дозы изменяются в зависимости от способа введения, используемых наполнителей, а также от того, применяют ли активный агент совместно с другими агентами в рамках терапии, направленной на лечение указанного состояния.
[26] Термин "лечить", "лечение" или "подвергаемый лечению" относится к введению активного агента с целью излечения, исцеления, ослабления, облегчения, изменения, устранения, улучшения, оздоровления или воздействия на состояние (например, на заболевание), на симптомы состояния или на предрасположенность к состоянию.
[27] "Эффективное количество средства доставки" представляет собой количество средства доставки, которое обеспечивает абсорбцию заданного количества активного агента при любом способе введения (в том числе при способах введения, рассматриваемых в настоящей заявке, включая без ограничения пероральный (например, в желудочно-кишечный тракт через биологическую мембрану), назальный, пульмонарный, дермальный, вагинальный и/или окулярный способы).
[28] Термин "кальцитонин", используемый в настоящем описании, относится ко всем формам кальцитонина, включая без ограничения кальцитонин человека, лосося, свиньи и угря, в том числе из природных, синтетических или рекомбинантных источников, а также производные кальцитонина, в частности, 1,7-Asu-кальцитонин угря. Предпочтительным является синтетический кальцитонин лосося.
[29] Термин "гормон паращитовидной железы" относится ко всем видам гормона паращитовидной железы, природного и синтетического, его фрагментам и агонистам. Так, например, указанный гормон паращитовидной железы может включать, в частности, но без ограничения гормон [1-36] паращитовидной железы человека и гормон [1-34] паращитовидной железы человека.
[30] Термин "инсулин" относится ко всем видам инсулина, природного и синтетического, включая без ограничения рекомбинантный инсулин человека.
[31] Термин "гормон роста" относится ко всем видам гормона роста, природного и синтетического, включая без ограничения гормон роста человека (например, рекомбинантный гормон роста человека).
[32] Термин "фрагменты" активных агентов, используемый в настоящем описании, относится к процессированным формам активного агента, которые при введении субъекту оказывают физиологическое воздействие, аналогичное воздействию непроцессированного активного агента. Термин "аналоги" активных агентов, используемый в настоящем описании, относится к незначительно модифицированным формам активного агента, которые при введении субъекту оказывают физиологическое воздействие, аналогичное воздействию активного агента, которому соотвествует аналог. Следует понимать, что аналоги активных агентов (например, аналоги инсулина, предложенные в патенте США №5474978) и фрагменты активных агентов (например, фрагменты РТН, предложенные в настоящей заявке) можно вводить совместно с формами I-IV 5-CNAC, при этом эффективность такого введения аналогична эффективности введения самого активного агента (например, инсулина и РТН) совместно с формами I-IV 5-CNAC.
[33] Используемый в настоящем описании термин "примерно" обозначает возможное расхождение в пределах до 10% от заданной величины, предпочтительно - в пределах до 5%, и более предпочтительно - в пределах до 1% от заданной величины. Альтернативно, термин "примерно" означает, что значение может находиться в пределах научно допустимого интервала расхождений для данного вида величин, который зависит от точности измерений, которая может быть обеспечена с помощью имеющихся средств.
Моногидратная форма I 5-CNAC
[34] Форма I 5-CNAC представляет собой моногидрат.Форма I является наиболее стабильной из форм I-IV при комнатной температуре. Согласно результатам анализа методом дифференциальной сканирующей калориметрии (differential scanning calorimetry, DSC), форма I характеризуется первым эндотермическим переходом с температурой начала перехода примерно 69°C (69,3°C) и максимумом примерно при 76°C (75,2°C) и последующим вторым широким эндотермическим переходом с температурой начала перехода примерно 98°С и максимумом примерно при 140°C (141,2°C) (см. фигуру 2). Порошковая рентгенограмма (XRPD) формы I 5-CNAC по существу идентична рентгенограмме, представленной на фигуре 1. Так, например, форма I имеет характеристический пик при 15,5° 2θ±0,2 или 0,1°2θ. Положение характеристических пиков XRPD (выраженное в градусах 2θ±0,2, 0,1, 0,05 или 0,01°2θ) и значения межплоскостного расстояния (d-spacing) для формы I представлены ниже в таблице 1.
[35] Форму I можно получить согласно способам, описанным выше и в примере 1.
[36] В настоящем изобретении также предложен фармацевтический состав, содержащий форму I 5-CNAC, в котором менее, чем 90, 80, 70 или 60% 5-CNAC представляют собой кристаллический материал (относительно 100% общей массы 5-CNAC).
[37] В настоящем изобретении предложен также фармацевтический состав, например, в виде таблетки, содержащий подвергнутую размолу (например, в шаровой мельнице) или прямому прессованию смесь формы I 5-CNAC и по меньшей мере одного активного агента и/или фармацевтически приемлемой добавки (в частности, одну из описанных ниже). Предпочтительно указанный фармацевтический состав (или подвергнутая размолу или прямому прессованию смесь) содержит по меньшей мере 50, 60, 70, 80, 90, 95, 96, 97, 98 или 99% масс, формы I относительно общей массы 5-CNAC в фармацевтическом составе (или смеси, подвергнутой размолу или прямому прессованию).
Форма II 5-CNAC
[38] Форма II представляет собой моноэтанолсольват 5-CNAC. Порошковая рентгенограмма формы II 5-CNAC по существу идентична рентгенограмме, представленной на фигуре 3. Так, например, форма II имеет характеристический пик при 16,5°2θ±0,2 или 0,1°2θ. Положение характеристических пиков на рентгенограмме (выраженное в градусах 2θ±0,2, 0,1, 0,05 или 0,01°2θ) и межплоскостные расстояния (d-spacing) для формы I представлены ниже в таблице 2.
[39] Форму II 5-CNAC можно получить согласно способам, описанным выше и в примере 2.
Октагидратная форма III 5-CNAC
[40] Форма III представляет собой октагидрат 5-CNAC. Форма III является нестабильной при относительной влажности ниже примерно 50%. Порошковая рентгенограмма формы III 5-CNAC по существу идентична рентгенограмме, представленной на фигуре 4. Так, например, форма III имеет характеристический пик при 4,8°2θ±0,2 или 0,1°2θ. Положение характеристических пиков на рентгенограмме (выраженное в градусах 2θ±0,2, 0,1, 0,05 или 0,01°2θ) и межплоскостное расстояние (d-spacing) для формы III представлены ниже в таблице 3.
[41] Форму III можно получить согласно способам, описанным выше и в примере 3. Так, например, форму III можно получить путем выдержки динатриевой соли 5-CNAC (в частности, ее этанольного сольвата) при относительной влажности 75% (или выше) по меньшей мере в течение шести дней.
[42] В настоящем изобретении предложен также фармацевтический состав, например, в виде таблетки, содержащий подвергнутую прямому прессованию смесь формы III 5-CNAC и по меньшей мере одного активного агента и/или фармацевтически приемлемой добавки (в частности, одной из описанных ниже). Предпочтительно указанный фармацевтический состав (или подвергнутая размолу или прямому прессованию смесь) содержит по меньшей мере 50, 60, 70, 80, 90, 95, 96, 97, 98 или 99% масс. формы III относительно общей массы 5-CNAC в фармацевтическом составе (или подвергнутой прямому прессованию смеси).
Моногидратная форма IV 5-CNAC
[43] Форма IV 5-CNAC представляет собой моногидрат.Порошковая рентгенограмма формы IV 5-CNAC по существу идентична рентгенограмме, представленной на фигуре 5. Так, например, форма IV имеет характеристические пики при 7,2° и/или 18,2°2θ±0,2 или 0,1°2θ. Положение характеристических пиков на рентгенограмме (выраженное в градусах 2θ±0,2, 0,1, 0,05 или 0,01°2θ) и межплоскостное расстояние для формы IV представлены ниже в таблице 4.
[44] Форму IV можно получить согласно способам, описанным выше и в примере 4.
[45] В настоящем изобретении предложен также фармацевтический состав, содержащий форму IV 5-CNAC, в котором по меньшей мере 50, 60, 70, 80 или 90% 5-CNAC представляют собой кристаллический материал относительно 100% массы 5-CNAC.
Смесь Форм I и IV 5-CNAC
[46] Формы I и IV 5-CNAC представляют собой моногидраты. Положение характеристических пиков на порошковой рентгенограмме (выраженное в градусах 2θ±0,2, 0,1, 0,05 или 0,01°2θ) и межплоскостное расстояние для указанной смеси представлены ниже в таблице 5.
[47] Указанную смесь можно получить согласно способам, описанными выше и в примере 5.
[48] Кристаллы, полученные согласно вышеописанным способам, могут быть выделены любым из способов, известных из уровня техники.
Активные агенты
[49] Активные агенты, подходящие для применения в соответствии с настоящим изобретением, включают биологически активные агенты и химически активные агенты, включая без ограничения пестициды, фармакологические агенты и терапевтические агенты. Подходящие активные агенты включают такие агенты, которые становятся менее эффективными, неэффективными или распадаются в желудочно-кишечном тракте в результате кислотного гидролиза, под действием ферментов и т.п.Кроме того, к подходящим активным агентам относятся макромолекулярные агенты, физико-химические характеристики которых, в частности, размер, структура или заряд, препятствуют абсорбции или замедляют ее при пероральном приеме.
[50] Так, например, биологически или химически активные агенты, подходящие для применения согласно настоящему изобретению, включают без ограничения белки, полипептиды, пептиды, гормоны, полисахариды и, в частности, смеси мукополисахаридов, углеводы, липиды, небольшие полярные органические молекулы (т.е. полярные органические молекулы с молекулярной массой 500 дальтонов или менее), а также другие органические соединения, в частности, соединения, которые, взятые в отдельности, не всасываются (или всасываются лишь частично) слизистой облочкой желудочно-кишечного тракта, и/или соединения, которые подвергаются химическому разложению под действием кислот и ферментов в желудочно-кишечном тракте, или их комбинации.
[51] Другие примеры включают без ограничения следующие синтетические, природные или рекомбинантные источники активных агентов: гормоны роста, включая гормоны роста человека (hGH), рекомбинантные гормоны роста человека (rhGH), бычьи гормоны роста и свиные гормоны роста; гормоны, высвобождающие гормоны роста; рилизинг-фактор гормонов роста; интерфероны, включая а (например, интерферон альфакон-1 (выпускаемый под торговым названием Infergen® компанией InterMune, Inc. of Brisbane, CA)), [3 и у; интерлейкин-1, интерлейкин-2; инсулин, включая свиной, бычий и рекомбинантный инсулин человека, который может дополнительно содержать противоионы, включая ионы цинка, натрия, кальция и аммония; инсулиноподобный фактор роста, включая IGF-1; гепарин, включая нефракционированный гепарин, гепариноиды, дерматаны, хондроитины, гепарин с низкой молекулярной массой, гепарин с очень низкой молекулярной массой и гепарин со сверхнизкой молекулярной массой; кальцитонин, включая кальцитонин лосося, угря, свиньи и человека; эритропоэтин, предсердный натрийуретический фактор, антигены, моноклональные антитела, соматостатин, ингибиторы протеазы, адренокортикотропин, гонадотропин- высвобождающий гормон, окситоцин, гормон, высвобождающий лютеинизирующий гормон; фолликостимулирующий гормон; глюкоцереброзидазу, тромбопоэтин, филграстим, простагландины, циклоспорин, вазопрессин, кромолин-натрий (натриевый или динатриевый кромогликат), ванкомицин, дезферриоксамин (desferrioxamine, DFO), бисфосфонаты, включая алендронат, тилудронат, этидронат, клодронат, памидронат, олпадронат и инкадронат; гормон паращитовидной железы (РТН), включая его фрагменты; противомигреневые агенты, в частности, BIBN-4096BS и другие генетически родственные кальцитонину белковые антагонисты, глюкагоноподобный пептид 1 (GLP-1); аргатробан, противомикробные агенты, включая антибиотики, противобактериальные и противогрибковые агенты, витамины, аналоги, фрагменты, миметики или модифицированные полиэтиленгликолем (PEG) производные этих соединений или их любые комбинации. Неограничительные примеры антибиотиков включают антибиотики, активные по отношению к грам-положительным микроорганизмам, бактерицидные, липопептидные и циклические пептидные антибиотики, в частности, даптомицин и его аналоги.
[52] Согласно одному из вариантов реализации изобретения активный агент представляет собой фармакологически активный пептид, в частности, агент, проявляющий активность по отношению к костной ткани (например, кальцитонин). Агенты, проявляющие активность по отношению к костной ткани, включают классы агентов, которые проявляют фармакологическую активность в организме животных in vivo, в частности, обеспечивают стабилизацию, регенерацию или рост костей, замедление или ингибирование ремоделирования костей, замедление или ингибирование резорбции костей, ингибирование активности остеокластов и стимулирование активности остеобластов. Некоторые из этих агентов могут быть пептидными, например, кальцитонины, гормон паращитовидной железы (РТН), фрагменты РТН (например, РТН[1-34]), трансформирующие факторы роста (Transforming Growth Factors, TGFs), а также аналоги и фрагменты вышеуказанных агентов. Агенты, проявляющие активность по отношению к костной ткани, также могут представлять собой небольшие молекулярные непептидные структуры, которые проявляют in vivo фармакологическую активность по отношению к костной ткани, как указано выше в данном абзаце.
[53] Известный класс таких фармакологически активных агентов - кальцитонинов - обладает широким спектром фармацевтических применений и обычно используется для лечения, например, болезни Педжета, гиперкальциемии и остеопороза (включая без ограничения постменопаузальный остеопороз). Различные виды кальцитонина, включая кальцитонин лосося, свиньи и угря, выпускаются серийно и широко используются для лечения, например, болезни Педжета, гиперкальциемии при злокачественных опухолях и остеопороза. Кальцитонин может представлять собой любой вид кальцитонина (например, человека, лосося, свиньи или угря), включая природные, синтетические или рекомбинантные источники кальцитонина, а также производные кальцитонина, в частности, 1,7-азу-кальцитонин угря (1,7-Asu-eel calcitonin). Составы могут содержать кальцитонин одного вида или комбинацию двух или более видов кальцитонина. Предпочтительным является синтетический кальцитонин лосося.
[54] Различные виды кальцитонина имеются в продаже и могут быть синтезированы известными способами.
[55] Если фармакологически активный агент представляет собой кальцитонин лосося, то соответствующая дозировка зависит, например, от организма, а также от природы и тяжести состояния, подвергаемого лечению. Подходящие дозировки приведены в международных публикациях патентов WO 2004/012772, WO 2005/004900 и WO 2005/014031, каждый из которых включен в настоящую заявку посредством ссылки. Доза для перорального приема кальцитонина лосося для человека обычно находится в пределах примерно от 0,05 мг до 5 мг, предпочтительно примерно от 0,1 мг до 2,5 мг при введении в комбинации со средством доставки, подходящим для перорального введения (например, 5-CNAC). Согласно одному из вариантов реализации настоящего изобретения пациенту, например, человеку, в частности, среднему человеку с массой тела примерно 70 кг, вводят ежедневно примерно от 0,4 мг до примерно 2,5 мг кальцитонина лосося. Более предпочтительно ежедневно вводят от примерно 0,8 до примерно 1,2 мг, например, примерно 1 мг. Предпочтительны также дозы менее 1 мг, но более 0,4 мг.
[56] Подходящие дозы гормона паращитовидной железы указаны в международных публикациях патентов WO 2005/002549, WO 03/015822 и WO 02/098453, каждый из которых включен в настоящую заявку посредством ссылки. Гормон паращитовидной железы вводят в количестве, эффективном для достижения заданных физиологических состояний. Согласно одному из вариантов реализации настоящего изобретения количество паратироидного компонента (например, РТН, РТН[1-28] - РТН[1-41]) представляет собой количество, составляющее суточную вводимую дозу компонента РТН от примерно 0,001 мкг/кг до примерно 10 мг/кг массы тела животного или от примерно 1 мкг/кг до примерно 6 мкг/кг массы тела животного. Стандартные лекарственные формы могут содержать, например, 800 мкг компонента РНТ. Конкретные дозы РТН для конкретных применений изменяются в зависимости от возраста, конституции, пола и состояния субъекта, подвергаемого лечению, и могут быть определены специалистами в данной области техники.
[57] Дозы HGH (гормона роста человека) или компонента HGH также могут быть определены специалистами в данной области техники. Согласно одному из вариантов реализации настоящего изобретения количество HGH (например, остатка 191 аминокислоты (соматропина)) или компонента HGH (например, N-концевой метиониновый остаток (met) 192 аминокислоты (соматрем)) представляет собой количество, содержащееся в стандартной лекарственной форме, и составляет от примерно 10 мг до примерно 300 мг HGH или компонента HGH (например, 100 мг HGH или компонента HGH). Конкретные дозы HGH для конкретных применений изменяются в зависимости от возраста, конституции, пола и состояния субъекта, подвергаемого лечению, и могут быть определены специалистами в данной области техники.
[58] Содержание фармакологически активного агента в общем случае составляет от примерно 0,05 процента до примерно 70 процентов масс, относительно общей массы фармацевтического состава, предпочтительно от примерно 0,01 процента до примерно 50 процентов масс, более предпочтительно от примерно 0,3 процента до примерно 30 процентов масс, относительно общей массы фармацевтического состава.
Фармацевтические составы
[59] Фармацевтический состав предпочтительно находится в твердом виде и может представлять собой лекарственную форму (например, твердую лекарственную форму, в частности, твердую лекарственную форму для перорального приема). Указанная твердая лекарственная форма может представлять собой капсулу, таблетку или измельченный материал, например, порошок или саше. Порошок может быть в виде саше, которое смешивают с жидкостью перед введением. Порошок может быть также заключен в капсулы или спрессован в таблетки, или же может вводиться субъекту в исходном виде.
[60] Альтернативно, твердая лекарственная форма может представлять собой топическую систему доставки, в частности, мазь, крем или полутвердый состав. Так, например, порошки можно добавлять к топическим наполнителям (например, к полиэтиленгликолю) и вводить в виде мази.
[61] Фармацевтический состав может содержать систему с замедленным или регулируемым высвобождением. Твердая лекарственная форма предпочтительно представляет собой форму для перорального введения.
[62] Содержание средства доставки в твердой лекарственной форме представляет собой количество, эффективное для доставки, которое можно определить для каждого конкретного соединения или биологически или химически активного агента способами, известными специалистам в данной области техники.
[63] После введения активный агент, содержащийся в стандартной лекарственной форме, поступает в систему кровообращения. Биологическая доступность активного агента может быть легко установлена путем измерения известной фармакологической активности в крови, например, увеличения времени свертывания крови, вызываемого гепарином, или уменьшения уровня кальция в крови, вызываемого кальцитонином. Альтернативно можно непосредственно определить содержание активного агента в крови.
[64] Твердая лекарственная форма может содержать фармацевтически приемлемые добавки, в частности, формообразующие агенты, носители, разбавители, стабилизаторы, пластификаторы, связующие, вещества, способствующие скольжению, дезинтегрирующие агенты, наполнители, смазывающие вещества, красители, пленкообразующие агенты, ароматизаторы, консерванты, поверхностно-активные вещества, а также любые сочетания вышеуказанных компонентов. Указанные добавки предпочтительно представляют собой фармацевтически приемлемые добавки, в частности, описанные в работе Remington′s, The Science и Practice of Pharmacy. (Gennaro, A.R., ed., 19th edition, 1995, Mack Pub. Co.), которая включена в настоящее описание посредством ссылки.
[65] Подходящие связующие включают без ограничения крахмал, желатин, сахара (в частности, сахарозу, мелассу и лактозу), дигидрат двухосновного фосфата кальция, природные и синтетические камеди, в частности, гуммиарабик, альгинат натрия, карбоксиметилцеллюлозу, метилцеллюлозу, поливинилпирролидон, полиэтиленгликоль, этилцеллюлозу и воски.
[66] Подходящие вещества, способствующие скольжению, включают без ограничени, тальк и диоксид кремния (кремнезем) (например, пирогенный кремнезем и коллоидный диоксид кремния).
[67] Подходящие дезинтегрирующие агенты включают, без ограничения, крахмалы, натриевую соль гликолята крахмала, кроскармелозу натрия, кросповидон, глины, целлюлозы (в частности, очищенную целлюлозу, метилцеллюлозу, натрийкарбоксиметилцеллюлозу), альгинаты, предварительно желатинизированные кукурузные крахмалы и камеди (в частности, камеди агара, гуара, плодов рожкового дерева, карайи, пектина и трагаканта). Предпочтительным дезинтегрирующим агентом является натриевая соль гликолята крахмала.
[68] Подходящие наполнители включают без ограничения крахмалы (например, рисовый крахмал), микрокристаллическую целлюлозу, лактозу (например, моногидрат лактозы), сахарозу, декстрозу, маннитол, сульфат кальция, дикальцийфосфат и трикальцийфосфат.
[69] Подходящие смазывающие вещества включают без ограничения стеариновую кислоту, стеараты (в частности, стеарат кальция и стеарат магния), тальк, борную кислоту, бензоат натрия, ацетат натрия, фумарат натрия, хлорид натрия, полиэтиленгликоль, гидрированное хлопковое и касторовое масла.
[70] Подходящие поверхностно-активные вещества включают без ограничения лаурилсульфат натрия, гидроксилированный соевый лецитин, полисорбаты и блок-сополимеры полипропиленоксида и этиленоксида.
[71] Фармацевтически приемлемые неактивные наполнители могут включать полимеры и инертные соединения, которые, например, способствуют приготовлению или промышленному получению твердой лекарственной формы для перорального приема согласно настоящему изобретению или могут способствовать высвобождению твердого состава для перорального приема в желудочно-кишечном тракте.
[72] Согласно другому варианту реализации настоящего изобретения фармацевтически приемлемый инертный наполнитель может представлять собой кросповидон или повидон, или оба указанных полимера.
[73] Вышеуказанные фармацевтические ин ертные ингредиенты могут включать любые кросповидоны и повидоны. Кросповидон представляет собой синтетический сшитый гомополимер N-винил-2-пирролидона, называемый также 1-этенил-2-пирролидиноном и имеющий молекулярную массу 1000000 или более. Выпускаемые кросповидоны включают Polyplasdone XL, PolyplasdoneXL-10, Polyplasdone INF-10 производства ISP и Kollidon CL производства BASF Corporation. Предпочтительным кросповидоном является Polyplasdone XL.
[74] Повидон представляет собой синтетический полимер, который состоит из групп линейного 1-винил-2-пирролидинона и имеет молекулярную массу, как правило, от 2500 до 3000000. Выпускаемые повидоны включают Kollidon K-30, Kollidon K-90F производства BASF Corporation, а также Plasdone K-30 и Plasdone K-29/32 производства ISP.
[75] Как указано выше, кросповидоны и повидоны доступны для приобретения. Альтернативно их можно синтезировать известными способами.
[76] Содержание в составах кросповидона, повидона или их комбинации обычно составляет примерно от 0,5 процента до 50 процентов масс.относительно общей массы фармацевтического состава, предпочтительно примерно от 2 процентов до 25 процентов, более предпочтительно от 5 процентов до 20 процентов масс, относительно общей массы фармацевтического состава.
Системы доставки
[77] Содержание активного агента в фармацевтическом составе согласно настоящему изобретению представляет собой количество, эффективное для реализации назначения конкретного активного агента при конкретном показании. Содержание активного агента в фармацевтическом составе обычно представляет собой фармакологически, биологически, терапевтически или химически эффективное количество. Однако содержание активного агента может быть меньше, чем указанное количество, в случае применения указанного состава в виде стандартной лекарственной формы, поскольку стандартная лекарственная форма может содержать множество соединений, выступающих в качестве средств доставки/составов, содержащих активные агенты, или может содержать часть фармакологически, биологически, терапевтически или химически эффективного количества. В этом случае общее эффективное количество можно вводить в виде кумулятивных доз, которые в сумме содержат эффективное количество активного агента.
[78] Общее количество активного агента, которое необходимо ввести, может быть установленосогласно способам, известнымиспециалистам в данной области техники. Однако, поскольку составы согласно настоящему изобретению могут доставлять активные агенты более эффективно, чем другие составы или составы, содержащие только активный агент, субъекту можно вводить меньшие дозы биологически или химически активных агентов по сравнению с известными стандартными лекарственными формами или системами доставки при обеспечении тех же содержаний активного агента в крови и/или тех же терапевтических эффектов.
[79] В общем случае соотношение массы средства доставки (например, 5-CNAC) и массы активного агента (например, HGH или компонента HGH, РТН или фрагмента РТН) составляет от примерно 0,1:1 до примерно 300:1 или 1000:1. Согласно одному из вариантов реализации изобретения соотношение массы средства доставки (например, 5-CNAC) и массы активного агента (например, HGH или компонента HGH, РТН или фрагмента РТН) составляет от примерно 50:1 или 40:1 до примерно 0,5:1 или 0,2:1. Согласно одному из вариантов реализации изобретения соотношение массы средства доставки (например, 5-CNAC) и массы активного агента (например, HGH или компонента HGH, РТН или фрагмента РТН) составляет от примерно 10:1 до примерно 0,5:1 (в частности, 2:1). Весовое соотношение для средства доставки (например, 5-CNAC) рассчитывают, исходя из формы свободной кислоты в составе средства доставки. Это соотношение изменяется в зависимости от активного агента и конкретного показания, в соответствии с которым вводят активный агент.
[80] Средства доставки согласно настоящему изобретению обеспечивают доставку биологически и химически активных агентов, в частности, в составе систем доставки, подходящих для перорального, сублингвального, трасбуккального, интрадуоденального, внутритолстокишечного, ректального, вагинального, мукозального, пульмонарного, интраназального и окулярного введения.
[81] Соединения и составы согласно настоящему изобретению подходят для введения биологически или химически активных агентов любым животным, включая без ограничения птиц, в частности, кур; млекопитающих, в частности, грызунов, коров, свиней, собак, кошек, приматов, в частности, человека; и насекомых.
[82] Указанные соединения и составы особенно предпочтительны для доставки химически или биологически активных агентов, которые в ином случае распадаются или становятся менее эффективными прежде чем активный агент достигает заданной области (т.е. области, где активный агент должен высвобождаться из средства доставки) в организме животного, которому их вводят. В частности, соединения и составы согласно настоящему изобретению подходят для перорального введения активных агентов, в частности, активных агентов, которые обычно не подходят для пероральной доставки или нуждаются в улучшении доставки.
[83] Составы, содержащие указанные соединения и активные агенты, используют для доставки активных агентов в заданные биологические системы и для увеличения или улучшения биологической доступности активного агента по сравнению с введением активного агента без средства доставки. Доставку можно усовершенствовать путем осуществления доставки более активного агента в течение неопределенного периода времени или доставки активного агента в течение заданного периода времени (в частности, путем осуществления ускоренной или замеделенной доставки) или в течение некоторого периода времени (в частности, непрерывной доставки).
[84] Согласно другому варианту реализации в настоящем изобретении предложен способ лечения или предотвращения заболевания или способ достижения заданных физиологических эффектов, в частности, указанных в приведенной ниже таблице, у животного путем введения состава согласно настоящему изобретению. Конкретные показания для активных агентов можно найти в работе Physicians′ Desk Reference (59th Ed., 2005, Medical Economics Company, Inc., Montvale, NJ), которая включена в настоящую заявку посредством ссылки. Активные агенты в приведенной ниже таблице включают аналоги, фрагменты, миметики и производные, модифицированные полиэтиленгликолем, указанных активных агентов.
[85] Согласно другому варианту реализации в настоящем изобретении предложен способ лечения нарушения, на которое оказывает воздействие кальцитонин, в частности, болезни Педжета, гиперкальциемии или остеопороза (например, лечение постменопаузального остеопороза у женщин, у которых постменопаузальный период длится более пяти лет и низкая костная масса по сравнению со здоровыми женщинами в пременопаузальном возрасте) у млекопитающего (например, у человека), нуждающегося в таком лечении, путем перорального введения фармацевтического состава согласно настоящему изобретению, содержащего формы I, II, III и/или IV 5-CNAC и кальцитонин. Указанный фармацевтический состав вводят предпочтительно на голодный желудок, преимущественно незадолго до приема пищи, чтобы увеличить биологическую доступность кальцитонина при пероральном введении.
[86] Согласно другому варианту реализации в настоящем изобретении предложен способ лечения нарушения, на которое оказывает воздействие гормон роста человека, в частности, нарушений роста (например, малый рост) у млекопитающего (например, у человека), нуждающегося в таком лечении, путем перорального введения фармацевтического состава согласно настоящему изобретению, содержащего формы I, II, III и/или IV 5-CNAC и гормон роста человека. Другие примеры состояний, поддающихся лечению, или эффектов, которые могут быть достигнуты с помощью фармацевтических составов согласно настоящему изобретению, содержащих формы I, II, III и/или IV 5-CNAC и гормон роста человека, включают длительное лечение детей с нарушением роста, связанным с нарушенной секреции эндогенного гормона роста, длительное лечение детей с нарушением роста, связанным с синдромом Прадера-Вилли (Prader-Willi syndrome, PWS), малого роста, связанного с синдромом Турнера, у пациентов с незакрытым эпифизом, детей с идиопатической низкорослостью, длительную заместительную терапиюие у взрослых, страдающих дефицитом гормона роста (growth hormone deficiency, GHD) с этиологией в детском или зрелом возрасте (например, дефицит гормона роста, связанный с заболеванием гипофиза, заболеванием гипоталамуса, хирургической операцией, лучевой терапии, хронической почечной недостаточностью или травмой), и длительное лечение нарушения роста у детей, родившихся маленькими для соответствующего срока беременности, у которых задержки роста не были выявлены до 2 лет.
[87] Согласно следующему варианту реализации в настоящем изобретении предложен способ лечения нарушения, на которое оказывает воздействие гормон паращитовидной железы, в частности, остеопороза (например, остеопороза у женщин в постменопаузальный период, у которых высока опасность переломов), у млекопитающего (например, у человека), нуждающегося в таком лечении, путем перорального введения фармацевтического состава согласно настоящему изобретению, содержащего формы I, II, III и/или IV 5-CNAC и гормон паращитовидной железы. Другие примеры состояний, поддающихся лечению, или эффектов, которые могут быть достигнуты с помощью фармацевтических составов согласно настоящему изобретению, содержащих формы I, II, III и/или IV 5-CNAC и гормон паращитовидной железы, включают повышение костной массы у мужчин с первичным или гипогонадальным остеопорозом, для которых велика опасность переломов.
[88] Согласно другому варианту реализации в настоящем изобретении преложен способ лечения нарушения, на которое оказывает воздействие имитинаб, в частности, хронического миелолейкоза и стромальных опухолей желудочно-кишечного тракта, у млекопитающего (например, у человека), нуждающегося в таком лечении, путем перорального введения фармацевтического состава согласно настоящему изобретению, содержащего формы I, II, III и/или IV 5-CNAC и имитинаб.
[89] Согласно следующему варианту реализации в настоящем изобретении предложен способ лечения нарушения, на которое оказывает воздействие противогриппозная вакцина, в частности, гриппозной инфекции, у млекопитающего (например, у человека), нуждающегося в таком лечении, путем перорального введения фармацевтического состава согласно настоящему изобретению, содержащего формы I, II, III и/или IV 5-CNAC и противогриппозную вакцину.
[90] Согласно другому варианту реализации в настоящем изобретении предложен способ лечения нарушения, на которое оказывает воздействие ранибизумаб, в частности, макулодистрофии (например, влажной макулодистрофии и возрастной макулодистрофии), у млекопитающего (например, у человека), нуждающегося в таком лечении, путем перорального введения фармацевтического состава согласно настоящему изобретению, содержащего формы I, II, III и/или IV5-CNAC и ранибизумаб.
[91] Настоящее изобретение далее иллюстрируется с помощью неограничивающих примеров. Все процентные содержания представляют собой массовые процентные содержания, если не указано иное.
Дифференциальная сканирующая калориметрия (DSC)
[92] Приведенные температуры плавления определеляли методом дифференциальной сканирующей калориметрии. Указанные значения были получены при помощи дифференциального сканирующего калориметра DSC-7 производства компании Перкин Элмер (Perkin Elmer Differential Scanning Calorimeter DSC-7). Кривые DSC были получены при скорости нагревания 20 К/мин и массе образца от 1 до 3 мг.
Порошковый рентгеноструктурный анализ (XRPD)
[93] Порошковый рентгеноструктурный анализ проводили при помощи дифрактометра Scintag X1 и медного излучения Кα1.
Пример 1
Получение формы I 5-CNAC
[94] Форму I 5-CNAC получили следующим способом. Реактор, футерованный стеклом, объемом 200 галлонов (757 л) подготовили для перегонки при атмосферном давлении. Подали охлаждение на холодильнику и приемник. Реактор продули азотом. В реактор загрузили 565 л ацетонитрила. Установили скорость мешалки равной 100 об/мин. Добавили в реактор 13,7 кг дистиллированной воды и 43,25 кг моноэтанолсольвата 5-CNAC. Содержимое реактора нагрели до начала дефлегмации, при этом приемнике начал собираться дистиллят. Перегонку при атмосферном давлении продолжали до получения примерно 102 л дистиллята. Прекращали подачу теплоносителя в рубашку реактора и добавляли в реактор смесь 102 л свежего ацетонитрила и 2,5 кг дистиллированной воды. Содержимое реактора охлаждали до температуры от 5 до 15°C и перемешивали в течение одного-двух часов. Полученную супензию отделяли центрифугированием. Влажный осадок, не промывая, высушивали в вакуумном сушильном шкафу при полном вакууме и температуре от 75 до 85°C в течение 48 часов. Выход моногидрата динатриевой соли 5-CNAC составил примерно 40 кг, что соответствовало примерно 99,9%.
[95] Спектры XRPD и DSC для формы I, полученной, как описано выше, приведены на фигурах 1 и 2, соответственно.
Пример 1А
Получение формы I 5-CNAC
[96] Форму I получили также следующим способом. В Круглодонную пятигорлую колбу из стекла Pyrex glass объемом 22 л оснастили подвесной мешалкой, термопарой для определения температуры и нагревательной рубашкой. В колбу загрузили 2602,3 г 5-CNAC и 4000 мл воды. К данной суспензии при перемешивании добавили раствор 660 г гидроксида натрия в 2000 мл воды. Смесь нагрели до 55°C, при этом основная часть твердого вещества растворилась. Немного помутневший горячий раствор профильтровали через фильтровальную бумагу Whatman №1 для удаления нерастворимых частицы. Фильтрат перенесли в колбу большого лабораторного роторного испарителя. В роторном испарителе процесс проводили при температуре 60°C и давлении 60 мм рт.ст. Воду удаляли из раствора динатриевой соли до тех пор, пока в колбе лабораторного роторного испарителя не образовалась твердая масса. Установку развакуумировали и вынули колбу из роторного испарителя. Твердую массу выгрузили из колбы на поддоны. Затем поместили эти поддоны в вакуумный сушильный шкаф и сушили твердое вещество при 60°С и полном вакууме в течение 48 часов. Высушенную массу подвергали размолу в лабораторной мельнице до тех пор, пока все частицы не проходили через сито 35 меш. Размолотый и просеянный моногидрат динатриевой соли 5-CNAC выложили на поддоны и снова поместили в сушильный шкаф. Продолжали сушку при 45°C и полном вакууме, получив 2957,1 г целевого продукта в виде сухого порошка.
Пример 2
Получение формы II 5-CNAC:
[97] Форму II 5-CNAC получили следующим способом. В реактор из нержавеющей стали объемом 200 галлонов (757 л) загрузили 132 л этанола и 11,6 кг гранулированного гидроксида натрия. Реактор нагрели примерно до 55°C и выдерживали при этой температуре до растворения гидроксида натрия. Раствор гидроксида натрия/этанола охладили и поддерживали температуру раствора на уровне по меньшей мере 25°C. От раствора гидроксида натрия/этанола отобрали пробу для установления основности методом титрования. Во второй реактор, футерованный стеклом, объемом 200 галлонов (757 л) загрузили 135 л этанола и 44,69 кг 5-CNAC. Суспензию нагрели до 55°C при перемешивании. Продолжали перемешивание при этой температуре до растворения твердого вещества. К раствору этанола/5-CNAC при перемешивании добавили два моль-эквивалента (на основании результатов анализа методом титрования) раствора этанола/гидроксида натрия. После добавления раствора гидроксида натрия из раствора начал осаждаться этанольный сольват 5-CNAC. Процесс добавления гидроксида натрия являлся экзотермическим, поэтому его проводили под контролем для предотвращения избыточной дефлегмации. Реактор подготовили для перегонки при атмосферном давлении и отогнали примерно 146 л этанола. Смесь охладили до температуры менее 10°C и выдерживали при этой температуре в течение примерно 4 часов. Твердый продукт отделили с помощью центрифугирования. Осадок после фильтрования поместили в сушильный шкаф и сушили при 45°C и полном вакууме в течение примерно от 16 до 24 часов. Выход сухого моноэтанолсольвата динатриевой соли 5-CNAC составил примерно 43,25 кг.
[98] Спектр XRPD для формы II приведен на фигуре 3.
Пример 3
Получение формы III 5-CNAC:
[99] Форму III получили следующим способом. Моноэтанолсольват динатриевой соли 5-CNAC был распределен тонким слоем по поверхности стеклянного поддона. Поддон с материалом поместили в камеру с изменяемой влажностью при температуре 40°C и относительной влажности 75%. Твердое вещество на стеклянном поддоне периодически перемешивали и взвешивали. Материал выдерживали в камере с изменяемой влажностью до тех пор, пока масса образеца не переставала изменяться или пока анализ методом газовой хроматографии не показывал отсутствие этанола. Указанную выдержку проводили в течение примерно шести дней.
[100] Спектр XRPD для формы III приведен на фигуре 4.
Пример 4
Получение формы IV 5-CNAC:
[101] Форму IV получили следующим способом. В реактор объемом один литр с нижним сливом загрузили 375 мл 2-бутанона, 125 мл воды и 125 г моногидрата динатриевой соли 5-CNAC. Содержимое реактора при перемешивании нагрели до 50°C. Твердое вещество растворилось с образованием двухфазного раствора. Затем перемешивание прекратили и выдержали раствор до разделения на два несмешивающихся жидких слоя. Через нижнее сливное отверстие реактора удалили и отправили в отходы нижний слой. Остаток раствора охладили до комнатной температуры. В процессе охлаждения продукт начал кристаллизоваться. К полученной суспензии добавили еще 250 мл 2-бутанона. Твердый продукт отделили при помощи фильтрования под вакуумом через воронку с фильтром из пористого стекла. Влажный осадок сушили в течение ночи при 55°C в вакуумном шкафу при полном вакууме. Масса сухой моногидрата динатриевой соли 5-CNAC составила 54,35 г.Выход составил 43%.
[102] Спектры XRPD и DSC для формы IV приведены на фигурах 5 и 6, соответственно.
Пример 5
Получение смеси форм I и IV 5-CNAC:
[103] Смесь форм I и IV 5-CNAC получили следующим способом. В чистый футерованный стеклом реактор объемом 200 галлонов (757 л) загрузили 525 л ацетона. Реактор продули азотом. Начали перемешивание. К содержимому реактора при перемешивании добавили 35 кг 5-CNAC. Содержимое реактора нагрели до температуры от 50 до 60°C и выдерживали при этой температуре в течение по меньшей мере 20 минут. За это время основная часть твердого вещества растворялась. Содержимое реактора перекачали через напорный фильтр в соседний реактор, футерованный стеклом, объемом 200 галлонов. Первый реактор и напорный фильтр промыли 20 л свежего ацетона, который после этого направили во второй реактор. В отдельной емкости приготовили водный раствор гидроксида натрия, растворив 8,92 кг гидроксида натрия в 44,6 л дистиллированной воды. Полученный водный раствор основания перекачали в реактор, содержащий фильтрат ацетона/5-CNAC. Добавление водного раствора основания приводило к началу процесса дефлегмации. Емкость, в которой был приготовлен водный раствор основания, промыли 8,9 л свежей воды, которую направили в реактор, где происходил процесс дефлегмации. Реактор не нагревали и не охлаждали, и его содержимое медленно охладилось до комнатной температуры. Затем подали охлаждающий агент в рубашку реактора, и его содержимое охладилось далее до температуры в пределах от 0°C до 5°C. Весь процесс охлаждения занял от 16 до 24 часов. Осадок, образовавшийся в реакционной смеси, отделили с помощью центрифугирования. Отфильтрованный материал поместили в сушильный шкаф и сушили при 60°C и полном вакууме в течение по меньшей мере 16 часов. Выход сухого моногидрата динатриевой соли 5-CNAC составил примерно 39,9 кг. Полученный моногидрат динатриевой соли представлял собой смесь форм I и IV. Было установлено, что в процессе хранения материала форма IV превращалась в форму I.
[104] Все патенты, заявки на патент, статьи, публикации и методы анализа, упомянутые в настоящем описании, включены в настоящую заявку посредством ссылок.
Реферат
Настоящее изобретение относится к способу получения динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты в виде моноэтанолсольвата, октагидрата и моногидрата, а также к способу получения смеси динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты в виде смеси двух моногидратов. Технический результат - получение новых форм динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты. 4 н. и 3 з.п. ф-лы, 6 ил., 6 табл., 5 пр.
Формула
(а) добавление гидроксида натрия к раствору N-(5-хлорсалицилоил)-8-аминокаприловой кислоты и этанола;
(б) осаждение из раствора динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты в виде моноэтанолсольвата;
(в) выдерживание смеси при температуре менее 10°C в течение по меньшей мере 4 ч;
(г) отделение динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты в виде моноэтанолсольвата с помощью центрифугирования; и
(д) сушка динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты в виде моноэтанолсольвата в вакууме в течение от 16 до 24 ч.
(а) растворение в метилэтилкетоне и нагревание до 50°C моногидрата динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере один пик в градусах 2θ±0,2°2θ, выбранный из группы, включающей пики при 7,5, 10,4, 14,2, 15,0, 15,5, 16,1, 18,4, 20,8, 23,6, 24,1, 24,5, 24,8, 25,4, 26,6, 27,2, 27,5, 29,6 и 31,5 градусах; и
(б) охлаждение раствора метилэтилкетона, полученного на операции (а), до комнатной температуры с образованием динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты в виде моногидрата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере один пик в градусах 2θ±0,2°2θ, выбранный из группы, включающей пики при 7,2, 18,2, и 24,7.
(а) моногидрата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере один пик в градусах 2θ±0,2°2θ, выбранный из группы, включающей пики при 7,5, 10,4, 14,2, 15,0, 15,5, 16,1, 18,4, 20,8, 23,6, 24,1, 24,5, 24,8, 25,4, 26,6, 27,2, 27,5, 29,6 и 31,5 градусах; и
(б) моногидрата, характеризующегося порошковой рентгенограммой, содержащей по меньшей мере один пик в градусах 2θ±0,2°2θ, выбранный из группы, включающей пики при 7,2, 18,2, и 24,7,
включающий операцию охлаждения раствора динатриевой соли N-(5-хлорсалицилоил)-8-аминокаприловой кислоты, ацетона и гидроксида натрия, имеющего температуру в интервале от 50 до 60°C, в течение периода времени в интервале от 16 до 24 ч для образования указанной смеси форм.

Комментарии