Производное триптолида, способ его получения и применение - RU2753036C9
Код документа: RU2753036C9
Чертежи
Описание
Область техники, к которой относится изобретение
Изобретение относится к области медицинской химии, в частности, к производному триптолида, обладающему противоопухолевым и иммунодепрессивным действием, а также к способу его получения и его применению.
Уровень техники
Натуральные продукты всегда были основным источником новых противоопухолевых препаратов. Однако эти соединения часто обладают плохими фармакокинетическими свойствами, и лишь несколько чисто натуральных продуктов были в клинических условиях превращены в противоопухолевые препараты.
Китайское травяное растение Tripterygium Wilfordii (TW) является обычным объектом исследования в области противоопухолевых препаратов. В настоящее время составной триптолид, экстрагированный из TW, является важным активным ингредиентом Tripterygium Wilfordii, а исследования показали, что он обладает противовоспалительным, противоопухолевым и иммунодепрессивным действием. В то же время исследования выявили, что триптолид имеет большую токсичность и различные побочные реакции, которые серьезно влияют на производство и использование триптолида. Эксперименты in vivo показали, что диапазон безопасного применения триптолида очень узок. Превышение эффективной дозы триптолида в два или четыре раза может вызвать смерть животного, а в некоторых исследованиях даже сообщается, что эффективная доза очень близка к летальной. Токсикологические исследования выявили, что побочные реакции триптолида затрагивают различные ткани и органы, включая желудочно-кишечный тракт, почки, сердце, печень, кроветворную и репродуктивную систему. Поэтому важным направлением научных исследований является проведение структурной модификации триптолида для получения высокоэффективного и малотоксичного производного триптолида, которое сможет проявлять противоопухолевые и другие биологические свойства, избегая при этом токсичности.
На основании обзора литературы установлено, что структурные модификации триптолида сосредоточены на C14 гидроксиле, C7/C8 эпоксиде, C12/C13 эпоксиде и ненасыщенном лактоновом кольце. Среди них структурная модификация ненасыщенного лактонового кольца в основном превращает лактоновое кольцо в фурановое кольцо или в лактам, или открывает лактоновое кольцо для увеличения растворимости в воде. Однако эти две стратегии приведут к снижению или даже исчезновению действия производных.
Краткое изложение сущности настоящего изобретения
Целью настоящего изобретения является создание производного триптолида с новой структурой, а также способа его получения и применения.
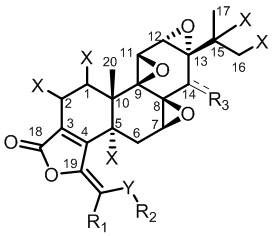
В первом аспекте настоящего изобретения обеспечивается соединение, представленное формулой I, или его фармацевтически приемлемая соль, или его энантиомер, диастереомер, таутомер, сольват, полиморф или пролекарство,
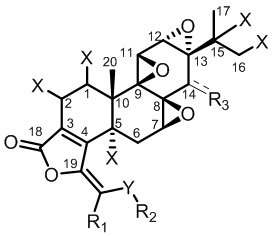
где,
R1 представляет собой замещенную или незамещенную группу, выбираемую из группы, состоящей из: C1-C6 алкила, C3-C8 циклоалкила, C2-C6 алкенила, C3-C8 циклоалкенила, C2-C6 алкинила, C6-C10 арила, C7-C15 арилалкила и 4-8-членного гетероарила;
Y представляет собой O, NH или S;
R2 представляет собой замещенную или незамещенную группу, выбираемую из группы, состоящей из: C1-C6 алкила, C3-C8 циклоалкила, C2-C6 алкенила, C3-C8 циклоалкенила, C2-C6 алкинила, C6-C10 арила, C7-C15 арилалкила, 4-8-членного гетероарила и -C(=O)R4, где R4 представляет собой замещенную или незамещенную группу, выбираемую из группы, состоящей из: C1-C6 алкила, C3-C8 циклоалкила, C2-C6 алкенила, C3-C8 циклоалкенила, C2-C6 алкинила, C6-C10 арила, C7-C15 арилалкила и 4-8-членного гетероарила;
каждый X независимо представляет собой H, OH или галоген;
каждый из вышеприведенных терминов «замещенный» независимо означает, что один или несколько атомов водорода в группе замещаются заместителем, выбираемым из группы, состоящей из: галогена, -ОН, NH2, CN, COOH, -OP(=O) (OH)2, незамещенного или галогенированного C1-C8 алкила, незамещенного или галогенированного C3-C8 циклоалкила, незамещенного или галогенированного C1-C8 алкокси, незамещенного или галогенированного C2-C6 алкенила, незамещенного или галогенированного C2-C6 алкинила, незамещенного или галогенированного C2-C6 ацила, незамещенного или галогенированного C2-C6 амидо, незамещенного или галогенированного 5-8-членного арила, незамещенного или галогенированного 5-8-членного гетероарила, незамещенного или галогенированного 4-8-членного насыщенного гетероцикла или карбоцикла; где каждая из вышеуказанных гетероарильных групп независимо содержит 1-3 гетероатома, выбираемых из группы, состоящей из N, O и S.
В настоящей заявке Boc представляет собой трет-бутоксикарбонил, TBS представляет собой трет-бутилдиметилсилил, а TES представляет собой триэтилсилил.
В другом предпочтительном варианте осуществления R3 представляет собой OH, OBoc, OCH2OP(=O)(OH)2, -OCH2OP(=O)(OBn)2, OTBS, OTES, OCH2SCH3, или OCH2OCH3. В другом предпочтительном варианте осуществления R3 представляет собой OH. В другом предпочтительном варианте осуществления R3 представляет собой β-OH. В другом предпочтительном варианте осуществления R3 представляет собой OBoc, OCH2OP(=O)(OH)2 или -OCH2OP(=O)(OBn)2.
В другом предпочтительном варианте осуществления максимум один X представляет собой ОН.
В другом предпочтительном варианте осуществления конфигурация углерода-14 представляет собой α-конфигурацию или β-конфигурацию.
В другом предпочтительном варианте осуществления каждый X представляет собой Н.
В другом предпочтительном варианте осуществления Y представляет собой О.
В другом предпочтительном варианте осуществления R1 представляет собой следующую замещенную или незамещенную группу: C1-C4 алкил, C3-C6 циклоалкил, C6-C10 арил или 4-8-членный гетероарил, где термин «замещенный» означает, что один или несколько атомов водорода в группе замещаются заместителем, выбираемым из группы, состоящей из галогена, -ОН, незамещенного или галогенированного C1-C4 алкила и незамещенного или галогенированного C1-C3 алкокси.
В другом предпочтительном варианте осуществления R1 представляет собой циклогексил, н-пропил, н-бутил, фенил, 2-фурил, п-метилфенил, п-метоксифенил или п-трифторметилфенил.
В другом предпочтительном варианте осуществления R2 представляет собой замещенную или незамещенную группу, выбираемую из группы, состоящей из: C1-C4 алкила, C7-C10 арилалкила, 4-6-членного гетероарила или -C(=O)R4, где R4 представляет собой замещенную или незамещенную группу, выбираемую из группы, состоящей из: C1-C4 алкила, C3-C6 циклоалкила, C6-C10 арила, C7-C15 арилалкила или 4-8-членного гетероарила, где термин «замещенный» означает, что один или несколько атомов водорода в группе замещаются заместителем, выбираемым из группы, состоящей из галогена, -ОН, незамещенного или галогенированного C1-C4 алкила и незамещенного или галогенированного C1-C3 алкокси.
В другом предпочтительном варианте осуществления R2 представляет собой C1-C4 алкил, C7-C10 арилалкил или (CO)R4. В другом предпочтительном варианте осуществления R2 представляет собой метил, этил, пропил или бутил. В другом предпочтительном варианте осуществления R4 представляет собой следующую замещенную или незамещенную группу: C1-C4 алкил, C3-C6 циклоалкил, C6-C10 арил и 4-8-членный гетероарил.
В другом предпочтительном варианте осуществления R4 представляет собой циклогексил, н-бутил, н-пропил, фенил, 2-фурил, п-метилфенил, п-трифторметилфенил или п-метоксифенил.
В другом предпочтительном варианте осуществления R1 и R2 идентичны или различны.
В другом предпочтительном варианте осуществления R1 и R4 идентичны или различны.
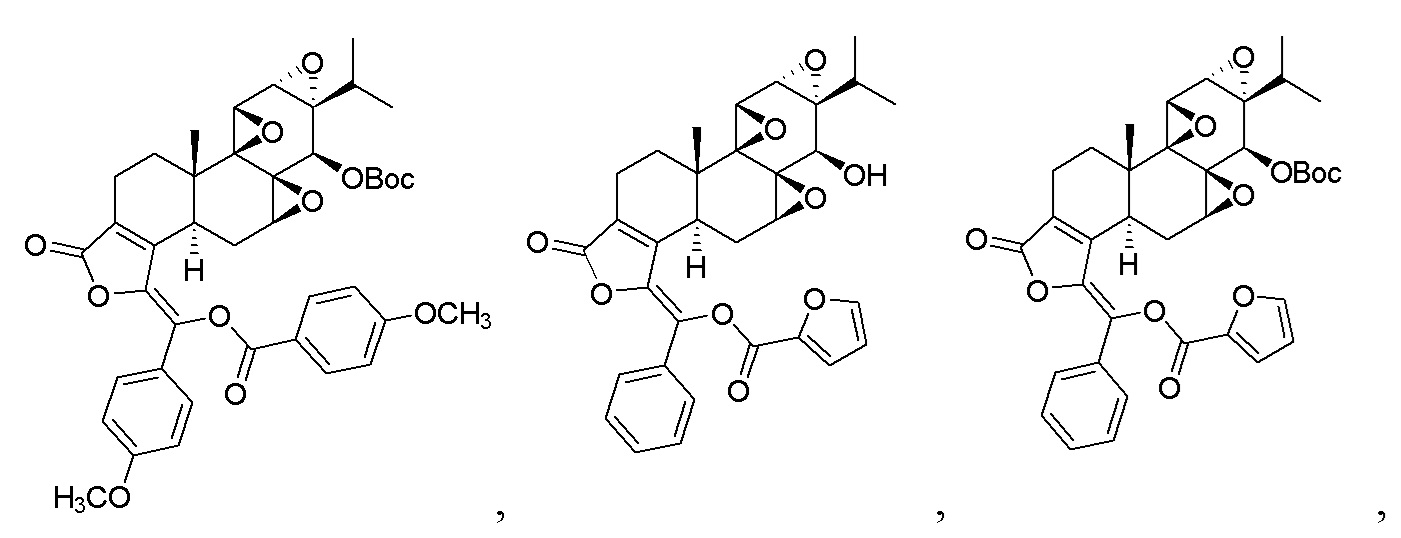
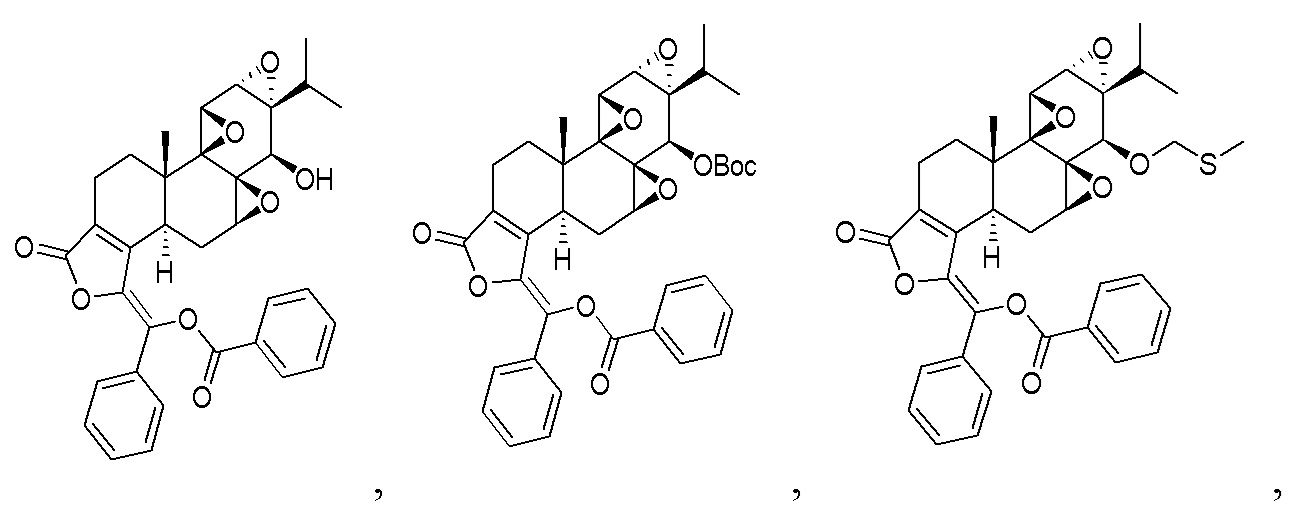
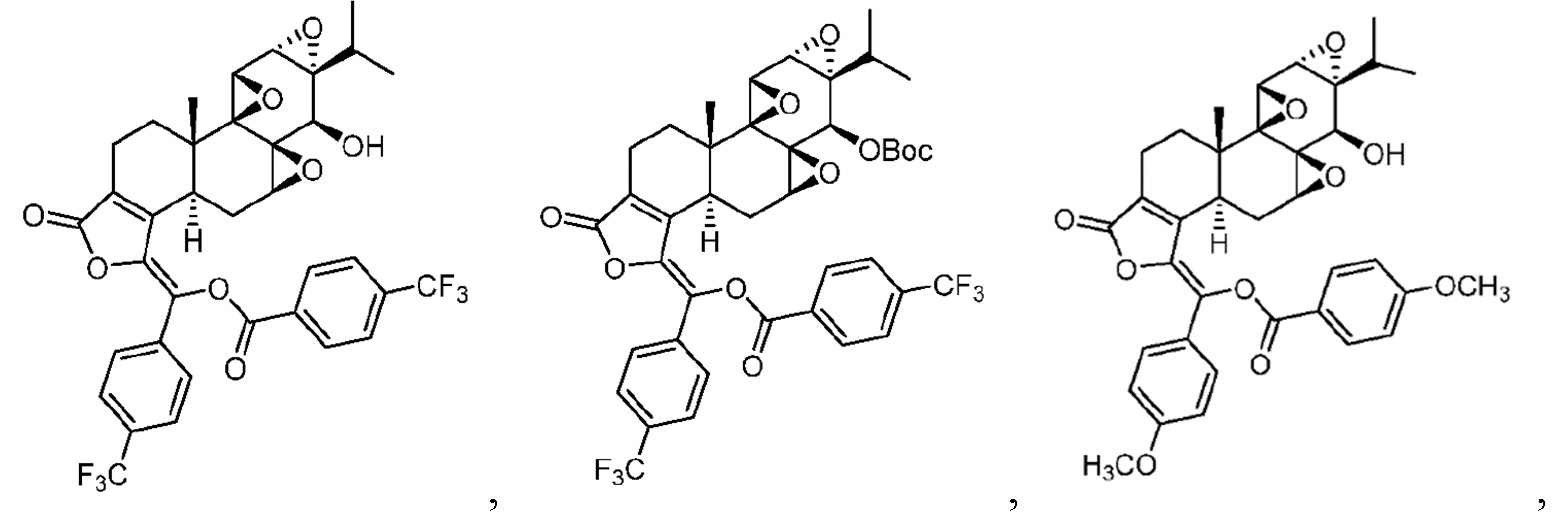
В другом предпочтительном варианте осуществления соединение представляет собой:
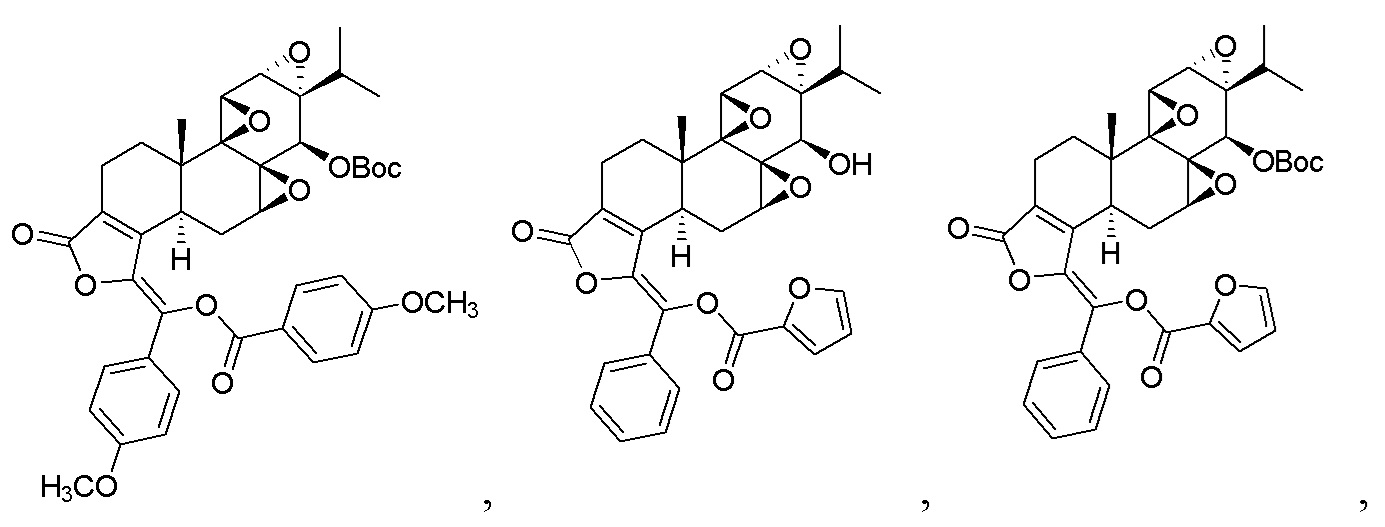
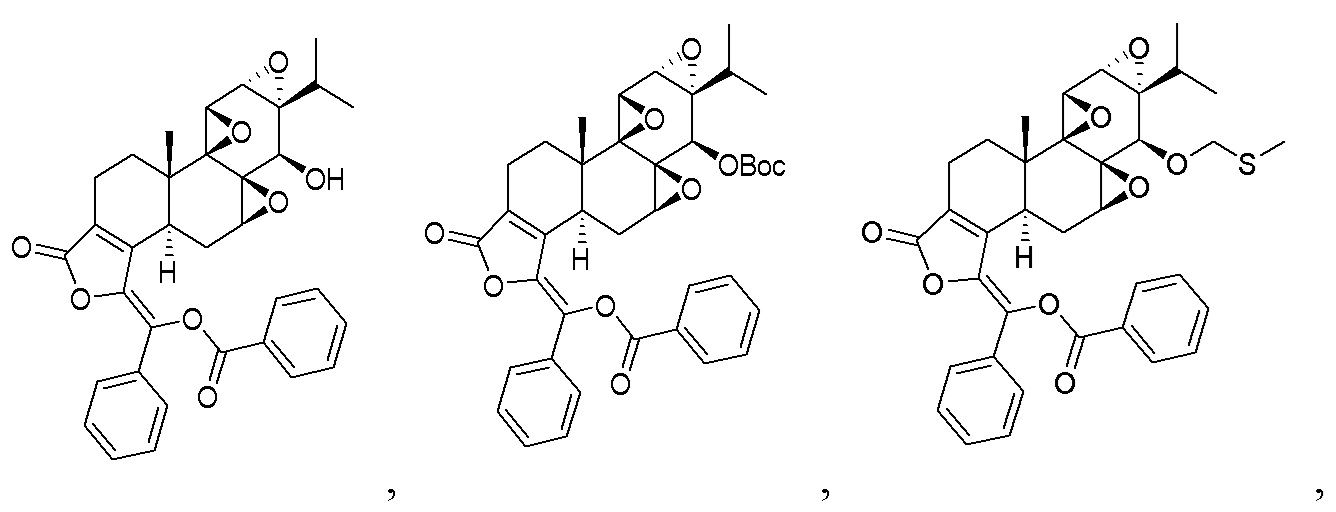
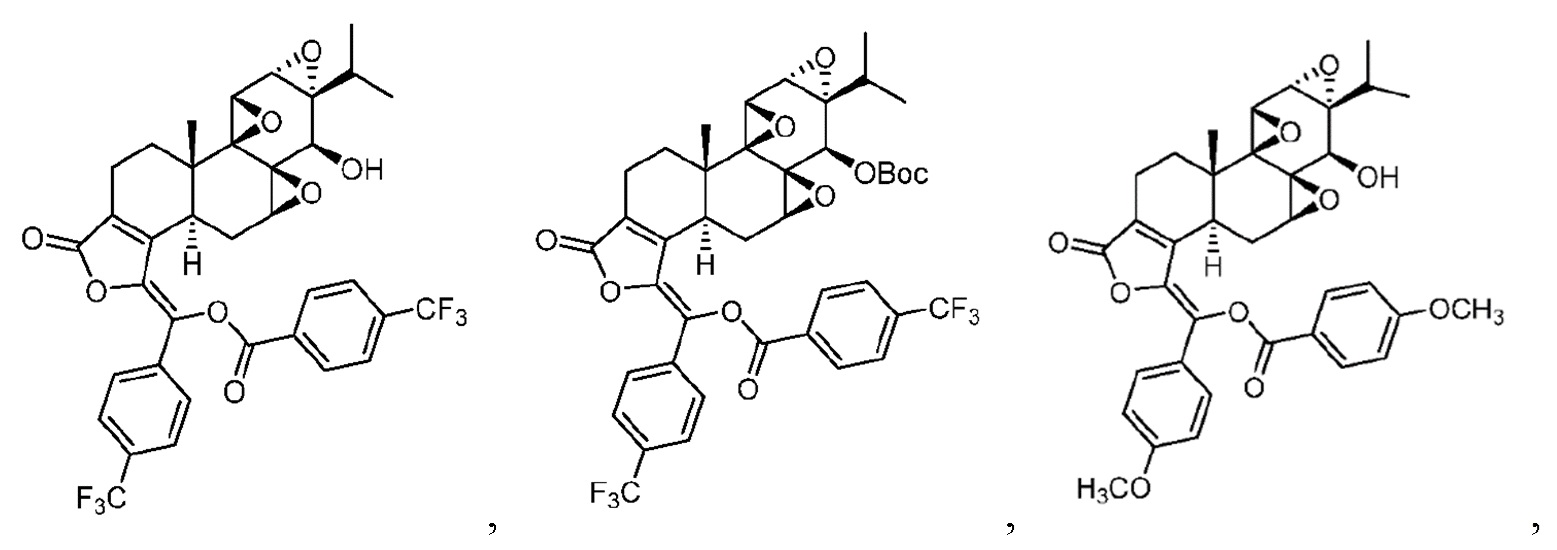
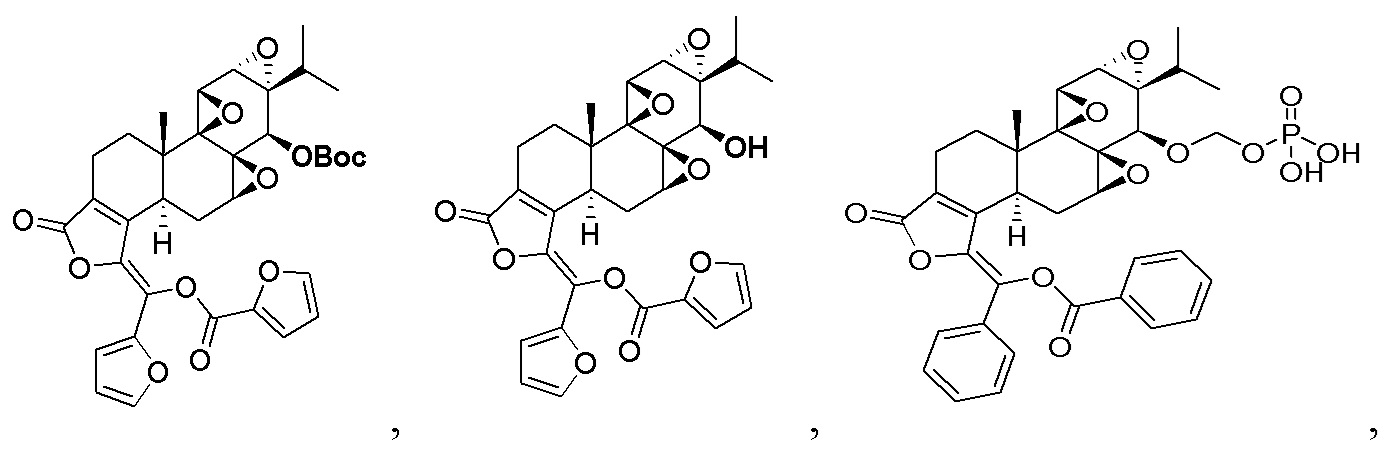
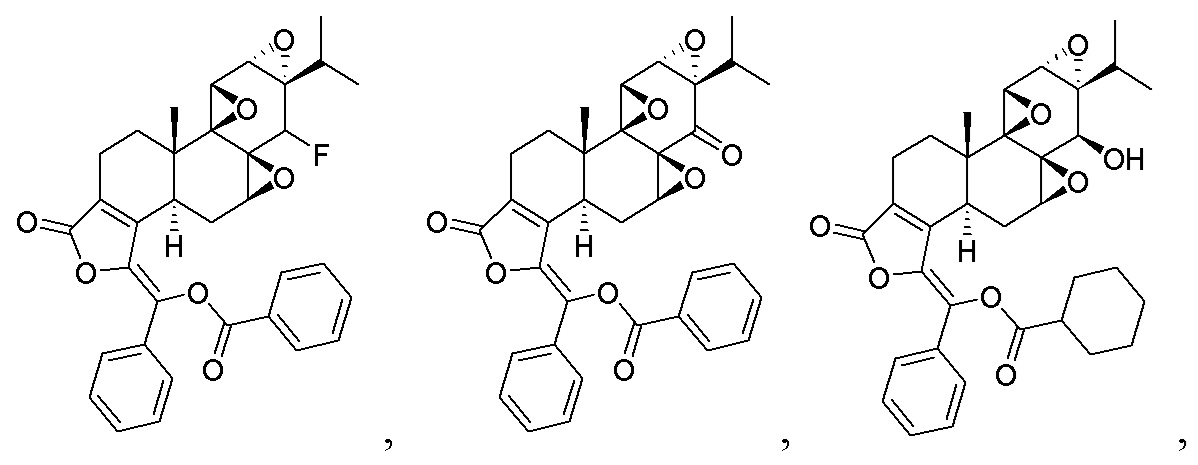
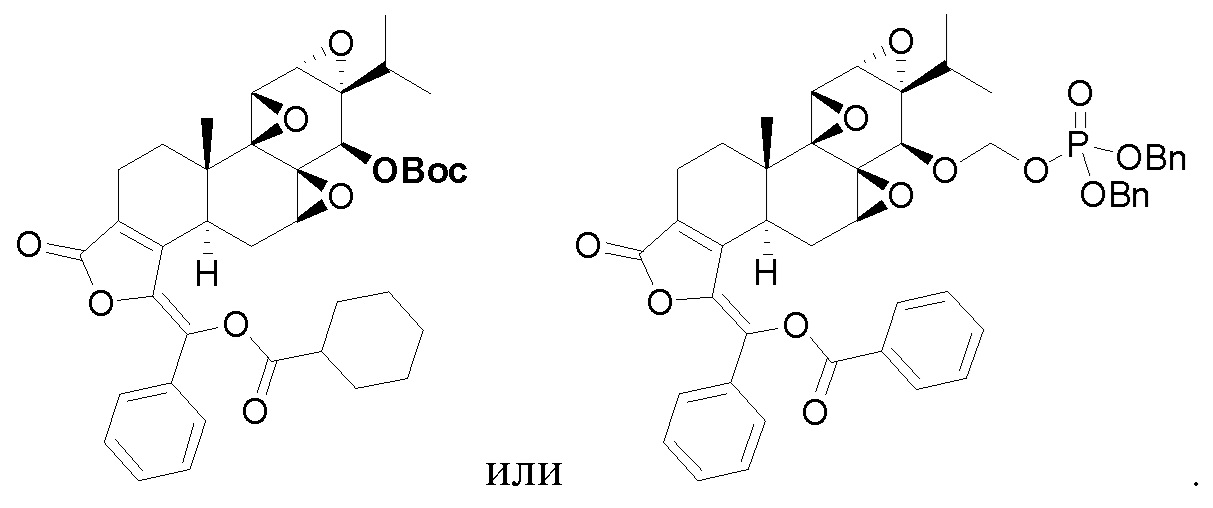
Во втором аспекте настоящего изобретения предлагается состав, отличающийся тем, что он включает соединение, или его фармацевтически приемлемую соль, или энантиомер, диастереомер, таутомер, сольват, полиморф или пролекарство в соответствии с первым аспектом; и примесь, причем
содержание примеси составляет 0,1-2 мас.%, предпочтительно 0,2-1 мас.% и более предпочтительно 0,3-0,6 мас.% от общей массы состава.
В другом предпочтительном варианте осуществления масса соединения или его фармацевтически приемлемой соли, или энантиомера, диастереомера, таутомера, сольвата, полиморфа или пролекарства в соответствии с первым аспектом составляет от 98% до 99,9% по массе, предпочтительно - от 99 до 99,8% по массе, более предпочтительно - от 99,2 до 99,6% по массе или от 99,3 до 99,5% по массе в расчете на общую массу состава.
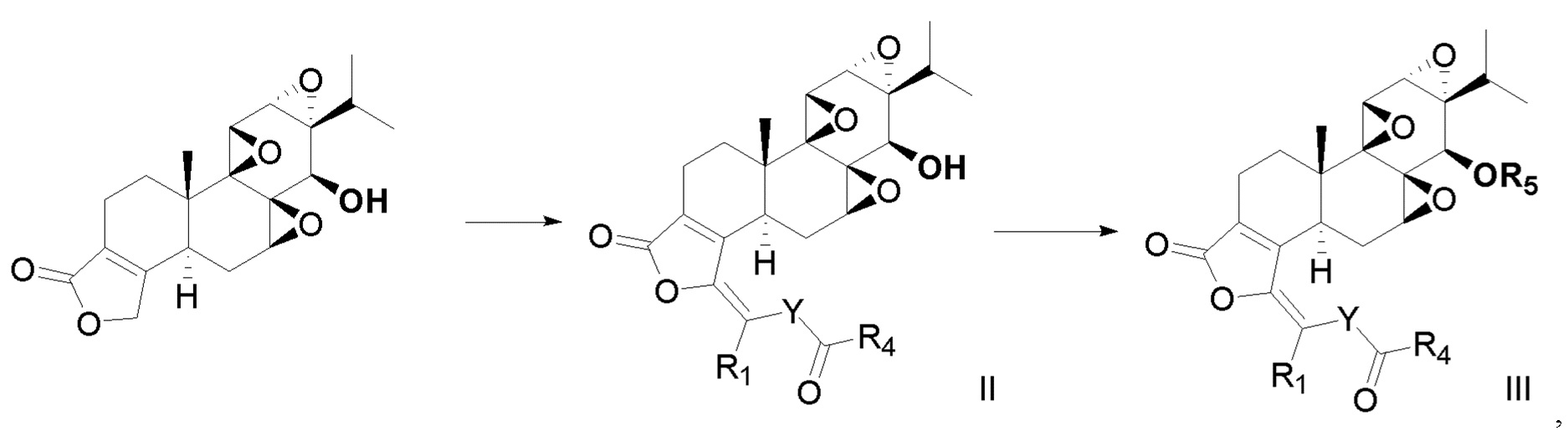
В третьем аспекте настоящего изобретения предлагается способ получения соединения в соответствии с первым аспектом, который включает следующие стадии:
когда R2 представляет собой -C(=O)R4 и R1=R4, способ получения включает следующие стадии:
взаимодействие триптолида с ацилирующим агентом с получением, таким образом, соединения формулы II и дериватизацию соединения формулы II с получением, таким образом, соединения формулы III; где ацилирующий агент представляет собой R1COCl, R1COBr или R1COOCOR1;
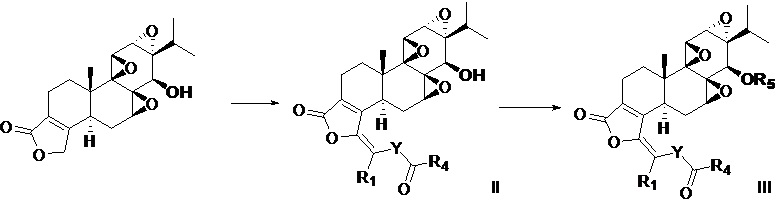
или когда R2 представляет собой -C(=O)R4 и R1≠R4, способ получения включает следующие стадии:
взаимодействие триптолида с первым ацилирующим реагентом и вторым ацилирующим реагентом, соответственно, с получением, таким образом, соединения формулы II и выведения соединения формулы II с получением, таким образом, соединения формулы III; причем первый ацилирующий агент представляет собой R1COCl, R1COBr или R1COOCOR1, и второй ацилирующий агент представляет собой R4COCl, R4COBr или R4COOCOR4;
где R1, R4 и R5 определяются так же, как в первом аспекте.
Типичными стадиями реакции являются:
В четвертом аспекте настоящего изобретения предлагается фармацевтический состав, содержащий:
соединение или его фармацевтически приемлемую соль, или его энантиомер, диастереомер, таутомер, сольват, полиморф или пролекарство согласно первому аспекту; а также
фармацевтически приемлемый носитель.
В четвертом аспекте настоящего изобретения предлагается применение соединения или его фармацевтически приемлемой соли, или его энантиомера, диастереомера, таутомера, сольвата, полиморфа или пролекарства в соответствии с первым аспектом, или фармацевтического состава в соответствии с третьим аспектом,
a) для приготовления лекарственного средства для лечения опухолей;
b) для приготовления лекарственного средства для индуцирования апоптоза; и/или
c) для приготовления иммунодепрессанта.
В другом предпочтительном варианте осуществления опухоль выбирается из группы, состоящей из лейкемии, стромальной опухоли желудочно-кишечного тракта, гистиоцитарной лимфомы, немелкоклеточного рака легких, мелкоклеточного рака легкого, рака поджелудочной железы, плоскоклеточной карциномы легких, аденокарциномы легких, рака груди, рака простаты, рака печени, рака кожи, рака эпителиальных клеток, рака шейки матки, рака яичников, рака кишечника, рака носоглотки, рака мозга, рака костей, рака пищевода, меланомы, рака почек и рака полости рта.
В другом предпочтительном варианте осуществления опухоль предпочтительно представляет собой рак поджелудочной железы, рак простаты, рак яичников или рак мозга.
Следует понимать, что в пределах объема настоящего изобретения вышеупомянутые технические особенности настоящего изобретения и технические характеристики, конкретно описанные ниже (например, примеры), могут быть объединены друг с другом для образования нового или предпочтительного технического решения. Каждая особенность, раскрытая в описании, может быть заменена любой альтернативной особенностью, которая служит той же, эквивалентной или аналогичной цели. Из-за ограничения по объему они не будут описываться повторно.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
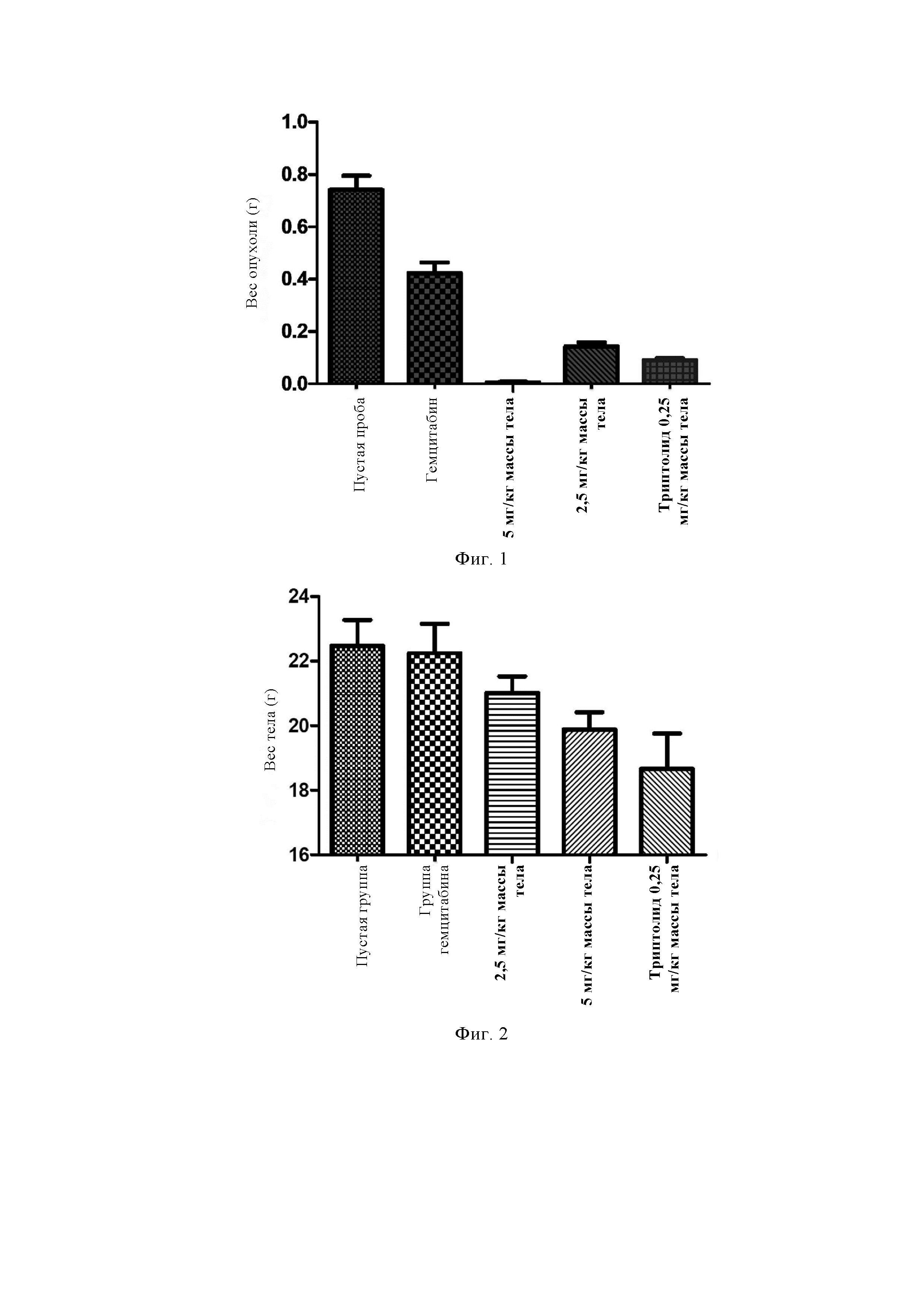
Фиг. 1 представляет собой график, показывающий изменение во времени веса тела мышей с опухолью.
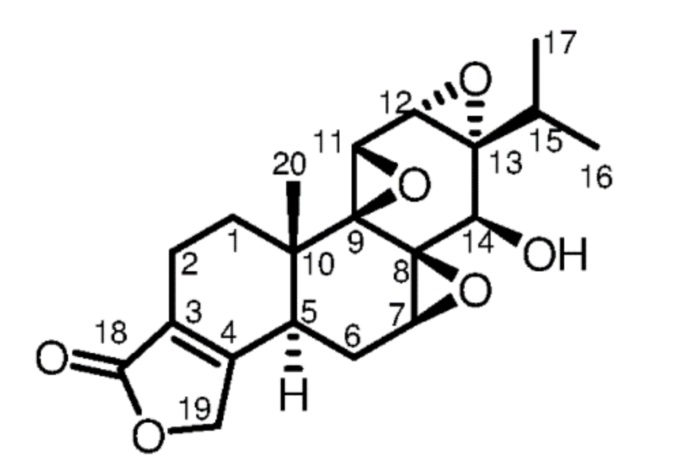
Фиг. 2 представляет собой график данных о весе.
Описание вариантов осуществления
После обширных и интенсивных исследований авторы настоящей заявки сначала ввели группу модификации в триптолид посредством двойной связи C-19 и, путем дальнейшего выведения, получили ряд новых производных триптолида с высокой активностью (улучшенная иммуносупрессивное и противоопухолевое действие) и высокой безопасностью (низкой токсичностью), которые имеют хорошую перспективу разработки и применения. На основе этого было выполнено настоящее изобретение.
Термины
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно подразумевается специалистами в данной области, к которой принадлежит предмет формулы изобретения. Если не указано иное, все патенты, заявки на патенты и опубликованные материалы, цитируемые в настоящем документе, полностью включены посредством ссылки.
Следует понимать, что приведенное выше краткое описание и последующее подробное описание являются примерными и предназначены только для объяснения. Они не накладывают никаких ограничений на предмет изобретения. В этой заявке использование единственного числа включает множественное число, если специально не указано иное. Следует отметить, что, если контекст четко не указывает иное, формы единственного числа, используемые в описании и формуле изобретения, включают формы множественного числа упомянутых вещей. Также следует отметить, что «или» используется для обозначения «и/или», если не указано иное. Кроме того, термины «содержать» и другие формы, такие как «включать» и «содержащий», не являются ограничивающими.
Определения стандартных химических терминов можно найти в справочной литературе. Если не указано иное, используются обычные методы, известные специалистам в данной области, такие как масс-спектрометрия, ЯМР, ИК и УФ/визуальная спектроскопия, а также фармакологические методы. Если не указано иное, термины, используемые в настоящем документе в соответствующих описаниях аналитической химии, органической синтетической химии, фармакологии и медицинской химии, известны в данной области. В химическом синтезе, химическом анализе, приготовлении лекарств, составлении и доставке, а также при лечении пациентов могут использоваться стандартные методы. Например, можно использовать инструкции производителя по применению набора, а реакцию и очистку можно проводить способами, известными в данной области техники, или в соответствии с описанием настоящего изобретения. Описанные выше методы и способы, как правило, могут быть реализованы в соответствии с обычными методами, хорошо известными в данной области техники, на основе описаний в нескольких обобщающих и более конкретных документах, цитируемых и обсуждаемых в данном описании. В данном описании группы и их заместители могут выбираться специалистами в данной области для получения стабильных фрагментов и соединений.
Если заместитель описывается обычной химической формулой, записанной слева направо, заместитель также включает химически эквивалентный заместитель, получаемый при записи структурной формулы справа налево. Например, формула -CH2O- эквивалентна формуле -OCH2-.
Заголовки разделов, используемые в настоящем документе, предназначены только для организационных целей и не должны рассматриваться как ограничение предмета изобретения. Все документы или части документов, цитируемые в данной заявке, включают, помимо прочего, патенты, заявки на патенты, статьи, книги, руководства по эксплуатации и документы, которые полностью включены в настоящий документ посредством ссылки.
Общее количество атомов углерода, присутствующих в группе, указано упрощенным символом перед определенными химическими группами, определенными в настоящем документе. Например, C1-6 алкил относится к алкильной группе, как определено ниже, содержащей всего от 1 до 6 атомов углерода. Общее количество атомов углерода в упрощенном символе не включает атомы углерода, которые могут присутствовать в заместителе группы.
В дополнение к вышеизложенному, при использовании в описании и формуле данной заявки указанные ниже термины имеют указанные значения, если не указано иное.
В настоящей заявке термин «галоген» относится к фтору, хлору, брому или йоду.
«Гидрокси» относится к -OH.
«Гидроксиалкил» относится к алкильной группе, как определено ниже, замещенной гидрокси (-ОН).
«Карбонил» относится к -C(=O)-.
«Нитро» относится к -NO2.
«Циано» относится к -CN.
«Амино» относится к -NH2.
«Замещенный амино» относится к аминогруппе, замещенной одним или двумя алкилами, алкилкарбонилом, аралкилом и гетероаралкилом, как определено ниже, например, моноалкиламино, диалкиламино, алкиламидо, аралкиламино, гетероаралкиламино.
«Карбокси» означает -COOH.
В настоящей заявке, в качестве группы или части другой группы (например, при использовании в группе, такой как галогензамещенный алкил), термин «алкил» означает группу с прямой или разветвленной углеводородной цепью без ненасыщенной связи, которая состоит только из атомов углерода и атома водорода, и имеет, например, от 1 до 12 (предпочтительно от 1 до 8, более предпочтительно от 1 до 6) атомов углерода и соединяется с остальной частью молекулы одинарной связью. Примеры алкила включают, помимо прочего, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 2-метилбутил, 2,2-диметилпропил, н-гексил, гептил, 2-метилгексил, 3-метилгексил, октил, нонил, децил и тому подобное.
В настоящей заявке, в качестве группы или части другой группы, термин «алкенил» означает группу с прямой или разветвленной углеводородной цепью, которая состоит только из атомов углерода и атомов водорода, содержит по меньшей мере одну двойную связь, имеет, например, от 2 до 14 (предпочтительно от 2 до 10, более предпочтительно от 2 до 6) атомов углерода и присоединяется к остальной части молекулы посредством одинарной связи, например, помимо прочего, винил, пропенил, аллил, бут-1-енил, бут-2-енил, пент-1-енил, пент-1,4-диенил и тому подобное.
В настоящей заявке, в качестве группы или части другой группы, термин «алкинил» означает группу с прямой или разветвленной углеводородной цепью, которая состоит только из атомов углерода и атомов водорода, содержит по меньшей мере одну тройную связь, имеет, например, от 2 до 14 (предпочтительно от 2 до 10, более предпочтительно от 2 до 6) атомов углерода и присоединяется к остальной части молекулы посредством одинарной связи, например, помимо прочего, этинил, проп-1-инил, бут-1-инил , пент-1-ен-4-инил и тому подобное.
В настоящей заявке, в качестве группы или части другой группы, термин «циклоалкил» означает стабильную неароматическую моноциклическую или полициклическую углеводородную группу, которая состоит только из атомов углерода и атомов водорода, может включать систему с сочлененными кольцами (конденсированную кольцевую систему), мостиковую кольцевую систему или спирокольцевую систему, имеет от 3 до 15 атомов углерода, предпочтительно от 3 до 10 атомов углерода, а более предпочтительно от 3 до 8 атомов углерода, является насыщенной или ненасыщенной и соединяется с остальной частью молекулы одинарной связью посредством любого подходящего атома углерода . Если иное специально не указано в данном описании, атомы углерода в циклоалкильной группе могут быть необязательно окислены. Примеры циклоалкила включают, помимо прочего, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогексадиенил, циклогептил, циклооктил, 1H-инденил, 2,3-дигидроинденил, 1,2,3,4-нафтилгидрогидрогид, 5,6,7,8-тетрагидро-нафтил, 8,9-дигидро-7H-бензоциклогептен-6-ил, 6,7,8,9-тетрагидро-5H-бензоциклогептенил, 5,6,7,8,9,10-гексагидробензоциклооктенил, флуоренил, бицикло[2.2.1]гептил, 7,7-диметил-бицикло[2.2.1]гептил, бицикло[2.2.1]гептенил, бицикло[2.2.2]октил, бицикло[3.1.1]гептил, бицикло[3.2.1]октил, бицикло[2.2.2]октенил, бицикло[3.2.1]октенил, адамантил, октагидро-4,7-метилен-1H-инденил и октагидро-2,5-метилен-циклопентадиенил и тому подобное.
В настоящей заявке, в качестве группы или части другой группы, термин «гетероциклил» означает стабильную 3 - 20-членную неароматическую циклическую группу, состоящую из 2 - 14 атомов углерода и 1 - 6 гетероатомов, выбираемых из азота, фосфора, кислорода и серы. Если в данном описании не указано иное, гетероциклил может быть моноциклической, бициклической, трициклической или более циклической кольцевой системой, которая может включать систему с сочлененными кольцами, мостиковую кольцевую систему или спирокольцевую систему; атомы азота, углерода или серы необязательно могут быть окислены; атомы азота могут быть необязательно кватернизованы; и гетероциклил может быть частично или полностью насыщенным. Гетероциклил может соединяться с остальной частью молекулы посредством углерода или гетероатома и посредством одинарной связи. В гетероциклиле, содержащем конденсированное кольцо, одно или несколько колец могут представлять собой арильную или гетероарильную группу, как определено ниже, при условии, что точкой присоединения к остальной части молекулы является неароматический кольцевой атом. Для целей настоящего изобретения гетероциклил предпочтительно представляет собой стабильную 4 - 11-членную неароматическую моноциклическую, бициклическую, мостиковую или спироциклическую группу, содержащую от 1 до 3 гетероатомов, выбираемых из азота, кислорода и серы, более предпочтительно - стабильную 4 - 8-членную неароматическую моноциклическую, бициклическую, мостиковую или спироциклическую группу, содержащую от 1 до 3 гетероатомов, выбираемых из азота, кислорода и серы. Примеры гетероциклила включают, помимо прочего: пирролидинил, морфолинил, пиперазинил, гомопиперазинил, пиперидинил, тиоморфолинил, 2,7-диаза-спиро[3.5]нон-7-ил, 2-окса-6-аза-спиро[3.3 ]гепт-6-ил, 2,5-диаза-бицикло[2.2.1]гепт-2-ил, азациклобутил, пиранил, тетрагидропиранил, тиоранил, тетрагидрофурил, оксазинил, диоксоциклопентил, тетрагидроизохинолинил, декагидидроизохинолинил, имиоизохинолинил, декаголидидроизохинолинил, , изотиазолидинил, изоксазолидинил, дигидроиндолил, октагидроиндолил, октагидроизоиндолил, пирролидинил, пиразолидинил, фталимид и т.п.
В настоящей заявке, в качестве группы или части другой группы, термин «арил» означает группу сопряженной углеводородной кольцевой системы, имеющую от 6 до 18 атомов углерода, предпочтительно от 6 до 10 атомов углерода. Для целей настоящего изобретения арил может быть моноциклической, бициклической, трициклической или более циклической кольцевой системой, а также может быть конденсирован с циклоалкилом или гетероциклилом, как определено выше, при условии, что арил связан с остальной частью молекулы одинарной связью посредством атома ароматического кольца. Примеры арила включают, помимо прочего, фенил, нафтил, антраценил, фенантрил, флуоренил, 2,3-дигидро-1H-изоиндолил, 2-бензоксазолинон, 2H-1,4-бензоксазин-3(4H)-он-7-ил и т.п..
В настоящей заявке термин «арилалкил» относится к алкилу, как определено выше, который замещается арилом, как определено выше.
В настоящей заявке, в качестве группы или части другой группы, термин «гетероарил» означает 5 - 16-членную группу сопряженной кольцевой системы, содержащую от 1 до 15 атомов углерода (предпочтительно от 1 до 10 атомов углерода) и от 1 до 6 гетероатомов, выбираемых из азота, кислорода и серы. Если иное не указано в данном описании, гетероарил может быть моноциклической, бициклической, трициклической или более циклической кольцевой системой и может быть конденсирован с циклоалкилом или гетероциклилом, как определено выше, при условии, что гетероарил связан с остальной частью молекулы одинарной связью посредством атома ароматического кольца. Атом азота, углерода или серы в гетероариле необязательно может быть окислен; и атом азота может быть необязательно кватернизован. Для целей настоящего изобретения гетероарил предпочтительно представляет собой стабильную 5 - 12-членную ароматическую группу, содержащую от 1 до 5 гетероатомов, выбираемых из азота, кислорода и серы, и более предпочтительно - стабильную 5 - 10-членную ароматическую группу, содержащую от 1 до 4 гетероатомов, выбираемых из азота, кислорода и серы, или стабильную 5 - 6-членную ароматическую группу, содержащую от 1 до 3 гетероатомов, выбираемых из азота, кислорода и серы. Примеры гетероарила включают, помимо прочего, тиенил, имидазолил, пиразолил, тиазолил, оксазолил, оксадиазолил, изоксазолил, пиридил, пиримидинил, пиразинил, пиридазинил, бензоимидазолил, бензопиразолил, индолил, фурил, пирролил, триазолил, тетразолил, триазинил, индолизинил, изоиндолил, индазолил, изоиндазолил, пуринил, хинолинил, изохинолинил, диазонафтил, нафтиридинил, хиноксалинил, птеридинил, карбазолил, карболинил, фенантридинил, фенантролинил, акридинил, феназинил, изотиазолил, бензотиазолил, бензотиенил, оксатриазолил, циннолинил, хиназолинил, фенилтио, пурроколинил, о-диазафенантрил, изоксазолил, феноксазинил, фенотиазинил, 4,5,6,7-тетрагидробензо[b]тиенил, нафтопиридил, [1,2,4] триазоло[4,3-b]пиридазин, [1,2,4]триазоло[4,3-a]пиразин, [1,2,4]триазоло[4,3-c]пиримидин, [1,2,4]триазоло[4,3-a]пиридин, имидазо[1,2-a]пиридин, имидазо[1,2-b]пиридазин, имидазо[1,2-a]пиразин и т.п..
В настоящей заявке термин «гетероарилалкил» относится к алкилу, как определено выше, который замещается гетероарилом, как определено выше.
В настоящей заявке «необязательный» или «необязательно» означает, что событие или условие, описанное ниже, может или не может произойти, и описание включает в себя как наступление, так и ненаступление события или условия. Например, «необязательно замещенный арил» означает, что арил замещен или не замещен, и описание включает как замещенный арил, так и незамещенный арил.
Используемые здесь термины «фрагмент», «структурный фрагмент», «химический фрагмент», «группа» и «химическая группа» относятся к конкретному фрагменту или функциональной группе в молекуле. Химический фрагмент обычно рассматривается как химическое соединение, встроенное в молекулу или присоединенное к ней.
«Стереоизомер» относится к соединению, которое состоит из одних и тех же атомов и связано одной и той же связью, но имеет разную трехмерную структуру. Изобретение охватывает различные стереоизомеры и их смеси.
Если соединение по настоящему изобретению содержит олефиновую двойную связь, предполагается, что соединение по настоящему изобретению включает E- и Z-геометрические изомеры, если не указано иное.
«Таутомер» относится к изомеру, образованному переносом протона от одного атома молекулы к другому атому той же молекулы. Все таутомерные формы соединений по изобретению также включены в объем изобретения.
Соединения по изобретению или их фармацевтически приемлемые соли могут содержать один или несколько хиральных атомов углерода и, таким образом, могут производить энантиомеры, диастереомеры и другие стереоизомерные формы. Каждый хиральный атом углерода может быть определен как (R)- или (S)- на основе стереохимии. Изобретение предназначено для включения всех возможных изомеров, а также их рацематов и оптически чистых форм. Соединения по настоящему изобретению можно получить с использованием рацематов, диастереомеров или энантиомеров в качестве исходных материалов или промежуточных продуктов. Оптически активные изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов или могут быть разделены с использованием обычных методик, таких как кристаллизация, хиральная хроматография и т.п.
Обычные методы получения/выделения отдельных изомеров включают хиральный синтез из подходящих оптически чистых прекурсоров или разделение рацематов (или рацематов солей или производных) с использованием, например, хиральной высокоэффективной жидкостной хроматографии.
В настоящей заявке термин «фармацевтически приемлемая соль» включает фармацевтически приемлемые соли присоединения кислоты и фармацевтически приемлемые соли присоединения основания.
«Фармацевтически приемлемая соль присоединения кислоты» относится к соли, образованной с участием неорганической или органической кислоты, которая сохраняет биологическую эффективность свободного основания без других побочных эффектов. Соли неорганических кислот включают, помимо прочего, гидрохлорид, гидробромид, сульфат, нитрат, фосфат и т.д.; соли органических кислот включают, помимо прочего, формиат, ацетат, 2,2-дихлорацетат, трифторацетат, пропионат, гексаноат, октаноат, деканоат, ундециленат, гликолят, глюконат, лактат, себацинат, адипат, глутарат, малонат, оксалат, малеат, сукцинат, фумарат, тартрат, цитрат, пальмитат, стеарат, олеат, циннамат, лаурат, малат, глутамат, пироглутамат, аспартат, бензоат, мезилат, бензолсульфонат, п-толуолсульфонат, альгинат, аскорбат, салицилат, 4-аминосалицилат, дисульфонат нафталина и т.п.. Эти соли можно получить способами, известными в данной области.
«Фармацевтически приемлемая соль присоединения основания» относится к соли, образованной с неорганическим или органическим основанием, способная поддерживать биологическую эффективность свободной кислоты без других побочных эффектов. Соли, полученные из неорганических оснований, включают, помимо прочего, соль натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п.. Предпочтительными неорганическими солями являются соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, включают, помимо прочего, следующие соли: первичные, вторичные и третичные амины, замещенные амины, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как аммиак, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, диэтаноламин, триэтаноламин, диметилэтаноламин, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, бициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, холин, бетаин, глюкомбинат, этилендиамин, бетаин, глюкомин, этилендиамин пиперидин, N-этилпиперидин, полиаминовая смола и т.п.. Предпочтительные органические основания включают изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин. Эти соли можно получить способами, известными в данной области.
«Полиморф» относится к различным твердым кристаллическим фазам определенного соединения по настоящему изобретению из-за наличия двух или более различных молекулярных структур в твердом состоянии. Некоторые соединения по настоящему изобретению могут существовать более чем в одной кристаллической форме, и предполагается, что изобретение включает различные кристаллические формы и их смеси.
Обычно кристаллизация производит сольват соединения по изобретению. Термин «сольват», используемый в настоящем изобретении, относится к агрегату, включающему одну или несколько молекул соединения по настоящему изобретению и одну или несколько молекул растворителя. Растворителем может быть вода, а сольватом в этом случае является гидрат. Альтернативно, растворитель может быть органическим растворителем. Таким образом, соединения по настоящему изобретению могут существовать в виде гидратов, включая моногидраты, дигидраты, полугидраты, сесквигидраты, тригидраты, тетрагидраты и т.п., а также в соответствующих сольватированных формах. Соединения по настоящему изобретению могут образовывать истинные сольваты, но в некоторых случаях также можно сохранить только нестабильную воду или смесь частично нестабильного растворителя и воды. Соединения по настоящему изобретению могут реагировать в растворителе или осаждаться или кристаллизоваться из растворителя. Сольваты соединений по настоящему изобретению также включены в объем изобретения.
Изобретение также включает пролекарства вышеупомянутых соединений. В настоящей заявке термин «пролекарство» означает соединение, которое может быть преобразовано в биологически активное соединение по настоящему изобретению в физиологических условиях или путем сольволиза. Соответственно, термин «пролекарство» относится к фармацевтически приемлемому метаболическому прекурсору соединения по настоящему изобретению. При введении нуждающемуся человеку пролекарство может быть неактивным, но трансформируется in vivo в активное соединение по настоящему изобретению. Пролекарства обычно быстро трансформируются в организме с образованием исходного соединения по настоящему изобретению, например, путем гидролиза в крови. Соединения пролекарств обычно обеспечивают преимущества растворимости, гистосовместимости или замедленного высвобождения в организмах млекопитающих. Пролекарства включают известные аминозащитные группы и карбоксизащитные группы.
В настоящей заявке «фармацевтический состав» относится к составу соединения по настоящему изобретению и среде, общепринятой в данной области, для доставки биологически активного соединения млекопитающему (например, человеку). Среда включает фармацевтически приемлемый носитель. Назначение фармацевтического состава состоит в том, чтобы облегчать введение в организм, что способствует абсорбции активного ингредиента, а затем проявляет биологическую активность.
Используемый здесь термин «фармацевтически приемлемый» относится к веществу (такому как носитель или разбавитель), которое не влияет на биологическую активность или свойства соединений по настоящему изобретению и является относительно нетоксичным, т.е. вещество может вводиться индивидууму, не вызывая побочных биологических реакций или не взаимодействуя с любым из компонентов, содержащихся в составе, нежелательным образом.
В настоящей заявке «фармацевтически приемлемый носитель» включает, помимо прочего, любой адъювант, носитель, наполнитель, глидант, подсластитель, разбавитель, консервант, краситель, ароматизатор, поверхностно-активное вещество, смачивающий реагент, диспергатор, суспендирующий реагент, стабилизатор, изотонический реагент, растворитель или эмульгатор, одобренный соответствующим государственным органом как приемлемый для использования человеком или животным.
«Опухоль» и «заболевания, связанные с аномальной пролиферацией клеток», описанные в настоящем изобретении, включают, помимо прочего, лейкемию, стромальную опухоль желудочно-кишечного тракта, гистиоцитарную лимфому, немелкоклеточный рак легких, мелкоклеточный рак легких, рак поджелудочной железы, плоскоклеточная карцинома легких, аденокарцинома легких, рак груди, рак простаты, рак печени, рак кожи, рак эпителия, рак шейки матки, рак яичников, рак кишечника, рак носоглотки, рак мозга, рак костей, рак пищевода, меланому, рак почки, рак полости рта и тому подобное.
Используемые здесь термины «профилактический», «предотвращать» и «предупреждение» включают в себя предоставление пациенту возможности снизить вероятность возникновения или ухудшения заболевания или расстройства.
Используемый здесь термин «лечение» и другие подобные синонимы включают следующие значения:
(i) предотвращение возникновения заболевания или состояния у млекопитающих, особенно когда такие млекопитающие восприимчивы к заболеванию или нарушению, но у них не диагностировано заболевание или нарушение;
(ii) подавление заболевания или нарушения, т.е. сдерживание развития заболевания;
(iii) облегчение заболевания или нарушения, т.е. регресс состояния заболевания или нарушения; или
(iv) облегчение симптомов, вызванных заболеванием или нарушением.
Используемые здесь термины «эффективное количество», «терапевтически эффективное количество» или «фармацевтически эффективное количество» относятся к количеству, по меньшей мере, одного реагента или соединения, достаточному для облегчения в определенной степени одного или нескольких симптомов заболевания или нарушения после введения. Результатом может быть уменьшение и/или облегчение признаков, симптомов или причин, или любое другое желаемое изменение в биологической системе. Например, «эффективное количество» для использования в терапии - это количество состава, содержащего описываемое здесь соединение, которое требуется для обеспечения значительного клинически смягчающего эффекта в отношении симптома. Эффективное количество, подходящее для любого индивидуального случая, можно определить с использованием таких методов, как тест на повышение дозы.
Используемые здесь термины «вводить», «введение» и т.п. относятся к способу доставки соединения или состава к желаемому участку для получения биологического эффекта. Эти способы включают, помимо прочего, пероральный путь, дуоденальный путь, парентеральные инъекции (включая внутривенные, подкожные, внутрибрюшинные, внутримышечные, внутриартериальные инъекции или инфузии), местное введение и ректальное введение. Специалисты в данной области знакомы с методиками введения, которые можно использовать в соединениях и способах, описанных здесь. В предпочтительном варианте осуществления обсуждаемые здесь соединения и составы вводятся перорально.
В контексте настоящего описания термины «фармацевтическое сочетание», «сочетание лекарственных средств», «комбинированное введение других лечебных средств», «введение других терапевтических реагентов» и т.п. относятся к форме препарата, полученной путем смешивания или объединения более чем одного активного ингредиента, включая фиксированные и нефиксированные сочетания активных ингредиентов. Термин «фиксированное сочетание» относится к одновременному введению по меньшей мере одного соединения, описанного в данном документе, и по меньшей мере одного синергетического агента пациенту в форме одного целого или одной лекарственной формы. Термин «нефиксированное сочетание» относится к одновременному, комбинированному или последовательному введению по меньшей мере одного соединения, описанного в данном документе, и, по меньшей мере, одного синергетического состава пациенту в форме отдельных компонентов. Они также применимы к коктейльной терапии, например, к введению трех или более активных ингредиентов.
Специалистам в данной области также будет понятно, что в способах, описанных ниже, функциональные группы промежуточных соединений могут нуждаться в защите подходящей защитной группой. Такие функциональные группы включают гидроксил, амино, меркапто и карбоновые кислоты. Подходящие гидроксизащитные группы включают триалкилсилил или диарилалкилсилил (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), тетрагидропиранил, бензил и тому подобное. Подходящие защитные группы для амино, гуанила и гуанидино включают трет-бутоксикарбонил, бензилоксикарбонил и тому подобное. Подходящие тиолзащитные группы включают -C(O)-R'' (где R'' представляет собой алкил, арил или аралкил), п-метоксибензил, тритил и тому подобное. Подходящие карбоксизащитные группы включают сложные алкиловые, ариловые или аралкиловые эфиры.
Защитные группы можно вводить и удалять в соответствии со стандартными методами, известными специалистам в данной области, и как описано в данном документе. Защитная группа также может быть полимерной смолой.
Далее настоящее изобретение будет описано со ссылкой на конкретные примеры. Следует понимать, что эти примеры используются только для иллюстрации настоящего изобретения, а не для ограничения объема настоящего изобретения. Экспериментальные методы без особых условий в следующих примерах обычно выполняются в соответствии с обычными условиями (например, условиями, описанными в Sambrook et al., Molecular Cloning: Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989)) или в соответствии с условиями, рекомендованными производителем. Если не указано иное, проценты и части являются массовыми процентами и массовыми частями.
Если не указано иное, все используемые здесь профессиональные и научные термины имеют те же значения, что и термины, известные специалистам в данной области. Кроме того, любые способы и материалы, подобные или эквивалентные описанным, могут быть использованы согласно способу по настоящему изобретению. Описанные здесь предпочтительные варианты осуществления и материалы предназначены только для демонстрационных целей.
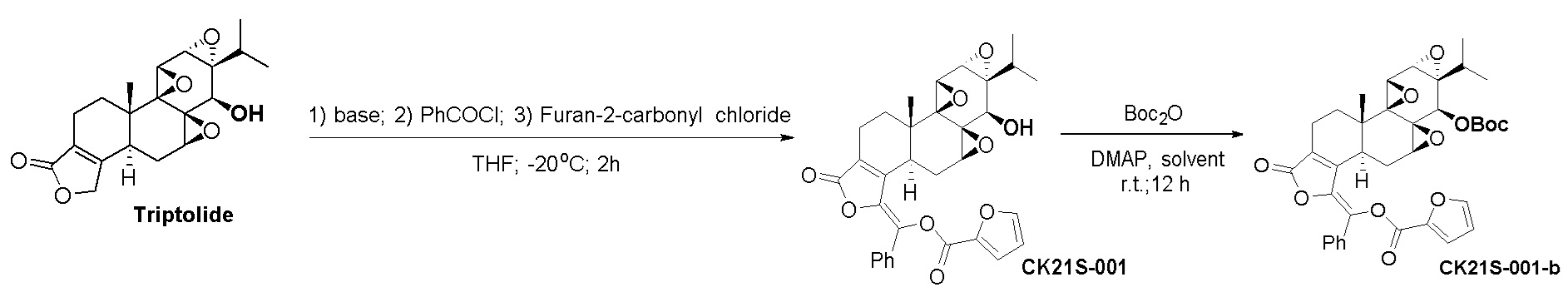
Пример 1. Получение соединения CK21S-001
1.1 Синтез соединения CK21S-001
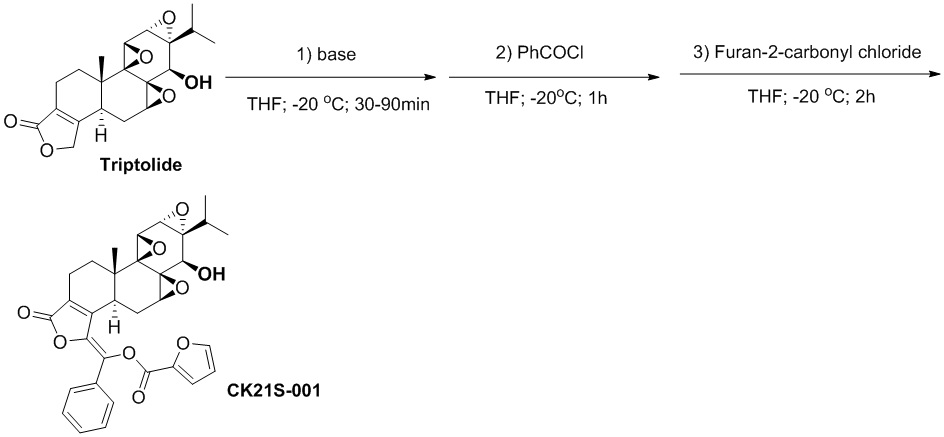
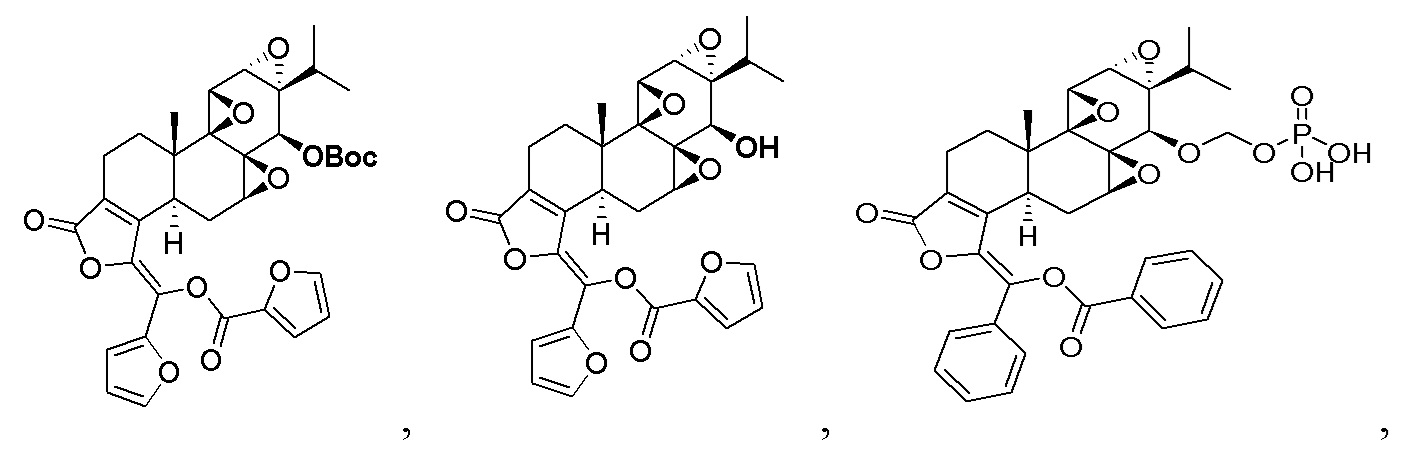
В атмосфере азота соединение триптолид (180 мг, 0,5 ммоль) добавляли в трехгорлую круглодонную колбу, добавляли безводный тетрагидрофуран (25 мл), температуру смеси понижали до -20°C и добавляли раствор 2,2,6,6-тетраметилпиперидин лития в тетрагидрофуране/толуоле (0,75 мл, 2,0 М, 1,5 ммоль) при этой температуре. После перемешивания смеси при этой температуре в течение 30 минут медленно по каплям добавляли бензоилхлорид (0,105 мл, 0,75 ммоль). После добавления по каплям смесь перемешивали и оставляли реагировать в течение 1 ч, а затем по каплям добавляли 2-фуроилхлорид (0,105 мл, 0,75 ммоль). Смесь перемешивали при -20°C и оставляли реагировать в течение 2 часов. Реакцию гасили добавлением водного карбоната натрия (10%), и смесь экстрагировали этилацетатом (25 мл x 3). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный продукт отделяли и очищали хроматографией на силикагеле (дихлорметан: этилацетат), целевой продукт (белое твердое вещество, 255 мг, выход 90%) собирали и дополнительно перекристаллизовывали в смешанном органическом растворителе с получением конечного продукта (213 мг, выход 85%, чистота > 99%).
1H ЯМР (400 МГц, CDCl3): δ 7,76 (d, J = 1,6 Гц, 1H), 7,74 (d, J = 1,2 Гц, 2H), 7,54 (dd, J1= 0,8 Гц, J2= 3,6 Гц, 1H), 7,44~7,36 (m, 3H), 6,63 (dd, J1= 1,6 Гц, J2= 3,6 Hz, 1H), 3,79 (d, J = 2,8 Гц, 1H), 3.40 (d, J = 2,4 Гц, 1H), 3,17 (d, J = 9,2 Гц, 1H), 2,97~2,89 (m, 2H), 2,63~2,56 (m, 2H), 2,37~2,33 (м, 2H), 2,21 (q, J = 6,4 Гц, 1H), 1.93 (t, J = 13,6 Гц, 1H), 1,57 (s, 3H), 1,56 ~1,51 (m, 1H), 1,43 (s, 3H), 1,12 (s, 3H), 1,15~1,08 (m, 1H), 0,96 (d, J = 7,2 Гц, 3H), 0,84 (d, J = 7,2 Гц, 3H).13C ЯМР (100 МГц, CDCl3): δ 171,3, 167,9, 155,9, 151,4, 150,5, 148,2, 142,7, 142,3, 134,6, 132,4, 131,5, 129,9, 129,5, 129,1, 128,9, 128,6, 128,0, 121,5, 113,3, 112,6, 73,1, 60,0, 65,6, 65,4, 60,7, 56,9, 56,4, 56,3, 53,9, 40,8, 36,7, 35,9, 30,1, 29,1, 27,9, 24,6, 17,8, 17,7, 16,8, 14,8. MS расч. для C32H30O9 (M+): 559,2, обнаружено 559,2.
1.2 Синтез соединения CK21S-001-b
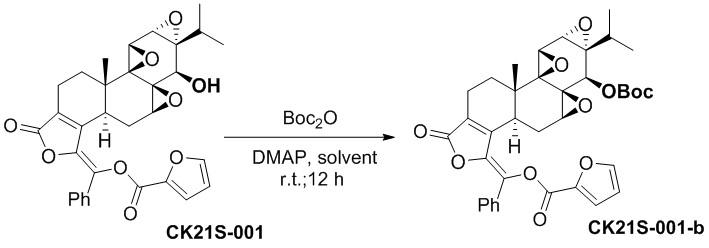
При комнатной температуре CK21S-001 (558 мг, 1 ммоль) загружали в сухую круглодонную колбу и добавляли 10 мл этилацетата. После растворения отдельно добавляли N,N-диметилпиридин (DMAP, 0,6 г, 5 ммоль) и ди-трет-бутилдикарбонат (0,65 г, 3 ммоль), и смесь реагировала при комнатной температуре в течение ночи. После завершения реакции смесь разбавляли этилацетатом (150 мл), и органическую фазу промывали разбавленной соляной кислотой (50 мл), водой (50 мл) и насыщенным хлоридом натрия (10 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт отделяли и очищали хроматографией на силикагеле (н-гексан: этилацетат), и собирали целевой продукт (белое твердое вещество, 0,6 г, 90%, чистота > 98%).
1H ЯМР (400 МГц, CDCl3): δ 7,77 (d, J = 0,8 Гц, 2H), 7,75 (dd, J1= 2,0 Гц, J2= 3,2 Гц, 1H), 7,54 (dd, J1= 0,8 Гц, J2= 3,6 Гц, 1H), 7,44~7,36 (m, 3H), 6,65 (dd, J1= 1,6 Гц, J2= 3,6 Гц, 1H), 4,53 (s, 1H), 4,12 (q, J = 7,2 Гц, 1H), 3,702 (d, J = 2,8 Гц, 1H), 3,41 (d, J = 2,4 Гц, 1H), 3,03 (d, J = 6,0 Гц, 1H), 3,94 ~2,88 (m, 1H), 2,56 ~2,52 (m, 1H), 2,39~2,31 (m, 2H), 1,94~1,86 (m, 2H), 1,60 (s, 3H), 1,58~1,50 (m, 1H), 1,49 (s, 9H), 1,33~1,24 (m, 4 H), 1,13 (s, 3H), 1,15~1,08 (m, 1H), 0,96 (d, J = 5,6 Гц, 3H), 0,88 (t, J = 7,2 Гц, 3H), 0,82 (d, J = 6,8 Гц, 3H). MS расч. для C37H38O11(M+): 659,2, обнаружено 659,2.
Пример 2. Получение соединения CK21S-002
2.1 Синтез соединения CK21S-002
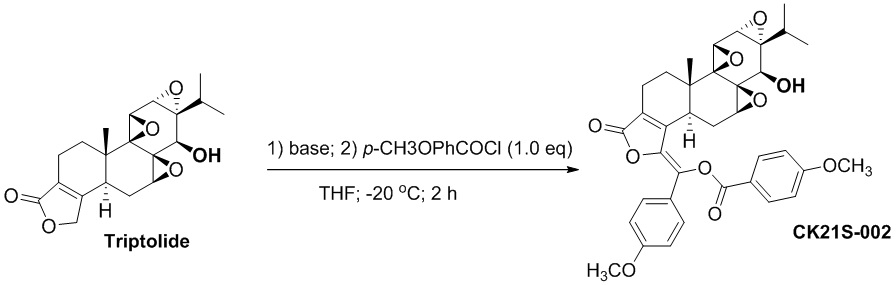
CK21S-002 было получено с использованием аналогичного метода получения CK21S-001 с выходом 89% и чистотой более 99%. Разница заключалась в том, что п-метоксибензоилхлорид использовался вместо бензоилхлорида и фуроилхлорида в примере 1, а другие условия были такими же.
1H ЯМР (400 МГц, CDCl3): δ 8,20 (d, J = 8,8 Гц, 2H), 7,71 (d, J = 8,8 Гц, 2H), 7,03 (d, J = 8,8 Гц, 2H), 6,92 (d, J = 8,8 Гц, 2H), 3,87 (s, 3H), 3,83 (s, 3H), 3,79 (d, J = 3,2 Гц, 1H), 3,37 (d, J = 3,2 Гц,1H), 3,02 (d, J = 9,6 Гц, 1H), 2,84~2,78 (m, 1H), 2,71 (d, J = 6,4 Гц, 1H), 2,59~2,53 (m, 2H), 2,35~2,32 (m, 2H), 2,19~2,12 (m, 1H), 1,92~1,85 (m, 1H), 1,53~1,50 (m, 1H), 1,15 (s, 3H), 1,12~1,09 (m, 1H), 0,90 (d, J = 6,8 Гц, 3H), 0,81(d, J = 6,8 Гц, 3H).13C ЯМР (100 МГц, CDCl3): δ 168,3, 164,6, 164,1, 160,7, 150,4, 141,2, 133,6, 132,7, 132,7, 129,8, 129,8, 127,7, 124,5, 120,2, 114,4, 114,4, 114,1, 114,1, 72,9, 65,9, 65,3. , 60,8, 60,1, 56,5, 55,5, 55,4, 53,7, 40,7, 36,7, 29,3, 28,0, 24,6, 17,6, 17,5, 16,7, 15,0. MS расч. для C36H36O10 (M+): 629,3, обнаружено 629,3.
2.2 Синтез соединения CK21S-002-b
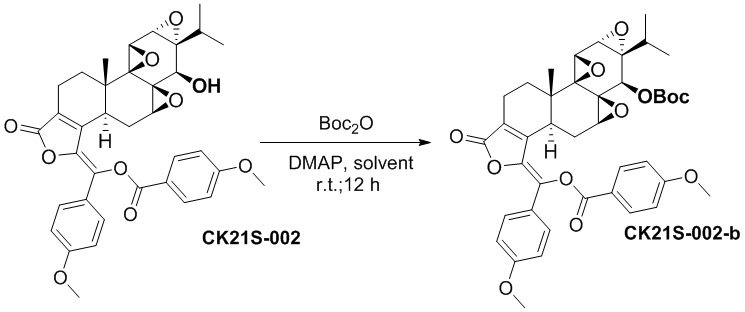
CK21S-002-b было получено из CK21S-001-a с использованием аналогичного метода получения CK21S-001-b с выходом 90% и чистотой более 99%.
1H ЯМР (400 МГц, CDCl3): δ 8,21(d, J = 8,8 Гц, 2H), 7,72 (d, J = 9,2 Гц, 2H), 7,05 (d, J = 9,2 Гц, 2H), 6,92 (d, J = 8,8 Гц, 2H), 4,35 (s, 1H), 3,89 (d, J = 6 Гц, 1H), 3,88 (s, 3H), 3,83 (s, 3H), 3,70 (d, J = 3,2 Гц, 1H), 3,38 (d, J = 2,8 Гц, 1H), 2,80~2,78 (m, 2H), 2,55~2,52 (m, 1H), 2,34~2,30 (m, 2H), 1,91~1,80 (m, 2H), 1,47 (s, 9H), 1,11 (s, 3H), 1,12~1,05 (m, 1H), 0,89 (d, J = 6,8 Гц, 3H), 0,79 (d, J = 6,8 Гц, 3H). MS расч. для C41H44O12 (M+): 729,3, обнаружено 729,3.
Пример 3. Получение соединения CK21S-003
3.1 Синтез соединения CK21S-003
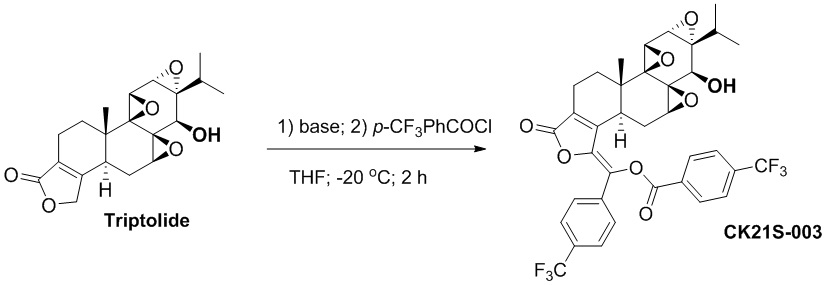
CK21S-003 было получено с использованием аналогичного метода получения CK21S-001 с выходом 90% и чистотой более 99%. Разница заключалась в том, что п-трифторметилбензоилхлорид использовался вместо бензоилхлорида и фуроилхлорида в примере 1, а другие условия были такими же.
1H ЯМР (400 МГц, CDCl3): δ 8,36 (d, J = 8,0 Гц, 2H), 7.88 (d, J = 8,0 Гц, 2H), 7,81 (d, J = 8,0 Гц, 2H), 7,67 (d, J = 8,0 Гц, 2H), 3,82 (d, J = 3,2 Гц, 1H), 3,44 (d, J = 3,2 Гц, 1H), 3,04 (d, J = 10 Гц, 1H), 2,68~2,58 (m, 3H), 2,55 (d, J = 10 Гц, 1H), 2,40~2,37 (m, 2H), 2,20~2,13 (m, 1H), 2,00~1,90 (m, 1H), 1,60 (m, 1H), 1,18 (s, 3H), 1,16~1,13 (m, 1H), 0,90 (d, J = 7,2 Гц, 3H), 0,83 (d, J = 7,2 Гц, 3H).13C ЯМР (100 МГц, CDCl3): δ 167,3, 163,3, 150,0, 143,2, 136,4, 136,1, 135,1, 131,6, 131,5, 131,3, 130,9, 130,4, 128,3, 126,3, 125,6, 73,0, 65,8, 65,5, 60,1, 60,1, 56,2, 54,0, 40,9, 36,8, 29,1 , 28,0, 24,7, 17,7, 17,5, 16,7, 14,9. MS расч. для C36H30O8F6 (M+): 705,2, обнаружено 705,2.
3.2 Синтез соединения CK21S-003-b
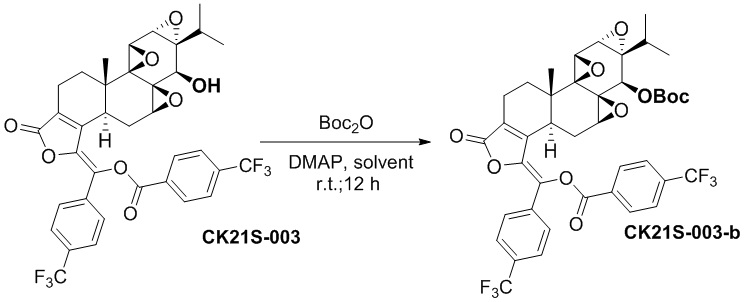
CK21S-003-b было получено с использованием аналогичного метода получения CK21S-001-b с выходом 92% и чистотой более 98%.
1H ЯМР (400 МГц, CDCl3): δ 8,37 (d, J = 8,0 Гц, 2H), 7,89 (d, J = 8,4 Гц, 2H), 7,81 (d, J = 8,0 Гц, 2H), 7,67 (d, J = 8,4 Гц, 2H), 4,36 (s, 1H), 3,73 (d, J = 2,8 Гц, 1H), 3,44 (d, J = 2,8 Гц, 1H), 2,72 (d, J = 6,0 Гц, 1H), 2,63~2,57 (m, 2H), 2,38~2,36 (m, 2H), 1,96~1,84 (m, 2H), 1,62~1,59 (m, 1H), 1,46 (s, 9H), 1,19~1,16 (m, 1H), 1,14 (s, 3H), 0,86 (d, J = 6,8 Гц, 3H), 0,80 (d, J = 7,2 Гц, 3H). MS расч. для C41H38O10F6 (M+): 805,2, обнаружено 805,2.
Пример 4. Получение соединения CK21S-004
4.1 Синтез соединения CK21S-004
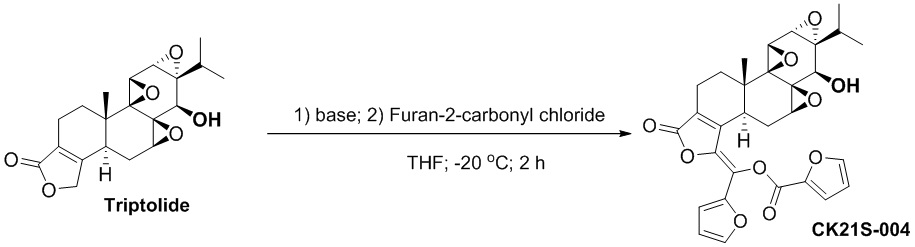
CK21S-004 было получено с использованием аналогичного метода получения CK21S-001 с выходом 88% и чистотой более 99%. Разница заключалась в том, что фуран-2-карбонилхлорид использовался вместо бензоилхлорида в примере 1, а другие условия были такими же.
1H ЯМР (400 МГц, CDCl3): δ 7,74~7,72 (m, 1H), 7,54 (dd, 1H), 7,49 (d, 1H), 7,17 (d, 1H), 6,63 (q, 1H), 6,56 (q, 1H), 3,77 (d, J = 3,2 Гц, 1H), 3,38 (d, J = 2,4 Гц, 1H), 3,18 (d, J = 10 Гц, 1H), 3,01 (d, J = 3,2 Гц, 1H), 3,04 ~2,97 (m, 1H), 3,62 (d, J = 10 Гц, 1H), 2,54~2,50 (m, 1H), 2,40~2,32 (m, 1H), 2,23~2,16 (m, 1H), 1,96~1,87 (m, 1H), 1,57~1,50 (m, 2H), 1,17 (s, 3H), 1,13~1,10 (m, 1H), 0,95 (d, J = 7,2 Гц, 3H), 0,823 (d, J = 7,2 Гц, 3H);13C ЯМР (100 МГц, CDCl3): δ 167,4, 155,6, 150,0, 148,0, 145,1, 144,2, 142,6, 140,3, 128,7, 124,6, 121,6, 115,5, 113,0, 112,6, 73,2, 66,1, 65,4, 60,6, 60,2, 56,3, 54,0, 40,4, 36,7, 29,1, 28,0 , 24,4, 17,8, 17,7, 16,8, 14,8. MS расч. для C30H28O10 (M+): 549,18, обнаружено 549,17.
4.2 Синтез соединения CK21S-004-b
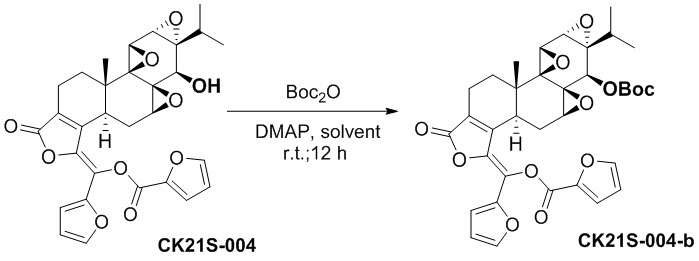
CK21S-004-b было получено с использованием аналогичного метода получения CK21S-001-b с выходом 93% и чистотой более 99%.
1H ЯМР (400 МГц, CDCl3): δ 7,76 (d, J = 0,8 Гц, 1H), 7,55 (d, J = 3,2 Гц, 1H), 7,50 (d, J = 1,2 Гц, 1H), 7,17 (d, J = 3,2 Гц, 1H), 6,66 (dd, J = 1,6 Гц, 3,6 Гц, 1H), 6,56 (dd, J = 1,6 Гц, 3,6 Гц, 1H), 4,54 (s, 1H), 3,68 (d, J = 3,2 Гц, 1H), 3,40 (d, J = 2,8 Гц, 1H), 3,08 (d, J = 6,4 Гц, 1H), 3,03~2,97 (m, 1H), 2,50~2,47 (m, 1H), 2,35~2,31 (m, 2H), 1,93~1,85 (m, 2H), 1,49 (s, 9H), 1,25 (m, 1H), 1,13 (s, 3H), 1,08~1,05 (m, 1H), 0,93 (d, J = 6,8 Гц, 3H), 0,80 (d, J = 6,8 Гц, 3H). MS расч. для C35H36O12 (M+): 649,2, обнаружено 649,2.
Пример 5. Получение соединения CK21S-005
5.1 Синтез соединения CK21S-005
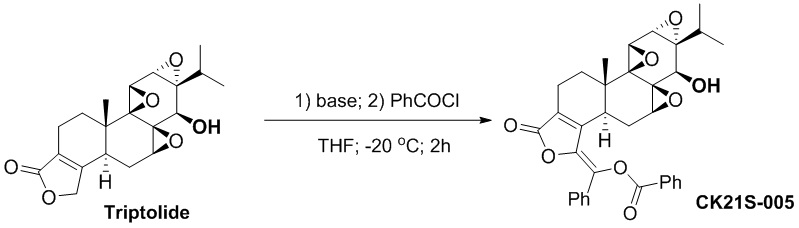
CK21S-005 было получено с использованием аналогичного метода получения CK21S-001 с выходом 80% и чистотой более 99%. Условия реакции аналогичные.
1H ЯМР (400 M, CDCl3): δ 8,25 (dd, J =1,6 Гц, 8 Гц, 2H), 7,76 (dd, J =1,6 Гц, 8,4 Гц, 2H), 7,67 (m, 1H), 7,58 (t, J = 7,2 Гц, 2H), 7,43~7,38 (m, 3H), 3,80 (d, J = 3,2 Гц, 1H), 3,39 (d, J = 2,8 Гц, 1H), 2,98 (d, J = 10 Гц, 1H), 2,75~2,69 (m, 1H), 2,63~2,58 (m, 1H), 2,56 (d, J = 6,4 Гц, 1H), 2,53 (d, J = 10 Гц, 1H), 2,40~2,32 (m, 2H), 2,21~2,14 (m, 1H), 1,88 (dd, J =14,0 Гц, 13,2 Гц, 1H), 1,55~1,52 (m, 1H), 1,18~1,11 (m, 1H), 1,15 (s, 3H), 0,92 (d, J = 7,2 Гц, 3H), 0,82 (d, J = 6,8 Гц, 3H);13C ЯМР (100 МГц, CDCl3): δ 168,1, 164,5, 150,3, 142,2, 134,4, 133,5, 131,9, 130,5, 129,9, 129,2, 128,9, 128,6, 128,1, 128,0, 72,8, 65,8, 65,3, 60,7, 60,0, 56,5, 53,7, 40,7, 36,7, 29,3, 27,9 , 24,6, 17,8, 17,6, 16,7, 15,0. MS расч. для C34H32O8 (M+): 569,2, обнаружено 569,2.
5.2 Синтез соединения CK21S-005-b
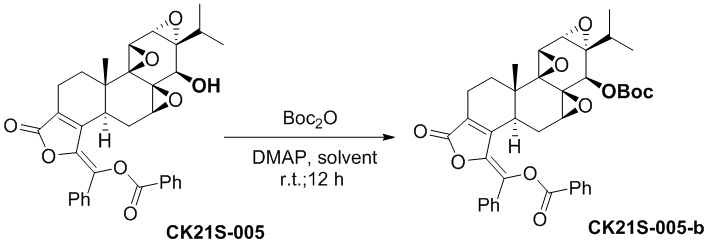
CK21S-005-b было получено с использованием аналогичного метода получения CK21S-001-b с выходом 90% и чистотой более 99%.
1H ЯМР (400M, CDCl3): δ 8,26 (dd, J =1,6 Гц, 8 Гц, 2H), 7,76 (dd, J =1,6 Гц, 8,4 Гц, 2H), 7,67 (m, 1H), 7,58 (t, J = 7,2 Гц, 2H), 7,44~7,38 (m, 3H), 4,30 (d, J = 3,2 Гц, 1H), 3,70 (d, J = 2,8 Гц, 1H), 3,40 (d, J = 10 Гц, 1H), 2,75~2,68 (m, 1H), 2,62 (d, J = 8,0 Гц, 1H), 2,58~2,54 (m, 1H), 2,33~2,27 (m, 2H), 1,91~1,81 (m, 2H), 1,49 (s, 9H), 1,11(s, 3H), 0,92 (d, J = 7,2 Гц, 3H), 0,82 (d, J = 6,8 Гц, 3H);13C-ЯМР (100 МГц, CDCl3): δ 168,1, 164,5, 150,3, 142,2, 134,4, 133,5, 131,9, 130,5, 129,9, 129,2, 128,9, 128,6, 128,1, 128,0, 82,9, 73,9, 63,4, 63,1, 61,6, 58,6, 55,2, 54,5, 40,8, 36,7, 29,3 , 27,9, 24,6, 17,8, 17,7, 16,7, 15,5. MS расч. для C39H40O10(M+): 669,2, обнаружено 669,2.
Пример 6. Получение соединения CK21S-006
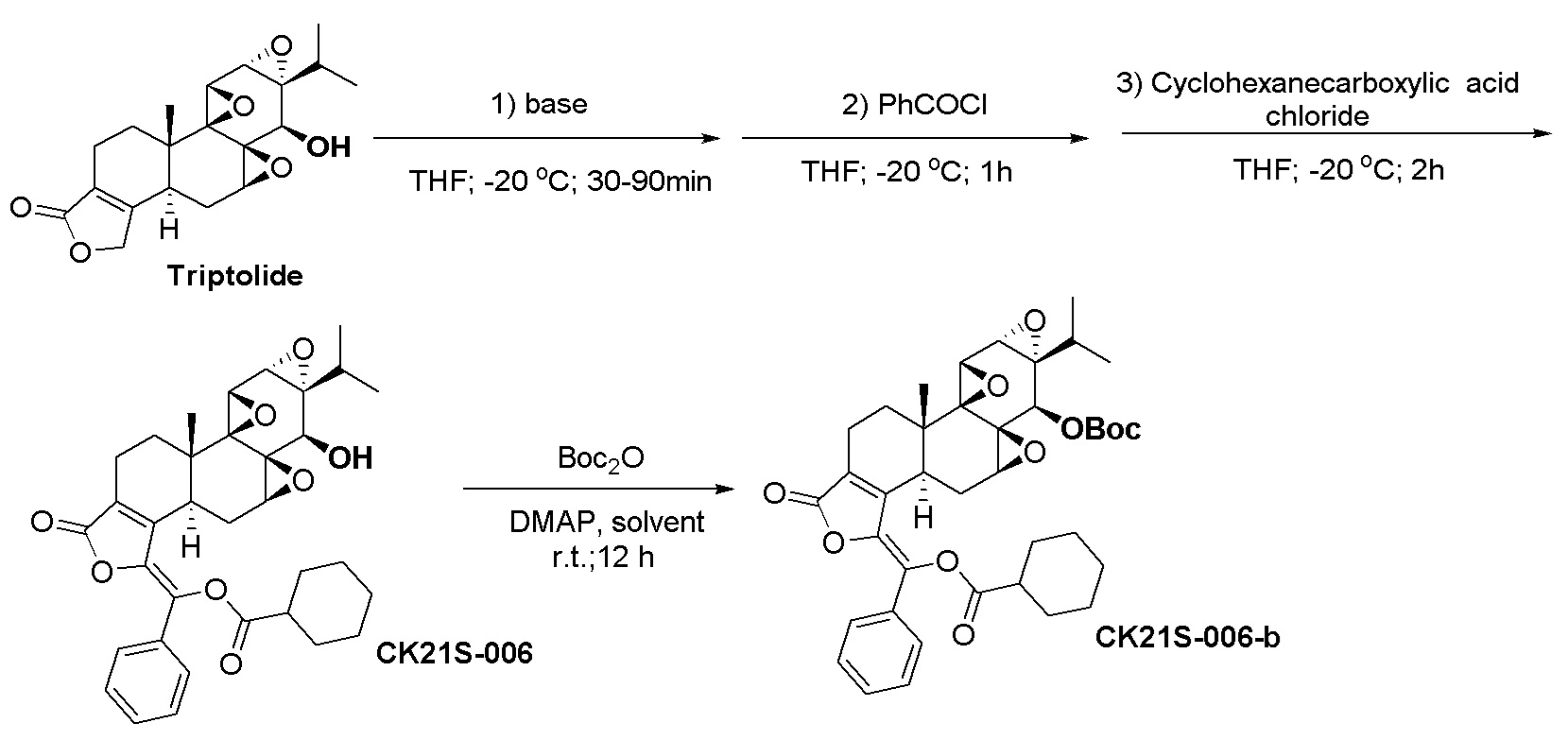
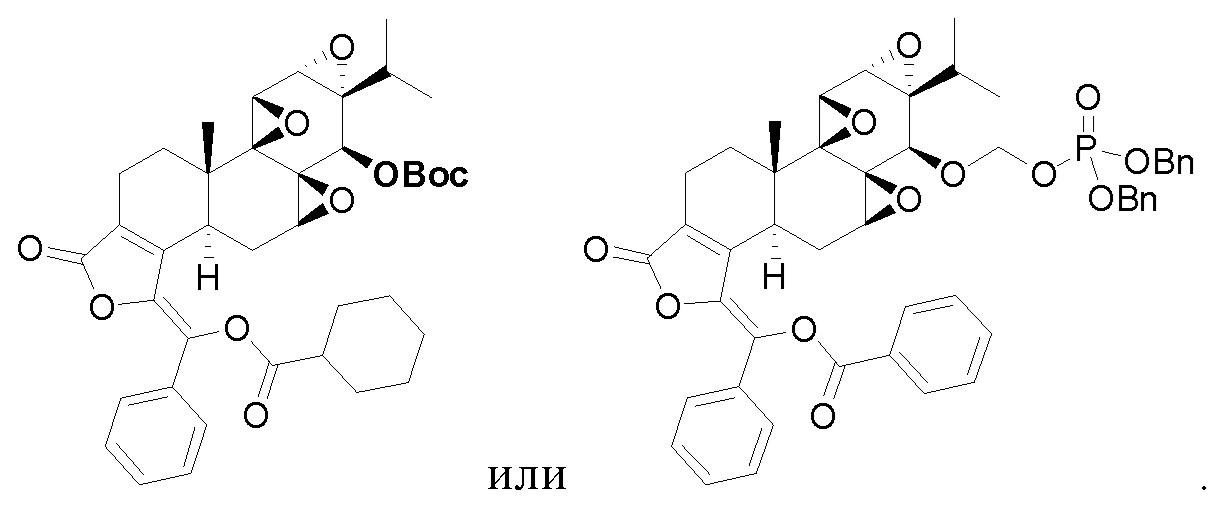
CK21S-006 было получено с использованием аналогичного метода получения CK21S-001 с выходом 75% и чистотой более 95%. Разница заключалась в том, что циклогексилформилхлорид использовался вместо фуроилхлорида в примере 1, а другие условия были такими же.
1H ЯМР (400 МГц, CDCl3): δ 7,67 (d, J = 2,0 Гц, 1H), 7,65 (d, J =1,6 Гц, 1H), 7,43~7,35(m, 2H), 3,86 (d, J = 2,8 Гц, 1H), 3,50 (d, J = 2,8 Гц, 1H), 3,42 (d, J = 10,4 Гц, 1H), 3,37 (d, J = 6,4 Гц, 1H), 3,0 (t, J = 4,8 Гц, 1H), 2,71 (d, J = 10,4 Гц, 1H), 2,62 ~ 2,55 (m, 2H), 2,37~2,32 (m, 2H), 2,28 (q, J = 6,8 Гц,1H), 2,22~2,16 (m, 2H), 1,97 (dd, J1=13,2 Гц, J2= 2,0 Гц, 1H), 1,90~1,84 (m, 2H), 1,73 (d, J =11,6 Гц,1H), 1,63~1,53 (m, 2H), 1,39 ~1,24 (m, 4H), 1,20 (s, 3H), 1,17~1,12 (m, 1H), 1,01 (d, J = 7,2 Гц, 3H), 0,87 (d, J = 7,2 Гц, 3H). MS расч. для C34H38O8 (M+): 575,2, обнаружено 575,2.
CK21S-006-b было получено с использованием аналогичного метода получения CK21S-001-b.
Пример 7. Получение соединения CK21S-007
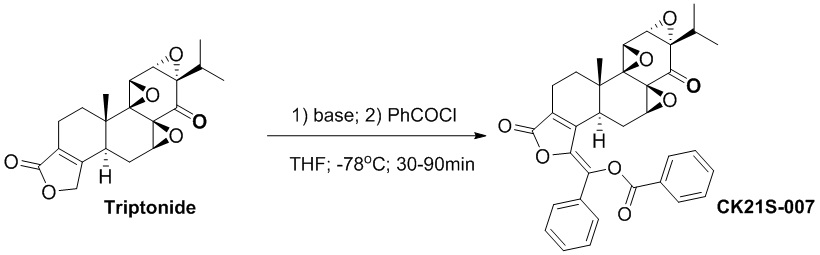
CK21S-007 было получено из триптонида с использованием аналогичного метода получения CK21S-001 с выходом 91% и чистотой более 98%.
1H ЯМР (400 МГц, CDCl3): δ 8,22~8,25 (m, 2H), 7,77~7,79 (m, 2H), 7,59~7,63 (m, 1H), 7,49~7,54 (m, 2H), 7,37~7,41 (m, 3H), 3,94 (d, J = 2,8 Гц, 1H), 3,71(d, J = 2,8 Гц, 1H), 2,79~2,85 (m, 1H), 2,56 ~ 2,61 (m, 2H), 2,33 ~ 2,45 (m, 2H), 2,20~2,29 (m, 1H), 1,88 (dd, J1= 13,6 Гц, J2 = 14,8 Гц, 1H), 1,54~1,58 (m, 1H), 1,19~1,28 (m, 1H), 1,09 (s, 3H), 0,93 (d, J = 6,8 Гц, 3H), 0,87 (d, J = 6,8 Гц, 3H). MS расч. для C34H30O8 (M+): 567,2, обнаружено 567,2.
Пример 8. Получение соединения CK21S-008
CK21S-005
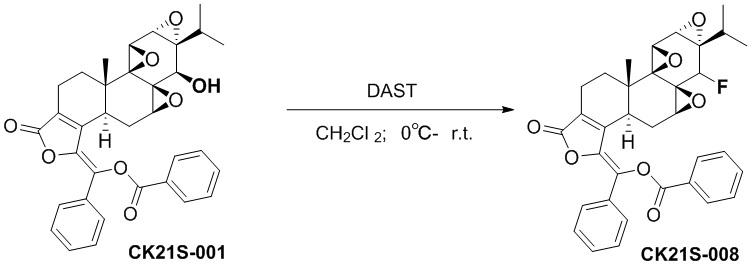
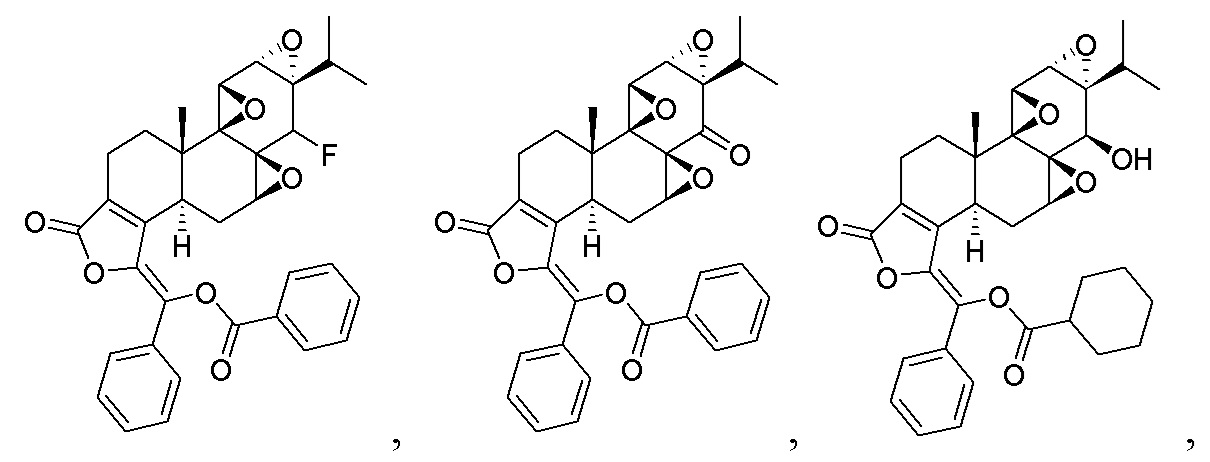
Соединение CK21S-005 (57 мг, 0,1 ммоль) загружали в высушенную трехгорлую круглодонную колбу, добавляли 3 мл дихлорметана для растворения и смесь охлаждали до 0°C. Реагент DAST F (0,3 мл, 2,289 ммоль) добавлялся по каплям в реакционную систему, и смесь тщательно перемешивалась. Система медленно приобрела желтоватый цвет. После 4 часов реакции добавляли насыщенный раствор NaHCO3, чтобы погасить реакцию. Смесь разбавляли этилацетатом. Органическую фазу промывали водой (10 мл), насыщенным карбонатом натрия (10 мл) и насыщенным хлоридом натрия (10 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт отделяли и очищали хроматографией на силикагеле (дихлорметан: этилацетат) и собирали с получением целевого продукта CK21S-008 (белое твердое вещество, 40 мг, выход 70%).
1H ЯМР (400 M, CDCl3)δ 0,89 (d, J = 6,9 Гц, 3H), 1,18 (d, J = 6,9 Гц, 3H), 1,13 (s, 3H), 1,23-1,28 (m, 1H), 1,51-1,54 (m, 1H), 1,83 ~ 1,90 (m, 1H), 1,92 ~ 1,99 (m, 1H), 2,25-2,36 (m, 2H), 2,58 ~ 2,61 (m, 1H), 2,74 ~ 2,80 (m, 1H), 2,98 ~ 2,99 (d, J = 6,4 Гц, 1H), 3,34 (t, J = 2,8 Гц,1H), 3,70 (t, J = 1,6 Гц, 1H), 4,95 (d, 1H), 7,38 ~ 7,45 (m ,3H), 7,47 ~ 7,49 (m, 1H), 7,56 ~ 7,60 (m,2H), 7,67 ~ 7,70 (m,1H), 7,75 ~ 7,78 (m,2H), 8,23 ~ 8,25(m, 1H);19F ЯМР (400 M, CDCl3) δ 213,49. MS расч. для C34H31FO7 (M+): 571,2, обнаружено 571,3.
Пример 9. Получение соединения CK21S-005-b'
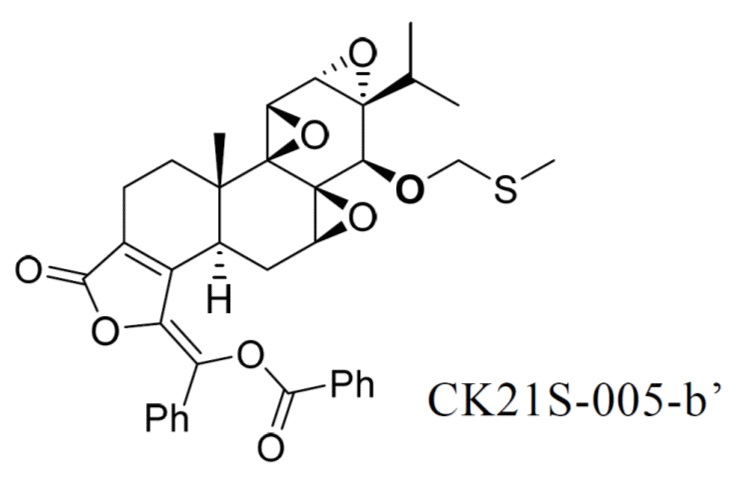
CK21S-005-b' было получено из CK21S-005 с использованием способа, аналогичного способу получения в J. Med. Chem., 2015, 58, 9334.
1H ЯМР (400 МГц, CDCl3): δ 8,25 (d, J = 5,2 Гц, 2H), 7.74 (d, J = 4,8 Гц, 2H), 7,68 (t, 1H), 7,61(t, 2H), 7,43~7,38 (m, 3H), 4,94 (d, J = 8 Гц, 1H), 4,85 (d, J = 8 Гц, 1H), 3,69 (d, J = 2 Гц, 1H), 3,38 (d, J = 2 Гц, 1H), 3,21(s, 1H), 2,62~2,72 (m, 2H), 2,44 (d, J = 4 Гц, 1H), 2,35~2,33 (m, 2H), 2,29~2,24 (m, 1H), 2,13 (s, 3H), 1,86 (t, 1H), 1,59~1,57 (m, 1H), 1,16~1,09 (m, 1H), 1,13 (s, 3H), 0,90 (d, J = 4,4 Гц, 3H), 0,78 (d, J = 4,4 Гц, 3H).13C ЯМР (100 МГц, CDCl3): δ 168,1, 164,5, 150,5, 142,2, 134,4, 133,5, 132,0, 130,5, 129,8, 129,3, 129,0, 128,6, 128,1, 128,0, 75,6, 64,1, 63,8, 60,8, 58,4, 54,9, 53,8, 40,7, 36,8, 29,6, 29,0 , 26,1, 24,4, 17,7, 17,3, 16,7, 15,0, 14,8. MS расч. для C36H36O12 S(M+): 628,2, обнаружено 628,2.
Пример 10. Получение соединения CK21S-009
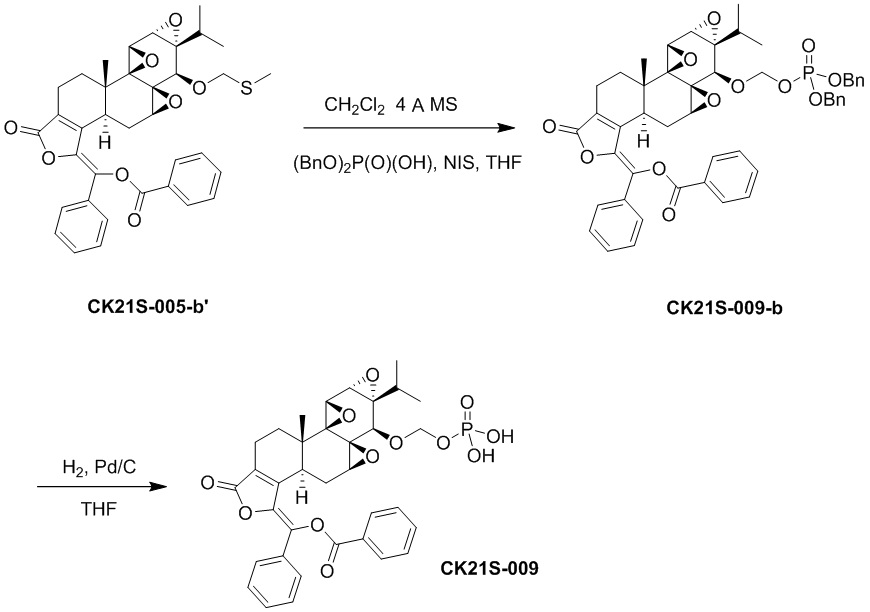
Соединение CK21S-005-b’ было в дальнейшем извлечено с получением соединения CK21S-009-b, а затем с соединения CK21S-009-b была снята защита для удаления бензила. Конкретная процедура описана ниже.
При комнатной температуре CK21S-005-b’ (300 мг, 0,48 ммоль) растворяли в дихлорметане (10 мл) и добавляли молекулярное сито (300 мг). Заменяли азот и смесь перемешивали при 15-20°C. Кроме того, NIS (йодсукцинимид) (129 мг, 0,57 ммоль) и дибензилфосфат (159 мг, 0,57 ммоль) растворяли в тетрагидрофуране (10 мл), а затем медленно по каплям добавляли в реакционный раствор. После завершения добавления по капле выполнялась реакция при комнатной температуре в течение 3 часов. После завершения реакции реакционный раствор фильтровали, а затем добавляли дихлорметан (120 мл) для разбавления. Затем для обесцвечивания добавляли 0,1 М тиосульфат натрия (10 мл), а затем смесь промывали насыщенным водным раствором карбоната натрия и насыщенным водным раствором хлорида натрия. Органическую фазу сушили и концентрировали с получением 300 мг продукта CK21S-009-b, который непосредственно подвергали следующей реакции без очистки на колонке.
Катализатор палладированный уголь (160 мг) помещали в тетрагидрофуран (12 мл), затем смесь охлаждали до 0°C и перемешивали. CK21S-009-b (300 мг) растворяли в ТГФ (12 мл), а затем медленно добавляли в указанный выше реакционный раствор. После завершения добавления водород заменяли, и реакцию поддерживали в атмосфере водорода, используя водородный баллон, и проводили реакцию при комнатной температуре в течение 2 часов. После завершения реакции реакционный раствор фильтровали, а затем добавляли небольшое количество водного раствора карбоната натрия (50 мг Na2CO3, 4 мл) для доведения pH до примерно 8-9. Добавляли небольшое количество воды и метанола, и смесь лиофилизировали и очищали препаративной жидкостной хроматографией с получением целевого продукта (белое твердое вещество, 80 мг, чистота > 99%).
1H ЯМР (400 МГц, CDCl3) δ 8,20 (d, J = 7,6 Гц, 2H), 7,76~7,79 (m, 1H), 7,65~7,71 (m, 4H), 7,42~7,51 (m, 3H), 7,27 (s, 2H), 4,89~4,97 (m, 2H), 3,75 (d, J = 2,8 Гц, 1H), 3,38 (d, J = 2,8 Гц, 1H), 3,32 (s, 1H), 2,73~2,82 (m, 2H), 2,31~2,40 (m, 2H), 2,22~2,26 (m, 2H), 1,81 (t, J = 14 Гц, 1H), 1,23~1,30 (m, 1H), 1,10~1,11(m, 1H), 0,97 (s, 3H), 0,82 (d, J = 6,4 Гц, 3H), 0,65 (d, J = 6,8 Гц, 3H).13C ЯМР (100 МГц, CDCl3): δ 167,2, 164,3, 150,3, 141,9, 135,0, 131,9, 131,7, 130,0, 129,8, 129,4, 128,9, 128,7, 127,6, 126,9, 90,7, 75,7, 63,7, 62,9, 60,5, 59,8, 54,7, 53,3, 36,1, 28,6, 25,3 , 23,8, 17,3, 17,2, 16,8, 15,0.31P-ЯМР (400 МГц, CDCl3): δ -2,1. MS расч. для C35H35O12 P(M-): 677,2, обнаружено 627,2.
Пример 11. Обнаружение in vitro противоопухолевого действия низкомолекулярных соединений CK21S-001, CK21S-001-b, CK21S-002, CK21S-002-b, CK21S-003, CK21S-003-b, CK21S-004, CK21S-004-b, CK21S-005, CK21S-005-b, CK21S-006, CK21S-006-b, CK21S-007, CK21S-008, CK21S-009 и триптолида
Опухолевые клетки включали AsPC-1 (опухолевая клетка поджелудочной железы человека), PC-3 (опухолевая клетка простаты человека) и SK-OV-3 (опухолевая клетка яичника человека). Источник и культуральная среда клеток показаны в таблице 1 ниже.
Таблица 1. Информация об опухолевых клетках
Триптолид использовали в качестве положительной контрольной пробы; рабочие концентрации исследуемого препарата составляли 1 мкМ, 0,33 мкМ, 0,11 мкМ, 0,037 мкМ, 0,012 мкМ, 0,004 мкМ, 1,4 нМ и 0,46 нМ. После оживления опухолевых клеток их ресуспендировали в соответствующей полной среде, помещали в 5% CO2 и культивировали при 37°C. Опухолевые клетки на стадии логарифмического роста суспендировали в соответствующей полной среде для регулирования концентрации клеток. В каждую лунку добавляли 90 мкл клеточной суспензии. Количество клеток каждого типа показано в таблице 2 ниже. Клетки инкубировали при 37°C в 5% CO2 в течение ночи. Добавляли каждую концентрацию тестируемого препарата, и клетки дополнительно культивировали в течение 48 часов. Наконец, для обнаружения использовали набор для анализа жизнеспособности люминесцентных клеток (Promega CellTiter-Glo Luminescent Cell Viability Assay Kit).
Таблица 2. Плотность выращивания клеток
Значения IC50 для противоопухолевого действия in vitro соединений CK21S-001, CK21S-001-b, CK21S-002, CK21S-002-b, CK21S-003, CK21S-003-b, CK21S-004, CK21S-004-b, CK21S-005, CK21S-005-b, CK21S-006, CK21S-006-b, CK21S-007, CK21S-008, CK21S-009 и триптолида показаны в таблице 3. Все соединения обладали противоопухолевым действием in vitro, которое не сильно отличалась от положительной контрольной пробы (триптолида).
Таблица 3. Противоопухолевое действие in vitro в виде IC50 (мкМ)
Пример 12.
Обнаружение in vitro иммуносупрессивного действия низкомолекулярных соединений CK21S-001, CK21S-001-b, CK21S-002, CK21S-002-b, CK21S-003, CK21S-003-b, CK21S-004, CK21S-004-b, CK21S-005, CK21S-005-b, CK21S-006, CK21S-006-b, CK21S-007, CK21S-008, CK21S-009 и триптолида
Подготовка лимфоцитов селезенки мыши
Белых мышей (BALB/c) умерщвляли путем смещения позвоночника и извлекали селезенку в асептических условиях. Готовили суспензию единичных клеток и доводили до необходимой концентрации.
Тест на пролиферацию клеток
Обычным способом готовили суспензию из 4 × 106 клеток/мл лимфоцитов селезенки, и 100 мкл клеток добавляли в каждую лунку 96-луночного планшета. Добавляли 50 мкл исследуемого образца в различных концентрациях и добавляли ConA (конканавалин A) (конечная концентрация 5 мкг/мл), чтобы вызвать активацию и пролиферацию Т-лимфоцитов, или добавляли LPS (липосахарид) (конечная концентрация 10 мкг/мл) (50 мкл) для индуцирования активации и пролиферации B-лимфоцитов. Устанавливали соответствующую положительную контрольную пробу и нестимулирующую фоновую контрольную пробу. Клетки культивировали в инкубаторе с 5% CO2 при 37°C в течение 48 часов. Вводили 0,25 мкКи H-тимидина, и культивирование завершали через 8 часов. По окончании культивирования планшет замораживали при -20°C в морозильной камере до измерения. Клетки собирали на мембране из стекловолокна с помощью сборщика клеток, а затем добавляли сцинтилляционный раствор. Количество нуклеотидовH-тимина, включенных в ДНК клеток, считывали на счетчике бета-частиц. Клеточная пролиферация была представлена значением числа отсчетов в минуту (cpm).
Значения IC50 для иммуносупрессивного действия in vitro соединений CK21S-001, CK21S-001-b, CK21S-002, CK21S-002-b, CK21S-003, CK21S-003-b, CK21S-004, CK21S-004-b, CK21S-005, CK21S-005-b и триптолида показаны в таблице 4. Все соединения обладали иммуносупрессивным действием in vitro, которое было сравнимым с положительной контрольной пробой (триптолидом).
Таблица 4. Иммуносупрессивное действие in vitro в виде IC50 (мкM)
Пример 13.
Обнаружение in vivo противоопухолевого действия низкомолекулярного соединения CK21S-005 и триптолида
Опухолевые клетки поджелудочной железы человека AsPC-1 подкожно инокулировали в правую часть брюшной полости самцов голых мышей. Мышей с опухолью случайным образом разделили на 5 групп: группа отрицательного контроля (контрольная проба, n = 8, пустая эмульсия, внутрибрюшинно/внутривенно, каждые сутки); группа триптолида (триптолид, n = 8, 0,25 мг/кг, вв, 1 раз в день); группа положительного контроля (гемцитабин, n = 8, 50 мг/кг, вб, три раза в неделю); группа эмульсии CK21S-005 (эмульсия CK21S-005, n = 8, 5 мг/кг, вб/вв, 1 раз в день); и группа эмульсии CK21S-005 (эмульсия CK21S-005, n = 8, 2,5 мг/кг, вб/вв, 1 раз в день). Мышам вводили по группам до конца эксперимента. Изменения размера опухоли и веса мыши-носителя опухоли с течением времени отслеживали в течение 2-недельного периода введения, и опухоли взвешивали в конце эксперимента для всесторонней оценки ингибирующего действия лекарственного средства CK21S-005 на рост опухоли.
Способ приготовления эмульсии описан ниже. Заданное количество масла для инъекций взвешивали и нагревали до 70-90°C. Заданное количество исходного материала взвешивали, диспергировали в масляной фазе и полностью растворяли при перемешивании со встряхиванием с образованием масляной фазы. Заданное количество воды для инъекций взвешивали и нагревали до 70°C. Заданное количество фосфолипида, соэмульгатора, глицерина и т.д. добавляли и диспергировали при перемешивании с образованием водной фазы. В условиях высокоскоростной ферментации масляную фазу медленно добавляли в водную фазу и смесь перемешивали в течение 3-15 минут с образованием первичной эмульсии. Первичную эмульсию гомогенизировали 3-6 раз под высоким давлением при 400-1000 бар с образованием равномерно распределенной эмульсии. Эмульсию помещали в стеклянный контейнер (ампулу) и подвергали стерилизации влажным теплом при 121°C в течение 15 минут. Стерилизованный образец отправляли в лабораторию контроля качества для обнаружения.
Данные об объеме и массе опухоли (см. фиг. 1) показали, что внутривенное или внутрибрюшинное введение эмульсии CK21S-005 (5 мг/кг, обозначено как 5 мг/кг массы тела), эмульсии CK21S-005 (2,5 мг/кг, обозначено как 2,5 мг/кг массы тела) или эмульсии триптолида (0,25 мг/кг) оказывало значительное ингибирующее действие на мышей-носителей опухоли AsPC-1 рака поджелудочной железы, что было значительно лучше, чем у группы положительного контроля (гемцитабина).
Данные о массе тела мышей (см. фиг. 2) показали, что введение эмульсии CK21S-005 (2,5 мг/кг, 5 мг/кг) или эмульсии триптолида (0,25 мг/кг) (внутривенное или внутрибрюшинное введение) значительно снижает массу тела мыши. С 6-го дня непрерывного внутривенного введения эмульсии триптолида (0,25 мг/кг) мыши умирали одна за другой с серьезными изъязвлениями в хвосте, а вскрытие показало черный некроз легкого во всем легком, и 5/8 мышей погибли. Эмульсия триптолида была высокотоксичной в этой дозе, оказавшейся смертельной. В группе эмульсии CK21S-005 смертей не наблюдалось, и все 8 мышей выжили до конца введения. Это доказывает, что безопасность CK21S-005 выше, чем у триптолида.
Все документы, упомянутые в настоящем изобретении, включены в данную заявку посредством ссылки, и каждый документ индивидуально включен посредством ссылки. Кроме того, следует понимать, что после прочтения вышеупомянутого обучающего содержания настоящего изобретения специалисты в данной области могут внести различные изменения или модификации в настоящее изобретение, и эти эквивалентные формы также попадают в объем, определенный прилагаемой формулой изобретения в настоящей заявке.
Реферат
Изобретение относится к соединению, представленному формулой I, или его фармацевтически приемлемой соли, где R1представляет собой замещенную или незамещенную группу, выбираемую из группы, состоящей из фенила и 5-членного гетероарила, содержащего 1 гетероатом, выбранный из О; Y представляет собой O; R2представляет собой -C(=O)R4, где R4представляет собой замещенную или незамещенную группу, выбираемую из группы, состоящей из циклогексила, фенила и 5-членного гетероарила, содержащего 1 гетероатом, выбранный из O;представляет собой двойную связь или одинарную связь, причем, когда это двойная связь, R3представляет собой O, когда это одинарная связь, R3представляет собой OR5или F, при этом R5представляет собой H, Boc, CH2SCH3, -CH2OP(=O)(OH)2или -CH2OP(=O)(OBn)2; каждый X представляет собой H; каждый из вышеприведенных терминов «замещенный» независимо означает, что один атом водорода в группе замещается заместителем, выбираемым из группы, состоящей из галогенированного C1-C8 алкила и незамещенного C1-C8 алкокси. Изобретение также относится к способам получения указанных соединений и к фармацевтическому составу, обладающему иммуносупрессивным и противоопухолевым действием, на их основе. Технический результат – получены новые соединения и фармацевтический состав на их основе, которые могут найти применение в медицине для лечения опухолевых заболеваний. 5 н. и 4 з.п. ф-лы, 2 ил., 4 табл., 13 пр.I
Формула
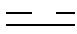


Комментарии