Новые аминопроизводные фузидовой кислоты, проявляющие противоопухолевую активность - RU2735665C1
Код документа: RU2735665C1
Описание
Изобретение относится к области медицинской химии, а именно к азотсодержащим производным фузидовой кислоты формулы (1)-(4), представляющим собой: (2Z)-2-[(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-11-гидрокси-4,8,10,14-тетраметил-3-пирролидин-1-илгонан-17-илиден]-6-метилгепт-5-еновую кислоту (1), (2Z)-2-[(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-3-(бутиламино)-11-гидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еновую кислоту (2), метил (2Z)-2-[(3β,4α,8α,14β,16β)-16-(ацетилокси)-4,8,10,14-тетраметил-11-оксо-3-пирролидин-1-илгонан-17-илиден]-6-метилгепт-5-еноат (3) и метил (2Z)-2-{(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-3-[(2-аминоэтил)амино]-11-гидрокси-4,8,10,14-тетраметил-гонан-17-илиден}-6-метилгепт-5-еноат (4), проявляющим высокую противоопухолевую активность по отношению к клеточным линиям лейкемии (HL-60, K-562, MOLT-4, SR).

Известны азотсодержащие производные фузидовой кислоты и ее метилового эфира, содержащие н-бутиламинный, пирролидиновый и этилендиаминный заместители в 3 положении молекулы (14)-(17) (схема 1) Противоопухолевые свойства данных соединений не изучены [E.V. Salimova, A.G. Mamaev, E.V. Tretyakova, О.S. Kukovinets, L.V. Parfenova. Mediterr. J. Chem. 2018, 7 (3), P. 198-203].
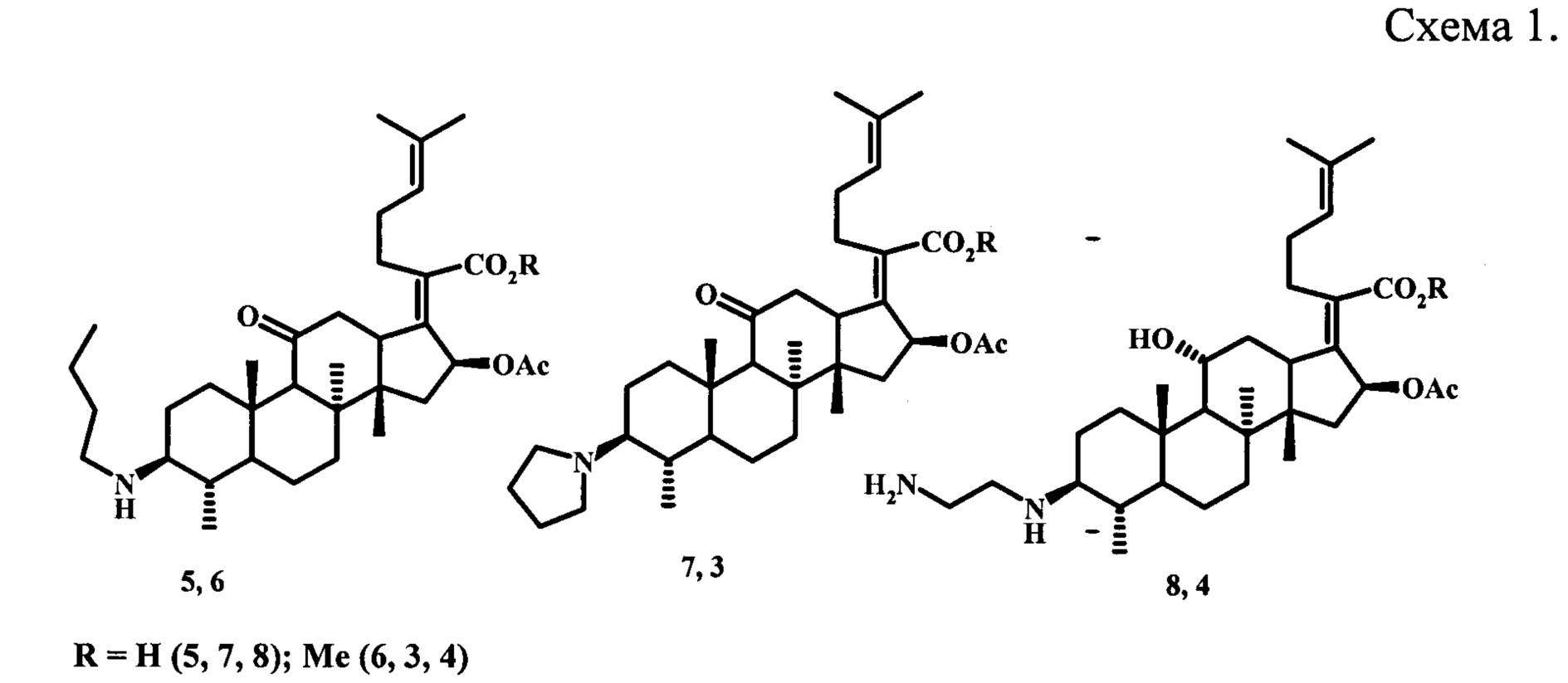
Известны азотсодержащие производные бензилового эфира фузидовой кислоты, содержащие аминогруппы с различной длиной цепи или гетероциклические заместители в 3 положении молекул (5)-(13), проявляющие антипролиферативную активность в отношении раковых клеточных линий HeLa (рак шейки матки), U87 (глиома), KBV (множественная лекарственно-устойчивая эпидермоидная карцинома полости рта) и MKN45 (рак желудка) (схема 2).


Показано, что производные (9)-(13) ингибируют рост всех четырех линий опухолевых клеток (HeLa, KBV, U87 и MKN45) до 77%. Соединение (15) показало хороший ингибирующий эффект в отношении клеточных линий HeLa, KBV, U87 (жизнеспособность раковых клеток ≤33%). Производное (14) ингибировало рост клеточной линии KBV до 82% и проявляло умеренный эффект в отношении линии U87 (59%). Амин (16) и гетероциклическое производное (17) продемонстрировали антипролиферативную активность в отношении клеток HeLa, ингибируя их рост до 78 и 53%, соответственно [Jingxuan Ni, Mengqi Guo, Yucheng Cao, Lei Lei, Kangli Liu, Binghua Wang, Fangfang Lu, Rong Zhai, Xiangwei Gao, Chunhong Yan, Hongbo Wang, Yi Bi. European Journal of Medicinal Chemistry. 2019,162, P. 122-131].
Таким образом, противоопухолевая активность 3-пирролидин- (1), 3-аминобутил- (2) производных фузидовой кислоты и 3-пирролидин- (3), 3-[(2-аминоэтил)амино]- (4) производных метилфузидата в литературе не описаны.
Задачей предлагаемого изобретения является изучение противоопухолевой активности in vitro (2Z)-2-[(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-11-гидрокси-4,8,10,14-тетраметил-3-пирролидин-1-илгонан-17-илиден]-6-метилгепт-5-еновой кислоты (1), (2Z)-2-[(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-3-(бутиламино)-11-гидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еновой кислоты (2), метил (2Z)-2-[(3β,4α,8α,14β,16β)-16-(ацетилокси)-4,8,10,14-тетраметил-11-оксо-3-пирролидин-1-илгонан-17-илиден]-6-метилгепт-5-еноата (3) и метил (2Z)-2-{(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-3-[(2-аминоэтил)амино]-11-гидрокси-4,8,10,14-тетраметилгонан-17-илиден}-6-метилгепт-5-еноата (4) в отношении клеток 60 линий 9 различных опухолей человека (легких, толстой кишки, центральной нервной системы, яичников, почек, простаты, головного мозга, лейкемии, меланомы) и оценка результатов в соответствии с системой скрининга противоопухолевых веществ, принятой в NCI [http://www.dtp.nci.nih.gov/branches/btb/ivclsp.html.] Синтез заявленных соединений осуществляли по реакции восстановительного аминирования, описанной в работе [E.V. Salimova, A.G. Mamaev, E.V. Tretyakova, О.S. Kukovinets, L.V. Parfenova. Mediterr. J. Chem. 2018, 7 (3), P. 198-203]. Соединения (1), (2) и (4) получали взаимодействием дикетона фузидовой кислоты (18) или ее метилового эфира (19) с 3 экв. н-бутиламина, пирролидина или этилендиамина в среде сухого метанола в присутствии катализатора Ti(Oi-Pr)4 с последующим восстановлением смеси 2 экв. NaBH4. Синтез производного (3) осуществляли посредством реакции дикетона фузидовой кислоты (18) с 3 экв. пирролидина в среде хлороформа в присутствии уксусной кислоты с последующей обработкой реакционной массы 2 экв. NaBH(OAc)3 (схема 3).

Сущность изобретения поясняется следующими примерами.
Пример 1. Смесь дикетона (18) (0.28 г, 0.5 ммоль), изопропоксида титана (IV) (0.055 г, 0.15 ммоль) и 1.5 ммоль н-бутиламина (0.11 г) или пирролидина (0.11 г) в 5 мл абсолютного метанола перемешивали в атмосфере аргона при комнатной температуре 2 часа. Реакционную массу охлаждали до -70°С и добавляли NaBH4 (0.04 г, 1.0 ммоль). Полученную смесь перемешивали в течение 0.5 часа при -70°С, после чего температуру постепенно повышали до комнатной и добавляли в реакционную массу 5 мл воды. Выпавший осадок отфильтровывали, промывали метанолом. Маточный раствор концентрировали в вакууме, получая сырой амин, который очищали колоночной хроматографией на силикагеле, элюируя смесью хлороформ/метанол, 4:1.
(2Z)-2-[(3β,4α,8α,11α,14β,16β)-16-(Ацетилокси)-11-гидрокси-4,8,10,14-тетраметил-3-пирролидин-1-илгонан-17-илиден]-6-метилгепт-5-еновая кислота (1). Кристаллическое вещество светло-желтого цвета, т.пл. 210-212°С,

Спектр ЯМР13С (CDCl3), δ, м.д.: 13.92 (С28), 16.51 (С18), 16.61 (С27), 19.72 (С32), 21.25 (С6), 22.41 (С30), 22.70 (С2), 23.02 (С19), 23.56 (С34, С35), 24.56 (С26), 27.83 (С23), 29.31 (С22), 31.58 (С7), 33.33 (С1), 34.71 (С4), 35.81 (С10), 36.11 (С12), 38.82 (С15), 39.12 (С8), 42.62 (С13), 42.94 (С5), 48.14 (С33), 48.52 (С14), 48.97 (С9), 53.43 (С36), 66.96 (С11), 67.69 (С3), 74.48 (С16), 123.74 (С24), 131.25 (С25), 136.07 (С20), 139.84 (С17), 171.55 (С31), 176.68 (С21). Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 570 (100) [М+Н]+, 608 (65.3) [М+K]+.
(2Z)-2-[(3β,4α,8α,11α,14β,16β)-16-(Ацетилокси)-3-(бутиламино)-11-гидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еновая кислота (2). Кристаллическое вещество светло-желтого цвета, т.пл. 182-184°С,

Пример 2. Смесь дикетона (19) (0.26 г, 0.5 ммоль), изопропоксида титана (IV) (0.055 г, 0.15 ммоль) и этилендиамина (0.09 г, 1.5 ммоль) в 5 мл абсолютного метанола перемешивали в атмосфере аргона при комнатной температуре 2 часа. Реакционную массу охлаждали до -70°С и добавляли NaBH4 (0.04 г, 1.0 ммоль). Полученную смесь перемешивали в течение 0.5 часа при -70°С, после чего температуру постепенно повышали до комнатной и добавляли в реакционную массу 5 мл воды. Выпавший осадок отфильтровывали, промывали метанолом. Маточный раствор концентрировали в вакууме, получая сырой амин, который очищали колоночной хроматографией на силикагеле, элюируя смесью хлороформ/метанол, 10:1.
Метил (2Z)-2-{(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-3-[(2-аминоэтил)амино]-11-гидрокси-4,8,10,14-тетраметил-гонан-17-илиден}-6-метилгепт-5-еноат (4). Спектральные характеристики описаны в работе [E.V. Salimova, A.G. Mamaev, E.V. Tretyakova, О.S. Kukovinets, L.V. Parfenova. Mediterr. J. Chem. 2018, 7 (3), P. 198-203]
Пример 3. Смесь дикетона (19) (0.26 г, 0.5 ммоль), пирролидина (0.11 г, 1.5 ммоль) и АсОН (0.06 г, 1.0 ммоль) смешивали в 5 мл сухого хлороформа и перемешивали в атмосфере аргона при комнатной температуре в течение 12 часов (контроль ТСХ; хлороформ-метанол, 10:1). Затем реакционную массу обрабатывали NaBH(OAc)3 (0.2 г, 1.0 ммоль) и продолжали перемешивание до прекращения газообразования. Реакционную смесь гасили добавлением 10% NaHCO3, и продукт реакции экстрагировали хлороформом. Органический экстракт промывали рассолом и сушили MgSO4. Растворитель упаривали, получая сырой амин, который очищали колоночной хроматографией на силикагеле, элюируя смесью хлороформ/метанол, 20:1.
Метил (2Z)-2-[(3β,4α,8α,14β,16β)-16-(ацетилокси)-4,8,10,14-тетраметил-11-оксо-3-пирролидин-1-илгонан-17-илиден]-6-метилгепт-5-еноат (3).
Кристаллическое вещество светло-желтого цвета, т.пл. 228-230°С, +14.0 (с 1.23, CHCl3). Спектр ЯМР1Н (CDCl3), δ, м.д.: 0.95-1.06 м (1Н, H6), 0.98 с (3Н, H19), 1.08 с (3Н, H18), 1.09 с (3Н, H30), 1.09-1.25 м (1Н, Н7), 1.23-1.36 м (1Н, H15), 1.24 м (3Н, H28), 1.28-1.38 м (1Н, Н5), 1.43-1.82 м (1Н, H6), 1.49 с (3Н, Н27), 1.49-1.63 м (1Н, Н2), 1.54-1.63 м (1Н, Н1), 1.56 с (3Н, Н26), 1.80-2.02 м (2Н, H23), 1.86-1.98 м (1Н, Н7), 1.91-2.44 м (4Н, H36, H37), 1.92 с (3Н, Н32), 1.95-2.14 м (1Н, Н15), 2.08-2.20 м (1Н, Н2), 2.17-2.29 м (1Н, Н4), 2.19-2.35 м (2Н, Н22), 2.47 с (1Н, Н9), 2.48-2.63 м (1Н, Н12), 2.61-2.73 м (1Н, Н1), 2.68-2.81 м (1Н, Н12), 2.69-2.86 м (1Н, Н13), 3.20-3.40 м (4Н, H34, H35), 3.41-3.50 м (1Н, H3), 3.56 с (3Н, H33), 4.96 т (1Н, H24,3J 7.0 Гц), 5.77 т (1Н, Н16,3J 7.0 Гц). Спектр ЯМР13С (CDCl3), δ, м.д.: 15.26 (С28), 16.86 (С18), 17.63 (С27), 20.81 (С32), 21.25 (С6), 23.48 (С19), 23.68 (С30), 23.79 (С36, С37), 25.63 (С26), 27.75 (С23), 28.84 (С22), 31.84 (С2), 33.14 (С7), 33.78 (С1), 35.24 (С10), 37.03 (С4), 37.92 (С15), 40.63 (С8), 44.82 (С12, С34), 46.54 (С5, С35), 47.27 (С13), 48.47 (С14), 51.45 (С33), 60.25 (С9), 66.12 (С3), 73.88 (С16), 122.47 (С24), 131.49 (С20), 132.93 (С25), 145.27 (С17), 169.85 (С31), 170.04 (С21), 209.65 (С11). Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 582 (100) [М+Н]+.
Контроль реакции осуществляли методом ТСХ на пластинах Sorbfil (Сорбполимер, Краснодар, Россия), проявляли 10% раствором серной кислоты. Для колоночной хроматографии использовали силикагель L (50-160 мкм) марки КСКГ. Температура плавления определена на приборе РНМК 80/2617. Спектры ЯМР 1D (1Н,13С) и 2D (COSY, NOESY, HSQC, НМВС) сняты на спектрометре Bruker Avance 500 (125.78 МГц для13С и 500.17 МГц для1Н) с использованием стандартных импульсных последовательностей фирмы Bruker, внутренний стандарт Me4Si, растворитель - CD3OD. Оптические углы измерены на поляриметре Perkin-Elmer 341. Масс-спектры MALDI TOF/TOF получены на спектрометре Bruker Autoflex ТМ III Smartbeam с использованием матрицы 3-(4-гидрокси-3,5-диметоксифенил)проп-2-еновой кислоты (синапиновая кислота).
Противоопухолевую активность in vitro соединений (1)-(4) исследовали в Национальном институте рака США (NCI). Исследование проводили на клетках 60 линий 9 различных опухолей человека (Leukemia, Non-Small Cell Lung Cancer, Colon Cancer, CNS Cancer, Melanoma, Ovarian Cancer, Renal Cancer, Prostate Cancer and Breast Cancer) и оценивали в соответствии с системой скрининга противоопухолевых веществ, принятых в NCI. При тестировании активности соединения вносили в среду культивирования клеток в конечной концентрации 10-5 М на 48 ч. После этого оценивали рост обработанных клеток по сравнению с необработанными контрольными клетками. Методика тестирования противоопухолевой активности in vitro соединений (1)-(4) приведена на сайте https://dtp.cancer.gov/compsub/
В табл. 1 приведены результаты, показывающие процент роста обработанных клеток по сравнению с контрольными клетками (отрицательные значения соответствуют полной гибели клеток). В соответствии с критерием, принятым в Национальном институте рака, вещества считаются активными в случае, если они ингибируют рост клеток до 32% от контроля или вызывают их гибель.
Анализ результатов противоопухолевого скрининга показал, что амины (1)-(4) обладают высокой противолейкозной активностью, полностью подавляя рост клеточной линии HL-60 (промиелоцитарная лейкемия). 3-[(2-Аминоэтил)амино]-фузидат (4) вызывал также полную гибель клеточных линий K-562 (хроническая миелогенная лейкемия), MOLT-4 (Т-лимфобластная лейкемия) и SR (острый миелоидный лейкоз). Пирролидин замещенное производное фузидовой кислоты (1) способствовало полной гибели раковых клеток MOLT-4, а в отношении клеточных линий K-562 и SR показывало высокую противоопухолевую активность, ингибируя их рост на 85 и 76%, соответственно. Амины (2) и (3) демонстрировали высокую противолейкозную активность в отношении клеток K-562 и MOLT-4, ингибируя их рост от 70 до 90%.
Таким образом, соединения (1)-(4) продемонстрировали высокую противоопухолевую активность in vitro по отношению к 4 клеточным линиям лейкемии: HL-60, K-562, MOLT-4 и SR, ингибируя их рост от 70%.

Реферат
Изобретение относится к применению аминопроизводных фузидовой кислоты формулы (1)-(4): (2Z)-2-[(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-11-гидрокси-4,8,10,14-тетраметил-3-пирролидин-1-илгонан-17-илиден]-6-метилгепт-5-еновая кислота (1), (2Z)-2-[(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-3-(бутиламино)-11-гидрокси-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еновая кислота (2), метил (2Z)-2-[(3β,4α,8α,14β,16β)-16-(ацетилокси)-4,8,10,14-тетраметил-11-оксо-3-пирролидин-1-илгонан-17-илиден]-6-метилгепт-5-еноат (3) и метил (2Z)-2-{(3β,4α,8α,11α,14β,16β)-16-(ацетилокси)-3-[(2-аминоэтил)амино]-11-гидрокси-4,8,10,14-тетраметилгонан-17-илиден}-6-метилгепт-5-еноат (4) в качестве средств, проявляющих высокую противоопухолевую активностьin vitroпо отношению к 4 клеточным линиям лейкемии: HL-60, K-562, MOLT-4 и SR. Технический результат: предложено применение аминопроизводных фузидовой кислоты формулы (1)-(4), проявляющих высокую противоопухолевую активностьin vitroпо отношению к 4 клеточным линиям лейкемии: HL-60, K-562, MOLT-4 и SR, ингибируя их рост от 70% до полной гибели раковых клеток. 1 табл., 3 пр.
Формула


Комментарии