Модуляторы ror-гамма - RU2658013C2
Код документа: RU2658013C2
Чертежи
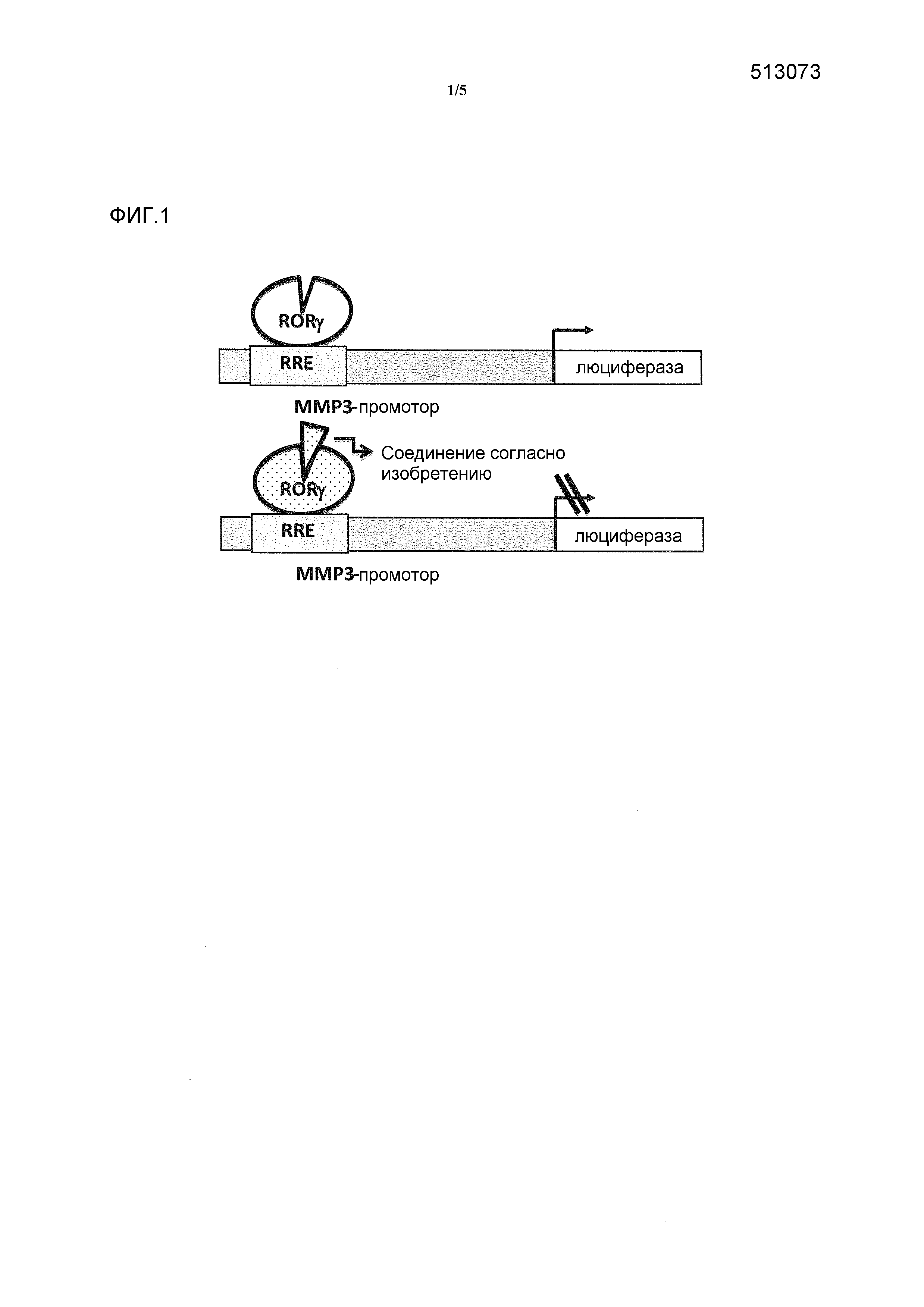


Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям для применения при лечении или предупреждении, подавлении или ослаблении заболевания, опосредуемого рецептором ROR-гамма, у субъекта, нуждающегося в этом, в особенности, в случае диабета и связанных с диабетом нарушений, конкретно, в случае диабета типа II, к способам получения таких соединений, а также к способам лечения или предупреждения таких заболеваний.
Предпосылки создания изобретения
Во всем мире существует приблизительно 250 миллионов человек, которые страдают от диабета (типа I и типа II), и их количество предположительно увеличится вдвое за следующие два десятилетия. Диабет типа 1 базируется на недостатке продуцирования инсулина поджелудочной железой. Несмотря на то, что причины полностью неизвестны, диабет типа 1 представляет собой полифакториальное аутоиммунное заболевание, проистекающее от специфической и прогрессирующей деструкции инсулина, продуцируемого бета-клетками поджелудочной железы. Типичное лечение диабета типа 1 включает (многократное) введение инсулина, которое, однако, не излечивает диабет или не предупреждает его возможные воздействия, такие как почечная недостаточность, слепота, повреждение нервов, ампутации, сердечные приступы и инсульт. Даже при лечении инсулином, диабет типа 1 обычно приводит в результате к радикальному снижению качества жизни и укорачивает среднюю продолжительность жизни на 15 лет. Диабет типа 2, также называемый как инсулиннезависимый сахарный диабет, представляет собой гетерогенное заболевание, характеризующееся анормальностями в случае метаболизма углеводов и жиров. Причины диабета типа 2 являются полифакториальными и включают как генетические, так и экологические элементы, которые воздействуют на функцию бета-клеток и чувствительность к инсулину в тканях, таких как мышцы, печень, поджелудочная железа и жировая ткань. Как следствие, наблюдают ухудшенную секрецию инсулина и параллельно обнаруживают прогрессирующее ухудшение функции бета-клеток и хроническую резистентность к инсулину. Неспособность эндокринной поджелудочной железы компенсировать периферическую резистентность к инсулину приводит к гипергликемии и началу диабета клинического типа 2, характеризующегося гипергликемией, резистеностью к инсулину, абсолютным или относительным дефицитом инсулина, гиперглюкагонемией и увеличивающимся продуцированием печеночной глюкозы. Однако, до сих пор не существует радикального лечения для этого заболевания.
Заявители данного изобретения в настоящий момент неожиданно нашли, что ретиноидный рецептор, относящийся к орфановым рецепторам, (ROR) может действовать в качестве центрального регулятора адипогенеза. Ретиноидный рецептор, относящийся к орфановым рецепторам, включает три члена семейства, а именно ROR-альфа (Becker-Andree, Biochem. Biophys. Res. Commun. 1993, 194:1371), ROR-бета (Andre и др., Gene 1998, 516:277) и ROR-гамма (He и др., Immunity 1998, 9:797), и составляет подгруппу NR1F (ROR/RZR) суперсемейства ядерного рецептора (Mangelsdorf и др., Cell 1995, 83:835). Заявители данного изобретения обнаружили, что, в особенности, рецептор ROR-гамма, связанный только с иммунологическими функциями, может ингибировать адипогенез и может позволять осуществлять защиту от диеты или генетически индуцируемой резистености к инсулину.
Таким образом, настоящее изобретение относится к соединениям согласно данному изобретению, в частности, к соединениям на основе скелета полигидроксилированного холана, которые способны действовать в качестве модуляторов или лигандов рецептора ROR (гамма), таким образом, оказывая влияние на биологические пути адипогенеза, контролируемые ROR (гамма), и, таким образом, могут быть пригодны для предупреждения, лечения и ослабления диабета и связанных с диабетом нарушений, в особенности, диабета типа II.
Краткое изложение сущности изобретения
Настоящее изобретение, в первом аспекте, относится к соединениям на основе скелета полигидроксилированного холана, и их фармацевтически приемлемым солям или их стереоизомерам, для применения в качестве модуляторов рецептора ROR, в особенности, в качестве селективных лигандов рецептора ROR-гамма (также, в дальнейшем, называемых соединениями согласно данному изобретению или лигандами или модуляторами рецептора ROR-гамма согласно настоящему изобретению), имеющим общую формулу I:

где
R1, R2, R2’, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, R2, вместе с атомами углерода, с которыми они связаны, образуют эпоксигруппу;
R3, R4, R5, R6, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R7, R8, R9, независимо друг от друга, означают Н, (С1-10)алкил, где одна или более не являющихся соседними групп CH2 могут быть заменены на -О-, -S-, -CO-, -CO-O-, -O-CO-, -NRa-, -CO-NRa-, -NRa-CO-, -C=C- или -C≡C-; где Ra означает Н или (С1-6)алкил;
L означает связующую группу, такую как С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным или замещенным, по меньшей мере, одним CN, галогеном, ОН, NRaRb, COORa, NO2, и где одна или более из не являющихся соседними групп CH2 могут быть заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-, -O-CO-, -NRa-, -NRa-CO-, -CO-NRa-, -CH=CH- или -C≡C-; где Ra и Rb, независимо друг от друга, означают Н или С(1-6)алкил;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
m означает целое число от 0 до 5.
В конкретных воплощениях, соединения, согласно данному изобретению, базируются на скелете полигидроксилированного холана, имеющем заместитель -L-X- в положении С17, и где гидроксильные (или оксо-) заместители, в одном или более положениях, предпочтительно, выбирают из С1, С3, С6, С7, С12, более предпочтительно, где гидроксильные (или оксо-) заместители, во всех из третьих или четвертых положений, выбирают из С1, С3, С6, С7, С12, наиболее предпочтительно, когда гидроксильные (или оксо-) заместители, во всех из третьих или четвертых положений, выбирают из С1, С3, С6, С7, С12, из которых один гидроксильный (или оксо-) заместитель находится в положении С1 или С6.
Предпочтительные соединения согласно данному изобретению имеют три гидроксильных (или оксо-) заместителя в положениях С1, С3 и С7; С1, С3 и С12; С1, С7 и С12; С3, С6 и С7; С3, С6 и С12; С6, С7 и С12; С1, С3 и С6; С1, С6 и С7; и С1, С6 и С12.
Другие предпочтительные соединения согласно данному изобретению имеют четыре гидроксильных (или оксо-) заместителя в положениях С1, С3, С7 и С12; С3, С6, С7 и С12; С1, С3, С6 и С7; С1, С3, С6 и С12; и С1, С6, С7 и С12.
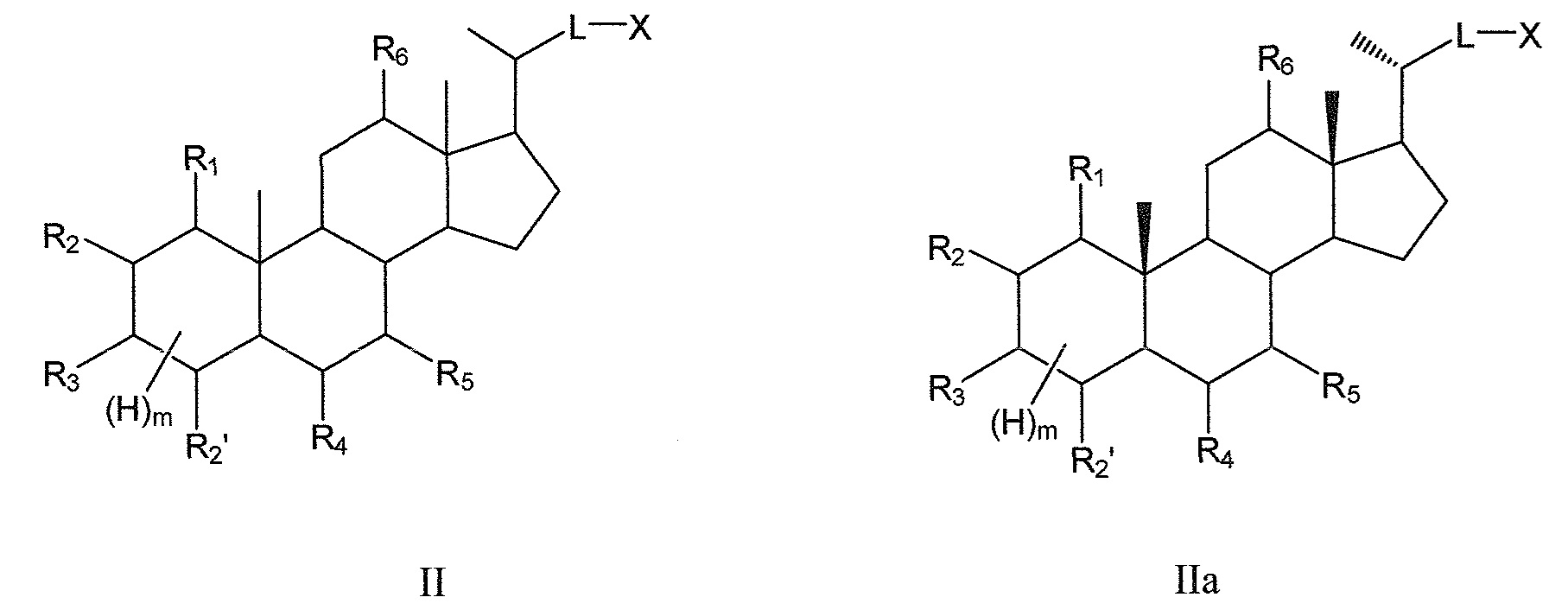
В некоторых воплощениях, данное изобретение включает соединения формулы II и их фармацевтически приемлемые соли или их стереоизомеры, предпочтительно, их стереоизомерную форму IIa:
где
R1, R2, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, R2, вместе с атомами углерода, с которыми они связаны, образуют эпоксигруппу;
R3, R4, R5, R6, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R2’ означает Н или галоген;
L означает связующую группу, такую как С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным или замещенным, по меньшей мере, одним CN, галогеном, ОН, NRaRb, COORa, NO2, и где одна или более из не являющихся соседними групп CH2 могут быть заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-, -O-CO-, -NRa-, -NRa-CO-, -CO-NRa-, -CH=CH-, -C≡C-; где Ra и Rb, независимо друг от друга, означают Н или С(1-6)алкил;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3 и Ra означает -Н или -(С1-6)алкил;
m означает целое число от 0 до 5.
В одном предпочтительном воплощении по меньшей мере три, предпочтительно, три или четыре, группы, выбираемые из R1, R3, R4, R5 и R6, означают -ORa или оксо, где Ra означает Н или С(1-6)алкил.
В другом предпочтительном воплощении, R1 и/или R4 означают -ORa или оксо.
Более конкретно, соединения согласно данному изобретению характеризуются формулой I, II или IIa, где или (i) R4 и R6 означают -ORa, или (ii) R1 и R6 означают -ORa, или (iii) R3 означает или -ORa или оксо и R6 означает -ORa, или (iv) R5 и R6 означают -OR, и остающиеся группы, в каждом из соединений, имеют следующие значения (где это подходит):
R1 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, вместе с R2 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н или галоген, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R2, вместе с R1 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R3, R4, R5, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, предпочтительно, Н, оксо, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R2’ означает Н или галоген;
L означает С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3 и Ra означает -Н или -(С1-6)алкил;
m означает от 0 до 5.
В предпочтительных воплощениях, данное изобретение включает соединения формулы IV и формулы V (с R3, означающим -ORa или оксо) и их фармацевтически приемлемые соли или их стереоизомеры:
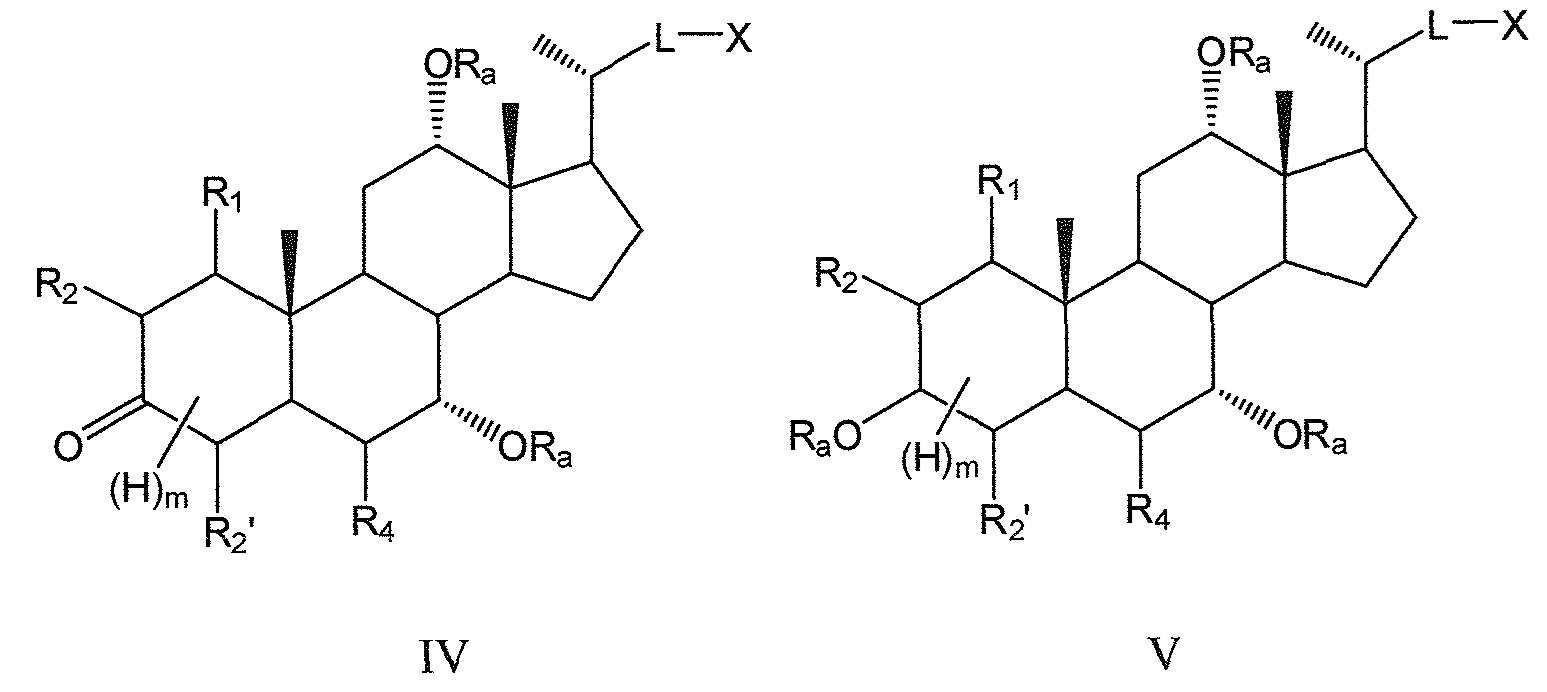
где
R1 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, вместе с R2 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2 означает Н или галоген, или R2, вместе с R1 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2’ означает Н или галоген;
R4 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, предпочтительно, Н, оксо, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
L означает С(1-12)алкил с линейной или разветвленной цепью;
X означает Н, -ORa, -COORс, -CONRaRс; где Ra означает Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3 и Ra означает -Н или -С(1-6)алкил;
Ra означает Н или С(1-6)алкил; и
m означает от 0 до 5.
В дальнейшем аспекте, способы согласно данному изобретению также относятся к пригодным и эффективным способам синтеза соединений согласно данному изобретению.
Настоящее изобретение также еще относится, в еще дальнейшем аспекте, к фармацевтическим композициям, содержащим по меньшей мере одно соединение согласно настоящему изобретению и фармацевтически приемлемый носитель, и, необязательно, по меньшей мере один дальнейший терапевтически активный агент.
В еще другом аспекте, настоящее изобретение относится к способам лечения или предупреждения нарушений, заболеваний или состояний, реагирующих на модуляцию рецептора ROR-гамма, у млекопитающих, нуждающихся в этом, в особенности, в случае диабета и связанных с диабетом нарушений, особенно, диабета типа II, путем введения по меньшей мере одного соединения (или включающей его фармацевтической композиции) согласно настоящему изобретению.
В еще дальнейшем аспекте, настоящее изобретение относится к комплектам, содержащим по меньшей мере одно соединение согласно настоящему изобретению (или включающую его фармацевтическую композицию).
Краткое описание чертежей
Фигура 1: схематически представлен анализ активности люциферазы.
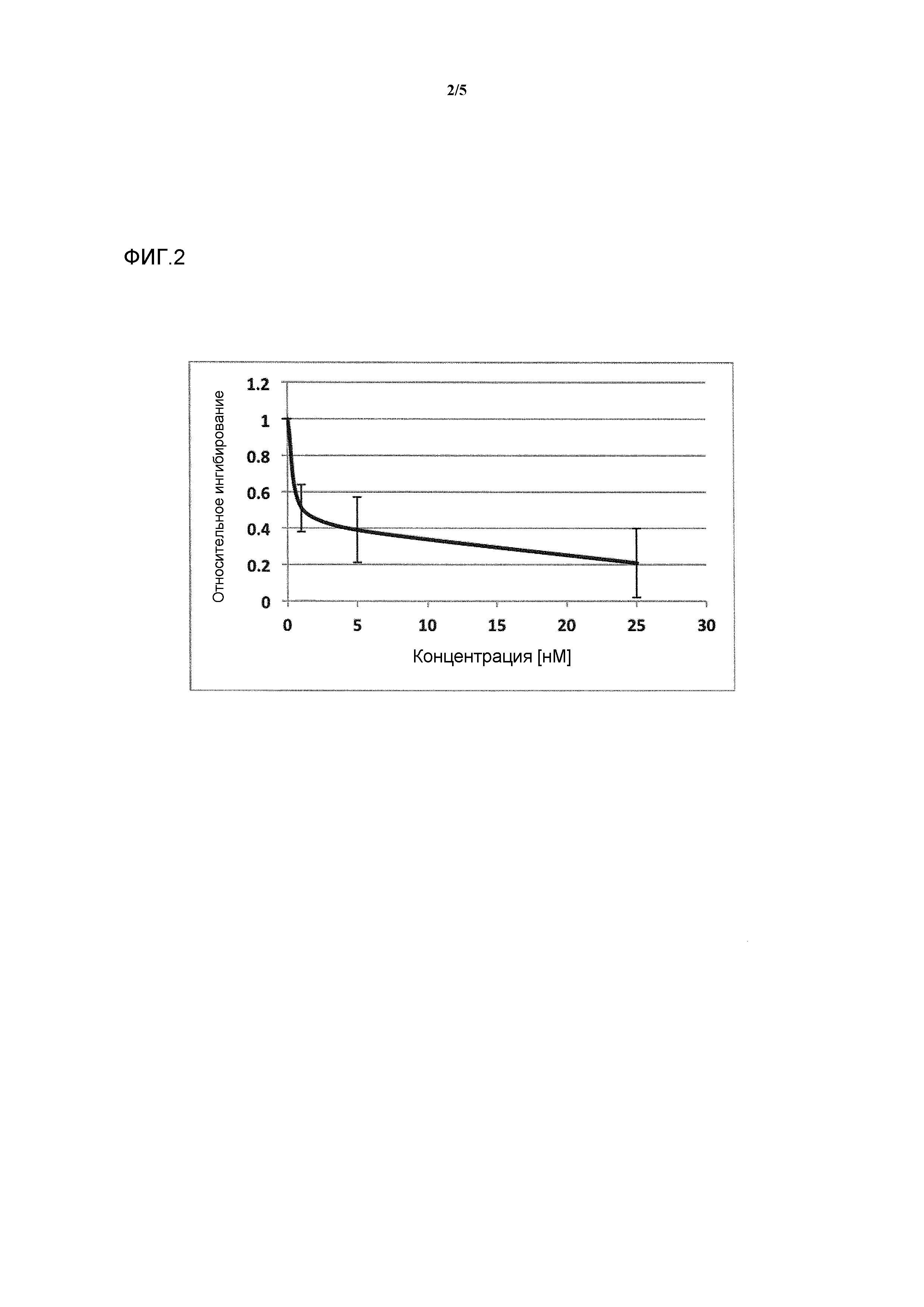
Фигура 2: ингибирование активности ROR-гамма (RI = относительное ингибирование; Conc = концентрация 1β,3α,7α,12α-тетрагидрокси-5β-холан-24-оата (тетраол), в нМ).
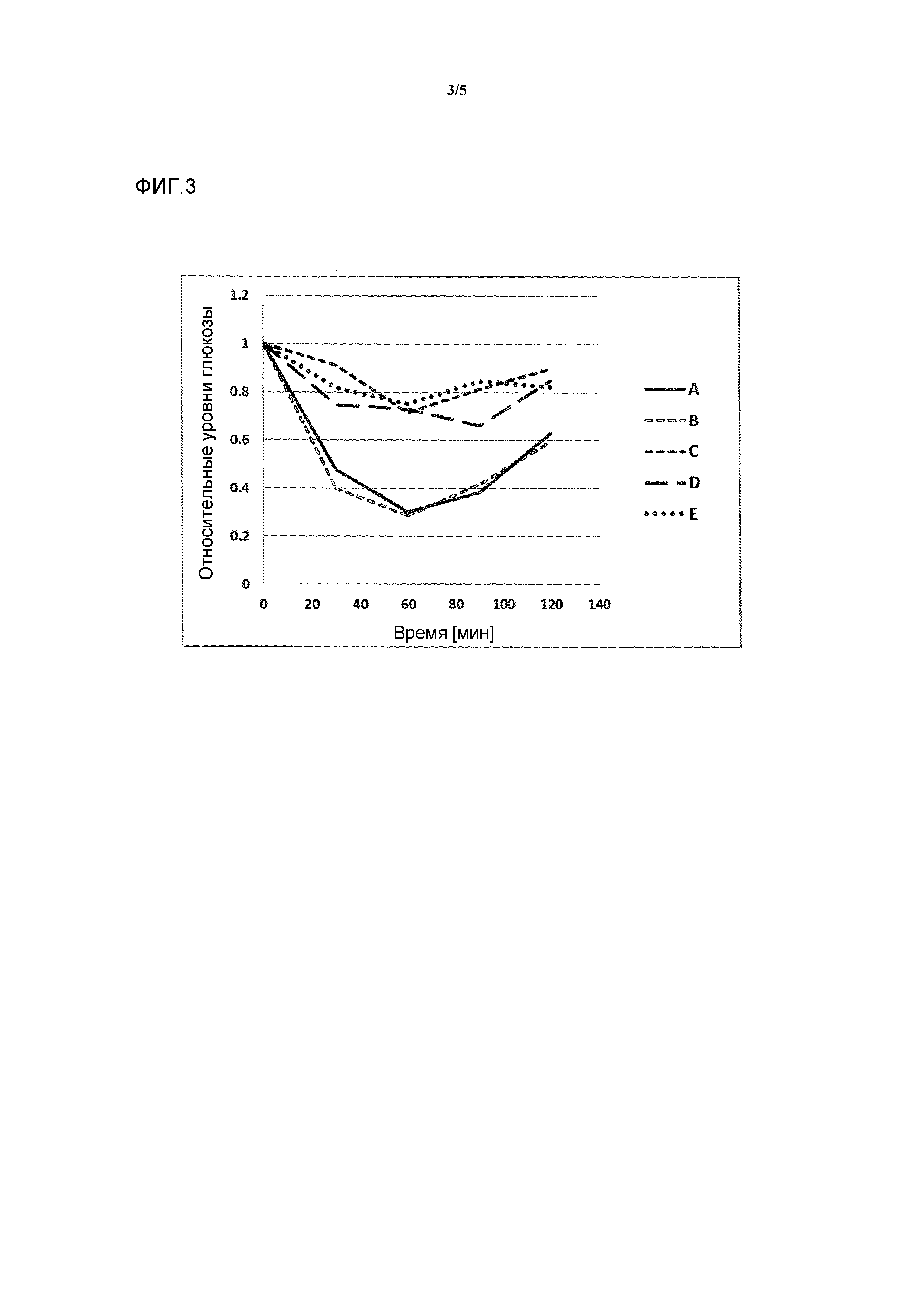
Фигура 3: воздействие на чувствительность к инсулину у мышей, которые получают рацион с высоким содержанием жира в комбинации с различными добавками в различных концентрациях. Ось y представляет собой относительные уровни глюкозы, ось х представляет собой время после инъекции инсулина в минутах. Рацион с высоким содержанием жира представлен как рацион (Е) или дополненный 0,1% тетраола (А), или 0,01% тетраола (В), или 0,1% холевой кислоты (С), или 0,01% холевой кислоты (D).
Фигура 4: воздействие тетраола и холевой кислоты в качестве контрольного соединения на уровни глюкозы в случае страдающих ожирением/резистентных к инсулину мышей в течение времени (ось х представляет собой мМ глюкозы, ось y представляет собой моменты времени из 6 и 12 недель, заштрихованные полосы представляют собой голодных мышей, закрашенные полосы представляют собой кормленых мышей).
Фигура 5: воздействие тетраола и холевой кислоты в качестве контрольного соединения на уровни инсулина в случае страдающих ожирением/резистентных к инсулину мышей в течение времени (ось х представляет собой пг/мл инсулина, ось y представляет собой моменты времени из 6 и 12 недель, заштрихованные полосы представляют собой голодных мышей, закрашенные полосы представляют собой кормленых мышей).
Подробное описание данного изобретения
За исключением иначе указанного, следующие термины имеют указанные значения:
Термин «субъект» означает млекопитающее, такое как человек или животное, существо или мужского или женского пола, предпочтительно, человек.
Термин «лиганд» или «модулятор» относится к природному или синтетическому соединению, которое связывает молекулу рецептора с образованием комплекса рецептор-лиганд. Термин «лиганд» может включать агонисты, антагонисты и соединения с частичным агонист/антагонист действием. «Агонист» представляет собой природное или синтетическое соединение, которое связывает рецептор с образованием комплекса рецептор-агонист, таким образом активируя вышеуказанный рецептор, инициируя путь передачи сигнала и дальнейшие биологические процессы. Под термином «антагонист» подразумевают природное или синтетическое соединение, которое обладает биологическим эффектом, противоположным эффекту агониста. Антагонист связывает рецептор и блокирует воздействие агониста рецептора. Термин «лиганд» или «модулятор», когда используется, в соответствии с настоящим изобретением, в комбинации с рецептором ROR (гамма), относится к эндогенному соединению, которое может взаимодействовать с рецептором ROR (гамма) и инициировать фармакологический или биохимический ответ.
Термин «аффинность к связыванию» относится к способности соединения к связыванию с его биологической мишенью. Согласно настоящему изобретению, это понятие относится к способности соединения согласно данному изобретению к связыванию с рецептором ROR (гамма).
Термин «эффективность» описывает относительную интенсивность ответа, индуцируемого соединением, когда происходит связывание с его рецептором. Максимальный ответ зависит от эффективности связывания с рецептором.
Термин «диабет», как используемый в данном контексте, включает как инсулинзависимый сахарный диабет (то есть, IDDM, также известный как диабет типа I), так и инсулиннезависимый сахарный диабет (то есть, NIDDM, также известный как диабет типа II). Диабет типа I, или инсулинзависимый диабет, является результатом абсолютного дефицита инсулина, гормона, который регулирует использование глюкозы. Диабет типа II, или инсулиннезависимый диабет (то есть, инсулиннезависимый сахарный диабет) часто встречается в виде нормальных или даже повышенных уровней инсулина и является результатом неспособности тканей соответствующим образом отвечать на инсулин. Соединения и композиции согласно настоящему изобретению могут быть пригодны для лечения как диабета типа I, так и диабета типа II, но могут быть особенно эффективными для лечения диабета типа II (как показано в дальнейшем).
Термин «связанные с диабетом нарушения», как используемый в данном контексте, включает заболевания, нарушения и состояния, связанные с диабетом типа 1 и диабетом типа 2, в особенности, заболевания, нарушения и состояния, связанные с диабетом типа 2, и, следовательно, могут быть подвергнуты лечению, контролированию или, в некоторых случаях, предупреждению, путем введения соединений и композиций согласно данному изобретению. Диабет, связанный с такими нарушениями, включает, например, гипергликемию, низкую толерантность к глюкозе, резистентность к инсулину, ожирение, липидные нарушения, дислипидемию, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, низкие уровни HDL, высокие уровни LDL, атеросклероз, сосудистый рестеноз, синдром раздраженной толстой кишки, воспалительное заболевание толстой кишки, включая болезнь Крона и язвенный колит, другие воспалительные состояния, панкреатит, абдоминальное ожирение, нейродегенеративное заболевание, ретинопатию, нефропатию, невропатию, синдром Х, овариальный гиперандрогенизм (поликистозный овариальный синдром) и другие нарушения, где резистентность к инсулину является существенным компонентом.
Термин «лечение» диабета согласно данному изобретению относится к введению, по меньшей мере, одного соединения, согласно настоящему изобретению, для лечения диабета и связанных с диабетом нарушений, как описано в данном контексте, например, субъекту, нуждающемуся в этом, например, диабетику. Возможными последствиями такого лечения могут быть снижение уровня глюкозы у субъекта с повышенными уровнями глюкозы и/или улучшение гликемического контроля, и/или снижение уровней инсулина у субъекта с повышенными уровнями инсулина, и/или снижение повышенной концентрации глюкозы в плазме, и/или снижение повышенной концентрации инсулина, и/или снижение повышенной концентрации триглицеридов в крови, и/или увеличение чувствительности к инсулину, и/или повышение толерантности к глюкозе у субъекта с нетолерантностью к глюкозе, и/или снижение резистентности к инсулину, и/или понижение уровней инсулина в плазме, и/или улучшение в отношении гликемического контроля, особенно, при диабете типа 2.
«Предупреждение» (или «профилактика») диабета согласно данному изобретению относится к введению по меньшей мере одного соединения согласно настоящему изобретению для предупреждения или лечения начала диабета и связанных с диабетом нарушений, как описано в данном контексте, у субъекта, нуждающегося в этом, например, предрасположенного к диабету субъекта.
Термин «субъект», как используемый в данном контексте, относится к животному, предпочтительно, млекопитающему, наиболее предпочтительно, к человеку.
Термин «скелет полигидроксилированного холана» включает, в особенности, полигидроксилированные холестаны и, более конкретно, полигидроксилированные желчные кислоты. Полигидроксилированный холан или желчная кислота согласно данному изобретению включает, но не ограничиваясь этим, от тригидроксилированных, тетрагидроксилированных, пентагидроксилированных, гексагидроксилированных желчных кислот, и т.д., вплоть до максимального уровня гидроксилирования, однако, предпочтительно, (по меньшей мере) тригидроксилированные и (по меньшей мере) тетрагидроксилированные желчные кислоты. Термин «желчная кислота» охватывает все встречающиеся в природе (химически синтезированные) желчные кислоты (происходят ли от человека или от другого животного), включая их конъюгаты (например, в частности, конъюгаты с глицином, таурином и, возможно, с другими аминокислотами), а также синтетические или полусинтетические аналоги. Наибольшее количество встречающихся в природе желчных кислот характеризуется гидроксильными группами в циклах А, В и С скелета холана, преимущественно, в одном или более из положений С3, С7, С12, возможно (но более редко), в положениях С1, С6 и других. Связывание циклов А и В в скелете холана (и в желчных кислотах) существует в двух изомерных формах, то есть, С5- и С8-заместители находятся в цис- (5-бетахолан) или транс- (5-альфахолан) конфигурации. В случае соединений согласно настоящему изобретению, если они иначе не описаны, предполагают соединение как альфа-, так и бета-изомера А/В-цикла, предпочтительно, бета-изомера.
Настоящее изобретение, в первом аспекте, относится к соединениям для применения в качестве модуляторов рецептора ROR, в особенности, в качестве селективных лигандов рецептора ROR-гамма, имеющих общую формулу I, или к их фармацевтически приемлемым солям или их стереоизомерам (нумерация указана в соответствии с правилами номенклатуры ИЮПАК):
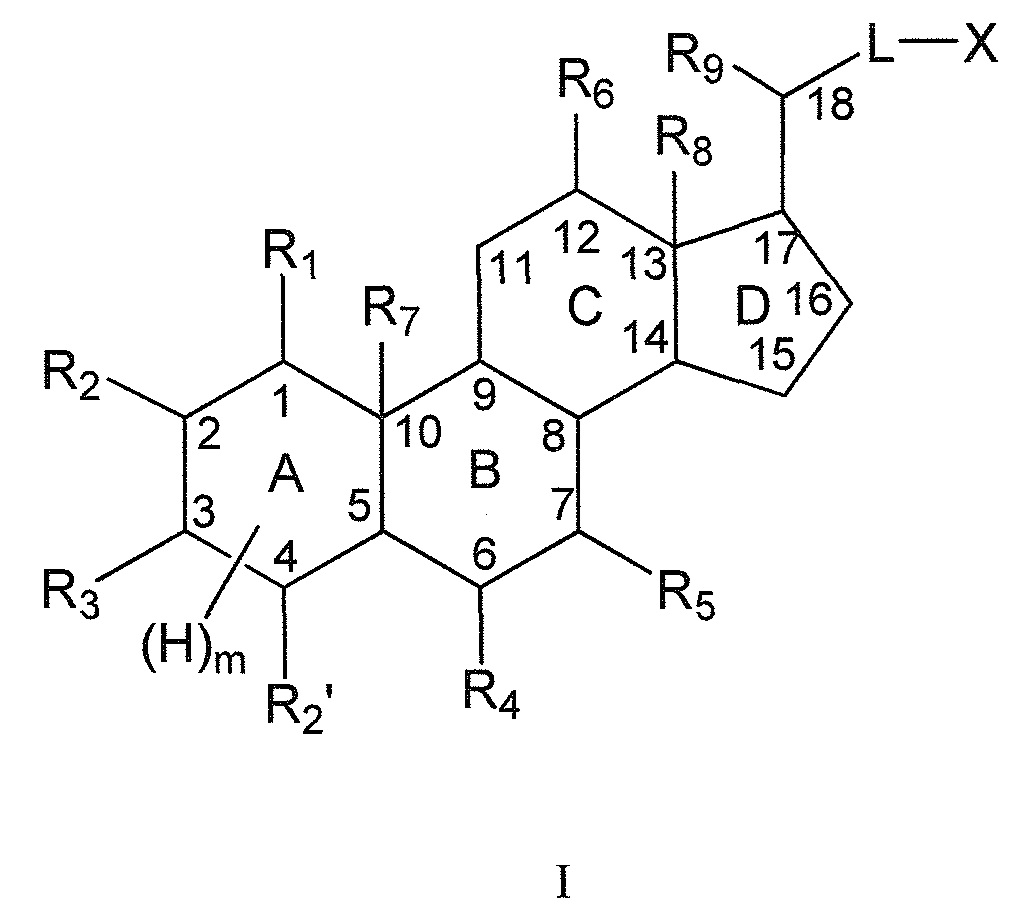
где
R1, R2, R2’, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, R2, вместе с атомами углерода, с которыми они связаны, образуют эпоксигруппу;
R3, R4, R5, R6, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R7, R8, R9, независимо друг от друга, означают Н, (С1-10)алкил, где одна или более из не являющихся соседними групп CH2 могут быть заменены на -О-, -S-, -CO-, -CO-O-, -O-CO-, -NRa-, -CO-NRa-, -NRa-CO-, -C=C- или -C≡C-; где Ra означает Н или (С1-6)алкил;
L означает связующую группу, такую как С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным или замещенным, по меньшей мере, одним CN, галогеном, ОН, NRaRb, COORa, NO2, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-, -O-CO-, -NRa-, -NRa-CO-, -CO-NRa-, -CH=CH- или -C≡C-; где Ra и Rb, независимо друг от друга, означают Н или С(1-6)алкил;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
m означает целое число от 0 до 5.
Подразумевают, что (H)m представляет собой все водородные заместители в указанном цикле А (то есть, у С1, С2, С3, С4, С5 и С10). Квалифицированному специалисту должно быть известно, сколько Н-заместителей представлено для конкретной картины замещения из групп R1, R2, R2’, R3 в цикле А. Например, m=5 может означать полностью насыщенный цикл, не имеющий двойных связей, m=3 может означать, например, цикл, имеющий одну двойную связь (например, между С1-С2 или между С4-С5), m=2 может означать, например, цикл, имеющий одну двойную связь (например, между С1-С2 или между С4-С5) и R3, означающий оксо, и m=0 может означать, например, полностью ненасыщенный цикл, имеющий двойные связи между С1-С2 и между С4-С5 и R3, означающий оксо. Таким образом, степень ненасыщенности и природа заместителей определяет наличие числа Н-атомов, или, наоборот, число Н-атомов указывает на степень ненасыщенности цикла А.
В конкретных воплощениях, соединения согласно данному изобретению, в соответствии с формулой I, базируются на скелете полигидроксилированного холана, имеющем заместитель -L-X- в положении С17, и где гидроксильные (или оксо-) заместители имеются, предпочтительно, в двух или более, предпочтительно, по меньшей мере, в трех, положениях, выбираемых из С1, С3, С6, С7, С12 (представленные группами R1, R3, R4, R5, R6, соответственно), более предпочтительно, где гидроксильные (или оксо-) заместители имеются во всех из третьих или четвертых положений, выбираемых из С1, С3, С6, С7, С12, наиболее предпочтительно, где гидроксильные (или оксо-) заместители имеются во всех третьих или четвертых положениях, выбираемых из С1, С3, С6, С7, С12, из которых один гидроксильный (или оксо-) заместитель находится в положении С1 или С6.
Таким образом, в некоторых воплощениях, соединения согласно данному изобретению имеют три гидроксильных (или оксо-) заместителя и картины гидроксилирования включают (i) гидроксильный (или оксо-) заместитель в С1 в комбинации со следующими комбинациями из двух дальнейших гидроксильных (или оксо-) заместителей в положениях С3 и С7, С3 и С12, С7 и С12, и (ii) гидроксильный (или оксо-) заместитель в С6 в комбинации со следующими комбинациями из двух дальнейших гидроксильных (или оксо-) заместителей в положениях С3 и С7, С3 и С12, и С7 и С12, и (iii) гидроксильный (или оксо-) заместитель и обоих положениях С1 и С6 в комбинации с дальнейшим гидроксильным (или оксо-) заместителем в положении С3 или С7 или С12.
В других воплощениях, соединения согласно данному изобретению имеют четыре гидроксильных (или оксо-) заместителя и картины гидроксилирования включают: (i) гидроксильный (или оксо-) заместитель в С1 в комбинации с тремя дальнейшими гидроксильными (или оксо-) заместителями в положениях С3, С7 и С12; (ii) гидроксильный (или оксо-) заместитель в С6 в комбинации с тремя дальнейшими гидроксильными (или оксо-) заместителями в положениях С3, С7 и С12, и (iii) гидроксильный (или оксо-) заместитель в положениях С1 и С6 в комбинации со следующими комбинациями из двух дальнейших гидроксильных (или оксо-) заместителей в положениях С3 и С7, С3 и С12, С7 и С12.
В предпочтительном воплощении, R7, R8, R9, независимо друг от друга, означают Н, (С1-10)алкил, более предпочтительно, метил, этил, пропил, бутил, наиболее предпочтительно, метил.
В некоторых воплощениях, R1, R2, независимо друг от друга, означают Н, галоген, -ORa, -COORa, где Ra означает Н или (С1-6)алкил, или, вместе с атомами углерода, с которыми они связаны, образуют эпоксигруппу.
Предпочтительно, R2 означает Н или галоген, или, вместе с R1и атомами углерода, с которыми R1 и R2 связаны, образует эпоксигруппу.
Предпочтительно, R2’ означает Н или галоген, более предпочтительно, Н или Cl, Br, I.
Предпочтительно, R3, R4, R5, R6, независимо друг от друга, означают Н, -ORa, -NRaRb, -COORa, -CONRaRbили оксо, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил.
Более предпочтительно, R3 означает Н, -ORa, -NRaRb или оксо, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил; R4, R5, R6, независимо друг от друга, означают Н, -ORa или -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил; и R7, R8, R9, независимо друг от друга, означают Н, (С1-10)алкил, более предпочтительно, метил, этил, пропил, бутил, наиболее предпочтительно, метил.
Таким образом, предпочтительно, данное изобретение включает соединения согласно формуле II и их фармацевтически приемлемые соли или их стереоизомеры, предпочтительно, их стереоизомерную форму IIa:
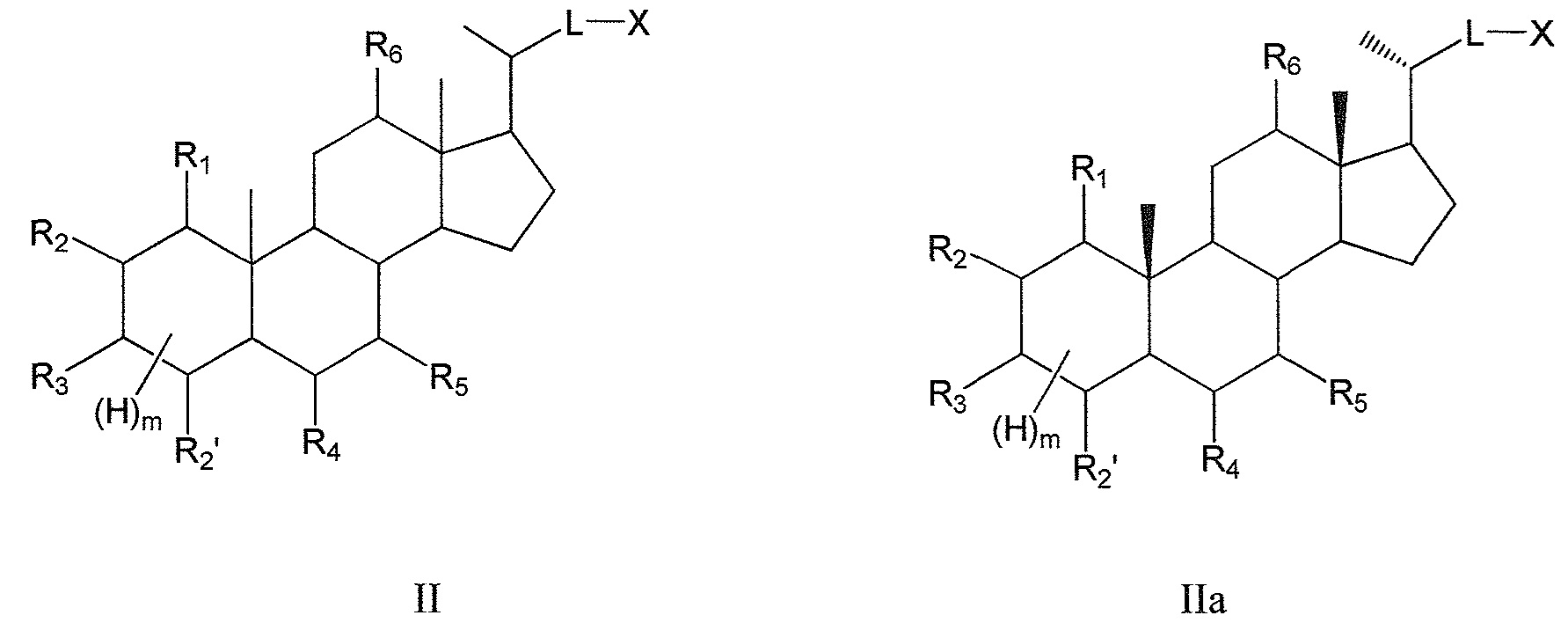
где
R1, R2, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, R2, вместе с атомами углерода, с которыми они связаны, образуют эпоксигруппу;
R3, R4, R5, R6, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R2’ означает Н или галоген;
L означает связующую группу, такую как С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным или замещенным, по меньшей мере, одним CN, галогеном, ОН, NRaRb, COORa, NO2, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-, -O-CO-, -NRa-, -NRa-CO-, -CO-NRa-, -CH=CH-, -C≡C-; где Ra и Rb, независимо друг от друга, означают Н или С(1-6)алкил;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
m означает от 0 до 5.
В предпочтительном воплощении, по меньшей мере, три группы, предпочтительно, три или четыре группы, выбираемые из R1, R3, R4, R5 и R6, означают -ORa или оксо, где Ra означает Н или С(1-6)алкил.
В другом предпочтительном воплощении, R1 и/или R4 означают -ORa или оксо.
Более предпочтительно, по меньшей мере три группы, предпочтительно, три или четыре группы, выбираемые из R1, R3, R4, R5 и R6, означают -ORa или оксо, при условии, что R1 и/или R4 означают -ORa или оксо, где Ra означает Н или С(1-6)алкил.
В конкретных воплощениях, L (во всех из приведенных в данном контексте формулах) представляет собой С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-. Предпочтительно, L представляет собой С(1-12)алкил с линейной или разветвленной цепью, более предпочтительно, С(1-6)алкил с линейной или разветвленной цепью, как определено в данном контексте.
Предпочтительно, Х (во всех из представленных в данном контексте формулах) представляет собой Н, -ORa, -COORс, -CONRaRс, где Ra означает Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3 и Ra означает -Н или -(С1-6)алкил. Предпочтительно, Rc означает -Н, -(С1-6)алкил, -NH-CH2-CO2Ra или -NH-(CH2)2-SO3Ra, где Ra означает -Н или -(С1-6)алкил.
В предпочтительных воплощениях, группа -L-X (во всех из представленных в данном контексте формулах) представляет собой -(С1-6)алкил-COORа, более предпочтительно, -(CH2)2-СООRa, где Ra означает -Н или -(С1-6)алкил.
Предпочтительно, R2 означает Н или галоген, или вместе с R1 и атомами углерода, с которыми R1 и R2 связаны, образует эпоксигруппу.
В конкретных воплощениях, R4, R6 означают -ORa, таким образом, данное изобретение, в особенности, включает соединения формулы IIIa и все их фармацевтически приемлемые соли или их стереоизомеры, предпочтительно, их стереоизомерную форму IIIb:


где
R1 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, вместе с R2 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н или галоген, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R2, вместе с R1 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R3, R5, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, предпочтительно, Н, оксо, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R2’ означает Н или галоген;
L означает С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
Ra означает Н или (С1-6)алкил;
m означает от 0 до 5.
В других конкретных воплощениях, R6 означает -ORa и R1 означает или -ORa или образует с R2 эпоксид, и, таким образом, данное изобретение, в особенности, включает соединения формулы IIIc и формулы IIId, и все их фармацевтически приемлемые соли или их стереоизомеры, предпочтительно, их стереоизомерные формы IIIe1/IIIe2 и IIIf1/IIIf2:
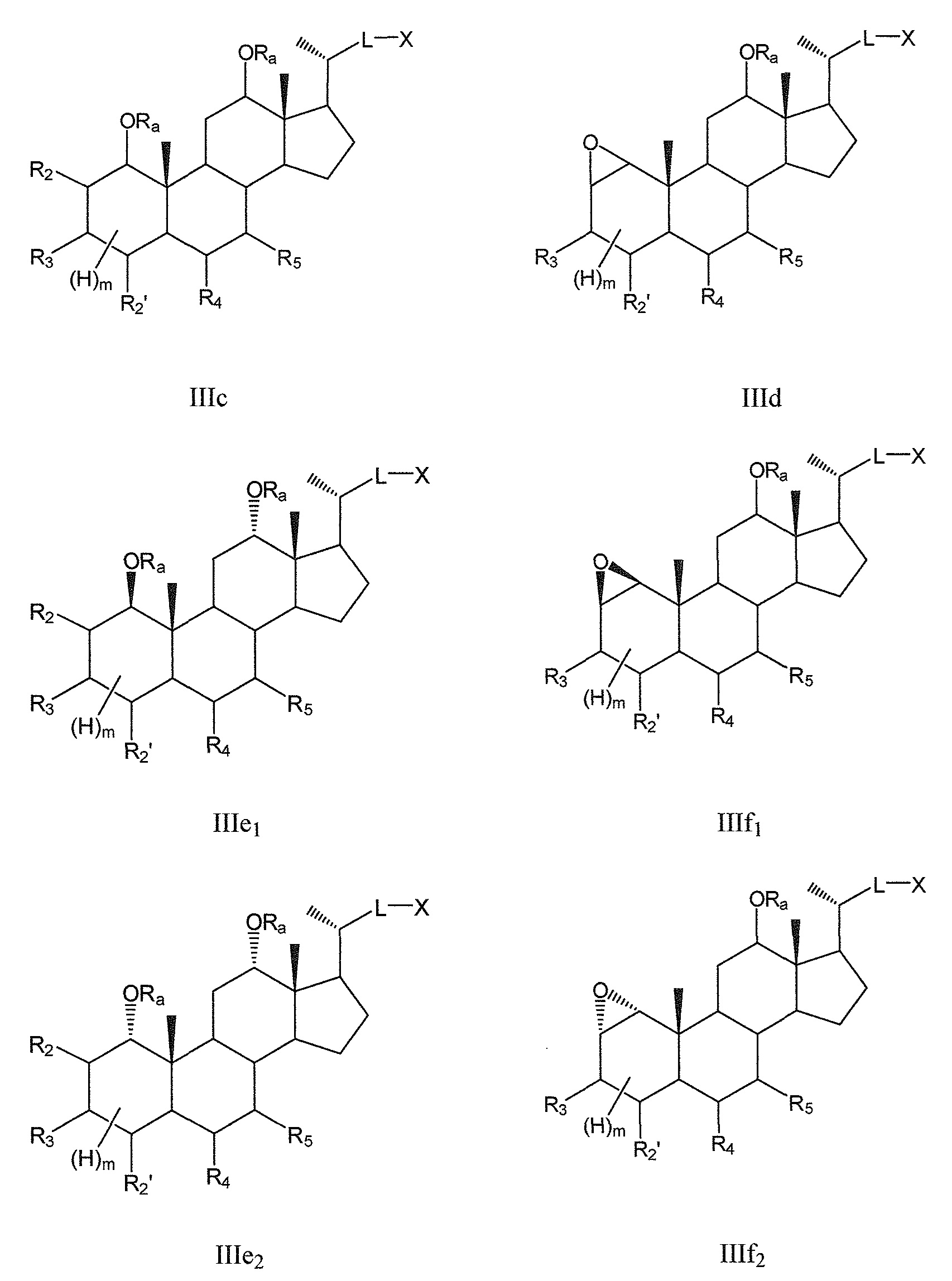
где
R2 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н или галоген, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R3, R4, R5, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, предпочтительно, Н, оксо, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R2’ означает Н или галоген;
L означает С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
Ra означает Н или (С1-6)алкил;
m означает от 0 до 5.
В конкретных воплощениях, R3 означает -ORa и R6 означает или -ORa или оксо, и, таким образом, данное изобретение, в особенности, включает соединения формулы IIIg и формулы IIIh, и все их фармацевтически приемлемые соли или их стереоизомеры, предпочтительно, их стереоизомерные формы IIIi1, IIIi2:
где
R1 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, вместе с R2 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н или галоген, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R2, вместе с R1 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R4, R5, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, предпочтительно, Н, оксо, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R2’ означает Н или галоген;
L означает С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
Ra означает Н или (С1-6)алкил;
m означает от 0 до 5.
В конкретных воплощениях, R5, R6 означают -ORa и, таким образом, данное изобретение, в особенности, включает соединения формулы IIIj, и все их фармацевтически приемлемые соли или их стереоизомеры, предпочтительно, их стереоизомерную форму IIIk:
где
R1 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, вместе с R2 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н или галоген, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R2, вместе с R1 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R3, R4, независимо друг от друга, означают Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, предпочтительно, Н, оксо, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
R2’ означает Н или галоген;
L означает С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
Ra означает Н или (С1-6)алкил;
m означает от 0 до 5.
В конкретных воплощениях, R1 означает -ORa в соединении формулы IIIa (и его стереоизомерных формах), или R4 означает -ORa в соединениях формул IIIс и IIId (и их стереоизомерных формах), или оба R1 и R4 означают -ORa в соединениях формул IIIg, IIIh и IIIk (и их стереоизомерных формах), где Ra означает Н или (С1-6)алкил.
В предпочтительных воплощениях, данное изобретение включает соединения формулы IV (где R3 означает оксо) и все их фармацевтически приемлемые соли или их стереоизомеры:

где
R1 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, вместе с R2 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2 означает Н или галоген, или R2, вместе с R1 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2’ означает Н или галоген;
R4 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, предпочтительно, Н, оксо, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
L означает С(1-12)алкил с линейной или разветвленной цепью;
X означает Н, -ORa, -COORс, -CONRaRс; где Raозначает Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
Ra означает Н или С(1-6)алкил; и
m означает 1, 2, 3 или 4.
Предпочтительно, m означает 4, если цикл А является полностью насыщенным, и m означает 0 или 2, если цикл А является частично (одна двойная связь) или полностью (две двойные связи) ненасыщенным.
В предпочтительном воплощении, R1илиR4или оба R1и R4 в соединении формулы IV означают -ORa, где Ra означает Н или (С1-6)алкил.
В других предпочтительных воплощениях, данное изобретение включает соединения формулы V (где R3 означает -ORa) и все их фармацевтически приемлемые соли или их стереоизомеры, предпочтительно, их стереоизомерные формы Va и Vb:
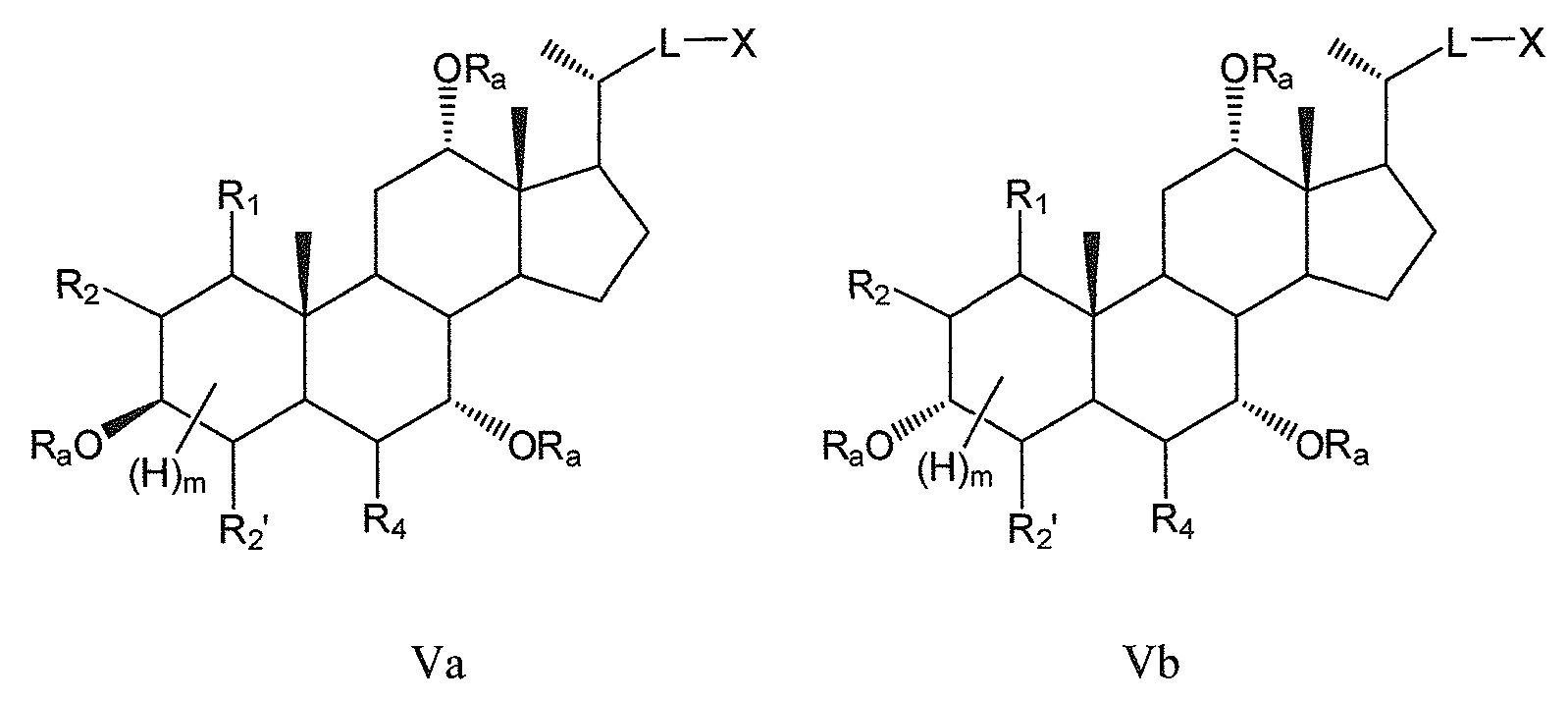
где
R1 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, предпочтительно, Н, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил, или R1, вместе с R2 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2 означает Н или галоген, или R2, вместе с R1 и атомами углерода, с которыми R1, R2 связаны, образует эпоксигруппу;
R2’ означает Н или галоген;
R4 означает Н, галоген, -ORa, -SRa, -NRaRb, -COORa, -CONRaRb, оксо, тио, предпочтительно, Н, оксо, -ORa, -NRaRb, где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил;
L означает С(1-12)алкил с линейной или разветвленной цепью;
X означает Н, -ORa, -COORс, -CONRaRс, где Raозначает Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил;
Ra означает Н или С(1-6)алкил; и
m означает 1, 2, 3, 4 или 5.
Предпочтительно, m означает 5, если цикл А является полностью насыщенным, и m означает 1 или 3, если цикл А является частично (одна двойная связь) или полностью (две двойные связи) ненасыщенным.
В предпочтительном воплощении, R1илиR4или оба R1и R4, в любых из соединений формул V, Va и Vb означают -ORa, где Ra означает Н или (С1-6)алкил.
Некоторые предпочтительные примеры, например, включают соединения, где R3=-ORa, R1=R2=R2'=Н и R4означает -ORa, формулы VIa, и все их фармацевтически приемлемые соли или их стереоизомеры, которые включают С3α- и С3β-стереоизомер (VIa1, VIa2); или
соединения с R3, означающим -ORa, R4=R2=R2'=Н и где R1означает -ORa, формулы VIb, и все их фармацевтически приемлемые соли или их стереоизомеры, которые включают С1α/С3α-, С1α/С3β-, С1β/С3α-, С1β/С3β-стереоизомер (VIb1, VIb2, VIb3, VIb4,); или
соединения с R3, означающим -ORa, R2=R2’=Н и R1и где R4означает -ORa, формулы VIс, которые включают С1α/С3α-, С1α/С3β-, С1β/С3α-, С1β/С3β-стереоизомер, каждый из которых, по отношению к С6, находится или в α- или в β-положении.
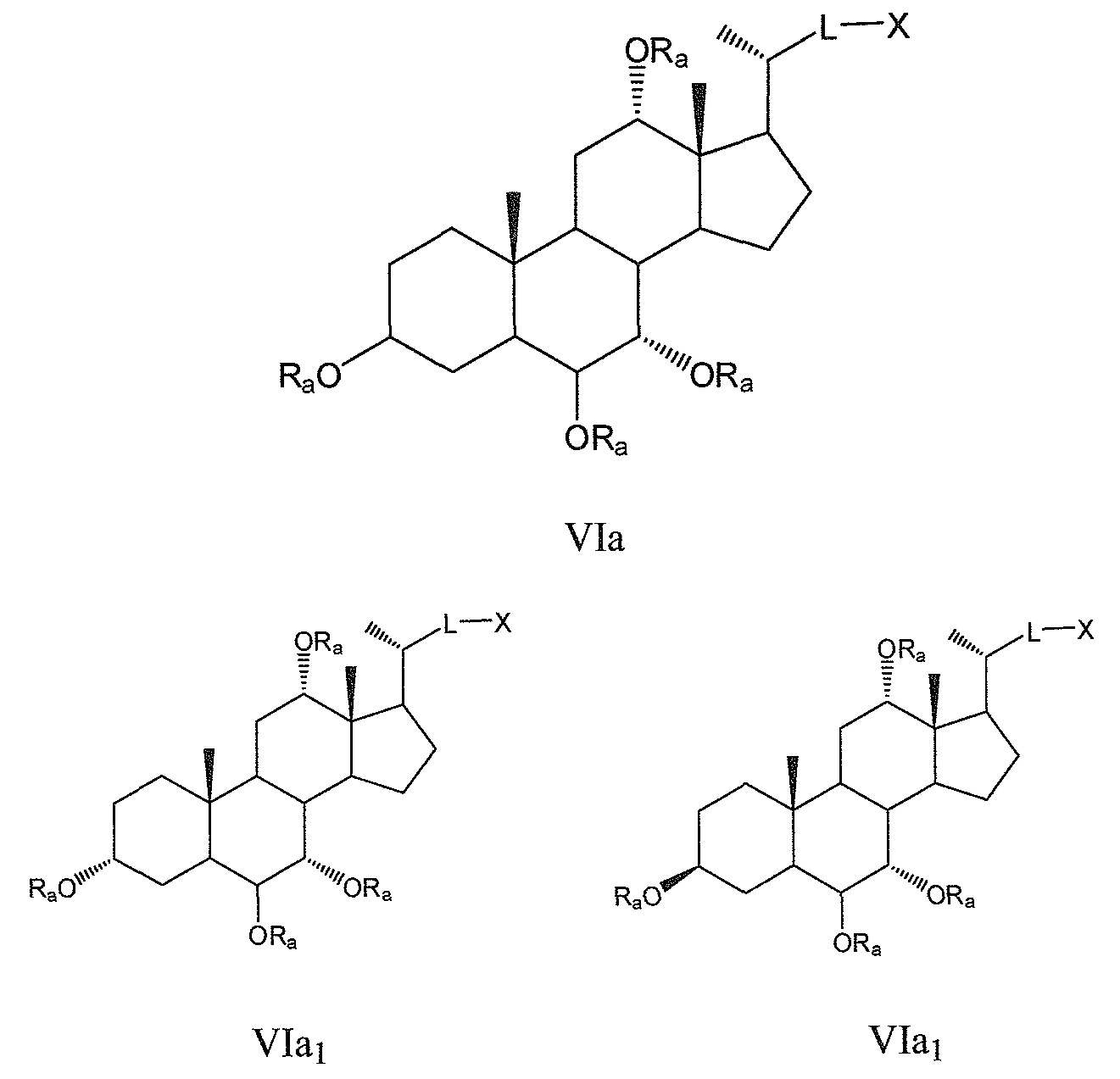
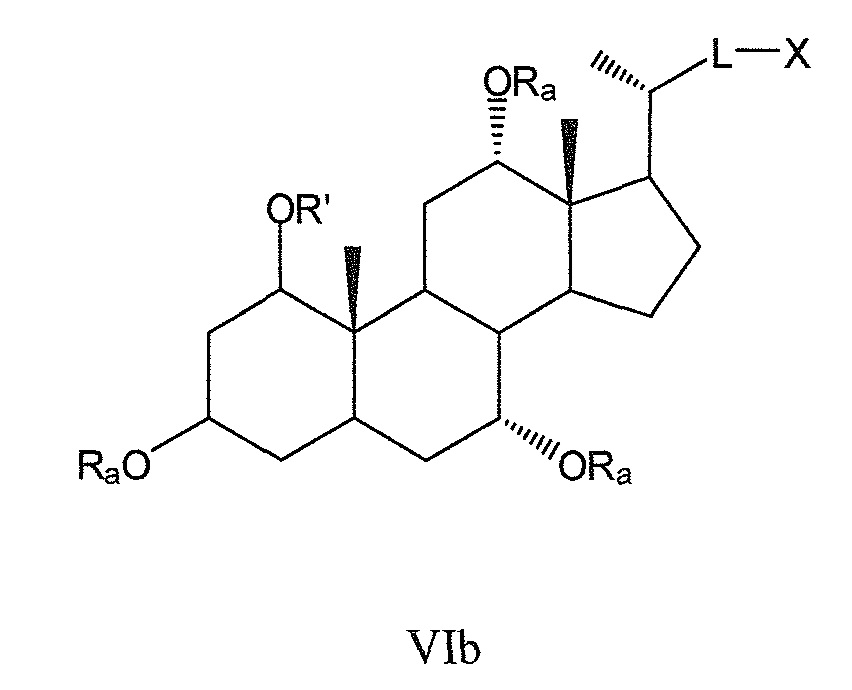

где L означает С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-, предпочтительно, С(1-6)алкил с линейной или разветвленной цепью;
Ra означает Н или С(1-6)алкил;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил, предпочтительно, Н, -ORa, -COORс, -CONRaRс.
Другие предпочтительные примеры, например, включают соединения, где R3=оксо, R1=R2=R2’=Н и R4означает -ORa и цикл А является частично ненасыщенным, формул VIIa, VIIb, и все их фармацевтически приемлемые соли или их стереоизомеры, которые включают С6α- и С6β-стереоизомер;
Соединения, где R3=оксо, R4=R2’ и или R1означает -ORa и R2означает Н, или R1и R2образуют эпоксид, формул VIIc, VIId, и все их фармацевтически приемлемые соли или их стереоизомеры, которые включают С1α- и С1β-стереоизомер (относительно эпоксида или -ORa); и
Соединения, где R3=оксо, R2’=Н, оба R1 и R4означают -ORa или оксо, и цикл А является насыщенным или частично ненасыщенным, формул VIIe, VIIf, и все их фармацевтически приемлемые соли или их стереоизомеры, которые включают С1α/С6α-, С1α/С6β-, С1β/С6α-, С1β/С6β-стереоизомер:
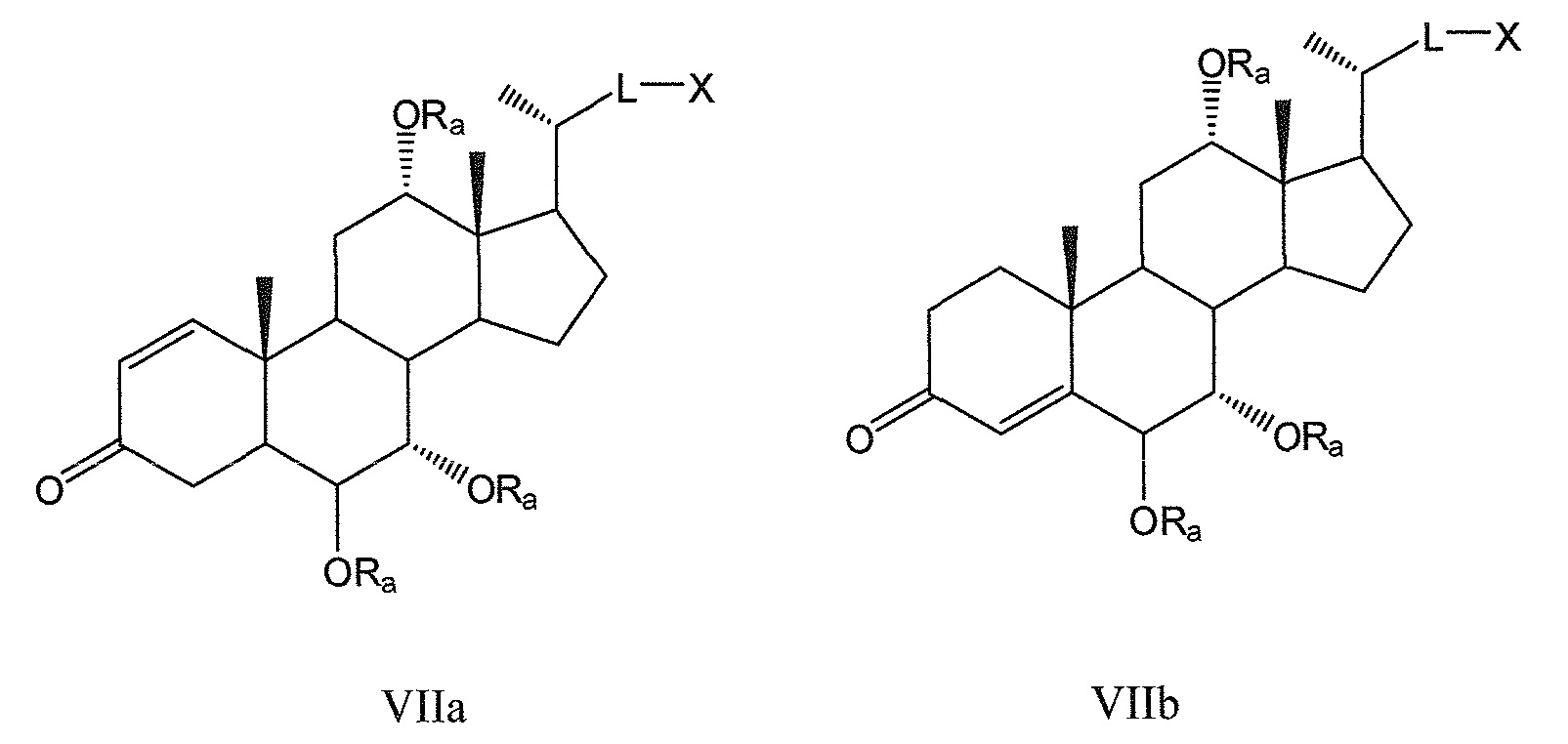
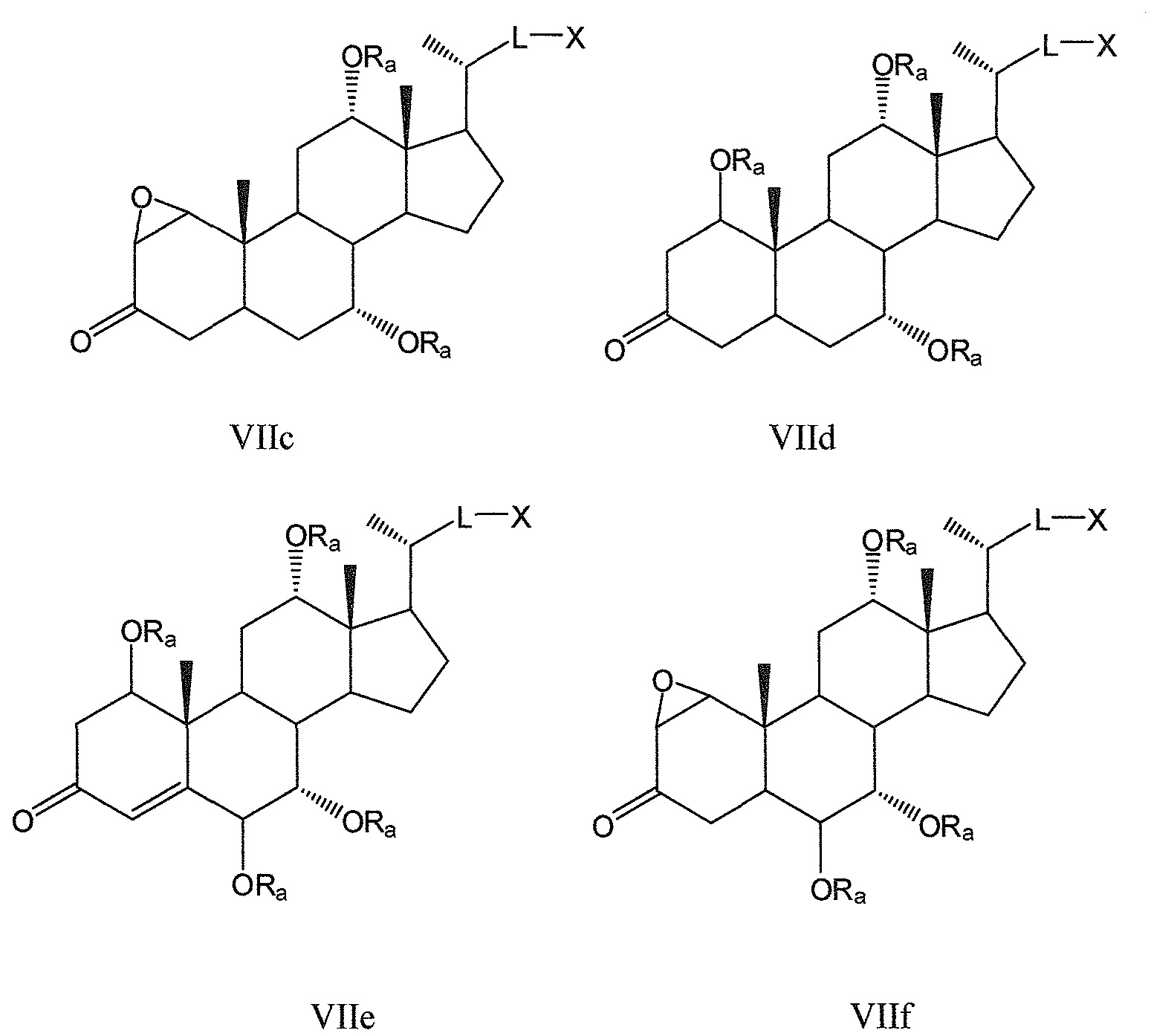
где L означает С(1-12)алкил с линейной или разветвленной цепью, который является незамещенным, и где одна или более из не являющихся соседними групп CH2 могут быть независимо заменены группой, выбираемой из группы, состоящей из -О-, -CO-, -CO-O-, предпочтительно, С(1-6)алкил с линейной или разветвленной цепью;
Ra означает Н или (С1-6)алкил;
X означает Н, -ORa, -SRa, -NRaRb, -COORс, -CONRaRс; где Ra и Rb, независимо друг от друга, означают Н или (С1-6)алкил и Rc означает -Н, -(С1-6)алкил, -NH-(CH2)n-CO2Ra или -NH-(CH2)p-SO3Ra, где n, p означают 1, 2 или 3, и Ra означает -Н или -(С1-6)алкил, предпочтительно, Н, -ORa, -COORс, -CONRaRс.
Термин «алкил» относится к линейной или разветвленной углеродной цепи, включающей определенное количество атомов углерода. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, 1-метилпропил, 2-метилпропил, трет-бутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,2-диметилпропил, 1,1-диметилпропил, 2,2-диметилпропил, н-гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1-этилбутил, 2-этилбутил, 3-этилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, н-гептил, 1-метилгексил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 1-этилпентил, 2-этилпентил, 3-этилпентил, 4-этилпентил, 1-пропилбутил, 2-пропилбутил, 3-пропилбутил, 1,1-диметилпентил, 1,2-диметилпентил, 1,3-диметилпентил, 1,4-диметилпентил, 2,2-диметилпентил, 2,3-диметилпентил, 2,4-диметилпентил, 3,3-диметилпентил, 3,4-диметилпентил, 4,4-диметилпентил, 1-метил-1-этилбутил, 1-метил-2-этилбутил, 2-метил-2-этилбутил, 1-этил-2-метилбутил, 1-этил-3-метилбутил, 1,1-диэтилпропил, н-октил, н-нонил, н-децил и т.п.
Таким образом, термин «С(1-6)алкил», как используемый в данном контексте, относится к алкильным группам с разветвленной или линейной цепью и включает «линейный С(1-6)алкил», такой как метил, этил, н-пропил, н-бутил, н-пентил и н-гексил, и «разветвленный С(3-6)алкил», такой как изопропил, изобутил, трет-бутил, 2-пентил, 3-пентил, 2-метилбутил, 3-метилбутил, 3-метил-2-бутил, 2,2-диметилпропил, 2-гексил, 3-гексил, 3-метил-2-пентил, 3-метил-3-пентил, 2,2-диметилбутил, 3,3-диметилбутил, 2,3-диметил-2-бутил, 2,3-диметил-3-бутил и 3,3-диметил-2-бутил.
Термин «галоген» (или «гало») включает фтор, хлор, бром и иод, предпочтительно, хлор и бром, более предпочтительно, бром.
Термин «оксо» относится к атому кислорода, присоединенному двойной связью (=О).
Термин «тио» относится к атому серы, присоединенному двойной связью (=S).
Индекс «m» означает 1, 2, 3, 4 или 5.
Подразумевают, что, если один или более из вышеуказанных терминов встречается более чем один раз, в формуле (например, Ra, Rb, Rc), каждый термин указан независимо от другого.
Соединения согласно данному изобретению могут включать одну хиральную плоскость, один или более асимметрических или хиральных центров и могут существовать в различных стереоизомерных формах, таких как рацематы и рацемические смеси, оптически чистые энантиомеры, энантиомерные смеси, оптически чистые диастереомеры и диастереомерные смеси. Все стереоизомерные формы промежуточных продуктов и соединений согласно настоящему изобретению, а также их смеси, включая рацемические и диастереомерные смеси, которые обладают свойствами, пригодными для лечения состояний, описанных в данном контексте, составляют часть настоящего изобретения.
Соединения согласно данному изобретению могут быть разделены на их индивидуальные энантиомеры и диастереоизомеры при использовании стандартных способов, известных в данной области, таких как, например, фракционная кристаллизация из подходящего растворителя, например, метанола или этилацетата или их смеси, или посредством хиральной хроматографии, используя оптически активную неподвижную фазу. Абсолютная стереохимия может быть определена с помощью кристаллографии рентгеновскими лучами кристаллических продуктов или кристаллических промежуточных продуктов, которые дериватизированы, если необходимо, с помощью реагента, включающего асимметрический центр известной абсолютной конфигурации. Энантиомеры и диастереомеры могут быть разделены путем использования хиральной колонки ВЭЖХ и путем превращения энантиомерной смеси в диастереомерную смесь путем введения во взаимодействие с соответствующим оптически активным соединением (например, хиральное вспомогательное вещество, такое как хиральный спирт или хлорангидрид кислоты Мошера), разделения диастереоизомеров и превращения (например, гидролиз) индивидуальных диастереоизомеров в соответствующие чистые энантиомеры. Альтернативно, любой стереоизомер соединения согласно данному изобретению может быть получен путем стереоспецифического синтеза, используя оптически чистые исходные вещества или реагенты известной абсолютной конфигурации.
Такое разделение энантиомеров или диастереомеров или стереоспецифический синтез может быть особенно желательным, если энантиомеры или диастереомеры различаются по биологической активности.
Подразумевают, что настоящее изобретение включает все такие изомерные формы соединений согласно данному изобретению, включая геометрические Е- и Z-изомеры по двойным связям и их смеси. Некоторое количество соединений согласно настоящему изобретению и их промежуточных продуктов, следовательно, проявляет таутомеризм и, следовательно, могут существовать в различных таутомерных формах при определенных условиях. Термин «таутомер» или «таутомерная форма» относится к структурным изомерам равных энергий (в смесях 50:50) или различных энергий, которые взаимозаменяемы через низкий энергический барьер. Например, протонные таутомеры включают взаимопревращения через миграцию протона, как например кето-енольная и имин-енаминная изомеризации. Валентные таутомеры включают взаимопревращения путем перестройки некоторых связывающих электронов. Все такие таутомерные формы входят в рамки данного изобретения. Подразумевают, что описание любой конкретной таутомерной формы в случае любой из структурных формул, согласно данному контексту, не является ограничивающим, что касается такой формы; однако, отображает полный таутомерный ряд.
В дальнейшем, подразумевают, что соединения согласно настоящему изобретению включают гидраты, сольваты, полиморфы, кристаллические вещества, гидратированные кристаллические и аморфные формы соединений согласно настоящему изобретению и их фармацевтически приемлемые соли.
Например, соединения согласно настоящему изобретению и промежуточные продукты могут существовать в несольватированных, а также в сольватированных формах, с растворителями, такими как вода, этанол, изопропанол и т.п., и как сольватированные, так и несольватированные формы включены в рамки данного изобретения. Сольваты, для использования в аспекте способов согласно данному изобретению, должны быть с фармацевтически приемлемыми растворителями.
Термин «фармацевтически приемлемые соли» относится к солям, получаемым с фармацевтически приемлемыми нетоксичными основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты. Соли, происходящие от неорганических оснований, включают соли алюминия, аммония, кальция, меди, содержащие трехвалентное железо соли, содержащие двухвалентное железо соли, соли лития, магния, содержащие трехвалентный марганец соли, содержащие двухвалентный марганец соли, соли калия, натрия, цинка и т.п. Особенно предпочтительными являются соли аммония, кальция, лития, магния, калия и натрия. Соли, происходящие от фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, соли циклических аминов и основные ионообменные смолы, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, ТЕА, триметиламин, трипропиламин, трометамин и т.п.
Когда соединение согласно настоящему изобретению является основным, соли могут быть получены с фармацевтически приемлемыми нетоксичными кислотами, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, муравьиную, фумаровую, глюконовую, глутаминовую, бромоводородную, соляную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, малоновую, слизевую, азотную, памоевую, пантотеновую, фосфорную, пропионовую, янтарную, серную, винную, п-толуолсульфоновую, трифтоуксусную кислоты и т.п. Особенно предпочтительными являются лимонная, фумаровая, бромоводородная, соляная, малеиновая, фосфорная, серная и винная кислоты. Должно быть понятно, что, как используется в данном контексте, подразумевают, что ссылки на соединения согласно данному изобретению также включают фармацевтически приемлемые соли, такие как гидрохлорид.
В дальнейшем аспекте, настоящее изобретение также относится к способам получения соединений согласно данному изобретению, которые способны преодолевать недостатки (например, недостаточный выход), связанные с известным в данной области способом. В соответствии с описанными методиками, 1,3,7,12-тетрагидроксильное соединение получают путем превращения подходящего защищенного производного С3-оксохолевой кислоты в соответствующий енон, затем путем функционализации енона посредством нуклеофильного эпоксидирования с последующим раскрытием эпоксидного цикла, получая (после подходящих схем снятия защиты) желательное 1,3,7,12-тетрагидроксильное соединение.
Найдено, что особенно пригодные способы введения гидроксильной функциональности (например, в случае С1) включают присоединение базирующегося на кремнии конъюгата к ключевому промежуточному енону и последующее окислительное удаление кремниевой группы (при условиях Тамао-Флеминга, как описано, например, у Fleming I. и др., J. Chem. Soc., Perkin Trans. 1, 1995, 317-337), которое позволяет получать конечные промежуточные продукты с высокими выходами и высокой стереоселективностью.
Альтернативно, заявители данного изобретения нашли, что, при определенных условиях, введение гидроксильной функциональности (например, в случае С1) может быть достигнуто с хорошими выходами через эпоксидирование ключевого промежуточного енона, если вышеуказанный енон является защищенным в виде разветвленного алкильного сложного эфира, как например сложный изопропиловый эфир (без существенного гидролиза функциональности сложного эфира в щелочных условиях).
Кроме того, раскрытие эпоксида с помощью бромида лития, индивидуально или в комбинации с триацетоксиборгидридом натрия (вместо альтернативных реагентов, включая селениды или иодид самария) приводит к промежуточному дибромированному кетону или спирту, соответственно, с высокими выходами, который может быть дебромирован для получения конечных ключевых соединений, используя нетоксичные и недорогие реагенты. Дополнительно, найдено, что восстановление всех гидроксикетонов, используемых в синтезах, когда это осуществляют с помощью триацетоксиборгидрида натрия, приводит к единственному диастереоизомеру (то есть, анти-диолу), в противоположность эпимерным смесям, получаемым путем использования боргидрида натрия или других восстановителей.
Соединения согласно данному изобретению являются пригодными в качестве эффективных лигандов или модуляторов рецептора ROR и, в особенности, рецептора ROR-гамма. Эти соединения, следовательно, являются пригодными для лечения и/или предупреждения нарушений, ответственных за модуляцию рецептора ROR-гамма, таких как диабет и связанные с диабетом нарушения, и, в особенности, диабет типа II.
Таким образом, настоящее изобретение также относится к применению, по меньшей мере, одного соединения согласно данному изобретению, в качестве эффективных лигандов или модуляторов рецептора ROR и, в особенности, рецептора ROR-гамма.
В особенности, настоящее изобретение также относится к применению, по меньшей мере, одного соединения согласно данному изобретению для лечения или предупреждения, подавления или ослабления заболевания, опосредуемого рецептором ROR-гамма, у субъекта, нуждающегося в этом.
Более конкретно, настоящее изобретение относится к применению терапевтически эффективного количества по меньшей мере одного лиганда рецептора ROR-гамма формул I-VII, или его фармацевтически приемлемой соли или его стереоизомера, для лечения или предупреждения или подавления заболевания, опосредуемого рецептором ROR-гамма, у субъекта, нуждающегося в этом, где заболевание выбирают из группы, состоящей из диабета и связанных с диабетом нарушений, в особенности, в случае диабета типа II.
Более конкретно, настоящее изобретение относится к применению терапевтически эффективного количества, по меньшей мере, одного соединения формул I-VII, или его фармацевтически приемлемой соли или его стереоизомера, для лечения или предупреждения или подавления диабета и/или связанных с диабетом нарушений, в особенности, диабета типа II.
В некоторых воплощениях, соединения согласно данному изобретению могут быть использованы индивидуально, в других воплощениях, соединения согласно данному изобретению могут быть использованы в комбинации с другими соединениями согласно данному изобретению или в комбинации с другими терапевтически активными агентами. Примеры других терапевтически активных ингредиентов (для комбинированного введения с одним или более соединениями согласно данному изобретению), которые могут быть пригодны для лечения и/или профилактики, и/или ослабления заболеваний или состояний, для которых соединения согласно данному изобретению являются пригодными, то есть, диабета и/или связанных с диабетом нарушений, в особенности, диабета типа II, включают, но не исчерпывающим образом, антидиабетические агенты, снижающие уровень липидов агенты, антигипертензивные агенты и агенты против ожирения, такие как следующие:
(а) антидиабетические агенты, например, (1) глитазоны (например, циглитазон, дарглитазон, энглитазон, изаглитазон, пио-глитазон, розиглитазон, троглитазон, туларик, BRL49653, CLX-0921, 5-BTZD), и PPAR-лиганды, как например GW-0207, LG-100641 и LY-300512; (2) бигуаниды, как например буформин, метформин и фенформин; (3) ингибиторы протеинтирозинфосфатазы-1В (РТР-1В); (4) сульфонилмочевины, как например ацетогексамид, хлорпропамид, диабинез, глибенкламид, глипизид, глибурид, глимепирид, гликлазид, глипентид, гликвидон, глизоламид, толазамид и толбутамид; (5) меглитиниды, как например репаглинид, натеглинид и т.п.; (6) ингибиторы α-глюкозидазы, как например акарбоз, адипозин, камиглибоз, эмиглитат, миглитол, воглибоз, прадимицин-Q, салбостатин, CKD-711, MDL-25,637, MDL-73,945 и MOR14; (7) ингибиторы α-амилазы, как например тендамистат, трестатин и А1-3688; (8) стимуляторы секреции инсулина, как например линоглирид, А-4166 и т.п.; (9) ингибиторы окисления жирной кислоты, как например, кломоксир и этомоксир; (10) антагонисты α-2, как например мида-глизол, изаглидол, дериглидол, идазоксан, эароксан и флупар-оксан; (11) инсулин и инсулиновые миметики, как например, биота, LP-100, новарапид, инсулин детемир, инсулин лизпро, инсулин гларгин, инсулин-цинковая суспензия (ленте или ультраленте), Lys-Pro инсулин, GLP-1 (73-7) (инсулинтропин) и GLP-1 (7-36)-NH2; (12) не-тиазолидиндионы, как например JT-501, фарглитазар (GW-2570/GL-262579) и мураглитазар; PPAR-антагонисты, как например мураглитазар и соединения, раскрытые в патенте США 6414002; (13) двойные агонисты PPAR, как например MK-0767/KRP-297, CLX-0940, GW-1536, GW-1929, GW-2433, L-796449, LR-90 и SB219994; (14) другие сенсибилизаторы инсулина; (15) агонисты VPAC2-рецептора; (16) активаторы глюкокиназы; и (17) ингибиторы DPP-4, как например ситаглиптин (Januvia™), изолейцинтиазолидид (Р32/98); NVP-DPP-728; вилдаглиптин (LAF 237); Р93/01; денаглиптин (GSK 823093), SYR322, RO 0730699, TA-6666 и саксаглиптин (BMS 477118).
(b) снижающие уровень липидов агенты, например, (1) усилители экскреции желчной кислоты, как например холестирамин, колесевелам, колестипол, диалкиламиноалкильные производные сшитого декстрана, Colestid(R), LoCholest(R) и Questran(R) и т.п.; (2) ингибиторы HMG-CoA-редуктазы, как например аторвастатин, ита-вастатин, флувастатин, ловастатин, питавастатин, правастатин, ривастатин, розувастатин и симвастатин, ZD-4522 и т.п.; (3) ингибиторы HMG-CoA-синтазы; (4) ингибиторы абсорбции холестерина, как например сложные эфиры станола, бета-ситостерол, стерогликозиды, такие как тиквезид, и подобный азетидинонам эзетимиб; (5) ингибиторы ацил-кофермента А-холестеринацилтрансферазы (АСАТ), как например авазимиб, эфлуцимиб, KY505 и SMP797 и т.п.; (6) ингибиторы СЕТР, как например JTT705, торсетрапиб, СР532632, BAY63-2149, SC591 и SC795 и т.п.; (7) ингибиторы скваленсинтазы; (8) антиоксиданты, как например пробукол; (9) агонисты PPAR-a, как например беклофибрат, бензафибрат, ципрофибрат, клофибрат, этофибрат, фенофибрат, гемкабен, гемфиброзил и другие производные фибровой кислоты, например, GW7647, BM170744, LY518674, Atromid(R), Lopid(R) и Tricor(R) и соединения, описанные в Международной заявке WO-97/36579, и т.п.; (10) модуляторы рецептора FXR, как например GW4064, SR103912 и т.п.; (11) лиганды рецептора LXR, как например GW3965, T9013137 и XTCO179628 и т.п.; (12) ингибиторы синтеза липопротеина, как например ниацин; (13) ингибиторы системы ренин/ангиотензин; (14) частичные агонисты PPAR-d; (15) ингибиторы реабсорбции желчной кислоты, как например BAR11453, SC435, PHA384640, S8921, AZD7706 и т.п.; (16) агонисты PPAR-d, как например GW501516, GW590735 и соединения, описанные в Международной заявке WO-97/28149, и т.п.; (17) ингибиторы синтеза триглицеридов; (18) ингибиторы микросомального транспорта триглицеридов (МТРР), как например инплитапид, LAB687 и CP346086; (19) модуляторы транскрипции; (20) ингибиторы сквален-эпоксидазы; (21) индукторы рецептора липопротеинов низкой плотности (LDL); (22) ингибиторы агрегации тромбоцитов; (23) ингибиторы 5-LO или FLAP; и (24) агонисты ниацинового рецептора; и
(с) антигипертензивные агенты, например, (1) диуретики, как например тиазиды, включающие хлорталидон, хлоротиазид, дихлорфенамид, гидрофлуметиазид, индапамид и гидрохлоротиазид; петлевые диуретики, как например буметанид, этакриновая кислота, фуросемид и торсемид; калийсберегающие агенты, как например амилорид, триамтерен; антагонисты альдостерона, как например спиронолактон и эпиренон, и т.п.; (2) бета-адренергические блокаторы, как например ацебутолол, атенолол, бетаксолол, бизопролол, бопиндолол, сартеолол, сарведилол, целипролол, эсмолол, инденолол, метапролол, надолол, небиволол, пенбутолол, пиндолол, пропанолол, соталол, тертатолол, тилисолол и тимолол и т.п.; (3) блокаторы кальциевого канала, как например амлодипин, аранидипин, азелнидипин, барнидипин, бенидипин, бепридил, циналдипин, клевидипин, дилтиазем, эфонидипин, фелодипин, галлопамил, исрадипин, лацидипин, лемилдипин, лерканидипин, никардипин, нифедипин, нилвадипин, нимодипин, низолдипин, нитрендипин, манидипин, пранидипин и верапамил и т.п.; (4) ингибиторы ангиотензинконвертирующего фермента (АСЕ), как например беназеприл, каптоприл, цилазаприл, делаприл, эналаприл, фозиноприл, имидаприл, лизиноприл, моэксиприл, квинаприл, квинаприлат, рамиприл, периндоприл, кваниприл, спираприл, тенокаприл, трандолаприл и зофеноприл и т.п.; (5) ингибиторы нейтральной эндопептидазы, как например омапатрилат, кадоксатрил, экадотрил, фозидотрил, сампатрилат, AVE7688, ER4030 и т.п.; (6) антагонисты эндотелина, как например босентан, тезосентан, А308165 и YM62899 и т.п.; (7) вазодилататоры, как например гидралазин, клонидин, миноксидил и никотиниловый спирт; (8) антагонисты рецептора ангиотензина II, как например сандесартан, эпросартан, ирбесартан, лосартан и гидрохлоротиазид, пратосартан, тазосартан, телмисартан, валсартан, ЕХР-3137, FI6828K и RNH6270 и т.п.; (9) α/β-адренергические блокаторы, как например нипрадилол, аротинолол и амосулалол; (10) а1-блокаторы, как например теразозин, урапидил, празозин, буназозин, тримазозин, доксазозин, нафтопидил, индорамин, WHIP164 и XEN010; (11) а2-агонисты, как например лофексидин, тиаменидин, моксонидин, рилменидин и гуанобенз; (12) ингибиторы альдостерона; и
(d) агенты против ожирения, как например (1) стимуляторы секреции гормона роста, агонисты/антагонисты рецептора стимуляции секреции гормона роста, как например NN703, гексарелин, MK-0677, SM-130686, CP-424391, L-692429 и L-163255; (2) ингибиторы протеинтирозинфосфатазы-1В (РТР-1В); (3) лиганды каннабиноидного рецептора, как например антагонисты или инверсные агонисты каннабиноидного СВ1 рецептора, как например римонабант (Sanofi Synthelabo), AMT-251 и SR-14778 и SR-141716A (Sanofi Synthelabo), SLV-319 (Solvay), BAY 65-2520 (Bayer); (4) серотонергические агенты против ожирения, как например фенфлурамин, дексфенфлурамин, фентермин и сибутрамин; (5) агонисты бета-3-адренорецептора, как например AD9677/TAK677 (Dainippon/Takeda), CL-316243, SB 418790, BRL-37344, L-796568, BMS-196085, BRL-35135A, CGP12177A, BTA-243, трекадрин, зенека D7114, SR 59119A; (6) ингибиторы панкреатической липазы, как например орлистат (Xenical(R)), тритон WR1339, RHС80267, липстатин, тетрагидролипстатин, теасапонин, диэтилумбеллиферилфосфат; (7) антагонисты нейропептида Y1, как например BIBP3226, J-115814, BIBO 3304, LY-357897, CP-671906, GI-264879A; (8) антагонисты нейропептида Y5, как например GW-569180A, GW-594884A, CW-587081X, GW-548118X, FR 226928, FR 240662, FR 252384, 1229U91, GI-264879A, CGP71683A, LY-377897, PD-160170, SR-120562A, SR-120819A и JCF-104; (9) антагонисты меланинконцентрирующего гормона (МСН), как например таковые, описанные в Международных заявках WO-01/21577 и WO-01/21169; (10) антагонисты рецептора меланинконцентрирующего гормона 1 (МСН1R), как например Т-226296 (Takeda); (11) агонисты/антагонисты рецептора меланинконцентрирующего гормона 2 (MCH2R); (12) антагонисты рецептора орексина-1, как например SB-334867-A и таковые, раскрытые в Международных заявках WO-01/96302, WO-01/68609, WO-02/51232 и WO-02/51838; (13) ингибиторы повторного поглощения серотонина, как например флуоксетин, пароксетин и сертралин; (14) агонисты меланокортина, как например меланотан II, CHIR86036 (Chiron), ME-10142 и ME-10145 (Melacure), CHIR86036 (Chiron); PT-141 и PT-14 (палатин); (15) другие агонисты MC4R (рецептор мелакортина 4); (16) агонисты 5НТ-2; (17) агонисты 5НТ2С (рецептор 2С серотонина), как например BVT933, DPCA37215, WAY161503, R-1065; (18) антагонисты галанина; (19) агонисты ССК; (20) агонисты ССК-1 (агонисты холецистокинина-А), как например AR-R 15849, GI 181771, JMV-180, A-71378, A-71623 и SR 146131; (21) агонисты GLP-1; (22) агонисты кортикотропинвысвобождающего гормона; (23) модуляторы рецептора-3 гистамина (Н3); (24) антагонисты/инверсные агонисты рецептора-3 гистамина (Н3), как например гиоперамид, 3-(1Н-имидазол-4-ил)пропил-N-(4-пентенил)карбамат, клобенпропит, иодофенпропит, имопроксифан, GT2394 (Gliatech) и О-[3-(1H-имидазол-4-ил)пропанол]карбаматы (Kiec-Kononowicz K. и др., Pharmazie, 55, 349-355 (2000)), антагонисты рецептора пиперидинсодержащего гистамина Н3 (Lazewska D. и др., Pharmazie, 56, 927-932 (2001), производные бензофенона и родственные соединения (Sasse A. и др., Arch. Pharm. (Weinheim), 334, 45-52 (2001)), замещенные N-фенилкарбаматы (Reidemeister S. и др., Pharmazie, 55, 83-86 (2000)) и проксифановые производные (Sasse A. и др., J. Med. Chem., 43, 3335-3343 (2000)); (25) ингибиторы бета-гидроксистероиддегидрогеназы-1 (бета-HSD-1); (26) ингибиторы PDE (фосфодиэстеразы), как например теофиллин, пентоксифиллин, запринаст, силденафил, амринон, милринон, цилостамид, ролипрам и циломиласт; (27) ингибиторы фосфодиэстеразы-3В (PDE3B); (28) ингибиторы транспорта NE (норэпинеприн), как например GW 320659, деспирамин, талсупрам и номифенсин; (29) антагонисты рецептора грелина; (30) лептин, включая рекомбинантный человеческий лептин (PEG-OB, Hoffman La Roche) и рекомбинантный человеческий метиониллептин (Amgen); (31) производные лептина; (32) другие агонисты BRS3 (подтип 3 бомбезинового рецептора), как например [D-Phe6,бета-Ala11,Phe13,Nle14]Bn(6-14)- и [D-Phe6,Phe13]Bn(6-13)-пропиламид; (33) CNTF (цилиарные нейротрофические факторы), как например GI-181771 (Glaxo-SmithKline), SR146131 (Sanofi Synthelabo), бутабиндид, PD 170292 и PD 149164 (Pfizer); (34) производные CNTF, как например аксокин (Regeneron); (35) ингибиторы повторного поглощения моноамина, как например сибутрамин; (36) активаторы UCP-1 (разобщающий белок-1), -2 или -3, как например фитановая кислота, 4-[(E)-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)-1-пропенил]бензойная кислота (TTNPB), ретиноевая кислота; (37) агонисты щитовидного гормона бета, как например KВ-2611 (KaroBioBMS); (38) ингибиторы FAS (жирная кислота-синтаза), как например керуленин и С75; (39) ингибиторы DGAT1 (диацилглицеринацилтрансфераза 1); (40) ингибиторы DGAT2 (диацилглицеринацилтрансфераза 2); (41) ингибиторы АСС2 (ацетил-СоА-карбоксилаза-2); (42) глюкокортикоидные антагонисты; (43) ацил-эстрогены; (44) ингибиторы дипептидилпептидазы-IV (DP-IV), как например изолейцинтиазолидид, валинпирролидид, NVP-DPP728, LAF237, P93/01, TSL 225, TMC-2A/2B/2c, FE 999011, P9310/K364, VIP 0177, SDZ 274-444 и ситаглиптин; (46) ингибиторы дикарбоксилатного транспортера; (47) ингибиторы транспортера глюкозы; (48) ингибиторы фосфатного транспортера; (49) метформин (Glucophage(R)); и (50) топирамат (Topimax(R)); и (50) пептид YY, PYY 3-36, аналоги, производные и фрагменты пептида YY, как например BIM-43073D, BIM-43004C (Olitvak D.A. и др., Dig. Dis. Sci., 44(3), 643-648 (1999)); (51) агонисты рецептора нейропептида Y2 (NPY2), как например NPY3-36, N-ацетил[Leu(28,31)]NPY 24-36, TASP-V и цикло(28/32)-Ас-[Lys28-Glu32]-(25-36)pNPY; (52) агонисты нейропептида Y4 (NPY4), как например панкреатический пептид (РР), как описанный Batterham и др., J. Clin. Endocrinol Metab., 88, 3989-3992 (3003), и другие агонисты Y4, как например 1229U91; (54) ингибиторы циклооксигеназы-2, как например эторикоксиб, целекоксиб, валдекоксиб, парекоксиб, лумиракоксиб, BMS347070, тиракоксиб или JTE522, ABT963, CS502 и GW406381; и их фармацевтически приемлемые соли; (55) антагонисты нейропептида Y1 (NPY1), как например BIBP3226, J-115814, BIBO 3304, LY-357897, CP-671906, GI-264879A; (56) опиоидные антагонисты, как например налмефен (Revex (R)), 3-метоксиналтрексон, налоксон, налтрексон; (57) ингибиторы 11-бета HSD-1 (11-бета-гидроксистероид-дегидрогеназа, тип 1), как например BVT 3498, BVT 2733; и другие соединения, такие как аминорекс; амфехлорал; амфетамин; бензфетамин; хлорфентермин; клобензорекс; клофорекс; кломинорекс; клортермин; циклекседрин; декстроамфетамин; дифеметоксидин, N-этиламфетамин; фенбутразат; фенизорекс; фенпропорекс; флудорекс; флуминорекс; фурфурилметиламфетамин; левамфетамин; левофацетоперан; мефенорекс; метамфепрамон; метамфетамин; норпсевдоэфедрин; пенторекс; фендиметразин; фенметразин; пицилорекс; фитофарм 57; зонисамид, нейромедин U и его аналоги или производные, оксинтомодулин и его аналоги и производные, антагонисты рецептора нейрокинина-1 (антагонисты NK-1); и Qnexa.
Соединения согласно данному изобретению могут быть использованы в форме фармацевтической композиции. Таким образом, в другом аспекте, настоящее изобретение относится к фармацевтической композиции, включающей по меньшей мере одно соединение согласно данному изобретению (или его фармацевтически приемлемую соль) и фармацевтически приемлемый носитель и необязательно, по меньшей мере один дополнительный терапевтически активный агент, как описано выше. Термин «фармацевтически приемлемые соли» относится к солям, получаемым при использовании фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические основания или кислоты и органические основания или кислоты, как описано выше.
Подходящим образом, соединения согласно данному изобретению могут быть комбинированы в виде плотной смеси с фармацевтическим носителем в соответствии со стандартными фармацевтическими способами. Носитель может включать широкое разнообразие форм в зависимости от формы лекарственного средства, желательного для введения (как описано ниже).
Соединения согласно данному изобретению представляют собой лиганды рецептора ROR (гамма) и показано, что они являются пригодными для лечения, контроля или предупреждения заболеваний, нарушений или состояний, чувствительных к модуляции рецептора ROR (гамма), как, например, диабет и связанные с диабетом нарушения, в особенности, диабет типа II.
Следовательно, в дальнейшем аспекте, настоящее изобретение относится к способу лечения или предупреждения нарушений, заболеваний или состояний, чувствительных к модуляции рецептора ROR (гамма), у субъекта, нуждающегося в этом, который включает введение субъекту терапевтически или профилактически эффективного количества по меньшей мере одного соединения согласно данному изобретению, или его фармацевтически приемлемой соли, необязательно в комбинации по меньшей мере с одним дополнительным терапевтически активным агентом, как описано выше.
Более конкретно, настоящее изобретение относится к способу лечения или предупреждения диабета и связанных с диабетом нарушений в случае субъекта, нуждающегося в этом, который включает введение вышеуказанному субъекту терапевтически или профилактически эффективного количества по меньшей мере одного лиганда рецептора ROR-гамма согласно настоящему изобретению, необязательно в комбинации по меньшей мере с одним дополнительным терапевтически активным агентом, как описано выше.
В особенности, настоящее изобретение относится к способу лечения или предупреждения диабета типа II у субъекта, нуждающегося в этом, который включает введение субъекту терапевтически или профилактически эффективного количества по меньшей мере одного соединения согласно данному изобретению, или его фармацевтически приемлемой соли, необязательно в комбинации по меньшей мере с одним дополнительным терапевтически активным агентом, как описано выше.
Должно быть понятно, что термины «введение» или «вводить» соединения согласно данному изобретению означают доставку соединения согласно данному изобретению (или пролекарства соединения согласно данному изобретению) или включающей его фармацевтической композиции субъекту, нуждающемуся в лечении. Введение соединений согласно настоящему изобретению для того, чтобы практиковать имеющиеся способы терапии согласно данному изобретению, осуществляют путем введения терапевтически или профилактически эффективного количества данного соединения (или композиции) согласно данному изобретению и необязательно терапевтически эффективного количества по меньшей мере одного дополнительного терапевтически активного соединения субъекту, нуждающемуся в таком лечении или профилактике.
Термин «терапевтически эффективное количество», как используется в данном контексте, означает количество соединения согласно данному изобретению, которое вызывает желательный биологический или медицинский ответ в ткани, системе или у субъекта, включая облегчение симптомов нарушения, которое подвергают лечению. Термин «профилактически эффективное количество», как используется в данном контексте, означает количество соединения согласно данному изобретению, которое вызывает желательный биологический или терапевтический ответ в ткани, системе или у субъекта для предупреждения проявления нарушения у субъектов, что касается риска нарушения. Терапевтически или профилактически эффективное количество или дозу конкретного соединения согласно данному изобретению определяет врач, однако, в зависимости от факторов, таких как точное заболевание, подвергаемое лечению, тяжесть заболевания и другие заболевания или состояния, от которых страдает пациент, выбор пути введения, другие лекарственные средства и лечения, которые могут сопутствующе требоваться пациенту, возраст пациентов и конституция (генотип) и другие факторы по заключению врача.
Для обеспечения субъекта, особенно, человека, терапевтически эффективной дозой соединения согласно настоящему изобретению может быть использован любой подходящий путь введения. Например, могут быть использованы пероральный, ректальный, местный, парентеральный (например, подкожная или внутривенная инфузия и подкожная или внутривенная инъекция), офтальмологический, пульмонарный, назальный и т.п. пути введения. Лекарственные формы включают таблетки, лепешки, дисперсии, суспензии, растворы, капсулы, крема, мази, аэрозоли и т.п. Предпочтительно, соединения согласно данному изобретению вводят перорально или парентерально.
Эффективная доза используемого активного ингредиента может варьироваться в зависимости от конкретного выбранного соединения, способа введения, подвергаемого лечению состояния и тяжести состояния, подвергаемого лечению. Такая доза может без труда установлена квалифицированным специалистом в данной области.
Обычно, соединение согласно данному изобретению (или их комбинации) вводят в виде суточной дозы от примерно 0,001 мг до примерно 50 мг на кг массы тела субъекта, предпочтительно, в виде разовой дозы или в виде разделенных доз, от двух до шести раз в сутки, или в виде формы с пролонгированным высвобождением. Например, в случае взрослого человека с массой тела 70 кг, общая суточная доза обычно должна составлять от примерно 0,07 мг до примерно 3500 мг. Эта схема приема может быть отрегулирована для обеспечения оптимального терапевтического ответа. В случае перорального введения, подходящий дозировочный диапазон составляет, например, от примерно 0,01 мг до примерно 1500 мг одного или более соединений, согласно данному изобретению, в сутки, предпочтительно, от примерно 0,1 мг до примерно 600 мг в сутки, более предпочтительно, от примерно 0,1 мг до примерно 100 мг в сутки. Для перорального введения, композиции предпочтительно предусматривают в форме таблеток, содержащих от 0,01 мг до 1000 мг, предпочтительно, 0,01, 0,05, 0,1, 0,5, 1, 2,5, 5, 10, 15, 20, 25, 30, 40, 50, 100, 250, 500, 600, 750, 1000, 1250 или 1500 мг активного ингредиента, для симптоматического установления дозы пациенту, подвергаемому лечению. В случае интраназального введения, имеется подходящий дозировочный диапазон, например, может быть использована композиция, включающая 0,001-10% масс. растворы или суспензии одного или более соединений согласно данному изобретению. В случае внутривенного введения, подходящий дозировочный диапазон составляет от примерно 0,001 мг до примерно 50 мг, предпочтительно, от 0,01 мг до примерно 50 мг, более предпочтительно, 0,1-10 мг, одного или более соединений согласно данному изобретению, на кг массы тела, в сутки.
Вышеуказанная схема приема может быть отрегулирована для обеспечения оптимального терапевтического ответа. В некоторых случаях, может быть необходимо применение доз вне этих пределов. Точное количество профилактической или терапевтической дозы одного или более соединений согласно данному изобретению, конечно, может варьироваться в зависимости от выбранного конкретного соединения или соединений, способа введения, подвергаемого лечению состояния и тяжести состояния, подвергаемого лечению. Также, это количество может варьироваться в соответствии с возрастом, массой тела и ответом отдельного пациента. Такая доза может без труда установлена квалифицированным специалистом в данной области.
Как указано выше, настоящее изобретение также относится к применению соединений согласно настоящему изобретению в комбинации по меньшей мере с одним дополнительным терапевтически активным соединением. Такое дополнительное терапевтически активное соединение может быть введено, следовательно, обычно используемым путем и в обычно используемом количестве и может быть введено отдельно или комбинированно (в одной или раздельных фармацевтических композициях), одновременно или последовательно с одним или более соединениями согласно данному изобретению. В случае одновременного применения, может быть использована фармацевтическая композиция, включающая как по меньшей мере одно соединение согласно данному изобретению, так и по меньшей мере один дополнительный терапевтически активный агент. Соответственно, настоящее изобретение также относится к введению одной фармацевтической готовой лекарственной формы, включающей, по меньшей мере, один лиганд рецептора ROR-гамма в комбинации, по меньшей мере, с одним дополнительным терапевтически активным агентом, а также к введению каждого активного агента в его собственной отдельной фармацевтической готовой лекарственной форме. В случаях, где используют отдельные готовые лекарственные формы, индивидуальные компоненты композиции могут быть введены, по существу, в одно и то же время, то есть, одновременно, или последовательно, то есть, до или после введения другого компонента композиции. Подразумевают, что настоящее изобретение включает все такие режимы одновременного или последовательного лечения, и соответствующим образом должны быть истолкованы термины «введение» и «вводить».
Различные органические или неорганические носители, обычно используемые в качестве веществ для фармацевтических препаратов, могут быть использованы в качестве фармацевтически приемлемого носителя для соединений согласно данному изобретению и выбранного пути введения. Их смешивают в качестве эксципиента, смазочного вещества, связующего вещества или дезинтегрирующего агента, в случае твердых лекарственных форм; и в качестве растворителя, солюбилизирующего агента, суспендирующего агента, изотонического агента, буфера, успокаивающего средства и т.п., в случае жидких лекарственных форм. В случаях, где необходимо, могут быть использованы добавки для фармацевтических препаратов, как например консервант, антиоксидант, краситель, подсластитель и т.п.
Типичные примеры эксципиента включают лактозу, сахарозу, D-маннит, D-сорбит, крахмал, предварительно желатинизированный крахмал, декстрин, кристаллическую целлюлозу, гидроксипропилцеллюлозу с низкой степенью замещения, натрийкарбоксиметилцеллюлозу, гуммиарабик, пуллулан, слегка обезвоженную кремниевую кислоту, синтетический алюмосиликат, алюмометасиликат магния и т.п. Типичные примеры смазочного вещества включают стеарат магния, стеарат кальция, тальк, коллоидный кремнезем и т.п. Типичные примеры связующего вещества включают предварительно желатинизированный крахмал, сахарозу, желатин, гуммиарабик, метилцеллюлозу, карбоксиметилцеллюлозу, натрийкарбоксиметилцеллюлозу, кристаллическую целлюлозу, сахарозу, D-маннит, трегалозу, декстрин, пуллулан, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон и т.п. Типичные примеры дезинтегрирующего агента включают лактозу, сахарозу, крахмал, карбоксиметилцеллюлозу, кальцийкарбоксиметилцеллюлозу, натрийкроскармеллозу, натрийкарбоксиметилкрахмал, слегка обезвоженную кремниевую кислоту, гидроксипропилцеллюлозу с низекой степенью замещения и т.п. Типичные примеры растворителя включают воду для инъекции, физиологический раствор, раствор Рингера, спирт, пропиленгликоль, полиэтиленгликоль, кунжутное масло, кукурузное масло, оливковое масло, хлопковое масло и т.п. Типичные примеры солюбилизирующего агента включают полиэтиленгликоль, пропиленгликоль, D-маннит, трегалозу, бензилбензоат, этанол, трисаминометан, холестерин, триэтаноламин, карбонат натрия, цитрат натрия, салицилат натрия, ацетат натрия и т.п. Типичные примеры суспендирующего агента включают поверхностно-активные вещества, такие как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионат, лецитин, бензалконийхлорид, бензетонийхлорид, моностеарат глицерина и т.п.; гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и т.п.; полисорбаты, полиоксиэтиленированное гидрирогенизированное касторовое масло; и т.п. Типичные примеры изотонического агента включают хлорид натрия, глицерин, D-маннит, D-сорбит, глюкозу и т.п. Типичные примеры буфера включают фосфатный буфер, ацетатный буфер, карбонатный буфер, цитратный буфер и т.п. Типичные примеры успокаивающего средства включают бензиловый спирт и т.п. Типичные примеры консерванта включают п-оксибензоаты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту, сорбиновую кислоту и т.п. Типичные примеры антиоксиданта включают сульфит, аскорбат и т.п. Типичные примеры красителя включают водные пищевые тар-пигменты (например, пищевые красители, такие как Food Color Red Nos. 2 и 3, Food Color Yellow Nos. 4 и 5, Food Color Blue Nos. 1 и 2, и т.д.), водонерастворимые лак-пигменты (например, соль алюминия вышеуказанного водного пищевого тар-пигмента), природные пигменты (например, бета-каротин, хлорофилл, красный оксид железа и желтый оксид железа (III)) и т.п. Типичные примеры подсластителя включают натрийсахарин, дикалийглицирризинат, аспартам, и т.п.
Примеры подходящей лекарственной формы для соединения согласно настоящему изобретению включают пероральные готовые лекарственные формы, такие как таблетка (включая покрытую сахаром таблетку, покрытую пленкой таблетку, подъязычную таблетку, пер-орально дезинтегрирующуюся таблетку), капсула (включая мягкую капсулу, микрокапсулу), гранула, порошок, пилюля, сироп, эмульсия, суспензия, пленка (например, дезинтегрирующаяся в полости рта пленка) и т.п.; или парентеральные готовые лекарственные формы, такие как инъекции (например, подкожные инъекции, внутривенные инъекции, внутримышечные инъекции и внутрибрюшинные инъекции), наружные агенты (например, готовые лекарственные формы для назального введения, трансдермальные готовые лекарственные формы и мази), суппозитории (например, ректальные суппозитории и вагинальные суппозитории), лепешки, капли, глазные капли, пульмонарные готовые лекарственные формы (ингаляции) и т.п. В дополнение, эти готовые лекарственные формы могут представлять собой готовые лекарственные формы с пролонгированным высвобождением (например, микрокапсула с пролонгированным высвобождением), такие как готовые лекарственные формы с немедленным высвобождением или готовые лекарственные формы с пролонгированным высвобождением.
Фармацевтические композиции согласно данному изобретению могут быть получены в соответствии со способом, обычно используемым в области технологии фармацевтических лекарственных форм. Содержание, по меньшей мере, одного соединения согласно данному изобретению в фармацевтической композиции варьируется в зависимости от природы соединения, пути введения (и, таким образом, природы фармацевтической готовой лекарственной формы) и т.д., и составляет, например, 1-90% масс., предпочтительно, 5-80% масс.
В дальнейшем аспекте, настоящее изобретение также относится к комплекту, включающему фармацевтическую композицию согласно данному изобретению, содержащую по меньшей мере одно соединение согласно данному изобретению и необязательно по меньшей мере одно дополнительное терапевтически активное соединение. В одном воплощении, комплект согласно данному изобретению может включать одну пероральную готовую лекарственную форму, включающую как по меньшей мере один лиганд рецептора ROR (гамма), так и по меньшей мере один дополнительный терапевтически активный ингредиент, в одном отделении комплекта. В другом воплощении, комплект согласно данному изобретению может включать по меньшей мере две отдельные фармацевтические композиции в раздельных отделениях, которые представляют собой первую разовую лекарственную форму, включающую профилактически или терапевтически эффективное количество по меньшей мере одного лиганда рецептора ROR (гамма), или его фармацевтически приемлемой соли или сложного эфира, и фармацевтически приемлемый носитель или разбавители, в первом отделении, и вторую разовую лекарственную форму, включающую профилактически или терапевтически эффективное количество по меньшей мере одного дополнительного активного ингредиента, или его фармацевтически приемлемой соли или сложного эфира, и фармацевтически приемлемый носитель или разбавитель, во втором отделении.
Настоящее изобретение, далее, проиллюстрировано следующими конкретными примерами, которые предназначены для иллюстрации данного изобретения и не могут быть истолкованы как ограничивающие рамки данного изобретения каким-либо образом. Понятно, что квалифицированный специалист в данной области без труда может получать дополнительные соединения согласно настоящему изобретению, базируясь на методиках, описанных в данном контексте. Квалифицированным специалистам в данной области без труда должно быть понятно, что известные вариации условий и способов следующих препаративных методик могут быть использованы для получения этих соединений.
ПРИМЕРЫ
Материалы и методы
Все реактивы и растворители приобретали у ABCR, Acros, Aldrich, J.T. Baker, Fluka, Merck, TCI или Lancaster, и использовали, как таковые, со следующими исключениями: ТГФ и ДМФА сушили путем пропускания через две колонки, размером 4'' × 36'', с безводным нейтральным оксидом алюминия А-2 (Macherey und Nagel; активирован в течение ночи при температуре 300°C в токе азота), в атмосфере аргона (содержание воды <30 ч/млн, титрование по Карлу-Фишеру). Все температуры выражали в градусах Цельсия, за исключением иначе указанного. Все неводные реакции осуществляли в стеклянной посуде, высушенной пламенем, в атмосфере аргона/азота, за исключением иначе указанного. ТСХ осуществляли на алюминиевых пластинах для ТСХ при использовании силикагеля Merck 60 F254 и визуализировали с помощью УФ тушения флуоресценции и п-анисового альдегида в качестве красителя. Концентрирования при пониженном давлении осуществляли с помощью роторного испарителя, при температуре 37°C, при соответствующем давлении, за исключением иначе указанного. Хроматографическую очистку на колонке проводили в виде флэш-хроматографии, при давлении, составляющем 0,3-0,5 бар, на силикагеле (60 Å, 40-64 мкм). Использовали перегнанные растворители технической чистоты. Выхода указывали по отношению к очищенным продуктам. Некоррелированные температуры плавления измеряли на аппарате Büchi B-540 для температур плавления, используя открытые стеклянные капилляры. Данные ЯМР регистрировали на спектрометрах VARIAN Mercury 300 МГц, Gemini 300 МГц, Bruker ARX 300, Bruker AV 400, Bruker DRX 400. Измерения осуществляли при комнатной температуре (приблизительно 22°C), за исключением иначе указанного. Химические сдвиги указывали в м.д. по отношению к сигналу остаточного растворителя, используя в качестве внутреннего стандарта [d]-хлороформ при 7,26 и 77,00 м.д., d6-ДМСО при 2,50 и 39,52 м.д., [d]-метанол при 3,31 и 49,00 м.д., для1Н- и13С, соответственно. Мультиплетности сокращали следующим образом: синглет (с), дублет (д), триплет (т), кажущийся триплет (кт), дублет-дублет (дд), триплет-дублет (тд), дублет-дублет-дублет (ддд) и мультиплет (м), константу(ы) взаимодействия указывали в Гц.13С-ЯМР-спектры регистрировали c 1Н-развязкой. Инфракрасные спектры регистрировали на спектрофотометре Perkin Elmer RXI FT-IR, используя тонкие пленки, поглощения указывали в волновых числах (см-1). Масс-спектрометрические анализы осуществляли, посредством сервиса масс-спектрометрии лаборатории по органической химии при ЕТН, Цюрих, L. Bertschi и O. Greter под руководством Dr. Zhang. ESI- и HRMS-Измерения осуществляли на оборудовании Bruker Daltonics maxis и Varian IonSpec ESI FT-ICR, при 4,7 Тл. EI-измерения осуществляли на оборудовании Waters Micromass AutoSpec Ultima, при 70 эВ.
Использование защитных групп для функциональностей амина и карбоновой кислоты в целях облегчения протекания желательной реакции и минимизации нежелательных реакций полностью подтверждено документально. Условия, требуемые для удаления защитных групп, находятся в стандартных руководствах, таких как Greene T. и Wuts P.G.M., Protective Groups in Organic Synthesis, John Wiley and Sons, Inc., New York, NY, 1991. CBZ и ВОС являются обычно используемыми защитными группами в органическом синтезе и условия их удаления известны квалифицированному специалисту в данной области. Например, CBZ можно удалять путем каталитического гидрирования в присутствии благородного металла или его оксида, такого как палладий-на-активированном угле, в протонном растворителе, таком как метанол или этанол. В случаях, где каталитическое гидрирование противопоказано вследствие присутствия других потенциально реакционноспособных функциональностей, удаления CBZ-групп также можно достигать путем обработки раствором бромоводорода в уксусной кислоте или путем обработки смесью ТФУК и диметилсульфида. Удаление защитных групп ВОС осуществляют с помощью сильной кислоты, такой как трифторуксусная кислота, соляная кислота или газообразный хлороводород, в растворителе, таком как метиленхлорид, метанол или этилацетат.
Анализ активности люциферазы. Стандартно, клетки 3Т3L1 культивировали до 60-70% конфлюэнтности на 24-луночном планшете и трансфецировали генами-репортерами (рMMP3-pCL3) (0,05 мкг), pCMV-Renilla в качестве внутреннего стандарта (0,05 мкг) и векторами экспрессии для ROR-гамма (0,1 мкг) путем использования реагента Фугена для трансфекции, в соответствии с производственным протоколом (Invitrogen). Клетки культивировали в течение дополнительных 48 часов после трансфекции. Активность люциферазы измеряли, используя систему Luciferase Detection System, следуя производственному протоколу (Promega).
Тест на толерантность к инсулину. Стандартно, мышей линии С57В6 (возраст 6 недель) кормили при использовании рациона с высоким содержанием жира (60% калорий, происходящих от жира, Kliba), дополненного 1β,3α,7α,12α-тетрагидрокси-5β-холан-24-оатом (или тетраолом) в количестве 0,1% или 0,01% или холевой кислотой (или СА) в количестве 0,1% и 0,01%. Кормление при использовании исключительно рациона с высоким содержанием жира служило в качестве контроля. Спустя 6 недель, мышей тестировали на чувствительность к инсулину с помощью инъекции 0,5 Ед/кг инсулина (интраперитонеально). Концентрации глюкозы в крови измеряли перед инъекцией и спустя 30, 60, 90 и 120 минут после инъекции. Относительное снижение глюкозы в крови рассчитывали для каждой мыши путем деления величины момента времени на исходную величину глюкозы в крови.
Терапевтическая эффективность. Стандартно, мышей линии С57В6 (возраст 6 недель) кормили при использовании рациона с высоким содержанием жира (60% калорий, происходящих от жира, Kliba) в течение 6 недель для стимулирования ожирения, связанного с резистентностью к инсулину. Затем мышей разделяли на три группы: первую группу продолжали кормить при использовании рациона с высоким содержанием жира, дополненного 0,01% тетраола, вторую группу кормили при использовании рациона с высоким содержанием жира, дополненного 0,01% холевой кислоты, и последнюю группу кормили при использовании рациона с высоким содержанием жира в качестве контроля. Спустя 6 и 12 недель кормления при использовании соответствующих рационов определяли содержание глюкозы в крови, используя монитор глюкозы Contour (Bayer AG, Diabetes Care, Switzerland), и определяли циркулирующие концентрации инсулина, используя анализ на инсулин для крысы/мыши, обеспечиваемый Meso Scale Discovery (Gaithersburg, Maryland, USA).
Пример 1: Синтез метил-1β,3α,7α,12α-тетрагидрокси-5β-холан-24-оата
(а) Метил-3-оксо,7α,12α-дигидрокси-5β-холан-24-оат
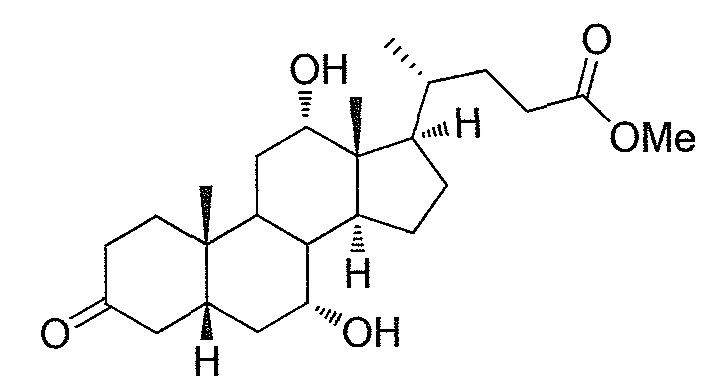
Холевую кислоту (50 г, 0,12 моль) превращают в соответствующий сложный метиловый эфир (51 г, выход 98%) в соответствии с известными из литературы способами (Rohacova J. и др., Org. Biomol. Chem., 2009, 7, 4973-4980; Tohma M. и др., Chem. Pharm. Bull. 1986, 34(7), 2890-2899). К раствору полученного сложного метилового эфира (23 г, 59 ммоль) в толуоле (400 мл) добавляют Ag2CO3/Celite® (40 г). Смесь нагревают при температуре 150°C, при энергичном перемешивании, до тех пор, пока ТСХ не покажет полную конверсию исходного вещества (Rf=0,27, AcOEt=100%) в один, менее полярный, продукт (Rf=0,58, AcOEt=100%). Спустя 9 часов, смесь оставляют охлаждаться до комнатной температуры и твердые осадки удаляют путем фильтрации через слой Celite®. Растворитель удаляют при пониженном давлении, получая сырой продукт, который растирают в Et2O, получая соответствующий кетон-диол (19,7 г, выход 87%) в виде твердого вещества белого цвета. Аналитические данные полностью согласуются с описанными значениями (Rohacova J. и др., Org. Biomol. Chem., 2009, 7, 4973-4980; Tohma M. и др., Chem. Pharm. Bull. 1986, 34(7), 2890-2899).
(b) Метил-3-оксо,7α,12α-диацетокси-5β-холан-24-оат
К раствору кетон-диола со стадии (а) (13 г, 31 ммоль) в смеси уксусного ангидрида и пиридина (50% об., 100 мл) добавляют DMAP (380 мг, 3,1 ммоль). Реакционную смесь перемешивают в течение часа при комнатной температуре, охлаждают до температуры 0°C и гасят путем добавления, по каплям, МеОН. Растворители концентрируют при пониженном давлении и остаток растворяют в EtOAc и промывают с помощью 1 М HCl и водного раствора NaHCO3. Органическую фазу концентрируют при пониженном давлении, получая твердый остаток, который перекристаллизуют из смеси EtOAc/гексаны, получая бис-ацетоксистирол (14,8 г, выход 95%), аналитические данные которого полностью согласуются с описанными значениями (Tohma M. и др., Chem. Pharm. Bull. 1986, 34(7), 2890-2899).
(с) Метил-7α,12α-диацетокси-2β,4β-дибром-3-оксо-5β-холан-24-оат
Бис-ацетоксикетон со стадии (b) (11,47 г, 23 ммоль) растворяют в смеси CHCl3 (20 мл) и уксусной кислоты (40 мл). По каплям добавляют раствор Br2 (2,34 мл, 46 ммоль) в уксусной кислоте (24 мл). После перемешивания в течение часа при комнатной температуре, смесь гасят с помощью водного раствора NaHSO3 и концентрируют при пониженном давлении до ¼ ее объема. Остаток растворяют в EtOAc и промывают с помощью водного раствора NaHCO3. Органическую фазу концентрируют при пониженном давлении и остаток растирают в диизопропиловом эфире, получая 2,4-дибром-производное (13,49 г, выход 90%), в виде смеси двух основных эпимеров (85:15), тем не менее, подходящее для использования, как таковое, на следующих стадиях. Аликвоту сырого вещества дважды кристаллизуют из смеси CH2Cl2/Et2O, получая чистое 2,4-дибром-производное (температура плавления=196°C, по литературным данным2=196-198°C), аналитические и спектроскопические данные которого идентичны описанным данным (Tohma M. и др., Chem. Pharm. Bull. 1986, 34(7), 2890-2899).
(d) Метил-7α,12α-диацетокси-3-оксо-5β-хол-1-ен-24-оат
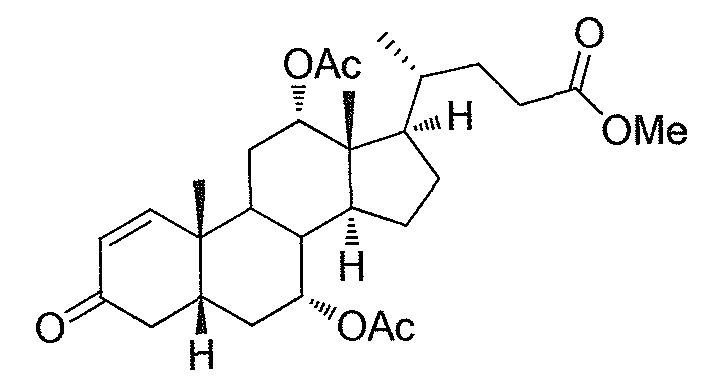
К раствору дибромкетона со стадии (с) (10,6 г, 16 ммоль) в ДМФА (85 мл) добавляют Li2CO3 (1,9 г, 24 ммоль) и LiBr (2,1 г, 24 ммоль). После перемешивания при температуре 80°C, в атмосфере азота, в течение 8 часов, ТСХ показывает полную конверсию исходного вещества (Rf=0,53, гексаны/EtОАс=80:20) в один, более полярный, продукт (одно пятно) (Rf=0,35, гексаны/EtОАс=80:20). Смесь разбавляют с помощью EtOAc и промывают с помощью 1 М HCl. Органическую фазу концентрируют при пониженном давлении, получая сырой остаток, который растирают в диизопропиловом эфире, получая промежуточный метил-7α,12α-диацетокси-4β-бром-3-оксо-5β-хол-1-ен-24-оат в виде твердого вещества белого цвета (8,6 г, выход 92%), который вводят во взаимодействие на следующий стадии, без дальнейшей очистки.
К раствору ранее полученного1Δ-4-бром-енона в уксусной кислоте (80 мл) добавляют порошок тонкоизмельченного цинка (4 г, 63 ммоль). После перемешивания в течение 30 минут при комнатной температуре, по ТСХ наблюдают полную конверсию исходного вещества в один продукт (одно пятно) (Rf=0,54, гексаны/EtОАс=70:30). Твердые вещества отфильтровывают через слой Celite® и полученный раствор концентрируют при пониженном давлении до 1/5 его объема. Остаток затем добавляют в колбу, содержащую 500 мл охлажденной льдом дистиллированной воды, получая твердый осадок, который отфильтровывают и очищают с помощью флэш-хроматографии (гексаны/EtOAc=70:30), получая желательный енон (5,6 г, выход 76%), аналитические данные которого полностью согласуются с описанными данными (Tohma M. и др., Chem. Pharm. Bull. 1986, 34(7), 2890-2899).
(е) Метил-1β-диметилфенилсилил-7α,12α-диацетокси-3-оксо-5β-холан-24-оат

Металлический литий (418 мг, 59,7 ммоль) суспендируют в ТГФ (20 мл), охлаждают до температуры 0°C и добавляют фенилдиметилхлорсилан (4,34 мл, 26,3 ммоль). Продолжают перемешивать в течение часа, при температуре 0°C, затем полученный раствор пурпурнокрасного цвета переносят через канюлю в суспензию CuI (2,5 г, 13,1 ммоль) в ТГФ (20 мл), предварительно охлажденную до температуры -30°C. Спустя 30 минут, по каплям добавляют раствор метил-7α,12α-диацетокси-3-оксо-5β-хол-1-ен-24-оата со стадии (d) (6 г, 11,9 ммоль) в ТГФ (20 мл). После перемешивания в течение 30 минут при температуре -30°C, реакционную смесь гасят путем добавления 0,1 М HCl и смесь экстрагируют с помощью Et2O. После выпаривания растворителей при пониженном давлении получают маслянистый остаток, который очищают с помощью флэш-хроматографии, получая силилкетон. Твердое вещество белого цвета: температура плавления=162°C; [α]D20=+44,9 (с=1,00, в CHCl3);1H ЯМР (400 МГц, CDCl3): δ 7,47-7,43 (м, 2H), 7,36-7,32 (м, 3H), 5,12 (кт, J=2,7 Гц, 1H), 4,93 (дд, J=5,6, 3,4 Гц, 1H), 3,65 (c, 3H), 2,99 (дд, J=15,6, 12,7 Гц, 1H), 2,44 (дд, J=14,8, 7,5 Гц, 1H), 2,34 (ддд, J=15,3, 10,0, 5,2 Гц, 1H), 2,32-2,15 (м, 3H), 2,10 (c, 3H), 2,05 (c, 3H), 2,00-1,75 (м, 6H), 1,75-1,60 (м, 3H), 1,60-1,47 (м, 3H), 1,44-1,24 (м, 4H), 1,15-1,04 (м, 1H), 0,99 (c, 3H), 0,81 (д, J=6,4 Гц, 3H), 0,71 (c, 3H), 0,38 (c, 3H), 0,33 (c, 3H);13С-ЯМР (101 МГц, CDCl3): δ 212,2, 174,4, 170,5, 170,1, 139,3, 133,8, 133,8, 129,0, 127,9, 127,9, 75,2, 70,3, 51,5, 47,3, 45,0, 44,5, 43,5, 40,3, 38,4, 38,2, 37,5, 34,6, 32,3, 30,9, 30,7, 30,7, 30,5, 27,2, 25,8, 22,7, 22,1, 21,5, 21,3, 17,5, 12,2, -0,3, -0,4; IR (пленка): ν=2949, 2870, 1734, 1435, 1425, 1376, 1240, 1110, 1024 см-1; HRMS (ES+): m/z: рассчитано для С37Н54О7NaSi (M+ + Na): 661,3531, найдено: 661,3525.
(f) Метил-1β,3α-дигидрокси-7α,12α-диацетокси-5β-холан-24-оат

К раствору силилкетона со стадии (е) (2,5 г, 3,91 ммоль) в смеси надуксусной кислоты (20 мл, 40%-й раствор в уксусной кислоте) и уксусной кислоты (10 мл), добавляют Hg(OAc)2 (1,5 г, 4,70 ммоль). Смесь перемешивают при комнатной температуре в течение 6 часов, охлаждают до температуры 0°C и осторожно гасят путем медленного добавления 40%-ого водного раствора NaHSО3. Реакционную смесь концентрируют при пониженном давлении, разбавляют AcOEt и промывают с помощью раствора NаHCO3 и насыщенного солевого раствора. Растворители выпаривают при пониженном давлении, получая сырой промежуточный гидроксикетон, в виде основного продукта (Rf=0,29, гексаны/EtОАс=4:3), который без очистки вводят во взаимодействие на следующей стадии.
Сырой продукт растворяют в смеси CH2Cl2/ТГФ (1:2, 45 мл) и добавляют к ранее полученному раствору Na(OAc)3BH, при температуре 0°C, полученному путем добавления NaBH4 (296 мг, 7,8 ммоль) к смеси уксусная кислота/ТГФ (1:1, 10 мл). После перемешивания при температуре 0°C в течение 30 минут, наблюдают полную конверсию исходного вещества в основной продукт (Rf=0,25, EtОАс=100%), без какого-либо детектируемого количества соответствующего 3β-эпимера (Rf=0,48, EtОАс=100%). Растворители выпаривают при пониженном давлении и остаток растворяют в АсOEt и промывают насыщенным солевым раствором. Растворители выпаривают при пониженном давлении и остаток очищают с помощью флэш-хроматографии (EtOAc/изопропанол=10:1), получая чистый диол (860 мг, выход 42%), аналитические и спектроскопические данные которого полностью согласуются с описанными данными (Tohma M. и др., Chem. Pharm. Bull. 1986, 34(7), 2890-2899).
(g) Метил-1β,3α,7α,12α-тетрагидрокси-5β-холан-24-оат
Селективный гидролиз ацетатных групп при использовании безводного основания (такого как метоксид натрия в метаноле) приводит к получению сложного тетрагидроксиметилового эфира. Идентичность соединения подтверждают через метилирование соответствующей свободной кислоты, 1β,3α,7α,12α-тетрагидрокси-5β-холан-24-овой кислоты. Свободную кислоту (7 мг, 0,016 ммоль) добавляют к смеси МеОН (1 мл), содержащей ацетилхлорид (1 мкл, 0,19 ммоль). Смесь перемешивают в течение 4 часов при комнатной температуре, растворители выпаривают, получая желательный сложный метиловый эфир (5 мг, 69%).1H ЯМР (300 МГц, CD3OD): δ 3,93 (кт, J=2,8, 1H), 3,90-3,82 (м, 2H), 3,80 (дд, J=5,0, 2,3 Гц, 1H), 3,65 (c, 3H), 2,45-2,28 (м, 4H), 2,01 (дд, J=12,0, 4,8 Гц, 1H), 1,92-1,48 (м, 12H), 1,47-1,24 (м,7H), 1,19-1,02 (м, 2H), 1,01 (c, 3H), 1,00 (д, J=6,2 Гц, 3H), 0,72 (c, 3H).
Пример 2: Синтез изопропил-1β,3α,7α,12α-тетрагидрокси-5β-холан-24-оата
(а) Метил-3α,7α,12α-триацетокси-5β-холан-24-оат
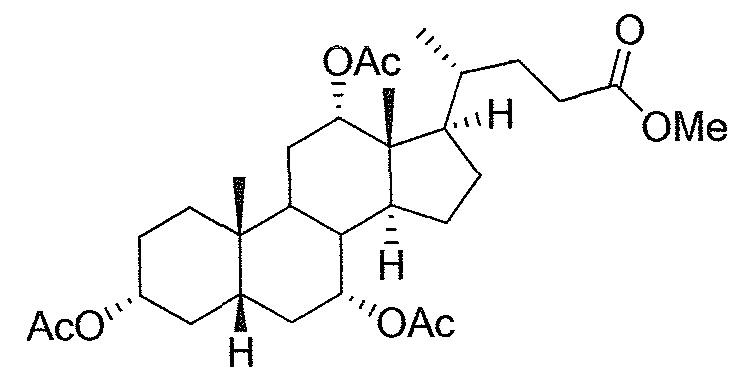
Холевую кислоту (50 г, 0,12 моль) превращают в соответствующий сложный метиловый эфир, как показано в примере 1(а). К раствору полученного сложного метилового эфира (30 г, 71 ммоль), в смеси уксусного ангидрида и пиридина (50 %об., 156 мл), добавляют DMAP (860 мг, 7,1 ммоль). Реакционную смесь перемешивают в течение 1 часа при комнатной температуре, охлаждают до температуры 0°C, гасят путем добавления, по каплям, МеОН (60 мл) и концентрируют почти досуха. Остаток растворяют в EtOAc и промывают с помощью 1 М HCl и водного раствора NaHCO3. Органическую фазу концентрируют при пониженном давлении, получая соответствующий триацетоксистерин (39 г, 100%), аналитические свойства которого идентичны, как описано в литературе (Opsenica D. и др., J. Med. Chem. 2000, 43, 3274-3282).
(b) Изопропил-3α-гидрокси,7α,12α-диацетокси-5β-холан-24-оат
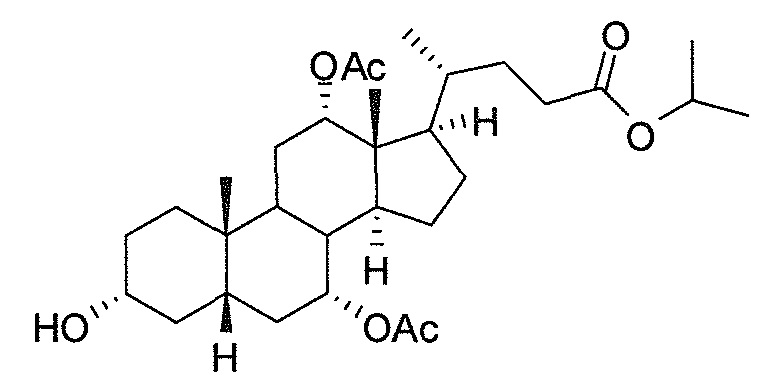
К раствору стерина со стадии (а) (29,5 г, 54 ммоль) в изопропаноле (150 мл) добавляют предварительно приготовленный раствор изопропоксида натрия, получаемый путем растворения тонкоизмельченного натрия (2,5 г, 108 ммоль) в изопропаноле (240 мл). Смесь перемешивают при комнатной температуре в течение 20 минут и затем гасят путем добавления насыщенного водного раствора KHSO4. Растворитель удаляют при пониженном давлении, получая сырой продукт, который повторно растворяют в EtOAc и промывают насыщенным солевым раствором. Выпаривание растворителя и растирание сырого остатка в диизопропиловом эфире приводит к соответствующему спирту (28,7 г, выход 100%).1H ЯМР (400 МГц, CDCl3): δ 5,09-5,07 (м, 1H), 4,99 (септ., J=6,3 Гц, 1H), 4,90 (дд, J=5,5, 2,9 Гц, 1H), 3,54-3,45 (м, 1H), 2,29 (ддд, J=15,6, 10,3, 5,1 Гц, 1H), 2,18 (дд, J=9,4, 6,9 Гц, 1H), 2,12 (c, 3H), 2,08 (c, 3H), 2,07-1,81 (м, 7H), 1,81-1,49 (м, 8H), 1,49-1,24 (м, 6H), 1,22 (д, J=6,3 Гц, 6H), 1,17-0,95 (м, 2H), 0,90 (c, 3H), 0,81 (д, J=6,8 Гц, 3H), 0,72 (c, 3H).
(с) Изопропил-3-оксо,7α,12α-диацетокси-5β-холан-24-оат
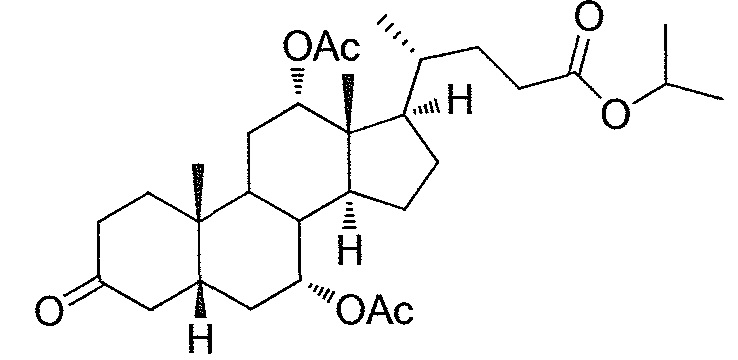
К раствору спирта со стадии (b) (28,7 г, 54 ммоль) в уксусной кислоте (550 мл), по каплям, добавляют 5%-ый водный раствор NaClO (218 мл, 268 ммоль). Реакционную смесь перемешивают в течение часа при комнатной температуре, гасят с помощью насыщенного водного раствора NaHSO3 и растворитель концентрируют при пониженном давлении. Остаток растворяют в EtOAc и промывают водным раствором NaHCO3 и насыщенным солевым раствором. Растворитель выпаривают при пониженном давлении, получая твердый остаток, который очищают с помощью флэш-хроматографии (гексаны/EtOAc=4:3), получая желательный кетон (21,6 г, выход 76%).1H ЯМР (400 МГц, CDCl3): δ 5,11 (кт, J=2,7 Гц, 1H), 5,04-4,95 (м, 2H), 2,98 (дд, J=15,6, 13,9 Гц, 1H), 2,29 (ддд, J=15,6, 6,9, 5,3 Гц, 1H), 2,23-2,07 (м, 6H), 2,11 (c, 3H), 2,06 (c, 3H), 1,99-1,74 (м, 5H), 1,74-1,57 (м, 4H), 1,49-1,24 (м, 6H), 1,22 (д, J=6,3 Гц, 6H), 1,19-1,07 (м, 1H), 1,01 (c, 3H), 0,82 (д, J=6,5 Гц, 3H), 0,76 (c, 3H).
(d) Изопропил-7α,12α-диацетокси-2β,4β-дибром-3-оксо-5β-холан-24-оат
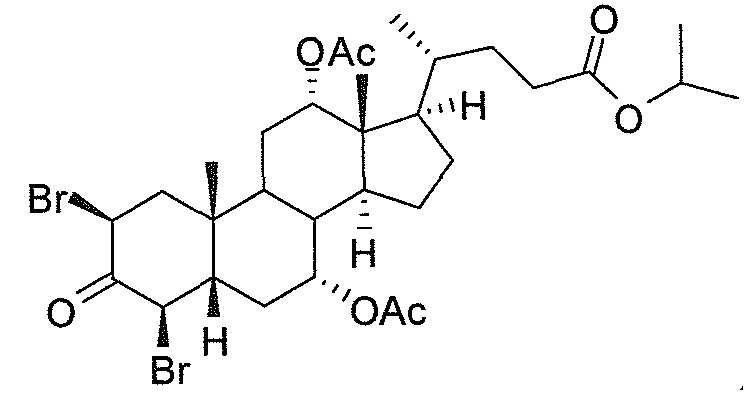
Кетон со стадии (с) (10 г, 18,8 ммоль) растворяют в уксусной кислоте (120 мл). По каплям добавляют раствор Br2 (1,93 мл, 37,5 ммоль) в уксусной кислоте (100 мл). После перемешивания в течение 1 часа при комнатной температуре, смесь выливают в воду. Твердое осажденное вещество отфильтровывают, высушивают и растирают в диизопропиловом эфире, получая 2,4-дибром-производное (9,2 г, 71%).1H ЯМР (400 МГц, CDCl3): δ 5,35 (д, J=11,9 Гц, 1H), 5,18 (кт, J=2,7 Гц, 1H), 5,06 (дд, J=6,0, 3,1 Гц, 1H), 4,99 (септ., J=6,3 Гц, 1H), 4,65 (дд, J=14,2, 4,9 Гц, 1H), 2,62 (дд, J=14,2, 5,5 Гц, 1H), 2,54 (дкт, J=15,7, 2,0 Гц, 1H), 2,30 (ддд, J=14,9, 9,4, 5,6 Гц, 1H), 2,21-2,10 (м, 2H), 2,13 (c, 3H), 2,12 (c, 3H), 2,04-1,81 (м, 4H), 1,80-1,62 (м, 6H), 1,50-1,24 (м, 4H), 1,21 (д, J =1,12 (м, 1H), 1,01 (c, 3H), 0,82 (д, J=6,4 Гц, 3H), 0,76 (c, 3H).
(е) Изопропил-7α,12α-диацетокси-4β-дибром-3-оксо-5β-хол-1-ен-24-оат
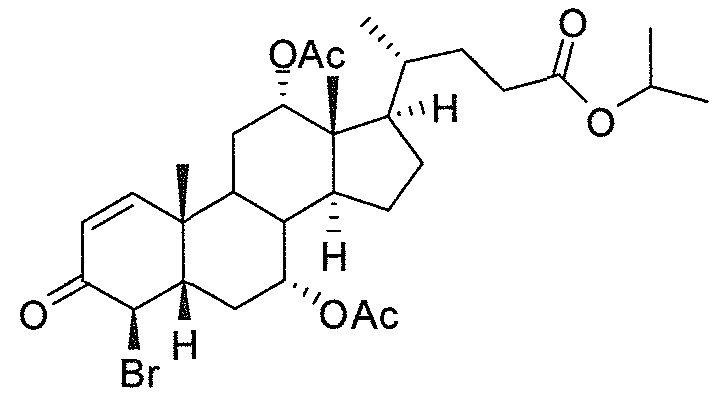
К раствору дибромкетона со стадии (d) (9,2 г, 13,3 ммоль) в ДМФА (60 мл) добавляют Li2CO3 (1,6 г, 20 ммоль) и LiBr (1,7 г, 20 ммоль). После перемешивания при температуре 80°C в атмосфере азота в течение 8 часов, смесь выливают в воду и твердый осадок отфильтровывают, высушивают и растирают в диизопропиловом эфире, получая желательный енон (6,8 г, 84%).1H ЯМР (400 МГц, CDCl3): δ 6,77 (д, J=10,3 Гц, 1H), 6,05 (д, J=10,3 Гц, 1H), 5,34 (д, J=13,4 Гц, 1H), 5,09-5,06 (м, 2H), 4,99 (септ., J=6,2 Гц, 1H), 2,62 (дкт, J=16,0, 2,0 Гц, 1H), 2,29 (ддд, J=15,3, 9,6, 5,7 Гц, 1H), 2,24-2,10 (м, 2H), 2,13 (c, 3H), 2,08 (c, 3H), 2,06-1,95 (м, 1H), 1,94-1,74 (м, 6H), 1,73-1,62 (м, 2H), 1,52-1,29 (м, 4H), 1,26 (c, 3H), 1,22 (д, J=6,1 Гц, 6H), 1,18-1,11 (м, 1H), 0,80 (д, J=6,5 Гц, 3H), 0,78 (c, 3H).
(f) Изопропил-1-эпокси-7α,12α-диацетокси-4β-бром-5β-холан-24-оат
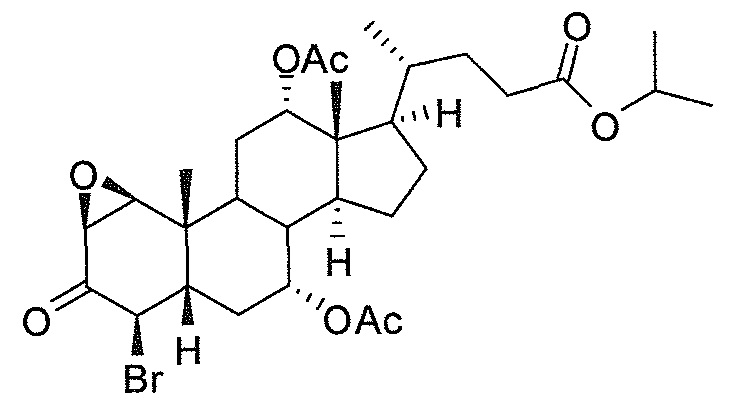
К раствору бром-енона со стадии (е) (6,8 г, 11,2 ммоль) в этаноле (450 мл), содержащему DBU (1,83 мл, 12,3 ммоль), в виде трех порций, в течение периода времени 5 часов, добавляют комплекс мочевина-Н2О2 (2,6 г, 27,6 ммоль), при перемешивании и при комнатной температуре. Смесь гасят с помощью водного раствора NaHSO3 и водного раствора KHSO4 и растворители концентрируют при пониженном давлении. Остаток растворяют в EtOAc и промывают с помощью 1 М HCl и насыщенного солевого раствора. Растворитель выпаривают при пониженном давлении и очищают сырой продукт с помощью флэш-хроматографии (гексаны/EtOAc=4:2), получая желательный эпоксид (4,2 г, 60%).1H ЯМР (400 МГц, CDCl3): δ 5,09 (кт, J=2,9 Гц, 1H), 5,06-5,04 (м, 1H), 4,99 (септ., J=6,4 Гц, 1H), 4,74 (д, J=11,1 Гц, 1H), 3,50 (д, J=3,6 Гц, 1H), 3,42 (д, J=3,6 Гц, 1H), 2,45-2,25 (м, 3H), 2,18 (дд, J=9,2, 6,9 Гц, 1H), 2,11 (c, 3H), 2,10 (c, 3H), 1,94-1,61 (м, 8H), 1,49-1,35 (м, 3H), 1,34 (c, 3H), 1,32-1-24 (м, 3H), 1,22 (д, J=6,4 Гц, 6H), 0,80 (д, J=6,5 Гц, 3H), 0,76 (c, 3H).
(g) Изопропил-1β-гидрокси-2α,4β-дибром-7α,12α-диацетокси-3-оксо-5β-холан-24-оат
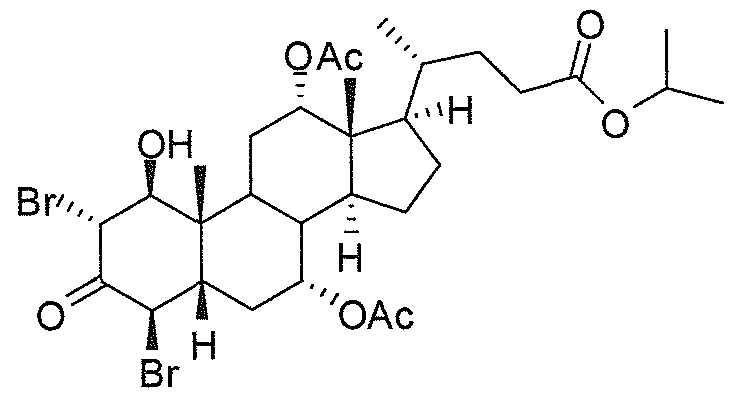
К раствору эпоксида со стадии (f) (300 мг, 0,48 ммоль) в уксусной кислоте (7 мл) добавляют LiBr (104 мг, 1,2 ммоль). После перемешивания при комнатной температуре в течение 30 минут, реакционную смесь выливают в воду и осадок белого цвета отфильтровывают и высушивают, получая соответствующий гидроксикетон (283 мг, 86%).1H ЯМР (400 МГц, CDCl3): δ 5,68 (д, J=13,3 Гц, 1H), 5,10 (кт, J=2,8 Гц, 1H), 5,05 (дд, J=5,6, 2,7 Гц, 1H), 4,99 (септ., J=6,0 Гц, 1H), 4,48 (д, J=4,6 Гц, 1H), 4,13 (кт, J=4,5 Гц, 1H), 2,72 (тд, J=11,7, 3,9 Гц, 1H), 2,61 (дкт, J=15,6, 2,6 Гц, 1H), 2,45 (д, J=4,0 Гц, 1H), 2,38 (ддд, J=12,8, 5,2, 2,2 Гц, 1H), 2,29 (ддд, J=15,2, 9,6, 5,2 Гц, 1H), 2,18 (дд, J=9,2, 7,0 Гц, 1H), 2,16-2,09 (м, 2H), 2,15 (c, 3H), 2,03 (c, 3H), 1,95-1,66 (м, 6H), 1,51-1,25 (м, 4H), 1,22 (c, 3H), 1,22 (д, J=6,4 Гц, 6H), 1,15 (м, 1H), 0,80 (д, J=6,5 Гц, 3H), 0,78 (c, 3H).
(h) Изопропил-1β,3α-дигидрокси-2α,4β-дибром-7α,12α-диацетокси-5β-холан-24-оат
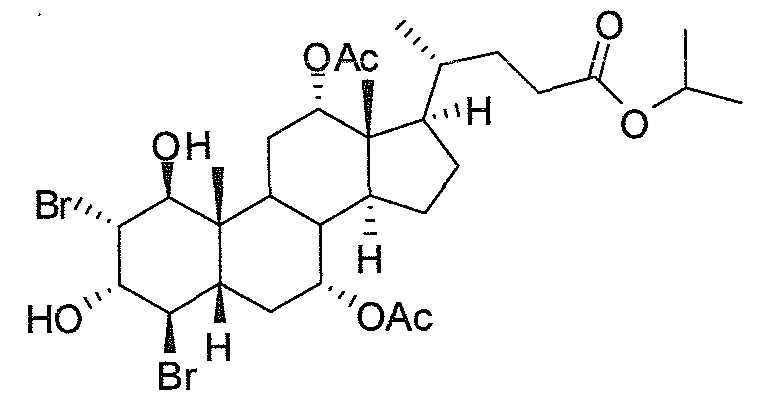
К раствору эпоксида со стадии (f) (420 мг, 0,67 ммоль) в уксусной кислоте (10 мл) добавляют LiBr (117 мг, 1,3 ммоль). К реакционной смеси добавляют предварительно приготовленный раствор триацетоксиборгидрида натрия в уксусной кислоте (получаемый путем добавления 30,5 мг NaBH4 к 2 мл уксусной кислоты, при температуре 0°C). После перемешивания при комнатной температуре в течение 30 минут, растворитель выпаривают и остаток растворяют в EtOAc и промывают насыщенным солевым раствором. Растворитель выпаривают и растирают сырой продукт в диизопропиловом эфире, получая дибромдиольное производное (402 мг, 85%).1H ЯМР (400 МГц, CDCl3): δ 5,04 (кт, J=2,4 Гц, 1H), 4,98 (септ., J=6,5 Гц, 1H), 5,00-4,95 (м, 1H), 4,84 (кт, J=11,1 Гц, 1H), 4,56 (дд, J=4,2, 3,1 Гц, 1H), 4,19 (шир., 1H), 4,06 (дкт, J=10,4, 4,4 Гц, 1H), 2,79 (д, J=4,5, 1H), 2,29 (ддд, J=15,2, 9,9, 5,5 Гц, 1H), 2,20-2,05 (м, 3H), 2,15 (c, 3H), 2,02 (c, 3H), 1,95-1,82 (м, 2H), 1,81-1,62 (м, 5H), 1,53-1,25 (м, 5H), 1,21 (д, J=6,3 Гц, 6H), 1,16-1,12 (м, 1H) 1,14 (c, 3H), 0,79 (д, J=6,5 Гц, 3H), 0,75 (c, 3H).
(i) Изопропил-1β-гидрокси-7α,12α-диацетокси-3-кето-5β-холан-24-оат
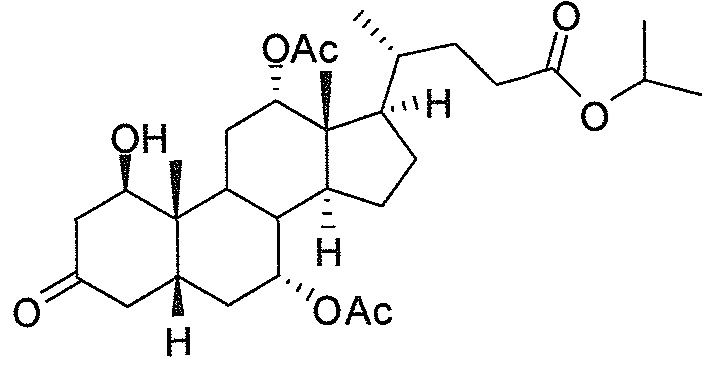
Дибромкетон со стадии (g) (100 мг, 0,14 ммоль) растворяют в ТГФ (5 мл) и гидрируют, при температуре и давлении окружающей среды, при использовании 5%-ого Pd/C (15,0 мг), в присутствии ацетата натрия (38 мг, 0,425 ммоль), в течение 5 часов. Катализатор отфильтровывают через слой Celite® и растворитель выпаривают при пониженном давлении, остаток очищают с помощью флэш-хроматографии (гексаны/EtOAc=40:60), получая гидроксикетон (35 мг, 45%).1H ЯМР (400 МГц, CDCl3): δ 5,11 (кт, J=2,4 Гц, 1H), 5,03-5,00 (м, 1H), 4,99 (септ., J=6,3 Гц, 1H), 4,09-4,04 (м, 1H), 2,98 (дд, J=15,5, 13,0, 1H), 2,54 (дд, J=14,8, 2,0 Гц, 1H), 2,39-2,29 (м, 3H), 2,22-2,04 (м, 2H), 2,11 (c, 3H), 2,07 (c, 3H), 1,94-1,64 (м, 10H), 1,48-1,24 (м, 6H), 1,22 (д, J=6,3 Гц, 6H), 1,14 (c, 3H), 0,82 (д, J=6,5 Гц, 3H), 0,77 (c, 3H).
(j) Изопропил-1β,3α-дигидрокси-7α,12α-диацетокси-5β-холан-24-оат
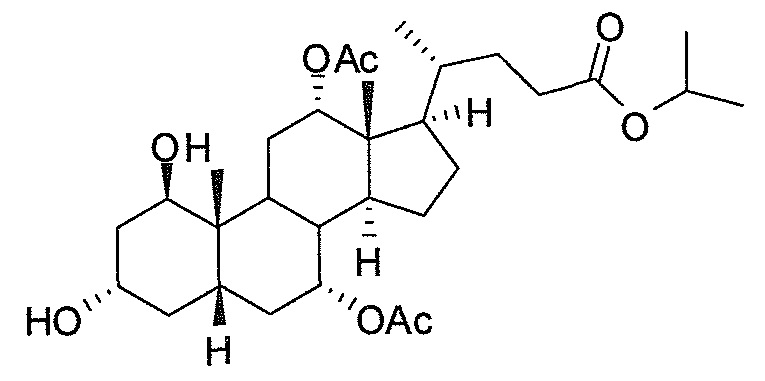
Дибромдиол со стадии (h) (50 мг, 0,71 ммоль) в этаноле (30 мл), содержащем NaOAc (11,5 мг, 0,14 ммоль) и уксусную кислоту (30 мкл), гидрируют при использовании никеля Ренея (8 мг), при давлении 180 атм. и при комнатной температуре, в течение 72 часов. Отфильтровывание катализатора через слой Celite®, выпаривание растворителей при пониженном давлении и очистка сырого продукта путем флэш-хроматографии на силикагеле (AcOEt=100%) приводят к желательному диолу (18 мг, 46%).1H ЯМР (400 МГц, CDCl3): δ 5,06 (кт, J=2,5 Гц, 1H), 4,99 (септ., J=6,3 Гц, 1H), 4,92-4,89 (м, 1H), 4,06-3,98 (м, 1H), 3,88-3,85 (м, 1H) 2,29 (ддд, J=15,5, 9,6, 5,6, 1H), 2,18 (дд, J=9,5, 6,8 Гц, 1H), 2,13 (c, 3H), 2,09 (c, 3H), 1,96-1,73 (м, 8H), 1,73-1,36 (м, 13H), 1,22 (д, J=6,3 Гц, 6H), 1,17-1,07 (м, 1H), 1,03 (c, 3H), 0,80 (д, J=6,5 Гц, 3H), 0,77 (c, 3H).
По аналогии с Примером 1(g), селективный гидролиз ацетатных групп при использовании безводного основания (такого как изопропоксид натрия в изопропаноле) приводит к получению сложного тетрагидроксиизопропилового эфира.
Пример 3: Синтез изопропил-1β,3α-дигидрокси-2α-бром-7α,12α-диацетокси-5β-холан-24-оата
(а) Изопропил-1-эпокси-7α,12α-диацетокси-5β-холан-24-оат
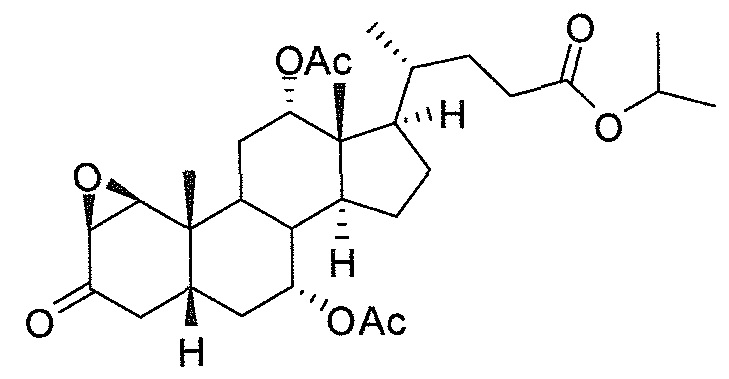
Бромид, полученный в Примере 2(f) (200 мг, 0,32 ммоль), в ТГФ (5 мл), содержащем NaOAc (52 мг, 0,64 ммоль), гидрируют при использовании никеля Ренея (20 мг), при температуре и давлении окружающей среды, в течение 30 минут. Катализатор отфильтровывают через слой Celite®, растворитель выпаривают при пониженном давлении и остаток растворяют в EtOAc и промывают насыщенным солевым раствором. Органические экстракты выпаривают при пониженном давлении и сырой остаток растирают в диизопропиловом эфире, получая эпоксикетон (141 мг, 81%).1H ЯМР (400 МГц, CDCl3): δ 5,10-5,08 (шир., 1H), 5,03-4,96 (м, 2H), 3,34 (д, J=3,8 Гц, 1H), 3,27 (д, J=3,8 Гц, 1H), 2,70 (дд, J=19,3, 11,9 Гц, 1H), 2,34-2,25 (м, 2H), 2,20-2,06 (м, 2H), 2,11 (c, 3H), 2,07 (c, 3H), 1,92-1,73 (м, 7H), 1,71-1,60 (м, 4H), 1,47-1,34 (м, 2H), 1,29 (c, 3H), 1,21 (д, J=6,3 Гц, 6H), 1,34-1,25 (м, 2H), 0,81 (д, J=6,5 Гц, 3H), 0,76 (c, 3H).
(b) Изопропил-1β-гидрокси-2α-бром-7α,12α-диацетокси-3-оксо-5β-холан-24-оат
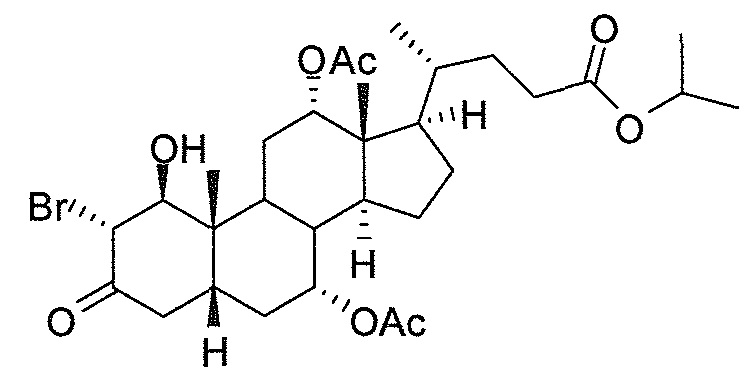
К раствору эпоксикетона, полученного на стадии (а), (30 мг, 0,05 ммоль) в уксусной кислоте (0,7 мл) добавляют LiBr (9,53 мг, 0,1 ммоль). После перемешивания при комнатной температуре в течение 30 минут, реакционную смесь выливают в воду и добавляют NaHCO3 для достижения нейтрального значения рН. Смесь затем экстрагируют с помощью EtOAc и растворители удаляют при пониженном давлении, получая гидроксикетон (33 мг, 96%).1H ЯМР (400 МГц, CDCl3): δ 5,13-5,10 (шир., 1H), 5,03-4,93 (м, 2H), 4,54 (д, J=8,1 Гц, 1H), 3,82 (дд, J=7,7 Гц, 1H), 3,20 (дд, J=16,4, 13,5 Гц, 1H), 2,38-2,12 (м, 7H), 2,10 (c, 3H), 2,09 (c, 3H), 1,96-1,61 (м, 8H), 1,41-1,23 (м, 5H), 1,22 (д, J=6,2 Гц, 6H), 1,15 (c, 3H), 0,80 (д, J=6,5 Гц, 3H), 0,78 (c, 3H).
(с) Изопропил-1β,3α-дигидрокси-2α-бром-7α,12α-диацетокси-5β-холан-24-оат

К раствору эпоксикетона, полученного на стадии (а), (50 мг, 0,091 ммоль) в уксусной кислоте (1 мл) добавляют LiBr (16 мг, 0,18 ммоль). К реакционной смеси добавляют предварительно приготовленный раствор триацетоксиборгидрида натрия в уксусной кислоте (получаемый путем добавления 4,1 мг NaBH4 к 0,5 мл уксусной кислоты, при температуре 0°C). После перемешивания при комнатной температуре в течение 30 минут, реакционную смесь концентрируют при пониженном давлении и остаток растворяют в EtOAc и промывают насыщенным солевым раствором, растворитель выпаривают при пониженном давлении, получая продукт (43 мг, 75%).1H ЯМР (400 МГц, CDCl3): δ 5,05 (кт, J=2,6 Гц, 1H), 4,99 (септ., J=6,2 Гц, 1H), 4,94-4,87 (м, 1H), 4,53-4,49 (м, 1H), 4,15-4,09 (м, 1H), 3,94-3,85 (м, 1H), 2,34-2,10 (м, 6H), 2,10 (c, 3H), 2,04 (c, 3H), 1,94-1,54 (м, 10H), 1,54-1,24 (м, 5H), 1,22 (д, J=6,2 Гц, 6H), 1,16-1,07 (м, 1H), 1,05 (c, 3H), 0,80 (д, J=6,4 Гц, 3H), 0,74 (c, 3H).
Последующее восстановление приводит к получению соответствующего диольного соединения, которое может быть превращено в сложный тетрагидроксиэфир или свободную кислоту путем частичного или полного гидролиза, соответственно.
Пример 4: Синтез 1β,3α,7α,12α-тетрагидрокси-5β-холан-24-овой кислоты

Диол, полученный на стадии 1(f), (1,5 г, 2,87 ммоль) добавляют к смеси МеОН/Н2О (3:2, 50 мл), содержащей NaOH (1,5 г, 28,7 ммоль). Смесь нагревают при температуре 120°C и спустя 13 часов ТСХ показывает наличие одного, соответствующего более полярному продукту, продукта (одно пятно) (Rf=0,48, CHCl3/MeOH/CH3COOH=5:1:0,5). Реакционную смесь оставляют охлаждаться до комнатной температуры и избыток основания нейтрализуют путем добавления катионообменной смолы DOWEX® 50WX2, 50-100, вплоть до достижения нейтрального/слегка кислого значения рН. Смолу отфильтровывают, промывают смесью Н2О/МеОН (50:50) и растворитель удаляют при пониженном давлении, получая желательную свободную тетраол-кислоту (1,1 г, 90%). Твердое вещество белого цвета: температура плавления=288-290°C; литературные данные (Tohma M. и др., Chem. Pharm. Bull. 1986, 34(7), 2890-2899)=288-290°C. [α]D20=+19,6 (с=0,33, в МеОН).1H ЯМР (400 МГц, d6-ДМСО): δ 3,76 (кт, J=2,8 Гц, 1H), 3,72-3,62 (м, 1H), 3,62-3,57 (м, 2H), 2,30-2,16 (м, 2H), 2,14-2,04 (м, 2H), 2,01-1,92 (м, 1H), 1,81-1,57 (м, 7H), 1,49-1,11 (м, 9H), 1,01-0,92 (м, 1H), 0,91 (д, J=6,4 Гц, 3H), 0,86 (c, 3H), 0,58 (с, 3H);13С-ЯМР (101 МГц, d6-ДМСО): δ 175,0, 71,4, 70,9, 66,1, 64,7, 46,1, 45,5, 41,3, 39,9, 39,2, 38,7, 37,6, 35,2, 35,1, 34,6, 31,0, 30,9, 28,6, 27,7, 27,2, 22,9, 17,3, 16,9, 12,4; IR (пленка): ν=3370, 2922, 2858, 2359, 2342, 1705, 1377, 1184, 1027, 1033 см-1; HRMS (ES+): m/z: рассчитано для С24Н39О6 (M- - Н): 423,2752, найдено: 423,2734.
Альтернативно, сложный диол-диацетат-изопропиловый эфир, полученный на стадии 2(j), (20 мг, 0,036 ммоль) может быть гидролизован при тех же самых условиях, описанных выше для получения свободной тетраол-кислоты, (13 мг, выход 84%), чьи аналитические данные идентичны данным соединения, полученного выше.
Пример 5: Синтез метил-3α-гидрокси-7α,12α-диацетокси-5β-хол-1-ен-24-оата
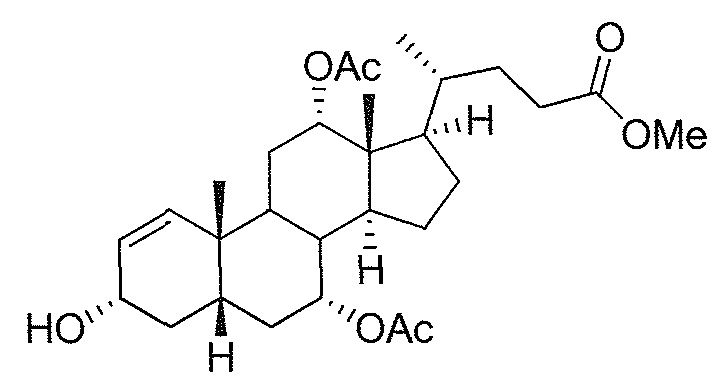
Суспензию из енона Примера 1(d) (250 мг, 0,49 ммоль) и CeCl3 (278 мг, 0,75 ммоль) в МеОН (8 мл) охлаждают до температуры -78°C и добавляют NaBH4 (28 мг, 0,75 ммоль). После перемешивания при температуре -78°C в течение 30 минут, реакционную смесь гасят ацетоном (0,5 мл) и растворитель выпаривают при пониженном давлении. Остаток разбавляют с помощью EtOAc и промывают насыщенным солевым раствором. Органическую фазу концентрируют при пониженном давлении, получая сырой продукт, который растирают в диизопропиловом эфире, получая желательный аллиловый спирт (244 мг, 97%).1H ЯМР (400 МГц, CDCl3): δ 5,55 (c, 2H), 5,06 (кт, J=2,8, 1H), 4,91 (дд, J=5,9, 3,1 Гц, 1H), 4,26-4,18 (м, 1H), 3,65 (c, 3H), 2,34 (ддд, J=15,9, 10,6, 5,1 Гц, 1H), 2,22 (дд, J=9,6, 6,9 Гц, 1H), 2,10 (c, 3H), 2,08 (c, 3H), 2,01-1,54 (м, 11H), 1,53-1,22 (м, 6H), 1,15-1,03 (м, 1H), 1,00 (c, 3H), 0,79 (д, J=6,3 Гц, 3H), 0,73 (c, 3H).
Пример 6: Синтез метил-1β-эпокси-3α-гидрокси-7α,12α-диацетокси-5β-холан-24-оата и метил-1α-эпокси-3α-гидрокси-7α,12α-диацетокси-5β-холан-24-оата
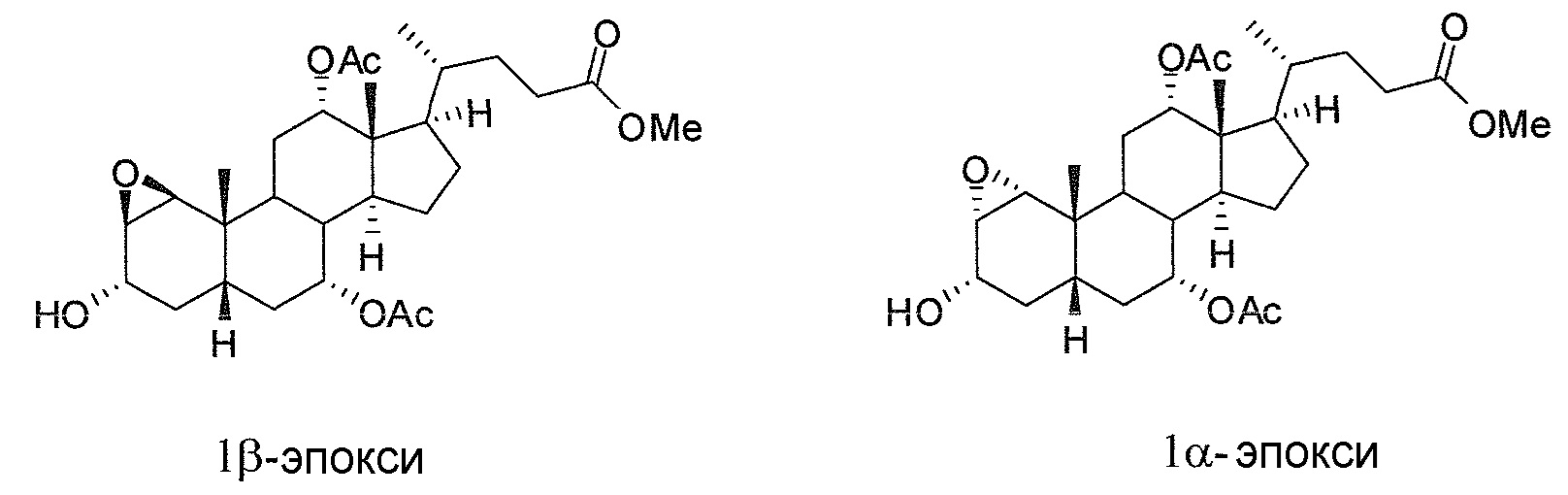
Аллиловый спирт, полученный в примере 4, (100 мг, 0,39 ммоль) растворяют в смеси ТГФ (3 мл) и воды (1 мл) и добавляют NBS (89 мг, 0,39 ммоль). Смесь перемешивают при комнатной температуре в течение времени 24 часа, спустя которое можно наблюдать полную конверсию исходного вещества в два продукта, согласно двум пятнам по ТСХ, соответствующим эпимерной смеси эпоксидов (гексан/EtOAc=3:4, Rf=0,38 и Rf=0,42, соответственно). Смесь гасят с помощью NaHSO3 и экстрагируют с помощью EtOAc. Растворитель выпаривают, получая сырой остаток, который очищают с помощью флэш-хроматографии (гексаны/EtOAc=3:4), получая 1β-эпоксид (31 мг, 30%).1H ЯМР (400 МГц, CDCl3): δ 5,08 (кт, J=2,9, 1H), 4,86 (дд, J=5,8, 2,9 Гц, 1H), 3,88 (дд, J=10,8, 6,3 Гц, 1H), 3,65 (c, 3H), 3,14 (шир.д, J=3,6 Гц, 1H), 3,05 (шир.д, J=3,6 Гц, 1H), 2,34 (ддд, J=15,4, 10,0, 4,7 Гц, 1H), 2,22 (дд, J=9,9, 7,0 Гц, 1H), 2,15 (c, 3H), 2,06 (c, 3H), 1,98-1,54 (м, 12H), 1,53-1,18 (м, 6H), 1,18-1,02 (м, 1H), 1,12 (c, 3H), 0,79 (д, J=6,3 Гц, 3H), 0,75 (c, 3H).
Дальнейшее элюирование приводит к эпимерному 1α-эпоксиду (29 мг, 28%).1H ЯМР (400 МГц, CDCl3): δ 5,09 (кт, J=2,8, 1H), 4,85 (дд, J=6,3, 3,6 Гц, 1H), 3,88 (дд, J=10,8, 6,3 Гц, 1H), 3,66 (c, 3H), 3,32 (шир.д, J=4,1 Гц, 1H), 2,93 (д, J=4,1 Гц, 1H), 2,35 (ддд, J=15,5, 10,3, 5,6 Гц, 1H), 2,21 (дд, J=8,9, 2,6 Гц, 1H), 2,14 (c, 3H), 2,06 (c, 3H), 1,98-1,54 (м, 12H), 1,53-1,18 (м, 7H), 1,07 (c, 3H), 0,82 (д, J=6,3 Гц, 3H), 0,75 (c, 3H).
Пример 7: Синтез 1β,3β,7α,12α-тетрагидрокси-5β-холан-24-овой кислоты
(а) Метил-1β,3β-дигидрокси-7α,12α-диацетокси-5β-холан-24-оат
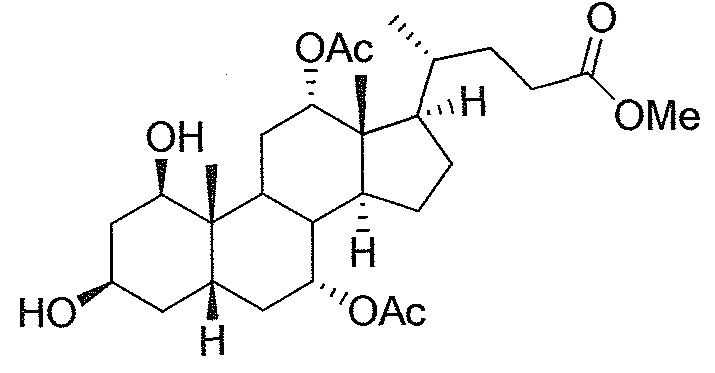
Гидроксикетон, полученный в соответствии с Tohma M. и др., Chem. Pharm. Bull. 1986, 34(7), 2890-2899, (100 мг, 0,19 ммоль) восстанавливают, в присутствии NaBH4 (7,5 мг, 0,19 ммоль), в ТГФ (4 мл), при комнатной температуре. Спустя 10 минут, растворитель выпаривают при пониженном давлении и остаток разбавляют с помощью EtOAc и промывают насыщенным солевым раствором, получая сырой продукт, состоящий из двух продуктов (два пятна по ТСХ), примерно в соотношении 1:1, соответствующих желательному 3β-эпимеру (Rf=0,48, EtOAc=100%) и 3α-эпимеру (Rf=0,25, EtOAc=100%). Очистка с помощью флэш-хроматографии (гексаны/EtOAc=40:60) приводит к желательному 3β-диолу (40 мг, 39,8%).1H ЯМР (400 МГц, CDCI3): δ 5,07 (кт, J=2,8, 1H), 4,94 (дд, J=6,3, 3,6 Гц, 1H), 4,17-4,13 (м, 1H), 3,78-3,74 (м, 1H), 3,66 (c, 3H), 2,40-2,14 (м, 2H), 2,10 (c, 3H), 2,08 (c, 3H), 2,03-1,64 (м, 8H), 1,63-1,54 (м, 6H), 1,53-1,23 (м, 4H), 1,18-1,00 (м, 2H), 1,11 (c, 3H), 0,81 (д, J=6,3 Гц, 3H), 0,75 (c, 3H).
(b) 1β,3β,7α,12α-Тетрагидрокси-5β-холан-24-овая кислота
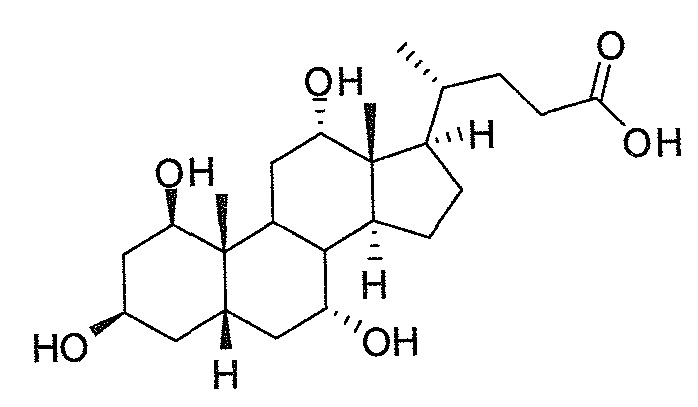
3β-Диол, полученный на стадии (а) (40 мг, 0,077 ммоль) добавляют к смеси МеОН/Н2О (3:2,3 мл), содержащей NaOH (31 мг, 0,77 ммоль). Смесь нагревают при температуре 120°C, спустя 13 часов ее охлаждают до комнатной температуры и избыток основания нейтрализуют путем добавления катионообменной смолы DOWEX®50WX2, 50-100, вплоть до нейтрального или слабокислого значения рН. Смолу отфильтровывают, промывают смесью Н2О/МеОН (50:50) и растворитель удаляют при пониженном давлении, получая желательный 1β,3β-тетраол (27 мг, 83%).1H ЯМР (300 МГц, CD3OD): δ 4,06 (кт, J=2,8, 1H), 3,94 (кт, J=2,4 Гц, 1H), 3,82 (дд, J=6,0, 3,2 Гц, 1H), 3,73-3,70 (м, 1H), 2,64 (кт, J=14,2 Гц, 1H), 2,33 (ддд, J=14,8, 9,9, 4,8 Гц, 1H), 2,20 (дд, J=9,4, 7,0 Гц, 1H), 2,16-1,71 (м, 12H), 1,71-1,22 (м, 6H), 1,19-1,02 (м, 1H), 1,07 (c, 3H), 1,01 (д, J=6,3 Гц, 3H), 0,73 (c, 3H).
Пример 8: Подавление активности ROR-гамма, используя люциферазный тест
1β,3α,7α,12α-Тетрагидрокси-5β-холан-24-оат (в данном контексте также называемый как тетраол или тетраольное соединение) тестировали в отношении его способности ингибировать транскрипционную активность RORγ, используя двойной люциферазный тест (фигура 1), согласно которому активацию промотора матричной металлопротеиназы 3 (ММР3), который представляет собой ген-мишень RORγ, тестировали посредством RORγ в присутствии различных концентраций соединения 1. Преадипоцитные клетки 3T3L1 трансфецировали с помощью гена-репортера вектора экспресси для RORγ, а также нормализации вектора, экспрессирующего люциферазу renilla. После инфекции клетки обрабатывали различными количествами RORγ, изменяющимися от 1 нМ до 25 нМ. Клетки лизировали спустя 24 часа после обработки с помощью тетраола и определяли активность люциферазы светлячков, а также люциферазы renilla. Подавление активности RORγ рассчитывали из соотношния люциферазы светлячков к люциферазе renilla. Анализ тетраола в тесте на активность показывает зависимое от дозы снижение активности ROR-гамма. Это проиллюстрировано на фигуре 2, на которой ясно видно, что относительное ингибирование (RI, ось y) уменьшается с возрастающей концентрацией тетраола (концентрация в нМ, ось х).
Пример 9: Эффективность предотвращения in vivo
Для тестирования in vivo эффективности тетраола, мышей кормили при использовании рациона с высоким содержанием жира (60 калорий, происходящих от жира) в течение 6 недель. Рацион дополняли с помощью 0,1% или 0,01% тетраола (А и В, соответственно, на фигуре 3). Мыши, получающие только рацион с высоким содержанием жира (Е на фигуре 3), и мыши, получающие рацион с высоким содержанием жира, дополненный с помощью 0,1% холевой кислоты (С на фигуре 3) и 0,01% холевой кислоты (D на фигуре 3), соответственно, служили в качестве контроля.
На фигуре 3 ясно видно, что обработка мышей с помощью тетраола приводит к поразительному улучшению чувствительности к инсулину при той и другой концентрации, как определено посредством теста на толерантность к инсулину.
Пример 10: Терапевтическая эффективность in vivo
Для тестирования терапевтической эффективности тетраола, мышей кормили при использовании рациона с высоким содержанием жира (60 калорий, происходящих от жира) в течение 6 недель. Потом резистентных к ожирению/инсулину мышей переводили на рацион, дополненный или 0,01% тетраола или 0,01% холевой кислоты в течение или 6 или 12 недель (0,01% тетраола и 0,01% холевой кислоты (СА), соответственно, на фигурах 4 и 5).
На фигурах 4 и 5 ясно видно, что обработка резистентных к ожирению/инсулину мышей с течением времени приводит к поразительному улучшению чувствительности к инсулину, как определено по циркулирующей глюкозе (фигура 4) и уровням инсулина (фигура 5): gluc=уровни глюкозы в мМ; ins=уровни инсулина в пг/мл.
Реферат
Изобретение относится к способу лечения или предупреждения, подавления или ослабления диабета типа 2 и/или заболеваний, расстройств и состояний, представляющих собой низкую толерантность к глюкозе, резистентность к инсулину и/или гипергликемию, связанные с диабетом типа 2 у субъекта, нуждающегося в этом, включающему введение указанному субъекту терапевтически или профилактически эффективного количества соединения формулы IIIg или его фармацевтически приемлемых солей и/или стереоизомеров, предпочтительно соединений формул IIIiи IIIi:IIIgв которых Rозначает Н, -OR; Rозначает Н или галоген; R, R, независимо друг от друга, означают Н, -OR, где Rпредставляет собой Н; Rозначает Н; L означает С(1-6)алкил с линейной или разветвленной цепью; X означает -COOR; Rозначает H или С(1-6)алкил; m означает от 0 до 5. Технический результат: предложен эффективный способ лечения диабета типа 2 соединениями формулы IIIg. 8 з.п. ф-лы, 5 ил., 10 пр.
Формула
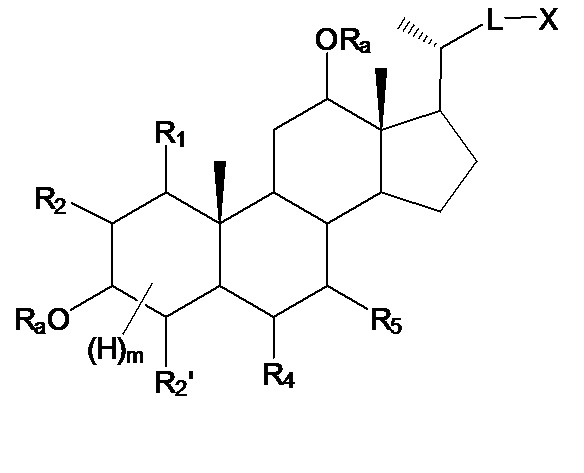
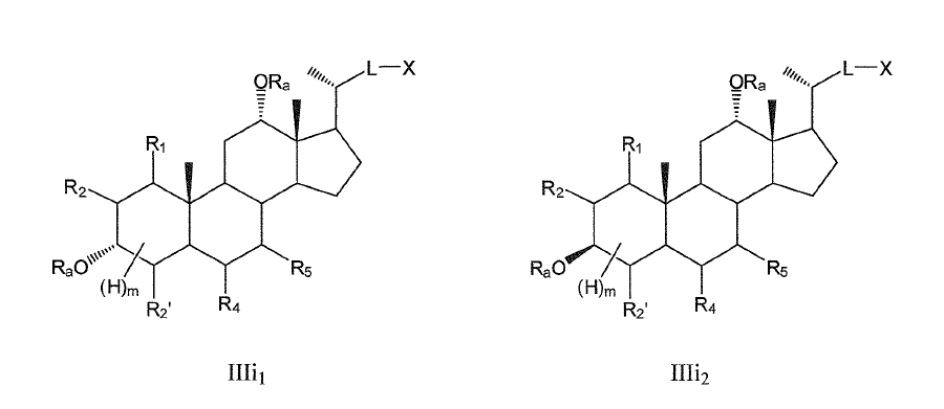
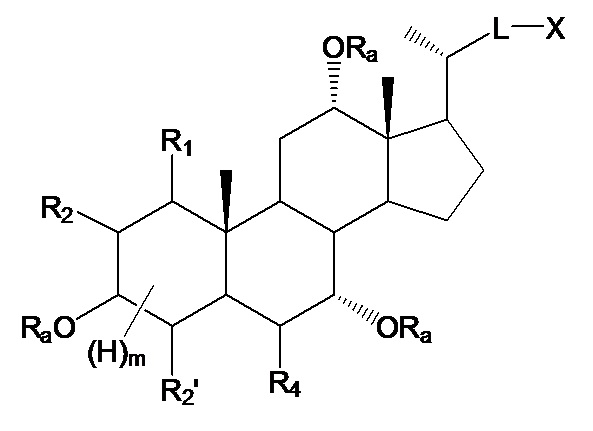
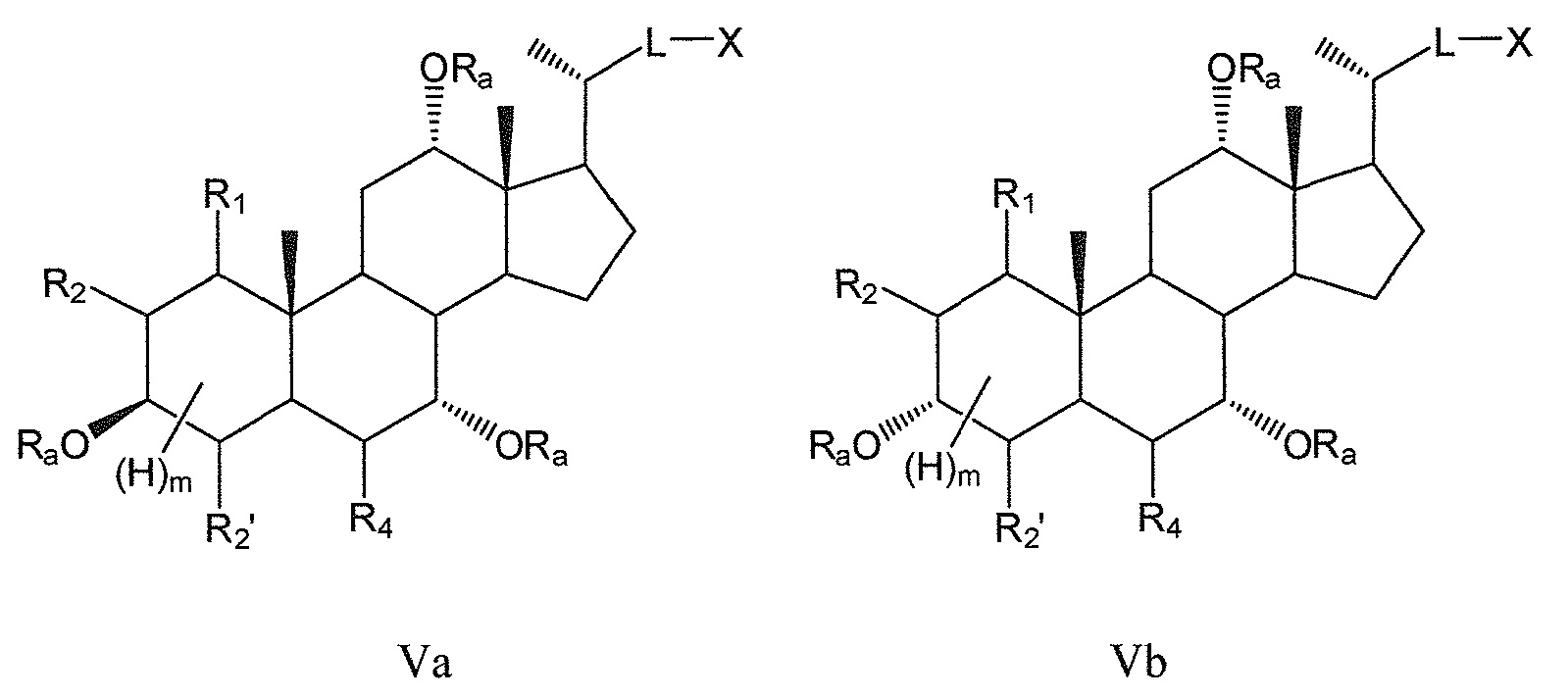
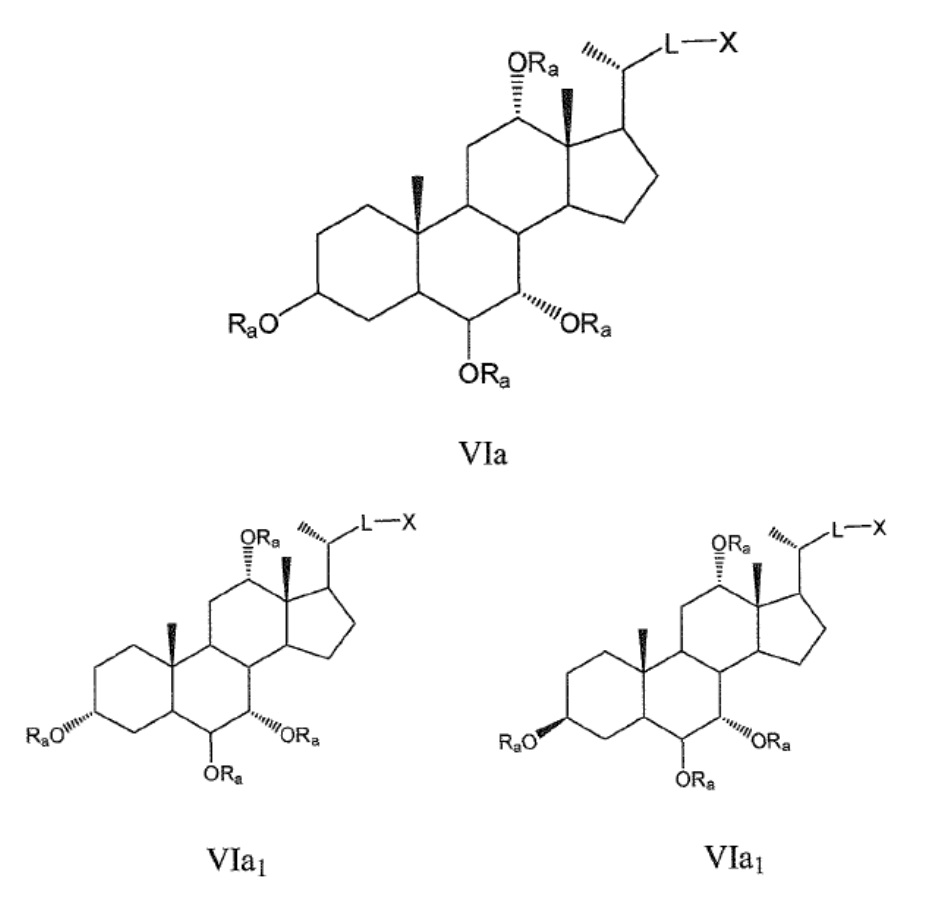
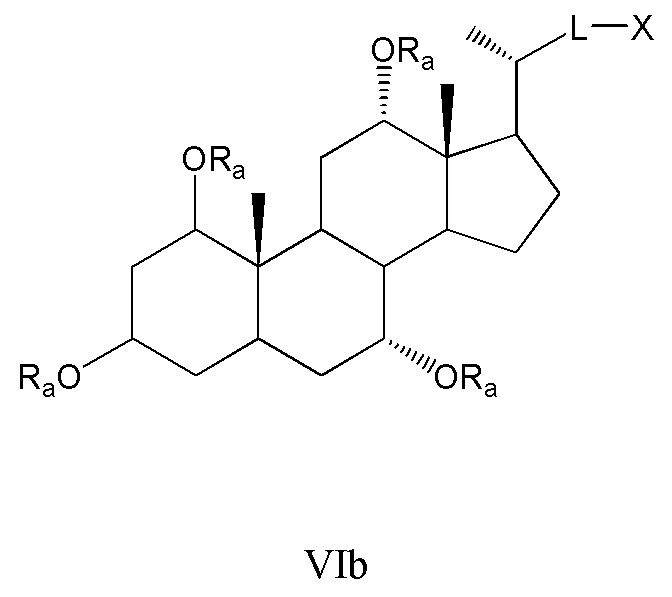
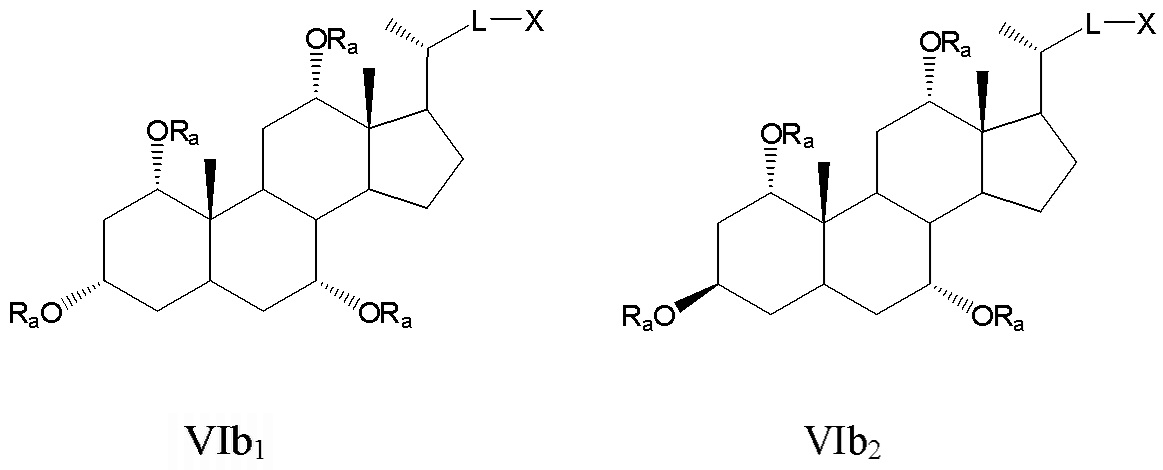
Документы, цитированные в отчёте о поиске
Получение водного прозрачного раствора лекарственных форм с желчными кислотами

Комментарии