Композиции и способы для лечения расстройств цнс - RU2733756C2
Код документа: RU2733756C2
Описание
Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки США № 62/064961, поданной 16 октября 2014 года, полное содержание которой включено в настоящую заявку посредством ссылки.
Предпосылки создания изобретения
Возбудимость головного мозга определяется как уровень активности ЦНС у животного, континуум от комы до судорог, и регулируется различными нейротрансмиттерами. Как правило, нейротрансмиттеры ответственны за регуляцию проводимости ионов через нейрональные мембраны. В состоянии покоя нейрональная мембрана имеет потенциал (или напряжение мембраны) приблизительно -70 мВ, при этом внутренняя поверхность клетки заряжена отрицательно по отношению к внешней поверхности клетки. Потенциал (напряжение) является результатом ионного (K+, Na+, Cl-, органические анионы) баланса через нейрональную полупроницаемую мембрану. Нейротрансмиттеры хранятся в пресинаптических везикулах и высвобождаются под воздействием потенциалов действия нейронов. При высвобождении в синаптическую щель возбудительный химический трансмиттер, такой как ацетилхолин, будет вызывать деполяризацию мембраны, например, изменение потенциала от -70 мВ до -50 мВ. Этот эффект опосредуется постсинаптическими никотиновыми рецепторами, которые стимулируются ацетилхолином, для увеличения проницаемости мембраны для Na+ ионов. Пониженный мембранный потенциал стимулирует нейрональную возбудимость в виде потенциала постсинаптического действия.
В случае гамма-аминомасляной кислоты, ГАМК, рецепторного комплекса (GRC), эффект на возбудимость головного мозга опосредуется ГАМК нейротрансмиттером. ГАМК оказывает сильное влияние на общую возбудимость головного мозга, поскольку до 40% всех нейронов головного мозга используют ГАМК как нейротрансмиттер. ГАМК регулирует возбудимость отдельных нейронов, регулируя проводимость ионов хлора через нейрональную мембрану. ГАМК взаимодействует с сайтом ее распознавания на GRC, способствуя протеканию хлоридных ионов по электрохимическому градиенту GRC в клетку. Внутриклеточное повышение уровней этого аниона вызывает гиперполяризацию трансмембранного потенциала, делая нейрон менее чувствительным к возбуждающим входам, т.е. приводя к пониженной нейронной возбудимости. Иными словами, чем выше концентрация хлоридных ионов в нейронах, тем меньше возбудимость головного мозга и уровень возбуждения ЦНС.
Документально подтверждено, что GRC является ответственным за опосредование тревожного состояния, судорожной активности и седации. Таким образом, ГАМК и лекарственные средства, которые действуют подобно ГАМК или способствуют эффектам ГАМК (например, терапевтически полезные барбитураты и бензодиазепины (BZs), такие как Валиум®), проявляют свои терапевтически полезные эффекты путем взаимодействия с специфическими регуляторными сайтами на GRC. Накопленные доказательства указывают на то, что, в дополнение к сайту связывания бензодиазепинов и барбитуратов, GRC содержит отдельный сайт для нейроактивных стероидов. См., например, Lan, N. C. et al., Neurochem. Res. (1991) 16:347-356.
Нейроактивные стероиды являются эндогенными. Самые сильные эндогенные нейроактивные стероиды представляют собой 3α-гидрокси-5-восстановленный прегнан-20-он и 3α-21-дигидрокси-5-восстановленный прегнан-20-он, метаболиты гормональных стероидов прогестерона и дезоксикортикостерона, соответственно. Способность этих стероидных метаболитов изменять возбудимость головного мозга была признана в 1986 году (Majewska, M. D. et al., Science 232:1004-1007 (1986); Harrison, N. L. et al., J Pharmacol. Exp. Ther. 241:346-353 (1987)).
Было продемонстрировано, что овариальный гормон прогестерон и его метаболиты оказывают глубокие эффекты на возбудимость головного мозга (Backstrom, T. et al., Acta Obstet. Gynecol. Scand. Suppl. 130:19-24 (1985); Pfaff, D.W and McEwen, B. S., Science 219:808-814 (1983); Gyermek et al., J Med Chem. 11: 117 (1968); Lambert, J. et al., Trends Pharmacol. Sci. 8:224-227 (1987)). Уровни прогестерона и его метаболитов варьируются в зависимости от фазы менструального цикла. Документально подтвеждено, что уровни прогестерона и его метаболитов уменьшаются перед началом менструации. Ежемесячное повторение определенных физических симптомов перед началом менструации также было подтверждено документально. Эти симптомы, которые стали связывать с предменструальным синдромом (PMS), включают стресс, беспокойство, мигрени и головные боли (Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Субъекты с PMS имеют ежемесячные рецидивы симптомов, которые присутствуют перед менструацией и отсутствуют после менструации.
Подобным образом, снижение прогестерона также соотносится по времени с увеличением частоты припадков у женщин, страдающих эпилепсией, т.е. катамениальной эпилепсией (Laidlaw, J., Lancet, 1235-1237 (1956)). Более прямая корреляция наблюдается при снижении метаболитов прогестерона (Rosciszewska et al., J. Neurol. Neurosurg. Psych. 49:47-51 (1986)). Кроме того, у субъектов с первичным генерализованным малым эпилептическим припадком время, когда возникают эпилептические припадки, соотносится с возникновением симптомов предменструального синдрома (Backstrom, T. et al., J. Psychosom. Obstet. Gynaecol. 2:8-20 (1983)). Было обнаружено, что стероид дезоксикортикостерон является эффективным для лечения субъектов с эпилептическими припадками, соотносящимися с их менструальными циклами (Aird, R.B. and Gordan, G., J. Amer. Med. Soc. 145:715-719 (1951)).
Синдром, также связанный с низким уровнем прогестерона, представляет собой послеродовую депрессию (PND). Сразу после родов уровень прогестерона резко снижается, приводя к PND. Симптомы PND являются разными от слабой депрессии до психоза, требующего госпитализации. PND тоже ассоциируется с сильным беспокойством и раздражительностью. PND-ассоциированная депрессия не поддается лечению классическими антидепрессантами, и женщины, испытывающие PND, демонстрируют большее число случаев PMS (Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)).
В совокупности эти наблюдения предполагают решающую роль прогестерона и дезоксикортикостерона и, более конкретно, их метаболитов в гомеостатической регуляции возбудимости головного мозга, что проявляется как увеличение судорожной активности или симптомов, связанных с катамениальной эпилепсией, PMS и PND. Корреляция между снижением уровней прогестерона и симптомами, связанными с PMS, PND и катамениальной эпилепсией (Backstrom, T. et al., J Psychosom.Obstet. Gynaecol. 2:8-20 (1983)); Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)), подсказала использование прогестерона в их лечении (Mattson et al., ʺMedroxyprogesterone therapy of ctamenial epilepsy,ʺ в Advances in Epileptology: XVth Epilepsy International Symposium, Raven Press, New York (1984), pp. 279-282, и Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Однако прогестерон не всегда эффективен в лечении вышеуказанных синдромов. Например, не существует взаимозависимости доза-ответ для прогестерона в лечении PMS (Maddocks et al., Obstet. Gynecol. 154:573-581 (1986); Dennerstein et al., Brit. Med J 290:16-17 (1986)).
Необходимы новые и улучшенные нейроактивные стероиды, которые действуют как средства, модулирующие возбудимость головного мозга, а также средства для профилактики и лечения ЦНС-связанных заболеваний. Соединения, композиции и способы, описанные в настоящей заявке, направлены на удовлетворение этих целей.
Сущность изобрения
Настоящее изобретение обеспечивает C21-замещенные нейроактивные стероиды, разработанные, например, для действия в качестве модуляторов ГАМК. В некоторых вариантах осуществления такие соединения предусматриваются как полезные в качестве терапевтических средств для индукции анестезии и/или седации у субъекта. В некоторых вариантах осуществления такие соединения предусматриваются как полезные в качестве терапевтических средств для лечения ЦНС-связанных расстройств (например, расстройства сна, расстройства настроения, такого как депрессия, расстройства шизофренического спектра, судорожного расстройства, расстройства памяти и/или познавательной способности, двигательного расстройства, расстройства личности, расстройства аутического спектра, боли, травматического поражения головного мозга, сосудистого заболевания, расстройства, связанного с злоупотреблением психоактивными веществами, и/или синдрома отмены или тиннитуса) у субъекта, нуждающегося в этом (например, у субъекта с синдромом Ретта, синдромом ломкой X-хромосомы или синдромом Ангельмана).
В одном аспекте, обеспечивается соединение формулы (I):

или его фармацевтически приемлемая соль; где: кольцо A представляет собой замещенный или незамещенный карбоциклил, гетероциклил, арил или гетероарил; R1 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил или замещенный или незамещенный C3-6карбоциклил; R2 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил или -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил; R3a представляет собой водород или -ORA3, где RA3 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R3b представляет собой водород; или R3a и R3b объединены вместе с образованием оксо (=O) группы; R4a представляет собой водород, замещенный или незамещенный C1-6алкил или -ORA4, где RA4 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R4b представляет собой водород или замещенный или незамещенный C1-6алкил; R4a и R4b объединены вместе с образованием оксо (=O) группы; или R4a и R4b вместе с атомом углерода, к которому они присоединены, образуют кольцо (например, 3-6-членное кольцо (например, карбоциклильное или гетероциклильное кольцо). R7a представляет собой водород или галоген; R7b представляет собой водород; R5 отсутствует или представляет собой водород; и




В одном варианте осуществления A означает Кольцо A, которое представляет собой замещенный или незамещенный азот-содержащий гетероциклил или азот-содержащий гетероарил. В одном варианте осуществления A присоединен через атом азота. В одном варианте осуществления A представляет собой моноциклический гетероарил или гетероциклил, например, замещенный моноциклический гетероарил. В одном варианте осуществления A представляет собой бициклический гетероарил, например, замещенный бициклический гетероарил. Типичные заместители описаны в настоящей заявке.
В одном варианте осуществления кольцо A представляет собой замещенный карбоциклил, гетероциклил, арил или гетероарил, например, замещенный гетероциклил или гетероарил. В некоторых вариантах осуществления гетероциклил или гетероарил присоединен через атом азота. В одном варианте осуществления A представляет собой замещенный гетероциклил, присоединенный через атом азота. В одном варианте осуществления A представляет собой незамещенный гетероциклил, присоединенный через атом азота. В одном варианте осуществления A представляет собой замещенный гетероарил, присоединенный через атом азота. В одном варианте осуществления A представляет собой незамещенный гетероарил, присоединенный через атом азота.
В одном варианте осуществления A представляет собой замещенный или незамещенный имидазол или бензимидазол (например, замещенный имидазол или бензимидазол). В некоторых вариантах осуществления имидазол или бензимидазол присоединен через атом азота.
В одном варианте осуществления A является замещенным или незамещенным и выбран из:

В одном варианте осуществления A является замещенным или незамещенным и выбран из:

В одном варианте осуществления A является замещенным или незамещенным и выбран из:

В одном варианте осуществления R1 представляет собой водород, метил, этил или пропил (например, метил). В одном варианте осуществления R1 представляет собой незамещенный C1-3алкил. В одном варианте осуществления R1 представляет собой замещенный C1-6алкил (например, галогеналкил или алкоксиалкил, такой как метоксиметил).
В одном варианте осуществления по меньшей мере один из R2, R3a, R4a или R4b не является водородом. Например, в одном варианте осуществления по меньшей мере 2 из R2, R3a, R4a или R4b не являются водородом.
В одном варианте осуществления R2 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил или -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил. В одном варианте осуществления R2 представляет собой -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, например, гидроксил или алкокси.
В одном варианте осуществления R3a представляет собой -ORA3, где RA3 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R3b представляет собой водород; или R3a и R3b объединены вместе с образованием оксо (=O) группы. В одном варианте осуществления R3a представляет собой -ORA3, где RA3 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, например, гидроксил или алкокси.
В одном варианте осуществления R4a представляет собой замещенный или незамещенный C1-6алкил или -ORA4, где RA4 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R4b представляет собой водород или замещенный или незамещенный C1-6алкил; или R4a и R4b объединены вместе с образованием оксо (=O) группы.
В одном варианте осуществления соединение представляет собой соединение формулы (I-a):

где: R6 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил, C1-6галогеналкил, галоген, циано, -ORA6, -C(=O)ORA6, -SRB6, -S(=O)RB6 или S(=O)2RB6, где RA6 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил или C1-6галогеналкил, и RB6 представляет собой замещенный или незамещенный C1-6алкил или замещенный или незамещенный C3-6карбоциклил; и n имеет значение 0, 1, 2 или 3.
В одном варианте осуществления соединение представляет собой соединение формулы (I-b):

В одном варианте осуществления соединение представляет собой соединение формулы (I-c1) или (I-c2):


В одном варианте осуществления соединение представляет собой соединение формулы (I-c1):

или его фармацевтически приемлемую соль; где: кольцо A представляет собой замещенный или незамещенный карбоциклил, гетероциклил, арил или гетероарил; R1 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил или замещенный или незамещенный C3-6карбоциклил; R2 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил или -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил; R3a представляет собой водород или -ORA3, где RA3 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R3b представляет собой водород; или R3a и R3b объединены вместе с образованием оксо (=O) группы; R4a представляет собой водород, замещенный или незамещенный C1-6алкил или -ORA4, где RA4 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R4b представляет собой водород или замещенный или незамещенный C1-6алкил; R4a и R4b объединены вместе с образованием оксо (=O) группы; или R4a и R4b вместе с атомом углерода, к которому они присоединены, образуют кольцо (например, 3-6-членное кольцо (например, карбоциклильное или гетероциклильное кольцо); R6 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил, C1-6галогеналкил, галоген, циано,-ORA6, -C(=O)ORA6, -SRB6, -S(=O)RB6 или S(=O)2RB6, где RA6 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил или C1-6галогеналкил, и RB6 представляет собой замещенный или незамещенный C1-6алкил или замещенный или незамещенный C3-6карбоциклил; и n имеет значение 0, 1, 2 или 3.
В одном варианте осуществления A представляет собой связанный с углеродом (например, A присоединен через атом углерода) замещенный или незамещенный 5- или 6-членный гетероарил или 6-членный арил.
В одном варианте осуществления A означает Кольцо A, которое представляет собой замещенный или незамещенный азот-содержащий гетероциклил или азот-содержащий гетероарил. В одном варианте осуществления A присоединен через азот. В одном варианте осуществления A представляет собой моноциклический гетероарил или гетероциклил, например, замещенный моноциклический гетероарил. В одном варианте осуществления A представляет собой бициклический гетероарил, например, замещенный бициклический гетероарил. Типичные заместители описаны в настоящей заявке.
В одном варианте осуществления R1 представляет собой водород. В одном варианте осуществления R1 представляет собой замещенный или незамещенный C1-6алкил, например, метил.
В одном варианте осуществления по меньшей мере один из R2, R3a, R4a или R4b не является водородом. Например, в одном варианте осуществления по меньшей мере 2 из R2, R3a, R4a или R4b не являются водородом.
В одном варианте осуществления R2 представляет собой замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил или -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил. В одном варианте осуществления R2 представляет собой -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, например, гидроксил или алкокси.
В одном варианте осуществления R3a представляет собой -ORA3, где RA3 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R3b представляет собой водород; или R3a и R3b объединены вместе с образованием оксо (=O) группы. В одном варианте осуществления R3a представляет собой -ORA3, где RA3 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, например, гидроксил или алкокси.
В одном варианте осуществления R4a представляет собой замещенный или незамещенный C1-6алкил или -ORA4, где RA4 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R4b представляет собой водород или замещенный или незамещенный C1-6алкил; или R4a и R4b объединены вместе с образованием оксо (=O) группы.
В одном варианте осуществления соединение представляет собой соединение формулы (II):

где: кольцо E представляет собой замещенный или незамещенный гетероциклил или гетероарил.
В одном варианте осуществления соединение представляет собой соединение формулы (II-a1) или (II-a2):


В одном варианте осуществления E представляет собой кольцо, включающее по меньшей мере один атом азота.
В одном варианте осуществления A представляет собой кольцо, включающее по меньшей мере один атом азота.
В одном варианте осуществления E выбран из:

В одном варианте осуществления E выбран из:

В одном варианте осуществления A представляет собой:

В одном варианте осуществления E представляет собой кольцо, включающее по меньшей мере два атома азота. В одном варианте осуществления E представляет собой кольцо, включающее по меньшей мере два атома азота, и R1 представляет собой замещенный или незамещенный C2-6алкил. В одном варианте осуществления E представляет собой кольцо, включающее по меньшей мере два атома азота, и по меньшей мере один из R2, R3a, R4a или R4b не является водородом.
В одном варианте осуществления E представляет собой кольцо, включающее по меньшей мере три атома азота. В одном варианте осуществления E представляет собой кольцо, включающее четыре атома азота.
В одном варианте осуществления R1 представляет собой замещенный или незамещенный C2-6алкил.
В одном варианте осуществления по меньшей мере один из R2, R3a, R4a или R4b не является водородом.
В одном варианте осуществления E представляет собой кольцо, включающее 2, 3 или 4 атома азота.
В одном варианте осуществления E представляет собой кольцо, выбранное из пиразола, триазола, тетразола, индазола, бензотриазола, триазолoпиридина, триазолoпиразина, пиразолoпиразина.
В одном варианте осуществления A представляет собой 6-членное гетероциклильное кольцо (например, 6-членное гетероциклильное кольцо, включающее по меньшей мере два гетероатома).
В одном варианте осуществления A представляет собой 5-6-членное гетероциклильное кольцо, и n имеет значение 1 или 2.
В одном варианте осуществления E представляет собой морфолин, и n имеет значение 1 или 2.
В одном варианте осуществления R1 представляет собой водород или незамещенный C1-6алкил. В одном варианте осуществления R1 представляет собой или метил. В одном варианте осуществления R1 представляет собой замещенный или незамещенный C2-6алкил.
В одном варианте осуществления R2 представляет собой водород, -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6алкил (например, метил, этил).
В одном варианте осуществления R3a представляет собой -ORA3, где RA3 представляет собой водород или замещенный или незамещенный C1-6алкил (например, метил).
В одном варианте осуществления R3a и R3b объединены вместе с образованием оксо (=O) группы.
В одном варианте осуществления R4a представляет собой водород или замещенный или незамещенный C1-6алкил (например, метил).
В одном варианте осуществления R4b представляет собой водород или замещенный или незамещенный C1-6алкил (например, метил).
В одном варианте осуществления R4a представляет собой водород, и R4b представляет собой замещенный или незамещенный C1-6алкил (например, метил).
В одном варианте осуществления R5 представляет собой водород.
В одном варианте осуществления n имеет значение 0.
В одном варианте осуществления n имеет значение 1, и R6 представляет собой замещенный или незамещенный C1-6алкил, C1-6галогеналкил, галоген (например, -F, -Br, -Cl), циано, -ORA6, -C(=O)ORA6, -SRB6, -S(=O)RB6 или S(=O)2RB6, где RA6 представляет собой водород или замещенный или незамещенный C1-6алкил (например, метил, этил), C1-6галогеналкил (например, -CF3), и RB6 представляет собой замещенный или незамещенный C1-6алкил.
В одном варианте осуществления n имеет значение 1, и R6 представляет собой галоген (например, -F, -Br, -Cl) или циано. В одном варианте осуществления n имеет значение 1, и R6 представляет собой замещенный или незамещенный C1-6алкил (например, метил). В одном варианте осуществления n имеет значение 1, и R6 представляет собой C1-6галогеналкил, -ORA6 или -C(=O)ORA6, где RA6 представляет собой водород или замещенный или незамещенный C1-6алкил (например, метил, этил), C1-6галогеналкил (например, -CF3). В одном варианте осуществления n имеет значение 1, и R6 представляет собой SRB6, -S(=O)RB6 или S(=O)2RB6, где RB6 представляет собой замещенный или незамещенный C1-6алкил (например, метил).
В одном варианте осуществления n имеет значение 2, и R6 независимо выбран из замещенного или незамещенного C1-6алкила, C1-6галогеналкила, галогена (например, -F, -Br, -Cl), циано, -ORA6, -C(=O)ORA6, -SRB6, -S(=O)RB6 или S(=O)2RB6, где RA6 представляет собой водород или замещенный или незамещенный C1-6алкил (например, метил, этил), C1-6галогеналкил (например, -CF3), и RB6 представляет собой замещенный или незамещенный C1-6алкил.
В одном варианте осуществления n имеет значение 2, и R6 независимо выбран из галогена (например, -F, -Br, -Cl). В одном варианте осуществления n имеет значение 2, и один из R6 представляет собой фтор.
В одном варианте осуществления n имеет значение 0, и R1 представляет собой замещенный или незамещенный C2-6алкил.
В одном варианте осуществления R1 представляет собой замещенный или незамещенный C1-6алкил, и по меньшей мере один из R2, R3a, R4a или R4b не является водородом.
В одном варианте осуществления соединение представляет собой соединение формулы (II-a1), и E представляет собой гетероарильное кольцо, включающее по меньшей мере 3 атома азота.
В одном варианте осуществления соединение представляет собой:






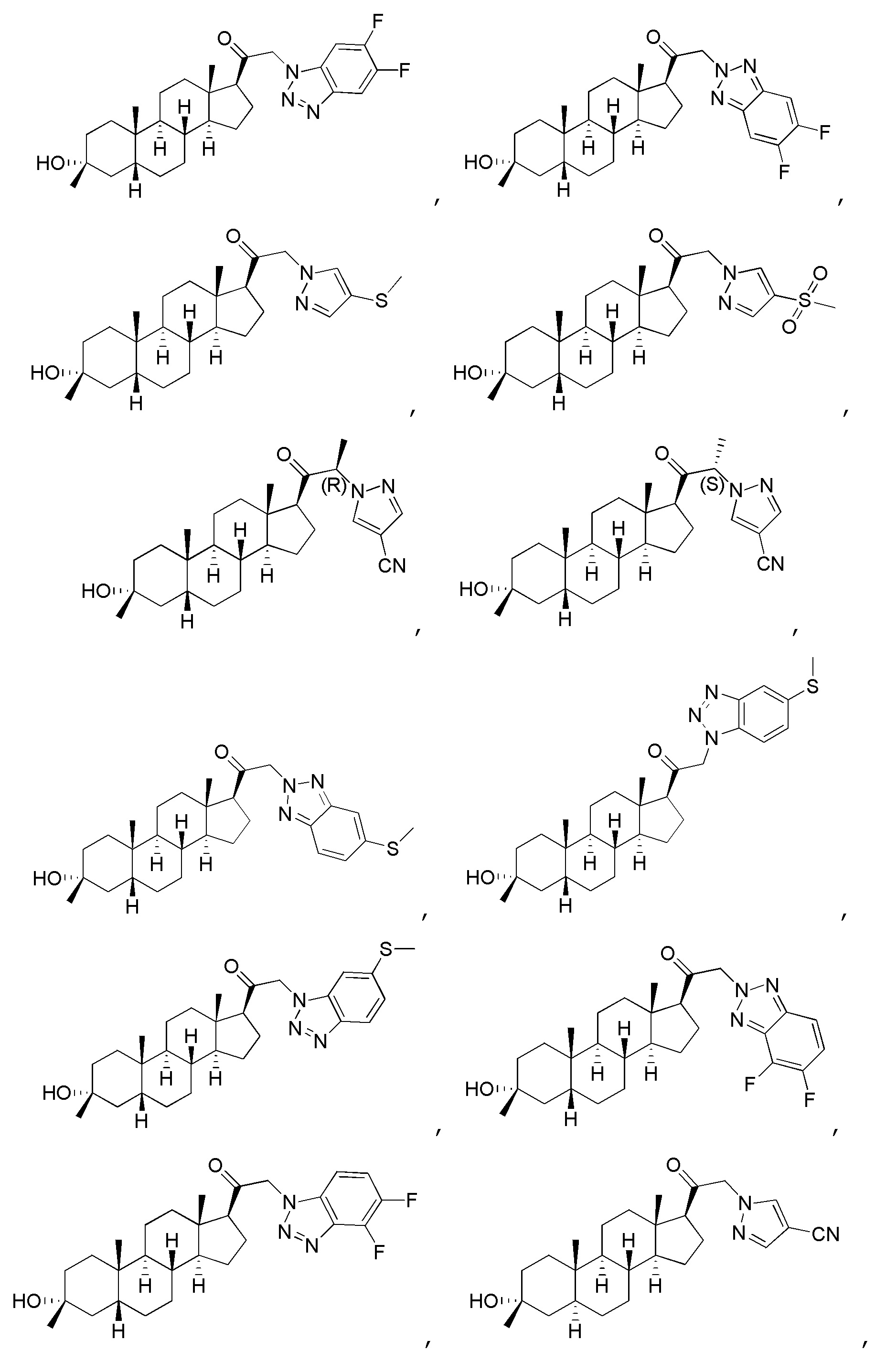









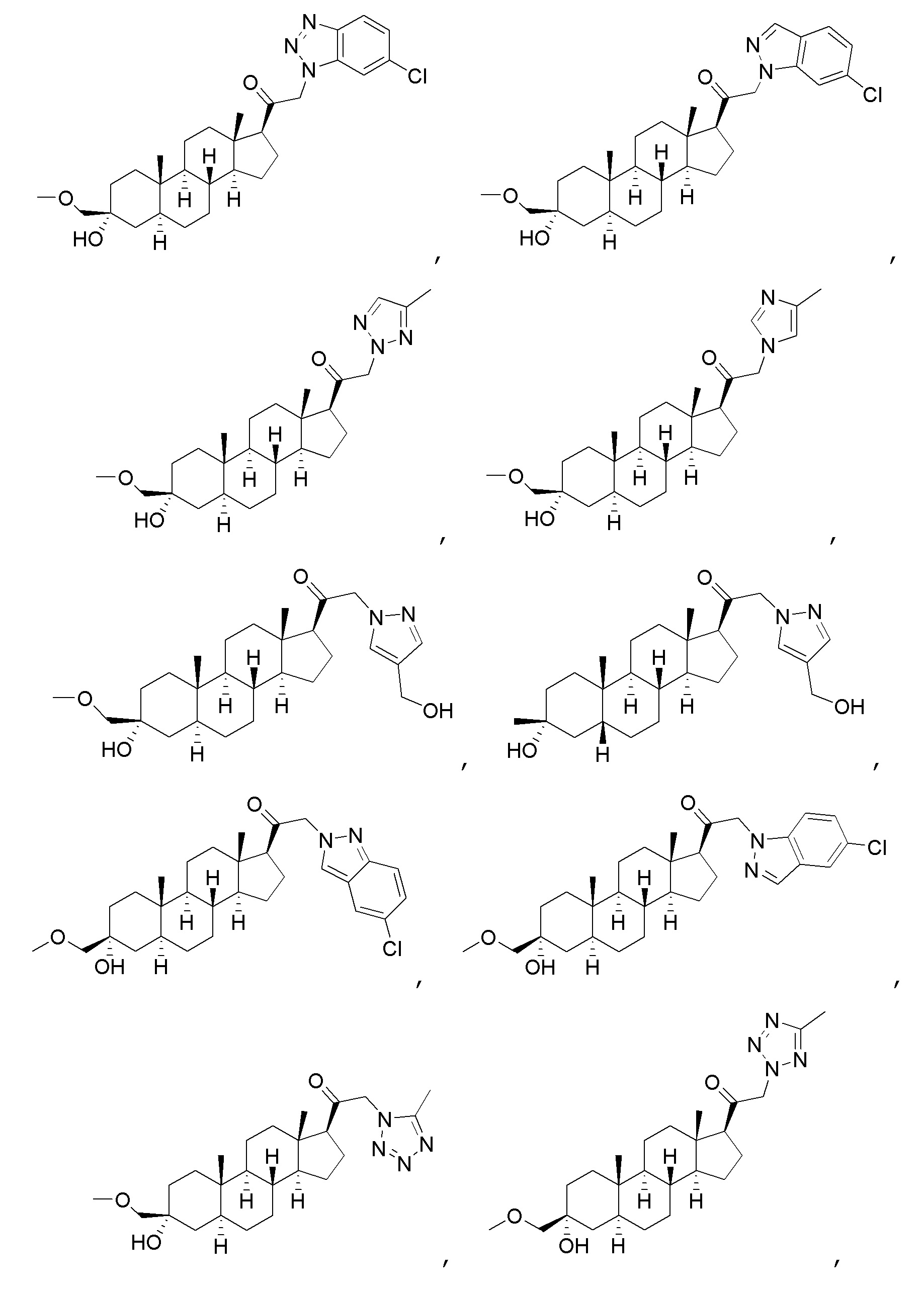
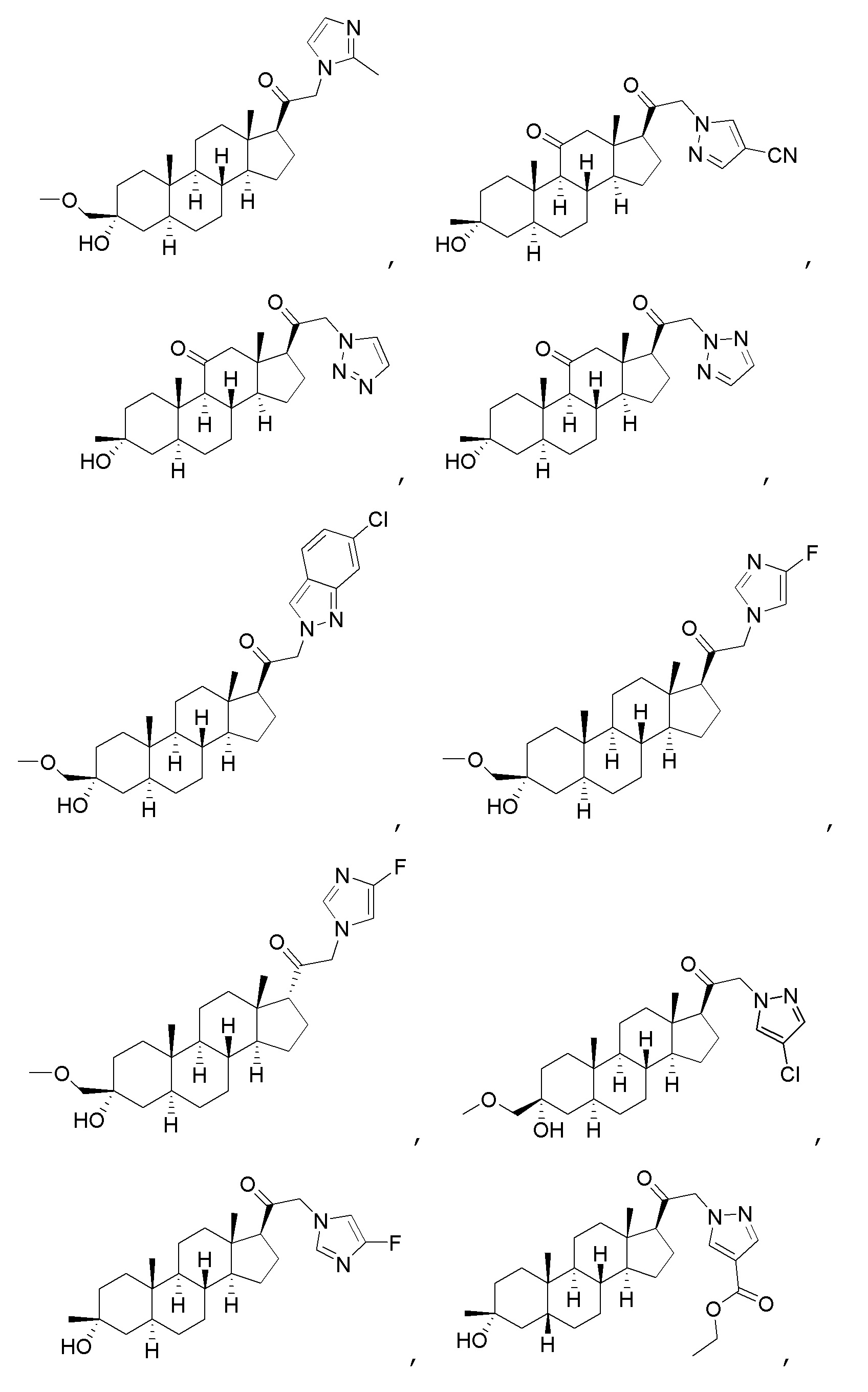

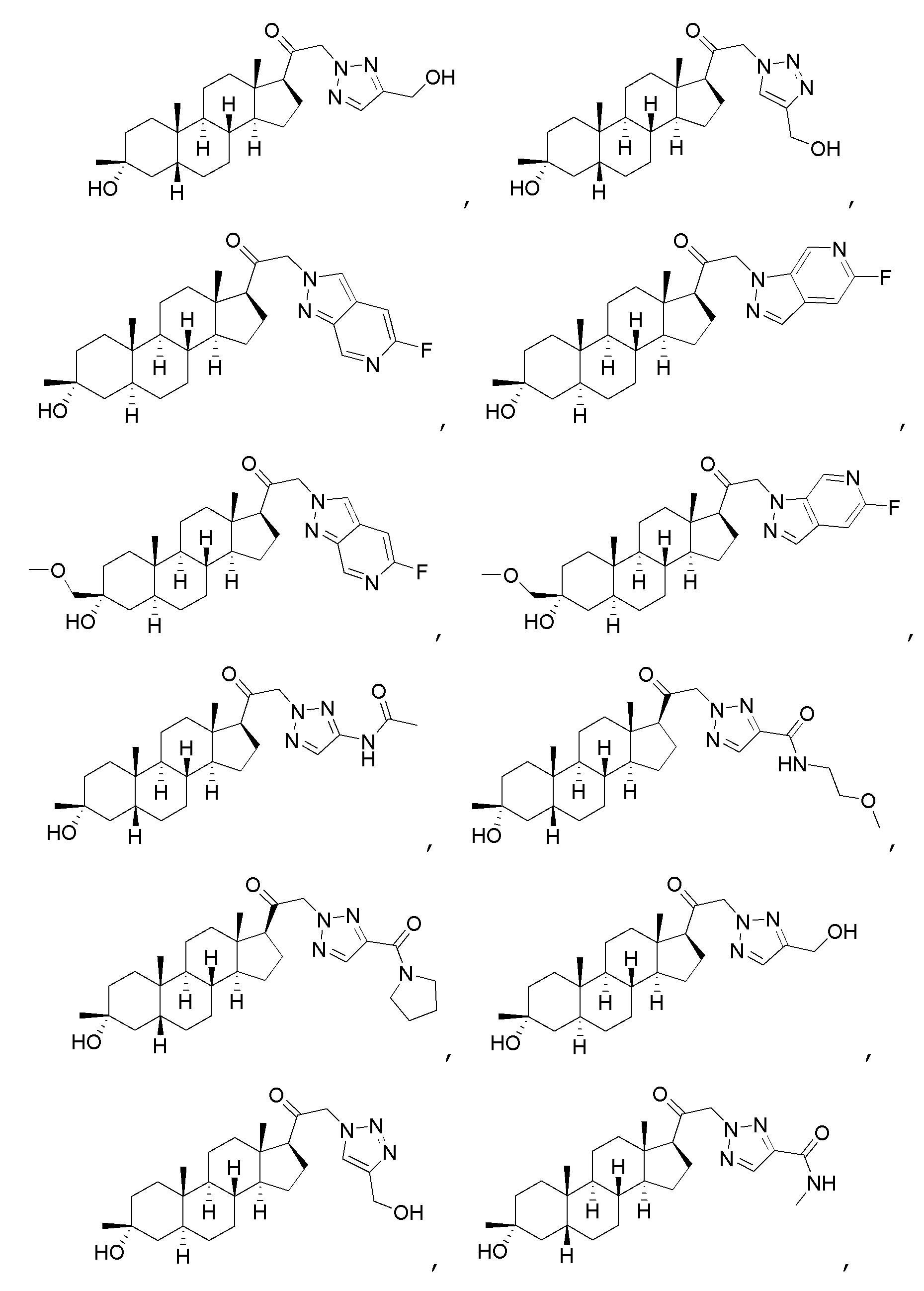



В одном аспекте, обеспечивается фармацевтическая композиция, включающая соединение формулы (I) и фармацевтически приемлемый эксципиент.
В одном аспекте, обеспечивается способ индукции седации и/или анестезии у субъекта, включающий введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В одном аспекте, обеспечивается способ введения эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции соединения формулы (I) субъекту, нуждающемуся в этом, где субъект ощущает седацию и/или анестезию в пределах двух часов после введения.
В одном варианте осуществления субъект ощущает седацию и/или анестезию в пределах одного часа после введения.
В одном варианте осуществления субъект ощущает седацию и/или анестезию мгновенно.
В одном варианте осуществления соединение вводят внутривенно.
В одном варианте осуществления соединение вводят в течение длительного периода времени.
В одном варианте осуществления субъект представляет собой млекопитающего. В одном варианте осуществления субъект представляет собой человека.
В одном варианте осуществления соединение вводят в комбинации с другим терапевтическим средством.
В одном аспекте, обеспечивается способ для лечения судорог у субъекта, включающий введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В одном аспекте, обеспечивается способ для лечения эпилепсии или эпилептического статуса у субъекта, где способ включает введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В одном варианте осуществления эпилептический статус представляет собой судорожный эпилептический статус (например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус) или не-судорожный эпилептический статус, (например, генерализованный эпилептический статус, парциальный комплексный эпилептический статус).
В одном аспекте, обеспечивается способ для лечения расстройств, связанных с ГАМК функцией у субъекта, нуждающегося в этом, где способ включает введение субъекту терапевтически эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции одного из соединений формулы (I).
В одном аспекте, обеспечивается способ для лечения ЦНС-связанных расстройств у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
В одном варианте осуществления ЦНС-связанное расстройство представляет собой расстройство сна, расстройство настроения, такое как депрессия, расстройство шизофренического спектра, судорожное расстройство, расстройство памяти и/или познавательной способности, двигательное расстройство, расстройство личности, расстройство аутического спектра, боль, травматическое поражение головного мозга, сосудистое заболевание, расстройство, связанное с злоупотреблением психоактивными веществами, и/или синдром отмены или тиннитус.
В одном варианте осуществления субъект представляет собой субъекта с синдромом Ретта, синдромом ломкой X-хромосомы или синдромом Ангельмана. В одном варианте осуществления ЦНС-связанное расстройство представляет собой расстройство сна, расстройство пищевого поведения, расстройство настроения, такое как депрессия, расстройство шизофренического спектра, судорожное расстройство, расстройство памяти и/или познавательной способности, двигательное расстройство, расстройство личности, расстройство аутического спектра, боль, травматическое поражение головного мозга, сосудистое заболевание, расстройство, связанное с злоупотреблением психоактивными веществами, и/или синдром отмены или тиннитус. В одном варианте осуществления ЦНС-связанное расстройство представляет собой депрессию (например, послеродовую депрессию). В одном варианте осуществления ЦНС-связанное расстройство представляет собой тремор (например, эссенциальный тремор). В одном варианте осуществления ЦНС-связанное расстройство представляет собой расстройство пищевого поведения (например, нервную анорексию, нервную булимию, компульсивное переедание, кахексию).
В одном варианте осуществления соединение вводят перорально. В одном варианте осуществления соединение вводят внутримышечно.
В одном аспекте, обеспечивается набор, включающий твердую композицию, включающую соединение формулы (I) и стерильный разбавитель.
Настоящее изобретение также обеспечивает фармацевтические композиции, включающие соединение по настоящему изобретению, и способы применения и лечения, например, такие как для индукции седации и/или анестезии, для лечения ЦНС-связанного расстройства.
Стероиды формулы (I), их подклассы и их фармацевтически приемлемые соли в совокупности называются в настоящей заявке ʺсоединениями по настоящему изобретению.ʺ
В другом аспекте, обеспечивается фармацевтическая композиция, включающая соединение по настоящему изобретению и фармацевтически приемлемый эксципиент. В некоторых вариантах осуществления соединение по настоящему изобретению обеспечивается в эффективном количестве в фармацевтической композиции. В некоторых вариантах осуществления соединение по настоящему изобретению обеспечивается в терапевтически эффективном количестве. В некоторых вариантах осуществления соединение по настоящему изобретению обеспечивается в профилактически эффективном количестве.
Соединения по настоящему изобретению, описанные в настоящей заявке, действуют, в некоторых вариантах осуществления, как модуляторы ГАМК, например, влияя на ГАМКA рецептор либо положительным, либо отрицательным образом. В качестве модуляторов возбудимости центральной нервной системы (ЦНС), что опосредовано их способностью модулировать ГАМКA рецептор, такие соединения, как ожидается, должны обладать ЦНС-активностью.
Таким образом, в другом аспекте, обеспечиваются способы лечения ЦНС-связанного расстройства у субъекта, нуждающегося в этом, включающие введение субъекту эффективного количества соединения по настоящему изобретению. В некоторых вариантах осуществления, ЦНС-связанное расстройство выбрано из группы, состоящей из расстройства сна, расстройства настроения, такого как депрессия, расстройства шизофренического спектра, судорожного расстройства, расстройства памяти и/или познавательной способности, двигательного расстройства, расстройства личности, расстройства аутического спектра, боли, травматического поражения головного мозга, сосудистого заболевания, расстройства, связанного с злоупотреблением психоактивными веществами, и/или синдрома отмены и тиннитуса. В некоторых вариантах осуществления соединение вводят перорально, подкожно, внутривенно или внутримышечно. В некоторых вариантах осуществления соединение вводят в течение длительного периода времени. В некоторых вариантах осуществления, соединение вводят непрерывно, например, путем непрерывной внутривенной инфузии.
Другие цели и преимущества станут очевидны для специалистов в данной области из рассмотрения последующего Подробного описания, Примеров и Формулы изобретения.
Определения
Химические определения
Определения конкретных функциональных групп и химических терминов описаны более подробно ниже. Химические элементы идентифицированы в соответствии с периодической таблицей элементов, CAS версия, Handbook of Chemistry and Physics, 75th Ed., внутренняя обложка, и конкретные функциональные группы в основном определяются, как описано в этом справочнике. Кроме того, общие принципы органической химии, а также конкретные функциональные группы и реактивности описаны в Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, Marchʹs Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
Соединения, описанные в настоящей заявке, могут содержать один или несколько асимметричных центров и, таким образом, могут существовать в различных изомерных формах, например, в виде энантиомеров и/или диастереомеров. Например, соединения, описанные в настоящей заявке, могут быть в форме индивидуального энантиомера, диастереомера или геометрического изомера, или могут быть в форме смеси стереоизомеров, включая рацемические смеси и смеси, обогащенные одним или несколькими стереоизомерами. Изомеры могут быть выделены из смеси способами, известными специалистам в данной области техники, включая хиральную высоко-эффективную жидкостную хроматографию (ВЭЖХ), сверхкритическую жидкостную хроматографию (СЭЖХ) и образование и кристаллизацию хиральных солей; или предпочтительные изомеры могут быть получены путем асимметрического синтеза. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972). Настоящее изобретение, кроме того, охватывает соединения, описанные в настоящей заявке, в виде индивидуальных изомеров по существу свободных от других изомеров, и альтернативно, в виде смесей различных изомеров.
Как используется в настоящей заявке, чистое энантиомерное соединение является по существу свободным от других энантиомеров или стереоизомеров этого соединения (т.е. присутствует в энантиомерном избытке). Иными словами, ʺSʺ форма соединения является по существу свободной от ʺRʺ формы соединения и, таким образом, присутствует в энантиомерном избытке относительно ʺRʺ формы. Термин ʺэнантиомерно чистыйʺ или ʺчистый энантиомерʺ означает, что соединение включает больше чем 75% по массе, больше чем 80% по массе, больше чем 85% по массе, больше чем 90% по массе, больше чем 91% по массе, больше чем 92% по массе, больше чем 93% по массе, больше чем 94% по массе, больше чем 95% по массе, больше чем 96% по массе, больше чем 97% по массе, больше чем 98% по массе, больше чем 98,5% по массе, больше чем 99% по массе, больше чем 99,2% по массе, больше чем 99,5% по массе, больше чем 99,6% по массе, больше чем 99,7% по массе, больше чем 99,8% по массе или больше чем 99,9% по массе этого энантиомера. В некоторых вариантах осуществления массы указаны в расчете на общую массу всех энантиомеров или стереоизомеров соединения.
В композициях, представленных в настоящей заявке, энантиомерно чистое соединение может присутствовать с другими активными или неактивными ингредиентами. Например, фармацевтическая композиция, включающая энантиомерно чистое R-соединение, может включать, например, около 90% эксципиента и около 10% энантиомерно чистого R-соединения. В некоторых вариантах осуществления энантиомерно чистое R-соединение в таких композициях может, например, включать по меньшей мере около 95% по массе R-соединения и не более чем около 5% по массе S-соединения, в расчете на общую массу соединения. Например, фармацевтическая композиция, включающая энантиомерно чистое S-соединение, может включать, например, около 90% эксципиента и около 10% энантиомерно чистого S-соединения. В некоторых вариантах осуществления энантиомерно чистое S-соединение в таких композициях может, например, включать по меньшей мере около 95% по массе S-соединения и не более чем около 5% по массе R-соединения, в расчете на общую массу соединения. В некоторых вариантах осуществления активный ингредиент можно сформулировать с небольшим количеством или вообще без эксципиента или носителя.
Соединение, описанное в настоящей заявке, также может включать одно или несколько изотопных замещений. Например, H может быть в любой изотопной форме, включая1H,2H (D или дейтерий) и3H (T или тритий); C может быть в любой изотопной форме, включая12C,13C и14C; O может быть в любой изотопной форме, включая16O и18O; и т.д.
Артикли ʺaʺ и ʺanʺ могут использоваться в настоящей заявке как относящиеся к одному или больше чем к одному (т.е. по меньшей мере одному) грамматическому объекту этого артикля. В качестве примера ʺаналог(an analogue)ʺ означает один аналог или больше чем онин аналог.
Когда указан диапазон значений, он предназначен для охвата каждого значения и субдиапазона в пределах этого диапазона. Например ʺC1-6алкилʺ предназначен для охвата, C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и C5-6алкила.
Предполагается, что следующие термины имеют значения, представленные ниже, и являются полезными для понимания описания и предполагаемого объема настоящего изобретения.
ʺАлкилʺ относится к радикалу, включающему линейную или разветвленную насыщенную углеводородную группу, содержащую от 1 до 20 атомов углерода (ʺC1-20 алкилʺ). В некоторых вариантах осуществления алкильная группа содержит от 1 до 12 атомов углерода (ʺC1-12 алкилʺ). В некоторых вариантах осуществления алкильная группа содержит от 1 до 8 атомов углерода (ʺC1-8 алкилʺ). В некоторых вариантах осуществления алкильная группа содержит от 1 до 6 атомов углерода (ʺC1-6 алкилʺ, также указывается в настоящей заявке как ʺнизший алкилʺ). В некоторых вариантах осуществления алкильная группа содержит от 1 до 5 атомов углерода (ʺC1-5 алкилʺ). В некоторых вариантах осуществления алкильная группа содержит от 1 до 4 атомов углерода (ʺC1-4 алкилʺ). В некоторых вариантах осуществления алкильная группа содержит от 1 до 3 атомов углерода (ʺC1-3 алкилʺ). В некоторых вариантах осуществления алкильная группа содержит от 1 до 2 атомов углерода (ʺC1-2 алкилʺ). В некоторых вариантах осуществления алкильная группа содержит 1 атом углерода (ʺC1 алкилʺ). В некоторых вариантах осуществления алкильная группа содержит от 2 до 6 атомов углерода (ʺC2-6алкилʺ). Примеры C1-6 алкильных групп включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (C6). Дополнительные примеры алкильных групп включают н-гептил (C7), н-октил (C8) и подобные. Если не указано иное, в каждом случае алкильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный алкилʺ) или замещенной (ʺзамещенный алкилʺ) одним или несколькими заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкильная группа представляет собой незамещенный C1-10 алкил (например, -CH3). В некоторых вариантах осуществления алкильная группа представляет собой замещенный C1-10 алкил. Общепринятые сокращенные обозначения алкила включают Me (-CH3), Et (-CH2CH3), iPr (-CH(CH3)2), nPr (-CH2CH2CH3), n-Bu (-CH2CH2CH2CH3) или i-Bu (-CH2CH(CH3)2).
ʺАлкенилʺ относится к радикалу, включающему линейную или разветвленную углеводородную группу, содержащую от 2 до 20 атомов углерода, одну или несколько углерод-углеродных двойных связей и отсутствие тройных связей (ʺC2-20 алкенилʺ). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 10 атомов углерода (ʺC2-10 алкенилʺ). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 8 атомов углерода (ʺC2-8 алкенилʺ). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 6 атомов углерода (ʺC2-6 алкенилʺ). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 5 атомов углерода (ʺC2-5 алкенилʺ). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 4 атомов углерода (ʺC2-4 алкенилʺ). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 3 атомов углерода (ʺC2-3 алкенилʺ). В некоторых вариантах осуществления алкенильная группа содержит 2 атома углерода (ʺC2алкенилʺ). Одна или несколько углерод-углеродных двойных связей могут быть внутренними (такими как в 2-бутениле) или концевыми (такими как в 1-бутениле). Примеры C2-4 алкенильных групп включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4) и подобные. Примеры C2-6 алкенильных групп включают указанные выше C2-4 алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6) и подобные. Дополнительные примеры алкенила включают гептенил (C7), октенил (C8), октатриенил (C8) и подобные. Если не указано иное, в каждом случае алкенильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный алкенилʺ) или замещенной (ʺзамещенный алкенилʺ) одним или несколькими заместителями, например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкенильная группа представляет собой незамещенный C2-10 алкенил. В некоторых вариантах осуществления алкенильная группа представляет собой замещенный C2-10 алкенил.
ʺАлкинилʺ относится к радикалу, включающему линейную или разветвленную углеводородную группу, содержащую от 2 до 20 атомов углерода, одну или несколько углерод-углеродных тройных связей и необязательно одну или несколько двойных связей (ʺC2-20 алкинилʺ). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 10 атомов углерода (ʺC2-10 алкинилʺ). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 8 атомов углерода (ʺC2-8 алкинилʺ). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 6 атомов углерода (ʺC2-6 алкинилʺ). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 5 атомов углерода (ʺC2-5 алкинилʺ). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 4 атомов углерода (ʺC2-4 алкинилʺ). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 3 атомов углерода (ʺC2-3 алкинилʺ). В некоторых вариантах осуществления алкинильная группа содержит 2 атомов углерода (ʺC2 алкинилʺ). Одна или несколько углерод-углеродных тройных связей могут быть внутренними (такими как в 2-бутиниле) или концевыми (такими как в 1-бутиниле). Примеры C2-4 алкинильных групп включают, без ограничения, этинил (C2), 1-пропинил (C3), 2-пропинил (C3), 1-бутинил (C4), 2-бутинил (C4) и подобные. Примеры C2-6 алкенильных групп включают указанные выше C2-4 алкинильные группы, а также пентинил (C5), гексинил (C6) и подобные. Дополнительные примеры алкинила включают гептинил (C7), октинил (C8) и подобные. Если не указано иное, в каждом случае алкинильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный алкинилʺ) или замещенной (ʺзамещенный алкинилʺ) одним или несколькими заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления алкинильная группа представляет собой незамещенный C2-10 алкинил. В некоторых вариантах осуществления алкинильная группа представляет собой замещенный C2-10алкинил.
ʺАрилʺ относится к радикалу, включающему моноциклическую или полициклическую (например, бициклическую или трициклическую) 4n+2 ароматическую кольцевую систему (например, содержащую 6, 10 или 14 π электронов, распределенных между этими циклами), содержащую 6-14 кольцевых атомов углерода и ноль гетероатомов, присутствующих в ароматической кольцевой системе (ʺC6-14 арилʺ). В некоторых вариантах осуществления арильная группа содержит шесть кольцевых атомов углерода (ʺC6арилʺ; например, фенил). В некоторых вариантах осуществления арильная группа содержит десять кольцевых атомов углерода (ʺC10арилʺ; например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых вариантах осуществления арильная группа содержит четырнадцать кольцевых атомов углерода (ʺC14арилʺ; например, антрацил). ʺАрилʺ также включает кольцевые системы, где арильное кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклильными или гетероциклильными группами, где радикал или точка присоединения находится на арильном кольце, и в таких случаях количество атомов углерода продолжает определение количества атомов углерода в арильной кольцевой системе. Арильные группы включают, но не ограничиваются этим, фенил, нафтил, инденил и тетрагидронафтил. Если не указано иное, в каждом случае арильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный арилʺ) или замещенной (ʺзамещенный арилʺ) одним или несколькими заместителями. В некоторых вариантах осуществления арильная группа представляет собой незамещенный C6-14 арил. В некоторых вариантах осуществления арильная группа представляет собой замещенный C6-14 арил.
В некоторых вариантах осуществления арильная группа замещена одной или несколькими группами, выбранными из галогена, C1-C8 алкила, C1-C8 галогеналкила, циано, гидрокси, C1-C8 алкокси и амино.
Примеры репрезентативных замещенных арилов включают следующие

где один из R56 и R57 может представлять собой водород, и по меньшей мере один из R56 и R57 каждый независимо выбран из C1-C8 алкила, C1-C8 галогеналкила, 4-10-членного гетероциклила, алканоила, C1-C8 алкокси, гетероарилокси, алкиламино, ариламино, гетероариламино, NR58COR59, NR58SOR59NR58SO2R59, COOалкила, COOарила, CONR58R59, CONR58OR59, NR58R59, SO2NR58R59, S-алкила, SOалкила, SO2алкила, Sарила, SOарила, SO2арила; или R56 и R57могут быть объединены с образованием циклического кольца (насыщенного или ненасыщенного), содержащего от 5 до 8 атомов, необязательно содержащего один или несколько гетероатомов, выбранных из группы N, O или S. R60 и R61 независимо представляют собой водород, C1-C8 алкил, C1-C4галогеналкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, замещенный C6-C10 арил, 5-10-членный гетероарил или замещенный 5-10-членный гетероарил.
Другие репрезентативные арильные группы, содержащие конденсированную гетероциклильную группу, включают следующие:
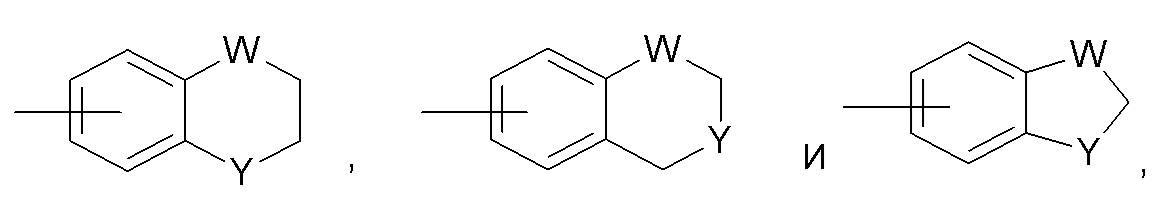
где каждый W выбран из C(R66)2, NR66, O и S; и каждый Y выбран из карбонила, NR66, O и S; и R66 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил и 5-10-членный гетероарил.
ʺГалоʺ или ʺгалоген,ʺ независимо или как часть другого заместителя, означают, если не указано иное, атом фтора (F), хлора (Cl), брома (Br) или иода (I). Термин ʺгалогенидʺ, как таковой или как часть другого заместителя, относится к фториду, хлориду, бромиду или иодиду. В некоторых вариантах осуществления группа галогена представляет собой либо фтор, либо хлор.
ʺГалогеналкилʺ и ʺгалогеналкоксиʺ могут включать алкильные и алкокси структуры, которые замещены одной или несколькими группами галогенов или их комбинациями. Например, термины ʺфторалкилʺ и ʺфторалкоксиʺ включают галогеналкильные и галогеналкокси группы, соответственно, в которых галоген представляет собой фтор.
ʺГетероарилʺ относится к радикалу, включающему 5-10-членную моноциклическую или бициклическую 4n+2 ароматическую кольцевую систему (например, содержащую 6 или 10 π электронов, распределенных между этими циклами), содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатомов, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-10-членный гетероарилʺ). В гетероарильных группах, которые содержат один или несколько атомов азота, точка присоединения может представлять собой атом углерода или азота, как позволяет валентность. Гетероарильные бициклические кольцевые системы могут включать один или несколько гетероатомов в одном или обоих кольцах. ʺГетероарилʺ включает кольцевые системы, где гетероарильное кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклильными или гетероциклильными группами, где точка присоединения находится на гетероарильном кольце, и в таких случаях количество кольцевых членов продолжает определение количества кольцевых членов в гетероарильной кольцевой системе. ʺГетероарилʺ также включает кольцевые системы, где гетероарильное кольцо, определенное выше, является конденсированным с одной или несколькими арильными группами, где точка присоединения находится либо на арильном, либо на гетероарильном кольце, и в таких случаях количество кольцевых членов означает количество кольцевых членов в конденсированной (арил/гетероарил) кольцевой системе. Бициклические гетероарильные группы, где одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил и подобные), точка присоединения может быть на любом кольце, т.е. либо на кольце, содержащем гетероатом (например, 2-индолил), либо на кольце, которое не содержит гетероатом (например, 5-индолил).
В некоторых вариантах осуществления гетероарильная группа представляет собой 5-10-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-10-членный гетероарилʺ). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-8-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-8-членный гетероарилʺ). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-6-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-6-членный гетероарилʺ). В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1-3 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1-2 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1 кольцевой гетероатом, выбранный из азота, кислорода и серы. Если не указано иное, в каждом случае гетероарильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный гетероарилʺ) или замещенной (ʺзамещенный гетероарилʺ) одним или несколькими заместителями. В некоторых вариантах осуществления гетероарильная группа представляет собой незамещенный 5-14-членный гетероарил. В некоторых вариантах осуществления гетероарильная группа представляет собой замещенный 5-14-членный гетероарил.
Примеры 5-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, пирролил, фуранил и тиофенил. Примеры 5-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Примеры 5-членных гетероарильных групп, содержащих три гетероатома, включают, без ограничения, триазолил, оксадиазолил и тиадиазолил. Примеры 5-членных гетероарильных групп, содержащих четыре гетероатома, включают, без ограничения, тетразолил. Примеры 6-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, пиридинил. Примеры 6-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения, пиридазинил, пиримидинил и пиразинил. Примеры 6-членных гетероарильных групп, содержащих три или четыре гетероатома, включают, без ограничения, триазинил и тетразинил, соответственно. Примеры 7-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, азепинил, оксепинил и тиепинил. Примеры 5,6-бициклических гетероарильных групп включают, без ограничения, индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Примеры 6,6-бициклических гетероарильных групп включают, без ограничения, нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
Примеры репрезентативных гетероарилов включают следующие формулы:

где каждый Y выбран из карбонила, N, NR65, O и S; и R65 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил и 5-10-членный гетероарил.
ʺКарбоциклилʺ или ʺкарбоциклическийʺ относится к радикалу, включающему неароматическую циклическую углеводородную группу, содержащую от 3 до 10 кольцевых атомов углерода (ʺC3-10 карбоциклилʺ) и ноль гетероатомов в неароматической кольцевой системе. В некоторых вариантах осуществления карбоциклильная группа содержит от 3 до 8 кольцевых атомов углерода (ʺC3-8 карбоциклилʺ). В некоторых вариантах осуществления карбоциклильная группа содержит от 3 до 6 кольцевых атомов углерода (ʺC3-6 карбоциклилʺ). В некоторых вариантах осуществления карбоциклильная группа содержит от 3 до 6 кольцевых атомов углерода (ʺC3-6 карбоциклилʺ). В некоторых вариантах осуществления карбоциклильная группа содержит от 5 до 10 кольцевых атомов углерода (ʺC5-10 карбоциклилʺ). Примеры C3-6 карбоциклильных групп включают, без ограничения, циклопропил (C3), циклопропенил (C3), циклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и подобные. Примеры C3-8 карбоциклильных групп включают, без ограничения, указанные выше C3-6 карбоциклильные группы, а также циклогептил (C7), циклогептенил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), циклооктенил (C8), бицикло[2.2.1]гептанил (C7), бицикло[2,2,2]октанил (C8) и подобные. Примеры C3-10 карбоциклильных групп включают, без ограничения, указанные выше C3-8 карбоциклильные группы, а также циклононил (C9), циклононенил (C9), циклодецил (C10), циклодеценил (C10), октагидро-1H-инденил (C9), декагидронафталенил (C10), спиро[4,5]деканил (C10) и подобные. Как проиллюстрировано в представленных выше примерах, в некоторых вариантах осуществления карбоциклильная группа является либо моноциклической (ʺмоноциклический карбоциклилʺ), либо содержит конденсированную, связанную мостиковой связью или спиро кольцевую систему, такую как бициклическая система (ʺбициклический карбоциклилʺ), и может быть насыщенной или может быть частично ненасыщенной. ʺКарбоциклилʺ также включает кольцевые системы, где карбоциклильное кольцо, определенное выше, является конденсированным с одной или несколькими арильными или гетероарильными группами, где точка присоединения находится на карбоциклильном кольце, и в таких случаях количество атомов углерода продолжает определение количества атомов углерода в карбоциклической кольцевой системе. Если не указано иное, в каждом случае карбоциклильная группа независимо является необязательно замещенной, т.е. незамещенной (ʺнезамещенный карбоциклилʺ) или замещенной (ʺзамещенный карбоциклилʺ) одним или несколькими заместителями. В некоторых вариантах осуществления карбоциклильная группа представляет собой незамещенный C3-10 карбоциклил. В некоторых вариантах осуществления карбоциклильная группа представляет собой замещенный C3-10 карбоциклил.
В некоторых вариантах осуществления ʺкарбоциклилʺ представляет собой моноциклическую насыщенную карбоциклильную группу, содержащую от 3 до 10 кольцевых атомов углерода (ʺC3-10 циклоалкилʺ). В некоторых вариантах осуществления циклоалкильная группа содержит от 3 до 8 кольцевых атомов углерода (ʺC3-8 циклоалкилʺ). В некоторых вариантах осуществления циклоалкильная группа содержит от 3 до 6 кольцевых атомов углерода (ʺC3-6 циклоалкилʺ). В некоторых вариантах осуществления циклоалкильная группа содержит от 5 до 6 кольцевых атомов углерода (ʺC5-6 циклоалкилʺ). В некоторых вариантах осуществления циклоалкильная группа содержит от 5 до 10 кольцевых атомов углерода (ʺC5-10 циклоалкилʺ). Примеры C5-6 циклоалкильных групп включают циклопентил (C5) и циклогексил (C5). Примеры C3-6 циклоалкильных групп включают указанные выше C5-6 циклоалкильные группы, а также циклопропил (C3) и циклобутил (C4). Примеры C3-8 циклоалкильных групп включают указанные выше C3-6 циклоалкильные группы, а также циклогептил (C7) и циклооктил (C8). Если не указано иное, в каждом случае циклоалкильная группа независимо является незамещенной (ʺнезамещенный циклоалкилʺ) или замещенной (ʺзамещенный циклоалкилʺ) одним или несколькими заместителями. В некоторых вариантах осуществления циклоалкильная группа представляет собой незамещенный C3-10 циклоалкил. В некоторых вариантах осуществления циклоалкильная группа представляет собой замещенный C3-10 циклоалкил.
ʺГетероциклилʺ или ʺгетероциклическийʺ относится к радикалу, включающему 3-10-членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния (ʺ3-10-членный гетероциклилʺ). В гетероциклильных группах, которые содержат один или несколько атомов азота, точка присоединения может представлять собой атом углерода или азота, как позволяет валентность. Гетероциклильная группа может представлять собой либо моноциклическую (ʺмоноциклический гетероциклилʺ), либо конденсированную, связанную мостиковой связью или спиро кольцевую систему, такую как бициклическая система (ʺбициклический гетероциклилʺ), и может быть насыщенной или может быть частично ненасыщенной. Гетероциклильные бициклические кольцевые системы могут включать один или несколько гетероатомов в одном или обоих кольцах. ʺГетероциклилʺ также включает кольцевые системы, где гетероциклильное кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклильными группами, где точка присоединения находится либо на карбоциклильном, либо на гетероциклильном кольце, или кольцевые системы, где гетероциклильное кольцо, определенное выше, является конденсированным с одной или несколькими арильными или гетероарильными группами, где точка присоединения находится на гетероциклильном кольце, и в таких случаях, количество кольцевых членов продолжает определение количества кольцевых членов в гетероциклильной кольцевой системе. Если не указано иное, в каждом случае гетероциклил независимо является необязательно замещенным, т.е. незамещенным (ʺнезамещенный гетероциклилʺ) или замещенным (ʺзамещенный гетероциклилʺ) одним или несколькими заместителями. В некоторых вариантах осуществления гетероциклильная группа представляет собой незамещенный 3-10-членный гетероциклил. В некоторых вариантах осуществления гетероциклильная группа представляет собой замещенный 3-10-членный гетероциклил.
В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-10-членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния (ʺ5-10-членный гетероциклилʺ). В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-8-членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-8-членный гетероциклилʺ). В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-6-членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода и серы (ʺ5-6-членный гетероциклилʺ). В некоторых вариантах осуществления 5-6-членный гетероциклил содержит 1-3 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил содержит 1-2 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил содержит один кольцевой гетероатом, выбранный из азота, кислорода и серы.
Примеры 3-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, азиридинил, оксиранил, тиоренил. Примеры 4-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, азетидинил, оксетанил и тиетанил. Примеры 5-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Примеры 5-членных гетероциклильных групп, содержащих два гетероатома, включают, без ограничения, диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Примеры 5-членных гетероциклильных групп, содержащих три гетероатома, включают, без ограничения, триазолинил, оксадиазолинил и тиадиазолинил. Примеры 6-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Примеры 6-членных гетероциклильных групп, содержащих два гетероатома включают, без ограничения, пиперазинил, морфолинил, дитианил, диоксанил. Примеры 6-членных гетероциклильных групп, содержащих два гетероатома включают, без ограничения, триазинанил. Примеры 7-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, азепанил, оксепанил и тиепанил. Примеры 8-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, азоканил, оксеканил и тиоканил. Примеры 5-членных гетероциклильных групп, конденсированных с C6 арильным кольцом (также указывается в настоящей заявке как 5,6-бициклическое гетероциклическое кольцо), включают, без ограничения, индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и подобные. Примеры 6-членных гетероциклильных групп, конденсированных с арильным кольцом (также указывается в настоящей заявке как 6,6-бициклическое гетероциклическое кольцо), включают, без ограничения, тетрагидрохинолинил, тетрагидроизохинолинил и подобные.
Конкретные примеры гетероциклильных групп показаны в следующих иллюстративных примерах:

где каждый W выбран из CR67, C(R67)2, NR67, O и S; и каждый Y выбран из NR67, O и S; и R67 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил и 5-10-членный гетероарил. Эти гетероциклильные кольца необязательно могут быть замещены одной или несколькими группами, выбранными из группы, состоящей из ацила, ациламино, ацилокси, алкокси, алкоксикарбонила, алкоксикарбониламино, амино, замещенного амино, аминокарбонила (например, амидо), аминокарбониламино, аминосульфонила, сульфониламино, арила, арилокси, азидо, карбоксила, циано, циклоалкила, галогена, гидрокси, кето, нитро, тиола, -S-алкила, -S-арила, -S(O)-алкила, -S(O)-арила, -S(O)2-алкила и -S(O)2-арила. Замещающие группы включают карбонил или тиокарбонил, которые обеспечивают, например, лактамные и мочевинные производные.
ʺАцилʺ относится к радикалу -C(O)R20, где R20 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, которые определены в настоящей заявке. ʺАлканоилʺ представляет собой ацильную группу, где R20 представляет собой группу, отличную от водорода. Репрезентативные ацильные группы включают, но не ограничиваются этим, формил (-CHO), ацетил (-C(=O)CH3), циклогексилкарбонил, циклогексилметилкарбонил, бензоил (-C(=O)Ph), бензилкарбонил (-C(=O)CH2Ph), -C(O)-C1-C8 алкил, -C(O)-(CH2)t(C6-C10 арил), -C(O)-(CH2)t(5-10-членный гетероарил), -C(O)-(CH2)t(C3-C10 циклоалкил) и -C(O)-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число, имеющее значение от 0 до 4. В некоторых вариантах осуществления R21 представляет собой C1-C8 алкил, замещенный галогеном или гидрокси; или C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
ʺАциламиноʺ относится к радикалу -NR22C(O)R23, где в каждом случае R22 и R23 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, которые определены в настоящей заявке, или R22 представляет собой амино-защитную группу. Примеры ʺациламиноʺ групп включают, но не ограничиваются этим, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметил-карбониламино, бензоиламино и бензилкарбониламино. Конкретные примеры ʺациламиноʺ групп включают -NR24C(O)-C1-C8 алкил, -NR24C(O)-(CH2)t(C6-C10 арил), -NR24C(O)-(CH2)t(5-10-членный гетероарил), -NR24C(O)-(CH2)t(C3-C10 циклоалкил) и -NR24C(O)-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число, имеющее значение от 0 до 4, и каждый R24 независимо представляет собой водород или C1-C8 алкил. В некоторых вариантах осуществления R25 представляет собой H, C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; и R26 представляет собой H, C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; при условии, что по меньшей мере один из R25 и R26 является отличным от H.
ʺАцилоксиʺ относится к радикалу -OC(O)R27, где R27 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, которые определены в настоящей заявке. Репрезентативные примеры включают, но не ограничиваются этим, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил и бензилкарбонил. В некоторых вариантах осуществления R28 представляет собой C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
ʺАлкоксиʺ относится к группе -OR29, где R29 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Конкретные алкокси группы представляют собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Конкретные алкокси группы представляют собой низший алкокси, т.е. содержащий от 1 до 6 атомов углерода. Другие конкретные алкокси группы содержат от 1 и 4 атомов углерода.
В некоторых вариантах осуществления R29 представляет собой группу, которая содержит 1 или более заместителей, например, от 1 до 5 заместителей и, в частности, от 1 до 3 заместителей, в частности, 1 заместитель, выбранный из группы, состоящей из амино, замещенного амино, C6-C10 арила, арилокси, карбоксила, циано, C3-C10 циклоалкила, 4-10-членного гетероциклила, галогена, 5-10-членного гетероарила, гидрокси, нитро, тиоалкокси, тиоарилокси, тиола, алкил-S(O)-, арил-S(O)-, алкил-S(O)2- и арил-S(O)2-. Примеры ʺзамещенных алкоксиʺ групп включают, но не ограничиваются этим, -O-(CH2)t(C6-C10 арил), -O-(CH2)t(5-10-членный гетероарил), -O-(CH2)t(C3-C10 циклоалкил) и -O-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число, имеющее значение от 0 до 4, и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы, сами могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Конкретные примеры ʹзамещенных алкоксиʹ групп представляют собой -OCF3, -OCH2CF3, -OCH2Ph, -OCH2-циклопропил, -OCH2CH2OH и -OCH2CH2Nme2.
ʺАминоʺ относится к радикалу -NH2.
ʺЗамещенный аминоʺ относится к амино группе формулы -N(R38)2, где R38 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или амино-защитную группу, где по меньшей мере один из R38 не является водородом. В некоторых вариантах осуществления каждый R38 независимо выбран из водорода, C1-C8 алкила, C3-C8 алкенила, C3-C8 алкинила, C6-C10 арила, 5-10-членного гетероарила, 4-10-членного гетероциклила или C3-C10 циклоалкила; или C1-C8 алкила, замещенного галогеном или гидрокси; C3-C8 алкенила, замещенного галогеном или гидрокси; C3-C8 алкинила, замещенного галогеном или гидрокси, или -(CH2)t(C6-C10 арил), -(CH2)t(5-10-членный гетероарил), -(CH2)t(C3-C10 циклоалкил) или -(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число, имеющее значение от 0 до 8, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; или обе R38 группы объединены вместе с образованием алкиленовой группы.
Примеры ʺзамещенных аминоʺ групп включают, но не ограничиваются этим, -NR39-C1-C8 алкил, -NR39-(CH2)t(C6-C10 арил), -NR39-(CH2)t(5-10-членный гетероарил), -NR39-(CH2)t(C3-C10 циклоалкил) и -NR39-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число, имеющее значение от 0 до 4, например, 1 или 2, каждый R39 независимо представляет собой водород или C1-C8 алкил; и любые присутствующие алкильные группы сами могут быть замещены галогеном, замещенным или незамещенным амино или гидрокси; и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы сами могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Для большей ясности нужно пояснить, что термин ʹзамещенный аминоʹ включает группы алкиламино, замещенный алкиламино, алкилариламино, замещенный алкилариламино, ариламино, замещенный ариламино, диалкиламино и замещенный диалкиламино, как они определены ниже. Замещенный амино охватывает как монозамещенные амино, так и дизамещенные амино группы.
ʺАзидоʺ относится к радикалу -N3.
ʺКарбамоилʺ или ʺамидоʺ относится к радикалу -C(O)NH2.
ʺЗамещенный карбамоилʺ или ʺзамещенный амидоʺ относится к радикалу -C(O)N(R62)2, где каждый R62 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или амино-защитную группу, где по меньшей мере один из R62 не является водородом. В некоторых вариантах осуществления R62 выбран из H, C1-C8 алкила, C3-C10 циклоалкила, 4-10-членного гетероциклила, C6-C10 арила и 5-10-членного гетероарила; или C1-C8 алкила, замещенного галогеном или гидрокси; или C3-C10 циклоалкила, 4-10-членного гетероциклила, C6-C10 арила или 5-10-членного гетероарила, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; при условии, что по меньшей мере один R62 является отличным от H.
ʺКарбоксиʺ относится к радикалу -C(O)OH.
ʺЦианоʺ относится к радикалу -CN.
ʺГидроксиʺ относится к радикалу -OH.
ʺНитроʺ относится к радикалу -NO2.
ʺЭтенилʺ относится к замещенному или незамещенному -(C=C)-. ʺЭтиленʺ относится к замещенному или незамещенному -(C-C)-. ʺЭтинилʺ относится к -(C≡C)-.
ʺАзот-содержащая гетероциклильнаяʺ группа означает 4-7-членную неароматическую циклическую группу, содержащую по меньшей мере один атом азота, например, но без ограничения, морфолин, пиперидин (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например, 2-пирролидинил и 3-пирролидинил), азетидин, пирролидон, имидазолин, имидазолидинон, 2-пиразолин, пиразолидин, пиперазин и N-алкилпиперазины, такие как N-метилпиперазин. Конкретные примеры включают азетидин, пиперидон и пиперазон.
Алкильные, алкенильные, алкинильные, карбоциклильные, гетероциклильные, арильные и гетероарильные группы, определенные в настоящей заявке, необязательно являются замещенными (например, ʺзамещеннаяʺ или ʺнезамещеннаяʺ алкильная, ʺзамещеннаяʺ или ʺнезамещеннаяʺ алкенильная, ʺзамещеннаяʺ или ʺнезамещеннаяʺ алкинильная, ʺзамещеннаяʺ или ʺнезамещеннаяʺ карбоциклильная, ʺзамещеннаяʺ или ʺнезамещеннаяʺ гетероциклильная, ʺзамещеннаяʺ или ʺнезамещеннаяʺ арильная или ʺзамещеннаяʺ или ʺнезамещеннаяʺ гетероарильная группа). Как правило, термин ʺзамещенныйʺ, независимо от того, предшествует ему термин ʺнеобязательноʺ или нет, означает, что по меньшей мере один атом водорода, присутствующий в группе (например, на атоме углерода или азота), заменяется допустимым заместителем, например, заместителем, который при замещении приводит к стабильному соединению, например, соединению, которое не подвргается спонтанной трансформации, например, перегруппировке, циклизации, элиминированию или другой реакции. Если не указано иное, ʺзамещеннаяʺ группа содержит заместитель в одном или нескольких замещаемых положениях группы, и когда больше чем одно положение в любой определенной структуре является замещенным, заместители являются либо одинаковыми, либо разными в каждом положении. Термин ʺзамещенныйʺ предполагается как включающий замещение всеми допустимыми заместителями органических соединений, любым из заместителей, описанных в настоящей заявке, что приводит к образованию стабильного соединения. Настоящее изобретение предусматривает любые возможные такие комбинации, чтобы можно было выйти на стабильное соединение. Для целей настоящего изобретения гетероатомы, такие как азот, могут иметь водородные заместители и/или любой подходящий заместитель, как описано в настоящей заявке, которые удовлетворяют валентностям гетероатомов и приводят к образованию стабильного соединения.
Примеры заместителей на атомах углерода включают, но не ограничиваются этим, галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)2, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -Osi(Raa)3 -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)2Raa, -OP(=O)2Raa, -P(=O)(Raa)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)2N(Rbb)2, -OP(=O)2N(Rbb)2, -P(=O)(NRbb)2, -OP(=O)(NRbb)2, -NRbbP(=O)(ORcc)2, -NRbbP(=O)(NRbb)2, -P(Rcc)2, -P(Rcc)3, -OP(Rcc)2, -OP(Rcc)3, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членный гетероарил, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами;
в каждом случае Raa независимо выбран из C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две Raa группы объединены вместе с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами;
в каждом случае Rbb независимо выбран из водорода, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две Rbb группы объединены вместе с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами;
в каждом случае Rcc независимо выбран из водорода, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклил, C6-14 арила и 5-14-членного гетероарила, или две Rcc группы объединены вместе с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами;
в каждом случае Rdd независимо выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2,-NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(=O)Ree, -Si(Ree)3, -Osi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)2Ree, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10-членного гетероциклила, C6-10 арила, 5-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rgg группами;
в каждом случае Ree независимо выбран из C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, C6-10 арила, 3-10-членного гетероциклила и 3-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rgg группами;
в каждом случае Rff независимо выбран из водорода, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10-членного гетероциклила, C6-10 арила и 5-10-членного гетероарила, или две Rff группы объединены вместе с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rgg группами; и
в каждом случае Rgg независимо представляет собой галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -OC1-6 алкил, -ON(C1-6 алкил)2, -N(C1-6 алкил)2, -N(C1-6 алкил)3+X-, -NH(C1-6 алкил)2+X-, -NH2(C1-6 алкил)+X-, -NH3+X-, -N(OC1-6 алкил)(C1-6 алкил), -N(OH)(C1-6 алкил), -NH(OH), -SH, -SC1-6 алкил, -SS(C1-6 алкил), -C(=O)(C1-6 алкил), -CO2H, -CO2(C1-6 алкил), -OC(=O)(C1-6 алкил), -OCO2(C1-6 алкил), -C(=O)NH2, -C(=O)N(C1-6 алкил)2, -OC(=O)NH(C1-6 алкил), -NHC(=O)(C1-6 алкил), -N(C1-6 алкил)C(=O)(C1-6 алкил), -NHCO2(C1-6 алкил), -NHC(=O)N(C1-6 алкил)2, -NHC(=O)NH(C1-6 алкил), -NHC(=O)NH2, -C(=NH)O(C1-6 алкил),-OC(=NH)(C1-6 алкил), -OC(=NH)OC1-6 алкил, -C(=NH)N(C1-6 алкил)2, -C(=NH)NH(C1-6 алкил), -C(=NH)NH2, -OC(=NH)N(C1-6 алкил)2, -OC(NH)NH(C1-6 алкил), -OC(NH)NH2, -NHC(NH)N(C1-6 алкил)2, -NHC(=NH)NH2, -NHSO2(C1-6 алкил), -SO2N(C1-6 алкил)2, -SO2NH(C1-6 алкил), -SO2NH2,-SO2C1-6 алкил, -SO2OC1-6 алкил, -OSO2C1-6 алкил, -SOC1-6 алкил, -Si(C1-6 алкил)3, -Osi(C1-6 алкил)3 -C(=S)N(C1-6 алкил)2, C(=S)NH(C1-6 алкил), C(=S)NH2, -C(=O)S(C1-6 алкил), -C(=S)SC1-6 алкил, -SC(=S)SC1-6 алкил, -P(=O)2(C1-6 алкил), -P(=O)(C1-6 алкил)2, -OP(=O)(C1-6 алкил)2, -OP(=O)(OC1-6 алкил)2, C1-6 алкил, C1-6 пергалогеналкил, C2-6 алкенил, C2-6 алкинил, C3-10 карбоциклил, C6-10 арил, 3-10-членный гетероциклил, 5-10-членный гетероарил; где X- представляет собой противоион.
ʺПротивоионʺ или ʺанионный противоионʺ представляет собой отрицательно заряженную группу, связанную с катионной четвертичной аминогруппой в целях поддержания электронной нейтральности. Примеры противоионов включают ионы галогенов (например, F-, Cl-, Br-, I-), NO3-, ClO4-, OH-, H2PO4-, HSO4-, сульфонатные ионы (например, метансульфонат, трифторметансульфонат, п-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафталин-2-сульфонат, нафталин-1-сульфоновая кислота-5-сульфонат, этан-1-сульфоновая кислота-2-сульфонат и подобные) и карбоксилатные ионы (например, ацетат, этаноат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят и подобные).
Атомы азота могут быть замещенными или незамещенными, как позволяет валентность, и включают первичные, вторичные, третичные и четвертичные атомы азота. Примеры заместителей по атомам азота включают, но не ограничиваются этим, водород, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членный гетероарил, или две Rcc группы, присоединенные к атому азота, объединены вместе с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами, и где Raa, Rbb, RccиRdd имеют значение, определенное выше.
В некоторых вариантах осуществления заместитель, присутствующий на атоме азота, представляет собой амино-защитную группу (также указывается в настоящей заявке как азот-защитная группа). Амино-защитные группы включают, но не ограничиваются этим, -OH, -ORaa, -N(Rcc)2, -C(=O)Raa, -C(=O)ORaa, -C(=O)N(Rcc)2, -S(=O)2Raa, -C(=NRcc)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, C1-10 алкильные, C2-10 алкенильные, C2-10 алкинильные, C3-10 карбоциклильные, 3-14-членные гетероциклильные, C6-14 арильные и 5-14-членные гетероарильные группы, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 Rdd группами, и где Raa, Rbb, RccиRdd имеют значение, определенное в настоящей заявке. Амино-защитные группы хорошо известны в данной области техники и включают группы, подробно описанные в Protecting Groups in Organic Synthesis, T. W. Greene and P. G. M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенном в настоящую заявку посредством ссылки.
Примеры амино-защитных групп включают, но не ограничиваются этим, амидные группы (например, -C(=O)Raa), которые включают, но не ограничиваются этим, формамид и ацетамид; карбаматные группы (например, -C(=O)ORaa), которые включают, но не ограничиваются этим, 9-флуоренилметилкарбамат (Fmoc), трет-бутилкарбамат (BOC) и бензилкарбамат (Cbz); сульфонамидные группы (например, -S(=O)2Raa), которые включают, но не ограничиваются этим, п-толуолсульфонамид (Ts), метансульфонамид (Ms) и N-[2-(триметилсилил)этокси]метиламин (SEM).
В некоторых вариантах осуществления заместитель, присутствующий на атоме кислорода, представляет собой кислород-защитную группу (также называемую гидроксил-защитной группой). Кислород-защитные группы включают, но не ограничиваются этим, -Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3,-P(Rcc)2, -P(Rcc)3, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)2N(Rbb)2 и -P(=O)(NRbb)2, где Raa, Rbb и Rcc имеют значение, определенное в настоящей заявке. Кислород-защитные группы хорошо известны в данной области техники и включают группы, подробно описанные в Protecting Groups in Organic Synthesis, T. W. Greene and P. G. M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенном в настоящую заявку посредством ссылки.
Примеры кислород-защитных групп включают, но не ограничиваются этим, метил, метоксилметил (MOM), 2-метоксиэтоксиметил (MEM), бензил (Bn), триизопропилсилил (TIPS), трет-бутилдиметилсилил (TBDMS), трет-бутилметоксифенилсилил (TBMPS), метансульфонат (мезилат) и тозилат (Ts).
В некоторых вариантах осуществления заместитель, присутствующий на атоме серы, представляет собой сера-защитную группу (также называемую как тиол-защитная группа). Сера-защитные группы включают, но не ограничиваются этим, -Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3,-P(Rcc)2, -P(Rcc)3, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)2N(Rbb)2 и -P(=O)(NRbb)2, где Raa, Rbb и Rcc имеют значение, определенное в настоящей заявке. Сера-защитные группы хорошо известн в данной области техники и включают групп, подробно описанные в Protecting Groups in Organic Synthesis, T. W. Greene and P. G. M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенном в настоящую заявку посредством ссылки.пример
Эти и другие типичные заместители описаны более подробно в Подробном описании, Примерах и Формуле изобретения. Настоящее изобретение не должно ограничиваться каким-либо образом представленным выше иллюстративным перечнем заместителей.
Другие определения
Как используется в настоящей заявке, термин ʺмодуляцияʺ означает ингибирование или потенцирование функции рецепторов ГАМК. ʺМодуляторʺ (например, модуляторное соединение) может быть, например, агонистом, частичным агонистом, антагонистом или частичным антагонистом рецептора ГАМК.
ʺФармацевтически приемлемыйʺ означает одобренный или утверждаемый государственным регулирующим органом или правительством штата или соответствующиим органом в других странах, кроме США, или указанный в Фармакопее США или другой общепризнанной фармакопее для применения для животных, в частности, для человека.
ʺФармацевтически приемлемая сольʺ относится к соли соединения по настоящему изобретению, которая является фармацевтически приемлемой и которая обладает желаемой фармакологической активностью исходного соединения. В частности, такие соли являются нетоксичными и могут представлять собой кислотно-аддитивные соли, образованные с неорганическими или органическими кислотами, и основно-аддитивные соли. В частности, такие соли включают: (1) кислотно-аддитивные соли, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этан-дисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, оксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и подобные; или (2) соли, образованные, когда кислотный протон, присутствующий в исходном соединении, либо замещается ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо координирует с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и подобные. Соли дополнительно включают, только в качестве примера, соли натрия, калия, кальция, магния, аммония, тетраалкиламмония и подобные; и, когда соединение содержит щелочную функциональную группу, соли нетоксичных органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и подобные. Термин ʺфармацевтически приемлемый катионʺ относится к приемлемому катионному противоиону кислотной функциональной группы. Примерами таких катионов являются катионы натрия, калия, кальция, магния, аммония, тетраалкиламмония и подобные. См., например, Berge, et al., J. Pharm. Sci. (1977) 66(1): 1-79.
ʺСольватʺ относится к формам соединения, которые находятся в ассоциации с растворителем или водой (также указыввается как ʺгидратʺ), обычно в результате реакции сольволиза. Эта физическая ассоциация включает водородные связи. Обычные растворители включают воду, этанол, уксусную кислоту и т.п. Соединения по настоящему изобретению могут быть получены, например, в кристаллической форме и могут быть сольватированы или гидратированы. Подходящие сольваты включают фармацевтически приемлемые сольваты, такие как гидраты, и также включают как стехиометрические сольваты, так и нестехиометрические сольваты. В некоторых случаях сольват можно выделить, например, когда одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. ʺСольватʺ охватывает как находящиеся в фазе раствора, так и выделяемые сольваты. Репрезентативные сольваты включают гидраты, этаноляты и метаноляты.
Как используется в настоящей заявке, термин ʺизотопный вариантʺ относится к соединению, которое содержит неестественные пропорции изотопов по одному или нескольким атомам, которые составляют такое соединение. Например, ʺизотопный вариантʺ соединения может содержать один или несколько нерадиоактивных изотопов, таких как, например, дейтерий (2H или D), углерод-13 (13C), азот-15 (15N) или т.п. Должно быть понятно, что в соединении, где осуществляется такое изотопное замещение, следующие атомы, в случае их присутствия, могут изменяться, например, любой водород может представлять собой2H/D, любой углерод может представлять собой13C, или любой азот может представлять собой15N, и что присутствие и размещение таких атомов сможет определить специалист в данной области техники. Подобным образом, настоящее изобретение может включать получение изотопных вариантов с радиоизотопами, в случае, например, когда получаемые в результате соединения можно использовать для исследований распределения лекарственного средства и/или тканей субстрата. Радиоактивные изотопы тритий, т.е. 3H, и углерод-14, т.е. 14C, являются особенно полезными для этих целей, благодаря простоте их включения и легко доступных средств их детекции. Кроме того, можно получить соединения, которые замещены позитрон-испускающими изотопами, такими как11C,18F,15O и13N, и которые могут быть полезны в методах позитрон-эмиссионной томографии (PET) для исследований занятости рецептора субстратом. Предполагается, что все изотопные варианты соединений, представленных в настоящей заявке, радиоактивные или нет, охватываются объемом настоящего изобретения.
ʺСтереоизомерыʺ: также должно быть понятно, что соединения, которые имеют одинаковую молекулярную формулу, но различаются природой или последовательностью связывания их атомов или расположением их атомов в пространстве, называются ʺизомерами.ʺ Изомеры, которые отличаются расположением их атомов в пространстве, называются ʺстереоизомерамиʺ. Стереоизомеры, которые не являются зеркальными отображениями друг друга, называются ʺдиастереоизомерамиʺ, а те, которые являются несовпадающими при наложении зеркальными отображениями друг друга, называются ʺэнантиомерамиʺ. Когда соединение содержит асимметрический центр, например, связанный с четырьмя различными группами, возможна пара энантиомеров. Энантиомер может быть охарактеризован абсолютной конфигурацией его асимметрического центра и описывается правилами R- и S-последовательности Кана и Прелога, или способом, в котором молекула вращает плоскость поляризованного света, и обозначается как правовращающий или левовращающий (т.е. как (+) или (-)-изомеры, соответственно). Хиральное соединение может существовать либо как индивидуальный энантиомер, либо как их смесь. Смесь, содержащая равные пропорции энантиомеров, называется ʺрацемической смесьюʺ.
ʺТаутомерыʺ относятся к соединениям, которые являются взаимозаменяемыми формами определенной структуры соединения, и которые различаются по перемещению атомов водорода и электронов. Таким образом, две структуры могут находиться в равновесии за счет перемещения π-электронов и атома (обычно Н). Например, енолы и кетоны являются таутомерами, поскольку они быстро взаимопревращаются при обработке либо кислотой, либо основанием. Другим примером таутомерии является аци- и нитро- формы фенилнитрометана, которые также образуются при обработке кислотой или основанием. Таутомерные формы могут иметь значение для достижения оптимальной химической реакционной способности и биологической активности соединения, представляющего интерес.
ʺСубъектʺ, которому предусматривается введение, включает, но не ограничивается этим, человека (т.е. мужчины или женщины любого возраста, например, субъекты детского возраста (например, младенец, ребенок, подросток) или взрослые субъекты (например, молодые взрослые, среднего возраста, или пожилые взрослые)) и/или отличных от человека животных, например млекопитающих, таких как приматы (например, яванские макаки, макаки-резусы), крупный рогатый скот, свиньи, лошади, овцы, козы, грызуны, кошки и/или собаки. В некоторых вариантах осуществления субъект представляет собой человека. В некоторых вариантах осуществления субъект представляет собой отличное от человека животное. Термины ʺчеловекʺ, ʺпациентʺ и ʺсубъектʺ используются взаимозаменяемо в настоящем изобретении.
Заболевание, расстройство и состояние используются взаимозаменяемо в настоящем изобретении.
Как используется в настоящей заявке, и если не указано иное, термины ʺлечитьʺ, ʺлечащийʺ и ʺлечениеʺ предусматривают действие, которое имеет место, когда субъект страдает от указанного заболевания, расстройства или состояния, которое уменьшает тяжесть заболевания, расстройства или состояния, или замедляет прогрессирование заболевания, расстройства или состояния (ʺлечениеʺ), а также предусматривают действие, которое происходит до того, как субъект начинает страдать от указанного заболевания, расстройства или состояния (ʺпрофилактическое лечениеʺ).
Как правило, ʺэффективное количествоʺ соединения относится к количеству, достаточному для того, чтобы вызвать желаемый биологический ответ, например, для лечения ЦНС-связанного расстройства, и является достаточным для индукции анестезии или седации. Как должно быть понятно рядовым специалистам в данной области, эффективное количество соединения по настоящему изобретению может варьироваться в зависимости от таких факторов, как желаемый биологический результат, фармакокинетика соединения, заболевание, подлежащее лечению, способ введения, возраст, масса тела, здоровье и состояние субъекта. Эффективное количество охватывает терапевтическое и профилактическое лечение.
Как используется в настоящей заявке, и если не указано иное, ʺтерапевтически эффективное количествоʺ соединения представляет собой количество, достаточное для обеспечения терапевтического эффекта в лечении заболевания, расстройства или состояния, или для задержки проявления или минимизации одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием. Терапевтически эффективное количество соединения означает количество терапевтического средства, отдельно или в сочетании с другими методами лечения, которое обеспечивает терапевтический эффект в лечении заболевания, расстройства или состояния. Термин ʺтерапевтически эффективное количествоʺ может охватывать количество, которое улучшает общую терапию, снижает или предотвращает симптомы или причины заболевания или состояния, или повышает терапевтическую эффективность другого терапевтического средства.
Как используется в настоящей заявке, и если не указано иное, ʺпрофилактически эффективное количествоʺ соединения представляет собой количество, достаточное для предотвращения заболевания, расстройства или состояния, или одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием, или предотвращения их рецидива. Профилактически эффективное количество соединения означает количество терапевтического средства, отдельно или в комбинации с другими средствами, которое обеспечивает профилактическую пользу в профилактике заболевания, расстройства или состояния. Термин ʺпрофилактически эффективное количествоʺ может охватывать такое количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического средства.
Подробное описание некоторых вариантов осуществления изобретения
Как в общем виде описано в настоящей заявке, настоящее изобретение обеспечивает C21-замещенные нейроактивные стероиды, разработанные, например, для действия в качестве модуляторов ГАМК. В некоторых вариантах осуществления такие соединения предусматриваются как являющиеся полезными в качестве терапевтических средств для индукции анестезии и/или седации у субъекта. В некоторых вариантах осуществления такие соединения предусматриваются как являющиеся полезными в качестве терапевтических средств для лечения ЦНС-связанного расстройства.
Соединения
В одном аспекте, обеспечивается соединение формулы (I):

или его фармацевтически приемлемая соль; где: кольцо A представляет собой замещенный или незамещенный карбоциклил, гетероциклил, арил или гетероарил; R1 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил или замещенный или незамещенный C3-6карбоциклил; R2 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C3-6карбоциклил или -ORA2, где RA2 представляет собой водород или замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил; R3a представляет собой водород или -ORA3, где RA3 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R3b представляет собой водород; или R3a и R3b объединены вместе с образованием оксо (=O) группы; R4a представляет собой водород, замещенный или незамещенный C1-6алкил или -ORA4, где RA4 представляет собой водород, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-6алкинил или замещенный или незамещенный C3-6карбоциклил, и R4b представляет собой водород или замещенный или незамещенный C1-6алкил; R4a и R4b объединены вместе с образованием оксо (=O) группы; или R4a и R4b вместе с атомом углерода, к которому они присоединены, образуют кольцо (например, 3-6-членное кольцо (например, карбоциклильное или гетероциклильное кольцо). R7a представляет собой водород или галоген; R7b представляет собой водород; R5 отсутствует или представляет собой водород; и




В одном аспекте, обеспечивается фармацевтическая композиция, включающая соединение формулы (I), (Ia), (Ib), (Ic-1), (Ic-2), (II), (II-a1) или (II-a2) и фармацевтически приемлемый эксципиент.
В одном аспекте, обеспечивается способ индукции седации и/или анестезии у субъекта, включающий введение субъекту эффективного количества соединения формулы (I), (Ia), (Ib), (Ic-1), (Ic-2), (II), (II-a1) или (II-a2) или его фармацевтически приемлемой соли.
В одном аспекте, обеспечивается способ введения эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции соединения, описанного в настоящей заявке, например, соединения формулы (I), (Ia), (Ib), (Ic-1), (Ic-2), (II), (II-a1) или (II-a2), субъекту, нуждающемуся в этом, где субъект испытывает седацию и/или анестезию в пределах двух часов после введения.
В некоторых вариантах осуществления субъект испытывает седацию и/или анестезию в пределах одного часа после введения.
В некоторых вариантах осуществления субъект испытывает седацию и/или анестезию мгновенно.
В некоторых вариантах осуществления соединение вводят внутривенно.
В некоторых вариантах осуществления соединение вводят в течение длительного периода времени.
В некоторых вариантах осуществления субъект представляет собой млекопитающее. В некоторых вариантах осуществления субъект представляет собой человека.
В некоторых вариантах осуществления соединение вводят в комбинации с другим терапевтическим средством.
В одном аспекте, обеспечивается способ для лечения судорог у субъекта, включающий введение субъекту эффективного количества соединения формулы (I), (Ia), (Ib), (Ic-1), (Ic-2), (II), (II-a1) или (II-a2) или его фармацевтически приемлемой соли.
В одном аспекте, обеспечивается способ для лечения эпилепси или эпилептического статуса у субъекта, где способ включает введение субъекту эффективного количества соединения, описанного в настоящей заявке, например, соединения формулы (I), (Ia), (Ib), (Ic-1), (Ic-2), (II), (II-a1) или (II-a2) или его фармацевтически приемлемой соли.
В одном аспекте, обеспечивается способ для лечения расстройств, связанных с функцией ГАМК у субъекта, нуждающегося в этом, где способ включает введение субъекту терапевтически эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции одного из соединений, описанных в настоящей заявке, например, соединения формулы (I), (Ia), (Ib), (Ic-1), (Ic-2), (II), (II-a1) или (II-a2).
В одном аспекте, обеспечивается способ для лечения ЦНС-связанного расстройства у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения, описанного в настоящей заявке, например, соединения формулы (I), (Ia), (Ib), (Ic-1), (Ic-2), (II), (II-a1) или (II-a2) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления ЦНС-связанное расстройство представляет собой расстройство сна, расстройство настроения, такое как депрессия, расстройство шизофренического спектра, судорожное расстройство, расстройство памяти и/или познавательной способности, двигательное расстройство, расстройство личности, расстройство аутического спектра, боль, травматическое поражение головного мозга, сосудистое заболевание, расстройство, связанное с злоупотреблением психоактивными веществами, и/или синдром отмены или тиннитус. В некоторых вариантах осуществления субъект представляет собой субъекта с синдромом Ретта, синдромом ломкой X-хромосомы или синдромом Ангельмана.
В одном аспекте, обеспечивается набор, включающий твердую композицию, включающую соединение, описанное в настоящей заявке, например, соединение формулы (I), (Ia), (Ib), (Ic-1), (Ic-2), (II), (II-a1) или (II-a2); и стерильный разбавитель.
Фармацевтические композиции
В одном аспекте, настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение по настоящему изобретению (также указываемое как ʺактивный ингредиентʺ) и фармацевтически приемлемый эксципиент. В некоторых вариантах осуществления фармацевтическая композиция включает эффективное количество активного ингредиента. В некоторых вариантах осуществления фармацевтическая композиция включает терапевтически эффективное количество активного ингредиента. В некоторых вариантах осуществления фармацевтическая композиция включает профилактически эффективное количество активного ингредиента.
Фармацевтические композиции, представленные в настоящей заявке, можно вводить различными способами, включая, но не ограничиваясь этим, пероральное (энтеральное) введение, парентерального (путем инъекций) введение, ректальное введение, чрескожное введение, внутрикожное введение, интратекальное введение, подкожное (пк) введение, внутривенное(в/в) введение, внутримышечное(в/м) введение и интраназальное введение (например, назальный спрей).
Как правило, соединения, представленные в настоящей заявке, вводят в эффективном количестве. Фактически вводимое количество соединения, как правило, определяется врачом, в свете соответствующих обстоятельств, включая состояние, подлежащее лечению, выбранный путь введения, конкретное вводимое соединение, возраст, массу тела и реакцию конкретного пациента, тяжесть симптомов пациента и т.п.
При использовании для предотвращения развития ЦНС-расстройства соединения, представленные в настоящей заявке, следует вводить субъекту, имеющему риск развития такого состояния, как правило, по совету и под наблюдением лечащего врача, при дозах на уровнях, описанных выше. Субъекты, имеющие риск развития определенного состояния, как правило, включают тех, которые имеют семейную историю такого состояния, или тех, которые были идентифицированы в генетическом испытании или скрининге как особенно подверженные развитию этого состояния.
Фармацевтические композиции, представленные в настоящей заявке, можно вводить также в течение длительного периода времени (ʺхроническое введениеʺ). Хроническое введение относится к введению соединения или фармацевтической композиции в течение длительного периода времени, например, в течение 3 месяцей, 6 месяцев, 1 года, 2 лет, 3 лет, 5 лет и т.д., или может продолжаться бесконечно, например, до конца жизни субъекта. В некоторых вариантах осуществления, хроническое введение предназначено для обеспечения постоянного уровня этого соединения в крови, например, в рамках терапевтического окна, в течение длительного периода времени.
Фармацевтические композиции по настоящему изобретению также можно доставлять с использованием различных способов ввкедения. Например, в некоторых вариантах осуществления, фармацевтическую композицию можно вводить в виде болюса, например, в целях повышения концентрации соединения в крови до эффективного уровня. Размещение болюсной дозы зависит от желаемых системных уровней активного ингредиента по всему организму, например, внутримышечная или подкожная болюсная доза обеспечивает возможность медленного высвобождения активного ингредиента, тогда как болюс, доставляемый непосредственно в вену (например, через внутривенную капельницу), делает возможной значительно более быструю доставку, которая быстро повышает концентрацию активного ингредиента в крови до эффективного уровня. В других вариантах осуществления фармацевтическую композицию можно вводить в виде непрерывной инфузии, например, с помощью капельницы, чтобы обеспечить поддержание постоянной концентрации активного ингредиента в организме субъекта. Кроме того, в других вариантах осуществления фармацевтическую композицию можно вводить сначала в виде болюсной дозы, с последующей непрерывной инфузией.
Композиции для перорального введения могут принимать форму жидких растворов или суспензий, или сыпучих порошков. Наиболее типично, однако, эти композиции представлены в виде стандартных лекарственных форм для облегчения точного дозирования. Термин ʺстандартные лекарственные формыʺ относится к физически дискретным единицам, подходящим в качестве унитарных доз для человека и других млекопитающих, при этом каждая единица содержит предварительно определенное количество активного вещества, рассчитанное для получения желаемого терапевтического эффекта, в ассоциации с подходящим фармацевтическим эксципиентом. Типичные стандартные лекарственные формы включают предварительно заполненные ампулы или шприцы с предварительно отмеренными жидкими композициями, или пилюли, таблетки, капсулы или тому подобное в случае твердых композиций. В таких композициях соединение обычно представляет собой минорный компонент (от примерно 0,1 до примерно 50% масс., или предпочтительно от около 1 до около 40% масс.), а остальное количество составляют различные носители или эксципиенты и технологические добавки, полезные для формирования нужной лекарственной формы.
В случае перорального введения, репрезентативные схемы введения включают от одной до пяти, и особенно от двух до четырех, и типично три пероральные дозы в день. При использовании этих схем введения каждая доза обеспечивает от около 0,01 до около 20 мг/кг соединения, представленного в настоящей заявке, при этом предпочтительные дозы обеспечивают каждая от около 0,1 до около 10 мг/кг, и особенно от около 1 до около 5 мг/кг.
Дозы для чрескожного введения обычно выбирают так, чтобы обеспечить аналогичные или более низкие уровни в крови по сравнению с теми, которые достигаются при введении путем инъекции, как правило, в количестве от примерно 0,01 до примерно 20% масс., предпочтительно от около 0,1 до около 20% масс., предпочтительно от около 0,1 до около 10% масс., и более предпочтительно от около 0,5 до около 15% масс.
Уровни доз, вводимых путем инъекции, находятся в диапазоне от примерно 0,1 мг/кг/час до по меньшей мере 20 мг/кг/час, все в течение от около 1 до около 120 часов, и особенно от 24 до 96 часов. Предварительно нагружающий болюс от около 0,1 мг/кг до около 10 мг/кг и более можно вводить для достижения адекватных стабильных уровней. Максимальная общая доза не должна превышать 5 г/день для пациента, такого как человек с массой тела от 40 до 80 кг.
Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный носитель с буферами, суспендирующие и диспергирующие агенты, красители, ароматизаторы и тому подобное. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений аналогичной природы: связующее, такое как микрокристаллическая целлюлоза, камедь трагаканта или желатин; эксципиент, такой как крахмал или лактоза, разрыхлитель, такой как альгиновая кислота, Primogel или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; вещество, предотвращающее слипание, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как мята перечная, метилсалицилат или апельсиновая отдушка.
Основой композиций для инъекций обычно является стерильный физиологический раствор или фосфатно-солевой буферный раствор для инъекций или другие используемые для инъекций эксципиенты, известные в данной области техники. Как уже было описано выше, активное соединение в таких композициях обычно является минорным компонентом, часто состовляющим от 0,05 до 10% масс., а остальное количество составляет инъекционный эксципиент и тому подобное.
Композиции для чрескожного введения, как правило, формулируют в виде мази или крема для местного применения, содержащих активный ингредиент(ингредиенты). При формулировании в виде мази, активные ингредиенты обычно объединяют либо с парафиновой, либо со смешиваемой с водой основой для мази. Альтернативно, активные ингредиенты могут быть сформулированы в виде крема, например, с использованием масло-в-воде основы для крема. Такие лекарственные формы для чрескожного введения хорошо известны в данной области и, как правило, включают дополнительные ингредиенты для усиления проникновения через кожу и стабильности активных ингредиентов или композиции. Все эти известные лекарственные формы и ингредиенты для чрескожного введения включены в объем настоящего изобретения.
Соединения, представленные в настоящей заявке, также можно вводить при помощи трансдермального устройства. Соответственно, чрескожное введение можно осуществить с использованием пластыря либо резервуарного типа, либо типа пористой мембраны, или различных твердых матриц.
Описанные выше компоненты для вводимых перорально, путем инъекции или местным путем композиций являются просто репрезентативными. Другие вещества, а также технологии изготовления и т.п. описаны в Части 8 Remingtonʹs Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, который включен в настоящую заявку посредством ссылки.
Соединения по настоящему изобретению также можно вводить с использованием форм замедленного высвобождения или систем доставки с замедленным высвобождением лекарственного средства. Описание репрезентативных замедляющих высвобождение веществ можно найти в Remingtonʹs Pharmaceutical Sciences.
Настоящее изобретение также также относится к фармацевтически приемлемой кислотно-аддитивной соли соединения по настоящему изобретению. Кислота, которую можно использовать для получения фармацевтически приемлемой соли, представляет собой такую, которая образует нетоксичную кислотно-аддитивную соль, т.е. соль, содержащую фармакологически приемлемый анион, такую как гидрохлорид, гидроиодид, гидробромид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, сукцинат, малеат, фумарат, бензоат, пара-толуолсульфонат и подобные.
В другом аспекте, изобретение обеспечивает фармацевтическую композицию, включающую соединение по настоящему изобретению и фармацевтически приемлемый эксципиент, например, композицию, подходящую для инъекции, например, для внутривенного (в/в) введения.
Фармацевтически приемлемые эксципиенты включают любые возможные растворители или другие жидкие носители, диспергирующие или суспендирующие вспомогательные вещества, поверхностно-активные вещества, изотонические агенты, консерванты, смазывающие вещества и подобные вещества, которые являются подходящими для конкретной необходимой лекарственной формы, например, инъекции. Общие положения, касающиеся формулирования и/или изготовления фармацевтических композиций, можно найти, например, в Remingtonʹs Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) и в Remington: The Science and Practice of Pharmacy, 21st Edition (Lippincott Williams & Wilkins, 2005).
Например, препараты для инъекций, такие как стерильные водные суспензии для инъекций, могут быть сформулированы в соответствии со способами, известными из уровня техники, с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих веществ. Примеры эксципиентов, которые можно использовать, включают, но не ограничиваются этим, воду, стерильный физиологический раствор или фосфатно-солевой буферный раствор или раствор Рингера.
В некоторых вариантах осуществления, фармацевтическая композиция дополнительно включает производное циклодекстрина. Наиболее часто испоьзуемые циклодекстрины представляют собой α-, β- и γ- циклодекстрины, состоящие из 6, 7 и 8 α-1,4-связанных глюкозных звеньев, соответственно, необязательно включающие один или несколько заместителей на связанных группах сахаров, которые включают, но не ограничиваются этим, замещенные или незамещенные метилированные, гидроксиалкилированные, ацилированные и сульфоалкилэфирные замещения. В некоторых вариантах осуществления циклодекстрин представляет собой сульфоалкиловый эфир β-циклодекстрина, например, сульфобутиловый эфир β-циклодекстрина, также известный как Captisol®. См., например, U.S. 5376645. В некоторых вариантах осуществления композиция включает гексапропил-β-циклодекстрин. В более конкретном варианте осуществления композиция включает гексапропил-β-циклодекстрин (10-50% в воде).
Композиции для инъекций могут быть стерилизованы, например, путем фильтрации через бактериальный фильтр или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной инъекционной среде перед использованием.
Как правило, соединения, представленные в настоящей заявке, вводят в эффективном количестве. Фактически вводимое количество соединения, как правило, определяется врачом в свете соответствующих обстоятельств, включая состояние, подлежащее лечению, выбранный путь введения, конкретное вводимое соединение, возраст, массу тела и реакцию конкретного пациента, тяжесть симптомов пациента и т.п.
Композиции представлены в виде стандартных лекарственных форм для облегчения точного дозирования. Термин ʺстандартные лекарственные формыʺ относится к физически дискретным единицам, подходящим в качестве унитарных доз для человека и других млекопитающих, при этом каждая единица содержит предварительно определенное количество активного вещества, рассчитанное для получения желаемого терапевтического эффекта, в ассоциации с подходящим фармацевтическим эксципиентом. Типичные стандартные лекарственные формы включают предварительно заполненные ампулы или шприцы с предварительно отмеренными жидкими композициями. В таких композициях соединение обычно представляет собой минорный компонент (от примерно 0,1 до примерно 50% масс., или предпочтительно от около 1 до около 40% масс.), а остальное количество составляют различные носители или эксципиенты и технологические добавки, полезные для формирования нужной лекарственной формы.
Соединения, представленные в настоящей заявке, можно вводить в виде единственного активного вещества, или их можно вводить в комбинации с другими активными веществами. В одном аспекте, настоящее изобретение обеспечивает комбинацию соединения по настоящему изобретению и другого фармакологически активного средства. Введение в комбинации можно осуществить любым путем, известным специалистам в данной области, включая, например, раздельное, последовательное, одновременное и чередующееся введение.
Хотя описание фармацевтических композиций, обеспечиваемых в настоящем изобретении, главным образом направлено на фармацевтические композиции, которые являются подходящими для введения человеку, специалистам в данной области будет понятно, что подобные композиции обычно подходят для введения животным всех видов. Модификация фармацевтических композиций, которые являются подходящими для введения человеку, чтобы сделать эти композиции подходящими для введения различным животным, хорошо известна, и обычно опытный ветеринарный фармаколог может разработать и/или осуществить такие модификации с помощью обычных экспериментов. Общие положения, касающиеся формулирования и/или изготовления фармацевтических композиций, можно найти, например, в Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005.
Способы применения и лечения
Как в общем виде описано в настоящей заявке, настоящее изобретение направлено на C21-замещенные нейроактивные стероиды, предназначенные, например, для действия в качестве модуляторов ГАМК. В некоторых вариантах осуществления такие соединения предусматриваются как являющиеся полезными в качестве терапевтических средств для индукции анестезии и/или седации у субъекта. В некоторых вариантах осуществления такие соединения предусматриваются как являющиеся полезными в качестве терапевтических средств для лечения ЦНС-связанного расстройства (например, расстройства сна, расстройства настроения, такого как депрессия, расстройства шизофренического спектра, судорожного расстройства, расстройства памяти и/или познавательной способности, двигательного расстройства, расстройства личности, расстройства аутического спектра, боли, травматического поражения головного мозга, сосудистого заболевания, расстройства, связанного с злоупотреблением психоактивными веществами, и/или синдрома отмены или тиннитуса) у субъекта, нуждающегося в этом (например, субъекта с синдромом Ретта, синдромом ломкой X-хромосомы или синдромом Ангельмана).
Таким образом, в одном аспекте, настоящее изобретение обеспечивает способ индукции седации и/или анестезии у субъекта, включающий введение субъекту эффективного количества соединения по настоящему изобретению или композиции, включающей такое соединение. В некоторых вариантах осуществления соединение вводят внутривенно.
Более ранние исследования (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987)) показали, что определенные 3α-гидроксилированные стероиды на порядки более эффективны как модуляторы ГАМК рецепторного комплекса(GRC) по сравнению с другими, о которых были сообщения (см., например, Majewska et al., Science 232:1004-1007 (1986); Harrison et al., J Pharmacol. Exp. Ther. 241:346-353 (1987)). Majewska et al. и Harrison et al. указывают, что 3α-гидроксилированные-5-восстановленные стероиды могут демонстрировать только значительно более низкие уровни эффективности. In vitro и in vivo экспериментальные данные показали, что высокая эффективность этих стероидов делает их терапевтически полезными для модуляции возбудимости головного мозга через GRC (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987); Wieland et al., Psychopharmacology 118(l):65-71 (1995)).
Также были получены различные синтетические стероиды в качестве нейроактивных стероидов. См., например, патент США 5232917, который раскрывает нейроактивные стероидные соединения, используемые в лечении стресса, тревоги, бессонницы, судорожных расстройств и расстройств настроения, которые не поддаются лечению GRC-активными средствами, таких как депрессия, терапевтически благоприятным образом. Кроме того, было ранее показано, что эти стероиды взаимодействуют в уникальном сайте GRC, который отличается от других известных сайтов взаимодействия (например, барбитураты, бензодиазепины и ГАМК), где терапевтически благоприятное воздействие на стресс, беспокойство, сон, расстройства настроения и судорожные расстройства были ранее выявлены (см., например, Gee, K.W. and Yamamura, H.I., ʺBenzodiazepines and Barbiturates: Drugs for the Treatment of Anxiety, Insomnia and Seizure Disorders,ʺ в Central Nervous System Disorders, Horvell, ed., Marcel-Dekker, New York (1985), pp. 123-147; Lloyd, K.G. and Morselli, P.L., ʺPsychopharmacology of GABAergic Drugs,ʺ в Psychopharmacology: The Third Generation of Progress, H.Y. Meltzer, ed., Raven Press, N.Y. (1987), pp. 183-195; и Gee et al., European Journal of Pharmacology, 136:419-423 (1987). Эти соединения являются желательными, благодаря длительности их действия, эффективности и пероральной активности (вместе с другими формами введения).
Соединения по настоящему изобретению, как они описаны в настоящей заявке, в основном предназначены для модуляции функции ГАМК и, следовательно, для действия в качестве нейроактивных стероидов для лечения и профилактики ЦНС-связанных состояний у субъекта. Модуляция, как это используется в настоящей заявке, относится к ингибированию или потенцированию функции рецепторов ГАМК. Соответственно, соединения и фармацевтические композиции, представленные в настоящей заявке, находят применение в качестве терапевтических средств для профилактики и/или лечения состояний ЦНС у млекопитающих, включая человека и отличных от человека млекопитающих. Таким образом, и как указано ранее, настоящее изобретение включает в свой объем, и распространяется на, указанные способы лечения, а также на соединения для таких способов и на применение таких соединений для получения лекарственных средств, полезных для таких способов.
Примеры ЦНС состояний, связанных с ГАМК-модуляцией, включают, но не ограничиваются этим, расстройства сна например [бессонница], расстройства настроения [например, депрессия, дистимическое расстройство (например, легкая депрессия), биполярное расстройство (например, I и/или II), тревожные расстройства (например, генерализованное тревожное расстройство (GAD), социальное тревожное расстройство), стресс, посттравматическое стрессовое расстройство (PTSD), компульсивные расстройства (например, обсессивно-компульсивное расстройство (OCD))], расстройства шизофренического спектра [например, шизофрения, шизоаффективное расстройство], судорожные расстройства [например, эпилепсия (например, эпилептический статус (SE)), судороги], расстройства памяти и/или познавательной способности [например, расстройства внимания (например, синдром дефицита внимания и гиперактивности (ADHD)), деменцию (например, деменция альцгеймеровского типа, деменция с тельцами Леви, деменция сосудистого типа], двигательные расстройства [например, болезнь Хантингтона, болезнь Паркинсона], расстройства личности [например, антисоциальное расстройство личности, обсессивно-компульсивное расстройство личности], расстройства аутистического спектра (ASD) [например, аутизм, моногенетические причины аутизма, такие как синаптопатия, например, синдром Ретта, синдром ломкой Х-хромосомы, синдром Ангельмана], боль [например, невропатическая боль, связанные с травмами болевые синдромы, острая боль, хроническая боль], травматическое поражение головного мозга (TBI), сосудистые заболевания [например, инсульт, ишемия, пороки развития сосудов], расстройства, связанные с злоупотреблением психоактивными веществами, и/или синдром отмены [например, в дополнение к опиатам, кокаину и/или алкоголю] и шум в ушах.
Еще в одном аспекте представлена комбинация соединения по настоящему изобретению и другого фармакологически активного средства. Соединения, представленные в настоящей заявке, можно вводить как единственное активное средство, или их можно вводить в комбинации с другими средствами. Введение в сочетании можно осуществить любым способом, очевидным специалистам в данной области, включая, например, раздельное, последовательное, одновременное и чередующиееся введение.
В другом аспекте, обеспечивается способ лечения или профилактики возбудимости головного мозга у субъекта, предрасположенного к развитию, или страдающего от, состояния, связанного с возбудимостью головного мозга, включающий введение субъекту эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ лечения или профилактики стресса или тревожного состояния у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению или композиции, включающей такое соединение.
Еще в одном аспекте, обеспечивается способ облегчения или профилактики судорожной активности у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ облегчения или профилактики бессонницы у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению или композиции, включающей такое соединение.
Еще в одном аспекте, обеспечивается способ индукции сна и поддержания в значительной степени уровня REM сна, который присутствует в нормальном сне, где не происходит индукция существенной рикошетной бессонницы, включающий введение эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ облегчения или профилактики PMS или PND у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ лечения или профилактики расстройств настроения у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению. В некоторых вариантах осуществления расстройство настроения представляет собой депрессию.
Еще в одном аспекте, обеспечивается способ индукции анестезии у субъекта, включающий введение субъекту эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ улучшения познавательной способности или лечения расстройства памяти путем введения субъекту терапевтически эффективного количества соединения по настоящему изобретению. В некоторых вариантах осуществления расстройство представляет собой болезнь Альцгеймера. В некоторых вариантах осуществления расстройство представляет собой синдром Ретта.
Еще в одном аспекте, обеспечивается способ лечения расстройств внимания путем введения субъекту терапевтически эффективного количества соединения по настоящему изобретению. В некоторых вариантах осуществления расстройство внимания представляет собой ADHD.
В некоторых вариантах осуществления соединение вводят субъекту в течение длительного периода времени. В некоторых вариантах осуществления соединение вводят субъекту перорально, подкожно, внутримышечно или внутривенно.
Нейродегенеративные заболевания и расстройства
Соединения, описанные в настоящей заявке, можно использовать в способе, описанном в настоящей заявке, например, для лечения расстройств, описанных в настоящей заявке, таких как нейродегенеративное заболевание.
Термин ʺнейродегенеративные заболеванияʺ включает в себя заболевания и расстройства, связанные с прогрессирующей потерей структуры и функции нейронов или гибелью нейронов. Нейродегенеративные заболевания и расстройства включают, но не ограничиваются этим, болезнь Альцгеймера (включая ассоциированные с заболеванием симптомы легких, средней тяжести или тяжелых когнитивных нарушений); боковой амиотрофический склероз (ALS); бескислородные и ишемические повреждения; атаксию и судороги (в том числе для лечения и профилактики судорог, вызванных шизоаффективным расстройством или лекарственными средствами, используемыми для лечения шизофрении); доброкачественную забывчивость; отек головного мозга; мозжечковую атаксию, в том числе синдром нейроакантоцитоза Маклеода (MLS); закрытую черепно-мозговую травму; коматозное состояние; контузионную травму (например, травму спинного мозга и травму головы); деменции, в том числе мультиинфарктную деменцию и старческое слабоумие; расстройства сознания; синдром Дауна; медикаментозный или лекарственно-индуцированный Паркинсонизм (например, нейролептик-индуцированная острая акатизия, острая дистония, Паркинсонизм или поздняя дискинезия, нейролептический злокачественный синдром, или медикаментозно-индуцированной постуральный тремор); эпилепсию; синдром ломкой Х-хромосомы, синдром Жиля де ла Туретта; травму головы; нарушение и потерю слуха; болезнь Гентингтона; синдром Леннокса; леводопа-индуцированную дискинезию; умственную отсталость; двигательные нарушения, в том числе акинезии и акинетические (ригидные) синдромы (в том числе кальцификация базальных ганглиев, кортикобазальная дегенерация, множественная системная атрофия, комплекс Паркинсонизм-ALS деменция, болезнь Паркинсона, постэнцефалитический паркинсонизм, и прогрессирующий супрануклеарный паралич); мышечные спазмы и расстройства, связанные с мышечной спастичностью или слабостью, в том числе хорею (например, доброкачественная наследственная хорея, медикаментозная хорея, гемибаллизм, болезнь Гентингтона, нейроакантоцитоз, хорея Сиденгама и симптоматическая хорея), дискинезию (в том числе тики, такие как сложные тики, простые тики и симптоматические тики), миоклонус (включая генерализованный миоклонус и фокальный миоклонус), тремор (такой как тремор покоя, постуральный тремор и интенционный тремор) и дистонию (в том числе аксиальную дистонию, дистонический графоспазм, гемиплегическую дистонию, пароксизмальную дистонию и очаговую дистонию, такую как блефароспазм, оромандибулярная дистония и спазматическая дисфония, и кривошее); нейрональное повреждение, в том числе глазное повреждение, ретинопатию или дегенерацию желтого пятна глаза; нейротоксическое поражение вследствие церебрального инсульта, тромбоэмболического инсульта, геморрагического инсульта, церебральной ишемии, церебрального вазоспазма, гипогликемии, амнезии, гипоксии, аноксии, перинатальной асфиксии и остановки сердца; болезнь Паркинсона; судороги; эпилептическое состояние; инсульт; шум в ушах; тубулярный склероз и индуцированную вирусной инфекцией нейродегенерацию (например, в результате синдрома приобретенного иммунодефицита (СПИД) и энцефалопатий). Нейродегенеративные заболевания также включают, но не ограничиваются этим, нейротоксическое поражение вследствие церебрального инсульта, тромбоэмболического инсульта, геморрагического инсульта, церебральной ишемии, церебрального вазоспазма, гипогликемии, амнезии, гипоксии, аноксии, перинатальной асфиксии и остановки сердца. Способы лечения или предотвращения нейродегенеративного заболевания также включают лечение или предотвращение потери функции нейронов, характерной для нейродегенеративного расстройства.
Расстройства настроения
Соединения, описанные в настоящей заявке, можно использовать в способе, описанном в настоящей заявке, например, для лечения расстройств, описанных в настоящей заявке, таких как расстройство настроения.
Клиническая депрессия также известна как большая депрессия, большое депрессивное расстройство (MDD), тяжелая депрессия, униполярная депрессия, униполярное расстройство и периодическая депрессия, и относится к психическому расстройству, характеризующемуся первазивным и персистентным подавленным настроением, которое сопровождается низкой самооценкой и потерей интереса к, или удовольствия от, обычно приятной деятельности. Некоторые люди с клинической депрессией имеют проблемы со сном, теряют в весе и вообще чувствуют себя возбужденным и раздражительным. Клиническая депрессия влияет на то, как индивид чувствует, думает и ведет себя, и может привести к целому ряду эмоциональных и физических проблем. Люди с клинической депрессией могут иметь проблемы, связанные с обычной повседневной деятельностью, и у них может быть такое чувство, как будто жизнь не стоит того, чтобы жить.
Постнатальную депрессию (PND) также называют послеродовой депрессией (PPD), и она относится к типу клинической депрессии, которую испытывают женщины после родов. Симптомы могут включать печаль, усталость, изменение сна и режима питания, пониженное сексуальное влечение, эпизоды плача, беспокойство и раздражительность. В некоторых вариантах осуществления PND представляет собой резистентную к лечению депрессию (например, резистентную к лечению депрессию, описанную в настоящей заявке). В некоторых вариантах осуществления PND представляет собой рефрактерную депрессию (например, рефрактерную депрессию, описанную в настоящей заявке).
Атипичная депрессия (AD) характеризуется реактивностью настроения (например, парадоксальная ангедония) и положительной значительной прибавкой в весе или повышением аппетита. Пациенты, страдающие AD, также могут иметь чрезмерный сон или сонливость (гиперсомния), ощущение тяжести конечностей, а также существенное ухудшение социального поведения как следствие гиперчувствительности к воспринимаемому межличностному неприятию.
Меланхолическая депрессия характеризуется потерей удовольствия (ангедония) в большинстве или всех видах деятельности, отсутствием реакции на приятные стимулы, депрессивным настроением, более выраженным, чем при печалях или потерях, чрезмерной потерей веса или чрезмерным ощущением вины.
Психотическая большая депрессия (PMD) или психотическая депрессия относится к большому депрессивному эпизоду, в частности, меланхолического характера, где индивидуум испытывает психотические симптомы, такие как бред и галлюцинации.
Кататоническая депрессия относится к глубокой депрессии, сопровождающейся нарушениями двигательного поведения и другими симптомами. Субъект может находиться в состоянии онемения и отупения и либо быть недвижим, либо может выполнять бесцельные или странные движения.
Сезонное аффективное расстройство (SAD) относится к типу сезонной депрессии, когда субъект имеет сезонную картину депрессивных эпизодов, наступающих осенью или зимой.
Дистимия относится к состоянию, связанному с униполярной депрессией, где очевидны такие же физические и когнитивные проблемы. Они не такие тяжелые и имеют тенденцию длиться дольше (например, не менее 2 лет).
Двойная депрессия относится к довольно подавленному настроению (дистимия), которое длится не менее 2 лет и перемежается периодами большой депрессии.
Депрессивное расстройство личности (DPD) относится к расстройству личности с депрессивными признаками.
Рецидивирующая краткая депрессия (RBD) относится к состоянию, когда субъекты имеют депрессивные эпизоды примерно раз в месяц, при этом каждый эпизод продолжается в течение 2 недель или меньше, и обычно не превышает 2-3 дней.
Небольшое депрессивное расстройство или небольшая депрессия относится к депрессии, когда по меньшей мере 2 симптома присутствуют в течение 2 недель.
Биполярное расстройство или маниакально-депрессивное расстройство вызывает экстремальные перепады настроения, которые включают эмоциональные максимумы (мания или гипомания) и минимумы (депрессия). В периоды мании субъекты могут чувствовать себя или вести себя как аномально счастливые, энергичные или раздражительные. Они часто принимают непродуманные решения, мало заботясь о последствиях. Потребность в сне обычно снижается. В периоды депрессии могут появиться плаксивость, плохой зрительный контакт с другими и негативные взгляды на жизнь. Риск самоубийства среди лиц с таким расстройством является высоким, науровне более 6% за 20 лет, в то время как случаи самоповреждения составляют 30-40%. Другие проблемы психического здоровья, такие как тревожное расстройство и расстройство, связанное с употреблением психоактивных веществ, обычно ассоциируются с биполярным расстройством.
Депрессия, вызванная хроническими заболеваниями, относится к депрессии, вызванной хроническими заболеваниями, такими как рак или хронические боли, химиотерапия, хронический стресс.
Резистентная к лечению депрессия относится к состоянию, когда субъектов лечат от депрессии, но симптомы не улучшаются. Например, антидепрессанты или психологические консультации (психотерапия) не облегчают симптомы депрессии для лиц с резистентной к лечению депрессией. В некоторых случаях, у лиц с резистентной к лечению депрессией симптомы улучшаются, но снова возвращаются к прежнему состоянию. Рефрактерная депрессия возникает у пациентов, страдающих от депрессии, которые являются резистентными к стандартным фармакологическим методам лечения, включающим трициклические антидепрессанты, MAOIs, SSRIs и двойные и тройные ингибиторы поглощения и/или анксиолитические лекарственные средства, а также не-фармакологическим методам лечения (например, психотерапия, электросудорожная терапия, стимуляция блуждающего нерва и/или транскраниальная магнитная стимуляция).
Суицидальность, суицидальные мысли, суицидальное поведение относится к склонности индивидуума к совершению самоубийства. Суицидальные мысли относятся к мыслям о, или к необычной потребности в, самоубийстве. Диапазон суицидальных мыслей широко варьируется, например, от мимолетных мыслей до глубоких мыслей, детального планирования, проигрывания роли, неполных попыток. Симптомы включают разговоры о самоубийстве, подготовку средств для самоубийства, выход из социального контакта, озабоченность смертью, чувство попадания в ловушку или безнадежности ситуации, повышенное употребление алкоголя или наркотиков, рискованные или саморазрушающие поступки, прощание с людьми так, как-будто они не увидятся снова.
Предменструальное дисфорическое расстройство (PMDD) относится к тяжелому, порой с потерей дееспособности, продлению предменструального синдрома (PMS). PMDD вызывает экстремальные изменения настроения с симптомами, которые обычно начинаются за семь-десять дней до начала менструации и продолжаются в течение первых нескольких дней менструации. Симптомы включают печаль или безысходность, тревогу или напряжение, крайнюю капризность, и отмечаются раздражительность или гнев.
Симптомы депрессии включают постоянные тревожные или печальные чувства, чувство беспомощности, безнадежности, пессимизм, собственную никчемность, упадок сил, беспокойство, раздражительность, усталость, потерю интереса к приятной деятельности или хобби, отсутствие позитивных мыслей или планов, избыточный сон, переедание, потерю аппетита, бессонницу, самоповреждения, мысли о самоубийстве и попытки суицида. Наличие, тяжесть, частота и продолжительность симптомов может меняться от случая к случаю. Симптомы депрессии и их характер может быть подтвержден врачом или психологом (например, путем наблюдения психического состояния).
Тревожные расстройства
Соединения, описанные в настоящей заявке, можно использовать в способе, описанном в настоящей заявке, например, в лечении расстройства, описанного в настоящей заявке, такого как тревожное расстройство.
Тревожное расстройство - это общий термин, охватывающий несколько различных форм аномального и патологического страха и тревоги. Существующие психиатрические диагностические критерии признают широкий спектр тревожных расстройств.
Генерализованное тревожное расстройство - это распространенное хроническое заболевание, характеризующееся длительным беспокойством, которое не сосредоточено на каком-либо одном объекте или ситуации. Те, кто страдает генерализованным тревожным расстройством, испытывают неспецифический постоянный страх и беспокойство и становятся слишком озабочены повседневной жизнью. Генерализованное тревожное расстройство является наиболее распространенным тревожным расстройством, которым страдают пожилые люди.
При паническом расстройстве человек страдает от краткой атаки сильного ужаса и страха, при этом часто отмечаются дрожь, тремор, спутанность сознания, головокружение, тошнота, затрудненное дыхание. Эти панические атаки, определенные APA как страх или дискомфорт, которые резко возникают и достигают пика менее чем за десять минут, могут длиться в течение нескольких часов и могут быть спровоцированы стрессом, страхом или даже физическими нагрузками; хотя конкретная причина не всегда очевидна. В дополнение к повторяющимся неожиданным паническим атакам, диагноз панического расстройства требует также, чтобы эти атаки имели хронические последствия: либо переживания по поводу возможных потенциальных предпосылок таких атак, постоянный страх будущих атак, либо существенные изменения в поведении, связанные с этими атаками. Соответственно, те, кто страдает от панического расстройства, имеют симптомы даже за пределами конкретных панических эпизодов. Часто нормальные изменения в сердцебиении, которые замечают субъекты, страдающие паническим расстройством, наводят их на мысль, что у них что-то не так с сердцем, или доводят их до грани еще одного панического приступа. В некоторых случаях повышенная настороженность (сверхбдительность), связанная с функционированием организма, возникает во время панических атак, при этом любое ощущаемое физиологическое изменение интерпретируются как возможное угрожающее жизни заболевание (т.е. крайняя ипохондрия).
Обсессивно-компульсивное расстройство представляет собой тип тревожного расстройства, преимущественно характеризующегося повторяющимися навязчивыми состояниями (стресс, постоянные и навязчивые мысли или образы) и компульсиями (побуждения к выполнению конкретных действий или ритуалов). OCD паттерн мышления может быть связан с иррациональными предрассудками, поскольку он включает веру в причинные взаимосвязи, которые, в действительности, не существуют. Часто этот процесс абсолютно нелогичен, например, компульсивное побуждение ходить определенным образом может быть использовано для облегчения одержимости надвигающейся угрозы. И во многих случаях побуждение является совершенно необъяснимым, просто стремление завершить ритуал, вызванный нервозностью. В меньшинстве случаев, страдающие обсессивно-компульсивным расстройством могут испытывать только навязчивое состояние, без явных компульсивных побуждений; значительно меньшее количество больных испытывают только компульсивное побуждение.
Отдельной крупной категорией тревожных расстройств являются фобии, которые включают все случаи, в которых страх и тревога вызваны определенным стимулом или ситуацией. Страдающие фобией субъекты обычно предвидят страшные последствия от встречи с объектом своего страха, который может быть чем угодно - от животного до какого-либо определенного места и до жидкости организма.
Посттравматическое стрессовое расстройство или PTSD - это тревожное расстройство, которое является результатом перенесенной травмы. Посттравматический стресс может возникнуть в результате чрезвычайной ситуации, такой как война, изнасилование, ситуации заложника или даже серьезной аварии. Он может быть также результатом длительного (хронического) воздействия сильного стрессора, например, солдаты, которые переносят отдельные сражения, но не в состоянии переносить непрерывные боевые действия. Общие симптомы включают флешбеки, поведение избегания и депрессии.
Расстройства пищевого поведения
Соединения, описанные в настоящей заявке, можно использовать в способе, описанном в настоящей заявке, например, в лечении расстройства, описанного в настоящей заявке, такого как расстройство пищевого поведения. Расстройства пищевого поведения характеризуются нарушениями пищевого поведения и регуляции веса, и это связано с широким спектром негативных психологических, физических и социальных последствий. Субъект с расстройством пищевого поведения может начать просто употреблять меньшее или большее количество пищи, но в какой-то момент желание съесть меньше или больше выходит из-под контроля. Расстройства пищевого поведения могут характеризоваться сильным расстройством или беспокойством по поводу веса или фигуры, или неимоверными усилиями, чтобы контролировать вес или прием пищи. Нарушения пищевого поведения включают нервную анорексию, булимию, компульсивное переедание, кахексию, а также их варианты.
Субъекты с нервной анорексией, как правило, считают, что у них избыточный вес, даже если они имеют недостаточный вес. Субъекты с нервной анорексией могут быть чрезмерно озабоченными тем, что связано с питанием, пищей и контролем веса. Субъекты с нервной анорексией, как правило, постоянно взвешиваются, тщательно отмеряют пищу, едят только определенные продукты в очень небольших количествах. У субъектов с анорексией может случаться компульсивное переедание с последующими экстремальными диетами, чрезмерными физическими нагрузками, самоиндуцируемой рвотой или злоупотреблениями слабительными средствами, диуретиками или клизмами. Симптомы включают экстремально низкую массу тела, сильное ограничение пищи, упорное стремление к худобе и нежелание поддерживать нормальный или здоровый вес, сильный страх набрать вес, искаженный телесный образ и самооценку, на что очень сильно влияет восприятие веса и фигуры или отрицание серьезности низкой массы тела, отсутствия менструаций у девушек и женщин. Другие симптомы включают истончение костей, ломкость волос и ногтей, сухую и желтоватую кожу, рост волос по всему телу, легкую анемию, атрофию мышц и слабость, тяжелые запоры, низкое кровяное давление или замедленное дыхание и пульс, нарушение структуры и функции сердца, повреждения мозга, полиорганную недостаточность, снижение внутренней температуры тела, вялость, медлительность и бесплодие.
Субъекты с нервной булимией имеют периодические и частые эпизоды потребления необычно большого количества пищи и чувствуют отсутствие контроля над этими эпизодами. За этим перееданием следует поведение, которое компенсирует переедание, такое как принудительная рвота, чрезмерное использование слабительных или мочегонных средств, голодание, чрезмерная физическая нагрузка, либо сочетание этих форм поведения.
В отличие от нервной анорексии, субъекты с нервной булимией, как правило, поддерживают то, что считается здоровым и нормальным весом, при этом некоторые имеют немного избыточный вес. Но также как субъекты с нервной анорексией они, как правило, боятся набрать вес, отчаянно хотят похудеть и недовольны своим размером и формой тела. Как правило, булимическое поведение осуществляется тайно, потому что оно часто сопровождается чувством брезгливости и стыда. Переедание и цикл очищения может происходить где угодно от нескольких раз в неделю несколько раз в день. Другие симптомы включают хронически воспаленное и больное горло, опухшие слюнные железы в области шеи и челюсти, износ зубной эмали и все более чувствительные и разрушающиеся зубы в результате воздействия желудочной кислоты, кислотного рефлюкса и других проблем желудочно-кишечного тракта, кишечное расстройство и раздражение от злоупотребления слабительными средствами, тяжелое обезвоживание в результате удаления жидкости, электролитный дисбаланс (что может привести к инфаркту или инсульту).
Субъекты, страдающие компульсивным перееданием, теряют контроль над потреблением пищи. В отличие от булимии, после периодов компульсивного переедания не следует компенсаторное поведение, такое как очищение, чрезмерные физические нагрузки или голодание. Субъекты, страдающие компульсивным перееданием, чаще имеют избыточный вес или страдают ожирением. Страдающие компульсивным перееданием субъекты с ожирением имеют более высокий риск развития сердечно-сосудистых заболеваний и высокое кровяное давление. Они также испытывают чувство вины, стыда и страданий по поводу их переедания, что может привести к большему перееданию.
Кахексия также известена как ʺистощающее расстройствоʺ и представляет собой связанные с едой проблемы, с которыми сталкиваются многие онкологические больные. Субъекты с кахексией могут продолжать нормально питаться, но их организм может отказываться усваивать витамины и питательные вещества, которые он переваривает, или они теряют аппетит и перестают есть. Когда субъект испытывает потерю аппетита и перестает есть, можно считать, что от страдает нервной анорексией.
Эпилепсия
Соединения, описанные в настоящей заявке, можно использовать в способе, описанном в настоящей заявке, например, для лечения расстройства, описанного в настоящей заявке, такого как эпилепсия, эпилептический статус или судороги, например, как описано в WO2013/112605 и WO/2014/031792, содержание которых включено в настоящую заявку во всей их полноте.
Эпилепсия - это расстройство головного мозга, характеризующееся повторными припадками с течением времени. Типы эпилепсии могут включать, но не ограничиваются этим, генерализованную эпилепсию, например, эпилепсию отсутствия детства, ювенильную миоклоническую эпилепсию, эпилепсию с сильными припадками при пробуждении, синдром Веста, синдром Леннокса-Гасто, парциальную эпилепсию, например, височную эпилепсию, лобную эпилепсию, доброкачественную фокальную эпилепсию детсткого возраста.
Эпилептический статус (SE)
Эпилептический статус (SE) может включать, например, судорожный эпилептический статус, например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; бессудорожный эпилептический статус, например, генерализованный эпилептический статус, комплексный парциальный эпилептический статус; генерализованные периодические эпилептиформные разряды; и периодические латерализованные эпилептиформные разряды. Судорожный эпилептический статус характеризуется наличием судорожного статуса эпилептических припадков, и может включать ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус. Ранний эпилептический статус лечат с использованием терапии первой линии. Установившийся эпилептический статус характеризуется состоянием эпилептических припадков, которые продолжаются, несмотря на лечение с использованием терапии первой линии, и вводят терапию второй линии. Рефрактерный эпилептический статус характеризуется состоянием эпилептических припадков, которые продолжаются, несмотря на лечение с использованием терапии первой линии и терапии второй линии, и обычно вводят общий анестетик. Супер-рефрактерный эпилептический статус характеризуется состоянием эпилептических припадков, которые продолжаются, несмотря на лечение с использованием терапии первой линии, терапии второй линии и общего анестетика, в течение 24 часов или более.
Бессудорожный эпилептический статус может включать, например, фокальный бессудорожный эпилептический статус, например, комплексный парциальный бессудорожный эпилептический статус, простой парциальный бессудорожный эпилептический статус, слабовыраженный бессудорожный эпилептический статус; генерализованный бессудорожный эпилептический статус, например, бессудорожный эпилептический статус абсансов с поздним дебютом, атипичный бессудорожный эпилептический статус абсансов или типичый бессудорожный эпилептический статус абсансов.
Композиции, описанные в настоящей заявке, также можно вводить в качестве профилактики для субъекта, имеющего расстройство ЦНС, например, такое как черепно-мозговая травма, эпилептический статус, например, судорожный эпилептический статус, например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; бессудорожный эпилептический статус, например, генерализованный эпилептический статус, комплексный парциальный эпилептический статус; генерализованные периодические эпилептиформные разряды; и периодические латерализованные эпилептиформные разряды; до начала припадка.
Судороги
Судороги представляют собой физические проявления или изменения поведения, которые происходят после эпизода аномальной электрической активности в головном мозге. Термин ʺсудорогиʺ часто используется взаимозаменяемо с ʺконвульсиейʺ. Судороги - это когда тело субъекта содрогается быстро и неконтролируемо. Во время судорог мышцы субъекта постоянно сокращаются и расслабляются.
В зависимости от типа поведения и деятельности головного мозга, припадки делятся на две большие категории: генерализованные и парциальные (также называемые местными или очаговыми). Классификации типа судорог помогает врачам определить, страдает пациент эпилепсией или нет.
Генерализованные судороги возникают из-за электрических импульсов от всего головного мозга, в то время как частичные судороги вызываются (по крайней мере изначально) электрическими импульсами в относительно небольшой части головного мозга. Часть головного мозга, генерирующую судороги, иногда называют фокусом.
Существует шесть типов генерализованных судорог. Наиболее распространенным и сильными, и поэтому наиболее известными, являются генерализованные судороги, также называемые большим судорожным припадком. При таком типе судорог пациент теряет сознание и, как правило, падает. Потеря сознания сопровождается генерализованным напряжением тела (так называемая ʺтоническаяʺ фаза судорог) в течение 30-60 секунд, с последующими сильными подергиваниями (ʺклоническаяʺ фаза) в течение 30 до 60 секунд, после чего пациент погружается в глубокий сон (ʺпослеприпадочнаяʺ или послесудорожная фаза). Во время большого судорожного припадка могут случаться травмы и случайности, такие как прикусывание языка и недержание мочи.
Абсансные судороги вызвают кратковременную потерю сознания (несколько секунд) с немногими или вообще с отсутствием симптомов. Пациент, чаще всего ребенок, как правило, прерывает деятельность, и смотрит непонимающе. Эти судороги начинаются и заканчиваются резко и могут возникать несколько раз в день. Пациенты обычно не осознают, что у них припадок, за исключением того, что они могут ощущать ʺпотерю времениʺ.
Миоклонические судороги состоят из спорадических подергиваний, как правило, на обеих сторонах тела. Пациенты иногда описывают подергивания как краткий электрический шок. Когда эти судороги являются сильными, субъект может уронить или невольно бросить предмет.
Клонические судороги представляют собой повторяющиеся ритмичные подергивания, в которые вовлечены обе стороны тела одновременно.
Тонические приступы характеризуются окостенением мышц.
Атонические судороги состоят из внезапной и общей потери мышечного тонуса, особенно в руках и ногах, которая часто приводят к падению.
Судороги, описанные в настоящей заявке, могут включать эпилептические судороги; острые повторяющиеся судороги; кластерные судороги; непрерывные судороги; непрекращающиеся судороги; продолжительные судороги; периодические судороги; судорожный эпилептический статус, например, рефрактерный судорожный эпилептический статус, бессудорожный эпилептический статус, эпилептические судороги; рефрактерные судороги; миоклонические судороги; тонические судороги; тонико-клонические судороги; простые парциальные судороги, комплексные парциальные судороги; вторично-генерализованные судороги; атипичные абсансы; абсансные припадки; атонические судороги; доброкачественные роландические судороги; фебрильные судороги; эмоциональные судороги; фокальные судороги; эпилептические припадки смеха; генерализованные судороги; инфантильные спазмы; джексоновские судороги; массивные двусторонние миоклонические судороги; мультифокальные судороги; неонатальные судороги; ночные судороги; затылочные судороги; посттравматические судороги; слабовыраженные судороги; судороги Сильва; визуальные рефлекторные судороги; или провокацию судорожного припадка.
Тремор
Соединения, описанные в настоящей заявке, можно использовать в способе, описанном в настоящей заявке, например, в лечении расстройства, описанного в настоящей заявке, такого как тремор.
Тремор - это непроизвольные, порой ритмические сокращения и расслабления мышц, которые могут включать колебания или подергивания одной или нескольких частей тела (например, рук, глаз, лица, головы, голосовых связок, туловища, ног).
Мозжечковый тремор или интенционный тремор - это медленный широкий тремор конечностей, который возникает после целенаправленного движения. Мозжечковый тремор вызывается поражениями или повреждением мозжечка в результате, например, опухоли, инсульта, заболевания (например, рассеянного склероза, наследственного дегенеративного заболевания).
Дистонический тремор возникает у лиц, страдающих дистонией, двигательным расстройством, при котором затяжные непроизвольные мышечные сокращения вызывают скручивающие и повторяющиеся движения и/или болезненные и ненормальные позы или положения. Дистонический тремор может поражать любую мышцу тела. Дистонический тремор возникает нерегулярно, и часто затем может следовать состояние полного покоя.
Эссенциальный тремор или доброкачественный эссенциальный тремор - это наиболее распространенный тип тремора. Эссенциальный тремор у некоторых может быть слабовыраженным и непрогрессирующим, а может быть медленно прогрессирующим, начиная с одной стороны тела, но затрагивая обе стороны в течение 3 лет. Руки чаще всего поражаются, но также могут быть затронуты голова, голос, язык, ноги и туловище. Частота приступов тремора может уменьшаться с возрастом, но их тяжесть может усиливаться. Повышенная эмоциональность, стресс, лихорадка, физические истощения или низкий уровень сахара в крови могут вызывать приступы тремора и/или усиливать их тяжесть.
Ортостатический тремор характеризуется быстрым (например, выше 12 Гц) ритмическим мышечным сокращением, которое происходит в ногах и туловище сразу после стояния. Спазмы ощущаются в бедрах и ногах, а пациент может испытывать неконтролируемые сотрясения тела, когда его просят постоять на одном месте. Ортостатический тремор может возникает у пациентов с эссенциальным тремором.
Паркинсонический тремор возникает из-за повреждения структур головного мозга, которые контролируют движение. Паркинсонический тремор часто является предшественником болезни Паркинсона и обычно проявляется как действие руками по типу ʺскатывания пилюльʺ, что также может затрагивать подбородок, губы, ноги и туловище. Проявление паркинсонического тремора, как правило, начинается после 60 лет. Движение начинается с одной конечности или с одной стороны тела и может прогрессировать, затрагивая другую сторону.
Физиологический тремор может возникать у здоровых людей и не имеет клинического значения. Его можно наблюдать во всех произвольно сокращающихся группах мышц. Физиологический тремор может быть вызван некоторыми лекарствами, отменой алкоголя или медицинскими состояниями, включая повышенную функцию щитовидной железы и гипогликемию. В классических случаях, такой тремор имеет частоту около 10 Гц.
Психогенный тремор или истерический тремор может возникать в состоянии покоя или во время постурального или кинетического движения. Пациент с психогенным тремором может иметь конверсионное расстройство или другое психиатрическое заболевание.
Рубральный тремор характеризуется простым медленным тремором, который может возникать в состоянии покоя, в определенном положении тела и намеренно. Этот тремор ассоциируется с состояниями, которые влияют на красное ядро в среднем мозге, классическими необычными приступами.
Анестезия/Седация
Соединения, описанные в настоящей заявке, можно использовать в способе, описанном в настоящей заявке, например, чтобы вызвать анестезию или седацию. Анестезия представляет собой фармакологически индуцируемое и обратимое состояние амнезии, анальгезии, потери способности к реагированию, потери рефлексов скелетных мышц, пониженной реакции на стресс или всего этого одновременно. Эти эффекты могут быть получены с использованием одного лекарственного средства, которое самостоятельно обеспечивает нужное сочетание эффектов, или иногда комбинации лекарственных средств (например, снотворных, седативных, парализующих, анальгетиков) для достижения очень специфических комбинаций результатов. Анестезия позволяет пациенту перенести операцию и другие процедуры без страданий и боли, которые они бы в противном случае испытывали.
Седация представляет собой снижение раздражительности или возбудимости путем введения фармакологического средства, как правило, для облегчения медицинской процедуры или диагностической процедуры.
Седация и анальгезия включают континуум состояний от минимальной седации (анксиолисиз) до общей анестезии.
Минимальная седация также известена как анксиолисиз. Минимальная седация представляет собой лекарственно-индуцированное состояние, во время которого пациент обычно реагирует на вербальные команды. Когнитивная функция и координация могут быть нарушены. Дыхание и сердечно-сосудистые функции, как правило, не затрагиваются.
Умеренная седация/анальгезия (седация с сохранением сознания) представляет собой лекарственно-индуцированное подавление сознания, при котором пациент целенаправленно реагирует на голосовые команды, либо подаваемые отдельно, либо вместе с легкой тактильной стимуляцией. Никакие вмешательства обычно не требуются для поддержания дыхательных путей пациента. Спонтанной вентиляции обычно достаточно. Сердечно-сосудистая функция обычно сохраняется.
Глубокая седация/аналгезия представляет собой лекарственно-индуцированное подавление сознания, при котором пациент не может легко пробудиться, но реагирует целенаправленно (не рефлективное отдергивание от болевого раздражителя) после неоднократной или болевой стимуляции. Независимая дыхательная функция может быть нарушена, и пациент может нуждаться в помощи для поддержания дыхания. Спонтанная вентиляция может быть недостаточной. Сердечно-сосудистая функция обычно сохраняется.
Общая анестезия - это лекарственно-индуцированная потеря сознания, в течение которого пациент не может пробудиться, даже в ответ на болевые раздражители. Способность поддерживать независимую дыхательную функцию часто нарушается, и часто требуется помощь для поддержания дыхания пациента. Вентиляция с положительным давлением может потребоваться из-за угнетенной спонтанной вентиляции или лекарственно-индуцированного подавления нервно-мышечной функции. Сердечно-сосудистая функция может быть нарушена.
Седация в отделении интенсивной терапии (ICU) позволяет подавлять восприятие пациентами окружающей среды и снижать их реакцию на внешние раздражения. Она может играть роль в уходе за тяжелобольным пациентом и охватывает широкий спектр контроля симптомов, который будут различаться между пациентами и между субъектами на протяжении их болезни. Тяжелую седацию в интенсивной терапии используют для облегчения переноссимости эндотрахеальной трубки и синхронизации вентилятора, часто с использованием нервно-мышечной блокирующих средств.
В некоторых вариантах осуществления седацию (например, длительную седацию, непрерывную седацию) индуцируют и поддерживают в ICU в течение длительного периода времени (например, 1 день, 2 дня, 3 дня, 5 дней, 1 неделя, 2 недели, 3 недели, 1 месяц, 2 месяца). Долгодействующие седативные средства могут иметь большую продолжительность действия. Седативные средства в ICU могут иметь короткий период полувыведения.
Процедурная седация и анальгезия, также называемая седация с сохранением сознания - это способ введения седативных или диссоциативных средств с использованием или без анальгетиков для индукции состояния, которое позволяет субъекту переносить неприятные процедуры при сохранении при этом кардиореспираторной функции.
Эквиваленты и объем
В формуле изобретения артикли, такие как ʺaʺ, ʺanʺ и ʺtheʺ, могут означать один или больше чем один, если не указано обратное или если из контекста не следует иное. Формула изобретения или описания, которые включают ʺилиʺ между одним или несколькими членами группы, считаются приемлемыми, если один, больше чем один или все из членов группы присутствуют или используются в данном продукте или процессе, или как-либо иначе связаны с этим продуктом или процессом, если не указано обратное или если из контекста не следует иное. Настоящее изобретение включает варианты осуществления, в которых именно один член группы присутствует или используется в данном продукте или процессе, или как-либо иначе связан с данным продуктом или процессом. Настоящее изобретение включает варианты осуществления, в которых больше чем один или все из членов группы присутствуют или используются в данном продукте или процессе, или как-либо иначе связаны с данным продуктом или процессом.
Кроме того, настоящее изобретение охватывает все варианты, комбинации и перестановки, в которых одно или несколько ограничений, элементов, условий и описательных терминов из одного или нескольких из перечисленных пунктов формулы изобретения включены в другой пункт. Например, любой пункт формулы изобретения, который является зависимым от другого пункта формулы изобретения, может быть модифицирован таким образом, чтобы он включал одно или несколько ограничений, присутствующих в любом другом пункте, который является зависимым от того же самого основного пункта. Когда элементы представлены в виде перечней, например, в формате группы Маркуша, каждая подгруппа элементов также раскрывается, и любой элемент(элементы) может быть удален из группы. Должно быть понятно, что, как правило, когда изобретение или аспекты изобретения указывается/указываются как включающие конкретные элементы и/или признаки, некоторые варианты осуществления изобретения или аспекты изобретения состоят из, или состоят по существу из, таких элементов и/или признаков. Для простоты, эти варианты осуществления не были специально описаны в тех же выражениях в настоящей заявке. Также следует отметить, что термины ʺвключающийʺ и ʺсодержащийʺ не ограничены и допускают включение дополнительных элементов или стадий. Когда указываются диапазоны, они включают конечные точки. Кроме того, если не указано иное или если иное не следует из контекста и толкования рядовым специалистом в данной области, значения, которые выражены в виде диапазонов, могут предполагать любое конкретное значение или суб-диапазон в рамках указанных диапазонов в разных вариантах осуществления изобретения, до десятой доли единицы нижнего предела диапазона, если из контекста явно не следует иное.
В настоящей заявке имеются ссылки на различные изданные патенты, опубликованные патентные заявки, журнальные статьи и другие публикации, которые все включены в настоящую заявку посредством ссылки. В случае каких-либо противоречий между каким-либо из включенных ссылочных документов и настоящим описанием, преимущество имеет настоящее описание. Кроме того, любой конкретный вариант осуществления настоящего изобретения, который подпадает под известный уровень техники, может быть однозначно исключен из любого одного или нескольких пунктов формулы изобретения. Поскольку такие варианты осуществления считаются известными рядовым специалистам в данной области, они могут быть исключены, даже если такое исключение определенным образом не указано в настоящей заявке. Любой конкретный вариант осуществления настоящего изобретения может быть исключен из любого пункта формулы изобретения по любой причине, независимо от того, связано это или нет с предшествующим уровнем техники.
Специалистам в данной области должны быть известны, или они должны быть способны определить, используя не более чем рутинное экспериментирование, многие эквиваленты конкретных вариантов осуществления, описанных в настоящей заявке. Объем вариантов осуществления, описанных в настоящей заявке, не должен ограничиваться представленным выше описанием изобретения, скорее он представляет собой такой объем, как изложено в прилагаемой формуле изобретения. Рядовым специалистам в данной области должно быть понятно, что можно осуществить различные изменения и модификации этого описания без отступления от сути или объема настоящего изобретения, как он определен в представленной далее формуле изобретения.
Примеры
Для более полного понимания изобретения, описанного в настоящей заявке, далее представлены следующие примеры. Примеры синтеза и биологические примеры, описанные в настоящей заявке, предназначены для иллюстрации соединений, фармацевтических композиций и способов, обеспечиваемых настоящим изобретением, и не должны рассматриваться как каким-либо образом ограничивающие их объем.
Материалы и методы
Соединения, представленные в настоящей заявке, можно получить из легко доступных исходных веществ с использованием следующих общих способов и процедур. Должно быть понятно, что, где указаны типичные или предпочтительные условия процесса (т.е. температуры реакции, время реакции, мольные соотношения взаимодействующих веществ, растворители, давления и т.д.), можно также использовать другие условия процесса, если не указано иное. Оптимальные реакционные условия могут варьироваться в зависимости от используемых конкретных реагентов или растворителей, но такие условия сможет определить специалист в данной области путем рутинной оптимизации.
Кроме того, специалистам в данной области должно быть понятно, что могут потребоваться традиционные защитные группы для предотвращения нежелательных взаимодействий некоторых функциональных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия для введения защиты и удаления защиты хорошо известны в данной области техники. Например, различные защитные группы и их введение и удаление описаны в T. W. Greene and P. G. M. Wuts, Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991 и в документах, на которые имеются ссылки в этом справочнике.
Соединения, представленные в настоящей заявке, могут быть выделены и очищены с использованием известных стандартных процедур. Такие процедуры включают (но не ограничиваются этим) перекристаллизацию, колоночную хроматографию, ВЭЖХ или сверхэффективную жидкостную хроматографию (СЭЖХ). Следующие схемы представлены для детального описания получения репрезентативных гетероарилов и гетероциклилов, которые перечислены в настоящей заявке. Соединения, представленные в настоящей заявке, сможет получить специалист в области органического синтеза из известных или коммерчески доступных исходных веществ и реагентов. Примеры хиральных колонок, доступных для использования в разделении/очистке энантиомеров/диастереомеров, представленных в настоящей заявке, включают, но не ограничиваются этим, ChiralPak® AD-10, CHIRALCEL® OB, CHIRALCEL® OB-H, CHIRALCEL® OD, CHIRALCEL® OD-H, CHIRALCEL® OF, CHIRALCEL® OG, CHIRALCEL® OJ и CHIRALCEL® OK.
Стереохимия, указанная в настоящей заявке (например, указание ʺRʺ или ʺSʺ для C21 положения стероида), может быть приписана ориентировочно (например, произвольно). Например, C21 положение может быть показано в ʺRʺ конфигурации, когда C21 положение находится в ʺSʺ конфигурации.
1H-ЯМР данные, представленные в настоящей заявке (например, для промежуточных соединений), могут быть частичным представлением полного ЯМР спектра соединения, например, соединения, описанного в настоящей заявке. Например, представленные1H ЯМР могут исключать область между δ (м.д.) около 1 до около 2,5 м.д.
Иллюстративный общий способ для препаративной ВЭЖХ: Колонка: Waters Rbridge prep 10 мкм C18, 19×250 мм. Подвижная фаза: ацетонитрил, вода (NH4HCO3) (30 л воды, 24 г NH4HCO3, 30 мл NH3.H2O). Скорость потока: 25 мл/мин
Иллюстративный общий способ для аналитической ВЭЖХ: Подвижная фаза: A: вода (10 мМ NH4HCO3), B: ацетонитрил Градиент: 5%-95% B в течение 1,6 или 2 мин; Скорость потока: 1,8 или 2 мл/мин; Колонка: Xbridge C18, 4,6×50мм, 3,5 мкм при 45°C.
Способы синтеза
Пример 1. Синтез соединения 1.
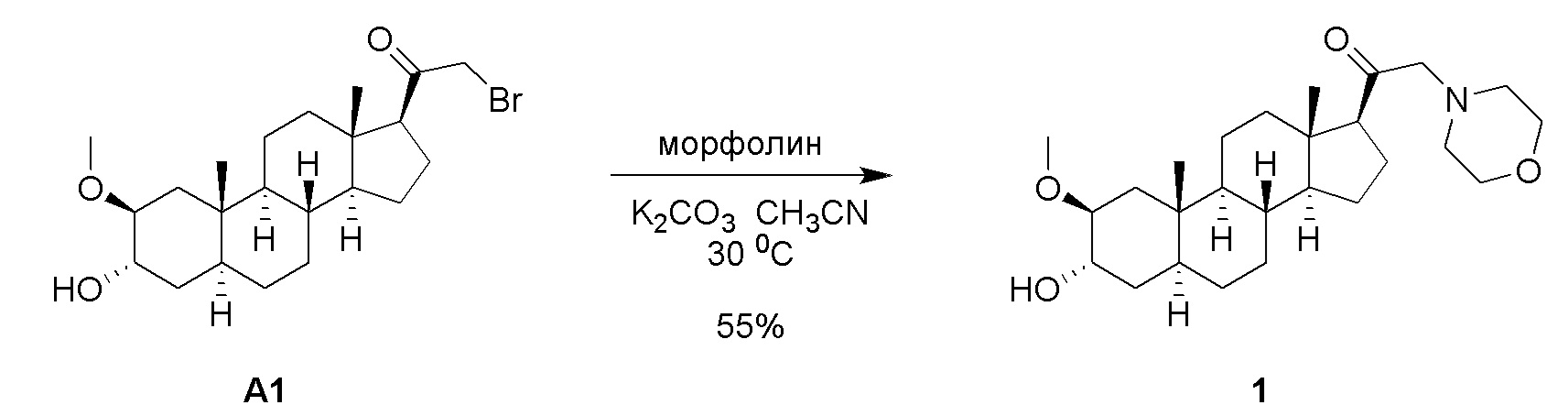
К суспензии соединения A1 (170 мг, 0,4 ммоль) в ацетонитриле (3,5 мл) добавляли карбонат калия (340 мг, 2,4 ммоль) и морфолин (340 мг, 3,9 ммоль) при 10°C. Смесь перемешивали при 30°C в течение 5 часов и затем концентрировали в вакууме, промывали водой, очищали колоночной хроматографией на силикагеле (элюент: петролейный эфир:этилацетат=2:1 до 1:2) с получением соединения 1 (94,1 мг, 55%) в виде белого твердого вещества.
1H ЯМР: (400 МГц, CDCl3) δ 4,02-3,90 (м, 1H), 3,75 (т, J=4,4Гц, 4H), 3,48-3,30 (м, 4H), 3,20-3,18 (м, 2H), 2,61-2,40 (м, 5H), 2,22-2,08 (м, 1H), 1,92-1,78 (м, 3H), 1,73-1,48 (м, 6H), 1,40-1,15 (м, 9H), 0,99-0,88 (м, 4H), 0,80-0,68 (м, 1H), 0,61 (с, 3H).
Пример 2. Синтез соединений 2 и 3.

К суспензии соединения A1 (260 мг, 0,61 ммоль) в ацетонитриле (5 мл) добавляли карбонат калия (500 мг, 3,6 ммоль) и 1,2,3-триазол (500 мг, 7,2 ммоль) при 10°C. Смесь перемешивали при 30°C в течение 5 часов и затем концентрировали в вакууме. Остаток промывали, экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, очищали препаративной ВЭЖХ с получением соединения 2 (38,1 мг, 15%) и 3 (71,5 мг, 28%) в виде белого твердого вещества.
1H ЯМР (2): (400 МГц, CDCl3) δ 7,68 (с, 2H), 5,32-5,15 (м, 2H), 4,01-3,91 (м, 1H), 3,41-3,29 (м, 4H), 2,62-2,50 (м, 1H), 2,28-2,14 (м, 1H), 2,13-2,04 (м, 1H), 1,95-1,88 (м, 1H), 1,88-1,62 (м, 5H), 1,56-1,19 (м, 11H), 1,02-0,95 (м, 1H), 0,93 (с, 3H), 0,81-0,72 (м, 1H), 0,69 (с, 3H).
1H ЯМР (3): (400 МГц, CDCl3) δ 7,75 (с, 1H), 7,64 (с, 1H), 5,32-5,09 (м, 2H), 4,01-3,91 (м, 1H), 3,41-3,29 (м, 4H), 2,70-2,58 (м, 1H), 2,28-2,14 (м, 1H), 2,12-2,04 (м, 1H), 1,95-1,88 (м, 1H), 1,88-1,62 (м, 5H), 1,56-1,20 (м, 11H), 1,03-0,95 (м, 1H), 0,93 (с, 3H), 0,81-0,72 (м, 1H), 0,66 (с, 3H).
Пример 3. Синтез соединений 4 и 5.

Стадия 1. Синтез соединения A3. К раствору Ph3PCH2CH2Br (60,41 г, 163,16 ммоль) в ТГФ (40 мл) добавляли раствор t-BuOK (18,31 г, 163,16 ммоль) в ТГФ (20 мл) в атмосфере N2. Смесь перемешивали при 15°C в течение 1 часа. Затем добавляли раствор соединения A2 (10 г, 32,63 ммоль)вТГФ (40 мл) и смесь перемешивали при кипячении с обратным холодильником в течение 3 часов. ТСХ анализ (этилацетат/петролейный эфир=1/1) показал, что исходное вещество израсходовано полностью. Смесь охлаждали и гасили насыщенным водным раствором NH4Cl (40 мл). Смесь экстрагировали при помощи EtOAc (60 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4иупаривали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир =1/10), с получением соединения A3 (6,8 г, 65%) в виде белого твердого вещества.
1H ЯМР (A3): (400 МГц, CDCl3) δ 5,11-5,02 (м, 1H), 4,39-4,35 (м, 1H), 4,07-4,02 (м, 1H), 2,41-2,32 (м, 2H), 2,21-2,09 (м, 2H), 1,91-1,71 (м, 4H), 1,70-1,57 (м, 8H), 1,57-1,42 (м, 4H), 1,41-1,29 (м, 3H), 1,11-1,06 (м, 4H), 1,06-1,04 (м, 3H), 1,01-0,93 (м, 2H), 0,89-0,81 (м, 1H).
Стадия 2. Синтез соединения A4. К раствору соединения A3 (4,2 г, 13,19 ммоль) и 1H-имидазола (1,80 г, 26,37 ммоль) в DMF (35 мл) добавляли TBSCl (3,98 г, 26,37 ммоль). Смесь перемешивали при 30°C в течение ночи. ТСХ анализ показал, что исходное вещество израсходовано полностью. К полученной смеси добавляли насыщенный солевой раствор (35 мл) и полученный раствор экстрагировали при помощи EtOAc (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (25 мл ×3), сушили над безводным Na2SO4иконцентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир=1/100), с получением соединения A4 (5,2 г, 91%) в виде белого твердого вещества.
1H ЯМР (A4): (400 МГц, CDCl3) δ 5,10-5,03 (м, 1H), 4,40-4,37 (м, 1H), 4,88-4,84 (м, 1H), 4,44-4,31 (м, 2H), 2,20-2,09 (м, 1H), 1,89-1,72 (м, 4H), 1,69-1,63 (м, 4H), 1,61-1,48 (м, 7H), 1,43-1,11 (м, 6H), 1,11-1,04 (м, 4H), 1,04-0,94 (м, 5H), 0,90-0,81 (м, 12H), 0,2 (с, 6H).
Стадия 3. Синтез соединения A5. К суспензии NaH (4,81 г, 120,16 ммоль) в ТГФ (50 мл) добавляли раствор соединения A4 (5,2 г, 12,02 ммоль) в ТГФ (20 мл) по каплям при 0°C в атмосфере N2. Смесь перемешивали при 0°C в течение 30 минут. Затем добавляли по каплям MeI (17,06 г, 120,16 ммоль). Смесь перемешивали при 30°C в течение ночи. ТСХ анализ (этилацетат/петролейный эфир=1/200) показал, что реакция завершилась. Реакцию гасили водным раствором NH4Cl (30 мл). Полученный раствор экстрагировали этилацетатом (35 мл ×3) и объединенные органические слои сушили и концентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир=1/2), с получением соединения A5 (4,7 г, 87,5%) в виде белого твердого вещества.
1H ЯМР (A5): (400 МГц, CDCl3) δ 5,11-5,02 (м, 1H), 3,99-3,96 (м, 1H), 3,23-3,17 (м, 1H), 3,28 (с, 3H), 2,73-2,67 (м, 1H), 2,46-2,32 (м, 1H), 2,23-2,11 (м, 1H), 1,88-1,74 (м, 2H), 1,71-1,64 (м, 4H), 1,63-1,61 (м, 4H), 1,51-1,33 (м, 5H), 1,22-1,08 (м, 5H), 1,04 (с, 3H), 0,96 (с, 3H), 0,94-0,88 (м, 11H), 0,87-0,78 (м, 2H), 0,2 (с, 6H).
Стадия 4. Синтез соединения A6. К раствору 9-BBN (210 мл, 0,5 M) в ТГФ добавляли раствор соединения A5 (4,7 г, 10,52 ммоль) в ТГФ (30 мл) по каплям при перемешивании при охлаждении на ледяной бане в атмосфере N2. Смесь перемешивали при 60°C в течение ночи. Реакционную смесь охлаждали на ледяной бане и добавляли по каплям 10% водный раствор NaOH (24 мл), затем добавляли по каплям 30% водный раствор H2O2 (12 мл), полученный раствор перемешивали при 15°C в течение 3 часов. Смесь гасили насыщенным водным раствором Na2S2O3(50 мл). Полученную смесь экстрагировали при помощи EtOAc (100 ×3 мл) и объединенные органические слои сушили над безводным Na2SO4 и концентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир=1/50), с получением соединения A6 (2,5 г, 51%) в виде белого твердого вещества.
1H ЯМР (A6): (400 МГц, CDCl3) δ 3,97-3,93 (м, 1H), 3,89-3,81 (м, 1H), 3,75-3,64 (м, 1H), 3,64-3,61 (м, 1H), 3,21 (с, 3H), 2,34 -2,27 (м, 1H),0,96-0,92 (м, 4H), 0,87 (с, 9H), 0,81 (с, 3H), 0,78-0,72 (м, 1H), 0,2 (м, 6H).
Стадия 5. Синтез соединения A7. К раствору соединения A6 (2,5 г, 5,38 ммоль) в дихлорметане (20 мл) добавляли реагент Десса-Мартина (1,28 г, 3,01 ммоль) в атмосфере N2. Смесь перемешивали при 40°C в течение ночи. ТСХ анализ показал, что исходное вещество израсходовано полностью. Смесь гасили насыщенным водным раствором Na2S2O3(25 мл). Полученную смесь экстрагировали при помощи EtOAc (20 мл×3). Объединенные органические слои промывали насыщенным водным раствором Na2S2O3(25 мл ×4), насыщенным водным раствором NaHCO3(20 мл), насыщенным солевым раствором (15 мл) и сушили над безводным Na2SO4иконцентрировали в вакууме с получением неочищенного соединения A7 (2,7 г), которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (A7): (400 МГц, CDCl3) δ 3,98-3,93 (м, 1H), 3,71-3,68 (м, 1H), 3,21 (с, 3H), 2,54-2,36 (м, 4H), 2,21-2,06 (м, 5H), 1,96-1,31 (м, 20H), 1,30-1,06 (м, 8H), 1,02-0,91 (м, 4H), 0,92-0,84 (м, 10H), 0,83-0,72 (м, 5H), 0,2 (м, 6H).
Стадия 6. Синтез соединения A8. К раствору соединения A7 (2,7 г, 5,83 ммоль) в дихлорметане (30 мл) добавляли TFA (5 мл, 67,09 ммоль) по каплям. Смесь перемешивали при 15°C в течение 1 часа. ТСХ анализ показал, что реакция завершилась. Смесь гасили насыщенным водным раствором Na2HCO3(25 мл). Полученный раствор экстрагировали дихлорметаном (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (45 мл ×3) и сушили над безводным Na2SO4иконцентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир=1/3), с получением соединения A8 (0,8 г, 34%) в виде белого твердого вещества.
1H ЯМР (A8): (400 МГц, CDCl3) δ 4,07-4,02 (м, 1H), 3,71-3,68 (м, 1H), 3,21 (с, 3H), 2,49-2,41 (м, 2H), 2,19-2,08 (м, 4H), 1,74-1,57 (м, 8H), 1,56-1,49 (м, 3H), 1,48-1,40 (м, 3H), 1,38-1,32 (м, 1H), 1,31-1,16 (м, 5H), 1,16-1,03 (м, 1H), 0,97 (с, 3H), 0,84-0,78 (м, 1H), 0,77 (с, 3H).
Стадия 7. Синтез соединения A9. К раствору соединения A8 (0,7 г, 2,01 ммоль) в MeOH (20 мл) добавляли водный раствор HBr (5 капель, 40% в воде). Затем добавляли Br2(353,07 мг, 2,21 ммоль) при перемешивании. Смесь перемешивали при 15°C в течение 3 часов. ТСХ анализ показал, что реакция завершилась. Смесь гасили насыщенным водным раствором NH4Cl (15 мл). Полученный раствор экстрагировали дихлорметаном (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (15 мл) и сушили над безводным Na2SO4иконцентрировали в вакууме с получением неочищенного соединения A9 (1,0 г), которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (A9): (400 МГц, CDCl3) δ 4,08-4,04 (м, 1H), 3,91 (с, 2H), 3,71-3,68 (м, 1H), 3,28-3,19 (м, 3H), 2,77-2,71 (м, 1H), 2,51-2,35 (м, 2H), 2,34-2,24 (м, 1H), 2,22-2,11 (м, 1H), 1,83-1,68 (м, 7H), 1,67-1,48 (м, 10H), 1,47-1,38 (м, 2H), 1,21-1,10 (м, 4H), 0,98 (с, 3H), 0,77-0,86 (м, 4H).
Стадия 8. Синтез соединений 4 и 5. К раствору 1,2,3-триазола (824,10 мг, 11,93 ммоль) в ТГФ (15 мл) добавляли LiHMDS (11,93 мл, 11,93 ммоль, 1 M в ТГФ) при охлаждении на ледяной бане в атмосфере N2. Смесь перемешивали при 0°C в течение 30 минут. Затем добавляли раствор соединения A9 (850 мг, 1,99 ммоль) в ТГФ (5 мл) и реакционную смесь перемешивали при 15°C в течение 4 часов. ТСХ анализ показал, что реакция завершилась. Смесь гасили насыщенным водным раствором NH4Cl (15 мл). Полученный раствор экстрагировали при помощи EtOAc (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (15 мл ×4) и сушили над безводным Na2SO4иконцентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир=1/3), с получением соединения 4 (77,5 мг, 9,4%) и соединения 5 (57,4 мг, 7%) в виде желтого твердого вещества.
1H ЯМР (4): (400 МГц, CDCl3) δ 7,78-7,70 (м, 2H), 5,28-5,26 (м, 2H), 4,10-4,03 (м, 1H), 3,73-3,68 (м, 4H), 3,26 (с, 3H), 2,48-2,57 (м, 1H), 2,23-2,12 (м, 1H), 1,78-1,69 (м, 4H), 1,47-1,42 (м, 2H), 1,41-1,07 (м, 8H), 1,04-0,93 (м, 4H), 0,93-0,82 (м, 5H).
1H ЯМР (5): (400 МГц, CDCl3) δ 7,79 (с, 3H), 7,69 (с, 3H), 5,38-5,27 (д, J=17,6Гц, 1H), 5,19-5,11 (д, J=18Гц, 1H), 4,12-4,06 (м, 1H), 3,81-3,68 (м, 1H), 3,24 (с, 3H), 2,67-2,52 (м, 2H), 2,31-2,26 (м, 1H), 1,89-1,68 (м, 5H), 1,52-1,38 (м, 2H), 1,46-1,14 (м, 9H), 0,98 (с, 3H), 0,93-0,78 (м, 7H).
Пример 4. Синтез соединений 6 и 7.

Стадия 1. Синтез соединения A11. трет-Бутоксид калия (3,24 г, 28,7 ммоль) в ТГФ (90 мл) добавляли к суспензии этилтрифенилфосфоний бромида (10,66 г, 28,7 ммоль) в ТГФ (20 мл) по каплям при 0°C. Полученную реакционную смесь нагревали до комнатной температуры (15°C) и перемешивали еще в течение 1 часа. Затем раствор соединения A10 (2,5 г, 7,18 ммоль) в ТГФ (20 мл) медленно вводили в указанную выше суспензию при 0°C. Раствор перемешивали еще в течение 10-20 минут и смеси давали медленно нагреться до температуры окружающей среды. Перемешивание продолжали в течение примерно 2 часов. ТСХ анализ (PE:EA=3:1) показал, что реакция завершилась. Смесь гасили путем добавления насыщенного раствора NH4Cl (10 мл). Раствор экстрагировали при помощи EtOAc (100 мл ×3) и объединенный органический слой промывали насыщенным солевым раствором и сушили над безводным Na2SO4. Растворитель удаляли. Остаток очищали флэш-хроматографией, элюируя смесью петролейный эфир:этилацетат=6:1, с получением соединения A11 (2,06 г, 80%) в виде белого твердого вещества.
1HЯМР (A11): (400МГц, CDCl3) δ 5,32-5,18 (м, 1H), 3,98-3,88 (м, 1H), 3,79-3,70 (м, 1H), 3,42-3,33 (м, 2H), 2,88-2,82 (м, 1H), 2,78-2,72 (м, 1H), 2,60-2,51 (м, 1H), 2,48-2,28 (м, 2H), 1,94-1,68 (м, 6H), 1,64-1,60 (м, 3H), 1,58-1,38 (м, 2H), 1,38-1,24 (м, 4H), 1,24-1,16 (м, 7H), 1,16-1,12 (м, 1H), 0,84 (с, 3H).
Стадия 2. Синтез соединения A12. К раствору соединения A11 (2 г, 5,5 ммоль) в DMF (20 мл) добавляли имидазол (1,12 г, 16,5 ммоль) и TBSCl (1,65 г, 11 ммоль). Затем раствор нагревали до 30°C и поддерживали при этой температуре в течение 16 часов. ТСХ и ЖХМС показали, что реакция завершилась. В этот раствор добавляли насыщенный солевой раствор и EtOAc и слои разделяли. Объединенный органический слой промывали насыщенным солевым раствором (100 мл ×3). Органический слой сушили над безводным Na2SO4 и концентрировали. Остаток очищали флэш-хроматографией, элюируя петролейным эфиром, с получением соединения A12 (2,88 г, 99%) в виде белого твердого вещества.
1H ЯМР (A12): (400МГц, CDCl3) δ 5,18-5,16 (м, 1H), 3,84-3,78 (м, 1H), 3,75-3,68 (м, 1H), 3,38-3,28 (м, 1H), 3,28-3,22 (м, 1H), 2,85-2,78 (м, 1H), 2,74-2,66 (м, 1H), 2,60-2,55 (м, 1H), 2,48-2,24 (м, 2H), 1,85-1,65 (м, 5H), 1,61-1,54 (м, 5H), 1,36-1,22 (м, 3H), 1,31-1,10 (м, 8H), 0,89-0,86 (м, 10H), 0,81 (с, 3H), 0,03 (с, 6H).
Стадия 3. Синтез соединения A13. Раствор BH3 в ТГФ (20 ммоль, 20 мл, 1M в ТГФ) добавляли к раствору соединения A12(1 г, 2,1 ммоль) в ТГФ (20 мл). Полученный раствор перемешивали при 45°C в течение 20 часов. Смесь охлаждали на ледяной бане и затем медленно добавляли насыщенный раствор NaHCO3, с последующим добавлением H2O2 (30%, 40 мл). Полученную суспензию перемешивали при 30°C в течение 3 часов. Смесь экстрагировали при помощи EtOAc (30 мл ×2). Объединенный органический слой сушили над безводным Na2SO4 и растворитель выпаривали. Остаток очищали флэш-хроматографией, элюируя смесью петролейный эфир:этилацетат=8:1, с получением соединения A13 (800 мг, 77%) в виде бесцветного твердого вещества.
1H ЯМР (A13): (400МГц, CDCl3) δ 4,34-4,26 (м, 1H), 3,86-3,80 (м, 1H), 3,73-3,64 (м, 1H), 3,60-3,51 (м, 1H), 3,46-3,35 (м, 1H), 3,34-3,30 (м, 1H), 1,96-1,83 (м, 2H), 1,83-1,65 (м, 4H), 1,41-1,30 (м, 3H), 1,30-1,21 (м, 7H), 1,19-1,10 (м, 9H), 1,10-0,94 (м, 3H), 0,86 (с, 12H), 0,78-0,73 (м, 1H), 0,03 (с, 6H).
Стадия 4. Синтез соединения A14. К раствору соединения A13 (600 мг, 1,2 ммоль) в CH2Cl2 (25 мл) добавляли реагент Десса-Мартина (1,55 г, 3,6 ммоль). Смесь перемешивали при 25°C в течение 1 часа. ТСХ анализ показал, что реакция завершилась. Реакцию гасили путем добавления насыщенного раствора Na2SO3 и слои разделяли. Органический слой промывали насыщенным раствором NaHCO3 и насыщенным солевым раствором. Объединенный органический слой сушили над безводным Na2SO4 и растворитель выпаривали с получением неочищенного продукта A14 (690 мг) в виде бледно-желтого масла.
1H ЯМР (A14) (400 МГц, CDCl3) δ 3,87-3,80 (м, 1H), 3,75-3,68 (м, 1H), 3,40-3,26 (м, 2H), 2,78-2,70 (м, 2H), 2,58-2,46 (м, 2H), 2,31-2,15 (м, 2H), 2,20 (с, 3H), 1,86-1,66 (м, 6H), 1,40-1,05 (м, 13H), 0,95-0,84 (м, 9H), 0,59 (с, 3H), 0,05 (с, 3H).
Стадия 5. Синтез соединения A15. К раствору соединения A14 (600 мг, 1,20 ммоль) в DCM (10 мл) добавляли TFA (2 мл). Полученный раствор перемешивали при 25°C в течение 3,5 часов. ТСХ анализ показал, что реакция завершилась. Затем в раствор добавляли насыщенный солевой раствор. Органический слой промывали насыщенным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и концентрировали. Остаток растворяли при помощи ТГФ. Затем добавляли водный раствор LiOH. Полученный раствор перемешивали при 25°C в течение 16 часов. ТСХ и ЖХМС показали, что реакция завершилась. Растворитель выпаривали. Остаток промывали при помощи EtOAc и H2O. Органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и концентрировали с получением неочищенного продукта A15 (480 мг) в виде бледно-желтого масла.
1H ЯМР (A15) (400 МГц, CDCl3) δ 3,96-3,88 (м, 1H), 3,78-3,70 (м, 1H), 3,42-3,34 (м, 2H), 2,76-2,68 (м, 2H), 2,60-2,45 (м, 2H), 2,30-2,18 (м, 1H), 2,12 (с, 3H), 1,92-1,73 (м, 8H), 1,61-1,50 (м, 2H), 1,38-1,25 (м, 9H), 1,25-1,14 (м, 10H), 0,93 (с, 3H), 0,59 (с, 3H).
Стадия 6. Синтез соединения A16. К раствору соединения A15 (430 мг, 1,14 ммоль) в MeOH (10 мл) добавляли HBr (0,08 мл) и Br2 (0,16 мл) в MeOH (1 мл). Полученный раствор перемешивали при 25°C в течение 1,5 часа. ТСХ анализ показал, что реакция завершилась. Растворитель выпаривали и остаток экстрагировали при помощи DCM (50 мл ×2). Органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и концентрировали с получением неочищенного соединения A16 (510 мг) в виде бледно-желтого масла.
1H ЯМР (A16) (400 МГц, CDCl3) δ 3,96-3,88 (м, 1H), 3,78-3,74 (м, 2H), 3,76-3,68 (м, 1H), 3,39-3,33 (м, 2H), 3,12-3,06 (м, 1H), 2,66-2,60 (м, 1H), 2,51-2,44 (м, 2H), 2,25-2,18 (м, 1H), 1,98-1,76 (м, 7H), 1,41-1,24 (м, 6H), 1,23-1,12 (м, 8H), 0,63 (с, 3H).
Стадия 7. Синтез соединений 6 и 7. В тщательно высушенную колбу добавляли 1,2,3-триазол (450 мг, 6,74 ммоль), K2CO3 (468 мг, 3,36 ммоль) и DMF (5 мл). Полученную суспензию перемешивали при 33°C в течение 30 минут в атмосфере N2. Затем к этой суспензии добавляли раствор соединения A16 (510 мг, 1,12 ммоль) в DMF (5 мл) и смесь перемешивали при 33°C еще в течение 4 часов. ЖХМС анализ показал, что реакция завершилась. Раствор гасили путем добавления насыщенного раствора NH4Cl. Смесь экстрагировали при помощи EtOAc. Органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и концентрировали. Остаток очищали препаративной ВЭЖХ с получением соединения 6 (55 мг, 9,9%) в виде бесцветного твердого вещества и соединения 7 (67 мг, 12,1%) в виде бледно-желтого твердого вещества.
1H ЯМР(6)(400 МГц, CDCl3) δ 7,71 (с, 2H), 5,21-5,20 (м, 2H), 3,95-3,90 (м, 1H), 3,80-3,70 (м, 1H), 3,42-3,33 (м, 2H), 2,78-2,70 (м, 2H), 2,63-2,58 (м, 1H), 2,40-2,35 (м, 1H), 1,90-1,70 (м, 7H), 1,43-1,25 (м, 7H), 1,24-1,13 (м, 8H), 0,69 (с, 3H).
1H ЯМР(7)(400 МГц, CDCl3) δ 7,79 (с, 1H), 7,65 (с, 1H), 5,26-5,10 (м, 2H), 3,98-3,90 (м, 1H), 3,80-3,70 (м, 1H), 3,40-3,35 (м, 2H), 2,85-2,80 (м, 1H), 2,75-2,65 (м, 1H), 2,60-2,45 (м, 2H), 2,31-2,20 (м, 1H), 1,98-1,78 (м, 7H), 1,46-1,25 (м, 7H), 1,24-1,13 (м, 7H), 0,68 (с, 3H).
Пример 5. Синтез соединений 8 и 9.

Стадия 1. Синтез соединения A18. К раствору соединения A17 (20,0 г, 49,2 ммоль) в ТГФ (100 мл) добавляли KOH (8,28 г, 147,6 ммоль). Смесь перемешивали при 27°C в течение 1,5 часа. ТСХ анализ (петролейный эфир/этилацетат=1/1) показал, что исходное вещество израсходовано полностью. К реакционной смеси добавляли H2O (50 мл) и полученный раствор экстрагировали при помощи EtOAc (80 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (150 мл), сушили над безводным Na2SO4иконцентрировали с получением неочищенного соединения A18 (17 г, 95%) в виде белого твердого вещества.
Стадия 2. Синтез соединения A19. К раствору соединения A18 (17 г, 46,64 ммоль) в CH3CN (1,5 л) добавляли TMSI (18,67 г, 93,28 ммоль) при охлаждении на ледяной бане в атмосфере N2. Смесь перемешивали при 15°C в течение 2 часов. ТСХ анализ (петролейный эфир/этилацетат=1/1) показал, что исходное вещество израсходовано полностью. Реакцию гасили при помощи Na2S2O3 (100 мл). Полученную смесь экстрагировали при помощи EtOAc (45 мл×3) и объединенные органические слои сушили над безводным Na2SO4 и концентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир =1/3), с получением соединения A19 (5,5 г, 31%) в виде желтого твердого вещества.
1H ЯМР(A19): (400 МГц, CDCl3) δ 4,74-4,61 (м, 1H), 4,39-4,36 (м, 1H), 4,35-3,31 (м, 1H), 4,22-4,15 (м, 2H), 3,29-3,22 (м, 1H), 3,16-3,05 (м, 1H), 2,77-2,58 (м, 1H), 2,54-2,36 (м, 3H), 2,38-2,13 (м, 8H), 1,15 (с, 3H), 0,88 (с, 3H).
Стадия 3. Синтез соединения A20. К раствору соединения A19 (2,4 г, 6,89 ммоль) и Et3N (2,09 мг, 20,66 ммоль) в CH2Cl2 (70 мл) добавляли MsCl (11,05 г, 96,42 ммоль) по каплям при 0°C в атмосфере N2. Реакционную смесь перемешивали при 25°C в течение 1 часа. ТСХ анализ (петролейный эфир/этилацетат=3/1) показал, что реакция завершилась. К реакционной смеси добавляли ледяную воду (35 мл) при 0°C при перемешивании. Полученный раствор экстрагировали при помощи CH2Cl2 (35 мл ×3). Объединенные органические слои сушили и концентрировали с получением неочищенного соединения A20 (1,6 г, 54%) в виде белого твердого вещества.
Стадия 4. Синтез соединения A21 и A22. К раствору соединения A20 (1,4 г, 3,28 ммоль) и 2H-1,2,3-триазола (1,13 г, 16,41 ммоль) в DMF (25 мл) добавляли K2CO3(2,27 г, 16,41 ммоль). Реакционную смесь перемешивали при 30°C в течение ночи. ТСХ анализ (петролейный эфир/этилацетат=1/2) показал, что реакция завершилась. К реакционной смеси добавляли насыщенный солевой раствор (20 мл). Полученный раствор экстрагировали при помощи EtOAc (25 мл ×3). Объединенные органические слои сушили и концентрировали с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (этилацетат/петролейный эфир=2/1 до 1/2), с получением соединения A21 (460 мг) и соединения A22 (480 мг) в виде белого твердого вещества.
Стадия 5-1. Синтез соединения 8. К раствору соединения A21 (360 мг, 901,07 мкмоль) в ТГФ (15 мл) добавляли K-селектрид (1,08 мл, 1M) при -78°C в атмосфере N2. Реакционную смесь перемешивали при -78°C в течение 2 часов. ТСХ анализ (DCM/MeOH=20/1) показал, что реакция завершилась. Реакцию гасили при помощи H2O2 (0,1 мл, 30%). Полученный раствор экстрагировали при помощи EtOAc (15 мл ×3) и объединенные органические слои промывали насыщенным водным раствором Na2S2O4 (15 мл ×2) и насыщенным солевым раствором (15 мл ×1). Смесь сушили и концентрировали с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=2/1), и затем очищали при помощи СЭЖХ, с получением соединения 8 (60,6 мг, 16,7%) в виде белого твердого вещества.
1H ЯМР (8): (400 МГц, CDCl3) δ 7,74-7,62 (м, 2H), 5,32-5,18 (м, 2H), 4,47-4,38 (м, 1H), 4,12-4,03 (м, 2H), 2,57-2,45 (м, 1H), 2,33-2,15 (м, 2H), 1,91-1,63 (м, 6H), 1,55-1,45 (м, 2H), 1,42-1,09 (м, 7H), 1,11-1,05 (м, 1H), 1,03 (с, 3H), 0,96 (с, 3H), 0,94-0,82 (м, 1H).
Стадия 5-2. Синтез соединения 9. К раствору соединения A22 (380 мг, 951,13 мкмоль) в ТГФ (15 мл) добавляли K-селектрид (1,14 мл, 1M) при -78°C в атмосфере N2. Реакционную смесь перемешивали при -78°C в течение 2 часов. ТСХ анализ (DCM/MeOH=20/1) показал, что реакция завершилась. Реакцию гасили при помощи H2O2 (0,1 мл, 30%). Полученный раствор экстрагировали при помощи EtOAc (15 мл ×3) и объединенные органические слои промывали насыщенным водным раствором Na2S2O4 (15 мл ×2) и насыщенным солевым раствором (15 мл ×1). Смесь сушили и концентрировали с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=1/1) и затем очищали при помощи хиральнойСЭЖХ-ВЭЖХ, с получением соединения 9 (79,8 мг, 21%) в виде белого твердого вещества.
1H ЯМР (9): (400 МГц, CDCl3) δ 7,78 (с, 1H), 7,68 (с, 1H), 5,31-5,25 (д, J=17,6Гц, 1H), 5,20-5,14 (д, J=17,6Гц, 1H), 4,48-4,45 (м, 1H), 4,12-4,03 (м, 1H), 2,65-2,53 (м, 2H), 2,32-2,15 (м, 1H), 1,92-1,71 (м, 5H), 1,68-1,59 (м, 4H), 1,54-1,42 (м, 1H), 1,41-1,15 (м, 4H), 1,13-1,05 (м, 1H), 1,04 (с, 3H), 0,94-0,85 (м, 4H).
Пример 6. Синтез соединения 10.

Стадия 1. Синтез соединения A24. К раствору (8S,9S,10R,13S,14S,17S)-17-ацетил-10,13-диметил-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-1H-циклопента[a]фенантрен-3(2H)-она (A23, 30 г, 95,5 ммоль) в 3-пиколине (150 мл) добавляли Pd/C (10%, 3,0 г) в атмосфере аргона. Суспензию дегазировали в вакууме и продували при помощи H2 несколько раз. Смесь перемешивали в атмосфере H2 (1 атм) при 25°Cв течение 12 часов. ТСХ анализ (петролейный эфир/этилацетат=3/1) показал, что исходное вещество израсходовано полностью. Суспензию фильтровали через слой целита и этот слой промывали при помощи EtOAc (200 мл ×3). Объединенные фильтраты промывали при помощи HCl (200 мл ×3, 1M), затем концентрировали досуха с получением (5R,8R,9S,10S,13S,14S,17S)-17-ацетил-10,13-диметилтетрадекагидро-1H-циклопента[a]фенантрен-3(2H)-она (A24, 29 г, 96%) в виде белого твердого вещества, которое использовали непосредственно на следующей стадии без очистки.
Стадия 2. Синтез соединения A25. К раствору 2,6-ди-трет-бутил-4-метилфенола (A24, 120 г, 549 ммоль) в толуоле (400 мл) добавляли раствор AlMe3 (137 мл, 274 ммоль, 2 M) при комнатной температуре, при этом сразу происходило выделение газообразного метана. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли раствор (5R,8R,9S,10S,13S,14S,17S)-17-ацетил-10,13-диметилтетрадекагидро-1H-циклопента[a]фенантрен-3(2H)-она A24 (29,0 г, 91,7 ммоль) в толуоле (300 мл) при -78°C в атмосфере азота. Затем реакционную смесь перемешивали в течение 30 минут, затем добавляли по каплям MeMgBr (91,3 мл, 274 ммоль, 3,0 M) при -78°C. Реакционную смесь перемешивали при этой температуре в течение 3 часов. Реакционную смесь гасили насыщенным водным раствором NH4Cl (300 мл) при -78°C. Суспензию фильтровали и фильтровальную лепешку промывали при помощи EtOAc (300 мл ×3). Объединенные органические фазы сушили над Na2SO4,упаривали с получением неочищенного продукта. Неочищенный продукт очищали колоночной хроматографией на силикагеле (PE: EtOAc=10:1 до 6:1) с получением 1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона A25 (6,0 г, 16,3%) в виде светло-желтого твердого вещества.
1H ЯМР (A25) (400 МГц, CDCl3) δ 2,54-2,52 (м, 1H), 2,13-2,10 (м, 4H), 1,98-1,63 (м, 4H), 1,49-1,30 (м, 8H), 1,25-1,00 (м, 12H), 0,91 (с, 3H), 0,90-0,85 (м, 1H), 0,58 (с, 3H).
Стадия 3. Синтез соединения A26. К перемешиваемому раствору (3S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона A25 (6,0 г, 18,04 ммоль) в MeOH (100 мл) добавляли HBr (0,29 г, 3,61 ммоль), затем добавляли по каплям Br2(1,35 мл, 27,06 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. ТСХ анализ показал, что реакция завершилась. Смесь гасили насыщенным водным раствором NaHCO3 и доводили до pH=7. Затем добавляли воду (200 мл) и осаждали твердое вещество. Твердое вещество фильтровали и промывали петролейным эфиром (100 мл ×2). Твердое вещество собирали и сушили при пониженном давлении. 2-бром-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанон A26 (6,0 г) получали в виде белого твердого вещества.
1H ЯМР (A26) (400 МГц, CDCl3) δ 3,94-3,87 (м, 2H), 2,83-2,79 (м, 1H), 2,18-2,16 (м, 1H), 1,94-1,71 (м, 6H), 1,57-1,47 (м, 8H), 1,26-1,10 (м, 11H), 0,93 (с, 3H), 0,61 (с, 3H).
Стадия 4. Синтез соединения 10. К смеси 2-бром-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (A26, 100 мг, 0,24 ммоль) и K2CO3(70 мг, 0,48 ммоль) в 3 мл ацетона добавляли 1H-пиразол-4-карбонитрил (30 мг, 0,36 ммоль) при 25°C. Реакционную смесь перемешивали при 40°C в течение 3 часов. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (PE/EtOAc=5/1 до 2/1) с получением 1-(2-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-оксоэтил)-1H-пиразол-4-карбонитрила (10, 25,5 мг, 25%) в виде белого твердого вещества.
1H ЯМР (10) (400 МГц, CDCl3)δ 7,85 (с, 1H), 7,80 (с, 1H), 5,03-4,87 (м, 2H), 2,25-2,15 (м, 1H), 2,10-1,80 (м, 3H), 1,75-1,71 (м, 3H), 1,54-1,35 (м, 8H), 1,33-0,95 (м, 10H), 0,94 (с, 3H), 0,64 (с, 3H). ЖХМС tR=1,268 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C26H37N3O2Na [M+Na]+ 446, найдено 446.
Пример 7. Синтез соединения 11 и 12.
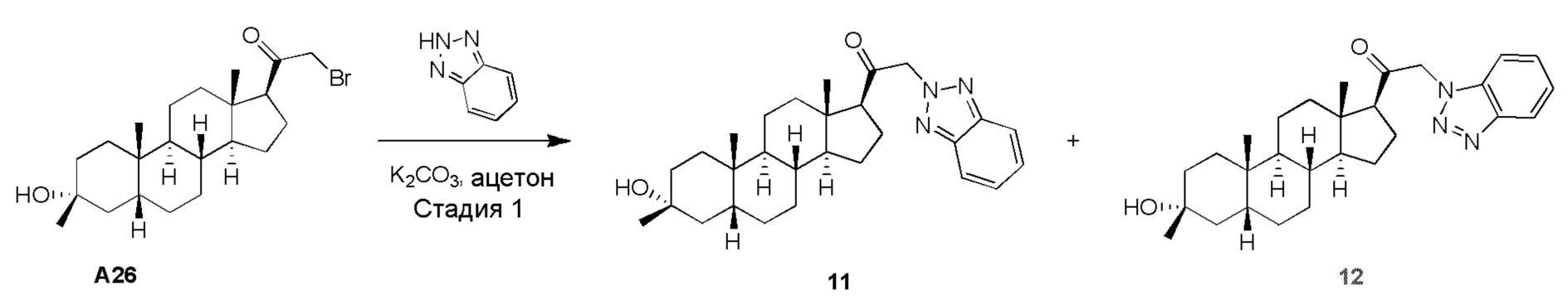
Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (11): (400 МГц, CDCl3)δ 7,89-7,86 (дд, J1=2,8 Гц, J2=6,4 Гц, 2H), 5,52-5,47 (м, 2H), 2,66-2,62 (т, J=8,8 Гц, 1H), 2,21-2,16 (м, 2H), 1,95-1,73 (м, 7H), 1,55-1,27 (м, 14H), 1,22-1,08 (м, 2H), 0,94 (с, 3H), 0,73 (с, 3H). ЖХМС tR=1,512 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H40N3O2 [M+H]+ 450, найдено 432([M+H-18].
1H ЯМР(12): (400 МГц, CDCl3)δ 8,09-8,07 (д, J=8,4 Гц, 1H), 7,51-7,40 (м, 1H), 7,38-7,32 (м, 2H), 5,41-5,40 (м, 2H), 2,72-2,70 (м, 1H), 2,20-2,17 (м, 2H), 1,96-1,74 (м, 7H), 1,45-1,23 (м, 14H), 1,22-1,08 (м, 2H), 0,96 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=1,438 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H40N3O2 [M+H]+ 450, найдено 450.
Пример 8. Синтез соединения 13.
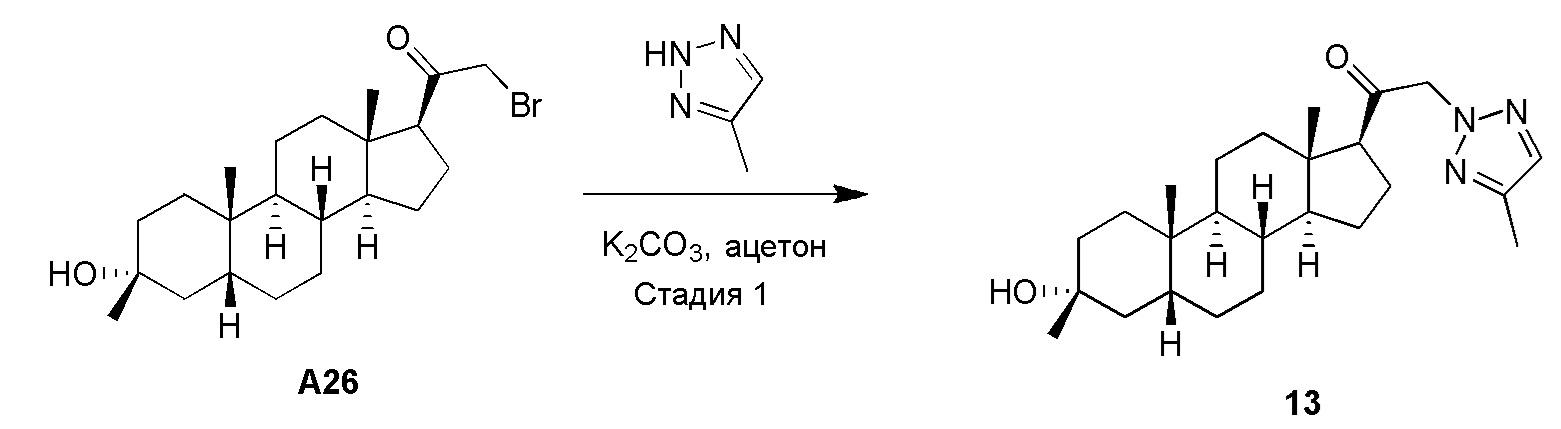
Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (13): (400 МГц, CDCl3)δ 7,41 (с, 1H), 5,13-5,12 (м, 2H), 2,57-2,52 (м, 1H), 2,32 (с, 3H), 2,25-2,15 (м, 1H), 2,10-2,00 (м, 1H), 1,94-1,59 (м, 5H), 1,52-1,40 (м, 9H), 1,26-1,06 (м, 10H), 0,94 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=0,93 мин в 1,5 мин хроматографии, 5-95AB, МС (ESI) рассчитано для C25H40N3O2 [M+H]+ 414, найдено 414.
Пример 9. Синтез соединений 14, 15 и 16.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (14): (400 МГц, CDCl3)δ 7,73-7,71 (м, 1H), 7,07-7,05 (м, 2H), 5,43-5,42 (м, 2H), 3,87 (с, 3H), 2,64-2,62 (м, 1H), 2,25-2,12 (м, 2H), 1,95-1,63 (м, 5H), 1,53-1,48 (м, 8H), 1,44-1,26 (с, 8H), 1,24-1,06 (м, 2H), 0,95 (с, 3H), 0,71(с, 3H). ЖХМС Rt =0,993 мин в 1,5 мин хроматографии, 5-95AB, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
1H ЯМР (15): (400 МГц, CDCl3)δ 7,38 (с, 1H), 7,21-7,19 (м, 1H), 7,15-7,13 (м, 1H), 5,36-5,35 (м, 2H), 3,88 (с, 3H), 2,67-2,65 (м, 1H), 2,25-2,10 (м, 2H), 1,95-1,63 (м, 5H), 1,52-1,44 (м, 8H), 1,43-1,26 (м, 8H), 1,22-1,08 (м, 2H), 0,95 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=0,944 мин в 1,5 мин хроматографии, 5-95 AB, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
1H ЯМР (16): (400 МГц, CDCl3)δ 7,92-7,90 (д, J=9,6 Гц, 1H), 7,02-6,99 (дд, J1=2,8 Гц, J2=9,6 Гц, 1H), 5,38-5,27 (м, 2H), 3,88 (с, 3H), 2,70-2,68 (м, 1H), 2,25-2,10 (м, 2H), 1,95-1,62 (м, 5H), 1,54-1,45 (м, 9H), 1,43-1,26 (м, 8H), 1,22-1,08 (м, 2H), 0,95 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=0,939 мин в 1,5 мин хроматографии, 5-95 AB, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
Пример 10. Синтез соединения 17 и 18.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (17): (400 МГц, CDCl3) δ 7,67 (д, J=9,2Гц, 1H), 7,35-7,27 (м, 1H), 7,06-7,02 (м, 1H), 5,59-5,50 (м, 2H), 2,67 (д, J=4Гц, 1H), 2,22-1,74 (м, 8H), 1,59-1,44 (м, 8H), 1,27-1,12 (м, 10H), 0,97 (с, 3H), 0,74 (с, 3H). ЖХМС Rt=0,992 мин в 1,5 мин хроматографии, 5-95AB, МС (ESI) рассчитано для C28H39FN3O2 [M+H]+ 468, найдено 450[ M+H-18].
1HЯМР (18): (400 МГц, CDCl3) δ 7,45-7,41 (м, 1H), 7,10 (д, J=8Гц, 1H) 7,04 (т, J=8Гц, 1H), 5,47-5,37 (м, 2H), 2,70 (т, J=12Гц, 1H), 2,21-1,74 (м, 10H), 1,56-1,44 (м, 5H), 1,27-1,09 (м, 11H), 0,96 (с, 3H),0,70 (с, 3H). ЖХМС Rt=1,402 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H39FN3O2 [M+H]+ 468, найдено 468.
Пример 11. Синтез соединения 19 и 20.
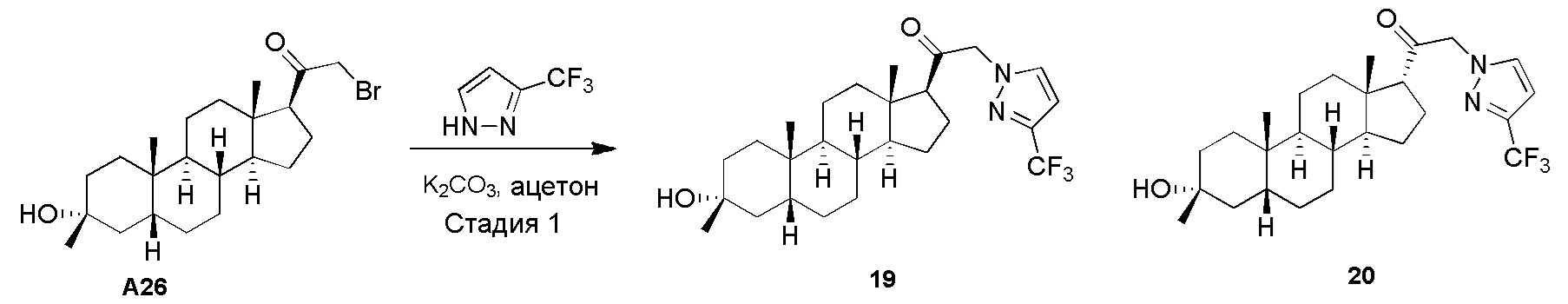
Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (19): (400 МГц, CDCl3) δ 7,46 (с, 1H), 6,58 (д, J=2Гц, 1H),5,02-4,91 (м, 2H), 2,59 (д, J=8Гц, 1H), 2,06-1,72 (м, 7H), 1,59-1,42 (м, 8H), 1,27-1,07 (м, 10H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=2,667 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C26H38F3N2O2 [M+H]+ 467, найдено 449 [M+H-18].
1H ЯМР (20): (400 МГц, CDCl3) δ 7,49 (с, 1H), 6,60 (д, J=1,6Гц, 1H),5,05-4,91 (м, 2H), 2,75 (т, J=8Гц, 1H), 1,88-1,80 (м, 8H), 1,57-1,41 (м, 8H), 1,38-0,95 (м, 10H), 0,92 (д, J=8Гц,6H). ЖХМС Rt=2,687 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C26H38F3N2O2 [M+H]+ 467, найдено 449 [M+H-18].
Пример 12. Синтез соединений 21, 22 и 23.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (21): (400 МГц, CDCl3) δ 7,86-7,84 (м, 1H), 7,46 (д, J=8Гц, 1H),7,20 (т, J=20Гц, 1H) 5,49-5,44 (м, 2H), 2,64(т, J=16Гц, 1H), 2,21-1,74 (м, 8H), 1,56-1,43 (м, 7H), 1,33-0,96 (м, 10H),0,83 (с, 3H),0,73 (с, 3H). ЖХМС Rt=2,712 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H39FN3O2 [M+H]+ 468, найдено 450 ([M+H]+-18).
1H ЯМР (22): δ 8,05-8,02 (м, 1H), 7,16 (т, J=9,2 Гц,1H), 6,99-6,96 (м, 1H), 5,43-5,31 (м, 2H), 2,72 (д, J=8,4 Гц,1H), 2,17-1,97 (м, 2H), 1,78-1,57 (м, 6H), 1,47-1,42 (м, 6H), 1,28-1,08 (м, 10H), 0,97 (с, 3H), 0,71 (с, 3H). ЖХМС Rt =2,589 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H39FN3O2 [M+H]+ 468, найдено 468.
1H ЯМР (23): (400 МГц, CDCl3) δ 7,70 (д, J=8Гц,1H), 7,28 (т, J=12Гц, 2H),5,46-5,35 (м, 2H), 2,71 (д, J=8Гц, 1H), 2,16-1,75 (м, 7H), 1,58-1,43 (м, 8H), 1,27-1,08 (м, 9H), 0,96 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=2,569 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H39FN3O2 [M+H]+468, найдено 468.
Пример 13. Синтез соединений 24 и 25.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (24): (400 МГц, CDCl3) δ 7,48 (д, J=1,6Гц, 1H), 6,72 (д, J=2,4Гц, 1H), 5,04-4,89 (м, 2H), 2,60(д, J=4Гц, 1H), 2,58-1,72 (м, 8H), 1,58-1,42 (м, 8H), 1,31-1,07 (м, 10H), 0,95 (с, 3H), 0,65 (с, 3H). ЖХМС Rt =2,385 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для: C26H38N3O2 [M+H]+ 424, найдено 406 [M+H-18]+.
1H ЯМР (25): (400 МГц, CDCl3) δ 7,50 (s,1H), 6,72 (д, J=2,4Гц, 1H), 6,75 (с, 1H), 5,09-4,89 (м, 2H), 2,76 (д, J=4Гц, 1H),1,88-1,81 (м, 8H), 1,57-1,41 (м, 8H), 1,38-1,20 (м, 10H),1,01 (д, J=48Гц, 6H). ЖХМС Rt =2,415 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для: C26H37N3O2 [M+H]+ 424, найдено 446 [M+23]+.
Пример 14. Синтез соединений 26 и 27.
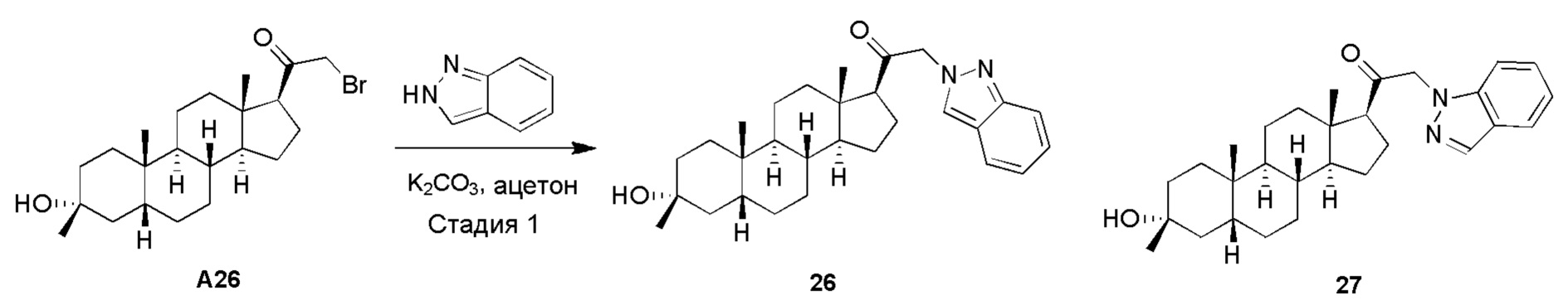
Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (26): (400 МГц, CDCl3) δ 7,93 (s,1H), 7,68 (т, J=20Гц, 2H), 7,29 (д, J=8Гц, 1H), 7,08 (т, J=16Гц, 2H),5,25-5,14 (м, 2H), 2,63 (д, J=8Гц, 1H), 2,20-1,72 (м, 9H), 1,57-1,42 (м, 6H), 1,26-1,07 (м, 10H), 0,95 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,194 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C29H41N2O2 [M+H]+ 449, найдено 449.
1HЯМР (27): (400 МГц, CDCl3) δ 8,05 (s,1H), 7,75 (т, J=8Гц, 1H), 7,37 (д, J=8Гц, 1H), 7,22-7,14 (м, 2H), 5,14 (м, 2H), 2,61 (т, J=16Гц, 1H), 2,22-1,69 (м, 9H), 1,55-1,42 (м, 7H), 1,26-1,06 (м, 10H), 0,95 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,213 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C29H41N2O2 [M+H]+ 449, найдено 449.
Пример 15. Синтез соединений 28, 29 и 30.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (28): (400 МГц, CDCl3) δ 7,30 (д, J=8Гц, 1H), 6,91 (т, J=20Гц, 1H), 5,55-5,46 (м, 2H), 2,65 (т, J=16Гц, 1H), 2,20 -1,74 (м, 8H), 1,60-1,43 (м, 8H), 1,27-1,08 (м, 10H), 0,96 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=2,662 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для химической формулы: C28H37F2N3O2 [M+H]+ 468, найдено 468.
1H ЯМР (29): (400 МГц, CDCl3) δ 7,54 (д, J=8Гц, 2H), 7,00 (т, J=8Гц, 1H), 5,52-5,37 (м, 2H), 2,73-2,63 (м, 1H), 2,12 -1,75 (м, 9H), 1,59-1,45 (м, 6H), 1,36-1,10 (м, 10H), 0,98 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=2,576 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H37F2N3O2 [M+H]+ 468, найдено 468.
1H ЯМР (30): (400 МГц, CDCl3) δ 6,89-6,79 (м, 2H), 5,43-5,31 (м, 2H), 2,70 (т, J=16Гц, 1H), 2,22-1,74 (м, 8H), 1,57-1,44 (м, 8H), 1,35-1,08 (м, 10H), 0,97 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=2,551 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H37F2N3O2 [M+H]+ 468, найдено 468.
Пример 16. Синтез соединений 31 и 32.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (31): (400 МГц, CDCl3) δ 5,16-5,02(м, 2H), 2,66-2,64 (м, 1H), 2,46 (с, 3H), 2,16-1,76 (м, 1H), 1,73-1,55 (м, 7H), 1,51-1,43 (м, 8H), 1,33-1,08 (м, 10H), 0,96 (с, 3H), 0,66 (с, 3H). ЖХМС Rt =1,070 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C24H39N4O2 [M+H]+ 415, найдено 415.
1H ЯМР (32): (400 МГц, CDCl3) δ 5,34 (с, 2H), 2,62-2,56 (м, 4H), 2,17-2,06 (м, 1H), 1,96-1,52 (м, 8H), 1,49-1,27 (м, 7H), 1,23-1,09 (м, 10H), 0,95 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=2,447 мин в 3 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C24H39N4O2 [M+H]+ 415, найдено 415.
Пример 17. Синтез соединений 33 и 34.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (33): (400 МГц, DMSO-d6) δ 8,32 (с, 1H), 7,86 (с, 1H),7,64 (д, J=8Гц, 1H), 7,23 (д, J=8Гц, 1H), 5,55-5,34(м, 2H), 4,28 (с, 1H), 2,51 (с, 1H), 1,86 -1,47 (м, 7H), 1,40-1,38 (м, 6H), 1,27-1,02 (м, 9H), 0,93 (с, 3H), 0,61 (с, 3H). ЖХМС Rt =1,444 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C29H39ClN2O2 [M+H]+ 483, найдено 483.
1H ЯМР (34): (400 МГц, CDCl3) δ 7,98 (с, 1H), 7,86 (с, 1H), 7,71 (д, J=1,6Гц, 1H), 7,13 (д, J=0,8Гц, 1H), 5,16-5,07 (м, 2H), 2,62 (д, J=8,8Гц,1H), 221-1,95 (м, 2H), 1,77-1,52 (м, 6H), 1,49-1,27 (м, 8H), 1,25-1,08 (м, 8H), 0,97 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,476 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C29H39ClN2O2 [M+H]+ 483, найдено 483.
Пример 18. Синтез соединений 35, 36 и 37.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (35): (400 МГц, CDCl3) δ 7,87 (д, J=1,6Гц, 1H), 7,82 (д, J=4,4Гц, 1H), 7,36-7,33 (м, 1H), 5,54-5,45 (м, 2H), 2,65 (д, J=4Гц, 1H), 2,23-2,00 (м, 2H), 1,96-1,58 (м, 5H), 1,51-1,42 (м, 9H), 1,27-1,08 (м, 10H), 0,96 (с, 3H), 0,72 (с, 3H). ЖХМС Rt =1,311 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C28H38ClN3O2 [M+H]+ 484, найдено [M+H-18]+466.
1H ЯМР (36): (400 МГц, CDCl3) δ 8,00 (д, J=4,6Гц,1H), 7,34 (д, J=6,4Гц,2H), 5,44-5,31 (м, 2H), 2,71 (т, J=8,8Гц,1H), 2,21-2,14 (м, 2H), 1,97-1,74 (м, 6H), 1,59-1,52 (м, 9H), 1,44-1,09 (м, 10H), 0,97 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=1,230 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C28H38ClN3O2 [M+H]+ 484, найдено 484.
1H ЯМР (37): (400 МГц, CDCl3) δ 8,06 (с, 1H), 7,44 (д, J=8Гц,1H), 7,30 (д, J=20Гц,1H) 5,45-5,34 (м, 2H), 2,70 (д, J=4Гц,1H), 2,19-2,17 (м, 2H), 1,96-1,74 (м, 6H), 1,56-1,51 (м, 9H), 1,46-1,09 (м, 10H), 0,96 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,261 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C28H38ClN3O2 [M+H]+ 484, найдено 484.
Пример 19. Синтез соединений 38 и 39.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (38): (400 МГц, CDCl3) δ 7,89 (с, 1H), 7,68-7,65 (м, 1H), 7,25 (т, J=2,4Гц, 1H), 7,09 (т, J=2,4Гц, 1H), 5,24-5,12 (м, 2H), 2,64 (т, J=8,4, 1H), 2,20-1,54 (м, 8H), 1,48-1,43 (м, 8H), 1,27-1,08 (м, 10H), 0,95 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,145 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C30H41FN2O2 [M+H]+ 467, найдено 467.
1HЯМР (39): (400 МГц, CDCl3) δ 7,99 (с, 1H), 7,35 (д, J=9,2Гц, 1H), 7,14 (д, J=6Гц, 1H), 5,12 (м, 2H), 2,61 (т, J=8,8, 1H), 2,20-1,95 (м, 2H), 1,72-1,53 (м, 7H), 1,43-1,10 (м, 18H), 0,95 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,117 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C29H39FN2O2 [M+H]+ 467, найдено 467.
Пример 20. Синтез соединения 40.

Стадия 1. Синтез соединения A28. К раствору соединения A27 (15 г, 47 ммоль) в EtOH (150 мл) добавляли Pd/C (1,5 г, 10%), Смесь перемешивали при 40°C в течение 12 часов в атмосфере H2 (45 ф/дюйм2(3,164 кг/см2)). Смесь фильтровали с получением органического слоя и концентрировали с получением соединения A28 (7,5 г) в виде белого твердого вещества.
1H ЯМР (A28): (400 МГц, CDCl3) δ 3,62-3,52 (м, 1H), 2,57-2,51 (м, 1H), 2,20-2,12(м, 4H), 2,05-1,98 (м, 1H), 1,87-1,78 (м, 1H), 1,75-1,58 (м, 6H), 1,45-1,09 (м, 11H), 1,03-0,89 (м, 2H), 0,81 (с, 3H), 0,71-0,63 (м, 1H), 0,60 (с, 3H).
Стадия 2. Синтез соединения A29. К раствору соединения A28 (7,5 г, 23,6 ммоль) в безводном пиридине (70 мл) добавляли TsCl (6,79 г, 35,4 ммоль) по порциям. Смесь перемешивали при 40°C в течение 6 часов. Медленно добавляли воду, затем осаждали белое твердое вещество. Белого твердое вещество фильтровали и промывали HCl (1 M) (200 мл ×3), затем водой (200 мл ×3). Фильтрат сушили при пониженном давлении с получением соединения A29 (9,5 г) в виде желтого твердого вещества.
Стадия 3. Синтез соединения A30. К перемешиваемому раствору коллидина (100 мл) добавляли соединение A29 (9,5 г, 20 ммоль). Смесь перемешивали при 130°C в течение 4 часов. После того, как ТСХ анализ показал, что исходное вещество израсходовано, смесь обрабатывали при помощи H2SO4(500 мл, 10%) и осаждали твердое вещество. Твердое вещество фильтровали и остаток промывали при помощи H2SO4(200 мл ×3) и концентрировали с получением соединения A30 (6 г) в виде желтого твердого вещества.
Стадия 4. Синтез соединения A31. К раствору соединения A30 (6 г, 20 ммоль) в CH2Cl2 (100 мл) добавляли m-CPBA (6,8 г, 39,6 ммоль) по порциям при 0°C. Смесь перемешивали при 0°C в течение 1 часа, затем при 15°C в течение 12 часов. Раствор промывали последовательно насыщенным водным раствором Na2S2O3 (50 мл) и насыщенным водным раствором Na2CO3 (200 мл), сушили над NaSO4, фильтровали и упаривали досуха. Осуществляли очистку колоночной флэш-хроматографией на силикагеле (элюент: петролейный эфир: этилацетат=50:1) с получением соединения A31 (0,92 г) и смеси (2,5 г) в виде белого твердого вещества.
1H ЯМР (A31): (400 МГц, CDCl3) δ 3,19-3,11 (м, 2H), 2,58-2,50 (м, 1H), 2,11 (с, 3H), 2,08-1,82 (м, 3H), 1,70-1,08 (м, 17H), 0,90-0,82 (м, 1H), 0,78 (с, 3H), 0,72-0,63 (м, 1H), 0,59 (с, 3H).
Стадия 5. Синтез соединения A32. К раствору соединения A31 (1 г, 3,16 ммоль) в EtOH (20 мл) добавляли 12 капель дымящей серной кислоты. Смесь перемешивали при 19°C в течение 3 часов, реакционную смесь гасили водным раствором NaHCO3 и упаривали до небольшого объема. Смесь обрабатывали водой и экстрагировали при помощи EtOAc (50 мл ×3). Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и упаривали с получением соединения A32 (0,95 г) в виде белого твердого вещества.
Стадия 6. Синтез соединения A33. К раствору соединения A32 (0,95 г, 2,6 ммоль) в MeOH (50 мл) добавляли водный раствор HBr (0,2 мл, 48% в воде) и Br2 (0,5 г, 3,14 ммоль). Смесь перемешивали при 19°C в течение 2 часов. Затем смесь гасили насыщенным водным раствором NH4Cl (20 мл). Смесь концентрировали, добавляли воду (50 мл) и экстрагировали при помощи EtOAc (50 мл ×3). Органическую фазу сушили над Na2SO4 и концентрировали с получением неочищенного продукта. Остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=13:1) с получением соединения A33 (500 мг) в виде белого твердого вещества.
1H ЯМР: (400 МГц, CDCl3) δ 3,95-3,88 (м, 3H), 3,60-3,52 (м, 1H), 3,45-3,37 (м, 2H), 2,83-2,78 (м, 1H), 2,23-2,13 (м, 1H), 1,94-1,78 (м, 3H), 1,80-1,61 (м, 4H), 1,44-1,12 (м, 14H), 0,96 -0,89 (м, 4H), 0,80-0,70 (м, 1H), 0,62 (с, 3H)
Стадия 7. Синтез соединения 40. К раствору K2CO3 (94 мг, 0,66 ммоль) в DMF (8 мл) добавляли этил 1H-пиразол-3-карбоксилат (158 мг, 1,12 ммоль). Смесь перемешивали при 20°C в течение 0,5 часа в атмосфере N2. Затем к смеси добавляли раствор соединения A33 (100 мг, 0,22 ммоль) в DMF (4 мл) и перемешивали при 20°C в течение 3 часов. Смесь разбавляли при помощи EtOAc (50 мл), промывали насыщенным солевым раствором (50 мл ×3) и органический слой сушили над безводным Na2SO4 и затем концентрировали с получением неочищенного продукта. Смесь очищали колоночной хроматографией (петролейный эфир:этилацетат=4:1) с получением соединения 40 (45 мг) в виде желтого твердого вещества.
1H ЯМР (40): (400 МГц, CDCl3) δ 7,44 (д, J=2 Гц, 1H), 6,87 (д, J=2,4 Гц, 1H), 5,30 (с, 3H), 4,40 (дд, J =7,6 Гц, J =14,8 Гц, 2H), 3,96-3,91 (м, 1H), 3,60-3,53 (м, 1H), 3,47-3,38 (м, 2H), 2,60-2,52 (м, 1H), 2,21-2,11 (м, 1H), 2,07-2,00 (м, 1H), 1,90 -1,61 (м, 6H), 1,52-1,15 (м, 17H), 1,03 -0,92 (м, 4H), 0,82-0,72 (м, 1H), 0,66 (с, 3H)
Пример 21. Синтез соединения 42.
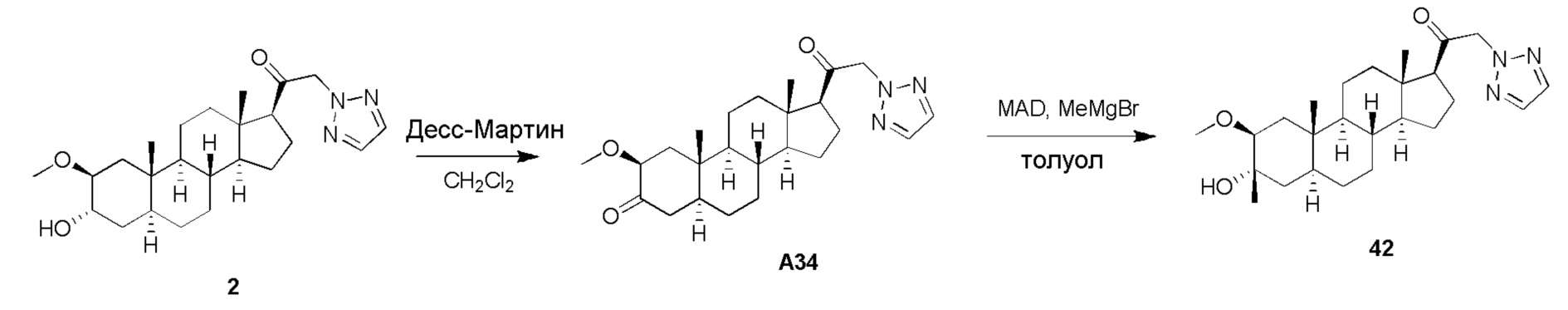
Стадия 1. Синтез соединения A34. К раствору соединения 2 (60 мг, 0,14 ммоль) в CH2Cl2 (4 мл) добавляли реагент Десса-Мартина (0,12 г, 0,28 ммоль) при 0°C. Реакционную смесь перемешивали при 30°C в течение 1,5 часа. После того, как ТСХ анализ показал, что исходное вещество израсходовано полностью, смесь гасили смесью водного раствора NaHCO3 и водного раствора Na2S2O3(5 мл). Смесь экстрагировали при помощи CH2Cl2 (15 мл). Органический слой промывали насыщенным солевым раствором (8 мл ×2), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат =20/1 до 10/1) с получением соединения A34 (27,2 мг) в виде белого твердого вещества.
1H ЯМР (A34): (400 МГц, CDCl3) δ 7,68 (с, 2H), 5,30-5,18 (м, 2H), 3,66-3,60 (м, 1H), 3,30 (с, 3H), 2,64-2,52 (м, 2H), 2,23-2,03 (м, 4H), 1,76-1,68 (м, 4H), 1,48-1,15 (м, 9H), 1,04 (с, 3H), 0,97-0,88 (м, 1H), 0,82-0,75 (м, 1H), 0,71 (с, 3H).
Стадия 2. Синтез соединения 42. К перемешиваемому раствору MAD (182,2 мг, 0,56 ммоль) в 5 мл толуола добавляли по каплям раствор соединения A34 (0,1 г, 0,24 ммоль) в толуоле (15 мл) при -78°C в течение 1 часа в атмосфере азота. После перемешивания при этой же температуре в течение 0,5 часа добавляли по каплям раствор MeMgBr (0,52 мл, 1,4 ммоль) при -78°C. Реакционную смесь нагревали до -40°C и перемешивали в течение 3 часов. После того, как ТСХ анализ показал, что реакция завершилась, реакционную смесь выливали в водный раствор NH4Cl и экстрагировали при помощи EtOAc (30 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Продукт очищали колоночной хроматографией на силикагеле (PE/EA=15/1 до 10/1) с получением соединения 42 (40 мг) в виде белого твердого вещества.
1H ЯМР (42): (400 МГц, CDCl3) δ 7,68 (с, 2H), 5,31-5,16 (м, 2H), 3,31 (с, 3H), 3,06-2,98 (м, 1H), 2,59-2,55 (м, 1H), 2,22-1,95 (м, 3H), 1,45-1,11 (м, 16H), 1,04-0,94 (м, 1H), 0,92 (с, 3H), 0,83-0,874 (м, 1H), 0,70 (с, 3H)
Пример 22. Синтез соединения 43.

К раствору соединения A26 (500 мг, 1,21 ммоль) в ацетоне (5 мл) добавляли морфолин (500 мг, 5,73 ммоль). После перемешивания при 25°C в течение 2 часов ТСХ анализ показал, что реакция завершилась. К реакционной смеси добавляли воду (2 мл), экстрагировали при помощи EtOAc (20 мл ×2). Объединенный органический слой промывали водой (10 мл), сушили над Na2SO4, концентрировали в вакууме с получением 1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-морфолинoэтанона(0,47 г) в виде светло-желтого твердого вещества.
1H ЯМР (43): (400 МГц, CDCl3)δ 3,74 (т, J=4,8 Гц, 1H), 3,21-3,11 (м, 2H), 2,62-2,45 (м, 5H), 2,22-2,10 (м, 1H), 2,00-1,05 (м, 25H), 0,93 (с, 3H), 0,60 (с, 3H). ЖХМС Rt=0,973 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C26H44NO3 [M+H]+ 418, найдено 418.
Пример 23. Синтез соединений 44, 45 и 46.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (44): (400 МГц, CDCl3) δ 7,63 (д, J=8Гц, 1H), 7,23 (д, J=8,4Гц, 1H), 6,76 (д, J=8Гц, 1H), 5,58 (д, J=1,6Гц, 2H), 3,89 (с, 3H), 2,66 (т, J=8,4, 1H), 2,19-1,97 (м, 2H), 1,78-1,57 (м, 5H), 1,46-1,41 (м, 7H), 1,27-1,09 (м, 7H), 0,97 (с, 3H), 071 (с, 3H). ЖХМС Rt=0,943 мин в 1,5 мин хроматографии, 5-95AB, МС (ESI) рассчитано для C29H41N3O3 [M+H]+ 480, найдено 480
1H ЯМР (45): (400 МГц, CDCl3) δ 7,38 (т, J=8Гц, 1H), 6,86 (д, J=8Гц, 1H), 6,69 (д, J=8,4Гц, 1H), 5,37 (с, 2H), 4,12 (с, 3H), 2,67 (т, J=8,4, 1H), 2,19-1,95 (м, 2H), 1,77-1,55 (м, 5H), 1,50-1,42 (м, 8H), 1,27-1,08 (м, 11H), 0,96 (с, 3H), 070 (с, 3H). ЖХМС Rt=1,113 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C29H41N3O3 [M+H]+ 480, найдено 480
1H ЯМР (46): (400 МГц, CDCl3) δ 7,43 (д, J=9,2Гц, 1H), 9,30 (т, J=8Гц, 1H), 6,64 (д, J=6,8Гц, 1H), 5,49 (с, 2H), 4,03 (с, 3H), 2,65-2,60 (м, 1H), 2,04-1,95 (м, 2H), 1,77-1,54 (м, 7H), 1,54-1,42 (м, 6H), 1,27-1,08 (м, 11H), 0,96 (с, 3H), 072 (с, 3H). ЖХМС Rt=1,168 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C29H41N3O3 [M+H]+ 480, найдено [M+H-18]+462.
Пример 24. Синтез соединений 47 и 48.
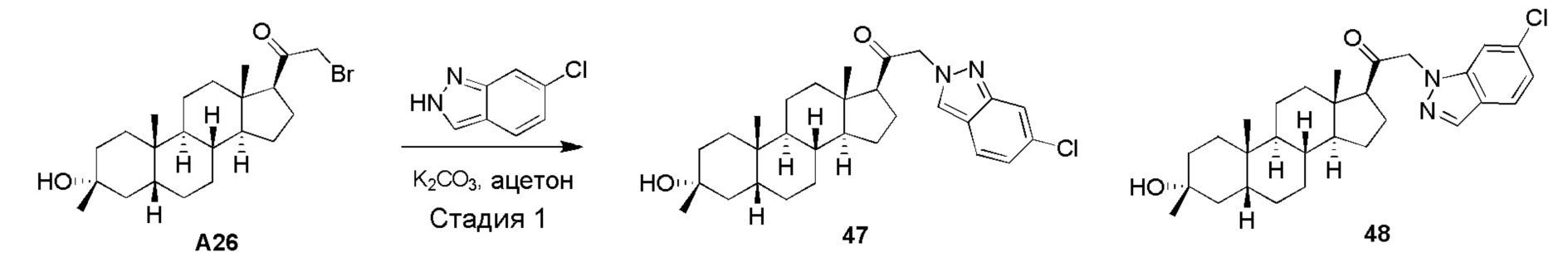
Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (47) (400 МГц, CDCl3) δ 7,92 (с, 1H), 7,68 (с, 1H), 7,20 (д, J=8,4Гц, 1H), 7,03 (т, J=8,4Гц, 1H), 5,23-5,11 (м, 2H), 2,63 (т, J=8,4, 1H), 2,22-1,95 (м, 2H), 1,77 -1,54 (м, 5H), 1,45-1,07 (м, 19H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,214 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C29H39ClN2O2 [M+H]+ 483, найдено 483.
1H ЯМР (48): (400 МГц, CDCl3) δ 8,00 (с, 1H), 7,65 (д, J=8,4Гц, 1H), 7,20 (с, 1H), 7,14-7,11 (м, 1H), 5,14-5,04 (м, 2H), 2,64 (т, J=8,4, 1H), 2,17-1,96 (м, 2H), 1,73 -1,52 (м, 6H), 1,48-1,11 (м, 18H), 0,96 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,239 мин в 2 мин хроматографии, 30-90AB; МС (ESI) рассчитано для C29H39ClN2O2 [M+H]+ 483, найдено 483.
Пример 25. Синтез соединений 49 и 50.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (49): (400 МГц, CDCl3) δ 8,68 (д, J=2, 1H), 7,76 (д, J=2, 1H), 5,51-5,34 (м, 2H), 2,73 (т, J=8,8, 1H), 2,21-1,97 (м, 2H), 1,78 -1,54 (м, 5H), 1,47-1,30 (м, 9H), 1,28-1,09 (м, 10H), 0,97 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=1,137 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C27H37ClN4O2 [M+H]+ 485, найдено 467[M+H-18]+
1H ЯМР (50): (400 МГц, CDCl3) δ 8,73 (д, J=2, 1H), 8,22 (д, J=2, 1H), 5,59-5,49 (м, 2H), 2,66 (т, J=8,4, 1H), 2,17-1,96 (м, 2H), 1,73 -1,53 (м, 6H), 1,45-1,43 (м, 8H), 1,27-1,08 (м, 10H), 0,96 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=0,977 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C27H37ClN4O2 [M+H]+ 485, найдено 467[M+H-18]+
Пример 26. Синтез соединений 51, 52 и 53.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (51): (400 МГц, CDCl3) δ 7,49-7,45 (м, 1H), 7,06 (д, J=8,2, 1H), 5,47-5,35 (м, 2H), 2,71 (д, J=8,8, 1H), 2,19-1,96 (м, 2H), 1,87 -1,55 (м, 7H), 1,46-1,44 (м, 6H), 1,27-1,09 (м, 11H), 0,96 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,234 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C28H37ClFN3O2[M+H]+ 502, найдено 502.
1H ЯМР (52) (400 МГц, CDCl3) δ 7,79 (д, J=8,8, 1H), 7,36-7,33 (м, 1H), 5,52 (с, 2H), 2,72 (д, J=8,4, 1H), 2,20-1,97 (м, 2H), 1,84 -1,55 (м, 7H), 1,47-1,44 (м, 6H), 1,27-1,09 (м, 11H), 0,97 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=1,013 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H37ClFN3O2[M+H]+ 502, найдено 502.
1H ЯМР (53): (400 МГц, CDCl3) δ 7,63 (т, J=8,8, 1H), 7,38-7,34 (м, 1H), 5,57-5,48 (м, 2H), 2,65 (т, J=8,8, 1H), 2,20-2,04 (м, 2H), 1,77 -1,57 (м, 6H), 1,45-1,43 (м, 7H), 1,27-1,08 (м, 11H), 0,96 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=1,310 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H37ClFN3O2[M+H]+ 502, найдено 484[M+H-18]+.
Пример 27. Синтез соединений 54 и 55.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (54): (400 МГц, CDCl3) δ 8,57 (с, 1H), 5,45 (с, 2H), 2,63 (т, J=8,8Гц,1H), 2,19-1,54 (м, 8H), 1,50-1,43 (м, 7H), 1,27-1,08 (м, 11H), 0,96 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=0,899 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C23H36N4O2 [M+H]+ 401, найдено [M+H-18]+ 383
1H ЯМР (55): (400 МГц, CDCl3) δ 8,74 (с, 1H), 5,33-5,16 (м, 2H), 2,67 (д, J=8,8Гц,1H), 2,20-1,54 (м, 8H), 1,51-1,43 (м, 8H), 1,31-1,09 (м, 10H), 0,95(с, 3H), 0,65 (с, 3H). ЖХМС Rt=0,8827 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C23H36N4O2 [M+H]+ 401, найдено [M+H-18]+ 383
Пример 28. Синтез соединений 56, 57, 58 и 59.

Стадия 1. Синтез соединений A35 и A36. К раствору соединения A26 (300 мг, 729 мкмоль, 1,00 экв.) в ацетоне (5 мл) добавляли K2CO3 (200 мг, 1,45 ммоль, 2,0 экв.) и 2H-1,2,3-триазол (60,3 мг, 874 мкмоль, 1,2 экв.) при 25°C. Реакционную смесь перемешивали при 25°C в течение 16 часов. После этого ТСХ анализ показал исчезновение исходного вещества. Смесь разбавляли водой (20 мл) и экстрагировали при помощи EA (30 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (силикагель 100-200 меш, Петролейный эфир/Этилацетат=2/1 до EA) с получением 1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(2H-1,2,3-триазол-2-ил)этанона (120 мг, 285 мкмоль) и 1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(1H-1,2,3-триазол-1-ил)этанона (130 мг, 309 мкмоль) в виде не совсем белого твердого вещества.
1H ЯМР (A35): (400 МГц, CDCl3)δ 7,69 (с, 2H), 5,28-5,19 (м, 2H), 2,59-2,55 (м, 1H), 0,95 (с, 3H), 0,69 (с, 3H).
1H ЯМР (A36): (400 МГц, CDCl3)δ 7,76 (д, J=8Гц, 1H), 7,64 (д, J=8Гц, 1H), 5,29-5,11 (м, 2H), 2,66-2,62 (м, 1H), 0,95 (с, 3H), 0,66 (с, 3H).
Стадия 2. Синтез соединений 56 и 57. К раствору соединения A35 (120 мг, 300 мкмоль, 1,00 экв.) и KOH (33,6 мг, 600 мкмоль, 2 экв.) в ТГФ (4,00 мл) добавляли CH3I (51 мг, 360 мкмоль, 1,2 экв.). Смесь перемешивали при 25°C в течение 3 часов. ТСХ анализ показал исчезновение исходного вещества. Реакцию гасили водой и экстрагировали при помощи EA (2×20 мл). Объединенную органическую фазу промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Остаток очищали препаративной ВЭЖХ (0,5% HCl) с получением (R)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидроксил-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(2H-1,2,3-триазол-2-ил)пропан-1-она (21 мг, 49,7 мкмоль) и (S)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(2H-1,2,3-триазол-2-ил)пропан-1-она (30 мг, 72,5 мкмоль) в виде белого твердого вещества.
1H ЯМР (56): (400 МГц, CDCl3)δ 7,68 (с, 2H), 5,25 (кв., J=6,8 Гц, 1H), 2,23-2,14 (м, 1H), 2,10-2,00 (м, 1H), 1,90-1,75 (м, 3H), 1,58-1,50 (м, 5H), 1,49-1,25 (м, 8H), 1,24-1,07 (м, 9H),1,04-1,00 (м, 3H), 0,95 (с, 3H), 0,64 (с, 3H). ЖХМС Rt=0,945 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H]+ 414, найдено 396([M+H-18]
1H ЯМР (57): (400 МГц, CDCl3)δ 7,67 (с, 2H), 5,40 (кв., J=7,6 Гц, 1H), 2,65-2,63 (м, 1H), 2,14-2,12 (м, 2H), 1,95-1,66 (м, 5H), 1,60-1,49 (м, 3H), 1,55-1,25 (м, 10H), 1,42-1,00 (м, 10H), 0,95 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=0,927 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H]+ 414, найдено 396([M+H-18]+
Стадия 3. Синтез соединений 58 и 59. К раствору соединения A36 (130 мг, 325 мкмоль, 1,00 экв.) и KOH (36,4 мг, 650 мкмоль, 2 экв.) в ТГФ (5,00 мл) добавляли CH3I (55,3 мг, 390 мкмоль, 1,2 экв.). Смесь перемешивали при 25°C в течение 3 часов. ТСХ анализ показал исчезновение исходного вещества. Реакцию гасили водой и экстрагировали при помощи EA (2×30 мл); объединенную органическую фазу промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Остаток очищали препаративной ВЭЖХ (0,5% HCl) с получением (R)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(1H-1,2,3-триазол-1-ил)пропан-1-она (41,5 мг, 98,5 мкмоль) и (S)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(1H-1,2,3-триазол-1-ил)пропан-1-она (24,5 мг, 58,5 мкмоль) в виде белого твердого вещества.
1H ЯМР (58): (400 МГц, CDCl3)δ 7,77 (с, 1H), 7,60 (с, 1H), 5,47 (кв., J=7,6Гц, 1H), 2,56-2,51 (м, 1H), 2,15-2,00 (м, 1H), 1,90-1,75 (м, 3H), 1,66-1,64 (м, 3H), 1,60-1,54 (м, 2H), 1,50-1,39 (м, 9H), 1,25-1,00 (м, 11H), 0,94 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,054 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H]+ 414, найдено 396([M+H-18]
1H ЯМР (59): (400 МГц, CDCl3)δ 7,79 (с, 1H), 7,74 (с, 1H), 5,64 (кв., J=7,2Гц, 1H), 2,80-2,78 (м, 1H), 2,22-2,20 (м, 2H), 1,96-1,75 (м, 2H), 1,69-1,54 (м, 6H), 1,58-1,43 (м, 9H), 1,40-1,00 (м, 10H), 0,93 (с, 3H), 0,51 (с, 3H). ЖХМС Rt=1,012 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H]+ 414, найдено 396([M+H-18]
Пример 29. Синтез соединений 60, 61, 62 и 63.
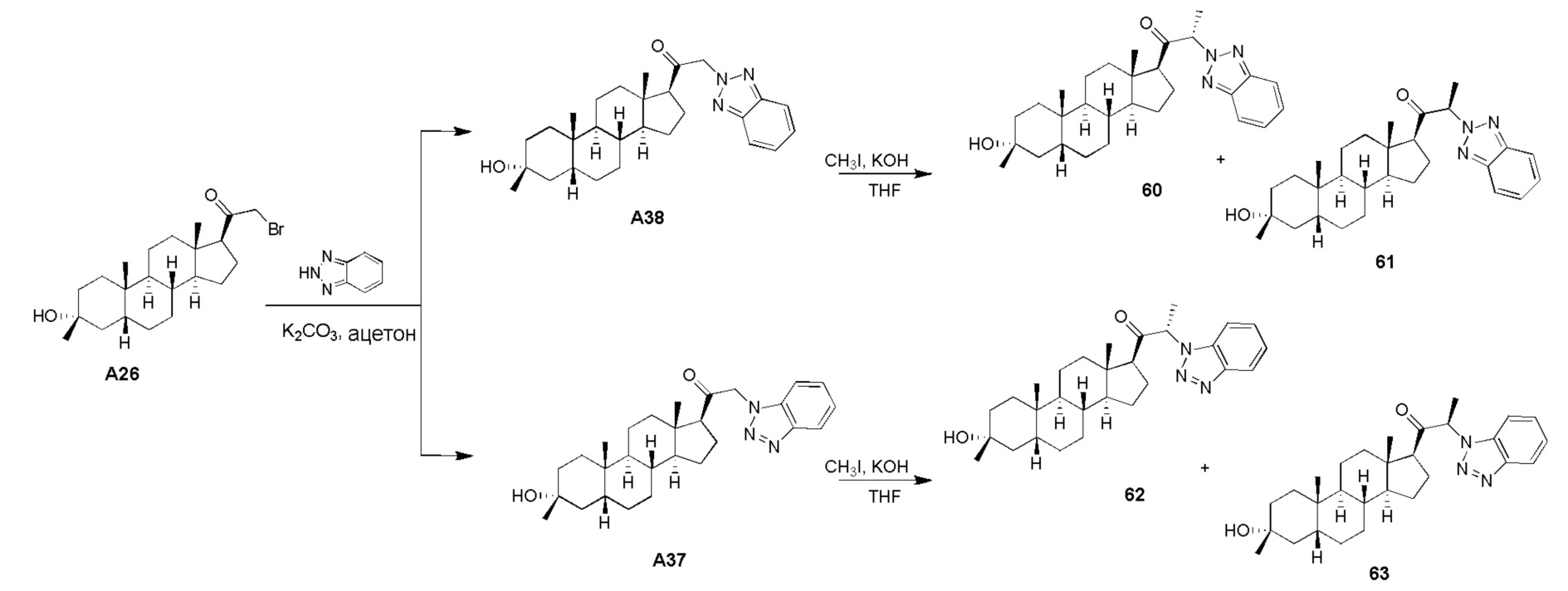
Стадия 7. Синтез соединений A37 и A38. К раствору соединения A26 (400 мг, 972 мкмоль) в ацетоне (5 мл) добавляли K2CO3 (268 мг, 1,94 ммоль) и 2H-бензо[d][1,2,3]триазол (138 мг, 1,16 ммоль) при 25°C. Реакционную смесь перемешивали при 25°C в течение 16 часов. После этого ТСХ анализ показал исчезновение исходного вещества и смесь разбавляли водой (20 мл) и экстрагировали при помощи EA (20 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (силикагель 100-200 меш, петролейный эфир/этилацетат=3/1) с получением 2-(2H-бензо[d][1,2,3]триазол-2-ил)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (95,0 мг, 211 мкмоль) и 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (290,0 мг, 612 мкмоль) в виде не совсем белого твердого вещества.
1H ЯМР (A37): 400 МГц δ 7,87 (дд, J1=3,2Гц, J2=6,4Гц, 2H), 7,39 (дд, J1=3,2Гц, J2=6,8Гц, 2H), 5,52-5,51 (м, 2H), 2,65-2,63 (м, 1H), 0,96 (с, 3H), 0,73 (с, 3H).
1H ЯМР (A38): 400МГцδ 8,09 (д, J=8,4Гц, 1H), 7,49-7,47 (м, 1H), 7,40-7,26 (м, 2H), 5,42-5,41 (м, 2H),2,72-2,68 (м, 1H), 0,96 (с, 3H), 0,71 (с, 3H).
Стадия 7. Синтез соединений 60 и 61. К раствору соединения A38 (95 мг, 211 мкмоль) и KOH (23,6 мг, 422 мкмоль) в ТГФ (3,00 мл) добавляли CH3I (35,9 мг, 253 мкмоль). Смесь перемешивали при 25°C в течение 16 часов. ТСХ анализ показал исчезновение исходного вещества. Затем реакцию гасили водой и экстрагировали при помощи EA (2×20 мл); объединенную органическую фазу промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Остаток очищали препаративной ВЭЖХ (0,5%HCl) с получением (R)-2-(2H-бензо[d][1,2,3]триазол-2-ил)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)пропан-1-она (9,4 мг, 20,0 мкмоль) и (S)-2-(2H-бензо[d][1,2,3]триазол-2-ил)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)пропан-1-она (15,2 мг, 32,4 мкмоль) в виде белого твердого вещества.
1H ЯМР (60): 400МГц δ 7,88 (дд, J1=3,2Гц, J2=6,8Гц, 2H), 7,40 (дд, J1=3,2Гц, J2=6,8Гц, 2H), 5,74-5,68 (м, 1H), 2,74-2,69 (м, 1H), 2,25-2,1(м, 1H), 2,00-1,75(м, 8H), 1,60-1,29 (м, 10H), 1,28-1,25 (м, 8H), 1,25-1,00 (м, 2H), 0,97 (с, 3H), 0,73 (с, 3H). ЖХМС Rt=0,997 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2 [M+H]+ 464, найдено 446([M+H-18]
1H ЯМР (61): 400МГц δ 7,88 (дд, J1=2,8Гц, J2=6,4Гц, 2H), 7,42 (дд, J1=3,2Гц, J2=6,4Гц, 2H), 5,54-5,49 (м, 1H), 2,26-2,05 (м, 2H), 1,95-1,50 (м, 8H), 1,48-1,30 (м, 8H), 1,28-1,15 (м, 9H), 1,13-1,04 (м, 3H), 0,93 (с, 3H), 0,67 (с, 3H)
ЖХМС Rt=1,006 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2 [M+H]+ 464, найдено 446([M+H-18]
Стадия 7. Синтез соединения 62 и 63. К раствору соединения A37 (290 мг, 6444 мкмоль, 1,00 экв.) и KOH (71,8 мг, 1280 мкмоль, 2 экв.) в ТГФ (6,00 мл) добавляли CH3I (109 мг, 772 мкмоль, 1,2 экв.). Смесь перемешивали при 25°C в течение 3 часов. ТСХ анализ показал исчезновение исходного вещества. Затем реакцию гасили водой и экстрагировали при помощи EA (2×30 мл), объединенную органическую фазу промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Остаток очищали препаративной ВЭЖХ (0,5% HCl) с получением (R)-2-(1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)пропан-1-она (41 мг, 84,7 мкмоль) и (S)-2-(1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)пропан-1-она (47,5 мг, 100 мкмоль) в виде белого твердого вещества.
1H ЯМР (62): 400МГцδ 8,09 (д, J=8,0Гц, 1H), 7,57-7,55 (м, 1H), 7,49-7,47 (м, 1H), 7,39-7,37 (м, 1H), 5,81-5,79 (м, 1H), 2,72-2,68 (м, 1H), 2,01-1,75 (м, 8H), 1,65-1,55 (м, 2H), 1,50-1,25(м, 8H), 1,24-1,00 (м, 11H), 0,93 (с, 3H), 0,61 (с, 3H). ЖХМС tR=1,161 мин в 2 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C29H41N3O2 [M+H]+ 464, найдено 446([M+H-18]
1H ЯМР (63): 400МГцδ 8,10 (д, J=7,6Гц, 1H), 7,51-7,47 (м, 1H), 7,42-7,39 (м, 2H), 5,64-5,58 (м, 1H), 2,36-2,33 (м, 1H), 2,20-2,00 (м, 1H), 1,77-1,57 (м, 7H), 1,50-1,25(м, 10H), 1,25-1,10 (м, 8H), 1,24-1,03 (м, 3H), 0,92 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,186 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2 [M+H]+ 464, найдено 446([M+H-18]
Пример 30. Синтез соединений 64 и 65.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (64): (400 МГц, CDCl3) δ 8,64 (с, 1H), 8,56 (с, 1H), 8,27 (с, 1H), 5,37-5,21 (м, 2H), 2,70 (т, J=8,4, 1H), 2,22-1,96 (м, 2H), 1,77 -1,58 (м, 6H), 1,51-1,43 (м, 8H), 1,27-1,08 (м, 10H), 0,96 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=0,937 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H38N4O2 [M+H]+ 451, найдено 473 [M+23]+.
1HЯМР (65): (400 МГц, CDCl3) δ 8,58 (д, J=1,6Гц, 1H), 8,44 (д, J=2Гц, 1H), 8,34 (с, 1H), 5,36-5,25 (м, 2H), 2,70 (т, J=8,4, 1H), 2,24-1,87 (м, 2H), 1,74 -1,54 (м, 6H), 1,46-1,43 (м, 8H), 1,27-1,08 (м, 10H), 0,96 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=0,916 мин в 1,5 мин хроматографии, для C27H38N4O2 [M+H]+ 451, найдено 451.
Пример 31. Синтез соединений 66 и 67.
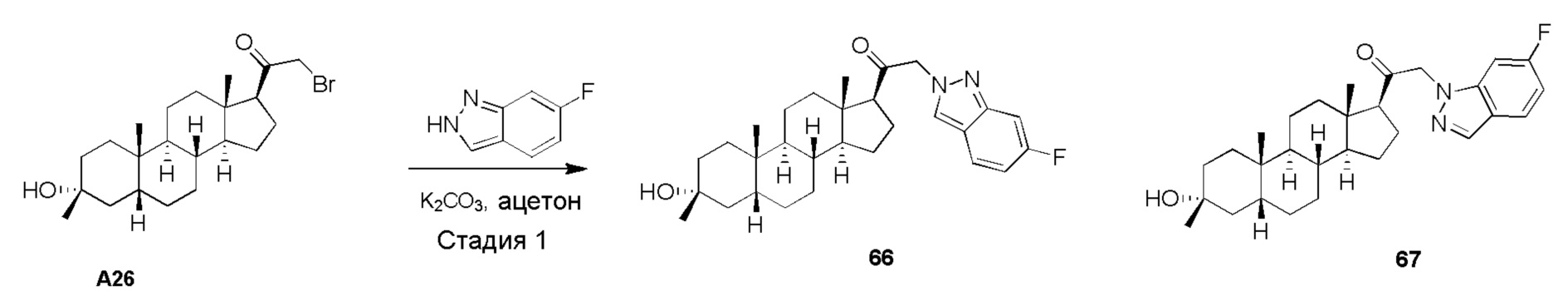
Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (66): (400 МГц, CDCl3) 7,94 (с, 1H),7,66-7,62 (м, 1H), 7,29 (с, 1H), 6,90 (т, J=8Гц, 1H), 5,18 (с, 2H), 2,64 (с, 1H), 2,13-2,00 (м, 2H), 1,95 -1,54 (м, 6H), 1,49-1,43 (м, 8H), 1,27-1,08 (м, 10H), 0,95 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=0,949 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C30H41FN2O2 [M+H]+ 467, найдено 467.
1HЯМР (67): (400 МГц, CDCl3) δ 8,01 (с, 1H),7,69-7,66 (м, 1H), 6,96-6,93 (м, 1H), 6,91-6,83 (м, 1H), 5,12-5,03 (м, 2H), 2,62 (т, J=9,2, 1H), 2,17-1,95 (м, 2H), 1,77 -1,54 (м, 6H), 1,47-1,43 (м, 8H), 1,27-1,07 (м, 10H), 0,73 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,151 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H39FN2O2 [M+H]+ 467, найдено 467.
Пример 32. Синтез соединения 68 и 69.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (68): (400 МГц, CDCl3) δ 7,82 (т, J=8,4, 1H), 7,12 (т, J=8, 1H), 5,44-5,31 (м, 2H), 2,72 (т, J=8,4, 1H), 2,19-1,96 (м, 2H), 1,87 -1,70 (м, 7H), 1,43-1,27 (м, 5H), 1,12-1,08 (м, 11H), 0,96 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=0,968 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H37F2N3O2 [M+H]+ 486, найдено 486.
1HЯМР (69): (400 МГц, CDCl3) δ 7,60 (т, J=8Гц, 2H), 5,52-5,42 (м, 2H), 2,64 (т, J=9,2, 1H), 2,14-1,96 (м, 2H), 1,87 -1,53 (м, 6H), 1,47-1,43 (м, 9H), 1,27-1,08 (м, 10H), 0,97 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=1,004 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H37F2N3O2 [M+H]+ 486, найдено [M+H-18]+ 468.
Пример 33. Синтез соединений 70 и 71.

Стадия 1. Синтез соединения 70. К раствору соединения A26 (300 мг, 0,729 ммоль) в ацетоне (2 мл) добавляли 4-(метилтио)-1H-пи(247 мг,2,17 ммоль), с последующим добавлением K2CO3 (200 мг, 1,45 ммоль). Полученную реакционную смесь перемешивали при 40°C в течение 16 часов, после этого анализ ЖХМС показал, что исходное вещество израсходовано полностью. Смесь разбавляли водой (10 мл) и затем экстрагировали при помощи EtOAc (8 мл ×3). Объединенные органические фазы концентрировали с получением остатка, который очищали при помощи ВЭЖХ.
Стадия 2. Синтез соединения 71. К раствору соединения 70 (25 мг, 56,2 мкмоль) в 2 мл CH2Cl2 добавляли m-CPBA (24,1 мг, 140 мкмоль) при 25°C. Реакционную смесь перемешивали в течение 3 часов при этой же температуре. ТСХ анализ (петролейный эфир/этилацетат=2:1, PMA) показал, что реакция завершилась. Реакционную смесь выливали в насыщенный водный раствор Na2S2O3 и экстрагировали при помощи CH2Cl2 (10 мл ×2). Органические слои промывали насыщенным водным раствором NaHCO3 (10 мл), насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=5/1-1/2) с получением соединения 71 (17,3 мг) в виде белого твердого вещества.
1HЯМР (71): (400 МГц, CDCl3) δ 7,92 (с, 1H), 7,87 (с, 1H), 5,04-4,89 (м, 2H), 3,13 (с, 3H), 2,62 (д, J=9,2Гц, 1H), 2,19-1,52 (м, 7H), 1,47-1,43 (м, 9H), 1,27-1,09 (м, 11H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,265 мин в 2 мин хроматографии, МС (ESI) рассчитано для химической формулы: C26H40N2O4S [M+H]+ 477, найдено [M+H-18]+ 459.
Пример 34. Синтез соединений 72 и 73.
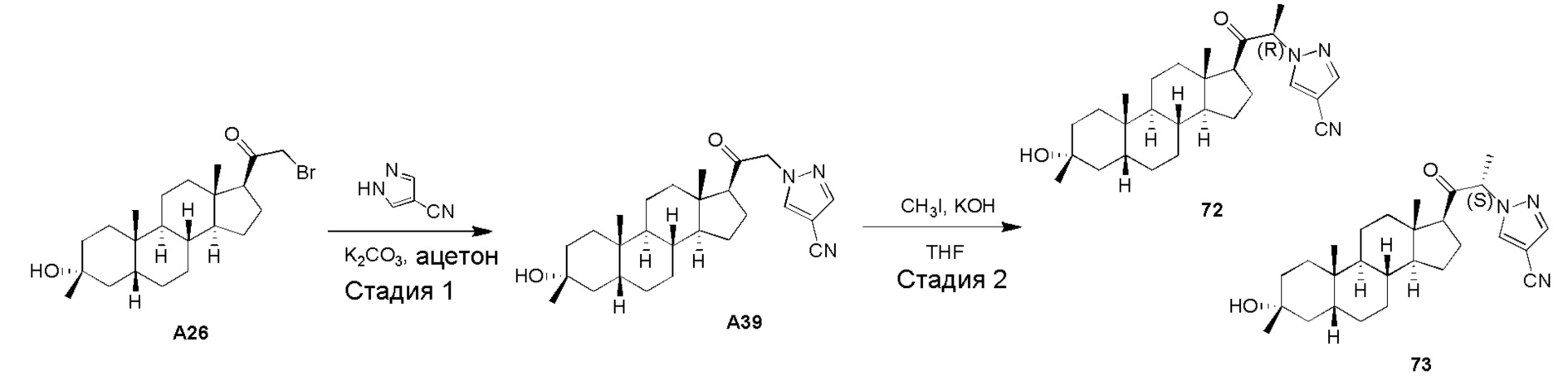
Стадия 1. Синтез соединения A39. К раствору соединения A26 (300 мг, 729 мкмоль, 1,00 экв.) в ацетоне (5 мл) добавляли K2CO3(200 мг, 1,45 ммоль, 2,0 экв.) и 1H-пиразол-4-карбонитрил (81,3 мг, 874 мкмоль, 1,2 экв.) при 25°C. Реакционную смесь перемешивали при 25°C в течение 16 часов. После этого ТСХ анализ показал исчезновение исходного вещества. Смесь разбавляли водой (20 мл) и экстрагировали при помощи EA (30 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (силикагель 100-200 меш, петролейный эфир/этилацетат=2/1) с получением соединения A39 (245 мг, 549 мкмоль) в виде не совсем белого твердого вещества.
1H ЯМР (A39): 400МГцδ 7,86 (с, 1H), 7,81 (с, 1H), 5,04-4,88 (м, 2H), 2,62-2,58 (м, 1H), 0,95 (с, 3H), 0,65 (с, 3H).
Стадия 2. Синтез соединений 72 и 73. К раствору соединения A39 (150 мг, 354 мкмоль, 1,00 экв.) и KOH (39,7 мг, 708 мкмоль, 2 экв.) в ТГФ (4,00 мл) добавляли CH3I (60,1 мг, 424 мкмоль, 1,2 экв.). Смесь перемешивали при 25°C в течение 3 часов. ТСХ анализ показал исчезновение исходного вещества. Реакцию гасили водой и экстрагировали при помощи EA (2×30 мл), объединенную органическую фазу промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта. Остаток очищали препаративной ВЭЖХ (0,5% HCl) с получением 65 мг (смесь P1 и P2) продукта. Смешанный продукт очищали при помощи СЭЖХ (0,2% NH4OH) с получением 1-((R)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-1-оксопропан-2-ил)-1H-пиразол-4-карбонитрила (20 мг, 45,5 мкмоль) и 1-((S)-1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-1-оксопропан-2-ил)-1H-пиразол-4-карбонитрила (35 мг, 79,9 мкмоль) в виде белого твердого вещества.
1H ЯМР (72): 400МГцδ 7,99 (с, 1H), 7,77 (с, 1H), 5,26 (кв., J=7,6 Гц, 1H), 2,71-2,62 (м, 1H), 2,18-2,16 (м, 2H), 2,00-1,72 (м, 2H), 1,70-1,65 (м, 6H), 1,52-1,41 (м, 10H), 1,43-1,02 (м, 11H), 0,94 (с, 3H), 0,55 (с, 3H). ЖХМС Rt=1,122 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H39N3O2 [M+H-18]+ 420, найдено 460([M+23]
1H ЯМР (73): 400МГц δ 7,77 (с, 1H), 7,72 (с, 1H), 5,04 (кв., J=7,6 Гц, 1H), 2,49-2,47 (м, 1H), 2,07-2,00 (м, 1H), 1,92-1,88 (м, 3H), 1,67-1,62(м, 6H), 1,60-1,40 (м, 8H), 1,27-1,06 (м, 11H), 0,94 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=1,132 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H39N3O2 [M+H-18]+ 420, найдено 460([M+Na]+.
Пример 35. Синтез соединений 74, 75 и 76

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (74) (400 МГц, CDCl3) δ 7,75 (д, J=8,8Гц, 1H), 7,57 (с, 1H), 7,28 (д, J=1,6Гц, 1H) 5,51-5,41 (м, 2H), 2,63 (т, J=8,4, 1H), 2,55 (с, 3H), 2,20-1,95 (м, 2H), 1,77-1,59 (м, 5H), 1,54-1,42 (м, 9H), 1,27-1,08 (м, 11H), 0,96 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=1,468 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2S [M+H]+ 496, найдено 478[M+H-18]+.
1H ЯМР (75) (400 МГц, CDCl3) δ 7,87 (с, 1H), 7,40 (д, J=9,2Гц, 1H), 7,23 (д, J=8,8Гц, 1H) 5,42-5,32 (м, 2H), 2,70-2,66 (м, 1H), 2,56 (с, 3H), 1,96-1,52 (м, 7H), 1,45-1,43 (м, 8H), 1,27-1,08 (м, 11H), 0,96 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=0,963 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2S [M+H]+ 496, найдено 496.
1H ЯМР (76): (400 МГц, CDCl3) δ 7,93 (д, J=8,8Гц, 1H), 7,27-7,25 (м, 1H), 5,40-5,30 (м, 2H), 2,69 (т, J=8,8, 1H), 2,53 (с, 3H), 2,22-1,96 (м, 2H), 1,77-1,52 (м, 8H), 1,51-1,27 (м, 6H), 1,24-1,08 (м, 12H), 0,96 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=1,160 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2S [M+H]+ 496, найдено 496.
Пример 36. Синтез соединений 77 и 78.
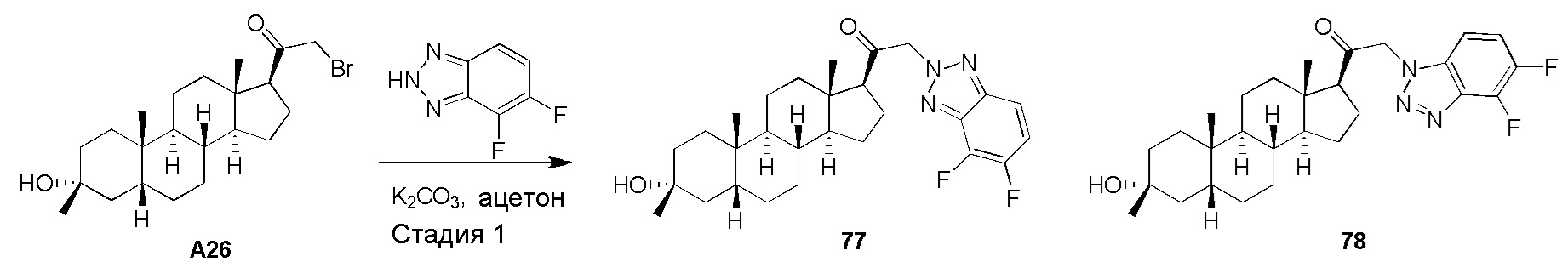
Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1H ЯМР (77): (400 МГц, CDCl3) δ 7,40-7,35 (м, 1H), 7,06-7,04 (м, 1H), 5,46-5,35 (м, 2H), 2,71 (д, J=8,4Гц,1H), 2,18-1,96 (м, 2H), 1,76-1,54 (м, 5H), 1,45-1,30 (м, 7H), 1,27-1,08 (м, 10H), 0,96 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=0,973 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H37F2N3O2[M+H]+ 468, найдено 468.
1H ЯМР (78): (400 МГц, CDCl3) δ 7,38-7,33 (м, 1H), 7,06-7,04 (м, 1H), 5,46-5,35 (м, 2H), 2,71 (д, J=8,8Гц,1H), 2,15-1,96 (м, 2H), 1,77-1,54 (м, 6H), 1,46-1,43 (м, 6H), 1,27-1,09 (м, 10H), 0,96 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,252 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H37F2N3O2[M+H]+ 468, найдено 468.
Пример 37. Синтез соединений 79, 80 и 81.

Стадия 1. Синтез соединения A41. К раствору соединения A40 (21 г, 66,3 ммоль) в ТГФ (300 мл) добавляли Pd/C (сухой, 10%, 2,1 г). После дегазирования три раза при помощи H2 реакционную смесь перемешивали в течение 16 часов при 50°C в атмосфере H2 (50 ф/дюйм2(3,515 кг/см2)). Когда H ЯМР анализ показал, что исходное вещество израсходовано и произошло образование желаемого продукта, катализатор удаляли путем отсасывания и фильтрат концентрировали с получением соединения A41 (21 г) в виде белого твердого вещества, которое использовали на следующей стадии непосредственно без дополнительной очистки.
1H ЯМР (A41): 400МГц δ 2,53-2,48 (м, 1H), 2,00 (с, 3H),1,81-1,58 (м, 9H), 1,38-1,16 (м, 12H), 1,29-1,07 (м, 10H), 0,98 (с, 3H), 067 (с, 3H).
Стадия 2. Синтез соединения A42. К раствору соединения A41 (21 г, 65,9 ммоль) в DCM (300 мл) добавляли реагент Десса-Мартина (41,9 г, 98,8 ммоль) при 0°C. После добавления смесь перемешивали в течение 3 часов при 25°C. После этого H ЯМР показал, что исходное вещество израсходовано и произошло образование желаемого продукта. Реакцию гасили при помощи Na2S2O3 (3 г), насыщенного раствора NaHCO3 (50 мл), сушили над Na2SO4 (10 г) и концентрировали с получением соединения A42 (20 г) в виде белого твердого вещества, которое использовали на следующей стадии непосредственно без дополнительной очистки.
1H ЯМР (A42): 400МГц δ 2,55-2,53 (м, 1H), 2,27-2,03 (м, 4H), 2,00 (с, 3H), 1,69-1,62 (м, 3H), 1,43-1,19 (м, 14H), 0,92(с, 3H), 062(с, 3H).
Стадия 3. Синтез соединения A43. К раствору соединения A42 (1,0 г, 3,15 ммоль) в толуоле (10 мл) добавляли метилмагнийбромид (9,45 ммоль, 3,15 мл, 3M в диэтиловом эфире) при -70°C. Смесь перемешивали при этой температуре в течение 2 часов. ТСХ анализ (PE:EA=3:1, PMA) показал, что реакция завершилась, и было обнаружено два основных пятна. К смеси добавляли насыщенный раствор NH4Cl (20 мл) и затем экстрагировали при помощи EtOAc (20 мл ×3). Объединенную органическую фазу сушили над Na2SO4 и концентрировали с получением остатка, который очищали флэш-хроматографией на системе combi-flash (PE:EA=100%-60%) с получением соединения A43 (0,3 г) в виде белого твердого вещества.
1H ЯМР (A43): (400 МГц, CDCl3) δ 2,52 (т, J=8,8 Гц, 1H), 2,17-2,12 (м, 1H), 2,11 (с, 3H), 1,70-1,18 (м, 23H), 1,05-0,85 (м, 1H), 0,80-0,79 (м, 1H), 0,74 (с, 3H), 0,59 (с, 3H).
Стадия 4. Синтез соединения A44. К раствору соединения A43 (0,3 г, 0,902 ммоль) в MeOH (10 мл) добавляли одну каплю HBr. Добавляли Br2 (215 мг, 1,35 ммоль) одной порцией. Реакционный раствор перемешивали при 25°C в течение 1 часа. ТСХ анализ (PE:EA=3:1, PMA) показал, что реакция завершилась, и было обнаружено основное пятно. Смесь гасили насыщенным раствором NaHCO3 до pH=7, концентрировали с получением остатка, к которому добавляли воду (20 мл) и затем экстрагировали при помощи EtOAc (15 мл ×3). Органические слои объединяли, сушили над Na2SO4 и концентрировали с получением неочищенного соединения A44 (0,4 г) в виде белого твердого вещества.
1H ЯМР (A44): (400 МГц, CDCl3) δ 3,94-3,87 (м, 2H), 2,81 (т, J=8,8Гц, 1H), 2,18-2,11 (м, 1H), 1,95-1,85 (м, 1H), 1,80-1,10 (м, 22H), 1,00-0,75 (м, 2H), 0,74 (с, 3H), 0,62 (с, 3H).
Стадия 5. Синтез соединения 79. К раствору соединения A44 (400 мг, 0,97 ммоль) в ацетоне (2 мл) добавляли 4H-пиразол-4-карбонитрил (134 мг, 1,45 ммоль), с последующим добавлением K2CO3 (267 мг, 1,94 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 2 часов. ТСХ анализ (PE:EA=3:1, PMA) показал, что реакция завершилась, и было обнаружено основное пятно. К смеси добавляли воду (4 мл) и затем экстрагировали при помощи EtOAc (2 мл ×3). Объединенные органические фазы концентрировали с получением остатка, который очищали флэш-хроматографией на системе combi-flash (PE:EA=100%-50%), с получением соединения 79 (0,4 г) в виде белого твердого вещества.
1H ЯМР (79): (400 МГц, CDCl3) δ 7,85 (с, 1H), 7,80 (с, 1H), 5,03-4,86 (м, 2H), 2,59 (т, J=8,4Гц,1H), 2,25-2,10 (м, 1H), 2,05-1,95 (м, 1H), 1,80-1,15 (м, H), 1,05-0,76 (м, 4H), 0,75 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=1,312 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H38N3O2[M+H]+ 423, найдено 406[M+H-H2O]+.
Стадия 6. Синтез соединений 80 и 81. К раствору соединения 79 (0,2 г, 0,472 ммоль) в ТГФ (5 мл) добавляли KOH (52,8 мг, 0,944 ммоль) и MeI (80,3 мг, 0,566 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 1 часа. ТСХ анализ (PE:EA=3:1) показал, что реакция завершилась. К реакционному раствору добавляли воду (10 мл) и затем экстрагировали при помощи EtOAc (5 мл ×2). Объединенную органическую фазу концентрировали и затем очищали препаративной ВЭЖХ с получением 1-((R)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-1-оксопропан-2-ил)-1H-пиразол-4-карбонитрила (12 мг) и 1-((S)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-1-оксопропан-2-ил)-1H-пиразол-4-карбонитрила (9 мг) в виде белого твердого вещества.
1H ЯМР (80): (400 МГц, CDCl3) δ 7,86 (с, 1H), 7,80 (с, 1H), 5,07-5,01 (м, 1H), 2,49 (т, J=8,8Гц, 1H), 2,15-1,80 (м, 2H), 1,75-1,15 (м, 25H), 0,95-0,85 (м, 1H), 0,84-0,75 (м, 1H), 0,74 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=1,370 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H40N3O2 [M+H]+ 438, найдено 420 [M+H-H2O]+.
1H ЯМР (81): (400 МГц, CDCl3) δ 7,99 (с, 1H), 7,77 (с, 1H), 5,30-5,24 (м, 1H), 2,73 (т, J=8,8Гц, 1H), 2,17-2,14 (м, 2H), 1,75-1,15 (м, 25H), 1,00-0,90 (м, 1H), 0,85-0,75 (м, 1H), 0,74 (с, 3H), 0,55 (с, 3H). ЖХМС Rt=1,374 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H40N3O2 [M+H]+ 438, найдено 420 [M+H-H2O]+.
Пример 40. Синтез соединения 89.

Синтез соединения A47 осуществляли в соответствии со способом Примера 5, стадия 4. К раствору 1-(2-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-оксоэтил)-1H-пиразол-4-карбоновой кислоты (A47, 100 мг, 0,225 ммоль) в DMF (2 мл) добавляли TEA (45,5 мг) и HATU (170 мг,0,450 ммоль), с последующим добавлением диметиламина (15,1 мг, 0,337 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 16 часов, после этого анализ ТСХ (DCM:MeOH=10:1) показал, что исходное вещество израсходовано полностью. Добавляли воду (10 мл) и смесь экстрагировали при помощи EtOAc (8 мл ×3). Объединенные органические фазы концентрировали и полученный остаток очищали препаративной ВЭЖХ с получением 1-(2-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-оксоэтил)-N,N-диметил-1H-пиразол-4-карбоксамида (6 мг).
1HЯМР (106): (400МГц, Метанол-d4) δ 8,00 (с, 1H), 783 (с, 1H), 5,16-5,07 (м, 2H), 3,29 (с, 3H), 3,10 (с, 3H), 2,75 (т, J=8,8 Гц, 1H), 2,20-2,17 (м, 2H), 1,77-1,25 (м, 25H), 1,18-0,85 (м, 3H), 0,82 (с, 3H), 0,70 (с, 3H). ЖХМС: Rt=0,861 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H43N3O3 [M+Na]+ 492, найдено 492.
Пример 41. Синтез соединений 90, 91, 92 и 93.
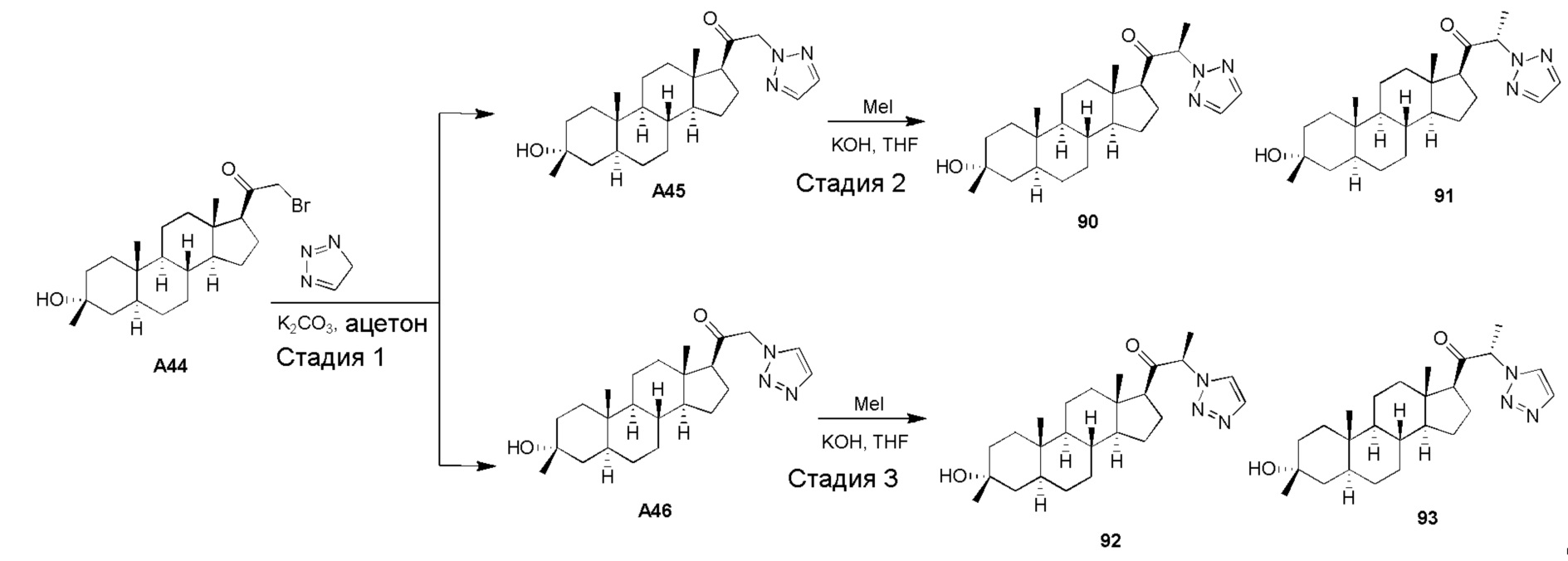
Стадия 1. Синтез соединений A45 и A46. К раствору соединения A44 (400 мг, 0,97 ммоль) в ацетоне (5 мл) добавляли 2H-1,2,3-триазол (100 мг, 1,45 ммоль), с последующим добавлением K2CO3 (267 мг, 1,94 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 2 часов. ТСХ анализ (PE:EA=3:1, PMA) показал, что реакция завершилась, и было обнаружено основное пятно. К смеси добавляли воду (4 мл) и затем экстрагировали при помощи EtOAc (2 мл×3). Объединенные органические фазы концентрировали с получением остатка, который очищали флэш-хроматографией на системе combi-flash (PE:EA=100%-50%), с получением 1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(2H-1,2,3-триазол-2-ил)этанона (0,1 г) и 1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(1H-1,2,3-триазол-1-ил)этанона (0,2 г) в виде белого твердого вещества.
1H ЯМР (A45): (400 МГц, CDCl3) δ 7,73 (с, 1H), 7,63 (с, 1H), 5,28-5,10 (м, 2H), 2,63 (т, J=8,8Гц, 1H), 2,25-2,10 (м, 1H), 1,80-0,80 (м, 25H), 0,68 (с, 3H), 0,65 (с, 3H).
1H ЯМР (A46): (400 МГц, CDCl3) δ 7,73 (с, 2H), 5,29-5,18 (м, 2H), 2,57 (т, J=8,4Гц,1H), 2,25-2,10 (м, 1H), 1,80-0,80 (м, 25H), 0,75 (с, 3H), 0,69 (с, 3H).
Стадия 2. Синтез соединений 90 и 91. К раствору соединения 90 (0,1 г, 0,25 ммоль) в ТГФ (5 мл) добавляли KOH (28 мг, 0,5 ммоль) и MeI (42,5 мг, 0,3 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 1 часа. ЖХМС анализ показал, что реакция завершилась. К реакционному раствору добавляли воду (10 мл) и затем экстрагировали при помощи EtOAc (5 мл×2). Объединенную органическую фазу концентрировали и затем очищали препаративной ВЭЖХ с получением (R)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(2H-1,2,3-триазол-2-ил)пропан-1-она (92, 10,6 мг) и (S)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(2H-1,2,3-триазол-2-ил)пропан-1-она (93, 12,5 мг) в виде белого твердого вещества.
1H ЯМР (90): (400 МГц, CDCl3) δ 7,66 (с, 2H), 5,28-5,22 (м, 1H), 2,24 (т, J=8,8Гц, 1H), 2,14-1,95 (м, 3H), 1,85-1,70 (м, 3H), 1,65-0,75 (м, H), 0,71(с, 3H), 0,64 (с, 3H). ЖХМС Rt=1,381 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H]+ 414, найдено 414.
1H ЯМР (91): (400 МГц, CDCl3) δ 7,66 (с, 2H), 5,43-5,37 (м, 1H), 2,65 (т, J=8,8Гц, 1H), 2,14-1,95 (м, 3H), 1,85-1,70 (м, 3H), 1,65-0,75 (м, 23H), 0,74 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=1,349 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H]+ 414, найдено 414.
Стадия 3. Синтез соединений 92 и 93. К раствору соединения 91 (0,2 г, 0,5 ммоль) в ТГФ (5 мл) добавляли KOH (56 мг, 1,0 ммоль) и MeI (85,1 мг, 0,6 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 1 часа. ЖХМС анализ показал, что реакция завершилась. К реакционному раствору добавляли воду (10 мл) и затем экстрагировали при помощи EtOAc (5 мл ×2). Объединенную органическую фазу концентрировали и затем очищали препаративной ВЭЖХ с получением (R)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(1H-1,2,3-триазол-1-ил)пропан-1-она (92, 6,9 мг) и (S)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(1H-1,2,3-триазол-1-ил)пропан-1-она (93, 1,5 мг) в виде белого твердого вещества.
1H ЯМР (92): (400 МГц, CDCl3) δ 7,76 (с, 1H), 7,60 (с, 1H), 5,48-5,46 (м, 1H), 2,57 (т, J=8,8Гц, 1H), 2,15-1,05 (м, 26H), 1,00-0,74 (м, 3H), 0,74 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,295 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H]+ 414, найдено 414.
1H ЯМР (93): (400 МГц, CDCl3) δ 7,79 (с, 1H), 7,75 (с, 1H), 5,68-5,64 (м, 1H), 2,78 (т, J=8,8Гц, 1H), 2,20-2,14 (м, 2H), 1,75-1,15 (м, 25H), 1,00-0,90 (м, 1H), 0,85-0,75 (м, 1H), 0,73 (с, 3H), 0,51 (с, 3H). ЖХМС Rt=1,260 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H]+ 414, найдено 414.
Пример 42. Синтез соединений 96, 97, 98, 99, 100, 101 и 102.
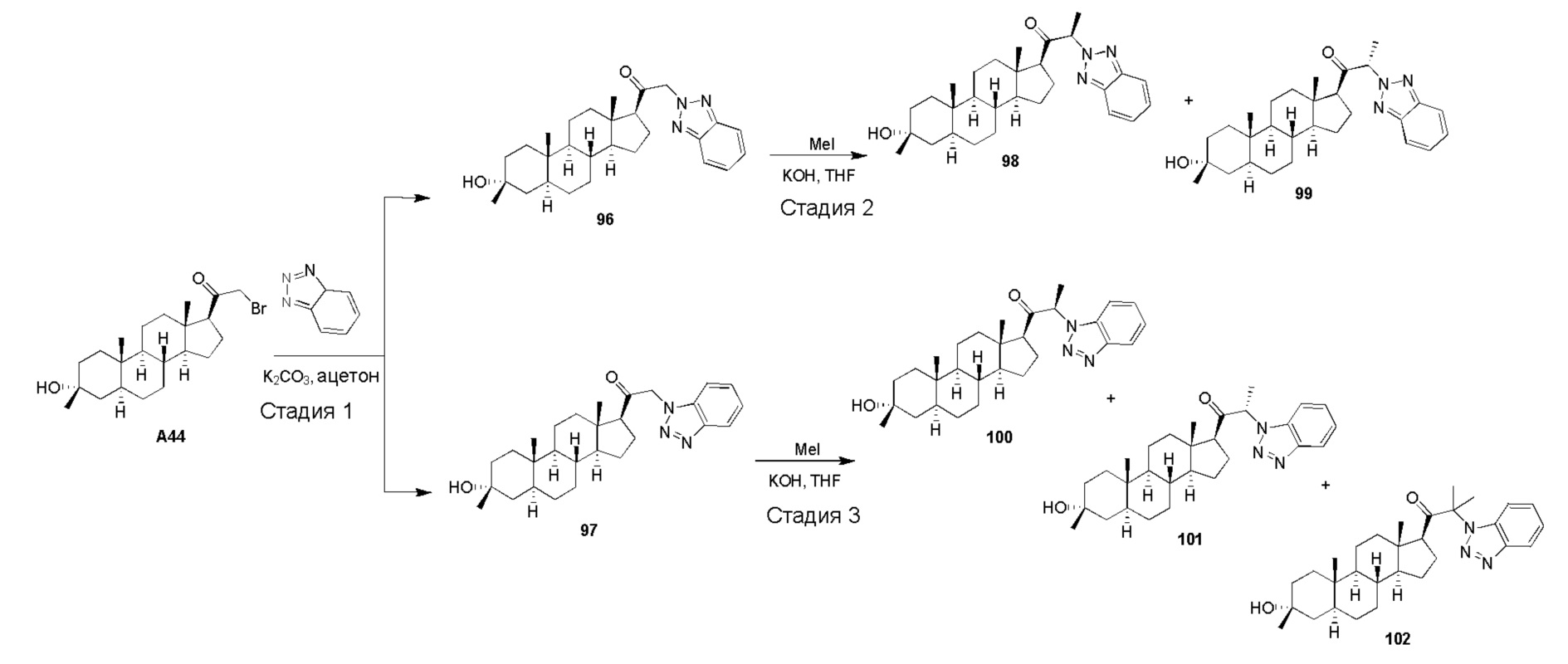
Стадия 1. Синтез соединений 96 и 97. К раствору соединения A44 (0,4 г, 0,972 ммоль) в ацетоне (5 мл) добавляли 2H-бензо[d][1,2,3]триазол (172 мг, 1,45 ммоль), с последующим добавлением K2CO3 (267 мг, 1,94 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 16 часов. ТСХ анализ показал, что реакция завершилась. К смеси добавляли воду (5 мл) и затем экстрагировали при помощи EtOAc (5 мл ×3). Объединенные органические фазы концентрировали с получением остатка, который очищали флэш-хроматографией на системе combi-flash (PE:EA=100%-50%), с получением соединения 2-(2H-бензо[d][1,2,3]триазол-2-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (96, 0,1 г) и 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (97, 0,2 г) в виде белого твердого вещества.
1H ЯМР (96): (400 МГц, CDCl3) δ 7,88-7,86 (м, 2H), 7,40-7,37 (м, 2H), 5,56-5,51 (м, 2H), 2,65 (т, J=8,8Гц,1H), 2,25-2,10 (м, 2H), 1,80-0,80 (м, 24H), 0,75 (с, 3H), 0,73 (с, 3H).
1H ЯМР (97): (400 МГц, CDCl3) δ 8,09-8,07 (м, 1H), 7,50-7,40 (м, 1H), 7,39-7,32 (м, 2H), 5,46-5,36 (м, 2H), 2,70 (т, J=8,8Гц,1H), 2,25-2,10 (м, 2H), 1,80-0,80 (м, 24H), 0,77 (с, 3H), 0,72 (с, 3H).
Стадия 2. Синтез соединений 98 и 99. К раствору соединения 96 (0,1 г, 0,22 ммоль) в ТГФ (5 мл) добавляли KOH (24,8 мг, 0,44 ммоль) и MeI (37,7 мг, 0,266 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 1 часа. ЖХМС анализ показал, что реакция завершилась. К реакционному раствору добавляли воду (10 мл) и затем экстрагировали при помощи EtOAc (5 мл ×2). Объединенную органическую фазу концентрировали и затем очищали препаративной ВЭЖХ с получением ((R)-2-(2H-бензо[d][1,2,3]триазол-2-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)пропан-1-она (98, 8,6 мг) и (S)-2-(2H-бензо[d][1,2,3]триазол-2-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)пропан-1-она (99, 9,7 мг) в виде белого твердого вещества.
1H ЯМР (98): (400 МГц, CDCl3) δ 7,89-7,86 (м, 2H), 7,42-7,38 (м, 2H), 5,54-5,49 (м, 1H), 2,26 (т, J=8.Гц, 1H), 2,20-2,05 (м, 2H), 1,85-1,75 (м, 3H), 1,75-0,78 (м, 24H), 0,69 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=1,493 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O2 [M+H]+ 464, найдено 446[M+H-H2O]+.
1H ЯМР (99): (400 МГц, CDCl3) δ 7,89-7,86 (м, 2H), 7,39-7,36 (м, 2H), 5,72-5,66 (м, 1H), 2,71 (т, J=8.Гц, 1H), 2,19-2,05 (м, 2H), 2,00-1,90 (м, 3H), 1,75-0,78 (м, 24H), 0,75 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,466 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O2 [M+H]+ 464, найдено 464.
Стадия 3. Синтез соединений 100, 101 и 102. К раствору соединения 97 (0,2 г, 0,44 ммоль) в ТГФ (5 мл) добавляли KOH (49,7 мг, 0,88 ммоль) и MeI (126 мг, 0,88 ммоль). Реакционную смесь перемешивали при 25°C в течение 1 часа. ЖХМС анализ показал, что реакция завершилась. К раствору добавляли H2O (10 мл) и экстрагировали при помощи EtOAc (5 мл ×2). Объединенную органическую фазу концентрировали и затем очищали препаративной ВЭЖХ с получением (R)-2-(1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)пропан-1-она (100, 3,8 мг), (S)-2-(1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)пропан-1-она (101, 10,3 мг) и 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-метилпропан-1-она (102, 24,7 мг) в виде белого твердого вещества.
1H ЯМР (100): (400 МГц, CDCl3) δ 8,09-8,07 (м, 1H), 7,48-7,36 (м, 3H), 5,64-5,59 (м, 1H), 2,34 (т, J=8,8Гц, 1H), 2,15-1,75 (м, 2H), 1,74-1,70 (м, 3H), 1,70-0,75 (м, 24H), 0,71 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,411 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O2 [M+H]+ 464, найдено 464.
1H ЯМР (101): (400 МГц, CDCl3) δ 8,08-8,06 (м, 1H), 7,56-7,54 (м, 1H), 7,49-7,47 (м, 1H), 7,37-7,35 (м, 1H), 5,81-5,75 (м, 1H), 2,70 (т, J=8,8Гц, 1H), 2,15-1,95 (м, 2H), 1,95-1,85 (м, 3H), 1,70-0,75 (м, 24H), 0,73 (с, 3H), 0,61 (с, 3H). ЖХМС Rt=1,391 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O2 [M+H]+ 464, найдено 464.
1H ЯМР (102): (400 МГц, CDCl3) δ 8,09-8,07 (м, 1H), 7,43-7,34 (м, 3H), 2,32 (т, J=8,8Гц, 1H), 2,05 (с, 3H), 1,90 (с, 3H), 1,70-1,00 (м, 22H), 0,90-0,50 (м, 10H). ЖХМС Rt=1,467 мин в 2 мин хроматографии, МС (ESI) рассчитано для C30H44N3O2 [M+H]+ 478, найдено 478.
Пример 43. Синтез соединения 103.

К раствору соединения 87 (50 мг, 0,1 ммоль) в 10 мл DCM добавляли m-CPBA (18,9 мг, 0,11 ммоль) при -78°C. Реакционную смесь перемешивали при этой же температуре в течение 3 часов. ТСХ анализ (петролейный эфир/этилацетат=1:1, PMA) показал, что реакция завершилась. Реакционную смесь выливали в насыщенный раствор Na2S2O3 и экстрагировали при помощи CH2Cl2 (50 мл ×2). Органические слои промывали насыщенным раствором NaHCO3 (50 мл), насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Остаток очищали препаративной ТСХ (PE:EtOAc=1:1,5) с получением соединения 103 (14 мг) в виде белого твердого вещества.
1H ЯМР: (103): 400МГц δ 8,29 (с, 1H), 8,03 (д, J=9,2Гц, 1H), 7,55 (т, J=7,2Гц, 1H), 5,61-5,51 (м, 2H), 2,78 (с, 3H), 2,68 (д, J=8,8Гц, 1H), 2,17-2,15 (м, 2H), 1,96-1,53 (м, 5H), 1,49-1,43 (м, 8H), 1,27-1,08 (м, 12H), 0,96 (с, 3H), 0,73 (с, 3H). ЖХМС Rt=0,877 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H41N3O3S [M+H]+ 512, найдено 494[M+H-18]+.
Пример 44. Синтез соединения 104.

К раствору соединения 87 (50 мг, 100 ммоль) в 10 мл CH2Cl2 добавляли m-CPBA (43,1 мг, 250 ммоль) при 25°C. Реакционную смесь перемешивали в течение 3 часов при этой же температуре. ТСХ анализ (петролейный эфир/этилацетат=1:1, PMA) показал, что реакция завершилась. Реакционную смесь выливали в насыщенный раствор Na2S2O3 и экстрагировали при помощи CH2Cl2 (50 мл ×2). Органические слои промывали насыщенным раствором NaHCO3 (50 мл), насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и концентрировали в вакууме. Остаток очищали препаративной ТСХ (PE:EtOAc=1:1,5) с получением 1-((3R,5R,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-(5-(метилсульфонил)-2H-бензо[d][1,2,3]триазол-2-ил)этанона (104, 8 мг) в виде белого твердого вещества.
1H ЯМР: (104): 400МГц δ 8,62 (с, 1H), 8,07 (д, J=9,2Гц, 1H), 7,88 (т, J=1,6Гц, 1H), 5,64-5,55 (м, 2H), 3,12 (с, 3H), 2,68 (т, J=8,8Гц, 1H), 2,21-2,17 (м, 2H), 1,96-1,54 (м, 6H), 1,51-1,44 (м, 9H), 1,27-1,09 (м, 11H), 0,97 (с, 3H), 0,73 (с, 3H). ЖХМС Rt=0,913 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H41N3O4S [M+H]+ 528, найдено 510[M+H-18]+.
Пример 45. Синтез соединений 105 и 106.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
1HЯМР (105): (400 МГц, CDCl3) δ 8,09 (д, J=8,8Гц, 1H), 7,27 (с, 1H), 7,18 (с, 1H), 5,47-5,35 (м, 2H), 2,72 (т, J=8,4, 1H), 2,21-1,97 (м, 2H), 1,86 -1,55 (м, 5H), 1,47-1,44 (м, 10H),1,29-1,09(м, 8H), 0,97 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=0,994 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H38F3N3O3 [M+H]+ 534, найдено 534.
Пример 47. Синтез соединений 107 и 108.
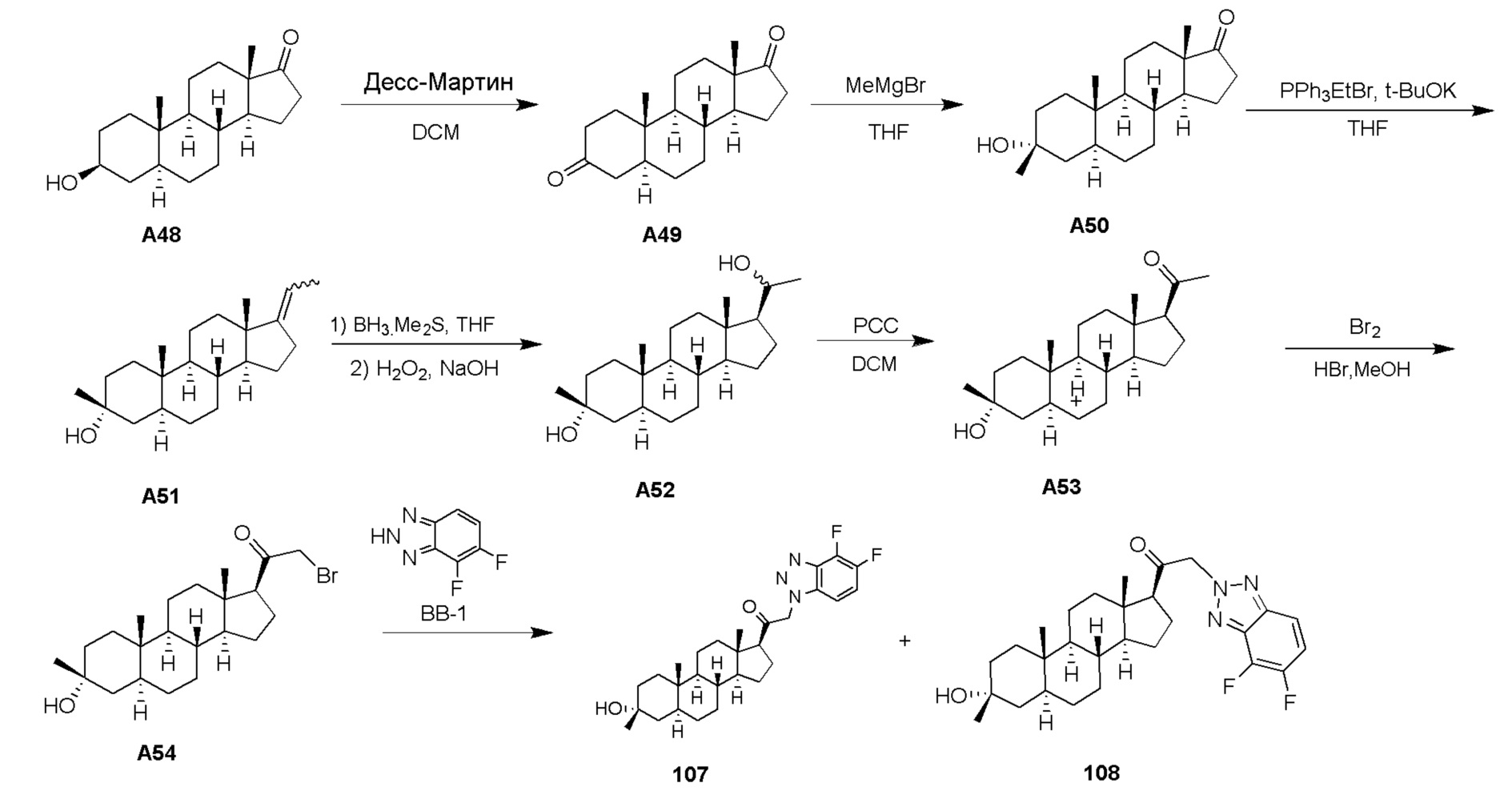
Синтез соединения A49: К раствору (3S,5S,8R,9S,10S,13S,14S)-3-гидрокси-10,13-диметилтетрадекагидро-1H-циклопента[a]фенантрен-17(2H)-она (A48, 30 г, 103 ммоль) в DCM (300 мл) добавляли DMP (65,3 г, 154 ммоль) по порциям при 0°C. После добавления смесь перемешивали при 25°C в течение 2 часов, после этого анализ ТСХ (PE:EA=3:1, PMA) показал, что реакция завершилась. Смесь гасили насыщенным раствором Na2S2O3 и раствором NaHCO3 (об:об =1:1) до тех пор, пока раствор не стал прозрачным. Смесь затем разбавляли водой (200 мл) и затем экстрагировали при помощи DCM (200 мл ×3) и объединенные органические слои сушили над Na2SO4 и концентрировали с получением неочищенного соединения (5S,8R,9S,10S,13S,14S)-10,13-диметилдодекагидро-1H-циклопента[a]фенантрен-3,17(2H,4H)-диона (35 г) в виде белого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 2,44-2,22 (м, 4H), 2,15-1,75 (м, 6H), 1,70-1,20 (м, 10H), 1,10-0,65 (м, 8H).
Синтез соединения A50: К раствору (5S,8R,9S,10S,13S,14S)-10,13-диметилдодекагидро-1H-циклопента[a]фенантрен-3,17(2H,4H)-диона (A49, 15,0 г, 52,0 ммоль) в ТГФ (200 мл) добавляли метилмагнийбромид (156 ммоль, 52 мл, 3M в диэтиловом эфире) при -70°C. Смесь перемешивали при -70°C в течение 3 часов, после этого ТСХ анализ (PE:EA=3:1, PMA) показал, что реакция завершилась. Реакционную смесь гасили насыщенным раствором NH4Cl (300 мл) и концентрировали и остаток экстрагировали при помощи DCM (500 мл ×3). Органическую фазу сушили, концентрировали и очищали флэш-хроматографией на системе combi-flash (PE:EA=100%-60%) с получением (3R,5S,8R,9S,10S,13S,14S)-3-гидрокси-3,10,13-триметилтетрадекагидро-1H-циклопента[a]-фенантрен-17(2H)-она (A50,6,5 г) в виде белого твердого вещества.
Синтез соединения A51: К раствору Ph3PEtBr (39,2 г, 106 ммоль) в ТГФ (50 мл) добавляли суспензию t-BuOK (11,8 г, 106 ммоль) в ТГФ (50 мл) в атмосфере N2. Смесь становилась красной, и ее перемешивали при 60°C в течение 1 часа и затем добавляли раствор (3R,5S,8R,9S,10S,13S,14S)-3-гидрокси-3,10,13-триметилтетрадекагидро-1H-циклопента[a]фенантрен-17(2H)-она (A50, 6,5 г, 21,3 ммоль) одной порцией. Реакционную смесь перемешивали при 60°C в течение 16 часов, после этого анализ ТСХ (PE:EA=3:1, PMA) показал, что реакция завершилась. Реакционную смесь охлаждали, разбавляли водой (200 мл) и экстрагировали при помощи EtOAc (100 мл ×3). Объединенную органическую фазу сушили, концентрировали и очищали флэш-хроматографией на системе combi-flash (PE:EA=100%-85%) с получением (3R,5S,8R,9S,10S,13S,14S)-17-этилиден-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-3-ола (A51, 5,5 г) в виде белого твердого вещества.1H (400 МГц, CDCl3)δ 5,12-5,09 (м, 1H), 2,40-2,10 (м, 4H), 1,75-1,10 (м, 23H), 1,05-0,75 (м, 8H).
Синтез соединения A52: К раствору (3R,5S,8R,9S,10S,13S,14S)-17-этилиден-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-3-ола (A51, 5,5 г, 17,3 ммоль) в ТГФ (100 мл) добавляли по каплям раствор BH3-Me2S (17,2 мл, 172 ммоль) при 0°C. Раствор перемешивали при 25°C в течение 3 часов. ТСХ анализ (PE/EtOAc=3/1) показал, что реакция завершилась. После охлаждения до 0°C добавляли раствор NaOH (100 мл, 3M) очень медленно. После того, как добавление было завершено, медленно добавляли H2O2 (100 мл, 30%) и внутреннюю температуру поддерживали ниже 10°C. Полученный раствор перемешивали при 25°C в течение 2 часов. Полученный раствор экстрагировали при помощи EtOAc (100 ×3). Объединенный органический раствор промывали насыщенным водным раствором Na2S2O3 (100 мл ×3), насыщенным солевым раствором (200 мл), сушили над Na2SO4 и концентрировали в вакууме с получением неочищенного продукта (6 г) в виде белого твердого вещества. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения A53: К раствору (3R,5S,8R,9S,10S,13S,14S,17S)-17-(1-гидроксиэтил)-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-3-ола (A52, 6 г, 17,9 ммоль) в DCM (50 мл) добавляли PCC (5,77 г, 26,8 ммоль) и SiliaBond Тиол (6 г). Реакционную смесь перемешивали при 25°C в течение 2 часов, после этого анализ ТСХ (PE:EA=3:1) показал, что реакция завершилась. Смесь концентрировали и очищали флэш-хроматографией на системе combi-flash (PE:EA= 100%-70%) с получением 1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (A53, 4 г) в виде белого твердого вещества.
Синтез соединения A54: К раствору 1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (A53, 4 г, 12 ммоль) в MeOH (50 мл) добавляли одну каплю HBr. Затем добавляли Br2 (2,28 г, 14,3 ммоль) одной порцией и реакционную смесь перемешивали при 25°C в течение 1 часа до тех пор, пока анализ ТСХ (PE:EA=3:1, PMA) не показал, что реакция завершилась. Смесь гасили насыщенным раствором NaHCO3 до достижения pH 7 и реакционную смесь концентрировали и фильтровали с получением 2-бром-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (A54, 4,5 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3)δ 3,91-3,90 (м, 2H), 2,85-2,75 (м, 1H), 2,25-1,80 (м, 2H), 1,75-1,10 (м, 20H), 1,05-0,63 (м, 10H).
Синтез соединений 107 и 108. К раствору (2-бром-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (A54, 0,2 г, 0,486 ммоль) в ацетоне (2 мл) добавляли 4,5-дифтор-2H-бензо[d][1,2,3]триазол (75,3 мг, 0,486 ммоль), с последующим добавлением K2CO3 (134 мг, 0,972 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 16 часов, после этого анализ ТСХ анализ показал, что реакция завершилась. Реакционную смесь разбавляли водой (5 мл) и затем экстрагировали при помощи EtOAc (5 мл ×3) и объединенную органическую фазу концентрировали с получением остатка, который очищали препаративной ВЭЖХ, с получением 2-(4,5-дифтор-1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (Соединение 107, 51,9 мг) и 2-(4,5-дифтор-2H-бензо[d][1,2,3]триазол-2-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этаноне (Соединение 108, 36,3 мг) в виде белого твердого вещества. Соединение 107: 1H ЯМР (400 МГц, CDCl3) δ 7,38-7,33 (м, 1H), 7,06-7,03 (м, 1H), 5,46-5,34 (м, 2H), 2,71 (т, J=8,8Гц, 1H), 2,21-2,14 (м, 2H), 1,80-1,15 (м, 22H), 1,05-0,80 (м, 2H), 0,77 (с, 3H), 0,70 (с, 3H). ЖХМС: Rt=1,421 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H38F2N3O2 [M+H]+ 486, найдено 486. Соединение 108: 1H ЯМР (400 МГц, CDCl3) δ 7,65-7,62 (м, 1H), 7,31-7,25 (м, 1H), 5,57-5,47 (м, 2H), 2,66 (т, J=8,8Гц, 1H), 2,30-2,14 (м, 2H), 1,80-1,15 (м, 22H), 1,05-0,73 (м, 8H). ЖХМС Rt=1,475 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H38F2N3O2 [M+H]+ 486, найдено 468[M+H-18]+.
Пример 48. Синтез соединений 109 и 110.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 109: 1H ЯМР (400 МГц, CDCl3) δ 7,44-7,40 (м, 1H), 7,12-7,09 (м, 1H), 7,09-7,03 (м, 1H), 5,47-5,36 (м, 2H), 2,70 (т, J=8,8 Гц, 1H), 2,21-2,16 (м, 2H), 1,80-1,10 (м, 21H), 1,05-0,55 (м, 9H). ЖХМС: Rt=1,387 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H39FN3O2 [M+H]+ 468, найдено 468.
Соединение 110:1H ЯМР (400 МГц, CDCl3) δ 7,89-7,82 (м, 1H), 7,33-7,27 (м, 1H), 7,18-7,07 (м, 1H), 5,54 (с, 2H), 2,76-2,67 (м, 1H), 2,27-2,10 (м, 3H), 1,81-1,10 (м, 19H), 1,09-0,80 (м, 4H), 0,77 (с, 3H), 0,72 (с, 3H). ЖХМС: Rt=1,408 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H39FN3O2 [M+H]+ 468, найдено 468.
Пример 49. Синтез соединений 111, 112 и 113.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 111:1H ЯМР: (400 МГц, CDCl3) δ 7,48-7,45 (м, 1H), 7,07-7,05 (м, 1H), 5,46-5,34 (м, 2H), 2,73-2,68 (м, 1H), 2,21-2,17 (м, 2H), 1,87-1,11 (м, 21H), 1,07-0,70 (м, 9H). ЖХМС: Rt=1,460 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H38FClN3O2 [M+H]+ 502, найдено 502.
Соединение 112:1H ЯМР: (400 МГц, CDCl3) δ 7,62 (д, J=8,8 Гц, 1H), 7,37 (д, J=6,8 Гц, 1H), 5,52 (д, J=5,3 Гц, 2H), 2,75-2,58 (м, 1H), 2,33-2,06 (м, 2H), 1,87-1,11 (м, 21H), 1,06-0,64 (м, 9H). ЖХМС: Rt=1,525 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H38FClN3O2 [M+H]+ 502, найдено 484 [M+H-18]+.
Соединение 113:1H ЯМР: (400 МГц, CDCl3) δ 7,82-7,74 (м, 1H), 7,38-7,30 (м, 1H), 5,52 (с, 2H), 2,79-2,63 (м, 1H), 2,28-2,07 (м, 2H), 1,90-1,13 (м, 21H), 1,10-0,63 (м, 9H). ЖХМС: Rt=1,482 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H38FClN3O2 [M+H]+ 502, найдено 484 [M+H-18]+.
Пример 50. Синтез соединения 114.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 114:1H ЯМР (400 МГц, CDCl3) δ 7,52(с, 1H), 7,41 (с, 1H), 4,93-4,79 (м, 2H), 2,57 (т, J=8,8Гц, 1H), 2,34 (с, 3H), 2,17-1,95 (м, 2H), 1,80-1,10 (м, 21H), 1,05-0,65 (м, 9H). ЖХМС: Rt=1,369 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H41SN2O2 [M+H]+ 445, найдено 445.
Пример 51. Синтез соединений 115, 116 и 117.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 115:1H ЯМР (400 МГц, CDCl3) δ 7,40-7,36 (м, 1H), 6,87-6,85 (м, 1H), 6,70-6,68 (м, 1H), 5,37-5,35 (м, 2H), 4,12 (с, 3H), 2,69-2,65 (м, 1H), 2,21-2,17 (м, 2H), 1,87-1,11 (м, 21H), 1,07-0,70 (м, 9H). ЖХМС: Rt=1,384 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
Соединение 116:1H ЯМР (400 МГц, CDCl3) δ 7,66-7,59 (м, 1H), 7,25-7,20 (м, 1H), 6,79-6,73 (м, 1H), 5,64-5,52 (м, 2H), 3,89 (с, 3H), 2,7 -2,63 (м, 1H), 2,25-2,10 (м, 2H), 1,82-1,14 (м, 22H), 1,04-0,79 (м, 2H), 0,79-0,68 (м, 6H). ЖХМС: Rt=1,373 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
Соединение 117:1H ЯМР (400 МГц, CDCl3) δ 7,44-7,42 (м, 1H), 7,31-7,27 (м, 1H), 6,64-6,63 (м, 1H), 5,54-5,45 (м, 2H), 4,02 (с, 3H), 2,65-2,60 (м, 1H), 2,21-2,10 (м, 2H), 1,87-1,11 (м, 21H), 1,07-0,70 (м, 9H). ЖХМС: Rt=1,397 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
Пример 52. Синтез соединения 118.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 118:1H ЯМР (400 МГц, CDCl3) δ 8,56 (с, 1H), 5,49-5,30 (м, 2H), 2,64 (т, J=8,8Гц, 1H), 2,22-2,06 (м, 2H), 1,80-1,10 (м, 19H), 1,05-0,70 (м, 9H). ЖХМС: Rt=1,305 мин в 2 мин хроматографии, МС (ESI) рассчитано для C23H37N4O2 [M+H]+ 401, найдено 401.
Пример 53. Синтез соединений 119 и 120.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 119: 1H ЯМР (400 МГц, CDCl3) δ 8,09-8,06 (м, 1H), 7,50-7,32(м, 3H), 5,46-5,36 (м, 2H), 2,70 (т, J=8,8Гц, 1H), 2,24-2,16 (м, 2H), 1,80-1,10 (м, 21H), 1,05-0,72 (м, 9H). ЖХМС Rt=1,360 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H40N3O2 [M+H]+ 450, найдено 450.
Соединение 120:1H ЯМР (400 МГц, CDCl3) δ 7,88-7,86 (м, 2H), 7,40-7,37(м, 2H), 5,56-5,46 (м, 2H), 2,65 (т, J=8,8Гц, 1H), 2,21-2,10 (м, 2H), 1,80-1,10 (м, 21H), 1,17-0,74 (м, 9H). ЖХМС: Rt=1,008 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H40N3O2 [M+H]+ 450, найдено 450.
Пример 54. Синтез соединения 121.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 121:1H ЯМР (400 МГц, CDCl3) δ 7,48-7,47(м, 1H), 6,73-6,72 (м, 1H), 5,05-4,88 (м, 2H), 2,59 (т, J=8,8Гц, 1H), 2,17-1,95 (м, 2H), 1,80-1,10 (м, 21H), 1,05-0,65 (м, 9H). ЖХМС Rt=0,949 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H38N3O2 [M+H]+ 424, найдено 406[M+H-18]+.
Соединение 122:1H ЯМР (400 МГц, CDCl3) δ 7,50-7,44 (м, 1H), 6,77-6,71 (м, 1H), 5,12-4,86 (м, 2H), 2,78-2,72 (м, 1H), 1,94-1,10 (м, 58H), 1,06-0,69 (м, 15H). ЖХМС: Rt=1,373 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H37N3O2 Na [M+Na]+ 446, найдено 446.
Пример 55. Синтез соединения 124.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 124:1H ЯМР (400 МГц, CDCl3) δ 7,84-7,80 (м, 1H), 7,14-7,10 (м, 1H), 5,44-5,31 (м, 2H), 2,73-2,69 (м, 1H), 2,25-2,05 (м, 2H), 1,80-1,10 (м, 22H), 1,05-0,90 (м, 2H), 0,77 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=1,404 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H38F2N3O2 [M+H]+ 486, найдено 486.
Пример 56. Синтез соединений 125, 126 и 127.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 125:1H ЯМР: (400 МГц, CDCl3) δ 7,77-7,73 (м, 1H), 7,13-7,06 (м, 1H), 5,53-5,40 (м, 2H), 3,90 (с, 3H), 2,72-2,61 (м, 1H), 2,35-2,12 (м, 3H), 1,90-0,72 (м, 30H). ЖХМС: Rt=1,422 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
Соединение 126:1H ЯМР: (400 МГц, CDCl3) δ 7,96-7,87 (м, 1H), 7,01 (дд, J=2,0, 9,0 Гц, 1H), 6,60 (д, J=2,0 Гц, 1H), 5,33 (д, J=5,8 Гц, 2H), 3,86 (с, 3H), 2,76-2,65 (м, 1H), 2,28-2,10 (м, 2H), 1,83-1,12 (м, 21H), 0,75 (д, J=17,6 Гц, 9H). ЖХМС: Rt=1,362 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
Соединение 127:1H ЯМР: (400 МГц, CDCl3) δ 7,95-7,89 (м, 1H), 7,43-7,34 (м, 1H), 7,18 (д, J=17,3 Гц, 2H), 7,0 -6,98 (м, 1H), 6,63-6,58 (м, 1H), 5,59-5,19 (м, 2H), 3,89 (с, 3H), 2,73-2,62 (м, 1H), 2,26-2,07 (м, 2H), 1,82-1,11 (м, 18H), 1,07-0,65 (м, 9H) ЖХМС: Rt=1,359 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42N3O3 [M+H]+ 480, найдено 480.
Пример 57. Синтез соединения 128.
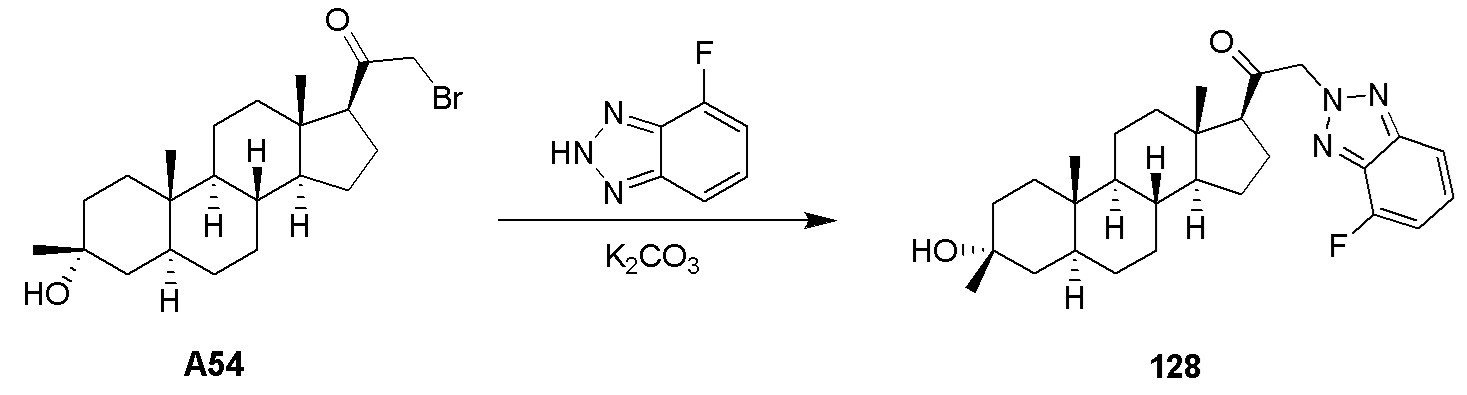
Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 128:1H ЯМР (400 МГц, CDCl3) δ 7,67 (д, J=8,8 Гц, 1H), 7,37-7,28 (м, 1H), 7,09-6,98 (м, 1H), 5,54 (д, J=5,5 Гц, 2H), 2,66 (с, 1H), 2,27-2,09 (м, 3H), 1,87-1,09 (м, 20H), 0,75 (д, J=11,3 Гц, 9H). ЖХМС: Rt=1,446 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H39FN3O2 [M+H]+ 468, найдено 450 [M+H-18]+.
Пример 58. Синтез соединения 129.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 129:1H ЯМР (400 МГц, CDCl3): δ 7,28 (с, 1H), 7,06 (с, 1H), 5,00-4,84 (м, 2H), 2,64 (т, J=8,4 Гц, 1H), 2,22-2,06 (м, 2H), 1,79-1,53 (м, 4H), 1,50-1,20 (м, 19H), 1,02-0,85 (м, 19H), 0,78 (с, 3H), 0,72 (с, 3H). ЖХМС: Rt=0,901 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H37N3O2 [M+H]+ 424, найдено 424.
Пример 59. Синтез соединения 130.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 130:1H ЯМР (400 МГц, CDCl3): δ 7,33 (с, 1H), 7,16 (с, 1H), 4,90-4,77 (м, 2H), 2,56 (т, J=8,4 Гц, 1H), 2,17-2,08 (м, 5H), 1,72-1,50 (м, 6H), 1,40-1,20 (м, 15H), 0,80-0,79 (м, 3H), 0,75 (с, 3H), 0,70 (с, 3H). ЖХМС: Rt=0,927 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H40N2O2 [M+H]+ 413, найдено 413.
Пример 60. Синтез соединения 131.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 131:1H ЯМР (400 МГц, CDCl3): δ 7,72 (с, 2H), 5,02-4,86 (м, 2H), 2,60 (т, J=8,4 Гц, 1H), 2,19-2,03 (м, 5H), 1,73-1,51 (м, 6H), 1,37-1,20 (м, 16H), 0,85-0,82 (м, 3H), 0,76 (с, 3H), 0,67(с, 3H). ЖХМС: Rt=0,983 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H37F3N2O2 [M+H]+ 467, найдено 467.
Пример 62. Синтез соединения 133.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 133:1H ЯМР (400 МГц, CDCl3) δ 7,43 (д, J=18,1 Гц, 1H), 4,94-4,76 (м, 1H), 2,61-2,53 (м, 1H), 2,25-2,13 (м, 1H), 2,08-1,80 (м, 3H), 1,79-1,66 (м, 3H), 1,63-1,35 (м, 11H), 1,34-1,18 (м, 9H), 1,17-1,01 (м, 2H), 0,95 (с, 3H), 0,65 (с, 3H). ЖХМС: Rt=1,127 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H37ClN2O2 [M+H]+ 433, найдено 433.
Пример 63. Синтез соединения 134.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 134:1H ЯМР (400 МГц, CDCl3) δ 7,72 (с, 1H), 5,03-4,84 (м, 1H), 2,64-2,55 (м, 1H), 2,27-1,02 (м, 28H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС: Rt=1,332 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H37F3N2O2 [M+H]+ 467, найдено 467.
Пример 64. Синтез соединения 135 и 136.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 135:1H ЯМР (400 МГц, CDCl3) δ 7,29 (с, 1H), 6,55 (с, 1H), 4,66-4,54 (м, 2H), 2,55 (т, J=8,4 Гц, 1H), 2,27-2,00 (м, 5H), 1,70-1,51 (м, 5H), 1,47-1,21 (м, 18H), 0,84-0,80 (м, 3H), 0,76 (с, 3H), 0,65(с, 3H). ЖХМС: Rt=0,795 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H40N2O2 [M+H]+ 413, найдено 413.
Соединение 136:1H ЯМР (400 МГц, DMSO-d6) δ 7,42 (с, 1H), 6,62(с, 1H), 5,03-4,77 (м, 2H), 3,88 (с, 1H), 2,68 (т, J=10 Гц, 3H), 2,34 (с, 1H) 2,04-1,63 (м, 5H), 1,44-1,15 (м, 27H), 1,07-0,75 (м, 4H), 0,72 (с, 3H), 0,59(с, 3H). ЖХМС: Rt=1,087 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H40N2O2 [M+H]+ 413, найдено 413.
Пример 65. Синтез соединения 137.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 137:1H ЯМР (400 МГц, CDCl3) δ 7,45 (с, 1H), 7,41 (с, 1H), 4,93-4,78 (м, 2H), 2,57 (т, J=8,8 Гц, 1H), 2,18-2,04 (м, 2H), 1,73-1,50 (м, 4H), 1,27-1,17 (м, 18H), 0,81-0,80 (м, 3H) 0,75 (с, 3H), 0,66(с, 3H). ЖХМС: Rt=0,953 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C25H37ClN2O2 [M+Na]+ 433, найдено 433.
Пример 66. Синтез соединения 138.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 138: 1H ЯМР (400 МГц, CDCl3) δ 7,43 (д, J=6,0 Гц, 1H), 4,79-4,68 (м, 1H), 2,65-2,53 (м, 1H), 2,20 (д, J=9,3 Гц, 1H), 2,04-1,02 (м, 29H), 0,96 (с, 3H), 0,70-0,59 (м, 3H). ЖХМС: Rt=0,891 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H37N3O2 [M+H]+ 424, найдено 424.
Пример 67. Синтез соединения 139.

Стадия 1. Синтез соединения AA2: В колбу к раствору Me3SOI (30,1 г, 137 ммоль) в ТГФ (200 мл) добавляли t-BuOK (15,3 г, 137 ммоль) и реакционную смесь перемешивали при 25°C в течение 0,5 часа. Добавляли (5S,8R,9S,10S,13S,14S,17S)-17-гидрокси-10,13-диметилтетрадекагидро-1H-циклопента[a]фенантрен-3(2H)-он (AA1, 20 г, 68,8 ммоль) и реакционную смесь перемешивали в течение 2 часов при 25°C. После того, как ТСХ анализ (PE:EA=3:1) показал, что реакция завершилась, реакцию гасили водным раствором NH4Cl (300 мл). Реакционную смесь экстрагировали при помощи EtOAc (200 мл ×2), промывали насыщенным солевым раствором (200 мл), сушили над Na2SO4 и упаривали в вакууме с получением неочищенного продукта (5S,8R,9S,10S,13S,14S,17S)-10,13-диметилгексадекагидроспиро-[циклопента[a]фенантрен-3,2'-оксиран]-17-ола (AA2, 23 г) в виде белого твердого вещества, который использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 2. Синтез соединения AA3. В колбу к раствору (5S,8R,9S,10S,13S,14S,17S)-10,13-диметилгексадекагидроспиро[циклопента[a]фенантрен-3,2'-оксиран]-17-ола (AA2, 23 г, 75,5 ммоль) в MeOH (200 мл) добавляли MeONa (12,2 г, 226 ммоль) и реакционную смесь нагревали до 60°C и перемешивали в течение 4 часов. После того, как ТСХ анализ (PE:EtOAc=3:1) показал, что реакция завершилась, реакцию гасили водным раствором NH4Cl (300 мл). Реакционную смесь экстрагировали при помощи EtOAc (200 мл ×2), промывали насыщенным солевым раствором (200 мл), сушили над Na2SO4 и упаривали в вакууме с получением неочищенного продукта (3R,5S,8R,9S,10S,13S,14S,17S)-3-(метоксиметил)-10,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-3,17-диола (AA3, 25 г) в виде желтого твердого вещества, который использовали непосредственно на следующей стадии без дополнительной очистки.1H ЯМР (CDCl3, 400 МГц): δ = 3,78-3,63 (м, 1H), 3,40 (с, 3H), 3,20 (с, 2H), 2,09-2,02 (м, 3H), 1,89-1,32 (м, 26H), 1,29-0,75 (м, 14H).
Стадия 3. Синтез соединения AA4. К раствору (3R,5S,8R,9S,10S,13S,14S,17S)-3-(метоксиметил)-10,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-3,17-диола (AA3, 25 г, 74,2 ммоль) в безводном DCM (200 мл) добавляли реагент Десса-Мартина (47,0 г, 111 ммоль) по порциям при 0°C. Реакционную смесь перемешивали при 30°C в течение 2 часов. ТСХ анализ (PE/EA=3:1) показал, что исходное вещество израсходовано полностью. Смесь гасили насыщенным раствором NaHCO3/Na2S2O3=1:3 (200 мл) и экстрагировали при помощи EtOAc (200 мл ×2). Органическую фазу промывали насыщенным солевым раствором (200 мл) и сушили над Na2SO4 и растворитель выпаривали при 40°C с получением неочищенного продукта (3R,5S,8R,9S,10S,13S,14S)-3-гидрокси-3-(метоксиметил)-10,13-диметилтетрадекагидро-1H-циклопента[a]фенантрен-17(2H)-она (AA4, 26 г), который использовали непосредственно на следующей стадии без дополнительной очистки.1HЯМР (CDCl3, 400 МГц): δ=3,39 (с, 3H), 3,18 (с, 2H), 2,69-2,65 (м, 1H), 2,44-2,40 (м, 1H), 2,09-1,41 (м, 28H), 1,38-1,31 (м, 11H)
Стадия 4. Синтез соединения AA5. К суспензии EtPPh3Br (144 г, 388 ммоль) в ТГФ (500 мл) добавляли t-BuOK (43,5 г, 388 ммоль). После перемешивания при 60°C в течение 1 часа добавляли по порциям (3R,5S,8R,9S,10S,13S,14S)-3-гидрокси-3-(метоксиметил)-10,13-диметилтетрадекагидро-1H-циклопента[a]фенантрен-17(2H)-он (AA4, 26 г, 77,7 ммоль) при 60°C. Реакционную смесь перемешивали при этой же температуре в течение 8 часов. ТСХ анализ (PE/EtOAc=3/1) показал, что реакция завершилась, и был обнаружен основной продукт с более низкой полярностью. Реакционную смесь гасили водным раствором NH4Cl (500 мл) и экстрагировали при помощи EtOAc (500 мл) три раза. Объединенный органический слой промывали насыщенным солевым раствором (500 мл), сушили над Na2SO4 и концентрировали в вакууме с получением неочищенного продукта. Неочищенный продукт очищали колоночной хроматографией (PE:EA=10:1-6:1) с получением (3R,5S,8R,9S,10S,13S,14S,Z)-17-этилиден-3-(метоксиметил)-10,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-3-ола (AA5, 20 г) в виде белого твердого вещества.1H ЯМР (CDCl3, 400 МГц): δ=5,12-5,10 (м, 1H), 3,39 (с, 3H), 3,18 (с, 2H), 2,40-2,12 (м, 3H), 1,66-1,16 (м, 25H), 1,10-0,70 (м, 9H)
Стадия 5. Синтез соединения AA6. К раствору (3R,5S,8R,9S,10S,13S,14S,Z)-17-этилиден-3-(метоксиметил)-10,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-3-ола (AA5, 20 г, 57,7 ммоль) в ТГФ (200 мл) добавляли по каплям раствор BH3-Me2S (57,6 мл, 10 M) при 0°C. Раствор перемешивали при 25°Cв течение 8 часов. ТСХ анализ (PE:EtOAc=3:1) показал, что реакция почти завершилась, и был обнаружен основной продукт с более высокой полярностью. После охлаждения до 0°C добавляли очень медленно раствор NaOH (230 мл, 3M). После того, как добавление было завершено, медленно добавляли H2O2 (104 мл, 33%) и внутреннюю температуру поддерживали ниже 10°C. Полученный раствор перемешивали при 25°C в течение 2 часов. Полученный раствор экстрагировали при помощи EtOAc (200 мл ×3). Объединенный органический раствор промывали насыщенным раствором Na2S2O3 (200 мл ×2), насыщенным солевым раствором (200 мл), сушили над Na2SO4 и концентрировали в вакууме с получением неочищенного продукта (AA6, 25 г) в виде желтого твердого вещества. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 6. Синтез соединения AA7. Смесь (3R,5S,8R,9S,10S,13S,14S,17S)-17-((R)-1-гидроксиэтил)-3-(метоксиметил)-10,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-3-ола (AA6, 25 г, 68,5 ммоль), PCC (21,9 г, 102 ммоль) и силикагеля (24 г, масс/масс=1/1,1) в DCM (200 мл) перемешивали при 25°C в течение 2 часов. Цвет реакционной смеси становился коричневым. ТСХ анализ (PE/EtOAc=3/1) показал, что реакция завершилась, и был обнаружен основной продукт с более низкой полярностью. Раствор фильтровали и фильтровальную лепешку промывали при помощи DCM (200 мл). Объединенный фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюировали при помощи PE/EtOAc=15/1 до 6/1 с получением 1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3-(метоксиметил)-10,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (AA7, 16 г) в виде белого твердого вещества.1HЯМР (CDCl3, 400 МГц): δ = 3,41 (с, 3H), 3,40 (с, 2H), 2,58-2,53 (м, 1H), 2,18-2,13 (м, 4H), 2,03-1,99 (м, 2H), 1,71-1,30 (м, 23H), 1,10-10,70 (м, 6H), 0,67 (с, 3H)
Стадия 7. Синтез соединения A55. К раствору 1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3-(метоксиметил)-10,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (AA7, 15 г, 41,3 ммоль) и каталитического количества HBr (167 мг, 40% в воде) в MeOH (150 мл) добавляли по каплям дибром (2,32 мл, 45,4 ммоль) при 0°C. Реакционную смесь перемешивали при 25°C в течение 2 часов. ТСХ анализ (PE:EtOAc=3:1) показал, что реакция завершилась. Реакцию гасили насыщенным раствором NaHCO3 и pH доводили до 7~8. Реакционную смесь экстрагировали при помощи DCM (200 мл ×2). Объединенный органический слой промывали насыщенным солевым раствором (200 мл), сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта 2-бром-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3-(метоксиметил)-10,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (A55, 16 г) в виде желтого масла.1H ЯМР (CDCl3, 400 МГц): δ = 3,92-3,91 (м, 2H), 3,50 (с, 5H), 3,39 (с, 5H), 3,18 (с, 3H), 2,82-3,72 (м, 1H), 2,30-2,10 (м, 1H), 1,72-1,12 (м, 34H), 1,08-0,70 (м, 9H), 0,67 (с, 3H).
Стадия 8. Синтез соединения 139. K2CO3 (125 мг, 906 мкмоль) добавляли к раствору соединения A55 (200 мг, 453 мкмоль) и 4-метил-1H-пиразола (48 мг, 588 мкмоль) в ацетоне (3 мл) при 25°C. Полученную смесь перемешивали при 25°C в течение 12 часов, после этого анализ ТСХ показал, что реакция завершилась. Реакционную смесь разбавляли водой (10 мл) и экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4, фильтровали и упаривали с получением неочищенного продукта (200 мг). Реакционную смесь очищали при помощи ВЭЖХ (колонка: Waters Xbridge Prep OBD C18 150×30 5мкм, градиент: 44-74% B (A=0,05% аммиака-ACN, B=ацетонитрил), скорость потока: 25 мл/мин) с получением соединения 139 (53,6 мг) в виде белого твердого вещества.1H ЯМР (Хлороформ-d, 400 МГц) δ=7,34 (с, 1H), 7,17 (с, 1H), 4,77-4,91 (м, 2H), 3,39 (с, 3H), 3,18 (с, 2H), 2,57 (т, J=8,8 Гц, 1H), 2,14-2,23 (м, 1H), 2,09 (с, 3H), 1,98-2,06 (м, 2H), 1,63-1,74 (м, 4H), 1,50-1,55 (м, 2H), 1,10-1,50 (м, 12H), 0,94-1,02 (м, 1H), 0,80-0,87 (м, 1H), 0,75 (с, 3H), 0,67 м.д. (с, 3H). ЖХМС Rt=2,848 мин в 4 мин хроматографии, МС (ESI) рассчитано для C27H42N2O3 [M+Na]+ 465,3, найдено 465,1 ([M+H-18]+).
Пример 68. Синтез соединения 140.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 140 (64,3 мг):1H ЯМР (Хлороформ-d, 400МГц) δ=7,72 (с, 2H), 4,86-5,02 (м, 2H), 3,33-3,43 (м, 3H), 3,19 (с, 2H), 2,61 (т, J=8,8 Гц, 1H), 2,16-2,25 (м, 1H), 1,99-2,08 (м, 2H), 1,63-1,78 (м, 4H), 1,06-1,55 (м, 14H), 0,94-1,03 (м, 1H), 0,82-0,89 (м, 1H), 0,72-0,80 (м, 3H), 0,67 (с, 3H). ЖХМС: Rt=3,106 мин в 4 мин хроматографии, МС (ESI) рассчитано для C27H39F3N2O3 [M+H]+ 497,3, найдено 497,1 ([M+H]+).
Пример 69. Синтез соединения 141.
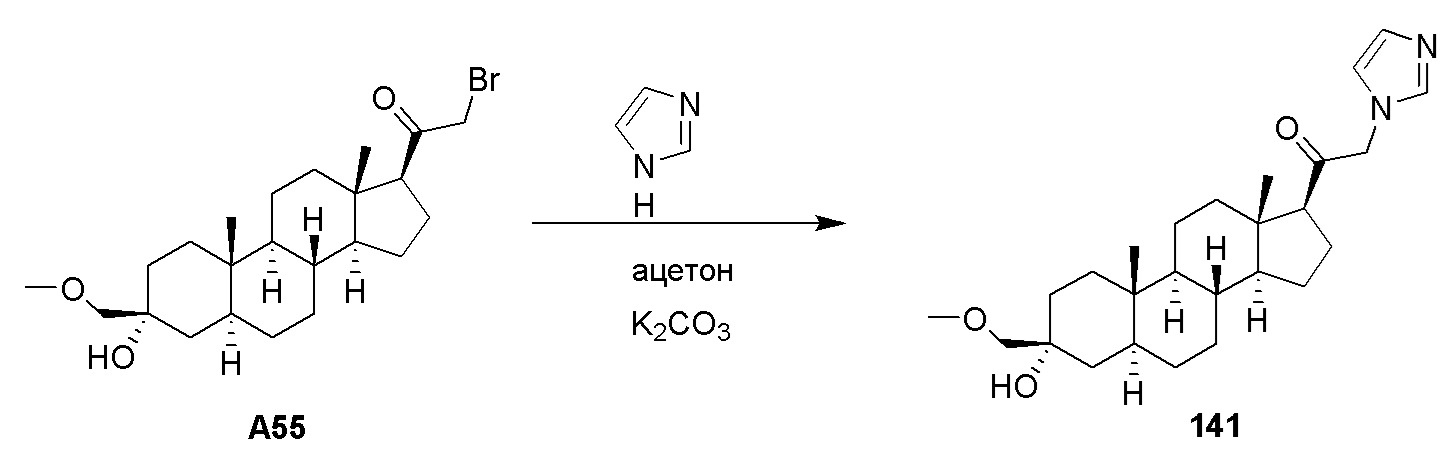
Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 141 (59,4 мг):1H ЯМР (Хлороформ-d, 400МГц): δ=9,65 (шир.с, 1H), 7,32 (с, 1H), 7,06 (с, 1H), 5,44 (д, J=17,6 Гц, 1H), 5,26 (д, J=18,2 Гц, 1H), 3,39 (с, 3H), 3,19 (с, 2H), 2,72 (т, J=9,0 Гц, 1H), 2,20 (д, J=10,6 Гц, 1H), 2,11 (д, J=11,6 Гц, 2H), 1,49-1,80 (м, 10H), 1,22-1,42 (м, 8H), 0,94-1,04 (м, 1H), 0,85 (т, J=9,6 Гц, 1H), 0,76 (с, 3H), 0,69 (с, 3H). ЖХМС: Rt=2,074 мин в 4 мин хроматографии, МС (ESI) рассчитано для C26H40N2O3 [M+Na]+ 451,3, найдено 451,2 ([M+Na]+.
Пример 70. Синтез соединения 142.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 141 (59,4 мг):1H ЯМР (Хлороформ-d, 400МГц) δ=7,86 (с, 1H), 7,82 (с, 1H), 4,87-5,05 (м, 2H), 3,40 (с, 3H), 3,19 (с, 2H), 2,61 (т, J=8,8 Гц,1H),2,16-2,26 (м, 1H), 2,01-2,08 (м, 2H), 1,66-1,77 (м, 4H), 1,14-1,55 (м, 14H), 0,94-1,04 (м, 1H), 0,82-0,89 (м, 1H), 0,76 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=2,827 мин в 4 мин хроматографии, МС (ESI) рассчитано для C27H39N3O3 [M+H]+ 454,3, найдено 454,2 ([M+H]+.
Пример 71. Синтез соединения 143.
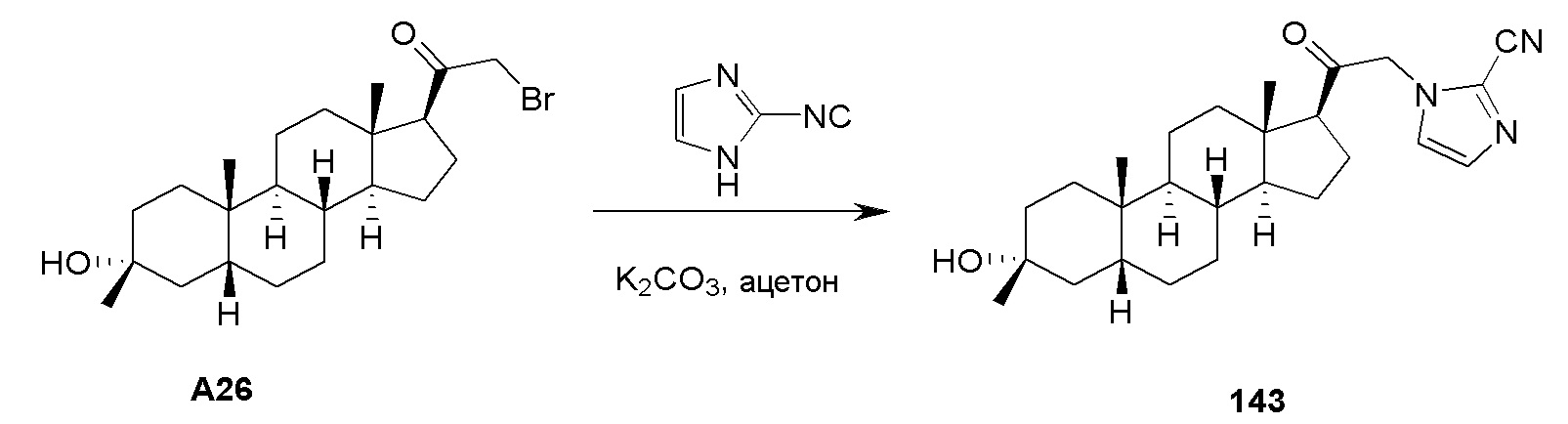
Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 143:1H ЯМР (400 МГц, CDCl3) δ 7,25 (д, J=1,0 Гц, 1H), 7,04 (д, J=1,0 Гц, 1H), 5,00-4,81 (м, 2H), 2,69-2,57 (м, 1H), 2,29-1,02 (м, 27H), 0,99-0,89 (м, 3H), 0,69 (с, 3H). ЖХМС: Rt=1,367 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H42N2O3 [M+H+Na]+ 424, найдено 424.
Пример 73. Синтез соединения 145.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 145:1H ЯМР (400 МГц, CDCl3) δ 7,28 (с, 1H), 7,07 (с, 1H), 4,86-4,73 (м, 2H), 3,97-3,92 (м, 2H), 2,54 (т, J=8,8 Гц, 1H), 2,19-1,70 (м, 9H), 1,43-1,07 (м, 22H), 0,94 (с, 3H), 0,65 (с, 3H). ЖХМС: Rt=0,918 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C27H42N2O3 [M+H]+ 443, найдено 443.
Пример 74. Синтез соединения 146.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 146:1H ЯМР (400 МГц, CDCl3) δ 8,17 (с, 1H), 8,08 (с, 1H), 5,05-4,83 (м, 2H), 2,67-2,55 (м, 1H), 2,28-1,01 (м, 28H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС: Rt=1,330 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H37N3O4 [M+H-H2O]+ 426, найдено 426.
Пример 75. Синтез соединения 147.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 147:1H ЯМР (400 МГц, CDCl3) δ 7,34 (с, 1H), 7,16 (с, 1H), 4,91-4,75 (м, 2H), 2,60-2,49 (м, 1H), 2,27-1,00 (м, 31H), 0,94 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=1,264 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H40N2O2 [M+H]+413, найдено 413.
Пример 76. Синтез соединения 148.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 148:1H ЯМР (400 МГц, CDCl3) δ 7,27 (с, 1H), 7,07 (с, 1H), 4,86-4,72 (м, 2H), 3,75 (с, 3H), 2,55 (т, J=9,2 Гц, 1H), 2,22-2,17 (м, 2H), 1,72-1,50 (м, 4H), 1,37-1,20 (м, 17H),0,80-0,79 (м, 3H) 0,75 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,306 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H40N2O3 [M+Na]+ 429, найдено 429.
Пример 77. Синтез соединения 149.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 149:1H ЯМР (400 МГц, CDCl3) δ 7,24 (с, 1H), 7,05 (д, J=6,8 Гц, 1H), 4,83-4,69 (м, 2H), 3,94-3,89 (м, 2H), 2,53 (т, J=8,8 Гц, 1H), 2,17-1,99 (м, 2H), 1,67-1,18 (м, 24H), 0,78-0,77 (м, 3H) 0,73 (с, 3H), 0,64 (с, 3H). ЖХМС Rt=1,334 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H42N2O3 [M+Na]+ 443, найдено 443.
Пример 78. Синтез соединения 150.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 149:1H ЯМР (400 МГц, CDCl3) δ 7,25 (с, 1H), 7,06 (с, 1H), 4,84-4,71 (м, 2H), 4,14-4,13 (м, 1H), 2,54 (т, J=8,8 Гц, 1H), 2,18-2,00 (м, 2H), 1,69-1,50 (м, 24H), 1,36-1,19 (м, 22H), 0,79-0,78 (м, 2H) 0,74 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=0,957 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H44N2O3 [M+Na]+ 479, найдено 479.
Пример 79. Синтез соединений 151, 152 и 153.

Соединение 151 получали в соответствии со способом Примера 47, стадия 7.
Соединение 151:1H ЯМР (400 МГц, CDCl3) δ 8,17 (с, 1H), 8,08 (с, 1H), 5,03-4,86 (м, 2H), 2,61 (т, J=8,8 Гц, 1H), 2,20-2,05 (м, 2H), 1,75-1,51 (м, 4H), 1,50-1,21 (м, 16H), 0,99-0,82 (м, 2H) 0,76 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=0,940 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C25H37N3O4 [M+H-H2O]+ 426, найдено 426.
Синтез соединения 152: К раствору соединения 151 (400 мг, 0,901 ммоль) в MeOH (5 мл) добавляли Pd/C (влажный, 10%, 40 мг). После дегазирования три раза при помощи H2 реакционную смесь перемешивали в течение 6 часов при 25°C в атмосфере H2 (15 ф/дюйм2(1,055 кг/см2)). Когда ТСХ анализ (PE:EA) показал, что исходное вещество израсходовано, реакционную смесь фильтровали для удаления Pd/C, фильтрат концентрировали с получением 2-(4-амино-1H-пиразол-1-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (200 мг). Соединение 152:1H ЯМР (400 МГц, CDCl3) δ 7,20 (с, 1H), 7,01 (с, 1H), 4,83-4,70 (м, 2H), 2,54 (т, J=8,8 Гц, 1H), 2,18-2,00 (м, 2H), 1,69-1,50 (м, 4H), 1,40-1,20(м, 15H), 0,79-0,78 (м, 2H) 0,75 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=0,754 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+Na]+ 436, найдено 436.
Синтез соединения 153: К раствору 2-(4-амино-1H-пиразол-1-ил)-1-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (150 мг, 0,362 ммоль) в DCM (2 мл) добавляли уксусный ангидрид (44,3 мг, 0,434 ммоль), с последующим добавлением TEA (0,15 мл, 0,362 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 12 часов. ЖХМС анализ показал, что исходное вещество израсходовано полностью. К смеси добавляли воду (10 мл) и затем экстрагировали при помощи EtOAc (8 мл ×3). Объединенные органические фазы концентрировали с получением остатка, который очищали препаративной ВЭЖХ, с получением N-(1-(2-((3R,5S,8R,9S,10S,13S,14S,17S)-3-гидрокси-3,10,13-триметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)-2-оксоэтил)-1H-пиразол-4-ил)ацетамида (13 мг). Соединение 153: 1H ЯМР (400 МГц, CDCl3) δ 7,90 (с, 1H), 7,42 (с, 1H), 7,09 (с, 1H), 4,91-4,78 (м, 2H), 2,54 (т, J=8,4 Гц, 1H), 2,19-2,01 (м, 5H), 1,67-1,51 (м, 5H), 1,40-1,17(м, 19H), 0,97-0,79 (м, 3H), 0,75 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,205 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H41N3O3 [M+H]+ 456, найдено 456.
Пример 80. Синтез соединения 154.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 154:1H ЯМР (400 МГц, CDCl3) δ 7,42 (д, J=6 Гц, 1H), 4,79-4,69 (м, 2H), 2,59 (т, J=8,8 Гц, 1H), 2,21-1,92 (м, 2H), 1,72-1,50 (м, 4H), 1,38-1,21 (м, 22H), 0,85-0,83 (м, 4H), 0,76 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=0,888 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H37N3O2 [M+H]+ 424, найдено 424.
Пример 81. Синтез соединения 155.

Соединение A50 получали в соответствии со способом Примера 47, стадия 2.
Синтез соединения A56. К суспензии бромтрифенил(пропил)фосфорана (11,6 г, 30,3 ммоль) в безводном ТГФ (160 мл) добавляли 2-метилпропан-2-олат калия (3,40 г, 30,3 ммоль) при 25°C в атмосфере N2. Полученную смесь перемешивали при 65°C в течение 1 часа, в этот момент добавляли соединение A50 (3,1 г, 10,1 ммоль) в безводном ТГФ (40 мл) при 65°C. Смесь перемешивали при 65°C в течение 16 часов, после этого анализ ТСХ (PE:EA =2:1) показал, что исходное вещество израсходовано. Реакцию гасили водой (100 мл) и экстрагировали этилацетатом (150 мл ×3) и объединенную органическую фазу промывали насыщенным солевым раствором (150 мл), сушили над Na2SO4 и концентрировали с получением остатка, который очищали хроматографией на силикагеле (PE:EtOAc=6:1), с получением соединения A56 (2,2 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,09-4,90 (м, 1H), 2,37 (дд, J=6,8, 16,3 Гц, 1H), 2,24-1,99 (м, 4H), 1,77-1,10 (м, 23H), 1,04-0,67 (м, 13H).
Синтез соединения A57. К раствору соединения A56 в ТГФ (30 мл) добавляли по каплям раствор BH3-Me2S (7,01 мл, 70,01 ммоль) при 0°C. Раствор перемешивали при 25°C в течение 12 часов, после этого анализ ТСХ (PE:EA=3:1) показал, что реакция завершилась. После охлаждения до 0°C медленно добавляли раствор NaOH (23,3 мл, 3M, 70,01 ммоль), с последующим добавлением H2O2(8,06 г, 33% масс/масс в воде, 70,1 ммоль), поддерживая при этом температуру ниже 10°C. Полученный раствор перемешивали при 25°C в течение 2 часов, затем экстрагировали при помощи EtOAc (40 мл ×3). Объединенную органическую фазу промывали насыщенным водным раствором Na2S2O3 (20 мл ×2), насыщенным солевым раствором (30 мл), сушили над Na2SO4 и концентрировали с получением соединения A57 в виде белого твердого вещества. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Синтез соединения A58. Смесь соединения A57, PCC (2,32 г, 10 ммоль) и силикагеля (2,5 г) в DCM (30 мл) перемешивали при 25°C в течение 1 часа, после этого ТСХ анализ (PE:EA=3:1) показал, что реакция завершилась. Раствор концентрировали в вакууме с получением неочищенного продукта, который очищали хроматографией на силикагеле (PE:EA=5:1), с получением соединения A58 (1,05 г) в виде желтого твердого вещества.
Синтез соединения A59. К раствору соединения A58 (200 мг, 577 мкмоль) и концентрированной HBr (9,7 мг, 57,6 мкмоль) в MeOH(5 мл) добавляли по каплям бром (138 мг, 865 мкмоль). Реакционную смесь перемешивали при 25°C в течение 8 часов и затем нагревали до 50°C в течение 8 часов, после этого анализ ТСХ (PE:EA=3:1) показал, что реакция завершилась. Реакцию гасили насыщенным водным раствором NaHCO3(4 мл) и pH доводили до 7-8. Раствор экстрагировали при помощи EtOAc (8 мл ×3) и объединенную органическую фазу сушили над Na2SO4 и концентрировали с получением соединения A59 (210 мг).
Синтез соединения 155. К раствору соединения A59 (250 мг, 587 мкмоль) в ацетоне (6 мл) добавляли карбонат калия (243 мг, 1,76 ммоль) и морфолин (255 мг, 2,93 ммоль) при 25°C и смесь перемешивали при 50°C в течение 8 часов. ТСХ (PE:EA=1:1) анализ показал, что реакция завершилась, и смесь затем экстрагировали водой (8 мл) и EA (12 мл ×3). Объединенную органическую фазу сушили над Na2SO4 и концентрировали с получением соединения 155 (220 мг, неочищенное) в виде желтого твердого вещества. Неочищенное твердое вещество очищали препаративной ВЭЖХ (0,05% HCl-ACN) с получением соединения 155 (42,0 мг) в виде белого твердого вещества.1H ЯМР (400 МГц, Метанол-d4) δ 3,80-3,60 (м, 4H), 3,28-3,17 (м, 1H), 2,81-2,48 (м, 4H), 2,18-1,83 (м, 2H), 1,79-1,13 (м, 22H), 1,11-0,77 (м, 7H), 0,75-0,58 (м, 3H). ЖХМС Rt=1,013 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H45NO3 [M+H]+432, найдено 432 ([M+H]+).
Пример 82. Синтез соединений 156 и 157.

Соединение A60 получали в соответствии со способом Примера 47, стадия 7.
Синтез соединения 156. К раствору соединения A60 (450 мг, 0,956 ммоль) в ТГФ (5 мл), CH3OH (2 мл) и H2O (5 мл) добавляли гидроксид лития гидрат (80,1 мг, 1,91 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 16 часов, после этого анализ ТСХ анализ (PE:EA=1:1) показал, что исходное вещество полностью израсходовано. Смесь затем разбавляли водой (10 мл) и затем экстрагировали при помощи EtOAc (8 мл ×3). Объединенную органическую фазу концентрировали с получением неочищенного (400 мг) остатка, который очищали препаративной ВЭЖХ, с получением соединения 16 мг соединения 156.1H ЯМР (400 МГц, CDCl3) δ 7,98 (с, 1H), 7,97 (с, 1H), 5,02-4,87 (м, 2H), 2,60 (т, J=8,8 Гц, 1H), 2,12-2,03 (м, 3H), 1,73-1,51 (м, 5H), 1,45-1,21 (м, 14H), 0,99-0,81 (м, 3H), 0,76 (с, 3H), 0,67 (с, 3H). ЖХМС: Rt=0,862 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H38N2O4 [M+H]+ 443, найдено 443.
Синтез соединения 157. К раствору соединения 156 в DMF (2 мл) добавляли HATU (170 мг,0,450 ммоль) и TEA (45,5 мг), с последующим добавлением метанамина (10,4 мг, 0,337 ммоль). Полученную реакционную смесь перемешивали при 25°C в течение 16 часов, после этого ТСХ анализ (DCM:MeOH=10:1) показал, что исходное вещество полностью израсходовано. Смесь затем разбавляли водой (10 мл) и затем экстрагировали при помощи EtOAc (8 мл ×3). Объединенную органическую фазу концентрировали, затем очищали препаративной ВЭЖХ с получением соединения 157 (5,5 мг) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,88 (с, 1H), 7,78 (с, 1H), 5,00-4,87 (м, 2H), 2,96 (с, 3H), 2,60(т, J=8,4 Гц, 1H), 2,14-2,02 (м, 2H), 1,77-1,20 (м, 18H), 0,98-0,81 (м, 3H), 0,75 (с, 3H), 0,66(с, 3H). ЖХМС Rt=0,839 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C27H41N3O3 [M+Na]+ 455, найдено 478.
Пример 83. Синтез соединения 158.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 158 (34 мг):1H ЯМР (400 МГц, CDCl3) δ 7,32 (с, 1H), 7,12 (с, 1H), 4,81-4,97 (м, 2H), 3,70-3,84 (м, 3H), 3,39 (с, 3H), 3,19 (с, 2H), 2,58 (т, J=8,7 Гц, 1H), 2,13-2,25 (м, 1H), 2,05 (д, J=11,3 Гц, 1H), 1,62-1,77 (м, 4H), 1,11-1,61 (м, 15H), 0,94-1,03 (м, 1H), 0,80-0,88 (м, 1H), 0,76 (с, 3H), 0,67 (с, 3H). ЖХМС: Rt=2,776 мин в 4 мин хроматографии, МС (ESI) рассчитано для C27H42N2O4 [M+H]+ 459,3, найдено 459,2 [M+H]+.
Пример 84. Синтез соединения 159.
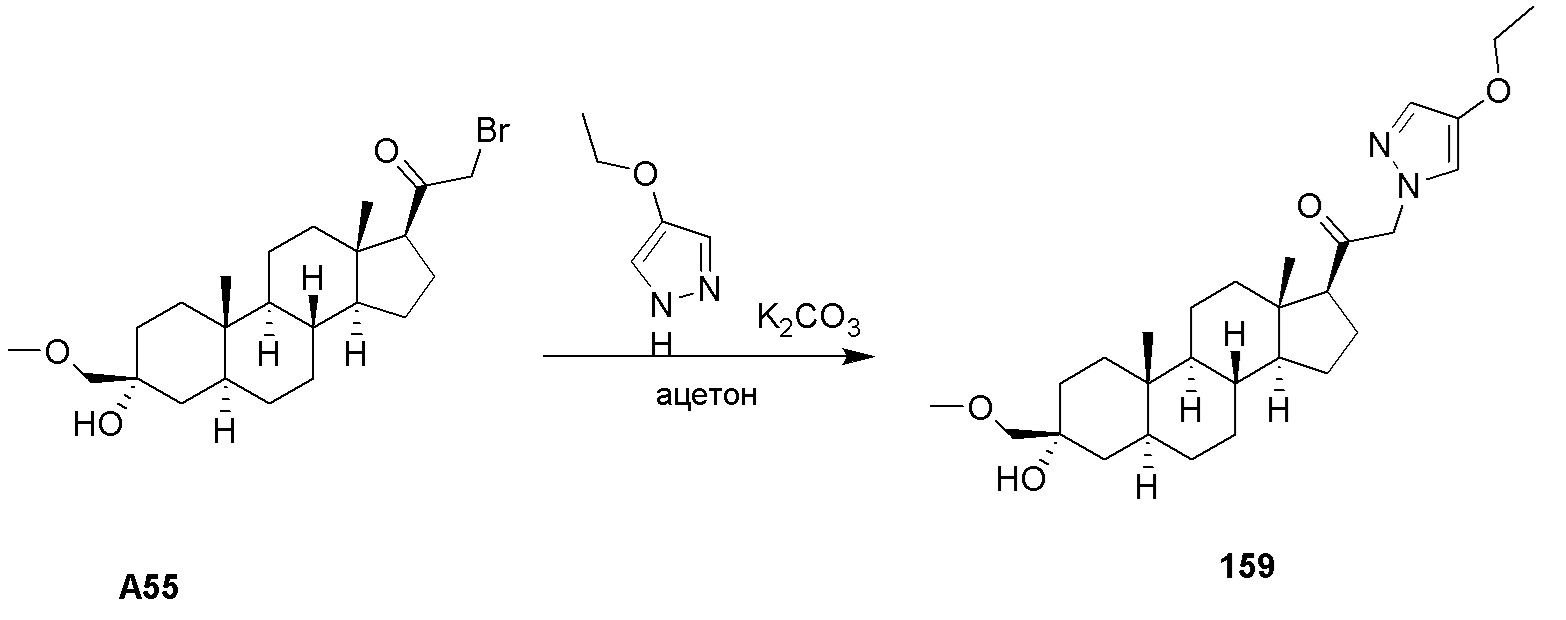
Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 159 (33,2 мг):1H ЯМР (DMSO-d6, 400МГц): δ=7,36 (с, 1H), 7,18 (с, 1H), 4,80-5,00 (м, 2H), 4,01 (с, 1H), 3,86 (кв., J=7,0 Гц, 2H), 3,24 (с, 3H), 3,03 (с, 2h), 2,59-2,67 (м, 1H), 2,33 (шир.с, 1H), 2,01 (д, J=11,0 Гц, 2H), 1,62 (шир.с, 4H), 1,17-1,54 (м, 12H), 1,15 (д, J=10,0 Гц, 4H), 1,04 (д, J=13,2 Гц, 1H), 0,82-0,95 (м, 1H), 0,69 (с, 3H), 0,55 (с, 3H). ЖХМС: Rt=2,869 мин в 4 мин хроматографии, МС (ESI) рассчитано для C28H44N2O4 [M+H]+ 473,3, найдено 473,6 ([M+H]+.
Пример 85. Синтез соединения 160.

Соединение A55 получали в соответствии со способом Примера 67.
Синтез соединения A61. K2CO3 (937 мг, 6,78 ммоль) добавляли к соединению A55 (1,5 г, 3,39 ммоль) и этил 1H-пиразол-4-карбоксилату (616 мг, 4,4 ммоль) в ацетоне (15 мл) при 25°C. Полученную смесь перемешивали при 25°C в течение 12 часов, после этого анализ ТСХ показал, что реакция завершилась. Реакционную смесь разбавляли водой (50 мл), затем экстрагировали при помощи EtOAc (50 мл ×3) и объединенные органические слои промывали насыщенным солевым раствором (50 мл). Органический слой сушили над Na2SO4, фильтровали и очищали хроматографией (силикагель: EtOAc в PE 20-50%) с получением соединения A61 (1,4 г, 82,8%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,06 (с, 1H), 7,91 (с, 1H), 4,81-5,04 (м, 2H), 4,28-4,33 (м, 2H), 3,33-3,46 (м, 3H), 3,12-3,24 (м, 2H), 2,60 (т, J=8,8 Гц, 1H), 2,15-2,26 (м, 1H), 1,63-1,76 (м, 4H), 1,15-1,55 (м, 19H), 0,99 (тд, J=12,2, 4,8 Гц, 1H), 0,82-0,89 (м, 1H), 0,74-0,79 (м, 3H), 0,47-0,73 (м, 3H). ЖХМС: Rt=0,911 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H44N2O5 [M+H]+ 501,3, найдено 501,7 ([M+H]+.
Синтез соединения 160. LiOH (200 мг, 906 мкмоль) добавляли к соединению A61 (1,4 г, 2,79 моль) в EtOH (10 мл) при 25°C. Полученную смесь перемешивали при 25°C в течение 5 часов, после этого анализ ТСХ анализ показал, что реакция завершилась. Реакционную смесь подкисляли до pH=4-5 при помощи 1 M HCl, затем фильтровали с получением соединения осадка (1,4 г), который очищали при помощи ВЭЖХ, с получением соединения 160 (1,2 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ=7,87-8,10 (м, 2H), 4,83-5,07 (м, 2H), 3,39 (с, 3H), 3,20 (с, 2H), 2,61 (шир.с, 1H), 2,12-2,27 (м, 1H), 1,99-2,07 (м, 1H), 1,63-1,80 (м, 4H), 1,12-1,60 (м, 14H), 0,94-1,05 (м, 1H), 0,85 (т, J=9,6 Гц, 1H), 0,76 (с, 3H), 0,67 (с, 3H). ЖХМС: Rt=2,542 мин в 4 мин хроматографии, МС (ESI) рассчитано для C27H40N2O5 [M+H]+ 473,2, найдено 473,3 ([M+H]+.
Пример 86. Синтез соединения 161.
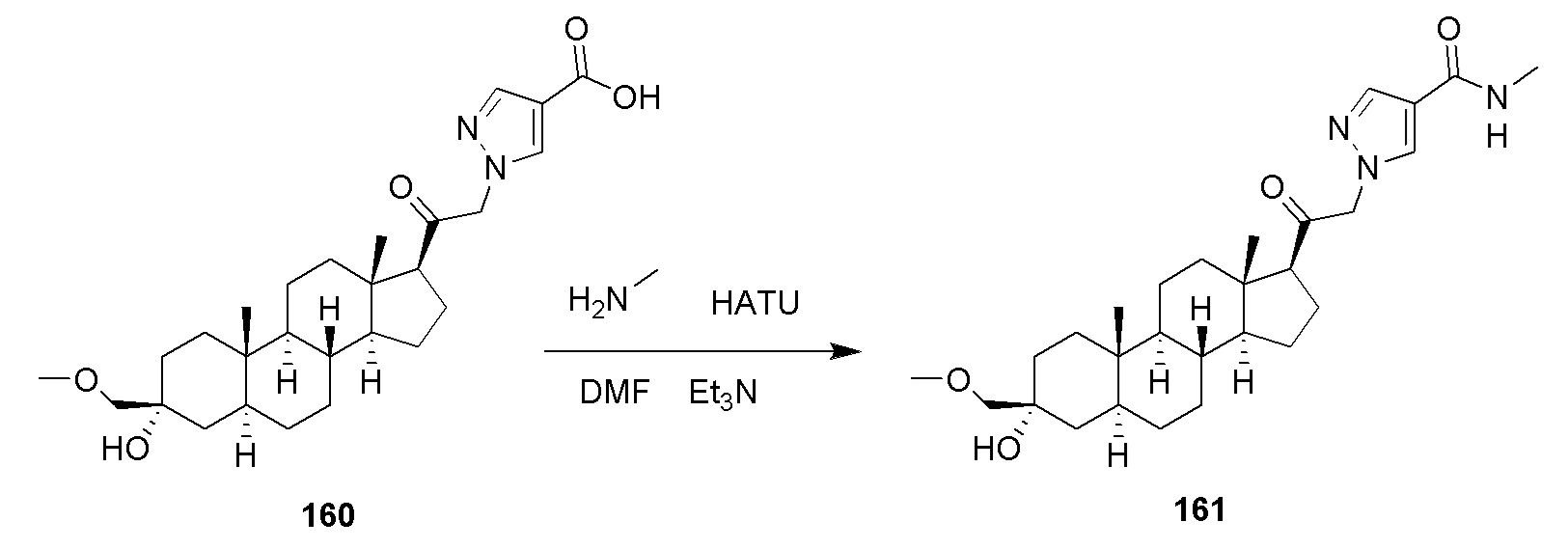
Соединение 160 получали в соответствии со способом Примера 85. Метиламин (1,26 мл, 1,26 ммоль) добавляли к соединению A61 (300 мг, 634 мкмоль), с последующим добавлением триэтиламина (192 мг, 1,9 ммоль) и HATU (288 мг,760 мкмоль) в DMF (3 мл) при 25°C. Полученную смесь перемешивали при 25°C в течение 3 часов, после этого анализ ЖХМС показал, что реакция завершилась. Реакционную смесь разбавляли водой (10 мл) и экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта (300 мг), который очищали при помощи ВЭЖХ, с получением соединения 161 (110 мг) в виде белого твердого вещества.1H ЯМР (CDCl3, 400МГц): δ 7,85 (с, 1H), 7,76 (с, 1H), 5,78 (шир.с, 1H), 4,84-5,00 (м, 2H), 3,39 (с, 3H), 3,19 (с, 2H), 2,96 (шир.с, 3H), 2,59 (т, J=8,8 Гц, 1H), 2,14-2,24 (м, 1H), 2,04 (д, J=11,6 Гц, 1H), 1,82 (шир.с, 2H), 1,62-1,78 (м, 4H), 1,12-1,59 (м, 13H), 0,95-1,03 (м, 1H), 0,81-0,89 (м, 1H), 0,76 (с, 3H), 0,66 (с, 3H). ЖХМС: Rt=2,487 мин в 4 мин хроматографии, МС (ESI) рассчитано для C28H43N3O4 [M+H]+486,3, найдено 486,2 ([M+H] +.
Пример 87. Синтез соединения 162.

Указанное в заголовке соединение получали в соответствии со способом Примера 87.
Соединение 162 (83,2 мг):1H ЯМР (CDCl3, 400МГц): δ 7,72-7,81 (м, 2H), 4,84-5,00 (м, 2H), 3,39 (с, 3H), 3,18 (с, 8H), 2,60 (т, J=8,6 Гц, 1H), 2,15-2,24 (м, 1H), 2,05 (д, J=11,6 Гц, 1H), 1,62-1,78 (м, 5H), 1,13-1,56 (м, 14H), 0,94-1,03 (м, 1H), 0,80-0,88 (м, 1H), 0,76 (с, 3H), 0,67 м.д. (с, 3H). ЖХМС Rt=2,572 мин в 4 мин хроматографии, МС (ESI) рассчитано для C29H45N3O4 [M+H]+500,3, найдено 500,2 ([M+H] +.
Пример 88. Синтез соединения 163.

Указанное в заголовке соединение получали в соответствии со способом Примера 86.
Соединение 163 (102 мг):1H ЯМР (CDCl3, 400МГц): δ 7,89 (шир.с, 1Н), 7,80 (шир.с, 1H), 5,78 (шир.с, 2H), 4,94 (д, J=19,2 Гц, 2H), 3,39 (с, 3H), 3,19 (с, 2Н), 2,61 (шир.с, 1H), 2,19 (шир.с, 1h), 2,01-2,07 (м, 1H), 1,90 (шир.с, 2H), 1,63-1,82 (м, 4H), 1,12-1,60 (м, 13H), 0,98 (д, J=11,6 Гц, 1H), 0,84 (т, J=9,8 Гц, 1H), 0,76 (с, 3H), 0,66 (шир.с, 3H). ЖХМС: Rt=2,293 мин в 4 мин хроматографии, МС (ESI) рассчитано для C27H41N3O4 [M+H]+ 472,3, найдено 472,2 ([M+H]+.
Пример 89. Синтез соединения 164.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 164 (8,2 мг):1H ЯМР (CDCl3, 400 МГц): δ 7,25 (с, 1H), 7,05 (с, 1H), 4,82-5,00 (м, 2H), 3,40 (с, 3H), 3,19 (с, 2H), 2,63 (т, J=8,4 Гц, 1H), 2,18-2,27 (м, 1H), 2,07 (д, J=11,6 Гц, 1H), 1,65-1,78 (м, 4H), 1,09-1,58 (м, 15H), 0,96-1,05 (м, 1H), 0,86 (т, J=9,8 Гц, 1H), 0,76 (с, 3H), 0,71 (с, 3H). ЖХМС: Rt=2,760 мин в 4 мин хроматографии, МС (ESI) рассчитано для C27H39N3O3 [M+H]+ 454,4, найдено 454,1 ([M+H]+.
Пример 90. Синтез соединения 165.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 165 (15,6 мг):1H ЯМР (CDCl3, 400МГц): δ 7,87 (с, 1H), 7,82 (д, J=9,0 Гц, 1H), 7,35 (дд, J=9,0, 2,0 Гц, 1H), 5,44-5,55 (м, 2H), 3,40 (с, 3H), 3,19 (с, 2H), 2,66 (т, J=8,6 Гц, 1H), 2,18-2,28 (м, 1H), 2,14 (д, J=11,6 Гц, 1H), 2,02 (шир.с, 1H), 1,65-1,81 (м, 4H), 1,12-1,54 (м, 14H), 0,95-1,04 (м, 1H), 0,82-0,89 (м, 1H), 0,77 (с, 3H), 0,73 м.д. (с, 3H). ЖХМС: Rt=3,012 мин в 4 мин хроматографии, МС (ESI) рассчитано для C29H40ClN3O3 [M+H]+ 514,2, найдено 514,1 ([M+H]+.
Пример 91. Синтез соединения 166.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 166:1H ЯМР (CDCl3, 400МГц): δ 7,28 (с, 1H), 7,08 (с, 1H), 4,87-4,71 (м, 2H), 3,76 (с, 3H), 2,55 (т, J=8,9 Гц, 1H), 2,25-1,01 (м, 31H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС: Rt=1,263 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H40N2O3 [M+H]+ 429, найдено 429.
Пример 92. Синтез соединения 167.
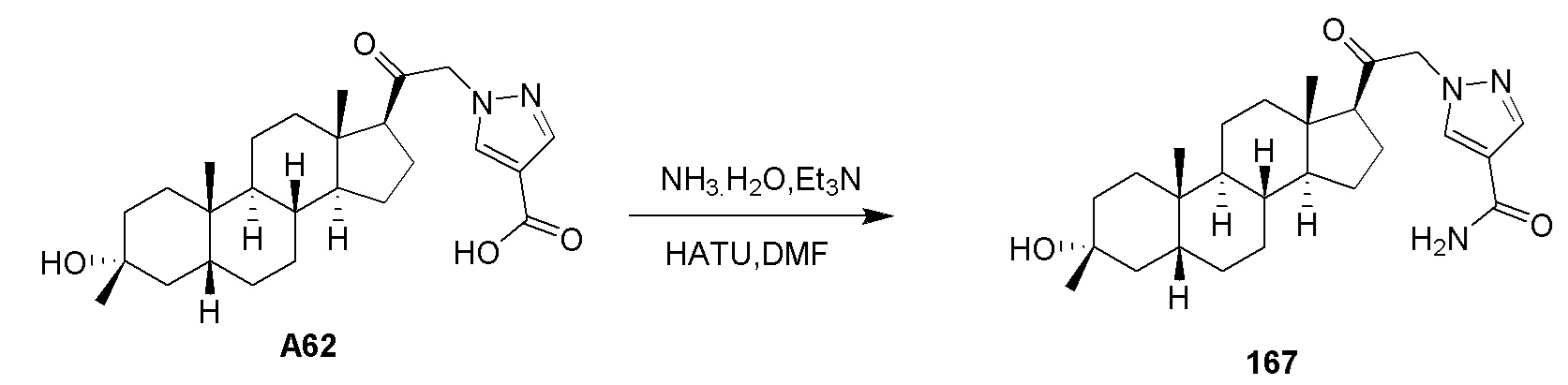
Указанное в заголовке соединение получали в соответствии со способом Примера 86.
Соединение 167:1H ЯМР (MeOD, 400МГц): δ 8,07 (с, 1H), 7,93 (с, 1H), 5,11 (д, J=4,3 Гц, 2H), 2,79-2,72 (м, 1H), 2,27-1,06 (м, 27H), 1,00 (с, 3H), 0,69 (с, 3H). ЖХМС: Rt=1,166 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H39N3O3 [M+H-H2O]+ 424, найдено 424.
Пример 93. Синтез соединения 168.

Указанное в заголовке соединение получали в соответствии со способом Примера 86.
Соединение 168:1H ЯМР (CDCl3, 400МГц): δ 8,01-7,76 (м, 2h), 6,10 (шир.с, 1h), 4,96 (шир.с, 2h), 2,97 (шир.с, 3H), 2,60 (шир.с, 1H), 2,28-1,00 (м, 31H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС: Rt=0,818 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H40N2O3 [M+H-H2O]+ 438, найдено 438.
Пример 94. Синтез соединения 169.

Указанное в заголовке соединение получали в соответствии со способом Примера 86.
Соединение 169:1H ЯМР (CDCl3, 400МГц): δ 7,80-7,72 (м, 1H), 5,05-4,81 (м, 1H), 3,12 (шир.с, 3H), 2,71-2,53 (м, 1H), 2,26-0,99 (м, 28H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС: Rt=1,194 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H43N3O3 [M+H-H2O]+ 452, найдено 452.
Пример 95. Синтез соединения 170.

Соединение 146 получали, как описано в Примере 74. К раствору соединения 146 (50 мг, 0,112 ммоль) в MeOH (5 мл) добавляли Pd-C (11,8 мг, 0,112 ммоль) в атмосфере N2 при 25°C и реакционную смесь перемешивали при 25°C в течение 3 часов в атмосфере H2. ТСХ анализ (PE:EA=1:1) показал, что реакция завершилась, и смесь фильтровали и концентрировали с получением неочищенного остатка, который очищали при помощи ВЭЖХ, с получением соединения 170 (149 мг) в виде красного твердого вещества.1H ЯМР (CDCl3, 400МГц): δ 7,21 (с, 1H), 7,01 (с, 1H), 4,85-4,68 (м, 2H), 2,53 (т, J=9,0 Гц, 1H), 2,22-0,99 (м, 29H), 0,94 (с, 3H), 0,65 (с, 3H). ЖХМС: Rt=1,019 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O2 [M+H-H2O]+ 396, найдено 396.
Пример 96. Синтез соединения 171.

Соединение 170 получали, как описано в Примере 96. К раствору соединения 170 (140 мг, 0,338 ммоль) в DCM (5 мл) добавляли DMAP (41,2 мг, 0,338 ммоль), уксусный ангидрид (69,0 мг, 0,676 ммоль) и триэтиламин (68,4 мг, 0,676 ммоль). Смесь перемешивали при 25°C в течение 16 часов, после чего анализ ЖХМС показал, что исходное вещество полностью израсходовано. Смесь разбавляли водой (6 мл) и EtOAc (8 мл) и экстрагировали при помощи EtOAc (9 мл ×2). Объединенную органическую фазу промывали водным раствором HCl (20 мл ×2, 4 M), насыщенным водным раствором NaCl (20 мл ×2), сушили над Na2SO4 и концентрировали с получением остатка, который очищали при помощи ВЭЖХ, с получением соединения 171 (33 мг) в виде белого твердого вещества.1H ЯМР (CDCl3, 400МГц): δ 7,93 (шир.с, 1h), 7,44 (шир.с, 1H), 7,35 (шир.с, 1H), 4,97-4,79 (м, 2H), 2,61-2,51 (м, 1H), 2,22-0,98 (м, 32H), 0,94 (с, 3H), 0,65 (с, 3H). ЖХМС: Rt=1,180 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H41N3O3 [M+H-H2O]+ 438, найдено 438.
Пример 97. Синтез соединения 172.
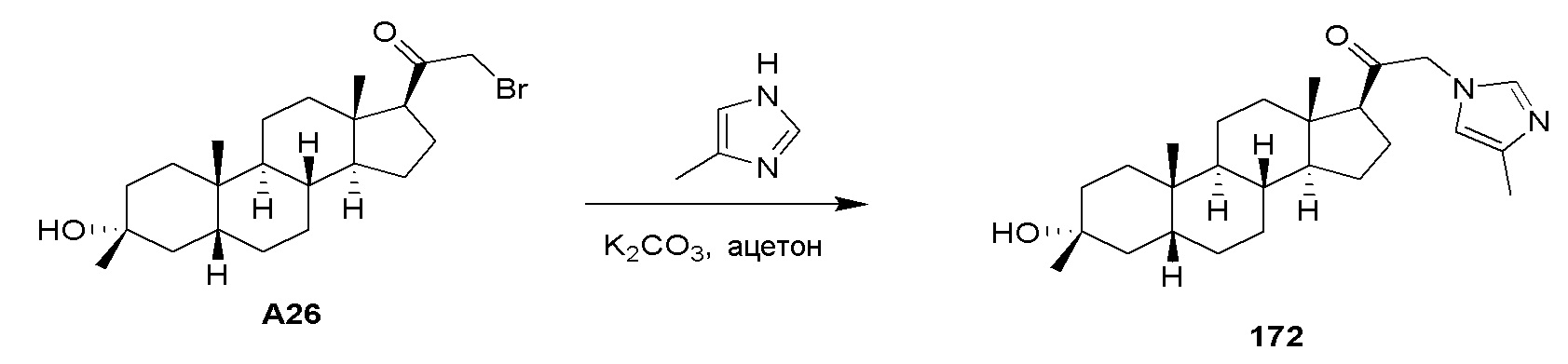
Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 172:1H ЯМР (CDCl3, 400МГц): δ 7,30 (шир.с, 1H), 6,54 (с, 1H), 4,67-4,51 (м, 2H), 2,54 (т, J=8,8 Гц, 1H), 2,28-1,00 (м, 32H), 0,95 (с, 3H), 0,64 (с, 3H).
ЖХМС Rt=1,072 мин в 1,5 мин хроматографии, 5-95AB, МС (ESI) рассчитано для C26H40N2O2 [M+H]+ 413, найдено 413.
Пример 98. Синтез соединения 173.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 173:1H ЯМР (CDCl3, 400МГц): δ 7,07 (шир.с, 1H), 4,89-4,64 (м, 2H), 4,17 (тд, J=6,0, 12,0 Гц, 1H), 2,65-2,47 (м, 1H), 2,25-1,00 (м, 31H), 0,94 (с, 3H), 0,75-0,56 (м, 3H). ЖХМС Rt=1,338 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H44N2O3 [M+H]+ 457, найдено 457.
Пример 99. Синтез соединения 174.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 174:1H ЯМР (CDCl3, 400МГц): δ 7,23 (шир.с, 1H), 6,99-6,97 (м, 1H), 7,00 (шир.с, 1H), 5,12-4,77 (м, 2H), 2,65 (шир.с, 3H), 2,27-1,01 (м, 28H), 0,99-0,87 (м, 3H), 0,66 (с, 3H). ЖХМС: Rt=1,065 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H40N2O2 [M+H]+ 413, найдено 413.
Пример 100. Синтез соединения 175.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 175:1H ЯМР (CDCl3, 400МГц): δ 7,56 (д, J=2 Гц, 1H), 7,48 (с, 1H), 5,37-5,10 (м, 2H), 3,86 (с, 1H), 2,74 (т, J=8,8 Гц, 1H), 2,41 (с, 3H), 2,32-2,03 (м, 3H), 1,72-1,10 (м, 20H), 1,05-0,74 (м, 2H), 0,70 (с, 3H), 0,58 (с, 3H). ЖХМС Rt=0,775 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H40N2O2 [M+H]+ 413, найдено 413.
Пример 101. Синтез соединения 176.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 176:1H ЯМР (CDCl3, 400МГц): δ 7,56 (с, 1H), 7,43 (с, 1H), 4,99-4,86 (м, 2H), 4,61 (с, 3H), 2,59 (т, J=9,2 Гц, 1H), 2,17-2,04 (м, 3H), 1,54-1,20 (м, 19H), 0,98-0,81 (м, 3H), 0,75 (с, 1H), 0,66 (с, 1H). ЖХМС Rt=1,200 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H40N2O3 [M+H]+ 429, найдено 429.
Пример 102. Синтез соединения 177.

Указанное в заголовке соединение получали в соответствии со способом Примера 82.
Соединение 177:1H ЯМР (CDCl3, 400МГц): δ 7,88 (с, 1H), 7,79 (с, 1H), 5,54 (с, 2H), 5,01-4,85 (м, 2H), 2,60 (т, J=8,4 Гц, 1H), 2,24-2,02 (м, 2H), 1,72-1,51 (м, 4H), 1,41-1,21 (м, 2H), 0,98-0,82 (м, 2H), 0,76 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,172 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H39N3O3 [M+H]+ 442, найдено 442.
Пример 103. Синтез соединения 178.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 178:1H ЯМР (CDCl3, 400МГц): δ 7,86 (с, 1H), 7,82 (с, 1H), 4,87-5,05 (м, 2H), 3,40 (с, 3H), 3,19 (с, 2H), 2,61 (т, J=8,8 Гц,1H),2,16-2,26 (м, 1H), 2,01-2,08 (м, 2H), 1,66-1,77 (м, 4H), 1,14-1,55 (м, 14H), 0,94-1,04 (м, 1H), 0,82-0,89 (м, 1H), 0,76 (с, 3H), 0,66 (с, 3H). ЖХМС: Rt=2,827 мин в 4 мин хроматографии, МС (ESI) рассчитано для C27H39N3O3 [M+H]+ 454,3, найдено 454,2 ([M+H]+.
Пример 104. Синтез соединения 179.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 179:1H ЯМР (CDCl3, 400МГц): δ 7,26-7,25 (м, 1H), 7,07 (с, 1H), 4,78 (д, J=19,6 Гц, 2H), 4,21-4,13 (м, 1H), 3,39 (с, 3H), 3,18 (с, 2H), 2,58-2,52 (м, 1H), 2,23-2,12 (м, 1H), 2,06-1,97 (м, 2H), 1,69 (д, J=3,3 Гц, 5H), 1,59-1,49 (м, 4H), 1,49-1,35 (м, 4H), 1,31 (д, J=6,0 Гц, 11H), 1,25-1,12 (м, 4H), 1,02-0,91 (м, 1H), 0,87-0,79 (м, 1H), 0,75 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,046 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H46N2O4 [M+H]+ 487, найдено 487.
Пример 105. Синтез соединений 180, 181 и 182.

Соединение 180 получали в соответствии со способом Примера 67. 1H ЯМР (CDCl3, 400МГц): δ 8,20-8,06 (м, 1H), 5,05-4,82 (м, 1H), 3,39 (с, 1H), 3,19 (с, 1H), 2,65-2,58 (м, 1H), 2,26-2,16 (м, 1H), 2,08-1,99 (м, 2H), 1,81-1,64 (м, 4H), 1,56-1,13 (м, 13H), 1,05-0,92 (м, 1H), 0,90-0,81 (м, 1H), 0,76 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=1,042 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H39N3O5 [M+H]+456, найдено 456 ([M+H]+).
Синтез соединения 181. К раствору соединения 180 (846 мг, 1,78 ммоль) в MeOH (10 мл) добавляли Pd/C (300 мг) при 25°C. Смесь перемешивали под баллоном H2 при 25°C в течение 3 часов, после этого анализ ЖХМС показал, что реакция завершилась. Реакционную смесь фильтровали через слой целита и промывали при помощи MeOH (5 мл ×2) и объединенный фильтрат концентрировали с получением неочищенного остатка, который очищали при помощи ВЭЖХ, с получением соединения 181 (9,4 мг) в виде белого твердого вещества. 1H ЯМР (CDCl3 400МГц) δ 7,20 (с, 1H), 7,01 (с, 1H), 4,85-4,69 (м, 2H), 3,39 (с, 3H), 3,18 (с, 2H), 2,91 (шир.с, 1H), 2,58-2,52 (м, 1H), 2,22-2,12 (м, 1H), 2,06-1,98 (м, 2H), 1,74-1,62 (м, 4H), 1,59-1,56 (м, 1H), 1,54-1,50 (м, 2H), 1,49-1,33 (м, 4H), 1,32-1,12 (м, 7H), 1,03-0,93 (м, 1H), 0,87-0,78 (м, 1H), 0,75 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=0,446 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H41N3O3 [M+H] =444.
Синтез соединения 182. К раствору соединения 181 (450 мг, 1,01 ммоль) в CH2Cl2 (5 мл) добавляли триэтиламин (204 мг, 2,02 ммоль) и уксусный ангидрид (206 мг, 2,02 ммоль) при 25°C в течение 2 часов, после этого анализ ЖХМС показал, что реакция завершилась. Смесь выливали в воду (10 мл) и экстрагировали при помощи CH2Cl2 (20 мл ×2). Объединенный органический раствор промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4 и органический слой фильтровали и концентрировали при пониженном давлении с получением остатка, который очищали при помощи ВЭЖХ, с получением соединения 182 (115 мг) в виде белого твердого вещества.1H ЯМР (CDCl3 400МГц) δ 7,92-7,87 (м, 1H), 7,46-7,38 (м, 1H), 7,14-7,07 (м, 1H), 4,93-4,76 (м, 2H), 3,39 (с, 3H), 3,18 (с, 2H), 2,61-2,52 (м, 1H), 2,14 (с, 4H), 2,06-1,97 (м, 2H), 1,76-1,62 (м, 5H), 1,55-1,49 (м, 3H), 1,30 (с, 15H), 1,04-0,92 (м, 1H), 0,88-0,79 (м, 1H), 0,76 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=0,898 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H43N3O4 [M+H]+486, найдено 486 ([M+H]+).
Пример 106. Синтез соединений 183 и 184.

Указанные в заголовке соединения получали в соответствии со способом Примера 67.
Соединение 183:1H ЯМР (CDCl3, 400МГц): δ 7,35 (с, 1H), 5,03-5,21 (м, 2H), 3,39 (с, 3H), 3,19 (с, 2H), 2,63 (т, J=8,8 Гц, 1H), 2,38 (с, 3H), 2,15-2,25 (м, 1H), 1,99-2,10 (м, 2H), 1,63-1,77 (м, 4H), 1,10-1,58 (м, 14H), 0,95-1,04 (м, 1H), 0,81-0,89 (м, 1H), 0,76 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=2,657 мин в 4 мин хроматографии, МС (ESI) рассчитано для C26H41N3O3 [M+H]+ 444,3, найдено 444,1 ([M+H]+.
Соединение 184:1H ЯМР (DMSO-d6, 400МГц): δ 7,49 (с, 1H), 5,46 (д, J=18,6 Гц, 1H), 5,23 (д, J=18,6 Гц, 1H), 4,02 (с, 1H), 3,24 (с, 3H), 3,04 (с, 2H), 2,80 (т, J=9,0 Гц, 1h), 2,67 (шир.с, 1H), 2,33 (шир.с, 1H), 2,13 (с, 3H), 2,04 (д, J=8,0 Гц, 1H), 1,64 (д, J=16,6 Гц, 4H), 1,49 (д, J=9,0 Гц, 13H), 0,93 (д, J=9,6 Гц, 1H), 0,76 (д, J=9,6 Гц, 1H), 0,70 (с, 3H), 0,58 (с, 3H). ЖХМС Rt=2,683 мин в 4 мин хроматографии, МС (ESI) рассчитано для C26H41N3O3 [M+H]+ 444,3, найдено 444,1 ([M+H]+.
Пример 107. Синтез соединения 185.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 185:1H ЯМР (CDCl3, 400МГц): δ 8,00 (д, J=9,6 Гц, 1H), 7,29-7,38 (м, 2H), 5,38 (кв., J=18,2 Гц, 2H), 3,40 (с, 3H), 3,19 (с, 2H), 2,73 (т, J=8,6 Гц, 1H), 2,13-2,26 (м, 2H), 2,03 (с, 1H), 1,67-1,82 (м, 4H), 1,13-1,56 (м, 14H), 0,97-1,06 (м, 1H), 0,84-0,91 (м, 1H), 0,78 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=3,150 мин в 4,0 мин хроматографии, МС (ESI) рассчитано для C29H40ClN3O3 [M+H]+ 514,1, найдено 514,1 ([M+H]+.
Пример 108. Синтез соединения 186.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 186:1H ЯМР (CDCl3, 400МГц): δ 8,01 (с, 1H), 7,66 (д, J=8,6 Гц, 1H), 7,20 (с, 1H), 7,08-7,16 (м, 1H), 5,04-5,16 (м, 2H), 3,39 (с, 3H), 3,19 (с, 2H), 2,65 (т, J=9,0 Гц, 1H), 2,10-2,24 (м, 2H), 2,01 (с, 1H), 1,66-1,75 (м, 4H), 1,13-1,54 (м, 14H), 0,94-1,03 (м, 1H), 0,82-0,90 (м, 1H), 0,77 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=3,269 мин в 4,0 мин хроматографии, МС (ESI) рассчитано для C30H41ClN2O3 [M+H]+ 513,3, найдено 513,0 ([M+H]+.
Пример 109. Синтез соединения 187.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 187:1H ЯМР (CDCl3, 400МГц): δ 7,43 (с, 1H), 5,15 (д, J=4,6 Гц, 2H), 3,40 (с, 3H), 3,19 (с, 2H), 2,58 (т, J=8,8 Гц, 1H), 2,34 (с, 3H), 2,15-2,23 (м, 1H), 2,00-2,09 (м, 2H), 1,63-1,76 (м, 4H), 1,09-1,56 (м, 14H), 0,94-1,03 (м, 1H), 0,81-0,87 (м, 1H), 0,76 (с, 3H), 0,70 м.д. (с, 3H). ЖХМС: Rt=2,873 мин в 4,0 мин хроматографии, МС (ESI) рассчитано для C26H41N3O3 [M+H]+ 444,3, найдено 444,2 ([M+H]+.
Пример 110. Синтез соединения 188.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 188:1H ЯМР (CDCl3, 400МГц): δ 7,30 (с, 1H), 6,56 (с, 1H), 4,55-4,67 (м, 2H), 3,39 (с, 3H), 3,19 (с, 2H), 2,56 (т, J=8,8 Гц, 1H), 2,23 (с, 3H), 2,13-2,21 (м, 1H), 2,00-2,08 (м, 1H), 1,95 (д, J=11,6 Гц, 1H), 1,66-1,75 (м, 4H), 1,14-1,58 (м, 14H), 0,94-1,04 (м, 1H), 0,81-0,88 (м, 1H), 0,76 (с, 3H), 0,65 (с, 3H). ЖХМС: Rt=2,194 мин в 4,0 мин хроматографии, МС (ESI) рассчитано для C27H42N2O3 [M+H]+ 443,3, найдено 443,2 ([M+H]+.
Пример 111. Синтез соединения 189.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 189:1H ЯМР (CDCl3, 400МГц): δ 7,54 (с, 1H), 7,41 (с, 1H), 4,96-4,82 (м, 1H), 4,61 (с, 3H), 3,39 (с, 3H), 3,18 (с, 3H), 2,59 (т, J=8,8 Гц, 1H), 2,20-2,01 (м, 4H), 1,71-1,22 (м, 22H), 0,99-0,84 (м, 2H), 0,75 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=0,818 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C27H42N2O4 [M+Na]+ 481, найдено 481.
Пример 112. Синтез соединения 190.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 190:1H ЯМР (CDCl3, 400МГц): δ 7,54 (с, 1H), 7,42 (с, 1H), 4,96-4,82 (м, 1H), 4,61 (с, 3H), 2,58 (т, J=8,8 Гц, 1H), 2,07-1,71 (м, 8H), 1,57-1,11 (м, 23H), 0,95 (с, 1H), 0,66 (с, 1H). ЖХМС Rt=0,823 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H40N2O3 [M+H]+ 429, найдено 429.
Пример 113. Синтез соединений 191 и 192.

Указанные в заголовке соединения получали в соответствии со способом Примера 67.
Соединение 191:1H ЯМР (CDCl3, 400МГц): δ 7,90 (с, 1H), 7,71-7,61 (м, 2H), 7,23 (дд, J=2,0, 9,0 Гц, 1H), 5,28-5,12 (м, 2H), 3,41 (с, 3H), 3,21 (с, 2H), 2,66 (т, J=8,7 Гц, 1H), 2,29-2,18 (м, 1H), 2,12 (д, J=12,0 Гц, 1H), 2,03 (с, 1H), 1,81-1,67 (м, 4H), 1,57 (шир.с, 2H), 1,50-1,36 (м, 4H), 1,35-1,17 (м, 8H), 1,05-0,96 (м, 1H), 0,91-0,84 (м, 1H), 0,78 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=1,217 мин в 2 мин хроматографии, МС (ESI) рассчитано для C30H41ClN2O3 [M+H]+ 513, найдено 513.
Пример 114. Синтез соединений 193 и 194.

Указанные в заголовке соединения получали в соответствии со способом Примера 67.
Соединение 193:1H ЯМР (CDCl3, 400МГц): δ 5,20-5,03 (м, 1H), 3,41 (с, 3H), 3,21 (с, 2H), 2,72-2,64 (м, 1H), 2,49 (с, 3H), 2,27-2,17 (м, 1H), 2,11-2,05 (м, 1H), 2,04 (с, 1H), 1,84-1,67 (м, 1H), 1,66-1,60 (м, 1H), 1,57-1,15 (м, 13H), 1,08-0,94 (м, 1H), 0,94-0,84 (м, 1H), 0,79 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=0,999 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H40N4O3 [M+H]+ 445, найдено 445.
Соединение 194:1H ЯМР (CDCl3, 400МГц): δ 5,45-5,29 (м, 2H), 3,41 (с, 3H), 3,20 (с, 2H), 2,65 (т, J=8,8 Гц, 1H), 2,58 (с, 3H), 2,29-2,18 (м, 1H), 2,13-1,99 (м, 2H), 1,83-1,66 (м, 4H), 1,58-1,14 (м, 14H), 1,06-0,94 (м, 1H), 0,92-0,82 (м, 1H), 0,78 (с, 3H), 0,72 (с, 3H)
ЖХМС: Rt=1,056 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H40N4O3 [M+H]+ 445, найдено 445.
Пример 115. Синтез соединения 195.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 195:1H ЯМР (CDCl3, 400МГц): δ 7,24 (с, 1H), 6,95 (шир.с, 1H), 5,05-4,73 (м, 2H), 3,41 (с, 3H), 3,20 (с, 2h), 2,68 (шир.с, 3h), 2,20 (шир.с, 1H), 1,96 (шир.с, 1H), 1,90-1,63 (м, 6H), 1,59-1,16 (м, 14H), 1,06-0,95 (м, 1H), 0,93-0,82 (м, 1H), 0,77 (с, 3H), 0,68 (с, 3H). ЖХМС Rt=0,681 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H42N2O3 [M+H]+ 443, найдено 443.
Пример 116. Синтез соединения 196.
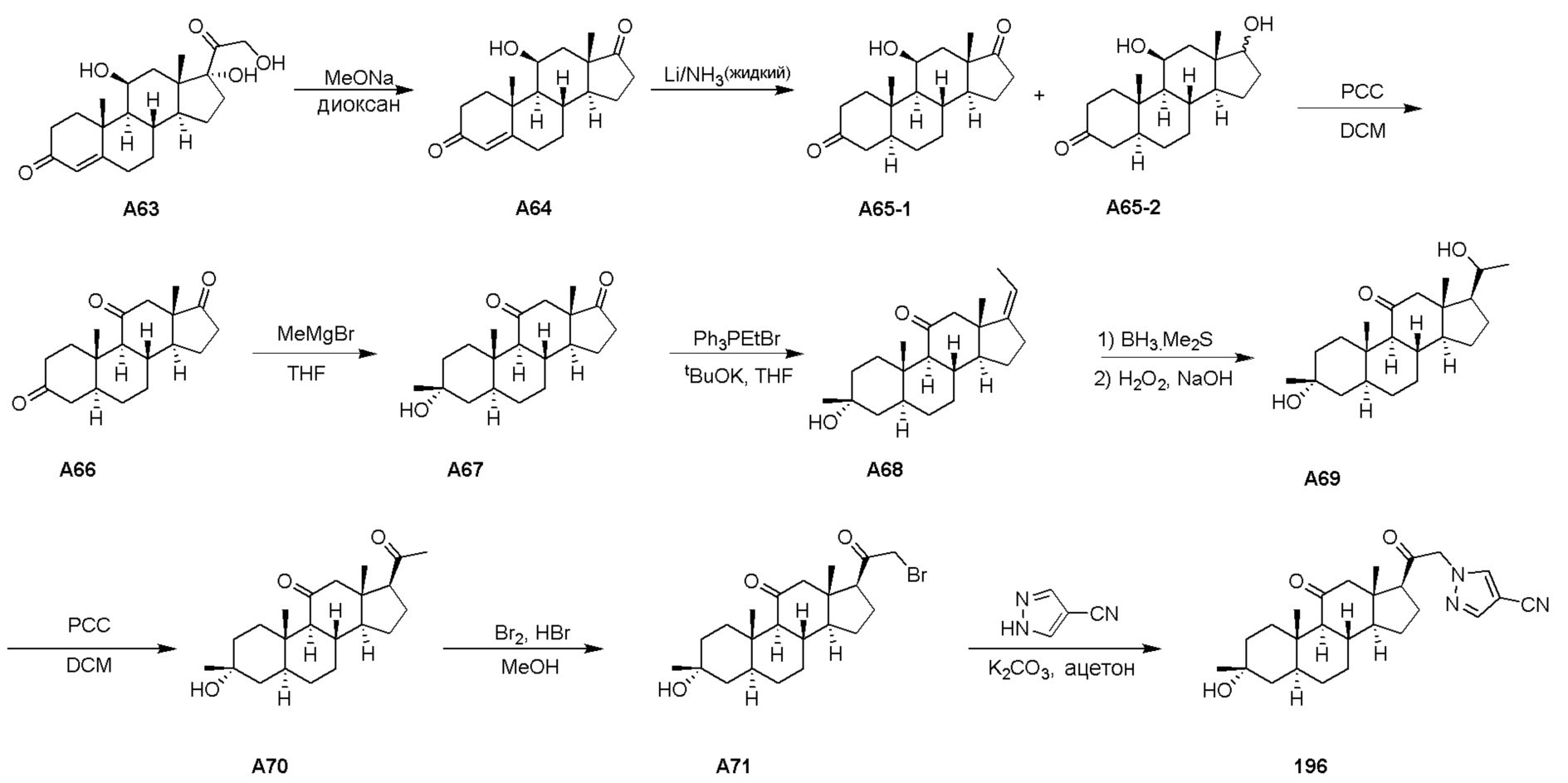
Синтез соединения A64. К раствору соединения A63 в безводном диоксанe (1000 мл) в атмосфере N2 добавляли метоксид натрия (74,0 г, 1,37 моль). Смесь перемешивали при 110°C в течение 16 часов, после этого анализ ТСХ (PE:EA=1:1) показал, что реакция завершилась. Растворитель выпаривали до 1/3 объема и смесь подкисляли при помощи 2 M HCl до pH=5~6, экстрагировали при помощи DCM (1000 мл ×2), промывали водным раствором бикарбоната натрия (1000 мл) и насыщенным солевым раствором (1000 мл), сушили над сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (PE:EA:MeOH=3:1:0,1) с получением соединения A64 (20 г) в виде белого твердого вещества.
Синтез соединений A65-1 и A65-2. Li (4,62 г, 660 ммоль) добавляли к жидкому аммонию (1500 мл, получали в 13-601 в течение 30 минут) при -70°C небольшими порциями и смесь перемешивали при -70°C в течение 10 минут вплоть до полного растворения Li. Добавляли по каплям раствор соединения A64 (20 г, 66,1 ммоль) и t-BuOH (14,6 г, 198 ммоль) в 200 мл безводного тетрагидрофурана и перемешивали в течение 90 минут до тех пор, пока реакционная смесь не стала светло-желтой, после чего анализ ТСХ (PE:EA=1:1, PMA) показал, что реакция завершилась. Добавляли хлорид аммония (40 г) и оставляли для испарения избытка аммиака. Остаток экстрагировали 0,5N раствором HCl (1000 мл) и дихлорметаном (1000 мл ×2) и объединенные органические слои промывали насыщенным раствором NaHCO3, сушили над Na2SO4, фильтровали и концентрировали с получением смеси соединения A65-1 и соединения A65-2 (18 г, неочищенная), которую использовали непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения A66. К раствору смеси A65-1 и A65-2 (18 г, 59,1 ммоль) в 300 мл безводного дихлорметана добавляли PCC (25,3 г, 118 ммоль) и силикагель (25,3 г). После перемешивания при 15°C в течение 2 часов ТСХ анализ (PE:EA=1:1, PMA) показал, что реакция завершилась. Полученный раствор концентрировали и очищали хроматографией на силикагеле (петролейный эфир/этилацетат=5:1 до 2:1) с получением соединения A66 (7,5 г, 42,1%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 2,80-2,70 (м, 1H), 2,60-2,40 (м, 3H), 2,35-2,20 (м, 4H), 2,15-1,85 (м, 6H), 1,75-1,15 (м, 9H), 0,84 (с, 3H).
Синтез соединения A67. К раствору соединения A66 (5 г, 16,5 ммоль) в ТГФ (80 мл) добавляли MeMgBr (16,5 мл, 49,5 ммоль, 3M в диэтиловом эфире) при -70°C в атмосфере N2. Реакционную смесь перемешивали при -70°C в течение 30 минут, после этого ТСХ анализ (PE:EA=1:1, PMA) показал, что реакция завершилась. Реакцию гасили насыщенным раствором NH4Cl (100 мл) и экстрагировали при помощи EtOAc (100 мл ×2). Органические слои объединяли, сушили, фильтровали и концентрировали с получением соединения 5 г соединения A67.
Синтез соединения A68. К суспензии бром(этил)трифенилфосфорана (29,1 г, 78,4 ммоль) в ТГФ (50 мл) добавляли раствор t-BuOK (8,78 г, 78,4 ммоль) в ТГФ (30 мл) в атмосфере N2. После добавления смесь перемешивали при 60°C в течение 30 минут, после чего добавляли соединение A67 (5 г, 15,7 ммоль) в ТГФ (20 мл). Полученную реакционную смесь перемешивали при 60°C в течение 2 часов, пока ТСХ анализ (PE:EA=1:1, PMA) не показал, что реакция завершилась. Смесь разбавляли насыщенным раствором NH4Cl (100 мл), затем экстрагировали при помощи EtOAc (50 мл ×2) и затем объединенную органическую фазу сушили, фильтровали, концентрировали и очищали флэш-хроматографией на системе combi-flash (PE:EA=100%- 80%) с получением соединения A68 (2,2 г) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3)δ 5,18-5,14 (м, 2H), 2,86-2,83 (м, 1H), 2,58-2,55 (м, 1H), 2,39-2,32 (м, 4H), 1,80-1,10 (м, 20H), 0,82 (с, 3H), 0,69 (с, 3H).
Синтез соединения A69. К раствору соединения A68 (2,2 г, 6,65 ммоль) в ТГФ (50 мл) добавляли по каплям раствор BH3-Me2S (6,65 мл, 66,5 ммоль, 10M в ТГФ) при 0°C. Раствор перемешивали при 15°C в течение 3 часов, после этого анализ ТСХ анализ (PE/EtOAc=1/1) показал, что реакция завершилась. После охлаждения до 0°C добавляли очень медленно раствор NaOH (39,9 мл, 2M), с последующим добавлением H2O2 (15 г, 133 ммоль, 30% в воде). Реакционную смесь охлаждали до 10°C и перемешивали в течение 2 часов. Смесь затем разбавляли насыщенным водным раствором Na2S2O3 (500 мл) до тех пор, пока реакционный раствор не становился прозрачным, затем экстрагировали при помощи EtOAc (50 мл ×3). Объединенный органический раствор промывали насыщенным водным раствором Na2S2O3 (100 мл ×2), насыщенным солевым раствором (100 мл), сушили над Na2SO4 и концентрировали в вакууме с получением неочищенного продукта A69 (2,0 г) в виде белого твердого вещества, который использовали на следующей стадии без дополнительной очистки.
Синтез соединения A70. К раствору соединения A69 (2,0 г, 5,73 ммоль) в 50 мл безводного дихлорметана добавляли PCC (2,45 г, 11,3 ммоль) и силикагель (2,45 г). После перемешивания при 15°C в течение 2 часов ТСХ анализ (PE:EA=1:1, PMA) показал, что исходное вещество израсходовано полностью. Полученный раствор концентрировали и очищали хроматографией на силикагеле (PE:EA=5:1 до 2:1) с получением соединения A70 (1,0 г, 51,2%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3)δ 2,80-2,60 (м, 1H), 2,57-2,45 (м, 2H), 2,35-2,20 (м, 2H), 2,17 (с, 3H), 1,85-1,10 (м, 20H), 0,96 (с, 3H), 0,57 (с, 3H).
Синтез A71. К раствору соединения A70 (1,0 г, 2,88 ммоль) в MeOH (20 мл) добавляли HBr (11,6 мг, 0,144 ммоль) и Br2 (552 мг, 3,45 ммоль). Реакционную смесь перемешивали при 15°C в течение 2 часов, после этого анализ ЖХМС показал, что реакция завершилась. Смесь разбавляли насыщенным раствором NaHCO3 (10 мл) с получением белого осадка, который фильтровали, с получением соединения A71 (1,2 г, 98,3%).1H ЯМР (400 МГц, CDCl3)δ 3,83 (с, 2H), 3,10-3,05 (м, 1H), 2,55-2,45 (м, 2H), 2,30-2,20 (м, 2H), 1,95-1,05 (м, 20H), 0,96 (с, 3H), 0,56 (с, 3H).
Синтез соединения 196. К раствору соединения A71 (0,1 г, 0,235 ммоль) в ацетоне (2 мл) добавляли K2CO3 (63,9 мг, 0,47 ммоль) и 1H-пиразол-4-карбонитрил (43,7 мг, 0,47 ммоль). Смесь перемешивали при 15°C в течение 2 часов, после этого анализ ЖХМС показал, что реакция завершилась. Смесь фильтровали, концентрировали и очищали препаративной ВЭЖХ с получением соединения 196. 1H ЯМР (400 МГц, CDCl3)δ 7,84-7,81 (м, 2H), 1,90 (с, 2H), 2,79 (т, J=8,6Гц, 1H), 2,60-2,45 (м, 2H), 2,30-2,20 (м, 2H), 1,95-1,10 (м, 20H), 0,96 (с, 3H), 0,63 (с, 3H). ЖХМС Rt=1,205 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H36N3O3 [M+H]+ 437, найдено 420[M-18]+.
Пример 117. Синтез соединений 197 и 198.

Указанные в заголовке соединения получали в соответствии со способом Примера 116.
Соединение 197:1H ЯМР (CDCl3, 400МГц): δ 7,77 (с, 1H), 7,62 (с, 1H), 5,24-5,08 (м, 2H), 2,85-2,82 (м, 1H), 2,58-2,45 (м, 2H), 2,30-2,20 (м, 2H), 1,95-1,15 (м, 20H), 0,97 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=1,142 мин в 2 мин хроматографии, МС (ESI) рассчитано для C24H36N3O3 [M+H]+ 414, найдено 414.
Соединение 198:1H ЯМР (CDCl3, 400МГц): δ 7,68 (с, 2H), 5,23-5,13 (м, 2H), 2,76-2,71 (м, 1H), 2,61-2,40 (м, 2H), 2,30-2,20 (м, 2H), 1,95-1,15 (м, 20H), 0,96 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=1,180 мин в 2 мин хроматографии, МС (ESI) рассчитано для C24H36N3O3 [M+H]+ 420, найдено 420.
Пример 118. Синтез соединения 199.
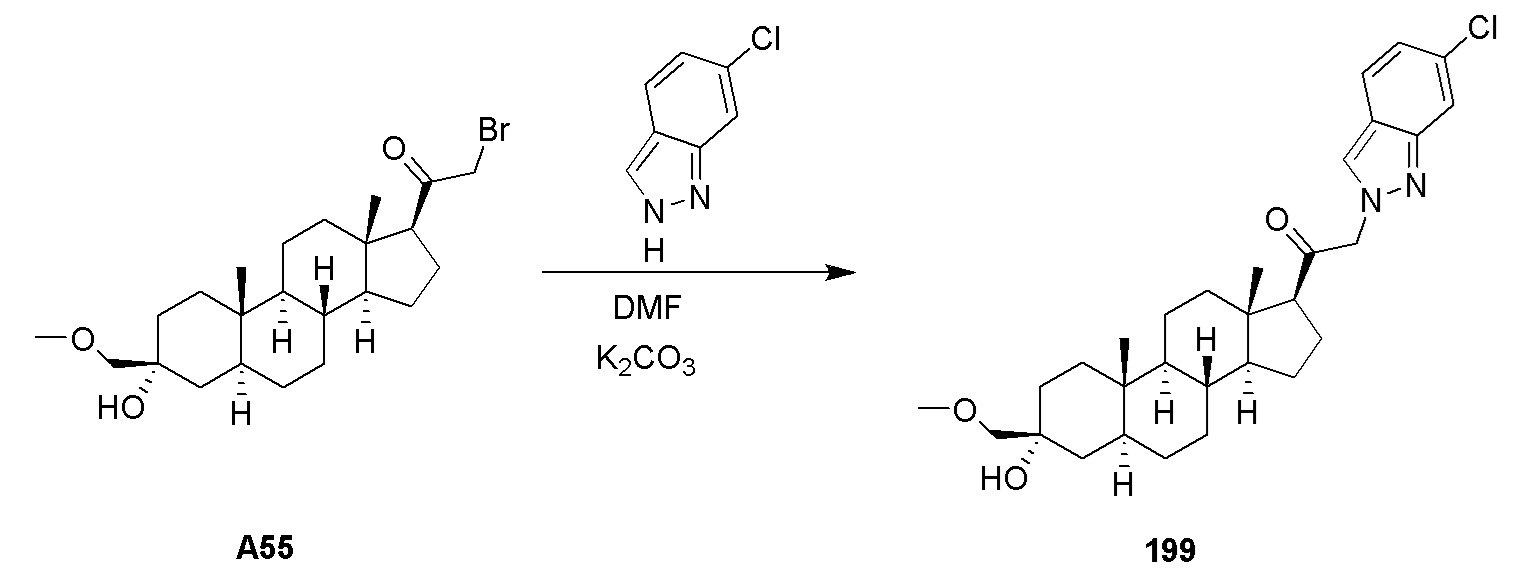
Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 199:1H ЯМР (CDCl3, 400МГц): δ 7,93 (с, 1H), 7,68 (с, 1H), 7,60 (д, J=9,0 Гц, 1H), 7,04 (д, J=7,6 Гц, 1H), 5,10-5,26 (м, 2H), 3,39 (с, 3H), 3,13-3,25 (м, 2H), 2,59-2,71 (м, 1H), 2,17-2,26 (м, 1H), 2,11 (д, J=12,0 Гц, 1H), 2,02 (шир.с, 1H), 1,65-1,76 (м, 4H), 1,06-1,55 (м, 14H), 0,93-1,03 (м, 1H), 0,82-0,89 (м, 1H), 0,77 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=3,190 мин в 4,0 мин хроматографии; МС (ESI) рассчитано для C30H44O3 [M+H]+ 513,11, найдено 513,1 ([M+H]+.
Пример 119. Синтез соединения 200.

Указанные в заголовке соединения получали в соответствии со способом Примера 67.
Синтез соединения A72:1H ЯМР (CDCl3, 400МГц): δ 7,00 (с, 1H), 6,33-6,41 (м, 1H), 4,52-4,64 (м, 2H), 3,34-3,41 (м, 3H), 3,06-3,25 (м, 3H), 2,56 (т, J=8,8 Гц, 1H), 2,13-2,25 (м, 1H), 2,01 (с, 1H), 1,90-1,96 (м, 1H), 1,64-1,75 (м, 4H), 1,15-1,50 (м, 13H), 0,93-1,01 (м, 1H), 0,81-0,89 (м, 1H), 0,73-0,79 (м, 3H), 0,65 (с, 3H). ЖХМС S Rt=1,942 мин в 4,0 мин хроматографии, МС (ESI) рассчитано для C26H39FN2O3 [M+H]+ 447, найдено 447.
Очистку Соединения 200 осуществляли при помощи СЭЖХ. Соединение 200:1H ЯМР (CDCl3, 400МГц): δ 7,00 (с, 1H), 6,37 (д, J=8,0 Гц, 1H), 4,52-4,66 (м, 2H), 3,39 (с, 3H), 3,18 (с, 2H), 2,56 (т, J=8,8 Гц, 1H), 2,11-2,25 (м, 2H), 2,01 (с, 1H), 1,93 (д, J=12,0 Гц, 1H), 1,63-1,77 (м, 4H), 1,10-1,54 (м, 13H), 0,97 (дд, J=12,0, 4,5 Гц, 1H), 0,81-0,88 (м, 1H), 0,76 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=1,949 мин в 4,0 мин хроматографии, МС (ESI) рассчитано для C26H39FN2O3 [M+H]+ 447, найдено 447.
Пример 120. Синтез соединения 202.

Указанное в заголовке соединение получали в соответствии со способом Примера 67.
Соединение 202:1H ЯМР (CDCl3, 400МГц): δ 0,66 (с, 3 H), 0,75 (с, 3 H), 0,78-1,03 (м, 3 H), 1,55 (с, 27 H), 2,00 (с, 1 H), 2,04 (шир.с, 1 H), 2,03-2,03 (м, 1 H), 2,13-2,23 (м, 1 H), 2,57 (т, J=8,78 Гц, 1 H), 3,18 (с, 2 H), 3,39 (с, 3 H), 4,82 (с, 1 H), 4,87-4,94 (м, 1 H), 7,38-7,43 (м, 1 H), 7,45 (с, 1 H). ЖХМС Rt=1,283 мин в 2,0 мин хроматографии, МС (ESI) рассчитано для C24H36N2O2 [M+H]+ 463, найдено 463.
Пример 121. Синтез соединения 203.

Указанное в заголовке соединение получали в соответствии со способом Примера 47, стадия 7.
Соединение 203:1H ЯМР (CDCl3, 400МГц): δ 7,00 (с, 1 H), 6,37 (дд, J=8,16, 1,63 Гц, 1 H), 4,48-4,68 (м, 2 H), 2,56 (т, J=8,78 Гц, 1 H), 2,13-2,30 (м, 1 H), 1,89-1,98 (м, 1 H), 1,63-1,81 (м, 4 H), 1,10-1,61 (м, 18 H), 0,89-1,03 (м, 1 H), 0,71-0,86 (м, 4 H), 0,65 (с, 3 H). ЖХМС: MS Рассчитано для: C25H37FN2O2 [M+H]+) 417; Найдено: 417.
Пример 122. Синтез соединения 204.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 204:1H ЯМР (CDCl3, 400МГц): δ 7,92 (д, J=8,8 Гц, 2H), 5,01-4,82 (м, 2H), 4,29 (кв., J=7,3 Гц, 2H), 2,63-2,55 (м, 1H), 2,26-2,14 (м, 1H), 2,06 (д, J=11,0 Гц, 1H), 1,96 (т, J=13,2 Гц, 1H), 1,90-1,80 (м, 1H), 1,79-1,68 (м, 3H), 1,53-1,38 (м, 8H), 1,37-1,31 (м, 4H), 1,30-1,20 (м, 8H), 1,18-1,00 (м, 2H), 0,95 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,088 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H42N2O4 [M+H]+ 471, найдено 471.
Пример 123. Синтез соединений 205 и 206.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 205:1H ЯМР (CDCl3, 400МГц): δ 5,17-5,04 (м, 2H), 2,68-2,64 (м, 1H), 2,47 (с, 3H), 2,06-2,04 (м, 2H), 1,76-1,24 (м, 23H), 0,84-0,83 (м, 2H), 0,76 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=1,241 мин в 2,0 мин хроматографии, МС (ESI) рассчитано для C24H38N4O2 [M+H]+ 415, найдено 415.
Соединение 206:1H ЯМР (CDCl3, 400МГц): δ 5,40-5,31 (м, 2H), 2,65-2,56 (м, 1H), 2,24 (с, 3H), 2,08-2,06 (м, 2H), 1,76-1,24 (м, 23H), 0,84-0,83 (м, 2H), 0,76 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,290 мин в 2,0 мин хроматографии, МС (ESI) рассчитано для C24H38N4O2 [M+H]+ 415, найдено 415.
Пример 124. Синтез соединений 207 и 208.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
Соединение 207:1H ЯМР (CDCl3, 400МГц): δ 7,69 (с, 2H), 5,30-5,17 (м, 2H), 2,61-2,52 (м, 1H), 2,26-1,01 (м, 31H), 0,95 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=0,904 мин в 1,5 мин хроматографии, ESI рассчитано для C24H37N3O2 [M+H-H2O]+382, найдено 382.
Соединение 208:1H ЯМР (CDCl3, 400МГц): δ 7,78 (с, 1H), 7,66 (с, 1H), 5,32-5,24 (м, 1H), 5,18-5,10 (м, 1H), 2,70-2,60 (м, 1H), 2,28-1,03 (м, 32H), 0,96 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=0,864 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C24H37N3O2[M+H]+400, найдено 400.
Пример 125. Синтез соединений 209 и 210.

Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
Соединение 209:1H ЯМР (CDCl3, 400МГц): δ 8,10 (с, 1H), 5,33-5,23 (м, 2H), 4,42 (кв., J=7,0 Гц, 2H), 3,47 (шир.с, 1H), 2,62-2,52 (м, 1H), 2,25-1,00 (м, 31H), 0,95 (с, 3H), 0,68 (с, 3H). ЖХМС Rt=1,342 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C27H41N3O4 [M+Na]+494, найдено 494.
Соединение 210:1H ЯМР (CDCl3, 400МГц): δ 8,17 (с, 1H), 5,32-5,12 (м, 2H), 4,44 (кв., J=7,0 Гц, 2H), 2,69-2,60 (м, 1H), 2,29-1,02 (м, 33H), 0,96 (с, 3H), 0,66 (с, 3H)
ЖХМС Rt=1,278 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H41N3O4 [M+H-H2O]+454, найдено 454.
Пример 126. Синтез соединения 211.
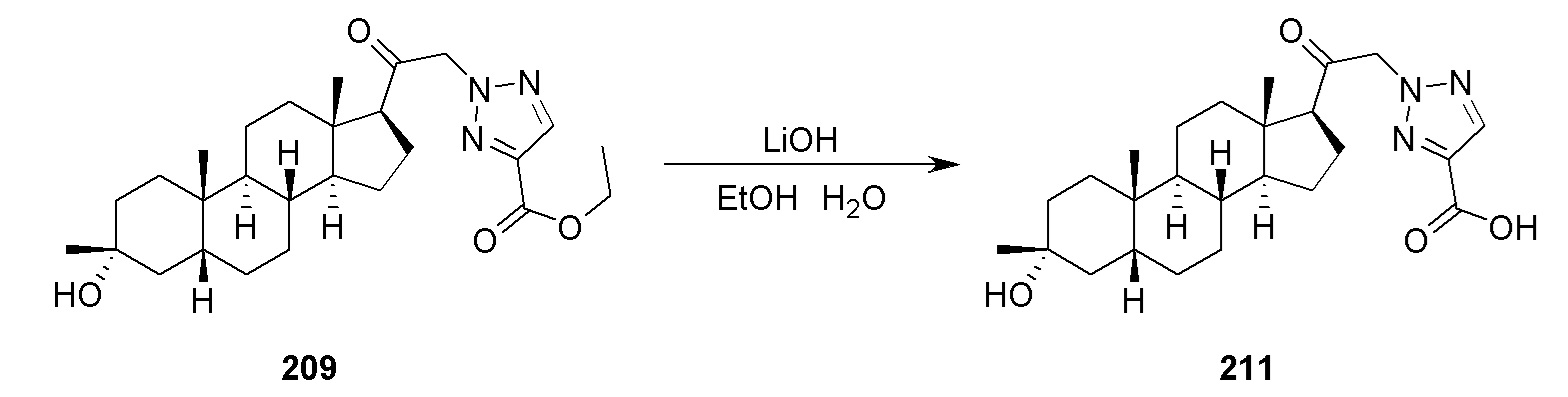
Соединение 209 получали в соответствии со способом Примера 127. К раствору соединения 209 (3,9 г, 8,26 ммоль) в EtOH (50 мл) и H2O (12 мл) добавляли LiOH (989 мг, 41,3 ммоль) при 25°C. Реакционную смесь перемешивали при 25°C в течение 1 часа, после чего анализ ЖХМС показал, что реакция завершилась. Реакционную смесь концентрировали с получением остатка, который затем экстрагировали EtOAc (100 мл ×2) и водой (100 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного продукта, который промывали при помощи MeOH (100 мл), с получением соединения 211 (2,9 г, 79,2%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,18 (с, 1H), 5,31 (с, 2H), 2,65-2,54 (м, 1H), 2,25-1,00 (м, 25H), 0,96 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=0,874 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C25H37N3O4 [M+ Na]+ 446, найдено 446.
Пример 127. Синтез соединения 212.

Указанное в заголовке соединение получали в соответствии со способом Примера 126.
Соединение 212:1H ЯМР (DMSO-d6, 400МГц): δ 8,58 (с, 1H), 5,60-5,53 (м, 1H), 5,41-5,34 (м, 1H), 4,27 (шир.с, 1H), 2,84-2,74 (м, 1H), 2,20-1,00 (м, 26H), 0,92 (с, 3H), 0,59 (с, 3H). ЖХМС Rt=0,837 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C25H37N3O4 [M+H-H2O]+ 425, найдено 425.
Пример 128. Синтез соединения 213.

Соединение 212 получали в соответствии со способом Примера 127. К раствору 212 (500 мг, 1,12 ммоль) в DCM (5 мл) добавляли HATU (638 мг, 1,68 ммоль) и Et3N (226 мг, 2,24 ммоль) при 25°C. После перемешивания при 25°C в течение 1 часа, аммиак гидрат (0,5 мл, 2,24 ммоль) добавляли к раствору при 25°C и реакционную смесь перемешивали при 25°C в течение 2 часов, после этого анализ ЖХМС анализ показал, что реакция завершилась. Реакционную смесь фильтровали и концентрировали и остаток очищали при помощи ВЭЖХ с получением соединения 213 (100 мг) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,13 (с, 1h), 7,04 (шир.с, 1H), 5,51 (шир.с, 1H), 5,28-5,12 (м, 2H), 2,67-2,62 (м, 1H), 1,76-0,75 (м, 29H), 0,66 (с, 3H). ЖХМС Rt=0,827 мин в 1,5 мин хроматографии МС (ESI) рассчитано для C25H38N4O3 [M+Na]+465, найдено 465.
Пример 129. Синтез соединения 214.

Указанное в заголовке соединение получали в соответствии со способом Примера 128.
Соединение 214:1H ЯМР (CDCl3, 400МГц): δ 8,13 (с, 1h), 6,58 (шир.с, 1H), 5,51 (шир.с, 1H), 5,31-5,17 (м, 2H), 2,64-2,56 (м, 1H), 2,30-1,03 (м, 26H), 0,96 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,189 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H38N4O3 [M+Na]+465, найдено 465.
Пример 130. Синтез соединения 215.

Соединение 213 получали в соответствии со способом Примера 128. К раствору соединения 213 (50 мг, 0,112 ммоль) в DCM (5 мл) добавляли пиридин (70,8 мг, 0,896 ммоль) и трифторуксусный ангидрид (141 мг, 0,672 ммоль) при 25°C в атмосфере N2. Реакционную смесь перемешивали при 25°C в течение 16 часов, после чего анализ ЖХМС показал, что исходное вещество израсходовано полностью. Смесь концентрировали и остаток очищали с получением соединения 215 (8 мг) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,12 (с, 1H), 5,35-5,13 (м, 2H), 2,71-2,67 (м, 1H), 2,32-1,06 (м, 26H), 0,97 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=1,073 мин в 1,5 мин хроматографии; МС (ESI) рассчитано для C25H36N4O2 [M+H-H2O]+ 407, найдено 407.
Пример 131. Синтез соединения 216.

Указанное в заголовке соединение получали в соответствии со способом Примера 130.
Соединение 216:1H ЯМР (CDCl3, 400МГц): δ 8,02 (с, 1H), 5,34-5,24 (м, 2H), 2,66-2,60 (м, 1H), 2,32-1,07 (м, 25H), 0,98 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,532 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H36N4O2 [M+H-H2O]+407, найдено 407.
Пример 132. Синтез соединений 217 и 218.
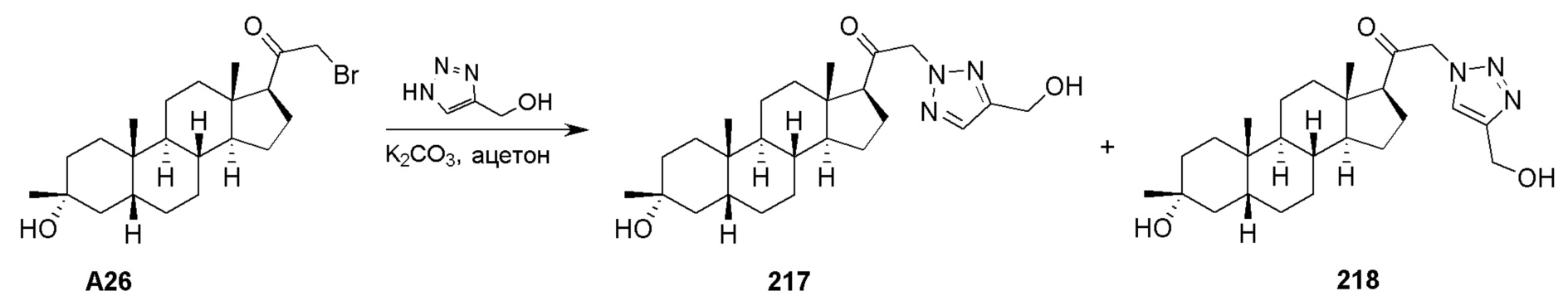
Указанные в заголовке соединения получали в соответствии со способом Примера 5, стадия 4.
Соединение 217:1H ЯМР (CDCl3, 400МГц): δ 7,66 (с, 1H), 5,23-5,14 (м, 2H), 4,80 (с, 2H), 2,62-2,53 (м, 1H), 2,26-1,01 (м, 27H), 0,96 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,165 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O3 [M+Na]+ 452, найдено 452.
Соединение 218:1H ЯМР (CDCl3, 400МГц): δ 7,62 (с, 1H), 5,30-5,05 (м, 2H), 4,84 (с, 2H), 2,64-2,62 (м, 1H), 2,33-1,00 (м, 27H), 0,95 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=1,138 мин в 2 мин хроматографии, МС (ESI) рассчитано для C25H39N3O3 [M+H]+ 430, найдено 430.
Пример 133. Синтез соединений 219 и 220.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 219:1H ЯМР (CDCl3, 400МГц): δ 8,93 (с, 1H), 7,97 (с, 1H), 7,07 (с, 1H), 5,38-5,12 (м, 2H), 2,67 (т, J=8,8 Гц, 1H), 2,30-2,07 (м, 2H), 1,83-1,64 (м, 4H), 1,62-1,10 (м, 35H), 1,05-0,90 (м, 1H), 0,89-0,79 (м, 1H), 0,77 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=2,135 мин в 4 мин хроматографии, 30-90AB, МС (ESI) рассчитано для C28H38FN3O2 [M +H]+ 468, найдено 468.19F ЯМР (CDCl3, 400МГц): δ -85,326.
Соединение 220:1H ЯМР (CDCl3, 400МГц): δ 8,35 (с, 1H), 8,07 (с, 1H), 7,19 (с, 1H), 5,29-5,15 (м, 2H), 2,68 (т, J=8,8 Гц, 1H), 2,26-2,08 (м, 2H), 1,81-1,64 (м, 4H), 1,63-1,12 (м, 21H), 0,97 (дкв., J=5,5, 12,0 Гц, 1H), 0,89-0,79 (м, 1H), 0,77 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=2,631 мин в 4 мин хроматографии, МС (ESI) рассчитано для C28H38FN3O2 [M +H]+ 468, найдено 468.19F ЯМР (CDCl3, 400МГц): δ -84,137.
Пример 134. Синтез соединений 221 и 222.
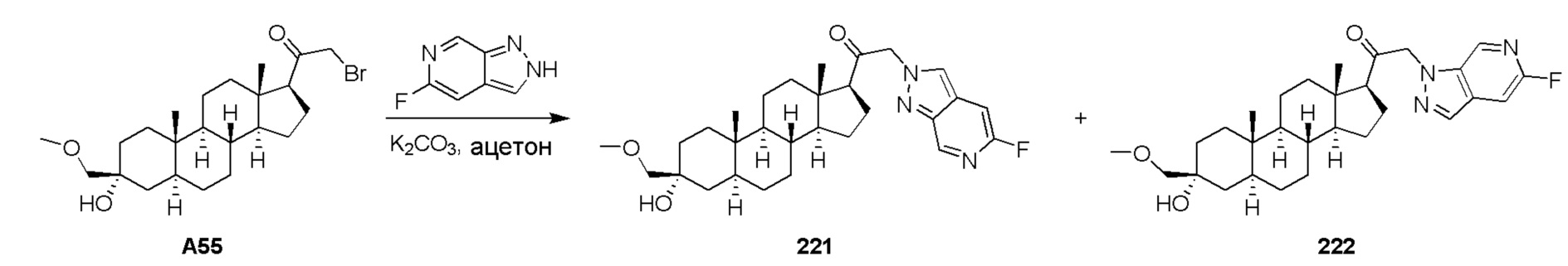
Указанные в заголовке соединения получали в соответствии со способом Примера 67.
Соединение 221:1H ЯМР (CDCl3, 400МГц): δ 8,95 (с, 1H), 7,99 (с, 1H), 7,11-7,07 (м, 1H), 5,38-5,19 (м, 2H), 3,41 (с, 3H), 3,21 (с, 2H), 2,70 (т, J=8,8 Гц, 1H), 2,30-2,11 (м, 2H), 2,08-2,01 (м, 1H), 1,85-1,68 (м, 4H), 1,56-1,14 (м, 14H), 1,08-0,84 (м, 2H), 0,79 (с, 3H), 0,73 (с, 3H). ЖХМС Rt=0,928 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H40FN3O3 [M+H]+ 498, найдено 498.
Соединение 222:1H ЯМР (CDCl3, 400МГц): δ 8,37 (с, 1H), 8,09 (с, 1H), 7,21 (д, J=1,0 Гц, 1H), 5,33-5,17 (м, 2H), 3,41 (с, 3H), 3,21 (с, 2H), 2,70 (т, J=8,9 Гц, 1H), 2,28-1,99 (м, 3H), 1,83-1,65 (м, 4H), 1,59-1,15 (м, 14H), 1,08-0,83 (м, 2H), 0,79 (с, 3H), 0,73 (с, 3H). ЖХМС Rt=0,950 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H40FN3O3 [M+H]+ 498, найдено 498.
Пример 135. Синтез соединения 223.

К раствору соединения A72 (20 мг, 0,048 ммоль) в DCM (2 мл) добавляли 4-(диметиламино)пиридин (6,47 мг, 0,053 ммоль) и уксусный ангидрид (7,38 мг, 0,072 ммоль) при 25°C. Реакционную смесь перемешивали при 25°C в течение 16 часов, после чего анализ ЖХМС показал, что реакция завершилась. Реакцию гасили водой (5 мл) и экстрагировали при помощи DCM (10 мл ×3) и объединенные органические слои сушили над Na2SO4, фильтровали, концентрировали и очищали при помощи ВЭЖХ с получением соединения 223 (3 мг) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 8,07 -s, 1H), 7,78 (шир.с, 1H), 5,13-5,01 (м, 2H), 2,55-2,52 (м, 1H), 2,18 (с, 3H), 2,10-1,01 (м, 26H), 0,95 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=1,209 мин в 2 мин хроматографии, МС (ESI) рассчитано для C26H40N4O3 [M+Na]+479, найдено 479.
Пример 134. Синтез соединения 224.

Указанное в заголовке соединение получали в соответствии со способом Примера 128.
Соединение 224:1H ЯМР (CDCl3, 400МГц): δ 8,10 (с, 1H), 7,01 (шир.с, 1H), 5,28-5,15 (м, 2H), 3,65-3,61 (м, 2H), 3,57-3,51 (м, 2H), 3,38 (с, 3H), 2,63-2,55 (м, 1H), 2,27-0,99 (м, 26H), 0,96 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=0,891 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H44N4O4 [M+Na]+523, найдено 523.
Пример 135. Синтез соединения 225.

Указанное в заголовке соединение получали в соответствии со способом Примера 128.
Соединение 225:1H ЯМР (CDCl3, 400МГц): δ 8,12 (с, 1H), 5,30-5,15 (м, 2H), 4,06-3,56 (м, 4H), 2,65-2,50 (м, 1H), 2,25-1,01 (м, 30H), 0,95 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,263 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H44N4O3 [M+Na]+519, найдено 519.
Пример 136. Синтез соединений 226 и 227.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 226:1H ЯМР (CDCl3, 400МГц): δ 7,64 (с, 1H), 5,25-5,11 (м, 2H), 4,76 (с, 2H), 2,58 (т, J=8,9 Гц, 1H), 2,24-2,13 (м, 1H), 2,10-2,00 (м, 1H), 1,79-1,10 (м, 23H), 1,05-0,90 (м, 1H), 0,85-0,78 (м, 1H), 0,75 (с, 3H), 0,68 (с, 3H). ЖХМС Rt=1,211 мин в 2,0 мин хроматографии, МС (ESI) рассчитано для C25H39N3O3 [M+H]+ 430, найдено 430.
Соединение 227:1H ЯМР (CDCl3, 400МГц): δ 7,63 (с, 1H), 5,31-5,04 (м, 2H), 4,84 (с, 2H), 2,70-2,55 (м, 1H), 2,25-2,15 (м, 1H), 2,10-2,00 (м, 1H), 1,88-1,13 (м, 30H), 1,04-0,90 (м, 1H), 0,89-0,78 (м, 1H), 0,76 (с, 3H), 0,66 (с, 3H). ЖХМС Rt=1,167 мин в 2,0 мин хроматографии, МС (ESI) рассчитано для C25H39N3O3 [M+H]+ 430, найдено 430.
Пример 137. Синтез соединения 228.

Указанное в заголовке соединение получали в соответствии со способом Примера 128.
Соединение 225:1H ЯМР (DMSO-d6, 400МГц): δ 8,40-8,35 (м, 1H), 8,15 (с, 1H), 5,66-5,34 (м, 2H), 4,27 (с, 1H), 2,81-2,70 (м, 4H), 2,10-1,99 (м, 2H), 1,93-1,58 (м, 5H), 1,54-1,31 (м, 7H), 1,29-1,08 (м, 10H), 1,08-0,95 (м, 2H), 0,92 (с, 3H), 0,60 (с, 3H). ЖХМС Rt=0,922 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C26H40N4O3 [M+Na]+ 479, найдено 479.
Пример 138. Синтез соединения 229.

Указанное в заголовке соединение получали в соответствии со способом Примера 128.
Соединение 229:1H ЯМР (DMSO-d6, 400МГц): δ 8,50-8,40 (м, 1H), 8,14 (с, 1H), 5,62-5,36 (м, 2H), 3,22-3,22 (м, 1H), 3,28-3,22 (м, 2H), 2,77-2,73 (м, 1H), 2,05-2,02 (м, 2H), 1,91-1,78 (м, 2H), 1,71-1,69 (м, 1H), 1,69-1,61 (м, 2H), 1,51-1,32 (м, 7H), 1,26-0,98 (м, 15H), 0,91 (с, 3H), 0,59 (с, 3H). ЖХМС Rt=1,123 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C27H42N4O3 [M+Na]+ 493, найдено 493.
Пример 139. Синтез соединения 230.

Указанное в заголовке соединение получали в соответствии со способом Примера 128.
Соединение 230:1H ЯМР (DMSO-d6, 400МГц): δ 8,43 (т, J=5,8 Гц, 1H), 8,15 (с, 1H), 5,64-5,35 (м, 2H), 3,23-3,14 (м, 2H), 2,80-2,71 (м, 1H), 2,10-2,00 (м, 2H), 1,91-1,61 (м, 5H), 1,57-1,31 (м, 10H), 1,26-0,95 (м, 11H), 0,91 (с, 3H), 0,86 (т, J=7,4 Гц, 3H), 0,59 (с, 3H). ЖХМС Rt=1,186 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H44N4O3 [M+Na]+ 507, найдено 507.
Пример 140. Синтез соединения 231.

Указанное в заголовке соединение получали в соответствии со способом Примера 128.
Соединение 231:1H ЯМР (DMSO-d6, 400МГц): δ 8,51 (д, J=4,4 Гц, 1H), 8,15 (с, 1H), 5,59 (д, J=18,1 Гц, 1H), 5,38 (д, J=17,8 Гц, 1H), 4,28 (с, 1H), 2,82-2,80 (м, 1H), 2,75- 2,72 (м, 1H), 2,10-0,95 (м, 26H), 0,91 (с, 3H), 0,75-0,47 (м, 6H). ЖХМС Rt=1,337 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H42N4O3 [M+Na]+ 505, найдено 505.
Пример 141. Синтез соединения 232.

Указанное в заголовке соединение получали в соответствии со способом Примера 128.
Соединение 232:1H ЯМР (DMSO-d6, 400МГц): δ 10,38 (с, 1H), 8,35 (с, 1H), 7,78 (д, J=7,8 Гц, 2H), 7,36 (т, J=8,0 Гц, 2H), 7,15-7,09 (м, 1H), 5,68 (д, J=17,8 Гц, 1H), 5,47 (д, J=18,1 Гц, 1H), 4,28 (с, 1H), 2,82-2,75 (м, 1H), 2,12-1,11 (м, 25H), 0,92 (с, 3H), 0,62 (с, 3H). ЖХМС Rt=1,474 мин в 2 мин хроматографии, МС (ESI) рассчитано для C31H42N4O3 [M+Na]+541, найдено 541.
Пример 142. Синтез соединений 233 и 234.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 233:1H ЯМР (CDCl3, 400МГц): δ 6,90-6,85 (м, 1H), 6,81 (т, J=6,8 Гц, 1H), 5,43-5,31 (м, 2H), 2,71 (т, J=8,8 Гц, 1H), 2,25-2,12 (м, 2H), 1,77-1,53 (м, 4H), 1,38-1,21 (м, 18H), 1,17-0,85 (м, 2H), 0,77 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=0,974 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H37F2N3O2 [M+H]+ 486, найдено 486.
Соединение 234:1H ЯМР (CDCl3, 400МГц): δ 7,30 (д, J=8 Гц, 1H), 6,93-6,89 (м, 1H), 5,56-5,46 (м, 2H), 2,66 (т, J=8,4 Гц, 1H), 2,59-2,12 (м, 2H), 1,74-1,53 (м, 4H), 1,47-1,24 (м, 18H), 1,21-0,84 (м, 2H), 0,77 (с, 3H), 0,74 (с, 3H). ЖХМС Rt=1,011 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H37F2N3O2 [M+H]+ 486, найдено 468
Пример 143. Синтез соединений 235 и 236.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 236:1H ЯМР (CDCl3, 400МГц): δ 8,58 (д, J=1,2 Гц, 1H), 8,43 (д, J=1,6 Гц, 1H), 8,33 (с, 1H) 5,37-5,24 (м, 2H), 2,70 (т, J=8 Гц, 1H), 2,24-2,11 (м, 2H), 1,72-1,55 (м, 7H), 1,50-1,20 (м, 16H), 0,99-0,83 (м, 3H), 0,77 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=1,336 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H38N4O2 [M+H]+ 451, найдено 451.
Пример 144. Синтез соединений 237 и 238.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 237:1H ЯМР (CDCl3, 400МГц): δ 7,93 (с, 1H), 7,65-7,61 (м, 1H), 7,28 (с, 1H), 6,91-6,87 (м, 1H), 5,22-5,10 (м, 2H), 2,64 (т, J=8,4 Гц, 1H), 2,12-2,02 (м, 2H), 1,73-1,54 (м, 7H), 1,37-1,20 (м, 16H), 0,81-0,78 (м, 3H), 0,76 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,389 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H39FN2O2 [M+H]+ 467, найдено 467.
Соединение 238:1H ЯМР (CDCl3, 400МГц): δ 8,00 (с, 1H), 7,69-7,66 (м, 1H), 6,95-6,91 (м, 1H), 6,84 (д, J=8,8 Гц, 1H), 5,13-5,03 (м, 2H), 2,64 (т, J=9,2 Гц, 1H), 2,12-2,09 (м, 2H), 1,71-1,52 (м, 8H), 1,37-1,22 (м, 16H), 1,20-0,82 (м, 3H), 0,76 (с, 3H), 0,70 (с, 3H).
ЖХМС Rt=1,436 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H39FN2O2 [M+H]+ 467, найдено 467.
Пример 145. Синтез соединений 239 и 240.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 239:1H ЯМР (CDCl3, 400МГц): δ 7,99 (с, 1H), 7,36 (д, J=8,4 Гц, 1H), 7,15 (д, J=6 Гц, 2H), 5,18-5,08 (м, 2H), 2,64 (д, J=8,8 Гц, 1H), 2,19-2,09 (м, 2H), 1,72-1,52 (м, 8H), 1,37-1,21 (м, 16H), 1,18-0,82 (м, 3H), 0,76 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=0,963 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H39FN2O2 [M+H]+ 467, найдено 467.
Соединение 240:1H ЯМР (CDCl3, 400МГц): δ 7,89 (с, 1H), 7,66 (т, J=8,4 Гц, 1H), 7,24 (т, J=2 Гц, 1H), 7,08 (д, J=2,4 Гц, 1H), 5,24-5,12 (м, 2H), 2,64 (т, J=8,4 Гц, 1H), 2,12-2,17 (м, 2H), 1,73-1,51 (м, 4H), 1,47-1,23 (м, 18H), 1,20-0,82 (м, 3H), 0,76 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=0,986 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H39FN2O2 [M+H]+ 467, найдено 467.
Пример 147. Синтез соединения 242.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 242:1H ЯМР (CDCl3, 400МГц): δ 8,63 (с, 1H), 8,55 (с, 1H), 8,26 (с, 1H) 5,37-5,20 (м, 2H), 2,69 (т, J=8,4 Гц, 1H), 2,26-2,17 (м, 2H), 1,75-1,52 (м, 7H), 1,37-1,20 (м, 16H), 0,86-0,83 (м, 3H), 0,77 (с, 3H), 0,74 (с, 3H). ЖХМС Rt=1,257 мин в 2 мин хроматографии, МС (ESI) рассчитано для C27H38N4O2 [M+H]+ 451, найдено 451.
Пример 148. Синтез соединений 244, 245 и 246.
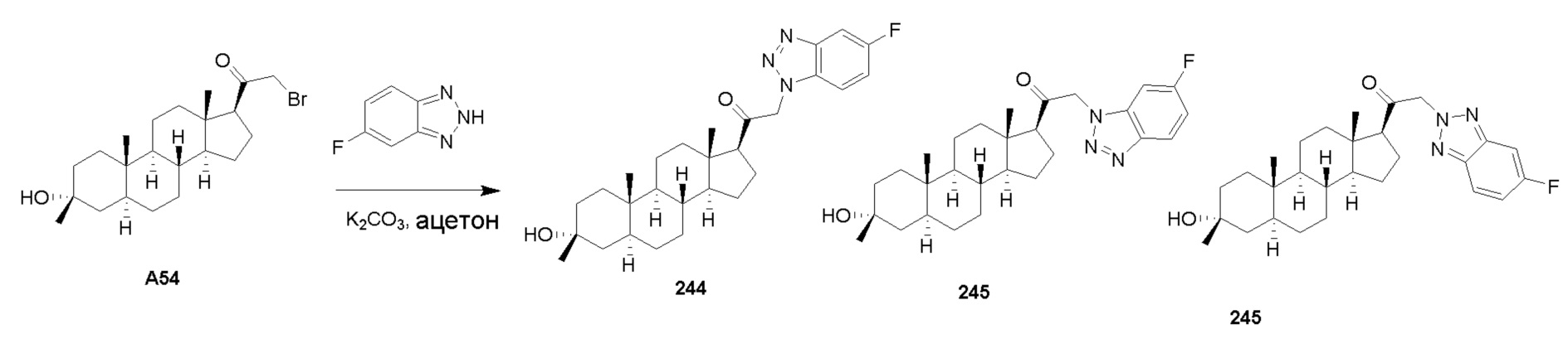
Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 244:1H ЯМР (CDCl3, 400МГц): δ 7,69 (д, J=7,6 Гц, 1H), 7,31 -7,27 (м, 2H), 5,46-5,35 (м, 2H), 2,71 (т, J=8,8 Гц, 1H), 2,14-2,15 (м, 2H), 1,75-1,52 (м, 8H), 1,41-1,24(м, 15H), 1,21-0,84(м, 2H), 0,77 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=1,373 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H38FN3O2 [M+H]+ 468, найдено 468.
Соединение 245:1H ЯМР (CDCl3, 400МГц): δ 8,05-8,01 (м, 1H), 7,17 -7,12 (м, 1H), 6,97 (т, J=8,8 Гц, 1H), 5,43-5,31 (м, 2H), 2,71 (т, J=8,8 Гц, 1H), 2,12-2,11 (м, 2H), 1,76-1,52 (м, 6H), 1,41-1,25 (м, 16H), 1,21-0,84(м, 2H), 0,77 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=1,392 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H38FN3O2 [M+H]+ 468, найдено 468.
Соединение 246:1H ЯМР (CDCl3, 400МГц): δ 7,87-7,84 (м, 1H), 7,47 -7,44 (м, 1H), 7,20 (т, J=2 Гц, 1H), 5,54-5,44 (м, 2H), 2,65 (т, J=8,8 Гц, 1H), 2,18-2,12 (м, 2H), 1,73-1,52 (м, 6H), 1,46-1,24 (м, 16H), 1,20-0,82 (м, 2H), 0,77 (с, 3H), 0,73 (с, 3H). ЖХМС Rt=0,999 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C28H38FN3O2 [M+H]+ 468, найдено 468.
Пример 149. Синтез соединений 247, 248 и 249.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 247:1H ЯМР (CDCl3, 400МГц): δ 7,88 (с, 1H), 7,40 (д, J=9,2 Гц, 1H), 7,23 (д, J=8,8 Гц, 1H), 5,43-5,30 (м, 2H), 2,69 (т, J=9,2 Гц, 1H), 2,21 (с, 3H), 2,19-2,15 (м, 2H), 1,74-1,51 (м, 5H), 1,41-1,21 (м, 17H), 0,85-0,83 (м, 4H), 0,77 (с, 3H), 0,71 (с, 3H). ЖХМС Rt=1,002 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2S [M+H]+ 496, найдено 496.
Соединение 248:1H ЯМР (CDCl3, 400МГц): δ 7,93 (т, J=8,4 Гц, 1H), 7,26 (д, J=3,6 Гц, 1H), 7,05 (м, 1H), 5,40-5,30 (м, 2H), 2,70 (т, J=8,4 Гц, 1H), 2,53 (с, 3H), 2,17-2,13 (м, 2H), 1,78-1,52 (м, 6H), 1,41-1,21 (м, 16H), 0,85-0,83 (м, 3H), 0,77 (с, 3H), 0,72 (с, 3H). ЖХМС Rt=0,970 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2S [M+H]+ 496, найдено 496.
Соединение 249:1H ЯМР (CDCl3, 400МГц): δ 7,74 (д, J=8,8 Гц, 1H), 7,55 (с, 1H), 7,28 (с, 1H), 5,51-5,41 (м, 2H), 2,63 (т, J=8,4 Гц, 1H), 2,55 (с, 3H), 2,52-2,11 (м, 2H), 1,74-1,51 (м, 5H), 1,40-1,23 (м, 17H), 1,20-0,81 (м, 3H), 0,76 (с, 3H), 0,73 (с, 3H). ЖХМС Rt=0,959 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H41N3O2S [M+H]+ 496, найдено 496.
Пример 150. Синтез соединений 250 и 251.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 250:1H ЯМР (CDCl3, 400МГц): δ 7,92 (с, 1H),7,68 (с, 1H), 7,60 (д, J=8,84 Гц, 1H), 7,04-7,02 (м, 1H), 5,24-5,11 (м, 2H), 2,64 (т, J=8,8 Гц, 1H), 2,20-2,12 (м, 2H), 1,76-1,51 (м, 4H), 1,28-1,21 (м, 20H), 1,18-0,82 (м, 3H), 0,76 (с, 3H), 0,74 (с, 3H). ЖХМС Rt=0,993 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H39ClN2O2 [M+H]+ 483, найдено 483.
Соединение 251:1H ЯМР (CDCl3, 400МГц): δ 8,00 (с, 1H),7,65 (д, J=8,4 Гц, 1H), 7,20 (с, 1H), 7,13 (д, J=8,4 Гц, 1H), 5,15-5,04 (м, 2H), 2,64 (т, J=8,8 Гц, 1H), 2,20-2,11 (м, 2H), 1,72-1,53 (м, 4H), 1,38-1,21 (м, 22H), 1,18-0,83 (м, 3H), 0,77 (с, 3H), 0,71 (с, 3H)
ЖХМС Rt=1,019 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H39ClN2O2 [M+H]+ 483, найдено 483.
Пример 151. Синтез соединений 252 и 253.

Указанные в заголовке соединения получали в соответствии со способом Примера 47, стадия 7.
Соединение 252:1H ЯМР (CDCl3, 400МГц): δ 7,88 (с, 1H), 7,62 (д, J=9,6 Гц, 2H), 7,22-7,19 (м, 1H), 5,30-5,12 (м, 2H), 2,64 (д, J=8 Гц, 1H), 2,20-2,09 (м, 2H), 1,73-1,51 (м, 4H), 1,37-1,21 (м, 19H), 1,18-0,98 (м, 3H), 0,76 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,016 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H39ClN2O2 [M+H]+ 483, найдено 483.
Соединение 253:1H ЯМР (CDCl3, 400МГц): δ 7,98 (с, 1H), 7,71 (с, 1H), 7,33-7,31 (м, 1H), 7,13 (д, J=9,2 Гц, 1H), 5,17-5,07 (м, 2H), 2,64 (д, J=8,8 Гц, 1H), 2,19-2,09 (м, 2H), 1,72-1,55 (м, 4H), 1,37-1,21 (м, 21H), 1,18-0,82 (м, 3H), 0,76 (с, 3H), 0,70 (с, 3H). ЖХМС Rt=1,013 мин в 1,5 мин хроматографии, МС (ESI) рассчитано для C29H39ClN2O2 [M+H]+ 483, найдено 483.
Пример 152. Синтез соединения 254.

Синтез соединения A24. Смесь соединения A23 (40 г, 127 ммоль) и Pd/C (4 г) в этилацетате (200 мл) и ТГФ (200 мл) перемешивали при 25°C в атмосфере H2(15 ф/дюйм2(1,055кг/см2)) в течение 4 часов, после этого анализ ТСХ (PE:EA=5:1) показал, что исходное вещество израсходовано полностью. Реакционную смесь фильтровали и фильтровальную лепешку промывали этилацетатом (40 мл × 5). Объединенную органическую фазу концентрировали в вакууме с получением соединения A24 (41 г, неочищенное) в виде белого твердого вещества.1H ЯМР (CDCl3, 400МГц): δ 2,69 (т, J=14,1 Гц, 1H), 2,61-2,48 (м, 1H), 2,43-2,25 (м, 1H), 2,24-1,96 (м, 8H), 1,95-1,78 (м, 2H), 1,75-1,07 (м, 15H), 1,03 (с, 3H), 0,64 (с, 3H).
Синтез соединения A25. К раствору 2,6-ди-трет-бутил-4-метилфенола (170 г, 774 ммоль) в толуоле (150 мл) добавляли триметилалюминий (193 мл, 387 ммоль, 2,0 M в толуоле) по каплям при 25°C в атмосфере N2. Полученную смесь перемешивали при 25°C в течение 1 часа, затем добавляли соединение A24 (41 г, 129 ммоль) в толуоле (50 мл) при -78°C и перемешивали в течение одного часа. Затем добавляли метилмагнийбромид (129 мл, 387 ммоль, 3,0 M в диэтиловом эфире) и реакционную смесь перемешивали при -78°C в течение 4 часов, после этого анализ ТСХ (PE:EA=2:1) показал, что исходное вещество израсходовано полностью. Смесь гасили насыщенным водным раствором NH4Cl (20 мл), экстрагировали этилацетатом (150 мл ×2) и объединенную органическую фазу промывали насыщенным солевым раствором (150 мл), сушили над безводным Na2SO4, концентрировали и очищали хроматографией на силикагеле (PE/EtOAc=7/1) с получением желаемого продукта A25 (36 г, неочищенный) в виде светло-желтого твердого вещества.1H ЯМР (CDCl3, 400МГц): δ 2,58-2,46 (м, 1H), 2,22-2,09 (м, 4H), 2,06-1,79 (м, 3H), 1,78-0,99 (м, 25H), 0,94 (с, 3H), 0,59 (с, 3H).
Синтез соединения A73. Жидкий бром (5,76 г, 36,0 ммоль) медленно добавляли к интенсивно перемешиваемому водному раствору гидроксида натрия (48,0 мл, 3 M, 144 ммоль) при 0°C. Когда бром полностью растворялся, смесь разбавляли холодным диоксаном (10 мл) и медленно добавляли к перемешиваемому раствору соединения A25 (4 г, 12,0 ммоль) в диоксанe (15 мл) и воде (10 мл). Гомогенный желтый раствор медленно становился бесцветным, и образовывался белый осадок, и реакционную смесь перемешивали при 25°C в течение 16 часов. Оставшийся окисляющий реагент гасили водным раствором Na2S2O3 (30 мл) и смесь затем нагревали при 80°C до тех пор, пока твердое вещество не растворилось. Раствор подкисляли хлористоводородной кислотой (3 N) с получением белого осадка. Твердое вещество фильтровали и промывали водой (100 мл ×3) с получением белого твердого вещества, которое сушили в вакууме, с получением соединения A73 (4,01 г, 100%) в виде белого твердого вещества.1H ЯМР (CDCl3, 400МГц): δ 11,90 (шир.с, 1H), 4,24 (с, 1H), 2,28 (т, J=9,0 Гц, 1H), 2,01-1,54 (м, 8H), 1,50-1,28 (м, 6H), 1,26-0,92 (м, 13H), 0,91 (с, 3H), 0,61 (с, 3H).
Синтез соединения A74. К суспензии соединения A73 (4,01 г, 11,9 ммоль) и гидрохлорида N,O-диметилгидроксиламина (4,64 г, 47,6 ммоль) в DMF (40 мл) добавляли HATU (9,04 г, 23,8 ммоль) при 25°C. К полученной смеси добавляли DIPEA (15,3 г, 119 ммоль). Реакционную смесь перемешивали при 25°C в течение 2 часов, после этого анализ ТСХ (PE:EA=2:1) показал, что исходное вещество израсходовано полностью. Реакционную смесь разбавляли при помощи H2O (500 мл), происходило образование осадка, и смесь затем фильтровали, промывали водой (40 мл ×3) и сушили в вакууме с получением соединения A74 (4,31 г, 95,9%) в виде светло-желтого твердого вещества.1H ЯМР (CDCl3, 400МГц): δ 11,90 (шир.с, 1H), 4,24 (с, 1H), 2,28 (т, J=9,0 Гц, 1H), 2,01-1,54 (м, 8H), 1,50-1,28 (м, 6H), 1,26-0,92 (м, 13H), 0,91 (с, 3H), 0,61 (с, 3H)
Синтез соединения 254. К раствору соединения A74 (100 мг, 264 мкмоль) в безводном ТГФ (2 мл) добавляли (2-фторбензил)магнийхлорид (5,26 мл, 0,5 M, 2,63 ммоль) при 25°C и реакционную смесь перемешивали при 25°C в течение 2 часов, после чего анализ ЖХМС показал, что исходное вещество израсходовано полностью. Реакцию гасили насыщенным водным раствором NH4Cl (1 мл) и концентрировали в вакууме с получением остатка, который очищали препаративной ВЭЖХ (0,05% HCl-ACN), с получением соединения 254 (22,5 мг, 20,0%) в виде белого твердого вещества.1H ЯМР (CDCl3, 400МГц): δ 3,80-3,60 (м, 4H), 3,28-3,17 (м, 1H), 2,81-2,48 (м, 4H), 2,18-1,83 (м, 2H), 1,79-1,13 (м, 22H), 1,11-0,77 (м, 7H), 0,75-0,58 (м, 3H). ЖХМС Rt=1,383 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H39FO2 [M+H]+427, найдено 409,3 ([M-H2O+H]+).
Пример 153. Синтез соединения 255.

Указанное в заголовке соединение получали в соответствии со способом Примера 152, стадия 4.
Соединение 255:1H ЯМР (CDCl3, 400МГц): δ 7,11 (д, J=8,3 Гц, 2H), 6,88 (д, J=8,5 Гц, 2H), 3,82 (с, 3H), 3,69-3,56 (м, 2H), 2,66 (т, J=8,8 Гц, 1H), 2,22-1,72 (м, 5H), 1,65 (д, J=7,8 Гц, 3H), 1,59-1,58 (м, 1H), 1,53-1,40 (м, 8H), 1,35-1,04 (м, 11H), 0,97 (с, 3H), 0,65 (с, 3H).
ЖХМС Rt=1,224 мин в 2 мин хроматографии, МС (ESI) рассчитано для C29H42O3 [M-18+H]+ 421, найдено 421.
Пример 154. Синтез соединения 256.

Указанное в заголовке соединение получали в соответствии со способом Примера 152, стадия 4.
Соединение 256:1H ЯМР (CDCl3, 400МГц): δ 7,38-7,31 (м, 2H), 7,28-7,24 (м, 1H), 7,22-7,16 (м, 2H), 3,76-3,63 (м, 2H), 2,67 (т, J=8,9 Гц, 1H), 2,25-2,02 (м, 2H), 1,97 (т, J=13,2 Гц, 1H), 1,92-1,72 (м, 2H), 1,71-1,58 (м, 3H), 1,55-1,39 (м, 9H), 1,36-1,26 (м, 5H), 1,25-1,18 (м, 3H), 1,16-1,02 (м, 2H), 0,97 (с, 3H), 0,67 (с, 3H). ЖХМС Rt=1,240 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28H40O2 [M-18+H]+ 391, найдено 391.
Пример 156. Синтез соединения 258.

Указанное в заголовке соединение получали в соответствии со способом Примера 155, стадия 8.
Соединение 258:1H ЯМР (CDCl3, 400МГц): δ 7,25-7,00 (м, 4H), 3,78-3,64 (м, 2H), 2,71-2,60 (м, 1H), 2,24-2,05 (м, 2H), 1,74-1,11 (м, 22H), 1,01-0,89 (м, 1H), 0,76 (с, 4H), 0,66 (с, 3H). ЖХМС 1,484 мин в 2 мин хроматографии, МС (ESI) рассчитано для C28F40FO2 [M+H]+ 427, найдено 409[M-18]+.
Пример 157. Синтез соединения 259.

Указанное в заголовке соединение получали в соответствии со способом Примера 5, стадия 4.
Соединение 259:1H ЯМР (CDCl3, 400МГц): δ 7,01 (с, 1H), 6,38 (дд, J=8,2, 1,5 Гц, 1H), 4,55-4,66 (м, 2H), 2,57 (т, J=8,8 Гц, 1H), 2,14-2,26 (м, 1H), 1,85-2,00 (м, 3H), 1,75 (т, J=7,4 Гц, 3H), 1,41-1,55 (м, 9H), 1,22-1,29 (м, 8H), 1,03-1,19 (м, 2H), 0,96 (с, 3H), 0,65 (с, 3H). ЖХМС Rt=2,747 мин в 4,0 мин хроматографии, МС (ESI) рассчитано для C25H37FN2O2 [M +H]+ 417,28, найдено 417,0 ([M +H]+.
Пример 158. Синтез соединения 260.

К раствору соединения 211 (50 мг, 112 мкмоль) в DCM (2 мл) добавляли DIEA (36,1 мг, 280 мкмоль) и HATU (85,1 мг, 224 мкмоль) при 25°C. Смесь перемешивали при 25°C в течение 30 минут. Добавляли N-метилпропан-1-амин (16,3 мг, 224 мкмоль). Смесь перемешивали при 25°C в течение 30 минут. ЖХМС анализ показал, что реакция завершилась. Смесь выливали в воду (10 мл) и экстрагировали при помощи EtOAc (20 мл ×2). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали при помощи ВЭЖХ (колонка: Phenomenex Synergi C18 250×21,2мм ×4мкм, градиент: 50-80% условия: (0,05% HCl-ACN), скорость потока: 25 мл/мин), с получением соединения 260 (16 мг) в виде белого твердого вещества.
1H ЯМР (260): (400 МГц, CDCl3) δ 8,04-8,03 (м, 1H), 5,27-5,17 (м, 2H), 3,65-3,48 (м, 2H), 3,29-3,09 (м, 3H), 2,59-2,57 (м, 1H), 2,21-2,20 (м, 1H), 2,06-2,05 (м, 3H), 1,95-1,67 (м, 2H), 1,66-1,60 (м, 5H), 1,57-1,45 (м, 8H), 1,42-1,27 (м, 9H), 1,23-1,05 (м, 2H), 0,96-0,87 (м, 4H), 0,85-0,83 (м, 2H), 0,69 (с, 3H). ЖХМС tR=1,238 мин в 2 мин хроматографии, 30-90 AB, МС (ESI) рассчитано для C29H46N4O3 [M+Na]+ 521, найдено 521.
Пример 159. Синтез соединения 261.

К раствору соединения 211 (50 мг, 112 мкмоль) в DCM (2 мл) добавляли DIEA (36,1 мг, 280 мкмоль) и HATU (85,1 мг, 224 мкмоль) при 25°C. Смесь перемешивали при 25°C в течение 30 минут. К смеси добавляли N-метилпропан-2-амин (16,3 мг, 224 мкмоль) при 25°C. Смесь перемешивали при 25°C в течение 30 минут. ЖХМС анализ показал, что реакция завершилась. Смесь выливали в воду (10 мл) и экстрагировали при помощи EtOAc (20 мл ×2). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали при помощи ВЭЖХ (колонка: Phenomenex Synergi C18 250×21,2мм × 4мкм, градиент: 50-80% условия: (0,05% HCl-ACN), скорость потока: 25 мл/мин), с получением соединения 261 (16,4 мг) в виде белого твердого вещества.
1H ЯМР (261): (400 МГц, CDCl3) δ 8,03-7,98 (м, 1H), 5,27-5,21 (м, 2H), 4,98-4,68 (м, 1H), 3,11-2,95 (м, 3H), 2,61-2,59 (м, 1H), 2,19-2,15 (м, 1H), 2,07-2,05 (м, 1H), 1,96-1,76 (м, 2H), 1,73-1,70 (м, 3H), 1,52-1,47 (м, 9H), 1,43-1,07 (м, 16H), 0,96 (с, 3H), 0,69 (с, 3H). ЖХМС Rt=1,213 мин в 2 мин хроматографии, 30-90 AB, МС (ESI) рассчитано для C29H46N4O3 [M+Na]+ 521, найдено 521.
Пример 160. Синтез соединения 262.
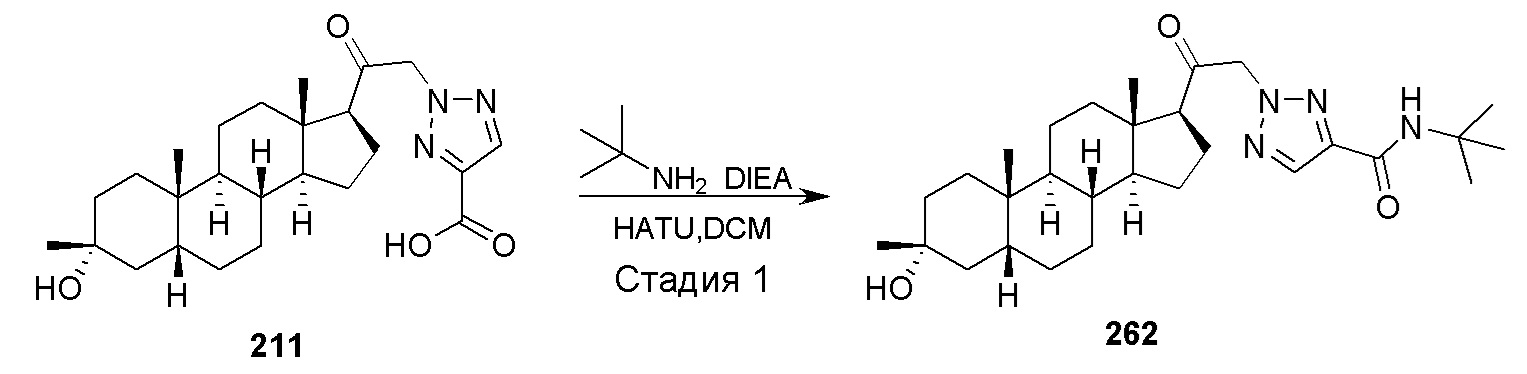
К раствору соединения 211 (50 мг, 0,112 ммоль) в DCM (2 мл) добавляли HATU (85,1 мг, 0,224 ммоль) и триэтиламин (22,6 мг, 0,224 ммоль) при 25°C. Реакционную смесь перемешивали при 25°C в течение 1 часа. Добавляли 2-метилпропан-2-амин (16,3 мг, 0,224 ммоль). Реакционную смесь перемешивали при 25°C в течение 16 часов. ЖХМС анализ показал ожидаемый МС. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали препаративной ВЭЖХ (колонка: Phenomenex Synergi C18 150×25 × 10мкм, градиент: 52-77% B (A=0,05% HCl-ACN, B=ацетонитрил), скорость потока: 30 мл/мин), с получением соединения 262 (14 мг, 25%) в виде белого твердого вещества.
1H ЯМР (262): (400МГц, DMSO-d6) δ 8,15 (с, 1H), 7,51 (с, 1H), 5,63-5,36 (м, 2H), 4,26 (с, 1H), 2,78-2,73 (м, 1H), 2,14-1,00 (м, 34H), 0,92 (с, 3H), 0,60 (м, 3H). ЖХМС tR=1,472 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C29H46N4O3 [M-H2O+H]+481, найдено 481.
Пример 161. Синтез соединения 263.

К раствору соединения 211 (50 мг, 0,112 ммоль) в DCM (2 мл) добавляли диизопропилэтиламин (43,4 мг, 0,336 ммоль) и HATU (85,1 мг, 0,224 ммоль). Смесь перемешивали при 25°C в течение 1 часа. Добавляли азетидин гидрохлорид (26,1 мг, 0,28 ммоль) и перемешивали в течение 16 часов. ЖХМС анализ показал ожидаемый МС. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме с получением неочищенного продукта, который очищали препаративной ВЭЖХ (колонка: Phenomenex Synergi C18 150×30мм × 4мкм, градиент: 0-68% B (A=вода (0,05% HCl)-ACN, B=ацетонитрил), скорость потока: 30 мл/мин), с получением продукта (4 мг) в виде белого твердого вещества.
1H ЯМР (263): (400МГц, CDCl3) δ 8,09 (с, 1H), 5,26-5,15 (м, 2H), 4,55-4,50 (м, 2H), 4,23-4,19 (м, 2H), 2,57-2,37 (м, 1H), 2,36-1,06 (м, 28H), 0,95 (с, 3H), 0,68 (м, 3H). ЖХМС tR=1,333 мин в 2 мин хроматографии, 10-80AB, МС (ESI) рассчитано для C28H42N4O3 [M-H2O+H]+ 453, найдено 453.
Методы анализов
Соединения, представленные в настоящей заявке, могут быть оценены с использованием различных анализов, примеры которых описаны ниже.
Стероидное ингибирование связывания TBPS
Анализы связывания TBPS с использованием кортикальных мембран головного мозга крысы в присутстви 5 мкМ ГАМК были описаны (Gee et al, J. Pharmacol. Exp. Ther. 1987, 241, 346-353; Hawkinson et al, Mol. Pharmacol. 1994, 46, 977-985; Lewin, A.H et al., Mol. Pharmacol. 1989, 35, 189-194).
Вкратце, у анестезированных диоксидом углерода крыс Sprague-Dawley (200-250 г) после декапитации быстро удаляли кору головного мозга. Кору головного мозга гомогенизировали в 10 объемах охлажденного льдом раствора 32 M сахарозы с использованием стеклянного/тефлонового гомогенизатора и центрифугировали при 1500 x g в течение 10 минут при 4°C. Полученные супернатанты центрифугировали при 10000 x g в течение 20 минут при 4℃ с получением в результате центрифугирования P2 осадков. Полученные после центрифугирования P2 осадки ресуспендировали в 200 мМ NaCl/50 мМ Na-K фосфат pH 7,4 буфере и центрифугировали при 10000 x g в течение 10 минут при 4°C. Эту процедуру промывки повторяли два раза и полученные в результате центрифугирования осадки ресуспендировали в 10 объемах буфера. Аликвоты (100 мкл) суспензий мембран инкубировали с 3 нМ [35S]-TBPS и 5 мкл аликвоты испытываемого лекарственного средства растворяли в диметилсульфоксиде (DMSO) (конечная концентрация 0,5%) в присутствии 5 мкМ ГАМК. Инкубационную смесь доводили до конечного объема 1,0 мл с использованием буфера. Неспецифическое связывание определяли в присутствии 2 мкМ немеченного TBPS, и оно составляло от 15 до 25%. После 90-минутной инкубации при комнатной температуре анализы останавливали путем фильтрования через стекловолоконные фильтры (Schleicher and Schuell No. 32) с использованием харвестера клеток (Brandel) и промывали три раза охлажденным льдом буфером. Связанную с фильтрами радиоактивность измеряли методом жидкостной сцинтилляционной спектрометрии. Подгонку нелинейным методом общих данных для каждого лекарственного средства, усредненных для каждой концентрации, осуществляли с использованием программы Prism (GraphPad). Подгонку данных осуществляли к модели частичного, вместо полного, ингибирования, если сумма квадратов была существенно ниже, как определено при помощи F-критерия. Подобным образом, данные подгоняли к двухкомпонентной вместо однокомпонентной модели ингибирования, если сумма квадратов была существенно ниже, как определено при помощи F-критерия. Концентрацию испытываемого соединения, обеспечивающую 50% ингибирование (IC50) специфического связывания и максимальную степень ингибирования (Imax), определяли для индивидуальных экспериментов с той же моделью, которую использовали для общих данных, и затем рассчитывали средние значения+стандартные отклонения (SEM) индивидуальных экспериментов. Пикротоксин использовали в качестве положительного контроля для этих испытаний, так как было продемонстрировано, что он сильно ингибирует связывание TBPS.
Различные соединения скринируют или можно скринировать для определения их потенциала в качестве модуляторов [35S]-TBPS связывания in vitro. Эти анализы осуществляют, или их можно осуществлять, в соответствии с обсуждаемыми выше процедурами.
В Таблице 1: ʺAʺ означает IC50<10 нМ, ʺBʺ означает IC50 от 10 нМ до 50 нМ, ʺCʺ означает IC50>50 нМ до 100 нМ, ʺDʺ означает IC50>100 нМ до 500 нМ, и ʺEʺ означает IC50>500 нМ.
Пэтч-кламп метод для электрофизиологического исследования рекомбинантных α1β2γ2 и α4β3δ ГАМКA рецепторов
Клеточную электрофизиологию использовали для определения фармакологических свойств модуляторов ГАМКA рецепторов по настоящему изобретению в гетерологичных клеточных системах. Каждое соединение испытывали на его способность влиять на ГАМК- опосредованные токи при субмаксимальной агонистической дозе (ГАМК EC20=2 мкМ). LTK клетки стабильно трансфицировали α1β2γ2 субъединицами ГАМК рецептора, а CHO клетки временно трансфицировали α4β3δ субъединицами способом с использованием липофектамина. Клетки пассировали при конфлюентности около 50-80% и затем высевали в 35-мм стерильные чашки для культивирвания, содержащие 2 мл полной среды для культивирвания без антибиотиков или противогрибковых средств. Конфлюентные кластеры клеток электрически объединяли (Pritchett et al., Science, 1988, 242, 1306-1308). Поскольку ответы в отдаленных клетках нельзя было достоверно измерить методом фиксации поенциала и из-за неопределенностей относительно степени слияния (Verdoorn et al., Neuron 1990, 4, 919-928), клетки культивировали при плотности, которая позволяет осуществлять регистрацию отдельных клеток (без видимых объединений с другими клетками).
Цельноклеточные токи измеряли при помощи HEKA EPC-10 усилителей с использованием программы PatchMaster или с использованием высокопроизводительной QPatch платформы (Sophion). Раствор в ванночке для всех экспериментов содержал (в мМ): NaCl 137 мМ, KCl 4 мМ, CaCl2 1,8 мМ, MgCl2 1 мМ, HEPES 10 мМ, D-Глюкоза 10 мМ, pH (NaOH) 7,4. В некоторых случаях также добавляли 0,005% кремофора. Внутриклеточный (пипетка) раствор содержал: KCl 130 мМ, MgCl2 1 мМ, Mg-АТФ 5 мМ, HEPES 10 мМ, EGTA 5 мМ, pH 7,2. В процессе осуществления экспериментов клетки и растворы поддерживали при комнатной температуре (19°C - 30°C). Для осуществляемых вручную пэтч-кламп регистраций чашки для культивирвания клеток помещали на держатель для чашек микроскопа и осуществляли непрерывную перфузию (1 мл/мин) раствором из ванночки. После образования гигаомного контакта между пэтч-электродами и клеткой (диапазон сопротивления пипетки: 2,5 MΩ - 6,0 MΩ; диапазон сопротивления контакта: >1 GΩ) клеточную мембрану пробивали кончиком пипетки для обеспечения электрического доступа внутрь клетки (пэтч-кламп конфигурация ʺцелая клеткаʺ). Для экспериментов с использованием QPatch системы клетки переносили в виде суспензии в QPatch систему в раствор в ванночке и осуществляли регистрации автоматизированным способом в формате целой клетки.
Клетки анализировали методом фиксации напряжения при исходном потенциале -80 мВ. Для анализа испытываемых веществ ГАМК рецепторы стимулировали при помощи 2 мкМ ГАМК после последовательной предварительной инкубации с увеличивающимися концентрациями испытываемого вещества. Продолжительность предварительной инкубации составляла 30 сек, и продолжительность ГАМК стимуляции составляла 2 сек. Испытываемые вещества растворяли в DMSO с получением исходных растворов (10 мМ). Испытываемые вещества разводили до 0,01, 0,1, 1 и 10 мкМ в растворе в ванночке. Все концентрации испытываемых веществ испытывали на каждой клетке. Относительный процент потенциации определяли как максимальную амплитуду в ответ на ГАМК EC20 в присутстви испытываемого вещества, деленную на максимальную амплитуду в ответ на ГАМК EC20 только, умноженную на 100. Таблица 2 представляет% эффективности ГАМКA рецепторов α1β2γ2 и α4β3δ: ʺAʺ 10-100, ʺBʺ >100-500, ʺCʺ >500; D означает, что данные не доступны или не определяли.
Метод PTZ-стимулированного приступа
Противосудорожный эффект испытываемых соединений оценивали методом анализа пентилентетразол-индуцированного судорожного припадка у мышей, таким как методы, описанные в Giardina & Gasior (Curr Protoc Pharmacol. 2009). Самцов CD-1 мышей размещали группами по пять животных в каждой группе в контролируемых условиях (температура 22±2°С и 12:12-часовой цикл свет-темнота, освещение с 8:00 часов утра), и вода и пища были доступны ad libitum. Мышей содержали в этих условиях в течение 1 недели перед осуществлением поведенческого испытания, к этому времени они весили 25-35 г. Пентилентетразол (PTZ, Sigma) растворяли в стерильном 0,9% физиологическом растворе при концентрации 12 мг/мл для подкожного введения. Испытываемые соединения формулировали и вводили через желудочный зонд или путем интраперитонеальной инъекции в предварительно определенной точке времени (типично 30 или 60 минут) до PTZ инъекции. Все растворы были свежеполученными, и их вводили в объеме, соответствующем 10 мл/кг массы тела.
Мышам давали акклиматизироваться в помещении для испытания в течение по меньшей мере 30 минут перед введением соединения. Мышей распределяли случайным образом, по меньшей мере, по четырем группам испытания (группа введения носителя и по меньшей мере три группы введения разных доз испытываемого соединения), по 10 мышей на группу. После введения соединения мышей наблюдали для качественной оценки седации в предварительно определенной точке времени (30 или 60 минут). По прошествии определенного времени после предварительной обработки лекарственным средством мышам вводили подкожную инъекцию PTZ (120 мг/кг). Сразу после PTZ инъекции мышей индивидуально помещали в камеры для наблюдения (25×15×15см) и включали трехканальный таймер. Каждую мышь непрерывно наблюдали в течение 30 минут, и наблюдателями, которые не были информированы об осуществляемых обработках, были зарегистрированы следующие поведения: 1) латентный период фазы клонических судорог, которые продолжались в течение 3 сек, с последующим отсутствием выпрямительного рефлекса, 2) латентный период фазы тонических судорог, характеризующихся ригидным вытягиванием всех четырех конечностей, которые образуют угол с телом больше чем 90 градусов, 3) латентный период до смерти, 4) количество клонических и тонических судорог. Данные представлены как среднее значение ± S.E.M(стандартная ошибка среднего), и однофакторный дисперсионный анализ с апостериорным критерием Даннета или Бонферрони использовали для определения значимых различий в латентности и количестве между группами введения носителя и дозы соединения. p значения <0,05 считались статистически значимыми.
A ≤1 мг/кг массы тела; B >1-5 мг/кг массы тела; C ≥5 мг/кг массы тела; PO - пероральное введение.
Реферат
Изобретение относится к соединению формулы (I-а), в которой кольцо A представляет собой 5-членный или 9-членный гетероарил, содержащий 2-4 атома азота; где кольцо А присоединено через атом азота; Rпредставляет собой незамещенный Cалкил или алкоксиСалкил; Rпредставляет собой водород; Rпредставляет собой водород и Rпредставляет собой водород; Rпредставляет собой водород; Rпредставляет собой незамещенный Cалкил, гидроксиCалкил, галогенCалкил, галоген, циано, нитро, OR, C(=O)OR, N(R)(R), C(=O)N(R)(R) или N(R)C(=O)R; n имеет значение 1; Rпредставляет собой водород или незамещенный Cалкил и каждый из Rи Rнезависимо представляет собой водород или незамещенный Cалкил; Rпредставляет собой водород; каждый из Rи Rнезависимо представляет собой водород ипредставляет собой простую связь. Изобретение также относится к индивидуальным соединениям, фармацевтической композиции, способу лечения судорог, способу лечения эпилепсии, способу лечения ЦНС-связанного расстройства. Технический результат: получены новые соединения формулы (I-а), обладающие свойствами модуляторов ГАМК. 11 н. и 27 з.п. ф-лы, 3 табл., 161 пр.(I-а)
Формула








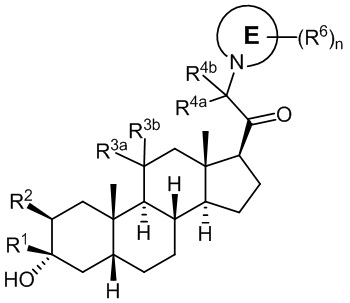






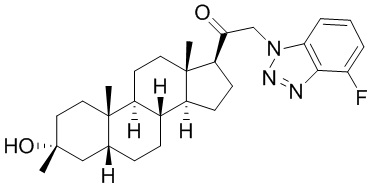





















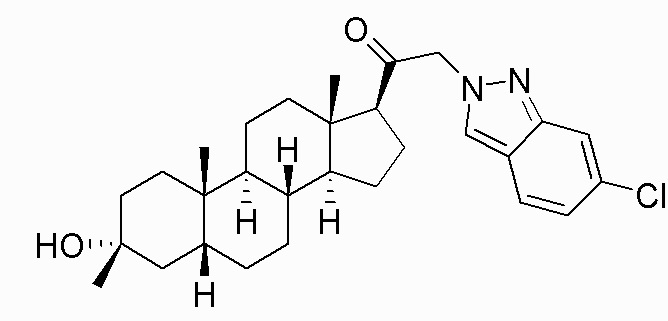





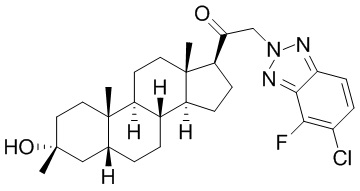





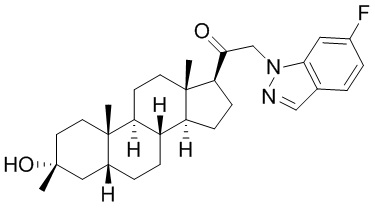








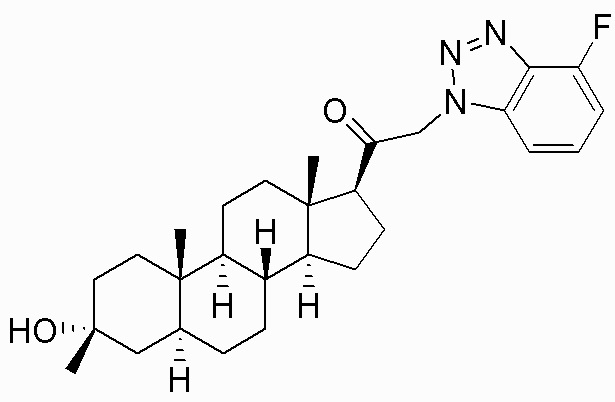



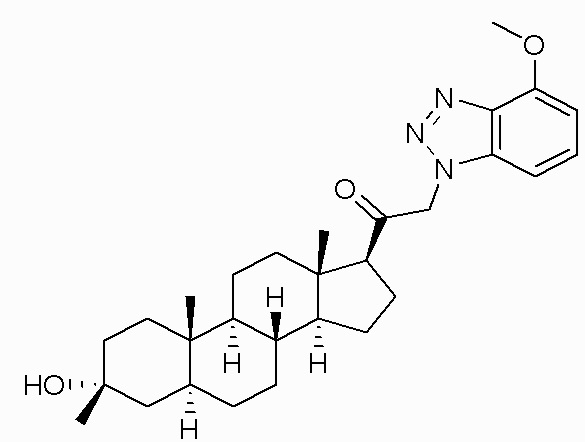




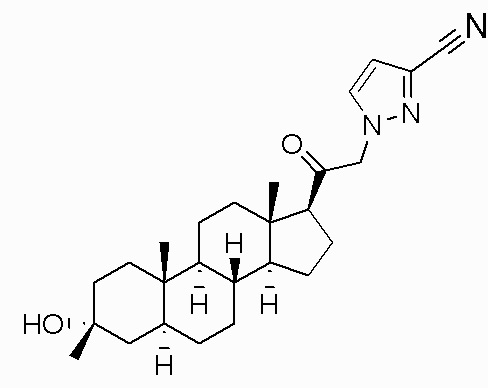

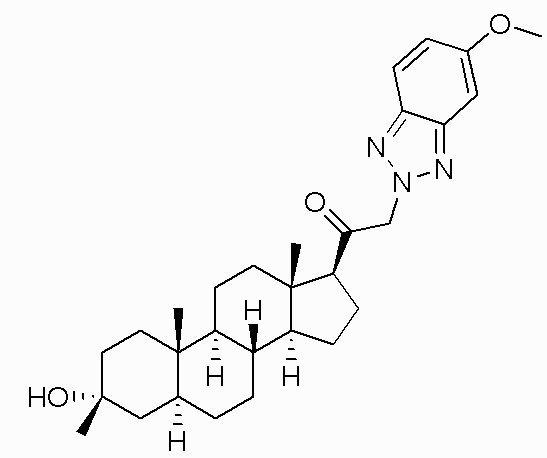



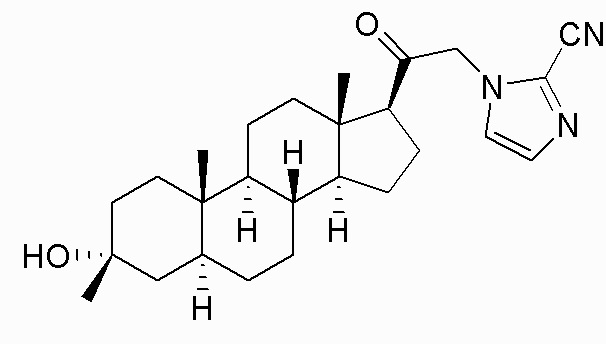
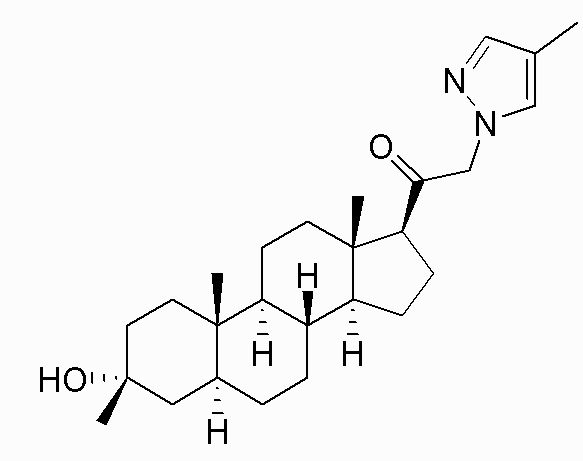

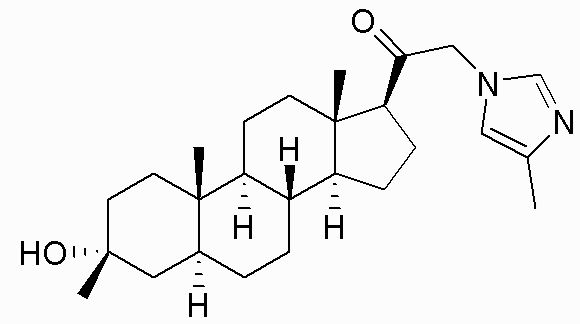













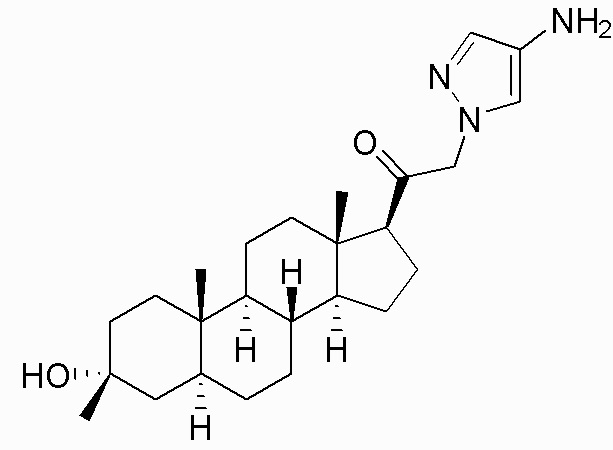


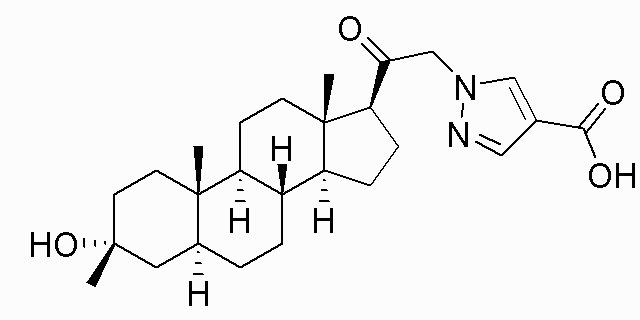











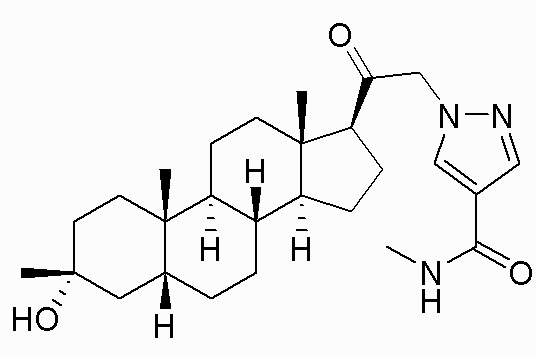

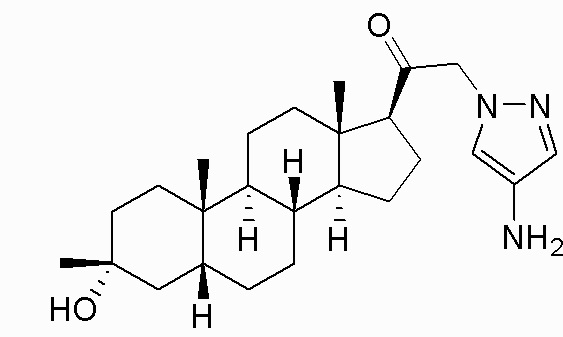
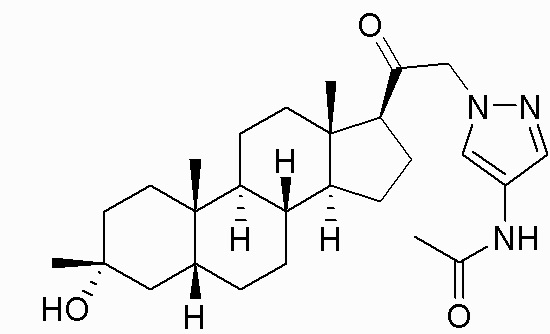







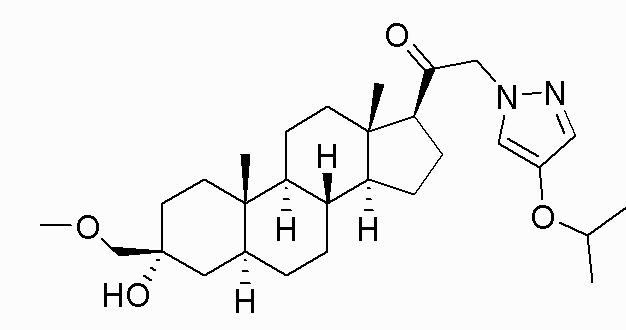







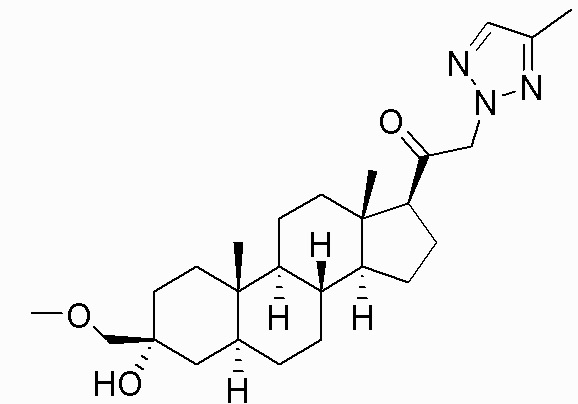














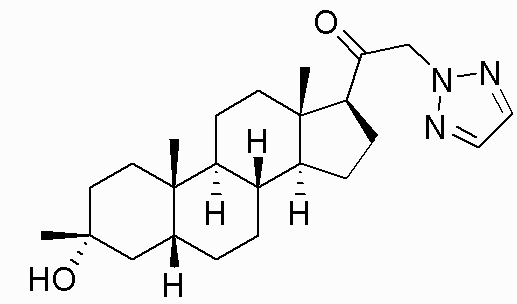











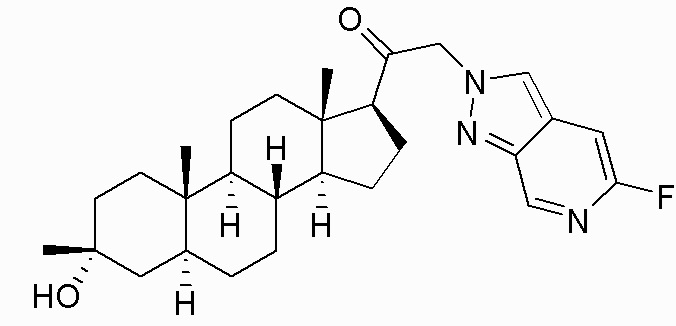

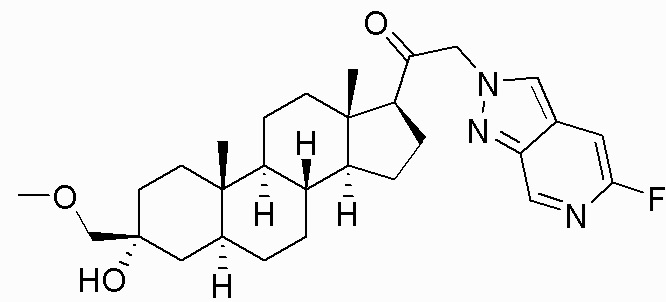














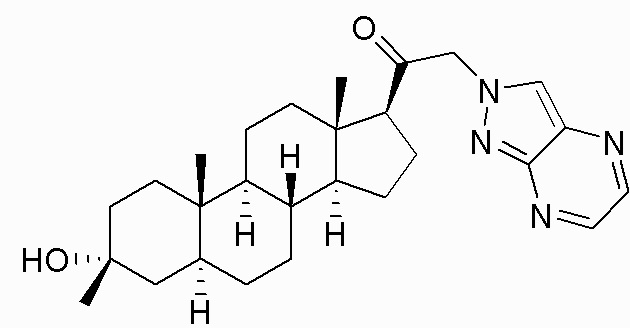



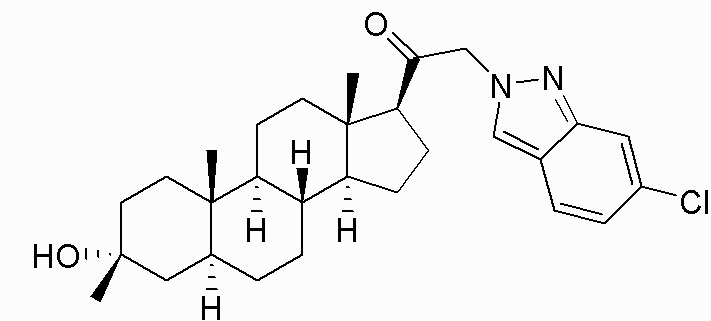

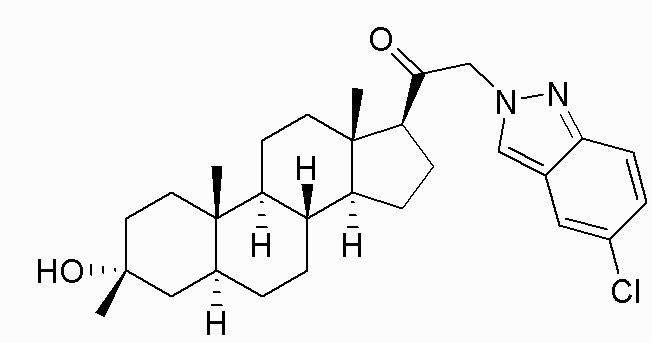







Документы, цитированные в отчёте о поиске
3альфа-гидрокси-3бета-метоксиметил-21-гетероцикл-замещенные стероиды, фармацевтическая композиция, способ облегчения или профилактики бессонницы или погружения в наркоз

Комментарии