Нейроактивные стероиды, композиции и их применения - RU2665571C2
Код документа: RU2665571C2
Описание
РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет согласно 35 U.S.C. § 119(e) предварительной пате309нтной заявки США U.S.S.N. 61/532427, зарегистрированной 8 сентября 2011 года, включенной в настоящее описание посредством ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Возбудимость головного мозга определяют как уровень активации животного, континуум которой находится в диапазоне от комы до судорог, и которую регулируют различные нейромедиаторы. Как правило, нейромедиаторы отвечают за регуляцию проводимости ионов через нейрональные мембраны. В состоянии покоя нейрональная мембрана обладает потенциалом (или потенциалом мембраны) приблизительно -70 мВ, где внутренняя поверхность клетки является отрицательным по отношению к внешней поверхности клетки. Потенциал (напряжение) представляет собой ионное (K+, Na+, Cl-, органические анионы) равновесие на противоположной стороне нейрональной полупроницаемой мембраны. Нейромедиаторы содержатся в пресинаптических везикулах и выделяются в результате нервных потенциалов действия. При выделении в синаптическую щель возбуждающий химический медиатор, такой как ацетилхолин, вызывает деполяризацию мембраны (изменение потенциала от -70 мВ до -50 мВ). Этот эффект является опосредованным постсинаптическими никотиновыми рецепторами, которые стимулирует ацетилхолин, с увеличением проницаемости мембраны для ионов Na+. Сниженный мембранный потенциал стимулирует нейрональную возбудимость в форме постсинаптического потенциала действия.
[0003] NMDA-рецепторы высоко экспрессируются в ЦНС и участвуют в возбуждающей синаптической передаче и синаптической пластичности, а также эксайтотоксичности. Эти рецепторы представляют собой лиганд-зависимые ионные каналы, которые пропускают Ca2+ после связывания нейромедиатора глутамата и являются основополагающими для передачи возбуждающих нервных импульсов и нормального функционирования ЦНС. NMDA-рецепторы представляют собой гетеромерные комплексы, состоящие из NR1, NR2 и/или NR3 субъединиц, и обладают различными участками распознавания экзогенных и эндогенных лигандов. Эти участки распознавания включают участки связывания глицина и агонистов и модуляторов глутамата. Такие модуляторы пригодны в качестве терапевтических средств с потенциальными клиническими применениями в качестве усилителей когнитивных функций и для лечения психиатрических расстройств, в которых глутаматергическая передача является сниженной или недостаточной (см., например, Horak et al., J. of Neuroscience, 2004, 24(46), 10318-10325).
[0004] Было показано, что нейроактивные стероиды, такие как прегненолонсульфат (PS) проявляют прямое модулирующее действие на несколько типов нейромедиаторных рецепторов, таких как рецепторы ГАМКа, глициновые, AMPA-каинатные и NMDA-рецепторы. NMDA-рецепторы положительно модулируются PS, однако степень модуляции значительно варьирует.
[0005] В дополнение к PS было показано, что несколько других 3β-гидроксистероидов потенцируют NMDA-рецепторы (см., например, Paul et al., J. Pharm. и Exp. Ther., 1994, 271, 677-682). В настоящее время описано 3β-гидроксиэргост-5-ен-стероидное производное (1) в качестве положительного модулятора NMDA (NR1a/NR2A). Выявлено, что соединение (1) (также обозначаемое как Org-1) избирательно модулирует NMDA по сравнению с ГАМКа (см., например, Madau et al., Program No. 613.2/B87, 2009, Neuroscience Meeting Planner. Chicago, IL: Society for Neuroscience, 2009; Connick et al., Program No. 613.1/B86, 2009, Neuroscience Meeting Planner. Chicago, IL: Society for Neuroscience, 2009).

[0006] Новые и улучшенные нейроактивные стероиды являются необходимыми для модуляции возбудимости головного мозга для профилактики и лечения связанных с ЦНС патологических состояний. Соединения, композиции и способы, описываемые в настоящем описании, относятся к этой цели.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Новые 3-α и 3β-гидроксистероиды, описываемые в настоящем описании, представляют собой потенциальные модуляторы NMDA-рецепторов и, таким образом, являются пригодными для профилактики и/или лечения широкого диапазона связанных с ЦНС патологических состояний, включая, но, не ограничиваясь ими, шизофрению, депрессию, биполярное расстройство (например, I и/или II), шизоаффективное расстройство, расстройства настроения, тревожные расстройства, расстройства личности, психозы, компульсивные расстройства, посттравматическое стрессовое расстройство (PTSD), расстройства аутистического спектра (ASD), дистимию (легкую степень депрессии), социальное тревожное расстройство, обсессивно-компульсивное расстройство (OCD), боль (например, болевой синдром или расстройство), расстройства сна, нарушения памяти, деменцию, болезнь Альцгеймера, судорожное расстройство (например, эпилепсию), травматическое повреждение головного мозга, инсульт, аддиктивные расстройства (например, пристрастие к опиатам, кокаину и/или алкоголю), аутизм, болезнь Гентингтона, бессонницу, болезнь Паркинсона, абстинентные синдромы или тиннитус. Ожидают, что эти соединения обладают улучшенной активностью in vivo фармакокинетическими (PK) свойствами, пероральной биодоступностью, формулируемостью, стабильностью и/или безопасностью.
[0008] Один из аспектов относится к соединениям формулы (I):

или его фармацевтически приемлемой соли, сольвату, пролекарству, стереоизомеру, таутомеру, изотопному варианту или N-оксиду или их сочетанию;
где:
Z представляет собой группу формул (i), (ii), (iii), (iv) или (v):

L1, L2, L3, X1, X2, Y, RZ4, RZ5, RZ6, n, R1, R2, R3a, R3b, R4a, R4b, R6a, R6b, R7a, R7b, R11a, R11b, R14, R17, R19, R20, R23a, R23b и R24 являются такими, как определено в настоящем описании, и группа -XR3b в положении C3 является альфа или бета.
[0009] Например, в определенных вариантах осуществления соединение формулы (I) имеет формулу (I-w):
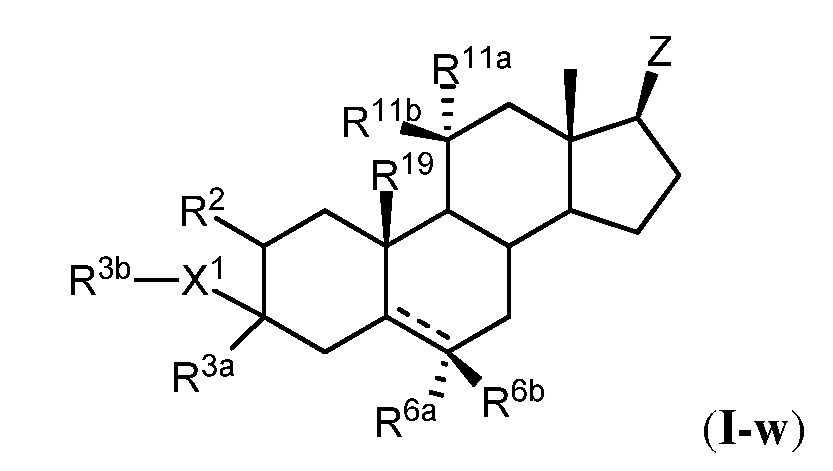
или его фармацевтически приемлемой солью;
Z представляет собой группу формул (i), (ii), (iii), (iv) или (v):

L1 и L2 выбраны из группы, состоящей из связи, замещенного или незамещенного C1-С6алкилена, замещенного или незамещенного C2-С6алкенилена, замещенного или незамещенного C2-С6алкинилена, замещенного или незамещенного гетеро(C1-C6)алкилена, замещенного или незамещенного гетеро(C2-C6)алкенилена и замещенного или незамещенного гетеро(C2-C6)алкинилена;
L3 представляет собой замещенный или незамещенный C1-С6алкилен, замещенный или незамещенный C2-С6алкенилен, замещенный или незамещенный C2-С6алкинилен, замещенный или незамещенный гетеро(C1-C6)алкилен, замещенный или незамещенный гетеро(C2-C6)алкенилен, или замещенный или незамещенный гетеро(C2-C6)алкинилен;
каждый из X1 и X2 независимо представляет собой -O-, -S- или -NH-;
R1 представляет собой водород или замещенный или незамещенный алкил;
R3b представляет собой водород;
R3a представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил или замещенный или незамещенный алкинил;
каждый из R2, R11a и R11b независимо представляет собой водород или -ORB1, где RB1 представляет собой водород или замещенный или незамещенный алкил, или R11a и R11b связаны с образованием оксогруппы (=O);
каждый из R6a и R6b независимо представляет собой водород, галоген или замещенный или незамещенный алкил, и

каждый из R19 и R20 независимо представляет собой водород или -CH3;
и каждый из R23a и R23b независимо представляет собой водород, галоген или замещенный или незамещенный алкил, или R23a и R23b соединены вместе с образованием замещенного или незамещенного C3-С6циклоалкила;
R24 представляет собой водород или замещенный или незамещенный алкил;
Y представляет собой -O-, -S- или -NRZ5-;
RZ4 независимо представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -ORZ5, -SRZ5 или -N(RZ5)2;
каждый из RZ5 независимо представляет собой водород или замещенный или незамещенный алкил, и
каждый из RZ6 независимо представляет собой водород или замещенный или незамещенный алкил, или две группы RZ6 связаны с образованием C3-6карбоциклического кольца, и
нижний индекс n представляет собой 0 или 1;
при условии, что следующие ниже соединения конкретно исключают:

[0010] В определенных вариантах осуществления изобретения Z представляет собой группу формул:

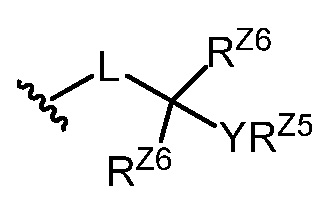
[0011] В определенных вариантах осуществления изобретения L3 представляет собой группу формул:

где p равно 1, 2 или 3, и каждый из RZ7 и RZ8 независимо представляет собой водород, галоген, замещенный или незамещенный C1-6алкил или -ORZ5.
[0012] В определенных вариантах осуществления изобретения L3 представляет собой группу формулы:

где w равно 0 или 1 и p равно 1, 2 или 3 или w равно 1 и p равно 0, 1, 2 или 3, и каждый из RZ7 и RZ8 независимо представляет собой водород, галоген, замещенный или незамещенный C1-6алкил или -ORZ5.
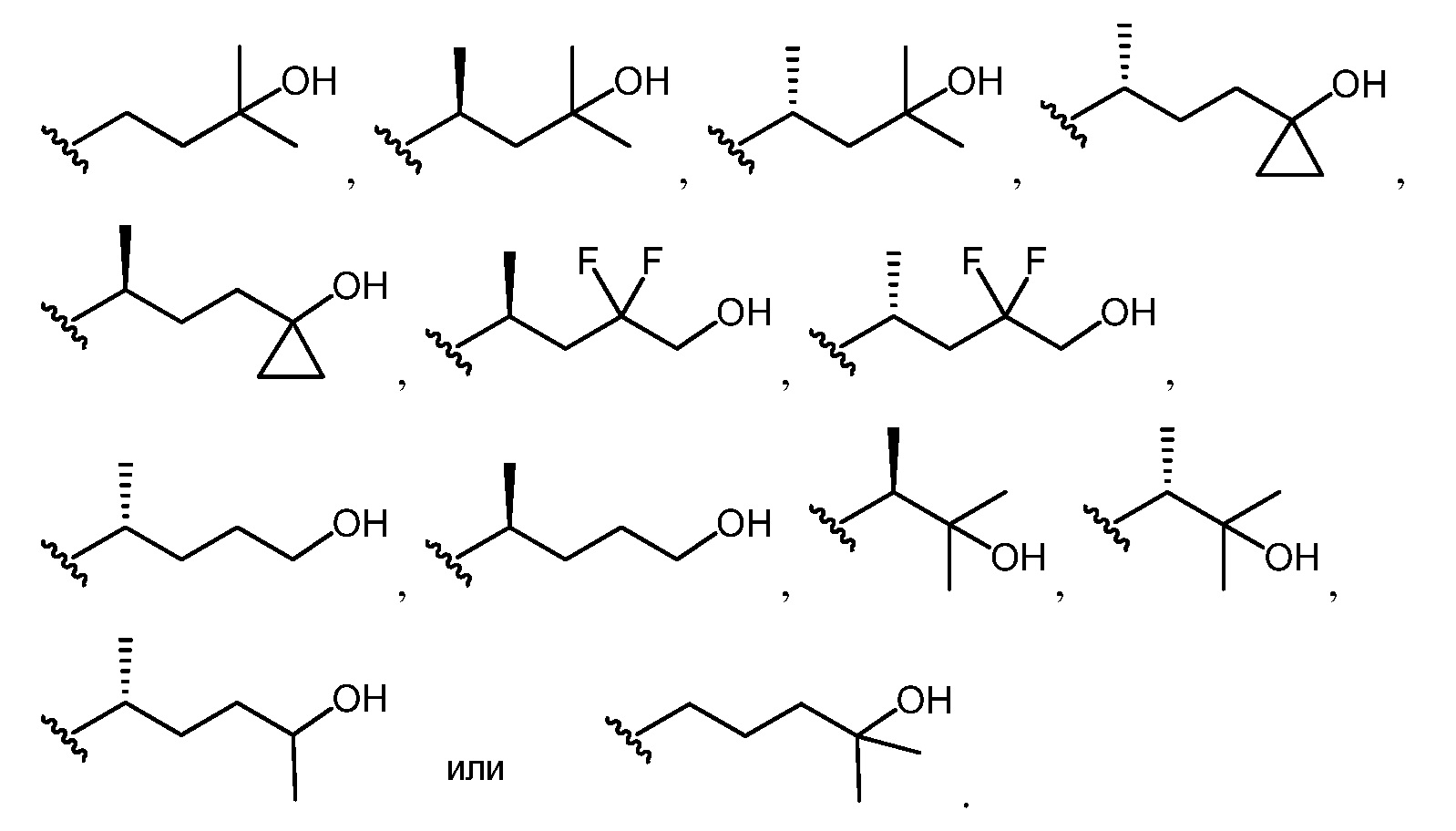
[0013] В определенных вариантах осуществления изобретения L3 представляет собой группу формул:

[0014] В определенных вариантах осуществления изобретения L3 представляет собой группу формул:

[0015] В определенных вариантах осуществления изобретения L3 представляет собой группу формул:


[0016] В определенных вариантах осуществления изобретения Z имеет формулу

[0017] В определенных вариантах осуществления изобретения группа




[0018] В определенных вариантах осуществления изобретения Z имеет формулу

[0019] В определенных вариантах осуществления изобретения Y представляет собой -O-, и L3 представляет собой алкилен или гетероалкиленовую группу.
[0020] В определенных вариантах осуществления изобретения группа

[0021] В определенных вариантах осуществления изобретения Z имеет формулу

[0022] В определенных вариантах осуществления изобретения Y представляет собой -O-, и L3 представляет собой алкилен или гетероалкилен.
[0023] В определенных вариантах осуществления изобретения группа


или

[0024] В определенных вариантах осуществления изобретения группа -X1R3b находится в бета-положении, и R3a находится в альфа-положении. В определенных вариантах осуществления изобретения -X1R3b представляет собой -OH. В определенных вариантах осуществления изобретения R3a представляет собой водород. В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R6b представляет собой галоген или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11b представляет собой водород или -ORB1, и R11a представляет собой водород. В определенных вариантах осуществления изобретения R11a и R11b совместно образуют оксогруппу. В определенных вариантах осуществления изобретения


[0025] Другой аспект относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый носитель. В определенных вариантах осуществления изобретения соединение по настоящему изобретению предоставлено в эффективном количестве. В определенных вариантах осуществления изобретения соединение по настоящему изобретению предоставлено в терапевтически эффективном количестве. В определенных вариантах осуществления изобретения соединение по настоящему изобретению предоставлено в профилактически эффективном количестве.
[0026] В определенных аспектах соединения по настоящему изобретению предоставлены в качестве отрицательных аллостерических регуляторов (NAM) NMDA-рецептора, и, таким образом, они являются пригодными для профилактики и/или лечения широкого диапазона патологических состояний ЦНС, включая, но, не ограничиваясь ими, шизофрению, депрессию, биполярное расстройство (например, I и II), шизоаффективное расстройство, расстройства настроения, тревожные расстройства, расстройства личности, психозы, компульсивные расстройства, посттравматическое стрессовое расстройство (PTSD), расстройства аутистического спектра (ASD), дистимию (легкую степень депрессии), социальное тревожное расстройство, обсессивно-компульсивное расстройство (OCD), все болевые синдромы или расстройства, расстройства сна, нарушения памяти, деменцию, болезнь Альцгеймера, эпилепсию любые судорожные расстройства, травматическое повреждение головного мозга (TBI), инсульт, аддиктивные расстройства, включая пристрастие к опиатам, кокаину и алкоголю, аутизм, болезнь Гентингтона, бессонницу, болезнь Паркинсона, абстинентные синдромы или тиннитус. Например, один из аспектов относится к способу модуляции NMDA-рецептора, включающему введение эффективного количества соединения по настоящему изобретению нуждающемуся в этом индивидууму. Другой аспект относится к способу модуляции активности ЦНС, включающему введение эффективного количества соединения по настоящему изобретению нуждающемуся в этом индивидууму. Еще один аспект относится к способу модуляции возбудимости головного мозга, включающему введение эффективного количества соединения по настоящему изобретению нуждающемуся в этом индивидууму.
[0027] Другие цели и преимущества станут понятны специалистам в данной области при рассмотрении следующего ниже подробного описания, примеров и формулы изобретения.
ОПРЕДЕЛЕНИЯ
Химические определения
[0028] Определения конкретных функциональных групп и химических терминов более подробно описаны ниже. Химические элементы определяют в соответствии с периодической таблицей элементов, версии CAS, Handbook of Chemistry and Physics, 75th Ed., внутренняя обложка, и конкретные функциональные группы, как правило, определяют, как в ней описано. Кроме того, основные принципы органической химии, а также конкретные функциональные группы и химическая реакционная способность описаны у Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, March's Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
[0029] Описываемые в настоящем описании соединения могут содержать один или более центров асимметрии и, таким образом, могут существовать в различных изомерных формах, например, энантиомеров и/или диастереомеров. Например, описываемые в настоящем описании соединения могут находиться в форме индивидуального энантиомера, диастереомера или геометрического изомера или могут находиться в форме смеси стереоизомеров, включая рацемические смеси и смеси с высоким содержанием одного или нескольких стереоизомеров. Изомеры можно выделять из смеси способами, известными специалистам в данной области, включая хиральную высокоэффективную жидкостную хроматографию (ВЭЖХ) и образование и кристаллизацию хиральных солей, или предпочтительно изомеры можно получать асимметрическим синтезом. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962), и Wilen, Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972). Изобретение дополнительно включает соединения, описываемые в настоящем описании, в виде индивидуальных изомеров по существу не содержащих другие изомеры, и, альтернативно, в виде смесей различных изомеров.
[0030] Когда перечисляют диапазон значений, предполагают, что он включает каждое значение и поддиапазон в диапазоне. Например, предполагают, что "C1-6алкил" включает C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и C5-6алкил.
[0031] Предполагают, что следующие ниже термины имеют значения, представленные ниже и являются пригодными для понимая описания и предполагаемого объема настоящего изобретения. При описании изобретения, которое может включать соединения, фармацевтические композиции, содержащие такие соединения, и способы применения таких соединений и композиций, при наличии следующие ниже термины имеют следующие значения, если не указано иное. Также следует понимать, что при описании в настоящем описании любая из групп, определяемых ниже, может являться замещенной различными заместителями, и что соответствующие определения предназначены включать в своем объеме такие замещенные группы, как установлено ниже. Если не указано иное, термин "замещенный" следует определять, как указано ниже. Следует также понимать, что термины "группы" и "радикалы" можно рассматривать взаимозаменяемо при использовании в настоящем описании. Формы единственного числа можно использовать в настоящем описании для обозначения одного или более одного (например, по меньшей мере одного) объекта в форме единственного числа. Например, "аналог" означает один аналог или более одного аналога.
[0032] "Алкил" относится к радикалу насыщенной углеводородной группы с неразветвленной или разветвленной цепью, содержащей от 1 до 20 атомов углерода ("C1-20алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 12 атомов углерода ("C1-12алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 10 атомов углерода ("C1-10алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 9 атомов углерода ("C1-9алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 8 атомов углерода ("C1-8алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 7 атомов углерода ("C1-7алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 6 атомов углерода ("C1-6алкил", также обозначаемая в настоящем описании как "низший алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 5 атомов углерода ("C1-5алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 4 атомов углерода ("C1-4алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 3 атомов углерода ("C1-3алкил"). В некоторых вариантах осуществления алкильная группа содержит от 1 до 2 атомов углерода ("C1-2алкил"). В некоторых вариантах осуществления алкильная группа содержит 1 атом углерода ("С1алкил"). В некоторых вариантах осуществления алкильная группа содержит от 2 до 6 атомов углерода ("C2-6алкил"). Примеры C1-6алкильных групп включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (C6). Дополнительные примеры алкильных групп включают н-гептил (C7), н-октил (C8) и т.п. Если не указано иное, каждая из алкильных групп независимо необязательно является замещенной, например, незамещенной ("незамещенный алкил") или замещенной ("замещенный алкил") одним или несколькими заместителями, например, от 1 до 5 заместителями, от 1 до 3 заместителями или 1 заместителем. В определенных вариантах осуществления изобретения алкильная группа представляет собой незамещенный C1-10алкил (например, -CH3). В определенных вариантах осуществления изобретения алкильная группа представляет собой замещенный C1-10алкил. Общепринятые сокращенные обозначения алкилов включают Me (-CH3), Et (-CH2CH3), iBt (-CH(CH3)2), nPr (-CH2CH2CH3), n-Bu (-CH2CH2CH2CH3) или i-Bu (-CH2CH(CH3)2).
[0033] Как используют в настоящем описании, "алкилен", "алкенилен" и "алкинилен" относятся к двухвалентному радикалу алкила, алкенила и алкинильной группы соответственно. Когда диапазон или количество атомов углерода предоставлено для конкретных "алкиленовых", "алкениленовых" и "алкиниленовых" групп, следует понимать, что диапазон или количество относится к диапазону или количеству атомов углерода в линейной двухвалентной углеродной цепи. "Алкиленовые", "алкениленовые" и "алкиниленовые" группы могут быть замещенными или незамещенными одним или несколькими заместителями, как описано в настоящем описании.
[0034] "Алкилен" относится к алкильной группе, где удаляют два водорода с получением двухвалентного радикала, и которая может являться замещенной или незамещенной. Незамещенные алкиленовые группы включает, но не ограничивается ими, метилен (-CH2-), этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), бутилен (-CH2CH2CH2CH2-), пентилен (-CH2CH2CH2CH2CH2-), гексилен (-CH2CH2CH2CH2CH2CH2-) и т.п. Иллюстративные замещенные алкиленовые группы, например, замещенные одной или несколькими алкильными (метильными) группами, включают, но не ограничиваются ими, замещенный метилен (-CH(CH3)-, (-C(CH3)2-), замещенный этилен (-CH(CH3)CH2-, -CH2CH(CH3)-, -C(CH3)2CH2-, CH2C(CH3)2-, замещенный пропилен (-CH(CH3)CH2CH2-, -CH2CH(CH3)CH2-, -CH2CH2CH(CH3)-, -C(CH3)2CH2CH2-, -CH2C(CH3)2CH2-, -CH2CH2C(CH3)2-) и т.п.
[0035] "Алкенил" относится к радикалу углеводородной группы с неразветвленной или разветвленной цепью, содержащей от 2 до 20 атомов углерода, одну или более двойных связей углерод-углерод (например, 1, 2, 3 или 4 двойных связи) и не содержит тройных связей ("C2-20алкенил"). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 10 атомов углерода ("C2-10алкенил"). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 9 атомов углерода ("C2-9алкенил"). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 8 атомов углерода ("C2-8алкенил"). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 7 атомов углерода ("C2-7алкенил"). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 6 атомов углерода ("C2-6алкенил"). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 5 атомов углерода ("C2-5алкенил"). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 4 атомов углерода ("C2-4алкенил"). В некоторых вариантах осуществления алкенильная группа содержит от 2 до 3 атомов углерода ("C2-3алкенил"). В некоторых вариантах осуществления алкенильная группа содержит 2 атома углерода ("С2алкенил"). Одна или более двойных связей углерод-углерод могут являться внутренними (такими как в 2-бутениле) или концевыми (такими как в 1-бутениле). Примеры C2-4алкенильных групп включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4) и т.п. Примеры C2-6алкенильных групп включают указанные выше C2-4алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6) и т.п. Дополнительные примеры алкенила включают гептенил (C7), октенил (C8), октатриенил (C8) и т.п. Если не указано иное, каждая из алкенильных групп независимо необязательно является замещенной, например, незамещенной ("незамещенный алкенил") или замещенной ("замещенный алкенил") один или несколькими заместителями, например, от 1 до 5 заместителей, от 1 до 3 заместителей или 1 заместителем. В определенных вариантах осуществления изобретения алкенильная группа представляет собой незамещенный C2-10алкенил. В определенных вариантах осуществления изобретения алкенильная группа представляет собой замещенный C2-10алкенил.
[0036] "Алкенилен" относится к алкенильной группе, где удаляют два водорода с получением двухвалентного радикала, и которая может быть замещенной или незамещенной. Иллюстративные незамещенные двухвалентные алкениленовые группы включают, но не ограничиваются ими, этенилен (-CH=CH-) и пропенилен (например, -CH=CHCH2-, -CH2-CH=CH-). Иллюстративные замещенные алкениленовые группы, например, замещенные одной или несколькими алкильными (метильными) группами, включают, но не ограничиваются ими, замещенный этилен (-C(CH3)=CH-, -CH=C(CH3)-), замещенный пропилен (например, -C(CH3)=CHCH2-, -CH=C(CH3)CH2-, -CH=CHCH(CH3)-, -CH=CHC(CH3)2-, -CH(CH3)-CH=CH-, -C(CH3)2-CH=CH-, -CH2-C(CH3)=CH-, -CH2-CH=C(CH3)-) и т.п.
[0037] "Алкинил" относится к радикалу углеводородной группы с неразветвленной или разветвленной цепью, содержащей от 2 до 20 атомов углерода, одну или более тройных связей углерод-углерод (например, 1, 2, 3 или 4 тройных связи) и необязательно одну или более двойных связей (например, 1, 2, 3 или 4 двойные связи) ("C2-20алкинил"). Алкинильная группа, которая содержит одну или более тройных связей и одну или более двойных связей также обозначают как "ен-иеновая" группа. В некоторых вариантах осуществления алкинильная группа содержит от 2 до 10 атомов углерода ("C2-10алкинил"). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 9 атомов углерода ("C2-9алкинил"). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 8 атомы углерода ("C2-8 алкинил"). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 7 атомов углерода ("C2-7алкинил"). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 6 атомов углерода ("C2-6алкинил"). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 5 атомов углерода ("C2-5алкинил"). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 4 атомов углерода ("C2-4алкинил"). В некоторых вариантах осуществления алкинильная группа содержит от 2 до 3 атомов углерода ("C2-3алкинил"). В некоторых вариантах осуществления алкинильная группа содержит 2 атома углерода ("С2алкинил"). Одна или более тройных связей углерод-углерод могут являться внутренними (такими как в 2-бутиниле) или конечными (такими как в 1-бутиниле). Примеры C2-4алкинильных групп включают без ограничения этинил (C2), 1-пропинил (C3), 2-пропинил (C3), 1-бутинил (C4), 2-бутинил (C4) и т.п. Примеры C2-6алкенильных групп включают указанные выше C2-4алкинильные группы, а также пентинил (C5), гексинил (C6) и т.п. Дополнительные примеры алкинила включают гептинил (C7), октинил (C8) и т.п. Если не указано иное, каждая из алкинильных групп независимо необязательно является замещенной, например, незамещенной ("незамещенный алкинил") или замещенной ("замещенный алкинил") одним или несколькими заместителями, например, от 1 до 5 заместителями, от 1 до 3 заместителями или 1 заместителем. В определенных вариантах осуществления изобретения алкинильная группа представляет собой незамещенный C2-10алкинил. В определенных вариантах осуществления изобретения алкинильная группа представляет собой замещенный C2-10алкинил.
[0038] "Алкинилен" относится к линейной алкинильной группе, где удаляют два водорода с получением двухвалентного радикала, и которая может являться замещенной или незамещенной. Иллюстративные двухвалентные алкиниленовые группы включают, но не ограничиваются ими, замещенный или незамещенный этинилен, замещенный или незамещенный пропинилен и т.п.
[0039] Термин "гетероалкил", как используют в настоящем описании, относится к алкильной группе, как определено в настоящем описании, которая дополнительно содержит 1 или более (например, 1, 2, 3 или 4) гетероатомов (например, кислород, серу, азот, бор, кремний, фосфор) в родительской цепи, где один или более гетероатомов введены между смежными атомами углерода в родительской углеродной цепи, и/или один или более гетероатомов введены между атомом углерода и родительской молекулой, например, между точкой прикрепления. В определенных вариантах осуществления изобретения гетероалкильная группа относится к насыщенной группе, содержащей от 1 до 10 атомов углерода и 1, 2, 3 или 4 гетероатома ("гетеро(C1-10)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 9 атомов углерода и 1, 2, 3 или 4 гетероатома ("гетеро(C1-9)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 8 атомов углерода и 1, 2, 3 или 4 гетероатома ("гетеро(C1-8)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 7 атомов углерода и 1, 2, 3 или 4 гетероатома ("гетеро(C1-7)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой группу, содержащую от 1 до 6 атомов углерода и 1, 2 или 3 гетероатома ("гетеро(C1-6)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 5 атомов углерода и 1 или 2 гетероатома ("гетеро(C1-5)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 4 атомов углерода и 1 или 2 гетероатома ("гетеро(C1-4)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 3 атомов углерода и 1 гетероатом ("гетеро(C1-3)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 2 атомов углерода и 1 гетероатом ("гетеро(C1-2)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую 1 атом углерода и 1 гетероатом ("гетеро(C1)алкил"). В некоторых вариантах осуществления гетероалкильная группа представляет собой насыщенную группу, содержащую от 2 до 6 атомов углерода и 1 или 2 гетероатома ("гетеро(C2-6)алкил"). Если не указано иное, каждая из гетероалкильных групп независимо является незамещенной ("незамещенной гетероалкил") или замещенной ("замещенный гетероалкил") одним или несколькими заместителями. В определенных вариантах осуществления изобретения гетероалкильная группа представляет собой незамещенный гетеро(C1-10)алкил. В определенных вариантах осуществления изобретения гетероалкильная группа представляет собой замещенный гетеро(C1-10)алкил.
[0040] Термин "гетероалкенил", как используют в настоящем описании, относится к алкенильной группе, как определено в настоящем описании, которая дополнительно содержит один или более (например, 1, 2, 3 или 4) гетероатомов (например, кислород, серу, азот, бор, кремний, фосфор), где один или более гетероатомов введены между смежными атомами углерода в родительской углеродной цепи, и/или один или более гетероатомов введены между атомом углерода и родительской молекулой, например, между точкой прикрепления. В определенных вариантах осуществления изобретения гетероалкенильная группа относится к группе, содержащей от 2 до 10 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатомов ("гетеро(C2-10)алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит от 2 до 9 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома ("гетеро(C2-9)алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит от 2 до 8 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома ("гетеро(C2-8)алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит от 2 до 7 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома ("гетеро(C2-7)алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну двойную связь и 1, 2 или 3 гетероатома ("гетеро(C2-6)алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит от 2 до 5 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома ("гетеро(C2-5)алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит от 2 до 4 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома ("гетеро(C2-4)алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит от 2 до 3 атомов углерода, по меньшей мере одну двойную связь и 1 гетероатом ("гетеро(C2-3)алкенил"). В некоторых вариантах осуществления гетероалкенильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома ("гетеро(C2-6)алкенил"). Если не указано иное, каждая из гетероалкенильных групп независимо является незамещенной ("незамещенный гетероалкенил") или замещенной ("замещенный гетероалкенил") одним или несколькими заместителями. В определенных вариантах осуществления изобретения гетероалкенильная группа представляет собой незамещенный гетеро(C2-10)алкенил. В определенных вариантах осуществления изобретения гетероалкенильная группа представляет собой замещенный гетеро(C2-10)алкенил.
[0041] Термин "гетероалкинил", как используют в настоящем описании, относится к алкинильной группе, как определено в настоящем описании, которая дополнительно содержит один или более (например, 1, 2, 3 или 4) гетероатомов (например, кислород, серу, азот, бор, кремний, фосфор), где один или более гетероатомов введены между смежными атомами углерода в родительской углеродной цепи, и/или один или более гетероатомов введены между атомом углерода и родительской молекулой, например, между точкой прикрепления. В определенных вариантах осуществления изобретения гетероалкинильная группа относится к группе, содержащей от 2 до 10 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома ("гетеро(C2-10)алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит от 2 до 9 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома ("гетеро(C2-9)алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит от 2 до 8 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома ("гетеро(C2-8)алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит от 2 до 7 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома ("гетеро(C2-7)алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну тройную связь и 1, 2 или 3 гетероатома ("гетеро(C2-6)алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит от 2 до 5 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома ("гетеро(C2-5)алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит от 2 до 4 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома ("гетеро(C2-4)алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит от 2 до 3 атомов углерода, по меньшей мере одну тройную связь и 1 гетероатом ("гетеро(C2-3)алкинил"). В некоторых вариантах осуществления гетероалкинильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома ("гетеро(C2-6)алкинил"). Если не указано иное, каждая из гетероалкинильных групп независимо является незамещенной ("незамещенный гетероалкинил") или замещенной ("замещенный гетероалкинил") одним или несколькими заместителями. В определенных вариантах осуществления изобретения гетероалкинильная группа представляет собой незамещенный гетеро(C2-10)алкинил. В определенных вариантах осуществления изобретения гетероалкинильная группа представляет собой замещенный гетеро(C2-10)алкинил.
[0042] Как используют в настоящем описании, "алкилен", "алкенилен", "алкинилен", "гетероалкилен", "гетероалкенилен" и "гетероалкинилен" относятся к двухвалентному радикалу алкила, алкенила, алкинильной группы, гетероалкила, гетероалкенила и гетероалкинильной группы соответственно. Когда диапазон или количество атомов углерода предоставлено для конкретной "алкиленовой", "алкениленовой", "алкиниленовой", "гетероалкиленовой", "гетероалкениленовой" или "гетероалкиниленовой" группы, следует понимать, что диапазон или количество относится к диапазону или количеству атомов углерода в линейной углеродной двухвалентной цепи. "Алкиленовая", "алкениленовая", "алкиниленовая", "гетероалкиленовая", "гетероалкениленовая" и "гетероалкиниленовая" группы могут являться замещенными или незамещенными одним или несколькими заместителями, как описано в настоящем описании.
[0043] "Арил" относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) ароматической циклической системы 4n+2 (например, содержащей 6, 10 или 14 π электронов, общих для циклической системы), содержащей 6-14 атомов углерода в кольце, и гетероатомы не содержатся в ароматической циклической системе ("C6-14арил"). В некоторых вариантах осуществления арильная группа содержит шесть атомов углерода в кольце ("С6арил", например, фенил). В некоторых вариантах осуществления арильная группа содержит десять атомов углерода в кольце ("С10арил", например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых вариантах осуществления арильная группа содержит четырнадцать атомов углерода в кольце ("С14арил", например, антрацил). "Арил" также включает циклические системы, где арильное кольцо, как определено выше, является конденсированным с одной или несколькими карбоциклильными или гетероциклильными группами, где радикал или точка присоединения находится на арильном кольце, и в таких случаях количество атомов углерода продолжает обозначать количество атомов углерода в арильной циклической системе. Характерные арильные группы включают, но не ограничиваются ими, группы, получаемые из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, асимм.-индецена, симм.-индецена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеиадена, пирена, пирантрена, рубицена, трифенилена и тринафталина. В частности арильные группы включают фенил, нафтил, инденил и тетрагидронафтил. Если не указано иное, каждая из арильных групп независимо необязательно является замещенной, например, незамещенной ("незамещенный арил") или замещенной ("замещенный арил") одним или несколькими заместителями. В определенных вариантах осуществления изобретения арильная группа представляет собой незамещенный C6-14арил. В определенных вариантах осуществления изобретения арильная группа представляет собой замещенный C6-14арил.
[0044] В определенных вариантах осуществления изобретения арильная группа замещена одной или несколькими группами, выбранными из галогена, C1-С8алкила, C1-С8галогеналкила, циано, гидрокси, C1-С8алкокси и амино.
[0045] Примеры характерных замещенных арилов включают следующие

где один из R56 и R57 может представлять собой водород, и по меньшей мере один из R56 и R57 каждый независимо выбран из C1-С8алкила, C1-С8галогеналкила, 4-10-членного гетероциклила, алканоила, C1-С8алкокси, гетероарилокси, алкиламино, ариламино, гетероариламино, NR58COR59, NR58SOR59 NR58SO2R59, COO-алкила, COO-арила, CONR58R59, CONR58OR59, NR58R59, SO2NR58R59, S-алкила, SO-алкила, SO2-алкила, S-арила, SO-арила, SO2-арила, или R56 и R57 могут быть связаны с образованием циклического кольца (насыщенного или ненасыщенного) от 5 до 8 атомов, необязательно содержащего один или более гетероатомов, выбранных из группы N, O или S. R60 и R61 независимо представляют собой водород, C1-С8алкил, C1-С4галогеналкил, C3-С10циклоалкил, 4-10-членный гетероциклил, C6-С10арил, замещенный C6-С10арил, 5-10-членный гетероарил или замещенный 5-10-членный гетероарил.
[0046] Другие характерные арильные группы, содержащие конденсированную гетероциклильную группу, включают следующие:

где каждый W выбран из C(R66)2, NR66, O и S, и каждый Y выбран из карбонила, NR66, O и S, и R66 независимо представляет собой водород, C1-С8алкил, C3-С10циклоалкил, 4-10-членный гетероциклил, C6-С10арил и 5-10-членный гетероарил.
[0047] "Конденсированный арил" относится к арилу, содержащему два общих углерода в своем кольце со вторым арилом или гетероарильным кольцом, или с карбоциклилом или гетероциклильным кольцом.
[0048] "Аралкил" представляет собой подгруппу алкила и арила, как определено в настоящем описании, и необязательно относится к замещенной алкильной группе, замещенной необязательно замещенной арильной группой.
[0049] "Гетероарил" относится к радикалу 5-10-членной моноциклической или бициклической ароматической циклической системы 4n+2 (например, содержащей 6 или 10 π электронов, общих с циклической системой), содержащей атомы углерода в кольце и 1-4 гетероатома в кольце, предоставленных в ароматической циклической системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-10-членный гетероарил"). В гетероарильных группах, которые содержат один или более атомов азота, точка прикрепления может представлять собой атом углерода или азота, в зависимости от валентности. Гетероарильные бициклические системы могут содержать один или более гетероатомов в одном или обоих кольцах. "Гетероарил" включает циклические системы, где гетероарильное кольцо, как определено выше, конденсировано с одним или несколькими карбоциклильными или гетероциклильными группами, где точка присоединения находится на гетероарильном кольце, и в таких случаях количество членов кольца продолжает обозначать количество членов кольца в гетероарильной циклической системе. "Гетероарил" также включает циклические системы, где гетероарильное кольцо, как определено выше, является конденсированным с одной или несколькими арильными группами, где точка присоединения находится на арильном или гетероарильном кольце, и в таких случаях количество членов в кольце означает количество членов в кольце в конденсированной (арильной/гетероарильной) циклической системе. В бициклических гетероарильных группах, где одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил и т.п.), точка присоединения может находиться на кольце, например, на кольце, содержащем гетероатом, (например, 2-индолиле) или на кольце, которое не содержит гетероатом, (например, 5-индолиле).
[0050] В некоторых вариантах осуществления гетероарильная группа представляет собой 5-10-членную ароматическую циклическую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, предоставленных в ароматической циклической системе, где каждый гетероатом независимо выбран из азота, кислорода и серы, ("5-10-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-8-членную ароматическую циклическую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, предоставленных в ароматической циклической системе, где каждый гетероатом независимо выбран из азота, кислорода и серы, ("5-8-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-6-членную ароматическую циклическую систему, содержащую атомы углерода в кольце и 1-4 гетероатома в кольце, предоставленных в ароматической циклической системе, где каждый гетероатом независимо выбран из азота, кислорода и серы, ("5-6-членный гетероарил"). В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1-3 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1-2 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил содержит 1 гетероатом в кольце, выбранный из азота, кислорода и серы. Если не указано иное, каждая из гетероарильных групп независимо необязательно является замещенной, например, незамещенной ("незамещенный гетероарил") или замещенной ("замещенный гетероарил") одним или несколькими заместителями. В определенных вариантах осуществления изобретения гетероарильная группа представляет собой незамещенный 5-14-членный гетероарил. В определенных вариантах осуществления изобретения гетероарильная группа представляет собой замещенный 5-14-членный гетероарил.
[0051] Иллюстративные 5-членные гетероарильные группы, содержащие один гетероатом, включают без ограничения пирролил, фуранил и тиофенил. Иллюстративные 5-членные гетероарильные группы, содержащие два гетероатома, включают без ограничения имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Иллюстративные 5-членные гетероарильные группы, содержащие три гетероатома, включают без ограничения триазолил, оксадиазолил и тиадиазолил. Иллюстративные 5-членные гетероарильные группы, содержащие четыре гетероатома, включают без ограничения тетразолил. Иллюстративные 6-членные гетероарильные группы, содержащие один гетероатом, включают без ограничения пиридинил. Иллюстративные 6-членные гетероарильные группы, содержащие два гетероатома, включают без ограничения пиридазинил, пиримидинил и пиразинил. Иллюстративные 6-членные гетероарильные группы, содержащие три или четыре гетероатома, включают без ограничения триазинил и тетразинил соответственно. Иллюстративные 7-членные гетероарильные группы, содержащие один гетероатом, включают без ограничения азепинил, оксепинил и тиепинил. Иллюстративные 5,6-бициклические гетероарильные группы включают без ограничения индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Иллюстративные 6,6-бициклические гетероарильные группы включают без ограничения нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
[0052] Примеры характерных гетероарилов включают следующие:
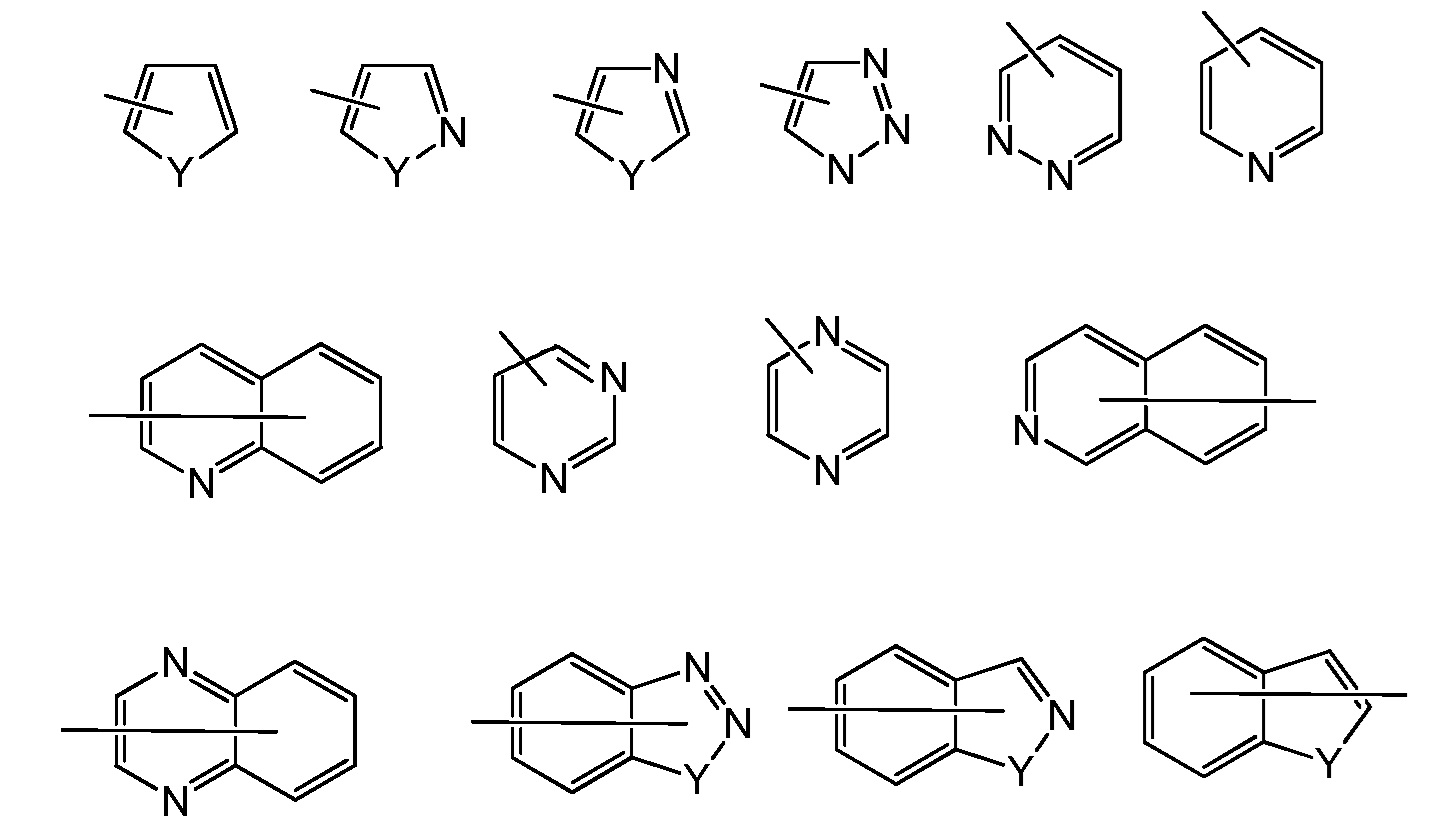
где каждый Y выбран из карбонила, N, NR65, O, и S, и R65 независимо представляет собой водород, C1-С8алкил, C3-С10циклоалкил, 4-10-членный гетероциклил, C6-С10арил и 5-10-членный гетероарил.
[0053] "Гетероаралкил" представляет собой подгруппу алкила и гетероарила, как определено в настоящем описании, и необязательно относится к замещенной алкильной группе, замещенной необязательно замещенной гетероарильной группой.
[0054] "Карбоциклил" или "карбоциклический" относится к радикалу неароматической циклической углеводородной группы, содержащей от 3 до 10 атомов углерода в кольце ("C3-10карбоциклил"), и не содержащей гетероатомы в неароматической циклической системе. В некоторых вариантах осуществления карбоциклильная группа содержит от 3 до 8 атомов углерода в кольце ("C3-8карбоциклил"). В некоторых вариантах осуществления карбоциклильная группа содержит от 3 до 6 атомов углерода в кольце ("C3-6карбоциклил"). В некоторых вариантах осуществления карбоциклильная группа содержит от 3 до 6 атомов углерода в кольце ("C3-6карбоциклил"). В некоторых вариантах осуществления карбоциклильная группа содержит от 5 до 10 атомов углерода в кольце ("C5-10карбоциклил"). Иллюстративные C3-6 карбоциклильные группы в качестве неограничивающих примеров включают, циклопропил (C3), циклопропенил (C3), циклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и т.п. Иллюстративные C3-8карбоциклильные группы включают без ограничения указанные выше C3-6карбоциклильные группы, а также циклогептил (C7), циклогептенил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), циклооктенил (C8), бицикло[2.2.1]гептанил (C7), бицикло[2.2.2]октанил (C8) и т.п. Иллюстративные C3-10карбоциклильные группы включают без ограничения указанные выше C3-8карбоциклильные группы, а также циклононил (C9), циклононенил (C9), циклодецил (C10), циклодеценил (C10), октагидро-1H-инденил (C9), декагидронафталенил (C10), спиро[4,5]деканил (C10) и т.п. Как указанные выше примеры иллюстрируют, в определенных вариантах осуществления карбоциклильные группы являются моноциклическими ("моноциклический карбоциклил") или содержат конденсированную, мостиковую или спиро-циклическую систему, такую как бициклическая система ("бициклический карбоциклил"), и могут являться насыщенными или могут являться частично ненасыщенными. "Карбоциклил" также включает циклические системы, где карбоциклильное кольцо, как определено выше, конденсировано с одним или несколькими арилами или гетероарильными группами, где точка присоединения находится на карбоциклильном кольце, и в таких случаях, количество атомов углерода продолжает обозначать количество атомов углерода в карбоциклической системе. Если не указано иное, каждая карбоциклильная группа независимо необязательно является замещенной, например, незамещенной ("незамещенный карбоциклил") или замещенной ("замещенный карбоциклил") одним или несколькими заместителями. В определенных вариантах осуществления изобретения карбоциклильная группа представляет собой незамещенный C3-10карбоциклил. В определенных вариантах осуществления изобретения карбоциклильная группа представляет собой замещенный C3-10карбоциклил.
[0055] В некоторых вариантах осуществления "карбоциклил" представляет собой моноциклическую, насыщенную карбоциклильную группу, содержащую от 3 до 10 атомов углерода в кольце ("C3-10циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит от 3 до 8 атомов углерода в кольце ("C3-8циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит от 3 до 6 атомов углерода в кольце ("C3-6циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит от 5 до 6 атомов углерода в кольце ("C5-6циклоалкил"). В некоторых вариантах осуществления циклоалкильная группа содержит от 5 до 10 атомов углерода в кольце ("C5-10циклоалкил"). Примеры C5-6циклоалкильных групп включают циклопентил (C5) и циклогексил (C5). Примеры C3-6циклоалкильных групп включают указанные выше C5-6циклоалкильные группы, а также циклопропил (C3) и циклобутил (C4). Примеры C3-8циклоалкильных групп включают указанные выше C3-6циклоалкильные группы, а также циклогептил (C7) и циклооктил (C8). Если не указано иное, каждая из циклоалкильных групп независимо является незамещенной ("незамещенный циклоалкил") или замещенной ("замещенный циклоалкил") одним или несколькими заместителями. В определенных вариантах осуществления изобретения циклоалкильная группа представляет собой незамещенный C3-10циклоалкил. В определенных вариантах осуществления изобретения циклоалкильная группа представляет собой замещенный C3-10циклоалкил.
[0056] "Гетероциклил" или "гетероциклический" относится к радикалу 3-10-членной неароматической циклической системы, содержащей атомы углерода в кольце и от 1 до 4 гетероатомов в кольце, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния ("3-10-членный гетероциклил"). В гетероциклильных группах, которые содержат один или более атомов азота, точкой присоединения может являться атом углерода или азота в зависимости от валентности. Гетероциклильная группа может являться моноциклической ("моноциклический гетероциклил") или конденсированной, мостиковой или спиро-циклической системой, такой как бициклическая система ("бициклический гетероциклил"), и может являться насыщенной или может являться частично ненасыщенной. Гетероциклильные бициклические системы могут содержать один или более гетероатомов в одном или обоих кольцах. "Гетероциклил" также включает циклические системы, где гетероциклильное кольцо, как определено выше, является конденсированным с одной или несколькими карбоциклильными группами, где точка присоединения находится на карбоциклильном или гетероциклильном кольце, или циклические системы, где гетероциклильное кольцо, как определено выше, является конденсированным с одной или несколькими арильными или гетероарильными группами, где точка присоединения находится на гетероциклильном кольце, и в таких случаях количество членов в кольце продолжает обозначать количество членов в гетероциклильной циклической системе. Если не указано иное, каждый из гетероциклилов независимо необязательно является замещенным, например, незамещенным ("незамещенный гетероциклил") или замещенным ("замещенный гетероциклил") одним или несколькими заместителями. В определенных вариантах осуществления изобретения гетероциклильная группа представляет собой незамещенный 3-10-членный гетероциклил. В определенных вариантах осуществления изобретения гетероциклильная группа представляет собой замещенный 3-10-членный гетероциклил.
[0057] В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-10-членную неароматическую циклическую систему, содержащую атомы углерода в кольце и 1-4 гетероатомов в кольце, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния ("5-10-членный гетероциклил"). В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-8-членную неароматическую циклическую систему, содержащую атомы углерода в кольце и 1-4 гетероатомов в кольце, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-8-членный гетероциклил"). В некоторых вариантах осуществления гетероциклильная группа представляет собой 5-6-членную неароматическую циклическую систему, содержащую атомов углерода в кольце и 1-4 гетероатомов в кольце, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-6-членный гетероциклил"). В некоторых вариантах осуществления 5-6-членный гетероциклил содержит 1-3 гетероатомов в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероциклил содержит 1-2 гетероатома в кольце, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6 членный гетероциклил содержит один гетероатом в кольце, выбранный из азота, кислорода и серы.
[0058] Иллюстративные 3-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения азирдинил, оксиранил, тиоренил. Иллюстративные 4-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения азетидинил, оксетанил и тиетанил. Иллюстративные 5-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Иллюстративные 5-членные гетероциклильные группы, содержащие два гетероатома, включают без ограничения диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Иллюстративные 5-членные гетероциклильные группы, содержащие три гетероатома, включают без ограничения триазолинил, оксадиазолинил и тиадиазолинил. Иллюстративные 6-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Иллюстративные 6-членные гетероциклильные группы, содержащие два гетероатома, включают без ограничения пиперазинил, морфолинил, дитианил, диоксанил. Иллюстративные 6-членные гетероциклильные группы, содержащие два гетероатома, включают без ограничения триазинанил. Иллюстративные 7-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения азепанил, оксепанил и тиепанил. Иллюстративные 8-членные гетероциклильные группы, содержащие один гетероатом, включают без ограничения азоканил, оксеканил и тиоканил. Иллюстративные 5-членные гетероциклильные группы, конденсированные с С6арильным кольцом, (также обозначаемые в настоящем описании как 5,6-бициклическое гетероциклическое кольцо) включают без ограничения индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и т.п. Иллюстративные 6-членные гетероциклильные группы, конденсированные с арильным кольцом, (также обозначаемые в настоящем описании как 6,6-бициклическое гетероциклическое кольцо) включают без ограничения тетрагидрохинолинил, тетрагидроизохинолинил и т.п.
[0059] Конкретные примеры гетероциклильных групп продемонстрированы в следующих ниже иллюстративных примерах:

где каждый W выбран из CR67, C(R67)2, NR67, O и S, и каждый Y выбран из NR67, O и S; и R67 независимо представляет собой водород, C1-С8алкил, C3-С10циклоалкил, 4-10-членный гетероциклил, C6-С10арил, 5-10-членный гетероарил. Эти гетероциклильные кольца могут необязательно являться замещенными одной или несколькими группами, выбранными из группы, состоящей из ацила, ациламино, ацилокси, алкокси, алкоксикарбонил, алкоксикарбониламино, амино, замещенной амино, аминокарбонилом (карбамоилом или амидо), аминокарбониламино, аминосульфонилом, сульфониламино, арилом, арилокси, азидо, карбоксилом, циано, циклоалкилом, галогеном, гидрокси, кето, нитро, тиолом, -S-алкилом, -S-арилом, -S(O)-алкилом, -S(O)-арилом, -S(O)2-алкилом и -S(O)2-арилом. Замещающие группы включают карбонил или тиокарбонил, которые предоставляют, например, лактам и производные мочевины.
[0060] "Гетеро" при использовании для описания соединения или группы, предоставленной на соединении, означает, что один или более атомов углерода в соединении или группу были заменены гетероатом азота, кислорода или серы. Гетеро можно применять к любой из описанных выше алкильных групп, таких как алкил, например, гетероалкил, циклоалкил, например, гетероциклил, арил, например, гетероарил, циклоалкенил, например, циклогетероалкенил, и т.п., содержащих от 1 до 5, и в частности от 1 до 3 гетероатомов.
[0061] "Ацил" относится к радикалу -C(O)R20, где R20 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящем описании. "Алканоил" представляет собой ацильную группу, где R20 представляет собой группу, отличную от водорода. Характерные ацильные группы включают, но не ограничиваются ими, формил (-CHO), ацетил (-C(=O)CH3), циклогексилкарбонил, циклогексилметилкарбонил, бензоил (-C(=O)Ph), бензилкарбонил (-C(=O)CH2Ph), -C(O)-C1-Салкил, -C(O)-(CH2)t(C6-С10арил), -C(O)-(CH2)t(5-10-членный гетероарил), -C(O)-(CH2)t(C3-С10циклоалкил) и -C(O)-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4. В определенных вариантах осуществления изобретения R21 представляет собой C1-С8алкил, замещенный галогеном или гидрокси, или C3-С10циклоалкил, 4-10-членный гетероциклил, C6-С10арил, арилалкил, 5-10членный гетероарил или гетероарилалкил, каждый из которых является замещенным незамещенным C1-С4алкилом, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-С4гидроксиалкилом или незамещенным C1-С4галогеналкокси или гидрокси.
[0062] "Ациламино" относится к радикалу -NR22C(O)R23, где каждый из R22 и R23 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящем описании, или R22 представляет собой защитную аминогруппу. Иллюстративные "ациламино" группы включают, но не ограничиваются, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметилкарбониламино, бензоиламино и бензилкарбониламино. Конкретные иллюстративные "ациламино" группы представляют собой -NR24C(O)-C1-С8алкил, -NR24C(O)-(CH2)t(C6-С10арил), -NR24C(O)-(CH2)t(5-10-членный гетероарил), -NR24C(O)-(CH2)t(C3-С10циклоалкил) и -NR24C(O)-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4, и каждый R24 независимо представляет собой H или C1-С8алкил. В определенных вариантах осуществления изобретения R25 представляет собой H, C1-С8алкил, замещенный галогеном или гидрокси, C3-С10циклоалкил, 4-10-членный гетероциклил, C6-С10арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-С4алкилом, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-С4гидроксиалкилом или незамещенным C1-С4галогеналкокси или гидрокси, и R26 представляет собой H, C1-С8алкил, замещенный галогеном или гидрокси; C3-С10циклоалкил, 4-10-членный гетероциклил, C6-С10арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-С4алкил, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-С4гидроксиалкилом или незамещенным C1-С4галогеналкокси или гидроксилом, при условии, что по меньшей мере один из R25 и R26 является отличным от H.
[0063] "Ацилокси" относится к радикалу -OC(O)R27, где R27 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящем описании. Характерные примеры включают, но не ограничиваются ими, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил и бензилкарбонил. В определенных вариантах осуществления изобретения R28 представляет собой C1-С8алкил, замещенный галогеном или гидрокси, C3-С10циклоалкил, 4-10-членный гетероциклил, C6-С10арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-С4алкилом, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-С4гидроксиалкилом или незамещенным C1-С4галогеналкокси или гидрокси.
[0064] "Алкокси" относится к группе -OR29, где R29 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Конкретные алкоксигруппы представляют собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Конкретные алкоксигруппы представляют собой низший алкокси, например, с 1-6 атомами углерода. Дополнительные конкретные алкоксигруппы содержат от 1 до 4 атомов углерода.
[0065] В определенных вариантах осуществления изобретения R29 представляет собой группу, которая содержит 1 или более заместителей, например, от 1 до 5 заместителей, и в частности от 1 до 3 заместителей, в частности 1 заместитель, выбранных из группы, состоящей из амино, замещенного амино, C6-С10арила, арилокси, карбоксила, циано, C3-С10циклоалкила, 4-10-членного гетероциклила, галогена, 5-10-членного гетероарила, гидроксила, нитро, тиоалкокси, тиоарилокси, тиола, алкил-S(O)-, арил-S(O)-, алкил-S(O)2- и арил-S(O)2-. Иллюстративные "замещенные алкокси" группы включают, но не ограничиваются ими, -O-(CH2)t(C6-С10арил), -O-(CH2)t(5-10-членный гетероарил), -O-(CH2)t(C3-С10циклоалкил) и -O-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4 и любой арил, гетероарил, циклоалкил, или содержащиеся гетероциклильные группы сами по себе могут являться замещенными незамещенным C1-С4алкилом, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-С4гелогеналкокси или гидрокси. Конкретные иллюстративные "замещенные алкокси" группы представляют собой -OCF3, -OCH2CF3, -OCH2Ph, -OCH2-циклопропил, -OCH2CH2OH и -OCH2CH2NMe2.
[0066] "Амино" относится к радикалу -NH2.
[0067] "Замещенный амино" относится к аминогруппе формулы -N(R38)2, где R38 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или защитную аминогруппу, где по меньшей мере один из R38 не является водородом. В определенных вариантах осуществления изобретения каждый R38 независимо выбран из водорода, C1-С8алкила, C3-С8алкенила, C3-С8алкинила, C6-С10арила, 5-10-членного гетероарила, 4-10-членного гетероциклила или C3-С10циклоалкила, или C1-С8алкила, замещенного галогеном или гидрокси, C3-С8алкенила, замещенного галогеном или гидрокси, C3-С8алкинила, замещенного галогеном или гидрокси, или -(CH2)t(C6-С10арила), -(CH2)t(5-10-членного гетероарила), -(CH2)t(C3-С10циклоалкила) или -(CH2)t(4-10-членного гетероциклила), где t представляет собой целое число от 0 до 8, каждый из которых замещен незамещенным C1-С4алкилом, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-С4гидроксиалкилом или незамещенным C1-С4галогеналкокси или гидрокси, или обе группы R38 связаны с образованием алкиленовой группы.
[0068] Иллюстративные "замещенные амино" группы включают, но не ограничиваются ими, -NR39-C1-С8алкил, -NR39-(CH2)t(C6-С10арил), -NR39-(CH2)t(5-10-членный гетероарил), -NR39-(CH2)t(C3-С10циклоалкил) и -NR39-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4, например, 1 или 2, каждый R39 независимо представляет собой H или C1-С8алкил, и любые содержащиеся алкильные группы могут сами по себе являться замещенными галогеном, замещенным или незамещенным амино или гидрокси, и любой содержащийся арил, гетероарил, циклоалкил или гетероциклильные группы могут сами по себе являться замещенными C1-С4алкилом, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-С4гидроксиалкилом или незамещенным C1-С4галогеналкокси или гидрокси. Во избежание неопределенности термин "замещенный амино" включает группы алкиламино, замещенный алкиламино, алкилариламино, замещенный алкилариламино, ариламино, замещенный ариламино, диалкиламино и замещенный диалкиламино, как определено ниже. Замещенный амино включает монозамещенные и дизамещенные аминогруппы.
[0069] "Азидо" относится к радикалу -N3.
[0070] "Карбамоил" или "амидо" относится к радикалу -C(O)NH2.
[0071] "Замещенный карбамоил" или "замещенный амидо" относится к радикалу -C(O)N(R62)2, где каждый R62 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или защитную аминогруппу, где по меньшей мере один из R62 не является водородом. В определенных вариантах осуществления изобретения R62 выбран из H, C1-С8алкила, C3-С10циклоалкила, 4-10-членного гетероциклила, C6-С10арила, аралкила, 5-10-членного гетероарила и гетероаралкила, или C1-С8алкила, замещенного галогеном или гидрокси, или C3-С10циклоалкила, 4-10-членного гетероциклила, C6-С10арила, аралкила, 5-10-членного гетероарила или гетероаралкила, каждый из которых замещен незамещенным C1-С4алкилом, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-С4гидроксиалкилом или незамещенным C1-С4галогеналкокси или гидрокси, при условии, что по меньшей мере один R62 является отличным от H.
[0072] Иллюстративные "замещенные карбамоильные" группы включают, но не ограничиваются ими -C(O)NR64-C1-С8алкил, -C(O)NR64-(CH2)t(C6-С10арил), -C(O)N64-(CH2)t(5-10-членный гетероарил), -C(O)NR64-(CH2)t(C3-С10циклоалкил) и -C(O)NR64-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4, каждый R64 независимо представляет собой H или C1-С8алкил, и любой содержащийся арил, гетероарил, циклоалкил или гетероциклильные группы могут сами по себе являться замещенными незамещенным C1-С4алкилом, галогеном, незамещенным C1-С4алкокси, незамещенным C1-С4галогеналкилом, незамещенным C1-С4гидроксиалкилом или незамещенным C1-С4галогеналкокси или гидрокси.
[0073] "Карбокси" относится к радикалу -C(O)OH.
[0074] "Циано" относится к радикалу -CN.
[0075] "Гало" или "галоген" относится к фтору (F), хлору (Cl), брому (Br) и йоду (I). В определенных вариантах осуществления изобретения галогеновая группа представляет собой фтор или хлор.
[0076] "Гидрокси" относится к радикалу -OH.
[0077] "Нитро" относится к радикалу -NO2.
[0078] "Циклоалкилалкил" относится к алкильному радикалу, в котором алкильная группа замещена циклоалкильной группой. Иллюстративные циклоалкилалкильные группы включают, но не ограничиваются ими, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил, циклооктилметил, циклопропилэтил, циклобутилэтил, циклопентилэтил, циклогексилэтил, циклогептилэтил и циклооктилэтил, и т.п.
[0079] "Гетероциклилалкил" относится к алкильному радикалу, в котором алкильная группа замещена гетероциклильной группой. Иллюстративные гетероциклилалкильные группы включают, но не ограничиваются ими, пирролидинилметил, пиперидинилметил, пиперазинилметил, морфолинилметил, пирролидинилэтил, пиперидинилэтил, пиперазинилэтил, морфолинилэтил и т.п.
[0080] "Циклоалкенил" относится к замещенной или незамещенной карбоциклильной группе, содержащей от 3 до 10 атомов углерода и содержащей одно циклическое кольцо или много конденсированных колец, включая конденсированные и мостиковые циклические системы, и содержащей по меньшей мере один, и в частности от 1 до 2 участков олефиновой ненасыщенности. Такие циклоалкенильные группы в качестве примера включают отдельные циклические структуры, такие как циклогексенил, циклопентенил, циклопропенил и т.п.
[0081] "Конденсированный циклоалкенил" относится к циклоалкенилу, который среди своих атомов углерода в кольце имеет два общих атома со вторым алифатическим или ароматическим кольцом и содержит олефиновую ненасыщенность, расположенной чтобы придавать ароматические свойства циклоалкенильному кольцу.
[0082] "Этенил" относится к замещенной или незамещенной -(C=C)-.
[0083] "Этилен" относится к замещенной или незамещенной -(C-C)-.
[0084] "Этинил" относится к -(C≡C)-.
[0085] "Содержащая азот гетероциклильная" группа означает 4-7-членную неароматическую циклическую группу, содержащую по меньшей мере один атом азота, например, но без ограничения, морфолин, пиперидин (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например, 2-пирролидинил и 3-пирролидинил), азетидин, пирролидон, имидазолин, имидазолидинон, 2-пиразолин, пиразолидин, пиперазин и N-алкилпиперазины, такие как N-метилпиперазин. Конкретные примеры включают азетидин, пиперидон и пиперазон.
[0086] "Тиокето" относится к группе =S.
[0087] Алкильные, алкенильные, алкинильные, карбоциклильные, гетероциклильные, арильные и гетероарильные группы, как определено в настоящем описании, необязательно являются замещенными (например, "замещенная" или "незамещенная" алкильная, "замещенная" или "незамещенная" алкенильная, "замещенная" или "незамещенная" алкинильная, "замещенная" или "незамещенная" карбоциклильная, "замещенная" или "незамещенная" гетероциклильная, "замещенная" или "незамещенная" арильная или "замещенная" или "незамещенная" гетероарильная группа). Как правило, термин "замещенный", когда находится перед термином "необязательно" или не, означает, что по меньшей мере один водород, содержащийся в группе (например, при атоме углерода или азота), является замещенным возможным заместителем, например, заместителем, который при замещении приводит к стабильному соединению, например, соединению, которое не претерпевает спонтанно трансформацию, такую как посредством перегруппировки, циклизации, отщепления или другой реакции. Если не указано иное, "замещенная" группа содержит заместитель в одной или нескольких возможных для замещения положениях группы, и когда более одного положения в любой данной структуре является замещенным, заместитель является одинаковым или различным в каждом положении. Предполагают, что термин "замещенный" включает замены всех возможных заместителей органических соединений любым из заместителей, описываемых в настоящем описании, который приводит к образованию стабильного соединения. В настоящем изобретении рассматривают любую и все такие комбинации для получения стабильного соединения. Для целей настоящего изобретения гетероатомы, такие как азот, могут содержать водородные заместители и/или любой подходящий заместитель, как описано в настоящем описании, которые соответствуют валентностям гетероатомов и приводят к образованию стабильной группы.
[0088] Иллюстративные заместители атома углерода включают, но не ограничиваются ими, галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)2, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -OSi(Raa)3, -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)2Raa, -OP(=O)2Raa, -P(=O)(Raa)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)2N(Rbb)2, -OP(=O)2N(Rbb)2, -P(=O)(NRbb)2, -OP(=O)(NRbb)2, -NRbbP(=O)(ORcc)2, -NRbbP(=O)(NRbb)2, -P(Rcc)2, -P(Rcc)3, -OP(Rcc)2, -OP(Rcc)3, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), C1-10алкил, C1-10пергалогеналкил, C2-10алкенил, C2-10алкинил, C3-10карбоциклил, 3-14-членный гетероциклил, C6-14арил и 5-14-членный гетероарил, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или 5 группами Rdd; или два геминальных водорода при атоме углерода замещены группой =O, =S, =NN(Rbb)2, =NNRbbC(=O)Raa, =NNRbbC(=O)ORaa, =NNRbbS(=O)2Raa, =NRbb, или =NORcc; каждый из Raa независимо выбран из C1-10алкила, C1-10пергалогеналкила, C2-10алкенила, C2-10алкинила, C3-10карбоциклила, 3-14-членного гетероциклила, C6-14арила и 5-14-членного гетероарила, или две группы Raa связаны с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, ари, и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или 5 группами Rdd; каждый из Rbb независимо выбран из водорода, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10алкила, C1-10пергалогеналкила, C2-10алкенила, C2-10алкинила, C3-10карбоциклила, 3-14-членного гетероциклила, C6-14арила и 5-14-членного гетероарила, или две группы Rbb связаны с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или 5 группами Rdd; каждый из Rcc независимо выбран из водорода, C1-10алкила, C1-10пергалогеналкила, C2-10алкенила, C2-10алкинила, C3-10карбоциклила, 3-14-членного гетероциклила, C6-14арила и 5-14-членного гетероарила, или две группы Rcc связаны с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или 5 группами Rdd; каждый из Rdd независимо выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2, -NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(=O)Ree, -Si(Ree)3, -OSi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)2Ree, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6алкила, C1-6пергалогеналкила, C2-6алкенила, C2-6алкинила, C3-10карбоциклила, 3-10-членного гетероциклила, C6-10арила, 5-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или 5 группами Rgg, или два геминальных заместителя Rdd могут быть связаны с образованием =O или =S; каждый из Ree независимо выбран из C1-6алкила, C1-6пергалогеналкила, C2-6алкенила, C2-6алкинила, C3-10карбоциклила, C6-10арила, 3-10-членного гетероциклила и 3-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или 5 группами Rgg; каждый из Rff независимо выбран из водорода, C1-6алкила, C1-6пергалогеналкила, C2-6алкенила, C2-6алкинила, C3-10карбоциклила, 3-10-членного гетероциклила, C6-10арила и 5-10-членного гетероарила, или две группы Rff связаны с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или 5 группами Rgg; и кажды из Rgg независимо представляет собой галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -OC1-6алкил, -ON(C1-6алкил)2, -N(C1-6алкил)2, -N(C1-6алкил)3+X-, -NH(C1-6алкил)2+X-, -NH2(C1-6алкил)+X-, -NH3+X-, -N(OC1-6алкил)(C1-6алкил), -N(OH)(C1-6алкил), -NH(OH), -SH, -SC1-6алкил, -SS(C1-6алкил), -C(=O)(C1-6алкил), -CO2H, -CO2(C1-6алкил), -OC(=O)(C1-6алкил), -OCO2(C1-6алкил), -C(=O)NH2, -C(=O)N(C1-6алкил)2, -OC(=O)NH(C1-6алкил), -NHC(=O)(C1-6алкил), -N(C1-6алкил)C(=O)(C1-6алкил), -NHCO2(C1-6алкил), -NHC(=O)N(C1-6алкил)2, -NHC(=O)NH(C1-6алкил), -NHC(=O)NH2, -C(=NH)O(C1-6алкил), -OC(=NH)(C1-6алкил), -OC(=NH)OC1-6алкил, -C(=NH)N(C1-6алкил)2, -C(=NH)NH(C1-6алкил), -C(=NH)NH2, -OC(=NH)N(C1-6алкил)2, -OC(NH)NH(C1-6алкил), -OC(NH)NH2, -NHC(NH)N(C1-6алкил)2, -NHC(=NH)NH2, -NHSO2(C1-6алкил), -SO2N(C1-6алкил)2, -SO2NH(C1-6алкил), -SO2NH2, -SO2C1-6алкил, -SO2OC1-6алкил, -OSO2C1-6алкил, -SOC1-6алкил, -Si(C1-6алкил)3, -OSi(C1-6алкил)3 -C(=S)N(C1-6алкил)2, C(=S)NH(C1-6алкил), C(=S)NH2, -C(=O)S(C1-6алкил), -C(=S)SC1-6алкил, -SC(=S)SC1-6алкил, -P(=O)2(C1-6алкил), -P(=O)(C1-6алкил)2, -OP(=O)(C1-6алкил)2, -OP(=O)(OC1-6лкил)2, C1-6алкил, C1-6пергалогеналкил, C2-6алкенил, C2-6алкинил, C3-10карбоциклил, C6-10арил, 3-10-членный гетероциклил, 5-10-членный гетероарил; или два герминальных заместителя Rgg могут быть связаны с образованием =O или =S; где X- представляет собой противоион.
[0089] "Противоион" или "анионный противоион" представляет собой отрицательно заряженную группу, ассоциированную с катионной четвертичной аминогруппой для поддержания электронного равновесия. Иллюстративные противоионы включают ионы галогенидов (например, F-, Cl-, Br-, I-), NO3-, ClO4-, OH-, H2PO4-, HSO4-, сульфонатные ионы (например, метансульфонат, трифторметансульфонат, пара-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафталин-2-сульфонат, нафталин-1-сульфоновая кислота-5-сульфонат, этан-1-сульфоновая кислота-2-сульфонат и т.п.), и карбоксилатные ионы (например, ацетат, этаноат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят и т.п.).
[0090] Атомы азота могут являться замещенными или незамещенными в зависимости от валентности и включают первичные, вторичные, третичные и четвертичные атомы азота. Иллюстративные заместители атомов азота включают, но не ограничиваются ими, водород, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10алкил, C1-10пергалогеналкил, C2-10алкенил, C2-10алкинил, C3-10карбоциклил, 3-14-членный гетероциклил, C6-14арил и 5-14-членный гетероарил, или две группы Rcc, присоединенные к атому азота, являются соединенными с образованием 3-14-членного гетероциклильного или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или группами 5 Rdd, и где Raa, Rbb, Rcc и Rdd представляют собой такие, как определено выше.
[0091] В определенных вариантах осуществления изобретения заместитель, содержащийся при атоме азота, представляет собой защитную аминогруппу (также обозначаемую в настоящем описании как азотная защитная группа). Защитные аминогруппы включают, но не ограничиваются ими, -OH, -ORaa, -N(Rcc)2, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, C1-10алкил (например, аралкил, гетероаралкил), C2-10алкенил, C2-10алкинил, C3-10карбоциклил, 3-14-членный гетероциклил, C6-14арил и 5-14-членные гетероарильные группы, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, аралкил, арил и гетероарил является независимо замещенным 0, 1, 2, 3, 4 или 5 группами Rdd, и где Raa, Rbb, Rcc и Rdd представляют собой такие, как определено в настоящем описании. Защитные аминогруппы хорошо известны в данной области и включают такие, как подробно описанные в Protecting Groups in Organic Synthesis, T.W. Greene and P.G.M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенной в настоящее описание посредством ссылки.
[0092] Например, защитные аминогруппы, такие как амидные группы (например, -C(=O)Raa) включают, но не ограничиваются ими, формамид, ацетамид, хлорацетамид, трихлорацетамид, трифторацетамид, фенилацетамид, 3-фенилпропанамид, пиколинамид, 3-пиридилкарбоксамид, производное N-бензоилфенилаланила, бензамид, пара-фенилбензамид, орто-нитрофенилацетамид, орто-нитрофеноксиацетамид, ацетоацетацетамид, (N'-дитиобензилоксиациламино)ацетамид, 3-(пара-гидроксифенил)пропанамид, 3-(орто-нитрофенил)пропанамид, 2-метил-2-(орто-нитрофенокси)пропанамид, 2-метил-2-(орто-фенилазофенокси)пропанамид, 4-хлорбутанамид, 3-метил-3-нитробутанамид, орто-нитроциннамид, производное N-ацетилметионина, орто-нитробензамид и орто-(бензоилоксиметил)бензамид.
[0093] Защитные аминогруппы, такие как карбаматные группы (например, -C(=O)ORaa) включают, но не ограничиваются ими, метилкарбамат, этилкарбамат, 9-флуоренилметилкарбамат (Fmoc), 9-(2-сульфо)флуоренилметилкарбамат, 9-(2,7-дибром)флуоренилметилкарбамат, 2,7-ди-трет-бутил[9-(10,10-диоксо-10,10,10,10-тетрагидротиоксантил)]метилкарбамат (DBD-Tmoc), 4-метоксифенацилкарбамат (Phenoc), 2,2,2-трихлорэтилкарбамат (Troc), 2-триметилсилилэтилкарбамат (Teoc), 2-фенилэтилкарбамат (hZ), 1-(1-адамантил)-1-метилэтилкарбамат (Adpoc), 1,1-диметил-2-галогенэтилкарбамат, 1,1-диметил-2,2-дибромэтилкарбамат (DB-t-BOC), 1,1-диметил-2,2,2-трихлорэтилкарбамат (TCBOC), 1-метил-1-(4-бифенилил)этилкарбамат (Bpoc), 1-(3,5-ди-трет-бутилфенил)-1-метилэтилкарбамат (t-Bumeoc), 2-(2'- и 4'-пиридил)этилкарбамат (Pyoc), 2-(N,N-дициклогексилкарбоксамидо)этилкарбамат, трет-бутилкарбамат (BOC), 1-адамантилкарбамат (Adoc), винилкарбамат (Voc), аллилкарбамат (Alloc), 1-изопропилаллилкарбамат (Ipaoc), циннамилкарбамат (Coc), 4-нитроциннамилкарбамат (Noc), 8-хинолилкарбамат, N-гидроксипиперидинилкарбамат, алкилдитиокарбамат, бензилкарбамат (Cbz), пара-метоксибензилкарбамат (Moz), пара-нитробензилкарбамат, пара-бромбензилкарбамат, пара-хлорбензилкарбамат, 2,4-дихлорбензилкарбамат, 4-метилсульфинилбензилкарбамат (Msz), 9-антрилметилкарбамат, дифенилметилкарбамат, 2-метилтиоэтилкарбамат, 2-метилсульфонилэтилкарбамат, 2-(пара-толуолсульфонил)этилкарбамат, [2-(1,3-дитианил)]метилкарбамат (Dmoc), 4-метилтиофенилкарбамат (Mtpc), 2,4-диметилтиофенилкарбамат (Bmpc), 2-фосфониоэтилкарбамат (Peoc), 2-трифенилфосфониоизопропилкарбамат (Ppoc), 1,1-диметил-2-цианоэтилкарбамат, мета-хлор-пара-ацилоксибензилкарбамат, пара-(дигидроксиборил)бензилкарбамат, 5-бензизоксазолилметилкарбамат, 2-(трифторметил)-6-хромонилметилкарбамат (Tcroc), мета-нитрофенилкарбамат, 3,5-диметоксибензилкарбамат, орто-нитробензилкарбамат, 3,4-диметокси-6-нитробензилкарбамат, фенил(орто-нитрофенил)метилкарбамат, трет-амилкарбамат, S-бензилтиокарбамат, пара-цианобензилкарбамат, циклобутилкарбамат, циклогексилкарбамат, циклопентилкарбамат, циклопропилметилкарбамат, пара-децилоксибензилкарбамат, 2,2-диметоксиацилвинилкарбамат, орто-(N,N-диметилкарбоксамидо)бензилкарбамат, 1,1-диметил-3-(N,N-диметилкарбоксамидо)пропилкарбамат, 1,1-диметилпропинилкарбамат, ди(2-пиридил)метилкарбамат, 2-фуранилметилкарбамат, 2-йодэтилкарбамат, изоборилкарбамат, изобутилкарбамат, изоникотинилкарбамат, пара-(пара'-метоксифенилазо)бензилкарбамат, 1-метилциклобутилкарбамат, 1-метилциклогексилкарбамат, 1-метил-1-циклопропилметилкарбамат, 1-метил-1-(3,5-диметоксифенил)этилкарбамат, 1-метил-1-(пара-фенилазофенил)этилкарбамат, 1-метил-1-фенилэтилкарбамат, 1-метил-1-(4-пиридил)этилкарбамат, фенилкарбамат, пара-(фенилазо)бензилкарбамат, 2,4,6-три-трет-бутилфенилкарбамат, 4-(триметиламмоний)бензилкарбамат и 2,4,6-триметилбензилкарбамат.
[0094] Защитные аминогруппы, такие как сульфонамидный группы (например, -S(=O)2Raa), включают, но не ограничиваются ими, пара-толуолсульфонамид (Ts), бензолсульфонамид, 2,3,6,-триметил-4-метоксибензолсульфонамид (Mtr), 2,4,6-триметоксибензолсульфонамид (Mtb), 2,6-диметил-4-метоксибензолсульфонамид (Pme), 2,3,5,6-тетраметил-4-метоксибензолсульфонамид (Mte), 4-метоксибензолсульфонамид (Mbs), 2,4,6-триметилбензолсульфонамид (Mts), 2,6-диметокси-4-метилбензолсульфонамид (iMds), 2,2,5,7,8-пентаметилхроман-6-сульфонамид (Pmc), метансульфонамид (Ms), β-триметилсилилэтансульфонамид (SES), 9-антраценсульфонамид, 4-(4',8'-диметоксинафтилметил)бензолсульфонамид (DNMBS), бензилсульфонамид, трифторметилсульфонамид и фенацилсульфонамид.
[0095] Другие защитные аминогруппы включают, но не ограничиваются ими, производное фенотиазинил-(10)-ацила, производное N'-пара-толуолсульфониламиноацила, производное N'-фениламинотиоацила, производное N-бензоилфенилаланила, производное N-ацетилметионина, 4,5-дифенил-3-оксазолин-2-он, N-фталимид, N-дитиасукцинимид (Dts), N-2,3-дифенилмалеимид, N-2,5-диметилпиррол, аддукт N-1,1,4,4-тетраметилдисилилазациклопентана (STABASE), 5-замещенный 1,3-диметил-1,3,5-триазациклогексан-2-он, 5-замещенный 1,3-дибензил-1,3,5-триазациклогексан-2-он, 1-замещенный 3,5-динитро-4-пиридон, N-метиламин, N-аллиламин, N-[2-(триметилсилил)этокси]метиламин (SEM), N-3-ацетоксипропиламин, N-(1-изопропил-4-нитро-2-оксо-3-пироолин-3-ил)амин, четвертичные аммонийные соли, N-бензиламин, N-ди(4-метоксифенил)метиламин, N-5-дибензосубериламин, N-трифенилметиламин (Tr), N-[(4-метоксифенил)дифенилметил]амин (MMTr), N-9-фенилфлуорениламин (PhF), N-2,7-дихлор-9-флуоренилметиленамин, N-фероценилметиламино (Fcm), N-2-пиколиламино-N'-оксид, N-1,1-диметилтиометиленамин, N-бензилиденамин, N-p-метоксибензилиденамин, N-дифенилметиленамин, N-[(2-пиридил)мезитил]метиленамин, N-(N',N'-диметиламинометилен)амин, N,N'-изопропилидендиамин, N-пара-нитробензилиденамин, N-салицилиденамин, N-5-хлорсалицилиденамин, N-(5-хлор-2-гидроксифенил)фенилметиленамин, N-циклогексилиденамин, N-(5,5-диметил-3-оксо-1-циклогексенил)амин, производное N-борана, производное N-дифенилбориновой кислоты, N-[фенил(пентаацилхром- или вольфрам)ацил]амин, хелат N-меди, хелат N-цинка, N-нитроамин, N-нитрозоамин, амин-N-оксид, дифенилфосфинамид (Dpp), диметилтиофосфинамид (Mpt), дифенилтиофосфинамид (Ppt), диалкилфосфорамидаты, дибензилфосфорамидаты, дифенилфосфорамидаты, бензолсульфенамид, орто-нитробензолсульфенамид (Nps), 2,4-динитробензолсульфенамид, пентахлорбензолсульфенамид, 2-нитро-4-метоксибензолсульфенамид, трифенилметилсульфенамид и 3-нитропиридинсульфенамид (Npys).
[0096] В определенных вариантах осуществления изобретения заместитель, находящийся при атоме кислорода, представляет собой защитную группу кислорода (также обозначаемую как гидроксильная защитная группа). Защитные группы кислорода включают, но не ограничиваются ими, -Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3, -P(Rcc)2, -P(Rcc)3, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)2N(Rbb)2 и -P(=O)(NRbb)2, где Raa, Rbb и Rcc представляют собой такие, как определено в настоящем описании. Защитные группы кислорода хорошо известны в данной области и включают такие, как подробно описанные в Protecting Groups in Organic Synthesis, T. W. Greene and P. G. M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенной в настоящее описание посредством ссылки.
[0097] Иллюстративные защитные группы кислорода включают, но не ограничиваются ими, метил, метоксилметил (MOM), метилтиометил (MTM), трет-бутилтиометил, (фенилдиметилсилил)метоксиметил (SMOM), бензилоксиметил (BOM), пара-метоксибензилоксиметил (PMBM), (4-метоксифенокси)метил (p-AOM), гваяколметил (GUM), трет-бутоксиметил, 4-пентенилоксиметил (POM), силоксиметил, 2-метоксиэтоксиметил (MEM), 2,2,2-трихлорэтоксиметил, бис(2-хлорэтокси)метил, 2-(триметилсилил)этоксиметил (SEMOR), тетрагидропиранил (THP), 3-бромтетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, 4-метокситетрагидропиранил (MTHP), 4-метокситетрагидротиопиранил, 4-метокситетрагидротиопиранил S,S-диоксид, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ил (CTMP), 1,4-диоксан-2-ил, тетрагидрофуранил, тетрагидротиофуранил, 2,3,3a,4,5,6,7,7a-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-ил, 1-этоксиэтил, 1-(2-хлорэтокси)этил, 1-метил-1-метоксиэтил, 1-метил-1-бензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 2-(фенилселенил)этил, трет-бутил, аллил, пара-хлорфенил, пара-метоксифенил, 2,4-динитрофенил, бензил (Bn), пара-метоксибензил, 3,4-диметоксибензил, орто-нитробензил, пара-нитробензил, пара-галогенбензил, 2,6-дихлорбензил, пара-цианобензил, пара-фенилбензил, 2-пиколил, 4-пиколио, 3-метил-2-пиколил-N-оксидо, дифенилметил, пара,пара'-динитробензгидрил, 5-дибензосуберил, трифенилметил, α-нафтилдифенилметил, пара-метоксифенилдифенилметил, ди(пара-метоксифенил)фенилметил, три(пара-метоксифенил)метил, 4-(4'-бромфенацилоксифенил)дифенилметил, 4,4',4''-трис(4,5-дихлорфталимидофенил)метил, 4,4',4''-трис(левулиноилоксифенил)метил, 4,4',4''-трис(бензоилоксифенил)метил, 3-(имидазол-1-ил)бис(4',4''-диметоксифенил)метил, 1,1-бис(4-метоксифенил)-1'-пиренилметил, 9-антрил, 9-(9-фенил)ксантенил, 9-(9-фенил-10-оксо)антрил, 1,3-бензодисульфуран-2-ил, бензизотиазолил-S,S-диоксидо, триметилсилил (TMS), триэтилсилил (TES), триизопропилсилил (TIPS), диметилизопропилсилил (IPDMS), диэтилизопропилсилил (DEIPS), диметилгексилсилил, трет-бутилдиметилсилил (TBDMS), трет-бутилдифенилсилил (TBDPS), трибензилсилил, три-пара-ксилилсилил, трифенилсилил, дифенилметилсилил (DPMS), трет-бутилметоксифенилсилил (TBMPS), формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксиацетат, трифенилметоксиацетат, феноксиацетат, пара-хлорфеноксиацетат, 3-фенилпропионат, 4-оксопентаноат (левулинат), 4,4-(этилендитио)пентаноат (левулиноилдитиоацеталь), пивалоат, адамантоат, кротонат, 4-метоксикротонат, бензоат, пара-фенилбензоат, 2,4,6-триметилбензоат (мезитоат), алкилметилкарбонат, 9-флуоренилметилкарбонат (Fmoc), алкилэтилкарбонат, алкил-2,2,2-трихлорэтилкарбонат (Troc), 2-(триметилсилил)этилкарбонат (TMSEC), 2-(фенилсульфонил)этилкарбонат (Psec), 2-(трифенилфосфонио)этилкарбонат (Peoc), алкилизобутилкарбонат, алкилвинилкарбонат, алкилаллилкарбонат, алкил-пара-нитрофенилкарбонат, алкилбензилкарбонат, алкил-пара-метоксибензилкарбонат, алкил-3,4-диметоксибензилкарбонат, алкил-орто-нитробензилкарбонат, алкил-пара-нитробензилкарбонат, алкил-S-бензил тиокарбонат, 4-этокси-1-нафтилкарбонат, метилдитиокарбонат, 2-йодбензоат, 4-азидобутират, 4-нитро-4-метилпентаноат, орто-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси)этил, 4-(метилтиометокси)бутират, 2-(метилтиометоксиметил)бензоат, 2,6-дихлор-4-метилфеноксиацетат, 2,6-дихлор-4-(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукциноат, (E)-2-метил-2-бутеноат, орто-(метоксиацил)бензоат, α-нафтоат, нитрат, алкил-N,N,N',N'-тетраметилфосфородиамидат, алкил-N-фенилкарбамат, борат, диметилфосфинотиоил, алкил-2,4-динитрофенилсульфенат, сульфат, метансульфонат (мезилат), бензилсульфонат и тозилат (Ts).
[0098] В определенных вариантах осуществления изобретения заместитель, содержащийся при атоме серы, представляет собой защитную группу серы (также обозначаемую как тиольная защитная группа). Защитные группы серы включают, но не ограничиваются ими, -Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3, -P(Rcc)2, -P(Rcc)3, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)2N(Rbb)2 и -P(=O)(NRbb)2, где Raa, Rbb и Rcc представляют собой такие, как определено в настоящем описании. Защитные группы серы хорошо известны в данной области и включают такие, как подробно описанны в Protecting Groups in Organic Synthesis, T. W. Greene and P. G. M. Wuts, 3rd edition, John Wiley & Sons, 1999, включенной в настоящее описание посредством ссылки.
[0099] "Соединения по настоящему изобретению" и эквивалентные выражения предназначены включая соединения, такие как описанные выше в настоящем описании, в частности соединения по любой из формул в настоящем описании, перечисленных и/или описанных, где выражение включает пролекарства, фармацевтически приемлемые соли и сольваты, например, гидраты, если не противоречит контексту. Аналогично, ссылка на промежуточные соединения независимо от того, заявлены они сами по себе или не заявлены, предназначена включать их соли и сольваты, если не противоречит контексту.
[0100] Эти и другие иллюстративные заместители более подробно описаны в подробном описании, примерах и формуле изобретения. Предполагают, что изобретение не ограничено каким-либо образом указанным выше иллюстративным списком заместителей.
Другие определения
[0101] "Фармацевтически приемлемый" означает одобренный или апробированный регулирующим органом федеральным правительством или правительством штата, или соответствующего органа в странах отличных от США, или такие, которые перечислены в Фармакопеи США или другой общепризнанной фармакопеи для применения у животных и более конкретно у людей.
[0102] "Фармацевтически приемлемая соль" относится к соли соединения по изобретению, которая является фармацевтически приемлемой и которая обладает желаемой фармакологической активностью родительского соединения. В частности, такие соли являются нетоксичными, могут представлять собой неорганические или органические соли присоединения кислот и соли присоединения оснований. Конкретно такие соли включают: (1) соли присоединения кислот, образуемые неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или образуемые органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п., или (2) соли, образуемые, когда кислый протон, содержащийся в родительском соединении, замещен ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия, или координирует с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и т.п. Соли дополнительно включают, только в качестве примера, натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и т.п., и когда соединение содержит основную функциональность, включают соли нетоксичных органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и т.п. Термин "фармацевтически приемлемый катион" относится к приемлемому катионному противоиону кислотной функциональной группы. Иллюстративные примеры таких катионов представляют собой натрий, калий, кальций, магний, аммоний, катионы тетраалкиламмония и т.п. (см., например, Berge, et al., J. Pharm. Sci., 66(1):1-79 (Jan.77).
[0103] "Фармацевтически приемлемый носитель" относится к разбавителю, адъюванту, эксципиенту или носителю, с которым вводят соединение по изобретению.
[0104] "Фармацевтически приемлемая метаболически расщепляемая группа" относится к группе, которая расщепляется in vivo с получением родительской молекулы структурных формул, указанных в настоящем описании. Примеры метаболически расщепляемых групп включают радикалы -COR, -COOR, -CONRR и -CH2OR, где R выбран независимо в каждом случае из алкила, триалкилсилила, карбоциклическеского арила или карбоциклического арила, замещенного одним или несколькими из алкила, галогена, гидрокси или алкокси. Конкретные примеры характерных метаболически расщепляемых групп включают ацетильные, метоксикарбонильные, бензоильные, метоксиметильные и триметилсилильные группы.
[0105] "Пролекарства" относятся к соединениям, включая производные соединений по изобретению, которые содержат расщепляемые группы и становятся посредством сольволиза или в физиологических условиях соединениями по изобретению, которые являются фармацевтически активными in vivo. Такие примеры включают, но не ограничиваются ими, производные холинового эфира и т.п., сложные эфиры N-алкилморфолина и т.п. Другие производные соединений по настоящему изобретению обладают активностью в своих формах кислоты или проиводного кислоты, но в чувствительной к кислоте форме обеспечивают преимущества в отношении растворимости, совместимостью с тканью или отсроченным высвобождением в организме млекопитающего (см., Bundgard H., Design of Prodrugs, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают производные кислот хорошо известные специалистам в данной области, такие как, например, сложные эфиры, получаемые реакцией родительской кислоты с подходящим спиртом, или амиды, получаемые реакцией соединения родительской кислоты с замещенным или незамещенным амином, или ангидриды кислот или смешанные ангидриды. Простые алифатические или сложные ароматические эфиры, амиды и ангидриды, получаемые из кислых групп, содержащихся в боковых цепях в соединениях по настоящему изобретению, представляют собой конкретные пролекарства. В некоторых случаях желательно получать пролекарства типа двойных сложных эфиров, такие как (ацилокси)алкильные эфиры или ((алкоксикарбонил)окси)алкильные эфиры. В частности, C1-С8алкильные, C2-С8алкенильные, C2-С8алкинильные, арильные, замещенные C7-С12арильные и C7-С12арилалкильные эфиры соединений по изобретению.
[0106] "Сольват" относится к формам соединения, которые являются ассоциированными с растворителем или водой (также обозначаемые как "гидрат"), как правило, в результате реакции сольволиза. Такая физическая ассоциация включает водородную связь. Общепринятые растворители включают воду, этанол, уксусную кислота и т.п. Соединения по изобретению можно получать, например, в кристаллической форме и их можно подвергать сольватации или гидратации. Подходящие сольваты включают фармацевтически приемлемые сольваты, такие как гидраты, и дополнительно включают стехиометрические сольваты и нестехиометрические сольваты. В определенных случаях сольват можно выделять, например, когда одна или более молекул растворителя включена в кристаллическую решетку кристаллического твердого вещества. "Сольват" включает фазу раствора и выделяемые сольваты. Характерные сольваты включают гидраты, этанолаты и метанолаты.
[0107] "Индивидуум", для которого предусматривают введение, включает, но не ограничивается ими, людей (например, мужчину или женщину любой возрастной группы, например, являющегося ребенком индивидуума (например, новорожденного, ребенка, подростка) или взрослого индивидуума (например, молодого совершеннолетнего, среднего возраста или пожилого возраста) и/или не являющееся человеком животное, например, млекопитающее, такое как приматы (например, яванских макак, макак-резус), крупный рогатый скот, свиней, лошадей, овец, коз, грызунов, кошек и/или собак. В определенных вариантах осуществления изобретения индивидуум представляет собой человека. В определенных вариантах осуществления изобретения индивидуум представляет собой не являющееся человеком животное. Термины "человек", "пациент" и "индивидуум" в настоящем описании используют взаимозаменяемо.
[0108] "Эффективное количество" означает количество соединения, которое при введении индивидууму для лечения или профилактики заболевания, является достаточным для действия, такого как лечение или профилактика. "Эффективное количество" может изменяться в зависимости от соединения, заболевания и его тяжести, и возраста, массы и т.д. подлежащего лечению индивидуума. "Терапевтически эффективное количество" относится к эффективному количеству для терапевтического лечения. "Профилактически эффективное количество" относится к эффективному количеству для профилактического лечения.
[0109] "Профилактический" или "профилактика" или "профилактическое лечение" относится к снижению риска получения или развития заболевания или нарушения (например, в результате чего по меньшей мере один из клинических симптомов заболевания не развивается у индивидуума, не подвергавшегося воздействию вызывающего заболевание агента, или предрасположенного к заболеванию до начала заболевания).
[0110] Термин "профилактика" относится к "предотвращению" и относится к средству или способу, целью которого является предотвращение, а не лечение или излечивание заболевания. Неограничивающие примеры профилактических средств могут включать введение вакцин, введение низкомолекулярного гепарина госпитализированным пациентам, подвергающихся риску тромбоза, например, вследствие иммобилизации, и введение противомалярийного средства, такого как хлорохин перед посещением географического региона, где малярия является эндемичной, или риск заражения малярий является высоким.
[0111] "Лечащий" или "лечение" или "терапевтическое лечение" любого заболевания или нарушения в одном из вариантов осуществления относится к улучшению состояния заболевания или нарушения (например, купирование заболевания или уменьшение проявления, степени или тяжести по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечащий" или "лечение" относится к улучшению по меньшей мере одного физического параметра, которое может являться неразличимым для индивидуума. В еще одном варианте осуществления "лечащий" или "лечение" относится к модуляции заболевания или нарушения, либо физически (например, стабилизация различимого симптома), либо физиологически (например, стабилизация физического параметра) или обоих. В дополнительном варианте осуществления "лечащий" или "лечение" относится к замедлению прогрессирования заболевания.
[0112] Как используют в настоящем описании, термин "изотопный вариант" относится к соединению, которое содержит неприродные пропорции изотопов в одном или нескольких атомах, которые составляют такое соединение. Например, "изотопный вариант" соединения может содержать один или более нерадиоактивных изотопов, например, таких как дейтерий (2H или D), углерод-13 (13C), азот-15 (15N) или т.п. Следует понимать, что, в соединении, где проведено такое замещение изотопов, следующие ниже атомы при наличии могут варьировать, например, таким образом, что любой водород может представлять собой2H/D, любой углерод может представлять собой13C или любой азот может представлять собой15N, и что наличие и замену таких атомов можно определять в данной области техники. Аналогично, изобретение может включать получение изотопных вариантов с радиоактивными изотопами, например, в случаях, когда получаемые соединения можно использовать для исследований распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий, например,3H, и углерода-14, например,14C, являются особенно пригодными для этой цели с точки зрения их простоты введения и готовых средств детекции. Кроме того, можно получать соединения, которые являются замещенными позитроном, излучающим изотопы, такие как11C,18F,15O и13N, и являются пригодными для исследований позитронно-эмиссионной томографии (PET) для анализа занятости рецептора субстратом. Предполагают, что все изотопные варианты соединений, предоставленные в настоящем описании, радиоактивные или нерадиоактивные, входят в объем изобретения.
[0113] Также следует понимать, что соединения, которые имеют одинаковые молекулярные формулы, но различные по природе или последовательностью связывания своих атомов или расположением своих атомов в пространстве называют "изомерами". Изомеры, которые отличаются расположением своих атомов в пространстве, называют "стереоизомерами".
[0114] Стереоизомеры, которые не представляют собой зеркальные отображения друг друга, называют "диастереомерами", и стереоизомеры, которые представляют собой несовпадающие зеркальные отображения друг друга, называют "энантиомерами". Когда соединение содержит центр асимметрии, например, оно связано с четырьмя различными группами, то возможной является пара энантиомеров. Энантиомер может характеризоваться абсолютной конфигурацией своего центра асимметрии, и его описывают по правилам R- и S-последовательности Кана и Прелога или способом, в котором молекула вращает плоскость поляризованного света, и ее обозначают как правовращающие или левовращающие (например, как (+) или (-)-изомеры соответственно). Хиральное соединение может существовать в виде индивидуального энантиомера или в виде их смеси. Смесь, содержащая равные пропорции энантиомеров называют "рацемической смесью".
[0115] "Таутомеры" относятся к соединениям, которые представляют собой взаимозаменяемые формы конкретной структуры соединения и которые изменяются по отношению к расположению атомов водорода и электронов. Таким образом, две структуры могут находиться в равновесии в результате движения π-электронов и атома (как правило, H). Например, енолы и кетоны представляют собой таутомеры, вследствие того, что они быстро взаимопревращаются при обработке кислотой или основанием. Другой пример таутомерии представляет собой аци- и нитро- формы фенилнитрометана, которые аналогично образуется при обработке кислотой или основанием. Таутомерные формы могут являться существенными для получения оптимальной химической реакционной способности и биологической активности представляющего интерес соединения.
[0116] Как используют в настоящем описании, чистое энантиомерное соединение по существу не содержит другие энантиомеры или стереоизомеры соединения (например, в энантиомерном избытке). Другими словами, форма "S" соединения по существу не содержит форму "R" соединения и, таким образом, в энантиомерном избытке форму "R". Термин "энантиомерно чистый" или "чистый энантиомер" означает, что соединение содержит более 75% по массе, более 80% по массе, более 85% по массе, более 90% по массе, более 91% по массе, более 92% по массе, более 93% по массе, более 94% по массе, более 95% по массе, более 96% по массе, более 97% по массе, более 98% по массе, более 98,5% по массе, более 99% по массе, более 99,2% по массе, более 99,5% по массе, более 99,6% по массе, более 99,7% по массе, более 99,8% по массе или более 99,9% по массе энантиомера. В определенных вариантах осуществления изобретения массы рассчитывают на основе общей массы всех энантиомеров или стереоизомеров соединения.
[0117] Как используют в настоящем описании и если не указано иное, термин "энантиомерно чистое R-соединение" относится к по меньшей мере приблизительно 80% по массе R-соединения и не более приблизительно 20% по массе S-соединения, по меньшей мере приблизительно 90% по массе R-соединения и не более приблизительно 10% по массе S-соединения, по меньшей мере приблизительно 95% по массе R-соединения и не более приблизительно 5% по массе S-соединения, по меньшей мере приблизительно 99% по массе R-соединения и не более приблизительно 1% по массе S-соединения, по меньшей мере приблизительно 99,9% по массе R-соединение или не более приблизительно 0,1% по массе S-соединения. В определенных вариантах осуществления изобретения массы рассчитывают на основании общей массы соединения.
[0118] Как используют в настоящем описании и если не указано иное, термин "энантиомерно чистое S-соединение" или "S-соединение" относится к по меньшей мере приблизительно 80% по массе S-соединения и не более приблизительно 20% по массе R-соединения, по меньшей мере приблизительно 90% по массе S-соединения и не более приблизительно 10% по массе R-соединения, по меньшей мере приблизительно 95% по массе S-соединения и не более приблизительно 5% по массе R-соединения, по меньшей мере приблизительно 99% по массе S-соединения и не более приблизительно 1% по массе R-соединения или по меньшей мере приблизительно 99,9% по массе S-соединения и не более приблизительно 0,1% по массе R-соединения. В определенных вариантах осуществления изобретения массы рассчитывают на основании общей массы соединения.
[0119] В композициях, предоставленных в настоящем описании, энантиомерно чистое соединение или его фармацевтически приемлемая соль, сольват, гидрат или пролекарство может содержаться с другими активными или неактивными ингредиентами. Например, фармацевтическая композиция, содержащая энантиомерно чистое R-соединение может содержать, например, приблизительно 90% эксципиента и приблизительно 10% энантиомерно чистого R-соединения. В определенных вариантах осуществления изобретения энантиомерно чистое R-соединение в таких композициях может, например, содержать по меньшей мере приблизительно 95% по массе R-соединения и не более приблизительно 5% по массе S-соединения от общей массы соединения. Например, фармацевтическия композиция, содержащая энантиомерно чистое S-соединение может содержать, например, приблизительно 90% эксципиента и приблизительно 10% энантиомерно чистого S-соединения. В определенных вариантах осуществления изобретения энантиомерно чистое S-соединение в таких композициях может, например, содержать, по меньшей мере приблизительно 95% по массе S-соединения и не более приблизительно 5% по массе R-соединения от общей массы соединения. В определенных вариантах осуществления изобретения активный ингредиент можно формулировать с небольшим содержанием или без эксципиента или носителя.
[0120] Соединения по настоящему изобретению может содержать один или более центров асимметрии, такие соединения, таким образом, можно получать в виде индивидуальных (R)- или (S)-стереоизомеров или в виде их смесей.
[0121] Если не указано иное, описание или название конкретного соединения в описании и формуле изобретения предназначено включать как индивидуальные энантиомеры, так и их рацемические или иные смеси. Способы определения стереохимии и разделения стереоизомеров хорошо известны в данной области.
[0122] Специалисту в данной области органического синтеза известно, что максимальное число гетероатомов в стабильном, химически возможном гетероциклическом кольце, является оно ароматическим или неароматическим, определяют по размеру кольца, степени ненасыщенности и валентности гетероатомов. Как правило, гетероциклическое кольцо может содержать от одного до четырех гетероатомов при условии, что гетероароматическое кольцо является химически возможным и стабильным.
ПОДРОБНОЕ ОПИСАНИЕ ОПРЕДЕЛЕННЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0123] В определенных аспектах в настоящем описании предоставлены соединения 3-α и 3β-гидроксистероидов в качестве модуляторов NMDA-рецептора и, таким образом, пригодных для профилактики и/или лечения широкого диапазона патологических состояний ЦНС в том числе шизофрению, депрессию, биполярное расстройство (например, I и/или II), шизоаффективное расстройство, расстройства настроения, тревожные расстройства, расстройства личности, психозы, компульсивное расстройство, посттравматическое стрессовое расстройство (PTSD), расстройства аутистического спектра (ASD), дистимию (легкую степень депрессии), социальное тревожное расстройство, обсессивно-компульсивное расстройство (OCD), боль (например, болевой синдром или расстройство), расстройства сна, нарушения памяти, деменцию, болезнь Альцгеймера, судорожное расстройство (например, эпилепсию), травматическое повреждение головного мозга, инсульт, аддиктивные расстройства (например, пристрастие к опиатам, кокаину и/или алкоголю), аутизм, болезнь Гентингтона, бессонницу, болезнь Паркинсона, абстинентные синдромы или тиннитус. Ожидают, что эти соединения обладают улучшенной активностью in vivo фармакокинетическими (PK) свойствами, пероральной биодоступностью, формулируемостью, стабильностью и/или безопасностью.
Соединения
[0124] В одном из аспектов в настоящем описании предоставлены соединения по формуле (I):

или его фармацевтически приемлемая соль, сольват, пролекарство, стереоизомер, таутомер, изотопный вариант или N-оксид или их сочетание;
где:
Z представляет собой группу формул (i), (ii), (iii), (iv) или (v):
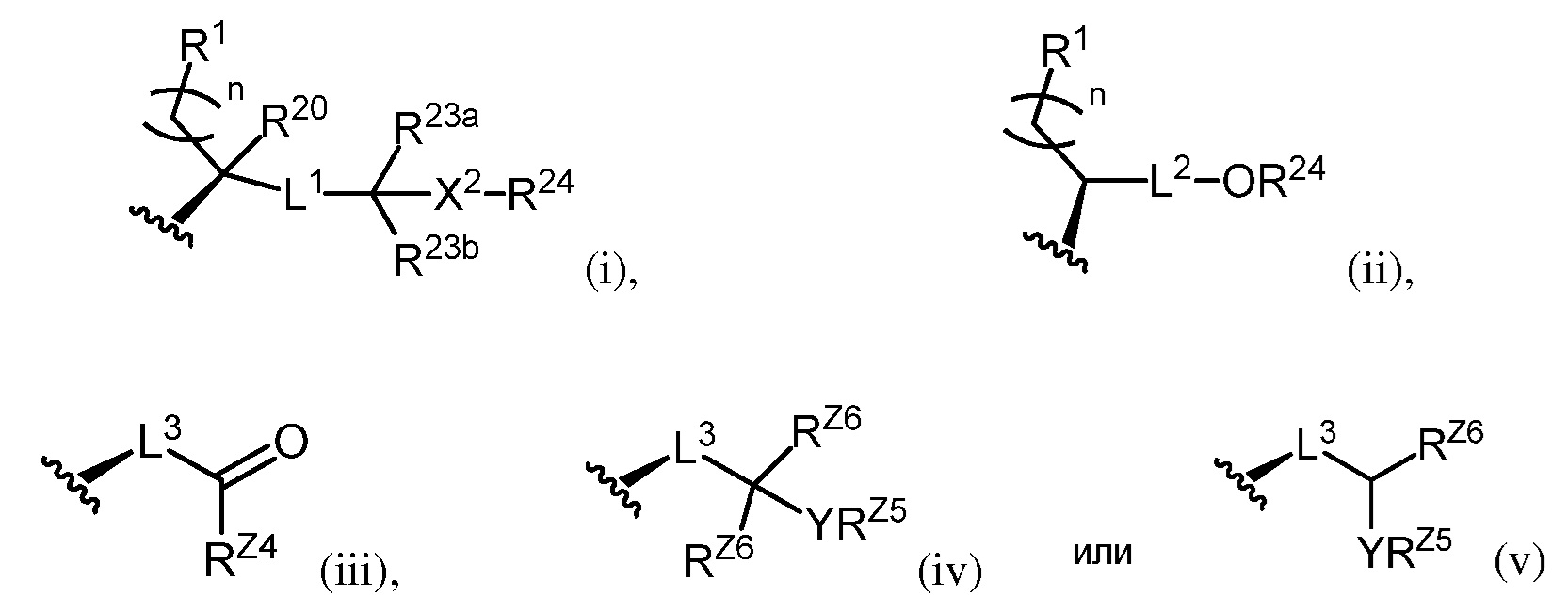
L1 и L2 выбраны из группы, состоящей из связи, замещенного или незамещенного C1-С6алкилена, замещенного или незамещенного C2-С6алкенилена, замещенного или незамещенного C2-С6алкинилена, замещенного или незамещенного гетеро(C1-C6)алкилена, замещенного или незамещенного гетеро(C2-C6)алкенилена и замещенного или незамещенного гетеро(C2-C6)алкинилена;
L3 представляет собой замещенный или незамещенный C1-С6алкилен, замещенный или незамещенный C2-С6алкенилен, замещенный или незамещенный C2-С6алкинилен, замещенный или незамещенный гетеро(C1-C6)алкилен, замещенный или незамещенный гетеро(C2-C6)алкенилен или замещенный или незамещенный гетеро(C2-C6)алкинилен;
каждый из X1 и X2 независимо представляет собой -O-, -S-, -N(RX)-, где каждый из RX независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероалкил или защитную аминогруппу;
R1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, галоген, -N3, -NO2, -SCN, -CN, -ORA1, -SRA1, -N(RA1)2, -N=NRA1, -N=C(RA1)2, -N(ORA1)(RA1), -C(=O)RA1, -C(=O)ORA1, -C(=O)SRA1, -C(=O)N(RA1)2, -C(=O)N(ORA1)(RA1),-OC(=O)RA1, -OC(=O)ORA1, -OC(=O)SRA1, -OC(=O)N(RA1)2, -NRA1C(=O)RA1, -NRA1C(=O)ORA1, -NRA1C(=O)SRA1, -NRA1C(=O)N(RA1)2, -SC(=O)RA2, -SC(=O)ORA1, -SC(=O)SRA1, -SC(=O)N(RA1)2, -OS(=O)2RA2, -OS(=O)2ORA1, -S-S(=O)2RA2, -S-S(=O)2ORA1, -S(=O)RA2, -SO2RA2, -NRA1SO2RA2 или -SO2N(RA1)2, где RA1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен атому серы, защитную группу азота, когда присоединен к атому азота, или две группы RA1 связаны с образованием замещенного или незамещенного гетероциклического кольца, и RA2 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, или группа RA1 и группа RA2 связаны с образованием замещенного или незамещенного гетероциклического кольца;
каждый из R2, R4a, R4b, R7a, R7b, R11a и R11b независимо представляет собой водород, -OH, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -N3, -NO2, -SCN, -CN, -ORB1, -SRB1, -N(RB1)2, -N=NRB1, -N=C(RB1)2, -N(ORB1)(RB1), -C(=O)RB1, -C(=O)ORB1, -C(=O)SRB1, -C(=O)N(Rb1)2, -C(=O)N(ORB1)(RB1), -OC(=O)RB1, -OC(=O)ORB1, -OC(=O)SRB1, -OC(=O)N(RB1)2, -NRB1C(=O)RB1, -NRB1C(=O)ORB1, -NRB1C(=O)SRB1, -NRB1C(=O)N(RB1)2, -SC(=O)RB2, -SC(=O)ORB1, -SC(=O)SRB1, -SC(=O)N(RB1)2, -OS(=O)2RB2, -OS(=O)2ORB1, -S-S(=O)2RB2, -S-S(=O)2ORB1, -S(=O)RB2, -SO2RB2, -NRB1SO2RB2 или -SO2N(RB1)2, где RB1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы, защитную группу азота, когда присоединен к атому азота, или две группы RB1 связаны с образованием замещенного или незамещенного гетероциклического кольца, и RB2 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, или группа RB1 и группа RB2 связаны с образованием замещенного или незамещенного гетероциклического кольца, или необязательно где каждый R4a и R4b, и/или R7a и R7b, и/или R11a и R11b связаны с образованием оксогруппы (=O);
R3a представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
R3b представляет собой водород, -C(=O)RC1, -C(=O)ORC1, -C(=O)SRC1, -C(=O)N(RC1)2, -S(=O)2RC2, -S(=O)2ORC1, -P(=O)2RC2, -P(=O)2ORC1, -P(=O)(ORC1)2, -P(=O)(RC2)2 или -P(=O)(RC2)(ORC1), где RC1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы, защитную группу азота, когда присоединен к атому азота, или две группы RC1 связаны с образованием замещенного или незамещенного гетероциклического кольца, и RC2 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
каждый из R6a и R6b независимо представляет собой водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил или замещенный или незамещенный алкинил, и ---- представляет собой одинарную или двойную связь, при условии если двойная связь содержится в кольце B, то один из R6a или R6b отсутствует, и при условии, если одинарная связь содержится в кольце B, то водород при C5 находится в альфа- или бета-положении;
R14 представляет собой водород или замещенный или незамещенный алкил;
R17 представляет собой водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или -ORD1, где RD1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или защитную группу кислорода;
каждый из R18, R19 и R20 независимо представляет собой водород или замещенный или незамещенный алкил;
и каждый из R23a и R23b независимо представляет собой водород, галоген или замещенный или незамещенный алкил, или R23a и R23b связаны друг с другом с образованием замещенного или незамещенного C3-С6циклоалкила;
R24 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -C(=O)RE1, -C(=O)ORE1, -C(=O)SRE1, -C(=O)N(RE1)2, -S(=O)2RE2, -S(=O)2ORE1, -P(=O)2RE2, -P(=O)2ORE1, -P(=O)(ORE1)2, -P(=O)(RE2)2, или -P(=O)(RE2)(ORE1), где RE1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы, защитную группу азота, когда присоединен к атому азота, или две группы RE1 связаны с образованием замещенного или незамещенного гетероциклического кольца, и RE2 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил;
Y представляет собой -O-, -S- или -NRZ5-;
RZ4 независимо представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -ORZ5, -SRZ5 или -N(RZ5)2;
каждый RZ5 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы, защитную группу азота, когда присоединен к атому азота, или две группы RZ5 связаны с образованием замещенного или незамещенного гетероциклического кольца, и
каждый из RZ6 независимо представляет собой водород или замещенный или незамещенный алкил, или две группы RZ6 связаны с образованием C3-6 карбоциклического кольца, и
нижний индекс n равен 0, 1, 2 или 3.
[0125] В определенных вариантах осуществления изобретения, когда R3a представляет собой H, n равно 1 и R19 представляет собой Me, тогда R1 является отличным от H, алкила, алкенила или алкинила. В определенных вариантах осуществления изобретения, когда R3a представляет собой H, R3b представляет собой -COMe, R19 представляет собой Me, и n равно 0, тогда R1 представляет собой OH. В определенных вариантах осуществления изобретения, когда R3a представляет собой H, n равно 0, и R20 представляет собой алкил, тогда R1 является отличным от OH. В определенных вариантах осуществления изобретения, когда R19 представляет собой Me, тогда R1 является отличным от H, алкила, алкенила или алкинила. В определенных вариантах осуществления изобретения R1 представляет собой H, и R19 является отличным от Me. В определенных вариантах осуществления изобретения каждый R1 и R3a представляет собой H, и R19 является отличным от Me.
[0126] В определенных вариантах осуществления изобретения, когда R3a представляет собой H, тогда R1 является отличным от H, замещенного или незамещенного алкила, замещенного или незамещенного алкенила или замещенного или незамещенного алкинила. В определенных вариантах осуществления изобретения, когда R3a представляет собой H, тогда R1 представляет собой замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, галоген, -N3, -NO2, -SCN, -CN, -ORA1, -SRA1, -N(RA1)2, -N=NRA1, -N=C(RA1)2, -N(ORA1)(RA1), -C(=O)RA1, -C(=O)ORA1, -C(=O)SRA1, -C(=O)N(RA1)2, -C(=O)N(ORA1)(RA1), -OC(=O)RA1, -OC(=O)ORA1, -OC(=O)SRA1, -OC(=O)N(RA1)2, -NRA1C(=O)RA1, -NRA1C(=O)ORA1, -NRA1C(=O)SRA1, -NRA1C(=O)N(RA1)2, -SC(=O)RA2, -SC(=O)ORA1, -SC(=O)SRA1, -SC(=O)N(RA1)2, -OS(=O)2RA2, -OS(=O)2ORA1, -S-S(=O)2RA2, -S-S(=O)2ORA1, -S(=O)RA2, -SO2RA2, -NRA1SO2RA2 или -SO2N(RA1)2.
[0127] В определенных дополнительных вариантах осуществления конкретно исключают следующие ниже соединения:

и их фармацевтически приемлемую соль, сольват, пролекарство, стереоизомер, таутомер, изотопный вариант или N-оксид, или их сочетание.
Различные варианты осуществления R3a
[0128] В основном, как определено выше, R3a представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Как правило, понимают, что R3a может находиться в альфа- (внизу) или бета- (наверну) положении. В определенных вариантах осуществления изобретения R3a находится в альфа-положении. В определенных вариантах осуществления изобретения R3a находится в бета-положении.
[0129] В определенных вариантах осуществления изобретения R3a представляет собой водород.
[0130] В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный алкил, например, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. Иллюстративные R3a C1-6алкильные группы включают, но не ограничиваются ими, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5), н-гексил (C6), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более фтор-групп (например, -CF3, -CH2F, -CHF2, дифторэтилом и 2,2,2-трифтор-1,1-диметилэтилом), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, или более хлор-группами (например, -CH2Cl, -CHCl2), и C1-6алкил, замещенный алкоксигруппами (например, -CH2OCH3 и -CH2OCH2CH3). В определенных вариантах осуществления изобретения R3a представляет собой замещенный алкил, например, R3a представляет собой галогеналкил, алкоксиалкил или аминоалкил. В определенных вариантах осуществления изобретения R3a представляет собой Me, Et, n-Pr, n-Bu, i-Bu, фторметил, хлорметил, дифторметил, трифторметил, трифторэтил, дифторэтил, 2,2,2-трифтор-1,1-диметил-этил, метоксиметил, метоксиэтил или этоксиметил. В определенных вариантах осуществления изобретения R3a представляет собой Me, Et, n-Pr, n-Bu или i-Bu. В определенных вариантах осуществления изобретения R3a представляет собой метоксиметил, этоксиметил, пропоксиметил, метоксиэтил или этоксиэтил. В определенных вариантах осуществления изобретения R3a представляет собой трифторметоксиметил. В определенных вариантах осуществления изобретения R3a представляет собой фторметил, хлорметил, дифторметил, трифторметил, дифторэтил, трифторэтил или 2,2,2-трифтор-1,1-диметил-этил. В определенных вариантах осуществления изобретения R3a представляет собой трифторметил.
[0131] В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный алкенил, например, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-3алкенил, замещенный или незамещенный C3-4алкенил, замещенный или незамещенный C4-5алкенил или замещенный или незамещенный C5-6алкенил. В определенных вариантах осуществления изобретения R3a представляет собой этенил (C2), пропенил (C3) или бутенил (C4), незамещенный или замещенный одним или несколькими заместителями, выбранными из группы, состоящей из алкила, галогена, галогеналкила, алкоксиалкила или гидроксила. В определенных вариантах осуществления изобретения R3a представляет собой этенил, пропенил или бутенил, незамещенный или замещенный алкилом, галогеном, галогеналкилом, алкоксиалкилом или гидрокси. В определенных вариантах осуществления изобретения R3a представляет собой этенил.
[0132] В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный алкинил, например, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C2-3алкинил, замещенный или незамещенный C3-4алкинил, замещенный или незамещенный C4-5алкинил или замещенный или незамещенный C5-6алкинил. Иллюстративные замещенные или незамещенные R3a алкинильные группы включают, но не ограничиваются ими, этинил, пропинил или бутинил, незамещенный или замещенный алкилом, галогеном, галогеналкилом (например, CF3), алкоксиалкилом, циклоалкилом (например, циклопропилом или циклобутилом) или гидроксилом. В определенных вариантах осуществления изобретения R3a выбран из группы, состоящей из трифторэтинила, циклопропилэтинила, циклобутилэтинила и пропинила, фторпропинила и хлорэтинила. В определенных вариантах осуществления изобретения R3a представляет собой этинил (C2), пропинил (C3) или бутинил (C4), незамещенный или замещенный одним или несколькими заместителями, выбранными из группы, состоящей из замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного карбоциклила и замещенного или незамещенного гетероциклила. В определенных вариантах осуществления изобретения R3a представляет собой этинил (C2), пропинил (C3) или бутинил (C4), замещенный замещенным фенилом. В определенном варианте осуществления фенильный заместитель является дополнительно замещенным одним или несколькими заместителями, выбранными из группы, состоящей из галогена, алкила, трифторалкила, алкокси, ацила, амино или амидо. В определенных вариантах осуществления изобретения R3a представляет собой этинил (C2), пропинил (C3) или бутинил (C4), замещенный замещенным или незамещенным пирролилом, имидазолилом, пиразолилом, оксазоилом, тиазолилом, изоксазоилом, 1,2,3-триазолилом, 1,2,4-триазолилом, оксадиазолилом, тиадиазолилом или тетразолилом.
[0133] В определенных вариантах осуществления изобретения R3a представляет собой этинил, пропинил или бутинил, незамещенный или замещенный алкилом, галогеном, галогеналкилом, алкоксиалкилом или гидроксилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным арилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный фенилом, незамещенным или замещенным галогеном, алкилом, алкокси, галогеналкилом, тригалогеналкилом или ацилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным карбоциклилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным циклопропилом, циклобутилом, циклопентилом или циклогексилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным гетероарилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным пиридинилом или пиримидинилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным пирролилом, имидазолилом, пиразолилом, оксазоилом, тиазолилом, изоксазоилом, 1,2,3-триазолилом, 1,2,4-триазолилом, оксадиазолилом, тиадиазолилом, тетразолилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным гетероциклилом. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный замещенным или незамещенным пирролидинилом, пиперидинилом, пиперазинилом или морфолинилом. В определенных вариантах осуществления изобретения R3a представляет собой пропинил или бутинил, замещенный гидроксилом или алкокси. В определенных вариантах осуществления изобретения R3a представляет собой пропинил или бутинил, замещенный метокси или этокси. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный Cl. В определенных вариантах осуществления изобретения R3a представляет собой этинил или пропинил, замещенный трифторметилом.
[0134] В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный карбоциклил, например, замещенный или незамещенный C3-6карбоциклил, замещенный или незамещенный C3-4карбоциклил, замещенный или незамещенный C4-5карбоциклил или замещенный или незамещенный C5-6карбоциклил.
[0135] В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный гетероциклил, например, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный 3-4-членный гетероциклил, замещенный или незамещенный 4-5-членный гетероциклил или замещенный или незамещенный 5-6-членный гетероциклил.
[0136] В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный арил. В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный фенил.
[0137] В определенных вариантах осуществления изобретения R3a представляет собой замещенный или незамещенный гетероарил, например, необязательно замещенный 5-6-членным гетероарилом.
[0138] Дополнительные варианты осуществления R3a в виде замещенного или незамещенного алкила, замещенного или незамещенного алкенила и замещенных или незамещенных алкинильных групп, описаны ниже:

где каждый из R3c представляет собой водород, галоген или -ORF1, где RF1 представляет собой замещенный или незамещенный алкил, и каждый из R3d представляет собой водород, галоген или замещенный или незамещенный алкил, замещенный или незамещенный карбоциклил или замещенный или незамещенный гетероциклил.
[0139] В определенных вариантах осуществления изобретения по меньшей мере один R3c представляет собой водород. В определенных вариантах осуществления изобретения по меньшей мере два R3c представляют собой водород. В определенных вариантах осуществления изобретения каждый R3c представляет собой водород. В определенных вариантах осуществления изобретения по меньшей мере один R3c представляет собой галоген (например, фтор, хлор, бром, йод). В определенных вариантах осуществления изобретения по меньшей мере два R3c представляют собой галоген (например, фтор, хлор, бром, йод). В определенных вариантах осуществления изобретения каждый R3c представляет собой галоген (например, фтор с получением группы -CF3). В определенных вариантах осуществления изобретения по меньшей мере один R3c представляет собой -ORF1 (например, OMe или OEt). В определенных вариантах осуществления изобретения по меньшей мере два R3c представляют собой -ORF1 (например, OMe или OEt). В определенных вариантах осуществления изобретения по меньшей мере один R3c представляет собой водород, F, -OMe или -OEt. В определенных вариантах осуществления изобретения один из R3c представляет собой F, -OMe или OEt, и оставшиеся представляют собой H.
[0140] В определенных вариантах осуществления изобретения по меньшей мере один R3d представляет собой водород. В определенных вариантах осуществления изобретения каждый R2c представляет собой водород. В определенных вариантах осуществления изобретения по меньшей мере один R3d представляет собой галоген (например, фтор, хлор, бром, йод). В определенных вариантах осуществления изобретения каждый R3d представляет собой галоген (например, фтор, хлор, бром, йод). В определенных вариантах осуществления изобретения каждый из R3d представляет собой алкил, например, каждый из R2c представляет собой Me. В определенных вариантах осуществления изобретения один из R3d представляет собой алкил, а другой представляет собой водород, например, один из R3d представляет собой Me, а другой представляет собой водород. В определенных вариантах осуществления изобретения один из R3d представляет собой замещенный или незамещенный карбоциклил, например, циклопропил или циклобутил, а другой представляет собой водород. В определенных вариантах осуществления изобретения по меньшей мере один R3d представляет собой водород, -F, -Br, -Cl, -I, -CH3, -CF3, циклопропил или циклобутил. В определенных вариантах осуществления изобретения каждый из R3d представляет собой H. В определенных вариантах осуществления изобретения в каждом случае R3d представляет собой галоген (например, фтор, хлор, бром, йод). В определенных вариантах осуществления изобретения в каждом случае R3d представляет собой алкил, например, -CH3, -CF3, -CH2CH2Cl. В определенных вариантах осуществления изобретения в каждом случае R3d представляет собой замещенный или незамещенный карбоциклил, например, циклопропил или циклобутил. В определенных вариантах осуществления изобретения R3d представляет собой замещенный или незамещенный циклопропил. В определенных вариантах осуществления изобретения в каждом случае R3d представляет собой водород, -F, -Br, -Cl, -I, -CH3, -CF3, -CH2CH2Cl, циклопропил или циклобутил. В определенных вариантах осуществления изобретения R3d представляет собой Me или Cl. В определенных вариантах осуществления изобретения R3d представляет собой замещенный или незамещенный гетероциклил.
Различные варианты осуществления -X1-R3b
[0141] В основном, как определено выше для группы -X1R3b, X1 представляет собой независимо -O-, -S- или -N(RX)-, где в каждом случае RX независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероалкил или защитную аминогруппу, и R3b представляет собой водород, -C(=O)RC1, -C(=O)ORC1, -C(=O)SRC1, -C(=O)N(RC1)2, -S(=O)2RC1, -S(=O)2ORC1, -P(=O)2RC1, -P(=O)2ORC1, -P(=O)(ORC1)2, -P(=O)(RC1)2 или -P(=O)(RC1)(ORC1), где RC1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы, защитную группу азота, когда присоединен к атому азота, или две группы RC1 связаны с образованием замещенного или незамещенного гетероциклического кольца. Как правило, понимают, что группа -X1-R3b может находиться в альфа- (внизу) или бета- (вверху) положении. В определенных вариантах осуществления изобретения группа -X1-R3b находится в альфа-положении. В определенных вариантах осуществления изобретения группа -X1-R3b находится бета-положении.
[0142] В определенных вариантах осуществления изобретения X1 представляет собой -O-. В определенных вариантах осуществления изобретения X1 представляет собой -S-. В определенных вариантах осуществления изобретения X1 представляет собой -N(RX)-. В определенных вариантах осуществления изобретения RX представляет собой алкил. В определенных вариантах осуществления изобретения RX представляет собой Me, Et или i-Pr. В определенных вариантах осуществления изобретения RX представляет собой H, например, где X1 представляет собой -NH-.
[0143] В определенных вариантах осуществления изобретения R3b представляет собой водород. Например, в определенных вариантах осуществления группа -X1R3b представляет собой -OH. В определенных вариантах осуществления изобретения группа -X1R3b представляет собой -SH. В определенных вариантах осуществления изобретения группа -X1R3b представляет собой -NH2 или -NHRX.
[0144] В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)RC1, -C(=O)ORC1, -C(=O)SRC1, -C(=O)N(RC1)2, -S(=O)2RC1, -S(=O)2ORC1, -P(=O)2RC1, -P(=O)2ORC1, -P(=O)(ORC1)2, -P(=O)(RC1)2 или -P(=O)(RC1)(ORC1).
[0145] В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой водород или защитную группу, например, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы или защитную группу азота, когда присоединен к атому азота. В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой водород.
[0146] В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой замещенный или незамещенный алкил, например, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. Иллюстративные RC1 C1-6алкильные группы включают, но не ограничиваются ими, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5), н-гексил (C6), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более фтор-группами (например, -CF3, -CH2F, -CHF2, дифторэтиломом и 2,2,2-трифтор-1,1-диметилэтиломом), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более хлор-группами (например, -CH2Cl, -CHCl2), и C1-6алкил, замещенный алкоксигруппами (например, -CH2OCH3 и -CH2OCH2CH3).
[0147] В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой замещенный или незамещенный алкенил, например, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-3алкенил, замещенный или незамещенный C3-4алкенил, замещенный или незамещенный C4-5алкенил или замещенный или незамещенный C5-6алкенил.
[0148] В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой замещенный или незамещенный алкинил, например, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C2-3алкинил, замещенный или незамещенный C3-4алкинил, замещенный или незамещенный C4-5алкинил или замещенный или незамещенный C5-6алкинил.
[0149] В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой замещенный или незамещенный карбоциклил, например, замещенный или незамещенный C3-6карбоциклил, замещенный или незамещенный C3-4карбоциклил, замещенный или незамещенный C4-5карбоциклил или замещенный или незамещенный C5-6карбоциклил.
[0150] В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой замещенный или незамещенный гетероциклил, например, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный 3-4-членный гетероциклил, замещенный или незамещенный 4-5-членный гетероциклил или замещенный или незамещенный 5-6-членный гетероциклил.
[0151] В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой замещенный или незамещенный арил, например, замещенный или незамещенный фенил.
[0152] В определенных вариантах осуществления изобретения по меньшей мере один из RC1 представляет собой замещенный или незамещенный гетероарил, например, необязательно замещенный 5-6-членный гетероарил.
[0153] В определенных вариантах осуществления изобретения две группы RC1 связаны с образованием замещенного или незамещенного гетероциклического кольца, например, замещенного или незамещенного пиперидинильного, замещенного или незамещенного пиперазинильного или замещенного или незамещенного морфолинильного кольца.
[0154] В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)RC1, -C(=O)ORC1, -C(=O)N(RC1)2 или -C(=O)N(ORC1)(RC1), где RC1 является таким, как определено в настоящем описании.
[0155] В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)RC1, например, где RC1, например, представляет собой замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6). В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)CH3. В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)(CH2)mCO2H, где m представляет собой целое число от 2 до 5 включительно. В определенных вариантах осуществления изобретения m равно 2. В определенных вариантах осуществления изобретения m равно 3. В определенных вариантах осуществления изобретения m равно 4. В определенных вариантах осуществления изобретения m равно 5. В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)CH2CH2C(=O)OH.
[0156] В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)ORC1, например, где RC1, например, представляет собой замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6).
[0157] В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)SRC1, например, где RC1, например, представляет собой замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6).
[0158] В определенных вариантах осуществления изобретения R3b представляет собой -C(=O)N(RC1)2, например, -C(=O)NH2 или -C(=O)NHRC1, где RC1, например, представляет собой замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6), или R1 представляет собой -C(=O)N(RC1)2, где две группы RC1 связаны с образованием замещенного или незамещенного гетероциклического кольца, например, замещенного или незамещенного пиперидинильного, замещенного или незамещенного пиперазинильного или замещенного или незамещенного морфолинильного кольца.
[0159] В определенных вариантах осуществления изобретения R3b представляет собой -S(=O)2RC1 или -S(=O)2ORC1, где RC1, например, представляет собой водород или замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6), или замещенный или незамещенный фенил. В определенных вариантах осуществления изобретения R3b представляет собой -S(=O)2RC1. В определенных вариантах осуществления изобретения R3b представляет собой -S(=O)2ORC1, например, -SO3H.
[0160] В определенных вариантах осуществления изобретения R3b представляет собой -P(=O)2RC1, -P(=O)2ORC1, -P(=O)(ORC1)2, -P(=O)(RC1)2 или -P(=O)(RC1)(ORC1), где каждый RC1, например, независимо представляет собой водород, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6), или замещенный или незамещенный фенил. В определенных вариантах осуществления изобретения R3b представляет собой -P(=O)2RC1. В определенных вариантах осуществления изобретения R1 представляет собой -P(=O)2ORC1. В определенных вариантах осуществления изобретения R3b представляет собой -P(=O)(ORC1)2. В определенных вариантах осуществления изобретения R1 представляет собой -P(=O)(RC1)2. В определенных вариантах осуществления изобретения R3b представляет собой -P(=O)(RC1)(ORC1).
Различные варианты осуществления, где Z представляет собой группу формул (i) или (ii)
[0161] В определенных вариантах осуществления изобретения Z представляет собой группу формул (i):

[0162] В других вариантах осуществления Z представляет собой группу формулы (ii):

[0163] В основном, как определено выше, L1 и L2 представляют собой связь (например, другими словами, отсутствуют) или представляют собой замещенный или незамещенный C1-С6алкилен, замещенный или незамещенный C2-С6алкенилен, замещенный или незамещенный C2-С6алкинилен, замещенный или незамещенный гетеро(C1-C6)алкилен, замещенный или незамещенный гетеро(C2-C6)алкенилен или замещенный или незамещенный гетеро(C2-C6)алкинилен.
[0164] В определенных вариантах осуществления изобретения L1 или L2 представляет собой связь.
[0165] В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C1-С6алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C1-С4алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C1-С3алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C1-С2алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С1алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С2алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С3алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С4алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С5алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С6алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой алкиленовую группу, как описано выше, замещенную одним или несколькими заместителями, выбранными из группы, состоящей из замещенного или незамещенного алкила и галогена. В определенных вариантах осуществления изобретения L1 или L2 представляет собой -CH2-, -CHMe-, -CMe2-, -CH2-CH2-, -CF2-CH2-, -CH2-CMe2-, -CH2-CH2-CH2- или -CH2-CH2-CMe2-.
[0166] В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C2-С6алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C2-С5алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C2-С4алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C2-С3алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С2алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С3алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С4алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С5алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С6алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой алкениленовую группу, как описано выше, замещенную одним или несколькими заместителями, выбранными из группы, состоящей из замещенного или незамещенного алкила и галогена.
[0167] В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C2-С6алкинилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C2-С5алкинилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C2-С4алкинилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный C2-С3алкинилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С2алкинилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С3алкинилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С4алкинилен. В определенных вариантах осуществления изобретения L1 представляет собой замещенный или незамещенный С5алкинилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный С6алкинилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой алкиниленую группу, как описано выше, замещенную одним или несколькими заместителями, выбранными из группы, состоящей из замещенного или незамещенного алкила и галогена.
[0168] Кроме того, в определенных вариантах осуществления L1 или L2 представляет собой замещенный или незамещенный гетеро(C1-6)алкилен, например, замещенный или незамещенный гетеро(C1-2)алкилен, замещенный или незамещенный гетеро(C2-3)алкилен, замещенный или незамещенный гетеро(C3-4)алкилен, замещенный или незамещенный гетеро(C4-5)алкилен, или замещенный или незамещенный гетеро(C5-6)алкилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный гетеро(C2-6)алкенилен, например, замещенный или незамещенный гетеро(C2-3)алкенилен, замещенный или незамещенный гетеро(C3-4)алкенилен, замещенный или незамещенный гетеро(C4-5)алкенилен или замещенный или незамещенный гетеро(C5-6)алкенилен. В определенных вариантах осуществления изобретения L1 или L2 представляет собой замещенный или незамещенный гетеро(C2-6)алкинилен, например, замещенный или незамещенный гетеро(C2-3)алкинилен, замещенный или незамещенный гетеро(C3-4)алкинилен, замещенный или незамещенный гетеро(C4-5)алкинилен или замещенный или незамещенный гетеро(C5-6)алкинилен. В любом из указанных случаев в определенных вариантах осуществления L1 или L2 представляет собой гетероалкилен, гетероалкенилен или гетероалкинилен, незамещенный или замещенный галогеном (например, фтором) или замещенным или незамещенным C1-6алкилом.
[0169] В основном, как определено выше, R1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, галоген, -N3, -NO2, -SCN, -CN, -ORA1, -SRA1, -N(RA1)2, -N=NRA1, -N=C(RA1)2, -N(ORA1)(RA1), -C(=O)RA1, -C(=O)ORA1, -C(=O)SRA1, -C(=O)N(RA1)2, -C(=O)N(ORA1)(RA1), -OC(=O)RA1, -OC(=O)ORA1, -OC(=O)SRA1, -OC(=O)N(RA1)2, -NRA1C(=O)RA1, -NRA1C(=O)ORA1, -NRA1C(=O)SRA1, -NRA1C(=O)N(RA1)2, -SC(=O)RA2, -SC(=O)ORA1, -SC(=O)SRA1, -SC(=O)N(RA1)2, -OS(=O)2RA2, -OS(=O)2ORA1, -S-S(=O)2RA2, -S-S(=O)2ORA1, -S(=O)RA2, -SO2RA2, -NRA1SO2RA2, или -SO2N(RA1)2, где RA1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы, защитную группу азота, когда присоединен к атому азота, или две группы RA1 связаны с образованием замещенного или незамещенного гетероциклического кольца, и RA2 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, или группа RA1 и группа RA2 связаны с образованием замещенного или незамещенного гетероциклического кольца.
[0170] В определенных вариантах осуществления изобретения R1 представляет собой водород.
[0171] В определенных вариантах осуществления изобретения R1 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил или замещенный или незамещенный алкинил. В определенных вариантах осуществления изобретения R1 представляет собой замещенный или незамещенный алкил, например, Me, Et или i-Pr. В определенных вариантах осуществления изобретения R1 представляет собой замещенный или незамещенный алкенил, например, замещенный или незамещенный этенил или замещенный или незамещенный пропенил. В определенных вариантах осуществления изобретения R1 представляет собой замещенный или незамещенный алкинил.
[0172] В определенных вариантах осуществления изобретения R1 выбран из замещенного или незамещенного карбоциклила или замещенного или незамещенного гетероциклила.
[0173] В определенных вариантах осуществления изобретения R1 представляет собой замещенный или незамещенный арил, например, фенил.
[0174] В определенных вариантах осуществления изобретения R1 представляет собой замещенный или незамещенный гетероарил, например, замещенный или незамещенный гетероарил, выбранный из пирролила, имидазолила, пиразолила, оксазоила, тиазолила, изоксазоила, 1,2,3-триазолила, 1,2,4-триазолила, оксадиазолила, тиадиазолила, тетразолила, пиридинила, пиримидинила, пиразинила, хинолинила, изохинолинила, хиназонила, хиноксилинила, нафтиридинила, индолила, индазолила, бензимидазолила, пирролопиридинила, пирролопиримидинила, пиридопиримидинила или пуринила. В определенных вариантах осуществления изобретения гетероарильная группа является замещенной одной или несколькими группами, выбранными из замещенного или незамещенного алкила, галогеналкила, алкенила, замещенного или незамещенного алкинила, оксо, гидрокси, галогена, алкокси, -S-алкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного -SO-алкила, замещенного или незамещенного -SO2-алкила, замещенного или незамещенного -SO-арила, замещенного или незамещенного -SO2-арила, замещенного или незамещенного -SO-гетероарила, замещенного или незамещенного -SO2-гетероарила, амино, циано и ацила. В определенных вариантах осуществления изобретения R1 представляет собой имидазолил, пиразолил 1,2,3-триазолил, 1,2,4-триазолил, оксадиазолил, тиадиазолил или тетразолил, где каждый является замещенным или замещенным одной или двумя группами, независимо выбранными из оксо, Me, F, Cl, -CN и -CF3. В определенных вариантах осуществления изобретения R1 представляет собой хинолинил, изохинолинил или пуринил, где каждый является незамещенным или замещенным одной или двумя группами, независимо выбранными из оксо, Me, F, Cl, -CN и -CF3.
[0175] В определенных вариантах осуществления изобретения R1 представляет собой -ORA1. В определенных вариантах осуществления изобретения R1 представляет собой -O-хинолинил, -O-изохинолинил, -O-пуринил, где каждый является незамещенным или замещенным одной или двумя группами, независимо выбранными из Me, F, Cl, -CN и -CF3. В определенных вариантах осуществления изобретения R1 представляет собой -OH или -O-CO-CH2-CH2-CO2H.
[0176] В определенных вариантах осуществления изобретения R1 представляет собой -SRA1. В определенных вариантах осуществления изобретения R1 представляет собой S-хинолинил, -S-изохинолинил или -S-пуринил, где каждый является незамещенным или замещенным одной или двумя группами, независимо выбранными из Me, F, Cl, -CN и -CF3. В определенных вариантах осуществления изобретения R1 представляет собой -SH.
[0177] В определенных вариантах осуществления изобретения R1 представляет собой -OS(=O)2RA2. В определенных вариантах осуществления изобретения R1 представляет собой -OS(=O)2ORA1, например, -O-SO3H. В определенных вариантах осуществления изобретения R1 представляет собой -S-S(=O)2RA2. В определенных вариантах осуществления изобретения R1 представляет собой -S-S(=O)2ORA1, например, -S-SO3H.
[0178] В основном, как определено выше, R20 независимо представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R20 представляет собой водород. В определенных вариантах осуществления изобретения R20 представляет собой замещенный или незамещенный алкил (например, -CH3).
[0179] В основном, как определено выше каждый из R23a и R23b независимо представляет собой водород, галоген или замещенный или незамещенный алкил, или R23a и R23b связаны друг с другом с образованием замещенного или незамещенного C3-С6циклоалкила. В определенных вариантах осуществления изобретения каждый из R23a и R23b представляет собой водород. В определенных вариантах осуществления изобретения один из R23a и R23b представляет собой галоген, например, фтор, а другой из R23a и R23b представляет собой водород, галоген или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения каждый из R23a и R23b представляет собой галоген, например, фтор. В определенных вариантах осуществления изобретения каждый из R23a и R23b независимо представляет собой замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения каждый из R23a и R23b представляет собой Me. В определенных вариантах осуществления изобретения один из R23a и R23b представляет собой H. В определенных вариантах осуществления изобретения один из R23a и R23b представляет собой H, а другой представляет собой замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения один из R23a и R23b представляет собой H, а другой представляет собой Me или Et. В определенных вариантах осуществления изобретения R23a и R23b связаны друг с другом с образованием замещенного или незамещенного C3-С6циклоалкила. В определенных вариантах осуществления изобретения R23a и R23b связаны друг с другом с образованием замещенного или незамещенного циклопропила.
[0180] В определенных вариантах осуществления изобретения группа

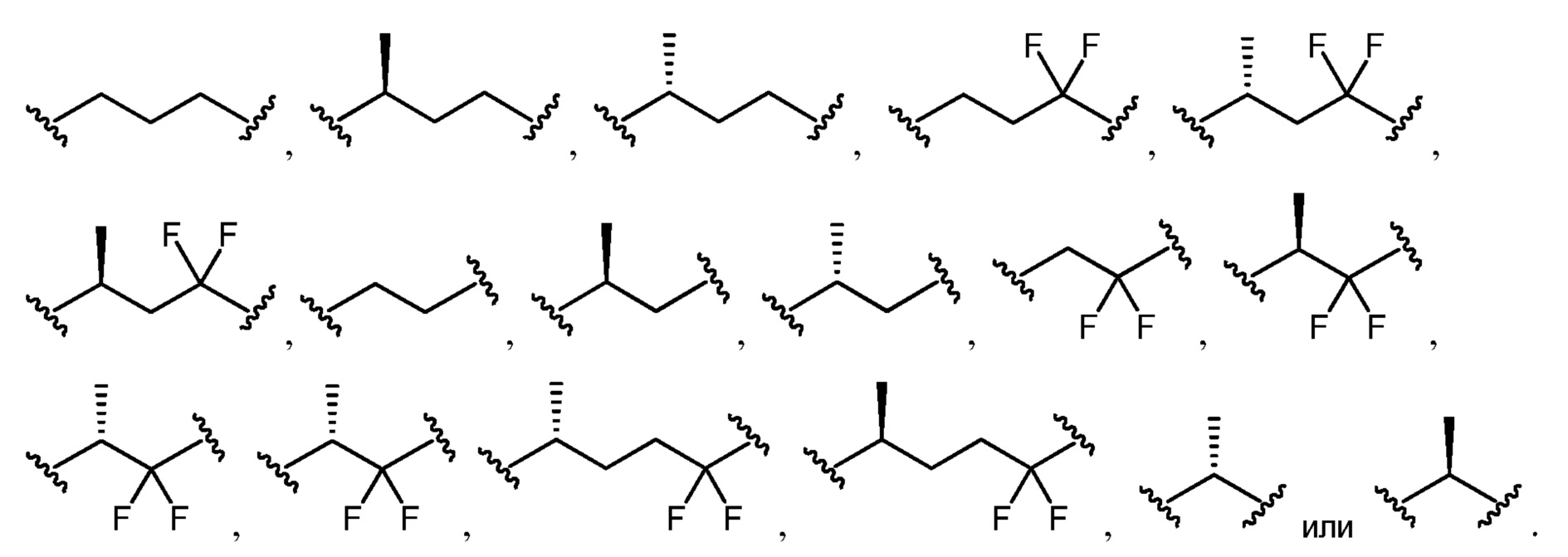
[0181] В основном, как определено выше, X2 независимо представляет собой -O-, -S- или -N(RX)-, где в каждом случае RX независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероалкил или защитную аминогруппу.
[0182] В определенных вариантах осуществления изобретения X2 представляет собой -O-. В определенных вариантах осуществления изобретения X2 представляет собой -S-. В определенных вариантах осуществления изобретения X2 представляет собой -N(RX)-. В определенных вариантах осуществления изобретения RX представляет собой алкил. В определенных вариантах осуществления изобретения RX представляет собой Me, Et или i-Pr. В определенных вариантах осуществления изобретения RX представляет собой водород.
[0183] В определенных вариантах осуществления изобретения X1 представляет собой -O-, и X2 представляет собой -O-. В определенных вариантах осуществления изобретения X1 представляет собой -O- и X2 представляет собой -S-. В определенных вариантах осуществления изобретения X1 представляет собой -O-, и X2 представляет собой -N(RX)-. В определенных вариантах осуществления изобретения X1 представляет собой -S-, и X2 представляет собой -O-. В определенных вариантах осуществления изобретения X1 представляет собой -S-, и X2 представляет собой -S-. В определенных вариантах осуществления изобретения X1 представляет собой -S-, и X2 представляет собой -N(RX)-. В определенных вариантах осуществления изобретения X1 представляет собой -N(RX)-, и X2 представляет собой -O-. В определенных вариантах осуществления изобретения X1 представляет собой -N(RX)-, и X2 представляет собой -S-. В определенных вариантах осуществления изобретения X1 представляет собой -N(RX)-, и X2 представляет собой -N(RX)-.
[0184] В основном, как определено выше, R24 представляет собой H, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -C(=O)RE1, -C(=O)ORE1, -C(=O)SRE1, -C(=O)N(RE1)2, -S(=O)2RE2, -S(=O)2ORE1, -P(=O)2RE2, -P(=O)2ORE1, -P(=O)(ORE1)2, -P(=O)(RE2)2 или -P(=O)(RE2)(ORE1).
[0185] В определенных вариантах осуществления изобретения R24 представляет собой водород.
[0186] В определенных вариантах осуществления изобретения R24 представляет собой замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R24 представляет собой алкил, незамещенный или замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена или/и гидроксила. В определенных вариантах осуществления изобретения R24 представляет собой замещенный или незамещенный алкенил. В определенных вариантах осуществления изобретения R24 представляет собой замещенный или незамещенный алкинил. В определенных вариантах осуществления изобретения R24 представляет собой замещенный или незамещенный карбоциклил. В определенных вариантах осуществления изобретения R24 представляет собой замещенный или незамещенный гетероциклил. В определенных вариантах осуществления изобретения R24 представляет собой замещенный или незамещенный арил. В определенных вариантах осуществления изобретения R24 представляет собой замещенный или незамещенный гетероарил.
[0187] В определенных вариантах осуществления изобретения R24 представляет собой -C(=O)RE1, например, R24 представляет собой -C(=O)(CH2)pCO2H, где p представляет собой целое число от 2 до 5 включительно. В определенных вариантах осуществления изобретения p равно 2. В определенных вариантах осуществления изобретения p равно 3. В определенных вариантах осуществления изобретения p равно 4. В определенных вариантах осуществления изобретения p равно 5. В определенных вариантах осуществления изобретения R24 представляет собой -C(=O)ORE1. В определенных вариантах осуществления изобретения R24 представляет собой -C(=O)SRE1. В определенных вариантах осуществления изобретения R24 представляет собой -C(=O)N(RE1)2. В определенных вариантах осуществления изобретения R24 представляет собой -S(=O)2RE2. В определенных вариантах осуществления изобретения R24 представляет собой -S(=O)2ORE1, например, -SO3H. В определенных вариантах осуществления изобретения R24 представляет собой -P(=O)2RE2. В определенных вариантах осуществления изобретения R24 представляет собой -P(=O)2ORE1. В определенных вариантах осуществления изобретения R24 представляет собой -P(=O)(ORE1)2. В определенных вариантах осуществления изобретения R24 представляет собой -P(=O)(RE2)2. В определенных вариантах осуществления изобретения R24 представляет собой -P(=O)(RE2)(ORE1).
[0188] В основном, как определено выше, нижний индекс n равен 0, 1, 2 или 3. В определенных вариантах осуществления изобретения n равно 0. В определенных вариантах осуществления изобретения n равно 1. В определенных вариантах осуществления изобретения n равно 2. В определенных вариантах осуществления изобретения n равно 3.
Различные варианты осуществления, где Z представляет собой группу формул (iii), (iv) или (v)
[0189] В определенных вариантах осуществления изобретения Z представляет собой группу формул (iii), (iv) или (v):

[0190] В определенных вариантах осуществления изобретения L3 представляет собой замещенный или незамещенный C1-6алкилен, например, замещенный или незамещенный C1-2алкилен, замещенный или незамещенный C2-3алкилен, замещенный или незамещенный C3-4алкилен, замещенный или незамещенный C4-5алкилен или замещенный или незамещенный C5-6алкилен. В определенных вариантах осуществления изобретения L3 представляет собой замещенный или незамещенный C2-6алкенилен, например, замещенный или незамещенный C2-3алкенилен, замещенный или незамещенный C3-4алкенилен, замещенный или незамещенный C4-5алкенилен или замещенный или незамещенный C5-6алкенилен. В определенных вариантах осуществления изобретения L3 представляет собой замещенный или незамещенный C2-6алкинилен, например, замещенный или незамещенный C2-3алкинилен, замещенный или незамещенный C3-4алкинилен, замещенный или незамещенный C4-5алкинилен или замещенный или незамещенный C5-6алкинилен. В любом из указанных выше случаев в определенных вариантах осуществления L3 представляет собой алкилен, алкенилен или алкинилен незамещенный или замещенный галогеном (например, фтором), замещенный или незамещенный C1-6алкилом и/или -ORZ5.
[0191] Кроме того, в определенных вариантах осуществления L3 представляет собой замещенный или незамещенный гетеро(C1-6)алкилен, например, замещенный или незамещенный гетеро(C1-2)алкилен, замещенный или незамещенный гетеро(C2-3)алкилен, замещенный или незамещенный гетеро(C3-4)алкилен, замещенный или незамещенный гетеро(C4-5)алкилен или замещенный или незамещенный гетеро(C5-6)алкилен. В определенных вариантах осуществления изобретения L3 представляет собой замещенный или незамещенный гетеро(C2-6)алкенилен, например, замещенный или незамещенный гетеро(C2-3)алкенилен, замещенный или незамещенный гетеро(C3-4)алкенилен, замещенный или незамещенный гетеро(C4-5)алкенилен или замещенный или незамещенный гетеро(C5-6)алкенилен. В определенных вариантах осуществления изобретения L3 представляет собой замещенный или незамещенный гетеро(C2-6)алкинилен, например, замещенный или незамещенный гетеро(C2-3)алкинилен, замещенный или незамещенный гетеро(C3-4)алкинилен, замещенный или незамещенный гетеро(C4-5)алкинилен или замещенный или незамещенный гетеро(C5-6)алкинилен. В любом из указанных выше случаев в определенных вариантах осуществления L3 представляет собой гетероалкилен, гетероалкенилен или гетероалкинилен, незамещенный или замещенный галогеном (например, фтором), замещенным или незамещенным C1-6алкилом и/или -ORZ5.
[0192] В любом из указанных выше или ниже случаев в определенных вариантах осуществления по меньшей мере один RZ5 представляет собой водород.
[0193] В любом из указанных выше или ниже случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ5 представляет собой замещенный или незамещенный алкил, например, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. Иллюстративные RZ5 C1-6алкильные группы включают, но не ограничиваются ими, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5), н-гексил (C6), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более фтор-группами (например, -CF3, -CH2F, -CHF2, дифторэтилом и 2,2,2-трифтор-1,1-диметилэтилом), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более хлор-группами (например, -CH2Cl, -CHCl2), и C1-6алкил, замещенный алкоксигруппами (например, -CH2OCH3 и -CH2OCH2CH3).
[0194] В любом из указанных выше или ниже случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ5 представляет собой замещенный или незамещенный алкенил, например, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-3алкенил, замещенный или незамещенный C3-4алкенил, замещенный или незамещенный C4-5алкенил или замещенный или незамещенный C5-6алкенил.
[0195] В любом из указанных выше или ниже случаев в определенных вариантах осуществления по меньшей мере один из RZ5 представляет собой замещенный или незамещенный алкинил, например, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C2-3алкинил, замещенный или незамещенный C3-4алкинил, замещенный или незамещенный C4-5алкинил или замещенный или незамещенный C5-6алкинил.
[0196] В любом из указанных выше или ниже случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ5 представляет собой замещенный или незамещенный карбоциклил, например, замещенный или незамещенный C3-6карбоциклил, замещенный или незамещенный C3-4карбоциклил, замещенный или незамещенный C4-5карбоциклил или замещенный или незамещенный C5-6карбоциклил.
[0197] В любом из указанных выше или ниже случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ5 представляет собой замещенный или незамещенный гетероциклил, например, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный 3-4-членный гетероциклил, замещенный или незамещенный 4-5-членный гетероциклил или замещенный или незамещенный 5-6-членный гетероциклил.
[0198] В любом из указанных выше или ниже случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ5 представляет собой замещенный или незамещенный арил, например, замещенный или незамещенный фенил.
[0199] В любом из указанных выше или ниже случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ5 представляет собой замещенный или незамещенный гетероарил, например, необязательно замещенный 5-6-членный гетероарил.
[0200] В любом из указанных выше или ниже случаев в определенных вариантах осуществления RZ5 представляет собой защитную группа, например, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы, защитную группу азота, когда присоединен к атому азота.
[0201] В определенных вариантах осуществления изобретения, где два RZ5 присоединены к атому азота, две группы RZ5 связаны с образованием замещенного или незамещенного гетероциклического кольца, например, замещенного или незамещенного пиперидинильного, замещенного или незамещенного пиперазинильного или замещенного или незамещенного морфолинильного кольца.
[0202] Кроме того, в любом из указанных выше или ниже случаев в определенных вариантах осуществления в каждом случае RZ6 независимо представляет собой водород, замещенный или незамещенный алкил, или две группы RZ6 связаны с образованием C3-6карбоциклического кольца.
[0203] В определенных вариантах осуществления изобретения по меньшей мере в одном из случаев RZ6 представляет собой водород.
[0204] В определенных вариантах осуществления изобретения по меньшей мере в одном из случаев RZ6 представляет собой замещенный или незамещенный алкил, например, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. Иллюстративные RZ4 C1-6алкильные группы включают, но не ограничиваются ими, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5), н-гексил (C6), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более фтор-группами (например, -CF3, -CH2F, -CHF2, дифторэтилом и 2,2,2-трифтор-1,1-диметилэтилом), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более хлор-группами (например, -CH2Cl, -CHCl2), и C1-6алкил, замещенный алкоксигруппами (например, -CH2OCH3 и -CH2OCH2CH3).
[0205] В определенных вариантах осуществления изобретения две группы RZ6 связаны с образованием C3-6карбоциклического кольца, например, замещенного или незамещенного циклопропила, замещенного или незамещенного циклобутила, замещенного или незамещенного циклопентила или замещенного или незамещенного циклогексильного кольца.
[0206] В определенных вариантах осуществления изобретения RZ4 представляет собой замещенный или незамещенный алкил, например, замещенный или незамещенный C1-6алкил, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. Иллюстративные RZ4 C1-6алкильные группы включают, но не ограничиваются ими, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5), н-гексил (C6), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более фтор-группами (например, -CF3, -CH2F, -CHF2, дифторэтилом и 2,2,2-трифтор-1,1-диметилэтилом), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более хлор-группами (например, -CH2Cl, -CHCl2), и C1-6алкил, замещенный алкоксигруппами (например, -CH2OCH3 и -CH2OCH2CH3).
[0207] В определенных вариантах осуществления изобретения RZ4 представляет собой замещенный или незамещенный алкенил, например, замещенный или незамещенный C2-6алкенил, замещенный или незамещенный C2-3алкенил, замещенный или незамещенный C3-4алкенил, замещенный или незамещенный C4-5алкенил или замещенный или незамещенный C5-6алкенил.
[0208] В определенных вариантах осуществления изобретения RZ4 представляет собой замещенный или незамещенный алкинил, например, замещенный или незамещенный C2-6алкинил, замещенный или незамещенный C2-3алкинил, замещенный или незамещенный C3-4алкинил, замещенный или незамещенный C4-5алкинил или замещенный или незамещенный C5-6алкинил.
[0209] В определенных вариантах осуществления изобретения RZ4 представляет собой замещенный или незамещенный карбоциклил, например, замещенный или незамещенный C3-6карбоциклил, замещенный или незамещенный C3-4карбоциклил, замещенный или незамещенный C4-5карбоциклил или замещенный или незамещенный C5-6карбоциклил.
[0210] В определенных вариантах осуществления изобретения RZ4 представляет собой замещенный или незамещенный гетероциклил, например, замещенный или незамещенный 3-6-членный гетероциклил, замещенный или незамещенный 3-4-членный гетероциклил, замещенный или незамещенный 4-5-членный гетероциклил или замещенный или незамещенный 5-6-членный гетероциклил.
[0211] В определенных вариантах осуществления изобретения RZ4 представляет собой замещенный или незамещенный арил, например, замещенный или незамещенный фенил.
[0212] В определенных вариантах осуществления изобретения RZ4 представляет собой замещенный или незамещенный гетероарил, например, необязательно замещенный 5-6-членный гетероарил.
[0213] В определенных вариантах осуществления изобретения RZ4 представляет собой -ORZ5, где RZ5 является таким, как определено в настоящем описании, например, RZ5 представляет собой водород, метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6).
[0214] В определенных вариантах осуществления изобретения RZ4 представляет собой -SRZ5, где RZ5 является таким, как определено в настоящем описании, например, RZ5 представляет собой водород, метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6).
[0215] В определенных вариантах осуществления изобретения RZ4 представляет собой -N(RZ5)2, например, RZ4 представляет собой -NH2 или -NHRZ5, где RZ5 является таким, как определено в настоящем описании, например, RZ5 представляет собой водород, метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) или н-гексил (C6), или RZ4 представляет собой -N(RZ5)2, где две группы RZ5 связаны с образованием замещенного или незамещенного гетероциклического кольца, например, замещенного или незамещенного пиперидинильного, замещенного или незамещенного пиперазинильного или замещенного или незамещенного морфолинильного кольца.
[0216] В настоящем описании рассматривают конкретные L3 алкиленовые группы. Например, в определенных вариантах осуществления L3 представляет собой алкиленовую группу формулы:

где p равно 1, 2 или 3, и каждый из RZ7 и RZ8 независимо представляет собой водород, галоген, замещенный или незамещенный C1-6алкил или -ORZ5. В определенных вариантах осуществления изобретения p равно 1. В определенных вариантах осуществления изобретения p равно 2. В определенных вариантах осуществления изобретения p равно 3.
[0217] В настоящем описании также рассматривают конкретные L3 алкениленовые группы. Например, в определенных вариантах осуществления L3 представляет собой алкениленовую группу формулы:

где q равно 0, 1 или 2, и каждый из RZ7 и RZ8 независимо представляет собой водород, галоген, замещенный или незамещенный C1-6алкил или -ORZ5. В определенных вариантах осуществления изобретения q равно 0. В определенных вариантах осуществления изобретения q равно 1. В определенных вариантах осуществления изобретения q равно 2.
[0218] В настоящем описании также рассматривают конкретные L3 гетероалкиленовые группы, например, в определенных вариантах осуществления L3 представляет собой гетероалкиленовую группу формулы:

где w равно 0 или 1 и p равно 1, 2 или 3, или w равно 1 и p равно 0, 1, 2 или 3, и каждый из RZ7 и RZ8 независимо представляет собой водород, галоген, замещенный или незамещенный C1-6алкил или -ORZ5.
[0219] В определенных вариантах осуществления изобретения p равно 0. В определенных вариантах осуществления изобретения p равно 1. В определенных вариантах осуществления изобретения p равно 2. В определенных вариантах осуществления изобретения p равно 3. В определенных вариантах осуществления изобретения w равно 0. В определенных вариантах осуществления изобретения w равно 1. В определенных вариантах осуществления изобретения w равно 0, и p равно 1. В определенных вариантах осуществления изобретения w равно 0, и p равно 2. В определенных вариантах осуществления изобретения w равно 0, и p равно 3. В определенных вариантах осуществления изобретения w равно 1, и p равно 1. В определенных вариантах осуществления изобретения w равно 1, и p равно 2. В определенных вариантах осуществления изобретения w равно 1, и p равно 3.
[0220] Например, в определенных вариантах осуществления, где w равно 0, L3 представляет собой гетероалкиленовую группу формулы:

где p и RZ8 являются такими, как определено в настоящем описании.
[0221] В определенных вариантах осуществления, где w равно 1, L3 представляет собой гетероалкиленовую группу формулы:

где p, R27 и RZ8 являются такими, как определено в настоящем описании.
[0222] В определенных вариантах осуществления изобретения по меньшей мере в одном из случаев RZ7 представляет собой водород. В любом из указанных выше случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ7 представляет собой галоген, например, фтор. В любом из указанных выше случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ7 представляет собой замещенный или незамещенный C1-6алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. Иллюстративные RZ7 C1-6алкильные группы включают, но не ограничиваются ими, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5), н-гексил (C6), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более фтор-группами (например, -CF3, -CH2F, -CHF2, дифторэтилом и 2,2,2-трифтор-1,1-диметилэтилом), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более хлор-группами (например, -CH2Cl, -CHCl2), и C1-6алкил, замещенный алкоксигруппами (например, -CH2OCH3 и -CH2OCH2CH3). В любом из указанных выше случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ7 представляет собой -CH3, -CF3, -CH2CH3 (Et) или -CH(CH3)2 (iPr). В любом из указанных выше случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ7 представляет собой -ORZ5, например, -OH.
[0223] В определенных вариантах осуществления изобретения по меньшей мере в одном из случаев RZ8 представляет собой водород. В любом из указанных выше случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ8 представляет собой галоген, например, фтор. В любом из указанных выше случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ8 представляет собой замещенный или незамещенный C1-6алкил, например, замещенный или незамещенный C1-2алкил, замещенный или незамещенный C2-3алкил, замещенный или незамещенный C3-4алкил, замещенный или незамещенный C4-5алкил или замещенный или незамещенный C5-6алкил. Иллюстративные RZ8 C1-6алкильные группы включают, но не ограничиваются ими, замещенный или незамещенный метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5), н-гексил (C6), C1-6 алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более фтор-группами (например, -CF3, -CH2F, -CHF2, дифторэтилом и 2,2,2-трифтор-1,1-диметилэтилом), C1-6алкил, замещенный 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более хлор-группами (например, -CH2Cl, -CHCl2), и C1-6алкил, замещенный алкоксигруппами (например, -CH2OCH3 и -CH2OCH2CH3). В любом из указанных выше случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ8 представляет собой -CH3, -CF3, -CH2CH3 (Et) или -CH(CH3)2 (iPr). В любом из указанных выше случаев в определенных вариантах осуществления по меньшей мере в одном из случаев RZ8 представляет собой -ORZ5, например, -OH.
[0224] Иллюстративные L3 алкиленовые группы включают, но не ограничиваются ими:
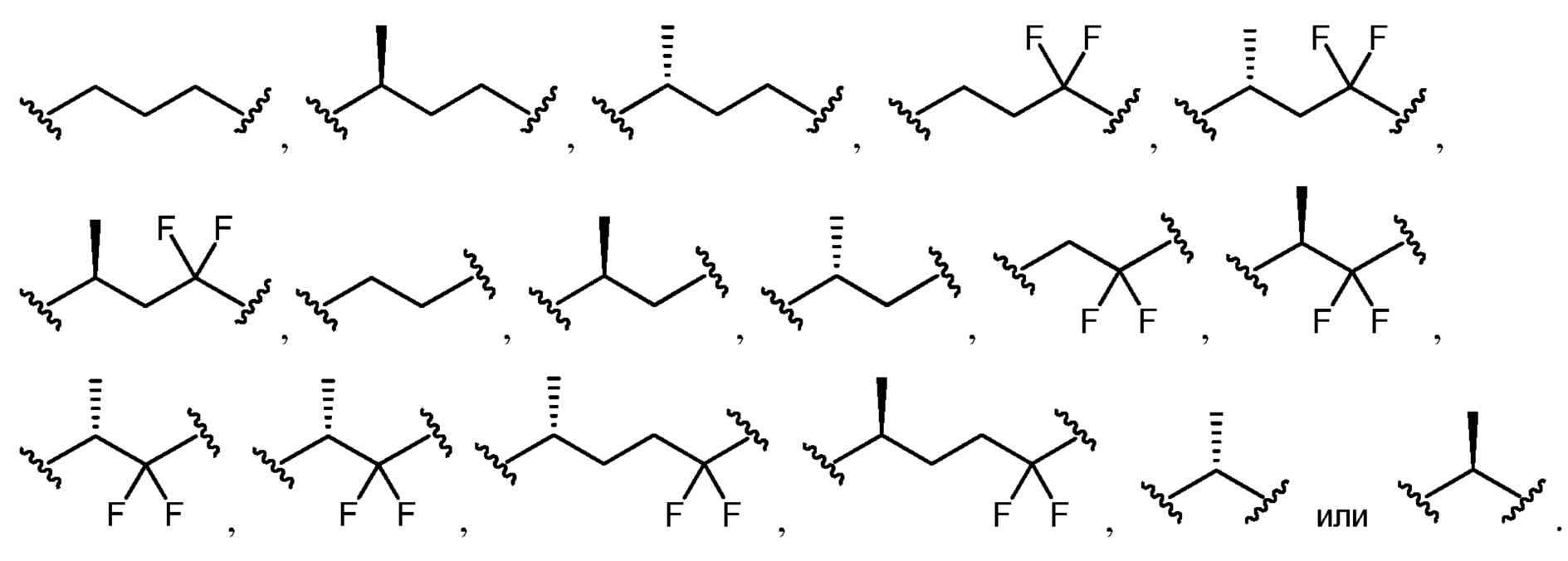
[0225] Иллюстративные L3 алкениленовые группы включают, но не ограничиваются ими:

[0226] Иллюстративные L3 гетероалкиленовые группы включают, но не ограничиваются ими:

[0227] В определенных вариантах осуществления изобретения группа



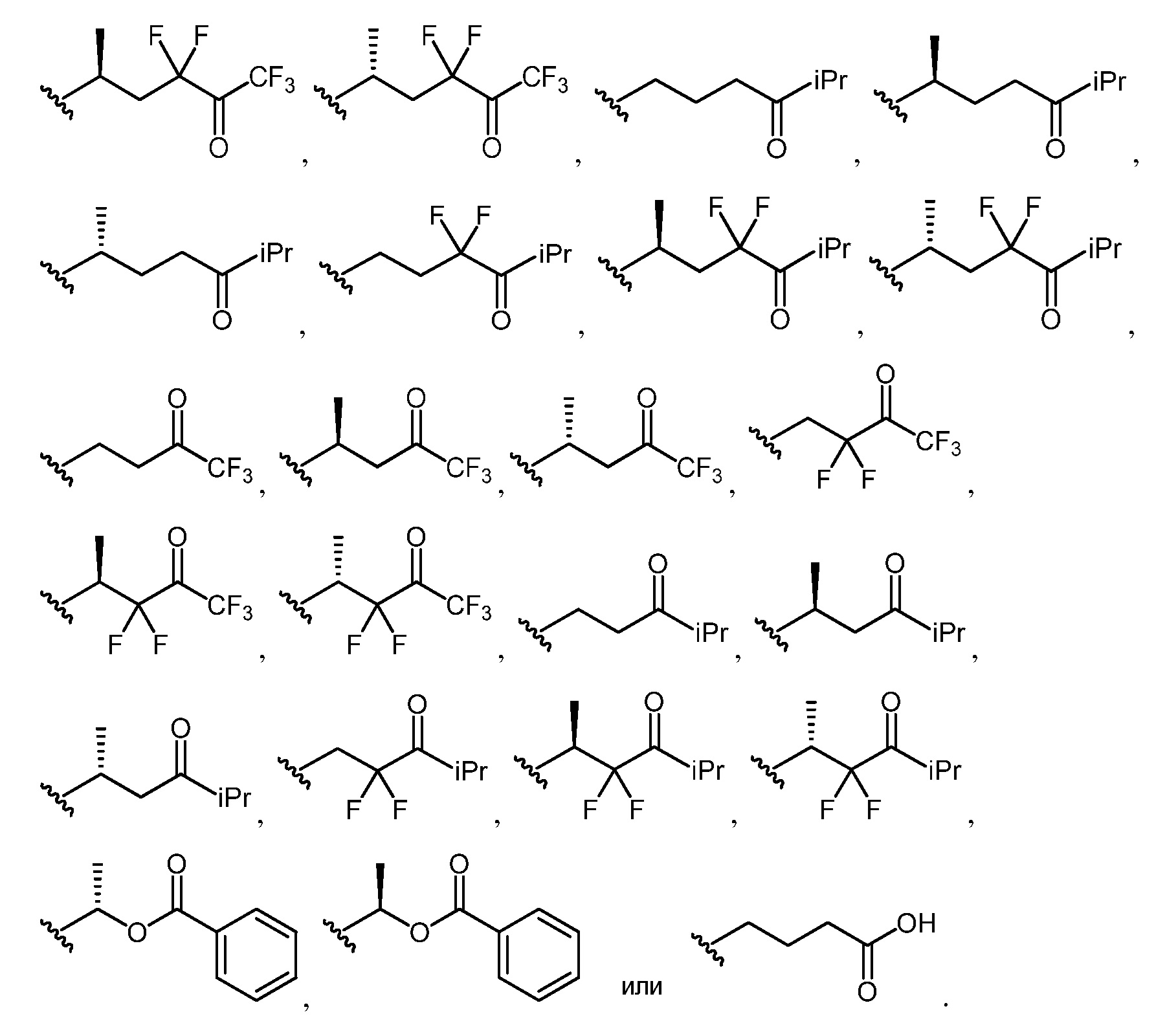
[0228] В определенных вариантах осуществления изобретения группа





[0229] В определенных вариантах осуществления изобретения группа

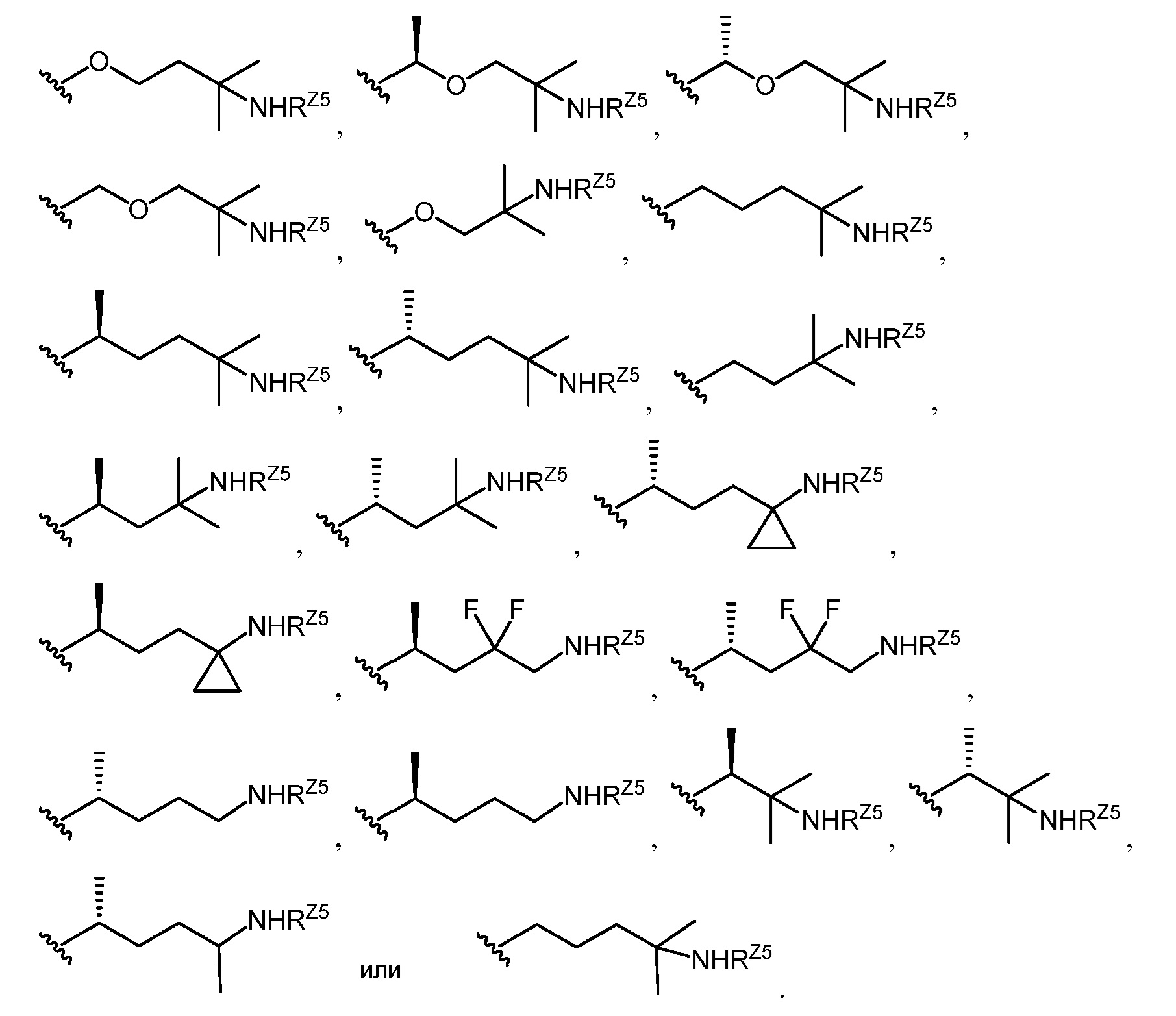

[0230] В определенных вариантах осуществления изобретения группа


[0231] В определенных вариантах осуществления изобретения группа



Различные варианты осуществления R2, R11a и R11b
[0232] В основном, как определено выше, каждый из R2, R11a и R11b независимо представляет собой H, -OH, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил или замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -N3, -NO2, -SCN, -CN, -ORB1, -SRB1, -N(RB1)2, -N=NRB1, -N=C(RB1)2, -N(ORB1)(RB1), -C(=O)RB1, -C(=O)ORB1, -C(=O)SRB1, -C(=O)N(Rb1)2, -C(=O)N(ORB1)(RB1), -OC(=O)RB1, -OC(=O)ORB1, -OC(=O)SRB1, -OC(=O)N(RB1)2, -NRB1C(=O)RB1, -NRB1C(=O)ORB1, -NRB1C(=O)SRB1, -NRB1C(=O)N(RB1)2, -SC(=O)RB2, -SC(=O)ORB1, -SC(=O)SRB1, -SC(=O)N(RB1)2, -OS(=O)2RB2, -OS(=O)2ORB1, -S-S(=O)2RB2, -S-S(=O)2ORB1, -S(=O)RB2, -SO2RB2, -NRB1SO2RB2, или -SO2N(RB1)2, и/или R11a и R11b связаны с образованием оксогруппы (=O).
[0233] В определенных вариантах осуществления изобретения R2 представляет собой H. В определенных вариантах осуществления изобретения R2 представляет собой замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой замещенный или незамещенный алкенил. В определенных вариантах осуществления изобретения R2 представляет собой замещенный или незамещенный алкинил. В определенных вариантах осуществления изобретения R2 представляет собой -ORB1. В определенных вариантах осуществления изобретения R2 представляет собой -SRB1. В определенных вариантах осуществления изобретения R2 представляет собой -N(RB1)2. В определенных вариантах осуществления изобретения R2 представляет собой H, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, -ORB1, -SRB1 или -N(RB1)2. В определенных вариантах осуществления изобретения R2 представляет собой F, Cl, Me, Et, n-Pr, метокси, этокси, пропокси, бутокси, этинил, гидроксибутинил, метоксипропинил, хлорэтинил или циклопропинил. В определенных вариантах осуществления изобретения R2 представляет собой CF3, амино или диметиламино. В определенных вариантах осуществления изобретения R2 представляет собой неводородную группу в альфа-положении. В определенных вариантах осуществления изобретения R2 представляет собой неводородную группу в бета-положении.
[0234] В определенных вариантах осуществления изобретения каждый из R11a и R11b представляет собой водород. В определенных вариантах осуществления изобретения один из R11a и R11b представляет собой водород. В определенных вариантах осуществления изобретения один из R11a и R11b представляет собой водород, а другой представляет собой -ORB1, -SRB1 или -N(RB1)2. В определенных вариантах осуществления изобретения один из R11a и R11b представляет собой H, а другой представляет собой -OH, -OMe, амино или диалкиламино. В определенных вариантах осуществления изобретения R11b представляет собой неводородную группу, и R11a представляет собой водород. В определенных вариантах осуществления изобретения R11a представляет собой неводородную группу, и R11b представляет собой водород.
[0235] В определенных вариантах осуществления изобретения R11a и R11b совместно образуют оксогруппу.
Различные варианты осуществления R4a, R4b, R6, R7a, R7b, R14, R17, R18 и R19
[0236] В основном, как определено выше, каждый из R4a, R4b, R7a и R7b независимо представляет собой водород, -OH, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, -N3, -NO2, -SCN, -CN, -ORB1, -SRB1, -N(RB1)2, -N=NRB1, -N=C(RB1)2, -N(ORB1)(RB1), -C(=O)RB1, -C(=O)ORB1, -C(=O)SRB1, -C(=O)N(Rb1)2, -C(=O)N(ORB1)(RB1), -OC(=O)RB1, -OC(=O)ORB1, -OC(=O)SRB1, -OC(=O)N(RB1)2, -NRB1C(=O)RB1, -NRB1C(=O)ORB1, -NRB1C(=O)SRB1, -NRB1C(=O)N(RB1)2, -SC(=O)RB2, -SC(=O)ORB1, -SC(=O)SRB1, -SC(=O)N(RB1)2, -OS(=O)2RB2, -OS(=O)2ORB1, -S-S(=O)2RB2, -S-S(=O)2ORB1, -S(=O)RB2, -SO2RB2, -NRB1SO2RB2 или -SO2N(RB1)2, где RB1 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, или замещенный или незамещенный гетероарил, защитную группу кислорода, когда присоединен к атому кислорода, защитную группу серы, когда присоединен к атому серы, защитную группу азота, когда присоединен к атому азота, или две группы RB1 связаны с образованием замещенного или незамещенного гетероциклического кольца, и RB2 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, или группа RB1 и группа RB2 являются связанными с образованием замещенного или незамещенного гетероциклического кольца или необязательно, где каждый из R4a и R4b и/или R7a и R7b являются связанными с образованием оксогруппы (=O).
[0237] В определенных вариантах осуществления изобретения каждый из R4a и R4b представляет собой водород. В определенных вариантах осуществления изобретения один из R4a и R4b представляет собой водород. В определенных вариантах осуществления изобретения один из R4a и R4b представляет собой водород, а другой представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил или замещенный или незамещенный алкинил. В определенных вариантах осуществления изобретения один из R4a и R4b представляет собой водород, а другой представляет собой Me, Et, этенил, этинил, пропенил или пропинил. В определенных вариантах осуществления изобретения каждый из R4a и R4b независимо представляет собой замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения каждый R4a и R4b представляет собой Me.
[0238] В определенных вариантах осуществления изобретения каждый из R7a и R7b представляет собой водород.
[0239] В основном, как определено выше, каждый из R6a и R6b независимо представляет собой водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил или замещенный или незамещенный алкинил, и

[0240] В определенных вариантах осуществления изобретения, где

[0241] В определенных вариантах осуществления изобретения, где

[0242] В определенных вариантах осуществления изобретения, где

[0243] В определенных вариантах осуществления изобретения, где





[0244] В основном, как определено выше, R17 представляет собой водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или -ORD1. В определенных вариантах осуществления изобретения R17 представляет собой водород. В определенных вариантах осуществления изобретения R17 представляет собой галоген. В определенных вариантах осуществления изобретения R17 представляет собой замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R17 представляет собой замещенный или незамещенный алкенил. В определенных вариантах осуществления изобретения R17 представляет собой замещенный или незамещенный алкинил. В определенных вариантах осуществления изобретения R17 представляет собой замещенный или незамещенный карбоциклил. В определенных вариантах осуществления изобретения R17 представляет собой замещенный или незамещенный гетероциклил. В определенных вариантах осуществления изобретения R17 представляет собой замещенный или незамещенный арил. В определенных вариантах осуществления изобретения R17 представляет собой замещенный или незамещенный гетероарил. В определенных вариантах осуществления изобретения R17 представляет собой -ORD1 (например, -OH).
[0245] В основном, как определено выше, R14 представляет собой H или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R14 представляет собой H. В определенных вариантах осуществления изобретения R14 представляет собой замещенный или незамещенный алкил (например, -CH3).
[0246] В основном, как определено выше, R18 независимо представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R18 представляет собой водород. В определенных вариантах осуществления изобретения R18 представляет собой замещенный или незамещенный алкил (например, -CH3).
[0247] В основном, как определено выше, R19 независимо представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R19 представляет собой водород. В определенных вариантах осуществления изобретения R19 представляет собой замещенный или незамещенный алкил (например, -CH3).
[0248] В определенных вариантах осуществления изобретения R14 представляет собой водород, R18 представляет собой -CH3, и R19 представляет собой -CH3.
[0249] В определенных вариантах осуществления изобретения R14 представляет собой водород, R18 представляет собой -CH3, и R19 представляет собой водород.
Дополнительные варианты осуществления формулы (I)
[0250] В настоящем описании дополнительно рассматривают различные комбинации указанных выше вариантов осуществления. Например, в определенных вариантах осуществления соединение формулы (I) имеют формулу(I-w):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3b представляет собой водород. В определенных вариантах осуществления изобретения группа -X1R3b в положении C3 является бета. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0251] В определенных вариантах осуществления изобретения соединение формулы (I) имеют формулу (I-x):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения группа -OH в положении C3 является бета. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0252] В определенных вариантах осуществления изобретения соединение формулы (I) имеет формулу (I-y):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения группа -OH в положении C3 является бета. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0253] В определенных вариантах осуществления изобретения соединение формулы (I) имеет формулу (I-z):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения группа -OH в положении C3 является бета. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0254] В определенных вариантах осуществления изобретения соединение формулы (I) имеют формулу (I-a1), (I-a2) или (I-a3):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3b представляет собой водород. В определенных вариантах осуществления изобретения группа -OR3b в положении C3 является бета. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R6a и R6b представляют собой водород. В определенных вариантах осуществления изобретения R6a представляет собой галоген, например, фтор, или алкил. В определенных вариантах осуществления изобретения R6b представляет собой галоген, например, фтор, или алкил, и R6a представляет собой водород. В определенных вариантах осуществления изобретения R6a и R6b представляют собой галоген, например, фтор.
[0255] В определенных вариантах осуществления изобретения соединение формулы (I) имеют формулу (I-b1), (I-b2) или (I-b3):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3b представляет собой водород. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R6a и R6b представляют собой водород. В определенных вариантах осуществления изобретения R6a представляет собой галоген, например, фтор, или алкил. В определенных вариантах осуществления изобретения R6b представляет собой галоген, например, фтор, или алкил, и R6a представляет собой водород. В определенных вариантах осуществления изобретения R6a и R6b представляют собой галоген, например, фтор.
[0256] В определенных вариантах осуществления изобретения соединение формулы (I) имеет формулу (I-c1), (I-c2) или (I-c3):


или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3b представляет собой водород. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R6a и R6b представляют собой водород. В определенных вариантах осуществления изобретения R6a представляет собой галоген, например, фтор, или алкил. В определенных вариантах осуществления изобретения R6b представляет собой галоген, например, фтор, или алкил, и R6a представляет собой водород. В определенных вариантах осуществления изобретения R6a и R6b представляют собой галоген, например, фтор.
[0257] В определенных вариантах осуществления изобретения соединение имеет формулу (I-d):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3b представляет собой водород. В определенных вариантах осуществления изобретения группа -X1R3b в положении C3 является бета. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0258] В определенных вариантах осуществления изобретения соединение имеет формулу (I-e):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0259] В определенных вариантах осуществления изобретения соединение имеет формулу (I-f):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3b представляет собой водород. В определенных вариантах осуществления изобретения группа -X1R3b в положении C3 является бета. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0260] В определенных вариантах осуществления изобретения соединение имеет формулу (I-g):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0261] В определенных вариантах осуществления изобретения соединение имеет формулу (I-h):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3b представляет собой водород. В определенных вариантах осуществления изобретения группа -X1R3b в положении C3 явлется бета. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0262] В определенных вариантах осуществления изобретения соединение имеет формулу (I-i):

или его фармацевтически приемлемой соли, сольвата, пролекарства, стереоизомера, таутомера, изотопного варианта или N-оксида, или их сочетания. В определенных вариантах осуществления изобретения R3a представляет собой водород или замещенный или незамещенный алкил. В определенных вариантах осуществления изобретения R2 представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения R11a представляет собой водород, и R11b представляет собой водород или -ORB1. В определенных вариантах осуществления изобретения


[0263] Дополнительные варианты осуществления формулы (I) включают соединения следующих ниже формул:





[0264] В определенных вариантах осуществления соединение представляет собой любое из следующих ниже соединений:







[0265] В определенных вариантах осуществления соединение представляет собой любое из следующих ниже соединений:




или их фармацевтически приемлемую соль, сольват, пролекарство, стереоизомер, таутомер, изотопный вариант или N-оксид, или их сочетание.
[0266] В определенных вариантах осуществления соединение представляет собой любое из следующих ниже соединений:


или их фармацевтически приемлемую соль, сольват, пролекарство, стереоизомер, таутомер, изотопный вариант или N-оксид, или их сочетание.
[0267] В определенных вариантах осуществления соединение представляет собой любое из следующих ниже соединений:
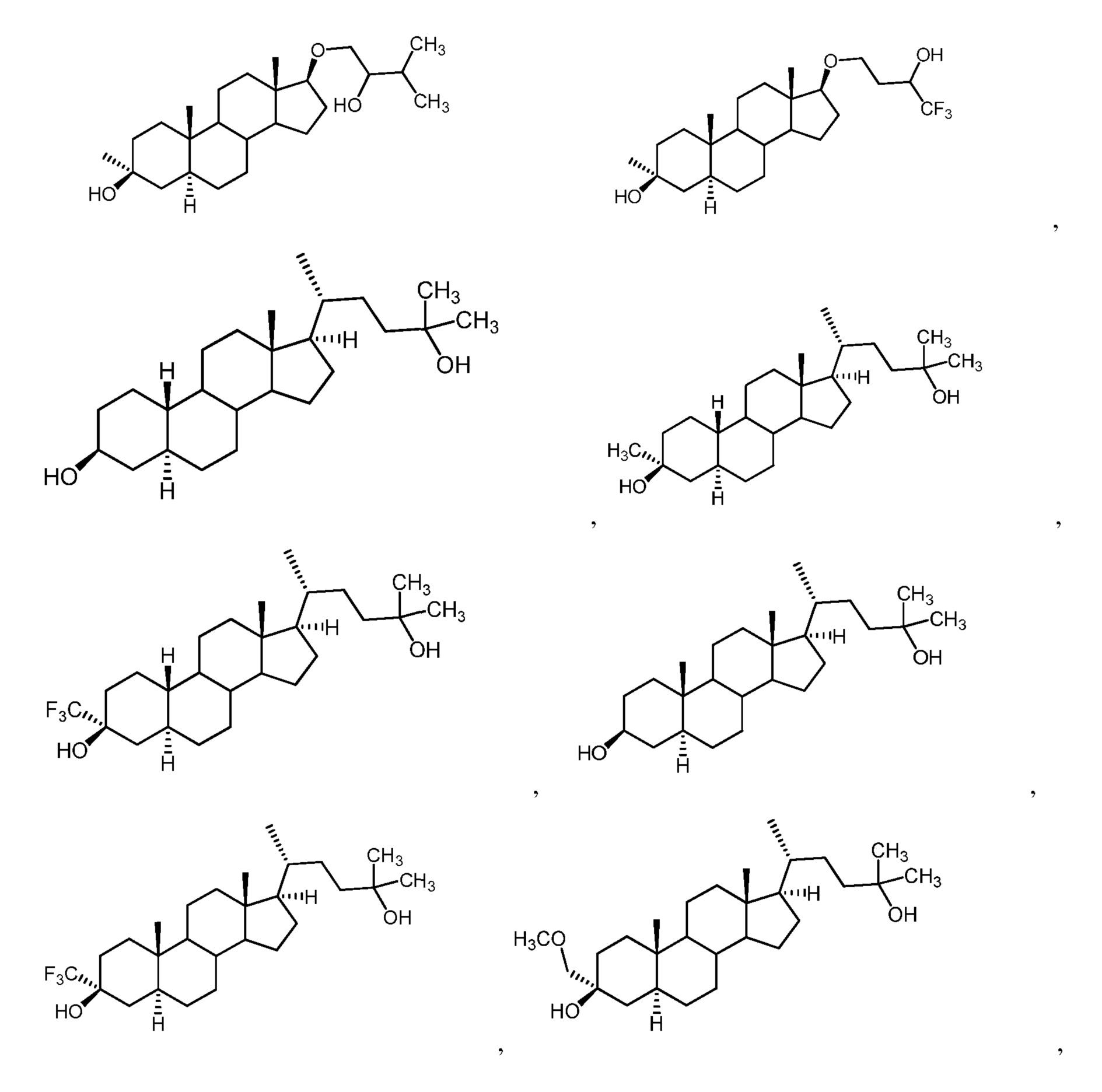

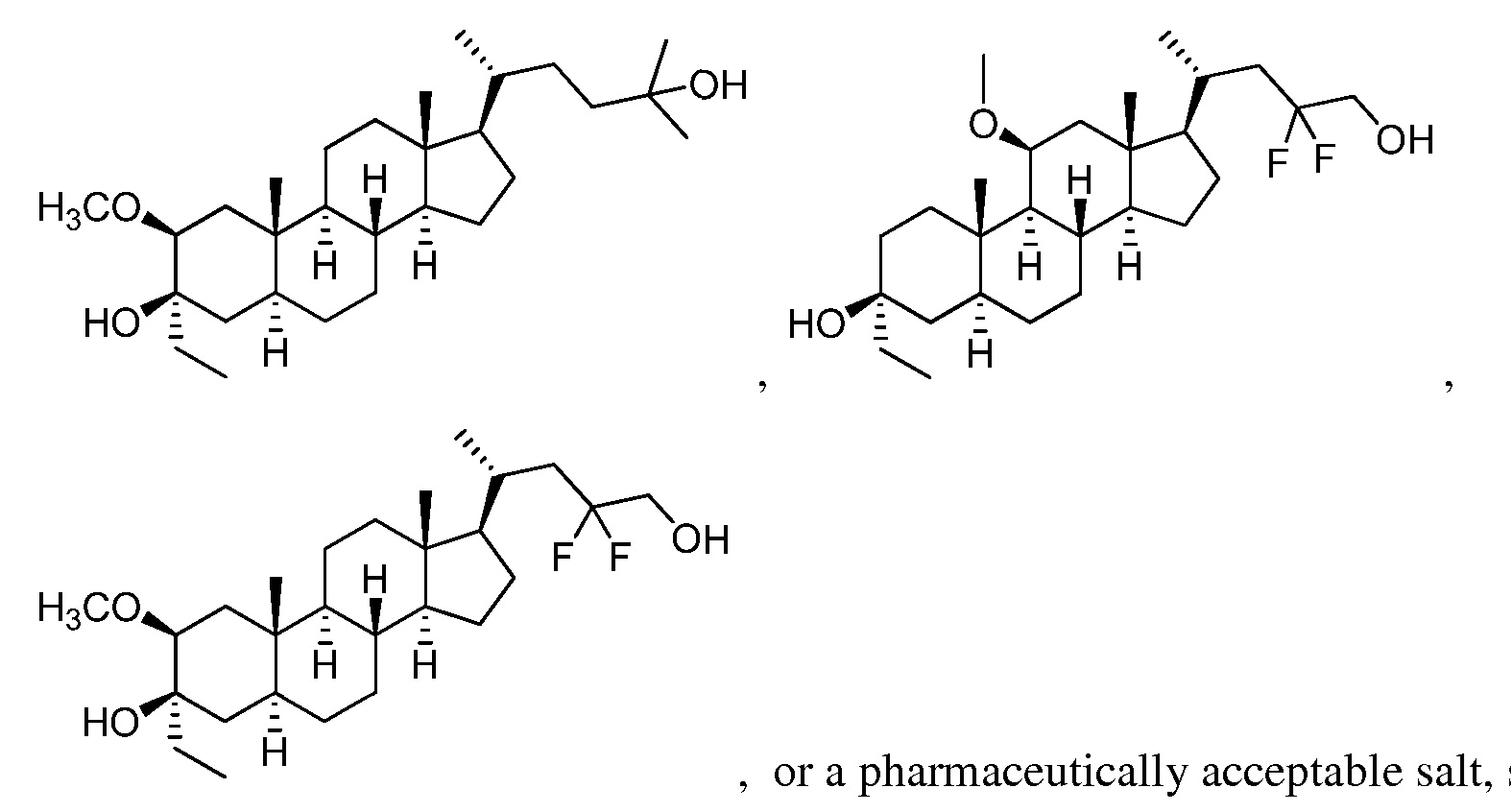

[0268] В определенных вариантах осуществления соединение представляет собой любое из следующих ниже соединений:

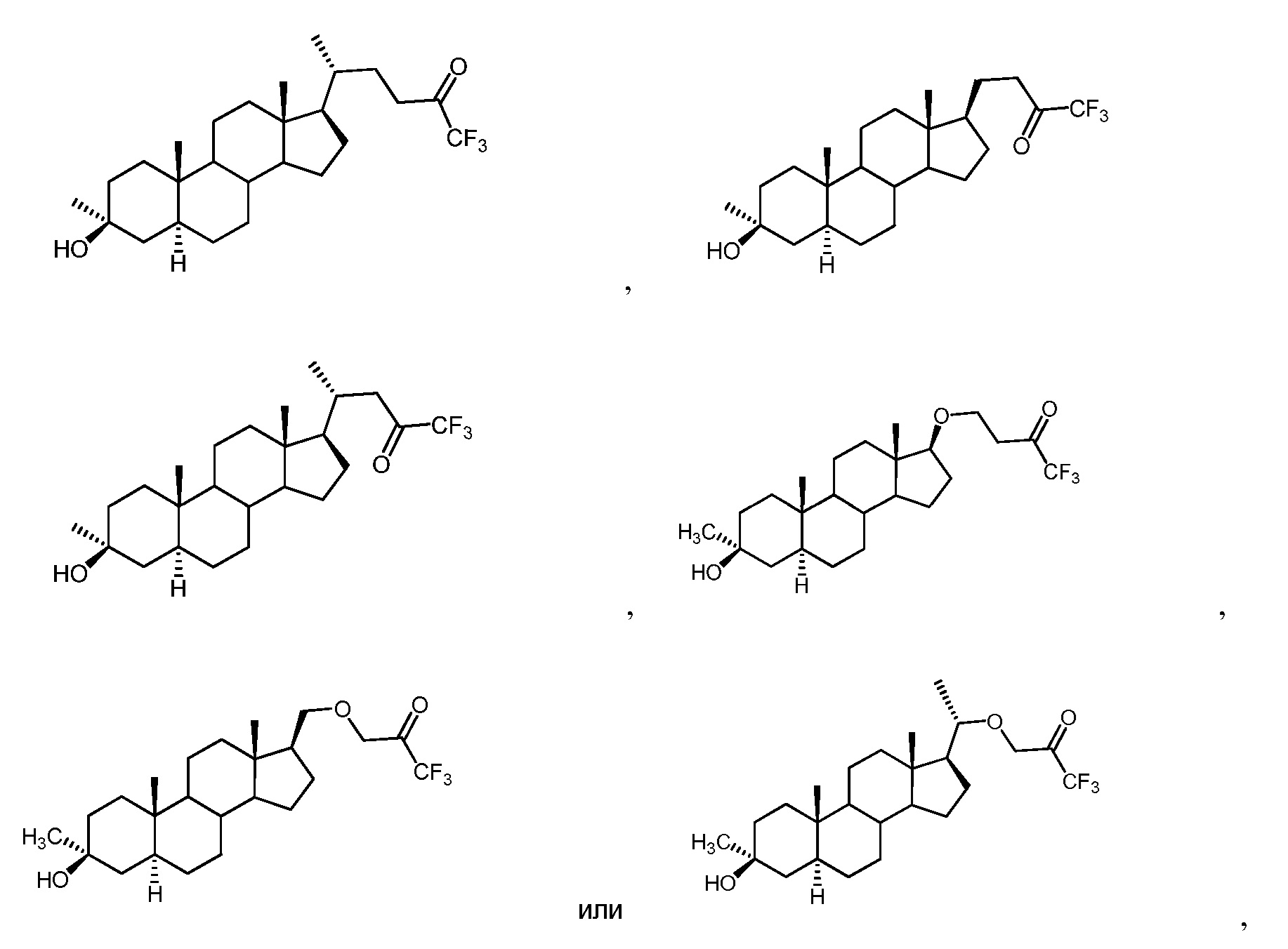
или фармацевтически приемлемую соль, сольват, пролекарство, стереоизомер, таутомер, изотопный вариант или N-оксид, или их сочетание.
[0269] В определенных вариантах осуществления соединение представляет собой любое из следующих ниже соединений:

или фармацевтически приемлемую соль, сольват, пролекарство, стереоизомер, таутомер, изотопный вариант или N-оксид, или их сочетание.
[0270] В определенных вариантах осуществления соединение представляет собой любое из следующих ниже соединений:

или фармацевтически приемлемую соль, сольват, пролекарство, стереоизомер, таутомер, изотопный вариант или N-оксид, или их сочетание.
[0271] В определенных вариантах осуществления изобретения соединение по настоящему изобретению представляет собой фармацевтически приемлемую соль.
Фармацевтические композиции
[0272] В другом аспекте изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и эффективное количество соединения формулы (I).
[0273] При применении в качестве фармацевтических средств, соединения, предоставленные в настоящем описании, как правило, вводят в форме фармацевтической композиции. Такие композиции можно получать способом, хорошо известным в фармацевтической области, и они содержат по меньшей мере одно активное соединение.
[0274] В одном из вариантов осуществления по отношению к фармацевтической композиции носитель представляет собой парентеральный носитель, пероральный или местный носитель.
[0275] Настоящее изобретение также относится к соединению по настоящему изобретению или его фармацевтической композиции для применения в качестве фармацевтического или лекарственного средства.
[0276] Как правило, соединения, предоставленные в настоящем описании, вводят в терапевтически эффективном количестве. Количество фактически вводимого соединения, как правило, определяет врач, учитывая соответствующие обстоятельства, включая патологическое состояние, подлежащее лечению, выбранный путь введения, фактически вводимое соединение, возраст, массу и ответ индивидуального пациента, тяжесть симптомов пациента и т.п.
[0277] Фармацевтические композиции, предоставленные в настоящем описании, можно вводить различными путями, включая пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. В зависимости от предполагаемого пути доставки, соединения, предоставленные в настоящем описании, предпочтительно формулируют в виде инъецируемых или пероральных композиций или в виде мазей, в виде лосьонов или в виде пластырей, все для трансдермального введения.
[0278] Композиции для перорального введения могут находиться в форме нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Однако более часто композиции находятся в стандартных лекарственных формах для облегчения точного дозирования. Термин "стандартные лекарственные формы" относится к физически дискретным единицам, подходящим в качестве однократных доз для индивидуумов, являющихся человеком, и других млекопитающих, где каждая единица содержит предопределенное количество активного вещества, рассчитанного чтобы оказывать желаемый терапевтический эффект, в ассоциации с подходящим фармацевтическим эксципиентом. Характерные стандартные лекарственные формы включают предварительно заполненные, дозированные ампулы или шприцы с жидкими композициями или пилюли, таблетки, капсулы или т.п. в случае твердых композиций. В таких композициях соединение, как правило, представляет собой минорный компонент (приблизительно от 0,1 приблизительно до 50% по массе или предпочтительно приблизительно от 1 приблизительно до 40% по массе), где остальная часть представляет собой различные наполнители или носители и технологические добавки, способствующие образованию желаемой формы дозирования.
[0279] Жидкие формы, подходящие для перорального введения могут содержать подходящий водный или неводный носитель с буферами, суспендирующими и диспергирующими средствами, красителями, вкусоароматическими добавками и т.п. Твердые формы могут содержать, например, любой из следующих ингредиентов или соединений аналогичной природы: связывающее средство, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин, эксципиент, такой как крахмал или лактоза, дезинтегрирующее средство, такое как альгиновая кислота, пимогель или кукурузный крахмал, смазочные средства, такие как стеарат магния, способствующее скольжению средство, такое как коллоидный диоксид кремния, подсластитель, такой как сахароза или сахарин, или ароматизатор, такой как мята перечная, метилсалицилат или апельсиновый ароматизатор.
[0280] Инъецируемые композиции, как правило, основаны на инъекционном стерильном физиологическом растворе или фосфатно-солевом буфере или других инъецируемых носителях, известных в данной области. Как указано выше, активное соединение в таких композициях, как правило, представляет собой минорный компонент, часто составляющий приблизительно от 0,05 до 10% по массе, где оставшаяся часть представляет собой инъецируемый носитель и т.п.
[0281] Трансдермальные композиции, как правило, формулируют в виде местной мази или крема, содержащего активный ингредиент(ы), в основном в количестве в диапазоне приблизительно от 0,01 приблизительно до 20% по массе, предпочтительно приблизительно от 0,1 приблизительно до 20% по массе, предпочтительно приблизительно от 0,1 приблизительно до 10% по массе и более предпочтительно приблизительно от 0,5 приблизительно до 15% по массе. Когда формулируют в виде мази, активные ингредиенты, как правило, комбинируют с парафиновой или смешивающейся с водой основой для мази. Альтернативно, активные ингредиенты можно формулировать в виде крема, например, с основой для крема масло-в-воде. Такие трансдермальные составы хорошо известны в данной области и, как правило, содержат дополнительные ингредиенты для усиления стабильности кожного проникновения активных ингредиентов или состава. Все такие известные трансдермальные составы и ингредиенты входят в объем, предоставленный в настоящем описании.
[0282] Соединения, предоставленные в настоящем описании, также можно вводить посредством трансдермального устройства. Таким образом, трансдермальное введение можно проводить с использованием пластыря типа резервуар или пористой мембраны или вида твердой матрицы.
[0283] Описанные выше компоненты для перорально вводимых, инъецируемых или местно вводимых композиций являются исключительно иллюстративными. Другие вещества, а также способы обработки и т.п. указаны в главе 8 Remington's Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, включенной в настоящее описание посредством ссылки.
[0284] Описанные выше компоненты для перорально вводимых, инъецируемых или местно вводимых композиций являются исключительно иллюстративными. Другие вещества, а также способы обработки и т.п. указаны в главе 8 Remington's The Science and Practice of Pharmacy, 21st edition, 2005, Publisher: Lippincott Williams & Wilkins, включенной в настоящее описание посредством ссылки.
[0285] Соединения по настоящему изобретению также можно вводить в формах с длительным высвобождением или из систем доставки с длительным высвобождение лекарственного средства. Описание характерных веществ с длительным высвобождением можно найти в Remington's Pharmaceutical Sciences.
[0286] Настоящее изобретение также относится к фармацевтически приемлемым составам соединений по настоящему изобретению. В одном из вариантов осуществления состав содержит воду. В другом варианте осуществления состав содержит производное циклодекстрина. Наиболее распространенные циклодекстрины представляют собой α-, β- и γ-циклодекстрины, состоящие из 6, 7 и 8 α-1,4-связанных звеньев глюкозы соответственно, необязательно содержащих один или более заместителей на связанных группах сахаров, которые включают, но не ограничиваются ими, метилированный, гидроксиалкилированный, ацилированный и сульфоалкилэфирный заместитель. В определенных вариантах осуществления изобретения циклодекстрин представляет собой сульфоалкильный эфир β-циклодекстрина, например, сульфобутильный эфир β-циклодекстрина, также известный как Captisol®. См., например, U.S. 5376645. В определенных вариантах осуществления изобретения состав содержит гексапропил-β-циклодекстрин. В более конкретном варианте осуществления состав содержит гексапропил-β-циклодекстрин (10-50% в воде).
[0287] Настоящее изобретение также относится к фармацевтически приемлемой соли присоединения кислот соединения по настоящему изобретению. Кислота, которую можно использовать для получения фармацевтически приемлемой соли представляет собой такую, которая образует нетоксичную соль присоединения кислоты, например, соль, содержащую фармакологически приемлемые анионы, такие как гидрохлорид, йодогидрат, гидробромид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, сукцинат, малеат, фумарат, бензоат, пара-толуолсульфонат и т.п.
[0288] Следующие ниже примеры составов иллюстрируют характерные фармацевтические композиции, которые можно получать в соответствии с настоящим изобретением. Однако настоящее изобретение не ограничено следующими ниже фармацевтическими композициями.
[0289] Иллюстративный состав 1 - таблетки: Соединение по настоящему изобретению можно смешивать в виде сухого порошка с сухим связывающим средством на основе желатина в массовом отношении приблизительно 1:2. В качестве смазочного средства добавляют незначительное количество стеарата магния. Смесь формулируют в таблетки 240-270 мг (80-90 мг активного соединения на таблетку) в таблетировочном прессе.
[0290] Иллюстративный состав 2 - капсулы: Соединение по настоящему изобретению можно смешивать в виде сухого порошка с разбавителем на основе крахмала в массовом отношении приблизительно 1:1. Смесь вносят в 250 мг капсулы (125 мг активного соединения на капсулу).
[0291] Иллюстративный состав 3 - жидкость: Соединение по настоящему изобретению (125 мг) можно смешивать с сахарозой (1,75 г) и ксантановой камедью (4 мг) и получаемую смесь можно смешивать, пропускать через сито № 10 меш U.S., а затем смешивать с предварительно полученным раствором микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия (11:89, 50 мг) в воде. Бензоат натрия (10 мг), вкусоароматическую добавку и краситель разбавляют водой и добавляют при перемешивании. Затем можно добавлять достаточное количество воды для получения общего объема 5 мл.
[0292] Иллюстративный состав 4 - таблетки: Соединение по настоящему изобретению можно смешивать в виде сухого порошка с сухим связывающим средством на основе желатина в массовом отношении приблизительно 1:2. В качестве смазочного средства добавляют незначительное количество стеарата магния. Смесь формулируют в таблетки 450-900 мг (150-300 мг активного соединения) в таблетировочном прессе.
[0293] Иллюстративный состав 5 - инъекция: Соединение по настоящему изобретению можно растворять или суспендировать в забуференной стерильной инъецируемой водной среде физиологического раствора до концентрации приблизительно 5 мг/мл.
[0294] Иллюстративный состав 6 - таблетки: Соединение по настоящему изобретению можно смешивать в виде сухого порошка с сухим связывающим средством на основе желатина в массовом отношении приблизительно 1:2. В качестве смазочного средства добавляют незначительное количество стеарата магния. Смесь формулируют в таблетки 90-150 мг (30-50 мг активного соединения на таблетку) в таблетировочном прессе.
[0295] Иллюстративный состав 7 - таблетки: Соединение по настоящему изобретению можно смешивать в виде сухого порошка с сухим связывающим средством на основе желатина в массовом отношении приблизительно 1:2. В качестве смазочного средства добавляют незначительное количество стеарата магния. Смесь формулируют в таблетки 30-90 мг (10-30 мг активного соединения на таблетку) в таблетировочном прессе.
[0296] Иллюстративный состав 8 - таблетки: Соединение по настоящему изобретению можно смешивать в виде сухого порошка с сухим связывающим средством на основе желатина в массовом отношении приблизительно 1:2. В качестве смазочного средства добавляют незначительное количество стеарата магния. Смесь формулируют в таблетки 0,3-30 мг (0,1-10 мг активного соединения на таблетку) в таблетировочном прессе.
[0297] Иллюстративный состав 9 - таблетки: Соединение по настоящему изобретению можно смешивать в виде сухого порошка с сухим связывающим средством на основе желатина в массовом отношении приблизительно 1:2. В качестве смазочного средства добавляют незначительное количество стеарата магния. Смесь формулируют в таблетки 150-240 мг (50-80 мг активного соединения на таблетку) в таблетировочном прессе.
[0298] Иллюстративный состав 10 - таблетки: Соединение по настоящему изобретению можно смешивать в виде сухого порошка с сухим связывающим средством на основе желатина в массовом отношении приблизительно 1:2. В качестве смазочного средства добавляют незначительное количество стеарата магния. Смесь формулируют в таблетки 270-450 мг (90-150 мг активного соединения на таблетку) в таблетировочном прессе.
[0299] Уровни дозирования инъекций находятся в диапазоне приблизительно от 0,1 мг/кг/час до по меньшей мере 10 мг/кг/час, все для приблизительно от 1 приблизительно до 120 часов, и в частности от 24 до 96 часов. Для получения соответствующих стационарных уровней также можно вводить болюсы для предварительной нагрузки приблизительно от 0,1 мг/кг приблизительно до 10 мг/кг или более. Ожидают, что максимальная суммарная доза не превышает приблизительно 2 г/сутки для являющегося человеком пациента массой от 40 до 80 кг.
[0300] Для профилактики и/или лечения хронических патологических состояний продолжительность схемы лечения, как правило, составляет много месяцев или лет, таким образом, пероральное дозирование является предпочтительным для удобства и переносимости пациентом. При пероральном дозировании от одной до пяти, в частности от двух до четырех, и, как правило, три пероральные дозы в сутки представляют собой характерные схемы лечения. С использованием таких схем дозирования каждая доза обеспечивает приблизительно от 0,01 приблизительно до 20 мг/кг соединения, предоставленного в настоящем описании, где каждая из предпочтительных доз обеспечивает приблизительно от 0,1 приблизительно до 10 мг/кг, и в частности приблизительно от 1 приблизительно до 5 мг/кг.
[0301] Трансдермальные дозы, как правило, выбирают, чтобы обеспечивать аналогичные или более низкие уровни в крови по сравнению с получаемыми уровнями с использованием инъекционных доз.
[0302] При применении для профилактики начала развития нарушения ЦНС соединения, предоставленные в настоящем описании, вводят индивидууму, подвергающему риску развития патологического состояния, как правило, предварительно и под наблюдением врача при уровнях дозирования, описанных выше. Индивидуумы, подвергающиеся риску развития конкретного патологического состояния, как правило, включают таких, которые имеют семейный анамнез патологического состояния, или таких, у которых идентифицировали посредством генетического тестирования или скрининга, что они являются особенно подверженными развитию патологического состояния.
Способы лечения и применения
[0303] Проведенные ранее исследования (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987)) продемонстрировали, что определенные 3α-гидроксилированные стероиды являются на несколько порядков более эффективными в качестве модуляторов GRC, чем другие описанные ранее (см., например, Majewska et al., Science, 232:1004-1007 (1986); Harrison et al., J. Pharmacol. Exp. Ther., 241:346-353 (1987)). Majewska et al. и Harrison et al. полагали, что 3α-гидроксилированные-5-восстановленные стероиды способны предоставлять только значительно более низкие уровни эффективности. В настоящее время экспериментальные данные in vitro и in vivo продемонстрировали, что высокая активность таких стероидов обеспечивает возможность их терапевтической пригодности для модуляции возбудимости головного мозга через GRC (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987); Wieland et al., Psychopharmacology, 118(l):65-71 (1995)).
[0304] Также в качестве нейроактивных стероидов получали различные синтетические стероиды. См., например, патент США № 5232917, в котором описаны соединения нейроактивных стероидов, пригодные для лечения стресса, тревожности, бессонницы, судорожных расстройств и расстройств настроения, такие как депрессия, которые поддаются лечению активными в отношении GRC средствами терапевтически благоприятным образом. Кроме того, ранее было продемонстрировано, что такие стероиды взаимодействуют с уникальным участком на GRC, который отличается от других известных участков взаимодействия (например, барбитуратов, бензодиазепинов и ГАМК), для которых ранее было выявлено терапевтически положительное воздействие на стресс, тревожность, сон, расстройства настроения и судорожные расстройства (см., например, Gee K.W. and Yamamura H.I., "Benzodiazepines and Barbiturates: Drugs for the Treatment of Anxiety, Insomnia and Seizure Disorders" в Central Nervous System Disorders, Horvell, ed., Marcel-Dekker, New York (1985), pp. 123-147; Lloyd K.G. and Morselli P.L., "Psychopharmacology of GABAergic Drugs" в Psychopharmacology: The Third Generation of Progress, H.Y. Meltzer, ed., Raven Press, N.Y. (1987), pp. 183-195, и Gee et al., European Journal of Pharmacology, 136:419-423 (1987). Эти соединения являются желательными вследствие продолжительности их действия, эффективности и пероральной активности (наряду с другими формами введения).
[0305] Таким образом, соединения и фармацевтические композиции, предоставленные в настоящем описании, находят применение в качестве терапевтических средств для профилактики и/или лечения патологических состояний ЦНС у млекопитающих, включая людей и не являющихся человеком млекопитающих. Таким образом, и как указано ранее, настоящее изобретение относится в своем объеме и распространяется на перечисленные способы лечения, а также к соединениям для таких способов и к применению таких соединений для получения лекарственных средств, пригодных для таких способов. Предусматривают, что новые 3α- и 3β-гидроксистероиды по изобретению могут действовать как негативные аллостерические регуляторы (NAM) NMDA-рецептора, и таким образом могут являться пригодными для профилактики и/или лечения широкого диапазона патологических состояний ЦНС.
[0306] В одном из аспектов соединения по настоящему изобретению предусмотрены в качестве терапевтических средств, например, для лечения патологических состояний ЦНС у млекопитающих, таких как для лечения шизофрении, депрессии, биполярного расстройства (например, I и/или II), шизоаффективного расстройства, расстройств настроения, тревожных расстройств, расстройств личности, психозов, компульсивного расстройства, посттравматического стрессового расстройства (PTSD), расстройств аутистического спектра (ASD), дистимии (легкой степени депрессии), социального тревожного расстройства, обсессивно-компульсивного расстройства (OCD), боли (например, болевого синдрома или расстройства), расстройств сна, нарушений памяти, деменции, болезни Альцгеймера, судорожного расстройства (например, эпилепсии), травматического повреждения головного мозга, инсульта, аддиктивных расстройств (например, пристрастия к опиатам, кокаину и/или алкоголю), аутизма, болезни Гентингтона, бессонницы, болезни Паркинсона, абстинентных синдромов или тиннитуса. В определенных вариантах осуществления изобретения соединения по настоящему изобретению являются пригодными для лечения депрессии, тревожности, расстройств настроения, расстройств сна, нарушений памяти, травматического повреждения головного мозга, инсульта, эпилепсии и шизофрении.
[0307] Другой аспект относится к способу лечения млекопитающего, восприимчивого или страдающего патологическим состоянием, ассоциированным с возбудимостью головного мозга, который включает введение эффективного количества одной или нескольких фармацевтических композиций, описываемых в настоящем описании.
[0308] Еще один аспект относится к применению соединений по настоящему изобретению в качестве фармацевтических средств, например, в частности для лечения или профилактики указанных выше патологических состояний и заболеваний.
[0309] Еще один другой аспект относится к способу получения лекарственного средства для лечения или профилактики одного из указанных выше патологических состояний и заболеваний.
[0310] В еще одном другом аспекте настоящее изобретение относится к способу профилактики, лечения, улучшения состояния или контроля заболевания или патологического состояния, который включает введение индивидууму, нуждающемуся в такой профилактике, лечении, улучшении состояния или контроля, профилактически или терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтической композиции.
[0311] В еще одном аспекте настоящее изобретение относится к применению соединения по настоящему изобретению для получения лекарственного средства для лечения заболевания или патологического состояния, ассоциированного с возбудимостью головного мозга. В одном из вариантов осуществления заболевание или патологическое состояние выбрано из депрессии, тревожности, шизофрении, расстройств сна, нарушений памяти и расстройств настроения.
[0312] В еще одном аспекте настоящее изобретение относится к способу лечения млекопитающего, например, человека, для лечения заболевания, ассоциированного с возбудимостью головного мозга, включая лечение указанного млекопитающего эффективным количеством соединения по настоящему изобретению или его композиции.
[0313] В еще одном аспекте настоящее изобретение относится к комбинации соединения по настоящему изобретению и другим фармакологически активным средством.
[0314] Соединения, предоставленные в настоящем описании, можно вводить в виде одного активного средства или их можно вводить в комбинации с другими средствами. Введение в комбинации можно проводить любым способом, известным специалистам в данной области, включая, например, раздельное, последовательное, одновременное и чередующееся введение.
ПРИМЕРЫ
[0315] Для того, чтобы изобретение, описываемое в настоящем описании, можно было более полно понять, приводят указанные ниже примеры. Синтетические и биологические примеры, описанные в настоящей заявке, приводят для иллюстрации соединений, фармацевтических композиций и способов, предоставленных в настоящем описании, и их не следует интерпретировать как ограничивающие каким-либо образом их объем.
Вещества и способы
[0316] Соединения, предоставленные в настоящем описании, можно получать из легкодоступных исходных веществ следующими ниже общепринятыми способами и процедурами. Следует понимать, что когда приводят характерные или предпочтительные условия обработки (например, температуры реакций, время, молярные отношения реагентов, растворителей, давления и т.д.), также можно использовать другие условия обработки, если не указано иное. Оптимальные условия реакции могут изменяться в зависимости от конкретных используемых реагентов или растворителей, но специалист в данной области может определять такие условия можно общепринятой оптимизацией.
[0317] Кроме того, как очевидно специалистам в данной области, для предотвращения протекания нежелательных реакций с определенными функциональными группами необходимыми могут являться общепринятые защитные группы. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящих условий для защиты и снятия защиты, является хорошо известным в данной области. Например, многие защитные группы и их введение и снятие описаны у T.W. Greene and P.G.M. Wuts, Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991 и в цитируемых в ней ссылках.
[0318] Соединения, предоставленные в настоящем описании, можно выделять и очищать известными стандартными способами. Такие способы включают (но не ограничиваются ими) перекристаллизацию, колоночную хроматографию или ВЭЖХ. Следующие ниже схемы подробно приведены в отношении получения характерных замещенных биариламидов, которые перечислены в настоящем описании. Специалист в данной области органического синтеза может получать соединения, предоставленные в настоящем описании, из известных или коммерчески доступных исходных веществ и реагентов.
[0319] Энантиомерно чистые соединения, предоставленные в настоящем описании, можно получать любыми способами, известными специалистам в данной области. Например, их можно получать хиральным или асимметричным синтезом из подходящего оптически чистого предшественника или получать из рацемата любым общепринятым способом, например, хроматографического разделения с использованием хиральной колонки, TLC, или посредством получения диастереоизомеров, их разделения и восстановления желаемого энантиомера. См., например, "Enantiomers, Racemates and Resolutions", by J. Jacques, A. Collet and S.H. Wilen, (Wiley-Interscience, New York, 1981); S.H. Wilen, A. Collet and J. Jacques, Tetrahedron, 2725 (1977); E.L. Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и S.H. Wilen, Tables of Resolving Agents and Optical Resolutions 268 (E.L. Eliel ed., Univ. of Notre Dame Press, Notre Dame, IN, 1972, Stereochemistry of Organic Compounds, Ernest L. Eliel, Samuel H. Wilen and Lewis N. Manda (1994 John Wiley & Sons, Inc.), и Stereoselective Synthesis A Practical Approach, Mihály Nógrádi (1995 VCH Publishers, Inc., NY, NY).
[0320] В определенных вариантах осуществления изобретения энантиомерно чистое соединение по настоящему изобретению можно получать посредством реакции рацемата с подходящей оптически активной кислотой или основанием. Подходящие кислоты или основания включают такие, как описанные у Bighley et al., 1995, Salt Forms of Drugs and Adsorption, в Encyclopedia of Pharmaceutical Technology, vol. 13, Swarbrick & Boylan, eds., Marcel Dekker, New York; ten Hoeve & H. Wynberg, 1985, Journal of Organic Chemistry 50:4508-4514; Dale & Mosher, 1973, J. Am. Chem. Soc. 95:512, и CRC Handbook of Optical Resolution via Diastereomeric Salt Formation, содержание которых, таким образом, полностью включено посредством ссылки.
[0321] Энантиомерно чистые соединения также можно выделять из кристаллического диастереомера или из маточного раствора в зависимости от свойств растворимости конкретного используемого расщепляющего кислоту средства и конкретного используемого энантиомера кислоты. Идентичность и оптическую чистоту конкретного соединения, выделяемого таким образом, можно определять посредством поляриметрии или другими известными в данной области аналитическими способами. Затем диастереоизомеры можно разделять, например, хроматографией или фракционной кристаллизацией, и восстанавливать желаемый энантиомер обработкой подходящим основанием или кислотой. Другой энантиомер можно получать из рацемата аналогичным образом или выделять из растворов от первого разделения.
В определенных вариантах осуществления изобретения энантиомерно чистое соединение можно выделять из рацемического соединения хиральной хроматографией. Различные хиральные колонки и элюенты для применения для разделения энантиомеров являются доступными, и подходящие условия для разделения можно эмпирически определять способами, известными специалисту в данной области. Иллюстративные хиральные колонки, доступные для применения для разделения энантиомеров, предоставленные в настоящем описании, включают, но не ограничиваются ими, CHIRALCEL® OB, CHIRALCEL® OB-H, CHIRALCEL® OD, CHIRALCEL® OD-H, CHIRALCEL® OF, CHIRALCEL® OG, CHIRALCEL® OJ и CHIRALCEL® OK.
Способы синтеза
[0322] Основные способы получения соединений по настоящему изобретению предоставлены в виде дополнительных вариантов осуществления изобретения и проиллюстрированы в обобщенных схемах 1-13 и примерах 1-36. Для целей схемы 1-13, если не определено, R' представляет собой алкил, R23 представляет собой R23a или R23b, и X1, L1, R1, R3a, R3b, R23a и R23b представляют собой такие, как описано в настоящем описании.
Схема 1. Синтез 3α-замещенных 3β-гидроксистероидов
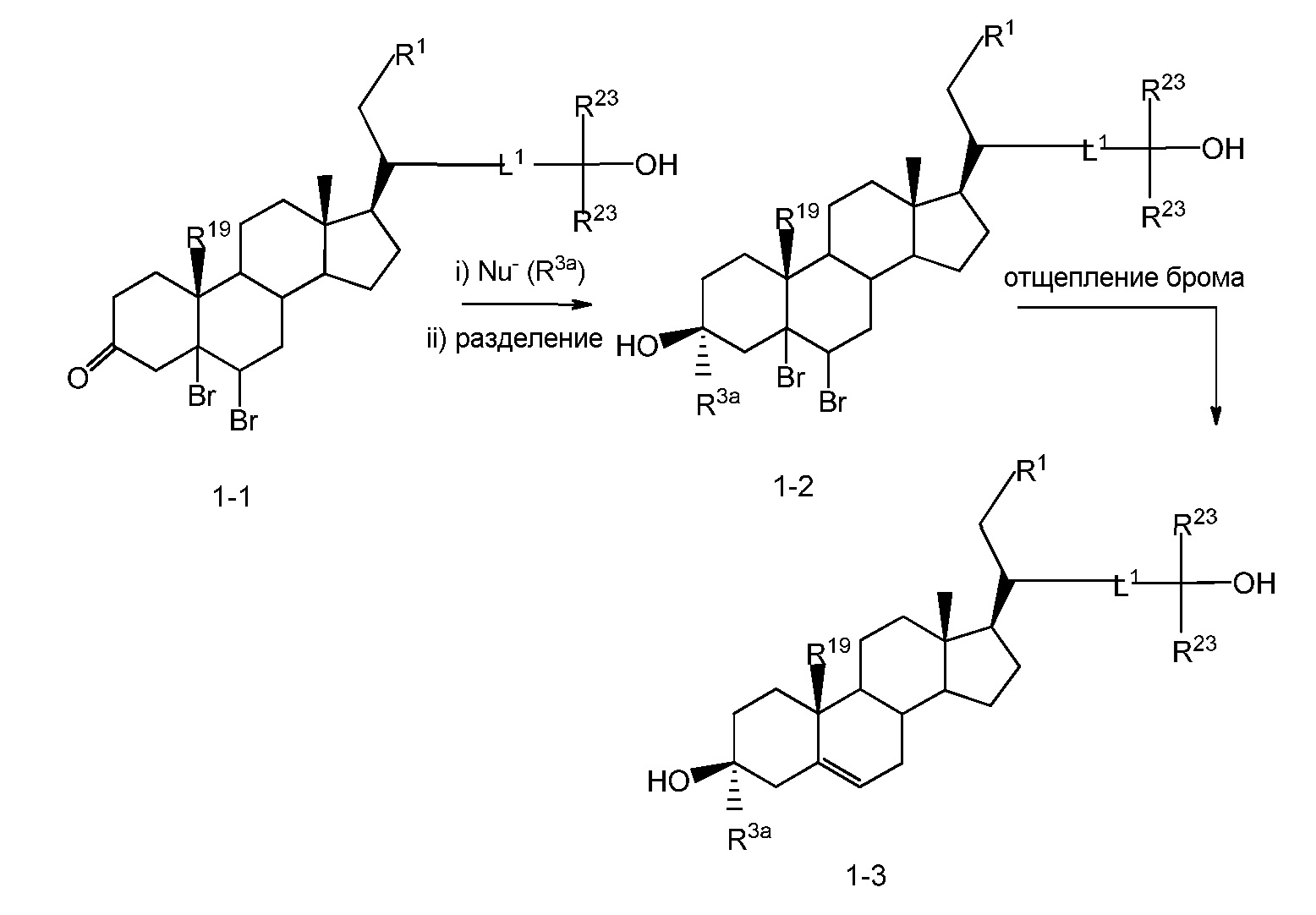
Схема 2. Синтез 3α-замещенных3β-гидроксистероидов

Схема 3. Синтез 3β-амино- и 3β-алкиламиностероидов

Схема 4. Синтез стероид-сульфатов

Схема 5. Синтез 3β-сложного эфира и амида стероидов

Схема 6. Синтез 3-оксостероидов

Схема 7. Синтез 21-гетероарил-3β-гидроксистероидов

Схема 8. Синтез 3α-замещенных 3β-гидроксистероидов

Схема 9. Синтез 3α-замещенных 3β-гидроксистероидов
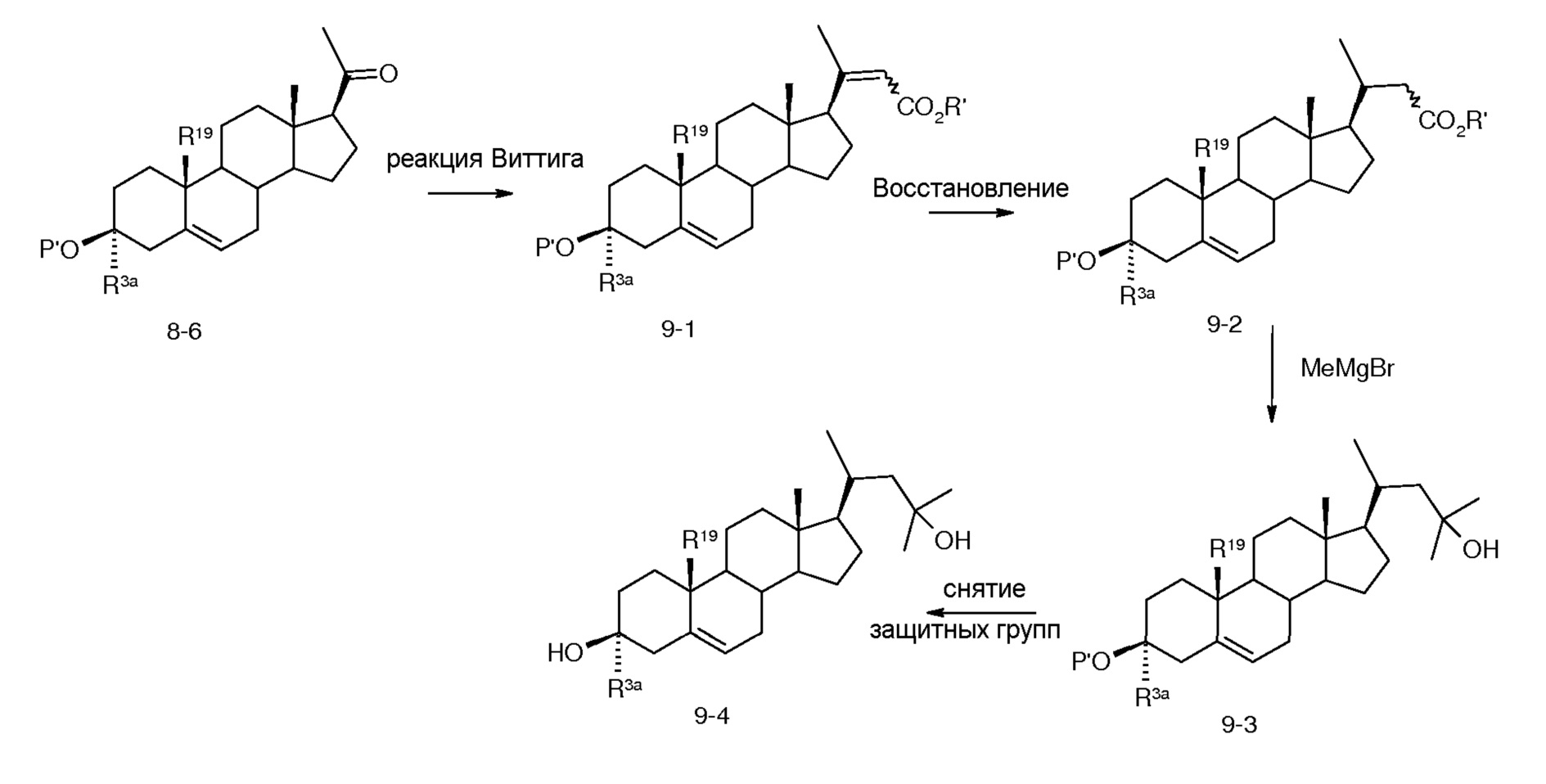
Схема 10. Синтез 3α-замещенных 3β-гидроксистероидов

Схема 11. Синтез 3α-замещенных 3β-гидроксистероидов

Схема 12. Синтез 3α-замещенных 3β-гидроксистероидов

Схема 13. Синтез 3α-замещенных 3β-гидроксистероидов

Пример 1. Получение соединения ST-200-A-001
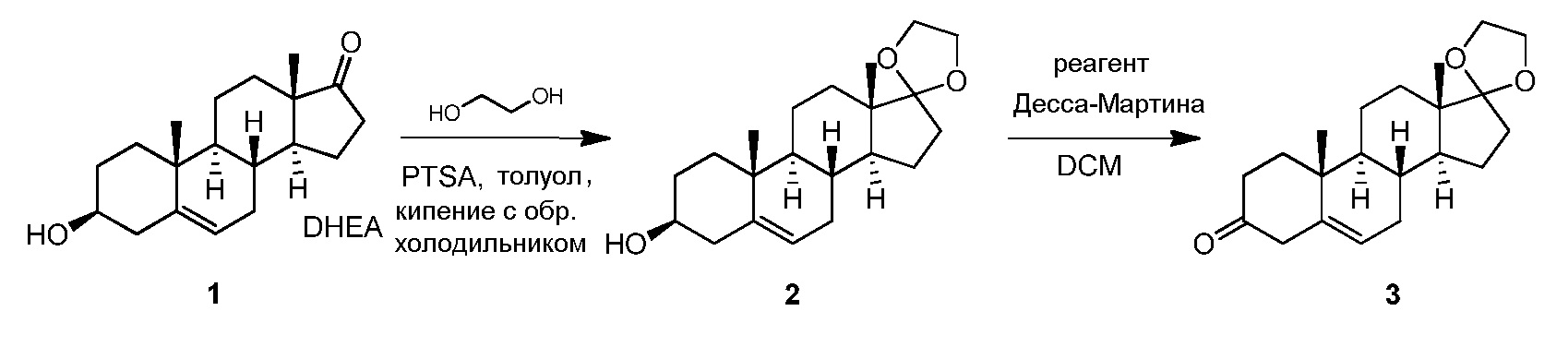

[0323] Получение соединения 2: К раствору кетона 1 (50,0 г, 0,17 моль, 1,0 экв.) и этиленгликоля (62 мл) в толуоле (600 мл) добавляли пара-толуолсульфоновую кислоту (1,4 г, 7,28 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи с насадкой Дина-Старка. LCMS демонстрировали, что исходное вещество полностью разрушалось. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом (500 мл) и промывали насыщенным водным бикарбонатом натрия (300 мл ×2) и насыщенным солевым раствором (300 мл ×2). Сушили органическую фазу сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта 2 (64,0 г, 100%), который непосредственно использовали на следующем этапе без дополнительной очистки.1H ЯМР: (400 МГц, CDCl3) δ 5,35 (д, J=5,6 Гц, 1H), 3,97-3,82 (м, 4H), 3,59-3,47 (м, 1H), 2,34-2,21 (м, 2H), 2,06-1,94 (м, 2H), 1,90-1,74 (м, 3H), 1,73-1,64 (м, 1H), 1,63-1,33 (м, 10H), 1,32-1,19 (м, 1H), 1,14-1,03 (м, 1H), 1,01 (с, 3H), 0,99-0,93 (м, 1H), 0,86 (с, 3H).
[0324] Получение соединения 3: К раствору соединения 2 (32 г, 96 ммоль, 1,0 экв.) в сухом CH2Cl2 (1200 мл) по частям добавляли реагент Десса-Мартина (81 г, 192 ммоль, 2,0 экв.) при 0ºC. Затем реакционную смесь перемешивали при комнатной температуре в течение 3 часов. TLC (PE:EA=3:1) демонстрировали, что исходное вещество полностью разрушалось. Реакционную смесь гасили насыщенной водной NaHCO3/Na2S2O3=1:3 (1 л). Органическую фазу промывали насыщенным солевым раствором (500 мл) и сушили Na2SO4, и выпаривали растворитель с получением неочищенного продукта 3 (33,0 г, 100%), который непосредственно использовали на следующем этапе без дополнительной очистки.1H ЯМР: (400 МГц, CDCl3) δ 5,34 (д, J=5,2 Гц, 1H), 3,77-4,00 (м, 4H), 3,19-3,39 (м, 1H), 2,83 (дд, J=16,44, 2,13 Гц, 1H), 2,38-2,59 (м, 1H), 2,21-2,37 (м, 1H), 1,95-2,09 (м, 3H), 1,54-1,73 (м, 4H), 1,74-1,90 (м, 2H), 1,37-1,51 (м, 3H), 1,21-1,34 (м, 2H), 1,19 (с, 3H), 0,98-1,12 (м, 1H), 0,83-0,93 (м, 3H).
[0325] Получение MAD: К раствору соединения 5 (96 г, 436 ммоль, 1,0 экв.) в толуоле (300 мл) добавляли раствор AlMe3 (109 мл, 218 ммоль, 0,5 экв., 2 M в гексане) при комнатной температуре, при этом сразу же выделялся газ метан. Получаемую смесь перемешивали при комнатной температуре в течение 1 часа и использовали в качестве раствора MAD в толуоле на следующем этапе без какой-либо очистки.
[0326] Получение соединения 4: К раствору MAD (218 ммоль, 2,3 экв., свежеприготовленного) в толуоле (300 мл) капельно добавляли раствор соединения 4 (33 г, 96 ммоль, 1,0 экв.) в толуоле (100 мл) при -78ºC в течение 1 часа под азотом. Затем реакционную смесь перемешивали в течение 30 минут, капельно добавляли раствор MeMgBr (205 мл, 288 ммоль, 3,0 экв., 1,4 M в толуоле) при -78ºC. Реакционную смесь нагревали до -40ºC и перемешивали при такой температуре в течение 3 часов. TLC (PE:EA=3:1) демонстрировали, что исходное вещество полностью разрушалось. Смесь вливали в насыщенный водный раствор NH4Cl (200 мл) и экстрагировали EA (150 мл ×2). Объединенные органические фазы сушили Na2SO4, и выпаривали растворитель с получением неочищенного продукта. Неочищенный продукт очищали хроматографией с силикагелем, элюировали PE:EA (15:1) с получением продукта (7,64 г, 22%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 1H), 3,75-4,04 (м, 4H), 2,42 (д, J=13,6 Гц, 1H), 1,88-2,12 (м, 3H), 1,73-1,86 (м, 2H), 1,64-1,72 (м, 2H), 1,52-1,63 (м, 4H), 1,35-1,51 (м, 4H), 1,19-1,32 (м, 1H), 1,12-1,18 (м, 1H), 1,10 (с, 3H), 0,99-1,03 (м, 3H), 0,92-0,98 (м, 1H), 0,86 (с, 3H).
[0327] Соединение INT A: К раствору соединения 4 (6,0 г, 17,3 ммоль, 1,0 экв.) в THF (200 мл) добавляли водный раствор HCl (35 мл, 1 M) и ацетона (35 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. TLC (PE:EA=3:1) подтверждали, что реакция проходила полностью. Затем реакционную смесь разбавляли EA (200 мл), промывали насыщенным водным раствором NaHCO3 (200 мл), сушили Na2SO4 и выпаривали при пониженном давлении с получением продукта (5,2 г, 99,2%).1H ЯМР: (400 МГц, CDCl3) δ 5,27 (д, J=6,8 Гц, 1H), 2,45-2,35 (м, 2H), 2,09-1,84 (м, 4H), 1,82-1,57 (м, 6H), 1,50-1,35 (м, 4H), 1,26-1,08 (м, 4H), 1,05 (с, 3H), 0,95 (с, 3H), 0,86 (с, 3H).
[0328] Соединение A_001_1: К раствору PPh3CH3Br (28,3 г, 79,35 ммоль) в THF (50 мл) добавляли раствор t-BuOK (8,96 г, 79,35 ммоль) в THF (20 мл) при комнатной температуре. После перемешивания в течение 1 часа капельно добавляли INT A (4,0 г, 13,22 ммоль), растворенное в THF (10 мл). Реакционную смесь кипятили с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным NH4Cl, экстрагировали EA. Объединенный органический слой промывали насыщенным солевым раствором, сушили и концентрировали с получением неочищенного продукта, который очищали хроматографией на испарительной колонкой (PE/EA=15/1) с получением соединения A_001_1 (3,2 г, выход=80%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 5,32 (д, J=5,2 Гц, 1H), 4,65-4,64 (м, 2H), 2,50-2,42 (м, 2H), 2,27-2,22 (м, 1H), 2,07-1,97 (м, 1H), 1,87-1,68 (м, 4H), 1,68-1,49 (м, 7H), 1,40-1,15 (м, 4H), 1,12 (с, 3H), 1,05 (с, 3H), 1,04-0,96 (м, 1H), 0,80 (с, 3H).
[0329] Получение соединения A_001_2: К раствору соединения A_001_1 (300 мг, 1,0 ммоль, 1,0 экв.) и метилпропиолата (250 мг, 3,0 ммоль, 3,0 экв.) в CH2Cl2 (5 мл) капельно добавляли Et2AlCl (4 мл, 4,0 ммоль, 4,0 экв., 1 M в толуоле) при перемешивании при 25ºC, затем перемешивали реакционную смесь в течение ночи. TLC (PE/EA=3/1) подтверждали, исходное вещество полностью разрушалось. Раствор промывали насыщенной водной NaHCO3 (5 мл), сушили Na2SO4 и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали хроматографией на силикагеле, элюировали PE:EA (15:1) с получением желаемого продукта (200 мг, 52%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 7,03-6,97 (м, 1H), 5,86 (дд, J1=1,2 Гц, J2=15,6 Гц, 1H), 5,35 (д, J=1,2 Гц, 1H), 5,32 (д, J=5,2 Гц, 1H), 3,72 (с, 3H), 2,87 (д, J=6,8 Гц, 2H), 2,42 (д, J=13,2 Гц, 1H), 2,13-1,95 (м, 3H), 2,00-1,40 (м, 11H), 1,40-1,20 (м, 4H), 1,11 (с, 3H), 1,06 (с, 3H), 0,90-0,82 (м, 3H), 0,78 (с, 3H).
[0330] Получение соединения A_001_3: К раствору соединения A_001_2 (192 мг, 0,5 ммоль, 1,0 экв.) в EA (5 мл) добавляли Pd/C (5%, 40 мг) под N2. Суспензию подвергали дегазации в вакууме и продували H2 несколько раз. Затем смесь перемешивали под баллоном с H2 при 30ºC в течение 1 часа. TLC (PE:EA=3:1) демонстрировали, что реакция проходила полностью. Суспензию фильтровали через фильтр из целита и промывали фильтр EA (5 мл ×2). Объединенные фильтраты концентрировали досуха с получением продукта (185 мг, 95%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,31 (д, J=4,4 Гц, 1H), 3,67 (с, 3H), 2,42 (д, J=13,2 Гц, 1H), 2,35-2,28 (м, 2H), 2,02-1,92 (м, 2H), 1,90-1,60 (м, 6H), 1,55-1,30 (м, 6H), 1,30-1,13 (м, 5H), 1,12 (с, 3H), 1,02(с, 3H), 1,00-0,75 (м, 4H), 0,58 (с, 3H).
[0331] Получение соединения ST-200-A-001: К раствору соединения A_001_3 (150 мг, 0,386 ммоль, 1,0 экв.) в THF (5 мл) капельно добавляли MeLi (2 мл, 3,200 ммоль, 8,3 экв., 1,6 M в THF) при -78ºC под азотом. После добавления реакционную смесь нагревали до -40ºC и перемешивали в течение 1 часа. TLC (PE:EA=3:1) демонстрировали, что реакция проходила полностью. Реакционную смесь гасили насыщенным водным NH4Cl (10 мл), экстрагировали EA (10 мл ×2). Объединенные органические слои концентрировали при пониженном давлении с получением неочищенного продукта, который очищали хроматографией с силикагелем, элюировали PE:EA (10:1) с получением продукта (91 мг, 60%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,31 (д, J=5,6 Гц, 1H), 2,43 (д, J=13,2 Гц, 1H), 2,05-1,95 (м, 2H), 1,90-1,60 (м, 6H), 1,21 (с, 6H), 1,12 (с, 3H), 1,11-1,04 (м, 1H), 1,03 (с, 3H), 1,01-0,92 (м, 2H), 0,58 (с, 3H).
Пример 2. Получение соединения ST-200-A-003

[0332] Получение соединения A_003_1: К раствору Ph3PEtBr (12,25 г, 33,00 ммоль, 10,0 экв.) в сухом THF (15 мл) капельно добавляли раствор t-BuOK (3,70 г, 33,00 ммоль, 10,0 экв.) в сухом THF (10 мл) под N2 при 0ºC. Смесь перемешивали при комнатной температуре в течение 1,5 часов. Затем раствор INT A (1,00 г, 3,31 ммоль, 1,0 экв.) в THF (10 мл) капельно добавляли и перемешивали получаемую смесь при 70ºC в течение 4 часов. TLC (PE:EA=3:1) подтверждали, что исходное вещество полностью разрушалось. Реакционную смесь гасили насыщенным водным раствором NH4Cl (50 мл) и экстрагировали EA (30 мл ×2). Объединенные органические фазы сушили Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (элюент: PE:EA=12:1) с получением продукта (900 мг, 90,9%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,32 (д, J=5,2 Гц, 1H), 5,15-5,12 (м, 1H), 2,44-2,30 (м, 3H), 2,29-2,21 (м, 1H), 2,05-1,97 (м, 2H), 1,81-1,45 (м, 14H), 1,30-1,15 (м, 3H), 1,12 (с, 3H), 1,02 (с, 3H), 0,95-1,01 (м, 1H), 0,90 (с, 3H).
[0333] Получение соединения A_003_2: К раствору соединения A_003_1 (1,00 г, 3,20 ммоль, 1,0 экв.) и метилпропиолата (0,67 г, 8,00 ммоль, 2,5 экв.) в сухом DCM (15 мл) капельно добавляли раствор Et2AlCl (12,8 мл, 12,8 ммоль, 4,0 экв., 1 M в толуоле) при перемешивании при 0ºC. Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. TLC (PE:EA=5:1) подтверждали, что исходное вещество полностью разрушалось. Смесь гасили насыщенным водным раствором NaHCO3 (30 мл) и экстрагировали DCM (30 мл ×2). Объединенные органические фазы сушили Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (элюент: PE:EA=10:1) с получением продукта (1,00 г, 78,7%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 6,97-6,91 (м, 1H) 5,82 (д, J=16 Гц, 1H), 5,42-5,41 (м, 1H), 5,32 (д, J=5,2 Гц, 1H), 3,73 (с, 3H), 3,04-3,00 (м, 1H), 2,43 (д, J=12,8 Гц, 1H), 2,11-1,97 (м, 3H), 1,88-1,50 (м, 12H), 1,40-1,20 (м, 3H), 1,21-1,26 (м, 1H), 1,18 (д, J=6,78 Гц, 3H), 1,12 (с, 3H), 1,04 (с, 3H), 0,82 (с, 3H).
[0334] Получение соединения A_003_3: К раствору соединения A_003_2 (160 мг, 0,40 ммоль) в EA (15 мл) добавляли Pd/C (30 мг, 5%). Затем перемешивали реакционную смесь под H2 при давлении 15 фунт/дюйм2 при комнатной температуре в течение 2 часов. TLC (PE/EA=3/1) демонстрировали, что исходное вещество полностью разрушалось. А затем фильтровали реакционную смесь и выпаривали фильтрат при пониженном давлении с получением продукта (150 мг, 92,8%).1H ЯМР: (400 МГц, CDCl3) δ 5,32 (д, J=5,2 Гц, 1H), 3,67 (с, 3H), 2,48-1,96 (м, 7H), 1,90-1,62 (м, 5H), 1,60-1,55 (м, 7H), 1,11 (с, 3H), 1,03-0,99 (м, 3H), 0,95-0,93 (м, 2H), 0,70-0,66 (м, 2H).
[0335] Получение соединения ST-200-A-003: К раствору соединения A_003_2 (100 мг, 0,25 ммоль, 1,0 экв.) в сухом THF (1 мл) под защитой N2 капельно добавляли MeLi (1,56 мл, 2,50 ммоль, 1,6 M в THF) при -78ºC и перемешивали смесь при такой температуре в течение 30 минут. TLC (PE:EA=3:1) демонстрировали, что реакция проходила полностью. Реакционную смесь гасили насыщенным водным NH4Cl (5 мл) и экстрагировали EA (5 мл ×2). Объединенные органические слои концентрировали при пониженном давлении с получением неочищенного продукта, который очищали хроматографией с силикагелем, элюировали PE:EA (10:1) с получением продукта (45 мг, 45%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 1H), 2,42 (д, J=12 Гц, 1H), 2,02-1,98 (м, 3H), 1,92-1,66 (м, 3H), 1,61-1,56 (м, 2H), 1,55-1,54 (м, 2H), 1,53-1,23 (м, 11H), 1,20 (с, 6H), 1,10 (с, 3H), 1,05 (с, 3H), 1,02 (с, 3H), 0,95-0,90 (м, 3H), 0,68 (с, 3H).
Пример 3. Получение соединения ST-200-A-007

[0336] Получение соединения INT E: К раствору 9-BBN (0,5 M в THF, 133 мл, 66,6 ммоль, 10,0 экв.) на ледяной бане капельно добавляли раствор A_001_1 (2,0 г, 6,66 ммоль, 1,0 экв.) в THF (10 мл). Реакционную смесь нагревали до 60ºC и перемешивали в течение 20 часов. Смесь охлаждали до 0ºC и добавляли 10% водный раствор NaOH (20 мл) с последующим добавлением 30% водного H2O2 (30%, 10 мл). Смесь перемешивали в течение 2 часов при 0ºC, а затем экстрагировали EA (30 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили Na2SO4 и концентрировали в вакууме с получением неочищенного продукта, который очищали хроматографией на испарительной колонке, элюировали PE/EA (10/1) с получением INT E (1,0 г, 47%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 1H), 3,75-3,71 (дд, J1=10,4 Гц, J2=6,8 Гц, 1H), 3,58-3,53 (дд, J1=10,4 Гц, J2=7,6 Гц, 1H), 2,43-2,41 (д, J=10,4 Гц, 1H), 2,02-1,96 (м, 2H), 1,91-1,75 (м, 3H), 1,72-1,44 (м, 10H), 1,33-1,20 (м, 5H), 1,18 (с, 3H), 1,06 (с, 3H), 1,04-0,99 (м, 1H), 0,67 (с, 3H).
[0337] Получение соединения INT B: К раствору INT E (100 мг, 0,314 ммоль, 1,0 экв.) в DCM (10 мл) на ледяной бане добавляли реагент Десса-Мартина (265 мг, 0,628 ммоль, 2,0 экв.). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Смесь вливали к раствору NaS2O3 (4,5 г) и NaHCO3 (1,5 г) в воде (20 мл), экстрагировали EA (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили Na2SO4 и концентрировали в вакууме с получением неочищенного продукта (100 мг, 100%), который непосредственно использовали на следующем этапе без дополнительной очистки.
[0338] Получение соединения A_007_1: Смесь INT B (100 мг, 0,316 ммоль, 1,0 экв.) и Ph3P=CHCOOCH3 (634 мг, 1,89 ммоль, 6,0 экв.) в толуоле (10 мл) перемешивали в течение 3 часов при 80ºC, а затем концентрировали в вакууме. Остаток очищали хроматографией на испарительной колонке, элюировали PE/EA (12/1) с получением продукта A_007_1 (65 мг, 55,2%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 6,99-6,93 (дд, J1=16 Гц, J2=8,4 Гц, 1H), 5,82-5,77 (дд, J1=15,6 Гц, J2=1,2 Гц, 1H), 5,30 (д, J=5,2 Гц, 1H), 3,73 (с, 3H), 2,42 (д, J=12,4 Гц, 1H), 2,14-2,11 (м, 1H), 2,05-1,99 (м, 2H), 1,98-1,41 (м, 15H), 1,29-1,24 (м, 2H), 1,12-1,14 (м, 1H), 1,12 (с, 3H), 1,06 (с, 3H), 1,02-0,95 (м, 1H), 0,66 (с, 3H).
[0339] Получение соединения A_007_2: Смесь соединения A_007_1 (65 мг, 0,174 ммоль, 1,0 экв.) и Pd/C (5%, 20 мг) в EA (5 мл) перемешивали в течение 2 часов при комнатной температуре под H2 (1 атм.). Смесь фильтровали и концентрировали фильтрат в вакууме с получением продукта A_007_2 (65 мг, 100%), который непосредственно использовали на следующем этапе без дополнительной очистки.
[0340] Получение соединения ST-200-A-007: К раствору A_007_2 (65 мг, 0,17 ммоль, 1,0 экв.) в THF (2 мл) при -78ºC капельно добавляли CH3Li (1,6 M в THF, 1 мл, 1,7 ммоль, 10,0 экв.) под азотом. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа. Смесь гасили насыщенным водным NH4Cl (10 мл), а затем экстрагировали EA (5 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (5 мл), сушили Na2SO4 и концентрировали в вакууме с получением неочищенного продукта, который очищали хроматографией на испарительной колонке (элюент: PE/EA=8/1) с получением ST-200-A-007 (27 мг, 41%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 1H), 2,42 (д, J=15,2 Гц, 1H), 2,02-1,96 (м, 2H), 1,86-1,38 (м, 14H), 1,25-1,14 (м, 4H), 1,21 (с, 6H), 1,11 (с, 3H), 1,09-1,05 (м, 2H) 1,02 (с, 3H), 1,01-0,94 (м, 3H), 0,61 (с, 3H).
Пример 4. Получение соединения ST-200-A-011

[0341] Получение соединения INT D: К раствору INT A (2,00 г, 6,58 ммоль, 1,0 экв.) в MeOH (30 мл) и THF (15 мл) добавляли CeCl3·7H2O (2,45 г, 6,58 ммоль, 1,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин. Затем медленно добавляли NaBH4 (0,50 г, 13,16 ммоль, 2,0 экв.) и перемешивали получаемую смесь в течение 30 минут при комнатной температуре. TLC (PE/EA=3/1) демонстрировали, что реакция проходила полностью. Реакционную смесь гасили добавлением насыщенного водного NH4Cl (50 мл) и экстрагировали EA (50 мл ×2). Объединенные органические слои сушили Na2SO4 и выпаривали досуха с получением желаемого продукта (1,84 г, 91%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 1H), 3,65 (т, J=8,6 Гц, 1H), 2,43 (д, J=13,2 Гц, 1H), 2,09-1,97 (м, 3H), 1,97-1,68 (м, 3H), 1,64-1,38 (м, 5H), 1,31-1,20 (м, 2H), 1,19-1,16 (м, 1H), 1,11 (с, 3H), 1,11-1,04 (м, 1H), 1,03 (с, 3H), 1,01-0,93 (м, 2H), 0,88-0,84 (м, 1H), 0,76 (с, 3H).
[0342] Получение соединения A_011_1: К раствору INT D (500 мг, 1,63 ммоль, 1,0 экв.) в DCM (10 мл) добавляли метилпропиолат (325 мг, 3,30 ммоль, 2,0 экв.) и NMM (287 мг, 3,30 ммоль, 2,0 экв.) по очереди. Реакционную смесь перемешивали при комнатной температуре в течение двух суток. TLC (PE/EA=3/1) демонстрировали, что реакция проходила полностью. Реакционную смесь промывали насыщенным водным NaHCO3 (20 мл) и насыщенным солевым раствором (20 мл), сушили Na2SO4 и выпаривали досуха с получением неочищенного продукта. Остаток очищали хроматографией с силикагелем, элюировали PE:EA (15:1) с получением желаемого продукта (274 мг, 43%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 7,54 (д, J=12,8 Гц, 1H), 5,29 (д, J=5,2 Гц, 1H), 5,24 (д, J=12,8 Гц, 1H), 3,88 (т, J=8,2 Гц, 1H), 3,68 (с, 3H), 2,42 (д, J=13,2 Гц, 1H), 2,19-2,09 (м, 1H), 2,00-1,89 (м, 2H), 1,88-1,84 (м, 1H), 1,80-1,70 (м, 2H), 1,62-1,50 (м, 5H), 1,49-1,41 (м, 2H), 1,39-1,29 (м, 1H), 1,19-1,10 (м, 2H), 1,11 (с, 3H), 1,02 (с, 3H), 1,00-0,91 (м, 2H), 0,79 (с, 3H).
[0343] Получение соединения A_011_2: К раствору соединения A_011_1 (50 мг, 0,128 ммоль) в EA (5 мл) добавляли 5% Pd/C (50%, 25 мг) под аргоном. Суспензию подвергали дегазации в вакууме и продували H2 несколько раз. Смесь перемешивали под баллоном H2 при комнатной температуре в течение 4 часов. TLC (PE/EA=3/1) демонстрировали, что исходное вещество полностью разрушалось. Затем суспензию фильтровали через фильтр из целита и промывали фильтр EA (5 мл ×3). Объединенные фильтраты концентрировали досуха с получением продукта (48 мг, 96%) в виде белого твердого вещества, который непосредственно использовали на следующем этапе без очистки.1H ЯМР: (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 1H), 3,77-3,69 (м, 2H), 3,66 (с, 3H), 3,32 (т, J=8,4 Гц, 1H), 2,56 (т, J=6,4 Гц, 2H), 2,42 (д, J=12,4 Гц, 1H), 2,00-1,89 (м, 4H), 1,81-1,67 (м, 2H), 1,57-1,44 (м, 6H), 1,43-1,32 (м, 1H), 1,30-1,13 (м, 4H), 1,11 (с, 3H), 1,02 (с, 3H), 0,99-0,91 (м, 2H), 0,74 (с, 3H).
[0344] Получение соединения ST-200-A-011: К раствору соединения A_011_2 (60 мг, 0,16 ммоль, 1,0 экв.) в безводном THF (5 мл) капельно добавляли MeLi (1 мл, 1,60 ммоль, 10,0 экв., 1,6 M в Et2O) при -78ºC под N2. Реакционную смесь перемешивали при -78ºC в течение 30 минут, а затем нагревали до комнатной температуры еще 30 минут. TLC (PE/EA=3/1) демонстрировали, что исходное вещество полностью разрушалось. Реакционную смесь гасили насыщенным водным NH4Cl (5 мл). Получаемый раствор экстрагировали EA (5 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (10 мл) и сушили Na2SO4, и концентрировали в вакууме. Остаток очищали хроматографией с силикагелем, элюировали PE:EA (10:1) с получением целевого продукта (25 мг, 42%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 5,29 (д, J=4,8 Гц, 1H), 3,80-3,62 (м, 2H), 3,27 (т, J=8,4 Гц, 1H), 2,39 (д, J=13,2 Гц, 1H), 2,05-1,86 (м, 4H), 1,76-1,64 (м, 3H), 1,59-1,37 (м, 8H), 1,27-1,20 (м, 1H), 1,19 (с, 6H), 1,12-1,08 (м, 2H), 1,07 (с, 3H), 0,99 (с, 3H), 0,98-0,89 (м, 2H), 0,72 (с, 3H).
Пример 5. Получение соединения ST-200-A-013
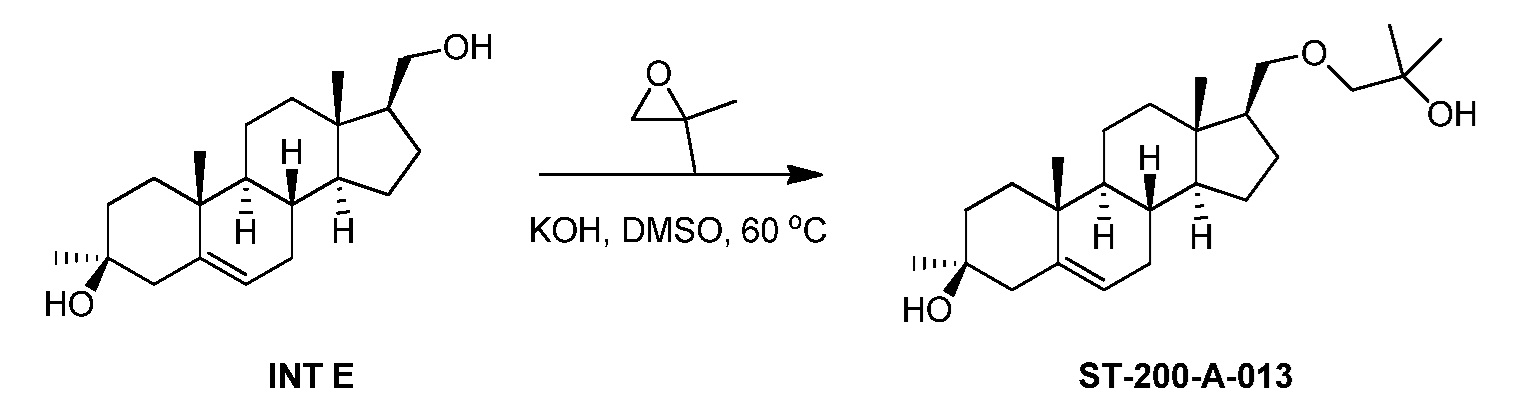
[0345] К раствору INT E (150 мг, 0,471 ммоль, 1,0 экв.) в DMSO (1 мл) добавляли KOH (53 мг, 0,942 ммоль, 2,0 экв.) и 2,2-диметилоксирана (340 мг, 4,717 ммоль, 10,0 экв.). Реакционную смесь перемешивали при 50ºC в течение 16 часов. TLC (PE/EA=3/1) демонстрировали, что исходное вещество полностью разрушалось. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом (20 мл) и промывали насыщенным водным NH4Cl (10 мл ×2) и водой (10 мл ×2). Органическую фазу сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией с последующей очисткой препаративной ВЭЖХ с получением чистого продукта ST-200-A-013 (14 мг, 8%).1H ЯМР (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 1H), 3,57-3,48 (м, 1H), 3,38-3,35 (м, 1H), 3,20 (с, 2H), 2,42-2,40 (м, 1H), 2,03-1,85 (м, 3H), 1,76 (м, 4H), 1,55-1,43 (м, 4H), 1,25 (с, 3H), 1,28-1,25 (м, 6H), 1,17-1,13 (м, 2H), 1,11 (с, 3H), 1,06-0,96 (м, 5H), 0,92-0,79 (м, 2H), 0,65 (с, 3H).
Пример 6. Получение соединения ST-200-A-017
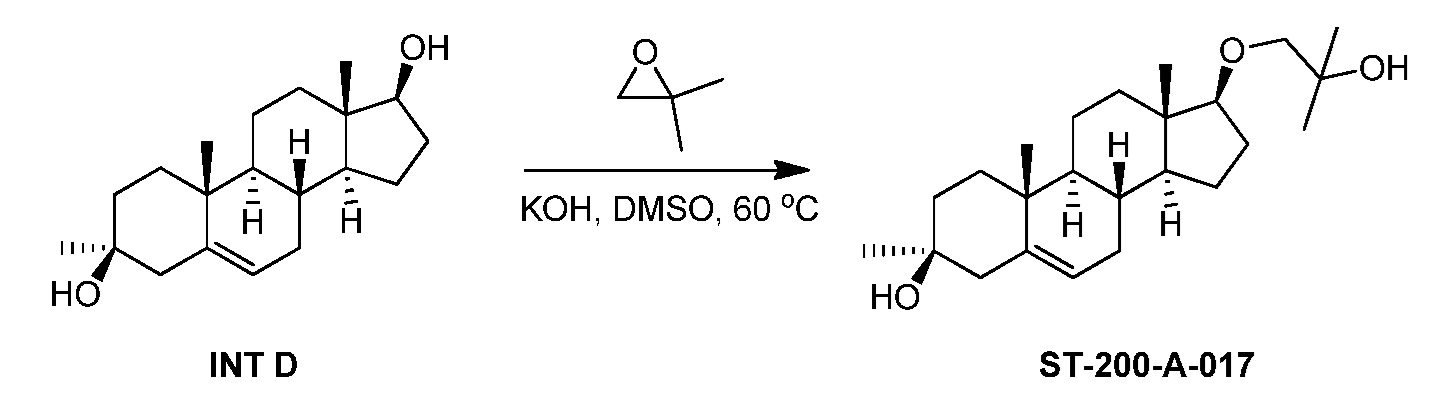
[0346] К раствору соединения INT D (150 мг, 0,49 ммоль, 1,0 экв.) и 2, 2-диметилоксирана (1,5 г, 20,8 моль, 42,0 экв.) в DMSO (3 мл) добавляли KOH (56 мг, 1,0 ммоль, 2,0 экв.), затем реакционную смесь перемешивали при 60ºC в течение 5 часов. TLC (PE:EA=3:1) подтверждали, что реакция проходила полностью. Раствор охлаждали до комнатной температуры, разбавляли водой (10 мл), экстрагировали EA (5 мл ×2). Объединенные органические слои концентрировали при пониженном давлении с получением неочищенного продукта, который очищали препаративной ВЭЖХ с получением продукта (6,6 мг, 3,5%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 1H), 3,33 (т, J=8,0 Гц, 1H), 3,29-3,22 (м, 2H), 2,40-2,50 (м, 2H), 2,05-1,85 (м, 4H), 1,82-1,65 (м, 2H), 1,60-1,35 (м, 9H), 1,34-1,22 (м, 1H), 1,20-1,15 (м, 6H), 1,14-1,11 (м, 1H), 1,12 (с, 3H), 1,05 (с, 3H), 0,90-1,00 (м, 2H), 0,79 (с, 3H).
Пример 7. Получение соединения ST-200-A-021

[0347] К раствору соединения A_001_3 (150 мг, 0,39 ммоль, 1,0 экв.) в THF/H2O (4 мл, 1/1) добавляли LiOH (90 мг, 2,20 ммоль, 5,6 экв.). Реакционную смесь перемешивали при комнатной температуре в течение ночи. TLC (PE/EA=3/1) демонстрировали, что соединение A_001_3 полностью разрушалось. Смесь разбавляли водой (3 мл), промывали MTBE (5 мл ×2), а затем подкисляли до pH=4 1M водной HCl. Собирали осадок посредством фильтрования и сушили в вакууме с получением продукта (54 мг, 37,3%).1H ЯМР: (400 МГц, CDCl3) δ 5,30 (д, J=5,2 Гц, 2H), 2,43-2,37 (м, 1H), 2,37-2,33 (м, 2H), 2,05-1,93 (м, 2H), 1,90-1,79 (м, 2H), 1,78-1,61 (м, 6H), 1,61-1,50 (м, 6H), 1,50-1,37 (м, 3H), 1,34-1,13 (м, 4H), 1,12 (с, 3H), 1,02 (с, 3H), 0,93-1,01 (м, 3H), 0,61 (с, 3H).
Пример 8. Получение соединений ST-200-A-022 и ST-200-A-023

[0348] Получение соединения 7: К раствору кетона 6 (16,7 г, 52,71 ммоль, 1,0 экв.) и этиленгликоля (20 мл) в толуоле (450 мл) добавляли пара-толуолсульфоновую кислоту (418 мг, 2,20 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи с насадкой Дина-Старка. LCMS демонстрировали, что исходное вещество полностью разрушалось. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом (400 мл) и промывали насыщенным водным бикарбонатом натрия (200 мл ×2) и насыщенным солевым раствором (200 мл ×2). Органическую фазу сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта 7 (19,0 г, 100%), который непосредственно использовали на следующем этапе без дополнительной очистки.1H ЯМР: (400 МГц, CDCl3) δ 5,34 (д, J=5,2 Гц, 2H), 4,00-3,85 (м, 4H), 3,53-3,51 (м, 1H), 2,28-2,22(м, 2H), 2,12-2,00 (м, 1H), 1,99-1,95 (м, 1H), 1,86-1,73 (м, 5H), 1,71-1,44 (м, 8H), 1,29 (с, 3H), 1,08 (с, 3H), 1,07 (с, 3H), 1,06-0,92 (м, 1H), 0,77 (с, 3H).
[0349] Получение соединения 8: К раствору соединения 7 (19,0 г, 52,71 ммоль, 1,0 экв.) в сухом CH2Cl2 (700 мл) по частям добавляли Реагент Десса-Мартина (45,0 г, 105,42 ммоль, 2,0 экв.) при 0ºC. Затем реакционную смесь перемешивали при комнатной температуре в течение 3 часов. TLC (PE/EA=3/1) демонстрировали, что исходное вещество полностью разрушалось. Смесь гасили насыщенным водным NaHCO3/Na2S2O3 (1 л, 1/3). Органическую фазу промывали насыщенным солевым раствором (500 мл) и сушили Na2SO4, и выпаривали растворитель при пониженном давлении с получением неочищенного продукта 8 (19,0 г, 100%), который непосредственно использовали на следующем этапе без дополнительной очистки.1H ЯМР: (400 МГц, CDCl3) δ 5,33 (д, J=5,2 Гц, 2H), 4,01-3,85 (м, 4H), 3,34-3,21 (м, 1H), 2,82 (дд, J=16,31, 2,01 Гц, 1H), 2,59-2,40 (м, 1H), 2,37-2,25 (м, 1H), 2,13-1,95 (м, 5H), 1,87-1,41 (м, 13H), 1,30 (с, 3H), 1,21-1,15 (м, 5H), 0,81 (с, 3H).
[0350] Получение соединения 9: К раствору MAD (158 мл, 158 ммоль, 3,0 экв., 1 M) в толуоле, получаемому способом, как описано в синтезе ST-200-A-001) добавляли раствор соединения 8 (19,0 г, 52,71 ммоль, 1,0 экв.) в толуоле при -78ºC под азотом. Затем реакционную смесь перемешивали при такой температуре в течение 30 мин. Капельно добавляли раствор MeMgBr (53 мл, 159 ммоль, 3,0 экв., 3M в Et2O) при -78ºC. Реакционную смесь нагревали до -40ºC и перемешивали при этой температуре в течение 3 часов. TLC (PE:EA=3:1) демонстрировали, что исходное вещество полностью разрушалось. Смесь вливали в насыщенный водный раствор NH4Cl (300 мл) и экстрагировали EA (150 мл ×2). Объединенные органические фазы сушили Na2SO4, и выпаривали растворитель при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очищали хроматографией с силикагелем, элюировали PE:EA (15:1) с получением продукта (7,70 г, 39%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,31 (д, J=5,2 Гц, 2H), 4,01-3,85 (м, 4H), 2,42 (д, J=12 Гц, 1H), 2,04-1,96 (м, 1H), 1,96-1,95 (м, 2H), 1,85-1,66 (м, 5H), 1,66-1,61 (м, 2H), 1,61-1,36 (м, 7H), 1,33 (с, 3H), 1,26-1,13 (м, 3H), 1,11 (с, 3H), 1,05 (с, 3H), 0,91-1,00 (м, 2H), 0,80 (с, 3H).
[0351] Получение соединения INT C: К раствору соединения 9 (2,7 г, 7,21 ммоль, 1,0 экв.) в THF (20 мл) добавляли водный раствор HCl (10 мл, 1 M) и ацетон (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. TLC (PE:EA=3:1) подтверждали, что реакция проходила полностью. Затем реакционную смесь разбавляли EA (50 мл), промывали насыщенным водным раствором NaHCO3 (50 мл ×2), сушили Na2SO4 и выпаривали при пониженном давлении с получением продукта (2,10 г, 88,2%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,31 (д, J=5,2 Гц, 2H), 2,55-2,50 (м, 1H), 2,40 (д, J=12 Гц, 1H), 2,20-2,19 (м, 1H), 2,15-2,10 (м, 3H), 2,08-1,94 (м, 3H), 1,83-1,76 (м, 1H), 1,74-1,65 (м, 3H), 1,62 (с, 3H), 1,61-1,39 (м, 7H), 1,30-1,13 (м, 4H), 1,12 (с, 3H), 1,01 (с, 3H), 0,61-0,65 (м, 3H).
[0352] Получение соединения A_022_1: К раствору INT C (700 мг, 2,1 ммоль, 1,0 экв.) в MeOH (10 мл) и THF (5 мл) добавляли NaBH4 (160 мг, 4,2 ммоль, 2,0 экв.) добавляли пятью частями. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. TLC (PE/EA=3/1) демонстрировали, что исходное вещество полностью разрушалось. Смесь гасили насыщенным водным NH4Cl (50 мл) и экстрагировали EA (20 мл ×2). Объединенные органические слои промывали водой (20 мл) и насыщенным солевым раствором (20 мл), сушили сульфатом натрия и концентрировали в вакууме с получением желаемого продукта A_022_1 (600 мг, 86%).
[0353] Получение соединений ST-200-A-022 и ST-200-A-023: К раствору A_022_1 (570 ммоль, 1,717 ммоль, 1,0 экв.) в DCM (15 мл) добавляли TEA (867 мг, 8,585 ммоль, 5,0 экв.) и DMAP (63 мг, 0,515 ммоль, 0,3 экв.). Затем капельно добавляли BzCl (961 мг, 6,867 ммоль, 4,0 экв.). Получаемую смесь перемешивали при комнатной температуре в течение 16 часа, а затем нейтрализовали добавлением 1M водной HCl. Водный слой отделяли и экстрагировали DCM (10 мл ×3). Объединенные органические слои промывали насыщенным водным NaHCO3 (10 мл) и насыщенным солевым раствором (10 мл), сушили сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией с силикагелем, элюировали PE:EA (15:1) с получением продукта (360 мг, 46,6%) в виде белого твердого вещества, который использовали для разделения SFC с получением целевых ST-200-A-022 (100 мг) и ST-200-A-023 (70 мг).1H ЯМР(ST-200-A-022): (400 МГц, CDCl3) δ 8,06 (д, J=7,2 Гц, 2H), 7,61-7,50 (м, 1H), 7,49-7,40 (м, 2H), 5,30 (д, J=5,2 Гц, 2H), 5,19-5,08 (м, 1H), 2,40 (д, J=12 Гц, 1H), 2,03-1,86 (м, 3H), 1,85-1,64 (м, 5H), 1,58-1,30 (м, 7H), 1,27 (д, J=6,0 Гц, 3H), 1,23-1,06 (м, 6H), 1,01-0,83 (м, 5H), 0,68 (с, 3H).1H ЯМР (ST-200-A-023): (400 МГц, CDCl3) δ 8,01 (д, J=8,4 Гц, 2H), 7,58-7,50 (м, 1H), 7,47-7,39 (м, 2H), 5,31 (д, J=6,0 Гц, 2H), 5,24-5,14 (м, 1H), 2,43 (д, J=13,2 Гц, 1H), 2,05-1,87 (м, 4H), 1,82-1,61 (м, 5H), 1,55-1,38 (м, 4H), 1,36 (д, J=6,0 Гц, 3H), 1,29-1,14 (м, 4H), 1,12 (с, 3H), 1,04-0,95 (м, 4H), 0,74 (с, 3H).
Пример 9. Получение соединения ST-200-C-001

[0354] К раствору соединения ST-200-A-001 (65 мг, 0,167 ммоль, 1,0 экв.) в этаноле (10 мл) добавляли Pd/C (10%, 15 мг) под N2. Суспензию подвергали дегазации в вакууме и продували H2 несколько раз. Затем смесь перемешивали при 50 фунтов/дюйм2 давления водорода при 60ºC в течение 24 часов. TLC (PE:EA=3:1) демонстрировали, что реакция проходила полностью. Суспензию фильтровали через фильтр из целита и промывали фильтр этанолом (5 мл ×2). Объединенные фильтраты концентрировали досуха с получением неочищенного продукта, который очищали хроматографией с силикагелем, элюировали PE:EA (10:1) с получением продукта (28 мг, 43%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 1,90-1,87 (м, 1H), 1,75-1,60 (м, 4H), 1,82-1,65 (м, 2H), 1,55-1,30 (м, 12H), 1,27-1,23 (м, 6H), 1,22 (с, 6H), 1,18-0,95 (м, 8H), 0,82 (с, 3H), 0,72-0,65 (м, 1H), 0,55 (с, 3H).
Пример 10. Получение соединений ST-200-C-003 и ST-200-C-003A

[0355] К раствору соединения ST-200-A-003 (40,0 мг, 0,10 ммоль, 1,0 экв.) в EtOH (30 мл) добавляли Pd/C (10 мг). Смесь перемешивали при 60ºC в течение ночи под давлением 50 фунтов/дюйм2 водорода.1H ЯМР подтверждали, что реакция проходила полностью. Затем смесь фильтровали через фильтр из целита и выпаривали фильтрат при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: PE:EA=2:1) с получением чистого продукта ST-200-C-003 (12,0 мг, 29,8%) и ST-200-C-003A (0,8 мг, 2,3%) в виде белого порошка.1H ЯМР (ST-200-C-003): (400 МГц, CDCl3) δ 1,97-1,83 (м, 2H), 1,65-1,55 (м, 7H), 1,55-1,42 (м, 4H), 1,41-1,2841 (м, 6H), 1,27-1,21 (м, 5H), 1,20 (с, 6H), 1,16-0,95 (м, 7H), 0,92 (д, J=6,27 Гц, 3H), 0,81 (с, 3H), 0,65 (с, 3H).1H ЯМР (ST-200-C-003A): (400 МГц, CDCl3) δ 1,98-1,79 (м, 4H), 1,64-1,53 (м, 6H), 1,52-1,29 (м, 7H), 1,25-1,22 (м, 6H), 1,22 (с, 3H), 1,20 (с, 3H), 1,05 (с, 3H), 0,96 (с, 3H), 0,91 (д, J=6,53 Гц, 3H), 0,86-0,80 (м, 2H), 0,65 (с, 3H).
Пример 11. Получение соединения ST-200-C-007

[0356] Получение соединения 10: Смесь соединения 1 (28,0 г, 0,097 моль, 1,0 экв.) и Pd/C (3,5 г) в этаноле (400 мл) гидрогенизировали при комнатной температуре в течение ночи при давлении водорода 40 фунтов/дюйм2. Суспензию фильтровали через фильтр из целита и промывали фильтр этанолом (20 мл ×3). Объединенные фильтраты концентрировали досуха с получением продукта (28,0 г, 0,097 моль, 100%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,63-3,53 (м, 1H), 2,42 (дд, J=19,2, 8,4 Гц, 1H), 2,11-2,06 (м, 1H), 19,6-1,87 (м, 1H), 1,83-1,09 (м, 18H), 1,04-0,91 (м, 2H), 0,85 (с, 3H), 0,82 (с, 3H).
[0357] Получение соединения 11: К раствору соединения 10 (28,0 г, 0,097 моль, 1,0 экв.) и этиленгликоля (30 мл) в толуоле (300 мл) добавляли пара-толуолсульфоновую кислоту (0,7 г, 3,64 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи с насадкой Дина-Старка. LCMS демонстрировали, что исходное вещество полностью разрушалось. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом (250 мл) и промывали насыщенным водным бикарбонатом натрия (100 мл ×2) и насыщенным солевым раствором (100 мл ×2). Органическую фазу сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта 11 (30,0 г, 0,090 моль, 93%), который непосредственно использовали на следующем этапе без дополнительной очистки.1H ЯМР: (400 МГц, CDCl3) δ 4,02-3,78 (м, 4H), 3,68-3,48 (м, 1H), 2,04-1,92 (м, 1H), 1,80-1,54 (м, 8H), 1,46-1,32 (м, 5H), 1,31-1,19(м, 5H), 1,14-1,05 (м, 1H), 1,02-0,86 (м, 2H), 0,83 (с, 3H), 0,80 (с, 3H), 0,72-0,61 (м, 1H).
[0358] Получение соединения 12: К раствору соединения 11 (30,0 г, 0,090 моль, 1,0 экв.) в сухом DCM (300 мл) добавляли окислитель Десса-Мартина (76,0 г, 0,180 моль, 2,0 экв.) при 0ºC. Реакционную смесь перемешивали при 0ºC в течение 30 минут, а затем при комнатной температуре в течение 2 часов. LCMS демонстрировали, что исходное вещество полностью разрушалось. Смесь гасили смешанным водным раствором насыщенной NaHCO3/Na2SO3 (200 мл, 1/3), а затем разбавляли DCM (250 мл). Органический слой промывали насыщенным водным бикарбонатом натрия (100 мл ×2) и насыщенным солевым раствором (100 мл ×2), сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта 12 (24,0 г, 0,072 моль, 80%) который непосредственно использовали на следующем этапе без дополнительной очистки.
[0359] Получение соединения 13: К раствору MAD (2,16 моль, 3,0 экв., получаемому способом, как описано в синтезе ST-200-A-001) в сухом толуоле (300 мл) капельно добавляли соединение 12 (24,0 г, 0,072 моль, 1,0 экв.) при -78ºC и перемешивали смесь при -78ºC в течение 30 минут под азотом. Затем капельно добавляли MeMgBr (72 мл, 2,16 моль, 3,0 экв., 3M в простом эфире) при -78ºC и перемешивали получаемую смесь при такой же температуре в течение 2 часов. LCMS демонстрировали, что вещество полностью разрушалось. Реакционную смесь вливали в насыщенный водный раствор NH4Cl4 (400 мл) и экстрагировали EA (300 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (200 мл ×2), сушили сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией с силикагелем, элюировали PE:EA (15:1) с получением продукта 13 (16,0 г, 0,046 моль, 72%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 3,95-3,88 (м, 2H), 3,87-3,82 (м, 2H), 2,02-1,92 (м, 1H), 1,84-1,73 (м, 1H), 1,71-1,50 (м, 9H), 1,50-1,43 (м, 1H), 1,42-1,33 (м, 4H), 1,33-1,28 (м, 1H), 1,27-1,19 (м, 7H), 1,08-0,88 (м, 2H), 0,83 (с, 3H), 0,81 (с, 3H).
[0360] Получение соединения INT G: Смесь соединения 13 (16,0 г, 46,0 ммоль, 1,0 экв.) в 1M водной HCl (60 мл), ацетона (60 мл) и THF (350 мл) перемешивали при комнатной температуре в течение ночи, а затем разбавляли водой (200 мл) и нейтрализовали твердым NaHCO3 до тех пор, пока CO2 переставал выделяться. Смесь экстрагировали EA (300 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (200 мл ×2), сушили сульфатом натрия и концентрировали в вакууме с получением продукта INT G (14,0 г, 46,0 ммоль, 100%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 2,44 (дд, J=19,20, 8,41 Гц, 1H), 2,13-2,01 (м, 1H), 1,98-1,89 (м, 1H), 1,85-1,76 (м, 2H), 1,69-1,60 (м, 3H), 1,59-1,42 (м, 5H), 1,33-1,13 (м, 10H), 1,08-0,94 (м, 2H), 0,86 (с, 3H), 0,84 (с, 3H), 0,68-0,77 (м, 1H).
[0361] Получение соединения 14: К раствору PPh3CH3Br (1,4 г, 3,94 ммоль, 5,0 экв.) в THF (10 мл) добавляли раствор t-BuOK (442 мг, 3,94 ммоль, 5,0 экв.) в THF (5 мл) при комнатной температуре. После перемешивания в течение 1 часа капельно добавляли раствор INT G (0,2 г, 0,657 ммоль, 1,0 экв.) в THF (5 мл). Реакционную смесь кипятили с обратным холодильником в течение 3 часов, затем охлаждали до комнатной температуры и гасили насыщенным водным NH4Cl (50 мл), экстрагировали EA (20 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта, который очищали хроматографией на испарительной колонке (элюент: PE/EA=15/1) с получением соединения 14 (180 мг, 90%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 4,62 (д, J=6,4 Гц, 2H), 2,51-2,44 (м, 1H), 2,24-2,22 (м, 1H), 1,82-1,78 (м, 1H), 1,75-1,30 (м, 9H), 1,29-1,11 (м, 11H), 1,03-0,95 (м, 3H), 0,83 (с, 3H), 0,77 (с, 3H), 0,72-0,68 (м, 1H).
[0362] Получение соединения INT I: К раствору 9-BBN (0,5 M в THF, 50 мл, 25,00 ммоль, 8,0 экв.) на ледяной бане капельно добавляли раствор соединения 14 (0,95 г, 3,14 ммоль, 1,0 экв.) в THF (10 мл). Реакционную смесь нагревали до 60ºC и перемешивали в течение 20 часов. Смесь охлаждали до 0ºC и добавляли 10% водный раствор NaOH (20 мл) с последующим добавлением 30% водного H2O2 (10 мл). Получаемую смесь перемешивали в течение 2 часов при 0ºC, а затем экстрагировали EA (10 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта, который очищали хроматографией на испарительной колонке (элюент: PE/EA=10/1) с получением INT I (0,63 г, 63%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 3,74-3,69 (дд, J1=10,4 Гц, J2=6,8 Гц, 1H), 3,56-3,52 (дд, J1=10,4 Гц, J2=7,6 Гц, 1H), 1,86-1,80 (м, 2H), 1,69-1,44 (м, 11H), 1,41-1,26 (м, 4H), 1,25-1,21 (м, 5H), 1,19-0,99 (м, 5H), 0,93-0,91 (м, 5H), 0,81 (с, 3H), 0,74-0,68 (м, 1H), 0,64 (с, 3H).
[0363] Получение соединения INT J: К раствору INT I (500 мг, 1,56 ммоль, 1,0 экв.) в DCM (20 мл) на ледяной бане добавляли реагент Десса-Мартина (1,3 г, 3,12 ммоль, 2,0 экв.). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Смесь вливали к раствору NaS2O3 (5 г) и NaHCO3 (1,5 г) в воде (20 мл), экстрагировали EA (20 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта (500 мг, 100%), который непосредственно использовали на следующем этапе без дополнительной очистки.
[0364] Получение соединения C_007_1: Смесь INT J (500 мг, 1,57 ммоль, 1,0 экв.) и Ph3P=CHCOOCH3 (3,1 г, 8,27 ммоль, 6,0 экв.) в толуоле (30 мл) перемешивали в течение 3 часов при 80ºC. Концентрировали смесь в вакууме и очищали остаток хроматографией на испарительной колонке (элюент: PE/EA=12/1) с получением продукта C_007_1 (188 мг, 32%) в виде белого твердого вещества.
[0365] Получение соединения C_007_2: Смесь соединения C_007_1 (188 мг, 0,5 ммоль, 1,0 экв.) и Pd/C (5%, 60 мг) в EA (10 мл) перемешивали в течение 2 часов при комнатной температуре под H2 (1 атм.). Смесь фильтровали и концентрировали фильтрат в вакууме с получением продукта C_007_2 (189 мг, 100%), который непосредственно использовали на следующем этапе без дополнительной очистки.
[0366] Получение соединения ST-200-C-007: К раствору соединения C_007_2 (100 мг, 0,26 ммоль, 1,0 экв.) в THF (2 мл) при -78ºC капельно добавляли CH3Li (1,6 M в THF, 1,6 мл, 2,6 ммоль, 10,0 экв.) под азотом. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа. Насыщенный водный NH4Cl (10 мл) добавляли для гашения реакции и экстрагировали смесь EA (10 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта, который очищали хроматографией на испарительной колонке (элюент: PE/EA=8/1) с получением целевого ST-200-C-007 (32,7 мг, 32,7%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 1,82-1,81 (м, 1H), 1,75-1,57 (м, 7H), 1,56-1,26 (м, 10H), 1,24 (с, 3H), 1,20 (с, 6H), 1,18-0,83 (м, 10H), 0,81 (с, 3H), 0,71-0,66 (м, 1H), 0,58 (с, 3H).
Пример 12. Получение соединения ST-200-C-011

[0367] Получение соединения INT H: К раствору INT G (1,00 г, 3,28 ммоль, 1,0 экв.) в MeOH (20 мл) и THF (8 мл) добавляли CeCl3·7H2O (1,22 г, 3,28 ммоль, 1,0 экв.). Затем пятью частями добавляли NaBH4 (0,25 г, 6,56 ммоль, 2,0 экв.) и перемешивали смесь при комнатной температуре в течение 1 часа. Реакционную взвесь гасили насыщенным водным NH4Cl (50 мл) и экстрагировали EA (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили сульфатом натрия и концентрировали в вакууме с получением желаемого продукта (0,97 г, 97%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 3,62 (т, J=8,4 Гц, 1H), 2,10-2,04 (м, 1H), 1,79-1,77 (м, 1H), 1,70-1,35 (м, 13H), 1,31-1,15 (м, 11H), 1,14-0,84 (м, 5H), 0,81 (с, 3H), 0,72 (с, 3H), 0,70-0,61 (м, 1H).
[0368] Получение соединения C_011_1: К раствору INT H (500 мг, 1,63 ммоль, 1,0 экв.) в DCM (20 мл) добавляли NMM (830 мг, 8,21 ммоль, 5,0 экв.) и метилпропиолат (690 мг, 8,21 ммоль, 5,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 часов, затем промывали водой (30 мл) и насыщенным солевым раствором (30 мл), сушили сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией с силикагелем, элюировали PE:EA (15:1) с получением продукта (500 мг, 78,6%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 7,53 (д, J=12,4 Гц, 1H), 5,24 (д, J=12,4 Гц, 1H), 3,86 (т, J=8,4 Гц, 1H), 3,68 (с, 3H), 2,18-2,06 (м, 1H), 1,84-1,81 (м, 1H), 1,70-0,85 (м, 30H), 0,81 (с, 3H), 0,78 (с, 3H), 0,72-0,64 (м, 1H).
[0369] Получение соединения C_011_2: К раствору C_011_1 (500 мг, 1,289 ммоль, 1,0 экв.) в EA (20 мл) добавляли Pd/C (10%, 50 мг). Суспензию подвергали дегазации в вакууме и продували H2 несколько раз. Смесь перемешивали при 30ºC в течение 16 часов при давлении водорода 30 фунтов/дюйм2. TLC (PE/EA=3/1) демонстрировали, что реакция проходила полностью. Суспензию фильтровали через фильтр из целита и промывали фильтр EA (20 мл ×5). Объединенные фильтраты концентрировали в вакууме с получением продукта (430 мг, 85,5%) в виде белого твердого вещества.
[0370] Получение соединения ST-200-C-011: К раствору C_011_2 (100 мг, 0,256 ммоль, 1,0 экв.) в сухом THF (1 мл) капельно добавляли MeLi (1,3 мл, 2,048 ммоль, 8,0 экв.) при -78ºC под N2. Получаемую смесь перемешивали при такой температуре в течение 0,5 часов, а затем оставляли, чтобы температура достигала комнатной температуры, и перемешивали при такой температуре еще 1 час. TLC (PE/EA=3/1) демонстрировали, что реакция проходила полностью. Смесь гасили насыщенным водным NH4Cl и экстрагировали EA (10 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией с силикагелем, элюировали PE:EA (10:1) с получением продукта (30 мг, 30%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 3,86 (с, 1H), 3,78-3,61 (м, 2H), 3,29 (т, J=8,3 Гц, 1H), 2,10-1,95 (м, 1H), 1,90-1,81 (м, 1H), 1,74 (т, J=5,6 Гц, 2H), 1,69-1,61 (м, 3H), 1,55-1,28 (м, 9H), 1,24-1,22 (м, 9H), 1,22-0,83 (м, 8H), 0,81 (с, 3H), 0,74 (с, 3H), 0,69-0,62 (м, 1H).
Пример 13. Получение соединения ST-200-C-013

[0371] К раствору INT I (150 мг, 0,469 ммоль, 1,0 экв.) в DMSO (1 мл) добавляли KOH (53 мг, 0,937 ммоль, 2,0 экв.) и 2,2-диметилоксиран(337 мг, 4,687 ммоль, 10,0 экв.). Реакционную смесь перемешивали при 50ºC в течение 16 часов. TLC (PE/EA=10/1) демонстрировали, что исходное вещество полностью разрушалось. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом (20 мл) и промывали насыщенным водным NH4Cl (10 мл ×2) и водой (10 мл ×2). Органическую фазу сушили сульфатом натрия и концентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией с последующей очисткой препаративной ВЭЖХ с получением чистого продукта ST-200-C-013 (26 мг, 15,8%).1H ЯМР: (400 МГц, CDCl3) δ 3,72 (дд, J=7,3, 9,3 Гц, 1H), 3,35 (дд, J=6,8, 9,3 Гц, 1H), 3,21 (с, 2H), 2,34 (с, 1H), 1,84-1,80 (м, 1H), 1,79-1,63 (м, 5H), 1,54-1,27 (м, 8H), 1,25 (с, 3H), 1,19 (с, 6H), 1,18-0,83 (м, 7H), 0,81 (с, 3H), 0,74-0,65 (м, 1H), 0,63 (с, 3H).
Пример 14. Получение соединений ST-200-C-017 и ST-200-C-017A
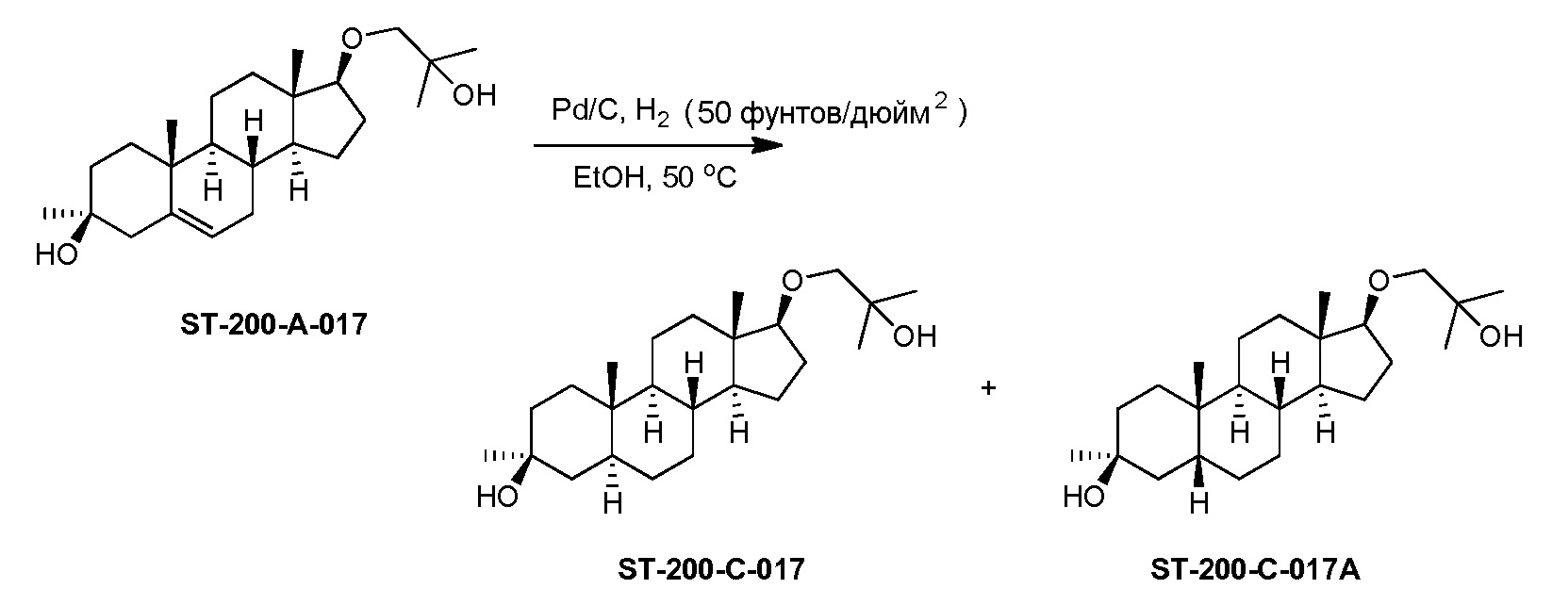
[0372] Раствор ST-200-A-017 (60 мг, 0,159 ммоль, 1,0 экв.) и Pd/C (10 мг) в EtOH (10 мл) перемешивали при 50ºC при давлении водорода 50 фунтов/дюйм2 в течение 16 часов. Реакционный раствор фильтровали через фильтр из целита и концентрировали фильтрат в вакууме. Остаток очищали хроматографией с силикагелем, элюировали PE:EA (20:1) с получением ST-200-C-017(21 мг) и ST-200-C-017A (4,6 мг) в виде белого твердого вещества.1H ЯМР (ST-200-C-017): (400 МГц, CDCl3) δ 3,73-3,71 (м, 1H), 3,31 (т, J=8,4 Гц, 1H), 3,27-3,22 (м, 2H), 2,48 (с, 1H), 2,01-1,91 (м, 1H), 1,88-1,84 (м, 1H), 1,68-1,52 (м, 4H), 1,51-1,49 (м, 4H), 1,47-1,42 (м, 1H), 1,31-1,24 (м, 7H), 1,20-1,83 (м, 6H), 1,15-1,10 (м, 1H), 1,03-0,95 (м, 2H), 0,90-0,85 (м, 1H), 0,81 (с, 3H), 0,65 (с,3H), 0,70-0,61 (м, 1H).1H ЯМР (ST-200-C-017a): (400 МГц, CDCl3) δ 3,33 (т, J=8,4 Гц, 1H), 3,27-3,22 (м, 2H), 2,45 (с, 1H), 2,10-1,91 (м, 1H), 1,89-1,78 (м, 3H), 1,69-1,61 (м, 1H), 1,58-1,51 (м, 1H), 1,50-1,30 (м, 7H), 1,29-1,24 (м, 5H), 1,20 (с, 3H), 1,29-1,10 (м, 8H), 1,09-1,01 (м, 1H), 0,98 (с, 3H), 0,75 (с, 3H).
Пример 15. Получение соединений 3-альфа-A2 и 3-бета-A2

[0373] Получение соединения BB-2: Раствор BB-1 (1,75 г, 4,06 ммоль) в THF (35 мл), получаемого как описано в Steroids (2006) 71:18, охлаждали до 0ºC под азотом. Капельно добавляли метилмагнийхлорид (22% (масс./масс.) в THF, 19,5 мл, 58,1 ммоль). Проводили перемешивали при 0ºC в течение 15 минут и оставляли реакционную смесь нагреваться до комнатной температуры, и продолжали перемешивать в течение двух часов. Медленно добавляли насыщенный водный NH4Cl (5 мл). Образовывался осадок, и его растворяли добавлением воды (10 мл). Добавляли EtOAc (50 мл) и насыщенный солевой раствор (20 мл). Разделяли слои. Водный слой экстрагировали EtOAc (2×50 мл). Объединенные органические слои сушили Na2SO4 и удаляли растворители в вакууме. Остаток выпаривали совместно с дихлорметаном (50 мл). BB-2 (1,54 г, 3,95 ммоль, 97%) получали в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3): δ (м.д.): 5,32-5,43 (1H, м), 3,46-3,61 (1H, м), 1,20 (3H, с), 1,19 (3H, с), 1,01 (3H, с), 0,93 (3H, д, J=6,6 Гц), 0,68 (3H, с).
[0374] Получение соединения BB-3: В высушенной в печи колбе под азотом охлаждали раствор оксалилхлорида (0,622 мл, 7,26 ммоль) в дихлорметане (19 мл) до -78ºC. Медленно добавляли диметилсульфоксид (0,60 мл, 8,47 ммоль). После 25 минут капельно добавляли раствор BB-2 (0,470 г, 1,209 ммоль) в CHCl3 (38 мл) в течение 25 минут. Раствор перемешивали при -78ºC в течение 2,5 часов. Капельно добавляли триэтиламин (3,36 мл, 24,19 ммоль) при -78ºC. Проводили перемешивание в течение 15 минут. Удаляли охлаждающую баню и продолжали перемешивать в течение 10 минут. Добавляли водный насыщенный NH4Cl (10 мл) и перемешивали реакционную смесь в течение 5 минут. Добавляли дихлорметан (50 мл) и воду (20 мл). Разделяли слои и промывали органический слой водой (20 мл). Объединенные водные слои разбавляли насыщенным солевым раствором (20 мл) и экстрагировали EtOAc (2×75 мл). Объединенные органические слои сушили Na2SO4 и удаляли растворители в вакууме. Флэш-хроматографией (гептан, 5%-30% EtOAc) получали BB-3 (238 мг, 0616 ммоль, 51%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3): δ (м.д.): 5,31-5,38 (1H, м), 3,22-3,34 (1H, м), 2,83 (1H, дд, J=16,4 Гц, 2,1 Гц), 2,41-2,54 (1H, м), 2,25-2,34 (1H, м), 1,95-2,08 (3H, м), 1,82-1,93 (1H, м), 1,21 (3H, с), 1,20 (3H, с), 1,19 (3H, с), 0,94 (3H, д, J=6,5 Гц), 0,71 (3H, с).
[0375] Получение соединений 3-α-OH A2 и 3-β-OH A2: В защитной камере с перчатками в высушенной над пламенем колбе к безводному хлориду церия (III) (0,319 г, 1,29 ммоль) добавляли THF (дегазированный, 3 мл). Суспензию перемешивали при комнатной температуре в течение ночи. Белую тонкодисперсную суспензию извлекали из защитной камеры с перчатками. Добавляли THF (сухой, 1 мл) и затем перемешивали смесь под аргоном в течение 15 минут при комнатной температуре. Белую тонкодисперсную суспензию охлаждали до -78ºC под аргоном. При этой температуре капельно добавляли метиллитий 1,6M в Et2O (0,79 мл, 1,27 ммоль). Образовывалась желтая суспензия, и ее перемешивали при -78ºC в течение 1,5 часов. Капельно добавляли раствор BB-3 (0,100 г, 0,259 ммоль) в THF (сухом, 2 мл) в течение 5 минут. Окраска реакционной смеси менялась от желтой до коричневой. Реакционную смесь перемешивали при -78ºC в течение 45 минут. Удаляли охлаждающую баню и перемешивали реакционную смесь в течение 10 минут. Добавляли 5% водный AcOH (2 мл). Реакционная смесь становилась бесцветным прозрачным раствором. Добавляли EtOAc (10 мл). Смесь оставляли нагреваться до комнатной температуры. Разделяли слои и экстрагировали водный слой EtOAc (2×10 мл). Объединенные органические слои сушили сульфатом натрия и удаляли растворители в вакууме. Флэш-хроматографией (H, 5%-20% EtOAc) получали соединение A2 (3α-OH) (33 мг, 0,082 ммоль; 63,5%) и соединение A2 (3β-OH) (13 мг, 0,032 ммоль; 25,0%). (3α-OH)1H-ЯМР (400 МГц, CDCl3): δ (м.д.): 5,43-5,38 (м, 1H), 2,46-2,37 (м, 1H), 2,05-1,80 (м, 4H), 1,73-1,23 (м, 15H), 1,22 (с, 3H), 1,20 (с, 3H), 1,19 (с, 3H), 1,18-0,99 (м, 9H), 0,98 (с, 1H), 0,94 (д, J=6,5 Гц, 3H), 0,68 (с, 3H). (3β-OH):1H-ЯМР (400 МГц, CDCl3): δ (м.д.): 5,34-5,28 (м, 1H), 2,47-2,38 (м, 1H), 2,07-1,92 (м, 3H), 1,91-1,66 (м, 3H), 1,63-1,24 (м, 13H), 1,20 (с, 3H), 1,19 (с, 3H), 1,18-1,12 (м, 3H), 1,11 (с, 3H), 1,10-1,02 (м, 2H), 1,01 (с, 3H), 1,00-0,94 (м, 1H), 0,93 (д, J=6,5 Гц, 3H), 0,91-0,82 (м, 1H), 0,68 (с, 3H).
Пример 16. Получение соединений 3-альфа-A28 и 3-бета-A28

[0376] В защитной камере с перчатками в высушенной над пламенем колбе к безводному хлориду церия (III) (0,207 г, 0,841 ммоль) добавляли THF (дегазированный, 1,5 мл). Суспензию перемешивали при комнатной температуре в течение ночи. Удаляли белую тонкодисперсную суспензию из защитной камеры с перчатками и перемешивали под аргоном в течение 15 минут. Охлаждали белую тонкодисперсную суспензию до -78ºC под аргоном. При этой температуре капельно добавляли этиллитий 0,5M в бензоле/циклогексане (1,68 мл, 0,841 ммоль). Образовывалась желтая суспензия, и ее перемешивали при -78ºC в течение 30 минут. Капельно добавляли раствор BB-3 (0,065 г, 0,168 ммоль) в THF (сухом, 1,5 мл) в течение 3 минут. Окраска реакционной смеси менялась от желтой до коричневой. Реакционную смесь перемешивали при -78ºC в течение 45 минут. Получали коричневую мутную суспензию, TLC (H/E; 2:1) демонстрировали полное преобразование исходного вещества и образование более полярной зоны. Удаляли охлаждающую баню и перемешивали реакционную смесь в течение 10 мин. Добавляли 5% водный AcOH (2 мл). После добавления насыщенного солевого раствора (2 мл) реакционная смесь становилась бесцветным прозрачным раствором. Добавляли EtOAc (5 мл). Смесь оставляли нагреваться до комнатной температуры. Разделяли слои и экстрагировали водный слой EtOAc (2×5 мл). Объединенные органические слои сушили сульфатом натрия и удаляли растворители в вакууме. Получали 60 мг белого твердого вещества. Разделением на силикагеле, пропитанным AgNO3 (H, 5%-20% EtOAc) получали соединение A28 (3α-OH) (6 мг, 0,014 ммоль, 8,56%) и соединение A28 (3β-OH) (4 мг, 0,0096 ммоль, 5,71%). (3α-OH)1H-ЯМР (400 МГц, CDCl3): δ (м.д.): 5,45-5,38 (м, 1H), 2,40-2,33 (м, 1H), 2,05-1,93 (м, 2H), 1,92-1,80 (м, 2H), 1,75-1,23 (м, 15H), 1,20 (с, 3H), 1,19 (с, 3H), 1,18-0,98 (м, 7H), 0,97 (с, 3H), 0,96-0,90 (м, 6H), 0,89-0,81 (м, 2H), 0,68 (с, 3H). (3β-OH):1H-ЯМР (400 МГц, CDCl3): δ (м.д.): 5,33-5,25 (м, 1H), 2,41-2,31 (м, 1H), 2,06-1,93 (м, 3H), 1,90-1,78 (м, 1H), 1,77-1,23 (м, 20H), 1,20 (с, 3H), 1,19 (с, 3H), 1,17-1,05 (м, 5H), 1,03 (с, 3H), 1,01-0,95 (м, 1H), 0,93 (д, J=6,5 Гц, 3H), 0,92-0,88 (м, 1H), 0,84 (т, J=7,4 Гц, 3H), 0,67 (с, 3H).
Пример 17. Получение соединения B6

[0377] Получение соединения B6a. Добавляли уксусный ангидрид (15,36 мл, 164 ммоль) к суспензии стигмастерол (22,5 г, 54,5 ммоль) в пиридине (90 мл) в атмосфере азота и инкубировали смесь при комнатной температуре в течение 42 часов. TLC [гептан (2):этилацетат (1)] демонстрировали полное преобразование до более высокого продукта элюирования после окрашивания пара-анисовым альдегидом. К реакционной смеси добавляли вода (300 мл) для гашения избытка уксусного ангидрида. После перемешивания в течение 1 часа фильтровали белое твердое вещество и тщательно промывали водой (9×250 мл). Сушили белое твердое вещество в вакуумной печи при 40ºC в присутствии химического стакана с гидроксидом натрия в течение выходных дней с получением продукта B6a (24,63 г, 54,2 ммоль, выход=99%) в виде белого порошка. B6a использовали в таком виде в последующем эксперименте(ах).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,38-5,37 (1H, м), 5,15 (1H, дд, J=15,1, 8,6 Гц), 5,01 (1H, дд, J=15,1, 8,6 Гц), 4,64-4,56 (1H, м), 2,33-2,31 (2H, м), 2,03 (3H, с), 1,90-1,82 (2H, м), 1,75-1,65 (1H, м), 1,02 (6H, т, J=3,2 Гц), 0,86-0,78 (9H, м), 0,68 (3H, с).
[0378] Получение соединения B6b. К раствору йодбензола (3,66 мл, 32,7 ммоль) в н-гептане (100 мл) добавляли бром (1,754 мл, 34,1 ммоль) и охлаждали раствор до -5ºC в атмосфере азота. Раствор стигмастерилацетата B6a (13,5 г, 29,7 ммоль) в н-гептане (700 мл) также охлаждали до -5ºC в атмосфере азота, интенсивно перемешивали и капельно добавляли раствор, получаемый, как указано выше, в течение 2,5 часов в атмосфере азота при сохранении бледно-желтой окраски раствора. Получаемый раствор перемешивали в течение ночи, а затем фильтровали. TLC [гептан (9):этилацетат (1)] демонстрировали полное предобразование до незначительно более низкого продукта элюирования после окрашивания ванилином. Раствор концентрировали в вакууме досуха. Остаток очищали хроматографий на колонке (900 г) [гептан (95):простой диизопропиловый эфир (5)]. Собирали фракции, содержащие чистый продукт, и выпаривали при пониженном давлении с получением B6b (9,06 г, 14,7 ммоль, выход=50%) в виде белого порошка. B6b использовали в таком виде в последующем эксперименте(ах).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,48 (1H, септ, J=5,4 Гц), 5,15 (1H, дд, J=15,1, 8,6 Гц), 5,02 (1H, дд, J=15,1, 8,6 Гц), 4,84 (1H, шир.д), 2,05 (3H, с), 1,46 (3H, с), 1,01 (3H, д, J=6,6 Гц), 0,90-0,79 (15H, м), 0,72 (3H, с).
[0379] Получение соединения B6c. Охлаждали раствор 5α,6β-дибромстигмастан-3β-ил-ацетата B6b (8,11 г, 13,20 ммоль) в высушенном на молекулярных ситах дихлорметане (240 мл) и пиридине (3,05 мл, 37,7 ммоль) в ванной с жидким азотом/этилацетатом. Струю озона с высоким содержанием кислорода пропускали через раствор через распылитель из пористого стекла в течение одного часа. Окраска реакционной смеси становилась немного голубой. TLC [гептан (9):этилацетат (1)] демонстрировали полное преобразование исходного вещества при УФ254. Реакцию озонолиза останавливали. Реакционную смесь немедленно вливали в смесь ледяной уксусной кислоты (33,2 мл, 581 ммоль) и цинковой пыли (21,57 г, 330 ммоль) и перемешивали при комнатной температуре в течение ночи. Раствор фильтровали, последовательно промывали водой (200 мл), 10% водным гидрокарбонатом натрия (200 мл), 5% водным гидроксидом натрия (200 мл) и насыщенным солевым раствором (200 мл), а затем сушили безводным сульфатом натрия. Выпариванием растворителя получали неочищенный холест-5-ен-3β-ол-22-аль B6c, который очищали хроматографией на испарительной колонке (300 г) [гептан (100→90):этилацетат (0→10)]. Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении с получением холест-5-ен-3β-ол-22-аль B6c (2,58 г, 6,93 ммоль, выход=53%) в виде белого порошка. B6c использовали в таком виде с последующем эксперименте(ах).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 9,57 (1H, д, J=3,3 Гц), 5,38 (1H, шир.д), 4,65-4,56 (1H, м), 2,41-2,28 (3H, м), 2,04 (3H, с), 2,03-1,92 (2H, м), 1,91-1,81 (3H, м), 1,13 (3H, д, J=6,8 Гц), 1,03 (3H, с), 0,73 (3H, с).
[0380] Получение соединения B6d. К раствору (метоксиметил)трифенилфосфонийхлорид (0,789 г, 2,30 ммоль) в сухом THF (6,4 мл) добавляли n-BuLi 1,6M в гексане (1,342 мл, 2,15 ммоль) при -10ºC в атмосфере аргона. Раствор перемешивали в течение 5 минут при комнатной температуре с последующим добавлением B6c (0,2 г, 0,54 ммоль) в сухом THF (1,3 мл). Смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь вливали в насыщенный водный NH4Cl (75 мл) и дважды экстрагировали CH2Cl2 (50 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили Na2SO4 и очищали неочищенный продукт хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→88:12) с получением B6d (103 мг, 0,29 ммоль, выход=54%). B6d получали в виде смеси E/Z 1:1 согласно ЯМР.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 6,24 (0,5H, д, J=12,6 Гц), 5,74 (0,5H, д, J=6,2 Гц), 5,34 (1H, шир.д), 4,59 (0,5H, дд, J=12,5, 9,3 Гц), 4,17 (0,5H, дд, J=9,8, 6,3 Гц), 3,58-3,46 (1H, м), 3,55 (1,5H, с), 3,47 (1,5H, с), 2,67-2,54 (0,5H, м), 2,33-2,18 (2H, м), 2,04-1,78 (6H, м), 1,77-1,65 (1H, м), 1,04 (1,5H, д, J=6,6 Гц), 1,01 (3H, с), 0,98 (1,5H, д, J=6,7 Гц), 0,72 (1,5H, с), 0,69 (1,5H, с).
[0381] Получение соединения B6e. Добавляли уксусный ангидрид (0,079 мл, 0,84 ммоль) к суспензии B6d (0,1 г, 0,279 ммоль) в пиридин (3 мл) в атмосфере азота и инкубировали смесь при комнатной температуре в течение 42 часов. К реакционной смеси добавляли воду (60 мл) для гашения избытка уксусного ангидрида. После перемешивания в течение 1 часа фильтровали белое твердое вещество и тщательно промывали водой (9×250 мл). Белое твердое вещество сушили в вакуумной печи при 40ºC в течение ночи с получением продукта B6e (111 мг, 0,28 ммоль, выход=99%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 6,24 (0,5H, д, J=12,6 Гц), 5,73 (0,5H, д, J=6,2 Гц), 5,37 (1H, шир.д), 4,66-4,55 (1H, м), 4,59 (0,5H, дд, J=12,5, 9,3 Гц), 4,17 (0,5H, дд, J=9,8, 6,3 Гц), 3,55 (1,5H, с), 3,47 (1,5H, с), 2,66-2,54 (0,5H, м), 2,35-2,28 (2H, м), 2,03 (3H, с), 2,02-1,91 (3H, м), 1,90-1,81 (2H, м), 1,77-1,66 (1H, м), 1,04 (1,5H, д, J=6,6 Гц), 1,02 (3H, с), 0,99 (1,5H, д, J=6,6 Гц), 0,72 (1,5H, с), 0,69 (1,5H, с).
[0382] Получение соединения B6f. К раствору B6e (0,111 г, 0,28 ммоль) в ацетоне (9 мл) добавляли 0,1M водную HCl (1 мл, 0,10 ммоль). Получаемую белую суспензию перемешивали в течение 1 часа при комнатной температуре с последующим перемешиванием в течение 1 часа при 70ºC и при комнатной температуре в течение ночи. Смесь нагревали до 70ºC в течение 2 часов, охлаждали до комнатной температуры и разбавляли H2O (50 мл). Реакционную смесь выпаривали досуха, выпаривали совместно с MeOH (50 мл) и CH2Cl2 (10 мл). Скорее всего это представляет собой смесь желаемого продукта и диметилацеталя. К раствору этой смеси (0,12 г, 0,28 ммоль) в ацетоне (10 мл) добавляли 0,1M водную HCl (1 мл, 0,10 ммоль). Получаемую белую суспензию перемешивали в течение 2 часов при 70ºC. Добавляли 1,4-диоксана (5 мл), который вызывал переход нерастворимой фракции в растворимую. Реакционную смесь нагревали до 70ºC в течение 2 часов, оставляли остывать до комнатной температуры и перемешивали в течение выходных дней. Реакционную смесь разбавляли H2O (50 мл) и экстрагировали CH2Cl2 (3×50 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили Na2SO4 и выпаривали растворители. Неочищенный продукт совместно выпаривали с CH2Cl2 (10 мл) с получением B6f (119 мг, 0,31 ммоль, выход=111%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 9,75 (1H, м), 5,37, (1H, шир.д), 4,66-.454 (1H, м), 2,47 (1H, дд, J=15,8, 2,4 Гц), 2,36-2,28 (2H, м), 2,17 (1H, ддд, J=15,8, 9,3, 3,3 Гц), 2,03 (3H, с), 1,02 (3H, д, J=6,4 Гц), 1,02 (3H, с), 0,70 (3H, с).
[0383] Получение соединения B6g. Соединение B6f (0,11 г, 0,285 ммоль) растворяли в t-бутаноле (5 мл) сухом THF (1 мл) и 2-метил-2-бутене (0,512 мл, 4,84 ммоль). Раствор перемешивали и охлаждали на ледяной бане. Медленно добавляли раствор NaClO2 (0,028 г, 0,313 ммоль) и K2HPO4 (0,043 г, 0,313 ммоль) в деминерализованной воде (3 мл) к раствору в течение 5 минут и перемешивали смесь 2 часа при 0ºC. Смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси медленно добавляли дополнительные NaClO2 (0,028 г, 0,313 ммоль) и K2HPO4 (0,043 г, 0,313 ммоль), растворенные в H2O (3 мл), и продолжали перемешивать в течение 2 часов. Реакционную смесь вливали в насыщенный водный NH4Cl (250 мл) и экстрагировали три раза CH2Cl2 (75 мл). Объединенные органические слои сушили Na2SO4, фильтровали и выпаривали при пониженном давлении. Белый твердый остаток (2,26 г, 163%) растирали в петролейном эфире 40-60 (10 мл). Фильтровали белое твердое вещество, дважды промывали петролейным эфиром 40-60 (5 мл) и сушили на воздухе в течение 0,5 часа с получением B6f (0,089 г, 0,22 ммоль, выход=78%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 10,0 (1H, шир.с), 5,37 (1H, шир.д), 4,66-4,55 (1H, м), 2,53-2,44 (1H, м), 2,36-2,26 (2H, м), 2,04 (3H, с), 1,04 (3H, д, J=6,4 Гц), 1,02 (3H, с), 0,72 (3H, с).
[0384] Получение соединения B6h. К раствору B6g (0,09 г, 0,224 ммоль) в CH2Cl2 (10 мл) добавляли оксалилхлорид (0,048 мл, 0,56 ммоль) и DMF (катализатор). Раствор перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь разбавляли сухим MeOH (150 мл, 3703 ммоль) и перемешивали при 40ºC до растворения всех твердых веществ. Реакционную смесь выпаривали досуха и очищали неочищенный продукт хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→95:5) и дважды совместно выпаривали с THF с получением B6h (85 мг, 0,20 ммоль, выход=91%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,37 (1H, шир.д), 4,66-4,55 (1H, м), 3,66 (3H, с), 2,43 (1H, дд, J=14,1, 2,9 Гц), 2,38-2,25 (2H, м), 2,04 (3H, с), 1,02 (3H, с), 0,99 (3H, д, J=6,2 Гц), 0,72 (3H, с).
[0385] Получение соединения B6. Раствор B6h (0,085 г, 0,20 ммоль) в сухом THF (3 мл) охлаждали до 0ºC в атмосфере аргона. Капельно добавляли MeMgCl 3,0M в THF (0,68 мл, 2,04 ммоль) с использованием шприца. Реакционную смесь перемешивали в течение 1 часа при 0ºC с последующим перемешиванием в течение 2 часов при комнатной температуре. Снова добавляли MeMgCl 3,0M в THF (0,68 мл, 2,04 ммоль) при комнатной температуре и продолжали перемешивать в течение ночи. Реакционную смесь гасили насыщенным водным NH4Cl (75 мл) и экстрагировали три раза CH2Cl2 (3×50 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили Na2SO4 и очищали неочищенный продукт хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→4:1) с получением B6 (45 мг, 0,12 ммоль, выход=59%) в виде белого рыхлого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,35 (1H, шир.д), 3,53 (1H, септ, J=5,1 Гц), 2,34-2,17 (2H, м), 2,03 (1H, дт, J=12,6, 3,3 Гц), 2,01-1,94 (1H, м), 1,93-1,79 (3H, м), 1,23 (6H, с), 1,06 (3H, д, J=6,5 Гц), 1,01 (3H, с), 0,72 (3H, с).
Пример 18. Получение соединения B7

[0386] Получение соединения B7d: Холест-5-ен-3β-ол-22-аль B7c (1,33 г, 3,57 ммоль) растворяли в трет-бутаноле (75 мл), тетрагидрофуране (сухом) (15 мл) и 2-метил-2-бутене (13,22 мл, 125 ммоль). Раствор перемешивали и охлаждали на ледяной бане. Свежеприготовленный раствор хлорита натрия (0,355 г, 3,93 ммоль) и одноосновного фосфата калия ч.д.а. (0,534 г, 3,93 ммоль) в деминерализованной воде (45 мл) медленно добавляли к раствору в течение 30 минут и перемешивали смесь 2 часа при 0ºC. Удаляли ледяную баню, повышали температуру смеси до комнатной температуры и перемешивали в течение ночи. TLC [гептан (2):этилацетат (1)] демонстрировали частичное преобразование до более низкого продукта элюирования после окрашивания ванилином. К реакционной смеси медленно добавляли избыток хлорита натрия (0,355 г, 3,93 ммоль) и одноосновного фосфата калия ч.д.а. (0,534 г, 3,93 ммоль), растворенных в воде (45 мл), и продолжали перемешивать в течение 2 часов. TLC [гептан (2):этилацетат (1)] демонстрировали полное преобразование до более низкого продукта элюирования после окрашивания ванилином. Реакционную смесь вливали в насыщенный водный хлорид аммония (250 мл) и экстрагировали три раза дихлорметаном (100 мл). Объединенные органические слои сушили сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Остаток дважды десорбировали толуолом (50 мл) с последующей десорбцией дихлорметаном (50 мл). Белый твердый остаток (2,26 г, 163%) растирали в петролейном эфире 40-60 (10 мл) в течение 0,5 часов. Белое твердое вещество фильтровали, промывали дважды петролейным эфиром 40-60 (10 мл) и сушили на воздухе (оставляя работающим вакуумный насос) в течение 0,5 часов с получением B7d (1,27 г, 3,26 ммоль, выход=91%) в виде белого порошка. B7d использовали в таком виде в последующем эксперименте(ах).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 10,31 (1H, шир.с), 5,37 (1H, шир.д), 4,65-4,56 (1H, м), 2,47-2,39 (1H, м), 2,36-2,26 (2H, м), 2,04 (3H, с), 2,01-1,92 (2H, м), 1,90-1,76 (3H, м), 1,24 (3H, д, J=6,8 Гц), 1,02 (3H, с), 0,71 (3H, с).
[0387] Получение соединения B7e. Карбоновую кислоту B7d (0,1 г, 0,257 ммоль) растворяли в дихлорметане (10 мл). Добавляли оксалилхлорид (0,044 мл, 0,515 ммоль) и N,N-диметилформамид (одну каплю) и перемешивали реакционную смесь в течение 1 часа. Образец реакционной смеси вливали в метанол, выпаривали досуха и анализировали TLC [гептан (3):этилацетат (1)], которая демонстрировала полное преобразование в сложный метиловый эфир после окрашивания ванилином. Реакционную смесь разбавляли метанолом (50 мл, 1234 ммоль) (высушенным на молекулярных ситах), выпаривали при пониженном давлении, десорбировали безводным толуолом и дихлорметаном. Остаток очищали хроматографией на испарительной колонке (4 г) [гептан (99→80):этилацетат (1→20)]. Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении с получением B7e (0,104 г, 0,257 ммоль, выход=100%). B7e перемешивали с толуолом (2×5 мл), дихлорметаном (2×5 мл) и безводным тетрагидрофураном (2×5 мл) и использовали в таком виде на следующем этапе реакции.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,37 (1H, шир.д), 4,65-4,56 (1H, м), 3,65 (3H, с), 2,47-2,38 (1H, м), 2,36-2,26 (2H, м), 2,03 (3H, с), 2,01-1,92 (2H, м), 1,90-1,82 (2H, м), 1,19 (3H, д, J=6,8 Гц), 1,02 (3H, с), 0,69 (3H, с).
[0388] Получение соединения B7. Сложный метиловый эфир B7e (0,104 г, 0,258 ммоль) растворяли в тетрагидрофуране (сухом) (2,6 мл) и охлаждали на ледяной бане под аргоном. Через 20 минут капельно добавляли метилмагнийхлорид 3,0M в THF (0,861 мл, 2,58 ммоль) через шприц. Наблюдали выделение некоторого количества газа. После перемешивания реакционной смеси в течение 0,5 часов удаляли охлаждающую баню и продолжали перемешивание в течение 2 часов. TLC [гептан (3):этилацетат (1)] демонстрировали полное преобразование исходного вещества до двух более высоких продуктов элюирования после окрашивания ванилином. Продолжали перемешивание в течение 1 часа. Реакционную смесь вливали в насыщенный водный раствор хлорида аммония (75 мл) при перемешивании и экстрагировали дихлорметаном (3×50 мл). Экстракты объединяли, сушили сульфатом натрия и выпаривали. Остаток растирали в метаноле (2 мл) в течение 0,5 часов, фильтровали белое твердое вещество и промывали остаток на фильтре метанолом (2 мл). На фильтре практически не оставалось вещества, большая его часть содержалась в фильтрате. Фильтрат и остаток на фильтре объединяли и очищали хроматографией на испарительной колонке [гептан (99→70):этилацетат (1→30)]. Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении. Остаток сушили при 40ºC в вакуумной печи в течение ночи с получением B7 (0,044 г, 0,122 ммоль, выход=47%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,35 (1H, м), 3,53 (1H, септ, J=5,2 Гц), 2,34-2,19 (2H, м), 2,10 (1H, дт, J=12,6, 3,4 Гц), 2,03-1,88 (2H, м), 1,88-1,79 (2H, м), 1,20 (3H, с), 1,15 (3H, с), 1,00 (3H, с), 0,98 (3H, д, J=6,9 Гц), 0,73 (3H, с).
Пример 19. Получение соединения B8

[0389] Получение соединения B8b. В высушенной над пламенем круглодонной колбе добавляли раствор NaHMDS (0,070 мл, 0,349 ммоль) в тетрагидрофуране (сухом) (1 мл) к раствору силилоксифосфонатного эфира B8a (0,143 г, 0,403 ммоль) в тетрагидрофуране (сухом) (1 мл) при -78ºC. Раствор перемешивали в течение 15 минут при -78ºC в атмосфере аргона. Затем медленно добавляли раствор холест-5-ен-3β-ол-22-аля B7c (0,1 г, 0,268 ммоль) в тетрагидрофуране (сухом) (1 мл) через шприц. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 20 часов. TLC [гептан (3):этилацетат (1)] демонстрировали частичное преобразование до более высокого продукта элюирования после окрашивания ванилином. Реакционную смесь гасили добавлением водного насыщенного хлорида аммония (50 мл) и экстрагировали дихлорметаном (3×50 мл). Объединенные органические слои промывали водой (50 мл), сушили сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией [гептан (100→90):простой диизопропиловый эфир (0→10)] на испарительной колонке (4 г). Собирали фракции, содержащие продукт и выпаривали при пониженном давлении с получением продукта B8b (0,117 г, 0,187 ммоль, выход=70%) в виде белого порошка. Согласно ЯМР получали смесь 7:3 E- и Z-изомеров.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,70 (1H, д, J=10,4 Гц), 5,23 (1H, шир.д), 5,17-5,13 (1H, м), 4,51-4,40 (1H, м), 4,11-4,00 (2H, м), 3,16-3,07 (0,3H[Z-изомер], м), 2,68-2,57 (0,7H[E-изомер], м), 2,20-2,10 (2H, м), 1,89 (3H, с), 1,89-1,77 (2H, м), 1,75-1,67 (2H, м), 0,89-0,85 (6H, м), 0,84-0,77 (10H, м), 0,59 (0,9H[Z-изомер], с), 0,57 (2,1H[E-изомер], с), 0,05-0,00 (6H, м).
[0390] Получение соединения B8c. К суспензии B8b (0,1 г, 0,175 ммоль) в ацетонитриле (безводном) (4 мл) добавляли ледяную уксусную кислоту (0,060 мл, 1,047 ммоль) и фторид цезия (0,080 г, 0,524 ммоль) в атмосфере азота при 0ºC. Получаемую смесь перемешивали при 0ºC в течение 30 минут и при комнатной температуре в течение 2 часов. LCMS-NQAD (кислотным) демонстрировали небольшое преобразование исходного вещества до продукта с неясной массой продукта. К реакционной смеси добавляли дихлорметан (2 мл), и реакционная смесь сразу же становилась желтым прозрачным раствором. Реакционную смесь перемешивали в течение ночи. К реакционной смеси добавляли избыток фторида цезия (0,080 г, 0,524 ммоль) и продолжали перемешивать в течение 24 часов. К реакционной смеси снова добавляли избыток фторида цезия (0,080 г, 0,524 ммоль) и продолжали перемешивать в течение 4 часов. Хотя TLC [гептан(3):этилацетат(1)] демонстрировали еще незначительное содержание исходного вещества в реакционной смеси, реакционную смесь разбавляли дихлорметаном (75 мл) и промывали насыщенным водным гидрокарбонатом натрия (50 мл). Органический слой сушили сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией [гептан (100→90):этилацетат (0→10)] на испарительной колонке (25 г) для удаления оставшегося исходного вещества (только видимого на TLC). Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении с получением продукта B8c (0,051 г, 0,111 ммоль, выход=64%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,37 (1H, шир.д), 4,65-4,55 (1H, м), 4,31, (2H, кв., J=7,1 Гц), 2,89 (1H, дд, J=16,8, 3,0 Гц), 2,57 (1H, дд, J=16,8, 9,9 Гц), 2,37-2,25 (2H, м), 2,04 (3H, с), 2,09-1,91 (2H, м), 1,90-1,77 (3H, м), 1,37 (3H, т, J=7,1 Гц), 1,02 (3H, с), 0,97 (3H, д, J=6,5 Гц), 0,72 (3H, с).
[0391] Получение соединения B8d. Раствор B8c (0,051 г, 0,111 ммоль) в дихлорметане (1 мл) охлаждали на ледяной бане в атмосфере азота в течение 0,5 часов. Добавляли диэтиламиносульфуртрифторид (DAST) (0,027 мл, 0,222 ммоль) и оставляли реакционную смесь нагреваться до комнатной температуры, и перемешивали в течение ночи. Добавляли избыток диэтиламиносульфуртрифторида (DAST) (0,027 мл, 0,222 ммоль) и продолжали перемешивать в течение 20 часов. TLC [гептан (3):этилацетат (1)] демонстрировали еще не полное разрушение исходного вещества после окрашивания ванилином. LCMS-ELSD (щелочной): 47% продукта при комнатной температуре=3,43 с массой/зарядом(+)=421, соответствует желаемому продукту, где удалена ацетатная группа [M-CH3COOH+H]+. Реакционную смесь разбавляли дихлорметаном (50 мл) и промывали насыщенным гидрокарбонатом натрия (50 мл). Водный слой разделяли и дважды экстрагировали дихлорметаном (50 мл). Экстракты объединяли с указанным выше органическим слоем, сушили сульфатом натрия и выпаривали при пониженном давлении. Остаток очищали хроматографией на испарительной колонке [гептан(100→90):этилацетат(0→90)]. Собирали фракции, содержащие продукт, выпаривали при пониженном давлении и десорбировали дихлорметаном (5 мл) с получением продукта B8d (0,027 г, 0,056 ммоль, выход=51%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,37 (1H, шир.д), 4,65-4,55 (1H, м), 4,32, (2H, кв., J=7,1 Гц), 2,37-2,28 (2H, м), 2,27-2,09 (1H, м), 2,03 (3H, с), 2,04-1,92 (2H, м), 1,90-1,81 (3H, м), 1,35 (3H, т, J=7,1 Гц), 1,06 (3H, д, J=6,1 Гц), 1,02 (3H, с), 0,88 (6H, т, J=6,8 Гц), 0,70 (3H, с).
[0392] Получение соединения B8. Соединение B8d (0,027 г, 0,056 ммоль) растворяли в тетрагидрофуране (сухом) (1 мл) в атмосфере аргона. Смесь охлаждали на ледяной бане в течение 15 минут и постепенно добавляли алюмогидрид лития 2,4M в THF (0,047 мл, 0,112 ммоль). Наблюдали выделение некоторого количества газа. Реакционную смесь охлаждали и перемешивали в течение 1 часа. TLC [гептан (3):этилацетат (1)] демонстрировали полное преобразование в основном до одного более низкого продукта элюирования после окрашивания ванилином. Удаляли ледяную баню и продолжали перемешивание в течение 1 часа. Реакционную смесь гасили насыщенным водным хлоридом аммония (50 мл) и экстрагировали три раза дихлорметаном (50 мл). Объединенные экстракты сушили сульфатом натрия и выпаривали при пониженном давлении. Остаток очищали хроматографией [гептан (100→85):этилацетат (0→15)] на испарительной колонке (4 г диоксида кремния). Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении. Остаток переносили во флакон (4 мл) с метанолом и выпаривали метанол при 37ºC под струей азота. Остаток сушили при 40ºC в вакуумной печи в течение ночи с получением продукта B8 (0,011 г, 0,028 ммоль, выход=49%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,35 (1H, м), 3,71 (2H, т, J=12,8 Гц), 3,58-3,48 (1H, м), 2,35-2,18 (2H, м), 2,15-1,93 (3H, м), 1,92-1,73 (5H, м), 1,70-1,40 (9H, м), 1,08 (3H, д, J=6,5 Гц), 1,01 (3H, с), 0,72 (3H, с).
Пример 20. Получение соединения B10

[0393] В высушенной над пламенем колбе под аргоном охлаждали раствор BB-1 (100 мг, 0,23 ммоль) и изопропоксид титана (IV) (0,07 мл, 0,23 ммоль) в THF (сухом, 2 мл) до 0ºC. Капельно добавляли этилмагнийбромид (1,0M в THF, 1,16 мл). Реакционную смесь перемешивали при 0ºC в течение 15 минут. TLC (H/E; 2:1) демонстрировали исходное вещество и два новых пятна. Реакционную смесь оставляли нагреваться до комнатной температуры и продолжали перемешивать в течение 1 часа. Затем реакционную смесь охлаждали до 0ºC и капельно добавляли этилмагнийбромид (1,0M в THF, 1,16 мл). Реакционную смесь перемешивали при 0ºC в течение 15 минут. TLC (H/E; 2:1) демонстрировали полное преобразование и одно новое пятно. Реакционную смесь разбавляли Et2O (2 мл). Добавляли водный насыщенный NH4Cl (2 мл) и H2O (2 мл) при 0ºC. Фильтровали твердые вещества через вату и промывали осадок на фильтре Et2O (10 мл). Разделяли бесцветные слои и экстрагировали водный слой Et2O (20 мл) и смесью Et2O и EtOAc (20 мл; 1:1). Органические слои сушили Na2SO4 и удаляли растворители в вакууме. Получали 125 мг белого твердого вещества. Флэш-хроматография (гептан, 5%-30% EtOAc) получали соединение B10 (37 мг, 0,096 ммоль; 41,2%). 1H-ЯМР (400 МГц, CDCl3) δ (м.д.): 5,36-5,35 (м, 1H), 3,58-3,46 (м, 1H), 2,32-2,21 (м, 2H), 2,03-1,93 (м, 2H), 1,91-1,80 (м, 3H) 1,77 (с, 1H), 1,69-1,37 (м, 10H), 1,34-0,82 (м, 9H), 1,01 (с, 3H), 0,93 (д, J=6,6 Гц, 3H), 0,75-0,71 (м, 2H), 0,69 (с, 3H), 0,46-0,39 (м, 2H).
Пример 21. Получение соединений B13a-B14

[0394] Получение соединения B13a. К раствору BB-2 (762 мг, 1,961 ммоль) в пиридине (15 мл) при 0ºC добавляли уксусный ангидрид (0,185 мл, 1,961 ммоль) и DMAP (23,95 мг, 0,196 ммоль) (слегка желтоватая суспензия, которая медленно растворялась). Смесь перемешивали при комнатной температуре в течение ночи. TLC (гептан/EtOAc 2:1) демонстрировали полное преобразование. Реакционную смесь разбавляли EtOAc (100 мл) и водой (100 мл) и разделяли слои. Водный слой экстрагировали EtOAc (2×). Объединяли органические слои и промывали водой (3×) и насыщенным солевым раствором, сушили Na2SO4 и концентрировали. Получаемое твердое вещество совместно выпаривали три раза с толуолом, EtOH и DCM. Вещество очищали флэш-хроматографией (40 г диоксида кремния, 4-40% EtOAc в гептане, нагруженным DCM). Соединение B13a (687 мг, 1,595 ммоль, 81%) получали в виде белого твердого вещества.1H ЯМР (300 МГц, CDCl3): δ (м.д.): 5,37 (1H, д, 5,1 Гц), 4,60 (1H, м), 1,99 (3H, с), 1,20 (6H, с), 1,01 (3H, с), 0,93 (3H, д, J=6,6 Гц), 0,68 (3H, с).
[0395] Получение соединения B13b. К раствору соединения B13a (687 мг, 1,595 ммоль) в дихлорметане (8,5 мл) под азотом добавляли TMS-N3 (0,233 мл, 1,755 ммоль) с последующим добавлением BF3·OEt2 (0,842 мл, 3,19 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. TLC демонстрировали почти полное преобразование в более высокое пятно элюирования. Присутствуют примеси. Перемешивали еще 30 минут, после чего реакционную смесь разбавляли 2M NaOH (25 мл) и DCM (25 мл). Разделяли слои. Водный слой экстрагировали DCM (2×). Органические слои объединяли и промывали насыщенным солевым раствором, сушили Na2SO4 и концентрировали, и очищали флеш-хроматографией (40 г диоксида кремния, 4-40% EtOAc в гептане, нагруженном DCM) с получением соединение B13b (660 мг, 1,376 ммоль, 86%).1H ЯМР (300 МГц, CDCl3): δ (м.д.): 5,37 (1H, д, 4,8 Гц), 4,60 (1H, м), 2,03 (3H, с), 1,20 (6H, с), 1,01 (3H, с), 0,93 (3H, д, J=6,6 Гц), 0,68 (3H, с).
[0396] Получение соединения B13. К раствору соединения B13b (660 мг, 1,448 ммоль) в простом диэтиловом эфире (сухом) (15 мл) при 0ºC под аргоном добавляли LiAlH4 в Et2O (0,797 мл, 3,19 ммоль) (образовывалась белая суспензия). Смесь перемешивали в течение 30 минут при 0ºC и в течение 1 часа при комнатной температуре, после чего TLC демонстрировали полное преобразование SM в более низкое пятно элюирования (амин). Смесь снова охлаждали до 0ºC и добавляли WATER (0,057 мл, 3,19 ммоль) и NaOH, 4M раствор в воде (0,797 мл, 3,19 ммоль). Перемешивали в течение 30 минут при комнатной температуре и фильтровали через целит с простым диэтиловым эфиром и THF. Органический слой сушили Na2SO4 и выпаривали растворитель. Неочищенный продукт очищали хроматографией (100 г диоксида кремния, нагруженного DCM) на колонке с гравитационным элюированием. Сначала колонку элюировали DCM:MeOH (95:5) для вымывания всех примесей. Затем колонку элюировали DCM:7M NH3 в MeOH (95:5) с получением соединения B13 (400 мг, 1,032 ммоль, 71,2%).1H ЯМР (300 МГц, CDCl3): δ (м.д.): 5,35 (1H, д, 5,1 Гц), 3,51 (1H, м), 1,07 (6H, с), 1,01 (3H, с), 0,93 (3H, д, J=6,6 Гц), 0,68 (3H, с).
[0397] Получение соединения B14. Соединение B13 (50 мг, 0,129 ммоль) растворяли в тетрагидрофуране (сухом) (2 мл) посредством слабого нагревания, затем добавляли MeI (8,07 мкл, 0,129 ммоль) (1 мл из исходного раствора 81 микролитров MeI в 10 мл THF) и K2CO3 (21,39 мг, 0,155 ммоль). Перемешивали в течение ночи при комнатной температуре. Отфильтровывали твердое вещество, промывали водой и сушили. Смесь очищали на предварительно нагруженной испарительной колонке 12g (GraceResolve™), элюируя в DCM/7н NH3 в MeOH 97,5/2,5 15 мл/минуту, фракции за 1 минуту. Таким образом, получали соединение B14 (18 мг, 0,045 ммоль, 34,7%).1H ЯМР (400 МГц, CDCl3): δ (м.д.): 5,35 (1H, д, 4,8 Гц), 3,53 (1H, м), 2,30 (3H, с), 1,02 (9H, с), 0,93 (3H, д, J=6,6 Гц), 0,68 (3H, с).
Пример 22. Получение соединения B17

[0398] Получение соединения B17a. К раствору 3β-гидроксихоленовой кислоты (0,5 г, 1,335 ммоль), N,O-диметилгидроксиламингидрохлорида (0,143 г, 1,468 ммоль) и N,N-диизопропилэтиламина (0,256 мл, 1,468 ммоль) в дихлорметане (15 мл) добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (EDCI) (0,282 г, 1,468 ммоль) и 1-гидрокси-7-азабензотриазол (HOAt) (0,018 г, 0,133 ммоль) при 0ºC в атмосфере азота. Реакционную смесь оставляли нагреваться до комнатной температуры в течение выходных дней. Добавляли избыток 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида (EDCI) (0,282 г, 1,468 ммоль) и 1-гидрокси-7-азабензотриазола (HOAt) (0,018 г, 0,133 ммоль) и продолжали перемешивать в течение 2 часов. Реакционную смесь разбавляли дихлорметаном (100 мл), промывали 0,5н водным гидросульфатом калия (75 мл) и насыщенным водным гидрокарбонатом натрия (75 мл), сушили сульфатом натрия и выпаривали при пониженном давлении. Остаток очищали хроматографией [гептан (80→66):этилацетат (20→33)] на испарительной колонке (4 г диоксида кремния). Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении. Остаток перемешивали с метанолом и сушили при 40ºC в течение ночи с получением B17a (0,495 г, 1,185 ммоль, выход=89%) в виде белого порошка.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,36-5,35 (1H, м), 3,69 (3H, с), 3,58-3,48 (1H, м), 3,18 (3H, с), 2,49-2,41 (1H, м), 2,37-2,20 (3H, м), 2,03-1,96 (2H, м), 1,96-1,75 (4H, м), 1,01 (3H, с), 0,95 (3H, д, J=6,5 Гц), 0,69 (3H, с).
[0399] Получение соединения B17b. В атмосфере аргона растворяли B17a (0,2 г, 0,479 ммоль) в тетрагидрофуране (сухом) (5 мл) и охлаждали до -75ºC. Капельно добавляли метилмагнийбромид 3,0 M в диэтилэфире (0,798 мл, 2,394 ммоль) (экзотермическая реакция, температура повышалась до -40ºC). После добавления реакционную смесь охлаждали до -75ºC. Удаляли охлаждающую баню и оставляли реакционную смесь нагреваться до комнатной температуры в течение 20 минут и перемешивали 5 часов. TLC [гептан (2):этилацетат (1)] демонстрировали полное преобразование до более высокого продукта элюирования после окрашивания ванилином. Реакционную смесь гасили добавлением насыщенного водного хлорида аммония (75 мл) и экстрагировали дихлорметаном (2×75 мл). Объединенные экстракты сушили сульфатом натрия и выпаривали при пониженном давлении. Остаток очищали хроматографией [гептан (80→66):этилацетат (20→33)] на испарительной колонке (4 г). Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении. Остаток перемешивали с метанолом и сушили при 40ºC в течение ночи с получением B17b (0,117 г, 0,314 ммоль, выход=66%) в виде белого твердого вещества. Продукт использовали в таком виде на следующем этапе.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,36-5,34 (1H, м), 3,56-3,48 (1H, м), 2,50-2,30 (2H, м) 2,30-2,19 (2H, м), 2,14 (3H, с), 2,02-1,94 (2H, м), 1,90-1,81 (3H, м), 1,01 (3H, с), 0,91 (3H, д, J=6,5 Гц), 0,67 (3H, с).
[0400] Получение соединения B17. Соединение B17b (0,117 г, 0,314 ммоль) растворяли в этаноле (Abs) (5 мл) в атмосфере азота и охлаждали до 0ºC. Добавляли борогидрид натрия (0,018 г, 0,471 ммоль) одной порцией (осторожно: образование пены) и оставляли реакционную смесь медленно нагреваться до комнатной температуры. После перемешивания в течение 3 часов TLC [гептан (2):этилацетат (1)] демонстрировали полное разрушение исходного вещества после окрашивания ванилином. Избыток борогидрида натрия разлагали насыщенным водным раствором хлорида аммония (50 мл). Реакционную смесь экстрагировали дихлорметаном (3×50 мл). Объединяли экстракты, сушили сульфатом натрия и выпаривали при пониженном давлении. Остаток сушили при 40ºC в вакуумной печи в течение ночи с получением B17 (0,105 г, 0,280 ммоль, выход=89%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,36-5,34 (1H, м), 3,75 (1H, кв., J=5,8 Гц), 3,53 (1H, септ, J=5,5 Гц), 2,32-2,20 (2H, м), 2,02-1,95 (2H, м), 1,90-1,79 (3H, м), 1,19 (3H, дд, J=6,1, 2,1 Гц), 1,01 (3H, с), 0,93 (3H, д, J=5,5 Гц), 0,68 (3H, с).
Пример 23. Получение соединения B18

[0401] 3β-гидроксихоленовую кислоту (0,1 г, 0,267 ммоль) суспендировали в тетрагидрофуране (сухом) (5 мл) в атмосфере аргона. Постепенно добавляли алюмогидрид лития, 2,4M в THF (0,222 мл, 0,534 ммоль). Наблюдали выделение некоторого количества газа. Реакционную смесь нагревали до 60ºC и перемешивали в течение ночи. TLC [гептан (2):этилацетат (1)] демонстрировали полное преобразование до более высокого продукта элюирования после окрашивания молибденом. Аккуратно добавляли этилацетат (50 мл) и воду (50 мл) для устранения избытка реагента. Нерастворимые вещества фильтровали и промывали этилацетатом (3×5 мл). Промывочные жидкости объединяли с фильтратом и разделяли органическую фазу. Водную фазу дважды или более экстрагировали этилацетатом (25 мл) и промывали объединенные экстракты насыщенным солевым раствором (75 мл), сушили сульфатом натрия и выпаривали при пониженном давлении с получением продукта B18 (0,032 г, 0,089 ммоль, выход=33%) в виде белого порошка.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,36-5,35 (1H, м), 3,65-3,58 (2H, шир.с), 3,57-3,48 (1H, м), 2,32-2,20 (2H, м), 2,03-1,93 (2H, м), 1,89-1,79 (3H, м), 1,01 (3H, с), 0,94 (3H, д, J=6,5 Гц), 0,68 (3H, с).
Пример 24. Получение C12, C32 и C33

[0402] Получение соединения C12. Соединение C12e (300 мг, 0,720 ммоль) растворяли в тетрагидрофуране (сухом) (7 мл) и охлаждали до 4ºC под аргоном. Затем добавляли метилмагнийхлорид, 3M в THF (2,400 мл, 7,20 ммоль) через шприц, при такой скорости, что температура не превышала 7ºC. Перемешивали при 4ºC в течение 20 минут, а затем при комнатной температуре. Через 2 часа TLC подтверждали завершение реакции. Реакционную смесь вливали в перемешиваемый насыщенный раствор NH4Cl и экстрагировали EtOAc (2×). Добавляли некоторое количество MeOH, чтобы обеспечить растворение всего продукта в органическом слое. Экстракт сушили (насыщенным солевым раствором, Na2SO4) и выпаривали. Остаток перемешивали в небольшом количестве MeOH (~5 мл) и отфильтровывали белое твердое вещество и сушили: соединение C12 (168 мг, 0,448 ммоль, 62,3%).1H ЯМР (400 МГц, DMSO-D6): δ (м.д.): 5,36 (1H, д, 4,6 Гц), 4,61 (1H, д, J=4,3 Гц), 4,03 (1H, с), 3,26 (1H, м), 2,32 (1H, м), 1,03 (6H, с), 0,87 (3H, д, J=6,6 Гц), 0,65 (3H, с).
[0403] Получение соединения C32a. Соединение C12e (74 мг, 0,178 ммоль) растворяли в этаноле (Abs) (10 мл) и добавляли палладий 10% на углероде (18,90 мг, 0,018 ммоль). Реакционную смесь последовательно продували азотом и водородом. Интенсивно перемешивали при комнатной температуре. Через 2 часа LCMS подтверждали полное преобразование, тогда как TLC не выявляли какого-либо изменения. Реакционную смесь снова продували азотом и фильтровали Pd/C через пористую трубку (3 фритты). В фильтрате все еще наблюдали Pd/C. Выпаривали EtOH и растворяли остаток в DCM и фильтровали через небольшую ватную пробку. Это давало прозрачный раствор. Выпаривали DCM с получением соединения C32a (68 мг, 0,162 ммоль, выход 91%). Использовали в таком виде без дополнительной очистки.1H ЯМР (400 МГц, CDCl3): δ (м.д.): 4,68 (1H, м), 3,66 (3H, с), 2,02 (3H, с), 0,91 (3H, д, J=6,6 Гц), 0,66 (3H, с).
[0404] Получение соединения C32. Соединение C32a (68 мг, 0,162 ммоль) растворяли в тетрагидрофуране (сухом) (1,5 мл) и охлаждали 0ºC под аргоном. Затем добавляли метилмагнийхлорид (0,541 мл, 1,624 ммоль). Наблюдали интенсивное выделение газа. Перемешивали при 0ºC и через 3 минуты при комнатной температуре. Через 2 часа добавляли немного больше метилмагнийхлорида (0,1 мл, 0,300 ммоль). Перемешивали в течение ночи при комнатной температуре. На следующие сутки реакционную смесь вливали в 50 мл насыщенного водного NH4Cl и экстрагировали 3× EtOAc. Сушили EtOAc (насыщенный солевой раствор, сульфат) и выпаривали. Остаток очищали колоночной хроматографией: неочищенную смесь растворяли в DCM с несколькими каплями MeOH для облегчения растворения и наносили на предварительно нагруженную испарительную колонку с диоксидом кремния. Элюировали фракции 30 мл/мин 30 секунд: 5 минут 100% гептаном; 20 минут 0→20% EtOAc/гептаном и 20 минут 20% EtOAc/гептаном изократически. Фракции продукта объединяли, выпаривали растворитель и белый твердый остаток растирали в Et2O, отфильтровывали и сушили с получением соединения C32 (25 мг, 0,063 мг, выход 38%),1H ЯМР (400 МГц, CDCl3): δ (м.д.): 3,58 (1H, м), 1,19 (6H, с), 0,91 (3H, д, J=6,6 Гц), 0,66 (3H, с).
[0405] Получение соединения C33a. Соединение C12 (110 мг, 0,294 ммоль) суспендировали в толуоле (сухом) (7 мл) и добавляли 1-метил-4-пиперидон (1,666 мг, 0,015 ммоль) и изопропоксид алюминия (93 мг, 1,028 ммоль). Перемешивали при температуре кипячения с обратным холодильником в течение 4 часов. TLC: еще присутствует исходное вещество. Добавляли еще изопропоксида алюминия (100 мг, 0,884 ммоль). Продолжали кипячение с обратным холодильником. Через 2 часа добавляли еще изопропоксида алюминия (100 мг, 0,884 ммоль). Продолжали кипячение с обратным холодильником в течение 3 часов. Затем добавляли последнее количество изопропоксида алюминия (100 мг, 0,884 ммоль). Кипятили с обратным холодильником еще 2 часа. Затем реакционную смесь оставляли охлаждаться до комнатной температуры, разбавляли EtOAc и экстрагировали 1н HCl для удаления 3. Экстрагировали водный слой желтого цвета 2× EtOAc. Объединенные фракции EtOAc промывали 1н HCl (3×), сушили (насыщенным солевым раствором, сульфатом) и выпаривали. Остаток перемешивали с DIPE до получения белого порошка. Эту неочищенную смесь очищали на предварительно нагруженной испарительное колонке (GraceResolve™) 40g, помещенной в CHCl3 с небольшим количеством MeOH, проводили элюирование в градиенте 30 мл/мин: 2 минуты 100% гептана; 38 минут 0→20% гептана/EtOAc; 10 минут 20% гептана/EtOAc; размер фракций 30 сек. Получали, таким образом, продукт C33a (84 мг, 0,225 ммоль, 77%).1H ЯМР (400 МГц, CDCl3): δ (м.д.): 5,82 (1H, с), 1,20 (6H, с), 0,93 (3H, д, J=6,5 Гц), 0,73 (3H, с).
[0406] Получение соединения C33b. Соединение C33a (84 мг, 0,225 ммоль) растворяли в этаноле (25 мл) и продували азотом. Затем добавляли палладий на карбонате кальция (~10% в виде Pd, 23,99 мг, 0,023 ммоль, 10%) и снова продували реакционную смесь азотом. Затем реакционную смесь продували водородом и интенсивно перемешивали под водородом. Через 3 часа TLC подтверждали завершение реакции. Снова продували азот и отфильтровывали катализатор через Hyflo, выпаривали EtOH. Смесь очищали на предварительно нагруженной испарительной колонке (GraceResolve™) 12g с изократическим элюированием в гептане/EtOAc 9/1; образец помещали в DCM; размер фракции 15 мл/мин 1 мин. Таким образом, получали продукт C33b (40 мг, 0,107 ммоль, 47,4%).1H ЯМР (400 МГц, CDCl3): δ (м.д.): 2,60 (1H, т, J=14,4 Гц), 1,20 (6H, с), 0,93 (3H, д, J=6,5 Гц), 0,70 (3H, с).
[0407] Получение соединения C33. Соединение C33b (5 мг, 0,013 ммоль) растворяли в тетрагидрофуране (сухом) (1 мл) и охлаждали до -78ºC. Затем добавляли K-селектрид (0,020 ммоль, 0,020 мл) и перемешивали реакционную смесь в течение 6 часов под азотом. Реакцию останавливали добавлением 10% раствора NaOH (0,1 мл) с последующим добавлением 30% раствора пероксида водорода (0,2 мл). Реакционную смесь нагревали до комнатной температуры и продолжали перемешивать в течение 30 минут. Смесь экстрагировали этилацетатом, объединенные органические слои промывали насыщенным солевым раствором, сушили Na2SO4, фильтровали и выпаривали. Неочищенный продукт очищали хроматографией на испарительной колонке с использованием 2:1 гептана/EtOAc. Таким образом, получали соединение C33 (2,2 мг, 0,00502 ммоль, 37,6%). LCMS: 83% чистое соединение содержит 17% изомера 3α-OH.1H ЯМР (400 МГц, CDCl3): δ (м.д.): 4,12 (1H, т, J=2,7 Гц), 1,20 (6H, с), 0,92 (3H, д, J=6,6 Гц), 0,67 (3H, с).
Пример 25. Получение D15
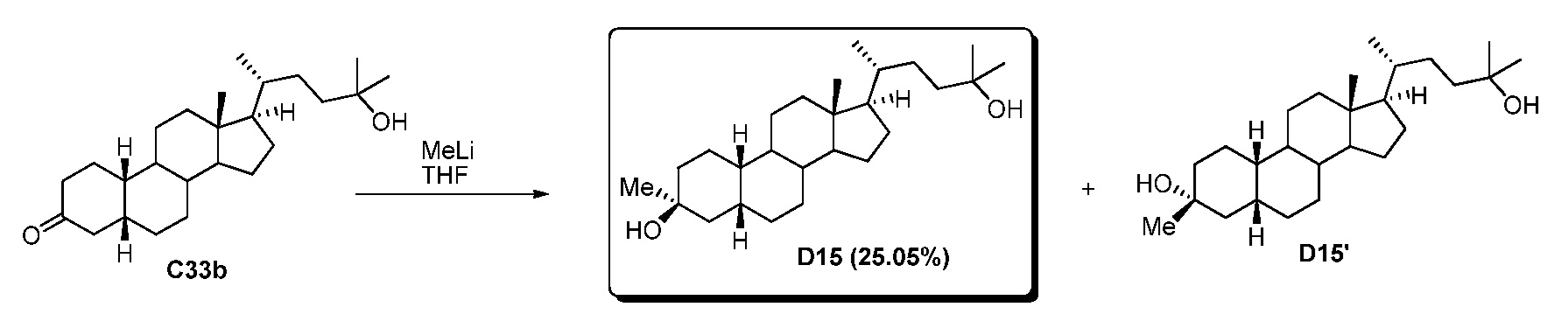
[0408] Соединение C33b (40 мг, 0,107 ммоль) растворяли в тетрагидрофуране (сухом) (1 мл) под аргоном и охлаждали до -78ºC. Затем добавляли метиллитий 1,6M (0,320 ммоль, 0,200 мл). Перемешивали при -78ºC. TLC через 2 часа: еще присутствуют исходное вещество. Реакционную смесь оставляли медленно нагреваться до комнатной температуры. TLC через 1 час: присутствует еще много исходного вещества, и присутствует толстый осадок. Добавляли еще тетрагидрофурана (сухого) (1 мл) для облегчения растворения. Через 30 минут реакционная смесь почти полностью растворялась. Продолжали перемешивание в течение 1 часа. TLC: еще присутствует исходное вещество, но 90+% преобразования. Реакционную смесь перемешивали более 30 минут, а затем гасили. Добавляли насыщенный водный NH4Cl и экстрагировали продукт DCM (3×). Выход продукта составлял 32 мг (неочищенного). Водный слой насыщали NaCl и снова экстрагировали на этот раз EtOAc (3×). Теперь получали 36 мг неочищенного продукта. Смесь очищали на предварительно нагруженной испарительной колонке (GraceResolve™) 12g, элюируя в градиенте 15 мл/мин: 2 минуты 100% гептаном; 28 минут 0→15% гептаном/EtOAc; 20 минут 15% гептаном/EtOAc; размер фракции 60 сек. Таким образом, получали продукт D15 (11 мг, 0,027 ммоль, 25,05%).1H ЯМР (400 МГц, CDCl3): δ (м.д.): 1,21 (3H, с), 1,20 (6H, с), 0,92 (3H, д, J=6,5 Гц), 0,67 (3H, с).
Пример 26. Получение D10 и D16

[0409] Получение соединения 3-альфа-D16. Соединение D10a (68 мг, 0,182 ммоль) растворяли в тетрагидрофуране (сухом) (2 мл) под аргоном и охлаждали до 0ºC. Затем добавляли метилмагнийхлорид (0,605 мл, 1,815 ммоль). Через 10 минут реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Затем реакционную смесь добавляли к 100 мл насыщенного водного NH4Cl, стакан из под реакционной смеси споласкивали THF и DCM и перемешивали в течение 0,5 часов с DCM. Продукт экстрагировали еще два раза DCM. DCM сушили (насыщенным солевым раствором, сульфатом) и выпаривали и проводили чистку на колонке с диоксидом кремния, элюируя в 30 мл/мин фракции 30 сек. Градиент: 5 мин 100% гептана; 25 минут 100/0 H/EtOAc→80/20 гептана/EtOAc; 20 минут 80/20 гептана/EtOAc. Таким образом, получали соединение D16 (3α-OH) (21 мг, 0,054 ммоль, 29,6%).1H ЯМР (400 МГц, CDCl3): δ (м.д.): 1,19 (9H, с), 0,91 (3H, д, J=6,6 Гц), 0,66 (3H, с).
[0410] Получение соединения 3-бета-D16. Соединение D10a (57 мг, 0,152 ммоль) растворяли в толуоле (сухом) (1 мл) под аргоном и охлаждали до -78ºC. Затем добавляли MAD, 0,4 M раствор в толуоле (1,141 мл, 0,456 ммоль). Через 10 минут перемешивали при -78ºC, добавляли метиллитий, 1,6 M раствор в простом диэтиловом эфире (0,285 мл, 0,456 ммоль). Перемешивали в течение 2 часов при -78ºC под аргоном. Через 2 часа при такой температуре реакционную смесь оставляли перемешиваться и нагреваться до комнатной температуры. Еще через 2 часа ее гасили добавлением к насыщенному NH4Cl. Стакан из под реакционной смеси споласкивали EtOAc. Продукт экстрагировали EtOAc (2×). Сушили EtOAc (насыщенным солевым раствором, Na2SO4) и выпаривали. Смесь очищали на предварительно нагруженной испарительной колонке (GraceResolve™) 12g, помещенной в DCM и элюировали в градиенте 30 мл/мин: 5 минут 100% гептаном; 25 минут 0→15% гептаном/EtOAc; 20 минут 15% гептаном/EtOAc; размер фракции 30 сек. Таким образом, получали продукт D16 (3β-OH) (35 мг, 0,090 ммоль, 58,8%).1H ЯМР (400 МГц, CDCl3): δ (м.д.): 1,23 (3H, с), 1,20 (6H, с), 0,91 (3H, д, J=6,6 Гц), 0,66 (3H, с).
[0411] Получение соединения D10a. Соединение C32 (222 мг, 0,589 ммоль) растворяли в хлороформе (сухом) (15 мл) путем небольшого нагревания. Затем охлаждали раствор на водяной бане (не кристаллизовался после охлаждения) и добавляли PCC (191 мг, 0,884 ммоль). При этом все еще перемешивали на водяной бане. TLC через 1 час: ~60-70% преобразования. Перемешивали в течение ночи. Затем раствор переносили в сортировочную воронку и тщательно промывали осадок DCM и добавляли в сортировочную воронку. Промывали 0,5н KHSO4. Промывали водную фазу DCM, объединяли органическую фазу и сушили Na2SO4 (ненасыщенный солевой раствор), и выпаривали. Смесь очищали на предварительно нагруженной испарительной колонке (GraceResolve™) 12g, элюируя в градиенте 30 мл/мин: 5 минут 100% H; 25 минут 0→15% H/EA; 20 минут 15% H/EA; размер фракции 30 сек 100 пробирок. Таким образом, получали соединение D10a (132 мг, 0,352 ммоль, 59,8%).1H ЯМР (400 МГц, CDCl3): δ (м.д.): 1,20 (6H, с), 0,92 (3H, д, J=6,6 Гц), 0,69 (3H, с).
[0412] Получение соединения D10. Соединение D10a (73 мг, 0,195 ммоль) растворяли в тетрагидрофуране (сухом) (2 мл) под аргоном и добавляли трифторметилтриметилсилан (0,086 мл, 0,585 ммоль) и фторид цезия (2,96 мг, 0,019 ммоль). Перемешивали при комнатной температуре. Раствор медленно становился слегка желтым. TLC через 3 часа: полное преобразование. Реакционную смесь разбавляли DCM и экстрагировали водой. Не наблюдали разделения фаз. Добавляли насыщенный солевой раствор (равный объем). Наблюдали хорошее разделение. Снова экстрагировали водный слой DCM, DCM объединяли и сушили (Na2SO4), и выпаривали. 103 мг неочищенного продукта (102%). Испарительную колонку на предварительно нагруженной колонке 12g элюировали 30 минут в градиенте от 0→2,5% DIPE в гептане. Таким образом, получали содержащее примесь TMS-промежуточное соединение в виде смеси примесей продуктов 3α- и 3β-OH и использовали в таком виде. Промежуточное соединение растворяли в 1,4-диоксане (4 мл) и добавляют 1н HCl (1 мл, 1000 ммоль). Перемешивали при комнатной температуре. TLC через 1 час: исчезало исходное вещество. Добавляли воду и экстрагировали продукт DCM 3×, и сушили Na2SO4 и выпаривали. Неочищенный продукт очищали на C18-колонке, элюируемой в градиенте MeCN/вода 95/5→0/100 12 минут, затем 12 минут изократически 100% водой. Таким образом, получали соединение D10 (14 мг, 0,030 ммоль, 22,9%).1H ЯМР (400 МГц, CDCl3): δ (м.д.): 1,19 (6H, с), 0,91 (3H, д, J=6,6 Гц), 0,67 (3H, с).
Пример 27. Получение соединения D1

[0413] В высушенной над пламенем пробирке охлаждали бесцветный прозрачный раствор соединения D13a (97 мг, 0,250 ммоль) и трифторметилтриметилсилана (0,119 мл, 0,749 ммоль) в THF (сухом, 1 мл) до 0ºC под аргоном. Добавляли фторид цезия (20 мг, 0,132 ммоль). Реакционная смесь оставалась бесцветной, и ее перемешивали при 0ºC в течение 5 минут. Удаляли охлаждающую баню и продолжали перемешивание при комнатной температуре в течение 1,5 часа. Реакционная смесь становилась коричнево-желтой, полное преобразование согласно TLC (гептан/EtOAc, 1:1). Реакционную смесь оставляли при комнатной температуре в течение ночи. Добавляли H2O (1 мл) и EtOAc (5 мл). Разделяли слои и экстрагировали водный слой EtOAc (2×5 мл). Объединенные органические слои сушили Na2SO4 и удаляли растворители в вакууме. Флэш-хроматографией (гептан, 5%-20% EtOAc) получали содержащее примеси промежуточное соединение 3-OTMS. Его использовали в таком виде. К раствору промежуточного соединения 3-OTMS в THF (1 мл) добавляли водную HCl (1н., 1 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, полное преобразование согласно TLC (H/E; 1:1). Растворители удаляли в вакууме. Получали желтое твердое вещество, очисткой флэш-хроматографией (гептан; 15%-35% EtOAc) получали соединение D1 (36 мг, 0,078 ммоль, 31,4%).1H-ЯМР (400 МГц, CDCl3): δ (м.д.): 1,20 (6H, с), 0,96 (3H, с), 0,89 (3H, д, J=10,6 Гц), 0,65 (3H, с).
Пример 28. Получение соединений D2a-D2

[0414] Получение соединения D2a. В атмосфере аргона растворяли соединение BB-1a (1 г, 2,57 ммоль) в метаноле (25 мл) и добавляли палладий 10% на активированном угле (0,137 г, 0,129 ммоль). Атмосферу аргона заменяли на водород (баллон) и энергично перемешивали реакционную смесь при комнатной температуре в течение ночи. Фильтровали реакционную смесь через Hyflo и промывали остаток на фильтре метанолом (50 мл) и дихлорметаном (2×50 мл). Фильтрат и жидкости от промываний объединяли и выпаривали при пониженном давлении с получением продукта D2a (1,01 г, 2,57 ммоль, выход=100%) в виде белого порошка.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,66 (3H, с), 3,59 (1H, окт., J=5,1 Гц), 2,35 (1H, ддд, J=15,4, 10,3, 5,1 Гц), 2,21 (1H, ддд, J=15,8, 9,5, 6,3 Гц), 1,94 (1H, дт, J=12,4, 3,3 Гц), 0,91 (3H, д, J=6,4 Гц), 0,65 (3H, с), 0,62 (1H, ддд, J=14,8, 8,1, 4,1 Гц).
[0415] Получение соединения D2b. Суспензию пиридинийхлорхромата (PCC) (0,969 г, 4,49 ммоль) в дихлорметане (10 мл) (высушенном на молекулярных ситах) охлаждали до 0ºC в атмосфере азота. Постепенно добавляли раствор D2a (0,585 г, 1,498 ммоль) в дихлорметане (5 мл) (высушенном на молекулярных ситах). После перемешивания в течение 1 часа наблюдали изменение окраски с оранжевой на темно-коричневую. Удаляли ледяную баню и продолжали перемешивать в течение 3,5 часов. TLC [гептан (2):этилацетат (1)] демонстрировали полное точное преобразование в более высокий продукт элюирования после окраски ванилином. Реакционную смесь разбавляли смесью 2:1 гептана/этилацетата (15 мл), элюировали через небольшой фильтр из диоксида кремния (30 г) и дважды ополаскивали фильтр гептаном/этилацетатом/дихлорметаном 2:1:1 (60 мл). Элюент промывали 0,5н водным гидросульфатом калия (90 мл). Промывочный раствор обратно экстрагировали дихлорметаном (90 мл) и этот экстракт объединяли с указанным выше органическим слоем, сушили сульфатом натрия, фильтровали и выпаривали при пониженном давлении. Остаток дважды перемешивали с дихлорметаном с получением D2b (0,555 г, 1,428 ммоль, выход=95%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,66 (3H, с), 2,04-1,94 (2H, м), 1,91-1,74 (2H, м), 1,73-1,66 (1H, м), 1,01 (3H, с), 0,92 (3H, д, J=6,4 Гц), 0,64 (3H, с).
[0416] Получение соединения D2c. В атмосфере аргона к перемешиваемой суспензии цинка (3,99 мл, 57,9 ммоль) в тетрагидрофуране (сухом) (30 мл) (незначительно экзотермическая реакция) добавляли дибромметан (1,268 мл, 18,01 ммоль). Смесь охлаждали до -40ºC на бане с сухим льдом/ацетонитрилом и перемешивали в течение 10 минут. Постепенно добавляли хлорид титан(IV) (1,533 мл, 13,90 ммоль) при такой скорости, что температура не превышала -30ºC (очень экзотермическая реакция). Удаляли баню с сухим льдом/ацетонитрилом и перемешивали смесь на ледяной бане в течение 4 часов в диапазоне температур 0-5ºC. Часть темной суспензии (~3 мл) добавляли при комнатной температуре к раствору D2b (0,1 г, 0,257 ммоль) в тетрагидрофуране (сухом) (10 мл). Смесь перемешивали в течение 10 минут. TLC [гептан (2): этилацетат (1)] демонстрировали в основном присутствие исходного вещества в реакционной смеси после окрашивания молибденом. Добавляли другую часть суспензии (~3 мл) и продолжали перемешивать в течение 5 минут. TLC [гептан (2):этилацетат (1)] демонстрировали все еще присутствие в основном исходного вещества в реакционной смеси после окрашивания молибденом. Добавляли оставшуюся часть суспензии, и после перемешивания в течение 5 минут TLC [гептан (2):этилацетат (1)] демонстрировали полное преобразование исходного вещества в основном в один очень полярный продукт после окрашивания молибденом. Реакционную смесь вливали в насыщенный водный гидрокарбонат натрия (100 мл) (осторожно: образование пены) и экстрагировали три раза этилацетатом (100 мл). Объединенные экстракты промывали насыщенным солевым раствором (150 мл), сушили сульфатом натрия и выпаривали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (испарительная колонка 12g) с использованием элюента в градиенте 0-5% простого диизопропилового эфира в гептане с получением D2c (0,058 г, 0,150 ммоль, выход=58%) в виде белого твердого продукта.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 4,55 (2H, шир.д), 3,66 (3H, с), 2,35 (1H, ддд, J=15,4, 10,3, 5,1 Гц), 2,21 (1H, ддд, J=15,8, 9,7, 6,4 Гц), 2,19-2,09 (2H, м), 2,06-1,71 (6H, м), 1,69-1,61 (1H, м), 0,91 (3H, д, J=6,4 Гц), 0,85 (3H, с), 0,69-0,60 (1H, м), 0,65 (3H, с).
[0417] Получение соединения D2d. К раствору D2c (0,058 г, 0,150 ммоль) в сухом дихлорметане (2 мл) (высушенном на молекулярных ситах) добавляли карбонат калия (безводный) (0,027 г, 0,195 ммоль) в атмосфере азота. Получаемую смесь охлаждали на ледяной/водяной бане и добавляли твердую 3-хлорпероксибензойную кислоту (70-75%) (mCPBA) (0,039 г, 0,158 ммоль) одной порцией. Реакционную смесь перемешивали в течение ночи. TLC [гептан (9):этилацетат (1)] демонстрировали частичное точное преобразование после окрашивания ванилином. Добавляли избыток карбоната калия (безводного) (0,027 г, 0,195 ммоль) и 3-хлорпероксибензойной кислоты (70-75%) (m-CPBA) (0,039 г, 0,158 ммоль) и продолжали перемешивать в течение 2 часов. TLC [гептан (9):этилацетат (1)] демонстрировали полное преобразование после окрашивания ванилином. Реакционную смесь фильтровали и осажденную соль бензоата промывали дихлорметаном (2×5 мл). Растворитель удаляли в вакууме с получением D2d (0,060 г, 0,149 ммоль, выход=99%) в виде белого твердого остатка. Согласно ЯМР получали смесь 2:1 α-O- и β-O-диастереоизомеров.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,66 (3H, с), 2,62 (0,33H[α-диастереоизомер], д, J=4,8 Гц), 2,61 (0,33H[α-диастереоизомер], д, J=4,9 Гц), 2,57 (0,33H[β-диастереоизомер], шир.с), 2,35 (1H, ддд, J=15,4, 10,3, 5,1 Гц), 2,21 (1H, ддд, J=15,7, 9,4, 6,3 Гц), 2,10-1,99 (1H, м), 1,99-1,92 (1H, м), 0,91 (3H, д, J=6,4 Гц), 0,86 (1H[β-диастереоизомер], с), 0,84 (2H[α-диастереоизомер], с), 0,66 (3H, с).
[0418] Получение соединения D2e (α-OH и β-OH). Смесь D2d (0,055 г, 0,137 ммоль) в метаноле (очень сухом) (5,5 мл) нагревали до получения прозрачного бесцветного раствора. Раствор оставляли остывать до комнатной температуры в атмосфере азота и добавляли метоксид натрия, 5,4M (30% масс.) раствора в метаноле (0,239 ммоль, 0,080 мл). Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение ночи. TLC [гептан (4):этилацетат (1)] демонстрировали полное преобразование после окрашивания ванилином, продукта не видно. Реакционную смесь вливали в насыщенный водный раствор хлорида аммония (50 мл) и три раза экстрагировали дихлорметаном (50 мл). Объединенные экстракты сушили сульфатом натрия и выпаривали. Согласно TLC образовывался очень полярный продукт. Метилэфирная группа гидролизовалась до карбоновой кислоты вследствие присутствия воды в реакционной смеси. Остаток растворяли в дихлорметане (10 мл). Добавляли оксалилхлорид (0,078 г, 0,612 ммоль, 0,053 мл) и N,N-диметилформамид (катализатор) и перемешивали реакционную смесь в течение 2 часов. Образец вливали в метанол, выпаривали досуха и анализировали TLC [дихлорметан (98):метанол (2)], которая демонстрировала полное преобразование до сложного метильного эфира после окрашивания молибденом. Реакционную смесь разбавляли метанолом (150 мл) (высушенным на молекулярных ситах) и выпаривали при пониженном давлении при 40ºC. Остаток очищали хроматографией [гептан (100→80):этилацетат (0→20)] на испарительной колонке (12g). Получали две фракции продукта, который собирали раздельно и выпаривали при пониженном давлении с получением D2e (α-OH) (0,035 г, 0,081 ммоль, выход=33%) и D2e (β-OH) (0,032 г, 0,074 ммоль, выход=30%) в виде белых твердых веществ. D2e (α-OH) и D2e (β-OH) использовали в таком виде в последующем эксперименте. D2e (α-OH)1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,66 (3H, с), 3,38 (3H, с), 3,18 (2H, с), 2,35 (1H, ддд, J=15,4, 10,3, 5,1 Гц), 2,21 (1H, ддд, J=15,7, 9,4, 6,3 Гц), 2,02 (1H, шир.с), 1,94 (1H, дт, J=12,3, 3,0 Гц), 1,90-1,73 (2H, м), 0,91 (3H, д, J=6,4 Гц), 0,74 (3H, с), 0,65 (3H, с). D2e (β-OH):1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,66 (3H, с), 3,39 (3H, с), 3,37 (2H, д, J=4,3 Гц), 2,54 (1H, шир.с), 2,35 (1H, ддд, J=15,4, 10,3, 5,1 Гц), 2,21 (1H, ддд, J=15,8, 9,5, 6,3 Гц), 1,95 (1H, дт, J=12,5, 3,0 Гц), 1,90-1,73 (2H, м), 0,91 (3H, д, J=6,4 Гц), 0,83 (3H, с), 0,65 (3H, с).
[0419] Получение соединения D2 (α-OH). В высушенной над пламенем круглодонной колбе (100 мл) растворяли D2e (α-OH) (0,035 г, 0,081 ммоль) в тетрагидрофуране (сухом) (1 мл) и охлаждали на ледяной бане под аргоном в течение 0,5 часов. Добавляли метилмагнийхлорид 3,0M в THF (0,805 ммоль, 0,268 мл) через шприц. Наблюдали выделение некоторого количества газа. После перемешивания реакционной смеси в течение 2 часов TLC [гептан (1):этилацетат (1)] демонстрировали полное преобразование исходного вещества до более низкого продукта элюирования после окрашивания молибденом. Реакционная смесь распределялась между насыщенным водным раствором хлорида аммония (20 мл) и дихлорметаном (20 мл), и ее оставляли в течение двух суток. Органический слой разделяли и экстрагировали водный слой еще два раза дихлорметаном (20 мл). Экстракты объединяли, сушили сульфатом натрия и выпаривали. Остаток очищали хроматографией [гептан (100→80):этилацетат (0→20)] на испарительной колонке (12g). Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении при 40ºC. Остаток переносили во флакон в виде раствора в дихлорметане/метанола и выпаривали при 37ºC под струей азота. Белый твердый остаток сушили при 45ºC в вакуумной печи в течение ночи с получением D2 (α-OH) (0,025 г, 0,055 ммоль, выход=68%) в виде белого порошка.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,38 (3H, с), 3,18 (2H, с), 1,98 (1H, шир.с), 1,95 (1H, дт, J=12,5, 3,2 Гц), 1,88-1,79 (1H, м), 1,68-1,61 (1H, м), 1,20 (3H, с), 1,19 (3H, с), 0,91, (3H, д, J=6,5 Гц), 0,74 (3H, с), 0,65 (3H, с).
[0420] Получение соединения D2 (β-OH). В высушенной над пламенем круглодонной колбе (100 мл) растворяли D2e (β-OH) (0,035 г, 0,081 ммоль) в тетрагидрофуране (сухом) (1 мл) и охлаждали на ледяной бане под аргоном в течение 0,5 часов. Добавляли метилмагнийхлорид 3,0M в THF (0,805 ммоль, 0,268 мл) через шприц. Наблюдали выделение некоторого количества газа. После перемешивания реакционной смеси в течение 2 часов TLC [гептан (1):этилацетат (1)] демонстрировали полное преобразование исходного вещества до более низкого продукта элюирования после окрашивания молибденом. Реакционная смесь распределялась между насыщенным водным раствором хлорида аммония (20 мл) и дихлорметаном (20 мл), и ее оставляли в течение двух суток. Органический слой разделяли и экстрагировали водный слой еще два раза дихлорметаном (20 мл). Объединяли экстракты, сушили сульфатом натрия и выпаривали. Остаток очищали хроматографией [гептан (100→80):этилацетат (0→20)] на испарительной колонке (12g). Собирали фракции, содержащие продукт, и выпаривали при пониженном давлении при 40ºC. Остаток переносили во флакон в виде раствора в дихлорметане/метаноле и выпаривали при 37ºC под струей азота. Белый твердый остаток сушили при 45ºC в вакуумной печи в течение ночи с получением D2 (β-OH) (0,018 г, 0,039 ммоль, выход=53%) в виде белого порошка.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,40 (3H, с), 3,39 (1H, д, J=9,2 Гц), 3,36 (1H, д, J=9,2 Гц), 2,51 (1H, шир.с), 1,96 (1H, дт, J=12,4, 3,1 Гц), 1,89-1,77 (1H, м), 1,20 (6H, с), 0,91, (3H, д, J=6,5 Гц), 0,83 (3H, с), 0,65 (3H, с).
Пример 29. Получение 3-альфа-D3 и 3-бета-D6

[0421] Получение соединения D6a. К раствору 18-краун-6 (0,315 г, 1,192 ммоль) и KHF2 (0,233 г, 2,98 ммоль) в сухом DMF (7,5 мл) в атмосфере аргона добавляли D5c (0,3 г, 0,745 ммоль). Нагревали реакционную смесь до 150ºC в течение ночи. Добавляли еще KHF2 (0,233 г, 2,98 ммоль) и продолжали нагревать в течение 8 часов. Смесь охлаждали до комнатной температуры, вливали в H2O (150 мл) и перемешивали с EtOAc (100 мл) в течение 30 минут. Водный слой дважды экстрагировали EtOAc (200 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×), сушили Na2SO4, фильтровали и выпаривали при пониженном давлении. Неочищенный продукт очищали хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→85:15) с получением продукта D6a (71 мг, 0,17 ммоль, выход=23%). Согласно ЯМР D6a получали в виде цис/транс-смеси 3:1.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 4,18 (1,5H [цис-изомер (β-OH)], д, J=47,8 Гц), 4,15 (0,5H [транс-изомер (α-OH)], д, J=48 Гц), 3,66 (3H, с), 2,35 (1H, ддд, J=15,4, 10,3, 5,2 Гц), 2,21 (1H, ддд, J=15,8, 9,5, 6,3 Гц), 0,98 (3H, с), 0,91 (3H, д, J=6,4 Гц), 0,65 (3H, с).
[0422] Получение соединения D6 (β-OH) и D3 (α-OH). Соединение D6a (0,071 г, 0,168 ммоль) совместно выпаривали с толуолом (50 мл) и растворяли в сухом THF (2 мл) в атмосфере аргона и охлаждали до 0ºC. Добавляли MeMgCl 3,0M в THF (0,560 мл, 1,680 ммоль) с использованием шприца. Реакционную смесь перемешивали в течение 2 часов при 0ºC. Реакционную смесь гасили насыщенным водным NH4Cl (50 мл) и экстрагировали три раза CH2Cl2 (100 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили Na2SO4 и очищали неочищенный продукт хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→85:15) с получением D6 (β-OH) (23 мг, 0,05 ммоль, выход=32%) и D3 (α-OH) (8 мг, 0,007 ммоль, выход=4%). D6 (β-OH):1H ЯМР (400 МГц, CDCl3) δ (м.д.): 4,19 (2H, д, J=47,8 Гц), 2,00-1,94 (1H, м), 1,76-1,69 (1H, м), 1,20 (6H, с), 0,98 (3H, с), 0,91 (3H, д, J=6,5 Гц), 0,65 (3H, с). D3 (α-OH):1H ЯМР (400 МГц, CDCl3) δ (м.д.): 4,15 (2H, д, J=47,8 Гц), 1,96 (1H, дт, J=12,4, 3,2 Гц), 1,89-1,78 (1H, м), 1,20 (3H, с), 1,19 (3H, с), 0,92 (3H, д, J=6,5 Гц), 0,76 (3H, с), 0,65 (3H, с).
Пример 30. Получение соединения D4

[0423] Получение соединения D4a. BB-3 (0,448 г, 1,153 ммоль) суспендировали в EtOH (abs) (12 мл) и добавляли MeOH (6 мл) в атмосфере аргона и палладий 10% на активированном угле (0,012 г, 0,012 ммоль). Атмосферу аргона заменяли водородом (атмосферным) и энергично перемешивали реакционную смесь при комнатной температуре в течение 2 часов. Продолжали перемешивать в течение 3 суток. Реакционную смесь фильтровали через Hyflo и выпаривали досуха. Остаток суспендировали в уксусной кислоте (5 мл), EtOAc (5 мл) и 1,4-диоксане (5 мл) и нагревали до получения прозрачного раствора. Реакционную смесь охлаждали до комнатной температуры и добавляли палладий 10% на активированном угле (0,012 г, 0,012 ммоль) в атмосфере аргона. Атмосферу аргона заменяли водородом (атмосферным) и энергично перемешивали реакционную смесь при комнатной температуре в течение ночи. Реакционную смесь фильтровали через Hyflo и промывали MeOH (2×50 мл) и CH2Cl2 (50 мл). Растворители выпаривали и остаток суспендировали насыщенным водным NaHCO3, отфильтровывали и сушили в вакуумной печи при 40ºC в течение ночи с получением D4a (385 мг, 0,99 ммоль, выход=85%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,59 (1H, септ, J=5,3 Гц), 1,96 (1H, дт, J=9,3, 3,1 Гц), 1,98-1,75 (2H, м), 1,71 (1H, дт, J=13,2, 3,4 Гц), 1,65 (1H, дкв., J=13,0, 3,4 Гц), 1,19 (6H, с), 0,91, (3H, д, J=6,5 Гц), 0,80 (3H, с), 0,65 (3H, с).
[0424] Получение соединения D4b. К ледяному охлажденному раствору пиридинийхлорхромата (PCC) (0,248 г, 1,152 ммоль) в сухом CH2Cl2 (4 мл) в атмосфере азота добавляли суспензию D4a (0,3 г, 0,768 ммоль) в сухом CH2Cl2 (4 мл). Капельно добавляли повторно растворенное твердое вещество в виде раствора в сухом CHCl3 (4 мл). Реакционную смесь перемешивали в течение 30 минут при 0ºC, с последующим перемешиванием 2 часа при комнатной температуре. Снова добавляли пиридинийхлорхромат (PCC) (0,248 г, 1,152 ммоль) одной порцией при комнатной температуре и перемешивали реакционную смесь в течение ночи. Реакционную смесь элюировали через небольшой фильтр из песка, диоксида кремния (5 г) и Hyflo и споласкивали фильтр CH2Cl2 (100 мл). Элюент дважды промывали водным 0,5н KHSO4 (100 мл). Объединенные растворы промываний экстрагировали один раз CH2Cl2 (100 мл) и сушили объединенные органические слои Na2SO4, фильтровали и выпаривали при пониженном давлении с получением D4b (306 мг, 0,79 ммоль, выход=103%) оранжево/коричневого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 2,38 (1H, td, J=14,5, 6,4 Гц), 2,32-2,21 (2H, м), 2,15-1,93 (3H, м), 1,90-1,79 (1H, м), 1,75-1,65 (1H, м), 1,20 (6H, с), 1,01 (3H, с), 0,92 (3H, д, J=6,4 Гц), 0,78-0,64 (1H, м), 0,68 (3H, с).
[0425] Получение соединения D4c. В высушенной над пламенем реакционной пробирке охлаждали раствор D4b (0,1 г, 0,257 ммоль) и (трифторметил)триметилсилана (0,053 мл, 0,34 ммоль) в сухом THF (2,5 мл) до 0ºC под аргоном. Добавляли CsF (на кончике шпателя) и перемешивали реакционную смесь при 0ºC в течение 5 минут. Удаляли охлаждающую баню и продолжали перемешивать при комнатной температуре в течение ночи. К реакционной смеси добавляли избыток (трифторметил)триметилсилана (0,053 мл, 0,34 ммоль) и CsF (на кончике шпателя) и продолжали перемешивать в атмосфере аргона в течение 3 часов. Добавляли H2O (50 мл) и EtOAc (50 мл). После перемешивания в течение 30 минут разделяли слои. Водный слой экстрагировали дважды EtOAc (50 мл). Объединенные органические слои сушили Na2SO4 и удаляли растворители в вакууме. Получали D4c (163 мг, 0,31 ммоль, выход=119%) в виде светло-желтого масла.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 2,04-1,92 (1H, м), 1,90-1,68 (2H, м), 1,09 (3H, с), 1,08 (3H, с), 0,80 (3H, с), 0,73 (3H, с), 0,55 (3H, с), 0,03 (12H, м).
[0426] Получение соединения D4. К раствору D4c (0,137 г, 0,258 ммоль) в 1,4-диоксане (8 мл) добавляли 1 M водную HCl (2 мл, 2,0 ммоль). Желтый раствор перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь разбавляли H2O (50 мл) и экстрагировали CH2Cl2 (3×50 мл). Объединенные органические слои промывали насыщенным водным NaHCO3, насыщенным солевым раствором, сушили Na2SO4 и выпаривали растворители. Неочищенный продукт очищали хроматографией на испарительной колонке (диоксид кремния, гептан/EtOAc, 1:0→4:1) и кристаллизовали из CH2Cl2 с получением D4 (44 мг, 0,10 ммоль, выход=37%) в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 2,09-2,02 (1H, м), 1,98 (1H, с), 1,96 (1H, дт, J=12,8, 3,4 Гц), 1,88-1,77 (2H, м), 1,72-1,61 (3H, м), 1,20 (3H, с), 1,19 (3H, с), 0,92 (3H, д, J=6,6 Гц), 0,85(3H, с), 0,65 (3H, с).
Пример 31. Получение соединения D5

[0427] Получение соединения D5a. К раствору BB-1 (2 г, 5,15 ммоль) и Al(iPrO)3 (3,68 г, 18,01 ммоль) в сухом толуоле (80 мл) добавляли 1-метил-4-пиперидон (29,1 г, 257 ммоль, 29,7 мл). Раствор перемешивали при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и разбавляли водной 0,5 M HCl (80 мл), насыщенным солевым раствором (80 мл) и Et2O (120 мл). Органический слой экстрагировали EtOAc (3×100 мл). Объединенные органические слои сушили Na2SO4, фильтровали и удаляли растворители в вакууме. Остаток разбавляли водной 1M HCl (250 мл) и экстрагировали EtOAc (2×250 мл). Органические растворители промывали насыщенным солевым раствором, сушили Na2SO4 и выпаривали досуха. Неочищенный продукт очищали хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→9:1) и совместно выпаривали с CH2Cl2 с получением D5a (1,27 г, 3,27 ммоль, выход=64%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 5,72 (1H, с), 3,67 (3H, с), 2,48-2,17 (6H, м), 2,02 (1H, дт, J=9,6, 3,8 Гц), 1,94-1,75 (3H, м), 1,69 (1H, td, J=14,0, 4,7 Гц), 1,18 (3H, с), 0,92 (3H, д, J=6,4 Гц), 0,71 (3H, с).
[0428] Получение соединения D5b. Суспензию D5a (1,26 г, 3,26 ммоль) в абсолютном EtOH (150 мл) нагревали до растворения исходного вещества. Раствор охлаждали до комнатной температуры и получали в атмосфере аргона. Добавляли палладий на карбонате кальция 10% (масс./масс.) (катализатор) и продували водород (атмосферный) через реакционную смесь в течение 15 минут. Реакционную смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Реакционную смесь продували аргоном, фильтровали твердые вещества через целит/силикагель и промывали фильтр EtOH (75 мл). Удаляли растворители в вакууме и очищали неочищенный продукт хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→9:1) с получением продукта D5b (1,12 г, 2,16 ммоль, выход=75%). Согласно ЯМР получали D5b в виде цис/транс-смеси 3:1.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,67 (3H, с), 2,70 (1H, т, J=14,2 Гц), 1,02 (2H[цис-изомер], с), 1,00 (1H[транс-изомер], с), 0,92 (3H, д, J=6,4 Гц), 0,68 (3H, с).
[0429] Получение соединения D5c. К раствору триметилсульфоксоний йодида (0,747 г, 3,39 ммоль) в сухом DMSO (10 мл) в атмосфере азота добавляли NaH (60% дисперсию в минеральном масле) (0,075 г, 3,13 ммоль) в виде 1 порции. Реакционную смесь перемешивали в течение 30 минут и добавляли раствор D5b (1,014 г, 2,61 ммоль) в сухом THF (10 мл). Реакционную смесь перемешивали в течение 1 часа с последующим добавлением избытка триметилсульфоксоний йодида (0,747 г, 3,39 ммоль) и NaH (60% дисперсии в минеральном масле) (0,075 г, 3,13 ммоль). Смесь перемешивали в течение 2 часов. Реакционная смесь разделялась между насыщенным водным NH4Cl (150 мл) и CH2Cl2 (150 мл). Водный слой экстрагировали CH2Cl2 (100 мл) и промывали объединенные органические слои насыщенным солевым раствором, сушили Na2SO4 и выпаривали досуха. Неочищенный продукт очищали хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→88:12) с получением продукта D5c (1 г, 2,48 ммоль, выход=75%). Согласно ЯМР D5c получали в виде цис/транс-смесь.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,67 (3H, с), 2,64-2,60 (2H, м), 2,42-2,30 (2H, м), 2,27-2,16 (1H, м), 0,99 (3H, с), 0,92 (3H, д, J=6,4 Гц), 0,66 (3H, с).
[0430] Получение соединения D5d. К суспензии D5c (0,1 г, 0,248 ммоль) в MeOH (2,5 мл) в атмосфере азота добавляли KOtBu (0,056 г, 0,497 ммоль) одной порцией. Реакционную смесь нагревали до кипения с обратным холодильником в течение 3 часов и охлаждали до комнатной температуры в течение ночи. Смесь разбавляли CH2Cl2 (5 мл) и вливали в насыщенный водный NH4Cl (25 мл). Водный слой экстрагировали CH2Cl2 (3×25 мл). Объединенные органические слои сушили Na2SO4, фильтровали и выпаривали при пониженном давлении. Неочищенный продукт очищали хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→9:1) и совместно выпаривали с CH2Cl2 (5 мл) с получением продукта D5d (0,08 г, 0,18 ммоль, выход=74%). Согласно ЯМР D5d получали в виде ~2:1 цис/транс-смеси.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,66 (3H, с), 3,39 (2H [цис-изомер (β-OH)], с), 3,38 (1H [транс-изомер (α-OH)], с), 3,24-3,12 (2H [цис-изомер (β-OH)/транс-изомер (α-OH)], м), 2,35 (1H, ддд, J=15,4, 10,3, 5,1 Гц), 2,21 (1H, ддд, J=15,8, 9,5, 6,3 Гц), 2,04 (1H, шир.с), 1,98-1,92 (1H, м), 1,92-1,75 (3H, м), 0,96 (3H, с), 0,91 (3H, д, J=6,4 Гц), 0,64 (3H, с).
[0431] Получение соединения D5. В высушенной над пламенем круглодонной колбе (100 мл) растворяли D5d (0,080 г, 0,184 ммоль) в сухом THF (3 мл) в атмосфере азота и охлаждали до 0ºC. Добавляли MeMgCl 3,0M в THF (0,614 мл, 1,841 ммоль) с использованием шприца. Реакционную смесь перемешивали в течение 1,5 часа при 0ºC. Реакционную смесь гасили насыщенным водным NH4Cl (20 мл) и экстрагировали три раза CH2Cl2 (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили Na2SO4 и очищали неочищенный продукт хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→85:15) с получением D5 (36 мг, 0,08 ммоль, выход=45%).1H ЯМР (400 МГц, CDCl3) δ (м.д.): 3,39 (3H, с), 3,22 (1H, д, J=9,0 Гц), 3,20 (1H, д, 9,0 Гц), 1,20 6H, с), 0,97 (3H, с), 0,91 (3H, д, J=6,5 Гц), 0,65 (3H, с).
Пример 32. Получение соединений C3-альфа-D13 и C3-бета-D13

[0432] К раствору D13a (0,080 г, 0,206 ммоль) в THF (сухом, 1 мл) капельно добавляли метиллитий 1,6M в простом диэтиловом эфире (0,26 мл, 0,412 ммоль) под аргоном при 0ºC. После добавления образовывался белый осадок. Добавляли THF (сухой, 5 мл). Продолжали перемешивать при 0ºC в течение 10 минут. Реакционную смесь оставляли нагреваться до комнатной температуры и продолжали перемешивать в течение 1 часа. TLC (H/E, 1:1) демонстрировали исходное вещество и два более полярных пятна. Добавляли метиллитий 1,6M в простом диэтиловом эфире (0,39 мл, 0,618 ммоль) при комнатной температуре под аргоном. Продолжали перемешивать в течение ночи. Реакционная смесь переходила в желтый раствор. Удаляли растворитель в вакууме. Добавляли THF (сухой, 1 мл) под аргоном при комнатной температуре. Капельно добавляли метиллитий 1,6M в простом диэтиловом эфире (0,26 мл, 0,412 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 3 часов. Добавляли водный насыщенный хлорид аммония (10 мл), H2O (5 мл) и простой диэтиловый эфир (20 мл). Разделяли слои и экстрагировали водный слой простым диэтиловым эфиром (2×25 мл). Объединенные органические слои сушили сульфатом натрия и удаляли растворители в вакууме. Флэш-хроматографией (H, 5%-25% EtOAc) получали 13 мг 3-бета-гидроксидиастереоизомера и 12 мг 3-альфа-гидроксидиастереоизомера. Соединение D13 (3α-OH) (12 мг, 0,030 ммоль, 14,4%) и соединение D13 (3β-OH) (13 мг, 0,032 ммоль, 15,6%). (3α-OH):1H-ЯМР (400 МГц, CDCl3): δ (м.д.): 2,03-1,92 (м, 2H), 1,90-1,79 (м, 2H), 1,78-1,70 (м, 1H), 1,63-0,99 (м, 25H), 1,25 (с, 3H), 1,20 (с, 3H), 1,19 (с, 3H), 0,93 (с, 3H), 0,91 (д, J=6,5 Гц, 3H), 0,64 (с, 3H). (3β-OH):1H-ЯМР (400 МГц, CDCl3): δ (м.д.): 2,00-1,78 (м, 4H), 1,67-0,99 (м, 25H), 1,22 (с, 3H), 1,20 (с, br, 6H), 0,96 (с, 3H), 0,94-0,86 (м, 4H), 0,65 (с, 3H).
Пример 33. Получение соединений C3-альфа и C3-бета D14

[0433] В высушенной над пламенем реакционной пробирке (20 мл) растворяли D4b (0,1 г, 0,257 ммоль) в сухом THF (3 мл) в атмосфере аргона и охлаждали до -10ºC. Капельно добавляли MeMgCl 3,0M в THF (0,86 мл, 2,57 ммоль) с использованием шприца MeMgCl 3,0M в THF (0,68 мл, 2,04 ммоль). Реакционную смесь доводили до комнатной температуры в течение 1,5 часов и перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь вливали в перемешиваемый раствор насыщенного водного NH4Cl (100 мл) и экстрагировали три раза CH2Cl2 (3×75 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили Na2SO4 и очищали неочищенный продукт хроматографией на испарительной колонке (диоксид кремния, гептан/этилацетат, 1:0→4:1) с получением D14 (α-OH) (28 мг, 0,07 ммоль, выход=27%) и D14 (β-OH) (21 мг, 0,05 ммоль, выход=20%) оба в виде белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (м.д.): 1,95 (1H, дт, J=12,3, 3,1 Гц), 1,89-1,77 (1H, м), 1,65 (1H, дкв., J=12,7, 3,3 Гц), 1,20 (9H, с), 0,92 (3H, д, J=6,5 Гц), 0,75 (3H, с), 0,78-0,69 (1H, м), 0,65 (3H, с). D14 (β-OH):1H ЯМР (400 МГц, CDCl3) δ (м.д.): 1,96 (1H, дт, J=12,5, 3,3 Гц), 1,89-1,77 (1H, м), 1,25 (3H, с), 1,20 (3H, с), 1,19 (3H, с), 0,92 (3H, д, J=6,5 Гц), 0,81(3H, с), 0,65 (3H, с), 0,70-0,61 (1H, м).
Пример 34. Синтез 6-дифторидных аналогов


а) H2SO4, MeOH, кипячение с обратным холодильником в течение ночи, 97%; b) реагент Джонса, ацетон, 0ºC 30 минут, 60%; c) HCl, MeOH, комнатная температура в течение ночи, 44%; d) Ac2O, пиридин, 70ºC, в течение ночи, 92%; e) 40ºC, 4 суток, 42%; f) HCl, MeOH, THF, комнатная температура в течение ночи; g) периодинан Десса-Мартина, CH2Cl2, комнатная температура в течение ночи; h) MeMgBr, THF, 0ºC.
Пример 35. Синтез 5,6-алкенил-6-монофторидных аналогов

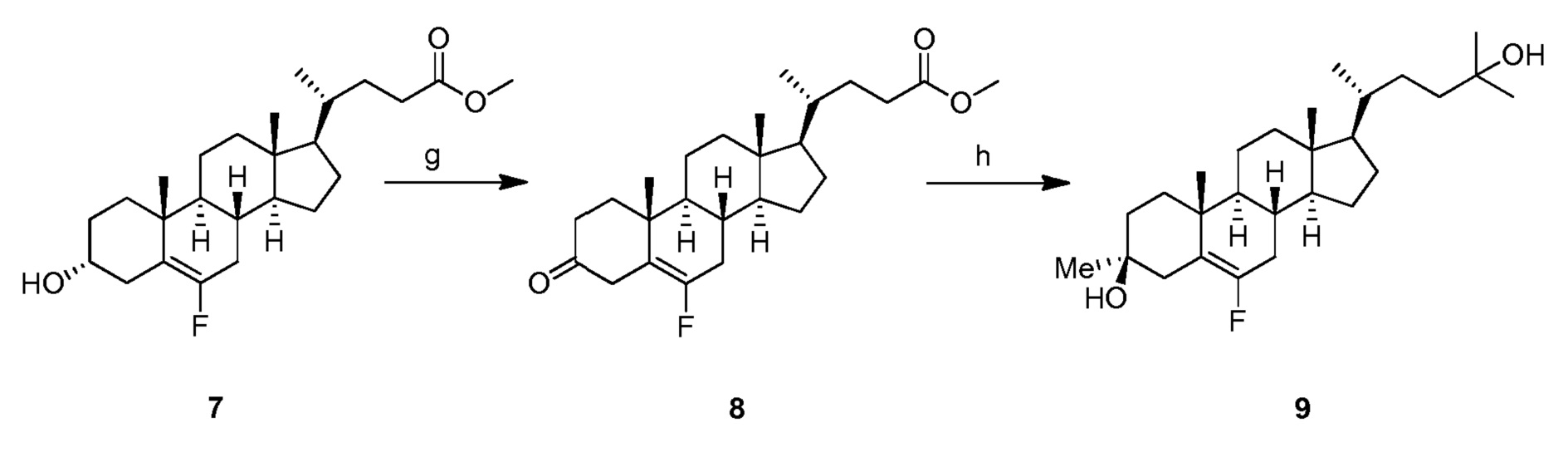
а) H2SO4, MeOH, кипячение с обратным холодильником в течение ночи, 97%; b) реагент Джонса, ацетон, 0ºC 30 минут, 60%; c) HCl, MeOH, комнатная температура в течение ночи, 44%; d) Ac2O, пиридин, 70ºC, в течение ночи, 92%; e) DAST (без примеси), катализатор дымящая H2SO4; f) HCl, MeOH, THF, комнатная температура в течение ночи; g) периодинан Десса-Мартина, CH2Cl2, комнатная температура в течение ночи; h) MeMgBr, THF, 0ºC.
Пример 36. Синтез 6-бета-метильных аналогов
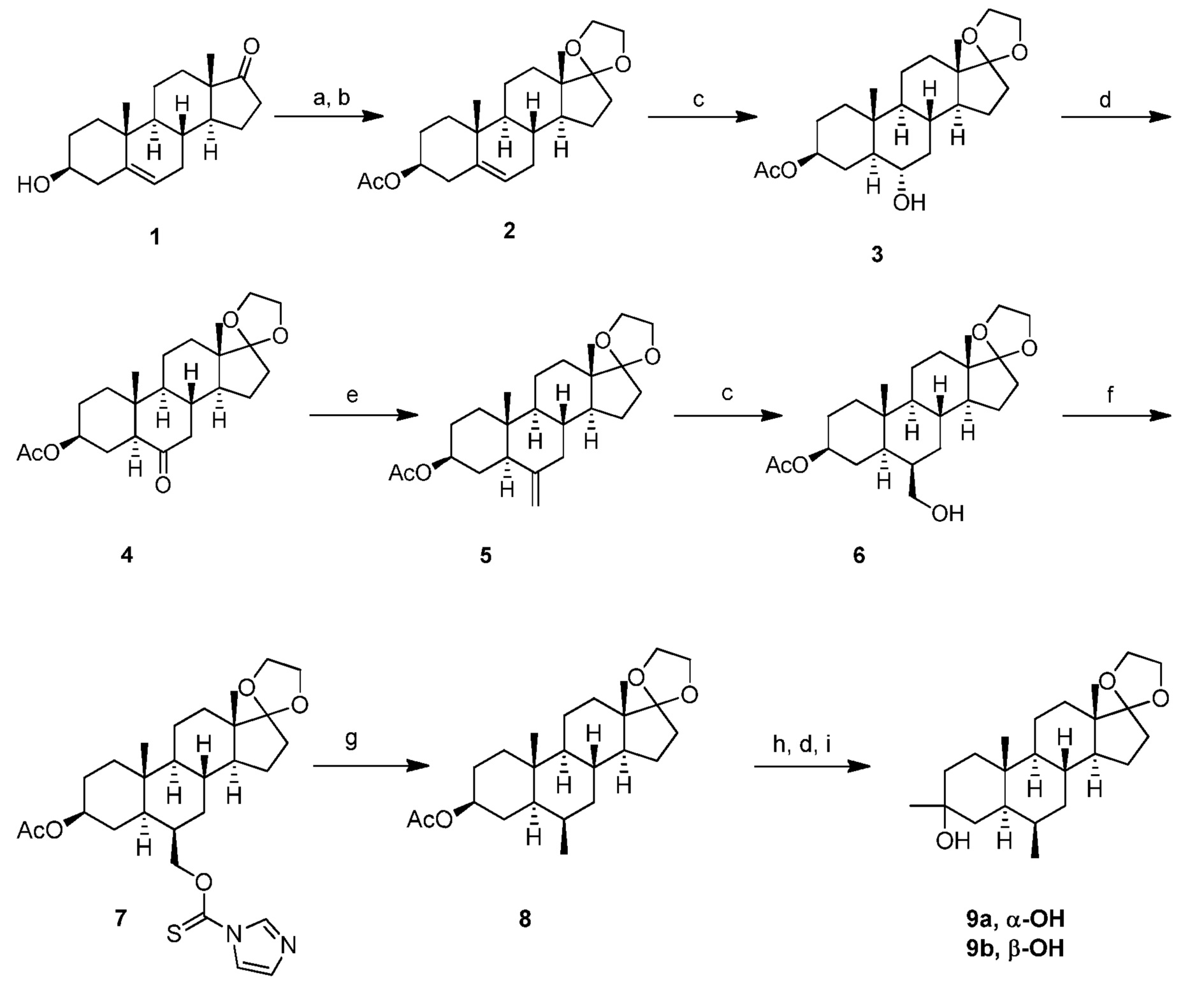
а) Этан-1,2-диол, катализатор TsOH, толуол, кипячение с обратным холодильником в течение ночи; b) Ac2O, пиридин, комнатная температура в течение ночи; c) BH3, THF, NaOH/H2O2, 0ºC затем комнатная температура; d) периодинан Десса-Мартина, CH2Cl2, комнатная температура в течение ночи; e) метилтрифенилфосфонийбромид, трет-бутоксид калия, THF, комнатная температура; f) TCDI, DMAP, CH2Cl2, 40ºC; g) Ph3SnH, AIBN, толуол, 110ºC; h) карбонат калия, MeOH, комнатная температура в течение ночи; i) MeMgBr, THF, 0ºC.

а) 3М HCl, ацетон; b) (этил)трифенилфосфонийбромид, t-BuOK, THF, 65ºC; e) метилакрилат, EtAlCl2, DCM, комнатная температура; f) 10% Pd/C, H2, EtOAc; g) MeMgBr, THF, 0ºC.
Способы анализа
[0434] Соединения по настоящему изобретению можно оценивать различными описанными в литературе анализами in vitro и in vivo, примеры которых описаны ниже.
[0435] Следующие ниже примеры приведены для иллюстрации биологической активности соединений, фармацевтических композиций и способов, предоставленных в настоящем описании, и их не следует интерпретировать как ограничивающие каким-либо образом его объем.
Анализ модулирующей активности в отношении NMDA
[0436] Соединения по изобретению тестируют или их можно тестировать в отношении их модулирующей активности по отношению к NMDA анализом, описанным Paul et al. в J. Pharm. and Exp. Ther., 1994, 271, 677-682. Протокол анализа воспроизведен ниже.
(1) Культура клеток
[0437] Нейроны гиппокампа от эмбрионов крыс Sprague-Dawley в возрасте 19 суток поддерживали в первичной культуре, как описано ранее (Segal, J. Neurophysiol., 50 1249-1264, 1983). В кратком изложении, ткань гиппокампа иссекают и механически разрушают, и высевают клеточную суспензию на покрытые поли-L-лизином (Sigma, St. Louis, MO) 35-мм чашки для культивирования со стеклянным дном, которые содержали модифицированную среду Игла с солями Игла с добавлением 10% эмбриональной телячьей сыворотки, 10% лошадиной сыворотки и 2 мМ глутамина (Sigma). Сывороточная добавка N3 (модифицированная у Guthrie et al., Brain Res. 420 313-323, 1987) состояла из: бычьего сывороточного альбумина 0,001%; трансферрина 20 мг/литр; инсулина 10 мг/литр; селена 60 нМ; кортикостерона 40 мкг/литр; трийодтиронина 20 мкг/литр; прогестерона 40 нМ и путресцина 200 мМ, которые добавляют к среде. Клетки инкубируют во влажной атмосфере, которая содержит 10% CO2 и 90% воздуха. Среды для культивирования, которые не содержат эмбриональную телячью сыворотку, добавляют через 7 суток после высевания. Клетки используют через 7-14 суток в культуре.
(2) Измерение внутриклеточного Ca++
[0438] Культуры отмывают три раза буфером, который содержит (в миллимолярных количествах), как указано ниже: 145 NaCl; 2,5 KCl; 10 HEPES; 1 CaCl2 и 10 глюкоза (доведенным pH 7,4 NaOH и до осмоляльности 315-325 мОсмоль сахарозой). Затем культуры инкубируют с от 2 до 5 мкМ ацетоксиметильного эфира фура-2 в течение 30-45 минут в темноте при 37ºC. После инкубации культуры снова промывают три раза буфером и оставляют в течение ≥15 мм для обеспечения полного гидролиза сложного эфира. Представляющий интерес нейрон орошали буфером при скорости приблизительно 250 мкл/минуту (37ºC). Устройство для орошения состояло из батареи из 10 трубок с водяной рубашкой, которые погружены в общий наконечник, располагаемый приблизительно в 500 мкм от клетки. Все растворы содержали 0,5 мкМ тетродотоксина для устранения потенциал-чувствительных токов Na+ и от 2 до 5 мкМ глицина для насыщения нечувствительного к стрихнину участка глицина NMDA-рецепторах.
[0439] [Ca++] измеряют посредством микроспектрофлуориметрии с чувствительным к Ca++ индикатором фура-2 (Groden et al., Cell Calcium 12: 279-287, 1991). Нейроны облучали на инвертированном микроскопе Nikon с системой освещения-фотометрии с двойной длиной волны (SPEX-DM3000 AR-CM, SPEX Industries, Edison, NJ).
[0440] Возбуждение фура-2 происходило при 340 и 380 нм с излучаемым светом, наблюдаемым при 510 нм. Нейроны визуализируют фазово-контрастной микроскопией и легко идентифицируют по их характерной морфологии. Свет, поступающий на фотоумножитель, является ограниченным, светом, испускаемым представляющей интерес клеткой, посредством микроотверстия. Подсчет количества фотонов хранят в цифровом формате для последующего анализа. Калибровку проводят, как описано Grynkiewicz et at. (J. Biol. Chem., 280, 34440-3450, 1985). Показатель флуоресценции при насыщении Ca++ (Rmax) определяют in situ промыванием клеток в буфере, который содержит (в миллимолярных количествах) следующие ингредиенты: 130 KC1; 17 NaCl; 10 HEPES; 10 глюкоза; 2 CaCl2 и 0,015 иономицин (pH 7,2, 37ºC). Некоторые буферы для калибровки содержали 10 мкМ карбонилцианид-м-хлорфенилгидразона для блокирования митохондриального окислительного фосфорилирования. Для определения показателя флуоресценции при нуле Ca++ (Rmin) буфер модифицировали таким образом, что 3 мМ EGTA и 80 мкМ ацетоксиметильного эфира EGTA заменяли на CaCl2. Для расчетов [Ca++]i используют кажущуюся Kd 285 нМ (Groden et at., 1991).
Электрофизиологический анализ
[0441] Соединения по изобретению тестируют или их можно тестировать в электрофизиологическом анализе, как описано Petrovic et al. в J. Neuroscience, 160 (2009), 616-628. Протокол анализа воспроизведен ниже.
(1) Культуры гиппокампа
[0442] Первичные диссоциированные культуры гиппокампа получают у крыс на 1-2 постнатальные сутки. Животных декапитируют и иссекают гиппокамп. Для получения клеточной суспензии используют расщепление трипсином с последующей механической диссоциацией. Отдельные клетки высевают при плотности 500000 клеток/см2 на 31- или 12-мм покрытые полилизином стеклянные покровные стекла. Нейрональные культуры поддерживают в среде NeurobasalTM-A (Invitrogen, Carlsbad, CA, USA) с добавлением глутамина (0,5 мМ) и не содержащей сыворотки добавки B27 (Invitrogen).
(2) Трансфекция и поддержание клеток HEK293
[0443] Клетки HEK293 (American Type Culture Collection, ATTC № CRL1573, Rockville, MD, USA) культивируют в Opti-MEM® I (Invitrogen) с 5% эмбриональной телячьей сывороткой при 37ºC и трансфицируют плазмидами с NR1-1a/NR2B/зеленым флуоресцентным белком (GFP), как описано ранее (Cais et al., Neuroscience, 151: 428-438, 2008). В кратком изложении, равные количества (0,3 мкг) кДНК, кодирующей NR1, NR2 и GFP (pQBI 25, Takara, Otsu, Shiga, Japan) смешивают с 0,9 мкл реагента Matra-A (IBA, Göttingen, Germany) и добавляют к конфлюэнтным клеткам HEK293 в 24-луночном планшете. После трипсинизации клетки ресуспендируют в Opti-MEM® I, содержащей 1% эмбриональную телячью сыворотку, с добавлением 20 мМ MgCl2, 1мМ D,L-2-амино-5-фосфонопентановой кислоты и 3 мМ кинуреновой кислоты и высевают на 30-мм покрытые полилизином стеклянные покровные стекла. Используют следующие гены, кодирующие субъединицы NMDAR: NR1-1a (номер доступа GeneBank U08261) (Hollmann et al., Science, 10:943-954 1993) и NR2B (номер доступа GeneBank M91562) (Monyer et al., Science, 256: 1217-1221, 1992).
(3) Регистрацию показаний от культивируемых клеток и применения лекарственных средств
[0444] Эксперименты проводят через 24-48 часов после окончания трансфекции HEK293; используют нейроны, поддерживаемые в культуре в течение 5-8 суток. Регистрацию точечной фиксации потенциалов целой клетки проводили с использованием усилителя для точечной фиксации потенциалов после 80%-90% компенсации емкости и последовательного сопротивления (<10 MΩ). Индуцируемые агонистом ответы фильтруют при низких частотах при 1 кГц с использованием восьмиполюсного фильтра Бесселя (Frequency Devices, Haverhill, MA, USA), преобразовывают в цифровом формате при 5 кГц и анализируют с использованием программного обеспечения pCLAMP версия 9 (Axon Instruments). Пэтч-пипетки (3-4 MΩ), выдутые из боросиликатого стекла, наполняют внутриклеточным раствором (Cs-ICS) на основе Cs+, содержащим (в мМ) 125 глюконовой кислоты, 15 CsCl, 5 EGTA, 10 Hepes, 3 MgCl2, 0,5 CaCl2 и 2 соль АТФ-Mg (pH, доведенный до 7,2 CsOH). Внеклеточный раствор (ECS) содержал (в мМ) 160 NaCl, 2,5 KCl, 10 Hepes, 10 глюкозы, 0,2 ЭДТА и 0,7 CaCl2 (pH, доведенный до 7,3 NaOH). В некоторых экспериментах концентрацию CaCl2 снижают до 0,2 мМ (без ЭДТА) или повышают до 2 мМ, как указано. Глицин (10 мкМ), коагонист NMDAR, содержится в контрольных и тестируемых растворах. В экспериментах на культивируемых нейронах гиппокампа используют тетродотоксин (0,5 мкМ) и бикукуллинметохлорид (10 мкМ). Растворы соединений по изобретению получают из свежеприготовленного исходного раствора 20 мМ в диметилсульфоксиде (DMSO). Аналогичную концентрацию DMSO поддерживают во всех ECS. Для применяемых тестируемых и контрольных растворов используют управляемую микропроцессором многокамерную систему для быстрого орошения с постоянной во времени заменой раствора вокруг клеток ~10 мс, (Vyklicky et al., J. Physiol. Lond., 470:575-600 1990).
[0445] Соединения по изобретению получают способами синтеза, описываемыми в настоящем описании, и их чистоту тестируют общепринятыми способами, известными специалисту в данной области.
Связывание с NMDA in vitro
[0446] Можно проводить скрининг соединений для определения их эффективности в качестве модуляторов связывания с NMDA in vitro. Эти анализы проводят или их можно проводить в соответствии с указанными выше способами.
Фармакология in vivo
[0447] Самцов мышей NSA массой 15-20 г получают от Harlan Sprague-Dawley (San Diego, CA). После поступления их содержат в стандартных поликарбонатных клетках (4 в клетке), содержащих стерильную подстилку в комнате с постоянной температурой (23,0±2,5ºC) с 12 часовым (07,00-19,00 день) циклом день/ночь. Пища (Teklad LM 485) и вода находятся в свободном доступе. До начала экспериментов мышей акклиматизируют по меньшей мере 4 суток.
Тест виса на проволоке
[0448] В тесте виса на проволоке использовали изготовленное по заказу устройство, которое состояло из металлической проволоки (2 мм диаметром), подвешенной горизонтально над мягкой поверхностью (25 см). Мышей держат за основание хвоста, приводят их передние лапы в соприкосновение с проволокой, а затем отпускают. Животным необходимо привести обе задние лапы в соприкосновение с проволокой за 5 секунд для того, чтобы получить оценку как успешная попытка. Результаты подвергают количественной обработке.
Метаболизм и фармакокинетика лекарственного средства: анализ HERG
[0449] Для электрофизиологического исследования используют клетки HEK 293, которые стабильно экспрессируют калиевый канал HERG. Способ стабильной трансфекции такого канала в клетках HEK можно найти в другом документе (Zhou et al., Biophys. J., 74:230-41, 1998). За сутки до эксперимента клетки собирают из флаконов для культивирования и высевают на стеклянные покровные стекла в стандартной минимальной поддерживающей среде (MEM) с 10% эмбриональной телячьей сывороткой (ЭТС). Посеянные клетки хранят в инкубаторе при 37ºC, поддерживаемой в атмосфере 95% O2/5% CO2. Клетки исследуют через 15-28 часов после сбора.
[0450] Токи HERG исследуют стандартным способом точечной фиксации потенциалов в режиме целой клетки. Во время эксперимента клетки обливают стандартным внешним раствором следующей композиции (мМ): 130 NaCl; 4 KCl; 2 CaCl2; 1 MgCl2; 10 глюкоза; 5 HEPES; pH 7,4 с NaOH. Регистрацию показаний целой клетки проводят с использованием усилителя для точечной фиксации потенциалов и пэтч-пипеток, которые имеют сопротивление 1-3 МОм, когда наполнены стандартным внутренним раствором следующей композиции (мМ): 130 KCl; 5 MgATP; 1,0 MgCl2; 10 HEPES; 5 EGTA, pH 7,2 с KOH. Только такие клетки с входными сопротивлениями менее 15 МОм и последовательными сопротивлениями >1ГОм принимали для дальнейшего проведения экспериментов. Применяли компенсацию последовательного сопротивления максимально до 80%. Не проводили никаких вычитаний утечки. Однако доступное входное сопротивление зависело от величины регистрируемых токов и уровня компенсации последовательного сопротивления, которые можно безопасно использовать.
[0451] После получения конфигурации целой клетки и достаточного времени для диализа клетки раствором из пипетки (>5 минут), к клетке применяли стандартный протокол напряжения для индукции мембранных токов. Протокол напряжения является таким, как указано ниже. Мембрану деполяризуют от исходного потенциала -80 мВ до +40 мВ за 1000 мс. Это сопровождается понижающимся линейным изменением напряжения (со скоростью 0,5 мВ мс-1) обратно до исходного потенциала. Протокол напряжения применяют к клетке непрерывно на всем протяжении эксперимента каждые 4 секунды (0,25 Гц). Измеряют амплитуду пикового тока, выявляемого приблизительно при -40 мВ во время линейного изменения. После получения стабильных откликов индуцируемого тока во внешнем растворе, применяют носитель (0,5% DMSO в стандартном внешнем растворе) в течение 10-20 минут посредством перистальтического насоса. В настоящем описании приведены минимальные изменения амплитуды отклика индуцируемых токов в условии контроля носителем, тестируемое соединение 0,3, 1, 3 или 10 мМ применяли в течение 10 минут. Период 10 минут включал время, за которое подаваемый раствор проходил через трубку от резервуара с раствором до регистрационной ячейки через насос. Время воздействия на клетки раствора с соединением составляло более 5 минут, после того как концентрация лекарственного средства в ячейке достигает испытываемой концентрации. Для оценки восстановления проводили последующие период промывания 10-20 минут. В заключении клетки подвергали воздействию высокой дозы дофетилида (5 мМ), специфического блокатора IKr, для оценки нечувствительного эндогенного тока.
[0452] Все эксперименты проводят при комнатной температуре (23±1ºC). Индуцируемые мембранные токи регистрировали в реальном времени на компьютере, фильтровали при 500-1 КГц (Бессель -3 дБ) и измеряли при 1-2 КГц с использованием усилителя для точечной фиксации потенциалов и конкретного программного обеспечения для анализа данных. Амплитуду пикового тока, которая возникала приблизительно при -40 мВ, измеряют автономно на компьютере.
[0453] Вычисляли среднее арифметическое десяти значений амплитуды для условий контроля носителем и в присутствии лекарственного средства. Процент снижения IN в каждом эксперименте получали нормализацией значения тока с использованием следующей формулы: IN=(1-ID/IC)×100, где ID представляет собой среднее значение тока в присутствии лекарственного средства, и IC представляет собой среднее значение тока в контрольных условиях. Для каждой концентрации лекарственного средства или соответствующего по времени контроля проводят отдельные эксперименты и определяют среднее арифметическое в каждом эксперименте как результат исследования.
Метаболизм и фармакокинетика лекарственного средства: время полужизни в микросомах печени человека (HLM)
[0454] Тестируемые соединения (1 мкМ) инкубируют с 3,3 мМ MgCl2 и 0,78 мг/мл HLM (HL101) в 100 мМ фосфатном калиевом буфере (pH 7,4) при 37ºC в 96-луночном планшете с глубокими лунками. Реакционную смесь разделяют на две группы: группу не-P450 и группу P450. NADPH добавляют только в реакционную смесь группы P450. Аликвоту образцов из группы P450 отбирают в моменты времени 0, 10, 30 и 60 минут, где момент времени 0 минут соответствовал времени, когда NADPH добавляли в реакционную смесь группы P450. Аликвоты образцов группы не-P450 отбирают в момент времени -10 и 65 минут. Отобранные аликвоты экстрагируют раствором ацетонитрила, содержащим внутренний стандарт. Осажденный белок откручивают на центрифуге (2000 об./мин, 15 минут). Концентрацию соединений в супернатанте измеряют системой LC/MS/MS. Величину времени полужизни получают построением графика зависимости натурального логарифма отношения площадей пиков соединений/внутреннего стандарта от времени. Наклон линии, наилучшим образом соответствующей точкам, дает скорость метаболизма (k), и его преобразуют в величину времени полужизни с использованием следующего уравнения: время полужизни=ln2/k.
Пример 37. Данные потенциации NMDA
[0455] Для исследования эффектов соединений (0,1 мМ и 1,0 мМ) на NMDA-рецептор (субъединицы GRIN1/GRIN2A), экспрессируемый в клетках HEK, использовали способ точечной фиксации потенциалов целой клетки. Пик NMDA/глицин и стационарные токи регистрировали в стабильно трансфицированных клетках, экспрессирующих NMDA-рецептор, и исследовали модулирующие эффекты тестируемых соединений по отношению к этим токам.
[0456] Клетки стабильно трансфицировали (Lipofectamine™) GRIN1 человека (вариант NR1-3). Эти клетки временно трансфицировали кДНК GRIN2A и кДНК антигена CD8 (pLeu). Приблизительно через 24-72 часов после трансфекции к идентифицированным как успешно трансфицированные клетки добавляли 1 мкл Dynabead M-45 к CD8 (Jurman et al., Biotechniques, (1994) 17:876-881). Клетки пересевали до конфлуэнтности 50-80%. Измеряли токи целой клетки с использованием усилителя HEKA EPC-10 с использованием программного обеспечения PatchMaster. Чашки с культивируемыми клетками для регистраций помещали на держатель для чашек микроскопа и постоянно орошали (1 мл/мин) омывающим раствором. Все растворы, применяемые к клеткам, включая раствор в пипетках, поддерживали при комнатной температуре (19ºC-30ºC). После образования гигаомного контакта между контактными электродами и трансфицированными индивидуальными клетками HEK 293 (диапазон сопротивления пипетки: 2,5 МВт-6,0 МВт, диапазон сопротивления в области контакта:>1 ГВт) разрушали клеточную мембрану через носик пипетки для обеспечения доступа электричества внутрь клетки (конфигурации фиксации потенциалов "целая клетка"). После установления стабильного контакта измеряли входящие токи NMDA после применения 30 мкМ NMDA (и 5,0 мкМ глицина) на клетках, к которым применяют фиксацию потенциалов, (2 применения) в течение 5 секунд. К клеткам применяли фиксацию потенциала при исходном потенциале -80 мВ.






ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[0457] В формуле изобретения формы единственного числа могут означать один или более одного, если не указано иное или иным образом очевидно из контекста. Формулу изобретения или описания, которые содержат "или" между одним или несколькими членами группы, рассматривают как удовлетворительные, если один, более одного или все из членов группы содержатся в, применяются в или иным образом относятся к данному продукту или способу, если не указано иное или иным образом очевидно из контекста. Изобретение включает варианты осуществления, в которых строго один член группы содержится в, применяется в или иным образом относится к данному продукту или способу. Изобретение включает варианты осуществления, в которых более одного или все члены группы содержатся в, применяются в или иным образом относятся к данному продукту или способу.
[0458] Кроме того, настоящее изобретение относится ко всем вариантам, комбинациям и перестановкам, в которых одно или несколько ограничений, элементов, пунктов и описательных терминов из одного или нескольких перечисленных пунктов формулы изобретения вводят в другой пункт формулы изобретения. Например, любой пункт формулы изобретения, который не зависит от другого пункта можно модифицировать для включения одного или нескольких ограничений, обнаруженных в любом другом пункте, который является независимым от аналогичного основного пункта. В случае если элементы предоставлены в виде перечислений, например, в формате группы Маркуша, также раскрывают каждую подгруппу элементов, и любой элемент(ы) можно удалять из группы. Следует понимать, что в основном, когда изобретение или аспекты изобретения обозначают как содержащие конкретные элементы и/или признаки, определенные варианты осуществления изобретения или аспекты изобретения состоят или по существу состоят из таких элементов и/или признаков. Для простоты такие варианты осуществления конкретно не указывали in haec verba в настоящем описании. Также следует отметить, что подразумевают, что термины "содержащий" и "состоящий" являются неограничивающими и обеспечивают возможность включения дополнительных элементов или этапов. В случае если приведены диапазоны, то конечные точки являются включенными. Кроме того, если не указано иное или иным образом очевидно из контекста, и понятно специалисту в данной области, значения, которые выражают в виде диапазонов, могут предполагать любое конкретное значение или поддиапазон в указанных диапазонах в различных вариантах осуществления изобретения до десятых долей единицы нижней границы диапазона, если из контекста явно не следует иное.
[0459] В настоящей заявке ссылаются на различные опубликованные патенты, опубликованные патентные заявки, статьи в журналах и другие публикации, которые все включены в настоящее описание посредством ссылки. Если существует противоречие между любой из включенных ссылок и настоящим описанием, описание является приоритетным. Кроме того, любой конкретный вариант осуществления настоящего изобретения, который относится к известному уровню техники, можно явно исключать из любого одного или нескольких пунктов формулы изобретения. Вследствие того, предполагают, что такие варианты осуществления известны специалисту в данной области, их можно исключать, даже если исключение явно не указано в настоящем описании. Любой конкретный вариант осуществления изобретения можно исключать из любого пункта формулы изобретения на любом основании вне связи с существующим известным уровнем техники.
[0460] Специалистам в данной области будет понятно, или они способны устанавливать с использованием не более, чем общепринятого экспериментирования многие эквиваленты конкретных вариантов осуществления, описываемых в настоящем описании. Предполагают, что объем настоящих вариантов осуществления, описываемых в настоящем описании, не ограничен указанным выше описанием, а является таким как указано в прилагаемой формуле изобретения. Специалистам в данной области понятно, что можно проводить различные изменения и модификации описания, не выходя за рамки сущности или объема настоящего изобретения, как определено в следующей ниже формуле изобретения.
Реферат
Изобретение относится к соединению формулы (I-a1) или его фармацевтически приемлемой соли. В формуле (I-a1) Z представляет собой группу формул (iv)(iv); Lпредставляет собой C-Cалкилен; Rпредставляет собой водород; Rпредставляет собой C-Cалкил; -ORнаходится в бета-положении и Rнаходится в альфа-положении; каждый из R, Rи Rпредставляет собой водород; Rпредставляет собой водород; Y представляет собой -O-; Rпредставляет собой водород; каждый из Rнезависимо представляет собой водород или C-Cалкил. Изобретение также относится к фармацевтической композиции и к способу профилактики, лечения, улучшения состояния или контроля заболевания или патологического состояния, опосредованного модулятором NMDA-рецепторов. Технический результат: получены новые соединения формулы (I-a1), представляющие собой потенциальные модуляторы NMDA-рецепторов. 3 н. и 4 з.п. ф-лы, 37 пр.(I-a1)
Формула











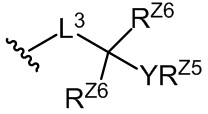

















Комментарии