17альфа-бензоат кортексолона для применения в лечении опухолей - RU2712752C2
Код документа: RU2712752C2
Чертежи








Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка согласно 35 USC 119 претендует на приоритет Европейской Патентной Заявки № 14188063.3, озаглавленной «17α-моноэфиры и 17α,21-диэфиры кортексолона для применения в лечении опухолей», поданной 8 октября 2014, содержание которой полностью включено в настоящую заявку посредством ссылки.
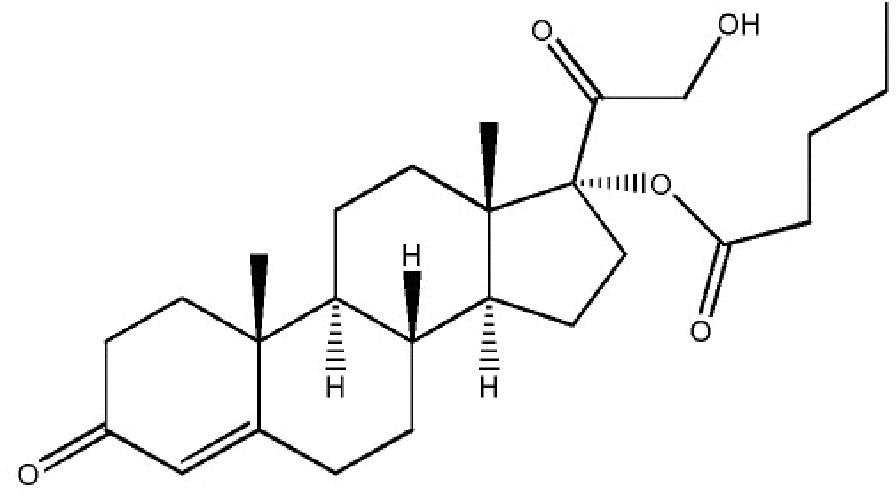
Настоящее изобретение в основном относится к определенным производным кортексолона формулы (I):
(I)
и указанным производным для применения в качестве противоопухолевых действующих ингредиентов для радикального, вспомогательного, неоадъювантного или паллиативного лечения предраковых состояний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы.
Другой аспект настоящего изобретения относится к фармацевтическим композициям, включающим по крайней мере одно производное кортексолона формулы (I) в качестве действующего ингредиента, наряду с как минимум одним физиологически приемлемым эксципиентом, а также к указанным фармацевтическим композициям для применения в качестве противоопухолевых медицинских продуктов для радикального, вспомогательного, неоадъювантного или паллиативного лечения предраковых состояний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Опухоль или новообразование (неоплазия) определяется, как масса новой ткани, которая продолжает существовать и расти независимо от окружающих ее структур, и которая не имеет физиологической пользы для организма (Dorelandʹs Medical Dictionary, 23 ED.1960).
Существует несколько классификаций опухолей: для реализации настоящей патентной заявки, наиболее важными являются эпителиальные опухоли.
Эпителиальные опухоли представляют собой новообразования, возникающие из эпителиальных клеток, т.е. типа клеток, которые выстилают полые внутренние органы и поверхности тела; эта группа заболеваний включает многие из наиболее обычных разновидностей рака, и большинство подобных опухолей развивается в груди, простате, легких, поджелудочной железе и желудочно-кишечном тракте.
В некоторых случаях эпителиальные опухоли могут также характеризоваться наличием в опухолевых клетках определенных рецепторов гормонов, которые придают опухолям восприимчивость к гормонам.
Карциномы, которые являются злокачественными опухолями, возникающими из эпителиальных клеток, составляют примерно 85 из каждых 100 случаев рака (85%).
Одним из примеров эпителиальной карциномы является карцинома поджелудочной железы (которую именуют также раком поджелудочной железы).
Рак поджелудочной железы является одной из наиболее летальных форм карцином. Экзокринные и эндокринные клетки поджелудочной железы образуют полностью различные типы опухолей. Экзокринные опухоли поджелудочной железы являются наиболее распространенным типом рака поджелудочной железы (более 95%). Хотя в поджелудочной железе могут развиваться доброкачественные (не раковые) кисты и доброкачественные опухоли (аденомы), большинство экзокринных опухолей поджелудочной железы являются злокачественными.
Карцинома поджелудочной железы, в частности экзокринная карцинома поджелудочной железы, и, более конкретно, наиболее распространенная карцинома, а именно, дуктальная аденокарцинома (аденокарцинома протоков), входит в число пяти наиболее распространенных причин смерти у мужчин и является четвертой по частоте причиной смерти у женщин. Она является одной из опухолей с наиболее неблагоприятным прогнозом, с выживаемостью лишь 5% у мужчин и 6% у женщин в течение 5 лет после постановки диагноза. Наиболее высокая заболеваемость наблюдается в возрастном промежутке 60-70 лет (AIOM. Linea Guida Carcinoma del Pancreas Esocrino, ed. 2013).
Этиология экзокринной карциномы поджелудочной железы неизвестна. Установлена генетическая предрасположенность (семейная наследственность) и определенные факторы риска, такие как курение, жирная пища, сахарный диабет 2 типа, хронический панкреатит, воздействие факторов окружающей среды, например, растворителей или пестицидов.
Экзокринная карцинома поджелудочной железы на раннем этапе является бессимптомной, что объясняет задержку постановки диагноза, который ставится обычно, когда болезнь достигает поздних стадий, за исключением случайного обнаружения при диагностике других заболеваний брюшной полости.
Пациенты, у которых обнаружен рак поджелудочной железы, как правило, имеют плохой прогноз, с учетом описанной выше задержки диагностики, лишь в 15% случаев опухоль ограничена поджелудочной железой, тогда как в остальных случаях примерно у 25% пациентов обнаруживается распространение опухоли на локально-региональные лимфатические узлы, и примерно в 60% случаев обнаруживается наличие метастазов.
Медианное время выживаемости с момента диагностики рака составляет примерно от трех до шести месяцев, причем пятилетняя выживаемость значительно менее 5%.
Лечение карциномы поджелудочной железы включает хирургическое вмешательство, когда оно возможно, также с паллиативными целями.
Радикальная панкреатодуоденэктомия в настоящее время является единственной возможностью излечения, в особенности при минимальном распространении заболевания.
Медицинское лечение, связанное также с радиационной терапией, ограничивается случаями, когда невозможно хирургическое вмешательство, или при наличии метастазов, или в качестве дополнительного лечения после хирургического вмешательства. Хотя имеется небольшое число сообщений об отдельных пациентах, которые прореагировали на гемцитабин или фторурацил, или комбинированные схемы с применением доксорубицина, метотрексата, цисплатина, оксалиплатина, иринотекана, эрлотиниба и т.п., результаты химиотерапии в целом являются неудовлетворительными и часто не лучше, чем полное отсутствие лечения (Martindale, 31 ed., page 530).
Theve et al, в 1983 рассмотрели возможное влияние половых гормонов на поджелудочную железу, исходя из сообщений о наличии белковых рецепторов стероидов в ткани поджелудочной железы, высокой активности эстроген-связывающего белка в поджелудочной железе человека и способности тканей поджелудочной железы человека превращать основной периферический эстроген, т.е. эстрона сульфат, в конечный биологически активный эстрадиол-17 бета.
Исходя из этих предпосылок, они опробовали тамокисфен (антагонист рецептора эстрогена) у пациентов с неоперабельной аденокарциномой поджелудочной железы и получили некоторые предварительные результаты, аналогичные полученным Wong et al., в 1993.
Клиническая практика последующего времени не принесла ожидаемых результатов, но вывод состоял в том, что даже если анти-эстрогены не являются оптимальной формой терапии, следует испробовать другие виды гормонального лечения при раке поджелудочной железы.
Ввиду изложенного выше, имеется значительная потребность в новых подходах к лечению опухолей, в частности, к лечению карцином и еще более конкретно, к лечению эпителиальных опухолей, в т.ч. карциномы простаты или карциномы поджелудочной железы (предпочтительно, экзокринной карциномы поджелудочной железы).
В технике известен ряд соединений, именуемых 17α-моноэфирами, 21-моноэфирами и 17α,21-диэфирами кортексолона, а также способы их получения.
В WO 03/014141 описаны соединения, принадлежащие к семейству стероидов, структурно родственных кортексолону (который известен также, как 11-дезоксикортизон), как имеющие главным образом антиандрогенную активность. Эти соединения, например, кортексолона 17α-пропионат, действуют за счет того, что они препятствуют непосредственному воздействию андрогенных гормонов на андрогенный рецептор (AR) в тканях.
В WO 2007/031349 раскрыты C3-C10 17α-эфиры 9,11-дегидрокортексолона, т.е. производные, структурно родственные кортексолону, в качестве антигонадотропных агентов, которые могут применяться для лечения расстройств, тесно связанных с избыточной выработкой гонадотропина.
В WO 2009/019138 раскрыт ферментный способ получения 17α-моноэфиров кортексолона и 9,11-дегидрокортексолона; кроме того, в заявке раскрыто наличие нескольких кристаллических форм кортексолона 17α-пропионата, а именно, кристаллической формы I, формы II, формы III и гидрата IV, а также некоторые способы их получения.
Ципротерона ацетат (сокращение CPA) представляет собой синтетический стероид, который рассматривался в качестве стандартной терапии для лечения андроген-чувствительных опухолей, в частности рака простаты. Стандартная терапия с применением ципротерона ацетата оказалась полностью неэффективной в случае опухолей с пониженной или отсутствующей экспрессией андрогенного рецептора (Br.J.Cancer (1989),60,789-792).
В технике известно, что присутствие сложноэфирной группы в положении 17α придает 17α-эфирам кортексолона широкий спектр антиандрогенной активности, которая продемонстрирована на животных (Celasco et al., Arzneim-Forsch 2005; 5:581-7).
В настоящем изобретении было неожиданно обнаружено, что 17α(альфа)-моноэфиры, 21-моноэфиры и 17α(альфа),21-диэфиры кортексолона обладают неизвестным ранее противоопухолевым действием, в отношении как изолированных линий раковых клеток, так и ксенотрансплантатов рака простаты и поджелудочной железы в организмах животных.
Противоопухолевый эффект по настоящему изобретению проявлялся как для клеток карциномы, несущих андрогенный рецептор (AR+), например, для клеток рака простаты LNCaP или рака поджелудочной железы Panc1 и, очень неожиданно, для клеток с отсутствующей или пониженной экспрессией андрогенного рецептора (AR-), например, клеток рака простаты PC3 или клеток рака поджелудочной железы MiaPaca. Противоопухолевый эффект по настоящему изобретению также был показан для карцином молочной железы и карцином желудочно-кишечного тракта.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
Далее по тексту настоящее изобретение будет описано с помощью следующих неограничивающих чертежей и примеров.
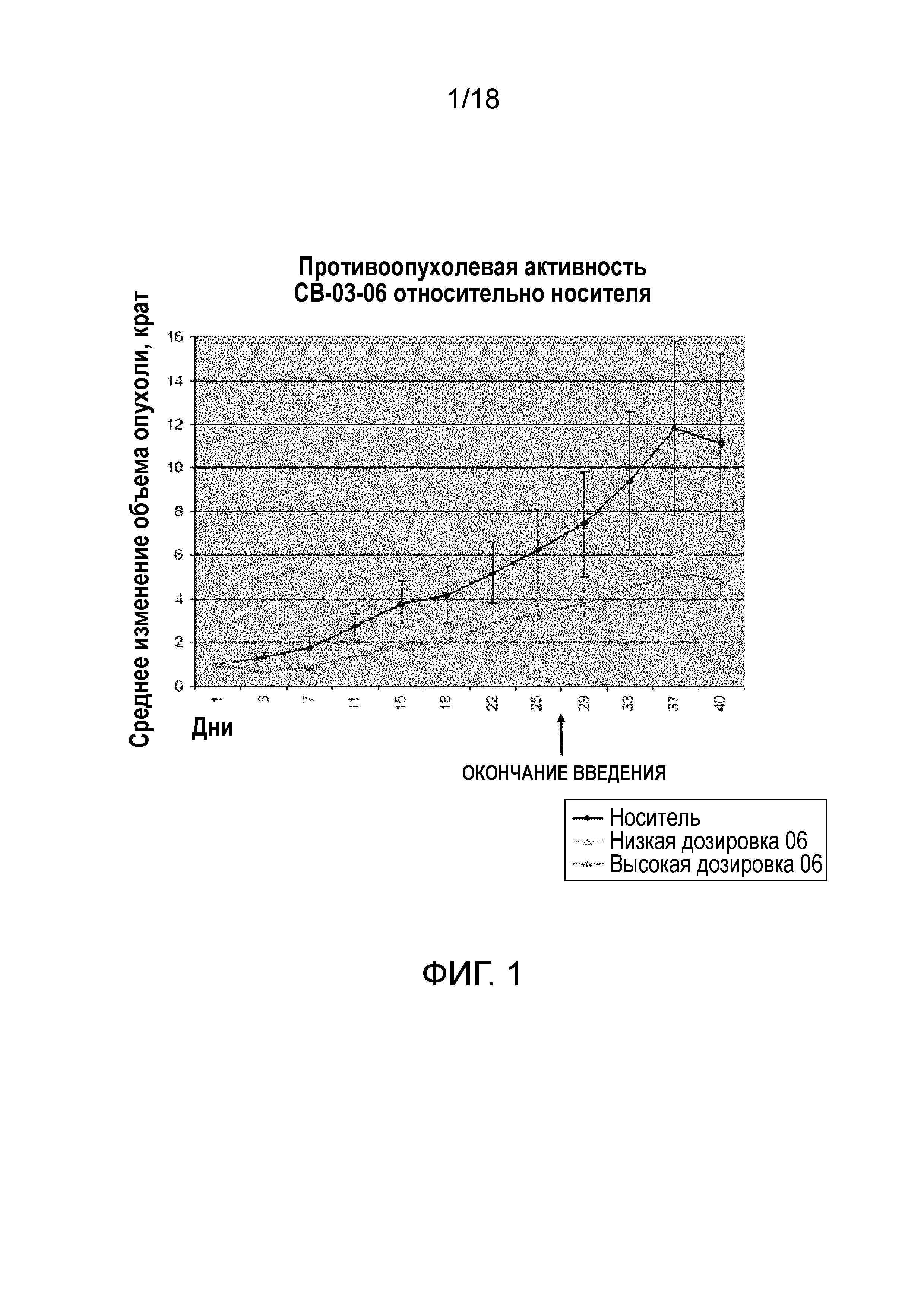
Фиг.1: Среднее изменение объема опухоли поджелудочной железы, измеренное относительно начала введения кортексолона 17α-бензоата (именуемого на чертежах «06» и «CB-03-06») в низкой дозировке (230 мкМ) и высокой дозировке (1150 мкМ), в животной модели ксенотрансплантата (линия клеток рака поджелудочной железы MiaPaca) голой (бестимусной) мыши. Обозначение «носитель» относится к контрольной группе, получавшей 0,4% (объем/объем) Tween80 и 0,5% (масса/объем) карбоксиметилцеллюлозы в нормальном солевом растворе. Соединение и носитель вводили мышам подкожно (CS) ежедневно в течение 28 дней подряд. Стрелки «конец введения» относятся к дню, когда введение заканчивалось.
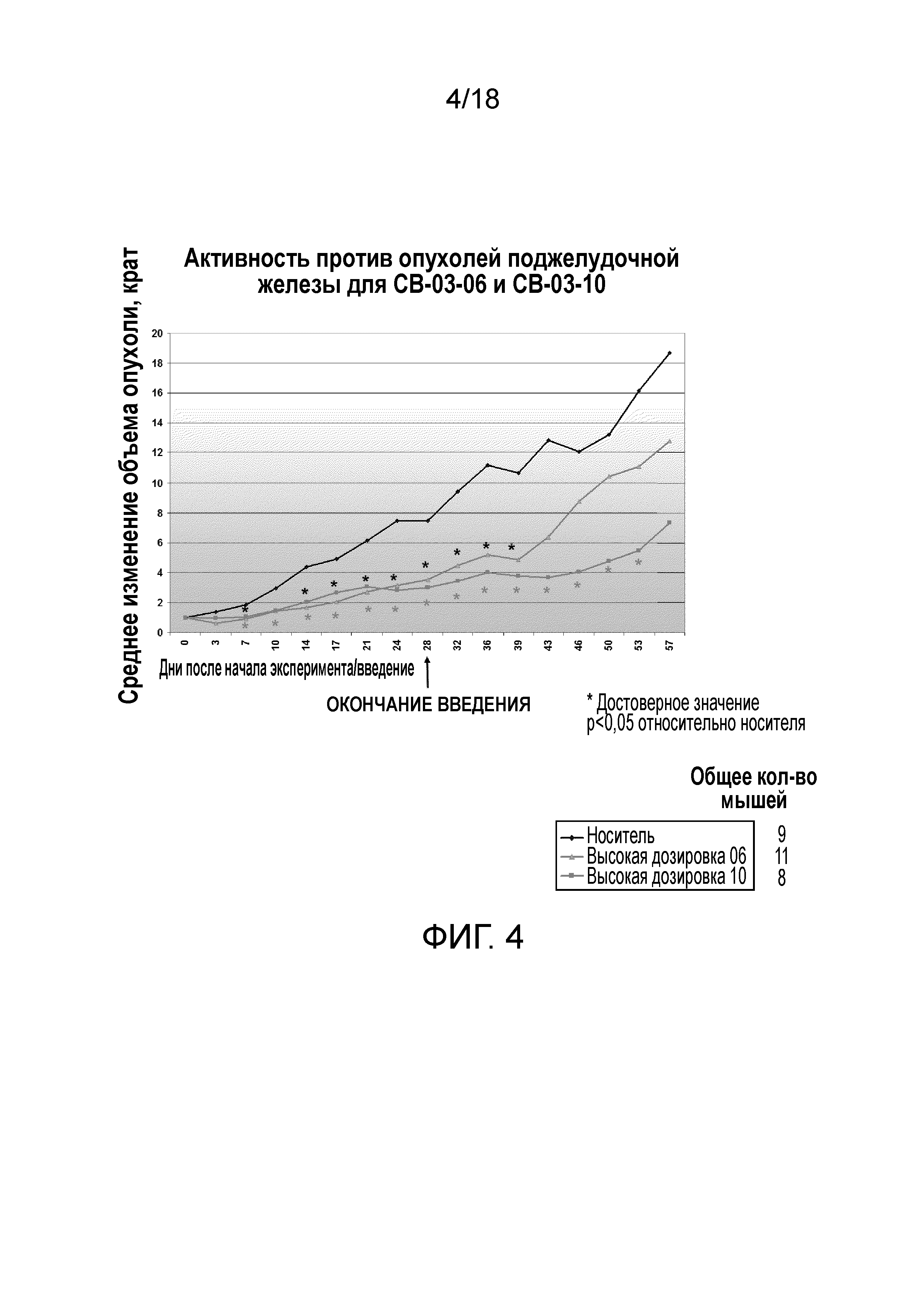
Фиг.2: Среднее изменение объема опухоли поджелудочной железы, измеренное относительно момента начала введения кортексолона 17α-валерата-21-пропионата (именуемого на чертежах «10» и «CB-03-10») в низкой дозировке (230 мкМ) и высокой дозировке (1150 мкМ), в животной модели ксенотрансплантата голой мыши (линия клеток поджелудочной железы MiaPaca). Обозначение «носитель» относится к контрольной группе, получавшей 0,4% (объем/объем) Tween80 и 0,5% (масса/объем) карбоксиметилцеллюлозы в нормальном солевом растворе. Соединение и носитель вводили мышам подкожно (CS) ежедневно в течение 28 дней подряд. Стрелки «конец введения» относятся к дню, когда введение заканчивалось.
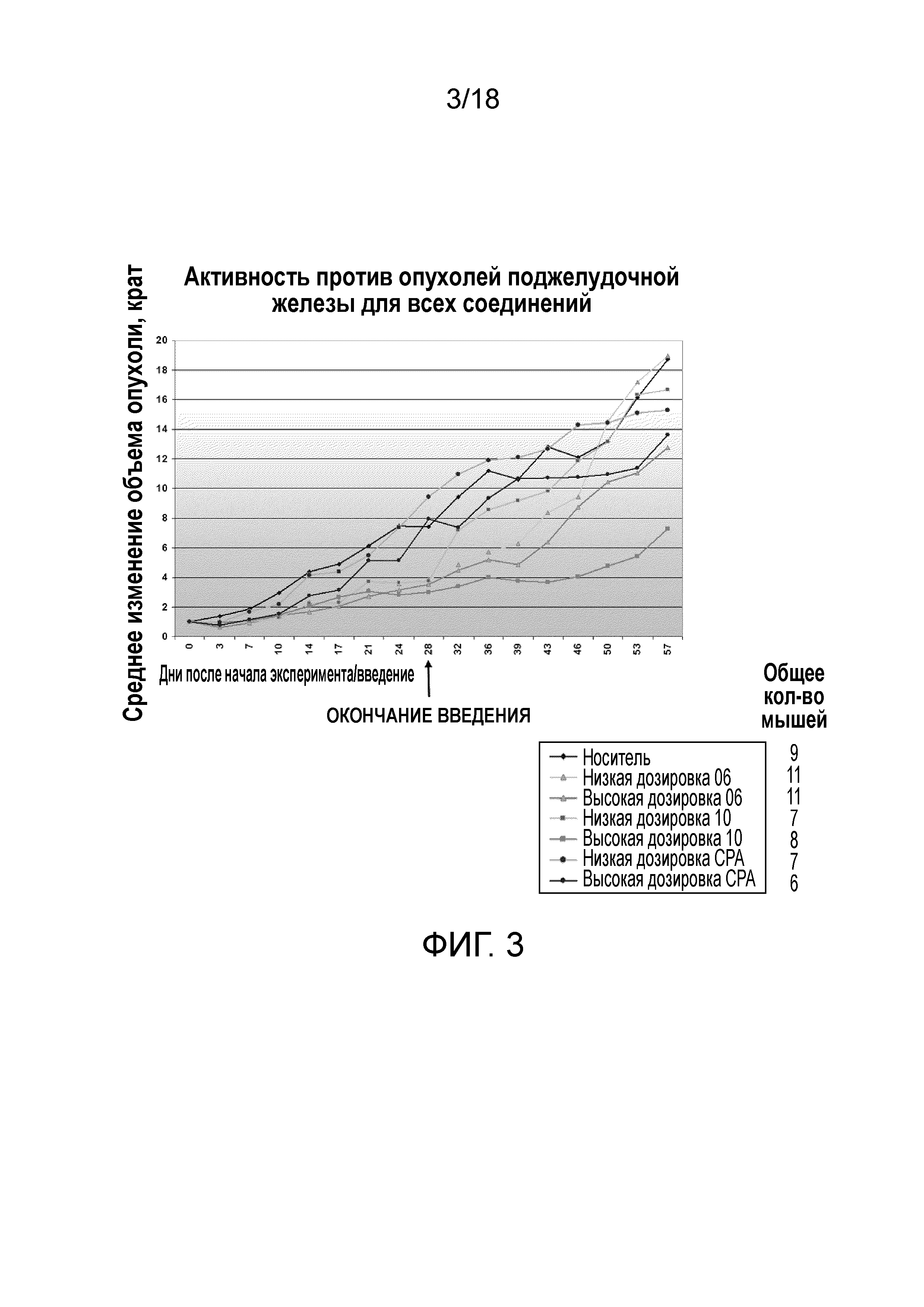
Фиг.3: Среднее изменение объема опухоли поджелудочной железы, измеренное в животной модели голой мыши (линия клеток поджелудочной железы MiaPaca) относительно момента начала SC введения ципротерона ацетата (именуемого на чертеже CPA), кортексолона 17α-валерата-21-пропионата (именуемого на чертеже «10») и кортексолона 17α-бензоата (именуемого на чертеже «06») (каждое соединение в низкой дозировке и высокой дозировке), а также носителя (т.е. 0,4% (объем/объем) Tween80 и 0,5% (масса/объем) карбоксиметилцеллюлозы в нормальном солевом растворе) в контрольной группе. Соединение и носитель вводили всем мышам подкожно (CS) ежедневно в течение 28 дней подряд (дни введения). Стрелки «конец введения» относятся к дню, когда введение заканчивалось.
Фиг.4: График, демонстрирующий значения P относительно контрольной группы, получавшей носитель (т.е. 0,4% (объем/объем) Tween80 и 0,5% (масса/объем) карбоксиметилцеллюлозы в нормальном солевом растворе), а именно лучших результатов с Фиг.3. Все мыши получали соединение и носитель SC ежедневно в течение 28 последовательных дней. Стрелки «конец введения» относятся к дню, когда введение заканчивалось (дни введения).
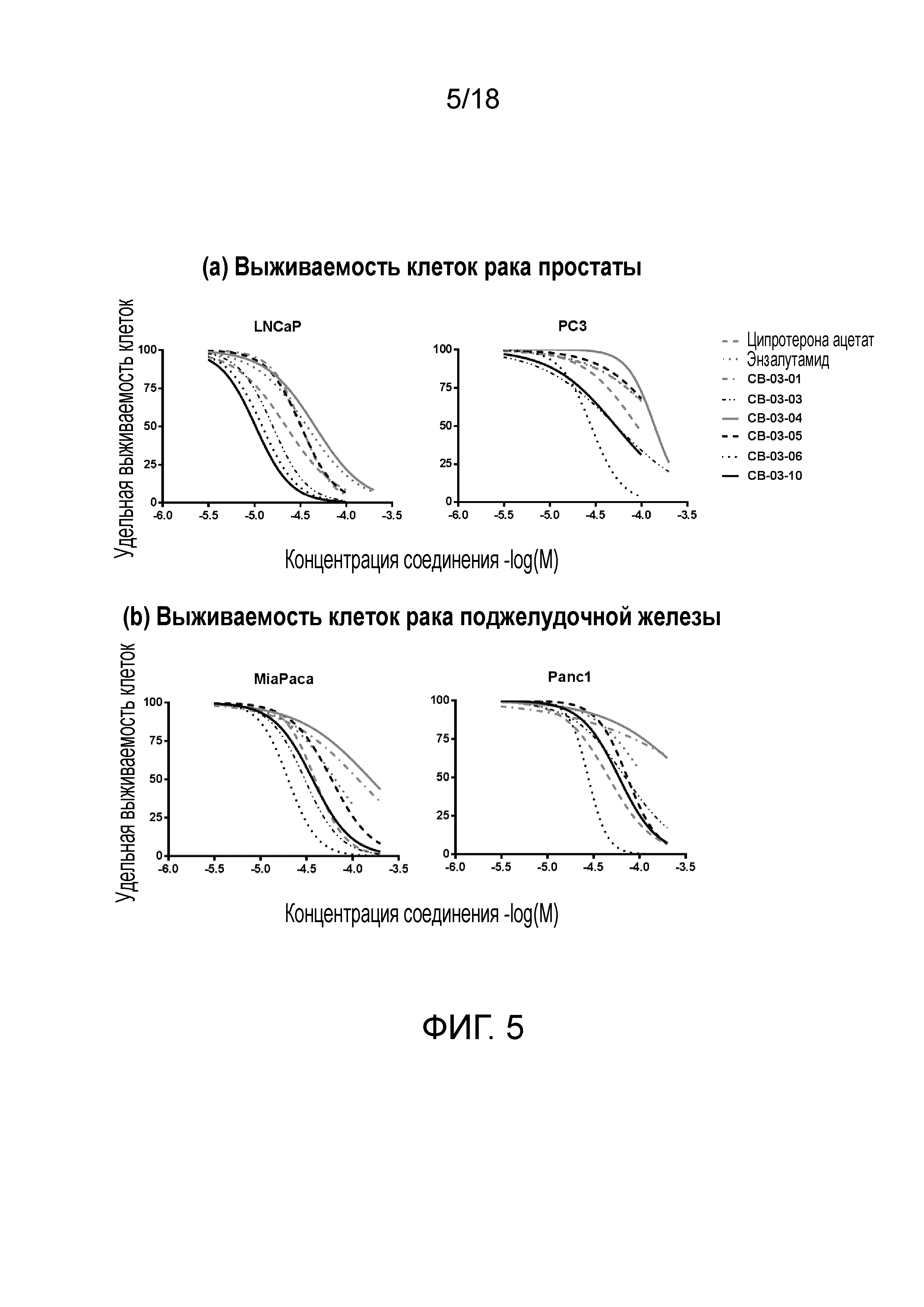
Фиг.5: Титрование дозы для определения цитотоксичности производных кортексолона в клеточных линиях рака простаты (a) и рака поджелудочной железы (b) человека.
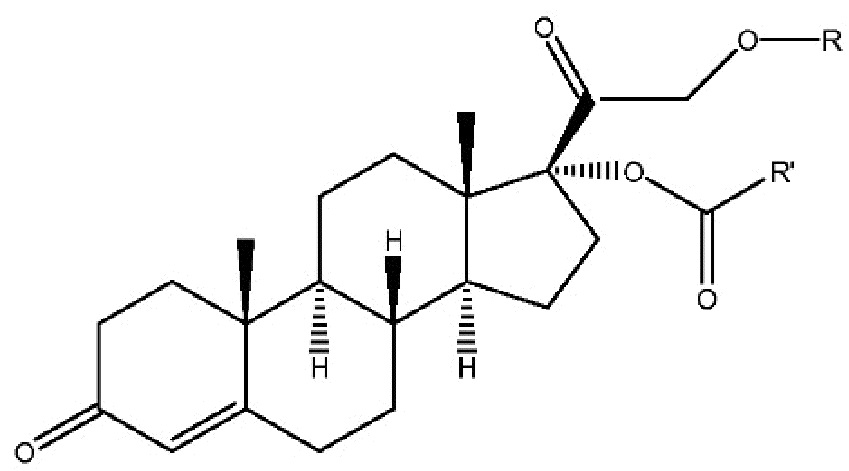
Фиг.6: Уровни экспрессии андрогенного рецептора (AR) на клетках раковых линий.
Фиг.7: Антагонистическая активность CB-03-06 в отношении глюкокортикоидов.
Фиг.8: Агонистическая активность CB-03-06 в отношении глюкокортикоидов.
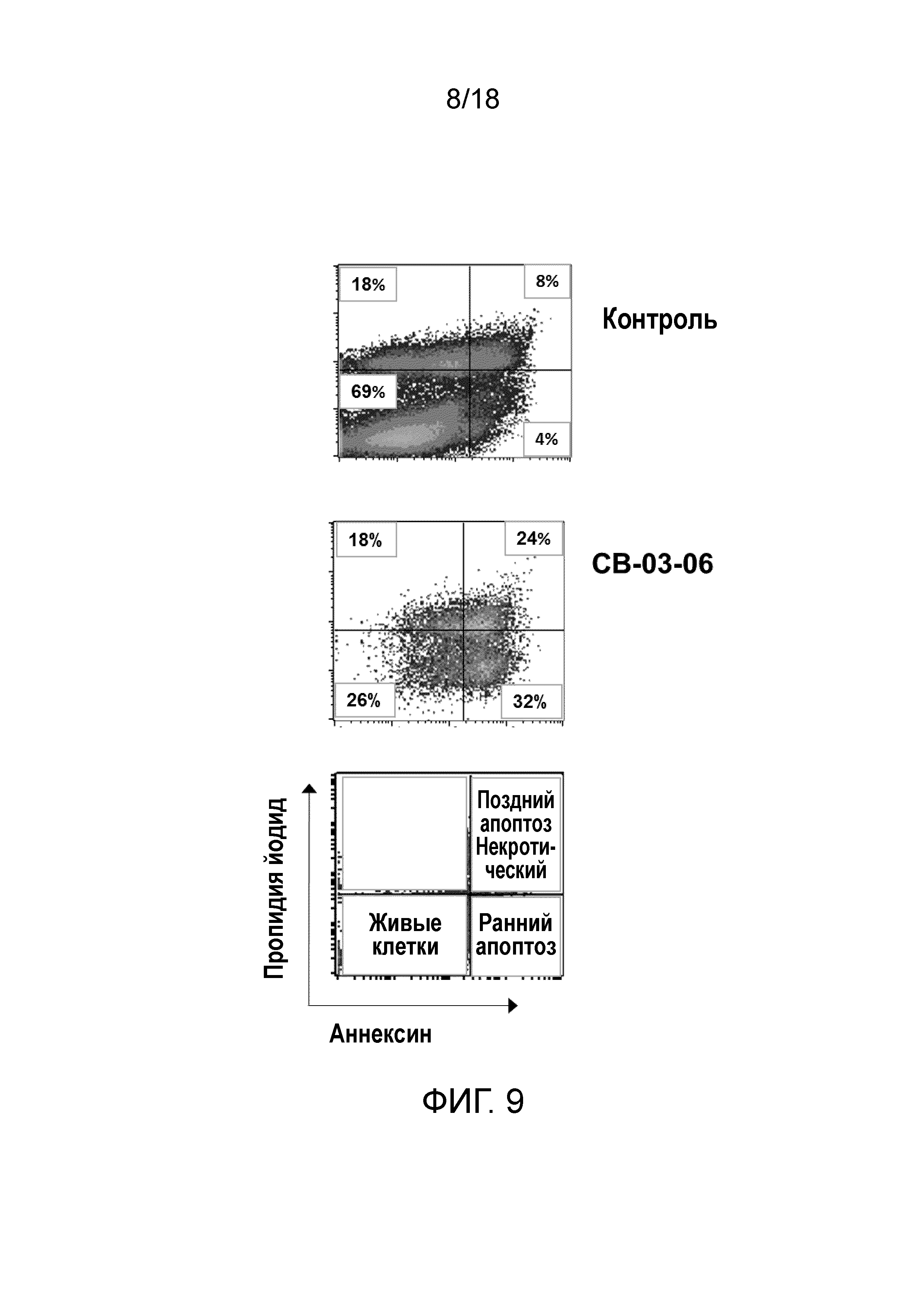
Фиг.9: Инициирование апоптоза клеток MiaPaca2 под действием CB-03-06.
Фиг.10: Инициирование ареста клеточного цикла в клетках MiaPaca2 под действием CB-03-06 в различных концентрациях.
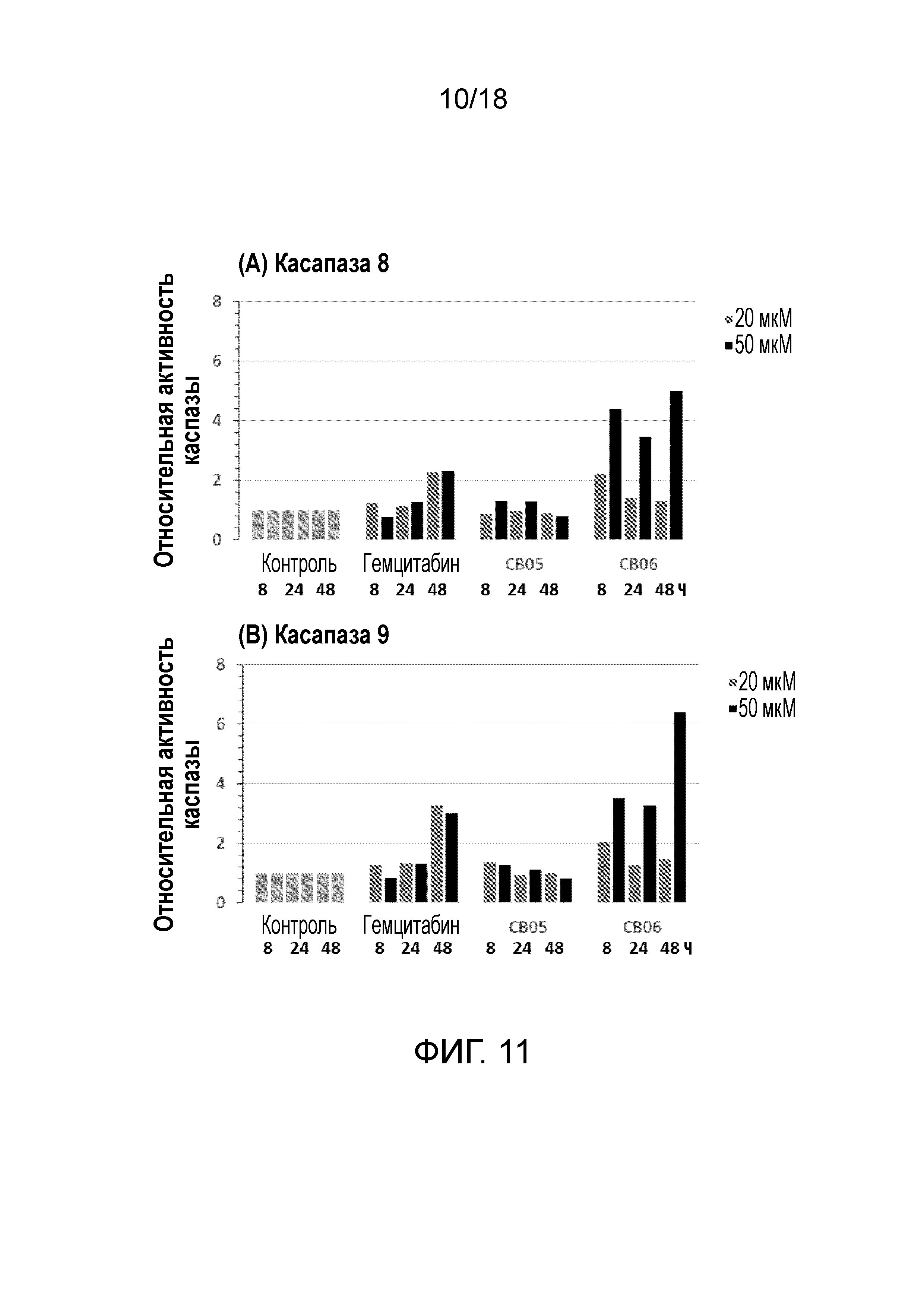
Фиг.11: Активация каспазы в клетках MiaPaca2 с течением времени (8-24-48 часов). 20 мкМ (полосатые бары) или 50 мкм (бары со сплошной заливкой) указывают на концентрацию соединения.
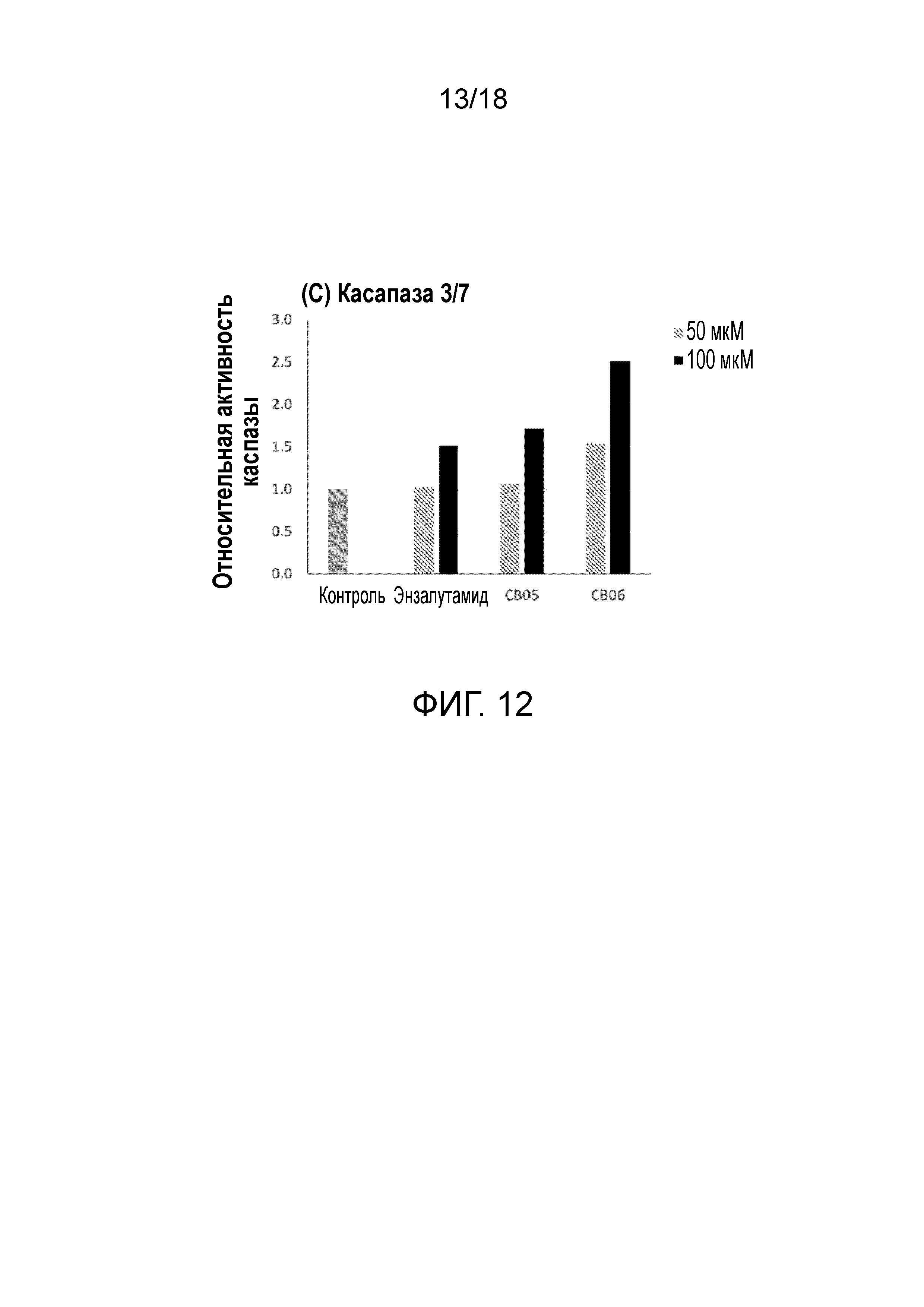
Фиг.12: Активация каспазы с течением времени в клеточных линиях рака простаты LNCaP.
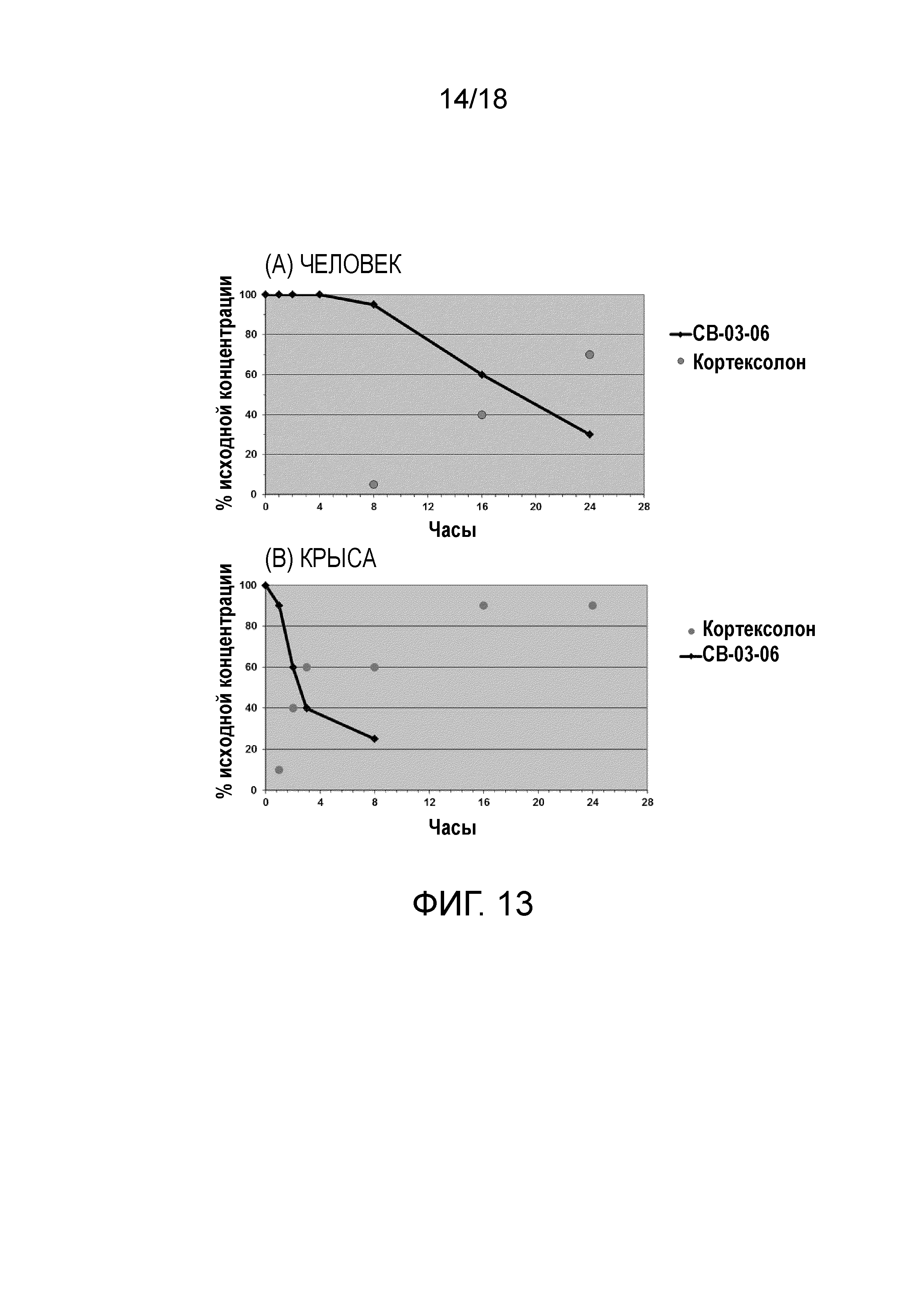
Фиг.13: In vitro метаболизм CB-03-06 в плазме (A) человека и (B) крысы.
Фиг.14: Оценка фармакокинетики CB-03-06 in vivo в плазме мышей после подкожного и перорального введения.
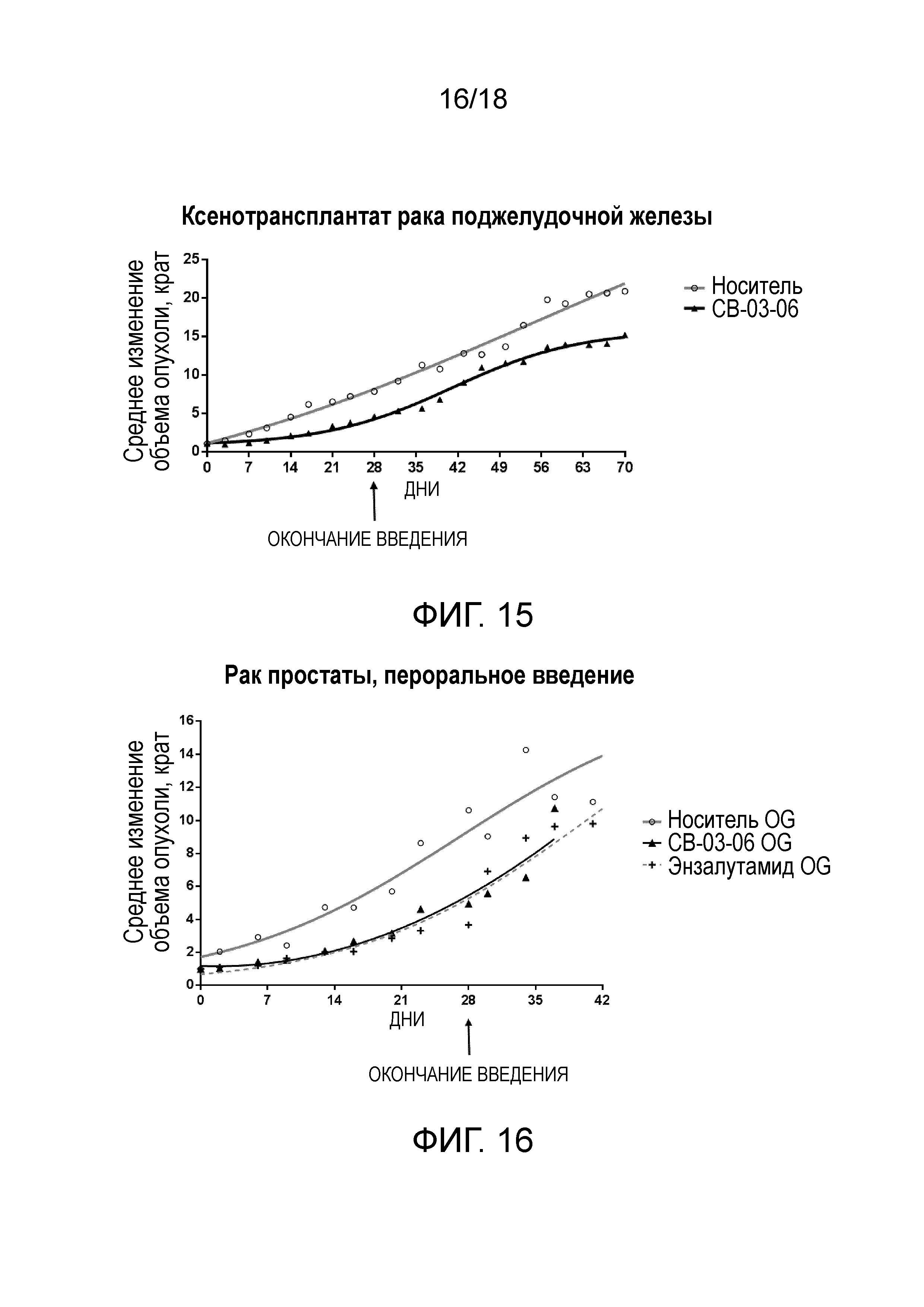
Фиг.15: Противоопухолевая активность CB-03-06 in vivo при подкожном введении в мышиной модели ксенотрансплантата рака поджелудочной железы.
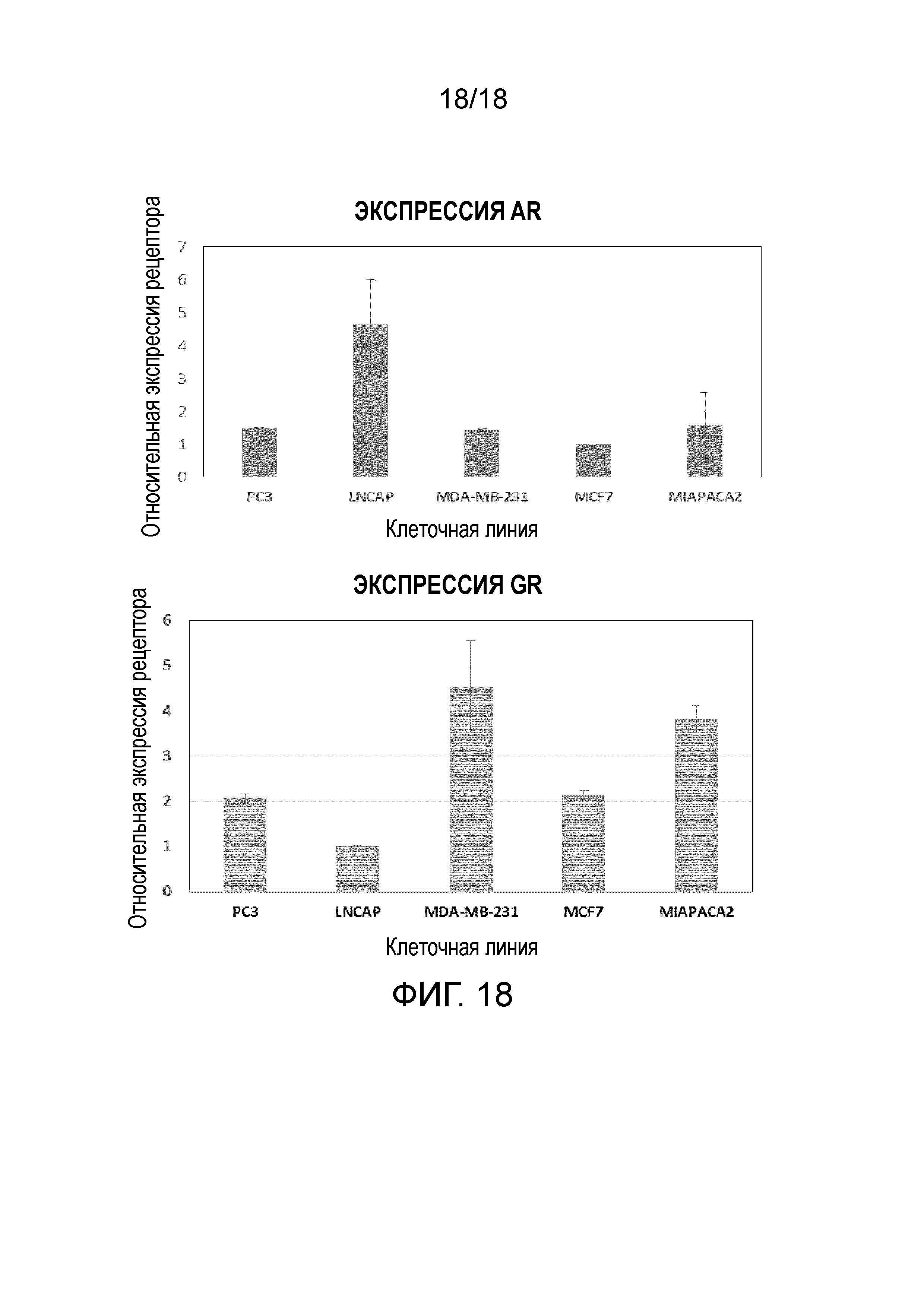
Фиг.16: Противоопухолевая активность CB-03-06 в мышиной модели рака простаты in vivo при введении путем принудительного кормления через рот.
Фиг.17: in vitro ингибирование исходного уровня секреции PSA из раковых клеток линии LNCaP под действием CB-03-06.
Фиг.18: Экспрессия андрогенного и глюкокортикоидного рецепторов в раковых клетках различных линий.
ОПРЕДЕЛЕНИЯ
Если не указано иное, имеется в виду, что все используемые в технике термины, условные обозначения и прочая научная терминология, которая применяется в тексте заявки, имеет значения, обычно подразумеваемые специалистом в той области техники, к которой относится изобретение. В некоторых случаях, термины, имеющие общепринятые значения, определяются в тексте заявки для ясности и/или для справки; таким образом, включение этих определений в текст заявки не следует понимать, как наличие существенных отличий от смысла, общепринятого в технике.
В частности, термины «физиологически приемлемый эксципиент» или «фармацевтически приемлемый эксципиент» в настоящей заявке относятся к веществу, не имеющему какого-либо собственного фармакологического действия и не вызывающему нежелательных реакций при введении млекопитающему, предпочтительно, человеку. Физиологически приемлемые эксципиенты хорошо известны в технике и раскрыты, например, в справочнике Handbook of Pharmaceutical Excipients, sixth edition (2009), который включен в настоящую заявку посредством ссылки.
Термин «алкил» в настоящей заявке означает насыщенный углеводород с линейной или разветвленной цепью.
Термин «арил» в настоящей заявке относится к ароматическим моно- и поли-карбоциклическим системам, где индивидуальные карбоциклы в поликарбоциклических системах могут быть конденсированными или соединенными друг с другом простой связью. Подходящие «арильные» группы включают, не ограничиваясь перечисленными, фенил, нафтил, бифенил и т.п.
Термин «гетероарил» в настоящей заявке относится к ароматическим моно- и поликарбоциклическим системам, где циклическая система включает по крайней мере один гетероатом, причем указанный гетероатом выбран из группы, включающей, не ограничиваясь перечисленными, азот, серу, кислород и т.п., и индивидуальные циклы в поликарбоциклической системе могут быть конденсированы или соединены друг с другом простой связью. Подходящие «гетероарильные» группы включают, не ограничиваясь указанными, пиридил, имидазолил, пирролил, фурил, бензимидазолил, тиофуранил и т.п.
Арильные группы необязательно могут быть замещены по крайней мере по одному из циклических атомов углерода группой, выбранной из низших алкилов, низших алкенилов, низших галогеналкилов, низших галогеналкенилов, низших алкоксигрупп, низших халькалкенилов, низших алкенилокси групп, галогенов, нитро, циано, низших алкилтиогрупп и т.п.
Гетероарильные группы необязательно могут быть замещены по крайней мере по одному из циклических атомов углерода или по одному из циклических гетероатомов группой, выбранной из низших алкилов, низших галогеналкилов, низших галогеналкенилов, низших алкоксигрупп, низших алкенилов, низших халькалкенилов, низших алкенилокси групп, галогенов, нитро, циано, низших алкилтиогрупп и т.п.
Термины «примерно», «приблизительно» в настоящей заявке относятся к диапазону экспериментальной ошибки, которая может присутствовать при измерении.
Термины «включающий», «имеющий» и «содержащий» следует понимать, как открытые термины (т.е. означающие «включающий, но не ограниченный чем-либо») и их следует рассматривать, как включающие и/или служащие основой для таких терминов, как «состоит в основном из», «состоящий в основном из», «состоит из» или «состоящий из».
Термины «состоит в основном из», «состоящий в основном из» следует понимать, как полузакрытые термины, означающие, что в состав не входят другие ингредиенты, которые существенно влияют на основные и новые характеристики настоящего изобретения (таким образом, в состав могут быть включены необязательные эксципиенты).
Термины «состоит из», «состоящий из» следует понимать, как закрытые термины.
В настоящей заявке термины «терапевтически эффективное количество» и «эффективное количество» относятся к количеству, достаточному для того, чтобы вызвать желаемую биологическую реакцию. В настоящем изобретении, желаемая биологическая реакция заключается в подавлении, уменьшении или ослаблении тяжести, продолжительности, прогрессирования или наступления заболевания, расстройства или состояния, предотвращении развития, рецидива или прогрессирования заболевания, расстройства или состояния, или симптома, связанного с заболеванием, расстройством или состоянием. Точное количество соединения, вводимого субъекту, будет зависеть от пути введения, типа и тяжести заболевания, расстройства или состояния и от характеристик субъекта, таких как общее состояние здоровья, возраст, пол, масса тела и переносимость препарата. Специалист в данной области техники должен быть способен определить подходящие дозировки, в зависимости от этих или других факторов. Подходящие дозировки известны для одобренных фармацевтических агентов и они могут регулироваться специалистом в данной области техники в соответствии с состоянием субъекта, типом состояния(ий), подвергаемого лечению, и количеством применяемого соединения, описанного в настоящей заявке. В случаях, когда количество не указано в явном виде, следует предполагать, что речь идет об эффективном количестве. Например, для терапевтического лечения соединения и фармацевтические композиции, описанные в тексте заявки, можно вводить субъекту в дозировках, находящихся в диапазоне от примерно 0,01 до 100 мг/кг массы тела/день.
В настоящей заявке, термины «лечить» и «лечение» относятся к терапевтическому лечению и включают уменьшение или ослабление прогрессирования, тяжести и/или продолжительности заболевания, расстройства или состояния, или ослабление одного или нескольких симптомов (конкретно, одного или нескольких выраженных симптомов) заболевания, расстройства или состояния, в результате введения одного или нескольких терапевтических средств (например, одного или нескольких из таких агентов, как соединения или композиции по настоящему изобретению). В конкретных вариантах осуществления, терапевтическое лечение включает облегчение по крайней мере одного измеримого физического параметра заболевания, расстройства или состояния. В других вариантах осуществления, терапевтическое лечение включает подавление прогрессирования состояния либо физически, путем, например, стабилизации выраженного симптома, либо физиологически, путем, например, стабилизации физического параметра, либо обоими путями. В других вариантах осуществления, терапевтическое лечение включает ослабление или стабилизацию заболевания, расстройства или состояния.
Термин «радикальное лечение» в настоящей заявке относится к лечению, которое нацелено на излечение заболевания или на улучшение симптомов, связанных с заболеванием.
Термин «паллиативное лечение» в настоящей заявке относится к лечению или терапии, которые нацелены не на излечение заболевания, а на его облегчение.
Термин «вспомогательное лечение» в настоящей заявке относится к лечению, которое назначается в дополнение к основному, главному или первоначально применявшемуся лечению.
Термин «неоадъювантное лечение» в настоящей заявке относится к лечению, которое назначается до основного лечения с целью уменьшения размера или распространенности опухоли, за счет чего уменьшаются последствия более масштабного лечения, которое могло бы потребоваться, если бы не было проведено уменьшение размеров или распространенности опухоли.
Как указано в тексте заявки, соединения по настоящему изобретению необязательно могут быть замещены одним или несколькими заместителями, например, описанными ниже по тексту в общих терминах, или входящими в конкретные примеры молекул по настоящему изобретению. Следует понимать, что фраза «необязательно замещенный» является взаимозаменяемой с фразой «замещенный или незамещенный». Как правило, термин «замещенный», независимо от того, предваряется ли он термином «необязательно» или нет, относится к замещению одного или нескольких атомов водорода в данной структуре остатком указанного заместителя. Если не указано иное, необязательно замещенная группа может иметь заместитель в каждом положении группы, доступном для замещения. Если в данной структуре можно заместить более одного положения более, чем одним заместителем, выбранным из указанной группы, заместители в каждом из положений могут быть одинаковыми или различными. Если термин «необязательно замещенный» находится перед списком, указанный термин относится ко всем следующим за ним замещающим группам в списке. Если замещающий радикал или структура не определены или определены как «необязательно замещенный», этот замещающий радикал или структура являются незамещенными.
Конкретные заместители и комбинации заместителей, предусмотренные настоящим изобретением, являются такими заместителями, которые приводят к образованию стабильных или химически возможных соединений. Термин «стабильный» в настоящей заявке относится к соединениям, которые не претерпевают значительных изменений в условиях, которые обеспечивают возможность их получения, детектирования и, конкретно, их выделения, очистки и применения для одной или нескольких целей, раскрытых в настоящем изобретении. В некоторых вариантах осуществления, стабильное соединение или химически возможное соединение представляет собой такое соединение, которое не претерпевает значительных изменений в случае хранения при температуре 40°C или менее, в отсутствии влаги или других реакционноспособных агентов, в течение по крайней мере недели. В настоящем изобретении рассматриваются только те заместители и их комбинации, которые приводят к образованию стабильных структур. Эти заместители и их комбинации будут очевидны рядовому специалисту в данной области техники и могут быть определены без слишком большой экспериментальной работы.
Термин «одновременное, раздельное или последовательное введение» в настоящей заявке относится к введению первого и второго соединения в одно и то же время или таким образом, чтобы два этих соединения действовали в организме пациента в одно и то же время, или к введению одного соединения после другого соединения с тем, чтобы обеспечить терапевтический эффект. В некоторых вариантах осуществления, соединения принимают с пищей. В других вариантах осуществления, соединения принимают после приема пищи, например, через 30 минут или 60 минут после приема пищи. В некоторых вариантах осуществления, одно соединение вводят пациенту через определенный период времени после введения другого соединения.
В настоящей заявке термины «субъект» и «пациент» являются взаимозаменяемыми. Термины «субъект» и «пациент» относятся к животным (например, птицам, таким как курица, куропатка или индейка, или млекопитающим), предпочтительно к «млекопитающим» в т.ч. не приматам (например, коровам, свиньям, лошадям, овцам, кроликам, морским свинкам, крысам, кошкам, собакам и мышам) и приматам (например, обезьянам, шимпанзе и человеку) и, более конкретно, к людям. В одном из вариантов осуществления, субъект является человеком.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении было неожиданно обнаружено, что некоторые производные кортексолона обладают терапевтически интересными противоопухолевыми свойствами и способны действовать против опухолей, предпочтительно эпителиальных и/или гормон-зависимых опухолей.
В соответствии с этой общей концепцией, изобретение относится к соединениям формулы (I)

(I)
где R означает водород или фрагмент C(O)-R1, где R1 представляет собой линейную алкильную цепь, включающую от 2 до 5 атомов углерода, и где Rʹ означает линейную алкильную цепь, содержащую от 3 до 6 атомов углерода, или необязательно замещенную арильную группу, или необязательно замещенную гетероарильную группу.
Предпочтительными соединениями формулы (I) являются такие соединения, в которых R означает водород или фрагмент C(O)-R1, где R1 представляет собой CH2CH3, и где Rʹ представляет собой фрагмент -(CH2)3-CH3 или фенил.
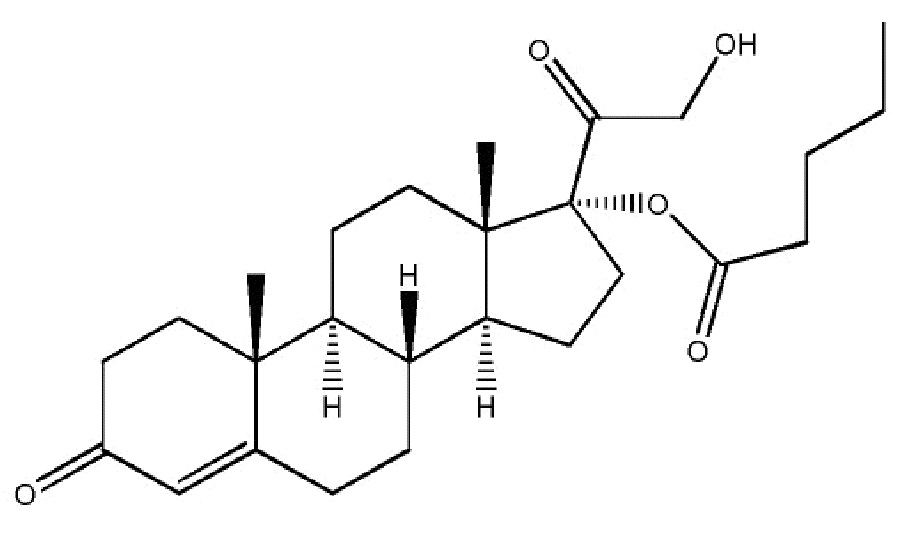
Наиболее предпочтительным соединением формулы (I) является соединение, в котором R означает водород, и Rʹ означает фенил, которое представляет собой кортексолона 17α-бензоат (в настоящей заявке именуемый также «06» или «CB-03-06»), имеющий приведенную ниже формулу

кортексолона 17α-бензоат
Фармацевтически приемлемые соли, сольваты, клатраты, пролекарства и другие производные
Описанные в настоящей заявке соединения могут находиться в свободной форме или, если это целесообразно, в форме солей. Те соли, которые являются фармацевтически приемлемыми, представляют особый интерес, поскольку они подходят для введения описанных ниже по тексту соединений с медицинскими целями. Соли, которые не являются фармацевтически приемлемыми, применимы при производстве, для целей выделения и очистки, а также в некоторых случаях для применения при разделении стереоизомерных форм соединений по настоящему изобретению или их интермедиатов.
В настоящей заявке термин «фармацевтически приемлемая соль» относится к солям соединения, которые, согласно обоснованному медицинскому суждению, подходят для применения в контакте с тканями людей и низших животных без неприемлемых побочных эффектов, таких как токсичность, раздражение, аллергические реакции и т.п., и удовлетворяют разумному соотношению польза/риск.
Фармацевтически приемлемые соли хорошо известны в технике. Например, S.M.Berge et al., подробно описывают фармацевтически приемлемые соли в J.Pharmaceutical Sciences, 1977, 66, 1-19, причем указанный источник включен в настоящую заявку посредством ссылки. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соли, полученные из подходящих неорганических и органических кислот и оснований. Эти соли можно получать in situ при окончательном выделении и очистке соединений.
Следует понимать, что настоящее изобретение включает смеси/комбинации различных фармацевтически приемлемых солей, а также смеси/комбинации соединений в свободной форме и фармацевтически приемлемых солей.
Помимо соединений, описанных в настоящей заявке, фармацевтически приемлемые сольваты (например, гидраты) и клатраты этих соединений также могут применяться в композициях для лечения или профилактики расстройств, указанных в настоящей заявке.
Термин «фармацевтически приемлемый сольват» в тексте заявки относится к сольвату, сформированному в результате ассоциации одной или нескольких молекул фармацевтически приемлемого растворителя с одним из соединений, описанных в настоящем изобретении. Термин «сольват» включает гидраты (например, гемигидрат, моногидрат, дигидрат, тригидрат, тетрагидрат и т.п.).
В настоящей заявке термин «гидрат» означает соединение, описанное в заявке, или его соль, которые дополнительно включают стехиометрическое или не стехиометрическое количество воды, связанной нековалентными межмолекулярными силами.
В настоящей заявке термин «клатрат» означает соединение, описанное в заявке, или его соль в форме кристаллической решетки, которая содержит пустоты (например, каналы), в которых находятся захваченные молекулы посторонних веществ (например, растворителя или воды).
Помимо соединений, описанных в тексте заявки, фармацевтически приемлемые производные или пролекарства этих соединений также могут применяться в композициях для лечения или профилактики расстройств, указанных в заявке.
Фраза «фармацевтически приемлемые производные или пролекарства» включает любые фармацевтически приемлемые сложные эфиры, соли эфиров, или другие производные или их соли соединений по настоящему изобретению, которые, при введении реципиенту, способны образовывать, прямо или опосредованно, соединение по настоящему изобретению или его метаболит, или остаток, обладающие ингибирующей активностью. Особенно предпочтительными производными или пролекарствами являются те продукты, которые повышают биодоступность соединений при введении этих соединений пациенту (например, обеспечивая более легкое поступление в кровь соединения в случае перорального введения) или которые улучшают доставку исходного соединения в определенный отдел организма (например, мозг или лимфатическую систему) относительно исходного соединения.
Фармацевтически приемлемые пролекарства соединений по настоящему изобретению включают, не ограничиваясь перечисленными, сложные эфиры, сложные эфиры аминокислот, эфиры фосфорной кислоты, соли металлов и эфиры сульфоновой кислоты.
Применение в медицине
Настоящее изобретение, главным образом, относится к соединениям формулы (I) для применения в качестве лекарственного средства.
Например, изобретение относится к указанному соединению формулы (I) для применения в качестве модулятора глюкокортикоидного рецептора (GR), предпочтительно, антагониста глюкокортикоидов.
В другом аспекте, изобретение относится к указанному соединению формулы (I) для применения в лечении заболевания или расстройства, опосредованного глюкокортикоидами.
В следующем аспекте, изобретение относится к указанному соединению формулы (I) для применения в лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы; согласно другому аспекту, такое лечение может быть радикальным, вспомогательным, неоадъювантным или паллиативным.
В наиболее предпочтительном варианте осуществления, изобретение относится к указанному соединению формулы (I) для применения в качестве противоопухолевого агента.
Предмет настоящего изобретения относится к кортексолона 17α-бензоату (CB-03-06) для применения в качестве лекарственного средства.
В другом аспекте, изобретение относится к кортексолона 17α-бензоату для применения в качестве модулятора глюкокортикоидного рецептора, предпочтительно, антагониста глюкокортикоидов.
В другом аспекте, изобретение относится к кортексолона 17α-бензоату для применения в лечении заболевания или расстройства, опосредованного глюкокортикоидами.
В следующем аспекте, изобретение относится к кортексолона 17α-бензоату для применения в лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы; согласно другому аспекту, такое лечение может быть радикальным, вспомогательным, неоадъювантным или паллиативным.
В наиболее предпочтительном варианте осуществления, кортексолона 17α-бензоат предназначен для применения в качестве противоопухолевого агента.
В одном из вариантов осуществления, указанные опухолевые заболевания представляют собой солидные опухоли, предпочтительно, эпителиальные опухоли, например, такие как карцинома простаты, карцинома молочной железы, карцинома поджелудочной железы, карцинома легких, карцинома желудочно-кишечного тракта (предпочтительно, карцинома ободочной кишки), рак почек, карцинома щитовидной железы, карцинома матки, карцинома надпочечников и т.п.
В предпочтительном варианте осуществления настоящего изобретения, указанные эпителиальные опухоли представляют собой карциному простаты, карциному поджелудочной железы (предпочтительно экзокринную карциному поджелудочной железы), карциному желудочно-кишечного тракта (предпочтительно, карциному ободочной кишки) и карциному молочной железы (предпочтительно, трижды негативный рак груди (TNBC)).
В предпочтительном варианте осуществления настоящего изобретения, опухолевое заболевание представляет собой рак простаты. В предпочтительном варианте осуществления настоящего изобретения рак простаты является аденокарциномой. В предпочтительном варианте осуществления настоящего изобретения, опухолевое заболевание представляет собой рак простаты с отсутствующей или пониженной экспрессией андрогенного рецептора. В другом предпочтительном варианте осуществления изобретения, опухолевое заболевание является раком простаты с мутировавшими или укороченными андрогенными рецепторами.
В наиболее предпочтительном варианте осуществления, кортексолона 17α-бензоат (CB-03-06) предназначен для применения в качестве противоопухолевого агента, где опухолевое заболевание представляет собой рак простаты с мутировавшими или укороченными андрогенными рецепторами. Одним из особенно предпочтительных применений кортексолона 17α-бензоата (CB-03-06), является применение в лечении раковых заболеваний простаты, которые являются или стали невосприимчивыми к лечению антиандрогенами, такими как энзалутамид. Этот вариант осуществления настоящего изобретения является особенно предпочтительным, т.к. в настоящее время обнаружено, что после 6 месяцев лечения 30% раковых заболеваний простаты становятся невосприимчивыми к энзалутамиду, поскольку AR подвергаются мутации или изменению. Интересно, что эти невосприимчивые раковые клетки характеризуются повышающей регуляцией GR. Кортексолона 17α-бензоат (CB-03-06) может применяться для лечения таких раковых заболеваний, поскольку его активность также опосредуется GR.
В другом предпочтительном варианте осуществления настоящего изобретения, экзокринная карцинома поджелудочной железы представляет собой аденокарциному. В предпочтительном варианте осуществления, экзокринный рак поджелудочной железы характеризуется отсутствующей или пониженной экспрессией андрогенного рецептора.
В предпочтительном варианте осуществления настоящего изобретения, указанная эпителиальная опухоль представляет собой карциному желудочно-кишечного тракта (предпочтительно карциному ободочной кишки).
В другом предпочтительном варианте осуществления настоящего изобретения, указанная эпителиальная опухоль является карциномой молочной железы (предпочтительно, трижды негативным раком груди). Необязательно, субъект или пациент, который подвергается лечению, страдает рецидивами или не реагирует на стандартную терапию.
В предпочтительном варианте осуществления, настоящее изобретение относится к соединению формулы (I), в котором R означает водород, и Rʹ означает фенил, которое представляет собой кортексолона 17α-бензоат (именуемый также в настоящей заявке «06» или «CB-03-06»), для применения в лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы; согласно другому аспекту, такое лечение может быть радикальным, вспомогательным, неоадъювантным или паллиативным.
Другим предметом настоящего изобретения является кортексолона 17α-валерат (именуемый также в настоящей заявке «05» или «CB-03-05»), представленный следующей формулой:
CB-03-05 (кортексолона 17α-валерат)
для применения в качестве лекарственного средства. CB-03-05 (кортексолона 17α-валерат) будет рассмотрен ниже по тексту, и его можно применять в качестве лекарственного средства для лечения тех же состояний, которые перечислены выше в связи с кортексолона 17α-бензоатом (CB-03-06).
Другим предметом настоящего изобретения являются соединения формулы (I), предпочтительно кортексолона 17α-бензоат или кортексолона 17α-валерат, или фармацевтические составы, содержащие указанные соединения, для применения в производстве лекарственного средства. Например, соединения формулы (I), предпочтительно, кортексолона 17α-бензоат или кортексолона 17α-валерат, или фармацевтические составы, включающие указанные соединения, могут быть предназначены для применения в производстве лекарственного средства для лечения предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы; согласно другому аспекту, такое лечение может быть радикальным, вспомогательным, неоадъювантным или паллиативным. В наиболее предпочтительном варианте осуществления, эти соединения или фармацевтические составы, включающие указанные соединения, предназначены для применения в производстве противоопухолевого агента.
В одном из вариантов осуществления, указанные опухолевые заболевания представляют собой солидные опухоли, предпочтительно, эпителиальные опухоли, например, такие как карцинома простаты, карцинома молочной железы (предпочтительно, трижды негативный рак груди), карцинома поджелудочной железы (предпочтительно, экзокринная карцинома поджелудочной железы), карцинома легких, карцинома желудочно-кишечного тракта (предпочтительно, карцинома ободочной кишки), рак почек, карцинома щитовидной железы, карцинома матки, карцинома надпочечников и т.п.
В другом аспекте, изобретение относится к соединениям формулы (I), а именно кортексолона 17α-бензоату или кортексолона 17α-валерату, или фармацевтическим составам, включающим указанные соединения, для применения в производстве лекарственного средства для лечения заболевания или расстройства, опосредованного глюкокортикоидами.
В одном из аспектов, настоящее изобретение относится к способу лечения предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы, где указанный способ включает введение субъекту, которому это необходимо, эффективного количества соединения формулы (I):

(I)
где R означает водород или фрагмент C(O)-R1, где R1 представляет собой линейную алкильную цепь, включающую от 2 до 5 атомов углерода, и где Rʹ означает линейную алкильную цепь, содержащую от 3 до 6 атомов углерода, или необязательно замещенную арильную группу, или необязательно замещенную гетероарильную группу. Предпочтительно, указанный субъект является млекопитающим. Указанное млекопитающее предпочтительно является человеком.
Предпочтительно, настоящее изобретение относится к способу лечения предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы, где указанный способ включает введение млекопитающему, которому это необходимо, эффективного количества кортексолона 17α-бензоата или кортексолона 17α-валерата. Предпочтительно, указанное млекопитающее является человеком.
В предпочтительном варианте осуществления, настоящее изобретение относится к способу лечения опухолей, где указанный способ включает введение млекопитающему, которому это необходимо, эффективного количества кортексолона 17α-бензоата или кортексолона 17α-валерата. В этих вариантах осуществления, указанные опухолевые заболевания представляют собой солидные опухоли, в том числе эпителиальные опухоли, например, такие как карцинома простаты, карцинома молочной железы (предпочтительно, трижды негативный рак груди), карцинома матки, карцинома поджелудочной железы (предпочтительно, экзокринная карцинома поджелудочной железы), карцинома легких, карцинома желудочно-кишечного тракта (предпочтительно, карцинома ободочной кишки), рак почек, карцинома щитовидной железы, карцинома матки, карцинома надпочечников и т.п.
В предпочтительном варианте осуществления настоящего изобретения, указанные эпителиальные опухоли представляют собой карциному простаты, карциному поджелудочной железы, более предпочтительно, экзокринную карциному поджелудочной железы, или карциному молочной железы, например, трижды негативный рак груди. Необязательно, субъект или пациент, подвергаемый лечению, страдает от рецидивов или невосприимчив к стандартной терапии.
В наиболее предпочтительном варианте осуществления, указанный способ включает введение эффективного количества соединения формулы (I), где R означает водород, и Rʹ означает фенил, которое представляет собой кортексолона 17α-бензоат.
Соединения по настоящему изобретению могут применяться в различных терапевтических приложениях, в особенности онкологических приложениях.
Соединения по настоящему изобретению, раскрытые в тексте заявки, как было обнаружено, являются особенно эффективными для радикального, вспомогательного, неоадъювантного или паллиативного лечения карциномы поджелудочной железы, предпочтительно, экзокринной карциномы поджелудочной железы, а также карциномы простаты.
Иллюстрацию фармакологических свойств соединений по настоящему изобретению можно найти ниже по тексту в экспериментальном разделе.
Соединения формулы (I) можно получать любым известным способом, например, способом раскрытым в WO 03/014141 и WO 2009/019138, причем содержание каждого из указанных документов включено в настоящую заявку во всей полноте посредством ссылки. Согласно одному из вариантов осуществления настоящего изобретения, эти соединения можно получать способом, раскрытым в примерах 10 и 11, соответственно.
Фармацевтические композиции
Соединения, описанные в настоящей заявке, можно включать в состав фармацевтических композиций, которые дополнительно содержат фармацевтически приемлемый носитель, разбавитель, адъювант или наполнитель. В одном из вариантов осуществления, настоящее изобретение относится к фармацевтической композиции, включающей соединение по настоящему изобретению, описанное в тексте заявки, а также фармацевтически приемлемый носитель, разбавитель, адъювант или наполнитель. В одном из вариантов осуществления, настоящее изобретение относится к фармацевтической композиции, включающей эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, а также фармацевтически приемлемый носитель, разбавитель, адъювант или наполнитель. Фармацевтически приемлемые носители включают, например, фармацевтические разбавители, эксципиенты или носители, выбранные надлежащим образом, с учетом намеченной формы введения и в соответствии со стандартной фармацевтической практикой.
Согласно наиболее предпочтительному варианту осуществления, указанная фармацевтическая композиция включает в качестве действующего ингредиента кортексолона 17α-бензоат (CB-03-06) в комбинации с как минимум одним физиологически приемлемым эксципиентом.
Согласно другому предпочтительному варианту осуществления, указанная фармацевтическая композиция включает в качестве действующего ингредиента кортексолона 17α-валерат (CB-03-05) в комбинации с как минимум одним физиологически приемлемым эксципиентом.
В другом аспекте, указанная фармацевтическая композиция предназначена для применения в качестве лекарственного средства. В следующем аспекте, указанная фармацевтическая композиция предназначена для применения в лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы; согласно другому аспекту, такое лечение может быть радикальным, вспомогательным, неоадъювантным или паллиативным.
В следующем аспекте, указанная фармацевтическая композиция предназначена для применения в качестве противоопухолевого агента.
Предпочтительно, указанные опухолевые заболевания являются солидными опухолями. Более предпочтительно, указанные солидные опухоли являются эпителиальными опухолями, например, такими как карцинома простаты, карцинома молочной железы, карцинома поджелудочной железы, карцинома легких, карцинома желудочно-кишечного тракта (предпочтительно, карцинома ободочной кишки), рак почек, карцинома щитовидной железы, карцинома матки, карцинома надпочечников и т.п.
В предпочтительном варианте осуществления настоящего изобретения, указанные эпителиальные опухоли представляют собой карциному простаты и карциному поджелудочной железы, более предпочтительно экзокринную карциному поджелудочной железы, карциному желудочно-кишечного тракта (предпочтительно карциному ободочной кишки), а также карциному молочной железы (предпочтительно, трижды негативный рак груди).
В предпочтительном варианте осуществления настоящего изобретения, опухолевое заболевание представляет собой рак простаты. В предпочтительном варианте осуществления настоящего изобретения рак простаты является аденокарциномой. В предпочтительном варианте осуществления настоящего изобретения, опухолевое заболевание является раком простаты с мутировавшими или отсутствующими AR, или пониженной экспрессией AR. В этом случае рак простаты, который можно лечить согласно настоящему изобретению, может являться или стать невосприимчивым к антиандрогенной терапии, например, к энзалутамиду.
В предпочтительном варианте осуществления настоящего изобретения, экзокринная карцинома поджелудочной железы представляет собой аденокарциному. В предпочтительном варианте осуществления, экзокринный рак поджелудочной железы характеризуется отсутствием или пониженной экспрессией AR.
В предпочтительном варианте осуществления, карцинома молочной железы представляет собой трижды негативный рак груди (TNBC). Необязательно, субъект или пациент, подвергаемый лечению, страдает от рецидивов или невосприимчив к стандартной терапии.
В другом аспекте настоящего изобретения, указанная фармацевтическая композиция включает кортексолона 17α-бензоат для применения в производстве лекарственного средства, предназначенного для лечения предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы; согласно еще одному аспекту, такое лечение может являться радикальным, вспомогательным, неоадъювантным или паллиативным.
В другом аспекте, указанная фармацевтическая композиция предназначена для применения в качестве модулятора глюкокортикоидного рецептора (GR), предпочтительно, в качестве антагониста глюкокортикоидов.
В другом аспекте, изобретение относится к указанной фармацевтической композиции для применения в производстве лекарственного средства, предназначенного для лечения заболевания или расстройства, опосредованного глюкокортикоидами.
В наиболее предпочтительном варианте осуществления, указанная фармацевтическая композиция включает кортексолона 17α-бензоат.
Согласно другому варианту осуществления, указанная фармацевтическая композиция может содержать по крайней мере один другой действующий ингредиент, предпочтительно, химиотерапевтический действующий ингредиент, необязательно, в качестве комбинации для одновременного, раздельного или последовательного введения.
Фармацевтические композиции по настоящему изобретению могут находиться в твердой форме, как, например, форме порошков, порошков, полученных лиофильной сушкой, гранул, драже, таблеток или капсул. Если это желательно, можно добавлять определенные подсластители, вкусоароматические или красящие агенты. Соединения по настоящему изобретению могут также находиться в микроинкапсулированной форме с одним или несколькими эксципиентами. Твердые дозированные формы, такие как таблетки, капсулы, пилюли и гранулы, можно получать с покрытиями и оболочками, например, кишечными покрытиями и другими покрытиями, хорошо известными в технике получения фармацевтических составов. Можно выбрать эксципиенты, подходящие для твердых фармацевтических композиций, без каких-либо ограничений, среди категорий, известных специалисту в данной области техники, таких как адсорбенты, наполнители, ПАВ, компоненты, способствующие прессованию, связующие вещества, смазывающие компоненты, дезинтегрирующие средства, разбавители, дезинтегрирующие средства, средства, улучшающие сыпучесть, средства, способствующие лиофильной сушке, средства для скольжения, средства, способствующие лиофилизации, пленкообразующие агенты, красители, антиоксиданты и т.п. В качестве примера, подходящие эксципиенты для твердых фармацевтических композиций могут быть выбраны, не ограничиваясь указанными, из фосфата кальция, стеарата магния, талька, сахаров, лактозы, декстрина, крахмала, желатина, целлюлозы и ее производных, поливинилпирролидона, покрывающих агентов, красителей и восков. Любая смесь этих эксципиентов может подойти для применения согласно настоящему изобретению.
В соответствии с настоящим изобретением, твердые фармацевтические композиции, например, таблетки, гранулы, драже, капсулы и т.п., можно получать в виде форм с немедленным высвобождением, форм с отсроченным высвобождением, форм с регулируемым высвобождением, форм с долговременным высвобождением или форм с продолжительным высвобождением, а также подходящие для приема пероральным или сублингвальным путем, или в форме имплантата.
Композиции с регулируемым, долговременным или продолжительным высвобождением можно получать с помощью любого известного способа или системы, например, согласно заявке WO 00/76478, включенной в настоящую заявку посредством ссылки во всей полноте.
Фармацевтические композиции по настоящему изобретению могут также находиться в жидкой форме, например, форме растворов, эмульсий, суспензий или сиропов.
Жидкие дозированные формы для перорального введения включают, не ограничиваясь этим, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо действующих соединений, жидкие дозированные формы могут содержать инертные разбавители, обычно применяемые в технике. Кроме инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, вкусоароматические добавки и отдушки.
Подходящие экципиенты для жидких фармацевтических композиций можно выбрать, без каких-либо ограничений, среди классов компонентов, хорошо известных специалисту в данной области техники, например, растворителей, сорастворителей, масляных носителей, буферных агентов, ПАВ, эмульгирующих агентов, агентов, улучшающих растворимость, суспендирующих агентов, солюбилизирующих агентов, хелатообразующих агентов, подкисляющих агентов, подщелачивающих агентов, антиоксидантов, консервантов, осмотических агентов, тонических агентов, средств, регулирующих вязкость, и т.п. В качестве примера, подходящие фармацевтические эксципиенты для жидких препаратов можно выбрать из воды для инъекций, органических растворителей или сорастворителей, таких как этанол, гликоли, глицерин и их смеси, природных масел, таких как соевое масло, триглицериды с цепями средней длины, полиоксил 15-гидроксистеарат, полисорбат 80, полиоксил 35-касторовое масло, хлорида натрия, фосфата натрия, фосфата калия и т.п. Согласно настоящему изобретению, указанные жидкие фармацевтические композиции могут являться стерильными или нестерильными. В одном из вариантов осуществления, жидкие фармацевтические композиции подвергают окончательной стерилизации с применением методик, хорошо известных специалисту в данной области техники, например, стерилизации сухим жаром, стерилизации влажным жаром, гамма излучения, стерилизации электронными пучками и т.п. В другом варианте осуществления, жидкие фармацевтические композиции стерилизуют путем стерилизующего фильтрования и в асептических условиях помещают их в конечные первичные упаковочные емкости. Жидкие фармацевтические композиции по настоящему изобретению могут применяться для инъекций, инфузий или перфузий, например, для внутривенного, внутримышечного, интраперитонеального, подкожного или внутриопухолевого введения.
Способы введения
Соединения и фармацевтические композиции по настоящему изобретению можно вводить перорально, парентерально, ингаляцией спреев, местно, ректально, назально, буккально, вагинально или с помощью имплантатов, содержащих определенное количество действующего вещества. Термин «парентерально» в настоящей заявке включает, не ограничиваясь этим, подкожные, внутривенные, внутримышечные, внутрисуставные, интрасиновиальные, интрастернальные, интратекальные, внутрипеченочные, внутриочаговые и внутричерепные инъекции или инфузии.
Препараты для инъекций, например, стерильные или масляные суспензии для инъекций, можно получать согласно известным в технике методикам, применяя подходящие диспергирующие или смачивающие агенты, а также суспендирующие агенты. Стерильные препараты для инъекций могут также являться стерильными растворами, супензиями или эмульсиями для инъекций в нетоксичном разбавителе или растворителе, подходящим для парентерального применения. Составы для инъекций можно стерилизовать, например, с помощью фильтрования через фильтр, удерживающий бактерии, или путем включения стерилизующих агентов в стерильные твердые композиции, которые перед применением можно растворить или диспергировать в стерильной воде или другой стерильной среде для инъекций.
Стерильные формы для инъекций соединений и композиций по настоящему изобретению, могут являться водными или масляными суспензиями. Эти суспензии можно получать по методикам, известным в технике, применяя подходящие диспергирующие или смачивающие агенты, а также суспендирующие агенты. Стерильные препараты для инъекций могут также являться стерильными растворами, супензиями или эмульсиями для инъекций в нетоксичном разбавителе или растворителе, подходящем для парентерального применения.
Соединения для применения в способах по настоящему изобретению, можно включать в дозированные лекарственные формы. Термин «дозированная лекарственная форма» относится к физически дискретным единицам, подходящим в качестве разовых доз для субъектов, которые подвергаются лечению, где каждая из этих единиц содержит заранее определенное количество действующего вещества, рассчитанное на достижение желаемого терапевтического эффекта, необязательно в комбинации с подходящим фармацевтическим носителем. Дозированная лекарственная форма может быть предназначена для введения полной дневной дозы или одной из нескольких частей дневной дозы (например, приблизительно от 1 до 4 или более раз в день). Если используется введение нескольких доз в день, дозированные лекарственные формы могут быть одинаковыми или различными для каждого из этих введений.
Согласно настоящему изобретению, соединения формулы (I) или фармацевтические композиции, включающие эти соединения, предпочтительно вводят внутривенной инъекцией, более предпочтительно, с применением инфузионного мешка, шприца или катетера с насосом, или внутримышечной инъекцией, или подкожной инъекцией, или перорально (через рот) в форме таблеток или капсул.
Согласно одному из вариантов осуществления, указанная фармацевтическая композиция является жидкой лекарственной формой, подходит для инъекций, и включает производное кортексолона формулы (I) в количестве от 0,1% до 50% масса к объему (масс/объем), предпочтительно, от 0,25% до 25% масс/объем, более предпочтительно от 0,5% до 10% масс/объем, еще более предпочтительно от 1% до 5% масс/объем.
Согласно другому варианту осуществления, указанная фармацевтическая композиция находится в твердой форме и включает производное кортексолона формулы (I) в количестве от 0,1% до 50% масса к массе (масс/масс), предпочтительно, от 0,5% до 40% масс/масс, более предпочтительно от 1% до 30% масс/масс.
Количество как минимум одного соединения формулы (I) в указанной фармацевтической композиции является таким, чтобы можно было получить эффективный уровень дозировки при введении млекопитающему, страдающему от предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы.
Соединения формулы (I) и фармацевтические композиции, включающие их в качестве действующих ингредиентов, предназначенные для применения в радикальном, вспомогательном, неоадъювантном или паллиативном лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы, предпочтительно вводят млекопитающим, где указанные млекопитающие являются людьми или животными, предпочтительно людьми.
Комбинированная терапия
Согласно другому варианту осуществления, такие соединения, как кортексолона 17α-бензоат (CB-03-06), кортексолона 17α-валерат (CB-03-05) и фармацевтические композиции, включающие указанные соединения, могут содержать как минимум один другой действующий ингредиент, предпочтительно химиотерапевтический действующий ингредиент, в качестве комбинации для одновременного, раздельного или последовательного введения.
В некоторых вариантах осуществления, соединения формулы (I) и фармацевтические композиции, включающие как минимум одно соединение формулы (I) и как минимум один физиологически приемлемый эксципиент по настоящему изобретению, могут применяться в комбинированной терапии вместе с как минимум одним другим лекарственным средством, в частности химиотерапевтическим препаратом. В некоторых вариантах осуществления, соединения по настоящему изобретению можно вводить одновременно с введением другого лекарственного средства, в частности химиотерапевтического препарата. В некоторых вариантах осуществления, соединения по настоящему изобретению можно вводить до или после введения другого лекарственного средства, в частности химиотерапевтического препарата. Указанное как минимум одно другое лекарственное средство, в частности химиотерапевтический препарат, могут являться эффективными для лечения того же самого или другого заболевания, расстройства или состояния. Способы по настоящему изобретению включают введение одного или нескольких соединений формулы (I) или фармацевтических композиций, включающих как минимум одно соединение формулы (I) по настоящему изобретению и как минимум одно другое лекарственное средство, предпочтительно химиотерапевтический препарат, при условии, что комбинированное введение не ослабляет терапевтическую эффективность указанного одного или нескольких соединений по настоящему изобретению и/или не вызывает неприемлемых нежелательных комбинированных эффектов.
Кортексолона 17α-валерат (также именуемый в настоящей заявке «05» или «CB-03-05»)
Как указано выше, другим предметом настоящего изобретения является кортексолона 17α-валерат (также именуемый в настоящей заявке «05» или «CB-03-05») представленный следующей формулой:
CB-03-05 (кортексолона 17α-валерат)
для применения в качестве лекарственного средства.
В наиболее предпочтительном варианте осуществления, кортексолона 17α-валерат предназначен для применения в лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, включая злокачественные новообразования и метастазы. Предпочтительно, кортексолона 17α-валерат предназначен для применения в качестве противоопухолевого агента. Предпочтительно, опухолевые заболевания являются солидными опухолями, предпочтительно, эпителиальными опухолями. Эпителиальные опухоли могут быть выбраны из карциномы простаты; карциномы молочной железы; карциномы поджелудочной железы (предпочтительно, экзокринной карциномы поджелудочной железы); карциномы легких; карциномы желудочно-кишечного тракта, например, карциномы ободочной кишки; рака почек; карциномы щитовидной железы; карциномы матки; и карциномы надпочечников.
Согласно одному из вариантов осуществления, эпителиальная опухоль является карциномой простаты. В другом предпочтительном варианте осуществления изобретения, опухолевое заболевание является раком простаты с мутировавшими или укороченными андрогенными рецепторами. В этом случае, рак простаты, который можно лечить согласно настоящему изобретению, может являться или стать невосприимчивым к антиандрогенной терапии, например, энзалутамиду.
Согласно другому варианту осуществления, эпителиальная опухоль является карциномой поджелудочной железы, предпочтительно, экзокринной карциномой поджелудочной железы.
Согласно одному из вариантов осуществления, эпителиальная опухоль представляет собой карциному молочной железы, предпочтительно, трижды негативный рак груди (TNBC). В одном из вариантов осуществления, карцинома молочной железы является трижды негативным раком груди, и заболевание является рецидивирующим или не реагирует на стандартную терапию.
Согласно другому варианту осуществления, эпителиальная опухоль является карциномой желудочно-кишечного тракта, например, карциномой ободочной кишки.
Согласно другому варианту осуществления, кортексолона 17α-валерат предназначен для применения в качестве модулятора глюкокортикоидного рецептора (GR), предпочтительно, антагониста глюкокортикоидов.
Согласно другому аспекту, изобретение относится к фармацевтической композиции, включающей соединение следующей структурной формулы:

и как минимум один физиологически приемлемый эксципиент, для применения в качестве лекарственного средства, предпочтительно, в лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний, необязательно включающих злокачественные новообразования и метастазы. Предпочтительно, указанные опухолевые заболевания являются солидными опухолями, предпочтительно, эпителиальными опухолями, например карциномой простаты; карциномой молочной железы; карциномой поджелудочной железы; карциномой легких; карциномой желудочно-кишечного тракта, например, карциномой ободочной кишки; раком почек; карциномой щитовидной железы; карциномой матки; и карциномой надпочечников.
Согласно другому варианту осуществления, указанная эпителиальная опухоль является карциномой простаты. В другом предпочтительном варианте осуществления изобретения, опухолевое заболевание является раком простаты с мутировавшими или укороченными андрогенными рецепторами. В этом случае, рак простаты, который можно лечить согласно настоящему изобретению, может являться или стать невосприимчивым к антиандрогенной терапии, например, энзалутамиду.
Согласно другому варианту осуществления, эпителиальная опухоль является карциномой поджелудочной железы, предпочтительно, экзокринной карциномой поджелудочной железы.
Согласно другому варианту осуществления, эпителиальная опухоль представляет собой карциному молочной железы, предпочтительно, трижды негативный рак груди (TNBC). В одном из вариантов осуществления, карцинома молочной железы является трижды негативным раком груди, и заболевание является рецидивирующим или не реагирует на обычную терапию.
Согласно еще одному варианту осуществления, эпителиальная опухоль является карциномой желудочно-кишечного тракта, например, карциномой ободочной кишки.
Фармацевтическая композиция может также включать по крайней мере один другой действующий ингредиент, предпочтительно, химиотерапевтический действующий ингредиент, для одновременного, раздельного или последовательного введения.
Согласно другому аспекту, изобретение относится к фармацевтической композиции, включающей соединение следующей структурной формулы:

и как минимум один физиологически приемлемый эксципиент, для применения в качестве модулятора глюкокортикоидного рецептора (GR), предпочтительно, антагониста глюкокортикоидов.
В другом аспекте, изобретение относится к способу лечения предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний у субъекта, которому это необходимо, включающему введение указанному субъекту терапевтически эффективного количества соединения следующей структурной формулы:

или фармацевтической композиции, включающей указанное соединение.
Согласно одному из вариантов осуществления, опухолевые заболевания являются злокачественными новообразованиями или метастазами.
Предпочтительно, субъект является млекопитающим. В наиболее предпочтительном варианте осуществления, млекопитающее является человеком.
Согласно одному из вариантов осуществления, опухолевые заболевания являются солидными опухолями. Необязательно, солидные опухоли являются эпителиальными опухолями. Эпителиальные опухоли могут быть выбраны из карциномы простаты, карциномы молочной железы, карциномы матки, карциномы поджелудочной железы, карциномы легких, карциномы желудочно-кишечного тракта (предпочтительно, карциномы ободочной кишки), рака почек, карциномы щитовидной железы, карциномы матки, карциномы надпочечников и т.п.
Согласно другому варианту осуществления, эпителиальные опухоли представляют собой карциному простаты, карциному поджелудочной железы, экзокринную карциному поджелудочной железы или карциному молочной железы.
Согласно другому варианту осуществления, указанная эпителиальная опухоль является карциномой простаты. В другом предпочтительном варианте осуществления изобретения, опухолевое заболевание является раком простаты с мутировавшими или укороченными андрогенными рецепторами. В этом случае, рак простаты, который можно лечить согласно настоящему изобретению, может являться или стать невосприимчивым к антиандрогенной терапии, например, энзалутамиду.
Согласно другому варианту осуществления, эпителиальная опухоль является карциномой поджелудочной железы, предпочтительно, экзокринной карциномой поджелудочной железы.
Согласно другому варианту осуществления, карцинома молочной железы представляет собой трижды негативный рак груди. В одном из вариантов осуществления, карцинома молочной железы является трижды негативным раком груди, и заболевание является рецидивирующим или не реагирует на стандартную терапию.
Согласно другому варианту осуществления, эпителиальная опухоль является карциномой желудочно-кишечного тракта, например, карциномой ободочной кишки.
Согласно еще одному аспекту, изобретение относится к способу лечения заболевания или расстройства, опосредованного глюкокортикоидами, у субъекта, которому это необходимо, где указанный способ включает введение терапевтически эффективного количества кортексолона 17α-валерата или фармацевтической композиции, включающей кортексолона 17α-валерат.
ПРИМЕРЫ
Пример 1: in vitro противоопухолевая активность кортексолона 17α-бензоата (CB-03-06) в отношении клеточных линий рака простаты
Этот эксперимент проводили для исследования и определения противоопухолевой активности in vitro кортексолона 17α-бензоата в отношении представителей клеточных линий рака простаты LNCaP (AR+) и PC3 (AR-), позитивных или негативных по экспрессии андрогенного рецептора (AR), соответственно.
Методика проведения эксперимента заключалась в следующем:
1. 3000 раковых клеток высевали в 96-лучночные плоскодонные планшеты в полную среду, содержащую 2% бычью сыворотку, очищенную на активированном угле.
2. Через 24 часа к культуре добавляли 10 нМ DHT (дигидротестостерон), содержащий или не содержащий антиандрогенные соединения, или носитель ДМСО (отрицательный контроль).
3. Через 3 дня подсчитывали количество выживших клеток, используя анализ АТФ-зависимой пролиферации.
Цель описанного теста заключалась в определении концентрации, при которой каждое соединение уничтожает 50% раковых клеток (IC50) в перспективе потенциального применения соединения в тесте на животных in vivo.
Данные эксперимента 1 аппроксимировали сигмоидальными кривыми доза-реакция и анализировали, используя программу статистического анализа Prizm. Данные эксперимента 2 анализировали подгонкой кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50, определенные для каждой линии клеток, помещены в приведенной ниже таблице в сравнении с хорошо известными эталонами, применяемыми в настоящее время в лечении рака простаты: наиболее эффективными антиандрогенными стероидами, а именно ципротерона ацетатом (CPA) и энзалутамидом - пероральными ингибиторами андрогенных рецепторов, способными продлить выживание мужчин с метастатическим кастрационно-резистентным раком простаты. Приведены результаты 2 серий экспериментов.
Эксперимент 1
Результаты аппроксимировали сигмоидальными кривыми зависимости реакции от дозы в программе статистического анализа Prizm.
Эксперимент 2
Приведенные ниже результаты получены в ходе экспериментов, дополняющих описанные в эксперименте 1. Результаты анализировали, используя аппроксимацию кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50 демонстрируют, что противоопухолевая активность кортексолона 17α-бензоата, несмотря на тенденцию к слабой корреляции, могла бы считаться не строго зависимой от экспрессии андрогенного рецептора, в отличии от соединений сравнения.
Пример 2: in vitro противоопухолевая активность кортексолона 17α-валерата-21-пропионата (CB-03-10) в отношении клеточных линий рака простаты
Этот эксперимент проводили для исследования и определения противоопухолевой активности in vitro кортексолона 17α-валерата-21-пропионата в отношении представителей клеточных линий рака простаты LNCaP (AR+) и PC3 (AR-), позитивных или негативных по экспрессии AR, соответственно.
Методика проведения эксперимента заключалась в следующем:
1. 3000 раковых клеток высевали в 96-лучночные плоскодонные планшеты в полную среду, содержащую 2% бычью сыворотку, очищенную на активированном угле.
2. Через 24 часа к культуре добавляли 10 нМ DHT (дигидротестостерон), содержащий или не содержащий антиандрогенные соединения, или носитель ДМСО (отрицательный контроль).
3. Через 3 дня подсчитывали количество выживших клеток, используя анализ АТФ-зависимой пролиферации.
Цель описанного теста заключалась в определении концентрации, при которой каждое соединение уничтожает 50% раковых клеток (IC50) в перспективе потенциального применения соединения в тесте на животных in vivo.
Данные эксперимента 1 аппроксимировали сигмоидальными кривыми доза-реакция и анализировали, используя программу статистического анализа Prizm. Данные эксперимента 2 анализировали подгонкой кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50, определенные для каждой линии клеток, помещены в приведенной ниже таблице, в сравнении с хорошо известными эталонами, применяемыми в настоящее время в лечении рака простаты: наиболее эффективными антиандрогенными стероидами, а именно ципротерона ацетатом (CPA) и энзалутамидом - пероральными антагонистами андрогенных рецепторов, способными продлить выживание мужчин с метастатическим кастрационно-резистентным раком простаты. Ниже приведены результаты 2 серий экспериментов.
Эксперимент 1
Результаты аппроксимировали сигмоидальными кривыми зависимости реакции от дозы в программе статистического анализа Prizm.
Эксперимент 2
Приведенные ниже результаты получены в ходе экспериментов, дополняющих описанные в эксперименте 1. Результаты анализировали, используя аппроксимацию кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50 демонстрируют, что противоопухолевая активность кортексолона 17α-валерата-21-пропионата (CB-03-10) возможно коррелирует с экспрессией андрогенного рецептора в клеточных линиях.
Пример 3: in vitro противоопухолевая активность кортексолона 17α-бензоата (CB-03-06) в отношении клеточных линий рака поджелудочной железы
Этот эксперимент проводили для исследования и определения противоопухолевой активности in vitro кортексолона 17α-бензоата в отношении двух клеточных линий опухолей поджелудочной железы Panc1 (AR+) и MiaPaca2 (низкая экспрессия AR), т.е. представителей клеточных линий рака поджелудочной железы.
Эти линии также подразделяли на позитивные (AR+) или с низкой экспрессией (AR+/-)/негативные (AR-), согласно присутствию и экспрессии андрогенных рецепторов.
Методика проведения эксперимента заключалась в следующем:
1. 3000 раковых клеток высевали в 96-лучночные плоскодонные планшеты в полную среду, содержащую 2% бычью сыворотку, очищенную на активированном угле.
2. Через 24 часа к культуре добавляли 10 нМ DHT (дигидротестостерон), содержащий или не содержащий антиандрогенные соединения, или носитель ДМСО (отрицательный контроль).
3. Через 3 дня подсчитывали количество выживших клеток, используя анализ АТФ-зависимой пролиферации.
Цель описанного теста заключалась в определении концентрации, при которой каждое соединение уничтожает 50% раковых клеток (IC50) в перспективе потенциального применения соединения в тесте на животных in vivo.
Данные эксперимента 1 аппроксимировали сигмоидальными кривыми доза-реакция и анализировали, используя программу статистического анализа Prizm. Данные эксперимента 2 анализировали подгонкой кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50, определенные для каждой линии клеток, помещены в приведенной ниже таблице в сравнении с хорошо известными эталонами, применяемыми в настоящее время в лечении рака простаты: наиболее эффективными антиандрогенными стероидами, а именно ципротерона ацетатом (CPA) и энзалутамидом -пероральными антагонистами андрогенного рецептора, способными продлить время выживания у мужчин с метастатическим кастрационно-резистентным раком простаты. Результаты двух серий экспериментов приведены ниже.
Эксперимент 1
Результаты аппроксимировали сигмоидальными кривыми зависимости реакции от дозы в программе статистического анализа Prizm.
Эксперимент 2
Приведенные ниже результаты получены в ходе экспериментов, дополняющих описанные в эксперименте 1. Результаты анализировали, используя аппроксимацию кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50 демонстрируют, что противоопухолевая активность кортексолона 17α-бензоата (CB-03-06) по крайней мере вдвое выше, чем активность соединений сравнения (CPA и энзалутамида), и что отсутствует корреляция с экспрессией андрогенного рецептора в клеточных линиях. Поскольку клетки MiaPaca2 характеризуются низкой/нулевой экспрессией AR, противораковая активность соединения не находится в прямой корреляции с экспрессией андрогенного рецептора в линиях раковых клеток.
Пример 4: in vitro противоопухолевая активность кортексолона 17α-валерата-21-пропионата (CB-03-10) в отношении клеточных линий рака поджелудочной железы
Этот эксперимент проводили с целью исследования и определения противоопухолевой активности in vitro кортексолона 17α-валерата-21-пропионата в отношении клеточных линий опухолей поджелудочной железы, а именно Panc1 (AR+) и MiaPaca2 (низкая экспрессия AR), т.е. представителей клеточных линий рака поджелудочной железы.
Эти линии также подразделяли на позитивные (AR+) или с низкой экспрессией (AR+/-)/негативные(AR-), исходя из присутствия и экспрессии андрогенных рецепторов.
Методика проведения эксперимента заключалась в следующем:
1. 3000 раковых клеток высевали в 96-лучночные плоскодонные планшеты в полную среду, содержащую 2% бычью сыворотку, очищенную на активированном угле.
2. Через 24 часа к культуре добавляли 10 нМ DHT (дигидротестостерон), содержащий или не содержащий антиандрогенные соединения, или носитель ДМСО (отрицательный контроль).
3. Через 3 дня подсчитывали количество выживших клеток, используя АТФ-зависимый анализ пролиферации.
Цель описанного теста заключалась в определении концентрации, при которой каждое соединение уничтожает 50% раковых клеток (IC50), в перспективе потенциального применения соединения в тесте на животных in vivo.
Данные эксперимента 1 аппроксимировали сигмоидальными кривыми доза-реакция и анализировали, используя программу статистического анализа Prizm. Данные эксперимента 2 анализировали подгонкой кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50, определенные для каждой линии клеток, помещены в приведенной ниже таблице в сравнении с хорошо известными эталонами: наиболее эффективными антиандрогенными стероидами, а именно ципротерона ацетатом (CPA) и энзалутамидом - пероральными антагонистами андрогенного рецептора, способными продлить время выживания у мужчин с раком. Ниже приведены результаты 2 серий экспериментов.
Эксперимент 1
Результаты аппроксимировали сигмоидальными кривыми зависимости реакции от дозы в программе статистического анализа Prizm.
Эксперимент 2
Приведенные ниже результаты получены в ходе экспериментов, дополняющих описанные в эксперименте 1. Результаты анализировали, используя аппроксимацию кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50 демонстрируют, что противоопухолевая активность кортексолона 17α-валерата-21-пропионата не коррелирует с экспрессией андрогенного рецептора на клеточных линиях рака поджелудочной железы.
Пример 5: in vivo ксенотрансплантат человеческой опухоли поджелудочной железы у мышей
Влияние кортексолона 17α-бензоата (CB-03-06) на рост ксенотрансплантата опухоли поджелудочной железы у самцов голых (бестимусных) мышей оценивали в сравнении с наиболее эффективным антиандрогенным стероидом ципротерона ацетатом (CPA).
Кортексолона 17α-бензоат и ципротерона ацетат отдельно разбавляли смесью ДМСО/2-гидроксипропил β-циклодекстрин (носитель).
В исследовании осуществляли сравнение противоопухолевой активности кортексолона 17α-бензоата в двух различных дозировках (8,0 мг/кг, что соответствует примерно 230 мкМ, и 40 мг/кг, что соответствует примерно 1150 мкМ), с активностью носителя (т.е. 0,4% (объем/объем) tween 80 и 0,5% (масса/объем) карбоксиметилцеллюлозы в нормальном солевом растворе) и с активностью препарата сравнения ципротерона ацетата в двух различных дозировках (7,4 мг/кг и 37 мг/кг).
1×106 клеток MiaPaca-2, суспендированных в матригеле, вводили подкожной инъекцией бестимусным голым мышам в возрасте 6 недель.
Введение тестируемых соединений, носителя и соединения сравнения начинали в момент, когда объем опухоли после трансплантации достигал 50 мм3. Все соединения вводили инъекцией в объеме 100 мкл/мышь раствора с низкой дозировкой (примерно 230 мкМ) или 100 мкл/мышь раствора с высокой дозировкой (примерно 1150 мкМ) кортексолона 17α-бензоата, носителя и ципротерона ацетата, соответственно. Соединения и контрольные растворы вводили подкожно в ежедневном режиме в течение 28 дней.
Измерение опухолей проводили каждые 4 дня с помощью цифрового штангенциркуля.
Результаты приведены на фиг.1 в виде среднего изменения объема опухоли относительно начала введения препарата. Объем опухоли вычисляли по формуле 0,5236(r1)2(r2), где r1
Отрезки, обозначающие ошибки, отображают SEM для 7-10 животных на группу. Значения P вычисляли согласно критерию Стьюдента.
Высокая доза кортексолона 17α-бензоата позволяла удерживать объем опухоли поджелудочной железы в пределах менее, чем 5-кратного увеличения относительно объема опухоли при начале введения. В противоположность этому, средний объем опухоли в группах, получавших носитель и ципротерона ацетат, возрастал до 12 раз. Из полученных данных очевидна противоопухолевая активность соединения по настоящему изобретению, а именно кортексолона 17α-бензоата.
Пример 6: in vivo ксенотрансплантат человеческой опухоли поджелудочной железы у мышей
Активность кортексолона 17α-валерата-21-пропионата (CB-03-10) в модели ксенотрансплантата опухоли поджелудочной железы у самцов голых мышей оценивали в сравнении с антиандрогенным стероидом ципротерона ацетатом (CPA).
Кортексолона 17α-валерат-21-пропионат и ципротерона ацетат отдельно разбавляли смесью ДМСО/2-гидроксипропил β-циклодекстрин (носитель).
В исследовании осуществляли сравнение противоопухолевой активности кортексолона 17α-валерата-21-пропионата в двух различных дозировках (примерно 8,6 мг/кг и 43 мг/кг), с активностью носителя (т.е. 0,4% (объем/объем) tween 80 и 0,5% (масса/объем) карбоксиметилцеллюлозы в нормальном солевом растворе) и с активностью препарата сравнения ципротерона ацетата в двух различных дозировках (7,4 мг/кг и 37 мг/кг).
1×106 клеток MiaPaca-2, суспендированных в матригеле, вводили подкожной инъекцией бестимусным голым мышам в возрасте 6 недель.
Введение тестируемых соединений, носителя и соединения сравнения начинали в момент, когда объем опухоли после трансплантации достигал 50 мм3, осуществляя подкожную инъекцию в объеме 100 мкл/мышь раствора с низкой дозировкой (примерно 230 мкМ) или 100 мкл/мышь раствора с высокой дозировкой (примерно 1150 мкМ) кортексолона 17α-валерата-21-пропионата, носителя и ципротерона ацетата, соответственно. Соединения и контрольные растворы вводили подкожно в ежедневном режиме в течение 28 дней. Измерение опухолей проводили каждые 4 дня с помощью цифрового штангенциркуля.
Результаты отображены на фиг.2 в виде среднего изменения объема опухоли относительно начала введения препаратов. Объем опухоли вычисляли по формуле 0,5236(r1)2(r2), где r1
Отрезки, обозначающие ошибки, отображают SEM для 7-10 животных на группу. Значения P вычисляли согласно критерию Стьюдента.
Кортексолона 17α-валерат-21-пропионат позволял удерживать объем опухоли поджелудочной железы в пределах менее, чем 5-кратного увеличения относительно объема опухоли при начале введения. Кроме того, когда введение препаратов прекращали, наблюдалась тенденция к повторному увеличению объема опухоли, но с меньшей скоростью и до меньших размеров. В противоположность этому, средний объем опухоли в группах, получавших носитель и ципротерона ацетат, возрастал до 12 раз и более, что приводило к необходимости умерщвления некоторых животных из этих групп по соображениям гуманизма. Из полученных данных очевидна противоопухолевая активность соединения по настоящему изобретению, а именно кортексолона 17α-валерата-21-пропионата.
Данные примеров 5 и 6 подтвердили in vivo противоопухолевую активность кортексолона 17α-бензоата и кортексолона 17α-валерата-21-пропионата против опухолей поджелудочной железы, причем оба указанных соединения обладали противоопухолевой активностью, превышающей активность ципротерона ацетата в той же животной модели (смотрите Фиг.3 и 4).
Пример 7: in vitro терапевтический индекс для клеточных линий рака поджелудочной железы
Для оценки безопасности соединений, которые предполагалось тестировать в экспериментах по выживаемости клеточных линий, должны быть учтены все факторы, оказывающие влияние на выживаемость и жизнеспособность клеток. В этом отношении действительно важна оценка собственной токсичности соединений и соединений сравнения. Отношение IC50 соединений для мононуклеарных клеток периферической крови (PBMC) и IC50 для клеток раковых линий представляет собой терапевтический индекс, и оно показывает насколько безопасно тестируемое соединение.
Значение IC50 для PBMC определяли в двух различных состояниях активации:
активированные - активно делящиеся клетки
покоящиеся - находящиеся в состоянии покоя, не делящиеся клетки.
Результаты приведены в помещенных ниже по тексту таблицах, которые относятся, соответственно, к активированным PBMC и покоящимся PBMC:
IC50 (микроМ) для активированных PBMC
Эксперимент 1
Эксперимент 2
Параллельно повторяли те же эксперименты на покоящихся PBMC и получали приведенные ниже по тексту результаты
IC50 (микроМ) для покоящихся PBMC
Эксперимент 1
Эксперимент 2
Полученные значения терапевтических индексов (TI), вычисленных для активированных PBMC, приведены в помещенных ниже таблицах:
TI для активированных PBMC
Эксперимент 1
Эксперимент 2
Полученные значения терапевтических индексов, вычисленные для покоящихся PBMC, приведены в помещенных ниже по тексту таблицах:
TI для покоящихся PBMC
Эксперимент 1
Эксперимент 2
В этих таблицах, значение 0 указывает на более высокую токсичность для PBMC, чем для линий раковых клеток.
Пример 8: in vitro противоопухолевая активность кортексолона 17α-бензоата и кортексолона 17α-валерата-21-пропионата (CB-03-10) в отношении клеточных линий эпителиального рака кишечника
Этот эксперимент проводили для исследования и определения противораковой активности in vitro кортексолона 17α-бензоата и кортексолона 17α-валерата-21-пропионата в отношении клеточных линий, являющихся представителями эпителиальных кишечных опухолей, а именно HT29. Методика проведения эксперимента состояла в следующем:
1. Монослой клеток HT-29 помещали в 96-луночные планшеты при плотности 2×104 клеток/мл. После распределения клетки хранили при 37°C в 5% CO2 и оставляли для прикрепления к стенкам в течение 24 ч.
2. Затем клетки инкубировали в течение 72 ч с тестируемыми соединениями при концентрации каждого из них 0,16, 0,8, 4, 20, 100 и 500 мМ.
3. Через 72 часа после обработки осуществляли колориметрический анализ MTT.
Цель данного теста заключалась в определении концентрации, при которой каждое соединение уничтожает 50% раковых клеток (IC50), ввиду потенциального применения соединения в тесте на животных in vivo.
Данные анализировали используя аппроксимацию кривых с помощью нелинейной регрессии по методу наименьших квадратов в программе статистического анализа Prizm.
Значения IC50, найденные для каждой клеточной линии, приведены в помещенной ниже таблице.
Ингибирование(%) при различных концентрациях в микромолях для двух соединений на клеточной линии HT29
Значения IC50, вычисленные для двух указанных соединений (приведены ниже по тексту), показывают, что оба соединения демонстрируют очевидную противораковую активность в отношении клеток HT29.
Вычисленные значения IC50 (концентрация в микромолях)
Пример 9: in vitro терапевтический индекс для клеточных линий эпителиального рака кишечника
Для оценки безопасности соединений, которые предполагалось тестировать в экспериментах по выживаемости клеточных линий, должны быть учтены все факторы, оказывающие влияние на выживаемость и жизнеспособность клеток. В этом отношении действительно важна оценка собственной токсичности соединений и соединений сравнения. Отношение IC50 соединений для мононуклеарных клеток периферической крови (PBMC) и IC50 для клеток раковых линий представляет собой терапевтический индекс, т.е. параметр, важный для определения эффективности продукта в безопасных условиях.
Значение IC50 для PBMC определяли в двух различных состояниях активации:
активированные - активно делящиеся клетки
покоящиеся - находящиеся в состоянии покоя, не делящиеся клетки.
Полученные значения терапевтических индексов (TI), вычисленные для активированных и покоящихся PBMC, приведены в помещенных ниже по тексту таблицах:
Эксперимент 1
Эксперимент 2
Приведенные данные для соединения по настоящему изобретению, а именно кортексолона 17α-валерата-21-пропионата, подтвердили его безопасность и противоопухолевую активность против линий клеток эпителиального рака кишечника.
Пример 10: Синтез кортексолона 17α-бензоата
Кортексолона 17α-бензоат получали по схеме синтеза, включающей следующие стадии:

На стадии 1 кортексолон растворяли в подходящем растворителе (например, этилацетате). В каталитическом количестве добавляли тозилат пиридиния или п-толуолсульфоновую кислоту (1-10 мольн.%), и затем триалкил ортобензоат (R=метил или R=этил). Реакционную смесь нагревали до 80°C в течение 3-6 часов.
После удаления растворителя и кристаллизации в спиртовом растворителе, получали кортексолона ортобензоат 1 в виде твердого вещества.
На стадии 2, кортексолона ортобензоат 1 (R=метил или R=этил) растворяли в спиртовом растворителе (например, метаноле) и обрабатывали 0,1н уксусным буфером при кипячении с обратным холодильником. После удаления растворителя, остаток очищали обработкой деминерализованной водой и выделяли кортексолона 17α-бензоат в виде твердого вещества.
Пример 11: Синтез кортексолона 17α-валерата-21-пропионата
Кортексолона 17α-валерат-21-пропионат получали согласно приведенной ниже схеме синтеза:
Стадия 1: кортексолон растворяли в подходящем растворителе (например, этилацетате). В каталитическом количестве добавляли тозилат пиридиния или п-толуолсульфоновую кислоту (1-10 мольн.%), и затем триалкил ортовалерат (R=метил или R=этил). Реакционную смесь нагревали до 80°C в течение 3-5 часов, и после удаления растворителя и кристаллизации в спиртовом растворителе, получали кортексолона ортовалерат 1.
На стадии 2, кортексолона ортовалерат 1 (R=метил или R=этил) растворяли в спиртовом растворителе (например, метаноле) и обрабатывали 0,1н уксусным буфером (pH 3-3,9) при кипячении с обратным холодильником. После удаления растворителя и последующей обработки очищенной водой, выделяли кортексолона 17α-валерат 2 в виде твердого вещества.
На стадии 3, кортексолона 17α-валерат 2 растворяли в пиридине и добавляли 1 эквивалент пропионилхлорида. По окончании реакции, смесь разбавляли водой, выделяли продукт 3 в виде твердого вещества и очищали кристаллизацией из спиртов.
Пример 12: Исследование in vitro противораковой активности производных кортексолона, в т.ч. CB-03-06
Исследовали способность ряда производных кортексолона, и в том числе CB-03-06, подавлять рост клеток раковых линий in vitro.
Клетки раковых линий высевали в количестве 3000 клеток в 96-луночные плоскодонные планшеты в полной среде, содержащей 2% бычью сыворотку, очищенную на активированном угле. Через 24 часа добавляли тестируемые соединения или ДМСО/носитель (конечная концентрация 0,1% в качестве отрицательного контроля). В качестве положительного контроля цитотоксичности для клеток использовали ципротерона ацетат (CPA) и энзалутамид, т.е. два мощных хорошо известных антиандрогена. Через 3 дня определяли количество выживших клеток, используя АТФ-зависимый анализ выживаемости клеток (Promega Cell Titer Glo). На фиг.5 показаны результаты определения цитотоксичности производных кортексолона в зависимости от дозы для клеточных линий опухолей простаты и поджелудочной железы человека.
Осуществляли определение концентрации, при которой каждое соединение уничтожает 50% раковых клеток (IC50), характеризующей способность CB-03-06 и других соединений подавлять рост раковых клеток. Концентрацию каждого соединения меняли от 3 мкМ до 200 мкМ. Через 3 дня определяли количество выживших клеток, используя АТФ-зависимый анализ пролиферации. Данные, приведенные в таблице I, анализировали, используя аппроксимацию кривых нелинейной регрессией по методу наименьших квадратов в программе статистического анализа Prizm.
Таблица I: IC50 для производных кортексолона при тестировании in vitro на клеточных линиях рака простаты и поджелудочной железы
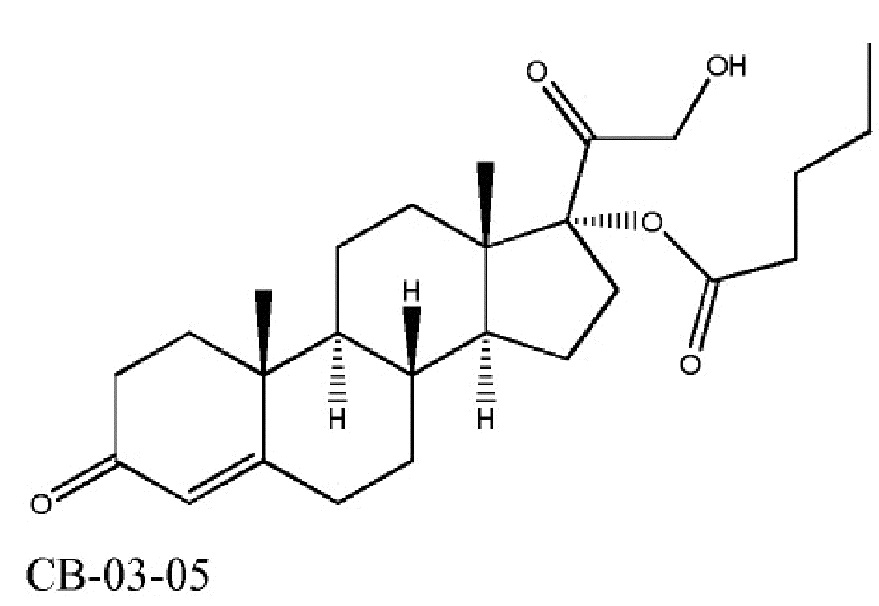


Из данных, показанных на Фиг.5 и в таблице I, ясно, что производные кортексолона уничтожают раковые клетки при различных концентрациях и c различными IC50. CB-03-06 уничтожает клетки рака простаты (панель a) лучше, чем мощный антиандроген CPA. Более важно, что они подавляют рост клеток рака простаты in vitro лучше, чем энзалутамид (панель b), т.е. новый и мощный антиандрогенный препарат, применяемый в настоящее время в клинической практике, в качестве препарата первого выбора для андроген-зависимого рака простаты.
Интересно отметить, что CB-03-06 ингибирует рост клеточных линий рака поджелудочной железы (панель b), которые, как известно, экспрессируют очень низкие уровни андрогенного рецептора. Эти данные позволяют предположить наличие независимого механизма действия, связанного с цитотоксичностью, отличающегося от антиандрогенной активности.
Пример 13: Исследование экспрессии андрогенного рецептора (AR) на тестируемых линиях раковых клеток
Проводили анализ FACS клеточных линий рака простаты и поджелудочной железы, приведенных в таблице I, для лучшего понимания взаимосвязи между экспрессией AR на линиях раковых клеток и способностью производных кортексолона, в т.ч. CB-03-06, подавлять рост раковых клеток.
На фиг.6 показаны уровни экспрессии AR на исследованных раковых клетках. Как и ожидалось, результаты FACS анализа экспрессии AR на клеточных линиях рака простаты и поджелудочной железы согласуются с опубликованными уровнями экспрессии: LNCaP>Panc1>PC3=MiaPaca2.
Для лучшего выявления корреляции между AR и IC50, таблица I дополнена данными по уровням экспрессии AR на протестированных линиях раковых клеток (Таблица II).
Таблица II: экспрессия AR на линиях раковых клеток простаты и поджелудочной железы, и IC50 производных кортексолона
Как и ожидалось, подавление роста, продемонстрированное мощными антиандрогенами CPA и энзалутамидом, коррелирует с экспрессией AR на клеточных линиях рака простаты. Ингибирующая активность CB-03-06 также находится в корреляции (менее строгой) с экспрессией AR на клетках рака простаты. Однако для раковых клеток поджелудочной железы присутствует обратная корреляция между экспрессией AR и ингибирующим действием. Все протестированные соединения оказались более активными в отношении клеток MiaPaca2 (AR+/-) с более низкой экспрессией AR, по сравнению с клетками Panc1 (AR+). Этот результат указывает на возможный AR-независимый механизм действия в случае рака поджелудочной железы. CB-03-06 является наиболее эффективным соединением в ряду исследованных производных кортексолона. Важно отметить, что CB-03-06 превосходит CPA для всех 4 протестированных линий раковых клеток. CB-03-06 также является более эффективным, чем энзалутамид в отношении клеточных линий рака простаты.
Пример 14: Исследование in vitro противораковой активности производных кортексолона, в т.ч. CB-03-06, на более широком наборе образцов линий раковых клеток, полученных из солидных опухолей
Поскольку оказалось, что цитотоксическая активность CB-03-06, по-видимому, не зависит от экспрессии AR, был протестирован более широкий набор образцов солидных опухолей. К предыдущему набору клеток были добавлены MCF7, т.е. клеточная линия рака груди (AR+/-), еще одна клеточная линия поджелудочной железы с более высокой экспрессией AR (BxPC3) и линия клеток рака кишечника (HT29) (AR-). Результаты отображены в таблице III.
Таблица III: IC50 производных кортексолона для линий раковых клеток, характеризующихся экспрессией AR
CB-03-06 значительно ослабляет выживаемость клеток широкого спектра раковых линий, происходящих из эпителиальных тканей различных органов. Цитотоксическая активность соединений не коррелирует с экспрессией андрогенного рецептора. Также отсутствует корреляция с экспрессией дикого типа (WT). Кроме того, для всех протестированных линий раковых клеток CB-03-06 оказался более эффективным, чем энзалутамид.
Пример 15: Терапевтический индекс производных кортексолона для различных линий раковых клеток
Терапевтически индекс (TI) (также именуемый терапевтическим окном или окном безопасности или, в некоторых случаях, терапевтическим отношением) представляет собой отношение количества терапевтического агента, которое вызывает терапевтический эффект, к количеству, которое проявляет токсическое действие. Определяли IC50 соединений для свежих клеток, выделенных из человеческой крови (PBMC). Токсичность соединений определяли по следующей формуле:
Терапевтический индекс=Безопасность/эффективность=IC50 для активированных PBMC/IC50 для раковых клеток
Результаты показаны в таблице IV
Таблица IV: Терапевтические индексы производных кортексолона для ряда линий раковых клеток
Все производные кортексолона демонстрируют устойчивый профиль безопасности. CB-03-06 демонстрирует наиболее высокий терапевтический индекс. Эти данные показывают, что CB-03-06 имеет более безопасный профиль по сравнению с CPA и энзалутамидом.
Пример 16: Сродство CB-03-06 к связыванию с андрогенным рецептором
Предыдущие эксперименты продемонстрировали значительную цитотоксическую активность CB-03-06 в отношении линий раковых клеток, полученных из опухолей различного происхождения. Цитотоксическая активность не полностью коррелирует с экспрессией андрогенного рецептора на тестируемых раковых клетках.
Исходя из этих данных, были разработаны исследования для определения сродства соединения к андрогенному рецептору (AR). Для определения относительного сродства CB-03-06 к связыванию с AR дикого типа, проводили конкурентный анализ, в котором использовали набор Polar Screen компании Life Technologies. Вкратце, AR добавляли к флуоресцентному андрогенному лиганду (FluormoneTM AL Green) с образованием комплекса AR-LBD. Конкурирующие вещества замещали флуоресцентный лиганд FluormoneTM AL Green в комплексе AR-LBD, что приводило к быстрой потере устойчивости флуоресцентного лиганда за время жизни флуоресценции, что приводило к низкой величине поляризации. Не конкурирующие вещества не замещали флуоресцентный лиганд в комплексе, в результате чего величина поляризации оставалась высокой. Изменение величины поляризации в присутствии тестируемых соединений использовали для определения относительного сродства тестируемых соединений к AR-LBD.
Сродство CB-03-06 к связыванию с рецептором AR составляло 2,6E-06 (IC50 моль). В том же самом анализе, сродство дигидротестостерона (обладающего мощным связыванием с рецептором AR) составляло 1,1E-08.
Сродство CB-03-06 к связыванию с рецептором AR по сравнению со сродством DHT является низким, что характеризует CB-03-06 как вещество, потенциально способное к связыванию с AR.
Пример 17: Транскрипционное влияние CB-03-06 на глюкокортикоидный рецептор
Андрогены и глюкокортикоидные гормоны вызывают разнообразные и часто противоположные эффекты в клетках, тканях и организмах животных. Широкий спектр физиологических и молекулярно-биологических данных позволяет предположить, что рецепторы, которые опосредуют эти эффекты, т.е. андрогенные и глюкокортикоидные рецепторы (AR и GR, соответственно) влияют на транскрипционную активность друг друга. Антагонистическую и агонистическую активность CB-03-06 в отношении GR исследовали в анализе in vitro. Вкратце, эпителиальные клетки человеческих почек трансфецировали ДНК-конструкцией, включающей сайты связывания GR, соединенные с люминесцентной репортерной молекулой. Через 24 часа клетки обрабатывали в антагонистических или агонистических условиях. Еще через 24 часа, производили измерение люминесценции, которая была пропорциональная транскрипционной активности агониста GR.
Анализ антагонистической активности был основан на подавлении люминесценции, вызванной дексаметазоном (Dex).
Антагонистическую активность CB-03-06 сравнивали с известным антагонистом GR, а именно мифепристоном (именуемым также RU486), как показано на Фиг.7.
Анализ агонистической активности был основан на инициировании люминесценции под действием CB-03-06. Агонистическую активность CB-03-06 сравнивали с RU486, который, как известно, не обладает агонистической активностью. Результаты показаны на Фиг.8.
Как показано на Фиг.7, CB-03-06 не является очень мощным антагонистом (в 100 раз слабее, чем RU486). В противоположность этому, CB-03-06 является мощным агонистом GR, активируя GR в концентрации 1,4E-08 M, в той же степени, как и Dex в концентрации 4,6E-09 M. CB-03-06 не является таким же мощным агонистом, как Dex, поскольку его активность достигает максимум 45% активности Dex. В качестве вывода, можно сказать, что CB-03-06 является слабым антагонистом GR и хорошим агонистом GR.
Пример 18: Инициирование апоптоза и ареста клеточного цикла CB-03-06
Было показано, что большинство цитотоксичных противораковых препаратов, применяемых в настоящее время, вызывают апоптоз в восприимчивых клетках. Тот факт, что самые разнообразные агенты, которые взаимодействуют с различными мишенями, вызывают смерть клеток с некоторыми общими признаками, позволяет предположить, что цитотоксичность определяется способностью клеток противостоять т.н. «запрограммированной» клеточной смерти. Исследовали действие CB-03-06, чтобы определить, опосредован ли механизм цитотоксического действия на клетки раковых линий апоптозом и арестом клеточного цикла. Клетки раковых линий высевали в 6-луночные плоскодонные планшеты. Через 24 часа добавляли тестируемые соединения или носитель ДМСО (отрицательный контроль). Еще через 24 часа клетки соскабливали, окрашивали Аннексином V, конъюгированным с флуоресцеином, и пропидий йодидом, и анализировали проточной цитометрией.
Фиг.9 явно показывает, что CB-03-06 способен вызвать апоптоз клеток раковой линии поджелудочной железы MiaPaca2. CB-03-06 вызывает апоптоз в общей сложности в 56% клеток (ранний и поздний апоптоз) против лишь 12% в случае контроля.
Апоптоз может возникать в точках перехода G1/S или G2/M клеточного цикла. Клетки обрабатывали CB-03-06 в течение 24 часов, затем фиксировали параформальдегидом и окрашивали пропидий йодидом. Данные на Фиг.10 показывают, что CB-03-06 вызывает блокирование S-фазы при более низких концентрациях, а затем блокирование G2/M в более высоких концентрациях. Отсутствие блокирования G1 указывает на отсутствие влияния на белок p53. Блокирование S и G2/M может указывать на влияние на молекулы, связанные с контрольными точками клеточного цикла. В случае S фазы, возможной мишенью является циклин-зависимая киназа 2 (CDK2). Гемзар и цисплатин являются примерами препаратов, которые действуют на S фазе. В случае фазы G2 возможной мишенью является CDK1.
Пример 19: Анализ стимулирования каспазы под действием CB-03-06
В предыдущих экспериментах, с использованием окрашивания клеток MiaPaca2 Аннексином V, было установлено, что CB-03-06 вызывает апоптоз. Для более тщательного исследования этого явления, измеряли ферментную активность каспазы 8 (инициирующей каспазы для внешнего пути апоптоза) и каспазы 9 (инициирующей каспазы для внутреннего пути апоптоза), а также каспаз 3 и 7 (эффекторных каспаз).
С этой целью клетки MiaPaca2 высевали в 96-луночные плоскодонные культуральные планшеты. Через 24 часа в лунки добавляли тестируемые соединения. Гемцитабин (известный химиотерапевтический агент для лечения рака поджелудочной железы) и ДМСО использовали в качестве положительного и отрицательного контроля, соответственно. Использовали три временных отрезка инкубирования: 8, 24 и 48 часов. По окончании каждого из этих сроков, клетки подвергали лизису в мультиплексном буфере, содержащем субстрат каспазы 3/7, смешанный с реагентами для определения каспазы 8 или каспазы 9, которые содержали стабильную люциферазу, в собственных буферах. Лизаты переносили в белые непрозрачные 96-луночные планшеты, и затем измеряли люминесценцию на приборе Tecan Safire. Планшеты с параллельными экспериментами, обработанные идентичным образом, использовались для определения выживания клеток. Активность всех каспаз корректировали согласно количеству выживших клеток. Результаты показаны на Фиг.11.
Активность каспаз 8 и 9 (панели A и B) стимулировалась CB-03-06. Это стимулирование являлось быстрым, дозозависимым и очевидным уже через 8 часов, и приводило к значительному 7-кратному увеличению активности относительно контроля.
Гемцитабин (известный химиотерапевтический агент, применяемый для лечения рака поджелудочной железы) также вызывал активность каспаз 8 и 9, но с отсроченной и менее сильной реакцией по сравнению с CB-03-06. 2,3-кратное увеличение активности каспазы 8 и 9 не наблюдалось до 48-часовой отметки.
Каспазы 3/7 (панель C) также подвергались сильному стимулированию под действием CB-03-06 после 48-часового инкубирования. Интересно отметить, что CB-03-05 не продемонстрировал хорошего профиля активации каспазы.
Аналогичные анализы повторяли с использованием клеток линии рака простаты LNCaP. В этом анализе, положительным контролем служил энзалутамид, эффективный и новый антиандроген, применяемый в настоящее время в клинической практике для лечения пациентов с раком простаты. Результаты показаны на фиг.12 после 24-часового инкубирования, когда активность каспазы достигала максимума.
Фиг.12 явно демонстрирует, что CB-03-06 стимулировал активность инициирующих (8 и 9) и эффекторных (3/7) каспаз лучше, чем энзалутамид (положительный контроль).
Эти результаты продемонстрировали сильное стимулирование активности каспаз в клеточных линиях рака простаты под действием CB-03-06, оказывающее влияние как на внутренний, так и на внешний пути апоптоза, что подтверждает ингибирование, наблюдаемое на клеточной линии MiaPaca2.
Пример 20: in vitro метаболизм CB-03-06 в плазме крысы и человека
Для получения определенного представления о метаболизме CB-03-06 в человеческой и крысиной плазме был разработан специальный анализ. Вкратце, соединение инкубировали в течение различных периодов времени в человеческой и крысиной плазме при 37°C. После инкубирования, образцы тестировали на наличие не подвергшегося метаболизму соединения с помощью жидкостной хроматографии. Изменение концентрации с течением времени показано на фиг.13.
Полученный результат демонстрирует, что через 8 часов в плазме сохраняется более 90% первоначальной концентрации CB-03-06, а в плазме крысы исследуемое вещество разрушается быстрее по сравнению с человеческой плазмой.
Пример 21: Исследование фармакокинетики CB-03-06 in vivo в животной модели (мыши)
Оценивали фармакокинетику CB-03-06 в плазме мыши после внутривенного (IV), подкожного (SC) и перорального введения (PO).
Мышам (3 животных на группу) вводили указанные ниже дозы действующего вещества и отбирали кровь в указанные моменты времени. Образцы плазмы анализировали с помощью ВЭЖХ-МС/МС.
Реальное воздействие CB-03-06 на организм (которое отображается значением AUC) является самым высоким после подкожного введения (1620 ч*нг/мл), уменьшается до 50% при внутривенном введении (896) и до 17% при пероральном введении (276).
Пример 22: in vivo тестирование CB-03-06 в мышиной модели ксенотрансплантата рака поджелудочной железы человека (клеточная линия MiaPaca2)
В предыдущих исследованиях было установлено, что CB-03-06 сильно подавляет рост клеточной линии рака поджелудочной железы MiaPaca2 (AR+/-) in vitro. Проводили исследование для выяснения того, можно ли перенести этот результат на in vivo модель ксенотрансплантата рака поджелудочной железы. В качестве контроля использовали ципротерона ацетат (CPA) -хорошо известный антиандроген. Вкратце, 1×106 клеток MiaPaca2, суспендированных в матригеле, вводили подкожной инъекцией (SC) бестимусным голым мышам в возрасте 6 недель. Размеры опухолей измеряли каждые 4 дня цифровым штангенциркулем. Объем опухоли вычисляли по формуле 0,5236(r1)2(r2), где r1
Как видно из Фиг.15, CB-03-06 демонстрирует статистически достоверную активность против опухолей поджелудочной железы, по сравнению с контролем. Кроме того, эксперименты показали достоверную противоопухолевую активность (p<0,5) при сравнении с только носителем или CPA (результаты не показаны).
Во время введения CB-03-06 позволял сохранить менее, чем 5-кратное увеличение размера опухоли относительно исходной величины. В противоположность этому, средний размер в группах носителя или CPA увеличивался до 12 раз. Помимо подавления роста опухоли, CB-03-06 благоприятно воздействовал на выживание мышей. Медианная выживаемость составляла 70 дней для мышей, получавших CB-03-06, по сравнению с 60 днями для мышей, получавших носитель, или 40 днями для CPA. Эта разница является достоверной, причем риск смерти в группе, получавшей носитель, от 2 до 4 раз выше.
Пример 23: in vivo исследование действия CB-03-10 при пероральном введении в мышиной модели ксенотрансплантата человеческого рака простаты (клетки LNCaP)
В проведенных ранее исследованиях было установлено, что CB-03-06 эффективен также для подавления роста клеточной линии рака простаты LNCaP in vitro. Проводили исследование, позволяющее выяснить можно ли перенести этот результат на in vivo модель ксенотрансплантата рака простаты. 3×106 клеток LNCaP, суспендированных в матригеле, вводили подкожной инъекцией (в правый бок) самцов голых бестимусных мышей в возрасте 6 недель. Размеры опухолей измеряли, как описано выше. Введение CB-03-06 и контрольных соединений начинали после того, как размер опухоли достигал 50 мм3. Составы для введения готовили в смеси 15% витамин E-TPGS и 65% 0,5% масса/объем раствора CMC в 20 мМ цитратном буфере (pH 4). Пероральное введение проводили ежедневно (100 мг/кг в объеме 200 мкл/мышь) в течение 28 последовательных дней. Результаты наносили на график в виде среднего изменения объема опухоли относительно начала введения. На фиг.16 показаны результаты, полученные для перорального введения CB-03-06 в in vivo модели ксенотрансплантата рака простаты. В качестве положительного контроля использовали энзалутамид, который является новым и эффективным антиандрогеном.
Результаты перорального введения CB-03-06 продемонстрировали значительную активность против рака простаты. Эта ингибирующая активность была почти идентична активности энзалутамида, который является лекарственным средством, применяемым в настоящее время для лечения андроген-зависимого рака простаты у людей.
Пример 24: in vitro ингибирование секреции простат-специфического антигена (PSA) из клеток рака простаты LNCaP под действием CB-03-06
Простат-специфический антиген или PSA представляет собой белок, продуцируемый клетками предстательной железы. В тесте на PSA измеряется уровень PSA в крови мужчины. Уровень PSA часто повышен у мужчин с раком простаты и это используется в качестве суррогатного маркера для определения распространенности рака простаты среди населения. После получения данных о том, что CB-03-06 способен подавлять рост рака простаты in vivo, определяли способность этого соединения ингибировать секрецию PSA из раковых клеток in vitro. Клетки LNCaP высевали в 96-луночные плоскодонные культуральные планшеты в среду, включающую сыворотку, очищенную активированным углем, содержащую или не содержащую 10 нМ DHT. Через 24 часа к клеткам добавляли тестируемые соединения, используя ДМСО в качестве носителя и отрицательного контроля, и энзалутамид в качестве положительного контроля. После 48-часового инкубирования с тестируемыми соединениями, супернатанты собирали и исследовали с помощью анализа ELISA на PSA, а сами клетки подвергали лизису для оценки выживаемости клеток.
Как и ожидалось, чистый антиандроген, а именно энзалутамид, эффективно ингибирует секрецию PSA с IC50<3 мкМ; CB-03-06 также является мощным ингибитором PSA (IC50 4 мкМ). Однако активность энзалутамида не растет с повышением дозировки так же как у CB-03-06. Примечательно, что кортексолон, т.е. родительское соединение и конечный метаболит всех тестируемых соединений, практически не оказывает влияния на секрецию PSA (IC50 612 мкМ). При исследовании выживаемости этих клеток, энзалутамид продемонстрировал значение IC50, равное 61 мкМ, и CB-03-06 продемонстрировал значение IC50 12 мкМ. Это подтверждает сильную способность обоих соединений подавлять рост клеток. Важно отметить, что кортексолон подавлял выживаемость клеток LNCaP лишь при очень высоких концентрациях (IC50 153 мкМ) и его можно считать неактивным в качестве цитотоксичного соединения для линий раковых клеток.
Пример 25: Исследование противораковой активности CB-03-06 in vitro в отношении клеточных линий рака груди
Трижды негативный рак груди (TNBC) составляет примерно 20% случаев вновь обнаруживаемого инвазивного рака груди. Раковые опухоли такого типа не поддерживаются ни такими гормонами, как эстроген и прогестерон, ни присутствием значительного количества рецепторов HER2, и по этой причине пациенты не реагируют на традиционные способы лечения (например, тамоксифен или герцептин). Таким образом, TNBC характеризуется невосприимчивостью к химиотерапии и низкой выживаемостью пациентов.
Имеется корреляция между невосприимчивостью раковых опухолей к химиотерапии и высокой экспрессией GR (Cancer Therapy 2013). Проводятся клинические исследования, в которых тестируется антагонист GR (мифепристон/RU486) в комбинации с химиотерапевтическим средствами для лечения TNBC. Однако клиническое применение мифепристона поставлено под угрозу из-за неоднозначного фармакологического действия, связанного с антагонизмом прогестероновому рецептору (PR). Чтобы оценить, можно ли применять CB-03-06 в качестве потенциального средства лечения рака груди, и, в частности TNBC, проводили исследования цитотоксичности, используя клеточные линии рака груди, характеризующиеся различной экспрессией рецепторов гормонов.
Для исследования выбирали следующие линии клеток рака груди:
клетки рака груди MCF7 (ER+PR+Her2+,GR+/-)
TBNC клетки MDA-MB-231 (ER-PR-Her2-,GR++)
Перед исследованием ингибирования клеточного роста, определяли характеристики клеток в отношении экспрессии рецепторов AR и GR с использованием FACS, которые были описаны ранее. Данные, показанные на Фиг.18, подтверждают данные по экспрессии рецепторов, приведенные в литературе.
Для исследования цитотоксичности, клетки высевали в 96-луночные плоскодонные культуральные планшеты в среду, содержащую сыворотку, очищенную активированным углем. Через 24 часа к клеткам добавляли тестируемые соединения. ДМСО использовали в качестве носителя и отрицательного контроля, и RU486 в качестве положительного контроля. После 72-часового инкубирования, клетки собирали, подвергали лизису для определения выживаемости с помощью анализа выживаемости на основе титрования по долговременной люминесценции (glow).
В таблице VI приведены значения IC50 CB-03-06 для указанных выше клеточных линий рака груди
CB-03-06 активен против обеих клеточных линий рака груди, но по-видимому более активен против клеток MCF7, чем MDA-MB-231, и это, возможно, дает основание предполагать, что GR не является единственной мишенью для этого соединения. RU486 (мифепристон, антагонист GR/PR), как и ожидалось, не оказывает влияния на выживаемость GR+/- клеток MCF7, в очень незначительной степени подавляя выживаемость TNBC GR+ клеток MDA-MB-231 максимум на 25% при 100 мкМ.
Интересно отметить, что CB-03-05 активен только против MCF7, а не MDA-MB-231. Неясно, какой рецептор несет ответственность за отмеченное различие в результатах, поскольку указанные клетки отличаются по крайней мере 4 рецепторами. Если причиной этого не является рецептор GR, то ей мог бы служить ER (рецептор эстрогена), PR (рецептор прогестерона) или Her2, которые экспрессируются в клетках MCF7, но не в MDA-MB-231.
Общие выводы
Рассмотренные примеры демонстрируют, что кортексолона 17α-бензоат (CB-03-06) в частности обладает прекрасной активностью, превосходящей активность других известных производных кортексолона. Авторы получили улучшенные результаты как in vitro, так и in vivo, например, в таких аспектах, как:
I) общая противоопухолевая активность in vitro;
II) противоопухолевая активность in vitro, не находящаяся в прямой корреляцией с экспрессией AR;
III) противоопухолевая активность in vitro, прямо коррелирующая с экспрессией GR;
IV) терапевтический индекс (TI); и
V) Противоопухолевая активность in vivo против опухолей поджелудочной железы и простаты.
I) Из данных показанных в таблице I ниже по тексту, очевидно, что производные кортексолона уничтожают раковые клетки при различных концентрациях и с различными значениями IC50. Однако CB-03-06 и CB-03-10 демонстрируют лучшие значения IC50 по сравнению с другими соединениями в ряду производных кортексолона в отношении линий раковых клеток различного происхождения. Даже метаболит CB-03-10, такой как CB-03-05, демонстрирует хорошее значение IC50 для клеток рака простаты LNCaP (IC50 32 мкМ). Более низкие значения IC50 свидетельствуют о более сильной противоопухолевой активности in vitro.
Таблица I: Значения IC50 производных кортексолона при тестировании на клеточных линиях рака простаты и поджелудочной железы
II) Экспрессию AR тестировали на линиях раковых клеток, смотрите таблицу II
В клеточных линиях рака простаты, как и ожидалось, подавление роста, продемонстрированное мощными антиандрогенами, такими как CPA и энзалутамид, коррелирует с экспрессией AR в клетках рака простаты. Примечательно, что активность CB-03-06 и CB-03-10 не зависит от андрогенного рецептора. CB-03-04 демонстрирует значение IC50, равное 46, при тестировании на клетках LNCaP (линия клеток рака простаты, которая экспрессирует андрогенный рецептор), но значительно более высокие значения IC50 (135) при тестировании на клетках PC3, которые экспрессируют невысокие или нулевые уровни андрогенных рецепторов. CB-03-06 и CB-03-10 продемонстрировали очень хорошие значения IC50 почти независимо от экспрессии AR. Такое же поведение наблюдалось в отношении линий клеток поджелудочной железы.
Таблица II: Экспрессия AR клеточными линиями рака простаты и поджелудочной железы и IC50 производных кортексолона
III) Терапевтический индекс (TI) (именуемый также терапевтическим окном, окном безопасности или терапевтическим отношением) представляет собой отношение количества терапевтического агента, которое вызывает терапевтический эффект, к количеству, которое вызывает токсическое действие. IC50 соединений определяли на свежих клетках, изолированных из человеческой крови (PBMC). Токсичность соединений определяли по следующему уравнению:
Терапевтический индекс=Безопасность/эффективность=IC50 для активированных PBMC/IC50 для раковых клеток;
Результаты показаны в таблице VII. Все производные кортексолона демонстрируют устойчиво безопасный профиль токсичности. Однако CB-03-06 продемонстрировал наиболее высокий терапевтический индекс при исследовании на всех 7 линиях раковых клеток, протестированных in vitro.
Таблица VII: Терапевтический индекс производных кортексолона для ряда линий раковых клеток
IV) Трижды негативный рак груди (TNBC), как показано в примере 24. Цитотоксическая активность, продемонстрированная CB-03-06, является особенно впечатляющей, поскольку обычные традиционно применяемые терапевтические агенты не действуют на клеточные линии трижды негативного рака груди (TNBC). TNBC определяется, как отсутствие экспрессии эстрогеновых и прогестероновых рецепторов, а также амплификации ERBB2. Такие клетки не реагируют на эндокринную или анти-ERBB2 терапию. В современных исследованиях были обнаружены некоторые потенциальные терапевтические мишени для TNBC. Однако заболевание по-прежнему приводит к плохому исходу. Принимая во внимание цитотоксическую активность и отличный профиль безопасности CB-03-06, это вещество является новым и улучшенным кандидатом для клинического лечения этих видов рака.
Ниже по тексту настоящее изобретение будет описано с помощью следующих нумерованных вариантов осуществления.
1. В одном из вариантов осуществления изобретение относится к соединению формулы (I)

где R означает водород или фрагмент C(O)-R1, где R1 представляет собой линейную алкильную цепь, включающую от 2 до 5 атомов углерода, и где Rʹ означает линейную алкильную цепь, содержащую от 3 до 6 атомов углерода, или необязательно замещенную арильную группу, или необязательно замещенную гетероарильную группу.
2. В другом варианте осуществления, изобретение относится к соединению формулы (I) по п.1, где необязательно замещенная арильная группа представляет собой фенил.
3. В другом варианте осуществления, изобретение относится к соединению формулы (I) по п.1, где R1 представляет собой водород или фрагмент CH2CH3, и Rʹ представляет собой фрагмент -(CH2)3-CH3 или фенил.
4. В другом варианте осуществления, изобретение относится к соединению по п.1, имеющему формулу:

5. В другом варианте осуществления, изобретение относится к соединению по п.1, имеющему формулу:
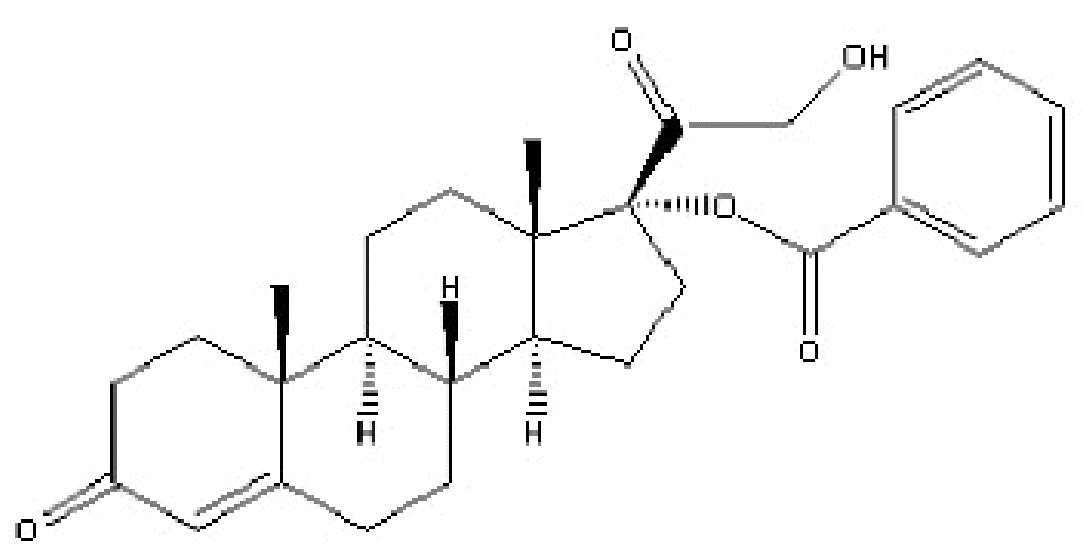
6. В другом варианте осуществления, изобретение относится к соединению по любому из пп.1-5 для применения в качестве лекарственного средства.
7. В другом варианте осуществления, изобретение относится к соединению по любому из пп.1-5 для применения в лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний.
8. В другом варианте осуществления, изобретение относится к соединению для применения по п.7, отличающемуся тем, что указанное опухолевое заболевание включает злокачественные новообразования и метастазы.
9. В другом варианте осуществления, изобретение относится к соединению для применения по п.8, отличающемуся тем, что указанные опухолевые заболевания являются солидными опухолями, предпочтительно эпителиальными опухолями, такими как карцинома простаты; карцинома молочной железы; карцинома поджелудочной железы; карцинома легких; карцинома желудочно-кишечного тракта, например, карцинома ободочной кишки; рак почек; карцинома щитовидной железы; карцинома матки; карцинома надпочечников.
10. В другом варианте осуществления, изобретение относится к соединению для применения по п.9, отличающемуся тем, что указанные эпителиальные опухоли представляют собой карциному простаты или карциному поджелудочной железы, предпочтительно экзокринную карциному поджелудочной железы.
11. В другом варианте осуществления, изобретение относится к фармацевтической композиции, включающей по крайней мере одно соединение формулы (I) по любому из пп.1-5, в комбинации с как минимум одним физиологически приемлемым эксципиентом.
12. В другом варианте осуществления, изобретение относится к фармацевтической композиции по п.11, отличающейся тем, что она находится в твердой или жидкой форме.
13. В другом варианте осуществления, изобретение относится к фармацевтической композиции в твердой форме по п.12, характеризующейся тем, что она имеет форму порошка, порошка, полученного лиофильной сушкой, гранул, драже, таблеток или капсул.
14. В другом варианте осуществления, изобретение относится к фармацевтической композиции в жидкой форме согласно п.12, характеризующейся тем, что она имеет форму раствора, эмульсии, суспензии или сиропа.
15. В другом варианте осуществления, изобретение относится к фармацевтической композиции по любому из пп.11-14, характеризующейся наличием по крайней мере одного другого действующего ингредиента, предпочтительно, химиотерапевтического действующего ингредиента, в качестве комбинации для одновременного, раздельного или последовательного введения.
16. В другом варианте осуществления, изобретение относится к фармацевтической композиции по пп.11-15 для применения в лечении предраковых заболеваний, дисплазий, метаплазий и опухолевых заболеваний.
17. В другом варианте осуществления, изобретение относится к фармацевтической композиции для применения по п.16, отличающейся тем, что указанные опухолевые заболевания включают злокачественные новообразования и метастазы.
18. В другом варианте осуществления, изобретение относится к фармацевтической композиции для применения по п.17, отличающейся тем, что указанное опухолевое заболевание является солидной опухолью, предпочтительно эпителиальной опухолью, такой как карцинома простаты, карцинома молочной железы; карцинома поджелудочной железы; карцинома легких; карцинома желудочно-кишечного тракта, например, карцинома ободочной кишки; рак почек; карцинома щитовидной железы; карцинома матки; карцинома надпочечников.
19. В другом варианте осуществления, изобретение относится к фармацевтической композиции для применения по п.18, отличающейся тем, что указанная эпителиальная опухоль является карциномой простаты или карциномой поджелудочной железы, предпочтительно, экзокринной карциномой поджелудочной железы.
Реферат
Изобретение относится к применению кортексолона 17α-бензоата в лечении опухолевого заболевания, которое представляет собой солидную опухоль. Изобретение также относится к фармацевтическим композициям, к способам лечения опухолевого заболевания, к способу лечения заболевания или расстройства, опосредованного глюкокортикоидом. Технический результат: предложено применение кортексолона 17α-бензоата при лечении заболевания или расстройства, опосредованного глюкокортикоидом. 7 н. и 32 з.п. ф-лы, 18 ил., 29 табл., 25 пр.
Формула
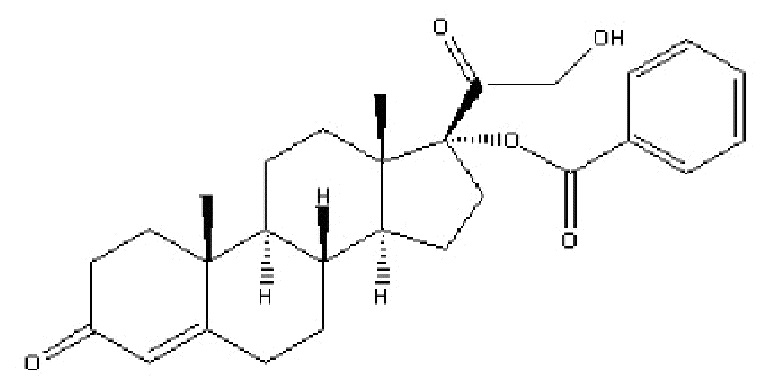






Документы, цитированные в отчёте о поиске
Кристаллические формы кортексолон-17α-пропионата и способы их получения

Комментарии