Средство, предназначенное для лечения и/или профилактики аутоиммунного заболевания и для образования регуляторных т-клеток - RU2531936C2
Код документа: RU2531936C2
Чертежи












Описание
Настоящее изобретение относится к средству, предназначенному для лечения и/или профилактики аутоиммунного заболевания, средству, предназначенному для образования регуляторных Т-клеток (TReg) в организме, и к различным способам, в которых применяют средства, предлагаемые в изобретении.
Аутоиммунные заболевания характеризуются избыточной реакцией иммунной системы на эндогенную ткань. Иммунная система ошибочно распознает эндогенную ткань в качестве чужеродных тел, которые подлежат уничтожению. Это приводит к серьезным воспалительным реакциям, повреждающим органы, в которых это имеет место. Важную роль в распознавании различий между эндогенными и экзогенными структурами играют Т-лимфоциты или Т-клетки, которые «обучаются» в тимусе связываться («причаливать») только с эндогенными молекулами клеточной поверхности, так называемыми молекулами главного комплекса гистосовместимости (ГКГ), и в результате быть толерантными к эндогенным структурам. Эти процессы обозначают как «клональная делеция» и «клональная селекция». В процессе начальной селекции в тимусе выживают только те Т-клетки, которые обладают способностью распознавать молекулы ГКГ на мембранах эндогенных клеток, однако при этом их связывание не является столь сильным, чтобы оно могло приводить к активации Т-клеток. Все Т-клетки, которые не могут связываться или распознавать эндогенные молекулы ГКГ, элиминируются. При клональной делеции, которая также имеет место в тимусе, происходит элиминация тех Т-клеток, которые могут «безошибочно» распознавать молекулы ГКГ и обладают способностью к сильному связыванию с эндогенными молекулами ГКГ, в результате чего они могут активироваться, что может приводить, в конце концов, к деструкции эндогенных клеток. Этот процесс представляет собой один из механизмов, которыми располагает иммунная система, предназначенных для защиты «своего» и уничтожения «чужого» (экзогенного).
При аутоиммунных заболеваниях поведение группы Т-клеток становится аномальным. Помимо того, что они еще сохраняют функциональную способность осуществлять защиту от экзогенных молекул и организмов, они приобретают также способность атаковать эндогенную структуру. Органы или ткани воспринимаются как экзогенные. Это может иметь различные последствия: если поражаются жизненно важные структуры, то аутоиммунное заболевание может приводить к фатальному концу. Иммунная система направляет свое защитное действие на эти структуры, запускаются клеточные, а также гуморальные защитные реакции и образуются аутоантитела, в результате чего с течением времени пораженные органы прекращают свою функцию. Наиболее часто происходит ослабление иммунной системы и организм становится чувствительным ко всем типам болезней. В некоторых обстоятельствах нарушается также распознавание экзогенных структур и в результате более не может эффективно предотвращаться распространения перерожденных раковых клеток, и пораженный организм становится более чувствительным к инфекционным болезням. В процессе развития заболевания клетки иммунной системы разрушают эндогенные структуры, в то время как механизмы восстановления организма пытаются по мере возможности осуществлять регенерацию поврежденных частей органа. Как правило, без лечения эта ошибочная атака защитной системы продолжается на протяжении всей жизни или вплоть до полного разрушения структуры-мишени.
Несмотря на интенсивные исследования, точные причины аутоиммунных заболеваний пока остаются неясными. Известные гипотезы базируются на предположении, что аутоиммунные заболевания возникают в результате генетической предрасположенности, например связаны с присутствием молекул ГКГ определенных типов, в сочетании с внешними стимулами. Если в организме пораженного индивидуума присутствуют указанные генетически обусловленные факторы, а также если они имеют место в сочетании с наличием неблагоприятных факторов окружающей среды, таких как сильный стресс, инфекции, беременность и т.д., то это может приводить к возникновению аутоиммунных заболеваний.
Иммунная система состоит из различных клеток, которые обладают способностью уничтожать инфекционные агенты, которые могут внедряться в организм. Механизм иммунного ответа включает активацию специализированных клеток и приобретение эффекторных функций, таких как цитотоксичность определенных Т-клеток, которые экспрессируют так называемый трансмембранный гликопротеин CD8, и которые поэтому обозначают как CD8+-Т-клетки.
Регуляторные Т-клетки (TReg), которые ранее обозначали также как супрессорные Т-клетки, представляют собой специализированную подгруппу Т-клеток. Им присуща функция подавления активации иммунной системы и, как следствие, они обладают способностью регулировать аутотолерантность (толерантность к «своему») иммунной системы. В результате в здоровом организме они препятствуют возникновению аутоиммунных заболеваний. Описаны различные популяции TReg, включая популяции, которые экспрессируют белки CD4, CD25 и Foxp3, и которые обозначают как CD4+CD25 Foxp3+-Т-клетки. Кроме того, известны TReg, которые экспрессируют CD4 и Foxp3, но не экспрессируют CD25, так называемые CD4+CD25-Foxp3+-Т-клетки.
У Lan с соавторами («Regulatory T cells: development, function and role in autoimmunity», Autoimmun. Rev. 4(6), 2005, cc.351-363) описана мышиная модель, с использованием которой установлено, что истощение регуляторных CD4+CD25+-Т-клеток приводит к спонтанному развитию аутоиммунных заболеваний.
У Chatila T.A. («Role of regulatory Т cells in human diseases», 116(5), 2006, cc.949-959) приведены данные о том, что врожденный дефицит регуляторных CD4+CD25+-T-клeтoк из-за мутации в гене, который кодирует белок Foxp3, способствует развитию аутоиммунных заболеваний.
Известен обзор, касающийся регуляторных Т-клеток, в журнале «Nature Immunology», который опубликован в марте 2005 г.
Аутоиммунные заболевания лечат в зависимости от пораженного органа. При этом основным принципом этиотропной терапии является подавление активности иммунной системы путем введения иммунодепрессантов, например кортизона. Эти субстанции характеризуются множеством системных побочных действий и взаимодействий, в связи с чем предпринимались попытки создания новых лекарственных средств, обладающих способностью специфически влиять на механизмы, которые участвуют в проявлении заболевания. Примерами таких лекарственных средств являются натализумаб и инфликсимаб. Натализумаб представляет собой моноклональное антитело и избирательный ингибитор IgG4, молекулы адгезии, которая локализована на поверхности лейкоцитов. Натализумаб ингибирует миграцию лейкоцитов к очагу воспаления и его применяют для лечения чрезвычайно агрессивных форм связанного с образованием бляшек прогрессирующего рассеянного склероза. Инфликсимаб представляет собой химерное моноклональное антитело к фактору некроза опухоли α (TNFα), который играет основную роль в аутоиммунных воспалительных реакциях. Инфликсимаб применяют при ревматоидном артрите, болезни Крона, болезни Бехтерева и псориазе.
Ehrenstein с соавторами («Compromised function of regulatory T cells in rheumatoid arthritis and reversal by anti-TNFα therapy», J. Exp.Med., т.200, №.3, 2004, cc.277-285) продемонстрировали, что моноклональное антитело к TNFα, т.е. инфликсимаб, может повышать эффективность лечения ревматоидного артрита.
Аналогичное предположение высказано Nadkarni с соавторами («Ariti-TNFα therapy induces a distinct regulatory T cell population in patients with rheumatoid arthritis via TGF-β», JEM, т.204, 2007, cc.33-39).
Bresson с соавторами предложили лечение диабета типа I путем совместного введения специфического антитела к CD3ε и пептида проинсулина.
Vandenbark с соавторами («Therapeutic vaccination with a trivalent T-cell receptor (TCR) peptide vaccine restores deficient FoxP3 expression and TCR recognition in subjects with multiple sclerosis», Immunology, т.123, 2008, cc.66-78) описали улучшение контроля автореактивного ответа при рассеянном склерозе после вакцинации пациентов определенными TCR-пептидами.
Хотя указанные новые субстанции обладают очень специфическим действием, при их применении могут возникать серьезные побочные действия, например возможно возникновение прогрессирующей мультифокальной лейкоэнцефалопатии. По этой причине всего лишь через 3 месяца после его первой регистрации в США натализумаб был вновь изъят из продажи. Стоимость этих новых активных субстанций является очень высокой. В настоящее время стоимость 300 мг натализумаба составляет порядка 2000.00 евро. Стоимость 200 мг инфликсимаба примерно 1700.00 евро.
С учетом вышесказанного задачей настоящего изобретения являлось создание новой фармацевтической композиции, предназначенной для лечения и/или профилактики аутоиммунного заболевания, которая максимально лишена недостатков, известных в данной области. В частности, предлагается фармацевтическая композиция, которая отличается хорошей переносимостью и низкой токсичностью.
Еще одной задачей настоящего изобретения является создание средства, предназначенного для образования регуляторных Т-клеток (TReg) в организме.
Эти проблемы решаются с помощью мутеина человеческого интерлейкина 2 (мутеин hIL-2) или его участка, или фрагмента, пронумерованного в соответствии с hIL-2 дикого типа и имеющего аминокислотную замену по меньшей мере в одном из положений 20, 88 или 126.
При создании изобретения неожиданно было установлено, что указанный мутеин hIL-2 или его участок обладает высоким терапевтическим потенциалом, который можно использовать для лечения и профилактики аутоиммунных заболеваний. Так, например, при создании изобретения удалось продемонстрировать на различных экспериментальных препаратах, что мутеин hIL-2 избирательно индуцирует образование в организме регуляторных Т-клеток, таких как CD4+CD25+Foxp3+и CD4+CD25-Foxp3+.
При создании изобретения неожиданно было установлено, что мутеин hIL-2, предлагаемый в изобретении, характеризуется существенно более высокой активностью в отношении регуляторных Т-клеток, чем hIL-2 дикого типа. Это наиболее ярко проявляется при применении в высоких концентрациях.
Касательно мутеина hIL-2, предлагаемого в изобретении, в WO 99/60128 описано, что он связывается с большей аффинностью с трехцепочечным рецептором IL-2 (IL-2Rαβγ), чем с двухцепочечным рецептором IL-2 (IL-2Rβγ). При создании настоящего изобретения впервые установлено, что по сравнению с hIL-2 дикого типа мутеин hIL-2, предлагаемый в изобретении, индуцирует, но, как неожиданно было установлено при создании изобретения, обладает также способностью усиливать образование регуляторных Т-клеток, в которых отсутствует α-субъединица рецептора IL-2 (CD25) (CD4+CD25-Foxp3+). Указанная субпопуляция участвует также в подавлении активации иммунной системы и в результате в регуляции аутотолерантности иммунной системы. В результате мутеин hIL-2, предлагаемый в изобретении, характеризуется существенно более высокой эффективностью в качестве активной субстанции, предназначенной для лечения аутоиммунных заболеваний, чем hIL-2 дикого типа.
При создании изобретения продемонстрировано также, что мутеин hIL-2 индуцирует образование cd8-позитивных регуляторных Т-клеток, таких как CD3+CD4-CD25+Foxp3+ и CD3+CD4-CD25-Foxp3+ (данные не представлены), которые играют решающую роль в подавлении аутоиммунных заболеваний.
Кроме того, мутеин hIL-2, предлагаемый в изобретении, обладает дополнительным преимуществом по сравнению С hIL-2 дикого типа, поскольку он избирательно активирует Т-клетки в отличие от естественных клеток-киллеров (NK-клетки), и в результате характеризуется пониженным профилем токсичности и повышенным терапевтическим индексом. В результате мутеин hIL-2, предлагаемый в изобретении, существенно лучше переносится, чем hIL-2 дикого типа (см. WO 99/60128).
Кроме того, с учетом цитотоксичности CD3+CD8+CD45RO+-T-клeтoк, при создании изобретения впервые неожиданно было установлено, что в отличие от hIL-2 дикого типа мутеин hIL-2, предлагаемый в изобретении, не оказывает воздействие или оказывает лишь небольшое воздействие на пролиферацию cd8-позитивных цитотоксических Т-клеток, которые обозначают также как «несенсибилизированные, центральные клетки памяти, недифференцированные (клетки-предшественники)» и «окончательно дифференцированные» CD8-T-клетки. Это является преимуществом, поскольку считается, что цитотоксические CD8+-Т-клетки могут быть ответственны за стойкие хронические воспалительные процессы при аутоиммунных заболеваниях (ср. Liu и др., Multiple Sclerosis, 13, 2007, с.149 и Haegele и др., Neuroimmunol, 183, 2007, с.168). Таким образом, по сравнению с hIL-2 дикого типа мутеин hIL-2, предлагаемый в изобретении, дополнительно препятствует интенсификации этой воспалительной реакции, вызываемой CD8+-Т-клетками, что является еще одним его преимуществом с позиций переносимости.
При создании изобретения установлено также, что мутеин hIL-2, предлагаемый в изобретении, может стимулировать также антигенспецифическую активность иммунных клеток. Преимуществом этого является то, что с помощью мутеина hIL-2 избирательно стимулируют специфические для заболевания иммунные клетки и тем самым ограничивают системное действие иммунной терапии. В результате при введении мутеина hIL-2 предотвращают также индукцию других заболеваний.
Кроме того, с помощью мышиной модели сахарного диабета типа I при создании изобретения было установлено также, что путем обработки мутеином hIL-2, предлагаемым в изобретении, можно предупреждать возникновение аутоиммунного заболевания.
Таким образом, полностью решена задача, положенная в основу изобретения.
Согласно изобретению под человеческим интерлейкином 2 «дикого типа» (hIL-2 дикого типа) подразумевают полипептид или белок, аминокислотная последовательность которого состоит из 133 аминокислот, которые присутствуют во встречающемся в естественных условиях человеческом IL-2 (без сигнального пептида, который состоит из дополнительных 20 аминокислот на N-конце). hIL-2 дикого типа можно экспрессировать как в естественных условиях, так и получать методом рекомбинации. Аминокислотная последовательность hIL-2 дикого типа описана у Fujita и др., PNAS USA 80, 1983, сс.7437-7441, как в виде последовательности, включающей дополнительный N-концевой метионин, который обязательно должен присутствовать, когда белок экспрессируют в Е.coli в виде внутриклеточной фракции, так и в виде последовательности без N-концевого метионина. Аминокислотная последовательность hIL-2 дикого типа описана в прилагаемом перечне последовательностей в виде SEQ ID No. 1. Нуклеотидная последовательность кДНК, которая кодирует hIL-2, описана в прилагаемом перечне последовательностей в виде SEQ ID No. 2.
Согласно изобретению под «мутеином» человеческого интерлейкина 2 (мутеин hIL-2) подразумевают полипептид или белок, в котором по сравнению с hIL-2 дикого типа осуществлены определенные замены. Идентификация положений, в которых осуществлены замены, основана на положениях аминокислот в последовательности hIL-2 дикого типа, в качестве которой можно применять, например, SEQ ID No. 1. Таким образом, аланин (А) локализован в положении 1, пролин (Р) в положении 2, треонин (Т) в положении 133 и т.д. Остаток аспарагиновой кислоты (D) в положении 20 («D20») можно заменять, например, на остаток изолейцина (I) или гистидина (Н), получая тем самым мутеины IL-2, которые обозначают как hIL-2-D20I и hIL-2-D20H соответственно.
Очевидно, что в мутеине hIL-2, предлагаемом в изобретении, можно осуществлять замены в нескольких из указанных положений 20, 88 или 126, получая в результате комбинированные мутанты, которые особенно пригодны для лечения аутоиммунного заболевания или для индукции регуляторных Т-клеток.
Согласно изобретению мутеин hIL-2 может представлять собой также модифицированный полипептид, например гликозилированный мутеин hIL-2. Гликозилированные мутеины hIL-2 описаны, например, в заявках на патент США 09/310026 и 10/051657, которые включены в настоящее описание в качестве ссылки.
Согласно изобретению под «участком» или «фрагментом» мутеина hIL-2 подразумевают полипептид, в котором по сравнению с мутеином hIL-2 отсутствует(ют) одна или несколько аминокислот на N- и/или С-конце, но который все еще обладает достаточной биологической активностью мутеина hIL-2, позволяющей применять его согласно изобретению для лечения и/или профилактики аутоиммунных заболеваний. Указанная активность рассматривается как достаточная, если участок или фрагмент обладает активностью, составляющей по меньшей мере 50%, предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95% от активности мутеина hIL-2, в отношении индукции регуляторных Т-клеток. Активность мутеина hIL-2 можно легко оценивать методами, известными специалисту в данной области. Такой метод описан, например, в WO 99/60128, примеры 3-5. Указанная публикация включена в настоящее описание в качестве ссылки.
Согласно изобретению предпочтительно, если замены в указанных положениях не представляют собой консервативные замены, при которых одну аминокислоту заменяют на другую аминокислоту, которая обладает сходными биохимическими свойствами.
Так, является предпочтительным, чтобы замена в положении 20 не представляла собой замену аспарагиновой кислоты (D) на глутаминовую кислоту (Е). Предпочтительно, чтобы замена в положении 88 не представляла собой замену аспарагина (N) на аланин (А), пролин (Р), глицин (G), глутамин (Q), серин (S) или треонин (Т). Кроме того, предпочтительно, чтобы замена в положении 126 не представляла собой замену глутамина (Q) на аланин (А), пролин (Р), глицин (G), аспарагин (N), серин (S) или треонин (Т). Эти замены не изменяют или лишь незначительно изменяют биологическую активность по сравнению с активностью hIL-2 дикого типа.
Кроме того, предпочтительным является, если в указанных положениях не осуществляют замен, интродуцирующих сайты межмолекулярных перекрестных сшивок или «неправильных» связей посредством дисульфидных мостиков.
Поэтому замена в мутеине hIL-2, предлагаемом в изобретении, в положении 20 предпочтительно не представляет собой замену аспарагиновой кислоты (D) на аргинин (R), аспарагин (N), аспарагиновую кислоту (D), цистеин (С), глутаминовую кислоту (Е), глицин (G), лейцин (L), лизин (К), фенилаланин (F), пролин (Р), треонин (Т) или триптофан (W). Замена в положении 88 предпочтительно не представляет собой замену аспарагина (N) на аспарагиновую кислоту (D), цистеин (С), глутамин (Q), триптофан (W) или пролин (Р). Замена в положении 126 предпочтительно не представляет собой замену глутамина (Q) на аланин (А), гистидин (Н), триптофан (W), цистеин (С), глутамин (Q), глутаминовую кислоту (Е) или лизин (К).
Мутеин hIL-2, предлагаемый в изобретении, можно получать любым приемлемым методом, известным в данной области. Такие методы предусматривают конструирование последовательности ДНК, которая кодирует мутеин IL-2, предлагаемый в изобретении, и которая, например, включает нуклеотидную последовательность, представленную в SEQ ID No. 2, и экспрессию этой последовательности в приемлемом хозяине. Этот метод позволяет получать мутеины, предлагаемые в изобретении, в рекомбинантной форме. Однако мутеин, предлагаемый в изобретении, можно получать также химическим синтезом и методом рекомбинантной ДНК. Получение мутеина, предлагаемого в изобретении, подробно описано в WO 99/60128, варианты осуществления изобретения 1 и 2, которые включены в настоящее описание в качестве ссылки.
Наиболее предпочтительный согласно изобретению мутеин hIL-2, в котором в положении 88 аспарагин (N) заменен на аргинин (R) (hIL-2-N88R), доступен специалисту в данной области под названием BAY50-4798 (см. Shanafelt и др., «A T-cell-selective interleukin 2 mutein exhibits potent antitumor activity and is well tolerated in vivo», Nat. Biotechnol., т.18, 2000, cc.1197-1202). Аминокислотная последовательность hIL-2-N88R описана в прилагаемом перечне последовательностей в виде SEQ ID No. 3.
При создании изобретения неожиданно было установлено, что в данной области отсутствуют сведения о такой активности мутеина IL-2.
Так, в WO 99/60128 описан мутеин hIL-2-N88R, который может избирательно активировать Т-клетки в отличие от естественных клеток-киллеров и обладает способностью уменьшать образование метастазов в легком.
В WO 02/00243 описана стабильная, содержащая гистидин, свободная от альбумина препаративная форма мутеина hIL-2-N88R.
В US 2002/0164300 описан гликозилированный вариант мутеина hIL-2-N88R.
Применение мутеина hIL-2, предлагаемого в изобретении, для целенаправленного лечения и/или профилактики аутоиммунных заболеваний или для избирательной активации регуляторных Т-клеток в организме ранее не было описано и оно не является очевидным, исходя из существующего уровня техники.
Даже для человеческого IL-2 дикого типа отсутствуют соответствующие сведения.
Van der Vliet с соавторами («Effects of the administration of high-dose interleukin-2 on immunoregulatory cell subsets in patients with advanced melanoma and renal cell cancer», Clin. Cancer Res., т.13, 2007, cc.2100-2108) продемонстрировали, что при введении IL-2 в высоких дозах его терапевтическая эффективность в отношении лечения опухолей снижается.
Ahmadzadeh и Rosenberg («IL-2 administration increases CD4+CD25hiFoxp3+ regulatory Т cells in cancer patients», Blood, т.107, 2006, cc.2409-2414) предложили осуществлять повышение терапевтической эффективности человеческого IL-2 дикого типа в отношении имеющих опухоли пациентов путем элиминации у пациентов регуляторных Т-клеток. Однако от этого подхода предложено отказаться в связи с его не перспективностью (см. Powell и др., «Inability to mediate prolonged reduction of regulatory Т cells after transfer of autologous CD25-depleted PBMC and interleukin-2 after lymphodepleting chemotherapy», J. Immunother., т.30, 2007, cc.438-447).
Antony и Restifo («CD4+CD25+Т regulatory cells, immunotherapy of cancer, and interleukin-2», J. Immunother., т.28, 2005, cc.120-128), указали на еще меньшую перспективность IL-2 в качестве иммунотерапевтического агента и даже предположили, что введение IL-2 может индуцировать аутоиммунитет.
Knoechel с соавторами («Sequential development of interleukin 2-dependent effector and regulatory Т cells in response to endogenous systemic antigen», JEM, т.202, 2005, cc.1375-1386) высказали аналогичный взгляд и даже предложили использовать антагонист IL-2, т.е. ингибитор механизмов IL-2, для лечения ранней фазы аутоиммунных заболеваний.
Таким образом, из существующего уровня техники не является очевидным решение, предлагаемое в изобретении.
Так, при создании изобретения было установлено также, что терапевтическое действие мутеина hIL-2 можно изменять в зависимости от показания и применяемой концентрации. Применение hIL-2 в высоких концентрациях может оказаться целесообразным для лечения аутоиммунных заболеваний, но противопоказано для лечения опухолевых заболеваний.
Применение, предлагаемое в изобретении, является предпочтительным, если используют следующие замены: аспарагин в положении 88 заменяют на аргинин (hIL-2-N88R) или на глицин (hIL-2-N88G), или на изолейцин (hIL-2-N881); и/или используют следующие замены: аспарагиновую кислоту в положении 20 заменяют на гистидин (hIL-2-D20H) или на изолейцин (hIL-2-D20I), или на тирозин (hIL-2-D20Y); или используют следующую замену: глутамин в положении 126 заменяют на лейцин (hIL-2-Q126L).
Преимущество такого подхода состоит в том, что применяют мутеин hIL-2, предлагаемый в изобретении, отличительным признаком которого является его способность специфически избирательно активировать Т-клетки в отличие от естественных клеток-киллеров, и поэтому он обладает высоким терапевтическим потенциалом и низкой токсичностью. Эти свойства предпочтительных мутеинов hIL-2, предлагаемых в изобретении, описаны в WO 99/60128, которая включена в настоящее описание в качестве ссылки.
Согласно изобретению является предпочтительным, если мутеин hIL-2 или его фрагмент несут по меньшей мере одну дополнительную аминокислотную замену в любом положении кроме положений 20, 88 или 126, в результате чего указанный имеющий дополнительную замену мутеин hIL-2 или указанный имеющий дополнительную замену его участок или фрагмент имеет аминокислотную последовательность, которая идентична по меньшей мере на 80%, предпочтительно на 85%, более предпочтительно на 90%, более предпочтительно на 95%, наиболее предпочтительно на 99% аминокислотной последовательности мутеина hIL-2 или его участка или фрагмента, который не имеет дополнительных замен по сравнению с hIL-2 дикого типа за исключением замены по меньшей мере в одном из положений 20, 88 или 126.
Преимуществом такого подхода является возможность получения альтернативных первичных структур, которые в некоторых случаях легче синтезировать, чем мутеин hIL-2, который, кроме замены по меньшей мере в одном из положений 20, 88 или 126, полностью соответствует hIL-2 дикого типа. Для получения полипептида, обладающего биологической активностью мутеина hIL-2 или его участка, и соответственно лекарственного средства, предназначенного для лечения и/или профилактики аутоиммунного заболевания, не является абсолютно необходимым получать полипептид, аминокислотная последовательность которого идентична на 100% аминокислотной последовательности мутеина hIL-2 или его участка, предлагаемого в изобретении. Наоборот, достаточным является наличие соответствующего высокого процента идентичности, если связанная с этим умеренная потеря активности является допустимой, но предпочтительно сохраняется по меньшей мере 50, 60, 70, 80, 90, 95 или 99% активности. Указанные величины идентичности относятся к участку мутеина hIL-2, предлагаемого в изобретении, который состоит из≥10 аминокислот. Степень гомологии можно легко определять с помощью методов, известных специалисту в данной области, например, путем анализа с использованием программы BLAST или модуля MegAlign программы Lasergene фирмы DNAStar Inc.
Согласно изобретению предпочтительным является также, если дополнительная аминокислотная замена в любом из положений кроме положений 20, 88 или 126 представляет собой консервативную аминокислотную замену.
Преимущество такого подхода состоит в том, что получают дополнительные варианты мутеина hIL-2, предлагаемого в изобретении, которые характеризуются достаточно высокой активностью, что позволяет применять их для лечения и/или профилактики аутоиммунных заболеваний или для индукции регуляторных Т-клеток в организме. Специалисту в данной области известно, что консервативные замены не оказывают никакого воздействия или оказывают лишь незначительное воздействие на вторичную или третичную структуру мутеина. Указанные консервативные замены включают замены, описанные Dayhoff в «The Atlas of Protein Sequence and Structure», т.5, изд-во Natl. Biomedical Research. Например, аминокислоты, которые принадлежат к одной из следующих групп, можно заменять друг на друга, т.е. использовать для консервативной замены:
- аланин (А), пролин (Р), глицин (G), аспарагин (N), серин (S), треонин (Т);
- цистеин (С), серин (S), тирозин (Y), треонин (Т);
- валин (V), изолейцин (I), лейцин (L), метионин (М), аланин (А), фенилаланин (F);
- лизин (К), аргинин (R), гистидин (Н);
- фенилаланин (F), тирозин (Y), триптофан (W), гистидин (И); и
- аспарагиновая кислота (D), глутаминовая кислота (Е).
Средство, предлагаемое в изобретении, предназначенное для индукции образования регуляторных Т-клеток в организме, предпочтительно представляет собой фармацевтическую композицию, которая содержит фармацевтически приемлемый носитель.
Преимущество такого подхода состоит в том, что средство уже имеет форму, пригодную для непосредственного введения в организм, предпочтительно в человеческий организм.
Фармацевтически приемлемые носители хорошо известны в данной области (см. Row и др., Handbook of Pharmaceutical Excipients, 5-ое изд., изд-во Pharmaceutical Press and American Pharmacists′ Association, 2006; Bauer и др., Lehrbuch der pharmazeutischen Technologie, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, 1999). Наиболее предпочтительная препаративная форма описана в WO 02/00243, которая включена в настоящее описание в качестве ссылки. Эта препаративная форма не содержит альбумин и стабилизацию мутеина hIL-2 или его участка осуществляют с помощью гистидина. Предпочтительно конечное лекарственное средство содержит следующие компоненты в указанных концентрациях: мутеин hIL-2 или его участок = 0,1-5 мг/мл; гистидин = 0,08-1,6 мас.%; NaCl = 0-0,9 мас.%; сахароза = 1-10 мас.%; глицин = 0-0,3 мас.%, и имеет значение рН, составляющее примерно 5-6,5.
Согласно конкретному варианту осуществления изобретения фармацевтическая композиция содержит также иммунодепрессант.
С учетом высокой эффективности мутеина hIL-2, предлагаемого в изобретении, саму фармацевтическую композицию можно применять для монотерапии в качестве единственного средства для лечения и/или профилактики аутоиммунных заболеваний. Такой препарат, предназначенный для монотерапии, содержит мутеин hIL-2, предлагаемый в изобретении, в качестве единственной активной субстанции. В этом контексте фармацевтически приемлемые носители, растворители (буферы, вода и т.д.), добавки и т.д. не относятся к активным субстанциям.
Преимущество такого подхода состоит в том, что терапевтический индекс лекарственного средства, предлагаемого в изобретении, дополнительно повышают путем включения стандартного иммунодепрессанта.
Предпочтительно иммунодепрессант выбирают из группы, включающей глюкокортикоид, в том числе декортин, преднизол; азатиоприн; циклоспорин А; микофенолята мофетил; такролимус; глобулин к Т-лифоцитам, антитела к CD3, включая муромонаб; антитела к CD25, включая базиликсимаб и даклизумаб; антитела к TNF-α, включая инфликсимаб и адалимумаб; азатиоприн; метотрексат; циклоспорин; сиролимус; эверолимус; финголимод; селлцепт (CellCept); мифортик и циклофосфамид.
Преимущество такого подхода состоит в том, что применяют иммунодепрессант, для которого продемонстрирована терапевтическая активность при аутоиммунных заболеваниях и использование которого является достаточно распространенным в данной области.
Кроме того, предпочтительно, если аутоиммунное заболевание выбирают из группы, включающей: сахарный диабет типа I, ревматоидный артрит, рассеянный склероз, хронический гастрит, болезнь Крона, базедова болезнь, болезнь Бехтерева, псориаз, тяжелая псевдопаралитическая миастения, аутоиммунный гепатит, APECED (аутосомальная полиэндокринопатия-кандидоз-эктодермальная дистрофия), синдром Черджа-Стросс, неспецифический язвенный колит, гломерулонефрит, синдром Гийена-Барре, тироидит Хашимото, лихен-склероз, системную красную волчанку, PANDAS (педиатрическое аутоиммунное нейропсихическое расстройство), ревматическую лихорадку, саркоидоз, синдром Шегрена, синдром «негнущегося человека», склеродерму, грануломатоз Вегенера, витилиго, аутоиммунную энтеропатию, синдром Гудпасчера, дерматомиозит, полимиозит, аутоиммунную аллергию, астму и аутоиммунную реакцию после трансплантаций органов.
Преимущество такого подхода состоит в том, что получают лекарственное средство, которое можно применять для лечения и/или профилактики наиболее важных аутоиммунных заболеваний.
Следующим объектом настоящего изобретения является фармацевтическая композиция, предназначенная для лечения и/или профилактики аутоиммунного заболевания, которая содержит мутеин hIL-2, предлагаемый в изобретении, или его фрагмент.
Особенности и преимущества, а также определение понятий, которые описаны касательно применения, предлагаемого в изобретении, относятся также к фармацевтической композиции, предлагаемой в изобретении.
Следующим объектом настоящего изобретения является средство, предназначенное для образования регуляторных Т-клеток (TReg) в организме, которое содержит мутеин hIL-2, предлагаемый в изобретении, или его фрагмент.
Преимущества и особенности, а также определение понятий, которые описаны касательно применения, предлагаемого в изобретении, относятся также к средству, предлагаемому в изобретении.
Другими объектами настоящего изобретения являются способы, предназначенные для лечения и/или профилактики аутоиммунного заболевания организма и для образования регуляторных Т-клеток (TReg) в организме, каждый из которых заключается в том, что осуществляют следующие стадии, на которых: (а) создают мутеин человеческого интерлейкина 2 (мутеин hIL-2) или его фрагмент, (б) вводят мутеин hIL-2 или его фрагмент в организм и (в) при необходимости повторяют стадии (а) и (б), при этом мутеин hIL-2 или его фрагмент представляет собой мутеин hIL-2, предлагаемый в изобретении, или его фрагмент.
Организм предпочтительно представляет собой млекопитающее, более предпочтительно человеческий организм.
Особенности и преимущества, а также определение понятий, которые описаны касательно применения, предлагаемого в изобретении, относятся также к вышеуказанным способам, предлагаемым в изобретении, предназначенным для лечения и/или профилактики аутоиммунного заболевания в организме и для образования регуляторных Т-клеток (TReg) в организме.
Следующим объектом настоящего изобретения является способ образования регуляторных Т-клеток (TReg) in vitro, заключающийся в том, что осуществляют следующие стадии, на которых: (а) создают мутеин человеческого интерлейкина 2 (мутеин hIL-2) или его фрагмент, (б) приводят в контакт мутеин hIL-2 или его фрагмент с мононуклеарными клетками периферической крови (РВМС) и (в) при необходимости повторяют стадии (а) и (б), при этом мутеин hIL-2 или его фрагмент представляет собой мутеин hIL-2, предлагаемый в изобретении, или его фрагмент.
Приведение в контакт hIL-2 или его фрагмента с РВМС можно осуществлять в любой среде, пригодной для культивирования РВМС.
Особенности и преимущества, а также определение понятий, которые описаны касательно применения, предлагаемого в изобретении, относятся также к вышеуказанному способу, предлагаемому в изобретении, предназначенному для образования регуляторных Т-клеток (TReg) in vitro.
Следующим объектом настоящего изобретения является способ лечения и/или профилактики аутоиммунного заболевания в организме, заключающейся в том, что осуществляют следующие стадии, на которых: (а) создают мутеин человеческого интерлейкина 2 (мутеин hIL-2) или его фрагмент, (б) приводят в контакт мутеин hIL-2 или его фрагмент с мононуклеарными клетками периферической крови (РВМС), полученными из первого организма, (в) инкубируют мутеин hIL-2 или его фрагмент с РВМС для получения клеточной популяции, которая содержит регуляторные Т-клетки (TReg), и (г) интродуцируют клеточную популяцию во второй организм, при этом мутеин hIL-2 или его фрагмент представляет собой мутеин hIL-2, предлагаемый в изобретении, или его фрагмент.
Первый организм и второй организм предпочтительно имеют идентичную группу крови, особенно предпочтительно, если первый и второй организмы являются идентичными организмами или индивидуумами.
Преимущество настоящего изобретения состоит в том, что при интродукции или реинфузии клеточной популяции не возникают нежелательные иммунные реакции на клетки, и поэтому для способа характерны очень незначительные побочные действия.
Особенности и преимущества, а также определение понятий, которые описаны касательно применения, предлагаемого в изобретении, относятся также к вышеуказанному способу, предлагаемому в изобретении, предназначенному для лечения и/или профилактики аутоиммунного заболевания организма.
Очевидно, что особенности, указанные выше, и те, которые будут объяснены ниже, без отклонения от объема настоящего изобретения можно использовать не только в конкретном указанном сочетании, но и в других комбинациях или индивидуально.
Ниже изобретение пояснено более детально на основе конкретных примеров, которые даны только для иллюстрации вариантов осуществления изобретения и не ограничивают объем изобретения. При этом сделана ссылка на прилагаемые чертежи, на которых показано:
на фиг.1 - результаты исследований на здоровых людях, свидетельствующие о том, что hIL-2-N88R при его применении в дозах, равных или более низких, чем дозы пролейкина, индуцирует увеличение количества регуляторных CD4+CD25+Fохр3+-Т-клеток в большей степени;
на фиг.2 - результаты исследований на здоровых людях, свидетельствующие о том, что hIL-2-N88R при его применении в дозах, равных или более низких, чем дозы пролейкина, индуцирует увеличение количества регуляторных CD4+CD25-Foxp3+-T-клeтoк в большей степени;
на фиг.3 - результаты исследований на страдающих меланомой пациентах, свидетельствующие о том, что hIL-2-N88R при его применении в дозах, равных или более низких, чем дозы пролейкина, индуцирует увеличение количества регуляторных CD4+CD25+Foxp3+-Т-клеток в большей степени;
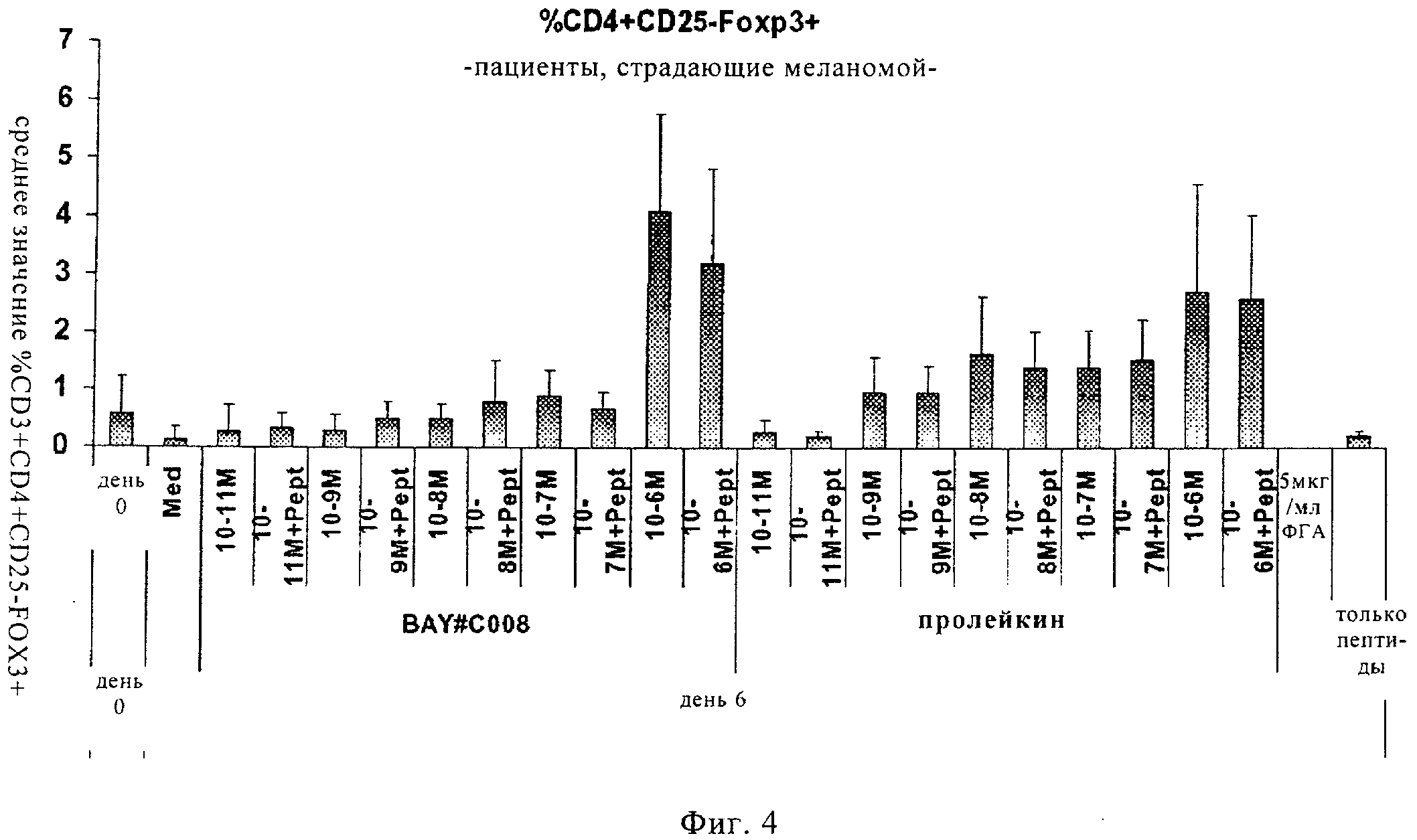
на фиг.4 - результаты исследований на страдающих меланомой пациентах, свидетельствующие о том, что hIL-2-N88R при его применении в дозах, равных или более низких, чем дозы пролейкина, индуцирует увеличение количества регуляторных CD4+CD25-Foxp3+-T-клeтoк в большей степени;
на фиг.5 - результаты исследований на страдающих рассеянным склерозом пациентах, свидетельствующие о том, что hIL-2-N88R при его применении в дозах, равных или более низких, чем дозы пролейкина, индуцирует увеличение количества регуляторных CD4+CD25+Foxp3+-T-клeтoк в большей степени;
на фиг.6 - результаты исследований на страдающих рассеянным склерозом пациентах, свидетельствующие о том, что hIL-2-N88R при его применении в дозах, равных или более низких, чем дозы пролейкина, индуцирует увеличение количества регуляторных CD4+CD25-Foxp3+-T-клeтoк в большей степени;
на фиг.7 - результаты исследований на страдающих рассеянным склерозом пациентах, свидетельствующие о том, что hIL-2-N88R при его применении в дозах, равных или более низких, чем дозы пролейкина, индуцирует увеличение количества цитотоксических CFSElow/CD3+CD8+CD45RO+-T-клeтoк в меньшей степени;
на фиг.8 - результаты исследований на здоровых людях, свидетельствующие о том, что hIL-2-N88R при его применении в дозах, равных или более низких, чем дозы пролейкина индуцирует увеличение количества цитотоксических CFSElow/CD3+CD8+CD45RO+-T-клeтoк в меньшей степени;
на фиг.9 - результаты исследований на мышиной модели диабета типа I, свидетельствующие о том, что hIL-2-N88R по сравнению с hIL-2 дикого типа обусловливает большее повышение содержания (в процентах) РохР3+-клеток в популяции CD4+-клeтoк (А). Кроме того, указанные CD4+FохР3+-клетки характеризуются более высоким уровнем экспрессии CD25 (Б);
на фиг.10 - результаты исследований на мышиной модели диабета типа I, свидетельствующие о том, что hIL-2-N88R в отличие от hIL-2 дикого типа предупреждает развитие диабета.
Варианты осуществления изобретения
1. Материал и методы
1.1 Выделение РВМС из цельной крови для применения в анализах in vitro
Мононуклеарные клетки периферической крови (РВМС) из организмов здоровых индивидуумов, страдающих меланомой пациентов или страдающих рассеянным склерозом (PC) пациентов выделяют из крови с использованием среды для разделения лимфоцитов (Histopaque, фирма Sigma Aldrich). Для этой цели две пробирки с кровью (7 или 10 мл), полученной из организма одного и того же здорового индивидуума или пациента, переносят в стерильную 50-миллилитровую пробирку и доводят объем до 30 мл с помощью среды RPMI 1640 (фирма InVitrogen, №14190-69). Затем 30 мл разведенной крови наслаивают на 15 мл раствора с непрерывным градиентом плотности (плотность = 1,077; Histopaque, фирма Sigma Aldrich, №10771).
После центрифугирования при 400 g в течение 40 мин при 20°С без встряхивания собирают два «содержащих лейкоциты кольца» и переносят в стерильную 50-миллилитровую пробирку и отмывают дважды забуференным фосфатом физиологическим раствором (ЗФР; фирма In Vitrogen, №14190-169). В случае загрязнения эритроцитами осуществляют лизис RBC («эритроциты»); к клеточному дебрису добавляют 2 мл раствора для лизиса RBC и осуществляют инкубацию в течение 2 мин при осторожном перемешивании при комнатной температуре с последующей процедурой отмывки с использованием большего объема полной среды (RPMI 1640 с 10% фетальной телячьей сыворотки).
Количество живых лейкоцитов определяют путем окрашивания методом исключения трипанового синего (фирма In Vitrogen, №15250-061) и с использованием гемоцитометра (FisherBioblock A2759B).
1.2 Мечение с использованием флуоресцентной метки CFSE
После подсчета клетки отмывают дважды ЗФР и ресуспендируют в ЗФР в концентрации 1×106 клеток/мл. Добавляют CFSE (фирма In Vitrogen, №С1157) в конечной концентрации 0,5 мкМ. После 10-минутной инкубации в темноте при 37°С меченные с помощью CFSE клетки отмывают трижды свежей полной средой при 4°С и ресуспендируют в полной среде в концентрации 1×106клеток/мл для посева.
1.3 Стимуляция РВМС in vitro
РВМС либо оставляют без стимуляции, либо стимулируют hIL-2 дикого типа (пролейкин) или hIL-2-N88R (BAY 50-4798; лот №PR312C008) с добавлением пула синтетических пептидов, которые получают из специфических для меланомы белков gp100, TRP-2, MART-1 и тирозиназы или из белка MOG, специфического для рассеянного склероза (PC), каждый пептид добавляют в конечной концентрации 2,5 мкМ (пептид, специфический для меланомы) или 30 мкг/мл (пептид, специфический для PC), или без добавления указанного пула пептидов.
Добавляют стимулятор и пептид, получая 23 следующих варианта:
Затем клетки культивируют в течение 6 дней при 37°С в атмосфере, содержащей 5% СО2.
1.4 Анализ пролиферации и фенотипирование с использованием проточного цитометра FC500
Окрашивание клеток флуоресцентномеченными антителами к расположенным на клеточной поверхности молекулам-маркерам позволяет изучать пролиферацию определенных подгрупп лимфоцитов (клетки памяти и маркеры активации, см. таблицу 2). Иммуноокрашивание с использованием меченных флуорохромом (РЕ: фикоэритрин, ECD: РЕ-техасский красный, АРС: аллофикоцианин, РС7: РЕ-Су7) антител осуществляют до начала культивирования и после культивирования в течение 6 дней с использованием стимуляторов.
В день 6 первые два окрашивания (1 и 1изо) осуществляют с использованием клеток, не меченных с помощью CFSE (CFSE: сукцинимидиловый эфир карбоксифлуоресцеиндиацетата); другие окрашивания осуществляют с использованием меченных с помощью CFSE клеток.
CD25-PE, Рохр3-АРС и крысиный IgG2a-APC получают от фирмы eBiosciences; CD25-APC, CD45RA-APC и CD45RO-APC от фирмы BD Biosciences. Все другие антитела получают от фирмы Beckman-Coulter, Франция.
1.5 Мышиная модель диабета типа I
12-недельных мышей линии NOD («диабет, не сопровождающийся ожирением») обрабатывают ежедневно мутеином hIL-2 или hIL-2 дикого типа. Применяемых в качестве отрицательного контроля животных обрабатывают аналогичным образом физиологическим соляным раствором (соляной раствор). Обрабатываемые группы состоят из 3-5 животных. Мышам вводят в дни 0-15 мутеин hIL-2 или hIL-2 дикого типа в дозе, составляющей 5К- или 25К-единиц. Начиная со дня 17, количество интерлейкина в группах, обработанных дозой, составляющей 5К-единиц, повышают до 100 К-единиц (6,112 мкг). Обработку животных дозой, составляющей 25К-единиц, оставляют без изменений. Введение последней дозы осуществляют в день 31. В параллельном эксперименте со дня 0 по день 31 осуществляют обработку фиксированной дозой, составляющей 25К-единиц. Для выявления диабета осуществляют мониторинг уровней глюкозы в моче. Сбор образцов крови мышей осуществляют в день 17 и день 30. Образцы анализируют с помощью FACS, используя окрашивание антителами к CD4, к CD25 и к FохР3, и определяют процентное содержание FохР3+-клеток среди CD4+-T-клeтoк и среднюю интенсивность флуоресценции (MFI), характеризующую экспрессию CD25 на CD4+FoxP3+-клетках.
2. Результаты
2.1 Индукция регуляторных Т-клеток с помощью hIL-2-N88R
В качестве приемлемой системы in vitro для оценки воздействия мутеинов, предлагаемых в изобретении, применяли мононуклеарные клетки периферической крови (РВМС). РВМС состоят из Т-клеток (~ 75% CD4- и CD8-позитивных клеток) и В- и NK-клеток (~ 25% позитивных клеток), и поэтому они представляют собой клеточную популяцию, в достаточной степени соответствующую иммунной системе.
РВМС, полученные из организма 6 здоровых индивидуумов (10 клеток/мл), стимулировали IL-2 дикого типа (пролейкин) или IL-2-N88R [BAY 50-4798, лот №PR312C008 («ВАY №С008»)] в концентрациях от 10-11 до 10-6М или в качестве положительного контроля неспецифическим митогеном фитогемагглютинином («ФГА») в концентрации 5 мкг/мл или только культуральной средой («Med»). В день 0 и на шестой день после стимуляции определяли содержание регуляторных CD4+CD25+Foxp3+-Т-клеток в популяции CD3+-лимфоцитов. Результаты представлены на фиг.1 и ниже в таблице 3.
Из этого эксперимента следует, что hIL-2-N88R в концентрациях 10-7 М и 10-6 М приводил к значительной индукции субпопуляции регуляторных CD4+CD25+Foxp3+-T-клeтoк. При этом индукция оказалась существенно выше, чем при стимуляции РВМС с помощью hIL-2 дикого типа.
С использованием второго препарата исследовали увеличение субпопуляции регуляторных CD4+CD25-Foxp3+-T-клeтoк после стимуляции hIL-2-N88R в сравнении с hIL-2 дикого типа. Результаты представлены на фиг.2 и ниже в таблице 4.
И в этом случае установлено также, что стимуляция hIL-2-N88R приводила к значительному увеличению субпопуляции регуляторных CD4+CD25-Foxp3+-Т-клеток, при этом при использовании мутеина в концентрации 10-6 М обнаружена существенно более высокая стимуляция по сравнению со стимуляцией с помощью hIL-2 дикого типа.
2.2 hIL-2-N88R индуцирует регуляторные Т-клетки в организме страдающих меланомой пациентов
Далее исследовали, может ли мутеин hIL-2 N88R, предлагаемый в изобретении, стимулировать также антигенспецифическую активность иммунных клеток. Для этой цели РВМС (106 клеток/мл), полученные из организма трех страдающих меланомой пациентов, стимулировали hIL-2-N88R (BAY 50-4798, лот №РR312С008) или hIL-2 дикого типа (пролейкин) в концентрациях от 10-11 до 10-6 М в присутствии ассоциированного с меланомой пула пептидов (Pept) или без них с использованием 5 мкг/мл ФГА или только культуральной среды. Затем оценивали субпопуляции регуляторных CD4+CD25+Foxp3+-T-клeтoк и CD4+CD25-Foxp3+-T-клeтoк соответственно. Результаты представлены на фиг.3 и в таблице 5 и на фиг.4 и в таблице 6 соответственно.
В этом эксперименте установлено, что введение hIL-2-88R приводит также к значительному увеличению регуляторных Т-клеток у страдающих меланомой пациентов. В этом случае установлено, что при использовании мутеина в концентрациях 10-7 М и 10-6 М субпопуляция CD4+CD25+Foxp3+-T-клeтoк и при использовании мутеина в концентрации 10-6 М субпопуляция CD4+CD25-Foxp3+-Т-клеток оказались существенно более крупными, чем при стимуляции соответствующими концентрациями IL-2 дикого типа (пролейкин).
2.3 hIL-2-N88R индуцирует регуляторные Т-клетки в организме страдающих рассеянным склерозом пациентов
Далее исследовали, может ли мутеин hIL-2 N88R, предлагаемый в изобретении, стимулировать также антигенспецифическую активность иммунных клеток. Для этой цели РВМС (10 клеток/мл), полученные из организма двух страдающих рассеянным склерозом пациентов, стимулировали hIL-2-N88R (BAY 50-4798, лот №РR312С008) или hIL-2 дикого типа (пролейкин) в концентрациях от 10-11 до 10-6 М в присутствии ассоциированного с рассеянным склерозом пула пептидов или без них с использованием 5 мкг/мл ФГА или только культуральной среды. Затем оценивали субпопуляции регуляторных CD4+CD25+Foxp3+-T-клeтoк и CD4+CD25-Foxp3+-T-клeтoк соответственно. Результаты представлены на фиг.5 и в таблице 7 и на фиг.6 и в таблице 8 соответственно.
В этом эксперименте установлено, что введение hIL-2-88R приводит также к значительному увеличению регуляторных Т-клеток у страдающих рассеянным склерозом пациентов. В этом случае установлено, что при использовании мутеина в концентрациях 10-8 М и 10-7 М субпопуляция CD4+CD25+Foxp3+-Т-клеток и при использовании мутеина в концентрации 10-6 М субпопуляция CD4+CD25-Foxp3+-T-клeтoк оказались существенно более крупными, чем при стимуляции соответствующими концентрациями IL-2 дикого типа (пролейкин).
2.4 ML-2-N88R индуцирует лишь минимальную пролиферацию цитотоксических CD8+-Т-клеток у пациентов, страдающих рассеянным склерозом, и у здоровых индивидуумов
Изучали также стимуляцию цитотоксических центральных CD8+-Т-клеток памяти. Для этой цели РВМС, полученные из организма здоровых индивидуумов или страдающих рассеянным склерозом пациентов, обрабатывали согласно методу, описанному в разделе 2.3. Определяли процентное содержание CFSElow/CD3+CD8+CD45RO+-T-клeтoк. Результаты представлены на фиг.7 и в таблице 9 и на фиг.8 и в таблице 10.
При исследовании с использованием крови страдающих рассеянным склерозом, а также здоровых индивидуумов, установлено, что отличие от hIL-2 дикого типа обработка с помощью hIL-2-N88R приводила лишь к небольшой пролиферации центральных CD8+-Т-клеток памяти при всех изученных концентрациях.
2.5 Обработка мутеином hIL-2 препятствует развитию диабета типа I при изучении на животной модели
По сравнению с обработкой hIL-2 дикого типа обработка NOD-мышей с помощью hIL-2-N88R приводила к более значительному повышению процентного содержания FохР3+-клеток в популяции CD4+-клеток (фиг.9 (А)). Кроме того, для этих CD4+FoxP3+-позитивных клеток характерен более высокий уровень экспрессии CD25 (фиг.9 (Б)). На фиг.10 продемонстрировано, что в отличие от обработки с помощью hIL-2 дикого типа обработка с помощью hIL-2-N88R мышей, применяемых в качестве модели диабета типа I, препятствовала развитию диабета у всех мышей в группе животных, которых обрабатывали мутеином.
3. Заключение
Эксперименты, проведенные при создании изобретения, четко продемонстрировали, что с учетом их способности осуществлять индукцию регуляторных Т-клеток (TReg) мутеины hIL-2, предлагаемые в изобретении, и их участки представляют собой субстанции, которые можно применять для лечения и/или профилактики аутоиммунного заболевания или для индукции TReg в организме и для образования TReg in vitro. При создании изобретения это продемонстрировано не только in vitro, но также и in vivo.
Реферат
Группа изобретений относится к медицине и касается применения мутеина человеческого интерлейкина-2 (мутеин hIL-2), имеющего аминокислотную замену аспарагина в положении 88 на аргинин или на глицин, или на изолейцин и/или замену аспарагиновой кислоты в положении 20 на гистидин или на изолейцин, или на тирозин и/или замену глутамина в положении 126 на лейцин для приготовления лекарственного средства, предназначенного для лечения и/или профилактики аутоиммунного заболевания и для образования регуляторных Т-клеток в живом организме. Группа изобретений обеспечивает хорошую переносимость и низкую токсичность средства. 5 н. и 7 з.п. ф-лы, 10 табл., 10 ил.
Формула
(а) создают мутеин человеческого интерлейкина 2 (мутеин hIL-2),
(б) приводят в контакт мутеин hIL-2 с мононуклеарными клетками периферической крови (РВМС) и
(в) при необходимости повторяют стадии (а) и (б),
отличающийся тем, что мутеин hIL-2 представляет собой мутеин hIL-2, предназначенный для применения по одному из пп.7-10.

Комментарии