Химические соединения и их применение для улучшения качества мышц - RU2724329C2
Код документа: RU2724329C2
Чертежи



Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается химических соединений и их терапевтического применения, в частности для улучшения качества мышц у млекопитающих.
Более конкретно, настоящее изобретение позволяет улучшать качество мышц у страдающих ожирением млекопитающих.
Настоящее изобретение также позволяет улучшать качество мышц у саркопенических млекопитающих.
Настоящее изобретение также касается применения указанных химических соединений в лечении и/или профилактике ожирения у млекопитающих.
Уровень техники
Мышечная атрофия может возникать вследствие нескольких причин: недостаточное питание, неиспользование мышц (например, иммобилизация вследствие перелома), рак или другие серьезные заболевания (сердечная или почечная недостаточность), вызывающие кахексию, или может естественным образом развиваться при старении организма (саркопения). Указанная атрофия может являться следствием снижения синтеза белка и/или усиления протеолиза и, соответственно, сопровождается фиброзом и/или инфильтрацией жировой ткани. Определение факторов и механизмов управления синтезом мышечного белка и мышечного протеолиза, соответственно, представляет собой необходимое условие для разработки подходящего лечения перечисленных патологических состояний.
На фиг. 1, являющейся частью предшествующего уровня техники, показаны основные механизмы синтеза белка и мышечного протеолиза (по работам Zhao et al., 2008 и Little et al., 2009).
Синтез мышечного белка жизненно необходим и в значительной степени контролируется на уровне трансляции. Разумеется, его необходимым условием является должное потребление аминокислот с пищей. Синтез мышечного белка стимулируется физической активностью и регулируется многими факторами, основными из которых являются IGF-1 и андрогены (Little et al., 2009).

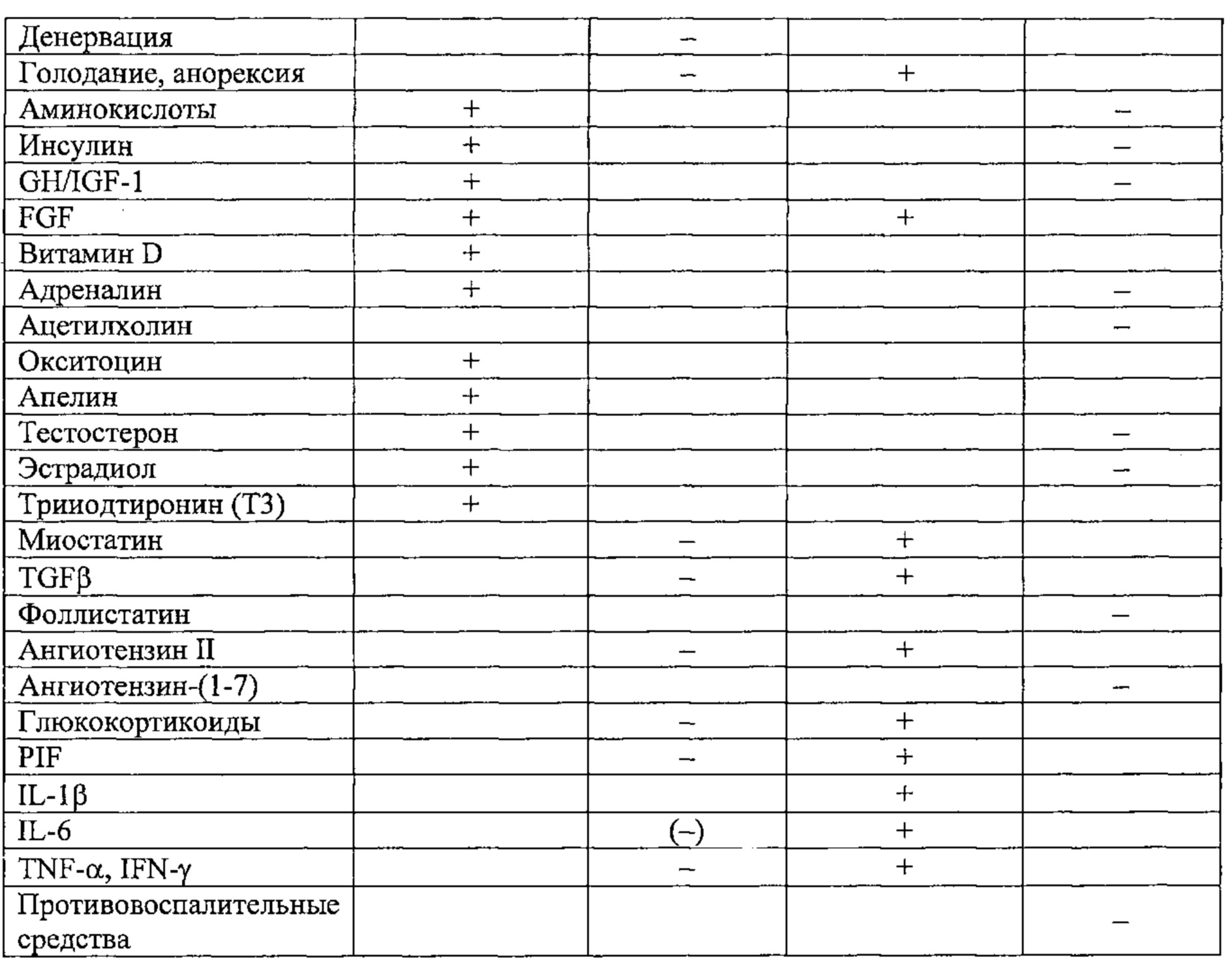
Протеолиз мышечных волокон протекает при участии протеасом, в то время как митохондрии разрушаются в процессе аутофагии (Zhao et al., 2008). Описаны также механизмы апоптоза с участием клеток-сателлитов (Murphy et al., 2010).
Миостатин, вырабатываемый аутокринным образом непосредственно в мышцах, представляет собой особенно значимый фактор, так как он действует и как стимулятор протеолиза, и как ингибитор синтеза белка. Также он стимулирует фиброз (Li et al., 2008).
Старение сопровождается изменением различных регуляторных факторов (Walston et al., 2012): физическая активность обычно снижается, потребление белка/витаминов может быть недостаточным, и после приема пищи содержание циркулирующих аминокислот, повышение которого необходимо для стимуляции синтеза бежа, демонстрирует пониженный рост, что может быть следствием висцеральной секвестрации (Boirie et al., 1997). Кроме того, старение сопровождается значительными изменениями гормонального фона: в частности, наблюдают повышение содержания миостатина (Leger et al., 2008), снижение содержания андрогенов (Seidman, 2007) и гормона роста (Macell et al., 2001; Sattler, 2013), а также повышение содержания маркеров воспаления (IL-6, TNF-α etc., Schaap et al., 2009; Verghese et al., 2011). Данные изменения неблагоприятны для синтеза белка, но в то же время содействуют протеолизу, что приводит к постепенному снижению мышечной массы (саркопения). Они также вызывают изменение распределения типов мышечных волокон в сторону уменьшения количества быстрых волокон, что выливается в уменьшение силы мышц (динапения). В конечном счете, наблюдается развитие соединительной ткани в мышцах (фиброз).
В контексте ожирения ситуация осложняется несколькими дополнительными факторами: жировая инфильтрация мышц усугубляет воспалительное состояние, инсулинорезистентность снижает влияние IGF-1 на синтез белка, не говоря о том, что вследствие избыточного веса снижается мобильность (Stenholm et al., 2009).
На фиг. 2, являющейся частью предшествующего уровня техники, показано усугубление саркопении в контексте ожирения (согласно Quillot et al., 2013).
В любом случае, при отсутствии лечения саркопения представляет собой процесс, который может идти только в отрицательном направлении, вплоть до полной потери мобильности. Однако саркопения не является единственным процессом, приводящим к атрофии скелетных мышц. Атрофия также возникает при неподвижности (например, вследствие перелома), при продолжительном голодании (или диете для похудения) или при серьезных патологических состояниях (например, рак, СПИД), которые вызывают кахексию. Также можно упомянуть различные мышечные дистрофии генетического характера. Эти разные ситуации имеют много общих признаков с саркопенией, но с разным вкладом факторов-триггеров (Tisdale, 2007; Saini et al., 2009).
Известные возможные способы лечения
Были разработаны и исследованы различные способы профилактики/лечения саркопении. Прежде всего, это физические упражнения, эффективность которых общепризнана (Bonnefoy et al, 2000; Bonnefoy, 2008; Ryan et al., 2013). Так, после упражнений, осуществляемых в течение 8 недель, наблюдали увеличение мышечной силы на 180% и мышечной массы на 11% (Fiatarone et al., 1990). Однако для достижения оптимальной эффективности требуется несколько часов физических упражнений ежедневно, что затруднительно обеспечивать в течение долгого периода времени.
Повышенное потребление субстратов для синтеза белка, за счет потребления быстро усваивающегося белка согласно оптимизированному графику (Coöffiei et al., 2009; Aussel et al., 2013), или за счет дополнительного приема некоторых аминокислот и их метаболитов (лейцин, НМВ [β-гидрокси-β-метилбутират], цитруллин, орнитин), могут усиливать синтез мышечного белка (Li & Heber, 2011).
Различные фармацевтические способы лечения нацелены на корректировку связанных со старением изменений гормонального фона (Crenn, 2013). Они включают:
- половые гормоны, такие как тестостерон (White et al., 2013) или его варианты, SARM (селективные модуляторы андрогенных рецепторов), или неполовые гормоны, такие как гормон роста (Liu et al., 2003) и IGF-1, грелин или програнулин, или даже витамин D;
- ингибиторы миостатина (антитела, направленные против этой молекулы, или ее рецептора, или пептида-предшественника миостатина) (Murphy et al., 2010; Han & Mitch, 2011);
- молекулы, которые нацелены на ренин-ангиотензиновую систему, такие как ингибиторы АСЕ или ангиотензина 1-7 (Dalla Libera et al., 2001; Shiuchi et al., 2004; Kalupahana & Moustaid-Moussa, 2012; Allen et al., 2013);
- агонисты β-адренорецептора (Ryall et al., 2004, 2007);
- разные натуральные вещества или даже сложные экстракты растительного происхождения (например, изофлавоноиды: Aubertin-Leheudre et al., 2007; экстракт оливкового масла: Pierno et al., 2014; ресвератрол: Shadfar et al., 2011; Bennett et al., 2013).
Большое разнообразие данных способов лечения свидетельствует о сложности лечения многофакторного патологического состояния, провоцирующие факторы которого полностью не определены. Кроме того, некоторые молекулы-кандидаты обладают побочными эффектами (например, в случае половых гормонов, SARM или β-агонистов), или на данный момент были исследованы только на животных моделях. Все перечисленные факторы объясняют недостаток на рынке доступных лекарственных средств.
В настоящее время научные исследования в большей степени нацелены на миостатин, на ингибирование его действия, например анти-миостатиновыми антителами или антителами к его рецептору (Dumonceaux et al., 2010; Greenberg, 2012; Sakuma & Yamaguchi, 2012; Arounleut et al., 2013; Buehring & Binkley, 2013; Collins-Hooper et al., 2014; White & Le Brasseur, 2014).
Фитоэкдизоны, и более конкретно 20-гидроксиэкдизон (20Е), являлись предметом многочисленных фармакологических исследований, которые были начаты в Японии и затем в Узбекистане, и затем проводились в некоторых других странах.
В ходе данных исследований были обнаружены противодиабетические и анаболические свойства указанной молекулы. Наблюдали ее стимулирующее воздействие на синтез белка в мышцах у крыс in vivo (Syrov, 2000; Toth et al., 2008; Lawrence, 2012) и на микротрубочки мышей С2С12 in vitro (Gorelick-Feldman et al., 2008). Этот эффект имеет место на уровне трансляции, и в него вовлечено фосфорилирование рибосомного белка p70S6K в конце каскада, включающего Akt/PkB протеинкиназу, данный путь также использует IGF-1 для стимулирования синтеза белка.
С помощью тех же С2С12 клеток Zubeldia et al. (2012) показали, что экстракт Ajuga turkestanica, обогащенный фитоэкдизонами (20-гидроксиэкдизон и туркестерон), ингибирует транскрипцию миостатина и каспазы 3 (белок, участвующий в процессах апоптоза).
Кроме того, 20-гидроксиэкдизон обладает противофиброзными свойствами, что было продемонстрировано не на примере мышц, а на примере почек, где механизмы фиброза протекают крайне схожим образом (Hung et al., 2012). Таким образом, он противодействует действию TGFβ белка, сходного с миостатином, и в частности стимуляции Smad 2,3, вызываемой данным веществом. Следовательно, можно считать, что 20-гидроксиэкдизон может оказывать аналогичное действие в мышцах (или в сердце).
20-гидроксиэкдизон снижает процент жира в организме мышей, которых кормили пищей, богатой жирами (Kizelsztein et al., 2009; Foucault et al., 2012), или в организме самок крыс после овариэктомии, в модели менопаузы (Seidlova-Wuttke et al., 2010).
Некоторые из эффектов, описанных выше для животных моделей, также были обнаружены в клинических исследованиях, количество которых еще меньше. Так, 20-гидроксиэкдизон повышал физическую силу (Azizov et al., 1995; Gadhzieva et al., 1995) и мышечную массу (Simakin et al., 1988) и вызывал снижение массы абдоминального жира у добровольцев, страдающих ожирением и избыточным весом (Wuttke et al., 2013; Foucault et al, 2014; патентная заявка PCT, опубликованная как WO 2013/068704).
Однако 20Е и его метаболиты обладают плохой биодоступностью для мышей (Dzhukharova et al., 1987; Hikino et al., 1972), крыс (Kapur et al., 2010 и Seidlova-Wuttke et al., 2010) и людей (Brandt 2003; Bolduc, 2006). Среди прочего, их общая эффективность в отношении улучшения качества мышц в целом не является полностью удовлетворительной.
В некоторых исследованиях описано, что туркестерон (11а,20-дигидроксиэкдизон), метаболит, образующийся из 20Е, демонстрирует более высокую активность, чем 20Е, in vivo (Syrov et al., 2001: Bathori et al., 2008). В настоящее время в терапевтическом применении, направленном на улучшение качества мышц у страдающих ожирением млекопитающих и страдающих саркопенией млекопитающих, все еще ощущается потребность в новых соединениях, обладающих хорошей биодоступностью, выражаемой в коэффициенте содержания вещества в плазме крови, и в то же время имеющих более высокую общую эффективность, чем 20Е, в отношении улучшения качества мышц, где общая эффективность выражается в эффективности ингибирования экспрессии гена миостатина в сочетании с усилением синтеза белка у млекопитающих.
Краткое описание сути изобретения
Авторы настоящего изобретения неожиданно обнаружили, что некоторые соединения семейства стероидов, имеющие определенную общую формулу, структура которой отличается от 20Е и его метаболитов, имеют коэффициент содержания в плазме крови более высокий, чем у 20Е, и оказывают более сильное или равное действие по сравнению с 20-гидроксиэкдизоном (20Е), в отношении ингибирования миостатина и стимуляции синтеза белка путем фосфорилирования белка S6K1. Данные свойства позволяют улучшать качество и/или силу мышц у страдающих саркопенией млекопитающих и у страдающих саркопеническим ожирением млекопитающих.
Соединения по настоящему изобретению не воздействуют на стероидные ядерные рецепторы половой системы (андрогеновые рецепторы и эстрогеновые рецепторы). Они демонстрируют хорошую химическую стабильность в плазме и в микросомах. Наконец, некоторые из этих соединений обладают заметно лучшим фармакокинетическим профилем по сравнению с 20-гидроксиэкдизоном. Они также обеспечивают лучшее ингибирование экспрессии гена миостатина и улучшенный синтез белка.
Так, в настоящем изобретении описано соединение общей формулы (I), изображенной ниже:
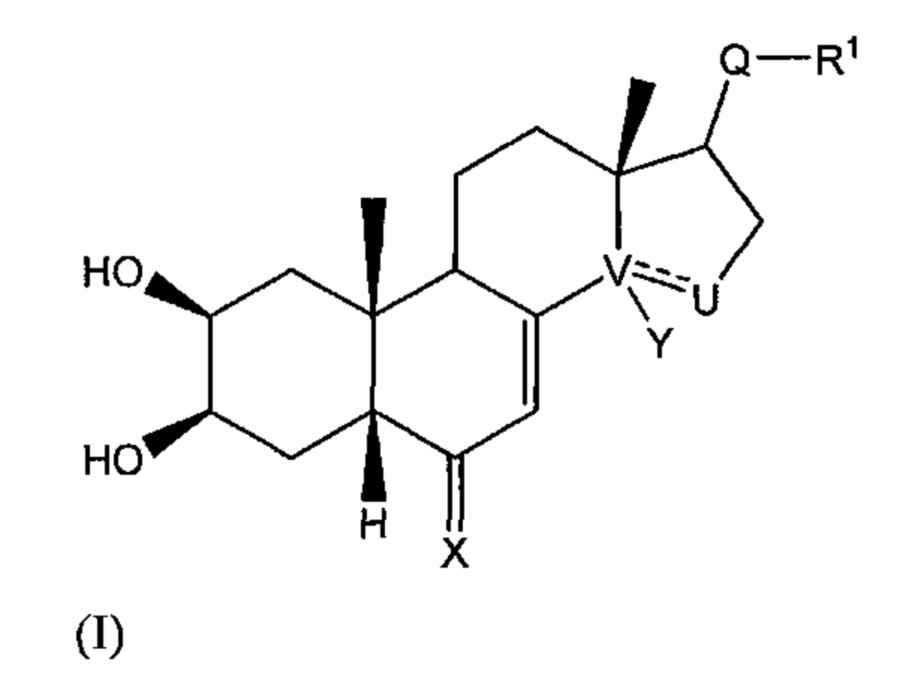
где:
V-U представляет собой углерод-углеродную простую связь, и Y представляет собой гидроксильную группу или атом водорода, или V-U представляет собой C=C этиленовую связь;
X выбран из: атома кислорода; N-OR5 группы,
R5 тогда выбран из: атома водорода; C1-C6 алкильной группы, необязательно содержащей ненасыщенные фрагменты в цепи; (C1-C6)CO2R6 группы, в которой R6 может представлять собой атом водорода или C1-C6 группу; (C1-C6)OR7 группы, где R7 представляет собой ароматический или гетероароматический цикл, необязательно монозамещенный или полизамещенный алкильной или алкоксильной группой, CF3, Cl; (C1-C6)NR8R9 группы, где R8 и R9 представляют собой C1-C6 группы, или (C1-C6)N(C1-C6) группы или (C1-C6)N(C1-C6)OR6 группы, в которых R6 такой, как описано выше, NR8R9 также может представлять собой гетероцикл; и где:
- Q представляет собой карбонильную группу;
R1 выбран из: (C1-C6)W(C1-C6) группы; (C1-C6)W(C1-C6)W(C1-C6) группы; (C1-C6)W(C1-C6)CO2(C1-C6) группы; (C1-C6)А группы, где A представляет собой гетероцикл, необязательно замещенный группой типа ОН, ОМе, (C1-C6), N(C1-C6) или CO2(С1-C6); CH2Br группы;
W представляет собой гетероатом, выбранный из N, О и S;
или
- Q представляет собой СНОН группу;
R1 выбран из: (C1-C6)W(C1-C6) группы; (C1-C6)W(C1-C6)W(C1-C6) группы; (C1-C6)W(C1-C6)CO2(C1-C6) группы;
W представляет собой гетероатом, выбранный из N и S; или
- Q выбран из: C=NOR5 группы, где значение R5 указано выше; CHNR2R3 группы,
где R1 представляет собой (C1-C6) алкильную группу;
где каждый из R2 и R3, которые могут быть одинаковыми или различаться, выбран из: атома водорода; (C1-C6) алкильной группы; (C1-C6)W(C1-C6) группы; циклоалкильной группы; (C1-C6)CHF2 группы; (C1-C6)А группы, в которой A представляет собой описанный выше гетероцикл; группы типа COR4,
где R4 выбран из: необязательно ненасыщенной (C1-C6) алкильной или циклоалкильной группы; описанной выше гетероциклической группы типа A, ароматической или гетероароматической группы, необязательно замещенной группой типа ОН, ОМе, (C1-C6), N(C1-C6), CO2(C1-C6), CF3, OCF3, CN, Cl, F; (C1-C6)W(C1-C6) группы;
где W представляет собой гетероатом, выбранный из N, О и S;
где указанное соединение имеет форму энантиомера, диастереоизомера, гидрата, сольвата, таутомера, рацемической смеси или фармацевтически приемлемой соли.
В другом частном варианте осуществления настоящего изобретения применяется описанное выше соединение общей формулы (I), в котором Q представляет собой карбонильную группу.
В одной частной форме настоящего изобретения применяется соединение общей формулы (I), где:
X представляет собой атом кислорода;
V-U представляет собой углерод-углеродную простую связь;
Y представляет собой гидроксильную группу;
Q представляет собой карбонильную группу;
R1 выбран из: (C1-C6)W(C1-C6) группы; (C1-C6)W(C1-C6)W(C1-C6) группы; (C1-C6)W(C1-C6)CO2(C1-C6) группы; (C1-C6)А группы, где A представляет собой гетероцикл, необязательно замещенный группой типа ОН, ОМе, (C1-C6), N(C1-C6) или CO2(C1-C6);
W представляет собой гетероатом, выбранный из N, О и S.
В другом частном варианте осуществления настоящего изобретения применяется соединение общей формулы (I), где Q представляет собой CHNR2R3 группу, в которой R2 и R3 выбраны из: атома водорода; (C1-C6) алкильной группы; (C1-C6)W(C1-C6) группы; циклоалкильной группы; (C1-C6)CHF2 группы; (C1-C6)А группы, где А представляет собой описанный выше гетероцикл; группы типа COR4,
R4 выбран из: необязательно ненасыщенной (C1-C6) алкильной или циклоалкильной группы; описанной выше гетероциклической группы типа A, ароматической или гетероароматической группы, необязательно замещенной группой типа ОН, ОМе, (C1-C6), N(C1-C6), CO2(C1-C6), CF3, OCF3, CN, Cl, F; (C1-C6)W(C1-C6) группы.
В другом частном варианте осуществления настоящего изобретения применяется соединение общей формулы (I), где:
X представляет собой атом кислорода;
V-U представляет собой углерод-углеродную простую связь;
Y представляет собой гидроксильную группу;
R1 представляет собой метальную группу;
Q представляет собой CHNR2R3 группу;
где R2 и R3 выбраны из: атома водорода; (C1-C6) алкильной группы; (C1-C6)W(C1-C6) группы; циклоалкильной группы; (C1-C6)CHF2 группы; (C1-C6)А группы, где A представляет собой описанный выше гетероцикл; группы типа COR4,
R4 выбран из: необязательно ненасыщенной (C1-C6) алкильной или циклоалкильной группы; описанной выше гетероциклической группы типа A, ароматической или гетероароматической группы, необязательно замещенной группой типа ОН, ОМе, (C1-C6), N(C1-C6), CO2(C1-C6), CF3, OCF3, CN, Cl, F; (C1-C6)W(C1-C6) группы;
W представляет собой гетероатом, выбранный из N, О и S.
В другом частном варианте осуществления настоящего изобретения применяется соединение общей формулы (I), где Q представляет собой C=NOR5 группу, a R5 такой, как описано выше.
В другом частном варианте осуществления настоящего изобретения применяется соединение общей формулы (I), где:
X представляет собой атом кислорода;
V-U представляет собой углерод-углеродную простую связь;
Y представляет собой гидроксильную группу;
R1 представляет собой метальную группу;
Q представляет собой C=NOR5 группу, a R5 такой, как описано выше.
В другом частном варианте осуществления настоящего изобретения применяется соединение общей формулы (I), где V-U представляет собой C=C этиленовую связь.
В другом частном варианте осуществления настоящего изобретения применяется соединение общей формулы (I), где X представляет собой N-OR5 группу, а значение R5 описано выше.
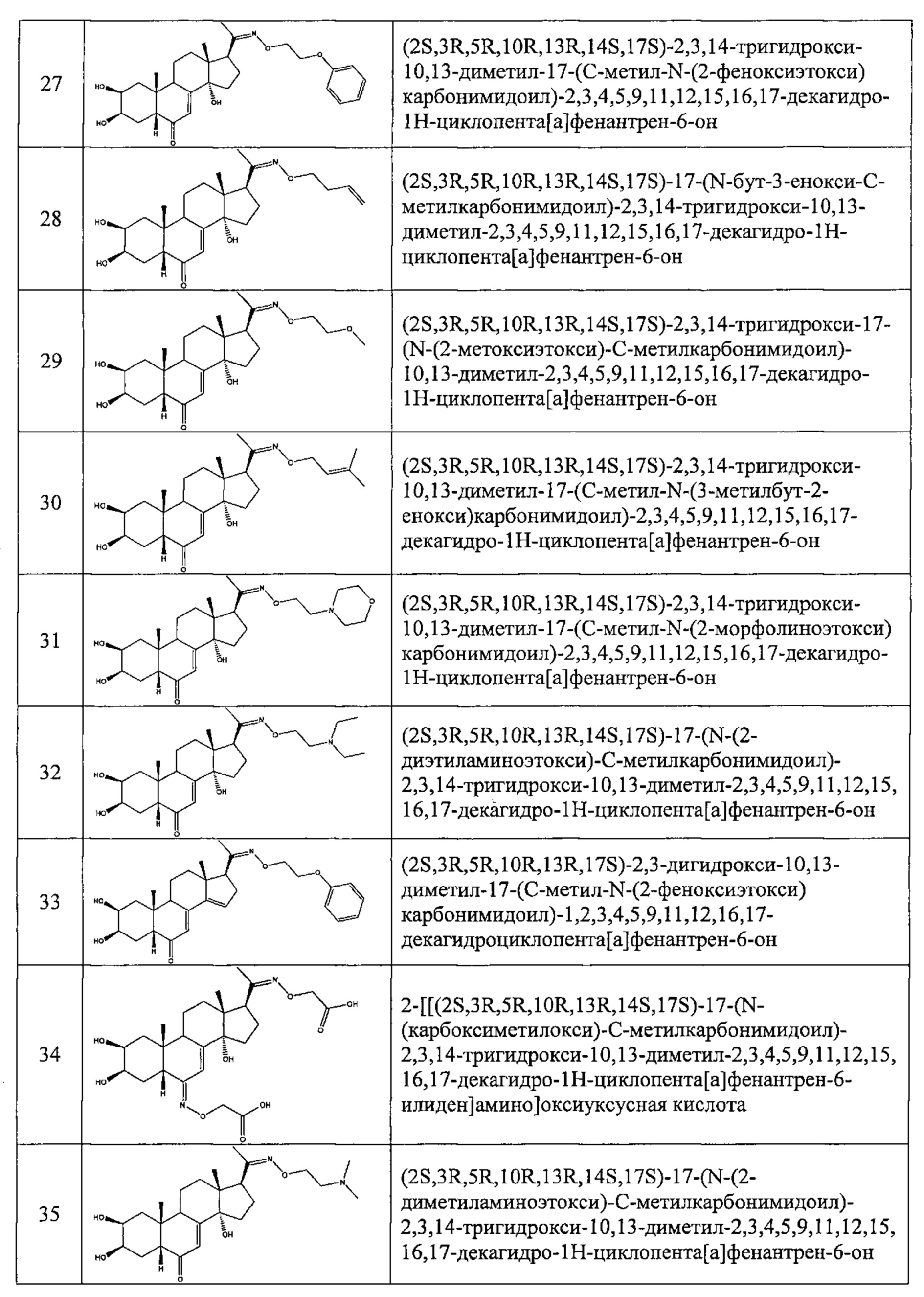
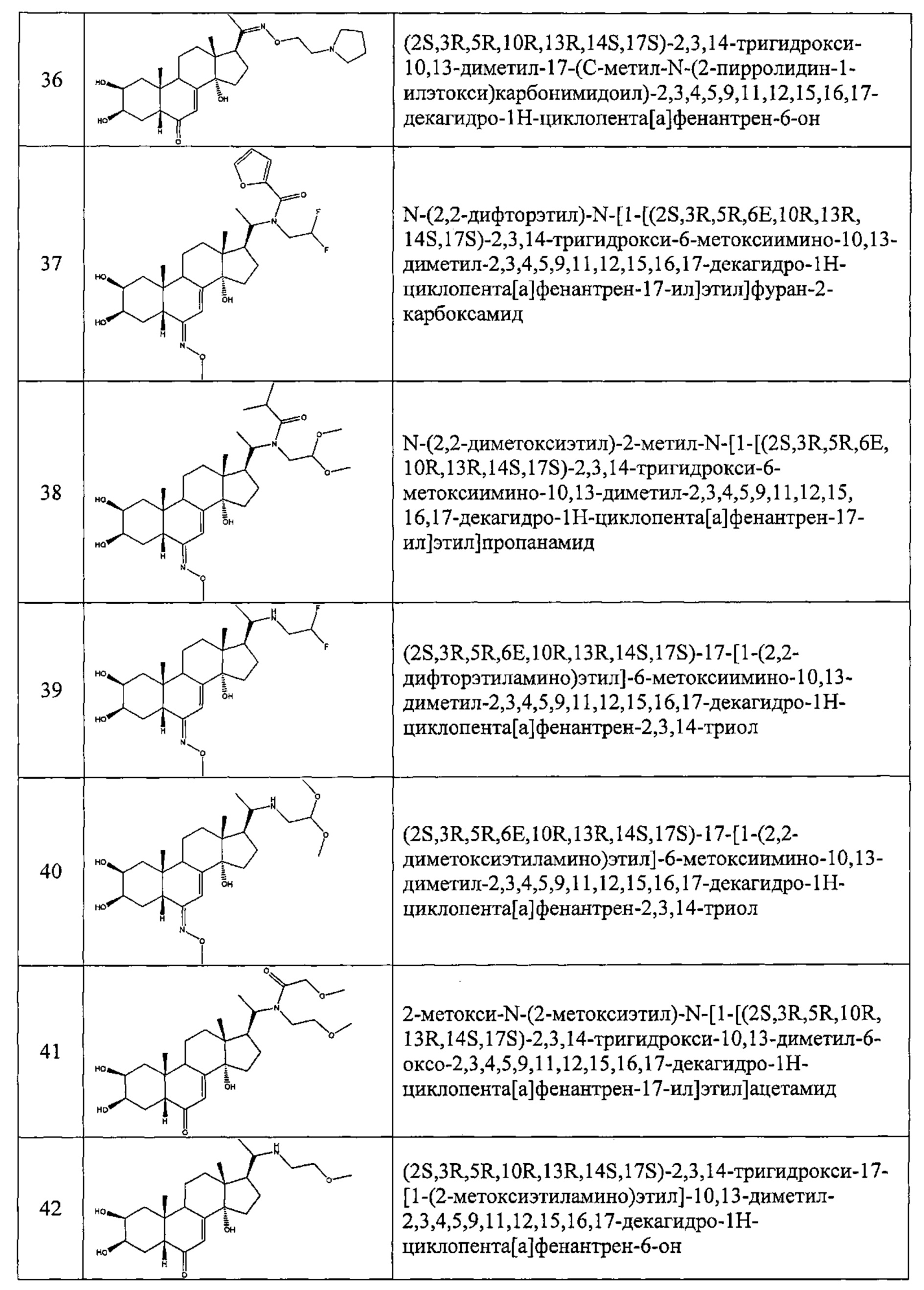
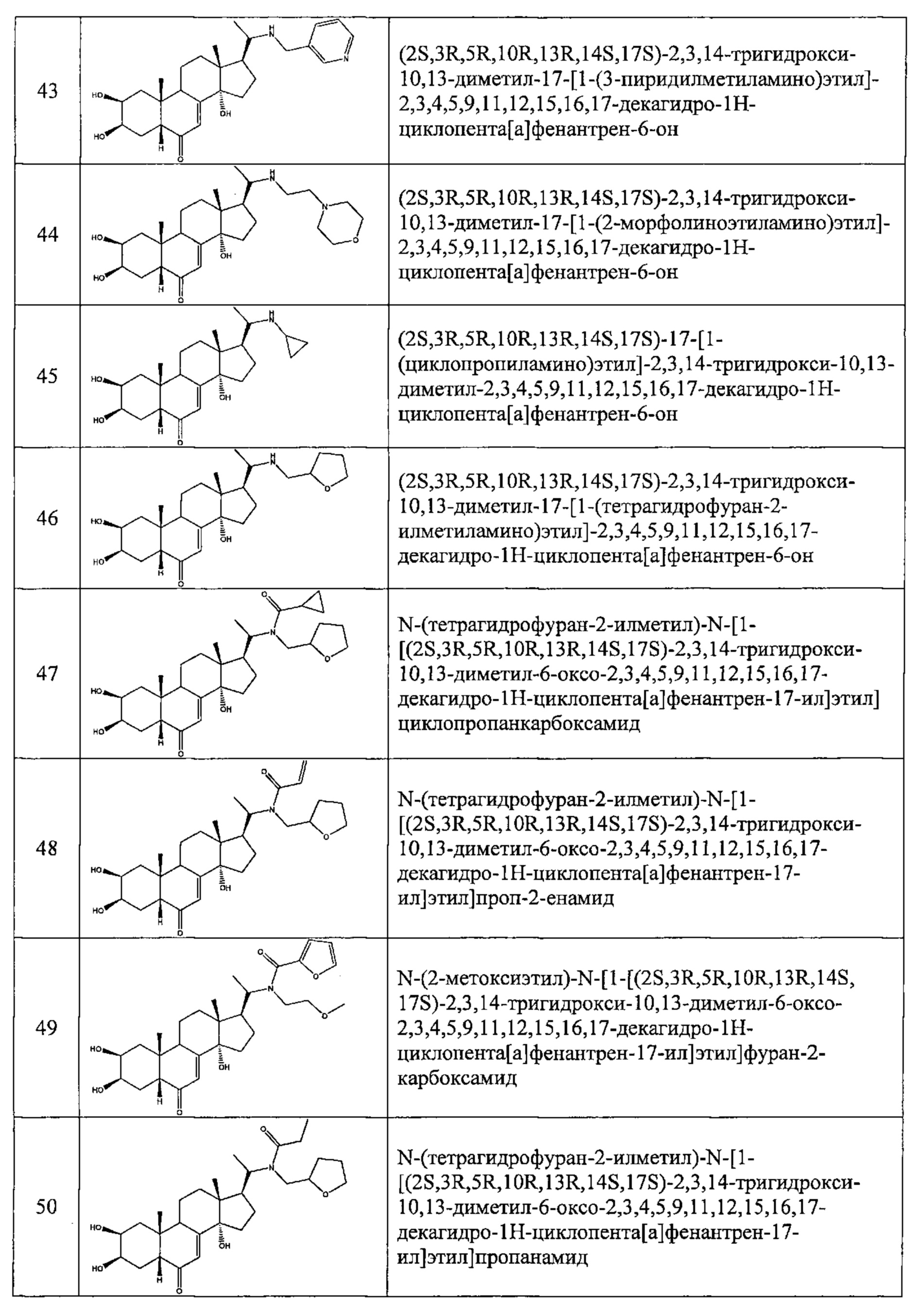
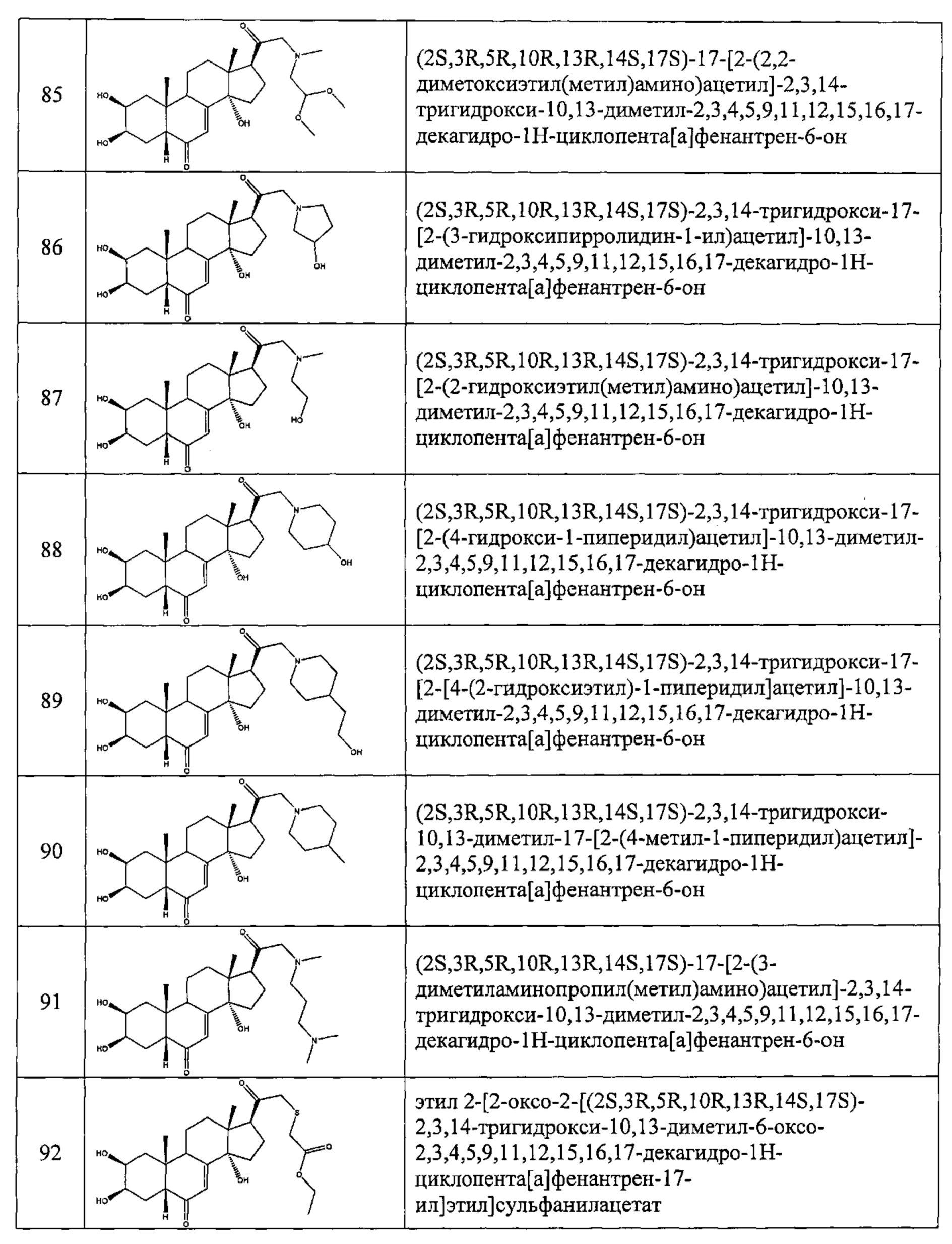
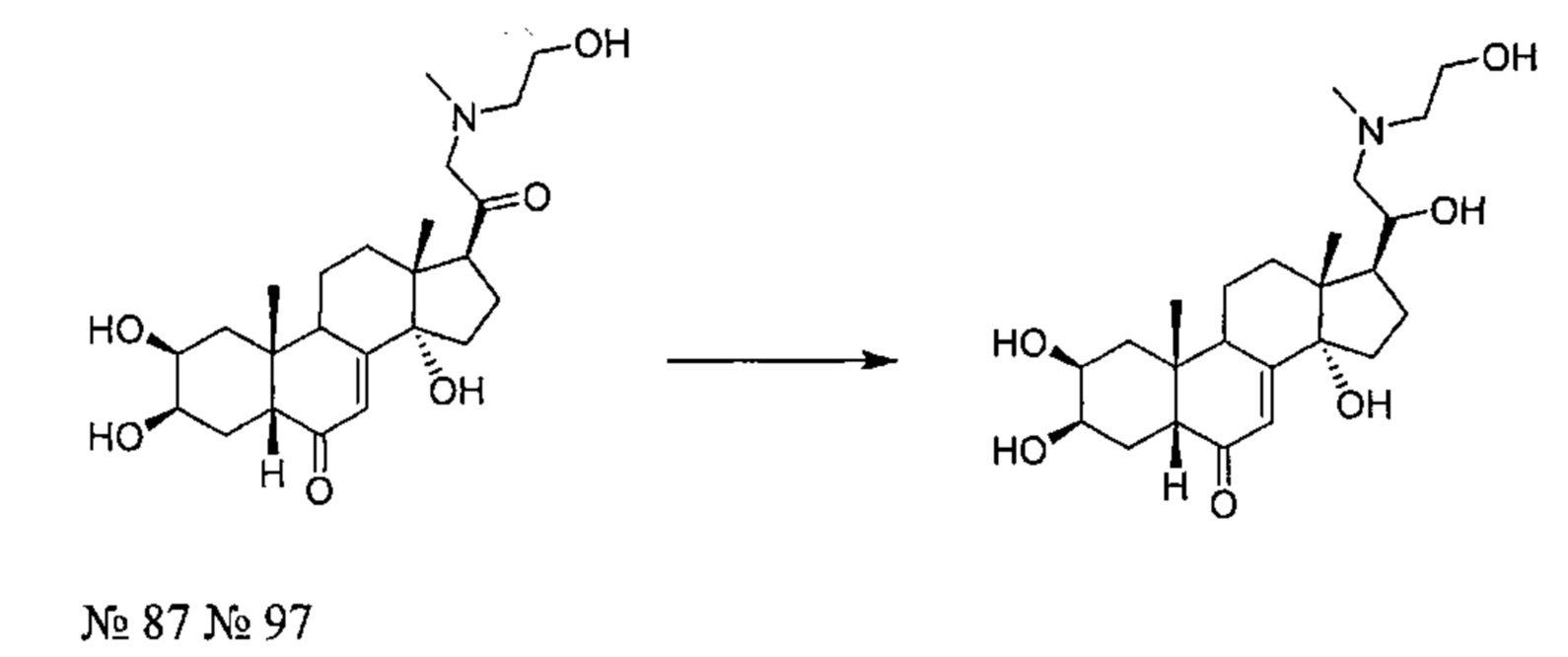
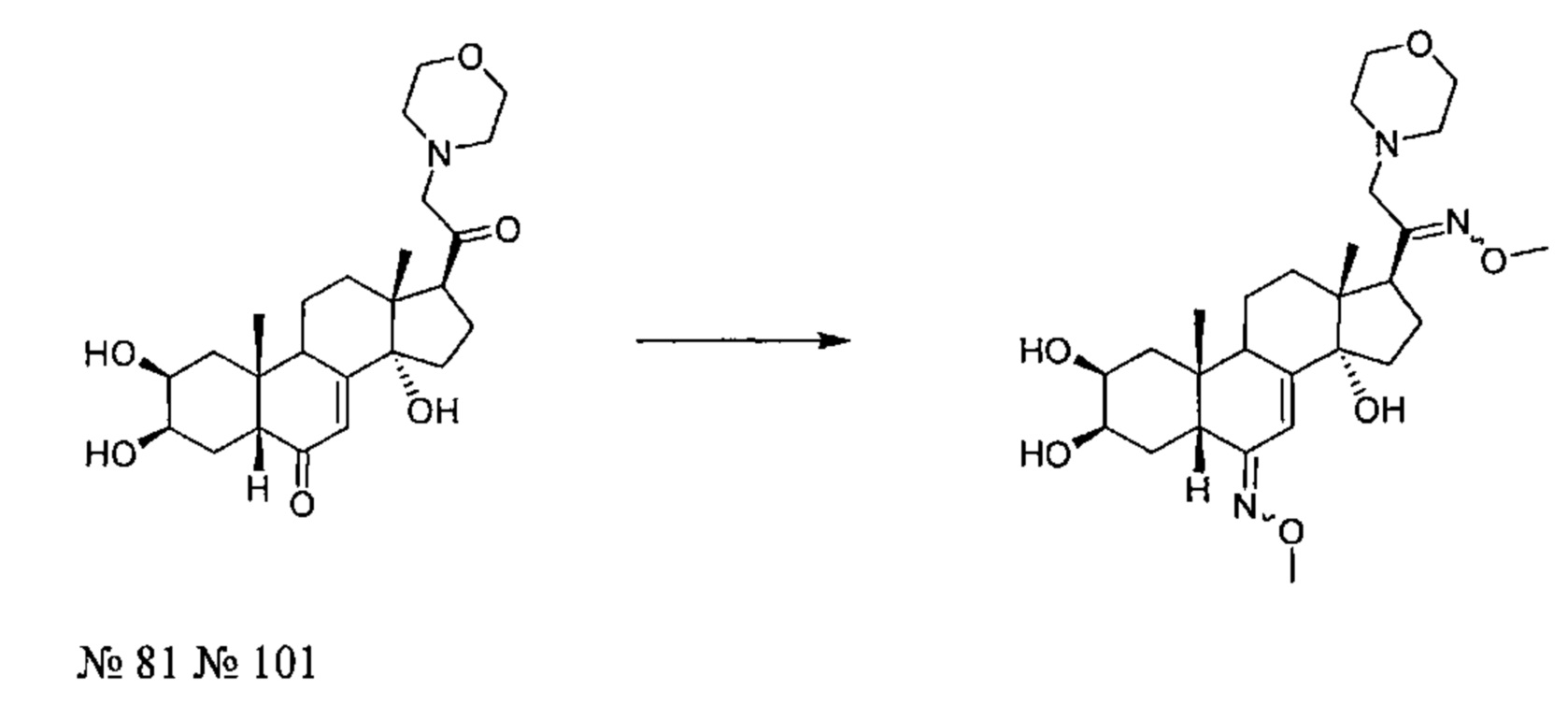
В другом частном варианте осуществления настоящего изобретения применяется соединение общей формулы (I), выбранное из следующих соединений:
- №28: (2S,3R,5R,10R,13R,14S,17S)-17-(N-бут-3-енокси-C-метил-карбонимидоил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №32: (2S,3R,5R,10R,13R,14S,17S)-17-(N-(2-диэтиламиноэтокси)-С-метил-карбонимидоил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №41: 2-метокси-N-(2-метоксиэтил)-N-[1-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]ацетамид
- №42: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-(2-метоксиэтиламино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №43: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-17-[1-(3-пиридилметиламино)этил]-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №46: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-17-[1-(тетрагидрофуран-2-илметиламино)этил]-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №51: 2-этил-N-(2-метоксиэтил)-N-[1-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]бутанамид
- №62: 2-метокси-N-(тетрагидрофуран-2-илметил)-N-[1-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]ацетамид
- №63: N-(тетратетрагидрофуран-2-илметил)-N-[1-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]фуран-2-карбоксамид
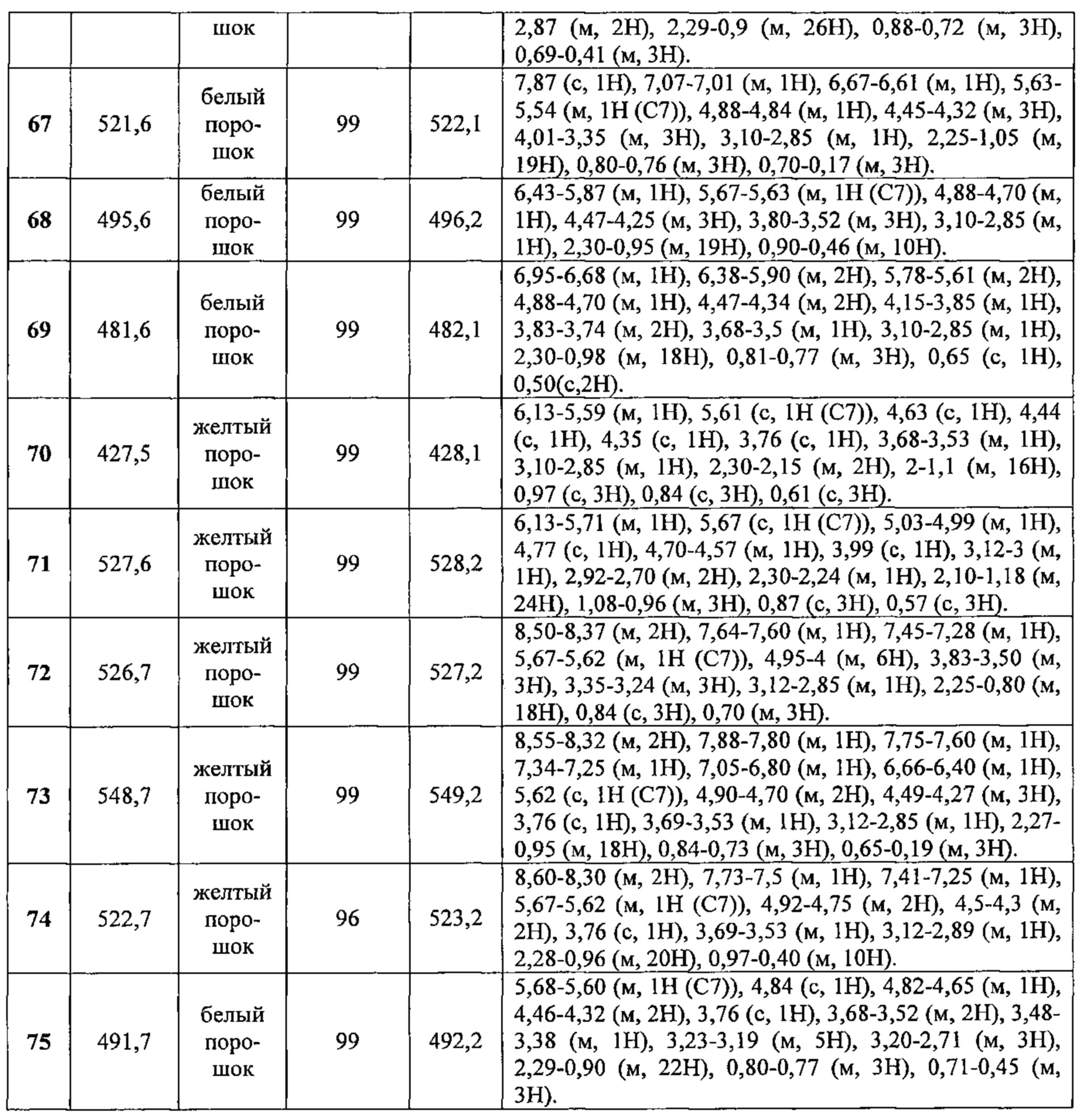
- №67: N-(2,2-дифторэтил)-N-[1-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]фуран-2-карбоксамид
- №76: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-(2-метоксиэтил(метил)амино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №81: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-17-(2-морфолиноацетил)-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №86: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[2-(3-гидроксипирролидин-1-ил)ацетил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №88: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[2-(4-гидрокси-1-пиперидил)ацетил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а] фенантрен-6-он
- №89: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[2-[4-(2-гидроксиэтил)-1-пиперидил]ацетил-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №91: (2S,3R,R5,10R,13R,14S,17S)-17-[2-(3-диметиламинопропил(метил)амино)ацетил]-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №92: 2-[2-оксо-2-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]сульфанилацетат этил
- №93: (2S,3R,5R,10R,13R,14S,17S)-17-(2-этилсульфанилацетил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
- №94: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[2-(2-гидроксиэтилсульфанил)ацетил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он.
Другой предмет настоящего изобретения касается применения соединения общей формулы (I) в качестве лекарственного средства, в частности с фармацевтически приемлемым носителем.
Другой предмет настоящего изобретения касается применения соединения общей формулы (I) в лечении и/или профилактике саркопении и саркопенического ожирения и связанных с ним осложнений и/или патологических состояний, таких как упадок сил, потеря мышечной массы, физической активности и способностей, и мобильности у млекопитающих. Физическую активность и способности можно оценивать посредством тестов, предполагающих ходьбу и физическую нагрузку.
Другой предмет настоящего изобретения касается применения соединения общей формулы (I) в лечении и/или профилактике ожирения и его осложнений и/или ассоциированных с ним патологических состояний, предпочтительно диабета 2 типа или метаболического синдрома у млекопитающих.
Краткое описание чертежей
На фиг. 1, являющейся частью предшествующего уровня техники, проиллюстрированы основные механизмы синтеза белка и протеолиза в мышцах (по работам Zhao et al., 2008 и Little et al, 2009).
На фиг. 2, являющейся частью предшествующего уровня техники, проиллюстрировано усиление саркопении на фоне ожирения (согласно Quillot et al., 2013).
На фиг. 3А проиллюстрировано влияние 20Е (сравнительное соединение) и соединений №51 и 93 по настоящему изобретению на вес C57BL/6 мышей, питавшихся кормом с высоким содержанием жиров в течение 6 недель.
На фиг. 3В проиллюстрировано влияние 20Е (сравнительное соединение) и соединений №51 и 93 по настоящему изобретению на количество белка в Soleus мышцах C57BL/6 мышей, питавшихся кормом с высоким содержанием жиров в течение 6 недель.
На фиг. 4 проиллюстрировано влияние 20Е (сравнительное соединение) и соединений №51 и 93 по настоящему изобретению на транскрипт миостатина в Soleus мышцах C57BL/6 мышей, питавшихся кормом с высоким содержанием жиров в течение 6 недель.
На фиг. 5А проиллюстрировано влияние 20Е (сравнительное соединение) и соединений №51 и 93 по настоящему изобретению на MyoD транскрипты у C57BL/6 мышей, питавшихся кормом с высоким содержанием жиров в течение 6 недель.
На фиг. 5В проиллюстрировано влияние 20Е (сравнительное соединение) и соединений по настоящему изобретению №51 и 93 на транскрипты миогенина у C57BL/6 мышей, питавшихся кормом с высоким содержанием жиров в течение 6 недель.
На фиг. 6 в форме таблицы проиллюстрированы результаты, полученные для соединений по настоящему изобретению во время экспериментов, в ходе которых анализировали экспрессию гена миостатина и синтез белка.
Подробное описание изобретения
Целью настоящего изобретения является разработка новых химических соединений, которые в точности отвечают поставленным выше целям касательно терапевтического применения для лечения и/или профилактики ожирения и/или саркопении у млекопитающих. Указанные соединения являются новыми, поскольку их нет в химических базах данных. Предпочтительно их можно синтезировать подходящими для использования в промышленности способами, то есть способами, требующими минимального количества стадий синтеза и характеризующимися оптимальными выходами. Они показывают лучший эффект, чем 20Е, в ингибировании миостатина и стимуляции синтеза белка путем фосфорилирования белка S6K1. Они демонстрируют хорошую химическую устойчивость в плазме и в микросомах. Они обладают улучшенным фармакокинетическим профилем и четким режимом дозирования. Они стимулируют мышечный анаболизм в С2С12 клетках и обладают антигипергликемическим действием.
В контексте настоящего изобретения, термин "арильная группа" означает ароматический цикл, содержащий 5-8 атомов углерода, или несколько конденсированных ароматических циклов, содержащих 5-14 атомов углерода. В частности, арильные группы могут представлять собой моноциклические или бициклические группы, предпочтительно фенил или нафтил. Предпочтительно они представляют собой фенильную группу (Ph).
В контексте настоящего изобретения, термин "гетероарильная группа" означает любую углеводородную ароматическую группу, содержащую 3-9 атомов, содержащую один или более гетероатомов, таких как, например, атомы серы, азота или кислорода. Гетероарил по настоящему изобретению может состоять из одного или более конденсированных циклов. Примерами гетероарильной группы являются фурильная, изоксазильная, пиридильная, тиазолильная, пиримидильная, бензимидазольная, бензоксазольная и бензотиазольная группы. Предпочтительно гетероарильная группа выбрана из фурильной, пиридильной и тиазолильной групп. Предпочтительно она представляет собой фурильную группу.
В контексте настоящего изобретения термин "атом галогена" означает любой атом галогена, предпочтительно выбранный из Cl, Br, I или F, в частности выбранный из F, Cl или Br, в частности F или Сl.
В контексте настоящего изобретения термин "C1-C6 алкильная группа" означает любую линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, в частности метальную, этильную, н-пропильную, изопропильную, н-бутильную, изобутильную, втор-бутильную, трет-бутильную, н-пентильную или н-гексильную группы. Предпочтительно указанный термин означает метильную, этильную, изопропильную или трет-бутильную группу, в частности метильную или этильную группу, более конкретно-метильную группу.
В контексте настоящего изобретения термин "C3-C6 циклоалкильная группа" означает любой насыщенный углеводородный цикл, содержащий от 3 до 6 атомов углерода, в частности циклопропильную, циклобутильную, циклопентильную или циклогексильную группу. Предпочтительно указанный термин означает циклопропильную или циклогексильную группу.
В контексте настоящего изобретения термин "(C1-C6 алкильная группа) арил" означает любую описанную выше арильную группу, присоединенную через описанную выше C1-C6 алкильную группу. В частности, примером (C1-C6 алкильная группа) арила является бензильная или -(CH2)2 фенильная группа.
В контексте настоящего изобретения термин "фармацевтически приемлемый" означает что-то, подходящее для приготовления фармацевтической композиции, которая в целом безопасна, нетоксична и не является биологически неблагоприятной или иным образом нежелательной, и приемлема для применения в ветеринарии и в общей фармацевтической практике.
В контексте настоящего изобретения термин "фармацевтически приемлемые соли соединения" означает соли, которые являются фармацевтически приемлемыми, как описано в настоящем тексте, и которые обладают целевым фармакологическим действием материнского соединения. Такие соли включают:
(1) соли, образующиеся при добавлении кислоты, сформированные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобные; или сформированные с органическими кислотами, такими как уксусная кислота, бензолсульфокислота, бензойная кислота, камфорсульфокислота, лимонная кислота, этансульфокислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глютаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфокислота, молочная кислота, малеиновая кислота, яблочная кислота, миндальная кислота, метансульфокислота, муконовая кислота, 2-нафталинсульфокислота, пропионовая кислота, салициловая кислота, янтарная кислота, дибензоил-L-винная кислота, винная кислота, п-толуолсульфокислота, триметилуксусная кислота, трифторуксусная кислота и тому подобные; или
(2) соли, образующиеся при замене кислотного протона, имеющегося в материнском соединении, на ион металла, например на ион щелочного металла, ион щелочноземельного металла или ион алюминия; или при координации с органическим или неорганическим основанием. Подходящие органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и тому подобные. Подходящие неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия.
В контексте настоящего изобретения термин "сольват соединения" означает любое соединение, полученное добавлением молекулы инертного растворителя в соединение по настоящему изобретению, при этом сольват образуется, благодаря силе их взаимного притяжения. Сольваты представляют собой, например, алкоксиды соединения. Гидрат представляет собой сольват, при получении которого в качестве инертного растворителя используют воду. Гидрат может быть моно-, ди- или тригидратом.
В контексте настоящего изобретения термин "таутомер" означает любые структурные изомеры соединений по настоящему изобретению, которые могут превращаться друг в друга посредством обратимой химической реакции, известной как таутомеризация. В большинстве случаев, эта реакция протекает за счет миграции атома водорода в сочетании с изменением положения двойной связи. В растворе соединения, способного к таутомеризации, создается равновесие между двумя таутомерами. В таком случае соотношение таутомеров зависит от растворителя, температуры и значения pH. Таким образом, таутомерия представляет собой превращение одной функциональной группы в другую, обычно за счет одновременного сдвига атома водорода и π-связи (двойной или тройной связи). Распространенные таутомеры представляют собой, например, следующие пары: альдегиды/кетоны - спирты, или, более конкретно, енолы; амиды - имидные кислоты; лактамы - лактимы; имины - енамины; енамины - енамины. В частности, таутомерия может включать кольчато-цепную таутомерию, которая имеет место в случае перемещения протона, сопровождающегося превращением открытой структуры в циклическую.
Описание общих способов синтеза и схем
Соединения общей формулы (I) можно получать с применением или адаптацией любого способа, известного квалифицированным специалистам в данной области техники и/или находящегося в рамках данной области техники, в частности способами, описанными в работе Larock (1989), или с применением или адаптацией способов, описанных в приведенных ниже методиках.
Указанные группы имеют приведенные выше определения.
Схема А: 20-гидроксиэкдизон A1 можно восстанавливать до соединения A2 реакцией с цинком в уксусной кислоте, как описано в работе Zhu et al.(2002). Полученное соединение А2 можно подвергать окислительному расщеплению по связи С20-С22 цепи реакцией с РСС в пиридине, получая соединение A3. Алкилоксимы типа R5ONH2 реагируют с карбонилом у атома С20, давая соответствующие имины А4, а также соединение А5, образующееся вследствие двойной реакции по С20 и С6.
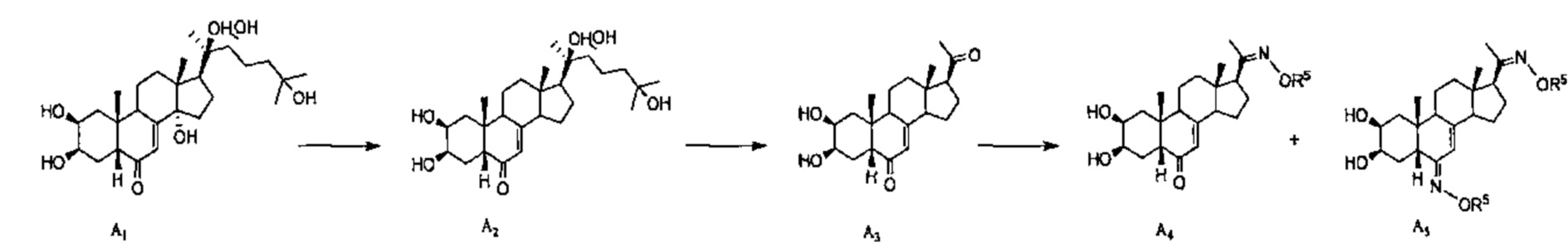
Схема B: Алкилоксимы типа R5ONH2 реагируют с карбонилом у атома С6 соединения А1, давая оксим В1, а также, необязательно, соединения В2 (Z конформер) и В'2 (Е конформер) вследствие отщепления гидроксила при С14-С15. Данные 3 соединения можно независимо подвергать расщеплению цепи, как описано в Схеме A, получая таким образом соединения В3 и В4, и (Z)-оксим соединения В'3 в качестве побочного продукта. Алкилоксимы типа R5ONH2 реагируют с карбонилом у атома С6 соединений В3 или В4, давая соединения В5 и В6.

Схема C: Соединение A1 также может подвергаться окислительному расщеплению, как описано в Схеме A, с получением соединения С1. Это соединение, именуемое в литературе постстерон, можно вводить в реакцию с алкоксимом типа R5ONH2 по карбонилу на атоме С20, обеспечивая таким образом получение соединения С2, а также соединения С3, образующегося вследствие двойной реакции по С6 и С20, и соединения С4 вследствие отщепления гидроксила при С14-С15.

Схема D: Смесь (Е) и (Z) конформеров В3 и В'3, полученных как описано в Схеме В, вводят в реакцию с хлоридом титана, который обеспечивает дегидратацию (Z) соединения В'3, с получением D1. Карбонил у атома С17 соединения В3, выделенного в предыдущей стадии, вступает в реакцию восстановительного аминирования с R3NH2 в присутствии цианоборгидрида, с получением соединения D2, которое можно ацилировать хлорангидридом R4COCl, получая соединения D3.

Схема E Постстерон С1подвергают восстановительному аминированию и затем ацилированию такого же типа, как описано в Схеме D, получая соединения E1 и затем E2.
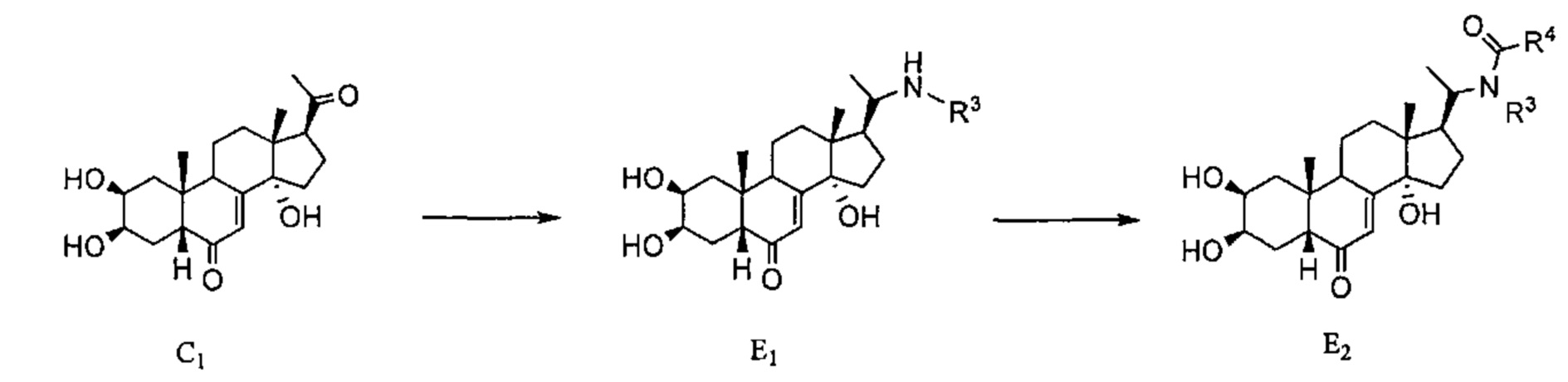
Схема F: Вторичный амин в соединении Е1, полученного в Схеме F, алкилируют бромалкильным соединением, получая таким образом третичный амин F2.

Схема G: Постстерон C1 можно бромировать по атому С21 бромом, получая бромированное соединение G1, которое можно алкилировать нуклеофилом WR, где W может представлять собой амин или тиол, получая соединение G2.

Схема Н: Бромированное соединение G1, полученное в Схеме G, может реагировать с алкоксидными соединениями типа OR, с получением простоэфирных соединений H1.
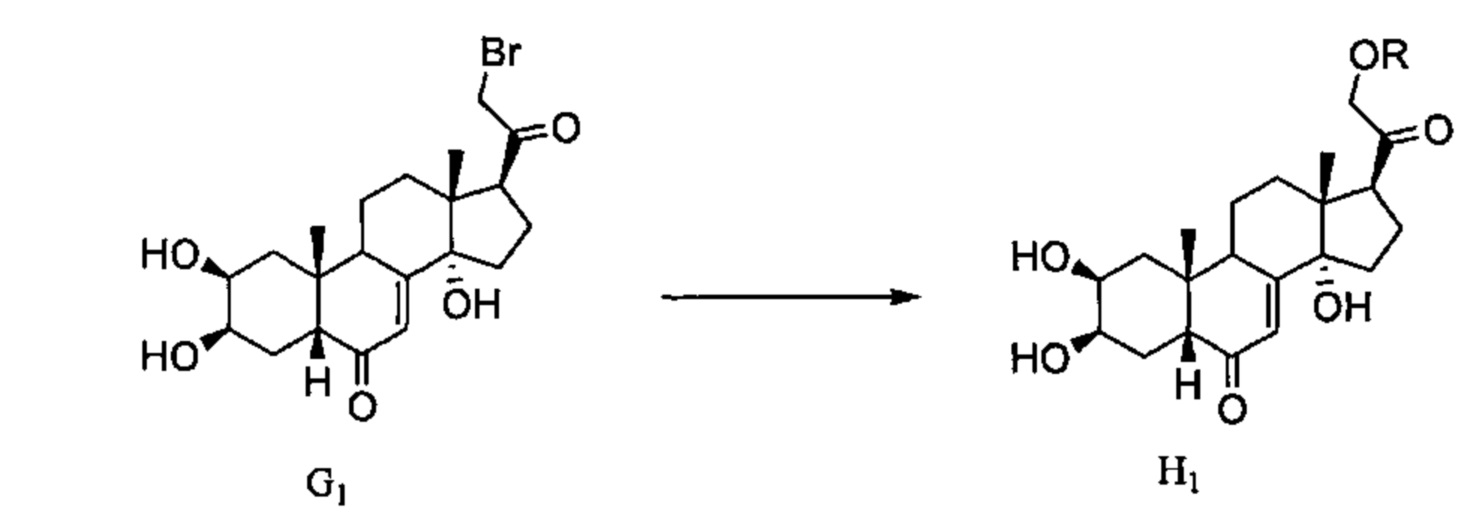
Схема I: Соединения G2, полученные в Схеме G, могут претерпевать восстановление карбонила у атома С20 с применением боргидрида натрия, давая спирты I2.
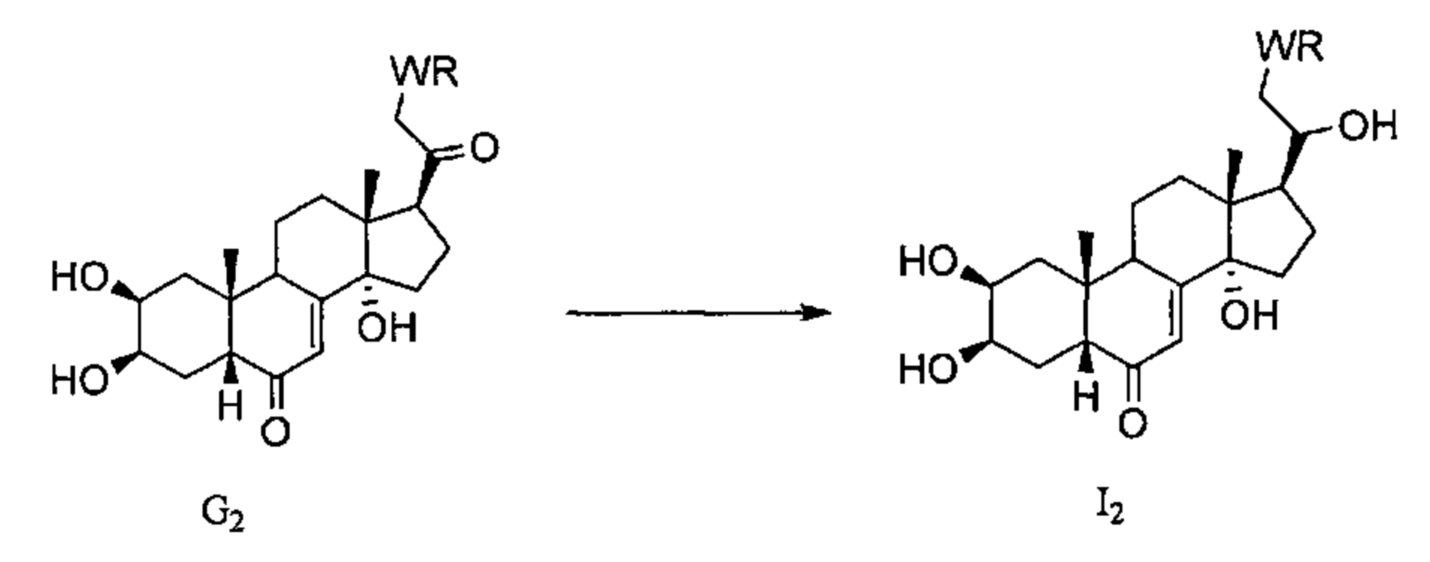
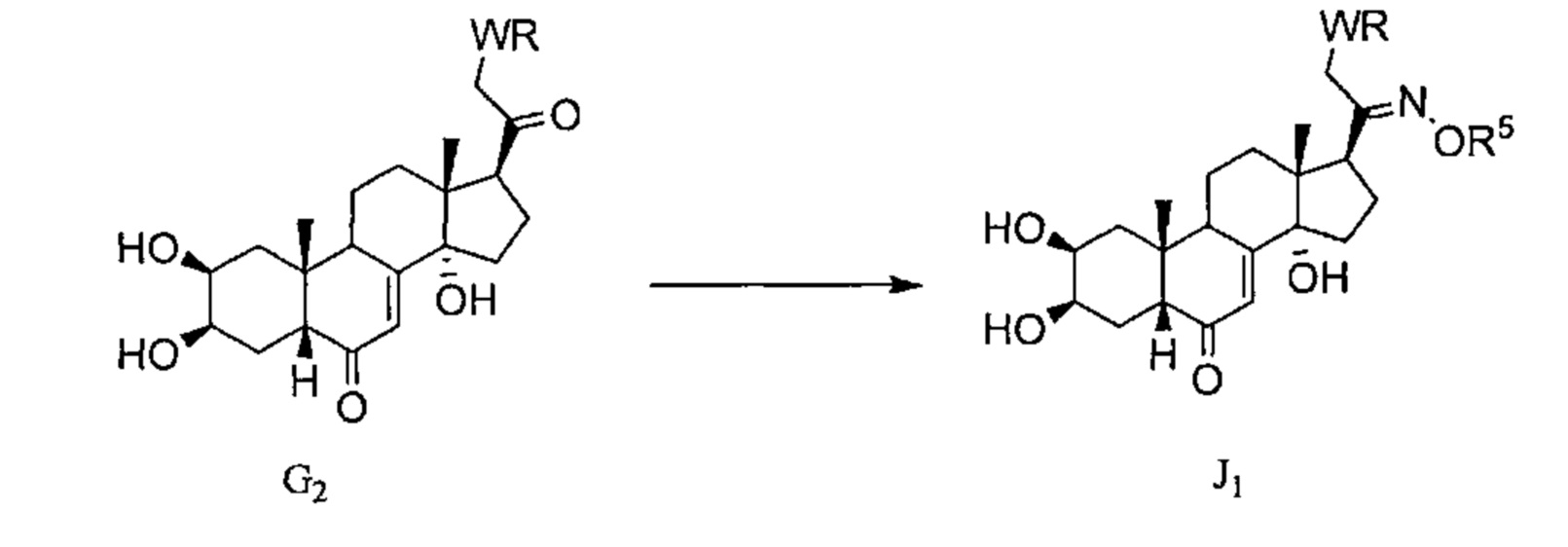
Схема J: Соединения G2, полученные в Схеме G, могут вступать в реакцию по атому С20 с алкоксамином типа R5ONH2, как описано в Схеме C, давая соединение J1.
Примеры:
Материалы и методы
Спектры протонного (1Н) ядерного магнитного резонанса (ЯМР) регистрировали на приборе Bruker Avance DPX300 (300,16 МГц). Значения химических сдвигов приведены в миллионных долях (м.д.). Спектры калибровали по химическим сдвигам применявшихся дейтерированных растворителей. Значения констант спин-спинового взаимодействия (J) приведены в герцах (Гц), а мультиплетность сигналов отражена следующим образом: синглет (с), дублет (д), дублет дублетов (дд), триплет (т), триплет дублетов (тд), квадруплет (кв), мультиплет (м). Масс-спектры (MS) записывали на спектрометре Agilent Technologies MSD, type G1946A, и ионизацию образцов осуществляли методом химической ионизации при атмосферном давлении (APCI).
Аббревиатуры
TBAF тетрабутиламмония фторид
ТГФ тетрагидрофуран
ДМФА диметилформамид
CDCl3 дейтерохлороформ
CD3OD дейтерометанол
ДМСО-d6 дейтеродиметилсульфоксид
РуВор (Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат
Boc трет-бутилоксикарбонил
ммоль милллимоль(-ли)
мкМ микромолярный
мл миллилитр(ы)
г грамм(ы)
М моль/литр
н. нормальность
нм нанометр(ы)
мин минута(-ты)
ч час(ы)
дн. день (дни)
a.t. температура окружающей среды
УФ ультрафиолет
ctrl контроль
MW молекулярный вес
MS масс спектрометрия
В качестве иллюстративных примеров настоящего изобретения были синтезированы соединения, представленные в Таблице 2.









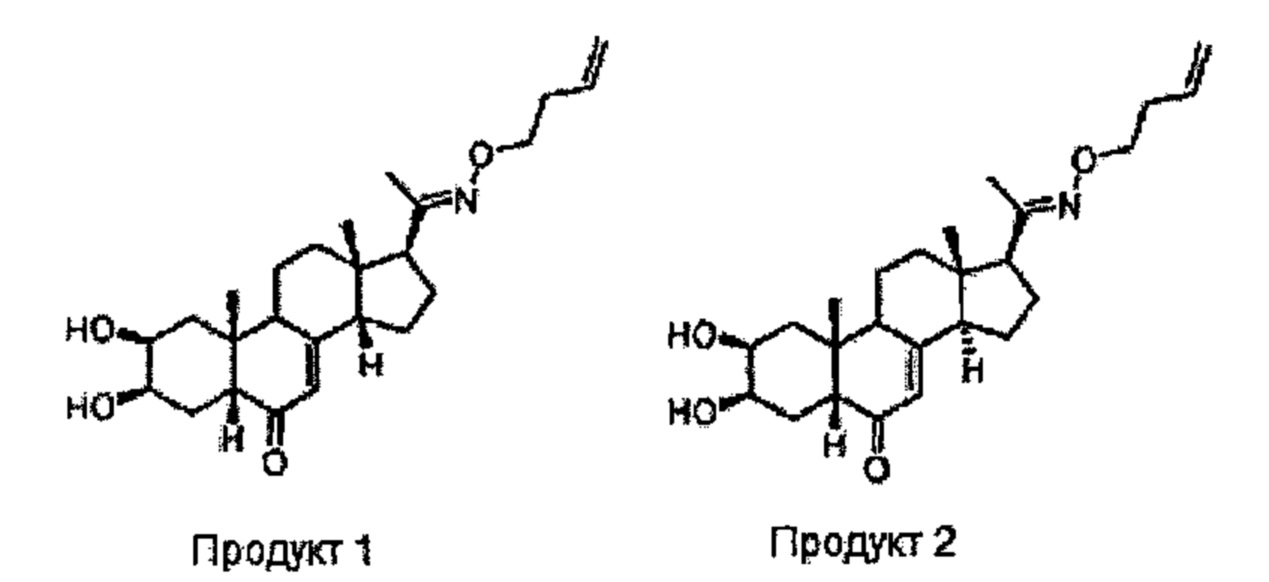
Пример 1. Схема А;
Получение соединений №1 и №2:
(2S,3R,5R,10R,13S,14S,17S)-17-(N-бут-3-енокси-C-метилкарбонимидоил)-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-он и (2S,3R,5R,10R,13S,14R,17S)-17-(N-бут-3-енокси-C-метилкарбонимидоил)-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-он
Стадия 1: Получение (2S,3R,5R,10R,13S,17S)-2,3-дигидрокси-10,13-диметил-17-[(1R,2R)-1,2,5-тригидрокси-1,5-диметилгексил]-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-она

20 г (41,6 ммоль) 20-гидроксиэкдизона (коммерчески доступный) растворяли в 280 мл уксусной кислоты, и полученный раствор нагревали до 67°C. Порциями добавляли 27,2 г (416 ммоль) цинкового порошка, и реакционный раствор нагревали при 67°C в течение 18 ч. Полученный раствор затем фильтровали при 20°C через слой целита, который затем промывали 50 мл метанола. Фильтрат упаривали, получая 33,7 г коричневого масла, которое очищали методом флэш-хроматографии на картридже с силикагелем (90/10 дихлорметан/метанол), получая 9,52 г желтого порошка (выход: 49%) (2S,ЗR,5R,10R,13S,17S)-2,3-дигидрокси-10,13-диметил-17-[(1R,2R)-1,2,5-тригидрокси-1,5-диметилгексил]-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-она.
LC-MS: m/z=465,3 (МН+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,72-5,43 (м, 1H (С7)), 4,42-4,32 (м, 2Н), 4,13 (с, 1Н), 3,76-2,62 (м, 2Н), 3,2-3,1 (м, 2Н), 2,21-2,14 (м, 2Н), 1,90-1,02 (м, 28Н), 1,03-0,77 (м, 6Н).
Стадия 2: Получение (2S,3R,5R,10R,13S,17S)-17-ацетил-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-она

9,52 г (20,28 ммоль) (2S,3R,5R,10R,13S,17S)-2,3-дигидрокси-10,13-диметил-17-[(1R,2R)-1,2,5-тригидрокси-1,5-диметилгексил]-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-она растворяли в 46 мл пиридина и 276 мл дихлорметана. Порциями добавляли 6,69 г (30,4 ммоль) хлорохромата пиридиния в течение 10 мин, и полученный раствор перемешивали при 20°C в течение 2 ч 30. Пиридин и дихлорметан затем упаривали в вакууме, и полученный остаток очищали методом флэш-хроматографии на картридже с силикагелем (95/5 дихлорметан/метанол), получая 4 г бежевого порошка (выход: 56%) (2S,3R,5R,10R,13S,17S)-17-ацетил-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-она.
LC-MS: m/z=347,2 (МН+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,68-5,46 (м, 1Н(С7)), 4,41-4,37 (м, 2Н), 3,76-3,55 (м, 2Н), 2,83-2,54 (м, 2Н), 2,33-1,95 (м, 6Н), 1,90-1,30 (м, 10Н), 1,28-1,18 (м, 1Н), 0,88-0,42 (м, 6Н).
Стадия 3: Получение эпимеров (2S,3R,5R,10R,13S,14S,17S)-17-(N-бут-3-енокси-C-метилкарбонимидоил)-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-она и (2S,3R,5R,10R,13S,14R,17S)-17-(N-бут-3-енокси-С-метилкарбонимидоил)-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-она
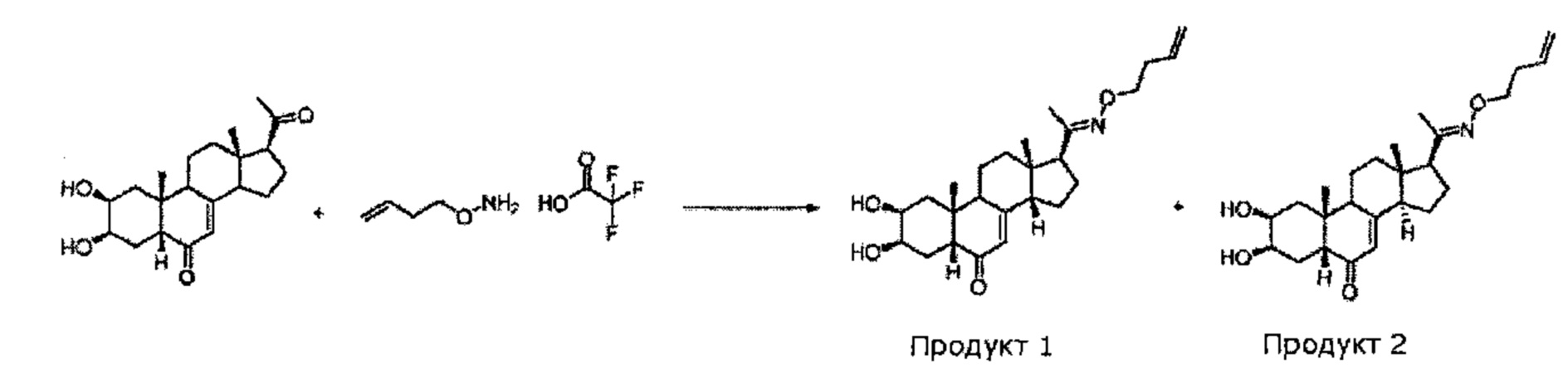
328 мг (0,947 ммоль) (2S,3R,5R,10R,13S,17S)-17-ацетил-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-она (14-деоксипостстерон), полученного на стадии 2, растворяли в 1,2 мл этанола и порциями добавляли 200 мг (0,994 ммоль) бут-3-еноксиаммония 2,2,2-трифторацетата. Реакционную смесь кипятили в течение 20 ч. Растворитель упаривали, и полученный остаток очищали методом препаративной хроматографии на С18 колонке (60/40 ацетонитрил/вода), получая 24 мг бежевого порошка (выход: 6%) соединения №1 (2S,3R,5R,10R,13S,14S,17S)-17-(N-бут-3-енокси-С-метилкарбонимидоил)-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-он и 57 мг бежевого порошка (выход: 14%) соединения №2 (2S,3R,5R,10R,13S,14R,17S)-17-(N-бут-3-енокси-С-метилкарбонимидоил)-2,3-дигидрокси-10,13-диметил-1,2,3,4,5,9,11,12,14,15,16,17-додекагидроциклопента[а]фенантрен-6-он.
Соединение №1:
LC-MS: m/z=416,2 (МН+). УФ чистота при 254 нм=99%.
1H ЯМР (300 МГц, ДМСО-d6) - С14 бета эпимер - δ 5,83-5,72 (м, 1H), 5,70 (с, 1Н (С7)), 5,1-5 (м, 2Н), 4,40-4,36 (м, 2Н), 4 (т, 2Н), 3,77-3,71 (м, 2Н), 2,80-2,60 (м, 1H), 2,40-1,20 (м, 20Н), 0,82-0,74 (м, 6Н).
Соединение №2:
LC-MS: m/z=416,2 (МН+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДМСО-d6) - С14 альфа эпимер - δ 5,87-5,72 (м, 1Н), 5,48 (с, 1Н (С7)), 5,1-4,9 (м, 2Н), 4,40-4,36 (м, 2Н), 4 (т, 2Н), 3,77-3,71 (м, 2Н), 2,80-2,60 (м, 1H), 2,44-1,23 (м, 20Н), 0,83 (с, 3Н), 0,47 (с, 33Н).
Соединения №№3-6 получали по той же Схеме, в форме С14 альфа и С14 бета эпимеров.

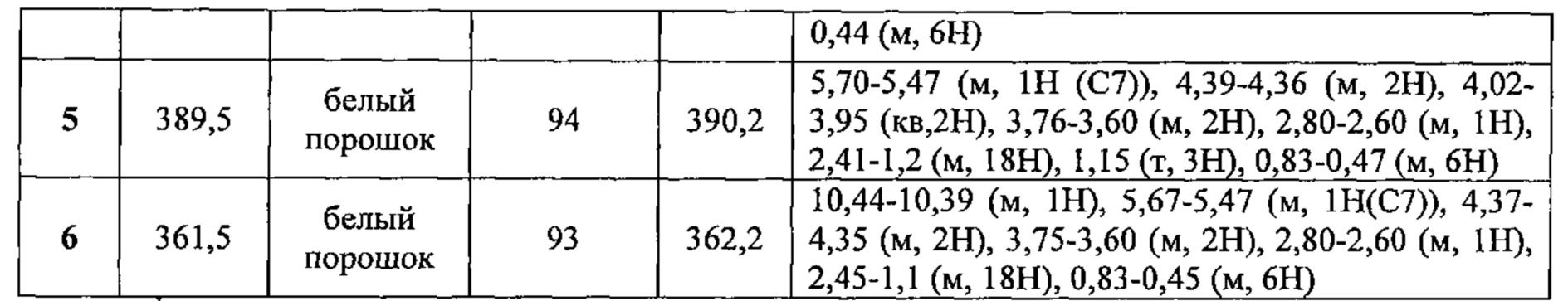
1LCMS чистота, УФ при 254 нм
Пример 2. Схема В;
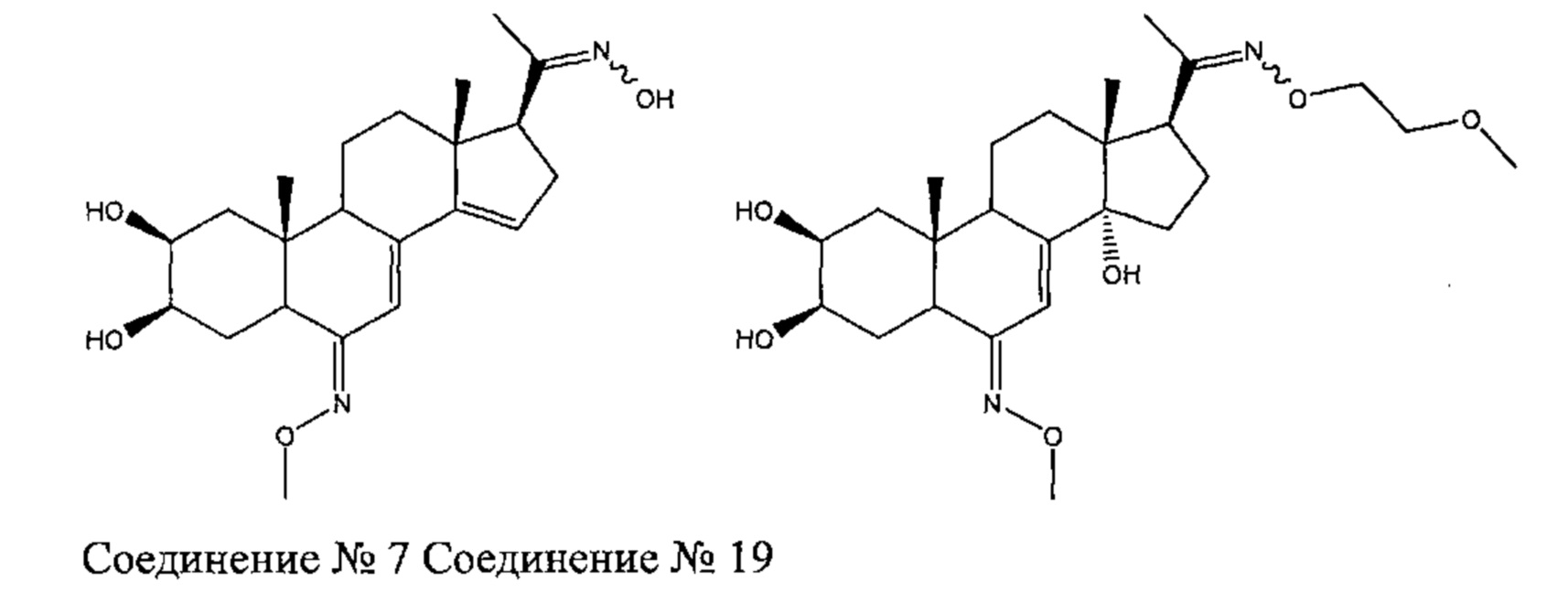
Получение соединения №7: [1-[(2S,3R,5R,6Z,10R,13R,17S)-2,3-дигидрокси-6-метоксиимино-10,13-диметил-1,2,3,4,5,9,11,12,16,17-декагидроциклопента[а]фенантрен-17-ил]этаноноксим] и соединения №19: [(2S,3R,5R,6E,10R,13R,14S,17S)-17-(N-(2-метоксиэтокси)-С-метилкарбонимидоил)-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол]
Получение соединения №7
Стадия 1: Получение соединения (a) [(2S,3R,5R,6E,10R,13R,14S,17S)-6-метоксиимино-10,13-диметил-17-[(1R,2R)-1,2,5-тригидрокси-1,5-диметилгексил]-2,3,4,5,9,11,12,15,16, 17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол] и соединения (b) [(2R,3R)-2-[(2S,3R,5R,6Z,10R,13R,17S)-2,3-дигидрокси-6-метоксииминo-10,13-диметил-1,2,3,4,5,9,11,12,16,17-декагидроциклопента[а] фенантрен-17-ил]-6-метилгептан-2,3,6-триол]
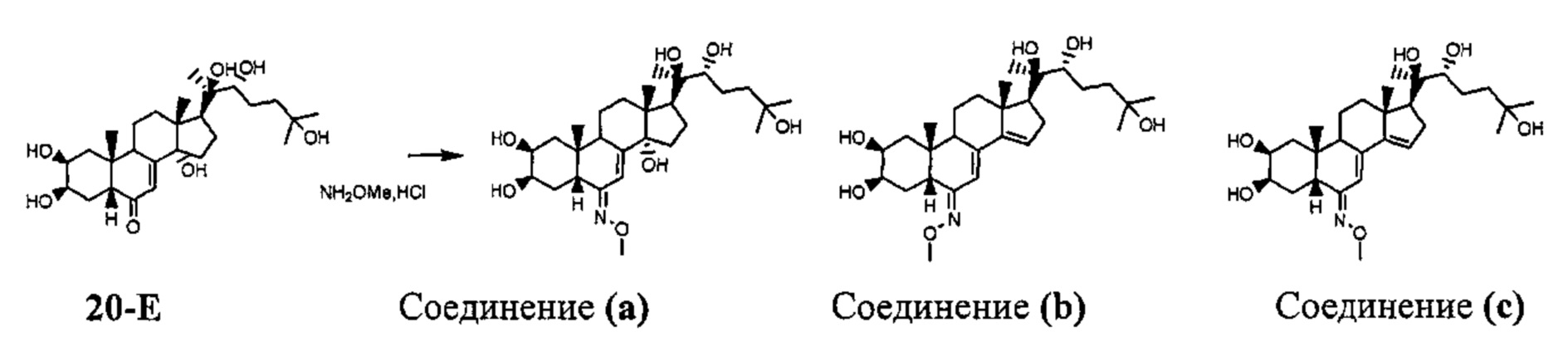
Согласно той же методике, которая описана на стадии 3 Схемы А, 788 мг бежевого порошка (выход: 37%) соединения (a) [(2S,3R,5R,6E,10R,13R,14S,17S)-6-метоксиимино-10,13-димeтил-17-[(1R,2R)-1,2,5-тpигидpoкcи-l,5-димeтилгeкcил]-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол] получали из 20-гидроксиэкдизона и O-метилгидроксиламина гидрохлорида. Также было выделено 667 мг (выход: 32%) образовавшегося вследствие элиминирования соединения (b) [(2R,3R)-2-[(2S,3R,5R,6Z,10R,13R,17S)-2,3-дигидрокси-6-метоксиимино-10,13-диметил-1,2,3,4,5,9,11,12,16,17-декагидроциклопента[а]фенантрен-17-ил]-6-метилгептан-2,3,6-триол], и 34 мг (выход: 2%) образовавшегося вследствие элиминирования соединения (с) [(2R,3R)-2-[(2S,3R,5R,6E,10R,13R,17S)-2,3-дигидрокси-6-метоксиимино-10,13-диметил-l,2,3,4,5,9,11,12,16,17-декагидроциклопента[а]фенантрен-17-ил]-6-метилгептан-2,3,6-триол].
Соединение (а):
LC-MS: m/z=510,2 (МН+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 6,25 (с, 1Н (С7)), 4,45-4,35 (м, 3Н), 4,31-4,29 (м, 1H), 4,14 (с, 1H), 3,74-3,69 (м, 4Н), 3,6-3,5 (м, 1H), 3,17-3,08 (м, 1H), 2,87-2,75 (м, 1Н), 2,26-2,20 (м, 2Н), 2,05-1,1 (м, 15Н), 1,1-0,98 (м, 11Н), 0,73 (с, 6Н).
Соединение (b):
LC-MS: m/z=492,2 (МН+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 6,04 (с, 1Н), 5,77 (с, 1H), 4,45-4,30 (м, 2Н), 4,25 (с, 1H), 4,11 (с, 1H), 3,75-3,65 (м, 5Н), 3,63-3,55 (м, 1H), 3,20-3,08 (м, 2Н), 2,17-1,90 (м,3), 1,70-1,20 (м, 11Н), 1,15-0,93 (м, 14Н), 0,74 (с, 3Н).
Соединение (с):
LC-MS: m/z=492,2 (МН+). УФ чистота при 254 нм=99%.
1H ЯМР (300 МГц, ДМСО-d6) δ 6,55 (с, 1Н), 5,81 (с, 1H), 4,44-4,26 (м, 3Н), 4,09 (с, 1H), 3,79-3,67 (м, 5Н), 3,62-3,54 (м, 1Н), 3,16-3,08 (м, 1H), 2,30-1,90 (м, 4Н), 1,70-1,20 (м, 11Н), 1,15-0,92 (м, 14Н), 0,73 (с, 3Н).
Начиная с выделенного соединения (b):
Стадия 2а: Получение соединения (d): [1-[(2S,3R,5R,6Z,10R,13R,17S)-2,3-дигидрокси-6-метоксиимино-10,13-диметил-1,2,3,4,5,9,11,12,16,17-декагидроциклопента[a]фенантрен-17-ил]этанон]

Согласно той же методике, которая описана на стадии 2 Схемы А, из соединения (b) получали 267 мг бежевого порошка (выход: 55%) соединения (d) [1-[(2S,3R,5R,6Z,10R,13R,17S)-2,3-дигидрокси-6-метоксиимино-10,13-диметил-1,2,3,4,5,9,11,12,16,17-декагидроциклопента[а] фенантрен-17-ил]этанон].
Соединение (d):
LC-MS: m/z=374,2 (МН+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 6,09 (с, 1Н), 5,81-5,75 (м, 1H), 4,39-4,37 (м, 1Н), 4,30-4,26 (м, 1H), 3,76 (с, 3Н), 3,72-3,68 (м, 1Н), 3,65-3,55 (м, 1H), 3,2-3 (м, 2Н), 2,75-2,60 (м, 1H), 2,29-2,10 (м, 5Н), 1,74-1,23 (м, 8Н), 0,74-0,70 (м, 6Н).
Стадия 3а: Получение соединения №7: [1-[(2S,3R,5R,6Z,10R,13R,17S)-2,3-дигидрокси-6-метоксиимино-10,13-диметил-1,2,3,4,5,9,11,12,16,17-декагидроциклопента[а]фенантрен-17-ил]этанон оксим]

Согласно той же методике, которая описана на стадии 3 Схемы А, из соединения (d) получали 81 мг белого порошка (выход: 71%) 1-[(2S,3R,5R,6Z,10R,13R,17S)-2,3-дигидрокси-6-метоксиимино-10,13-диметил-1,2,3,4,5,9,11,12,16,17-декагидроциклопента[а]фенантрен-17-ил]этанон оксима.
Соединение №7:
LC-MS: m/z=389,2 (MH+). УФ чистота при 254 нм=99%.
1H ЯМР (300 МГц, ДМСО-d6) δ 10,53 (с, 1H), 6,09 (с, 1H), 5,04 (с, 1H), 4,37 (д, 1H), 4,30-4,26 (м, 1H), 3,77-3,67 (м, 4Н), 3,65-3,55 (м, 1Н), 3,15-3,03 (м, 1Н), 2,80-2,65 (м, 2Н), 2,25-2,12 (м, 1Н), 2,05-1,99 (м, 1Н), 1,79 (с, 3Н), 1,74-1,20 (м, 8Н), 0,76-0,66 (м, 6Н).
Получение соединения №19 из выделенного соединения (а) (2S,3R,5R,6E,10R,13R,14S,178)-6-метоксиимино-10,13-диметил-17-[(1R,2R)-1,2,5-тригидрокси-1,5-диметилгексил] -2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триола:
Стадия 2b: Получение соединений (е): [1-[(2S,3R,5R,6E,10R,13R,14S,17S)-2,3,14-тригидрокси-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этанон] и (f): [1-[(2S,3R,5R,6Z,10R,13R,14S,17S)-2,3,14-тригидрокси-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этанон]
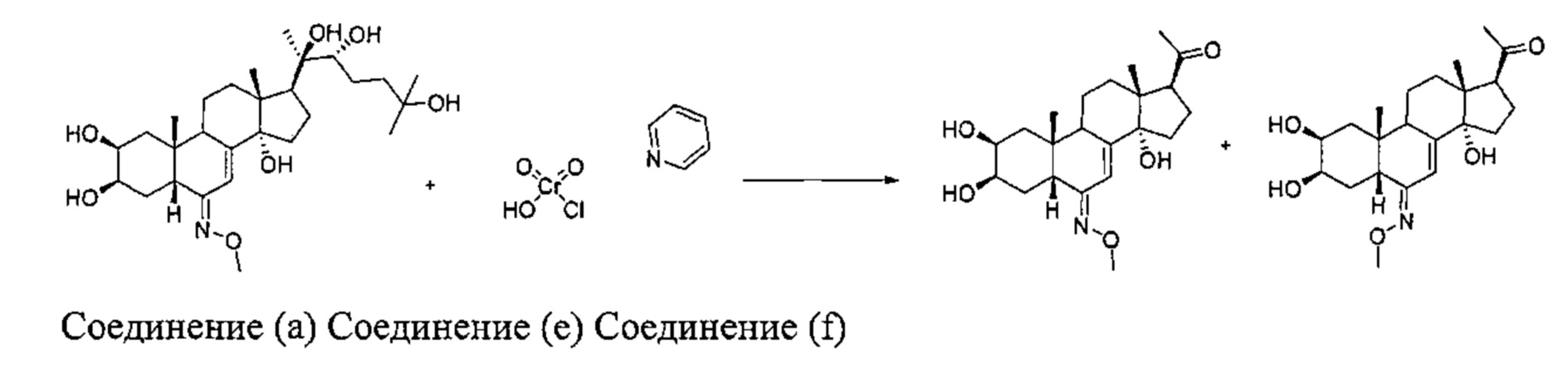
Согласно той же методике, которая описана на стадии 2 Схемы А, получали 891 мг бежевого порошка (выход: 36%) соединения (е) [1-[(2S,3R,5R,6E,10R,13R,14S,17S)-2,3,14-тригидрокси-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этанон], а также 23 мг (выход: 0,9%) соединения (f): [1-[(2S,3R,5R,6Z,10R,13R,14S,17S)-2,3,14-тригидрокси-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этанон], исходя из 3,5 г выделенного соединения (a) [2S,3R,5R,6E,10R,13R,14S,17S)-6-метоксииминo-10,13-димeтил-17-[(1R,2R)-1,2,5-тpигидpoкcи-1,5-димeтилгeкcил]-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол].
Соединение (е):
LC-MS: m/z=392,2 (МН+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДMCO-d6) δ 6,28 (с, 1H (С7)), 4,74 (с, 1H), 4,42-4,36 (м, 1H), 4,32-4,28 (м, 1H), 3,76-3,70 (м, 4Н), 3,68-3,52 (м, 1Н), 3,20-3,12 (м, 1Н), 2,90-2,76 (м, 1Н), 2,30-2,00 (м, 5Н), 1,90-1,50 (м, 8Н), 1,49-1,24 (м, 3Н), 0,72 (с, 3Н), 0,45 (с, 3Н).
Соединение (f):
LC-MS: m/z=392,2 (МН+). УФ чистота при 254 нм=99%.
1H ЯМР (300 МГц, ДМСО-d6) δ 5,71 (с, 1H (С7)), 4,45 (с, 1H), 4,45-4,41 (м, 1H), 4,26-4,23 (м, 1H), 3,76-3,70 (м, 4Н), 3,65-3,55 (м, 1H), 3,18-3,09 (м, 1Н), 2,90-2,80 (м, 1H), 2,22-2,00 (м, 5Н), 1,88-1,22 (м, 11Н), 0,73 (с, 3Н), 0,47 (с, 3Н).
Стадия 3b: Получение соединения №19: [(2S,3R,5R,6E,10R,13R,14S,17S)-17-(N-(2-метоксиэтокси)-C-метилкарбонимидоил)-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол]
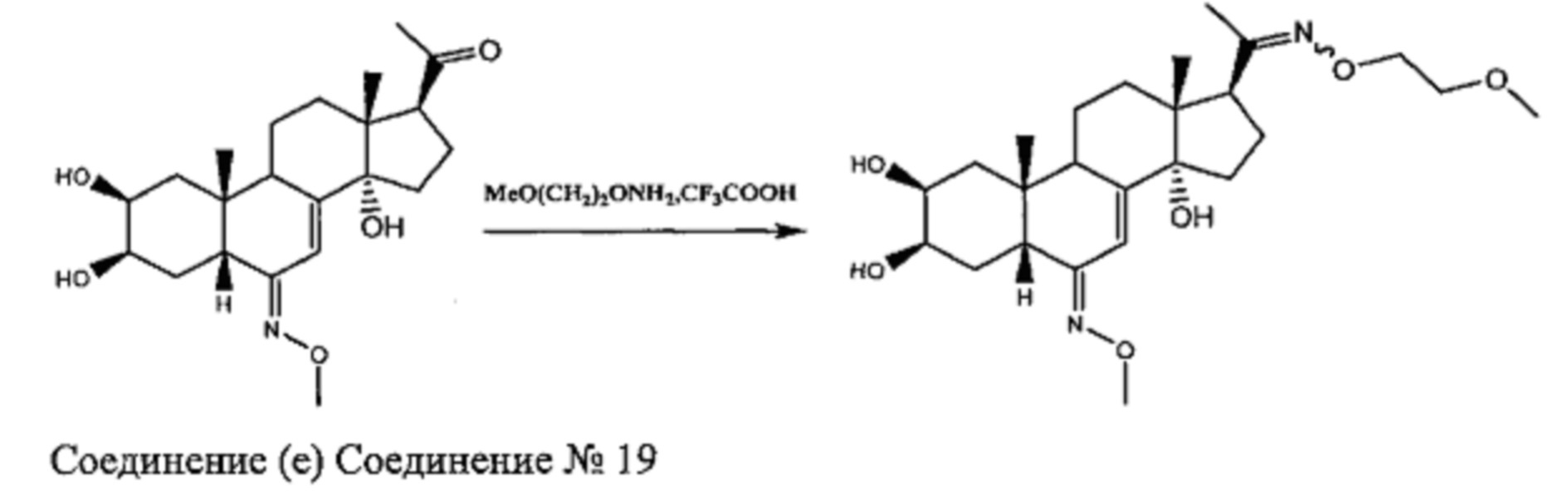
Согласно той же методике, которая описана на стадии 3 Схемы A, получали 46 мг белого порошка (выход: 48%) соединения №19 [(2S,3R,5R,6E,10R,13R,14S,17S)-17-(N-(2-метоксиэтокси)-C-метилкарбонимидоил)-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а] фенантрен-2,3,14-триол], из 233 мг соединения (е).
Соединение №19:
LC-MS: m/z=465,2 (МН+). УФ чистота при 254 нм=99%.
1H ЯМР (300 МГц, ДМСО-d6) δ 6,28 (с, 1Н (С7)), 4,66 (с, 1Н), 4,44-4,38 (м, 1H), 4,34-4,28 (м, 1H), 4,10-4,01 (м, 2Н), 3,75-3,70 (м, 4Н), 3,65-3,45 (м, 3Н), 3,24 (с, 3Н), 2,98-2,76 (м, 2Н), 2,30-1,90 (м, 4Н), 1,80-1,24 (м, 12Н), 0,73 (с, 3Н), 0,49 (с, 3Н).
Соединение №21 получали по той же Схеме.
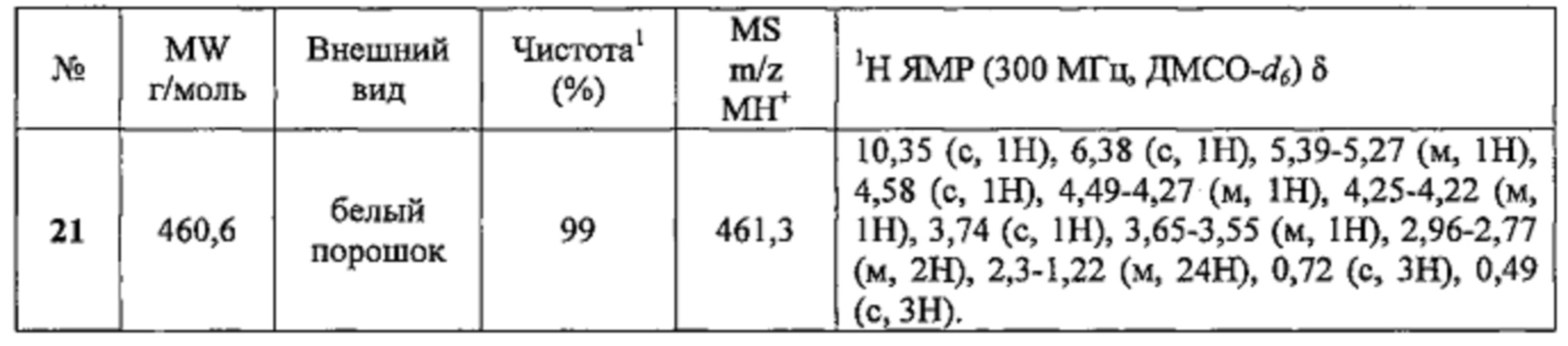
1 LCMS чистота, УФ при 254 нм
Пример 3: Схема C;
Получение соединения №23:
(2S,3R,5R,10R,13R,14S,17S)-17-(N-этокси-C-метил-карбонимидоил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а] фенантрен-6-он
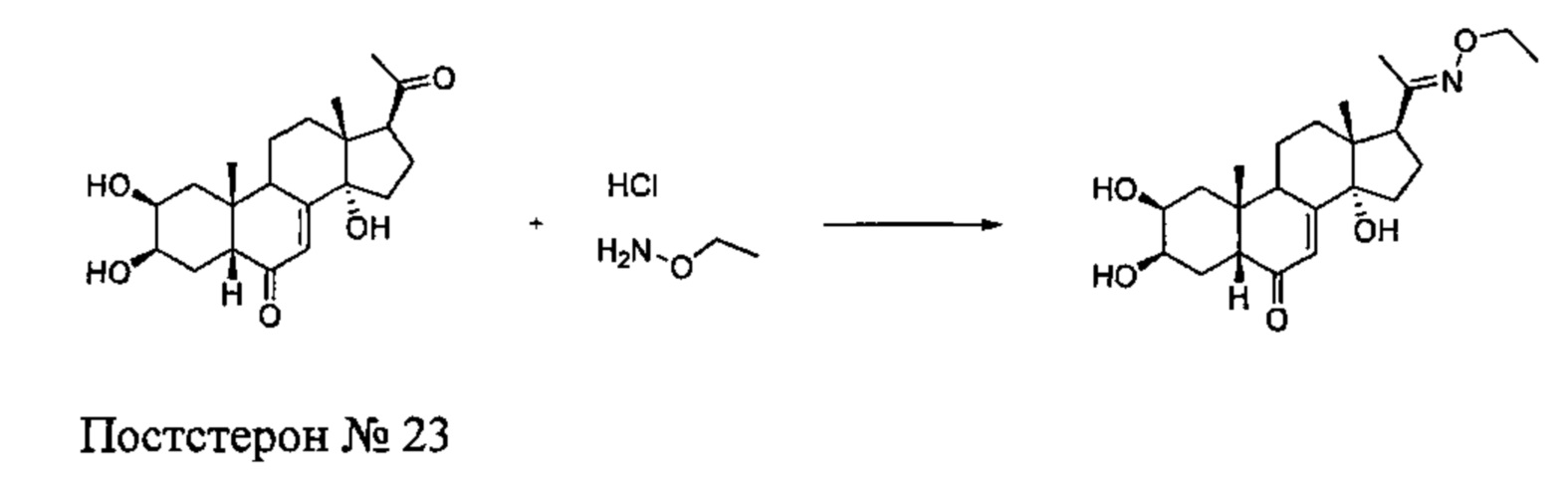
Согласно той же методике, которая описана на стадии 3 Схемы А, получали 64 мг белого порошка (выход: 22%) (2S,3R,5R,10R,13R,14S,17S)-17-(N-этокси-С-метил-карбонимидоил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-она из постстерона (получен окислительным расщеплением цепи 20-гидроксиэкдизона по той же методике, которая описана на стадии 2 Схемы В).
Соединение №23:
LC-MS: m/z=406,2 (МН+). УФ чистота при 254 нм=93%.
1Н ЯМР (300 МГц, CD3OD) δ 5,82 (с, 1H (С7)), 4,04 (кв, 2Н), 3,97-3,92 (м, 1Н), 3,89-3,80 (м, 1Н), 3,22-3,10 (м, 1H), 3,04 (т, 1H), 2,43-1,55 (м, 15Н), 1,45-1,37 (м, 1H), 1,21 (т, 3Н), 0,96 (с, 3Н), 0,64 (с, 3Н).
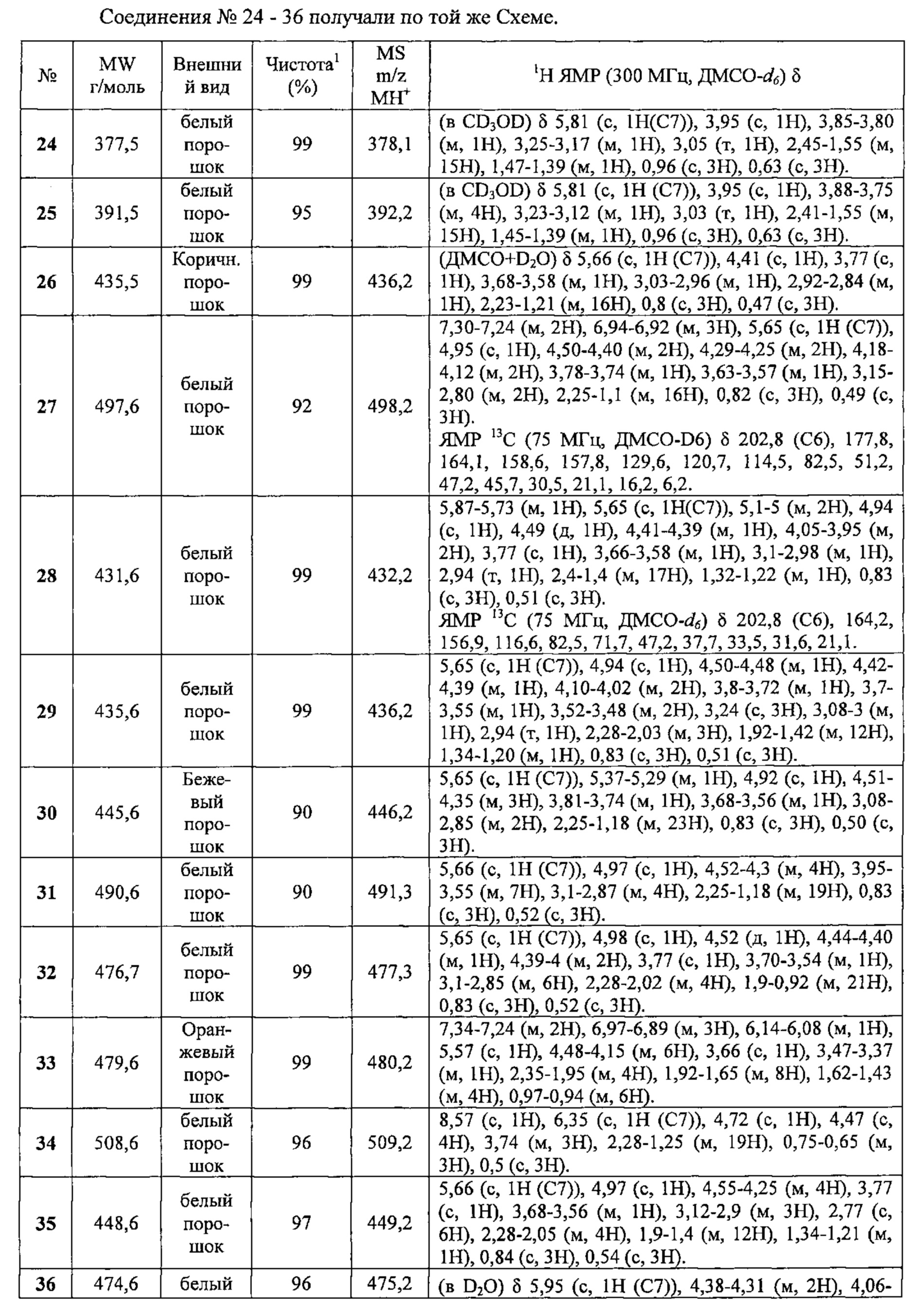

1LCMS чистота, УФ при 254 нм
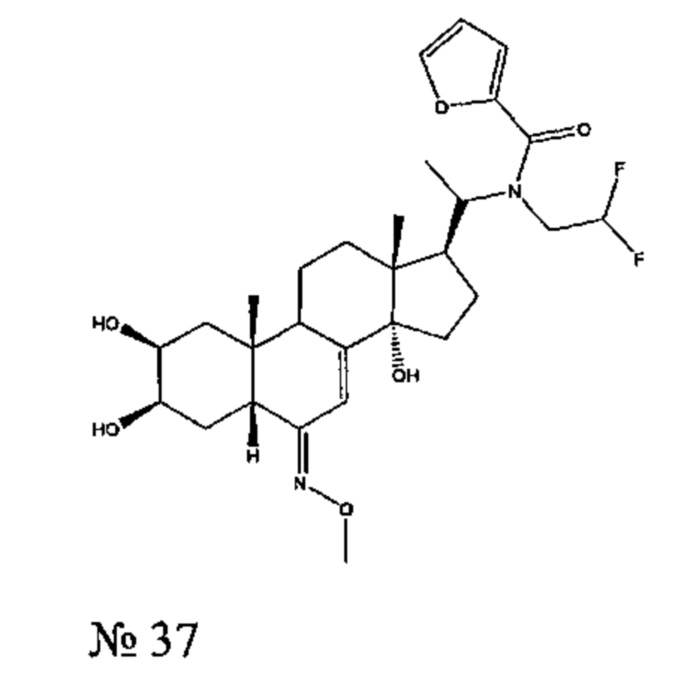
Пример 4. Схема D;
Получение соединения №37:
N-(2,2-дифторэтил)-N-[1-[(2S,3R,5R,6E,10R,13R,14S,17S)-2,3,14-тригидрокси-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]фуран-2-карбоксамид
Стадия 1: Получение соединения №39: [(2S,3R,5R,6E,10R,13R,14S,17S)-17-[1-(2,2-дифторэтиламино)этил]-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол]
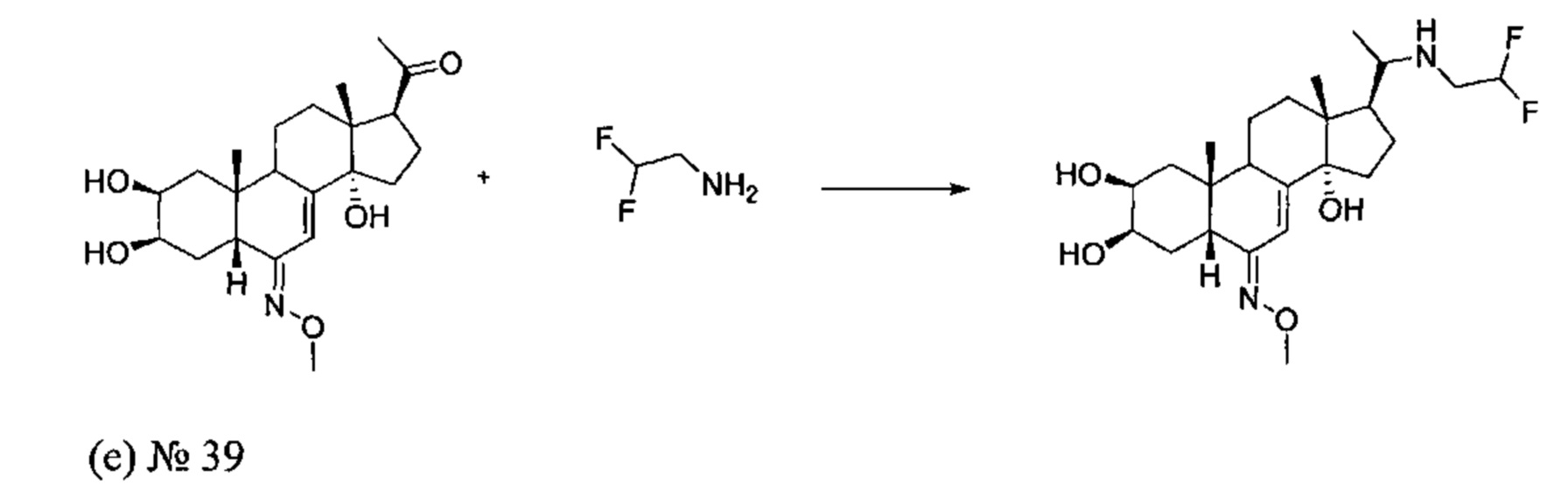
180 мг (0,46 ммоль) соединения (е) [1-[(2S,3R,5R,6E,10R,13R,14S,17S)-2,3,14-тригидрокси-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этанон], полученного на стадии 2b способа B, растворяли в 5 мл метанола, и добавляли 0,21 мл (2,76 ммоль) 2,2-дифторэтанамина в полученную реакционную смесь. Значение pH раствора доводили до 6 достаточным количеством концентрированной уксусной кислоты. Затем порциями добавляли 31,8 мг (0,506 ммоль) цианоборгидрида натрия, и полученную суспензию кипятили в течение 20 ч. Растворитель упаривали, полученный остаток растворяли в 20 мл воды, и значение pH доводили до 8 насыщенным раствором бикарбоната натрия. Водную фазу дважды экстрагировали по 15 мл бутанола, и бутанольную фазу сушили над сульфатом, фильтровали и упаривали, получая желтое твердое вещество, которое растворяли в 30 мл изопропилового эфира и фильтровали, получая после сушки 134 мг (выход: 62%) соединения №39 (2S,3R,5R,6Е,10R,13R,14S,17S)-17-[1-(2,2-дифторэтиламино)этил]-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол, в виде желтого порошка.
Соединение №39:
LC-MS: m/z=457,4 (МН+). УФ чистота при 254 нм=97%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 6,30-6,23 (м, 1H), 5,95-5,70 (м, 1Н), 4,43-4,25 (м, 3Н), 3,72 (с, 3Н), 3,65-3,55 (м, 1Н), 3,42-3,32 (м, 1H), 2,88-2,76 (м, 2Н), 2,29-2,23 (м, 1Н), 1,99-1,15 (м, 16Н), 1,05-0,82 (м, 3Н), 0,73 (с, 3Н), 0,61-0,53 (м, 3Н).
Стадия 2: Получение соединения №37: N-(2,2-дифторэтил)-N-[1-[(2S,3R,5R,6Е,10R,13R,14S,17S)-2,3,14-тригидрокси-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а] фенантрен-17-ил]этил]фуран-2-карбоксамид

134 мг (0,285 ммоль) соединения №39 [(2S,3R,5R,6E,10R,13R,14S,17S)-17-[1-(2,2-дифторэтиламино)этил]-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол] растворяли в 2 мл ТГФ, и добавляли 52 мг (0,854 ммоль) бикарбоната натрия в полученную смесь в атмосфере аргона. Добавляли 30 мкл (0,299 ммоль) фуроилхлорида, и реакционную смесь перемешивали в течение 20 ч при 20°C. Полученный раствор затем выливали в 5 мл воды и дважды экстрагировали по 10 мл бутанола. Бутанольную фазу упаривали, получая 118 мг твердого вещества, которое очищали методом флэш-хроматографии на картридже с силикагелем (95/5 дихлорметан/МеОН), получая 100 мг белого порошка (выход: 60%) соединения №37: N-(2,2-дифторэтил)-N-[1-[(2S,3R,5R,6E,10R,13R,14S,17S)-2,3,14-тригидрокси-6-метоксиимино-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]фуран-2-карбоксамид.
Соединение №37:
LC-MS: m/z=551,3 (МН+). УФ чистота при 254 нм=93%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 7,87 (с, 1H), 7,03 (с, 1H), 6,64 (с, 1H), 6,25 (с, 1H), 4,58 (д, 1H), 4,43-4,27 (м, 3Н), 3,95-3,83 (м, 1H), 3,75-3,65 (м, 4Н), 3,63-3,49 (м, 2Н), 2,85-2,68 (м, 1Н), 2,31-2,18 (м, 1Н), 2,01-1 (м, 17Н), 0,73-0,15 (м, 6Н).
Соединения №38 и 40 получали по той же Схеме.
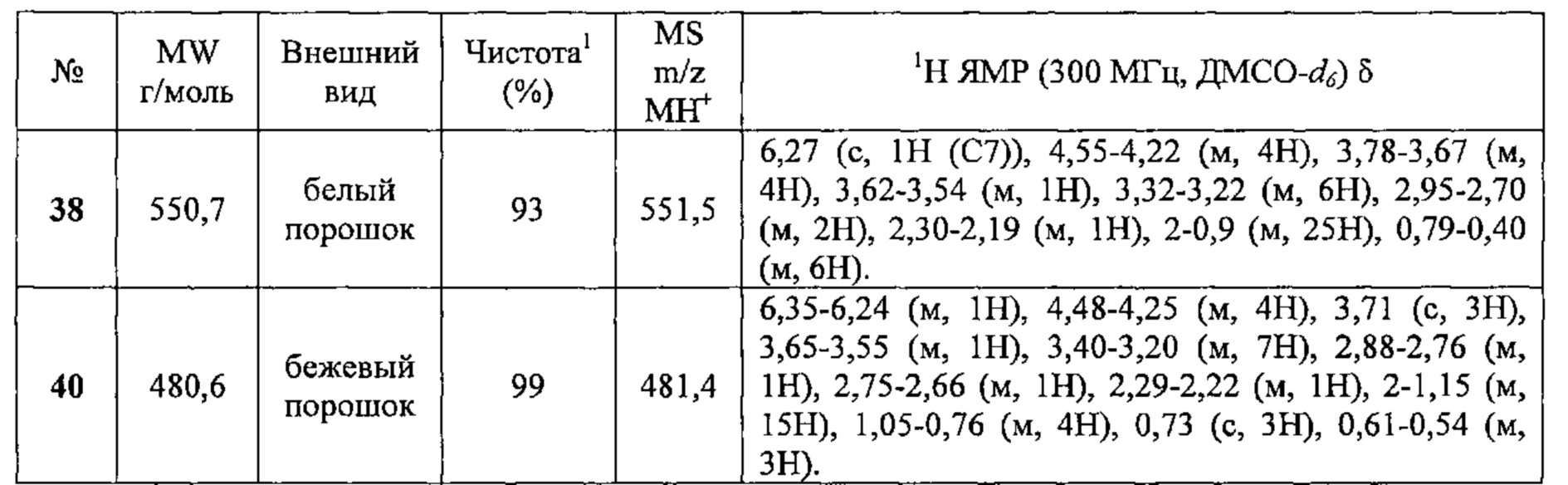
1LCMS чистота, УФ при 254 нм
Пример 5. Схема E;
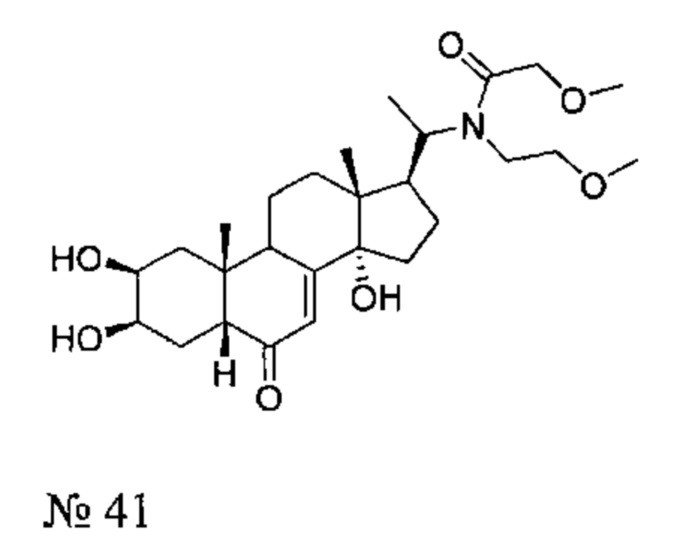
Получение соединения №41:
2-метокси-N-(2-метоксиэтил)-N-[1-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]ацетамид
Стадия 1: Получение соединения №42:
(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-(2-метоксиэтиламино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он

5 г (13,8 ммоль) постстерона (получен окислительным расщеплением цепи 20-гидроксиэкдизона согласно той же методике, которая описана на стадии 2 Схемы В) растворяли в 250 мл метанола и по каплям добавляли 7,2 мл (83 ммоль) 2-метоксиэтиламина. Значение pH полученного раствора доводили до 6 добавлением концентрированной уксусной кислоты, затем добавляли 250 мл ТГФ. Порциями добавляли 0,954 г цианоборгидрида натрия, и реакционную смесь кипятили в течение 20 ч. Растворители упаривали, полученный неочищенный продукт растворяли в 100 мл воды, и значение pH доводили до 8 добавлением насыщенного раствора бикарбоната натрия. Реакционную смесь трижды экстрагировали по 80 мл бутанола, и бутанольную фазу упаривали, получая коричневую пену, которую растворяли в 5 мл этилацетата, получая после фильтрования и сушки 3,32 г (выход: 57%) соединения №42: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-(2-метоксиэтиламино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он, в виде серого порошка.
Соединение №42:
LC-MS: m/z=422,2 (MH+). УФ чистота при 254 нм=95%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,70-5,60 (м, 1H (С7)), 4,80-4,62 (м, 1H), 4,55-4,47 (м, 1H), 4,43-4,35 (м, 1Н), 3,78-3,70 (м, 2Н), 3,68-3,50 (м, 3Н), 3,30-3,18 (м, 5Н), 3,10-2,91 (м, 1H), 2,30-0,9 (м, 18Н), 0,82 (с, 3Н), 0,59 (с, 3Н).
13С ЯМР (75 МГц, ДМСО-d6) δ 202,9 (С6), 120,5, 82,9, 66,7, 58,1, 46,2, 37,8, 30,5, 23,9, 6,2.
Стадия 2: Получение соединения №41:
2-метокси-N-(2-метоксиэтил)-N-[1-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]ацетамид

По той же методике, которая описана на стадии 2 Примера 5, из соединения №42 получали 89 мг (выход: 58%) соединения №41 [2-метокси-N-(2-метоксиэтил)-N-[1-[(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-6-оксо-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-17-ил]этил]ацетамид], в виде оранжевого порошка.
Соединение №41:
LC-MS: m/z=494,4 (MH+). УФ чистота при 254 нм - 94%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,63 (с, 1H (С7)), 4,88-4,7 (м, 1Н), 4,5-4,35 (м, 2Н), 4,2-3,9 (м, 2Н), 3,76 (с, 1H), 3,68-3,52 (м, 1H), 3,5-3,3 (м, 4Н), 3,28-3,18 (м, 6Н), 3,08-2,9 (м, 1H), 2,3-0,95 (м, 18Н), 0,88-0,75 (м, 3Н), 0,7-0,42 (м, 3Н).
Соединения №№43-75 получали по той же Схеме:


1LCMS чистота, УФ при 254 нм
Пример 6. Схема F;
Получение соединения №76:
(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-(2-метоксиэтил(метил)амино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
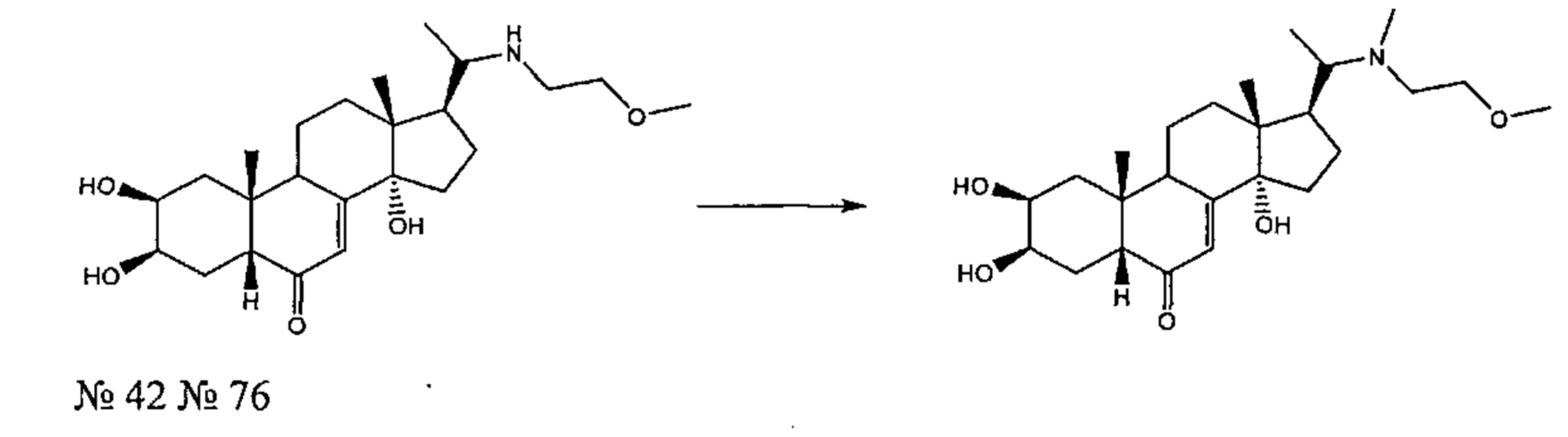
155 мг (0,368 ммоль) соединения №42 [(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-(2-метоксиэтиламино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он], полученного согласно методике, описанной на стадии 1 Примера 5, растворяли в 2,5 мл ДМФА и добавляли 61,8 мг (0,735 ммоль) бикарбоната натрия, вместе с 0,034 мл (0,552 ммоль) подметана. Полученную суспензию перемешивали при 20°C в течение 20 ч. Полученный раствор затем выливали в 15 мл воды и трижды экстрагировали по 15 мл бутанола. Бутанольную фазу упаривали, получая 220 мг порошка, который очищали методом флэш-хроматографии на картридже с силикагелем (95/5 дихлорметан/МеОН), получая 40 мг белого порошка (выход: 25%) соединения №76: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-(2-метоксиэтил(метил)амино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он, в виде белого порошка.
Соединение №76:
LC-MS: m/z=436,3 (МН+). УФ чистота при 254 нм = 99%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,61 (с, 1H (С7)), 4,64 (с, 1Н), 4,47-4,34 (м, 2Н), 3,75 (с, 1Н), 3,67-3,50 (м, 1H), 3,25-3,16 (м, 5Н), 3,05-2,85 (м, 1Н), 2,27-1,15 (м, 20Н), 0,90-0,70 (м, 6Н), 0,59 (с, 3Н).
Соединения №№77-80 получали по той же Схеме.


1LCMS чистота, УФ при 254 нм
Пример 7: Схема G;
Получение соединения №81:
(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-17-(2-морфолино-ацетил)-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он

Стадия 1: Получение соединения №102: (2S,3R,5R,10R,13R,14S,17S)-17-(2-бромацетил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
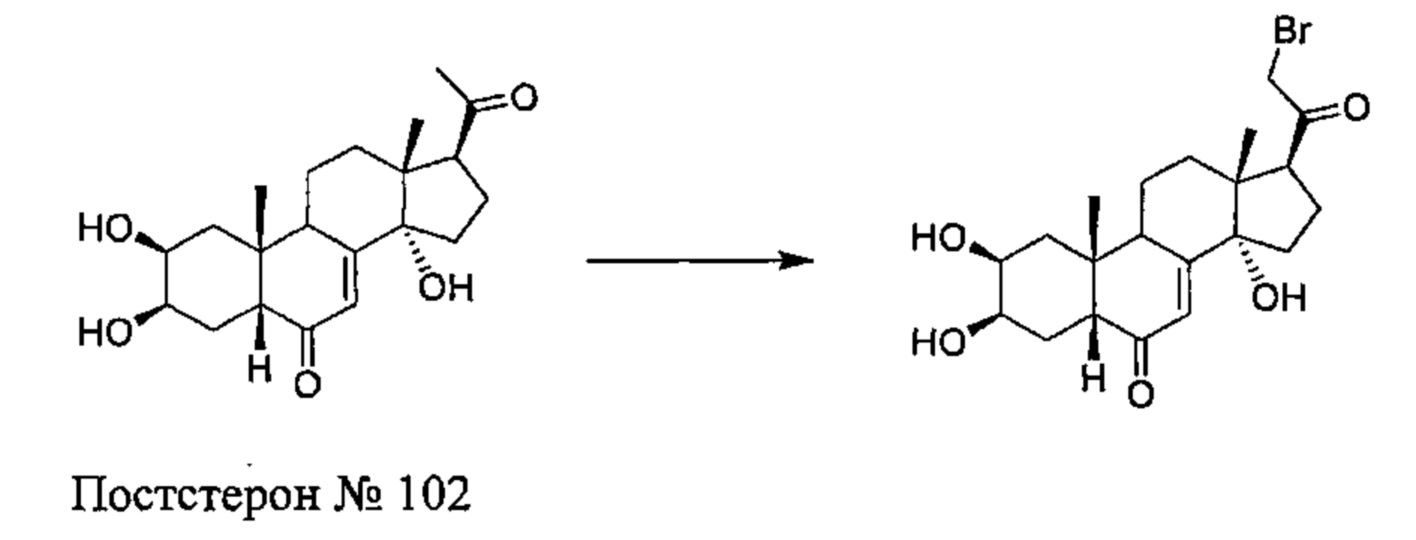
1 г (2,76 ммоль) постстерона (получен окислительным расщеплением цепи 20-гидроксиэкдизона согласно той же методике, которая описана на стадии 2 Схемы В) растворяли в 20 мл метанола. Полученный раствор охлаждали до 0°C, по каплям добавляли 0,284 мл (5,52 ммоль) брома и перемешивали в течение 1 ч при той же температуре, затем оставляли при температуре окружающей среды на 16 ч. Реакционную смесь выливали в 50 мл насыщенного раствора бикарбоната натрия и трижды экстрагировали по 100 мл этилацетата. Органические фазы промывали 50 мл насыщенного раствора бикарбоната натрия, затем насыщенным раствором хлорида натрия, сушили над сульфатом натрия и фильтровали, растворитель упаривали, получая 833 мг порошка, который растворяли в 30 мл дихлорметана, получая после фильтрования и сушки 412 мг (выход: 31%) соединения №102: 2S,3R,5R,10R,13R,14S,17S)-17-(2-бромацетил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он, в виде желтого порошка.
Соединение №102:
LC-MS: m/z=443,1 (МН+). УФ чистота при 254 нм=91%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,69-5,63 (м, 1Н (С7)), 5,08 (с, 1H), 4,42-4,35 (м, 3Н), 4,33-4,22 (м, 1Н), 3,77 (с, 1H), 3,66-3,58 (м, 1H), 3,39 (т, 1Н), 3,10-2,95 (м, 1H), 2,25-1,20 (м, 13Н), 0,83 (с, 3Н), 0,51 (с, 3Н).
Стадия 2: Получение соединения №81:(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-17-(2-морфолиноацетил)-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он

50 мг (0,103 ммоль) соединения №102 [(2S,3R,5R,10R,13R,14S,17S)-17-(2-бромацетил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он] растворяли в 1 мл ДМФА и добавляли 42,7 мг карбоната калия, вместе с 10,78 мкл (0,124 ммоль) морфолина. После перемешивания в течение 18 ч при 20°C, реакционную смесь выливали в 10 мл воды, и водную фазу дважды экстрагировали по 15 мл бутанола. Органическую фазу упаривали, получая 71 мг порошка, который очищали методом флэш-хроматографии на картридже с силикагелем (90/10 дихлорметан/МеОН), получая 28 мг (выход: 60%) соединения №81: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-17-(2-морфолиноацетил)-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он, в виде белого порошка.
Соединение №81:
LC-MS: m/z=448,4 (МН+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,65 (с, 1H (С7)), 5,02 (с, 1Н), 4,45 (д, 1Н), 4,40-4,37 (м, 1Н), 3,77 (с, 1H), 3,68-3,53 (м, 5Н), 3,34-3,24 (м, 4Н), 3,08-2,95 (м, 1Н), 2,45-1,17 (м, 16Н), 0,82 (с, 3Н), 0,48 (с, 3Н).
Соединения №№82-94 получали по той же Схеме.


Пример 8: Схема Н;
Получение соединения №95:
(2S,3R,5R,10Е,13R,14S,17S)-17-(2-этоксиацетил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он

100 мг (0,227 ммоль) соединения №102 [2S,3R,5R,10R,13R,14S,17S)-17-(2-бромацетил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он], полученного на стадии 1 Примера 7, растворяли в 2 мл этанола, по каплям добавляли 0,102 мл (0,272 ммоль) 21%-ного раствора этоксида натрия в этаноле, разбавленного 1 мл этанола, и полученный раствор кипятили в течение 30 мин. Реакционную смесь охлаждали до 20°C, выливали в 25 мл воды и дважды экстрагировали по 20 мл бутанола. Органическую фазу упаривали, получая 30 мг масла, которое очищали методом флэш-хроматографии на картридже с силикагелем (95/5 дихлорметан/МеОН), получая 13,5 мг (выход: 14%) соединения №95: (2S,3R,5R,10R,13R,14S,17S)-17-(2-этоксиацетил)-2,3,14-тригидрокси-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он, в виде желтого масла.
Соединение №95:
LC-MS: m/z=407,2 (МН+). УФ чистота при 254 нм=93%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,65-5,59 (м, 1Н (С7)), 4,96 (с, 1H), 4,46 (д, 1Н), 4,41-4,36 (м, 1Н), 4,03 (кв, 2Н), 3,77 (с, 1Н), 3,68-3,55 (м, 1Н), 3,08-2,90 (м, 1H), 2,75-2,62 (м, 1H), 2,3-2,15 (м, 2Н), 1,92-1,42 (м, 13Н), 1,18 (т, 3Н), 0,83 (с, 3Н), 0,58-0,49 (м, 3Н).
Соединение №96 получали по той же Схеме

1 LCMS чистота, УФ при 254 нм
Пример 9: Схема I;
Получение соединения №97:
(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-гидрокси-2-(2-гидроксиэтил(метил)амино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он
157 мг (0,360 ммоль) соединения №87 [(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[2-(2-гидроксиэтил(метил)амино)ацетил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он], полученного способом, описанным на стадии 2 Примера 7, растворяли в 7,5 мл этанола и порциями добавляли 21,14 мг (0,559 ммоль) боргидрида натрия. После перемешивания в течение 16 ч при 20°C, реакционную смесь выливали в 20 мл воды и трижды экстрагировали по 15 мл бутанола. Органическую фазу упаривали, получая порошок, который очищали методом флэш-хроматографии на картридже с силикагелем (85/14/1 дихлорметан/МеОН/NH4OH), получая 96 мг (выход: 60%) соединения №97: (2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-17-[1-гидрокси-2-(2-гидроксиэтил(метил)амино)этил]-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он, в виде белого порошка.
Соединение №97:
LC-MS: m/z=438,2 (MH+). УФ чистота при 254 нм=99%.
1Н ЯМР (300 МГц, ДМСО-d6) δ 5,6 (с, 1Н (С7)), 5,32-5,2 (м, 2Н), 4,77 (с, 1H), 4,47 (д, 1H), 4,42-4,38 (м, 1H), 3,92-3,57 (м, 4Н), 3,3-2,95 (м, 4Н), 2,82 (с, 3Н), 2,31-1,18 (м, 16Н), 0,85 (с, 3Н), 0,69 (с, 3Н).
13С ЯМР (75 МГц, ДМСО-d6) δ 203,2, 164,9, 121,0, 82,8, 66,9, 59,0, 55,6, 50,6, 46,9, 40,7, 37, 34, 31,9, 31,1, 30,3, 24,5, 23,2, 20,4, 16,3.
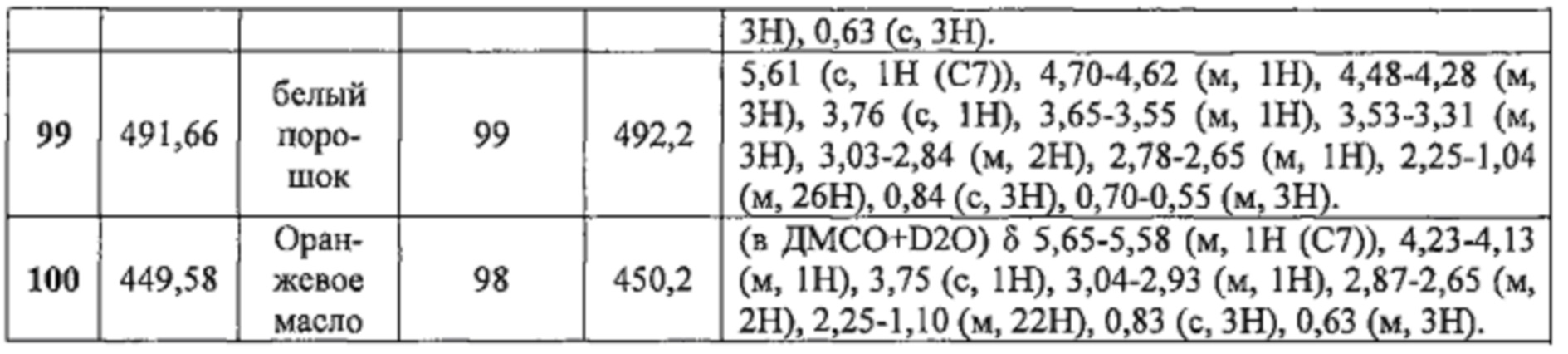
Соединения №98-100 получали по той же Схеме

1LCMS чистота, УФ при 254 нм
Пример 10. Схема J;
Получение соединения №101:
(2S,3R,5R,6E,10R,13R,14S,17S)-6-метоксиимино-17-(N-метокси-C-(морфолинометил)карбонимидоил)-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол
30 мкл (0,301 ммоль) метоксиламина гидрохлорида растворяли в 0,6 мл пиридина и порциями добавляли 136 мг (0,301 ммоль) соединения №81 [(2S,3R,5R,10R,13R,14S,17S)-2,3,14-тригидрокси-10,13-диметил-17-(2-морфолиноацетил)-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-6-он], полученного на стадия 2 Примера 7. После перемешивания в течение 36 ч при 20°C реакционную смесь разбавляли добавлением 10 мл дихлорметана, и полученный раствор дважды промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали, получая порошок, который очищали методом флэш-хроматографии на картридже с силикагелем (90/10 дихлорметан/МеОН), получая 81 мг (выход: 53%) соединения №101: (2S,3R,5R,6E,10R,13R,14S,17S)-6-мeтoкcииминo-17-(N-мeтoкcи-C-(мopфoлинoмeтил)карбонимидоил)-10,13-диметил-2,3,4,5,9,11,12,15,16,17-декагидро-1Н-циклопента[а]фенантрен-2,3,14-триол, в виде желтого порошка.
Соединение №101:
LC-MS: m/z=506,2 (МН+). УФ чистота при 254 нм=99%.
1H ЯМР (300 МГц, ДМСО-d6) δ смесь С6 (Z) и (Е) конформеров: 6,28 (с, 0,45Н (С7- конформер Е), 5,72 (с, 0,55Н (С7-конформер Z), 4,62 (с, 0,45Н-конформер Е), 4,53 (с, 0,55Н-конформер Z), 4,47-4,35 (м, 1H), 4,33-4,21 (м, 1Н), 3,77-3,70 (м, 7Н), 3,60-3,48 (м, 5Н), 3,16-3,06 (м, 1H), 2,90-2,70 (м, 2Н), 2,45-1,20 (м, 18Н), 0,72 (с, 3Н), 0,64-0,57 (м, 3Н).
Каскад для скрининга и исследования биологических эффектов производных 20-гидроксиэкдизона по настоящему изобретению
Разработка скринингового тестирования была инициирована на основе описанных в литературе исследований, в ее основе лежат характеристики саркопении как патологии. На физиопатологическом уровне данное заболевание характеризуется ослаблением синтеза белков и усилением протеолиза. Поэтому при разработке будущих лекарственных средств необходим скрининг на молекулярных факторах, имеющих отношение к двум указанным явлениям.
На клеточном уровне на культурах мышечных клеток, полученных из линии мышей С2С12, в работе Gorelick-Feldman et al. (2008) показано, что введение фитоэкдизонов увеличивало синтез белка в среднем на+20%. Первые разработки основывались на культуре и условиях лечения, описанных в работе Gorelick-Feldman, в присутствии продуктов сравнения (IGF-1 и 20-гидроксиэкдизон или 20Е). Проводили замеры внедрения тритий-меченого лейцина в указанные клетки для оценки синтеза белка de novo. Эти первые результаты позволили определить, что оптимальной последовательностью действий для наблюдения за оказываемым фитоэкдизонами эффектом на синтез белка была дифференциация клеток в течение 5 дней, с последующим добавлением тритий-меченого лейцина на 2 часа 30 минут в присутствии IGF-1 или 20Е.
Анализ литературы показал, что такие молекулы, как IGF-1, усиливали синтез белка только на 20%, хотя активация мишеней данного сигнального пути более устойчивым образом позволяла достичь стимулирования примерно на 200% [Kazi et al., 2010]. Данные мишени включали фосфорилирование, которое активирует такие белки, как Akt или S6 киназа. Кроме того, на той же клеточной системе С2С12, в работе Zubeldia et al. (2012) анализировали явления апоптоза и протеолиза. В этом исследовании авторы в частности сообщали, что растительные экстракты, содержащие фитоэкдизоны, такие как туркестерон или 20Е, были способны, после 24 часов воздействия на дифференцированные С2С12 клетки, ингибировать экспрессию генов миостатина и каспазы 3 в 4 и в 2 раза, соответственно [Zubeldia et al., 2012].
После нескольких экспериментов, в которых клетки С2С12, дифференцированные в мышечные волокна, инкубировали в присутствии IGF-1 или 20Е в течение 2 ч 30 мин или 6 ч, были разработаны два метода скрининга. Так, фосфорилирование S6 протеинкиназы и экспрессию гена миостатина изучали с целью оценки их модулирования гормоном роста или экдизоном, а также с целью описания этих модулирований со статистической точки зрения.
Методики
Ингибирование экспрессии миостатина в клетках С2С12:
С2С12 миобласты (АТСС CRL-1772) распределяли в 24-луночные планшеты с плотностью 30 ООО клеток на лунку и выращивали в среде DMEM, содержащей глюкозу в количестве 4,5 г/л, добавку эмбриональной телячьей сыворотки (10%) и антибиотики (пенициллин и стрептомицин). Через 48 часов индуцировали дифференциацию миобластов путем частичного снижения количества сыворотки (2% вместо 10%) в течение 5 дней. Затем клетки помещали в среду, обедненную глюкозой (DMEM, содержащая 1 г/л глюкозы) и не содержащую сыворотки, в присутствии испытуемых соединений или соединений сравнения (100 нг/мл IGF-1 или 10 мкМ 20Е) на 6 часов. В конце эксперимента экстрагировали матричные РНК (мРНК) по стандартной методике, основанной на применении фенола и хлороформа. Вкратце, клетки лизировали с применением раствора Trizol (Sigma Т9424), содержащего сильную кислоту и фенол. мРНК отделяли от белков путем добавления хлороформа и последующего центрифугирования. Затем их высаживали из изопропанола и суспендировали в концентрации 1 мкг/мл в ультрачистой воде, не содержащей РНКаз и ДНКаз. Затем 1 мкг мРНК превращали путем обратной транскрипции в комплементарную ДНК посредством фермента AMV в присутствии праймера и смеси нуклеотидов, согласно методике от поставщика (Applied Biosystems 4368814). Экспрессию гена изучали с помощью цепной реакции, инициируемой полимеразой и обычно именуемой полимеразной цепной реакцией (ПЦР), в условиях количественного определения, чем и обусловлено название кПЦР. кПЦР проводили в ПЦР-анализаторе в режиме реального времени 7900НТ Fast real-Time (Applied Biosystems). Программируемые условия были стандартными и состояли из 1 цикла при 95°C в течение 15 минут, затем 40 циклов при 95°C в течение 15 сек и при 60°C в течение 1 мин, и программа завершалась стадией кривой плавления при температуре от 60°C до 95°C. Анализируемые образцы все содержат 100 нг кДНК, кПЦР буфер, содержащий фермент, смесь олигонуклеотидов и интеркалирующий агент (sybergreen или SYBRgreen), и пару праймеров, специфичную для исследуемого гена, стратегически выбираемую между двумя последовательностями экзона и в конечной концентрации 200 нМ. Флуоресцентные зонды связываются с двухцепочечной ДНК и флуоресцируют только при связывании с ДНК. Порог флуоресценции определяется программой прибора. Когда количество ДНК позволяет флуоресцентному датчику превысить данный порог, регистрируется число циклов ПЦР, называемое "Ct" сокращенно от "Cycle Threshold". Это значение служит основой для вычислений с целью количественного определения ДНК. Определяют соотношение R между количеством исходной ДНК в образце и в контроле, который не подвергался обработке (т.е. R=2-(Ct образец-ct контроль), и это значение будет релевантно конститутивному гену, для которого известно, что на него не влияет такая обработка (т.е. R=2-ΔΔCt).
Применявшиеся праймеры указаны ниже в таблице:

Фосфорилирование S6 киназы:
С2С12 миобласты (АТСС CRL-1772) распределяли в 6-луночные планшеты с плотностью 170 ООО клеток на лунку и выращивали в среде DMEM, содержащей глюкозу в количестве 4,5 г/л, добавку эмбриональной телячьей сыворотки (10%) и антибиотики (пенициллин и стрептомицин). Через 48 часов индуцировали дифференциацию миобластов путем частичного снижения количества сыворотки (2% вместо 10%) в течение 5 дней. Затем клетки помещали в среду, обедненную глюкозой (DMEM, содержащая 1 г/л глюкозы) и не содержащую сыворотки, в присутствии испытуемых соединений или соединений сравнения (100 нг/мл IGF-1 или 10 мкМ 20Е) на 2 часа. В конце эксперимента клетки лизировали коммерческим лизирующим буфером (Invitrogen FNN0011) с добавкой коммерчески доступной смеси анти-протеаз (Roche 05056489001). После центрифугирования, цитоплазматическую фракцию, содержащую растворимые белки, собирали и определяли концентрацию белков с помощью коммерчески доступного набора (Biorad 500-0114), принцип работы которого основан на анализе методом Лоури. Анализ фосфорилирования S6 киназы осуществляли с помощью коммерчески доступного набора (Cell signaling 7063) для ИФА (твердофазного иммуноферментного анализа). Вкратце, 50 мкг лизата белка помещали в 96-луночный микропланшет и инкубировали в течение ночи при 4°C с раствором антигена, специфичным для pS6 киназа треонин 389 антитела. Связывание антигена с дном лунки осуществляется электростатически. Затем раствор участвующего в тесте антитела (pS6K Т389) инкубируют при 37°C в лунках в течение 2 часов. Антитела специфично связываются с антигеном. Затем лунки промывают промывочным буфером для удаления участвующих в тесте антиген-специфичных первичных антител, находящихся в избытке. Третья стадия состоит в связывании детекторного антитела. Раствор детекторных антител инкубируют при 37°C в лунках в течение 1 часа. Затем лунки промывают для удаления избытка детекторных антител. Следует отметить, что детекторные антитела связываются с ферментом, который в присутствии субстрата превращает его в продукт реакции, который можно детектировать и определить его количество по появлению окраски. Последняя стадия состоит в выявлении связанных антител. Выявляющий раствор, содержащий субстрат для фермента, в данном случае ТМВ (3,3',5,5'-тетраметилбензидин), инкубируют при 37°C в темноте в течение 30 минут. Появление синего окрашивания в субстрате указывает на присутствие участвующих в тесте антител. Для предотвращения явления насыщения, добавляют останавливающий раствор (обычно содержащий гидроксид натрия), что вызывает изменение окраски, которая меняется с синей на желтую. Ее интенсивность пропорциональна количеству присутствующего фермента и, следовательно, концентрации определяемых антител. Интенсивность сигнала определяют спектрофотометрически при длине волны 450 нм.
Оценка действия молекул в модели мышей, находящихся на диете с высоким содержанием жира
20Е в качестве соединения сравнения и соединения по настоящему изобретению (№51 и 93) вводили перорально, в дозировке 5 мг/кг веса тела, 12-недельным мышам C57BL/6J, находившимся на диете с высоким содержанием жира в течение 6 недель. Оценивали влияние соединений на вес и количество белка в камбаловидной мышце, а также количество транскриптов генов, участвующих в миогенезе.
Миогенез, который представляет собой процесс формирования мышечных тканей, управляется несколькими миогенными факторами транскрипции, которые выступают в роли конечного звена сигнального каскада и продуцируют транскрипты, участвующие в разных стадиях развития. Роль факторов транскрипции была описана в различных журналах (Sabourin and Rudnicki 2000 и Le Grand and Rudnicki 2007). Белок Pax7 (Paired-box protein 7) поддерживает популяцию клеток-сателлитов в неактивном состоянии и, вместе с Myf5 (Миогенный фактор 5), участвует в процессе роста активированных миобластов. Белок MyoD (Myoblast Determination protein) определяет потенциал дифференциации активированных миобластов и кооперируется с миогенином и белком MEF2 (Myocyte Enhancer Factor 2) в функции контроля и индуцирования дифференциации. Наконец, MRF4 (Muscle-specific Regulatory Factor 4) необходим для гипертрофии, даже несмотря на то, что он, вероятно, имеет и другие функции. Совершенно понятно, что указанные факторы транскрипции не работают в одиночку, а работают в контексте сложных сигнальных каскадов, которые управляют каждой стадией миогенеза (Knight and Kothary, 2011).
Количество белков определяют, сначала лизируя образец мышцы в 0,1н растворе NaOH по методике FastPrep. Количественное определение белков проводят посредством колориметрического анализа на основе метода Лоури.
Для проведения анализа экспрессии генов мышечные ткани гомогенизировали в растворе Trizol (500 мкл), и РНК экстрагировали и очищали с применением фенольно/хлороформенного метода. РНК в количестве 1 пг использовали в качестве темплата для синтеза первой кДНК цепочки с применением oligo (dT)s в качестве праймеров и AMV обратной транскриптазы согласно инструкциям производителя (Applied Biosystems 4368814). Затем проводили кПЦР с помощью прибора 7900НТ, оснащенного быстрой системой для детектирования ПЦР в реальном времени (Applied Biosystems), и стандартной программы для кПЦР (1 цикл при 95°C в течение 15 минут, 40 циклов при 95°C в течение 15 сек и 60°C в течение 1 мин, 60-95°C кривая плавления для Sybergreen). Эксперименты проводили в смеси Sybergreen SYBR master mix (Applied Biosystems), содержащей 100 нг образцов кДНК и набор праймеров, которые связываются с двумя разными экзонами, и при окончательной концентрации 200 нМ.
Относительные различия в экспрессии генов между образцами выражали как увеличение или уменьшение числа циклов [Ct] по сравнению с контрольной группой, при этом значение [Ct] для каждого гена стандартизировали по гену бета-актина.
Исследование пероральной фармакокинетики полученных молекул на крысах
Фармакокинетику полученных соединений оценивали при пероральном введении с использованием самцов крыс линии Wistar (Charles River). 20Е в качестве соединения сравнения вводили в дозировке 50 мг/кг веса тела. Новые соединения по настоящему изобретению вводили в дозировке 10 мг/кг веса тела в виде смеси 4-6 продуктов. После введения брали образцы крови из хвоста в моменты времени t=0,25 ч, 0,5 ч, 1 ч, 3 ч, 6 ч и 8 ч. Образцы крови центрифугировали и отделяли плазму. Анализ образцов плазмы позволил вычислить фармакокинетические параметры, а именно значение Смакс, которое соответствует максимальной концентрации, наблюдаемой после введения молекулы, значение Тмакс, которое представляет собой время, требующееся для достижения максимальной концентрации после введения молекулы, и значение AUC: площадь под кривой, построенной по различным концентрациям соединений в различные моменты времени отбора проб.
Результаты
- Влияние на экспрессию миостатина
Таблица 4: влияние на экспрессию миостатина. Результаты выражены в процентах экспрессии гена миостатина в клетках, находящихся в контакте с соединениями, относительно экспрессии в контрольных клетках. А соответствует проценту ниже 70%. В соответствует проценту от 71% до 85%. Соединения тестировали в концентрации 10 мкМ.

Следующие 38 соединениий:4, 5, 7, 21, 25, 27-29, 31-33, 38, 41, 43, 46, 47, 51-54, 62-65, 67, 68, 71, 75, 76, 79, 81, 86, 89, 92-94, 99 и 101 очень значительно подавляли экспрессию миостатина в мышечных клетках.
Следующие 15 соединений: 19, 23, 30, 35-37, 48, 56, 57, 60, 73, 83, 85, 88 и 91 значительно подавляли экспрессию миостатина в мышечных клетках.
- Влияние на синтез белка через фосфорилирование S6K1
Таблица 5. Влияние на синтез белка. Результаты выражены в процентах роста фосфирилирования S6K в мышечных клетках. А соответствует значениям выше 130%, В соответствует значениям от 110% до 129%. Соединения тестировали в концентрации 10 мкМ.
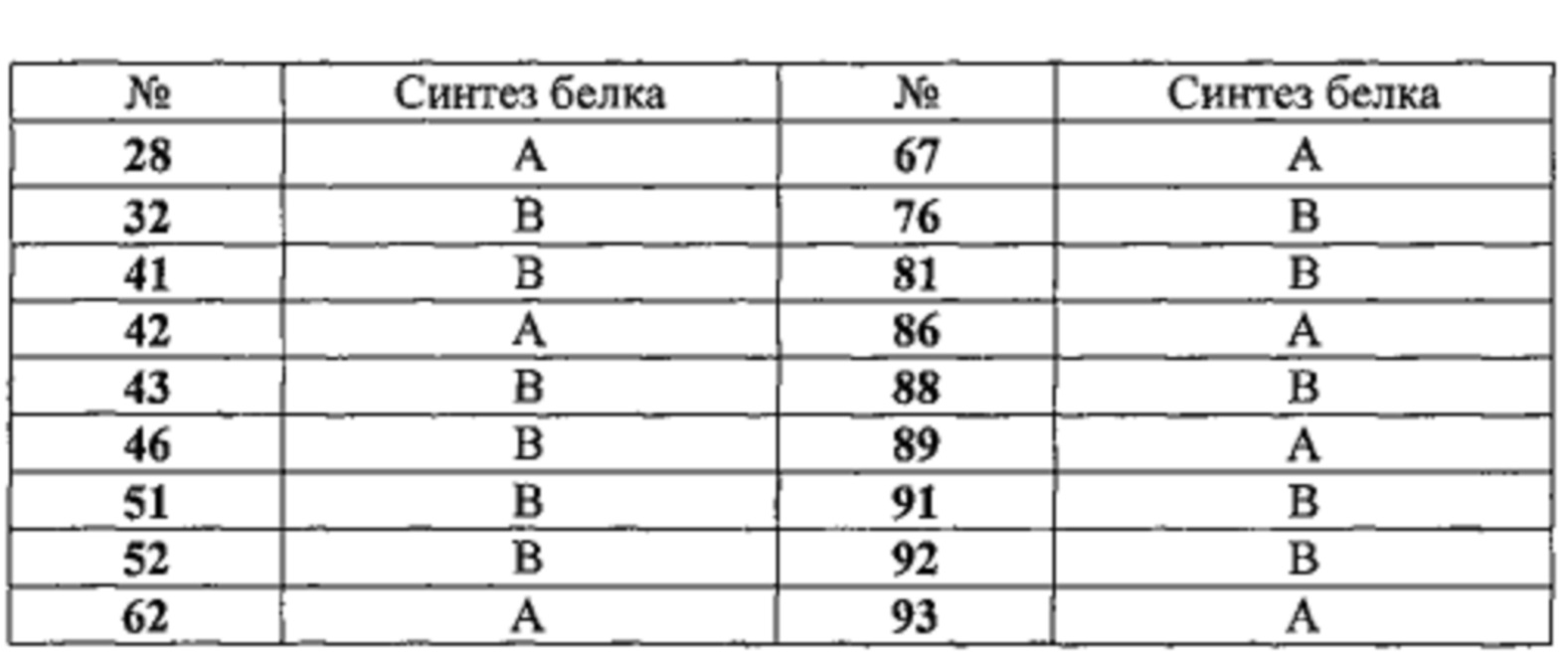

Следующие 8 соединений: 28, 42, 62, 67, 86, 89, 93 и 94 очень значительно стимулируют S6Ka фосфорилирование, на уровне, эквивалентом IGF-1 (130-140%).
Следующие 12 соединений: 32, 41, 43, 46, 51, 52, 63, 76, 81, 88, 91 и 92 значительно стимулируют S6Ka фосфорилирование, на уровне, эквивалентом 20Е (120%).
- Исследование молекул в модели мышей на диете с высоким содержанием жира
Исследование in vivo проводили посредством оценки влияния 20Е как соединения сравнения и молекул по настоящему изобретению (№51 и 93), вводимых перорально в дозировке 5 мг/кг веса тела, на мышей C57BL/6, находившихся на диете с высоким содержанием жира в течение 6 недель. Оценивали влияние молекул на вес и количество белка в камбаловидной мышце, а также количество транскриптов генов, участвующих в миогенезе.
Влияние 20Е как соединения сравнения и соединений по настоящему изобретению №51 и 93 на вес мышцы проиллюстрировано на фиг. 3А, а влияние 20Е и соединений №51 и 93 на количество белка в камбаловидной мышце проиллюстрировано на фиг. 3В.
Все три из соединений 20Е, №51 и №93, вводимые в дозировке 5 мг/кг, увеличивали вес и количество белка в камбаловидной мышце по сравнению с контрольной группой. Соединения по настоящему изобретению показывают такую же высокую эффективность, как 20Е. Наблюдалось даже значительное увеличение содержания белка с соединением №93.
Влияние 20Е как соединения сравнения и соединений по настоящему изобретению №51 и 93 на транскрипт миостатина в камбаловидной мышце показано на фиг. 4.
20Е и соединения №51 и 93 сопоставимо подавляют экспрессию миостатина в камбаловидной мышце. Эти молекулы также подавляют транскрипт миостатина в in vitro экспериментах на клеточной линии С2С12, как показано выше в Таблице 4.
Влияние 20Е как соединения сравнения и соединений по настоящему изобретению №51 и 93 на транскрипт MyoD и миогенина, которые являются генами, участвующими в миогенезе в камбаловидной мышце, проиллюстрировано, соответственно, на фиг. 5А и 5В.
20Е и соединения №51 и 93 индуцируют рост транскриптов гена MyoD, который определяет потенциал дифференциации, и гена Myf5, участвующего в разрастании миоцитов. Они также вызывают рост транскриптов гена миогенина, участвующего в ранней дифференциации миоцитов.
- Изучение фармакокинетики молекул на крысах
Фармакокинетику 20Е и соединений по настоящему изобретению оценивали на крысах при пероральном введении, в дозировке 10 мг/кг в случае соединений по настоящему изобретению и 50 мг/кг в случае 20Е.
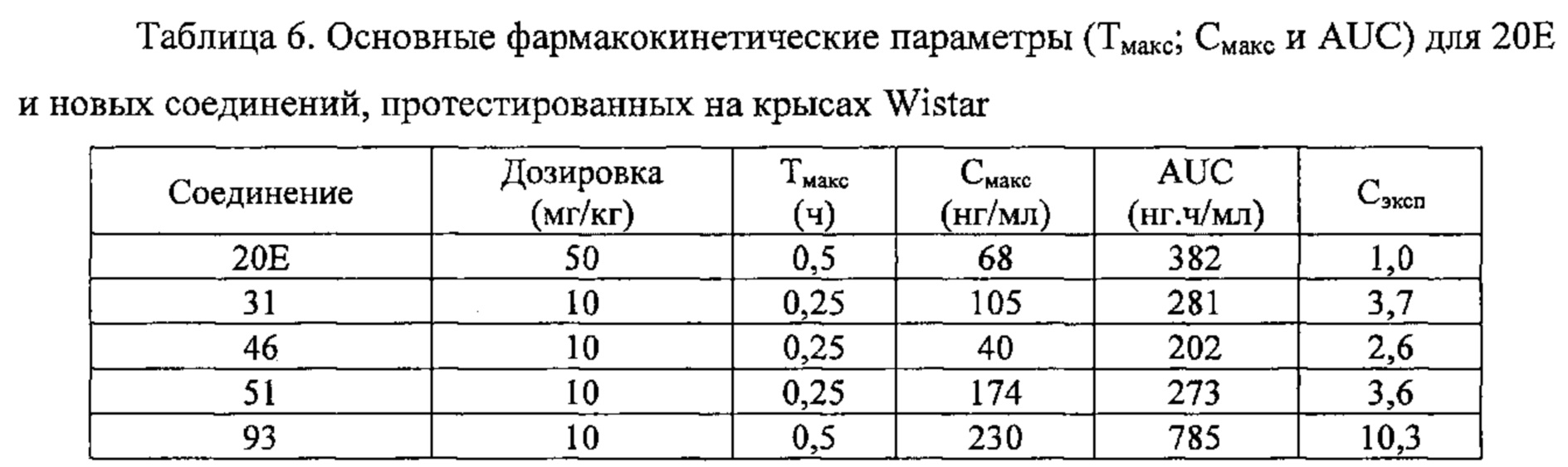
Принимая во внимание, что дозировка 20E в 5 раз выше (50 мг/кг; дозировки соединений по настоящему изобретению (10 мг/кг), коэффициент содержания вещества в плазме крови Сэксп [Сэксп=(Доза20Е × AUCcoединение):(Дoзасоединения× AUC20E)] показывает улучшение фармакокинетического профиля всех протестированных соединений по сравнению с 20Е. Таким образом, данное исследование на крысах показывает, что соединения №31; 46; 51 и 93 характеризуются более высоким содержанием вещества в плазме крови по сравнению с 20Е.
- Обзор
В таблице на фиг. 6 показаны результаты, полученные для соединений по настоящему изобретению в эксперименте, в котором анализировали экспрессию гена миостатина и синтез белка.
Для экспрессии гена миостатина результаты выражены в процентах экспрессии гена миостатина в клетках, находящихся в контакте с соединениями, относительно экспрессии в контрольных клетках. А соответствует проценту ниже 70%. В соответствует проценту между 71% и 85%.
Для анализа синтеза белка результаты выражены в процентах увеличения фосфорилирования S6K в мышечных клетках. А соответствует значениям выше 130%, В соответствует значениям от 110% до 129%.
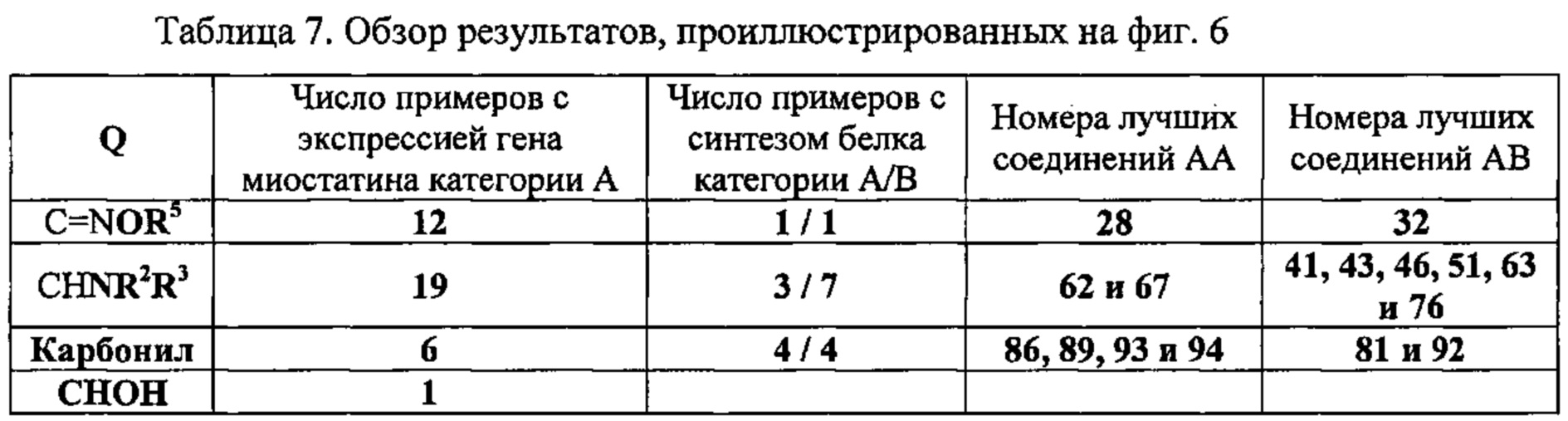
Наиболее привлекательные продукты принадлежат к категории АА или АВ, а именно к категории A по экспрессии гена миостатина, в комбинации с категорией А или В по синтезу белка.
Список процитированной литературы
Arounleut Р, Bialek Р, Liang LF, et al. 2013. A myostatin inhibitor (propeptide-Fc) increases muscle mass and muscle fiber size in aged mice but does not increase bone density or bone strength. Exper Gerontol 48: 898-904.
Aubertin-Leheudre M, Lord C, Khalil A, Dionne IJ. 2007. Six months of isofiavone supplement increases fat-free mass in obese-sarcopenic postmenopausal women: a randomized double-blind controlled trial. Eur J Clin Nutr 61: 1442-1444.
Aussel C, Woelffle E, Lemoigne P, Depailler L, Bouillanne O. 2013. Une nouvelle strategie nutritionnelle pour lutter contre la denutrition et la sarcopenie: le regime proteique pulsé [A novel nutritional strategy for combating undernutritionment and sarcopenia: the pulsed protein diet]. Cahiers Nutrition Dietetique 48: 33-40.
Azizov AP, Seifulla RD, Ankudinova IA, Kondrat'eva II, Borisova IG. 1998. Effect of the antioxidants elton and leveton on the physical work capacity of athletes. Eksp Klin Farmakol 61 (1): 60-62.
Baptista IL, Leal ML, Artioli GG, et al. 2010. Leucine attenuates skeletal muscle wasting via inhibition of ubiquitin ligases. Muscle Nerve 41 (6):800-808.
Báthori M, Tóth N, Hunyadi A, Márki A, Zador E. (2008). Phytoecdysteroids and anabolic-androgenic steroids - Structure and effects on Humans. Current Medicinal Chemistry 15: 75-91.
Bennett ВТ, Mohamed JS, Alway SE. 2013. Effects of resveratrol on the recovery of muscle mass following disuse in the plantaris muscle of aged rats. PLoS One 8 (12): e83518.
Boirie Y, Gachon P, Beaufrere B. 1997. Splanchnic and whole body leucine kinetics in young and elderly men. Am J Clin Nutr. 65: 489-495.
Bonnefoy M, Constans T, Ferry M. 2000. Dénutrition du sujet âgé. Influence de la nutrition et de I'activeté physique sur le muscle au grand âge [Undernutritionment in the elderly. Influence of nutrition and physical activity on muscle in old age]. Presse Med 29: 2177-2182.
Bonnefoy M. 2008. Interventions pour restaurer la masse musculaire chez le sujet âge [Interventions for restoring muscle mass in the elderly]. Nutr Clin Metab 22:80-83.
Buehring B, Binkley N. 2013. Myostatin - the holy grail for muscle, bone, and fat? Curr Osteoporos Rep 11(4):407-414.
Castan-Laurell I, Dray C, Knauf C, Kunduzova O, Valet P. 2012. Apelin, a promising target for type 2 diabetes treatment? Trends Endocrinol Metab 23 (5):234-241.
CheЯMPykh NS, Shimanovsky NL, Shutko GV, Syrov VN. 1988. Effects of methandrostenolone and ecdysterone on physical endurance of animals and protein metabolism in the skeletal muscles. Farmakologiya i Toksikologiya 6: 57-62.
Collins-Hooper H, Sartori R, Macharia R, et al. 2014. Propeptide-mediated inhibition of myostatin increases muscle mass through inhibiting proteolytic pathways in aged mice. J Gerontol A Biol Sci Med Sci, doi: 10, 1093/gerona/gh170.
Crenn P. 2013. Sarcopénie et cachexie: approche médicamenteuse [Sarcopenia and cachexia: a drug approach]. Nutrition Clinique Métabolisme 27: 69-73.
de Jager N, Hudson NJ, Reverter A, et al. 2011. Chronic exposure to anabolic steroids induces the muscle expression of oxytocin and a more than fiftyfold increase in circulating oxytocin in cattle. Physiol Genomics 43:467-478.
Dumonceaux J, Marie S, Beley C, Trollet C, Vignaud A, Ferry A, Butler-Browne G, Garcia L. 2010. Combination of myostatin pathway interference and dystrophin rescue enhances tetanic and specific force in dystrophic mdx mice. Mol Ther 18 (5): 881-887.
Fiatarone MA, Marks EC, Ryan ND, Meredith CN, Lipsitz LA, Evans WJ. 1990. High-intensity strength training in nonagerians. JAMA 263: 3029-3034.
Foucault AS, Mathé V, Lafont R, Even P, Dioh W, Veillet S, Tóme S, Huneau D, Hermier D, Quignard-Boulangé A. 2012. Quinoa extract enriched in 20-hydroxyecdysone protects mice from diet-induced obesity and modulates adipokines expression. Obesity 20: 270-277.
Foucault AS, Dioh W, Lafont R, Veillet S, Tóme S, Quignard-Boulangé A, Clément K, Rizkalla S. 2014. 20-Hydroxyecdysone increases android fat mass loss with no significant effect on muscle mass loss during a weight loss program in obese and overweight subjects. ICFSR 2014 International Conference of Frailty and Sarcopenia Research, Barcelona, 12-14/03/2014.
Gadzhieva RM, Portugalov SN, Paniushkin VV, Kondrat'eva II. 1995. A comparative study of the anabolic action of ecdysten, leveton and Prime Plus, preparations of plant origin. Eksp Klin Farmakologiya 58 (5): 46-48.
Gilson H, Schakman O, Combaret L, et al. 2007. Myostatin gene deletion prevents glucocorticoid-induced muscle atrophy. Endocrinology 148: 452-460.
Gorelick-Feldman J, MacLean D, Ilic N, Poulev A, Lila MA, Raskin I. 2008. Phytoecdysteroids increase protein synthesis in skeletal muscle cells. J. Agric. Food Chem. 56: 3532-3537.
Gorelick-Feldman J, Cohick W, Raskin I. 2010. Ecdysteroids elicit a rapid Ca2+ flux leading to Akt activation and increased protein synthesis in skeletal muscle cells. Steroids 70: 632-637.
Greenberg SA. 2012. Pathogenesis and therapy of inclusion body myositis. Curr Opin Neurol 25 (5): 630-639.
Han HQ, Mitch WE. 2011. Targeting the myostatin signaling pathway to treat muscle wasting diseases. Curr Opin Support Palliat Care 5 (4): 334-341.
Hung TJ, Chen WM, Liu SF, et al. 2012. 20-Hydroxyecdysone attenuates TGF-β1-induced renal cellular fibrosis in proximal tubule cells. J Diabetes Complications 26 (6): 463-469.
Kazi AA, Lang CH 2010. PRAS40 Regulates Protein Synthesis and Cell Cycle in C2C12 Myoblasts Mol Med, 16 (9-10): 359-371.
Kizelsztein P, Govorko D, Komarnytsky S, Evans A, Wang Z, Cefalu WT, Raskin I. 2009. 20-Hydroxyecdysone decreases weight and hyperglycemia in a diet-induced obesity mice model. Am. J. Physiol. Endocrinol. Metab. 296: E433-E439.
KnightJDR, Kothary R. 2011. The myogenic kinome: protein kinases critical tomammalian skeletal myogenesis Skeletal Muscle, 1:29,
http://www. skeletalmusclejournal.com/ content/1/1/29
Lafont R,

Lafont R, Harmatha J, Marion-Poll F, Dinan L, Wilson ID. 2002. Ecdybase, a free ecdysteroid database, http://ecdybase.org
Larock RC. 1989. Comprehensive organic transformations: A guide to functional group preparations. VCH Publishers, New York.
Lawrence MM. 2012. Ajuga turkestanica as a countermeasure against sarcopenia and dynapenia. Ms thesis, Appalachian State University.
Le Grand F, Rudnicki MA. 2007. Skeletal muscle satellite cells and adult myogenesis. Curr Opin Cell Biol, 19: 628-633.
Léger B, Derave W, De Bock K; Hespel P, Russell AP. 2008. Human sarcopenial reveals an increase in SOCS-3 and myostatin and a reduced efficiency of Akt phosphorylation. Rejuvenation Res 11 (1): 163-175.
Li Z, Heber D. 2011. Sarcopenic obesity in the elderly and strategies for weight management. Nutrition Reviews 70 (1): 57-64.
Li ZB, Kollias HD, Wagner KR. 2008. Myostatin directly regulates skeletal muscle fibrosis. J. Biol. Chem. 283 (28): 19371-19378.
Little JP, Phillips SM. 2009. Resistance exercise and nutrition to counteract muscle wasting. Appl Physiol Nutr Metab 34: 817-828.
Liu W, Thomas SG, Asa SL, et al. 2003. Myostatin is a skeletal muscle target of growth hormone anabolic action. J Clin Endocr Metab 88 (11): 5490-5496.
Macell TJ, Harman SM, Urban RJ, et al. 2001. Comparison of GH, IGF-I, and testosterone with mRNA of receptors and myostatin in skeletal muscle in older men. Am J Physiol Endocrinol Metab 281: E1159-E1164.
Murad MH, Elamin KB, Abu Elnour NO, et al. 2011. Clinical review: the effect of vitamin D on falls: a systematic review and meta-analysis. J Clin Endocrinol Metab 96 (10): 2997-3006.
Murphy KT, Koopman R, Naim T, et al. 2010. Antibody-directed myostatin inhibition in 21-mo-old mice reveals novel roles for myostatin signaling in skeletal muscle structure and function. FASEB J 24: 4433-4442.
Pierno S, Tricarico D, Liantonio A, et al. 2014. An olive oil-derived antioxidant mixture ameliorates the age-related decline of skeletal muscle function. AGE 36:73-88.
Quillot D, Bölune P, Malgras P, Malgras A, Ziegler O. 2013. L'obésité du sujet âgé [Obesity in the elderly]. Nutr Clin Métabolisme 27: 95-101.
Ryall JG, Plant DR, Gregorevic P, Silence MN, Lynch GS. 2004. β2-Agonist administration reverses muscle wasting and improves muscle function in aged rats. J Physiol 555 (1): 175-188.
Ryall JG, Church JE, Lynch GS. 2007. A novel role of β-adrenoreceptor signalling in skeletal muscle growth, development and regeneration. Proc Australian Physiol Soc 40: 103-108.
Ryan AS, Li G, Blumenthal JB, Ortmeyer HK. 2013. Aerobic exercise+weight loss decreases skeletal muscle myostatin expression and improves insulin sensitivity in older adults. Obesity 21 (7): 1350-1356.
Sabourin LA, Rudnicki MA. 2000. The molecular regulation of myogenesis. Clin Genet 57: 16-25. Saini A, Faulkner S, AL-Shanti N, Stewart C. 2009. Powerful signals for weak muscles. Ageing Res Rev 8: 251-267.
Sakuma K, Yamaguchi A. 2012. Sarcopenia and age-related endocrine function. Int J Endocrinol, doi: 10, 1155/2012/127362.
Sattler FR. 2013. Growth hormone in the aging male. Best Practice Res Clin Endocr Metab 27:541-555.
Schaap LA, Pluijm SMF, Deeg DJH, et al. 2009. Higher inflammatory marker levels in older persons: associations with 5-year change in muscle mass and muscle strength. J Gerontol A Biol Sci Med Sci 64A (11): 1183-1189.
Seidlova-Wuttke D, Erhardt C, Wuttke W. 2010. Metabolic effects of 20-OH ecdysone in ovariectomized rats. J Steroid Biochem Mol Biol 119: 121-126.
Seidman SN. 2007. Androgens and the aging male. Psychopharmacol Bull 40: 205-218.
Shadfar S, Couch ME, McKinney KA, et al. 2011. Oral resveratrol therapy inhibits cancer-induced skeletal muscle and cardiac atrophy in vivo. Nutr Cancer 63 (5): 749-762.
Simakin SYu, Panyushkin VV, Portugalov SN, Kostina LV, Martisorov EG. 1988. Combined application of preparation Ecdysten and product Bodrost during training in cyclic sports. Sports Science Bulletin N°2, 29-31.
Stenholm S, Alley D, Bandinelli S, et al. 2009. The effect of obesity combined with low muscle strength on decline in mobility in older persons: results from the InCHIANTI study. Int J Obesity 33:635-644.
Syrov VN. 2000. Comparative experimental investigations of the anabolic activity of ecdysteroids and steranabols. Pharm Chem Journal 34(4):193-197.
Syrov VN, Saatov V, Sagdullaev ShSh, Mamatkhanov AU. (2001). Study of the structure - anabolic activity relationship for the phytoecdysteroids extracted from some plants of central Asia. Pharmaceutical Chemistry Journal35: 667-671.
Tchoukouegno Ngueu S. 2013. Estrogenic, cytotoxic and anabolic effects on estrogen target organs of an extract of Erythrina excelsa and ecdysterone. PhD thesis, German Sports University of Cologne.
Tisdale MJ. 2001. Facteurs lipolytiques et protéolytiques de la cachexie cancéreuse [Lipolytic and proteolytic factors of cancer-related cachexia]. Nutr Clin Métabol 15: 266-272.
Todorov IN, Mitrokhin YuI, Efremova OI, Sidorenko LI. 2000. The effect of ecdysterone on the biosynthesis of proteins and nucleic acids in mice. Pharmaceut Chem J 34 (9): 455-458.
Tóth N, Szabó A, Kacsala P, Héger J, Zádor E. 2008. 20-Hydroxyecdysone increases fiber size in a muscle-specific fashion in rat. Phytomedicine 15: 691-698.
Verghese J, Holtzer R, Oh-Park M, et al. 2011. Inflammatory markers and gait speed decline in older adults. J Gerontol A Biol Sci Med Sci 66A: 1083-1089.
Walston JD. 2012. Sarcopenia in older adults. Curr. Opinion Rheumatol. 24: 623-627.
White JP, Gao S, Puppa MJ, et al. 2013. Testosterone regulation of Akt/mTORCl/FoxO3a signaling in skeletal muscle. Mol Cell Endocrinol 365: 174-186.
White ТА, LeBrasseur, NK. 2014. Myostatin and sarcopenia: opportunities and challenges - a mini-review. Gerontology, doi: 10, 1159/000356740.
Wuttke W, Seidlová-Wuttke 2013. Pflanzliche Präparate fürdie Therapie klimaterischer und postmenopausaler Beschwerden und Erkrankungen. Frauenartz 54: 580-587.
Zhao J, Brault JJ, Schild A, Goldberg AL. 2008. Coordinate activation of autophagy and the proteasome pathway by FoxO transcription factor. Autophagy 4 (3):378-380.
Zhu WM, Zhu HJ, Tian WS, Hao XJ, Pittman Jr CU. 2002. The selective dehydroxylation of 20-hydroxyecdysone by Zn powder and anhydrous acetic acid. Synthetic Communications 32:1385-1391.
Zubeldia JM, Hernández-Santana A, Jiménez-de-Rio M, et al. 2012. In vitro characterization of the efficacy and safety profile of a proprietary Ajuga turkestanica extract. Chinese Medicine 3: 215-222.
Реферат
Изобретение относится к соединению общей формулы (I), в которой V-U представляет собой углерод-углеродную простую связь, и Y представляет собой гидроксильную группу или атом водорода, или V-U представляет собой C=C этиленовую связь; X выбран из атома кислорода; N-ORгруппы, где Rвыбран из: атома водорода; C-Cалкильной группы; или (C-Cалкил)CORгруппы, в которой Rможет представлять собой атом водорода или C-Cалкильную группу; и в которой: Q представляет собой карбонильную группу; Rвыбран из: (C-Cалкил)W(C-Cалкил) группы, необязательно замещенной группой OH; (C-Cалкил)W(C-Cалкил)W(C-Cалкил) группы; (C-Cалкил)W(C-Cалкил)CO(C-Cалкил) группы; (C-Cалкил)A группы, A представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пирролидинила, пиперидинила, где указанный гетероцикл необязательно замещен группой типа OH, OMe, (C-Cалкил), необязательно замещенный группой OH, N(C-Cалкил) или CO(C-Cалкил); W представляет собой гетероатом, выбранный из NCH, O и S. Изобретение также относится к промежуточному соединению, индивидуальным соединениям. Технический результат: получены новые соединения общей формулы (I), которые способны ингибировать миостатин и стимулировать синтез белка путем фосфорилирования белка S6K1. 4 н. и 7 з.п. ф-лы, 8 ил., 7 табл., 10 пр.(I)
Формула


Документы, цитированные в отчёте о поиске
Стероидные лиганды и их применение для модуляции переключения генов

Комментарии