Нейроактивные стероиды, композиции и их использование - RU2754534C2
Код документа: RU2754534C2
Чертежи



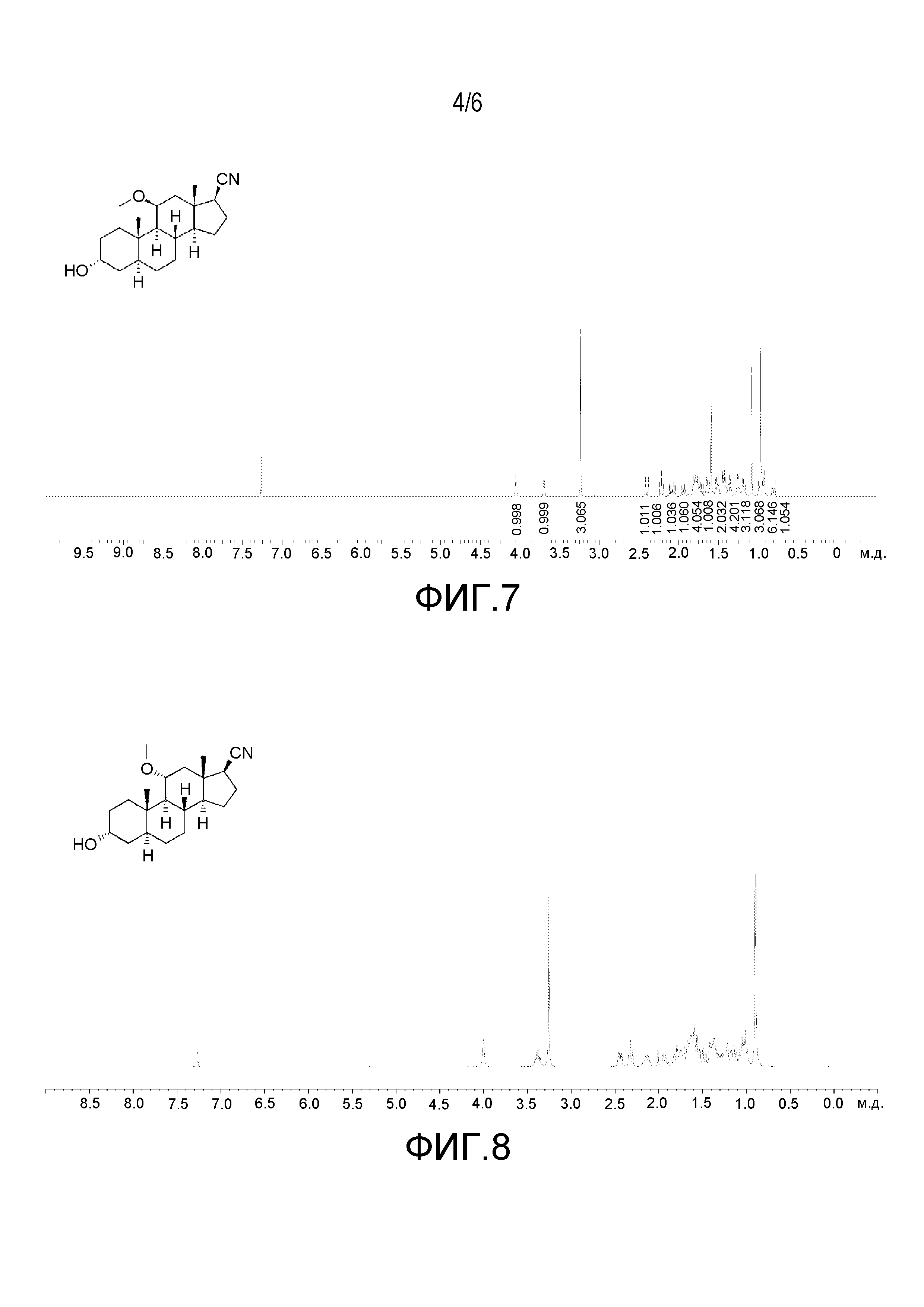


Описание
Родственные заявки
Настоящая заявка заявляет приоритет в соответствии п.35 свода законов США § 119(e), к предварительной заявке на патент США, U.S.S.N. 61/856592, поданой 19 июля 2013 года, которая включена в настоящую заявку посредством ссылки.
Предпосылки создания изобретения
Возбудимость головного мозга определяют как уровень возбуждения животного, континуум, который находится в диапазоне от комы до конвульсий и регулируется различными нейротрансмиттерами. В общем, нейротрансмиттеры отвечают за регулирование проводимости ионов через нейронные мембраны. В состоянии покоя нейронная мембрана имеет потенциал (или напряжение мембраны) примерно -70 мВ, при этом внутренняя оболочка клетки имеет отрицательный заряд по отношению к внешней оболочке. Потенциал (напряжение) является результатом ионного (K+, Na+, Cl-, органические анионы) баланса через нейронную полупроницаемую мембрану. Нейротрансмиттеры хранятся в пресинаптических везикулах и высвобождаются под влиянием нейронных потенциалов действия. При высвобождении в синаптическую щель, возбуждающий химический транмиттер, такой как ацетилхолин, будет вызывать деполяризацию мембраны (изменение потенциала от -70 мВ до -50 мВ). Этот эффект опосредован постсинаптическими никотиновыми рецепторами, которые стимулируются ацетилхолином с повышением проницаемости мембраны для ионов Na+. Пониженный мембранный потенциал стимулирует возбудимость нейронов в виде постсинаптического потенциала действия.
В случае ГАМК (гамма-аминомасляная кислота) рецепторного комплекса (ГРК), воздействие на возбудимость головного мозга опосредовано ГАМК, нейротрансмиттером. ГАМК оказывает сильное влияние на общую возбудимость головного мозга, поскольку до 40% нейронов головного мозга используют ГАМК в качестве нейротрансмиттера. ГАМК регулирует возбудимость отдельных нейронов путем регулирования проводимости хлорид-ионов через нейронную мембрану. ГАМК взаимодействует с сайтом своего распознавания на ГРК для продвижения потока хлорид-ионов по градиенту электрохимического потенциала ГРК в клетку. Внутриклеточный рост уровней этого аниона вызывает гиперполяризацию трансмембранного потенциала, делая нейрон менее чувствительным к возбуждающим стимулам (то есть, снижается возбудимость нейрона). Иными словами, чем выше концентрация хлорид-ионов в нейроне, тем ниже возбудимость головного мозга (уровень возбуждения).
Документально подтверждено, что ГРК отвечает за опосредование состояния беспокойства, судорожной активности и седативного эффекта. Таким образом, ГАМК и лекарственные средства, которые действуют подобно ГАМК или способствуют эффектам ГАМК (например, терапевтически полезные барбитураты и бензодиазепины (BZs), такие как Валиум®), обеспечивают их терапевтически полезные эффекты путем взаимодействия с определенными регуляторными сайтами в ГРК. Полученные свидетельства на данный момент указывают, что помимо сайта связывания бензодиазепинов и барбитуратов, ГРК содержит отдельный сайт для нейроактивных стероидов (Lan, N. C. et al., Neurochem. Res. 16:347-356 (1991)).
Нейроактивные стероиды могут возникать эндогенно. Самые сильные эндогенные нейроактивные стероиды представляют собой 3α-гидрокси-5-восстановленный прегнан-20-он и 3α-21-дигидрокси-5-восстановленный прегнан-20-он, метаболиты гормональных стероидов прогестерона и дезоксикортикостерона, соответственно. Способность этих стероидных метаболитов изменять возбудимость головного мозга была признана в 1986 году (Majewska, M. D. et al., Science 232:1004-1007 (1986); Harrison, N. L. et al., J Pharmacol. Exp. Ther. 241:346-353 (1987)).
Было продемонстрировано, что гормон яичников прогестерон и его метаболиты оказывают сильные эффекты на возбудимость головного мозга (Backstrom, T. et al., Acta Obstet. Gynecol. Scand. Suppl. 130:19-24 (1985); Pfaff, D.W and McEwen, B. S., Science 219:808-814 (1983); Gyermek et al., J Med Chem. 11: 117 (1968); Lambert, J. et al., Trends Pharmacol. Sci. 8:224-227 (1987)). Уровни прогестерона и его метаболитов изменяются в зависимости от фазы менструального цикла. Документально доказано, что уровни прогестерона и его метаболитов снижаются перед началом менструации. Ежемесячное повторение определенных физических симптомов перед началом менструации также было подтверждено документально. Эти симптомы, которые стали ассоциироваться с предменструальным синдромом (ПМС), включают стресс, тревожность, головные боли по типу мигрени (Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Субъекты с ПМС имеют повторяющиеся ежемесячно симптомы, которые присутствуют в предменструальном цикле и отсутствуют в постменструальном цикле.
Аналогичным образом, снижение уровня прогестерона также соотносится во времени с увеличением частоты припадков у женщин-эпилептиков, то есть, менструальной эпилепсией (Laidlaw, J., Lancet, 1235-1237 (1956)). Более прямую корреляцию наблюдали со снижением метаболитов прогестерона (Rosciszewska et al., J. Neurol. Neurosurg. Psych. 49:47-51 (1986)). Кроме того, для субъектов с первичным генерализованным малым эпилептическим припадком, периодическую частоту припадков соотносили с частотой симптомов предменструального синдрома (Backstrom, T. et al., J. Psychosom. Obstet. Gynaecol. 2:8-20 (1983)). Было определено, что стероид дезоксикортикостерон является эффективным для лечения субъектов с эпилептическими приступами, соотносящимися с их менструальными циклами (Aird, R.B. and Gordan, G., J. Amer. Med. Soc. 145:715-719 (1951)).
Синдром, также связанный с низкими уровнями прогестерона, представляет собой послеродовую депрессию (ПРД). Сразу же после родов уровни прогестерона резко снижаются, приводя к возникновению ПРД. Симптомы ПРД бывают разной степени тяжести от легкой депрессии до психоза, требующего госпитализации. ПРД также ассоциируется с тяжелыми тревожными расстройствами и раздражительностью. ПРД-ассоциированная депрессия не поддается лечению классическими антидепрессантами и женщины с ПРД наблюдается большее число случаев ПМС (Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)).
В совокупности, эти наблюдения предполагают решающую роль для прогестерона и дезоксикортикостерона и, более конкретно, их метаболитов в гомеостатическом регулировании возбудимости головного мозга, что проявляется как увеличение судорожной активности или симптомов, связанных с менструальной эпилепсией, ПМС и ПРД. Корреляция между пониженными уровнями прогестерона и симптомами, связанными с ПМС, ПРД и менструальной эпилепсией (Backstrom, T. et al., J Psychosom.Obstet. Gynaecol. 2:8-20 (1983)); Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)), подсказала возможность использования прогестерона в их лечении (Mattson et al., «Medroxyprogesterone therapy of catamenial epilepsy,» in Advances in Epileptology: XVth Epilepsy International Symposium, Raven Press, New York (1984), pp. 279-282 and Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Однако прогестерон не является неизменно эффективным при лечении вышеупомянутых синдромов. Например, не существует никакой взаимозависимости доза - ответ для прогестерона в лечении ПМС (Maddocks et al., Obstet. Gynecol. 154:573-581 (1986); Dennerstein et al., Brit. Med J 290:16-17 (1986)).
Необходимы новые и улучшенные нейроактивные стероиды, которые действуют как модулирующие средства для возбудимости головного мозга, а также как средства для профилактики и лечения заболеваний, связанных с ЦНС. Соединения, композиции и способы, описанные в настоящей заявке, напралены на эту цель.
Краткое описание изобретения
В настоящей заявке представлены 7-циано замещенные нейроактивные стероиды, включающие по меньшей мере один заместитель в одном или нескольких положениях 2, 4, и/или 11 на стероидном остове и предназначены, например, действовать в качестве модуляторов ГАМК. В некоторых вариантах осуществления, такие соединения предусматриваются как полезные в качестве терапевтических средств для индукции седативного эффекта и/или анестезии у субъекта. В некоторых вариантах осуществления, такие соединения предусматриваются как полезные в качестве терапевтических средств для лечения расстройства, связанного с ЦНС (например, расстройство сна, аффективное расстройство, расстройство шизофренического спектра, судорожный синдром, нарушение памяти и/или когнитивной способности, двигательное расстройство, расстройство личности, расстройства аутистического спектра, боль, травматическое поражение головного мозга, сосудистое заболевание, расстройства, связанные со злоупотреблением психоактивными веществами и/или абстинентный синдром отмены или шум в ушах) у субъекта, нуждающегося в этом (например, субъект с синдромом Ретта, синдромом фрагильной X-хромосомы или синдромом Эйнджелмена).
В одном аспекте, настоящее изобретение обеспечивает соединения формулы (I):

Формула (I)
где R1aпредставляет собой водород, галоген, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); R1b представляет собой H, галоген, гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rd)(Re), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); где один из R1a и R1b представляет собой водород; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; и каждый Rd и Re представляет собой водород, замещенный метил или C2-C6 алкил или Rd и Re,вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо.
Настоящее изобретение также обеспечивает фармацевтические композиции, включающие соединение по настоящему изобретению и способы использования и лечения, например, такие, как для индукции седативного эффекта и/или анестезии.
Определения
Химические определения
Определения конкретных функциональных групп и химических терминов описаны ниже более подробно. Химические элементы идентифицированы в соответствии с периодической таблицей элементов, версия CAS, Handbook of Chemistry and Physics, 75th Ed., на обороте обложки и специфические функциональные группы, как правило, определяются, как описано в этом документе. Кроме того, общие принципы органической химии, а также конкретные функциональные группы и реакционная способность описаны в Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, March’s Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of Organic Synthesis, 3Rd Edition, Cambridge University Press, Cambridge, 1987.
Соединения, описанные в настоящей заявке, могут включать один или несколько центров асимметрии и, таким образом, могут существовать в различных изомерных формах, например, в виде энантиомеров и/или диастереомеров. Например, соединения, описанные в настоящей заявке, могут быть в форме отдельного энантиомера, диастереомера или геометрического изомера или могут быть в форме смеси стереоизомеров, включая рацемические смеси и смеси, обагащенные одним или несколькими стереоизомерами. Изомеры могут быть выделены из смесей при помощи способов, известных специалисту в данной области, включая хиральную высокоэффективную жидкостную хроматографию (ВЭЖХ) и образование и кристаллизацию хиральных солей; или предпочтительные изомеры могут быть получены путем асимметричного синтеза. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972). Изобретение дополнительно охватывает соединения, описанные в настоящей заявке в виде индивидуальных изомеров по существу свободных от других изомеров и, альтернативно, в виде смесей различных изомеров.
В настоящей заявке чистое энантиомерное соединение является по существу свободным от других энантиомеров или стереоизомеров соединения (то есть, в энантиомерном избытке). Другими словами, «S» форма соединения является по существу свободной от «R» формы соединения и является, таким образом, в энантиомерном избытке «R» формы. Термин «энантиомерно чистый» или «чистый энантиомер» означает, что соединение включает более чем 75% по массе, более чем 80% по массе, более чем 85% по массе, более чем 90% по массе, более чем 91% по массе, более чем 92% по массе, более чем 93% по массе, более чем 94% по массе, более чем 95% по массе, более чем 96% по массе, более чем 97% по массе, более чем 98% по массе, более чем 98,5% по массе, более чем 99% по массе, более чем 99,2% по массе, более чем 99,5% по массе, более чем 99,6% по массе, более чем 99,7% по массе, более чем 99,8% по массе или более чем 99,9% по массе энантиомера. В некоторых вариантах осуществления, значения масс основаны на общей массе всех энантиомеров или стереоизомеров соединения.
В композициях, представленных в настоящей заявке, энантиомерно чистое соединение может присутствовать с другими активными или неактивными ингредиентами. Например, фармацевтическая композиция, включающая энантиомерно чистое R-соединение, может включать, например, около 90% эксципиента и около 10% энантиомерно чистого R-соединения. В некоторых вариантах осуществления, энантиомерно чистое R-соединение в таких композициях может, например, включать, по меньшей мере около 95% по массе R-соединения и не больше чем около 5% по массе S-соединения, от общей массы соединения. Например, фармацевтическая композиция, включающая энантиомерно чистое S-соединение, может включать, например, около 90% эксципиента и около 10% энантиомерно чистого S-соединения. В некоторых вариантах осуществления, энантиомерно чистое S-соединение в таких композициях может, например, включать, по меньшей мере около 95% по массе S-соединения и не больше чем около 5% по массе R-соединения, от общей массы соединения. В некоторых вариантах осуществления, активный ингредиент может быть сформулирован с небольшим количеством или без эксципиента или носителя.
Соединения, описанные в настоящей заявке, также могут включать одно или несколько изотопных замещений. Например, H может быть в любой изотопной форме, включая1H,2H (D или дейтерий) и3H (T или тритий); C может быть в любой изотопной форме, включая12C,13C и14C; O может быть в любой изотопной форме, включая16O и18O; и подобные.
Когда указан диапазон значений, это предназначено для того, чтобы охватить каждое значение и поддиапазон в этом диапазоне. Например, «C1-6 алкил» предназначен для охвата C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и C5-6 алкила.
Следующие термины предполагаются как имеющие значения, представленные ниже и являются полезными для понимания описания и предполагаемого объема настоящего изобретения. При описании изобретения, которое может включать соединения, фармацевтические композиции, содержащие такие соединения и способы применения таких соединений и композиций, следующие термины, если они присутствуют, имеют следующие значения, если не указано иное. Следует также понимать, что, когда описанные в настоящей заявке любые из групп, определенных ниже, могут быть замещены различными заместителями, то соответствующие определения предназначены для включения таких замещенных групп в пределах их объема, как описано ниже. Если не указано иное, термин «замещенный» должен определяться, как описано ниже. Следует также понимать, что термины «группы» и «радикалы» можно считать взаимозаменяемыми при использовании в настоящей заявке. Артикли «a» и «an» могут быть использованы в настоящей заявке для обозначения одного или более чем одного (т.е., по меньшей мере одного) из грамматических объектов этого артикля. В качестве примера, «аналог» (определяемый неопределенным артиклем «an») означает один аналог или более чем один аналог.
«Алкил» относится к радикалу насыщенной углеводородной группы с прямой или разветвленной цепью, содержащей от 1 до 20 атомов углерода («C1-20 алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит от 1 до 12 атомов углерода («C1-12 алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит от 1 до 8 атомов углерода («C1-8 алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит от 1 до 6 атомов углерода («C1-6 алкил», также называемый в настоящей заявке как «низший алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит от 1 до 5 атомов углерода («C1-5 алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит от 1 до 4 атомов углерода («C1-4 алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит от 1 до 3 атомов углерода («C1-3 алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит от 1 до 2 атомов углерода («C1-2 алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит 1 атом углерода («C1 алкил»). В некоторых вариантах осуществления настоящего изобретения алкильная группа содержит от 2 до 6 атомов углерода («C2-6алкил»). Примеры C1-6 алкильных групп включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изо-бутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (C6). Дополнительные примеры алкильных групп включают н-гептил (C7), н-октил (C8) и подобные. Если не указано иное, в каждом случае алкильная группа независимо является необязательно замещенной, то есть, незамещенной («незамещенный алкил») или замещенной («замещенный алкил») одним или несколькими заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления, алкильная группа представляет собой незамещенный C1-10 алкил (например, -CH3). В некоторых вариантах осуществления, алкильная группа представляет собой замещенный C1-10 алкил. Общепринятые алкильные аббревиатуры включают Me (-CH3), Et (-CH2CH3), iPr (-CH(CH3)2), nPr (-CH2CH2CH3), n-Bu (-CH2CH2CH2CH3) или i-Bu (-CH2CH(CH3)2).
В контексте настоящей заявки, «алкилен», «алкенилен» и «алкинилен» относятся к двухвалентному радикалу алкильной, алкенильной и алкинильной группы, соответственно. Когда представлен диапазон или число углеродных атомов для конкретной «алкиленовой», «алкениленовой» и «алкиниленовой» группы, следует понимать, что диапазон или количество относится к диапазону или количеству углеродных атомов в линейной углеродной двухвалентной цепи. «Алкиленовые», «алкениленовые» и «алкиниленовые» группы могут быть незамещенными или замещенными одним или несколькими заместителями, описанными в настоящей заявке.
«Алкилен» относится к алкильной группе, где два атома водорода удалены с получением двухвалентного радикала и которая может быть замещенной или незамещенной. Незамещенные алкиленовые группы включают, но не ограничиваются этим, метилен (-CH2-), этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), бутилен (-CH2CH2CH2CH2-), пентилен (-CH2CH2CH2CH2CH2-), гексилен (-CH2CH2CH2CH2CH2CH2-) и подобные. Типичные замещенные алкиленовые группы, например, замещенные одной или несколькими алкильными (метильными) группами, включают, но не ограничиваются этим, замещенный метилен (-CH(CH3)-, (-C(CH3)2-), замещенный этилен (-CH(CH3)CH2-, -CH2CH(CH3)-, -C(CH3)2CH2-,-CH2C(CH3)2-), замещенный пропилен (-CH(CH3)CH2CH2-, -CH2CH(CH3)CH2-, -CH2CH2CH(CH3)-, -C(CH3)2CH2CH2-, -CH2C(CH3)2CH2-, -CH2CH2C(CH3)2-) и подобные.
«Алкенил» относится к радикалу углеводородной группы с прямой или разветвленной цепью, содержащей от 2 до 20 атомов углерода, одну или несколько двойных связей углерод-углерод и не содержит тройных связей («C2-20 алкенил»). В некоторых вариантах осуществления настоящего изобретения алкенильная группа содержит от 2 до 10 атомов углерода («C2-10 алкенил»). В некоторых вариантах осуществления настоящего изобретения алкенильная группа содержит от 2 до 8 атомов углерода («C2-8 алкенил»). В некоторых вариантах осуществления настоящего изобретения алкенильная группа содержит от 2 до 6 атомов углерода («C2-6 алкенил»). В некоторых вариантах осуществления настоящего изобретения алкенильная группа содержит от 2 до 5 атомов углерода («C2-5 алкенил»). В некоторых вариантах осуществления настоящего изобретения алкенильная группа содержит от 2 до 4 атомов углерода («C2-4 алкенил»). В некоторых вариантах осуществления настоящего изобретения алкенильная группа содержит от 2 до 3 атомов углерода («C2-3 алкенил»). В некоторых вариантах осуществления настоящего изобретения алкенильная группа содержит 2 атома углерода («C2алкенил»). Одна или несколько двойных связей углерод-углерод могут быть внутренними (такими, как в 2-бутениле) или концевыми (такими, как в 1-бутениле). Примеры C2-4 алкенильных групп включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4) и подобные. Примеры C2-6 алкенильных групп включают указанные выше C2-4 алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6) и подобные. Дополнительные примеры алкенила включают гептенил (C7), октенил (C8), октатриенил (C8) и подобные. Если не указано иное, в каждом случае алкенильная группа независимо является необязательно замещенной, то есть, незамещенной («незамещенный алкенил») или замещенной («замещенный алкенил») одним или несколькими заместителями, например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления, алкенильная группа представляет собой незамещенный C2-10 алкенил. В некоторых вариантах осуществления, алкенильная группа представляет собой замещенный C2-10 алкенил.
«Алкенилен» относится к алкенильной группе, где два атома водорода удалены с получением двухвалентного радикала и которая может быть замещенной или незамещенной. Типичные незамещенные двухвалентные алкениленовые группы включают, но не ограничиваются этим, этенилен (-CH=CH-) и пропенилен (например, -CH=CHCH2-, -CH2-CH=CH-). Типичные замещенные алкениленовые группы, например, замещенные одной или несколькими алкильными (метильными) группами, включают, но не ограничиваются этим, замещенный этилен (-C(CH3)=CH-, -CH=C(CH3)-), замещенный пропилен (например, -C(CH3)=CHCH2-, -CH=C(CH3)CH2-, -CH=CHCH(CH3)-, -CH=CHC(CH3)2-, -CH(CH3)-CH=CH-,-C(CH3)2-CH=CH-, -CH2-C(CH3)=CH-, -CH2-CH=C(CH3)-) и подобные.
«Алкинил» относится к радикалу углеводородной группы с прямой или разветвленной цепью, содержащей от 2 до 20 атомов углерода, одну или несколько тройных связей углерод-углерод и необязательно одну или несколько двойных связей углерод-углерод («C2-20 алкинил»). В некоторых вариантах осуществления настоящего изобретения алкинильная группа содержит от 2 до 10 атомов углерода («C2-10 алкинил»). В некоторых вариантах осуществления настоящего изобретения алкинильная группа содержит от 2 до 8 атомов углерода («C2-8 алкинил»). В некоторых вариантах осуществления настоящего изобретения алкинильная группа содержит от 2 до 6 атомов углерода («C2-6 алкинил»). В некоторых вариантах осуществления настоящего изобретения алкинильная группа содержит от 2 до 5 атомов углерода («C2-5 алкинил»). В некоторых вариантах осуществления настоящего изобретения алкинильная группа содержит от 2 до 4 атомов углерода («C2-4 алкинил»). В некоторых вариантах осуществления настоящего изобретения алкинильная группа содержит от 2 до 3 атомов углерода («C2-3 алкинил»). В некоторых вариантах осуществления настоящего изобретения алкинильная группа содержит 2 атома углерода («C2 алкинил»). Одна или несколько тройных связей углерод-углерод могут быть внутренними (такими, как в 2-бутиниле) или концевыми (такими, как в 1-бутиниле). Примеры C2-4 алкинильных групп включают, без ограничения, этинил (C2), 1-пропинил (C3), 2-пропинил (C3), 1-бутинил (C4), 2-бутинил (C4) и подобные. Примеры C2-6 алкенильных групп включают указанные выше C2-4 алкинильные группы, а также пентинил (C5), гексинил (C6) и подобные. Дополнительные примеры алкинила включают гептинил (C7), октинил (C8) и подобные. Если не указано иное, в каждом случае алкинильная группа независимо является необязательно замещенной, то есть, незамещенной («незамещенный алкинил») или замещенной («замещенный алкинил») одним или несколькими заместителями; например, 1-5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых вариантах осуществления, алкинильная группа представляет собой незамещенный C2-10 алкинил. В некоторых вариантах осуществления, алкинильная группа представляет собой замещенный C2-10алкинил. «
«Алкинилен» относится к линейной алкинильной группе, где два атома водорода удалены с получением двухвалентного радикала и которая может быть замещенной или незамещенной. Типичные двухвалентные алкиниленовые группы включают, но не ограничиваются этим, замещенный или незамещенный этинилен, замещенный или незамещенный пропинилен и подобные.
Термин «гетероалкил», в контексте настоящей заявки, относится к алкильной группе, определенной в настоящей заявке, которая дополнительно включает 1 или несколько (например, 1, 2, 3 или 4) гетероатомов (например, кислород, сера, азот, бор, кремний, фосфор) в исходной цепи, где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи, и/или один или несколько гетероатомов встроены между атомом углерода и родительской молекулой, то есть, между точкой присоединения. В некоторых вариантах осуществления, гетероалкильная группа относится к насыщенной группе, содержащей от 1 до 10 атомов углерода и 1, 2, 3 или 4 гетероатома («гетероC1-10 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 9 атомов углерода и 1, 2, 3 или 4 гетероатома («гетероC1-9 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 8 атомов углерода и 1, 2, 3 или 4 гетероатома («гетероC1-8 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 7 атомов углерода и 1, 2, 3 или 4 гетероатома («гетероC1-7 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой группу, содержащую от 1 до 6 атомов углерода и 1, 2 или 3 гетероатома («гетероC1-6 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 5 атомов углерода и 1 или 2 гетероатома («гетероC1-5 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 4 атомов углерода и 1 или 2 гетероатома («гетероC1-4 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 3 атомов углерода и 1 гетероатом («гетероC1-3 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую от 1 до 2 атомов углерода и 1 гетероатом («гетероC1-2 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую 1 атом углерода и 1 гетероатом («гетероC1 алкил»). В некоторых вариантах осуществления настоящего изобретения гетероалкильная группа представляет собой насыщенную группу, содержащую от 2 до 6 атомов углерода и 1 или 2 гетероатома («гетероC2-6алкил»). Если не указано иное, в каждом случае гетероалкильная группа независимо является незамещенной («незамещенный гетероалкил») или замещенной («замещенный гетероалкил») одним или несколькими заместителями. В некоторых вариантах осуществления, гетероалкильная группа представляет собой незамещенный гетероC1-10 алкил. В некоторых вариантах осуществления, гетероалкильная группа представляет собой замещенный гетероC1-10 алкил.
Термин «гетероалкенил», в контексте настоящей заявки, относится к алкенильной группе, определенной в настоящей заявке, которая дополнительно включает один или несколько (например, 1, 2, 3 или 4) гетероатомов (например, кислород, сера, азот, бор, кремний, фосфор), где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи, и/или один или несколько гетероатомов встроены между атомом углерода и родительской молекулой, то есть, между точкой присоединения. В некоторых вариантах осуществления, гетероалкенильная группа относится к группе, содержащей от 2 до 10 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома («гетероC2-10 алкенил»). В некоторых вариантах осуществления настоящего изобретения гетероалкенильная группа содержит от 2 до 9 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома («гетероC2-9 алкенил»). В некоторых вариантах осуществления настоящего изобретения гетероалкенильная группа содержит от 2 до 8 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома («гетероC2-8 алкенил»). В некоторых вариантах осуществления настоящего изобретения гетероалкенильная группа содержит от 2 до 7 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома («гетероC2-7 алкенил»). В некоторых вариантах осуществления настоящего изобретения гетероалкенильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну двойную связь и 1, 2 или 3 гетероатомов («гетероC2-6 алкенил»). В некоторых вариантах осуществления настоящего изобретения гетероалкенильная группа содержит от 2 до 5 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома («гетероC2-5 алкенил»). В некоторых вариантах осуществления настоящего изобретения гетероалкенильная группа содержит от 2 до 4 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома («гетероC2-4 алкенил»). В некоторых вариантах осуществления настоящего изобретения гетероалкенильная группа содержит от 2 до 3 атомов углерода, по меньшей мере одну двойную связь и 1 гетероатом («гетероC2-3 алкенил»). В некоторых вариантах осуществления настоящего изобретения гетероалкенильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома («гетероC2-6алкенил»). Если не указано иное, в каждом случае гетероалкенильная группа независимо является незамещенной («незамещенный гетероалкенил») или замещенной («замещенный гетероалкенил») одним или несколькими заместителями. В некоторых вариантах осуществления, гетероалкенильная группа представляет собой незамещенный гетероC2-10 алкенил. В некоторых вариантах осуществления, гетероалкенильная группа представляет собой замещенный гетероC2-10 алкенил.
Термин «гетероалкинил», в контексте настоящей заявки, относится к алкинильной группе, определенной в настоящей заявке, которая дополнительно включает один или несколько (например, 1, 2, 3 или 4) гетероатомов (например, кислород, сера, азот, бор, кремний, фосфор), где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи, и/или один или несколько гетероатомов встроены между атомом углерода и родительской молекулой, то есть, между точкой присоединения. В некоторых вариантах осуществления, гетероалкинильная группа относится к группе, содержащей от 2 до 10 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома («гетероC2-10 алкинил»). В некоторых вариантах осуществления настоящего изобретения гетероалкинильная группа содержит от 2 до 9 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома («гетероC2-9 алкинил»). В некоторых вариантах осуществления настоящего изобретения гетероалкинильная группа содержит от 2 до 8 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома («гетероC2-8 алкинил»). В некоторых вариантах осуществления настоящего изобретения гетероалкинильная группа содержит от 2 до 7 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома («гетероC2-7 алкинил»). В некоторых вариантах осуществления настоящего изобретения гетероалкинильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну тройную связь и 1, 2 или 3 гетероатома («гетероC2-6 алкинил»). В некоторых вариантах осуществления настоящего изобретения гетероалкинильная группа содержит от 2 до 5 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома («гетероC2-5 алкинил»). В некоторых вариантах осуществления настоящего изобретения гетероалкинильная группа содержит от 2 до 4 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома («гетероC2-4 алкинил»). В некоторых вариантах осуществления настоящего изобретения гетероалкинильная группа содержит от 2 до 3 атомов углерода, по меньшей мере одну тройную связь и 1 гетероатом («гетероC2-3 алкинил»). В некоторых вариантах осуществления настоящего изобретения гетероалкинильная группа содержит от 2 до 6 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома («гетероC2-6алкинил»). Если не указано иное, в каждом случае гетероалкинильная группа независимо является незамещенной («незамещенный гетероалкинил») или замещенной («замещенный гетероалкинил») одним или несколькими заместителями. В некоторых вариантах осуществления, гетероалкинильная группа представляет собой незамещенный гетероC2-10 алкинил. В некоторых вариантах осуществления, гетероалкинильная группа представляет собой замещенный гетероC2-10 алкинил.
В контексте настоящей заявки, «алкилен», «алкенилен», «алкинилен», «гетероалкилен», «гетероалкенилен» и «гетероалкинилен» относятся к двухвалентному радикалу алкильной, алкенильной, алкинильной группы, гетероалкильной, гетероалкенильной и гетероалкинильной группы, соответственно. Когда диапазон или число углеродных атомов представлены для конкретной «алкиленовой», «алкениленовой», «алкиниленовой», «гетероалкиленовой», «гетероалкениленовой» или «гетероалкиниленовой» группы, следует понимать, что диапазон или количество относится к диапазону или количеству углеродных атомов в линейной углеродной двухвалентной цепи. «Алкиленовые», «алкениленовые», «алкиниленовые», «гетероалкиленовые», «гетероалкениленовые» и «гетероалкиниленовые» группы могут быть незамещенными или замещенными одним или несколькими заместителями, описанными в настоящей заявке.
«Арил» относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) 4n+2 ароматической кольцевой системы (например, содержащей 6, 10 или 14 π электронов, распределенных в циклическом порядке), содержащей 6-14 кольцевых атомов углерода и ноль гетероатомов, предусмотенных в ароматической кольцевой системе («C6-14 арил»). В некоторых вариантах осуществления настоящего изобретения арильная группа содержит шесть кольцевых атомов углерода («C6арил»; например, фенил). В некоторых вариантах осуществления настоящего изобретения арильная группа содержит десять кольцевых атомов углерода («C10арил»; например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых вариантах осуществления настоящего изобретения арильная группа содержит четырнадцать кольцевых атомов углерода («C14арил»; например, антрацил). «Арил» также включает кольцевые системы, где арильное кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклильными или гетероциклильными группами, где радикал или точка присоединения находятся на арильном кольце и в таких случаях число атомов углерода продолжает обозначать число атомов углерода в арильной кольцевой системе. Типичные арильные группы включают, но не ограничиваются этим, группы, образованные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флурена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеиадена, пирена, пирантрена, рубицена, трифенилена и тринафталина. В частности, арильные группы включают фенил, нафтил, инденил и тетрагидронафтил. Если не указано иное, в каждом случае арильная группа независимо является необязательно замещенной, то есть, незамещенной («незамещенный арил») или замещенной («замещенный арил») одним или несколькими заместителями. В некоторых вариантах осуществления, арильная группа представляет собой незамещенный C6-14 арил. В некоторых вариантах осуществления, арильная группа представляет собой замещенный C6-14 арил.
В некоторых вариантах осуществления, арильная группа замещена одной или несколькими группами, выбранными из галогена, C1-C8 алкила, C1-C8 галогеналкила, циано, гидрокси, C1-C8 алкокси и амино.
Примеры репрезентативных замещенных арилов включают следующие

где один из R56 и R57 может представлять собой водород и по меньшей мере один из R56 и R57, каждый независимо, выбран из C1-C8 алкила, C1-C8 галогеналкила, 4-10-членного гетероциклила, алканоила, C1-C8 алкокси, гетероарилокси, алкиламино, ариламино, гетероариламино, NR58COR59, NR58SOR59NR58SO2R59, COOалкила, COOарила, CONR58R59, CONR58OR59, NR58R59, SO2NR58R59, S-алкила, SOалкила, SO2алкила, Sарила, SOарила, SO2арила; или R56 и R57могут быть объединены с образованием циклического кольца (насыщенного или ненасыщенного), состоящего из 5-8 атомов, необязательно содержащего один или несколько гетероатомов, выбранных из группы N, O или S. R60 и R61 независимо представляют собой водород, C1-C8 алкил, C1-C4 галогеналкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, замещенный C6-C10 арил, 5-10-членный гетероарил или замещенный 5-10-членный гетероарил.
Другие репрезентативные арильные группы, содержащие конденсированную гетероциклильную группу, включают следующие:

где каждый W выбран из C(R66)2, NR66, O и S; и каждый Y выбран из карбонила, NR66, O и S; и R66 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил и 5-10-членный гетероарил
«Конденсированный арил» относится к арилу, содержащему два из его кольцевых атомов углерода, общих со вторым арильным или гетероарильным кольцом или с карбоциклильным или гетероциклильным кольцом.
«Аралкил» представляет собой подгруппу алкила и арила, определенных в настоящей заявке и относится к необязательно замещенной алкильной группе, которая замещена необязательно замещенной арильной группой.
«Гетероарил» относится к радикалу 5-10-членной моноциклической или бициклической 4n+2 ароматической кольцевой системы (например, содержащей 6 или 10 π электронов, распределенных в циклическом порядке), содержащей кольцевые атомы углерода и 1-4 кольцевых гетероатома, предусмотенных в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-10-членный гетероарил»). В гетероарильных группах, которые содержат один или несколько атомов азота, точкой присоединения может быть атом углерода или азота, как позволяет валентность. Гетероарильные бициклические кольцевые системы могут включать один или несколько гетероатомов в одном или обоих кольцах. «Гетероарил» включает кольцевые системы, где гетероарильное кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклильными или гетероциклильными группами, где точка присоединения находится на гетероарильном кольце и в таких случаях число кольцевых атомов продолжает обозначать число кольцевых атомов в гетероарильной кольцевой системе.«Гетероарил» также включает кольцевые системы, где гетероарильное кольцо, определенное выше, является конденсированным с одной или несколькими арильными группами, где точка присоединения находится либо на арильном, либо гетероарильном кольце и в таких случаях, число кольцевых атомов обозначает число кольцевых атомов в конденсированной (арил/гетероарил) кольцевой системе.Вбициклических гетероарильных группах, где одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил и подобные), точка присоединения может быть на любом кольце, то есть, либо на кольце, содержащем гетероатом (например, 2-индолил), либо на кольце, которое не содержит гетероатом (например, 5-индолил).
В некоторых вариантах осуществления настоящего изобретения гетероарильная группа представляет собой 5-10-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-10-членный гетероарил»). В некоторых вариантах осуществления настоящего изобретения гетероарильная группа представляет собой 5-8-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-8-членный гетероарил»). В некоторых вариантах осуществления настоящего изобретения гетероарильная группа представляет собой 5-6-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-6-членный гетероарил»). В некоторых вариантах осуществления настоящего изобретения 5-6-членный гетероарил содержит 1-3 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления настоящего изобретения 5-6-членный гетероарил содержит 1-2 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления настоящего изобретения 5-6-членный гетероарил содержит 1 кольцевой гетероатом, выбранный из азота, кислорода и серы. Если не указано иное, в каждом случае гетероарильная группа независимо является необязательно замещенной, то есть, незамещенной («незамещенный гетероарил») или замещенной («замещенный гетероарил») одним или несколькими заместителями. В некоторых вариантах осуществления, гетероарильная группа представляет собой незамещенный 5-14-членный гетероарил. В некоторых вариантах осуществления, гетероарильная группа представляет собой замещенный 5-14-членный гетероарил.
Иллюстративные 5-членные гетероарильные группы, содержащие один гетероатом, включают, без ограничения, пирролил, фуранил и тиофенил. Иллюстративные 5-членные гетероарильные группы, содержащие два гетероатома, включают, без ограничения, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил.Иллюстративные 5-членные гетероарильные группы, содержащие три гетероатома, включают, без ограничения, триазолил, оксадиазолил и тиадиазолил. Типичные 5-членные гетероарильные группы, содержащие четыре гетероатома, включают, без ограничения, тетразолил.Иллюстративные 6-членные гетероарильные группы, содержащие один гетероатом, включают, без ограничения, пиридинил. Иллюстративные 6-членные гетероарильные группы, содержащие два гетероатома, включают, без ограничения, пиридазинил, пиримидинил и пиразинил. Иллюстративные 6-членные гетероарильные группы, содержащие три или четыре гетероатома, включают, без ограничения, триазинил и тетразинил, соответственно. Иллюстративные 7-членные гетероарильные группы, содержащие один гетероатом, включают, без ограничения, азепинил, оксепинил и тиепинил. Иллюстративные 5,6-бициклические гетероарильные группы включают, без ограничения, индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Иллюстративные 6,6-бициклические гетероарильные группы включают, без ограничения, нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
Примеры репрезентативных гетероарилов включают следующие формулы:

где каждый Y выбран из карбонила, N, NR65, O и S; и R65 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил и 5-10-членный гетероарил.
«Гетероаралкил» представляет собой подгруппу алкила и гетероарила, определенных в настоящей заявке и относится к необязательно замещенной алкильной группе, которая замещена необязательно замещенной гетероарильной группой.
«Карбоциклил» или «карбоциклический» относится к радикалу не-ароматической циклической углеводородной группы, содержащей от 3 до 10 кольцевых атомов углерода («C3-10 карбоциклил») и ноль гетероатомов в не-ароматической кольцевой системе. В некоторых вариантах осуществления настоящего изобретения карбоциклильная группа содержит от 3 до 8 кольцевых атомов углерода («C3-8 карбоциклил»). В некоторых вариантах осуществления настоящего изобретения карбоциклильная группа содержит от 3 до 6 кольцевых атомов углерода («C3-6 карбоциклил»). В некоторых вариантах осуществления настоящего изобретения карбоциклильная группа содержит от 3 до 6 кольцевых атомов углерода («C3-6 карбоциклил»). В некоторых вариантах осуществления настоящего изобретения карбоциклильная группа содержит от 5 до 10 кольцевых атомов углерода («C5-10 карбоциклил»). Иллюстративные C3-6 карбоциклильные группы включают, без ограничения, циклопропил (C3), циклопропенил (C3), циклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и подобные. Иллюстративные C3-8 карбоциклильные группы включают, без ограничения, указанные выше C3-6 карбоциклильные группы, а также циклогептил (C7), циклогептенил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), циклооктенил (C8), бицикло[2.2.1]гептанил (C7), бицикло[2.2.2]октанил (C8) и подобные. Иллюстративные C3-10 карбоциклильные группы включают, без ограничения, указанные выше C3-8 карбоциклильные группы, а также циклононил (C9), циклононенил (C9), циклодецил (C10), циклодеценил (C10), октагидро-1H-инденил (C9), декагидронафталинил (C10), спиро[4.5]деканил (C10) и подобные. Как проиллюстрируют вышеуказанные примеры, в некоторых вариантах осуществления карбоциклильная группа является либо моноциклической («моноциклический карбоциклил»), либо содержит конденсированную, связанную мостиковой связью или спиро-кольцевую систему, такую как бициклическая система («бициклический карбоциклил») и может быть насыщенной или может быть частично ненасыщенной. «Карбоциклил» также включает кольцевые системы, где карбоциклильное кольцо, определенное выше, является конденсированным с одной или несколькими арильными или гетероарильными группами, где точка присоединения находится на карбоциклильном кольце и в таких случаях число атомов углерода продолжает обозначать число атомов углерода в карбоциклической кольцевой системе. Если не указано иное, в каждом случае карбоциклильная группа независимо является необязательно замещенной, то есть, незамещенной («незамещенный карбоциклил») или замещенной («замещенный карбоциклил») одним или несколькими заместителями. В некоторых вариантах осуществления, карбоциклильная группа представляет собой незамещенный C3-10 карбоциклил. В некоторых вариантах осуществления, карбоциклильная группа представляет собой замещенный C3-10 карбоциклил.
«Гетероциклил» или «гетероциклический» относится к радикалу 3-10-членной не-ароматической кольцевой системы, содержащей кольцевые атомов углерода и от 1 до 4 кольцевых гетероатомов, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния («3-10-членный гетероциклил»). В гетероциклильных группах, которые содержат один или несколько атомов азота, точкой присоединения может быть атом углерода или азота, как позволяет валентность. Гетероциклильная группа может быть либо моноциклической («моноциклический гетероциклил»), либо может представлять собой конденсированную, связанную мостиковой связью или спиро-кольцевую систему, такую как бициклическая система («бициклический гетероциклил») и может быть насыщенной или может быть частично ненасыщенной. Гетероциклильные бициклические кольцевые системы могут включать один или несколько гетероатомов в одном или обоих кольцах. «Гетероциклил» также включает кольцевые системы, где гетероциклильное кольцо, определенное выше, является конденсированным с одной или несколькими карбоциклильными группами, где точка присоединения находится либо на карбоциклильном, либо гетероциклильном кольце, или кольцевые системы, где гетероциклильное кольцо, определенное выше, является конденсированным с одной или несколькими арильными или гетероарильными группами, где точка присоединения находится на гетероциклильном кольце и в таких случаях число кольцевых атомов продолжает обозначать число кольцевых атомов в гетероциклильной кольцевой системе. Если не указано иное, в каждом случае гетероциклил независимо является необязательно замещенным, то есть, незамещенным («незамещенный гетероциклил») или замещенным («замещенный гетероциклил») одним или несколькими заместителями. В некоторых вариантах осуществления, гетероциклильная группа представляет собой незамещенный 3-10-членный гетероциклил. В некоторых вариантах осуществления, гетероциклильная группа представляет собой замещенный 3-10-членный гетероциклил.
В некоторых вариантах осуществления настоящего изобретения гетероциклильная группа представляет собой 5-10-членную не-ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния («5-10-членный гетероциклил»). В некоторых вариантах осуществления настоящего изобретения гетероциклильная группа представляет собой 5-8-членную не-ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-8-членный гетероциклил»). В некоторых вариантах осуществления настоящего изобретения гетероциклильная группа представляет собой 5-6-членную не-ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, где каждый гетероатом независимо выбран из азота, кислорода и серы («5-6-членный гетероциклил»). В некоторых вариантах осуществления настоящего изобретения 5-6-членный гетероциклил содержит 1-3 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления настоящего изобретения 5-6-членный гетероциклил содержит 1-2 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления настоящего изобретения 5-6-членный гетероциклил содержит один кольцевой гетероатом, выбранный из азота, кислорода и серы.
Иллюстративные 3-членные гетероциклильные группы, содержащие один гетероатом, включают, без ограничения, азиридинил, оксиранил, тиоренил. Иллюстративные 4-членные гетероциклильные группы, содержащие один гетероатом, включают, без ограничения, азетидинил, оксетанил и тиетанил. Иллюстративные 5-членные гетероциклильные группы, содержащие один гетероатом, включают, без ограничения, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Иллюстративные 5-членные гетероциклильные группы, содержащие два гетероатома, включают, без ограничения, диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Иллюстративные 5-членные гетероциклильные группы, содержащие три гетероатома, включают, без ограничения, триазолинил, оксадиазолинил и тиадиазолинил. Иллюстративные 6-членные гетероциклильные группы, содержащие один гетероатом, включают, без ограничения, пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Иллюстративные 6-членные гетероциклильные группы, содержащие два гетероатома, включают, без ограничения, пиперазинил, морфолинил, дитианил, диоксанил. Иллюстративные 6-членные гетероциклильные группы, содержащие два гетероатома, включают, без ограничения, триазинанил. Иллюстративные 7-членные гетероциклильные группы, содержащие один гетероатом, включают, без ограничения, азепанил, оксепанил и тиепанил. Иллюстративные 8-членные гетероциклильные группы, содержащие один гетероатом, включают, без ограничения, азоцанил, оксецанил и тиоцанил. Иллюстративные 5-членные гетероциклильные группы, конденсированные с C6 арильным кольцом (также называемые в настоящей заявке как 5,6-бициклическое гетероциклическое кольцо), включают, без ограничения, индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и подобные. Типичные 6-членные гетероциклильные группы, конденсированные с арильным кольцом (также называемые в настоящей заявке как 6,6-бициклическое гетероциклическое кольцо), включают, без ограничения, тетрагидрохинолинил, тетрагидроизохинолинил и подобные.
Конкретные примеры гетероциклильных групп представлены в следующих иллюстративных примерах:

где каждый W выбран из CR67, C(R67)2, NR67, O и S; и каждый Y выбран из NR67, O и S; и R67 независимо представляет собой водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, 5-10-членный гетероарил. Эти гетероциклильные кольца могут быть необязательно замещены одной или несколькими группами, выбранными из группы, включающей ацил, ациламино, ацилокси, алкокси, алкоксикарбонил, алкоксикарбониламино, амино, замещенный амино, аминокарбонил (карбамоил или амидо), аминокарбониламино, аминосульфонил, сульфониламино, арил, арилокси, азидо, карбоксил, циано, циклоалкил, галоген, гидрокси, кето, нитро, тиол, -S-алкил, -S-арил, -S(O)-алкил,-S(O)-арил, -S(O)2-алкил и -S(O)2-арил. Замещающие группы включают карбонил или тиокарбонил, которые обеспечивают, например, лактамные и мочевинные производные.
«Гетеро», когда используется для описания соединения или группы, присутствующей в соединении, означает, что один или несколько атомов углерода в соединении или группе были заменены гетероатомом азота, кислорода или серы. Гетеро может относиться к любой из углеводородных групп, описанных выше, таким как алкил, например, гетероалкил, циклоалкил, например, гетероциклил, арил, например, гетероарил, циклоалкенил, например, циклогетероалкенил и подобные, содержащим от 1 до 5 и, в частности, от 1 до 3 гетероатомов.
«Ацил» относится к радикалу -C(O)R20, где R20 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящей заявке. «Алканоил» представляет собой ацильную группу, где R20 представляет собой группу, отличную от водорода. Репрезентативные ацильные группы включают, но не ограничиваются этим, формил (-CHO), ацетил (-C(=O)CH3), циклогексилкарбонил, циклогексилметилкарбонил, бензоил (-C(=O)Ph), бензилкарбонил (-C(=O)CH2Ph), --C(O)-C1-C8 алкил, -C(O)-(CH2)t(C6-C10 арил), -C(O)-(CH2)t(5-10-членный гетероарил), -C(O)-(CH2)t(C3-C10 циклоалкил) и -C(O)-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4. В некоторых вариантах осуществления, R21 представляет собой C1-C8 алкил, замещенный галогеном или гидрокси; или C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
«Ациламино» относится к радикалу -NR22C(O)R23, где каждый из R22 и R23 в каждом случае независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящей заявке, или R22 представляет собой амино-защитную группу. Иллюстративные «ациламино» группы включают, но не ограничиваются этим, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметил-карбониламино, бензоиламино и бензилкарбониламино. Конкретные иллюстративные «ациламино» группы представляют собой -NR24C(O)-C1-C8 алкил, -NR24C(O)-(CH2)t(C6-C10 арил), -NR24C(O)-(CH2)t(5-10-членный гетероарил), -NR24C(O)-(CH2)t(C3-C10 циклоалкил) и -NR24C(O)-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4 и каждый R24 независимо представляет собой H или C1-C8 алкил. В некоторых вариантах осуществления, R25 представляет собой H, C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; и R26 представляет собой H, C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидроксилом; при условии, что по меньшей мере один из R25 и R26 отличен от H.
«Ацилокси» относится к радикалу -OC(O)R27, где R27 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящей заявке. Репрезентативные примеры включают, но не ограничиваются этим, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил и бензилкарбонил. В некоторых вариантах осуществления, R28 представляет собой C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
«Алкокси» относится к группе -OR29, где R29 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Конкретные алкокси группы представляют собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Конкретные алкокси группы представляют собой низший алкокси, то есть, содержащие от 1 до 6 атомов углерода. Дополнительные конкретные алкокси группы содержат от 1 до 4 атомов углерода.
В некоторых вариантах осуществления, R29 представляет собой группу, которая содержит 1 или несколько заместителей, например от 1 до 5 заместителей и конкретно от 1 до 3 заместителей, в частности, 1 заместитель, выбранный из группы, включающей амино, замещенный амино, C6-C10 арил, арилокси, карбоксил, циано, C3-C10 циклоалкил, 4-10-членный гетероциклил, галоген, 5-10-членный гетероарил, гидроксил, нитро, тиоалкокси, тиоарилокси, тиол, алкил-S(O)-, арил-S(O)-, алкил-S(O)2- и арил-S(O)2-. Типичные группы ‘замещенный алкокси’ включают, но не ограничиваются этим, -O-(CH2)t(C6-C10 арил), -O-(CH2)t(5-10-членный гетероарил), -O-(CH2)t(C3-C10 циклоалкил) и -O-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4 и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы, сами по себе могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Конкретные иллюстративные группы ‘замещенный алкокси’ представляют собой -OCF3, -OCH2CF3, -OCH2Ph, -OCH2-циклопропил, -OCH2CH2OH и -OCH2CH2NMe2.
«Амино» относится к радикалу -NH2.
«Замещенный амино» относится к амино группе формулы -N(R38)2, где R38 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или амино-защитную группу, где по меньшей мере один из R38 не является водородом. В некоторых вариантах осуществления, каждый R38 независимо выбран из водорода, C1-C8 алкила, C3-C8 алкенила, C3-C8 алкинила, C6-C10 арила, 5-10-членного гетероарила, 4-10-членного гетероциклила или C3-C10 циклоалкила; или C1-C8 алкила, замещенного галогеном или гидрокси; C3-C8 алкенила, замещенного галогеном или гидрокси; C3-C8 алкинила, замещенного галогеном или гидрокси, или -(CH2)t(C6-C10 арил), -(CH2)t(5-10-членный гетероарил), -(CH2)t(C3-C10 циклоалкил) или -(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число, имеющее значение от 0 до 8, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; или обе группы R38 объединены с образованием алкиленовой группы.
Иллюстративные группы «замещенный амино» включают, но не ограничиваются этим, -NR39-C1-C8 алкил, -NR39-(CH2)t(C6-C10 арил), -NR39-(CH2)t(5-10-членный гетероарил), -NR39-(CH2)t(C3-C10 циклоалкил) и -NR39-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4, например, 1 или 2, каждый R39 независимо представляет собой H или C1-C8 алкил; и любые присутствующие алкильные группы, сами по себе, могут быть замещены галогеном, замещенным или незамещенным амино или гидрокси; и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы, сами по себе, могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Во избежание сомнений, термин ‘замещенный амино’ включает группы алкиламино, замещенный алкиламино, алкилариламино, замещенный алкилариламино, ариламино, замещенный ариламино, диалкиламино и замещенный диалкиламино, как определено ниже. Замещенный амино охватывает как монозамещенные амино, так и дизамещенные амино группы.
«Азидо» относится к радикалу -N3.
«Карбамоил» или «амидо» относится к радикалу -C(O)NH2.
«Замещенный карбамоил» или «замещенный амидо» относится к радикалу -C(O)N(R62)2, где каждый R62 независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или амино-защитную группу, где по меньшей мере один из R62 не является водородом. В некоторых вариантах осуществления, R62 выбран из H, C1-C8 алкила, C3-C10 циклоалкила, 4-10-членного гетероциклила, C6-C10 арила, аралкила, 5-10-членного гетероарила и гетероаралкила; или C1-C8 алкила, замещенного галогеном или гидрокси; или C3-C10 циклоалкила, 4-10-членного гетероциклила, C6-C10 арила, аралкила, 5-10-членного гетероарила или гетероаралкила, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; при условии, что по меньшей мере один R62 отличен от H.
Иллюстративные группы «замещенный карбамоил» включают, но не ограничиваются этим, -C(O) NR64-C1-C8 алкил, -C(O)NR64-(CH2)t(C6-C10 арил), -C(O)N64-(CH2)t(5-10-членный гетероарил), -C(O)NR64-(CH2)t(C3-C10 циклоалкил) и -C(O)NR64-(CH2)t(4-10-членный гетероциклил), где t представляет собой целое число от 0 до 4, каждый R64 независимо представляет собой H или C1-C8 алкил и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы, сами по себе, могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
«Карбокси» относится к радикалу -C(O)OH.
«Циано» относится к радикалу -CN.
«Гало» или «галоген» относится к фтору (F), хлору (Cl), брому (Br) и йоду (I). В некоторых вариантах осуществления, галогеновая группа представляет собой или фтор или хлор.
«Гидрокси» относится к радикалу -OH.
«Нитро» относится к радикалу -NO2.
«Циклоалкилалкил» относится к алкильному радикалу, в котором алкильная группа замещена циклоалкильной группой. Типичные циклоалкилалкильные группы включают, но не ограничиваются этим, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил, циклооктилметил, циклопропилэтил, циклобутилэтил, циклопентилэтил, циклогексилэтил, циклогептилэтил и циклооктилэтил и подобные.
«Гетероциклилалкил» относится к алкильному радикалу, в котором алкильная группа замещена гетероциклильной группой. Типичные гетероциклилалкильные группы включают, но не ограничиваются этим, пирролидинилметил, пиперидинилметил, пиперазинилметил, морфолинилметил, пирролидинилэтил, пиперидинилэтил, пиперазинилэтил, морфолинилэтил и подобные.
«Циклоалкенил» относится к замещенной или незамещенной карбоциклильной группе, содержащей от 3 до 10 атомов углерода и содержащей одно циклическое кольцо или несколько конденсированных колец, включая конденсированные кольцевые системы и кольцевые системы, связанные мостиковой связью и содержащей по меньшей мере один и, в частности, от 1 до 2 участков олефиновой ненасыщенности. Такие циклоалкенильные группы включают, в качестве примера, содержащие одно кольцо структуры, такие как циклогексенил, циклопентенил, циклопропенил и подобные.
«Конденсированный циклоалкенил» относится к циклоалкенилу, в котором два из его кольцевых атомов углерода являются общими со вторым алифатическим или ароматическим кольцом и где его олефиновая ненасыщенность расположена так, чтобы придать ароматичность циклоалкенильному кольцу.
«Этенил» относится к замещенной или незамещенной группе -(C=C)-. «Этилен» относится к замещенной или незамещенной группе -(C-C)-.
«Этинил» относится к группе -(C≡C)-.
«Азот-содержащая гетероциклильная» группа означает 4-7-членную не-ароматическую циклическую группу, содержащую по меньшей мере один атом азота, например, но без ограничения, морфолин, пиперидин (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например 2-пирролидинил и 3-пирролидинил), азетидин, пирролидон, имидазолин, имидазолидинон, 2-пиразолин, пиразолидин, пиперазин и N-алкилпиперазины, такие как N-метилпиперазин. Конкретные примеры включают азетидин, пиперидон и пиперазон.
«Тиокето» относится к группе =S.
Алкильные, алкенильные, алкинильные, карбоциклильные, гетероциклильные, арильные и гетероарильные группы, как определено в настоящей заявке, необязательно замещены (например, «замещенные» или «незамещенные» алкильные, «замещенные» или «незамещенные» алкенильные, «замещенные» или «незамещенные» алкинильные, «замещенные» или «незамещенные» карбоциклильные, «замещенные» или «незамещенные» гетероциклильные, «замещенные» или «незамещенные» арильные или «замещенные» или «незамещенные» гетероарильные группы).Как правило, термин «замещенный», независимо от того, предшествует ему термин «необязательно» или нет, означает, что по меньшей мере один водород, присутствующий на группе (например, по атому углерода или азота), замещен допустимым заместителем, например, заместителем, который при замещении приводит к стабильному соединению, например, соединению, которое не подвержено самопроизвольным трансформациям, таким как перегруппировка, циклизация, элиминирование или другие реакции. Если не указано иное, «замещенная» группа содержит заместитель в одном или нескольких замещаемых положениях группы и когда более чем одно положение в любой данной структуре является замещенным, заместитель является тем же самым или отличным в каждом положении. Термин «замещенный» предусматривается как включающий замещения всеми возможными заместителями органических соединений, любым из заместителей, описанных в настоящей заявке, что приводит к образованию стабильного соединения. Для целей настоящего изобретения, гетероатомы, такие как азот, могут иметь водородные заместители и/или любой подходящий заместитель, описанный в настоящей заявке, которые удовлетворяют валентности гетероатомов и приводят к образованию стабильной группы.
Иллюстративные заместители атома углерода включают, но не ограничиваются этим, галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)2, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(O)Raa, например,-S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -OSi(Raa)3 -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)2Raa, -OP(=O)2Raa, -P(=O)(Raa)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)2N(Rbb)2, -OP(=O)2N(Rbb)2, -P(=O)(NRbb)2, -OP(=O)(NRbb)2, -NRbbP(=O)(ORcc)2, -NRbbP(=O)(NRbb)2, -P(Rcc)2, -P(Rcc)3, -OP(Rcc)2, -OP(Rcc)3, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членный гетероарил, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
или два геминальных водорода на атоме углерода замещены группой =O, =S, =NN(Rbb)2, =NNRbbC(=O)Raa, =NNRbbC(=O)ORaa, =NNRbbS(=O)2Raa, =NRbb или =NORcc;
Raa, в каждом случае, независимо, выбран из C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две группы Raa объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
Rbb, в каждом случае, независимо, выбран из водорода, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две группы Rbb объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
Rcc, в каждом случае, независимо, выбран из водорода, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14-членного гетероциклила, C6-14 арила и 5-14-членного гетероарила, или две группы Rcc объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd;
Rdd, в каждом случае, независимо, выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2,-NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(O)Ree, например, -S(=O)Ree, -Si(Ree)3, -OSi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)2Ree, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10-членного гетероциклила, C6-10 арила, 5-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rgg, или два геминальных заместителя Rdd могут быть объединены с образованием =O или =S;
Ree, в каждом случае, независимо, выбран из C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, C6-10 арила, 3-10-членного гетероциклила и 3-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rgg;
Rff, в каждом случае, независимо, выбран из водорода, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10-членного гетероциклила, C6-10 арила и 5-10-членного гетероарила, или две группы Rff объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rgg; и
Rgg, в каждом случае, независимо, представляет собой галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -OC1-6 алкил, -ON(C1-6 алкил)2, -N(C1-6 алкил)2, -N(C1-6 алкил)3+X-, -NH(C1-6 алкил)2+X-, -NH2(C1-6 алкил)+X-, -NH3+X-, -N(OC1-6 алкил)(C1-6 алкил), -N(OH)(C1-6 алкил), -NH(OH), -SH, -SC1-6 алкил, -SS(C1-6 алкил), -C(=O)(C1-6 алкил), -CO2H, -CO2(C1-6 алкил), -OC(=O)(C1-6 алкил), -OCO2(C1-6 алкил), -C(=O)NH2, -C(=O)N(C1-6 алкил)2, -OC(=O)NH(C1-6 алкил), -NHC(=O)(C1-6 алкил), -N(C1-6 алкил)C(=O)(C1-6 алкил), -NHCO2(C1-6 алкил), -NHC(=O)N(C1-6 алкил)2, -NHC(=O)NH(C1-6 алкил), -NHC(=O)NH2, -C(=NH)O(C1-6 алкил),-OC(=NH)(C1-6 алкил), -OC(=NH)OC1-6 алкил, -C(=NH)N(C1-6 алкил)2, -C(=NH)NH(C1-6 алкил), -C(=NH)NH2, -OC(=NH)N(C1-6 алкил)2, -OC(NH)NH(C1-6 алкил), -OC(NH)NH2, -NHC(NH)N(C1-6 алкил)2, -NHC(=NH)NH2, -NHSO2(C1-6 алкил), -SO2N(C1-6 алкил)2, -SO2NH(C1-6 алкил), -SO2NH2,-SO2C1-6 алкил, -SO2OC1-6 алкил, -OSO2C1-6 алкил, -SOC1-6 алкил, -Si(C1-6 алкил)3, -OSi(C1-6 алкил)3 -C(=S)N(C1-6 алкил)2, C(=S)NH(C1-6 алкил), C(=S)NH2, -C(=O)S(C1-6 алкил), -C(=S)SC1-6 алкил, -SC(=S)SC1-6 алкил, -P(=O)2(C1-6 алкил), -P(=O)(C1-6 алкил)2, -OP(=O)(C1-6 алкил)2, -OP(=O)(OC1-6 алкил)2, C1-6 алкил, C1-6 пергалогеналкил, C2-6 алкенил, C2-6 алкинил, C3-10 карбоциклил, C6-10 арил, 3-10-членный гетероциклил, 5-10-членный гетероарил; или два геминальных заместителя Rgg могут быть объединены с образованием =O или =S; где X- представляет собой противоион.
«Противоион» или «анионный противоион» представляет собой отрицательно заряженную группу, связанную с катионной четвертичной амино группой, для поддержания электронной нейтральности. Типичные противоионы включают галогенидные ионы (например, F-, Cl-, Br-, I-), NO3-, ClO4-, OH-, H2PO4-, HSO4-, SO4-2сульфонатные ионы (например, метансульфонат, трифторметансульфонат, пара-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафталин-2-сульфонат, нафталин-1-сульфоновая кислота-5-сульфонат, этан-1-сульфоновая кислота-2-сульфонат и подобные) и карбоксилатные ионы (например, ацетат, этаноат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят и подобные).
Атомы азота могут быть замещенными или незамещенными, как позволяет валентность и включают первичные, вторичные, третичные и четвертичные атомы азота. Типичные заместители атома азота включают, но не ограничиваются этим, водород, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членный гетероарил, или две группы Rcc, связанные с атомом азота, объединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd и где Raa, Rbb, RccиRdd имеют значение, определенное выше.
В некоторых вариантах осуществления, заместитель, присутствующий на атоме азота, представляет собой амино-защитную группу (именуемую также в настоящей заявке как азот-защитная группа).Амино-защитные группы включают, но не ограничены этим, -OH, -ORaa, -N(Rcc)2, -C(=O)Raa, -C(=O)ORaa, -C(=O)N(Rcc)2, -S(=O)2Raa, -C(=NRcc)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, C1-10 алкил (например, аралкил, гетероаралкил), C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членные гетероарил группы, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, аралкил, арил и гетероарил независимо замещен 0, 1, 2, 3, 4 или 5 группами Rdd и где Raa, Rbb, RccиRdd такие, как определены в настоящей заявке. Амино-защитные группы хорошо известны в данной области и включают группы, подробно описанные в Protecting Groups in Organic Synthesis (T. W. Greene и P. G. M. Wuts, 3Rd Ed., John Wiley & Sons, 1999), включенный в настоящую заявку посредством ссылки.
Иллюстративные амино-защитные группы включают, но не ограничены этим, амидные группы (например, -C(=O)Raa), которые включают, но не ограничены этим, формамид и ацетамид; карбаматные группы (например, -C(=O)ORaa), которые включают, но не ограничены этим, 9-флуоренилметил карбамат (Fmoc), трет-бутил карбамат (BOC) и бензилкарбамат (Cbz); сульфонамидные группы (например, -S(=O)2Raa), которые включают, но не ограничены этим, пара-толуолсульфонамид (Ts), метансульфонамид (Ms) и N-[2-(триметилсилил)этокси]метиламин (SEM).
В некоторых вариантах осуществления, заместитель, присутствующий на атоме кислорода, представляет собой кислород-защитную группу (также называемую как гидроксил-защитная группа).Кислород-защитные группы включают, но не ограничены этим,-Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3,-P(Rcc)2, -P(Rcc)3, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)2N(Rbb)2 и -P(=O)(NRbb)2, где Raa, Rbb и Rcc такие, как определены в настоящей заявке.Кислород-защитные группы хорошо известны в данной области и включают группы, подробно описанные в Protecting Groups in Organic Synthesis (T. W. Greene и P. G. M. Wuts, 3Rd Ed., John Wiley & Sons, 1999), включенный в настоящую заявку посредством ссылки.
Иллюстративные кислород-защитные группы включают, но не ограничены этим, метил, метоксилметил (MOM), 2-метоксиэтоксиметил (MEM), бензил (Bn), триизопропилсилил (TIPS), трет-бутилдиметилсилил (TBDMS), трет-бутилметоксифенилсилил (TBMPS), метансульфонат (мезилат) и тозилат (Ts).
В некоторых вариантах осуществления, заместитель, присутствующий на атоме серы, представляет собой сера-защитную группу (также называемую как тиол-защитная группа).Сера-защитные группы включают, но не ограничены этим,-Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3,-P(Rcc)2, -P(Rcc)3, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)2N(Rbb)2 и -P(=O)(NRbb)2, где Raa, Rbb и Rcc такие, как определены в настоящей заявке.Сера-защитные группы хорошо известны в данной области и включают группы, подробно описанные в Protecting Groups in Organic Synthesis (T. W. Greene и P. G. M. Wuts, 3Rd Ed., John Wiley & Sons, 1999), включенный в настоящую заявку посредством ссылки.
Эти и другие иллюстративные заместители описаны более подробно в разделах Подробное описание, Примеры и Формула изобретения. Изобретение не предназначено для ограничения каким-либо образом приведенным выше иллюстративным перечнем заместителей.
Другие определения
«Фармацевтически приемлемый» означает утвержденный или одобренный регулирующим агентством Федерального или государственного правительства или соответствующим агентством в других странах, кроме Соединенных Штатов, или перечисленный в Фармакопее США или другой общепризнанной фармакопее для использования на животных и, более конкретно, на человеке.
Термин «фармацевтически приемлемая соль» относится к таким солям, которые, согласно взвешенной медицинской оценке, являются подходящими для использования в контакте с тканями человека и низших животных без излишней токсичности, раздражения, аллергической реакции и т.п., и соизмеримы с разумным соотношением польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, Berge et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences (1977) 66:1-19. Фармацевтически приемлемые соли соединений по настоящему изобретению включают такие соли, которые образованы из подходящих неорганических и органических кислот и оснований. Примеры фармацевтически приемлемых нетоксичных кислотно-аддитивных солей представляют собой соли амино группы, образованные с неорганическим кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическим кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с использованием других способов, используемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лауринат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, пара-толуолсульфонат, ундеканоат, валерат и подобные соли. Фармацевтически приемлемые соли, образованные из подходящих оснований, включают соли щелочных металлов, щелочно-земельных металлов, аммония и соли N+(C1-4алкил)4. Репрезентативные соли щелочных и щелочно-земельных металлов включают соли натрия, лития, калия, кальция, магния и подобные. Другие фармацевтически приемлемые соли включают, когда это целесообразно, нетоксичные аммониевые, четвертичные аммониевые и аминовые катионы, образованные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
«Сольват» относится к формам соединения, которые связаны с растворителем или водой (также называемые как «гидрат»), обычно посредством реакции сольволиза. Это физическое объединение включает водородное связывание. Обычные растворители включают воду, этанол, уксусную кислоту и подобные. Соединения по настоящему изобретению могут быть получены, например, в кристаллической форме и могут быть сольватированы или гидратированы. Подходящие сольваты включают фармацевтически приемлемые сольваты, такие как гидраты и дополнительно включают как стехиометрические сольваты, так и не-стехиометрические сольваты. В некоторых случаях сольват можно будет выделить, например, когда одна или несколько молекул растворителя инкорпорированы в кристаллическую решетку критсаллического твердого вещества. «Сольват» охватывает как растворенные, так и способные к выделению сольваты. Типичные сольваты включают гидраты, этаноляты и метаноляты.
«Субъект», для которого предусматривается введение, включает, но не ограничивается этим, людей (то есть, мужчин или женщин любой возрастной группы, например, педиатритрических пациентов (например, младенцы, дети, подростки) или взрослых субъектов (например, молодежь, люди среднего возраста или пожилые люди)) и/или не относящихся к человеку животных, например, млекопитающих, таких как приматы (например, яванский макак, макак-резус), крупный рогатый скот, свиней, лошадей, овец, коз, грызунов, кошек и/или собак. В некоторых вариантах осуществления, субъект представляет собой человека. В некоторых вариантах осуществления, субъект представляет собой не относящегося к человеку животного. Термины «человек», «пациент» и «субъект» взаимозаменяемы в настоящей заявке.
Заболевание, расстройство и состояние являются взаимозаменяемыми терминами в настоящей заявке.
В контексте настоящей заявки, и если не указано иное, термины «лечить», «лечащий» и «лечение» рассматривают как действие, которое имеет место, когда субъект страдает от указанного заболевания, расстройства или состояния, которое уменьшает тяжесть заболевания, расстройства или состояния или задерживает или замедляет развитие заболевания, расстройства или состояния («терапевтическое лечение»), а также рассматривают как действие, которое имеет место, прежде чем субъект начинает страдать от указанного заболевания, расстройства или состояния («профилактическое лечение»).
Как правило, «эффективное количество» соединения относится к количеству, достаточному, чтобы вызвать желаемый биологический ответ. Как будет понятно среднему специалисту в данной области, эффективное количество соединения по настоящему изобретению может различаться в зависимости от таких факторов, как желаемый биологический эффект, фармакокинетика соединения; заболевание, которое лечат; режим введения и возраст, здоровье и состояние субъекта. Эффективное количество охватывает терапевтическое и профилактическое лечение.
В контексте настоящей заявки, и если не указано иное, «терапевтически эффективное количество» соединения - это количество, достаточное для обеспечения терапевтической пользы при лечении заболевания, расстройства или состояния, или для отсрочки или сведения к минимуму одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием. Терапевтически эффективное количество соединения означает количество терапевтического средства, отдельно или в комбинации с другими терапиями, которое обеспечивает терапевтическую пользу при лечении заболевания, расстройства или состояния. Термин «терапевтически эффективное количество» может включать в себя количество, которое улучшает общую терапию, снижает или предотвращает симптомы или причины заболевания или состояния или повышает терапевтическую эффективность другого терапевтического средства.
В контексте настоящей заявки, и если не указано иное, «профилактически эффективное количество» соединения означает количество, достаточное для предотвращения заболевания, расстройства или состояния или одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием, или для предотвращения его повторного возникновения. Профилактически эффективное количество соединения означает количество терапевтического средства, отдельно или в комбинации с другими средствами, которое обеспечивает профилактическую пользу в предотвращении заболевания, расстройства или состояния. Термин «профилактически эффективное количество» может включать в себя количество, которое улучшает общую профилактику или повышает профилактическую эффективность другого профилактического средства.
Краткое описание рисунков
Фиг. 1-12 представляют репрезентативные спектры 1H ЯМР для иллюстративных соединений, описанных в настоящей заявке.
Подробное описание конкретных вариантов осуществления настоящего изобретения
Как описано в настоящей заявке, настоящее изобретение обеспечивает 17-циано замещенные нейроактивные стероиды, включающие по меньшей мере один заместитель в одном или нескольких положениях 2, 4 или 11 на стероидном остове и предназначенные, например, для действия в качестве ГАМК модуляторов. В некоторых вариантах осуществления, настоящее изобретение обеспечивает 17-циано замещенные нейроактивные стероиды, включающие по меньшей мере один заместитель в одном или нескольких положениях 2, 4 и 11 на стероидном остове. В некоторых вариантах осуществления, такие соединения предусматриваются как полезные в качестве терапевтических средств для стимулирования анестизирующего и/или успокаивающего действия у субъекта. В некоторых вариантах осуществления, такие соединения предусматриваются как полезные в качестве терапевтических средств для лечения расстройства, связанного с ЦНС.
В одном аспекте, обеспечивается соединение формулы (I):

Формула (I)
где R1aпредставляет собой водород, галоген, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); R1b представляет собой водород, галоген, гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rd)(Re), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); где один из R1a и R1b представляет собой водород; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; и каждый Rd и Re представляет собой водород, замещенный метил или C2-C6 алкил или Rd и Re,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо.
В некоторых вариантах осуществления, R1aпредставляет собой водород и R1b представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1b представляет собой гидрокси или алкокси. В некоторых вариантах осуществления, R1b представляет собой гидрокси. В некоторых вариантах осуществления, R1b представляет собой метокси. В некоторых вариантах осуществления, R1b представляет собой алкил.
В некоторых вариантах осуществления, R1b представляет собой водород и R1aпредставляет собой алкил или алкокси. В некоторых вариантах осуществления, R1aпредставляет собой алкокси. В некоторых вариантах осуществления, R1aпредставляет собой метокси.
В некоторых вариантах осуществления, соединение представляет собой соединение Формулы (Ia):

Формула (Ia)
где R1aпредставляет собой водород, галоген, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); R1b представляет собой водород, галоген, гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rd)(Re), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); где один из R1a и R1b представляет собой водород; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; и каждый Rd и Re представляет собой водород, замещенный метил или C2-C6 алкил или Rd и Re,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо.
В некоторых вариантах осуществления, R1aпредставляет собой водород и R1b представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1b представляет собой гидрокси или алкокси. В некоторых вариантах осуществления, R1b представляет собой гидрокси. В некоторых вариантах осуществления, R1b представляет собой метокси. В некоторых вариантах осуществления, R1b представляет собой алкил.
В некоторых вариантах осуществления, R1b представляет собой водород и R1aпредставляет собой алкил или алкокси. В некоторых вариантах осуществления, R1aпредставляет собой алкокси. В некоторых вариантах осуществления, R1aпредставляет собой метокси.
В некоторых вариантах осуществления, соединение представляет собой соединение Формулы (Ib):

Формула (Ib)
где R1aпредставляет собой водород, галоген, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); R1b представляет собой водород, галоген, гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rd)(Re), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); где один из R1a и R1b представляет собой водород; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; и каждый Rd и Re представляет собой водород, замещенный метил или C2-C6 алкил или Rd и Re,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо.
В некоторых вариантах осуществления, R1aпредставляет собой водород и R1b представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1b представляет собой гидрокси или алкокси. В некоторых вариантах осуществления, R1b представляет собой гидрокси. В некоторых вариантах осуществления, R1b представляет собой метокси. В некоторых вариантах осуществления, R1b представляет собой алкил.
В некоторых вариантах осуществления, R1b представляет собой водород и R1aпредставляет собой алкил или алкокси. В некоторых вариантах осуществления, R1aпредставляет собой алкокси. В некоторых вариантах осуществления, R1aпредставляет собой метокси.
В одном аспекте, обеспечивается соединение, выбранное из:

В некоторых вариантах осуществления, соединение выбрано из:

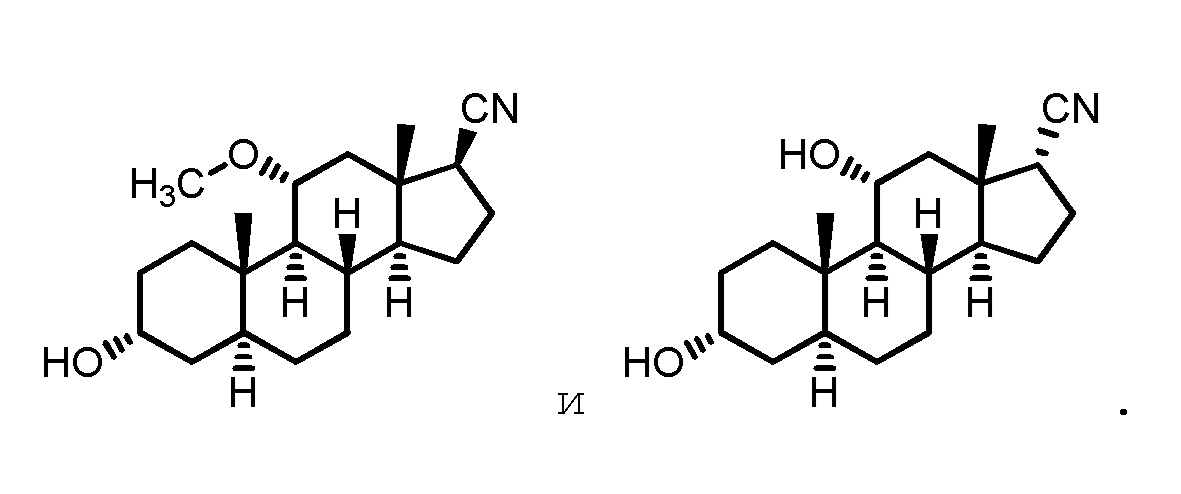
В некоторых вариантах осуществления, соединение выбрано из:

В одном аспекте, обеспечивается соединение Формулы (II):

Формула (II)
где R2a представляет собой водород, галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, метокси, замещенный этокси, C3-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rf)(Rg), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); R2b представляет собой водород, галоген, гидрокси, алкил, метокси, замещенный этокси, C3-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); где один из R2a и R2b представляет собой водород; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; и каждый Rf и Rg независимо представляет собой водород или C1-C6 алкил или Rf и Rg,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из азота, кислорода и серы.
В некоторых вариантах осуществления, R2a представляет собой водород и R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой метил. В некоторых вариантах осуществления, R2b представляет собой метокси.
В некоторых вариантах осуществления, R2b представляет собой водород и R2a представляет собой алкил, метокси, замещенный этокси или C3-C6 алкокси. В некоторых вариантах осуществления, R2a представляет собой алкил. В некоторых вариантах осуществления, R2a представляет собой метил. В некоторых вариантах осуществления, R2a представляет собой этил. В некоторых вариантах осуществления, R2a представляет собой метокси. В некоторых вариантах осуществления, R2a представляет собой -OCF3. В некоторых вариантах осуществления, R2a представляет собой замещенный этокси. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OMe. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OH. В некоторых вариантах осуществления, R2a представляет собой -OCH2CF3. В некоторых вариантах осуществления, R2a представляет собой C3-C6 алкокси. В некоторых вариантах осуществления, R2a представляет собой пропокси. В некоторых вариантах осуществления, R2a представляет собой -OCH(CH3)2. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH(CH3)2. В некоторых вариантах осуществления, R2a представляет собой циклопропокси.
В некоторых вариантах осуществления, соединение представляет собой соединение Формулы (IIa):

Формула (IIa)
где R2a представляет собой водород, галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, метокси, замещенный этокси, C3-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rf)(Rg), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); R2b представляет собой водород, галоген, гидрокси, алкил, метокси, замещенный этокси, C3-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); где один из R2a и R2b представляет собой водород; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; и каждый Rf и Rg независимо представляет собой водород или C1-C6 алкил или Rf и Rg,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из азота, кислорода и серы.
В некоторых вариантах осуществления, R2a представляет собой водород и R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой метил. В некоторых вариантах осуществления, R2b представляет собой метокси.
В некоторых вариантах осуществления, R2b представляет собой водород и R2a представляет собой алкил, метокси, замещенный этокси или C3-C6 алкокси. В некоторых вариантах осуществления, R2a представляет собой алкил. В некоторых вариантах осуществления, R2a представляет собой метил. В некоторых вариантах осуществления, R2a представляет собой этил. В некоторых вариантах осуществления, R2a представляет собой метокси. В некоторых вариантах осуществления, R2a представляет собой -OCF3. В некоторых вариантах осуществления, R2a представляет собой замещенный этокси. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OMe. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OH. В некоторых вариантах осуществления, R2a представляет собой -OCH2CF3. C3-C6 алкокси. В некоторых вариантах осуществления, R2a представляет собой пропокси. В некоторых вариантах осуществления, R2a представляет собой -OCH(CH3)2. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH(CH3)2. В некоторых вариантах осуществления, R2a представляет собой циклопропокси.
В некоторых вариантах осуществления, соединение представляет собой соединение Формулы (IIb):

Формула (IIb)
где R2a представляет собой водород, галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, метокси, замещенный этокси, C3-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rf)(Rg), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); R2b представляет собой водород, галоген, гидрокси, алкил, метокси, замещенный этокси, C3-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); где один из R2a и R2b представляет собой водород; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил, или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; и каждый Rf и Rg независимо представляет собой водород или C1-C6 алкил, или Rf и Rg,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из азота, кислорода и серы.
В некоторых вариантах осуществления, R2a представляет собой водород и R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой метил. В некоторых вариантах осуществления, R2b представляет собой метокси.
В некоторых вариантах осуществления, R2b представляет собой водород и R2a представляет собой алкил, метокси, замещенный этокси или C3-C6 алкокси. В некоторых вариантах осуществления, R2a представляет собой алкил. В некоторых вариантах осуществления, R2a представляет собой метил. В некоторых вариантах осуществления, R2a представляет собой этил. В некоторых вариантах осуществления, R2a представляет собой метокси. В некоторых вариантах осуществления, R2a представляет собой -OCF3. В некоторых вариантах осуществления, R2a представляет собой замещенный этокси. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OMe. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OH. В некоторых вариантах осуществления, R2a представляет собой -OCH2CF3. C3-C6 алкокси. В некоторых вариантах осуществления, R2a представляет собой пропокси. В некоторых вариантах осуществления, R2a представляет собой -OCH(CH3)2. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH(CH3)2. В некоторых вариантах осуществления, R2a представляет собой циклопропокси.
В одном аспекте, обеспечивается соединение, выбранное из:



В некоторых вариантах осуществления, соединение выбрано из:



В некоторых вариантах осуществления, соединение выбрано из:



В одном аспекте, обеспечивается соединение Формулы (III):

Формула (III)
где один из R1a и R1b представляет собой галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rh)(Ri), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc) и другой представляет собой водород; или R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O); один из R2a и R2b представляет собой хлор, фтор, гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rf)(Rg), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc) и другой представляет собой водород; R3 представляет собой водород или C1-C6 алкил; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил, или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; каждый Rf и Rg независимо представляет собой водород или C1-C6 алкил, или Rf и Rg,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из азота, кислорода и серы; и каждый Rh представляет собой незамещенный C1-C4 алкил; каждый Ri представляет собой водород, замещенный метил или C2-C6 алкил, или Rh и Ri,вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо.
В некоторых вариантах осуществления, R1a представляет собой водород и R1b представляет собой гидрокси, алкил или алкокси.
В некоторых вариантах осуществления, R1b представляет собой водород и R1a представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1a представляет собой гидрокси. В некоторых вариантах осуществления, R1a представляет собой алкокси. В некоторых вариантах осуществления, R1a представляет собой метокси.
В некоторых вариантах осуществления, R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O).
В некоторых вариантах осуществления, R2a представляет собой водород и R2b представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R2b представляет собой гидрокси. В некоторых вариантах осуществления, R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой метил. В некоторых вариантах осуществления, R2b представляет собой алкокси.
В некоторых вариантах осуществления, R2b представляет собой водород и R2a представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R2a представляет собой гидрокси. В некоторых вариантах осуществления, R2a представляет собой алкил. В некоторых вариантах осуществления, R2a представляет собой метил. В некоторых вариантах осуществления, R2a представляет собой алкокси. В некоторых вариантах осуществления, R2a представляет собой метокси. В некоторых вариантах осуществления, R2a представляет собой этокси. В некоторых вариантах осуществления, R2a представляет собой пропокси. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OCH3. В некоторых вариантах осуществления, R2a представляет собой -OCH(CH3)2.
В некоторых вариантах осуществления, R3 представляет собой алкил (например, C1-C6 алкил) или алкокси (например, C1-C6 алкокси).
В некоторых вариантах осуществления, соединение представляет собой соединение формулы (IIIa):

Формула (IIIa)
где один из R1a и R1b представляет собой галоген, гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rh)(Ri), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc) и другой представляет собой водород; или R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O); один из R2a и R2b представляет собой галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rf)(Rg), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc) и другой представляет собой водород; R3 представляет собой водород или C1-C6 алкил; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; каждый Rf и Rg независимо представляет собой водород или C1-C6 алкил или Rf и Rg,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из азота, кислорода и серы; и каждый Rh представляет собой незамещенный C1-C4 алкил; каждый Ri представляет собой водород, замещенный метил или C2-C6 алкил или Rh и Ri,вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо.
В некоторых вариантах осуществления, R1a представляет собой водород и R1b представляет собой гидрокси, алкил или алкокси.
В некоторых вариантах осуществления, R1b представляет собой водород и R1a представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1a представляет собой гидрокси. В некоторых вариантах осуществления, R1a представляет собой алкокси. В некоторых вариантах осуществления, R1a представляет собой метокси.
В некоторых вариантах осуществления, R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O).
В некоторых вариантах осуществления, R2a представляет собой H и R2b представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R2b представляет собой гидрокси. В некоторых вариантах осуществления, R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой метил. В некоторых вариантах осуществления, R2b представляет собой алкокси.
В некоторых вариантах осуществления, R2b представляет собой H и R2a представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R2a представляет собой гидрокси. В некоторых вариантах осуществления, R2a представляет собой алкил. В некоторых вариантах осуществления, R2a представляет собой метил. В некоторых вариантах осуществления, R2a представляет собой алкокси. В некоторых вариантах осуществления, R2a представляет собой метокси. В некоторых вариантах осуществления, R2a представляет собой этокси. В некоторых вариантах осуществления, R2a представляет собой пропокси. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OCH3. В некоторых вариантах осуществления, R2a представляет собой -OCH(CH3)2.
В некоторых вариантах осуществления, R3 представляет собой водород. В некоторых вариантах осуществления, R3 представляет собой C1-C6 алкил.
В некоторых вариантах осуществления, соединение представляет собой соединение формулы (IIIb):

Формула (IIIb)
где один из R1a и R1b представляет собой галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rh)(Ri), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc) и другой представляет собой водород; или R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O); один из R2a и R2b представляет собой галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rf)(Rg), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc) и другой представляет собой водород; R3 представляет собой водород или C1-C6 алкил; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; каждый Rf и Rg независимо представляет собой водород или C1-C6 алкил или Rf и Rg,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из азота, кислорода и серы; и каждый Rh представляет собой незамещенный C1-C4 алкил; каждый Ri представляет собой водород, замещенный метил или C2-C6 алкил или Rh и Ri,вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо.
В некоторых вариантах осуществления, R1a представляет собой водород и R1b представляет собой гидрокси, алкил или алкокси.
В некоторых вариантах осуществления, R1b представляет собой водород и R1a представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1a представляет собой гидрокси. В некоторых вариантах осуществления, R1a представляет собой алкокси. В некоторых вариантах осуществления, R1a представляет собой метокси.
В некоторых вариантах осуществления, R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O).
В некоторых вариантах осуществления, R2a представляет собой H и R2b представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R2b представляет собой гидрокси. В некоторых вариантах осуществления, R2b представляет собой алкил. В некоторых вариантах осуществления, R2b представляет собой метил. В некоторых вариантах осуществления, R2b представляет собой алкокси.
В некоторых вариантах осуществления, R2b представляет собой H и R2a представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R2a представляет собой гидрокси. В некоторых вариантах осуществления, R2a представляет собой алкил. В некоторых вариантах осуществления, R2a представляет собой метил. В некоторых вариантах осуществления, R2a представляет собой алкокси. В некоторых вариантах осуществления, R2a представляет собой метокси. В некоторых вариантах осуществления, R2a представляет собой этокси. В некоторых вариантах осуществления, R2a представляет собой пропокси. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OCH3. В некоторых вариантах осуществления, R2a представляет собой -OCH(CH3)2.
В некоторых вариантах осуществления, R3 представляет собой водород. В некоторых вариантах осуществления, R3 представляет собой C1-C6 алкил.
В одном аспекте, обеспечивается соединение, выбранное из:





В одном аспекте, обеспечивается соединение, выбранное из:



В одном аспекте, обеспечивается соединение Формулы (IV):

Формула (IV)
где один из R1aи R1b представляет собой галоген, гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc) и другой представляет собой водород; или R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O); R3 представляет собой алкил или алкокси; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,вмсете с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо.
В некоторых вариантах осуществления, R1bпредставляет собой водород и R1a представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1a представляет собой гидрокси. В некоторых вариантах осуществления, R1a представляет собой алкил. В некоторых вариантах осуществления, R1a представляет собой алкокси. В некоторых вариантах осуществления, R1a представляет собой метокси.
В некоторых вариантах осуществления, R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O).
В некоторых вариантах осуществления, R3 представляет собой алкил. В некоторых вариантах осуществления, R3 представляет собой метил.
В некоторых вариантах осуществления, обеспечивается соединение, выбранное из:

В одном аспекте, обеспечивается соединение Формулы (V):
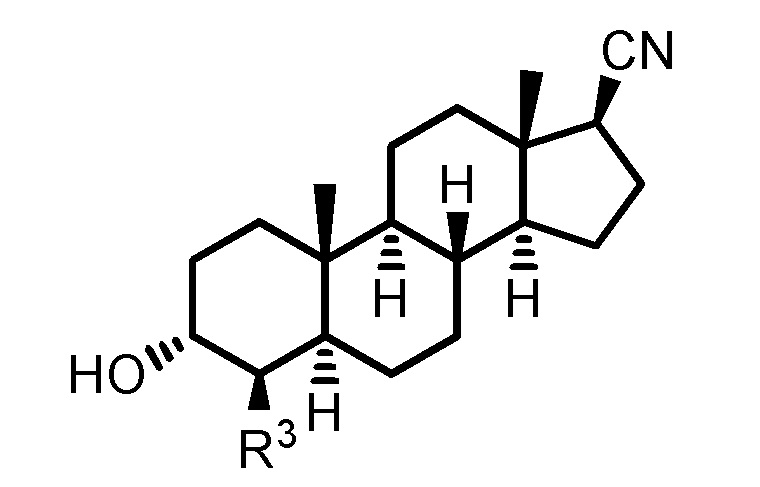
Формула (V)
где R3 представляет собой алкил или алкокси.
В некоторых вариантах осуществления, R3 представляет собой алкил. В некоторых вариантах осуществления, R3 представляет собой метил или этил.
В некоторых вариантах осуществления, обеспечивается соединение, выбранное из:

В одном аспекте, обеспечивается фармацевтическая композиция, включающая соединение формулы (I), (Ia), (Ib), (II), (IIa), (IIb), (III), (IIIa), (IIIb), (IIIc), (IV) или (V) и фармацевтически приемлемый эксципиент.
В одном аспекте, обеспечивается сольват, изотопный вариант или таутомер соединения формулы (I), (Ia), (Ib), (II), (IIa), (IIb), (III), (IIIa), (IIIb), (IIIc), (IV) или (V).
В одном аспекте, обеспечивается способ индукции седативного эффекта и/или анестезии у субъекта, включающий введение субъекту эффективного количества соединения Формулы (IIIc),
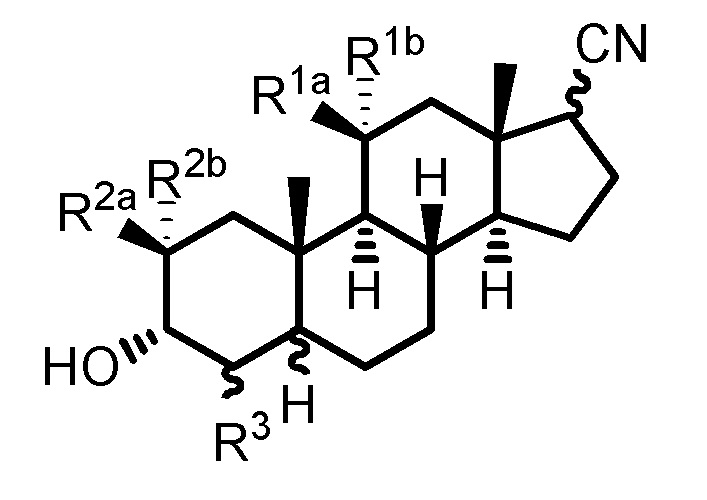
Формула (IIIc)
его фармацевтически приемлемой соли или фармацевтической композиции,
где один из R1a и R1b представляет собой галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); или R1a и R1bнеобязательно взяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O); один из R2a и R2b представляет собой галоген (например, хлор, фтор, бром, йод), гидрокси, алкил, метокси, замещенный этокси, C3-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rf)(Rg), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc), где один из R1a, R1b, R2a и R2b не представляет собой водород и когда R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O), один из R2a и R2b представляет собой водород; R3 представляет собой водород или C1-C6 алкил; каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc независимо представляет собой водород или C1-C6 алкил или Rb и Rc,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо; каждый Rf и Rg независимо представляет собой водород или C1-C6 алкил или Rf и Rg,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из азота, кислорода и серы; и каждый Rj и Rk независимо представляет собой водород, замещенный метил или C3-C6 алкил или Rj и Rk,взятые вместе с атомом азота, к которому они присоединены, образуют 3-7-членное (например, 5-7-членное) гетероциклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из азота, кислорода и серы.
В некоторых вариантах осуществления, R1a представляет собой водород и R1b представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1b представляет собой гидрокси. В некоторых вариантах осуществления, R1b представляет собой алкил. В некоторых вариантах осуществления, R1b представляет собой метил или этил. В некоторых вариантах осуществления, R1b представляет собой алкокси. В некоторых вариантах осуществления, R1b представляет собой метокси. В некоторых вариантах осуществления, R1b представляет собой этокси. В некоторых вариантах осуществления, R1b представляет собой пропокси.
В некоторых вариантах осуществления, R1b представляет собой водород и R1a представляет собой гидрокси, алкил или алкокси. В некоторых вариантах осуществления, R1a представляет собой гидрокси. В некоторых вариантах осуществления, R1a представляет собой алкил. В некоторых вариантах осуществления, R1a представляет собой метил или этил. В некоторых вариантах осуществления, R1a представляет собой алкокси. В некоторых вариантах осуществления, R1a представляет собой метокси. В некоторых вариантах осуществления, R1a представляет собой этокси. В некоторых вариантах осуществления, R1a представляет собой пропокси.
В некоторых вариантах осуществления, R1a и R1bвзяты вместе с атомом углерода, к которому они присоединены, с образованием C(=O).
В некоторых вариантах осуществления, R2a представляет собой водород и R2b представляет собой гидрокси, алкил, метокси, замещенный этокси или C3-C6 алкокси. В некоторых вариантах осуществления, R2b представляет собой метокси. В некоторых вариантах осуществления, R2b представляет собой -OCF3. В некоторых вариантах осуществления, R2b представляет собой замещенный этокси. В некоторых вариантах осуществления, R2b представляет собой -OCH2CH2OMe. В некоторых вариантах осуществления, R2b представляет собой -OCH2CH2OH. В некоторых вариантах осуществления, R2b представляет собой -OCH2CF3. В некоторых вариантах осуществления, R2b представляет собой C3-C6 алкокси. В некоторых вариантах осуществления, R2b представляет собой пропокси. В некоторых вариантах осуществления, R2b представляет собой -OCH(CH3)2. В некоторых вариантах осуществления, R2b представляет собой -OCH2CH(CH3)2. В некоторых вариантах осуществления, R2b представляет собой циклопропокси.
В некоторых вариантах осуществления, R2b представляет собой водород и R2a представляет собой метокси. В некоторых вариантах осуществления, R2a представляет собой -OCF3. В некоторых вариантах осуществления, R2a представляет собой замещенный этокси. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OMe. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH2OH. В некоторых вариантах осуществления, R2a представляет собой -OCH2CF3. В некоторых вариантах осуществления, R2a представляет собой C3-C6 алкокси. В некоторых вариантах осуществления, R2a представляет собой пропокси. В некоторых вариантах осуществления, R2a представляет собой -OCH(CH3)2. В некоторых вариантах осуществления, R2a представляет собой -OCH2CH(CH3)2. В некоторых вариантах осуществления, R2a представляет собой циклопропокси.
В некоторых вариантах осуществления, R3 представляет собой водород. В некоторых вариантах осуществления, R3 представляет собой C1-C6 алкил.
В некоторых вариантах осуществления, соединение вводят путем внутривенного введения.
В некоторых вариантах осуществления, соединение вводят в комбинации с другим терапевтическим агентом.
В одном аспекте, обеспечивается способ для лечения расстройств, связанных с функцией ГАМК, у нуждающегося в этом субъекта, при этом способ включает введение субъекту терапевтически эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции соединения, как описано в настоящей заявке (например, соединение формулы (I), (Ia), (Ib), (II), (IIa), (IIb), (III), (IIIa), (IIIb), (IIIc), (IV) или (V)).
В одном аспекте, обеспечивается способ введения эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции данного соединения, как описано в настоящей заявке (например, соединение формулы (I), (Ia), (Ib), (II), (IIa), (IIb), (III), (IIIa), (IIIb), (IIIc), (IV) или (V)), нуждающемуся в этом субъекту, где субъект подвергается седативному действию и/или анестезии в течение двух часов.
В некоторых вариантах осуществления, субъект представляет собой млекопитающее. В некоторых вариантах осуществления, субъект представляет собой человека.
В некоторых вариантах осуществления, способ введения представляет собой внутривенное введение.
В некоторых вариантах осуществления, субъект подвергается седативному действию и/или анестезии при введении в течение одного часа. В некоторых вариантах осуществления, субъект подвергается мгновенному седативному действию и/или анестезии.
Фармацевтические композиции
В другом аспекте, настоящее изобретение обеспечивает фармацевтическую композицию, включающую соединение по настоящему изобретению и фармацевтически приемлемый эксципиент, например, композицию, подходящую для инъекции, такую как для внутривенного (IV) введения.
Фармацевтически приемлемые эксципиенты включают любой и все разбавители или другие жидкие носители, дисперсионные или суспензионные вспомогательные средства, поверхностно-активные агенты, изотонические агенты, консерванты, смазочные материалы и подобные, подходящие к конкретной желаемой дозированной форме, например, инъекции. Общие суждения в разработке и/или изготовлении агентов фармацевтических композиций можно найти, например, в Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) и Remington: The Science and Practice of Pharmacy, 21st Edition (Lippincott Williams & Wilkins, 2005).
Например, инъекционные препараты, такие как стерильные инъекционные водные суспензии, могут быть сформулированы в соответствии с известными в данной области знаниями, с использованием подходящих диспергирующих или смачивающих агентов и агентов для суспендирования. Иллюстративные эксципиенты, которые могут быть применены, включают, но не ограничены этим, воду, стерильный физиологический раствор или фосфатно-буферный солевой раствор или раствор Рингера.
В некоторых вариантах осуществления, фармацевтическая композиция дополнительно включает циклодекстриновое производное. Большинство общеизвестных циклодекстринов представляют собой α-, β- и γ-циклодекстрины, состоящие из 6, 7 и 8 α-1,4-связанных глюкозных единиц, соответственно, необязательно включающие один или несколько заместителей на связанных сахарных фрагментах, которые включают, но не ограничены этим, замещенное или незамещенное метилированное, гидроксиалкилированное, ацилированное и сульфоалкилэфирное замещение. В некоторых вариантах осуществления, циклодекстрин представляет собой сульфоалкиловый эфир β-циклодекстрина, например, например, сульфобутиловый эфир β-циклодекстрина, также известный как Captisol®. См., например, U.S. 5376645.В некоторых вариантах осуществления, композиция включает гексапропил-β-циклодекстрин. В более конкретном варианте осуществления, композиция включает гексапропил-β-циклодекстрин (10-50% в воде).
Композиция для инъекций может быть стерилизована, например, при помощи фильтрации через удерживающий бактерии фильтр или путем включения стерилизующих агентов в форме стерильной твердой композиции, которая может быть растворена или диспергирована в стерильной воде или другой стерильной среде для инъекций перед использованием.
Обычно, соединения, представленные в настоящей заявке, вводят в эффективном количестве. Количество фактически вводимого соединения обычно определяется врачом в свете соответствующих обстоятельств, включая подвергаемое лечению состояние, выбранный путь введения, фактическое вводимое соединение, возраст, массу, реакцию конкретного пациента, тяжесть симптомов пациента и подобные.
Композиции представлены в стандартной лекарственной форме для облегчения точного дозирования. Термин «стандартные лекарственные формы» относится к физически дискретным единицам, подходящих в качестве единичных дозировок для человека в качестве субъекта и других млекопитающих, каждая единица, содержащая заданное количество активного вещества, рассчитана для получения желаемого терапевтического эффекта, в сочетании с подходящим фармацевтическим эксципиентом. Типичные стандартные лекарственные формы включают предварительно наполненные, предварительно измеренные ампулы или шприцы с жидкими композициями. В таких композициях, соединение обычно представляет собой минорный компонент (от около 0,1% до около 50% по массе или предпочтительно от около 1% до около 40% по массе) с остатком, представляющим собой различные наполнители или носители и вспомогательные вещества, используемые в производственном процессе, полезные для формирования требуемой дозированной формы.
Уровни дозы для инъекций находятся в диапазоне от около 0,1 мг/кг/час до по меньшей мере 10 мг/кг/час, все в течение около 1 до около 120 часов и от около 24 до около 96 часов. Предварительная болюсная нагрузка от около 0,1 мг/кг до около 10 мг/кг или более также может быть вводена для достижения адекватных уровней стабильного состояния. Максимальная общая доза согласно прогнозам, не превышает около 2 г/сутки для пациента с массой тела от 40 до 80 кг. Иллюстративная композиция, например, может быть растворена или суспендирована в буферном стерильном физиологическом растворе инъецируемой водной среды до концентрации приблизительно 5 мг/мл.
Соединения, представленные в настоящей заявке, можно вводить в качестве единственного активного агента или они могут быть введены в комбинации с другими активными агентами. В одном аспекте, настоящее изобретение обеспечивает комбинацию соединения по настоящему изобретению и другого фармакологически активного агента. Введение в комбинации может осуществлять при использовании любой методики, очевидной специалисту в данной области, включая, например, раздельное, последовательное, параллельное и чередующееся введение.
Хотя описания фармацевтических композиций, представленные в настоящей заявке, направлены принципиально на фармацевтические композиции, которые являются подходящими для введения человеку, специалисту в данной области будет понятно, что такие композиции обычно подходят для введения животным различных видов. Модификация фармацевтических композиций, подходящих для введения людям для придания композиции свойств, подходящих для введение различным животным, хорошо изучена и обычный квалифицированный ветеринарный врач можем разработать и/или осуществить такие модификации при помощи простых экспериментов. Общие суждения в разработке и/или изготовлении фармацевтических композиций можно найти, например, в Remington: The Science и Practice of Pharmacy 21st Edition (Lippincott Williams & Wilkins, 2005).
Способы использования и Лечения
Как описано в настоящей заявке, настоящее изобретение направлено на 17-циано замещенные нейроактивные стероиды, включающие по меньшей мере один заместитель в одном или нескольких положениях 2, 4, и/или 11 на стероидном остове, предназначенные, например, для действия в качестве модуляторов ГАМК. В некоторых вариантах осуществления, такие соединения предусматриваются как полезные в качестве терапевтических средств для стимулирования анестизирующего и/или успокаивающего действия у субъекта. В некоторых вариантах осуществления, такие соединения предусматриваются как полезные в качестве терапевтических средств для лечения расстройства, связанного с ЦНС (например, расстройство сна, аффективное расстройство, расстройство шизофренического спектра, судорожный синдром, нарушение памяти и/или когнитивной способности, двигательное расстройство, расстройство личности, расстройства аутистического спектра, боль, травматическое поражение головного мозга, сосудистое заболевание; расстройства, связанные со злоупотреблением психоактивными веществами и/или абстинентный синдром отмены или шум в ушах) у субъекта, нуждающегося в этом (например, субъект с синдромом Ретта, синдромом фрагильной X-хромосомы или синдромом Эйнджелмена).
Таким образом, в одном аспекте, настоящее изобретение обеспечивает способ индукции седативного эффекта и/или анестезии у субъекта, включающий введение субъекту эффективного количества соединения по настоящему изобретению или его композиции. В некоторых вариантах осуществления, соединение вводят путем внутривенного введения.
Более ранние исследования (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987)) продемонстрировали, что некоторые 3α-гидроксилированные стероиды на порядки более сильные в качестве модуляторов комплекса ГАМК рецепторов (ГРК) по сравнению с другими, которые были описаны (см., например, Majewska et al., Science 232:1004-1007 (1986); Harrison et al., J Pharmacol. Exp. Ther. 241:346-353 (1987)). Majewska et al. и Harrison et al. раскрывают, что 3α-гидроксилированные-5-восстановленные стероиды могут только иметь намного более низкие уровни эффективности. In vitro и in vivo экспериментальные данные продемонстрировали, что высокая эффективность этих стероидов делает их терапевтически полезными в модуляции возбудимости головного мозга через ГРК (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987); Wieland et al., Psychopharmacology 118(l):65-71 (1995)).
Различные синтетические стероиды также были получены в качестве нейроактивных стероидов. См., например, Патент США № 5232917, который раскрывает нейроактивные стероидные соединения, полезные для лечения стресса, состояния тревоги, бессонницы, эпилепсии и аффективных расстройств, которые можно лечить ГРК-активными средствами, такие как депрессия, терапевтически благоприятным образом. Кроме того, ранее было продемонстрировано, что эти стероиды взаимодействуют на уникальном сайте на ГРК, который отличен от других известных сайтов взаимодействия (например, барбитураты, бензодиазепины и ГАМК), где ранее были выявлены терапевтически благоприятные эффекты на стресс, состояние тревоги, сон, аффективные расстройства и эпилепсию (см., например, Gee, K.W. and Yamamura, H.I., «Benzodiazepines and Barbiturates: Drugs for the Treatment of Anxiety, Insomnia and Seizure Disorders,» in Central Nervous System Disorders, Horvell, ed., Marcel-Dekker, New York (1985), pp. 123-147; Lloyd, K.G. and Morselli, P.L., «Psychopharmacology of GABAergic Drugs,» in Psychopharmacology: The Third Generation of Progress, H.Y. Meltzer, ed., Raven Press, N.Y. (1987), pp. 183-195; и Gee et al., European Journal of Pharmacology, 136:419-423 (1987). Эти соединения являются желательными, поскольку обладают продолжительностью действия, эффективностью и пероральной активностью (наряду с другими формами введения).
Соединения по настоящему изобретению, описанные в настоящей заявке, в основном, предназначены для модуляции ГАМК функции и, соответственно, для действия в качестве нейроактивных стероидов для лечения и профилактики связанных с ЦНС состояний у субъекта. Модуляция, в контексте настоящей заявки, относится к ингибированию или потенциированию функции ГАМК рецептора. Соответственно, соединения и фармацевтические композиции, представленные в настоящей заявке, можно использовать в качестве терапевтических средств для профилактики и/или лечения ЦНС состояний у млекопитающих, включая человека и отличных от человека млекопитающих. Таким образом, и как было указано выше, настоящее изобретение включает в свой объем и распространяется на описанные способы лечения, а также на соединения для таких способов и на применение таких соединений для получения лекарственных средств, полезных для таких способов.
В одном аспекте, настоящее изобретение обеспечивает способ для лечения расстройств, связанных с функцией ГАМК, у нуждающегося в этом субъекта, при этом способ включает введение субъекту терапевтически эффективного количества соединения, как описано в настоящей заявке, его фармацевтически приемлемой соли или фармацевтической композиции, включающей одно из соединений, как описано в настоящей заявке.
Типичные ЦНС состояния, связанные с ГАМК-модуляцией, включают, но не ограничиваются этим, расстройства сна [например, бессонница], аффективные расстройства [например, депрессия, дистимическое расстройство (например, легкая степень депрессии), биполярное расстройство (например, I и/или II), состояния тревоги (например, генерализованное тревожное расстройство (GAD), социальное тревожное расстройство), стресс, пост-травматическое стрессовое расстройство (PTSD), компульсивные расстройства (например, обсессивно-компульсивное расстройство (OCD))], расстройства шизофренического спектра [например, шизофрения, шизоаффективное расстройство], судорожные синдромы [например, эпилепсия (например, эпилептическое состояние (SE)), судорожные припадки], нарушения памяти и/или познавательной способности [например, нарушения внимания (например, синдром гиперактивности с дефицитом внимания (ADHD)), деменция (например, деменция альцгеймеровского типа, деменция с тельцами Леви, деменция сосудистого типа], двигательные расстройства [например, болезнь Гентингтона, болезнь Паркинсона], расстройства личности [например, антисоциальное расстройство личности, обсессивно-компульсивное расстройство личности], расстройства аутистического спектра (ASD) [например, аутизм, моногенетические причины аутизма, такие как синаптопатические, например, синдром Ретта, синдром фрагильной X-хромосомы, синдром Эйнджелмена], боль [например, невропатическая боль, связанные с травмами болевые синдромы, острая боль, хроническая боль], травматическое поражение головного мозга (TBI), сосудистые заболевания [например, острое нарушение мозгового кровообращения, ишемия, сосудистая патология], злоупотребление алкоголем и психоактивными веществами и/или абстинентные синдромы отмены [например, пристрастие к опиатам, кокаину и/или алкоголю] и шум в ушах.
Еще в одном аспекте, обеспечивается комбинация соединения по настоящему изобретению и другого фармакологически активного средства. Соединения, представленные в настоящей заявке, можно вводить в виде отдельного активного вещества, или их можно вводить в комбинации с другими веществами. Введение в комбинации можно осуществить любым способом, очевидным для специалистов в данной области, включая, например, раздельное, последовательное, одновременное и чередующееся введение.
В другом аспекте, обеспечивается способ лечения или профилактики возбудимости головного мозга у субъекта, подверженного или страдающего от состояния, связанного с возбудимостью головного мозга, включающий введение субъекту эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ лечения или профилактики стресса или состояния тревоги у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению или содержащей его композиции.
Еще в одном аспекте, обеспечивается способ облегчения или профилактики судорожной активности у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ облегчения или профилактики бессонницы у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению или содержащей его композиции.
Еще в одном аспекте, обеспечивается способ индукции сна и поддержания по существу уровня REM сна, присутствующего в нормальном сне, где не вызывается существенное повторение симптомов бессонницы, включающий введение эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ облегчения или профилактики ПМС или ПРД у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ лечения или профилактики аффективных расстройств у субъекта, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению. В некоторых вариантах воплощения аффективное расстройство представляет собой депрессию.
Еще в одном аспекте, обеспечивается способ индукции анестезии у субъекта, включающий введение субъекту эффективного количества соединения по настоящему изобретению.
Еще в одном аспекте, обеспечивается способ введения эффективного количества соединения по настоящему изобретению, нуждающемуся в этом субъекту, где субъект подвергается седативному действию и/или анестезии при введении в течение двух часов. В некоторых вариантах осуществления, субъект подвергается седативному действию и/или анестезии при введении в течение одного часа. В некоторых вариантах осуществления, субъекта подвергают мгновенному седативному действию и/или анестезии.
Еще в одном аспекте, обеспечивается способ улучшения познавательной способности или лечения нарушения памяти путем введения субъекту терапевтически эффективного количества соединения по настоящему изобретению. В некоторых вариантах воплощения, расстройство представляет собой болезнь Альцгеймера. В некоторых вариантах воплощения, расстройство представляет собой синдром Ретта.
Еще в одном аспекте, обеспечивается способ лечения нарушений внимания путем введения субъекту терапевтически эффективного количества соединения по настоящему изобретению. В некоторых вариантах воплощения, нарушение внимания представляет собой ADHD.
В некоторых вариантах воплощения, соединение вводят субъекту в течение длительного времени. В некоторых вариантах воплощения, соединение вводят субъекту перорально, подкожно, внутримышечно или внутривенно.
Анестезия/Седативный эффект
Анестезия представляет собой фармакологически индуцированное и обратимое состояние амнезии, аналгезии, потери чувствительности, потери рефлексов скелетных мышц, пониженной ответной реакции на стресс, или все это одновременно. Эти эффекты могут достигаться с использованием одного лекарственного средства, которое само обеспечивает правильную комбинацию эффектов, или иногда с использованием комбинации лекарственных средств (например, снотворных, седативных, паралитических, анальгетических) для достижения очень специфических комбинаций результатов. Анестезия позволяет пациентам подвергаться операциям и другим процедурам без дистресса и боли, которые бы они иначе испытывали.
Седативный эффект представляет собой уменьшение раздражимости или возбудимости путем введения фармакологического средства, обычно для облегчения медицинск процедуры или диагностической процедуры.
Седативный эффект и аналгезия включают продолжительность состояний сознания от минимального седативного эффекта (анксиолизис) до общей анестезии.
Минимальный седативный эффект также известен как анксиолизис. Минимальный седативный эффект представляет собой лекарственно-индуцированное состояние, при котором пациент отвечает нормально на вербальные комманды. Когнитивная функция и координация могут быть понижены. Дыхательная и сердечно-сосудистая функции типично не затрагиваются.
Умеренный седативный эффект/аналгезия (седация при сохраненном сознании) представляет собой лекарственно-индуцированное подавление сознания, при котором пациент отвечает целенаправленно на вербальную комманду, либо просто, либо вместе с легкой тактильной стимуляцией. Никаких вмешательств обычно не требуется для поддержания дыхания патента. Самопроизвольное дыхание типично является адекватным. Сердечно-сосудистая функция обычно сохраняется.
Глубокий седативный эффект/аналгезия представляет собой лекарственно-индуцированное подавление сознания, при котором пациент не может легко пробуждаться, но отвечает целенаправленно (не рефлекс отдергивания от болезненного стимула) после повторной или болезненной стимуляции. Независимая дыхательная функция может ухудшаться, и пациенту может потребоваться помощь для поддержания дыхания патента. Самопроизвольное дыхание может быть неадекватным. Сердечно-сосудистая функция обычно сохраняется.
Общая анестезия представляет собой лекарственно-индуцированную потерю сознания, при которой пациент не пробуждается даже в ответ на болезненные стимулы. Способность поддержания независимой дыхательной функции часто нарушается, и часто требуется помощь для поддержания дыхания патента. Может потребоваться вентиляция легких при положительном давлении в дыхательных путях из-за подавления самопроизвольного дыхания или лекарственно-индуцированного подавления нервно-мышечной функции. Сердечно-сосудистая функция может ухудшаться.
Седация в отделении интенсивной терапии (ICU) позволяет подавлять ощущение пациентами окружающей обстановки и ослаблять их ответ на внешние стимулы. Она может играть роль в уходе за критически больным пациентом и охватывает широкий спектр контроля симптомов, который варьируется у разных пациентов и у разных индивидуумов в ходе их заболевания. Тяжелый седативный эффект в интенсивной терапии используют для того, чтобы способствовать переносимости пациентами эндотрахеальной трубки, и для синхронизации аппарата искусственной вентиляции легких, часто с нервно-мышечными блокаторами.
В некоторых вариантах воплощения настоящего изобретения седативный эффект (например, длительный седативный эффект, непрерывный седативный эффект) индуцируют и поддерживают в ICU в течение продолжительного периода времени (например, 1 день, 2 дня, 3 дня, 5 дней, 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца). Средства, вызывающие длительный седативный эффект, могут иметь длительную продолжительность действия. Седативные средства в ICU могут иметь короткий период полувыведения.
Процедурная седация и аналгезия, также называемые как седация при сохраненном сознании, представляют собой метод введения седативных средств или диссоциативных средств с анальгетиками или без анальгетиков для индукции состояния, которое позволяет субъекту переносить неприятные процедуры, поддерживая при этом кардиореспираторную функцию.
Тревожные расстройства
Тревожное расстройство представляет собой общий термин, охватывающий несколько различных форм аномального и патологического страха и состояния тревоги. Существующие психиатрические диагностические критерии распознают широкий ряд тревожных расстройств.
Генерализованное тревожное расстройство представляет собой общее хроническое расстройство, характеризующееся длительным состоянием тревоги, которое не сфокусировано на каком-либо объекте или ситуации. Субъекты, страдающие от генерализованного состояния тревоги, испытывают не-специфический постоянный страх и беспокойство и чрезмерно беспокоятся по поводу текущих каждодневных дел. Генерализованное тревожное расстройство представляет собой наиболее распространенное тревожное расстройство, поражающее пожилых людей.
При паническом расстройстве, субъект страдает от кратких приступов сильного страха и опасения, часто выраженных дрожанием, лихорадкой, состоянием спутанности, головокружением, тошнотой, затрудненностью дыхания. Эти панические приступы, определяемые APA как страх или дискомфорт, которые резко возникают и достигают пика в течение менее десяти минут, могут длиться в течение нескольких часов и могут вызываться стрессом, страхом или даже физическими нагрузками; хотя точная причина не всегда очевидна. Помимо повторяющихся неожиданных панических приступов, диагноз панического расстройства также требует, чтобы указанные приступы имели хронические последствия: либо беспокойство по поводу потенциальной подоплеки этих приступов, постоянный страх будущих приступов или существенные изменения в поведении, связанном с приступами. Соответственно, субъекты, страдающие от панического расстройства, испытывают симптомы даже во время, не относящееся к конкретным паническим эпизодам. Часто субъекты, страдающие паническим расстройством, замечают нормальные изменения сердцебиентия, и это приводит к тому, что они считают, что что-то не в порядке с сердцем, или почти на грани следующего панического приступа. В некоторых случаях, при панических приступах возникает усиленное ощущение (соматосенсорная амплификация) функционирования организма, где любое ощущаемое физиологическое изменение интерпретируется как возможное угрожающее жизни заболевание (т.е. чрезмерная ипохондрия).
Обсессивно-компульсивное расстройство представляет собой тип тревожного расстройства, преимущественно характеризующегося повторяющимися навязчивыми состояниями (тревога, повтоянные и навязчивые мысли или образы) и импульсивными желаниями (побуждения совершить специфические акты или ритуалы). OCD паттерн мышления может быть связан с нерациональными понятиями, поскольку он включает веру в причинную взаимосвязь, которая, в реальности, не существует. Часто такой процесс является абсолютно нелогичным; например, импульсивное желание совершить прогулку в определенном паттерне может быть использовано для заглушения навязчивой идеи о грозящей опасности. И во многих случаях импульсивное желание совершенно необъяснимо, это просто побуждение совершить ритуал, инициируемое болезненной возбудимостью нервной системы. В редких случаях, субъекты, страдающие OCD, могут только испытывать навязчивые идеи, без каких-либо выраженных импульсивных желаний; гораздо меньшее число страдающих этим расстойством субъектов испытывают только импульсивные желания.
Отдельная самая большая категория тревожных расстройств - это фобия, которая включает все случаи, в которых страх и состояние тревоги вызываются специфическим стимулом или ситуацией. Субъекты, страдающие этим расстройством, типично предчувствуют ужасные последствия от встречи с объектом их страха, который может представлять собой любой объект от животного до определенной локализации до физиологической жидкости.
Пост-травматическое стрессовое расстройство или PTSD представляет собой тревожное расстройство, которое является результатом пережитой травмы. Пост-травматический стресс может быть результатом чрезвычайной ситуации, такой как боевая ситуация, насилие, ситуации с заложниками или даже серьезный несчастный случай. Оно также может быть результатом длительного (хронического) воздействия тяжелого стресса или, например, может быть у солдат, которые выдержали отдельные сражения, но не могут справиться с постоянной болевой ситуацией. Типичные симптомы включают непроизвольные прокручивания в памяти произошедшего, замкнутое поведение и депрессию.
Нейродегенеративные заболевания и расстройства
Термин «нейродегенеративное заболевание» включает заболевания и расстройства, которые связаны с прогрессивной потерей структуры или функции нейронов или гибелью нейронов. Нейродегенеративные заболевания и расстройства включают, но не ограничиваются этим, болезнь Альцгеймера (включая сопутствующие симптомы легкого, умеренного или тяжелого когнитивного нарушения); амиотрофический боковой склероз (ALS); гипоксические и ишемические поражения; атаксию и судороги (в том числе для лечения и профилактики судорожных припадков, вызванных шизоаффективным расстройством или лекарственными средствами, используемыми для лечения шизофрении); легкую забывчивость; отек головного мозга; церебеллярную атаксию включая нейроакантоцитозный синдром Мак-Лауда (MLS); закрытую травму головы; кому; контузионные поражения (например, травма позвоночника и травма головы); деменции, включая мультиинфарктную деменцию и старческую деменцию; нарушения сознания; синдром Дауна; лекарственно-индуцированн или медикаментозно-индуцированный Паркинсонизм (такой как нейролептически-индуцированная острая акатизия, острая дистония, Паркинсонизм или поздняя дискинезия, нейролептический злокачественный синдром или медикаментозно-индуцированный постуральный тремор); эпилепсию; синдром фрагильной X-хромосомы; синдром Жилль де ла Туретта; травму головы; ухудшение и потерю слуха; болезнь Гентингтона; синдром Леннокса; леводопа-индуцированную дискинезию; умственную отсталость; двигательные расстройства, включая акинезии и акинетические (ригидные) синдромы (включая кальцификацию базальных ганглиев, кортикобазальную дегенерацию, полисистемную атрофию, комплекс Паркинсонизм-ALS деменция, болезнь Паркинсона, постэнцефалический паркинсонизм и прогрессивный супрануклеарный паралич); мышечные спазмы и расстройства, связанные с мышечной спазматичностью или слабостью, включая хорею (такую как доброкачественная наследственная хорея, лекарственно-индуцированная хорея, гемибаллизм, болезнь Гентингтона, нейроакантоцитоз, хорея Сиденхэма и симптоматическая хорея), дискинезию (включая тики, такие как комплексные тики, простые тики и симптоматические тики), миоклонус (включая генерализованный миоклонус и фокальный циклоклонус), тремор (такой как тремор покоя, постуральный тремор и интенционный тремор) и дистонию (включая аксиальную дистонию, дистонический писчий спазм, гемиплегическую дистонию, пароксимальную дистонию и фокальную дистонию, такую как блефароспазм, оромандибулярную дистонию и спазматическую дисфонию и кривошею); нейрональное поражение, включая поражение зрения, ретинопатию или дегенерацию желтого пятна; нейротоксичное поражение, являющееся последствием острого нарушения мозгового кровообращения, тромбоэмболического инсульта, геморрагического о инсульта, церебральной ишемии, церебрального вазоспазма, гипогликемии, амнезии, гипоксии, аноксии, перинатальной асфиксии и остановки сердца; болезнь Паркинсона; судорожный припадок; эпилептический статус; острое нарушение мозгового кровообращения; шум в ушах; тубулярный склероз и нейродегенерацию, вызванную вирусной инфекцией (например, вызванную синдромом приобретенного иммунодефицита (СПИД) и энцефалопатиями). Нейродегенеративные заболевания также включают, но не ограничиваются этим, нейротоксичное поражение, которое является результатом церебрального инсульта я, тромбоэмболического инсульта, геморрагического инсульта, церебральной ишемии, церебрального вазоспазма, гипогликемии, амнезии, гипоксии, аноксии, перинатальной асфиксии и остановки сердца. Способы лечения или профилактики нейродегенеративного заболевания также включают лечение или профилактику потери нейронной функции, что является характерным для нейродегенеративного расстройства.
Эпилепсия
Эпилепсия представляет собой расстройство головного мозга, характеризующееся повторяющимися судорожными припадками в течение долгого времени. Типы эпилепсии могут включать, но не ограничиваются этим, генерализованную эпилепсию, например, детскую абсанс-эпилепсию, ювенильную миоклоническую эпилепсию, эпилепсию с большими судорожными припадками при пробуждении, синдром Уэста, синдром Леннокса-Гасто, парциальную эпилепсию, например, височную эпилепсию, лобнодолевую эпилепсию, доброкачественную фокальную эпилепсия у детей.
Эпилептическое состояние (SE)
Эпилептическое состояние (SE) может включать, например, судорожное эпилептическое состояние, например, раннее эпилептическое состояние, установившееся эпилептическое состояние, рефракторное эпилептическое состояние, супер-рефракторное эпилептическое состояние; не-судорожное эпилептическое состояние, например, генерализованное эпилептическое состояние, комплексное парциальное эпилептическое состояние; генерализованные периодические эпилептиформные разряды; и периодические латерализованные эпилептиформные разряды. Судорожное эпилептическое состояние характеризуется присутствием судорожного состояния с эпилептическими припадками, и может включать раннее эпилептическое состояние, установившееся эпилептическое состояние, рефракторное эпилептическое состояние, супер-рефракторное эпилептическое состояние. Раннее эпилептическое состояние лечат при помощи терапии первой линии. Установившееся эпилептическое состояние характеризуется состоянием эпилептических припадков, которые продолжаются, не смотря на лечение с использованием терапии первой линии, и применяют терапию второй линии. Рефракторное эпилептическое состояние характеризуется состоянием эпилептических припадков, которые продолжаются, не смотря на лечение с использованием терапии первой линии и терапии второй линии, обычно применяют общий анестетик. Супер-рефракторное эпилептическое состояние характеризуется состоянием эпилептических припадков, которые продолжаются, не смотря на лечение с использованием терапии первой линии, терапии второй линиии общего анестетика, в течение 24 часов или больше.
Не-судорожное эпилептическое состояние могут включать, например, фокальное не-судорожное эпилептическое состояние, например, комплексное парциальное не-судорожное эпилептическое состояние, простое парциальное не-судорожное эпилептическое состояние, слабовыраженное не-судорожное эпилептическое состояние; генерализованное не-судорожное эпилептическое состояние, например, позднее не-судорожное абсанс-эпилептическое состояние, атипичное не-судорожное абсанс-эпилептическое состояние или типичное не-судорожное абсанс-эпилептическое состояние.
В одном аспекте, настоящее изобретение обеспечивает способ лечения эпилепсии или состояния или эпилептического состояния у субъекта, включающий введение субъекту терапевтически эффективного количества соединения, как описано в настоящей заявке, его фармацевтически приемлемой соли или фармацевтической композиции, включающей одно из соединений, как описано в настоящей заявке.
Композиции, описанные в настоящей заявке, также можно вводить в виде профилактики субъекту, имеющему ЦНС расстройство, например, травматическое поражение головного мозга, эпилептическое состояние, например, судорожное эпилептическое состояние, например, раннее эпилептическое состояние, установившееся эпилептическое состояние, рефракторное эпилептическое состояние, супер-рефракторное эпилептическое состояние; не-судорожное эпилептическое состояние, например, генерализованное эпилептическое состояние, комплексное парциальное эпилептическое состояние; генерализованные периодические эпилептиформные разряды; и периодические латерализованные эпилептиформные разряды; до возникновения судорожного припадка.
Судорожный припадок
Судорожный припадок представляет собой физические обнаружения или изменения в поведении, которые возникают после эпизода аномальной электрической активности в головном мозге. Термин «судорожный припадок» часто используется взаимозаменяемо с термином «судороги». Судороги - это когда тело человека быстро и неконтролируемо сострясается. При судорогах мышцы человека повторно сокращаются и релаксируют.
На основании типа поведения и активности головного мозга, судорожные припадки подразделяют на две широкие категории: генерализованные и парциальные (также называемые локальными или фокальными). Классификация типа судорожного припадка помогает врачам диагностировать, имеет или нет пациент эпилепсию.
Генерализованные судорожные припадки индуцируются электрическими импульсами через весь головной мозг, тогда как парциальные судорожные припадки индуцируются (по меньшей мере изначально) электрическими импульсами в относительно небольшой части головного мозга. Часть головного мозга, генерирующую судорожные припадки, иногда называют очагом.
Существует шесть типов генерализованных судорожных припадков. Наиболее распространенный и драматический и поэтому наиболее хорошо известный представляет собой генерализованные судороги, также называемые большим судорожным припадком. В этом типе судорожного припадка пациент теряет сознание и обычно испытывает состояние коллапса. После потери сознания следует общее окостенение тела (называемое «тонической» фазой судорожного припадка) в течение 30-60 секунд, затем сильное дергание («клоническая» фаза) в течение 30-60 секунд, после которой пациент погружается в глубокий сон («послеприпадочная» или послесудорожная фаза). При большом судорожном припадке могут возникать поражения и осложнения, такие как прикусывание языка и недержание мочи.
Абсанс-судорожные припадки вызывают короткую потерю сознания (только на несколько секунд) с незначительными или вообще без симптомов. Пациент, наиболее часто ребенок, типично прерывает активность и безучастно смотрит. Эти судорожные припадки начинаются и заканчиваются внезапно, и могут возникать несколько раз в день. Пациентя обычно не понимают, что у них судорожный припадок, за исключением того, что они могут осозначать «потерю времени».
Миоклонические судорожные припадки состоят из спорадических судорожных движений, обычно по обеим сторонам тела. Пациенты иногда описывают судорожные движения как краткие электрические шоки. Когда они являются сильными, эти судорожные припадки могут привести к тому, что субъект роняет или непроизвольно бросает предметы.
Клонические судорожные припадки представляют собой повторяющиеся ритмические судорожные движения, которые затрагивают обе стороны тела одновременно.
Тонические судорожные припадки характеризуются затвердеванием мышц.
Атонические судорожные припадки состоят из внезапной и общей потери мышечного тонуса, особенно в руках и ногах, что часто приводит к падению.
Судорожные припадки, описанные в настоящей заявке, могут включать эпилептические судорожные припадки; острые повторяющиеся судорожные припадки; кластерные судорожные припадки; непрерывные судороги; перемежающиеся судороги; продолжительные судорожные припадки; повторяющиеся судорожные припадки; имеющие эпилептическй статус судорожные припадки, например, имеющее эпилептический статус рефракторное судорожное состояние, не-судорожное эпилептическое состояние; рефракторные судорожные припадки; миоклонические судороги; тонические судороги; тонические-клонические судороги; простые парциальные судороги; комплексные парциальные судороги; вторичные генерализованные судорожные припадки; атипичные абсанс-судорожные состояния; абсанс-судорожные состояния; атонические судороги; доброкачественную роландическую эпилепсию; фебрильные судороги; эмоциональные судороги; фокальные судороги; эпилептические припадки смеха; генерализованный судорожный приступ; младенческие судороги; джексоновскую эпилепсию; массивные билатеральные миоклонические судороги; мультифокальные судороги; младенческие судороги; ночные судороги; эпилепсию затылочной доли; пост-травматические судорожные припадки; слабовыраженные судороги; доброкачественную детскую эпилепсию с пиками на ЭЭГ в центрально-височной области; зрительные рефлекторные эпилептические припадки; или спровоцированные судорожные припадки.
Эквиваленты и Объем настоящего изобретения
В формуле изобретения артикли, такие как «a», «an» и «the», могут означать один или более чем один, если не указано иное или если из контекста не следует иное. Формула изобретения или описания, которые включают «или» между одним или несколькими членами группы, считаются удовлетворительными, если один, более чем один или все из членов группы присутствуют в, используются в, или связаны каким-либо иным образом с данным продуктом или способом, если не указано иное или если из контекста не следует иное. Настоящее изобретение включает варианты воплощения, в которых конкретно один член группы присутствует в, используется в, или связан каким-либо иным образом с данным продуктом или способом. Настоящее изобретение включает варианты воплощения, в которых более чем один или все из членов группы присутствуют в, используются в, или связаны каким-либо иным образом с данным продуктом или способом.
Кроме того, настоящее изобретение охватывает все варианты, комбинации и перестановки, в которых одно или несколько ограничений, элементов, условий и описательных терминов из одного или нескольких из перечисленных пунктов формулы изобретения включены в другой пункт. Например, любой пункт, который является зависимым от другого пункта, может быть модифицирован так, что он включает одно или несколько ограничений, присутствующих в любом другом пункте, который является зависимым от того же основного пункта. Когда элементы представлены в виде перечней, например, в формате группы Маркуша, каждая подгруппа элементов также является раскрытой, и любой элемент(элементы) может быть удален из группы. Должно быть понятно, что, как правило, когда на настоящее изобретение или аспекты настоящего изобретения ссылаются как на включающие конкретные элементы и/или характерные признаки, некоторые варианты воплощения настоящего изобретения или аспекты настоящего изобретения состоят или по существу состоят из таких элементов и/или характерных признаков. Для упрощения, такие варианты воплощения не были специальным образом описаны в тех же выражениях в настоящей заявке. Также следует отметить, что термины «включающий» и «содержащий» предполагаются как открытые и допускают включение дополнительных элементов или стадий. При указании диапазонов включены конечные точки. Кроме того, если не указано иное или если иное не следует из контекста и понимания специалистом в данной области, значения, которые выражены как диапазоны, подразумевают любое конкретное значение или поддиапазон в пределах указанного диапазона в различных вариантах воплощения настоящего изобретения, с точностью до одной десятой единицы нижнего предела диапазона, если только из контекста явно не следует иное.
Настоящая заявка содержи ссылки на различные изданные патенты, опубликованные патентные заявк, журнальные статьи и другие публикации, которые все включены в настоящую заявку посредством ссылки. В случае конфликта между каким-либо из включенных ссылочных документов и настоящим описанием, преимущество имеет настоящее описание. Кроме того, любой конкретный вариант воплощения настоящего изобретения, который подпадает под известный уровень техники, может быть явным образом исключен из любого одного или нескольких пунктов формулы изобретения. Поскольку такие варианты воплощения считаются известными специалистам в данной области, они могут быть исключены, даже если такое исключение явным образом не указано в настоящей заявке. Любой конкретный вариант воплощения настоящего изобретения может быть исключен из любого пункта формулы изобретения, по любой причине, независимо от того, связано это или нет с существующим уровнем техники.
Специалистам в данной области должны быть известны, или они могут определить с использованием не более чем рутинного экспериментировании, многие эквиваленты конкретных вариантов воплощения, описанных в настоящей заявке. Объем вариантов воплощения, описанных в настоящей заявке, нельзя рассматривать как ограничивающийся представленным выше Описанием, а как объем, представленный в формуле изобретения. Специалистам в данной области должно быть понятно, что возможны различные изменения и модификации этого описания, без отступления от сути или объема настоящего изобретения, определенных в следующей далее формуле изобретения.
Примеры
Для более полного понимания изобретения, описанного в настоящей заявке, ниже представлены следующие примеры. Примеры синтеза и биологические примеры, описанные в настоящей заявке, предназначены для иллюстрирации соединений, фармацевтических композиций и способов, представленных в настоящей заявке, и никоим образом не должны рассматриваться как ограничивающие их объем.
Способы синтеза
Соединения, представленные в настоящей заявке, можно получить из легко доступных исходных веществ с использованием следующие общих способов и процедур. Должно быть понятно, что, когда указаны типичные или предпочтительные условия способа (то есть, температуры, время реакций, мольные отношения взаимодействующих веществ, растворители, давлениеи т.п.), другие условия способа также можно использовать, если не указано иное. Оптимальные реакционные условия могут варьироваться в зависимости от конкретных используемых взаимодействующих веществ или растворителя, но такие условия может определить специалист в данной области путем рутинной оптимизации.
Кроме того, как должно быть очевидно специалистам в данной области, может возникнуть необходимость использования традиционных защитных групп для предотвращения нежелательных реакций, которым могут подвергаться некоторые функциональные группы. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия для введения и удаления защиты хорошо известны в данной области. Например, различные защитные группы и их введение и удаление описаны в T. W. Greene and P. G. M. Wuts, Protecting Groups in Organic Synthesis, 3nd Edition (John Wiley & Sons, New York, 1999) и цитируемых в нем ссылочных документах.
Соединения, представленные в настоящей заявке, можно выделить и очистить с использованием известных стандартных процедур. Такие процедуры включают (но не ограничиваются этим) перекристаллизацию, колоночную хроматографию, ВЭЖХ или сверхкритическую жидкостную хроматографию (SFC). Соединения, представленные в настоящей заявке, может получить специалист в области органического синтеза из известных или коммерчески доступных исходных веществ и реагентов. Типичные хиральные колонки, доступные для использования для разделения/очистки энантиомеров/диастереомеров, представленные в настоящей заявке, включают, но не ограничиваются этим, ChiralPak® AD-10, CHIRALCEL® OB, CHIRALCEL® OB-H, CHIRALCEL® OD, CHIRALCEL® OD-H, CHIRALCEL® OF, CHIRALCEL® OG, CHIRALCEL® OJ и CHIRALCEL® OK.
1H-ЯМР данные, представленные в настоящей заявке (например, для промежуточных соединений), могут быть частичным представлением ЯМР спектра соединения, например, соединения описанного в настоящей заявке. Например, представленные1H ЯМР данные могут исключать область между δ (млн.д.) около 1 до около 2,5 млн.д. Копии полного1H-ЯМР спектра для репрезентативных примеров распределенны на Фигурах 1-12.
Иллюстративный общий способ для препаративной ВЭЖХ: Колонка: Waters RBridge prep 10 мкм C18, 19×250 мм. Подвижная фаза: ацетонитрил, вода (NH4HCO3) (30 л воды, 24 г NH4HCO3, 30 мл NH3.H2O). Скорость потока: 25 мл/мин
Типичный общий способ для аналитической ВЭЖХ:Подвижная фаза: A: вода (10 мМ NH4HCO3), B: ацетонитрил Градиент: 5%-95% в в течение 1,6 или 2 минуты. Скорость потока: 1,8 или 2 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм при 45°C.
Пример 1. Синтез Соединений 1 и 2.

К раствору соединения 006-1, дегидроэпиандростерона (11 г, 38,17 ммоль) в EtOH (150 мл) добавляли 10% Pd/C (1,1 г). Затем смесь перемешивали в атмосфере H2 (2,812 кг/см2) при 40°C в течение 12 часов. ТСХ показывала, что исходное вещество полностью израсходовано. Смесь фильтровали и фильтрат концентрировали в вакууме с получением соединения 008-1(11 г, 99%) в виде белого твердого вещества.1H ЯМР (008-1): (400 МГц, CDCl3) δ 3,59-3,51 (м, 1H), 2,46-2,39 (м, 1H), 2,10-2,01 (м, 1H), 1,92-1,81 (м, 1H), 1,80-0,94 (м, 19H), 0,85 (с, 3H), 0,82 (с, 3H), 0,69-0,62 (м, 1H).
К раствору соединения 008-1 (11 г, 37,8 ммоль) в сухом пиридине (150 мл) порциями добавляли p-TsCl (11,4 г, 68,2 ммоль). Смесь перемешивали при 40°C в течение 6 часов. Медленно добавляли воду, затем белое твердое вещество осаждали. Белое твердое вещество фильтровали и промывали водным раствором HCl (200 мл ×3, 1M), с последующей промывкой водой (200 мл ×3). Твердое вещество сушили с получением соединения 008-2(13 г, 77%) в виде белого твердого вещества.1H ЯМР (008-2): (400 МГц, CDCl3) δ 7,78 (д, J=8,4 Гц, 2H), 7,32 (д, J=8,0 Гц, 1H), 4,44-4,38 (м, 1H), 2,46-2,39 (м, 4H), 2,10-2,00 (м, 1H), 1,94-1,87 (м, 1H), 1,80-1,45 (м, 12H), 1,29-0,89 (м, 8H), 0,83 (с, 3H), 0,80 (с, 3H), 0,67-0,61 (м, 1H).
К перемешиваемому раствору коллидина (150 мл) добавляли соединение 008-2 (12,0 г, 27,0 ммоль). Смесь перемешивали при 150°C в течение 4 часов. ТСХ показывала, что исходное вещество полностью израсходовано. Реакционную смесь обрабатывали водным раствором H2SO4(500 мл, 10%) и твердое вещество осаждали. Твердое вещество фильтровали, промывали при помощи H2SO4(500 мл ×3, 10%) и водой и сушили с получением неочищенного продукта. Очистка при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=100:1-50:1) давала смесь соединений 008-3 и 008-3A (7,2 г, 98%, 008-3:008-3A=3,5:1, подтверждено Н-ЯМР) в виде белого твердого вещества.1H ЯМР (008-3 и 008-3A): (400 МГц, CDCl3) δ 5,61-5,59 (м, 2H), 2,47-2,40 (м, 1H), 2,11-1,60 (м, 10H), 1,59-1,20 (м, 9H), 0,99-0,95 (м, 1H), 0,87 (м, 3H), 0,79-0,75 (м, 4H).
К перемешиваемому раствору смеси соединений 008-3 и 008-3A (7,2 г, 26,4 ммоль) в CH2Cl2 (100 мл) порциями добавляли m-CPBA (6,8 г, 39,6 ммоль) при 0°C. Смесь перемешивали при 0°C в течение 1 часа, затем при комнатной температуре в течение 12 часов. Растворитель удаляли и остаток разбавляли при помощи EtOAc; затем раствор последовательно промывали насыщенным водным раствором Na2SO3 (200 мл) и насыщенным водным раствором Na2CO3 (200 мл), сушили над MgSO4, фильтровали и упаривали досуха. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=50:1-30:1) с получением смеси соединений 008-4 и 008-4A (7,0 г, 94,7%) в виде белого твердого вещества.1H ЯМР (008-4 и 008-4A): (400 МГц, CDCl3) δ 3,16-3,15 (м, 1H), 3,12-3,11 (м, 1H), 2,46-2,39 (м, 1H), 2,08-2,01 (м, 1H), 1,94-0,90 (м, 19H), 0,87-0,85 (м, 3H), 0,79-0,77 (м, 3H), 0,69-0,68 (м, 1H).
Раствор смеси соединений 008-4 и 008-4A (3,0 г, 10,4 ммоль) в MeOH (30 мл) обрабатывали 5 каплями H2SO4(98%) при комнатной температуре. Через 1 час ТСХ показывала, что исходное вещество полностью израсходовано. Реакционную смесь обрабатывали водным раствором NaHCO3 и экстрагировали при помощи EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и упаривали досуха. Неочищенный продукт очищали при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=15:1-10:1) с получением соединения A1(1,7 г, 51%) и A2(0,5 г, 15%) в виде белого твердого вещества.1H ЯМР (A1): (400 МГц, CDCl3) δ 3,95-3,93 (м, 1H), 3,35-3,33 (м, 4H), 2,46-2,39(м, 1H), 2,10-1,66 (м, 7H), 1,62-1,18 (м, 11H), 1,05-0,98 (м, 1H), 0,95 (с, 3H), 0,85 (с, 3H), 0,79-0,73 (м, 1H).1H ЯМР (A2): (400 МГц, CDCl3) δ 4,02-4,01 (м, 1H), 3,30 (с, 3H), 3,03-3,02 (м, 1H), 2,46-2,39 (м, 1H), 2,11-1,60 (м, 7H), 1,59-1,43 (м, 4H), 1,33-0,99 (м, 7H), 0,97 (с, 3H), 0,85 (с, 3H), 0,77-0,70 (м, 1H).
К перемешиваемому раствору t-BuOK (3,5 г, 31,2 ммоль) в BuOH (20 мл) добавляли раствор соединения A1 (1,0 г, 3,12 ммоль) в этиленгликоль диметиловом эфире (20 мл) в атмосфере N2. Раствор TosMic (2,5 г, 12,48 ммоль) в этиленгликоль диметиловом эфире (10 мл) добавляли по каплям. Реакционную смесь перемешивали при комнатной температуре в течение 12 часов и затем обрабатывали водным раствором хлорида натрия с последующей обработкой хлористоводородной кислотой (2 M) до кислотного уровня. Смесь экстрагировали при помощи CH2Cl2 и органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали с получением остатка, который очищали при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=15:1-10:1) с получением соединения 2 (250 мг, 24%) и 1 (110 мг, 11%) в виде белого твердого вещества.1H ЯМР (2): (400 МГц, CDCl3) δ 3,95-3,93 (м, 1H), 3,35-3,33 (м, 4H), 2,28-2,23(м, 1H), 2,11-2,04 (м, 1H), 1,96-1,54 (м, 8H), 1,42-1,23 (м, 8H), 1,15-0,98 (м, 2H), 0,93 (с, 3H), 0,90 (с, 3H), 0,76-0,69 (м, 1H).1H ЯМР (1): (400 МГц, CDCl3) δ 3,95-3,93 (м, 1H), 3,35-3,30 (м, 4H), 2,57-2,54 (дд, J1=2,0 Гц, J2=7,2 Гц, 1H), 2,17-2,12 (м, 1H), 2,00-1,57 (м, 9H), 1,40-1,22 (м, 10H), 1,04-1,00 (м, 1H), 0,95 (с, 3H), 0,93-0,83 (м, 1H), 0,80 (с, 3H).
Пример 2. Синтез Соединений 3 и 38.


К раствору соединения 001-1 (20 г, 55 ммоль) в пиридине (200 мл) добавляли по каплям AC2O (8,45 г, 82,8 ммоль), затем смесь перемешивали при комнатной температуре в течение ночи. ТСХ (петролейный эфир:этилацетат=1:1) показывала, что исходное вещество полностью израсходовано. Смесь выливали в воду (1,5 л) при перемешивании. Полученное твердое вещество собирали при помощи фильтрации и промывали при помощи 500 мл HCl (1 M), с последующей промывкой водой (500 мл ×3). Твердое вещество сушили при помощи лиофилизации и получали соединение 001-2 (19,1 г, 85,9%) в виде белого твердого вещества.1H ЯМР (001-2): (400 МГц, CDCl3) δ 5,68 (с, 1H), 5,03 (д, J=17,6 Гц, 1H), 4,84 (д, J=17,6 Гц, 1H), 4,48-4,47 (м, 1H), 2,81-2,77 (м, 1H), 2,57-2,20 (м, 5H), 2,17 (с, 3H), 2,17-1,97 (м, 3H), 1,91-1,79 (м, 2H), 1,76-1,64 (м, 2H), 1,54-1,46 (м, 2H), 1,42 (с, 3H), 1,30-1,07 (м, 3H), 0,98 (с, 3H), 0,90-0,89 (м, 1H).
К раствору соединения 001-2 (17 г, 42 ммоль) в EtOH (19 мл) и THF (190 мл) добавляли CH(OEt)3(38,6 мл, 231 ммоль) и p-TsOH (463 мг, 2,31 ммоль). Смесь перемешивали при 20°C в течение 4 часов. ТСХ (петролейный эфир:этилацетат=1:1) показывала, что исходное вещество полностью израсходовано. Затем смесь разбавляли при помощи EtOAc (200 мл) и промывали водным раствором NaHCO3. Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=7:1) с получением соединения 001-3(12 г, 66,0%) в виде белого твердого вещества.1H ЯМР (001-3): (300 МГц, DMSO) δ 5,39 (с, 1H), 5,13-5,07 (м, 2H), 5,07-5,01 (м, 1H), 4,77-4,71 (д, J=23,4 Гц, 1H), 4,27 (м, 1H), 4,18-4,17 (м, 1H), 3,73-3,67 (м, 2H), 2,50-2,19 (м, 2H), 2,09 (с, 3H), 2,03-1,92 (м, 4H), 1,80-1,60 (м, 4H), 1,52-1,39 (м, 1H), 1,47-1,12 (м, 6H), 1,09 (с, 3H), 0,95-0,92 (м, H), 0,74 (с, 3H).
К раствору соединения 001-3 (1 г, 2,31 ммоль) в EtOAc (20 мл) и EtOH (20 мл) добавляли 10% Pd/C (100 мг). Смесь перемешивали при 20°C в течение 30 минут в атмосфере H2(1 атм), затем смесь фильтровали. К полученному раствору добавляли водный раствор HCl (12%, 50 мл) и перемешивали в течение 20 минут. Смесь экстрагировали при помощи EtOAc (50 мл). Органическую фазу промывали водным раствором NaHCO3 (50 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=2:1) с получением соединения 001-4(605 мг, 64,4%) в виде белого твердого вещества.1H ЯМР (001-4): (400 МГц, CDCl3) δ 5,04 (д, J=17,2 Гц, 1H), 4,83 (д, J=17,2 Гц, 1H), 4,45-4,44 (м, 1H), 2,75-2,65 (м, 1H), 2,52-2,40 (м, 1H), 2,35-2,20 (м, 3H), 2,18 (с, 3H), 2,10-2,02 (м, 2H), 2,00-1,78 (м, 3H), 1,78-1,60 (м, 3H), 1,58-1,30 (м, 6H), 1,26 (с, 3H), 0,94 (с, 3H), 0,83-0,79 (м, 1H).
К раствору соединения 001-4 (5,3 г, 13,05 ммоль) в THF (50 мл) добавляли по каплям раствор K-селектрида (19,34 мл, 19,34 ммоль, 1M в THF) при -78°C. Смесь перемешивали при -78°C в течение 3 часов. Затем смесь гасили при помощи H2O2(0,4 мл). Смесь экстрагировали при помощи EtOAc (80 мл) и H2O (80 мл). Органическую фазу промывали водным раствором NaHCO3 (100 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта (5,9 г), который использовали на следующей стадии без очистки.
К раствору соединения 001-5(5,9 г, 14,46 ммоль) в EtOH (33 мл) и CH2Cl2 (33 мл) порциями добавляли NaBH4(1,1 г, 28,92 ммоль). Смесь перемешивали при 15°C в течение ночи. Реакционную смесь гасили ацетоном (33 мл) и H2O (33 мл). К смеси добавляли MeOH (200 мл), H2O (200 мл) и NaIO4(12,26 г, 57,56 ммоль), затем смесь перемешивали при 60°C в течение ночи. Смесь охлаждали до комнатной температуры и экстрагировали при помощи EtOAc (3×100 мл). Объединенную органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=2:1) с получением соединения 001-6(2,5 г, 62%, две стадии) в виде белого твердого вещества.1H ЯМР (001-6): (400 МГц, CDCl3) δ 4,45-4,40 (м, 1H), 4,10-4,05 (м, 1H), 2,50-2,43 (м, 1H), 2,01-1,90 (м, 5H), 1,78-1,35 (м, 12H), 1,28-1,22 (м, 4H), 1,10 (с, 3H), 1,04 (с, 3H), 0,93-0,83 (м, 4H),
К раствору соединения 001-6(2,5 г, 8,17 ммоль) в пиридине (25 мл) добавляли TsCl (2,33 г, 12,25 ммоль). Смесь перемешивали при 25°C в течение 10 часов. ТСХ показывала, что большая часть исходного вещества израсходована. Реакционную смесь экстрагировали при помощи EtOAc (50 мл ×2), промывали насыщенным солевым раствором (50 мл), органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир=1/4) с получением соединения 001-7(2 г, 53%) в виде белого твердого вещества.1H ЯМР (001-7): (400 МГц, CDCl3) δ 7,78 (д, J=8,0 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 4,43-4,37 (м, 1H), 4,35-4,30 (м, 1H), 2,44 (с, 3H), 2,00-1,68 (м, 8H), 1,62-1,57 (м, 3H), 1,54-1,38 (м, 3H), 1,35-1,14 (м, 5H), 1,12 (с, 3H), 1,03 (с, 3H), 1,01-0,95 (м, 2H).
К раствору соединения 001-7 (8,0 г, 17,39 ммоль) в CH2Cl2 (100 мл) порциями добавляли PCC (7,5 г, 34,8 ммоль) при комнатной температуре, затем реакционную смесь перемешивали в течение ночи. ТСХ (петролейный эфир:этилацетат=1:1) показывала, что реакция завершена. Смесь отфильтровывали, фильтрат концентрировали с получением неочищенного продукта, который очищали при помощи флэш-хроматографии, элюируя смесью (петролейный эфир:этилацетат=3:1), с получением соединения 018-1 (6,5 г, 81%) в виде белого твердого вещества.
Соединение 018-1 (12 г, 26,2 ммоль) растворяли в коллидине (40 мл), затем раствор нагревали до 130°C и поддерживали при такой температуре в течение 2 часов. ТСХ (петролейный эфир:этилацетат=3:1) показывала, что реакция завершена. После того, как смесь была восстановлена до комнатной температуры, ее выливали в водный раствор H2SO4(10%). Раствор экстрагировали этилацетатом (100 мл ×3). Объединенный органический слой промывали насыщенным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4иконцентрировали растворитель с получением практически чистого соединения 018-2 (7,0 г, 93,0%) в виде белого твердого вещества.1H ЯМР (018-2): (400 МГц, CDCl3) δ 5,65-5,50 (м, 2H), 2,85-2,75 (м, 1H), 2,57-2,50 (м, 1H), 2,45-2,40 (м, 2H), 2,39-2,13 (м, 3H), 2,11-2,07 (м, 1H), 1,96-1,74 (м, 3H), 1,65-1,60 (м, 2H),1,51-1,48 (м, 1H), 1,28-1,18 (м, 4H), 0,98 (с, 3H), 0,84 (с, 3H).
К раствору соединения 018-2 (7,0 г, 24,3 ммоль) в CH2Cl2 (50 мл) порциями добавляли m-CPBA(6,3 г, 36,5 ммоль). Полученную смесь перемешивали при 10°C в течение 20 часов. ТСХ (петролейный эфир:этилацетат=3:1) показывала, что всегда оставалось незначительное количество исходного вещества. Затем в раствор добавляли насыщенный раствор Na2SO3 (100 мл). Органический слой промывали насыщенным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4иконцентрировали растворитель. Остаток очищали при помощи флэш-хроматографии, элюируя смесью (петролейный эфир:этилацетат=10:1), с получением соединения 018-3 (4,8 г, 66%) в виде белого твердого вещества.1H ЯМР (018-3): (400 МГц,CDCl3) δ 3,17-3,10 (м, 2H), 2,84-2,78 (м, 1H), 2,56-2,22 (м, 4H), 2,10-2,00 (м, 2H), 1,98-1,80 (м, 3H), 1,74-1,58 (м, 3H), 1,42-1,05 (м, 5H), 0,98 (с, 3H), 0,82 (с, 3H).
К раствору смеси соединений 018-3 и 018-3A (0,9 г, 3 ммоль) в MeOH (10 мл) добавляли H2SO4(5 капель, 98%). Смесь перемешивали при 20°C в течение 2 часов. ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором NaHCO3 (40 мл). Смесь экстрагировали при помощи EtOAc (20 мл ×2) и промывали насыщенным солевым раствором (20 мл). Органическую фазу сушили над Na2SO4 и концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=4:1) с получением чистого соединения 044-1 (200 мг, 20%) и смеси соединений 044-1 и 044-1A (400 мг, 40%) в виде белого твердого вещества.
1H ЯМР (044-1): (300 МГц, CDCl3) δ 3,96-3,90 (м, 1H), 3,37 (с, 3H), 3,31-3,23 (м, 1H), 2,80-2,71 (м, 1H), 2,59-2,47 (м, 1H), 2,45-2,37 (м, 1H), 2,34-2,23 (м, 2H), 2,20-2,15(м, 1H), 2,14-2,04 (м, 1H), 1,98-1,71 (м, 5H), 1,68-1,57 (м, 1H), 1,44-1,39 (м, 1H), 1,38-1,23 (м, 4H), 1,17 (с, 3H), 1,15-1,09 (м, 1H), 0,82 (с, 3H).
К перемешиваемому раствору t-BuOK (6,53 г, 58,35 ммоль) в BuOH (50 мл) добавляли раствор соединения 044-1 (3,9 г, 11,67 ммоль) в 1,2-диметоксиэтан (50 мл) в атмосфере N2. Затем добавляли по каплям раствор TosMic (3,41 г, 17,5 ммоль) в 1,2-диметоксиэтане (30 мл). Смесь перемешивали при комнатной температуре в течение 4 часов. Смесь обрабатывали водным раствором хлорида натрия с последующей обработкой хлористоводородной кислотой (2 M) до достижения уровня pH=2. Смесь экстрагировали при помощи CH2Cl2 и органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4, затем концентрировали с получением остатка, который очищали при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=4:1) с получением соединения3(1,24 г, 32%) и соединения 38(0,75 г, 19%) в виде белого твердого вещества.1H ЯМР: (3) (300 МГц, CDCl3) δ 3,92-3,89 (м, 1H), 3,30 (с, 3H), 3,30-3,25 (м, 1H), 2,78-2,73 (м, 1H), 2,55-2,47 (м, 2H), 2,29-2,17 (м, 2H), 2,08-1,92 (м, 1H), 1,90-1,82 (м, 1H), 1,80-1,68 (м, 4H), 1,67-1,59 (м, 1H), 1,58-1,48 (м, 2H), 1,47-1,32 (м, 1H), 1,30-1,23 (м, 3H), 1,17 (с, 3H), 1,10-1,09 (м, 1H), 0,87 (с, 3H).1H ЯМР: (38) (300 МГц, CDCl3) δ 3,95-3,90 (м, 1H), 3,37 (с, 3H), 3,30-3,25 (м, 1H), 2,78-2,70 (м, 2H), 2,52-2,45 (м, 1H), 2,33-2,30 (м, 1H), 2,30-1,21 (м, 1H), 2,20-2,19 (м, 1H), 2,07-1,92 (м, 2H), 1,88-1,78 (м, 3H), 1,77-1,68 (м, 1H), 1,55-1,50 (м, 1H), 1,49-1,26 (м, 7H),1,13 (с, 3H), 0,88 (с, 3H).
Пример 3. Синтез Соединений 47 и 48.

К раствору смеси соединений 008-4 и 008-4A (2,5 г, 8,68 ммоль) в EtOH (75 мл) добавляли H2SO4(10 капель, 98%). Смесь перемешивали при 20°C в течение 3 часов. ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором NaHCO3 (40 мл). Смесь экстрагировали при помощи EtOAc (100 мл ×2) и промывали водным раствором NaCl (50 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат:петролейный эфир=1:2) с получением смеси соединений 039-1 и 051-1 (1,8 г, 60%) в виде белого твердого вещества.
К раствору t-BuOK (1,47 г, 13,16 ммоль) в t-BuOH (10 мл) по каплям добавляли раствор соединения 039-1(440 мг, 1,32 ммоль) в 1,2-диметоксиэтане (4 мл) при комнатной температуре. Затем раствор TosMic (1,0 г, 5,1 ммоль) в 1,2-диметоксиэтане (6 мл) добавляли по каплям к смеси. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 часов. После того, как ВЭЖХ показывала, что исходное вещество полностью израсходовано, смесь гасили водным раствором HCl и экстрагировали при помощи EtOAc (15 мл ×3). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали с получением неочищенного продукта. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=20:1) с получением продуктов 47 (40,8 мг, 8,98%) и 48 (25,5 мг, 5,61%).1H ЯМР (47): (400 МГц, CDCl3) δ 3,96-3,92 (м, 1H), 3,61-3,52 (м, 1H), 3,45-3,35 (м, 2H), 2,32-2,22 (м, 1H), 2,18-2,05 (м, 1H), 2,00-1,60 (м, 7H), 1,45-1,20 (м, 9H), 1,20-1,05 (м, 4H), 1,05-0,91 (м, 5H), 0,88 (с, 3H), 0,80-0,71 (м, 1H).1H ЯМР (48): (400 МГц, CDCl3) δ 3,95-3,91 (м, 1H), 3,64-3,50 (м, 1H), 3,45-3,31 (м, 2H), 2,58-2,52 (м, 1H), 2,15-2,11 (м, 1H), 2,05-1,96 (м, 1H), 1,92-1,75 (м, 3H), 1,75-1,62 (м, 4H), 1,48-1,23 (м, 10H), 1,20-1,11 (м, 3H), 1,10-0,98 (м, 1H), 0,95 (с, 3H), 0,85-0,82 (м, 4H).
Пример 4. Синтез Соединения 4.

Раствор соединения 008-4 (1,0 г, 3,46 ммоль) в 2-метоксиэтаноле (10 мл) обрабатывали 3 каплями дымящей H2SO4 при комнатной температуре. Через 1 час реакционную смесь обрабатывали водным раствором NaHCO3. Полученный раствор экстрагировали при помощи 2×100 мл этилацетата и органические слои объединяли и сушили над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=10:1) с получением продукта 063-1 (330 мг, 26%) в виде белого твердого вещества.1H ЯМР (063-1): (400 МГц, CDCl3) δ 3,97-3,96 (м, 1H), 3,67-3,63 (м, 1H), 3,53-3,51 (м, 3H), 3,50-3,45 (м, 1H), 3,38 (с, 3H), 2,46-2,41 (м, 1H), 1,92-1,65 (м, 8H), 1,54-1,21 (м, 11H), 1,02-0,98 (м, 1H), 0,96 (с, 3H), 0,85 (с, 3H), 0,78-0,75 (м, 1H).
К перемешиваемому раствору t-BuOK (1,01 г, 9,00 ммоль) в BuOH (3 мл) добавляли раствор соединения 063-1 (330 мг, 0,90 ммоль) в 1,2-диметоксиэтане (3 мл) в атмосфере N2. Раствор TosMic (720 мг, 3,60 ммоль) в 1,2-диметоксиэтане (3 мл) затем добавляли по каплям. Смесь перемешивали при комнатной температуре в течение 12 часов. Смесь обрабатывали водным раствором хлорида натрия с последующей обработкой хлористоводородной кислотой (2 M) до достижения уровня pH=2. Смесь экстрагировали при помощи CH2Cl2 и органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, затем концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=15:1-10:1) с получением соединения 4 (25 мг, 12%).1H ЯМР (4): (400 МГц, CDCl3) δ 3,97-3,96 (м, 1H), 3,68-3,64 (м, 1H), 3,53-3,51 (м, 3H), 3,50-3,46 (м, 1H), 3,38 (с, 3H), 2,28-2,23 (м, 1H), 2,11-2,07 (м, 1H), 1,95-1,60 (м, 7H), 1,53-1,23 (м, 10H), 1,15-1,11 (м, 1H), 1,02-0,97 (м, 1H), 0,96 (с, 3H), 0,92 (с, 3H), 0,76-0,70 (м, 1H).
Пример 5. Синтез Соединений 5 и 6.

К раствору соединения 008-4(2 г, 6,9 ммоль) в изопропаноле (20 мл) добавляли концентрированный раствор H2SO4 (10 капель). Раствор перемешивали при комнатной температуре в течение 3 часов. После того, как ТСХ показывала, что исходное вещество полностью израсходовано, смесь гасили водным раствором NaHCO3 и экстрагировали при помощи EtOAc (25 мл ×3). Объединенные органические слои сушили над Na2SO4, концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=20:1) с получением соединения 062-1(430 мг, 17,77%) в виде белого твердого вещества.1H ЯМР (062-1): (400 МГц, CDCl3) δ 3,85-3,80 (м, 1H), 3,70-3,60 (м, 1H), 3,50-3,45 (м, 1H), 2,50-2,35 (м, 1H), 2,10-1,75 (м, 5H), 1,35-1,25 (м, 9H), 1,15-1,06 (м, 5H), 0,95 (с, 3H), 0,85-0,86 (м, 9H), 0,8-0,7 (м, 1H).
К раствору t-BuOK (1,38 г, 12,35 ммоль) в t-BuOH (10 мл) по каплям добавляли раствор соединения 062-1(430 мг, 1,23 ммоль) в 1,2-диметоксиэтане (4 мл) при комнатной температуре. Затем раствор TosMic (964 мг, 4,94 ммоль) в 1,2-диметоксиэтане (6 мл) добавляли по каплям к смеси. Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 часов. После этого ВЭЖХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором HCl и экстрагировали при помощи EtOAc (15 мл ×3). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали с получением неочищенного продукта. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=20:1) с получением продукта 5 (27,1 мг, 6,1%) в виде белого порошка и соединения 6 (12,7 мг, 2,86%).1H ЯМР(5): (400 МГц, CDCl3) δ 3,87-3,80 (м, 1H), 3,68-3,60 (м, 1H), 3,52-3,46 (м, 1H), 2,30-2,20 (м, 1H), 2,15-2,05 (м, 1H), 2,0-1,6 (м, 7H), 1,55-1,45 (м, 2H), 1,45-1,19 (м, 9H), 1. 1,19-1,03 (м, 7H), 1,03-0,92 (м, 5H), 0,92-0,88 (м, 4H), 0,75-0,65(м, 1H).1H ЯМР(6): (400 МГц, CDCl3) δ 3,86-3,80 (м, 1H), 3,68-3,60 (м, 1H), 3,52-3,47 (м, 1H), 2,58-2,52 (м, 1H), 2,20-2,10 (м, 1H), 2,00-1,90 (м, 1H), 1,90-1,60 (м, 7H), 1,55-1,45 (м, 2H), 1,45-1,20 (м, 9H), 1,20-1,05 (м, 6H), 1,05-1,00 (м, H), 0,95 (с, 3H), 0,85-0,75 (м, 4H).
Пример 6. Синтез Соединения 7.
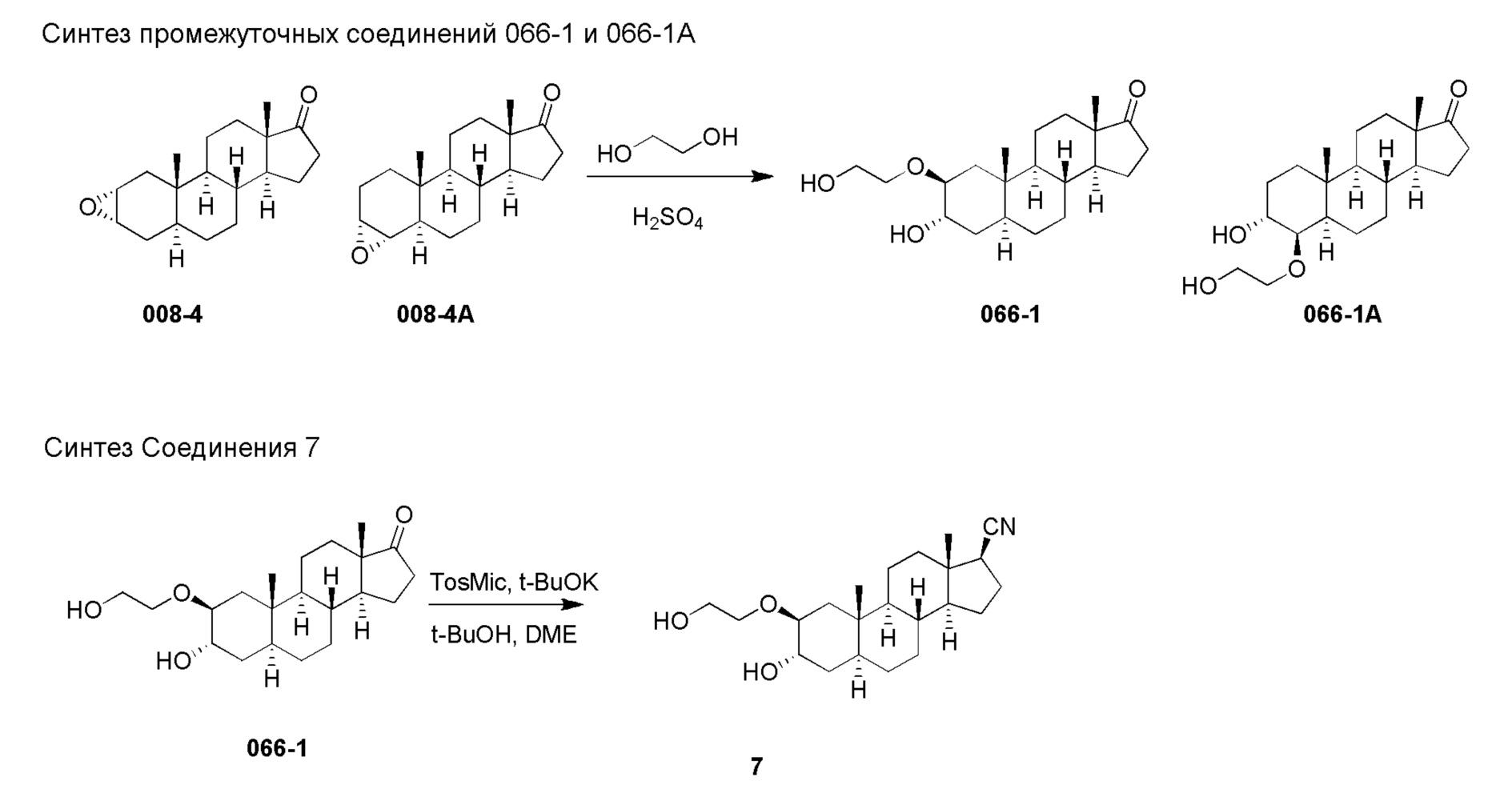
К раствору смеси соединений 008-4 и 008-4A (4,0 г, 13,87 ммоль) в THF (10 мл) добавляли этан-1,2-диол (30 мл). Затем медленно добавляли 4 капли дымящей H2SO4. Смесь перемешивали при комнатной температуре в течение 1 часа. ТСХ (петролейный эфир:этилацетат =1:3) указывала, что реакция завершена, затем реакционную смесь обрабатывали водным раствором NaHCO3. Полученный раствор экстрагировали при помощи 3×100 мл этилацетата и органические слои объединяли и сушили над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=3:1) с получением продукта 066-1 (2,8 г, 57,6%) и 066-1A (0,6 г, 12,3%) в виде белого твердого вещества.1H ЯМР(066-1): (400 МГц, CDCl3) δ 3,97-3,96 (м, 1H), 3,71-3,65 (м, 2H), 3,64-3,60 (м, 1H), 3,51-3,46 (м, 2H), 2,46-2,39 (м, 1H), 2,10-2,01 (м, 1H), 1,95-1,45 (м, 11H), 1,34-1,21 (м, 7H), 1,03-0,98 (м, 1H), 0,95 (с, 3H), 0,85 (с, 3H), 0,79-0,76 (м, 1H).1H ЯМР(066-1A): (400 МГц, CDCl3) δ 3,99-3,98 (м, 1H), 3,70-3,67 (м, 3H), 3,45-3,43 (м, 1H), 3,21-3,20 (м, 1H), 2,46-2,39 (м, 1H), 2,08-1,45 (м, 11H), 1,42-1,20 (м, 6H), 1,04-1,01 (м, 1H), 0,99-0,95 (м, 3H), 0,85 (с, 3H), 0,79-0,75 (м, 1H).
К перемешиваемому раствору t-BuOK (1,28 г, 11,4 ммоль) в t-BuOH (3 мл) добавляли раствор соединения 066-1 (400 мг, 1,14 ммоль) в 1,2-диметоксиэтане (3 мл) в атмосфере N2. Затем добавляли по каплям раствор TosMic (890 мг, 4,56 ммоль) в 1,2-диметоксиэтане (3 мл). Смесь перемешивали при комнатной температуре в течение 12 часов. Смесь обрабатывали водным раствором хлорида натрия с последующей обработкой хлористоводородной кислотой (2 M) до кислотного уровня. Смесь экстрагировали при помощи 3×100 мл CH2Cl2 и органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, затем концентрировали с получением остатка, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=5:1-2:1) с получением неочищенного продукта. Затем неочищенный продукт очищали при помощи препаративной ВЭЖХ с получением соединения 7 (60 мг, 14,5%).1H ЯМР (7): (400 МГц, CDCl3) δ 3,97-3,96 (м, 1H), 3,71-3,65 (м, 2H), 3,64-3,61 (м, 1H), 3,51-3,48 (м, 2H), 2,28-2,24 (м, 1H), 2,09-2,08 (м, 1H), 1,95-1,61 (м, 9H), 1,50-1,21 (м, 10H), 1,18-1,05 (м, 1H), 1,03-0,98 (м, 1H), 0,95 (с, 3H), 0,92 (с, 3H), 0,79-0,76 (м, 1H).
Пример 7. Синтез Соединений 8 и 14.

Раствор соединения 001-7(2 г, 4,35 ммоль) в коллидине (10 мл) перемешивали при 140°C в течение 4 часов. ТСХ показывала, что исходное вещество полностью израсходовано. К смеси добавляли H2SO4(10 мл, 1 M) и экстрагировали при помощи EtOAc (30 мл ×2) и водным раствором NaCl (30 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир=1/20) с получением смеси соединений 001-8 и 001-8A (1,1 г, 88%) в виде белого твердого вещества.
К раствору смеси соединений 001-8 и 001-8A(1,1 г, 3,82 ммоль) в CH2Cl2(10 мл) порциями добавляли m-CPBA (0,99 г, 5,73 ммоль) при 0°C. Смесь перемешивали при 0°C в течение 1 часа и нагревали до комнатной температуры и перемешивали в течение ночи. ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором Na2S2O3 (30 мл) и водным раствором NaHCO3(30 мл), экстрагировали при помощи EtOAc (30 мл ×2) и промывали насыщенным солевым раствором (30 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир =1/15) с получением смеси соединений 001-9 и 001-9A(1,0 г, 86%).
К раствору смеси соединений 001-9 и 001-9A (1 г, 3,29 ммоль) в MeOH (25 мл) добавляли H2SO4(10 капель, 98%). Смесь перемешивали при 20°C в течение 1 часа. ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором NaHCO3 (40 мл). Смесь экстрагировали при помощи EtOAc (50 мл ×2) и промывали насыщенным солевым раствором (50 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир=1/2) с получением соединения A3 (550 мг, 42,6%) и A4 (240 мг, 18,6%) в виде белого твердого вещества.1H ЯМР (A3): (400 МГц, CDCl3) δ 4,45-4,42 (м, 1H), 3,98-3,94 (м, 1H), 3,42-3,39 (м, 1H), 3,34 (с, 3H), 2,50-2,43 (м, 1H), 2,10-1,78 (м, 7H), 1,65-1,20 (м, 10H), 1,19 (с, 4H), 1,12 (с, 3H), 1,10-1,00 (м, 1H), 0,86-0,79 (м, 1H).1H ЯМР (A4): (400 МГц, CDCl3) δ 4,41-4,40 (м, 1H), 4,04-4,03 (м, 1H), 3,34 (с, 3H), 3,05-3,01 (м, 1H), 2,51-2,44 (м, 1H), 2,08-1,96 (м, 5H), 1,95-1,94 (м, 1H), 1,82-1,78 (м, 1H), 1,65-1,55 (м, 3H), 1,53-1,48 (м, 5H), 1,27 (с, 3H), 1,10 (с, 3H), 1,10-1,00 (м, 1H), 0,77-0,74 (м, 1H).
К перемешиваемому раствору t-BuOK (830 мг, 7,4 ммоль) в BuOH (4 мл) добавляли раствор соединенияA3 (250 мг, 0,74 ммоль) в 1,2-диметоксиэтане (3 мл) в атмосфере N2. Затем добавляли по каплям раствор TosMic (290 мг, 1,48 ммоль) в 1,2-диметоксиэтане (3 мл). Смесь перемешивали при комнатной температуре в течение 12 часов. Смесь обрабатывали водным раствором хлорида натрия с последующей обработкой хлористоводородной кислотой (2 M) до кислотного уровня. Смесь экстрагировали при помощи CH2Cl2 и органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, затем концентрировали с получением остатка, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=10:1-8:1) с получением соединений 8 (43 мг, 16%) и 14 (15 мг, 6%) в виде белых порошков.1H ЯМР (8): (400 МГц, CDCl3) δ 4,40-4,39 (м, 1H), 3,96-3,95 (м, 1H), 3,37-3,34 (м, 4H), 2,22-2,18 (м, 1H), 2,11-1,76 (м, 8H), 1,53-1,52 (м, 1H), 1,46-1,18 (м, 7H), 1,14-1,13 (м, 6H), 1,00-0,94 (м, 1H), 0,80-0,77 (м, 1H).1H ЯМР (14): (300 МГц, CDCl3) δ 4,48-4,46 (м, 1H), 3,96-3,95 (м, 1H), 3,35-3,33 (м, 4H), 2,55-2,51 (м, 1H), 2,20-2,16 (м, 1H), 2,05-1,59 (м, 8H), 1,50-1,22 (м, 7H), 1,21-1,18 (м, 1H), 1,15 (с, 3H), 1,03 (с, 3H), 0,92-0,83 (м, 1H).
Пример 8. Синтез Соединений 9 и 15.

К раствору соединения 001-1 (4 г, 11,02 ммоль) в DMF (50 мл) добавляли 10% Pd/C (400 мг). Смесь перемешивали в атмосфере H2(3,515 кг/см2) при 30°C в течение ночи. Затем смесь фильтровали и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир=1/2) с получением соединения 005-1 (4 г, 100%) в виде белого твердого вещества.1H ЯМР (005-1): (400 МГц, CDCl3) δ 5,06 (д, J=17,2 Гц, 1H), 4,83 (д, J=17,2 Гц, 1H), 4,45-4,40 (м, 1H), 2,79-2,62 (м, 1H), 2,35-2,34 (м, 1H), 2,27-2,21 (м, 3H), 2,13-1,96 (м, 3H), 2,83-1,80 (м, 2H), 1,76-1,72 (м, 1H), 1,67-1,63 (м, 2H), 1,63-1,59 (м, 1H), 1,51-1,42 (м, 3H), 1,27 (с, 3H), 1,23-1,21 (м, 1H), 1,20-1,17 (м, 1H), 0,96 (с, 3H).
К раствору соединения 005-1(4 г, 11,02 ммоль) в пиридине (40 мл) добавляли AC2O (2,2 г, 22 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали в холодную воду (200 мл). Твердое вещество собирали при помощи фильтрации и промывали при помощи 200 мл HCl (1 M). Полученное твердое вещество промывали водой (100 мл ×3). Твердое вещество сушили на воздухе с получением соединения 005-2 (3,0 г, 69%) в виде белого твердого вещества, которое использовали без дополнительной очистки.
К раствору соединения 005-2 (2,4 г, 5,35 ммоль) в EtOH (20 мл) и CH2Cl2(20 мл) добавляли NaBH4(404 мг, 10,7 ммоль). Смесь перемешивали при 15°C в течение ночи. Затем смесь гасили ацетоном (20мл) и H2O(20 мл). NaIO4(3,3 г, 21,4 ммоль) добавляли к реакционной смеси. Смесь перемешивали при 30°C в течение ночи. Затем смесь экстрагировали при помощи EtOAc (50 мл) и H2O (50 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир=1/2) с получением соединения 005-3 (1,3 г, 79,7%) в виде белого твердого вещества.1H ЯМР (005-3): (400 МГц, CDCl3) δ 4,42-4,29 (м, 1H), 3,67-3,56 (м, 1H), 2,51-2,44 (м, 1H), 2,10-1,94 (м, 5H), 1,73-1,65 (м, 2H), 1,62-1,50 (м, 5H), 1,48-1,37 (м, 5H), 1,19 (с, 3H), 1,10 (с, 3H), 0,96-0,82 (м, 2H).
К раствору t-BuOK (2,2 г, 19,58 ммоль) в t-BuOH (10 мл) добавляли по каплям раствор соединения 005-3(600 мг, 1,958 ммоль) в 1,2-диметоксиэтане (5 мл) при комнатной температуре в атмосфере N2. Смесь перемешивали при комнатной температуре в течение 20 минут. Затем добавляли по каплям TosMic (574 мг, 2,94 ммоль) в 1,2-диметоксиэтане (5 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. ТСХ (петролейный эфир:этилацетат=3:1) показывала, что реакция завершена. Реакционную смесь гасили водой (50 мл). Полученный раствор экстрагировали при помощи 2×50 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=5,5:1) с получением продукта9 (170 мг, 23%) и 15 (200 мг, 27%) в виде белого твердого вещества.1H ЯМР (9): (300 МГц, CDCl3) δ 4,22-4,18 (м, 1H), 3,66-3,55 (м, 1H), 2,19-2,12 (м, 1H), 2,06-1,55 (м, 10H), 1,49-1,12 (м, 9H), 1,11 (с, 3H), 1,08 (с, 3H), 1,05-0,94 (м, 2H).1H ЯМР (15): (300 МГц, CDCl3) δ 4,31-4,24 (м, 1H), 3,68-3,51 (м, 1H), 2,52-2,45 (м, 1H), 2,19-1,41 (м, 16H), 1,31-1,17 (м, 5H), 1,11(с, 3H), 1,08-1,02 (м, 1H), 0,96 (с, 3H).
Пример 9. Синтез Соединений 10 и 11.

К раствору соединения 001-9(500 мг, 1,64 ммоль) в EtOH (10 мл) добавляли концентрированный раствор H2SO4 (5 капель). Раствор перемешивали при комнатной температуре в течение 3 часов. ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором NaHCO3 (20 мл) и экстрагировали при помощи EtOAc (15 мл ×3). Объединенные органические слои сушили над Na2SO4, концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=6:1) с получением соединения 075-1 (160 мг, 28%) в виде белого твердого вещества.1H ЯМР (075-1): (400 МГц, CDCl3) δ 4,45-4,40 (м, 1H), 3,96-3,90 (м, 1H), 3,65-3,55 (м, 1H), 3,50-3,35 (м, 2H), 2,55-2,42 (м, 1H), 2,10-1,70 (м, 8H), 1,48-1,40 (м, 2H), 1,40-1,20 (м, 6H), 1,20-1,12 (м, 6H), 1,12-1,10(м, 4H), 1,08-0,98 (м, 1H), 0,85-0,80 (м, 1H).
К раствору t-BuOK (511,17 мг, 4,57 ммоль) в t-BuOH (8 мл) добавляли раствор соединения 075-1(160 мг, 0,56 ммоль) в 1,2-диметоксиэтане (3 мл) по каплям при комнатной температуре. Затем к смеси добавляли по каплям раствор TosMic (178,38 мг, 0,91 ммоль) в 1,2-диметоксиэтане (5 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 часов. После того, как ВЭЖХ показывала, что исходное вещество полностью израсходовано, смесь гасили водой и экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали с получением неочищенного продукта. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=6:1) с получением продукта 10 (56,8 мг, 33,41%) в виде белого порошка и соединения 11 (32,8 мг, 19,29%).1H ЯМР (10): (400 МГц, CDCl3) δ 4,45-4,35 (м, 1H), 3,98-3,90 (м, 1H), 3,65-3,55 (м, 1H), 3,50-3,35 (м, 2H), 2,25-2,15 (м, 1H), 2,10-1,80 (м, 8H), 1,45-1,10 (м, 19H), 1,05-0,95 (м, 1H), 0,82-0,75 (м, 1H).1H ЯМР (11): (400 МГц, CDCl3) δ 4,5-4,45 (м, 1H), 3,98-3,90 (м, 1H), 3,65-3,55 (м, 1H), 3,50-3,35 (м, 2H), 2,56-2,50 (м, 1H), 2,25-2,15 (м, 1H), 2,00-1,80 (м, 7H), 1,45-1,15 (м, 16H), 1,05-1,02 (м,4H), 0,95-0,85 (м, 1H).
Пример 10. Синтез Соединений 12 и 13.

К раствору смеси соединений 003-2 и 003-2A (2,2 г, 5,67 ммоль) в ацетоне (20 мл) добавляли TsOH.H2O (975 мг, 5,67 ммоль). Смесь перемешивали при 10°C в течение 3 часов. ТСХ (петролейный эфир:этилацетат=10:1) показывала, что исходное вещество полностью израсходовано. Затем смесь гасили водным раствором NaHCO3 раствор (40 мл) и разбавляли при помощи EtOAc (80 мл ×2). Органическую фазу сушили над Na2SO4 и упаривали с получением смеси соединений 003-3 и 003-3A(2,1 г, неочищенная) в виде желтого масла, которое использовали непосредственно на следующей стадии без какой-либо очистки.
К раствору смеси соединений 003-3 и 003-3A (2,1 г, неочищенная) в CH2Cl2 (20 мл) добавляли 3-хлорбензопероксокислоту (1,7 г, 10,43 ммоль). Смесь перемешивали при 10°C в течение 3 часов. ТСХ (петролейный эфир:этилацетат=5:1) показывала, что исходное вещество полностью израсходовано. Затем смесь гасили при помощи раствора Na2S2O3/NaHCO3 (3/1, 40 г) в воде (40 мл) и экстрагировали при помощи EtOAc (70 мл ×2). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=20:1) с получением смеси соединений 003-4 и 003-4A(1,35 г, 61%) в виде белого твердого вещества.1H ЯМР (003-4 и 003-4A): (400 МГц, CDCl3) δ 3,68-3,67 (м, 1H), 3,24 (с, 3H), 3,20-3,13 (м, 2H), 2,49-2,42 (м, 1H), 2,30-2,23 (м, 1H), 2,04-1,31 (м, 12H), 1,20-1,10 (м, 1H), 1,04-0,97 (м, 6H), 0,95-0,92 (м, 1H), 0,70-0,65 (м, 1H).
К раствору смеси соединений 003-4 и 003-4A (1 г, 3,1 ммоль) в MeOH (25 мл) добавляли концентрированный раствор H2SO4(10 капель, 98%). Смесь перемешивали при 10°C в течение 2 часов. ТСХ (петролейный эфир:этилацетат=3:1) показывала, что исходное вещество полностью израсходовано. Затем смесь гасили смесью водного раствора NaHCO3 (30 мл) и разбавляли при помощи EtOAc (60 мл ×2). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=7:1) с получением соединения 003-5(600 мг, 55%) и 003-5A(250 мг, 25%) в виде белого твердого вещества.1H ЯМР(003-5): (400 МГц, CDCl3) δ 3,96-3,95 (м, 1H), 3,73-3,72 (м, 1H), 3,36-3,35 (м, 4H), 3,26 (с, 3H), 2,49-2,42 (м, 1H), 2,29-2,25 (м, 1H), 2,09-1,80 (м, 6H), 1,61-1,50 (м, 3H), 1,43-1,16 (м, 6H), 1,10 (с, 3H), 1,04 (с, 3H), 0,80-0,77 (м, 1H).1H ЯМР(003-5A): (400 МГц, CDCl3) δ 4,03-4,01 (м, 1H), 3,71-3,69 (м, 1H), 3,35 (с, 3H), 3,20 (с, 3H), 3,02-3,01 (м, 1H), 2,49-2,42 (м, 1H), 2,27-2,23 (м, 1H), 2,07-2,00 (м, 4H), 1,91-1,79 (м, 1H), 1,60-1,21 (м, 8H), 1,19 (с, 3H), 1,02 (с, 3H), 0,99-0,97 (м, 1H), 0,74-0,71 (м, 1H).
К перемешиваемому раствору t-BuOK (324 мг, 2,9 ммоль) в BuOH (10 мл) добавляли раствор соединения 003-5 (100 мг, 0,29 ммоль) в 1,2-диметоксиэтане (5 мл) в атмосфере N2. Затем добавляли по каплям раствор TosMic (84 мг, 0,43 ммоль) в 1,2-диметоксиэтане. Смесь перемешивали при комнатной температуре (15°C) в течение 4 часов. Смесь обрабатывали водным раствором хлорида натрия с последующей обработкой хлористоводородной кислотой (2M) до кислотного уровня. Смесь экстрагировали при помощи CH2Cl2 и органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4, затем концентрировали с получением остатка, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=8:1) и препаративной ВЭЖХ с получением соединения12 (25 мг, 24,3%) и 13 (20 мг, 19,4%) в виде белого твердого вещества.1H ЯМР (12): (400 МГц, CDCl3) δ 3,97-3,93 (м, 1H), 3,72-3,68 (м, 1H), 3,39-3,32 (м, 4H), 3,23 (с, 3H), 2,44-2,38 (м, 1H), 2,23-2,18 (т, J=9,6 Гц, 1H), 2,12-2,02 (м, 1H), 1,97-1,88 (м, 2H), 1,86-1,72 (м, 4H), 1,53-1,17 (м, 9H), 1,09 (с, 3H), 1,07 (с, 3H), 0,97-0,90 (м, 3H), 0,79-0,72 (м, 1H).1H ЯМР (13): (400 МГц, CDCl3) δ 3,97-3,93 (м, 1H), 3,72-3,68 (м, 1H), 3,39-3,32 (м, 4H), 3,23 (с, 3H), 2,52-2,50 (м, 1H), 2,21-2,12 (м, 2H), 1,98-1,71 (м, 6H), 1,60-1,43 (м, 3H), 1,41-1,18 (м, 8H), 1,07 (с, 3H), 1,04-0,99 (м, 1H), 0,96 (с, 3H), 0,89-0,84 (м, 1H).
Пример 11. Синтез Соединений 16 и 18.

К раствору соединения 008-4 (1,0 г, 3,47 ммоль) в n-PrOH (20 мл) добавляли H2SO4 (5 капель, 98%). Смесь перемешивали при комнатной температуре в течение 5 часов. ТСХ (петролейный эфир/этилацетат=3/1) показывала, что исходное вещество полностью израсходовано. Смесь гасили добавлением насыщенного водного раствора NaHCO3 (10 мл). Смесь экстрагировали при помощи EtOAc (15 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (20 мл) и сушили над безводным Na2SO4иконцентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир/этилацетат=20/1) с получением чистого соединения 061-1 (360 мг, 30%) в виде белого твердого вещества.1H ЯМР (061-1): (400 МГц, CDCl3) δ 3,89-3,97 (м, 1H), 3,37-3,49 (м, 2H), 3,26-3,32 (м, 1H), 2,39-2,48 (м, 1H), 2,01-2,11 (м, 1H), 1,73-1,97 (м, 6H), 1,14-1,71 (м, 22H), 0,71-1,05 (м, 16H).
К раствору t-BuOK (1,16 г, 10,33 ммоль) в t-BuOH (10 мл) добавляли соединение 061-1(0,36 г, 1,03 ммоль) в 1,2-диметоксиэтане (7 мл) при комнатной температуре в атмосфере N2. Смесь перемешивали при комнатной температуре в течение 30 минут, затем добавляли раствор TosMic (0,405 г, 2,07 ммоль) в 1,2-диметоксиэтане (7 мл) и полученный раствор перемешивали при комнатной температуре в течение ночи. ТСХ (петролейный эфир/этилацетат=3/1) показывала полный расход исходного вещества. К полученной смеси добавляли насыщенный водный раствор NaCl (10 мл) и полученную смесь экстрагировали дихлорметаном (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (15 мл ×2) и сушили над безводным Na2SO4иконцентрировали в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир/этилацетат=12/1) и далее очищали при помощи препаративной ВЭЖХ с получениемсоединения 16(39,7 мг, 10,7%) и 18(46,2 мг, 12,4%) в виде белого твердого вещества.1H ЯМР (16): (400 МГц, CDCl3) δ 3,89-3,96 (м, 1H), 3,41-3,47 (м, 1H), 3,37-3,42 (м, 1H), 3,26-3,32 (м, 1H), 2,22-2,39 (м, 1H), 2,03-2,15 (м, 1H), 1,88-1,95 (м, 2H), 1,81-1,87 (м, 2H), 1,60-1,79 (м, 3H), 1,48-1,59 (м, 5H), 1,19-1,44 (м, 9H), 1,02-1,17 (м, 1H), 0,77-1,02 (м, 11H), 0,68-0,75 (м, 1H).1H ЯМР (18): (400 МГц, CDCl3) δ 3,89-3,95 (м, 1H), 3,37-3,48 (м, 2H), 3,27-3,32 (м, 1H), 2,52-2,56 (м, 1H), 2,11-2,21 (м, 1H), 1,92-2,01 (м, 2H), 1,77-1,89 (м, 3H), 1,62-1,76 (м, 4H), 1,19-1,40 (м, 10H), 0,95-1,09 (м, 1H), 0,86-0,97 (м, 5H), 0,76-0,87 (м, 4H).
Пример 12. Синтез Соединений 17.

К раствору соединения 018-3 (950 мг, 3,13 ммоль) в 2-метоксиэтаноле (15 мл) добавляли концентрированный раствор H2SO4 (5 капель). Смесь перемешивали при 30°C в течение 2 часов. ТСХ (петролейный эфир:этилацетат=1:1) показывала, что реакция завершена. Растворитель выпаривали и остаток разбавляли при помощи EtOAc (50 мл) и промывали водным раствором NaHCO3. Органический слой сушили над безводным Na2SO4иконцентрировали растворитель. Остаток очищали при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=3:1) с получением соединения 022-1 (680 мг, 57%) в виде белого твердого вещества.1H ЯМР (022-1): (400 МГц,CDCl3) δ 3,95-3,91 (м, 1H), 3,85-3,78 (м, 1H), 3,48-3,57 (м, 3H), 3,45-3,37 (м, 4H), 2,72-2,68 (м, 1H), 2,58-2,49 (м, 1H), 2,42-2,36 (м, 1H), 2,31-2,18 (м, 2H), 2,14-2,07 (м, 1H), 1,95-1,83 (м, 4H), 1,78-1,51 (м, 2H), 1,36-1,14 (м, 9H), 0,81 (с, 3H).
К раствору t-BuOK (888 мг, 7,94 ммоль) в t-BuOH (10 мл) добавляли по каплям раствор соединения 022-1(300 мг, 0,79 ммоль) в 1,2-диметоксиэтане (5 мл) при комнатной температуре в атмосфере N2. Смесь перемешивали при комнатной температуре в течение 20 минут. Затем добавляли по каплям TosMic (300 мг, 1,58 ммоль) в 1,2-диметоксиэтане (5 мл). Смесь перемешивали при комнатной температуре в течение 3 часов. ТСХ (петролейный эфир:этилацетат =3:1) показывала, что реакция завершена. Реакционную смесь гасили водой (50 мл). Полученную смесь экстрагировали при помощи 2×100 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме и неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=5,5:1) с получением продукта 17 (82 мг, 27%) в виде желтого масла.1H ЯМР (17): (400 МГц, CDCl3) δ 3,98-3,96 (м, 1H), 3,74-3,68 (м, 1H), 3,56-3,45 (м, 3H), 3,42-3,36 (м, 4H), 2,73-2,68 (м, 1H), 2,52-2,46 (м, 2H), 2,30-2,20 (м, 2H), 2,08-1,98 (м, 1H), 1,94-1,71 (м, 6H), 1,49-1,38 (м, 2H), 1,35-1,26 (м, 4H), 1,18-1,15 (м, 4H), 0,88 (с, 3H).
Пример 13. Синтез Соединений 19 и 20.

К раствору соединения 001-7 (8,0 г, 17,39 ммоль) в CH2Cl2 (100 мл) порциями добавляли PCC (7,5 г, 34,8 ммоль) при комнатной температуре, затем реакционную смесь перемешивали в течение ночи. ТСХ (петролейный эфир:этилацетат =1:1) показывала, что реакция завершена. Смесь отфильтровывали, фильтрат концентрировали с получением неочищенного продукта, который очищали при помощи флэш-хроматографии, элюируя смесью (петролейный эфир:этилацетат=3:1), с получением соединения 018-1 (6,5 г, 81%) в виде белого твердого вещества.
Соединение 018-1 (12 г, 26,2 ммоль) растворяли в коллидине (40 мл), затем раствор нагревали до 130°C и поддерживали при такой температуре в течение 2 часов. ТСХ (петролейный эфир:этилацетат=3:1) показывала, что реакция завершена. После того, как смесь была восстановлена до комнатной температуры, ее выливали в водный раствор H2SO4(10%). Раствор экстрагировали этилацетатом (100 мл ×3). Объединенный органический слой промывали насыщенным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4иконцентрировали растворитель с получением практически чистого соединения 018-2 (7,0 г, 93,0%) в виде белого твердого вещества.1H ЯМР (018-2): (400 МГц, CDCl3) δ 5,65-5,50 (м, 2H), 2,85-2,75 (м, 1H), 2,57-2,50 (м, 1H), 2,45-2,40 (м, 2H), 2,39-2,13 (м, 3H), 2,11-2,07 (м, 1H), 1,96-1,74 (м, 3H), 1,65-1,60 (м, 2H),1,51-1,48 (м, 1H), 1,28-1,18 (м, 4H), 0,98 (с, 3H), 0,84 (с, 3H).
К раствору соединения 018-2 (7,0 г, 24,3 ммоль) в CH2Cl2 (50 мл) порциями добавляли m-CPBA(6,3 г, 36,5 ммоль). Полученную смесь перемешивали при 10°C в течение 20 часов. ТСХ (петролейный эфир:этилацетат=3:1) показывала, что всегда оставалось незначительное количество исходного вещества. Затем к раствору добавляли насыщенный раствор Na2SO3(100 мл). Органический слой промывали насыщенным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4иконцентрировали растворитель. Остаток очищали при помощи флэш-хроматографии, элюируя смесью (петролейный эфир:этилацетат=10:1), с получением соединения 018-3 (4,8 г, 66%) в виде белого твердого вещества.1H ЯМР (018-3): (400 МГц, CDCl3) δ 3,17-3,10 (м, 2H), 2,84-2,78 (м, 1H), 2,56-2,22 (м, 4H), 2,10-2,00 (м, 2H), 1,98-1,80 (м, 3H), 1,74-1,58 (м, 3H), 1,42-1,05 (м, 5H), 0,98 (с, 3H), 0,82 (с, 3H).
К раствору соединения 018-3 (0,95 г, 3,13 ммоль) в EtOH (20 мл) добавляли H2SO4 (98%, 5 капель). Смесь перемешивали при 30°C в течение 2 часов. ТСХ (петролейный эфир:этилацетат=1:1) показывала, что реакция завершена. Смесь гасили водным раствором NaHCO3 и экстрагировали этилацетатом (30 мл ×2). Объединенный органический слой сушили над безводным Na2SO4иконцентрировали растворитель. Остаток очищали при помощи флэш-хроматографии, элюируя смесью (петролейный эфир:этилацетат=6:1), с получением соединения 018-4 (500 мг, 47%) в виде белого твердого вещества.1H ЯМР (018-4): (400 МГц, CDCl3) δ 3,95-3,91 (м, 1H), 3,76-3,69 (м, 1H), 3,40-3,31 (м, 2H), 2,73-2,69 (м, 1H), 2,56-2,49 (м, 1H), 2,42-2,20 (м, 3H), 2,12-2,07 (м, 1H), 1,96-1,60 (м, 5H), 1,42-1,12 (м, 12H), 0,72 (с, 3H).
В абсолютно сухую колбу добавляли t-BuOH (5 мл) и t-BuOK (644 мг, 5,70 ммоль). Смесь упаривали и наполняли N2. Затем добавляли TosMic (224 мг, 1,14 ммоль) в 1,2-диметоксиэтане (4 мл) и смесь становилась желтой. Соединение 018-4 (200 мг, 0,57 ммоль) в 1,2-диметоксиэтане (4 мл) добавляли в суспензию. Полученную смесь перемешивали при комнатной температуре (10°С) в течение 16 часов. ТСХ (петролейный эфир:этилацетат=1:1) показывала, что реакция завершена. Добавляли воду и смесь перемешивали, затем экстрагировали этилацетатом (50 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4иконцентрировали в вакууме. Остаток очищали при помощи колоночной флэш-хроматографии на силикагеле (петролейный эфир:этилацетат=6:1) с получением соединения 19(43 мг, 21%)и 20(14 мг, 7%) в виде белого твердого вещества.1H ЯМР (19): (400 МГц, CDCl3) δ 3,91-3,86 (м, 1H), 3,74-3,66 (м, 1H), 3,40-3,30 (м, 2H), 2,73-2,68 (м, 1H), 2,53-2,44 (м, 2H), 2,30-2,18 (м, 2H), 2,08-1,95 (м, 1H), 1,93-1,70 (м, 5H), 1,68-1,58 (м, 1H), 1,51-1,40 (м, 2H), 1,33-1,22 (м, 3H), 1,20-1,11 (м, 8H), 0,87 (с, 3H).1H ЯМР (20): (400 МГц, CDCl3) δ 3,92-3,88 (м, 1H), 3,76-3,69 (м, 1H), 3,41-3,33 (м, 2H), 2,78-2,65 (м, 2H), 2,65-2,54 (м, 1H), 2,38-2,30 (м, 1H), 2,28-2,10 (м, 2H), 2,04-1,92 (м, 2H), 1,90-1,70 (м, 4H), 1,42-1,26 (м, 6H), 1,21-1,14 (м, 7H), 0,78 (с, 3H).
Пример 14. Синтез Соединения 21.

К раствору смеси соединений 018-3 и 018-3A (500 мг, 1,65 ммоль) в 1-пропаноле (10 мл) добавляли H2SO4 (5 капель, 98%). Смесь перемешивали при 15°С в течение 3 часов. ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором NaHCO3 (20 мл), экстрагировали при помощи EtOAc (20 мл ×2) и водным раствором NaCl (20 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колонки с силикагелем (петролейный эфир:этилацетат=6:1) с получением смеси соединений 080-1 и 080-1A (250 мг, 41,7%) в виде белого твердого вещества.
К перемешиваемому раствору t-BuOK (773 мг, 6,9 ммоль) в BuOH (10 мл) добавляли раствор смеси соединений 080-1 и 080-1A (250 мг, 0,69 ммоль) в 1,2-диметоксиэтане (5 мл) в атмосфере N2. Затем добавляли по каплям раствор TosMic (269 мг, 1,38 ммоль) в 1,2-диметоксиэтане (5 мл). Смесь перемешивали при комнатной температуре в течение 16 часов. К смеси добавляли воду (20 мл), экстрагировали при помощи EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4, затем концентрировали с получением остатка, который очищали при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=8:1) и препаративной ВЭЖХ с получением соединения21 (40,4 мг, 15,6%) в виде белого твердого вещества.1H ЯМР (21): (300 МГц, CDCl3) δ 3,94-3,89 (м, 1H), 3,64-3,57 (м, 1H), 3,36-3,32 (м, 1H), 3,29-3,22 (м, 1H), 2,74-2,67 (м, 1H), 2,55-2,47 (м, 2H), 2,28-2,20 (м, 2H), 2,03-1,70 (м, 6H), 1,66-1,58 (м, 3H), 1,53-1,49 (м, 2H), 1,48-1,23 (м, 6H), 1,16 (с, 3H), 1,12-1,09 (м, 1H), 0,92 (т, J=9 Гц, 3H), 0,87 (с, 3H).
Пример 15. Синтез Соединения 22.

К раствору смеси соединений 018-3 и 018-3A (500 мг, 1,65 ммоль) в изопропаноле (10 мл) добавляли H2SO4(5 капель, 98%). Смесь перемешивали при 15°C в течение 3 часов. ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором NaHCO3 (20 мл). Смесь экстрагировали при помощи EtOAc (20 мл ×2) и водным раствором NaCl (20 мл). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колонки с силикагелем (петролейный эфир:этилацетат=6:1) с получением смеси соединений 081-1 и 081-1A (150 мг, 25%) в виде белого твердого вещества.
К перемешиваемому раствору t-BuOK (459 мг, 4,1 ммоль) в BuOH (10 мл) добавляли раствор смеси соединений 081-1 и 081-1A (150 мг, 0,41 ммоль) в 1,2-диметоксиэтане (3 мл) в атмосфере N2. Затем добавляли по каплям раствор TosMic (162 мг, 0,83 ммоль) в 1,2-диметоксиэтане. Смесь перемешивали при комнатной температуре в течение 12 часов. В смесь добавляли воду (20 мл) и экстрагировали при помощи EtOAc (20 мл ×2) и органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4, затем концентрировали с получением остатка, который очищали при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=7:1) и препаративной ВЭЖХ, с получением соединения 22 (31,3 мг, 20,2%) в виде желтого масла.1H ЯМР (22): (300 МГц, CDCl3) δ 3,86-3,81 (м, 1H), 3,80-3,71 (м, 1H), 3,47-3,40 (м, 1H), 2,63-2,56 (м, 1H), 2,55-2,45 (м, 2H), 2,30-2,21 (м, 2H), 2,08-1,64 (м, 7H), 1,58-1,24 (м, 6H), 1,20-1,05 (м, 11H), 0,86 (с, 3H).
Пример 16. Синтез Соединения 23.

К раствору соединения 001-9(500 мг, 1,64 ммоль) в пропан-2-оле (10 мл) по каплям добавляли концентрированный раствор H2SO4 (0,125 мл). Раствор перемешивали при комнатной температуре в течение 3 часов. После этого ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором NaHCO3, затем смесь концентрировали при пониженном давлении. Смесь выливали в воду (10 мл) и экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические слои сушили над Na2SO4, концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=6:1) с получением соединения 077-1 (150 мг, 25,05%) в виде белого твердого вещества.1H ЯМР (077-1): (400 МГц, CDCl3) δ 4,45-4,38(м, 1H), 3,95-3,85(м, 1H), 3,72-3,62 (м, 1H), 3,55-3,45 (м, 2H), 2,55-2,40 (м, 1H), 2,12-1,85 (м, 8H), 1,45-1,38 (м, 3H), 1,30-1,24 (м, 5H), 1,18-1,05 (м, 13H), 0,85-0,75 (м, 1H).
К раствору t-BuOK (461,33 мг, 4,12 ммоль) в t-BuOH (6 мл) по каплям добавляли раствор соединения 077-1(150 мг, 0,41 ммоль) в 1,2-диметоксиэтане (2 мл) при комнатной температуре. Затем в смесь добавляли по каплям раствор TosMic (160,80 мг, 0,82 ммоль) в 1,2-диметоксиэтане (4 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 4 часов. После того, как ВЭЖХ показывала, что исходное вещество полностью израсходовано, смесь экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали с получением неочищенного продукта. Неочищенный продукт сначала очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=7:1) и затем очищали при помощи препаративной ВЭЖХ с получением соединения 23 (16,6 мг, 11,07%) в виде белого порошка.1H ЯМР (23): (400 МГц, CDCl3) δ 4,44-4,36 (м, 1H), 3,95-3,82 (м, 1H), 3,74-3,64 (м, 1H), 3,55-3,50 (м, 1H), 2,25-2,18 (м, 1H), 2,14-2,04 (м, 2H), 2,00-1,75 (м, 6H), 1,49-1,18 (м, 8H), 1,18-1,08 (м, 13H), 1,02-0,94 (м, 2H), 0,84-0,75 (м, 1H).
Пример 17. Синтез Соединений 24 и 25.

К раствору соединения 001-9 (500 мг, 1,64 ммоль) в 2-метокси-этаноле (10 мл) добавляли дымящую серную кислоту (3 капли). Раствор перемешивали при комнатной температуре в течение 3 часов. После того, как ТСХ показывала, что исходное вещество полностью израсходовано, реакционную смесь гасили водным раствором NaHCO3(30 мл) и экстрагировали при помощи EtOAc (10 мл ×3). Объединенный органический слой сушили над Na2SO4, концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=6:1) с получением соединения 078-1 (270 мг, 43%) в виде белого твердого вещества.1H ЯМР (078-1): (400 МГц, CDCl3) δ 4,46-4,40 (м, 1H), 3,99-3,97 (м, 1H), 3,72-3,64 (м, 1H), 3,59-3,46 (м, 4H), 3,37 (с, 3H), 2,51-2,41 (м, 1H), 2,09-1,82 (м, 8H), 1,63-0,98 (м, 20H), 0,84-0,77 (м, 1H).
К раствору t-BuOK (795,46 мг, 7,10 ммоль) в t-BuOH (10 мл) по каплям добавляли раствор соединения 078-1(270 мг, 0,71 ммоль) в 1,2-диметоксиэтане (4 мл) при комнатной температуре. Затем добавляли по каплям раствор TosMic (277,26 мг, 1,42 ммоль) в 1,2-диметоксиэтане (6 мл). Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 часов. После этого ЖХ-МС показывала, что исходное вещество полностью израсходовано. Смесь экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали с получением неочищенного продукта. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=3:1) 3 раза с получением продукта 24 (22,2 мг, 7,93%) и 25 (10,6 мг, 3,79%).1H ЯМР (25): (400 МГц, CDCl3) δ 4,45-4,35(м, 1H), 4,02-3,95 (м, 1H), 3,75-3,65 (м, 1H), 3,58-3,46 (м, 4H), 3,38 (с, 3H), 2,35-2,16 (м, 1H), 2,12-1,76 (м, 8H), 1,46-1,18 (м, 10H), 1,18-1,10 (м, 6H), 1,06-0,86 (м, 3H), 0,82-0,75 (м, 1H).1H ЯМР (24): (400 МГц, CDCl3) δ 4,55-4,45 (м, 1H), 4,05-3,95 (м, 1H), 3,75-3,65 (м, 1H), 3,60-3,50 (м, 4H), 3,38 (с, 3H), 2,58-2,52 (м, 1H), 2,26-2,14 (м, 1H), 2,12-1,92 (м, 3H), 1,88-1,72 (м, 4H), 1,40-1,10 (м, 13H), 1,06-0,98 (м, 4H), 0,95-0,86 (м, 1H).
Пример 18. Синтез Соединения 26.

К раствору смеси соединений 001-9 и 001-9A(500 мг, 1,64 ммоль) в пропан-1-оле (10 мл) по каплям добавляли раствор дымящей H2SO4(0,125 мл). Раствор перемешивали при комнатной температуре в течение 3 часов. После этого ТСХ показывала, что исходное вещество полностью израсходовано. Смесь гасили водным раствором NaHCO3 и концентрировали при пониженном давлении. Смесь выливали в воду (10 мл) и экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические слои сушили над Na2SO4, концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=6:1) с получением смеси соединений 076-1 и 076-1A (250 мг, 41,8%) в виде белого твердого вещества.
К раствору t-BuOK (768 мг, 6,86 ммоль) в t-BuOH (10 мл) по каплям добавляли раствор соединения 076-1(250 мг, 0,686 ммоль) в 1,2-диметоксиэтане (5 мл) при комнатной температуре в атмосфере N2. Затем к смеси добавляли по каплям раствор TosMic (267 мг, 1,372 ммоль) в 1,2-диметоксиэтане (5 мл). Реакционную смесь перемешивали в течение 4 часов. После этого ЖХ-МС показывала, что исходное вещество полностью израсходовано. Смесь экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические фазы сушили над Na2SO4 и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=6:1) с получением неочищенного соединения 26 (110 мг), которое очищали при помощи препаративной ВЭЖХ с получением чистого соединения 26(36 мг, 27,9%) в виде белого порошка.1H ЯМР (26): (400 МГц, CDCl3) δ 4,42-4,38 (м, 1H), 3,96-3,90 (м, 1H), 3,53-3,40 (м, 2H), 3,33-3,26 (м, 1H), 2,23-2,17 (м, 1H), 2,15-1,72 (м, 8H), 1,63-1,48 (м, 5H), 1,46-1,10 (м, 14H), 1,04-0,85 (м, 5H), 0,83-0,76 (м, 1H).
Пример 19. Синтез Соединений 27 и 39.

К раствору t-BuOK (1,83 г, 16,32 ммоль) в t-BuOH (10 мл) добавляли соединение 001-6(0,5 г, 1,63 ммоль) в 1,2-диметоксиэтане (7 мл) при комнатной температуре в атмосфере N2. Смесь перемешивали при комнатной температуре в течение 30 минут, затем добавляли раствор TosMic (0,640 г, 3,26 ммоль) в 1,2-диметоксиэтане (7 мл) и раствор перемешивали при комнатной температуре в течение ночи. ТСХ (этилацетат/петролейный эфир =1/3) показывала полный расход исходного вещества. К смеси добавляли насыщенный водный раствор NaCl (10 мл) и экстрагировали дихлорметаном (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (15 мл ×2), сушили над безводным Na2SO4иконцентрировали в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир =1/5) и далее очищали при помощи ELSD-ВЭЖХ с получением соединения 27(110,6 мг, 21%) и 39(63,8 мг, 12,3%) в виде белого твердого вещества.1H ЯМР (27): (400 МГц, CDCl3) δ 4,43-4,39 (м, 1H), 4,09-4,04 (м, 1H), 2,25-2,18 (м, 1H), 2,16-2,03 (м, 1H), 1,99-1,88 (м, 1H), 1,87-1,76 (м, 3H), 1,74-1,68 (м, 1H), 1,64-1,68 (м, 1H), 1,64-1,61 (м, 4H), 1,60-1,57 (м, 1H), 1,56-1,50 (м, 2H), 1,49-1,32 (м, 4H), 1,32-1,27 (м, 1H), 1,27-1,18 (м, 2H), 1,16 (с, 3H), 1,10-1,07 (м, 1H), 1,01-0,91 (м, 1H), 0,86-0,78 (м, 1H).1H ЯМР (39): (400 МГц, CDCl3) δ 4,45-4,38 (м, 1H), 4,01-3,97 (м, 1H), 2,50-2,44 (м, 1H), 2,19-2,07 (м, 1H), 1,98-1,64 (м, 7H), 1,64-1,58 (м, 1H), 1,58-1,53 (м, 1H), 1,52-1,49 (м, 4H), 1,39-1,21 (м, 4H), 1,21-1,08 (м, 3H), 1,06-0,90 (м, 7H), 0,89-0,80 (м, 1H).
Пример 20. Синтез Соединения 28.

К раствору соединения 9 (800 мг, 2,52 ммоль) в DMF (10 мл) добавляли TBSCl (569 мг, 3,78 ммоль) и имидазол (343 мг, 5,04 ммоль) при комнатной температуре. Смесь перемешивали в течение ночи при комнатной температуре. ТСХ (петролейный эфир:этилацетат =1:1) показывала, что реакция завершена. Реакционную смесь гасили водой (50 мл) и полученный раствор экстрагировали при помощи 3×30 мл этилацетата и органические слои объединяли и сушили над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=20:1) с получением продукта 069-1 (800 мг, 73%) в виде белого твердого вещества.
1H ЯМР (069-1): (300 МГц, CDCl3) δ 4,28-4,15 (м, 1H), 3,63-3,51 (м, 1H), 2,19-1,52 (м, 11H), 1,52-1,48 (м, 3H), 1,42-1,12 (м, 7H), 1,12 (с, 3H), 1,08 (с, 3H), 0,84 (с, 9H), 0,00 (с, 3H).
К раствору соединения 069-1 (800 мг, 1,86 ммоль) в THF (10 мл) добавляли NaH (372 мг, 9,3 ммоль) при 0°C. Смесь перемешивали при комнатной температуре в течение 30 минут. Затем добавляли по каплям MeI (528 мг, 3,72 ммоль) и смесь перемешивали в течение ночи при 40°C. ТСХ (петролейный эфир:этилацетат =3:1) показывала, что реакция завершена. Реакционную смесь гасили раствором NH4Cl (50 мл) и полученную смесь экстрагировали при помощи 3×30 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме с получением неочищенного продукта (700 мг, неочищенный) в виде желтого твердого вещества, которое использовали напрямую на следующей стадии.
К раствору соединения 069-2 (700 мг, неочищенный) в THF (10 мл) добавляли TBAF (9 мл, 1M в THF) при комнатной температуре. Смесь перемешивали в течение ночи при 30°C. ТСХ (петролейный эфир:этилацетат=5:1) показывала, что реакция завершена. Реакционную смесь гасили раствором NaHCO3 (20 мл) и полученный раствор экстрагировали при помощи 3×30 мл этилацетата, органические слои объединяли и сушили над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=3:1), с получением продукта 28 (230 мг, 37% за две стадии) в виде белого твердого вещества.1H ЯМР (28): (400 МГц, CDCl3) δ 3,72-3,62 (м, 1H), 3,56-3,55 (м, 1H), 3,25 (с, 3H), 2,43-2,39 (м, 1H), 2,25-2,22 (м, 1H), 2,16 (м, 1H), 2,15-2,04 (м, 1H), 1,99-1,87 (м, 2H), 1,84-1,62 (м, 5H), 1,55-1,13 (м, 8H), 1,11 (с, 3H), 1,08 (с, 3H), 1,03-0,96 (м, 2H).
Пример 21. Синтез Соединений 29 и 37.

К раствору соединения 008-4(2 г, ммоль) в 2-метил-пропан-1-оле (10 мл) по каплям добавляли раствор H2SO4 (10 капель, 98%). Раствор перемешивали при комнатной температуре в течение 2 часов. После того, как ТСХ показывала, что исходное вещество полностью израсходовано, смесь гасили водным раствором NaHCO3 и затем концентрировали при пониженном давлении. Смесь выливали в воду (20 мл) и экстрагировали при помощи EtOAc (20 мл ×3). Объединенные органические слои сушили над Na2SO4, концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=30:1) с получением соединения 094-1 (1 г, 40%) в виде белого твердого вещества.1H ЯМР (094-1): (400 МГц, CDCl3) δ 4,00-3,90 (м, 1H), 3,40-3,35 (м, 1H), 3,30-3,24 (м, 1H), 3,15-3,06 (м, 1H), 2,50-2,36 (м, 1H), 2,14-2,00 (м, 1H), 1,98-1,60 (м, 8H), 1,50-1,10 (м, 10H), 1,10-0,92 (м, 4H), 0,92-0,80 (м, 9H), 0,80-0,70 (м, 1H).
К раствору t-BuOK (3,1 г, 27,58 ммоль) в t-BuOH (25 мл) по каплям добавляли раствор соединения 094-1(1 г, 2,76 ммоль) в 1,2-диметоксиэтане (10 мл) при комнатной температуре. Затем к смеси добавляли по каплям раствор TosMic (1,08 мг, 5,51 ммоль) в 1,2-диметоксиэтане (15 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 часов. После того, как ВЭЖХ показывала, что исходное вещество полностью израсходовано, смесь экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=7:1) с получением неочищенного продукта 29 и 37, затем смесь двух продуктов очищали при помощи препаративной ВЭЖХ, соответственно, с получением соединения 29 (130,3 мг, 12,7%) и 37(14,1 мг, 1,2%)в виде белого порошка.1H ЯМР (29): (400 МГц, CDCl3) δ 3,95-3,90 (м, 1H), 3,40-3,35 (м, 1H), 3,30-3,22 (м, 1H), 3,15-3,06 (м, 1H), 2,30-2,24 (м, 1H), 2,16-2,04 (м, 1H), 1,96-1,62 (м, 8H), 1,42-1,22 (м, 8H), 1,16-1,06 (м, 1H), 1,06-0,94 (м, 5H), 0,94-0,84 (м, 10H), 0,76-0,68 (м, 1H).1H ЯМР (37): (400 МГц, CDCl3) δ 3,95-3,90 (м, 1H), 3,41-3,35 (м, 1H), 3,30-3,20 (м, 1H), 3,15-3,05 (м, 1H), 2,60-2,50 (м, 1H), 2,20-2,08 (м, 1H), 2,02-1,92 (м, 1H), 1,88-1,68 (м, 8H), 1,42-1,22 (м, 9H), 1,10-0,80 (м, 15H).
Пример 22. Синтез Соединений 30 и 35.

К раствору соединения 001-6 (4 г, 13 ммоль) в толуоле (80 мл) добавляли TsOH.H2O (745 мг, 3,9 ммоль). Смесь перемешивали при 70°C в течение ночи. Смесь гасили водным раствором NaHCO3 (100 мл) и экстрагировали при помощи EtOAc (100 мл ×2). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=10:1) с получением 1,5 г соединения 074-1 (Выход: 40%) в виде белого твердого вещества.1H ЯМР (074-1): (400 МГц, CDCl3) δ 5,38-5,37(м, 1H), 4,06-4,05(м, 1H), 2,49-2,42(м, 1H), 2,22-2,15(м, 1H), 2,13-1,98(м, 7H), 1,75-1,54(м, 6H), 1,52-1,25(м, 9H), 1,11-1,03(м, 2H), 0,96(с, 3H), 0,82 (с, 3H).
К раствору соединения 074-1(1,5 г, 5,2 ммоль) в толуоле (30 мл) добавляли 2,2-диметилпропан-1,3-диол (2,16 г, 20,8 ммоль), CH(OEt)3 (2,26 г, 15,6 ммоль) и TsOH.H2O (30 мг, 0,16 ммоль). Смесь перемешивали при 40°C в течение ночи. Затем смесь гасили при помощи NaHCO3 раствор (50 мл) и экстрагировали при помощи EtOAc (50 мл ×2). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=25:1) с получением 1,3 г соединения074-2 (Выход: 67%) в виде белого твердого вещества.1H ЯМР (074-2): (400 МГц, CDCl3) δ 5,38-5,36 (м, 1H), 4,03-4,02 (м, 1H), 3,66-3,64 (м, 1H), 3,47-3,45 (м, 1H), 3,39-3,34 (м, 2H), 2,65-2,61 (м, 1H), 2,32-2,29 (м, 1H), 2,03-2,01 (м, 1H), 1,89-1,84 (м, 1H), 1,78-1,41(м, 14H), 1,36-1,24 (м, 5H), 1,14 (с, 3H), 1,03-0,95 (м, 2H), 0,91 (с, 3H), 0,74 (с, 3H), 0,71 (с, 3H).
К раствору соединения 074-2 (1,3 г, 3,47 ммоль) в THF (15 мл) добавляли катехолорат (2,49 г, 10,4 ммоль) и LiBH4 (113 мг, 5,2 ммоль). Смесь перемешивали при 14°C в течение ночи. К смеси добавляли NaOH (1,6 г в 5 мл H2O), EtOH (16 мл) и H2O2 (11 мл) при 0°C и перемешивали при 14°C в течение 5 часов. Смесь экстрагировали этилацетатом (30 мл ×2). Органическую фазу сушили над Na2SO4 и упаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=1:1) с получением 1,0 г соединения074-3 (Выход: 76%) в виде белого твердого вещества.1H ЯМР (074-3): (400 МГц, CDCl3) δ 4,01-4,00 (м, 1H), 3,93-3,92 (м, 1H), 3,63-3,62 (м, 1H), 3,44-3,41 (м, 1H), 3,36-3,34 (м, 1H), 2,28-2,20 (м, 1H), 2,16-2,10 (м, 1H), 1,85-1,81 (м, 1H), 1,76-1,32 (м, 15H), 1,21-1,15 (м, 2H), 1,12 (с, 3H), 0,91 (с, 3H), 0,90-0,85 (м, 1H), 0,79 (с, 3H), 0,70 (с, 3H).
К раствору соединения 074-3 (1 г, 2,55 ммоль) в ацетоне (10 мл) добавляли TsOH.H2O (485 мг, 1,27 ммоль). Смесь перемешивали при 15°C в течение 1 часа. Затем реакционную смесь гасили раствором NaHCO3 (30 мл) и экстрагировали при помощи EtOAc (50 мл ×2). Органическую фазу сушили над Na2SO4 и упаривали с получением 750 мг соединения 074-4(Выход: 94%) в виде белого твердого вещества.1H ЯМР (074-4): (400 МГц, CDCl3) δ 4,01-4,00 (м, 1H), 3,93-3,92 (м, 1H), 2,48-2,40 (м, 1H), 2,14-2,05 (м, 3H), 1,95-1,48 (м, 12H), 0,93 (с, 3H), 0,91 (с, 3H), 0,84 (с, 3H).
К раствору t-BuOK (1,65 г, 14,7 ммоль) в t-BuOH (10 мл) по каплям добавляли раствор соединения 074-4 (450 мг, 1,47 ммоль) в 1,2-диметоксиэтане (5 мл) при комнатной температуре. Затем к смеси добавляли по каплям раствор TosMic (573 мг, 2,94 ммоль) в 1,2-диметоксиэтане (5 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 часов. После того, как ВЭЖХ показывала, что исходное вещество полностью израсходовано, смесь экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические фазы сушили над Na2SO4 и растворитель выпаривали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=1:1) с получением соединения 30 (220 мг, 47%) и 35 (51 мг, 12%) в виде белого порошка.1H ЯМР (30): (400 МГц, CDCl3) δ 4,03-4,02 (м, 1H), 4,01-3,95 (м, 1H), 2,35 -2,30 (м, 1H), 2,29-2,25 (м, 1H), 2,20-2,02 (м, 2H), 2,00-1,90 (м, 1H), 1,80-1,61 (м, 5H), 1,57-1,49 (м, 2H), 1,45-1,10 (м, 10H), 0,92 (с, 3H), 0,90 (с, 3H).
1H ЯМР (35): (400 МГц, CDCl3) δ 4,03-4,01 (м, 1H), 3,95-3,93 (м, 1H), 2,57-2,55 (м, 1H), 2,19-2,00 (м, 4H), 1,90-1,80 (м, 1H), 1,75-1,50 (м, 11H), 1,50-1,08 (м, 10H), 1,57-1,49 (м, 2H), 1,45-1,10 (м, 10H), 0,93 (с, 3H), 0,82 (с, 3H).
Пример 23. Синтез Соединения 31.

К раствору соединения 27(650 мг, 2,05 ммоль) и 1H-имидазоле (278,77 мг, 4,09 ммоль) в DMF (8 мл) добавляли TBSCl (462,9 мг, 4,09 ммоль) в DMF(4 мл) при комнатной температуре в атмосфере N2. Смесь перемешивали при комнатной температуре в течение ночи. ТСХ показывала, что исходное вещество полностью израсходовано. В полученную смесь добавляли насыщенный солевой раствор (10 мл) и полученный раствор экстрагировали дихлорметаном (20 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (15 мл ×3) и сушили над безводным Na2SO4и концентрировали в вакууме с получением неочищенного вещества, которое очищали при помощи колоночной хроматографии, элюируя смесью (этилацетат/петролейный эфир=1/150), с получением соединения 070-1 (500 мг, 56,6%) в виде белого твердого вещества.
1H ЯМР (070-1): (400 МГц, CDCl3) δ 4,44-4,38 (м, 1H), 3,98-3,94 (м, 1H), 2,14-2,06 (м, 2H), 2,03-1,87 (м, 1H), 1,85-1,73 (м, 3H), 1,62-1,47 (м, 7H), 1,47-1,28 (м, 4H), 1,28-1,17 (м, 2H), 1,17-1,12 (м, 4H), 1,07-1,02 (м, 2H), 1,01-0,92 (м, 4H), 0,91-0,84 (м, 12H), 0,83-0,78 (м, 1H), 0,02 (с, 6H).
К суспензии NaH (463,21 мг, 11,58 ммоль) в THF (10 мл) добавляли по каплям раствор соединения 070-1(0,5 г, 1,16 ммоль) в THF (5 мл) при 0°C в атмосфере N2. Смесь перемешивали при 0°C в течение 30 минут. Затем добавляли по каплям MeI (1,64 г, 11,58 ммоль) и смесь перемешивали при 30°C в течение ночи. ТСХ показывала, что реакция завершена. Реакционную смесь гасили водным раствором NH4Cl (10 мл), полученный раствор экстрагировали этилацетатом (15 мл ×2) и органические слои объединяли и сушили над безводным Na2SO4, концентрировали в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир=1/50) с получением продукта 070-2 (270 мг, 52,3%) в виде белого твердого вещества.1H ЯМР (070-2): (400 МГц, CDCl3) δ 3,98-3,92 (м, 1H), 3,72-3,68 (м, 1H), 3,21 (с, 3H), 2,40-2,37 (м, 1H), 2,26-2,18 (м, 1H), 1,98-1,82 (м, 1H), 1,82-1,71 (м, 4H), 1,47-1,31 (м, 5H), 1,23-1,16 (м, 2H), 1,08 (с, 3H), 1,02-091 (м, 7H), 0,88 (с, 12H), 0,78-0,72 (м, 1H), 0,06-0,02 (м, 7H).
К смеси соединения070-2 (270 мг, 605,72 μммоль) и TBAF (1,58 г, 6,06 ммоль) в THF (6 мл) перемешивали при 30°C в течение 2 дней. ТСХ показывала, что реакция завершена. К реакционной смеси добавляли насыщенный солевой раствор (10 мл) и полученный раствор экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические слои промывали насыщенным солевым раствором (10 мл ×2), сушили над безводным Na2SO4иконцентрировали в вакууме с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (этилацетат/петролейный эфир=1/5) с получением соединения31(65,4 мг, 24,2%) в виде белого твердого вещества.1H ЯМР (31): (400 МГц, CDCl3) δ 4,06-4,02 (м, 1H), 3,71-3,68 (м, 1H), 3,23 (с, 3H), 2,41-2,37 (м, 1H), 2,24-2,18 (м, 1H), 2,14-2,06 (м, 1H), 1,98-1,87 (м, 1H), 1,84-1,68 (м, 5H), 1,78-1,79 (м, 1H), 1,59-1,48 (м, 3H), 1,48-1,32 (м, 5H), 1,32-1,13 (м, 4H), 108 (с, 3H), 0,99-0,89 (м, 7H), 0,82-0,77 (м, 1H).
Пример 24. Синтез Соединения 32.

К смеси соединения008-4(2 г, 6,934 ммоль) в CF3CH2OH (20 мл) при комнатной температуре в атмосфере N2 добавляли каталитическое количество концентрированного раствора H2SO4 (одну каплю). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. ТСХ показывала, что реакция завершена. Реакционную смесь разбавляли при помощи EtOAc (30 мл) и водным раствором NH4Cl (50 мл), экстрагировали при помощи EtOAc (30 мл). Объединенные органические слои промывали водным раствором NaHCO3(2×50 мл), сушили над Na2SO4 и концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=6:1) с получением продукта A5 (720 мг, 26,6% выход).
К смеси t-BuOK(1,73 г, 15,44 ммоль) в t-BuOH (10 мл) добавляли раствор соединения 093-1 (600 мг, 1,544 ммоль) в 1,2-диметоксиэтане (5 мл) в атмосфере N2. Добавляли раствор TosMic (603 мг, 3,089 ммоль) в 1,2-диметоксиэтане (5 мл). Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь разбавляли при помощи CH2Cl2(30 мл) и H2O (50 мл) и экстрагировали при помощи CH2Cl2(30 мл). Объединенные органические слои промывали водным раствором NH4Cl (50 мл) и сушили над Na2SO4, затем концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=10:1) с получением неочищенного продукта A5 (250 мг, 40,5% выход, смесь 17-CN эпимеров).
К суспензии соединения A5 (300 мг, 0,751 ммоль) в пиридине (10 мл) при комнатной температуре в атмосфере N2 по каплям добавляли PhCOCl (316 мг, 2,253 ммоль). Реакционную смесь нагревали до 100°C и перемешивали в течение 3 часов. ТСХ показывала, что реакция завершена. Реакционную смесь разбавляли при помощи CH2Cl2(30 мл) и H2O (50 мл), экстрагировали при помощи CH2Cl2(30 мл). Объединенные органические слои промывали при помощи 1N раствора HCl (30 мл ×2), сушили над Na2SO4 и концентрировали с получением неочищенного продукта. Этот продукт очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=25:1) с получением чистого целевого продукта A6 (100 мг, 26,4% выход).1H ЯМР (A6): (400 МГц, CDCl3) δ 5,20 (м, 1H), 3,99-3,86 (м, 2H), 3,73 (м, 1H), 2,29-2,22 (м, 1H), 2,18-1,88 (м, 5H), 1,79-1,21 (м, 14H), 1,20-0,72 (м, 11H).
К раствору соединения A6(100 мг, 0,2 ммоль) в MeOH (5 мл) добавляли раствор LiOH.H2O (20 мг, 1 ммоль) в H2O (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. ТСХ показывала, что реакция завершена. Реакционную смесь разбавляли при помощи EtOAc (10 мл) и водным раствором NH4Cl (10 мл), экстрагировали при помощи EtOAc (10 мл). Объединенные органические слои промывали при помощи H2O (10 мл), сушили над Na2SO4 и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=10:1) с получением соединения 32 (67 мг, 85% выход).1H ЯМР (32): (400 МГц, CDCl3) δ 3,99 (м, 1H), 3,89-3,70 (м, 2H), 3,58 (м, 1H), 2,30-2,22 (м, 1H), 2,15-2,02 (м, 1H), 1,97-1,60 (м, 7H), 1,44-1,20 (м, 9H), 1,18-0,70 (м, 11H).
Пример 25. Синтез Соединений 33 и 36.
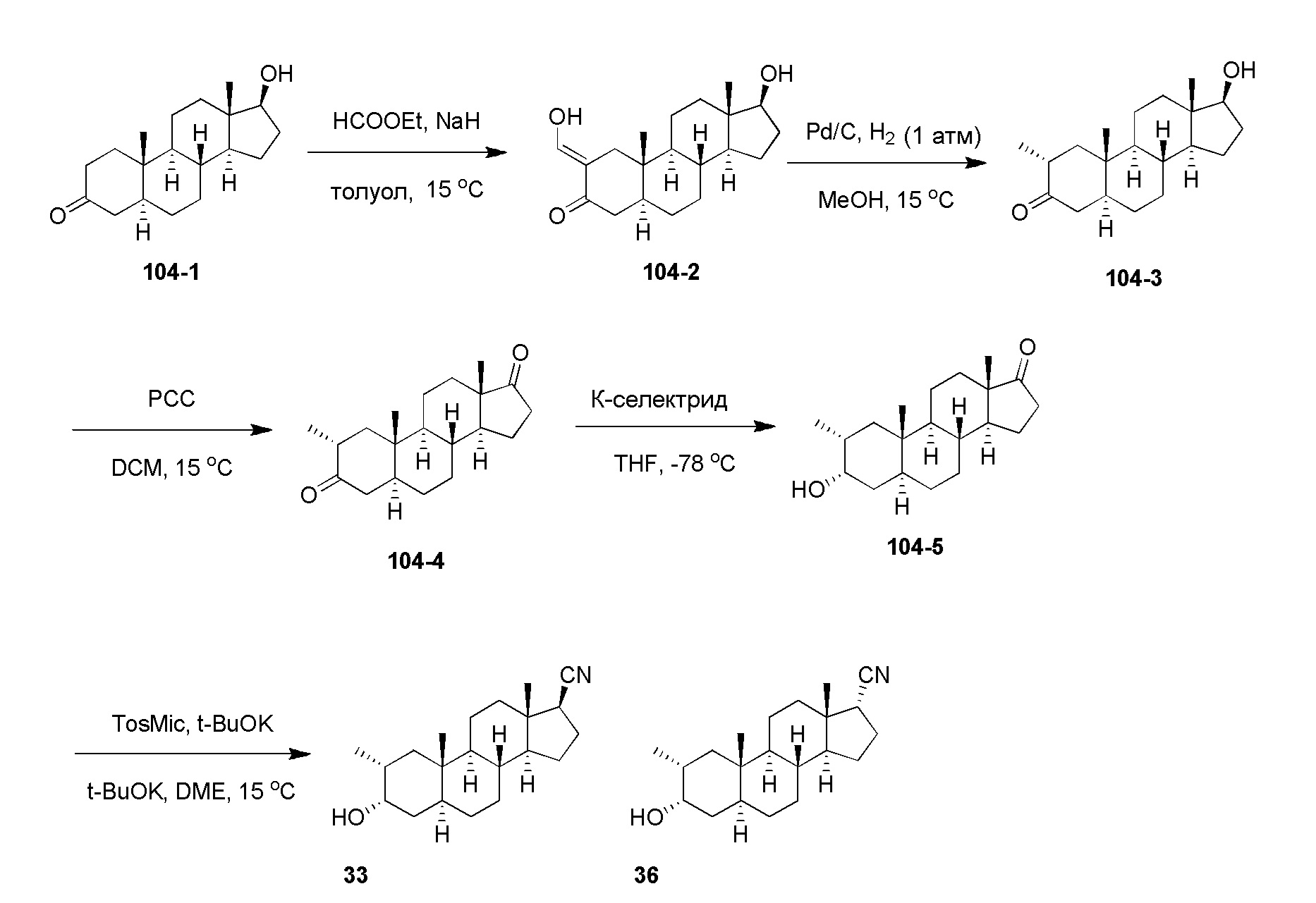
К раствору соединения 104-1 (10 г, 34 ммоль) в толуоле (100 мл) добавляли гидрид натрия (5,2 г, 60%, 130 ммоль) и этилформиат (3,7 г, 51 ммоль). Смесь затем перемешивали при 10°C в течение 16 часов. Смесь затем фильтровали. Твердое вещество промывали петролейным эфиром, добавляли к раствору HCl (1N, водный), фильтровали и промывали водой. Твердое вещество сушили в вакууме с получением 20 г неочищенного соединения 104-2 в виде белого твердого вещества.1H ЯМР (104-2): (400 МГц, CDCl3) δ 14,37 (шир.с, 1H), 8,62 (с, 1H), 3,64 (т, J=8,6 Гц, 1H), 2,39-2,20 (м, 2H), 2,14-1,94 (м, 3H), 1,88-1,79 (м, 1H), 1,54-1,32 (м, 7H), 1,31-1,16 (м, 3H), 1,13-0,80 (м, 5H), 0,77 (с, 3H), 0,75 (с, 3H).
К раствору соединения 104-2 (20 г неочищенного продукта) в метаноле (400 мл) добавляли Pd/C (3 г). Смесь затем перемешивали при 10°C в течение 16 часов в атмосфере водорода (1 атм.). Смесь затем фильтровали, концентрировали в вакууме, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=8:1 до этилацетата) с получением соединения 104-3 (3,1 г, 30% за 2 стадии) в виде бесцветного масла.1H ЯМР (104-3): (400 МГц, CDCl3) δ 3,63 (т, J=8,6 Гц, 1H), 2,66-2,40 (м, 1H), 2,38-2,20 (м, 1H), 2,10-1,92 (м, 3H), 1,85-1,75 (м, 1H), 1,70-1,20 (м, 12H), 1,10-0,81 (м, 7H), 0,80-0,75 (м, 6H).
К раствору соединения 104-3 (3,1 г, 10,1 ммоль) в дихлорметане (30 мл) добавляли пиридиний хлорхромат (4,8 г, 22,3 ммоль) при 15°C и перемешивали при 15°C в течение 2 часов. К смеси затем добавляли воду и фильтровали. Органический слой затем отделяли, сушили над безводным сульфатом натрия, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=8:1) с получением соединения 104-4(2,6 г, 84%) в виде белого твердого вещества.1H ЯМР (104-4): (400 МГц, CDCl3) δ 2,67-2,55 (м, 1H), 2,48-2,41 (м, 1H), 2,32-1,24 (м, 1H), 2,12-1,95 (м, 5H), 1,83-1,79 (м, 2H), 1,58-1,36 (м, 5H), 1,32-1,23 (м, 4H), 1,03-0,98 (м, 4H), 0,88-0,76 (м, 4H), 0,78 (с, 3H).
К раствору соединения 104-4 (2,1 г, 7 ммоль) в тетрагидрофуране (20 мл) добавляли K-селектрид (10 мл, 1M в THF, 10 ммоль) по каплям при -78°C. Смесь перемешивали при -78°C в течение 5 часов и затем добавляли по каплям пероксид водорода (2 мл, 30% в воде) при -78°C. Смесь затем нагревали до 10°C и добавляли водный раствор тиосульфат натрия. Смесь затем экстрагировали этилацетатом (30 мл ×3), органический слой сушили над безводным сульфатом натрия, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=4:1) с получением соединения 104-5 (700 мг, 30%) в виде белого твердого вещества.1H ЯМР (104-5): (400 МГц, CDCl3) δ 3,82-3,75 (м, 1H), 2,42 (дд, J=19,4 Гц, J=9,0 Гц, 1H), 2,12-2,00 (м, 1H), 1,97-1,89 (м, 1H), 1,82-1,67 (м, 4H), 1,56-1,44 (м, 5H), 1,37-1,20 (м, 7H), 1,07-0,97 (м, 2H), 0,93 (д, J=6,8 Гц, 3H), 0,85 (с, 3H), 0,81 (с, 3H), 0,79-0,73 (м, 1H).
К раствору трет-бутилата калия (1,4 г, 13 ммоль) в трет-бутаноле (5 мл) добавляли раствор соединения104-5 (400 мг, 1,3 ммоль) в 1,2-диметоксиэтане (5 мл) и раствор TosMic (600 мг, 3,3 ммоль) в 1,2-диметоксиэтане (5 мл). Смесь перемешивали при 15°C в течение 16 часов. К смеси добавляли воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, концентрировали в вакууме и полученное неочищенное твердое вещество очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=15:1) с получением соединения33 (87,2 мг, 21%) и соединения36(70,3 мг, 17%) в виде белого твердого вещества.1H ЯМР (33): (400 МГц, CDCl3) δ 3,82-3,75 (м, 1H), 2,26 (т, J=9,6 Гц, 1H), 2,18-2,04 (м, 1H), 1,98-1,87 (м, 2H), 1,79-1,62 (м, 4H), 1,56-1,40 (м, 3H), 1,39-1,10 (м, 8H), 1,10-0,95 (м, 3H), 0,93 (д, J=7,2 Гц, 3H), 0,90 (с, 3H), 0,79 (с, 3H), 0,78-0,71 (м, 1H).
1H ЯМР (36): (400 МГц, CDCl3) δ 3,81-3,75 (м, 1H), 2,55 (дд, J=9,2 Гц, J=2,0 Гц, 1H), 2,20-2,11 (м, 1H), 2,02-1,91 (м, 1H), 1,89-1,80 (м, 1H), 1,77-1,62 (м, 5H), 1,53-1,41 (м, 3H), 1,38-1,13 (м, 8H), 1,08-0,98 (м, 2H), 0,93 (д, J=6,8 Гц, 3H), 0,89-0,82 (м, 1H), 0,80 (с, 3H), 0,79 (с, 3H).
Пример 26. Синтез Соединения 34.

К раствору соединения 30 (170 мг, 0,53 ммоль) в DMF (2 мл) добавляли имидазол (73 мг, 1,07 ммоль) и TBSCl (121 мг, 0,80 ммоль). Реакционную смесь перемешивали при 15°C в течение 16 часов. ТСХ (петролейный эфир:EtOAc=1:2) показывала полный расход исходного вещества. Реакционную смесь экстрагировали при помощи EtOAc (20 мл) и водным раствором NaCl (20 мл). Органический слой сушили над безводным сульфатом натрия. Органическую фазу концентрировали в вакууме и очищали при помощи хроматографии на силикагеле, с элюированием смесью этилацетат/петролейный эфир (1/60) с получением 150 мг соединения071-1 (65%) в виде белого твердого вещества.
К раствору соединения 071-1 (150 мг, 0,35 ммоль) в THF (2 мл) добавляли NaH (56 мг, 1,39 ммоль). Смесь перемешивали при 12°C в течение 30 минут. К реакционной смеси добавляли MeI (197 мг, 1,39 ммоль) и перемешивали при 40°C в течение 16 часов. ТСХ (петролейный эфир:EtOAc=5:1) показывала полный расход исходного вещества. Реакционную смесь гасили водным раствором NH4Cl (5 мл) и экстрагировали при помощи EtOAc (20 мл). Органический слой сушили над безводным сульфатом натрия и органическую фазу концентрировали в вакууме. Неочищенный продукт очищали при помощи хроматографии на силикагеле, с элюированием смесью этилацетат/петролейный эфир (1/30), с получением 100 мг соединения071-2 (65%) в виде белого твердого вещества.
К раствору соединения 071-2 (100 мг, 0,22 ммоль) в CH2Cl2 (3 мл) добавляли TFA (0,5 мл). Смесь перемешивали при 15°C в течение 15 минут. ТСХ (петролейный эфир:EtOAc=5:1) показывала полный расход исходного вещества. Реакционную смесь гасили водным раствором NaHCO3 (5 мл) и экстрагировали при помощи EtOAc (20 мл). Органический слой сушили над безводным сульфатом натрия и органическую фазу концентрировали в вакууме. Неочищенный продукт очищали при помощи хроматографии на силикагеле, с элюированием смесью этилацетат/петролейный эфир (1/1) с получением 66 мг соединения34 (88%) в виде белого твердого вещества.1H ЯМР (34): (400 МГц, CDCl3) δ 4,00 (м, 1H), 3,41-3,35 (м, 1H), 2,25 (с, 3H), 2,46-2,42 (м, 1H), 2,34-2,29 (м, 1H), 2,19-2,09 (м, 1H), 2,00-1,88 (м, 1H), 1,82-1,56 (м, 7H), 1,53-0,98 (м, 12H), 0,90 (с, 3H), 0,89 (с, 3H).
Пример 27. Синтез Соединений 40 и 49.


К раствору соединения 008-1 (20 г, 69 ммоль) в толуоле (200 мл) добавляли Me2C(CH2OH)2 (22 г, 211 ммоль), HC(OEt)3 (40 г, 270 ммоль) и TsOH.H2O (2,5 г, 13 ммоль). Смесь затем перемешивали при 50°C в течение 48 часов. К смеси затем добавляли водный раствор NaHCO3. Органический слой сушили над Na2SO4, концентрировали в вакууме, очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=4:1) с получением соединения 105-1 (23 г, 88%) в виде белого твердого вещества.
1H ЯМР (105-1): (400 МГц, CDCl3) δ 3,65-3,30 (м, 5H), 2,25-2,15 (м, 1H), 1,84-1,18 (м, 16H), 1,15-0,62 (м, 18H).
К раствору соединения 105-1 (23 г, 61 ммоль) в пиридине (100 мл) добавляли TsCl (20 г, 105 ммоль). Смесь затем перемешивали при 50°C в течение 4 часов. Смесь затем выливали в воду и фильтровали. Полученное твердое вещество промывали водой, растворяли в CH2Cl2, сушили над Na2SO4 и концентрировали в вакууме с получением соединения 105-2 (35 г, 100%) в виде не совсем белого твердого вещества.1H ЯМР (105-2): (400 МГц, CDCl3) δ 7,80-7,74 (м, 2H), 7,38-7,28 (м, 2H), 4,45-4,33 (м, 1H), 3,65-3,58 (м, 1H), 3,47-3,30 (м, 3H), 2,43 (с, 3H), 2,25-2,15 (м, 1H), 1,80-0,57 (м, 33H).
Раствор соединения105-2 (35 г, 66 ммоль) в коллидине (60 мл) перемешивали при 180°C в течение 2 часов. Смесь затем выливали в воду, подкисляли 1N раствором HCl до уровня pH=3 и экстрагировали при помощи CH2Cl2. Органический слой сушили над Na2SO4 и концентрировали в вакууме с получением неочищенного соединения 105-3 и 105-3A (23 г, 100%) в виде не совсем белого твердого вещества.1H ЯМР (105-3 и 105-3A): (400 МГц, CDCl3) δ 5,63-5,50 (м, 1,75H, алкен-2,3-CH), 5,30-5,24 (м, 0,25H, алкен-4-CH), 3,67-3,60 (м, 1H), 3,48-3,40 (м, 1H), 3,38-3,30 (м, 2H), 2,27-2,16 (м, 1H), 2,05-1,05 (м, 16H), 0,95-0,65 (м, 15H).
К раствору соединений 105-3 и 105-3A (23 г, 64 ммоль) в CH2Cl2 (100 мл) добавляли m-CPBA (18 г, 105 ммоль). Смесь затем перемешивали при 15°C в течение 16 часов. К смеси добавляли NaHCO3/Na2S2O3 (водный раствор). Органический слой сушили над Na2SO4 и очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=20:1) с получением соединения 105-4 и 105-4A(8 г, 32%) в виде белого твердого вещества.1H ЯМР (105-4 и 105-4A): (400 МГц, CDCl3) δ 3,67-3,57 (м, 1H), 3,48-3,40 (м, 1H), 3,38-3,30 (м, 2H), 3,17-3,03 (м, 1,75H, эпокси-2,3-CH), 2,70-2,65 (м, 0,25H, эпокси-4-CH), 2,27-2,14 (м, 1H), 2,06-0,55 (м, 31H).
К суспензии CuCN (2,3 г, 26 ммоль) в THF (20 мл) добавляли MeLi (53 мл, 1M раствор в 2-Me-THF, 53 ммоль) при -78°C по каплям. Смесь нагревали до 0°C и затем охлаждали до -78°C. Раствор BF3.Et2O (1,5 г, 10,6 ммоль) в THF (10мл) добавляли по каплям и затем перемешивали при -78°C в течение 30 минут. Затем добавляли по каплям раствор соединения105-4 и 105-4A(2 г, 5,3 ммоль) в THF (10 мл) и перемешивали при -78°C еще в течение 3 часов. К смеси затем добавляли смесь MeOH (15 мл) и Et3N (15 мл). Смесь затем нагревали до 10°C. К смеси добавляли NH4Cl (водный раствор) и этилацетат. Смесь затем фильтровали. Органический слой отделяли, сушили над Na2SO4 и концентрировали в вакууме с получением соединения 105-5 и 105-5A (3,1 г, неочищенный) в виде светло-желтого масла.1H ЯМР (105-5 и 105-5A): (400 МГц, CDCl3) δ 3,72-3,67 (м, 0,4H, 3-CHOH 4-метильного соединения), 3,67-3,62 (м, 0,6H, 3-CHOH 2-метильного соединения), 3,58-3,52 (м, 1H), 3,41-3,34 (м, 1H), 3,32-3,25 (м, 2H), 2,20-2,03 (м, 2H), 1,86-0,58 (м, 35H).
К раствору соединений 105-5 и 105-5A(3,1 г, неочищенный) в ацетоне (30 мл) добавляли TsOH.H2O (1,5 г, 7,9 ммоль). Смесь перемешивали при 15°C в течение 1 часа. К смеси добавляли NaHCO3 (водный раствор) до уровня pH=7. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, концентрировали в вакууме и очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=8:1-5:1) с получением соединения 105-6 и 105-6A(1,2 г, 70% за две стадии) в виде белого твердого вещества.1H ЯМР (105-6 и 105-6A): (400 МГц, CDCl3) δ 3,72-3,67 (м, 0,4H, 3-CHOH 4-метильного соединения), 3,67-3,62 (м, 0,6H, 3-CHOH 2-метильного соединения), 2,48-2,38 (м, 1H), 2,13-1,98 (м, 1H), 1,97-1,15 (м, 18H), 1,05-0,63 (м, 11H).
К раствору t-BuOK (2,2 г, 20 ммоль) в t-BuOH (20 мл) добавляли раствор TosMic (900 мг, 5 ммоль) в 1,2-диметоксиэтане (10 мл) и раствор соединений105-6 и 105-6A (600 мг, 2 ммоль) в 1,2-диметоксиэтане (10 мл). Смесь перемешивали при 15°C в течение 3 часов. К смеси добавляли воду и эту смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4 и очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=15:1-10:1) с получением соединения A7 и A8 (600 мг, неочищенный) в виде белого твердого вещества.1H ЯМР (A7 и A8): (400 МГц, CDCl3) δ 3,72-3,67 (м, 0,25H, 3-CHOH 4-метильного соединения), 3,67-3,62 (м, 0,75H, 3-CHOH 2-метильного соединения), 2,26 (т, J=9,2 Гц, 1H), 2,15-0,68 (м, 31H).
К раствору соединений A7 и A8 (600 мг, 1,9 ммоль) в пиридине (6 мл) добавляли BzCl (1 г, 7 ммоль). Смесь затем перемешивали при 15°C в течение 3 дней. К смеси затем добавляли NaHCO3 (водный раствор) и затем экстрагировали этилацетатом. Органический слой концентрировали в вакууме и очищали при помощи препаративной ВЭЖХ и затем SFC с получением соединения 105-7 (90 мг) и соединения105-7A (40 мг, общий выход за две стадии: 30%) в виде белого твердого вещества.1H ЯМР (105-7): (400 МГц, CDCl3) δ 8,08-8,03 (м, 2H), 7,61-7,55 (м, 1H), 7,51-7,44 (м, 2H), 5,08-5,00 (м, 1H), 2,29 (т, J=9,6 Гц, 1H), 2,22-0,90 (м, 29H), 0,83-0,74 (м, 1H).1H ЯМР (105-7A): (400 МГц, CDCl3) δ 8,10-8,05 (м, 2H), 7,63-7,55 (м, 1H), 7,52-7,44 (м, 2H), 5,11-5,04 (м, 1H), 2,29 (т, J=9,6 Гц, 1H), 2,23-1,13 (м, 18H), 1,07-0,88 (м, 11H), 0,85-0,75 (м, 1H).
К раствору соединения 105-7 (90 мг, 0,2 ммоль) в THF (2 мл) добавляли MeOH (1 мл) и раствор LiOH.H2O (0,1 г, 2,4 ммоль) в воде (1 мл). Смесь перемешивали при 40°C в течение 16 часов. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4 и очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=8:1-5:1) с получениемсоединения40 (72 мг, 100%) в виде не совсем белого твердого вещества.1H ЯМР (40): (400 МГц, CDCl3) δ 3,74-3,67 (м, 1H), 2,24 (т, J=9,6 Гц, 1H), 2,24-2,00 (м, 1H), 1,97-1,81 (м, 3H), 1,78-1,45 (м, 7H), 1,43-0,75 (м, 19H), 0,75-0,65 (м, 1H).
К раствору соединения 105-7A (40 мг, 0,1 ммоль) в THF (2 мл) добавляли MeOH (1 мл) и раствор LiOH.H2O (0,1 г, 2,4 ммоль) в воде (1 мл). Смесь перемешивали при 40°C в течение 16 часов. Затем смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4 и очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=8:1-5:1) с получением соединения49 (25 мг, 100%) в виде не совсем белого твердого вещества.1H ЯМР (49): (400 МГц, CDCl3) δ 3,83-3,77 (м, 1H), 2,27 (т, J=9,6 Гц, 1H), 2,17-2,03 (м, 1H), 1,99-1,50 (м, 11H), 1,50-0,73 (м, 19H).
Пример 28. Синтез Соединений 41 и 50.

К суспензии CuCN (1,88 г, 21,2 ммоль) в THF (150 мл) по каплям добавляли EtLi (85 мл, 0,5M в бензол/циклогексан, 42,5 ммоль) при -78°C. Смесь нагревали до 0°C и затем охлаждали до -78°C. Раствор BF3.Et2O (1,5 г, 10,6 ммоль) в THF (10мл) добавляли по каплям и затем перемешивали при -78°C в течение 30 минут. Раствор соединений 105-4 и 105-4A (2 г, 5,3 ммоль) в THF (10 мл) добавляли по каплям и перемешивали при -78°C в течение еще 3 часов. К смеси затем добавляли смесь MeOH (15 мл) и Et3N (15 мл). Смесь нагревали до 10°C. К смеси добавляли NH4Cl (водный раствор) и этилацетат. Смесь фильтровали и органический слой отделяли, сушили над Na2SO4 и концентрировали в вакууме с получением соединения 107-1 и 107-1A (2,5 г, неочищенное) в виде светло-желтого масла, смеси 2β-Et, 3-αOH и 3-αOH, 4β-Et изомеров.1H ЯМР (107-1 и 107-1A): (400 МГц, CDCl3) δ 3,94-3,90 (м, 0,1H, 3-CHOH 4-этильного соединения), 3,85-3,74 (м, 0,6H, 3-CHOH 2-этильного соединения), 3,68-3,62 (м, 1H), 3,51-3,43 (м, 1H), 3,41-3,33 (м, 2H), 2,28-2,18 (м, 1H), 1,78-0,70 (м, 38H).
К раствору соединений 107-1 и 107-1A (2,5 г, неочищенный) в ацетоне (20 мл) добавляли TsOH.H2O (0,5 г, 2,6 ммоль). Смесь перемешивали при 15°C в течение 3 часов. К смеси добавляли NaHCO3 (водный раствор) до уровня pH=7. Смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=10:1-5:1) с получением соединения 107-2 и 107-2A (1,2 г, 70% за две стадии) в виде белого твердого вещества.1H ЯМР (107-2 и 107-2A): (400 МГц, CDCl3) δ 3,93-3,88 (м, 0,2H, 3-CHOH 4-этильного соединения), 3,83-3,77 (м, 0,8H, 3-CHOH 2-этильного соединения), 2,46-2,34 (м, 1H), 2,10-1,97 (м, 1H), 1,95-1,13 (м, 20H), 1,06-0,70 (м, 11H).
К раствору t-BuOK (4,2 г, 38 ммоль) в t-BuOH (20 мл) добавляли раствор TosMic (1,8 г, 9,5 ммоль) в 1,2-диметоксиэтане (20 мл) и раствор соединений107-2 и 107-2A (1,2 г, 3,8 ммоль) в 1,2-диметоксиэтане (20 мл). Смесь перемешивали при 15°C в течение 5 часов. К смеси добавляли воду и экстрагировали этилацетатом. Органический слой сушили над Na2SO4 и очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=10:1-8:1) с получением соединенияA9 и A10 (1 г, неочищенное) в виде белого твердого вещества.1H ЯМР (A9 и A10): (400 МГц, CDCl3) δ 3,97-3,93 (м, 0,15H, 3-CHOH 4-этильного соединения), 3,87-3,80 (м, 0,8H, 3-CHOH 2-этильного соединения), 2,28 (т, J=9,2 Гц, 1H), 2,17-2,06 (м, 1H), 1,98-1,90 (м, 2H), 1,82-0,70 (м, 30H).
К раствору соединений A9 и A10 (1 г, 3 ммоль) в пиридине (10 мл) добавляли BzCl (1,5 г, 10,6 ммоль). Смесь перемешивали при 20°C в течение 16 часов. К смеси добавляли NaHCO3 (водный раствор) и экстрагировали этилацетатом. Органический слой концентрировали в вакууме, очищали при помощи препаративной ВЭЖХ и затем SFC с получением соединения 107-3 (450 мг) и 107-3A(80 мг, общий выход за две стадии: 40%) в виде белого твердого вещества.1H ЯМР (107-3): (400 МГц, CDCl3) δ 8,07-8,00 (м, 2H), 7,59-7,52 (м, 1H), 7,50-7,42 (м, 2H), 5,15-5,10 (м, 1H), 2,27(т, J=9,6 Гц, 1H), 2,15-2,05 (м, 1H), 1,98-0,85 (м, 30H), 0,82-0,73 (м, 1H).1H ЯМР (107-3A): (400 МГц, CDCl3) δ 8,10-8,02 (м, 2H), 7,58-7,52 (м, 1H), 7,50-7,42 (м, 2H), 5,25-5,18 (м, 1H), 2,26 (т, J=9,6 Гц, 1H), 2,18-2,05 (м, 1H), 1,98-1,50 (м, 13H), 1,45-1,10 (м, 6H), 1,07-0,84 (м, 11H), 0,84-0,74 (м, 1H).
К раствору соединения 107-3 (450 мг, 1 ммоль) в THF (4 мл) добавляли MeOH (2 мл) и раствор LiOH.H2O (0,4 г, 10 ммоль) в воде (2 мл). Смесь перемешивали при 40°C в течение 16 часов. Смесь затем экстрагировали этилацетатом. Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=8:1-5:1) с получением соединения 41 (233 мг, 80%) в виде белого твердого вещества.
1H ЯМР (41): (400 МГц, CDCl3) δ 3,86-3,70 (м, 1H), 2,26 (т, J=9,6 Гц, 1H), 2,16-2,03 (м, 1H), 1,97-1,84 (м, 2H), 1,79-1,06 (м, 18H), 1,05-0,88 (м, 8H), 0,83 (с, 3H), 0,77-0,67 (м, 1H).
К раствору соединения 107-3A (80 мг, 0,2 ммоль) в THF (2 мл) добавляли MeOH (1 мл) и раствор LiOH.H2O (0,1 г, 2,4 ммоль) в воде (1 мл). Смесь перемешивали при 40°C в течение 16 часов. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:этилацетат=8:1-5:1) с получением соединения 50 (40 мг, 80%) в виде белого твердого вещества.1H ЯМР (50): (400 МГц, CDCl3) δ 3,95-3,90 (м, 1H), 2,26 (т, J=9,6 Гц, 1H), 2,16-2,03 (м, 1H), 1,98-0,85 (м, 28H), 1,82-0,70 (м, 4H).
Пример 29. Синтез Соединения 42.

Смесь соединения008-4 (20 г, 69,34 ммоль) и AcOH (200 мл) перемешивали при 120°C в течение 3 часов. ТСХ показывала, что исходное вещество полностью израсходовано. Растворитель удаляли и смесь доводили до уровня pH=7 насыщенным водным раствором Na2CO3 (100 мл). Смесь обрабатывали водой и экстрагировали при помощи EtOAc (200 мл ×2). Органическую фазу промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и затем концентрировали с получением неочищенного продукта. Неочищенный продукт очищали при помощи колоночной флэш-хроматографии на силикагеле (PE:EtOAc=5:1) с получением соединения 032-1 (17 г, 70%) в виде белого твердого вещества.1H ЯМР (032-1): (400 МГц, CDCl3) δ 4,89-4,88 (м, 1H), 3,88-3,87 (м, 1H), 2,48-2,41 (м, 1H), 2,13-2,03 (м, 4H), 1,96-1,93 (м, 1H), 1,87-1,76 (м, 5H), 1,69-1,50 (м, 5H), 1,49-1,23 (м, 6H), 1,07-1,02 (м, 1H), 0,95 (с, 3H), 0,87 (с, 3H), 0,84-0,81 (м, 1H).
К перемешиваемому раствору соединения 032-1 (16 г, 45,6 ммоль) в сухом DMF (150 мл) добавляли имидазол (6,2 г, 91,8 ммоль) и TBSCl (13,8 г, 91,8 ммоль) и смесь перемешивали при 50°C в течение 12 часов. Смесь обрабатывали водой и экстрагировали при помощи EtOAc (200 мл ×2). Объединенный органический слой промывали водой (200 мл ×4). Органический слой сушили над безводным Na2SO4 и концентрировали с получением неочищенного продукта, который очищали при помощи колоночной флэш-хроматографии на силикагеле (PE:EtOAc=40:1) с получением соединения 032-2 (18,6 г, 88%) в виде белого твердого вещества.1H ЯМР (032-2): (400 МГц, CDCl3) δ 4,78-4,77 (м, 1H), 3,79-3,78 (м, 1H), 2,46-2,41 (м, 1H), 2,10-2,05 (м, 4H), 1,96-1,93 (м, 1H), 1,83-1,60 (м, 6H), 1,51-1,22 (м, 9H), 1,10-1,00 (м, 1H), 0,93 (с, 3H), 0,91-0,89 (м, 9H), 0,87 (с, 3H), 0,84-0,81 (м, 1H), 0,12-,001 (м, 6H).
К перемешиваемому раствору соединения 032-2 (18 г, 38,9 ммоль) в THF (150 мл) добавляли LiOH.H2O (4,6 г, 194,6 ммоль), MeOH (30 мл) и H2O (30 мл). Смесь перемешивали при 50°C в течение 12 часов. Растворитель удаляли при пониженном давлении и твердое вещество отделяли. Твердое вещество фильтровали и фильтровальный слой промывали при помощи EtOAc, сушили в вакууме. Получали белое твердое вещество 092-1(10,8 г, 66%).1H ЯМР (092-1): (400 МГц, CDCl3) δ 3,82-3,80 (м, 1H), 3,79-3,76 (м, 1H), 2,46-2,41 (м, 1H), 2,10-2,05 (м, 1H), 1,95-1,92 (м, 2H), 1,83-1,80 (м, 2H), 1,79-1,64 (м, 2H), 1,54-1,51 (м, 2H), 1,41-1,20 (м, 8H) 1,11-0,98 (м, 4H), 0,95 (с, 9H), 0,93 (с, 3H), 0,80-0,72 (м, 1H), 0,0,7-,001 (м, 6H).
К перемешиваемому раствору t-BuOK (13,4 г, 119 ммоль) в t-BuOH (80 мл) добавляли раствор соединения 092-1 (10 г, 23,8 ммоль) в THF (40 мл) в атмосфере азота. Раствор тозилметилизоцианида (9,3 г, 47,6 ммоль) в 1,2-диметоксиэтане (40 мл) добавляли по каплям. Смесь перемешивали при комнатной температуре в течение 12 часов. Смесь затем обрабатывали разбавленным водным раствором хлорида натрия с последующей обработкой хлористоводородной кислотой (1 M)до кислотного уровня. Смесь экстрагировали при помощи EtOAc и органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4, концентрировали с получением остатка, который очищали при помощи колоночной флэш-хроматографии на силикагеле (PE:EtOAc=10:1) с получением соединения 092-2 (4,2 г, 41%) в виде белого твердого вещества.1H ЯМР (092-2): (400 МГц, CDCl3) δ 3,82-3,80 (м, 1H), 3,79-3,76 (м, 1H), 2,30-2,23 (м, 1H), 2,20-2,00 (м, 1H), 1,94 -1,88 (м, 3H), 1,80-1,61 (м, 5H), 1,52-1,23 (м, 10H), 1,15-1,04 (м, 2H), 0,99 (с, 3H), 0,97-0,89 (м, 12H), 0,73-0,65 (м, 1H), 0,0,7-,001 (м, 6H).
К перемешиваемому раствору соединения 092-2 (2,0 г, 1,16 ммоль) в этоксиэтилене (20 мл) добавляли Hg(AcO)2 (2,2 г, 6,95 ммоль). Смесь перемешивали при 25°C в течение 12 часов. Смесь фильтровали и фильтрат упаривали с получением остатка, который очищали при помощи колоночной флэш-хроматографии на Al2O3(PE:EtOAc=100:1), с получением соединения 092-3 (672 мг, 32%) в виде белого твердого вещества.1H ЯМР (092-3): (400 МГц, CDCl3) δ 6,32-6,27 (м, 1H), 4,34-4,30 (дд, J1=1,6, J2=14, 1H), 4,05-4,03 (дд, J1=1,6, J2=6,8, 1H), 3,94-3,93 (м, 1H), 3,78-3,77 (м, 1H), 2,27-2,251 (м, 1H), 2,18-2,10 (м, 1H), 2,07-1,93 (м, 1H), 1,90-1,65 (м, 5H), 1,43-1,20 (м, 10), 1,18-1,10 (м, 1H), 1,00 (с, 3H), 0,99-0,93 (м, 1H), 0,92-0,91 (м, 12H), 0,80-0,70 (м, 1H), 0,07-0,01 (м, 6H).
К перемешиваемому раствору соединения092-3 (600 мг, 1,31 ммоль) в сухом толуоле (6 мл) добавляли диэтилцинк (3,93 мл, 3,93 ммоль) при -40°C в атмосфере азота. Через 1 час добавляли по каплям хлорйодметан (461 мг, 2,62 ммоль). Реакционную смесь перемешивали при -40°C в течение 2 часов, затем нагревали до комнатной температуры и перемешивали в течение 12 часов. Смесь гасили насыщенным водным раствором NH4Cl (20 мл). Смесь обрабатывали водой и экстрагировали при помощи EtOAc (20 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4, упаривали досуха и очищали при помощи колоночной флэш-хроматографии на силикагеле (PE:EtOAc=200:1) с получением соединения 092-4 (252 мг, 41%) в виде белого твердого вещества.1H ЯМР (092-4): (400 МГц, CDCl3) δ 3,94-3,93 (м, 1H), 3,44-3,43 (м, 1H), 3,29-3,27 (м, 1H), 2,24-2,22 (м, 1H), 2,18-2,04 (м, 1H), 1,92-1,89 (м, 2H), 1,75-1,60 (м, 6H), 1,52-1,15 (м, 9), 1,14-1,03 (м, 2H), 1,00-0,98 (м, 5H), 0,92-0,91 (м, 12H), 0,77-0,68 (м, 1H), 0,60-0,45 (м,4H), 0,02-0,01 (м, 6H).
К перемешиваемому раствору соединения 092-4 (252 мг, 0,36 ммоль) в сухом CH2Cl2 (3 мл) добавляли трифторуксусную кислоту (0,27 мл, 3,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Смесь затем гасили насыщенным водным раствором NaHCO3(15 мл). Смесь обрабатывали водой и экстрагировали при помощи CH2Cl2 (30 мл ×2). Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и упаривали досуха и очищали при помощи колоночной флэш-хроматографии на силикагеле (PE:EtOAc=8:1) с получениемсоединения42 (38 мг, 30%) в виде белого твердого вещества.1H ЯМР (42): (400 МГц, CDCl3) δ 4,03-4,02 (м, 1H), 3,57 -3,56 (м, 1H), 3,32-3,29 (м, 1H), 2,28-2,25 (м, 1H), 2,20-2,04 (м, 1H), 1,93-1,61 (м, 2H), 1,73-1,60 (м, 5H), 1,52-1,25 (м, 10H), 1,20-1,02 (м, 1H), 0,99 (с, 3H), 0,98-0,92 (м, 1H), 0,90 (с, 3H), 0,87-0,80 (м, 5H), 0,60-0,47 (м, 4H).
Пример 30. Синтез Соединения 43.

К суспензии NaH (220 мг, 5,55 ммоль) в THF (5 мл) добавляли по каплям раствор соединения 092-2 (800 мг, 1,85 ммоль) в THF (5 мл). Полученную смесь нагревали при кипячении с обратным холодильником в течение 1 часа, затем охлаждали до комнатной температуры и медленно добавляли CS2 (560 мг, 7,4 ммоль) к реакционной смеси. Полученную смесь перемешивали в течение 30 минут. Добавляли по каплям MeI (1,31 г, 9,25 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. При 0°C добавляли ледяную воду и смесь обрабатывали водным раствором хлористоводородной кислоты (1M, 5 мл). Смесь экстрагировали при помощи EtOAc и объединенную органическую фазу промывали насыщенным раствором NaHCO3, затем насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали при помощи флэш-хроматографии (PE: EtOAc=150:1) с получением соединения 096-1(450 мг, 46%) в виде белого твердого вещества.1H ЯМР (096-1): (400 МГц, CDCl3) δ 5,10-5,05 (м, 1H), 4,03-4,01 (м, 1H), 2,58 (с, 3H), 2,30-2,25 (м, 1H), 2,20-2,11 (м, 1H), 2,00-1,91 (м, 4H), 1,84-1,62 (м, 6H), 1,53-1,20 (м, 12H), 1,19-1,10 (м, 2H), 1,04 (с, 3H), 1,03-0,90 (м, 14H), 0,78-0,72 (м, 1H), 0,98 (с, 3H), 0,10 (с, 3H), 0,08 (с, 3H).
К перемешиваемому раствору 1,3-дибром-5,5-диметилгидантоина (245 мг, 0,86 ммоль) в сухом CH2Cl2 (2 мл) добавляли пиридин (1,5 мл) и HF/пиридин (1,5мл) по каплям при -78°C. Смесь перемешивали при комнатной температуре в течение 10 минут и охлаждали до 0°C. Раствор соединения 096-1 (450 мг, 0,86 ммоль) в CH2Cl2 (2 мл) добавляли по каплям. Полученную смесь перемешивали в течение 1 часа при 0°C. Смесь гасили насыщенным водным раствором NaHCO3 (20 мл). Смесь экстрагировали при помощи CH2Cl2 (20 мл ×2) и органический слой промывали водным раствором хлористоводородной кислоты (0,5 M, 10 мл), затем насыщенным солевым раствором. Объединенный органический слой сушили над безводным Na2SO4 и упаривали досуха и очищали при помощи колоночной флэш-хроматографии на силикагеле (PE:EtOAc=20:1) с получением соединения 096-2 (120 мг, 28%) в виде бесцветного масла.1H ЯМР (096-2): (400 МГц,CDCl3) δ 4,13-4,11(м, 1H), 3,95-3,94 (м, 1H), 2,26-2,23(м, 1H), 2,11-2,08 (м, 1H), 2,00-1,58 (м, 9H), 1,55-1,01(м, 16H), 0,98 (с, 3H), 0,92-0,80(м, 13H), 0,78-0,70 (м, 2H), 0,10-0,02(м, 6H).
К перемешиваемому раствору соединения 096-2(120 мг, 0,24 ммоль) в сухом CH2Cl2 (3 мл) добавляли трифторуксусную кислоту (0,09 мл, 1,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Смесь гасили насыщенным водным раствором NaHCO3(10 мл). Смесь затем обрабатывали водой и экстрагировали при помощи CH2Cl2 (10 мл ×2). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и упаривали досуха и очищали при помощи колоночной флэш-хроматографии на силикагеле (PE:EtOAc=20:1) с получением соединения 43 (31 мг, 32%) в виде белого твердого вещества.1H ЯМР (43):(400 МГц, CDCl3) δ 4,31-4,30 (м, 1H), 4,07-4,03 (м, 1H), 2,29-2,24(м, 1H), 1,96-1,92 (м, 1H), 1,80-1,57 (м, 5H), 1,50-1,25 (м, 8H), 1,20-1,10 (м, 1H), 1,01 (с, 3H), 0,99-0,92 (м, 1H), 0,91(с, 3H), 0,76-0,72(м, 1H).
Пример 31. Синтез Соединения 44.

К смеси t-BuOK(15,45 г, 138 ммоль) в t-BuOH (50 мл) добавляли раствор соединения 008-1(4 г, 14 ммоль) в 1,2-диметоксиэтане (20 мл) в атмосфере N2. Затем добавляли раствор TosMic (5,38 г, 28 ммоль) в 1,2-диметоксиэтане (30 мл). Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь разбавляли при помощи CH2Cl2(50 мл), H2O (50 мл) и экстрагировали при помощи CH2Cl2(50 мл). Объединенные органические слои промывали водным раствором NH4Cl (50 мл), сушили над Na2SO4 и концентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=20:1) с получением продукта 108-1(1,52 г, 36,63% выход).1H ЯМР(неочищенное соединение 108-1): (400 МГц, CDCl3) δ 4,72-4,62 (м, 1H), 2,30-2,22 (м, 1H), 2,18-2,03 (м, 1H), 1,98-1,58 (м, 8H), 1,41-1,10 (м, 8H), 1,06-0,79 (м, 8H), 0,70-0,62 (м, 1H).
К раствору соединения 108-1 (2,3 г, 7,64 ммоль) в пиридине (15 мл) добавляли TsCl (1,7 г, 9,17 ммоль). Реакционную смесь нагревали до 50°C и перемешивали в течение 6 часов. ТСХ показывала, что реакция завершена. Реакционную смесь концентрировали для удаления пиридина. Остаток разбавляли при помощи H2O (20 мл), экстрагировали при помощи EtOAc (30 мл ×2). Объединенные органические слои промывали 1N раствором HCl (20 мл ×2), сушили над Na2SO4 и концентрировали с получением неочищенного продукта 108-2 (3,5 г)в виде желтого масла.1H ЯМР(неочищенный 108-2): (400 МГц, CDCl3) δ 7,80-7,77 (д, 2H), 7,33-7,30 (д, 2H), 4,45-4,35 (м, 1H), 2,45 (с, 3H), 2,28-2,21 (м, 1H), 2,18-2,03 (м, 1H), 1,98-1,85 (м, 2H), 1,80-1,50 (м, 11H), 1,40-0,75 (м, 18H), 0,63-0,57 (м, 1H).
Раствор соединения108-2 (3,5 г, 7,68 ммоль) в коллидине (10 мл) нагревали до 140°C и перемешивали в течение 5 часов. ТСХ показывала, что реакция завершена. После охлаждения, реакционную смесь выливали в 2N раствор HCl, затем экстрагировали при помощи EtOAc (30 мл ×2). Объединенные органические слои промывали 1N раствором HCl (20 мл ×2) и сушили над Na2SO4, затем концентрировали с получением неочищенного продукта 108-3 (2,1 г)в виде желтого масла.
К раствору OsO4(50 мг, 1,64 ммоль) и NMO (1,8 г, 15,876 ммоль) в t-BuOH (20 мл), THF (20 мл) и H2O (2 мл) добавляли раствор соединения108-3(1,5 г, 5,292 ммоль) в THF (5 мл). Раствор перемешивали при комнатной температуре в течение 3 часов. После того, как ТСХ показывала, что исходное вещество полностью израсходовано, смесь гасили водным раствором NaHS и экстрагировали при помощи EtOAc (10 мл ×3). Объединенные органические слои промывали водным раствором Na2SO3, сушили над Na2SO4иконцентрировали с получением неочищенного продукта, который очищали при помощи колоночной хроматографии на силикагеле (элюент: петролейный эфир:EtOAc=3:1) с получением соединения 108-4 (1,1 г, 65,4%) в виде белого твердого вещества.1H ЯМР(неочищенный 108-4): (400 МГц, CDCl3) δ 3,98-3,93 (м, 1H), 3,81-3,75 (м, 1H), 2,30-2,23 (м, 1H), 2,15-1,50 (м, 14H), 1,49-0,78 (м, 18H).
К смеси соединения108-4 (800 мг, 2,524 ммоль) в толуоле (15 мл) добавляли Novozym 435 (2 г) и виниловый эфир уксусной кислоты (5 мл). Реакционную смесь нагревали до 50°C и перемешивали в течение 3 дней. Полученную смесь фильтровали и фильтрат концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=5:1) с получением продукта 108-5 (330 мг, 36,4% выход).1H ЯМР(неочищенный 108-5): (400 МГц, CDCl3) δ 5,13 (м, 1H), 3,88-3,81 (м, 1H), 2,30-2,22 (м, 1H), 2,18-2,05 (м, 4H), 1,98-1,52 (м, 12H), 1,43-1,10 (м, 9H), 1,03-0,78 (м, 10H).
К раствору соединения108-5 (250 мг, 0,695 ммоль) в THF (5 мл) добавляли NaH (278 мг, 6,95 ммоль). Реакционную смесь перемешивали в течение 10 минут. Затем добавляли MeI (987 мг, 6,95 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение еще 1 часа. Реакционную смесь гасили водным раствором NH4Cl (10 мл) и экстрагировали при помощи EtOAc (30 мл ×2). Объединенные органические слои промывали водным раствором NaCl (20 мл) и сушили над Na2SO4, затем концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=10:1) с получением неочищенного продукта 108-6 (80 мг, 30,8% выход).
К раствору соединения 108-6(80 мг, 0,214 ммоль) в MeOH (2 мл) и THF (2 мл) добавляли раствор NaOH (26 мг, 0,642 ммоль) в H2O (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. ТСХ показывала, что реакция завершена. Реакционную смесь разбавляли при помощи EtOAc (10 мл) и водным раствором NH4Cl (10 мл) и экстрагировали при помощи EtOAc (10 мл). Объединенные органические слои промывали при помощи H2O (10 мл), сушили над Na2SO4 и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали при помощи колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=8:1) с получением очищенного продукта44(17 мг, 23,9% выход).1H ЯМР (44):(400 МГц, CDCl3) δ 4,15-4,08 (м, 1H), 3,37 (с, 3H), 2,30-2,22 (м, 1H), 2,15-2,07 (м, 1H), 1,98-1,90 (м, 2H), 1,75-1,55 (м, 5H), 1,45-1,10 (м, 9H), 1,07-0,90 (м, 5H), 0,87-0,80 (м, 4H).
Пример 32. Синтез Соединений 45 и 46.


К раствору соединения 001-6 (10 г, 30 ммоль) в толуоле (200 мл) добавляли Me2C(CH2OH)2 (9,4 г, 90 ммоль), HC(OEt)3 (13,3 г, 90 ммоль) и TsOH.H2O (280 мг, 1,5 ммоль). Смесь перемешивали при 40°Cв течение 3 часов. К смеси затем добавляли MeOH (100 мл) и раствор LiOH.H2O (8 г, 200 ммоль) в воде (100 мл). Смесь перемешивали в течение дополнительных 4 часов при 20°C. Смесь экстрагировали этилацетатом. Объединенный органический слой отделяли, сушили над Na2SO4, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=8:1) с получением соединения 106-1(9 г, 70%) в виде бесцветного масла.
1H ЯМР (106-1): (400 МГц, CDCl3) δ 4,45-4,35(м, 1H), 3,75-3,20(м, 5H), 2,20-2,10(м, 1H), 1,90-0,80(м, 30H), 0,70(с, 3H).
К раствору соединения 106-1(9 г, 23 ммоль) в DMF (30 мл) добавляли имидазол (3,1 г, 46 ммоль) и TBSCl (5,1 г, 34 ммоль). Смесь перемешивали при 20°C в течение 5 часов. К смеси затем добавляли воду и экстрагировали этилацетатом. Органический слой промывали водой, сушили над Na2SO4, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=100:1-25:1) с получением соединения 106-2 (9 г, 80%) в виде белого твердого вещества.1H ЯМР (106-2): (400 МГц, CDCl3) δ 4,46-4,38(м, 1H), 4,02-3,95(м, 1H), 3,68-3,62(м, 1H), 3,48-3,42(м, 1H), 3,40-3,30(м, 2H), 2,25-2,15(м, 1H), 2,08-2,00(м, 1H), 1,90-0,95(м, 27H),0,92-0,85(м, 10H), 0,73(с, 3H), 0,08-0,00(м, 6H).
К суспензии NaH (4 г, 60%, 100 ммоль) в DMF (60 мл) добавляли раствор соединения106-2 (9 г, 16 ммоль) в DMF (40 мл) и тетрагидрофуране (10 мл). Смесь перемешивали при 20°C в течение 30 минут. Затем добавляли MeI (20 мл) и смесь перемешивали при 40°C в течение 5 часов. Смесь выливали в NH4Cl (водный раствор), экстрагировали петролейным эфиром и этилацетатом (1:1). Органический слой отделяли, промывали водой, сушили над Na2SO4 и концентрировали в вакууме с получением соединения 106-3 (10,6 г, неочищенный продукт) в виде белого твердого вещества.1H ЯМР (106-3): (400 МГц, CDCl3) δ 4,00-3,95 (м, 1H), 3,78-3,72 (м, 1H), 3,70-3,65 (м, 1H), 3,50-3,35 (м, 3H), 3,25-3,20 (м, 3H), 2,25-2,15 (м, 1H), 1,80-0,80 (м, 37H), 0,75-0,70 (м, 4H).
К раствору соединения 106-3 (10 г, 19 ммоль) в тетрагидрофуране (20 мл) добавляли TBAF (30мл, 1M в тетрагидрофуране). Смесь перемешивали при 60°C в течение 3 дней. Затем смесь концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=15:1-10:1) с получением соединения 106-4 (6,1 г, 75% за 2 стадии) в виде белого твердого вещества.1H ЯМР (106-4): (400 МГц, CDCl3) δ 4,10-3,30 (м, 6H), 3,22 (с, 3H), 2,23-2,15 (м, 1H), 1,98-1,92 (м, 1H), 1,85-0,80 (м, 28H), 0,70 (с, 3H).
К раствору соединения 106-4 (5,1 г, 12,5 ммоль) в CH2Cl2 (50 мл) добавляли реагент Десса-Мартина (15 г, 35 ммоль). Смесь перемешивали при 20°C в течение 2 часов. К смеси добавляли NaHCO3/Na2S2O3 (водный раствор). Органический слой отделяли, сушили над Na2SO4, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=30:1-25:1) с получением соединения 106-5 (4,5 г, 75%) в виде белого твердого вещества.1H ЯМР (106-5): (400 МГц, CDCl3) δ 3,75-3,60 (м, 2H), 3,50-3,33 (м, 3H), 3,25 (с, 3H), 2,50-2,40 (м, 1H), 2,35-2,20 (м, 3H), 2,08-1,95 (м, 3H), 1,90-1,25 (м, 11H), 1,20 (с, 3H), 1,15 (с, 3H), 0,98 (с, 3H), 0,95-0,78 (м, 23H), 0,71 (с, 3H).
К суспензии соединения106-5 (3,5 г, 8,6 ммоль) в толуоле (35 мл) добавляли NaH (1,03 г, 60%, 26 ммоль) и HCOOEt (1,28 г, 17,3 ммоль). Смесь перемешивали при 20°C в течение 16 часов. К смеси затем добавляли NH4Cl (водный раствор) и смесь экстрагировали этилацетатом. Объединенный органический слой сушили над Na2SO4, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=30:1) с получением соединения 106-6 (3,5 г, 95%) в виде белого твердого вещества.1H ЯМР (106-6): (400 МГц, CDCl3) δ 14,37 (шир.с, 1H), 8,66 (с, 1H), 3,78-3,70 (м, 1H), 3,70-3,60 (м, 3H), 3,26 (м, 3H), 2,40-0,78 (м, 27H), 0,71 (с, 3H).
К раствору соединения 106-6 (4,5 г, 10 ммоль) в метаноле (50 мл) добавляли Pd/C (2 г). Смесь затем перемешивали при 30°C в течение 3 дней в атмосфере водорода (2,109 кг/см2). Смесь затем фильтровали, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=80:1-40:1) с получением соединения 106-7 (0,7 г, 20%) и соединения 106-7A (0,8 г, 22%) и 0,4 г смеси.1H ЯМР (106-7): (400 МГц, CDCl3) δ 3,78-3,72 (м, 1H), 3,70-3,63 (м, 1H), 3,48-3,44 (м, 1H), 3,40-3,33 (м, 2H), 3,26 (с, 3H), 2,55-2,50 (м, 1H), 2,35-2,28 (м, 1H), 2,25-2,14 (м, 1H), 2,08-1,95 (м, 3H), 1,90-0,75 (м, 25H), 0,71 (с, 3H).1H ЯМР (106-7A): (400 МГц, CDCl3) δ 3,78-3,72 (м, 1H), 3,70-3,63 (м, 1H), 3,48-3,44 (м, 1H), 3,40-3,33 (м, 2H), 3,23 (с, 3H), 2,60-2,55 (м, 1H), 2,25-2,15 (м, 3H), 2,05-1,95 (м, 2H), 1,85-0,80 (м, 25H), 0,71 (с, 3H).
К раствору соединения 106-7 (0,7 г, 1,9 ммоль) в тетрагидрофуране (12 мл) по каплям добавляли K-селектрид (4 мл, 1M в тетрагидрофуране, 4 ммоль) при -78°C. Смесь перемешивали при -78°C в течение 5 часов и затем добавляли по каплям H2O2 (2 мл, 30% в воде) при -78°C. Смесь затем нагревали до 10°C и добавляли Na2S2O3 (водный раствор). Смесь экстрагировали этилацетатом. Объединенный органический слой сушили над Na2SO4, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=40:1) с получением соединения 106-8 (600 мг, 85%) в виде белого твердого вещества.1H ЯМР (106-8): (400 МГц, CDCl3) δ 3,80-3,70 (м, 2H), 3,68-3,60 (м, 1H), 3,48-3,44 (м, 1H), 3,40-3,33 (м, 2H), 3,23 (с, 3H), 2,20-2,15 (м, 1H), 1,98-1,90 (м, 1H), 1,72-1,50 (м, 6H), 1,45-1,05 (м, 12H), 1,00-0,80 (м, 12H), 0,71 (с, 3H).
К раствору соединения 106-8 (0,66 г, 1,4 ммоль) в ацетоне (5 мл) добавляли TsOH.H2O (0,1 г, 0,3 ммоль). Смесь перемешивали при 25°C в течение 1 часа. К смеси добавляли NaHCO3 (водный раствор), экстрагировали этилацетатом. Органический слой отделяли, объединяли и очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=12:1-8:1) с получением соединения 106-9 (0,5 г, 100%) в виде белого твердого вещества.1H ЯМР (106-9): (400 МГц, CDCl3) δ 3,82-3,72 (м, 2H), 3,23 (с, 3H), 2,52-2,42 (м, 1H), 2,30-2,25 (м, 1H), 2,08-1,70 (м, 5H), 1,60-1,10 (м, 9H), 1,05-0,75 (м, 13H).
К раствору t-BuOK (0,5 г, 4,5 ммоль) в t-BuOH (4 мл) добавляли DME (4 мл), TosMic (0,21 г, 1,07 ммоль) и затем соединение106-9 (0,15 г, 0,45 ммоль). Смесь перемешивали при 25°C в течение 16 часов. К смеси добавляли NH4Cl (водный раствор) и экстрагировали этилацетатом. Объединенные органические слои отделяли, сушили над Na2SO4, концентрировали в вакууме и очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=10:1-8:1) с получением соединения45 (67 мг, 45%) и 46(23 мг, 15%) в виде белого твердого вещества. 1H ЯМР (45): (400 МГц, CDCl3) δ 3,82-3,74 (м, 1H), 3,73-3,68 (м, 1H), 3,25 (с, 3H), 2,44-2,35 (м, 1H), 2,25-2,18 (м, 1H), 2,10-2,00 (м, 1H), 1,98-1,88 (м, 1H), 1,85-1,60 (м, 4H), 1,56-1,50 (м, 1H), 1,48-1,06 (м, 11H), 1,00-0,90 (м, 9H), 0,78-0,75 (м, 1H). 1H ЯМР (46): (400 МГц, CDCl3) δ 3,82-3,74 (м, 2H), 3,24 (с, 3H), 2,55-2,48 (м, 1H), 2,25-2,15 (м, 2H), 2,00-1,70 (м, 5H), 1,60-1,10 (м, 11H).
Пример 33. Синтез Соединений 51 и 52.

К раствору соединения 31 (1,2 г, 3,6 ммоль) в пиридине (6 мл) добавляли TsCl (1,4 г, 7,2 ммоль). Смесь затем перемешивали при 50°C в течение 2 часов. Смесь затем выливали в воду, фильтровали. Твердое вещество промывали водой, растворяли в CH2Cl2, сушили над Na2SO4, концентрировали в вакууме с получением 150-1 (1,4 г, 80%) в виде не совсем белого твердого вещества.1H ЯМР (150-1): (400 МГц, CDCl3) δ 7,80-7,75 (м, 2H), 7,35-7,28 (м, 2H), 4,45-4,68 (м, 1H), 3,65-3,60 (м, 1H), 3,25-3,15 (м, 3H), 2,44 (с, 3H), 2,42-2,35 (м, 1H), 2,25-2,15 (м, 1H), 2,15-0,75 (м, 25H).
Раствор соединения150-1 (1,4 г, 2,9 ммоль) в коллидине (6 мл) перемешивали при 180°C в течение 1 часа. Смесь затем выливали в H2SO4 (водный раствор). Смесь экстрагировали при помощи CH2Cl2. Органический слой сушили над Na2SO4, концентрировали в вакууме с получением соединения 150-2 и 150-2A (1 г, неочищенный) в виде светло-желтого масла.1H ЯМР (150-2 и 150-2A): (400 МГц, CDCl3) δ 5,65-5,58 (м, 1,75H, алкен-2,3-CH), 5,30-5,24 (м, 0,25H, алкен-4-CH), 3,75-3,66 (м, 1H), 3,30-3,20 (м, 3H), 2,45-2,38 (м, 1H), 2,27-2,18 (м, 1H), 2,15-1,65 (м, 8H), 1,45-0,65 (м, 15H).
К раствору соединения 150-2 (1 г, 3,2 ммоль) в CH2Cl2 (5 мл) добавляли m-CPBA (1 г, 1,8 ммоль). Смесь затем перемешивали при 25°C в течение 1 часа. К смеси добавляли NaHCO3/Na2S2O3 (водный раствор). Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=20:1-10:1) с получением соединения 150-3 и 150-3A(0,65 г, 60% за 2 стадии) в виде белого твердого вещества.1H ЯМР (150-3 и 150-3A): (400 МГц, CDCl3) δ 3,67-3,60 (м, 1H), 3,28-3,12 (м, 5H), 2,45-2,35 (м, 1H), 2,25-2,17 (м, 1H), 2,14-1,17 (м, 12H), 1,07-0,6 (м, 11H).
К суспензии CuCN (667 мг, 7,5 ммоль) в THF (20 мл) добавляли MeLi (15 мл, 1M in 2-Me-THF, 15 ммоль) при -78°C по каплям. Смесь нагревали до 0°C и затем охлаждали до -78°C. Раствор BF3.Et2O (426 мг, 3 ммоль) в THF (5 мл) добавляли по каплям и затем перемешивали при -78°C в течение 30 минут. Раствор 150-3 и 150-3A(500 мг, 1,5 ммоль) в THF (5 мл) затем добавляли по каплям и перемешивали при -78°C еще в течение 1 часа. К смеси затем добавляли смесь MeOH (6 мл) и Et3N (6 мл). Смесь затем нагревали до 10°C. К смеси добавляли NH4Cl (водный раствор) и этилацетат. Смесь затем фильтровали. Органический слой отделяли, сушили над Na2SO4, концентрировали в вакууме, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=10:1-5:1) с получением соединения51 и 52 (420 мг, 82%, включая 4-метильную смесь) в виде белого твердого вещества.1H ЯМР (51 и 52): (400 МГц, CDCl3) δ 3,78-3,66 (м, 2H), 3,27-3,20 (м, 3H), 2,42-2,35 (м, 1H), 2,24-2,16 (м, 1H), 2,14-2,02 (м, 1H), 1,97-1,63 (м, 6H), 1,55-0,70 (м, 21H).

К раствору соединения 51 и 52 (550 мг, 1,6 ммоль) в пиридине (6 мл) добавляли BzCl (500 мг, 3,5 ммоль). Смесь затем перемешивали при 25°C в течение 16 часов. К смеси затем добавляли NaHCO3 (водный раствор), экстрагировали этилацетатом. Органический слой концентрировали в вакууме, очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=15:1) и затем SFC с получением соединения 150-4 (430 мг) и 150-4A (170 мг, общий выход: 85%) в виде белого твердого вещества.1H ЯМР (150-4): (400 МГц, CDCl3) δ 8,06-8,02 (м, 2H), 7,59-7,50 (м, 1H), 7,48-7,41 (м, 2H), 5,05-5,00 (м, 1H), 3,74-3,67 (м, 1H), 3,27 (с, 3H), 2,45-2,36 (м, 1H), 2,25-1,73 (м, 7H), 1,68-1,13 (м, 12H), 1,12-0,74 (м, 9H).1H ЯМР (150-4A): (400 МГц, CDCl3) δ 8,07-8,00 (м, 2H), 7,60-7,52 (м, 1H), 7,50-7,41 (м, 2H), 5,09-5,05 (м, 1H), 3,75-3,67 (м, 1H), 3,24 (с, 3H), 2,44-2,35 (м, 1H), 2,25-2,18 (м, 7H), 2,13-0,73 (м, 27H).
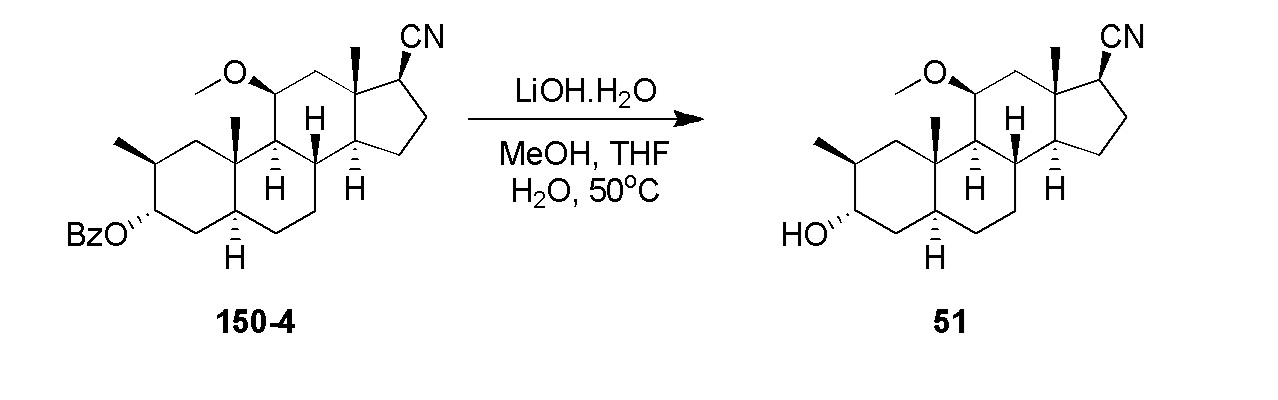
К раствору соединения 150-4 (430 мг, 0,96 ммоль) в THF (2 мл) добавляли MeOH (1 мл) и раствор LiOH.H2O (0,2 г, 4,7 ммоль) в воде (1 мл). Смесь перемешивали при 50°C в течение 16 часов. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=8:1-5:1) с получением соединения 51 (236 мг, 70%) в виде не совсем белого твердого вещества. Абсолютная конфигурация была подтверждена при помощи 2D-ЯМР.1H ЯМР (51): (400 МГц, CDCl3) δ 3,80-3,76 (м, 1H), 3,74-3,67 (м, 1H), 3,27 (с, 3H), 2,44-2,35 (м, 1H), 2,26-2,17 (м, 1H), 2,15-2,04 (м, 1H), 1,99-1,88 (м, 2H), 1,75-1,50 (м, 7H), 1,46-1,15 (м, 5H), 1,10-1,05 (м, 6H), 1,04-0,88 (м, 6H), 0,80-0,74 (м, 1H).

К раствору соединения 150-4A (170 мг, 0,38 ммоль) в THF (2 мл) добавляли MeOH (1 мл) и раствор LiOH.H2O (0,2 г, 4,7 ммоль) в воде (1 мл). Смесь перемешивали при 50°C в течение 16 часов. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=8:1-5:1) с получением соединения52 (79 мг, 61%) в виде не совсем белого твердого вещества. Абсолютная конфигурация была подтверждена при помощи 2D-ЯМР.1H ЯМР (52): (400 МГц, CDCl3) δ 3,82-3,78 (м, 1H), 3,75-3,65 (м, 1H), 3,22 (с, 3H), 2,40-2,33 (м, 1H), 2,24-2,15 (м, 1H), 2,12-2,02 (м, 1H), 1,97-1,30 (м, 13H), 1,13-1,02 (м, 7H), 1,00-0,82 (м, 6H), 0,78-0,70 (м, 1H).
Пример 34. Синтез Соединений 53 и 54.

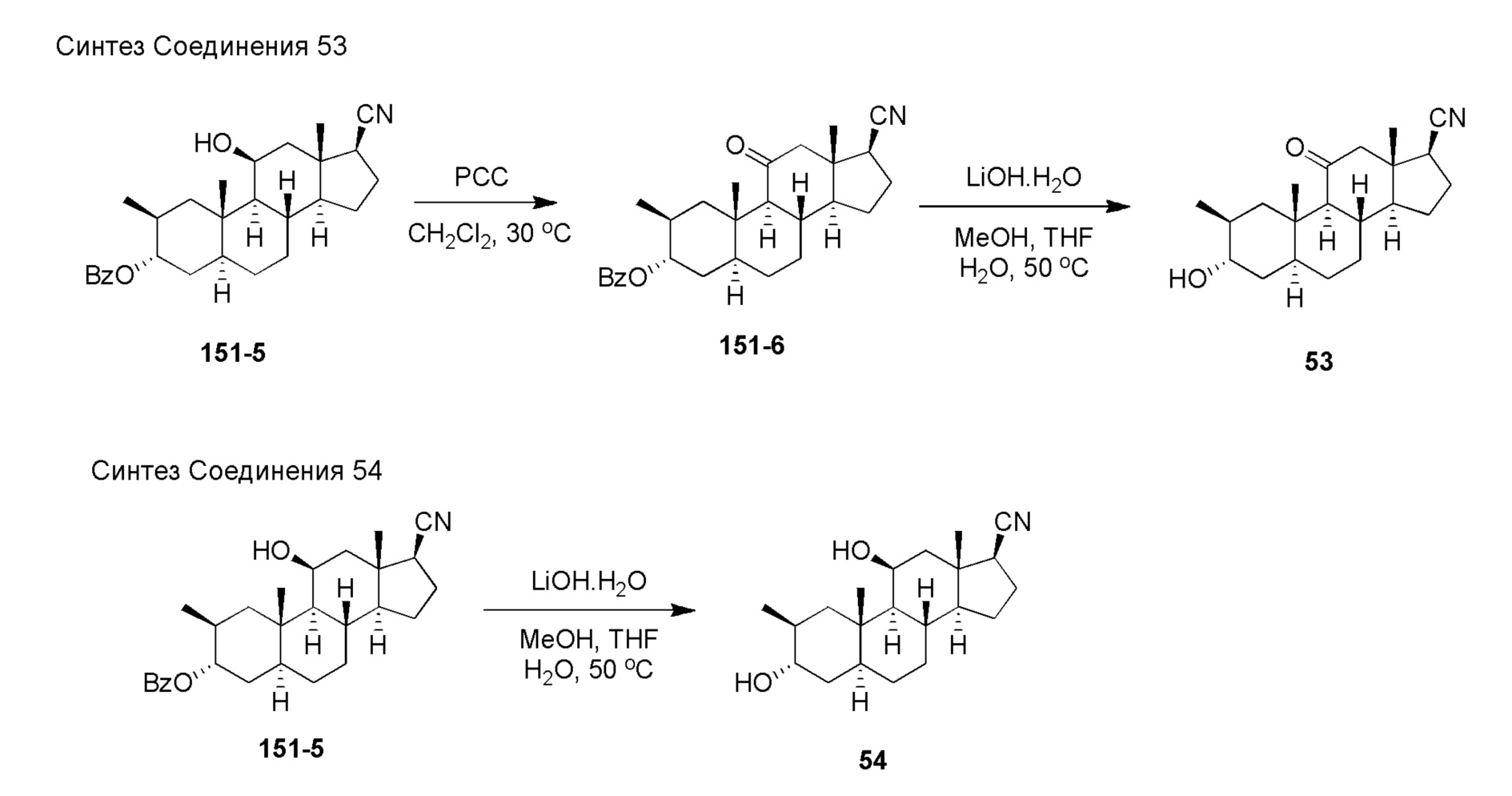
К раствору соединения 27 (2 г, 6,3 ммоль) в пиридине (8 мл) добавляли TsCl (1,8 г, 9,5 ммоль). Смесь затем перемешивали при 25°C в течение 16 часов. К смеси добавляли NaHCO3 (водный раствор), экстрагировали этилацетатом. Органический слой сушили над Na2SO4, концентрировали в вакууме с получением соединения 151-1 (3,5 г, неочищенное) в виде коричневого твердого вещества.1H ЯМР (151-1): (400 МГц, CDCl3) δ 7,80-7,75(м, 2H), 7,35-7,28(м, 2H), 4,85-4,65(м, 1H), 4,45-4,32(м, 1H), 3,25-3,15(м, 3H), 2,44(с, 3H), 2,25-0,80(м, 28H).
Раствор соединения151-1 (3,5 г, 6,3 ммоль) в коллидине (10 мл) перемешивали при 180°C в течение 1 часа. К смеси добавляли HCl (водный раствор), экстрагировали этилацетатом. Органический слой сушили над Na2SO4, концентрировали в вакууме с получением соединения 151-2 и 151-2A(2 г, 100% за две стадии) в виде светло-желтого твердого вещества.1H ЯМР (151-2 и 151-2A): (400 МГц, CDCl3) δ 5,65-5,57(м, 2H), 4,50-4,35(м, 1H), 2,25-2,17(м, 1H), 2,15-0,66(м, 25H).
К раствору соединений 151-2 и 151-2A(2 г, 6,7 ммоль) в CH2Cl2 (15 мл) добавляли m-CPBA (1,8 г, 10,5 ммоль). Смесь затем перемешивали при 25°C в течение 1 часа. К смеси добавляли NaHCO3/Na2S2O3 (водный раствор). Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=10:1) с получением соединения 151-3 и 151-3A(1,5 г, 75%) в виде белого твердого вещества.1H ЯМР (151-3 и 151-3A): (400 МГц, CDCl3) δ 4,46-4,30(м, 1H), 3,24-3,12(м, 2H), 2,25-0,60(м, 26H).
К суспензии CuCN (2,1 г, 23,5 ммоль) в THF (30 мл) добавляли MeLi (47 мл, 1M in 2-Me-THF, 47 ммоль) при -78°C по каплям. Смесь нагревали до 0°C и затем охлаждали до -78°C. Добавляли по каплям раствор BF3.Et2O (1,33 г, 9,4 ммоль) в THF (10 мл) и затем перемешивали при -78°C в течение 30 минут. Затем добавляли по каплям раствор соединения 151-3 и 151-3A (1,5 г, 4,7 ммоль) в THF (10 мл) и перемешивали при -78°C в течение еще 1 часа. К смеси затем добавляли смесь MeOH (10 мл) и Et3N (10 мл). Смесь затем нагревали до 10°C. К смеси добавляли NH4Cl (водный раствор) и этилацетат. Смесь затем фильтровали. Органический слой отделяли, сушили над Na2SO4, концентрировали в вакууме, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=10:1-5:1) с получением соединения 151-4 и 151-4A(560 мг, 33%) в виде белого твердого вещества.1H ЯМР (151-4 и 151-4A): (400 МГц, CDCl3) δ 4,45-4,35 (м, 1H), 3,86-3,75 (м, 1H), 2,25-2,15 (м, 1H), 2,15-0,70 (м, 30H).
К раствору соединения 151-4 и 151-4A(0,56 г, 1,6 ммоль) в пиридине (5 мл) добавляли BzCl (0,5 г, 3,5 ммоль). Смесь затем перемешивали при 30°C в течение 16 часов. К смеси затем добавляли NaHCO3 (водный раствор), экстрагировали этилацетатом. Органический слой концентрировали в вакууме, очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=15:1-5:1) и затем SFC с получением соединения соединения 151-5 (310 мг) и соединения 151-5A (170 мг, общий выход: 69%) в виде белого твердого вещества. Абсолютная конфигурация двух соединений была подтверждена при помощи 2D-ЯМР.1H ЯМР (151-5): (400 МГц, CDCl3) δ 8,06-8,02 (м, 2H), 7,59-7,50 (м, 1H), 7,48-7,41 (м, 2H), 5,05-5,00 (м, 1H), 4,45-4,38 (м, 1H), 2,25-0,74 (м, 30H).1H ЯМР (151-5A): (400 МГц, CDCl3) δ 8,06-8,02 (м, 2H), 7,59-7,50 (м, 1H), 7,48-7,41 (м, 2H), 5,09-5,05 (м, 1H), 4,45-4,38 (м, 1H), 2,25-0,74 (м, 30H).
К раствору соединения 151-5 (20 мг, 0,46 ммоль) в CH2Cl2 (5 мл) добавляли PCC (300 мг, 1,4 ммоль). Смесь перемешивали при 30°C в течение 1 часа. К смеси добавляли MgSO4, фильтровали. Фильтрат концентрировали в вакууме, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=10:1) с получением соединения 151-6 (170 мг, 85%) в виде не совсем белого твердого вещества.1H ЯМР (151-6): (400 МГц, CDCl3) δ 8,06-8,02 (м, 2H), 7,59-7,50 (м, 1H), 7,48-7,41 (м, 2H), 5,03-4,95 (м, 1H), 2,55-2,45 (м, 2H), 2,30-1,65 (м, 11H), 1,60-1,40 (м, 4H), 1,35-1,10 (м, 9H), 0,89 (с, 3H).
К раствору соединения 151-6 (200 мг, 0,46 ммоль) в THF (4 мл) добавляли MeOH (2 мл) и раствор LiOH.H2O (150 мг, 3,6 ммоль) в воде (1 мл). Смесь перемешивали при 50°C в течение 16 часов. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=5:1) с получением соединения 53 (112 мг, 74%) в виде не совсем белого твердого вещества.1H ЯМР (53): (400 МГц, CDCl3) δ 3,80-3,70 (м, 1H), 2,57-2,45 (м, 2H), 2,32-2,20 (м, 2H), 2,15-1,55 (м, 10H), 1,45-1,12 (м, 7H), 1,10-1,03 (м, 6H), 0,89 (с, 3H).
К раствору соединения 151-5 (80 мг, 0,18 ммоль) в THF (2 мл) добавляли MeOH (2 мл) и раствор LiOH.H2O (70 мг, 1,6 ммоль) в воде (0,5 мл). Смесь перемешивали при 50°C в течение 16 часов. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=5:1) с получением соединения 54 (39 мг, 63%) в виде не совсем белого твердого вещества.1H ЯМР (54): (400 МГц, CDCl3) δ 4,42-4,37 (м, 1H), 3,82-3,75 (м, 1H), 2,25-2,17 (м, 1H), 2,15-2,05 (м, 2H), 2,00-1,88 (м, 2H), 1,85-1,50 (м, 10H), 1,45-1,18 (м, 6H), 1,15 (с, 3H), 1,10-0,90 (м, 8H), 0,82-0,74 (м, 1H).
Пример 35. Синтез Соединений 55 и 56.

К раствору соединения 151-5A (120 мг, 0,28 ммоль) в CH2Cl2 (4 мл) добавляли PCC (180 мг, 0,84 ммоль). Смесь перемешивали при 30°C в течение 1 часа. К смеси добавляли MgSO4, фильтровали. Фильтрат концентрировали в вакууме, очищали при помощи колоночной хроматографии (петролейный эфир:этилацетат=10:1) с получением соединения 151-6A (110 мг, 90%) в виде не совсем белого твердого вещества.1H ЯМР (151-6A): (400 МГц, CDCl3) δ 8,06-8,02 (м, 2H), 7,59-7,50 (м, 1H), 7,48-7,41 (м, 2H), 5,05-5,00 (м, 1H), 2,55-2,45 (м, 3H), 2,30-2,20 (м, 2H), 2,05-1,85 (м, 5H), 1,80-1,60 (м, 4H), 1,50-1,10 (м, 8H), 1,03 (д, J=7,6 Гц, 3H), 0,90-0,76 (м, 4H).
К раствору соединения 151-6A (110 мг, 0,25 ммоль) в THF (4 мл) добавляли MeOH (2 мл) и раствор LiOH.H2O (150 мг, 3,6 ммоль) в воде (1 мл). Смесь перемешивали при 50°C в течение 16 часов. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=5:1) с получением соединения 55 (21 мг, 26%) в виде не совсем белого твердого вещества.1H ЯМР (55): (400 МГц, CDCl3) δ 3,85-3,74 (м, 1H), 2,55-2,45 (м, 2H), 2,35-2,20 (м, 3H), 2,10-1,85 (м, 4H), 1,78-1,60 (м, 4H), 1,50-1,37 (м, 4H), 1,33-1,15 (м, 4H), 1,09 (с, 1H), 0,94 (д, J=7,6 Гц, 3H), 0,89 (с, 3H).

К раствору соединения 151-5A (50 мг, 0,11 ммоль) в THF (2 мл) добавляли MeOH (2 мл) и раствор LiOH.H2O (70 мг, 1,6 ммоль) в воде (0,5 мл). Смесь перемешивали при 50°C в течение 16 часов. Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, очищали при помощи колоночной хроматографии (петролейный эфир: этилацетат=5:1) с получением соединения 56 (11 мг, 27%) в виде не совсем белого твердого вещества.1H ЯМР (56): (400 МГц, CDCl3) δ 4,45-4,36 (м, 1H), 3,85-3,78 (м, 1H), 2,25-2,16 (м, 1H), 2,14-1,70 (м, 8H), 1,50-1,25 (м, 7H), 1,20-1,10 (м, 7H), 1,00-0,75 (м, 8H).
Пример 36. Синтез Соединения 57.

К перемешиваемому раствору t-BuOK (4,54 г, 40,5 ммоль) в t-BuOH (30 мл) добавляли раствор соединения 092-1 (3,4 г, 8,1 ммоль) в THF (15 мл) в атмосфере азота. Добавляли по каплям раствор тозилметилизоцианида (3,16 г, 16,2 ммоль) в 1,2-диметоксиэтане (15 мл). Смесь перемешивали при 25°C в течение 12 часов. Смесь обрабатывали разбавленным водным раствором хлорида натрия (50 мл) с последующей обработкой хлористоводородной кислотой (1 M)до кислотного уровня. Смесь экстрагировали при помощи EtOAc (100 мл ×2) и органический слой промывали насыщенным солевым раствором (100 мл), сушили над безводным Na2SO4, затем концентрировали. Остаток очищали при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=12:1) с получением соединения 092-2A (530 мг, 15%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 3,81-3,80 (м, 1H), 3,74-3,73 (м, 1H), 2,56-2,53 (м, 1H), 2,22-2,11 (м, 1H), 2,00 -1,80 (м, 3H), 1,71-1,61 (м, 5H), 1,53-1,23 (м, 10H), 1,15-1,04 (м, 1H), 0,97 (с, 3H), 0,89-0,88 (м, 12H), 0,87-0,86 (м, 4H), 0,0,7-0,01 (м, 6H).
К перемешиваемому раствору соединения 092-2A (530 мг, 1,22 ммоль) в этоксиэтене (10 мл) добавляли Hg(AcO)2 (585,6 мг, 1,83 ммоль). Смесь перемешивали при 25°C в течение 12 часов. Смесь фильтровали и фильтрат упаривали. Остаток очищали при помощи колоночной флэш-хроматографии на Al2O3 (элюент: петролейный эфир:этилацетат=100:1) с получением соединения 092-3A (230 мг, 41%) в виде бесцветного масла.1H ЯМР: (400 МГц, CDCl3) δ 6,30-6,25 (м, 1H), 4,33-4,29 (дд, J1=1,6, J2=14, 1H), 4,03-4,01 (дд, J1=1,6, J2=6,8, 1H), 3,92-3,91 (м, 1H), 3,75-3,74 (м, 1H), 2,56-2,253 (м, 1H), 2,20-2,10 (м, 1H), 1,99-1,90 (м, 1H), 1,88-1,63 (м, 7H), 1,41-1,00 (м, 12), 0,97-0,80 (м, 13H), 0,79 (с, 3H), 0,07-0,01 (м, 6H).
К перемешиваемому раствору соединения 092-3A (230 мг, 0,5 ммоль) в сухом толуоле (3 мл) добавляли диэтилцинк (2,0 мл, 2,0 ммоль) при -40°C в атмосфере азота. После перемешивания в течение 1 часа, добавляли по каплям хлорйодметан (351,8 мг, 2,0 ммоль). Реакционную смесь перемешивали при -40°C в течение 2 часов, затем нагревали до 25°C и перемешивали в течение 12 часов. Смесь гасили насыщенным водным раствором NH4Cl (20 мл), экстрагировали при помощи EtOAc (30 мл ×2). Объединенный органический слой промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривали досуха. Очистка при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=100:1) с получением соединения 092-4A (100 мг, 42%) в виде бесцветного масла.1H ЯМР: (400 МГц, CDCl3) δ 3,94-3,93 (м, 1H), 3,44-3,43 (м, 1H), 3,29-3,27 (м, 1H), 2,56-2,53 (м, 1H), 2,23-1,90 (м, 2H), 1,85-1,60 (м, 4H), 1,53-1,00 (м, 10H), 0,97-0,65 (м, 14H), 0,64-0,40 (м, 4H), 0,02-0,01 (м, 6H)
К перемешиваемому раствору соединения 092-4A (100 мг, 0,21 ммоль) в сухом CH2Cl2 (4 мл) добавляли 2,2,2-трифторуксусную кислоту (1 мл). Реакционную смесь перемешивали при 25°C в течение 1 часа. Смесь гасили насыщенным водным раствором NaHCO3(15 мл), экстрагировали при помощи CH2Cl2 (20 мл ×2). Объединенный органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали досуха. Очистка при помощи колоночной флэш-хроматографии на силикагеле (элюент: петролейный эфир:этилацетат=10:1) с получением неочищенного продукта, который очищали при помощи препаративной ВЭЖХ с получением соединения 57(6 мг, 9%) в виде белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 4,06-4,05 (м, 1H), 3,58 -3,57 (м, 1H), 3,33-3,30 (м, 1H), 2,58-2,55 (м, 1H), 2,16-2,10 (м, 1H), 2,01-1,90 (м, 1H), 1,85-1,58 (м, 8H), 1,50-1,25 (м, 9H), 1,01 (с, 3H), 0,90-0,82 (м, 4H), 0,60-0,48 (м, 4H)
Методы анализа
Соединения, представленные в настоящей заявке, можно исследовать с использованием различных анализов; примеры которых описаны ниже.
Стероидное ингибирование связывания TBPS
Анализы связывания с использованием кортикальных мембран головного мозга крыс в присутствии 5 мкМ ГАМК были описаны в литературе (Gee et al, J. Pharmacol. Exp. Ther.1987, 241, 346-353; Hawkinson et al, Mol. Pharmacol. 1994, 46, 977-985). Вкратце, у анестезированных диоксидом углерода крыс Sprague-Dawley (200-250 г) после декапитации быстро удаляли кору головного мозга. Кору головного мозга гомогенизировали в 10 объемах охлажденного льдом раствора 0,32 M сахарозы с использованием гомогенизатора из стекла/тефлона и центрифугировали при 1500×g в течение 10 минут при 4°C. Полученные супернатанты центрифугировали при 10000×g в течение 20 минут при 4°C с получением P2 клеточного осадка. P2 клеточный осадок ресуспендировали в 200 мМ NaCl/50 мМ Na-K фосфат pH 7,4 буфера и центрифугировали при 10000×g в течение 10 минут при 4°C. Эту процедуру промывки повторяли дважды и клеточный осадок после центрифугирования ресуспендировали в 10 объемах буфера. Аликвоты (100 мкл) суспензии мембран инкубировали с 3 нМ [35S]-TBPS и 5 мкл аликвоты испытываемого лекарственного средства растворяли в диметилсульфоксиде (DMSO) (конечная концентрация 0,5%) в присутствии 5 мкМ ГАМК. Инкубацию доводили до конечного объема 1,0 мл при помощи буфера. Неспецифическое связывание определяли в присутствии 2 мкМ немеченного TBPS, и оно составляло 15-25%. После 90 минут инкубации при комнатной температуре анализы завершали путем фильтрования через стекловолоконные фильтры (Schleicher and Schuell No. 32) с использованием харвестера клеток (Brandel) и промывки три раза охлажденным льдом буфером. Связанную на фильтре радиоактивность измеряли методом жидкостной сцинтилляционной спектрометрии. Осуществляли не-линейную подгонку кривой общих данных для каждого лекарственного средства, усредненных для каждой концентрации, с использованием Prism (GraphPad). Данные подгоняли к модели частичного, вместо полного, ингибирования, если сумма квадратов была существенно ниже в соответствии с F-критерием. Подобным образом, данные подгоняли к двухкомпонентной, вместо однокомпонентной модели ингибирования, если сумма квадратов была существенно ниже в соответствии с F-критерием. Концентрацию испытываемого соединения, обеспечивающую 50% ингибирование (IC50) специфического связывания и максимальную степень ингибирования (Imax) определяли для отдельных экспериментов при помощи той же модели, которую использовали для общих данных, и затем рассчитывали средние значения ±SEM(стандартная ошибка среднего) отдельных экспериментов.
Различные соединения скринировали, или их можно скринировать, для определения их потенциала в качестве модуляторов [35S]-TBPS связывания in vitro. Эти анализы осуществляли, или их можно осуществлять, в соответствии с обсуждаемыми выше процедурами.
Электрофизиологический пэтч-кламп анализ рекомбинантных α1β2γ2 и α4β3δ ГАМКA рецепторов
Клеточную электрофизиологию использовали для измерения фармакологических свойств описанных соединений в гетерологичных клеточных системах. Каждое соединение испытывали на его способность влиять на ГАМК-опосредованные токи при субмаксимальной дозе агониста (ГАМК EC20=2 мкМ). LTK клетки стабильно трансфицировали α1β2γ2субъединицами ГАМК рецептора и CHO клетки транзиторно трансфицировали α4β3δ субъединицами с использованием Липофектаминового метода. Пассаж клеток осуществляли при конфлюентности около 50-80% и затем высевали на 35 мм стерильные чашки для культивирования, содержащие 2 мл культуральной полной среды без антибиотиков или противогрибковых средств. Конфлюентные кластеры клеток электрически объединяли (Pritchett et al., Science, 1988, 242, 1306-1308). Поскольку ответы находящихся в отдалении клеткок нельзя было адекватно определить методом фиксации напряжения и из-за неопределенностей, связанных со степенью объединения (Verdoorn et al., Нейрон 1990, 4, 919-928), клетки культивировали при плотности, которая позволяет осуществлять регистрацию отдельных клеток (без видимых соединений с другими клетками).
Цельноклеточные токи измеряли при помощи HEKA EPC-10 усилителей с использованием PatchMaster программы или с использованием высокопроизводительной системы QPatch platform (Sophion). Раствор в ванночке для всех экспериментов содержал (в мМ): NaCl 137 мМ, KCl 4 мМ, CaCl2 1,8 мМ, MgCl2 1 мМ, HEPES 10 мМ, D-Глюкоза 10 мМ, pH (NaOH) 7,4. В некоторых случаях также добавляли 0,005% cremophor. Внутриклеточный (пипетка) раствор содержал: KCl 130 мМ, MgCl2 1 мМ, Mg-ATP 5 мМ, HEPES 10 мМ, EGTA 5 мМ, pH 7,2. В процессе осуществления экспериментов клетки и растворы поддерживали при комнатной температуре (19°C-30°C). Для осуществляемых вручную пэтч-кламп регистраций, чашки с клеточной культурой помещали на оборудованный на микроскопе держатель для чашек и непрерывно пропускали через них (1 мл/мин) раствор в ванночке. После образования гигаом уплотнения между пэтч-электродами и клеткой (сопротивление на пипетке: 2,5 MΩ-6,0 MΩ; сопротивление уплотнения:>1 GΩ) клеточную мембрану по кончику пипетки разрывали для обеспечения электрического доступа во внутреннюю часть клетки (пэтч-кламп анализ в формате цельной клетки). Для экспериментов с использованием QPatch системы, клетки переносили в виде суспензии в QPatch систему в раствор в ванночке и осуществляли автоматизированную регистрацию в формате цельной клетки.
Фиксацию напряжения в клетках осуществляли при потенциале удерживания -80 мВ. Для анализа испытываемых соединений, ГАМК рецепторы стимулировали при помощи 2 мкМ ГАМК после последовательной пре-инкубации увеличивающихся концентрациий испытываемого соединения. Время пре-инкубации составляло 30 сек, и продолжительность ГАМК стимула составляла 2 сек. Испытываемые соединения растворяли в DMSO с получением исходных растворов (10 мМ). Испытываемые соединения разбавляли до 0,01, 0,1, 1 и 10 мкМ в растворе в ванночке. Все концентрациии испытываемых соединений испытывали на каждой клетке. Относительное процентное потенцирование определяли как максимальную амплитуду в ответ на ГАМК EC20 в присутствии испытываемого соединения, деленную на максимальную амплитуду в ответ на ГАМК EC20 без соединения, умноженную на 100.
Потеря рефлекса переворачивания у крыс
Фармакокинетику в плазме и качестввенную оценку седативного эффекта осуществляли у самцов крыс Sprague Dawley в соответствии со следующей процедурой. Крысам вводили внутривенную болюсную дозу (60 секунд) через дорсальную вену стопы в дозе 5 мг/кг в подходящем носителе. Для оценки седативного эффекта крыс осторожно удерживали рукой в положении на боку в процессе введения дозы. Если наблюдали пониженный мышечный тонус при введении дозы, удерживание постепенно ослабляли. Если животное было неспособно возвращаться в вертикальное положение, регистрировали время как начало потери рефлекса переворачивания (LRR). Если же LRR не возникал в процессе введения, животных оценивали с 5-минутными интервалами после введения дозы путем переворачивания в лежачее положение. Вялое или неполное переворачивание два раза подряд в течение 30 секундного промежутка времени определяли как потерю рефлекса переворачивания. После начала LRR, животных оценивали через каждые 5 минут таким же способом. Восстановление рефлекса переворачивания определяли как способность крысы полностью выпрямляться в течение 20 секунд после того, как ее переворачивали в лежачее положение. Продолжительность LRR определяли как интервал времени между LRR и восстановлением рефлекса переворачивания.
Продолжительность лежачего положения у собак
Фармакокинетику в плазме и качестввенную оценку седативного эффекта осуществляли у самцов собаки породы бигль в соответствии со следующей процедурой. Собакам вводили внутривенную болюсную дозу (60 секунд) через головную вену в дозировках в диапазоне от 2 до 5 мг/кг в подходящем носителе. Для оценки седативного эффекта собак осторожно удерживали в положении на боку в процессе введения дозы. Если в процессе введения дозы наблюдали пониженный мышечный тонус, слабость в конечностях или недержание головы, регистрировали начало лежачего положения. В случае, когда не наблюдалось положения лежания на боку при введении дозы, животных оценивали через 5-минутные интервалы после этого, помещая их в лежачее положение. Вялое или неполное переворачивание в стернальное положение определяли как положение лежа на боку. После того как животное принимало положение лежа на боку, животных оценивали каждые 5 минут аналогичным образом. Продолжительность положение лежа на боку определяли как интервал времени между установлением положения на боку и возвращением в стернальное положение.
Реферат
Изобретение относится к соединению Формулы (II), в которой R2aпредставляет собой метил, этил, метокси, трифторметокси, циклопропилокси, C3-C6алкокси, этокси, –OCH2CH2OCH3, –OCH2CH2OH, –CH(CH3)2, –OCH2CH(CH3)2или –OCH2CF3; и R2bпредставляет собой водород. Изобретение также относится к индивидуальным соединениям, к фармацевтической композиции, к способу индукции седативного эффекта и/или анестезии, к способу лечения расстройств, связанных с функцией ГАМК, к способу лечения судорожного припадка, к способу лечения эпилепсии или эпилептического состояния, к способу лечения депрессии. Технический результат: получены новые соединения Формулы (II), которые обладают свойствами модулятора ГАМК. 8 н. и 3 з.п. ф-лы, 12 ил., 4 табл., 36 пр.Формула (II)
Формула
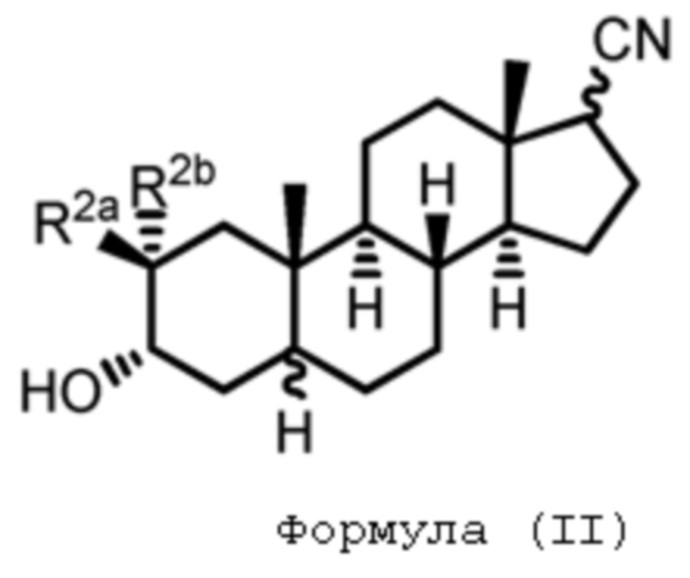

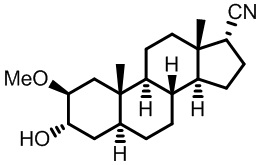

















Документы, цитированные в отчёте о поиске
Производное 17β-циано-18а-гомо-19-нор-андрост-4-ена, его применение и лекарственные средства, содержащие производное

Комментарии