Калмангафодипир, новое химическое соединение и другие смешанные комплексные соединения с металлами, способы получения, композиции и способы лечения - RU2765805C2
Код документа: RU2765805C2
Чертежи

















Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к смешанному комплексному соединению с металлами соединения дипиридоксила, например, N,N'-бис(пиридоксаль-5-фосфат)-этилендиамин-N,N'-диуксусной кислоты (DPDP или фодипиру) или другим соединениям формулы I (далее производные пиридоксилэтилдиамин или производные PLED), где смешанные металлы включают переходный металл III-XII группы и металл II группы. В конкретных вариантах осуществления смешанное комплексное соединение с металлами представляет собой комплексное соединение с кальцием и марганцем. Настоящее изобретение также относится к композициям, содержащим такое смешанное комплексное соединение с металлами, способам получения такого смешанного комплексного соединения с металлами, например, в одностадийной кристаллизации, и способам лечения, в которых применяют такое смешанное комплексное соединение с металлами. Такие способы лечения включают способы, в которых общепринято применяют комплексные соединения марганец-DPDP для терапевтического действия. В конкретном варианте осуществления композиции можно использовать при лечении патологических состояний, обусловленных наличием образуемых из кислорода свободных радикалов в организме, т. е. окислительного стресса. Смешанные комплексные соединения с металлами и, в частности, смешанное комплексное соединение с кальцием-марганцем калмангафодипир, описываемое в настоящем описании, представляют собой новые химические соединения.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[0002] Окислительный стресс начинается с генерации активных форм кислорода (ROS) и реактивных форм азота (RNS) в ходе нормального клеточного функционирования. Существует много клеточных источников образования ROS, но наиболее значительные источники представляют собой комплексы I и III переноса электронов митохондрий, ферменты P450 в эндоплазматическом ретикулуме и мембранно-связанную NADPH-оксидазу. Продукция ROS каждым из этих источников может быть стимулирована цитокинами, воспалением, вирусными белками и посредством других механизмов, таких как химиотерапевтические лекарственные средства, ишемия-реперфузия и перегрузка железом и медью. Следует отметить, что в этих процессах изначально генерируется свободный радикал супероксид ((O2-), который последовательно восстанавливается с образованием пероксида водорода, гидроксильного радикала и в конечном итоге воды. В условиях сильного окислительного стресса и, таким образом, высокой продукции супероксида эти реакционноспособные промежуточные соединения, тем не менее, легко взаимодействуют с другими молекулами с образованием вторичных вредных ROS, таких как продукты перекисного окисления липидов и пероксинитриты (Singal et al., Liver Int., 2011, 31:1432-1448). Это свидетельствует о важности сохранения клеточного количества супероксида под строгим контролем. В нормальных условиях это достигается посредством супероксиддисмутаз (SOD). Хотя SOD имеют самую высокую скорость реакции среди известных ферментов в условиях сильного окислительного стресса, эти ферменты могут быть вытеснены на второй план и даже необратимо инактивированы ROS и RNS. Это, в свою очередь, открывает низкомолекулярные лекарственные средства, которые имитируют ферменты SOD, т. е. так называемые миметики SOD, для терапевтического применения для борьбы с патологическим окислительным стрессом.
[0003] Давно известно, что короткоживущие, но высокореакционноспособные, образуемые из кислорода свободные радикалы участвуют в патологическом повреждении тканей, в частности во время лечения цитотоксическими средствами/цитостатическими средствами и лучевой терапией у пациентов со злокачественными опухолями (Towart et al., Arch. Pharmacol., 1998; 358 (Suppl 2):R626, Laurent et al., Cancer Res., 2005, 65:948-956, Karlsson et al., Cancer Res., 2006; 66:598, Alexandre et al., J. Natl. Cancer Inst., 2006, 98:236-244, Doroshow, J. Natl. Cancer. Inst., 2006, 98:223-225, Citrin et al, Oncologist, 2010, 15:360-371, Kurz et al., Transl. Oncol., 2012, 5:252-259), индуцированной ацетаминофеном печеночной недостаточностью (Bedda et al., J. Hepatol., 2003; 39:765-772, Karlsson, J. Hepatol., 2004, 40:872-873), при ишемической болезни сердца (Cuzzocrea et al., Pharmacol. Rev., 2001, 53:135-159) и при различных нейродегенеративных заболеваниях, включая болезнь Альцгеймера, боковой амиотрофический склероз (ALS), болезнь Паркинсона и рассеянный склероз (Knight, Ann. Clin. Lab. Sci., 1997, 27:11-25). Сверхпродукция образуемых из кислорода свободных радикалов также вовлечена в патологические состояния перегрузки железом (Rachmilewitz et al., Ann. NY Acad. Sci., 2005, 1054:118-23), например, при талассемии, серповидно-клеточной анемии и трансфузионном гемосидерозе. Образуемые из кислорода свободные радикалы также вовлечены в индуцируемый гепатитом цирроз печени (Farrell et al., Anat. Rec., 2008, 291:684-692) и в потерю слуха в результате воздействия шума (Wong et al., Hear. Res., 2010, 260:81-88).
[0004] В медицине известно применение хелатирующих средств на основе дипиридоксила и его хелатов металлов и определенных, содержащих марганец соединений, в частности хелаты марганца. См. EP 0910360, US 6147094, EP 0936915, US 6258828, EP 1054670, US 6310051, EP 1060174 и US 6391895, например, в которых описано, что определенные хелатирующие средства, в частности хелатирующие средства на основе дипиридоксила и его хелаты металлов, являются эффективными при лечении или профилактики индуцируемой антрациклином кардиотоксичности, индуцируемой облучением токсичности, индуцируемых ишемией-реперфузией повреждений и индуцируемой парацетамолом (ацетаминофеном) печеночной недостаточности или с более общей точки зрения любого патологического состояния, обусловленного наличием образуемых из кислорода свободных радикалов, т. е. окислительного стресса, у людей и животных. Кроме того, дополнительно и неожиданно было обнаружено, что соединение дипиридоксила мангафодипир (MnDPDP) обладает цитотоксическими эффектами в отношении злокачественных клеток (EP 16944338). Однако, как описано в WO 2009/078794 A1 и у Kurz et al., 2012, это является характерным свойством только фодипира (DPDP) или его дефосфорилированных аналогов DPMP и PLED, а не комплексного соединения с металлами MnDPDP или его дефосфорилированных аналогов MnDPMP и MnPLED.
[0005] Одно из производных MnPLED, а именно марганец-N,N'-бис(пиридоксаль-5-фосфат)-этилендиамин-N,N'-диуксусная кислота (дипиридоксилдифосфат марганца, MnDPDP), также известный как мангафодипир, одобрено для применения в качестве диагностического контрастного средства для MRI у людей. Следует отметить, что продемонстрировано, что мангафодипир защищает мышей от серьезных побочных эффектов некоторых цитотоксических/цитостатических лекарственных средств (доксорубицина, оксалиплатина, 5-фторурацила и паклитаксела), не оказывая отрицательного влияния на противоопухолевые эффекты этих лекарственных средств (Towart et al., 1998, Laurent et al., 2005, Karlsson et al., 2006, Alexandre et al., 2006, Doroshow, 2006, Kurz et al., 2012). Мангафодипир тестировали на одном пациенте с раком толстого кишечника, проходящего паллиативное лечение в комбинации с фолинатом, 5-фторурацилом и оксалиплатином (Yri et al., Acta Oncol., 2009; 48:633-635). Доклинические данные и результаты у этого единственного пациента являлись такими обнадеживающими, что было начато клиническое тестирование у пациентов со злокачественными опухолями. Однако, что касается наиболее опасного побочного эффекта оксалиплатина, а именно индуцированной оксалиплатином сенсорной нейротоксичности, насколько известно авторам, не существует доклинических данных, демонстрирующих защитные эффекты мангафодипира (Karlsson et al., Transl. Oncol., 2012, 5:32-38). Yri et al., 2009, описали пациента, получавшего 15 полных доз "Nordic FLOX". На 14 цикле пациент получал предварительное лечение мангафодипиром. Пациент получал суммарную дозу 1275 мг/м2 оксалиплатина, что представляет собой дозу, вероятно, вызывающую нейротоксические симптомы. Не детектировали нейротоксических симптомов за исключением пятнадцатого цикла, когда мангафодипир намеренно исключали, и пациент испытывал периферическую сенсорную нейропатию. Это позволяет предположить, что мангафодипир может защищать от периферической нейротоксичности. После пяти циклов общее состояние пациента существенно улучшалось, и потребность в анальгетиках значительно снижалась. Нейтропения не возникала во время любого из циклов химиотерапии.
[0006] Было проведено первое исследование экономической целесообразности (MANFOL I), и положительные результаты, включая миелопротекторные эффекты, были предоставлены Медицинскому агентству Швеции и опубликованы (Karlsson et al., 2012).
[0007] Также описано, что мангафодипир защищает мышей от индуцированной ацетаминофеном острой печеночной недостаточности у мышей (ALF) (Bedda et al., 2003, Karlsson, 2004). ALF характеризуется массовой гибелью гепатоцитов, состоянием, обусловленным снижением глутатиона, образуемыми из кислорода свободными радикалами и повреждением митохондрий.
[0008] Мангафодипир представляет собой пролекарство в том смысле, что, вероятно, метаболизируется в N,N'-дипиридоксилэтилендиамин-N,N'-диуксусную кислоту (MnPLED) до того, как он оказывает цитопротекторное действие в условиях in vivo (например, см. Karlsson et al., Acta Radiol., 2001, 42:540-547, Kurz et al., 2012). Марганец является основным, а также потенциально нейротоксичным металлом. В течение многих лет известно, что в условиях хронической экспозиции высокими уровнями марганца часто возникает синдром экстрапирамидальной недостаточности, сходный с синдром Паркинсона, хотя клинически является отличной нозологической единицей (см. Scheuhammer & Cherian, Arch. Environm. Contam. Toxicol., 1982, 11:515-520). Когда людям внутривенно инъецируют дозу мангафодипира для диагностической МР-томографии, высвобождается приблизительно 80% вводимого марганца (Toft et al., Acta Radiol., 1997, 38:677-689). Высвобождение парамагнитного марганца является фактически необходимым условием для свойств мангафодипира в отношении диагностической МР-томографии (Wendland, NMR Biomed., 2004, 17:581-594). Elizondo et al., 1991 (Radiology, 1991, 178:73-78) установили, что группа фодипира связывается с рецептором пиридоксил-5'-фосфата в гепатоцитах и обеспечивает высокую внутриклеточную концентрацию мангафодипира в печени. Недавно эту гипотезу также подтвердили в статье Coriat et al., (PLoS One, 2011, 6:1-6, e27005). Это хорошая гипотеза, но, к сожалению, недоказанная и очень маловероятная гипотеза, которая быстро перестала быть популярной после того, как была представлена. Когда мангафодипир инъецируют внутривенно (в/в), приблизительно 80% комплексного соединения с металлами теряется (Toft et al., Radiol., 1997), и в очень эквимолярной дозе Mn MnCl2 обладает равной или лучшей контрастной эффективностью для МР-томографии печени по сравнению с мангафодипиром (Southon et al., Acta Radiol., 1997). Кроме того, после инъекции мангафодипира практически весь фодипир обнаруживают в моче (основную его часть в виде), тогда как большую часть марганца обнаруживают в кале (Hustvedt et al., Acta Radiol., 1997; 38:690-699). С другой стороны, терапевтические эффекты мангафодипира (MnDPDP) и его дефосфорилированных аналогов MnDPMP (N,N'-дипиридоксилэтилендиамин-N,N'-диацетат-5-фосфат) и MnPLED зависят от целого комплексного соединения с металлами (Brurok et al., Biochem. Biophys. Res. Commun., 1999, 254:768-721, Karlsson et al., 2001, 42:540-547).
[0009] Производные PLED имитируют митохондриальный фермент марганцевую супероксиддисмутазу (MnSOD) (Brurok et al., 1999). MnSOD защищает клетку млекопитающего от супероксидного радикала, побочного продукта метаболизма кислорода, который продуцируется в достаточно больших количествах в нормальных аэробных условиях, ни одно млекопитающее не выживает без функциональной MnSOD. MnSOD обладает самым высоким числом оборотов (скоростью реакции с ее субстратом) любого известного фермента (>109 M-1 сек-1) (Fridovich, J. Exp. Biol., 1998, 201:1203-1209). Низкомолекулярные миметики MnSOD могут обладать скоростями оборота, близкими к скорости нативной MnSOD (Cuzzocrea et al., 2001). Следует отметить, что физиологические буферы, содержащие переходные металлы, такие как марганец, могут обладать аналогичными высокими числами оборотов (Culotta et al., Biochim. Biophys. Acta, 2006, 1763:747-758). Однако важность нативных ферментов SOD соответствует процессу отбора в пользу организмов, которые выработали средство, локализирующее катализатор на основе переходного металла для дисмутации супероксида в части клеток, где существует высокая потребность в такой дисмутации, например, митохондрии. Кроме того, результаты ишемии-реперфузии миокарда на анестезированных свиньях неизбежно демонстрируют, что целый MnPLED, но не марганец сам по себе, защищает от окислительного стресса, что наблюдают как уменьшение размера инфаркта (Karlsson et al., 2001). Эффективная инактивация супероксида является существенной для предотвращения генерации очень опасных гидроксильных радикалов и пероксинитрита (Cuzzocrea et al., 2001). Во время патологического окислительного стресса образование супероксидных радикалов часто превышает эндогенную способность инактивации. Кроме того, супероксид стимулирует продукцию пероксинитрита, который нитрует эндогенную MnSOD. Этот белок нитруется пероксинитритом в Tyr-34 (Radi, Proc. Natl. Acad. Sci. USA, 2004, 101:4003-4008). После нитрования MnSOD теряет свою ферментативную активность, событие, способствующее накоплению супероксида и вызываемым супероксидом повреждениям (Muscoli et al., Br. J. Pharmacol., 2003; 140:445-460).
[0010] Последние результаты указывают на то, что инактивация MnSOD нитрованием является ранним событием при индуцируемой парацетамолом печеночной токсичности (Agarwal et al., J. Pharmacol. Exp. Ther., 2011, 337:110-116). Кроме того, полученные ранее результаты указывают на то, что нитрование и инактивация MnSOD вовлечены в хроническое отторжение трансплантированных почек у людей (MacMillan-Crow et al., Proc. Natl. Acad. Sci. USA, 1996, 93:11853-11858). Также может быть уместным отметить, что актин, который может составлять 5% или более клеточного белка, в значительной степени подвергается нитрованию при серповидно-клеточной анемии, и что наблюдаемая степень нитрования является достаточной для индукции полимеризации цитоскелета (Radi, 2004). Кроме того, уровни циркулирующего в крови 3-нитротирозина могут служить в качестве биомаркера для оценки рисков атеросклероза. Кроме того, в дополнение к атеросклерозу полагают, что пероксинитрит и 3-нитротирозин вовлечены в ишемию миокарда, септическое и пораженное легкое, воспалительное заболевание кишечника, боковой амиотрофический склероз (Beckman et al., Am. J. Physiol., 1996, 271:C1424-C1437) и диабет (Fonstermann et al., Br. J. Pharmacol., 2011, 164:213-223).
[0011] Ослабленные механизмы антиоксидантной системы защиты, включая сниженную активность SOD, а затем повышенную продукцию пероксинитрита, могут являться важным фактором в патогенезе неалкогольного стеатогепатита (NASH) (Koruk et al., Ann. Clin. Lab. Sci., 2004, 34:57-62). Очевидным является существенная эпидемиологическая и клиническая взаимосвязь инфекций вируса гепатита В или гепатита С и развития хронического гепатита и возникновения печеночноклеточной карциномы. Следует отметить, что индуцируемое пероксинитритом нитрование тирозина является заметно повышенным у пациентов с хроническим вирусным гепатитом (Garcia-Monzon et al., J. Hepatol., 2000, 32:331-338). В настоящее время, как правило, упоминаемый механизм развития патологии при болезни Вильсона включает окислительное повреждение, обусловленное перегрузкой меди. Генерация активных форм кислорода (ROS), а также окисление липидов и повреждения ДНК детектировали в печени, в частности, на поздних стадиях этого заболевания (Burkhead et al., Biometals, 2011, 24:455-466).
[0012] Производные MnPLED не являются мишенями для пероксинитрита, и добавление экзогенных производных MnPLED может в таких ситуациях восстановить защитный потенциал. Кроме того, производные PLED представляют собой сильные связывающее железо средства, как описано в EP 1054670, US 6310051 и Rocklage et al., (Inorg. Chem., 1989, 28:477-485), и некоторые производные MnPLED могут обладать активностью каталазы и глутатионредуктазы (Laurent et al., 2005), которые могут дополнительно увеличивать их антиоксидантную емкость.
[0013] Для использования в диагностической визуализации и других единичных применениях диссоциация марганца из мангафодипира не является основной токсикологической проблемой. Тем не менее, вследствие поглощения в ЦНС при более частом использовании, например в терапевтических способах, суммарная токсичность марганца может представлять собой серьезную нейротоксикологическую проблему (Crossgrove et al., NMR Biomed., 2004, 17:544-53). Таким образом, для более частого терапевтического применения следует избегать соединений, которые легко диссоциируют на марганец, и существует необходимость в разработке способов получения желаемых терапевтических эффектов, при этом снижая нежелательные побочные эффекты, ассоциированные с таким терапевтическим применением.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0014] Комплексные соединения, композиции и способы по настоящему изобретению обеспечивают улучшение получения и применения комплексных соединений с металлами производных PLED. В одном из вариантов осуществления изобретение относится к смешанному комплексному соединению с металлами соединения формулы I или его соли, где смешанные металлы включают переходный металл III-XII группы и металл II:
Формула I

где
X представляет собой CH или N,
каждый R1 независимо представляет собой водород или -CH2COR5,
R5 представляет собой гидрокси, необязательно гидроксилированный алкокси, амино или алкиламидо,
каждый R2 независимо представляет собой ZYR6, где Z представляет собой связь или C1-3алкиленовую или оксоалкиленовую группу, необязательно замещенную R7,
Y представляет собой связь, атом кислорода или NR6,
R6 представляет собой атом водорода, COOR8, алкильную, алкенильную, циклоалкильную, арильную или аралкильную группу, необязательно замещенную одной или более группами, выбранными из COOR8, CONR82, NR82, OR8, =NR8, =O, OP(O) (OR8)R7 и OSO3M,
R7 представляет собой гидрокси, необязательно гидроксилированную, необязательно алкоксиилированную алкильную или аминоалкильную группу,
R8 представляет собой атом водорода или необязательно гидроксилированную, необязательно алкоксилированную алкильную группу
M представляет собой атом водорода или один эквивалент физиологически приемлемого катиона,
R3 представляет собой C1-8алкилен, 1,2-циклоалкиленовую или 1,2-ариленовую группу, необязательно замещенную R7, и
каждый R4 независимо представляет собой водород или C1-3алкил или его соль.
[0015] В другом варианте осуществления изобретение относится к комплексному соединению с кальцием и магнием соединения формулы I. Смешанные комплексные соединения с металлами и, в частности, смешанное комплексное соединение с кальцием-марганцем калмангафодипир, описываемое в настоящем описании, представляют собой новые химические соединения.
[0016] Настоящее изобретение также относится к способам получения смешанного комплексного соединения с металлами, которые включают одностадийную кристаллизацию из раствора переходного металла III-XII группы, металла II группы и соединения формулы I.
[0017] В другом варианте осуществления изобретение относится к способу лечения патологического состояния у пациента, включающему введение пациенту смешанного комплексного соединения с металлами по изобретению, необязательно совместно с одним или более физиологически приемлемыми носителями и/или эксципиентами.
[0018] Комплексные соединения по изобретению являются предпочтительными по той причине, что металл II группы стабилизирует комплексное соединение, устраняя выделение переходного металла III-XII. Это снижает токсические эффекты, ассоциированные с использованием ранее получаемых комплексных соединений с переходными металлами III-XII группы, например, производных MnPLED, таких как мангафодипир. Комплексные соединения по изобретению также могут обеспечивать улучшенное лечение и/или защиту от патологических состояний, в частности состояний, обусловленных наличием образуемых из кислорода свободных радикалов, т. е. окислительного стресса. Дополнительные улучшения и преимущества по настоящему изобретению станут более очевидны в свете подробного описания, указанного ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0019] Следующее ниже подробное описание будет более полно понятно, принимая во внимание чертежи, где:
[0020] на фиг. 1 представлены порошковые рентгеновские дифрактограммы (XRPD) для трех кристаллических форм комплексного соединения фодипира (DPDP) с кальцием-марганцем с примерным молярным отношением Ca:Mn приблизительно 4:1, обозначаемым в настоящем описании как "калмангафодипир", получаемого способом одностадийной кристаллизации по изобретению, как описано в примере 1.
[0021] На фиг. 2 представлены дифрактограммы XRPD смесей кальция-фодипира (калфодипира) и марганца-фодипира (мангафодипир) в отличие от комплексного соединения по изобретению; эти дифрактограммы указывают, что все продукты являются аморфными, и было продемонстрировано, что они быстро абсорбируют воду, как описано в примере 2.
[0022] На фиг. 3 представлен спектр поглощения с преобразованием Фурье в инфракрасной области (FT-IR) калмангафодипира, партия № 7755-C-R0-01-30-01, с характерными полосами поглощения в инфракрасной области (волновое число) и соответствующими соотнесениями, описанными в примере 3.
[0023] На фиг. 4A и 4B представлен масс-спектр (фиг. 4A) и расширенный масс-спектр (фиг. 4B) калмангафодипира, партия № 7755-C-R0-01-30-01 (масса/заряд 660-850), как описано в примере 3.
[0024] На фиг. 5 представлена химическая структура калмангафодипира, как описано в примере 3.
[0025] На фиг. 6A представлено повышение содержания марганца (Mn) в моче через 0-24 часа, выраженное в виде общего содержания Mn минус фоновое содержание Mn, у крыс, которым инъецировали мангафодипир или калмангафодипир, содержащий 2,59 мкмоль и 2,52 мкмоль Mn соответственно. На фиг. 6B представлено повышение содержания Mn в моче, выраженное в виде процентного содержания инъецируемой дозы. На фиг. 6C представлено повышение содержания цинка в моче через 24 часа у тех же самых животных. Результаты выражают в виде среднего значения ± S. E. M., n=4 в каждой группе. Эти фигуры более подробно описаны в примере 4.
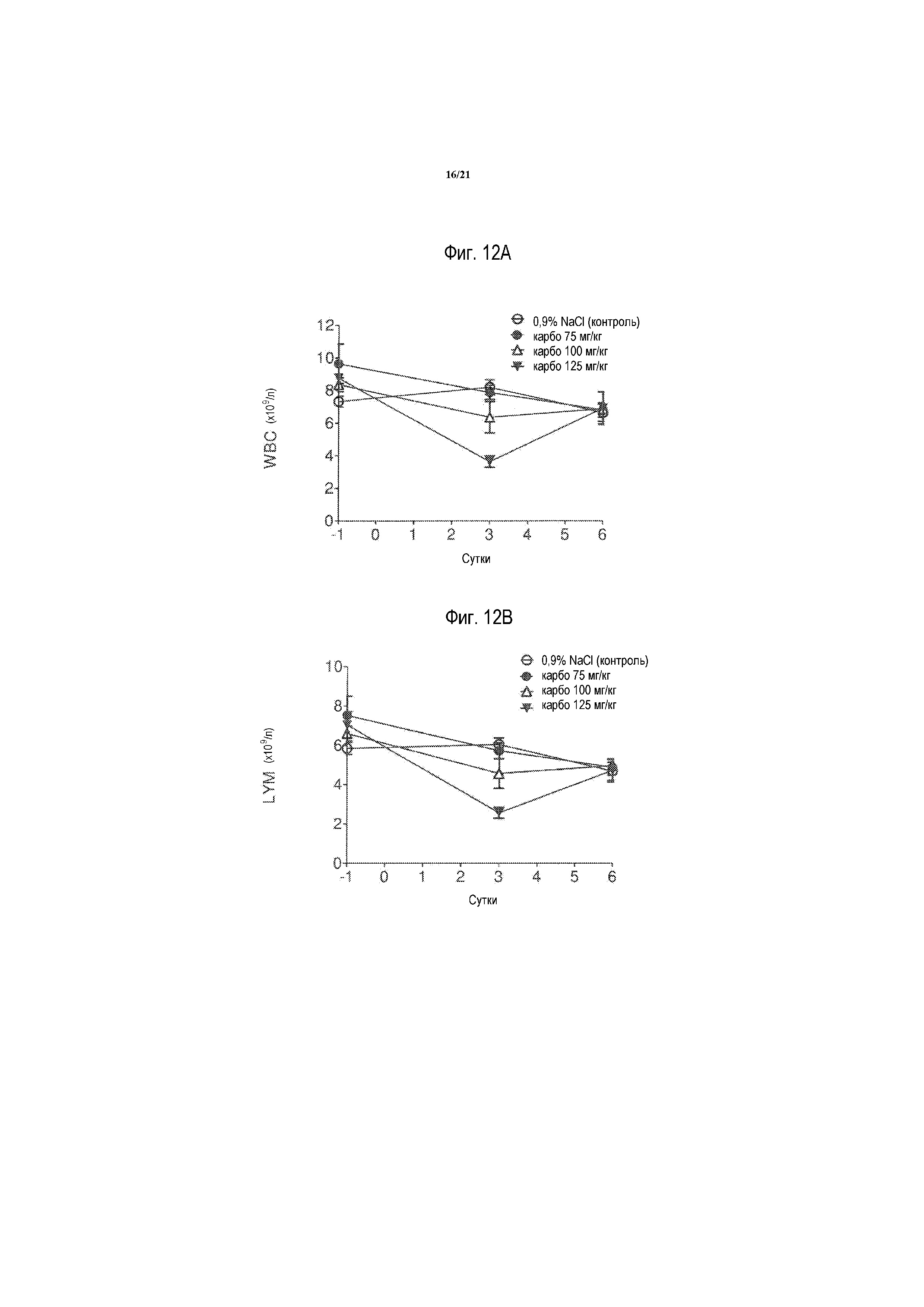
[0026] На фиг. 7A-7D представлены миелосупрессивные эффекты на лейкоциты (WBC), лимфоциты (LYM), нейтрофилы (NEU) и тромбоциты (PLC), соответственно, однократной внутривенной инъекции увеличивающихся доз (7,5, 10,0 и 12,5 мг/кг) оксалиплатина на 3 и 6 суток после инъекции. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 5.
[0027] На фиг. 8A-8D представлены WBC, LYM, NEU и PLC соответственно после обработки одним оксалиплатином или в комбинации с калмангафодипиром или мангафодипиром у мышей balb/c. Контроли получали только обработку носителем. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 5.
[0028] На фиг. 9A-9B представлена цитотоксическая активность различных производных PLED и СаСl2 в увеличивающихся концентрациях в отношении клеток CT26 рака толстого кишечника. Результаты выражают в виде среднего значения ± S. E. M., n=3, как описано в примере 6.
[0029] На фиг. 10A представлен противоопухолевый эффект высокой дозы оксалиплатина (20 мг/кг) у сингенных по CT26 мышей balb/c в отсутствие и в присутствии относительно высокой дозы калмангафодипира (50 мг/кг). На фиг. 10B представлен противоопухолевый эффект низкой дозы оксалиплатина (10 мг/кг) в отсутствие и в присутствии относительно низкой дозы калмангафодипира. Результаты выражают в виде среднего значения ± S. E. M., n=10 в группах носителя и оксалиплатина 20 мг/кг на фиг. 10A, n=5 во всех других группах, как описано в примере 7.
[0030] На фиг. 11A-11C представлено содержание Mn в головном мозге, поджелудочной железе и печени, соответственно, после 39 доз NaCl (контроли), мангафодипира или калмангафодипира (соответствующих в обоих случаях суммарной дозе 2800 мкмоль/кг марганца). Результаты выражают в виде среднего значения ± S. E. M., n=17-18 в каждой группе, как описано в примере 8.
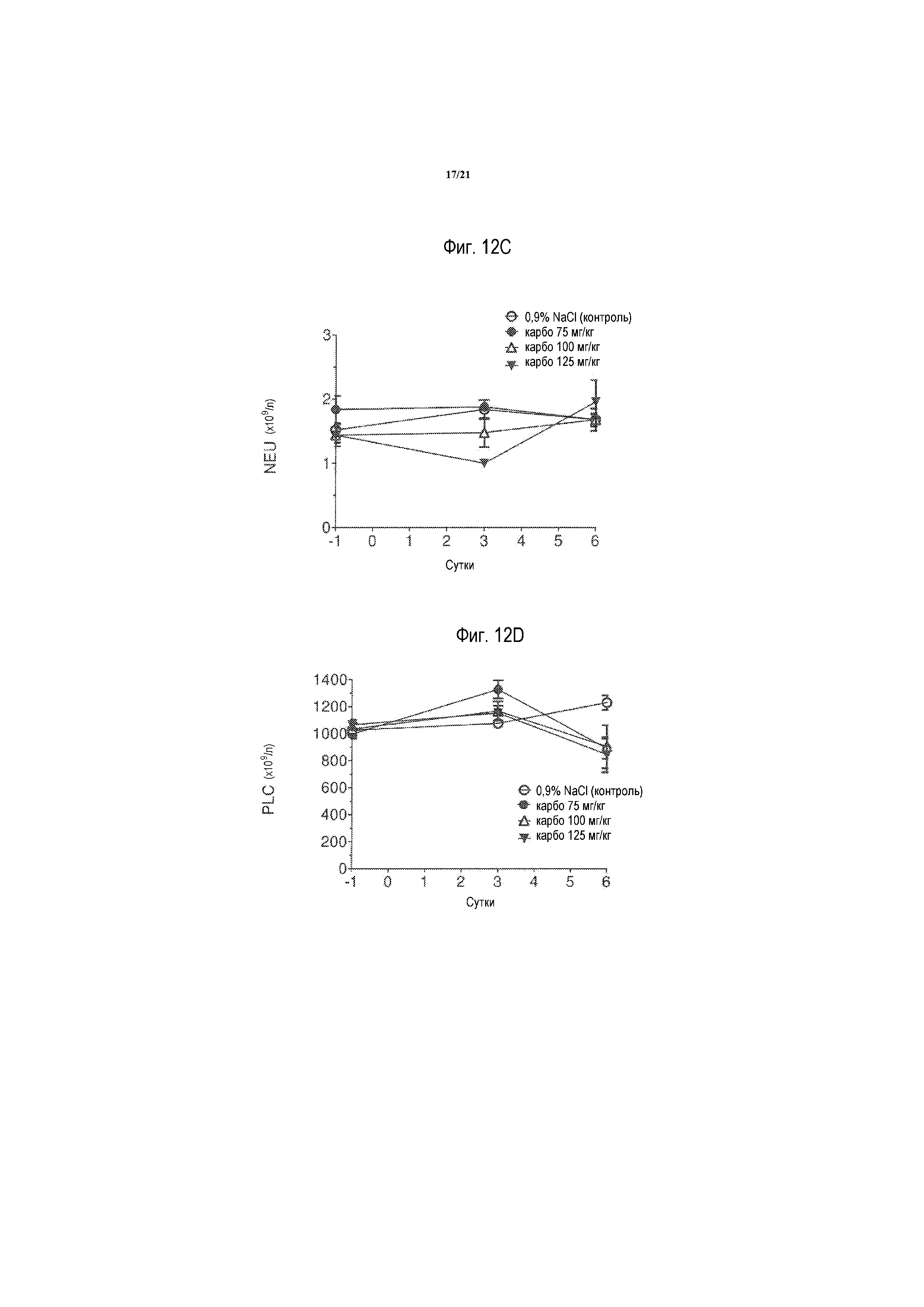
[0031] На фиг. 12A-12D представлены миелосупрессивыне эффекты на лейкоциты (WBC), лимфоциты (LYM), нейтрофилы (NEU) и тромбоциты (PLC), соответственно, однократной внутривенной инъекции увеличивающихся доз (75, 100 и 125 мг/кг) карбоплатина на 3 и 6 сутки после инъекции. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 9.
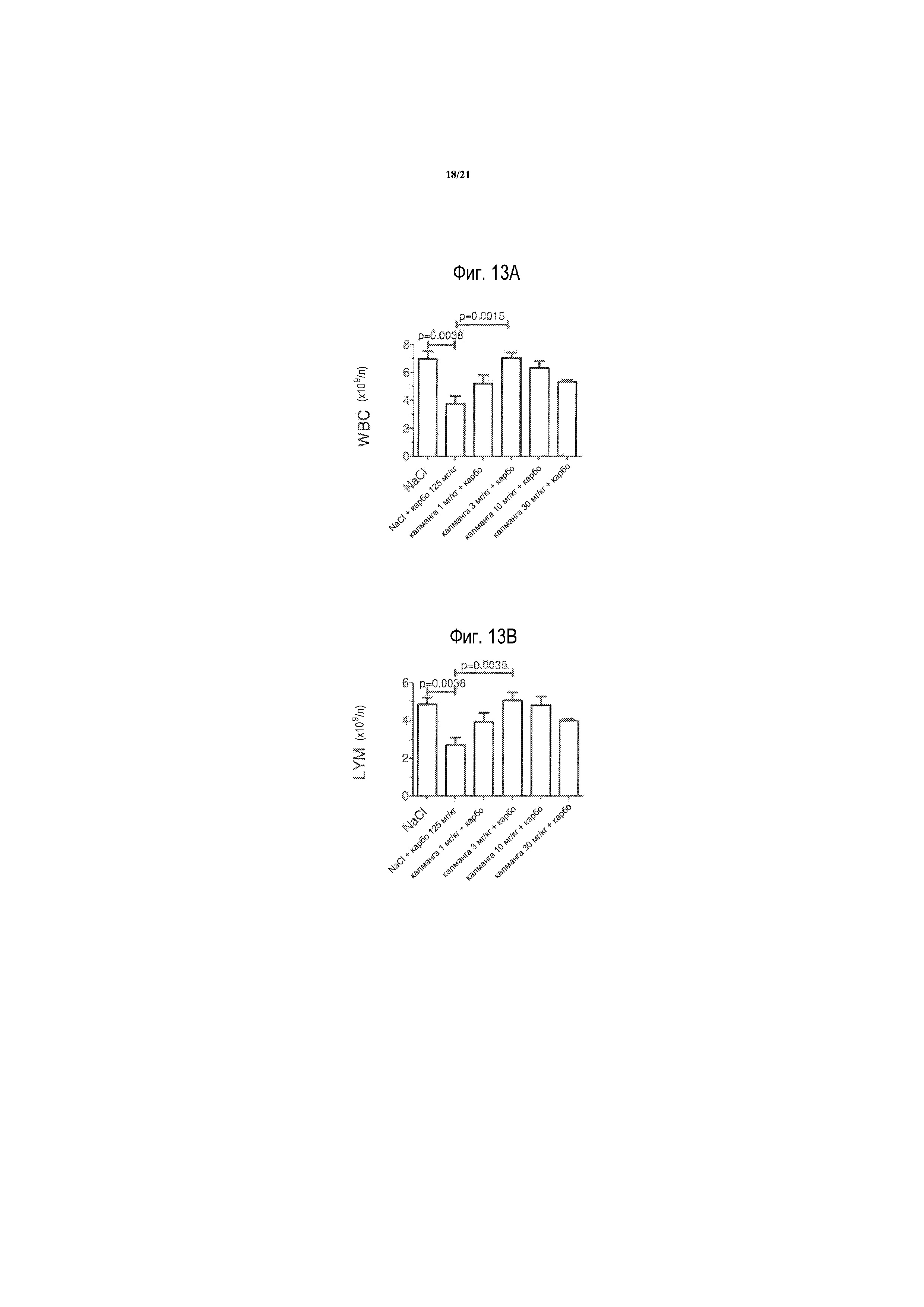
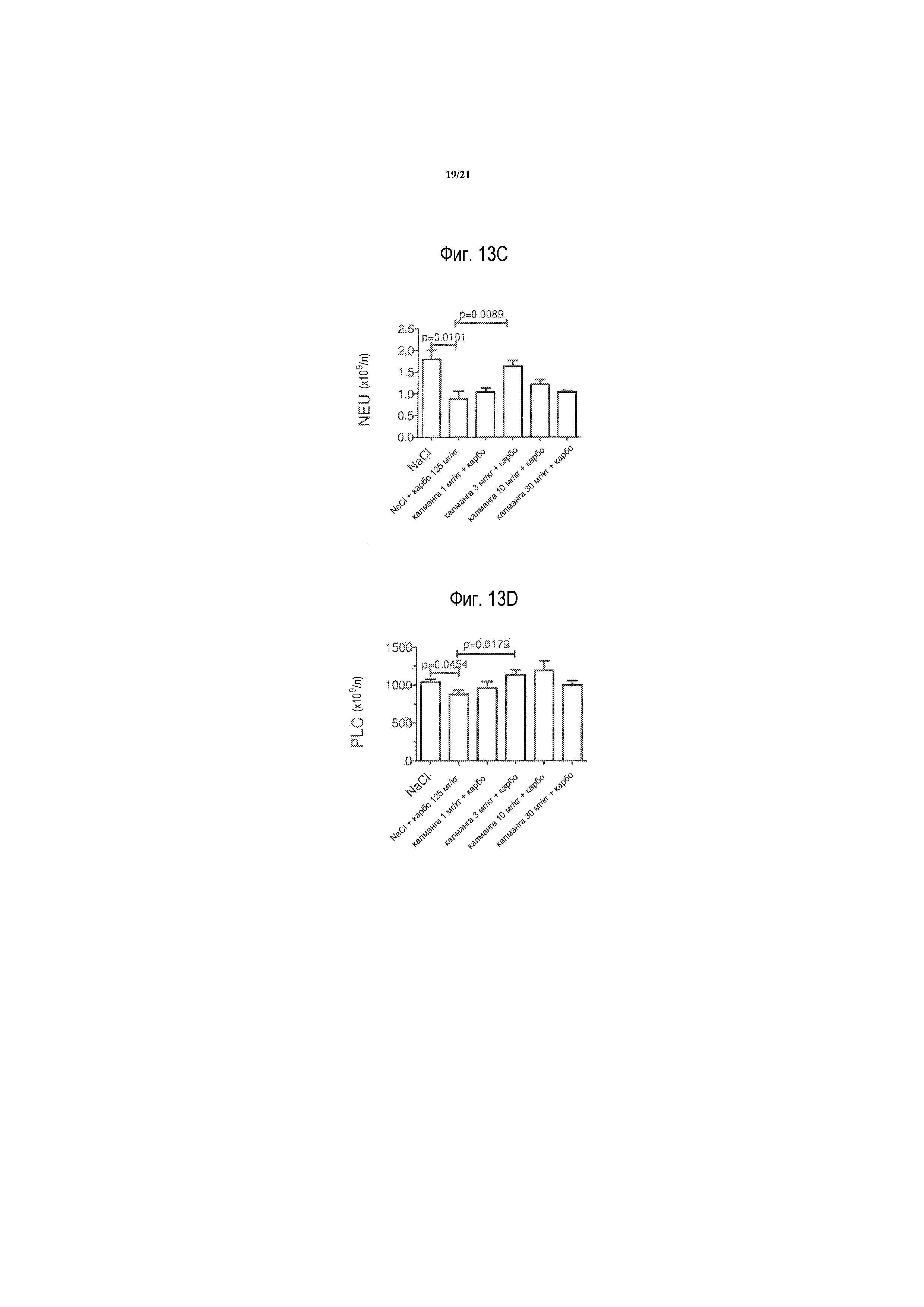
[0032] На фиг. 13A-13D представлены WBC, LYM, NEU и PLC, соответственно, после карбоплатина в комбинации с калмангафодипиром у мышей balb/c. Контроли получали только обработку носителем. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 9.
[0033] На фиг. 14 представлен противоопухолевый эффект низкой дозы оксалиплатина (10 мг/кг) у несущих CT26 иммунокомпетентных мышей balb/c и у иммунодефицитных бестимусных мышей balb/c (nu/nu) в отсутствие и в присутствии относительно низкой дозы калмангафодипира. Результаты выражают в виде среднего значения ± S. E. M., n=5 в каждой группе, как описано в примере 10.
[0034] На фиг. 15A и 15B представлена цитотоксическая активность калмангафодипира и мангафодипира на клетках U1810 и LLC1 немелкоклеточного рака легких соответственно. Результаты выражают в виде среднего значения ± S. E. M., n=3, как описано в примере 11.
[0035] Чертежи будут более полно понятны при рассмотрении примеров.
ПОДРОБНОЕ ОПИСАНИЕ
[0036] Комплексные соединения, композиции и способы по настоящему изобретению обеспечивают улучшение получения и применения комплексных соединений с металлами производных PLED, т. e. производных пиридоксилэтилдиамина, хотя установлено, что производные также действуют в качестве пролекарств PLED, т. к. они могут метаболизироваться с образованием PLED in vivo.
[0037] В WO 2011/004325 A1 продемонстрировано, как добавляемый избыток фодипира (DPDP) к мангафодипиру (MnDPDP) стабилизирует его, предотвращая выделение марганца после введения, и, таким образом, снижает поглощение в ЦНС и, таким образом, значительно снижает нейротоксический потенциал мангафодипира. Вследствие того, что оно представляет собой содержащее интактный марганец комплексное соединение, которое оказывает имитирующее SOD и цитопротекторное действие, таким образом, избыток фодипира не только снижает нейротоксический потенциал, но он также значительно повышает цитопротекторную эффективность.
[0038] Выделение in vivo марганца из производных MnPLED, включая марганец-N,N'-бис(пиридоксаль-5-фосфат)-этилендиамин-N,N'-диуксусную кислоту (мангафодипир), зависит от наличия свободного или быстро диссоциируемого цинка в организме. Цинк обладает приблизительно в 1000 раз более высокой аффинностью, чем марганец для фодипира или его дефосфорилированных аналогов (Rocklage et al., 1989). Экспериментальные исследования позволяют предположить, что выделение марганца in vivo из мангафодипира насыщается при дозах, превышающих 5 мкмоль/кг (Southon et al., 1997). Визуализация сердца и печени с использованием мангафодипира у здоровых добровольцев указывает на аналогичную дозу насыщения у человека (Skjold et al., J. Magn. Reson. Imaging, 2004, 20:948-952, Toft et al., 1997).
[0039] В изобретении, описанном в WO 2011/004325 A1, предполагают, что конкретную терапевтическую композицию можно получать смешиванием двух активных фармацевтических ингредиентов (API), например, мангафодипира и фодипира, в готовый к применению раствор или вводить их раздельно. Продемонстрировано, что фодипир при уровне дозирования приблизительно от 5 до 10 мкмоль/кг обладал значительным стабилизирующим эффектом in vivo на мангафодипир. Первый клинический опыт (Yri et al., 2009 и Karlsson et al., 2011) продемонстрировал, что мангафодипир является терапевтически эффективным при уровне дозирования приблизительно от 2 до 10 мкмоль/кг у человека. Принимая во внимание более высокую эффективность мангафодипира плюс фодипир, можно полагать, что мангафодипир является терапевтически эффективным у пациентов при уровне дозирования, близком к 1 мкмоль/кг. Это в свою очередь указывает, что отношение (фодипир + мангафодипир)/мангафодипир, близкое к 5, т. е. готового к применению состава, содержащего в 4 раза больше фодипира, чем мангафодипира, должно являться эффективным. Кроме того, это подтверждает, что готовый к применению состав, содержащий 40 мМ фодипира и 10 мМ мангафодипира - при введении от 0,1 до 0,2 мл этого состава на кг массы тела - приводит к дозе от 1 до 2 мкмоль/кг мангафодипира и от 4 до 8 мкмоль/кг фодипира.
[0040] Кальций имеет приблизительно в 109 раз более низкую аффинность к фодипиру по сравнению с цинком и приблизительно в 106 раз более низкую аффинность к фодипиру, чем марганец. Однако, принимая во внимание тот факт, что кальций содержится в гораздо более высоких внеклеточных концентрациях, чем цинк и марганец, быстрое внутривенное болюсное введение фодипира может вызывать резкое снижение внеклеточной концентрации свободного кальция вследствие того, что сердце полностью зависит от внеклеточного кальция вследствие его активности накачивать кровь; снижение внеклеточного содержания свободного кальция может в свою очередь вызывать острую сердечную недостаточность. Однако, как описано в WO 2011/004325 A1, эту проблему можно легко решать применением образующего комплекс с кальций DPDP, т. е. CaDPDP.
[0041] Неожиданно было открыто, что CaDPDP можно применять в комплексе с марганцем в производных PLED. Кроме того, неожиданно можно получать комплексные соединения кальция и марганца, например калмангафодипир, и комплексное соединение металлов II группы и переходных металлов III-XII группы.
[0042] Таким образом, по одному из аспектов изобретение относится к смешанному комплексному соединению с металлами соединения формулы I или его соли, где смешанные металлы содержат переходный металл III-XII группы и металл II группы:
Формула I

где
X представляет собой CH или N,
каждый R1 независимо представляет собой водород или -CH2COR5,
R5 представляет собой гидрокси, необязательно гидроксилированный алкокси, амино или алкиламидо,
каждый R2 независимо представляет собой ZYR6, где Z представляет собой связь или C1-3алкиленовую или оксоалкиленовую группу, необязательно замещенную R7,
Y представляет собой связь, атом кислорода или NR6,
R6 представляет собой атом водорода, COOR8, алкильную, алкенильную, циклоалкильную, арильную или аралкильную группу, необязательно замещенную одной или более группами, выбранными из COOR8, CONR82, NR82, OR8, =NR8, =O, OP(O) (OR8)R7 и OSO3M,
R7 представляет собой гидрокси, необязательно гидроксилированную, необязательно алкоксилированную алкильную или аминоалкильную группу,
R8 представляет собой атом водорода или необязательно гидроксилированную, необязательно алкоксилированную алкильную группу,
M представляет собой атом водорода или один эквивалент физиологически приемлемого катиона,
R3 представляет собой C1-8алкиленовую, 1,2-циклоалкиленовую или 1,2-ариленовую группу, необязательно замещенную R7, и
каждый R4 независимо представляет собой водород или C1-3алкил.
[0043] Как используют в настоящем описании, термины "алкил" и "алкилен" включают углеводы с неразветвленной и разветвленной цепью, насыщенные и ненасыщенные. Термин "1,2-циклоалкилен" включает цис- и транс-циклоалкиленовые группы и алкилзамещенные циклоалкиленовые группы, содержащие от 5-8 атомов углерода. Термин "1,2-арилен" включает фенильную и нафтильную группы и их алкилзамещенные производные, содержащие от 6 до 10 атомы углерода. Если не указано иное, любая алкильная, алкиленовая или алкенильная группа может подходящим образом содержать от 1 до 20, более конкретно 1-8, более конкретно 1-6 и даже более конкретно 1-4 атома углерода. Циклоалкильные группы могут подходящим образом содержать 3-18 атомов в кольце, в частности 5-12 атомов в кольце и даже более конкретно 5-8 атомов в кольце. Предпочтительными являются арильные группы, содержащие фенильные или нафтильные группы. В качестве аралкильных групп фенилС1-8алкил, в частности бензил, являются предпочтительными. В случаях, когда группы могут необязательно являться замещенными гидроксильными группами, они могут быть монозамещенными или полизамещенными, и в случае полизамещения алкокси- и/или гидроксильные заместители могут быть замещены алкоксизаместителями.
[0044] Соединение формулы I могут содержать аналогичные или различные группы R2 в двух пиридильных кольцах, и они могут быть присоединены в одних и тех же или различных положениях в кольце. В конкретном варианте осуществления замена происходит в положениях 5 и 6 или более конкретно положении 6, т. е. пара-положении по отношению к гидроксильной группе. В конкретном варианте осуществления группы R2 являются идентичными и идентично расположенными и более конкретно находятся в 6,6'-положениях. В еще более конкретных вариантах осуществления каждый R6 представляет собой моно- или поли(гидрокси или алкоксилированную)алкильную группу или группу формулы OP(O)(OR8)R7.
[0045] В другом варианте осуществления изобретение относится к комплексному соединению с кальцием и магнием соединения формулы I. В одном из вариантов осуществления R5 представляет собой гидрокси, C1-8алкокси, этиленгликоль, глицерин, амино или C1-8алкиламидо, Z представляет собой связь или группу, выбранную из CH2, (CH2)2, CO, CH2CO, CH2CH2CO и CH2COCH2, Y представляет собой связь, R6 представляет собой моно- или поли(гидрокси или алкоксилированную)алкильную группу или группу формулы OP(O)(OR8)R7, и R7 представляет собой гидрокси или незамещенную алкильную или аминоалкильную группу. В более конкретном варианте осуществления R представляет собой этилен, и каждая группа R1 представляет собой -CH2COR5, в которой R5 представляет собой гидрокси. В дополнительном варианте осуществления соединение формулы I представляет собой N,N'-бис(пиридоксаль-5-фосфат)-этилендиамин-N,N'-диуксусную кислоту (DPDP) или ее фармацевтически приемлемую соль. В дополнительных вариантах осуществления фармацевтическое вещество представляет собой смешанной комплексное соединение с марганцем и кальцием N,N'-бис(пиридоксаль-5-фосфат)-этилендиамин-N,N'-диуксусной кислоты или ее соли.
[0046] Смешанное комплексное соединение с металлами может включать любую комбинацию металлов из указанных групп. В конкретном варианте осуществления переходный металл III-XII группы представляет собой Mn2+, Cu2+, Fe2+ и/или Ni2+, и металл II группы представляет собой Ca2+ и/или Mg2+. В более конкретном варианте осуществления переходный металл III-XII группы представляет собой Mn2+, и металл II группы представляет собой Ca2+ или смесь Ca2+ и Мg. В более конкретных вариантах осуществления металл II группы представляет собой смесь Ca2+ и Mg2+ с молярным отношением Ca2+/Mg2+ приблизительно 0,1-50, более конкретно приблизительно 0,1-10.
[0047] В дополнительных вариантах осуществления смешанное комплексное соединение с металлами содержит молярное отношение металла II группы к переходному металлу III-XII группы приблизительно 1-10. В конкретном варианте осуществления переходный металл III-XII группы представляет собой Mn2+, и металла II группы представляет собой Ca2+, и молярное отношение Ca2+/Mn2+ составляет приблизительно 4. В более конкретном варианте осуществления переходный металл III-XII группы представляет собой Mn2+, и металл II группы представляет собой Ca2+, и молярное отношение Ca2+/Mn2+ составляет приблизительно 4, и соединение формулы I представляет собой DPDP, т. е. комплексное соединение представляет собой соединение калмангафодипира, как описано в настоящем описании.
[0048] В другом аспекте изобретение относится к способу получения смешанного комплексного соединения с металлами по изобретению за одно получение/стадию кристаллизации. Способ включает одностадийную кристаллизацию из раствора переходного металла III-XII группы, металла II группы и соединения формулы I. В конкретном варианте осуществления проводят одностадийную кристаллизацию из раствора марганца, кальция и соединения формулы I. В более конкретном варианте осуществления раствор имеет отношение (Ca+Mn)/Mn, близкое к (4+1)/1=5, т. е. с композицией, стехиометрически близкой к Ca4Mn(DPDP)5.
[0049] Рентгеновская порошковая дифрактометрия (XRPD) наиболее широко используется для идентификации и характеристики кристаллических твердых веществ, каждое из которых дает отличную от других картину дифракционной решетки. Положения (соответствующие периодам решеки) и относительная интенсивность линий являются показателем конкретной фазы и вещества, обеспечивая "отпечаток" для сравнения. Как продемонстрировано в примерах, анализ XRPD калмангафодипира демонстрирует без сомнений, что калмангафодипир представляет собой одно химическое соединение, т. е. комплексное соединение, а не простую смесь, см. пример 1. На фиг. 1 представлена собранная гистограмма трех кристаллических форм калмангафодипира, которые взаимопревращаются друг в друга в зависимости от влажности окружающей среды. Анализ XRPD при изменяющейся влажности демонстрировал, что форма В является стабильной при относительной влажности (RFI) более 40%, форма A является стабильной при 0-10% RFI, и форма С является стабильной в диапазоне 6-36% RFI. Смеси форм В и С наблюдали в диапазоне 38-44% RFI и наблюдали, что преобразования форм происходили в течение 3 часов на шкале 10 мг.
[0050] Одностадийное получение можно проводить с затравливанием или без него, но затравливание (как проиллюстрировано в примере 1) обеспечивает лучший контроль кристаллизации.
[0051] Кратко упомянутое выше одностадийное получение является лучше получения смешиванием индивидуальных комплексных соединений с металлами. Таким образом, в конкретном варианте осуществления комплексное соединение кальция и марганца представляет собой кристаллическое вещество и является легко отличимым от простой смеси мангафодипира (MnDPDP) и кальфодипира (CaDPDP) в желаемым количествах, как продемонстрировано в примере 2.
[0052] Примеры также демонстрируют улучшения и преимущества комплексных соединений по изобретению, как представлено комплексным соединением с кальцием-марганцем калмангафодипиром. В отношении стабильности марганца in vivo калмангафодипир является по меньшей мере таким же стабильным, как настоящая смесь мангафодипира и фодипира, как продемонстрировано в примере 4. Это приводит к значительно меньшему удерживанию марганца в головном мозге, как продемонстрировано в примере 8. Вследствие того, что цитопротекторная эффективность в основном зависит от целого комплексного соединения мангафодипира с марганцем или его дефосфорилированных аналогов, MnDPMP и MnPLED, эффективность калмангафодипира превосходит эффективность мангафодипира, как проиллюстрировано в примере 5. Кроме того, неожиданно было выявлено, что мангафодипир обладает цитотоксическими эффектами в отношении злокачественных клеток, например, клеток CT26 (Laurent et al., 2005, Alexandre et al., 2006, EP 16944338). Однако, как описано в WO 2009/078794 A1 и у Kurz et al., 2012, это является характерным свойством только фодипира или его дефосфорилированных аналогов, DPMP и PLED, а не целого комплексного соединения мангафодипира с металлами или его дефосфорилированных аналогов, MnDPMP и MnPLED. В примере 6 показано, что фодипир является приблизительно в 20 раз более эффективным, чем мангафодипир при цитолизе клеток CT26 рака толстого кишечника, и в примере 11 демонстрируют, что калмангафодипир является приблизительно в 28 раз более эффективным, чем мангафодипир при цитолизе клеток U1810 немелкоклеточного рака легких. Диссоциация до некоторой степени марганца из фодипира в условиях in vitro, вероятнее всего, объясняется цитотоксической эффективностью мангафодипира по отношению к злокачественной опухоли. С другой стороны, калмангафодипир, как описано в примерах 1, 2 и 3, по сравнению с мангафодипиром при эквимолярных концентрациях марганца является таким же эффективным, как один фодипир, т. е. цитотоксическая эффективность калмангафодипира является гораздо выше, чем цитотоксическая эффективность мангафодипира при эквимолярных концентрациях марганца. Это открытие подтверждает два важных свойства. Во-первых, дефосфорилированный PLED, вероятнее всего, является таким же эффективным, как его фосфорилированный аналог фодипир в отношении его способности вызывать цитолиз злокачественных клеток, и, во-вторых, более низкая стабильность MnPLED по сравнению со стабильностью мангафодипира (Rocklage et al., 1989), скорее всего, объясняется более высокой эффективностью MnPLED. Отсутствие какой-либо цитотоксической активности ZnDPDP и ZnPLED обусловлено в 1000 раз более высокой стабильностью этих комплексных соединений по сравнению с их аналогами с марганцем (Rocklage et al., 1989).
[0053] Во время разработки мангафодипира в качестве контрастного средства для MRI, было открыто, что MnDPDP вызывал аномалии скелета плода у крыс, ноне у кроликов. Следует отметить, что такой тератогенный эффект, наблюдаемый у крыс, не обусловлен целым мангафодипиром самим по себе, а диссоциирующим марганцем (Grant et al., Acta Radiol., 1997, 38:759-769). Хотя не определено, вызывает ли марганец аномалии скелета у плода человека, конечно, следует предохранять потенциально беременных женщин от экспозиции мангафодипиром. Это представляет незначительную проблему для большей части клинических применений, но значительную профессиональную проблему, в частности во время получения, где необходимо применять дорогостоящие меры, для предохранения фертильных и потенциально беременных женщин от экспозиции мангафодипиром. Следует отметить, что тот факт, что калмангафодипир выделяет марганец гораздо в меньшей степени, чем мангафодипир после того, как случайно всасывается в организме, естественно будет значительно снижать риск, что у плода развиваются пороки развития скелета. Во-вторых, вследствие того, что калмангафодипир является значительно более эффективным, чем мангафодипир при эквимолярных дозах марганца, потребность в марганце значительно снижается для каждой дозы получаемого калмангафодипира, что приводит к меньшей экспозиции марганцем во время получения.
[0054] Кроме того, получение одного активного фармацевтического ингредиента снижает стоимость производства терапевтической дозы. Кроме того, необходимость дозирования одного вещества снижает вероятность ошибок в составе продукта. В испытании стабильности было продемонстрировано, что стабильность кристаллического продукта превосходит стабильность аморфного вещества, такого как вещество, получаемое сушкой распылением смеси двух API. Как проиллюстрировано в примере 2, продемонстрировано, что аморфное вещество, получаемое сушкой распылением, быстро абсорбирует воду, образуя склеенные частицы и/или липкие твердые вещества при экспонировании в течение 24 часов при 25°C/60% RH и 40°C/75% RH. В противоположность этому кристаллический калмангафодипир оставался свободным сыпучим твердым веществом даже через 7 суток при тех же условиях экспонирования.
[0055] Было открыто, как описано в WO 2011/004325 A1, что добавление избытка не содержащего марганец производного PLED, например DPDP, в терапию на основе производного MnPLED предотвращает выделение из мангафодипира нейротоксического марганца in vivo. Хотя механизм поглощения марганца в головном мозге не полностью понятен, избыток не содержащего марганец производного PLED, такого как фодипир, вводимый в комбинации с содержащим марганец производным PLED, таким как мангафодипир, значительно снижает поглощение марганца в головном мозге. Не желая быть связанными теорией, полагают, что комбинация по изобретению WO 2011/004325 A1 сохраняет хелатирующую форму MnPLED, таким образом, для экскреции доступны увеличенные количества хелатов, и количество свободного Mn для поглощения в головном мозге и других органов снижается. Низкомолекулярные хелаты марганца, такие как производные MnPLED и их аналоги с Zn, легко выводятся почками, в зависимости от скорости клубочковой фильтрации (GFR), тогда как марганец, не связанный с низкомолекулярным хелатором, удерживается в течение длительного периода времени в организме и выделяется медленно и в основном билиарным путем (Toft et al., 1997). Как продемонстрировано в следующем ниже примере 8 в настоящем описании, повторные (39 раз в течение 3 месяцев) внутривенные инъекции высокой дозы (в 36 раз больше принятой клинической допустимой дозы) калмангафодипира у крыс вызывали значительно меньшее удерживание марганца в головном мозге по сравнению с удерживанием, вызываемым мангафодипиром. Суммарная доза в обоих случаях соответствовала приблизительно 2800 мкмоль/кг марганца. Этот пример также демонстрирует, что поджелудочная железа в относительно большой степени поглощает и удерживает диссоциированный марганец, свойство, ранее описанное Ni et al. (Acta Radiol., 1997, 38:700-707) и используемое как перспективный способ диагностики MRI поджелудочной железы (Ahlstrom et al., Acta Radiol., 1997, 38:660-664). Значительно более низкий уровень марганца в поджелудочной железе обрабатываемых калмангафодипиром крыс по сравнению с крысами, обрабатываемыми мангафодипиром, дополнительно подтверждает улучшенный токсикологический профиль калмангафодипира. Хотя содержание Mn в печени являлось статистически значимо повышенным в группе мангафодипира, относительное повышение являлось значительно меньшим, чем повышение в головном мозге и поджелудочной железе. Известно, что однократная диагностическая доза мангафодипира (5 мкмоль/кг массы тела) вызывает быстрое повышение содержания Mn в поджелудочной железе и печени крыс - через 2 часа содержание Mn в поджелудочной железе являлось приблизительно в 10 раз выше фонового значения, и соответствующее значение в печени являлось повышенным приблизительно в 2 раза (Ni et al., 1997). При этом Ni et al. обнаружили, что содержание Mn остается все еще повышенным через 24 часа в поджелудочной железе (приблизительно в 5 раз больше фонового значения), в печени к этому моменту времени оно возвращается к фоновому уровню. Предположительно это отражает высокую способность печени перерабатывать марганец и ее важную физиологическую роль в гомеостазе марганца. Это дополнительно подтверждается настоящими результатами, демонстрирующими только умеренное увеличение Mn в печени после длительной экспозиции мангафодипиром. Улучшенный токсикологический профиль калмангафодипира ясно проиллюстрирован примером 8 в настоящем описании.
[0056] Когда клиническую дозу производного MnPLED, такого как мангафодипир (т. е. 5-10 мкмоль/кг массы тела, внутривенное введение) используют в качестве контрастного средства MRI у человека, приблизительно 80% марганца, связанного с фодипиром (DPDP), замещается цинком (Toft et al., 1997). Чем меньшие дозы мангафодипира вводят, тем даже выше процентное содержание марганца, который диссоциирует. Мангафодипир ведет себя в этом отношении аналогичным образом у крыс и собак (Hustvedt et al., 1997), однако практически весь марганец в мангафодипире замещается цинком, когда соединение вводят свиньям, и, таким образом, оно не обладает цитопротекторными эффектами у свиней (Karlsson et al., 2001). С другой стороны, введение низких доз MnPLED вызывает значительные цитопротекторные эффекты у свиней, наблюдаемые как значительно уменьшенный размер инфаркта миокарда после ишемии-реперфузии. Хотя опубликованная константа устойчивости Mn2+ и PLED является значительно ниже, чем соответствующий показатель для Mn2+ и фодипира (Rocklage et al., 1989), в MnPLED в виду некоторых неизвестных причин не происходит замещения металлов. Замена марганца является необходимым условием и, таким образом, является желательной для применения в качестве контрастного средства для MRI, например, в целях диагностики печени и поджелудочной железы. Однако терапевтический эффект миметика SOD в отношении различных форм окислительного стресса полностью зависит от целого комплексного соединения производного PLED с марганцем (Brurok et al., 1999, Karlsson et al., 2001). Например, несмотря на то, что введение мангафодипира in vivo защищает от различных окислительных факторов, например, ишемии-реперфузии, цитотоксических/цитостатических лекарственных средств и интоксикации ацетаминофена, оно не защищает сердце свиней от индуцируемого ишемией-реперфузией инфаркта миокарда (Karlsson et al., 2001), результаты, из которых можно заключить, что цитопротекторные эффекты производных MnPLEDin vivo являются характерным свойством целого комплексного соединения марганца.
[0057] Наличие избытка Ca приблизительно в 4 раза по отношению к Mn, как в калмангафодипире, в значительной степени стабилизирует комплексное соединение или его дефосфорилированные аналоги от выделения марганца после инъекций и, таким образом, предоставляет другое важное преимущество, а именно повышенную терапевтическую эффективность. Например, когда клинически значимые дозы для визуализации MnDPDP (5-10 мкмоль/кг) инъецируют внутривенно, выделяется приблизительно 80% марганца, изначально связанного с DPDP, способствуя эффективности визуализации. Таким образом, менее 20% остается связанным с DPDP или его дефосфорилированными аналогами, способствуя терапевтической активности MnDPDP. Вследствие того, что выделение марганца из комплексного соединения может эффективно снижать избытки приблизительно в 4 раза Ca по сравнению с Mn в калмангафодипире, это значит, что марганец можно значительно снижать для равноэффективного терапевтического эффекта, как ясно проиллюстрировано в настоящем изобретении. При более низких и в определенных вариантах осуществления более высоких терапевтически релевантных дозах стабилизирующий эффект Ca является даже более усиленным. Это в свою очередь означает, что использование калмангафодипира по сравнению с мангафодипиром обладает значительными эффектами на нейротоксический потенциал - как в результате стабилизирующего эффектаin vivo, так и в результате повышенной терапевтической эффективности нового фармацевтического вещества калмангафодипира с композицией, стехиометрически близкой к Ca4Mn(DPDP)5.
[0058] Цинк содержится во всех тканях или жидкостях организма. Подсчитано, что общее содержание цинка в организме у людей составляет 2-3 г (Folin et al., BioMetals, 1994, 7:75-79). Цинк в плазме составляет приблизительно 0,1% от общего содержания цинка в организме, и в основном только эта небольшая часть цинка, которая конкурирует с марганцем за связывание с фодипиром или его дефосфорилированными аналогами, DPMP и PLED, после введения. Организм человека обладает очень высокой способностью поддерживать гомеостаз цинка путем синергической регуляции желудочно-кишечного всасывания и экскреции (King et al., J. Nutr., 2000, 130:1360S-1366S).
[0059] Не желая быть связанными теорией, из доклинической работы (Southon et al., 1997) и из клинической работы (Skjold et al., 2004) может быть уместным предположить, что организм содержит от 5 до 10 мкмоль/кг масса тела (м. т.) цинка, который легко заменяет марганец в производном MnPLED, такой как мангафодипир. Это по существу соответствует содержанию цинка в плазме, как описано выше. Производные PLED, такое как фодипир, содержит один участок связывания для марганца/цинка в молекуле. Таким образом, принимая внимание в 1000 раз более высокую аффинность цинка к хелатору, содержание кальция в калмангафодипире в отношении приблизительно 4 по сравнению с марганцем предотвращает выделение марганца после парентерального введения пациенту.
[0060] В другом варианте осуществления изобретение относится к способам лечения патологического состояния у пациента, включая, но, не ограничиваясь ими, патологическое состояние, обусловленное наличием образуемых из кислорода свободных радикалов, т. е. окислительного стресса, путем введения комплексного соединения. В конкретном варианте осуществления патологическое состояние обусловлено супероксидом, приводящим к последовательному перекисному окислению липидов и/или нитрованию белка. В конкретном варианте осуществления комплексное соединение можно вводить для терапевтического лечения такого патологического состояния у являющегося человеком пациента или другого млекопитающего. В другом конкретном варианте осуществления комплексное соединение по изобретению вводят для лечения патологического состояния, обусловленного наличием образуемых из кислорода свободных радикалов, т. е. окислительного стресса у млекопитающего.
[0061] В одном из вариантов осуществления комплексное соединение применяют при лечении цитотоксическим или цитостатическим лекарственным средством, где комплексное соединение вводят для обеспечения защиты от неблагоприятных побочных эффектов цитотоксических средств/цитостатических лекарственных средств, например, одного или более лекарственных средств против злокачественных опухолей у пациентов со злокачественными опухолями. В более конкретном варианте осуществления цитотоксическое или цитостатическое лекарственное средство содержит по меньшей мере один из доксорубицина, эпирубицина, оксалиплатина, карбоплатина, цисплатина, 5-фторурацила, доцетаксела или паклитаксела. В дополнительных вариантах осуществления патологическое состояние представляет собой миелосупрессию или нейротоксичность или и то и другое.
[0062] Способы по изобретению также могут включать, но не ограничиваться ими, лечение индуцированной ацетаминофеном печеночной недостаточности, неалкогольного стеатогепатита (NASH), индуцированного вирусом хронического гепатита, болезни Вильсона, диабета, ишемической болезни сердца, включая индуцируемое ишемией-реперфузией повреждение или индуцируемое ишемией-реперфузией миокарда повреждение, как в экстренном, а также в рекомендуемом режиме, состояния, ассоциированного с лечением тромболитиками, экстракорпоральным кровообращением или чрескожной транслюминальной ангиопластики или являющееся результатом операции на сердце или операции по трансплантации органа или инсульта. В дополнительных вариантах осуществления способы по изобретению также могут включать лечение связанных с железом состояний, включая перегрузку железом, например, талассемию, серповидно-клеточную анемию или трансфузионный гемосидероз, индуцированный гепатитом цирроз печени, индуцированные облучением поражения, например, являющиеся результатом лучевой терапии, различных нейродегенеративных заболеваний, включая болезнь Альцгеймера, боковой амиотрофический склероз (ALS), болезнь Паркинсона и рассеянный склероз и т. п.
[0063] В дополнительных вариантах осуществления способы по изобретению проводят в виде заместительной терапии патологического состояния низкой активности марганцевой супероксиддисмутазы (MnSOD), такого как возникает при различных формах злокачественной опухоли (Buettner, Anticancer Agents Med. Chem., 2011, 11:341-346). Таким образом, в одном из вариантов осуществления изобретение относится к способу лечения немелкоклеточного рака легких путем введения комплексного соединения по изобретению или более конкретно калмангафодипира. В дополнительных вариантах осуществления изобретение относится к способу лечения колоректального рака, рака предстательной железы, рака молочной железы, рака поджелудочной железы или злокачественной меланомы путем введения комплексного соединения по изобретению или более конкретно калмангафодипира.
[0064] Интересным и, возможно, важным свойством противоопухолевого эффекта мангафодипира может являться его защитное свойство по отношению к лимфоцитам, как продемонстрировано в примере 5 и Laurent et al., 2005 и Alexandre et al., 2006. Хотя воспалительные процессы, вторичные по отношению к окислительному стрессу, повреждают нормальную ткань, они могут фактически являться благоприятными для опухолевой ткани, создавая микроокружение с высоким содержанием факторов роста и способствуя росту злокачественных клонов (Anscher, Onclogist, 2010, 15:350-359, Kareva, Transl. Oncol., 2011, 4:266-270, Kerkar et al., Cancer Res., 2012, 72:3125-3130). Ярким примером является существование опухолеассоциированных макрофагов, которые накапливаются преимущественно в слабо васкуляризованных областях опухолей и секретируют цитокины, которые фактически способствуют росту опухоли. Кроме того, эти цитокины не только могут способствовать росту опухоли, но также было продемонстрировано, что они подавляют активацию CD8+ T-лимфоцитов, которые являются наиболее эффективными при элиминации опухолей. Фактически существует возрастающий интерес касательно важности опосредованного T-лимфоцитами иммунного ответа для исхода химиотерапии злокачественной опухоли (Zitvogel et al., Nat. Rev. Clin. Oncol., 2011, 8:151-160, Kerkar et al., 2012). Известно, что тяжелая лимфопения (<1000 клетки/мкл) отрицательно влияет на ответ на химиотерапию. Коллекции злокачественных опухолей мышей, включая рак толстого кишечника CT26, фибросаркомы MCA205, линии клеток TSA рака молочной железы, линии клеток GOS остеосаркомы и злокачественной опухоли щитовидной железы EL4, отвечали на химиотерапию доксорубицином и оксалиплатином гораздо более эффективно, когда их имплантировали сингенным иммунокомпетентным мышам по сравнению с иммунодефицитными хозяевами, т. е. бестимусными мышами (Zitvogel et al., 2011). Это находится в соответствии с клиническими исследованиями, в которых выявляли, что продуцирующие IFN-γ CD8+ T-лимфоциты представляют собой эффективные иммунные эффекторы злокачественных опухолей. Кроме того, высокое отношение нейтрофилов/лимфоцитов ассоциировано с низкой общей выживаемостью пациентов с колоректальным раком на поздней стадии (Chua et al., Br. J. Cancer, 2011, 104:1288-1295). Принимая во внимание, что мангафодипир и, в частности, калмангафодипир представляют собой высокоэффективные защищающие лимфоциты средства при химиотерапии, вероятно, что это свойство имеет особое значение в условиях in vivo.
[0065] Чтобы являться клинически пригодным, протективное средство при химиотерапии или протективное средство при лучевой терапии, используемое у пациентов со злокачественными опухолями, должно соответствовать трем критериям: (i) средство должно защищать нормальную ткань от индуцируемой химиотерапией/лучевой терапией токсичности, но не защищать опухолевую ткань (по меньшей мере не в большей степени), в ином случае не получают благоприятного действия; (ii) средство следует доставлять относительно просто и с минимальной токсичностью, и (iii) средство должно защищать нормальные ткани от ограничивающей дозу токсичности или от токсичности, обуславливающей значительное снижение качества жизни (Citrin et al., 2010). Соединения по изобретению и калмангафодипир, в частности, соответствуют всем этим критериям, как продемонстрировано в примерах в настоящем описании. Причина, по которой мангафодипир и калмангафодипир защищают незлокачественные клетки, но повреждают злокачественные клетки, по-видимому является парадоксальным явлением. Не желая быть связанными теорией, однако вполне возможно, что защита незлокачественных клеток и цитотоксические действия в отношении злокачественных клеток представляют собой только две стороны одной монеты. Повышенный окислительный статус является необходимым для митогенной стимуляции в трансформированных клетках (Irani et al., Science, 1997, 275:1649-1652). В ряде исследований опубликовано, что активные формы кислорода (ROS) играют важную роль в стимуляции метастаза опухоли (например, Behrend et al., Mol. Cell Biol., 2005, 25:7758-7769). Эти данные соответствуют большому объему литературы, подтверждающей, что окислительно-восстановительный баланс многих эпителиальных опухолевых клеток способствует повышенной окислительной заданной величине (Doroshow, 2006), включая клетки CT26 (Laurent et al., 2005, Alexandre et al., 2006). MnSOD подавляет рост клеток в ряде линий злокачественных клеток и на моделях на мышах. Кроме того, сверхэкспрессия MnSOD индуцировала арест роста в линии клеток HCT116 колоректального рака человека и усиливала старение, которое необходимо для индукции p53 (Behrend et al., 2005). Индукция нормального гена MnSOD в злокачественных клетках изменяет фенотип, и клетки теряют свою способностью образовывать колонии в культуре и опухолях у бестимусных мышей (Church et al., Proc. Natl. Acad. Sci. USA, 1993, 90:3113-3117). Повышенный окислительный статус, наблюдаемый в злокачественных клетках, как правило, приводит к повышенной продукции ∙O2-, который быстро взаимодействует с ∙NO с образованием высокотоксичного ONOO-, приводя к нитрованию тирозина, "опасной" стороне ∙NO (Beckman et al, 1996, Radi, 2004). Следует отметить, что убедительные доказательства позволяют предположить, что нитрование тирозина участвует в описанном выше подавлении опосредованного CD8+ лимфоцитами иммунного ответа в опухолях (Bronte et al., J. Exp. Med., 2005, 201, 1257-1268, Molon et al., J. Exp. Med., 2011, 208:1949-1962). Возможно, что калмангафодипир посредством своей активности миметика SOD ингибирует продукцию ONOO- и, таким образом, иммуносупрессию, что объясняет повышенный противоопухолевый эффект, наблюдаемый у иммунокомпетентных мышей, но не у иммунонекомпетентных мышей, как продемонстрировано примером 10. Пероксинитрит не способен непосредственно нитровать белок и, как правило, нуждается в редокс-активном переходном металле, таком как железо или медь (и даже марганец может соответствовать этим потребностям) (Radi, 2004). Фодипир и его дефосфорилированные метаболиты обладают чрезвычайно высокой аффинностью к Fe3+ (Rocklage et al., 1989). Это свойство наряду с активностью миметика SOD калмангафодипира может представлять особую важность для противоопухолевой активности. В дополнение к зависимому от T-лимфоцитов действию непосредственное независимое от иммунного ответа действие DPDP и PLED может быть обусловлено ингибированием топоизомеразы II, как можно предполагать в недавней статье Kurz (2012).
[0066] Комплексное соединение можно вводить в фармацевтическую композицию. Необязательно фармацевтические композиции по настоящему изобретению могут содержать один или более физиологически приемлемых носителей и/или эксципиентов, таким образом, хорошо известных специалистам в данной области. В одном из вариантов осуществления комплексное соединение можно, например, суспендировать или растворять в жидкой среде, необязательно с добавлением фармацевтически приемлемых эксципиентов. Подходящие эксципиенты для фармацевтических композиций включают любые общепринятые эксципиенты фармацевтических или ветеринарных составов, включая, но, не ограничиваясь ими, стабилизаторы, антиоксиданты, средства регуляции осмоляльности, буферы, средства регуляции pH, связывающие средства, наполнители и т. п. Фармацевтические композиции могут находиться в подходящей для введения форме, включая парентеральное и энтеральное введение. В конкретном варианте осуществления композиция находится в форме, подходящей, например, для инъекции или инфузии. Таким образом, фармацевтические композиции по настоящему изобретению могут находиться в общепринятой форме для фармацевтического введения, такой как таблетка, капсула, порошок, раствор, суспензия, дисперсия, сироп, суппозиторий, аэрозоль, мазь, пластырь или т. п. В дополнительном варианте осуществления комплексное соединение находится в лиофилизированной форме, и при желании перед введением его можно восстанавливать. Лиофилизированное комплексное соединение может находиться в лиофилизированной композиции, содержащей один или более стабилизаторов и/или других эксципиентов, известных для применения для лиофилизации.
[0067] Такие композиции по настоящему изобретению можно вводить различными путями, например перорально, трансдермально, ректально, интратекально, местно или посредством ингаляции или инъекции, в частности, подкожной, внутримышечной, интраперитонеальной или внутрисосудистой инъекции. Также можно использовать другие пути введения, включая интратимпанальный и интраназальный, и предпочтительными являются пути, которые повышают эффективность, биодоступность или переносимость продуктов. Специалисты в данной области могут выбирать наиболее подходящий путь в зависимости от конкретного состава, который используют. Подходящие дозы будут очевидны в зависимости от выбранного лечения. В одном из вариантов осуществления способ лечения по изобретению включает введение приблизительно от 0,01 до 50 мкмоль/кг массы тела смешанного комплексного соединения с металлами. В более конкретных вариантах осуществления способ лечения по изобретению включает введение приблизительно от 0,1 до 10 мкмоль/кг или приблизительно от 0,1 до 5 мкмоль/кг массы тела смешанного комплексного соединения с металлами.
[0068] Следующие ниже примеры демонстрируют различные варианты осуществления и аспекты изобретения.
[0069] Пример 1
[0070] Способ
[0071] В 100 л реактор с рубашкой, продуваемый N2, нагружали фодипир (DPDP) (4,0 кг безводного основания, 6,27 моль, 1 экв.) и деионизованной (DI) воды (19,2 л, 4,88 об.). pH смеси доводили до 5,7 разбавленным NaOH (всего 8,9 л, 17,5 моль NaOH, 2,8 экв., получаемый из 1,41 кг 50% масс. NaOH и 8,0 л DI воды) в течение 35 минут (21,0-23,3°C, внешнее охлаждение). Взвесь перемешивали в течение 1 часа при 20-25°C, за это время образовывался раствор. К нему последовательно нагружали Са(ОН)2 (361,1 г, 4,87 моль, 0,78 экв.), L-аскорбиновую кислоту (55,1 г, 0,313 моль, 5% моль) и MnO (80 г, 1,13 моль, 0,18 экв.). После добавления каждого реагента смесь перемешивали в течение 30-60 минут при 20-25°C и измеряли pH (после Ca=6,24, немного мутный от бледно-желтого до цвета ржавчины, после аскорбиновой кислоты=6,28 менее мутно ржавого цвета, после Mn=6,38, от мутно ржавого цвета до желто-зеленого). Мутную смесь перемешивали в течение 16 часов при 20-25°C, измеряли pH (6,36) и фильтровали смесь через 0,3 мкм встроенный фильтр в чистый 100 л реактор. Тем временем получали раствор этанола (EtOH) 23A с ацетоном (5,9 л, 1,47 об.) и EtOH (74 л, 18,5 об.). Часть раствора EtOH 23A (8,0 л, 2 об.) нагружали в смесь в течение 30 минут при 20-25°C, за это время раствор становился мутным. В смесь вносили затравку калмангафодипир (40 г, 1% масс.) и перемешивали в течение 30 минут при 20-25°C, обеспечивая сохранение твердого вещества.
[0072] Температуру смеси регулировали при 15°C в течение 1 часа, а затем понижали в течение 30 минут до 13,8-15,5°C. В смесь нагружали EtOH 23A (56 л, 14 об.) в течение 10 часов (11-14°C). Взвесь смешивали в течение 13 часа при 5-10°C, а затем фильтровали, собирая твердые вещества. Реактор и твердые вещества промывали охлажденным (0-10°C) EtOH 23A (14 л, 3,5 об.), твердые вещества выдерживали в течение 2 часов, а затем сушили в вакуумной печи при 45°C в течение 72 часов с получением 4,819 кг (выход продукта 93% с поправкой на содержание воды) калмангафодипира (серия № 11AK0105B) в виде желтого твердого вещества. ВЭЖХ анализ демонстрировал чистоту 98,8%. Анализ Карла Фишера в печи (@170°C) демонстрировал 10,1% воды. Анализ ICP показывал 4,27% Ca, 1,37% Mn, 8,64% Na для отношения Ca/Mn 4,27, т. е. с композицией стехиометрически близкой к Ca4Mn(DPDP)5.
[0073] Результаты
[0074] Проводили анализ XRPD (рентгеновской порошковой дифрактометрии), и получаемые дифрактограммы представлены на фиг. 1. Дифрактограммы XRPD демонстрируют, что калмангафодипир представляет собой одно химическое соединение, а не простую смесь. На фиг. 1 представлена собранная гистограмма трех известных кристаллических форм калмангафодипира, которые взаимопревращаются друг в друга в зависимости от влажности окружающей среды. Анализ XRPD при переменной влажности демонстрировал, что форма В является стабильной при RFI более 40%, форма A стабильна при 0-10% RFI, и форма С стабильна в диапазоне 6-36% RFI. Смеси из форм В и С наблюдали в диапазоне 38-44% RFI и наблюдали, что преобразование форм происходит в течение 3 часов на шкале 10 мг.
[0075] Заключение
[0076] XRPD неожиданно демонстрировал калмангафодипир, как являющийся одним химическим соединением, а не простой смесью (фиг. 1).
[0077] Пример 2
[0078] Способ
[0079] В отношении 4:1 приблизительно 200 мг кальфодипира (CaDPDP) и 50 мг мангафодипира (MnDPDP) взвешивали в 40 мл флаконе и растворяли в 40 мл DI воды при комнатной температуре с получением желтого раствора. Желтый водный раствор сушили распылением с использованием мини-распылительной сушилки Buchi B-290, при этом присоединенной к высушивающему устройству Buchi B-296 в качестве кондиционера, обеспечивая подачу воздуха из лаборатории. Эксперименты оптимизации сушки распылением проводили при повышенных температурах на входе (220°C) при различных скоростях подачи (20, 30, 40, 50 и 60%). Выделение продукта находилось в диапазоне 180-230 мг.
[0080] Результаты
[0081] Получаемые вещества анализировали XRPD (фигура 2), который свидетельствовал, что все продукты являлись аморфными, и было продемонстрировано, что они быстро абсорбируют воду, образуя слитые частицы и/или липкие твердые частицы при экспозиции в течение 24 часов при 25°C/60% RH и 40°C/75% RH.
[0082] Пример 3
[0083] В этом примере выявляют структуру нового химического соединения калмангафодипира с использованием инфракрасной абсорбционной спектроскопии, масс-спектроскопии и элементного анализа. Анализ ЯМР невозможно применять для анализа калмангафодипира вследствие парамагнитной природы Mn.
[0084] Способы
[0085] Анализы, описанные в этом примере, проводили на продукте, получаемом в соответствии с одностадийным способом, описываемым в настоящем описании. Продукт идентифицировали как серию № 7755-C-RO-01-30-01 и получали по существу, как описано в примере 1. Часть этого продукта сертифицировали в качестве эталонного стандарта для калмангафодипира.
[0086] Инфракрасная абсорбционная спектроскопия. Спектр поглощения с преобразованием Фурье в инфракрасной области (FT-IR) калмангафодипира серии № 7755-C-R0-01-30-01 получали с использованием нарушенного полного отражения (ATR) на спектрометре Thermo-Nicolet Avatar 370.
[0087] Масс-спектроскопия. Масс-спектр калмангафодипира серии № 7755-C-R0-01-30-01 получали на системе Waters Q-Tof Micro MS/MS. Для анализа MS выбирали ионизацию распылением в электрическом поле (ESI) (режим положительной полярности ионов). Образец растворяли в растворе 50:50 ацетонитрила/воды +0,1% муравьиной кислоты в концентрации 10 мкг/мл. Раствор водили непосредственно в источник при скорости 10 мкл/минута.
[0088] Элементный анализ. Калмангафодипир серии № 7755-C-R0-01-30-01 получали с использованием молярного отношения Ca/Mn 4,26 и 2,8 моль Na/моль фодипира. Теоретическое содержание металлов комплексного соединения в этой композиции составляло 1,41% Mn, 4,38% Ca и 8,69% Na.
[0089] Результаты
[0090] Спектр поглощения в инфракрасной области представлен на фиг. 3, и характерные полосы поглощения в инфракрасной области (волновое число) и соответствующие соотнесения являются такими, как указано ниже:
[0091] Масс-спектр и расширенный масс-спектр образца представлены на фиг. 4A и 4B соответственно. Спектр представлен в виде спектров кальфодипира и мангафодипира, наложенных друг на друга. Точная масса полностью протонированного кальфодипира составляет 676, и для [M+1] наблюдают массу 677. Точные массы мононатрия, динатрия, тринатрия и тетранатрия составляют 698, 720, 742 и 764 соответственно. Спектр демонстрирует [M+1] для каждого пика 699, 721, 743 и 765, соответственно. Точная масса полностью протонированного мангафодипира составляет 691 с соответствующими пиками мононатрия, динатрия, тринатрия и тетранатрия при 713, 735, 757 и 779 соответственно. Спектр демонстрирует массы при 692, 714, 736, 758 и 780 для [M+1] для каждого пика.
[0092] Результаты содержания металлов для серии № 7755-C-R0-01-30-01 составляли 1,48% Mn, 4,44% Ca и 8,56% Na и находились в соответствии с ожидаемыми значениями, подтверждая, что марганец и кальций образуют комплекс с натрием в качестве противоиона, и что немного кальция содержится в виде противоина или совсем не содержится.
[0093] Заключение
[0094] Эти результаты соответствуют структуре, представленной на фиг. 5. На фиг. 5 представлена идеальная и получаемая структура 4:1 Ca/Mn с 3 Na в виде противоиона, молекулярная масса которой составляет 745,43, представленная на фиг. 5. Средняя молекулярная масса вещества, получаемого, как описано и исследовано в примере, с отношением Ca/Mn 4,26 и 2,8 Na в виде противоинов, составляет 740,89.
[0095] Пример 4
[0096] В этом примере измеряли выделение марганца (Mn) и цинка (Zn) с мочой у животных, получавших калмангафодипир или мангафодипир в эквимолярных дозах Mn.
[0097] Способ
[0098] Восьми самцам крыс Wistar (приблизительно 250 г) инъецировали внутривенно через хвостовую вену 0,25 мл раствора 50 мМ калмангафодипира (серия № 11AK0105B), содержащего приблизительно 10 мМ Mn и 40 мМ Ca, или 0,25 мл 10 мМ мангафодипира (серия № 02090106), содержащего 10 мМ Mn. После инъекции крыс сразу же помещали в метаболические клетки для сбора мочи в течение периода времени 0-24 часов. Для получения фонового содержания марганца (Mn) и цинка (Zn) в моче две дополнительные (контрольные) крысы получали 0,25 мл физиологического раствора, и их помещали в метаболические клетки для сбора мочи в течение аналогичного периода времени. Затем образцы мочи хранили при -80°C до анализа Mn. Перед анализом образцы размораживали и интенсивно перемешивали с получением гомогенных образцов. Из каждого образца отбирали аликвоту пять мл и добавляли 5 мл концентрированной азотной кислоты. Затем образцы обрабатывали в микроволновой печи, а затем разбавляли дистиллированной водой до конечного объема 50 мл. Содержание Mn каждого образца анализировали ICP-MS (масс-спектрометрия с индуктивно-связанной плазмой). Отбирали идентичные образцы калмангафодипира и мангафодипир как образцы, инъецируемые крысам (т. е. 0,25 мл), и впрыскивали в тестовые пробирки. Эти образцы обрабатывали аналогичным образом как образцы мочи и анализировали в них содержание Mn. Результаты представлены в виде общего содержания Mn в моче 0-24 часов (выражены в виде пмоль/кг ± S. E. M.) и в виде процентного содержания (±S. E. M.) от инъецируемой дозы. Статистически значимое отличие между животными, получавшими калмангафодипир и мангафодипир, в отношении выделения марганца в моче определяли с использованием непарного t-критерия Стьюдента. Значение p менее 0,05 считали как статистически значимое отличие.
[0099] Результаты
[0100] Результаты указаны на фиг. 6A, 6B и 6C. Через двадцать четыре часа после в/в инъекции 0,25 мл 10 мМ мангафодипира, содержащего 2,59 пмоль марганца (Mn), в моче выявляли 0,60±0,04 мкмоль Mn (фиг. 6A), соответствующих 23,1±1,4% инъецируемой дозы (после вычитания фонового выделения 0,035 мкмоль, фиг. 6B). Соответствующий показатель после инъекции 0,25 мл 50 мМ калмангафодипира, содержащего 2,52 мкмоль Mn, составлял 1,27±0,07 мкмоль Mn (фиг. 6A), соответствующих 50,5±2,6% инъецируемой дозы (фиг. 6B). Различие между мангафодипиром и калмангафодипиром являлось высокозначимым (p<0,0001). Разница в выделении Mn с мочой более или менее отражалась в разнице выделения цинка (Zn) с мочой, выражаемая в виде повышенного выделения Zn, т. е. вычитали фоновое выделение в течение 24 часов (0,068 мкмоль) (фиг. 6C).
[0101] Заключение
[0102] Таким образом, в эквивалентной дозе Mn калмангафодипир увеличивает вдвое выделение Mn с мочой по сравнению с мангафодипиром. Процентное содержание Mn, выделяемого с мочой в течение 0-24 часов после внутривенной инъекции мангафодипира, очень хорошо согласуется с ранее описанными показателями у крыс (Hustvedt et al., 1997) и людей (Toft et al., 1997). Настоящие результаты демонстрируют, что калмангафодипир выделяет гораздо меньше Mn в условиях in vivo по сравнению с мангафодипиром. Это предоставляет значительные преимущества, которые заключаются в том, что снижается количество свободного Mn, доступного для поглощения головным мозгом и другими органами, и что значительно повышается терапевтический индекс, т. к. больше терапевтического мангафодипира или его дефосфорилированных аналогов, MnDPMP и MnPLED, доступны in vivo. Таким образом, калмангафодипир обеспечивает возможность терапевтического лечения, значительно менее токсичного и гораздо более эффективного, чем лечение мангафодипиром.
[0103] Пример 5
[0104] В этом примере сравнивают цитопротекторный эффект калмангафодипира с цитопротекторным эффектом мангафодипира и MnPLED в отношении миелосупрессивны эффектов оксалиплатина у мышей balb/c.
[0105] Способ
[0106] В первой серии экспериментов 3 группы каждую, состоящую из 5 самок мышей balb/c однократно обрабатывали интраперитонеально оксалиплатином в дозе 7,5, 10,0 и 12,5 мг/кг оксалиплатина соответственно. За одни сутки (фоновый уровень), а также через 3 и 6 суток после обработки оксалиплатином образцов крови с 50 мкл EDTA отбирали из глазничного венозного сплетения с использованием стеклянного капилляра. Образцы крови анализировали с использованием автоматической системы CELL-DYN® Emerald (Abbott Diagnostics) в отношении содержания лейкоцитов (WBC), лимфоцитов (LYM), нейтрофилов (NEU) и тромбоцитов (PLC). Из результатов (фиг. 7A-7D) заключали, что дальнейшие эксперименты тестирования миелопротекторных эффектов калмангафодипира, мангафодипира и MnPLED следует проводить при 12,5 мг/кг оксалиплатина, и что анализы образца клеток крови необходимо проводить за сутки и через 6 суток после введения оксалиплатина у каждой мыши. За тридцать минут до введения оксалиплатина (12,5 мг/кг) и через 24 часа после мыши получали физиологический раствор, калмангафодипир (5 мг/кг, серия № 11AK0105B), мангафодипир (1 и 10 мг/кг, серия № 02090106) или MnPLED (1 мг/кг), внутривенно (5 мышей в каждой группе). Доза 5 мг/кг калмангафодипира содержала аналогичное количество марганца, как доза 1 мг/кг мангафодипира, т. е. 1,3 мкмоль, 1 мг/кг MnPLED содержал немного больше марганца (приблизительно 2 мкмоль). Контрольная группа получала вместо оксалиплатина носитель (5% глюкозы) и физиологический раствор. Результаты представлены на графиках в виде относительных изменений от фонового уровня для различных видов лечения и клеток крови (±S. E. M.). При необходимости определяли статистически значимые отличия между группами посредством непарного t-критерия Стьюдента. Значение p менее 0,05 считали как статистически значимое отличие.
[0107] Результаты
[0108] Результаты указаны на фигурах 8A-8D. В эквивалентной дозе марганца, т. е. 5 мг/кг калмангафодипира, являлись статистически значимо более эффективными, чем 1 мг/кг мангафодипира, для защиты мышей от индуцируемого оксалиплатином снижения общего числа лейкоцитов (WBC) (фиг. 8A). Однократная доза 12,5 мг/кг оксалиплатина вызывала снижение WBC более 80%, тогда как снижение у животных, обрабатываемых калмангафодипиром, составляло только приблизительно 25%. Соответствующее снижение у мышей, обрабатываемых 1 или 10 мг/кг мангафодипира, составляло приблизительно 50%. Эти результаты предположительно также позволяют предположить, что MnDPDP должен подвергаться дефосфорилированию в MnPLED перед тем, как он сможет оказывать миелопротекторное действие, 1 мг/кг MnPLED, такого как калмангафодипир, являлся значительно более эффективным в защите WBC, чем 1 и 10 мг/кг мангафодипира. После обработки оксалиплатином аналогичные снижения наблюдали в лимфоцитах (LYM, фиг. 8B) и в нейтрофилах (NEU, фиг. 8C). Качественно аналогичные результаты также получали, когда анализировали нейтрофилы (NEU) (фиг. 8C). Касательно тромбоцитов (PLC, фиг. 7D и 8D) по сравнению с WBC LYM и NEU различались в чувствительности к оксалиплатину и по отношению к цитотоксическим эффектам тестируемых веществ.
[0109] Заключение
[0110] Калмангафодипир в эквимолярной дозе марганца являлся значительно более эффективным, чем мангафодипир в отношении защиты мышей balb/c против миелосупрессивных эффектов лекарственного средства против злокачественной опухоли оксалиплатина.
[0111] Пример 6
[0112] Цитотоксическая активность калмангафодипира на клетках рака толстого кишечника мыши сравнивали с цитотоксической активностью мангафодипира, фодипира, MnPLED, ZnPLED, ZnDPDP, кальфодипира (CaDPDP), PLED и CaCl2.
[0113] Способ
[0114] Выживаемость клеток измеряли анализом MTT. В кратком изложении 8000 клеток CT26 (клоны карциномы мышей) высевали на лунку в 96-луночный планшет и выращивали в течение ночи в среде RPMI (Roswell Park Memorial Institute) 1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 МЕд/мл пенициллина и 100 мкг/мл стрептомицина при 37°C в увлажненном воздухе с 5% CO2. Затем клетки экспонировали в течение 48 часов 1-1000 мкМ калмангафодипира (серя № 11AK0105B), фодипира (DPDP, серия № RDL02090206), PLED (серия № KER-AO-122(2)), кальфодипира (CaDPDP), мангафодипира (серия № 02090106), MnPLED, ZnPLED, ZnDPMP и CaCl2 при 37°C. Затем оценивали выживаемость клеток, добавляя 5 мг/мл метилтиазолтетразолия (MTT) до конечной концентрации 0,5 мг/мл и инкубируя клетки в течение еще 4 часов при 37°C. Затем синий формазан, который образуется митохондриальными дегидрогеназами жизнеспособных клеток, растворяли в течение ночи при 37°C добавлением 10% SDS и 10 мМ HCl до конечной концентрации 5% SDS и 5 мМ HCl. В заключение оптическую плотность раствора считывали при 570 нм с контролем сравнения при 670 нм на микропланшетном спектрофотометре Spectramax 340 (Molecular Devices, Sunnyvale, CA, USA), соединенном с компьютером Apple Macintosh, с запущенной программой Softmax Pro V1.2.0 (Molecular Devices, Sunnyvale, CA, USA).
[0115]Результаты
[0116] Цитотоксическая активность фодипира, PLED, кальфодипира или калмангафодипира являлась приблизительно в 20 раз больше цитотоксической активности мангафодипира (фиг. 9A и 9B). MnPLED являлся практически в 10 раз более эффективным, чем мангафодипир в отношении своей способности вызывать гибель злокачественных клеток CT26 (фиг. 9A). Ни ZnDPDP, ZnPLED, ни CaCl2 совсем не проявлял какой-либо цитотоксической активности при используемых концентрациях (фиг. 9A и 9B).
[0117] Заключение
[0118] Когда сравнивали калмангафодипир и мангафодипир, выявляли, что калмангафодипир является приблизительно в 20 раз более эффективным, чем мангафодипир в отношении цитолиза злокачественных клеток CT26. Диссоциация марганца до некоторой степени из фодипира, вероятно, о цитотоксическую эффективность мангафодипира в отношении объясняет злокачественную опухоль. Калмангафодипир, как определено в примерах 1 и 3, при эквимолярных концентрациях марганца с другой стороны является таким же эффективным, как один фодипир, т. е. цитотоксическая эффективность калмангафодипира является гораздо выше, чем цитотоксическая эффективность мангафодипира при эквимолярных концентрациях марганца. Эти открытия подтверждают два важных свойства. Во-первых, дефосфорилированный PLED, вероятно, является таким же эффективным, как его фосфорилированный аналог фодипир в отношении своей способности вызывать гибель злокачественных клеток, и, во-вторых, более низкая стабильность MnPLED по сравнению со стабильностью мангафодипира (Rocklage et al., 1989), вероятно, объясняет более высокую эффективность MnPLED. Отсутствие какой-либо цитотоксической активности ZnDPDP и ZnPLED предположительно обусловлено в 1000 раз более высокой стабильностью этих комплексных соединений по сравнению с марганцевыми аналогами (Rocklage et al., 1989).
[0119] Пример 7
[0120] В этом примере сравнивают противоопухолевую активность оксалиплатина на модели на мышах, несущих рак толстого кишечника (CT26) мышей, в присутствии и в отсутствие калмангафодипира.
[0121] Способ
[0122] Клетки CT26 выращивали в 75 см2 флаконах для культивирования в среде RPMI (Roswell Park Memorial Institute) 1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 МЕд/мл пенициллина и 100 мкг/мл стрептомицина, при 37°C в увлажненном воздухе с 5% CO2. Когда клетки достигали ~50% конфлуэнтности, их собирали посредством трипсинизации. В кратком изложении клетки отмывали физиологическим раствором на основе фосфатов (PBS) (pH 7,3) и подвергали воздействию 0,05% трипсина/0,53 мМ ЭДТА при 37°C в течение ~5 минут. Трипсинизацию останавливали добавлением среды RPMI1640 для культивирования. Подсчитывали клетки и центрифугировали при 200×g в течение 5 минут. Затем их отмывали в PBS, снова центрифугировали и ресуспендировали в PBS в концентрации 2×106/350 мкл для инъекции мышам. Использовали самок мышей balb/c в возрасте от 6 до 8 недель, как описано Laurent et al., 2005. В кратком изложении каждой мыши подкожно инъецировали в загривок 2×106 клеток CT26 на сутки 0. Через 7 суток (сутки 7), когда опухоль являлась детектируемой, определяли размер опухоли с использованием штангенциркуля и разделяли мышей на группы (5 в каждой группе) таким образом, чтобы размер опухоли статистически значимо не отличался между группами. Инъецировали оксалиплатин ± калмангафодипир (серия № 11AK0105B), и одна группа мышей получала только обработку носителем (0,9% физиологический раствор + 5% глюкозы). В первой серии экспериментов мышам инъецировали в/в физиологический раствор или 50 мг/кг калмангафодипира за 30 минут до и/п введения 20 мг/кг оксалиплатина (разбавленного в 5% глюкозе) или 5% глюкозы. Кроме того, эти мыши получали физиологический раствор или 50 мг/кг калмангафодипира через 24 часа (сутки 8). В другой серии экспериментов мышам инъецировали в/в физиологический раствор или 5 мг/кг калмангафодипира за 30 минут до 10 мг/кг оксалиплатина (разбавленного в 5% глюкозе) или 5% глюкозы и физиологический раствор или 5 мг/кг калмангафодипира через 24 часа (сутки 8). Мышей умерщвляли на сутки 10 и вырезали опухоли и определяли сырую массу. При необходимости определяли статистически значимые отличия между группами обработки посредством непарного t-критерия Стьюдента. Значение p менее 0,05 считали как статистически значимое отличие.
[0123] Результаты
[0124] Результаты указаны на фиг. 10A и 10B. В первой серии эксперимента мыши получали 20 мг/кг оксалиплатина, что является близким к максимальной переносимой дозе. Однократная обработка оксалиплатином приводила к статистически значимому и более 50% снижению массы опухоли. Обработка калмангафодипиром (50 мг/кг) в высокой дозе не оказывала какого-либо отрицательного влияния на противоопухолевый эффект оксалиплатина (фиг. 10A). Однако во второй серии экспериментов, в которых использовали 10 мг/кг оксалиплатин, обработка относительно низкой дозой калмангафодипира (5 мг/кг) приводила к статистически значимому лучшему противоопухолевому эффекту (фиг. 10B); комбинированное действие 10 мг/кг оксалиплатина плюс 5 мг/кг калмангафодипира являлось практически таким же эффективным, как 20 мг/кг одного оксалиплатина.
[0125] Заключение
[0126] Калмангафодипир не оказывал отрицательного влияния на противоопухолевую активность оксалиплатина, а наоборот, при относительно низкой дозе оксалиплатина (10 мг/кг) калмангафодипир фактически повышал противоопухолевую эффективность.
[0127] Пример 8
[0128] В этом примере сравнивают уровни марганца после повторных внутривенных инъекций калмангафодипира и мангафодипира (39 раз в течение 33 недель) в головном мозге, поджелудочной железе и печени крыс.
[0129] Способ
[0130] Самцам и самкам крыс Wistar внутривенно инъецировали 0,9% NaCl, 72,0 мкмоль/кг мангафодипира (серия № 02090106, соответствующих 72 мкмоль/кг марганца) или 374,4 мкмоль/кг калмангафодипира (серия № 11AK0105B, соответствующее 72 пмоль/кг марганца) 3 раза в неделю в течение 13 недель (каждая группа обработки состояла из 9 самцов + 9 самок). Каждая доза калмангафодипира соответствовала приблизительно в 36 раз больше принятой клинической дозы (ACD). После периода введения в течение 13 недель крыс умерщвляли и вырезали головной мозг и поджелудочную железу и хранили приблизительно 0,5 г образцов замороженными до анализа Mn. Содержание Mn каждого образца анализировали посредством ICP-MS. Результаты выражают в виде мкг/г сырой массы ± S. E. M. Статистически значимое отличие между группой мангафодипира и группой калмангафодипира в отношении содержания Mn определяли посредством парного t-критерия Стьюдента. Значение p менее 0,05 считали как статистически значимое отличие.
[0131] Результаты
[0132] Результаты указаны на фиг. 11A-С. Содержание Mn в головном мозге у обрабатываемых NaCl контрольных крыс, обрабатываемых мангафодипиром крыс и обрабатываемых калмангафодипиром крыс, составляло 0,38±0,01, 0,99±0,02 и 0,74±0,01 мкг/г сырой массы соответственно. Соответствующее содержание Mn в поджелудочной железе составляло 1,66±0,06, 5,54±0,45 и 3,35±0,19 мкмоль/кг соответственно. Хотя содержание Mn в печени являлось статистически значимо повышенным в группе мангафодипира (фиг. 11C), относительное повышение являлось гораздо меньшим, чем повышение, наблюдаемое в головном мозге и поджелудочной железе.
[0133] Заключение
[0134] Введение высокой суммарной дозы калмангафодипира крысам приводит к значительному снижению удерживания марганца в головном мозге и поджелудочной железе по сравнению с мангафодипиром (суммарная доза в обоих случаях соответствовала приблизительно 2800 мкмоль/кг марганца). Эти результаты демонстрируют улучшенный токсикологический профиль калмангафодипира по сравнению с токсикологическим профилем мангафодипира.
[0135] Пример 9
[0136] Этот пример демонстрирует цитопротекторный эффект калмангафодипира по отношению к миелосупрессивному эффекту карбоплатина у мышей balb/c.
[0137] Способ
[0138] В первой серии экспериментов 3 группы каждую, состоящую из 5 самок мышей balb/c, однократно обрабатывали интраперитонеально карбоплатином в дозе 75, 100 и 125 мг/кг карбоплатина соответственно. За одни сутки (фоновый уровень), а также через 3 и 6 суток после обработки карбоплатином отбирали образцы крови с 50 мкл EDTA из глазничного венозного сплетения с использованием стеклянного капилляра. Образцы крови анализировали с использованием автоматической системы CELL-DYN® Emerald (Abbott Diagnostics) в отношении содержания лейкоцитов (WBC), лимфоцитов (LYM), нейтрофилов (NEU) и тромбоцитов (PLC). На основании результатов (фиг. 12A-12D) заключали, что дальнейшие эксперименты по тестированию миелопротекторного эффекта калмангафодипира следует проводить при 125 мг/кг карбоплатина, и что в случае WBC, NEU и LYM анализ образцов клеток крови следует проводить за сутки и через 3 суток после введения карбоплатина, и в случае PLC анализ образцов клеток крови следует проводить за сутки и через 6 суток после введения карбоплатина. За тридцать минут до введения карбоплатина (125 мг/кг) и через 24 часов после введения мыши получали физиологический раствор или калмангафодипир (1, 3, 10 или 30 мг/кг, серия № 11AK0105B). Контрольная группа получала носитель (физиологический раствор) и физиологический раствор вместо карбоплатина. Результаты представлены на графиках в виде относительных изменений от фонового уровня для различных видов обработки (среднее значение ± S. E. M.). При необходимости определяли статистически значимое отличие между группами обработки посредством непарного t-критерия Стьюдента. Значение p менее 0,05 считали как статистически значимое отличие.
[0139] Результаты
[0140] Результаты указаны на фиг. 13A-13D. Карбоплатин (125 мг/кг) вызывал приблизительно 50% снижение WBC, а также NEU и LYM. Обработка калмангафодипиром в дозе 3 мг/кг устраняла эти снижения. Для эффекта дозы в каждом случае калмангафодипира выявляли куполообразный вид аналогичным образом, как описано ранее для мангафодипира в отношении его кардиопротекторного эффекта в отношении доксорубицина у мышей CD (Kurz et al., Transl. Oncol. 2012, 5:252-259).
[0141] Касательно тромбоцитов (PLC, фиг. 12D и 13D) по сравнению с WBC, LYM и NEU они отличались по чувствительности по отношению к карбоплатину.
[0142] Заключение
[0143] Калмангафодипир в значительной степени защищает мышей balb/c от миелосупрессивных эффектов лекарственного средства против злокачественных опухолей карбоплатина.
[0144] Пример 10
[0145] В этом примере сравнивают противоопухолевую активность оксалиплатина на иммунокомпетентных мышах balb/c, несущих рак толстого кишечника (CT26), и иммунодефицитных бестимусных мышах balb/c (nu/nu) несущих рак толстого кишечника (CT26), в присутствии и в отсутствие калмангафодипира.
[0146] Способ
[0147] Клетки CT26 выращивали в 75 см2 флаконах для культивирования в среде RPMI1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 МЕд/мл пенициллина и 100 мкг/мл стрептомицина при 37°C в увлажненном воздухе с 5% CO2. Когда клетки достигали ~50% конфлуэнтности, их собирали посредством трипсинизации. В кратком изложении клетки отмывали с PBS (pH 7,3) и подвергали воздействию 0,05% трипсина/0,53 мМ EDTA при 37°C в течение ~5 минут. Трипсинизацию останавливали добавлением среды для культивирования RPMI 1640. Подсчитывали клетки и центрифугировали при 200×g в течение 5 минут. Затем их отмывали в PBS, снова центрифугировали и ресуспендировали в PBS при концентрации 2×106/350 мкл для инъекции мышам. Использовали самок иммунокомпетентных мышей balb/c (balb/c) и самок иммунонекомпетентных бестимусных мышей balb/c (blab/c nu/nu) в возрасте от 6 до 8 недель, как описано Laurent et al., 2005. В кратком изложении каждой мыши в загривок подкожно инъецировали 2×106 клеток CT26 на сутки 0. Через 7 суток (сутки 7), когда опухоли являлись детектируемыми, определяли размер опухоли с использованием штангенциркуля и разделяли мышей на группы (5 в каждой группе) таким образом, чтобы размеры опухолей статистически значимо не отличались между группами. Группам мышей (5 в каждой группе, как проиллюстрировано на фиг. 14) инъецировали в/в физиологический раствор или 5 мг/кг калмангафодипира (серия № 11AK0105B) за 30 минут до и/п введения 10 мг/кг оксалиплатина (разбавленного 5% глюкозой) или 5% глюкозы. Кроме того мыши получали физиологический раствор или 5 мг/кг калмангафодипира через 24 часа (сутки 8). Мышей умерщвляли на сутки 10 и вырезали опухоли и определяли сырую массу. Результаты представлены на графике для различных видов обработки (среднее значение ± S. E. M.). При необходимости определяли статистически значимые отличия между группами обработки посредством непарного t-критерия Стьюдента. Значение p менее 0,05 считали как статистически значимое отличие.
[0148] Результаты
[0149] Результаты указаны на фиг. 14. Наблюдали явную тенденцию, что опухоли росли больше у иммунодефицитных мышей balb/c по сравнению с иммунокомпетентными мышами balb/c nu/nu, но это отличие не достигало статистической значимости (p=0,0870). Однократная обработка 10 мг/кг оксалиплатина приводила к статистически незначительному от 20 до 30% уменьшению массы опухоли у иммунокомпетентных и иммунодефицитных мышей balb/c. Обработка 5 мг/кг калмангафодипира не оказывала какого-либо отрицательного влияния на противоопухолевый эффект оксалиплатина у иммунокомпетентных или иммунонекомпетентных мышей. Средняя масса опухоли фактически статистически значимо снижалась у иммунокомпетентных мышей, обрабатываемых 5 мг/кг калмангафодипира, по сравнению с контролями. Однако такого снижения не наблюдали у иммунодефицитных мышей.
[0150] Заключение
[0151] Калмангафодипир не оказывал отрицательного влияния на противоопухолевую активность оксалиплатина у иммунокомпетентных или иммунодефицитных мышей, но только у иммунокомпетентных мышей наблюдали, что калмангафодипир фактически повышает противоопухолевую эффективность.
[0152] Пример 11
[0153] Цитотоксическую активность калмангафодипира по отношению к клеткам U1810 немелкоклеточного рака легких (NSCLC) человека и клеткам немелкоклеточного рака легких (LLC1) мышей сравнивали с цитотоксической активностью мангафодипира.
[0154] Способы
[0155] Выживаемость клеток измеряли анализом MTT. В кратком изложении 8000 клеток в лунку U1810 NSCLC человека или LLC1 NSCLC высевали на 96-луночный планшет и выращивали в течение ночи в среде RPMI (Roswell Park Memorial Institute) 1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 МЕд/мл пенициллина и 100 мкг/мл стрептомицина при 37°C в увлажненном воздухе с 5% CO2. Затем экспонировали в течение 48 часов 1-1000 мкМ калмангафодипиром (серия № 11AK0105B) или мангафодипиром (серия № 02090106). Затем оценивали выживаемость клеток, добавляя 5 мг/мл метилтиазолтетразолия (MTT) до конечной концентрации 0,5 мг/мл и инкубируя клетки в течение еще 4 часов при 37°C. Затем синий формазан, который образуется митохондриальными дегидрогеназами жизнеспособных клеток, растворяли в течение ночи при 37°C добавлением 10% SDS и 10 мМ HCl до конечной концентрации 5% SDS и 5 мМ HCl. В заключение считывали оптическую плотность раствора при 570 нм с контролем сравнения при 670 нм на микропланшетном спектрофотометре Spectramax 340 (Molecular Devices, Sunnyvale, CA, USA), соединенном с компьютером Apple Macintosh с запущенной программой Softmax Pro V1.2.0 (Molecular Devices, Sunnyvale, CA, USA). Выживаемость клеток U1810 или LLC1 в присутствии увеличивающихся концентраций калмангафодипира или мангафодипира представлена в виде кривых концентрация-эффект (среднее значение ± S. D.). Индивидуальные кривые подбирали к логистическому уравнению сигмоидальной кривой ответа с переменным наклоном (Graphpad Prism, version 5.02). На основании этого анализа рассчитывали концентрации, вызывающие 50% ингибирование (IC50) тестируемых веществ.
[0156] Результаты
[0157] Цитотоксическая активность калмангафодипира и мангафодипира по отношению к клеткам NSCLC U1810 и LLC1 представлена на фиг. 15A и 15B. Рассчитываемое отношение IC50 мангафодипира к калмангафодипиру (0,0006329/0,00002274) демонстрировало, что калмангафодипир являлся приблизительно в 28 раз более эффективным, чем мангафодипир в отношении гибели клеток U1810 (фиг. 15A). Хотя калмангафодипир являлся значительно более эффективным, чем мангафодипир в отношении гибели клеток LLC1 вследствие неоднозначного вида кривой мангафодипира (фиг. 15B), рассчитывать отношение IC50 мангафодипира к калмангафодипиру не имело смысла.
[0158] Заключения
[0159] Результаты демонстрируют превосходную эффективность калмангафодипира по сравнению с мангафодипиром в отношении гибели клеток U1810 и LLC1 немелкоклеточного рака легких.
[0160] Примеры и конкретные варианты осуществления, указанные в настоящем описании, по своей природе являются только иллюстративными, и их не следует рассматривать как ограничивающие объем изобретения, определяемый следующей ниже формулой изобретения. Дополнительные конкретные варианты осуществления и преимущества настоящего изобретения станут понятны из настоящего описания и входят в объем описываемого в заявке изобретения.
Реферат
Изобретение относится к фармацевтической композиции для лечения патологического состояния у пациента, обусловленного наличием образуемых из кислорода свободных радикалов. Фармацевтическая композиция образована путем объединения смешанного комплексного соединения с металлами соединения формулы I или его соли, с одним или более физиологически приемлемыми эксципиентами, где по меньшей мере один эксципиент выбран из группы, состоящей из стабилизаторов, антиоксидантов, средств регуляции осмоляльности, буферов, средств регуляции pH, связывающих средств и наполнителей, где смешанные металлы включают кальций и марганец. В формуле I: X представляет собой CH, каждый R1 независимо представляет собой -CH2COR5, R5 представляет собой гидрокси, каждый R2 независимо представляет собой ZYR6, где Z представляет собой связь или C1-3алкиленовую группу, Y представляет собой связь, R6 представляет собой OR8 или OP(O)(OR8)R7, R7 представляет собой гидрокси или незамещенную алкильную или аминоалкильную группу, R8 представляет собой водород или C1-6алкильную группу, R3 представляет собой незамещенную C1-8алкиленовую группу, и каждый R4 независимо представляет собой C1-3алкил. Также предложен способ лечения патологического состояния у пациента, обусловленного наличием образуемых из кислорода свободных радикалов, включающий введение пациенту вышеуказанного смешанного комплексного соединения. Предложенная композиция обеспечивает лечение патологического состояния, обусловленного наличием образуемых из кислорода свободных радикалов. 2 н. и 28 з.п. ф-лы, 35 ил., 11 пр.
Формула I

Формула
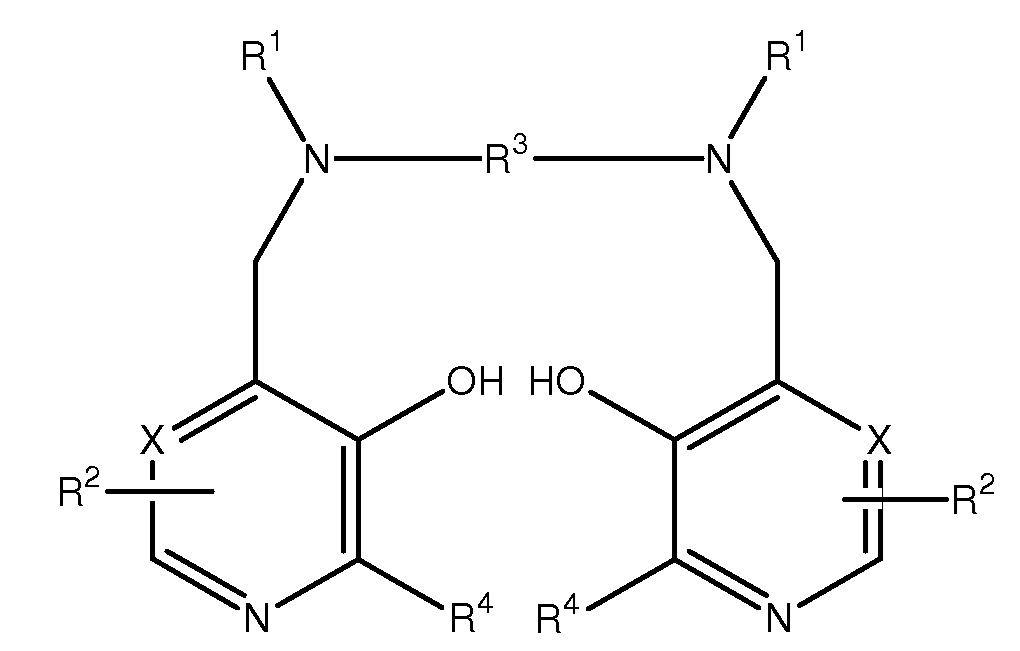
Документы, цитированные в отчёте о поиске
Фармацевтическая композиция и способ предупреждения, подавления или лечения заболевания, ассоциированного с присутствием свободных радикалов

Комментарии