Бициклические тетрагидротиазепиновые производные, полезные для лечения неопластических и/или инфекционных заболеваний - RU2730524C2
Код документа: RU2730524C2
Описание
Настоящее изобретение относится к бициклическим тетрагидротиазиновым производным. Изобретение также относится к фармацевтическим композициям, содержащим такие соединения, а также к их применению в качестве лекарственных средств, особенно в способах лечения или профилактики неопластических и/или инфекционных заболеваний и in vitro способах.
Сегодня злокачественная неоплазия (рак) и инфекционные заболевания являются двумя основными причинами смерти во всем мире. Во все большем числе случаев известно, что между неопластическими и инфекционными заболеваниями часто имеет взаимозависимость, такая как, например, между неоплазией шейки матки и вирусными инфекциями простого герпеса. Хотя было обнаружено большое количество соединений для лечения и профилактики этих заболеваний, хорошо известно, что такие соединения имеют существенные недостатки, такие как возникновение серьезных побочных эффектов. Поэтому до сих пор имеется потребность в новых соединениях для лечения и профилактики неопластических и/или инфекционных заболеваний.
Чтобы преодолеть эти недостатки, терапевтические и профилактические подходы, основанные на модуляции иммунного ответа пациента, приобретают все большее значение в современной медицине. Таким образом, иммунологическая активность пациента часто поддерживается лекарственным лечением. На практике в этом контексте особый интерес представляют иммунологические терапии против неопластических и инфекционных заболеваний. В этом отношении хорошо известно, что в организме несколько типов иммунных клеток, такие как, например, природные клетки-киллеры (NK), Т-клетки, В-клетки, дендритные клетки, моноциты и макрофаги, часто вовлечены в инактивацию и удаление патогенов. Что касается неоплазии, например, известно, что каждое созревшее новообразование (опухоль) несет специфические антигены и/или нео-антигены (например, Sensi and Anichini, 2006, Clin Cancer Res. 12:5023-5032). Это может в общем инициировать адаптивную иммунную систему (например, Т-клетки и/или В-клетки), а также врожденную иммунную систему (например, природные клетки-киллеры (NK)). Иммунная система в здоровом организме в основном достаточно эффективна для предотвращения или излечения указанного организма от неопластических и инфекционных заболеваний.
В некоторых случаях иммунная система, однако, не устраняет такие неопластические или инфекционные заболевания, и такое заболевание становится хроническим. В этих случаях, особенно когда пациент страдает от злокачественной неоплазии (рака), иммунная система часто подавляется. Принимая во внимание, что в здоровом организме (то есть при неподавленной иммунной среде) обнаруживается подходящая экспрессия главного комплекса гистосовместимости I (МНС I), представляющая антигены иммунным клеткам, например, цитотоксические CD8 Т-клетки, экспрессия МНС I снижается в опухолевых клетках. Этому можно противодействовать NK-клетками, в частности, распознающими и разрушающими клетки с уменьшенной экспрессией МНС-I на поверхности. Однако во время созревания новообразований (в частности, прогрессирования опухоли) из-за множества иммуноподавляющих механизмов, ведущих к иммунной толерантности, созревающие новообразования могут вес больше выходить за пределы иммунной системы, т.е. неопластический антиген не распознается как чужое, а иммунная система не активируется.
Этот механизм является общим принципом созревания новообразований и не ограничивается конкретными новообразованиями и не зависит от конкретных неопластических антигенов. Примечательно, что было обнаружено, что у большинства больных раком пациентов связанные с раком Т-клетки и NK-клетки существуют, но не продуцируют достаточное количество ряда цитокинов (таких как, например, IL-2 и IFN-γ) или не проявляют цитотоксическую активность в отношении опухоли, поскольку подавление различными механизмами препятствует эффективным противоопухолевым иммунным ответам (De Paola et al., 2003, British Journal of Cancer 88:320-326; Ahmadzadeh et al, 2009, Blood 114:1537-1544, in particular pages 1541-1542, section "PD-1+ TILs display an impaired effector function"). Это, очевидно, также является одной из причин, по которым вакцинация опухолей часто является неудачной.
Подобным образом, многочисленные инфекции, как известно, снижают иммунную систему пациента, в частности вирусные инфекции, такие как, например, инфекции вируса иммунодефицита человека (ВИЧ) или инфекции вируса простого герпеса (HSV). Также в этом контексте продуцирование цитокинов Т-клетками и другими противовирусными иммунными клетками нарушается.
Говоря в общем, ряд цитокинов, как хорошо известно, способствует стимуляции иммунной системы и, очевидно, играет важную роль в активации иммунного ответа. Такая секреция цитокинов играет важную роль в запуске иммунных реакций на опухолевые и/или инфекционные патогены, особенно в отношении рака и/или вирусных инфекций.
Соответственно, предполагают дополнительно вводить пациентам, страдающим неоплазией или инфекционными заболеваниями, один или более цитокинов, чтобы систематически увеличивать соответствующие уровни цитокинов и тем самым повышать и стимулировать иммунную систему в организме пациента. В этом контексте были рассмотрены, в частности, цитокины интерлейкин 2 (IL-2), интерферон-гамма (IFN-γ) и начальный фактор некроза опухолей альфа (TNF-α).
IL-2 является фактором эффективного иммунного ответа в организме человека, поскольку он опосредует, с одной стороны, пролиферацию и поддержание CD4-хелпера и CD8-киллерных Т-клеток (CD4+ и CD8+Т-клеток)), а с другой стороны поддерживает и активирует NK клеток (Parmiani et al., 2000, Immunology Letters 74: 41-44). Из-за его высокой биоактивности в физиологическом контексте организма продуцирование IL-2 строго контролируется и тесно связано с антиген-активацией Т-клеток через рецептор Т-клеток. Таким образом, организм предотвращает аутоиммунные эффекты чрезмерного системного продуцирования IL-2. Поскольку IL-2 представляет собой высокоактивный противопатогенный (например, противоопухолевый) агент, системное введение IL-2 было использовано в качестве терапевтического средства для лечения неоплазии у пациента (Rosenberg, 2005, Annals of Surgical Oncology 12(5):1-3). IFN-γ был определен как еще один ключевой фактор противоопухолевого иммунитета. Мыши с дефицитом продуцирования IFN-γ страдают от увеличения числа опухолей. IFN-γ использует несколько механизмов для усиления противоопухолевого иммунитета. Он увеличивает экспрессию MHC-I опухолевых клеток, которая, как указано выше, часто необычайно низка, и это вызывает экспрессию нескольких рецепторов, которые повышают чувствительность к апоптозу, опосредованному иммунными клетками (Schroder et al., 2004, Journal of Leukocyte Biology 75:163-189, in particular page 165, left column, last paragraph, and pages 170ff, section "Cellular Effects of IFN-γ").
Однако системное введение цитокинов имеет ряд существенных недостатков. Во-первых, повышенные уровни цитокинов часто вызывают серьезные нежелательные побочные эффекты. Например, системное введение IL-2 может даже вызвать опасные для жизни побочные эффекты, связанные пропотеванием жидкости через сосуды, поскольку IL-2 нацеливается на все Т и NK клетки пациента, а не селективно на те, которые участвуют в местных противопатогенных реакциях (например, противоопухолевых). То же самое относится к введению TNF-α, который также хорошо известен как опасный для жизни при дозе выше определенного диапазона доз. Аналогичным образом, также введение IFN-γ имеет серьезные недостатки из-за его системной активности. Во-вторых, цитокины, такие как IL-2, IFN-γ и TNF-α, являются сравнительно дорогостоящими. И, в-третьих, такие цитокины имеют неблагоприятные фармакокинетические и фармакологические свойства.
Соответственно, необходимы стратегии увеличения уровней цитокинов без необходимости их системного введения. Например, терапевтические вмешательства для усиления продуцирования IL-2 и IFN-γ активированных Т-клеток, например, блокадой передачи сигналов CTLA4, рассматривалось в качестве противораковой терапии. Например, CTLA4-блокада может вызвать полную ремиссию у пациентов, страдающих метастатической меланомой поздней стадии, широко прогрессирующей неоплазией. Показано, что клиническое преимущество такого лечения коррелирует с усиленными ответами Т-клеток, в частности, с продуцированием IFN-γ и TNF-α CD8 и CD4-Т-клетками (Yuan et al., 2008, PNAS 105(51):20410-20415, in particular pages 20411-20412, section "Evaluation of NY-ESO-1 Specific T Cell Response").
С учетом вышесказанного очевидно, что цитокины, такие как IL-2, IFN-γ и TNF-α, являются хорошо установленными маркерами для иммунореактивности, коррелирующей с клиническим исходом иммунной терапии. Кроме того, также очевидно, что локальное или системное повышение уровня одного или более таких цитокинов также активирует иммунные клетки врожденной и адаптивной иммунной системы, такие как, например, Т-клетки и/или NK-клетки, подвергнутые такому повышенному уровню цитокинов.
Подобным образом, известно также множество других маркеров, которые коррелируют с иммунологической активностью, подходящей в этом контексте, например, уровнем экспрессии CD40-лиганда (CD40L, также известный как CD154), а также скоростями пролиферации иммунных клеток, таких как Т-клетки, NK-клетки, В-клетки и/или моноциты. Более подробно экспрессия CD40L на поверхности является хорошо известным маркером активности Т-клеток. CD40L связывается с рецептором CD40, который интенсивно экспрессируется на В-клетках и профессиональных антигенпредставляющих клетках (Ма and Clark, 2009, Semin Immunol. 21(5):265-272, in particular page 2, forth paragraph, and pages 8-10). Цитирование рецептора CD40 приводит к внутриклеточной передаче активирующих сигналов в этих клетках. Для В-клеток эффективное лигирование рецептора CD40 является основным фактором для выживаемости, пролиферации и переключения В клеток, которые необходимы для развития и поддержания защитного гуморального иммунитета (van Kooten and Banchereau, 2000, Journal of Leukocyte Biology 67:2-17, в частности реферат). Для дендритных клеток лигирование рецептора CD40 приводит к усиленной активации дендритных клеток, которые, в свою очередь, регулируют ко-стимулирующие поверхностные молекулы (например, семейства В7), что приводит к более сильной и более устойчивой активации Т-клеток. Более того, лигирование CD40 на дендритных клетках также важно для секреции цитокинов, централизованно участвующих в противоопухолевом иммунитете, таких как интерлейкин 12 (IL-12) (Gladue et al., 2011, Cancer Immunol Immunother. 60:1009-1017, в частности, и стр. 1010 и 1016, в каждом случае левая колонка).
Очевидно, что соединения, приводящие к увеличению таких маркеров иммунологической активности, в частности вышеуказанных цитокинов (например, IL-2, IFN-γ и/или TNF-α), способны повышать иммунологическую активность и являются, таким образом, подходящими в качестве соединений для эффективного лечения неопластических и/или инфекционных заболеваний.
В настоящее время все еще сохраняется потребность в таких соединениях, позволяющих повысить иммунологическую активность и тем самым способствующих лечению и/или профилактике неопластических и/или инфекционных заболеваний.
Представляющим интерес классом соединений являются 2,3,4,5-тетрагидро-1,5-бензотиазепиновын производные. Такие соединения известны в данной области.
В WO 2003/031376 А1 описывается такой твердофазный синтез 1,5-бензодиазепин-2-она и 1,5-бензотиазепин-4-онов.
В Е. Ayral et al., Bioorganic & Medicinal Chemistry Letters 19 (2009) 1386-1391 описываются 1,5-бензотиазепин-4-оновые производные, нацеленные на VIIa/тканевый фактор.
В T.F. Herpin et al., Methods in enzymology 369 (2003) 75-98 и Tetrahedron Letters 41 (2000), 3029-3033, раскрываются 1,5-бензотиазепин-4-оновые производные в качестве примеров направленного подхода сортировки для синтеза больших комбинаторных библиотек.
В WO 2014/125444 А1 раскрываются гетероциклические амиды в качестве киназных ингибиторов. В WO 98/35941 А1 раскрываются производные бензолактама и медицинские композиции, содержащие их.
В ЕР 0433683 А2 описывается применение бензотиазепинов в качестве кандидатов для противораковых лекарственных средств.
Однако вышеупомянутый тип соединений не описан для лечения и/или профилактики неопластических и/или инфекционных заболеваний.
Таким образом, задачей настоящего изобретения является обеспечение новых бициклических тетрагидротиазепиновых соединений, которые могут быть использованы, как описано выше.
Эта задача решается посредством соединений формулы (I)
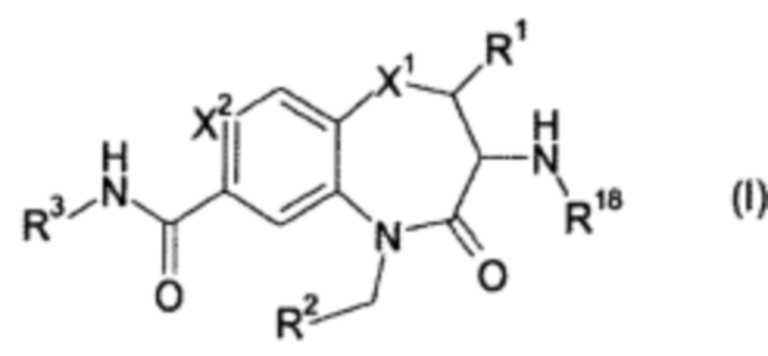
или их фармацевтически приемлемых солей, где
X1 представляет собой S; S(O); или S(O)2;
X2 представляет собой N; или C(R4);
R1 представляет собой Н; или метил;
R2 представляет собой фенил; 3-7 членный гетероциклил; или 7-11 членный гетеробициклил, где R2 необязательно замещен одним или более R5, которые являются одинаковыми или разными;
R5 представляет собой галоген; CN; C(O)OR6; OR6; C(O)R6; C(O)N(R6R6a); S(O)2N(R6R6a); S(O)N(R6R6a); S(O)2R6; S(O)R6; N(R6)S(O)2N(R6aR6b); SR6; N(R6R6a); OC(O)R6; N(R6)C(O)R6a; N(R6)S(O)2R6a; N(R6)S(O)R6a; N(R6)C(O)OR6a; N(R6)C(O)N(R6aR6b); OC(O)N(R6R6a); оксо (=O), где кольцо является по меньшей мере частично насыщенным; Т1; C1-6 алкил; С2-6 алкенил; или С2-6 алкинил, где C1-6 алкил; С2-6 алкенил; и С2-6 алкинил необязательно замещены одним или более галогенами, которые являются одинаковыми или разными;
R6, R6a, R6b независимо выбирают из группы, состоящей из Н; C1-6 алкила, С2-6 алкенила; и С2-6 алкинила, где C1-6 алкил; С2-6 алкенил; и С2-6 алкинил необязательно замещены одним или более галогенами, которые являются одинаковыми или разными;
Т1 представляет собой фенил; С3-7 циклоалкил; или 3-7 членный гетероциклил, где Т1 необязательно замещен одним или более R7, которые являются одинаковыми или разными;
R7 представляет собой галоген; CN; C(O)OR8; OR8; C(O)R8; C(O)N(R8R8a); S(O)2N(R8R8a); S(O)N(R8R8a); S(O)2R8; S(O)R8; N(R8)S(O)2N(R8aR8b); SR8; N(R8R8a); OC(O)R8; N(R8)C(O)R8a; N(R8)S(O)2R8a; N(R8)S(O)R8a; N(R8)C(O)OR8a; N(R8)C(O)N(R8aR8b); OC(O)N(R8R8a); оксо (=O), где кольцо является по меньшей мере частично насыщенным; С1-6 алкил; С2-6 алкенил; или С2-6 алкинил, где C1-6 алкил; С2-6 алкенил; и С2-6 алкинил необязательно замещены одним или более галогенами, которые являются одинаковыми или разными;
R8, R8a, R8b независимо выбирают из группы, состоящей из Н; C1-6 алкила; С2-6 алкенила; и С2-6 алкинила, где C1-6 алкил; С2-6 алкенил; и С2-6 алкинил необязательно замещены одним или более галогенами, которые являются одинаковыми или разными;
R3 представляет собой R3a; OR3a; NHR3a; или NHC(O)R3a;
R3a представляет собой Т2; С1-12 алкил; С2-12 алкенил; или С2-12 алкинил, где С1-12 алкил; С2-12 алкенил; и С2-12 алкинил необязательно замещены одним или более R9, которые являются одинаковыми или разными;
R9 представляет собой галоген; CN; C(O)OR10; OR10; C(O)R10; C(O)N(R10R10a); S(O)2N(R10R10a); S(O)N(R10R10a); S(O)2R10; S(O)R10; N(R10)S(O)2N(R10aR10b); SR10; N(R10R10a); OC(O)R10; N(R10)C(O)R10a; N(R10)S(O)2R10a; N(R10)S(O)R10a; N(R10)C(O)N(R10aR10b); N(R10)C(O)OR10a; OC(O)N(R10R10a); T2; C1-12 алкил; C2-12 алкенил; или C2-12 алкинил, где C1-12 алкил; C2-12 алкенил; и С2-12 алкинил необязательно замещены одним или более R11, которые являются одинаковыми или разными;
R10, R10a, R10b независимо выбирают из группы, состоящей из Н; Т2; С1-12 алкила; С2-12 алкенила; и С2-12 алкинила, где С1-12 алкил; С2-12 алкенил; и С2-12 алкинил необязательно замещены одним или более R11, которые являются одинаковыми или разными;
Т2 представляет собой фенил; С3-7 циклоалкил; 3-7 членный гетероциклил; или 7-11 членный гетеробициклил, где Т2 необязательно замещен одним или более R12, которые являются одинаковыми или разными;
R12 представляет собой галоген; CN; C(O)OR13; OR13; C(O)R13; C(O)N(R13R13a); S(O)2N(R13R13a); S(O)N(R13R13a); S(O)2R13; S(O)R13; N(R13)S(O)2N(R13aR13b); SR13; N(R13R13a); OC(O)R13; N(R13)C(O)R13a; N(R13)S(O)2R13a; N(R13)S(O)R13a; N(R13)C(O)OR13a; N(R13)C(O)N(R13aR13b); OC(O)N(R13R13a); оксо (=O), где кольцо является по меньшей мере частично насыщенным; Т3; С1-6 алкил; С2-6 алкенил; или С2-6 алкинил, где С1-6, алкил; С2-6 алкенил; и С2-6 алкинил необязательно замещены одним или более R14, которые являются одинаковыми или разными;
R13, R13a, R13b независимо выбирают из группы, состоящей из Н; С1-6, алкил; С2-6 алкенил; и С2-6 алкинил, где С1-6, алкил; С2-6 алкенил; и С2-6 алкинил необязательно замещены одним или более R14, которые являются одинаковыми или разными;
R11, R14 независимо выбирают из группы, состоящей из галогена; CN; C(O)OR15; OR15; C(O)R15; C(O)N(R15R15a); S(O)2N(R15R15a); S(O)N(R15R15a); S(O)2R15; S(O)R15; N(R15)S(O)2N(R15aR15b); SR15; N(R15R15a); OC(O)R15; N(R15)C(O)R15a; N(R15)S(O)2R15a; N(R15)S(O)R15a; N(R15)C(O)OR15a; N(R15)C(O)N(R15aR15b); OC(O)N(R15R15a); и T3;
R15, R15a, R15b независимо выбирают из группы, состоящей из H; Т3; C1-6 алкила; С2-6 алкенила; и С2-6 алкинила, где C1-6 алкил; С2-6 алкенил; и С2-6 алкинил необязательно замещены одним или более галогенами, которые являются одинаковыми или разными;
Т3 представляет собой фенил; С3-7 циклоалкил; или 3-7 членный гетероциклил, где T3 необязательно замещен одним или более R16, которые являются одинаковыми или разными;
R16 представляет собой галоген; CN; C(O)OR17; OR17; C(O)R17; C(O)N(R17R17a); S(O)2N(R17R17a); S(O)N(R17R17a); S(O)2R17; S(O)R17; N(R17)S(O)2N(R17aR17b); SR17; N(R17R17a); OC(O)R17; N(R17)C(O)R17a; N(R17)S(O)2R17a; N(R17)S(O)R17a; N(R17)C(O)OR17a; N(R17)C(O)N(R17aR17b); OC(O)N(R17R17a); оксо (=O), где кольцо является по меньшей мере частично насыщенным; С1-6 алкил; С2-6 алкенил; или С2-6 алкинил, где C1-6 алкил; С2-6 алкенил; и C2-6 алкинил необязательно замещены одним или более галогенами, которые являются одинаковыми или разными;
R17, R17a, R17b независимо выбирают из группы, состоящей из Н; С1-6 алкила; С2-6 алкенила; и С2-6 алкинила, где С1-6 алкил; С2-6 алкенил; и С2-6 алкинил необязательно замещены одним или более галогенами, которые являются одинаковыми или разными;
R4 представляет собой Н; F; Cl; или N(CH3)2;
R18 представляет собой Н; C1-6 алкил; С2-6 алкенил; или С2-6 алкинил; где C1-6 алкил; С2-6 алкенил; и C2-6 алкинил необязательно замещены одним или более R19, которые являются одинаковыми или разными;
R19 представляет собой галоген; CN; C(O)OR20; OR20; C(O)R20; C(O)N(R20R20a); S(O)2N(R20R20a); S(O)N(R20R20a); S(O)2R20; S(O)R20; N(R20)S(O)2N(R20aR20b); SR20; N(R20R20a); NO2; OC(O)R20; N(R20)C(O)R20a; N(R20)SO2R20a; N(R20)S(O)R20a; N(R20)C(O)N(R20aR20b); N(R20)C(O)OR20a; или OC(O)N(R20R20a);
R20, R20a, R20b независимо выбирают из группы, состоящей из Н; и С1-6 алкила, где C1-6, алкил необязательно замещен одним или более галогенами, которые являются одинаковыми или разными.
Неожиданно было обнаружено, что соединения по изобретению полезны для лечения и/или профилактики неопластических и/или инфекционных заболеваний. Интересно, что эти соединения подходят для усиления уровня цитокинов, секретируемых стимулированными иммунными клетками, и, таким образом, увеличения локальной активности иммунных клеток в непосредственной близости от указанных стимулированных иммунных клеток. Что касается формулы (I), было неожиданно установлено, что для активности выгодно, когда оба азота, азот амина -NH(R18) и амин амидной функции -C(O)NH(R3) несут водород.
В примере 6 в WO 03/031376 А1 описано промежуточное соединение следующей формулы:

Соответственно указанное соединение или его фармацевтически приемлемая соль могут быть исключены из объема настоящего изобретения.
В примере 8 в WO 03/031376 А1 приведены несколько списков различных исходных материалов и требуются множественные выборки из указанных списков, чтобы получить соединения формулы (I) согласно настоящему изобретению. Соответственно, следующие соединения или их фармацевтически приемлемые соли могут быть исключены из объема настоящего изобретения:

где X1 имеет значение, как определено в настоящей заявке;
R2 представляет собой фенил; 3-хлорфенил; 4-фторфенил; 4-метоксифенил; 3,5-диметил-1,2-оксазол-4-ил; 2-хлортиофен-5-ил; пиридин-4-ил; 1,3-бензодиоксол-5-ил; 5-фенил-1,2,4-оксадиазол-3-ил; 3-(4-трет-бутилфенил)-1,2,4-оксадиазол-5-ил; бифен-4-ил; или 3,4,5-триметоксифенил;
R3 представляет собой н-бутил; 2-гидрокси-1-гидроксикарбонил-этил; 2-гидроксикарбонилэтил; фенил; или бензил;
или
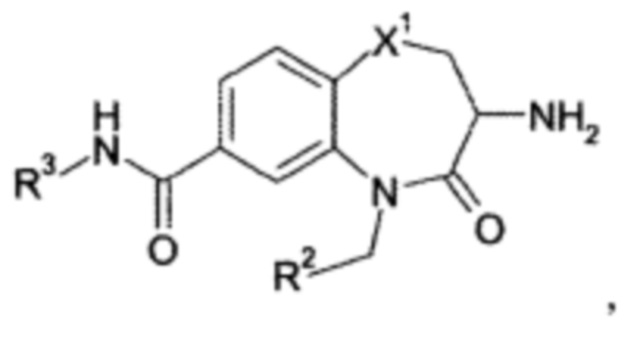
где X1 и R2 имеют значения, как указано в настоящей заявке;
R3 представляет собой н-бутил; 2-гидрокси-1-гидроксикарбонил-этил; 2-гидроксикарбонилэтил; фенил; или бензил.
В предпочтительном варианте осуществления настоящего изобретения эти соединения или их фармацевтически приемлемые соли исключаются из объема настоящего изобретения.
Поскольку эти соединения или их фармацевтические соли не относятся к любому фармацевтическому применению, они, только предпочтительно, исключаются из объема настоящего изобретения до степени, касающейся этих соединений и их фармацевтически приемлемых солей как таковых. Однако в менее предпочтительном варианте осуществления эти соединения и их фармацевтически приемлемые соли также исключаются до степени, касающейся их применения в качестве лекарственного средства или в способах лечения или для получения активированных иммунных клеток или фармацевтических композиций согласно настоящему изобретению.
Что касается формулы (I) в случае, если переменная или заместитель могут быть выбраны из группы различных вариантов, и такая переменная или заместитель встречается более чем один раз, соответствующие варианты могут быть одинаковыми или разными.
В контексте настоящего изобретения термины имеют следующие значения:
Термин «необязательно замещенный» означает незамещенный или замещенный. Обычно, но не ограничиваясь этим, «один или более заместителей» означает один, два или три, предпочтительно один или два заместителя и более предпочтительно один заместитель. Обычно эти заместители могут быть одинаковыми или разными.
"Алкил" означает неразветвленную или разветвленную углеводородную цепь. Каждый водород алкильного углерода может быть замещен заместителем, как указано в настоящей заявке.
"Алкенил" означает неразветвленную или разветвленную углеводородную цепь, которая содержи] по меньшей мере одну двойную связь углерод-углерод. Каждый водород алкенильного углерода может быть замещен заместителем, как далее указано в настоящей заявке.
"Алкинил" означает неразветвленную или разветвленную углеводородную цепь, которая содержит по меньшей мере одну тройную связь углерод-углерод. Каждый водород алкинильного углерода может быть замещен заместителем, как далее указано в настоящей заявке.
"С1-3 алкил" означает алкильную цепь, имеющую 1-3 атома углерода, например, если присутствует в конце молекулы: метил, этил, н-пропил, изопропил, или например, -СН2-, -СН2-СН2-, -СН(CH3)-, -CH2-CH2-CH2-, -СН(С2Н5)-, -С(СН3)2-, когда две составляющие молекулы связаны алкильной группой. Каждый водород C1-3 алкильного углерода может быть замещен заместителем, как далее указано в настоящей заявке.
"С1-4 алкил" означает алкильную цепь, имеющую 1-4 атома углерода, например, если присутствует в конце молекулы: метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, или например, -СН2-, -СН2-СН2-, -CH(CH3)-, -СН2-СН2-СН2-, -CH(C2H5)-, -С(СН3)2-, когда две составляющие молекулы связаны алкильной группой. Каждый водород С1-4 алкильный углерод может быть замещен заместителем, как далее указано в настоящей заявке.
"С1-6 алкил" означает алкильную цепь, имеющую 1-6 атома углерода, например, если присутствует в конце молекулы: С1-4 алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил; трет-бутил, н-пентил, н-гексил, или например, -СН2-, -СН2-СН2-, -СН(СН3)-, -СН2-СН2-СН2-, -СН(С2Н5)-, -С(СН3)2-, когда две составляющие молекулы связаны алкильной группой. Каждый водород C1-6 алкильный углерод может быть замещен заместителем, как далее указано в настоящей заявке. Термин "C1-12 алкил" определяется соответствующим образом.
"С2-6 алкенил" означает алкенильную цепь, имеющую 2-6 атома углерода, например, если присутствует в конце молекулы: -СН=СН2, -СН=СН-СН3, -СН2-СН=CH2, -CH=CH-CH2-CH3, -СН=CH-СН=CH2, или например, -CH=СН-, когда две составляющие молекулы связаны алкенильной группой. Каждый водород С2-6 алкенильного углерода может быть замещен заместителем, как далее указано в настоящей заявке. Термин "С2-12 алкенил" определяется соответствующим образом.
"С2-6 алкинил" означает алкинильную цепь, имеющую 2-6 атома углерода, например, если присутствует в конце молекулы: -С≡СН, -СН2-С≡СН, СН2-СН2-С≡СН, CH2-С≡С-СН3, или например, -С≡С- когда две составляющие молекулы связаны алкинильной группой. Каждый водород С2-6 алкинильный углерод может быть замещен заместителем, как далее указано в настоящей заявке. Термин "С2-12 алкинил" определяется соответствующим образом.
"C3-7 циклоалкил" или "С3-7 циклоалкильное кольцо" означает циклическую алкильную цепь, имеющую 3-7 атомов углерода, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил. Предпочтительно, циклоалкил относится к циклопропилу, циклобутилу, циклопентилу, циклогексилу или циклогептилу. Каждый водород циклоалкильный углерод может быть замещен заместителем, как далее указано в настоящей заявке.
"Галоген" означает фтор, хлор, бром или иод. Особенно предпочтительно галогеном является фтор или хлор.
«3-7 членный гетероциклил» или «3-7 членный гетероцикл» означает кольцо с 3, 4, 5, 6 или 7 кольцевыми атомами, которое может содержать до максимального количества двойных связей (ароматическое или неароматическое кольцо, которое полностью насыщено, частично насыщено или ненасыщенно), где по меньшей мере от одною кольцевого атома до 4 кольцевых атомов замещены гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-) и где кольцо связано с остальной частью молекулы через атом углерода или азота. Примерами 3-7 членных гетероциклов являются азиридин, азетидин, оксетан, тиетан, фуран, тиофен, пиррол, пирролин, имидазол, имидазолин, пиразол, пиразолин, оксазол, оксазолин, изоксазол, изоксазолин, тиазол, тиазолин, изотиазол, изотиазолин, тиадиазол, тиадиазолин, тетрагидрофуран, тетрагидротиофен, пирролидин, имидазолидин, пиразолидин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, тиадиазолдидин, сульфолан, пиран, дигидропиран, тетрагидропиран, имидазолидин, пиридин, пиридазин, пиразин, пиримидин, пиперазин, пиперидин, морфолин, тетразол, триазол, триазолидин, тетразолидин, диазепан, азепин или гомопиперазин.
"5-6-членный ароматический гетероциклил" или "5-6-членный ароматический гетероцикл" означает гетероцикл, производный от циклопентадиенила или бензола, где по меньшей мере один атом углерода замещен гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-). Примерами таких гетероциклов являются фуран, тиофен, пиррол, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, тиадиазол, триазол, тетразол, пиридин, пиримидин, пиридазин, пиразин, триазин.
«5-ти членный ароматический гетероциклил» или «5-ти членный ароматический гетероцикл» означает гетероцикл, производный от циклопентадиенила, где по меньшей мере один атом углерода замещен гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-). Примерами таких гетероциклов являются фуран, тиофен, пиррол, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, тиадиазол, триазол, тетразол.
"7-11-членный гетеробициклил" или "7-11-членный гетеробицикл" означает гетероциклическую систему из двух колец, содержащую 7-11 кольцевых атомов, где по меньшей мере один кольцевой атом разделяется обоими кольцами, и которая может содержать до максимального числа двойных связей (ароматическое или неароматическое кольцо, которое является полностью насыщенным, частично насыщенным или ненасыщенным), где от по меньшей мере одного кольцевого атома до шести кольцевых атомов замещены гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-), и где кольцо связано с остатком молекулы через атом углерода или азота. Примерами 7-11-членного гетеробицикла являются индол, индолин, бензофуран, бензотиофен, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензимидазол, бензимидазолин, хинолин, хиназолин, дигидрохиназолин, дигидрохинолин, тетрагидрохинолин, декагидрохинолин, изохинолин, декагидроизохинолин, тетрагидроизохинолин, дигидроизохинолин, бензазепин, пурин или птеридин. Термин 7-11-членный гетеробицикл также включает спироструктуры двух колец, такие как 2-оксаспиро[3.3]гептан, 6-окса-2-азаспиро[3,4]октан, 2-окса-6-азаспиро[3.3]гептан-6-ил или 2,6-диазаспиро[3.3]гептан-6-ил или мостиковые гетероциклы, такие как 8-аза-бицикло[3.2.1]октан или 2,5-диазабицикло[2.2.2]октан-2-ил или 3,8-диазабицикло[3.2.1]октан.
"9-11-членный ароматический гетеробициклил" или "9-11-членный ароматический гетеробицикл" означает гетероциклическую систему из двух колец, где по меньшей мере одно кольцо является ароматическим, и гетероциклическая кольцевая система имеет от 9 до 11 кольцевых атомов, где два кольцевых атома разделены обоими кольцами, и может содержать до максимального числа двойных связей (полностью или частично ароматическое), где от по меньшей мере одного кольцевого атома до шести кольцевых атомов замещены гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-), и где кольцо связано с остатком молекулы через атом углерода или азота. Примерами 9-11-членного ароматического гетеробицикла являются индол, индолин, бензофуран, бензотиофен, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензимидазол, бензимидазолин, хинолин, хиназолин, дигидрохиназолин, дигидрохинолин, тетрагидрохинолин, изохинолин, тетрагидроизохинолин, дигидроизохинолин, бензазепин, пурин или птеридин.
Предпочтительными соединениями формулы (I) являются те соединения, в которых один или более остатков, содержащихся в них, имеют значения, приведенные ниже, при этом все комбинации предпочтительных определений заместителей являются объектом согласно настоящею изобретения. Что касается всех предпочтительных соединений формулы (1), настоящее изобретение также включает все таутомерные и стереоизомерные формы и их смеси во всех отношениях, если специально не указано иное, и их фармацевтически приемлемые соли.
В предпочтительных вариантах осуществления настоящего изобретения заместители, упомянутые ниже, независимо имеют следующее значение. Следовательно, один или более из этих заместителей могут иметь предпочтительные или более предпочтительные значения, приведенные ниже.
Предпочтительно R18 представляет собой Н.
Предпочтительно X1 представляет собой S(O)2.
Предпочтительно R1 представляет собой Н.
Предпочтительно X2 представляет собой C(R4).
Предпочтительно R4 представляет собой Н; F; или N(CH3)2. Более предпочтительно R4 представляет собой Н; или F.
Предпочтительно R2 представляет собой фенил, 5-6 членный ароматический гетероциклил, или 9-11 членный ароматический гетеробициклил; более предпочтительно фенил, пиридил, тиадиазолил, или хинолинил; даже более предпочтительно фенил, или пиридил; даже более предпочтительно фенил, где R2 необязательно замещен одним или более R5, которые являются одинаковыми или разными.
Предпочтительно, R2 замещен одним или двумя R5, которые являются одинаковыми или разными.
Предпочтительно Т1 представляет собой циклопропил; или 3-7 членный гетероциклил (более предпочтительно 3-7 членный гетероциклил), где Т1 незамещен или замещен незамещенным С1-6 алкилом.
Предпочтительно R5 представляет собой галоген; CN; OR6; C(O)N(R6R6a); Т1; или C1-6 алкил, где С1-6 алкил необязательно замещен одним или более галогенами, которые являются одинаковыми или разными. Более предпочтительно R5 представляет собой F; Cl; Br; CN; ОСН3; OCHF2; OCF3; C(O)NH2; 1Н-1,2,4-триазол-1-ил; циклопропил; 5-метил-1,2,4-оксадиазол-3-ил; 1,2,3-тиадиазол-4-ил; морфолин-4-ил; трет-бутил; или CF3. Даже более предпочтительно R5 представляет собой F; Cl; CN; OCF3; C(O)NH2; 1Н-1,2,4-триазол-1-ил; циклопропил; 5-метил-1,2,4-оксадиазол-3-ил; 1,2,3-тиадиазол-4-ил; морфолин-4-ил; трет-бутил; или CF3.
Предпочтительно R2 в формуле (I) выбирают с получением формулы (IIaa) или (IIab)
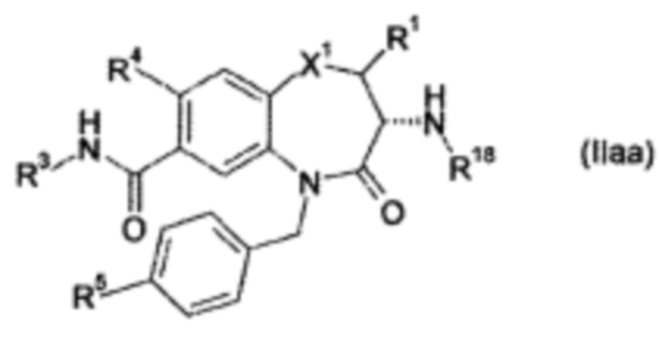

Предпочтительно R3a представляет собой Т2; С1-12 алкил; незамещенный С2-12 алкенил; или незамещенный С2-12 алкинил, где С1-12 алкил необязательно замещен одним, двумя или тремя R9, которые являются одинаковыми или разными. Более предпочтительно R3a представляет собой Т2; С1-12 алкил; или С2-12 алкенил, где С1-12 алкил необязательно замещен одним, двумя или тремя R9, которые являются одинаковыми или разными. Даже более предпочтительно R3a представляет собой Т2; СН2Т2; CH2CH2T2; C(CH3)T2; незамещенный C1-12 алкил; незамещенный С2-12 алкенил; С1-2 алкил, который замещен OR10; N(R10)C(O)R10a; С1-12 алкилом; или CF3.
Предпочтительно Т2 представляет собой фенил; C3-7 циклоалкил; или 3-7 членный гетероциклил, где Т2 необязательно замещен одним или более R12, которые являются одинаковыми или разными.
Предпочтительно Т2 незамещен или замещен одним или двумя R12, которые являются одинаковыми или разными.
Предпочтительно R12 представляет собой галоген; OR13; незамещенный Т3; Т3, который замещен незамещенным С1-6 алкилом; или незамещенный С1-6 алкил.
Соединения формулы (I), в которых некоторые или все из вышеуказанных групп имеют предпочтительные или более предпочтительные значения, также являются объектом настоящего изобретения.
Предпочтительные конкретные соединения или их фармацевтически приемлемые соли согласно настоящему изобретению выбирают из группы, состоящей из
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2,2-дифторциклопропил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-5-[(4-трет-бутилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-трет-бутилфенил)метил]-4-оксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-8-фтор-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бензил-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-[(4-метоксифенил)метил]-4-оксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(оксан-4-ил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-4-оксо-5-{[3-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-{[4-(морфолин-4-ил)фенил]метил}-4-оксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
N-(3-{[(3R)-3-амино-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-ил]формамидо}пропил)-2,2-диметилпропанамид;
(3R)-3-амино-N-бутил-5-{[4-(морфолин-4-ил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-N-(оксан-4-ил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-4-оксо-N-(пропан-2-ил)-5-{[4-(трифторметокси)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бензил-8-фтор-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-метил-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-этил-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-({4-[(5-ацетамидопентил)окси]фенил}метил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2-метоксиэтил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-5-[(4-цианофенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-4-оксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(5-трет-бутил-1,2-оксазол-3-ил)-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-4-оксо-N-(пиридин-3-ил)-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-1-(4-метоксифенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(оксан-3-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-4-оксо-N-(4,4,4-трифторбутил)-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(оксан-4-илметил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-[(4-фторфенил)метил]-4-оксо-5-{[4-(трифторметокси)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-[(4-фторфенил)метил]-4-оксо-5-{[4-(1,2,3-тиадиазол-4-ил)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(4,4-дифторциклогексил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[1-(4-фторфенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1S)-1-(4-метоксифенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-4-оксо-N-(4,4,4-трифторбутил)-5-{[6-(трифторметил)пиридин-3-ил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-[(4-фторфенил)метил]-4-оксо-5-{[6-(трифторметил)пиридин-3-ил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-1-(4-фторфенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфепил)метил]-8-фтор-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[(4-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-фторфенил)метил]-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-4-оксо-5-{[4-(1H-1,2,4-триазол-1-ил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-5-[(4-карбамоилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2-гидрокси-2-метилпропил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1S)-1-(4-фторфенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(2-гидрокси-2-метилпропил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(2R,3R)-3-амино-5-[(4-хлорфенил)метил]-2-метил-4-оксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N'-(4-фторфенил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбогидразид;
(3R)-3-амино-N'-бутаноил-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбогидразид;
(3R)-3-амино-N-бутил-5-[(4-хлор-2-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлор-2-фторфенил)метил]-8-фтор-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлор-3-фторфенил)метил]-8-фтор-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-5-[(4-хлор-3-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-N-пропокси-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(2-метилпропокси)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N'-(2-метилпропил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбогидразид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-4-оксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2-метилпропокси)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3-метилбутан-2-ил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(бут-3-ен-1-ил)-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N'-(2-метилпропил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбогидразид;
(3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-1,4-диоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-1,1,4-триоксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(4,4,4-трифтор-бутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(оксан-4-илметил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-N-(оксан-4-илметил)-1,1,4-триоксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-1,1,4-триоксо-N-фенокси-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(2-метилпропокси)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-фенокси-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-({4-[(5-ацетамидопентил)окси]фенил}-метил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2-метилпропокси)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-пропокси-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3-метилбутан-2-ил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(бут-3-ен-1-ил)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-циклопропил-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-циклобутил-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлор-2-фторфенил)метил]-8-фтор-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(3,4-дихлорфенил)метил]-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлор-3-фторфенил)метил]-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(циклогексилокси)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(циклогексилметокси)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(2,2,2-трифтор-этил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(3,3,3-трифтор-пропил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-[(2S)-1,1,1-трифторпропан-2-ил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(бутан-2-ил)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-трет-бутил-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(трет-бутокси)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-[(1S,2R)-2-фенилциклопропил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(1-метилциклопропил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(1-метилциклобутил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2,2-диметилциклопропил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3,3-дифторциклобутил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бензил-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-гептил-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3,3-дифторциклопентил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-2,2-дифторциклопропил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1S)-2,2-дифторциклопропил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(2R,3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2,2-дифторциклопропил)-2-метил-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-гексадецил-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(циклопропилметил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(2R,3R)-3-амино-5-[(4-хлорфенил)метил]-2-метил-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-8-фтор-4-оксо-5-(хинолин-2-илметил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-N-(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
трет-бутил N-(5-{[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[(4-метоксифенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]амино}пентил)карбамат; и
(3R)-3-амино-N-бутил-1-[(4-хлорфенил)метил]-2,5,5-триоксо-1Н,2Н,3Н,4Н-5λ6-пиридо[3,4-b][1,4]тиазепин-8-карбоксамид.
Другие предпочтительные специфические соединения или их фармацевтически приемлемые соли согласно настоящему изобретению выбирают из группы, состоящей из
(3R)-3-амино-N-бензил-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(2,2-дифторциклопропил)-8-фтор-5-{[4-метокси-3-(трифторметил)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(2R,3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-2-метил-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(2-метоксиэтил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(2,2-дифторциклопропил)-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(1S,3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1Н-1,5-бензотиазепин-1-ия-1-олат;
(1R,3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1Н-1,5-бензотиазепин-1-ия-1-олат;
(3R)-3-амино-5-[(4-цианофенил)метил]-N-(2,2-дифторциклопропил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-цианофенил)метил]-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(4,4-дифторциклогексил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-[2-(трифторметил)циклопропил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3,3-дифторциклобутил)-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(2,2-дифторциклопропил)-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бензил-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бутил-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-бензил-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[2-(оксан-4-ил)этил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-бензил-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-N-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-5-[(4-фторфенил)метил]-N-[(оксан-4-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(3,3-дифторциклобутил)-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-5-[(4-метоксифенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-фтор-5-[(4-метоксифенил)метил]-N-[(оксан-4-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(2,2-дифторциклопропил)-8-фтор-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(оксан-4-ил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3,3-дифторциклобутил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1S)-3,3-дифторциклопентил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R,2S)-2-фторциклопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(3,3-дифторциклобутил)-5-[(2-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(3,3-дифторциклобутил)-5-[(3-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-метоксифенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N,5-бис[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-бензил-N-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(4,4-дифторциклогексил)-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-(3,3,3-трифторпропил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-[(3R)-оксолан-3-ил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-[(оксолан-3-ил)метил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-2,2-дифторцикпопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-циклопропилфенил)метил]-N-[(1R)-2,2-дифторциклопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-[(1R)-2,2-дифторциклопропил]-5-{[4-(дифторметокси)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-[(1R)-2,2-дифторциклопропил]-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-бензил-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-хлор-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-{[4-(дифторметокси)фенил]метил}-N-[(оксан-4-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(4-фтороксан-4-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-1-(оксан-4-ил)этил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-бензил-N-[(1R)-2,2-дифторциклопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(6-метилпиридин-3-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-(1R)-3,3-дифторциклопентил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-цианофенил)метил]-8-фтор-N-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(3,3-дифторциклобутил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[2-(2-метоксиэтокси)этил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-(бут-3-ин-1-ил)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(пент-4-ин-1-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-8-хлор-5-[(4-хлорфенил)метил]-N-[(1R)-2,2-дифторциклопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[2-(морфолин-4-ил)этил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(6-метоксипиридин-3-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-{[4-(prop-2-ин-1-илокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-N-[(1R)-2,2-дифторциклопропил]-1,1,4-триоксо-5-{[4-(трифторметил)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-бромфенил)метил]-N-(2,2-дифторциклопропил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид;
(3R)-3-амино-5-[(4-хлорфенил)метил]-N-{2-оксаспиро[3.3]гептан-6-ил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид; и
(3R)-5-[(4-хлорфенил)метил]-3-(этиламино)-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид.
В случае таутомерии, подобно, например, кето-енольной таутомерии, соединений формулы (I), могут присутствовать отдельные формы, подобно, например, кето и енольной форме, отдельно и вместе в виде смесей в любом соотношении. То же самое относится к стереоизомерам, таким как, например, энантиомеры, цис/трансизомеры, конформеры, если иное специально не указано, и тому подобное.
В частности, когда энантиомерные или диастереомерные формы присутствуют для соединения согласно формуле (I), каждая чистая форма отдельно, и любая смесь по меньшей мере двух чистых форм в любом отношении охватывается формулой (I) и является объектом настоящего изобретения, если не указано иное.
В качестве примера в отношении амина-NH(R18) в формуле (I) R- и S-форма включаются, поскольку не указывается конкретная ориентация. Однако предпочтительной является R-форма.
Соответственно предпочтительная структура формулы (I) приводится в виде формулы (IIa)

Что касается R1, представляющего собой метил, то цис- и транс-диастереомерная форма относительно амина-NH(R18) охватываются формулой (1), поскольку не указана конкретная ориентация. Однако цис-диастеромер является предпочтительным.
Изотопные меченые соединения формулы (I) также входят в объем настоящего изобретения. Способы внесения изотопных меток известны в данной области техники. Предпочтительными изотопами являются изотопы из элементов Н, С, N, О и S. Сольваты соединений формулы (I) также входят в объем настоящего изобретения.
Если желательно, изомеры могут быть разделены способами, хорошо известными в данной области, например, с помощью жидкостной хроматографии. То же самое относится к энантиомерам с использованием, например, хиральных стационарных фаз. Кроме того, энантиомеры могут быть выделены путем превращения их в диастереомеры, то есть связывания с энантиомерно чистым вспомогательным соединением, последующего разделения полученных диастереомеров и отщепления вспомогательного остатка. Альтернативно, любой энантиомер соединения формулы (I) может быть получен в результате стереоселективного синтеза с использованием оптически чистых исходных материалов, реагентов и/или катализаторов.
В случае, если соединения согласно формуле (I) содержат одну или более кислотных или основных групп, изобретение также включает их соответствующие фармацевтически приемлемые соли, в частности их фармацевтически используемые соли. Таким образом, соединения формулы (I), которые содержат кислотные группы, могут быть использованы в соответствии с изобретением, например, в виде солей щелочных металлов, солей щелочноземельных металлов или в виде солей аммония. Более конкретные примеры таких солей включают соли натрия, соли калия, соли кальция, соли магния или соли с аммиаком или органическими амины, такие как, например, этиламин, этаноламин, триэтаноламин или аминокислоты. Соединения формулы (I), которые содержат одну или более основные группы, то есть группы, которые могут быть протонированы, могут присутствовать и могут быть использованы согласно изобретению в форме их аддитивных солей с неорганическими или органическими кислотами. Примеры подходящих кислот включают хлорид водорода, бромид водорода, фосфорную кислоту, серную кислоту, азотную кислоту, метансульфоновую кислоту, п-толуолсульфоновую кислоту, нафталиндисульфоновые кислоты, щавелевую кислоту, уксусную кислоту, винную кислоту, молочную кислоту, салициловую кислоту, бензойную кислоту, муравьиную кислоту, пропионовую кислоту, пивалиновую кислоту, диэтилуксусную кислоту, малоновую кислоту, янтарную кислоту, пимелиновую кислоту, фумаровую кислоту, малеиновую кислоту, яблочную кислоту, сульфаминовую кислоту, фенилпропионовую кислоту, глюконовую кислоту, аскорбиновую кислоту, изоникотиновую кислоту, лимонную кислоту, адипиновую кислоту, и другие кислоты, известные специалисту в данной области. Если соединения формулы (I) одновременно содержат кислотные и основные группы в молекуле, изобретение также включает в дополнение к упомянутым солевым формам внутренние соли или бетаины (цвиттерионы). Соответствующие соли в соответствии с формулой (I) могут быть получены обычными способами, которые известны специалисту в данной области, например, путем их контактирования с органической или неорганической кислотой или основанием в растворителе или диспергирующем средстве, или анионного обмена или катионного обмена с другими солями. Настоящее изобретение также включает все соли соединений формулы (I), которые из-за низкой физиологической совместимости не являются непосредственно подходящими для использования в фармацевтических препаратах, но которые могут быть использованы, например, в качестве промежуточных соединений для химических реакций или для получения фармацевтически приемлемых солей.
В общем, соединения согласно настоящему изобретению предпочтительно используют в форме фармацевтически приемлемой соли, как например в виде их гидрохлоридов.
Как указано выше, настоящее изобретение также относится к применению соединения согласно настоящему изобретению в фармацевтическом контексте. Здесь фармацевтический контекст может быть понят в самом широком смысле как любое средство для улучшения состояния здоровья и/или хорошего самочувствия пациента. Термины «фармацевтический» и «лекарственный» могут пониматься взаимозаменяемо.
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая по меньшей мере одно соединение согласно настоящему изобретению и по меньшей мере один фармацевтически приемлемый носитель.
В этом объекте, относящемся к фармацевтической композиции, определения, изложенные подробно выше, также применяются, с необходимыми изменениями.
Фармацевтически приемлемый носитель в соответствии с настоящим изобретением может представлять собой любую добавку, которая является фармацевтически приемлемой, поэтому любую добавку, которая не токсична для пациента. Например, фармацевтически приемлемый носитель может содержать растворитель, такой как, например, вода, диметилсульфоксид (DMSO), этанол, растительное масло, парафиновое масло или их комбинации. Кроме того, носитель может содержать один или более детергентов, один или более пенообразователей (например, лаурилсульфат натрия (SLS)/доцеилсульфат натрия (SDS)), один или более красителей (например, TiO2, пищевой краситель), один или более витаминов, одну или более солей (например, соли натрия, калия, кальция, цинка), один или более увлажнителей (например, сорбит, глицерин, маннит, пропиленгликоль, полидекстроза), один или более ферментов, один или более консервантов (например, бензойная кислота, метилпарабен), один или более структурирующих агентов (например, карбоксиметилцеллюлоза (CMC), полиэтиленгликоль (ПЭГ), сорбит), один или более эмульгаторов, один или более наполнителей, один или более покрывающих агентов, один или более разделяющих агентов, один или более антиоксидантов, один или более травяных и растительных экстрактов, один или более стабилизирующих агентов, один или более полимеров (например, гидроксипропилметакриламид (НРМА), полиэтиленимин (PEI), карбоксиметилцеллюлоза (CMC), полиэтилтенгликоль (PEG)), один или более медиаторов поглощения (например, полиэтиленимин (PEI), диметилсульфоксид (DMSO), проникающий в клетку пептид (СРР), домен белковой трансдукции (PTD), антимикробный пептид и т.д.) одно или более антител, один или более подсластителей (например, сахароза, ацесульфам К, сахарин Na, стевия), один или более контрастных красителей (например, флуоресцеин, производные флуоресцеина, Су красители, краситель (красители) Alexa Fluor, S краситель (красители), родамин, квантовая точка (точки) и т.п.), один или более гомеопатических ингредиентов, одно или более вкусовых веществ и/или один или более ароматизаторов.
Фармацевтическая композиция согласно настоящему изобретению содержит по меньшей мере одно соединение согласно настоящему изобретению. Необязательно, фармацевтическая композиция может также содержать более одного соединения согласно настоящему изобретению, как например комбинация двух, трех, четырех, пяти или даже более соединений согласно настоящему изобретению.
Необязательно, фармацевтическая композиция может также содержать один или более других фармацевтически активных агентов, таких как, например, один или более дополнительный стимулирующий агент(ы), активирующий иммунные клетки, которые могут быть другими фармацевтически активными ингредиентами фармацевтической композиции, отличными от соединений согласно настоящему изобретению. Примеры такого дополнительного стимулирующего агента (агентов), активирующего иммунные клетки, приведены ниже.
Как уже указывалось выше, соединение, а также фармацевтическая композиция согласно настоящему изобретению, могут быть использованы в качестве лекарственного средства.
Поэтому другим объектом настоящего изобретения является соединение или фармацевтическая композиция согласно настоящему изобретению, для применения в качестве лекарственного средства.
В этом объекте, относящемся к применению в качестве лекарственного средства, определения, изложенные подробно выше, также применяются с необходимыми изменениями.
В контексте настоящего изобретению термины «медикамент», «терапевтическое средство», «лекарственное средство», «лекарство», «терапевтический агент», «фармацевтическое средство», «фармацевтический агент», «профилактический агент» и т.п. могут быть поняты в их широком смысле, как любой вид соединения, пригодный для использования в лекарственном контексте, то есть для лечения и/или профилактики патологического состояния.
Соединение или фармацевтическую композицию, содержащую его, можно вводить пациенту любыми способами, известными в данной области, такими как, например, перорально, посредством инъекций, назально, чрескожно/подкожно и т.п. Введение может быть локальным (например, внутриматочно, внутриузлово (т.е. в лимфатические узлы), интратекально, интрацеребровентрикулярно (icv), местно или интравитреально) или системным введением (например, внутривенное (i.v.), внутриартериальное (i.a.), внутрибрюшинное (i.p.), внутримышечное i.m.), подкожное (s.c), пероральное, назальное). Предпочтительно, введение является пероральным, внутривенным, подкожным, внутриматочным или внутриузловым введением, в частности пероральным или внутривенным введением.
Введение может осуществляться один раз ((однократное) единичное введение) или может повторяться, как например, введение повторных доз или длительное введение. Повторное введение можно, например, осуществлять два раза, три раза, четыре раза, пять раз, шесть раз, семь раз, восемь раз, девять раз, десять раз, более десяти раз или даже постоянно. Между двумя введениями может быть временной интервал менее одного часа, один час или более, шесть часов или более, двенадцать часов или более, 24 часа или более. Введение может быть ежедневным, может быть два раза в день, три раза в день, четыре раза в день, каждый второй день, каждые три дня, еженедельно, раз в две недели, ежемесячно, два раза в год или ежегодно. Клинически схемы введения могут быть определены специалистом в данной области на основе эффективности дозирования и токсичности.
Предпочтительно, лекарственное средство подходит для лечения или профилактики патологических состояний, связанных с недостаточным иммунным ответом. Другими словами, настоящее изобретение также относится к лекарственному средству, подходящему для усиления иммунного ответа. Как используется в контексте активности иммунного ответа, термины «активизация», «усиление», «повышение», «увеличение», «инициирование», «стимулирование» и т.п. могут пониматься взаимозаменяемо в самом широком смысле, как обеспечение повышенной активности иммунного ответа.
В контексте настоящего изобретения, усиление иммунного ответа является предпочтительно локальным повышением иммунного ответа, то есть увеличением иммунного ответа в непосредственной близости от антигена, распознаваемого иммунными клетками, ответственными за соответствующий иммунный ответ.
Более конкретно, иммунные клетки, подвергнутые соединению согласно настоящему изобретению, показывают значительно повышенную секрецию нескольких цитокинов, таких как, например, IL-2, IFN-γ и/или TNF-α, тогда как соответствующие не стимулированные иммунные клетки этого не делают. Это приводит к локальной секреции цитокинов в непосредственной близости от опухолевого и/или инфекционного патогена, улучшающая местный иммунный ответ на указанный опухолевый и/или инфекционный патоген. Более предпочтительно соединения согласно настоящему изобретению, обеспечивают терапевтическое или профилактическое вмешательство, которое увеличивает локальную эффекторную эффективность противоопухолевых или противовирусных Т-клеток, В-клеток и NK-клеток. Однако нежелательное значительное повышение системного уровня цитокина может быть предотвращено на большом расстоянии. Когда антиген типично локализуется на поверхности неопластических клеток (например, созревших неопластических клеток (раковых клеток)), активность иммунных клеток, в частности Т-клеток, контактирующих с таким антигеном, может быть увеличена. Было обнаружено, что при введении соединений согласно настоящему изобретению стимулированные иммунные клетки, в частности активированные Т-клетки, контактирующие со своим родственным антигеном (например, антиген опухоли и/или патогена), проявляют повышенную локальную активацию иммунной системы. Таким образом, иммунный ответ в непосредственной близости от новообразования затем увеличивается. Когда антиген типично локализуется на поверхности инфицированных вирусом клеток (например, ВИЧ-инфицированных клеток), активность иммунных клеток, контактирующих с таким антигеном, может быть увеличена.
Примечательно, что в отличие от стратегий, основанных на вакцинации (например, вакцинации против опухолей), для их активности соединения согласно настоящему изобретению не обязательно требуют, чтобы иммунные клетки контактировали со специфическим опухолевым антигеном, но стимуляция клеток также может быть достигнута другими способами, например стимулируя путь TCR/CD3 и/или ко стимулирующий путь, такой как CD28. В контексте настоящего изобретения повышенный иммунный ответ предпочтительно характеризуется увеличением секреции по меньшей мере одного цитокина, более предпочтительно увеличением секреции по меньшей мере одного цитокина, выбранного из группы, состоящей из IL-2, IFN-γ, TNF-α, IL-1 и IL-6, даже более предпочтительно секреции по меньшей мере одного цитокина, выбранного из группы, состоящей из IL-2, IFN-γ и TNF-α. Особенно предпочтительно повышенный иммунный ответ предпочтительно характеризуется увеличением секреции по меньшей мере двух цитокинов, таких как, в частности, IL-2 и IFN-γ, IL-2 и TNF-α, или IFN-γ и TNF-α. Также весьма предпочтительным является увеличение по меньшей мере трех цитокинов, таких как IL-2, IFN-γ и TNF-α. Дополнительно или альтернативно, также могут быть увеличены другие маркеры, связанные с иммунологической активностью, такие как, например, CD40-лиганд (CD40L, также известный как CD154), гранзим/перфорин, CD69, CD25 и/или CD71. Предпочтительно таким маркером является CD40L.
Как указано выше, усиленная продукция IL-2 и IFN-гамма опухолевыми инфильтрирующими лимфоцитами (TIL), в частности Т-клетками, специфичными для неопластических и/или инфекционных антигенов, как известно, связана с улучшенным иммунитетом к неопластическому и/или инфекционному поражению (поражениям). TNF-альфа также имеет такие эффекты. IL-2 может непосредственно активировать клетки CD8 и природные клетки-киллеры (NK). Поэтому его высвобождение может быть полезным при неопластическом и/или инфекционном поражении, но также может иметь общую роль для стимулирования выживаемости Т-клеток. Поэтому его высвобождение во время стимуляции антиген-представляющей клеткой (АРС) Т-клеток (например, в лимфатических узлах) также может усилить иммунный ответ.
Гранзим/перфорин считается эффекторной молекулой и, следовательно, является маркером для прямого уничтожения неопластических клеток, в частности опухолевых клеток, и может быть высвобожден специфически непосредственно рядом или даже в новообразовании. Аналогично, IFN-гамма и TNF-альфа могут активировать иммунные клетки (такие как, например, NK клетки и миелоидные клетки), по также непосредственно регулировать пути апоптоза в неопластических клетках.
I IL-6 представляет собой плейотропный цитокин, который, как известно, поддерживает выживаемость В-клеток и их высвобождение в лимфатическом узле, следовательно, также может поддерживать выживаемость В-клеток.
Высвобождение IL-1 и IL-6 может усилить развитие Т-хелперных клеток (например, клеток Th17), которые, как известно, играют значительную роль в иммунитете против неопластических и инфекционных заболеваний. Поэтому наличие повышенных уровней IL-1 и IL-6 как при неопластическом и/или инфекционном поражении, так и в лимфатическом узле может оказывать благотворное влияние на иммунный ответ.
CD25, CD69, CD71 и CD40L являются хорошо известными поверхностными маркерами активации Т-клеток и, как известно, демонстрируют эффекты соединений на уровне активации отдельных Т-клеток. CD69 является, в частности, ранним маркером активации Т-клеток. CD25 является рецептором IL-2, и высокая (более высокая) экспрессия обычно поддерживает (более быстрое) быстрое расширение активированных Т-клеток. CD71 является рецептором трансферрина и обычно поддерживает Т-клетки для доставки Fe для пролиферации. CD40L является рецептором на Т-хелперных клетках, который, как известно, поддерживает активацию, выживаемость и пролиферацию как АРС, так и В клеток.
В частности, в разделе примера ниже также показано увеличение экспрессии IL-2, IFN-γ и/или TNF-α, и/или CD40L. Все эти маркеры являются хорошо известными факторами в противоопухолевом иммунном ответе, свидетельствующими анти-неопластической (в частности, противоопухолевой) активности соединений согласно настоящему изобретению.
Такое увеличение секреции цитокинов иммунными клетками может быть увеличено на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 75% по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, или, по меньшей мере в 5 раз по сравнению с секрецией соответствующего цитокина иммунными клетками, подвергнутыми одному и тому же стимулирующему агенту, и культивированными в сопоставимых условиях, но не подвергнутыми воздействию соединения согласно настоящему изобретению. Специалист в данной области техники заметит, что скорость увеличения, как правило, также будет зависеть от количества соединения согласно настоящему изобретению, подвергнутого соответствующим иммунным клеткам дозозависимым образом. Соответственно, во многих случаях это также будет зависеть от дозы соединения согласно настоящему изобретению, введенной пациенту, дозозависимым образом. В пределах подходящего диапазона дозы более высокая доза, как правило, также приведет к более высокому увеличению. Специалисту в данной области также известно, что зависимость от дозы также относится к массе тела пациента, содержанию жира и содержанию воды в организме пациента, индивидуальному метаболизму пациента при дезактивации и/или выведении соединения, индивидуальном иммунологическому состоянию пациента и т.п. Поэтому специалист в данной области может соответствующим образом регулировать дозу.
Дополнительно или альтернативно, также могут быть увеличены скорости пролиферации иммунных клеток, таких как Т-клетки, NK-клетки, В-клетки и/или моноциты. Например, пролиферация CD4 + и/или CD8 + клеток может быть увеличена. Дополнительно или, альтернативно, также поддержание (то есть коэффициент выживаемости, продолжительность активности или время жизни) иммунных клеток, таких как, например, Т-клетки, NK-клетки, В-клетки и/или моноциты (например, CD4 + и/или CD8 + клетки) может быть увеличено.
Примечательно, что соединения согласно настоящему изобретению могут также повышать реакционноспособность Т-клеток в отношении опухолевых антигенов, представленных от МНС I до CD8-Т клетками или от МНС-II до CD4-T клетками независимо от типа опухоли и независимо от опухолевых антигенов. Кроме того, соединения согласно настоящему изобретению могут увеличить иммунологическую активность NK-клеток пациента, чтобы помочь разрушению опухолевых клеток, которые уменьшили опосредованное MHC-I проявление опухолевых антигенов. Более того, сильные антиген-специфичные Т-клеточные ответы могут быть дополнительно увеличены В-клетками и другими иммунными клетками, которые также могут быть нацелены на соединения согласно настоящему изобретению. Таким образом, соединения согласно настоящему изобретению могут также исключить иммунологическое нераспознавание в отношении опухолевых и/или инфекционных патогенов, так что специфические опухолевые антигены пациента распознаются как чужеродные, и, следовательно, собственная иммунная система пациента может быть повторно активирована, чтобы нападать на опухолевые клетки, присутствующие у пациента, независимо от соответствующего типа неопластического и/или инфекционного заболевания.
С точки зрения вышесказанного, еще одним объектом настоящего изобретения является соединение или фармацевтическая композиция согласно настоящему изобретению для применения в способе лечения или профилактики неопластического и/или инфекционного заболевания.
Другими словами, настоящее изобретение относится к способу лечения или профилактики неопластического и/или инфекционного заболевания у пациента, включающему введение указанному пациенту количества соединения или фармацевтической композиции согласно настоящему изобретению, достаточного для лечения или профилактики указанного неопластического и/или инфекционного заболевания у указанного пациента.
В этом объекте, касающемся такого медицинского применения и способа лечения или профилактики, соответственно, определения, изложенные подробно выше (в частности, в контексте соединения, фармацевтической композиции и их применения в качестве лекарственного средства) также применяются с необходимыми изменениями.
Как используется в настоящей заявке, термин «пациент» может быть понят в самом широком смысле, как любой субъект или индивидуум, подлежащий профилактике или лечению, посредством соединения или фармацевтической композиции согласно настоящему изобретению, в частности страдающий от или имеющий риск развития неопластического и/или инфекционного заболевания, независимо от того, возникают или не возникают клинические симптомы. Пациентом может быть любое животное, включая людей. Предпочтительно, пациент является млекопитающим (например, человек, мышь, крыса, корова, свинья, собака, кошка, лошадь, осел, коза и т.д.), Наиболее предпочтительно человек.
В контексте настоящего изобретения термин «заболевание» может быть понят в самом широком смысле как любое патологическое состояние, независимо от того, возникают или не возникают клинические симптомы. Поэтому заболевание может быть связано с фенотипом или может быть скрытым. Предпочтительно, заболевание является патологическим состоянием, сопровождающимся одним или более клиническими симптомами.
Заболевание в контексте настоящего изобретения может быть хроническим и/или острым заболеванием. Предпочтительно, это хроническое заболевание. Хроническое заболевание является постоянным или иным долговременным по своим эффектам. В контексте настоящего изобретения хроническое заболевание также включает заболевание с рецидивирующим течением, то есть рецидивирующее заболевание, рецидивирующее повторно, с периодами ремиссии между ними. Соответственно, как используется в настоящей заявке, хроническое заболевание можно понимать в самом широком смысле как любое заболевание, которое длится по меньшей мере педелю, по меньшей мере месяц, по меньшей мере три месяца, по меньшей мере шесть месяцев, по меньшей мере год или даже несколько лет (с клиническими симптомами или без них). Когда пациентом является человеком, хроническое заболевание обычно понимается как продолжающее в течение по меньшей мере одного месяца или предпочтительно по меньшей мере трех месяцев. Это определение также может быть применено к настоящему изобретению. В этом контексте можно понимать, что, например, новообразование может типично, но не обязательно, расти в течение нескольких месяцев или даже лет до появления первых клинических симптомов. Тем не менее, неопластическое заболевание уже существует в результате возникновения первых неопластических клеток, обычно не связанных с какими-либо клиническими симптомами. Поэтому обнаруженное неопластическое заболевание обычно, но не обязательно, является хроническим заболеванием как таковым. Аналогичным образом, инфекционное заболевание, такое как инфекция вируса иммунодефицита человека (ВИЧ), обычно является хроническим заболеванием, когда оно начинает вызывать клинические симптомы и впервые обнаруживается.
Как используется в настоящей заявке, неопластическое заболевание может быть понято в самом широком смысле как любая ткань, возникающая в результате роста клеток, неконтролируемым образом. Во многих случаях новообразование приводит к по меньшей мере массивной массе ткани, необязательно иннервируемой кровеносными сосудами. Оно может включать или может не включать образование одного или более метастазов/ метастаз. Неопластическим заболеванием согласно настоящему изобретению может быть любое новообразование, классифицированное по классам C00-D48 Международной статистической классификации болезней и связанных со здоровьем нарушений 10-ая редакция (ICD-10) классы C00-D48.
Например, неопластическим заболеванием в соответствии с настоящим изобретением может быть присутствие одного или более злокачественных новообразований (опухолей) (ICD-10 классы С00-С97), может быть наличие одной или более in situ неоплазм (ICD-10 классы D00-D09), может быть наличие одного или более доброкачественных новообразований (ICD-10 классы D10-D36) или может быть наличие одной или более неоплазм неопределенного или неизвестного поведения (ICD-10 классы D37-D48). Предпочтительно, неопластическое заболевание в соответствии с настоящим изобретением относится к наличию одного или более злокачественных новообразований, т.е. является злокачественной опухолью (ICD-10 классы С00-С97).
В более предпочтительном варианте выполнения настоящего изобретения неопластическим заболеванием является рак.
Рак может быть понят в самом широком смысле как любое злокачественное неопластическое заболевание, то есть наличие одного или более злокачественных новообразований у пациента. Рак может быть твердым или гематологическим злокачественным новообразованием. Предпочтительно, рак является восприимчивым к по меньшей мере одному типу иммунотерапии (включая, например, терапевтические антитела, направленные против опухолевых антигенов и/или экспериментальные подходы, такие как, например, вакцинация против рака).
Подтипы рака могут быть классифицированы различными путями, например, по местонахождению в организме основной или только опухолевой массы, или по тканям, из которых происходит/происходят опухоль (опухоли).
Например, такое злокачественное новообразование в соответствии с настоящим изобретением может быть расположено на или в губе, полости рта и глотки (ICD-10 классы С00-С14), на или в органах пищеварения (ICD-10 классы С15-С26), на или в дыхательной системе и органах грудной полости (ICD-10 классы С30-С39), на или в костном и суставном хряще (ICD-10 С40-С41), на или в коже (ICD-10 классы С43-С44), па или в соединительной и мягкой ткани (ICD-10 классы С45-С49), на и в молочной железе и женских половых органах (ICD-10 классы С50-С58), на или в мужских половых органах (ICD-10 классы С60-С63), на или в мочевых органах (ICD-10 классы С64-С68), на или в глазах, головном мозге и центральной нервной системе (ICD-10 классы С69-С72), на или в эндокринных железах и связанных с ними структурах (ICD-10 классы С73-С75), может быть вторичными и неопределенными новообразованиями (ICD-10 классы С76-С80), может быть установлено или считаться первичным новообразованием лимфоидных, гемопоэтических и родственных тканей (ICD-10 классы С81-С96), и/или может быть новообразованиями независимых (первичных) множественных сайтов (ICD-10 класс С97).
Например, рак в контексте настоящего изобретения может быть выбран из группы, состоящей из карциномы (т.е. рака, происходящего из эпителиальных клеток, например, аденокарцинома, плоскоклеточная карцинома, аденосквамозная карцинома, анапластическая карцинома, крупноклеточная карцинома и мелкоклеточная карцинома), саркомы (т.е. рака, происходящего из соединительной ткани, например, опухоль Аскина, гроздевидная саркома, хондросаркома, саркома Юинга, злокачественная гемангиоэндотелиома, злокачественная шваннома, остеосаркома и саркомы мягких тканей), лимфомы и лейкемии (т.е. рака, происходящего из гематопоэтических (кроветворных) клеток, например, зрелые В-клеточные новообразования, зрелые новообразование из Т-клеток и природных клеток-киллеров (NK), лимфома Ходжкина, лимфопролиферативные нарушения, связанные с иммунодефицитом, лимфоцитарный лейкоз, миелогенная лейкемия), гоноцитомы (то есть рака, происходящего из плюрипотентных клеток в половых органах, например, герминома (включая дисгерминому и семинома), дисгерминома, семинома), бластомы (т.е. раковых образований, происходящих из незрелых клеток «предшественников» или эмбриональной ткани, например, гепатобластома, медуллобластома, нефробластома, нейробластома, панкреатобластома, плевролегочная бластома, ретинобластома, глиобластома) и меланомы и ее преформ (т.е. раковых образований, происходящих из меланоцитов, например, злокачественное лентиго, поверхностная распространяющаяся меланома, акральная лентигинозная меланома, меланома слизистой оболочки, меланома узлов, полипоидная меланома, десмопластическая меланома, амеланотическая меланома, меланома мягких тканей) и немеланоцитарного рака кожи (т.е. немеланомных образований, происходящих из кожи, например базальноклеточная карцинома, плоскоклеточный рак, возвышающаяся дерматофибросаркома, карцинома из клеток Меркеля, саркома Капоши, кератоакантома, опухоли из веретенообразных клеток, карциномы сальных желез, микрокистозная карцинома придатков, болезнь Паджета молочной железы, атипичная фиброксантома, лейомиосаркома, ангиосаркома) и глиомы (т.е. раковых образований, происходящих из клеток мозга или позвоночника, например, эпендимома, астроцитома, олигодендроглиомы, глиома головного мозга, глиома зрительного нерва, смешанная глиома).
Предпочтительно, рак может быть образованием одной или более твердых опухолей, таких как, например, выбранные из группы, состоящей из меланомы, немелкоклеточного рака легкого, мелкоклеточного рака легкого и почечно-клеточной карциномы, кроме того, рак молочной железы, рак простаты, рак толстой кишки, гепатоклеточной карциномы, рака мозга, рака мочевого пузыря, рака пищевода, рака поджелудочной железы, рак желудка, рака яичников, мезотелиомы и рака головы и шеи.
Альтернативно, рак может быть образованием одной или более гематопоэтических опухолей, таких как, например, тех, которые выбраны из группы, состоящей из множественной миеломы, неходжкинской лимфомы, AML (острый миелоидный лейкоз, DLBCL (диффузная крупноклеточная В-клеточная лимфома) и В-CLL (В-клеточная хроническая лимфоцитарная лимфома).
В альтернативном предпочтительном варианте выполнения настоящего изобретения, заболеванием может быть инфекционное заболевание.
Как используется в контексте настоящего изобретения, термин «инфекционное заболевание» может быть понят в самом широком смысле как любое патологическое состояние, вызванное вторжением в организм пациента одного или более биологических агентом, чужеродных для организма, способных вызвать иммунную реакцию в организме пациента. Инфекционное заболевание может сопровождаться или не сопровождаться воспалительной реакцией (воспалением). Предпочтительно, инфекционное заболевание в контексте настоящего изобретения сопровождается воспалительной реакцией. Например, такая иммунная реакция в организме пациента может быть более подробно вызвана самим биологическим агентом (например, наличием его поверхностных антигенов), антигенами, происходящими из биологического агента, предоставленными на главном комплексе гистосовместимости I или II (МНС I или МНС II), путем размножения биологического агента, путем реакции тканей хозяина на такой биологический агент, соединениями, продуцированными или вызванными таким биологическим агентом (например, токсинами, химическими сигнальными веществами, цитокинами и т.д.), или образованием антигена из гаптена, происходящего из такого биологического агента. Такие биологические агенты могут быть неживыми или живыми агентами. Например, инфекционное заболевание может быть вызвано биологическими агентами, выбранными из группы, состоящей из вирусов, вироидов, прионов, микроорганизмов, таких как бактерии, нематоды, такие как круглые черви и острицы, членистоногих (например, клещи, зудень, блохи и вши), грибов, стригущего лишая и ленточных червей. Предпочтительно, инфекционное заболевание в соответствии с настоящим изобретением вызвано вирусами или бактериями, в частности является вирусной инфекцией.
Вирусная инфекция в контексте настоящего изобретения может быть заражением любым вирусом. Вирусная инфекция может быть острой вирусной инфекцией или хронической вирусной инфекцией. Предпочтительно, это хроническая вирусная инфекция. Неограничивающие примеры клинически значимых семейств и видов вирусов в контексте настоящего изобретения включают аденовирус, простой герпес типа 1, простой герпес типа 2, вирус ветряной оспы, вирус Эпштейна-Барра, цитомегаловирус человека, вирус герпеса человека типа 8, человеческий папилломавирус, вирус BK, вирус JC, оспу, вирус гепатита В, бокавирус человека, парвовирус В19, человеческий астровирус, норовирус, вирус Коксаки, вирус гепатита A, полиовирус, риновирус, вирус денге, вирус Западного Нила, вирус краснухи, вирус гепатита Е, вирус иммунодефицита человека, вирус гриппа, вирус Гуанарито, вирус Джунин, вирус Ласса, вирус Мачупо, вирус Sabiα, вирус конго-крымской геморрагической лихорадки, вирус Эбола, вирус, вызывающий "марбургскую болезнь", вирус кори, вирус свинки, вирус парагриппа, респираторно-синцитиальный вирус, метапневмовирус человека, вирус Хендра, вирус Нипах, вирус бешенства, гепатит D, ротавирус, орбивирус, вирус Coltivirus и вирус Banna.
В контексте настоящего изобретения, эти вирусные инфекции, связанные с понижающей регуляцией иммунного ответа, представляют особый интерес, например, вирус иммунодефицита человека (ВИЧ), без симптомов или связанных с симптомами (синдром приобретенного иммунодефицита (СПИД)).
Кроме того, также особенно интересны такие вирусные инфекции, связанные с неоплазией, такие как, например, вирус простого герпеса (HSV) типа 1 или 2. В контексте настоящего изобретения соединения или фармацевтическая композиция согласно настоящему изобретению могут одновременно быть фармацевтически активными против вирусной инфекции, а также новообразования, вызванного указанной вирусной инфекцией.
Кроме того, также интерес представляют такие вирусные инфекции, которые скрыты в течение более длительного времени и, таким образом, скрываются от иммунной системы, такие как, например, HSV 1 или HSV2.
Необязательно, но не обязательно, инфекционное заболевание, в частности хроническое инфекционное заболевание (например, хроническая вирусная инфекция), может быть связано с воспалением. В этом контексте воспаление может характеризоваться увеличением активности NF-κВ, уровня реактивного С-белка (CRP), уровня интерферона-гамма (IFN-гамма), уровня интерлейкина 1 (IL-1) и/или интерлейкина 8 (IL-8).
В контексте лечения или профилактики неопластического и/или инфекционного заболевания соединение (соединения) согласно настоящему изобретению можно вводить в виде единственного фармацевтически активного агента или его можно вводить в комбинации с одним или более другими фармацевтически активными агентами). Например, такой другой фармацевтически активный агент может быть стимулирующим агентом, активирующим иммунные клетки, может быть анти-пролиферативным агентом (например, противораковым средством, таким как химиотерапевтическое средство, антиметаболит, гормон, антитело (Ab)), противовирусным средством и/или антибиотиком.
Предпочтительно, такой другой фармацевтически активный агент представляет собой биологическое соединение, такое как терапевтическое моноклональное антитело, которое, как было показано, является эффективным при лечении новообразований. Например, такое терапевтическое моноклональное антитело направлено против молекулы PD-1, молекулы PD-L1 или другого лиганда молекулы PD-1, молекулы CTLA-4, молекулы TIM3, молекулы LAG3, молекулы VISTA или BTLA-4.
Применение такой комбинированной терапии будет зависеть от фармакокинетических и фармакодинамических свойств выбранных соединений и агентов, используемых в такой комбинированной терапии (добавление).
Необязательно, дополнительный агент может вводиться одновременно, ранее или после одного или более соединения (соединений) согласно настоящему изобретению. Как используется в настоящей заявке, совместным введением может быть введение в одной композиции (например, объединенной в фармацевтической композиции согласно настоящему изобретению) или в двух отдельных композициях, которые также могут быть необязательно введены одним и тем же или разными путями введения (например, посредством инъекции, перорально, назально, подкожно и т.д.). Как используется в настоящей заявке, при введении соединения согласно настоящему изобретению ранее или впоследствии может существовать временной интервал между введением указанного соединения (соединений) и дополнительного агента (агентов), равный менее одного часа, один час или более, три часа или более, шесть часов или более, двенадцать часов или более, 24 часа или более, два дня или более или неделю или более.
Как упоминалось в контексте соединения согласно настоящему изобретению выше, также один или более дополнительных агентов могут вводиться один раз (однократное введение) или могут повторно вводиться, как например, два раза, три раза, четыре раза, пять раз, шесть раз, семь раз, восемь раз, девять раз, десять раз, более десяти раз или даже постоянно. Между двумя введениями может быть временной интервал менее одного часа, один час или более, шесть часов или более, двенадцать часов или более, 24 часа или более. Введение может быть ежедневным, может быть два раза в день, три раза в день, четыре раза в день, каждый второй день, каждые три дня, еженедельно, раз в две недели, ежемесячно, два раза в год или ежегодно.
В предпочтительном варианте выполнения настоящего изобретения соединение или фармацевтическая композиция согласно настоящему изобретению вводится в комбинации с одним или более дополнительными стимулирующими агентами, активирующими иммунные клетки.
Иммунными клетками, используемыми в контексте настоящего изобретения, могут быть любые иммунные клетки, известные в данной области. Иммунные клетки могут быть клетками адаптивной иммунной системы (например, Т-клетки или В-клетки, клетки врожденной иммунной системы (природные клетки-киллеры (NK), макрофаги, моноциты), и/или клетки, принадлежащие обеим группам (например, дендритные клетки (DC), антигенпредставляющие клетки (АРС))) и/или клетки, известные для фагоцитарной активности, такие как базофильные, нейтрофильные или эозинофильные гранулоциты.
В предпочтительном варианте выполнения настоящего изобретения, иммунными клетками являются мононуклеарные клетки периферической крови (РВМС).
В предпочтительном варианте выполнения настоящего изобретения иммунные клетки выбраны из тех, которые несут Т-клеточный рецептор для распознавания антигенов (TCR) и CD4 и/или CD8 корецептор на их клеточной поверхности. Те иммунные клетки, которые несут корецептор CD4 на их клеточной поверхности, могут быть выбраны из группы, состоящей из Т-хелперных клеток (Th-клетки), макрофагов и дендритных клеток (DC). Те иммунные клетки, которые несут корецептор CD8 на их клеточной поверхности, могут быть выбраны из группы, состоящей из цитотоксических Т-клеток, природных клеток-киллеров (NK), кортикальных тимоцитов и дендритных клеток (DC).
В другом предпочтительном варианте выполнения настоящего изобретения иммунные клетки выбирают из группы, состоящей из Т клеток, NK клеток, моноцитов и В клеток.
В другом предпочтительном варианте выполнения настоящего изобретения иммунные клетки представляют собой Т клетки и/или NK клетки.
Хорошо известно, что Т клетки и NK клетки обладают особой эффективностью против неоплазии (в частности противоопухолевый иммунитет) и инфекционных заболеваний. NK клетки являются предпочтительными лимфоцитами, которые могут стимулироваться через Fc-рецептор (FcR). В частности, в контексте антителозависимой клеточноопосредованной цитотоксичности (ADCC) это может быть полезным в контексте настоящего изобретения (например, как однократное применение или при совместном введении терапевтического антитела против неопластических и/или инфекционных антигенов).
Хорошо известно, что В-клетки играют значительную роль в гуморальном ответе на инфекционные патогены. В данной области также известно, что также В-клетки могут также играть роль в развитии гуморального иммунитета против неопластических клеток.
Моноциты можно понимать как переходный фенотип клеток миелоидных клеток, присутствующих в большом количестве в РВМС. Более того, миелоидные клетки включают дендритные клетки (DC). Макрофаги могут оказывать как положительное, так и подавляющее воздействие на иммунитет, в частности противоопухолевые терапии. Макрофаги, представляющие особый интерес, включают макрофаги типа M1. Миелоидные клетки могут также включать супрессорные клетки миелоидного происхождения (MDSC), которые оказывают отрицательное влияние на противоопухолевый иммунный ответ. Миелоидные клетки могут стимулироваться через FC-рецептор (FcR). В частности, в контексте антителозависимой клеточноопосредованной цитотоксичности (ADCC) это может быть полезным в контексте настоящего изобретения (например, как однократное применение или при совместном введении терапевтического антитела против опухолевых и/или инфекционных антигенов). Это может также способствовать усилению естественного развития гуморального иммунитета против опухолевых антигенов у пациента.
Активация иммунных клеток может пониматься в самом широком смысле как увеличение иммунологической активности такой клетки и/или увеличение клеточной пролиферации таких клеток.
В более предпочтительном варианте выполнения настоящего изобретения дополнительный стимулирующий агент (агенты), активирующий/активирующие иммунные клетки, выбирают из группы, состоящей из одного или более антигенов опухолевого и/или инфекционного патогена, подлежащего лечению, одного или более агонистов TCR или CD3, одного или более агонистов CD28, одного или более агонистов к другим костимулирующим рецепторам поверхности Т-клеток, таким как CD40L, CD69, ОХ40, GITR, CD137, CD27 и/или HVEM и комбинации двух или более из них.
Агонистом TCR/CD3 может быть любой агент, запускающий CD3. Это может быть пептидный или непептидный агонист, связывающийся с внеклеточной стороной TCR/CD3 в контексте или отсутствии МНС-зависимого представления антигена, может быть агонист, связывающийся с внутриклеточной стороной TCR/CD3, или может быть агент, активирующий внутриклеточный путь сигнальной трансдукции, запускаемый TCR/CD3 включением. Предпочтительно, агонист CD3 может представлять собой анти-CD3-антитело, пептидный антиген, представленный МНС I или МНС II, фрагмент анти-CD3 антитела или миметик анти-CD3-антитела. Весьма предпочтительно, агонист CD3 является опухолевым антигеном, представленным МНС I или МНС II.
Агонистом CD28 может быть любой агент, запускающий CD28. Это может быть агонист, связывающийся с внеклеточной стороной CD28, может быть агонист, связывающийся с внутриклеточной стороной CD28 или может быть агент, активирующий внутриклеточный путь сигнальной трансдукции, запускаемый CD28. Предпочтительно, агонист CD28 может представлять собой анти-CD28-антитело, фрагмент анти-CD28-антитела, миметик анти-CD28-антитела или белок, содержащий природный лиганд для CD28, такой как В7.1 или В7.2. Весьма предпочтительно, агонист CD28 представляет собой (агонистическое) анти-CD28-антитело или Ig слитый белок, содержащий природный лиганд для CD28, такой как В7.1 или В7.2.
Антитело в контексте настоящего изобретения может быть моноклональным или поликлональным антителом любого вида или происхождения. Оно может связываться с любым эпитопом (эпитопами), содержащимся в полипептиде, несущем соответствующий родственный антиген (например, CD3 или CD28, соответственно), включая его посттрансляционные модификации. Родственный антиген может быть, например, линейным эпитопом, структурным эпитопом, первичным эпитопом, и/или вторичным эпитопом. Антитело может быть природного происхождения, генно-технологического происхождения и/или синтетического происхождения.
Фрагмент антитела можно понимать в самом широком смысле как любой фрагмент антитела, который все еще имеет аффинность связывания с его целевым полипептидом. В качестве примера, фрагмент антитела может быть антигенсвязывающим доменом (Fab-фрагментом), усеченным антителом, содержащим одну или обе области, определяющие комплементарность (CDR) или вариабельный фрагмент (Fv) антитела. Фрагменты антител могут быть природного происхождения, генно-технологического происхождения и/или синтетического происхождения.
Миметик антитела может быть понят в самом широком смысле как органические соединения, которые, подобно антителам, могут специфически связывать антигены и которые обычно имеют молекулярную массу в диапазоне от приблизительно 3 кДа до приблизительно 25 кДа. Миметики антител могут быть, например, молекулами Affibody (Affibodies), Affilins, Affitins, Anticalins, Avimers, DARPins, Fynomers, пептидами домена Куница, однодоменными антителами (например, антителами VHH или антителами VNAR), монотелами, диателами, триотелами, flexibodies и tandabs. Миметики антител могут быть природного происхождения, генно-технологического происхождения и/или синтетического происхождения.
Пептидные антигены могут быть поняты в самом широком смысле как органические соединения, которые специфически связываются с молекулами МНС I или МНС II и которые обычно состоят из 8-30 аминокислот и предпочтительно состоят из 9-25 аминокислот. Пептиды могут быть природного происхождения, генно-технологического происхождения и/или синтетического происхождения.
Предпочтительно, дополнительные стимулирующие агенты, активирующие иммунные клетки, представляют собой комбинацию одного или более агонистов CD3 и одного или более агонистов CD28. В частности, предпочтительными дополнительными стимулирующими агентами, активирующими иммунные клетки, являются комбинация по меньшей мере одного (агонистического) анти-CD3-антитела и по меньшей мере одного (агонистического) анти-CD28-антитела. Как видно из приведенных ниже примеров, стимуляция иммунных клеток путем их контактирования с (агонистическими) анти-CD3-антителами и/или (агонистическими) анти-CD28-антителами механически имитирует Т-клетки, независимо от отдельного TCR-распознаваемого специфического антигена. Стимуляция (агонистическими) анти-CD3-антителами и (агонистическими) анти-CD28-антителами очень хорошо имитирует активацию Т-клеток в организме пациента in vivo.
Дополнительно или альтернативно, иммунные клетки могут также запускаться антигеном опухолевого и/или инфекционного патогена (например, путем вакцинации пациента одним или более антигенами). Затем антиген рассматривается как стимулирующий агент. Антиген опухолевого и/или инфекционного патогена может быть, например, вакциной, содержащей один или более антигенов опухолевого и/или инфекционного патогена, такой как, например, вакцина на основе полипептида, полинуклеотидная вакцина, олигосахаридная вакцины или вакцина на основе фрагментов опухолевых того же типа или на основе фрагментов инфекционных патогенов того же типа. Специалисту в данной области известны многочисленные способы обеспечения таких вакцин. Некоторые противоопухолевые и противовирусные вакцины также являются коммерчески доступными.
Дополнительно или альтернативно, иммунные клетки могут также запускаться антиген-загруженными антиген-представляющими клетками (АРС). Затем антиген-загруженные АРС рассматриваются как дополнительный стимулирующий агент. В этом контексте антигены также являются антигенами опухолевых и/или инфекционных патогенов, как упоминалось ранее.
Дополнительно или альтернативно, один или более дополнительные стимулирующие агенты могут быть выбраны из группы, состоящей из терапевтических средств, блокирующих контрольную точку (в частности, агентов, связывающих поверхностные рецепторы Т-клеток, таких как, например, связывающих один или более, выбранный из группы, состоящей из CTLA4, PD-1, PDL-1, TIM3, LAG3, BTLA, VISTA и/или их лиганда (например, антитела против CTLA4, PD-1 и/или PDL-1)), цитокинов (например, IL-2, IL-15 и/или IL-7), АРС - активирующих агентов (например, агонисты CD40), адоптивных клеточных агентов (в частности, адоптивные Т-клетки (например, Т-клеточная терапия химерного иммунного рецептора, такая как, например, CAR Т-клеточная терапия), терапевтических дендритых клеток (например, сипулеуцел-Т) и/или природных терапевтических клеток-киллеров), усилителей функций Т-клеток (например, леналидомид и связанные агенты), усилителей функций природных клеток-киллеров (например, антитела против KIR) и терапевтических антител, направленных против опухолевых антигенов.
Необязательно, в частности, когда пациент страдает от неопластического заболевания, пациенту может дополнительно вводиться одно или более химиотерапевтических средств, цитокин (цитокины) и/или другое противонеопластическиое средство (средства) в дополнение к одному или более соединениям согласно настоящему изобретению. Например, такие химиотерапевтические средства, цитокины и противораковые средства могут быть выбраны из группы, состоящей из поликлональных или моноклональных антител (например, ритуксимаб, трастузумаб, цетуксимаб, бевацизумаб, базиликсимаб, даклизумаб), антиметаболитов (например, 5-фторурацил, азатиоприн, 6-меркаптопурин, меркаптопурин, пиримидины, тиогуанин, флударабин, флоксуридин, цитозин арабинозид (цитарабин), пеметрексед, ралтитрексед, пралатрексат, метотрексат), алкилирующих агентов (например, мехлорэтамин, циклофосфамид, хлорамбуцил, ифосфамид), платины (например, цисплатин, карбоплатин, оксалиплатин), растительных алкалоидов и терпеноидов (например, алкалоиды барвинка (винкристин, винбластин, винорелбин, виндезин), таксанов (например, паклитаксел), цитоксан), ингибиторов топоизомеразы (например, камптотецины: иринотекан, топотекан, этопозид, этопозидфосфат, тенипозид), мелфалаан, противонеопластических средств (например, доксорубицин (адриамицин), доксорубицин липо, эпирубицин, блеомицин)), актиномицина D, аминоглутетимида, амсакрина, анастрозола, антагонистов пуриновых и пиримидиновых оснований, антрациклинов, ингибиторов ароматазы, аспарагиназы, антиэстрогенов, бексаротена, бусерелина, бусульфан, производных камптотецина, капецитабина, кармустина, кладрибина, цитарабина, цитозин арабинозида, алкилирующих цитостатиков, дакарбазина, даунорубицина, доцетаксела, эпирубицина, эстрамустина, этопозида, экземестана, флударабина, фторурацила, антагонистов фолиевой кислоты, форместана, гемцитабина, глюкокортикоидов, гозерелинв, гормонов и антагонистов гормонов, гикамтина, гидроксимочевины, идарубицина, иринотекана, летрозола, лейпрорелина, ломустина, меркаптонурина, милтефозина, митомицинов, ингибиторов митоза, митоксантрона, нимустина, прокарбазина, тамоксифена, темозоломида, тенипозида, тестолактона, тиотепа, ингибиторов топоизомеразы, треосульфана, третиноина, трипторелина, трофосфамида, цитостатически активных антибиотиковв, эверолимуса, пимекролимуса, такролимуса, азитромицина, спирамицина, сиролимуса (рапамицин), рокситромицина, аскомицина, бафиломицина, эритромицина, мидекамицина, джозамицина, конканкамицина, кларитромицина, тролеандомицина, фолимицина, тобрамицина, мутимицина, дактиномицина, дактиномицина, ребеккамицина, статина (например, церивастатина, симвастатина, ловастатина, соматостатина, флувастатина, нистатина, розувастатина, аторвастатина, правастатина, питавастатина, пентостатина), 4-гидроксиоксициклофосмида, бендамустина, тимозина α-1, акларубицина, флударабин-5'-дигидрофосфата, гидроксикарбамида, алдеслейкина, пегаспаргазы, цефарантина, эпотилона А и В, азатиоприна, микофенолат мофетила, с-myc-антисмысловой, b-myc-антисмысловой, бетулиновой кислоты, камптотецина, меланоцит-стемулирующего гормона (α-MSH), активированного белка С, ингибитора IL-1β, фумаровой кислоты и ее сложных эфиров, дермицидина, кальципотриола, такклацита, лапахола, β-лапахона, подофиллотоксина, бетулина, 2-этилгидразида подофилловой кислоты, молграмостима (rhuGM-CSF), пэгинтерферона αа-2b, ленограстима (r-HuG-CSF), филграстима, макрогола, цефаломаннина, селектина (антагонист цитокина), ингибитора СЕТР, кадгеринов, ингибиторов цитокинина, ингибитора СОХ-2 (СОХ-2 или СОХ-3 ингибитор), ангиопептина, ципрофлоксацина, флуробластина, антагонистов bFGF, пробукола, простагландинов, 1,11-диметоксикантин-6-она, 1-гидрокси-11-метоксикантин-6-она, скополектина, колхицина, доноров NO, пентаэритритол тетранитрата, синдноиминов, S-нитрозопроизводных,, стауроспорина, β-эстрадиола, α-эстрадиола, эстриола, эстрона, этинилэстрадиола, фосфестрола, медроксипрогестерона, циклоспорина А, паклитаксела и его производных, в частности 6-α-гидроксипаклитаксела, баккатина, таксотера, мофебутазона, ацеметацина, диклофенака, лоназолака, дапсона, о-карбамоилфеноксиуксусной кислоты, лидокаина, кетопрофена, мефенамовой кислоты, пироксикама, мелоксикама, хлорохин фосфата, пеницилламина, гидроксихлорохина, ауранофина, аутротиомалата натрия, оксасепрола, целекоксиба, β-ситостерола, адеметионина, миртекаина, полидоканола, нонивамида, левоментола, бензокаина, аэсцина, элиптицина, Calbiochem D-24851, кольцемида, цитохалазина А-Е, инданоцина, нокодазола, бацитрацина, антагонистов витронектинового рецептора, азеластина, свободных нуклеиновых кислот, нуклеиновых кислот, инкорпорированных в вирусные переносчики, фрагментов ДНК и РНК, ингибиторов активатора плазминогена 1, ингибиторов активатора плазминогена 2, антисмысловых олигонуклеотидов, ингибиторов VEGF, IGF-1, активных агентов из группы антибиотиков цефадроксил, цефазолина, цефаклора, цефокситина, гентацимина, пенициллина, диклоксациллина, оксациллина, сульфонамидов, метронидазола, антитромботических препаратов, аргатробана, аспирина, абциксимаба, синтетического антитромбина, бивалирудина, коумадина, эноксорапина, мембранного рецептора тромбоцитов GpIIb/IIIa, антитело-ингибитор фактора Ха, гепарина, гирудина, r-гирудина, PPACK, протамина, проурокиназы, стрептокиназа, варфарина, урокиназа, вазодилататора, дипирамидола, трапидила, нитропруссидов, антагонистов PDGF, триазолпиримидина, серамина, ингибиторов АСЕ, каптоприла, силазаприла, лизиноприла, эналаприла, лосартана, ингибиторов тиопротеазы, простациклина, вапипроста, α-, β- и γ-интерферона, антагонистов гистамина, блокаторов серотонина, ингибиторов апоптоза, регуляторов апоптоза, антисмысловых олигонуклеотидов р65 NF-kB и Bcl-xL, галофугинона, нифедипина, токоферола, молсидомина, полифенолов чая, эпикатехингаллата, эпигаллокатехингаллата, босвелловых кислот и их производных, лефлуномида, анакинра, этанерцепта, сульфасалазина, тетрациклина, триамицинолона, прокаинимида, ретиноевой кислоты, хинидина, дисопиримида, флекаинида, пропафенона, сотолола, амидорона, природных и полученных синтетическим путем стероидов, такие как бриофиллин А, инотодиол, маквирозид А, мансонин, стреблозид, гидроксикортизон, бетаметазон, дексаметазон, фенопрофен, ибупрофен, индометацин, напроксен, фенилбутазон, ацикловир, ганцикловир, зидовудин, противогрибковые препараты, клотримазол, флуцитозин, гризеофульвин, кетоконазол, миконазол, тербинафин, хлорохин, мефлохин, хинин, природные терпеноиды, гиппокаескулин, баррингтогенол-С21-ангелат, 14-дегидроагростистахин, агроскерин, агроститахин, 17-гидроксиагроститахин, оватодиолиды, 4,7-оксициклоанизомеловая кислота, баккариноиды B1, В2, В3 и В7, тубеимозид, бруцеанол А, В, С, бруцентинозид С, йаданциозиды N и Р, изодезоксиэлефантопин, томенфантопин А и В, коронарин А, В, С и D, урсоловой кислоты, гиптатовой кислоты А, цеорина, изоиридогерманала, майтенфолиола, эффусантина А, эксцисанина А и В, лонгикаурина В, скальпонеатина С, камебаунина, лейкаменина А и В, 13,18-дегидро-6-α-сенециоилоксишапаррина, таксамаирина А и В, регенилола, триптолида, цимарина, апоцимарина, аристолоховой кислоты, аноптерина, гидроксианоптерина, анемонина, протоанемонина, берберина, хелибурин хлорида, циктоксина, синококулина, комбрестатина А и В, кудраизофлавона А, куркумина, дигидронитидина, нитидин хлорида, 12-β-гидроксипрегнадиен-3,20-диона, билобола, гинкгол, гинкголовой кислоты, хеленалина, индицина, индицин-N-оксида, ласиокарпина, инотодиола, гликозида 1а, джастицидина А и В, ларреатина, маллотерина, маллотохроманола, изобутирилмаллотохроманола, маршантина А, майтанзина, ликоридицина, маргентина, панкратистатина, лириоденина, биспартенолидина, оксоушинсунина, аристолактам-AII, периплокозида А, галакинозида, дезоксипсороспермина, псикорубина, рицина А, сангвинарина, кислоты из пшеницы манву, метилсорбифолина, хромонов пленки, стизофиллинакагерина, дигидроусамбарензина, гидроксиусамбарина, стрихнопентамина, стрихнофиллина, усамбарина, усамбарензина, дафноретина, ларициресинола, метоксиларициресинола, сирингаресинола, умбеллиферона, афромосона, ацетилвисмиона В, дезацетилвисмиона А, висмиона А и В), лучевой терапии (например, лучевая терапия с модулированной интенсивностью (IMRT), трехмерной конформной лучевой терапии (3DCRT), стереотаксической радиотерапии (SBRT), стереотаксической радиохирургии (SRS), лучевой терапии с визуальным контролем (IGRT), лучевой терапии заряженными частицами (например, протонная терапия), близкофокусной лучевой терапии, радиоизотопной терапии (RIT) (например, йод-131, лютеций-177, стронций-89 и самарий (153Sm) лексидронам и/или иттрий-90)), антиангиогенной терапии (например, карбоксиамидотриазол, TNP-470, СМ101, сурамин, SU5416, тромбоспондин, антагонисты VEGFR, ангиостатические стероиды + гепарин, ангиогенез ингибирующий фактор, полученный из хряща, ингибиторы матричной металлопротеиназы, 2-метоксиэстрадиол, текогалан, тетратиомолибдат, талидомид, тромбоспондин, растворимые VEGFR-1 и NRP-1, ангиопоэтин 2, ангиостатин (например, ангиостатин TSP-1 и TSP-2), эндостатина, вазостатина, канстатина, кальретикулина, тромбоцитарного фактора-4, TIMP и CDAI, Meth-1 и Meth-2, CXCL10протромбина ("kringle"-домен-2), фрагмента антитромбина III пролактин, VEGI, SPARC, остеопонтина, маспина, связанного с пролиферином белока, рестина), киназных ингибиторов (например, иматиниб, иматиниб мезилат, гефитиниб, эрлотиниб, пазопаниб, апатитиб), ингибиторов протеасомы (например, бортезомиб), ингибиторов PARP (например, инипариб, олапариб) и комбинаций двух или более из них.
Альтернативно или дополнительно, пациенту, страдающему от или подверженному риску развития неопластического и/или инфекционного заболевания, может дополнительно вводиться один или более цитокинов, гормонов или их аналогов (например, селективный модулятор эстрогенового рецептора тамоксифен, IL-2, IFN-α, IFN-β, IFN-γ, IL-4, IL-12, IL-18, тромбоцитарный фактор-4, TNF-α). Эти цитокины, гормоны или их аналоги могут дополнительно стимулировать иммунную систему пациента. Как упоминалось ранее, высокие дозы многих таких агентов могут вызывать серьезные побочные эффекты. Однако более низкие дозы могут быть необязательно использованы для поддержки лечения или профилактики в соответствии с настоящим изобретением.
Необязательно, в частности, когда пациент страдает от вирусной инфекции, пациенту могут дополнительно вводиться одно или более противовирусных соединений в дополнение к одному или более соединениям согласно настоящему изобретению. Такое противовирусное соединение может быть, например, выбрано из группы, состоящей из ингибитора проникновения или слияния, нуклеозидного/нуклеотидного ингибитора обратной транскриптазы, ненуклеозидного ингибитора обратной транскриптазы, ингибитора интегразы и ингибитора протеазы.
Необязательно, в частности, когда пациент страдает от бактериальной инфекции, пациенту может дополнительно вводиться один или более антибактериальных антибиотиков в дополнение к одному или более соединениям согласно настоящему изобретению. Такой антибактериальный антибиотик может, например, быть выбран из группы, состоящей из антибиотиков, нацеленных на стенки бактериальных клеток (например, пенициллины и цефалоспорины) или клеточную мембрану (например, полимиксины), вмешивающихся в основные бактериальные ферменты (например, рифамицины, липиармицины, хинолоны и сульфонамид), и/или нацеленных на синтез полипептидов (например, макролиды, линкосамиды и тетрациклины).
Кроме того, лечение или профилактика в соответствии с настоящим изобретением также могут быть объединены с другими средствами лечения, такими как, например, лучевая терапия (например, на основе рентгеновского излучения, ультрафиолетового (УФ) излучения (например, УФ-А, УФ-В, и/или UV-C), альфа-излучения, бета-излучения, гамма-излучения или космического излучение), и/или хирургия.
Как указано выше, следует понимать, что соединения согласно настоящему изобретению, могут очень хорошо применяться для лечения и/или профилактики неопластических и/или инфекционных заболеваний у пациента in vivo. Однако соединение согласно настоящему изобретению может не просто использоваться для применения in vivo, но также и для любого вида ex vivo и/или in vitro применения. Кроме того, оно может также применяться для активации иммунных клеток in vivo, ex vivo и in vitro.
Например, соединения согласно настоящему изобретению, могут быть использованы любым способом, поддерживающим образование и/или амплификацию иммунных клеток ex vivo и/или in vitro, в частности, но не обязательно для дальнейшего использования в адоптивной клеточной терапии (ACT). Для ACT предпочтительно использовать антигенспецифичные Т-клетки. Такие способы могут также обеспечивать активированные DC, которые могут быть необязательно полезны для подходов DC-вакцинации.
Поэтому другим объектом настоящего изобретения является способ получения активированных иммунных клеток, включающий стадии:
(i) обеспечение иммунных клеток;
(ii) контакт клеток со стадии (i) с:
(а) по меньшей мере одним соединением или его фармацевтически приемлемой солью согласно настоящему изобретению, и необязательно
(b) одним или более другими стимулирующими агентами, активирующими указанные иммунные клетки; и
(iii) культивирование клеток со стадии (ii) в условиях, подходящих для поддержания жизнеспособности указанных клеток.
В отношении этого объекта, относящегося к такому способу, определения, подробно изложенные выше, также применяются с необходимыми изменениями.
Предпочтительно, способ проводят ex vivo и/или in vitro, т.е., он представляет собой ex vivo и/или in vitro способ. Следовательно, в контексте этого объекта, относящегося к такому способу, иммунные клетки активируются за пределами живого существа, в частности вне пациента.
Предпочтительно, иммунные клетки (например, Т-клетки и/или природные клетки-киллеры) представляют собой зрелые иммунные клетки. Такие клетки (в частности, Т-клетки) могут представлять собой CD4 + и/или CD8 + клетки. Иммунные клетки могут быть получены из любого источника, подходящего для этой цели. Альтернативно или дополнительно клетки могут также представлять собой В-клетки, такие как, например, CD19 + В-клетки. Специалисту в данной области известны различные способы получения таких иммунных клеток. Например, зрелые иммунные клетки могут быть получены из образца крови (например, сохраненной консервированной крови или свежей крови). Затем мононуклеарные клетки периферической крови (РВМС) могут быть, например, получены из лейкоцитарной пленки после центрифугирования образца крови и, необязательно, дополнительно выделены/очищены, например, путем введения маркеров специфичного к клеточной поверхности типа с флуорисцентно-меченными антителами, затем флуоресцентно активированной клеточной сортировки (проточная цитометрия), или путем введения маркеров специфичного к клеточной поверхности типа с антителами, меченными металлическими шариками, а затем магнитной экстракции желаемых клеток. Альтернативно, зрелые иммунные клетки также могут быть получены из клеточной культуры. Способы получения лейкоцитарной пленки и выделения и очистки клеток далее приведены в части Примеры ниже. (Зрелые) иммунные клетки также являются коммерчески доступными. Альтернативно, незрелые иммунные клетки или их предшественники могут быть использованы и созревать на стадии промежуточного соединения хорошо известными способами добавления соответствующих цитокинов и факторов роста.
Иммунные клетки затем контактируют, по меньшей мере с одним соединением согласно настоящему изобретению, и, необязательно, одним или более дополнительными стимулирующими агентами, активирующими иммунные клетки. Специалист в данной области немедленно отметит, что это соединение (соединения) и агент (агенты) могут быть добавлены к клеткам в любом виде раствора или среды, подходящей для клеток. Например, такой раствор или среда могут также содержать ингредиенты, определенные в контексте вышеприведенной фармацевтической композиции. Дополнительный стимулирующий агент, активирующий иммунные клетки-киллеры, может быть понят в самом широком смысле, как определено выше. Необязательно, дополнительный агент может вводиться одновременно, ранее или после относительно одного или более соединений согласно настоящему изобретению. Клетки могут контактировать с соединением (соединениями) и/или агентом (агентами) менее 30 мин, по меньшей мере 30 мин, по меньшей мере 1 ч, в течение по меньшей мере 2 ч, в течение по меньшей мере 5 ч, в течение по меньшей мере 12 ч, в течение по меньшей мере 1 дня и более.
После или одновременно с контактом клеток с соединением (соединениями) и необязательным агентом (агентами) (стадия (ii)) клетки культивируют в условиях, подходящих для поддержания жизнеспособности указанных клеток (стадия (iii)). Следовательно, стадии (ii) и (iii) могут проводиться как одна стадия (одновременно) или две отдельные стадии (последовательно) или с частично временным перекрытием. Как правило, клетки культивируют в подходящей клеточной культуральной среде (например, X-Vivo 15), оптимизированной для культивирования клеток в отсутствие FCS RPMI 1640), необязательно дополненной фетальной телячьей сывороткой (FCS) при 5% CO2 и температуре 30°C-39°C, предпочтительно (около) 37°C. Предпочтительно, клетки культивируют в течение по меньшей мере 1 ч, в течение по меньшей мере 2 ч, в течение по меньшей мере 5 часов, в течение по меньшей мере 12 часов, в течение по меньшей мере 1 дня или в течение по меньшей мере 3 дней.
В результате способа согласно настоящему изобретению, могут быть получены активированные иммунные клетки (например, Т-клетки и/или природные клетки-киллеры).
Эти активированные иммунные клетки могут быть необязательно выделены любыми способами, известными в данной области (необязательная стадия (iv)). Необязательно, в качестве дополнительной стадии (v) активированные иммунные клетки могут впоследствии вводиться пациенту, нуждающемуся в этом. Альтернативно, выделенные активированные иммунные клетки, полученные на стадии (iv), или клетки со стадии (iii), также могут храниться и/или консервироваться (например, диспергироваться в среде, содержащей DMSO, и храниться при -80°C). Альтернативно, выделенные активированные иммунные клетки со стадии (iv) или клетки со стадии (iii) могут быть использованы для любых других in vitro и/или in vivo целей. Например, такие активированные иммунные клетки могут использоваться в целях исследования, предназначенных для дальнейшего исследования активированных иммунных клеток (в частности, активированных Т-клеток и/или природных клеток-киллеров).
Например, активированные иммунные клетки (в частности активированные Т-клетки и/или природные клетки-киллеры) могут быть использованы для получения цитокинов, секретируемых клетками. Затем дополнительная стадия (iv) представляет собой культивирование клеток до тех пор, пока уровень (уровни) желаемого цитокина (цитокинов), секретируемые в среду, не достигнет желаемого уровня, а затем стадия (v) выделения и, необязательно очищения желаемого цитокина (цитокинов). Выделение и необязательная очистка цитокинов могут выполняться любыми способами, известными в данной области, такими как, например, хроматографические средства. Необязательно, такой цитокин (цитокины) может затем быть сохранен и/или законсервирован (например, заморожен, высушен или лиофилизирован).
Кроме того, соединение согласно настоящему изобретению, может быть дополнительно использовано в качестве инструмента для исследования активации иммунных клеток более подробно.
Изобретение далее объясняется следующими примерами, которые предназначены для иллюстрации, но не ограничивают объем настоящего изобретения.
Примеры
Аббревиатуры
Химические соединения, композиции и способы, описанные в настоящей заявке, дополнительно иллюстрируются следующими неограничивающими примерами.
Как используется в настоящей заявке, следующие аббревиатуры имеют следующее значение. Если аббревиатура не определена, она имеет общепринятое значение.


Общие экспериментальные методики
Коммерчески доступные реагенты и растворители (класс ВЭЖХ) использовали без дальнейшей очистки. Спектры 1Н ЯМР регистрировали на спектрометре Bruker DRX 500 или спектроскопе Bruker DPX 250 МГц или Bruker Avance спектрометрах 300 МГц или Bruker Avance спектрометре 400 МГц в дейтерированных растворителях. Химические сдвиги (δ) определяли в ppm.
Соединения очищали колоночной флэш-хроматографией на диоксиде кремния с нормальной фазой на системах Biotage Isolera с использованием соответствующего картриджа SNAP и градиента. Альтернативно соединения очищали на обратной фазе с использованием систем Biotage Isolera с соответствующим картриджем SN18 С18 и обращеннофазным элюентом или с помощью препаративной ВЭЖХ (если указано иное).
Аналитическая HPLC-MS (METCR1278 GENERIC 3.5 Minutes) проводится на LCMS-2010EV, применяя обращеннофазные колонки Atlantis dC18 (3 мкм, 2.1 X 50 мм), при температуре колонки 40°C, градиент 5-100% В (А = вода / 0.1% муравьиная кислота, В = ацетонитрил / 0.1% муравьиная кислота) за 2.5 минут, затем 100% В в течение 0.2 минут, объем инъекции 3 мкл, поток = 1.0 мл/минут. УФ спектр получали при 215 нм, применяя SPD-M20A детектор с фотодиодной матрицей. Масс-спектр получали для диапазона m/z 150-850 при скорости взятия образца 2 скана в секунду, применяя a LCMS2010EV. Данные интегрировали и представляли, применяя программное обеспечение Shimadzu LCMS-Solutions и PsiPort.
Альтернативно аналитическая HPLC-MS (MET-LCMS (MUX)-A-008) представляет собой METCR1278 Generic 3.5 minutes, проводимую на системе Waters 1525 HPLC, применяя детектор длин волн Waters 2488 Dual и систему Waters LCT MUX.
Аналитическая HPLC-MS (METCR1673 GENERIC 2 Minutes) проводилась на Shimadzu LCMS-2010EV, применяя обращеннофазные колонки Supelco Ascentis Express (2.7 мкм, 2.1 X 30 мм), при температуре колонки 40°C, градиент 5-100% В (А = вода / 0.1% муравьиная кислота, В = ацетонитрил / 0.1% муравьиная кислота) за 1.5 минут, затем 100% В в течение 0.1 минут, объем инъекции 3 мкл, поток = 1.0 мл/минут. УФ спектр получали при 215 нм, применяя SPD-M20A детектор с фотодиодной матрицей. Масс-спектр получали для диапазона m/z 100-1000 при скорости взятия образца 2 скана в секунду, применяя а LCMS2010EV. Данные интегрировали и представляли, применяя программное обеспечение Shimadzu LCMS-Solutions и PsiPort.
Альтернативно, (METCR1416 GENERIC 7 MINUTES) аналитическая HPLC-MS на Shimadzu LCMS-2010EV, применяя обращеннофазные колонки Water Atlantis dC18 (3 мкм, 2.1 X 100 мм), при температуре колонки 40°C, градиент 5-100% В (А = вода / 0.1% муравьиная кислота, В = ацетонитрил / 0.1% муравьиная кислота) за 5.0 минут, затем 100% В в течение 0.4 минут, объем инъекции 3 мкл, поток = 0.6 мл/минут. УФ спектр получали при 215 нм, применяя SPD-M20A детектор с фотодиодной матрицей. Масс-спектр получали для диапазона m/z 150-850 при скорости взятия образца 2 скана в секунду, применяя aLCMS2010EV. Данные интегрировали и представляли, применяя программное обеспечение Shimadzu LCMS-Solutions и PsiPort.
Альтернативно, (METCR1410 GENERIC 1.7 MINUTES) аналитическая HPLC-MS на Shimadzu LCMS-2010EV, применяя обращеннофазные колонки Kinetex Core shell С18 (5 мкм, 2.1 X 50 мм), при температуре колонки 40°C, градиент 5-100% В (А = вода / 0.1% муравьиная кислота, В = ацетонитрил / 0.1% муравьиная кислота) за 1.2 минут, затем 100% В в течение 0.1 минут, объем инъекции 3 мкл, поток = 1.2 мл/минут. УФ спектр получали при 215 нм, применяя SPD-M20A детектор с фотодиодной матрицей. Масс-спектр получали для диапазона m/z 130-850 при скорости взятия образца 2 скана в секунду, применяя aLCMS2010EV. Данные интегрировали и представляли, применяя программное обеспечение Shimadzu LCMS-Solutions и PsiPort.
Альтернативно, (MET-uHPLC-AB-101) аналитическая HPLC-MS проводилась на системе Waters Acquity UPLC с Waters PDA и ELS детекторами, применяя Phenomenex Kinetex-XB C-18 колонку, (1.7 мкМ, 2.1 мм X 100 мм) при температуре колонки 40°C, градиент 5-100% В (А = вода / 0.1% муравьиная кислота; В = ацетонитрил / 0.1% муравьиная кислота) за 5.3 минут, затем 100% В в течение 0.5 минут, поток = 0.6 мл/минут. УФ спектр получали при 215 нм, применяя Waters Acquity фотодиодную матрицу. Масс-спектр получали для диапазона m/z 150-850 при скорости взятия образца 5 скана в секунду, применяя Waters SQD. Данные интегрировали и представляли, применяя программное обеспечение Waters MassLynx и OpenLynxsoftware.
Альтернативно, (MET-CR1600) аналитическая HPLC-MS проводилась на системе Agilent G1312A с Waters PDA и ELS детекторами, применяя Phenomenex Gemini-NX С-18 колонку, (3.0 мкМ, 2.0 мм X 100 мм) при температуре колонки 50°C, градиент 5-100% В (А = 2 мМ бикарбонат аммония, буферизованный до pH10 раствором гидроксида аммония; В = ацетонитрил) за 5.5 минут, затем 100% В в течение 0.4 минут, поток = 0.5 мл/минут. УФ спектр получали при 215 нм, применяя Waters 2996 фотодиодную матрицу. Масс-спектр получали для диапазона m/z 100-1000 при скорости взятия образца 5 скана в секунду, применяя Waters ZQ. Данные интегрировали и представляли, применяя программное обеспечение Waters MassLynx и OpenLynxsoftware.
Альтернативно, (MET-CR0990) аналитическая HPLC-MS проводилась на системе Agilent G1312A с Waters PDA и ELS детекторами, применяя Phenomenex Gemini-NX С-18 колонку, (3.0 мкМ, 2.0 мм X 50 мм) при температуре колонки 60°C, градиент 1-100% В (А = 2 мМ бикарбонат аммония, буферизованный до pH10 раствором гидроксида аммония; В = ацетонитрил) за 1.80 минут, затем 100% В в течение 0.3 минут, поток = 1 мл/минут. УФ спектр получали при 215 нм, применяя Waters 2996 фотодиодную матрицу. Масс-спектр получали для диапазона m/z 100-1000 при скорости взятия образца 5 скана в секунду, применяя Waters ZQ. Данные интегрировали и представляли, применяя программное обеспечение Waters MassLynx и OpenLynxsoftware.
Альтернативно, (METUPLCMS-A-004) аналитическая HPLC-MS проводилась на системе Waters Acquity UPLC с Waters PDA и 3100 MS, применяя Acquity UPLC ВЕН C18 (1.7 мкМ, 2.1 мм X 50 мм) при температуре колонки, равной температуре окружающей среды, градиент 5-100% В (А = вода : ацетонитрил (9:1, с 0.1% муравьиной кислоты); В = ацетонитрил : вода (9:1, с 0.1% муравьиной кислоты)) за 1.5 минут, затем 100% В в течение 0.2 минут, объем инъекции 4 мкл, поток = 0.7 мл/минут. УФ спектр получали при 215 нм, применяя Waters Acquity фотодиодную матрицу. Масс-спектр получали для диапазона m/z 150-850 при скорости взятия образца 5 скана в секунду. Данные интегрировали и представляли, применяя программное обеспечение Waters MassLynx и OpenLynxsoftware.
Альтернативно, (MET-UPLCMS-A-006) аналитическая HPLC-MS проводилась на системе Waters Acquity UPLC с детекторами Waters PDA и ELS, применяя Acquity UPLC HSS T3, (1.8 мкМ, 2.1 мм X 100 мм) при температуре колонки 40°C, градиент 5-100% В (А = вода : ацетонитрил (9:1, с 0.1% муравьиной кислоты); В = ацетонитрил : вода (9:1, с 0.1% муравьиной кислоты)) за 5.3 минут, затем 100% В в течение 0.5 минут, поток = 0.6 мл/минут. УФ спектр получали при 215 нм, применяя Waters Acquity фотодиодную матрицу. Масс-спектр получали для диапазона m/z 150-800 при скорости взятия образца 5 скана в секунду, применяя Waters 3100 спектрометр. Данные интегрировали и представляли, применяя программное обеспечение Waters MassLynx и OpenLynxsoftware.
Альтернативно, (MET-UPLCMS-B-007) аналитическая HPLC-MS проводилась на системе Waters Acquity UPLC с детекторами Waters PDA и ELS, применяя Acquity UPLC ВЕН С18, (1.7 мкМ, 2.1 мм, X 100 м) при температуре колонки 40°C, градиент 5-100% В (А = 2 мМ бикарбонат аммония, буферизованный до pH10; В = ацетонитрил и 2 мМ бикарбоната аммония буферизованный до pH10 (95:5)) за 5.30 минут, затем 100% В в течение 0.5 минут, поток = 0.6 мл. УФ спектр получали при 215 нм, применяя Waters Acquity фотодиодную матрицу. Масс-спектр получали для диапазона m/z 150-800 при скорости взятия образца 5 скана в секунду, применяя Waters 3100 спектрометр. Данные интегрировали и представляли, применяя программное обеспечение Waters MassLynx и OpenLynxsoftware.
Альтернативно, (METCR1981 hydrophobic 3 minutes) аналитическая HPLC-MS на системе Shimadzu LCMS-2010EV, применяя обращеннофазные колонки waters Symmetryshield RP8 (3.5 мкм, 2.1 X 50 мм), при температуре колонки 40°C, градиент 5-100% В (А = вода / 0.1% муравьиная кислота, В = ацетонитрил / 0.1% муравьиная кислота) за 2.2 минут, 100% В в течение 0.5 минут, объем инъекции 3 мл, поток = 1 мл/минут. УФ спектр получали при 215 нм, применяя SPD-M20A детектор с фотодиодной матрицей. Масс-спектр получали для диапазона m/z 130-850 при скорости взятия образца 2 скана в секунду, применяя aLCMS2010EV. Данные интегрировали и представляли, применяя программное обеспечение Shimadzu LCMS-Solutions и PsiPort.
Все соединения проявляли чистоту >95% как определено этими способами, если иного не указано.
Названия соединений были получены с применением программного обеспечения ChemAxon: Instant JChem Excel IUPACName function.
Синтез промежуточных соединений/синтетических структурных блоков
Синтез промежуточного соединения А-03

Промежуточные соединения А-01, А-02 и А03 были синтезированы посредством адаптации способа, описанного R. Breitschuh, D. Seebach Synthesis, 1992, 1-2, 83-89.
Стадия 1: Синтез трет-бутил N-[(2S,3S)-2-метил-4-оксооксетан-3-ил]карбамата (промежуточное соединение А-01)
Et3N (2.67 мл, 19.16 ммоль), а затем HBTU (3.63 г, 9.68 ммоль) добавили в раствор (2S,3S)-2-{[(трет-бутокси)карбонил]амино}-3-гидроксибутановой кислоты (2 г, 4.79 ммоль) в безводном DCM (100 мл). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удалили при пониженном давлении, и остаток очистили посредством колоночной флеш-хроматографии (элюент : гептаны, 0-40% EtOAc) с получением 630 мг целевого продукта в виде твердого вещества белого цвета с выходом 65% и хорошей чистотой по ЯМР (>95%)
ЯМР: 1H ЯМР (500 МГц, DMSO-d6) δ 7.79 (d, J=8.0 Гц, 1H), 4.79-4.68 (m, 1H), 4.61 (dd, J=8.0, 4.3 Гц, 1H), 1.47 (d, J=6.2 Гц, 3H), 1.40 (s, 9H).
Стадия 2: (2R,3R)-3-(ацетилсульфанил)-2-{[(трет-бутокси)карбонил]-амино}бутановой кислоты (промежуточное соединение A-02)
Промежуточное соединение А-01 (95%, 430 мг, 2.03 ммоль) растворили в безводном DMF (14 мл), этантиоат калия (348 мг, 3.05 ммоль, 1.5 зкв.) добавили, и реакционную смесь перемешивали при комнатной температуре в атмосфере азота (выход газа очищали с помощью водного осветлителя) в течение 18 ч. Еще этантиоат калия (347.78 мг, 3.05 ммоль, и 1.5 зкв.) добавили, и перемешивание продолжали в течение 18 ч. Реакционную смесь погасили с помощью 1H водной HCl (15 мл), и смесь экстрагировали с помощью EtOAc (3×15 мл). Объединенные органические экстракты промыли водой (15 мл) и соляным раствором (15 мл) и высушили над Na2SO4. Посредством фильтрации и концентрирования при пониженном давлении получили 673 мг целевого продукта в виде твердого вещества белого цвета с 97% УФ чистотой и количественным выходом, который применяли на следующей стадии без дальнейшей очистки.
LCMS: METCR1673 Generic 2 minutes rt=1.12 мин, M/Z (ES-)=276 [M-H+], 97% УФ
NMR: 1H ЯМР (500 МГц, DMSO-d6) δ 12.89 (s, 1H), 7.08 (d, J=8.5 Гц, 1H), 4.22 (dd, J=8.1, 5.5 Гц, 1H), 3.93-3.67 (m, 1H), 2.30 (s, 3H), 1.39 (s, 9H), 1.25 (d, J=7.0 Гц, 3H)
Стадия 3: Синтез (2R,3R)-2-{[(трет-бутокси)карбонил]амино}-3-сульфанилбутановой кислоты (промежуточное соединение А-03)
1М водный LiOH⋅H2O (12 мл) добавили в раствор промежуточное соединение А-02 (673 мг, 2.08 ммоль) в МеОН (27 мл). Полученную смесь перемешивали при комнатной температуре в течение 1.5 ч. Насыщенный водный NaHCO3 (13 мл) добавили в реакционную смесь, и органический растворитель удалили при пониженном давлении. Водный остаток промыли с помощью Et2O (10 мл), и затем pH довели до pH 1 с помощью водного 1М раствора HCl. Полученный основный водный слой экстрагировали с помощью EtOAc (2×50 мл). Объединенные EtOAc экстракты высушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении с получением 526 мг целевого продукта в виде масла желтого цвета с 80% УФ чистотой при 87% выходе, который применяли на следующей стадии без дальнейшей очистки.
LCMS: METCR1673 Generic 2 minutes rt=1.09 мин, M/Z (ES-)=234 [M-H+], 80% УФ
Синтез промежуточного соединения I-03

Путь синтеза осуществляли путем адаптации способа, описанного в Е. Ayral et al. Bioorg. Med. Chem. Lett. 2009, 19, 1386-1391.
Стадия 1: Синтез (2R)-2-{[(трет-бутокси)карбонил]амино}-3-{[4-(метоксикарбонил)-2-нитрофенил]сульфанил}пропановой кислоты (промежуточное соединение I-01)
Метил 4-фтор-3-нитробензоат (15 г, 75.33 ммоль) растворили в 300 мл EtOH. N-(трет-бутоксикарбонил)-L-цистеин (15.15 г, 68.48 ммоль) добавили в виде одной части, а затем раствор NaHCO3 (12.6 г, 150.6 ммоль) в воде (75 мл). Суспензию ярко желтого цвета перемешивали при 80°C в течение 3 ч. Растворитель удалили при пониженном давлении. Остаток разбавили водой (100 мл) и промыли с помощью Et2O (3×50 мл). Водную фазу подкислили с помощью 1М HCl и экстрагировали с помощью EtOAc (2×80 мл). Объединенные органические фазы промыли соляным раствором, высушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении с получением 29.36 г целевого продукта в виде твердого вещества бледно-желтого цвета с выходом 86.7%.
LCMS: METCR1416 Generic 7 minutes rt=3.15 мин, M/Z (ES-)=399 [M-H+], 81%
NMR: 1H ЯМР (500 МГц, CDCl3) δ 8.80 (s, 1H), 8.18 (dd, J=8.5, 1.6 Гц, 2H), 7.62 (d, J=8.3 Гц, 1H), 5.38 (d, J=6.9 Гц, 1H), 4.73-4.67 (m, 1H), 3.96 (s, 3H), 1.43 (s, 9H).
Стадия 2: Синтез (2R)-3-{[2-амино-4-(метоксикарбонил)фенил]сульфанил}-2-{[(трет-бутокси)карбонил]амино}пропановой кислоты (промежуточное соединение I-02)
1М HCl (6.5 мл, 6.53 ммоль, 0.1 экв.) добавили к промежуточному соединению I-01 (89%, 29.4 г, 65.26 ммоль, 1 экв.), растворенному в 60/1 EtOH / воде (610 мл). Реакционную смесь нагревали при 50°C, затем железо (36.44 г, 652.6 ммоль, 10 экв.) добавили в реакционную смесь. Реакционную смесь перемешивали и нагревали при 80°C в течение 16 ч. Реакционную смесь затем охладили и отфильтровали через Celite®. Celite® промыли с помощью EtOH (4×400 мл). Фильтраты объединили и концентрировали до 400 мл. Раствор темного цвета отфильтровали еще раз через целит и промыли с помощью EtOH (4×300 мл). Фильтраты объединили и концентрировали при пониженном давлении с получением 24.9 г целевого продукта в виде твердого вещества темного цвета с выходом 80%.
LCMS: METCR1673 Generic 2 minutes rt=1.71 мин, M/Z (ES+)=393 [M+Na+], 71% УФ
Стадия 3: Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (промежуточное соединение I-03)
NaHCO3 (22.0 г, 262.16 ммоль, 5 экв.), а затем PyBOP (30.0 г, 57.68 ммоль, 1.1 экв.) добавили к промежуточному соединению I-02 (78%, 24.9 г, 52.43 ммоль, 1 экв.) в безводном DMF (500 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток суспендировали в DCM (500 мл), и суспензию промыли с помощью 1N NaOH (200 мл). Полученную эмульсию отфильтровали через спеченную воронку, и остаток промыли с помощью DCM (2×150 мл). Фильтраты объединили, и слои разделили. Органический слой промыли с помощью нас. NaHCO3 (2×100 мл), 1% раствора лимонной кислоты (100 мл) затем соляным раствором (100 мл), и высушили на Na2SO4. Посредством фильтрации и концентрирования при пониженном давлении получили неочищенный продукт в виде масла коричневого цвета. Очистка посредством колоночной флэш-хроматографии (диоксид кремния, элюент : DCM и 0-0.1% МеОН), а затем измельчение в Et2O обеспечили 9.9 г целевого соединения в виде твердого вещества грязновато-белого цвета с выходом 48%.
LCMS: METCR1673 Generic 2 minutes: rt=1.91 min, M/Z (ES+)=375 [M+Na+], 91% УФ
NMR (500 МГц, CDCl3) δ 1.40 (s, 9H), 3.01 (t, J=11.38 Гц, 1H), 3.82 (dd, J=6.27, 10.90 Гц, 1H), 3.93 (s, 3H), 4.42-4.52 (m, 1H), 5.58 (d, J=7.33 Гц, 1H), 7.63-7.72 (m, 2H), 7.76 (d, J=1.56 Гц, 1H), 7.83 (dd, J=1.61, 8.03 Гц, 1H)
Синтез промежуточного соединения II-03

Стадия 1: Синтез метил 2,4-дифтор-5-нитробензоата (промежуточное соединение II-01')
2,4-дифтор-5-нитробензойную кислоту (25.00 г, 123 ммоль) растворили в МеОН (300 мл). Серную кислоту (0.7 мл, 12.3 ммоль, 0.1 экв.) добавили по каплям. Реакцию нагрели до 65°C в течение 40 ч. Реакционную смесь охладили и концентрировали при пониженном давлении. Остаток растворили в DCM (100 мл) и промыли с помощью воды (50 мл), насыщенного водного раствора NaHCO3 (50 мл) и соляного раствора (50 мл). Водный слой обратно-экстрагировали с помощью DCM (2×50 мл). Объединенные органические фазы высушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении с получением 25.21 г целевого продукта в виде твердого вещества светло-коричневого цвета. Выход: 93% при чистоте 99%.
LCMS: METCR1673 Generic 2 minutes rt=1.14 мин, M/Z (ES+) нет ионизации, 99%;
NMR: 1H ЯМР (500 МГц, DMSO-d6) δ 8.70-8.58 (m, 1H), 7.90 (t, J=11.0 Гц, 1H), 3.91 (s, 3H).
Стадия 2: Синтез (2R)-2-{[(трет-бутокси)карбонил]амино}-3-{[5-фтор-4-(метоксикарбонил)-2-нитрофенил]сульфанил}пропановой кислоты (промежуточное соединение II-01)
К перемешиваемому раствору промежуточного соединения II-01' (99%, 24 г, 110 ммоль, 1.01 экв.) и N-(трет-бутоксикарбонил)-L-цистеина (95%, 5.500 г, 24 ммоль, 1 экв.) в DCE (700 мл) добавили DIPEA (30.55 мл, 219 ммоль, 2 экв.). Реакцию нагрели до 80°C и перемешивали в течение 3 ч. Реакционную смесь добавили в воду (400 мл) и DCM (200 мл) и подкислили до pH 1 с помощью 1Н HCl. Органический слой отделили и промыли с помощью соляного раствора (200 мл), высушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении с получением неочищенного продукта в виде пены желтого цвета, который применяли на следующей стадии без дальнейшей очистки. Выход 45.90 г, 81% при чистоте 81%.
LCMS: METCR1673 Generic 2 minutes rt=1.28 мин, M/Z (ES+) 441 [M+Na+], 81% УФ
NMR: 1H ЯМР (500 МГц, Хлороформ-d) δ 11.33 (s, 1H), 8.88 (d, J=6.6 Гц, 1H), 7.35 (d, J=11.3 Гц, 1H), 5.44 (d, J=6.4 Гц, 1H), 4.77-4.68 (m, 1H), 3.99 (s, 3H), 3.69-3.59 (m, 1H), 3.43 (dt, J=13.2, 6.7 Гц, 1H), 1.46 (s, 9H).
Стадия 4: Синтез месил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (промежуточное соединение II-03)
Способ А:
Промежуточное соединение II-02 (85%, 40 г, 87.54 ммоль) и DIPEA (54.69 мл, 306 ммоль, 3.5 экв.) растворили в DMF (600 мл). После охлаждения до 0°C, HATU (49.93 г, 131 ммоль, 1.5 экв.) добавили по частям за 20 минут, позволяя реакционной смеси нагреться до комнатной температуры, которую затем перемешивали в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток растворили в хлороформе: IPA (2:1) (600 мл) и отфильтровали. Фильтрат промыли с помощью воды (200 мл), а затем соляным раствором (200 мл). Водные слои обратно-экстрагировали с помощью DCM (2×100 мл). Объединенные органические экстракты концентрировали при пониженном давлении с получением неочищенного продукта в виде масла темно-коричневого цвета (95 г), которое очистили посредством нормальнофазовой флэш-хроматографии (элюент : EtOAc : гептан) с получением целевого продукта в виде желтого твердого вещества. Выход 11.2 г, 28% при чистоте 85%
LCMS: METCR1673 Generic 2 minutes: rt=1.24 мин, M/Z (ES-)=369 [М-Н+], 85% УФ;
1Н ЯМР (500 МГц, Хлороформ-d) δ 7.71 (d, J=6.2 Гц, 1Н), 7.62 (s, 1H), 7.45 (d, J=9.6 Гц, 1H), 5.59 (s, 1H), 4.49 (s, 1H), 3.97 (s, 3H), 3.86-3.77 (m, 1H), 3.03 (t, J=11.2 Гц, 1H), 1.43 (s, 9H).
Способ В:
В суспензию промежуточного соединения II-02 (69%, 8 г, 14 ммоль) в THF (100 мл) добавили DIPEA (6.19 мл, 35.5 ммоль) и Т3Р® 50% раствор в EtOAc (16.75 мл, 28 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и затем погасили водой (150 мл). Смесь экстрагировали с помощью EtOAc (150 мл×2). Органические экстракты объединили и высушили с помощью MgSO4 и растворитель удалили при пониженном давлении. Неочищенный продукт очистили посредством флэш-хроматографии (элюент : EtOAc : гептан) с получением целевого продукта в виде грязновато-белого твердого вещества. Выход 4.16 г, 67% при чистоте 86%.
LCMS: METCR1410 Generic 2 minutes: rt=1.1 мин, M/Z (ES-)=369 [М-Н+], 86% УФ;
1H ЯМР (250 МГц, DMSO-d6) δ 10.11 (s, 1H), 7.70-7.54 (m, 2Н), 7.31 (d, J=8.3 Гц, 1H), 4.21-4.02 (m, 1H), 3.88 (s, 3H), 3.56 (dd, J=11.2, 6.4 Гц, 1H), 3.17 (t, J=11.8 Гц, 1H), 1.34 (s, 9H).
Синтез промежуточного соединения III-03
Стадия 1: Синтез метил 2-хлор-4-фтор-5-нитробензоата (промежуточное соединение III-01')
К перемешиваемому раствору 2-хлор-4-фтор-5-нитробензойной кислоты (9.93 г, 45.23 ммоль) в МеОН (100 мл) добавили серную кислоту (2.5 мл, 46.9 ммоль). Реакционную смесь перемешивали при 65°C в течение 4 ч, молекулярные сита добавили, и реакционную смесь перемешивали при 65°C в течение еще 3 ч. Реакционную смесь отфильтровали через Celite® для удаления сит, затем концентрировали при пониженном давлении. Остаток растворили в DCM (200 мл), промыли водой (150 мл). Воду далее экстрагировали с помощью DCM (4×100 мл). Объединенные органические фазы промыли водным насыщенным раствором NaHCO3 (2×150 мл), соляным раствором (150 мл), и высушили над MgSO4, отфильтровали и концентрировали при пониженном давлении с получением 7.12 г целевого продукта в виде твердого вещества бледно-желтого цвета с выходом 67% и чистотой 99%.
LCMS: METCR1410 Generic 1.7 min rt=1.09 мин, M/Z (ES+) без ионизации, 99%;
1Н ЯМР (250 МГц, Хлороформ-d) δ 8.67 (d, J=8.0 Гц, 1H), 7.45 (d, J=10.2 Гц, 1H), 3.98 (s, 3H).
Стадия 2: Синтез (2R)-2-{[(трет-бутокси)карбонил]амино}-3-{[5-хлор-4-(метоксикарбонил)-2-нитрофенил]сульфанил}пропановой кислоты (промежуточное соединение III-01)
К перемешиваемому раствору промежуточного соединения III-01' (99.5%, 2 г, 8.52 ммоль) и N,N-диэтилэтанамина (2.46 мл, 17.65 ммоль) в DCE (25 мл) добавили по частям N-(трет-бутоксикарбонил)-L-цистеин (1.98 г, 8.95 ммоль). Экзотермическая реакция вызвала повышение внутренней температуры до ~30°C. Реакцию перемешивали в течение еще 1.5 ч. Реакционную смесь разбавили с помощью DCM (20 мл), промыли водой (3×20 мл), 1М водным раствором HCl (2×20 мл), соляным раствором (20 мл), высушили над MgSO4, отфильтровали и концентрировали при пониженном давлении с получением 3.5 г неочищенного продукта в виде иены желтого цвета, который применяли на следующей стадии без дальнейшей очистки, при выходе 85% и чистоте 90%.
LCMS: METCR1410 Generic 1.7 min rt=1.17 мин, M/Z (ES+) 433/435 [M+H+], 94% УФ
1H ЯМР (250 МГц, Хлороформ-d) δ 8.76 (s, 1H), 7.59 (s, 1H), 5.37 (d, J=7.3 Гц, 1Н), 4.73 (s, 1Н), 3.96 (s, 3Н), 3.70-3.55 (m, 1H), 3.49-3.32 (m, 1Н), 1.44 (s, 9Н).
Стадия 3: Синтез (2R)-3-{[2-амино-5-хлор-4-(метоксикарбонил)фенил]сульфанил}-2-{[(трет-бутокси)карбонил]амино}пропановой кислоты (промежуточное соединение III-02)
Промежуточное соединение III-01 (3.5 г, 8.05 ммоль) растворили в EtOH (100 мл) и воде (25 мл). 1М водный раствор HCl (0.8 мл, 0.8 ммоль) добавили, и реакционную смесь нагрели до 50°C. Железо (900 мг, 16.12 ммоль) добавили в горячую и перемешиваемую реакционную смесь. Нагревание продолжали при 80°C в течение 0.5 ч. Реакционную смесь охладили до 70°C и еще обработали железом (500 мг, 8.95 ммоль), затем нагревание продолжали при 80°C в течение 6.5 ч. Реакционную смесь отфильтровали через Celite®. Остаток на фильтре промыли с помощью EtOAc (50 мл×2), и концентрировали при пониженном давлении с получением продукта в виде темно-коричневого твердого вещества, которое применяли на следующей стадии без дальнейшей очистки. Выход 3.49 г, предположительно количественный (содержит следы железа) при чистоте 89% (по LCMS).
ECMS: METCR1410 Generic 1.7 min, rt=1.07, M/Z (ES+)=304.95 [M-Boc+H+], 348.8 [M-tBu+H+], 89% УФ
Стадия 4: Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-хлор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (промежуточное соединение III-03)
К перемешиваемому раствору промежуточного соединения III-02 (89%, 3.49 г, 7.67 ммоль) в THF (30 мл) добавили DIPEA (3.4 мл, 19.18 ммоль) и T3P® 50% раствор в EtOAc (9.1 мл, 15.44 ммоль). Реакцию перемешивали при комнатной температуре в течение 1 ч и затем концентрировали при пониженном давлении. Остаток разбавили водой (30 мл) и экстрагировали в DCM (3×30 мл), промыли соляным раствором, и высушили над MgSO4, отфильтровали и концентрировали при пониженном давлении. Неочищенный продукт очистили посредством флэш-хроматографии (элюент: гептаны, 0-100% EtOAc) с получением 2.44 г целевого продукта в виде кремового твердого вещества при выходе 79% и 96% УФ чистоте.
LCMS: METCR1410 Generic 1.7 min: rt=1.12 мин, M/Z (ES+)=330.9/332.7 [М-tBu+H+], 97% УФ
1Н ЯМР: (500 МГц, Хлороформ-d) δ 7.80 (s, 1Н), 7.73 (s, 1H), 7.61 (s, 1H), 5.56 (d, J=7.6 Гц, 1H), 4.46 (dt, J=13.4, 7.0 Гц, 1H), 3.94 (s, 3H), 3.80 (dd, J=10.9, 6.2 Гц, 1H), 3.01 (t, J=11.4 Гц, 1H), 1.40 (s, 9H).
Синтез промежуточного соединения IV-03

Стадия 1: Синтез (2R,3R)-2-{[(трет-бутокси)карбонил]амино}-3-{[4-(метоксикарбонил)-2-нитрофенил]сульфанил}бутановой кислоты (промежуточное соединение IV-01)
Промежуточное соединение А-03 (526 мг, 2.01 ммоль) растворили в MeCN (12 мл) и DIPEA (0.56 мл, 4 ммоль) добавили. Полученную смесь перемешивали при комнатной температуре в течение 5 мин до добавления метил 4-фтор-3-нитробензоата (361 мг, 1.8 ммоль). Полученную смесь нагрели до 80°С в течение 18 ч. Реакционную смесь охладили до комнатной температуры перед добавлением 2М водной HCl (20 мл). Смесь экстрагировали с помощью EtOAc (2×15 мл), объединенные органические экстракты высушили над Na2SO4 и концентрировали при пониженном давлении с получением 756 мг целевого продукта в виде желтого твердого вещества при 80% УФ чистоте и 72.5% выходе, которое применяли на следующей стадии без дальнейшей очистки.
LCMS: METCR1673 Generic 2 minutes rt=1.31 мин, M/Z (ES+) 437 [M+Na+], 80%
NMR: 1H ЯМР (500 МГц, DMSO-d6) δ 8.57 (d, J=1.9 Гц, 1H), 8.27-8.10 (m, 1H), 7.90 (d, J=8.6 Гц, 1H), 7.36 (d, J=9.0 Гц, 1H), 4.33-4.20 (m, 1H), 4.06-3.98 (m, 1H), 3.91 (s, 3H), 1.43-1.32 (m, 12H).
Стадия 2: Синтез (2R,3R)-3-{[2-амино-4-(метоксикарбонил)фенил]сульфанил}-2-{[(трет-бутокси)карбонил]амино}бутановой кислоты (промежуточное соединение IV-02)
Промежуточное соединение IV-01 (80%, 1.04 г, 2.09 ммоль) растворили в смеси EtOH (20 мл) и воды (2 мл). 1N HCl (0.2 мл) добавили, и реакционную смесь нагрели до 50°С. Железо (586 мг, 10.44 ммоль) добавили в горячую перемешиваемую реакционную смесь. Темную реакционную смесь перемешивали при 80°С в течение 2.5 ч. После охлаждения, смесь отфильтровали через Celite® и остаток на фильтре промыли с помощью EtOAc (3×100 мл), а затем mEtOH (1×50 мл). Объединенные фильтраты концентрировали при пониженном давлении с получением 1.29 г целевого продукта в виде черного твердого вещества при 72% УФ чистоте (содержит следы железа), которое применяли на следующей стадии без дальнейшей очистки.
LCMS: METCR1673 Generic 2 minutes: rt=1.65 мин, M/Z (ES-) 383 [M-H+], 72% УФ;
Стадия 3: Синтез метил (2R,3R)-3-{[(трет-бутокси)карбонил]амино}-2-метил-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (промежуточное соединение IV-03)
Промежуточное соединение IV-02 (72%, 1035 мг, 1.94 ммоль) и DIPEA (0.338 мл, 1.94 ммоль) растворили в DMF (20 мл). После охлаждения до 0°С, HATU (811 мг, 2.13 ммоль) добавили по частям. Реакции позволили нагреться до комнатной температуры и перемешивали в течение 18 ч. Смесь концентрировали при пониженном давлении. Остаток распределили между EtOAc (50 мл) и 1N NaOH (50 мл). Органический слой промыли с помощью 1N HCl (50 мл) и соляным раствором (50 мл). Оба водных слоя (кислотный и основный) по отдельности реэкетрагировали с помощью IPA/хлороформ смеси (1/1). Объединенные органические экстракты высушили над Na2SO4, отфильтровали и фильтрат концентрировали при пониженном давлении. Неочищенный остаток очистили посредством колоночной хроматографии (диоксид кремния, элюент: гептаны, 0-50% EtOAc) с получением 341 мг целевого продукта в виде желтого твердого вещества при 97% УФ чистоте и выходе 47%.
LCMS: METCR1673 Generic 2 minutes rt=1.32 мин, M/Z (ES-) 365 [М-Н+], 97% УФ
NMR: 1H ЯМР (500 МГц, DMSO-d6) δ 10.34 (s, 1H), 7.87-7.56 (m, 3H), 6.99 (d, J=8.2 Гц, 1H), 4.33 (dd, J=8.0, 5.3 Гц, 1H), 3.93 (m, 1H), 3.87 (s, 3H), 1.37-1.21 (m, 12H)
Синтез промежуточного соединения V-03
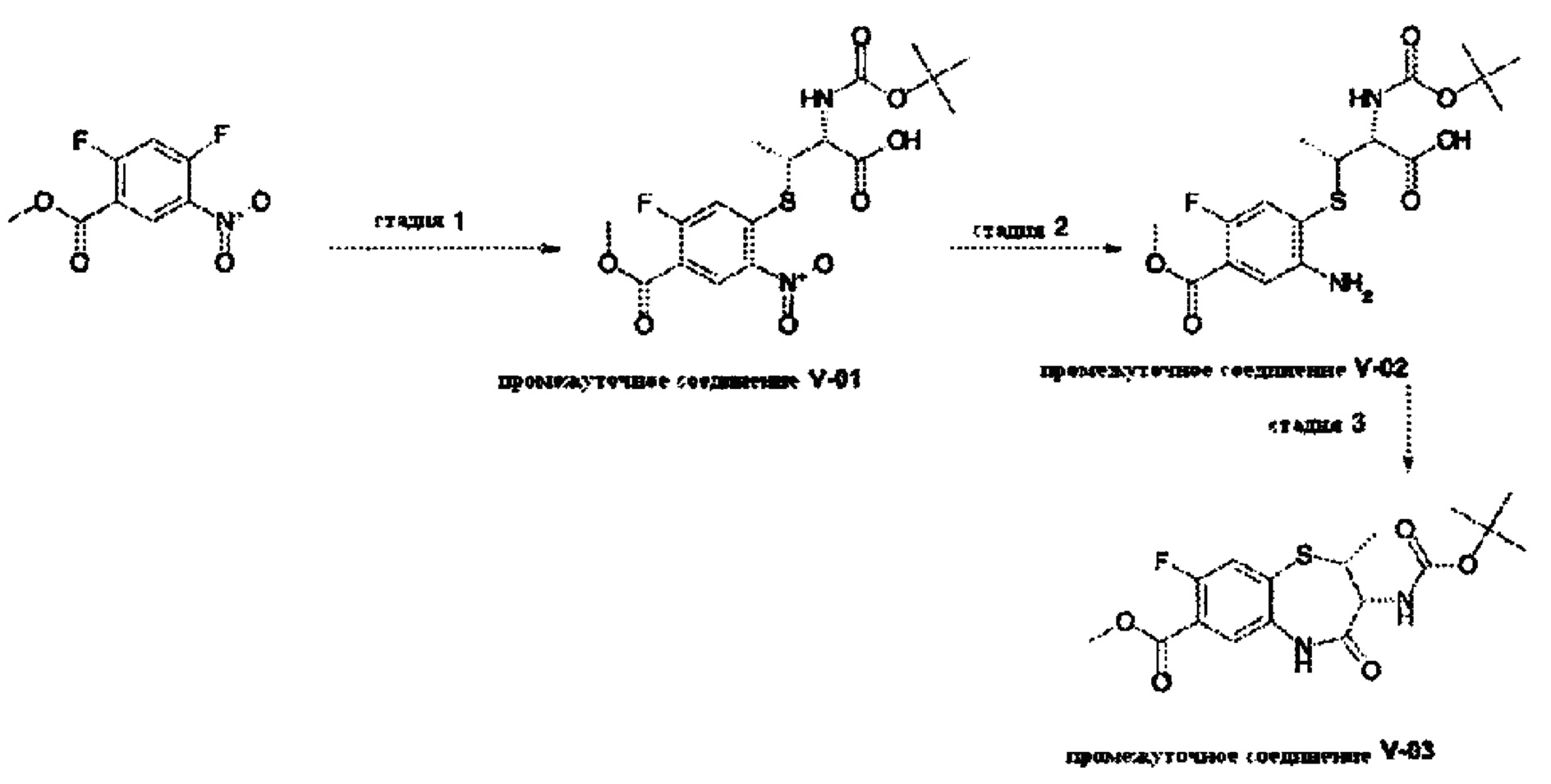
Стадия 1: Синтез (2R,3R)-2-{[(трет-бутокси)карбонил]амино}-3-{[5-фтор-4-(метоксикарбонил)-2-нитрофенил]сульфанил}бутановой кислоты (промежуточное соединение V-01)
Промежуточное соединение А-03 (466 мг, 1.78 ммоль) растворили в 1,2-дихлорэтане (30 мл). Затем, DIPEA (0.50 мл, 3.57 ммоль) добавили. Полученную смесь перемешивали при комнатной температуре в течение 5 мин до добавления метил 2,4-дифтор-5-нитробензоата (387 мг, 1.78 ммоль). Полученную смесь перемешивали в течение 22 ч, до ее распределения между DCM (40 мл) и водой (40 мл). Значение рН довели до рН=1 путем добавления 1М водного HCl. Органическую фазу отделили и высушили над MgSO4, отфильтровали, и фильтрат концентрировали при пониженном давлении с получением 767 мг желтого масла при 55% УФ чистоте и выходе 55%.
LCMS: METCR1410 Generic 1.5 minutes, rt=1.16 мин, M/Z (ES+) 455 [M+Na+], 55% УФ
NMR: 1H ЯМР (250 МГц, DMSO-d6) δ 13.21 (br. s, 1H), 8.62 (d, J=7.0 Гц, 1H), 7.76 (d, J=11.6 Гц, 1H), 7.39 (d, J=7.8 Гц, 1H), 4.30 (s, 1H), 4.04 (t, J=6.4 Гц, 1H), 3.93-3.89 (m, 311), 1.38 (d, J=9.4 Гц, 12H)
Стадия 2: Синтез (2R,3R)-3-{[2-амино-5-фтор-4-(метоксикарбонил)фенил]сульфанил}-2-{[(трет-бутокси)карбонил]амино}бутановой кислоты (промежуточное соединение V-02)
Промежуточное соединение V-01 (55%, 0.76 г, 0.98 ммоль) растворили в EtOH (9 мл) и воде (2 мл). 1Н HCl (0.1 мл) добавили, и реакционную смесь нагрели до 50°С. Железо (381 мг, 6.83 ммоль) добавили, и реакцию нагревали до 80°С в течение 2 ч. Реакционную смесь оставили охлаждаться до комнатной температуры и отфильтровали через Celite®, элюируя EtOAc (3×100 мл). Фильтрат концентрировали при пониженном давлении с получением 0.69 г темно-коричневого масла при 55% УФ чистоте и выходе 97%, которое применяли на следующей стадии без дальнейшей очистки.
LCMS: METCR1410 Generic 1.5 minutes rt=1.10 мин, M/Z (ES-) 401 [М-Н+], 55% УФ
Стадия 3: Синтез метил (2R, 3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-2-метил-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (промежуточное соединение V-03)
Промежуточное соединение V-02 (55%, 690 мг, 0.94 ммоль) и DIPEA (0.411 мл, 2.36 ммоль) растворили в THF (20 мл). Т3Р® 50% в EtOAc (1.11 мл, 1.89 ммоль) добавили, и реакцию перемешивали в течение 1.5 ч при комнатной температуре. Смесь погасили с помощью воды (15 мл) и экстрагировали с помощью EtOAc (15 мл × 2). Экстракты высушили над MgSO4 и растворитель удалили при пониженном давлении с получением неочищенного масла. Неочищенное вещество очистили посредством флэш-хроматографии (элюент: гептаны, 10%-100% EtOAc) с получением 341 мг желтого твердого вещества при 90% УФ чистоте и выходе 74%.
LCMS: METCR1410 Generic 1.5 minutes, rt=1.26 мин, M/Z (ES-) 383 [M-H+], 90% УФ;
NMR: 1H ЯМР (250 МГц, DMSO-d6) δ 10.26 (s, 1H), 7.64-7.54 (m, 2H), 6.99 (d, J=8.1 Гц, 1H), 4.34 (dd, J=8.0, 5.3 Гц, 1H), 4.00-3.90 (m, 1H), 3.86 (s, 3H), 1.41-1.22 (m, 12H).
Соответствующие (2S, 3R)-диастереоизомеры промежуточного соединения IV-03 и V-03 могут быть синтезированы, применяя (2R,3S)-2-{[(трет-бутокси)карбонил]амино}-3-гидроксибутановую кислоту согласно указанным выше методикам.
Синтез промежуточного соединения (1R)-2,2-дифторциклопропан-1-амин гидрохлорида
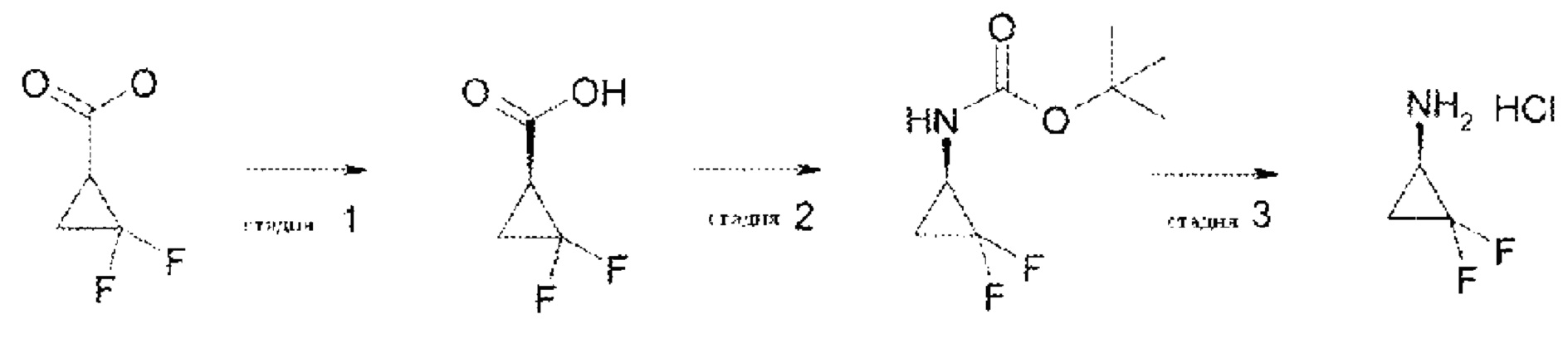
Стадия 1: Синтез (1S)-2,2-дифторциклопропан-1-карбоновой кислоты
К перемешиваемому раствору 2,2-дифторциклопропан-1-карбоновой кислоты (50%, 36 г, 147.46 ммоль) в MeCN (300 мл) добавили (1S)-1-(4-метоксифенил)этан-1-амин (43.55 мл, 147.46 ммоль). Реакцию перемешивали при комнатной температуре в течение 4 ч до осаждения твердого вещества грязновато-белого цвета. Целевой (S) энантиомер кислоты выпадает в осадок из раствора, образуя конгломерат с (1S)-1-(4-метоксифенил)этан-1-амином, и нежелательный (R) энантиомер остается в растворе, и может быть вымыт в ходе фильтрации (Ссылка: WO 2014/170197 А1). Начальный осажденный конгломерат (49 г) перекристаллизовали из горячего MeCN (х8). Кристаллическое твердое вещество выделили путем фильтрации и промыли холодным MeCN. Затем 22.8 конгломерата отделили с помощью SCX-2 картриджей (2×70 g, элюент МеОН), и фракции концентрировали при пониженном давлении с получением 8.56 г целевого продукта в виде грязновато-белого твердого вещества при выходе 47.5% и 100% чистоте, как определено путем ЯМР.
ЯМР: 1Н ЯМР (250 МГц, Хлороформ-d) δ 9.65 (s, 1H), 2.45 (ddd, J=12.6, 10.7, 7.8 Гц, 1Н), 2.09 (dtd, J=12.1, 7.8, 6.5 Гц, 1Н), 1.92-1.59 (m, 1Н).
Стадия 2: Синтез трет-бутил N-[(1R)-2,2-дифторциклонронил]карбамата
К перемешиваемому раствору (1S)-2,2-дифторциклопропан-1-карбоновой кислоты (8.56 г, 70.12 ммоль) в tBuOH (100 мл) добавили TEA (11.83 мл, 84.15 ммоль), а затем дифенилфосфорил амид (18.09 мл, 84.15 ммоль) при комнатной температуре. Реакцию затем нагревали при 90°С в течение 18 ч. Реакцию контролировали посредством тонкослойной хроматографии (элюент: гептаны, 10% EtOAc, окрашивание KMnO4, Rf0.27). Растворитель удалили при пониженном давлении, и полученный неочищенный остаток очистили посредством колоночной хроматографии (100g SNAP, элюент: гептаны, 0-10% EtOAc) с получением 8.1 г целевого продукта в виде твердого вещества белого цвета с выходом 60% и чистотой 100%, как определено нулем ЯМР.
ЯМР: 1Н ЯМР (250 МГц, Хлороформ-d) δ 4.82 (s, 1Н), 3.14 (s, 1Н), 1.85-1.62 (m, 1Н), 1.46 (s, 1Н), 1.34 (td, J=9.0, 4.1 Гц, 1Н).
Стадия 3: Синтез (1R)-2,2-дифторциклопропан-1-амин гидрохлорида
К перемешиваемому раствору трет-бутил N-[(1R)-2,2-дифторциклопропил]карбамата (8.1 г, 41.93 ммоль) в диоксане (5 мл) добавили 4М HCl раствор в 1,4-диоксане (41.93 мл). Реакцию перемешивали в течение 3 ч при комнатной температуре. Развитие реакции контролировали посредством тонкослойной хроматографии (элюент: гептаны, 10% EtOAc, KMnO4, Rf0.27). Осадок выделили путем фильтрации, промыли 1,4-диоксаном и высушили при пониженном давлении с получением 3.38 г целевого продукта в виде твердого вещества белого цвета. При 62% выходе и чистоте 100%, как определено путем ЯМР.
NMR: 1Н ЯМР (250 МГц, DMSO-d6) δ 9.02 (s, 2Н), 3.52-3.32 (m, 1H), 2.21-2.00 (m, 1H), 1.99-1.80 (m, 1H).
Общие методики для
2,3,4,5-тетрагидро-1,5-бензотиазепин производные
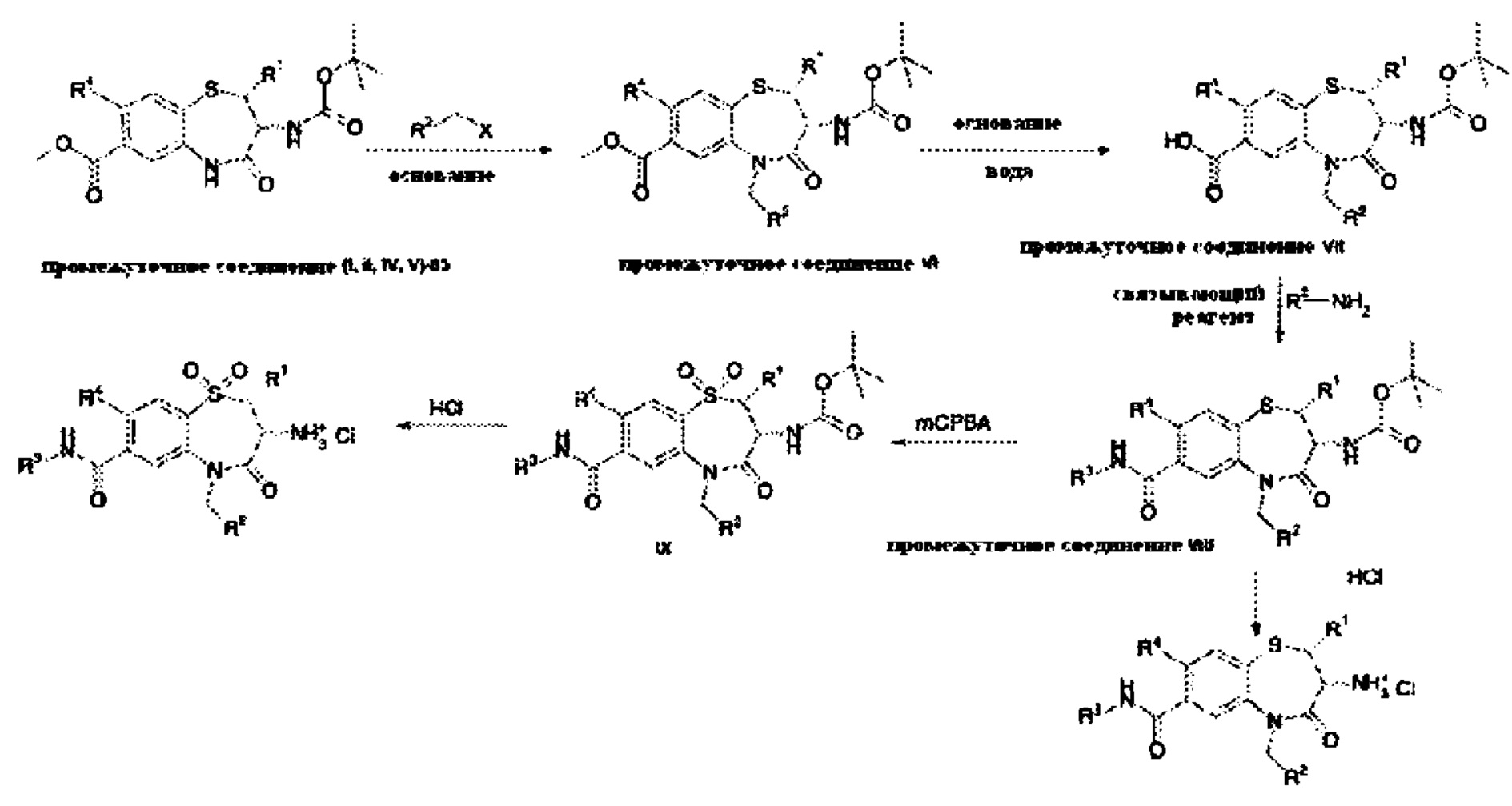
Общая методика 1 (GP1): Синтез промежуточного соединения VI
Условия 1: К перемешиваемому раствору промежуточного соединения (I-II, IV-V)-03 в безводном DMSO (20 об.) добавили K2CO3 (3 экв.), R2-CH2-X (1.5 экв.) (X представляет собой гало или соответствующую уходящую группу) и KI (0.5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Воду (50 об.) добавили по каплям к смеси и охладили до 0°С, что образовало осадок. Осадок отфильтровали и промыли с помощью воды (2×50 об.) и затем очистили с помощью колоночной флэш-хроматографии с получением целевого промежуточного соединения VI.
Условия 2: Суспензию NaH (60%, 1.2 экв.) в безводном THF (20 об.) (или DMF) при 0°С добавили по каплям в раствор промежуточного соединения (I-II, IV-V)-03 в безводном THF (10 об.) (или DMF). Реакционную смесь перемешивали при 0°С в течение 20 мин, затем R2-CH2-X (1.5 экв.) (X представляет собой гало или соответствующую уходящую группу) добавили медленно. Реакционной смеси позволили нагреться до комнатной температуры и перемешивали в течение 18 ч. Реакционную смесь погасили с помощью воды (10 об.). DCM добавили, и водный слой экстрагировали с помощью еще DCM (2×15 об.). Объединенные органические слои промыли соляным раствором, высушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении. Неочищенный продукт очистили с помощью колоночной флэш-хроматографии с получением целевого промежуточного соединения VI.
Общая методика 2 (GP2): Синтез промежуточного соединения VII
Промежуточное соединение VI растворили в смеси THF/MeOH/вода (10/1/3; 10 об.). Гидрат гидроксида лития (2 экв.) добавили, и реакционную смесь перемешивали в течение 16 ч или до завершения.
Реакционную смесь концентрировали при пониженном давлении. Остаток растворили в DCM (10 об.) и промыли с помощью 2N HCl (3 об.). Водный слой обратно-экстрагировали с помощью DCM (2×10 об.) и смеси IPA/хлороформ (1/1, 10 об.). Объединенные органические слои промыли соляным раствором (10 об.), высушили на Na2SO4 и отфильтровали. Фильтрат концентрировали при пониженном давлении с получением промежуточного соединения VII, который применяли на следующей стадии без дальнейшей очистки.
Общая методика 3 (GP3): Синтез промежуточного соединения VIII
Амидное связывание, применяя HATU в качестве реагента
Промежуточное соединение VII растворили в DMF (3 об.), и DIPEA (3.5 экв.) добавили. После охлаждения до 0°С, HATU (1.5-3 экв.) добавили в реакционную смесь, которую перемешивали при 0°С в течение 20 мин. Амин R3NH2 (1.2 экв.) добавили, и реакцию перемешивали при 0°С в течение 5 мин и затем перемешивали при комнатной температуре в течение 16 ч. Смесь концентрировали при пониженном давлении, и остаток обработали с получением целевого промежуточного соединения VIII либо следующими методами, либо при их адаптации:
Способ обработки а:
DCM добавили к остатку, дважды промыли водой и один раз соляным раствором. Органические фазы повторно объединили, высушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии
Способ обработки b:
DCM добавили к остатку, промыли водой, 1Н HCl, 1Н NaOH и один раз соляным раствором. Органические фазы повторно объединили, высушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии
Способ обработки с:
Реакционную смесь концентрировали при пониженном давлении, и остаток очистили посредством колоночной хроматографии.
Амидное связывание с применением Т3Р® в качестве реагента
К раствору промежуточного соединения VII (700 мг, 1.36 ммоль) в DCM (10 об.) добавили TEA (5 экв.) и 50% раствор Т3Р® в EtOAc (2 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин. Затем амин R3NH2 (0.9 экв.) добавили. Реакционную смесь перемешивали при комнатной температуре в течение 8 ч. Реакционную смесь разбавили с помощью воды и DCM, и насыщенный раствор K2CO3 добавили. Водный слой экстрагировали с помощью DCM. Объединенные органические экстракты промыли водой, высушили над сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного промежуточного соединения VIII, которое очистили посредством колоночной хроматографии (если требуется).
Общая методика 4 (GP4): Синтез промежуточного соединения IX
Промежуточное соединение VIII растворили в DCM (2 об.), и реакционную смесь охладили до 0°С. m-СРВА (3.5 экв.) добавили по частям, и реакционную смесь перемешивали при 0°С в течение 15-30 мин. и при комнатной температуре в течение 16-54 ч до завершения. Реакционную смесь разбавили с помощью DCM и промыли с помощью водного 1М раствора NaOH (х2) и соляным раствором. Органический слой высушили над сульфатом натрия, отфильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очистили посредством обращеннофазовой колоночной хроматографии (Biotage нейтральный рН) с получением целевого промежуточного соединения IX.
Общая методика 5 (GP5): Синтез конечных соединений (примеры 1-183)
Промежуточное соединение VIII или промежуточное соединение IX подвергли удалению защитной группы с высвобождением первичного амина путем обработки избытком эфирного раствора HCl, например 4Н HCl в диоксане. После перемешивания при комнатной температуре в течение 2-12 ч реакционную смесь концентрировали при пониженном давлении с получением целевых соединений в виде гидрохлоридных солей.
Необязательно требовалась дальнейшая очистка, которая проводилась посредством обращеннофазовой колоночной хроматографии, после чего чистый продукт повторно обрабатывали с помощью HCl в диоксане или использовали в качестве свободного основания (как указано).
Альтернативно гидрохлоридные соли могут быть превращены в свободное основание путем адаптации одного из следующих способов:
Способ на основе свободного основания 1: SCX-2 картридж
HCl соль конечного соединения растворили в минимальном МеОН, и раствор загрузили на SCX-2 картридж. Картридж продули МеОН (3×10 мл). Соединение затем элюировали с помощью 7М NH3 в МеОН растворе (3×10 мл). Фракции объединили и концентрировали при пониженном давлении с получением свободного основания конечного соединения.
Способ на основе свободного основания 2: KP-NH колонка
HCl соль конечного соединения растворили в DCM (с МеОН, если необходимо), и свободное основание элюировали из картриджа Biotage SNAP KP-NH основного диоксида кремния Biotage Isolera (градиент 0-10% МеОН в DCM). Фракции объединили и концентрировали при пониженном давлении с получением свободного основания конечного соединения.
Способ на основе свободного основания 3: Водная экстракция
HCl соль конечного продукта суспендировали в DCM (5 мл), и насыщенный водный NaHCO3 (1 мл) раствор и воду (5 мл) добавили. Слои разделили, и органический слой промыли с помощью воды (5 мл), пропустили через TELOS сепаратор гидрофобных фаз и концентрировали при пониженном давлении с получением свободного основания конечного соединения.
Рацемические смеси соединений формулы (I) могут быть синтезированы в соответствии с вышеуказанными методиками с использованием соответствующих рацемических исходных материалов или промежуточных соединений.
Способ, которым могут быть получены соединения по изобретению, будет дополнительно понят с помощью следующих примеров.
Пример GP1: Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-01)

К перемешиваемому раствору промежуточного соединения II-03 (86%, 3.00 г, 6.97 ммоль) в безводном DMSO (40 мл), K2CO3 (2.89 г, 20.9 ммоль, 3 экв.) добавили 1-(бромметил)-4-хлорбензол (98%, 2.19 г, 10.5 ммоль, 1.5 экв.) и KI (0.58 г, 3.48 ммоль, 0.5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь охладили, и воду (50 мл) добавили. Полученный осадок выделили путем фильтрации и промыли водой (50 мл). Выделенное твердое вещество далее очистили посредством колоночной хроматографии (диоксид кремния, элюент: гептаны, 0-50% EtOAc) с получением целевого промежуточного соединения VI-01 в виде твердого вещества грязновато-белого цвета. Выход 2.00 г, 57% при 98% чистоте;
LCMS: METCR1440 Generic 1.5 minutes: rt=1.35 мин, M/Z (ES+) 517/519 [M+Na+]; 98% УФ
1Н ЯМР (500 МГц, Хлороформ-d) δ 8.94 (d, J = 10.7 Гц, 1H), 7.73 (dd, J=10.5, 6.4 Гц, 1H), 7.61-7.55 (m, 1H), 7.45 (d, J = 8.4 Гц, 1H), 7.29 (q, J=8.4 Гц, 4H), 5.31-5.19 (m, 1H), 4.89 (d, J=15.6 Гц, 1H), 4.16 (dt, J=12.1, 7.6 Гц, 1H), 3.49 (dd, J=11.2, 7.0 Гц, 2H), 3.13 (t, J=11.8 Гц, 1H), 2.04-1.91 (m, 1H), 1.62 (dd, J=14.0, 5.5 Гц, 1H), 1.36 (s, 9H).
Пример GP2: Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (промежуточное соединение VII-01)

Промежуточное соединение VI-01 (2 г, 3.96 ммоль) растворили в смеси THF/MeOH/вода (7/1/2, 27.7 мл). Гидрат гидроксида лития (0.19 г, 7.92 ммоль, 2 экв.) добавили, и реакцию перемешивали в течение 3 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и остаток растворили в DCM (30 мл). Раствор промыли с помощью 1Н HCl (30 мл × 2), воды (30 мл) и соляным раствором (30 мл). Водные слои обратно-экстрагировали с помощью DCM (50 мл). Объединенные органические экстракты высушили (Na2SO4), отфильтровали, и фильтрат концентрировали при пониженном давлении с получением промежуточного соединения VII-01 в виде желтого твердого вещества (2 г, 100%) при 95% чистоте.
LCMS: METCR1440 Generic 1.5 minutes: rt 1.23 мин, M/Z (ES-) 479/481 [М-Н+], 95%УФ
1H ЯМР (500 МГц, Хлороформ-d) δ 7.87 (d, J = 6.7 Гц, 1H), 7.58 (d, J = 9.9 Гц, 1H), 7.47 (d, J=8.2 Гц, 1Н), 7.30 (q, J=8.5 Гц, 4Н), 5.18 (d, J=15.8 Гц, 1Н), 4.94 (d, J=15.7 Гц, 1H), 4.17 (dt, J=12.2, 7.8 Гц, 1H), 3.49 (dd, J=11.2, 6.8 Гц, 1Н), 3.14 (t, J=11.7 Гц, 1Н), 1.36 (s, 9Н).
Пример GP3: Синтез N-[(3R)-5-[(4-хлорфенил)метил]-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамат (промежуточное соединение VIII-01)

Промежуточное соединение VII-01 (90%, 2 г, 3.83 ммоль) растворили в DMF (20 мл), и DIPEA (3 мл, 17.24 ммоль, 4.5 экв.) добавили. Смесь охладили до 0°С, HATU (4.37 г, 11.49 ммоль, 3 экв.) добавили, и смесь перемешивали в течение 30 мин. Реакцию нагрели до комнатной температуры, 2,2-дифторциклопропанамин гидрохлорид (1:1) (0.744 г, 5.75 ммоль, 1.5 экв.) добавили, и перемешивание продолжали в течение 4 ч. Растворитель удалили при пониженном давлении. Остаток растворили в DCM (100 мл), промыли водой (50 мл × 2) и соляным раствором (50 мл). Органическую фазу высушили над сульфатом натрия, отфильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии (диоксид кремния, элюент: гептаны, 0-50% EtOAc) с получением целевого промежуточного соединения VIII-01 в виде грязновато-белого твердого вещества (1.03 г, 47%) при 99% чистоте.
LCMS: METCR1440 Generic 1.5 minutes: rt=1.31 мин, M/Z (ES+) 578/580 [M+Na+], 99% УФ;
1Н ЯМР (500 МГц, DMSO-d6) δ 8.94 (d, J=10.8 Гц, 1H), 7.73 (dd, J=10.5, 6.4 Гц, 1H), 7.58 (d, J=9.2 Гц, 1H), 7.45 (d, J=8.3 Гц, 1H), 7.29 (q, J=8.4 Гц, 4H), 5.34-5.15 (m, 1H), 4.89 (d, J=15.6 Гц, 1H), 4.16 (dt, J=12.1, 7.8 Гц, 1H), 3.49 (dd, J=11.2, 6.9 Гц, 2H), 3.13 (t, J=11.7 Гц, 1H), 2.05-1.91 (m, 1H), 1.68-1.54 (m, 1H), 1.36 (s, 9H).
Пример GP4: Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(2,2-дифторциклопронил)-карбамоил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (промежуточное соединение IX-01)

Промежуточное соединение VIII-01 (99%, 1.03 г, 1.83 ммоль) растворили в DCM (30 мл), и реакционную смесь охладили до 0°С в атмосфере азота. m-СРВА (77%, 1 г, 4.49 ммоль, 2.5 экв.) добавили по частям. Реакционную смесь перемешивали при 0°С в течение 15 мин и затем при комнатной температуре в течение 18 ч или до завершения. После разбавления DCM (50 мл), смесь промыли с помощью водного 1H раствора NaOH (50 мл × 2) и соляным раствором (50 мл). Органическую фазу высушили над сульфатом натрия, отфильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очистили посредством обращеннофазовой колоночной хроматографии (Biotage С18 120 g SNAP® картридж, элюент: вода, 0-100% MeCN) с получением промежуточного соединения IX-01 в виде твердого вещества белого цвета (0.92 г, 86%) при 99% чистоте.
LCMS: METCR1440 Generic 1.5 minutes: rt=1.25 мин, M/Z (ES+) 610/612 [M+Na+], 99% УФ,
1Н ЯМР (500 МГц, DMSO-d6) δ 9.13 (d, J=13.6 Гц, 1H), 7.76 (d, J=8.4 Гц, 1H), 7.63 (dd, J=5.4, 3.0 Гц, 1H), 7.53 (d, J=8.0 Гц, 1H), 7.34 (d, J=1.5 Гц, 4H), 5.23-5.12 (m, 1H), 4.87-4.79 (m, 1H), 4.49-4.36 (m, 1H), 4.13-4.04 (m, 1H), 3.82-3.72 (m, 1H), 3.50 (s, 1H), 2.00 (s, 1H), 1.65-1.57 (m, 1H), 1.37 (s, 9H).
Пример GP5: Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2,2-дифторциклопропил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида
(Пример 1)

Промежуточное соединение IX-01 (99%, 0.166 г, 0.279 ммоль) растворили в 4Н HCl в диоксане (3 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2.5 ч или до завершения. Смесь концентрировали при пониженном давлении, высушили в вакуумной печи, с получением Примера 1 в виде твердого вещества белого цвета (0.134 г, 91.4%) при чистоте 100%.
LCMS: METCR1416 GENERIC 7 MINUTES: rt=3.02 мин, M/Z (ES+) 488/490 [M+H+], 100% УФ,
1H ЯМР (500 МГц, DMSO-d6,) δ 9.14 (d, J=15.1 Гц, 1Н), 8.43 (s, 3Н), 7.85 (d, J=8.4 Гц, 1H), 7.73 (dd, J=20.2, 5.4 Гц, 1H), 7.42-7.36 (m, 4H), 5.25-5.14 (m, 1H), 4.99-4.86 (m, 1H), 4.47 (q, J=9.9 Гц, 1H), 4.18-4.09 (m, 1H), 4.04-3.93 (m, 1H), 3.57-3.45 (m, 1H), 2.07-1.96 (m, 1H), 1.70-1.57 (m, 1H).
Общая методика 6 (GP6): Вариация порядка реакций
Вышеуказанные методики могут быть адаптированы путем изменения порядка реакционных стадий

Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-1,1,4-триоксо-5-{[4-(трифторметокси) фенил) метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксилата (промежуточное соединение VI-22)
m-СРВА (1.1 г, 4.89 ммоль, 5 экв.) добавили к промежуточному соединению VI-13 (92%, 579 мг, 0.98 ммоль) в безводном DCM (20 мл). Реакционную смесь перемешивали при комнатной температуре до завершения. Реакционную смесь промыли с помощью 1Н NaOH (2×15 мл), и органический слой высушили над сульфатом натрия, отфильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии (диоксид кремния, гептаны, 5-50% EtOAc) с получением промежуточного соединения VI-22, 0.41 г в виде грязновато-белого твердого вещества, 71% выход при 98% УФ чистоте.
LCMS: METCR1673 GENERIC 2 MINUTES: rt=1.50 мин, M/Z (ES+) 599 [M+Na+], 98% УФ
1Н ЯМР (500 МГц, CDCl3) δ 1.41 (s, 9H), 3.51 (dd, J=11.03, 13.28 Гц, 1H), 3.92 (s, 3H), 4.08 (dd, J=6.90, 13.35 Гц, 1H), 4.53 (dt, J=7.13, 10.86 Гц, 1H), 4.59 (d, J=15.23 Гц, 1H), 5.40 (d, J=15.23 Гц, 1H), 5.68 (d, J=7.15 Гц, 1H), 7.20 (d, J=8.14 Гц, 2H), 7.36 (d, J=8.61 Гц, 2H), 7.67 (d, J=5.61 Гц, 1H), 7.83 (d, J=8.65 Гц, 1H).
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-1,1,4-триоксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоновой кислоты (промежуточное соединение VII-22)
Гидрат гидроксида лития (1:1:1) (58.3 мг, 1.39 ммоль, 2 экв.) добавили к промежуточному соединению VI-22 (98%, 408.6 мг, 0.70 ммоль, 1 экв.) в 8/2/1 THF/вода/МеОН (11 мл). Реакционную смесь перемешивали при комнатной температуре до завершения, затем концентрировали при пониженном давлении. Остаток растворили в DCM (5 мл) и промыли с помощью 1N HCl (3 мл). Водный слой экстрагировали с помощью DCM (2×5 мл). Объединенные органические слои высушили над сульфатом натрия, отфильтровали, и фильтрат концентрировали при пониженном давлении с получением промежуточного соединения VII-22 в виде светло-желтого твердого вещества. Выход 212 мг, 38% при 70% УФ чистоте.
LCMS: METCR1673 GENERIC 2 MINUTES: rt=1.50 мин, M/Z (ES+) 585 [M+Na+], 70% УФ
1H ЯМР (500 МГц, DMSO-d6) δ 1.36 (s, 9H), 3.72-3.82 (m, 1H), 4.06 (dd, J=7.32, 13.20 Гц, 1H), 4.44 (dt, J=7.64, 11.73 Гц, 1H), 4.77 (d, J=16.13 Гц, 1H), 5.28 (d, J=16.16 Гц, 1H), 7.29 (d, J=8.19 Гц, 2H), 7.43 (d, J=8.44 Гц, 2H), 7.52 (d, J=8.09 Гц, 1H), 7.71-7.79 (m, 2H)
Синтез трет-бутил N-[(3R)-8-фтор-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (промежуточное соединение IX-08)
DIPEA (54 мкл, 0.31 ммоль, 3.5 экв.) добавили к промежуточному соединению VII-22 (70%, 70 мг, 0.09 ммоль, 1 экв.) в DMF (1.5 мл). Смесь охладили до 0°С; затем HATU (50 мг, 0.13 ммоль, 1.5 экв.) добавили в виде одной части. Реакцию перемешивали при 0°С в течение 15 мин; затем 4,4,4-трифторбутан-1-амин (13 мкл, 0.13 ммоль, 1.5 экв.) добавили. Через 15 мин при 0°С, реакции позволили нагреться до комнатной температуры и перемешивали до завершения. Смесь концентрировали при пониженном давлении, и остаток очистили посредством препаративной LC (способ нейтрального рН) с получением промежуточного соединения IX-08 в виде твердого вещества желтого цвета. Выход: 32 мг, 53% при 96% УФ чистоте.
LCMS: METCR1673 GENERIC 2 MINUTES: rt=1.49 мин, M/Z (ES+) 694 [M+Na+], 96% УФ
1H ЯМР (500 МГц, Хлороформ-d) δ 1.40 (s, 9Н), 1.92 (dt, J=7.19, 14.69 Гц, 2H), 2.11-2.26 (m, 2Н), 3.55 (qd, J=8.97, 13.63 Гц, 3Н), 4.08 (dd, J=6.71, 13.53 Гц, 1H), 4.53 (dt, J=7.00, 10.86 Гц, 1H), 4.84 (d, J=15.25 Гц, 1H), 5.22 (d, J=15.24 Гц, 1H), 5.70 (d, J=7.13 Гц, 1H), 6.77 (dt, J=5.76, 11.56 Гц, 1H), 7.16 (d, J=8.08 Гц, 2H), 7.37 (d, J=8.63 Гц, 2H), 7.82 (d, J=9.87 Гц, 1H), 7.99 (d, J=6.04 Гц, 1H)
Общая методика 7 (GP7): Вариация порядка реакций
Вышеуказанные общие методики могут быть адаптированы путем изменения порядка реакционных стадий
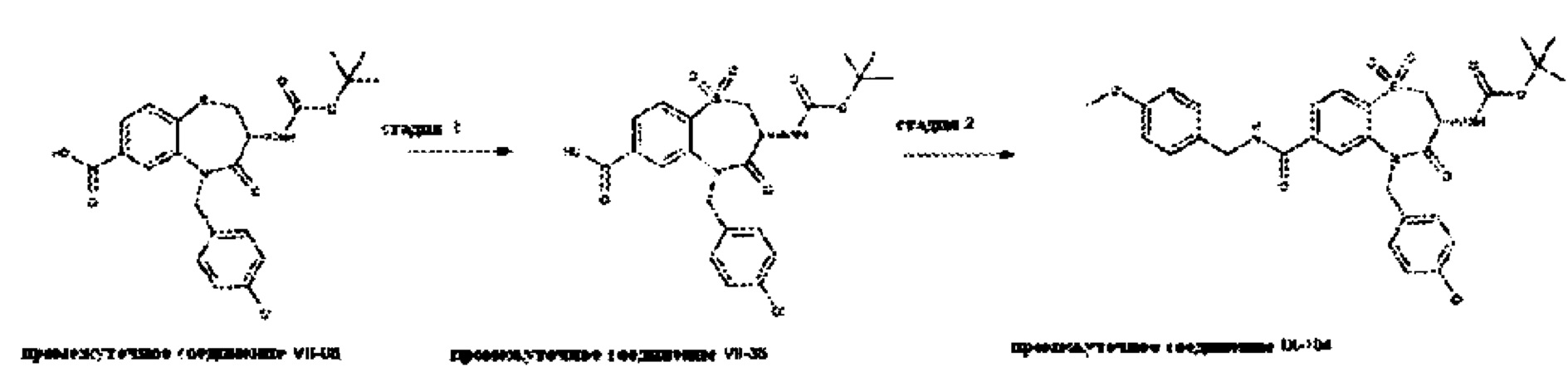
Стадия 1: Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-35)
3-Хлорбензолкарбопероксовую кислоту (77%, 733 мг, 3.27 ммоль) добавили к перемешиваемому раствору промежуточного соединения VII-06 (94%, 700 мг, 1.42 ммоль) в DCM (30 мл). Реакцию перемешивали в течение 18 ч при комнатной температуре, и образовался белый осадок. Осадок выделили путем фильтрации с получением 120 мг (17%) указанного в названии соединения в виде твердого вещества белого цвета. Фильтрат концентрировали, и остаток суспендировали в MeCN. Твердое вещество собрали путем фильтрации с получением 131 мг (18%) указанного в названии соединения. Полученный фильтрат концентрировали с получением неочищенного остатка. Очистка неочищенного остатка посредством обращеннофазовой колоночной хроматографии (Biotage, 60 g SNAP Ultra, 5-100% MeCN в воде) дала другую часть указанного в названии соединения (278 мг 37%). Объединенный выход составил 529 мг, 72% (93% чистота)
LCMS: METCR1410 Generic 1.7 min rt=1.11 мин, M/Z (ES-) 493/495 [M-H+] 93% УФ
1H ЯМР (500 МГц, DMSO-d6) δ 8.08-7.98 (m, 2Н), 7.80 (s, 1H), 7.53 (d, J=8.0 Гц, 1H), 7.41-7.33 (m, 4Н), 5.30 (d, J=16.2 Гц, 1H), 4.73 (d, J=16.3 Гц, 1H), 4.39 (dt, J=11.7, 7.6 Гц, 1H), 4.09 (dd, J=13.2, 7.3 Гц, 1H), 3.75 (t, J=12.5 Гц, 1H), 1.36 (s, 9H).
Стадия 2: Синтез трет-бутил N[(3R)-5-[(4-хлорфенил)метил]-7-{[(6-метоксиниридин-3-ил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-104)
Промежуточное соединение IX-104 получили из промежуточного соединения VII-35 согласно методике, описанной в GP3 (амидное сочетание с применением Т3Р® в качестве реагента). Выход=78%
LCMS: METCR1410 Generic 1.7 min rt=1.17 мин, M/Z (ES+) 615/617 [М+Н+] 96% УФ
1Н ЯМР (500 МГц, DMSO-d6) δ 9.31 (t, J=5.7 Гц, 1H), 8.12 (d, J=2.3 Гц, 1H), 8.01-7.94 (m, 2H), 7.84 (s, 1H), 7.63 (dd, J=8.5, 2.4 Гц, 1H), 7.51 (d, J=8.0 Гц, 1H), 7.37-7.30 (m, 4H), 6.79 (d, J-8.5 Гц, 1H), 5.19 (d, J=16.0 Гц, 1H), 4.85 (d, J=16.0 Гц, 1H), 4.43-4.33 (m, 3H), 4.07 (dd, J=13.1, 7.2 Гц, 1H), 3.83 (s, 3H), 3.76-3.69 (m, 1H), 1.35 (s, 9H).
Согласно описанной выше и проиллюстрированной общей методике GP1 следующие метилсложноэфирные промежуточные соединения VI были синтезированы из подходящего промежуточного соединения (I-V)-03, применяя подходящий алкилирующий агент R2-CH2-X и основание:
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-трет-бутилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензогиазепин-7-карбоксилата (Промежуточное соединение VI-02)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 64%.
LCMS: METUPLCMS-A-004, rt=1.8 мин, M/Z (ES+) 499 [М+Н+], 522 [M+Na+] 78% УФ
ЯМР данные: 1Н ЯМР (400 МГц, Хлороформ-d) δ 7.92 (d, J=1.7 Гц, 1Н), 7.81 (dd, J=8.0, 1.6 Гц, 1Н), 7.65 (d, J=8.0 Гц, 1H), 7.27 (d, J=8.0 Гц, 2H), 7.21 (d, J=8.4 Гц, 2H), 5.59 (d, J=8.3 Гц, 1H), 5.27 (d, J=15.1 Гц, 1H), 4.91 (d, J=15.1 Гц, 1H), 4.43 (dd, J=11.7, 6.7 Гц, 1H), 3.94 (s, 3H), 3.72 (dd, J=10.8, 6.6 Гц, 1H), 2.94 (t, J=11.3 Гц, 1H), 1.39 (s, 9H), 1.28-1.25 (m, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-03)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 81%.
LCMS: METCR1278 Generic 3.5 minutes, rt=2.34 мин, M/Z (ES+) 549 [М+Н+], 526 [M+Na+] 90% УФ
ЯМР данные: 1HNMR (500 МГц, DMSO-d6) δ 7.95 (s, 1Н), 7.84-7.74 (m, 2H), 7.49 (d, J=8.2 Гц, 1H), 7.40 (d, J=8.5 Гц, 2H), 7.25 (d, J=8.2 Гц, 2H), 5.18 (d, J=15.9 Гц, 1H), 5.08 (d, J=16.0 Гц, 1H), 4.15 (dt, J=12.3, 7.6 Гц, 1H), 3.85 (s, 3H), 3.50 (dd, J=11.2, 6.8 Гц, 1H), 3.15 (t, J=11.8 Гц, 1H), 1.35 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[4-(трифторметил)феиил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-04)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 100%.
LCMS: METCR1410 Generic 1.7 min, rt=1.35 мин, M/Z (ES+) 533.2 [M+Na+], 455.0 [M-tBu+H+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.97-7.93 (m, 1Н), 7.80 (dd, J=8.0, 1.5 Гц, 1Н), 7.76 (d, J=8.0 Гц, 1Н), 7.62 (d, J=8.1 Гц, 2Н), 7.53-7.48 (m, 3Н), 5.26 (d, J=16.3 Гц, 1Н), 5.14 (d, J=16.2 Гц, 1Н), 4.16 (dt, J=12.2, 7.5 Гц, 1H), 3.84 (s, 3Н), 3.50 (dd, J=11.2, 6.8 Гц, 1Н), 3.15 (t, J=11.8 Гц, 1H), 1.35 (s, 9Н).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[3-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-05)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 76%.
LCMS: METUPLCMS-A-004, rt=1.74 мин, M/Z (ES+) 527, 83% УФ
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-06)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 69%.
LCMS: METCR1278 Generic 3.5 minutes, rt=2.32 мин, M/Z (ES+) 499/501 [M+Na+] 100% УФ
ЯМР данные:1Н ЯМР (500 МГц, Хлороформ-d) δ 7.93 (d, J=1.7 Гц, 1H), 7.82 (dd, J=8.0, 1.5 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1Н), 7.20 (s, 4Н), 5.55 (d, J=8.2 Гц, 1Н), 5.44 (d, J=15.1 Гц, 1Н), 4.75 (d, J=15.1 Гц, 1Н), 4.41 (dt, J=14.3, 7.4 Гц, 1Н), 3.92 (s, 3Н), 3.71 (dd, J=10.8, 6.6 Гц, 1Н), 2.93 (t, J=11.3 Гц, 1Н), 1.39 (s, 9Н).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-{[4-(морфолин-4-ил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-07)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 46%.
LCMS: METUPLCMS-A-004, rt=1.72 min, M/Z (ES+)528 [М+Н+] 86% УФ
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-цианофенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-08)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 65%).
LCMS: MET-LCMS (MUX)-A-008, rt=1.54 мин, M/Z (ES+) 368 [M+H-boc] 93% УФ
ЯМР данные: 1Н ЯМР (400 МГц, Хлороформ-d) 1.40 (s, 9Н), 2.94 (t, J=11.2 Гц, 1Н), 3.72 (dd, J=10.7, 6.5 Гц, 1H), 3.93 (s, 3Н), 4.45 (m, 1Н), 4.85 (d, J=15.5 Гц, 1Н), 5.49 (d, J=15.9 Гц, 2H), 7.41 (d, J=8.5 Гц, 2Н), 7.57-7.53 (m, 2H), 7.67 (d, J=8.0 Гц, 1H), 7.84 (dd, J=8.0, 1.7 Гц, 1Н), 7.93 (d, J=1.7 Гц, 1Н).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[6-(трифторметил)пиридин-3-ил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-09)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 22%.
LCMS: METCR1673 Generic 2 minutes, rt=1.44 мин, M/Z (ES-) 510 [М-Н+] 87% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.52 (s, 1Н), 7.93 (d, J=1.7 Гц, 1Н), 7.83-7.77 (m, 2Н), 7.60 (d, J=8.0 Гц, 1H), 7.51 (d, J=8.1 Гц, 1Н), 5.57 (d, J=15.4 Гц, 1Н), 5.43 (d, J=8.1 Гц, 1H), 4.71 (d, J=15.4 Гц, 1H), 4.40-4.31 (m, 1Н), 3.87 (s, 3Н), 3.64 (dd, J=11.0, 6.6 Гц, 1Н), 2.85 (t, J=11.3 Гц, 1Н), 1.33 (s, 9Н).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-10)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 73%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 425 [M+H-boc] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.95 (s, 1H), 7.86 (d, J=8.2 Гц, 2Н), 7.82-7.72 (m, 2Н), 7.51 (d, J=8.3 Гц, 1Н), 7.46 (d, J=8.1 Гц, 2Н), 5.24-5.09 (m, 2Н), 4.16 (dt, J=12.5, 7.8 Гц, 1H), 3.83 (s, 3Н), 3.50 (dd, J=11.1, 6.8 Гц, 1Н), 3.16 (t, J=11.8 Гц, 1Н), 2.64 (s, 3Н), 1.35 (s, 9Н).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-11)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 51%.
LCMS: METCR1673 Generic 2 minutes, rt=l.46 мин, M/Z (ES+) 483 [M+Na+], 84% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.97 (s, 1Н), 7.79 (dd, J=8.0, 1.6 Гц, 1H), 7.74 (d, J=8.0 Гц, 1H), 7.47 (d, J=8.3 Гц, 1Н), 7.29 (dd, J t=8.3, 5.6 Гц, 2Н), 7.06 (t, J=8.8 Гц, 2H), 5.21 (d, J=15.6 Гц, 1H), 4.98 (d, J=15.6 Гц, 1H), 4.13 (dd, J=7.4, 4.7 Гц, 1Н), 3.86 (s, 3Н), 3.48 (dd, J=11.2, 6.8 Гц, 1H), 3.14 (t, J=11.8 Гц, 1H), 1.35 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[4-(1Н-1,2,4-триазол-1-ил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-12)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 66%.
LCMS: METCR1673 Generic 2 minutes, rt=1.29 мин, M/Z (ES+) 510 [М+Н+], 79% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.21 (s, 1H), 8.17 (s, 1H), 7.96 (d, J=1.5 Гц, 1H), 7.75 (dd, J=8.0, 1.6 Гц, 1H), 7.70 (dd, J=8.2, 4.9 Гц, 3Н), 7.50 (d, J=8.3 Гц, 1H), 7.40 (d, J=8.5 Гц, 2H), 5.24 (d, J=15.9 Гц, 1H), 5.04 (d, J=15.9 Гц, 1H), 4.11 (dt, J=12.4, 7.7 Гц, 1H), 3.81 (s, 3H), 3.46 (dd, J=11.2, 6.8 Гц, 1H), 3.12 (t, J=11.8 Гц, 1H), 1.31 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-13)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде пенообразного твердого вещества белого цвета с выходом 43%.
LCMS: METCR1278 Generic 3.5 minutes, rt=2.39 мин, M/Z (ES+) 608 [M+Na+MeCN] 88% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.82 (d, J=6.4 Гц, 1Н), 7.39 (d, J=9.6 Гц, 1H), 7.29 (d, J=8.6 Гц, 2Н), 7.10 (d, J=8.1 Гц, 2Н), 5.54 (d, J=7.7 Гц, 1Н), 5.38-5.34 (m, 1H), 4.78 (d, J=15.1 Гц, 1Н), 4.42 (dt, J=11.6, 7.5 Гц, 1Н), 3.93 (s, 3Н), 3.71 (dd, J=10.9, 6.5 Гц, 1Н), 2.93 (t, J=11.3 Гц, 1H), 1.40 (s, 9Н).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[4-(1,2,3-тиадиазол-4-ил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазспин-7-карбоксилата (Промежуточное соединение VI-14)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 44%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 549 [M+Na+], 427 [M+H-boc] 86% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.59 (s, 1H), 7.99 (d, J=1.6 Гц, 1Н), 7.92 (d, J=8.2 Гц, 2Н), 7.82 (d, J=7.9 Гц, 1Н), 7.65 (d, J=8.0 Гц, 1Н), 7.43 (d, J=8.2 Гц, 2Н), 5.55 (d, J=15.2 Гц, 2Н), 4.86 (d, J=15.2 Гц, 1H), 4.45 (d, J=11.8 Гц, 1Н), 3.92 (s, 3Н), 3.73 (dd, J=10.8, 6.6 Гц, 1Н), 2.96 (t, J=11.3 Гц, 1Н), 1.40 (s, 9Н).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-карбамоилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-15)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 76%).
LCMS: METCR1673 Generic 2 minutes, rt=1.22 мин, M/Z (ES+) 508 [M+H+Na+] 90% УФ ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.94 (d, J=1.7 Гц, 1Н), 7.81 (dd, J=8.0, 1.5 Гц, 1Н), 7.69 (d, J=8.3 Гц, 2Н), 7.64 (d, J=8.0 Гц, 1H), 7.37 (d, J=8.2 Гц, 2Н), 6.05 (s, 1H), 5.71-5.41 (m, 3H), 4.85 (d, J=15.3 Гц, 1Н), 4.43 (dt, J=12.7, 6.8 Гц, 1Н), 3.92 (s, 3Н), 3.72 (dd, J=10.9, 6.5 Гц, 1Н), 2.94 (t, J=11.3 Гц, 1Н), 1.40 (s, 9Н).
Синтез метил (2R,3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-2-метил-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-16)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета при выходе 100%.
LCMS: METCR1673 Generic 2 minutes, rt=1.68 мин, M/Z (ES+) 513/515 [M+Na+] 93% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.99 (s, 1H), 7.79 (dd, J=8.0, 1.7 Гц, 1Н), 7.73 (d, J=8.0 Гц, 1H), 7.31 (s, 4H), 7.12 (d, J=8.3 Гц, 1H), 5.31 (d, J=16.0 Гц, 1H), 4.98 (d, J=15.9 Гц, 1H), 4.42-4.30 (m, 1H), 3.86 (m, 4H), 1.43-1.26 (m, 12H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлор-2-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-17)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде бесцветного твердого вещества с выходом 55%.
LCMS: METCR1673 Generic 2 minutes. rt=1.63 мин, M/Z (ES+) 535/537 [M+Na+] 87% УФ
ЯМР данные: 1Н ЯМР (500 МГц, CDCl3) d 7.89 (d, J=6.4 Гц, 1H), 7.43-7.36 (m, 2Н), 7.05 (dd, J=8.3, 1.8 Гц, 1H), 6.98 (dd, J=9.6, 2.0 Гц, 1H), 5.52 (d, J=7.9 Гц, 1H), 5.37 (d, J=15.2 Гц, 1H), 4.79 (d, J=15.2 Гц, 1H), 4.40 (dt, J=14.1, 7.1 Гц, 1H), 3.95 (s, 3H), 3.68 (dd, J=10.9, 6.5 Гц, 1H), 2.89 (t, J=11.3 Гц, 1H), 1.40 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлор-3-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-18)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 44%.
LCMS: METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES+) 535/537 [M+Na+] 81% УФ
ЯМР данные: 1H ЯМР (500 МГц, CDCl3) d 7.83 (d, J=6.4 Гц, 1H), 7.40 (d, J=9.5 Гц, 1H), 7.28-7.24 (m, 1H), 7.12 (dd, J=9.6, 1.9 Гц, 1H), 7.01-6.93 (m, 1H), 5.52 (d, J=7.9 Гц, 1H), 5.38 (d, J=15.3 Гц, 1H), 4.69 (d, J=15.1 Гц, 1H), 4.49-4.34 (m, 1H), 3.94 (s, 3H), 3.71 (dd, J=11.0, 6.4 Гц, 1H), 2.94 (t, J=11.3 Гц, 1H), 1.40 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(3,4-дихлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-19)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 51%).
LCMS: METCR1673 Generic 2 minutes, rt=1.64 мин, M/Z (ES+) 533/535/537 [M+Na+] 61% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 1.40 (s, 9Н), 2.94 (t, J=11.28 Гц, 1H), 3.71 (dd, J=6.63, 10.86 Гц, 1Н), 3.93 (s, 3Н), 4.40-4.45 (m, 1H), 4.72 (d, J=15.3 Гц, 1Н), 5.42 (d, J=15.3 Гц, 1Н), 5.52 (d, J=8.09 Гц, 1H), 7.12 (dt, J=2.38, 8.23 Гц, 1H), 7.30 (d, J=8.25 Гц, 1H), 7.42 (d, J=2.15 Гц, 1H), 7.67 (d, J=8.01 Гц, 1H), 7.84 (dd, J=1.66, 7.99 Гц, 1H), 7.93 (d, J=1.69 Гц, 1H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-4-оксо-5-(хинолин-2-илметил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-20)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 53%).
LCMS: METCR1673 Generic 2 minutes, rt=1.41 мин, M/Z (ES+) 512 [M+Na+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.80-7.61 (m, 7H), 7.44 (d, J=9.5 Гц, 1H), 5.81 (s, 1H), 5.55-5.45 (m, 2H), 4.58-4.45 (m, 1H), 3.94 (s, 3H), 3.78 (dd, J=10.8, 6.8 Гц, 1H), 2.98 (t, J=11.4 Гц, 1H), 1.40 (d, J=7.0 Гц, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-21)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества оранжевого цвета с выходом 66%.
LCMS: METCR1673 Generic 2 minutes, rt=1.28 мин, M/Z (ES+) 509 [М+Н+] 90% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.18 (d, J=6.5 Гц, 1Н), 7.67 (d, J=10.0 Гц, 1H), 7.50 (d, J=8.2 Гц, 1H), 5.43 (d, J=15.6 Гц, 1H), 5.18 (d, J=15.7 Гц, 1H), 4.12 (dt, J=11.8, 7.3 Гц, 1H), 3.90 (s, 3H), 3.48 (dd, J=11.4, 6.9 Гц, 1H), 3.10 (t, J=11.8 Гц, 1H), 2.48-2.43 (m, 1H), 1.35 (s, 9H), 1.19 (dd, J=11.4, 9.3 Гц, 2H), 1.03-0.93 (m, 2H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(2-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-22)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 47%.
LCMS: METCR1410 Generic 1.7 min, rt=1.27 мин, M/Z (ES+) 483 [M+Na+] 95% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.97 (d, J=1.7 Гц, 1Н), 7.83 (dd, J=8.0, 1.7 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1Н), 7.46 (t, J=6.9 Гц, 1Н), 7.22-7.14 (m, 1Н), 7.11-6.89 (m, 2H), 5.56 (d, J=8.0 Гц, 1H), 5.40 (d, J=15.3 Гц, 1H), 4.96 (d, J=15.3 Гц, 1H), 4.40 (s, 1H), 3.92 (s, 3H), 3.70 (dd, J=10.9, 6.5 Гц, 1H), 2.91 (t, J=11.3 Гц, 1H), 1.39 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(3-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-23)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 70%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 495.2 [M+Na+] 96% УФ
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-24)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 100%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 417.15 [M-tBu+H+], 495.15 [M+Na+], 88% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 7.98 (d, J=1.3 Гц, 1Н), 7.81-7.66 (m, 2H), 7.44 (d, J=8.4 Гц, 1H), 7.16 (d, J=8.6 Гц, 2H), 6.78 (d, J=8.6 Гц, 2H), 5.18 (d, J=15.4 Гц, 1H), 4.90 (d, J=15.4 Гц, 1H), 4.22-4.07 (m, 1H), 3.85 (s, 3H), 3.68 (s, 3H), 3.47 (dd, J=11.2, 6.8 Гц, 1H), 3.14 (t, J=11.8 Гц, 1H), 1.35 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-25)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества очень бледно желтого цвета с выходом 96%.
LCMS: METCR1410 Generic 1.7 min, rt=1.31 мин, M/Z (ES+) 423.05 [M-tBu+H+], 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.83 (d, J=6.5 Гц, 1Н), 7.37 (d, J=9.7 Гц, 1H), 7.22 (dd, J=8.6, 5.4 Гц, 2H), 6.92 (t, J=8.6 Гц, 2H), 5.55 (d, J=7.9 Гц, 1H), 5.39 (d, J=14.9 Гц, 1H), 4.70 (d, J=14.9 Гц, 1H), 4.40 (dt, J=12.7, 6.3 Гц, 1H), 3.94 (s, 3H), 3.70 (dd, J=10.9, 6.5 Гц, 1H), 2.92 (t, J=11.3 Гц, 1H), 1.40 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-циклопропилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-26)
Перемешиваемый раствор промежуточного соединения VI-32 (93%, 190 мг, 0.34 ммоль), циклопропилбороновой кислоты (73 мг, 0.85 ммоль) и трикалия фосфата (215.8 мг, 1.02 ммоль) в смеси толуола (4 мл) и воды (0.2 мл) дегазировали с помощью N2 в течение 5 мин при комнатной температуре. Pd(OAc)2 (7.61 мг, 0.03 ммоль) и Р(Су)3 (9.5 мг, 0.03 ммоль) добавили, и реакционную смесь нагревали до 110°С в течение 2 часов. Реакционную смесь разбавили с помощью EtOAc и промыли с помощью воды (х2), затем соляным раствором. Затем органический слой высушили (Na2SO4), отфильтровали и концентрировали при пониженном давлении с получением коричневого масла (350 мг), которое очистили посредством обращеннофазовой колоночной хроматографии (SNAP Ultra C18, 12 g, 5-100% MeCN в воде) с получением 121 мг (71%) указанного в названии соединения в виде твердого вещества желтого цвета.
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 71%.
LCMS: METCR1410 Generic 1.7 min, rt=1.36 мин, M/Z (ES+) 505.1 [M+Na+], 427.1 [М-tBu+H+], 100% УФ;
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.92 (d, J=1.7 Гц, 1Н), 7.80 (dd, J=8.0, 1.6 Гц, 1Н), 7.62 (d, J=8.0 Гц, 1Н), 7.14 (d, J=8.1 Гц, 2Н), 6.92 (d, J=8.1 Гц, 2Н), 5.58 (d, J=8.1 Гц, 1H), 5.36 (d, J=15.0 Гц, 1Н), 4.79 (d, J=15.0 Гц, 1Н), 4.45-4.35 (m, 1Н), 3.91 (s, 3Н), 3.71 (dd, J=10.9, 6.7 Гц, 1Н), 2.93 (t, J=11.2 Гц, 1H), 1.81 (ddd, J=13.5, 8.4, 5.0 Гц, 1Н), 1.39 (s, 9Н), 0.94-0.88 (m, 2Н), 0.65-0.60 (m, 2Н).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-цианофенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-27)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 100%.
LCMS: METCR1673 Generic 2 minutes, rt=1.23 мин, M/Z (ES+) 430 [M-tBu+H+] 88% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.91 (d, J=6.5 Гц, 1Н), 7.75 (d, J=8.3 Гц, 2H), 7.66 (d, J=9.8 Гц, 1H), 7.51 (d, J=8.2 Гц, 1H), 7.47 (d, J=8.2 Гц, 2H), 5.25 (d, J=16.2 Гц, 1H),5.06 (d, J=16.2 Гц, 1H), 4.18 (dt, J=12.4, 7.7 Гц, 1H), 3.86 (s, 3H), 3.51 (dd, J=11.2, 6.8 Гц, 1H), 3.16 (t, J=11.8 Гц, 1H), 1.36 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-5-[(4-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-28)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 74%.
LCMS: METCR1410 Generic 1.7 min, rt=1.31 мин, M/Z (ES+) 513.2 [M+Na+], 435.1 [M-tBu+H+] 91% УФ;
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.83 (d, J=6.5 Гц, 1Н), 7.35 (d, J=9.7 Гц, 1Н), 7.19-7.11 (m, 2Н), 6.83-6.69 (m, 2Н), 5.58 (d, J=7.8 Гц, 1H), 5.36 (d, J=14.8 Гц, 1H), 4.67 (d, J=14.8 Гц, 1H), 4.39 (dt, J=11.6, 7.3 Гц, 1H), 3.93 (s, 3Н), 3.75 (s, 3Н), 3.69 (dd, J=10.9, 6.5 Гц, 1H), 2.92 (t, J=11.2 Гц, 1H), 1.40 (s, 9Н).
Синтез метил (2R,3R)-3-{[(трст-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-8-фтор-2-метил-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-29)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде масла желтого цвета с выходом 92%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 452.75/454.90 [М-tBu+H+] 82% УФ
ЯМР данные: 1Н ЯМР (250 МГц, DMSO-d6) δ 7.94 (d, J=6.6 Гц, 1Н), 7.61 (d, J=10.1 Гц, 1H), 7.30 (d, J=2.2 Гц, 4H), 7.12 (d, J=8.3 Гц, 1H), 5.31 (d, J=15.9 Гц, 1H), 4.89 (d, J=15.7 Гц, 1H), 4.45-4.34 (m, 1H), 3.86 (m, 4H), 1.40-1.27 (m, 12H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-5-{[4-(дифторметокси)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-30)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 83%.
LCMS: METCR1410 Generic 1.7 min, rt=1.28 мин, M/Z (ES+) 531 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.86 (d, J=1.7 Гц, 1Н), 7.75 (dd, J=8.0, 1.7 Гц, 1H), 7.58 (d, J=8.0 Гц, 1Н), 7.22 (s, 2H), 6.91 (d, J=8.6 Гц, 2H), 6.39 (td, J=73.9, 7.4 Гц, 1H), 5.48 (d, J=8.1 Гц, 1H), 5.35 (d, J=15.1 Гц, 1H), 4.81-4.63 (m, 1H), 4.41 (d, J=46.4 Гц, 1H), 3.86 (d, J=5.5 Гц, 3H), 3.64 (dd, J=10.9, 6.6 Гц, 1H), 2.86 (t, J=11.3 Гц, 1Н), 1.32 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-хлор-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-31)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 98%.
LCMS: METCR1410 Generic 1.7 min, rt=1.37 мин, M/Z (ES+) 533.05/535.05 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 7.70 (d, J=12.3 Гц, 2Н), 7.21 (d, J=2.0 Гц, 4Н), 5.52 (d, J=7.6 Гц, 1Н), 5.35 (d, J=15.1 Гц, 1H), 4.73 (d, J=15.1 Гц, 1Н), 4.50-4.32 (m, 1Н), 3.93 (s, 3Н), 3.70 (dd, J=10.9, 6.5 Гц, 1H), 2.93 (t, J=11.3 Гц, 1H), 1.40 (s, 9Н).
Синтез метил (3R)-5-[(4-бромфенил)метил]-3-{[(трет-бутокси)карбонил]амино}-4-оксо-2,3,4,5-тстрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-32)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 66%.
LCMS: METCR1410 Generic 1.7 min, rt=1.34 мин, M/Z (ES+) 543.05/544.85 [M+Na+], 96% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.93 (d, J=1.7 Гц, 1H), 7.82 (dd, J=8.0, 1.7 Гц, 1H), 7.64 (d, J=8.0 Гц, 1H), 7.40-7.29 (m, 2H), 7.15 (d, J=8.4 Гц, 2H), 5.54 (d, J=7.6 Гц, 1H), 5.42 (d, J=15.1 Гц, 1H), 4.73 (d, J=15.1 Гц, 1H), 4.49-4.31 (m, 1H), 3.92 (s, 3H), 3.70 (dd, J=10.9, 6.6 Гц, 1H), 2.92 (t, J=11.3 Гц, 1H), 1.39 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-5-{[4-метокси-3-(трифторметил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата (Промежуточное соединение VI-33)
Указанное в названии соединение синтезировали согласно общей методике GP1 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 87%.
LCMS: METCR1410 Generic 1.7 min, rt=1.36 мин, M/Z (ES+) 580 [M+Na+] 87% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 7.95 (d, J=6.6 Гц, 1H), 7.63 (d, J=10.0 Гц, 1H), 7.54 (s, 1H), 7.46 (t, J=6.9 Гц, 2H), 7.13 (d, J=8.6 Гц, 1H), 5.24 (d, J=15.4 Гц, 1H), 4.91 (d, J=15.4 Гц, 1H), 4.15 (dt, J=12.2, 7.4 Гц, 1H), 3.87 (s, 3H), 3.83 (s, 3H), 3.49 (dd, J=11.3, 6.8 Гц, 1H), 3.15 (t, J=11.7 Гц, 1H), 1.35 (s, 9H).
Согласно описанной выше и проиллюстрированной общей методике GP2 следующие кислотные промежуточные соединения VII были синтезированы из подходящего промежуточного соединения VI:
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-трет-бутилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-02)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 91% и чистоте 91%, как оценено с помощью ЯМР.
ЯМР данные: 1Н ЯМР (400 МГц, DMSO-d6) δ 7.94 (s, 1Н), 7.79-7.76 (m, 1H), 7.64 (d, J=7.9 Гц, 1H), 7.47 (d, J=8.5 Гц, 1H), 7.32 (d, J=8.3 Гц, 2H), 7.27 (d, J=8.4 Гц, 2H), 5.12-5.06 (m, 2H), 4.28-4.19 (m, 1H), 3.56-3.49 (m, 1H), 3.16 (t, J=11.8 Гц, 1H), 1.41 (s, 9Н), 1.29 (s, 9Н). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-03)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде пены белого цвета при выходе 98%.
LCMS: METCR1278 Generic 3.5 minutes, rt=2.1 мин, M/Z (ES-) 511.10[М-Н+], 100%, УФ ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.92 (d, J=1.6 Гц, 1Н), 7.79 (dd, J=8.0, 1.7 Гц, 1H), 7.74 (d, J=8.0 Гц, 1H), 7.53 (d, J=8.3 Гц, 1H), 7.41 (d, J=8.6 Гц, 2H), 7.26 (d,J=8.2 Гц, 2H), 5.16 (d, J=16.1 Гц, 1H), 5.09 (d, J=16.1 Гц, 1H), 4.15 (dt, J=12.3,7.6 Гц, 1H), 3.53-3.45 (m, 1H), 3.21-3.04 (m, 1H), 1.42-1.28 (m, 9H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[4-(трифторметил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-04)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 92%.
LCMS: METCR1410 Generic 1.7 min, rt=1.2 мин, M/Z (ES+) 441.0 [M-tBu+H+], 519.1 [M+Na+] 96% УФ ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.92 (d, J=1.3 Гц, 1H), 7.78 (dd, J=8.0, 1.6 Гц, 1H), 7.74 (d, J=8.0 Гц, 1H), 7.63 (d, J=8.2 Гц, 2H), 7.55-7.47 (m, 3H), 5.23 (d, J=16.2 Гц, 1H), 5.16 (d, J=16.3 Гц, 1H), 4.17 (dt, J=12.3, 7.6 Гц, 1H), 3.50 (dd, J=11.2, 6.9 Гц, 1H), 3.15 (t, J=11.8 Гц, 1H), 1.35 (s, 9H) [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[3-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-05)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 97%.
LCMS: METUPLCMS-A-004, rt=1.49 мин, M/Z (ES-) 511 [М-Н+] 95% УФ
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-06)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 91%о.
LCMS: METCR1278 Generic 3.5 minutes, rt=1.35 мин, M/Z (ES-) 461/463 [М-Н+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.93-7.90 (m, 1Н), 7.76 (dd, J=8.0, 1.6 Гц, 1H), 7.70 (d, J=8.0 Гц, 1H), 7.47 (d, J=8.1 Гц, 1H), 7.31-7.28 (m, 4H), 5.15 (d, J=15.9 Гц, 1H), 5.01 (d, J=15.9 Гц, 1H), 4.14 (dt, J=12.3, 7.4 Гц, 1H), 3.50-3.47 (m, 1H), 3.14 (d, J=11.8 Гц, 1H), 1.35 (s, 9H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-{[4-(морфолин-4-ил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-07)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 41% (73% чистота по ЯМР).
ЯМР данные: 1Н ЯМР (400 МГц, хлороформ-d) δ 7.95 (d, J=1.6 Гц, 1Н), 7.79 (d, J=8.0 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1Н), 7.16 (d, J=8.7 Гц, 2Н), 6.76 (d, J=8.8 Гц, 2Н), 5.66 (d, J=8.2 Гц, 1H), 5.39 (d, J=14.8 Гц, 1H), 4.72 (d, J=14.7 Гц, 1Н), 3.85-3.77 (m, 4Н), 3.72 (dd, J=10.9, 6.5 Гц, 2Н), 3.12-3.06 (m, 4Н), 2.95 (t, J=11.2 Гц, 1H), 1.40 (s, 9Н). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-цианофенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-08)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде бесцветного твердого вещества при выходе 69%.
LCMS: METUPLCMS-A-004, rt=1.28 мин, M/Z (ES-) 452 [М-Н+] 73% УФ
ЯМР данные: 1Н ЯМР (400 МГц, хлороформ-d) δ 1.41 (s, 9Н), 2.97 (t, J=11.3 Гц, 1Н), 3.82-3.70 (m, 1H), 4.61-4.46 (m, 1Н), 4.86 (d, J=15.7 Гц, 1Н), 5.48 (d, J=15.6 Гц, 1H), 5.66 (d, J=8.4 Гц, 1H), 7.42 (d, J=8.2 Гц, 2Н), 7.54 (d, J=8.2 Гц, 2Н), 7.81-7.63 (m, 2Н), 7.92 (s, 1H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[6-(трифторметил)пиридин-3-ил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-09)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 27%.
LCMS: METCR1673 Generic 2 minutes, rt=1.3 мин, M/Z (ES-) 496 [M-H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.67 (s, 1Н), 7.98 (d, J=1.3 Гц, 1H), 7.94 (d, J=8.5 Гц, 1H), 7.83-7.79 (m, 2H), 7.74 (d, J=8.0 Гц, 1H), 7.50 (d, J=8.2 Гц, 1H), 5.75 (s, 1H), 5.35 (d, J=16.2 Гц, 1H), 5.12 (d, J=16.1 Гц, 1H), 4.14 (dt, J=12.2, 7.5 Гц, 1H), 3.49 (dd, J=11.3, 6.8 Гц, 1H), 3.13 (t, J=11.8 Гц, 1H), 1.34 (s, 9H).
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-10)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 91%.
LCMS: METCR1673 Generic 2 minutes, rt=1.29 мин, M/Z (ES-) 509 [М-Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.92-7.86 (m, 3Н), 7.79-7.71 (m, 2Н), 7.49 (dd, J=17.4, 8.2 Гц, 3Н), 5.17 (s, 2Н), 4.18 (dt, J=12.3, 7.7 Гц, 1Н), 3.51 (dd, J=11.2, 6.8 Гц, 2H), 3.16 (t, J=11.8 Гц, 1H), 2.64 (s, 3Н), 1.36 (s, 9H).
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-4-оксо-5-{[4-(1Н-1,2,4-триазол-1-ил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-12)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 95%.
LCMS: METCR1673 Generic 2 minutes, rt=1.18 мин, M/Z (ES+) 496 [М+Н+] 90% УФ ЯМР данные:1H ЯМР (500 МГц, DMSO-d6) δ 9.24 (s, 1Н), 8.20 (s, 1Н), 7.94 (s, 1H), 7.80-7.66 (m, 4Н), 7.47 (dd, J=16.0, 8.4 Гц, 3Н), 5.23 (d, J=15.9 Гц, 1Н), 5.10 (d, J=15.9 Гц, 1Н), 4.27-4.03 (m, 1H), 3.49 (dd, J=11.3, 6.8 Гц, 1Н), 3.15 (t, J=11.7 Гц, 1H), 1.35 (s, 9Н). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-13)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 83%.
LCMS: METCR1278 Standard 3.5 minutes, rt=2.16 мин, M/Z (ES-) 529 [М-Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, хлороформ-d) δ 7.87 (d, J=6.7 Гц, 1H), 7.60 (d, J=9.9 Гц, 1Н), 7.52 (d, J=8.2 Гц, 1H), 7.38 (d, J=8.7 Гц, 2Н), 7.25 (d, J=8.1 Гц, 2H), 5.17 (d, J=15.9 Гц, 1Н), 5.00 (d, J=15.9 Гц, 1H), 4.16 (dt, J=12.3, 7.6 Гц, 1H), 3.13 (t, J=11.8 Гц, 2H), 1.35 (s, 9H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил)амино}-4-оксо-5-{[4-(1,2,3-тиадиазол-4-ил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-14)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 71%.
LCMS: METCR1673 Generic 2 minutes, rt=1.3 min M/Z (ES-) 511 [M-H-] 77% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 13.28 (s, 1Н), 9.57 (s, 1H), 8.02 (d, J=8.2 Гц, 2H), 7.95 (s, 1H), 7.80-7.65 (m, 3H), 7.45 (d, J=8.2 Гц, 2H), 5.22 (d, J=16.1 Гц, 1H), 5.14 (d, J=16.1 Гц, 1H), 4.24-4.13 (m, 1H), 3.51 (dd, J=10.4, 5.9 Гц, 2H), 1.35 (d, J=6.6 Гц, 9H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-карбамоилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-15)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 25%.
LCMS: METCR1673 Generic 2 minutes, rt=1.1 мин, M/Z (ES-) 470 [М-Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.86 (d, J=1.6 Гц, 1Н), 7.77 (d, J=7.9 Гц, 1H), 7.63 (d, J=8.3 Гц, 2H), 7.58 (d, J=8.0 Гц, 1H), 7.31 (d, J=8.3 Гц, 2H), 5.34 (d, J=15.3 Гц, 1H), 4.85 (d, J=15.3 Гц, 1H), 4.40-4.33 (m, 1H), 3.71-3.59 (m, 2H), 2.94-2.85 (m, 1H), 1.33 (s, 9H). [ОН и NH2 невидимый]
Синтез (2R,3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-2-метил-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-16)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде рыхлого твердого вещества белого цвета при выходе 82%.
LCMS: METCR1673 Generic 2 minutes, rt=1.49 мин, M/Z (ES+) 499/501 [M+Na+] 93% УФ
ЯМР данные: 7.94 (d, J=1.4 Гц, 1Н), 7.77 (dd, J=8.0, 1.6 Гц, 1H), 7.70 (d, J=7.9 Гц, 1H), 7.31 (s, 4H), 7.10 (d, J=8.2 Гц, 1H), 5.27 (d, J=15.8 Гц, 1H), 5.00 (d, J=16.0 Гц, 1H), 4.46-4.34 (m, 1H), 3.93-3.80 (m, 1H), 1.39-1.22 (m, 12H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлор-2-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-17)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде пены бежевого цвета при выходе 87%.
LCMS: METCR1673 Generic 2 minutes, rt=1.36 мин, M/Z (ES-) 497 [М-Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.89 (d, J=6.5 Гц, 1Н), 7.41 (dd, J=8.8, 4.8 Гц, 2Н), 7.08-7.03 (m, 1Н), 6.97 (dd, J=9.6, 2.0 Гц, 1Н), 5.61 (d, J=8.5 Гц, 1H), 5.37 (d, J=15.1 Гц, 1Н), 4.79 (d, J=15.1 Гц, 1Н), 4.55-4.44 (m, 1Н), 3.72 (dd, J=11.0, 6.5 Гц, 1H), 2.91 (t, J=11.3 Гц, 1H), 1.41 (s, 9H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлор-3-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-18)
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде смолы желтого цвета при выходе 94%.
LCMS: METCR1673 Generic 2 minutes, rt=1.36 мин, M/Z (ES+) 521/523 [M+Na+] 98% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 7.82 (d, J=6.6 Гц, 1H), 7.43 (d, J=9.6 Гц, 1H), 7.26 (t, J=7.9 Гц, 1H), 7.15 (dd, J=9.8, 1.8 Гц, 1H), 7.04-6.93 (m, 1H), 5.72 (d, J=8.2 Гц, 1H), 5.36 (d, J=15.4 Гц, 1H), 4.69 (d, J=15.4 Гц, 1H), 4.65-4.54 (m, 1H), 3.76 (dd, J=10.9, 6.6 Гц, 1H), 2.97 (t, J=11.3 Гц, 1H), 1.42 (s, 9H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(3,4-дихлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензогиазенин-7-карбоновой кислоты (Промежуточное соединение VII-19)
Указанное в названии соединение синтезировали согласно общей методике GP2 с по лучением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 94%.
LCMS: METCR1673 Generic 2 minutes, rt=1.4 мин, M/Z (ES+) 519/521/523 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 1.35 (s, 9Н), 3.08 (t, J=11.8 Гц, 1H), 3.45 (dd, J=6.9, 11.31 Гц, 1H), 4.14 (dt, J=7.5, 12.2 Гц, 1H), 5.04 (s, 2H), 7.27 (dd, J=1.6, 8.3 Гц, 1H), 7.44 (d, J=8.2 Гц, 1H), 7.52 (d, J=8.3 Гц, 1H), 7.56 (d, J=7.9 Гц, 1H), 7.57-7.61 (m, 1H), 7.72 (d, J=7.8 Гц, 1H), 7.82 (s, 1H). [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-4-оксо-5-(хинолин-2-илметил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-20)

Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде пенообразного твердого вещества оранжевого цвета при выходе 75%.
LCMS: METCR1673 Generic 2 minutes, rt=1.26 мин, M/Z (ES+) 498[М+Н+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 1.34 (s, 9Н), 3.18 (t, J=11.7 Гц, 1H), 3.53 (dd, J=6.8, 11.2 Гц, 1H), 4.27 (dt, J=7.9, 12.3 Гц, 1H), 5.21 (d, J=16.3 Гц, 1H), 5.35 (d, J=16.3 Гц, 1H), 7.45 (d, J=8.3 Гц, 1H), 7.55-7.67 (m, 3H), 7.75 (t, J=7.7 Гц, 1H), 7.95 (dd, J=8.3, 19.2 Гц, 2H), 8.03 (d, J=6.7 Гц, 1H), 8.35 (d, J=8.5 Гц, 1H). [ОН невидимый] Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-21)

Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 93%.
LCMS: METCR1981 Hydrophobic 3 min, rt=1.68 мин, M/Z (ES+) 494.95[М+Н+] 90% УФ
ЯМР данные:1H ЯМР (500 МГц, DMSO-d6) δ 8.13 (d, J=6.6 Гц, 1H), 7.63 (d, J=9.8 Гц, 1H), 7.49 (d, J=8.3 Гц, 1H), 5.40 (d, J=15.6 Гц, 1H), 5.20 (d, J=15.7 Гц, 1H), 4.34 (s, 1H), 4.12 (dt, J=12.0, 7.8 Гц, 1H), 3.48 (dd, J=11.3, 6.9 Гц, 1H), 3.14-3.04 (m, 1H), 2.50-2.42 (m, 1H), 1.35 (s, 9H), 1.22-1.12 (m, 2H), 0.94 (s, 2H).
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(2-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-22)

Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 85%.
LCMS: METCR1410 Generic1.7 min, rt=1.14 мин, M/Z (ES+) 469.1 [M+Na+] 97% УФ
ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 7.98 (d, J=1.5 Гц, 1H), 7.80 (d, J=7.8 Гц, 1Н), 7.66 (d, J=8.0 Гц, 1H), 7.48 (t, J=6.8 Гц, 1H), 7.25-7.12 (m, 1H), 7.05 (t, J=6.9 Гц, 1H), 7.00-6.83 (m, 1H), 5.66 (d, J=8.2 Гц, 1H), 5.39 (d, J=15.3 Гц, 1H), 4.97 (d, J=15.4 Гц, 1H), 4.48 (s, 1H), 3.74-3.69 (m, 1H), 2.94 (t, J=11.3 Гц, 1H), 1.40 (s, 9H), [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(3-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-23)
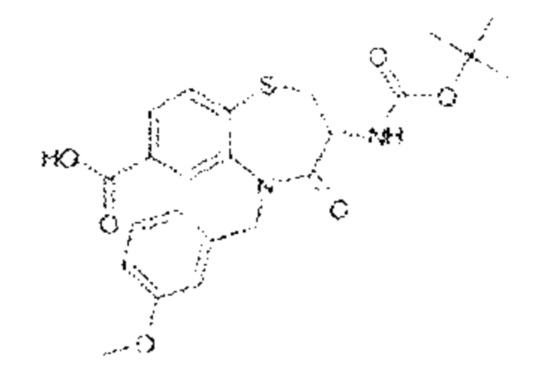
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 89%.
LCMS: METCR1410 Generic 1.7 min, rt=1.13 мин, M/Z (ES+) 481 [M+Na+] 95% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.93 (d, J=1.5 Гц, 1Н) 7.77 (d, J=8.0 Гц, 1Н), 7.66 (d, J=8.0 Гц, 1Н), 7.14 (t, J=7.9 Гц, 1Н), 6.84 (d, J=7.4 Гц, 2Н), 6.78-6.65 (m, 1H), 5.70 (d, J=8.2 Гц, 1H), 5.43 (d, J=15.2 Гц, 1Н), 4.82 (d, J=15.2 Гц, 1Н), 4.51 (s, 1H), 3.74 (m, 4H), 2.99 (t, J=11.2 Гц, 1Н), 1.41 (s, 9H), [OH невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-24)

Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде пены желтого цвета при выходе 93%.
LCMS: METCR1410 Generic 1.7 min, rt=1.12 мин, M/Z (ES+) 481.15 [M+Na+] 83% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.95 (d, J=1.5 Гц, 1Н), 7.76 (d, J=8.0 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1Н), 7.17 (d, J=8.7 Гц, 2Н), 6.79-6.70 (m, 2Н), 5.76 (d, J=8.2 Гц, 1H), 5.44 (d, J=14.8 Гц, 1Н), 4.71 (d, J=14.9 Гц, 1Н), 4.48 (dt, J=11.6, 7.5 Гц, 1H), 3.73 (m, 4Н), 2.96 (t, J=11.3 Гц, 1Н), 1.41 (s, 9Н), [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-25)

Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества желтого цвета (пена) при выходе 96%.
LCMS: METCR1410 Generic 1.7 min. rt=1.14 мин, M/Z (ES+) 409.35 [M-tBu+] 96% УФ
ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 7.81 (d, J=6.5 Гц, 1H), 7.40 (d, J=9.8 Гц, 1Н), 7.21 (dd, J=8.6, 5.4 Гц, 2Н), 6.91 (t, J=8.7 Гц, 2Н), 5.74 (d, J=8.3 Гц, 1Н), 5.43 (d, J=14.9 Гц, 1H), 4.73-4.59 (m, 1Н), 4.53 (dt, J=11.5, 5.9 Гц, 1H), 3.82-3.77 (m, 1H), 2.95 (t, J=11.3 Гц, 1H), 1.42 (s, 9H), [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-циклопропилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-26)
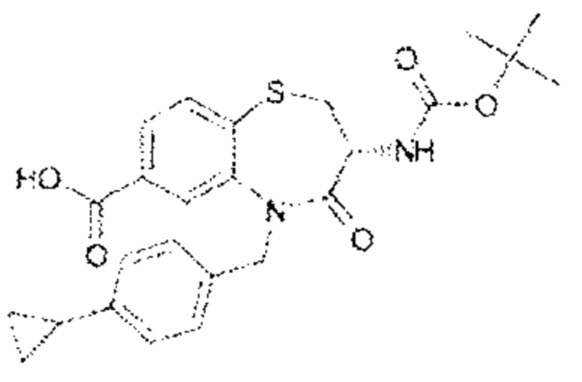
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 99%.
LCMS: METCR1410 Generic 1.7 min. rt=1.21 мин, M/Z (ES+) 491.10 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 7.94 (d, J=1.4 Гц, 1H), 7.77 (d, J=7.9 Гц, 1H), 7.64 (d, J=8.0 Гц, 1H), 7.14 (d, J=8.1 Гц, 2H), 6.92 (d, J=8.2 Гц, 2H), 5.69 (d, J=8.1 Гц, 1H), 5.40 (d, J=15.0 Гц, 1H), 4.76 (d, J=15.0 Гц, 1H), 4.47 (dt, J=11.4, 7.4 Гц, 1H), 4.01-3.90 (m, 1H), 2.95 (t, J=11.2 Гц, 2H), 1.83-1.77 (m, 1H), 1.40 (s, 9H), 0.93-0.86 (m, 2H), 0.65-0.59 (m, 2H).
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-цианофенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-27)
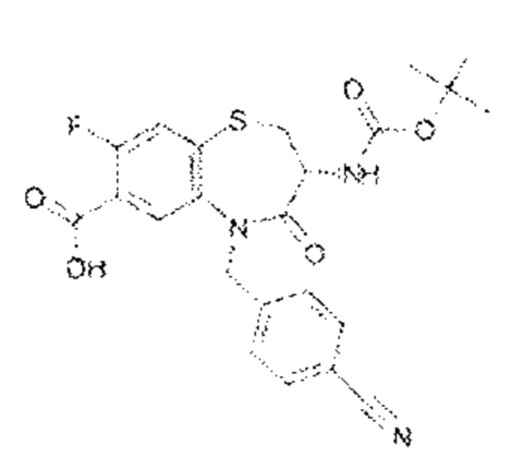
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества светло-желтого цвета при выходе 100%.
LCMS: METCR1410 Generic 1.7 min. rt=1.1 мин, M/Z (ES-) 469.70 [М-Н+] 88% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 13.65 (s, 1Н), 7.84 (d, J=6.5 Гц, 1H), 7.75 (d, J=8.2 Гц, 2H), 7.60 (d, J=9.8 Гц, 1H), 7.51-7.46 (m, 3H), 5.22 (d, J=16.4 Гц, 1H), 5.09 (d, J=16.3 Гц, 1H), 4.19 (dt, J=12.1, 7.4 Гц, 1H), 3.51 (dd, J=11.2, 6.7 Гц, 1H), 3.15 (t, J=11.7 Гц, 1H), 1.36 (s, 9H).
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-5-[(4-метоксифенил)метил]-4оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-28)
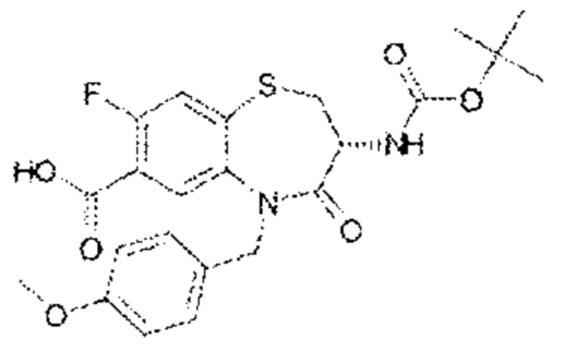
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 96%.
LCMS: METCR1410 Generic 1.7 min, rt=1.12 мин, M/Z (ES+) 499.5 [M+Na+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.89 (d, J=6.7 Гц, 1Н), 7.56 (d, J=9.9 Гц, 1H), 7.44 (d, J=8.4 Гц, 1H), 7.15 (d, J=8.6 Гц, 2H), 6.79 (d, J=8.6 Гц, 2H), 5.17 (d, J=15.4 Гц, 1H), 4.84 (d, J=15.4 Гц, 1H), 4.15 (dt, J=12.2, 7.5 Гц, 1H), 3.69 (s, 3H), 3.48 (dd, J=11.2, 6.8 Гц, 1H), 3.14 (t, J=11.7 Гц, 1H), 1.36 (s, 9H), [ОН невидимый]
Синтез (2R,3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-8-фтор-2-метил-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-29)

Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде бесцветной пены при выходе 99%.
LCMS: METCR1410 Generic 1.7 min, rt=1.29 мин, M/Z (ES+) 517/519 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (250 МГц, DMSO-d6) δ 7.87 (d, J=6.7 Гц, 1Н), 7.54 (d, J=9.9 Гц, 1H), 7.40-7.24 (m, 4H), 7.09 (d, J=7.7 Гц, 1H), 5.27 (d, J=15.5 Гц, 1H), 4.90 (d, J=15.7 Гц, 1H), 4.44-4.32 (m, 1H), 3.92-3.80 (m, 1H), 1.43-1.20 (m, 12H), [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-5-{[4-(дифторметокси)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-30)
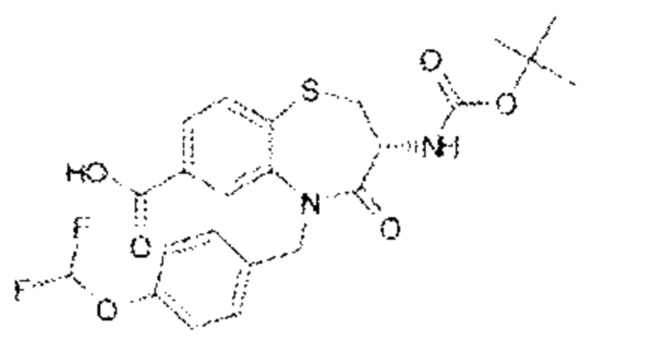
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 94%.
LCMS: METCR1410 Generic 1.7 min. rt=1.1 мин, M/Z (ES+) 517.45 [M+Na+] 87% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.86 (d, J=1.3 Гц, 1H), 7.71 (d, J=8.0 Гц, 1H), 7.60 (d, J=8.0 Гц, 1Н), 7.21 (d, J=8.6 Гц, 2Н), 6.91 (d, J=8.5 Гц, 2Н), 6.37 (t, J=74.0 Гц, 1H), 5.61 (d, J=8.3 Гц, 1H), 5.36 (d, J=15.1 Гц, 1H), 4.71 (d, J=15.2 Гц, 1H), 4.43 (dt, J=11.5, 7.6 Гц, 1H), 3.70-3.64 (m, 1H), 2.89 (t, J=11.3 Гц, 1H), 1.34 (s, 9H), [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-8-хлор-5-[(4-хлорфенил)метил]-4оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-31)
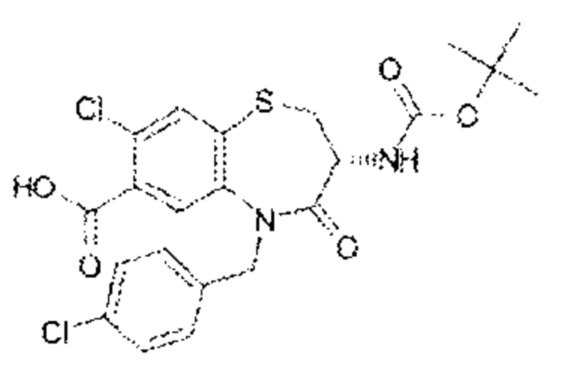
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 99%.
LCMS: METCR1410 Generic 1.7 min. rt=1.21 мин, M/Z (ES+) 440.85/442.90 [М-tBu+], 519/521.05 [M+Na+] 94.3% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.58 (s, 2Н), 7.45 (d, J=8.3 Гц, 1Н), 7.33-7.24 (m, 4H), 5.14 (d, J=15.9 Гц, 1H), 4.93 (d, J=15.9 Гц, 1H), 4.14 (dt, J=12.1, 7.6 Гц, 1H), 3.49-3.44 (m, 1H), 3.08 (t, J=11.8 Гц, 1H), 1.35 (s, 9H), [ОН невидимый]
Синтез (3R)-5-[(4-бромфенил)метил]-3-{[(трет-бутокси)карбонил)амино}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-32)
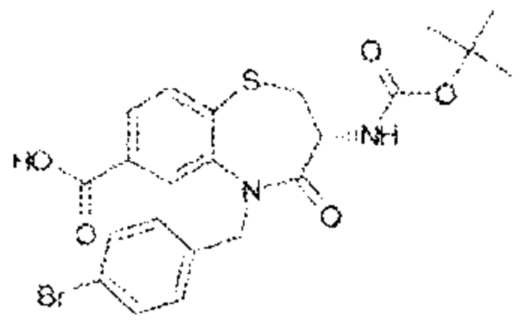
Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 96%.
LCMS: METCR1410 Generic 1.7 min, rt=1.23 мин, M/Z (ES+) 451.0/453.05 [М-tBu+H+], 529.1/531.1 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.91 (d, J=1.4 Гц, 1Н), 7.77 (dd, J=8.0, 1.6 Гц, 1H), 7.71 (d, J=8.0 Гц, 1H), 7.47 (d, J=8.3 Гц, 1H), 7.44 (d, J=8.4 Гц, 2H), 7.23 (d, J=8.3 Гц, 2H), 5.14 (d, J=16.0 Гц, 1H), 5.00 (d, J=15.9 Гц, 1H), 4.14 (dt, J=12.3, 7.6 Гц, 1H), 3.48 (dd, J=11.2, 6.8 Гц, 1H), 3.13 (t, J=11.8 Гц, 1H), 1.35 (s, 9H), [ОН невидимый]
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-8-фтор-5-{[4-метокси-3-(трифторметил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты (Промежуточное соединение VII-33)

Указанное в названии соединение синтезировали согласно общей методике GP2 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 566.90 [M+Na+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.81 (d, J=6.3 Гц, 1Н), 7.54 (s, 1H), 7.51-7.40 (m, 3H), 7.13 (d, J=8.6 Гц, 1H), 5.22 (d, J=15.6 Гц, 1H), 4.89 (d, J=15.6 Гц, 1Н), 4.15 (dt, J=12.1, 7.6 Гц, 1H), 3.91-3.85 (m, 1H), 3.83 (s, 3H), 3.47 (dd, J=11.3, 6.8 Гц, 1H), 3.11 (r, J=11.7 Гц, 1H), 1.35 (s, 9H), [ОН невидимый]
Согласно описанной выше и проиллюстрированной общей методике GP3 следующие амидные промежуточные соединения VIII синтезировали из кислотного промежуточного соединения VII и подходящего амина R3-NH2:
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-4-оксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-02)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 53%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 526/528 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 1.25 (dd, J=5.2, 6.5 Гц, 6Н), 1.39 (s, 9Н), 2.90 (t, J=11.3 Гц, 1Н), 3.67 (dd, J=6.6, 11.0 Гц, 1Н), 4.23 (dp, J=6.6, 13.2 Гц, 1H), 4.39 (dt, J=7.5, 11.4 Гц, 1H), 4.81 (d, J=15.0 Гц, 1Н), 5.31 (d, J=15.0 Гц, 1H), 5.58 (d, J=8.0 Гц, 1Н), 5.91 (d, J=7.5 Гц, 1Н), 7.17-7.24 (m, 4Н), 7.46 (dd, J=1.8, 8.0 Гц, 1Н), 7.60 (d, J=8.0 Гц, 1H), 7.66 (d, J=1.5 Гц, 1Н)
Синтез трет-бутил N-[(3R)-7-({[4-(морфолин-4-ил)фенил]метил}карбамоил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-03)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения и применяли на следующей стадии без дальнейшего анализа
Синтез трет-бутил N-[(3R)-7-[(бут-3-ен-1-ил)карбамоил]-5[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-04)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 84%.
LCMS: METCR1673 Generic 2 minutes, rt=1.44 мин, M/Z (ES-) 514/516 [М-Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.63 (t, J=5.6 Гц, 1Н), 7.91 (s, 1H), 7.67 (s, 2H), 7.45 (d, J=8.3 Гц, 1H), 7.28 (s, 4H), 5.82 (ddt, J=17.0, 10.2, 6.7 Гц, 1H), 5.29 (d, J=15.7 Гц, 1H), 5.11-4.99 (m, 2H), 4.91 (d, J=15.7 Гц, 1H), 4.13 (dt, J=12.2, 7.6 Гц, 1H), 3.46 (dd, J=11.3, 6.8 Гц, 1H), 3.11 (t, J=11.8 Гц, 1H), 2.52 (d, J=1.9 Гц, 2H), 2.28 (q, J=7.0 Гц, 2H), 1.34 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[({4-[(5-ацетамидопентил)окси]фенил}метил)карбамоил]-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-05)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 14% (95% чистота по ЯМР)
ЯМР данные: 1Н ЯМР (400 МГц, DMSO-d6) δ 1.35-1.21 (m, 9Н), 1.48-1.35 (m, 4Н), 1.72-1.62 (m, 2Н), 1.76 (s, 3Н), 3.01 (q, J=6.4 Гц, 2Н), 3.10 (t, J=11.8 Гц, 1Н), 3.46 (dd, J=11.3, 6.9 Гц, 1H), 3.91 (t, J=6.5 Гц, 2H),4.10 (d, J=6.9 Гц, 1H), 4.39 (qd, J=14.7, 5.6 Гц, 2H), 4.97 (d, J=15.7 Гц, 1H), 5.28 (d, J=15.8 Гц, 1H), 6.87 (d, J=8.7 Гц, 2H), 7.22 (dd, J=8.8, 2.6 Гц, 4H), 7.38 (d, J=8.7 Гц, 2H), 7.46 (d, J=8.4 Гц, 1H),7.68 (d, J=8.0 Гц, 1H), 7.73 (dd, J=8.0, 1.6 Гц, 1H), 7.79 (s, 1H), 7.96 (d, J=1.5 Гц, 1H), 9.13 (t, J=5.9 Гц, 1H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-(циклопропилкарбамоил)-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-06)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 88%.
LCMS: METCR1673 Generic 2 minutes, rt=1.41 мин, M/Z (ES+) 542/544 [M+Na+] 95% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.54 (d, J=4.1 Гц, 1H), 7.68 (d, J=6.4 Гц, 1Н), 7.53 (d, J=9.3 Гц, 1H), 7.43 (d, J=8.4 Гц, 1H), 7.34-7.23 (m, 4H), 5.26 (d, J=15.6 Гц, 1H), 4.87 (d, J=15.5 Гц, 1H), 4.14 (dt, J=12.2, 7.9 Гц, 2H), 3.15-3.06 (m, 1H), 2.76 (s, 1H), 1.35 (s, 9H), 0.75-0.65 (m, 2H), 0.54 (d, J=2.0 Гц, 2H)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-4-оксо-7-(пропоксикарбамоил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-07)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 52%.
LCMS: METCR1673 Generic 2 minutes, rt=1.41 мин, M/Z (ES-) 518/520 [М-Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.66 (s, 1Н), 7.73-7.41 (m, 3Н), 7.20 (s, 4H), 5.58 (d, J=8.2 Гц, 1H), 5.34 (t, J=14.6 Гц, 1H), 4.79 (dd, J=15.0, 8.6 Гц, 1H), 4.45-4.34 (m, 1H), 4.03 (dt, J=65.1, 6.7 Гц, 2H), 3.68 (dd, J=11.0, 6.6 Гц, 1H), 2.98-2.85 (m, 1H), 1.73 (h, J=7.1, 6.5 Гц, 2H), 1.40 (s, 9H), 0.99 (dt, J=11.7, 7.5 Гц, 3Н)
Синтез трет-бутил N-[(3R)-5[(4-хлорфенил)метил]-8-фтор-4-оксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-08)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 51%.
LCMS: METCR1673 Generic 2 minutes, rt=1.47 мин, M/Z (ES+) 544/546 [M+Na+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.05 (d, J=7.1 Гц, 1H), 7.34 (d, J=10.8 Гц, 1H), 7.23-7.16 (m, 4Н), 6.54-6.42 (m, 1Н), 5.56 (d, J=7.7 Гц, 1Н), 5.51 (d, J=15.1 Гц, 1H), 4.64 (d, J=15.1 Гц, 1H), 4.43-4.34 (m, 1H), 4.29 (dt, J=11.8, 6.5 Гц, 1H), 3.70 (dd, J=10.9, 6.5 Гц, 1H), 2.92 (t, J=11.3 Гц, 1H), 1.39 (s, 9H), 1.27 (d, J=6.6 Гц, 6H)
Синтез трет-бутил N-[(3R)-5-[(4-хлор-3-фторфенил)метил]-4-оксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-09)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бесцветного масла при выходе 74%.
LCMS: METCR1673 Generic 2 minutes, rt=1.45 мин, M/Z (ES+) 544/546 [M+Na+] 98% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 1.25 (dd, J=4.2, 6.5 Гц, 6Н), 1.39 (s, 9Н), 2.91 (t, J=11.3 Гц, 1Н), 3.68 (dd, J=6.6, 11.0 Гц, 1H), 4.24 (dp, J=6.6, 13.2 Гц, 1Н), 4.40 (dt, J=7.5, 11.5 Гц, 1H), 4.77 (d, J=15.2 Гц, 1H), 5.36 (d, J=15.2 Гц, 1H), 5.56 (d, J=8.1 Гц, 1H), 5.94 (d, J=7.5 Гц, 1H), 6.96-7.02 (m, 1H), 7.14 (dd, J=1.9, 9.8 Гц, 1H), 7.24 (t, J=7.9 Гц, 1H), 7.46 (dd, J=1.8, 8.0 Гц, 1H), 7.62 (d, J=8.0 Гц, 1H), 7.68-7.74 (m, 1H).
Синтез трет-бутил N-[(3R)-7-{[(4-метоксифенил)метил]карбамоил}-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-10)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 62%.
LCMS: MET-UPLCMS-A-006, rt=4.08 мин, M/Z (ES+) 632 [М+Н+] 94% УФ
ЯМР данные: 1H ЯМР (400 МГц, Хлороформ-d) δ 1.39 (s, 9Н), 2.91 (t, J=11.3 Гц, 1Н), 3.74-3.59 (m, 1Н), 3.81 (s, 3Н), 4.47-4.34 (m, 1Н), 4.61-4.49 (m, 2Н), 4.84(d, J=15.2 Гц, 1H), 5.37 (d, J=15.2 Гц, 1Н), 6.93-6.87 (m, 2Н), 7.06 (d, J=8.0 Гц, 2Н), 7.33-7.23 (m, 6Н), 7.47 (dd, J=8.0, 1.8 Гц, 1Н), 7.62 (d, J=8.0 Гц, 1H), 7.76 (d, J=1.7 Гц, 1Н).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-карбамоилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-11)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 35%.
LCMS:METCR1673 Generic 2 minutes, rt=1.22 мин, M/Z (ES+)549 [M+Na+], 427 [M+H-boc] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.56 (t, J=5.6 Гц, 1H), 7.88 (d, J=12.0 Гц, 2H), 7.72 (d, J=8.2 Гц, 2H), 7.66 (s, 2H), 7.45 (d, J=8.4 Гц, 1H), 7.33 (d, J=8.2 Гц, 2H), 7.27 (s, 1H), 5.29 (d, J=15.8 Гц, 1H), 5.01 (d, J=16.0 Гц, 1H), 4.15 (dt, J=11.9, 7.8 Гц, 1H), 3.46 (dd, J=11.3, 6.8 Гц, 1H), 3.24 (dt, J=13.0, 6.6 Гц, 2H), 3.12 (t, J=11.8 Гц, 1H), 1.49 (p, J=7.1 Гц, 2H), 1.34 (s, 9H), 1.31-1.25 (m, 2H), 0.89 (t, J=7.4 Гц, 3H)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(3-метилбутан-2-ил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-12)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 69%.
LCMS: METCR1673 Generic 2 minutes, rt=1.53 мин, M/Z (ES+) 554/556 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.66-7.58 (m, 2Н), 7.49-7.43 (m, 1Н), 7.22 (s, 4Н), 5.74 (t, J=9.7 Гц, 1H), 5.56 (d, J=8.0 Гц, 1Н), 5.21 (dd, J=27.0, 15.1 Гц, 1Н), 4.98-4.86 (m, 1Н), 4.41 (s, 1Н), 4.10-3.97 (m, 1Н), 3.70 (dd, J=10.9, 6.6 Гц, 1Н), 2.91 (t, J=11.3 Гц, 1H), 1.86-1.73 (m, 1H), 1.40 (s, 9Н), 1.17 (dd, J=6.7, 1.5 Гц, 3Н), 0.99-0.90 (m, 6Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[N'-(2-метилпропил)гидразин-карбонил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-13)
Указанное к названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 26%.
LCMS: METCR1673 Generic 2 minutes, rt=1.44 мин, M/Z (ES-) 531/533 [М-Н+] 95%, УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.69 (d, J=1.7 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1H), 7.48-7.41 (m, 1H), 7.21 (s, 4H), 5.55 (d, J=8.1 Гц, 1H), 5.35 (d, J=15.2 Гц, 1H), 4.81 (d, J=15.2 Гц, 1H), 4.41 (dt, J=11.7, 7.4 Гц, 1H), 3.70 (dd, J=10.9, 6.6 Гц, 1H), 2.98-2.86 (m, 1H), 2.76 (dd, J=6.8, 1.2 Гц, 2H), 1.81 (tt, J=13.4, 6.7 Гц, 1H), 1.40 (s, 9H), 0.99 (d, J=6.7 Гц, 6H). [NH-NH невидимый]
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-(циклобутилкарбамоил)-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-14)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 81%.
LCMS: METCR1673 Generic 2 minutes, rt=1.5 мин, M/Z (ES+) 556/558 [M+Na+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=7.1 Гц, 1Н), 7.35 (d, J=10.9 Гц, 1H), 7.23-7.14 (m, 4Н), 6.79 (dd, J=13.3, 7.4 Гц, 1Н), 5.56 (d, J=7.3 Гц, 1H), 5.51 (d, J=15.1 Гц, 1Н),4.63 (d, J=15.1 Гц, 1Н), 4.61-4.50(m, 1H), 4.43-4.33 (m, 1H), 3.70 (dd, J=10.9, 6.4 Гц, 1Н), 2.93 (t, J=11.2 Гц, 1Н), 2.50-2.40 (m, 2Н), 2.04-1.93 (m, 2Н), 1.88-1.75 (m, 2Н), 1.39 (s, 9Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(1-метилциклопропил)-карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-15)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде коричневого масла при выходе 54%.
LCMS: METCR1673 Generic 2 minutes, rt=1.47 мин, M/Z (ES-) 532/534 [М-Н+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.67 (s, 1H), 8.15 (s, 1H), 7.65 (d, J=6.4 Гц, 1H), 7.51 (d, J=9.3 Гц, 1H), 7.42 (d, J=8.3 Гц, 1H), 7.28 (q, J=8.5 Гц, 3H), 5.24 (d, J=15.6 Гц, 1H), 4.86 (d, J=15.6 Гц, 1H), 4.12 (dt, J=12.1, 7.7 Гц, 1H), 3.47-3.45 (m, 1H), 3.12-3.07 (m, 1H), 1.39-1.26 (m, 12H), 0.76-0.69 (m, 2H), 0.63-0.58 (m, 2H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(2-гидрокси-2-метилпропил)-карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-16)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 95%.
LCMS: METCR1673 Generic 2 minutes, rt=1.32 мин, M/Z (ES+) 556/558 [M+Na] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ d 7.72 (d, J=1.8 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1H), 7.52 (dd, J=8.0, 1.7 Гц, 1H), 7.21 (s, 4H), 6.47 (t, J=5.6 Гц, 1H), 5.56 (d, J=8.2 Гц, 1H), 5.31 (d, J=15.1 Гц, 1H), 4.85 (d, J=15.1 Гц, 1H), 4.45-4.37 (m, 1H), 3.70 (dd, J=11.0, 6.6 Гц, 1H), 3.51-3.40 (m, 2H), 2.91 (t, J=11.3 Гц, 1H), 1.89 (s, 1H), 1.40 (s, 9H), 1.29 (s, 6H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(2-метилпропокси)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-17)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 25%.
LCMS: METCR1673 Generic 2 minutes, rt=1.46 мин, M/Z (ES-) 532/534 [М-Н+] 100%, УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.53 (s, 1H), 7.73-737 (m, 3H), 7.20 (s, 4H), 5.56 (d, J=8.2 Гц, 1H), 5.33 (t, J=15.8 Гц, 1H), 4.80 (dd, J=15.0, 7.4 Гц, 1H), 4.46-4.34 (m, 1H), 3.85 (dd, J=61.1, 6.8 Гц, 2H), 3.69 (dd, J=11.0, 6.6 Гц, 1H), 2.97-2.84 (m, 1H), 2.12-2.02 (m, 1H), 1.40 (s, 9H), 0.98 (dd, J=15.8, 6.7 Гц, 6H)
Синтез трет-бутил N-[(3R)-7-[(бутан-2-ил)карбамоил]-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-20)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 43%.
LCMS: METCR1673 Generic 2 minutes, rt=1.55 мин, M/Z (ES+) 558/560 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.25 (d, J=8.2 Гц, 1Н), 7.62 (d, J=6.4 Гц, 1H), 7.54 (d, J=9.1 Гц, 1H), 7.43 (d, J=8.4 Гц, 1H), 7.32-7.26 (m, 4H), 5.20 (d, J=15.7 Гц, 1H), 4.93 (s, 1H), 4.15 (dt, J=12.1, 7.5 Гц, 1H), 3.86 (dt, J=14.3, 6.9 Гц, 1H), 3.47 (dd, J=11.4, 6.9 Гц, 1H), 3.11 (t, J=11.8 Гц, 1H), 1.50-1.43 (m, 2H), 1.35 (s, 9H), 1.11 (d, J=6.6 Гц, 3H), 0.85 (t, J=7.4 Гц, 3H).
Синтез трет-бутил N-[(3R)-7-(трет-бутилкарбамоил)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-21)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 45%.
LCMS: METCR1673 Generic 2 minutes, rt=1.58 мин, M/Z (ES+) 558/560 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.01 (s, 1Н), 7.62 (d, J=6.4 Гц, 1H), 7.51 (d, J=9.1 Гц, 1H), 7.41 (d, J=8.3 Гц, 1H), 7.31-7.27 (m, 4H), 5.22 (d, J=15.7 Гц, 1H), 4.90 (d, J=15.7 Гц, 1H), 4.15 (dt, J=12.2, 8.1 Гц, 1H), 3.46 (dd, J=11.4, 6.9 Гц, 1H), 3.10 (t, J=11.8 Гц, 1H), 1.35-1.34 (m, 18H).
Синтез трет-бутил N-[(3R)-5-[(3,4-дихлорфенил)метил]-4-оксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-22)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бесцветного масла при выходе 74%.
LCMS: METCR1673 Generic 2 minutes, rt=1.5 мин, M/Z (ES+) 560/562 [M+Na+] 100%, УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 1.26 (dd, J=5.1, 6.5 Гц, 6Н), 1.39 (s, 9Н), 2.91 (t, J=11.3 Гц, 1Н), 3.68 (dd, J=6.6, 11.0 Гц, 1Н), 4.24 (dp, J=6.6, 13.1 Гц, 1H), 4.40 (dt, J=7.5, 11.5 Гц, 1Н), 4.75 (d, J=15.2 Гц, 1H), 5.36 (d, J=15.2 Гц, 1H), 5.56 (d, J=8.1 Гц, 1H), 5.94 (d, J=7.5 Гц, 1H), 7.11 (dd, J=1.9, 8.3 Гц, 1H), 7.29 (d, J=8.3 Гц, 1H), 7.42 (d, J=2.0 Гц, 1H), 7.47 (dd, J=1.8, 8.0 Гц, 1H), 7.62 (d, J=8.0 Гц, 1H), 7.68-7.73 (m, 1H).
Синтез трет-бутил N-[(3R)-7-(N'-бутаноилгидразинкарбонил)-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-25)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 27%.
LCMS: METCR1673 Generic 2 minutes, rt=1.3 мин, M/Z (ES-) 545 [М-Н+] 74% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.93 (s, 1H), 8.37 (s, 1H), 7.78 (d, J=1.7 Гц, 1Н), 7.65 (dd, J=8.0, 2.9 Гц, 1Н), 7.57-7.49 (m, 1Н), 7.20 (d, J=2.7 Гц, 4Н), 5.56 (d, J=8.1 Гц, 1H), 5.41 (dd, J=15.1, 12.2 Гц, 1H), 4.79-4.73 (m, 1H), 4.42 (s, 1H), 3.70 (dd, J=10.9, 6.6 Гц, 1H), 2.92 (q, J=10.7, 10.2 Гц, 1H), 2.30 (q, J=7.7 Гц, 2H), 1.79-1.71 (m, 2H), 1.39 (s, 9H), 1.01 (t, J=7.4 Гц, 3Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(1-метилциклобутил)-карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-26)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 49%.
LCMS: METCR1673 Generic 2 minutes, rt=1.55 мин, M/Z (ES-) 546/548 [М-Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.47 (s, 1Н), 7.67 (d, J=6.4 Гц, 1H), 7.52 (d, J=9.2 Гц, 1H), 7.42 (d, J=8.4 Гц, 1H), 7.32-7.27 (m, 4H), 5.24 (d, J=15.7 Гц, 1H), 4.89 (d. J=15.6 Гц, 1H), 4.14 (dt, J=12.1, 7.7 Гц, 1H), 3.46 (dd, J=11.3, 6.9 Гц, 1H), 3.11 (t, J=11.7 Гц, 1H), 2.33-2.29 (m, 2H), 2.00-1.91 (m, 2H), 1.85-1.76 (m, 2H), 1.46 (s, 3H), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(2,2-диметилциклопропил)-карбамоил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-27)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 55%.
LCMS: METCR1673 Generic 2 minutes, rt=1.58 мин, M/Z (ES-) 546/548 [М-Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.44 (d, J=3.9 Гц, 1H), 7.63 (d, J=6.4 Гц. 1H), 7.54 (d, J=9.1 Гц, 1H), 7.44 (d, J=8.4 Гц, 1H), 7.32-7.26 (m, 4H), 5.19 (d, J=15.7 Гц, 1H), 4.93 (d, J=15.7 Гц, 1H), 4.16 (dt, J=12.2, 7.6 Гц, 1H), 3.48 (dd, J=11.3, 6.9 Гц, 1H), 3.12 (t, J=11.7 Гц, 1H), 2.55 (dt, J=8.2, 4.1 Гц, 1H), 1.35 (s, 9H), 1.07 (s, 3H), 0.98 (s, 3H), 0.67 (dd, J=7.9, 5.2 Гц, 1H), 0.47 (t, J=4.7 Гц, 1H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[N'-(2-метилпропил)гидразинкарбонил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-28)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 28%.
LCMS: METCR1673 Generic 2 minutes, rt=1.49 мин, M/Z (ES+) 573/575 [M+Na+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.92 (s, 1Н), 7.63 (d, J=6.3 Гц, 1H), 7.55 (d, J=9.2 Гц, 1H), 7.46-7.42 (m, 1H), 7.32-7.27 (m, 4H), 5.22-5.10 (m, 2H), 4.92 (d, J=15.7 Гц, 1H), 4.15 (dt, J=12.1, 7.7 Гц, 1H), 3.48 (dd, J=11.4, 6.9 Гц, 1H), 3.11 (t, J=11.7 Гц, 1H), 2.60 (d, J=6.4 Гц, 2H), 1.71 (m, 6.7 Гц, 1H), 1.35 (s, 9H), 0.90 (d, J=6.7 Гц, 6H).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-4-оксо-5-{[4-(1Н-1,2,4-триазол-1-ил)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-29)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 37%.
LCMS: METCR1673 Generic 2 minutes, rt=1.3 мин, M/Z (ES-) 549 [М-Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.22 (s, 1Н), 8.58 (t, J=5.6 Гц, 1H), 8.19 (s, 1H), 7.94 (s, 1H), 7.72 (d, J=8.5 Гц, 2H), 7.66 (d, J=8.0 Гц, 2H), 7.45 (t, J=7.6 Гц, 3H), 5.36 (d, J=15.8 Гц, 1H), 5.00 (d, J=15.7 Гц, 1H), 4.15 (dt, J=12.2, 7.7 Гц, 1H), 3.47 (dd, J=11.4, 6.8 Гц, 1H), 3.28-3.22 (m, 2H), 3.13 (t, J=11.8 Гц, 1H), 1.50 (m, 2H), 1.35 (s, 9H), 1.32-1.28 (m, 2H), 0.89 (t, J=7.4 Гц, 3H).
Синтез трет-бутил N-[(2R,3R)-5-[(4-хлорфенил)метил]-7-[(2,2-дифторциклопропил)-карбамоил]-2-метил-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-30)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 33%.
LCMS: METCR1673 Generic 2 minutes, rt=1.35 мин, M/Z (ES+) 574/576 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.96 (s, 1H), 7.96 (d, J=8.2 Гц, 1H), 7.74-7.66 (m, 2H), 7.30 (s, 4H), 7.08 (d, J=8.0 Гц, 1H), 5.47-5.34 (m, 1H), 4.90 (dd, J=15.7, 3.5 Гц, 1H), 4.41-4.33 (m, 1H), 3.87-3.78 (m, 1H),3.46(s, 1H), 2.06-1.93 (m, 1H), 1.67 (s, 1H), 1.39-1.25 (m, 12H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(2-гидрокси-2-метил-пропил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бснзотиазепин-3-ил]карбамата (Промежуточное соединение VIII-31)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 47%.
LCMS: METCR1673 Generic 2 minutes, rt=1.36 мин, M/Z (ES+) 574/576 [M+Na+] 100%, УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.05 (d, J=7.0 Гц, 1Н), 7.37 (d, J=10.8 Гц, 1H), 7.20 (s, 4Н), 5.56 (s, 1Н), 5.50 (d, J=15.1 Гц, 1Н), 4.66 (d, J=15.1 Гц, 1H), 4.39 (s, 1H), 3.71 (dd, J=10.8, 6.5 Гц, 1H), 3.58-3.43 (m, 2H), 2.93 (t, J=11.2 Гц, 1H), 1.40 (s, 9H), 1.31 (s, 6H) [2 × NH невидимый]
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(2-метилпропокси)-карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-32)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде желтого вязкого масла при выходе 98%.
LCMS: METCR1673 Generic 2 minutes, rt=1.51 мин, M/Z (ES+) 574/576 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 9.12 (d, J=11.8 Гц, 1Н), 8.04 (d, J=6.5 Гц, 1H), 7.36 (d, J=10.5 Гц, 1H), 7.19 (s, 4H), 5.57 (d, J=7.8 Гц, 1H), 5.52 (d, J=15.1 Гц, 1H), 4.63 (d, J=15.1 Гц, 1H), 4.39 (dt, J=11.6, 7.1 Гц, 1H), 3.83 (d, J=6.7 Гц, 2H), 3.70 (dd, J=10.9, 6.4 Гц, 1H), 2.94 (t, J=11.2 Гц, 1H), 2.04 (s, 1H), 1.39 (s, 9H), 1.01 (d, J=6.7 Гц, 6H)
Синтез трет-бутил N-[(3R)-7-{[3-(2,2-диметилпропанамидо)пронил]карбамоил}-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-33)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 23%.
LCMS: MET-UPLCMS-A-006, rt=4.31 мин, M/Z (ES+) 653 [M+H+] 99% УФ
ЯМР данные: 1H ЯМР (400 МГц, DMSO-d6) δ 1.07 (s, 9Н), 1.30 (s, 9Н), 1.63 (р, J=6.9 Гц, 2Н), 3.13-3.03 (m, 3Н), 3.28-3.18 (m, 2Н), 3.45 (dd, J=11.3, 6.9 Гц, 1H), 4.18-4.05 (m, 1H), 4.97 (d, J=15.8 Гц, 1Н), 5.30 (d, J=15.8 Гц, 1Н), 7.22 (d, J=8.0 Гц, 2Н), 7.39 (d, J=8.7 Гц, 2Н), 7.49 (dd, J=14.6, 7.1 Гц, 2Н), 7.72-7.64 (m, 2Н), 7.93 (s, 1H), 8.64 (t, J=5.7 Гц, 1H).
Синтез трет-бутил N-[(3R)-7-(бензилкарбамоил)-8-фтор-4-оксо-5-{[4-(трифторметокси)-фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-34)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 53% (92% чистота по ЯМР)
ЯМР данные: 1H ЯМР (400 МГц, Хлороформ-d) δ 8.12 (d, J=7.0 Гц, 1H), 7.40-7.28 (m, 8Н), 7.08 (d, J=7.9 Гц, 2Н), 7.05-6.97 (m, 1H), 5.55 (t, J=11.5 Гц, 2Н), 4.67 (td, J=14.8, 6.3 Гц, 3Н), 4.46-4.35 (m, 1H), 3.71 (dd, J=10.8, 6.4 Гц, 1Н), 2.94 (t, J=11.3 Гц, 1Н), 1.40 (s, 9Н).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-хлор-2-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-35)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бледно-коричневого твердого вещества при выходе 75%.
LCMS: METCR1416 generic 7minutes, rt=4.89 мин, M/Z (ES+) 576/578 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.09 (d, J=7.0 Гц, 1Н), 7.44-7.32 (m, 2Н), 7.04 (dd, J=8.2, 1.6 Гц, 1Н), 6.97 (dd, J=9.6, 2.0 Гц, 1Н), 6.73-6.59 (m, 1H), 5.54 (d, J=7.8 Гц, 1Н), 5.40 (d, J=15.3 Гц, 1Н), 4.79 (d, J=15.2 Гц, 1Н), 4.43-4.34 (m, 1H), 3.68 (dd, J=11.6, 7.2 Гц, 1H), 3.48 (dq, J=13.2, 6.5 Гц, 2Н), 2.88 (t, J=11.3 Гц, 1H), 1.62 (р, J=7.2 Гц, 2Н), 1.46-1.40 (m, 2Н), 1.39 (s, 9Н), 0.97 (t, J=7.4 Гц, 3Н).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-хлор-3-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-36)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 68%.
LCMS: METCR1673 Generic 2 minutes, rt=1.56 мин, M/Z (ES+) 576/578 [M+Na] 90% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.06 (d, J=7.0 Гц, 1Н), 7.37 (d, J=10.8 Гц, 1H), 7.25-7.22 (m, 1H), 7.13 (d, J=9.8 Гц, 1Н), 7.02-6.96 (m, 1H), 6.72-6.63 (m, 1H), 5.54 (d, J=8.4 Гц, 1H), 5.50 (d, J=15.3 Гц, 1Н), 4.64 (d, J=15.3 Гц, 1Н), 4.46-4.34 (m, 1Н), 3.78-3.63 (m, 1Н), 3.54-3.38 (m, 2Н), 2.94 (t, J=11.4 Гц, 1H), 1.66-1.58 (m, 2Н), 1.48-1.41 (m, 2Н), 1.40 (s, 9Н), 0.97 (t, J=7.3 Гц, 3Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(оксан-4-илметил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-37)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1673 Generic 2 minutes, rt=1.37 мин, M/Z (ES+) 560/562 [М+Н+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.67 (d, J=1.8 Гц, 1H), 7.63 (d, J=8.0 Гц, 1H), 7.46 (dd, J=8.0, 1.8 Гц, 1Н), 7.21 (s, 4H), 6.07 (t, J=5.9 Гц, 1Н), 5.55 (d, J=8.1 Гц, 1Н), 5.28 (d, J=15.2 Гц, 1Н), 4.86 (d, J=15.1 Гц, 1H), 4.45-4.36 (m, 1Н), 4.00 (dd, J=11.3, 3.2 Гц, 2Н), 3.69 (dd, J=11.0, 6.6 Гц, 1H), 3.46-3.27 (m, 4Н), 2.91 (t, J=11.3 Гц, 1Н), 1.87 (ddt, J=11.6,8.4, 4.2 Гц, 1Н), 1.65 (d, J=12.4 Гц, 2Н), 1.40 (s, 11H)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(оксан-3-илметил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-38)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 74%.
LCMS: METCR1673 Generic 2 minutes, rt=1.4 мин, M/Z (ES+) 560/562 [М+Н+] 100%. УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.61 (s, 1H), 7.89 (s, 1H), 7.66 (s, 2H), 7.43 (d, J=8.3 Гц, 1H), 7.27 (s, 4H), 5.27 (d, J=15.7 Гц, 1H), 4.91 (d, J=15.6 Гц, 1H), 4.12 (dt, J=12.3, 8.0 Гц, 1H), 3.76-3.69 (m, 3H), 3.26-2.92 (m, 4H), 1.76 (d, J=14.2 Гц, 2H), 1.58 (d, J=13.5 Гц, 2H), 1.33 (s, 9H), 1.26 (s, 2H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(циклогексилокси)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-39)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 84%.
LCMS: METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES+) 582/584 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 1.16-1.49 (m, 14Н), 1.51-1.63 (m, 1H), 1.77 (s, 2Н), 1.92-2.06 (m, 2H), 2.89 (t, J=11.27 Гц, 1H), 3.52-3.76 (m, 1H), 3.84-4.15 (m, 1Н), 4.28-4.47 (m, 1H), 4.63-4.88 (m, 1Н), 5.31-5.45 (m, 1Н), 5.51-5.80 (m, 1Н), 7.13-7.23 (m, 4Н), 7.42-7.95 (m, 3Н), 9.73 (s, 1Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-[(2,2,2-трифторэтил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-40)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 71%.
LCMS: METCR1673 Generic 2 minutes, rt=1.48 мин, M/Z (ES+) 584/586 [M+Na+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.06 (d, J=7.0 Гц, 1Н), 7.40 (d, J=11.0 Гц, 1H), 7.20 (s, 4Н), 6.92 (dt, J=13.3, 6.4 Гц, 1Н), 5.63-5.44 (m, 2Н), 4.65 (d, J=15.1 Гц, 1Н), 4.39 (dt, J=14.4, 7.2 Гц, 1H), 4.16 (ddt, J=24.6, 16.9, 8.1 Гц, 2Н), 3.71 (dd, J=10.9, 6.4 Гц, 1Н), 2.95 (t, J=11.2 Гц, 1Н), 1.40 (s, 9Н).
Синтез трет-бутил N-[(3R)-8-фтор-7-[(оксан-4-ил)карбамоил]-4-оксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-41)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 67%.
LCMS: METUPLCMS-A-004, rt=1.46 мин, M/Z (ES+) 614 [M+H+] 92% УФ
ЯМР данные: 1H ЯМР (400 МГц,Хлороформ-d) δ 8.05 (d, J=7.1 Гц, 1H), 7.38 (d, J=10.9 Гц, 1H), 7.31 (d, J=8.7 Гц, 2H), 7.08 (d, J=8.0 Гц, 2H), 6.63-6.50 (m, 1H), 5.56 (d, J=8.1 Гц, 1H), 5.51 (d, J=15.1 Гц, 1H), 4.71 (d, J=15.2 Гц, 1H), 4.37 (d, J=7.5 Гц, 1H), 4.22 (s, 1H), 4.00 (d, J=11.7 Гц, 2H), 3.70 (dd, J=10.8, 6.4 Гц, 1H), 3.54 (ddd, J=11.7, 9.3, 2.5 Гц, 2H), 2.94 (t, J=11.2 Гц, 1H), 2.07-1.96 (m, 2H), 1.66-1.57 (m, 2H),1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-42)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 85%.
LCMS: METCR1278 Standard 3.5 minute, rt=2.33 мин, M/Z (ES+) 590 [M+Na+] 96% УФ
ЯМР данные: 1H ЯМР (500 МГц, CDCl3) d 1.14 (t, J=7.4 Гц, 3Н), 1.50-1.67 (m, 11H), 1.70-1.82 (m, 2Н), 3.11 (t, J=11.3 Гц, 1Н), 3.57 (р, J=6.4 Гц, 2Н), 3.83 (dd, J=6.6, 11.0 Гц, 1Н), 4.60 (dt, J=7.7, 11.3 Гц, 1H), 4.95 (d, J=15.1 Гц, 1H), 5.60 (d, J=15.1 Гц, 1H), 6.01 (d, J=8.3 Гц, 1H), 7.06-7.16 (m, 1H), 7.25 (d, J=8.3 Гц, 2H), 7.49 (d, J=8.5 Гц, 2H), 7.72-7.82 (m, 2H), 7.93 (s, 1H)
Синтез трет-бутил N-[(3R)-5-1(4-хлорфенил)метил]-7-[(3,3-дифторциклобутил)карбамоил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-43)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бледно желтого твердого вещества при выходе 40%.
LCMS: METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES+) 592/594 [М+Na+] 88% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.95 (d, J=6.5 Гц, 1H), 7.75 (d, J=6.4 Гц, 1H), 7.57 (d, J=9.3 Гц, 1H), 7.44 (d, J=8.4 Гц, 1H), 7.30 (d, J=8.5 Гц, 2H), 7.27 (d, J=8.6 Гц, 2H), 5.27 (d, J=15.5 Гц, 1H), 4.87 (d, J=15.6 Гц, 1H), 4.29-4.19 (m, 1H), 4.19-4.10 (m, 1H), 3.48 (dd, J=11.3,6.9 Гц, 1H), 3.12 (t, J=11.8 Гц, 1H). 3.03-2.91 (m, 2H), 2.79-2.65 (m, 2H), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(4-фторфенил)метил]-карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-44)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 73%.
LCMS: METCR 1278 Generic 3 minutes, rt=2.26 мин, M/Z (ES+) 570/572 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 7.73 (d, J=1.6 Гц, 1H), 7.62 (d, J=8.0 Гц, 1H), 7.48 (dd, J=8.0, 1.7 Гц, 1H), 7.31 (dd, J=8.5, 5.4 Гц, 3Н), 7.19 (d, J=3.3 Гц, 5H), 6.32 (s, 1H), 5.55 (d, J=8.0 Гц, 1H), 5.33 (d, J=15.1 Гц, 1H), 4.81 (d, J=15.1 Гц, 1H), 4.59 (dd, J=8.4, 5.8 Гц, 2H), 3.68 (s, 1H), 2.91 (s, 1H), 1.39 (s, 9H). [NH невидимый]
Синтез трет-бутил N-[(3R)-7-(бензилкарбамоил)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-45)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 100%.
LCMS: METCR1673 Generic 2 minutes, rt=1.56 мин, M/Z (ES+) 592/594 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.04 (t, J=5.8 Гц, 1Н), 7.75 (d, J=6.5 Гц, 1H), 7.58 (d, J=9.4 Гц, 1H), 7.45 (d, J=8.3 Гц, 1H), 7.40-7.23 (m, 9H), 5.22 (d, J=15.7 Гц, 1H), 4.92 (d, J=15.6 Гц, 1H), 4.55-4.39 (m, 2H), 4.17 (dt, J=12.1, 7.4 Гц, 1H), 3.49 (dd, J=11.3, 6.9 Гц, 1H), 3.12 (t, J=11.7 Гц, 1H), 1.41-1.25 (m, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-(феноксикарбамоил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-46)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 67%.
LCMS: METCR1673 Generic 2 minutes, rt=1.5 мин, M/Z (ES+) 594/596 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 1.39 (s, 9Н), 2.96 (t, J=11.3 Гц, 1H), 3.70 (dd, J=6.4, 10.8 Гц, 1Н), 4.41 (dt, J=7.2, 11.7 Гц, 1H), 4.65 (d, J=15.1 Гц, 1H), 5.48 (d, J=15.1 Гц, 1Н), 5.60 (d, J=7.8 Гц, 1H), 7.12-7.07 (m, 3Н), 7.19 (s, 4Н), 7.33 (t, J=8.0 Гц, 2Н), 7.41 (d, J=10.3 Гц, 1Н), 8.03 (d, J=4.9 Гц, 1Н), 9.72 (d, J=9.6 Гц, 1H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(циклогексилметокси)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-47)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 73%.
LCMS: METCR1673 Generic 2 minutes, rt=1.61 мин, M/Z (ES+) 596/598 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 0.87-1.08 (m, 2H), 1.08-1.33 (m, 3Н), 1.40 (s, 9Н), 1.58-1.91 (m, 6Н), 2.89 (t, J=11.1 Гц, 1H), 3.53-3.71 (m, 1Н), 3.71-4.00 (m, 2Н), 4.27-4.48 (m, 1Н), 4.55-4.87 (m, 1H), 5.30-5.50 (m, 1H), 5.50-5.83 (m, 1Н), 7.06-7.24 (m, 4Н), 7.38-7.81 (m, 3Н), 9.71 (s, 1Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-1(3,3,3-трифторпропил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-48)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бесцветного масла при выходе 64%.
LCMS: METCR1673 Generic 2 minutes, rt=1.55 мин, M/Z (ES+) 598/600 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=7.0 Гц, 1Н), 7.37 (d, J=10.9 Гц, 1Н), 7.20 (s, 4H), 6.96 (s, 1Н), 5.68-5.44 (m, 2H), 4.65 (d, J=15.1 Гц, 1H), 4.41 (s, 1H), 3.84-3.64 (m, 3H), 2.94 (t, J=11.3 Гц, 1H), 2.49 (ddt, J=17.0, 10.8, 5.4 Гц, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-{[(2S)-1,1,1-трифторпропан-2-ил]карбамоил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-49)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бледно желтого масла при выходе 70%.
LCMS: METCR1673 Generic 2 minutes, rt=1.54 мин, M/Z (ES+) 598/600 [M+Na+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=7.0 Гц, 1H), 7.39 (d, J=11.0 Гц, 1Н), 7.20 (s, 4Н), 6.70 (dd, J=13.4, 9.4 Гц, 1Н), 5.64-5.39 (m, 2Н), 5.12-4.77 (m, 1H), 4.65 (d, J=15.1 Гц, 1Н), 4.38 (dt, J=11.6, 7.2 Гц, 1H), 3.69 (dd, J=10.9, 6.4 Гц, 1Н), 2.95 (t, J=5.6 Гц, 1H), 1.45 (d, J=7.0 Гц, 3Н), 1.39 (s, 9H)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(оксан-4-илметил)-карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-50)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бледно оранжевого твердого вещества при выходе 76%.
LCMS: METuPLCAB101 uPLC 7 minute, rt=3.8 мин, M/Z (ES+) 578/580 [M+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=7.1 Гц, 1H), 7.36 (d, J=10.9 Гц, 1H), 7.23-7.17 (m, 4H) , 6.76 (dt, J=12.7, 5.9 Гц, 1H), 5.61-5.47 (m, 2H), 4.65 (d, J=15.1 Гц, 1H), 4.39 (dt, J=13.9, 7.1 Гц, 1H), 4.00 (dd, J=11.4, 3.9 Гц, 2H), 3.70 (dd, J=10.9, 6.5 Гц, 1H), 3.42-3.37 (m, 4H), 2.93 (t, J=11.3 Гц, 1H), 1.89 (ttt, J=10.7, 7.1, 3.7 Гц, 1H), 1.71-1.63 (m, 2H), 1.44-1.33 (m, 11H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-(гептилкарбамоил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-51)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 60%.
LCMS: METCR1673 Generic 2 minutes, rt=1.78 мин, M/Z (ES+) 600/602 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.44 (s, 1Н), 7.66 (d, J=6.3 Гц, 1H), 7.54 (d, J=9.2 Гц, 1H), 7.44 (d, J=8.3 Гц, 1H), 7.33-7.25 (m, 4H), 5.20 (d, J=15.6 Гц, 1H), 4.91 (d, J=15.7 Гц, 1H), 4.19-4.11 (m, 1H), 3.47 (dd, J=11.1, 6.9 Гц, 1H), 3.21 (dt, J=13.6, 7.0 Гц, 2H), 3.11 (t, J=11.7 Гц, 1H), 1.50 (d, J=11.2 Гц, 2H), 1.31 (m, 17H), 0.86 (t, J=6.8 Гц, 3Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(4,4-дифгорциклогексил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-52)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 56%.
LCMS: METCR1673 Generic 2 minutes, rt=1.6 мин, M/Z (ES+) 602/604 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.44 (d, J=7.6 Гц, 1H), 7.93 (s, 1H), 7.74-7.65 (m, 2Н), 7.45 (d, J=8.3 Гц, 1H), 7.33-7.25 (m, 4H), 5.29 (d, J=15.6 Гц, 1H), 4.92 (d, J=15.6 Гц, 1H), 4.12 (dt, J=12.2, 7.6 Гц, 1H), 3.98 (s, 1H), 3.46 (dd, J=11.3, 6.8 Гц, 1H), 3.11 (t, J=11.8 Гц, 1H), 2.03 (d, J=30.8 Гц, 2H), 1.98-1.85 (m, 4H), 1.64 (q, J=12.3, 11.2 Гц, 2H), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(3,3-дифторциклопентил)карбамоил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-53)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 33%.
LCMS: METCR1673 Generic 2 minutes, rt=1.53 мин, M/Z (ES+) 606/608 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.72 (d, J=4.0 Гц, 1Н), 7.71 (d, J=6.4 Гц, 1H), 7.57 (d, J=9.2 Гц, 1H), 7.45 (d, J=8.3 Гц, 1H), 7.29 (q, J=8.5 Гц, 4H), 5.26 (d, J=14.0 Гц, 1H), 4.89 (d, J=15.6 Гц, 1H), 4.39 (q, J=7.5 Гц, 1H), 4.15 (dt, J=12.1, 8.0 Гц, 1H), 3.48 (dd, J=11.4, 6.9 Гц, 1H), 3.12 (t, J=11.8 Гц, 1H), 2.34-2.03 (m, 5H), 1.86-1.73 (m, 1H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[1-(4-фторфенил)этил]-карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-54)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 74%.
LCMS: METCR1673 Generic 2 minutes, rt=1.64 мин, M/Z (ES+) 584 [M+H+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.95 (d, J=7.6 Гц, 1H), 7.96 (s, 0H), 7.75 (t, J=7.3 Гц, 1H), 7.69 (d, J=8.0 Гц, 1H), 7.48-7.37 (m, 3H), 7.29 (s, 4H), 7.16 (td, J=8.9, 2.3 Гц, 2H), 5.28 (dd, J=15.7, 5.4 Гц, 1H), 5.20-5.11 (m, 1H), 4.94 (d, J=15.7 Гц, 1H), 4.14 (dt, J=12.2, 7.7 Гц, 1H), 3.46 (dd, J=11.3,6.9 Гц, 1H), 3.12 (t, J=11.8 Гц, 1H), 1.48 (dd, J=7.0, 2.2 Гц, 3H), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1S)-1-(4-фторфенил)этил]-карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-55)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 86%.
LCMS: METCR1673 Generic 2 minutes, rt=1.54 мин, M/Z (ES+)606/608 [M+Na+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.95 (d, J=7.9 Гц, 1H), 7.95 (d, J=1.4 Гц, 1H), 7.77-7.71 (m, 1H), 7.69 (d, J=8.0 Гц, 1H), 7.48-7.38 (m, 3H), 7.29 (s, 4H), 7.15 (t, J=8.9 Гц, 2H), 5.28 (d, J=15.6 Гц, 1H), 5.23-5.10 (m, 1H), 4.94 (d, J=15.6 Гц, 1H), 4.20-4.06 (m, 1H), 3.46 (dd, J=11.5, 6.8 Гц, 1H), 3.10 (d, J=11.7 Гц, 1H), 1.48 (d, J=7.1 Гц, 3H), 1.35 (s, 9H).
Синтез трет-бутил N-[(2R,3R)-5-[(4-хлорфенил)метил]-2-метил-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-56)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 80%.
LCMS: METCR1673 Generic 2 minutes, rt=1.61 мин, M/Z (ES+) 608/610 [M+Na+] 98% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.68 (t, J=5.5 Гц, 1H), 7.94 (s, 1H), 7.73-7.64 (m, 2H), 7.30 (s, 4H), 7.06 (d, J=8.3 Гц, 1H), 5.40 (d, J=15.7 Гц, 1H), 4.91 (d, J=15.7 Гц, 1H), 4.43-4.34 (m, 1H), 3.88-3.78 (m, 1H), 3.39-3.33 (m, 2H), 2.38-2.26 (m, 2H), 1.76 (p, J=7.1 Гц, 2H), 1.38-1.27 (m, 12H).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-8-фтор-4-оксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-57)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 64%.
LCMS: METCR1416 Generic 2 minutes, rt=4.91 мин, M/Z (ES+) 608 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.45 (s, 1H), 7.67 (d, J=6.4 Гц, 1Н), 7.56 (d, J=9.3 Гц, 1H), 7.45 (d, J=8.3 Гц, 1H), 7.40 (d, J=8.6 Гц, 2H), 7.25 (d, J=8.2 Гц, 2H), 5.20 (d, J=15.8 Гц, 1H), 4.98 (d, J=15.9 Гц, 1H), 4.17 (dt, J=12.0, 7.4 Гц, 1H), 3.49 (dd, J=11.3, 6.9 Гц, 1H), 3.29-3.16 (m, 2H), 3.12 (t, J=11.7 Гц, 1H), 1.48 (p, J=7.0 Гц, 2H), 1.40-1.21 (m, 11H), 0.89 (t, J=7.4 Гц, 3H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[(4-фторфенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-58)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 83%.
LCMS: METuPLCAB101 uPLC 7 minute, rt=4.29 мин, M/Z (ES+)588 [M+H+]100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.08 (d, J=7.1 Гц, 1H), 7.38-7.30 (m, 3H), 7.20 (d, J=1.3 Гц, 4H), 7.08-6.95 (m, 3H), 5.60-5.50 (m, 2H), 4.70-4.57 (m, 3H), 4.39 (dt, J=11.6, 7.3 Гц, 1H), 3.70 (dd, J=10.9, 6.5 Гц, 1H), 2.94 (t, J=11.3 Гц, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[N'-(4-фторфенил)-гидразинкарбонил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-59)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде масла желтого цвета при выходе 21%.
LCMS: METCR1673 Generic 2 minutes, rt=1.48 мин, M/Z (ES+) 611/613 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 1.40 (s, 9Н), 2.96 (t, J=11.3 Гц, 1H), 3.72 (dd, J=6.4, 10.9 Гц, 1H), 4.41 (dt, J=7.2, 13.9 Гц, 1H), 4.64 (d, J=15.1 Гц, 1H), 5.48 (d, J=15.1 Гц, 1H), 5.58 (d, J=7.9 Гц, 1H), 6.86-6.91 (m, 2H), 6.94-7.00 (m, 2H), 7.19 (s, 4H), 7.44 (d, J=10.6 Гц, 1H), 8.02 (d, J=6.7 Гц, 1H), 8.41 (d, J=12.0 Гц, 1H) [NH невидимый].
Синтез трет-бутил N-[(3R)-4-оксо-7-[(пиридин-3-ил)карбамоил]-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-60)
Указанное в названии соединение синтезировали согласно общей методике GP3c получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 55%.
LCMS: METCR1673 Generic 2 minutes, rt=1.31 мин, M/Z (ES+) 589 [M+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 10.61 (s, 1H), 8.91 (d, J=2.3 Гц, 1H), 8.35 (dd, J=4.7, 1.2 Гц, 1H), 8.18 (d, J=8.4 Гц, 1H), 8.10 (d, J=1.5 Гц, 1H), 7.85 (dd, J=8.0, 1.6 Гц, 1H), 7.78 (d, J=8.0 Гц, 1H), 7.48 (d, J=8.4 Гц, 1H), 7.43 (dd, J=8.4, 4.0 Гц, 3Н), 7.24 (d, J=8.2 Гц, 2H), 5.36 (d, J=15.8 Гц, 1H), 5.02 (d, J=15.8 Гц, 1H), 4.20 (dt, J=12.2, 7.7 Гц, 1H), 3.51 (dd, J=11.3, 6.8 Гц, 1H), 3.19-3.12 (m, 1H), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-61)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 78%.
LCMS: METuPLCAB101 uPLC 7 minute, rt=4.2 мин, M/Z (ES+) 590/592 [M+H+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=7.1 Гц, 1H), 7.37 (d, J=10.9 Гц, 1H), 7.20 (s, 4H), 6.76 (dt, J=12.3, 5.9 Гц, 1H), 5.61-5.49 (m, 2H), 4.64 (d, J=15.1 Гц, 1H), 4.39 (dt, J=13.7, 7.1 Гц, 1H), 3.70 (dd, J=10.9, 6.5 Гц, 1H), 3.55 (dh, J=13.4, 6.8 Гц, 2H), 2.94 (t, J=11.3 Гц, 1H), 2.25-2.13 (m, 2H), 1.92 (dt, J=14.8, 6.9 Гц, 2H), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-{[(1S,2R)-2-фенилциклопропил]карбамоил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-62)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 48%.
LCMS: METCR1673 Generic 2 minutes, rt=1.62 мин, M/Z (ES-) 594 [M-H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.79 (d, J=4.1 Гц, 1H), 7.73 (dd, J=6.4, 2.9 Гц, 1H), 7.55 (d, J=9.2 Гц, 1H), 7.44 (d, J=8.2 Гц, 1H), 7.29 (q, J=8.3 Гц, 7H), 5.27 (d, J=15.6 Гц, 1H), 4.87 (d, J=15.6 Гц, 1H), 4.15 (dt, J=12.0, 8.1 Гц, 1H), 3.50-3.46 (m, 2H), 3.13 (t, J=11.9 Гц, 1H), 2.11-2.07 (m, 1H), 1.35 (s, 9H), 1.19-1.11 (m, 2H). [2 × NH невидимый]
Синтез трет-бутил N-[(3R)-5-[(4-хлор-2-фторфенил)метил]-8-фтор-7-[(оксан-4-илметил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-63)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бледно желтого твердого вещества при выходе 77%.
LCMS: METCR1416 generic 7min, rt=4.49 мин, M/Z (ES+) 618/620 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.08 (d, J=7.1 Гц, 1Н), 7.43-7.34 (m, 2H), 7.04 (dd, J=8.2, 1.6 Гц, 1Н), 6.97 (dd, J=9.6, 2.0 Гц, 1Н), 6.81-6.70 (m, 1Н), 5.54 (d, J=7.8 Гц, 1Н), 5.40 (d, J=15.2 Гц, 1Н), 4.79 (d, J=15.2 Гц, 1Н), 4.42-4.33 (m, 1Н), 4.00 (dd, J=11.3, 3.9 Гц, 2H), 3.71-3.64 (m, 1H), 3.47-3.30 (m, 4Н), 2.89 (t, J=11.3 Гц, 1Н), 1.95-1.84 (m, 1H), 1.71-1.64 (m, 2Н), 1.42-1.36 (m, 11H).
Синтез трет-бутил N-[(3R)-5-[(4-хлор-3-фторфенил)метил]-8-фтор-7-[(оксан-4-илметил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-64)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 44%.
LCMS: METCR1673 Generic 2 minutes, rt=1.42 мин, M/Z (ES-) 618/620 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.05 (d, J=7.0 Гц, 1H), 7.39 (d, J=11.0 Гц, 1H), 7.25-7.23 (m, 1H), 7.12 (d, J=9.8 Гц, 1H), 6.99 (d, J=6.7 Гц, 1H), 5.54 (d, J=8.0 Гц, 1H), 5.49 (d, J=15.3 Гц, 1H), 4.65 (d, J=15.3 Гц, 1H), 4.00 (dd, J=11.6, 3.9 Гц, 2H), 3.71 (dd, J=10.9, 6.5 Гц, 1H), 3.48-3.29 (m, 4H), 2.94 (t, J=11.3 Гц, 1H), 1.96-1.83 (m, 1H), 1.67 (d, J=11.0 Гц, 2H), 1.44-1.33 (m, 11H). [2 × NH невидимый]
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R)-1-(4-метоксифенил)этил]-карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-65)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 73%.
LCMS: METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES+) 596/598 [M+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.87 (d, J=8.0 Гц, 1H), 7.94 (d, J=1.3 Гц, 1H), 7.74 (dd, J=8.0, 1.5 Гц, 1H), 7.68 (d, J=8.0 Гц, 1H), 7.29 (d, J=7.3 Гц, 6H), 6.89 (d, J=8.7 Гц, 2H), 5.26 (d, J=15.6 Гц, 1H), 5.17-5.04 (m, 1H), 4.94 (d, J=15.6 Гц, 1H), 4.13 (dt, J=12.3, 7.6 Гц, 1H), 3.73 (s, 3H), 3.11 (s, 1H), 1.46 (d, J=7.0 Гц, 3Н), 1.34 (s, 9H), 1.26 (s, 1H). [NH невидимый]
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1S)-1-(4-метоксифенил)этил]-карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-66)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 64%.
LCMS: METCR1673 Generic 2 minutes, rt=1.61 мин, M/Z (ES+) 596/598 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.88 (d, J=8.0 Гц, 2Н), 7.94 (s, 1H), 7.78-7.71 (m, 1H), 7.68 (d, J=8.0 Гц, 2Н), 7.45 (d, J=8.4 Гц, 2Н), 7.30 (d, J=8.4 Гц, 4Н), 6.89 (d, J=8.7 Гц, 1Н), 5.28 (d, J=15.6 Гц, 1H), 5.12 (q, J=7.3 Гц, 1H), 4.94 (d, J=15.6 Гц, 1H), 4.12 (s, 1H), 3.73 (s, 3H), 3.46 (dd, J=11.3, 6.8 Гц, 1H), 3.11 (t, J=11.8 Гц, 1H), 1.47 (d, J=7.0 Гц, 3Н), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[(4-метоксифенил)-метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-67)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде пены белого цвета при выходе 86%.
LCMS: METCR1416 Generic 7 minutes, rt=4.22 мин, M/Z (ES+) 600/602 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, хлороформ-d) δ 8.09 (d, J=7.0 Гц, 1H), 7.34 (d, J=10.8 Гц, 1H), 7.28 (d, J=8.6 Гц, 2H, частично закрытый CHCl3), 7.22-7.18 (m, 4H), 6.92-6.88 (m, 2H), 5.59-5.50 (m, 2H), 4.68-4.55 (m, 3Н), 4.39 (dt, J=14.4, 7.2 Гц, 1H), 3.81 (s, 3H), 3.70 (dd, J=10.9, 6.4 Гц, 1H), 2.93 (t, J=11.3 Гц, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-7-[(оксан-4-илметил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-68)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 61%.
LCMS: METCR1673 Generic 2 minutes, rt=1.3 мин, M/Z (ES-) 606 [М-Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.66 (t, J=5.8 Гц, 1H), 7.94-7.82 (m, 3Н), 7.68 (s, 2H), 7.52 (d, J=8.3 Гц, 1H), 7.46 (d, J=8.3 Гц, 2H), 5.27 (d, J=16.0 Гц, 1H), 5.08 (d, J=15.9 Гц, 1H), 4.23-4.09 (m, 1H), 3.82 (dd, J=11.0, 3.1 Гц, 2H), 3.47 (dd, J=11.3, 6.8 Гц, 1H), 3.28-3.20 (m, 2H), 3.19-3.05 (m, 3H), 2.64 (s, 3H), 1.76 (ddd, J=11.2, 7.4, 4.0 Гц, 1H), 1.56 (d, J=11.5 Гц, 2H), 1.34 (s, 9H), 1.16 (qd, J=12.4, 4.6 Гц, 2H).
Синтез трет-бутил N-[(3R)-7-[(оксан-4-илметил)карбамоил]-4-оксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-69)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 72%.
LCMS: METCR1278 Standard 3.5 minutes, rt=2.15 мин, M/Z (ES+) 632 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, хлороформ-d) δ 1.30-1.46 (m, 11H), 1.64-1.72 (m, 2Н), 1.80-1.94 (m, 1Н), 2.92 (t, J=11.3 Гц, 1H), 3.26-3.46 (m, 4Н), 3.69 (dd, J=6.6, 10.9 Гц, 1Н), 4.00 (dd, J=3.6, 11.3 Гц, 2Н), 4.42 (dt, J=7.2, 13.8 Гц, 1Н), 4.88 (d, J=15.2 Гц, 1H), 5.34 (d, J=15.2 Гц, 1H), 5.55 (d, J=8.0 Гц, 1H), 6.12 (t, J=5.9 Гц, 1H), 7.08 (d, J=8.3 Гц, 2H), 7.31 (d, J=8.5 Гц, 2H), 7.46 (d, J=7.9 Гц, 1H), 7.64 (d, J=7.9 Гц, 1H), 7.71 (s, 1H)
Синтез трет-бутил N-[(3R)-7-{[(4-фторфенил)метил]карбамоил}-4-оксо-5-{[4-(1,2,3-тиадиазол-4-ил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-70)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 46%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 642 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.55 (s, 1H), 9.22 (t, J=5.9 Гц, 1H), 8.01 (d, J=8.5 Гц, 3Н), 7.77-7.67 (m, 2H), 7.46 (t, J=7.1 Гц, 3Н), 7.35 (dd, J=8.4, 5.7 Гц, 2H), 7.14 (t, J=8.8 Гц, 2H), 5.37 (d, J=15.8 Гц, 1H), 5.04 (d, J=15.8 Гц, 1H), 4.46 (q, J=9.2 Гц, 2H), 4.18 (dt, J=12.3, 7.8 Гц, 1H), 3.15 (t, J=11.7 Гц, 2H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-7-{[(4-фторфенил)метил]карбамоил}-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-71)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 81%.
LCMS: METCR1278 Standard 3.5 minute, rt=2.34 мин, M/Z (ES+) 642 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, хлороформ-d) δ 1.39 (s, 9Н), 2.91 (t, J=11.3 Гц, 1H), 3.67 (dd, J=6.6, 11.0 Гц, 1Н),4.40 (dt, J=7.3, 11.5 Гц, 1H), 4.49-4.64 (m, 2Н), 4.81 (d, J=15.2 Гц, 1H), 5.36 (d, J=15.2 Гц, 1H), 5.57 (d, J=8.0 Гц, 1H), 6.47 (t, J=5.00 Гц, 1H), 7.00-7.09 (m, 4H), 7.27-7.33 (m, 4H), 7.49 (dd, J=1.7, 8.0 Гц, 1H), 7.62 (d, J=8.0 Гц, 1H), 7.72-7.77 (m, 1H).
Синтез трет-бутил N-[(3R)-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-72)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 78%.
LCMS: METCR1278 Standard 3.5 minute, rt=2.31 мин, M/Z (ES+) 644 [M+Na+] 96% УФ
ЯМР данные: 1H ЯМР (500 МГц, хлороформ-d) δ 1.40 (s, 9H), 1.90 (р, J=7.3 Гц, 2Н), 2.12-2.26 (m, 2Н), 2.92 (t, J=11.3 Гц, 1Н), 3.53 (q, J=6.7 Гц, 2Н), 3.70 (dd, J=6.6, 10.9 Гц, 1H), 4.35-4.48 (m, 1Н), 4.86 (d, J=15.2 Гц, 1Н), 5.36 (d, J=15.2 Гц, 1Н), 5.55 (d, J=8.1 Гц, 1Н), 6.12 (t, J=5.8 Гц, 1H), 7.09 (d, J=8.2 Гц, 2Н), 7.31 (d, J=8.6 Гц, 2Н), 7.46 (dd, J=1.7, 7.9 Гц, 1Н), 7.65 (d, J=8.0 Гц, 1H), 7.72 (d, J=1.4 Гц, 1H)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[({4-[(5-ацетамидопентил)-окси]фенил}метил)-карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-73)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 75%.
LCMS: METCR1673 Generic 2 minutes, rt=1.39 мин, M/Z (ES+) 695/696 [М+Н+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.12 (t, J=5.8 Гц, 1H), 7.97 (s, 1H), 7.79 (s, 1H), 7.76-7.70 (m, 1H), 7.68 (d, J=8.0 Гц, 1H), 7.45 (d, J=8.3 Гц. 1H), 7.29 (s, 4H), 7.23 (d, J=8.5 Гц, 2H), 6.89 (d, J=8.6 Гц, 2H), 5.30 (d, J=15.6 Гц, 1H), 4.92 (d, J=15.7 Гц, 1H), 4.41 (qd, J=15.0, 6.1 Гц, 2H), 4.12 (d, J=7.6 Гц, 1H), 3.93 (t, J=6.5 Гц, 2H), 3.47 (dd, J=11.3, 6.8 Гц, 1H), 3.12 (t, J=11.8 Гц, 1H), 3.03 (q, J=6.5 Гц, 2H), 1.78 (s, 3H), 1.70 (p, J=6.6 Гц, 2H), 1.47-1.30 (m, 13H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-(гексадецилкарбамоил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-74)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде прозрачного масла при выходе 47%.
LCMS: METCR1981 Hydrophobic 3 min, rt=2.69 мин, M/Z (ES+) 726/728 [M+Na+] 92% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.44 (s, 1Н), 7.67 (d, J=6.4 Гц, 1H), 7.55 (d, J=9.3 Гц, 1H), 7.45 (d, J=8.4 Гц, 1H), 7.35-7.24 (m, 4H), 5.21 (d, J=15.7 Гц, 1H), 4.92 (d, J=15.7 Гц, 1H), 4.16 (dt, J=12.1, 7.7 Гц, 1H), 3.48 (dd, J=11.3, 6.8 Гц, 1H), 3.25-3.20 (m, 2H), 3.12 (t, J=11.8 Гц, 1H), 1.54-1.45 (m, 2H), 1.30 (m, 40H), 0.86 (t, J=6.9 Гц, 3Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлор-2-фторфенил)метил]-8-фтор-4-оксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-75)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 60%.
LCMS: METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES+) 562/564 [M+Na+] 100%, УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.10 (d, J=7.0 Гц, 1Н), 7.49-7.34 (m, 2H), 7.05-7.01 (m, 2H), 6.51 (dd, J=12.0, 7.8 Гц, 1H), 5.56 (d, J=7.8 Гц, 1H), 5.42 (d, J=15.2 Гц, 1H), 4.81 (d, J=15.2 Гц, 1H), 4.39-4.33 (m, 2H), 3.70 (dd, J=10.9, 6.5 Гц, 1H), 2.90 (t, J=11.3 Гц, 1H), 1.41 (s, 9H), 1.30 (d, J=6.6 Гц, 6H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-4-оксо-7-[(4,4,4-трифторбутил)-карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-76)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получение указанного в названии соединения в виде твердого вещества белого цвета при выходе 32%.
LCMS: METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES+) 594/596 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.70 (d, J=1.6 Гц, 1H), 7.64 (d, J=8.0 Гц, 1H), 7.45 (dd, J=8.0, 1.6 Гц, 1Н), 7.21 (s, 4Н), 6.11 (s, 1H), 5.56 (d, J=7.8 Гц, 1H), 5.36 (d, J=15.1 Гц, 1H), 4.80 (d, J=15.1 Гц, 1H), 4.41 (dt, J=11.4, 7.6 Гц, 1H), 3.69 (dd, J=10.9, 6.6 Гц, 1Н), 3.53 (q, J=6.7 Гц, 2Н), 2.92 (t, J=11.3 Гц, 1Н), 2.27-2.09 (m, 2H), 1.96-1.84 (m, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(5-трет-бутил-1,2-оксазол-3-ил)карбамоил]-5-[(4-хлорфенил)-метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-77)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 26%.
LCMS: METCR1673 Generic 2 minutes, rt=1.62 мин, M/Z (ES-) 583/585 [М-Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 9.19 (s, 1Н), 7.92 (s, 1H), 7.78-7.64 (m, 2Н), 7.23 (s, 4Н), 6.84 (s, 1Н), 5.61 (d, J=8.1 Гц, 1Н), 5.49 (d, J=15.2 Гц, 1Н), 4.79 (d, J=15.2 Гц, 1Н), 4.52-4.41 (m, 1H), 3.76 (dd, J=10.9, 6.5 Гц, 1Н), 2.98 (t, J=11.3 Гц, 1Н), 1.42 (s, 9Н), 1.40 (s, 9Н).
Синтез трет-бутил N-[(3R)-7-{[(4-фторфенил)метил]карбамоил}-4-оксо-5-{[6-(трифторметил)пиридин-3-ил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-78)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 63%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 627 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.61 (s, 1H), 7.94-7.87 (m, 2H), 7.67 (d, J=8.0 Гц, 1H), 7.59 (d, J=8.1 Гц, 1H), 7.50 (dd, J=8.0, 1.8 Гц, 1H), 7.35 (dd, J=8.6, 5.3 Гц, 2H), 7.11-7.05 (m, 2H), 6.39 (t, J=5.5 Гц, 1H), 5.66 (d, J=15.3 Гц, 1H), 5.52 (d, J=8.2 Гц, 1H), 4.78 (d, J=15.4 Гц, 1H), 4.69-4.58 (m, 2H), 4.44 (dt, J=11.5, 7.5 Гц, 1Н), 3.71 (dd, J=11.0, 6.7 Гц, 1H), 2.92 (t, J=11.3 Гц, 1H), 1.42 (s,9H).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-цианофенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-79)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 53%.
LCMS: METUPLCMS-A-004, rt=1.47 мин, M/Z (ES+) 509 [M+H+] 57% УФ
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-80)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 89%.
LCMS: METUPLCMS-A-004, rt=1.67 мин, M/Z (ES+) 518/520 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (400 МГц, хлороформ-d) δ 7.69 (d, J=1.8 Гц, 1Н), 7.62 (d, J=8.0 Гц, 1Н), 7.46 (dd, J=8.0, 1.8 Гц, 1Н), 7.22 (d, J=9.3 Гц, 4Н), 6.00 (s, 1Н), 5.57 (d, J=8.1 Гц, 1Н), 5.32 (t, J=9.9 Гц, 1Н), 4.82 (d, J=15.1 Гц, 1Н), 4.41 (dt, J=11.7, 7.3 Гц, 1Н), 3.69 (dd, J=11.0, 6.6 Гц, 1Н), 3.52-3.34 (m, 2H), 2.91 (t, J=11.3 Гц, 1Н), 1.66-1.49 (m, 3H), 1.46-1.41 (m, 1Н), 1.40 (s, 9H), 0.97 (t, J=7.3 Гц, 3H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(2-метоксиэтил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-81)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения, которое применяется на следующей стадии без дальнейшего анализа или очистки.
Синтез трет-бутил N-[(3R)-7-(метилкарбамоил)-4-оксо-5-{[4-(трифторметокси)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-82)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения, которое применяется на следующей стадии без дальнейшего анализа или очистки.
Синтез трет-бутил N-[(3R)-5-[(4-трет-бутилфенил)метил]-4-оксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-83)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 62%.
LCMS: METUPLCMS-A-004, rt=1.76 мин, M/Z (ES+) 526 [М+Н+] 92% УФ
ЯМР данные: 1Н ЯМР (400 МГц, Хлороформ-d) δ 7.62 (dd, J=6.1, 5.0 Гц, 2Н), 7.50 (dd, J=7.9, 1.7 Гц, 1Н), 7.29 (d, J=8.5 Гц, 2Н), 7.23 (d, J=8.4 Гц, 2Н), 5.74 (d, J=7.7 Гц, 1Н), 5.59 (d, J=8.0 Гц, 1Н), 5.06 (s, 2Н), 4.42 (dt, J=11.2, 7.4 Гц, 1Н), 4.31-4.17 (m, 1H), 3.70 (dd, J=11.0, 6.6 Гц, 1H), 2.92 (t, J=11.3 Гц, 1H),, 1.40 (s, 9H), 1.27 (s, 9H), 1.24 (d, J=3.1 Гц, 3Н), 1.23 (d, J=3.1 Гц, 3Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(циклопропилметил)карбамоил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-84)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 62%.
LCMS METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES-) 534/536 [M-H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.54 (s, 1Н), 7.69 (d, J=6.5 Гц, 1Н), 7.55 (d, J=9.4 Гц, 1Н), 7.44 (d, J=8.3 Гц, 1H), 7.35-7.25 (m, 4H), 5.21 (d, J=15.7 Гц, 1Н), 4.91 (d, J=15.7 Гц, 1H), 4.16 (dt, J=12.1,7.2 Гц, 1Н), 3.48 (dd, J=11.3, 6.9 Гц, 1Н),3.17-3.12 (m, 3Н), 1.35 (s, 9H), 1.05-0.95 (m, 1H), 0.51-0.37 (m, 2Н), 0.22 (q, J=4.9, 4.4 Гц, 2Н).
Синтез трет-бутил N-[(3R)-7-(этилкарбамоил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-85)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения, которое применяется на следующей стадии без дальнейшего анализа или очистки.
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-трет-бутилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-86)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 65%.
LCMS: METUPLCMS-A-004, rt=1.85 мин, M/Z (ES+) 540 [М+Н+] 99% УФ
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-4-оксо-5-{[3-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-87)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 81%.
LCMS: METUPLCMS-A-004., rt=1.7 мин, M/Z (ES+) 568 [M+H+] 97% УФ
ЯМР данные: 1Н ЯМР (300 МГц, Хлороформ-d) δ 0.98 (t, J=7.3 Гц, 3Н), 1.41 (s, 9H), 1.69-1.54 (m, 3Н), 2.93 (t, J=11.3 Гц, 1Н), 3.45 (dd, J=12.9, 7.0 Гц, 2Н), 3.71 (dd, J=11.0, 6.6 Гц, 1Н), 4.44 (dt, J=11.3, 7.2 Гц, 1Н), 4.86 (d, J=15.2 Гц, 1Н), 5.43 (d, J=15.2 Гц, 1H), 5.59 (d, J=8.1 Гц, 1Н), 6.09 (s, 1Н), 7.08 (d, J=7.9 Гц, 1H), 7.28-7.16 (m, 3Н), 7.49 (dd, J=8.0, 1.8 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1Н), 7.73 (d, J=1.6 Гц, 1Н). [NH невидимый]
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-{[4-(морфолин-4-ил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазенин-3-ил]карбамат (Промежуточное соединение VIII-88)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 34%.
LCMS: METUPLCMS-A-004, rt=1.47 мин, M/Z (ES+) 569 [M+H+] 95% УФ
Синтез трет-бутил N-[(3R)-8-фтор-4-оксо-7-[(пропан-2-ил)карбамоил]-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-89)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 55%.
LCMS: METUPLCMS-A-004, rt=1.55 мин, M/Z (ES+) 572 [M+H+] 92% УФ
ЯМР данные: 1Н ЯМР (400 МГц, Хлороформ-d) δ 8.06 (d, J=7.1 Гц, 1Н), 7.37-7.29 (m, 3H), 7.07 (d, J=8.0 Гц, 2Н), 6.56-6.43 (m, 1Н), 5.61-5.47 (m, 2H), 4.69 (d, J=15.1 Гц, 1Н), 4.44-4.24 (m, 2Н), 3.70 (dd, J=11.0, 6.5 Гц, 1Н), 2.96-2.90 (m, 1Н), 1.39 (s, 9H), 1.28(d, J=6.6 Гц, 6H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R)-1-(4-фторфенил)-этил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-90)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 96%.
LCMS: METCR1416, generic 7 minutes, rt=3.32 мин, M/Z (ES+) 484/486 [M+H-boc] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.98 (d, J=7.9 Гц, 1Н), 8.00 (s, 1Н), 7.81 (d, J=8.0 Гц, 1Н), 7.72 (d, J=8.0 Гц, 1Н), 7.41 (dd, J=8.7, 5.6 Гц, 2Н), 7.31 (q, J=8.6 Гц, 4Н), 7.15 (t, J=8.9 Гц, 2Н), 5.37 (d, J=15.4 Гц, 1Н), 5.15 (t, J=7.3 Гц, 1Н), 4.97 (d, J=15.4 Гц, 1Н), 3.99-3.89 (m, 1Н), 3.62-3.56 (m, 1Н), 3.18 (t, J=11.7 Гц, 1Н), 1.48(d, J=7.0 Гц, 3Н), 1.40 (s, 9H). [NH невидимый]
Синтез трет-бутил N-[(3R)-7-[(оксан-4-ил)карбамоил]-4-оксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-91)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 46%.
LCMS: METUPLCMS-A-004, rt=1.53 мин, M/Z (ES+) 596 [М+Н+] 80% УФ
ЯМР данные: 1Н ЯМР (400 МГц, Хлороформ-d) δ 7.70 (d, J=1.6 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1Н), 7.47 (dd, J=8.0, 1.8 Гц, 1Н), 7.32 (d, J=8.7 Гц, 2H), 7.09 (d, J=7.9 Гц, 2Н), 5.87 (d, J=7.9 Гц, 1Н), 5.54 (d, J=8.3 Гц, 1Н), 5.42-5.27 (m, 2H), 4.88 (d, J=15.2 Гц, 1Н), 4.39 (d, J=8.1 Гц, 1Н), 4.18 (dd, J=7.8, 3.7 Гц, 1Н), 4.01 (d, J=12.0 Гц, 3Н), 3.69 (dd, J=11.0, 6.7 Гц, 1Н), 3.57-3.49 (m, 2H), 2.92 (t, J=11.3 Гц, 1Н), 1.99 (d, J=12.6 Гц, 2H), 1.40 (s, 9H). [NH невидимый]
Синтез трет-бутил N-[(3R)-7-(бензилкарбамоил)-4-оксо-5-{[4-(трифторметокси)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-92)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 78%.
LCMS: MET-UPLCMS-A-006, rt=4.14 мин, M/Z (ES+) 602 [M+H+] 92% УФ
ЯМР данные: 1Н ЯМР (400 МГц, Хлороформ-d) δ 1.39 (s, 9H), 2.91 (t, J=11.3 Гц, 1Н), 3.69 (dd, J=11.0, 6.6 Гц, 1Н), 4.47-4.38 (m, 1Н), 4.69-4.57 (m, 2H), 4.84 (d, J=15.2 Гц, 1Н), 5.38 (d, J=15.2 Гц, 1Н), 5.55 (d, J=8.1 Гц, 1Н), 6.30 (s, 1Н), 7.06 (d, J=8.0 Гц, 2H), 7.41-7.28 (m, 7H), 7.49 (dd, J=8.0, 1.8 Гц, 1Н), 7.63 (d, J=8.0 Гц, 1H), 7.78 (d, J=1.7 Гц, 1Н).
Синтез трет-бутил N-[(3R)-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-5-{[6-(трифторметил)пиридин-3-ил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-93)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 35%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 629 [M-Na] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.59 (s, 1Н), 7.90-7.83 (m, 2H), 7.66 (d, J=8.0 Гц, 1Н), 7.58 (d, J=8.1 Гц, 1Н), 7.47 (dd, J=8.0, 1.8 Гц, 1Н), 6.23 (t, J=5.5 Гц, 1Н), 5.64 (d, J=15.4 Гц, 1Н), 5.52 (d, J=8.2 Гц, 1Н), 4.76 (d, J=15.4 Гц, 1Н), 4.42 (dt, J=11.6, 7.5 Гц, 1Н), 3.69 (dd, J=11.0, 6.6 Гц, 1Н), 3.55 (q, J=6.7 Гц, 2H), 2.90 (t, J=11.3 Гц, 1Н), 2.27-2.15 (m, 2Н), 1.92 (p, J=7.2 Гц, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-8-фтор-4-оксо-5-(хинолин-2-илметил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-94)

Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде масла желтого цвета с выходом 66%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 553 [M+H+] 100% УФ
ЯМР данные; 1Н ЯМР (250 МГц, Хлороформ-d) δ 0.95 (t, J=7.2 Гц, 3Н), 1.26-1.49 (m, 11Н), 1.60 (dt, J=7.2, 14.5 Гц, 2H), 2.97 (t, J=11.2 Гц, 1Н), 3.45 (q, J=6.8 Гц, 2H), 3.76 (dd, J=6.5, 10.7 Гц, 1Н), 4.40-4.59 (m, 1Н), 5.26-5.49 (m, 2H), 5.49-5.63 (m, 1Н), 6.75 (s, 1H), 7.37 (d, J=10.6 Гц, 1Н), 7.54 (t, J=7.6 Гц, 1Н), 7.64-7.78 (m, 2H), 7.80 (d, J=7.8 Гц, 1Н), 8.10 (d, J=8.2 Гц, 1Н), 8.19 (d, J=8.5 Гц, 1Н), 8.32 (d, J=7.0 Гц, 1H).
Синтез трет-бутил N-[(3R)-5-[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-7-{[(4-фторфенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-95)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 46%.
LCMS: METCR1673 Generic 2 minutes, rt=1.36 мин, M/Z (ES+) 602 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.16 (d, J=6.9 Гц, 1Н), 7.39 (d, J=10.6 Гц, 1H), 6.81-6.68 (m, 1Н), 5.58-5.45 (m, 2H), 5.13 (d, J=15.2 Гц, 1Н), 4.45-4.33 (m, 1H), 3.69 (dd, J=10.9,6.6 Гц, 1Н), 3.63-3.51 (m, 2H), 2.86 (t, J=11.2 Гц, 1Н), 2.39-2.30 (m, 1Н), 2.27-2.14 (m, 2H), 1.97-1.86 (m, 2H), 1.39 (s, 9H), 1.25-1.17 (m, 2H), 1.13-1.06 (m, 2H).
Синтез трет-бутил N-[(3R)-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-5-{[4-метокси-3-(трифторметил)фенил]метил}-4-оксо-2,3,4,5-теграгидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-96)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 59%.
LCMS: METCR1410 Generic 1.7 min, rt=1.28 мин, M/Z (ES+) 641.90 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.94 (d, J=8.1 Гц, 1Н), 7.76 (dd, J=12.5, 6.4 Гц, 1Н), 7.59 (dd, J=9.3, 2.5 Гц, 1H), 7.55 (s, 1Н), 7.45 (t, J=7.8 Гц, 2H), 7.13 (d, J=8.6 Гц, 1Н), 5.30 (dd, J=15.5, 9.4 Гц, 1Н), 4.88 (d, J=15.5 Гц, 1Н), 4.15 (dt, J=12.1, 7.8 Гц, 1H), 3.83 (s, 3Н), 3.49 (dd, J=11.3, 7.0 Гц, 2Н), 3.13 (t, J=11.8 Гц, 1Н), 2.05-1.94 (m, 1Н), 1.63 (dd, J=9.3, 5.2 Гц, 1Н), 1.35 (s, 9H).
Синтез трет-бутил N-[(2R,3R)-5-[(4-хлорфенил)метил]-8-фтор-2-метил-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-теграгидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-97)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бесцветного масла при выходе 78%.
LCMS: METCR1410 Generic 1.7 min, rt=1.42 мин, M/Z (ES+) 625.95/627.90 [M+Na+] 83% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.02 (d, J=7.0 Гц, 1Н), 7.35 (d, J=10.9 Гц, 1Н), 7.23-7.16 (m, 4H), 6.77 (dt, J=12.3, 5.8 Гц, 1Н), 5.60 (d, J=6.3 Гц, 1Н), 5.56 (d, J=15.2 Гц, 1Н), 4.62 (d, J=15.2 Гц, 1Н), 4.49 (t, J=6.8 Гц, 1Н), 3.98 (p, J=6.6 Гц, 1H), 3.55 (dp, J=13.8, 6.9 Гц, 2Н), 2.25-2.13 (m, 2Н), 1.91 (dt, J=14.8, 7.0 Гц, 2Н), 1.39 (s, 9H), 1.32 (d, J=6.8 Гц, 3Н).
Синтез трет-бутил N-[(3R)-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-98)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бесцветного масла при выходе 92%.
LCMS: METCR1410 Generic 1.7 min, rt=1.27 мин, M/Z (ES+) 642 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.85 (d, J=8.0 Гц, 2Н), 7.66 (s, 1H), 7.54 (d, J=8.0 Гц, 1H), 7.42 (d, J=8.0 Гц, 1H), 7.31 (d, J=8.0 Гц, 2Н), 6.49 (s, 1H), 5.56 (s, 1H), 5.38 (d, J=15.2 Гц, 1H), 4.79 (d, J=15.2 Гц, 1H), 4.35 (dt, J=14.0, 7.6 Гц, 1H), 3.61 (dd, J=10.3, 7.0 Гц, 1H), 3.41 (d, J=5.9 Гц, 2Н), 2.55 (s, 3H), 2.18-2.02 (m, 2H), 1.80 (p, J=7.2 Гц, 2Н), 1.33 (s, 9H). [NH невидимый]
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(2-метоксиэтил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-99)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 47%.
LCMS: METCR1410 Generic 1.7 min, rt=1.25 мин, M/Z (ES+) 559.90/561.90 [M+Na+], 482.35/483.95 [M-tBu+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.51 (s, 1H), 7.70 (d, J=6.5 Гц, 1H), 7.56 (d, J=9.4 Гц, 1H), 7.45 (d, J=8.3 Гц, 1H), 7.37-7.24 (m, 4H), 5.21 (d, J=15.6 Гц, 1H), 4.91 (d, J=15.7 Гц, 1H), 4.16 (dt, J=12.2, 7.6 Гц, 1H), 3.52-3.37 (m, 5H), 3.27 (s, 3H), 3.12 (t, J=11.7 Гц, 1H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(2,2-дифторциклопропил)карбамоил]5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-100)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 34%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 608 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.92 (dd, J=8.3, 1.6 Гц, 2Н), 7.72 (dd, J=6.8, 1.5 Гц, 1Н), 7.62 (dd, J=8.0, 2.3 Гц, 1Н), 7.51-7.42 (m, 1H), 7.38 (d, J=7.6 Гц, 2Н), 6.47-6.34 (m, 1Н), 5.66-5.57 (m, 1Н), 5.45 (dd, J=15.2, 2.4 Гц, 1Н), 4.88 (dd, J=15.2, 6.1 Гц, 1Н), 4.42 (dt, J=11.5, 7.5 Гц, 1Н), 3.68 (ddd, J=10.3, 6.5, 2.9 Гц, 1Н), 3.48 (d, J=5.0 Гц, 1Н), 2.94 (t, J=11.3 Гц, 1Н), 2.62 (s, 3H), 1.89 (ddd, J=12.9, 6.5, 3.3 Гц, 1Н), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-цианофенил)метил]-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-101)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 57%.
LCMS: METCR1410 Generic 1.7 min, rt=1.18 мин, M/Z (ES+) 490.95 [M-tBu+H+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.94 (d, J=11.2 Гц, 1Н), 7.77-7.68 (m, 3H), 7.61 (d, J=9.2 Гц, 1Н), 7.48 (d, J=7.9 Гц, 3H), 5.29 (dd, J=16.1, 7.3 Гц, 1Н), 5.03 (d, J=16.2 Гц, 1Н), 4.18 (dt, J=12.1, 7.5 Гц, 1Н), 3.51 (dd, J=11.2, 6.8 Гц, 2Н), 3.14 (t, J=11.7 Гц, 1Н), 2.06-1.90 (m, 1Н), 1.70-1.55 (m, 1Н), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-цианофенил)метил]-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-102)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 76%.
LCMS: METCR1410 Generic 1.7 min, rt=1.23 мин, M/Z (ES+) 524.95 [M-tBu+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.59 (t, J=5.5 Гц, 1Н), 7.74 (d, J=8.3 Гц, 2H), 7.71 (d, J=6.4 Гц, 1Н), 7.59 (d, J=9.3 Гц, 1Н), 7.48 (d, J=8.2 Гц, 3Н), 5.28 (d, J=16.3 Гц, 1Н), 5.04 (d, J=16.3 Гц, 1Н), 4.18 (dt, J=12.3, 7.8 Гц, 1Н), 3.50 (dd, J=11.3, 6.9 Гц, 1Н), 3.38-3.33 (m, 2H), 3.14 (t, J=11.7 Гц, 1Н), 2.36-2.24 (m, 2H), 1.73 (dt, J=14.8, 7.0 Гц, 2H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(4,4-дифторциклогексил)карбамоил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-103)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 70%.
LCMS: METCR1410 Generic 1.7 min, rt=1.34 мин, M/Z (ES+) 620.10/622.10 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.48 (d, J=7.5 Гц, 1Н), 7.68 (d, J=6.4 Гц, 1Н), 7.56 (d, J=9.2 Гц, 1Н), 7.44 (d, J=8.3 Гц, 1Н), 7.34-7.25 (m, 4H), 5.24 (d, J=15.7 Гц, 1Н), 4.90 (d, J=15.6 Гц, 1Н), 4.16 (dt, J=12.2, 8.1 Гц, 1Н), 3.96 (s, 1Н), 3.48 (dd, J=11.4, 6.9 Гц, 1Н), 3.12 (t, J=11.8 Гц, 1Н), 2.10-1.83 (m, 6H), 1.61 (s, 2H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-{[2-(трифторметил)циклопропил]карбамоил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-104)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 61%.
LCMS: METCR1410 Generic 1.7 min, rt=1.34 мин, M/Z (ES+) 610/612 [M+Na+] 86% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.82 (t, J=4.1 Гц, 1Н), 7.77 (dd, J=6.4, 2.5 Гц, 1Н), 7.57 (d, J=9.4 Гц, 1Н), 7.45 (d, J=8.3 Гц, 1Н), 7.32-7.26 (m, 4H), 5.33-5.27 (m, 1Н), 4.85 (d, J=15.6 Гц, 1Н), 4.15 (dt, J=12.1, 7.8 Гц, 1Н), 3.53-3.45 (m, 1Н), 3.24-3.17 (m, 1Н), 3.12 (t, J=11.7 Гц, 1Н), 2.15-2.01 (m, 1Н), 1.36 (s, 9H), 1.31-1.28 (m, 1Н), 0.89-0.86 (m, 1H).
Синтез трет-бутил N-[(3R)-8-фтор-5-[(4-фторфенил)метил]-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-105)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 87%.
LCMS: METCR1410 Generic 1.7 min, rt=1.29 мин, M/Z (ES+) 518.45 [M-tBu+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=7.1 Гц, 1Н), 7.36 (d, J=10.9 Гц, 1Н), 7.23 (dd, J=8.6, 5.4 Гц, 2Н), 6.91 (t, J=8.7 Гц, 2Н), 6.82-6.70 (m, 1Н), 5.58 (d, J=8.0 Гц, 1Н), 5.50 (d, J=14.9 Гц, 1Н), 4.65 (d, J=15.0 Гц, 1Н), 4.38 (ddd, J=19.4, 12.9, 6.8 Гц, 1Н), 3.70 (dd, J=10.8, 6.5 Гц, 1Н), 3.56 (dp, J=14.0, 6.8 Гц, 2Н), 2.93 (t, J=11.2 Гц, 1Н), 2.27-2.14 (m, 2Н), 1.92 (dt, J=14.6, 7.0 Гц, 2Н), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-106)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 69%.
LCMS: METCR1410 Generic 1.7 min, rt=1.23 мин, M/Z (ES+) 484.40 [M-tBu+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.05 (dd, J=7.0, 4.5 Гц, 1Н), 7.37 (d, J=10.9 Гц, 1Н), 7.23 (dd, J=8.0, 5.5 Гц, 2Н), 6.91 (td, J=8.7, 2.3 Гц, 3Н), 5.57 (d, J=6.4 Гц, 1Н), 5.50 (dd, J=15.0, 7.3 Гц, 1Н), 4.66 (dd, J=15.0, 5.9 Гц, 1Н), 4.45-4.31 (m, 1Н), 3.79-3.64 (m, 1Н), 3.56 (s, 1Н), 2.94 (t, J=11.2 Гц, 1Н), 1.92 (ddd, J=13.6, 9.7, 7.0 Гц, 1Н), 1.48 (dt, J=14.5, 4.8 Гц, 1Н), 1.43-1.33 (m, 9H).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-107)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 81%.
LCMS: METCR1410 Generic 1.7 min, rt=1.29 мин, M/Z (ES+) 464.45 [M-tBu+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.06 (d, J=7.1 Гц, 1Н), 7.34 (d, J=10.9 Гц, 1Н), 7.25-7.20 (m, 2Н), 6.90 (t, J=8.7 Гц, 2Н), 6.74-6.60 (m, 1Н), 5.58 (d, J=7.8 Гц, 1Н), 5.51 (d, J=14.9 Гц, 1Н), 4.64 (d, J=15.0 Гц, 1Н), 4.38 (dt, J=11.6, 7.1 Гц, 1Н), 3.69 (dd, J=10.9, 6.5 Гц, 1Н), 3.48 (m, 2Н), 2.92 (t, J=11.2 Гц, 1Н), 1.65-1.57 (m, 2Н), 1.43 (dd, J=15.1, 7.5 Гц, 2Н), 1.39 (s, 9H), 0.97 (t, J=7.4 Гц, 3Н).
Синтез трет-бутил N-[(3R)-7-(бензилкарбамоил)-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-108)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 80%.
LCMS: METCR1410 Generic 1.7 min, rt=1.35 мин, M/Z (ES+) 498.15 [M-tBu+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.10 (d, J=7.1 Гц, 1Н), 7.38 (d, J=7.4 Гц, 1Н), 7.37-7.33 (m, 4H), 7.33-7.29 (m, 1Н), 7.25-7.21 (m, 2H), 7.00 (dt, 1Н), 6.94-6.85 (m, 2H), 5.59 (d, J=7.8 Гц, 1Н), 5.52 (d, J=15.0 Гц, 1Н), 4.74-4.66 (m, 2H), 4.66-4.61 (m, 1Н), 4.39 (dt, J=11.6, 7.2 Гц, 1Н), 3.70 (dd, J=10.9, 6.5 Гц, 1Н), 2.93 (t, J=11.3 Гц, 1H),1.40(s,9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[2-(оксан-4-ил)этил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-109)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде грязновато-белого рыхлого твердого вещества при выходе 85%.
LCMS: METCR1410 Generic 1.7 min, rt=1.27 мин, M/Z (ES+) 614.15/616.20 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.47 (s, 1Н), 7.68 (d, J=6.4 Гц, 1Н), 7.56 (d, J=9.3 Гц, 1Н), 7.45 (d, J=8.3 Гц, 1Н), 7.34-7.26 (m, 5H), 5.22 (d, J=15.7 Гц, 1Н), 4.92 (d, J=15.7 Гц, 1Н), 4.16 (dt, J=12.1, 7.7 Гц, 1Н), 3.83 (dd, J=10.3, 4.2 Гц, 3Н), 3.48 (dd, J=11.3, 6.9 Гц, 1Н), 3.12 (t, J=11.8 Гц, 1Н), 1.63-1.51 (m, 4H), 1.45 (q, J=7.1 Гц, 2H), 1.36 (s, 9H), 1.16 (m, 3H).
Синтез трет-бутил N-[(3R)-5-бензил-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-110)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 76%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 500.10 [M-tBu+H+], 578.15[M+Na+] 99% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.58 (d, J=5.2 Гц, 1Н), 7.71 (d, J=6.4 Гц, 1Н), 7.56 (d, J=9.4 Гц, 1Н), 7.43 (d, J=8.4 Гц, 1Н), 7.30-7.19 (m, 5H), 5.21 (d, J=15.7 Гц, 1Н), 4.94 (d, J=15.7 Гц, 1Н), 4.18 (dt, J=12.2, 7.5 Гц, 1Н), 3.49 (dd, J=11.3, 6.9 Гц, 1Н), 3.30 (s, 2H), 3.14 (t, J=11.7 Гц, 1Н), 2.33-2.25 (m, 2H), 1.76-1.69 (m, 2H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[(4-метоксифенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-нл]карбамата (Промежуточное соединение VIII-111)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 84%.
LCMS: METCR1410 Generic 1.7 min, rt=1.39 мин, M/Z (ES+) 544.10/546.15 [M-tBu+H+] 96% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 8.15 (d, J=7.1 Гц, 1Н), 7.40 (d, J=10.9 Гц, 1Н), 7.36-7.32 (m, 6H), 7.05-6.88 (m, 3H), 5.68-5.53 (m, 2H), 4.76-4.63 (m, 3Н), 4.53-4.37 (m, 1Н), 3.87 (s, 3H), 3.76 (dd, J=10.9, 6.7 Гц, 1Н), 2.99 (t, J=11.3 Гц, 1Н), 1.46 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-7-{[(4-фторфенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-112)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде желтовато-коричневого твердого вещества при выходе 86%.
LCMS: METCR1410 Generic 1.7 min, rt=1.19 мин, M/Z (ES+) 546.1 [M-tBu+H+], 602.5 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.19 (d, J=6.9 Гц, 1Н), 7.37 (d, J=10.6 Гц, 1Н), 7.35-7.29 (m, 2H), 7.07-7.01 (m, 2H), 7.02-6.94 (m, 1Н), 5.59-5.44 (m, 2H), 5.12 (d, J=15.3 Гц, 1Н), 4.67-4.58 (m, 2H), 4.39 (dt, J=11.3, 7.3 Гц, 1Н), 3.68 (dd, J=11.0, 6.7 Гц, 1Н), 2.86 (t, J=11.3 Гц, 1Н), 2.37-2.30 (m, 1Н), 1.39 (s. 9H), 1.22-1.17 (m, 2H), 1.11-1.06 (m, 2H).
Синтез трет-бутил N-[(3R)-8-фтор-5-[(4-фторфенил)метил]-7-{[(оксан-4-ил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-113)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 76%.
LCMS: METCR1410 Generic 1.7 min, rt=1.18 мин, M/Z (ES+) 584 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=7.1 Гц, 1Н), 7.35 (d, J=10.9 Гц, 1Н), 7.26-7.20 (m, 2H), 6.94-6.87 (m, 2H), 6.81-6.70 (m, 1Н), 5.58 (d, J=7.8 Гц, 1Н), 5.49 (d, J=15.0 Гц, 1Н), 4.65 (d, J=15.0 Гц, 1Н), 4.43-4.34 (m, 1Н), 4.00 (dd, J=11.3, 3.9 Гц, 2H), 3.69 (dd, J=10.9, 6.5 Гц, 1Н), 3.47-3.30 (m, 4H), 2.93 (t, J=11.2 Гц, 1Н), 1.89 (ttt, J=10.8, 7.1, 3.8 Гц, 1Н), 1.71-1.63 (m, 2H), 1.43-1.33 (m, 11H).
Синтез трет-бутил N-[(3R)-7-[(3,3-дифторциклобутил)карбамоил]-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-114)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 86%.
LCMS: METCR1410 Generic 1.7 min, rt=1.24 мин, M/Z (ES+) 576 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.02 (d, J=7.1 Гц, 1Н), 7.36 (d, J=10.9 Гц, 1Н), 7.25-7.18 (m, 2H), 6.94-6.83 (m, 3H), 5.59 (d, J=7.9 Гц, 1Н), 5.50 (d, J=15.0 Гц, 1Н), 4.64 (d, J=15.0 Гц, 1Н), 4.50-4.41 (m, 1Н), 4.41-4.32 (m, 1Н), 3.69 (dd, J=10.9, 6.4 Гц, 1Н), 3.18-3.03 (m, 2H), 2.93 (t, J=11.3 Гц, 1Н), 2.66-2.53 (m, 2H), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-8-фтор-5-[(4-метоксифенил)метил]-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-115)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 77%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 608.1 [M+Na+], 530.1 [M-tBu+H+] 99% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.58 (t, J=5.5 Гц, 1Н), 7.74 (d, J=6.5 Гц, 1Н), 7.54 (d, J=9.3 Гц, 1Н), 7.41 (d, J=8.4 Гц, 1Н), 7.16 (d, J=8.6 Гц, 2H), 6.78 (d, J=8.6 Гц, 2H), 5.23 (d, J=15.3 Гц, 1Н), 4.79 (d, J=15.3 Гц, 1Н), 4.15 (dt, J=12.1, 8.1 Гц, 1Н), 3.69 (s, 3H), 3.47 (dd, J=11.3, 6.9 Гц, 1Н), 3.12 (t, J=11.7 Гц, 1Н), 2.39-2.24 (m, 2H), 1.74 (p, J=7.0 Гц, 2H), 1.36 (s, 9H), 1.32-1.23 (m, 2H).
Синтез трет-бутил N-[(3R)-8-фтор-5-[(4-метоксифенил)метил]-7-{[(оксан-4-ил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-116)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 80%.
LCMS: METCR1410 Generic 1.7 min, rt=1.16 мин, M/Z (ES+) 596.2 [M+Na+], 518.1 [M-tBu+H+] 96% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.50 (t, J=5.7 Гц, 1Н), 7.66 (d, J=6.4 Гц, 1Н), 7.52 (d, J=9.2 Гц, 1Н), 7.40 (d, J=8.4 Гц, 1Н), 7.16 (d. J=8.5 Гц, 2Н), 6.78 (d, J=8.6 Гц, 2Н), 5.15 (d, J=15.3 Гц, 1Н), 4.83 (d. J=15.3 Гц, 1Н), 4.14 (dt, J=12.1, 7.6 Гц, 1Н), 3.88-3.80 (m, 2Н), 3.69 (s, 3H), 3.46 (dd, J=11.3, 6.9 Гц, 1Н), 3.26 (t, J=10.8 Гц, 2Н), 3.16-3.07 (m, 3H), 1.80-1.68 (m, 1Н), 1.57 (d, J=12.8 Гц, 2Н), 1.35 (s, 9Н), 1.23-1.12 (m, 2H).
Синтез трет-бутил N-[(3R)-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-5-[(4-метоксифеннл)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-117)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 71%.
LCMS: METCR1410 Generic 1.7 min, rt=1.2 мин, M/Z (ES+) 574.1 [M+Na+], 496.05 [M-tBu+H+] 93% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.93 (d, J=8.8 Гц, 1Н), 7.74 (dd, J=9.7, 6.5 Гц, 1Н), 7.56 (dd, J=9.3, 2.0 Гц, 1Н), 7.41 (d, J=8.4 Гц, 1Н), 7.16 (d, J=7.5 Гц, 2Н), 6.78 (d, J=7.6 Гц, 2Н), 5.23 (dd, J=15.2, 8.7 Гц, 1Н), 4.79 (d, J=15.3 Гц, 1Н), 4.14 (dt, J=12.1, 7.7 Гц, 1Н), 3.69 (s, 3H), 3.47 (dd, J=11.1, 6.9 Гц, 2Н), 2.01-1.93 (m, 1Н), 1.68-1.55 (m, 1Н), 1.36 (s, 9Н), 1.18 (t, J=7.1 Гц, 1Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(оксан-4-ил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-118)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде белого кристаллического твердого вещества при выходе 60%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 586.15/588.20 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 8.03 (d, J=7.0 Гц, 1Н), 7.36 (d, J=10.9 Гц, 1Н), 7.20 (s, 4H), 6.58 (s, 1Н), 5.49 (d, J=15.0 Гц, 2Н), 4.66 (d, J=15.1 Гц, 1Н), 4.29 (m, 2Н), 4.00 (d, J=11.8 Гц, 2Н), 3.70 (dd, J=10.9, 6.5 Гц, 1Н), 3.54 (t, J=11.6 Гц, 2Н), 2.93 (t, J=11.2 Гц, 1Н), 2.02 (d, J=12.0 Гц, 3Н), 1.39 (s, 10Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(3,3-дифторциклобутил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-119)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 87%.
LCMS: METCR1410 Generic 1.7 min, rt=1.28 мин, M/Z (ES+) 496.10/498.20 [M-tBu+H+], 574.15/576.20 [M+Na+] 97% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.69 (s, 1Н), 7.66 (d, J=8.0 Гц, 1Н), 7.50 (dd, J=8.0, 1.7 Гц, 1Н), 7.23 (s, 4H), 6.39 (d, J=6.4 Гц, 1Н), 5.62 (d, J=8.1 Гц, 1Н), 5.45-4.76 (m, 2Н), 4.42 (dt, J=14.8, 7.3 Гц, 2Н), 3.70 (dd, J=11.0, 6.6 Гц, 1Н), 3.21-3.03 (m, 2Н), 2.94 (t, J=11.3 Гц, 1Н), 2.60 (m, 2H), 1.42 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1S)-3,3-дифторциклопентил]карбамоил}-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-120)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде белого кристаллического твердого вещества при выходе 67%.
LCMS: METCR1410 Generic 1.7 min, rt=1.32 min, M/Z (ES+) 606.15/608.15 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.02 (d, J=7.1 Гц, 1Н), 7.36 (d, J=10.9 Гц, 1Н), 7.20 (s, 4H), 6.80 (dd, J=13.1, 7.3 Гц, 1Н), 5.56 (d, J=7.8 Гц, 1Н), 5.50 (d, J=15.1 Гц, 1Н), 4.69-4.60 (m, 2H), 4.38 (dt, J=11.6, 7.2 Гц, 1Н), 3.69 (dd, J=10.9, 6.5 Гц, 1Н). 2.94 (t, J=11.3 Гц, 1Н), 2.61 (m, 1Н), 2.41-2.24 (m, 2H), 2.23-2.05 (m, 2H), 1.88-1.78(m, 1H), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R,2S)-2-фторциклопропил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-121)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 63%.
LCMS: METCR1410 Generic 1.7 min, rt=1.2 мин, M/Z (ES+) 542.1/544.1 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.74 (d, J=1.6 Гц, 1Н), 7.65 (d, J=8.0 Гц, 1Н), 7.50 (dd, J=8.0, 1.7 Гц, 1Н), 7.23 (s, 4H), 6.26 (d, J=3.5 Гц, 1Н), 5.58 (d, J=7.9 Гц, 1Н), 5.36 (d, J=15.1 Гц, 1Н), 4.90-4.80 (m, 1Н), 4.77-4.68 (m, 1Н), 4.42 (dt, J=11.7, 7.3 Гц, 1Н), 3.74-3.69 (m, 1Н), 3.16-3.02 (m, 1Н), 1.42 (s, 9H), 1.36-1.20 (m, 2H), 1.14-0.98 (m, 1Н).
Синтез трет-бутил N-[(3R)-7-[(3,3-дифторциклобутил)карбамоил]-5-[(2-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-122)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения при выходе 79%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 558 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.66 (d, J=9.2 Гц, 2H), 7.55 (dd, J=8.0, 1.6 Гц, 1Н), 7.50 (t, J=7.6 Гц, 1Н), 7.24 (q, J=5.9 Гц, 1Н), 7.09 (t, J=7.3 Гц, 1Н), 7.02-6.90 (m, 1Н), 6.30 (d, J=6.6 Гц,1Н), 5.59 (d, J=8.1 Гц, 1Н), 5.33 (d, J=15.2 Гц, 1Н), 5.05 (d, J=15.2 Гц, 1Н), 4.43 (dd, J=19.5, 7.6 Гц, 2Н), 3.71 (dd, J=10.9, 6.6 Гц, 1Н), 3.28-3.00 (m, 2Н), 2.94 (m, 1Н), 2.77-2.50 (m, 2H), 1.42 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(3,3-дифторциклобутил)карбамоил]-5-[(3-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-123)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 73%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 570.15 [M+Na+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.65 (d, J=7.9 Гц, 1Н), 7.55 (d, J=1.7 Гц, 1Н), 7.50 (dd, J=8.0, 1.7 Гц, 1Н), 7.17 (t, J=7.9 Гц, 1Н), 6.89-6.82 (m, 2Н), 6.78 (dd, J=8.2, 2.3 Гц, 1Н), 6.17 (d, J=6.5 Гц, 1Н), 5.59 (d, J=7.9 Гц, 1Н), 5.16-4.98 (m, 2Н), 4.50-4.31 (m, 2Н), 3.75 (s, 3H), 3.74-3.65 (m, 1Н), 3.08 (m, 2Н), 2.67-2.42 (m, 2Н), 1.40 (s, 9H), 1.31-1.27 (m, 1H).
Синтез трет-бутил N-[(3R)-5-[(4-метоксифенил)метил]-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-124)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 71%.
LCMS: METCR1410 Generic 1.7 min, rt=1.28 мин, M/Z (ES+) 512.1 [M-tBu+H+], 590.1 [M+Na]+93% УФ; ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.67-7.56 (m, 2Н), 7.48 (dd, J=8.1, 1.5 Гц, 1Н), 7.17 (d, J=8.6 Гц, 2Н), 6.75 (d, J=8.5 Гц, 2Н), 6.24 (t, J=5.6 Гц, 1Н), 5.63 (d, J=8.2 Гц, 1Н), 5.22 (d, J=14.8 Гц, 1Н), 4.84 (d, J=14.8 Гц, 1Н), 4.47-4.28 (m, 1Н), 3.74 (s, 3H), 3.67 (dd, J=11.0, 6.6 Гц, 1Н), 3.49 (q, J=6.8 Гц, 2Н), 2.90 (t, J=11.2 Гц, 1Н), 2.30-2.09 (m, 2Н), 1.88 (dt, J=14.5, 7.2 Гц, 2Н), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-метоксифенил)метил]-7-{[(4-метоксифенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-125)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 91%.
LCMS: METCR1410 Generic 1.7 min, rt=1.23 мин, M/Z (ES+) 600.25 [M+Na]+98% УФ
Синтез трет-бутил N-[(3R)-5-бензил-7-{[(4-метоксифенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-126)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 97%.
LCMS: METCR1410 Generic 1.7 min, rt=1.24 мин, M/Z (ES+) 492.1 [M-tBu+H+] 98% УФ;
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.65-7.56 (m, 2H), 7.49 (dd, J=8.0, 1.7 Гц, 1Н), 7.31-7.14 (m, 7H), 6.90 (d, J=8.6 Гц, 2H), 6.20-6.08 (m, 1Н), 5.58 (d, J=8.0 Гц, 1Н), 5.26-5.12 (m, 1Н), 5.05-4.89 (m, 1Н), 4.52 (d, J=5.8 Гц, 2Н), 4.49-4.32 (m, 1H), 3.82 (s, 3H), 3.69 (dd, J=10.9, 6.6 Гц, 1Н), 2.91 (t, J=11.2 Гц, 1Н), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(4-метоксифенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-127)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 77%.
LCMS: METCR1410 Generic 1.7 min, rt=1.3 мин, M/Z (ES+) 526.20 [M-tBu+H+], 604.30 [M+Na+] 89% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.11 (t, J=5.7 Гц, 1H), 7.97 (d, J=1.4 Гц, 1Н), 7.73 (dd, J=8.0, 1.6 Гц, 1Н), 7.67 (d, J=8.0 Гц, 1Н), 7.44 (d, J=8.3 Гц, 1Н), 7.28 (s, 4H), 7.24 (d, J=8.6 Гц, 2Н), 6.89 (d, J=8.6 Гц, 2Н), 5.29 (d, J=15.6 Гц, 1Н), 4.91 (d, J=15.6 Гц, 1Н), 4.41 (ddt, J=20.6, 14.8, 6.6 Гц, 2Н), 4.13 (dt, J=12.1, 8.0 Гц, 1Н), 3.73 (s, 3H), 3.46 (dd, J=11.3, 6.9 Гц, 1Н), 3.11 (t, J=11.8 Гц, 1Н), 1.34 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(4,4-дифторциклогексил)карбамоил]-5-[(4-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-128)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 79%.
LCMS: METCR1410 Generic 1.7 min, rt=1.24 мин, M/Z (ES+) 520.15 [M-tBu+H+], 598.20 [M+Na+] 97% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.43 (d, J=7.7 Гц, 1Н), 7.96 (d, J=1.4 Гц, 1Н), 7.73-7.63 (m, 2Н), 7.41 (d, J=8.5 Гц, 1Н), 7.16 (d. J=8.6 Гц, 2Н), 6.77 (d, J=8.7 Гц, 2Н), 5.30 (d, J=15.2 Гц, 1Н), 4.81 (d, J=15.2 Гц, 1Н), 4.12 (dt, J=12.2, 8.2 Гц, 1Н), 4.04-3.93 (m, 1Н), 3.68 (s, 3H), 3.44 (dd, J=11.3, 6.8 Гц, 1Н), 3.11 (t, J=11.8 Гц, 1Н), 2.08 (d, J=14.2 Гц, 3H), 1.90 (d, J=12.7 Гц, 3H), 1.66 (t, J=11.3 Гц, 2Н), 1.35 (8, 9Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-4-оксо-7-[(3,3,3-трифторпропил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-129)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 91%.
LCMS: METCR1410 Generic 1.7 min, rt=1.27 мин, M/Z (ES+) 580.10/582.15 [M+Na+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.85 (t, J=5.6 Гц, 1H), 7.92 (s, 1H), 7.73-7.66 (m, 2H), 7.46 (d, J=8.3 Гц, 1H), 7.32-7.26 (m, 4H), 5.30 (d, J=15.7 Гц, 1H), 4.91 (d, J=15.7 Гц, 1H), 4.13 (dt, J=12.2, 7.5 Гц, 1H), 3.48 (ddd, J=15.3, 11.5, 6.3 Гц, 3Н), 3.12 (t, J=11.8 Гц, 1H), 2.57 (dd, J=11.4, 6.8 Гц, 2H), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-4-оксо-7-{[(3R)-оксолан-3-ил]карбамоил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-130)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 99%.
LCMS: METCR1410 Generic 1.7 min, rt=1.17 мин, M/Z (ES+) 476.05/478.10 [M-tBu+H+], 554.10/556.15 [M+Na+] 94% УФ; ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 7.68 (d, J=1.7 Гц, 1H), 7.63 (d, J=8.0 Гц, 1H), 7.48 (dd, J=8.0, 1.9 Гц, 1H), 7.21 (s, 4H), 6.24 (d, J=7.5 Гц, 1H), 5.56 (d, J=7.9 Гц, 1H), 5.34 (d, J=15.1 Гц, 1H), 4.81 (d, J=15.0 Гц, 1H), 4.76-4.61 (m, 1H), 4.48-4.30 (m, 1H), 4.06-3.94 (m, 1H), 3.94-3.74 (m, 3H), 3.68 (dd, J=11.0, 6.6 Гц, 1H), 2.91 (t, J=11.3 Гц, 1H), 2.46-2.27 (m, 1H), 1.98-1.80 (m, 1H), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-4-оксо-7-{[(оксолан-3-ил)метил]карбамоил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-131)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения с выходом 64%.
LCMS: METCR1410 Generic 1.7 min, rt=1.18 мин, M/Z (ES+) 568.15/570.15 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.68-7.49 (m, 2H), 7.39 (d, J=8.0 Гц, 1Н), 7.14 (s, 4H), 6.21 (s, 1Н), 5.49 (d, J=8.1 Гц, 1Н), 5.26 (d, J=15.0 Гц, 1Н), 4.76 (d, J=15.1 Гц, 1Н), 4.32 (s, 1Н), 3.95-3.50 (m, 5H), 3.41 (q, J=6.2 Гц, 2H), 2.85 (t, J=11.3 Гц, 1Н), 2.53 (s, 1Н), 2.05 (m, 1Н), 1.61 (td, J=12.6, 7.5 Гц, 1Н), 1.33 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-132)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 72%.
LCMS: METCR1410 Generic 1.7 min, rt=1.24 мин, M/Z (ES+), 482.10/484.05 [M-tBu+H+], 560.05/562.10 [M+Na+] 86% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.71 (d, J=1.7 Гц, 1Н), 7.65 (d, J=7.9 Гц, 1Н), 7.48 (dd, J=8.0, 1.9 Гц, 1Н), 7.21 (s, 4H), 6.26 (s, 1Н), 5.56 (d, J=8.1 Гц, 1Н), 5.36 (d, J=15.1 Гц, 1Н), 4.82 (d, J=15.1 Гц, 1Н), 4.41 (dt, J=11.2, 7.6 Гц, 1Н). 3.70 (dd, J=10.9, 6.6 Гц, 1Н), 3.58-3.49 (m, 1H), 2.93 (t, J=11.3 Гц, 1Н), 1.98-1.87 (m, 1Н), 1.50-1.43 (m, 1Н), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-циклопропилфенил)метил]-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-133)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде грязновато белого твердого вещества при выходе 42%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 566.2 [M+Na+], 488.1 [M-tBu+H+] 80% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.64 (d, J=7.9 Гц, 1Н), 7.55-7.49 (m, 2H), 7.14 (d, J=8.1 Гц, 2H), 6.95 (d, J=8.1 Гц, 2H), 6.16-6.09 (m, 1Н), 5.58 (d, J=8.1 Гц, 1Н), 5.09 (d, J=15.0 Гц, 1Н), 5.00 (d, J=14.9 Гц, 1Н), 4.43-4.36 (m, 1Н), 3.69 (dd, J=10.9, 6.5 Гц, 1Н), 3.56-3.44 (m, 1Н), 1.96-1.77 (m, 2H), 1.39 (s, 9Н), 0.96-0.82 (m, 4H), 0.67-0.60 (m, 2H).
Синтез трет-бутил N-[(3R)-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-5-{[4-(дифторметокси)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-134)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 60%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 592.5 [M+Na+], 514.4 [M-tBu+H+] 79% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.69 (d, J=1.6 Гц, 1Н), 7.65 (d, J=8.0 Гц, 1Н), 7.48 (dd, J=8.0, 1.9 Гц, 1Н), 7.27 (d, J=8.7 Гц, 2H), 6.99 (d, J=8.6 Гц, 2H), 6.45 (t, J=73.9 Гц, 1Н), 6.23 (s, 1Н), 5.55 (d, J=7.8 Гц, 1Н), 5.32 (d, J=15.2 Гц, 1Н), 4.87 (d, J=15.1 Гц, 1Н), 4.45-4.34 (m, 1Н), 3.70 (dd, J=10.9, 6.6 Гц, 1Н), 3.60-3.46 (m, 1Н), 2.93 (t. J=11.3 Гц, 1Н), 1.98-1.85 (m, 1Н), 1.49-1.43 (m, 1H), 1.40 (s, 9Н).
Синтез трет-бутил N-[(3R)-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-5-[(4-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-135)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 70%.
LCMS: METCR1410 Generic 1.7 min, rt=1.17 мин, M/Z (ES+) 478.1 [M-tBu+H+], 556.1 [M+Na+] 91% УФ; ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.69-7.53 (m, 2H), 7.50 (dd, J=8.0, 1.8 Гц, 1Н), 7.17 (d, J=8.6 Гц, 2H), 6.77 (d, J=8.7 Гц, 2H), 6.22 (s, 1Н), 5.59 (d, J=8.1 Гц, 1Н), 5.16 (d, J=14.7 Гц, 1Н), 4.90 (d, J=14.6 Гц, 1Н), 4.47-4.28 (m, 1Н), 3.75 (s, 3H), 3.68 (dd, J=11.0, 6.6 Гц, 1Н), 3.52 (s, 1Н), 2.92 (t, J=11.3 Гц, 1Н), 2.02-1.79 (m, 1Н), 1.54-1.42 (m, 1Н), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-5-бензил-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-136)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 42%.
LCMS: METCR1981 Hydrophobic 3 min, rt=1.51 мин, M/Z (ES+) 482.1 [M-tBu+H+], 560.15 [M+Na+] 100% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.64 (d, J=7.9 Гц, 1Н), 7.58 (d, J=1.8 Гц, 1Н), 7.48 (dd, J=8.0, 1.8 Гц, 1Н), 7.30-7.21 (m, 5H), 6.09-5.94 (m, 1Н), 5.59 (d, J=8.0 Гц, 1Н), 5.18 (d, J=15.1 Гц, 1Н), 5.03 (d, J=15.0 Гц, 1Н), 4.42 (dt, J=11.5, 7.4 Гц, 1Н), 3.70 (dd, J=11.0, 6.6 Гц, 1Н), 3.50 (m, 2H), 2.93 (t, J=11.3 Гц, 1Н), 2.22-2.09 (m, 2H), 1.87 (dt, J=14.6, 7.1 Гц, 2Н), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-8-хлор-5-[4-хлорфенил)метил]-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-137)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 65%.
LCMS: METCR1410 Generic 1.7 min, rt=1.61 мин, M/Z (ES+) 628.10/629.85 [M+Na]+97% УФ;
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.64 (d, J=5.8 Гц, 2H), 7.24-7.16 (m, 4H), 6.47-6.33 (m, 1Н), 5.54 (d, J=8.3 Гц, 1Н), 5.40 (d, J=15.1 Гц, 1Н), 4.71 (d, J=15.2 Гц, 1Н), 4.45-4.35 (m, 1Н), 3.69 (dd, J=10.9, 6.5 Гц, 1Н), 3.63-3.46 (m, 2H), 2.93 (t, J=11.3 Гц, 1Н), 2.29-2.16 (m, 2H), 1.98-1.87 (m, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-{[4-(дифторметокси)фенил]метил}-7-{[(оксан-4-ил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-138)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 89%.
LCMS: METCR1410 Generic 1.7 min, rt=1.16 мин, M/Z (ES+) 614.2 [M+Na+] 99% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.69 (d, J=1.7 Гц, 1Н), 7.63 (d, J=7.9 Гц, 1Н), 7.46 (dd, J=7.9, 1.7 Гц, 1Н), 7.28 (d, J=8.6 Гц, 2Н), 6.99 (d, J=8.5 Гц, 2Н), 6.46 (t, J=73.9 Гц, 1Н), 6.08 (t, J=6.0 Гц, 1Н), 5.55 (d, J=8.4 Гц, 1Н), 5.30 (d, J=15.1 Гц, 1Н), 4.88 (d, J=15.1 Гц, 1Н), 4.45-4.35 (m, 1Н), 4.00 (dd, J=10.9, 3.7 Гц, 2Н), 3.69 (dd, J=10.9, 6.6 Гц, 1Н), 3.45-3.30 (m, 4H), 2.91 (t, J=11.3 Гц, 1Н), 1.91-1.82 (m, 1Н), 1.70-1.62 (m, 2Н), 1.40 (s, 9H). Далее 2Н под толстым пиком.
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(4-фтороксан-4-ил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-139)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 90%.
LCMS: METCR1410 Generic 1.7 min, rt=1.2 мин, M/Z (ES+) 522.05/524.05 [M-tBu+H+], 600.15/602.20 [M+Na+] 99% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.82 (t, J=6.1 Гц, 1Н), 7.96 (s, 1Н), 7.76-7.70 (m, 1Н), 7.68 (d, J=8.0 Гц, 1Н), 7.45 (d, J=8.4 Гц, 1Н), 7.29 (s, 4H), 5.28 (d, J=15.6 Гц, 1Н), 4.95 (d, J=15.7 Гц, 1Н), 4.14 (dt, J=12.2, 7.6 Гц, 1Н), 3.73 (d, J=11.5 Гц, 3Н), 3.57 (s, 3H), 3.50-3.44 (m, 2Н), 3.12 (t, J=11.8 Гц, 1Н), 1.73-1.66 (m, 3H), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R)-1-(оксан-4-ил)этил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-140)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 93%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 596.10/598.20 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.30 (d, J=8.6 Гц, 1H), 7.88 (s, 1H), 7.73-7.65 (m, 2H), 7.44 (d, J=8.4 Гц, 1H), 7.34-7.27 (m, 4H), 5.25 (d, J=15.6 Гц, 1H), 4.97 (d, J=15.7 Гц, 1H), 4.18-4.09 (m, 1H), 3.92-3.79 (m, 3H), 3.46 (dd, J=11.3, 6.8 Гц, 1H), 3.28-3.20 (m, 2H), 3.11 (t, J=11.7 Гц, 1H), 1.67-1.54 (m, 3H), 1.35 (s, 9H), 1.21 (td, J=12.2, 3.9 Гц, 2H), 1.13 (d, J=6.7 Гц, 3Н).
Синтез трет-бутил N-[(3R)-5-бензил-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-141)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 25%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 448 [M-tBu+H+], 526 [M+Na+] 98% УФ
ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 7.64 (d, J=7.9 Гц, 1H), 7.57 (d, J=1.8 Гц, 1H), 7.50 (dd, J=8.0, 1.8 Гц, 1H), 7.26 (s, 5H), 6.21 (s, 1H), 5.59 (d, J=8.0 Гц, 1H), 5.19 (d, J=15.0 Гц, 1H), 5.01 (d, J=15.0 Гц, 1H), 4.50-4.31 (m, 1H), 3.70 (dd, J=11.0, 6.6 Гц, 1H), 3.59-3.43 (m, 1H), 2.93 (t, J=11.2 Гц, 1H), 2.02-1.78 (m, 1H). 1.51-1.42 (m, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-(3R)-5-[(4-хлорфенил)метил]-7-{[(3,3-дифторциклобутил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-142)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 52%.
LCMS: METCR1410 Generic 1.7 min, rt=1.28 мин, M/Z (ES+) 510.10/512.10 [M-tBu+H+] 93% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.75 (t, J=5.6 Гц, 1Н), 7.91 (s, 1H), 7.68 (s, 2H), 7.45 (d, J=8.3 Гц, 1Н), 7.28 (s, 4H), 5.29 (d, J=15.5 Гц, 1Н), 4.91 (d, J=15.7 Гц, 1Н), 4.13 (dt, J=12.1, 7.6 Гц, 1Н), 3.46 (dd, J=11.3, 6.7 Гц, 1Н), 3.39 (t, J=5.7 Гц, 2H), 3.11 (t, J=11.8 Гц, 1Н), 2.70-2.58 (m, 2H), 2.41-2.34 (m, 3H), 1.34 (s, 9H).
Синтез трет-бутил N-[(3R)-8-хлор-5-[(4-хлорфенил)метил]-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-143)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде бесцветного стекла с выходом 53%.
LCMS: METCR1410 Generic 1.7 min, rt=1.28 мин, M/Z (ES+) 515.95/518.05 [M-tBu+H+], 594/596.05 [M+Na+] 96% УФ; ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.59 (s, 2H), 7.17 (s, 4H), 6.93 (s, 1Н), 5.61 (d, J=8.0 Гц, 1Н), 5.34 (d, J=15.1 Гц, 1Н), 4.67 (d, J=15.1 Гц, 1Н), 4.34 (dt, J=11.4, 7.3 Гц, 1Н), 3.61 (dd, J=10.9, 6.5 Гц, 1Н), 3.47 (dt, J=10.1, 6.0 Гц, 1Н), 2.90 (t, J=11.3 Гц, 1Н), 1.94-1.77 (m, 1Н), 1.56-1.41 (m, 1H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-4-оксо-5-{[4-(трифторметил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-144)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 53%.
LCMS: METCR1410 Generic 1.7 min, rt=1.3 мин, M/Z (ES+) 594.2 [M+Na+] 86% УФ;
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.97 (s, 1H), 7.92 (s, 1H), 7.74-7.67 (m, 2H), 7.61 (d, J=8.2 Гц, 2H), 7.55-7.48 (m, 2H), 7.46 (d, J=8.3 Гц, 1H), 5.32 (d, J=16.1 Гц, 1H), 5.05 (d, J=16.0 Гц, 1H), 4.20-4.11 (m, 1H), 3.47 (dd, J=11.4, 6.9 Гц, 1Н), 3.13 (t, J=11.8 Гц, 1H), 2.04-1.92 (m, 1H), 1.70-1.52 (m, 2H), 1.34 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-бромфенил)метил]-7-[(2,2-дифторциклопропил)карбамоил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-145)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 71%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 604.0/605.8 [M+Na+] 88% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.00-8.94 (m, 1H), 7.95 (d, J=12.7 Гц, 1H), 7.71 (s, 2H), 7.48-7.39 (m, 3H), 7.27-7.19 (m, 2H), 5.36-5.22 (m, 1H), 4.95-4.82 (m, 1H), 4.18-4.08 (m, 1H), 3.50-3.43 (m, 2H), 3.12 (t, J=11.7 Гц, 1H), 2.04-1.93 (m, 1H), 1.75-1.56 (m, 1H), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-цианофенил)метил]-8-фтор-7-{[(4-фторфенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение VIII-146)
Указанное в названии соединение синтезировали согласно общей методике GP3 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 78%.
LCMS: METCR1410 Generic 1.7 min, rt=1.29 мин, M/Z (ES+) 523.2 [M-tBu+H+] 92% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 8.08 (d, J=7.0 Гц, 1Н), 7.54 (d, J=8.4 Гц, 2Н), 7.45-7.28 (m, 5H), 7.11-6.94 (m, 3H), 5.60-5.48 (m, 2Н), 4.77 (d, J=15.6 Гц, 1Н), 4.68-4.57 (m, 2Н), 4.40 (s, 1H), 3.71 (dd, J=10.9, 6.5 Гц, 1Н), 2.94 (t, J=11.3 Гц, 1Н), 1.40 (s, 9H).
Согласно описанной выше и проиллюстрированной общей методике GP4 следующие сульфоновые промежуточные соединения IX синтезировали из амидного промежуточного соединения VIII:
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-1,1,4-триоксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-02)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 69%.
LCMS: METCR1673 Generic 2 minutes, rt=1.47 мин, M/Z (ES+) 622 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (250 МГц, DMSO-d6) δ 8.76 (d, J=5.3 Гц, 1Н), 8.03-7.92 (m, 2Н), 7.78 (s, 1Н), 7.52 (d, J=7.9 Гц, 1Н), 7.46 (d, J=8.4 Гц, 2Н), 7.28 (d, J=8.2 Гц, 2Н), 5.26 (d, J=16.1 Гц, 1Н), 4.85 (d, J=16.2 Гц, 1Н), 4.39 (dt, J=11.6, 7.7 Гц, 1Н), 4.09 (dd, J=13.2, 7.2 Гц, 1Н), 3.74 (t, J=12.5 Гц, 1Н), 3.30-3.20 (m, 2Н), 1.49 (p, J=7.2 Гц, 2Н), 1.39-1.21 (m, 11Н), 0.89 (t, J=7.3 Гц, 3Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[(4-фторфенил)-метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-03)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 21%.
LCMS: METCR1673 Generic 2 minutes, rt=1.46 мин, M/Z (ES+) 642 [M+Na+] 90% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 8.03 (d, J=6.1 Гц, 1Н), 7.80 (d, J=9.9 Гц, 1Н), 7.35-7.26 (m, 6H), 7.06 (t, J=8.6 Гц, 2Н), 5.70 (d, J=7.1 Гц, 1Н), 5.17 (d, J=15.2 Гц, 1Н), 4.84 (d, J=15.2 Гц, 1Н), 4.63 (t, J=6.1 Гц, 2Н), 4.54 (s, 1Н), 4.16-4.00 (m, 1Н), 3.58-3.45 (m, 1Н), 1.40 (s, 9H). [NH невидимый]
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-04)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 89%.
LCMS: METCR1673 Generic 2 minutes, rt=1.45 мин, M/Z (ES+) 590 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.61 (t, J=5.5 Гц, 1Н), 7.73 (d, J=8.4 Гц, 1Н), 7.53 (dd, J=14.6, 6.8 Гц, 2Н), 7.38-7.32 (m, 4H), 5.22 (d, J=16.0 Гц, 1Н), 4.77 (d, J=16.0 Гц, 1Н), 4.41 (dt, J=11.6, 7.7 Гц, 1Н), 4.12-4.04 (m, 1Н), 3.83-3.70 (m, 1H), 3.26-3.17 (m, 2Н), 1.51-1.42 (m, 2Н), 1.36 (s, 9H), 1.29-1.25 (m, 2Н), 0.88 (t, J=7.4 Гц, 3Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-05)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 78%.
LCMS: METCR1673 Generic 2 minutes, rt=1.48 мин, M/Z (ES+) 644 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.75 (d, J=5.3 Гц, 1Н), 7.75 (d, J=8.5 Гц, 1H), 7.64 (d, J=5.5 Гц, 1Н), 7.52 (d, J=8.0 Гц, 1Н), 7.38-7.29 (m, 4H), 5.19 (d, J=16.0 Гц, 1Н), 4.83 (d, J=15.9 Гц, 1Н), 4.41 (dt, J=11.7, 7.7 Гц, 1Н), 4.09 (dd, J=13.1, 7.4 Гц, 1Н), 3.82-3.71 (m, 1Н), 3.45-3.35 (m, 2H), 2.29 (dd, J=16.2, 11.4 Гц, 2Н), 1.79-1.64 (m, 2H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(оксан-4-илметил)-карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-06)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 28%.
LCMS: METCR1673 Generic 2 minutes, rt=1.38 мин, M/Z (ES+) 510 [M+H-boc] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.01 (d, J=6.1 Гц, 1Н), 7.83 (d, J=9.9 Гц, 1Н), 7.30 (d, J=2.5 Гц, 4H), 6.77 (dt, J=11.5, 5.6 Гц, 1Н), 5.73 (d, J=7.1 Гц, 1Н), 5.19 (d, J=15.2 Гц, 1Н), 4.85 (d, J=15.2 Гц, 1Н), 4.54 (dt, J=10.9, 7.0 Гц, 1Н), 4.10 (dd, J=13.9, 6.3 Гц, 1Н), 4.02 (dd, J=11.1, 3.7 Гц, 2H), 3.54 (dd, J=13.2, 11.1 Гц, 1Н), 3.50-3.32 (m, 4H), 1.91 (ddt, J=11.4, 8.0, 4.0 Гц, 1Н), 1.72-1.63 (m, 2H), 1.61 (s, 2H), 1.48-1.35 (m,9H).
Синтез трет-бутил N-[(3R)-8-фтор-7-[(оксан-4-илметил)карбамоил]-1,1,4-триоксо-5-{[4-трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-07)
Указанное в названии соединение синтезировали согласно общей методике GP6 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 62%.
LCMS: METCR1673 Generic 2 minutes, rt=1.38 мин, M/Z (ES+) 682 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 1.40 (s, 11H), 1.64 (dt, J=7.0, 14.1 Гц, 2Н), 1.88 (ttt, J=3.9, 7.2, 10.9 Гц, 1H), 3.38 (tdq, J=6.8, 13.3, 20.0 Гц, 4Н), 3.52 (dd, J=11.2, 13.2 Гц, 1H), 4.00 (dd, J=3.7, 11.2 Гц, 2Н), 4.03-4.12 (m, 1H), 4.52 (dt, J=7.0, 10.8 Гц, 1H), 4.84 (d, J=15.3 Гц, 1Н), 5.21 (d, J=15.3 Гц, 1H), 5.70 (d, J=7.1 Гц, 1Н), 6.76 (dt, J=5.8, 11.8 Гц, 1H), 7.16 (d, J=8.1 Гц, 2Н), 7.37 (d, J=8.6 Гц, 2Н), 7.82 (d, J=9.9 Гц, 1H), 8.00 (d, J=6.0 Гц, 1Н).
Синтез трет-бутил N-[(3R)-8-фтор-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-08)
Указанное в названии соединение синтезировали согласно общей методике GP6 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 53%.
LCMS: METCR1673 Generic 2 minutes, rt=1.49 мин, M/Z (ES+) 694 [M+Na+] 96% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 1.40 (s, 9H), 1.92 (dt, J=7.2, 14.7 Гц, 2Н), 2.11-2.26 (m, 2Н), 3.55 (qd, J=9.0, 13.6 Гц, 3Н), 4.08 (dd, J=6.7, 13.5 Гц, 1H), 4.53 (dt, J=7.0, 10.9 Гц, 1H), 4.84 (d, J=15.3 Гц, 1H), 5.22 (d, J=15.2 Гц, 1H), 5.70 (d, J=7.1 Гц, 1H), 6.77 (dt, J=5.8, 11.6 Гц, 1H), 7.16 (d, J=8.1 Гц, 2Н), 7.37 (d, J=8.6 Гц, 2Н), 7.82 (d, J=9.9 Гц, 1H), 7.99 (d, J=6.0 Гц, 1H)
Синтез трет-бутил N-[(3R)-8-фтор-1,1,4-триоксо-7-(феноксикарбамоил)-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-09)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 40%.
LCMS: METCR1673 Generic 2 minutes, rt=1.47 мин, M/Z (ES+) 676 [M+Na+] 97% УФ ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 1.41 (s, 9H), 3.47-3.61 (m, 1H), 4.10 (dd, J=6.9, 13.3 Гц, 1H), 4.55 (h, J=8.7, 9.7 Гц, 1H), 4.84 (d, J=14.9 Гц, 1H), 5.23 (d, J=15.2 Гц, 1H), 5.72 (d, J=7.0 Гц, 1H), 7.04-7.18 (m, 5H), 7.29-7.44 (m, 4H), 7.88 (d, J=9.36 Гц, 1H), 8.03 (s, 1H), 9.62 (d, J=9.7 Гц, 1Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(2-метилпропокси)-карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-10)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 82%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 606/608 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 9.11 (d, J=11.2 Гц, 1H), 8.01 (d, J=6.1 Гц, 1H), 7.82 (d, J=9.6 Гц, 1H), 7.30-7.27 (m, 4H), 5.70 (s, 1H), 5.16 (d, J=15.3 Гц, 1H), 4.85 (d, J=15.2 Гц, 1H), 4.52 (s, 1H), 4.08 (d, J=6.7 Гц, 1H), 3.83 (d, J=6.8 Гц, 2Н), 3.58-3.48 (m, 1H), 2.12-1.99 (m, 1H), 1.41 (s, 9H), 1.01 (d, J=6.7 Гц, 6Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-(феноксикарбамоил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-11)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 47%.
LCMS: METCR1673 Generic 2 minutes, rt=1.44 мин, M/Z (ES+) 626/628 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 9.54 (s, 1Н), 8.05 (s, 1H), 7.95-7.88 (m, 1Н), 7.44-7.35 (m, 2H), 7.34-7.30 (part. obsc. m, 4H), 7.13 (t, J=7.8 Гц, 3Н), 5.74 (d, J=7.0 Гц, 1Н), 5.22 (d, J=15.2 Гц, 1Н), 4.85 (d, J=15.5 Гц, 1Н), 4.65-4.52 (m, 1Н), 4.13 (dd, J=13.4, 6.8 Гц, 1Н), 3.64-3.49 (m, 1Н), 1.44 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-12)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 82%.
LCMS: METCR1673 Generic 2 minutes, rt=1.40 мин, M/Z (ES+) 576/578 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.00 (d, J=6.1 Гц, 1Н), 7.79 (d, J=9.8 Гц, 1Н), 7.30-7.27 (m, 4H), 6.53-6.40 (m, 1Н), 5.70 (d, J=6.8 Гц, 1Н), 5.17 (d, J=15.2 Гц, 1Н), 4.83 (d, J=15.2 Гц, 1Н), 4.56-4.46 (m, 1Н), 4.33-4.21 (m, 1Н), 4.08 (dd, J=13.3, 6.9 Гц, 1Н), 3.51 (dd, J=13.3, 11.0 Гц, 1Н), 1.40 (s, 9H), 1.28 (dd, J=6.5, 3.7 Гц, 6Н)
Синтез трет-бутил N-[(2R,3R)-5-[(4-хлорфенил)метил]-2-метил-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамат (Промежуточное соединение IX-13)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 85%.
LCMS: METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES+) 640/642 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.90 (d, J=6.0 Гц, 1Н), 7.78 (d, J=9.9 Гц, 1H), 7.23-7.16 (m, 4H), 6.73 (dt, J=11.6, 5.7 Гц, 1Н), 5.61 (d, J=6.9 Гц, 1Н), 5.07 (d, J=15.3 Гц, 1Н), 4.74 (d, J=15.3 Гц, 1Н), 4.53 (t, J=6.8 Гц, 1Н), 3.96 (p, J=6.9 Гц, 1H), 3.48 (qq, J=13.5, 6.7 Гц, 2Н), 2.18-2.05 (m, 2H), 1.85 (dt, J=14.7, 7.2 Гц, 2Н), 1.41 (d, J=7.0 Гц, 3Н), 1.33 (s, 9Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[({4-[(5-ацетамидопентил)окси]-фенил}метил)-карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-14)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 62%.
LCMS: METCR1416 Generic 7 minutes, rt=4.23 мин, M/Z (ES+) 727/729 [M+H+], 627/629 [M+H-Boc] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.29 (t, J=5.8 Гц, 1Н), 7.99 (s, 2H), 7.85 (s, 1Н), 7.79 (s, 1Н), 7.52 (d, J=8.0 Гц, 1Н), 7.34 (s, 4H), 7.20 (d, J=8.6 Гц, 2Н), 6.88 (d, J=8.6 Гц, 2Н), 6.21 (d, J=15.9 Гц, 1Н), 4.85 (d, J=16.0 Гц, 1Н), 4.37 (s, 3H), 4.08 (dd, J=13.1, 7.3 Гц, 1Н), 3.93 (t, J=6.5 Гц, 2Н), 3.78-3.68 (m, 1Н), 3.03 (q, J=6.5 Гц, 2H), 1.78 (s, 3H), 1.70 (р, J=6.8 Гц, 2Н), 1.48-1.37 (m, 4H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил-7-[(циклопропилметил)карбамоил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-15)
Указанное в названии соединение синтезировали согласно общей методике GP4 c получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 88%.
LCMS: METCR1673 Generic 2 minutes, rt=1.45 мин, M/Z (ES+) 588/590 [M+Na+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.51 (t, J=5.5 Гц, 1Н), 7.54 (d, J=8.5 Гц, 1H), 7.37 (d, J=5.4 Гц, 1Н), 7.32 (d, J=8.0 Гц, 1Н), 7.14 (s, 4H), 5.01 (d, J=16.0 Гц, 1Н), 4.58 (d, J=16.0 Гц, 1Н), 4.21 (dt, J=11.5, 7.7 Гц, 1Н), 3.89 (dd, J=13.3, 7.3 Гц, 1Н), 3.60-3.51 (m, 1Н), 2.93 (qt, J=13.4, 6.0 Гц, 2Н), 1.17 (s, 9H), 0.78 (s, 1Н), 0.23 (q, J=5.6 Гц, 2H), -0.00 (q, J=4.9 Гц, 2H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-7-[(пропан-2-ил]карбамоил-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-16)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 83%.
LCMS: METCR1673 Generic 2 minutes, rt=1.36 мин, M/Z (ES+) 558/560 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 1.24 (d, J=6.6 Гц, 6Н), 1.40 (s, 9H), 3.50 (dd, J=11.1, 13.2 Гц, 1Н), 4.05 (dd, J=7.0, 13.3 Гц, 1Н), 4.22 (dh, J=6.6, 13.2 Гц, 1Н), 4.51 (dt, J=7.2, 10.9 Гц, 1Н), 4.60 (d, J=15.2 Гц, 1Н), 5.39 (d, J=15.2 Гц, 1Н), 5.72 (dd, J=7.5, 18.3 Гц, 2Н), 7.26-7.34 (m, 4H), 7.50 (d, J=1.3 Гц, 1Н), 7.75 (dd, J=1.3, 8.1 Гц, 1Н), 8.06 (d, J=8.1 Гц, 1Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-7-[(4,4,4-трифторбутил)-карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-17)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 93%.
LCMS: METCR1673 Generic 2 minutes, rt=1.43 мин, M/Z (ES+) 626/628 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.86 (t, J=5.6 Гц, 1Н), 8.01-7.92 (m, 2H), 7.81 (s, 1Н), 7.51 (d, J=8.1 Гц, 1Н), 7.37-7.30 (m, 4H), 5.20 (d, J=16.0 Гц, 1Н), 4.85 (d, J=16.0 Гц, 1Н), 4.43-4.33 (m, 1Н), 4.07 (dd, J=13.2, 7.3 Гц, 1Н), 3.77-3.70 (m, 1Н), 3.43-3.34 (m, 2H), 2.36-2.23 (m, 2H), 1.81-1.63 (m, 2H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(2-метилпропокси)карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-18)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 72%.
LCMS: METCR1673 Generic 2 minutes, rt=1.41 мин, M/Z (ES+) 588/590 [M+Na+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.47-7.41 (m, 4H), 7.33-7.27 (m, 4H), 5.70 (d, J=7.0 Гц, 1Н), 5.39 (dd, J=36.7, 15.3 Гц, 1Н), 4.66 (d, J=15.4 Гц, 2H), 4.06 (d, J=6.9 Гц, 1Н), 3.91 (dd, J=6.9, 1.5 Гц, 1Н), 3.76 (s, 1Н), 3.57-3.43 (m, 1Н), 2.12-1.93 (m, 1Н), 1.41 (s, 9H), 0.97 (dd, J=16.1, 6.6 Гц, 6Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-7-(пропоксикарбамоил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-19)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 49%.
LCMS: METCR1673 Generic 2 minutes, rt=1.35 мин, M/Z (ES+) 574/576 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.06 (dd, J=36.0, 8.1 Гц, 4Н), 7.35-7.27 (m, 4Н), 5.70 (d, J=7.9 Гц, 1Н), 5.39 (d, 15.3 Гц, 1Н), 4.65 (d, J=15.3 Гц, 2Н), 4.08 (dt, J=14.1, 6.8 Гц, 2Н), 3.95 (s, 1Н), 3.57-3.42 (m, 1Н), 1.72 (p, J=7.1 Гц, 2Н), 1.41 (s, 9H), 0.99 (dt, J=14.9, 7.6 Гц, 3H)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(3-метилбутан-2-ил)карбамоил-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-20)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 79%.
LCMS: METCR1673 Generic 2 minutes, rt=1.46 мин, M/Z (ES+) 586/588 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.09 (dd, J=8.1, 1.9 Гц, 1Н), 7.78 (t, J=7.8 Гц, 1Н), 7.51-7.41 (m, 1Н), 7.34-7.27 (m, 4Н), 5.70 (d, J=7.2 Гц, 1Н), 5.64 (dd, J=27.2, 8.9 Гц, 1Н), 5.46 (dd, J=15.3, 3.1 Гц, 1Н), 4.60-4.47 (m, 2Н), 4.12-3.96 (m, 2H), 3.51 (dd, J=13.2, 11.0 Гц, 1Н), 1.78 (dq, J=13.1, 6.6 Гц, 1Н), 1.41 (s, 9H), 1.16 (d, J=6.7 Гц, 3Н), 0.92 (ddd, J=6.2, 4.2, 1.5 Гц, 6Н)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-(гексадецилкарбамоил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-21)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 42%.
LCMS: METCR1981, hydrophobic 3 minutes, rt=2.6 мин, M/Z (ES+) 758/760 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.62 (t, J=5.5 Гц, 1Н), 7.73 (d, J=8.4 Гц, 1H), 7.57-7.49 (m, 2H), 7.34 (s, 4H), 5.22 (d, J=16.1 Гц, 1Н), 4.78 (d, J=16.1 Гц, 1Н), 4.42 (dt, J=11.8, 7.8 Гц, 1Н), 4.09 (dd, J=13.3, 7.3 Гц, 1Н), 3.81-3.70 (m, 1Н), 3.25-3.19 (m, 2H), 1.52-1.42 (m, 2H), 1.32-1.17 (m, 35H), 0.88-0.83 (m, 3H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-(циклопропилкарбамоил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-22)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 80%.
LCMS: METCR1673 Generic 2 minutes, rt=1.35 мин, M/Z (ES+) 574/576 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.72 (d, J=4.2 Гц, 1Н), 7.72 (d, J=8.4 Гц, 1Н), 7.60 (d, J=5.4 Гц, 1Н), 7.51 (d, J=8.0 Гц, 1Н), 7.39-7.30 (m, 4H), 5.17 (d, J=15.9 Гц, 1Н), 4.84 (d, J=15.9 Гц, 1H),4.39 (dt, J=11.6, 7.6 Гц, 1Н), 4.09 (dd, J=13.2, 7.4 Гц, 1Н), 3.80-3.69 (m, 1Н), 2.83 (dq, J=7.3, 3.7 Гц, 1Н), 1.37 (s, 9H), 0.72 (d, J=5.5 Гц, 2H), 0.53 (dd, J=3.7, 1.9 Гц, 2Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-(циклобутилкарбамоил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-23)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 61%.
LCMS: METCR1673 Generic 2 minutes, rt=1.44 мин, M/Z (ES+) 588/590 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.00 (d, J=6.1 Гц, 1Н), 7.80 (d, J=9.9 Гц, 1Н), 7.30-7.26 (m, 4H), 6.84-6.72 (m, 1Н), 5.70 (d, J=7.1 Гц, 1Н), 5.16 (d, J=15.2 Гц, 1Н), 4.83 (d, J=15.2 Гц, 1Н), 4.60-4.46 (m, 2H), 4.08 (dd, J=13.3, 6.9 Гц, 1Н), 3.51 (dd, J=13.2, 11.0 Гц, 1Н), 2.50-2.40 (m, 2H), 2.05-1.93 (m, 2H), 1.88-1.74 (m, 2H), 1.40 (s, 9H)
Синтез трет-бутил N-[(3R)-5-[(4-хлор-2-фторфенил)метил]-8-фтор-1,1,4-триоксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-24)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 85%.
LCMS: METCR1673 Generic 2 minutes, rt=1.41 мин, M/Z (ES+) 594/596 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.14 (d, J=6.0 Гц, 1Н), 7.80 (d, J=9.8 Гц, 1Н), 7.41 (t, J=8.1 Гц, 1Н), 7.10 (dd, J=8.3, 1.7 Гц, 1Н), 7.04 (dd, J=9.7, 2.0 Гц, 1Н), 6.56-6.44 (m, 1Н), 5.66 (d, J=7.2 Гц, 1Н), 5.08 (d, J=15.2 Гц, 1Н), 5.01 (d, J=15.1 Гц, 1Н), 4.49 (dt, J=10.9, 7.0 Гц, 1Н), 4.34-4.25 (m, 1Н), 4.04 (dd, J=13.4, 6.9 Гц, 1Н), 3.46 (dd, J=13.3, 11.1 Гц, 1Н), 1.40 (s, 9H), 1.30 (dd, J=6.6, 2.0 Гц, 6Н)
Синтез трет-бутил N-[(3R)-5-[(3,4-дихлорфенил)метил]-1,1,4-триоксо-7-[(пропан-2-ил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-25)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 90%.
LCMS: METCR1673 Generic 2 minutes, rt=1.42 мин, M/Z (ES+) 592/594 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.09 (d, J=8.1 Гц, 1Н), 7.75 (dd, J=8.1, 1.4 Гц, 1Н), 7.60 (d, J=1.4 Гц, 1Н), 7.46 (d, J=2.1 Гц, 1Н), 7.41 (d, J=8.2 Гц, 1Н), 7.18 (dd, J=8.2, 2.0 Гц, 1Н), 5.76 (d, J=7.5 Гц, 1Н), 5.66 (d, J=7.3 Гц, 1Н), 5.31 (d, J=15.4 Гц, 1Н), 4.64 (d, J=15.4 Гц, 1Н), 4.53 (dt, J=10.9, 7.2 Гц, 1Н), 4.25 (dq, J=13.1, 6.5 Гц, 1Н), 4.06 (dd, J=13.4, 7.0 Гц, 1Н), 3.50 (dd, J=13.3, 11.1 Гц, 1Н), 1.41 (s, 9H), 1.26 (d, J=6.6 Гц, 6H)
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(циклогексилокси)карбамоил]-1,1,4,-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-27)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде бесцветного масла при выходе 43%.
LCMS: METCR1673 Generic 2 minutes, rt=1.45 мин, M/Z (ES+) 614/616 [M+Na+] 91% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 1.18-1.50 (m, 15Н), 1.78 (s, 2H), 1.99 (s, 2H), 3.43-3.58 (m, 1Н), 3.83-4.15 (m, 2H), 4.42-4.65 (m, 2H), 5.33-5.49 (m, 1Н), 5.73 (d, J=7.1 Гц, 1Н), 7.26-7.33 (m, 4H), 7.37-7.62 (m, 1Н), 7.63-7.93 (m, 1H), 7.93-8.08 (m, 1H), 8.83 (s, 1H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(циклогексилметокси)карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -28)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде бесцветного масла при выходе 82%.
LCMS: METCR1673 Generic 2 minutes, rt=1.53 мин, M/Z (ES+) 628/630 [M+Na+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 0.90-1.08 (m, 211), 1.12-1.34 (m, 3Н), 1.40 (s, 9Н), 1.64-1.85 (m, 6Н), 3.43-3.58 (m, 1H), 3.78 (s, 1Н), 3.88-3.98 (m, 1H), 3.98-4.13 (m, 1H), 4.44-4.73 (m, 2H), 5.28-5.44 (m, 1H), 5.66-5.76 (m, 1H), 7.26-7.33 (m, 4Н), 7.43-7.94 (m, 2Н), 7.98- 8.09 (m, 1H), 8.79 (s, 1Н)
Синтез трет-бутил N-(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-[(2,2,2-трифторэтил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -29)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 73%.
LCMS: METCR1673 Generic 2 minutes, rt=1.41 мин, M/Z (ES+) 616/618 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.00 (d, J=6.0 Гц, 1H), 7.86 (d, J=9.9 Гц, 1H), 7.27 (d, J=13.2 Гц, 6H), 6.98-6.83 (m, 1H), 5.70 (d, J=7.1 Гц, 1H), 5.19 (d, J=15.2 Гц, 1H), 4.83 (d, J=15.2 Гц, 1H), 4.52 (dt, J=11.0, 7.0 Гц, 1H), 4.25-4.00 (m, 1H), 3.53 (dd, J=13.3, 11.1 Гц, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-[(3,3,3-трифторпронил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -30)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 76%.
LCMS: METCR1673 Generic 2 minutes, rt=1.44 мин, M/Z (ES+) 630/632 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 7.98 (d, J=6.1 Гц, 1H), 7.82 (d, J=9.9 Гц, 1Н), 7.31-7.24 (m, 5H), 7.01-6.82 (m, 1H), 5.70 (d, J=7.2 Гц, 1H), 5.19 (d, J=15.2 Гц, 1H), 4.82 (d, J=15.2 Гц, 1H), 4.66-4.41 (m, 1H), 4.09 (dd, J=13.5, 6.9 Гц, 1H), 3.75 (p, J=5.9 Гц, 1H), 3.52 (dd, J=13.4, 11.1 Гц, 1H), 2.54-2.38 (m, 2H), 1.40 (s, 9H).
Синтез трст-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-{[(2S)-1,1,1-трифторпропан-2-ил]карбамоил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -31)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 85%.
LCMS: METCR1673 Generic 2 minutes, rt=1.46 мин, M/Z (ES+) 630/632 [M+Na+] 100% УФ
Синтез трет-бутил N-[(3R)-7-[(бутан-2-ил)карбамоил]-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -32)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 79%.
LCMS: METCR1673 Generic 2 minutes, rt=1.47 мин, M/Z (ES+) 590/592 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.41 (d, J=8.2 Гц, 1H), 7.72 (d, J=8.3 Гц, 1H), 7.54-7.48 (m, 2H), 7.33 (s, 4H), 5.23 (d, J=15.9 Гц, 1H), 4.77 (d, J=15.9 Гц, 1H), 4.40 (dt, J=11.7, 7.7 Гц, 1H), 4.09 (dd, J=13.3, 7.3 Гц, 1H), 3.84 (dt, J=14.0, 7.3 Гц, 1H), 3.79-3.73 (m, 1H), 1.45 (ddd, J=20.9, 14.3, 7.0 Гц, 2H), 1.37 (s, 9H), 1.10 (d, J=6.6 Гц, 3H), 0.82 (t, J=7.4 Гц, 3H).
Синтез трет-бутил N-[(3R)-7-(трет-бутилкарбамоил)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -33)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 55%.
LCMS: METCR1673 Generic 2 minutes, rt=1.49 мин, M/Z (ES+) 590/592 [M+Na+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.19 (s, 1H), 7.70 (d, J=8.2 Гц, 1H), 7.50 (dd, J=11.7, 6.8 Гц, 2H), 7.36-7.31 (m, 4H), 5.21 (d, J=15.9 Гц, 1H), 4.79 (d, J=15.9 Гц, 1H), 4.38 (dt, J=11.7, 7.7 Гц, 1H), 4.09 (dd, J=13.3, 7.3 Гц, 1H), 3.80-3.68 (m, 1H), 1.36 (s, 9H), 1.33 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(трет-бутокси)карбамоил]-5-[(4-хлорфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -34)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 50%.
LCMS: METCR1673 Generic 2 minutes, rt=1.38 мин, M/Z (ES+) 588/590 [M+Na+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 11.23 (s, 1H), 7.98 (d, J=8.2 Гц, 1H), 7.87 (d, J=8.2 Гц, 1H), 7.65 (s, 1H), 7.52 (d, J=8.1 Гц, 1H), 7.39-7.31 (m, 4H), 5.30 (d, J=16.3 Гц, 1H), 4.73 (d, J=16.2 Гц, 1H), 4.39 (dt, J=11.6, 7.6 Гц, 1H), 4.11-4.08 (m, 1H), 3.80-3.71 (m, 1H), 1.37 (s, 9H), 1.19 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(бут-3-ен-1-ил)карбамоил]-5-[(4-хлорфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-35)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 13%.
LCMS: METCR1673 Generic 2 minutes, rt=1.38 мин, M/Z (ES+) 570/572 [M+Na+] 91% УФ
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-{[(1S,2R)-2-фенилциклопропил]карбамоил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -36)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 77%.
LCMS: METCR1673 Generic 2 minutes, rt=1.52 мин, M/Z (ES+) 650/652 [M+Na+]100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.97 (s, 1H), 7.74 (d, J=8.3 Гц, 1H), 7.65 (d, J=5.3 Гц, 1H), 7.51 (d, J=8.0 Гц, 1H), 7.40-7.31 (m, 4H), 7.28 (t, J=7.4 Гц, 2H), 7.17 (dd, J=16.6, 7.6 Гц, 3Н), 5.16 (d, J=15.9 Гц, 1H), 4.85 (d, J=15.5 Гц, 1H), 4.43-4.35 (m, 1H), 4.09 (dd, J=12.8, 8.2 Гц, 1H), 3.75 (t, J=12.5 Гц, 1H), 3.06-2.99 (m, 1H), 1.36 (s, 9H), 1.31-1.21 (m, 3H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(1-метилциклопропил)карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX -37)
Указанное в названии соединение синтезировали согласно общей методике GP4 c получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 63%.
LCMS: METCR1673 Generic 2 minutes, rt=1.41 мин, M/Z (ES+) 588/590 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.84 (s, 1Н), 7.70 (d, J=8.4 Гц, 1H), 7.55 (d, J=5.5 Гц, 1H), 7.50 (d, J=8.1 Гц, 1H), 7.36-7.29 (m, 4H), 5.17 (d, J=15.8 Гц, 1H), 4.81 (d, J=15.9 Гц, 1H), 4.37 (dt, J=11.7, 7.7 Гц, 1H), 4.07 (dd, J=13.3, 7.3 Гц, 1H), 3.77-3.69 (m, 1H), 1.41-1.27 (m, 12H), 0.74-0.67 (m, 2H), 0.64-0.59 (m, 2H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(1-метилциклобутил)карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-38)
Указанное в названии соединение синтезировали согласно общей методике GP4 c получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 66%.
LCMS: METCR1673 Generic 2 minutes, rt=1.51 мин, M/Z (ES+) 602/604 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.65 (s, 1H), 7.71 (d, J=8.3 Гц, 1H), 7.55 (d, J=5.5 Гц, 1H), 7.51 (d, J=8.1 Гц, 1H), 7.34 (s, 4H), 5.19 (d, J=15.9 Гц, 1H), 4.81 (d, J=15.9 Гц, 1H), 4.38 (dt, J=11.7, 7.7 Гц, 1H), 4.08 (dd, J=13.3, 7.3 Гц, 1H), 3.80-3.68 (m, 1H), 2.35-2.24 (m, 2H), 1.96 (dt, J=12.2, 6.2 Гц, 2H), 1.80 (ddd, J=15.4, 9.6, 6.5 Гц, 2H), 1.44 (s, 3H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(2,2-диметилциклопропил)-карбамоил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-39)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 56%.
LCMS: METCR1673 Generic 2 minutes, rt=1.49 мин, M/Z (ES+) 602/604 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.60 (d, J=4.1 Гц, 1H), 7.73 (d, J=8.3 Гц, 1H), 7.51 (dd, J=10.5, 6.7 Гц, 2H), 7.33 (s, 4H), 5.24 (d, J=15.9 Гц, 1H), 4.77 (d, J=15.9 Гц, 1H), 4.40 (dt, J=11.7, 7.8 Гц, 1H), 4.12-4.09 (m, 1H), 3.81-3.73 (m, 1H), 2.55 (dt, J=8.3, 4.3 Гц, 1H), 1.37 (s, 9H), 1.06 (s, 3H), 0.93 (s, 3H), 0.68 (dd, J=7.9, 5.3 Гц, 1H), 0.43 (t, J=4.7 Гц, 1H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(3,3-дифторциклобутил)карбамоил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-40)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 67%.
LCMS: METCR1673 Generic 2 minutes, rt=1.45 мин, M/Z (ES+) 624/626 [M+Na+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.14 (d, J=6.5 Гц, 1H), 7.76 (d, J=8.5 Гц, 1H), 7.66 (d, J=5.5 Гц, 1H), 7.52 (d, J=8.1 Гц, 1H), 7.33 (s, 4H), 5.17 (d, J=15.9 Гц, 1H), 4.85 (d, J=15.9 Гц, 1H), 4.40 (dt, J=11.8, 7.7 Гц, 1H), 4.28-4.19 (m, 1H), 4.10 (dd, J=13.3, 7.3 Гц, 1H), 3.80-3.71 (m, 1H), 3.06-2.91 (m, 2H), 2.76-2.61 (m, 2H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-7-(бензилкарбамоил)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-41)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 70%.
LCMS: METCR1673 Generic 2 minutes, rt=1.49 мин, M/Z (ES+) 624/626 [M+Na+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.20 (t, J=5.9 Гц, 1H), 7.75 (d, J=8.5 Гц, 1H), 7.62 (d, J=5.5 Гц, 1H), 7.51 (d, J=8.0 Гц, 1H), 7.40-7.20 (m, 9H), 5.21 (d, J=16.0 Гц, 1H), 4.79 (d, J=16.0 Гц, 1H), 4.52-4.38 (m, 3H), 4.09 (dd, J=12.9, 7.0 Гц, 1H), 3.80-3.71 (m, 1H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-(гептилкарбамоил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-42)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 84%.
LCMS: METCR1673 Generic 2 minutes, rt=1.72 мин, M/Z (ES+) 632/634 [M+Na+] 95% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.62 (t, J=5.4 Гц, 1Н), 7.74 (d, J=8.4 Гц, 1H), 7.59-7.50 (m, 2H), 7.40-7.32 (m, 4H), 5.21 (d, J=16.1 Гц, 1H), 4.79 (d, J=16.0 Гц, 1Н), 4.42 (dt, J=11.6, 7.5 Гц, 1H), 4.15-4.04 (m, 1H), 3.84-3.72 (m, 1H), 3.21 (dq, J=12.8, 6.3, 5.8 Гц, 2H), 1.52-1.43 (m, 2H), 1.40-1.19 (m, 17H), 0.87 (t, J=7.0 Гц, 3H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(3,3-дифторциклопентил)карбамоил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-43)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 75%.
LCMS: METCR1673 Generic 2 minutes, rt=1.31 мин, M/Z (ES+) 638/640 [M+Na+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.89 (d, J=6.9 Гц, 1Н), 7.75 (d, J=8.4 Гц, 1H), 7.61 (d, J=5.3 Гц, 1H), 7.52 (d, J=8.0 Гц, 1H), 7.34 (s, 4H), 5.19 (d, J=15.9 Гц, 1H), 4.83 (d, J=16.0 Гц, 1H), 4.39 (dq, J=15.3, 7.8 Гц, 2H), 4.10 (dd, J=13.2, 7.3 Гц, 1H), 3.82-3.71 (m, 1H), 2.31-2.18 (m, 1H), 2.18-2.03 (m, 4H), 1.77 (dd, J=20.2, 7.2 Гц, 1H), 1.37 (s, 9H).
Синтез трет-бутил N-[(2R,3R)-5-[(4-хлорфенил)метил]-7-[(2,2-дифторциклопропил)-карбамоил]-2-метил-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-44)
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 81%.
LCMS: METCR1673 Generic 2 minutes, rt=1.27 мин, M/Z (ES+) 606/608 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.16 (s, 1Н), 8.08 (d, J=8.1 Гц, 1H), 8.03-7.96 (m, 1H), 7.83 (d, J=11.1 Гц, 1H), 7.42-7.31 (m, 4H), 7.25 (s, 1H), 5.23-5.12 (m, 1Н), 4.88 (t, J=16.4 Гц, 1H), 4.63 (s, 1H), 4.09-3.94 (m, 1H), 3.48 (s, 1H), 2.01 (s, 1H), 1.67 (d, J=6.2 Гц, 1H), 1.46-1.29 (m, 12H)
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-хлорфенил)метил]-1,4-диоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил)карбамата (Промежуточное соединение IX-45)
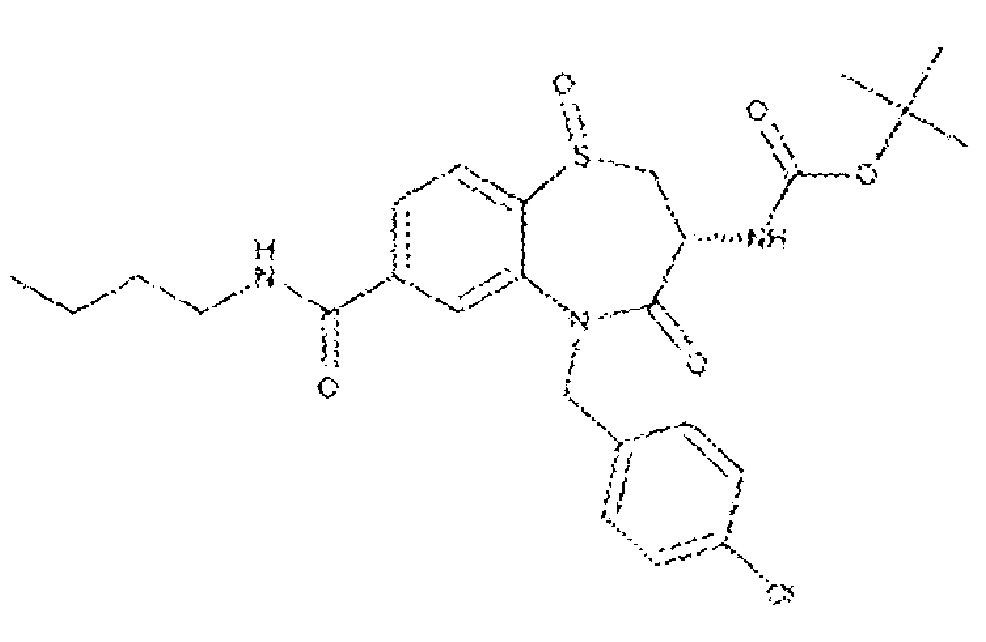
Промежуточное соединение VIII-80 (37 мг, 0.07 ммоль) растворили в МеОН (1 мл), и реакционную смесь охладили до 0°С. m-СРВА (77%, 43 мг, 0.22 ммоль) в воде (1 мл) добавили порционно. Реакционную смесь перемешивали при 0°С в течение 1 ч и затем при комнатной температуре в течение 12 ч. После разбавления EtOAc (8 мл), смесь промыли с помощью воды (5 мл × 2) и соляного раствора (5 мл). Органическую фазу высушили над сульфатом натрия, отфильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очистили с помощью обращеннофазовой колоночной хроматографии (Biotage С18 SNAP картридж, элюент: вода, 0-100% MeCN) с получением целевого сульфоксидного промежуточного соединения IX-45 в виде твердого вещества белого цвета (19 мг, 48%) с чистотой 94% (соответствующий сульфон (Промежуточное соединение IX-04) также выделили в виде твердого вещества белого цвета (10 мг, 24%, аналитические данные приведены выше)).
LCMS: METCR1416 Generic 7 minutes, rt=1.41 мин, M/Z (ES+) 556/558 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.69 (t, J=5.6 Гц, 1H), 8.03 (dd, J=8.1, 1.2 Гц, 1H), 8.01-7.97 (m, 1H), 7.71 (d, J=8.1 Гц, 1H), 7.45 (d, J=7.9 Гц, 1H), 7.34 (d, J=8.4 Гц, 2H), 7.22 (d, J=8.4 Гц, 2H), 5.32 (d, J=15.2 Гц, 1H), 4.82 (d, J=15.2 Гц, 1H), 4.14 (dt, J=10.7, 8.2 Гц, 1H), 3.98 (t, J=11.1 Гц, 1H), 3.30-3.22 (m, 3H), 1.54 (p, J=7.1 Гц, 2H), 1.35 (s, 11H), 0.92 (t, J=7.4 Гц, 3H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1S)-2,2-дифторциклопропил]карбамоил}-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-46) и трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-47)
Промежуточное соединение IX-01 разделили на его энантиомеры, применяя препаративную хиральную SFC:
Промежуточное соединение IX-01 (125 мг) растворили до 25 мг/мл в EtOH и затем очистили посредством SFC. Каждая инъекция составляла 0.75 мл (19 мг). Применялась колонка YMC AMY-C (20 мм × 250 м, 5 мкм). Элюентом был МеОН/CO2 15%. Скорость потока составляла 50 мл/мин при длине волны 225 нм.
Влажные фракции затем выпаривали до безводного состояния, применяя роторный испаритель и вакуумную печь при 40°С и 5 мбар с достижением постоянной массы.
Конечный анализ осуществили посредством SFC, применяя YMC AMY-C (4.6 мм × 250 мм, 5 мкм). Элюентом был МеОН/СО2 10%. Скорость потока составляла 4 мл/мин.
Изомер_1 (промежуточное соединение IX 46): Количество: 48.3 мг
rt=5.21 мин, Химическая чистота: 99.8%, Энантиомерный избыток: 100%
Изомер _2 (промежуточное соединение IX 47): Количество: 47.3 мг
rt=5.24 мин, Химическая чистота: 99.1%, Энантиомерный избыток: 99.4%
Синтез трет-бутил N-[(3R)-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-5-{[4-метокси-3-(трифторметил)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-48)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 40%.
LCMS: METCR1416 Generic 7 min, rt=4.42 мин, M/Z (ES+) 673.90 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 9.14 (d, J=11.3 Гц, 1H), 7.76 (d, J=8.4 Гц, 1Н), 7.70 (dd, J=7.3, 5.6 Гц, 1H), 7.60 (s, 1H), 7.51 (t, J=7.4 Гц, 2H), 7.15 (d, J=8.6 Гц, 1H), 5.15 (d, J=15.5 Гц, 1H), 4.91 (dd, J=15.5, 12.7 Гц, 1H), 4.39 (dtd, J=11.7, 7.7, 4.1 Гц, 1H), 4.08 (ddd, J=13.3, 7.4, 3.3 Гц, 1H), 3.85 (d, J=1.1 Гц, 3Н), 3.81-3.73 (m, 1H), 3.51 (s, 1H), 2.04-1.96 (m, 1H), 1.60 (d, J=5.3 Гц, 1H), 1.37 (s, 9H).
Синтез трет-бутил N-[(2R,3R)-5-[(4-хлорфенил)метил]-8-фтор-2-метил-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-49)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде бесцветного твердого вещества при выходе 97%.
LCMS: METCR1410 Generic 1.7 min, rt=1.34 мин, M/Z (ES+) 657.95/659.90 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.90 (d, J=6.0 Гц, 1H), 7.78 (d, J=9.9 Гц, 1Н), 7.23-7.16 (m, 4Н), 6.73 (dt, J=11.6, 5.7 Гц, 1Н), 5.61 (d, J=6.9 Гц, 1H), 5.07 (d, J=15.3 Гц, 1Н), 4.74 (d, J=15.3 Гц, 1H), 4.53 (t, J=6.8 Гц, 1Н), 3.96 (р, J=6.9 Гц, 1H), 3.48 (m, 2H), 2.18-2.05 (m, 2Н), 1.85 (dt, J=14.7, 7.2 Гц, 2H), 1.41 (d, J=7.0 Гц, 3Н), 1.33 (s, 9Н).
Синтез трет-бутил N-[(3R)-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-50)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде бесцветного твердого вещества при выходе 89%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 674 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.06 (d, J=8.1 Гц, 1Н), 8.03 (d, J=8.3 Гц, 2Н), 7.78-7.71 (m, 1H), 7.56-7.51 (m, 1H), 7.44 (d, J=8.2 Гц, 2H), 6.10 (t, J=5.7 Гц, 1H), 5.73 (d, J=7.3 Гц, 1H), 5.50 (d, J=15.4 Гц, 1H), 4.66 (d, J=15.4 Гц, 1H), 4.56 (dt, J=10.9, 7.1 Гц, 1H), 4.07 (dd, J=13.3, 7.0 Гц, 1H), 3.52 (dd, J=13.1, 11.2 Гц, 1H), 3.45 (q, J=6.8 Гц, 2H), 2.64 (s, 3H), 2.20-2.05 (m, 2H), 1.82 (p, J=7.4 Гц, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(2-метоксиэтил)карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-51)
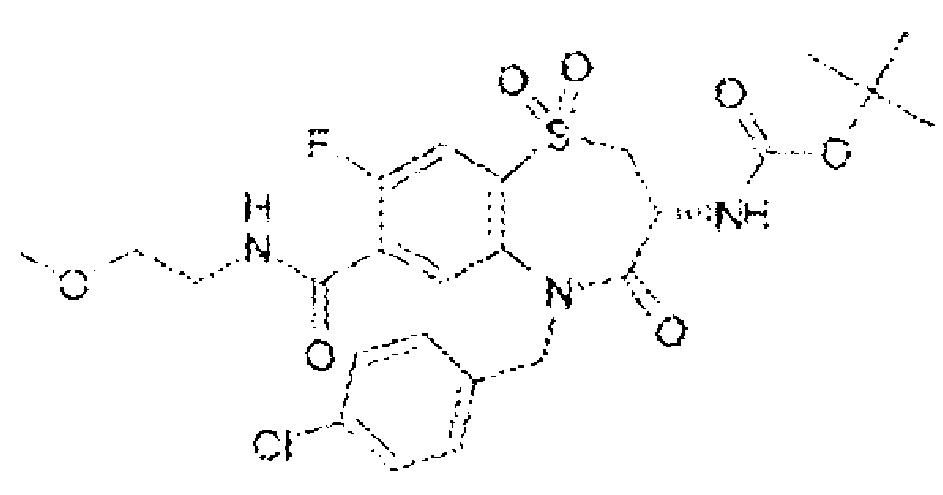
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1416 generic 7 min, rt=4.23 мин, M/Z (ES+) 591.95 [M+Na+], 513.95/515.95 [M-tBu+H] 100% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.71 (s, 1Н), 7.74 (d, J=8.5 Гц, 1H), 7.58 (d, J=5.5 Гц, 1H), 7.52 (d, J=8.0 Гц, 1H), 7.34 (s, 4H), 5.21 (d, J=16.1 Гц, 1H), 4.79 (d, J=16.0 Гц, 1H), 4.41 (dt, J=11.7, 7.7 Гц, 1H), 4.09 (dd, J=13.3, 7.4 Гц, 1H), 3.84-3.67 (m, 1H), 3.50-3.37 (m, 4H), 3.25 (s, 3H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(2,2-дифторциклопропил)карбамоил]-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-52)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде бесцветного масла при выходе 69%.
LCMS: METCR1410 Generic 1.7 min, rt=1.18 мин, M/Z (ES+) 640 [M+Na+] 78% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.10-8.00 (m, 2H), 8.00-7.95 (m, 1Н), 7.78-7.72 (m, 1Н), 7.61-7.53 (m, 2Н), 7.47-7.39 (m, 2Н), 6.33 (s, 1Н), 5.78 (m, 1Н), 5.50 (m, 1H), 4.66 (m, 1H), 4.56 (dt, J=11.0, 7.2 Гц, 1H), 4.05 (dd, J=13.3, 6.9 Гц, 1Н), 3.58-3.51 (m, 1H), 3.44 (m, 1H), 2.65 (s, 3H), 1.87 (m, 1H), 1.40 (s, 9H).
Синтез и хиральное разделение с образованием (1S,3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфснил)метил]-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1Н-1,5-бензотиазепин-1-ия-1-олата (Промежуточное соединение IX-53) и (1R,3R)-3-{[(трет-бутокси)карбонил]амино}-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1Н-1,5-бензотиазепин-1-ия-1-олата (Промежуточное соединение IX-54)

В раствор промежуточного соединения VIII-61 (100 мг, 0.17 ммоль) в DCM (4 мл) добавили 3-хлорбензол карбопероксовуюя кислоту (77%, 36 мг) в атмосфере азота при 0°С. Реакционную смесь перемешивали при 0°С в течение 1 ч. Реакционную смесь разбавили DCM, промыли 1 Н водным раствором NaOH, а затем соляным раствором. Органическую фазу высушили (Na2SO4), отфильтровали и концентрировали при пониженном давлении. Остаток очистили посредством обращеннофа-зовой препаративной ВЭЖХ с получением смеси диастерсоизомеров (61 мг, 55% выход), их часть (33 мг) отделили посредством хиральной SFC, применяя Lux С4 колонку (20 мм × 250 мм, 5 мкм). Элюентом был 25% МеОН/СО2. Скорость потока составляла 50 мл/мин с УФ обнаружением при длине волны 225 нм. Это дало Промежуточное соединение IX-53 (8 мг) и Промежуточное соединение IX-54 (4 мг). Стереохимия сульфоксида произвольно назначена.
Промежуточное соединение IX-53 (позднее элюируемый энантиомер):
LCMS: METCR1416 generic 7 min, rt=4.46 мин, M/Z (ES+) 627.90/630 [M+Na+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Метанол-d4) d 8.65 (s, 1Н), 7.87 (d, J=5.5 Гц, 1H), 7.53 (d, J=8.8 Гц, 1H), 7.32-7.22 (m, 411), 5.41 (d, J=14.9 Гц, 1H), 4.74 (d, J=14.9 Гц, 1H), 4.37 (dd, J=10.6, 8.4 Гц, 1H), 4.01 (t, J=11.2 Гц, 1H), 3.51 (q, J=6.6 Гц, 2H), 3.38-3.35 (m, 1H), 2.36-2.22 (m, 2H), 1.90 (dt, J=14.7, 7.0 Гц, 2H), 1.42 (s, 9H). NH невидимый по ЯМР
Промежуточное соединение IX-54 (ранее элюируемый энантиомер):
LCMS: METCR1416 generic 7 min, rt=4.36 мин, M/Z (ES+) 627.90/630 [M+Na+] 96% УФ
ЯМР данные: 1H ЯМР (500 МГц, Метаноле) δ 8.59 (s, 1H), 7.62 (d, J=8.6 Гц, 1H), 7.58 (d, J=5.8 Гц, 1H), 7.39 (d, J=8.3 Гц, 2H), 7.31 (q, J=7.2, 6.8 Гц, 3H), 5.36 (d, J=15.8 Гц, 1H), 4.64 (d, J=15.9 Гц, 1H), 4.61-4.55 (m, 1H), 3.93-3.83 (m, 1H), 3.44 (q, J=6.6 Гц, 2H), 3.37-3.34 (m, 1H), 2.30-2.17 (m, 2H), 1.91-1.79 (m, 2H), 1.44 (s, 9H). NH невидимый по ЯМР
Синтез трет-бутил N-[(3R)-5-[(4-цианофенил)метил]-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-55)
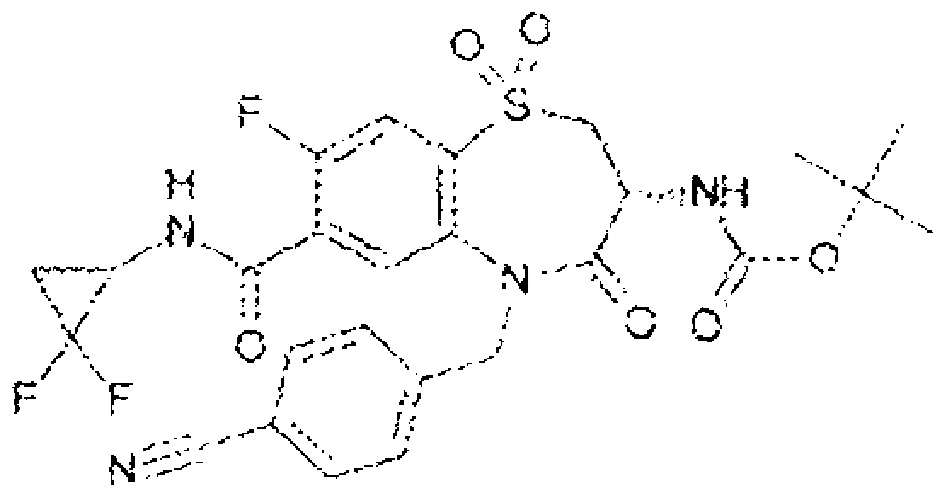
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 81%.
LCMS: METCR1410 Generic 1.7 min, rt=1.14 мин, M/Z (ES+) 522.95 [M-tBu+H] 99% УФ;
ЯМР данные: 1Н ЯМР (250 МГц, DMSO-d6) δ 9.19-9.07 (m, 1Н), 7.78 (d, J=8.5 Гц, 3Н), 7.64-7.58 (m, 1H), 7.59-7.47 (m, 3H), 5.28 (d, J=16.3 Гц, 1H), 5.04-4.82 (m, 1H), 4.56-4.30 (m, 1H), 4.22-3.96 (m, 1H), 3.90-3.68 (m, 1H), 3.57-3.40 (m, 1H), 2.10-1.90 (m, 1H), 1.73-1.52 (m, 1H), 1.42-1.26 (m, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-цианофенил)метил]-8-фтор-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-56)
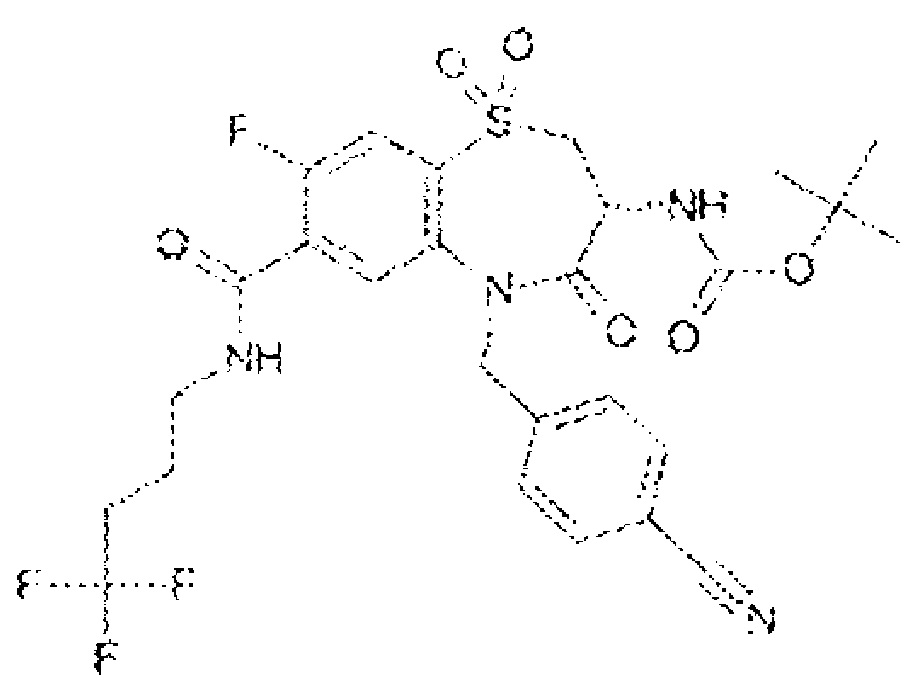
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1410 Generic 1.7 min, rt=1.27 мин, M/Z (ES+) 557 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.76 (t, J=5.6 Гц, 1Н), 7.80-7.74 (m, 3Н), 7.61 (d, J=5.5 Гц, 1H), 7.57-7.49 (m, 3H), 5.28 (d, J=16.6 Гц, 1H), 4.91 (d, J=16.5 Гц, 1H), 4.44 (dt, J=11.7, 7.7 Гц, 1H), 4.11 (dd, J=13.2, 7.3 Гц, 1H), 3.83-3.71 (m, 1H), 3.30-3.26 (m, 2H), 2.34-2.19 (m, 2H), 1.71 (dt, J=14.4, 6.8 Гц, 2H), 1.41-1.31 (m, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(4,4-дифторциклогексил)карбамоил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-57)
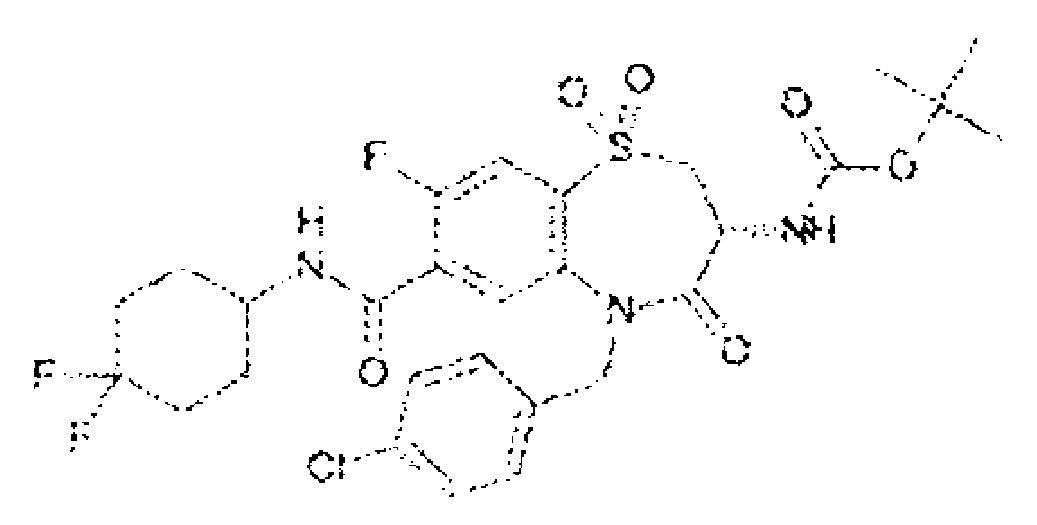
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 77%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 574/576 [M-tBu+H], 652.10/654.20 [M+Na+] 100% УФ; ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.65 (d, J=7.6 Гц, 1H), 7.74 (d, J=8.3 Гц, 1H), 7.57 (d, J=5.5 Гц, 1H), 7.53 (d, J=8.0 Гц, 1H), 7.34 (s, 4H), 5.21 (d, J=15.8 Гц, 1H), 4.81 (d, J=15.9 Гц, 1H), 4.40 (dt, J=11.7, 7.6 Гц, 1H), 4.10 (dd, J=13.3, 7.3 Гц, 1H), 4.00-3.92 (m, 1H), 3.82-3.71 (m, 1H), 2.06-1.80 (m, 6H), 1.60 (d, J=9.1 Гц, 2H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-{[2-(трифторметил)циклопронил]карбамоил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-58)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 50%.
LCMS: MET-uPLC-AB-101, rt=3.93 мин, M/Z (ES+) 620.1/622.1 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.02 (d, J=4.0 Гц, 1Н), 7.76 (d, J=8.5 Гц, 1H), 7.69 (d, J=5.3 Гц, 1H), 7.52 (d, J=8.0 Гц, 1H), 7.40-7.30 (m, 4H), 5.14 (d, J=15.9 Гц, 1H), 4.87 (dd, J=16.0, 3.8 Гц, 1H), 4.44-4.35 (m, 1H), 4.15-4.05 (m, 1H), 3.80-3.72 (m, 1H), 3.24-3.18 (m, 1H), 2.13-2.03 (m, 1H), 1.37 (s, 9H), 1.32-1.19 (m, 2H).
Синтез трет-бутил N-[(3R)-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-59)
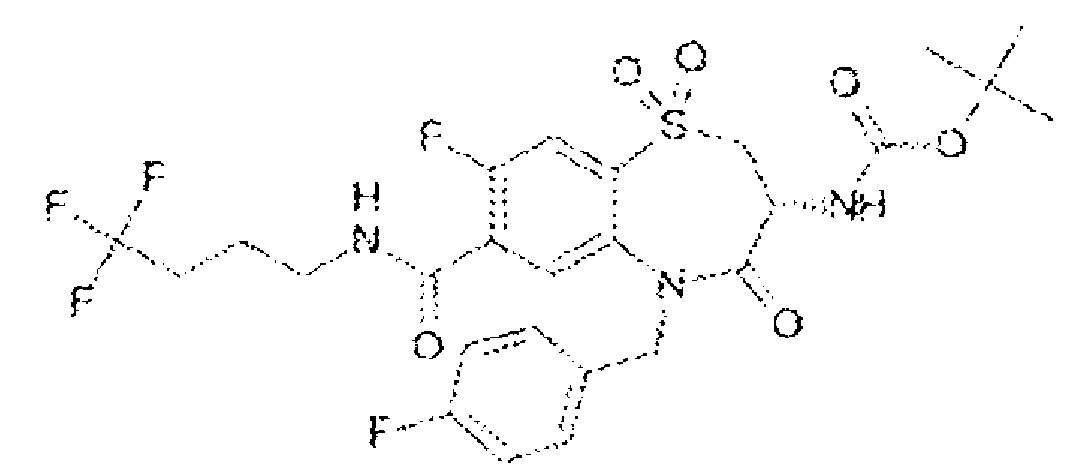
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 86%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 550.05 [M-tBu+H] 99% УФ;
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.97 (d, J=6.1 Гц, 1Н), 7.81 (d, J=10.0 Гц, 1Н), 7.37-7.23 (m, 2Н), 7.08-6.91 (m, 2Н), 6.77 (dt, J=11.7, 5.8 Гц, 1Н), 5.72 (d, J=7.1 Гц, 1H), 5.20 (d, J=15.0 Гц, 1Н), 4.81 (d, J=15.0 Гц, 1Н), 4.51 (dt, J=10.9, 7.0 Гц, 1H), 4.18-3.97 (m, 1H), 3.64-3.43 (m, 3H), 2.32-2.05 (m, 2H), 1.91 (p, J=7.1 Гц, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-60)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 89%.
LCMS: METCR1410 Generic 1.7 min, rt=1.16 мин, M/Z (ES+) 516.05 [M-tBu+H] 100% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.97 (dd, J=6.0, 3.4 Гц, 1Н), 7.81 (d, J=9.9 Гц, 1Н), 7.38-7.26 (m, 2Н), 7.00 (t, J=8.6 Гц, 2Н), 6.92 (d, J=13.0 Гц, 1Н), 5.73 (d, J=7.0 Гц, 1H), 5.21 (d, J=15.0 Гц, 1Н), 4.79 (dd, J=15.1, 1.6 Гц, 1H), 4.60-4.41 (m, 1Н), 4.07 (m, 1Н), 3.52 (dd, J=13.2, 11.1 Гц, 2Н), 1.93 (m, 1Н), 1.49 (dt, J=9.7, 4.6 Гц, 1Н), 1.40 (s, 9Н).
Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-61)
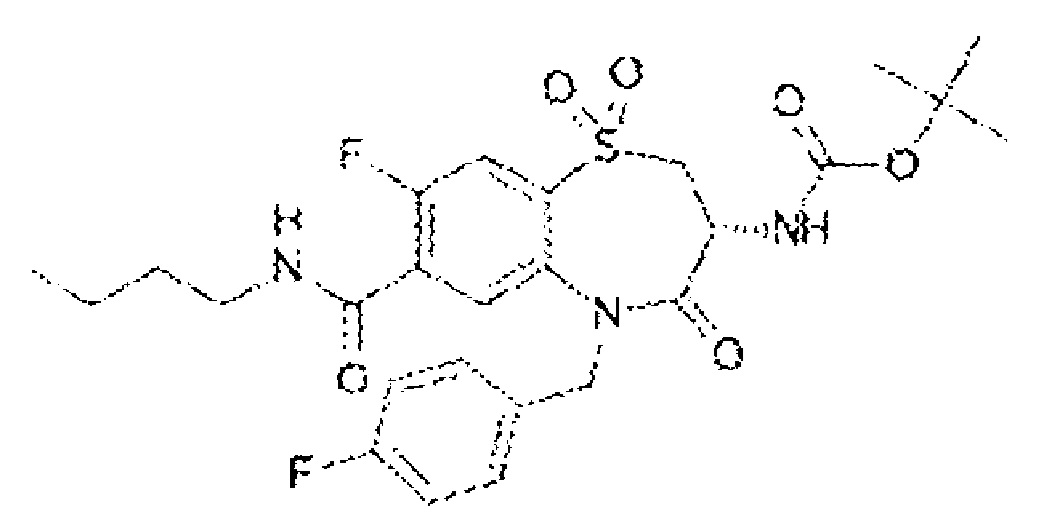
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 90%.
LCMS: METCR1410 Generic 1.7 min, rt=1.27 мин, M/Z (ES+) 496.05 [M-tBu+H] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.00 (d, J=6.1 Гц, 1Н), 7.79 (d, J=9.9 Гц, 1Н), 7.34-7.28 (m, 2Н), 7.03-6.96 (m, 2Н), 6.67 (dt, J=11.1, 5.3 Гц, 1H), 5.73 (d, J=7.1 Гц, 1H), 5.18 (d, J=15.1 Гц, 1H), 4.81 (d, J=15.1 Гц, 1H), 4.50 (dt, J=10.9, 7.0 Гц, 1H), 4.08 (dd, J=13.3, 6.9 Гц, 1H), 3.55-3.41 (m, 3H), 1.64-1.57 (m, 2H), 1.45-1.37 (m, 11H), 0.96 (t, J=7.4 Гц, 3H).
Синтез трет-бутил N-[(3R)-7-(бензилкарбамоил)-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-62)
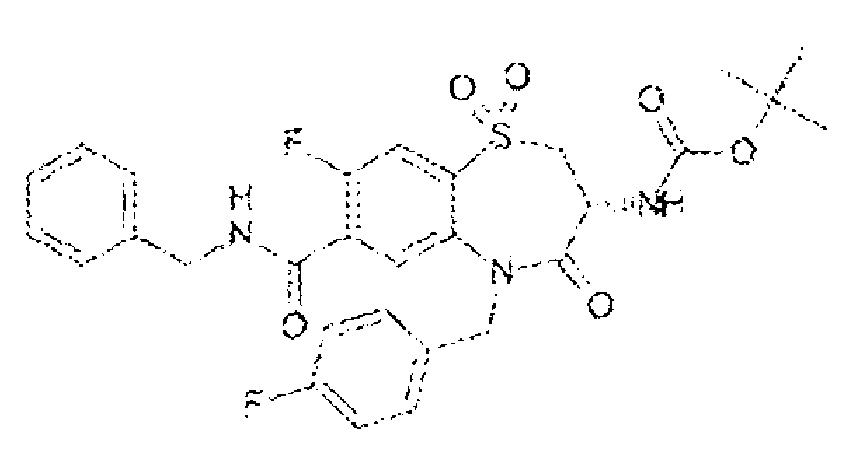
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 77%.
LCMS: METCR1410 Generic 1.7 min, rt=1.28 мин, M/Z (ES+) 530.05 [M-tBu+H] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.02 (d, J=6.1 Гц, 1H), 7.79 (d, J=9.8 Гц, 1H), 7.42-7.34 (m, 2H), 7.35-7.27 (m, 5H), 7.04-6.95 (m, 3H), 5.73 (d, J=7.1 Гц, 1H), 5.18 (d, J=15.1 Гц, 1H), 4.83 (d, J=15.1 Гц, 1H), 4.74-4.60 (m, 2H), 4.51 (dt, J=10.9, 7.0 Гц, 1H), 4.07 (dd, J=13.4, 6.9 Гц, 1H), 3.51 (dd, J=13.3, 11.1 Гц, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[2-(оксан-4-ил)этил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-63)
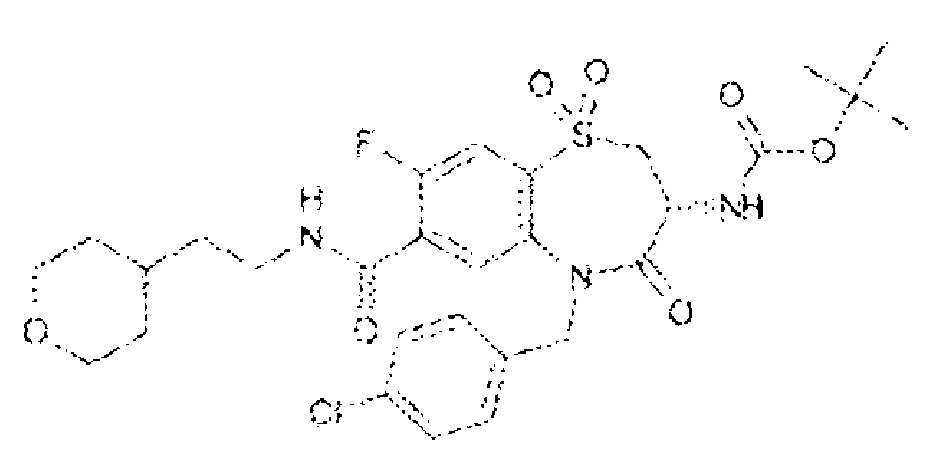
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 59%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 524.10/526.10 [М-Вос+Н] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.64 (t, J=5.5 Гц, 1Н), 7.74 (d, J=8.4 Гц, 1H), 7.56 (d, J=5.5 Гц, 1Н), 7.53 (d, J=8.1 Гц, 1H), 7.34 (s, 4Н), 5.21 (d, J=16.1 Гц, 1Н), 4.80 (d, J=16.0 Гц, 1Н), 4.42 (dt, J=11.7, 7.7 Гц, 1H), 4.13-4.08 (m, 1H), 3.86-3.73 (m, 3Н), 3.29-3.20 (m, 4Н), 1.58 (d, J=13.9 Гц, 2Н), 1.53-1.47 (m, 1H), 1.43 (q, J=6.8 Гц, 2Н), 1.37 (s, 9H), 1.20-1.10 (m, 2Н).
Синтез трет-бутил N-[(3R)-5-бензил-8-фтор-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-64)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде смолы бледно желтого цвета с выходом 91%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 532.05 [M-tBu+H], 610.15 [M+Na+] 98% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.73 (t, J=5.6 Гц, 1H), 7.76 (d, J=8.5 Гц, 1H), 7.56-7.50 (m, 2H), 7.35-7.24 (m, 5H), 5.29 (d, J=16.1 Гц, 1H), 4.70 (d, J=16.0 Гц, 1H), 4.44 (dt, J=11.7, 7.8 Гц, 1H), 4.11 (dd, J=8.7, 4.6 Гц, 1H), 3.83-3.74 (m, 1H), 3.32-3.27 (m, 2H), 2.34-2.18 (m, 2H), 1.70 (dt, J=14.8, 7.0 Гц, 2H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[(4-метоксифенил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-65)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 46%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 654.15/656.20 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.03 (d, J=6.0 Гц, 1H), 7.78 (d, J=9.8 Гц, 1H), 7.31-7.23 (m, 6H), 6.94-6.87 (m, 3H), 5.71 (d, J=7.1 Гц, 1H), 5.16 (d, J=15.2 Гц, 1H), 4.84 (d, J=15.2 Гц, 1H), 4.64-4.54 (m, 2H), 4.51 (dt, J=10.9, 7.0 Гц, 1H), 4.07 (dd, J=13.4, 6.9 Гц, 1H), 3.81 (s, 3H), 3.51 (dd, J=13.3, 11.1 Гц, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-7-{[(4-фторфенил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-66)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества коричнево-желтого цвета при выходе 64%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 634.25 [М+Н+] 97.9% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 8.40 (d, J=5.9 Гц, 1Н), 7.79 (d, J=9.5 Гц, 1Н), 7.42-7.29 (m, 2Н), 7.15-6.92 (m, 3Н), 5.65 (d, J=7.0 Гц, 1Н), 5.45 (d, J=15.4 Гц, 1Н), 5.02 (d, J=15.4 Гц, 1Н), 4.64 (d, J=5.5 Гц, 2Н), 4.49 (dt, J=10.9, 7.1 Гц, 1Н), 4.09 (dd, J=14.2, 7.1 Гц, 1H), 3.55-3.40 (m, 1H), 2.38 (td, J=8.2, 4.1 Гц, 1Н), 1.39 (s, 9Н), 1.25-1.18 (m, 2Н), 1.18-1.11 (m, 2Н).
Синтез трет-бутил N-[(3R)-8-фтор-5-[(4-фторфенил)метил]-7-{[(оксан-4-ил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-67)
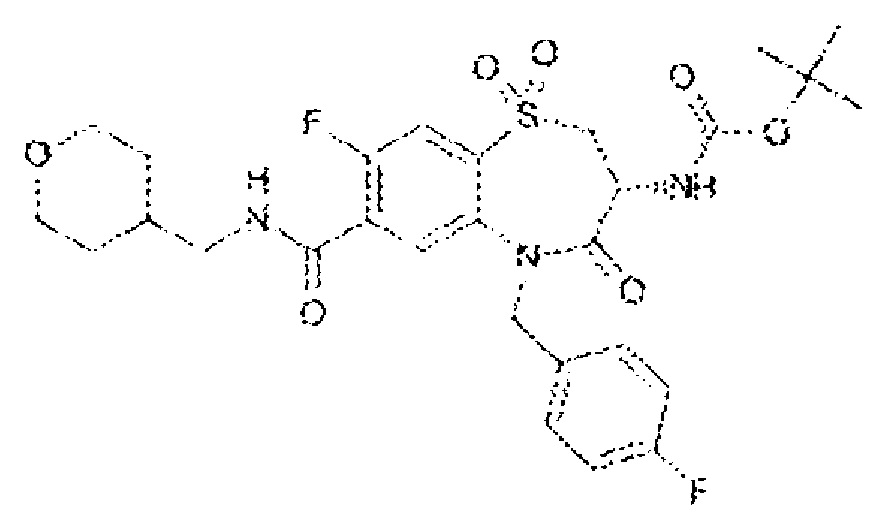
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 100%.
LCMS: METCR1410 Generic 1.7 min, rt=1.12 мин, M/Z (ES+) 616 [M+Na+] 100% УФ;
ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 7.97 (d, J=6.1 Гц, 1H), 7.80 (d, J=9.9 Гц, 1Н), 7.36-7.27 (m, 2H), 7.04-6.95 (m, 2H), 6.82-6.66 (m, 1H), 5.72 (d, J=7.1 Гц, 1H), 5.19 (d, J=15.0 Гц, 1H), 4.81 (d, J=15.0 Гц, 1H), 4.58-4.42 (m, 1H), 4.17-3.93 (m, 3H), 3.58-3.45 (m, 1H), 3.45-3.26 (m, 4H), 1.98-1.78 (m, 1H), 1.72-1.61 (m, 2H), 1.47-1.33 (m, 11H).
Синтез трет-бутил N-[(3R)-7-[(3,3-дифторциклобутил)карбамоил]-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-68)
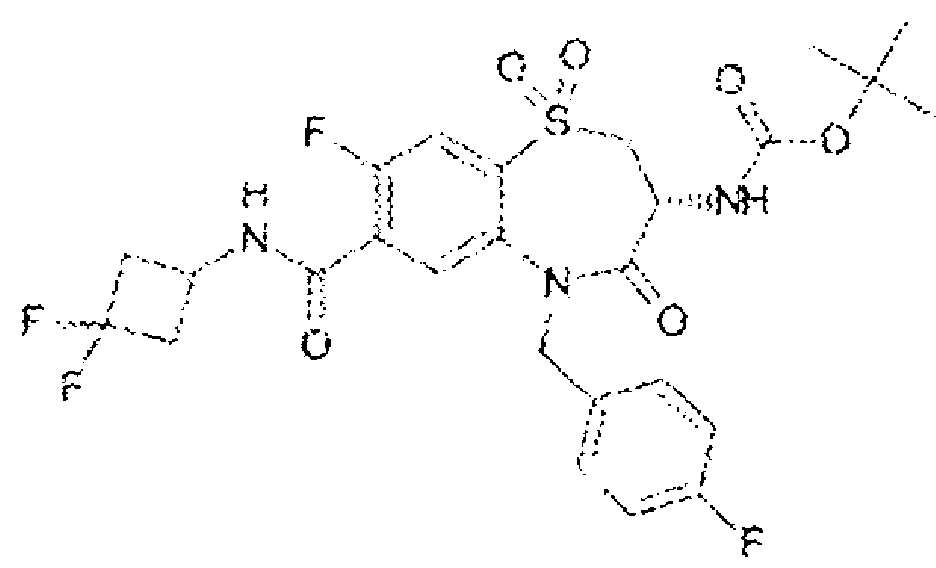
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 83%.
LCMS: METCR1410 Generic 1.7 min, rt=1.2 мин, M/Z (ES+) 608 [M+Na+] 100% УФ;
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.96 (d, J=6.1 Гц, 1H), 7.82 (d, J=10.0 Гц, 1H), 7.35-7.27 (m, 2Н), 7.05-6.95 (m, 2H), 6.94-6.81 (m, 1H), 5.71 (d, J=7.1 Гц, 1H), 5.19 (d, J=15.1 Гц, 1H), 4.82 (d, J=15.1 Гц, 1H), 4.59-4.36 (m, 2H), 4.17-4.01 (m, 1H), 3.52 (dd, J=13.2, 11.1 Гц, 1H), 3.24-2.99 (m, 2H), 2.75-2.47 (m, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-8-фтор-5-[(4-метоксифенил)метил]-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-69)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 640.2 [M+Na+] 99% УФ;
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.73 (t, J=5.6 Гц, 1H), 7.73 (d, J=8.5 Гц, 1H), 7.61 (d, J=5.5 Гц, 1H), 7.49 (d, J=8.2 Гц, 1H), 7.22 (d, J=8.6 Гц, 2H), 6.81 (d, J=8.6 Гц, 2H), 5.15 (d, J=15.5 Гц, 1H), 4.73 (d, J=15.5 Гц, 1H), 4.38 (dt, J=11.6, 7.8 Гц, 1H), 4.10-4.00 (m, 1H), 3.79-3.73 (m, 1H), 3.71 (s, 3H), 2.34-2.19 (m, 2H), 1.71 (dt, J=14.6, 7.0 Гц, 2H), 1.37 (s, 9H). [2H под пиком воды]
Синтез трет-бутил N-[(3R)-8-фтор-5-[(4-метоксифенил)метил]-7-{[(оксан-4-ил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-70)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 89%.
LCMS: METCR1410 Generic 1.7 min, rt=1.11 мин, M/Z (ES+) 628.2 [M+Na+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.66 (t, J=5.7 Гц, 1H), 7.72 (d, J=8.4 Гц, 1H), 7.50 (dd, J=10.5, 6.9 Гц, 2H), 7.23 (d, J=8.6 Гц, 2H), 6.82 (d, J=8.6 Гц, 2H), 5.21 (d, J=15.6 Гц, 1H), 4.64 (d, J=15.5 Гц, 1H), 4.39 (dt, J=11.6, 7.8 Гц, 1H), 4.08 (dd, J=13.2, 7.3 Гц, 1H), 3.87-3.80 (m, 2H), 3.80-3.73 (m, 1H), 3.72 (s, 3H), 3.25 (t, J=11.2 Гц, 2H), 3.17-3.07 (m, J=6.4 Гц, 2H), 1.77-1.66 (m, 1H), 1.52 (d, J=13.2 Гц, 2H), 1.37 (s, 9H), 1.22-1.11 (m, 2H).
Синтез трет-бутил N-[(3R)-7-[(2,2-дифторциклопропил)карбамоил]-8-фтор-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-71)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 75%.
LCMS: METCR1410 Generic 1.7 min, rt=1.16 мин, M/Z (ES+) 606.2 [M+Na+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.11 (d, J=9.6 Гц, 1Н), 7.74 (d, J=8.4 Гц, 1H), 7.60 (d, J=5.4 Гц, 1H), 7.49 (d, J=7.9 Гц, 1H), 7.25-7.16 (m, 2H), 6.82 (dd, J=8.8, 2.4 Гц, 2H), 5.16 (dd, J=15.5, 2.3 Гц, 1H), 4.72 (dd, J=15.5, 9.8 Гц, 1H), 4.38 (dtd, J=11.5, 7.8, 3.7 Гц, 1H), 4.08 (dq, J=9.6, 3.6 Гц, 1H), 3.79-3.73 (m, 1H), 3.72 (s, 3H), 2.05-1.93 (m, 1H), 1.65-1.54 (m, 1H), 1.37 (s, 9H), 1.30-1.22 (m, 1H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-[(оксан-4-ил)карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-72)
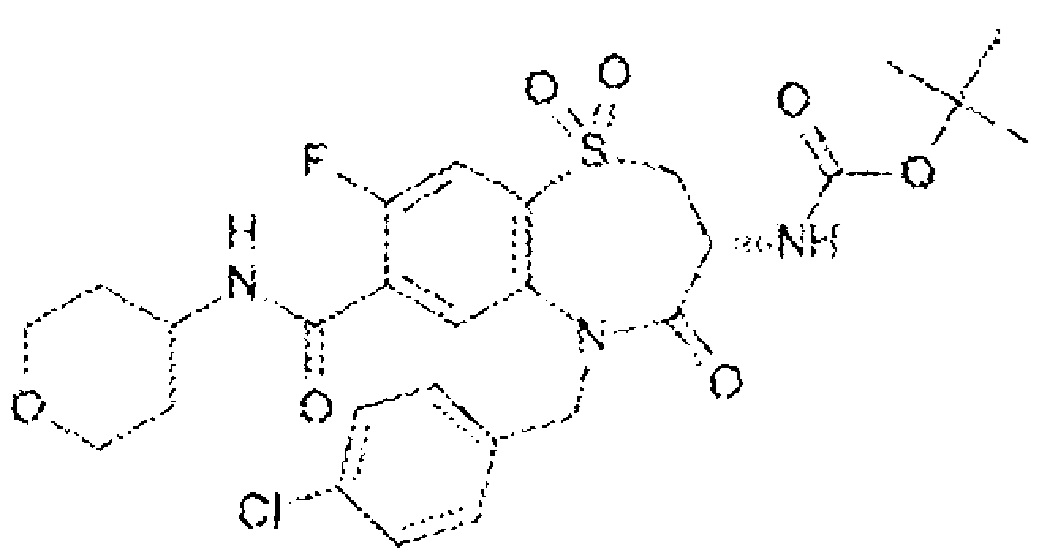
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде белого кристаллического твердого вещества при выходе 72%.
LCMS: METCR1410 Generic 1.7 min, rt=1.15 мин, M/Z (ES+) 618.20/620.25 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.91 (d, J=6.1 Гц, 1Н), 7.74 (d, J=9.9 Гц, 1Н), 7.21 (s, 3Н), 6.47 (d, J=11.9 Гц, 1Н), 5.63 (d, J=7.1 Гц, 1Н), 5.13 (d, J=15.2 Гц, 1H), 4.73 (d, J=15.2 Гц, 1Н), 4.42(s, 1Н), 4.02-3.87 (m, 3Н), 3.46 (t, J=10.4 Гц, 3H), 1.92 (s, 2Н), 1.57 (d, J=7.9 Гц, 2H), 1.33 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-[(3,3-дифторциклобутил)карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-73)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 94%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 606.20/608.30 [M+Na+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.09 (d, J=8.1 Гц, 1Н), 7.76 (d, J=8.1 Гц, 1Н), 7.53 (d, J=1.3 Гц, 1Н), 7.33-7.27 (m, 4Н), 6.18 (d, J=6.3 Гц, 1Н), 5.69 (d, J=7.3 Гц, 1Н), 5.41-4.59 (m, 2Н), 4.52 (dt, J=10.8, 7.1 Гц, 1H), 4.42 (d, J=2.0 Гц, 1H), 4.06 (dd, J=13.3, 6.9 Гц, 1Н), 3.52 (dd, J=13.2, 11.1 Гц, 1H), 3.16-3.04 (m, 2H), 2.55 (qd, J=13.0, 6.5 Гц, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1S)-3,3-дифторциклопентил]карбамоил}-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-74)
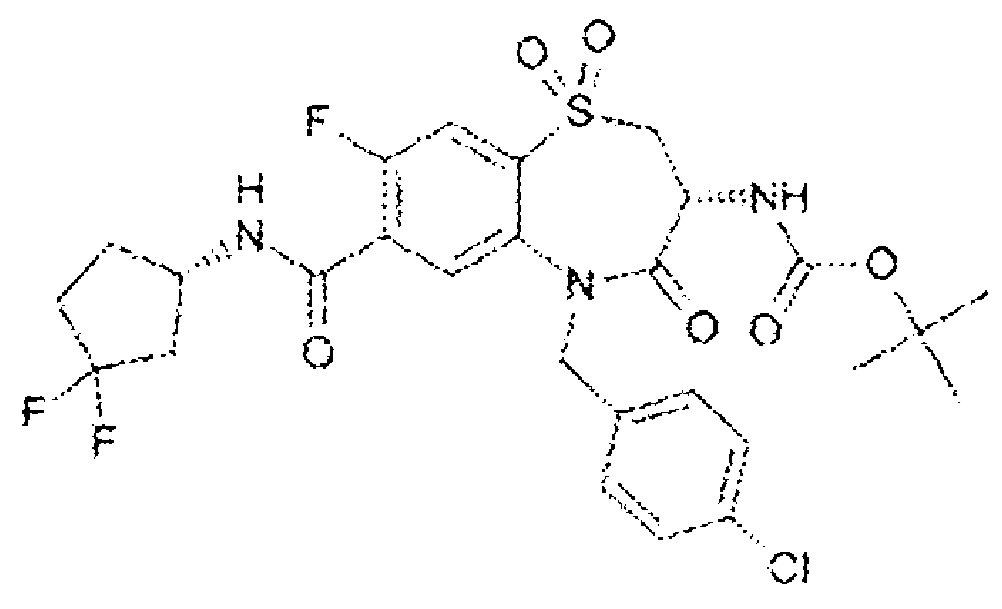
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 96%.
LCMS: METCR1410 Generic 1.7 min, rt=1.25 мин, M/Z (ES+) 560.15/ 562.15 [М-tBu+H] 99% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.97 (d, J=6.1 Гц, 1Н), 7.81 (d, J=9.9 Гц, 1Н), 7.36-7.24 (m, 4Н), 6.80 (dd, J=12.1, 7.1 Гц, 1H), 5.70 (d, J=6.8 Гц, 1Н), 5.19 (d, J=15.1 Гц, 1H), 4.81 (d, J=15.2 Гц, 1Н), 4.70-4.57 (m, 1H), 4.51 (dt, J=10.6, 6.9 Гц, 1Н), 4.08 (dt, J=11.2, 4.3 Гц, 1H), 3.62-3.43 (m, 1Н), 2.73-2.46 (m, 1Н), 2.46-2.24 (m, 2Н), 2.24-2.05 (m, 2Н), 1.94-1.75 (m, 1Н), 1.40 (s, 9Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R,2S)-2-фторциклопропил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-75)
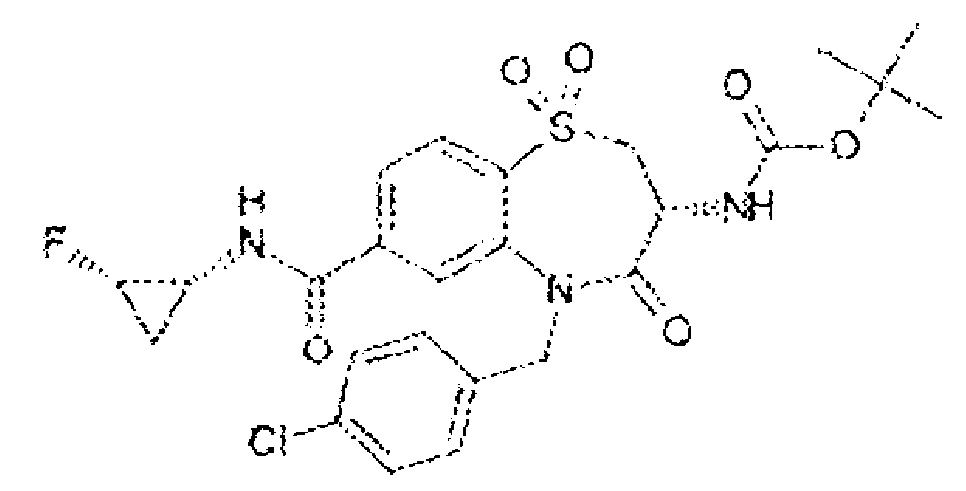
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 41%.
LCMS: METCR1410 Generic 1.7 min, rt=1.15 мин, M/Z (ES+) 574/576 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 8.09 (d, J=8.1 Гц, 1H), 7.77 (dd, J=8.1, 1.6 Гц, 1Н), 7.57 (d, J=1.5 Гц, 1Н), 7.29 (d, J=2.4 Гц, 4Н), 6.13 (s, 1H), 5.70 (d, J=7.0 Гц, 1Н), 5.38 (d, J=15.2 Гц, 1Н), 4.97-4.87 (m, 1H), 4.70-4.40 (m, 3Н), 4.13-4.01 (m, 1H), 3.51 (dd, J=13.3, 11.0 Гц, 1Н), 3.03 (dd, J=8.5, 4.9 Гц, 1Н), 1.40 (s, 9H), 1.10-0.92 (m, 1H).
Синтез трет-бутил N-[(3R)-7-[(3,3-дифторциклобутил)карбамоил]-5-[(2-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-76)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 33%.
LCMS: METCR1410 Generic 1.7 min, rt=1.17 мин, M/Z (ES+) 590 [M+Na+] 99% УФ
ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 8.02 (d, J=8.1 Гц, 1H), 7.74 (d, J=8.1 Гц, 1H), 7.55 (s, 1H), 7.43 (t, J=6.8 Гц, 1H), 7.31-7.21 (m, 1H), 7.12-6.89 (m, 2H), 6.14 (d, J=6.5 Гц, 1H), 5.62 (d, J=6.8 Гц, 1H), 5.29 (d, J=15.3 Гц, 1H), 4.80 (d, J=15.1 Гц, 1H), 4.58-4.27 (m, 2H), 4.02 (m, 1H), 3.43 (dd, J=13.2, 10.9 Гц, 1H), 3.20-2.90 (m, 2H), 2.64-2.31 (m, 2H), 1.33 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(3,3-дифторциклобутил)карбамоил]-5-[(3-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-77)
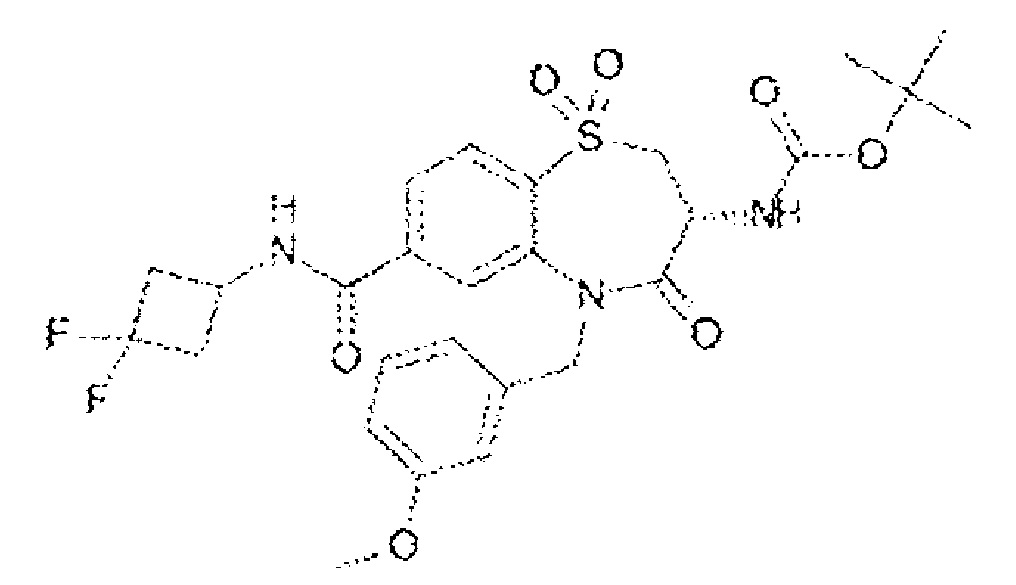
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 40%.
LCMS: METCR1410 Generic 1.7 min, rt=1.17 мин, M/Z (ES+) 602 [M+Na+] 98% УФ
ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 8.03 (d, J=8.1 Гц, 1Н), 7.75 (d, J=9.6 Гц, 1H), 7.28-7.20 (m, 1Н и 0.5 Н), 6.96-6.69 (m, 3H), 5.77 (dd, J=59.6, 6.7 Гц, 1H и 0.5Н), 5.57-5.34 (m, 1Н), 4.57-4.23 (m, 3Н), 4.14-3.97 (m, 2Н), 3.72 (s, 3Н), 3.58-3.38 (m, 1Н), 3.01 (s, 2Н), 2.60-2.26 (m, 2Н), 1.34 (s, 9Н).
Синтез трет-бутил N-[(3R)-5-[(4-метоксифенил)метил]-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-78)
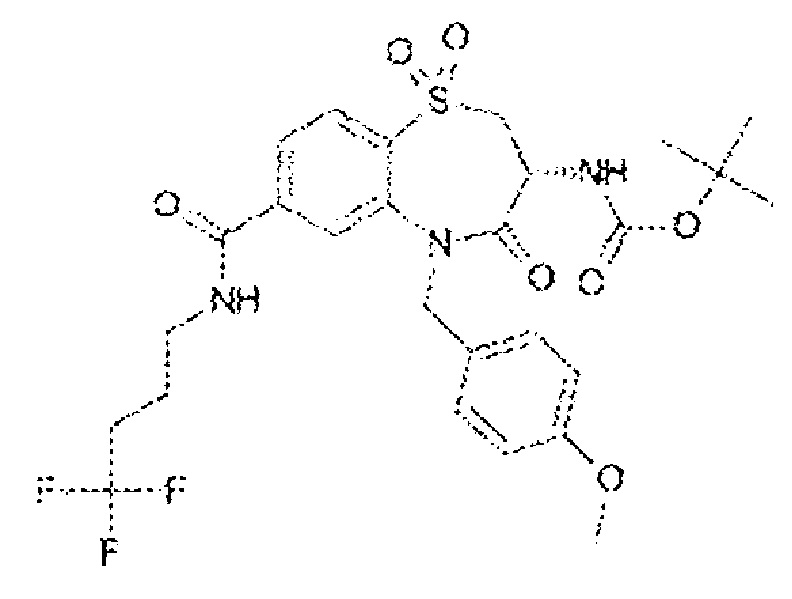
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 45%.
LCMS: METCR1410 Generic 1.7 min, rt=1.19 мин, M/Z (ES+) 622.15 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.05 (d, J=8.1 Гц, 1H), 7.77 (dd, J=8.1, 1.2 Гц, 1Н), 7.40 (s, 1H), 7.25 (d, J=8.7 Гц, 2Н), 6.86 (d, J=8.7 Гц, 2Н), 6.02 (t, J=5.5 Гц, 1H), 5.75 (d, J=7.2 Гц, 1H), 5.44 (d, J=14.9 Гц, 1Н), 4.54-4.45 (m, 2Н), 4.05 (dd, J=13.3, 6.9 Гц, 1H), 3.78 (s, 3Н), 3.56-3.44 (m, 3Н), 2.22-2.10 (m, 2Н), 1.86 (dt, J=14.8, 7.2 Гц, 2Н), 1.40 (s, 9Н).
Синтез трет-бутил N-[(3R)-5-[(4-метоксифенил)метил]-7-{[(4-метоксифенил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-79)
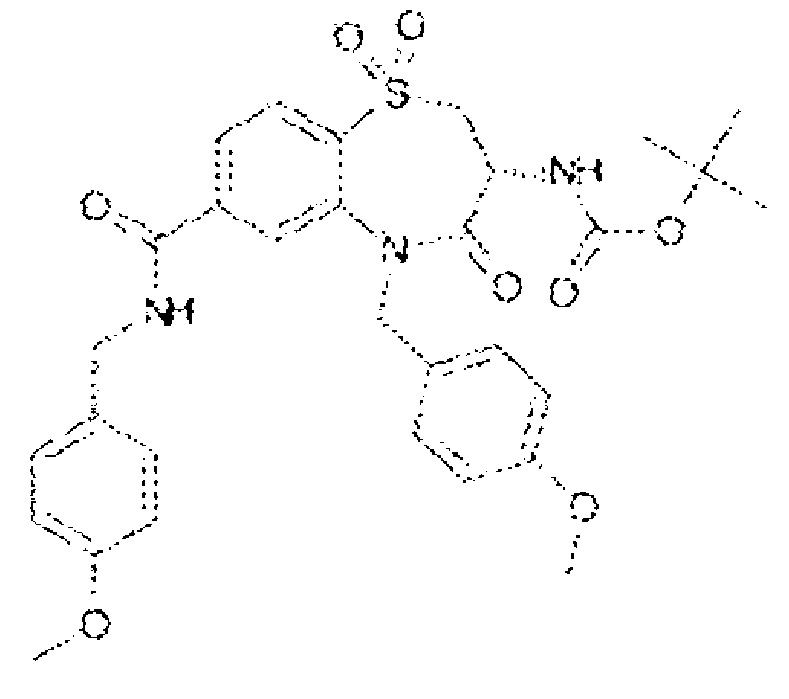
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 71%.
LCMS: METCR1410 Generic 1.7 min, rt=1.19 мин, M/Z (ES+) 632.2 [M+Na+], 554.1 [M-tBu+H] 100% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=8.1 Гц, 1Н), 7.78 (dd, J=8.1, 1.2 Гц, 1H), 7.52-7.46 (m, 1H), 7.25-7.20 (m, 4H), 6.94-6.87 (m, 2H), 6.82-6.76 (m, 2H), 6.14 (t, J=5.1 Гц, 1H), 5.74 (d, J=7.2 Гц, 1H), 5.39 (d, J=14.9 Гц, 1H), 4.58-4.42 (m, 4H), 4.04 (dd, J=13.3, 6.9 Гц, 1H), 3.82 (s, 3H), 3.74 (s, 3H), 3.49 (dd, J=13.2, 11.1 Гц, 1H), 1.39 (s, 9H).
Синтез трет-бутил N-[(3R)-5-бензил-7-{[(4-метоксифенил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-80)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 75%.
LCMS: METCR1410 Generic 1.7 min, rt=1.19 мин, M/Z (ES+) 602.2 [M+Na+] 96% УФ
ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 8.07 (d, J=8.1 Гц, 1Н), 7.81 (dd, J=8.1, 1.5 Гц, 1H), 7.36-7.17 (m, 8Н), 6.95-6.87 (m, 2Н), 5.99-5.89 (m, 1Н), 5.73 (d, J=6.9 Гц, 1H), 5.57 (d, J=15.0 Гц, 1H), 4.58-4.38 (m, 4H), 4.09-4.00 (m, 1H), 3.83 (s, 3H), 3.50 (dd, J=13.3, 11.0 Гц, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(4-метоксифенил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-81)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 97%.
LCMS: METCR1416 generic 7 min, rt=1.23 мин, M/Z (ES+) 558.05/560.10 [M-tBu+H] 98% УФ
ЯМР данные: 1Н ЯМР (250 МГц, DMSO-d6) δ 9.28 (t, J=6.0 Гц, 1Н), 7.99 (s, 2Н), 7.84 (s, 1Н), 7.51 (d, J=7.9 Гц, 1Н), 7.34 (s, 4Н), 7.21 (d, J=8.6 Гц, 2Н), 6.89 (d, J=8.6 Гц, 2Н), 5.21 (d, J=16.2 Гц, 1Н), 4.84 (d, J=15.8 Гц, 1Н), 4.40 (d, J=5.8 Гц, 3Н), 4.18-3.96 (m, 2Н), 3.73 (s, 3Н), 1.36 (s, 9Н).
Синтез трет-бутил N-[(3R)-7-[(4,4-дифторциклогексил)карбамоил]-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-82)
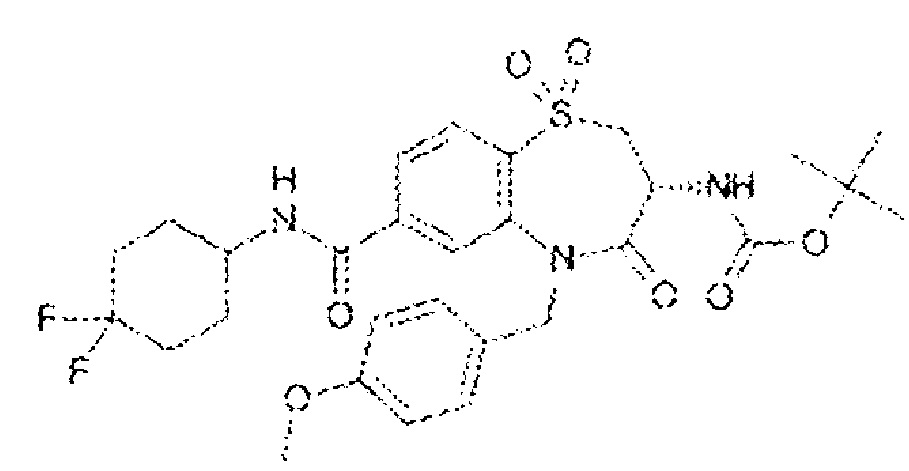
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 42%.
LCMS: METCR1410 Generic 1.7 min, rt=1.2 мин, M/Z (ES+) 552.15 [M-tBu+H] 630.20 [M+Na+] 96% УФ; ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.59 (d, J=7.6 Гц, 1H), 7.95 (q, J=9.5, 8.8 Гц, 2H), 7.81 (s, 1H), 7.50 (d, J=8.2 Гц, 1H), 7.24 (d, J=8.6 Гц, 2H), 6.82 (d, J=8.7 Гц, 2H), 5.18 (d, J=15.4 Гц, 1H), 4.76 (d, J=15.6 Гц, 1H), 4.35 (dt, J=11.8, 7.7 Гц, 1H), 4.10-4.01 (m, 1H), 3.98 (s, 1H), 3.77-3.74 (m, 1H), 3.72 (s, 3H), 2.05 (s, 3H), 1.96-1.84 (m, 3H), 1.63 (d, J=11.2 Гц, 2H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-7-[(3,3,3-трифторпропил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-83)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 47%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 534/536 [M-tBu+H], 612.10/614.10 [M+Na+] 100% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.03 (t, J=5.6 Гц, 1H), 8.02 (d, J=8.2 Гц, 1H), 7.97-7.92 (m, 1H), 7.81 (s, 1H), 7.53 (d, J=8.1 Гц, 1H), 7.40-7.31 (m, 4H), 5.21 (d, J=16.0 Гц, 1H), 4.85 (d, J=16.1 Гц, 1H), 4.38 (dt, J=11.8, 7.7 Гц, 1H), 4.14-4.04 (m, 1H), 3.80-3.69 (m, 1H), 3.54-3.48 (m, 2H), 2.59-2.53 (m, 2H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-7-{[(3R)-оксолан-3-ил]карбамоил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-84)
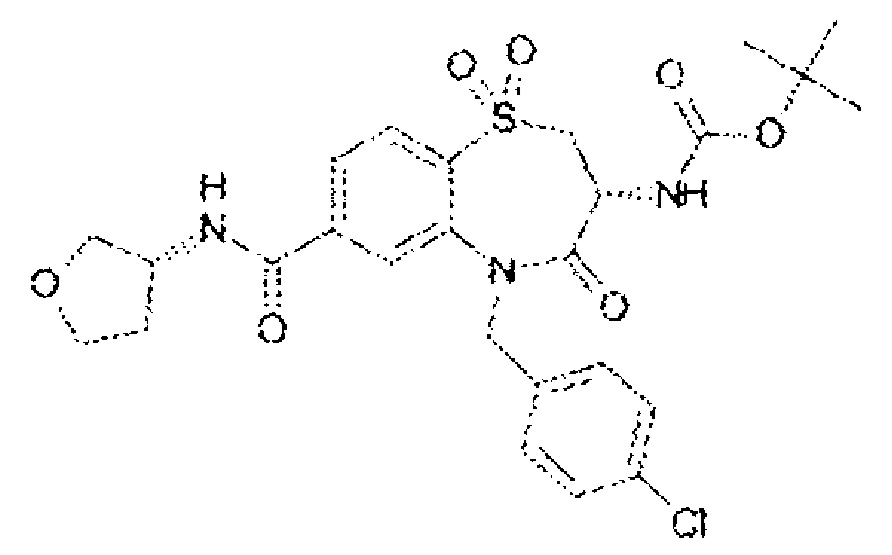
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 95%.
LCMS: METCR1410 Generic 1.7 min, rt=1.12 мин, M/Z (ES+) 508.05/510.10 [М-tBu+H], 586.15/588.15 [M+Na+] 95.2% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 7.75 (d, J=8.0 Гц, 1H), 7.46 (dd, J=8.1, 1.4 Гц, 1Н), 6.99 (dd, J=18.7, 9.1 Гц, 5Н), 6.00 (s, 1H), 5.42 (d, J=7.2 Гц, 1H), 5.06 (d, J=15.2 Гц, 1H), 4.40-4.35 (m, 1H), 4.33 (d, J=15.3 Гц, 1H), 4.22 (dt, J=10.8, 7.2 Гц, 1Н), 3.72 (m, 2H), 3.53 (m, 2Н), 3.45 (d, J=9.7 Гц, 1Н), 3.21 (dd, J=13.2, 11.1 Гц, 1H), 2.06 (m, 1Н), 1.57 (m, 1H), 1.09 (s, 9Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-7-{[(оксолан-3-ил)метил]карбамоил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-85)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 79%.
LCMS: METCR1410 Generic 1.7 min, rt=1.12 мин, M/Z (ES+) 522.05/524.15 [М-tBu+H], 600.15/602.20 [M+Na+] 84% УФ; ЯМР данные: 1Н ЯМР (250 МГц, DMSO-d6) δ 8.89 (t, J=6.2 Гц, 1Н), 8.04-7.90 (m, 2H), 7.75 (d, J=14.1 Гц, 1H), 7.52 (d, J=7.9 Гц, 1H), 7.34 (s, 4H), 5.22 (d, J=16.2 Гц, 1H), 4.83 (d, J=15.9 Гц, 1H), 4.49-4.28 (m, 1H), 4.19-3.97 (m, 2H), 3.89 (d, J=8.1 Гц, 1H), 3.81-3.54 (m, 5H), 3.52-3.37 (m, 1H), 1.97-1.82 (m, 1H), 1.71-1.47 (m, 1H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R)-2,2-дифторциклопронил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-86)
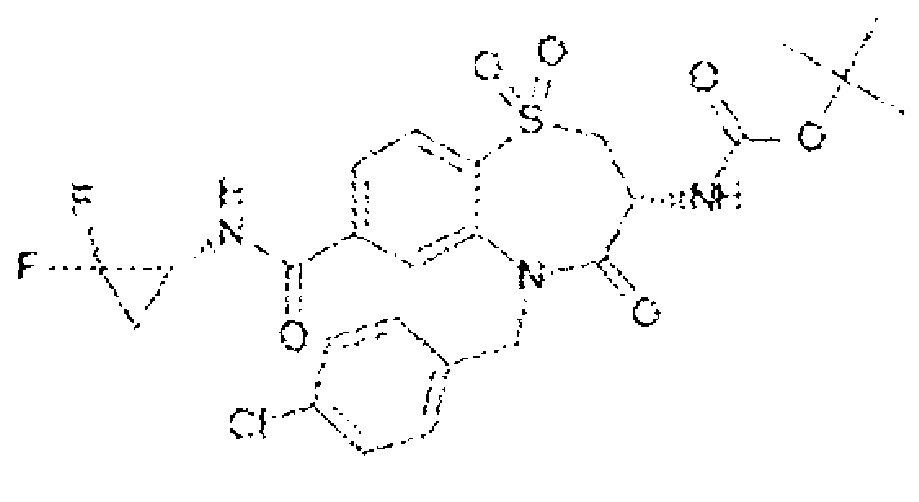
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 75%.
LCMS: METCR1410 Generic 1.7 min, rt=1.18 мин, M/Z (ES+) 514/516 [M-tBu+H], 592.10/594.15 [M+Na+] 97% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.10 (d, J=8.1 Гц, 1H), 7.76 (dd, J=8.1, 1.4 Гц, 1Н), 7.56 (d, J=1.5 Гц, 1H), 7.33-7.29 (m, 2H), 7.29-7.26 (m, 2H), 6.20 (s, 1H), 5.69 (d, J=7.3 Гц, 1H), 5.37 (d, J=15.3 Гц, 1H), 4.65 (d, J=15.2 Гц, 1H), 4.52 (dt, J=10.8, 7.1 Гц, 1H), 4.07 (dd, J=13.3, 6.9 Гц, 1H), 3.56-3.47 (m, 2H), 1.94 (m, 1H), 1.50-1.42 (m, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-циклопропилфенил)метил]-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-87)
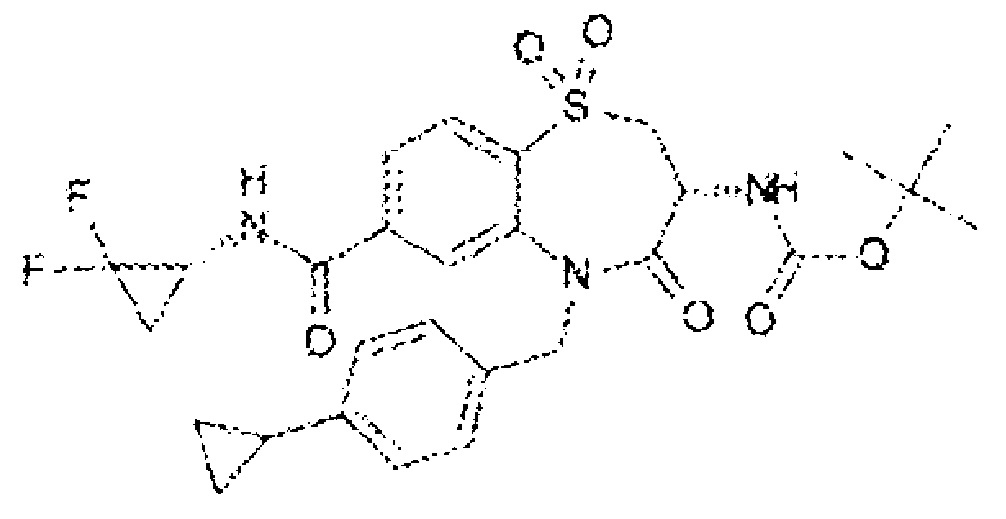
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 76%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 598.2 [M+Na+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.14 (s, 1Н), 8.04-7.98 (m, 1H), 7.97-7.92 (m, 1H), 7.80 (s, 1H), 7.50 (d, J=8.2 Гц, 1H), 7.19 (d, J=8.0 Гц, 2H), 6.98 (d, J=8.1 Гц, 2H), 5.21 (d, J=16.0 Гц, 1H), 4.72 (d, J=15.8 Гц, 1H), 4.38 (dt, J=11.7, 7.8 Гц, 1H), 4.07 (dd, J=12.1, 6.2 Гц, 1H), 3.79-3.70 (m, 1H), 3.50-3.42 (m, 1H), 2.05-1.94 (m, 1H), 1.93-1.83 (m, 1H), 1.70-1.61 (m, 1H), 1.37 (s, 9H), 0.95-0.90 (m, 2H), 0.65-0.60 (m, 2H).
Синтез трет-бутил N-[(3R)-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-5-{[4-(дифторметокси)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-88)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 85%.
LCMS: METCR1410 Generic 1.7 min, rt=1.16 мин, M/Z (ES+) 624.1 [M+Na+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.11 (d, J=8.1 Гц, 1H), 7.77 (dd, J=8.1, 1.4 Гц, 1Н), 7.53 (d, J=1.5 Гц, 1H), 7.34 (d, J=8.6 Гц, 2H), 7.09 (d, J=8.5 Гц, 2Н), 6.51 (t, J=73.7 Гц, 1Н), 6.17-6.11 (m, 1H), 5.69 (d, J=7.2 Гц, 1H), 5.41 (d, J=15.2 Гц, 1H), 4.64 (d, J=15.2 Гц, 1H), 4.52 (dt, J=11.0, 7.0 Гц, 1H), 4.07 (dd, J=13.4, 7.0 Гц, 1H), 3.55-3.46 (m, 2H), 1.98-1.88 (m, 1H), 1.48-1.42 (m, 1H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-89)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 91%.
LCMS: METCR1410 Generic 1.7 min, rt=1.14 мин, M/Z (ES+) 510.1 [M-tBu+H], 588.15 [M+Na+] 98% УФ; ЯМР данные: 1Н ЯМР (250 МГц, Хлороформ-d) δ 7.99 (d, J=8.1 Гц, 1Н), 7.77 (d, J=8.1 Гц, 1H), 7.44 (d, J=1.4 Гц, 1H), 7.23 (d, J=8.6 Гц, 2H), 6.84 (d, J=8.4 Гц, 2H), 6.49 (s, 1H), 5.77 (d, J=7.2 Гц, 1H), 5.40 (d, J=14.8 Гц, 1H), 4.56-4.39 (m, 2H), 3.99 (dd, J=13.4, 6.9 Гц, 1H), 3.77 (s, 3H), 3.58-3.35 (m, 2H), 1.97-1.71 (m, 1H), 1.46 (dd, J=9.9, 4.7 Гц, 1H), 1.38 (s, 9H).
Синтез трет-бутил N-[(3R)-5-бензил-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-90)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 89%.
LCMS: METCR1410 Generic 1.7 min, rt=1.19 мин, M/Z (ES+) 514.1 [M-tBu+H, 592.15 [M+Na+] 96% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.06 (d, J=8.1 Гц, 1H), 7.82-7.69 (m, 1H), 7.38 (d, J=1.2 Гц, 1H), 7.37-7.30 (m, 5H), 6.02 (t, J=5.4 Гц, 1H), 5.75 (d, J=7.3 Гц, 1H), 5.57 (d, J=15.1 Гц, 1H), 4.53 (dt, J=10.9, 7.1 Гц, 1H), 4.47 (d, J=15.1 Гц, 1H), 4.06 (dd, J=13.3, 6.9 Гц, 1H), 3.51 (dd, J=13.2, 11.1 Гц, 1H), 3.49-3.42 (m, 2H), 2.19-2.08 (m, 2H), 1.84 (dt, J=14.6, 7.1 Гц, 2H), 1.40 (s, 9H).
Синтез трет-бутил N-[(3R)-8-хлор-5-[(4-хлорфенил)метил]-1,1,4-триоксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-91)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 88%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 581.9/584.05 [М-tBu+H], 660.10/612.10 [M+Na+] 100% УФ; ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 7.98 (s, 1H), 7.41 (s, 1Н), 7.32-7.18 (m, 4Н), 6.37 (t, J=5.7 Гц, 1Н), 5.68 (d, J=7.2 Гц, 1H), 5.25 (d, J=15.3 Гц, 1Н), 4.63 (d, J=15.3 Гц, 1H), 4.50 (dt, J=10.9, 7.1 Гц, 1H), 4.03 (dd, J=13.7, 7.1 Гц, 1H), 3.56-3.43 (m, 3H), 2.30-2.07 (m, 2H), 1.97-1.79 (m, 2H), 1.38 (s, 9H).
Синтез трет-бутил N-[(3R)-5-{[4-(дифторметокси)фенил]метил}-7-{[(оксан-4-ил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-92)
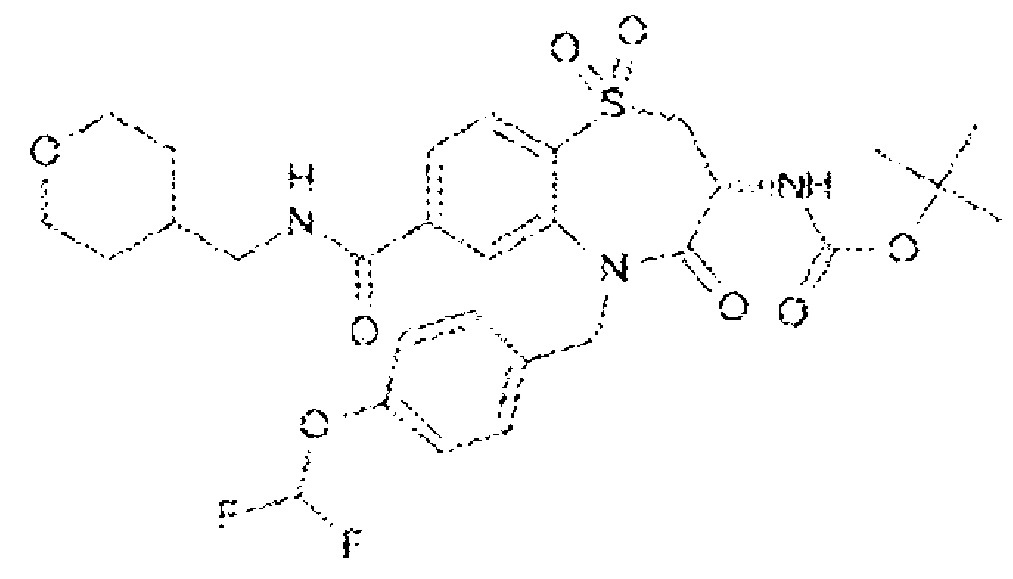
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 79%.
LCMS: METCR1410 Generic 1.7 min, rt=1.12 мин, M/Z (ES+) 524.2 [М-Вос+Н+], 646.2 [M+Na+] 99% УФ; ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.79 (t, J=5.6 Гц, 1H), 8.00-7.95 (m, 1H), 7.95-7.90 (m, 1H), 7.77 (s, 1H), 7.51 (d, J=8.1 Гц, 1H), 7.37 (d, J=8.6 Гц, 2H), 7.20 (t, J=74.2 Гц, 1H), 7.07 (d, J=8.5 Гц, 2H), 5.23 (d, J=16.0 Гц, 1H), 4.80 (d, J=15.9 Гц, 1H), 4.37 (dt, J=11.7, 7.7 Гц, 1H), 4.11-4.04 (m, 1H), 3.86-3.80 (m, 2H), 3.78-3.70 (m, 1H), 3.24 (t, J=10.8 Гц, 2H), 3.18-3.11 (m, 2H), 1.82-1.69 (m, 1H), 1.54 (d, J=12.3 Гц, 2H), 1.36 (s, 9H), 1.22-1.10 (m, 2H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(4-фтороксан-4-ил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-93)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 63%.
LCMS: METCR1410 Generic 1.7 min, rt=1.15 мин, M/Z (ES+) 510.10/512.05 [М-Boc+H+]; 632.15/634.20 [M+Na+] 95% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.97 (t, J=6.1 Гц, 1H), 8.02-7.94 (m, 2Н), 7.80 (s, 1Н), 7.52 (d, J=8.1 Гц, 1H), 7.38-7.30 (m, 4H), 5.24 (d, J=16.0 Гц, 1H), 4.83 (d, J=16.0 Гц, 1H), 4.38 (dt, J=11.8, 7.7 Гц, 1H), 4.13-4.05 (m, 1H), 3.79-3.70 (m, 3H), 3.58-3.49 (m, 4H), 1.78-1.70 (m, 1H), 1.66 (d, J=12.2 Гц, 3H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R)-1-(оксан-4-ил)этил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-94)

Указанное в названии соединение синтезировали согласно общей методике GP4 с полугением указанного в названии соединения в виде твердого вещества белого цвета при выходе 71%.
LCMS: METCR1410 Generic 1.7 min, rt=1.17 мин, M/Z (ES+) 506.10/508.10 [М-Вос+Н+], 628.15/630.20 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.45 (d, J=8.7 Гц, 1Н), 7.98 (d, J=8.1 Гц, 1Н), 7.93 (d, J=8.2 Гц, 1H), 7.72 (s, 1Н), 7.53 (d, J=8.0 Гц, 1Н), 7.35 (s, 4Н), 5.27 (d, J=16.0 Гц, 1H), 4.81 (d, J=16.0 Гц, 1H), 4.38 (dt, J=11.7, 7.7 Гц, 1Н), 4.09 (dt, J=13.3, 6.2 Гц, 1H), 3.90-3.79 (m, 3H), 3.78-3.72 (m, 1H), 3.28-3.20 (m, 2Н), 1.65-1.54 (m, 2Н), 1.51 (d, J=13.5 Гц, 1H), 1.37 (s, 9Н), 1.24-1.13 (m, 2Н), 1.11 (d, J=6.7 Гц, 3H).
Синтез трет-бутил N-[(3R)-5-бензил-7-{[(1R)-2,2-дифторциклопронил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-95)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 65%.
LCMS: METCR1410 Generic 1.7 min, rt=1.14 мин, M/Z (ES+) 558.45 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.10 (d, J=8.1 Гц, 1H), 7.82 (dd, J=8.1, 1.4 Гц, 1H), 7.41-7.30 (m, 6Н), 5.99 (s, 1Н), 5.73 (d, J=7.4 Гц, 1H), 5.61 (d, J=15.0 Гц, 1Н), 4.52 (dt, J=10.9, 7.1 Гц, 1Н), 4.45 (d, J=15.0 Гц, 1H), 4.07 (dd, J=13.3, 7.0 Гц, 1Н), 3.52 (dd, J=13.3, 11.1 Гц, 1Н), 3.49-3.42 (m, 1H), 1.97-1.85 (m, 1Н), 1.40 (s, 9Н), 1.39-1.35 (m, 1Н).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(6-метилпиридин-3-ил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-96)
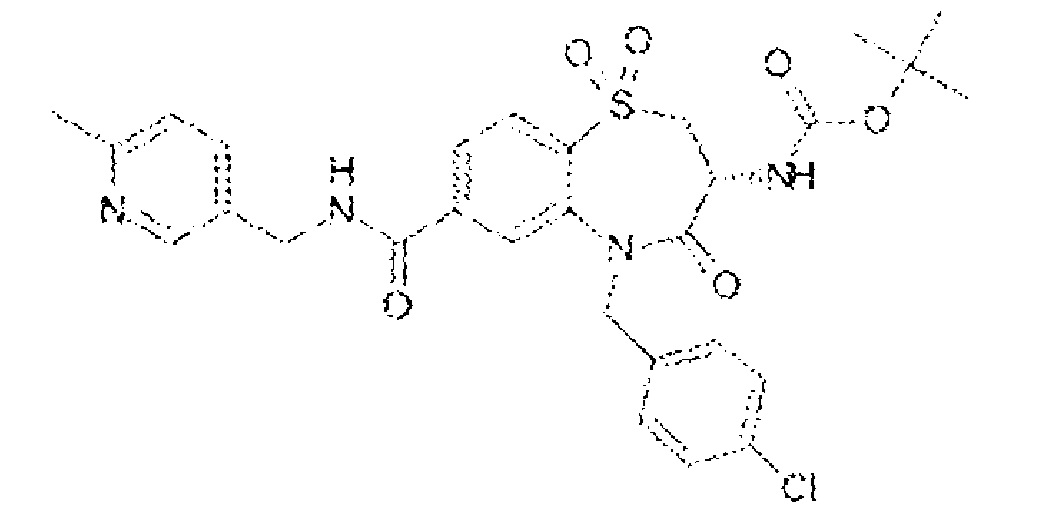
Указанное в названии соединение синтезировали согласно общей методике GP7 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 84%.
LCMS: METCR1410 Generic 1.7 min, rt=1.03 мин, M/Z (ES+) 599.55/ 601.20 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.36 (t, J=5.6 Гц, 1H), 8.41 (d, J=2.0 Гц, 1Н), 8.03-7.95 (m, 2H), 7.85 (s, 1H), 7.58 (dd, J=8.0, 2.3 Гц, 1H), 7.52 (d, J=8.1 Гц, 1H), 7.38-7.29 (m, 4H), 7.22 (d, J=7.9 Гц, 1H), 5.20 (d, J=16.0 Гц, 1H), 4.86 (d, J=16.0 Гц, 1H), 4.45 (d, J=5.7 Гц, 2H), 4.38 (dt, J=11.7, 7.6 Гц, 1H), 4.08 (dd, J=13.5, 7.6 Гц, 1H), 3.78-3.70 (m, 1H), 2.45 (s, 3H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(1R)-3,3-дифторциклопентил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-97)
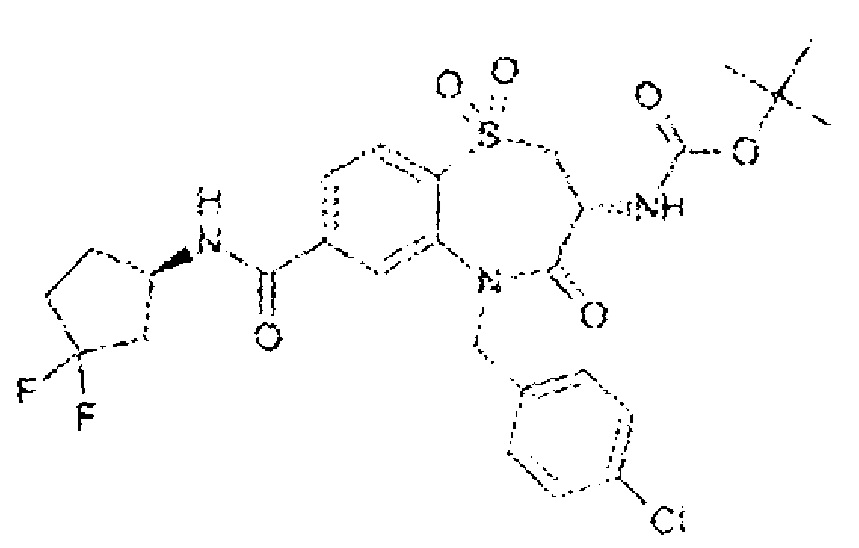
Указанное в названии соединение синтезировали согласно общей методике GP7 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 92%.
LCMS: METCR1410 Generic 1.7 min, rt=1.23 мин, M/Z (ES+) 620.15/622.20 [M+Na+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.88 (d, J=7.0 Гц, 1Н), 8.04-7.92 (m, 2H), 7.81 (s, 1H), 7.52 (d, J=8.1 Гц, 1H), 7.33 (s, 4H), 5.21 (d, J=15.9 Гц, 1H), 4.84 (d, J=15.9 Гц, 1H), 4.44-4.31 (m, 2H), 4.07 (dd, J=13.3, 7.3 Гц, 1H), 3.76-3.70 (m, 1H), 2.32-2.04 (m, 4H), 1.86-1.74 (m, 1H), 1.66-1.55 (m, 1H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(3,3-дифторциклобутил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-98)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 87%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 542.05/544.10 [M-tBu+H], 620.10/622.15 [M+Na+] 100% УФ; ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.10 (d, J=8.1 Гц, 1Н), 7.74 (dd, J=8.1, 1.3 Гц, 1Н), 7.53 (d, J=1.4 Гц, 1Н), 7.34-7.26 (m, 4H), 6.03 (t, J=5.5 Гц, 1Н), 5.70 (d, J=7.6 Гц, 1Н), 5.38 (d, J=15.3 Гц, 1Н), 4.63 (d, J=15.2 Гц, 1Н), 4.53 (dt, J=10.8, 7.1 Гц, 1Н), 4.06 (dd, J=13.3, 6.9 Гц, 1Н), 3.73-3.34 (m, 3H), 2.84-2.62 (m, 2H), 2.54-2.39 (m, 1Н), 2.38-2.25 (m, 2H), 1.41 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[2-(2-метоксиэтокси)этил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-99)
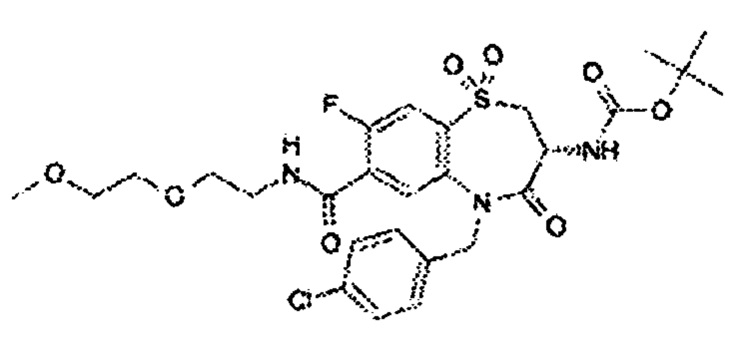
Указанное в названии соединение синтезировали согласно общей методике GP7 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 68%.
LCMS: METCR1410 Generic 1.7 min, rt=1.16 мин, M/Z (ES+) 636.10/638.15 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.70 (t, J=5.5 Гц, 1Н), 7.74 (d, J=8.5 Гц, 1Н), 7.59 (d, J=5.5 Гц, 1Н), 7.52 (d, J=8.1 Гц, 1Н), 7.34 (s, 4H), 5.19 (d, J=16.0 Гц, 1Н), 4.80 (d, J=16.1 Гц, 1Н), 4.42 (dt, J=11.6, 7.7 Гц, 1Н), 4.09 (dd, J=13.2, 7.3 Гц, 1Н), 3.81-3.71 (m, 1Н), 3.55-3.48 (m, 4H), 3.45-3.38 (m, 4H), 3.23 (s, 3H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-7-[(бут-3-ин-1-ил)карбамоил]-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-100)

Указанное в названии соединение синтезировали согласно общей методике GP7 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 65%.
LCMS: METCR1410 Generic 1.7 min, rt=1.19 мин, M/Z (ES+) 586.05/588.10 [M+Na+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.80 (t, J=5.5 Гц, 1Н), 7.75 (d, J=8.5 Гц, 1Н), 7.62 (d, J=5.5 Гц, 1Н), 7.52 (d, J=8.0 Гц, 1Н), 7.34 (s, 4H), 5.19 (d, J=16.1 Гц, 1Н), 4.80 (d, J=16.0 Гц, 1Н), 4.42 (dt, J=11.5, 7.7 Гц, 1Н), 4.09 (dd, J=13.3, 7.3 Гц, 1Н), 3.80-3.71 (m, 1Н), 3.37 (dd, J=14.4, 7.2 Гц, 2Н), 2.78 (t, J=2.6 Гц, 1Н), 2.41 (td, J=7.0, 2.6 Гц, 2Н), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-[(пент-4-ин-1-ил)карбамоил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-101)
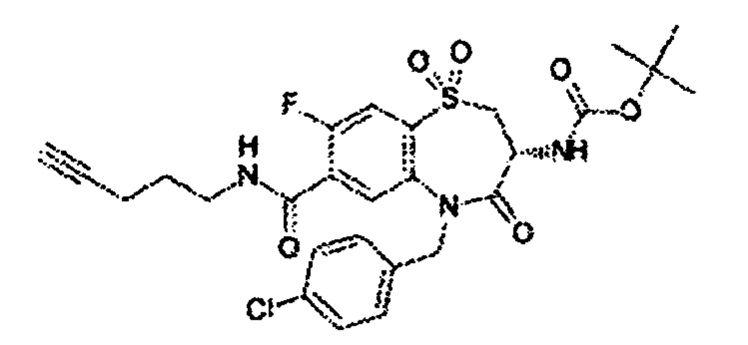
Указанное в названии соединение синтезировали согласно общей методике GP7 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 60%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 600.10/602.10 [M+Na+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.70 (t, J=5.3 Гц, 1Н), 7.74 (d, J=8.4 Гц, 1Н), 7.62 (d, J=5.5 Гц, 1Н), 7.52 (d, J=8.1 Гц, 1Н), 7.34 (s, 4H), 5.19 (d, J=16.0 Гц, 1Н), 4.83 (d, J=16.0 Гц, 1Н), 4.41 (dt, J=11.5. 7.7 Гц, 1Н), 4.09 (dd, J=13.2, 7.3 Гц, 1Н), 3.81-3.72 (m, 1Н), 3.30 (s, 2H), 2.80 (t, J=2.6 Гц, 1Н), 2.21 (td, J=7.2, 2.6 Гц, 2H), 1.68 (р, J=7.0 Гц, 2H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-8-хлор-5-[(4-хлорфенил)метил]-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-102)
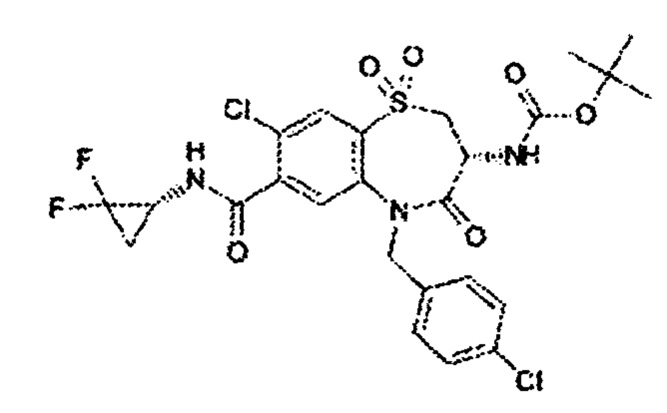
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 77%.
LCMS: METCR1410 Generic 1.7 min, rt=1.22 мин, M/Z (ES+) 626.05/628.10 [M+Na+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.06 (s, 1Н), 7.51 (s, 1H), 7.33-7.28 (m, 2H), 7.26 (s, 2H), 6.53 (s, 1Н), 5.68 (d, J=7.2 Гц, 1Н), 5.25 (d, J=15.3 Гц, 1Н), 4.71 (d, J=15.3 Гц, 1Н), 4.53 (dt, J=10.9, 7.1 Гц, 1Н), 4.06 (dd, J=13.4, 6.9 Гц, 1Н), 3.58-3.47 (m, 2H), 1.95 (m, 1Н), 1.49 (m, 1Н), 1.41 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[2-(морфолин-4-ил)этил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-103)
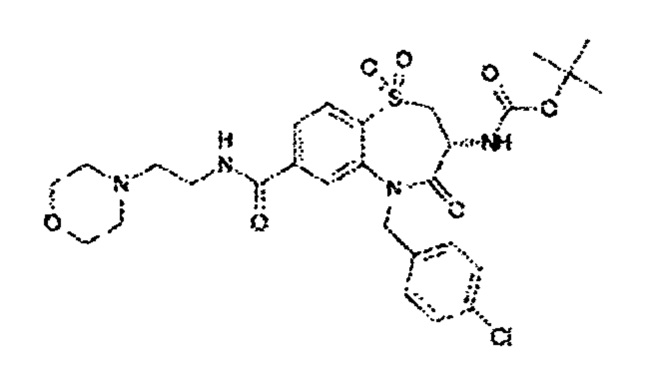
Указанное в названии соединение синтезировали согласно общей методике GP7 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 61%.
LCMS: METCR1410 Generic 1.7 min, rt=1 мин, M/Z (ES+) 607.55/609.15 [M+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.74 (t, J=5.6 Гц, 1Н), 8.00 (d, J=8.2 Гц, 1Н), 7.94 (d, J=8.2 Гц, 1Н), 7.79 (s, 1Н), 7.53 (d, J=8.1 Гц, 1Н), 7.38-7.31 (m, 4H), 5.21 (d, J=16.0 Гц, 1Н), 4.85 (d, J=16.1 Гц, 1Н), 4.38 (dt, J=11.6, 7.6 Гц, 1Н), 4.08 (dd, J=13.2, 7.2 Гц, 1Н), 3.78-3.69 (m, 1H), 3.57-3.52 (m, 4H), 3.41-3.36 (m, 2H), 2.45 (t, J=6.8 Гц, 2Н), 2.42-2.37 (m, 4H), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-7-{[(6-метоксипиридин-3-ил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-104)
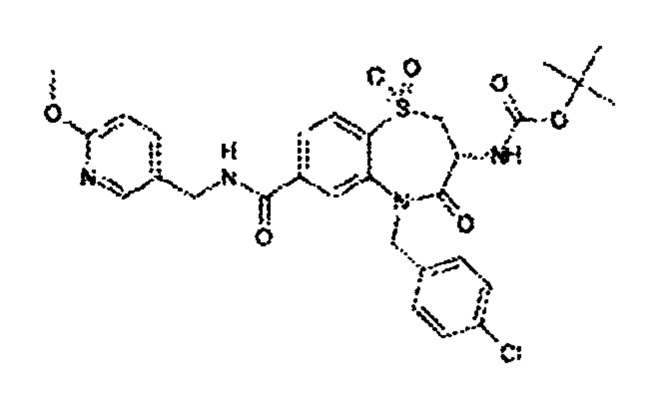
Указанное в названии соединение синтезировали согласно общей методике GP7 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 78%.
LCMS: METCR1410 Generic 1.7 min, rt=1.18 мин, M/Z (ES+) 615.55/617.10 [M+H+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.31 (t, J=5.7 Гц, 1Н), 8.12 (d, J=2.3 Гц, 1Н), 8.01-7.94 (m, 2H), 7.84 (s, 1Н), 7.63 (dd, J=8.5, 2.4 Гц, 1Н), 7.51 (d, J=8.0 Гц, 1Н), 7.37-7.30 (m, 4H), 6.79 (d, J=8.5 Гц, 1Н), 5.19 (d, J=16.0 Гц, 1Н), 4.85 (d, J=16.0 Гц, 1Н), 4.43-4.33 (m, 3H), 4.07 (dd, J=13.1, 7.2 Гц. 1Н), 3.83 (s, 3H), 3.76-3.69 (m, 1Н), 1.35 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-7-({[4-(prop-2-ин-илокси)фенил]метил}карбамоил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-105)

Указанное в названии соединение синтезировали согласно общей методике GP7 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 53%.
LCMS: METCR1410 Generic 1.7 min, rt=1.26 мин, M/Z (ES+) 678.20/680.20 [M+Na+] 93% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.15 (t, J=5.9 Гц, 1Н), 7.75 (d, J=8.5 Гц, 1Н), 7.63 (d, J=5.5 Гц, 1Н), 7.52 (d, J=8.1 Гц, 1Н), 7.35 (s, 4H), 7.23 (d, J=8.6 Гц, 2Н), 6.96 (d, J=8.6 Гц, 2Н), 5.21 (d, J=15.9 Гц, 1Н), 4.83-4.78 (m, 3H), 4.46-4.34 (m, 3H), 4.14-4.05 (m, 1Н). 3.82-3.72 (m, 1Н), 3.55 (t, J=2.4 Гц, 1Н), 1.37 (s, 9H).
Синтез трет-бутил N-[(3R)-7-{[(1R)-2,2-дифторциклопропил]карбамоил}-1,1,4-триоксо-5-{[4-(трифторметил)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-106)
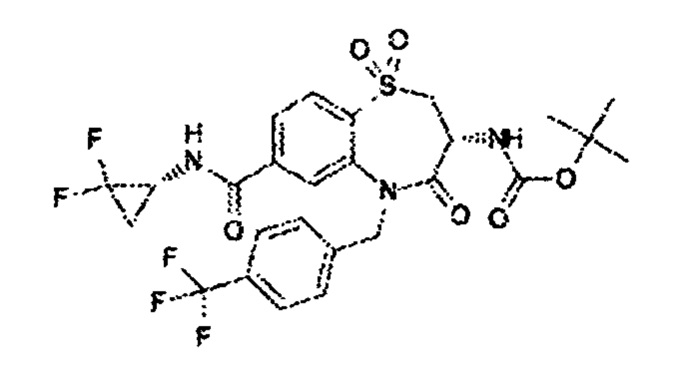
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 80%.
LCMS: METCR1410 Generic 1.7 min, rt=1.21 мин, M/Z (ES+) 626.1 [M+Na+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.17 (s, 1H), 8.04 (d, J=8.2 Гц, 1Н), 7.98 (dd, J=8.2, 1.2 Гц, 1Н), 7.80 (s, 1Н), 7.66 (d, J=8.2 Гц, 2Н), 7.59-7.51 (m, 3Н), 5.32 (d, J=16.4 Гц, 1Н), 4.91 (d, J=16.4 Гц, 1Н), 4.42 (dt, J=11.8, 7.6 Гц, 1Н), 4.10 (dd, J=13.2, 7.4 Гц, 1Н), 3.79-3.71 (m, 1Н), 2.05-1.93 (m, 1Н), 1.70-1.56 (m, 2H), 1.36 (s, 9H).
Синтез трет-бутил N-[(3R)-5-[(4-бромфенил)метил]-7-[(2,2-дифторциклопропил)карбамоил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-107)

Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 82%.
LCMS: METCR1410 Generic 1.7 min, rt=1.2 мин, M/Z (ES+) 558.0/560.0 [M-Вос+Н+], 636.0/638.0 [M+Na+] 100% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.17 (s, 1Н), 8.01 (d, J=8.2 Гц, 1Н), 7.98-7.92 (m, 1Н), 7.82 (d, J=16.4 Гц, 1Н), 7.51 (d, J=8.0 Гц, 1Н), 7.46 (d, J=8.2 Гц, 2Н), 7.27 (d, J=8.3 Гц, 2Н), 5.18 (dd, J=16.0, 10.6 Гц, 1Н), 4.83 (dd, J=23.0, 16.0 Гц, 1Н), 4.37 (dtd, J=11.9, 7.6, 4.6 Гц, 1Н), 4.12-4.05 (m, 1Н), 2.05-1.93 (m, 1Н), 1.75-1.55 (m, 2H), 1.36 (s, 9Н).
Синтез трет-бутил N-[(3R)-5-[(4-цианофенил)метил]-8-фтор-7-{[(4-фторфенил)метил]карбамоил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-108)
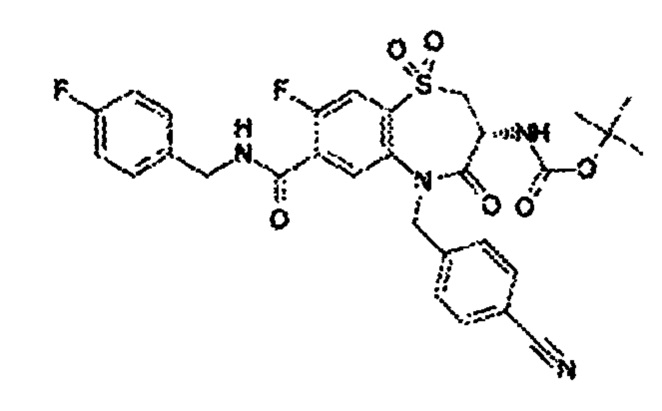
Указанное в названии соединение синтезировали согласно общей методике GP4 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 87%.
LCMS: METCR1410 Generic 1.7 min, rt=1.23 мин, M/Z (ES+) 555.05 [M-tBu+H] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.04 (d, J=6.0 Гц, 1Н), 7.83 (d, J=9.8 Гц, 1Н), 7.64-7.60 (m, 2H), 7.45 (d, J=8.3 Гц, 2Н), 7.34-7.29 (m, 2H), 7.09-7.04 (m, 2H), 7.02 (dd, J=10.9, 5.0 Гц, 1Н), 5.65 (d, J=7.2 Гц, 1Н), 5.23 (d, J=15.6 Гц, 1Н), 4.93 (d, J=15.6 Гц, 1Н), 4.70-4.57 (m, 2H), 4.57-4.50 (m, 1H), 4.16-4.09 (m, 1Н), 3.52 (dd, J=13.3, 11.1 Гц, 1Н), 1.41 (s, 9H).
Синтез трет-бутил N-[(3R)-7-(бензилкарбамоил)-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-109)
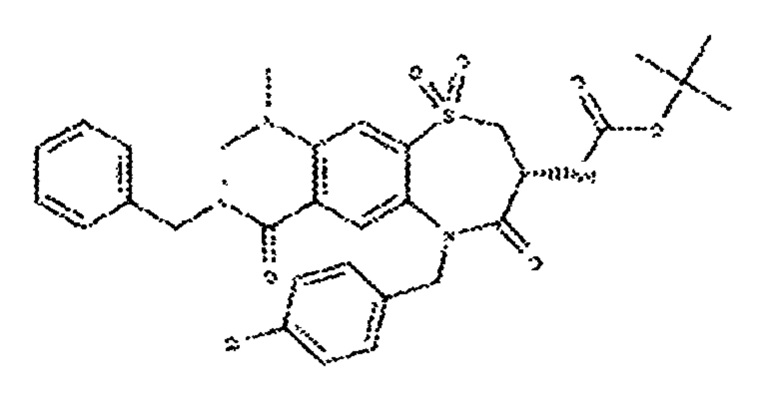
2М N-метилметанамин в THF (0.15 мл, 0.3 ммоль) добавили к перемешиваемому раствору промежуточного соединения IX-41 (100%, 36.0 мг, 0.06 ммоль) в этаноле (2 мл) в герметичной пробирке. Реакцию нагревали до 80°С в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении, растворили DCM (5 мл), промыли водой и соляным раствором (5 мл), и высушили над Na2SO4 отфильтровали и концентрировали при пониженном давлении с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1673 Generic 2 minutes: rt=1.30 min M/Z (ES+) 626.95/629 [M+H+] 100% УФ
ЯМР данные:1Н ЯМР (500 МГц, DMSO-d6) δ 9.10 (t, J=5.9 Гц, 1Н), 7.44 (d, J=8.3 Гц, 1Н), 7.37-7.23 (m, 11Н), 5.24 (d, J=16.0 Гц, 1Н), 4.53 (d, J=16.0 Гц, 1Н), 4.39 (dd, J=14.0, 6.6 Гц, 3Н), 4.03 (dd, J=13.3, 7.1 Гц, 1Н), 3.74-3.66 (m, 1Н), 2.81 (s, 6H), 1.37 (s, 9H).
Примеры
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2,2-дифторциклопропил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 1) был описан в качестве примерного синтеза в начале части Общие методики.
Согласно описанной выше и проиллюстрированной общей методике GP5 следующие примеры были синтезированы из амидного промежуточного соединения VIII: LCMS данные для гидрохлоридных солей, приведенные ниже, показывают отношения массы к заряду ионов (M/Z) соответствующего свободного основания.
Синтез (3R)-3-амино-N-бутил-5-[(4-трет-бутилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 2)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 51%.
LCMS: MET-UPLCMS-B-007, rt=2.77 мин, M/Z (ES+) 440 [М+Н+] 92% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 0.96-0.82 (m, 3H), 1.22 (s, 9H), 1.40-1.26 (m, 2H), 1.57-1.44 (m, 2H), 3.30-3.17 (m, 3H), 3.73-3.60 (m, 1Н), 4.07-3.93 (m, 1Н), 4.98 (d, J=15.6 Гц, 1Н), 5.37 (d, J=15.6 Гц, 1Н), 7.25 (q, J=8.5 Гц, 4Н), 7.80-7.65 (m, 2H), 8.05 (s, 1Н), 8.70 (t, J=5.7 Гц, 1Н).
Синтез (3R)-3-амино-N-бутил-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 3)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета.
LCMS: MET-UPLCMS-B-007, rt=2.83 мин, M/Z (ES+) 468 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) d 0.90 (t, J=7.3 Гц, 3H), 1.38-1.26 (m, 2H), 1.56-1.46 (m, 2H), 3.31-3.19 (m, 3H), 3.68 (dd, J=11.4, 6.9 Гц, 1Н), 4.00 (dd, J=11.7, 6.9 Гц, 1Н), 5.07 (d, J=15.6 Гц, 1Н), 5.42 (d, J=15.6 Гц, 1Н), 7.26 (d, J=8.0 Гц, 2Н), 7.43 (d, J=8.7 Гц, 2H), 7.72 (d, J=8.0 Гц, 1Н), 7.77 (dd, J=8.0, 1.7 Гц, 1Н), 8.07 (d, J=1.6 Гц, 1Н), 8.52 (s, 3H), 8.76 (t, J=5.7 Гц, 1Н).
Синтез (3R)-3-амино-5-[(4-трет-бутилфенил)метил]-4-оксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 4)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 63%.
LCMS: MET-UPLCMS-A-006, rt=2.57 мин, M/Z (ES+) 426 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (300 МГц, DMSO) δ 1.20-1.14 (m, 6H), 1.22 (s, 9H), 3.26 (t, J=11.6 Гц, 1Н), 3.69 (dd, J=11.5, 6.8 Гц, 1Н), 4.02-3.90 (m, 1Н), 4.16-4.02 (m, 1Н), 5.01 (d, J=15.5 Гц, 1Н), 5.36 (d, J=15.6 Гц, 1Н), 7.34-7.15 (m, 4H), 7.72 (d, J=8.0 Гц, 1Н), 7.78 (dd, J=8.0, 1.6 Гц, 1Н), 8.06 (d, J=1.5 Гц, 1Н), 8.49 (d, J=7.7 Гц, 1Н), 8.55 (s, 3H).
Синтез (3R)-3-амино-N-бутил-8-фтор-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 5)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 93%.
LCMS: METCR 1416 generic 7 minutes, rt=3.37 мин, M/Z (ES+) 486 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (300 МГц, DMSO) δ 8.44 (t, J=5.4 Гц, 1Н), 8.31 (s, 3H), 7.76 (d, J=6.4 Гц, 1Н), 7.64 (d, J=9.3 Гц, 1Н), 7.42 (d, J=8.7 Гц, 2Н), 7.29 (d, J=8.1 Гц, 2Н), 5.32 (d, J=15.5 Гц, 1Н), 5.00 (d, J=15.6 Гц, 1Н), 4.04 (dd, J=11.6, 6.9 Гц, 1Н), 3.65 (dd, J=11.5, 6.9 Гц, 1Н), 3.30-3.18 (m, 3H), 1.49 (p, J=7.0 Гц, 2Н), 1.32 (h, J=7.4 Гц, 2Н), 0.90 (t, J=7.4 Гц, 3Н).
Синтез (3R)-3-амино-N-бензил-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 6)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 65%.
LCMS: MET-UPLCMS-A-006., rt=3.78 мин, M/Z (ES+) 502 [M+H+] 95% УФ
ЯМР данные: 1Н ЯМР (300 МГц, DMSO) δ 3.25 (t, J=11.6 Гц, 1Н), 3.67 (dd, J=11.4, 6.8 Гц, 1Н), 4.03 (dd, J=11.7, 6.9 Гц, 1Н), 4.59-4.42 (m, 2Н), 5.05 (d, J=15.5 Гц, 1Н), 5.44 (d, J=15.5 Гц, 1Н), 7.29-7.22 (m, 3Н), 7.37-7.30 (m, 4H), 7.43 (d, J=8.7 Гц, 2Н), 7.75 (d, J=8.0 Гц, 1Н), 7.83 (dd, J=8.1, 1.8 Гц, 1Н), 8.14 (d, J=1.6 Гц, 1Н), 8.49 (s, 2Н), 9.37 (s, 1Н).
Синтез (3R)-3-амино-N-[(4-метоксифенил)метил]-4-оксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 7)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 60%.
LCMS: MET-UPLCMS-A-006, rt=3.73 мин, M/Z (ES+) 532 [М+Н+] 96% УФ
ЯМР данные: 1Н ЯМР (300 МГц, DMSO) 3.25 (t, J=11.6 Гц, 1Н), 3.67 (dd, J=11.4, 6.8 Гц, 1Н), 3.72 (s, 3Н), 4.02 (dd, J=11.8, 6.9 Гц, 1Н), 4.49-4.34 (m, 2H), 5.05 (d, J=15.5 Гц, 1Н), 5.44 (d, J=15.5 Гц, 1Н), 6.94-6.84 (m, 2Н), 7.29-7.21 (m, 4H), 7.42 (d, J=8.7 Гц, 2Н), 7.74 (d, J=8.0 Гц, 1Н), 7.81 (dd, J=8.1, 1.8 Гц, 1Н), 8.12 (d, J=1.6 Гц, 1Н), 8.49 (s, 2H), 9.29 (t, J=5.8 Гц, 1H).
Синтез (3R)-3-амино-N-(оксан-4-ил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 8)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 40%.
LCMS: MET-UPLCMS-A-006, rt=2.08 мин, M/Z (ES+) 496 [М+Н+] 97% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 1.20 (dd, J=16.6, 9.3 Гц, 1Н), 1.60 (dd, J=19.5, 11.8 Гц, 2Н), 1.75 (d, J=11.9 Гц, 2Н), 3.24 (t, J=11.6 Гц, 1Н), 3.38 (dd, J=13.2, 9.0 Гц, 2Н), 3.65 (dd, J=11.4, 6.8 Гц, 1Н), 3.88 (d, J=9.5 Гц, 2Н), 4.00 (dd, J=7.2, 3.8 Гц, 2Н), 5.07 (d, J=15.5 Гц, 1Н), 5.41 (d, J=15.5 Гц, 1Н), 7.27 (d, J=8.1 Гц, 2Н), 7.42 (d, J=8.6 Гц, 2Н), 7.73 (d, J=8.0 Гц, 1H), 7.80 (dd, J=8.0, 1.6 Гц, 1Н), 8.05 (d, J=1.5 Гц, 1Н), 8.48 (s, 2Н), 8.58 (d, J=7.6 Гц, 1Н).
Синтез (3R)-3-амино-N-бутил-4-оксо-5-{[3-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 9)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 90%.
LCMS: MET-UPLCMS-A-006, rt=3.19 мин, M/Z (ES+) 468 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (300 МГц, DMSO) δ 0.89 (t, J=7.2 Гц, 3Н), 1.39-1.26 (m, 2Н), 1.58-1.43 (m, 2Н), 3.31-3.19 (m, 3Н), 3.72-3.61 (m, 1Н), 4.10-3.95 (m, 1Н), 5.07 (d, J=15.7 Гц, 1Н), 5.53 (d, J=15.7 Гц, 1H), 7.20 (d, J=7.6 Гц, 1Н), 7.45-7.27 (m, 3Н), 7.80-7.66 (m, 2Н), 8.08 (s, 1Н), 8.50 (s, 3Н), 8.74 (t, J=5.0 Гц, 1Н).
Синтез (3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 10)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 83%.
LCMS: MET-UPLCMS-A-006, rt=2.4 мин, M/Z (ES+) 418/420 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 0.90 (t, J=7.3 Гц, 3H), 1.39-1.26 (m, 2Н), 1.57-1.45 (m, 2Н), 3.31-3.15 (m, 3Н, скрытый под пиком растворителя), 3.74-3.60 (m, 1Н), 4.07-3.93 (m, 1Н), 5.01 (d, J=15.4 Гц, 1Н), 5.41 (d, J=15.4 Гц, 1Н), 7.31 (s, 4H), 7.71 (d, J=8.0 Гц, 1Н), 7.76 (d, J=8.3 Гц, 1Н), 8.06 (s, 1Н), 8.52 (s, 3H), 8.76 (t, J=5.4 Гц, 1Н).
Синтез (3R)-3-амино-N-{[4-(морфолин-4-ил)фенил]метил}-4-оксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида
(Пример 11)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 91%.
LCMS: MET-UPLCMS-A-006, rt=3.04 мин, M/Z (ES+) 587 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 3.27-3.09 (m, 4H), 3.32 (t, J=11.6 Гц, 1Н), 3.75 (dd, J=11.4, 6.8 Гц, 1Н), 3.96-3.80 (m, 4H), 4.14-4.00 (m, 1Н), 4.55-4.38 (m, 2Н), 5.13 (d, J=15.5 Гц, 1Н), 5.50 (d, J=15.6 Гц, 1Н), 6.61 (s, 1Н), 7.16 (bs, 2H), 7.32 (d, J=8.1 Гц, 4H), 7.49 (d, J=8.7 Гц, 2H), 7.80 (d, J=8.0 Гц, 1Н), 7.87 (dd, J=8.0, 1.7 Гц, 1Н), 8.21 (d, J=1.5 Гц, 1Н), 8.62 (s, 3H), 9.42 (t, J=5.4 Гц, 1Н).
Синтез N-(3-{[(3R)-3-амино-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-ил]формамидо}пропил)-2,2-диметилпропанамид гидрохлорида
(Пример 12)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 44%.
LCMS: MET-UPLCMS-A-006, rt=2.32 мин, M/Z (ES+) 553 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (300 МГц, DMSO) 1.16-1.03 (m, 9H), 1.72-1.55 (m, 2H), 3.15-3.03 (m, 2H), 3.32-3.18 (m, 3H), 3.65 (dd, J=11.4, 6.8 Гц, 1Н), 4.07-3.90 (m, 1H, скрытый под пиком растворителя), 5.07 (d, J=15.4 Гц, 1Н), 5.46 (d, J=15.4 Гц, 2H), 7.26 (d, J=7.9 Гц, 2H), 7.43 (d, J=8.7 Гц, 2H), 7.60 (t, J=5.7 Гц, 1Н), 7.73 (d. J=8.0 Гц, 1Н), 7.78 (dd, J=8.1, 1.5 Гц, 1Н), 8.11 (d, J=1.2 Гц, 1Н), 8.45 (s, 3H), 8.82 (t, J=5.6 Гц, 1Н).
Синтез (3R)-3-амино-N-бутил-5-{[4-(морфолин-4-ил)фенил]метил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 13)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 80%.
LCMS: MET-UPLCMS-A-006, rt=1.58 мин, M/Z (ES-) 513 [М+Муравьиная кислота-Н], 467 [М-Н] 97% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 8.69 (t, J=5.6 Гц, 1Н), 8.44 (s, 3H), 8.06 (d, J=1.6 Гц, 1Н), 7.74 (dd, J=8.0, 1.7 Гц, 1Н), 7.69 (d, J=8.0 Гц, 1Н), 7.13 (d, J=8.7 Гц, 2Н), 6.82 (d, J=8.4 Гц, 2Н), 5.41 (d, J=15.1 Гц, 1Н), 4.83 (d, J=15.1 Гц, 1Н), 3.75-3.67 (m, 4H), 3.64 (dd, J=11.4, 6.8 Гц, 1Н), 3.34-3.18 (m, 3H), 3.11-2.97 (m, 4H), 1.59-1.45 (m, 2H), 1.33 (dq, J=14.4, 7.3 Гц, 2Н), 0.89 (t, 3H).
Синтез (3R)-3-амино-8-фтор-N-(оксан-4-ил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 14)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 46%.
LCMS: UPLCMS-1 MET-UPLCMS-A-006, rt=2.13 мин, M/Z (ES+) 514 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 1.59-1.46 (m, 2Н), 1.81-1.71 (m, 2H), 3.25 (t, J=11.6 Гц, 1Н), 3.43-3.37 (m, 2H), 3.69 (dd, J=11.4, 6.9 Гц, 1Н), 3.90-3.80 (m, 2H), 4.05-3.92 (m, 2H), 5.02 (d, J=15.6 Гц, 1Н), 5.32 (d, J=15.6 Гц, 1Н), 7.29 (d, J=7.9 Гц, 2H), 7.42 (d, J=8.7 Гц, 2H), 7.65 (d, J=9.2 Гц, 1Н), 7.75 (d, J=6.4 Гц, 1Н), 8.49 (d, J=7.6 Гц, 1Н), 8.54 (s, 3H).
Синтез (3R)-3-амино-8-фтор-4-оксо-N-(пропан-2-ил)-5-{[4-(трифторметокси)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 15)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 51%.
LCMS: MET-UPLCMS-A-006, rt=2.31 мин, M/Z (ES+) 472/474 [М+Н+] 97% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 1.14 (dd, J=6.6,2.9 Гц, 6Н), 3.24 (t, J=11.6 Гц, 1Н), 3.66 (dd, J=11.4, 6.9 Гц, 1Н), 4.08-3.97 (m, 2H), 5.01 (d, J=15.6 Гц, 1Н), 5.33 (d, J=15.5 Гц, 1Н), 7.29 (d, J=7.9 Гц,2Н), 7.42 (d, J=8.7 Гц, 2H), 7.64 (d, J=9.2 Гц, 1Н), 7.74 (d, J=6.4 Гц, 1Н), 8.32 (d, J=7.6 Гц, 1Н), 8.48 (s, 3H).
Синтез (3R)-3-амино-N-бензил-8-фтор-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 16)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 32%.
LCMS: MET-UPLCMS-A-006, rt=2.69 мин, M/Z (ES+) 520 [М+Н+] 98% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 3.25 (t, J=11.6 Гц, 1Н), 3.66 (dd, J=11.4, 6.9 Гц, 1Н), 4.07 (dd, J=11.5, 7.0 Гц, 1Н), 4.44 (dd, J=15.1, 5.8 Гц, 1Н), 4.52 (dd, J=15.2, 6.2 Гц, 1Н), 5.00 (d, J=15.5 Гц, 1H), 5.34 (d, J=15.5 Гц, 1Н), 7.38-7.23 (m, 7H), 7.41 (d, J=8.7 Гц, 2H), 7.67 (d, J=9.4 Гц, 1Н), 7.84 (d, J=6.5 Гц, 1Н), 8.44 (s, 3H), 9.05 (t, J=5.7 Гц, 1H).
Синтез (3R)-3-амино-N-метил-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 17)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 64%.
LCMS: MET-UPLCMS-A-006, rt=1.92 мин, M/Z (ES+) 426 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 2.80 (d, J=4.5 Гц, 3H), 3.25 (t, J=11.6 Гц, 1Н), 3.68 (dd, J=11.4, 6.8 Гц, 1Н), 4.09-3.92 (m, 1Н), 5.05 (d, J=15.6 Гц, 1Н), 5.45 (d, J=15.6 Гц, 1Н), 7.26 (d, J=7.9 Гц, 2Н), 7.42 (d, J=8.7 Гц, 2Н), 7.72 (d, J=8.0 Гц, 1Н), 7.75 (dd, J=8.0, 1.6 Гц, 1Н), 8.09 (d, J=1.5 Гц, 1Н), 8.52 (s, 3H), 8.78 (q, J=4.3 Гц, 1Н).
Синтез (3R)-3-амино-N-этил-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 18)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 60%.
LCMS: MET-UPLCMS-A-006, rt=2.31 мин, M/Z (ES+) 440 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 1.13 (t, J=7.2 Гц, 3H), 3.35-3.18 (m, 3Н), 3.69 (dd, J=11.4, 6.8 Гц, 1Н), 4.06-3.90 (m, 1Н), 5.07 (d, J=15.6 Гц, 1Н), 5.44 (d, J=15.6 Гц, 1Н), 7.26 (d, J=7.9 Гц, 2Н), 7.43 (d, J=8.7 Гц, 2Н), 7.72 (d, J=8.0 Гц, 1Н), 7.77 (dd, J=8.0, 1.7 Гц, 1Н), 8.10 (d, J=1.6 Гц, 1Н), 8.57 (s, 3H), 8.83 (t, J=5.5 Гц, 1Н).
Синтез (3R)-3-амино-N-({4-[(5-ацетамидопентил)окси]фенил}метил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 19)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 69%.
LCMS: MET-UPLCMS-A-006, rt=2.71 мин, M/Z (ES+) 645 [М+Н+] 97% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 1.48-1.33 (m, 4H), 1.73-1.64 (m, 2H), 1.77 (s, 3H), 3.02 (dd, J=12.3, 6.4 Гц, 2H), 3.24 (t, J=11.6 Гц, 1Н), 3.65 (dd, J=11.3, 6.8 Гц, 1Н), 3.92 (t, J=6.5 Гц, 2H), 4.09-4.01 (m, 1Н), 4.49-4.34 (m, 2H), 5.03 (d, J=15.5 Гц, 1Н), 5.44 (d, J=15.5 Гц, 1Н), 6.88 (d, J=8.7 Гц, 2H), 7.24 (dd, J=15.7, 8.3 Гц, 4Н), 7.41 (d, J=8.7 Гц, 2H), 7.74 (d, J=8.0 Гц, 1Н), 7.81 (dd, J=8.0, 1.7 Гц, 2Н), 8.10 (d, J=1.5 Гц, 1Н), 8.44 (s, 3H), 9.24 (t, J=5.8 Гц, 1Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2-метоксиэтил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 20)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде грязновато-белого твердого вещества.
LCMS: MET-UPLCMS-A-006, rt=2.18 мин, M/Z (ES+) 420 [М+Н+] 89% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 3.29-3.18 (m, 4H), 3.52-3.39 (m, 4H), 3.68 (dd, J=11.4, 6.8 Гц, 1Н), 3.98 (dd, J=11.7, 6.8 Гц, 1Н), 5.00 (d, J=15.4 Гц, 1Н), 5.43 (d, J=15.5 Гц, 1Н), 7.31 (s, 4H), 7.71 (d, J=8.0 Гц, 1Н), 7.77 (dd, J=8.0, 1.8 Гц, 1Н), 8.09(d, J=1.7 Гц, 1Н), 8.55 (s, 3H), 8.88 (t, J=4.8 Гц, 1Н).
Синтез (3R)-3-амино-N-бутил-5-[(4-цианофенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 21)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде грязновато-белого твердого вещества.
LCMS: MET-UPLCMS-A-006, rt=1.89 мин, M/Z (ES+) 409 [M+H+] 95% УФ
ЯМР данные: 1Н ЯМР (400 МГц, DMSO) δ 0.89 (t, J=7.3 Гц, 3H), 1.38-1.25 (m, 2H), 1.56-1.42 (m, 2H), 3.30-3.16 (m, 3H), 3.69 (dd, J=11.3, 6.8 Гц, 1Н), 4.03 (dd, J=11.4, 6.7 Гц, 1Н), 5.17 (d, J=16.0 Гц, 1Н), 5.43 (d, J=16.0 Гц, 1Н), 7.52 (d, J=8.0 Гц, 2Н), 7.84-7.67 (m, 4H), 8.03 (s, 1Н), 8.52 (s, 3H), 8.75 (t, J=5.3 Гц, 1Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-4-оксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 22)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 95%.
LCMS: METCR1416 generic 7 minutes, rt=3.25 мин, M/Z (ES+) 472/474 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.82 (d, J=4.1 Гц, 1Н), 8.41 (s, 3H), 8.05 (s, 1Н), 7.85-7.69 (m, 2H), 7.32 (d, J=2.3 Гц, 4H), 5.44 (d, J=15.5 Гц, 1Н), 4.98 (d, J=15.4 Гц, 1Н), 4.03 (dd, J=11.7, 6.9 Гц, 1Н), 3.65 (dd, J=11.5, 6.7 Гц, 1Н), 3.31-3.18 (m, 2H), 2.43-2.25 (m, 3H), 1.76 (dt, J=14.8, 7.1 Гц, 2Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 23)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 90%.
LCMS: METCR1416 generic 7 minutes, rt=3 мин, M/Z (ES+) 460/462 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.74 (t, J=5.7 Гц, 1Н), 8.44 (s, 3Н), 8.02 (s, 1Н), 7.76 (dd, J=8.0, 1.7 Гц, 1Н), 7.72 (d, J=8.0 Гц, 1Н), 7.39-7.24 (m, 4H), 5.40 (d, J=15.4 Гц, 1Н), 5.00 (d, J=15.5 Гц, 1Н), 4.02 (dd, J=11.7, 6.9 Гц, 1Н), 3.92-3.80 (m, 2H), 3.65 (dd, J=11.5, 6.9 Гц, 1Н), 3.30-3.11 (m, 5H), 1.79 (ddd, J=11.3, 7.4, 4.0 Гц, 1Н), 1.57 (d, J=13.1 Гц, 2H), 1.19 (qd, J=12.0,4.4 Гц, 2H).
Синтез (3R)-3-амино-N-(5-трет-бутил-1,2-оксазол-3-ил)-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 24)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 100%.
LCMS: METCR1416 generic 7 minutes, rt=3.47 мин, M/Z (ES+) 485/487 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 11.58 (s, 1Н), 8.40 (s, 3H), 8.18 (d, J=1.8 Гц, 1Н), 7.89 (dd, J=8.1, 1.8 Гц, 1Н), 7.78 (d, J=8.1 Гц, 1Н), 7.41-7.22 (m, 4H), 5.45 (d, J=15.4 Гц, 1Н), 5.00 (d, J=15.4 Гц, 1Н), 4.05 (dd, J=11.7, 6.8 Гц, 1Н), 3.66 (dd, J=11.4, 6.8 Гц, 1Н), 3.29-3.22 (m, 2H), 1.33 (s, 9H).
Синтез (3R)-3-амино-4-оксо-N-(пиридин-3-ил)-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид дигидрохлорида (пример 25)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 90%.
LCMS: METCR1416 generic 7 minutes, rt=2.96 мин, M/Z (ES+) 489 [M+H+] 100% УФ
ЯМР данные: (s, 1Н), 9.29 (s, 1H), 8.66 (d, J=8.0 Гц, 1H), 8.55 (s, 4H), 8.45 (s, 1H), 7.98 (d, J=6.7 Гц, 1H), 7.83 (d, J=8.0 Гц, 1H), 7.79 (s, 1H), 7.48 (d, J=8.5 Гц, 2Н), 7.27 (d, J=8.2 Гц, 2Н), 5.50 (d, J=15.6 Гц, 1H), 5.25 (d, J=15.5 Гц, 1H), 4.05 (s, 1H), 3.71 (dd, J=11.3, 6.8 Гц, 1H), 3.34-3.26 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 26)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 80%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.27 мин, M/Z (ES+) 470/472 [M+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.30 (t, J=5.9 Гц, 1H), 8.30 (s, 2Н), 8.06 (d, J=1.6 Гц, 1H), 7.78 (dd, J=8.0, 1.7 Гц, 1H), 7.71 (d, J=8.0 Гц, 1H), 7.34 (dd, J=8.5, 5.7 Гц, 2Н), 7.29 (d, J=2.4 Гц, 4H), 7.14 (t, J=8.9 Гц, 2Н), 5.40 (d, J=15.4 Гц, 1H), 4.95 (d, J=15.4 Гц, 1H), 4.52-4.39 (m, 2Н), 3.98 (s, 1H), 3.65-3.58 (m, 1H), 3.22 (d, J=11.6 Гц, 1Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-1-(4-метоксифенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамида (Пример 27)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 51%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.36 мин, M/Z (ES+) 496/498 [M+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.83 (d, J=8.0 Гц, 1H), 7.92 (d, J=1.6 Гц, 1Н), 7.74-7.61 (m, 2H), 7.29 (d, J=7.1 Гц, 6Н), 6.89 (d, J=8.7 Гц, 2Н), 5.35 (d, J=15.5 Гц, 1Н), 5.11 (p, J=7.1 Гц, 1Н), 4.90 (d, J=15.5 Гц, 1Н), 3.73 (s, 3H), 2.97 (s, 1Н), 2.87 (t, J=13.2 Гц, 1Н), 1.45 (d, J=7.0 Гц, 3H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(оксан-3-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 28)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 98%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.04 мин, M/Z (ES+) 460/462 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.73 (s, 1Н), 8.35 (s, 2H), 8.02 (s, 1Н), 7.79-7.69 (m, 2H), 7.37-7.28 (m, 4H), 5.42 (d, J=15.4 Гц, 1Н), 4.98 (d, J=15.4 Гц, 1Н), 4.01 (dd, J=11.7, 6.9 Гц, 1Н), 3.80-3.60 (m, 4H), 3.28-3.08 (m, 4H), 1.85-1.73 (m, 2H), 1.59 (dd, J=9.8, 3.7 Гц, 1Н), 1.51-1.40 (m, 1Н), 1.24 (q, J=9.8 Гц, 1Н).
Синтез (3R)-3-амино-4-оксо-N-(4,4,4-трифторбутил)-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 29)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 100%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.33 мин, M/Z (ES+) 522 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO) d 1.75 (dt, J=7.06, 14.74 Гц, 2H), 2.24-2.35 (m, 2H), 3.24 (t, J=11.56 Гц, 1Н), 3.34-3.43 (m, 2H), 3.63 (dd, J=6.43, 11.14 Гц, 1Н), 4.03 (dd, J=6.89, 11.55 Гц, 1Н), 5.03 (d, J=15.25 Гц, 1Н), 5.43 (d, J=15.56 Гц, 1Н), 7.26 (d, J=8.34 Гц, 2Н), 7.42 (d, J=8.50 Гц, 2Н), 7.71-7.79 (m, 2H), 8.04 (s, 1Н), 8.36 (s, 3Н), 8.80 (s, 1Н)
Синтез (3R)-3-амино-N-(оксан-4-илметил)-4-оксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 30)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 96%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.09 мин, M/Z (ES+) 510 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO) d 1.20 (qd, J=4.28, 12.04 Гц, 2Н), 1.54-1.61 (m, 2Н), 1.80 (ddt, J=3.88, 7.19, 10.88 Гц, 1Н), 3.11-3.30 (m, 5H), 3.59-3.67 (m, 1H), 3.82-3.89 (m, 2Н), 4.04 (dd, J=6.98, 11.61 Гц, 1Н), 5.03 (d, J=13.61 Гц, 1Н), 5.42 (d, J=15.55 Гц, 1Н), 7.28 (d, J=8.39 Гц, 2Н), 7.42 (d, J=8.49 Гц, 2Н), 7.74 (d, J=8.01 Гц, 1Н), 7.78 (d, J=8.10 Гц, 1Н), 8.01 (s, 1Н), 8.35 (s, 3H), 8.70 (s, 1H)
Синтез (3R)-3-амино-N-[(4-фторфенил)метил]-4-оксо-5-{[4-(трифторметокси)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 31)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 94%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.38 мин, M/Z (ES+) 520 [M+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, d6-DMSO) d 3.25 (t, J=11.59 Гц, 1H), 3.67 (dd, J=6.86, 11.35 Гц, 1Н), 4.02 (dd, J=6.88,11.71 Гц, 1Н), 4.47 (qd, J=5.93,15.05 Гц, 2H), 5.05 (d, J=15.56 Гц, 1Н), 5.44 (d, J=15.55 Гц, 1Н), 7.12-7.19 (m, 2H), 7.26 (d, J=8.19 Гц, 2Н), 7.36 (dd, J=5.63, 8.59 Гц, 2H), 7.42 (d, J=8.66 Гц, 2H), 7.74 (d, J=8.02 Гц, 1Н), 7.82 (dd, J=1.74, 8.05 Гц, 1Н), 8.13 (d, J=1.51 Гц, 1Н), 8.46 (s, 3H), 9.37 (t, J=5.80 Гц, 1Н)
Синтез (3R)-3-амино-N-[(4-фторфенил)метил]-4-оксо-5-{[4-(1,2,3-тиадиазол-4-ил)фенил]-метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 32)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 94%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.14 мин, M/Z (ES+) 520 [M+H+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.57 (s, 1Н), 9.30 (t, J=5.9 Гц, 1H), 8.24 (s, 2H), 8.14 (d, J=1.6 Гц, 1Н), 8.04 (d, J=8.2 Гц, 2H), 7.81 (dd, J=8.0, 1.7 Гц, 1H), 7.75 (d, J=8.0 Гц, 1Н), 7.48 (d, J=8.2 Гц, 2H), 7.36 (dd, J=8.5, 5.6 Гц, 2H), 7.16 (t, J=19 Гц, 2H), 5.53 (d, J=15.6 Гц, 1Н), 5.07 (d, J=15.5 Гц, 1Н), 4.57-4.39 (m, 2H), 4.06 (dd, J=11.8, 6.9 Гц, 1Н), 3.66 (dd, J=11.4, 6.8 Гц, 1Н), 3.31-3.23 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(4,4-дифторциклогексил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 33)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 97%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.26 мин, M/Z (ES+) 480/482 [M+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.55 (d, J=7.7 Гц, 1Н), 8.44 (s, 3H), 8.05 (d, J=1.7 Гц, 1Н), 7.79 (dd, J=8.0, 1.7 Гц, 1Н), 7.73 (d, J=8.0 Гц, 1Н), 7.40-7.26 (m, 4H), 5.40 (d, J=15.4 Гц, 1Н), 5.01 (d, J=15.4 Гц, 1Н), 3.99 (dd, J=11.7,6.9 Гц, 2Н), 3.66 (dd, J=11.4, 6.8 Гц, 1Н), 3.24 (t, J=11.6 Гц, 1Н), 1.98 (ddd, J=64.0, 29.8, 11.0 Гц, 6Н), 1.67 (q, J=11.7, 10.7 Гц, 2Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[1-(4-фторфенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 34)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 97%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.35 мин, M/Z (ES+) 484/486 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.04 (d, J=7.9 Гц, 1Н), 8.23 (s, 3H), 8.05 (dd, J=9.6, 1.6 Гц, 1Н), 7.83 (td, J=7.0, 6.1,1.7 Гц, 1Н), 7.74 (d, J=8.0 Гц, 1Н), 7.43 (dd, J=8.6, 5.6 Гц, 2Н), 7.36-7.27 (m, 4H), 7.16 (t, J=8.9 Гц, 2Н), 5.39 (dd, J=15.5, 5.5 Гц, 1Н), 5.17 (td, J=7.3, 3.5 Гц, 1Н), 5.01 (d, J=15.4 Гц, 1Н), 3.99 (dd, J=11.7, 6.8 Гц, 1Н), 3.63 (dd, J=11.4, 6.8 Гц, 1Н), 3.23 (t, J=11.6 Гц, 1Н), 1.49 (dd, J=7.0,3.2 Гц, 3Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1S)-1-(4-метоксифенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамида (Пример 35)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 50%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.3 мин, M/Z (ES+) 496/498 [M+H+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.82 (d, J=8.0 Гц, 1Н), 7.93 (d, J=1.7 Гц, 1H), 7.70 (dd, J=8.0. 1.7 Гц, 1Н), 7.64 (d, J=8.0 Гц, 1Н), 7.33-7.26 (m, 6H), 6.89 (d, J=8.7 Гц, 2H), 5.37 (d, J=15.5 Гц, 1Н), 5.12 (m, 1Н), 4.90 (d, J=15.5 Гц, 1Н), 3.73 (s, 3H), 3.41 (q, J=6.3 Гц, 2H), 3.03-2.83 (m, 1Н), 1.93 (br, 2H), 1.47 (d, J=7.0 Гц, 3H).
Синтез (3R)-3-амино-4-оксо-N-(4,4,4-трифторбутил)-5-{[6-(трифторметил)пиридин-3-ил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 36)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 19%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.11 мин, M/Z (ES+) 507 [M+H+] 93% УФ
ЯМР данные: 1Н ЯМР (500 МГц, MEtOH-d4) δ 8.79 (s, 1Н), 8.67 (s, 1Н), 8.07 (s, 1Н), 7.97 (d, J=8.0 Гц, 1Н), 7.77 (s, 2H), 7.70 (d, J=8.1 Гц, 1Н), 5.70 (d, J=15.4 Гц, 1Н), 5.00 (d, J=15.3 Гц, 1Н), 4.56 (s, 2H), 4.11 (dd, J=11.6, 6.9 Гц, 1Н), 3.75 (dd, J=11.5, 7.4 Гц, 1Н), 3.50-3.42 (m, 2H), 3.23 (t, J=11.5 Гц, 1Н), 2.33-2.17 (m, 2H), 1.88 (p, J=7.2 Гц, 2H).
Синтез (3R)-3-амино-N-[(4-фторфенил)метил]-4-оксо-5-{[6-(трифторметил)пиридин-3-ил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 37)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 43%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.13 мин, M/Z (ES+) 505 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.41 (t, J=5.8 Гц, 1Н), 8.72 (d, J=1.4 Гц, 1H), 8.49 (s, 3H), 8.15 (d, J=1.5 Гц, 1Н), 7.97 (dd, J=8.1, 1.6 Гц, 1Н), 7.86-7.81 (m, 2H). 7.76 (d, J=8.0 Гц, 1Н), 7.36 (dd, J=8.6, 5.6 Гц, 2H), 7.19-7.11 (m, 2H), 5.51 (d, J=15.8 Гц, 1Н), 5.19 (d, J=15.8 Гц, 1Н), 4.47 (qd, J=15.1, 5.9 Гц, 2H), 4.04 (dd, J=11.7, 6.9 Гц, 1Н), 3.67 (dd, J=11.4, 6.9 Гц, 1Н), 3.24 (t, J=11.6 Гц, 1Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-1-(4-фторфенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 38)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 96%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.32 мин, M/Z (ES+) 484/486 [M+H+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.98 (d, J=7.9 Гц, 1Н), 8.00 (s, 1Н), 7.81 (d, J=8.0 Гц, 1Н), 7.72 (d, J=8.0 Гц, 1Н), 7.41 (dd, J=8.7, 5.6 Гц, 2H), 7.31 (q, J=8.6 Гц, 4Н), 7.15 (t, J=8.9 Гц, 2H), 5.37 (d, J=15.4 Гц, 1Н), 5.15 (t, J=7.3 Гц, 1Н), 4.97 (d, J=15.4 Гц, 1Н), 3.99-3.89 (m, 1Н), 3.62-3.56 (m, 1Н), 3.18 (t, J=11.7 Гц, 1Н), 1.48 (d, J=7.0 Гц, 3Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 39)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 95%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.29 мин, M/Z (ES+) 488/490 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.12 (t, J=5.8 Гц, 1Н), 8.56 (s, 3H), 7.83 (d, J=6.4 Гц, 1Н), 7.67 (d, J=9.4 Гц, 1Н), 7.38-7.29 (m, 6H), 7.18 (t, J=8.8 Гц, 2H), 5.33 (d, J=15.5 Гц, 1Н), 4.96 (d, J=15.5 Гц, 1Н), 4.45 (qd, J=15.1, 6.0 Гц, 2Н), 4.04 (dd, J=11.6, 6.9 Гц, 1Н), 3.69 (dd, J=11.4, 6.9 Гц, 1Н), 3.26 (t, J=11.6 Гц, 1Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 40)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.21 мин, M/Z (ES+) 490/492 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.64 (t, J=5.5 Гц, 1Н), 8.52 (s, 3H), 7.81 (d, J=6.4 Гц, 1Н), 7.65 (d, J=9.3 Гц, 1Н), 7.32 (q, J=8.6 Гц, 4Н), 5.34 (d, J=15.5 Гц, 1Н), 4.94 (d, J=15.5 Гц, 1Н), 4.02 (dd, J=11.7, 6.9 Гц, 1Н), 3.68 (dd, J=11.4, 6.9 Гц, 1Н), 3.33-3.21 (m, 3H), 2.35-2.24 (m, 2Н), 1.73 (dt, J=14.7, 7.0 Гц, 2Н).
Синтез (3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 41)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвев при выходе 100%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.19 мин, M/Z (ES+) 436/438 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.60-8.47 (m, 4H), 7.75 (d, J=6.3 Гц, 1H), 7.63 (d, J=9.3 Гц, 1Н), 7.32 (q, J=8.4 Гц, 4H), 5.31 (d, J=15.5 Гц, 1Н), 4.95 (d, J=15.5 Гц, 1Н), 4.01 (dd, J=11.6, 6.9 Гц, 1Н), 3.68 (dd, J=11.3, 6.8 Гц, 1Н), 3.28-3.16 (m, 3Н), 1.48 (р, J=7.2 Гц, 2Н), 1.31 (h, J=7.3 Гц, 2Н), 0.89 (t, J=7.3 Гц, 3Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 42)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде бледно оранжевого твердого вещества при выходе 98%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=2.98 мин, M/Z (ES+) 478/490 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.62-8.54 (m, 4H), 7.73 (d, J=6.4 Гц, 1Н), 7.64 (d, J=9.2 Гц, 1Н), 7.32 (q, J=8.6 Гц, 4H), 5.29 (d, J=15.5 Гц, 1Н), 4.97 (d, J=15.5 Гц, 1Н), 4.01 (dd, J=11.5, 7.0 Гц, 1Н), 3.85 (dd, J=11.2, 2.9 Гц, 2Н), 3.69 (dd, J=11.6, 7.0 Гц, 1Н), 3.27-3.22 (m, 3H), 3.14 (dq, J=31.8, 6.8 Гц, 2Н), 1.80-1.69 (m, 1H), 1.56 (d, J=12.7 Гц, 2Н), 1.18 (qd, J=12.2, 4.4 Гц, 2Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[(4-метоксифенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 43)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде бледно оранжевого твердого вещества при выходе 100%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.23 мин, M/Z (ES+) 500/502 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.03 (t, J=5.8 Гц, 1Н), 8.59 (s, 3H), 7.80 (d, J=6.4 Гц, 1Н), 7.64 (d, J=9.3 Гц, 1Н), 7.32 (q, J=8.4 Гц, 4Н), 7.23 (d, J=8.4 Гц, 2Н), 6.89 (d, J=8.5 Гц, 2Н), 5.30 (d, J=15.4 Гц, 1Н), 4.96 (d, J=15.5 Гц, 1Н), 4.39 (qd, J=14.9, 5.9 Гц, 2Н), 4.01 (dd, J=11.5, 6.9 Гц, 1Н), 3.74-3.67 (m, 4Н), 3.25 (t, J=11.6 Гц, 1Н).
Синтез (3R)-3-амино-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 44)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 96%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=2.83 мин, M/Z (ES+) 508 [M+H+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.73 (t, J=5.8 Гц, 1Н), 8.14 (br, 2Н), 8.02 (d, J=1.6 Гц, 1Н), 7.89 (d, J=8.3 Гц, 2Н), 7.80-7.70 (m, 2Н), 7.49 (d, J=8.3 Гц, 2Н), 5.45 (d, J=15.7 Гц, 1Н), 5.10 (d, J=15.8 Гц, 1Н), 4.03 (dd, J=11.7, 6.9 Гц, 1Н), 3.84 (d, J=7.3 Гц, 2Н), 3.63 (dd, J=11.4, 6.8 Гц, 1Н), 3.28-3.12 (m, 5H), 2.65 (s, 3H), 1.85-1.71 (m, 1Н), 1.56 (d, J=12.7 Гц, 2Н), 1.19 (qd, J=12.2, 4.7 Гц, 2Н).
Синтез (3R)-3-амино-5-[(4-фторфенил)метил]-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамида (Пример 45)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 28%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=2.86 мин, M/Z (ES+) 444 [M+H+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.64 (t, J=5.8 Гц, 1Н), 7.92 (d, J=1.4 Гц, 1H), 7.78-7.56 (m, 2H), 7.31 (dd, J=8.6, 5.6 Гц, 2Н), 7.06 (t, J=8.9 Гц, 2Н), 5.39 (d, J=15.3 Гц, 1Н), 4.88 (d, J=15.3 Гц, 1Н), 3.92-3.77 (m, 2Н), 3.31-3.23 (m, 3H), 3.23-3.07 (m, 3H), 2.97-2.82 (m, 1Н), 1.77 (d, J=3.6 Гц, 1Н), 1.58 (d, J=11.5 Гц, 2Н), 1.39-1.31 (m, 1Н), 1.19 (qd, J=12.0, 4.5 Гц, 3Н).
Синтез (3R)-3-амино-N-бутил-4-оксо-5-{[4-(1Н-1,2,4-триазол-1-ил)фенил]метил}-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 46)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде светло-коричневого твердого вещества при выходе 98%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=2.82 мин, M/Z (ES+) 451 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.23 (s, 1Н), 8.67 (t, J=5.6 Гц, 1Н), 8.43 (s, 3H), 8.20 (s, 1Н), 8.05 (s, 1Н), 7.84-7.64 (m, 4H), 7.46 (d, J=8.5 Гц, 2Н), 5.49 (d, J=15.6 Гц, 1Н), 5.05 (d, J=15.6 Гц, 1Н), 4.05 (s, 1Н), 3.65 (dd, J=11.4, 6.9 Гц, 1Н), 3.28-3.23 (m, 3H), 1.50 (p, J=7.0 Гц, 2Н), 1.32 (h, J=7.3 Гц, 2Н), 0.89 (t, J=7.4 Гц, 3Н).
Синтез (3R)-3-амино-N-бутил-5-[(4-карбамоилфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 47)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 95%.
LCMS: MET-UHPLC-AB-101, rt=1.44 мин, M/Z (ES+) 427 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.67 (t, J=5.6 Гц, 1Н), 8.35 (s, 3H), 8.03 (d, J=1.5 Гц, 1Н), 7.90 (s, 1Н), 7.81-7.64 (m, 4H), 7.37 (d, J=8.3 Гц, 2H), 7.31 (s, 1Н), 5.45 (d, J=15.7 Гц, 1Н), 5.07 (d, J=15.7 Гц, 1Н), 4.04 (dd, J=11.7, 6.8 Гц, 1Н), 3.72-3.63 (m, 1Н), 3.29-3.22 (m, 3H), 1.51 (quin, J=7.1 Гц, 2Н), 1.32 (h, J=7.3 Гц, 2Н), 0.90 (t, J=7.4 Гц, 3H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2-гидрокси-2-метилпропил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамида (Пример 48)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета при выходе 52%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=2.91 мин, M/Z (ES+) 434/436 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.39 (t, J=6.2 Гц, 1Н), 7.94 (d, J=1.6 Гц, 1Н), 7.70-7.61 (m, 2Н), 7.29 (s, 4H), 5.38 (d, J=15.5 Гц, 1Н), 4.90 (d, J=15.5 Гц, 1Н), 4.53 (s, 1Н), 3.41 (q, J=6.5 Гц, 2Н), 3.28-3.17 (m, 2Н), 2.91-2.83 (m, 1Н), 2.03 (d, J=40.0 Гц, 2Н), 1.09 (d, J=3.2 Гц, 6Н)
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1S)-1-(4-фторфенил)этил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 49)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 90%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.45 мин, M/Z (ES+) 484/486 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 9.02 (d, J=7.9 Гц, 1Н), 8.31 (s, 3H), 8.05 (d, J=1.6 Гц, 1Н), 7.81 (dd, J=8.0, 1.7 Гц, 1Н), 7.72 (d, J=8.0 Гц, 1Н), 7.41 (dd, J=8.6, 5.6 Гц, 2Н), 7.35-7.26 (m, 4H), 7.15 (t, J=8.9 Гц, 2Н), 5.39 (d, J=15.4 Гц, 1Н), 5.16 (р, J=7.1 Гц, 1Н), 5.00 (d, J=15.4 Гц, 1Н), 3.99 (dd, J=11.7, 6.8 Гц, 1Н), 3.62 (dd, J=11.4, 6.9 Гц, 1Н), 3.22 (t, J=11.5 Гц, 1Н), 1.48 (d, J=7.1 Гц, 3Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(2-гидрокси-2-метилпропил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамида (Пример 50)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 64%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3 мин, M/Z (ES+) 452/454 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.06 (d, J=7.0 Гц, 1Н), 7.37 (d, J=10.7 Гц, 1Н), 7.24-7.16 (m, 4H), 7.16-7.09 (m, 1Н), 5.52 (d, J=15.1 Гц, 1Н), 4.63 (d, J=15.0 Гц, 1Н), 3.70-3.56 (m, 2Н), 3.57-3.40 (m, 2Н), 3.05-2.94 (m, 1Н), 1.30 (s, 6H)
Синтез (2R,3R)-3-амино-5-[(4-хлорфенил)метил]-2-метил-4-оксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 51)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 74%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.25 мин, M/Z (ES+) 486/488 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.82 (t, J=5.7 Гц, 1Н), 8.25 (s, 3H), 8.06 (d, J=1.6 Гц, 1H), 7.76 (dd, J=8.0, 1.7 Гц, 1Н), 7.71 (d, J=8.0 Гц, 1Н), 7.32 (s, 4H), 5.49 (d, J=15.5 Гц, 1Н), 4.99 (d, J=15.5 Гц, 1Н), 4.14 (d, J=6.1 Гц, 1Н), 4.04 (p, J=6.5 Гц, 1Н), 3.41-3.35 (m, 2H), 2.36-2.26 (m, 2H), 1.76 (dt, J=14.8, 7.1 Гц, 2Н), 1.32 (d, J=6.6 Гц, 3Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N'-(4-фторфенил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбогидразид гидрохлорида (пример 52)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества светло-оранжевого цвета с выходом 91%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.14 мин, M/Z (ES+) 489/491 [M+H+] 93% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 3.26 (t, J=11.58 Гц, 1Н), 3.68 (dd, J=6.86, 11.42 Гц, 1Н), 4.08 (dd, J=6.87, 11.67 Гц, 1Н), 5.00 (d, J=15.42 Гц, 1Н), 5.30 (d, J=15.44 Гц, 1Н), 6.76-6.82 (m, 2H), 6.99-7.06 (m, 2H), 7.29-7.39 (m, 4H), 7.69 (d, J=9.20 Гц, 1Н), 7.80 (d, J=6.32 Гц, 1Н), 8.02 (d, J=2.78 Гц, 1Н), 8.44 (s, 3H), 10.36 (d, J=2.57 Гц, 1Н).
Синтез (3R)-3-амино-N'-бутаноил-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбогидразид гидрохлорида (пример 53)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 81%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=2.87 мин, M/Z (ES+) 447/449 [M+H+] 82% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 10.49 (s, 1Н), 9.93 (s, 1Н), 8.31 (s, 3Н), 8.06-8.00 (m, 1Н), 7.80-7.73 (m, 2H), 7.35-7.27 (m, 4H), 5.49-5.39 (m, 1Н), 4.99-4.89 (m, 1H), 4.05 (dd, J=11.7, 6.9 Гц, 1Н), 3.68-3.60 (m, 1H), 3.24 (t, J=11.6 Гц, 1Н), 2.17 (t, J=7.3 Гц, 2Н), 1.58 (h, J=7.4 Гц, 2Н), 0.92 (t, J=7.4 Гц, 3Н)
Синтез (3R)-3-амино-N-бутил-5-[(4-хлор-2-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 54)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 99%.
LCMS: MET-uPLC-AB-101, rt=2.39 мин, M/Z (ES+) 454/456 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.46 (t, J=5.4 Гц, 1H), 8.42-8.19 (m, 3Н), 7.85 (d, J=6.4 Гц, 1H), 7.63 (d, J=9.3 Гц, 1H), 7.43 (t, J=8.2 Гц, 1H), 7.36 (dd, J=9.8, 2.0 Гц, 1H), 7.22 (dd, J=8.3, 2.0 Гц, 1H), 5.35 (d, J=15.3 Гц, 1H), 4.90 (d, J=15.3 Гц, 1H), 3.98 (dd, J=11.6, 6.9 Гц, 1H), 3.64 (dd, J=11.4, 6.9 Гц, 1H), 3.30-3.22 (m, 2H), 3.18 (t, J=11.6 Гц, 1Н), 1.50 (p, J=7.1 Гц, 2Н), 1.39-1.28 (m, 2Н), 0.91 (t, J=7.4 Гц, 3Н).
Синтез (3R)-3-амино-5-[(4-хлор-2-фторфенил)метил]-8-фтор-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 55)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 100%.
LCMS: MET-uPLC-AB-101, rt=2.05 мин, M/Z (ES+) 496/498 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.52 (t, J=5.7 Гц, 1H), 8.48-8.27 (m, 3Н), 7.83 (d, J=6.4 Гц, 1H), 7.63 (d, J=9.3 Гц, 1H), 7.42 (t, J=8.2 Гц, 1H), 7.36 (dd, J=9.8, 2.0 Гц, 1H), 7.21 (dd, J=8.3, 1.9 Гц, 1H), 5.34 (d, J=15.3 Гц, 1H), 4.90 (d, J=15.3 Гц, 1H), 3.99 (dd, J=11.7, 6.9 Гц, 1H), 3.85 (dd, J=11.3, 2.6 Гц, 2Н), 3.67-3.60 (m, 1H), 3.26 (td, J=11.7, 1.8 Гц, 2H), 3.22-3.10 (m, 3H), 1.83-1.71 (m, 1H), 1.62-1.53 (m, 2H), 1.26-1.15 (m, 2H).
Синтез (3R)-3-амино-5-[(4-хлор-3-фторфенил)метил]-8-фтор-N-(оксан-4-илметил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 56)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 76%.
LCMS: METCR1600, rt=4.01 мин, M/Z (ES+) 496/498 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.63-8.46 (m, 4H), 7.70 (d, J=6.4 Гц, 1H), 7.65 (d, J=9.2 Гц, 1H), 7.51 (t, J=8.0 Гц, 1H), 7.36 (d, J=10.4 Гц, 1H), 7.16 (d, J=8.2 Гц, 1H), 5.25 (d, J=15.7 Гц, 1H), 5.04 (d, J=15.7 Гц, 1H), 4.03 (dd, J=11.7, 6.8 Гц, 1H), 3.89-3.81 (m, 2H), 3.75-3.64 (m, 1H), 3.30-3.21 (m, 3H), 3.21-3.07 (m, 2H), 1.81 -1.66 (m, 1H), 1.56 (d, J=11.1 Гц, 2H), 1.25-1.13 (m, 2H).
Синтез (3R)-3-амино-N-бутил-5-[(4-хлор-3-фторфенил)метил]-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамида (Пример 57)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 27%.
LCMS: METCR1278 Generic 3.5 minutes, rt=2.4 мин, M/Z (ES+) 454/456 [М+Н+] 96% УФ
ЯМР данные: 1H ЯМР (500 МГц, MEtOH-d4) d 7.74 (d, J=6.6 Гц, 1H), 7.47 (d, J=9.8 Гц, 1H), 7.32 (t, J=7.9 Гц, 1H), 7.25 (dd, J=10.1, 1.9 Гц, 1H), 7.10 (d, J=8.2 Гц, 1H), 5.41 (d, J=15.4 Гц, 1H), 4.81 (d, J=10.2 Гц, 1H), 3.62-3.49 (m, 2H), 3.45-3.34 (m, 2H), 3.01-2.89 (m, 1H), 1.59 (p, J=7.2 Гц, 2H), 1.50-1.35 (m, 2H), 0.97 (t, J=7.4 Гц, 3Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-N-пропокси-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 58)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 68%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.06 мин, M/Z (ES+) 438/440 [M+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 11.62 (s, 1H), 8.42 (s, 3H), 7.79 (d, J=6.2 Гц, 1H), 7.64 (d, J=9.1 Гц, 1H), 7.31 (dd, 4H), 5.34 (d, J=15.4 Гц, 1H), 4.91 (d, J=15.4 Гц, 1H), 4.08-3.99 (m, 1H), 3.84 (t, J=6.5 Гц, 2Н), 3.68-3.61 (m, 1H), 3.24 (t, J=11.5 Гц, 1H), 1.61 (h, J=7.2 Гц, 2Н), 0.93 (t, J=7.4 Гц, 3H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(2-метилпропокси)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 59)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 90%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.21 мин, M/Z (ES+) 452/453 [M+H+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 11.65 (s, 1H), 8.35 (s, 3H), 7.80 (d, J=6.2 Гц, 1H), 7.65 (d, J=9.0 Гц, 1H), 7.34 (d, J=8.4 Гц. 2Н), 7.30 (d, J=8.4 Гц, 2Н), 5.35 (d, J=15.5 Гц, 1H), 4.92 (d, J=15.3 Гц, 1H), 4.04 (dd, J=11.2, 7.0 Гц, 1H), 3.67 (dd, J=17.1, 5.6 Гц, 3H), 3.24 (t. J=11.5 Гц, 1H), 1.93 (dt, J=13.4, 6.7 Гц, 1H), 0.94 (d, J=6.7 Гц, 6Н)
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N'-(2-метилпропил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбогидразид гидрохлорида (пример 60)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 99%.
LCMS: MET-UHPLC-AB-101, rt=2.28 мин, M/Z (ES+) 451/452 [М+Н+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 10.15 (s, 1H), 8.44 (s, 3H), 7.74 (d, J=6.3 Гц, 1H), 7.64 (d, J=9.2 Гц, 1H), 7.37-7.28 (m, 4H), 5.29 (d, J=15.4 Гц, 1H), 4.96 (d, J=15.4 Гц, 1H), 4.05 (s, 1H), 3.65 (dd, J=11.4. 6.8 Гц, 1H), 3.24 (s, 1H), 2.66 (d, J=6.7 Гц, 2H), 1.75 (m, 1H), 0.92 (d, J=6.7 Гц, 6Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-4-оксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 61)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 92%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.08 мин, M/Z (ES+) 404/406 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (250 МГц, DMSO-d6) δ 1.19 (d, J=6.60 Гц, 6Н), 3.16-3.29 (m, 1H), 3.58-3.74 (m, 1H), 4.00 (dd, J=6.76, 11.58 Гц, 1H), 4.12 (dq, J=6.60, 13.83 Гц, 1H), 4.99 (d, J=15.41 Гц, 1H), 5.41 (d, J=15.39 Гц, 1H), 7.24-7.40 (m, 4H), 7.71 (d, J=8.03 Гц, 1H), 7.79 (dd, J=1.65, 8.05 Гц, 1H), 8.03 (d, J=1.53 Гц, 1H), 8.20-8.66 (m, 4H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2-метилпропокси)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 62)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 82%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.19 мин, M/Z (ES+) 434/436 [M+H+] 93% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 11.93 (s. 1H), 8.43 (s, 3H), 7.99-7.92 (m, 1H), 7.85-7.70 (m, 1H), 7.69-7.62 (m, 1H), 7.40-7.25 (m, 4H), 5.44-5.26 (m, 1H), 5.05 -4.92 (m, 1H), 4.09-3.96 (m, 1H), 3.72-3.62 (m, 3H), 3.24 (t, J=11.6 Гц, 1H), 2.00-1.86 (m, 1H), 1.01-0.80 (m, 6H)
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3-метилбутан-2-ил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 63)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 98%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.27 мин, M/Z (ES+) 432/434 [M+H+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.40-8.12 (m, 4H), 7.97 (dd, J=4.5, 1.7 Гц, 1H), 7.80-7.75 (m, 1H), 7.71 (d, J=8.0 Гц, 1H), 7.35-7.27 (m, 4H), 5.36 (d, J=15.3 Гц, 1H), 5.00 (dd, J=15.5, 7.8 Гц, 1H), 4.01 (dd, J=11.1, 7.5 Гц, 1H), 3.88-3.76 (m, 1H), 3.65-3.58 (m, 1H), 3.22 (td, J=11.6, 3.9 Гц, 1Н), 1.76 (h, J=6.9 Гц, 1H), 1.11 (dd, J=6.8, 3.3 Гц, 3H), 0.88 (t, J=7.1 Гц, 6Н)
Синтез (3R)-3-амино-N-(бут-3-ен-1-ил)-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 64)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 98%.
LCMS: MET-UHPLC-AB-101, rt=2.1 мин, M/Z (ES+) 416/418 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.74 (t, J=5.6 Гц, 1Н), 8.53-8.16 (m, 3Н), 8.02 (d, J=1.4 Гц, 1Н), 7.77-7.66 (m, 2H), 7.34-7.28 (m, 4H), 5.82 (ddt, J=17.0, 10.3, 6.7 Гц, 1Н), 5.42 (d, J=15.5 Гц, 1Н), 5.11-5.00 (m, 2H), 4.98 (d, J=15.5 Гц, 1Н), 4.01 (dd, J=11.7, 6.7 Гц, 1Н), 3.64 (dd, J=11.4,6.8 Гц, 1Н), 3.39-3.35 (m, 2H), 3.23 (dd, J=13.1, 10.0 Гц, 1Н), 2.29 (q, J=7.0 Гц, 2Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N'-(2-метилпропил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбогидразид гидрохлорида (пример 65)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 61%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.11 мин, M/Z (ES+) 433/435 [М+Н+] 92% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 10.96 (s, 2H), 8.44 (s, 3H), 8.08 (s, 1Н), 7.81-7.71 (m, 2H), 7.35-7.26 (m, 4H), 5.43 (d, J=15.4 Гц, 1Н), 5.01 (d, J=15.5 Гц, 1Н), 4.09-3.97 (m, 1Н), 3.68-3.61 (m, 1Н), 3.30-3.21 (m, 1Н), 2.77 (d, J=6.5 Гц, 2Н), 1.89 -1.78 (m, 1Н), 0.98-0.91 (m, 6H).
Согласно описанной выше и проиллюстрированной общей методике GP5 следующие примеры были синтезированы из промежуточного соединения IX:
Синтез (3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-1,4-диоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 66)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 75%.
LCMS: METCR1600, rt=3.77 мин, M/Z (ES+) 434/436 [М+Н+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 8.76 (t, J=5.6 Гц, 1Н), 8.25 (s, 3H), 8.16-8.02 (m, 2H), 7.75 (d, J=8.1 Гц, 1Н), 7.37 (d, J=8.4 Гц, 2Н), 7.26 (d, J=8.4 Гц, 2Н), 5.38 (d, J=15.0 Гц, 1Н), 4.90 (d, J=15.0 Гц, 1Н), 4.22-4.10 (m, 2Н), 3.32-3.22 (m, 3H), 1.54 (p, J=7.1 Гц, 2Н), 1.45-1.24 (m, 2Н), 0.92 (t, J=7.4 Гц, 3Н).
Синтез (3R)-3-амино-N-бутил-1,1,4-триоксо-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 67)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 72%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.27 мин, M/Z (ES+) 500 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 8.87 (t, J=5.6 Гц, 1Н), 8.46 (s, 3H), 8.04 (s, 2Н), 7.93 (s, 1Н), 7.52 (d, J=8.7 Гц, 2Н), 7.32 (d, J=8.1 Гц, 2Н), 5.27 (d, J=15.8 Гц, 1Н), 4.99 (d, J=15.8 Гц, 1Н), 4.46 (dd, J=10.9, 7.6 Гц, 1Н), 4.13 (dd, J=13.3. 7.5 Гц, 1Н), 3.96 (dd, J=13.1, 11.2 Гц, 1Н), 3.27 (q, J=6.6 Гц, 2Н), 1.50 (p, J=7.1 Гц, 2Н), 1.31 (h, J=7.3 Гц, 2Н), 0.89 (t, J=7.4 Гц, 3Н).
Синтез (3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 69)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 72%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=2.33 мин, M/Z (ES+) 468/470 [M+H+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.68-8.50 (m, 4H), 7.81 (d, J=8.4 Гц, 1H), 7.63 (d, J=5.5 Гц, 1Н), 7.38 (s, 4H), 5.21 (d, J=15.7 Гц, 1Н), 4.86 (d, J=15.7 Гц, 1Н), 4.48 (dd, J=10.9, 7.5 Гц, 1Н), 4.14 (dd, J=13.3, 7.5 Гц, 1Н), 4.04-3.90 (m, 1Н), 3.29-3.11 (m, 2H), 1.47 (p, J=7.0 Гц, 2Н), 1.35-1.24 (m, 2H), 0.88 (t, J=7.4 Гц, 3Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(4,4,4-трифтор-бутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 70)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде розового твердого вещества при выходе 99%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.29 мин, M/Z (ES+) 522/524 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 8.76 (t, J=5.6 Гц, 1Н), 8.52 (s, 3H), 7.83 (d, J=8.4 Гц, 1Н), 7.71 (d, J=5.5 Гц, 1Н), 7.42-7.32 (m, 4H), 5.18 (d, J=15.7 Гц, 1Н), 4.91 (d, J=15.7 Гц, 1Н), 4.47 (dd, J=10.9, 7.6 Гц, 1Н), 4.13 (dd, J=13.3, 7.5 Гц, 1Н), 3.98 (dd, J=13.2, 11.0 Гц, 1Н), 3.37 (d, J=6.6 Гц, 2H), 2.35-2.22 (m, 2H), 1.72 (dt, J=14.7, 6.9 Гц, 2Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(оксан-4-илметил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 71)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 87%.
LCMS: METCR1673 Generic 2 minutes, rt=1.02 мин, M/Z (ES+) 510/512 [M+H+] 92% УФ ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 8.65 (s, 1H), 7.96 (bs, 3H), 7.81 (d, J=8.7 Гц, 1H), 7.60 (s, 1H), 7.39 (s, 4H), 5.22 (d, J=14.8 Гц, 1H), 4.84 (d, J=16.0 Гц, 1H), 4.39 (s, 1H), 4.10 (s, 1H), 3.97 (s, 1H), 3.85 (s, 2H), 3.14 (s, 2H), 1.74 (s, 1H), 1.53 (d, J=11.7 Гц, 3H), 1.18 (d, J=9.0 Гц, 3Н).
Синтез (3R)-3-амино-8-фтор-N-(оксан-4-илметил)-1,1,4-триоксо-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 72)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 95%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.12 мин, M/Z (ES+) 560 [M+H+], 94% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 1.18 (qd, J=4.32, 12.21 Гц, 2H), 1.53 (d, J=12.72 Гц, 2H), 1.66-1.80 (m, 1H), 3.14 (dh, J=6.24, 25.75 Гц, 2H), 3.25 (t, J=11.57 Гц, 2H), 3.78-3.89 (m, 2H), 3.93-4.05 (m, 1H), 4.13 (dd, J=7.47, 13.32 Гц, 1H), 4.48 (dd, J=7.59, 10.81 Гц, 1H), 4.87 (d, J=15.84 Гц, 1H), 5.25 (d, J=15.77 Гц, 1H), 7.32 (d, J=8.27 Гц, 2H), 7.50 (d, J=8.61 Гц, 2H), 7.63 (d, J=5.42 Гц, 1H), 7.83 (d, J=8.33 Гц, 1Н), 8.47 (s, 3H), 8.67 (t, J=5.83 Гц, 1Н).
Синтез (3R)-3-амино-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-5-{[4-(трифторметокси)-фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 73)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 100%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.35 мин, M/Z (ES+) 572 [M+H+] 97% УФ ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 1.72 (dt, J=7.00, 14.60 Гц, 2Н), 2.21-2.34 (m, 2Н), 3.32-3.40 (m, 2Н), 3.99 (dd, J=11.15, 13.06 Гц, 1Н), 4.14 (dd, J=7.51, 13.32 Гц, 1Н), 4.47 (dd, J=7.60. 10.84 Гц, 1Н), 4.91 (d, J=15.77 Гц, 1Н). 5.24 (d, J=15.77 Гц, 1Н), 7.31 (d, J=8.33 Гц, 2Н), 7.50 (d, J=8.60 Гц, 2Н), 7.69 (d, J=5.47 Гц, 1Н), 7.84 (d, J=8.42 Гц, 1Н), 8.49 (s, 3H), 8.76 (t, J=5.66 Гц, 1Н).
Синтез (3R)-3-амино-8-фтор-1,1,4-триоксо-N-фенокси-5-{[4-(трифторметокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 74)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 46%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.31 мин, M/Z (ES+) 554 [М+Н+] 96% УФ ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 3.97-4.07 (m, 1Н), 4.16 (dd, J=7.42, 13.19 Гц, 1Н), 4.53 (dd, J=7.86, 10.51 Гц, 1Н), 4.98 (d, J=15.63 Гц, 1Н), 5.25 (d, J=15.87 Гц, 1Н), 7.08 (d, J=7.91 Гц, 3H), 7.26-7.42 (m, 4H), 7.52 (d, J=8.50 Гц, 2Н), 7.88 (d, J=4.07 Гц, 1Н), 7.93 (d, J=8.27 Гц, 1Н), 8.59 (s, 3H), 12.80 (s, 1Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(2-метилпропокси)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 75)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.16 мин, M/Z (ES+) 484/486 [M+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 0.93 (d, J=6.69 Гц, 6Н), 1.90 (dp, J=6.97, 13.67 Гц, 1Н), 3.67 (dd, J=2.94, 6.55 Гц, 2Н), 3.99 (t, J=11.95 Гц, 1Н), 4.06-4.20 (m, 1Н), 4.48 (dd, J=7.77, 10.75 Гц, 1Н), 4.92 (d, J=15.64 Гц, 1Н), 5.17 (d, J=15.57 Гц, 1Н), 7.38 (s, 4Н), 7.72 (d, J=4.81 Гц, 1Н), 7.84 (d, J=8.21 Гц, 1Н), 8.62 (s, 3H), 11.83 (s, 1Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-фенокси-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 76)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 57%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.21 мин, M/Z (ES+) 504/506 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 7.89 (d, J=8.4 Гц, 1Н), 7.83 (d, J=5.2 Гц, 1Н), 7.40 (d, J=6.6 Гц, 6Н), 7.09 (dd, J=13.1, 7.7 Гц, 3H), 5.21 (d, J=15.8 Гц, 1Н), 4.94 (d, J=15.8 Гц, 1Н), 4.28 (s, 1Н), 4.07 (dd, J=13.2, 7.4 Гц, 1Н), 3.96-3.84 (m, 1Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 77)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 95%.
LCMS: MET-uHPLC-AB-101, rt=2.09 мин, M/Z (ES+) 454/456 [M+H+] 100% УФ ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.71-8.18 (m, 4Н), 7.80 (d, J=8.2 Гц, 1Н), 7.62 (d, J=5.4 Гц, 1Н), 7.38 (s, 4Н), 5.20 (d, J=15.6 Гц, 1Н), 4.88 (d, J=15.6 Гц, 1Н), 4.46-4.39 (m, 1Н), 4.12 (dd, J=13.2, 7.4 Гц, 1Н), 4.07-3.93 (m, 2Н), 1.14 (dd, J=8.4,6.7 Гц, 6Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-({4-[(5-ацетамидопентил)окси]фенил}-метил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепнн-7-карбоксамид гидрохлорида (пример 78)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 95%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.2 мин, M/Z (ES+) 627/629 [M+H+] 95% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 9.39 (t, J=5.9 Гц, 1Н), 8.60 (s, 3H), 8.10-8.01 (m, 2H), 7.99 (s, 1Н), 7.81 (s, 1Н), 7.44-7.33 (m, 4H), 7.21 (d, J=8.6 Гц, 2Н), 6.89 (d, J=8.7 Гц, 2H), 5.22 (d, J=15.7 Гц, 1Н), 5.00 (d. J=15.7 Гц, 1Н), 4.49 (dd, J=10.9, 7.6 Гц, 1Н), 4.42 (d, J=5.9 Гц, 2H), 4.11 (dd, J=13.3, 7.5 Гц, 1Н), 4.03-3.89 (m, 3H), 3.03 (q, J=6.5 Гц, 2H), 1.78 (s, 3H), 1.69 (p, J=6.7 Гц, 2H), 1.50-1.31 (m, 4H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 79)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 92%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.02 мин, M/Z (ES+) 436/438 [M+H+], 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 1.17 (dd, J=1.56, 6.58 Гц, 6Н), 3.95 (dd, J=11.30, 13.11 Гц, 1Н), 4.01-4.17 (m, 2H), 4.42 (dd, J=7.48, 11.05 Гц, 1Н), 4.95 (d, J=15.70 Гц, 1Н), 5.24 (d, J=15.70 Гц, 1Н), 7.32-7.45 (m, 4H), 7.92 (s, 1H), 7.97-8.08 (m, 2Н), 8.50 (s, 3H), 8.65 (d, J=7.61 Гц, 1Н)
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 80)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 98%.
LCMS: MET-uHPLC-AB-101, rt=2.29 мин, M/Z (ES+) 504/506 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.02 (t, J=5.6 Гц, 1Н), 8.49 (s, 3H), 8.04 (s, 2Н), 7.97 (s, 1Н), 7.42-7.33 (m, 4H), 5.23 (d, J=15.7 Гц, 1Н), 4.99 (d, J=15.7 Гц, 1Н), 4.45 (dd, J=10.9, 7.6 Гц, 1Н), 4.11 (dd, J=13.3, 7.5 Гц, 1Н), 3.96 (dd, J=13.1, 11.3 Гц, 1Н), 3.37-3.35 (m, 2Н), 2.34-2.24 (m, 2Н). 1.75 (dt, J=14.7, 7.1 Гц, 2Н).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2-метилпропокси)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 81)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 79%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.14 мин, M/Z (ES+) 466/468 [M+H+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 12.11 (s, 1Н), 8.54 (s, 3H), 8.15-7.98 (m, 1Н), 8.01-7.89 (m, 1Н), 7.89-7.84 (m, 1Н), 7.46-7.28 (m, 4H), 5.33-5.16 (m, 1H), 5.02-4.79 (m, 1Н), 4.54-4.41 (m, 1Н), 4.17-4.06 (m, 1Н), 4.03-3.90 (m, 1Н), 3.77-3.62 (m, 2Н), 1.91 (dt, J=13.4, 6.8 Гц, 1Н), 1.00-0.78 (m, 6H)
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-пропокси-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 82)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 68%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3 мин, M/Z (ES+) 452/454 [М+Н+] 95% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 12.10 (s, 1Н), 8.57 (s, 3H), 8.14-7.82 (m, 3H), 7.46-7.32 (m, 4H), 5.32-5.14 (m, 1H), 5.02-4.77 (m, 1H), 4.55-4.40 (m, 1H), 4.18-4.05 (m, 1H), 4.03-3.89 (m, 1H), 3.84 (t, J=6.5 Гц, 2H), 1.60 (h, J=7.1 Гц, 2H), 0.99-0.82 (m, 3H)
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3-метилбутан-2-ил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 83)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 86%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.23 мин, M/Z (ES+) 464/466 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.86-8.17 (m, 4Н), 8.09-7.98 (m, 2Н), 7.86 (d, J=20.5 Гц, 1Н), 7.45-7.35 (m, 4Н), 5.28 (dd, J=15.7, 11.0 Гц, 1Н), 4.92 (dd, J=15.7, 4.5 Гц, 1H), 4.47 (dt, J=11.0, 7.3 Гц, 1H), 4.16-4.07 (m, 1H), 3.97 (dd, J=13.2, 11.2 Гц, 1H), 3.81 (dt, J=13.9, 6.8 Гц, 1H), 1.75 (dp, J=13.6, 6.7 Гц, 1H), 1.11 (d, J=6.8 Гц, 3H), 0.93-0.80 (m, 6H)
Синтез (3R)-3-амино-N-(бут-3-ен-1-ил)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 84)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 96%.
LCMS: MET-uHPLC-AB-101, rt=2.11 мин, M/Z (ES+) 448/450 [М+Н+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.91 (t, J=5.5 Гц, 1H), 8.55 (s, 3H), 8.02 (q, J=8.2 Гц, 2H), 7.92 (s, 1H), 7.41-7.35 (m, 4H), 5.80 (ddt, J=17.0, 10.2, 6.7 Гц, 1H), 5.22 (d, J=15.8 Гц, 1H), 5.09-4.99 (m, 2H), 4.97 (d, J=15.8 Гц, 1H), 4.47 (dd, J=10.9, 7.6 Гц, 1H), 4.11 (dd, J=13.3, 7.5 Гц, 1H), 4.00-3.93 (m, 1H), 3.37-3.34 (m, 2H), 2.28 (q, J=6.9 Гц, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-циклопронил-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 85)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 99%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.02 мин, M/Z (ES+) 452/454 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) 8.70 (d, J=4.3 Гц, 1H), 8.39 (s, 3H), 7.79 (d, J=8.3 Гц, 1H), 7.68 (d, J=5.5 Гц, 1H), 7.37 (s, 4H), 5.16 (d, J=15.6 Гц, 1H), 4.91 (d, J=15.6 Гц, 1H), 4.42 (dd, J=10.9, 7.6 Гц, 1H), 4.11 (dd, J=13.3, 7.5 Гц, 1H), 3.96 (dd, J=13.2, 11.1 Гц, 1H), 2.83 (tq, J=7.9, 4.0 Гц, 1H), 0.76-0.65 (m, 2H), 0.53 (dd, J=3.8, 1.9 Гц, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-циклобутил-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 86)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 95%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.13 мин, M/Z (ES+) 466/468 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.90 (d, J=7.6 Гц, 1H), 8.64 (s, 311), 7.80 (d, J=8.3 Гц, 1H), 7.66 (d, J=5.5 Гц, 1H), 7.42-7.32 (m, 4H), 5.18 (d, J=15.7 Гц, 1H), 4.91 (d, J=15.7 Гц, 1H), 4.44 (dd, J=11.0, 7.5 Гц, 1H), 4.35 (h, J=8.0 Гц, 1H), 4.17 (dd, J=13.3, 7.5 Гц, 1H), 3.99 (dd, J=13.2, 11.1 Гц, 1H), 2.22 (dtp, J=15.2, 7.8, 4.0, 3.5 Гц, 2H), 2.00 (p, J=9.6 Гц, 2H), 1.68 (ddt, J=14.7, 10.4, 5.8 Гц, 2H)
Синтез (3R)-3-амино-5-1(4-хлор-2-фторфенил)метил]-8-фтор-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 87)
Указанное в названии сое динение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 66%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.09 мип, M/Z (ES+) 472/474 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.64 (s, 3H), 8.57 (d, J=7.6 Гц, 1Н), 7.87 (d, J=5.4 Гц, 1H), 7.79 (d, J=8.3 Гц, 1H), 7.46 (t, J=8.2 Гц, 1H), 7.35 (dd, J=9.8, 2.0 Гц, 1H), 7.22 (dd, J=8.3, 1.9 Гц, 1H), 5.14-4.99 (m, 2H), 4.39 (dd, J=10.9, 7.5 Гц, 1H), 4.12 (dd, J=13.4, 7.5 Гц, 1H), 4.05 (dt, J=13.4, 6.7 Гц, 1H), 3.91 (dd, J=13.2, 11.1 Гц, 1H), 1.17 (t, J=6.2 Гц, 6H)
Синтез (3R)-3-амино-5-[(3,4-дихлорфенил)метил]-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 88)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 94%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.13 мин, M/Z (ES+) 470/472/474 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.66 (d, J=7.7 Гц, 1Н), 8.58 (s, 3H), 8.08-8.00 (m, 2H), 7.94 (d, 1H), 7.68 (d, J=1.9 Гц, 1H), 7.58 (d, J=8.3 Гц, 1H), 7.33 (dd, J=8.3, 2.0 Гц, 1H), 5.22 (d, J=15.8 Гц, 1H), 5.00 (d, J=15.8 Гц, 1H), 4.45 (dd, J=11.0, 7.5 Гц, 1H), 4.16-4.02 (m, 2H), 3.96 (dd, J=13.2, 11.2 Гц, 1H), 1.18 (dd, J=6.6, 2.6 Гц, 6H)
Синтез (3R)-3-амино-5-[(4-хлор-3-фторфенил)метил]-1,1,4-триоксо-N-(пропан-2-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 89)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 92%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.05 мин, M/Z (ES+) 454/456 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.65 (d, J=7.7 Гц, 1Н), 8.58 (s, 3H), 8.09-8.00 (m, 211), 7.90 (d, J=1.1 Гц, Hi), 7.54 (t, J=8.0 Гц, 1H), 7.45 (dd, J=10.4, 1.8 Гц, 1H), 7.23 (dd, J=8.3, 1.6 Гц, 1H), 5.26 (d, J=16.0 Гц, 1H), 4.95 (d, J=16.0 Гц, 1H), 4.46 (dd, J=11.0, 7.5 Гц, 1H), 4.17-4.02 (m, 2H), 3.97 (dd, J=13.2, 11.2 Гц, 1H), 1.17 (dd, J=6.6, 2.4 Гц, 6H)
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(циклогексилокси)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 90)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 44%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.28 мин, M/Z (ES+) 492/494 [M+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 1.14-1.56 (m, 6Н), 1.71 (s, 2Н), 1.86 (s, 211), 3.85 (s, 1H), 3.96 (t, J=11.84 Гц, 1H), 4.06-4.23 (m, 1H), 4.45 (s, 1H), 4.93 (d, J=15.42 Гц, 1H), 5.23 (d, J=15.64 Гц, 1H), 7.21-7.51 (m, 4H), 7.84 (s, 1H), 7.98 (m, 2H), 8.47 (s, 311), 11.89 (s, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(циклогексилметокси)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 91)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 82%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.47 мин, M/Z (ES+) 506/508 [М+Н+]100%УФ
ЯМР данные: 1H ЯМР (250 МГц, DMSO-d6) δ 0.75-1.39 (m, 5Н), 1.47-1.92 (m, 6Н), 3.70 (d, J=5.77 Гц, 2Н), 3.83-4.04 (m, 1H), 4.13 (dd, J=7.51, 13.25 Гц, 1H), 4.33-4.53 (m, 1H), 4.96 (d, J=15.65 Гц, 1H), 5.22 (d, J=15.95 Гц, 1H), 7.39 (s, 4H), 7.78-8.12 (m, 3H), 8.44 (s, 3H), 12.12 (s, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(2,2,2-трифтор-этил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 92)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 86%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.14 мин, M/Z (ES+) 494/496 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.36 (t, J=6.3 Гц, 1H), 8.68 (s, 3H), 7.86 (d, J=8.4 Гц, 1H), 7.70 (d, J=5.5 Гц, 1H), 7.55-7.22 (m, 4H), 5.21 (d, J=15.7 Гц, 1H), 4.89 (d, J=15.7 Гц, 1H), 4.49 (dd, J=10.9, 7.5 Гц, 1H), 4.26-3.92 (m, 4H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-[(2S)-1,1,1-трифторпропан-2-ил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 94)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 45%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.27 мин, M/Z (ES+) 508/510 [М+Н+] 98% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.27 (d, J=8.8 Гц, 1H), 8.68 (s, 3H), 7.86 (d, J=8.2 Гц, 1H), 7.59 (d, J=5.4 Гц, 1H), 7.39 (q, J=8.6 Гц, 4H), 5.24 (d, J=15.6 Гц, 1H), 4.93-4.68 (m, 211), 4.45 (dd, J=10.9, 7.5 Гц, 1H), 4.18 (dd, J=13.3, 7.5 Гц, 1H), 4.01 (dd, J=13.2, 11.2 Гц, 1H), 1.33 (d, J=7.0 Гц, 3H).
Синтез (3R)-3-амино-N-(бутан-2-ил)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 95)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 95%.
LCMS: MET-uHPLC-AB-101, rt=2.27 мин, M/Z (ES+) 468/470 [М+Н+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.49 (s, 3H), 8.39 (d, J=8.2 Гц, 1H), 7.81 (d, J=8.2 Гц, 1Н), 7.55 (d, J=5.4 Гц, 1H), 7.40-7.37 (m, 4H), 5.25 (d, J=15.6 Гц, 1H), 4.83 (d, J=15.7 Гц, 1H), 4.45 (dd, J=10.9, 7.6 Гц, 1H), 4.14 (dd, J=13.3, 7.4 Гц, 1H), 4.04-3.95 (m, 1H), 3.85 (dt, J=14.1, 7.6 Гц, 1H), 1.51-1.40 (m, 2H), 1.11 (d, J=6.6 Гц, 3H), 0.81 (t, J=7.4 Гц, 3H).
Синтез (3R)-3-амино-N-трет-бутил-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 96)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 97%.
LCMS: MET-uHPLC-AB-101, rt=2.38 мин, M/Z (ES+) 468/470 [M+H+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.53 (s, 3H), 8.15 (s, 1Н), 7.78 (d, J=8.1 Гц, 1H), 7.54 (d, J=5.4 Гц, 1H), 7.39 (s, 4H), 5.22 (d, J=15.6 Гц, 1H), 4.85 (d, J=15.6 Гц, 1H), 4.42 (dd, J=10.8, 7.6 Гц, 1H), 4.13 (dd, J=13.3, 7.4 Гц, 1H), 4.02-3.95 (m, 1H), 1.34 (s, 9H).
Синтез (3R)-3-амино-N-(трет-бутокси)-5-[(4-хлорфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 97)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 99%.
LCMS: MET-uHPLC-AB-101, rt=2.07 мин, М/Z (ES+) 467/469 [M+H+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 11.32 (s, 1Н), 8.51 (s, 3H), 8.04 (d, J=8.1 Гц, 1H), 7.96 (d, J=8.3 Гц, 1H), 7.79 (s, 1H), 7.40 (q, J=8.6 Гц, 4H), 5.28 (d, J=15.7 Гц, 1H), 4.88 (d, J=15.7 Гц, 1H), 4.54-4.41 (m, 1H), 4.12 (dd, J=13.3, 7.4 Гц, 1H), 4.02-3.92 (m, 1H), 1.21 (s, 9H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-[(1S,2R)-2-фенилциклопропил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 98)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 94%.
LCMS: MET-uHPLC-AB-101, rt=2.66 мин, M/Z (ES+)528/530 [М+Н+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.00 (s, 1Н), 8.65 (s, 3H), 7.83 (d, J=8.3 Гц, 1H), 7.73 (d, J=3.9 Гц, 1H), 7.38 (s, 4H), 7.28 (t, J=7.5 Гц, 2H), 7.21-7.12 (m, 3H), 5.18 (d, J=15.7 Гц, 1H), 4.94 (dd, J=15.6, 4.7 Гц, 1H), 4.51-4.44 (m, 1H), 4.15 (dd, J=12.0, 7.6 Гц, 1H), 4.03-3.95 (m, 1H), 3.04 (dt, J=7.8, 3.9 Гц, 1H), 2.07 (td, J=6.3, 3.1 Гц, 1H), 1.28 (ddq, J=28.7, 12.0, 5.3 Гц, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(1-метилциклопропил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 99)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 99%.
LCMS: MET-uHPLC-AB-101, rt=2.13 мин, М/Z (ES+) 4667/468 [M+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.85 (s, 1H), 8.57 (s, 3H), 7.78 (d, J=8.3 Гц, 1H), 7.62 (d, J=5.5 Гц, 1H), 7.38 (s, 4H), 5.17 (d, J=15.6 Гц, 1H), 4.90 (d, J=15.6 Гц, 1H), 4.42 (dd, J=10.9, 7.5 Гц, 1H), 4.14 (dd, J=13.3, 7.5 Гц, 1H), 3.97 (dd, J=13.2, 11.1 Гц, 1H), 1.35 (s, 3H), 0.74-0.67 (m, 2H), 0.67-0.61 (m, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-8-(1-метилциклобутил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 100)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде коричневого твердого вещества при выходе 97%.
LCMS: MET-uHPLC-AB-101, rt=2.36 мин, M/Z (ES+) 480/482 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.63 (s, 1Н), 8.59-7.82 (m, 2H), 7.78 (d, J=8.2 Гц, 1H), 7.61 (d, J=5.4 Гц, 1H), 7.38 (s, 4H), 5.20 (d, J=15.7 Гц, 1H), 4.89 (d, J=15.6 Гц, 1H), 4.42-4.35 (m, 1H), 4.10 (dd, J=13.4, 7.4 Гц, 1H), 3.99-3.91 (m, 1H), 2.35-2.24 (m, 2H), 2.02-1.94 (m, 2H), 1.87-1.76 (m, 2H), 1.45 (s, 3H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2,2-диметилциклопропил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 101)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 100%.
LCMS: MET-uHPLC-AB-101, rt=2.35 мин, M/Z (ES+) 480/482 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.58 (d, J=3.9 Гц, 1Н), 8.41 (s, 3H), 7.81 (d, J=8.2 Гц, 1H), 7.53 (d, J=5.4 Гц, 1H), 7.40-7.35 (m, 4H), 5.25 (d, J=15.6 Гц, 1H), 4.82 (d, J=15.6 Гц, 1H), 4.46 (dd, J=10.8, 7.6 Гц, 1H), 4.13 (dd, J=13.3, 7.4 Гц, 1H), 3.99 (dd, J=13.1, 11.2 Гц, 1H), 2.55 (dt, J=8.2, 4.2 Гц, 1H), 1.06 (s, 3H), 0.92 (s, 3H), 0.69 (dd, J=7.9, 5.2 Гц, 1H), 0.45 (t, J=4.8 Гц, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3,3-дифторциклобутил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 102)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 59%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.11 мин, M/Z (ES+) 502/504 [М+Н+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.17 (d, J=6.5 Гц, 1Н), 8.49 (s, 3H), 7.85 (d, J=8.4 Гц, 1H), 7.75 (d, J=5.5 Гц, 1H), 7.38 (s, 4H), 5.18 (d, J=15.6 Гц, 1H), 4.94 (d, J=15.7 Гц, 1H), 4.46 (dd, J=10.9, 7.6 Гц, 1H), 4.31-4.19 (m, 1H), 4.14 (dd, J=13.3, 7.5 Гц, 1H), 3.98 (dd, J=13.2, 11.1 Гц, 1H), 3.06-2.92 (m, 2H), 2.77-2.65 (m, 2H).
Синтез (3R)-3-амино-N-бензил-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 103)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 97%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.28 мин, M/Z (ES+) 502/504 [М+Н+] 95% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 9.20 (t, J=6.0 Гц, 1Н), 7.91 (s, 3H), 7.83 (d, J=8.5 Гц, 1H), 7.71 (d, J=5.5 Гц, 1H), 7.43-7.32 (m, 6H), 7.32-7.22 (m, 3H), 5.21 (d, J=15.7 Гц, 1H), 4.88 (d, J=15.7 Гц, 1H), 4.48 (qd, J=15.2, 6.0 Гц, 2H), 4.42-4.36 (m, 1H), 4.11 (dd, J=13.3,7.4 Гц, 1H), 4.00-3.85 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-гептил-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 104)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде светло-коричневого твердого вещества при выходе 67%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.62 мин, M/Z (ES+) 510/512 [М+Н+] 95% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 8.62 (t, J=5.6 Гц, 4Н), 7.82 (d, J=8.4 Гц, 1H), 7.65 (d, J=5.5 Гц, 1H), 7.39 (t, J=2.6 Гц, 4H), 5.21 (d, J=15.8 Гц, 1H), 4.87 (d, J=15.7 Гц, 1H), 4.48 (dd, J=10.9, 7.6 Гц, 1H), 4.16 (dd, J=13.3, 7.5 Гц, 1H), 3.99 (dd, J=13.2, 11.1 Гц, 1H), 3.24 (dq, J=18.8, 7.1, 6.6 Гц, 2H), 1.53-1.44 (m, 2H), 1.27 (t, J=11.3 Гц, 8H), 0.87 (t, J=7.0 Гц, 3H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3,3-дифторциклопентил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 105)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 81%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.18 мин, M/Z (ES+) 516/518 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 8.89 (d, J=7.0 Гц, 1Н), 8.33 (s, 3H), 7.83 (d, J=8.3 Гц, 1H), 7.68 (d, J=5.4 Гц, 1H), 7.42-7.32 (m, 4H), 5.19 (d, J=15.7 Гц, 1H), 4.91 (d, J=15.6 Гц, 1H), 4.48-4.32 (m, 2H), 4.12 (dd, J=13.0, 7.2 Гц, 1H), 4.01-3.93 (m, 1H), 2.31-2.20 (m, 1H), 2.20-2.03 (m, 4H), 1.84-1.71 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1H)-2,2-дифторциклопропил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 106)
Указанное в названии соединение синтезировали согласно общей методике GP5 из промежуточного соединения IX-46 (стереохимически произвольно заданный) с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 71%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.05 мин, M/Z (ES+) 488/490 [M+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.15 (s, 1Н), 8.44 (s, 3H), 7.85 (d, J=8.4 Гц, 1H), 7.71 (d, J=5.4 Гц, 1H), 7.38 (s, 4H), 5.20 (d, J=15.6 Гц, 1H), 4.92 (d, J=15.6 Гц, 1H), 4.53-4.40 (m, 1H), 4.07-4.20 (m, 1H), 3.99 (1, J=12.0 Гц, 1H), 3.50 (dd, J=9.8, 6.2 Гц, 1H), 2.07-1.94 (m, 1H), 1.64 (d, J=5.3 Гц, 1H).
Альтернативно пример 106 синтезировали из промежуточного соединения VII-01, применяя (1R)-2,2-дифторциклопропан-1-амин гидрохлорид согласно GP7 и GP5.
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1S)-2,2-дифторциклопропил]-8-фтор-1,1,4-триоксо-2,394,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 107)
Указанное в названии соединение синтезировали согласно общей методике GP5 из промежуточного соединения IX-47 (стереохимически произвольно заданный) с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 86%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.05 мин, M/Z (ES+) 488/490 [M+H+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.15 (s, 1H), 8.44 (s, 3H), 7.85 (d, J=8.4 Гц, 1H), 7.71 (d, J=5.4 Гц, 1H), 7.38 (s, 4H), 5.20 (d, J=15.6 Гц, 1H), 4.92 (d, J=15.6 Гц, 1H), 4.53-4.40 (m, 1H), 4.07-4.20 (m, 1H), 3.99 (t, J=12.0 Гц, 1H), 3.50 (dd, J=9.8, 6.2 Гц, 1H), 2.07-1.94 (m, 1H), 1.64 (d, J=5.3 Гц, 1H).
Синтез (2R,3R)-3-амино-5-[(4-хлорфенил)метил]-N-(2,2-дифторциклопропил)-2-метил-1,l,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 108)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 91%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.09 мин, M/Z (ES+) 484/486 [М+Н+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) 9.32 (d, J=16.5 Гц, 1H), 8.58 (s, 3H), 8.12 (dd, J=8.2, 1.5 Гц, 1H), 8.07 (ddd, J=8.2, 4.1, 1.4 Гц, 1H), 8.04-7.94 (m, 1H), 7.39 (d, J=4.6 Гц, 4H), 5.28-5.18 (m, 1H), 5.09-4.94 (m, 1H), 4.64 (dd, J=9.9, 6.9 Гц, 1H), 4.16-4.06 (m, 1H), 3.49 (dd, J=15.2, 4.8 Гц, 1H), 2.09-1.96 (m, 1H), 1.80-1.69 (m, 1H), 1.47-1.37 (m, 3H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-гексадецил-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 109)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=5.52 мин, M/Z (ES+) 636/638 [M+H+] 94% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) 8.60 (t, J=5.6 Гц, 1H), 8.23 (s, 3H), 7.81 (d, J=8.4 Гц, 1H), 7.65 (d, J=5.5 Гц. 1H), 7.39 (s, 4H), 5.21 (d, J=15.7 Гц, 1H), 4.87 (d, J=15.7 Гц, 1H), 4.49-4.35 (m, 1H), 4.11 (dd, J=13.3, 7.5 Гц, 1H), 3.95 (d, J=13.0 Гц, 1H), 3.23 (dt, J=16.4, 7.0 Гц, 2H), 1.54-1.41 (m, 2H), 1.25 (s, 26H), 0.92-0.79 (m, 3H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(циклопропилметил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 110)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 46%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.23 мин, M/Z (ES+) 466/468 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.75-8.43 (m, 3H), 7.81 (d, J=8.4 Гц, 1Н), 7.65 (d, J=5.5 Гц, 1H). 7.41-7.34 (m, 4H), 5.20 (d, J=15.7 Гц, 1H), 4.86 (d, J=15.7 Гц, 1H), 4.49-4.43 (m, 1H), 4.18-4.11 (m, 1H), 4.02-3.95 (m, 1H), 3.21-3.08 (m, 2H), 1.02-0.95 (m, 1H), 0.45-0.40 (m, 2H), 0.21-0.17 (m, 2H).
(2R,3R)-3-амино-5-[(4-хлорфенил)метил]-2-метил-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 111)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 79%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.27 мин, M/Z (ES+) 518/520 [M+H+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.00 (t, J=5.6 Гц, 1H), 8.47 (s, 3H), 8.10 (d, J=8.2 Гц, 1H), 8.05 (dd, J=8.2, 1.4 Гц, 1H), 7.95 (d, J=1.2 Гц, 1H), 7.42-7.34 (m, 4H), 5.21 (d, J=15.8 Гц, 1H), 5.00 (d, J=15.7 Гц, 1H), 4.60 (d, J=6.7 Гц, 1H), 4.11 (p, J=6.9 Гц, 1H), 3.37 2H m, под пиком воды), 2.36-2.24 (m, 2H), 1.75 (dt, J=14.7, 7.1 Гц, 2H), 1.42 (d, J=7.0 Гц, 3H).
Согласно описанной выше и проиллюстрированной общей методике GP5 следующие дополнительные примеры синтезировали из промежуточного соединения VIII:
Синтез (3R)-3-амино-N-бутил-8-фтор-4-оксо-5-(хинолин-2-илметил)-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид дигидрохлорида (пример 112)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 76%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=3.2 мин, M/Z (ES+) 453 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 0.84 (t, J=7.32 Гц, 3H), 1.28 (dt, J=7.29, 14.80 Гц, 2Н), 1.44 (р, J=7.03 Гц, 2Н), 3.21 (dp, J=6.46, 13.47 Гц, 2Н), 3.29 (t, J=11.56 Гц, 1Н), 3.73 (dd, J=6.91, 11.38 Гц, 1Н), 4.05-4.18 (m, 1Н), 5.30 (d, J=12.79 Гц, 1Н), 5.41 (d, J=16.21 Гц, 1H), 7.62 (t, J=7.45 Гц, 1H), 7.65-7.74 (m, 2H), 7.78 (t, J=7.59 Гц, 1H), 7.98 (dd, J=8.25, 14.13 Гц, 2H), 8.02-8.08 (m, 1H), 8.37-8.47 (m, 2H), 8.54 (s, 3H)
Синтез (3R)-3-амино-5-[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-N-(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 113)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 86%.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=2.92 мин, M/Z (ES+) 502 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6)

Синтез (3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 114)
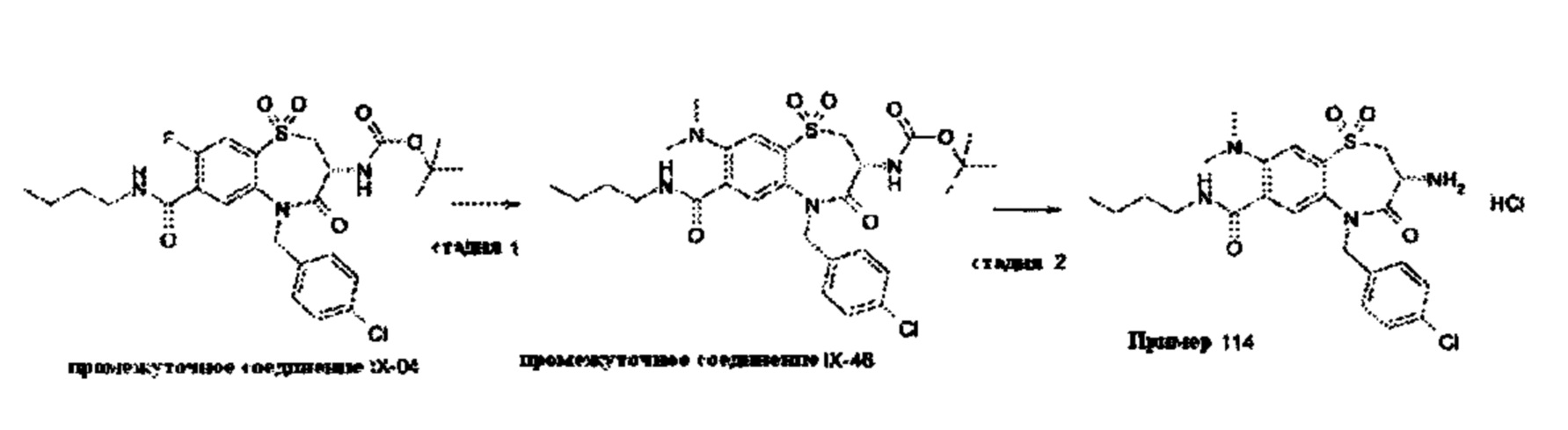
Стадия 1: Синтез трет-бутил N-[(3R)-7-(бутилкарбамоил)-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-48)
2 М N-метилметанамин в THF (170.76 мкл, 0.342 ммоль) добавили к перемешиваемому раствору промежуточного соединения IX-04 (97%о, 40.0 мг, 0.068 ммоль) в этаноле (2 мл) в герметичной пробирке. Реакцию нагрели до 80°C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении, растворили в DCM (5 мл), промыли водой (5 мл), высушили над Na2SO4 отфильтровали и концентрировали при пониженном давлении. Остаток очистили посредством обращеннофазовой колоночной хроматографии (Biotage, ацетонитрил : вода) с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 53%.
LCMS: METCR1673 Generic 2 minutes: rt=1.48 min M/Z (ES+) 593.15 [M+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.52 (t, J=5.7 Гц, 1H), 7.43 (d, J=8.3 Гц, 1H), 7.34 (s, 4H), 7.27 (s, 1H), 7.15 (s, 1H), 5.24 (d, J=16.0 Гц, 1H), 4.48 (d, J=15.9 Гц, 1H), 4.37 (dt, J=11.6, 7.6 Гц, 1H), 4.02 (dd, J=13.3, 7.3 Гц, 1H), 3.74-3.65 (m, 1H), 3.17 (q, J=6.7 Гц, 2H), 2.84 (s, 6H), 1.42 (dt, J=14.5, 6.9 Гц, 2H), 1.36 (s, 9H), 1.25-1.22 (m, 2H), 0.86 (t, J=7.4 Гц, 3H).
Стадия 2: Синтез (3R)-3-амино-N-бутил-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 114)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 89%.
LCMS: METCR-uPLC-AB101 rt=2.32 min M/Z (ES+) 493 [M+H+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.64 (s, 3H), 8.46 (t, J=5.7 Гц, 1H), 7.40 (s, 4Н), 7.26 (s, 1Н), 7.18 (s, 1Н), 5.24 (d, J=15.7 Гц, 1H), 4.55 (d, J=15.7 Гц, 1Н),4.36 (s, 1Н), 4.12 (dd, J=13.3, 7.4 Гц, 1Н), 3.91 (dd, J=13.2, 11.1 Гц, 1Н), 3.18 (qt, J=13.1, 6.7 Гц, 2Н), 2.87 (s, 6Н), 1.48-1.37 (m, 2Н), 1.25 (m, 2Н), 0.87 (t, J=7.3 Гц, 3H).
Синтез трет-бутил N-(5-{[(3R)-5-[(4-хлорфенил)метил]-8-фтор-7-{[(4-метоксифенил)метил]карбамоил}-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]амино}пентил)карбамата (Пример 115)
Пример 43 (200 мг, 0.37 ммоль) растворили в безводном MeCN (10 мл) и K2CO3 (129 мг, 2.5 экв.) добавили, а затем иодид калия (62 мг, 1 экв.). Трет-бутил N-{5-[(4-метилбензолсульфонил)окси]пентил}карбамат (159.93 мг, 0.45 ммоль) (ссылка: Otsuki, S. et al. Bioorg. Med. Chem. Lett., 23(6), 1608-1611) добавили в виде раствора в MeCN (3 мл), и реакционную смесь перемешивали при 80°C в течение 12 ч. Еще K2CO3 (115 мг, 2.2 экв.), иодид калия (65 мг, 1экв.) и трет-бутил N-{5-[(4-метилбензолсульфонил)окси]пентил}карбамат (160 мг, 0.45 ммоль) добавили в реакционную смесь, и нагревание продолжали в течение 3 ч. Дополнительный трет-бутил N-{5-[(4-метилбензолсульфонил)-окси]пентил}карбамат (160 мг, 0.45 ммоль) добавили, и реакционную смесь перемешивали при 80°C в течение 16 ч. Реакционную смесь охладили до комнатной температуры и концентрировали при пониженном давлении. Остаток растворили в DCM (15 мл) и промыли с помощью воды (2х 10 мл) и соляным раствором (10 мл). Органический слой высушили над Na2SO4 и концентрировали при пониженном давлении. Остатки очистили с помощью колоночной флэш-хроматографии (диоксид кремния, элюент: гептаны, 0-100% этилацетат) с получением 155 мг указанного в названии соединения в виде твердого вещества белого цвета при выходе 61%.
LCMS: METCR-uPLC-AB101 rt=2.92 min M/Z (ES+) 685/687 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.88 (t, J=6.1 Гц, 1Н), 7.72 (d, J=6.5 Гц, 1H), 7.52 (d, J=9.5 Гц, 1H), 7.38-7.18 (m, 6H), 6.90 (d, J=8.6 Гц, 2H), 6.72 (s, 1H), 5.25 (d, J=15.4 Гц, 1H), 4.89 (d, J=15.5 Гц, 1H), 4.47-4.29 (m, 2H), 3.74 (s, 3H), 3.48 (dd, J=11.2, 6.6 Гц, 1H), 3.28-3.22 (m, 1H), 2.94-2.82 (m, 3H), 2.41 (d, J=9.8 Гц, 1H), 2.21 (s, 1H), 2.11 (s, 1H), 1.36 (s, 9H), 1.34-1.25 (m, 4H), 1.24-1.14 (m, 2H).
Синтез (3R)-3-амино-N-бензил-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида
(Пример 116)
Стадия 1: Синтез трет-бутил N-[(3R)-7-(бензилкарбамоил)-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (Промежуточное соединение IX-112)
2 М N-метилметанамин в THF (0.15 мл, 0.3 ммоль) добавили к перемешиваемому раствору промежуточного соединения IX-41 (100%, 36.0 мг, 0.06 ммоль) в этаноле (2 мл) в герметичной пробирке. Реакцию нагрели до 80°C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении, растворили в DCM (5 мл), промыли водой и соляным раствором (5 мл), и высушили над Na2SO4 отфильтровали и концентрировали при пониженном давлении с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS: METCR1673 Generic 2 minutes: rt=1.30 min M/Z (ES+) 627/629 [M+H+] 100% УФ
ЯМР данные:1Н ЯМР (500 МГц, DMSO-d6) δ 9.10 (t, J=5.9 Гц, 1H), 7.44 (d, J=8.3 Гц, 1H), 7.37-7.23 (m, 11Н), 5.24 (d, J=16.0 Гц, 1Н), 4.53 (d, J=16.0 Гц, 1H), 4.39 (dd, J=14.0, 6.6 Гц, 3H), 4.03 (dd, J=13.3, 7.1 Гц, 1Н), 3.74-3.66 (m, 1Н), 2.81 (s, 6Н), 1.37 (s, 9Н).
Стадия 2: Синтез (3R)-3-амино-N-бензил-5-[(4-хлорфенил)метил]-8-(диметиламино)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 116)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 98%.
LCMS: METCR1416 Generic 2 minutes, rt=3.310 мин, M/Z (ES+)526.95/529.05 [M+H+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.03 (t, J=6.0 Гц, 1H), 8.35 (s, 3H), 7.43-7.36 (m, 4H), 7.34-7.29 (m, 2H), 7.28-7.22 (m, 5H), 5.21 (d, J=15.7 Гц, 1H), 4.58 (d, J=15.7 Гц, 1H), 4.47-4.28 (m, 3H), 4.08 (dd, J=13.4, 7.4 Гц, 1H), 3.92-3.83 (m, 1H), 2.82 (s, 6H).
Синтез (3R)-3-амино-N-(2,2-дифторциклопропил)-8-фтор-5-{[4-метокси-3-(трифторметил)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 117)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 99%.
LCMS: METCR1416 Generic 7 minutes, rt=3.28 мин, M/Z (ES+) 551.95 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.17 (d, J=14.6 Гц, 1Н), 8.43 (s, 3H), 7.96-7.76 (m, 211), 7.64 (s, 1H), 7.55 (d, J=8.6 Гц, 1H), 7.15 (d, J=8.7 Гц, 1H), 5.18-5.06 (m, 2H), 4.47-4.39 (m, 1H), 4.11 (dd, J=13.2, 7.4 Гц, 1H), 4.02-3.94 (m, 1H), 3.85 (d, J=1.2 Гц, 3H), 3.51 (s, 1H), 2.08-1.96 (m, 1H), 1.70-1.60 (m, 1H).
Синтез (2R,3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-2-метил-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 118)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде бесцветного твердого вещества при выходе 95%.
LCMS: METCR1416 Generic 7 minutes, rt=2.51 мин, M/Z (ES+) 536/538 [M+H+] 96% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.72 (s, 4Н), 7.88 (d, J=8.5 Гц, 1Н), 7.70 (d, J=5.5 Гц, 1H), 7.43-7.33 (m, 4H), 5.19 (d, J=15.7 Гц, 1H), 4.92 (d, J=15.7 Гц, 1H), 4.63 (d, J=6.8 Гц, 1H), 4.21 (m, 1H), 3.36 (d, J=7.4 Гц, 2H), 2.35-2.23 (m, 2H), 1.73 (dt, J=14.7, 7.0 Гц, 2H), 1.43 (d, J=7.0 Гц, 3H).
Синтез (3R)-3-амино-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 119)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде бесцветного твердого вещества при выходе 91%.
LCMS: METCR1416 Generic 7 minutes, rt=2.13 мин, M/Z (ES+) 552 [М+Н] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.02 (d, J=5.3 Гц, 1H), 8.62 (s, 3H), 8.06 (s, 2H), 7.97 (s, 1H), 7.94 (d, J=8.3 Гц, 2H), 7.58 (d, J=8.2 Гц, 2H), 5.35 (d, J=16.0 Гц, 1H), 5.01 (d, J=16.0 Гц, 1H), 4.51 (dd, J=11.0, 7.6 Гц, 1H), 4.15 (dd, J=13.2, 7.4 Гц, 1H), 4.04-3.95 (m, 1H), 3.35 (d, J=6.9 Гц, 2H), 2.66 (s, 3H), 2.29 (m, 2H), 1.74 (dt, J=14.7,7.1 Гц, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(2-метоксиэтил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 120)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 87%.
LCMS: MET-UHPLC-AB-101, rt=1.9 мин, M/Z (ES+) 470/472 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.67 (d, J=5.1 Гц, 1H), 8.43 (s, 3H), 7.82 (d, J=8.5 Гц, 1H), 7.68 (d, J=5.5 Гц, 1H), 7.39 (s, 4H), 5.20 (d, J=15.7 Гц, 1H), 4.88 (d, J=15.7 Гц, 1H), 4.46 (dd, J=10.9, 7.5 Гц, 1H), 4.13 (dd, J=13.3, 7.5 Гц, 1H), 3.98 (dd, J=13.2, 11.0 Гц, 1H), 3.48-3.37 (m, 4H), 3.26 (s, 3H).
Синтез (3R)-3-амино-N-(2,2-дифторциклопропил)-5-{[4-(5-метил-1,2,4-оксадиазол-3-ил)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 121)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде бесцветного твердого вещества при выходе 79%.
LCMS: METCR1416 Generic 7 minutes, rt=2.96 мин, M/Z (ES+) 518 [М+Н+] 98% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.38 (br. s, 1Н), 8.61 (s, 3H), 8.10-7.96 (m, 3H), 7.93 (t, J=6.4 Гц, 2H), 7.57 (d, J=7.3 Гц, 2H), 5.36 (d, J=15.6 Гц, 1H), 5.06-5.00 (m, 1H), 4.51 (q, J=10.9 Гц, 1H), 4.21-4.05 (m, 1H), 4.00 (d, J=11.0 Гц, 1H), 3.46 (s, 1H), 2.66 (s, 3H), 1.99 (s, 1H), 1.75 (s, 1H).
Синтез (1S,3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1Н-1,5-бензотиазепин-1-ия-1-олат гидрохлорида (пример 122)
Указанное в названии соединение синтезировали из промежуточного соединения IX-53 (позднее элюирование энантиомера, стереохимия сульфоксида произвольно назначена) согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 74%.
LCMS: METCR1416 Generic 7 minutes, rt=3.09 мин, M/Z (ES+) 506.05 [М+Н+] 99% УФЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.72 (t, J=5.6 Гц, 1Н), 8.28 (s, 3H), 7.90 (d, J=5.4 Гц, 1H), 7.47 (d, J=8.5 Гц, 1H), 7.38 (d, J=8.4 Гц, 2H), 7.26 (d, J=8.4 Гц, 2H), 5.33 (d, J=15.0 Гц, 1H), 4.87 (d, J=15.1 Гц, 1H), 4.20 (s, 2H), 3.40 (dd, J=13.2, 6.4 Гц, 3Н), 2.40-2.26 (m, 2H), 1.76 (dt, J=14.5, 7.0 Гц, 2Н).
Синтез (1R,3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-4-оксо-7-[(4,4,4-трифторбутил)карбамоил]-2,3,4,5-тетрагидро-1Н-1,5-бензотиазепин-1-ия-1-алат гидрохлорида (пример 123)
Указанное в названии соединение синтезировали из промежуточного соединения IX-54 (ранее элюируемый энантиомер, стереохимия сульфоксида произвольно назначена) согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 43%.
LCMS: METCR1416 Generic 7 minutes, rt=3.03 мин, M/Z (ES+) 506 [М+Н+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.72 (t, J=5.6 Гц, 1Н), 8.28 (s, 3H), 7.90 (d, J=5.4 Гц, 1H), 7.47 (d, J=8.5 Гц, 1H), 7.38 (d, J=8.4 Гц, 2H), 7.26 (d, J=8.4 Гц, 2H), 5.33 (d, J=15.0 Гц, 1H), 4.87 (d, J=15.1 Гц, 1H), 4.20 (s, 2H), 3.40 (dd, J=13.2,6.4 Гц, 3H), 2.40-2.26 (m, 2H), 1.76 (dt, J=14.5, 7.0 Гц, 2H).
Синтез (3R)-3-амино-5-[(4-цианофенил)метил]-N-(2,2-дифторциклопропил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 124)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 43%.
LCMS: METCR1416 Generic 7 minutes, rt=2.83 мин, M/Z (ES+) 479 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.12 (d, J=14.5 Гц, 1Н), 8.56 (s, 3H),7.89-7.86 (m, 1H), 7.83 (dd, J=8.4, 3.2 Гц, 2H), 7.70 (dd, J=23.2, 5.4 Гц, 1H), 7.58 (dd, J=8.4, 2.3 Гц, 2H),5.33-5.22 (m, 1H), 5.05-4.94 (m, 1H), 4.54 (q, J=9.9, 9.5 Гц, 1H),4.19-4.10 (m, 1H), 4.00 (dd, J=13.3, 11.0 Гц, 1H), 3.55-3.45 (m, 1H), 2.08-1.94 (m, 1H), 1.71-1.55 (m, 1H).
Синтез (3H)-3-амино-5-[(4-цианофенил)метил]-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 125)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 96%.
LCMS: METCR1416 Generic 7 minutes, rt=3.02 мин, M/Z (ES+) 513.45 [М+Н+]100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.75 (t, J=5.6 Гц, 1Н), 8.45 (s, 3H), 7.86 (d, J=8.4 Гц, 1H), 7.82 (d, J=8.3 Гц, 2H), 7.68 (d, J=5.5 Гц, 1H), 7.58 (d, J=8.3 Гц, 2H), 5.28 (d, J=16.2 Гц, 1H), 4.98 (d, J=16.3 Гц, 1H), 4.57-4.45 (m, 1H), 4.14 (dd, J=13.3, 7.6 Гц, 1H), 4.03-3.93 (m, 1H), 3.32-3.29 (m, 2H), 2.36-2.19 (m, 2H), 1.72 (dt, J=14.6, 7.0 Гц, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(4,4-дифторциклогексил)-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 126)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 83%.
LCMS: MET-UHPLC-AB-101, rt=2.46 мин, M/Z (ES+) 530.1/532.1 [М+Н+]100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.63 (d, J=5.6 Гц, 1Н), 8.40 (s, 3H), 7.83 (d, J=8.2 Гц, 1H), 7.63 (d, J=5.4 Гц, 1H), 7.39 (s, 4H), 5.21 (d, J=15.6 Гц, 1H), 4.88 (d, J=15.6 Гц, 1H), 4.47-4.40 (m, 1H), 4.17-4.09 (m, 1H), 4.02-3.93 (m, 2H), 2.10-1.82 (m, 6H), 1.67-1.53 (m, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-[2-(трифторметил)циклопронил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (Пример 127)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 70%.
LCMS: METCR1416 Generic 7 minutes, rt=3.26 мин, M/Z (ES+) 520/522 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.03 (s, 1H), 8.49-8.07 (m, 3H), 7.84 (d, J=8.4 Гц, 1H), 7.78 (t, J=5.6 Гц, 1H), 7.38 (s, 4H), 5.20-5.13 (m, 1H), 5.05-4.90 (m, 1H), 4.47-4.40 (m, 1H), 4.12 (ddd, J=13.1, 7.5, 2.8 Гц, 1H), 4.03-3.90 (m, 1H), 3.26-3.20 (m, 1H), 2.16-2.03 (m, 1H), 1.34-1.18 (m, 2H).
Синтез (3R)-3-амино-5-((4-хлорфенил)метил]-N-(3,3-дифторциклобутил)-8-фтор-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 128)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде розового твердого вещества при выходе 30%.
LCMS: METCR1416 Generic 7 minutes, rt=3.18 мин, M/Z (ES+) 469/471 [М+Н+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.99 (d, J=6.5 Гц, 1Н), 8.37 (s, 3H), 7.84 (d, J=6.4 Гц, 1H), 7.66 (d, J=9.3 Гц, 1H), 7.37-7.28 (m, 4H), 5.37 (d, J=15.4 Гц, 1H), 4.94 (d, J=15.4 Гц, 1H), 4.31-4.19 (m, 1H), 4.02 (dd, J=11.6, 6.9 Гц, 1H), 3.67 (dd, J=11.5, 6.9 Гц, 1H), 3.25 (t, J=11.6 Гц, 1H), 3.04-2.92 (m, 2H), 2.80-2.66 (m, 2H).
Синтез (3R)-3-амино-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 129)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 91%.
LCMS: MET-UHPLC-AB-101, rt=2.29 мин, M/Z (ES+) 506.1 [M+H+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.75 (t, J=5.4 Гц, 1Н), 8.57 (s, 3H), 7.83 (d, J=8.4 Гц, 1H), 7.70 (d, J=5.5 Гц, 1H), 7.39 (dd, J=8.6, 5.6 Гц, 2H), 7.13 (t, J=8.9 Гц, 2H), 5.19 (d, J=15.5 Гц, 1H), 4.90 (d, J=15.5 Гц, 1H), 4.47 (dd, J=10.9, 7.6 Гц, 1H), 4.13 (dd, J=13.3, 7.5 Гц, 1H), 3.99 (dd, J=13.2, 11.1 Гц, 1H), 3.40-3.23 (m, 2H), 2.34-2.21 (m, 2H), 1.72 (dt, J=14.6, 6.9 Гц, 2H).
Синтез (3R)-3-амино-N-(2,2-дифторциклопропил)-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 130)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета с выходом 95%.
LCMS: MET-UHPLC-AB-101, rt=1.98 & 2.01 мин, M/Z (ES+) 472.1 [М+Н+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.14 (d, J=14.9 Гц, 1H), 8.60 (s, 3H), 7.84 (d, J=8.3 Гц, 1H), 7.71 (dd, J=22.9, 5.5 Гц. 1H), 7.39 (dd, J=8.3, 5.7 Гц, 2H), 7.18-7.10 (m, 2H), 5.19 (dd, J=15.4, 10.4 Гц, 1H), 4.91 (dd, J=15.5, 9.3 Гц, 1H), 4.47 (dt, J=10.8, 7.7 Гц, 1H), 4.18-4.09 (m, 1H), 3.99 (dd, J=13.2, 11.1 Гц, 1H), 3.48 (dd, J=14.8, 5.0 Гц, 1H), 2.06-1.94 (m, 1H), 1.69-1.58 (m, 1H).
Синтез (3R)-3-амино-N-бутил-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 131)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 74%.
LCMS:: MET-UHPLC-AB-101, rt=2.24 мин, M/Z (ES+) 420.1 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.51 (s, 3H), 8.47 (t, J=5.6 Гц, 1H), 7.76 (d, J=6.4 Гц, 1Н), 7.62 (d, J=9.3 Гц, 1H), 7.31 (dd, J=8.6, 5.6 Гц, 2H), 7.10 (t, J=8.9 Гц, 2H), 5.31 (d, J=15.3 Гц, 1H), 4.93 (d, J=15.3 Гц, 1H), 4.01 (dd, J=11.7, 6.9 Гц, 1H), 3.67 (dd, J=11.4, 6.9 Гц, 1H), 3.29-3.19 (m, 3H), 1.48 (m, 2H), 1.31 (h, J=7.3 Гц, 2H), 0.89 (t, J=7.4 Гц, 3H).
Синтез (3R)-3-амино-N-бензил-8-фтор-5-[(4-фторфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 132)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 100%).
LCMS:: MET-UHPLC-AB-101, rt=2.31 мин, M/Z (ES+) 454.1 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.04 (t, J=5.8 Гц, 1H), 8.34 (s, 3H), 7.83 (d, J=6.5 Гц, 1H), 7.65 (d, J=9.4 Гц, 1H), 7.31 (m, 7H), 7.10 (t, J=8.9 Гц, 2H), 5.33 (d, J=15.3 Гц, 1H), 4.93 (d, J=15.3 Гц, 1H), 4.56-4.41 (m, 2H), 4.04 (dd, J=11.7, 6.9 Гц, 1H), 3.63 (dd, J=11.4, 6.8 Гц, 1H), 3.23 (t, J=11.6 Гц, 1H).
Синтез (3R)-3-амино-N-бутил-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 133)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 100%.
LCMS:: MET-UHPLC-AB-101, rt=2.17 мин, M/Z (ES+) 452.1 [М+Н+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.61 (t, J=5.4 Гц, 1H), 8.50 (s, 3H), 7.81 (d, J=8.4 Гц, IH), 7.64 (d, J=5.5 Гц, 1H), 7.39 (dd, J=8.5, 5.6 Гц, 2H), 7.15 (t, J=8.9 Гц, 2H), 5.20 (d, J=15.6 Гц, 1H), 4.86 (d, J=15.5 Гц, 1H), 4.47 (dd, J=10.8, 7.7 Гц, 1H), 4.14-4.07 (m, 1H), 4.02-3.93 (m, 1H), 3.27-3.19 (m, 2H), 1.46 (p, J=7.0 Гц, 2H), 1.29 (h, J=7.3 Гц, 2H), 0.88 (t, J=7.4 Гц, 3H).
Синтез (3R)-3-амино-N-бензил-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 134)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 100%.
LCMS: MET-UHPLC-AB-101, rt=2.23 мин, M/Z (ES+) 486.1 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.22 (t, J=5.9 Гц, 1H), 8.61 (s, 3H), 7.84 (d, J=8.4 Гц, IH), 7.71 (d, J=5.5 Гц, IH), 7.40 (dd, J=8.5, 5.6 Гц, 2H), 7.37-7.32 (m, 2H), 7.30-7.25 (m, 3H), 7.14 (t, J=8.8 Гц, 2H), 5.20 (d, J=15.5 Гц, 1H), 4.88 (d, J=15.5 Гц, 1H), 4.53-4.41 (m, 3H), 4.14 (dd, J=13.2, 7.5 Гц, 1H), 4.04-3.95 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[2-(оксан-4-ил)этил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 135)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного соединения в виде твердого вещества грязновато белого цвета с выходом 92%.
LCMS:: MET-UHPLC-AB-101, rt=2.14 мин, M/Z (ES+) 524/526 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.64 (t, J=5.6 Гц, 1Н), 8.55 (s, 3H), 7.83 (d, J=8.4 Гц, 1H), 7.65 (d, J=5.5 Гц, 1H), 7.39 (s, 4H), 5.21 (d, J=15.8 Гц, 1H), 4.88 (d, J=15.8 Гц, 1H), 4.48 (dd, J=10.9, 7.6 Гц, 1H), 4.18-4.11 (m, 1H), 3.99 (dd, J=13.2, 11.1 Гц, 1H), 3.83 (dd, J=11.3, 3.0 Гц, 2H), 3.30-3.20 (m, 4H), 1.58 (d, J=14.4 Гц, 2H), 1.55-1.47 (m, 1H), 1.44 (q, J=6.6 Гц, 2H), 1.21-1.10 (m, 2H).
Синтез (3R)-3-амино-5-бензил-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 136)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 39%.
LCMS: METCR1416 Generic 7 minutes, rt=2.18 мин, M/Z (ES+) 488.12 [M+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.71 (t, J=5.8 Гц, 1H), 8.37 (s, 3H), 7.83 (d, J=8.5 Гц, 1H), 7.62 (d, J=5.5 Гц, 1H), 7.46-7.25 (m, 5H), 5.27 (d, J=15.7 Гц, 1H), 4.79 (d, J=15.7 Гц, 1H), 4.53- 4.38 (m, 1H), 4.11 (dd, J=13.3, 7.5 Гц, 1H), 4.05-3.89 (m, 1H), 3.28 (d, part obsc, J=7.3 Гц, 2H), 2.33-2.16 (m, 2H), 1.71 (dt, J=14.6, 6.9 Гц, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 137)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного соединения в виде твердого вещества белого цвета при выходе 100%.
LCMS:: MET-UHPLC-AB-101, rt=2.4 мин, M/Z (ES+) 532.15/534.10 [M+H+] 99% УФ
ЯМР данные: 1H ЯМР (250 МГц, DMSO-d6) δ 9.13 (t, J=5.9 Гц, 1Н), 8.56 (s, 3H), 7.83 (d, J=8.5 Гц, 1H), 7.69 (d, J=5.6 Гц, 1H), 7.38 (s, 4H), 7.21 (d, J=8.7 Гц, 2H), 6.98-6.80 (m, 2H), 5.20 (d, J=15.7 Гц, 1H), 4.87 (d, J=15.7 Гц, 1H), 4.48 (dd, J=10.9, 7.4 Гц, 1H), 4.44-4.30 (m, 2H), 4.14 (dd, J=13.2, 7.4 Гц, 1H), 4.05-3.91 (m, 1H), 3.74 (s, 3H).
Синтез (3R)-3-амино-5-[(5-циклопропил-1,3,4-тиадиазол-2-ил)метил]-8-фтор-N-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 138)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества желтого цвета при выходе 51%.
LCMS:: MET-UHPLC-AB-101, rt=2.01 мин, M/Z (ES+) 534.1 [М+Н+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Метаноле-d4) d 8.20 (d, J=5.5 Гц, 1H), 7.90 (d, J=8.6 Гц, 1H), 7.45-7.38 (m, 2H), 7.12-7.06 (m, 2H), 5.47 (d, J=15.9 Гц, 1H), 5.26 (d, J=15.9 Гц, 1H), 4.64-4.53 (m, 211), 4.49 (dd, J=10.9, 7.6 Гц, 1H), 4.13 (dd, J=13.3, 7.6 Гц, 1H), 3.88 (dd, J=13.3, 11.0 Гц, 1H), 2.46 (tt, J=8.3, 4.9 Гц, 1H), 1.31-1.26 (m, 2H), 1.10-1.04 (m, 2H). NH амид и NH2.HCl невидимый по ЯМР
Синтез (3R)-3-амино-8-фтор-5-[(4-фторфенил)метил]-N-[(оксан-4-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 139)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного соединения в виде твердого вещества белого цвета при выходе 83%.
LCMS: MET-UHPLC-AB-101, rt=1.84 мин, M/Z (ES+) 494.1 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.65 (t, J=5.8 Гц, 1H), 8.46 (s, 3H), 7.81 (d, J=8.3 Гц, 1H), 7.60 (d, J=5.5 Гц, 1H), 7.39 (dd, J=8.6, 5.5 Гц, 2H), 7.15 (t, J=8.9 Гц, 2H), 5.22 (d, J=15.5 Гц, 1H), 4.84 (d, J=15.6 Гц, 1H), 4.46 (dd, J=10.7, 7.7 Гц, 1H), 4.11 (dd, J=13.3, 7.4 Гц, 1H), 3.98 (dd, J=13.2, 11.1 Гц, 1H), 3.85 (dd, J=11.0, 2.9 Гц, 2H), 3.25 (t, J=11.0 Гц, 2H), 3.20-3.08 (m, 2H), 1.80-1.66 (m, 1H), 1.52 (d, J=12.3 Гц, 2H), 1.17 (qd, J=12.1,4.5 Гц, 2H).
Синтез (3R)-3-амино-N-(3,3-дифторциклобутил)-8-фтор-5-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамид гидрохлорида (пример 140)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества кремового цвета с выходом 71%.
LCMS: MET-UHPLC-AB-101, rt=2.11 мин, M/Z (ES+) 486.0 [М+Н+] 98% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.20 (d, J=6.5 Гц, 1H), 8.68 (s, 3H), 7.84 (d, J=8.4 Гц, 1H), 7.74 (d, J=5.5 Гц, 1H), 7.39 (dd, J=8.7, 5.5 Гц, 2H), 7.17-7.09 (m, 2H), 5.17 (d, J=15.4 Гц, 1H), 4.94 (d, J=15.5 Гц, 1H), 4.46 (dd, J=10.9, 7.5 Гц, 1H),4.24 (dt, J=14.8, 6.8 Гц, 1H), 4.16 (dd, J=13.3, 7.5 Гц, 1H), 3.99 (dd, J=13.2, 11.0 Гц, 1H), 3.05-2.92 (m, 2H), 2.75-2.65 (m, 2H).
Синтез (3R)-3-амино-8-фтор-5-[(4-метоксифенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 141)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 79%.
LCMS: METCR1416 Generic 7 minutes, rt=3.18 мин, M/Z (ES+) 518.25 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.65 (t, J=5.6 Гц, 1H), 7.71 (d, J=8.6 Гц, 1H), 7.57 (d, J=5.6 Гц, 1H), 7.26 (d, J=8.7 Гц, 2H), 6.86-6.82 (m, 2H), 5.17-5.07 (m, 1H), 4.76-4.68 (m, 1H), 3.89 (dd, J=12.1, 5.8 Гц, 1H), 3.71 (s, 3H), 3.71-3.57 (m, 2H), 2.33-2.19 (m, 2H), 2.00 (s, 2H), 1.71 (dt, J=14.6, 6.9 Гц, 2H). [2H скрытый под пиком воды]
Синтез (3R)-3-амино-8-фтор-5-[(4-метоксифенил)метил]-N-[(оксан-4-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 142)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 95%.
LCMS: METCR1416 Generic 7 minutes, rt=2.85 мин, M/Z (ES+) 506.3 [М+Н+] 99%, УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.57 (t, J=5.8 Гц, 1H), 7.70 (d, J=8.5 Гц, 1H), 7.48 (d, J=5.6 Гц, 1H), 7.26 (d, J=8.7 Гц, 2H), 6.87-6.82 (m, 2H), 5.22-5.11 (m, 1H), 4.67-4.58 (m, 1H), 3.89 (dd, J=12.2, 5.8 Гц, 1H), 3.86-3.81 (m, 2H), 3.72 (s, 3H), 3.71-3.58 (m, 2H), 3.25 (td, J=11.7, 1.8 Гц, 2H), 3.17-3.07 (m, 2H), 2.03 (s, 2H), 1.78-1.66 (m, 1H), 1.52 (d, J=12.9 Гц, 2H), 1.18 (td, J=12.9, 12.4, 4.3 Гц, 2H).
Синтез (3R)-3-амино-N-(2,2-дифторциклопропил)-8-фтор-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 143)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 57%.
LCMS: METCR1416 Generic 7 minutes, rt=3.03 мин, M/Z (ES+) 484.2 [М+Н+] 97% УФ
ЯМР данные: 1Н ЯМР (250 МГц, DMSO-d6) δ 9.06-8.95 (m, 1H), 7.72 (d, J=8.6 Гц, 1Н), 7.56 (dd, J=5.5, 4.3 Гц, 1H), 7.25 (dd, J=8.6, 1.3 Гц, 2H), 6.84 (dd, J=8.7, 1.7 Гц, 2H), 5.18-5.07 (m, 1H), 4.76-4.65 (m, 1H), 3.98-3.80 (m, 1H), 3.72 (s, 3H), 3.72-3.58 (m, 2H), 3.57-3.40 (m, 1H), 2.10-1.88 (m, 3H), 1.69-1.50 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-(оксан-4-ил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 144)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде белого кристаллического твердого вещества при выходе 52%.
LCMS: METCR1416 Generic 7 minutes, rt=2.94 мин, M/Z (ES+) 496.1/ 498.2 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (250 МГц, DMSO-d6) δ 8.55 (d, J=7.7 Гц, 1Н), 7.72 (d, J=8.5 Гц, 1H), 7.53 (d, J=5.6 Гц, 1H), 7.37 (s, 4H), 5.19 (d, J=15.6 Гц, 1H), 4.78 (d, J=15.6 Гц, 1H), 4.11-3.82 (m, 4H), 3.80-3.59 (m, 2H), 3.41 (d, J=11.4 Гц, 2H), 2.02 (s, 2H), 1.74 (s, 2H), 1.59-1.40 (m, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-(3,3-дифторциклобутил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 145)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного соединения в виде твердого вещества светло-желтого цвета при выходе 65%.
LCMS: METCR1416 Generic 7 minutes, rt=2.21 мин, M/Z (ES+) 484.1/486.1 [M+H+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.11 (d, J=6.4 Гц, 1H), 8.00 (d, J=8.1 Гц, 1H), 7.95 (d, J=7.9 Гц, 1H), 7.82 (s, 1H), 7.37 (s, 4H), 5.22-4.81 (m, 2H), 4.31-4.19 (m, 1H), 3.89 (dd, J=12.6, 6.2 Гц, 1H), 3.69 (s, 1H), 3.66-3.57 (m, 1H), 2.97 (td, J=13.3, 6.7 Гц, 2H), 2.74 (s, 2H), 2.00 (s, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1S)-3,3-дифторциклопентил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 146)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде бесцветного кристаллического твердого вещества при выходе 72%.
LCMS: METCR1416 Generic 7 minutes, rt=3.22 мин, M/Z (ES+) 516.20/518.2 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.79 (d, J=7.0 Гц, 1Н), 7.72 (d, J=8.4 Гц, 1H), 7.57 (d, J=5.5 Гц, 1H), 7.36 (s, 4H), 5.15 (d, J=15.6 Гц, 1H), 4.81 (d, J=15.7 Гц, 1H), 4.36 (q, J=7.5 Гц, 1H), 3.90 (dd, J=12.2, 5.9 Гц, 1H), 3.75-3.60 (m, 2H), 2.30-2.18 (m, 1H), 2.19-1.90 (m, 6H), 1.75 (dt, J=12.1, 7.7 Гц, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R,2S)-2-фторциклопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 147)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 67%.
LCMS: METCR1416 Generic 7 minutes, rt=2.93 мин, M/Z (ES+) 452.05/454.05 [M+H+]; 474/476 [M+Na+] 96% УФ
ЯМР данные: 1H ЯМР (250 МГц, DMSO-d6) δ 8.87 (d, J=3.5 Гц, 1H), 8.06-7.87 (m, 2H), 7.83 (s, 1H), 7.37 (s, 4H), 5.19 (d, J=15.8 Гц, 1H), 4.98-4.79 (m, 1H), 4.76-4.56 (m, 1H), 3.98-3.83 (m, 1H), 3.79-3.53 (m,2H), 2.80 (d, J=8.4 Гц, 1H), 1.99 (s, 2H), 1.26-1.03 (m, 2H).
Синтез (3R)-3-амино-N-(3,3-дифторциклобутил)-5-[(2-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 148)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 79%.
LCMS: METCR1416 Generic 7 minutes, rt=2.93 мин, M/Z (ES+) 468.4 [М+Н+], 490.05 [M+Na+] 99% УФ; ЯМР данные: 1H ЯМР (250 МГц, DMSO-d6) δ 9.12 (d, J=6.3 Гц, 1H), 8.08-7.93 (m, 2Н), 7.90 (s, 1Н), 7.45 (t, J=7.7 Гц, 1H), 7.30 (t, J=5.9 Гц, 1H), 7.21-7.01 (m, 2H), 5.17 (d, J=16.0 Гц, 1H), 4.90 (d, J=15.2 Гц, 1Н), 4.25 (s, 1H), 3.96-3.79 (m, 1H), 3.75-3.54 (m, 2H), 2.96 (s, 2H), 2.78 (s, 2H), 1.97 (s, 2H)
Синтез (3R)-3-амино-N-(3,3-дифторциклобутил)-5-[(3-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 149)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 62%.
LCMS: METCR1416 Generic 7 minutes 215 и 254 нм, rt=2.98 мин, M/Z (ES+) 480.5 [М+Н+]; 502.1 [M+Na+] 98% УФ
ЯМР данные: 1H ЯМР (250 МГц, DMSO-d6) δ 9.09 (d, J=6.6 Гц, 1H), 8.08-7.91 (m, 2Н), 7.82 (s, 1H), 7.22 (t, J=7.9 Гц, 1H), 6.93 (d, J=7.6 Гц, 2H), 6.88-6.74 (m, 1H), 5.20 (d, J=15.7 Гц, 1H), 4.80 (d, J=15.6 Гц, 1Н), 4.24 (s, 1H), 4.02-3.85 (m, 1H), 3.71 (s, 4H), 3.58 (s, 1H), 3.12-2.89 (m, 2H), 2.85-2.66 (m, 2H), 2.07 (s, 2H).
Синтез (3R)-3-амино-5-[(4-метоксифенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 150)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 89%.
LCMS: MET-UHPLC-AB-101, rt=2.1 мин, M/Z (ES+) 500.2 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.80 (t, J=5.6 Гц, 1H), 7.95 (d, J=8.1 Гц, 1H), 7.90 (d, J=8.9 Гц, 1H), 7.83 (s, 1H), 7.26 (d, J=8.6 Гц, 2H), 6.83 (d, J=8.7 Гц, 2H), 5.11 (d, J=15.4 Гц, 1H), 4.82 (d, J=15.3 Гц, 1H), 3.87 (dd, J=12.4, 6.1 Гц, 1H), 3.71 (s, 3H), 3.70-3.58 (m, 2H), 3.38-3.33 (m, 2H), 2.35-2.24 (m, 2H), 2.07 (s, 2H), 1.74 (dt, J=14.8, 7.0 Гц, 2H).
Синтез (3R)-3-амино-N,5-бис[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 151)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 82%о.
LCMS: MET-UHPLC-AB-101, rt=2.11 мин, M/Z (ES+) 510.2 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.22 (t, J=6.0 Гц, 1H), 7.98-7.89 (m, 2H), 7.86 (s, 1H), 7.26 (d, J=8.6 Гц, 2H), 7.22 (d, J=8.6 Гц, 2H), 6.89 (d, J=8.7 Гц, 2H), 6.83 (d, J=8.7 Гц, 2H), 5.11 (d, J=15.4 Гц, 1H), 4.83 (d, J=15.3 Гц, 1H), 4.40 (d, J=5.8 Гц, 2Н), 3.86 (dd, J=12.6, 6.1 Гц, 1Н), 3.73 (s, 3H), 3.71 (s, 3H), 3.69-3.64 (m, 1H), 3.64-3.57 (m, 1H), 2.00 (s, 2H).
Синтез (3R)-3-амино-5-бензил-N-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 152)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 82%.
LCMS: METCR1416 Generic 7 minutes, rt=3.04 мин, M/Z (ES+) 480.5 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.06 (d, J=8.1 Гц, 1Н), 7.78 (dd, J=8.1, 1.5 Гц, 1H), 7.36-7.11 (m, 8Н), 6.94-6.86 (m, 211), 6.01-5.90 (m, 1H), 5.57 (d, J=15.0 Гц, 1H), 4.54-4.41 (m, 3H), 3.83 (s, 3H), 3.77 (dd, J=12.9, 6.7 Гц, 1H), 3.70 (dd, J=9.9, 7.3 Гц, 1H), 3.48 (dd, J=12.9, 11.0 Гц, 1H). (NH2 невидимый)
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 153)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 67%.
LCMS: METCR1416 Generic 7 minutes, rt=3.27 мин, M/Z (ES+) 514.10 /516.10 [М+Н+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.23 (t, J=5.8 Гц, 1Н), 7.97 (s, 2H), 7.85 (s, 1H), 7.42-7.32 (m, 4H), 7.22 (d, J=8.6 Гц, 2H), 6.95-6.84 (m, 2H), 5.16 (d, J=15.7 Гц, 1H), 4.89 (d, J=15.7 Гц, 1H), 4.40 (d, J=5.9 Гц, 2H), 3.88 (dd, J=12.8, 6.6 Гц, 1H), 3.83-3.61 (m, 4H), 3.65-3.55 (m, 1H), 1.98 (s, 2H).
Синтез (3R)-3-амино-N-(4,4-дифторциклогексил)-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 154)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 90%.
LCMS: METCR1416 Generic 7 minutes, rt=3.08 мин, M/Z (ES+) 508.50 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.54 (d, J=7.6 Гц, 1H), 7.98-7.88 (m, 2Н), 7.78 (d, J=1.2 Гц, 1H), 7.27 (d, J=8.7 Гц, 2H), 6.85 (d, J=8.7 Гц, 2H), 5.17 (d, J=15.3 Гц, 1H), 4.75 (d, J=15.2 Гц, 1H), 4.01-3.92 (m, 1H), 3.89-3.83 (m, 1H), 3.72 (s, 3H), 3.71-3.58 (m, 2H), 2.12-1.83 (m, 8H), 1.68-1.57 (m, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-(3,3,3-трифторпропил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 155)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 82%.
LCMS: METCR1416 Generic 7 minutes, rt=3.21 мин, M/Z (ES+) 490.10/492.10 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.98 (t, J=5.6 Гц, 1Н), 7.99 (d, J=8.1 Гц, 1H), 7.91 (d, J=8.1 Гц, 1H), 7.81 (s, 1H), 7.36 (s, 411), 5.17 (d, J=15.8 Гц, 1H), 4.88 (d, J=15.8 Гц, 1H), 3.89 (dd, J=12.9, 6.5 Гц, 1H), 3.74-3.68 (m, 1H), 3.66-3.59 (m, 1H), 3.50 (q, J=6.4 Гц, 2H), 2.60-2.53 (m, 211), 2.15-1.88 (m, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-[(3R)-оксолан-3-ил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 156)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 37%.
LCMS: MET-UHPLC-AB-101, rt=1.86 мин, M/Z (ES+) 464.1/466.1 [М+Н+] 97% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.82 (d, J=6.6 Гц, 1Н), 7.95 (s, 2H), 7.81 (s, 1H), 7.36 (s, 4H), 5.18 (d, J=15.7 Гц, 1H), 4.86 (d, J=15.7 Гц, 1H), 4.49-4.39 (m, 1H), 3.91-3.80 (m, 3H), 3.75-3.65 (m, 2H), 3.65-3.55 (m, 2H), 2.21-2.10 (m, 1H), 1.99 (s, 2H), 1.92-1.82 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-1,1,4-триокс-N-[(оксолан-3-ил)метил]-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 157)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде белого кристаллического твердого вещества при выходе 40%.
LCMS: MET-UHPLC-AB-101, rt=1.9 мин, M/Z (ES+) 478.1/480.1 [М+Н+] 94% УФ
ЯМР данные: 1Н ЯМР (500 МГц, Хлороформ-d) δ 8.12 (dd,.1=8.1, 1.1 Гц, 1H), 7.75 (ddd, J=8.1, 4.1, 1.6 Гц, 1H), 7.58 (dd, J=3.6, 1.5 Гц, 1Н), 7.32 (s, 4Н), 6.25 (s, 1H), 5.44-4.66 (m, 2Н), 3.93 (dtd, J=13.7, 8.5, 5.2 Гц, 1Н), 3.85-3.71 (m, 4Н), 3.65 (dt, J=9.3, 5.0 Гц, 1Н), 3.50 (m, 3H), 2.60 (dt, J=11.6, 6.5 Гц, 1Н), 2.17-2.08 (m, 1Н), 1.71-1.63 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-2,2-дифторциклопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 158)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 78%.
LCMS: METCR1416 Generic 7 minutes, rt=3.03 мин, M/Z (ES+) 470.1/472.10 [М+Н+] 98% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.12 (s, 1H), 7.99 (d, J=8.1 Гц, 1H), 7.93 (d, J=8.2 Гц, IH), 7.81 (s, 1H), 7.36 (s, 4H), 5.17 (d, J=15.7 Гц, 1H), 4.86 (d, J=15.8 Гц, 1H), 3.88 (dd, J=12.9, 6.5 Гц, 1H), 3.71 (dd, J=11.0, 6.6 Гц, 1H), 3.67-3.56 (m, 1H), 3.50-3.42 (m, 1H), 2.17-1.91 (m, 3H), 1.70-1.60 (m, 1H).
Синтез (3R)-3-амино-5-[(4-циклопропилфенил)метил]-N-[(1H)-2,2-дифторциклопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 159)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 69%.
LCMS: METCR1416 Generic 7 minutes, rt=2.22 мин, M/Z (ES+) 476.1 [М+Н+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.09 (s, 1H), 7.98 (d, J=8.1 Гц, 1H), 7.91 (d, J=8.1 Гц, 1H), 7.80 (s, 1H), 7.21 (d, J=8.1 Гц, 2H), 6.99 (d, J=8.2 Гц, 2H), 5.17 (d, J=15.6 Гц, 1H), 4.73 (d, J=15.6 Гц, 1H), 3.87 (dd, J=12.8, 6.4 Гц, 1H), 3.70 (dd, J=11.0, 6.5 Гц, 1H), 3.66-3.56 (m, 1H), 3.51-3.40 (m, 1H), 2.22-1.91 (m, 3H), 1.92-1.82 (m, 1H), 1.70-1.61 (m, 1H), 0.95-0.88 (m, 2H), 0.65-0.60 (m, 2H).
Синтез (3R)-3-амино-N-[(1R)-2,2-дифторциклопропил]-5-{[4-(дифторметокси)фенил]метил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 160)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 70%.
LCMS: METCR1416 Generic 7 minutes, rt=3.01 мин, M/Z (ES+) 502.5 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.12 (s, 1H), 8.00 (d, J=8.1 Гц, 1H), 7.93 (d, J=8.2 Гц, 1H), 7.84 (s, 1H), 7.40 (d, J=8.6 Гц, 2H), 7.21 (t, J=74.2 Гц, 1H), 7.11 (d, J=8.6 Гц, 2H), 5.19 (d, J=15.7 Гц, 1H), 4.85 (d, J=15.7 Гц, 1H), 3.89 (dd, J=12.8, 6.5 Гц, 1H), 3.72 (dd, J=11.2, 6.3 Гц, 1H), 3.67-3.58 (m, 1H), 3.51-3.43 (m, 1H), 2.11-1.89 (m, 3H), 1.71-1.59 (m, 1H).
Синтез (3R)-3-амино-N-[(1R)-2,2-дифторциклопропил|-5-[(4-метоксифенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 161)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 59%.
LCMS: MET-UHPLC-AB-101, rt=1.84 мин, M/Z (ES+) 466.1 [М+Н+] 95% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.09 (s, 1Н), 7.97 (d, J- 8.1 Гц, 1H), 7.90 (d, J=8.3 Гц, 1H), 7.82 (d, J=1.1 Гц, 1H), 7.26 (d, J=8.6 Гц, 2H), 6.84 (d, J=8.7 Гц, 2H), 5.13 (d, J=15.3 Гц, 1H), 4.78 (d, J=15.3 Гц, 1H), 3.86 (dd, J=12.6, 6.2 Гц, 1H), 3.72 (s, 3H), 3.71-3.65 (m, 1H), 3.65-3.58 (m, 1H), 3.50-3.43 (m, 1H), 2.20-1.94 (m, 3H), 1.70-1.61 (m, 1H).
Синтез (3R)-3-амино-5-бензил-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 162)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде пены/твердого вещества кремового цвета при выходе 46%.
LCMS: METCR1416 Generic 7 minutes, rt=3 мин, M/Z (ES+) 470.50 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.79 (t, J=5.6 Гц, 1H), 7.97 (d, J=8.1 Гц, 1H), 7.91 (d, J=9.0 Гц, 1H), 7.78 (s, 1H), 7.35 (d, J=7.2 Гц, 2H), 7.30 (t, J=7.4 Гц, 2H), 7.24 (t, J=7.2 Гц, 1H), 5.23 (d, J=15.7 Гц, 1H), 4.79 (d, J=15.7 Гц, 1H), 3.88 (dd, J=12.9, 6.5 Гц, 1H), 3.71 (dd, J=11.1,6.3 Гц, 1H), 3.67-3.59 (m, 1H), 3.37-3.32 (m, 2H), 2.34-2.22 (m, 2H), 2.05 (s, 2H), 1.72 (dt, J=14.7, 7.1 Гц, 2H).
Синтез (3R)-3-амино-8-хлор-5-[(4-хлорфенил)метил]-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 163)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 53%.
LCMS: MET-UHPLC-AB-101, rt=1.05 мин, M/Z (ES+) 538.05/540.05 [М+Н+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.68 (t, J=5.7 Гц, 1H), 7.85 (s, 1Н), 7.55 (s, 1H), 7.39-7.31 (m, 4H), 5.12 (d, J=15.6 Гц, 1H), 4.93 (d, J=15.6 Гц, 1H), 3.94 (dd, J=12.6, 6.3 Гц, 1H), 3.76-3.69 (m, 1H), 3.69-3.63 (m, 1H), 3.30-3.24 (m, 2H), 2.35-2.06 (m, 4H), 1.71 (dt, J=14.6, 6.9 Гц, 2H).
Синтез (3R)-3-амино-5-{[4-(дифторметокси)фенил}-N-[(оксан-4-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 164)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 86%.
LCMS: METCR1416 Generic 7 minutes, rt=2.87 мин, M/Z (ES+) 524.2 [М+Н+] 100%о УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.75 (t, J=5.7 Гц, 1Н), 7.97 (d, J=8.1 Гц, 1H), 7.92 (d, J=8.2 Гц, 1H), 7.80 (s, 1H), 7.41 (d, J=8.6 Гц, 2H), 7.21 (t, J=74.2 Гц, 1H), 7.10 (d, J=8.5 Гц, 2H), 5.19 (d, J=15.7 Гц, 1H), 4.85 (d, J=15.7 Гц, 1H), 3.92-3.80 (m, 3H), 3.74-3.67 (m, 1H), 3.66-3.59 (m, 1H), 3.29-3.21 (m, 2H), 3.15 (ap. t, J=6.3 Гц, 2H), 2.15-1.88 (m, 2H), 1.81-1.70 (br. m, 1H), 1.59-1.49 (m, 2H), 1.18 (ap. qd, J=12.3, 4.4 Гц, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(4-фтороксан-4-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 165)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 99%.
LCMS: METCR1416 Generic 7 minutes, rt=2.86 мин, M/Z (ES+) 510.50/512 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.92 (t, J=6.1 Гц, 1Н), 8.00-7.93 (m, 211), 7.81 (s, 1H), 7.40-7.33 (m, 4H), 5.20 (d,.1=15.7 Гц, 1H), 4.87 (d, J=15.6 Гц, 1H), 3.89 (dd, J=12.8, 6.5 Гц, 1H), 3.77-3.68 (m, 3H), 3.66-3.60 (m, 1H), 3.54 (dd, J=21.1, 6.4 Гц, 411), 2.23-1.87 (m, 2H), 1.79-1.70 (m, 1H), 1.70-1.64 (m, 3H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-1-(оксан-4-ил)этил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 166)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 93%.
LCMS: METCR1416 Generic 7 minutes, rt=2.9 мин, M/Z (ES+) 507.05/509.20 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.41 (d, J=8.6 Гц, 1H), 7.96 (d, J=8.1 Гц, 1H), 7.91 (d, J=8.1 Гц, 1H), 7.72 (d, J=1.3 Гц, 1H), 7.42-7.33 (m, 4H), 5.23 (d, J=15.7 Гц, 1H), 4.83 (d, J=15.8 Гц, 1H), 3.92-3.77 (m, 4H), 3.75-3.69 (m, 1H), 3.66-3.58 (m, 1H), 3.29-3.18 (m, 2H), 2.00 (s, 2H), 1.66-1.48 (m, 3H), 1.26-1.14 (m, 2H), 1.12 (d, J=6.7 Гц, 3H).
Синтез (3R)-3-амино-5-бензил-N-[(1R)-2,2-дифторциклопронил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 167)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 88%.
LCMS: METCR1416 Generic 7 minutes, rt=2.75 мин, M/Z (ES+) 436.45 [М+Н+] 95.6% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.09 (s, 1Н), 7.99 (d, J=8.1 Гц, 1H), 7.91 (d, J=8.2 Гц, 1H), 7.79 (s, 1H), 7.39-7.22 (m, 5H), 5.24 (d, J=15.7 Гц, 1H), 4.77 (d, J=15.7 Гц, 1H), 3.88 (dd, J=12.9, 6.5 Гц, 1H),3.73 (dd, J=11.0, 6.6 Гц, 1H), 3.63 (dd, J=12.8, 11.2 Гц, 1H), 3.45 (d, J=9.2 Гц, 1H), 2.19-1.92 (m, 3H), 1.64 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(6-метилпиридин-3-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 168)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 96%.
LCMS: METCR1416 Generic 7 minutes, rt=2.38 мин, M/Z (ES+) 499.10/501.20 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.31 (t, J=5.8 Гц, 1H), 8.40 (d, J=1.8 Гц, IH), 7.99-7.89 (m, 2H), 7.85 (s, 1H), 7.57 (dd, J=7.9, 2.3 Гц, 1H), 7.39-7.29 (m, 4H), 7.21 (d, J=8.0 Гц, IH), 5.15 (d, J=15.8 Гц, 1H), 4.89 (d, J=15.8 Гц, 1H), 4.45 (d, J=5.8 Гц, 2H), 3.87 (dd, J=12.7, 6.3 Гц, 1H), 3.77-3.65 (m, 1H), 3.65-3.55 (m, 1H), 2.44 (s, 3H), 1.99 (br. s, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(1R)-3,3-дифторциклопентил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 169)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 80%».
LCMS: METCR1416 Generic 7 minutes, rt=3.11 мин, M/Z (ES+) 498.50/ 500.10 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.82 (d, J=7.0 Гц, 1H), 8.01-7.90 (m, 2H), 7.79 (s, 1H), 7.36 (s, 4H), 5.18 (d, J=15.7 Гц, 1H), 4.84 (d, J=15.7 Гц, 1H), 4.39 (h, J=7.6 Гц, 1H), 3.87 (dd, J=12.6, 6.2 Гц, 1H), 3.73-3.66 (m, 1H), 3.66-3.53 (m, 1H), 2.58-2.43 (m, 1H), 2.33-2.20 (m, 1H), 2.20-2.04 (m, 3H), 1.99 (s, 2H), 1.85-1.74 (m, 1H).
Синтез (3R)-3-амино-5-4-цианофенил)метил]-8-фтор-N-[(4-фторфенил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазенин-7-карбоксамида (Пример 170)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 42%.
LCMS: MET-UHPLC-AB-101. rt=2.16 мин, M/Z (ES+) 511.1 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.12 (t, J=5.9 Гц, 1H), 7.81-7.77 (m, 2H), 7.74 (d, J=8.6 Гц, 1H), 7.60 (d, J=5.5 Гц, 1H), 7.54 (d, J=8.3 Гц, 2H), 7.35-7.27 (m, 2H), 7.22-7.13 (m, 2H), 5.23 (d, J=16.3 Гц, 1H), 4.88 (d, J=16.2 Гц, 1H), 4.49-4.36 (m, 2H), 3.91 (dd, J=13.0, 6.7 Гц, 1H), 3.81-3.72 (m, 1H), 3.65 (dd, J=12.9, 11.1 Гц, 1H), 2.00 (s, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(3,3-дифторциклобутил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 171)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 62%.
LCMS: MET-UHPLC-AB-101. rt=2.31 мин, M/Z (ES+) 498.1/500.1 [М+Н+] 100% УФ
ЯМР данные: 1H ЯМР (250 МГц, Хлороформ-d) δ 8.09 (d, J=8.1 Гц, 1H), 7.71 (dd, J=8.2, 1.4 Гц, 1H), 7.53 (s, 1Н), 7.29 (s, 4H), 6.13-6.00 (m, 1H), 5.37 (d, J=15.2 Гц, 1H), 4.69 (d, J=15.1 Гц, 1H), 3.93-3.64 (m, 2H), 3.64-3.42 (m, 3H), 2.87-2.60 (m, 2H), 2.55-2.17 (m, 3H) [NH2 невидимый]
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-N-[2-(2-метоксиэтокси)этил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 172)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 66%.
LCMS: METCR1416 Generic 7 minutes. rt=2.87 мин, M/Z (ES+) 515/517.25 [М+Н+]; 536.10/538.05 [M+Na+] 99% УФ; ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.61 (t, J=5.4 Гц, 1H), 7.72 (d, J=8.6 Гц, 1H), 7.59 (d, J=5.5 Гц, 1H), 7.37 (s, 4H), 5.15 (d, J=15.8 Гц, 1H), 4.80 (d, J=15.8 Гц, 1H), 3.90 (dd, J=12.9, 6.5 Гц, 1H), 3.77-3.70 (m, 1H), 3.69-3.61 (m, 1H), 3.55-3.48 (m, 4H), 3.45-3.38 (m, 4H), 3.24 (s, 3H), 2.02 (s, 2H).
Синтез (3R)-3-амино-N-(бут-3-ин-1-ил)-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 173)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 79%.
LCMS: METCR1416 Generic 7 minutes. rt=2.97 мин, M/Z (ES+) 464.05/466.05 [М+Н+] 96% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.71 (t, J=5.5 Гц, 1Н), 7.73 (d, J=8.6 Гц, 1H), 7.62 (d, J=5.6 Гц, 1H), 7.37 (s, 4H), 5.15 (d, J=15.8 Гц, 1H), 4.80 (d, J=15.8 Гц, 1H), 3.90 (dd, J=12.9, 6.5 Гц, 1H), 3.73 (dd, J=10.9, 6.6 Гц, 1H), 3.68-3.61 (m, 1H), 3.37 (dt, J=13.7, 7.1 Гц, 2H), 2.80 (t, J=2.6 Гц, 1H), 2.41 (td, J=7.0, 2.6 Гц, 2H), 2.12-1.97 (m, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(пент-4-ин-1-ил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 174)
Указанное в названии соединение синтезировали согласно общей методике GP5 с по лучением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 81%.
LCMS: METCR1416 Generic 7 minutes. rt=3.04 мин, M/Z (ES+) 477/479 [М+Н+] 95% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.61 (t, J=5.5 Гц, 1H), 7.72 (d, J=8.5 Гц, 1Н), 7.60 (d, J=5.5 Гц, 1H), 7.37 (s, 4H), 5.15 (d, J=15.7 Гц, 1H), 4.82 (d, J=15.7 Гц, 1H), 3.90 (dd, J=12.7, 6.3 Гц, 1H), 3.76-3.70 (m, 1H), 3.68-3.60 (m, 1H), 3.32 (s, 2H), 2.80 (t, J=2.6 Гц, 1H), 2.21 (td, J=7.1, 2.6 Гц, 2H), 2.01 (s, 2H), 1.68 (t, J=7.0 Гц, 2H)
Синтез (3R)-3-амино-8-хлор-5-[(4-хлорфенил)метил]-N-[(1R)-2,2-дифторциклопропил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 175)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 64%.
LCMS: METCR1416 Generic 7 minutes. rt=3.03 мин, M/Z (ES+) 504.95/507.05 [М+Н+] 97% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.07 (s, 1Н), 7.86 (s, 1H), 7.56 (s, 1H), 7.35 (s, 4H), 5.12 (d, J=15.7 Гц, 1H), 4.91 (d, J=15.6 Гц, 1H), 3.93 (dd, J=12.4, 6.0 Гц, 1H), 3.79-3.58 (m, 2H), 3.55-3.43 (m, 1H), 2.20-1.93 (m, 3H), 1.54 (ddt, J=14.6, 9.0, 5.6 Гц, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[2-(морфолин-4-ил)этил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 176)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 93%.
LCMS: MET-UHPLC-АВ-101. rt=1.28 мин, M/Z (ES+) 507.1/509.1 [М+H+] 95% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.70 (t, J=5.7 Гц, 1Н), 7.97 (d, J=8.1 Гц, 1H), 7.91 (d, J=8.2 Гц, 1H), 7.80 (s, 1H), 7.39-7.32 (m, 4H), 5.17 (d, J=15.8 Гц, 1H), 4.88 (d, J=15.9 Гц, 1H), 3.88 (dd, J=13.0, 6.6 Гц, 1H), 3.76-3.67 (m, 1H), 3.67-3.58 (m, 1H), 3.58-3.50 (m, 4H), 3.41-3.36 (m, 2H), 2.45 (t, J=6.8 Гц, 2H), 2.42-2.38 (m, 4H), 2.00 (br. s, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-[(6-метоксипиридин-3-ил)метил]-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 177)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато-белого цвета при выходе 76%.
LCMS: MET-UHPLC-AB-101. rt=2.16 мин, M/Z (ES+) 515.1/517.1 [М+Н+] 98% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.28 (t, J=5.8 Гц, 1H), 8.13 (d, J=2.3 Гц, 1H), 8.01-7.91 (m, 2H), 7.86 (s, 1H), 7.64 (dd, J=8.5, 2.5 Гц, 1H), 7.40-7.30 (m, 4H), 6.80 (d, J=8.5 Гц, 1H), 5.16 (d, J=15.7 Гц, 1H), 4.90 (d, J=15.7 Гц, 1H), 4.42 (d, J=5.7 Гц, 2H), 3.88 (dd, J=13.3, 7.0 Гц, 1H), 3.84 (s, 3H), 3.73-3.66 (m, H1), 3.66-3.56 (m, 1H), 1.96 (s, 2H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-{[4-(prop-2-ин-1-илокси)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 178)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества грязновато белого цвета с выходом 65%.
LCMS: METCR1416 Generic 7 minutes. rt=3.27 мин, M/Z (ES+) 556.50/558.10 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.06 (t, J=5.7 Гц, 1Н), 7.73 (d, J=8.6 Гц, 1Н), 7.62 (d, J=5.5 Гц, 1H), 7.37 (s, 4H), 7.23 (d, J=8.6 Гц, 2H), 6.96 (d, J=8.7 Гц, 2H), 5.17 (d, J=15.7 Гц, 1H), 4.84-4.74 (m, 3H), 4.49-4.31 (m, 2H), 3.91 (dd, J=12.8, 6.4 Гц, 1H), 3.77-3.69 (m, 1H), 3.68-3.62 (m, 1H), 3.55 (t, J=2.4 Гц, 1H), 2.00 (s, 2H).
Синтез (3R)-3-амино-N-[(1R)-2,2-дифторциклопропил]-1,1,4-триоксо-5-{[4-(трифторметил)фенил]метил}-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 179)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 87%.
LCMS: METCR1416 Generic 7 minutes. rt=3.07 мин, M/Z (ES+) 504.5 [М+Н+] 99% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 9.11 (s, 1H), 8.01 (d, J=8.1 Гц, 1H), 7.95 (d, J=8.2 Гц, 1H), 7.82 (s, 1H), 7.68 (d, J=8.2 Гц, 2H), 7.58 (d, J=8.1 Гц, 2H), 5.28 (d, J=16.1 Гц, 1H), 4.93 (d, J=16.1 Гц, 1H), 3.90 (dd, J=13.0, 6.6 Гц, 1H), 3.74 (dd, J=11.0, 6.7 Гц, 1H), 3.64 (dd, J=12.9, 11.1 Гц, 1H), 3.52-3.40 (m, 1H), 2.08-1.91 (m, 3H), 1.69-1.58 (m, 1H).
Синтез (3R)-3-амино-5-[(4-бромфенил)метил]-N-(2,2-дифторциклопропил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 180)
Указанное в названии соединение синтезировали согласно общей методике GP5 с получением указанного в названии соединения в виде твердого вещества белого цвета при выходе 88%.
LCMS: METCR1416 Generic 7 minutes. rt=3.01 мин, M/Z (ES+) 515.75/517.10 [М+Н+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 9.12 (s, 1Н), 8.00 (d, J=8.1 Гц, 1H), 7.97-7.91 (m, 1H), 7.84 (d, J=11.6 Гц, 1H), 7.50 (dd, J=8.5, 2.2 Гц, 2H), 7.31 (d, J=8.0 Гц, 2H), 5.21-5.07 (m, 1H), 4.92-4.77 (m, 1H), 3.89 (dd, J=12.6, 5.9 Гц, 1H), 3.78-3.67 (m, 1H), 3.67-3.58 (m, 1H), 3.52-3.41 (m, 1H), 2.25 (br. s, 2H), 2.07-1.95 (m, 1H), 1.74-1.57 (m, 1H).
Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-{2-оксаспиро[3.3]гептан-6-ил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазенин-7-карбоксамида (Пример 181)
Стадия 1: Синтез метил (3R)-3-амино-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилат гидрохлорида
Указанное в названии соединение синтезировали из промежуточного соединения IV-06 согласно общей методике GP5 с получением указанного в названии соединения с количественным выходом.
LCMS: METCR1410 Generic 1.7 minutes. rt=0.94 мин, M/Z (ES+) 377/379 [М+Н+] 98% УФ
1Н ЯМР (500 МГц, DMSO-d6) δ 8.59 (s, 3Н), 8.00 (d, J=1.6 Гц, 1Н), 7.84 (dd, J=8.0, 1.7 Гц, 1H), 7.79 (d, J=8.0 Гц, 1H), 7.36-7.28 (m, 4H), 5.31 (d, J=15.6 Гц, 1H), 5.02 (d, J=15.6 Гц, 1H), 4.02 (dd, J=11.8, 6.8 Гц, 1H), 3.87 (s, 3H), 3.74-3.67 (m, 1H), 3.28 (t, J=11.7 Гц, 1H).
Стадия 2: Синтез метил (3R)-3-{[(бензилокси)карбонил]амино}-5-[(4- хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата
В раствор метил (3R)-3-амиио-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилат гидрохлорида (230 мг, 0.56 ммоль) в DCM (6 мл) добавили DIPEA (290 мкл, 1.67 ммоль), затем бензил хлорформиат (945 мкл, 0.67 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1.5 ч. В реакционную смесь добавили воду (20 мл) и DCM (20 мл). Смесь распределили посредством фазового разделителя (TELOS). Органический слой концентрировали с получением бледно-желтого масла. Остаток очистили посредством колоночной хроматографии (диоксид кремния, элюент: гептаны, 0-50% EtOAc) с получением целевого указанного в названии соединения в виде твердого вещества белого цвета (0.28 г, количественный выход) при 99% чистоте.
LCMS: METCR1410 Generic 1.7 min. rt=1.31 мин, M/Z (ES+) 533/535 [M+Na+] 99% УФ
1H ЯМР (500 МГц, Хлороформ-d) δ 7.92 (s, 1Н), 7.84 (dd, J=8.0, 1.7 Гц, 1H), 7.66 (d, J=8.0 Гц, 1H), 7.37-7.27 (m, 5H), 7.19 (s, 4H), 5.82 (d, J=7.7 Гц, 1H), 5.44 (d, J=15.1 Гц, 1H), 5.04 (s, 2H), 4.72 (d, J=15.1 Гц, 1H), 4.51-4.37 (m, 1H), 3.93 (s, 3H), 3.74 (dd, J=10.9, 6.6 Гц, 1H), 2.94 (t, J=11.2 Гц, 1H).
Стадия 3: Синтез (3R)-3-{[(бензилокси)карбонил]амино}-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты
Указанное в названии соединение синтезировали из метил (3R)-3-{[(бензилокси)карбонил]амино}-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоксилата согласно общей методике GP2 с получением указанного в названии соединения при выходе 94% (94% чистота).
LCMS: METCR1410 Generic 1.7 min. rt=1.19 мин, M/Z (ES+) 519/521 [M+Na+] 99% УФ
1H ЯМР (500 МГц, Хлороформ-d) δ 7.94 (d, J=1.5 Гц, 1H), 7.84 (d, J=8.0 Гц, 1H), 7.69 (d, J=8.0 Гц, 1H), 7.38-7.28 (m, 5H), 7.20 (s, 4H), 5.90 (d, J=7.9 Гц, 1H), 5.45 (d, J=15.1 Гц, 1Н), 5.06 (s, 2H), 4.74 (d, J-15.1 Гц, 1H), 4.55-4.46 (m, 1H), 3.81-3.72 (m, 1H), 2.98 (t, J=11.3 Гц, 1H).
Стадия 4: Синтез бензил N-[(3R)-5-[(4-хлорфенил)метил]-7-({2-оксаспиро[3.3]гептан-6-ил}карбамоил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата
Указанное в названии соединение синтезировали из (3R)-3-{[(бензилокси)карбонил]амино}-5-[(4-хлорфенил)метил]-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-7-карбоновой кислоты согласно общей методике GP3 с получением указанного в названии соединения при выходе 83% (94% чистота).
LCMS: METCR1410 Generic 1.7 min, rt=1.18 мин. M/Z (ES+) 592/594 [М+Н+] и 614/616 [M+Na+] 100% УФ;1H ЯМР (500 МГц, DMSO-d6) δ 8.70 (d, J=7.0 Гц, 1Н), 7.93 (d, J=9.0 Гц, 2Н), 7.68 (s, 2Н), 7.37-7.21 (m, 9Н), 5.33 (d, J=15.5 Гц, 1Н), 4.99 (s, 2Н), 4.88 (d, J=15.5 Гц, 1Н), 4.63 (s, 2Н), 4.51 (s, 2Н), 4.24-4.14 (m, 2Н), 3.50 (dd, J=11.1,6.9 Гц, 1H), 3.11 (t, J=11.8 Гц, 1H), 2.62-2.55 (m, 2Н), 2.29-2.19 (m, 2Н).
Стадия 5: Синтез бензил N-[(3R)-5-[(4-хлорфснил)метил]-7-({2-оксаспиро[3.3]гептан-6-ил}карбамоил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамат
Указанное в названии соединение синтезировали из бензил N-[(3R)-5-[(4-хлорфенил)метил]-7-({2-оксаспиро[3.3]гептан-6-ил}карбамоил)-4-оксо-2,3,4,5-тетрагидро-1,5-бензотиазепин-3-ил]карбамата согласно общей методике GP4 с получением указанного в названии соединения при выходе 84% (92% чистота).
LCMS: METCR1410 Generic 1.7 min. rt=1.12 мин, M/Z (ES+) 624/626 [М+Н+] и 646/648 [M+Na+] 100% УФ; 1Н ЯМР (500 МГц, DMSO-d6) δ 8.90 (d, J=7.0 Гц, 1H), 8.03-7.92 (m, 3H), 7.81 (s, 1H), 7.33 (t, J=8.3 Гц, 9H), 5.19 (d, J=15.9 Гц, 1H), 5.03 (s, 2H), 4.86 (d, J=15.9 Гц, 1H), 4.63 (s, 2H), 4.51 (s, 2H), 4.47-4.39 (m, 1H), 4.23-4.09 (m, 2H), 3.77-3.67 (m, 1H), 2.59 (dd, J=11.8, 7.5 Гц, 2H), 2.28-2.18 (m, 2H).
Стадия 6: Синтез (3R)-3-амино-5-[(4-хлорфенил)метил]-N-{2-оксаспиро[3.3]гептан-6-ил}-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 181)
Суспензию бензил N-[(3R)-5-[(4-хлорфенил)метил]-7-({2-оксаспиро[3.3]гептан-6-ил}карбамоил)-1,1,4-триоксо-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-3-ил]карбамата (55 мг, 0.08 ммоль) и Pd/C (10%, 8.63 мг, 0.01 ммоль) в смеси EtOH (2 мл) и DCM (2 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 3 ч. Реакционную смесь отфильтровали через слой Celite® и промыли с помощью EtOH. Фильтрат концентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии (диоксид кремния, 0-10% (7N NH3 в МеОН) в DCM) с получением смеси указанного в названии соединения (86%) и дегалогенированного побочного продукта (14%)
LCMS: METCR1416 Generic 7 minutes: rt=2.81 мин, M/Z (ES+) 490/492 [М+Н+] UV=86%
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.84 (d, J=7.1 Гц, 1H), 7.96 (d, J=8.1 Гц, 1H), 7.91 (d, J=7.9 Гц, 1H), 7.78 (s, 1H), 7.35 (s, 4H), 5.17 (d, J=15.7 Гц, 1H), 4.85 (d, J=15.7 Гц, 1H), 4.62 (s, 2H), 4.50 (s, 2H), 4.18 (ap. h, J=8.1 Гц, 1H), 3.87 (dd, J=12.6, 6.2 Гц, 1H), 3.67 (s, 1H), 3.64-3.57 (m, 1H), 2.58 (td, J=7.5, 4.0 Гц, 2H), 2.22 (ddd, J=12.9, 8.2, 4.9 Гц, 2H), 1.98 (br. s, 2H).
Синтез (3R)-5-[(4-хлорфенил)метил]-3-(этиламино)-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (Пример 182)
В раствор (3R)-3-амино-5-[(4-хлорфенил)метил]-8-фтор-1,1,4-триоксо-N-(4,4,4-трифторбутил)-2,3,4,5-тетрагидро-1λ6,5-бензотиазепин-7-карбоксамида (100 мг, 0.19 ммоль) в 1,2 DCE (2 мл) добавили ацетальдегид (8.2 мкл, 0.15 ммоль). Ацетат натрия (19 мг, 0.23 ммоль) добавили, а затем триацетоксиборгидрид натрия (61 мг, 0.287 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавили DCM (10 мл) и промыли с водой (5 мл), высушили (Na2SO4), отфильтровали и концентрировали при пониженном давлении, с получением неочищенного остатка, 125 мг, содержащего указанное в названии соединения (70%), близко элюируемый исходный амин (~10%) и диэтиловый побочный продукт (10%). Неочищенный продукт обработали с помощью Вос2О (47 мг, 0.22 ммоль) и DIPEA (28 мкл, 0.22 ммоль) в THF (2 мл) в течение 3 ч при комнатной температуре. Реакционную смесь концентрировали до сухости при пониженном давлении, повторно растворили в DCM (10 мл) и промыли с помощью воды (5 мл). Органические экстракты высушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении. Неочищенный продукт очистили посредством препаративной ВЭЖХ (кислотный метод) с получением указанного в названии соединения в виде соли муравьиной кислоты, а затем SCX (2 г, промыли МеОН, элюировали 7М NH3 раствор в МеОН) с получением 27 мг (23%) указанного в названии соединения в виде твердого вещества белого цвета.
LCMS: MET-UHPLC-AB-101, rt=2.56 мин, M/Z (ES+) 550.1/552.1 [М+Н+] 100% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 8.67 (t, J=5.4 Гц, 1Н), 7.72 (d, J=8.6 Гц, 1H), 7.62 (d, J=5.6 Гц, 1H), 7.40-7.27 (m, 4H), 5.19 (d, J=15.8 Гц, 1H), 4.80 (d, J=15.8 Гц, 1H), 3.96 (dd, J=12.5, 6.2 Гц, 1H), 3.74-3.57 (m, 2H), 3.35-3.31 (m, 2H), 2.48-2.42 (m, 1H), 2.34-2.15 (m, 4H), 1.72 (dt, J=14.7, 7.0 Гц, 2H), 0.92 (t, J=7.0 Гц, 3H).
Методики для
1H,2Н,3Н,4Н-5λ6-пиридо[3,4-b][1,4]тиазепин производных
Синтез (3R)-3-амино-N-бутил-1-[(4-хлорфенил)метил]-2,5,5-триоксо-1Н,2Н,3Н,4Н-5λ6-пиридо[3,4-b][1,4]тиазепин-8-карбоксамид гидрохлорида (Пример 183)
Синтез метил 4-амино-5-иодпиридин-2-карбоксилата (Промежуточное соединение Х-01)
N-иодсукцинимид (4.44 г, 19.72 ммоль) добавили в раствор метил 4-аминопиридин-2-карбоксилата (3 г, 19.72 ммоль) в 1,2-DCE (115 мл), охлажденный на ледяной бане. Полученной смеси позволили нагреться до комнатной температуры и затем перемешивали при 80°С в течение 16 ч. Еще N-иодсукцинимид (1 г, 0.23 экв.) добавили в реакционную смесь и нагревание продолжали в течение 5 ч. Реакционную смесь затем распределили между DCM (50 мл) и водой (50 мл). Органическую фазу промыли с помощью воды и соляным раствором (100 мл), высушили над Na2SO4 и отфильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в названии соединения в виде красного твердого вещества при выходе 95%.
LCMS: METCR0990: rt=1.12 min M/Z (ES+) 279 [М+Н+] 97% УФ
ЯМР данные:1Н ЯМР (500 МГц, DMSO-d6) δ 8.48 (s, 1Н), 7.35 (s, 1H), 6.50 (s, 2H), 3.82 (s, 3H).
Синтез (2R)-3-{[4-амино-6-(метоксикарбонил)пиридин-3-ил]сульфанил}-2-{[(трет-бутокси)карбонил]амино}пропановой кислоты (промежуточное соединение Х-02)
Смесь промежуточного соединения Х-01 (97%, 1500 мг, 5.23 ммоль), Boc-L-цистеина (1.16 г, 5.23 ммоль) и DIPEA (1.87 мл, 10.47 ммоль) в безводном толуоле (30 мл) дегазировали и поместили в атмосферу азота. Затем, (1Е,4Е)-1,5-дифенилпента-1,4-диен-3-он-палладий (3:2) (120 мг, 0.131 ммоль) и (9,9-диметил-9Н-ксантен-4,5-диил)бис(дифенилфосфан) (151 мг, 0.262 ммоль) добавили. Реакционную смесь дегазировали, поместили в атмосферу азота и нагревали при 100°С в течение 1.5 ч. Реакционную смесь охладили до комнатной температуры, разбавили с помощью DCM и отфильтровали через Celite®. Фильтрат концентрировали при пониженном давлении и очистили посредством обращеннофазовой колоночной хроматографии с получением 2.88 г указанного в названии соединения в виде коричневого твердого вещества при 66% чистоте по ЯМР (диРЕА в качестве основной примеси), 98% выход.
LCMS: MS19 METCR1410 rt=0.75 min M/Z (ES+) 372[M+H+] 96% УФ
ЯМР данные: 1H ЯМР (500 МГц, Метанол-d4) δ 8.35 (s, 1H), 7.43 (s, 1H), 4.19 (s, 1H), 3.93 (s, 3H), 3.30-3.26 (m, 1H), 3.20-3.12 (m, 1H), 1.40 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-2-оксо-1Н,2Н,3Н,4Н-пиридо[3,4-b][1,4]тиазенин-8-карбоксилата (Промежуточное соединение X-03)
К суспензии промежуточного соединения Х-02 (66%, 2.38 г, 4.23 ммоль) в THF (25 мл) добавили DIPEA (1.47 мл, 1.78 ммоль) и Т3Р® (50% раствор в EtOAc, 5 мл, 8.46 ммоль), и реакцию перемешивали при комнатной температуре в течение 1 ч. Смесь погасили с помощью воды (15 мл) и экстрагировали с помощью EtOAc (15 мл × 2). Объединенные органические экстракты промыли соляным раствором, высушили над Na2SO4 и отфильтровали. Фильтрат концентрировали при пониженном давлении, и остаток очистили посредством колоночной флеш-хроматографии (диоксид кремния, элюент: гептаны, 20-100% EtOAc) с получением 0.69 г указанного в названии соединения в виде твердого вещества грязновато-белого цвета при 90% чистоте по ЯМР, выход 41%.
LCMS: METCR1410 rt=0.94 min M/Z (ES+) 354 [M+H+] 99% УФ
ЯМР данные: 1Н ЯМР (500 МГц, DMSO-d6) δ 10.62 (s, 1Н), 8.72 (s, 1H), 7.72 (s, 1H), 7.45 (d, J=8.0 Гц, 1H), 4.20-4.11 (m, 1H), 3.90 (s, 3H), 3.63 (dd, J=11.3, 6.4 Гц, 1H), 3.28 (t, J=11.7 Гц, 1H), 1.34 (s, 9H).
Синтез метил (3R)-3-{[(трет-бутокси)карбонил]амино}-1-[(4-хлорфенил)метил]-2-оксо-1Н,2Н,3Н,4Н-пиридо[3,4-b][1,4|тиазенин-8-карбоксилата (Промежуточное соединение Х-04)
Смесь промежуточного соединения Х-03 (135 мг, 0.38 ммоль), 1-(бромметил)-4-хлорбензол (117.74 мг, 0.57 ммоль), K2CO3 (158.39 мг, 1.15 ммоль) и KI (31.71 мг, 0.19 ммоль) в DMSO (2 мл) перемешивали при комнатной температуре в течение 1.5 ч. Реакционную смесь охладили на ледяной бане, и воду (5 мл) добавили. Полученный осадок выделили путем фильтрации и промыли с помощью воды (10 мл) с получением 182 мг указанного в названии соединения в виде твердого вещества кремового цвета с 90% чистотой.
LCMS: METCR1673 Generic 2 minutes rt=1.21 min M/Z (ES+) 478/480 [M+H+] 90%УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.78 (s, 1Н), 8.04 (s, 1H), 7.67-7.59 (m, 1H), 7.35-7.28 (m, 4H), 5.19 (q, J=16.3 Гц, 2H), 4.20 (s, 1H), 3.89 (s, 3H), 3.59 (dd, J=11.1, 6.7 Гц, 1H), 3.30-3.22 (m, 1H), 1.36 (s, 9H).
Синтез (3R)-3-{[(трет-бутокси)карбонил]амино}-1-[(4-хлорфенил)метил]-2-оксо-1Н,2Н,3Н,4Н-пиридо[3,4-b][1,4] тиазенин-8-карбоновой кислоты (промежуточное соединение Х-05)
Смесь промежуточного соединения Х-04 (95%, 371 мг, 0.74 ммоль) и гидрата гидроксида лития (1:1:1) (61.89 мг, 1.47 ммоль) в THF/MeOH/вода (10/3/1,20 мл)) перемешивали при комнатной температуре в течение 1.5 ч.
Реакционную смесь концентрировали при пониженном давлении. Остаток растворили в DCM и промыли с помощью 1М вод. раствора HCl (20 мл). Органическую фазу высушили над Na2SO4 и отфильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в названии соединения в виде твердого вещества бледно-желтого цвета, при чистоте 89% и выходе 84%.
LCMS: METCR1673 Generic 2 minutes rt=1.24 min M/Z (ES+) 464/466 [M+H+] 89% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.72 (s, 1H), 8.07 (s, 1Н), 7.24-7.17 (m, 4Н), 5.56 (d, J=15.7 Гц, 1Н), 5.51 (s, 1Н), 4.81 (d, J=15.6 Гц, 1Н), 4.50-4.39 (m, 1Н), 3.78 (dd, J=10.9, 6.3 Гц, 1Н), 3.11 (t, J=11.4 Гц, 1Н), 1.40 (s, 9Н)
Синтез трет-бутил N-[(3R)-8-(бутилкарбамоил)-1-[(4-хлорфенил)метил]-2-оксо-1Н,2Н,3Н,4Н-пиридо[3,4-b][1,4]тиазепин-3-ил]карбамата (Промежуточное соединение Х-06)
DIPEA (0.12 мл, 0.67 ммоль) добавили в раствор промежуточного соединения X-05 (89%, 100 мг, 0.19 ммоль) в DMF (2.6 мл). Полученную смесь охладили на ледяной бане, и HATU (109.41 мг, 0.29 ммоль) добавили. Реакцию перемешивали при 0°С в течение 15 мин, затем бутан-1-амин (28.44 мкл, 0.29 ммоль) добавили. Через 15 мин при 0°С, реакции позволили нагреться до комнатной температуры и перемешивали в течение 1.5 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии (диоксид кремния, элюент: гептаны, 12-100% EtOAc) с получением указанного в названии соединения в виде масла бледно-желтого цвета (84 мг) при 86% чистоте по ЯМР и выходе 72%.
LCMS: METCR1673 Generic 2 minutes rt=1.57 min M/Z (ES+) 519/521 [M+H+] 99%УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 8.62 (s, 1Н), 8.09 (s, 1H), 7.91 (t, J=5.9 Гц, 1H), 7.21 (s, 4H), 5.57-5.48 (m, 2H), 4.81 (d, J=15.5 Гц, 1H), 4.45-4.37 (m, 1H), 3.74 (dd, J=10.9, 6.4 Гц, 1H), 3.47 (dh, J=13.7, 6.8 Гц, 2H), 3.04 (t, J=11.3 Гц, 1H), 1.62 (p, J=7.2 Гц, 2H), 1.44 (dd, J=15.1, 7.5 Гц, 2H), 1.39 (s, 9H), 0.96 (t, J=7.4 Гц, 3H)
Синтез трет-бутил N-[(3R)-8-(бутилкарбамоил)-1-[(4-хлорфенил)метил]-2,5,5-триоксо-1Н,2Н,3Н,4Н-5λ6-пиридо[3,4-b][1,4|тиазепин-3-ил]карбамата (промежуточное соединение Х-07)
m-СРВА (77%, 32.75 мг, 0.15 ммоль) добавили в раствор промежуточного соединения Х-06 (86%, 42 мг, 0.07 ммоль) в DCM (1.5 мл), охлажденный на ледяной бане. Полученной смеси позволили нагреться до комнатной температуры и перемешивали в течение 16 ч. Реакционную смесь распределили между DCM (5 мл) и 1М вод. Раствором NaOH (2 мл). Органическую фазу промыли с помощью 1М вод. NaOH (2 мл) и затем концентрировали при пониженном давлении с получением указанного в названии соединения в виде твердого вещества белого цвета (34 мг) при чистоте 100% и выходе 87%.
LCMS: METCR1673 Generic 2 minutes rt=1.47 min M/Z (ES+) 551/553 [M+H+], 100% УФ
ЯМР данные: 1H ЯМР (500 МГц, Хлороформ-d) δ 9.04 (s, 1Н), 8.13 (s, 1H), 7.95 (t, J=6.0 Гц, 1H), 7.27 (s,4H), 5.64 (d, J=7.3 Гц, 1H), 5.19 (d, J=15.5 Гц, 1H), 5.12 (d, J=15.6 Гц, 1H), 4.58 (dt, J=11.2, 7.1 Гц, 1H), 4.18 (dd, J=13.3, 7.0 Гц, 1H), 3.59 (dd, J=13.1, 11.4 Гц, 1H), 3.54-3.42 (m, J=6.6 Гц, 2H), 1.63 (p, J=7.2 Гц, 2H), 1.47- 1.41 (m, 2H), 1.41 (s, 9H), 0.97 (t, J=7.4 Гц, 3H)
Синтез (3R)-3-амино-N-бутил-1-1(4-хлорфенил)метил]-2,5,5-триоксо-1Н,2Н,3Н,4Н-5λ6-пиридо[3,4-b][1,4]тиазепин-8-карбоксамид гидрохлорида
4М HCl в диоксане (1 мл) и МеОН (1 мл) добавили к промежуточному соединению Х-07 (98%, 31 мг, 0.06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении с получением указанного в названии соединения в виде твердого вещества коричневого цвета (34 мг) при 96% чистоте при количественном выходе.
LCMS: METCR1416 GENERIC 7 MINUTES, rt=1.47 min M/Z (ES+) 451/453 [M+H+], 98% УФ
ЯМР данные: 1H ЯМР (500 МГц, DMSO-d6) δ 8.91 (t, J=6.0 Гц, 1H), 8.72 (t, J=5.7 Гц, 1H), 8.52 (s, 1H), 8.50 (s, 1H), 7.57 (s, 1H), 7.35 (dd, J=8.3 Гц, 4H), 4.69-4.63 (m, 1H), 4.36-4.30 (m, 2H), 3.89-3.64 (m, 2H), 3.28-3.20 (m, 2H), 1.52-1.44 (m, 2H), 1.33-1.21 (m, 2H), 0.88 (t, J=7.3 Гц, 3H).
Биологическая активность
Для определения их биологической активности соединения оценивали в различных анализах
Сущность экспериментальных методов
Выделение РВМС из лейкоцитарной пленки
- Содержимое лейкоцитарной пленки перенесли в стерильную пластиковую бутылку и наполнили до 480 мл с помощью PBS, и равномерно распредели в 16×50 мл пробирок (30 мл/пробирка)
- Подложили с помощью ~11 мл Lymphoprep и центрифугировали 20 мин (2200 оборотов в минуту)
- Интерфазу, содержащую лимфоциты, снимали с помощью переносной пипетки, клетки дважды промывали с помощью PBS и объединяли в одну пробирку для определения количества клеток (Coulter Diff ACT)
Выделение подфракций иммунных клеток из РВМС посредством MACS
- РВМС ресуспендировали в буфере MACS (80 мкл МАС5-буфера/10∧7 клеток), и клетки выделили с помощью устройства Auto-MACS, применяя соответствующий набор согласно инструкциям производителя
TCR стимуляция и измерение активации Т клеток
Изолированные Т-клетки высевали в среду Xvivo при 1,5*10∧5 на лунку в 96-ти луночном культуральном планшете и TCR-стимурировали с использованием анти-CD3/28 mAbs в присутствии соединения, как указано. Продуцирование цитокинов определяли через 24 ч или 48 ч после стимуляции TCR в супернатантах клеточной культуры, применяя коммерчески доступные наборы ELISA (BD и eBioscience) в соответствии с рекомендациями производителя. Т-клеточную пролиферацию и экспрессию CD25 (CD25-PC5 реагент, приобретенный у Beckman Coulter) определяли проточной цитометрией (Beckman-Coulter FC500) и анализировали посредством программного обеспечения Kaluza Software.
Для измерения CD69 экспрессии, выделенные CD4 и CD8 Т клетки поместили в Xvivo среду при 0,8*10∧5 на лунку в 96-ти луночном культуральном планшете и TCR-стимурировали с помощью анти-CD3/28 mAbs в присутствии соединения. CD69 экспрессию определили через 24 часа после TCR стимуляции посредством проточной цитометрии (CD4eF450, CD8APCeF780 и CD69-PC7 реагенты, приобретенные у eBioscience) и проанализировали посредством программного обеспечения Kaluza.
Стимуляция иммунных клеток контактом с опухолью
Выделенные РВМС, NK-клетки или СВ8-положительные клетки высевали в среду Xvivo при 1,5*10∧5 на лунку в 96-ти луночном культуральном планшете в присутствии опухолевых клеток 0,3*10∧4, где указано. Секрецию цитокинов определяли с помощью ELISA, активацию иммунных клеток (с использованием Beckman-Coulter Abs CD25-PC5, CD69-PC7), жизнеспособность клеток и число клеток с помощью проточной цитометрии (Beckman-Coulter FC500 или Gallios), применяя выключение 7-AAD в качестве критерия жизни клетки.
Для экспериментов, изучающих эффекты блокады PD-1, РВМС предварительно инкубировали с 1 ч облученными опухолевыми клетками М21 (50000 опухолевых клеток на 1 милл. РВМС) в течение 14 дней. Впоследствии CD8 Т-клетки выделяли и стимулировали с помощью опухолевых клеток М21, как описано выше. Соединения и анти-PD-1 антитело (Ниволумаб) или контрольное антитело без прямого воздействия на Т-клетки CD8 (Ипилимумаб) добавили, где указано.
Стимуляция NK клеток посредством IL-2
Выделенные NK клетки высевали в среду Xvivo при 1,5*10∧5 на лунку в 96-ти луночном культуральном планшете и стимулировали с помощью 50 нг/мл IL-2 (Aldesleukin), где указано. Секрецию цитокинов определяли с помощью ELISA, активацию иммунных клеток проточной цитометрией (Beckman-Coulter Abs CD25-PC5, CD69-PC7, и выделение на Beckman-Coulter Gallios), применяя выключение 7-AAD в качестве критерия жизни клеток.
Стимуляция FC рецептора на миелоидных тетках
Выделенные моноциты высевали в среду Xvivo при 1,5*10∧5 на лунку в 96-ти луночном культуральном планшете и стимулировли предварительно покрытыми анти-GD2-Abs (10 мкг/мл, Apeiron), где указано. Секрецию цитокинов определяли с помощью твердофазного иммуноферментного анализа (ELISA).
Выделение мышиных спленоцитов
- Суспензию отдельных клеток спленоцитов получили из селезенки селезенка посредством промывания клеток через стерильный 70 мкМ фильтр с помощью PBS
- Клетки собрали посредством центрифугирования в пробирке объемом 15 мл, клеточный осадок ресуспендировали в 1 мл буфера Erylyse и инкубировали при комнатной температуре в течение 5 минут, пробирки, наполненные PBS и клетками, дважды промыли
- Клетки посчитали и ресуспендировали в желаемом объеме буфера для анализа MACS-обогащения или проточной цитометрии
Выделение CD4 Т клеток из ОТ-II трансгенных мышей
- Спленоциты ресуспендировали в MACS буфере (80 мкл MACS-буфер/10∧7 клетки)
- CD4 Т клетки выделили, применяя набор для выделения CD4 Т клеток (Miltenyi) с LS-колонками согласно рекомендациям производителя
CFSE-мечение Т клеток
- Клетки ресуспендировали в PBS с 0.1% BSA при 1×107 клеток/мл, и CFSE-раствор добавили до конечной концентрации 2,5 мкМ CFSE
- Инкубировали в течение 10 мин при 37°С, взбалтывали каждые 2 мин
- Такой же объем FCS добавили и инкубировали в течение 5 мин при комнатной температуре
- Клетки дважды промыли с помощью RMPI-10% FCS среды
- Клетки посчитали и ресуспендировали в PBS или среде при желаемой концентрации
ОТ-II перенос
- День 0: ОТ-II клетки перенесли в PBS (3*10∧6. клеток в 100 мкл PBS) посредством ретро-орбитальной инъекции
- День 1: WT мыши были OVA вакцинированы (подкожно в бок, 10 мкг LPS, 2 мкг OVA на животное)
- через 2 и 4 ч соединения вводили; для перорального введения соединение применяли в виде суспензии (0.5% метилцеллюлозы в воде), для внутривенного введения соединение солюбилизировали в DMSO и разбавили PBS
- День 2: соединения вводили дважды утром (с интервалом в 2 ч)
- День 3: Мышей умертвили, и спленоциты выделяли
- Т клеточную пролиферацию и фенотип определяли проточной цитометрией
i. Проточная цитометрия - окрашивание (все Abs приобретали у eBioscience и применяли согласно рекомендациям производителя): B220-eF450, CD4-PE, CD25PerCPCy5.5, CD69-PC7, TCRVa2-APC, CD8-AF700, CD3-eF780; CFSE; 7-AAD
ii. Выделение на Beckman-Coulter Gallios, Анализ, применяя программное обеспечение Kaluza
Перенос OT-I мышам с B16-F10-OVA опухолями
- День 0: 100000 B16-F10-OVA опухолевые клетки инокулировали подкожно в бок WT-мышей
- День 7: OT-I клетки перенесли в PBS (3*10∧6. клеток в 100 мкл PBS) посредством ретро-орбитальной инъекции
- через 2 и 4 ч соединения вводили пероральным дозированием соединения в виде суспензии (0,5% метилцеллюлозы в воде)
День 10: Мышей умертвляли, и иммунные клетки из опухоль-несущих лимфатических узлов и спленоциты выделяли
Т клеточную пролиферацию и фенотип определяли посредством проточной цитометрии
- Проточная цитометрия-окрашивание (все Abs приобретали у eBioscience или Biolegend и применяли согласно инструкциям производителя): CD4-eF450, B220-BV510, CD107a-PE, CD69-РС5, PD1-PC7, TCRVa2-APC, CD8-AF700, CD3-eF780; CFSE; 7-AAD
- Выделяли на Beckman-Coulter Gallios, анализ, применяя программное обеспечение Kaluza
Иммуномодуляция B16-F10-OVA мышей, несущих опухоль
- День 0: 100000 B16-F10-OVA опухолевые клетки инокулировали подкожно в бок WT-мышей
- День 7 и 8: соединения вводили посредством перорального введения соединения в виде суспензии (0.5% метилцеллюлозы в воде) дважды ежедневно (с интервалом в 4 ч)
- День 9-14: соединения вводили посредством перорального введения соединения в виде суспензии (0.5% метилцеллюлозы в воде) один раз в день
- День 15: Мышей умертвили, и иммунные клетки из опухоль-несущих лимфатических узлов и спленоциты выделяли; образцы опухоли эксплантировали и замораживали в жидком азоте, а мРНК выделяли, применяя GenElute mammalian total RNA miniprep kit (RTN350-1KT)
Т клеточный фенотип определяли проточной цитометрией
- Проточная цитометрия-окрашивание (все Abs приобретали у eBioscience или Biolegend и применяли согласно рекомендациям производителя): CD4-eF450, B220-BV510, PD1-FITC, CD107a-PE, CD25-PerCPCy5.5, CD69-PC7, NK1.1-APC, CD8-AF700, CD3-eF780; CFSE; 7-AAD
- Выделение на Beckman-Coulter Gallios, Анализ, применяя программное обеспечение Kaluza
- Инфильтрацию опухоли иммунными клетками определяли с помощью количественной ОТ-ПЦР на Agilent Мх3005Р QPCR System (Stratagene), применяя анализ экспрессии генов TaqMan® для гена калибратора «домашнего хозяйства» клетки EF1a и для аналитов CD4, CD8, IL-2, IL-12, IL-23, EOMES, Foxp3, IFN-g, Rorgc, T-bet, TNF-a, в соответствии с рекомендациями производителей.
Активность соединения в aCD3/aCD28 стимулированных человеческих РВМС
Чтобы определить иммуномодулирующий эффект соединений согласно настоящему местному в РВМС человека, соединения оценивали по следующей методике анализа:
Лейкоцитарные пленки получали из местной больницы, разбавляли 3 раза PBS и наносили на изотонический разделительный раствор Ficoll d=1,077 г/мл в центрифужных пробирках, объемом 50 мл. Пробирки центрифугировали при 914 g в течение 25 мин при комнатной температуре с отключением тормоза. Слой РВМС удаляли и дважды промывали ледяным PBS. Эритроциты лизировали добавлением ddH2O, и клетки ресуспендировали в X-Vivo 15 (Lonza).
1 е6 клеток/мл стимулировали с помощью растворимых анти-CD3/CD28 антител (1 мкг/мл обоих клонов ОКТ3 и 28,2) в присутствии описанных соединений. Клетки инкубировали в течение 18 ч при 37°С, 5% CO2.
Анализируемые планшеты центрифугировали при 400g в течение 5 мин, и собрали супернатанты. Концентрацию цитокинов в супернатантах тканевой культуры определили с помощью наборов MSD или HTRF (MSD и Cisbio), согласно инструкциям производителя.
Примеры соединений согласно настоящему изобретению классифицировали согласно следующим критериям активности и перечислили в Таблице 3:
Класс активности A: IL-2 или IFN-γ pEC50>5.8 М
Класс активности В IL-2 или IFN-γ pEC50 между 5.3-5.8М
Класс активности С: IL-2 или IFN-γ pEC50<5.3 М и более чем 2-кратное увеличение секреции цитокинов по сравнению со стимулированными клетками в отсутствии соединений.
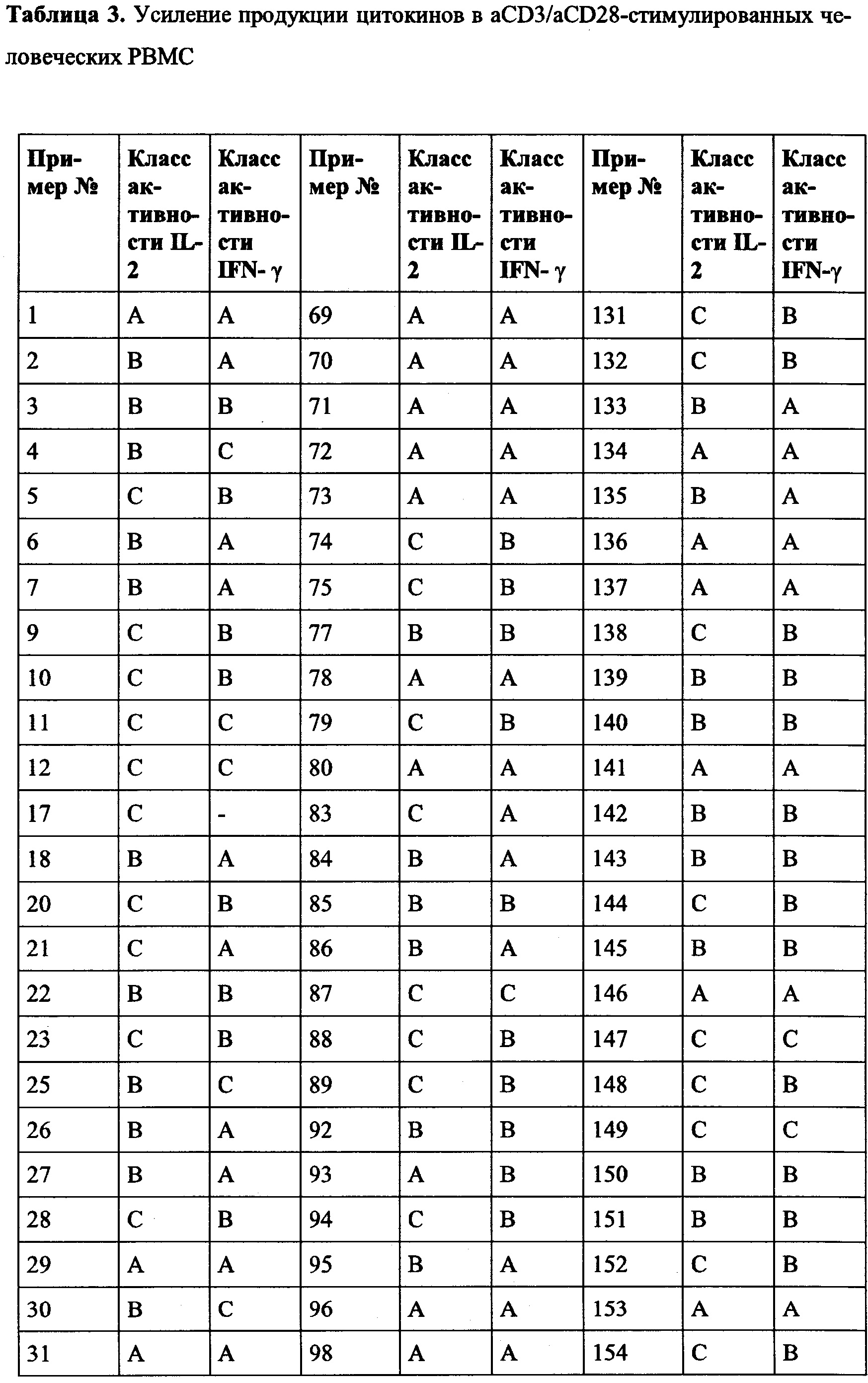
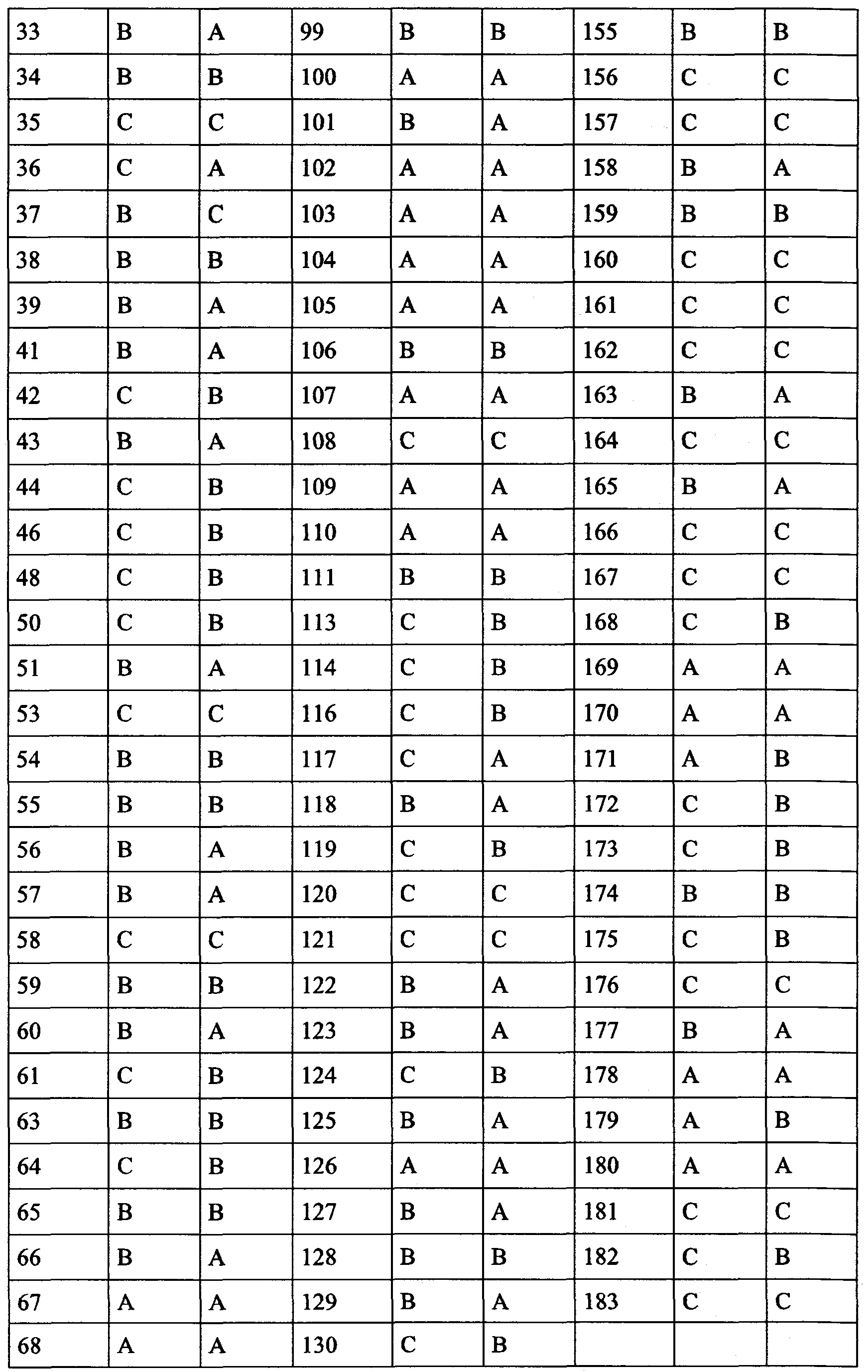
Следующие примеры соединений были протестированы с нестимулированными РВМС и не усиливали секрецию цитокинов или другие признаки активации Т-клеток: примеры соединений 1, 40, 67, 77, 78 и 107. Это важный вывод для соединений, которые должны избирательно действовать на Т-клетки, которые были активированы присутствием антигена из патогенов или опухолей, но не должны приводить к нежелательной общей активации всех Т-клеток пациента.
Активность соединения в aCD3/aCD28 стимулированных выделенных человеческих CD4+-Т-клетках
Лейкоцитарные пленки получали у Австрийского Красного Креста, разбавляли 3 раза PBS и наносили на изотонический разделительный раствор Ficoll d=1,077 г/м в центрифужных пробирках, объемом 50 мл. Пробирки центрифугировали при 914 g в течение 25 мин при комнатной температуре с отключением тормоза. Слой РВМС удаляли и дважды промывали ледяным PBS. CD4 Т-клетки выделяли, применяя CD4-микрошарики (Milteny) и устройство AutoMACS, следуя инструкциям производителя.
Примеры соединений согласно настоящему изобретению классифицировали согласно следующим критериям активности и перечислили в Таблице 4а:
Класс активности A: IL-2 продукция при 3 мкМ концентрации соединения >10 нг/мл
Класс активности В: IL-2 продукция при 3 мкМ концентрации соединения между 2-10 нг/мл
Класс активности С: IL-2 продукция при 3 мкМ концентрации соединения между 2-ым увеличением по сравнению со средней продукцией IL-2 стимулированных клеток в отсутствии соединений и <2 нг/мл
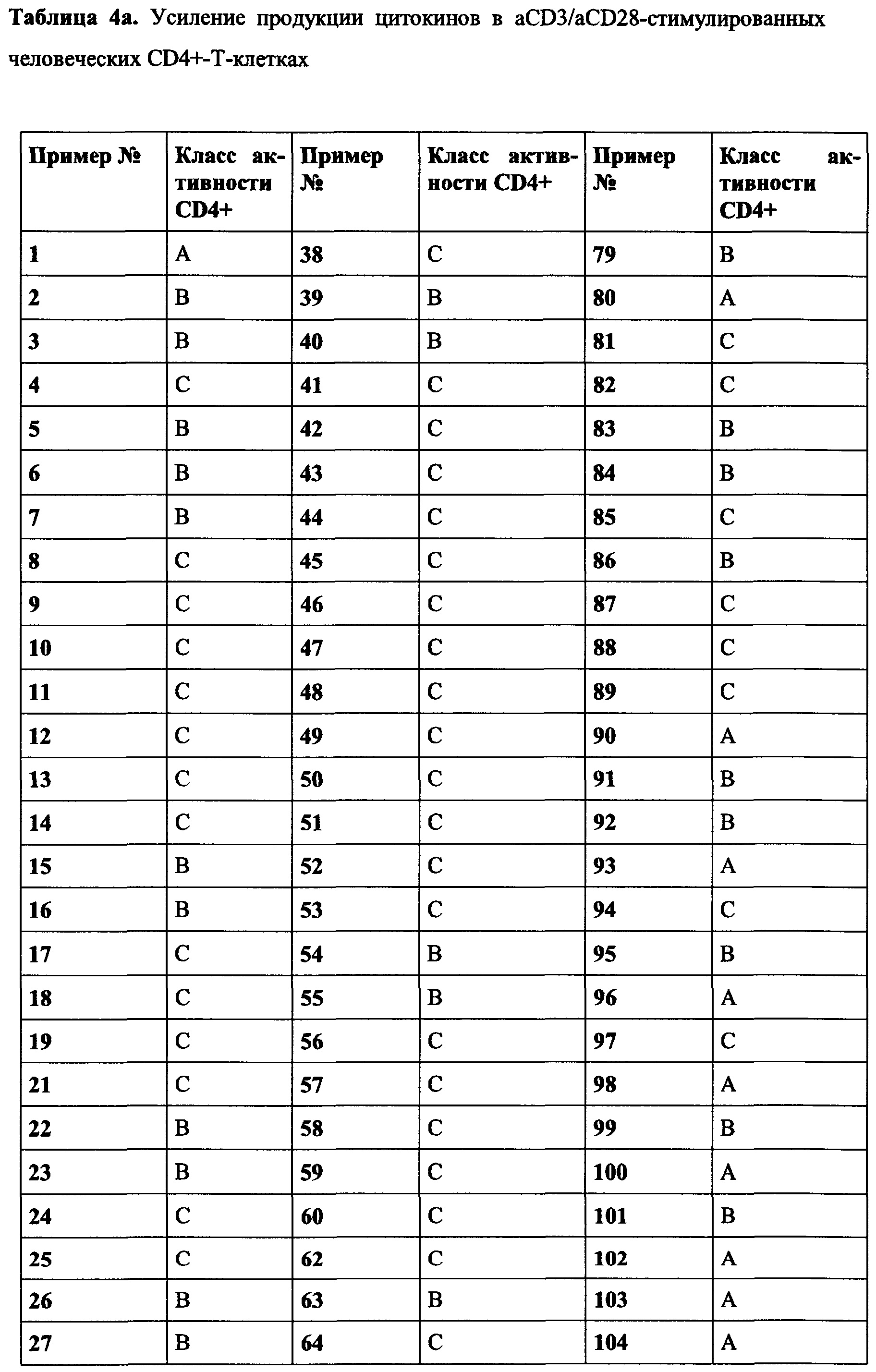

В дополнение к данным, перечисленным в таблице 4а, соединения класса активности А и В показали значительную индукцию по меньшей мере одного из маркеров активации CD25, CD69, CD71 или CD154 (CD40L), как измерено проточной цитометрией.
Активность соединения в aCD3/aCD28 стимулированных выделенных человеческих CD4+ и CD8+ Т-клетках
Для измерения CD69 экспрессии, выделенные CD4 и CD8 Т клетки поместили в Xvivo среду при 80000 на лунку в 96-ти луночном культуральном планшете и TCR-стимурировали с помощью анти-CD3/28 mAbs в присутствии соединения. CD69 экспрессию определили через 24 часа после TCR стимуляции посредством проточной цитометрии (CD4eF450, CD8APCeF780 и CD69-PC7 реагент, приобретенный у eBioscience) и проанализировали посредством программного обеспечения Kaluza.
Примеры соединений согласно настоящему изобретению классифицировали согласно следующим критериям активности и перечислили в Таблице 4b:
Класс активности A: CD69+ на CD4 или CD8 Т- клетках рЕС50>5.8 М
Класс активности В CD69+ на CD4 или CD8 Т- клетках рЕС50 между 5.3-5.8М
Класс активности С: CD69+ на CD4 или CD8 Т- клетках рЕС50<5.3 М


Усиление релевантных аспектов TCR-опосредованной активации CD4 Т клеток
Выделенные CD4 Т клетки были CFSE-мечеными и стимулированными анти-CD3 и анти-CD28 антителами. Соединение 67 значительно усиливало продуцирование ключевых цитокинов для противоопухолевых и противопатогенных иммунных ответов (IL-2, IFN-гамма, TNF-альфа). Кроме того, соединение примера 67 также усиливало Т-клеточную пролиферацию и экспрессию поверхностного маркера активации CD25 (компонент рецептора IL-2), еще более обосновывая потенциальные эффекты на иммунные ответы in vivo, поскольку быстрое распространение Т-клеток при TCR стимуляции является признаком защитного Т-клеточного иммунитета.


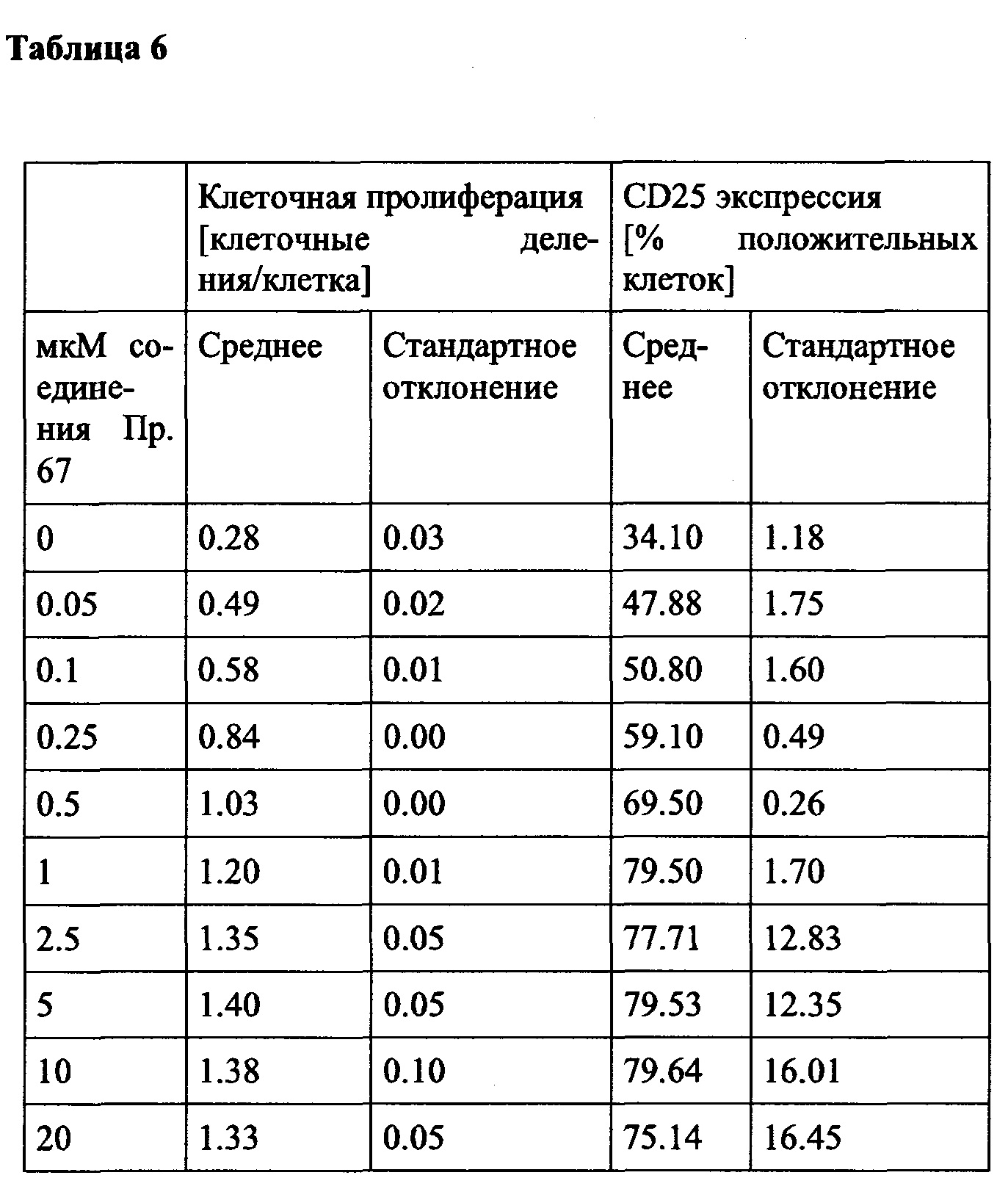
Усиление реакционной способности CD8 Т клеток к TCR стимуляции
Выделенные CD8 Т-клетки были CFSE-мечеными и стимулированными анти-CD3 и анти-CD28 антителами. Помимо повышения релевантных аспектов TCR опосредованной активации CD4 Т клеток, показанной выше, относительно CD8 Т-клеток соединение примера 67 сильно усилило продуцирование цитокинов IL-2, IFN-гамма и TNF-альфа, а также экспрессию CD25 и Т-клеточную пролиферацию. Эти результаты показывают, что соединение примера 67 усиливало ответы как CD4, так и CD8 Т клеток на TCR активацию.


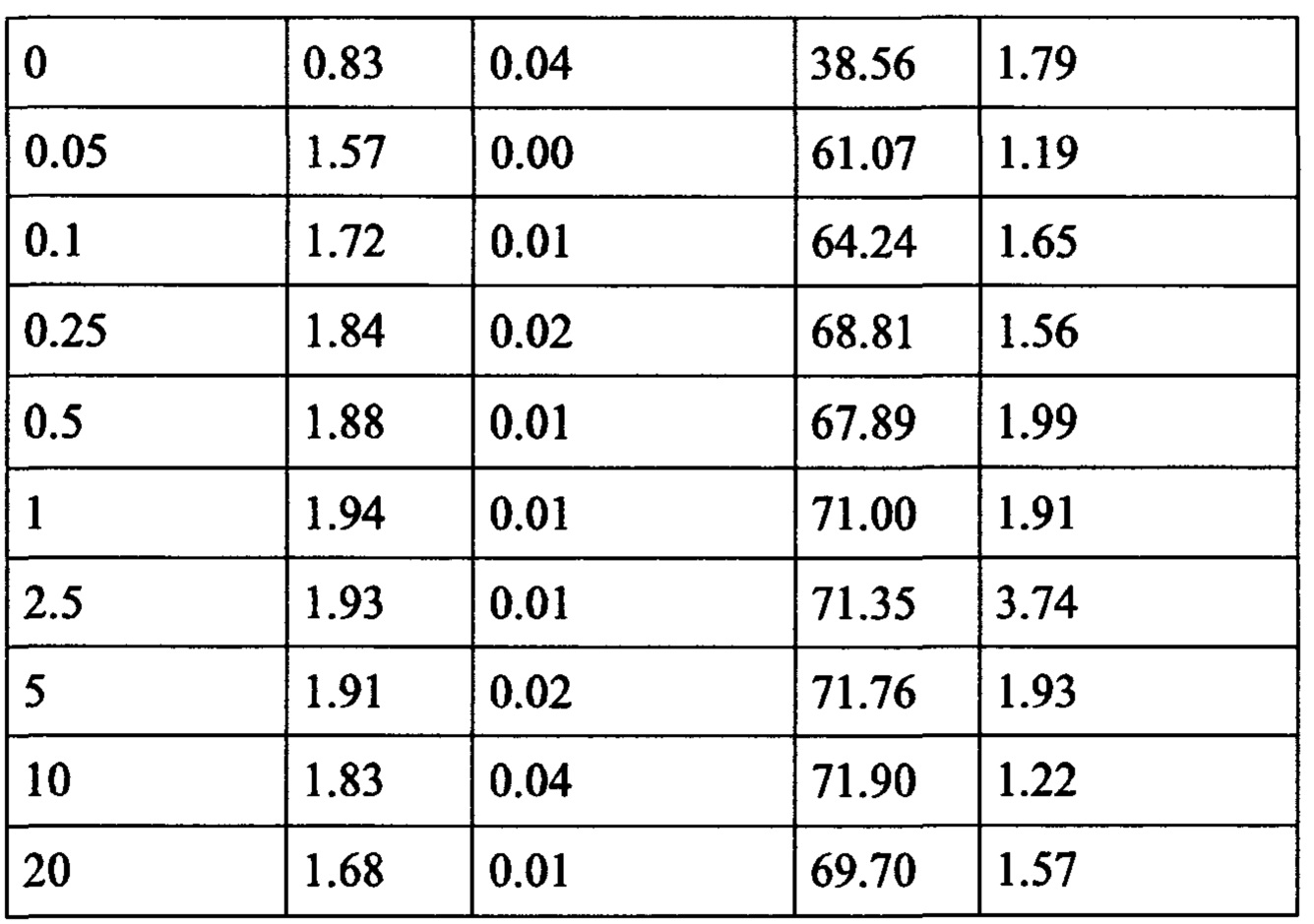
Усиление противоопухолевой реакционной способности CD8 положительных лимфоцитов
С08-положтиельные иммунные клетки выделяли из РВМС и инкубировали с и без соединения примера 67 либо отдельно, либо совместно с клетками меланомы М21. Контакт с опухолевыми клетками приводил к активации иммунных клеток для продуцирования IL-2 и IFN-гамма. Соединение примера 67 улучшало продуцирование обоих цитокинов, особенно при контакте с опухолевыми клетками; такой эффект не был обнаружен в отсутствие опухолевых клеток. Кроме того, соединение примера 67 также усиливало опосредованное контактом с опухолевыми клетками высвобождение цитотоксического эффектора гранзима, который непосредственно связано с убийством опухолевых клеток. В соответствии с этим, присутствие соединения примера 67 в сокультурах иммунных клеток с опухолевыми клетками приводило к сильному уменьшению жизнеспособных опухолевых клеток, в то время как ни количество CD8-Т-клеток, ни количество опухолевых клеток в отсутствие CD8-Т-клеток не были в значительной степени модулированы.
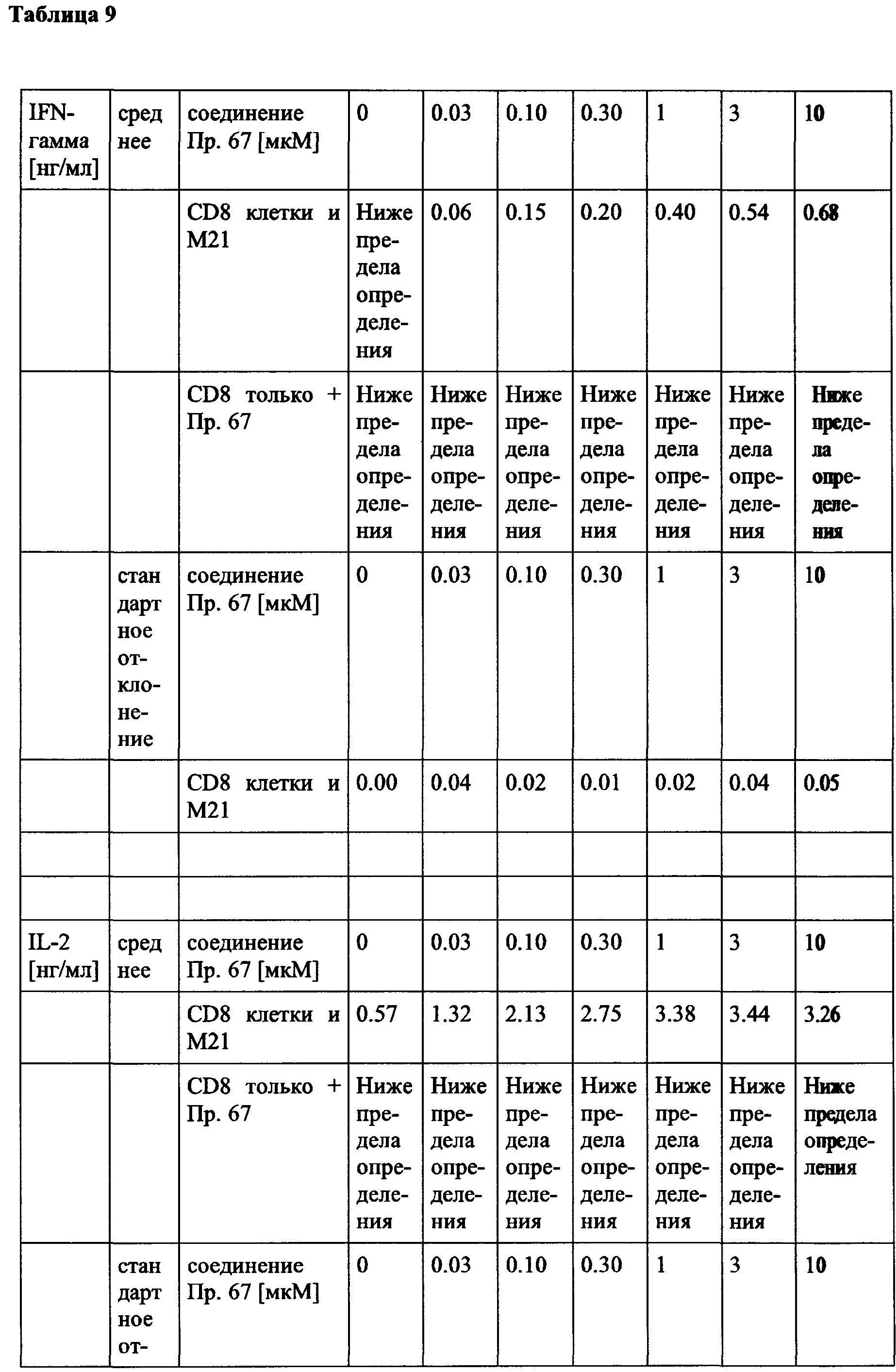
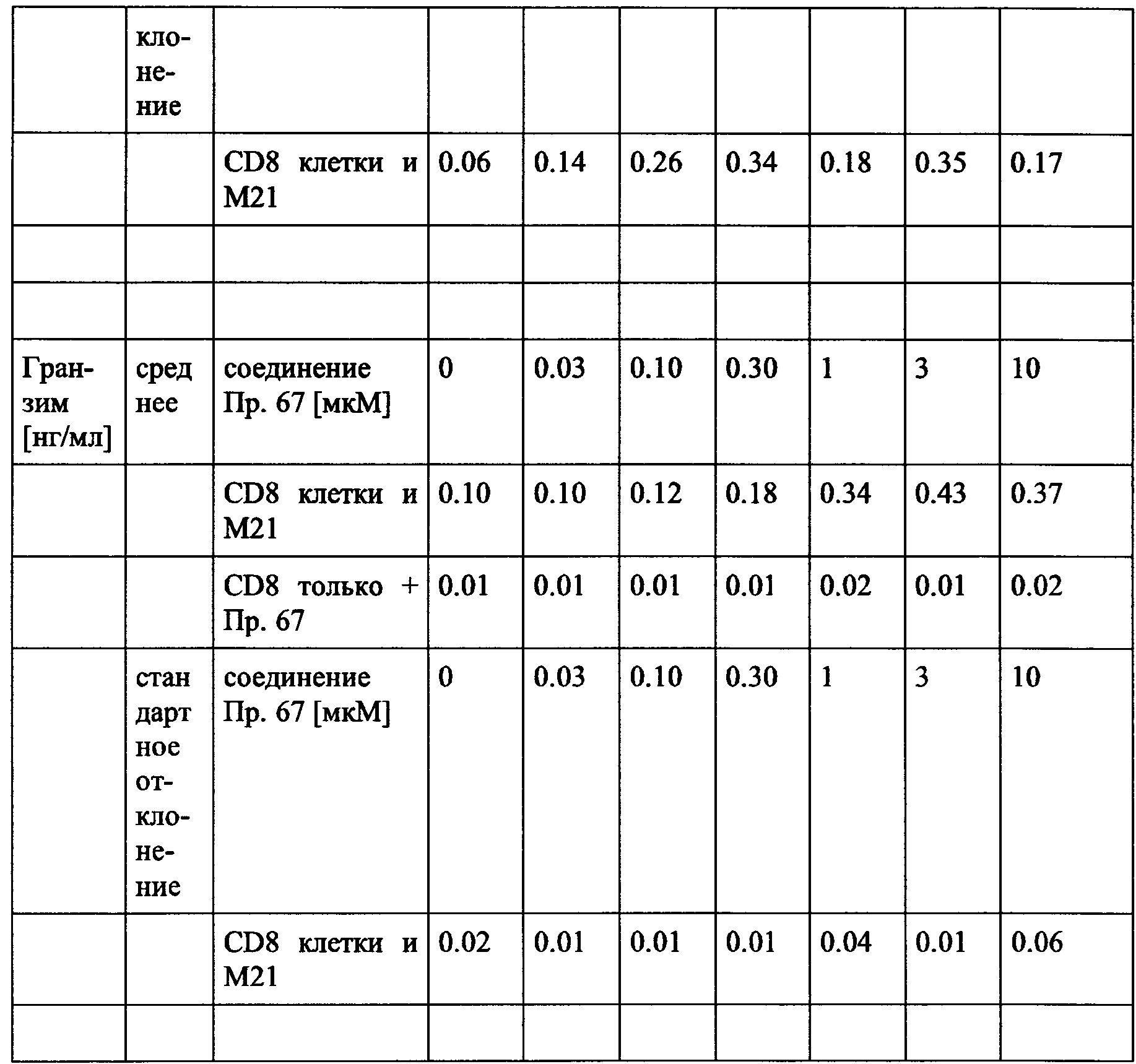
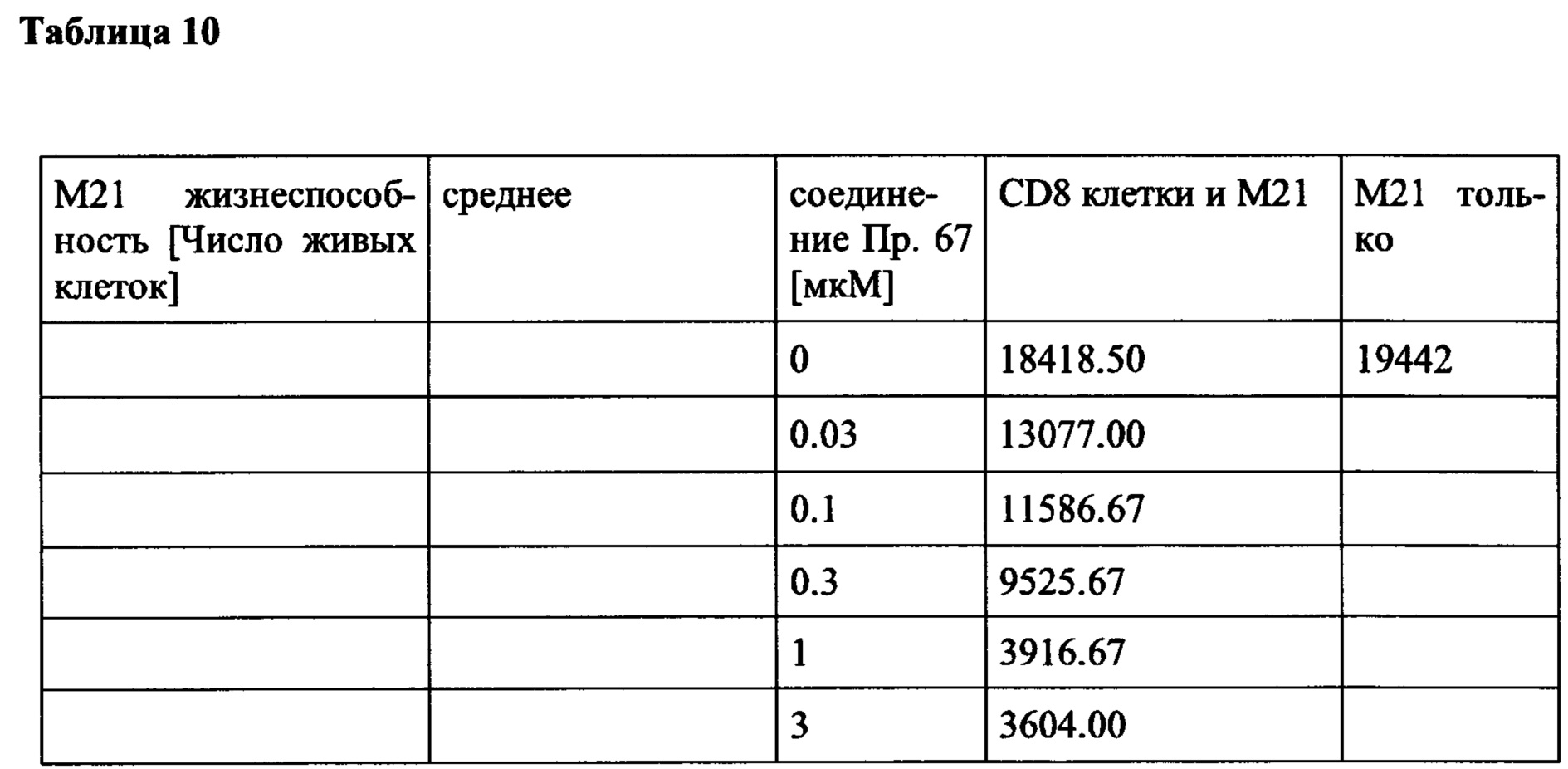
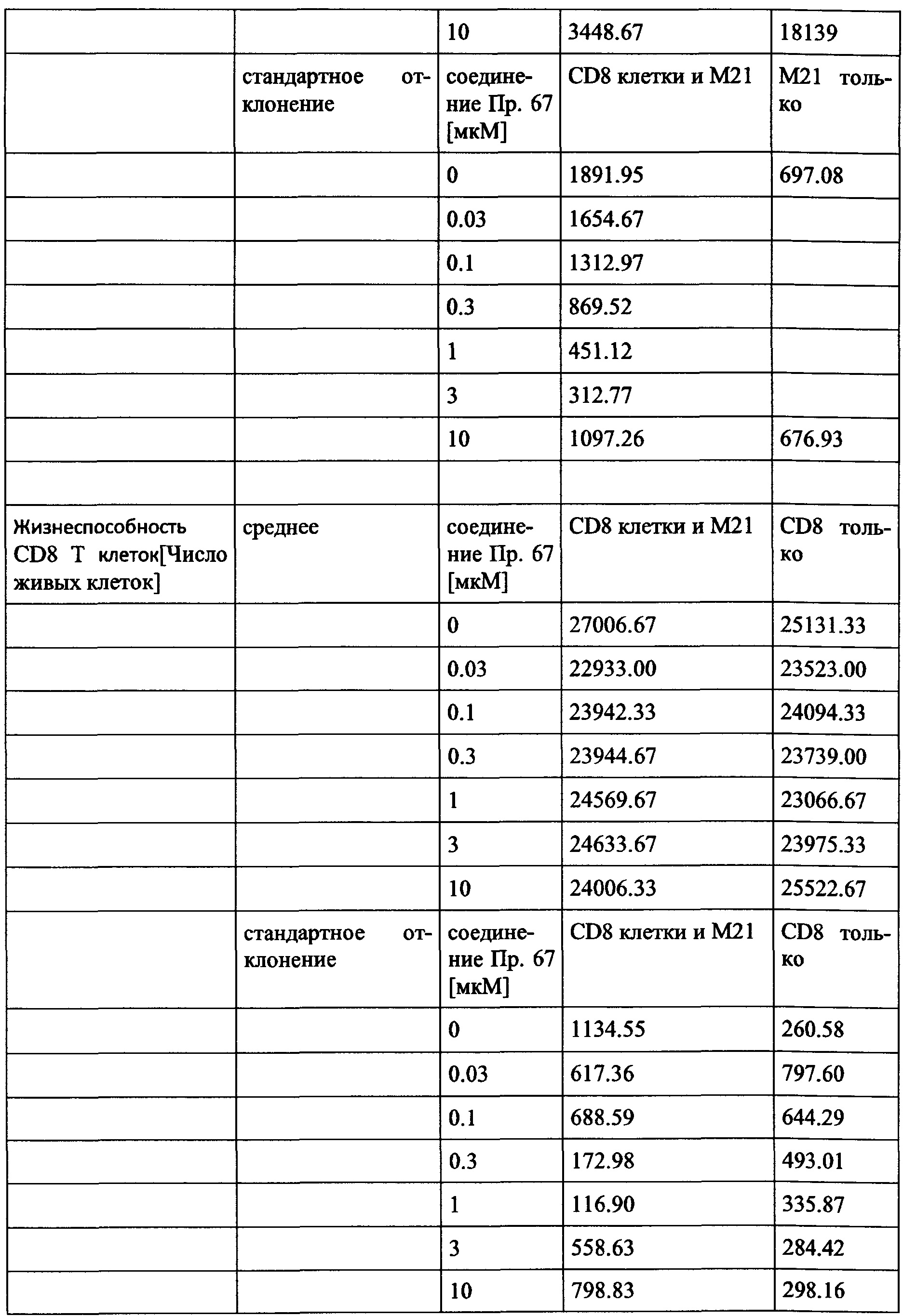
Усиление противоопухолевой реакционной способности NK клеток
Одной из физиологических функций клеток NK в противоопухолевом иммунитете является распознавание и разрушение опухолевых клеток, которые имеют низкую экспрессию молекул МНС, таким образом избежать распознавание CD8 Т-клетками. Понижающая регуляции молекул МНС часто активно опосредуется заражающим вирусом или происходит при развитии злокачественных новообразований. Клеточная линия лейкемии K52 экспрессирует только очень низкие количества МНС-молекул и поэтому часто используется в качестве модельной системы для исследования реакционной способности противоопухолевых NK клеток.
NK-клетки выделяли из РВМС и инкубировали с и без соединений, либо отдельно, либо совместно с клетками лейкемии К562. Контакт с опухолевыми клетками приводил к активации NK-клсток с продуцированием IFN-гамма и TNF-альфа. Оба соединения примера 67 и 77 усиливали продуцирование обоих цитокинов, особенно при контакте с опухолевыми клетками; такой эффект не был обнаружен при отсутствии опухолевых клеток. Повышенная активация NK-клеток при контакте с опухолью также была продемонстрирована на одноклеточной основе путем определения экспрессии поверхностного маркера активации, где фракция CD25 и CD69 дважды положительных NK-клеток представляет собой сильно активированные NK-клетки. Соединения также усиливали опосредованное опухолевыми клетками высвобождение цитотоксического эффектора гранзима, что привело к значительному уменьшению жизнеспособных опухолевых клеток в присутствии NK-клеток.
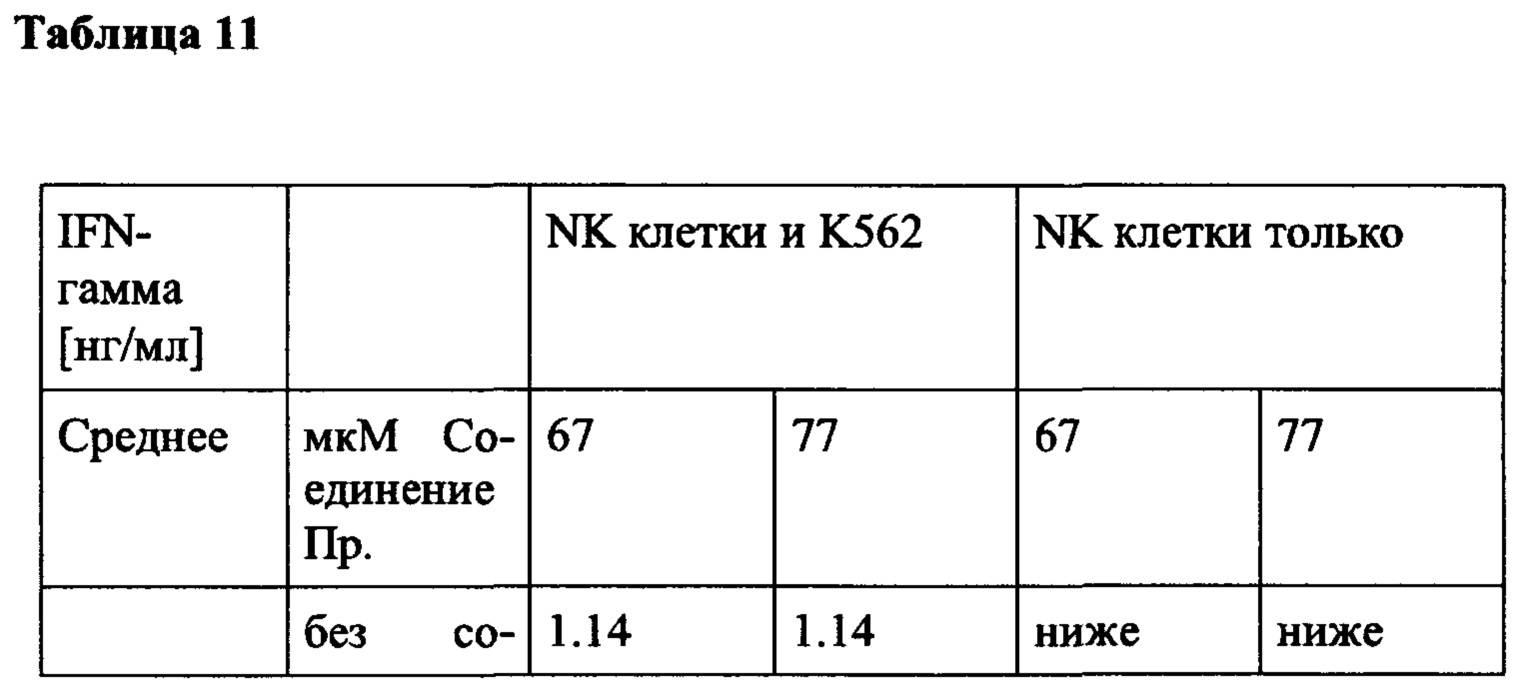




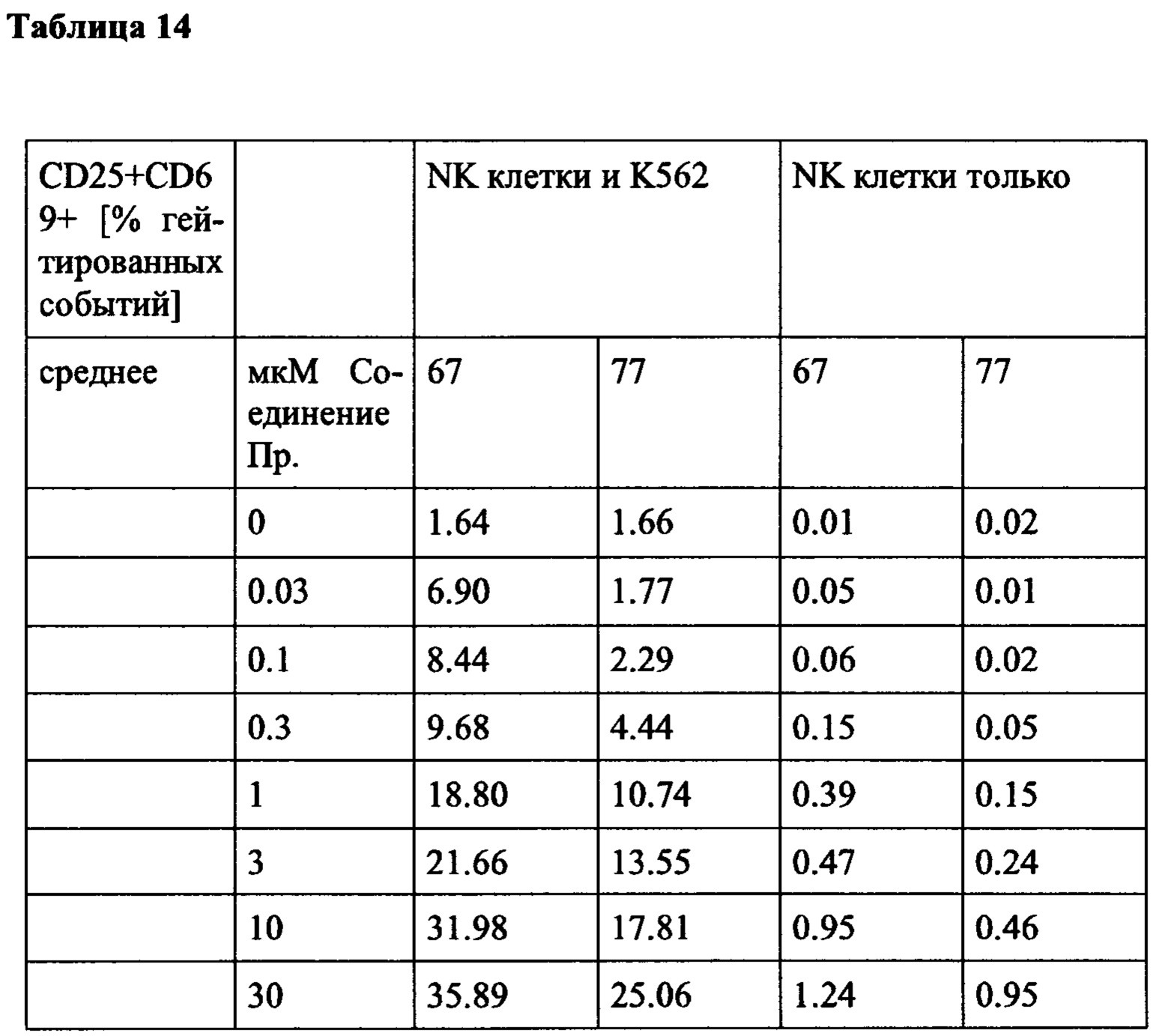
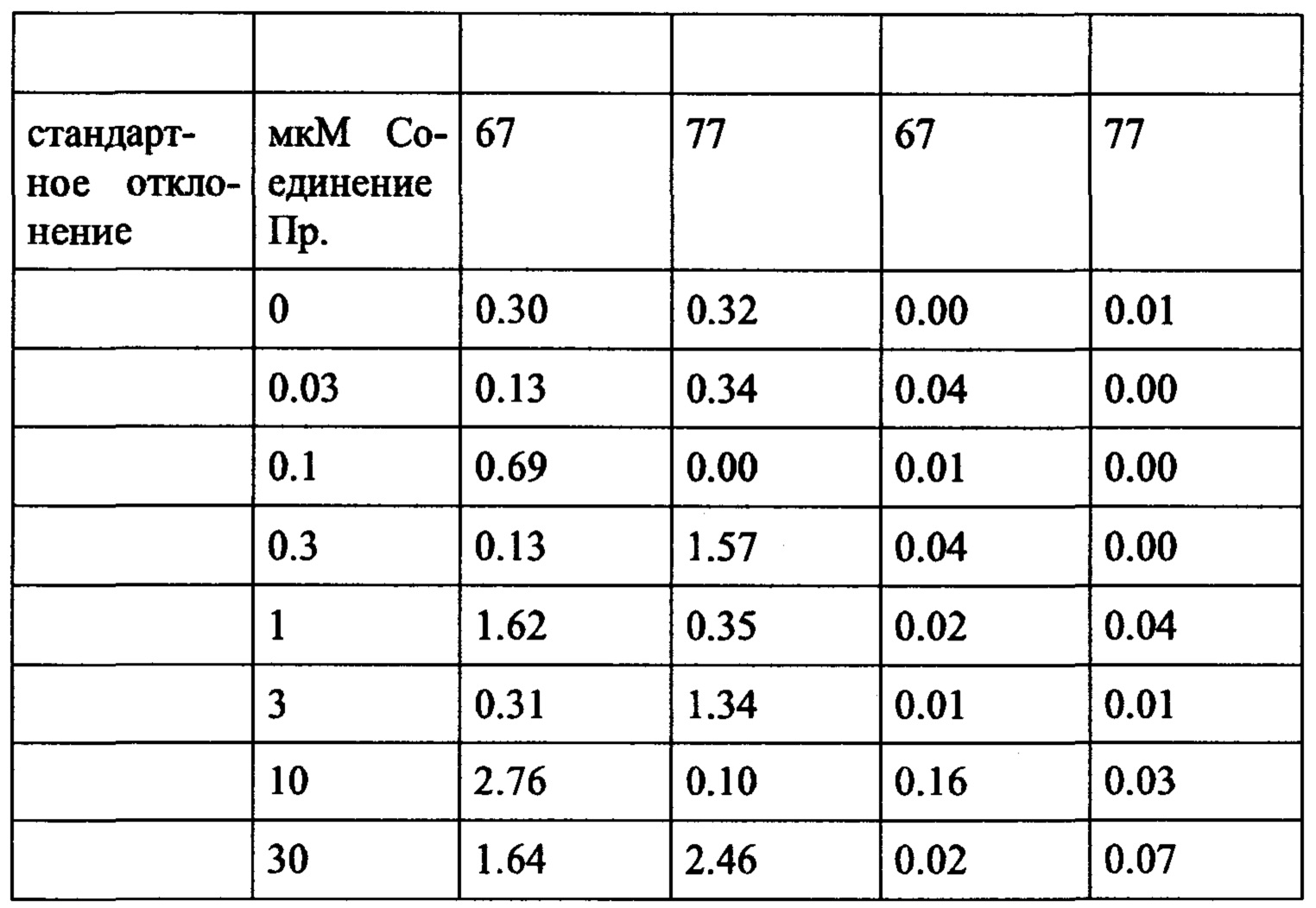
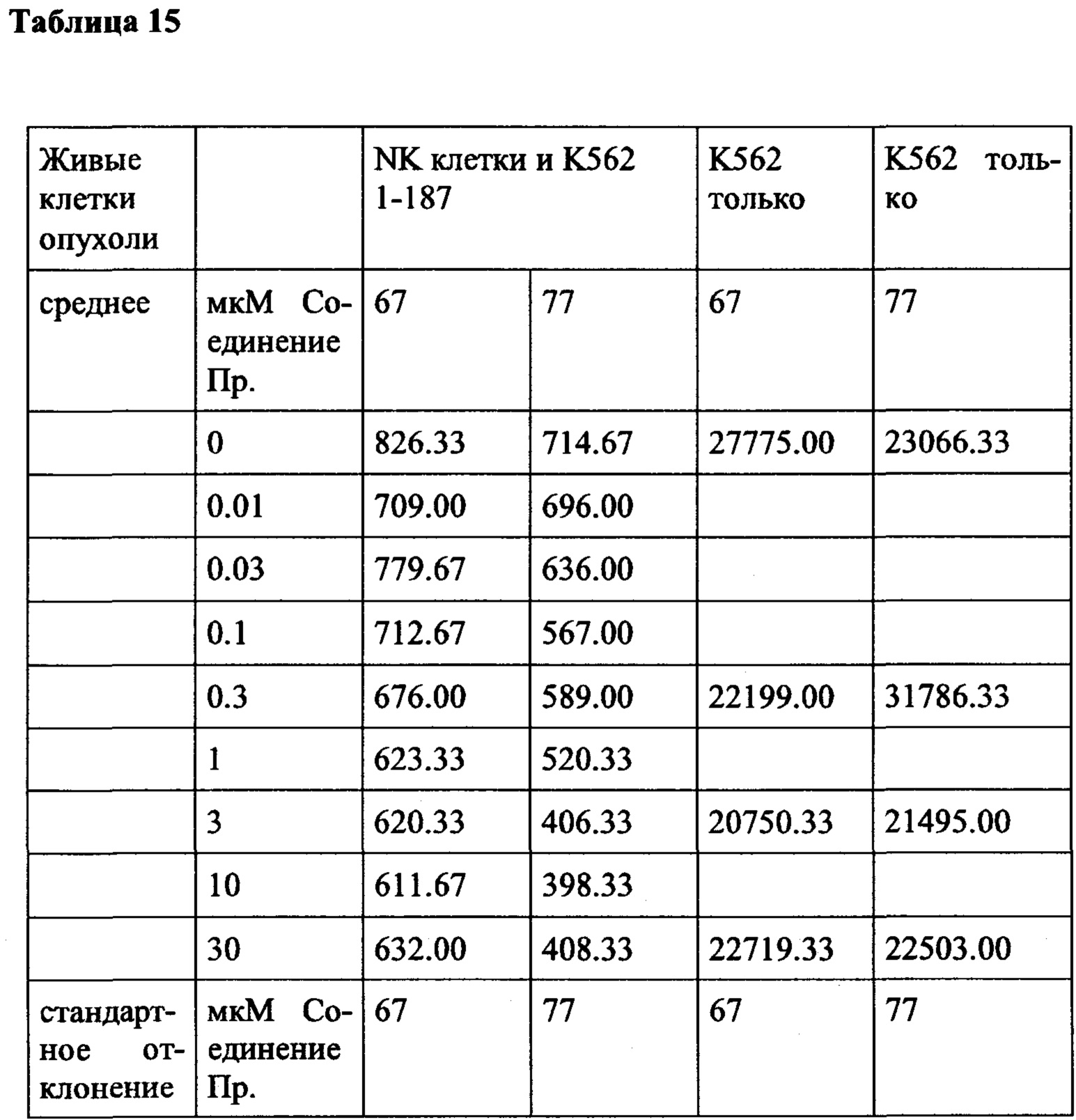
Повышение реакционной способности иммунных клеток к опухолевым клеткам различного происхождения
Линии опухолевых клеток М21 и K562 представляют собой две широко распространенные опухолевые линии меланомы и лейкемии, соответственно. Однако известно, что опухолевые клетки используют различные механизмы для подавления иммунных функций, поэтому было исследовано, можно ли обобщить влияние соединений на активность иммунных клеток на опухолевые клетки на широкий спектр опухолевых клеток с очень разнообразным происхождением из различных типов опухолей.
РВМС выделяли и инкубировали с и без соединений, либо отдельно, либо совместно с различными опухолевыми клетками. Контакт с опухолевой клеткой приводил к активации иммунных клеток с продуцированием цитокинов IL-2 и IFN-гамма и высвобождению гранзима, хотя и в разной степени, на основе также МНС и KIR экспрессионной модели различных линий опухолевых клеток. Соединение примера 40 улучшало секрецию цитокинов и гранзима сильно специфически при контакте с опухолевыми клетками в различных линиях опухолевых клеток; такой эффект не был обнаружен в отсутствие опухолевых клеток. Аналогичные результаты были получены в последующих экспериментах с соединением примера 70 с выделенными клетками CD8, включая также дополнительные линии опухолевых клеток.
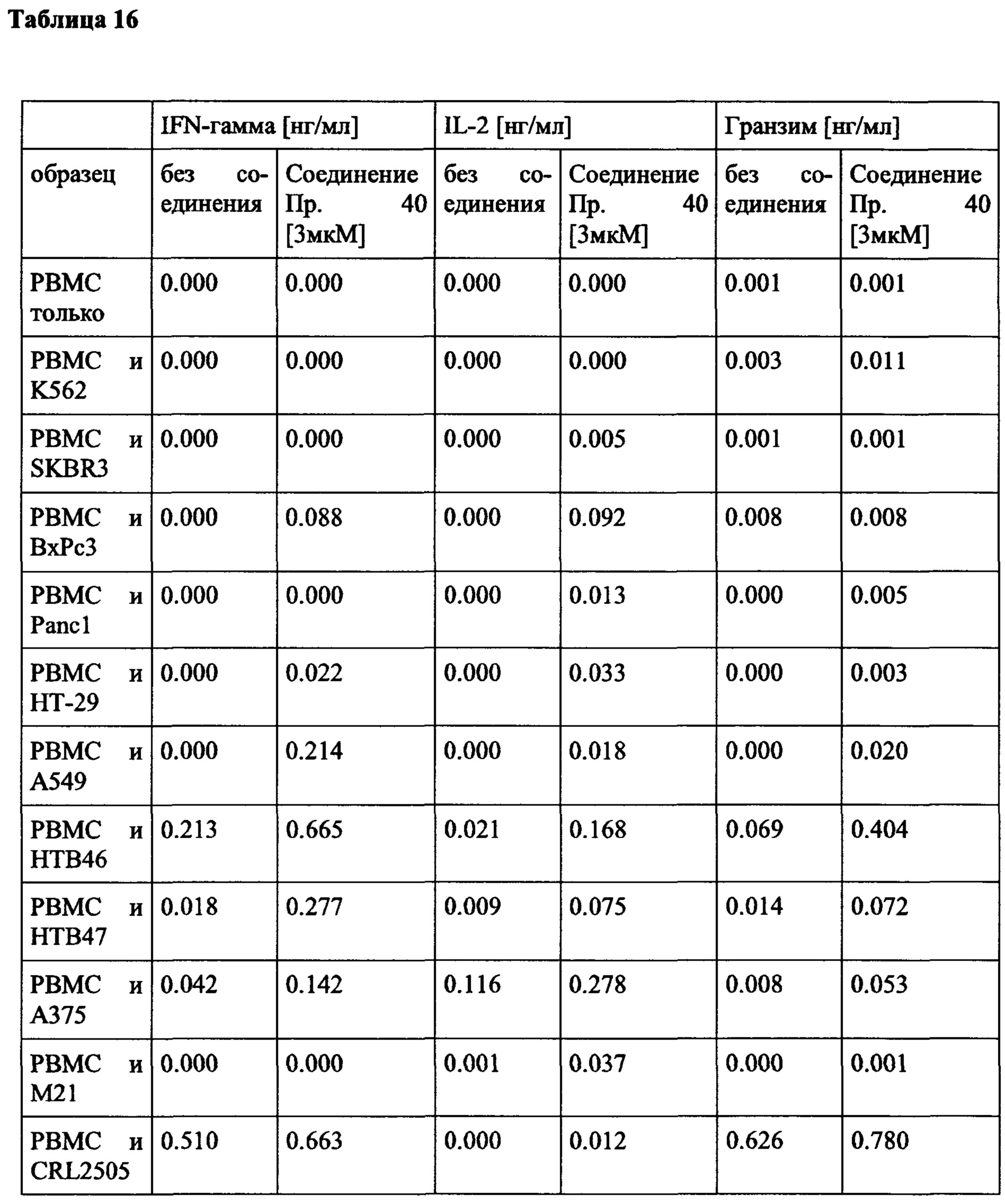

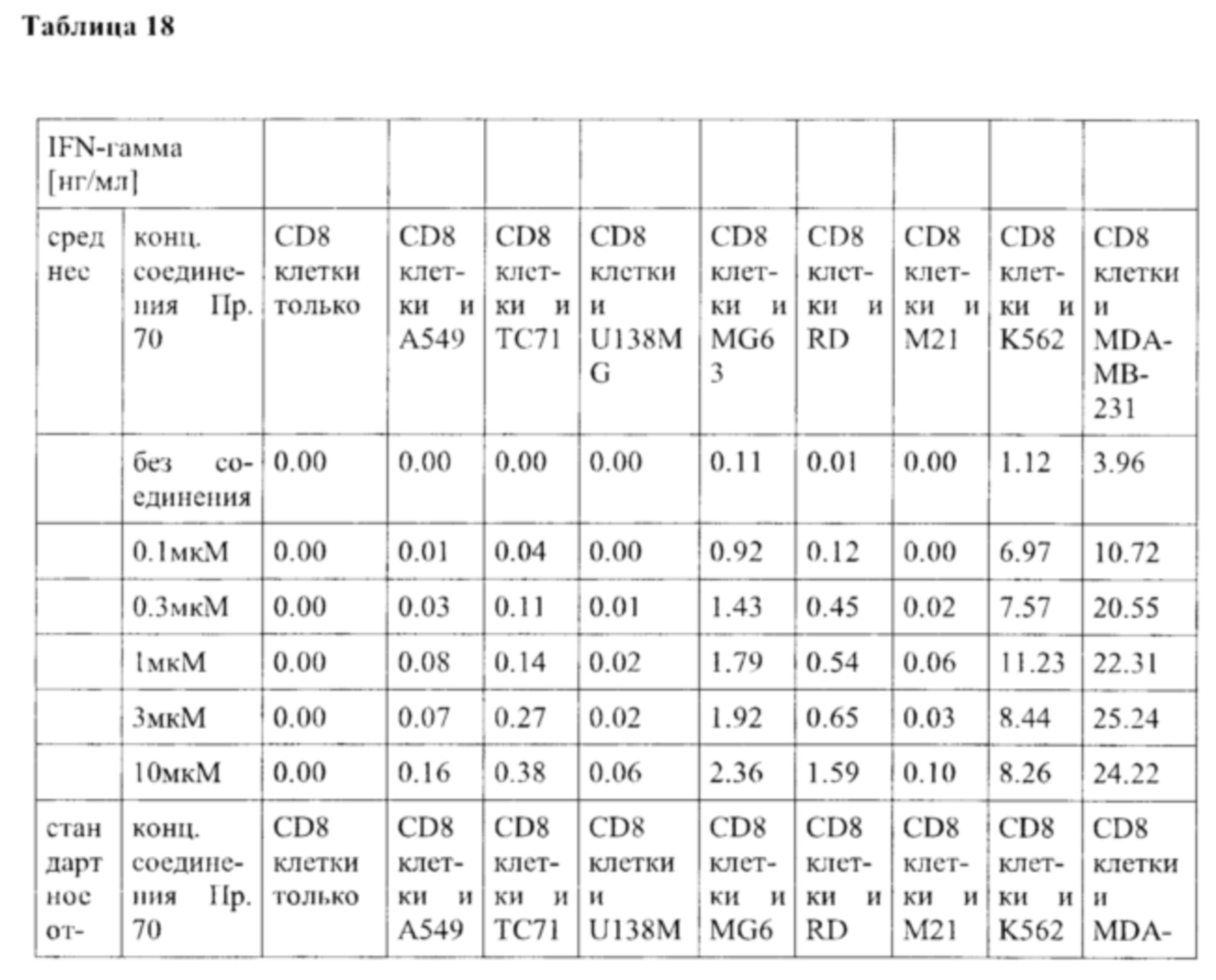
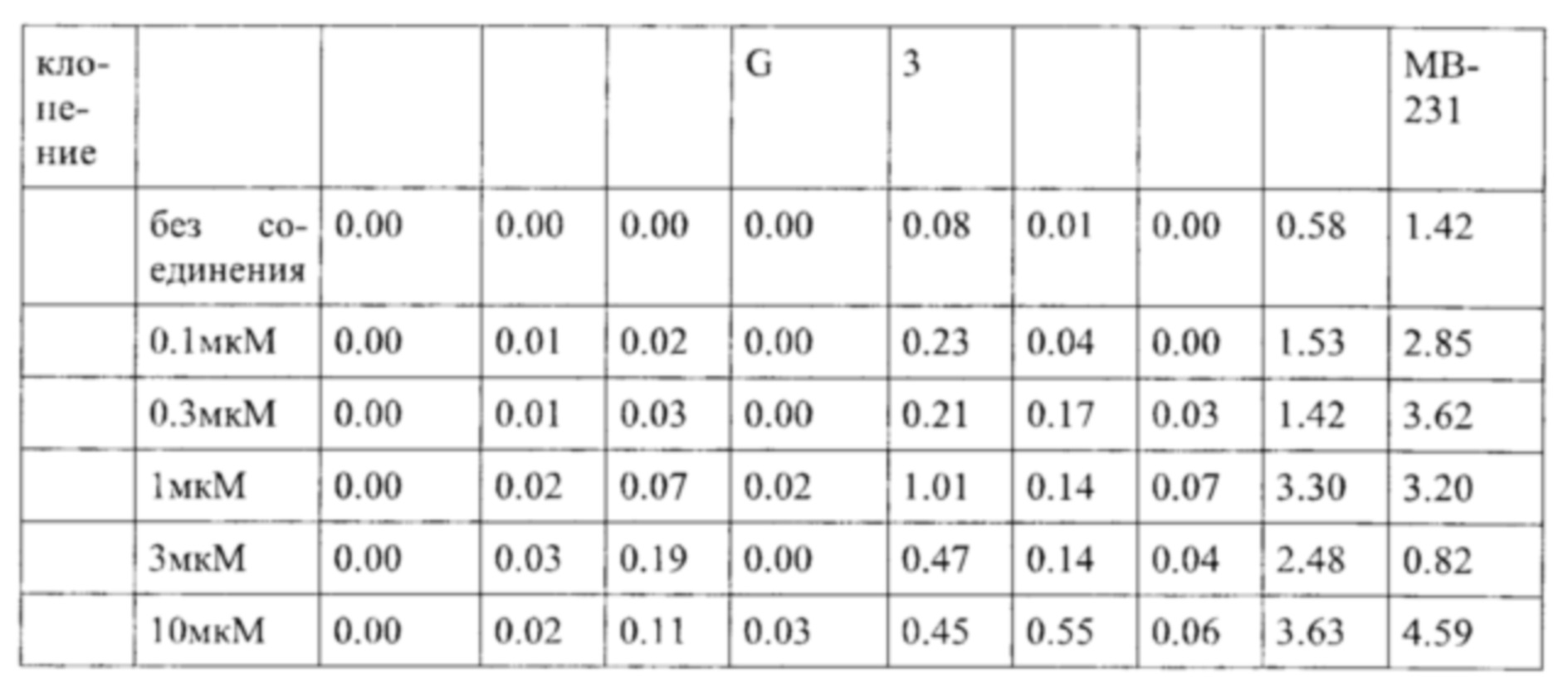
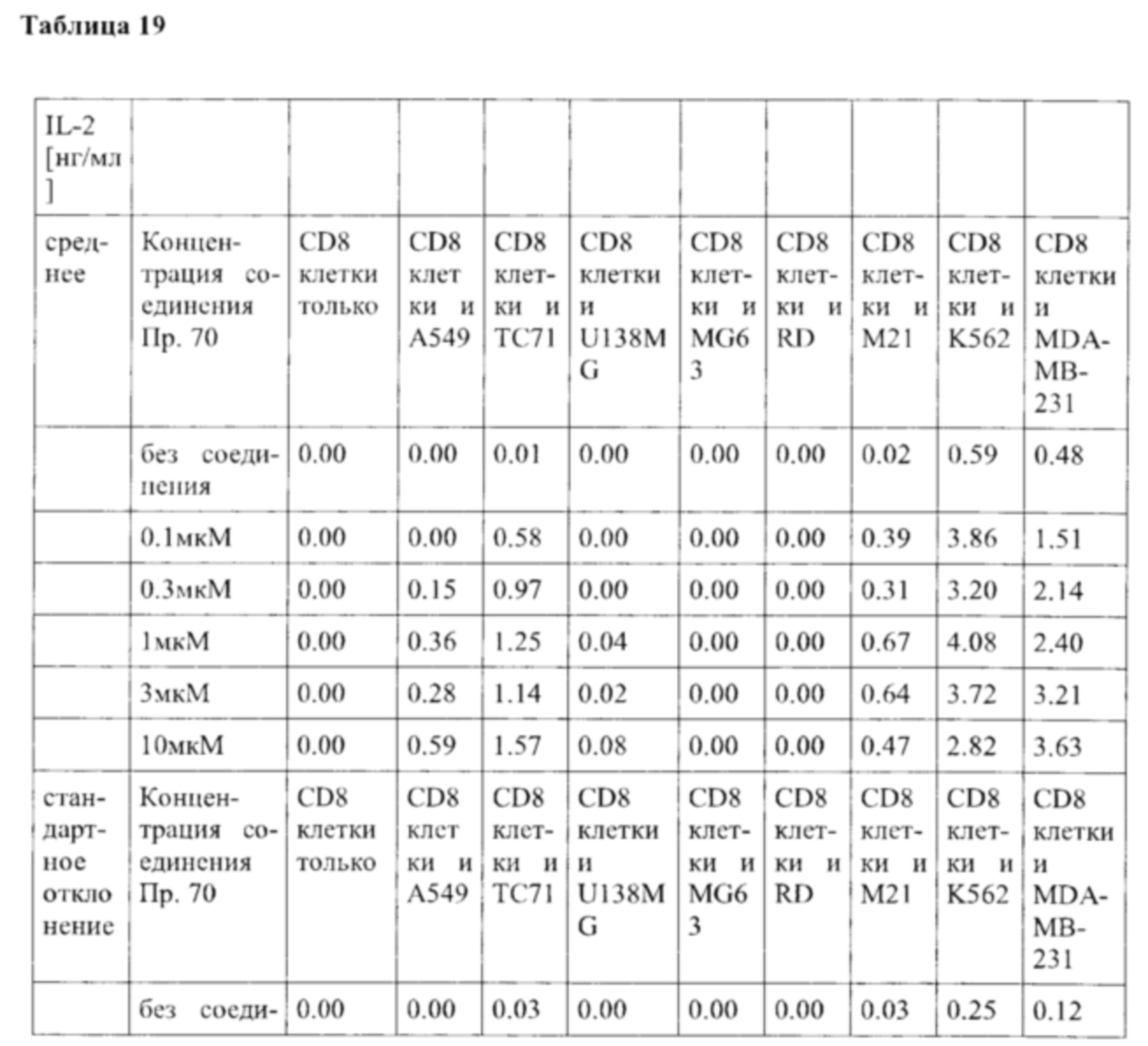
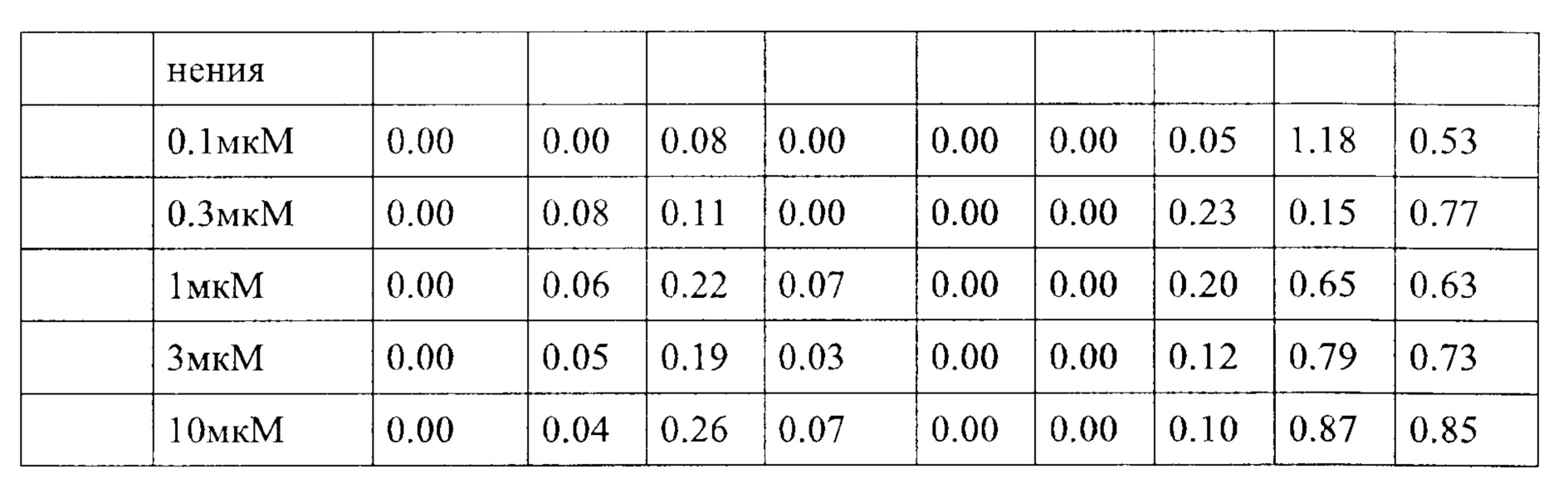



Усиление реакционной способности NK клеток к цитокиновой стимуляции
IL-2 является ключевым фактором для выживания, пролиферации и активации NK-клеток, таким образом, связывая адаптивный иммунитет опосредованный Т-клетками, с врожденным иммунитетом, опосредованным NK-клетками. Особенно CD8 Т-клетки выделяют IL-2 локально в месте антиген-энкаунтером в опухоли и, таким образом, поддерживают и активируют противоопухолевые функции NK-клеток. В качестве примера был выбран пример соединения 67. Как уже было показано выше, соединения усиливали опосредованное Т-клетками высвобождение IL-2 и усиливали опосредованную контактом с опухолевыми клетками активацию NK-клеток. Кроме того, приведенные ниже данные показывают, что соединение примера 67 также может непосредственно повышать чувствительность NK-клеток при активации IL-2, как определено высвобождением цитокинов IFN-гамма и TNF-альфа. Таким образом, соединения обладают уникальным потенциалом для поддержки связанного противоопухолевого иммунитета Т и NK-клеток в физиологическом контексте in vivo.


Повышение реакционной способности иммунных клеток к стимуляции с помощью связанного с опухолевыми клетками терапевтического антитела
Эффективные иммунные реакции против патогенов обычно не только основаны на клеточных иммунных функциях (опосредуемых клетками Т и NK), но также и на гуморальном иммунитете, который опосредуется антителами. Антитела, которые связаны с патогенами или инфицированными патогеном клетками, запускают активацию иммунных клеток через Fc-рецепторы, которые экспрессируются, в частности, на NK-клетках и миелоидных клетках. Этот механизм также используется для лечения рака, когда терапевтические антитела против антигенов, которые предпочтительно экспрессируются на раковых клетках, вводят пациентам, которые в свою очередь рекрутируют и активируют иммунные клетки для непосредственной атаки на раковые клетки. GD2-антиген сильно экспрессируется на раковых клетках определенного происхождения (среди нейробластомы и меланомы) и поэтому развивается клинически как антираковая терапия. Для клеток меланомы М21 GD2 является единственным антигеном, который был охарактеризован как доступный как опухолевый антиген. Таким образом, анти-GD2-антитело, которое было доступно в клиническом качестве, было использовано для проверки того, могут ли соединения усиливать опосредованную Fc-рецептором активацию иммунных клеток к связанным с опухолевыми клетками терапевтическими антителами. Нижеследующие данные показывают, что соединение Пр. 40 повышало реакционноспособность иммунных клеток к анти-GD2-антителам, связанным с клетками меланомы М21, что приводит к усилению секреции цитокина и активации NK-клеток. Таким образом, соединения не только повышают реакционную способность иммунных клеток к контакту с опухолевыми клетками, по также и антителам, нацеленным на опухолевые антигены на раковых клетках.


Усиления реакционной способности миелоидных клеток к FcR стимуляции
Результаты вышеупомянутого эксперимента под названием «Повышение реакционной способности иммунных клеток к стимуляции с помощью связанного с опухолевыми клетками терапевтического антитела» указывают на то, что соединения могут усилить FcR стимуляцию иммунных клеток. Однако при использовании в нем трудно выделить эффекты контакта опухолевых клеток от эффектов стимуляции Fc-рецептора. Поэтому влияние FcR-стимулляции на то же анти-GD2-Ab тестировали в бесклеточном анализе, в котором анти-GD2-антитела были нанесены на планшеты для культивирования клеток, тем самым имитируя связанные с клеткой антитела. Нижеследующие данные показывают соединение Пр. 77 в качестве примера и показывают, что соединение непосредственно усиливает активацию миелоидных клеток с помощью FcR стимула, что приводит к усиленной секреции TNF-альфа, IL-1 и IL-6. Вместе данные этих двух экспериментов показывают, что соединения могут поддерживать анти-опухолевые эффекты терапевтических антител против антигенов на опухолевых клетках путем повышенной чувствительности иммунных клеток к FcR стимуляции антителами, связанными с клетками.


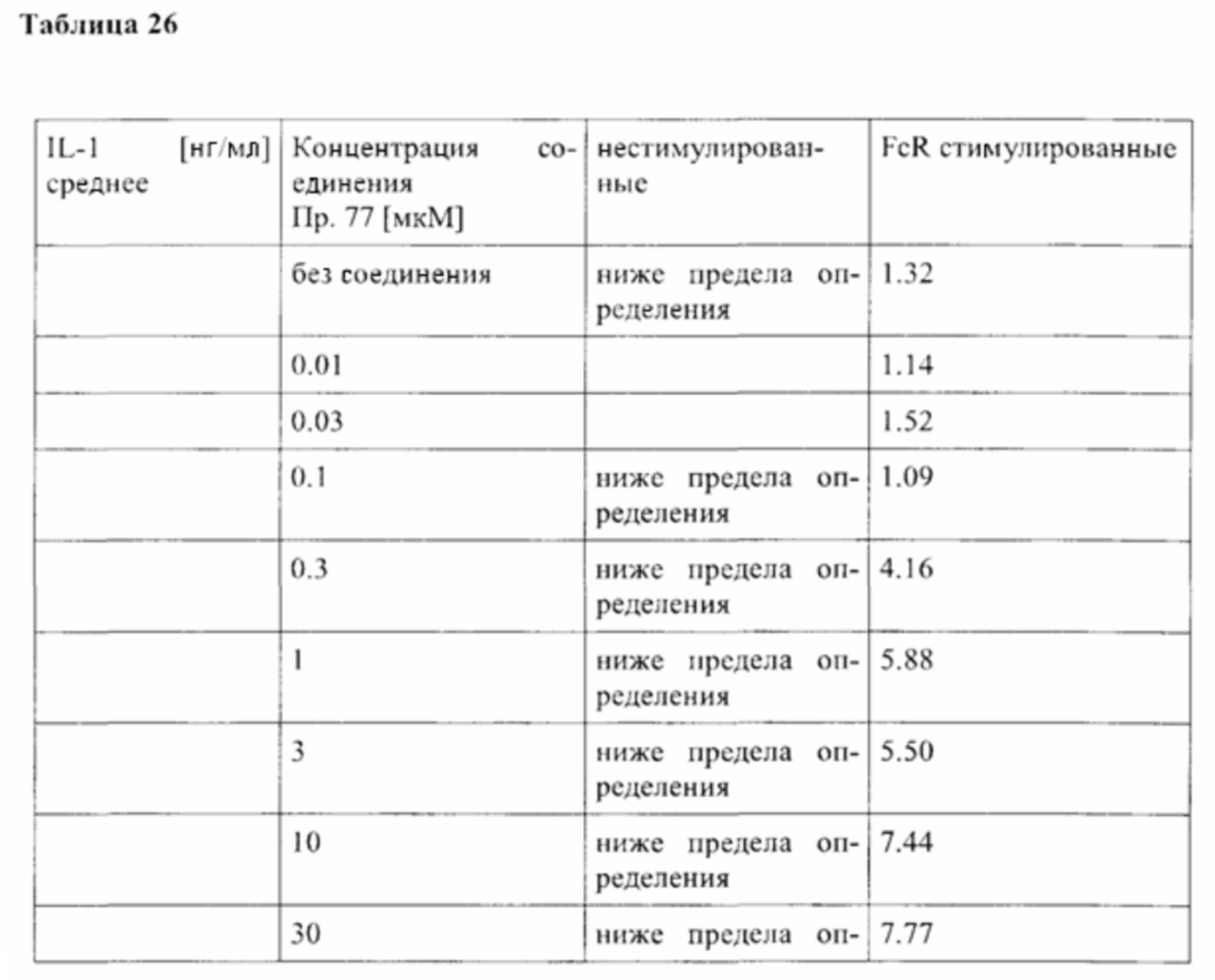
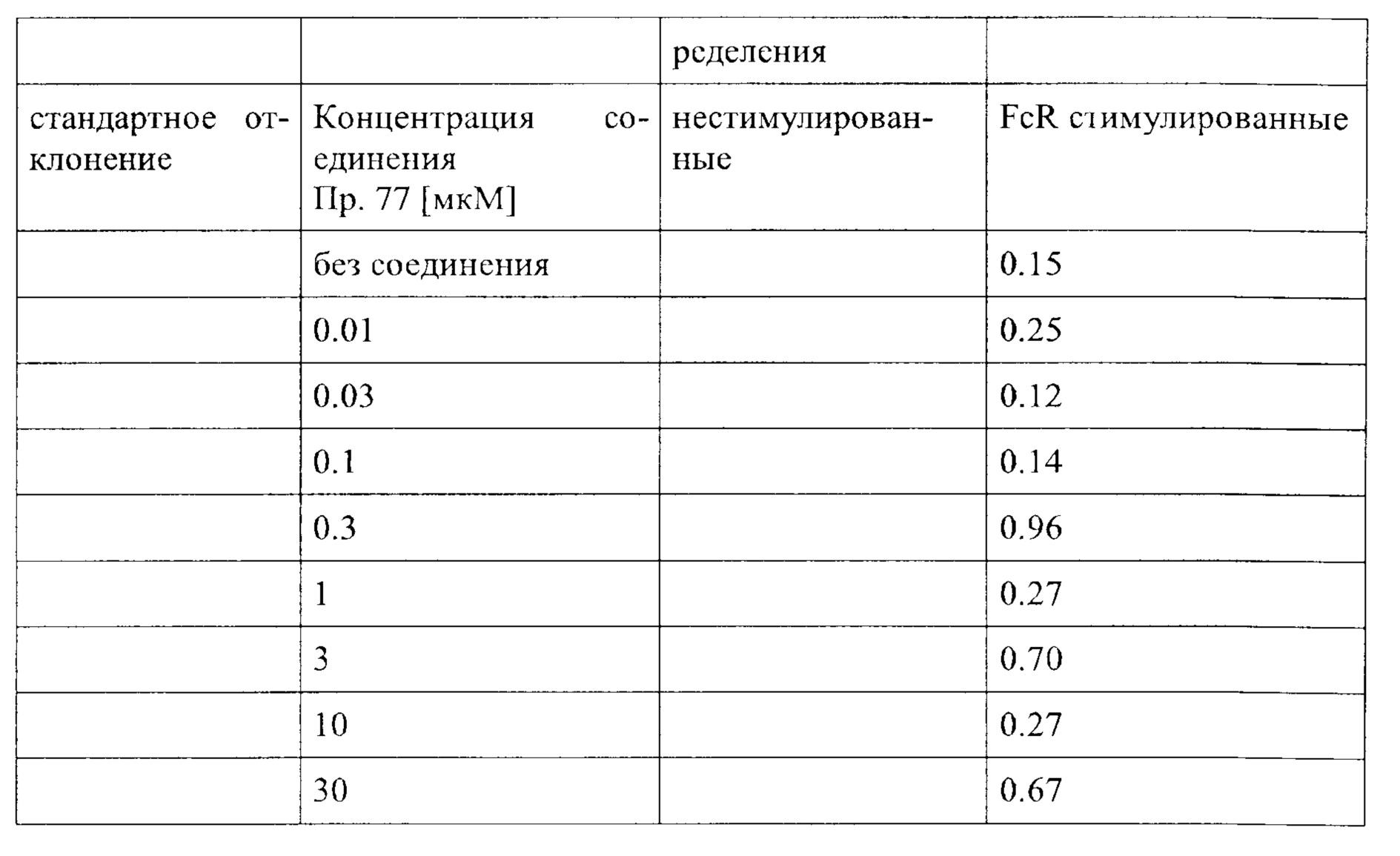

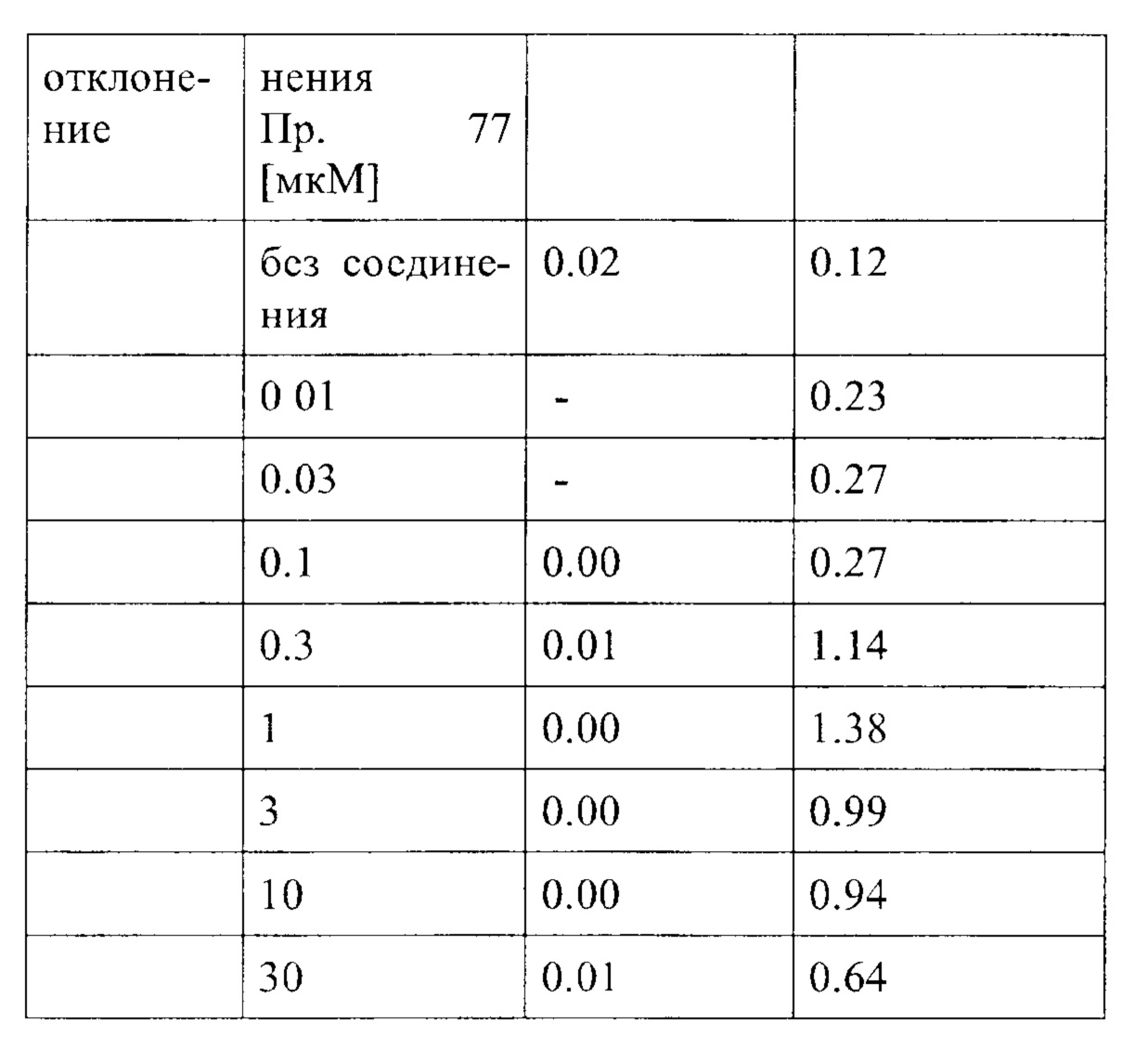
Активность соединения в выделенных человеческих очищенных CD19+ В-клетках
Лейкоцитарные пленки получали из местной больницы, разбавляли 3 раза PBS и наносили на изотонический разделительный раствор Ficoll d=1,077 г/мл в центрифужных пробирках, объемом 50 мл. Пробирки центрифугировали при 914 g в течение 25 мин при комнатой температуре с отпусканием тормоза. Слой РВМС удаляли и дважды промывали ледяным PBS. Эритроциты лизировали добавлением ddH2O, и клетки ресуспендировали в X-Vivo15 (Lonza).
CD19 + В-клетки были выделены из РВМС путем отрицательного отбора с помощью наборов MACs (Miltenyi) в соответствии с инструкциями производителя. Очищенные фракции были на >95% CD19-положительными, что оценивалось путем окрашивания антителом и оценки цитометрией. В-клетки стимулировали путем добавления различных концентраций человеческого IgM (1,25-20 мкг/мл козы F(ab')2 против человеческого IgM-LE/AF, Biozol) в присутствии примера 1. Клетки инкубировали в течение 18 ч при 37°С, 5% CO2.
Аналитические планшеты центрифугировали при 400 г в течение 5 мин и собирали супернатанты. Концентрацию цитокинов в супернатантах тканевой культуры определяли с помощью наборов MSD или HTRF (MSD и Cisbio) в соответствии с инструкциями производителя.
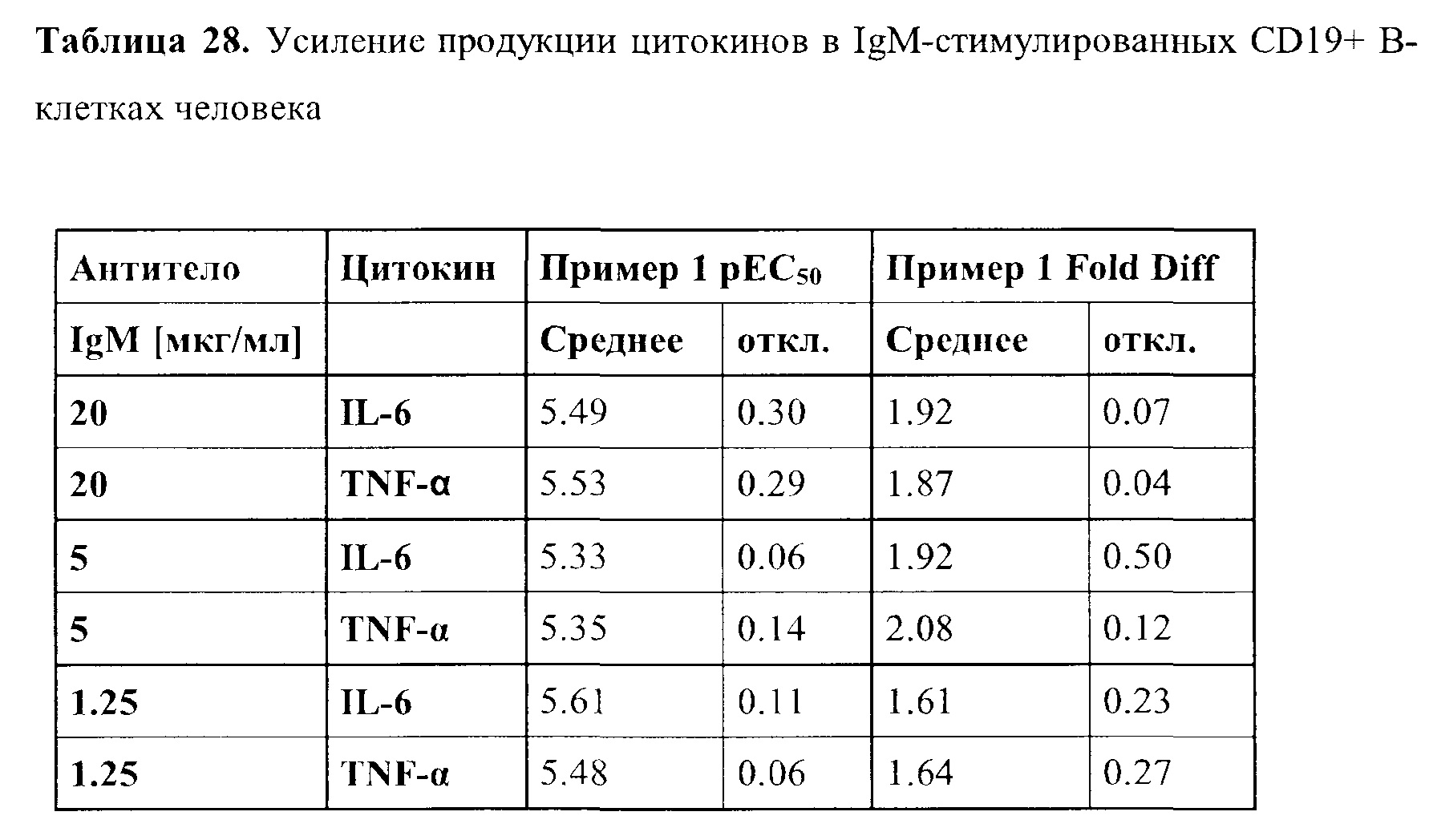
Повышение активности мышиных Т клеток до TCR стимуляции
Иммунная система млекопитающих является эволюционно консервативной, и поэтому большинство сигнальных путей сходны для иммунных клеток мышей и человека. Для фармацевтической разработки соединений жизненно важно генерировать данные in vivo, главным образом, с помощью мышиных моделей механизма и болезней. Поэтому было исследовано, оказывают ли соединения аналогичные эффекты на Т-клетки мышей, как показано для Т-клеток человека. Спленоциты служат легко доступной фракцией иммунных клеток у мышей, поскольку РВМС не могут быть получены в достаточном количестве для экспериментов in vitro, как это обычно делается с человеческими РВМС. Спленоциты выделяли из селезенки мышей BL6 и стимулировали анти-CD3 и анти-CD28 антителами, либо оставляли нестимулированными. Оба примера соединений 1 и 70 сильно усиливали продуцирование цитокинов, сравнимым образом с данными для РВМС человека, снова специфично для TCR-стимулмулированных иммунных клеток; такой эффект не был обнаружен на нестимулированных клеток. Подобным образом, экспрессия CD25 усиливалась как на CD4, так и на CD8 Т-клетках, особенно в присутствии TCR-стимулляции.

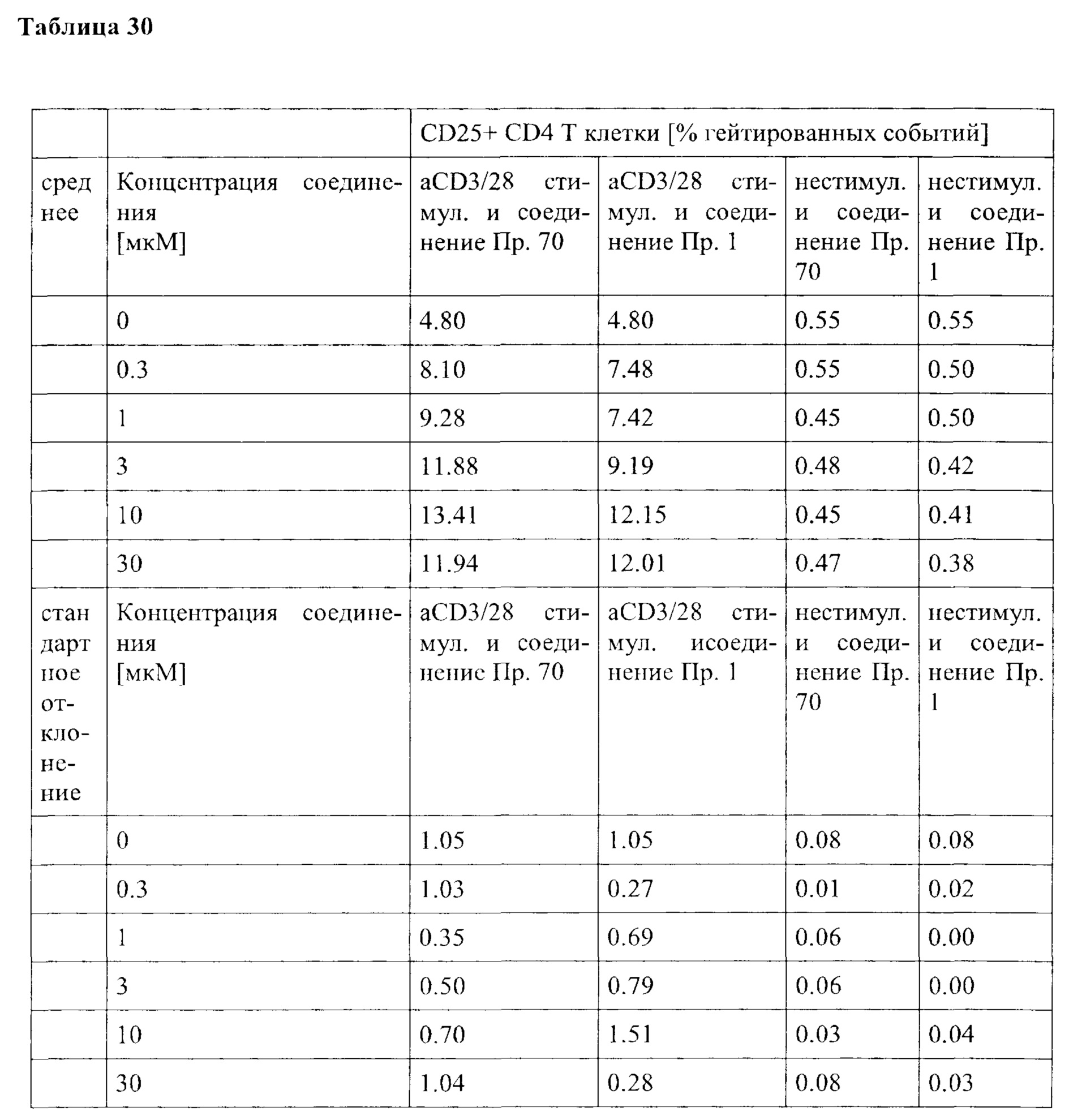

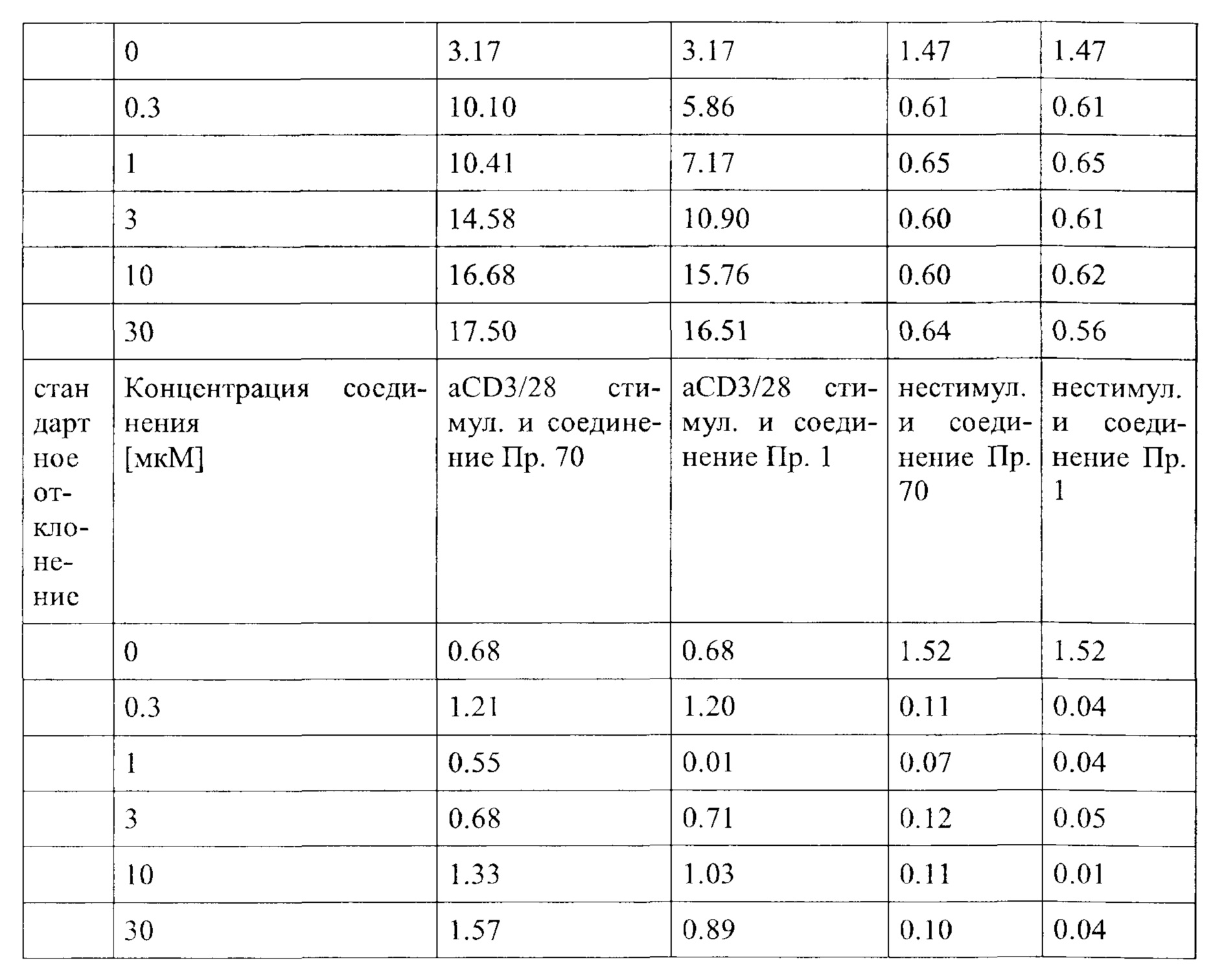
In vivo оценка эффекта соединения на модели Анти-CD3 PD
Обнаружение активации и пролиферации антигенспецифичных Т-клеток in vivo является технически сложной задачей, поскольку для этого требуется разработка и валидация исследовательских реагентов для выявления редких Т-клеток, специфичных для родственного антигена, а также установление конкретной процедуры измерения для последующей клеточной активации и/или пролиферация в крови или вторичных лимфоидных органах. В качестве суррогатной модели для определения активации поликлональных Т-клеток у мышей была разработана и применена фармакологическая система, где взрослым мышам B57/BL6 инъецировали анти-CD3-антитело, чтобы вызвать запуск TCR и ответы широкой популяции периферических Т-клеток. Чтобы количественно определить ответы Т-клеток, были измерены системные уровни IL-2, TNF-альфа и IFN-гамма в сыворотке крови, а также экспрессия раннего маркера активации CD69 на CD4 или CD8 Т-клетках селезенки через 5 часов после обработки.
Было исследовано, влияет ли пероральное применение соединения на низкий уровень активации основного подмножества Т-клеток селезенки путем инъекции анти-CD3-антитела, как показано на увеличении уровней IL-2, IFN-гамма и TNF-альфа в сыворотке необработанных мышей, а также увеличение CD69-экспрессирующих селезеночных Т-клеток от 2-10% до 15-20%. Неожиданно было обнаружено значительное, существенное и дозозависимое увеличение всех этих параметров активации Т-клеток при пероральном применении соединения 25, 50 или 100 мг/кг в дополнение к применению анти-CD3.
Эти данные показывают, что соединение 1 может существенно усилить TCR - опосредованную активацию CD4 и CD8 клеток in vivo уже через короткий промежуток времени (пять часов).
Чтобы определить иммуномодулирующий эффект соединений по пункту (1), мышиная модель, описанная Hirsch et al., J Immunol. 1989, 142 (3), 737-43, была адаптирована следующим образом:
1. 8-14-недельным самцам мышей C57BL/6N интраперитонеально вводили 0.1 мкг/мышь анти-CD3 моноклональное антитело (BD Bioscience, cat no: 553058, Hamster Anti-Mouse CD3e Clone 145-2C11) при t=0 ч для достижения более низкого уровня предварительной активации Т-клеток по сравнению с Hirsch et al., 1989
2. Соединение по примеру 1 дважды вводили в виде суспензии (0,5% метил-целлюлозы в воде) при t=-1,0 ч и t=1,0 ч.
3. Мышей умертвили при t=4,0 ч, а их селезенку и плазму собирали для анализа проточной цитометрии и соответственно анализа цитокинов.
4 Концентрации цитокинов в образцах конечной плазмы определяли с помощью наборов MSD в соответствии с инструкциями производителя


Пероральное введение соединений усиливает активацию антигенспецифичных Т-клеток in vivo
Прямое обнаружение пролиферации антигенспецифичных Т-клеток in vivo является технически сложным, так как оно требует наличия Т-клеток, специфичных для родственного антигена, а также конкретной процедуры измерения пролиферации клеток. Оба эти требования выполняются в модели переноса OT-II, которая использует прямой перенос Т-клеток CD4, трансгенных для рецептора Т-клеток, распознающего пептид, полученный из овальбумина, в качестве антигена. Перед переносом эти клетки помечены флуоресцентным красителем CFSE, который разбавляется каждым делением клеток и, следовательно, позволяет обнаруживать клеточные пролиферация. После переноса Т-клеток, меченных CFSE, мышей вакцинируют антигеном Овальбумин и TLR-агонистом (LPS) в качестве адъюванта для активации и созревания антиген-представляющих клеток (АРС). Эти АРС затем мигрируют в лимфоидные органы (особенно лимфатические узлы и селезенку) и представляют OVA-антиген Т-клеткам в лимфоидных органах. Однако только перенесенные клетки OT-II способны распознавать OVA-антиген, и только эти перенесенные Т-клетки затем активируются.
Таким образом, модель OT-II является оптимальной для определения влияния соединений на физиологическую стимуляцию антигенспецифичных Т-клеток через АРС-представленный антиген, где природная среда для активации и костимуляции Т-клеток, предоставляемая АРС, является лимфоидными органами. Более того, только перенесенные OT-II Т-клетки стимулируются, Т-клетки реципиентных мышей могут служить контролем для неспецифической активации соединениями, поскольку анализ проточной цитометрии уровней CFSE в клетках OT-II можно комбинировать с измерением маркера активации CD69.
В этом эксперименте мыши получали CFSE-меченные OT-II Т-клетки, как описано в части способ, и затем были разделены на группы, которые либо не получали антиген для вакцинации, либо не получали соединение (только LPS), либо получали антиген, но не соединение (LPS и OVA) или получали антиген и соединение по примере 1 при 10 мг/кг, вводимые перорально. Нижеследующие данные показывают, что в отсутствие антигена наблюдалась только минимальная пролиферация Т-клеток и отсутствие регуляции CD69 на перенесенных клетках OT-II. Напротив, пролиферация и регуляция CD69 были явно обнаружены, когда присутствовал антиген для клеток OT-II. Пролиферация клеток OT-II была значительно увеличена (р<0,00001) присутствием соединения 1, в то время как CD69 больше не регулировались; это согласуется с кинетикой активации Т-клеток, поскольку сильно пролиферирующие Т-клетки имеют тенденцию к снижению регуляции CD69 в течение следующих дней. Важно отметить, что CD69 экспрессия CD4 и CD8 Т-клеток, а также на В-клетках самих реципиентных мышей не усиливалась присутствием этого соединения, что свидетельствует о том, что активация Т-клеток одним соединением отсутствует, если родственный антиген не предоставляется. Таким образом, влияние соединения in vivo на активацию Т-клеток соответствует тому, которое наблюдается in vitro. Более того, во время эксперимента не отмечалось никаких признаков высокой токсичности, что еще раз подтверждало выводы данных in vitro, что функции иммунных клеток усиливаются в контексте клетка-специфичных стимулов, но не нежелательным общим видом.

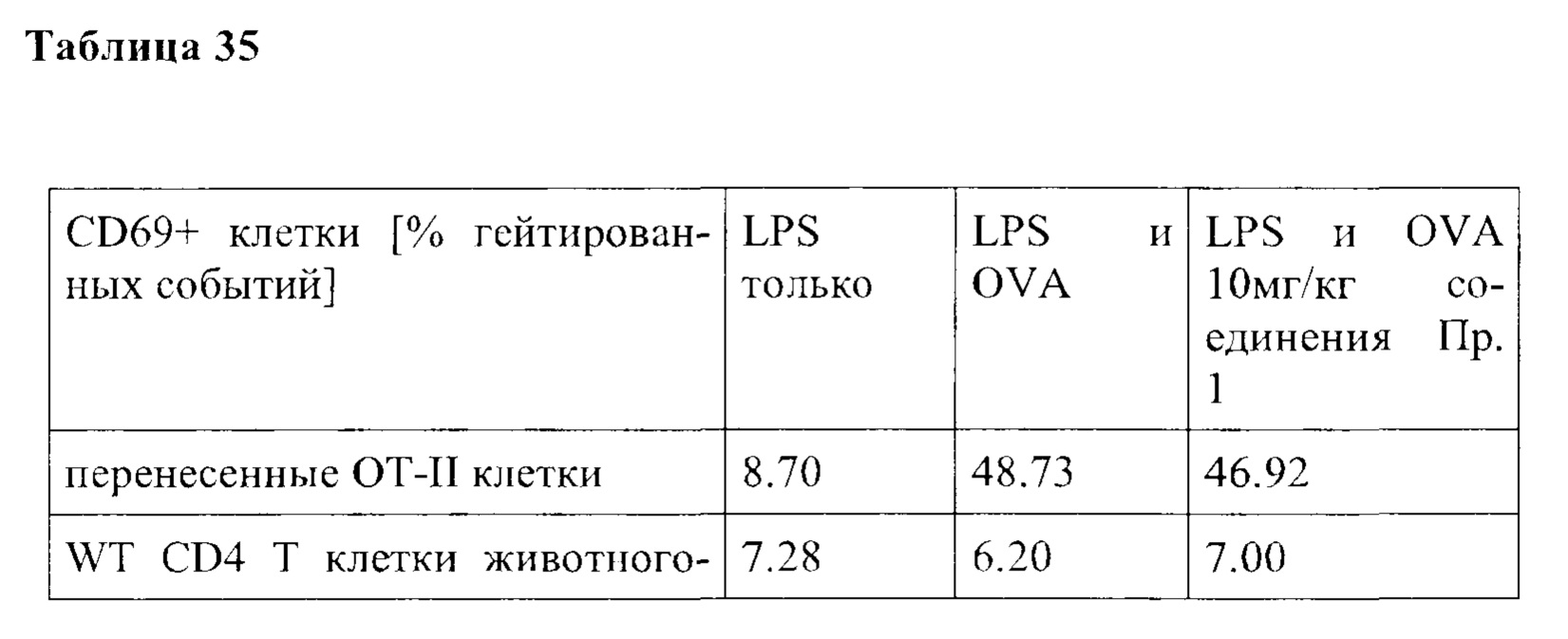
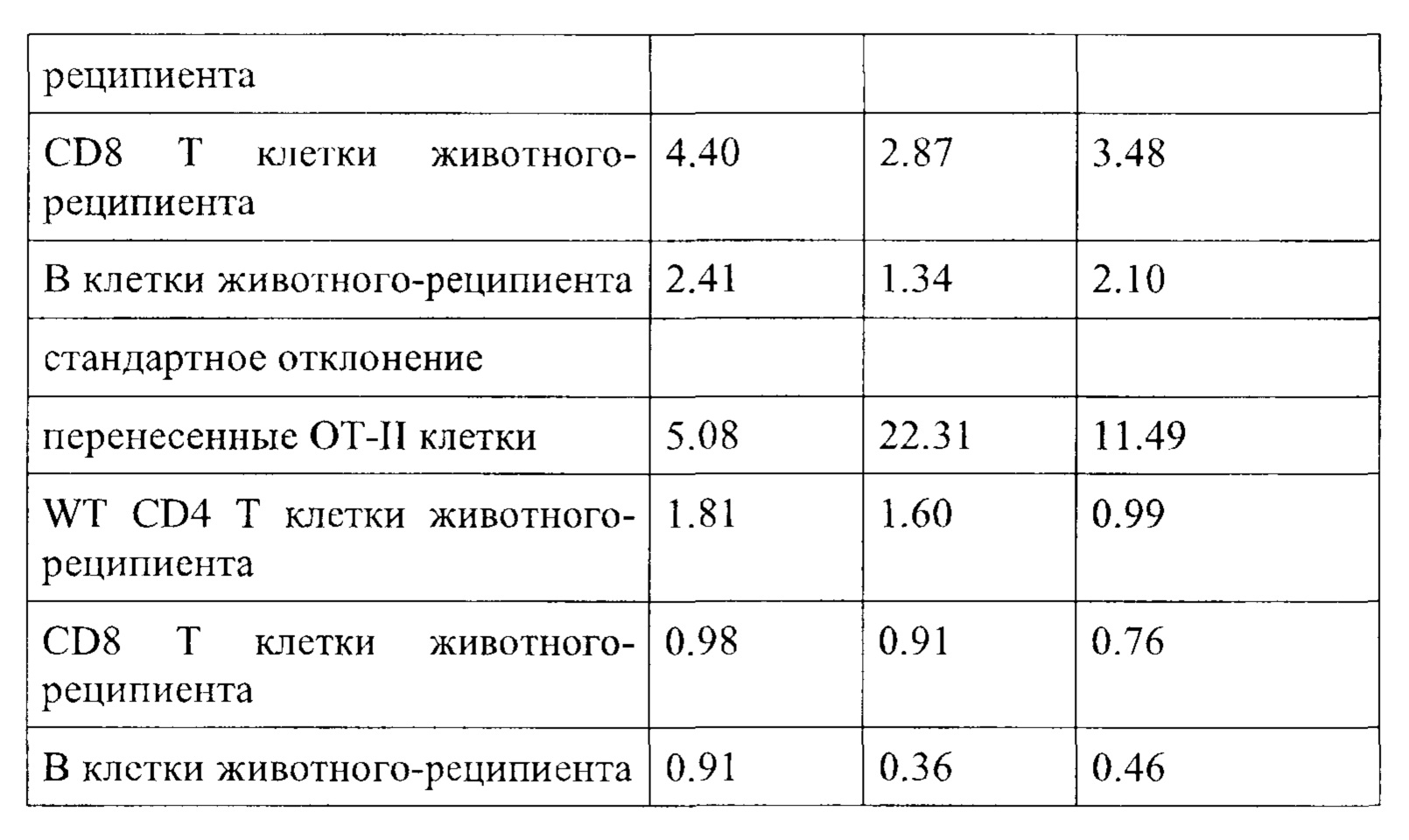
Внутривенное введение соединений усиливает активацию антигенспецифичных Т-клеток in vivo
Пероральное введение лекарственных средств, как правило, является желательным путем для усвоения в амбулаторном контексте. Тем не менее, на развитых стадиях рака опухолевая терапия часто вводится пациентам. Внутривенное введение выбирают для лечения, при котором высокие уровни лекарственного средства необходимо стабильно удерживать в течение продолжительных периодов времени. Кроме того, побочные эффекты прошлых лечений могут повредить желудочно-кишечный тракт, и поэтому предпочтительное, что внутривенное введение также будет эффективным путем. Таким образом, было исследовано, может ли внутривенное введение соединений быть эффективным при идентичном лечении, как указано выше.
Нижеследующие данные показывают, что внутривенное введение соединений столь же эффективно, как и пероральное введение, при специфическом усилении пролиферации антиген-стимулированных Т-клеток (р=0,0012), хотя и существенно не влияет на покоящиеся Т-клетки реципиентных мышей. Важно отметить, что в этом эксперименте не было отмечено никаких признаков острой токсичности, что свидетельствует о том, что внутривенное введение соединений является безопасным и эффективным путем.

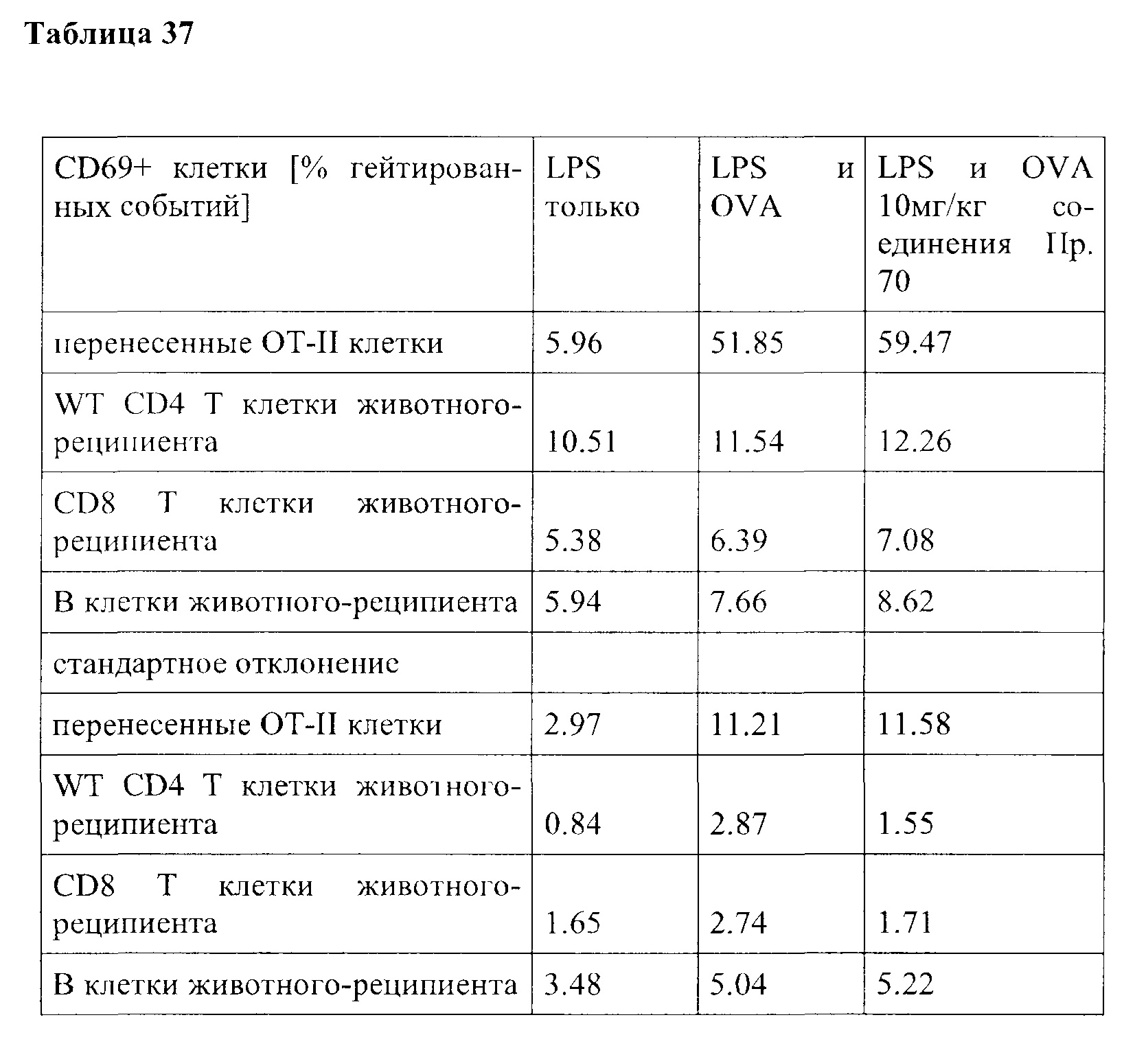
Усиление противоопухолевой активности CD8-положительных лимфоцитов является синергетическим с блокадой PD-1
Клетки CD8 выделяли из М21-престимулированных РВМС и повторно стимулировали опухолевыми клетками М21, как описано в разделе «Материалы и методы». Пример 107, без антитела (нет Ig), антитело против PD-1 (Ниволумаб) или контрольное антитело без прямого воздействия на Т-клетки CD8 (Ипилимумаб) были включены там, где это указано.
Контакт с опухолевой клеткой приводил к активации иммунных клеток для секреции цитокинов IL-2, IFN-гамма и цитотоксического медиатора гранзима. Пример 107 улучшал продукцию обоих цитокинов, особенно при контакте с опухолевыми клетками, такой эффект не обнаруживался в отсутствие опухолевых клеток. Аналогично, блокада PD-1 также усиливает секрецию цитокинов, поскольку линия опухолевых клеток М21 экспрессирует PD-L1, лиганд PD-1. Когда присутствовали как пример 107, так и антитело против PD-1 (Ниволумаб), усиление продукции цитокинов было синергетическим, то есть более чем аддитивным (таблица 38 и 39). Такие эффекты не наблюдались, когда в качестве контроля применялось отсутствие антитела (нет Ig) или антитело, не нацеленное на CD8 Т-клетки (Ипилимумаб).


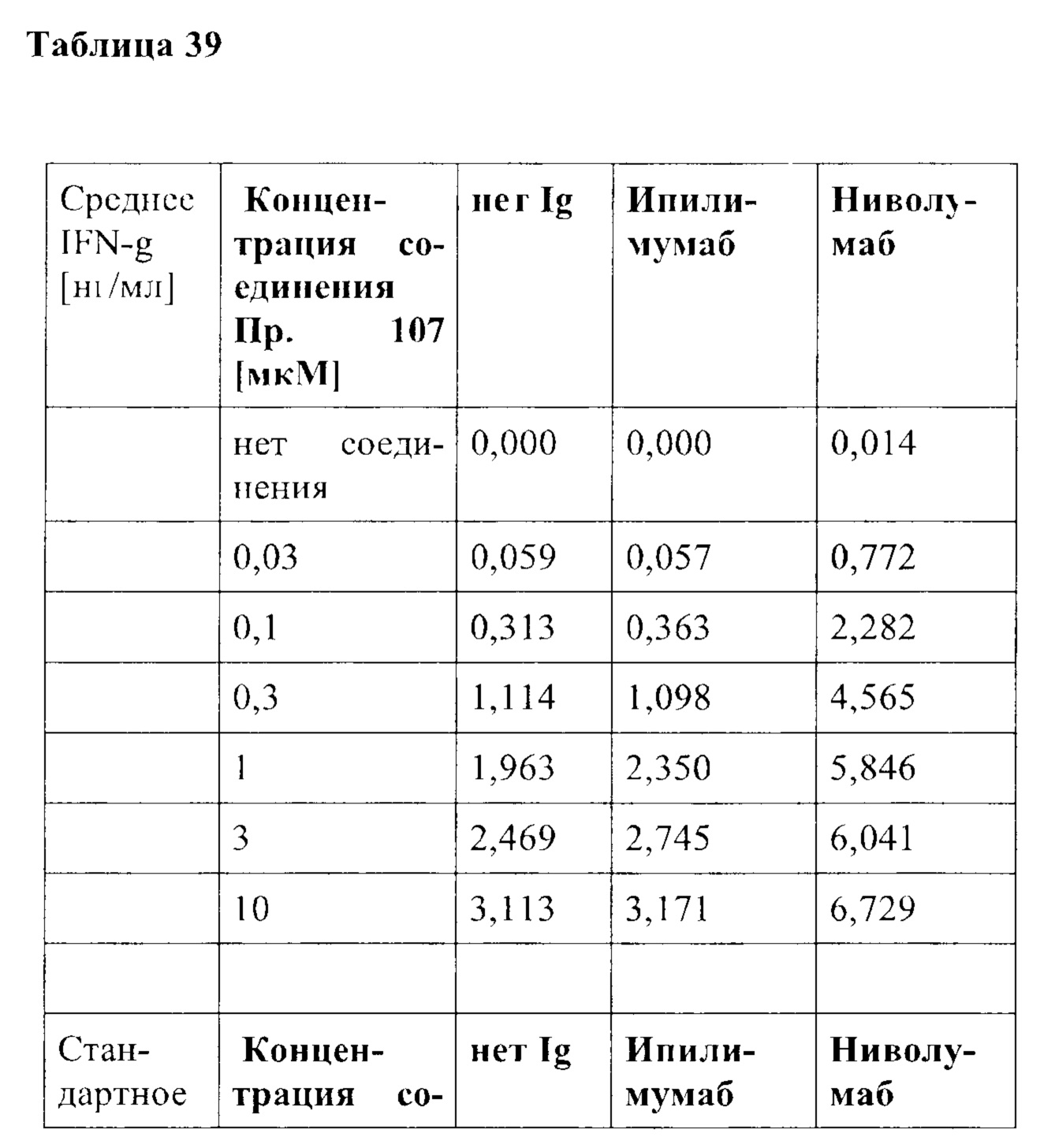
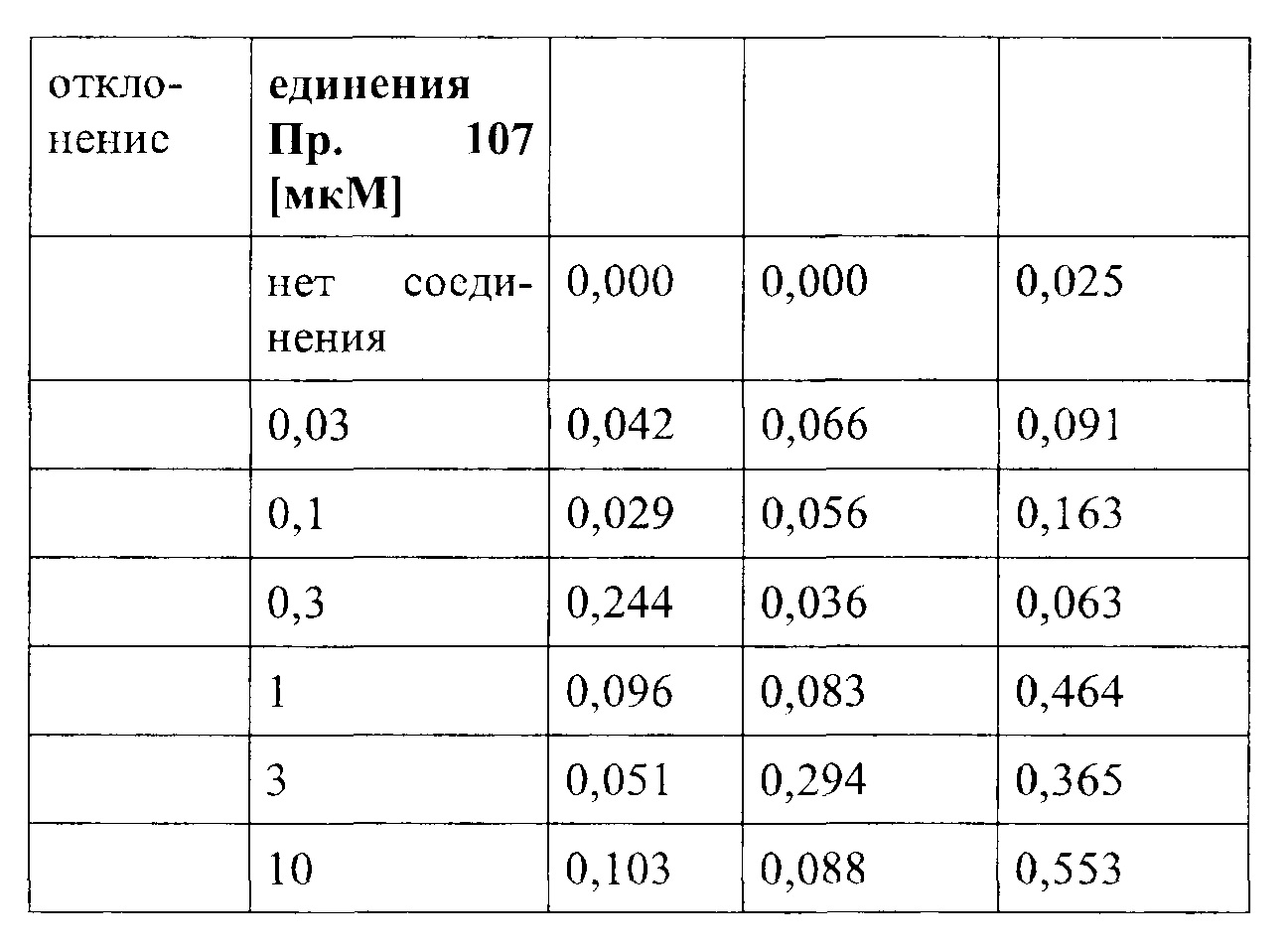
Более того, пример 107 также опосредовал синергическое усиление выделения цитотоксического эффектора гранзима при контакте с опухолевыми клетками (Таблица 40), что напрямую связано с убийством опухолевых клеток. В согласии, наличие примера 107 в сокультурах иммунных клеток с опухолевыми клетками приводило к сильному снижению жизнеспособных опухолевых клеток, что было даже более выраженным и достигалось с более низкими концентрациями соединения в присутствии Ниволумаба (таблица 41). Только Ниволумаб не смог вызвать значительное снижение жизнеспособных опухолевых клеток.

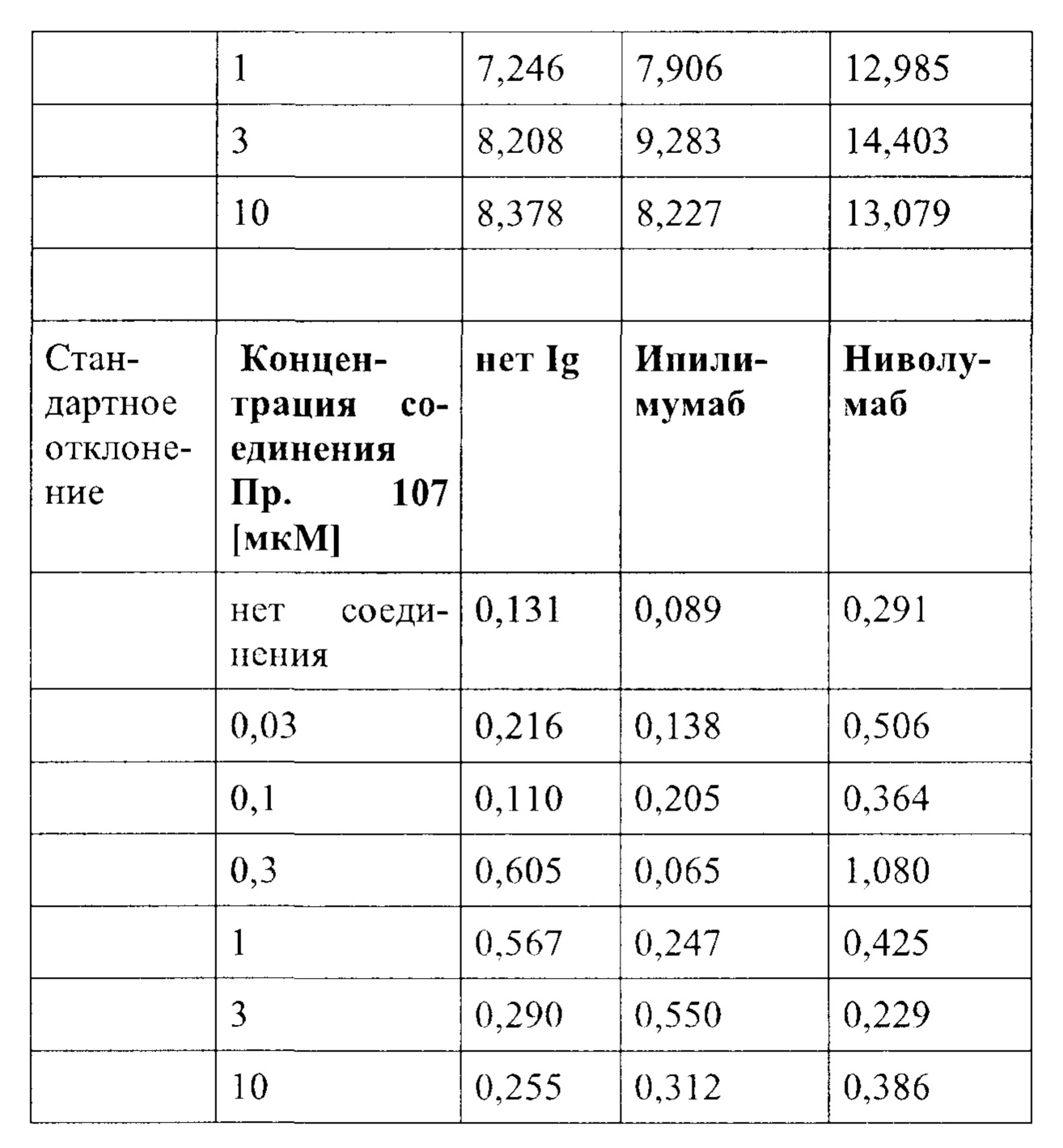


Соединения усиливают активацию опухолевых антигенспецифичных Т-клеток in vivo
Прямое обнаружение пролиферации опухолевых антиген-специфичных Т-клеток in vivo требует присутствия Т-клеток, специфичных для родственного опухолевого антигена. Однако широко используемая модель меланомы B16-F10-OVA характеризуется агрессивным ростом опухоли в течение нескольких дней, не позволяя генерировать de novo противоопухолевый иммунный ответ, приводя к устойчивой популяции специфичных к опухолевому антигену Т-клеток против их антигена овальбумина, который мог бы быть использованы для специфического измерения пролиферации Т-клеток. В качестве альтернативы, в модели переноса OT-I, можно использовать прямой перенос Т-клеток CD8, трансгенных для рецептора Т-клеток, распознавая пептид, полученный из овальбумина, в качестве антигена. Перед переносом эти клетки пометили флуоресцентным красителем CFSE, что позволяет обнаруживать клеточную пролиферацию, как описанной выше, в модели переноса OT-II. После переноса ТСЕ-клеток, меченных CFSE, в мышей, несущих опухоль B16-F10-OVA, часть этих клеток контактирует с антигеном опухоли овальбумином, либо непосредственно в месте опухоли, либо в контексте антиген-представляющих клеток (АРС). Эти АРС присутствуют в лимфоидных органах (особенно лимфатических узлах и селезенке) и представляют OVA-антиген к Т-клеткам OT-I в лимфоидных органах.
Таким образом, модель переноса OT-I является оптимальной для определения влияния соединений на стимуляцию антигенспецифичных Т-клеток экспрессируемыми опухолью антигенами.
В этом эксперименте мышей, несущих опухоль B16-F10-OVA, получивших CFSE-меченные OT-I Т-клетки, как описано в части способ, и затем были разделены на группы, которые либо не получали никакого соединения, либо пример 1 при 10 мг/кг, вводимый перорально. Таблица 42 показывает, что пролиферация OT-I Т-клеток была значительно достоверной (р=0,0002) усиленной присутствием примера 1 в опухоль-дренирующих лимфоузлах. Кроме того, было обнаружено, что пролиферация OT-I Т-клеток значительно (р=0,006) увеличена среди ОТ-I Т-клеток, выделенных из селезенки, когда пример 1 был введен животным.
Таким образом, влияние соединения па увеличение пролиферации Т-клеток релевантно in vivo также в отсутствии вакцинации, когда единственным источником антигена является сама опухоль и ясно показывает, что это соединение усиливает активацию опухолевых антигенспецифичных Т-клеток in vivo.
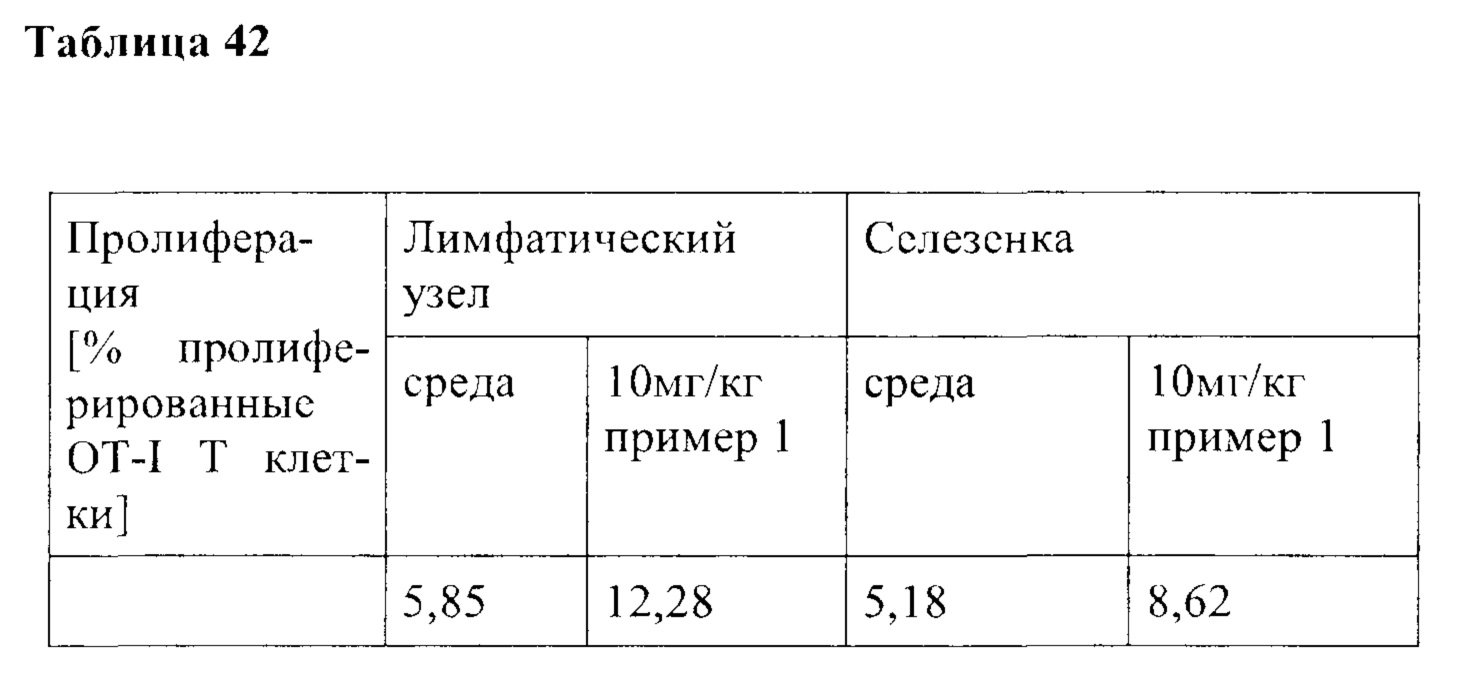

Соединения обладают иммуномодулирующей активностью и усиливают противоопухолевый иммунитет in vivo
Мышей дикого типа инокулировали опухолевыми клетками B16-F10-OVA и рандомизировали на 7-й день, когда все мыши в экспериментальном наборе имели четко видимые опухоли, в группы, которые либо получали только среду, либо пример 1 при 10 мг/кг или 30 мг/кг, как указано в части способ. Кроме того, был включен набор из 3 мышей без опухолей, которые были обработаны только контролем средой. На 15-й день мышей умерщвляли, а активационный статус иммунных клеток в опухолевых дренирующих лимфатических узлах анализировали с помощью проточной цитометрии.
Анализ маркеров активации CD4 Т-клеток в лимфатических узлах показал значительную повышающую регуляцию CD25 (р=0,006 для 10 мг/кг и 0,015 для 30 мг/кг), CD69 (р=0,011 для 10 мг/кг и 0,021 для 30 мг/кг), CD107a (р=0,023 для 10 мг/кг и 0,018 для 30 мг/кг) и PD-1 (р=0,0005 для 10 мг/кг и 0,005 для 30 мг/кг) в группах, обработанных соединением, но сравнению с контрольными животными, обработанными средой (Таблица 43). Аналогично, маркеры активации CD8 Т-клеток в лимфатических узлах показали подобную повышающую регуляцию CD25 (р=0,002 для 30 мг/кг), CD69 (р=0,026 для 30 мг/кг), CD107a (р=0,046 для 30 мг/кг) и PD-1 (р=0,0004 для 30 мг/кг) в группах, обработанных соединением, по сравнению с контрольными животными, обработанными средой (таблица 43). Сравнение опухолевых мышей с необработанными контрольными мышами без опухоли показало, что наличие опухоли привело к глубокому подавлению активации Т-клеток. Примечательно, что при сравнении маркеров активации Т-клеток обработка соединением способна восстанавливать иммуносупрессию у мышей, несущих 435опухоль, до уровней здоровых контрольных животных, указывая на иммуномодулирующие активности этих соединений in vivo.
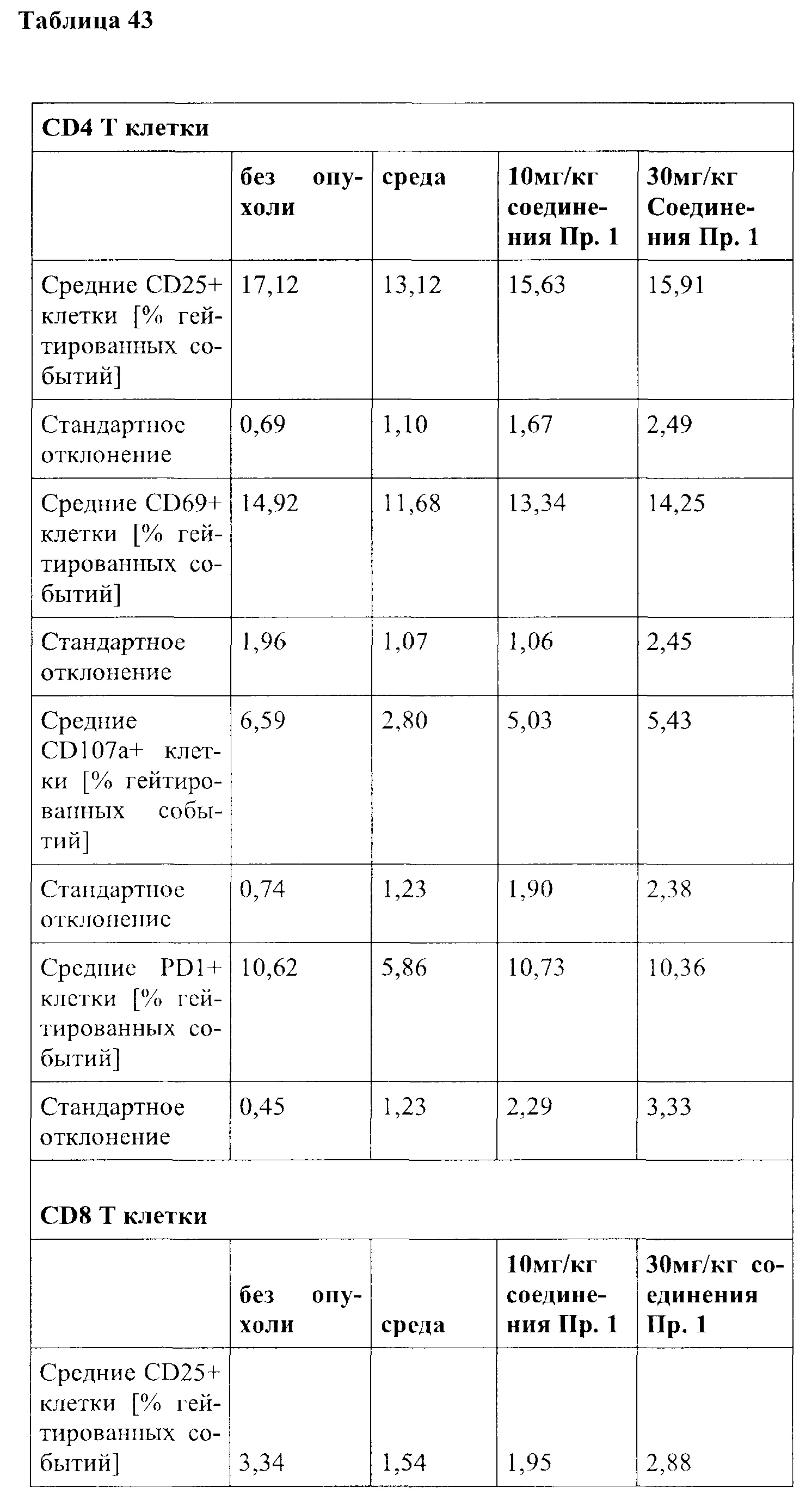
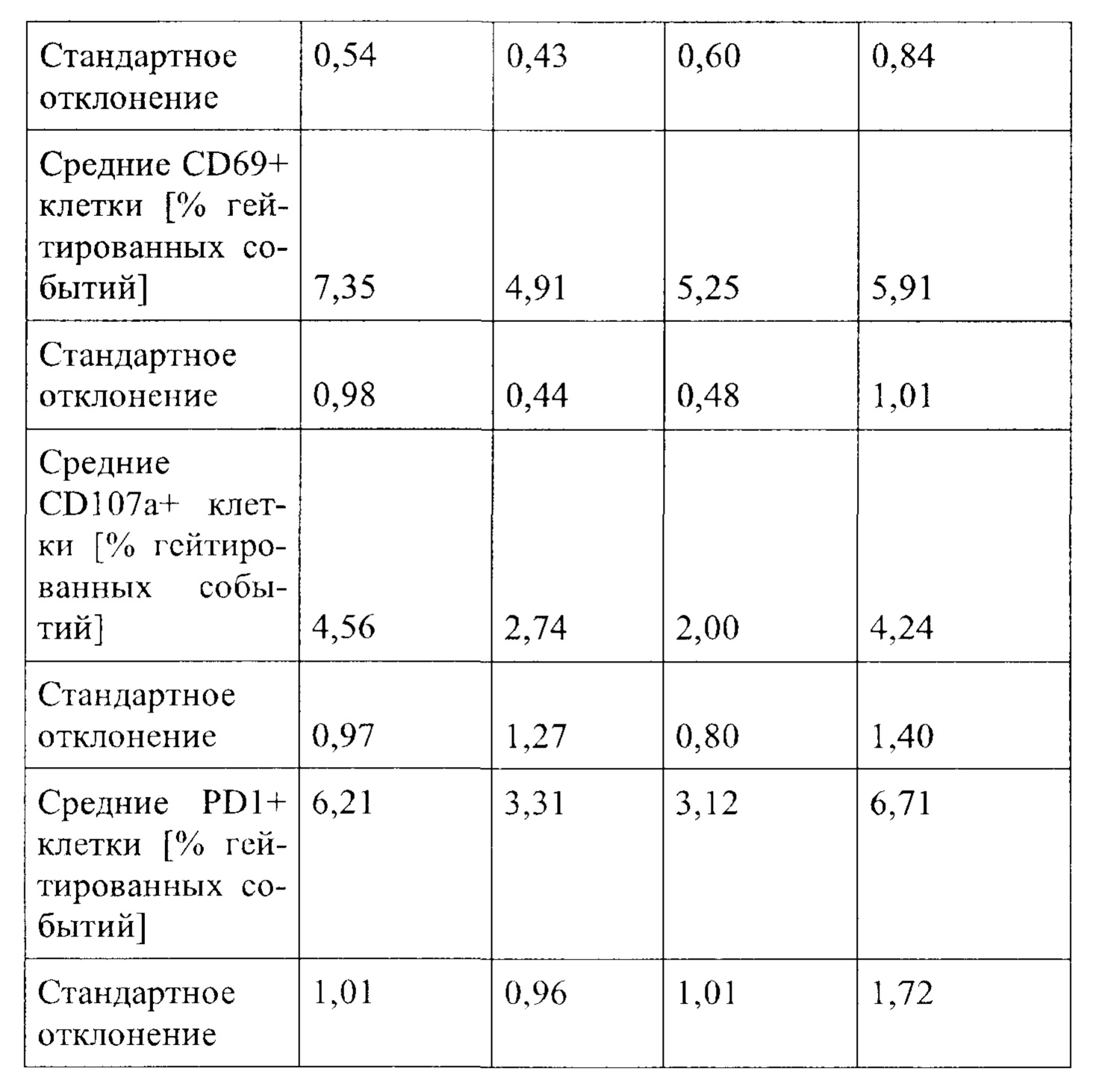
Также для NK-клеток повышались маркеры активации CD69 (NK-клетки: р=0,044 для 10 мг/кг;), CD107a (NK-клетки: р=0,013 для 10 мг/кг) и PD-1 (NK-клетки: р=0,0002 для 10 мг/кг и 0,018 для 30 мг/кг) в группах, обработанных соединением, по сравнению с группой среды (Таблица 44), что снова приводит к по меньшей мере частичному восстановлению до уровней необработанных здоровых контрольных животных без опухолей.
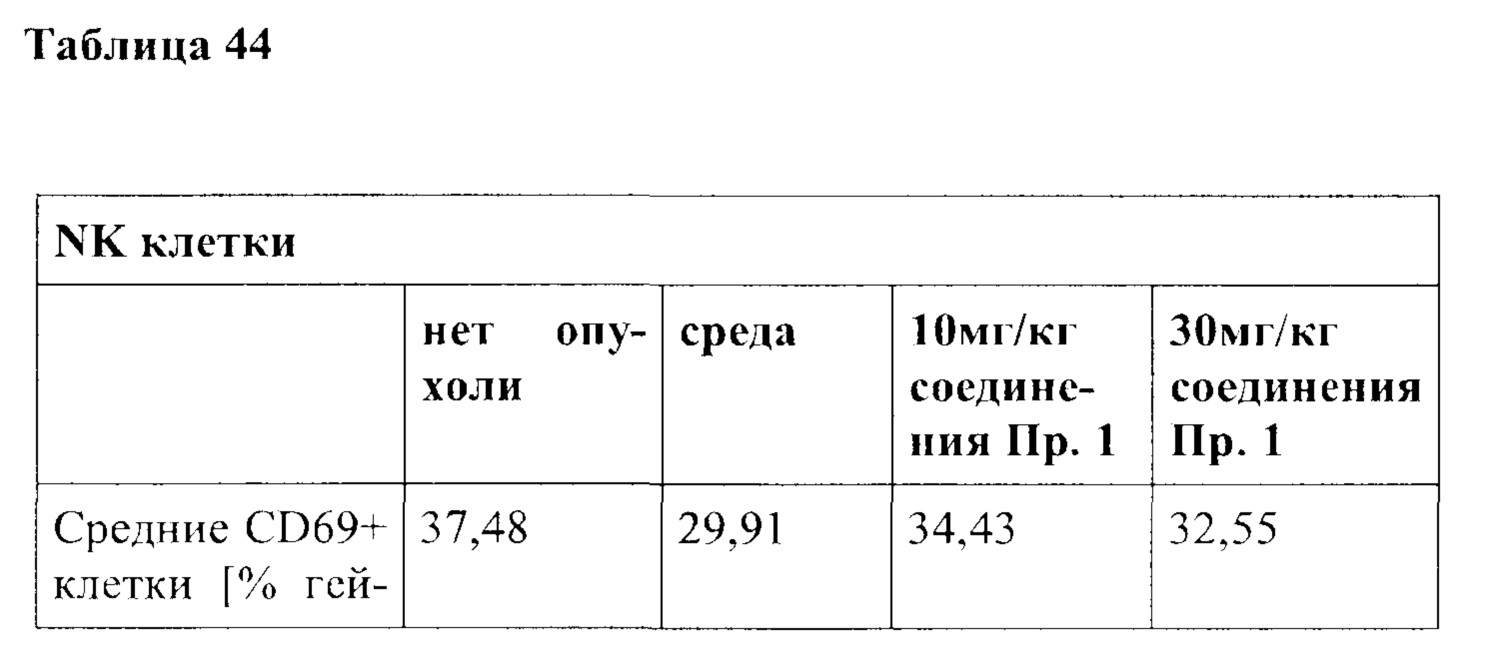
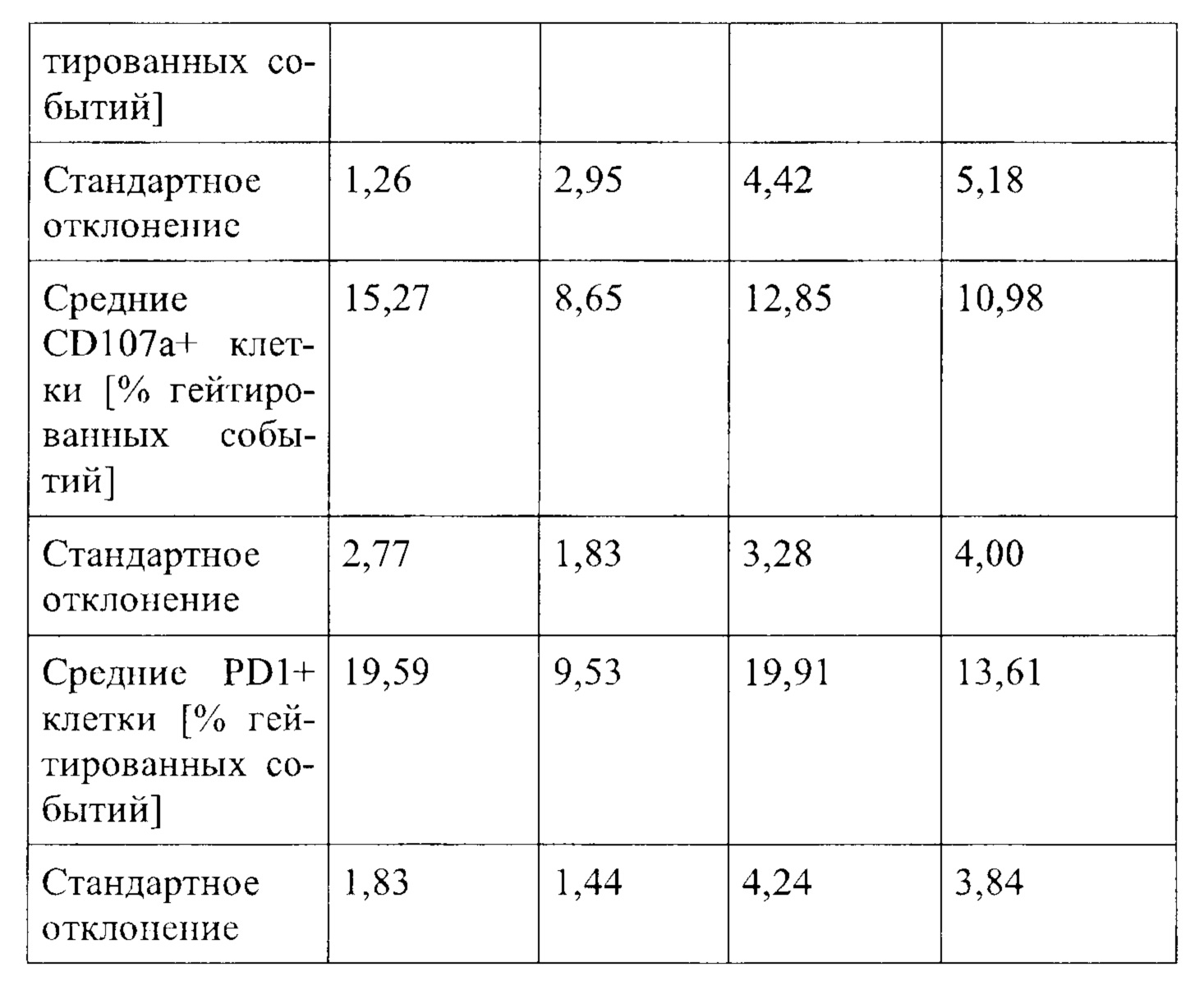
Ключевой особенностью противоопухолевого иммунитета является инфильтрация опухоли активированными иммунными клетками. В качестве способа оценки жизнеспособности для уровней и активностей опухолевых инфильтрирующих лейкоцитов (TIL) обычно используется анализ транскриптов мРНК, присутствующих в опухоли, с помощью ОТ-ПЦР. Для всех примеров опухолей мышей в наборе были получены образцы опухолей и выделены мРНК. Затем инфильтрацию опухоли иммунными клетками определяли с помощью количественной ОТ-ПЦР для CD4, CD8, IL-2, IL-12, IL-23, EOMES, Foxp3, IFN-g, Rorgc, T-bet, TNF-a. Примечательно, что по сравнению с контролем среды, инфильтрация опухоли CD4 (р=0,04 для 30 мг/кг) и CD8 Т-клеток была улучшена в группах животных, обработанных соединением, а также уровни экспрессии цитокинов IL-2 (р=0,02 для 30 мг/кг), IFN-g и TNF-a (Таблица 45).
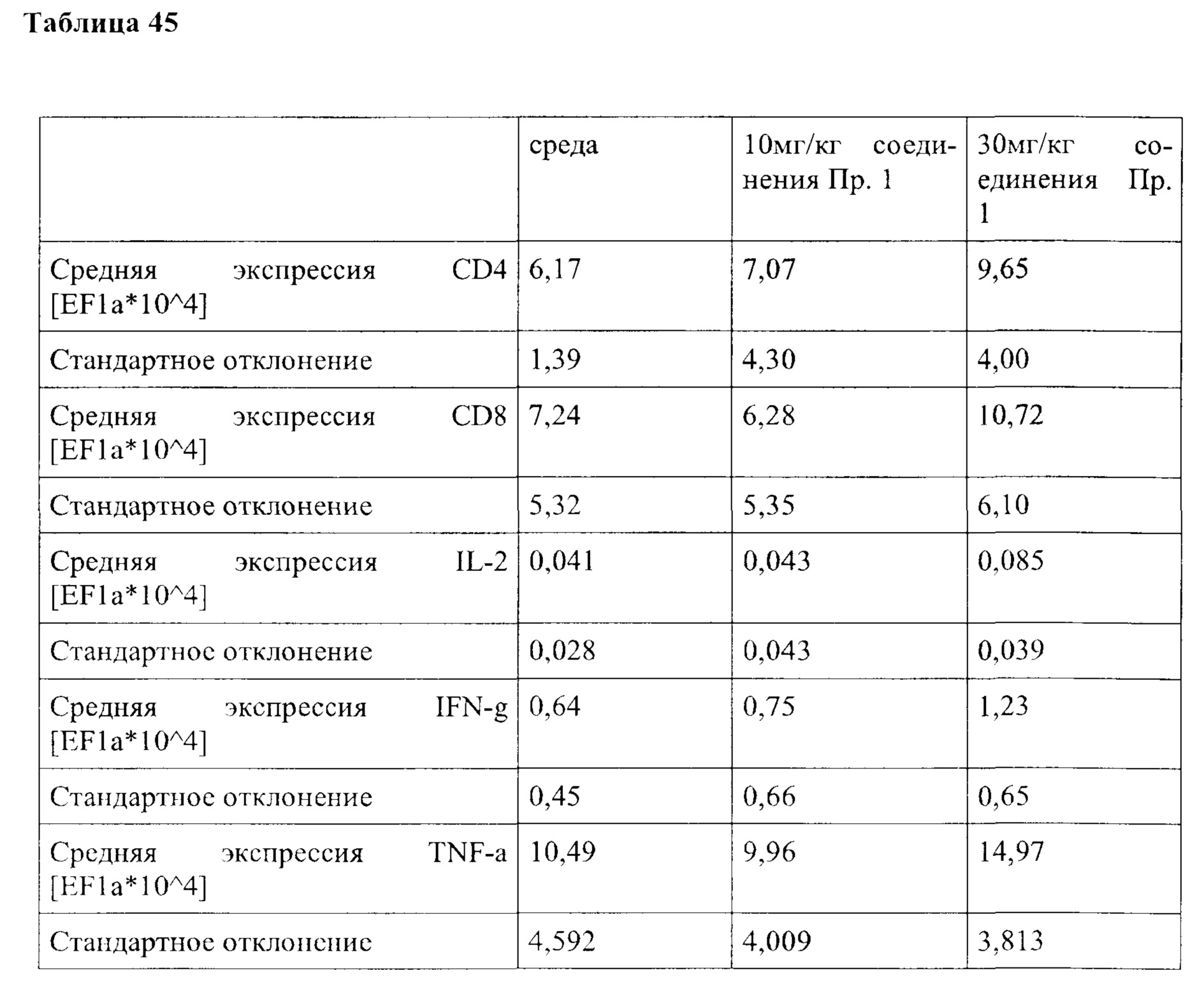
Инфильтрация опухолей эффекторными Т-клетками обычно связана с улучшенным противоопухолевым иммунитетом и лучшей общей выживаемостью, тогда как инфильтрация опухоли регуляторными Т-клетками не связана и может рассматриваться как супрессор противоопухолевых иммунных ответов. Поэтому относительное отношение транскрипционных факторов, которые либо характеризуют регуляторные Т-клетки (Foxp3), либо эффекторные клетки линии Th1 и Th17 (T-bet, Rorgc, EOMES), определяли с помощью ОТ-ПЦР. Результаты ясно показывают, что это соотношение отклонялось в отношении противоопухолевых Th1 и Th17 иммунных от 439ветов у животных, обработанных соединением, по сравнению с контрольной группой, обработанной средой (Таблица 46). В соответствии с этим, продунирование ключевых управляющих цитокинов для ответов Th1 и Th17, IL-12 и IL-23, присутствовало при повышенных уровнях в группах животных, обработанных соединением (Таблица 47).
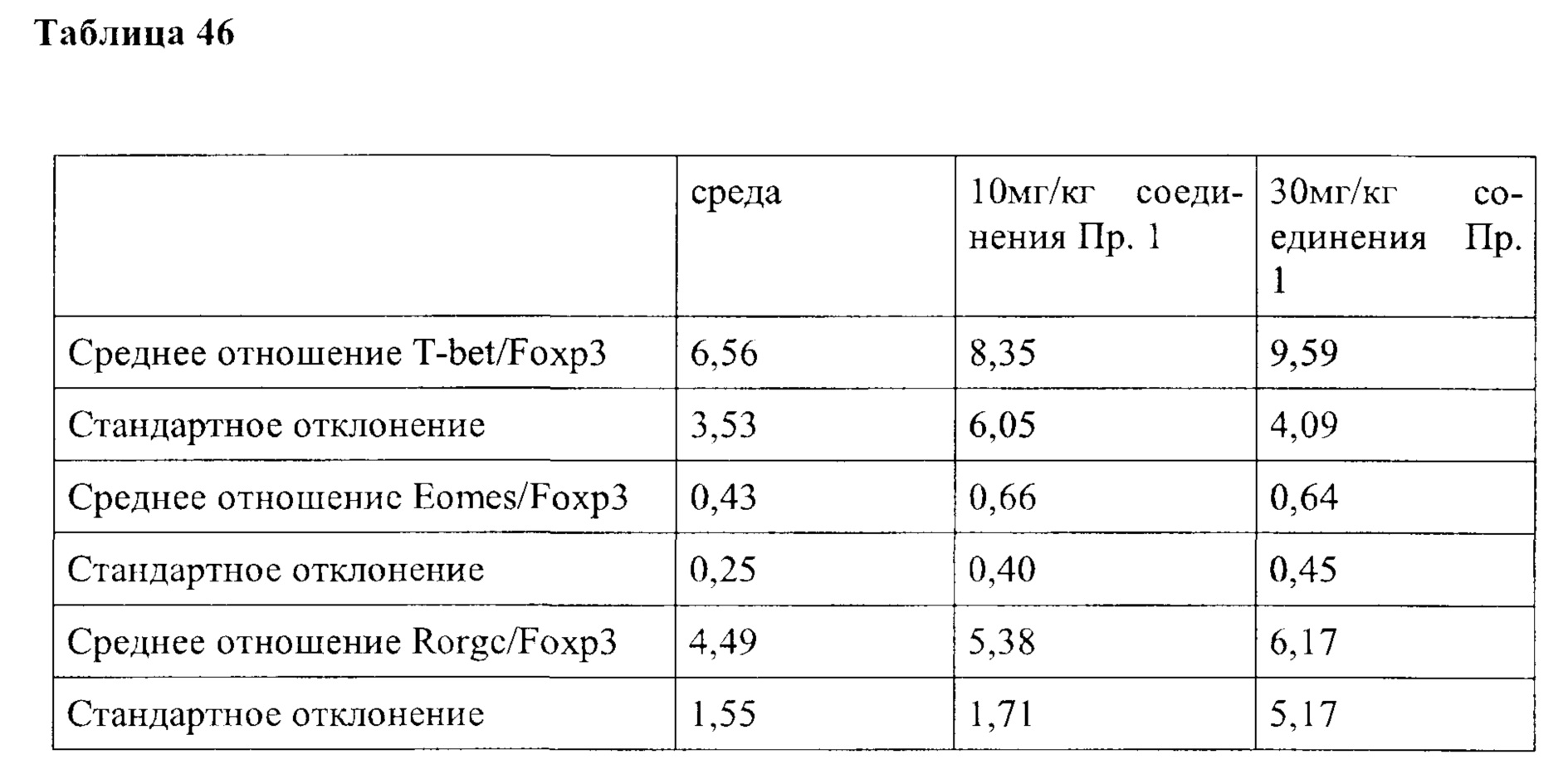

Вместе эти данные показывают, что пример соединения обладает иммуномодулирующей активностью и, таким образом, может непосредственно усиливать противоопухолевый иммунитет in vivo.
Реферат
Изобретение относится к органической химии, а именно к иммуномодулятору, представляющему собой соединение формулы (I) или его фармацевтически приемлемую соль, где Xпредставляет собой S; S(O) или S(O); Xпредставляет собой N или C(R); Rпредставляет собой Н или метил; Rпредставляет собой фенил; пиридинил; хинолинил или тиадиазолил, где Rнеобязательно замещен одним или более R, которые являются одинаковыми или разными; Rпредставляет собой галоген; CN; OR; C(O)N(RR); Тили Cалкил, где Салкил необязательно замещен одним или более галогенами, которые являются одинаковыми или разными; R, Rнезависимо выбраны из группы, состоящей из Н и Cалкила, где Салкил необязательно замещен одним или более галогенами, которые являются одинаковыми; Тпредставляет собой Сциклоалкил; оксадиазолил; тиадиазолил; триазолил или морфолинил, где Тнеобязательно замещен одним R; Rпредставляет собой Салкил; Rпредставляет собой R; OR; NHRили NHC(O)R; Rпредставляет собой Т; Салкил; Салкенил или Салкинил, где Салкил; Салкенил и Салкинил необязательно замещены одним или тремя R, которые являются одинаковыми или разными; Rпредставляет собой галоген; OR; C(O)N(RR); N(R)C(O)R; Тили Салкил; R, Rнезависимо выбраны из группы, состоящей из Н или Салкила, где Салкил необязательно замещен одним R; Тпредставляет собой фенил; Сциклоалкил; оксанил; морфолинил; оксазолил; пиридинил; оксоланил или оксаспирогептанил, где Тнеобязательно замещен одним или двумя R, которые являются одинаковыми или разными; Rпредставляет собой галоген; OR; OC(O)N(RR); Тили Cалкил, где Салкил необязательно замещен от одного до трех R, которые являются одинаковыми или разными; RRнезависимо выбраны из группы, состоящей из Н; Салкила; Салкенила и Салкинила, где Салкил необязательно замещен одним или более R, которые являются одинаковыми; R, Rнезависимо выбраны из группы, состоящей из галогена; OR; C(O)N(RR); или N(R)C(O)R; R, Rнезависимо выбраны из группы, состоящей из Н и Салкила; Тпредставляет собой фенил или морфолинил; Rпредставляет собой Н; F; Cl или N(CH); Rпредставляет собой Н или Cалкил, где Cалкил необязательно замещен одним R; Rпредставляет собой N(R)C(O)OR; R, Rнезависимо выбраны из группы, состоящей из Н и Cалкила. Изобретение также относится к фармацевтической композиции на основе соединения формулы (I). Технический результат - получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения рака. 8 н. и 15 з.п. ф-лы, 47 табл.
Формула
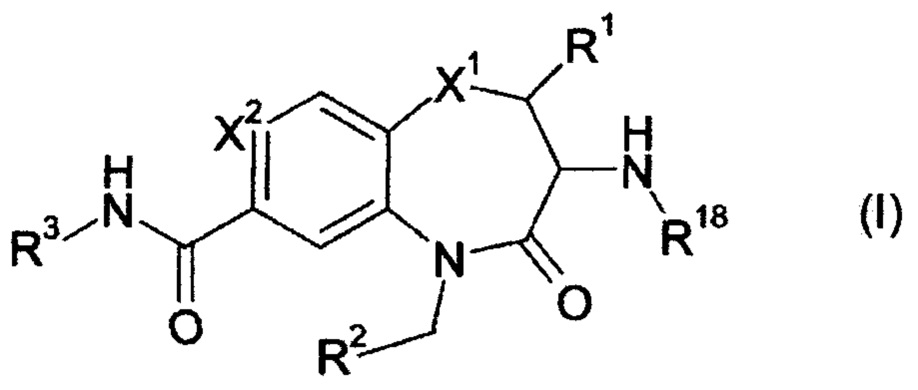


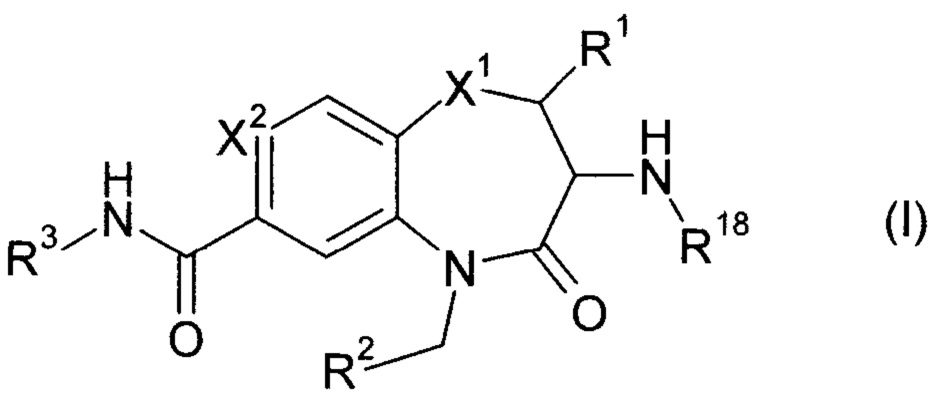
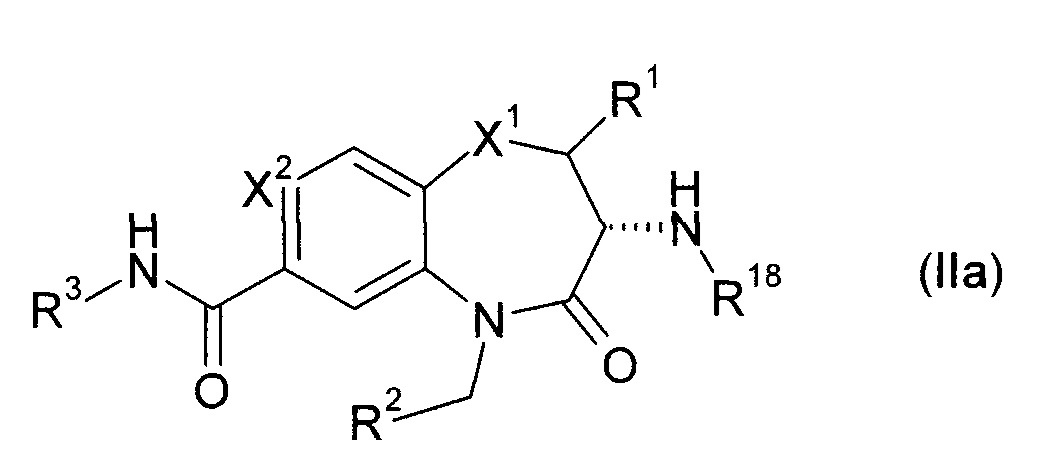
Документы, цитированные в отчёте о поиске
Гиполипидемические 1,4-бензотиазепин-1,1-диоксиды и способы их получения

Комментарии