Замещенные 1-аминоалкиллактамы, фармацевтическая композиция на их основе и способ их получения - RU2241702C2
Код документа: RU2241702C2
Описание
Данное изобретение относится к соединениям общей формулы I
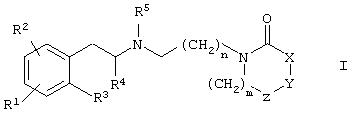
где R1, R2 и R3 означают независимо в каждом случае водород, галоид, (С1-С6)алкил, -OR', -SR', -NR'R", -SOR', -SO2R', -COOR', -OCOR', -OCONR'R", -OSO2R', -OSO2NR'R", -NR'SO2R", -NR'COR", -SO2 NR'R", -SO2(CH2)1-3CONR'R", -CONR'R", циано, галоидалкил или нитро или
R1 и R2, если они смежные, вместе с атомами углерода, к которым они присоединены, могут также образовать 5-7-членный насыщенный или ненасыщенный цикл, необязательно включающий один или два кольцевых гетероатома, выбранных из N, S(O)0-2, или О и необязательно замещенных (С1-С6)алкилом, галоидом, циано или (низш.)алкокси;
R’ и R" означают независимо в каждом случае водород, (С1-С6)алкил, замещенный (С1-С6)алкил, (С0-С3)алкилалкокси, арил, гетероциклил, гетероарил, арил(С1-С3)алкил, гетероарил(С1-С3 )алкил, гетероциклил(С1-С3)алкил, циклоалкилалкил, циклоалкил или
R' и R" вместе с атомом азота, к которому они присоединены, могут также образовать 5-7-членный цикл, необязательно включающий один дополнительный кольцевой гетероатом, выбранный из N, О или S(O)0-2;
R4 означает независимо в каждом случае (С1-С6)алкил;
R5 означает независимо в каждом случае (С1-С6)алкил, (С2-С6)алкенил, (С2-С6)алкинил или циклоалкил;
один из X, Y или Z означает независимо от других -S-, -О-, -СН2- или >N-R6, другие означают -СН2-;
R6 означает водород, (С1-С6)алкил, галоидалкил, арил(С1-С6)алкил, гетероарил(С1-С6)алкил, -(С1-С6)-CR'R'R', -COOR', -SO2R', -C(O)R', -SO2-(CH2)0-3-NR'R", -CONR'R", -C(O)OCH2OC(O)R', -C(O)O-CH2-S-C(O)R' или -PO(OR')2, где R' и R" имеют приведенные выше значения;
m означает целое число 0-3;
n означает целое число 1-6;
или пролекарства, индивидуальные изомеры, рацемические или нерацемические смеси изомеров, или фармацевтически приемлемые соли, или их сольваты.
Неожиданно было обнаружено, что соединения формулы I являются селективными антагонистами мускариновых рецепторов М2/М3.
Ацетилхолин (Ach) является основным медиатором парасимпатической нервной системы. Физиологические активности Ach опосредованы активацией или никотиновых, или мускариновых рецепторов. Оба этих класса рецепторов являются гетерогенными, например семейство мускариновых рецепторов включает пять подтипов (M1, М2, М3, М4 и M5), каждый кодируется различными генами и обладает уникальной фармакологией и распределением.
Почти все ткани гладких мышц экспрессируют мускариновые рецепторы как М2, так и М3, оба из которых играют функциональную роль. Рецепторы М2 численно превосходят рецепторы М3 в соотношении приблизительно 4:1. Как правило, рецепторы М3 опосредуют непосредственные сократительные эффекты ацетилхолина в подавляющем большинстве тканей гладких мышц. С другой стороны, рецепторы М2 вызывают сокращение гладкой мышцы косвенным образом, путем ингибирования симпатически (β -адренорецепторной) опосредованной релаксации.
Соединения, которые действуют как антагонисты мускариновых рецепторов, применяли для лечения некоторых болезненных состояний, ассоциированных с ненадлежащей функцией гладких мышц. До недавнего времени большинство этих соединений не обладало селективностью по отношению к различным подтипам мускариновых рецепторов, вызывая неприятные антихолинергические побочные эффекты, такие, как сухость во рту, запоры, неясность зрения или тахикардия. Наиболее распространенным из этих побочных эффектов является сухость во рту, возникающая в результате блокады мускаринового рецептора в слюнной железе. Показано, что у недавно созданных специфических антагонистов М2 и М3 побочные эффекты уменьшены. Данные дают основание предположить, что конкурентная блокада рецепторов М2 и М3 могла бы быть терапевтически эффективной в лечении болезненных состояний, ассоциированных с повреждениями гладких мышц.
Селективных антагонистов М2/М3 создано немного. Настоящее изобретение восполняет такую необходимость, обеспечивая эти типы антагонистов, применимые для лечения болезненных состояний, ассоциированных с ненадлежащей функцией гладких мышц.
Больше информации о подтипах мускариновых рецепторов и их антагонистов можно получить из следующей литературы. Некоторые подтипы мускариновых рецепторов гладкой мышцы описаны Ehlert и др., Life Sciences 1997, 61, 1729-1740. Hedge и др., Life Sciences 1999, 64, 419-428, ссылаются на подтипы мускариновых рецепторов, модулирующие сокращение гладкой мышцы мочевого пузыря. Eglen и др., Trends. Pharmacol. Sci. 1994, 15, 114-119, и Eglen и др., Pharmacol. Rev. 1996, 48, 531-565, ссылаются на некоторые подтипы мускариновых рецепторов и функцию гладкой мышцы. Клинические исследования селективных мускариновых антагонистов описаны Nilvebrant и др., Life Sciences 1997, 60, 1129-1136, Alabaster, Life Sciences 1997, 60, 1053-1060; Osayu и др., Drug Res. 1994, 44, 1242-1249, и Homma и др., Neurourology and Urodynamics 1997, 345-346. О селективной модуляции подтипов мускариновых рецепторов сообщено Eglen и Hegde, Emerging Drugs 1998, 3, 67-79. Eglen и др., Curr. Opin. Chem. Biol. 1999, 3, 426-432, ссылаются на лиганды мускариновых рецепторов и их терапевтический потенциал. Некая классификация мускариновых рецепторов ацетилхолина описана Caulfield и др., Pharmacological Reviews 1998, 50(2), 279-290.
В следующих литературных источниках описаны соединения, относящиеся к соединениям общей формулы I. Патент US №5693630 от фирмы Astra Aktiebolag ссылается на некоторые фенилэтиламины и фенилпропиламины для лечения психиатрических нарушений. Патенты US №5382595, №5177089, №5047417 и №5607953 от фирмы Eisai Co., Ltd., ссылаются на некоторые производные бутеновой и пропеновой кислот. Некоторые N-(4-амино-2-бутинил)-N-алкилкарбоксамиды, применимые в качестве стимуляторов депрессантов центральной нервной системы, описаны в патентах US №3354178 и №4065471 от фирмы Sterling Drug. Inc. Патенты US №4087541 и №4038407 от фирмы Boehringer Ingelheim GmbH цитируют некоторые 2-(аралкиламиноалкил)фталимиды, применимые для замедления сердечного ритма. Патент US №4490369 от Dr. Karl Thomae GmbH раскрывает некоторые производные бензазепина и их применение в качестве средств при брадикардии. Патент US №3054794 от фирмы US Vitamin & Pharmaceutical Co. отсылает к способу получения 3-(аминоалкил)оксазолидин-2,4-дионов. Некоторые производные бензола для лечения ишемической болезни описаны в патенте US №5998452 от фирмы Chugai Seiyaku Kabushiki Kaisha. Бензотиазепиновые производные с аралкильными заместителями, обладающие сосудорасширяющими свойствами, раскрыты в патенте US №4729994 от фирмы McNeilab Inc. Патент FR №2302733 от Dr. Karl Thomae GmbH цитирует некоторые арилалкоиламины и ЕР 259793 от Dr. Karl Thomae GmbH цитирует некоторые нафтильные производные. WO 9943657 от фирмы F. Hoffmann-La Roche AG цитирует некоторые производные 2-арилэтил(пиперидин-4-илметил)амина в качестве антагонистов мускариновых рецепторов. Некоторые 1-этил-3-(2-диалкиламиноэтил)гексагидропиримидин-2-оны описаны Singh и др., Indian Journal of Chemistry 1976, 14, 528-531. Glozman и др., Khim.-Farm.Zh. 1996, 30(4), 11-14, цитируют некоторые замещенные 1-(диалкиламиноалкил)-4-фенилпирролидин-2-оны.
Все публикации, патенты и заявки на патенты, процитированные в контексте ранее или позднее, тем самым включены в виде ссылок во всей своей полноте.
Объектами по настоящему изобретению являются производные гетероциклилалкиламинов формулы I, пролекарства, индивидуальные изомеры, рацемические и нерацемические смеси изомеров и фармацевтически приемлемые их соли или их сольваты. Кроме того, изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество, по меньшей мере, одного соединения формулы I или пролекарств, индивидуальных изомеров, рацемических или нерацемических смесей изомеров или фармацевтически приемлемых солей или их сольватов в смеси, по меньшей мере, с одним подходящим носителем. В более предпочтительном варианте воплощения изобретения фармацевтические композиции применимы для введения пациенту, находящемуся в болезненном состоянии, которое облегчается при терапии антагонистом мускариновых рецепторов М2/М3.
В другом аспекте изобретение относится к применению данных соединений в лечении пациента, находящегося в болезненном состоянии, которое облегчается с помощью терапии антагонистом мускариновых рецепторов М2/М3. В предпочтительном варианте воплощения изобретения пациент находится в болезненном состоянии, включающем нарушения, связанные с гладкой мускулатурой, предпочтительно нарушения мочеполового тракта, нарушения дыхательных путей, нарушения желудочно-кишечного тракта, более предпочтительно нарушения мочеполового тракта, такие, как повышенная активность мочевого пузыря или гиперактивность детрузора, и его симптомы, такие, как изменения, симптоматически проявляющиеся в виде безотлагательной необходимости мочеиспускания, его частоты, сниженной способности к заполнению мочевого пузыря, случаев недержания и тому подобного; симптомы, проявляющиеся в динамике мочевыделения, такие, как изменения в функциональной активности мочевого пузыря, порог мочеиспускания, нестабильные сокращения мочевого пузыря, мышечная спастичность сфинктера и тому подобное, и симптомы, обычно проявляющиеся в гиперрефлексии детрузора (неврогенный мочевой пузырь), в таких состояниях, как обструкция истечения, недостаточноость истечения, повышенная тазовая чувствительность, или при идиопатических состояниях, таких, как нестабильность детрузора и тому подобное. В другом предпочтительном варианте воплощения изобретения заболевание включает нарушения дыхательных путей, такие, как аллергии и астма. В другом предпочтительном варианте воплощения изобретения болезненное состояние включает нарушения желудочно-кишечного тракта.
В другом аспекте изобретение относится к способу получения соединения формулы I, к способу, который включает
(а) взаимодействие соединения, имеющего общую формулу II
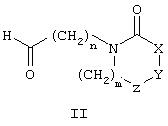
с соединением общей формулы III

с целью получения соединения общей формулы I
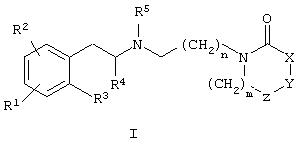
где R1, R2, R3, R4, R5, m, n, X, Y, и Z имеют значения, определенные в контексте, или
(б) (i) взаимодействие производного арилметалла, имеющего общую формулу IV
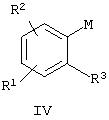
где М означает металл или галогенид магния,
с соединением формулы V

где R означает алкил, арил или арилалкил и
Ra и Rb означают алкил или алкокси или
Ra и Rb вместе с атомом азота, к которому они присоединены, образуют цикл, с образованием соединения формулы VI
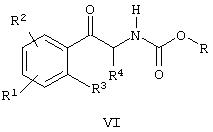
и (ii) восстановление соединения формулы VI, сопровождаемое циклизацией и обработкой соединением формулы R5L, где L означает уходящую группу, с образованием соединения формулы VII

и (iii) восстановление соединения формулы VII и обработка соединением общей формулы II
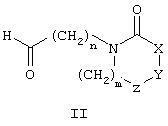
с целью получения соединения общей формулы I

где R1, R2, R3, R4, R5, m, n, X, Y, и Z имеют значения, приведенные в контексте, или
(в) (i) восстановление соединения формулы VI
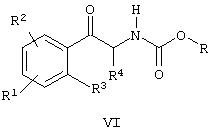
сопровождаемое циклизацией, и
(ii) обработка соединения формулы VI соединением формулы VIII

где L означает уходящую группу, и
(iii) восстановление продукта для получения соединения формулы IX

и (iv) алкилирование соединения формулы IX соответствующим альдегидом или соединением формулы R5L, где L означает уходящую группу, с целью получения соединения формулы I

где R1, R2, R3, R4, R5, X, Y, Z, m и n имеют значения, описанные в контексте.
Если иначе не отмечено, следующие термины, используемые в данной заявке, включая описание и пункты формулы изобретения, имеют значения, приведенные ниже. Следует отметить, что используемые в описании и приложенных пунктах формулы изобретения определенные и неопределенные формы единственного числа допускают применение множественного числа, если в контексте четко не оговорено иначе.
Термин “(низш.)алкил” означает одновалентный линейный или разветвленный углеводородный радикал, содержащий от одного до шести атомов углерода включительно, если не указано иначе. Примеры (низш.)алкилов включают, но без ограничения, метил, этил, пропил, изопропил, 1-этилпропил, втор-бутил, трет-бутил, н-пентил, н-гексил и тому подобное.
Термин “замещенный (низш.)алкил” означает (низш.)алкил, как он определен в контексте, содержащий 1-3 заместителя, предпочтительно один заместитель, такой, как гидрокси, алкокси, амино, амидо, карбокси, ацил, галоид, циано, нитро, тиол. Данные группы могут быть присоединены к любому атому углерода в (низш.)алкильной части. Примеры замещенных (низш.)алкильных радикалов включают, но без ограничения, 2-метоксиэтил, 2-гидроксиэтил, диметиламинокарбонилметил, 4-гидрокси-2,2-диметилбутил, трифторметил, трифторбутил и тому подобное.
Термин “алкилен” означает двухвалентный линейный или разветвленный насыщенный углеводородный радикал, содержащий от одного до шести атомов углерода включительно, если не указано иначе. Примеры алкиленовых радикалов включают, но без ограничения, метилен, этилен, пропилен, 2-метилпропилен, бутилен, 2-этилбутилен и тому подобное.
Термин “алкенил” означает одновалентный линейный или разветвленный ненасыщенный углеводородный радикал, содержащий двойную связь и от двух до шести атомов углерода включительно, если не указано иначе. Примеры алкенильных радикалов включают, но без ограничения, этенил, аллил, 1-пропенил, 2-бутенил и тому подобное.
Термин “алкинил” означает одновалентный линейный или разветвленный ненасыщенный углеводородный радикал, содержащий тройную связь и от двух до шести атомов углерода включительно, если не указано иначе. Примеры алкинильных радикалов включают, но без ограничения, этинил, 1-пропинил, 2-бутинил, пропаргил и тому подобное.
Термин “алкокси” означает радикал -OR, где R означает (низш.)алкильный радикал, как определено в контексте. Примеры алкоксирадикалов включают, но без ограничения, метокси, этокси, изопропокси и тому подобное.
Термин “арил” означает одновалентный ароматический карбоциклический радикал, состоящий из одного отдельного кольца или из одного либо нескольких конденсированных колец, из которых, по меньшей мере, одно кольцо является ароматическим по своей природе, которое необязательно может быть замещено одним или несколькими, предпочтительно одним или двумя, заместителями, выбранными из гидрокси, циано, (низш.)алкила, (низш.)алкокси, галоид(низш.)алкокси, алкилтио, галоида, галоидалкила, гидроксиалкила, нитро, алкоксикарбонила, (низш.)алкилалкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино, арилкарбониламино, если не указано иначе. В качестве альтернативы два смежных атома арильного кольца могут быть замещены метилендиокси- или этилендиоксигруппой. Примеры арильных радикалов включают, но без ограничения, фенил, нафтил, бифенил, инданил, антрахинолил, трет-бутилфенил, 1,3-бензодиоксолил и тому подобное.
Термин “арилалкил” (или “аралкил”) означает радикал R'R"-, где R' означает арильный радикал, как он определен в контексте, и R" означает алкильный радикал, как он определен в контексте. Примеры арилалкильных радикалов включают, но без ограничения, бензил, фенилэтил, 3-фенилпропил и тому подобное.
Термин “циклоалкил” означает одновалентный насыщенный карбоциклический радикал, состоящий из одного или нескольких колец, предпочтительно из одного или двух колец, из трех - восьми атомов углерода на кольцо, которые необязательно могут быть замещены одним или несколькими, предпочтительно одним или двумя, заместителями, выбранными из гидрокси, циано, (низш.)алкила, (низш.)алкокси, галоид(низш.)алкокси, алкилтио, галоида, галоидалкила, гидроксиалкила, нитро, алкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино, арилкарбониламино, если не указано иначе. Примеры циклоалкильных радикалов включают, но без ограничения, циклопропил, циклобутил, 3-этилциклобутил, циклопентил, циклогептил и тому подобное.
Термин “циклоалкилалкил” означает радикал R'R"-, где R' означает циклоалкильный радикал, как он определен в контексте, и R" означает алкильный радикал, как он определен в контексте. Примеры циклоалкилалкильных радикалов включают, но без ограничения, циклопропилметил, циклогексилметил, циклопентилэтил и тому подобное.
Термин “гетероарил” означает одновалентный ароматический циклический радикал, содержащий одно или несколько колец, предпочтительно одно - три кольца из 4-8 атомов в каждом кольце, включая один или несколько гетероатомов, предпочтительно один или два атома в кольце (выбираемые из азота, кислорода или серы), которое необязательно может быть замещено одним или несколькими, предпочтительно одним или двумя заместителями, выбранными из гидрокси, циано, (низш.)алкила, (низш.)алкокси, галоид(низш.)алкокси, алкилтио, галоида, галоидалкила, гидроксиалкила, нитро, алкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино, арилкарбониламино, если не указано иначе. Примеры гетероарильных радикалов включают, но без ограничения, имидазолил, оксазолил, тиазолил, пиразинил, тиенил, фуранил, пиридинил, хинолинил, изохинолинил, бензофурил, бензотиофенил, бензотиопиранил, бензимидазолил, бензоксазолил, бензотиазолил, бензопиранил, индазолил, индолил, изоиндолил, хинолинил, изохинолинил, нафтиридинил, бензолсульфонилтиофенил и тому подобное.
Термин “гетероарилалкил” (или “гетероаралкил”) означает радикал формулы R'R"-, где R' означает гетероарильный радикал, как он определен в контексте, и R" означает алкильный радикал, как он определен в контексте. Примеры гетероарилалкильных радикалов включают, но без ограничения, 2-имидазолилметил, 3-пирролилэтил и тому подобное.
Термин “гетероциклил” означает одновалентный насыщенный циклический радикал, состоящий из одного или нескольких колец, предпочтительно одного - двух колец, из 3-8 атомов в каждом кольце, включая один или несколько кольцевых гетероатомов (выбранных из N, О или S(O)0-2), которые необязательно могут быть замещены одним или несколькими, предпочтительно одним или двумя заместителями, выбранными из гидрокси, оксо, циано, (низш.)алкила, (низш.)алкокси, галоид(низш.)алкокси, алкилтио, галоида, галоидалкила, гидроксиалкила, нитро, алкоксикарбонила, амино, алкиламино, алкилсульфонила, арилсульфонила, алкиламиносульфонила, ариламиносульфонила, алкилсульфониламино, арилсульфониламино, алкиламинокарбонила, ариламинокарбонила, алкилкарбониламино, арилкарбониламино, если не указано иначе. Примеры гетероциклических радикалов включают, но без ограничения, морфолинил, пиперазинил, пиперидинил, пирролидинил, тетрагидропиранил, тиоморфолинил, хинуклидинил и тому подобное.
Термин “гетероциклоалкил” (или “гетероциклилалкил”) означает радикал формулы R'R"-, где R' означает гетероциклический радикал, как он определен в контексте, и R" означает алкильный радикал, как он определен в контексте. Примеры гетероциклоалкильных радикалов включают, но без ограничения, 1-пиперазинилметил, 2-морфолинометил и тому подобное.
Термин “галоид” означает атом фтора, брома, хлора и/или йода.
Термин “галоидалкил” означает (низш.)алкильный радикал, который определен в контексте, замещенный по любому положению одним или несколькими атомами галоида, как определено в контексте. Примеры галоидалкильных радикалов включают, но без ограничения, 1,2-дифторпропил, 1,2-дихлорпропил, трифторметил, 2,2,2-трифторэтил и тому подобное.
Термин “гидроксиалкил” означает (низш.)алкильный радикал, который определен в контексте, замещенный одной или несколькими гидроксильными группами. Примеры гидроксиалкильных радикалов включают, но без ограничения, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 1-(гидроксиметил)-2-гидроксиэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил, 2-(гидроксиметил)-3-гидроксипропил и тому подобное.
Термин “алкилтио” означает радикал -SR, где R означает (низш.)алкил, который определен в контексте. Примеры алкилтиорадикалов включают, но без ограничения, метилтио, бутилтио и тому подобное.
Термин “алкиламино” означает радикал NR'R"-, где R' означает (низш.)алкильный радикал, как он определен в контексте, и R" означает водород или (низш.)алкильный радикал, как он определен в контексте. Примеры алкиламинорадикалов включают, но без ограничения, метиламино, (1-метилпропил)амино, диметиламино, метилэтиламино, диэтиламино, гидроксиэтилэтиламино, метоксиэтилэтиламино и тому подобное.
Термин “ацилокси” означает радикал -OC(O)R, где R означает (низш.)алкильный радикал, как он определен в контексте. Примеры ацилоксильных радикалов включают, но без ограничения, ацетокси, пропионилокси и тому подобное.
Термин “алкоксикарбонил” или “алкиловый сложный эфир” означает радикал -C(O)-O-R, где R означает (низш.)алкильный радикал, как он определен в контексте. Примеры алкоксикарбонильных радикалов включают, но без ограничения, метоксикарбонил, этоксикарбонил, втор-бутоксикарбонил, изопропилоксикарбонил и тому подобное.
Термин “арилоксикарбонил” или “арильный сложный эфир” означает радикал -C(O)-O-R, где R означает арильный радикал, как он определен в контексте. Примеры арилоксикарбонильных радикалов включают, но без ограничения, сложный фениловый эфир, сложный нафтиловый эфир и тому подобное.
Термин “арилалкоксикарбонил” или “сложный арилалкиловый эфир” означает радикал -C(O)-O-RR', где R означает (низш.)алкильный радикал и R' означает арильный радикал, как они определены в контексте. Примеры арилоксикарбонильных радикалов включают, но без ограничения, сложный бензиловый эфир, сложный фенилэтиловый эфир и тому подобное.
Термин “алкилкарбонил” (или “ацил”) означает радикал R-C(O)-, где R означает (низш.)алкильный радикал, как он определен в контексте. Примеры алкилкарбонильных радикалов включают, но без ограничения, ацетил, пропионил, н-бутирил, втор-бутирил, трет-бутирил, изопропил и тому подобное.
Термин “арилкарбонил” означает радикал R-C(O)-, где R означает арильный радикал, как он определен в контексте. Примеры арилкарбонильных радикалов включают, но без ограничения, бензоил, нафтоил и тому подобное.
Термин “арилалкилкарбонил” (или аралкилкарбонил) означает радикал R-С(O)-, где R означает аралкильный радикал, как он определен в контексте.
Примеры аралкилкарбонильных радикалов включают, но без ограничения, фенилацетил и тому подобное.
Термин “гетероарилкарбонил” означает радикал R-C(O)-, где R означает гетероарильный радикал, как он определен в контексте. Примеры гетероарилкарбонильных радикалов включают, но без ограничения, пиридиноил, 3-метилизоксазолоил, изоксазолоил, тиеноил, фуроил и тому подобное.
Термин “гетероциклилкарбонил” (или “гетероциклокарбонил) означает радикал R-C(O)-, где R означает гетероциклильный радикал, как он определен в контексте. Примеры гетероциклилкарбонильных радикалов включают, но без ограничения, пиперазиноил, морфолиноил, пирролидиноил и тому подобное.
Термин “циклоалкилкарбонил” означает радикал R-C(O)-, где R означает циклоалкильный радикал, как он определен в контексте. Примеры циклоалкилкарбонильных радикалов включают, но без ограничения, циклобутаноил, циклопентаноил, циклогексаноил и тому подобное.
Термин “алкиламинокарбонил” означает радикал -C(O)NR'R", где R' означает (низш.)алкил, как он определен в контексте, и R" означает водород или (низш.)алкил, как он определен в контексте. Примеры алкиламинокарбонильных радикалов включают, но без ограничения, метиламинокарбонил, диметиламинокарбонил, трет-бутиламинокарбонил, н-бутиламинокарбонил, изопропиламинокарбонил и тому подобное.
Термин “ариламинокарбонил” означает радикал -C(O)NR'R", где R' означает арил, как он определен в контексте, и R" означает водород или арил, как он определен в контексте. Примеры ариламинокарбонильных радикалов включают, но без ограничения, фениламинокарбонил, метоксифениламинокарбонил, дифениламинокарбонил, диметоксифениламинокарбонил и тому подобное.
Термин “гетероариламинокарбонил” означает радикал -C(O)NR'R", где R’ означает гетероарил, как он определен в контексте, и R" означает водород или гетероарил, как он определен в контексте. Примеры гетероариламинокарбонильных радикалов включают, но без ограничения, пиридиниламинокарбонил, тиениламинокарбонил, фураниламинокарбонил и тому подобное.
Термин “алкилкарбониламино” означает радикал -NC(O)R', где R' означает (низш.)алкил, как он определен в контексте. Примеры алкилкарбониламинорадикалов включают, но без ограничения, метилкарбониламино, изопропилкарбониламино, трет-бутилкарбониламино и тому подобное.
Термин “арилкарбониламино” означает радикал -NC(O)R', где R' означает арил, как он определен в контексте. Примеры арилкарбониламинорадикалов включают, но без ограничения, фенилкарбониламино, анизоилкарбониламино и тому подобное.
Термин “алкилкарбамоил” означает радикал -OC(O)NR'R", где R' означает (низш.)алкил, как он определен в контексте, и R" означает водород или (низш.)алкил, как он определен в контексте. Примеры алкилкарбамоильных радикалов включают, но без ограничения, метилкарбамоил, этилкарбамоил и тому подобное.
Термин “арилкарбамоил” означает радикал -OC(O)NR'R", где R' означает арил, как он определен в контексте, и R" означает водород или арил, как он определен в контексте. Примеры арилкарбамоильных радикалов включают, но без ограничения, фенилкарбамоил, нафтилкарбамоил и тому подобное.
Термин “арилалкилкарбамоил” означает радикал -OC(O)NR'R", где R' означает (низш.)алкил, как он определен в контексте, и R" означает арил, как он определен в контексте. Примеры алкилкарбамоильных радикалов включают, но без ограничения, бензилкарбамоил, фенилкарбамоил и тому подобное.
Термин “алкиламиносульфонил” означает радикал -S(O)2NR'R", где R' означает (низш.)алкил, как он определен в контексте, и R" означает водород или (низш.)алкил, как он определен в контексте. Примеры алкиламиносульфонильных радикалов включают, но без ограничения, метиламиносульфонил, диметиламиносульфонил и тому подобное.
Термин “ариламиносульфонил” означает радикал -S(O)2NR'R", где R' означает арил, как он определен в контексте, и R" означает водород или арил, как он определен в контексте. Примеры ариламиносульфонильных радикалов включают, но без ограничения, фениламиносульфонил, метоксифениламиносульфонил и тому подобное.
Термин “гетероариламиносульфонил” означает радикал -S(O)2NR'R", где R' означает гетероарил, как он определен в контексте, и R" означает водород или гетероарил, как он определен в контексте. Примеры гетероариламиносульфонильных радикалов включают, но без ограничения, тиениламиносульфонил, пиперидиниламиносульфонил, фураниламиносульфонил, имидазолиламиносульфонил и тому подобное.
Термин “алкилсульфониламино” означает радикал -NS(O)2R', где R' означает (низш.)алкил, как он определен в контексте. Примеры алкилсульфониламинорадикалов включают, но без ограничения, метилсульфониламино, пропилсульфониламино и тому подобное.
Термин “арилсульфониламино” означает радикал -NS(O)2R', где R' означает арил, как он определен в контексте. Примеры арилсульфониламинорадикалов включают, но без ограничения, фенилсульфониламино, нафтилсульфониламино и тому подобное.
Термин “алкилсульфонил” означает радикал -S(O)2R, где R означает (низш.)алкил или замещенный (низш.)алкил, как он определен в контексте. Примеры алкилсульфонильного радикала включают, но без ограничения, метилсульфонил, трифторметилсульфонил, пропилсульфонил и тому подобное.
Термин “арилсульфонил” означает радикал -S(O)2R, где R означает арил, как он определен в контексте. Примеры арилсульфонильного радикала включают, но без ограничения, фенилсульфонил, толуолсульфонил, нитрофенилсульфонил, метоксифенилсульфонил, 3,4,5-триметоксифенилсульфонил и тому подобное.
Термин “гетероарилсульфонил” означает радикал -S(O)2R, где R означает гетероарил, как он определен в контексте. Примеры гетероарилсульфонильного радикала включают, но без ограничения, тиенилсульфонил, фуранилсульфонил, имидазолилсульфонил, N-метилимидазолилсульфонил и тому подобное.
Термин “гетероциклилсульфонил” означает радикал -S(O)2R, где R означает гетероциклил, как он определен в контексте. Примеры гетероциклилсульфонильного радикала включают, но без ограничения, пиперидинилсульфонил, пиперазинилсульфонил и тому подобное.
Термин “алкилсульфонилокси” означает радикал -OS(O)2R, где R означает (низш.)алкил или замещенный (низш.)алкил, как он определен в контексте. Примеры алкилсульфонилоксирадикала включают, но без ограничения, метилсульфонилокси, трифторметилсульфонилокси, пропилсульфонилокси и тому подобное.
Термин “необязательный” или “необязательно” означает, что описываемое впоследствии событие или случай может произойти, но в этом нет надобности, и что описание включает примеры, в которых событие или случай происходит, и примеры, в которых этого нет. Например, термин “необязательная связь” означает, что связь может существовать или может не существовать и что описание включает одинарные, двойные или тройные связи.
Термин “уходящая группа” подразумевает группу со значением, обычно ассоциируемым с ней в синтетической органической химии, т.е. атом или группу, замещаемые в условиях алкилирования. Примеры уходящих групп включают, но без ограничения, галоид, алкан- или арилсульфонилокси, такой, как метансульфонилокси, этансульфонилокси, тиометил, бензолсульфонилокси, тозилокси и тиенилокси, дигалоидфосфиноилокси, необязательно замещенный бензилокси, изопропилокси, ацилокси и тому подобное.
Термин “защитная группа” или “блокирующая группа” означает группу, которая избирательно блокирует одно реакционноспособное положение в многофункциональном соединении, так что химическая реакция может избирательно проходить по другому незащищенному реакционноспособному положению, группу со значением, обычно ассоциируемым с ней в синтетической химии. Некоторые способы по данному изобретению основаны на применении защитных групп, чтобы блокировать реакционноспособные атомы кислорода, присутствующие в реагирующих соединениях. Приемлемые защитные группы для спиртовых или фенольных гидроксилов, которые могут быть легко и избирательно удалены, включают группы, обеспечивающие защиту в виде ацетатов, галоидалкилкарбонатов, простых бензиловых эфиров, простых алкилсилиловых эфиров, простых гетероциклиловых эфиров и простых метиловых либо алкиловых эфиров и тому подобное. Защитные или блокирующие группы для карбоксилов подобны тем, которые описаны для гидроксилов, предпочтительно с образованием трет-бутиловых, бензиловых или метиловых сложных эфиров. Примеры защитных групп можно найти у T.W. Greene и др., Protective Groups in Organic Chemistry (J. Wiley, 2-ое изд., 1991), и Harrison и др., Compendium of Synthetic Organic Methods, T. 1-8 (J. Wiley and Sons. 1971-1996).
Термин “аминозащитная группа” подразумевает такую блокирующую группу, которая предназначена для защиты атома азота от нежелательных реакций в ходе синтеза и включает, но без ограничения, бензил, бензилоксикарбонил (карбобензокси, CBZ), n-метоксибензилоксикарбонил, n-нитробензилоксикарбонил, трет-бутилоксикарбонил (ВОС), трифторацетил и тому подобное. Предпочтительно применять или ВОС, или CBZ в качестве аминозащитной группы из-за относительно легкого их удаления, например, слабыми кислотами в случае ВОС, к примеру трифторуксусной кислотой или соляной кислотой в этилацетате, или каталитическим гидрированием в случае CBZ.
Термин “гидроксизащитная группа” означает блокирующую группу, предохраняющую гидроксил, который иначе был бы модифицирован в ходе некоторых химических реакций. Соответствующая защита гидроксила включает образующие простые эфиры группы, которые могут быть легко удалены после завершения всех других этапов реакций, такие, как бензильная или тритильная группа, необязательно замещенные по фенильному кольцу. Другая соответствующая защита гидроксила включает группы, образующие простые алкиловые эфиры, тетрагидропиранил, триалкилсилильные группы и аллильную группу.
Термин “снятие защиты” или “деблокирование” означает реакцию, с помощью которой удаляют защитную группу после завершения избирательного взаимодействия. Некоторые защитные группы могут быть предпочтительнее других благодаря удобству или относительной легкости их удаления. Деблокирующие реагенты для защищенных гидроксильных или карбоксильных групп включают карбонаты калия или натрия, гидроксид лития в спиртовых растворах, цинк в метаноле, уксусную кислоту, трифторуксусную кислоту, палладиевые катализаторы или трибромид бора и тому подобное.
Термин “изомерия” подразумевает соединения, которые имеют идентичные молекулярные формулы, но отличаются по природе или последовательности соединения их атомов, или по пространственному расположению их атомов.
Изомеры, которые различаются по пространственному расположению их атомов, называют “стереоизомерами”. Стереоизомеры, которые не являются зеркальным отображением друг друга, называют “диастереоизомерами” и стереоизомеры, которые не совпадают при наложении их зеркальных отображений, называют “энантиомерами” или иногда оптическими изомерами. Атом углерода, связанный с четырьмя неидентичными заместителями, называют “хиральным центром”.
Термин “хиральный изомер” означает соединение с одним хиральным центром. Оно имеет две энантиомерные формы противоположной хиральности и может существовать или в виде индивидуального энантиомера, или в виде смеси энантиомеров. Смесь, содержащая равные количества индивидуальных энантиомерных форм противоположной хиральности, называют “рацемической смесью”. Соединение, которое содержит более одного хирального центра, имеет 2n-1 энантиомерных пар, где n означает количество хиральных центров. Соединения с более чем одним хиральным центром может существовать или как индивидуальный диастереомер, или как смесь диастереомеров, называемая “диастереомерной смесью”. Если в соединении присутствует один хиральный центр, стереоизомер может быть охарактеризован абсолютной конфигурацией (R или S) данного хирального центра. Абсолютная конфигурация относится к пространственному расположению заместителей, соединенных с хиральным центром. Заместители, связанные с хиральным центром, при рассмотрении располагают в ряд в соответствии с правилом последовательности Кана, Ингольда и Прелога (Cahn и др., Angew. Chem. Inter. Edit. 1966, 5, 385; опечатка 511; Cahn и др., Angew. Chem. 1966, 78, 413; Cahn и Ingold, J. Chem. Soc. 1951 (London), 612; Cahn и др. Experientia 1956, 12, 81; Cahn, J. Chem.Educ. 1964, 41, 116).
Термин “геометрические изомеры” означает, что диастереомеры обязаны своим существованием затрудненному вращению вокруг двойных связей. Эти конфигурации различаются по своим названиям с помощью префиксов цис и транс или букв Z и Е, указывающих, что группы находятся по одну сторону или по противоположным сторонам двойной связи в молекуле в соответствии с правилом Кана-Ингольда-Прелога.
Термин “атропические изомеры” означает изомеры, которые обязаны своим существованием затрудненному вращению, вызванному препятствием, создаваемым при вращении объемных групп вокруг основной оси.
Термин “фактически чистый” означает, что присутствует, по меньшей мере, примерно 80 мол.%, более предпочтительно, по меньшей мере, примерно 90 мол.% и наиболее предпочтительно, по меньшей мере, примерно 95 мол.%, требуемого энантиомера или стереоизомера.
Термин “фармацевтически приемлемый” означает то, что применимо в приготовлении фармацевтической композиции, т.е., как правило, безопасно, нетоксично и ни биологически, ни как-либо иначе не является нежелательным, и включает то, что приемлемо для ветеринарии, а также для фармацевтического применения у человека.
Термин “фармацевтически приемлемые соли” соединения означает соли, которые являются фармацевтически приемлемыми, как определено выше, и которые обладают требуемой фармакологической активностью исходного соединения. Такие соли включают
(1) кислотно-аддитивные соли, образованные с неорганическими кислотами, такими, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, или образованные с органическими кислотами, такими, как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глютаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфоновая кислота, молочная кислота, малеиновая кислота, яблочная кислота, миндальная кислота, метансульфоновая кислота, муконовая кислота, 2-нафталинсульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, дибензоил-L-винная кислота, винная кислота, n-толуолсульфокислота, триметилуксусная кислота, трифторуксусная кислота и тому подобное, или
(2) соли, образованные, когда кислотный протон, присутствующий в исходном соединении, заменен ионом металла, например ионом щелочного металла, ионом щелочно-земельного металла или ионом алюминия; или образует координационные связи с органическим или неорганическим основанием.
Приемлемые органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и тому подобное. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия.
Предпочтительными фармацевтически приемлемыми солями являются соли, образованные из хлористоводородной кислоты, трифторуксусной кислоты, дибензоил-L-винной кислоты и фосфорной кислоты.
Следует понимать, что все ссылки на фармацевтически приемлемые соли включают растворитель-аддитивные формы (сольваты) или кристаллические формы (полиморфы), как определено в контексте, вышеупомянутой кислотно-аддитивной соли.
Термин “кристаллические формы” (или полиморфы) означает кристаллические структуры, в форме которых соединение может кристаллизоваться, при различном расположении компоновки кристаллов, которые все имеют один и тот же элементный состав. Различные кристаллические формы обычно имеют различные рентгенограммы, инфракрасные спектры, точки плавления, плотность, конфигурацию кристалла, оптические и электрические свойства, стабильность и растворимость. Перекристаллизация из растворителя, скорость кристаллизации, температура хранения и другие факторы могут вызвать преобладание одной кристаллической формы.
Термин “сольваты” означает растворитель-аддитивные формы, которые содержат или стехиометрические или нестехиометрические количества растворителя. Некоторые соединения в твердом кристаллическом состоянии имеют тенденцию улавливать молекулы растворителя в определенном молярном соотношении, тем самым образуя сольват. Если растворителем является вода, то образованный сольват является гидратом, если растворителем является спирт, то образованный сольват является алкоголятом. Гидраты образуются путем присоединения одной или нескольких молекул воды к одному из веществ, в котором вода сохраняет свое молекулярное состояние как Н2О, причем такое присоединение способно образовать один гидрат или несколько.
Термин “пролекарство” означает фармакологически неактивную форму соединения, которая после введения субъекту должна метаболизироваться in vivo, например, с помощью биологических жидкостей или ферментов в фармакологически активную форму соединения, чтобы обеспечить требуемое фармакологическое действие. Пролекарство может метаболизироваться до абсорбции, в ходе абсорбции, после абсорбции или в специфическом участке. И хотя для многих соединений первоначально метаболизм происходит в печени, почти все другие органы и ткани, особенно легкое, способны осуществлять меняющиеся уровни метаболизма. Пролекарственные формы соединений могут использоваться, например, чтобы улучшить биодоступность, чтобы улучшить для субъекта переносимость, например, путем маскировки или уменьшения неприятных характеристик, таких, как горький вкус или раздражение желудочно-кишечного тракта, изменить растворимость, например, для внутривенного применения, обеспечить пролонгированное или непрерывное высвобождение или доставку, облегчить получение лекарственной формы или обеспечить направленную доставку соединения. Пролекарства описаны Richard В. Silverman, The Organic Chemistry of Drug Design and Drug Action, Academic Press, San Diego, 1992. Глава 8: "Prodrugs and Drug Delivery Systems" стр.352-401; Design of Prodrugs, редактор Н. Bundgaard, Elsevier Science, Amsterdam, 1985; Design of Biopharmaceutical Properties through Prodrugs and Analogs, редактор Е. B. Roche, American Pharmaceutical Association, Washington, 1977, и Drug Delivery Systems, редактор R.L. Juliano, Oxford Univ. Press, Oxford, 1980.
Термин “субъект” означает млекопитающих и немлекопитающих. Под млекопитающим подразумевается любой член класса Mammalia, включая, но без ограничения, человека, нечеловекообразных приматов, таких, как шимпанзе и другие обезьяны и виды обезьян; сельскохозяйственных животных, таких, как крупный рогатый скот, лошади, овцы, козы и свиньи; домашних животных, таких, как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких, как крысы, мыши и морские свинки и тому подобное. Примеры немлекопитающих включают, но без ограничения, птиц и тому подобное.
Термин “терапевтически эффективное количество” означает количество соединения, которое при введении субъекту для лечения болезненного состояния является достаточным, чтобы сделать эффективным такое лечение болезненного состояния. Терапевтически эффективное количество будет меняться в зависимости от соединения, болезненного состояния, подвергаемого лечению, тяжести или природы заболевания, возраста и относительного здоровья субъекта, пути и формы введения, мнения оказывающего помощь практикующего медицинского или ветеринарного врача и других факторов.
Термин “фармакологический эффект”, как он использован в контексте, охватывает все последствия, вызываемые у субъекта, которые достигают предполагаемой цели терапии. В одном предпочтительном воплощении изобретения фармакологический эффект означает, что первичные симптомы у субъекта, подвергаемого лечению, предотвращены, облегчены или уменьшены. Например, фармакологический эффект мог бы быть таковым, который приводит к предупреждению, облегчению или уменьшению первичных симптомов у леченного субъекта. В другом предпочтительном воплощении изобретения фармакологический эффект означает, что нарушения или симптомы первичных признаков у субъекта, подвергаемого лечению, предотвращены, облегчены или уменьшены. Например, фармакологический эффект мог бы быть таковым, который приводит к предотвращению или уменьшению первичных симптомов у леченного субъекта.
Термин “болезненное состояние” означает любое заболевание, состояние, симптом или показание.
Термин “лечение” или “обработка” болезненного состояния включает
(1) предотвращение болезненного состояния, т.е. препятствие появлению клинических симптомов болезненного состояния у субъекта, который может быть подвержен или предрасположен к болезненному состоянию, но еще не ощутил или не обнаружил его симптомы;
(2) подавление болезненного состояния, т.е. прекращение развития болезненного состояния или его клинических симптомов, или
(3) ослабление болезненного состояния, т.е. вызывание временной или постоянной регрессии болезненного состояния или его клинических симптомов.
Термин “антагонист” означает молекулу, такую, как соединение, препарат, ингибитор фермента или гормон, которая снижает или предотвращает действие другой молекулы или рецепторного сайта.
Термин “нарушения мочевого тракта” или “уропатия”, используемый взаимозаменяемо с термином “симптомы мочевого тракта”, означает патологические изменения в мочевом тракте. Симптомы мочевого тракта включают повышенную активность мочевого пузыря (известную также как гиперфункция детрузора), обструкцию выпускного отверстия, недостаточность выпускного отверстия и повышенную тазовую чувствительность.
Термин “повышенная активность мочевого пузыря” или “гиперфункция детрузора” включает, но без ограничения, изменения с такими проявляющимися симптомами, как безотлагательная необходимость, частота мочеиспускания, сниженная емкость мочевого пузыря, периоды недержания и тому подобное, изменения в уродинамике, проявляющиеся как изменения в емкости мочевого пузыря, порог мочеиспускания, нестабильные сокращения мочевого пузыря, спастичность сфинктера и тому подобное, и симптомы, обычно проявляемые при гиперрефлексии детрузора (неврогенном мочевом пузыре), в таких условиях, как обструкция выпускного отверстия, недостаточность выпускного отверстия, повышенная тазовая чувствительность, или в таких идиопатических условиях, как нестабильность детрузора и тому подобное.
Термин “обструкция выпускного отверстия” включает, но без ограничения, доброкачественную гипертрофию предстательной железы (ВРН), уретральное стриктурное заболевание, опухоли и тому подобное. Обычно это проявляется как обструктивный симптом (низкие скорости истечения, затруднение в начальной стадии мочеиспускания и тому подобное) или как раздражающий (безотлагательная необходимость, надлобковая боль и тому подобное).
Термин “недостаточность выпускного отверстия” включает, но без ограничения, уретральную повышенную мобильность, врожденный недостаток сфинктера или смешанное недержание. Обычно это проявляется в виде симптома стрессового недержания.
Термин “повышенная тазовая чувствительность” включает, но без ограничения, боль в области таза, интерстициальный (клеточный) цистит, простадинию, вулвадинию, уретрит, орхидалгию и тому подобное. Это проявляется в виде симптома боли, воспаления или дискомфорта в области таза и обычно включает симптомы мочевого пузыря с повышенной активностью.
Номенклатура: наименование и нумерация соединений по данному изобретению, иллюстрируются ниже.
Как правило, номенклатура, использованная в данной заявке, основана на AUTONOMTM, компьютеризованной системе Института Бельштейна для образования систематической номенклатуры ИЮПАК. Например, соединение формулы I, где R1 означает этансульфонил, R2 и R3 означают Н, R4 означает метил, R5 означает этил, n означает 3, m означает 2 и X, Y и Z означают СН2, называется 1-(4-{[2-(4-этансульфонилфенил)-1-метилэтил]этиламино}бутил)азепан-2-он.
Подобным образом соединение формулы I, где R1 означает хлор, R2 и R3означают Н, R4 означает метил, R5 означает пропил, n означает 2, m означает 1, Х означает N и Y и Z означают СН2, называется
1-[3-{[2-(4-хлорфенил)-1-метилэтил]пропиламино}пропил]тетрагидропиримидин-2-он.
Подобным образом соединение формулы I, где R1 означает метансульфонил, R2 и R3 означают Н, R4 означает метил, R5 означает этил, n означает 3, m означает 2, Х и Z означают СН2, Y означает N-метансульфонил, называется 1-(4-{этил-[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-метансульфонил[1,4]диазепан-2-он.
Среди соединений по настоящему изобретению, приведенных в кратком изложении изобретения, некоторые соединения формулы I или пролекарства, индивидуальные изомеры, рацемические и нерацемические смеси изомеров, или фармацевтически приемлемые соли, или их сольваты являются предпочтительными.
R1, R2 и R3 означают независимо в каждом случае предпочтительно водород, галоид, (С1-С6)алкил, алкокси, алкилсульфонил или алкилсульфонилокси и более предпочтительно водород, метокси, метилсульфонил или метилсульфонилокси.
Другая предпочтительная группа включает соединения, где R1 и R2, если они смежные, то вместе с кольцом, к которому они присоединены, образуют 5- или 6-членный моноциклический насыщенный или ненасыщенный цикл, необязательно содержащий 0, 1 или 2 циклических гетероатома, независимо выбранных из азота, кислорода или серы, более предпочтительно R1 и R2, если они смежные, то вместе с кольцом, к которому они присоединены, образуют нафталин, индол, 2,3-дигидробензофуран, 2,3-дигидробензо[1,4]диоксин, хроман, бензо[1,3]диоксол, бензо[1,3]оксатиолил, бензо[1,3]оксатиолдиоксид и даже более предпочтительно 2, 3-дигидробензо[1,4]диоксин.
R4 означает независимо в каждом случае предпочтительно (С1-С6)алкил и более предпочтительно метил.
R5 означает независимо в каждом случае предпочтительно (С1-С6)алкил, (низш.)алкенил или (низш.)алкинил, более предпочтительно этил, пропил, изопропил, аллил или пропаргил и даже более предпочтительно этил или пропил;
m означает предпочтительно 0-3, более предпочтительно 1-2 и даже более предпочтительно 2, и
n означает предпочтительно 1-6, более предпочтительно 1-3 и даже более предпочтительно 3.
Один из X, Y или Z означает независимо в каждом случае предпочтительно -S-, -О-, -СН2- или >N-R6, наиболее предпочтительно -CH2- или >N-R6 и даже более предпочтительно >NH.
Особенно предпочтительными являются соединения формулы I, где R4означает метил. В более предпочтительном варианте воплощения R4 означает метил и m означает 0.
В другом предпочтительном варианте воплощения R4 означает метил и m означает 1. Примером такого соединения является 1-(2-{этил-[2-(4-метоксифенил)-1-метилэтил]амино}этил)пиперидин-2-он. В более предпочтительном варианте воплощения R4 означает метил, m означает 1 и Y означает >N-R6.
Примерами таких соединений являются следующие:
1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)пиперазин-2-он;
1-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-метилпиперазин-2-он или
N-метил-4-((S)-2-{[4-(2-оксопиперазин-1-ил)бутил]пропиламино}пропил)бензолсульфонамид.
В другом предпочтительном варианте воплощения R4 означает метил и m означает 2, более предпочтительно R4 означает метил, m означает 2 и n означает 3.
Примерами таких соединений являются следующие:
1-(4-{этил-[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)азепан-2-он;
4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]оксазепан-3-он
или 4-(2-{этил-[4-(2-оксоазепан-1-ил)бутил]амино}пропил)фениловый эфир 1,1,1 -трифторметансульфоновой кислоты.
Особенно предпочтительными являются соединения формулы I, где R4 означает метил, m означает 2 и один из X, Y или Z означает >N-R6, а другие означают -СН2-. Даже более предпочтительно, когда R4 означает метил, m означает 2 и Х означает >N-R6. В другом предпочтительном варианте воплощения R4 означает метил, m означает 2 и Y означает >N-R6, в другом предпочтительном варианте воплощения R4 означает метил, m означает 2 и Z означает >N-R6.
Даже более предпочтительными являются соединения формулы I, где R4означает метил, m означает 2 и Y означает >N-R6.
Примерами таких соединений являются следующие:
1-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1, 4]диазепан-2-он;
1-(4-{этил-[(S)-1-метил-2-(4-трифторметилфенил)этил]амино}бутил)[1,4]диазепан-2-он или
1-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-метил[1,4]диазепан-2-он.
Особенно предпочтительными являются также соединения формулы I, где R4 означает метил, m означает 2 и Z означает >N-R6.
Примерами таких соединений являются следующие:
4-(4-{аллил-[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1,4]диазепан-5-он;
4-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-он;
этиловый эфир 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо-[1,4]диазепан-1-карбоновой кислоты;
4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-он;
4-((S)-2-{[4-(7-оксо[1,4]диазепин-1-ил)бутил]пропиламино}пропил)фениловый эфир пропан-2-сульфоновой кислоты или
4-(4-{[(S)-2-(2,3-дигидро-1,4-бензодиоксин-6-ил)-1-метилэтил]пропиламино}бутил)-[1,4]диазепан-5-он.
В другом предпочтительном варианте воплощения R4 означает метил и один из X, Y или Z означает -О- или -S-.
Другие предпочтительные соединения по настоящему изобретению включают фармацевтически приемлемые соли соединений по настоящему изобретению, где фармацевтически приемлемые соли образуются из хлористоводородной кислоты, 2,2,2-трифторуксусной кислоты, дибензоил-L-винной кислоты, серной или фосфорной кислоты, более предпочтительны соли, образуемые из хлористоводородной кислоты, 2,2,2-трифторуксусной кислоты или фосфорной кислоты, или даже более предпочтительны соли, образуемые из хлористоводородной кислоты.
Соединения по настоящему изобретению могут быть получены способами, изображенными на иллюстративных схемах реакций синтеза и описанных ниже.
Исходные материалы и реагенты, использованные при получении этих соединений, как правило, или получены от коммерческих поставщиков, таких, как Aldrich Chemical Co., или синтезированы способами, известными специалистам в этой области, в соответствии с методиками, представленными в ссылках, таких, как Fieser и Fieser (1991) Reagents or Organic Synthesis: Wiley & Sons: New York, тома 1-15; Rodd (1989) Chemistry of Carbon Compounds, Elsevier Science Publishers, тома 1-5 и Supplementals, и (1991) Organic Reactions, Wiley & Sons: New York, тома 1-40. Последующие схемы реакций синтеза являются всего лишь иллюстрацией некоторых способов, которыми могут быть синтезированы соединения по настоящему изобретению, и различные модификации этих схем синтеза могут быть проведены и будут предложены специалистам со ссылкой на раскрытие сущности изобретения, содержащееся в данной заявке.
Исходные материалы и промежуточные соединения, приведенные на схемах синтеза, могут быть выделены и при необходимости очищены с применением обычных приемов, включающих, но без ограничения, фильтрацию, дистилляцию, кристаллизацию, хроматографию и тому подобное. Такие материалы могут быть охарактеризованы с применением обычных данных, включая физические константы и спектральные данные.
Если не указано иначе, реакции, описанные в контексте, предпочтительно проводят при атмосферном давлении при температуре в диапазоне от примерно -78° С до примерно 150° С, более предпочтительно 0-125° С и наиболее предпочтительно и удобно примерно при комнатной температуре (температуре окружающей среды), например около 20° С.
В основном, соединения формулы I могут быть получены способами, описанными на следующих схемах реакций.
Схема А
Схема А, в основном, описывает способ получения соединения формулы I, где X, Y, Z, R1, R2, R3, R4, R5, m и n имеют значения, описанные ранее.
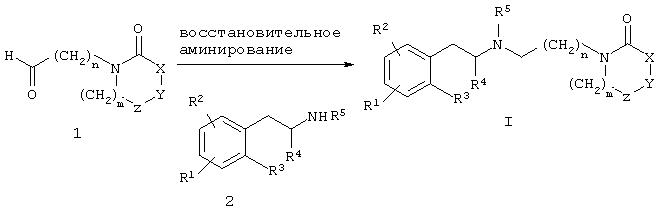
Соединение формулы I, как правило, может быть получено конденсацией карбоксальдегида 1 с фенилалкиламином 2 в условиях восстановительного аминирования. Соответствующие условия восстановления включают применение тетраацетоксиборгидрида натрия, цианборгидрида натрия, изопропоксида титана и цианборгидрида натрия, водорода и металлического катализатора и переносящих водород агентов, таких, как циклогексен, муравьиная кислота и ее соли, цинка и хлористоводородной кислоты, муравьиной кислоты или диметилсульфидборана с последующей обработкой муравьиной кислотой.
Соответствующие инертные органические растворители для реакции включают дихлорметан, 1,2-дихлорэтан, тетрагидрофуран, спирты или этилацетат и тому подобное. Предпочтительно реакцию проводят при основных условиях с триацетоксиборгидридом натрия в 1,2-дихлорэтане.
Методики восстановительного аминирования описаны в химической литературе. Например, J. Org. Chem. 1996, 61, 3849, и Tetrahedron Letters 1996, 37, 3977, описывают методики, использующие триацетоксиборгидрид натрия в качестве реагента для восстановительного аминирования альдегидов с применением большого разнообразия аминов. Например, J. Am. Chem. Soc. 1971, 93, 2897, и Org. Synth. Coil. 1988, 6, 499, описывают методики, использующие цианборгидрид натрия в качестве реагента для восстановительного аминирования карбонильных соединений.
Общеизвестные исходные материалы схемы А являются коммерчески доступными или известными специалистам в этой области, или могут быть легко синтезированы ими, как показано на следующих схемах реакций (1), (2) и (3).
Схема (1)

Карбоксальдегид 1, где X, Y, Z, m и n имеют определенные выше значения, может быть получен взаимодействием амидогруппы соединения а с алкилирующим агентом формулы L(СН2)n СН=СН2, где L означает уходящую группу, такую, как галоид или метансульфонилокси, предпочтительно хлор, при основных условиях, чтобы получить соединение b. Реакция алкилирования сопровождается окислением/расщеплением концевой алкеновой группы соединения b в альдегидную группу с целью получения карбоксальдегида 1. Разнообразные окисляющие агенты, применяемые для окисления/расщепления алкенов в альдегиды, описаны в химической литературе. Например, J. Org. Chem. 1956, 21, 478, описывает способы, использующие тетраоксид осмия и (мета)периодат натрия; Syn. Comm. 1982, 12, 1063, описывает способы, использующие перманганат калия и (мета)периодат натрия; J. Org. Chem. 1987, 52, 3698, описывает способы, использующие перманганат калия и силикагель; Chem. Rev. 1958, 58, 925, описывает способы, использующие озон; J. Org. Chem. 1986, 51, 3213, описывает способы, использующие только перманганат калия; J. Org. Chem. 1987, 52, 2875, описывает способы, использующие (мета)периодат натрия и каталитический рутений. Предпочтительно реакцию проводят с тетраоксидом осмия и (мета)периодатом натрия или озоном.
Схема (2)
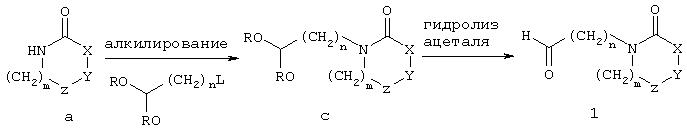
Альтернативно карбоксальдегид 1, где X, Y, Z, m и n имеют значения, описанные выше, может быть получен взаимодействием свободной аминогруппы соединения а с алкилирующим агентом формулы L(CH2)nC(OR)2, где R означает (С1-С6)алкил и L означает уходящую группу, такую, как галоид, предпочтительно бром, чтобы получить соединение с. Реакция алкилирования сопровождается гидролизом ацетальной группы соединения с в кислых условиях, чтобы получить карбоксальдегид 1.
Схема (3)
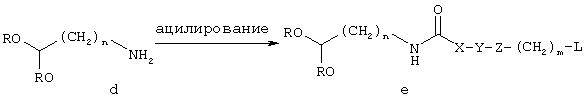

Альтернативно карбоксальдегид 1, где X, Y, Z, m и n имеют значения, описанные в кратком содержании изобретения, может быть получен взаимодействием аминоацеталя d, где R означает (С1-С6)алкил, с соответствующим ацилирующим агентом, таким, как ацилирующий агент формулы L(CH2)nCOL', или L(CH2)nОСОL', или L(CH2)nN=C=O, где в каждом случае L' означает уходящую группу, такую, как галоид, предпочтительно хлор, чтобы получить соединение е. Реакция ацилирования сопровождается внутренним N-алкилированием соединения е и последующим гидролизом ацетальной группы соединения f, чтобы получить карбоксальдегид 1.
Например, исходный фенилалкиламин 2 может быть также легко синтезирован, как показано на следующих схемах реакций (4), (5) и (6).
Схема 4

Фенилалкиламин 2, где R1, R2, R3, R4 и R5 имеют описанные выше значения, может быть получен взаимодействием бензальдегида g, c нитроалканом в условиях реакции Кновенагеля или Генри для получения соединения h, затем восстановлением нитрогруппы в аминогруппу и восстановлением алкеновой связи соединения h для получения соединения i. Фенилалкиламин 2 может быть получен последующей реакцией свободной аминогруппы соединения i с альдегидом RCHO в условиях восстановительного аминирования или с ацилирующим агентом RCOL, затем восстановлением (R означает (С1-С6)алкильную группу, где CH2R означает R3), или с алкилирующим агентом R5L, где L означает уходящую группу, такую, как галоид.
Схема 5
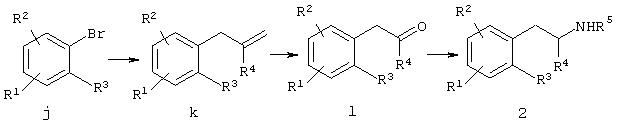
Альтернативно фенилалкиламин 2, где R1, R2, R3, R4 и R5 имеют значения, описанные в кратком содержании изобретения, может быть получен взаимодействием бромбензола j c металлическим магнием и алкенилгалоидом для получения соединения k, затем озонолизом соединения k для получения соединения 1. Фенилалкиламин 2 может быть получен последующей обработкой соединения 1 с первичным амином формулы R5NH2 в условиях восстановительного аминирования. Различные способы синтеза фенилалкиламина 2 описаны в химической литературе, например J. Med. Chem. 1973, 6, 480-483; J. Med. Chem. 1986, 29, 2009-2015, и J. Med Chem. 1991, 34, 1662-1669.
Схема (6)
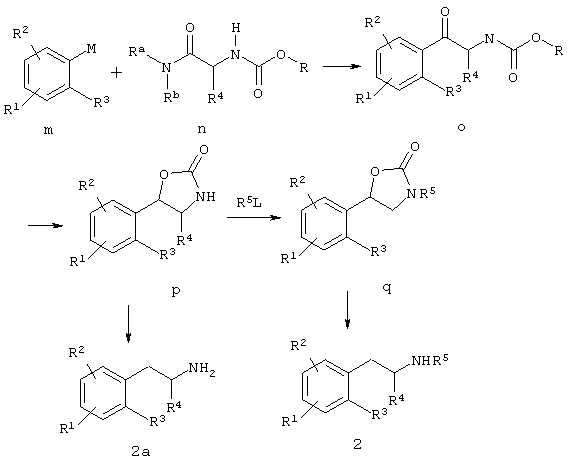
Альтернативно фенилалкиламин 2, где R1, R2, R3, R4 и R5 имеют значения, описанные ранее, может быть получен взаимодействием соединения общей структуры n, где R означает алкил, арил или алкиларил, более предпочтительно R означает бензил, и Ra и Rb означают алкил или алкокси или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют цикл, более предпочтительно Ra и Rb образуют морфолиновый цикл, с производным арилметалла, более предпочтительно арильным реагентом Гриньяра общей структуры m, для получения сложного эфира карбаминовой кислоты общей структуры о, где R означает алкил, арил или алкиларил, более предпочтительно R означает бензил. Восстановление слабым восстанавливающим агентом, таким, как боргидрид натрия или лития или боран, предпочтительно боргидридом натрия, сопровождающееся обработкой основанием, таким, как гидроксид калия или трет-бутилат калия, дает оксазолидин-2-он p. Оксазолидинон p можно алкилировать с помощью алкила, замещенного уходящей группой, предпочтительно алкилгалоидом, получая N-алкилоксазолидинон q. Расщепление оксазолидинонового цикла соединений р или q может быть достигнуто гидрогенолизом, например, с солью муравьиной кислоты, предпочтительно с формиатом аммония и палладием на угле, чтобы получить соответствующие хиральные амфетамины формулы 2 или формулы 2а.
Схема Б
Схема Б описывает, в частности, способ получения соединения формулы I, где X, Y и Z означают каждый -СН2- и R1, R2, R3, R4, R5, m и n имеют значения, определенные ранее.
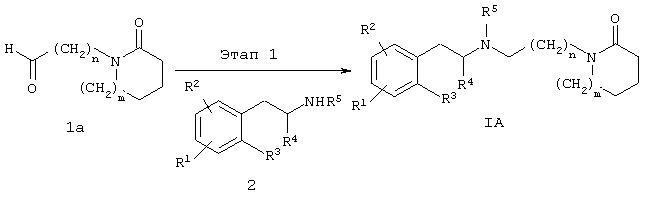
Соединение формулы IA может быть получено по реакции, описанной на схеме Б. Предпочтительно соединение формулы IA может быть получено взаимодействием карбоксальдегида la, с фенилалкиламином 2 в условиях восстановительного аминирования, как описано на схеме Б.
Типичные способы получения соединений формулы IA приведены в примере 1.
Схема В
Схема В описывает, в частности, способ получения соединения формулы I, где Х означает >NR6, -О- или -S-; Y и Z означают каждый –СН2- и R1, R2, R3 , R4, R5, m и n имеют значения, определенные ранее.
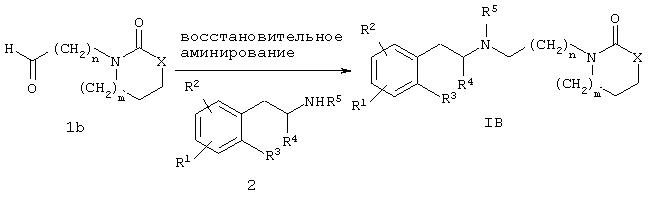
Соединение формулы IB может быть получено по реакции, описанной на схеме В. Предпочтительно соединение формулы IB может быть получено взаимодействием карбоксальдегида 1b с фенилалкиламином 2 в условиях восстановительного аминирования, как описано на схеме В.
Типичные способы получения соединений формулы IB приведены в примере 2.
Схема Г
Схема Г описывает, в частности, способ получения соединения формулы I, где Х и Z означают каждый -СН2-; Y означает >N-R6, -О- или -S- и R1, R2, R3, R4, R5, R6, m и n имеют описанные ранее значения.
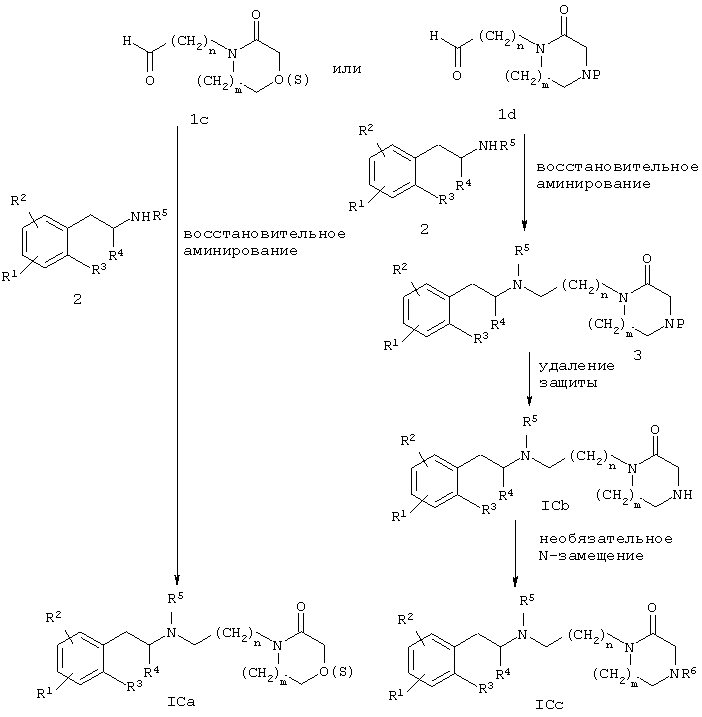
Соединения формулы ICa, ICb или ICc могут быть получены путем реакций, описанных на схеме Г.
Соединение формулы ICa, где Y означает -О- или -S-, предпочтительно может быть получено взаимодействием карбоксальдегида 1с с фенилалкиламином 2 в условиях восстановительного аминирования, как описано на схеме Г.
Альтернативно соединение формулы 1Сс, где Y означает >N-R6, может также быть получено конденсацией защищенного по азоту карбоксальдегида 1d, где Р означает соответствующую N-защитную группу, с фенилалкиламином 2 в условиях восстановительного аминирования, как описано на схеме А. Данная реакция сопровождается удалением N-защитной группы соединения 3 в кислых условиях с целью получения соединения формулы ICb, где Y означает >NH. Затем соединение формулы ICb может далее реагировать с соответствующим алкилирующим агентом или сульфонилирующим агентом по методикам, известным специалистам в этой области, чтобы получить соединение формулы IСс, где R6 не означает Н.
Иллюстративные способы получения соединения формулы ICa, ICb или IСс приведены в примерах 3, 4 и 5.
Схема Д
Схема Д описывает, в частности, способ получения соединения формулы I, где Х и Y означают каждый -СН2-; Z означает >N-R6, -О- или -S- и R1, R2, R3, R4, R5, R6, m и n имеют значения, описанные выше.
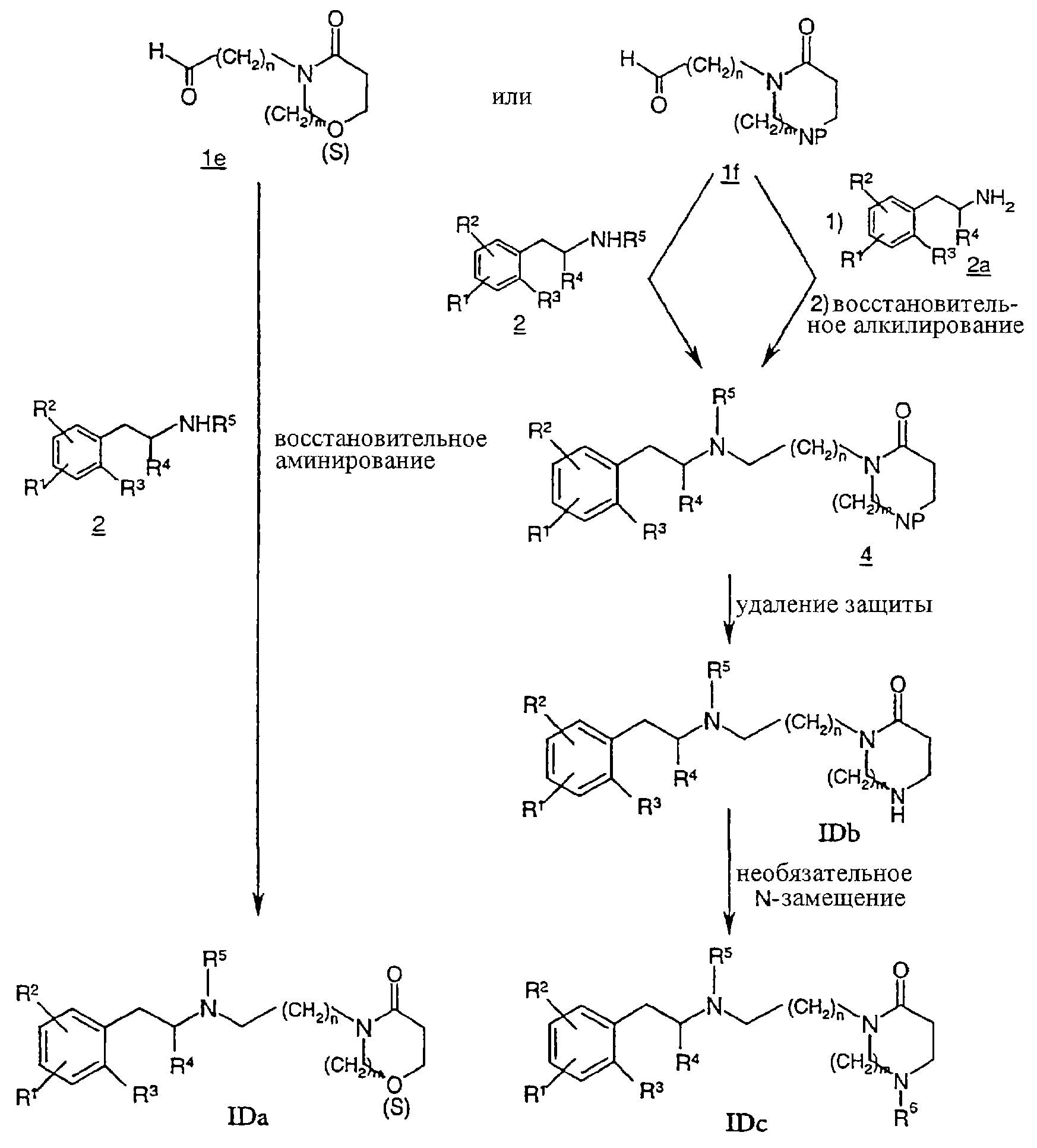
Соединение формулы IDa, IDb или IDc может быть получено путем реакций, описанных на схеме Д.
Предпочтительно соединение формулы IDa, где Z означает -О- или -S-, может быть получено взаимодействием карбоксальдегида 1e в условиях восстановительного аминирования, как описано на схеме Д.
Альтернативно соединение формулы IDc, где Z означает >N-R6, может быть получено конденсацией N-защищенного карбоксальдегида 1f, где Р означает соответствующую аминозащитную группу, с фенилалкиламином 2 в условиях восстановительного аминирования, как описано на схеме Д. Альтернативно соединение 4 может быть получено из N-защищенного карбоксальдегида If конденсацией с фенилалкиламином 2а, сопровождаемой восстановительным алкилированием.
Удаление N-защитной группы в соединении 4 в кислых условиях может дать соединение формулы IDb, где Z означает >NH. Затем необязательно соединение формулы IDb может далее реагировать с соответствующим алкилирующим агентом, ацилирующим агентом или сульфонилирующим агентом по методикам, известным специалистам, с целью получения соединения формулы IDc, где R6 не означает Н.
Иллюстративно способы получения соединения формулы IDa, IDb или IDc приведены в примерах 6, 7 и 8.
Схема Е
Схема Е описывает, в частности, альтернативный способ получения соединения формулы I, где X, Y, Z, R1, R2, R3, R4, R5, m и n имеют значения, определенные выше.

Соединение формулы I может быть получено с помощью реакций, описанных на схеме Е. Альтернативно соединение формулы I может быть получено алкилированием соответствующим образом защищенного оксазолидинона p соединением общей формулы r, где L означает уходящую группу, предпочтительно галоид, давая N-алкилированный оксазолидинон 5. Если X, Y или Z означают N, то вторичная аминогруппа соединения r будет защищена по методике, известной специалистам, как описано выше. Эта реакция сопровождается расщеплением оксазолидинонового цикла в условиях гидрогенолиза, например, с солью муравьиной кислоты в присутствии гидроксида палладия, давая промежуточный амин 6. Алкилирование вторичного амина в цепочке соединения формулы 6 соответствующим альдегидом в условиях восстановительного аминирования, как описано на схеме Е, или соответствующим алкилгалоидом дает требуемый продукт формулы I. Если X, Y или Z означают N, то N-защитная группа может быть удалена в кислых условиях.
Иллюстративная методика получения соединения формулы I по способу, приведенному на схеме Е, дана в примере 9.
Соединения по данному изобретению являются антагонистами мускариновых рецепторов. Соединения, которые действуют как антагонисты мускариновых рецепторов, применяются для лечения некоторых болезненных состояний, ассоциированных с ненадлежащей функцией гладких мышц. До недавнего времени большинство этих соединений не обладало селективностью по отношению к различным подтипам мускариновых рецепторов, приводя к неприятным антихолинергическим побочным эффектам, таким, как ксеростомия, запор, неясность зрения или тахикардия, из которых наиболее часто встречающимся является ксеростомия, возникающая при блокаде рецептора в слюнной железе. Показано, что созданные недавно специфические антагонисты М2 или М3 обладают сниженными побочными эффектами. Данные позволяют предположить, что конкурентная блокада рецепторов М2 и М3 могла бы оказаться терапевтически эффективной в лечении болезненных состояний, ассоциированных с нарушениями гладких мышц, такими, как нарушения мочеполового тракта, нарушения дыхательных путей, нарушения желудочно-кишечного тракта и нарушения гладкой мускулатуры.
Нарушения мочеполового тракта, подвергаемые лечению соединениями по данному изобретению, включают, в частности, повышенную активность мочевого пузыря или гиперфункцию детрузора и их симптомы, такие, как изменения, проявляющиеся в виде симптомов безотлагательной необходимости, частоты мочеиспускания, пониженной емкости мочевого пузыря, приступы недержания и тому подобное; изменения уродинамики, проявляющиеся как изменения емкости мочевого пузыря, порог мочеиспускания, нестабильные сокращения мочевого пузыря, спастичность сфинктера и тому подобное, и симптомы, обычно проявляющиеся как гиперрефлексия детрузора (неврогенный мочевой пузырь), при состояниях, таких, как обструкция выпускного отверстия, недостаточность выпускного отверстия, повышенная тазовая чувствительность, или идиопатические состояния, такие, как нестабильность детрузора и тому подобное.
Нарушения желудочно-кишечного тракта, подвергаемые лечению соединениями по данному изобретению, в частности, включают синдром раздраженной толстой кишки, дивертикулярную болезнь, ахалазию, желудочно-кишечную гиперкинезию и диарею. Нарушения дыхательных путей, подвергаемые лечению соединениями по данному изобретению, включают, в частности, хроническое обструктивное легочное заболевание, астму и легочный фиброз.
Эти и другие варианты терапевтического применения описаны, например, Goodman & Gilman (1996). The Pharmacological Basis of Therapeutics, девятое издание, McGraw-Hill, New York, глава 26, 601-616, и Coleman R.A. (1994). Pharmacological Reviews, 46, 205-229.
Сродство исследуемых соединений к мускариновым рецепторам можно идентифицировать с помощью анализа связывания рецептора in vitro, в котором используется препарат клеточной мембраны из клеток яичника китайского хомяка, экспрессирующих рекомбинантные человеческие мускариновые рецепторы (М1-М5), и который более подробно описан в примере 17.
Свойства исследуемых соединений в качестве мускариновых антагонистов можно идентифицировать с помощью анализа in vivo, в котором определяется ингибиторная активность в отношении мускаринового рецептора, опосредованная секрецией слюны у крыс под наркозом, и который более подробно описан на модели индуцированного оксотреморином/пилокарпином (OIS/PIS) слюноотделения у крыс под наркозом, пример 18.
Свойства исследуемых соединений в качестве мускариновых антагонистов можно идентифицировать с помощью анализа in vivo, в котором определяется ингибиторная активность в отношении мускаринового рецептора, опосредованная сокращением мочевого пузыря у крыс под наркозом, и который более подробно описан в анализе подавления сокращений мочевого пузыря, индуцированных его объемом, пример 19.
Свойства исследуемых соединений в качестве мускариновых антагонистов можно идентифицировать с помощью анализа in vivo, в котором определяется ингибиторная активность в отношении мускаринового рецептора, опосредованная сокращением мочевого пузыря и секрецией слюны у собак под наркозом, и который более подробно описан в примере 20.
Настоящее изобретение включает фармацевтические композиции, содержащие, по меньшей мере, одно соединение по настоящему изобретению или пролекарство, индивидуальный изомер, рацемическую или нерацемическую смесь мезомеров, или фармацевтически приемлемую соль, или его сольват наряду, по меньшей мере, с одним фармацевтически приемлемым носителем и необязательно другие терапевтические и/или профилактические ингредиенты.
В основном, соединения по настоящему изобретению будут вводиться в терапевтически эффективном количестве любым из принятых способов введения для агентов, которые имеют подобные полезные свойства. Приемлемые диапазоны доз обычно составляют 1-500 мг в сутки, предпочтительно 1-100 мг в сутки и наиболее предпочтительно 1-30 мг в сутки, в зависимости от многочисленных факторов, таких, как тяжесть заболевания, подвергаемого лечению, возраст и относительное здоровье субъекта, эффективность применяемого соединения, путь и лекарственная форма для введения, показание, по которому предписано введение, и выбор и опыт лечащего врача. Любой из обычных специалистов в лечении таких заболеваний будет в состоянии определить терапевтически эффективное количество соединения по настоящему изобретению для определенного заболевания без излишнего экспериментирования и опираясь на собственные знания и раскрытие сущности данной заявки.
В общем, соединения по настоящему изобретению будут вводиться как лекарственные формы, включая те, которые применимы для перорального введения (включая щечное и подъязычное), ректального, назального, местного, легочного, вагинального или парентерального введения (включая внутримышечное, внутриартериальное, подоболочечное, подкожное и внутривенное), или в форме, пригодной для введения путем ингаляции или инсуффляции. Предпочтительным способом введения, как правило, является пероральный, использующий удобный суточный дозовый режим, который можно регулировать в соответствии с тяжестью недуга.
Соединение или соединения по настоящему изобретению вместе с одним или несколькими обычными вспомогательными агентами, носителями или разбавителями могут выпускаться в форме фармацевтических композиций или стандартных доз. Формы фармацевтических композиций и стандартных доз могут состоять из обычных ингредиентов в общеизвестных пропорциях, с дополнительными активными соединениями либо составными частями или без них, и стандартные дозированные формы могут содержать любое соответствующее эффективное количество активного ингредиента, соразмерное с предполагаемым суточным диапазоном доз, которые должны применяться. Фармацевтические композиции могут использоваться в виде твердых форм, таких, как таблетки или заполненные капсулы, полутвердые вещества, порошки, смеси с непрерывным высвобождением, или жидкостей, таких, как растворы, суспензии, эмульсии, эликсиры, или заполненных капсул для перорального применения, или в форме суппозиториев для ректального или вагинального введения, или в форме стерильного инъекционного раствора для парентерального применения. Смеси, содержащие примерно 1 мг активного ингредиента или, более широко, примерно от 0,01 до примерно 100 мг/таблетку, являются соответственно приемлемыми репрезентативными формами стандартных доз.
Соединения по настоящему изобретению могут быть разработаны в виде самых разнообразных дозированных форм для перорального введения. Фармацевтические композиции и дозированные формы могут содержать соединение или соединения по настоящему изобретению или их фармацевтически приемлемые соли в качестве активного компонента. Фармацевтически приемлемые носители могут быть или твердыми, или жидкими. Твердые формы препаратов включают порошки, таблетки, пилюли, капсулы, кахетки, суппозитории и диспергируемые гранулы. Твердым носителем может быть одно или несколько веществ, которые действуют также как разбавители, ароматизаторы, солюбилизаторы, смазки, суспендирующие агенты, связывающие вещества, консерванты, агенты для дезинтеграции таблеток или инкапсулирующий материал. В порошках носитель, как правило, является измельченным твердым веществом, которое находится в смеси с измельченным активным компонентом. В таблетках активный компонент, как правило, смешивают с носителем, обладающим необходимой связывающей способностью, в соответствующих соотношениях и прессуют до требуемой формы и размера. Порошки и таблетки предпочтительно содержат от примерно одного 1 до примерно 70% активного соединения. Соответствующие носители включают, но без ограничения, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, карбоксиметилцеллюлозу в натриевой форме, низкоплавкий воск, масло какао и тому подобное. Подразумевается, что термин “препарат” включает композицию активного соединения с таким инкапсулирующим материалом, как носитель, образующий капсулу, в которой активный компонент, с носителями или без, окружен носителем, который ассоциирован с ним. Подобным образом включаются в состав облатки и лепешки. Таблетки, порошки, капсулы, пилюли, облатки и лепешки могут быть в качестве твердых форм, пригодных для перорального введения.
Другие формы, пригодные для перорального введения, включают жидкие формы препаратов, содержащие эмульсии, сиропы, эликсиры, водные растворы, водные суспензии, или твердые формы препаратов, которые, как подразумевается, незадолго до применения должны быть превращены в жидкие формы препаратов. Эмульсии могут быть приготовлены в растворах, например в водных растворах пропиленгликоля, или могут содержать эмульгаторы, например, такие, как лецитин, моноолеат сорбитана или гуммиарабик. Водные растворы могут быть приготовлены растворением активного компонента в воде и добавлением соответствующих красителей, ароматизаторов, стабилизирующих и загущающих агентов. Водные суспензии могут быть приготовлены путем диспергирования измельченного активного компонента в воде с вязким материалом, таким, как природные или синтетические камеди, смолы, метилцеллюлоза, карбоксиметилцеллюлоза в натриевой форме и другие хорошо известные суспендирующие агенты. Жидкие формы препаратов включают растворы, суспензии и эмульсии и в дополнение к активному компоненту могут содержать красители, ароматизаторы, стабилизаторы, буферы, искусственные и природные подсластители, диспергаторы, загустители, солюбилизирующие агенты и тому подобное.
Соединения по настоящему изобретению могут быть разработаны в форме для парентерального введения (например, путем инъекции, например, болюсным вливанием или непрерывной инфузией) и могут быть представлены в форме стандартных доз в ампулах, предварительно заполненных шприцах, контейнерах с малым инъекционным объемом или в многодозовых контейнерах с добавленным консервантом. Композиции могут иметь такую форму, как суспензии, растворы или эмульсии в масляных или водных наполнителях, например растворы в водном полиэтиленгликоле. Примеры масляных или неводных носителей, разбавителей, растворителей или наполнителей включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое масло) и инъецируемые органические сложные эфиры (например, этиловый эфир олеиновой кислоты) и могут содержать входящие в композицию агенты, такие, как консервирующие, увлажняющие, эмульгирующие или суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно активный ингредиент может быть в форме порошка, полученного асептическим выделением стерильного твердого вещества или лиофилизацией из раствора для состава перед применением с соответствующим наполнителем, например, со стерильной водой, не содержащей пирогенов.
Соединения по настоящему изобретению могут быть разработаны в форме для местного введения в эпидермис в качестве мазей, кремов или лосьонов, или в качестве трансдермальной бляшки. Мази и кремы могут быть разработаны, например, на водной или масляной основе с добавлением соответствующих загущающих и/или желирующих агентов. Лосьоны могут быть разработаны на водной или масляной основе и будут, в основном, также содержать один или несколько эмульгирующих агентов, стабилизирующих агентов, диспергирующих агентов, суспендирующих агентов, загущающих агентов или окрашивающих агентов. Составы, пригодные для местного введения в ротовую полость, включают лепешки, содержащие активные агенты на ароматизированной основе, обычно это сахароза и гуммиарабик или трагакант; пастилки, включающие активный ингредиент на инертной основе, такой, как желатин и глицерин или сахароза и гуммиарабик, и жидкости для промывания ротовой полости, включающие активный ингредиент и соответствующий жидкий носитель.
Соединения по настоящему изобретению могут быть разработаны в форме для введения в качестве суппозиториев. Низкоплавкий воск, такой, как смесь глицеридов жирных кислот или масло какао, сначала расплавляют и активный компонент гомогенно диспергируют, например, перемешиванием. Затем расплавленную гомогенную смесь выливают в формы подходящего размера, дают охладиться и затвердеть.
Соединения по настоящему изобретению могут быть разработаны в форме для назального введения. Растворы или суспензии применяют непосредственно в полости носа с помощью общепринятых средств, например капельницы, пипетки или распылителя. Составы могут быть предусмотрены в форме одной дозы или множества доз. В последнем случае это может быть достигнуто путем введения пациенту из капельницы или пипетки соответствующего, заранее обусловленного объема раствора или суспензии. В случае распылителя это может быть достигнуто, например, посредством измерительного распыляющего впрыскивающего насоса.
Соединения по настоящему изобретению могут быть разработаны в форме для аэрозольного введения, особенно в дыхательный тракт, включая интраназальное введение. Соединение, как правило, будет состоять из частиц малого размера, например, порядка 5 микрон или менее. Частица такого размера может быть получена способами, известными специалистам, например тонким измельчением. Активный ингредиент снабжают герметизированной упаковкой с соответствующим газом-вытеснителем, таким, как хлорфторуглерод (CFC), например, дихлордифторметан, трихлорфторметан или дихлортетрафторэтан, или диоксид углерода или другой соответствующий газ. Обычно аэрозоль может содержать также поверхностно-активное вещество, такое, как лецитин. Дозу лекарства можно контролировать с помощью измерительного клапана. Альтернативно активные ингредиенты могут разрабатываться в форме сухого порошка, например, смеси порошка соединения с соответствующей порошковой основой, такой, как лактоза, крахмал, производные крахмала, такие, как гидроксипропилметилцеллюлоза и поливинилпирролидоп (PVP). Порошковый носитель в назальной полости будет образовывать гель. Композиция в виде порошка может быть представлена в форме стандартной дозы, например, в капсулах или картриджах, например, из желатина, или в блистерных упаковках, из которых порошок может быть введен посредством ингалятора.
Соединения по настоящему изобретению могут быть разработаны в форме трансдермальных или подкожных средств доставки препарата. Эти системы доставки являются полезными, когда необходимо непрерывное высвобождение соединения и когда соблюдение пациентом режима и схемы лечения является решающим. Соединения в трансдермальных системах доставки часто прикрепляются к прилипаемой к коже твердой подложке. Соединение, представляющее интерес, можно также объединять с усилителем проницаемости, например с азоном (1-додецилазациклогептан-2-оном). Системы доставки с непрерывным высвобождением вводят в подкожный слой с помощью хирургической операции или инъекции. Подкожные имплантаты инкапсулируют соединение в липидную растворимую мембрану, например силиконовый каучук, или в биодеградируемый полимер, например в полиуксусную кислоту.
Фармацевтические препараты преимущественно изготавливают в стандартных дозированных формах. В такой форме препарат подразделяют на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная дозированная форма может быть упакованным препаратом, упаковкой, содержащей раздельные количества препарата, такой, как пачки таблеток, капсул и порошков во флаконах или в ампулах. Кроме того, стандартная дозированная форма сама может быть капсулой, таблеткой, облаткой или лепешкой или может быть соответствующим количеством любой их них в упакованном виде.
Другие соответствующие фармацевтические носители и их составы описаны Remington, The Science and Practice of Pharmacy, 1995, редактор E. W. Martin, Mack Publishing Company, 19-oe издание, Easton, Pennsylvania. Репрезентативные фармацевтические составы, содержащие соединение по настоящему изобретению, описаны в примерах 10-16.
Следующие препараты и примеры даны, чтобы облегчить специалистам более четкое понимание и применение на практике настоящего изобретения. Они должны рассматриваться не как ограничивающие объем изобретения, а просто как иллюстрирующие и представляющие его сущность.
Примеры
Опыт 1 (получение соединения формулы 1)
4-(2-Оксоазокан-1-ил)масляный альдегид
К перемешиваемой суспензии гидрида натрия (0,9 г, 37,5 ммоля) в диметилформамиде (50 мл) прибавляли азокан-2-он (3,83 г, 30 ммолей). Смесь перемешивали при комнатной температуре в течение 15 мин, затем медленно прибавляли 5-бром-1-пентен (5,03 г, 33,7 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем при 80° С в течение 16 ч. Растворитель удаляли при пониженном давлении и к остатку прибавляли воду. Смесь экстрагировали этиловым эфиром, органическую фазу промывали водой, сушили (сульфатом магния) и концентрировали, получая 1-пент-4-енилазокан-2-он (5,53 г) в виде масла.
Тетраоксид осмия (17 мг, 0,07 ммоля) прибавляли к 1-пент-4-енилазокан-2-ону (5,52 г, 28,3 ммоля) в смеси тетрагидрофурана (100 мл) и воды (50 мл) при охлаждении в водяной бане с температурой окружающей среды. Смесь перемешивали в течение 5 мин и прибавляли порциями твердый периодат натрия (15,11 г, 70,65 ммоля) в течение 15 мин. Реакционную смесь перемешивали в течение 3 ч и фильтровали. Фильтрат концентрировали, насыщали твердым хлоридом натрия и экстрагировали метиленхлоридом. Органическую фазу сушили (сульфатом магния) и концентрировали. Очистка хроматографией на силикагеле, элюирование хлороформом, дала 4-(2-оксоазокан-1-ил)масляный альдегид (4,72 г).
Подобным образом, следуя описанной выше методике, но необязательно заменяя азокан-2-он другими соответствующими соединениями формулы а и необязательно заменяя 5-бром-1-пентен другими соответствующими алкилирующими агентами формулы L(СН2)nСН=СН2, где L означает уходящую группу, такую, как галоид, и используя известные специалистам модификации, получали дополнительные соединения формулы 1: 4-(5-оксо[1,4]оксазепан-4-ил)масляный альдегид и трет-бутиловый эфир 5-оксо-4-(4-оксобутил)[1,4]диазепан-1-карбоновой кислоты.
Опыт 2 (альтернативное получение соединения формулы 1)
трет-Бутиловый эфир 5-оксо-4-(4-оксобутил)[1,4]диазепан-1-карбоновой кислоты
К суспензии 60% гидрида натрия в минеральном масле (0,2 г, 5 ммолей) в N,N-диметилформамиде (6 мл) прибавляли трет-бутиловый эфир 5-оксо[1,4]диазепан-1-карбоновой кислоты (1,0 г, 4,67 ммоля). Реакционную смесь нагревали при 50° С в течение 5 мин и затем при комнатной температуре в течение 15 мин. К полученному раствору прибавляли диметилацеталь 4-броммасляного альдегида (0,99 г, 5 ммолей). После перемешивания реакционной смеси при комнатной температуре в течение 16 ч растворитель удаляли и остаток распределяли между водой и этилацетатом. Органическую фазу промывали водой, сушили (сульфатом магния) и концентрировали. Остаток растворяли в диэтиловом эфире, суспензию фильтровали и фильтрат концентрировали. Очистка хроматографией на силикагеле при элюировании 2% метанолом в хлороформе дала трет-бутиловый эфир 4-(4, 4-диметоксибутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты (0,8 г) в виде густого сиропа.
1Н-ЯМР (CDCl3, δ , м.д.): 1,49, с, 9Н; 2,64, м, 3Н; 3,32, с 3Н; 4,37, м, 1Н.
Раствор трет-бутилового эфира 4-(4,4-диметоксибутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты (3 г, 9,08 ммоля) в ледяной уксусной кислоте, содержащей 0,5 мл воды (10 мл), перемешивали при комнатной температуре в течение 24 ч. Раствор концентрировали при 35° С при пониженном давлении и остаток распределяли между насыщенным водным раствором бикарбоната натрия и диэтиловым эфиром. Органическую фазу сушили (сульфатом магния), концентрировали и остаток перекристаллизовывали из смеси диэтиловый эфир/гексан, получая трет-бутиловый эфир 5-оксо-4-(4-оксобутил)[1,4]диазепан-1-карбоновой кислоты (0,85 г), tпл 86-87° С.
Опыт 3 (альтернативное получение соединения формулы 1)
(2-Оксопиперидин-1-ил)масляный альдегид
К перемешиваемой смеси диметилацеталя аминоацетальдегида (0,74 г, 7 ммолей) в этилацетате (20 мл) и 2 М карбонате натрия (20 мл) прибавляли хлорангидрид 5-хлорвалерьяновой кислоты (1,55 г, 10 ммолей). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Водный слой отделяли и экстрагировали этилацетатом. Объединенную органическую фазу промывали 1% хлористоводородной кислотой и водой, сушили (сульфатом магния) и концентрировали. Маслянистый остаток растворяли в тетрагидрофуране и прибавляли гидрид натрия (60% в масле) (0,3 г, 7,5 ммоля). Реакционную смесь нагревали при кипении в течение 1,5 ч и фильтровали. Фильтрат концентрировали, получая 1-(2,2-диметоксиэтил)пиперидин-2-он (1,06 г) в виде бледно-желтого масла.
Смесь 1-(2,2-диметоксиэтил)пиперидин-2-она (1,06 г, 5,67 ммоля) в 5% водном тетрагидрофуране (20 мл) нагревали при кипении в течение 1 ч. Смесь сушили над безводным сульфатом магния, фильтровали и концентрировали, получая (2-оксопиперидин-1-ил)ацетальдегид (0,69 г) в виде бледно-желтого масла.
4-(2-Оксо[1,3]оксазокан-3-ил)масляный альдегид
К охлажденному льдом 1,93 М раствору фосгена в толуоле (31 мл, 60 ммолей) прибавляли по каплям раствор 5-хлор-1-пентанола (4,9 г, 40 ммолей) и N,N-диэтиланилин (5,97 г, 40 ммолей) в толуоле (40 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 4 ч. Смесь фильтровали, фильтрат концентрировали. Остаток обрабатывали этилацетатом, фильтровали и раствор прибавляли по каплям к охлажденному льдом раствору диэтилацеталя 4-аминомасляного альдегида (7,09 г, 44 ммоля) и триэтиламина (4,45 г, 44 ммоля) в этилацетате (60 мл). Реакционную смесь перемешивали при комнатной температуре в течение 15 ч, фильтровали и концентрировали. Очистка хроматографией на силикагеле при элюировании 10% этилацетатом в гексане дала 5-хлорпентиловый эфир (4, 4-диэтоксибутил)карбаминовой кислоты (11,4 г) в виде масла.
К раствору 5-хлорпентилового эфира (4,4-диэтоксибутил)карбаминовой кислоты (11,4 г, 44 ммоля) в N,N-диметилформамиде (100 мл) прибавляли освобожденный от масла гидрид натрия (1,01 г, 42,3 ммоля). Реакционную смесь перемешивали в течение 15 ч при комнатной температуре и затем при 70° С в течение 3 ч. Смесь разбавляли водой, прибавляли насыщенный водный раствор хлорида натрия и экстрагировали эфиром. Органическую фазу промывали водой, сушили (сульфатом магния) и концентрировали. Очистка хроматографией на силикагеле дала 3-(4,4-диэтоксибутил)[1,3]оксазокан-2-он (2,03 г) в виде вязкого масла.
Смесь 3-(4,4-диэтоксибутил)[1,3]оксазокан-2-она (2 г, 7,3 ммоля) и 1,5 г ионообменной смолы Dowex 50W2-200 в 3% водном растворе тетрагидрофурана (30 мл) нагревали при кипении в течение 24 ч. Смесь фильтровали, фильтрат концентрировали и растворяли в дихлорметане. Раствор сушили над сульфатом магния и концентрировали, получая 4-(2-оксо[1,3]оксазокан-3-ил)масляный альдегид (1,45 г) в виде вязкого затвердевающего масла.
3-(2-Оксотетрагидропиримидин-1-ил)пропионовый альдегид
К перемешиваемому и охлаждаемому льдом раствору диэтилацеталя 3-аминопропионового альдегида (5,88 г, 40 ммолей) в диэтиловом эфире (35 мл) прибавляли по каплям 3-хлорпропилизоцианат (4,78 г, 40 ммолей). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Смесь концентрировали и растворяли в N,N-диметилформамиде (40 мл). К этому раствору прибавляли освобожденный от масла гидрид натрия (0,96 г, 40 ммолей). Реакционную смесь перемешивали при 70° С в течение 18 ч, концентрировали, обрабатывали диэтиловым эфиром (40 мл) и фильтровали. Фильтрат концентрировали и очищали хроматографией на силикагеле при элюировании смесью гексан-этилацетат-метанол (10:9,7:0,3), получая 1-(3,3-диэтоксипропил)тетрагидропиримидин-2-он (9,05 г) в виде масла.
Смесь 1-(3,3-диэтоксипропил)тетрагидропиримидин-2-она (1 г, 4,35 ммоля) и ионообменной смолы Dowex 50W2-200 в 3% водном растворе тетрагидрофурана (30 мл) нагревали при кипении в течение 24 ч. Смесь фильтровали, фильтрат концентрировали и остаток растворяли в дихлорметане (30 мл), высушенном над сульфатом магния, и концентрировали, получая 3-(2-оксотетрагидропиримидин-1-ил)пропионовый альдегид (0,46 г).
Опыт 4 (получение соединения формулы 2)
(R1 и R3=H, R2=трет-бутил, R4=метил, R5=этил)
[(S)-2-(4-трет-Бутилфенил)-1-метилэтил]этиламин
Этап 1: бензиловый эфир [(S)-2-(4-трет-6утилфенил)-1-метил-2-оксоэтил]карбаминовой кислоты (о)
К суспензии 0,85 г (34,6 ммоля) магниевой стружки в 25 мл тетрагидрофурана прибавляли 5 мл раствора 5 г (28,8 ммоля) 1-бром-4-трет-бутилбензола в 25 мл тетрагидрофурана. Прибавляли один кристалл иода и 1,2-дибромэтан (0,3 мл), смесь нагревали до кипения, чтобы инициировать реакцию. Затем прибавляли по каплям остаток 1-бром-4-трет-бутилбензола и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Оставшемуся магнию давали осесть и надосадочную жидкость порциями прибавляли к охлажденной, заранее приготовленной смеси 8 г (27,4 ммоля) бензилового эфира ((S)-1-метил-2-морфолин-4-ил-2-оксоэтил)карбаминовой кислоты n в 30 мл тетрагидрофурана и 30 мл (60 ммолей) 2 М изопропилмагнийхлорида в диэтиловом эфире. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем эту смесь прибавляли к хорошо перемешиваемой смеси 100 мл 5% хлористоводородной кислоты и колотого льда. Смесь экстрагировали двумя порциями по 50 мл этилацетата. Органическую фазу промывали 25 мл насыщенного раствора хлорида натрия, сушили (сульфатом магния) и концентрировали при пониженном давлении. Бензиловый эфир [(S)-2-(4-трет-бутилфенил)-1-метил-2-оксоэтил]карбаминовой кислоты о выделяли в виде твердого вещества, 9,2 г, tпл 156-158° С.
Этап 2: (4S, 5S)-5-(4-трет-бутилфенил)-4-метилоксазолидин-2-он (р)
К раствору 9 г (26,5 ммоля) бензилового эфира [(S)-2-(4-трет-бутилфенил)-1-метил-2-оксоэтил]карбаминовой кислоты о в 40 мл толуола и 10 мл 2-пропанола прибавляли по каплям раствор 7 г (18,42 ммоля) боргидрида натрия в 2 мл воды, содержащей 1 каплю 50% раствора гидроксида натрия. Реакционную смесь перемешивали при комнатной температуре в течение 15 ч. Слои разделяли и органический слой промывали 25 мл 10% раствора гидроксида натрия. 2-Пропанол удаляли при пониженном давлении, оставшийся толуольный раствор нагревали при кипении в течение 1 ч. Растворитель удаляли при пониженном давлении. Остаток перекристаллизовывали из смеси диэтиловый эфир/гексан, получая (4S,5S)-5-(4-трет-бутилфенил)-4-метилоксазолидин-2-он p, 3g; tпл199-200° C.
Подобным образом, следуя описанной выше методике, получали следующие соединения:
(S)-5-(4-бензилоксифенил)-4-метилоксазолидин-2-он, tпл 138-139° С;
(S)-4-метил-5-(4-трифторметилфенил)оксазолидин-2-он, tпл 158-159° C, диэтиловый эфир/гексан;
(S)-5-(2, 3-дигидробензо[1,4]диоксин-6-ил)-4-метилоксазолидин-2-он,
М+Н=235, и
(S)-4-метил-5-(4-метилсульфанилфенил)оксазолидин-2-он, tпл 112-114° С.
Этап 3: (4S,5S)-5-(4-трет-бутилфенил)-4-метил-3-этилоксазолидин-2-он (q)
К раствору 1 г (4,3 ммоля) (4S,5S)-5-(4-трет-бутилфенил)-4-метилоксазолидин-2-она р в 10 мл N, N-диметилформамида прибавляли 5,2 мл (5,2 ммоля) 1 М трет-бутилата, калия в тетрагидрофуране. К полученному гелю прибавляли 4 мл (4,7 ммоля) иодэтана. Реакционную смесь нагревали при 70° С в течение 1 ч. Прибавляли холодную воду (25 мл) и смесь экстрагировали 30 мл этилацетата. Органическую фазу промывали двумя порциями по 10 мл воды, сушили (сульфатом магния) и концентрировали при пониженном давлении. (4S,5S)-5-(4-трет-Бутилфенил)-4-метил-3-этилоксазолидин-2-он q выделяли в виде твердого кристаллического вещества из смеси этилацетат/гексан, 1,06 г, М+Н=261.
Подобным образом, следуя описанной выше методике, получали следующее соединение:
(S)-5-(2,3-дигидробензо[1,4]диоксин-6-ил)-4-метил-3-пропилоксазолидин-2-он, М+Н-277.
Этап 4: (S)-2-(4-трет-бутилфенил)-1-метилэтил]этиламин
Смесь 1 г (3,83 ммоля) (4S,5S)-5-(4-трет-бутилфeнил)-4-мeтил-3-этилоксазолидин-2-она, 2 г (31,74 ммоля) формиата аммония и 1 г 10% палладия на угле в 20 мл метанола нагревали при кипении в течение 2 ч. Смесь фильтровали, фильтрат концентрировали при пониженном давлении и остаток распределяли между 10 мл насыщенного водного раствора карбоната натрия и 40 мл этилацетата. Органическую фазу сушили (сульфатом магния) и концентрировали при пониженном давлении. (S)-2-(4-трет-Бутилфенил)-1-метилэтил]этиламин выделяли в виде гидрохлорида из диэтилового эфира, 0,93 г, tпл169,4-171,0° C.
Опыт 5 (получение соединения формулы 2)
(R1, R3 и R5=H, R4=метил, R2=трет- бутил)
(S)-2-(4-трет-Бутилфенил)-1-метилэтиламин
Смесь 1 г (4,3 ммоля) (4S,5S)-5-(4-трет-бутилфенил)-4-метилоксазолидин-2-она р (смотри опыт 4, этап 2), 2 г (31,74 ммоля) формиата аммония и 0,1 г 10% палладия на угле в 25 мл метанола нагревали при кипении в течение 2 ч. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток распределяли между 10 мл 10% водного раствора карбоната натрия и 25 мл этилацетата. Органическую фазу сушили (сульфатом магния) и концентрировали при пониженном давлении. Заглавное соединение выделяли в виде гидрохлорида из диэтилового эфира, 0,93 г (95%), tпл 259,5-261,3° С.
Пример 1
(Получение соединения формулы IA, как описано на схеме Б)
1-(2-{Этил-[2-(4-метоксифенил)-1-метилэтил]амино}этил)азепан-2-он

Смесь [2-(4-метоксифенил)-1-метилэтил]этиламина (0,3 г, 2,75 ммоля), (2-оксоазепан-1-ил)ацетальдегида (0,5 г, 3,2 ммоля) и триацетоксиборгидрида натрия (0,88 г, 4,1 ммоля) в 1,2-дихлорэтане (15 мл) перемешивали при комнатной температуре в течение 60 ч. Смесь концентрировали и остаток распределяли между диэтиловым эфиром (50 мл) и насыщеннм водным раствором бикарбоната натрия (25 мл). Органический раствор экстрагировали 5% хлористоводородной кислотой (20 мл), водную кислую фазу промывали диэтиловым эфиром и доводили рН до 12 25% раствором гидроксида натрия. Смесь экстрагировали дихлорметаном, органическую фазу сушили (сульфатом натрия) и концентрировали, получая 1-(2-{этил-[2-(4-метоксифенил)-1-метилэтил]амино}этил)азепан-2-он 11 (0,84 г) в виде вязкого масла, которое превращали в соль дибензоил-L-винной кислоты.
Анализ: вычислено для С38Н46N2O10: С 66,07; Н 6,71; N 4,06%; найдено: С 64,69; Н 6,5; N 3,0%.
Подобным образом, следуя методике, описанной выше в примере 1, но необязательно заменяя (2-оксоазепан-1-ил)ацетальдегид соответствующими соединениями формулы 1а, необязательно заменяя [2-(4-метоксифенил)-1-метилэтил]этиламин другими соответствующими соединениями формулы 2а и используя модификации, известные специалистам в этой области, получали дополнительные соединения формулы I, где X, Y и Z означают каждый -СН2-:
дибензоил-L-тартрат 1-(2-{этил-[2-(4-метоксифенил)-1-метилэтил] амино}этил)пирролидин-2-она, 12, анализ: вычислено для C36H42N2O10: С 65,24; Н 6,39; N 4,23%; найдено: С 64,75; Н 6,08; N 3,97%;
дибензоил-L-тартрат 1-(4-{[2-(4-бром-2, 5-диметоксифенил)-1-метилэтил]этиламино}бутил)пиперидин-2-она 13, tпл 97-98° С, М+Н=455;
дибензоил-L-тартрат 1-(2-{этил[2-(4-метоксифенил)-1-метилэтил]амино}этил)пиперидин-2-она 14, анализ: вычислено для C37H44N2O10: С 65,67; Н 6,55; N 4.14%; найдено: С 64,86; Н 6, 23; N 3,92%;
дибензоил-L-тартрат 1-(3-{этил[2-(4-метоксифенил)-1-метилэтил]амино}пропил)пиперидин-2-она 15, анализ: вычислено для C38H46N2O10 ·0,5Н2O: С 65,22; Н 6,77; N 4,00%; найдено: С 65,37; Н 6,48; N 3,94%;
дибензоил-L-тapтpат 1-(2-{[2-(4-метоксифенил)-1-метилэтил]пропиламино}этил)пиперидин-2-она 16, анализ: вычислено для С38Н46N2O10: С 66,07; Н 6,71; N 4,06%; найдено: С 65,10; Н 6,29; N 3,71%;
дибензоил-L-тapтpат 1-(2-{этил[2-(4-фторфенил)-1-метилэтил]амино}этил)пиперидин-2-она 17, tпл 95-96° С, М+Н=307;
дибензоил-L-тapтpат 1-(2-{[2-(4-хлорфенил)-1-метилэтил]этиламино}этил)пиперидин-2-она 18, М+Н=323;
дибензоил-L-тapтpат 1-(2-{этил[2-(4-трифторметоксифенил)-1-метилэтил]амино}этил)пиперидин-2-она 19, анализ: вычислено для C37H41F3N2O10: С 60,82; Н 5,66; N 3,83%; найдено С 60,70; Н 5,46; N 3,56%;
дибензоил-L-тартрат 1-(4-{этил[2-(4-метоксифенил)-1-метилэтил]амино}бутил)пиперидин-2-она 20, анализ: вычислено для C39H48N2O10: С 66,46; Н 6,84; N 3,97%; найдено: С 66,29; Н 6, 69; N 4,04%;
дибензоил-L-тартрат 1-(2-{этил[2-(4-изобутоксифенил)-1-метилэтил]амино}этил)пиперидин-2-она 21, анализ: вычислено для C40H50N2O10: С 66,84; Н 7,01; N 3,90%; найдено: С 66,03; Н 6,76; N 3,74%;
дибензоил-L-тapтpат 1-(2-{[2-(3-феноксифенил)-1-метилэтил]пропиламино}этил)пиперидин-2-она 22, анализ: вычислено для C43H48N2O10: С 68,60; Н 6,43; N 3,72%; найдено: С 67,56; Н 6,23; N 3,48%;
дибензоил-L-тартрат 1-(2-(изобутил[2-(4-метоксифенил)-1-метилэтил]амино}этил)пиперидин-2-она 23, М+Н=347;
дибензоил-L-тapтpат 1-{2-[2-нафталин-2-ил)-1-метилэтил]пропиламино}этил)пиперидин-2-она 24, анализ: вычислено для C41H46N2O9: С 69,28; Н 6,52; N 3,94%; найдено: С 67,58; Н 6,16; N 3,48%;
гидрохлорид 1-(2-{[2-(6-метоксинафталин-2-ил)-1-метилэтил]пропиламино}этил)пиперидин-2-она 25, анализ: вычислено для С24Н35С1N2O9·0,4Н2O: С 67,63; Н 8,47; N 6,69%; найдено: С 67,42; Н 8,30; N 6,63%;
дибензоил-L-тартрат 1-(2-{[2-(4-хлорфенил)-1-метилэтил]пропиламино}этил)пиперидин-2-она 26, М+Н=377;
дибензоил-L-тартрат 1-(4-{[2-(4-хлорфенил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 27, М+Н=365;
дибензоил-L-тартрат 4-(2-{этил[2-(2-оксопиперидин-1-ил)этил]амино}пропил)фенилового эфира диэтилкарбаминовой кислоты 28, М+Н=404;
дибензоил-L-тартрат 4-(2-{этил[2-(2-оксопиперидин-1-ил)этил]амино}пропил)фенилового эфира диметилкарбаминовой кислоты 29, М+Н=321;
дибензоил-L-тартрат 4-(2-{этил[2-(2-оксопиперидин-1-ил)этил]амино}этил)фенилового эфира пропан-2-сульфоновой кислоты 30, М+Н=411;
дибензоил-L-тартрат 1-(2-{этил[2-(4-гидроксифенил)-1-метилэтил]амино}этил)пиперидин-2-она 31, М+Н=305;
дибензоил-L-тартрат 4-(2-{этил[2-(2-оксопиперидин-1-ил)этил]амино}пропил)фенилового эфира изопропилкарбаминовой кислоты 32, М+Н=390;
гидрохлорид 1-(4-{[2-(3-трифторметилфенил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 33, М+Н=399;
дибензоил-L-тартрат 1-(6-{этил[2-(4-метоксифенил)-1-метилэтил]амино)гексил)пиперидин-2-она 34, М+Н=375;
дибензоил-L-тартрат 1-(4-{[2-(3-хлорфенил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 35, анализ: вычислено для С39Н47ClN2O9·0,8Н2O: С 63,35; Н 6,65; N 3,79%; найдено: С 63,64; Н 6,65; N 3,79%;
дибензоил-L-тартрат 1-(4-{[2-(3-фторфенил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 36, М+Н=349;
дибензоил-L-тартрат 1-(4-{[2-(4-бромфенил)-1-метилэтил]этиламино}бутил)пиперидин-2-она 37, М+Н=395;
гидрохлорид 1-(5-{этил[2-(4-метоксифенил)-1-метилэтил]амино}пентил)пиперидин-2-она 38, М+Н=361;
гидрохлорид 1-{4-[2-нафталин-2-ил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 39, анализ: вычислено для С25Н37СlN2O,· 0,8Н2O: С 69,60; Н 9,02; N 6,49%; найдено: 69,69; Н 8,80; N 6,70%;
гидрохлорид 1-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 40, М+Н=387;
гидрохлорид 1-(4-{[2-(2,3-дигидробензо[1,4]диоксин-6-ил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 41, М+Н=389;
гидрохлорид 1-(4-{изопропил[2-(3-трифторметилфенил)-1-метилэтил]амино}бутил)пиперидин-2-она 42, М+Н=377;
гидрохлорид 1-(4-{[2-(2, 3-дигидробензофуран-5-ил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 43, М+Н=373;
гидрохлорид 1-(4-{[1-(4-хлорбензил)пропил]пропиламино}бутил)пиперидин-2-она 44, М+Н=379;
гидрохлорид 1-(4-{[1-(3-метокси-4-метилбензил)пропил]пропиламино}бутил)пиперидин-2-она 45, М+Н =389;
гидрохлорид N-[3-(2-{[4-(2-оксопиперидин-1-ил)бутил]пропиламино}пропил)фенил]метансульфонамида 46, М+Н=424;
гидрохлорид 1-{4-[(2-(1-бензопиран-6-ил-1-метилэтил)пропиламино]бутил}пиперидин-2-она 47, М+Н=387;
гидрохлорид 1-{4-[(2-бензо[1,3]диоксол-5-ил-1-метилэтил)этиламино]бутил}пиперидин-2-она 48, М+Н =361;
гидрохлорид 1-(4-{[2-(3-хлор-4-фторфенил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 49, М+Н=383;
гидрохлорид 1-(4-{[2-(4-метилсульфанилфенил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 50, М+Н=377;
гидрохлорид 1-(4-{изопропил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)пиперидин-2-она 51, М+Н=409;
гидрохлорид 1-(4-{[2-(1H-индол-5-ил)-1-метилэтил]изопропиламино}бутил)пиперидин-2-она 52, М+Н=370;
гидрохлорид 1-(4-{[2-(2,3-дигидробензо[1, 4]диоксин-6-ил)-1-метилэтил]изопропиламино}бутил)пиперидин-2-она 53, М+Н=389;
гидрохлорид 1-(4-{[2-(3,3-диметил-2, 3-дигидробензофуран-6-ил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 54, анализ: вычислено для C25H41ClN2O2: С 68,70; Н 9,45; N 6,41%; найдено: С 63,93; Н 9,16; N 6,34%;
гидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)пиперидин-2-она 55, анализ: вычислено для С22Н37СlН2O3S· 1,5Н2O: С 55,97; Н 8,54; N 5,93%; найдено: С 55,83; Н 8,21; N 6,70%;
2,2,2-трифторацетат 1-(4-{этил[2-(4-трифторметилсульфонилфенил)-1-метилэтил]амино}бутил)пиперидин-2-она 56, М+Н=449;
гидрохлорид 1-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]этиламино}бутил)пиперидин-2-она 57, анализ: вычислено для C24H41ClN2O· 0,65H2O: С 68,51; Н 10,13; N 6,66%; найдено: С 68,48; Н 9,92, N 6,85%;
фосфат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира пропан-2-сульфоновой кислоты 58, анализ: вычислено для C25H45N2O8PS· l,75H2O: С 47,05; Н 7,46; N 4,39%; найдено: С 46,96; Н 7,35; N 4,40%;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 4-метансульфонилбензолсульфоновой кислоты 59, М+Н=579;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира бензолсульфоновой кислоты 60, М+H=510;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 5-бензолсульфонилтиофен-2-сульфоновой кислоты 61, M+H=647;
2,2, 2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира бутан-1-сульфоновой кислоты 62, М+Н=481;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 4-хлорбензолсульфоновой кислоты 63, М+Н=535;
2,2, 2-трифторацетат4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 3,4-диметоксибензолсульфоновой кислоты 64, М+Н=561;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира этансульфоновой кислоты 65, М+Н=453;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира диметилсульфаминовой кисоты 66, М+Н=468;
2,2,2-трифторацетат 4-(2-{[2-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира метансульфоновой кислоты 67, М+Н=439;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 4-метоксибензолсульфоновой кислоты 68, М+Н=531;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира нафталин-1-сульфоновой кислоты 69, М+Н=551;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира нафталин-2-сульфоновой кислоты 70, М+Н=551;
2,2,2-трифторацетат 4-(2-{[2-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 4-нитробензолсульфоновой кислоты 71, M+H=546;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира пропан-1-сульфоновой кислоты 72, М+Н=467;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира тиофен-1-сульфоновой кислоты 73, М+Н=507;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира фенилметансульфоновой кислоты 74, М+Н=515;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 4-трифторметоксибензолсульфоновой кислоты 75, М+Н=585;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 4-цианобензолсульфоновой кислоты 76, М+Н=526;
2,2,2-трифторацетат 4-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира 1,1,1-трифторметансульфоновой кислоты 77, М+Н=493;
фосфат 4-(2-{[4-(2-оксоазепан-1-ил)этил]пропиламино}пропил)фенилового эфира пропан-2-сульфоновой кислоты 78, анализ: вычислено для C23H41N2O8PS: С 51,48; Н 7,70; N 5,22%; найдено: С 45,23; Н 7,12, N 9,45%;
гидрохлорид 4-метансульфонил-N-[3-(2-{[2-(2-оксоазепан-1-ил)этил]пропиламино}пропил)фенил]бензамида 79, анализ: вычислено для С28 Н40СlН3O4S· 0,7Н2O: С 59,76; Н 7,41; N 7,47%; найдено: С 59,71; Н 7,20; N 7,44%;
гидрохлорид 4-метил-N-[3-(2-{[2-(2-оксоазепан-1-ил)этил]пропиламино}пропил)фенил]бензамида 80, анализ: вычислено для С28Н40СlN3O2·0,7Н2O: С 67,44; Н 8,37; N 8,43%; найдено: С 67,32; Н 8,18; N 8,43%;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)азепан-2-она 81, tпл 78-79° C, М+Н=409;
гидрохлорид 1-(4-{[2-(4-этансульфонилфенил)-1-метилэтил]этиламино}бутил)азепан-2-она 82, М+Н=423;
гидрохлорид 1-(4-{этил[2-(4-изопропансульфонилфенил)-1-метилэтил]амино}бутил)азепан-2-она 83, М+Н=437;
4-трет-бутил-N-[3-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенил]бензамид 84, анализ: вычислено для C33H49N3O2: С 76,26; Н 9,50; N 8,08%; найдено: С 76,32; Н 9,39; N 8,19%;
гидрохлорид 1-(4-{[2-(3-бензолсульфонилфенил)-1-метилэтил]этиламино}бутил)азепан-2-она 85, М+Н=471;
гидрохлорид 1-(4-{[2-(3,3-диметил-1,1-диоксо-2, 3-дигидро-1H-1-бензо[b]тиофен-5-ил)-1-метилэтил]изопропиламино}бутил)азепан-2-она 86, анализ: вычислено для C26H37ClN2O3S: С 62,56; Н 8,68; N 5,61%; найдено: С 58,09; Н 8,16; N 5,26%;
гидрохлорид 1-(4-{[2-(4-бензолсульфонилфенил)-1-метилэтил]этиламино}бутил)азепан-2-она 87, М+Н=471;
гидрохлорид 1-(4-{этил[2-(4-(2-метилпропан-1-сульфонил)фенил)-1 -метилэтил]амино}бутил)азепан-2-она 88, М+Н=451;
гидрохлорид [2-метансульфонил-5-(2-{[4-(2-оксоазепан-1-ил)бутил]пропиламино}пропил)фенил]амида бензо[1,3]диоксол-5-карбоновой кислоты 89, анализ: вычислено для С31Н44СlN3ОбS· 1,9Н2О: С 56,72; Н 7,34; N 6,40%; найдено: С 56,79; Н 6,98; N 6,40%;
гидрохлорид 1-(4-{[2-(3,3-диоксо-2,3-дигидробензо[1, 3]оксатиол-5-ил)-1-метилэтил]этиламино}бутил)азепан-2-она 90, М+Н=423;
гидрохлорид 1-(4-{[2-(2,3-дигидробензо[1,3]оксатиол-5-ил)-1-метилэтил]изопропиламино}бутил)азепан-2-она 91, М+Н=405;
гидрохлорид 1-(4-{этил[2-(3-метансульфонилфенил)-1-метилэтил]амино}бутил)азепан-2-она 92, М+Н=409;
гидрохлорид 1-(4-{[2-(3,3-диоксо-2,3-дигидробензо[1, 3]оксатиол-5-ил)-1-метилэтил]изопропиламино}бутил)азепан-2-она 93, М+Н=437;
гидрохлорид 1-(4-{изопропил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)азепан-2-она 94, М+Н=423;
гидрохлорид 1-(4-{(1-этилпропил)[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)азепан-2-она 95, М+Н=451;
гидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)азепан-2-она 96, М+Н=423;
гидрохлорид 4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)-N,N-диметилбензолсульфонамида 97, М+Н=438;
гидрохлорид 1-(3-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}пропил)азепан-2-она 98, М+Н=409;
дигидрохлорид 1-[4-(этил{2-[4-(4-метилпиперазин-1-сульфонил)фенил]-1-метилэтил}амино)бутил]азепан-2-она 99, М+Н=493;
гидрохлорид 4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)-N-метилбензолсульфонамида 100, М+Н=424;
гидрохлорид 1-{4-[этил(1-метил-2-фенилэтил)амино]бутил}азепан-2-она 101, М+Н-331;
гидрохлорид 1-(4-{[2-(3-хлор-4-метансульфонилфенил)-1-метилэтил]этиламино}бутил)азепан-2-она 102, анализ: вычислено для С22Н36Сl2O3S· 1, 4Н2O: С 52,35; Н 7,75; N 5,55%; найдено: С 52,34; Н 7,36; N 5,65%;
гидрохлорид 4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)бензолсульфонамида 103, М+Н=410;
N-диметилэтил-4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)бензолсульфонамид 104, М+Н=466;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)азепан-2-она 105, М+Н=463;
гидрохлорид 1-(4-{этил[2-(4-трифторметилсульфанилфенил)-1-метилэтил]амино}бутил)азепан-2-она 106, М+Н=431;
гидрохлорид 1-(4-{этил[2-(4-нитрофенил)-1-метилэтил]амино}бутил)азепан-2-она 107, анализ: вычислено для С21Н34СlN3О3·0,7Н2O: С 59,41; Н 8,40; N 9,90%; найдено: С 59,48; Н 8,21; N 9,92%;
гидрохлорид 4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)фенилового эфира 1,1,1-трифторметансульфоновой кислоты 108, М+Н=479;
натриевая соль N-[4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)фенил]-1,1,1-трифторметансульфонамида 109, анализ: вычислено для C22H34F3N3NaO3S: С 55,33; Н 7,18, N 8,80%; найдено: С 51,96; Н 6,73;N 8,62%;
2,2,2-трифторацетат 1-(3-{этил[2-(4-трифторметилсульфонилфенил)-1-метилэтил]амино}пропил)азепан-2-она 110, М+Н=449;
2, 2,2-трифторацетат 1-(2-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}этил)азепан-2-она 111, М+Н=435;
гидрохлорид 1-[4-(этил{2-[4-(тиазол-2-сульфонил)фенил]-1-метилэтил}амино)бутил]азепан-2-она 112, анализ: вычислено для С24Н36СlN3О3S2· 1Н2O: С 54,17; Н 7,20; N 7,90%; найдено: С 54,09; Н 6,91; N 7,86%;
2,2,2-трифторацетат 4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)-N-изопропилбензолсульфонамида 113, М+Н=452;
2,2,2-трифторацетат 4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)-N-(2-гидроксиэтил)бензолсульфонамида 114, М+Н=454;
2,2,2-трифторацетат 4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)-N-(2-метоксиэтил)бензолсульфонамида 115, М+Н=468;
2,2,2-трифторацетат 1-[4-{этил(2-[4-(морфолин-4-сульфонил)фенил]-1-метилэтил}амино)бутил]азепан-2-она 116, М+Н=480;
2,2,2-трифторацетат 4-(2-{этил[4-(2-оксоазепан-1-ил)бутил]амино}пропил)-N-(2,2, 2-тpифтopэтил)бeнзoлcyльфoнaмидa 117, М+Н=492;
гидрохлорид 1-(4-{этил[2-(4-трет-бутилфенил)-1-метилэтил]амино)бутил)азепан-2-она 118, анализ: вычислено для C25H43 ClN2O· 0,45H2O: С 69,64; Н 8,53; N 5,55%; вычислено: С 57,12; Н 8,41; N 5,61%, или
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)азокан-2-она 119, анализ: вычислено для C23H39ClN2O3S· 2H2O: С 55,75; Н 8,14; N 5,65%; найдено: С 55,67; Н 8,52; N 5,43%.
Пример 2
(Получение соединения формулы IB, как описано на схеме В)
3-(4-{Этил[(S)-2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1,3]оксазинан-2-он

К суспензии гидрохлорида этил[(S)-2-(4-метилсульфанилфенил)-1-метилэтил]амина (0,25 г, 1 ммоль) в 1,2-дихлорэтане (10 мл) прибавляли триэтиламин (0,2 мл, 1,5 ммоля). К этой смеси прибавляли 4-(2-оксо[1,3]оксазинан-3-ил)масляный альдегид (0,18 г, 1,05 ммоля) и триацетоксиборгидрид натрия (0,32 г, 1,5 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 15 ч, концентрировали и остаток распределяли между 5% раствором гидроксида натрия (5 мл) и диэтиловым эфиром (20 мл). Органическую фазу сушили (сульфатом магния) и концентрировали, получая 3-(4-{этил[(S)-2-(4-метилсульфанилфенил)-1-метилэтил]амино}бутил)[1,3]оксазинан-2-он (0,33 г) в виде вязкого масла.
К охлажденному льдом раствору 3-(4-{этил[(S)-2-(4-метилсульфанилфенил)-1-метилэтил]амино}бутил)[1,3]оксазинан-2-она (0,33 г, 0,9 ммоля) в метаноле (10 мл) прибавляли раствор пероксимоносульфата калия (оксон® ) (1,22 г, 1,98 ммоля) в воде (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Затем прибавляли 1,5 М раствор карбоната натрия (10 мл) и смесь экстрагировали диэтиловым эфиром (20 мл). Органическую фазу сушили (сульфатом магния) и концентрировали. Остаток очищали хроматографией на силикагеле с 10% этилацетатом в хлороформе, получая 3-(4-{этил[(S)-2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1,3]оксазинан-2-он 122, (0,17 г) в виде бесцветного масла.
Анализ: вычислено для C20H33ClN2O4S: С 55,48; Н 7,68; N 6,47%; найдено: С 52,32; Н 7,42; N 5,97%.
Подобным образом, следуя методике, описанной выше в примере 2, но необязательно заменяя 4-(2-оксо[1, 3]оксазинан-3-ил)масляный альдегид другими соответствующими соединениями формулы 1b и необязательно заменяя гидрохлорид этил[(S)-2-(4-метилсульфанилфенил)-1-метилэтил]амина соответствующими соединениями формулы 2 и используя модификации, известные специалистам, получали дополнительные соединения формулы I, где Х означает -О- или -S-:
гидрохлорид 3-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1,3]оксазепан-2-она 123, анализ: вычислено для C21H35ClN2O4S: С 60,78; Н 8,50; N 6,75%; найдено: С 52,82; Н 7,82; N 5,84%;
гидрохлорид 3-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,3]оксазепан-2-она 124, анализ: вычислено для C22H37ClN2O4S· 0,85H2O: С 55,47; Н 8,19; N 5,88%; найдено: С 55,42; Н 7,94; N 5,75%;
гидрохлорид 3-(4-{изопропил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1,3]оксазепан-2-она 125, анализ: вычислено для С22Н37СlN2O4S· 1,5Н2O: С 54,14; Н 8,26; N 5,74%; найдено: С 54,12; Н 7,94; N 5,64%;
2,2,2-трифторацетат 3-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)[1,3]оксазепан-2-она 126, М+Н=465;
2,2,2-трифторацетат 3-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)[1,3]оксазинан-2-она 127, М+Н=451;
гидрохлорид 3-[4-(этил{2-[4-(пропан-2-сульфонилметил)фенил]-1-метилэтил}амино)бутил][1,3]оксазепан-2-она 128, анализ: вычислено для C24H41ClN2O4S· 0,85H2O: С 57,15; Н 8,53; N 5,55%; найдено: С 57,12; Н 8,41; N 5,61%;
гидрохлорид 3-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1,3]оксазокан-2-она 129, анализ: вычислено для C22H37ClN2O4S· 0,95H2О: С 55,26; Н 8,20; N 5,86%; найдено: С 55,26; Н 7,92; N 5,99%;
2,2,2-трифторацетат 3-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)[1,3]оксазокан-2-она 130, М+Н=479, или
гидрохлорид 3-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1, 3]тиазинан-2-она 131, М+Н=413.
Подобным образом, следуя методике, описанной выше в примере 2, но необязательно заменяя 4-(2-оксо[1,3]оксазинан-3-ил)масляный альдегид другими соответствующими соединениями формулы 1b и необязательно заменяя гидрохлорид этил[(S)-2-(4-метилсульфанилфенил)-1-метилэтил]амина другими соответствующими соединениями формулы 2, и используя модификации, известные специалистам в этой области, получали дополнительные соединения формулы IB, где Х означает >N-R6:
дибензоил-L-тартрат 1-[4-{этил[2-(4-метоксифенил)-1-метилэтил]амино)бутил]тетрагидропиримидин-2-она 134, анализ: вычислено для С38Н47N3О10: С 64,67; Н 6,71; N 5,95%; найдено: С 62,96; Н 6,28; N 5,76%;
дибензоил-L-тартрат 1-[4-{этил[2-(4-метоксифенил)-1-метилэтил]амино)бутил]-3-метилтетрагидропиримидин-2-она 135, анализ: вычислено для С39H49N3О10·0,9Н2O: С 63,64; Н 6,96; N 5,71%; вычислено: С 63,66; Н 6,61; N 5,62%;
дибензоил-L-тартрат 3-[4-{[2-(3-трифторметилфенил)-1-метилэтил]пропиламино)бутил]-1-метилтетрагидропиримидин-2-она 136, анализ: вычислено для С40Н48F3N3O9: С 62,25; Н 6,27; N 5,44%; найдено: С 60,64; Н 6,05; N4,81%;
гидрохлорид 1-[4-{[2-(3-трифторметилфенил)-1-метилэтил]пропиламино)бутил]тетрагидропиримидин-2-она 137, анализ: вычислено для С21Н33СlF3N3O9·0,8Н2O: С 56,00; Н 7,74; N 9,33%; найдено: С 56,00; Н 7,45; N 9,11%;
гидрохлорид 3-[4-{[2-нафталин-2-ил-1-метилэтил]пропиламино)бутил]-1-метилтетрагидропиримидин-2-она 138, анализ: вычислено для С25Н38СlN3O· 1,4Н2O: С 65,67; Н 8, 99; N 9,19%; найдено: С 65,64; Н 8,99; N 9,19%;
гидрохлорид 1-[3-{[2-(4-хлорфенил)-1-метилэтил]пропиламино)пропил]тетрагидропиримидин-2-она 139, анализ: вычислено для С19 Н31Сl2N3O· 1,15Н2O: С 55,78; Н 8,20; N 10,27%; найдено: С 55,81; Н 7,93; N 10,25%;
гидрохлорид 1-(4-{этил[(S)-2-(4-мeтaнcyльфoнилфeнил)-l-метилэтил]амино}бутил)тетрагидропиримидин-2-она 140, М+Н=396;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-3-метил[1,3]диазепан-2-она 141, М+Н=424;
гидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1, 3]диазепан-2-она 142, М+Н=424;
гидрохлорид 1-[4-({2-[4-(тиазол-2-сульфонил)фенил]-1-метилэтил}пропиламино)бутил]тетрагидропиримидин-2-она 143, анализ: вычислено для С23Н35СlN4O3S2: С 53,63; Н 6,85; N 10,88%; найдено: С 48,86; Н 6,42; N 9,84%, или
гидрохлорид 1-[4-(этил{2-[4-(тиазол-2-сульфонил)фенил]-1-метилэтил}амино)бутил]тетрагидропиримидин-2-она 144, анализ: вычислено для С22Н33СlN4O3S2: С 52,73; Н 6,64; N 11,18%; найдено: С 48,74; Н 6,31, N 10,33%.
Пример 3
(Получение соединения формулы IСа, как описано на схеме Г)
4-[4-(Этил{(S)-2-[4-(тиазол-2-сульфонил)фенил]-1-метилэтил]амино)бутил][1,4]оксазепан-3-он
Смесь этил{(S)-1-метил-2-[4-(тиазол-2-сульфонил)фенил]-1-этил}амина (0,326 г, 1,02 ммоля) и 4-(3-oкco[l,4]окcaзeпaн-4-ил)мacлянoгo альдегида (0,22 г, 1,2 ммоля) и триацетоксиборгидрида натрия (0,3 г, 1,4 ммоля) в 1,2-дихлорэтане (10 мл) перемешивали при комнатной температуре в течение 15 ч. Растворитель удаляли при пониженном давлении и остаток распределяли между 50% хлористоводородной кислотой и диэтиловым эфиром. Водную фазу доводили до рН 12 25% раствором гидроксида натрия и смесь экстрагировали дихлорметаном. Органическую фазу сушили (сульфатом магния) и концентрировали, получая 4-(4-{этил[2-(4-тиазол-2-сульфонилфенил)-1-метилэтил]амино}бутил)[1,4]оксазепан-3-он 145 в виде масла.
Анализ: вычислено для С23Н34 СlN3O4S2·1Н2O: С 51,72; Н 6,79; N 7,87%; найдено: С 51,71; Н 6,49; N 7,82%.
Подобным образом, следуя методике, описанной выше в примере 3, но необязательно заменяя 4-(3-оксо[1,4]оксазепан-4-ил)масляный альдегид другими соответствующими соединениями формулы 1c и необязательно заменяя этил{(S)-1-метил-2-[4-(тиазол-2-сульфонил)фенил]этил}амин другими соответствующими соединениями формулы 2, используя модификации, известные специалистам в этой области, получали дополнительные соединения формулы IСа, где Y означает -О- или -S-:
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил[1,4]оксазепан-3-она 146, анализ: вычислено для C22H37ClN2O4S· 1,5H2O: С 54,14; Н 8,26; N 5,74%; найдено: С 54,19; Н 8,26; N 5,85%, или
2,2,2-трифторацетат 4-(4-{этил[2-(4-трифторметансульфонилфенил) -1-метилэтил]амино}бутил)[1,4]оксазепан-3-она 147, М+Н=465.
Пример 4
(Получение соединения формулы ICb, как описано на схеме Г)
1-(4-{[(S)-2-(4-Метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-2-он
Смесь гидрохлорида пропил[(S)-2-(4-метансульфонилфенил)-1-метилэтил]амина (0,50 г, 1,7 ммоля), трет-бутилового эфира 3-оксо-4-(4-оксобутил)[1, 4]диазепан-1-карбоновой кислоты (0,5 г, 1,76 ммоля), триэтиламина (0,24 мл, 1,7 ммоля) и триацетоксиборгидрида натрия (0,54 г, 2,6 ммоля) в 1,2-дихлорэтане (20 мл) перемешивали при комнатной температуре в течение 17 ч. Растворитель удаляли, остаток распределяли между этилацетатом (30 мл) и 5% раствором карбоната натрия (20 мл). Органическую фазу сушили (сульфатом магния) и концентрировали, получая трет-бутиловый эфир 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-3-оксо[1,4]диазепан-1-карбоновой кислоты (0,89 г) в виде сиропа.
1 Н-ЯМР (CDCl3), δ , м.д.: 0,82, т, 3Н; 0,94, д, 3Н; 1,46, с, 9Н; 3,05, с, 3Н; 7,36, д, 2Н; 7,83, д, 2Н.
Смесь трет-бутилового эфира 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-3-оксо[1,4]диазепан-1-карбоновой кислоты (0,9 г, 1,75 ммоля) и 3 н. хлористоводородной кислоты (4 мл) нагревали до 50° С. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, значение рН доводили до 10 с помощью насыщенного раствора карбоната натрия, органическую фазу сушили (сульфатом магния) и концентрировали. Остаток растворяли в диэтиловом эфире (10 мл) и прибавляли 1 М раствор хлористого водорода в диэтиловом эфире (2 мл). Осадок собирали, промывали диэтиловым эфиром и гексаном и сушили в вакууме, получая дигидрохлорид 1-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-2-она (0,49 г) 149, М+Н=424.
Подобным образом, следуя методикам, описанным выше в примере 4, но необязательно заменяя трет-бутиловый эфир 3-оксо-4-(4-оксобутил)[1,4]диазепан-1-карбоновой кислоты другими соответствующими соединениями формулы 1d и необязательно заменяя гидрохлорид пропил[(S)-2-(4-метансульфонилфенил)-1-метилэтил]амина другими соответствующими соединениями формулы 2, используя модификации, известные специалистам в этой области, получали дополнительные соединения формулы ICb, где Y означает >NH:
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)[1,4]диазепан-2-она 150, М+Н=464;
гидрохлорид 1-(4-{этил[2-(4-тиазол-2-сульфонилфенил)-1-метилэтил]амино}бутил)[1,4]диазепан-2-она 151, анализ: вычислено для С23Н35СlN4O3S2·1,25Н2O: С 48,12; Н 6,76; N 9,76%; найдено: С 48,10; Н 6,52; N 9,81%;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)пиперазин-2-она 152, М+Н=450;
гидрохлорид N-метил-4-(2-{[4-(2-оксопиперазин-1-ил)бутил]пропиламино}пропил)бензолсульфонамида 153, М+Н=425;
гидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)пиперазин-2-она 154, М+Н=410;
гидрохлорид 1-(4-{[2-(4-тиазол-2-сульфонилфенил)-1-метилэтил]пропиламино}бутил)пиперазин-2-она 155, анализ: вычислено для С25Н35ClN4O3S2·1, 5Н2O: С 48,81; Н 6,66; N 9,49%; найдено: С 48,69; Н 6,54; N 9,64%;
гидрохлорид 1-(4-{[2-(4-тиазол-2-сульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-2-она 156, анализ: вычислено для С24Н36СlN4O3S2·0,75Н2O: С 49,78; Н 6,88; N 9,67%; найдено: С 49,74; Н 6,75; N 9,69%;
дигидрохлорид N-метил-4-(2-{[4-(2-оксо[1,4]диазепан-1-ил)бутил]пропиламино}пропил)бензолсульфонамида 157, М+Н=439;
1-[4-(этил{2-[4-(4-метоксибензолсульфонил)фенил]-1-метилэтил}амино)бутил][1,4]диазепан-2-он 158, М+Н=502;
4-[4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил}пропиламино)бутил][1,4]диазепан-2-он 159, М+Н=530;
полугидрат дигидрохлорида 1-(4-{этил[2-(4-трифторметилфенил)-1-метилэтил]амино}бутил)[1, 4]диазепан-2-она 160, анализ: вычислено для C21H33ClF3N3O· 0,5H2O: С 52,39; Н 7,33; N 8,73%; найдено: С 52,44; Н 7,32; N 8,58%, или
гидрохлорид 1-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]пропиламино}бутил)пиперазин-2-она 161, М+Н=374.
Пример 5
(Получение соединения формулы IСс, как описано на схеме Г)
1-(4-{[(S)-2-(4-Метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-метил[1,4]диазепан-2-он
К раствору 1-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил-1,4-диазепин-2-она (0,08 г, 0,19 ммоля) в тетрагидрофуране (10 мл) прибавляли триэтиламин (3 капли), сопровождаемый триацетоксиборгидридом натрия (0,06 г, 0,3 ммоля) и 37% формальдегид (0,1 мл, 1,2 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь концентрировали и остаток распределяли между 5% раствором карбоната натрия и хлороформом. Органическую фазу сушили (сульфатом магния) и концентрировали, получая 1-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-метил[1,4]диазепан-2-он, который выделяли в виде дигидрохлорида из диэтилового эфира (гигроскопичен) (0,07 г), 166, М+Н=438.
Подобным образом, следуя методикам, описанным выше в примере 5, но необязательно заменяя 1-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино)бутил-1,4-диазепин-2-он другими свободными аминопроизводными формулы ICb и необязательно заменяя формальдегид другими соответствующими ацилирующими, алкилирующими или сульфонилирующими агентами и используя модификации, известные специалистам в этой области, получали дополнительные соединения формулы IСс, где Y означает >N-R6:
трет-бутиловый эфир 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-3-оксопиперазин-1-карбоновой кислоты 167, М+Н=496;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-метансульфонилпиперазин-2-она 168, М+Н=474;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(морфолин-4-карбонил)пиперазин-2-она 169, М+Н=509;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-метансульфонил[1,4]диазепан-2-она 170, М+Н=488;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-метансульфонил-4-этил[1,4]диазепан-2-она 171, М+Н=438;
1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-ацетил[1,4]диазепан-2-он 172, М+Н=466;
1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-пропионил[1, 4]диазепан-2-он 173, М+Н=480;
1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-пентаноил[1,4]диазепан-2-он 174, М+Н=508;
1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(3-циклопентилпропаноил[1,4]диазепан-2-он 175, М+Н=548;
1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(тиофен-2-карбонил)[1,4]диазепан-2-он 176, М+Н=534;
метиловый эфир 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-3-оксо[1,4]диазепан-1-карбоновой кислоты 177, М+Н=482;
1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-бензолсульфонил[1,4]диазепан-2-он 178, М+Н=564;
1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(тиофен-2-сульфонил[1,4]диазепан-2-он 179, М+Н=570;
изопропиламид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-3-оксо[1,4]диазепан-1-карбоновой кислоты 180, М+Н=509;
бутиламид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-3-оксо[1,4]диазепан-1-карбоновой кислоты 181, М+Н=523;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-бензоил[1,4]диазепан-2-она 182, М+Н=528;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-фенилацетил[1,4]диазепан-2-она 183, М+Н=542;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(3-фенилпропионил[1,4]диазепан-2-она 184, М+Н=556;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(пиридин-3-карбонил)[1,4]диазепан-2-она 185, М+Н=529;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(изоксазол-5-карбонил)[1,4]диазепан-2-она 186, М+Н=519;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(фуран-2-карбонил)[1,4]диазепан-2-она 187, М+Н=518;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(пропан-1-сульфонил)[1,4]диазепан-2-она 188, М+Н=530;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(1-метил-1H-имидазол-4-сульфонил)[1,4]диазепан-2-она 189, М+Н=568;
2,2,2-трифторацетат метиламида 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-3-оксо[1,4] диазепан-1-карбоновой кислоты 190, М+Н=481;
2,2,2-трифторацетат этиламида 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-3-оксо[1,4]диазепан-1-карбоновой кислоты 191, М+Н=495;
2,2,2-трифторацетат фениламида 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-3-оксо[1,4]диазепан-1-карбоновой кислоты 192, М+Н=543;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-метансульфонил[1,4]диазепан-2-она 193, М+Н=502;
гидрохлорид 1-(4-{[2-(4-тиазол-2-сульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-метилпиперазин-2-она 194, анализ: вычислено для С25Н37СlN4O3S2·1,8Н2O: С 48,20; Н 7,01; N 9,37%; найдено: С 48,25; Н 6,64; N 9,41%;
гидрохлорид 1-(4-{этил[2-(4-тиазол-2-сульфонилфенил)-1-метилэтил]амино}бутил)-4-(пиридин-3-сульфонил)пиперазин-2-она 195, анализ: вычислено для С27Н36СlN5O5S3 ·1,25Н2O: С 46,25; Н 5,68; N 9,99%; найдено: С 46,26; Н 5,68; N 9.99%;
гидрохлорид 1-(4-{этил[2-(4-тиазол-2-сульфонилфенил)-1-метилэтил]амино}бутил)-4-(пиридин-3-сульфонил)[1,4]диазепан-2-она 196, анализ: вычислено для C28H38ClN5O5S2·1,05H2O: С 47,26; Н 5,82; N 9,84%; найдено: С 47,26; Н 5,65; N 9,81%;
моногидрат гидрохлорида 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)-4-(пиридин-3-сульфонил)пиперазин-2-она 197, М+Н=511;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)-4-метилпиперазин-2-она 198, М+Н=464;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(пиридин-3-сульфонил)[1,4]диазепан-2-она 199, М+Н=551;
моногидрат гидрохлорида 1-(4-{этил[2-(4-метансульфонил)-1-метилэтил]амино}бутил)-4-(пиридин-3-сульфонил)пиперазин-2-она 200, М+Н=537;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)-4-(пиридин-3-сульфонил)[1,4]диазепан-2-она 201, М+Н=605;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-трифторметансульфонил[1,4]диазепан-2-она 202, анализ: вычислено для С22Н35СlF3N4O5 S· 0,75Н2O: С 44,66; Н 6,22; N 7,10%; найдено: С 44,66; Н 6,08; N 6,96%;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-тиазол-2-илметил[1,4]диазепан-2-она 203, анализ: вычислено для С25Н39СlN4O3S2 ·0,85Н2O: С 47,56; Н 6,82; N 8,87%; найдено: С 47,58; Н 6,77; N 9,12%;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)-4-тиазол-2-илметил[1,4]диазепан-2-она 204, М+Н=561;
гидрохлорид 1-(4-{этил[2-(3-трифторметилфенил)-1-метилэтил]амино}бутил)-4-(пиридин-3-сульфонил)пиперазин-2-она 205, М+Н=527;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)-4-(1-метил-1H-имидазол-4-сульфонил)пиперазин-2-она 206, М+Н=594;
гидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2,2,2-трифторацетил)[1,4]диазепан-2-она 207, анализ: вычислено для С23Н37СlF3N3O4 S· 1,05Н2O: С 49,25; Н 6,67; N 7,49%; найдено: С 48,90; Н 6,27; N 7,47%;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)-4-(1-метил-1H-имидазол-4-сульфонил)[1,4] диазепан-2-она 208, М+Н=608;
дигидрохлорид 1-(4-{этил[2-(3-трифторметилфенил)-1-метилэтил]амино}бутил)-4-(1-метил-1H-имидазол-4-сульфонил)пиперазин-2-она 209, М+Н=530;
дигидрохлорид 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2,2,2-трифторэтил)[1,4]диазепан-2-она 210, анализ:вычислено для C23H38Cl2F3N3 O3S· l,20H2O: С 47,13; Н 6,95; N 7,17%; найдено: С 47.17; Н 6,59; N 7,22%;
дигидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(2-диметиламиноэтансульфонил)[1,4]диазепан-2-она 211, М+Н=559;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)-4-(1H-имидазол-4-илметил)[1,4]диазепан-2-она 212, М+Н=544;
гидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-метилпиперазин-2-она 213, М+Н=424;
гидрохлорид 1-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]этиламино}бутил)-4-(1-метил-1H-имидазол-4-сульфонил)[1,4]диазепан-2-она 214, М+Н=532;
гидрохлорид 1-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-метил-1H-имидазол-4-сульфонил)[1,4] диазепан-2-она 215, М+Н=608;
гидрохлорид 1-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]этиламино}бутил)-4-(2-метил-1H-имидазол-4-сульфонил)[1,4]диазепан-2-она 216, М+Н=532;
гидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(2-имидазол-1-илэтансульфонил)[1,4]диазепан-2-она 217, М+Н=582;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(3-метоксибензоил)[1,4]диазепан-2-она 218, М+Н=664;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(фуран-2-карбонил)[1,4]диазепан-2-она 219, М+Н=624;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино)бутил)-4-(тиофен-2-карбонил)[1,4]диазепан-2-она 220, М+Н=640;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(3-нитробензоил)[1,4]диазепан-2-она 221, М+Н=679;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(пиридин-3-карбонил)[1,4] диазепан-2-она 222, М+Н=635;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(пиридин-4-карбонил)[1,4]диазепан-2-она 223, М+Н=635;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(изоксазол-5-карбонил)[1,4]диазепан-2-она 224, М+Н=625;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-бензоил[1,4]диазепан-2-она 225, М+Н=634;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(4-метоксибензоил)[1,4]диазепан-2-она 226, М+Н-664;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(2-хлорпиридин-4-карбонил)[1,4]диазепан-2-она 227, М+Н=670;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(3,4-диметоксибензоил)[1,4]диазепан-2-она 228, М+Н=694;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(5-метилизоксазол-3-карбонил)[1,4]диазепан-2-она 229, М+Н=639;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(тиофен-2-сульфонил)[1,4]диазепан-2-она 230, М+Н=676;
2,2,2-трифторацетат диметиламида 4-[4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил}пропиламино)бутил]-3-оксо[1,4]диазепан-1-сульфоновой кислоты 231, М+Н=637;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-бензолсульфонил[1,4]диазепан-2-она 232, М+Н=670;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-метансульфонил[1,4]диазепан-2-она 233, М+Н=608;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(3-нитробензолсульфонил)[1,4]диазепан-2-она 234, М+Н=715;
2,2,2-трифторацетат 1-(4-({2-[3-(бензо[1, 3]диоксол-5-сульфонил)фенил]-1-метилэтил]пропиламино}бутил)-4-(1-метил-1H-имидазол-4-сульфонил)[1,4]диазепан-2-она 235, М+Н=674;
2,2,2-трифторацетат (2-метоксифенил)амида 4-[4-({2-[3-(бензо[1,3]диоксол-5-сульфонил)фенил]-1-метилэтил}пропиламино)бутил]-3-оксо[1,4]диазепан-1-карбоновой кислоты 236, М+Н=679;
2,2,2-трифторацетат (3-метоксифенил)амида 4-[4-({2-[3-(бензо[1,3]диоксол-5-сульфонил)фенил]-1-метилэтил} пропиламино)бутил]-3-оксо[1,4]диазепан-1-карбоновой кислоты 237, М+Н=679;
2,2,2-трифторацетат (4-метоксифенил)амида 4-[4-({2-[3-(бензо[1,3]диоксол-5-сульфонил)фенил]-1-метилэтил}пропиламино)бутил]-3-оксо[1,4]диазепан-1-карбоновой кислоты 238, М+Н=679;
2,2,2-трифторацетат метиламида 4-[4-({2-[3-(бензо[1,3]диоксол-5-сульфонил)фенил]-1-метилэтил}пропиламино)бутил]-3-оксо[1,4]диазепан-1-карбоновой кислоты 239, М+Н=587;
2,2,2-трифторацетат (3,4,5-триметоксифенил)амида 4-[4-({2-[3-(бензо[1,3]диоксол-5-сульфонил)фенил]-1-метилэтил}пропиламино)бутил]-3-оксо[1,4]диазепан-1-карбоновой кислоты 240, М+Н=739;
2,2,2-трифторацетат 1-[4-(этил{2-[4-(4-метоксибензолсульфонил)фенил]-1-метилэтил}амино)бутил]-4-(пиридин-3-карбонил)[1,4]диазепан-2-она 241, М+Н=607;
2,2,2-трифторацетат 1-[4-(этил{2-[4-(4-метоксибензолсульфонил)фенил]-1-метилэтил}амино)бутил]-4-бензоил[1,4]диазепан-2-она 242, М+Н=606;
2,2,2-трифторацетат 1-[4-(этил{2-[4-(4-метоксибензолсульфонил)фенил]-1-метилэтил}амино)бутил]-4-(1-метил-1H-имидазол-4-сульфонил)[1,4]диазепан-2-она 243, М+Н=646;
дигидрохлорид 1-(4-{этил[2-(4-трифторметилфенил)-1-метилэтил]амино}бутил-4-(2-метил-1H-имидазол-4-сульфонил)[1,4]диазепан-2-она 244, анализ: вычислено для С25Н37СlF3N5 O3S· 1,0Н2O: С 47,32; Н 6,35; N 11,04%; найдено: С 47,24; Н 6,11; N 11,21%;
гидрохлорид 1-(4-{[2-(4-хлорфенил)-1-метилэтил]этиламино}бутил-4-(1-метил-1H-имидазол-4-сульфонил)[1,4]диазепан-2-она 245, М+Н=510;
гидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-хлорметансульфонил[1,4]диазепан-2-она 246, М+Н=536;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]этиламино}бутил)-4-(2-диметиламиноэтансульфонил[1,4]диазепан-2-она 247, М+Н=545;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-пирролидин-1-илэтансульфонил)[1,4]диазепан-2-она 248, М+Н=571;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-пиррол-1-илэтансульфонил)[1,4]диазепан-2-она 249, М+Н=567;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-пиперазин-1-илэтансульфонил)[1,4]диазепан-2-она 250, М+Н=586;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-[2-(4-метилпиперазин-1-ил)этансульфонил][1,4]диазепан-2-она 251, М+Н=600;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]этиламино}бутил)-4-(2-метиламиноэтансульфонил)[1,4]диазепан-2-она 252, М+Н=531;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]этиламино)бутил)-4-(2-диэтиламиноэтансульфонил)[1,4]диазепан-2-она 253, М+Н=573;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]этиламино}бутил)-4-(2-изопропиламиноэтансульфонил)[1,4]диазепан-2-она 254, М+Н=559;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]этиламино}бутил)-4-(2-бензиламиноэтансульфонил)[1,4]диазепан-2-она 255, М+Н=607;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]этиламино}бутил)-4-(2-бензилметиламиноэтансульфонил)[1,4]диазепан-2-она 256, М+Н=621;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-[2-(2-метоксиэтиламино)этансульфонил][1,4]диазепан-2-она 257, М+Н=575;
2,2,2-трифторацетат метилового эфира {2-[4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-3-оксо[1,4]диазепан-1-сульфонил]этиламино}уксусной кислоты 258, М+Н=589;
2,2,2-трифторацетат 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]этиламино}бутил)-4-(2-аминоэтансульфонил)[1,4]диазепан-2-она 259, М+Н-517;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-диметиламиноэтансульфонил)пиперазин-2-она 260, М+Н=531;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-диэтиламиноэтансульфонил)пиперазин-2-она 261, М+Н=559;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-изопропиламиноэтансульфонил)пиперазин-2-она 262, М+Н=545;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-пирролидин-1-илэтансульфонил)пиперазин-2-она 263, М+Н=557;
2,2,2-трифторацетат 1-(4-(этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-бензиламиноэтансульфонил)пиперазин-2-она 264, М+Н=593;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-бензилметиламиноэтансульфонил)пиперазин-2-она 265, М+Н=607;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-[2-(2-гидроксиэтиламино)этансульфонил]пиперазин-2-она 266, М+Н=547;
2,2,2-трифторацетат 1-(4-(этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-[2-(2-метоксиэтиламино)этансульфонил]пиперазин-2-она 267, М+Н=561;
2,2,2-трифторацетат метилового эфира {2-[4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-3-оксопиперазин-1-сульфонил]этиламино} уксусной кислоты 268, М+Н=575;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-пиперазин-1-илэтансульфонил)пиперазин-2-она 269, М+Н=572;
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-[2-(4-метилпиперазин-1-ил)этансульфонил]пиперазин-2-она 270, М+Н=586, или
2,2,2-трифторацетат 1-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-4-(2-аминоэтансульфонил)пиперазин-2-она 271, М+Н=503.
Пример 6
(Получение соединения формулы IDa, как описано на схеме Д)
4-(4-{[(S)-(4-Метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]оксазепан-5-он

К смеси [(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламина (0,2 г, 0,78 ммоля) и 4-(5-оксо[1,4]оксазепан-4-ил)масляного альдегида (0,22 г, 1,2 ммоля) в 1,2-дихлорэтане (8 мл) прибавляли триацетоксиборгидрид натрия (0,25 г, 1,17 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 15 ч. Смесь разбавляли дихлорметаном и промывали 5% раствором гидроксида натрия. Органическую фазу сушили (сульфатом магния) и концентрировали, получая 4-(4-{[(S)-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]оксазепан-5-он, который выделяли в виде гигроскопичного гидрохлорида в диэтиловом эфире (0,23 г) 273.
Анализ: вычислено для С25Н37СlN2O4S· 1,4Н2O: С 54,34; Н 8,25; N 5,76%; найдено: С 54,32; Н 8,03; N 5,98%.
Подобным образом, следуя приведенной выше методике, описанной в примере 6, но необязательно заменяя 4-(5-оксо[1, 4]оксазепан-4-ил)масляный альдегид другими соответствующими соединениями формулы 1e и необязательно заменяя [(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламин другими соответствующими соединениями формулы 2 и используя модификации, известные специалистам в этой области, получали дополнительные соединения формулы IDa, где Z означает -О- или -S-:
4-трет-бутил-N-[3-(2-{[4-(5-оксо[l, 4]оксозепан-4-ил)бутил]пропиламино}пропил)фенил]бензамид 274, анализ: вычислено для C32H47N3O3: С 73,67; Н 9,08; N 8,05%; найдено: С 73,74; Н 8,99; N 8,23%, или
2,2,2-трифторацетат 4-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)[1,4]оксазепан-5-она 275, М+Н=465.
Пример 7
(Получение соединения формулы IDb, как описано на схеме Д)
4-(4-{[(S)-2-(4-Метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-он
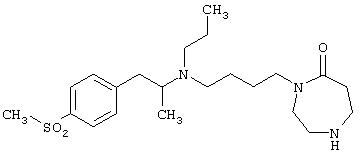
Смесь гидрохлорида [(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламина (2,05 г, 7,03 ммоля), триэтиламина (0,98 мл, 7 ммолей), трет-бутилового эфира 5-оксо-4-(4-оксобутил)[1,4]диазепан-1-карбоновой кислоты (2,0 г, 7,03 ммоля) и триацетоксиборгидрида натрия (2,23 г, 10,5 ммоля) в 1,2-дихлорэтане (40 мл) перемешивали при комнатной температуре в течение 15 ч. Смесь концентрировали и остаток распределяли между диэтиловым эфиром и насыщенным раствором карбоната натрия. Органическую фазу сушили (сульфатом магния) и концентрировали, получая трет-бутиловый эфир 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты (3,6 г) в виде густого сиропа. М+Н=524. Гидрохлорид перекристаллизовывали из смеси ацетон/диэтиловый эфир, tпл 156-158° С.
К трет-бутиловому эфиру 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты (3,7 г, 7,06 ммоля) прибавляли 6 н. хлористоводородную кислоту (7 мл). Реакционную смесь нагревали при 50° С в течение 1 мин, затем перемешивали при комнатной температуре в течение 30 мин. Доводили значение рН реакционной смеси до 10 с помощью насыщенного раствора карбоната натрия и экстрагировали этилацетатом. Органическую фазу сушили (сульфатом магния) и концентрировали, получая 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-он в виде дигидрохлорида (гигроскопичен) из диэтилового эфира (2,86 г) 277, М+Н=424.
Подобным образом, следуя методике, описанной выше в примере 7, но необязательно заменяя трет-бутиловый эфир 5-оксо-4-(4-оксобутил)[1,4]диазепан-1-карбоновой кислоты другими соответствующими соединениями формулы 1f и необязательно заменяя гидрохлорид [(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламина другими соответствующими соединениями формулы 2 и используя модификации, известные специалистам в этой области, получали дополнительные соединения формулы IDb, где Z означает >NH:
гидрохлорид 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1,4]диазепан-5-она 278, М+Н=410;
гидрохлорид 4-(4-{этил[2-(4-трифторметансульфонилфенил)-1-метилэтил]амино}бутил)[1,4]диазепан-5-она 279, М+Н=464;
2,2,2-трифторацетат 4-(4-{[2-(2,3-дигидробензо[1, 4]диоксин-6-ил)-1-метилэтил]этиламино}бутил)[1,4]диазепан-5-она 280, М+Н=390;
2,2,2-трифторацетат 4-(4-{[2-(2,3-дигидробензо[1,4]диоксин-6-ил)-1-метилэтил]пропиламино}бутил)[1, 4]диазепан-5-она 281, М+Н=404;
гидрохлорид 4-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-она 282, М+Н=402;
гидрохлорид 4-(4-{[2-(3-трифторметилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-она 283, М+Н=414;
гидрохлорид 4-(4-{[2-(4-метоксифенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-она 284, М+Н=376;
гидрохлорид 4-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]этиламино}бутил)[1,4]диазепан-5-она 285, М+Н=388;
гидрохлорид 4-(4-{[2-(4-трет-бутилфенил)-1-метилэтил]изопропиламино}бутил)[1,4]диазепан-5-она 286, М+Н=402;
гидрохлорид 4-(4-{[2-(4-пропансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1, 4]диазепан-5-она 287, анализ: вычислено для С24Н42СlN3О3S· 0,75Н2O: С 53,57; Н 8,34; N 7,81%; найдено: С 53,55; Н 8,19; N 7,91%;
гидрохлорид 4-[4-({2-[4-(пропан-2-сульфонил)фенил]-1-метилэтил}пропиламино)бутил][1,4]диазепан-5-она 288, анализ: вычислено для С25Н44СlN3О3 S· 0,95Н20: С 54,03; Н 8,51; N 7,56%; найдено: С 54,05; Н 8,36; N 7,55%;
гидрохлорид 4-(4-{[2-(4-этансульфонилфенил)-1-метилэтил]пропиламино}бутил[1,4]диазепан-5-она 289, анализ: вычислено для С23Н40СlN3О3S: С 54,11; Н 8,09; N 8,23%; найдено: С 50,88; Н 7,85; N 7,67%;
гидрохлорид 4-(4-{[2-(4-нафталин-2-ил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-она 290, М+Н=396;
гидрохлорид 4-(4-{[2-(4-тиазол-2-сульфонилфенил)-1-метилэтил]пропиламино}бутил)[1, 4]диазепан-5-она 291, анализ: вычислено для С25Н37СlN4O3S2·1,35Н2O: С 48,86; Н 6,77; N 9,91%; найдено: С 48,89; Н 6, 71; N 9,40%;
гидрохлорид 4-(4-{аллил[2-(4-метансульфонилфенил)-1-метилэтил] амино}бутил)[1,4]диазепан-5-она 292, анализ: вычислено для С22Н37СlN3О3S· 0,8Н2O: С 51,92; Н 7,65; N 8,26%; найдено: С 51,82; Н 7,48; N 8,27%;
гидрохлорид 4-(4-{[2-(4-изобутоксифенил)-1-метилэтил] пропиламино}бутил)[1, 4]диазепан-5-она 293, М+Н=418;
гидрохлорид 4-[4-({2-[4-(2-метоксипропан-2-сульфонил)фенил]-1-метилэтил}пропиламино)бутил][1,4]диазепан-5-она 294, М+Н=452;
гидрохлорид 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)[1,4]диазепан-5-она 295, М+Н=410;
гидрохлорид 4-(4-{[2-(4-аминофенил)-1-метилэтил]этиламино}бутил)[1,4]диазепан-5-она 296, М+Н=347;
гидрохлорид 4-(4-{этил[2-(4-нитрофенил)-1-метилэтил]амино}бутил)[1,4]диазепан-5-она 297, М+Н==377;
гидрохлорид 4-(4-{[2-(4-гидроксифенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-она 298, М+Н=362;
гидрохлорид 4-[4-(этил{2-[4-(тиазол-2-сульфонил)фенил]-1-метилэтил}амино)бутил][1, 4]диазепан-5-она 299, анализ: вычислено для С25Н35СlN4O3S2·1,80Н2O: С 47,30; Н 6,83; N 9,59%; найдено: С 47,31; Н 6, 43; N 9,45%;
гидрохлорид метилового эфира 4-(2-{этил[4-(7-оксо[1,4]диазепан-1-ил)бутил]амино}пропил)бензойной кислоты 300, анализ: вычислено для С22Н36ClN3О3·0,80Н2O: С 55,41; Н 8,16; N 8,81%; найдено: С 55,38; Н 8,04; N 8,87%;
гидрохлорид N-[4-(2-{этил[4-(7-оксо[1, 4]диазепан-1-ил)бутил]амино}пропил)фенил]метансульфонамида 301, М+Н=425;
N-этил-4-(2-{этил[4-(7-оксо[1,4]оксазепан-1-ил)бутил]амино}пропил)бензамид 302, анализ: вычислено для C23H39ClN4O2: С 58,10; Н 8,48; N 11,78%; найдено: С 52,73; Н 8,10; N 10,80%;
гидрохлорид 4-[4-(этил{2-[4-(пирролидин-1-карбонил)фенил]-1-метилэтил}амино)бутил][1,4]диазепан-5-она 303, анализ: вычислено для C25H41ClN4O: С 59,87; Н 8,44; N 11,17%; найдено: С 50,76; Н 7,95; N 9,52%;
гидрохлорид 4-[4-(этил{2-[4-(2-оксопиперидин-1-ил)фенил]-1-метилэтил}амино)бутил][1,4]диазепан-5-она 304, М+Н=429;
гидрохлорид 4-[4-({2-[4-(1H-имидазол-2-сульфонил)фенил]-1-метилэтил}амино)бутил][1,4]диазепан-5-она 305, анализ: вычислено для С25Н40СlN5O3S· 0,3Н2O: С 49,68; Н 7,10; N 11,59%; найдено: С 49,63; Н 7,00; N 11,62%;
N,N-диметил-2-[4-(2-{[4-(7-оксо[1,4]диазепан-1-ил)бутил]пропиламино}пропил)-бензолсульфонил]ацетамид 306, анализ: вычислено для С25Н43СlN4O4S:С 52,90; Н 7,81; N 9.87%; найдено: С 50,43; Н 7,56; N 9,38%;
гидрохлорид 4-[4-({2-[4-(тиазол-2-илокси)фенил]-1-метилэтил}пропиламино)бутил][1,4]диазепан-5-она 307, М+Н=445;
гидрохлорид 4-(2-{[4-(7-оксо[1,4]диазепан-1-ил)бутил]пропиламино}пропил)фенилового эфира пропан-2-сульфоновой кислоты 308, М+Н=468;
гидрохлорид 4-[4-({2-[4-(1,1-диоксоизотиазолидин-2-ил)фенил]-1-метилэтил}этиламино)бутил][1,4]диазепан-5-она 309, М+Н=451, или
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]проп-2-иниламино}бутил)[1,4]диазепан-5-она 310, анализ: вычислено для С22Н34ClN3О3S: С 53, 65; Н 7,16; N 8,53%; найдено: С 49,57; Н 6,83; N 7,84%.
Пример 8
(Получение соединения формулы IDc, как описано на схеме Д)
4-(4-{Этил[2-(4-метансульфонилфенил)-1-метилэтил]амино)бутил)-1-(изоксазол-5-карбонил)[1,4]диазепан-5-он
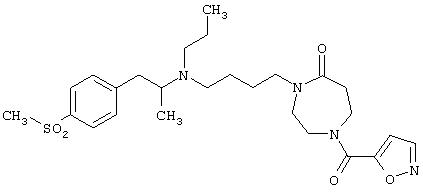
К смеси дигидрохлорида 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-она (0,15 г, 0,3 ммоля) в толуоле (5 мл) и насыщенного раствора карбоната натрия (2 мл) прибавляли изоксазол-5-карбонилхлорид (0,04 г, 0,31 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили (сульфатом магния) и концентировали, получая 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-(изоксазол-5-карбонил)[1,4]диазепан-5-он в виде гигроскопичного гидрохлорида (0,14 г) в смеси этилацетат/диэтиловый эфир 316, М+Н=505.
Подобным образом, следуя методикам, описанным выше в примере 8, но необязательно заменяя дигидрохлорид 4-(4-{[(5)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1, 4]диазепан-5-она другими свободными аминопроизводными формулы IDb и необязательно заменяя изоксазол-5-карбонилхлорид другими соответствующими ацилирующими, алкилирующими или сульфонилирующими агентами и используя модификации, известные специалистам в этой области, получали дополнительные соединения формулы I, где Z означает >N-R6:
гидрохлорид 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-бензил[1,4]диазепан-5-она 317, М+Н=500;
гидрохлорид 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-метансульфонил[1,4]диазепан-5-она 318, М+Н=488;
гидрохлорид амида 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 319, М+Н=453;
2,2,2-трифторацетат диметиламида 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 320, М+Н=481;
2,2,2-трифторацетат этилового эфира 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино)бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 321, М+Н=482;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-(2-метоксиацетил)[1,4]диазепан-5-она 322, М+Н=482;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-пропионил[1,4]диазепан-5-она 323, М+Н=466;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-(фуран-2-карбонил)[1,4]диазепан-5-она 324, М+Н=504;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-изобутирил[1,4]диазепан-5-она 325, М+Н=480;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-бензоил[1,4]диазепан-5-она 326, М+Н=514;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-циклобутанкарбонил[1,4]диазепан-5-она 327, М+Н=492;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-(морфолин-4-карбонил)[1,4]диазепан-5-она 328, М+Н-523;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-(пиридин-3-карбонил)[1,4]диазепан-5-она 329, М+Н=515;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-циклогексанкарбонил[1,4]диазепан-5-она 330, М+Н=520;
2,2,2-трифторацетат диметиламида 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-5-оксо[1,4]диазепан-1-сульфоновой кислоты 331, М+Н=526;
2,2,2-трифторацетат трет-бутиламида 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 332, М+Н=509;
2,2,2-трифторацетат фениламида 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 333, М+Н=529;
2,2,2-трифторацетат (2-метоксифенил)амида 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 334, М+Н=559;
2,2,2-трифторацетат 4-(4-{этил[2-(4-метансульфонилфенил)-1-метилэтил]амино}бутил)-1-этил[1,4]диазепан-5-она 335, М+Н=438;
гидрохлорид 1-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-4-(изоксазол-5-карбонил)[1,4]диазепан-5-она 336, М+Н=519;
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-1-метил[1,4]диазепан-5-она 337, М+Н=438;
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-1-(2-амино-3-метилбутирил)[1,4]диазепан-5-она 338, М+Н=523;
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-1-(2-диметиламиноэтансульфонил)[1,4]диазепан-5-она 339, М+Н=559;
гидрохлорид фенилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 340, анализ: вычислено для С29Н42СlN3O5S: С 60,04; Н 7,30; N 7,24%; найдено: С 58,80; Н 7,84; N 6,57%;
гидрохлорид трет-бутилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4] диазепан-1-карбоновой кислоты 341, tпл 156-158° С;
гидрохлорид диэтилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино]бутил}-5-оксо[1,4]диазепан-1-ил)фосфоновой кислоты 342, М+Н=560;
гидрохлорид этилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 343, tпл 135-137° С;
гидрохлорид 2-[4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбонил]фенилового эфира уксусной кислоты 344, М+Н=586;
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-1-(2-гидроксибензоил)[1,4]диазепан-5-она 345, М+Н=465;
гидрохлорид пропилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 346, tпл 152-154° С;
гидрохлорид изобутилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 347, анализ: вычислено для С27Н46СlN3O5S· 1, 80Н2O: С 57,89; Н 8,28; N 7,50%; найдено: С 57,59; Н 8,20; N 7,39%;
гидрохлорид 2,2-диметилпропилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 348, М+Н=538;
гидрохлорид бутилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 349, М+Н=524;
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбальдегида 350, М+Н=452;
гидрохлорид изопропилового эфира 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]-пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 351, tпл 142-143° C;
гидрохлорид 1-ацетил-4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-она 352, М+Н=466;
гидрохлорид 2-[4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбонил]бензилового эфира уксусной кислоты 353, М+Н=600;
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-1-(4-трифторметилбензил)[1,4]диазепан-5-она 354, М+Н=582;
гидрохлорид 4-[4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-илметил]фенилового эфира уксусной кислоты 355, М+Н=572;
гидрохлорид 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино} бутил)-1-[2-(3-трифторметилфенил)этил][1,4]диазепан-5-она 356, М+Н=596;
гидрохлорид 1-[2-(4-хлорфенил)этил]-4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-она 357, М+Н=562;
4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-1-(2-метоксиацетил)[1,4]диазепан-5-он 358, М+Н=496;
1-(2-изопропоксиацетил)-4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)[1,4]диазепан-5-он 359, М+Н=524;
бензоилсульфанилметиловый эфир 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4] диазепан-1-карбоновой кислоты 360, М+Н=618;
ацетоксиметиловый эфир 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 361, tпл 143-144° С;
2,2-диметилпропионилоксиметиловый эфир 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4] диазепан-1-карбоновой кислоты 362, tпл 129-130° С;
5-метил-2-оксо[1, 3]диоксол-4-илметиловый эфир 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4] диазепан-1-карбоновой кислоты 363, М+Н=580;
ацетилсульфанилметиловый эфир 4-(4-{[2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты 364, tпл 142-144° С.
Пример 9
(Альтернативное получение соединений формулы I, как описано на схеме Е)
трет-Бутиловый эфир 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты
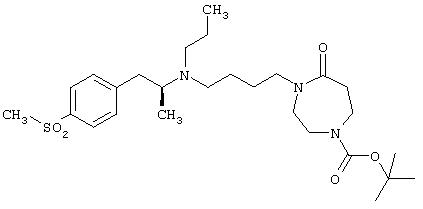
Этап 1: трет-бутиловый эфир 4-{4-[5-(4-метансульфонилфенил)-4-метил-2-оксооксазолидин-3-ил]бутил}-5-оксо[1,4]диазепан-1-карбоновой кислоты
К охлажденной смеси 2,5 г 5-(4-метансульфонилфенил)-4-метилоксазолидин-2-она и 7,5 мл N-метилпирролидона медленно прибавляли 5 г 25% раствора трет-амилата калия в толуоле. Смесь перемешивали, затем охлаждали и прибавляли 4,5 г трет-бутилового эфира 4-(4-иодбутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты. Смесь перемешивали в условиях окружающей среды в течение 6 ч. Прибавляли воду и смесь перемешивали. Осажденный продукт собирали и сушили, получая около 3,5 г трет-бутилового эфира 4-{4-[5-(4-метансульфонилфенил)-4-метил-2-оксооксазолидин-3-ил]бутил}-5-оксо[1,4]диазепан-1-карбоновой кислоты.
Этап 2: трет-бутиловый эфир 4-{4-[2-(4-метансульфонилфенил)-1-метилэтиламино]бутил}-5-оксо[1,4]диазепан-1-карбоновой кислоты
Смесь 10 г трет-бутилового эфира 4-{4-[5-(4-метансульфонилфенил)-4-метил-2-оксооксазолидин-3-ил]бутил}-5-оксо[1,4]диазепан-1-карбоновой кислоты, 1 г 20% Pd/C, 10 мл воды и 90 мл изопропанола перемешивали и нагревали до 50-60° С. Медленно прибавляли раствор 3,5 г формиата калия в 5 мл воды. Смесь перемешивали в течение 3 ч, затем охлаждали и фильтровали. Фильтрат упаривали, получая около 9 г трет-бутилового эфира 4-{4-[2-(4-метансульфонилфенил)-1-метилэтиламино]бутил}-5-оксо[1,4]диазепан-1-карбоновой кислоты.
Этап 3: трет-бутиловый эфир 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты
Смесь боргидрида натрия (0,55 г) и тетрагидрофурана (40 мл) перемешивали и медленно прибавляли смесь уксусной кислоты (2,62 г) и тетрагидрофурана (10 мл) при охлаждении, чтобы поддерживать температуру ниже температуры окружающей среды. Смесь пермешивали в течение нескольких часов. Готовили раствор трет-бутилового эфира 4-{4-[2-(4-метансульфонилфенил)-1-метилэтиламино]бутил}-5-оксо[1,4]диазепан-1-карбоновой кислоты (7,0 г) и пропионового альдегида (0,85 г) в тетрагидрофуране (25 мл). Раствор медленно прибавляли при перемешивании к боргидридной смеси. Смесь перемешивали несколько часов с последующим медленным прибавлением 25% раствора гидроксида натрия (14 г). Верхний органический слой перегоняли в вакууме. Остаток растворяли в толуоле и промывали водой. Органический слой перегоняли в вакууме, получая 7,5 г трет-бутилового эфира 4-(4-{[(S)-2-(4-метансульфонилфенил)-1-метилэтил]пропиламино}бутил)-5-оксо[1,4]диазепан-1-карбоновой кислоты в виде масла.
Пример 10

Ингредиенты смешивали и рапределяли в капсулах, содержащих около 100 мг каждого; одна капсула соответствовала примерно общей суточной дозе.
Пример 11

Ингредиенты объединяли и гранулировали, используя такой растворитель, как метанол. Затем смесь сушили и формировали в таблетки (содержащие примерно 20 мг активного соединения) с применением соответствующей таблетирующей машины.
Пример 12

Ингредиенты смешивали, образуя суспензию для перорального введения.
Пример 13

Активный ингредиент растворяли в части воды для инъекции. Затем при перемешивании прибавляли хлорид натрия в количестве, достаточном для того, чтобы сделать раствор изотоническим. Раствор доводили до требуемого количества с помощью оставшейся воды для инъекции, фильтровали через мембранный фильтр с размером пор 0,2 мк и упаковывали в стерильных условиях.
Пример 14

Ингредиенты расплавляли и смешивали в паровой бане и выливали в формы, содержащие 2,5 г общей массы.
Пример 15

Все ингредиенты, кроме воды, объединяли и нагревали примерно до 60° С при перемешивании. Затем при интенсивном перемешивании примерно при 60° С прибавляли количество воды, достаточное для эмульгирования ингредиентов, и после этого прибавляли воду примерно до 100 г.
Пример 16
Составы для назального спрея
Готовили несколько водных суспензий, содержащих примерно 0,025-0,5% активного соединения, в качестве составов для назального спрея. Составы необязательно содержали неактивные ингредиенты, такие, как, например, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза в натриевой форме, декстроза и тому подобное. Хлористоводородная кислота может быть добавлена для регулирования рН. Составы для назального спрея могут быть доставлены с помощью насоса с измеряемым назальным распылением, обычно доставляющим примерно 50-100 мкл смеси на запуск. Типичный режим дозирования составляет 2-4 распыления каждые 4-12 ч.
Пример 17
Исследования связывания радиоактивного лиганда
Ингибиторную активность in vitro соединений по данному изобретению определяли, используя модификацию способа, описанного Hegde S.S. и др., Br. J. Pharmacol. 1997, 120, 1409-1418.
Использовали клеточные мембраны клеток яичника китайского хомячка, экспрессирующих рекомбинантные человеческие мускариновые рецепторы (m1 - m5). Анализы проводили с радиоактивным лигандом [3H]N-метилскополамином (0,4 нМ, специфическая активность 84 Ки/ммоль) в конечном объеме 0,25 мл трис-буфера Кребса. Неспецифическое связывание определяли с 1 мкМ атропином. Испытания проводили, используя методику сцинтилляционного экспресс-анализа. Кривые конкуренции-замещения получали, используя 10 концентраций исследуемых соединений, и анализировали с помощью аппроксимации итерационной кривой к четырехпараметровому логистическому уравнению. Значения pIC50 (-log IC50) преобразовывали в значения pKi, используя уравнение Ченга-Прусова.
Ингибиторные активности (выраженные в виде значений pKi) в отношении мускариновых рецепторов некоторых, приводимых в качестве примеров, соединений по настоящему изобретению смотри в табл. 7.
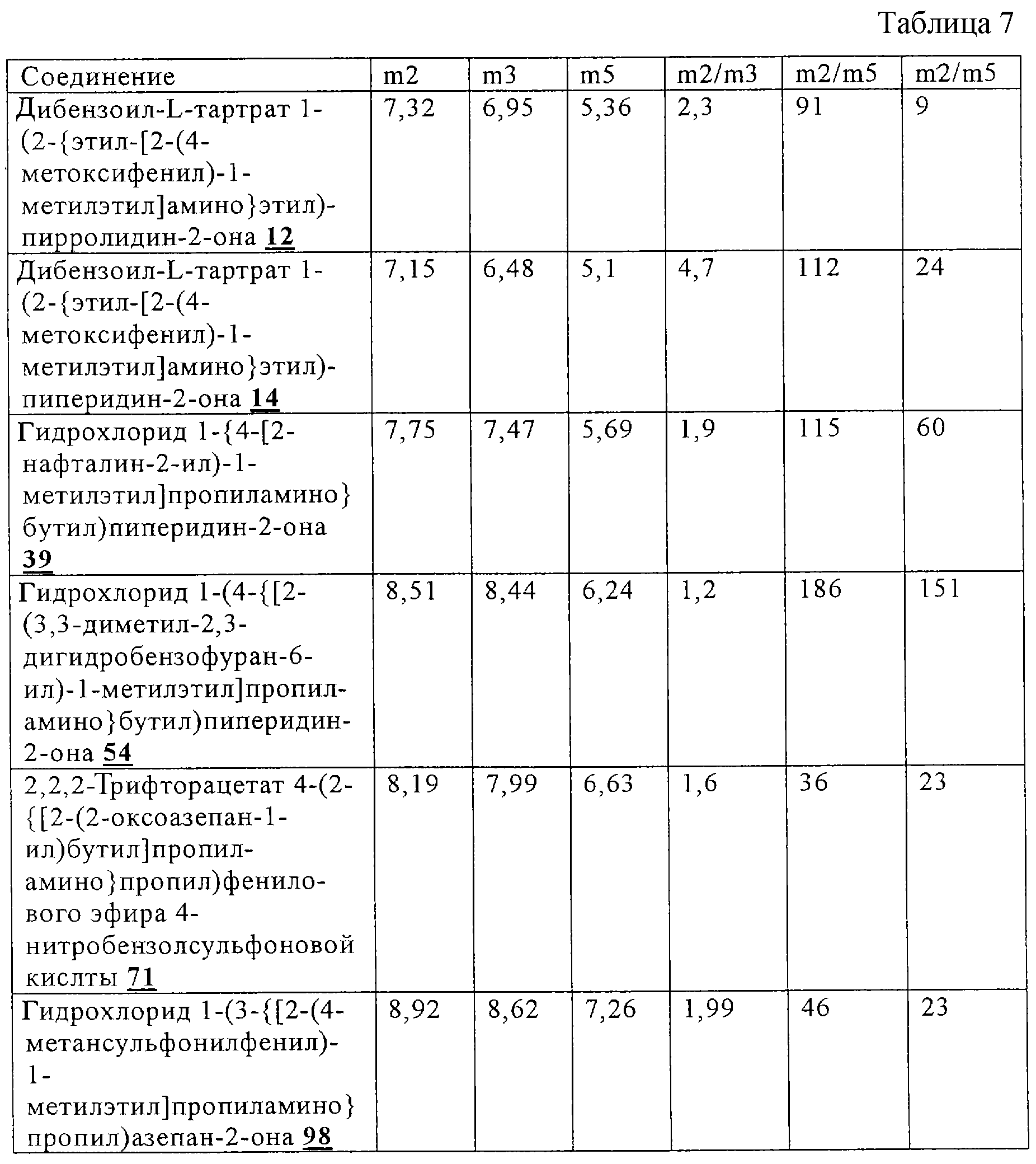


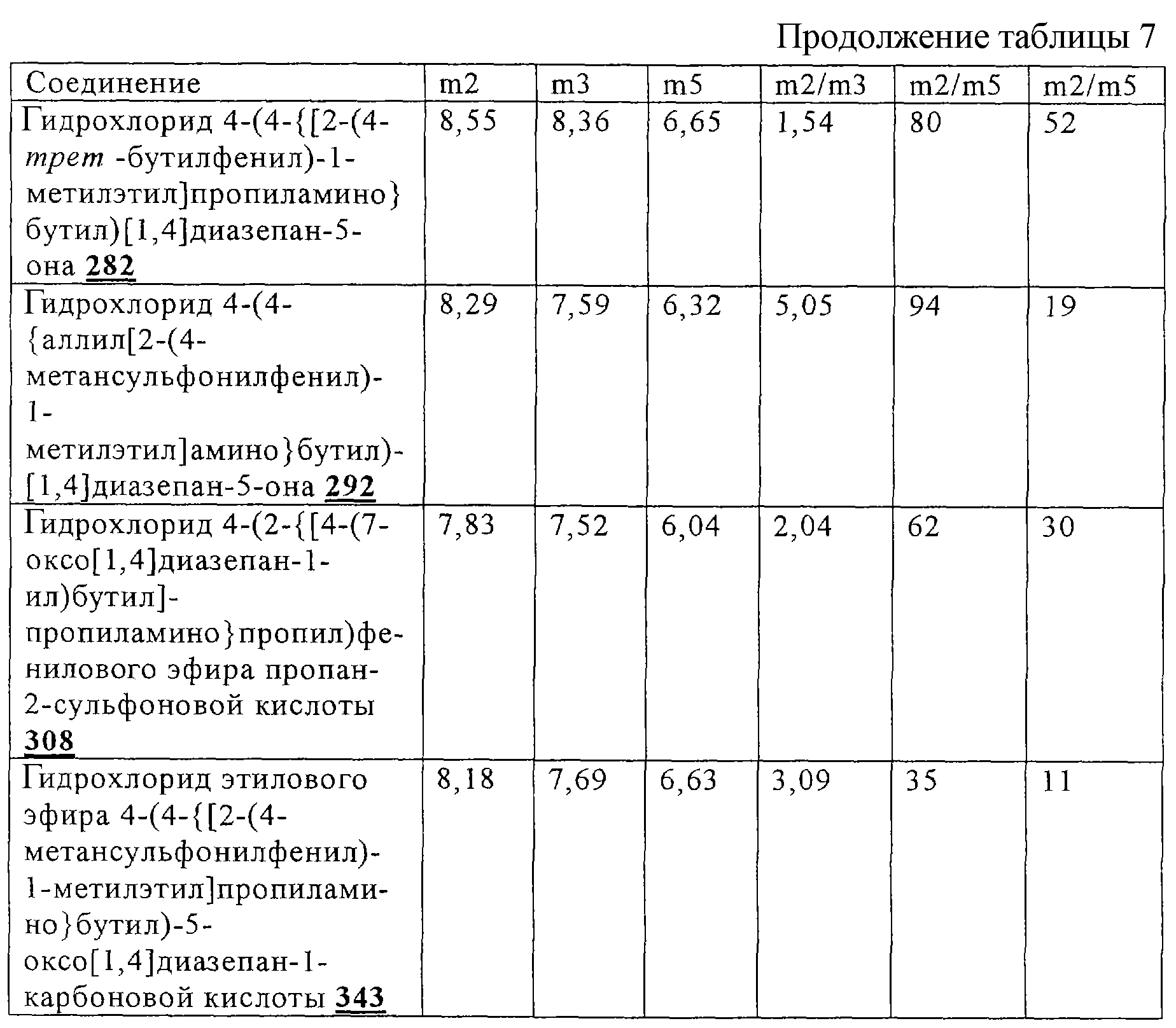
Пример 18
Модель индуцированного оксотреморином/пилокарпином слюноотделения (OIS/PIS) у анестезированных крыс
Крыс-самок линии Sprague-Dawley (от Charles-River, 200-300 г) анестезировали уретаном (1,5 г/кг подкожно) и подвергали трахеотомии. Одну бедренную вену канюлировали для введения препарата. После часового стабилизационного периода крыс предварительно обрабатывали метоктрамином (только для OIS), чтобы противодействовать брадикардии, опосредованной рецептором М2. Каждому животному вводили внутривенно одну дозу наполнителя или соединения-стандарта. Десятью минутами позже предварительно взвешенные хлопчатобумажные подушечки помещали в ротовую полость животных, вслед за этим им вводили наполнитель или оксотреморин (0,1 мг/кг внутривенно)/пилокарпин (1 мг/кг внутривенно). Свежие хлопчатобумажные подушечки помещали на пятой минуте после обработки оксотреморином/пилокарпином и собирали слюну в течение дополнительных 5 мин. Затем хлопчатобумажные подушечки (5- и 10-минутного периода) снова взвешивали, чтобы определить количество слюны, секретированной в течение 10-минутного периода.
Все группы, обработанные оксотреморином/пилокарпином, сравнивали с использованием одномерного дисперсионного анализа. Попарные сравнения проводили с использованием критерия Даннетта. Упорядоченные данные (непараметрический метод) или фактические уровни данных (параметрический метод) применяли в анализе в зависимости от результатов теста Бартлетта, который анализирует однородность дисперсии. Группы, обработанные наполнителем/оксотреморином и наполнителем/пилокарпином, сравнивали с группой, обработанной наполнителем/наполнителем, используя критерий ранговой суммы Уилкоксона. Получали оценку ID50 для каждого соединения в отношении 10-минутной общей секретируемой массы для каждого животного. Сигмоидальная модель представлена в форме зависимости:
Ответная реакция=мин+(макс-мин)/(1+(доза/ID50)**N),
где ID50 означает дозу для достижения половины максимальной ответа, N означает параметр кривизны и макс означает максимальный ответ для кривой ответной реакции на дозу. Минимальный ответ (мин) был фиксирован на модели при 0.
В этом анализе соединения по данному изобретению были активны.
Пример 19
Ингибирование индуцированных объемом сокращений у крыс
Ингибиторную активность соединений по данному изобретению в отношении мускариновых рецепторов in vivo определяли на крысах с использованием модификации способа, описанного Hegde S.S. и др., Proceedings of the 26th Annual Meeting of the International Continence Society 1996 (27-30 августа), реферат 126.
Крыс-самок линии Sprague-Dawley анестезировали уретаном и подготавливливали к внутривенному введению препаратов и в некоторых случаях для измерения артериального давления и давления внутри мочевого пузыря. Влияние исследуемых соединений на индуцированные объемом сокращения мочевого пузыря определяли у раздельных групп животных.
Индуцированные объемом рефлекторные сокращения мочевого пузыря вызывали путем заполнения мочевого пузыря физиологическим раствором. Исследуемые соединения вводили внутривенно кумулятивным способом с 10-минутными интервалами. Атропин (0,3 мг/кг внутривенно) вводили в конце исследования в качестве положительного контроля.
В этом анализе соединения по данному изобретению были активны.
Пример 20
Антимускариновая активность у анестезированных собак
Ингибиторную активность соединений по данному изобретению в отношении мускариновых рецепторов in vivo определяли на собаках, используя модификацию способа, описанного Newgreen D.T. и др., J. Urol. 1996, 155 (Suppl. 5), 1156.
Собак-самок породы бигл (от Marshall Farms, North Rose, NY) подвергали голоданию в течение 18 ч перед экспериментом при свободном доступе к воде. В день эксперимента собакам давали наркоз и поддерживали на фенобарбитале (сначала 36 мг/кг внутривенно, затем 5-10 мг/кг внутривенно для поддержки). Внутривенные жидкости также вводили собакам в течение оставшейся части эксперимента. Собакам проводили искусственную вентиляцию легких посредством эндотрахеальной трубки с респиратором Гарварда (модель 613). Как бедренные вены, так и одна бедренная артерия были канюлированы для введения препарата и измерения кровяного давления сответственно. Кровяное давление измеряли с помощью датчика Гоулда (модель 332XL) и регистрировали на записывающем приборе Гоулда (модель 3400). Был сделан подъязычный разрез, чтобы обнажить левый нижнечелюстной проток, который затем был канюлирован для сбора слюны в предварительно взвешенные пробирки. Левую слюнную железу обнажали посредством подчелюстного разреза. Выделяли хордальный язычный нерв и помещали на него биполярный электрод для стимуляции. Пробные ответные реакции на стимуляцию хордального язычного нерва получали для подтверждения надлежащего положения электрода.
По завершении хирургического вмешательства проводили инфузию физостигмина (180 мкг/кг· ч внутривенно) в течение оставшейся части эксперимента. После часа стабилизационого периода проводили две контрольных стимуляции хордального язычного нерва при 12 Гц, 10 В и продолжительности 0,5 мсек (Grass S48). Хордальный язычный нерв стимулировали в течение 20 сек и 2 мин соответственно с минимальным 10-минутным интервалом между каждой серией стимуляций. После получения двух совместимых контрольных ответов дозу наполнителя или соединения-стандарта вводили кумулятивным способом, за 3 мин перед каждой стимуляцией хордального язычного нерва. Эксперименты, в которых совместимые ответные реакции слюноотделения не были получены, не включали в анализ. Атропин (1,0 мг/кг внутривенно) давали в качестве положительного контроля в конце исследования.
Среднее артериальное давление рассчитывали как диастолическое артериальное давление + (систолическое артериальное давление - диастолическое артериальное давление)/3. Частоту сердечных сокращений получали при измерении пульсового артериального давления. Слюну собирали в предварительно взвешенные пробирки и взвешивали после каждого отбора, чтобы определить объем секретрируемой слюны. Ингибирование ответных реакций слюнной железы выражали как процент от воздействия атропина (1 мг/кг внутривенно),
Определение ED50
В случае максимального процента ингибирования слюноотделения оценку параметров проводили с использованием нелинейной смешанной модели. Методику осуществляли, используя исходно PROC NLIN и повторно PROC MIXED. Данная методика предполагает следующую сигмоидальную модель доза-ответ:

где ответ означает процент максимального ингибирования сокращения мочевого пузыря в высшей точке, х=log10 дозы обработки и 4 параметрами являются: log10 ED50 (μ ), максимальный и минимальный ответ (Макс и Мин) и кривизна (σ ). Предполагалось, что минимальный ответ составляет 0%. Данная методика предусматривала симметрию соединения для ковариоционной структуры. Это была процедура повторного построения кривой, которая объясняет зависимость между многочисленными измерениями, получаемыми от одного и того же животного, и оценкой требуемых параметров и их доверительных интервалов путем уточнения ошибочных расчетов, чтобы нести ответственность за корреляцию в пределах субъекта.
Сопоставления с базовой линией
Чтобы сопоставить каждую дозу с контролем базовой линии для каждой переменной величины, проводили двумерный дисперсионный анализ ANOVA с основными эффектами субъекта и обработки, сопровождавшийся парным t-тестом при каждом дозовом уровне. Если общий эффект обработки не был значимым (значение р>0,05) в ANOVA, уточнение Бонферрони для значений уровня значимости р использовали в парном t-тесте при каждой дозе.
Соединения по данному изобретению были активны в этом анализе.
Несмотря на то, что настоящее изобретение описано со ссылкой на специфические варианты его воплощения, специалистам должно быть понятно, что могут быть сделаны различные изменения и эквиваленты могут быть заменены без отхода от истинной сущности и объема изобретения. Кроме того, может быть проведено много модификаций, чтобы адаптировать особую ситуацию, материал, состав вещества, способ, этап или этапы способа к цели, сущности и объему настоящего изобретения. Подразумевается, что все такие модификации входят в объем прилагаемых пунктов формулы изобретения.
Реферат
Изобретение относится к органической химии и может найти применение в медицине. Описывается соединение общей формулы I

Формула
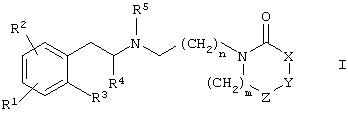


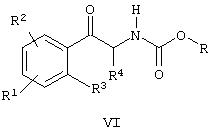
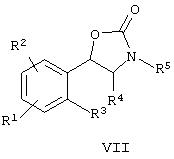
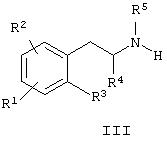
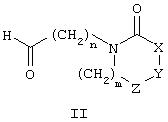

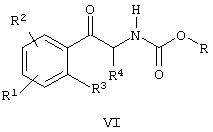
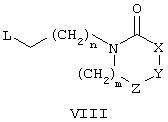

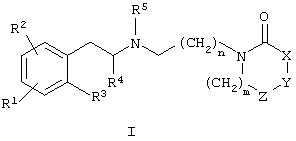

Комментарии