Способ получения высокофункциональных тромбоцитов - RU2724533C2
Код документа: RU2724533C2
Чертежи







Описание
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к способу получения тромбоцитов in vitro.
Уровень техники изобретения
[0002] Гемопоэтические клетки, используемые для терапевтического применения, требуются в случаях лечения заболеваний крови или в случаях хирургического лечения. Среди этих гемопоэтических клеток тромбоциты, которые представляют собой клетки, важные для свертывания крови (гемостаза), предшественники тромбоцитов и мегакариоциты, которые представляют собой клетки, которые продуцируют тромбоциты, являются клетками, в которых имеется особенно высокая потребность. В частности, на тромбоциты существует высокий спрос при лейкозе, трансплантации костного мозга, противораковой терапии и тому подобном, и имеется большая потребность в их стабильных поставках.
[0003] Способ получения мегакариоцитов посредством дифференцировки стволовых клеток различных типов с их последующим культивированием для высвобождения тромбоцитов в среду ранее был разработан в качестве способа получения тромбоцитов in vitro. В последнее время применимость полипотентных стволовых клеток в качестве важного источника для клеточной терапии в регенеративной медицине привлекла еще больше внимания вследствие открытия iPS клеток. Takayama, et al., например, ранее преуспели в индуцировании человеческих ES клеток для дифференцировки в мегакариоциты и тромбоциты (Непатентный документ 1).
Однако у тромбоцитов, полученных до настоящего времени in vitro, наблюдалось отсутствие присущей им функции, а именно способности сворачивать кровь.
[0004] В дополнение, при обычных способах получения тромбоцитов in vitro сталкивались с трудностью получения достаточно функциональных тромбоцитов без использования питающих клеток. Однако, поскольку питающие клетки часто используют клетки, полученные из видов, не являющихся людьми, при получении тромбоцитов желательно не использовать питающие клетки для введения людям.
[0005] Один пример ранее предложенного способа получения тромбоцитов из гемопоэтических клеток-предшественников in vitro включает культивирование мегакариоцитов в присутствии TPO и антагониста арил-гидрокарбонового рецептора (AhR) (Патентный документ 1).
Список цитирования
Патентные документы
[0006] Патентный документ 1: WO 2014/138485
Непатентные документы
[0007] Непатентный документ 1: Takayama, N. et al., Blood, 111, pp. 5298-5306, 2008
Сущность
Техническая проблема
[0008] Цель настоящего изобретения состоит в предоставлении способа эффективного получения высокофункциональных тромбоцитов из мегакариоцитов in vitro.
Решение проблемы
[0009] В результате проведения обширных исследований для решения упомянутой выше проблемы, авторы настоящего изобретения обнаружили, что, когда мегакариоциты культивируют в присутствии антагониста AhR, количество полученных тромбоцитов увеличивается, а их функция усиливается, и что в случае комбинирования с использованием ингибитора ROCK их действие является не аддитивным, но синергетическим. Также исследовали условия культивирования для получения тромбоцитов, демонстрирующих еще более высокую функциональность, что таким образом ведет к завершению настоящего изобретения.
[0010] Кроме того, авторы настоящего изобретения также обнаружили, что за счет подавления экспрессии или функции HMGA-белков увеличивается количество полученных тромбоцитов на мегакариоцитарную единицу. В дополнение, при визуальном исследовании этих мегакариоцитов наблюдали, что они становились многоядерными и увеличивались, также образуя при этом разделительную мембрану и секреторные гранулы, показывая таким образом, что авторы настоящего изобретения преуспели в стимуляции созревания мегакариоцитов in vitro, и что таким образом ведет к завершению настоящего изобретения.
[0011] А именно, настоящее изобретение относится к указанному ниже.
[A1] Средство, способствующее получению высокофункциональных тромбоцитов, которое содержит один или множество антагонистов арил-гидрокарбонового рецептора (AhR) и один или множество ингибиторов Rho-ассоциированных суперспираль-формирующих киназ (ROCK).
[A2] Средство, способствующее получению тромбоцитов, описанное в [A1], при этом антагонист AhR выбирают из группы, состоящей из 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенола (SR-1), 2-метил-2H-пиразол-3-карбоновой кислоты (2-метил-4-o-толилазо-фенил)-амида (CH-223191), N-[2-(3H-индол-3-ил)этил]-9-изопропил-2-(5-метил-3-пиридил)пурин-6-амина (GNF-351), 6,2',4'-триметоксифлавона (TMF) и 3',4'-диметоксифлавона (DMF).
[A3] Средство, способствующее получению тромбоцитов, описанное в [A1] или [A2], при этом ингибитор ROCK выбирают из группы, состоящей из Y27632, Y39983, фазудила гидрохлорида, рипазудила, SLX-2119, RKI-1447, азаиндола-1, SR-3677, стауроспорина и H1152 дигидрохлорида.
[A4] Средство, способствующее получению тромбоцитов, описанное в любом из [A1]-[A3], при этом антагонист AhR представляет собой SR-1, GNF-351 и/или CH-223191, а ингибитор ROCK представляет собой Y27632, Y39983, фазудила гидрохлорид и/или рипазудил.
[A5] Способ получения тромбоцитов, который включает стадию введения средства, способствующего получению тромбоцитов, описанного в любом из [A1]-[A4], в контакт с мегакариоцитами или с их клетками-предшественниками.
[A6] Способ, описанный в [A5], при этом стадия контакта выполняется в условиях, когда питающие клетки не используются.
[A7] Способ, описанный в [A6], который выполняется в условиях культивирования со встряхиванием.
[A8] Способ, описанный в любом из [A5]-[A7], дополнительно включающий стадию подавления экспрессии или функции группы белков At-hook с высокой подвижностью (HMGA) в мегакариоцитах или их клетках-предшественниках.
[A9] Способ, описанный в [A8], при этом подавление экспрессии или функции HMGA-белков выполняется посредством миРНК или микроРНК, которая непосредственно или опосредованно подавляет экспрессию гена HMGA.
[A10] Способ, описанный в любом из [A5]-[A9], при этом мегакариоциты представляют собой клетки, полученные посредством сверхэкспрессии по меньшей мере одного гена, выбранного из группы, состоящей из гена рака, гена polycomb и гена-супрессора апоптоза, в клетках, менее дифференцированных, чем мегакариоциты, с последующим завершением сверхэкспрессии.
[A11] Способ, описанный в [A10], при этом клетками, менее дифференцированными, чем мегакариоциты, являются гемопоэтические клетки-предшественники, вырабатываемые из полипотентных стволовых клеток.
[A12] Способ, описанный в любом из [A5]-[A11], дополнительно включающий стадию извлечения тромбоцитов из мегакариоцитов.
[A13] Препарат тромбоцитов, содержащий тромбоциты, полученные согласно способу, описанному в любом из [A5]-[A12].
[0012] [B1] Способ получения тромбоцитов, включающий стадию культивирования мегакариоцитов, на которой экспрессия или функция HMGA-белков было подавлена.
[B2] Способ, описанный в [B1], при этом подавление экспрессии или функции HMGA-белков выполняется с использованием миРНК против гена HMGA.
[B3] Способ, описанный в [B1] или [B2], при этом стадия культивирования выполняется в присутствии антагониста арил-гидрокарбонового рецептора (AhR).
[B4] Способ, описанный в любом из [B1]-[B3], при этом стадия культивирования выполняется в присутствии ингибитора ROCK.
[B5] Способ, описанный в любом из [B1]-[B4], при этом стадия культивирования выполняется в условиях, когда питающие клетки не используются.
[B6] Способ, описанный в любом из [B1]-[B5], дополнительно включающий стадию извлечения тромбоцитов из культуры, полученной согласно стадии культивирования.
[B7] Препарат тромбоцитов, содержащий тромбоциты, полученные согласно способу, описанному в любом из [B1]-[B6].
[B8] Способ созревания мегакариоцитов, включающий стадию подавления экспрессии или функции HMGA-белков в мегакариоцитах.
[B9] Способ, описанный в [B8], при этом стадия подавления экспрессии или функции HMGA-белков выполняется посредством миРНК или микроРНК, которая подавляет экспрессию гена HMGA.
[B10] Способ, описанный в [B8], при этом стадия подавления экспрессии или функции HMGA-белков выполняется с использованием миРНК или микроРНК против гена HMGA.
[B11] Способ, описанный в любом из [B8]-[B10], при этом стадия подавления экспрессии или функции HMGA-белков выполняется посредством культивирования в среде, содержащей антагонист AhR.
[B12] Способ, описанный в любом из [B8]-[B11], при этом стадия подавления экспрессии или функции HMGA-белков выполняется посредством культивирования в среде, содержащей ингибитор ROCK.
[B13] Способ, описанный в любом из [B8]-[B12], при этом стадия подавления экспрессии или функции HMGA-белков выполняется в условиях, когда питающие клетки не используются.
[B14] Способ, описанный в любом из [B3]-[B6] и [B11]-[B13], при этом антагонист AhR выбирают из группы, состоящей из 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенола (SR-1), 2-метил-2H-пиразол-3-карбоновой кислоты (2-метил-4-o-толилазо-фенил)-амида (CH-223191), N-[2-(3H-индол-3-ил)этил]-9-изопропил-2-(5-метил-3-пиридил)пурин-6-амина (GNF-351), 6,2',4'-триметоксифлавона (TMF) и 3',4'-диметоксифлавона (DMF).
[B15] Способ, описанный в любом из [B4]-[B6] и [B12]-[B14], при этом ингибитор ROCK выбирают из группы, состоящей из Y27632, Y39983, фазудила гидрохлорида, рипазудила, SLX-2119, RKI-1447, азаиндола-1, SR-3677, стауроспорина и H1152 дигидрохлорида.
[B16] Способ, описанный в любом из [B1]-[B15], при этом мегакариоциты представляют собой клетки, в которых по меньшей мере один ген, выбранный из группы, состоящей из гена рака, гена polycomb и гена-супрессора апоптоза, был сверхэкспрессирован в клетках, менее дифференцированных, чем мегакариоциты, с последующим завершением этой сверхэкспрессии.
[B17] Способ, описанный в [B16], при этом клетками, менее дифференцированными, чем мегакариоциты, являются гемопоэтические клетки-предшественники, вырабатываемые из полипотентных стволовых клеток.
[B18] Мегакариоциты, в которых экспрессия или функция HMGA-белков было подавлена.
[B19] Мегакариоциты, описанные в [B18], содержащие миРНК, микроРНК или кодирующую их нуклеиновую кислоту, которая подавляет экспрессию HMGA-белков.
[B20] Мегакариоциты, описанные в [B18] или [B19], содержащие по меньшей мере один экзогенный ген, выбранный из группы, состоящей из гена рака, гена polycomb и гена-супрессора апоптоза, в их хромосоме.
[B21] Способ получения тромбоцитов, включающий стадию культивирования мегакариоцитов в среде, содержащей антагонист арил-гидрокарбонового рецептора (AhR).
[B22] Способ, описанный в [B21], при этом среда дополнительно содержит ингибитор ROCK.
[B23] Способ, описанный в [B21] или [B22], при этом стадия культивирования выполняется в условиях, когда питающие клетки не используются.
[B24] Способ, описанный в любом из [B21]-[B23], при этом антагонист AhR выбирают из группы, состоящей из 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенола (SR-1), 2-метил-2H-пиразол-3-карбоновой кислоты (2-метил-4-o-толилазо-фенил)-амида (CH-223191), N-[2-(3H-индол-3-ил)этил]-9-изопропил-2-(5-метил-3-пиридил)пурин-6-амина (GNF-351), 6,2',4'-триметоксифлавона (TMF) и 3',4'-диметоксифлавона (DMF).
[B25] Способ, описанный в любом из [B21]-[B24], при этом ингибитор ROCK выбирают из группы, состоящей из Y27632, Y39983, фазудила гидрохлорида, рипазудила, SLX-2119, RKI-1447, азаиндола-1, SR-3677, стауроспорина и H1152 дигидрохлорида.
[B26] Способ, описанный в любом из [B21]-[B25], при этом мегакариоциты представляют собой клетки, в которых по меньшей мере один ген, выбранный из группы, состоящей из гена рака, гена polycomb и гена-супрессора апоптоза, был сверхэкспрессирован в клетках, менее дифференцированных, чем мегакариоциты, с последующим завершением этой сверхэкспрессии.
[B27] Способ, описанный в [B26], при этом клетками, менее дифференцированными, чем мегакариоциты, являются гемопоэтические клетки-предшественники, вырабатываемые из полипотентных стволовых клеток.
Положительные результаты изобретения
[0013] Согласно настоящему изобретению, высокофункциональные тромбоциты можно эффективно получать без использования питающих клеток. Поскольку не требуется использование питающих клеток, для получения тромбоцитов может использоваться вертикальное, крупномасштабное устройство для культивирования, и тромбоциты для клинического применения можно эффективно получать в больших объемах.
Краткое Описание чертежей
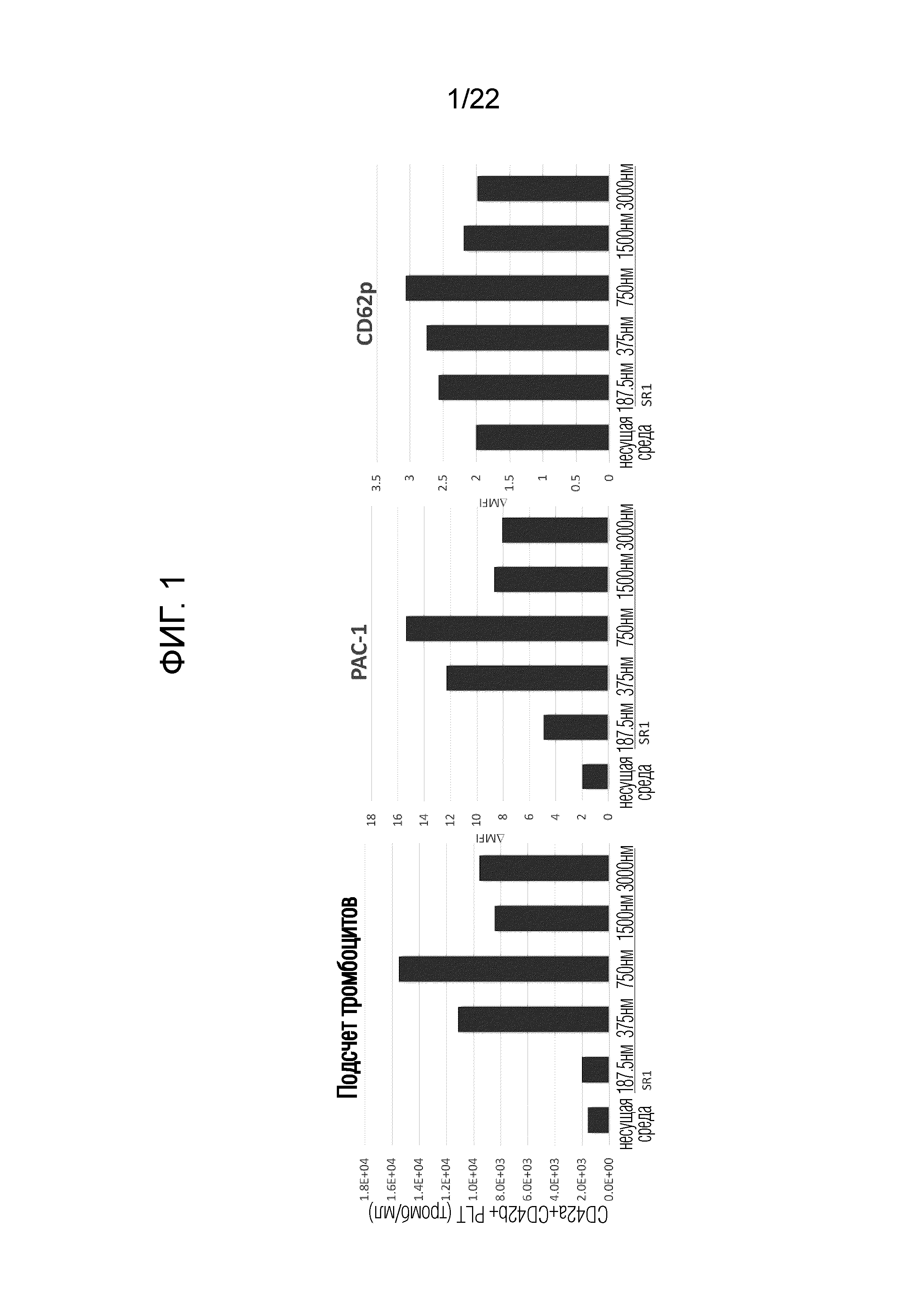
[0014] Фиг. 1 показывает результаты измерения количества и функции полученных тромбоцитов путем проведения статического культивирования в разных концентрациях SR-1 (антагониста AhR) в среде мегакариоцитов.
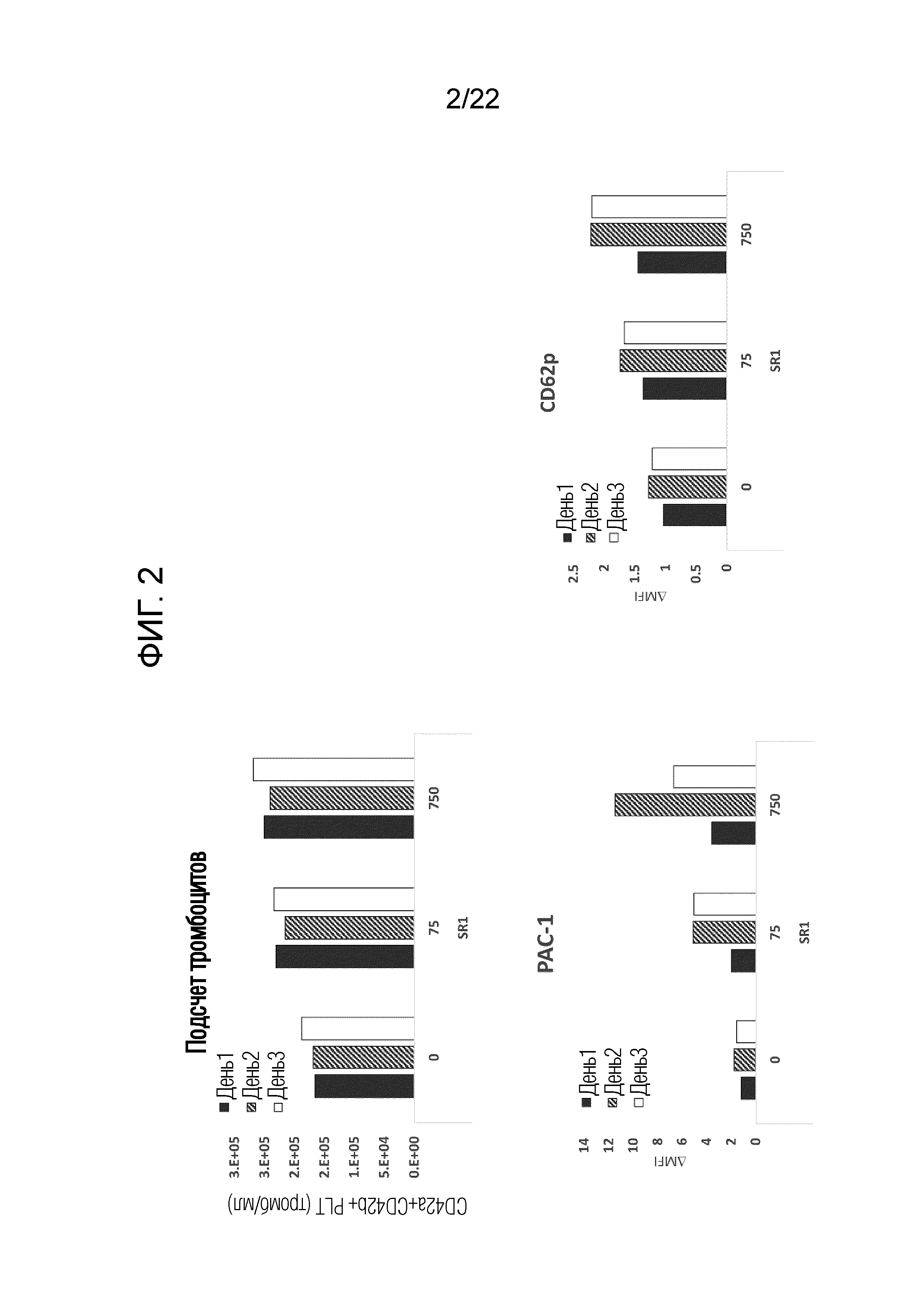
Фиг. 2 показывает результаты измерения количества и функции полученных тромбоцитов при проведении статического культивирования после добавления SR-1, изменяя в то же время количество дней культивирования после субкультивирования.
Фиг. 3 показывает результаты измерения количества и функции полученных тромбоцитов путем проведения культивирования со встряхиванием в разных концентрациях SR-1 в среде мегакариоцитов.
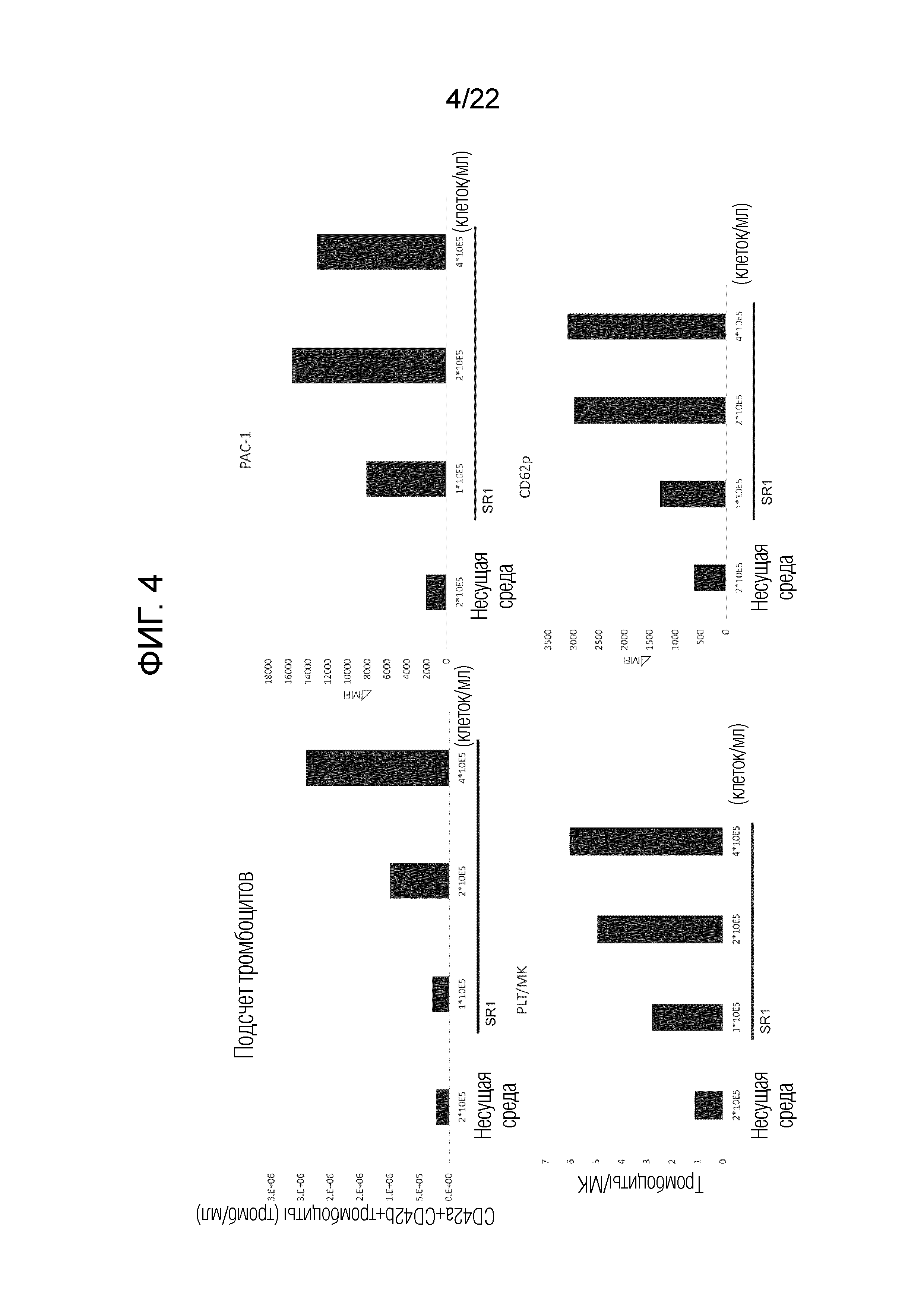
Фиг. 4 показывает результаты измерения количества и функции полученных тромбоцитов путем проведения культивирования со встряхиванием с разной плотностью посева мегакариоцитов во время добавления SR-1.
Фиг. 5 показывает результаты измерения количества и функции полученных тромбоцитов путем добавления в среду мегакариоцитов аналогов SR-1 и проведения статического культивирования.
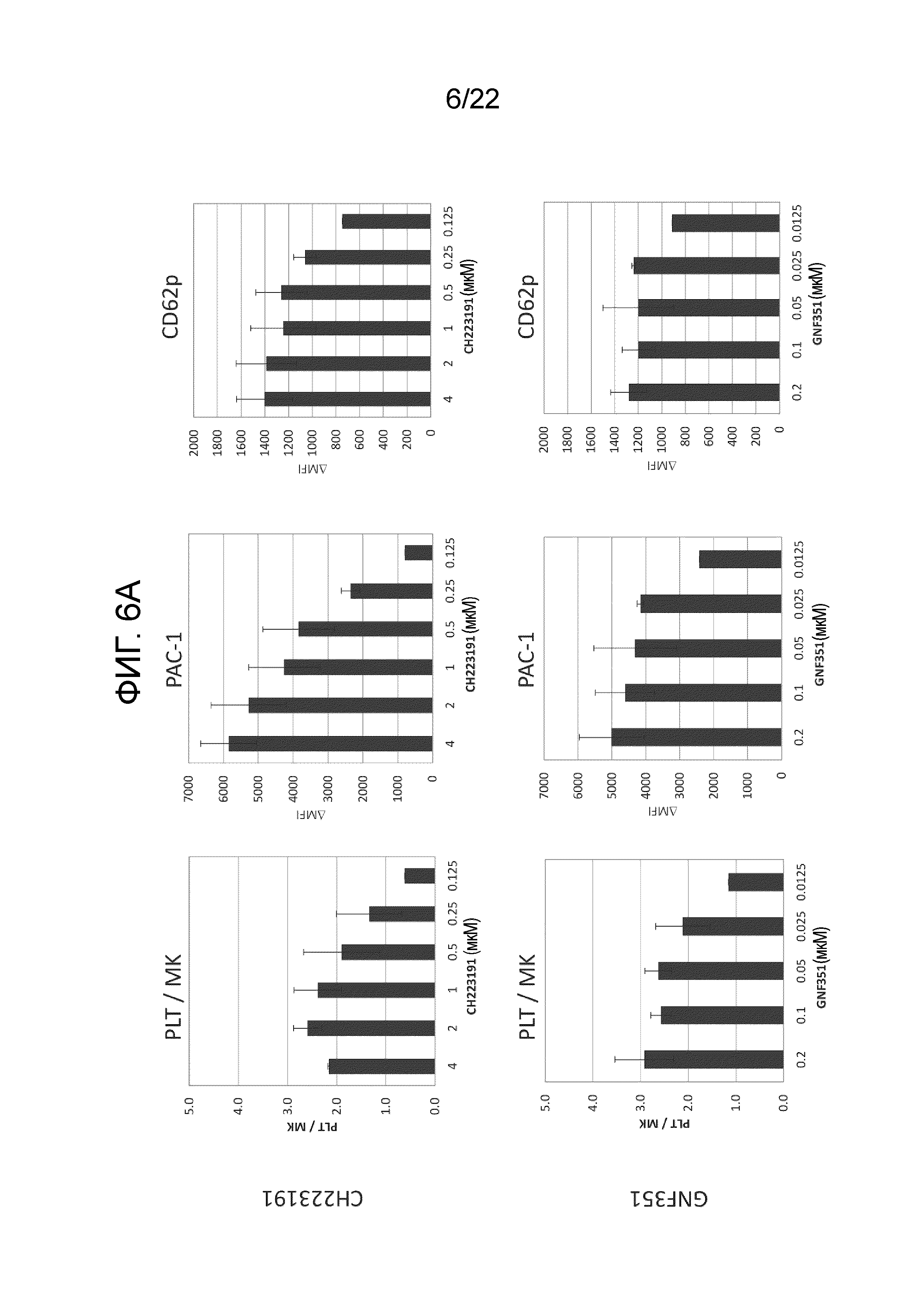
Фиг. 6A показывает результаты измерения количества и функции полученных тромбоцитов путем добавления в среду мегакариоцитов разных концентраций аналогов SR-1 (CH-223191 или GNF-351) и проведения статического культивирования.
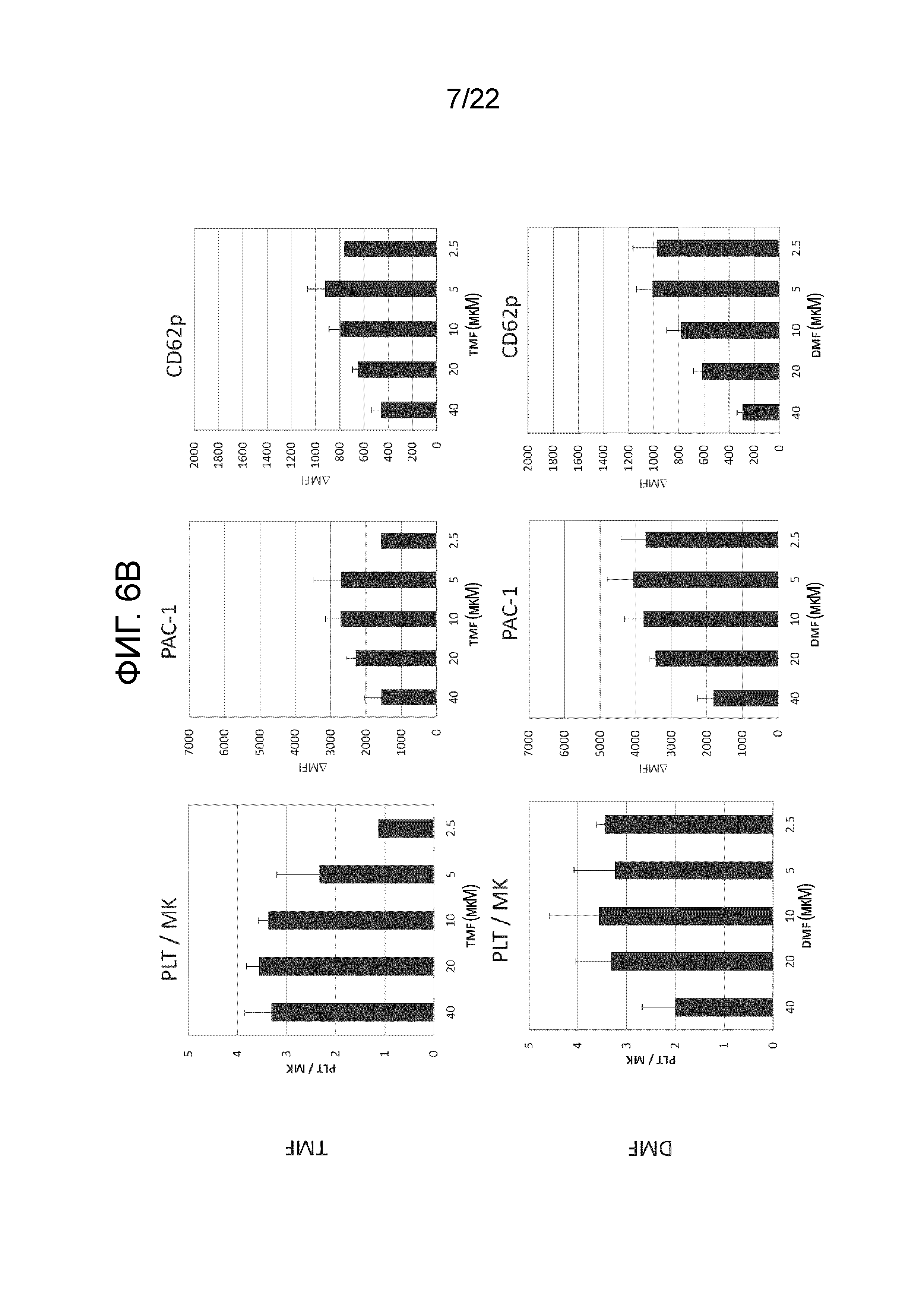
Фиг. 6B показывает результаты измерения количества и функции полученных тромбоцитов путем добавления в среду мегакариоцитов разных концентраций аналогов SR-1 (TMF или DMF) и проведения статического культивирования.
Фиг. 7 показывает результаты измерения количества и функции тромбоцитов, полученных путем добавления только SR-1, только Y27632 (ингибитора ROCK) или комбинации SR-1 и Y27632, и статического культивирования (6 лунок) или культивирования со встряхиванием (E125) мегакариоцитов.
Фиг. 8 показывает результаты измерения функции полученных тромбоцитов путем добавления только SR-1, только Y27632 (ингибитора ROCK) или комбинации SR-1 и Y27632 и статического культивирования (6 лунок) или культивирования со встряхиванием (E125) мегакариоцитов.
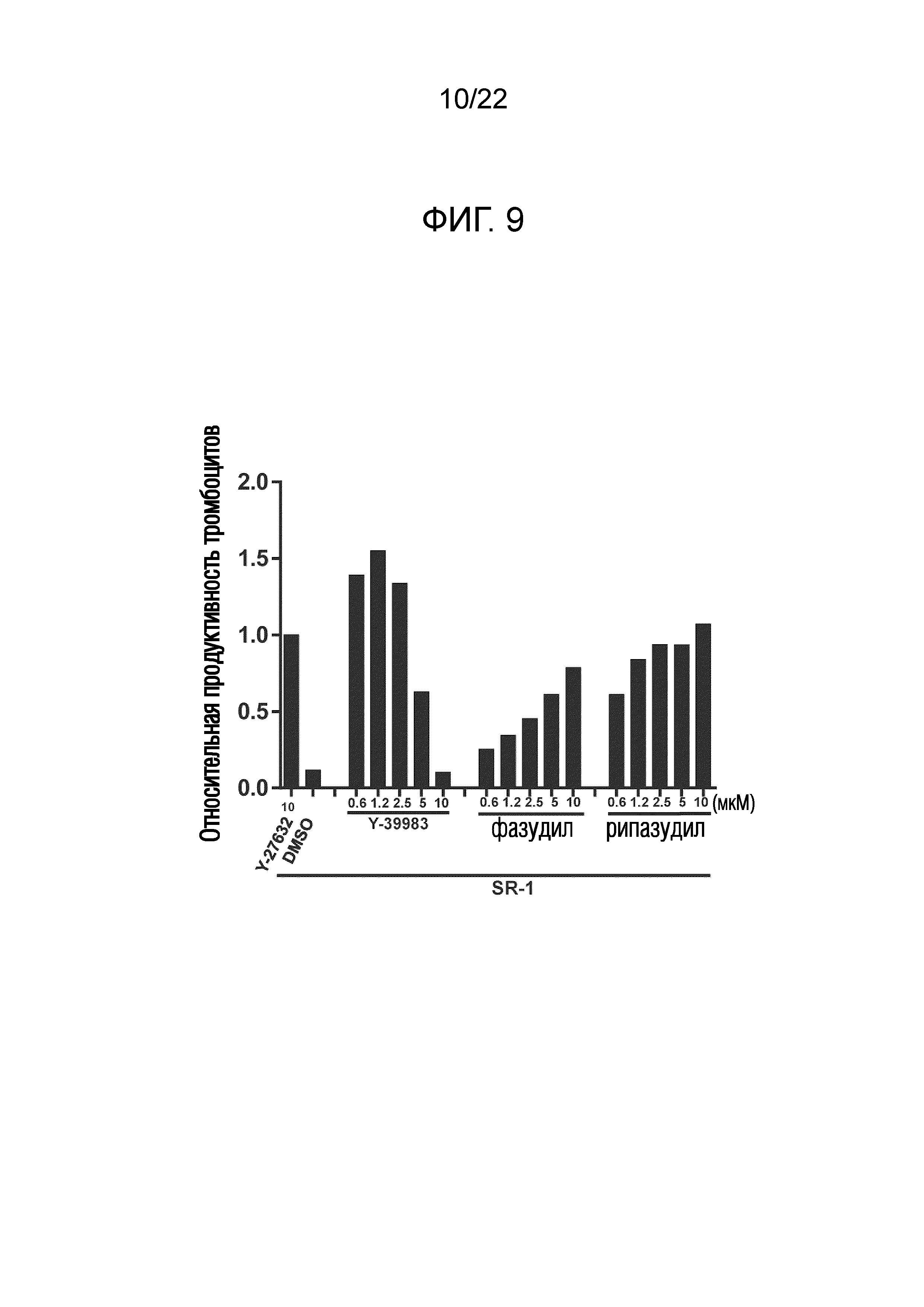
Фиг. 9 показывает результаты измерения количества полученных тромбоцитов путем добавления комбинации SR-1 и Y-39983, фазудила гидрохлорида или рипазудила (ингибиторов ROCK) и культивирования мегакариоцитов со встряхиванием (E125).
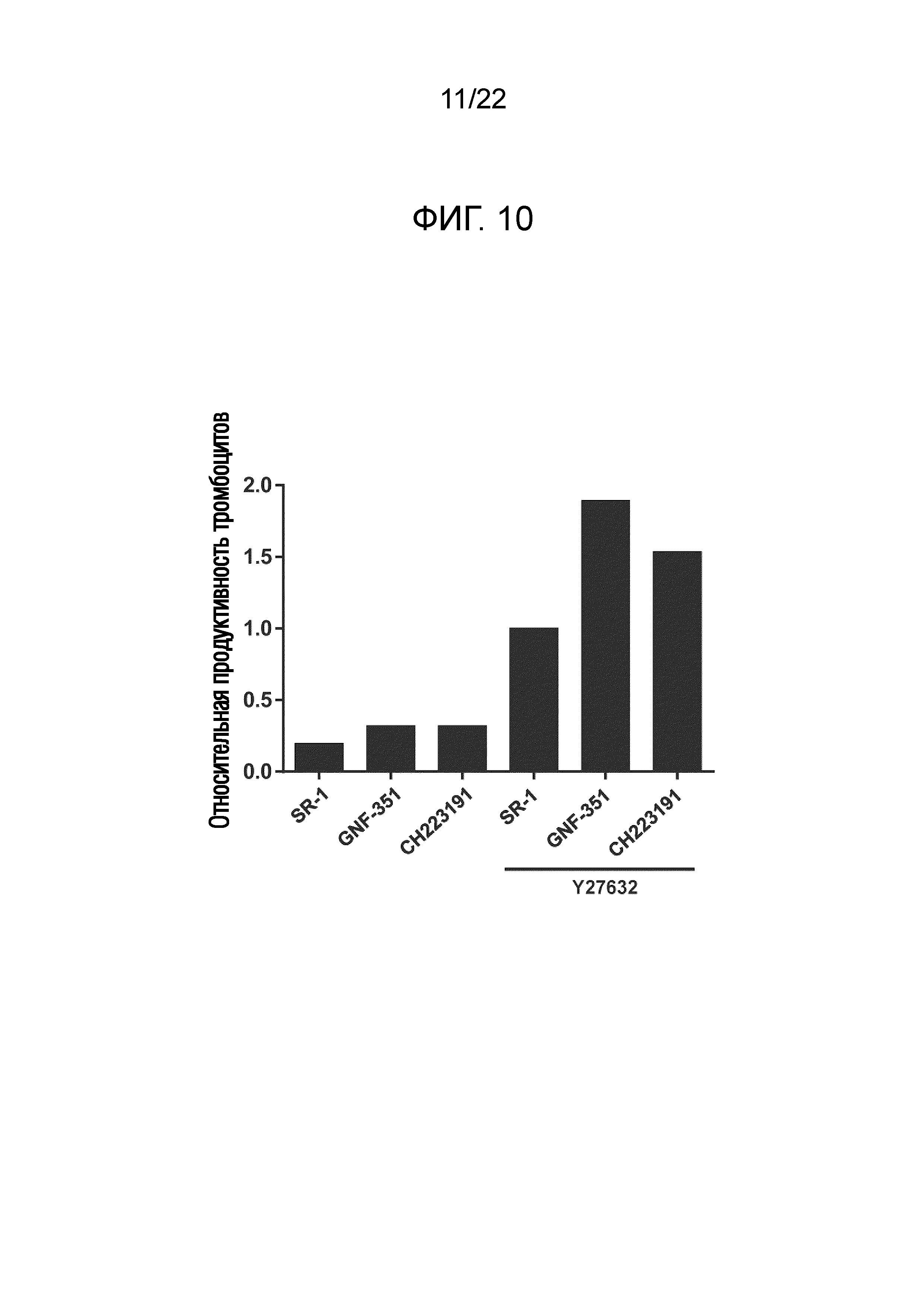
Фиг. 10 показывает результаты измерения количества полученных тромбоцитов путем добавления комбинаций GNF-351 или CH-223191 (антагонистов AhR) и Y27632 (ингибитора ROCK) и культивирования мегакариоцитов со встряхиванием (E125).
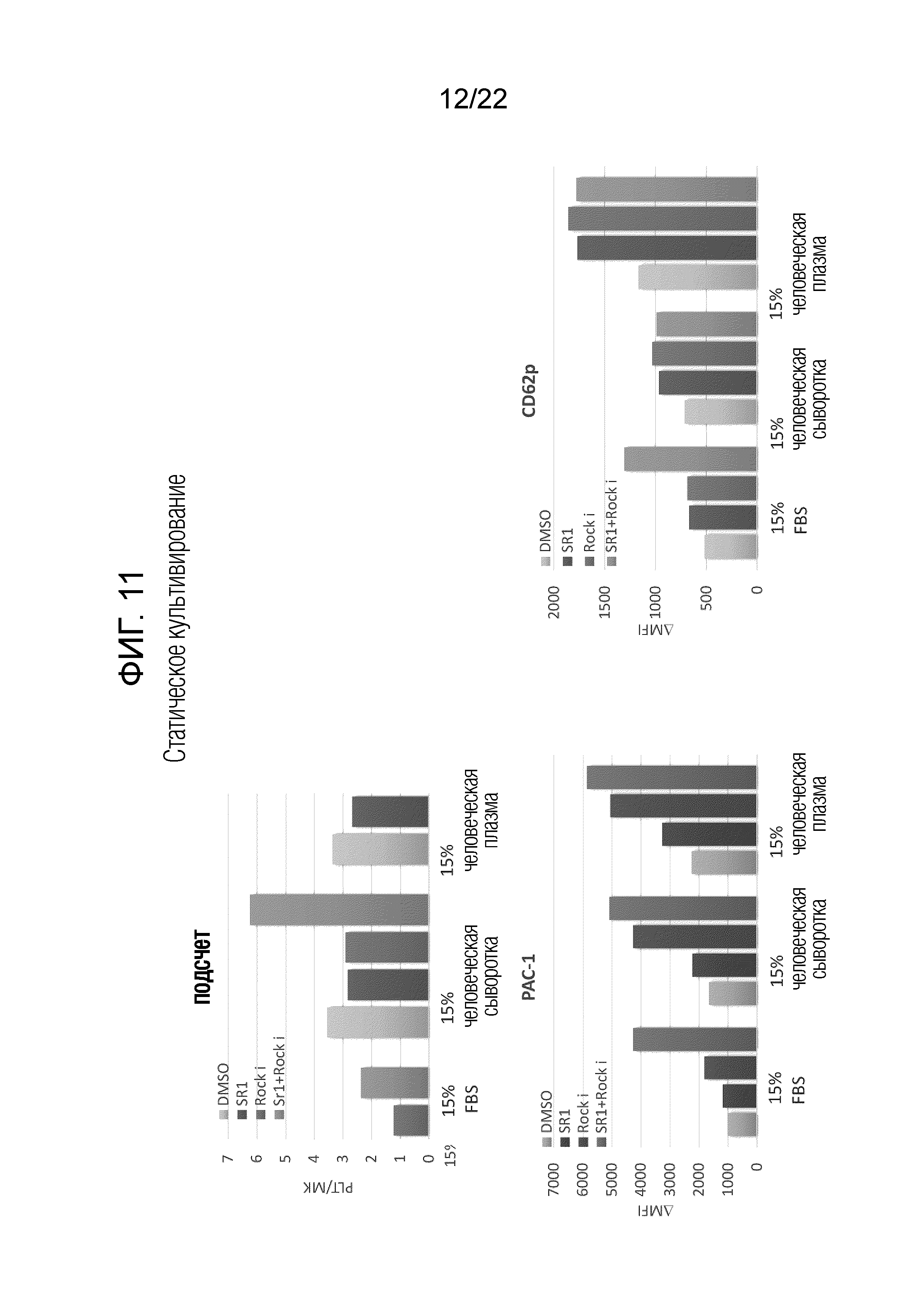
Фиг. 11 показывает количество полученных тромбоцитов на один мегакариоцит и долю PAC-1-позитивных тромбоцитов или CD62p-позитивных тромбоцитов, когда мегакариоциты статически культивировали после добавления 15% человеческой сыворотки или 15% человеческой плазмы вместо FBS в присутствии только SR-1, в присутствии только Y27632 или в присутствии комбинации SR-1 и Y27632.
Фиг. 12 показывает количество полученных тромбоцитов на один мегакариоцит и долю PAC-1-позитивных тромбоцитов или CD62p-позитивных тромбоцитов, когда мегакариоциты культивировали со встряхиванием после добавления 15% человеческой сыворотки или 15% человеческой плазмы вместо FBS в присутствии комбинации SR-1 и Y27632.
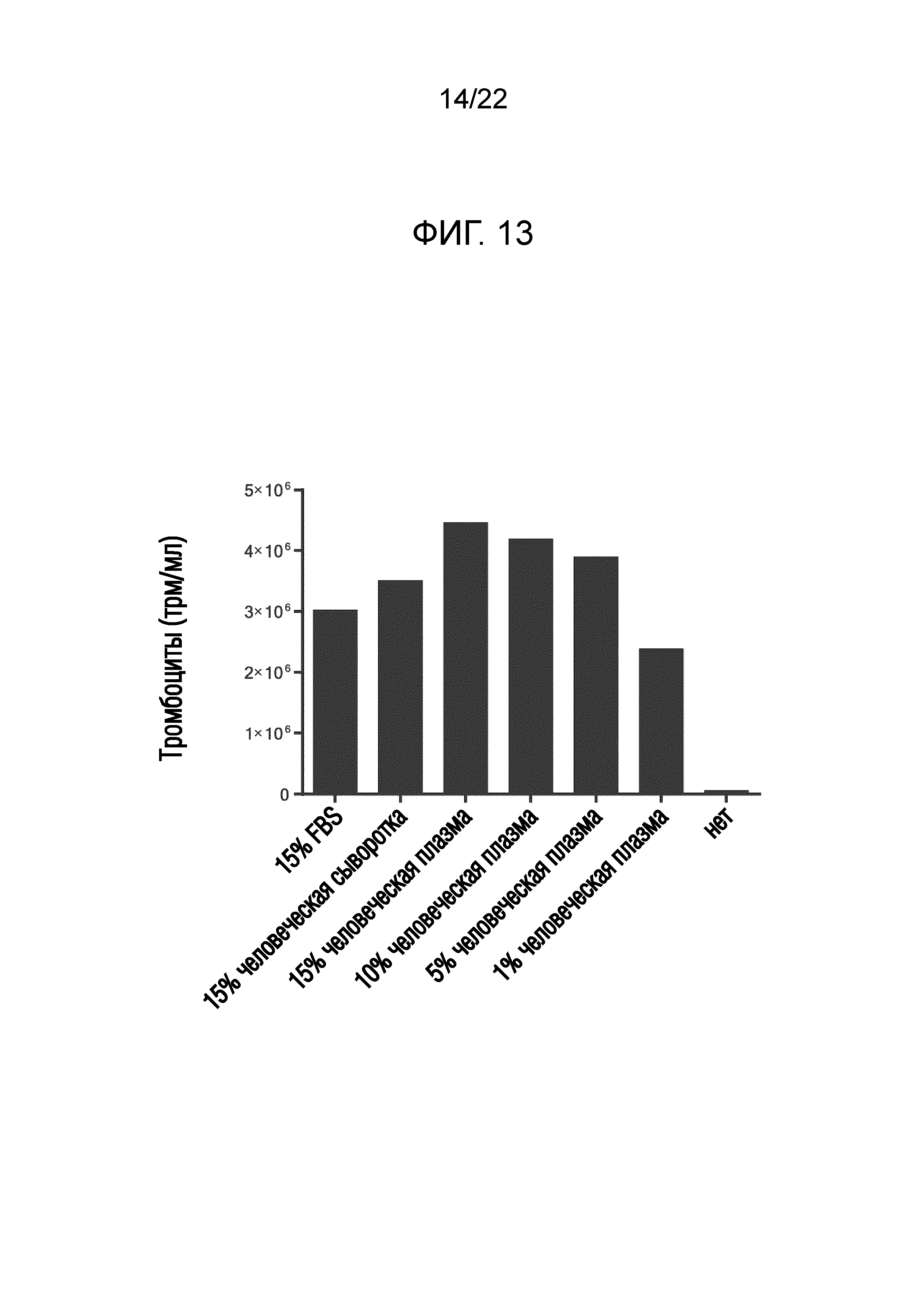
Фиг. 13 показывает результаты исследования зависимости количества полученных тромбоцитов от концентрации плазмы в присутствии комбинации SR-1 и Y27632.
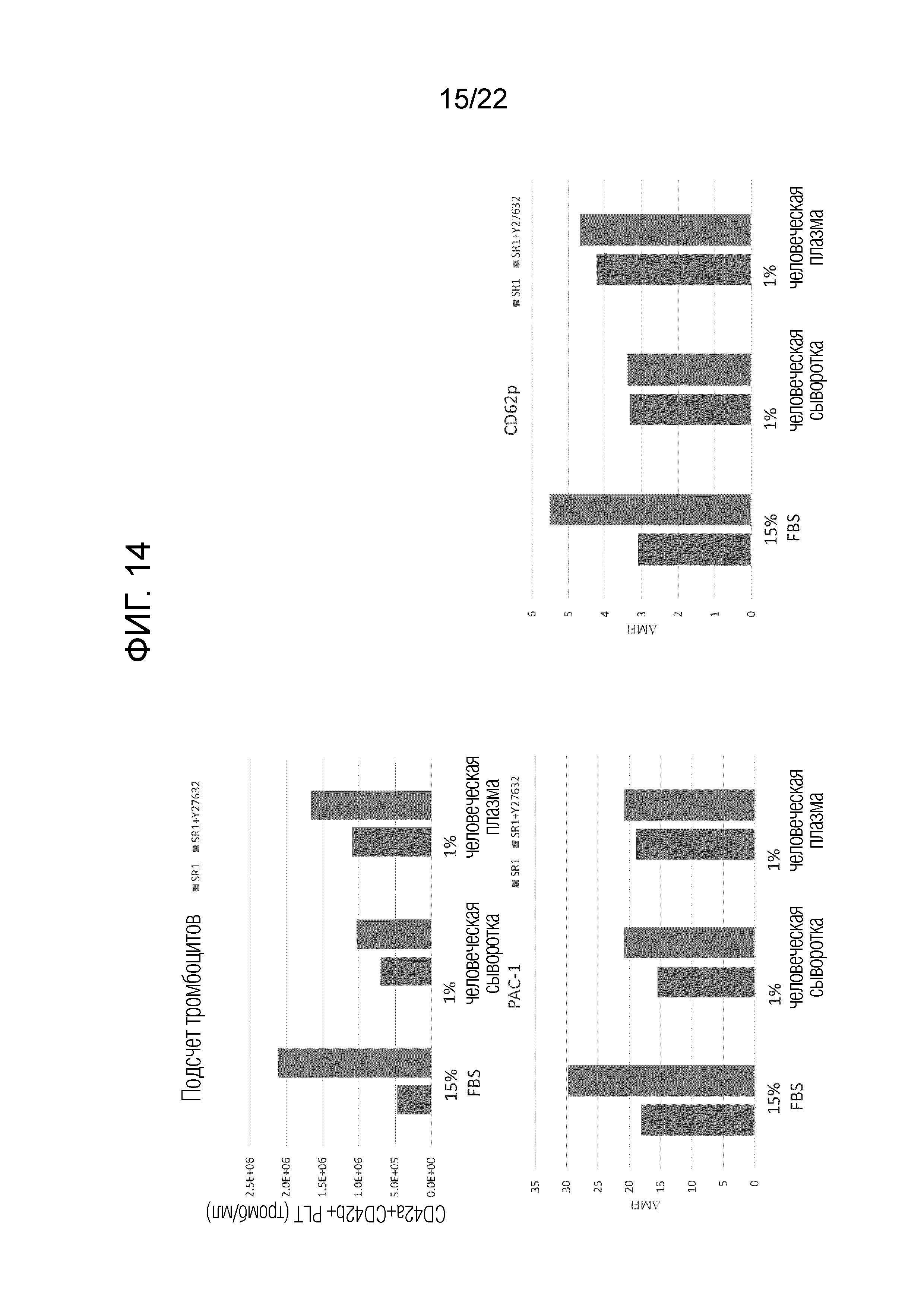
Фиг. 14 показывает количество полученных тромбоцитов на один мегакариоцит и долю PAC-1-позитивных тромбоцитов или CD62p-позитивных тромбоцитов, когда мегакариоциты статически культивировали после добавления 1% человеческой сыворотки или 1% человеческой плазмы в присутствии только SR-1 или в присутствии комбинации SR-1 и Y27632.
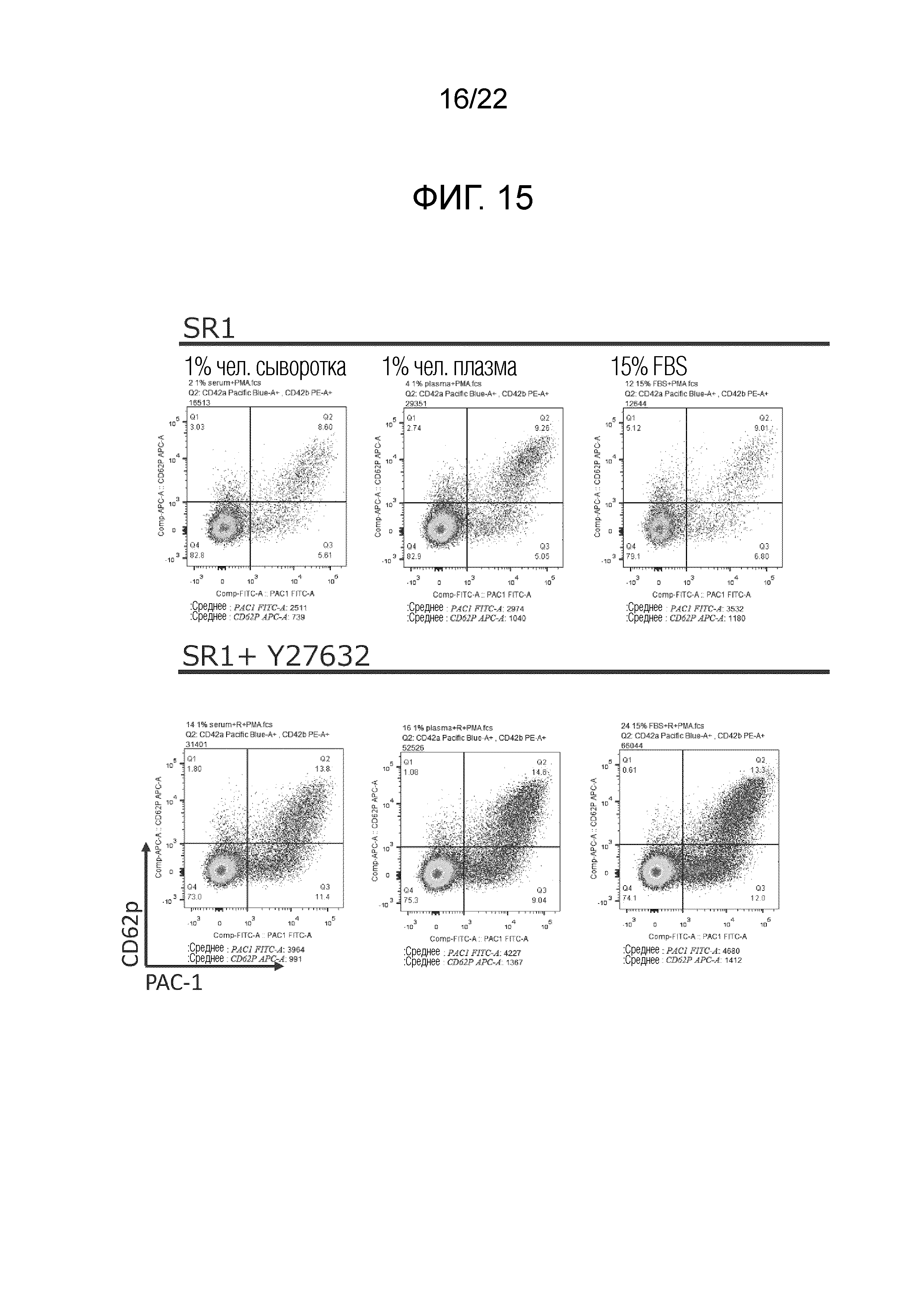
Фиг. 15 показывает результаты проведения проточной цитометрии на культуре в случае фиг. 14 с использованием антител анти-CD62p и антител анти-PAC-1.
Фиг. 16 показывает обзор эксперимента, включающего подавление экспрессии гена HMGA2 и гена RUNX1 shRNA в мегакариоцитах, иммортализованных посредством сверхэкспрессии гена BMI1, гена c-MYC и гена BCL-xL.
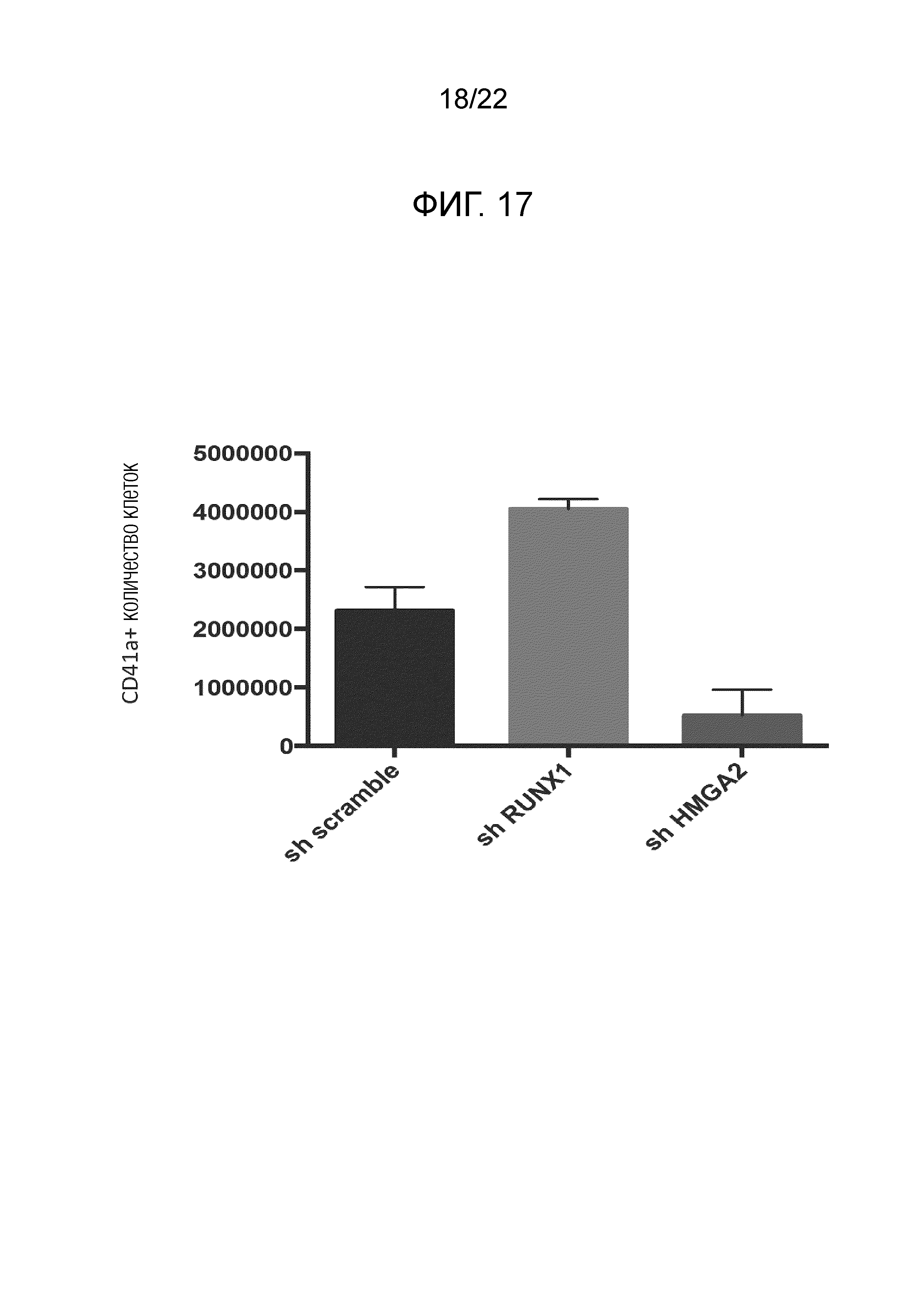
Фиг. 17 показывает результаты измерения количества CD41a-положительных клеток после культивирования мегакариоцитов, иммортализованных путем сверхэкспрессии гена BMI1, гена c-MYC и гена BCL-xL в присутствии shRNA, показанной на фиг. 16.
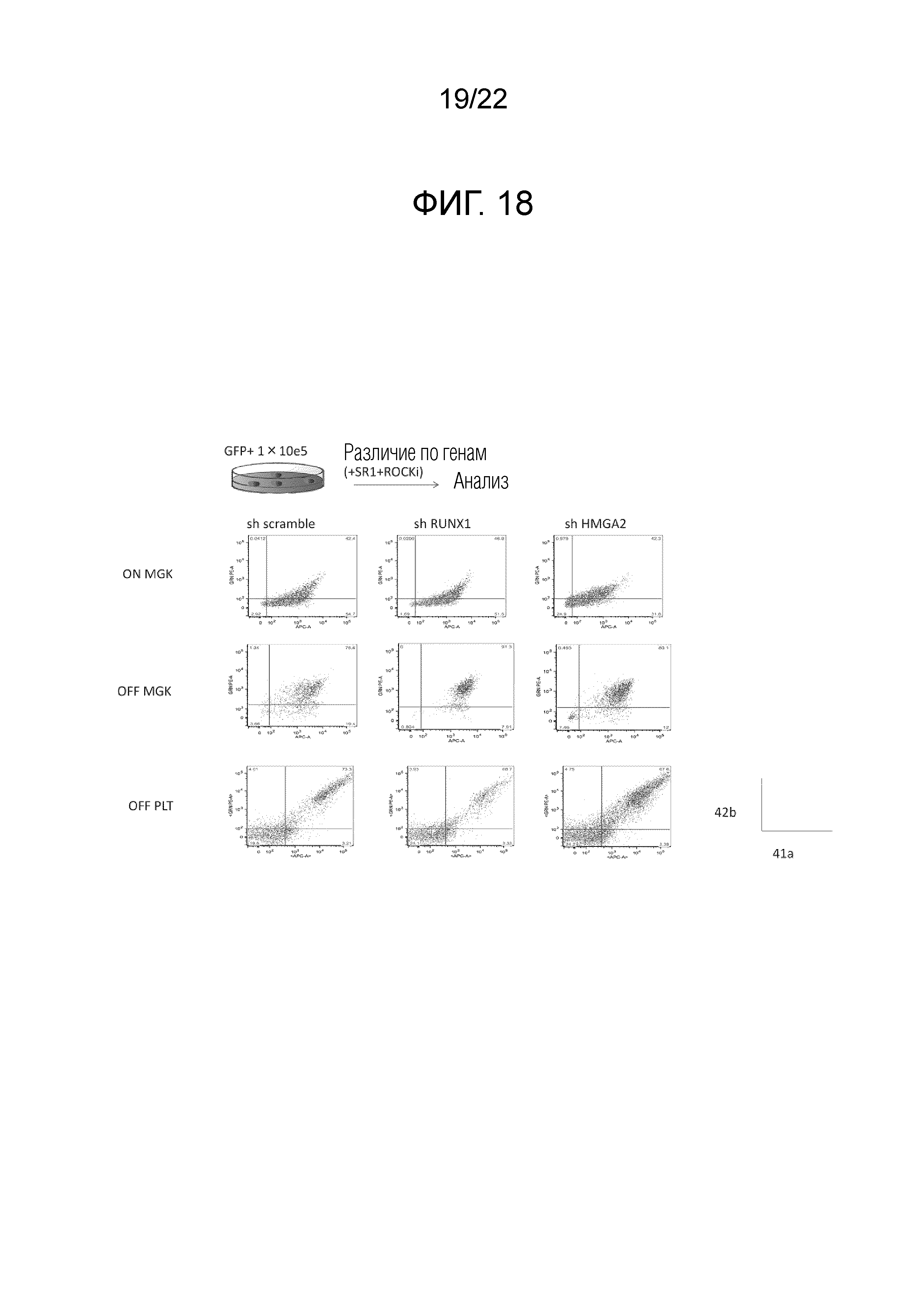
Фиг. 18 показывает результаты проведения проточной цитометрии с использованием антител анти-CD42b и антител анти-41a на мегакариоцитах и тромбоцитах перед и после окончания сверхэкспрессии гена BMI1, гена c-MYC и гена BCL-xL.
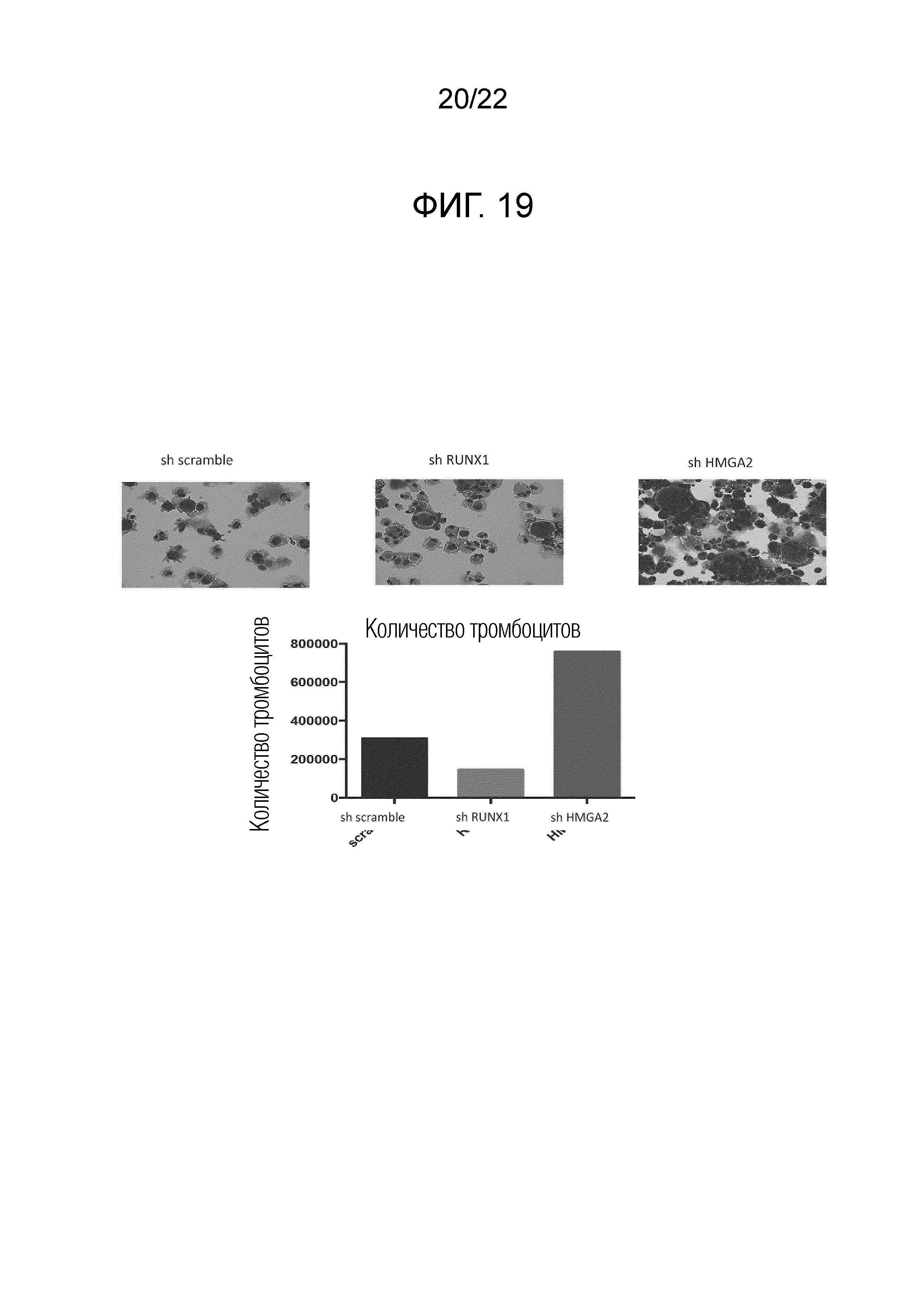
Фиг. 19 показывает результаты наблюдения состояния мегакариоцитов (сверху) и измерения количества полученных тромбоцитов (снизу), когда мегакариоциты культивировали после окончания сверхэкспрессии гена BMI1, гена c-MYC и гена BCL-xL.
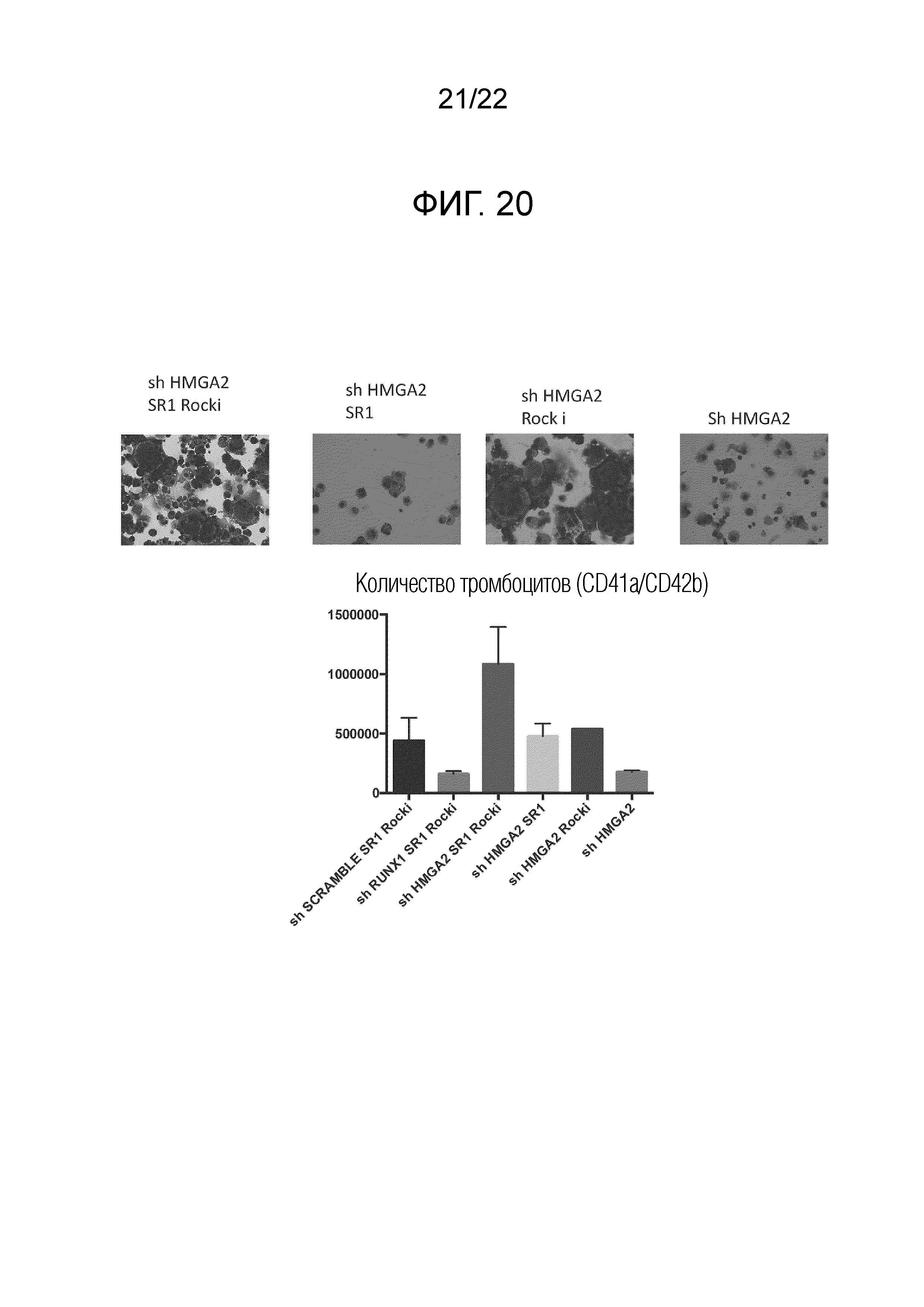
Фиг. 20 показывает результаты наблюдения состояния мегакариоцитов (сверху) и количества полученных тромбоцитов на единицу клеток (1×105 клеток) (снизу), когда мегакариоциты, введенные с миРНК против HMGA2 и RUNX1 или контроля (показано, как shHMGA2, shRUNX1 и shSCRAMBLE, соответственно), культивировали в присутствии или отсутствии добавления SR-1 и/или ингибитора ROCK после окончания сверхэкспрессии гена BMI1, гена c-MYC и гена BCL-xL. На чертеже SR-1 относится к добавлению SR-1, тогда как ROCKi относится к добавлению Y27632.
Фиг. 21 изображает электронные микрофотограммы мегакариоцитов, введенных с миРНК против HMGA2 и RUNX1 или контроля (показано, как shHMGA2, shRUNX1 и shSCRAMBLE, соответственно), которые культивировали после добавления SR-1 и ингибитора ROCK после окончания сверхэкспрессии гена BMI1, гена c-MYC и гена BCL-xL. Нижний ряд микрофотограмм показывает увеличенные изображения верхнего ряда микрофотограмм.
Описание вариантов осуществления
[0015] (Первый Аспект)
В своем первом аспекте настоящее изобретение предоставляет средство, способствующее получению тромбоцитов, содержащее один или множество антагонистов арил-гидрокарбонового рецептора (AhR) или один или множество ингибиторов ROCK (Rho-ассоциированной суперспираль-формирующей киназы). В другом аспекте настоящее изобретение дополнительно предоставляет способ получения тромбоцитов, который включает стадию введения мегакариоцитов или их клеток-предшественников в контакт с упомянутым выше средством, способствующим получению тромбоцитов.
[0016] Как использовано в данном документе, «мегакариоциты» относятся к самым большим клеткам, имеющимся в костном мозге в организме, и характеризуются высвобождением тромбоцитов. В дополнение, мегакариоциты также характеризуются тем, что они являются позитивными для маркеров CD41a, CD42a и CD42b клеточной поверхности, а также могут дополнительно экспрессировать маркеры, выбранные из группы, состоящей из CD9, CD61, CD62p, CD42c, CD42d, CD49f, CD51, CD110, CD123, CD131 и CD203c. Хотя мегакариоциты имеют геном, который в 16-32 раза больше, чем геном нормальных клеток, когда они становятся многоядерными (полиплоидными), в настоящем описании, в случае простого упоминания мегакариоцитов, охватываются как многоядерные мегакариоциты, так и мегакариоциты перед тем, как они становятся многоядерными, при условии, что они обладают упомянутыми выше характеристиками. «Мегакариоциты перед тем, как они становятся многоядерными» имеют такое же значение, как «незрелые мегакариоциты» или «мегакариоциты фазы роста».
[0017] Мегакариоциты могут быть получены разными известными способами. В WO 2011/034073 описан неограничивающий пример способа получения мегакариоцитов. В этом способе неограниченно пролиферирующие иммортализованные мегакариоциты могут быть получены посредством сверхэкспрессии гена рака и гена polycomb в «клетках, менее дифференцированных, чем мегакариоциты», или другими словами, клетках-предшественниках мегакариоцитов (также в рассматриваемом описании просто называемые «клетки-предшественники»). В дополнение, согласно способу, описанному в WO 2012/157586, иммортализованные мегакариоциты также могут быть получены посредством сверхэкспрессии гена-супрессора апоптоза в «клетках, менее дифференцированных, чем мегакариоциты». Эти иммортализованные мегакариоциты становятся многоядерными и высвобождают тромбоциты в результате окончания этой сверхэкспрессии гена.
[0018] Для получения мегакариоцитов способы, описанные в упомянутых выше публикациях, также могут быть объединены. В этом случае сверхэкспрессия гена рака, гена polycomb и гена-супрессора апоптоза может проводиться одновременно или последовательно. Например, многоядерные мегакариоциты могут быть получены посредством сверхэкспрессии гена рака и гена polycomb, подавления их сверхэкспрессии, а затем сверхэкспрессии гена-супрессора апоптоза с последующим подавлением их сверхэкспрессии. В дополнение, многоядерные мегакариоциты также могут быть получены путем одновременной сверхэкспрессии гена рака, гена polycomb и гена-супрессора апоптоза с последующим одновременным подавлением их сверхэкспрессии. Многоядерные мегакариоциты также могут быть получены путем сначала сверхэкспрессии гена рака и гена polycomb с последующей сверхэкспрессией гена-супрессора апоптоза, и в заключение одновременного подавления их сверхэкспрессии.
[0019] В настоящем описании «клетки, менее дифференцированные, чем мегакариоциты» или «клетки-предшественники мегакариоцитов» относятся к клеткам, обладающим способностью дифференцировки в мегакариоциты, которые на разных стадиях дифференцировки изменяются от гемопоэтических стволовых клеток до мегакариоцитов. Неограничивающие примеры клеток, менее дифференцированных, чем мегакариоциты, включают гемопоэтические стволовые клетки, гемопоэтические клетки-предшественники, CD34-положительные клетки и эритро/мегакариоцитарные предшественники (MEP). Эти клетки могут быть получены путем выделения, например, из костного мозга, пуповинной крови или периферической крови и, кроме того, могут быть получены путем индуцирования дифференцировки из менее дифференцированных клеток, таких как ES клетки, iPS клетки и другие полипотентные стволовые клетки.
[0020] В настоящем описании «ген рака» относится к гену, который вызывает злокачественное перерождение клеток в организме, и их примеры включают гены семейства MYC (такие как c-MYC, N-MYC или L-MYC), гены семейства SRC, гены семейства RAS, гены семейства RAF и гены семейства протеинкиназ, такие как c-Kit, PDGFR или Abl.
[0021] В настоящем описании «ген polycomb» известен как ген, функция которого состоит в том, чтобы избежать старения клеток путем отрицательного контроля гена CDKN2a (INK4a/ARF) (Okura, et al., Regenerative Medicine, Vol. 6, No. 4, pp. 26-32; Jseus, et al., Nature Reviews Molecular Cell Biology, Vol. 7, pp. 667-677, 2006; Proc. Natl. Acad. Sci. USA, Vol. 100, pp. 211-216, 2003). Неограничивающие примеры генов polycomb включают BMI1, Mel18, Ring1a/b, Phc1/2/3, Cbx2/4/6/7/8, Ezh2, Eed, Suz12, HADC и Dnmt1/3a/3b.
[0022] В настоящем описании «ген-супрессор апоптоза» относится к гену, имеющему функцию, которая подавляет апоптоз клеток, и их примеры включают ген BCL2, ген BCL-xL, ген Survivin и ген MCL1.
[0023] Сверхэкспрессия гена и окончание этой сверхэкспрессии может быть осуществлено способом, описанным в WO 2011/03473, WO 2012/157586, WO 2014/123242 или Nakamura, S. et al., Cell Stem Cell. 14, 535-548, 2014, а также другими известными способами или способами в соответствии с ними.
[0024] В настоящем описании «арил-гидрокарбоновый рецептор (AhR)» относится к фактору транскрипции, относящемуся к семейству Per/ARNT/SIM(PAS). AhR неактивен, когда не связан лигандом, и мигрирует в ядро, когда связан арил-гидрокарбоновым соединением, служащим в качестве лиганда. Внутри ядра AhR образует гетеродимер, называемый AhR ядерный транслокатор (ARNT), а потом активирует транскрипцию путем связывания с элементом ксенобиотического ответа (XRE), имеющимся в ДНК.
[0025] В настоящем описании «антагонист AhR» относится к веществу, которое подавляет всю или часть по меньшей мере одной реакции, которая происходит, когда агонист связывается с AhR. Антагонист AhR может воздействовать непосредственно на AhR или может воздействовать на AhR опосредованно через действие другого вещества.
[0026] В настоящем описании «агонист AhR» относится к веществу, которое вызывает по меньшей мере одну реакцию, которая индуцируется в случае, когда его собственный лиганд связан с AhR. Агонист AhR может воздействовать непосредственно на AhR или может воздействовать на AhR опосредованно через другое вещество.
[0027] «Вещество, которое воздействует на AhR», включает, но без ограничения, соединения с низкой молекулярной массой, соединения с высокой молекулярной массой, белки, такие как антитела или их фрагменты, пептиды и нуклеиновые кислоты.
[0028] Неограничивающие примеры антагонистов AhR, используемых в настоящем изобретении, включают следующее:
4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенол (SR-1),
α-нафтофлавон,
1,4-дигидроксиантрахинон
1,5-дигидроксиантрахинон,
1,8-дигидроксиантрахинон,
галангин,
ресвератрол,
2-метил-2H-пиразол-3-карбоновая кислота (2-метил-4-o-толилазо-фенил)-амид (CH-223191),
N-[2-(3H-индол-3-ил)этил]-9-изопропил-2-(5-метил-3-пиридил)пурин-6-амин (GNF-351),
2-(29-амино-39-метоксифенил)-оксанафтален-4-он (PD98059),
(Z)-3-[(2,4-диметилпиррол-5-ил)метилиденил]-2-индолинон (TSU-16),
2-(29-амино-39-метоксифенил)-оксанафталенe-4-он (PD98059),
6,2',4'-триметоксифлавон (TMF), и
3',4'-диметоксифлавон (DMF).
[0029] AhR предпочтительно представляет собой SR-1, GNF-351, CH-223191, TMF или DMF, более предпочтительно SR-1, GNF-351 или CH-223191, и еще более предпочтительно GNF-351 или SR-1 с точки зрения культивирования мегакариоцитов в условиях отсутствия питающих клеток и увеличения количества и/или улучшения функции полученных тромбоцитов. GNF-351 является особенно предпочтительным, поскольку он демонстрирует результаты, равные или лучше, чем результаты SR-1 и CH-223191 при более низких концентрациях. Множество антагонистов AhR может использоваться в комбинации, если желаемые результаты не ухудшаются.
[0030] В дополнение к упомянутым выше примерам, в настоящем изобретении также могут быть использованы соединения, описанные в WO 2012/015914 в качестве антагонистов AhR,.
[0031] Нет отдельных ограничений концентрации антагониста AhR на стадии контакта с мегакариоцитами, и она может быть соответствующим образом определена рядовым специалистом в данной области. Например, если концентрация антагониста AhR в среде составляет от 200 нМ до менее чем 1000 нМ в случае использования SR-1, от 0,2 мкМ до менее чем 4 мкМ в случае использования CH-223191, от 20 нМ до менее чем 300 нМ в случае использования GNF-351, от 2,5 мкМ до менее чем 40 мкМ в случае использования TMF, или от 2,5 мкМ до менее чем 40 мкМ в случае использования DMF, количество и функцию полученных в результате тромбоцитов может быть улучшено, хотя антагонист AhR также может присутствовать в количестве за пределами этих диапазонов.
[0032] В случае использования «клеток, в которых по меньшей мере один ген, выбранный из группы, состоящей из гена рака, гена polycomb и гена-супрессора апоптоза, был сверхэкспрессирован в клетках, менее дифференцированных, чем мегакариоциты, с последующим завершением этой сверхэкспрессии», нет отдельных ограничений времени этой сверхэкспрессии, и оно может быть соответствующим образом определено рядовым специалистом в данной области.
[0033] Кроме того, клетки могут быть субкультивированы после сверхэкспрессии, и хотя нет отдельных ограничений количества времени от финального цикла субкультивирования до дня, в который завершается сверхэкспрессия, это количество времени может составлять, например, 1 день, 2 дня или 3 дня или больше.
[0034] Хотя нет отдельных ограничений времени, в которое антагонист AhR контактирует с мегакариоцитами или их клетками-предшественниками, если улучшается объем выработки и/или функция тромбоцитов, предпочтительно мегакариоциты являются по меньшей мере многоядерными и находятся на ранней стадии созревания.
[0035] В случае продолжения мультинуклеации иммортализованных мегакариоцитов путем получения иммортализованных мегакариоцитов посредством сверхэкспрессии гена рака, гена polycomb и гена-супрессора апоптоза в клетках, менее дифференцированных, чем мегакариоциты, с последующим завершением этой сверхэкспрессии, предпочтительно добавлять антагонист AhR в среду после окончания сверхэкспрессии.
[0036] Нет отдельных ограничений периода времени, в которое мегакариоциты контактируют с антагонистом AhR. Когда антагонист AhR добавляют в среду после окончания сверхэкспрессии, функциональные тромбоциты постепенно высвобождаются, начиная приблизительно с третьего дня после добавления антагониста AhR в среду, и количество тромбоцитов увеличивается с числом дней культивирования. В случае добавления SR-1 в качестве антагониста AhR, хотя имеется тенденция получения высокофункциональных тромбоцитов, в частности, после культивирования в течение 5 дней, продолжительность культивирования может быть сокращена или удлинена при условии получения функциональных тромбоцитов.
[0037] Нет отдельных ограничений количества времени до добавления в среду антагониста AhR после окончания сверхэкспрессии упомянутых выше генов в мегакариоцитах, и культивирование может начинаться в присутствии антагониста AhR в пределах 1 дня, 2 дней или 3 дней или больше. Во время периода культивирования антагонист AhR можно добавлять в среду за одно или более добавлений.
[0038] Помимо антагониста AhR, мегакариоциты могут контактировать с ингибитором ROCK. Совместное использование антагониста AhR и ингибитора ROCK обеспечивает возможность существенного улучшения количества и функции полученных тромбоцитов. В частности, результат содействия выработке тромбоцитов демонстрирует синергетический эффект по сравнению со случаем использования только антагониста AhR и ингибитора ROCK, соответственно. В настоящем описании «ингибитор ROCK» относится к антагонисту Rho-ассоциированной суперспираль-формирующей киназы (ROCK). Примеры ингибиторов ROCK включают, но без ограничения Y27632, Y39983, фазудила гидрохлорид, рипазудил, SLX-2119, RKI-1447, азаиндол-1, SR-3677, стауроспорин и H1152 дигидрохлорид, AR-12286 и INS-117548. Множество ингибиторов ROCK может использоваться в комбинации, если желаемые результаты не ухудшаются.
[0039] С точки зрения культивирования мегакариоцитов в условиях отсутствия питающих клеток и увеличения количества и/или улучшения функции полученных тромбоцитов ингибитор ROCK предпочтительно представляет собой Y27632, Y39983, фазудила гидрохлорид или рипазудил, а более предпочтительно Y39983. Хотя нет отдельных ограничений времени, в которое ингибитор ROCK контактирует с мегакариоцитами или их клетками-предшественниками, если улучшается объем выработки и/или функция тромбоцитов, мегакариоциты предпочтительно представляют собой мегакариоциты, которые являются по меньшей мере многоядерными.
[0040] Как указано в примерах, которые будут потом описаны, когда мегакариоциты или их клетки-предшественники контактируют с антагонистом AhR и ингибитором ROCK, количество полученных в результате выработанных тромбоцитов увеличивается, а их функция улучшается даже в условиях культивирования в отсутствии питающих клеток. Особенно примечательно то, что по сравнению со случаем использования отдельно каждого антагониста AhR и ингибитора ROCK, совместное использование двух препаратов синергетически действует на результат содействия выработки тромбоцитов. Хотя нет отдельных ограничений комбинации антагониста AhR и ингибитора ROCK, с точки зрения существенного улучшения количества и функции тромбоцитов предпочтительной является комбинация одного или множества антагонистов AhR, выбранных из группы, состоящей из SR-1, GNF-351 и CH-223191, и одного или множества ингибиторов ROCK, выбранных из группы, состоящей из Y27632, Y39983, фазудила гидрохлорида и рипазудила. Среди них более предпочтительной является комбинация SR-1 и/или GNF-351 и Y27632 и/или Y39983. В случае использования конкретно комбинации GNF-351 и Y39983 объем получения функциональных тромбоцитов значительно увеличивается (данные не показаны). Антагонист AhR и ингибитор ROCK можно добавлять одновременно, или сначала можно добавлять любой из препаратов.
[0041] «Тромбоциты» составляют часть клеточных компонентов крови, и в настоящем описании характеризуются, являясь CD41a-позитивными и CD42b-позитивными. В дополнение к осуществлению важной роли в тромбообразовании и гемостазе, тромбоциты также вовлечены в регенерацию тканей после ранения и патофизиологию воспаления. Когда тромбоциты активируются такими факторами, как кровотечение, на их мембране экспрессируются рецепторы факторов клеточной адгезии, таких как интегрин αIIBβ3 (гликопротеин IIb/IIIa; комплекс CD41a и CD61). В результате начинается агрегация тромбоцитов, вследствие свертывания фибрина под действием факторов коагуляция крови разных типов, высвобождаемых из тромбоцитов, образуются тромбы, и развивается гемостаз.
[0042] При использовании в настоящем описании, «функции» тромбоцитов относятся к тем функциям, которые известны в данной области, таким как функция циркуляции, функция тромбообразования или функция гемостаза. В настоящем описании выражения «высокофункциональный», «высокая тромбоцитарная функция» или «активированный» или аналогичные им выражения относятся к функции тромбоцитов (или физиологической активности), равной или более высокой, а предпочтительно значительно более высокой, что измеряют с помощью по меньшей мере одного способа, который будет описан далее, или к сформированным тромбоцитам, равным или меньшим, а предпочтительно значительно меньшим, по сравнению с тромбоцитами, полученными обычным способом без использования антагониста AhR или ингибитора ROCK, или тромбоцитами, выделенными из организма. В качестве альтернативы, эти выражения относятся к состоянию, о котором рядовой специалист в данной области способен вынести суждение, что тромбоцитарная функция имеет тенденцию к улучшению, даже если разница незначительна.
[0043] В качестве альтернативы, в настоящем изобретении такие выражения, как «высокофункциональные тромбоциты», «высокая тромбоцитарная функция» или «активированный» означает, что тромбоцитарная функция, которую измеряют с помощью по меньшей мере одного способа, который будет описан далее, составляет 50% или больше, 60% или больше, 70% или больше, 80% или больше или 90% или больше функции тромбоцитов, полученных обычным способом без использования антагониста AhR или ингибитора ROCK, или естественных тромбоцитов, выделенных из организма.
[0044] Упомянутая выше тромбоцитарная функция может быть оценена путем измерения согласно известному способу. Например, количество активированных тромбоцитов может быть измерено с использованием антител PAC-1, которые представляют собой антитела, которые специфически связываются с маркером активации, интегрином αIIBβ3 (гликопротеином IIb/IIIa; комплексом CD41a и CD61), имеющимся на мембране активированных тромбоцитов. В дополнение, количество активированных тромбоцитов также может быть аналогично измерено путем обнаружения маркера активации тромбоцитов, CD62b (P-селектина), с помощью антител. Измерение количества тромбоцитов может проводиться путем, например, гейтирования тромбоцитов по антителам для независимой активации маркера CD61 или CD41 тромбоцитов с использованием проточной цитометрии, с последующим обнаружением связывания антител PAC-1 или антител анти-CD62P с тромбоцитами. Эти стадии также могут проводиться в присутствии аденозиндифосфата (ADP).
[0045] В дополнение, оценка тромбоцитарной функции может проводиться путем наблюдения, связываются ли или не связываются тромбоциты с фибриногеном в присутствии ADP. В результате связывания тромбоцитов с фибриногеном происходит активация интегрина, который первоначально требуется для тромбообразования. Кроме того, оценка тромбоцитарной функции также может проводиться способом, включающим визуализацию, а в последующем наблюдение способности образовывать тромб in vivo, как указано на фиг. 6 WO 2011/034073.
[0046] Оценка функции циркуляции тромбоцитов в организме может проводиться в соответствии с обычными способами. Более конкретно, после введения тромбоцитов в количестве 2×108 тромбоцитов/животное в хвостовые вены NOG мышей, служащих в качестве модели тромбоцитопении, индуцируемой гамма-излучением (2,4 Gy), тромбоциты человеческого происхождения, имеющиеся в крови, собранной из яремной вены с одинаковыми интервалами, для оценки функции циркуляции тромбоцитов оценивают с использованием античеловеческих антител CD41.
[0047] Оценка функции гемостаза тромбоцитов может быть проведена в соответствии с обычными способами. Более конкретно, после введения тромбоцитов в количестве 2×108 тромбоцитов/животное в хвостовые вены NOG мышей, служащим в качестве модели тромбоцитопении, индуцируемой гамма-излучением (2,4 Gy), пунктируют хвостовую вену (2 см от кончика) с использованием 28G шприца под анестезией (уретан, 1,5 г/кг) с последующим измерением количества времени до наступления гемостаза с одновременным погружением кончика хвоста в PBS, нагретый до 37°C для оценки функции гемостаза.
[0048] С другой стороны, тромбоциты оценивают как подвергшиеся деградации или аномальные, в случае, когда уровень экспрессии CD42b тромбоцитами является низким, или в случае, когда положительный уровень аннексина V является высоким. Эти тромбоциты не используются клинически, поскольку они не обладают адекватной способностью к тромбообразованию или демонстрации гемостаза.
[0049] В настоящем описании «деградация тромбоцитов» относится к уменьшению CD42b (GPIbα) на поверхности тромбоцитов. Таким образом, деградированные тромбоциты включают тромбоциты, у которых экспрессия CD42b снизилась, и тромбоциты, в которых внеклеточная область CD42b была расщеплена посредством реакции отслоения. Когда на поверхности тромбоцитов больше нет CD42b, более невозможна конъюгация с фактором фон Виллебранда (VWF), и в результате этого тромбоциты теряют функцию свертывания крови. Деградацию тромбоцитов можно оценить путем использования в качестве показателя отношения отрицательного уровня CD42b (или количества CD42b-отрицательных частиц) к положительному уровню CD42b (или количеству CD42b-положительных частиц), имеющегося во фракции тромбоцитов. Тромбоциты продолжают деградировать по мере того, как отношение отрицательного уровня CD42b к положительному уровню CD42b становится более высоким, или по мере того, как количество CD42b-отрицательных частиц становится больше относительно количества CD42b-положительных частиц. Положительный уровень CD42b связан с долей тромбоцитов, содержащихся во фракции тромбоцитов, которые способны связываться антителами анти-CD42b, в то время, как отрицательный уровень CD42b связан с долей тромбоцитов, не связываемых антителами анти-CD42b.
[0050] В настоящем описании «аномальные тромбоциты» относятся к тромбоцитам, в которых отрицательно заряженный фосфолипид в виде фосфатидилсерина выходит на поверхность изнутри кнаружи липидного бислоя. В организме фосфатидилсерин выходит на поверхность, сопровождая активацию тромбоцитов, и известно, что каскадная реакция свертывания крови расширяется в результате связывания с ним многочисленных факторов свертывания крови. С другой стороны, в аномальных тромбоцитах на поверхности все время имеется большое количество фосфатидилсерина, и когда такие тромбоциты вводят пациенту, это индуцирует чрезмерную реакцию свертывания крови, которая может приводить к серьезному патологическому состоянию, такому как синдром диссеминированного внутрисосудистого свертывания. Поскольку аннексин V связывается с фосфатидилсерином, фосфатидилсерин на поверхности тромбоцитов может быть обнаружен с помощью проточной цитометрии с использованием определенного количества меченого флуоресцином связанного аннексина V в качестве индикатора. Соответственно, количество аномальных тромбоцитов можно оценить на основании положительного уровня аннексина V или, другими словами, доли или количества тромбоцитов, связанных аннексином. Чем выше становится количество аномальных тромбоцитов, тем выше положительный уровень аннексина V, или тем больше количество частиц аннексина V.
[0051] В дополнение, оценка тромбоцитарной функции также может проводиться путем наблюдения, связываются или не связываются тромбоциты с фибриногеном в присутствии ADP. В результате связывания тромбоцитов с фибриногеном активируется интегрин, который требуется для образования первичного тромба.
[0052] Кроме того, оценка тромбоцитов также может проводиться способом, включающим визуализацию, а потом наблюдение способности образовывать тромб in vivo, как указано на фиг. 6 WO 2011/034073.
[0053] В случае продолжения мультинуклеации иммортализованных мегакариоцитов путем получения иммортализованных мегакариоцитов посредством сверхэкспрессии гена рака, гена polycomb и гена-супрессора апоптоза в клетках, менее дифференцированных, чем мегакариоциты, с последующим завершением этой сверхэкспрессии, после окончания сверхэкспрессии в среду предпочтительно добавлять ингибитор ROCK.
[0054] (Второй Аспект)
Во втором своем аспекте настоящее изобретение предоставляет способ получения тромбоцитов, который включает стадию подавления экспрессии или функции белка At-hook группы с высокой подвижностью (HMGA) в мегакариоцитах или в их клетках-предшественниках.
[0055] Белок At-hook группы с высокой подвижностью (или группы с высокой подвижностью A) (HMGA) представляет собой негистоновый хроматиновый белок, который связывается главным образом с ДНК, содержащей большие количества AT, и известный как HMGA1 и HMGA2. Как использовано в данном документе, HMGA в частности предпочтительно представляет собой HMGA2. Человеческий белок HMGA2 также упоминается как эталонная последовательность NCBI: NP_001287847.1.
[0056] В настоящем описании термин «экспрессия белка» используется на основании концепции, включающей как транскрипцию, так и трансляцию, а в случае упоминания как «подавление экспрессия» означает подавление всей или части экспрессии на уровне транскрипции или на уровне трансляции.
[0057] Стадия подавления экспрессии или функции белка HMGA может проводиться с использованием известного способа или соответствующего ему способа.
[0058] В дополнение, в качестве способа подавления функции белка HMGA может быть использован доминантно-негативный способ. Доминантно-негативный способ включает экспрессию большого количества белка HMGA, для которого его активность была снижена или потеряна за счет введения в клетки мутации для увеличения в подавляющем большинстве случаев отношения неактивного белка HMGA к нормальному белку HMGA в клетках, и получения клеток, которые демонстрируют поведение, которое препятствует получению функции белка HMGA.
[0059] Для ингибирования функции белка HMGA могут использоваться антитела анти-HMGA. Для антител анти-HMGA могут использоваться антитела, полученные согласно известному способу, или коммерчески доступные антитела, и могут использоваться любые такие антитела, если результаты настоящего изобретения получают через подавление функции HMGA-белков.
[0060] Пример способа подавления экспрессии HMGA-белков включает использование микроРНК, которая непосредственно или опосредованно подавляет экспрессию гена HMGA. МикроРНК может представлять собой микроРНК, которая непосредственно действует на ген HMGA, или микроРНК, которая действует опосредованно. Например, этот способ может выполняться путем использования микроРНК, называемой let-7. В настоящем изобретении, хотя в случае людей let-7 является любая микроРНК, выбранная из группы, состоящей из hsa-let-7a-1, hsa-let-7a-2, hsa-let-7a-3, hsa-let-7b, hsa-let-7c, hsa-let-7d, hsa-let-7e, hsa-let-7f-1, hsa-let-7f-2, hsa-let-7g и hsa-let-7i, также может использоваться, например, let-7 других видов животных. Последовательность let-7 и так далее может быть должным образом получена из информации, зарегистрированной в базе данных (такой как http://www.mirbase.org/ или http://www.microrna.org/). В настоящем изобретении let-7 предпочтительно представляет собой hsa-let-7b.
[0061] В дополнение, подавление экспрессии белков HMGA2 также может проводить с использованием способа, включающего использование микроРНК, которая подавляет экспрессию Lin28b, который отрицательно регулирует экспрессию let-7. Примером этой микроРНК является miR181a. Хотя в случае людей miR181a является любая микроРНК, выбранная из группы, состоящей из hsa-mir-213, hsa-mir-181a-1 и hsa-mir-181a-2, например, также может использоваться miR181a других видов животных. Последовательность miR181a и так далее может быть должным образом получена из информации, зарегистрированной в тех же самых базах данных, как описано выше.
[0062] «МикроРНК» относится к некодирующей РНК, имеющей короткую цепь (от 20 до 25 оснований), присутствующей в клетках, которая вовлечена в экспрессию регулирующих генов через ингибирование трансляции из мРНК в белки и разложение мРНК. Эта микроРНК функционирует путем транскрибирования в виде прай-микроРНК, отличающейся от нее единственной цепью, которая способна принимать структуру петли шпильки, содержащую микроРНК, и ее комплементарную цепь, и имеющей участок, расщепленный ферментом, называемым DROSHA, внутри ядра клетки, в результате чего образуется пре-микроРНК, с последующей транспортировкой этой пре-микроРНК за пределы клетки и дальнейшим расщеплением Dicer. Таким образом, в настоящем изобретении используемой let-7 или miR181 может быть одноцепочечная прай-микроРНК или двухцепочечная пре-микроРНК.
[0063] Примеры методов, которые могут использоваться для подавления экспрессии гена HMGA, включают антисмысловой метод, метод рибозим и метод РНК-интерференции.
[0064] Антисмысловой метод включает подавление экспрессии гена с использованием одноцепочечной нуклеиновой кислоты обычно 10-100 оснований в длину, а предпочтительно 15-30 оснований в длину, которая имеет последовательность оснований, комплементарную гену-мишени (в основном, продукту его транскрипции в виде мРНК). Экспрессию генов подавляют путем введения в клетки антисмысловой нуклеиновой кислоты и гибридизации антисмысловой нуклеиновой кислоты с геном-мишенью. Не требуется, чтобы антисмысловая нуклеиновая кислота была полностью комплементарна гену-мишени, если она позволяет получить эффект подавления экспрессии гена-мишени. Антисмысловая нуклеиновая кислота может быть должным образом сконструирована рядовым специалистом в данной области с использованием известного программного обеспечения и тому подобного. Антисмысловой нуклеиновой кислотой может быть любая из ДНК, РНК или химеры ДНК/РНК, и не требуется, чтобы она была модифицирована.
[0065] Рибозимы представляют собой молекулы нуклеиновой кислоты, которые каталитически гидролизуют целевую РНК и состоят из антисмысловой цепи, имеющей последовательность, комплементарную РНК-мишени, и центральной каталитической области, ответственной за реакцию расщепления. Рибозимы могут быть должным образом сконструированы рядовым специалистом в данной области в соответствии с известными способами. Хотя рибозимы обычно представляют собой молекулы РНК, также могут использоваться химерные молекулы ДНК-РНК.
[0066] Метод РНК-интерференции представляет собой специфичный к последовательности механизм подавления экспрессии генов, индуцируемой двухцепочечной нуклеиновой кислотой. В дополнение к специфичности к мишени, являющейся чрезвычайно высокой, он также обеспечивает высокую степень безопасности, поскольку он использует механизм подавления экспрессии генов, врожденно имеющийся в организме.
[0067] Примером двухцепочечной нуклеиновой кислоты, имеющей эффект RNAi, является миРНК. В случае использования у млекопитающих, миРНК представляет собой двухцепочечную РНК, обычно имеющую приблизительно от 19 до 30 оснований и предпочтительно от 21 до 25 оснований. Как правило, одна из нитей двухцепочечных нуклеиновых кислот, демонстрирующая эффект RNAi, имеет последовательность оснований, комплементарную части целевой нуклеиновой кислоты, в то время как другая цепь имеет последовательность, комплементарную ей. миРНК, подавляющая экспрессию HMGA, может быть соответствующим образом разработана специалистом в данной области с использованием известного программного обеспечения и тому подобного, а целевая последовательность, используемая в примерах, которые будут описаны далее, проиллюстрирована в качестве последовательности одной из нитей двухцепочечной нуклеиновой кислоты. миРНК, подавляющая экспрессию HMGA, может действовать непосредственно на ген HMGA (путем включения в себя последовательности, комплементарной части гена HMGA) или может действовать опосредованно (путем подавления экспрессии гена, не являющегося геном HMGA, для подавления экспрессии гена HMGA в результате этого).
[0068] Вышеупомянутые let-7, miR181a, антисмысловая нуклеиновая кислота и рибозимы могут быть экспрессированы внутри клеток путем введения вектора (такого как лентивирусный вектор), содержащего нуклеиновую кислоту, соответственно кодирующую их в клетках, или могут быть введены в клетки в виде РНК. В случае введения в виде РНК let-7, miR181a, антисмысловая нуклеиновая кислота или рибозимы могут быть введены в клетки посредством известного способа, такого как липофекция или микроинъекция, и РНК, включающая 5-метилцитидин и псевдоуридин (TriLink Biotechnologies) (Warren, L., Cell Stem Cell, 7: 618-630 (2010)) или химера ДНК-РНК, включающая ДНК, также может быть использована для подавления деградации РНК. В случае уридина или цитидина локализацией модифицированных оснований могут быть независимо друг от друга все или часть локализаций, а в случае только части локализаций могут быть случайными локализациями с произвольным отношением. Вектор, содержащий ДНК, кодирующую каждую двойную цепь, может быть использован для вектора, содержащего нуклеиновую кислоту, кодирующую let-7, miR181a или миРНК, или может быть использован вектор, который содержит ДНК, кодирующую одноцепочечную нуклеиновую кислоту, способную связывать двухцепочечную нуклеиновую кислоту посредством петли. В случае миРНК одноцепочечная РНК, полученная посредством внутриклеточной транскрипции, может быть сконструирована так, чтобы гибридизироваться с комплементарной частью миРНК внутри ее молекулы, чтобы принять структуру шпильки. Этот тип РНК называют короткой шпилечной РНК (shRNA). Когда shRNA мигрирует в цитоплазму, часть петли расщепляется ферментом (Dicer), что приводит к образованию миРНК и позволяет RNAi продемонстрировать ее действие.
[0069] В настоящем описании, когда речь идет о подавлении экспрессии белка как «производимом миРНК» или «производимом микроРНК», это в конечном счете означает, что миРНК или микроРНК подавляют экспрессию, и миРНК, shRNA или микроРНК можно вводить в форме РНК или можно вводить вектор, который содержит нуклеиновую кислоту, кодирующую миРНК, shRNA или микроРНК.
[0070] В случае введения let-7, miR181a или миРНК или shRNA против HMGA с вектором и т.п., экспрессию этой РНК можно контролировать посредством препарат-реактивного промотора. Вектор, способный к препарат-реактивному регулированию РНК таким способом, можно получить, например, у Takara Bio Inc. В этом случае введение этой РНК означает, что РНК экспрессируется в клетках путем контакта с соответствующим лекарственным средством.
[0071] Как будет понятно из примеров, с точки зрения эффективности в процессе созревания мегакариоцитов, включая мультинуклеацию и увеличение, подавление экспрессии или функции белка HMGA может проводиться на мегакариоцитах перед мультинуклеацией, или с точки зрения инициирования многоядерных мегакариоцитов подвергаться дополнительной мультинуклеации, подавление экспрессии или функции белка HMGA может проводиться на многоядерных мегакариоцитах. Поскольку мультинуклеация и увеличение мегакариоцитов стимулируются, и количество полученных тромбоцитов на клетку резко возрастает, предпочтительно проводить подавление экспрессии или функции белка HMGA на стадии получения тромбоцитов из мегакариоцитов.
[0072] Зрелые мегакариоциты, полученные в соответствии с настоящим изобретением, способны эффективно продуцировать функциональные тромбоциты. В настоящем описании созревание мегакариоцитов означает, что мегакариоциты становятся достаточно многоядерными, чтобы быть способными продуцировать функциональные тромбоциты. Созревание мегакариоцитов может быть подтверждено увеличением экспрессии группы генов, ассоциированных с созреванием мегакариоцитов, таких как GATA1, p45 NF-E2 или бета1-тубулин, образование протромбоцитов и внутриклеточной мультинуклеации.
[0073] Кроме того, в случае продолжения мультинуклеации иммортализованных мегакариоцитов посредством сверхэкспрессии гена рака, гена polycomb и гена-супрессора апоптоза в клетках, менее дифференцированных, чем мегакариоциты, для получения иммортализованных мегакариоцитов с последующим завершением этой сверхэкспрессии, хотя нет особых ограничений на то, начинается ли подавление экспрессии или функции белка HMGA до или после прекращения сверхэкспрессии этих генов, экспрессия или функция белка HMGA предпочтительно подавляется, по крайней мере, после прекращения сверхэкспрессии. Поскольку количество CD41a-положительных клеток, а именно количество мегакариоцитов перед мультинуклеацией, имеет тенденцию уменьшаться путем подавления экспрессии или функции белка HMGA до прекращения сверхэкспрессии этих генов, начало подавления экспрессии или функции белка HMGA более предпочтительно проводят после прекращения сверхэкспрессии этих генов с точки зрения поддержания количества мегакариоцитов до мультинуклеации.
[0074] (Третий Аспект)
В третьем аспекте настоящего изобретения предлагается способ получения мегакариоцитов, который включает стадию культивирования мегакариоцитов, в которой подавление экспрессии или функции белков HMGA подавляли в присутствии антагониста АРR и/или ингибитора ROCK. Кроме того, этап культивирования может быть выполнен таким же образом, как упомянутая выше стадия контакта. В другом аспекте способ получения мегакариоцитов, согласно настоящему изобретению, также может содержать стадию получения тромбоцитов.
[0075] (Условия культивирования и другие параметры)
В любом аспекте настоящего изобретения условия культивирования мегакариоцитов могут включать условия, которые используются при обычном культивировании. Например, температурой может быть температура, составляющая приблизительно от 35°C до приблизительно 42°C, приблизительно от 36°C до приблизительно 40°C или приблизительно от 37°C до приблизительно 39°C, а культивирование может проводиться в присутствии 5% CO2 и/или 20% O2. Культивирование может проводиться посредством статического культивирования или культивирования со встряхиванием. Согласно настоящему изобретению, поскольку культивирование может выполняться в условиях отсутствия питающих клеток в случае использования антагониста AhR, такого как SR-1, в случае получения большего количества тромбоцитов культивирование со встряхиванием является предпочтительным. В случае культивирования со встряхиванием нет отдельных ограничений на скорость встряхивания, и можно применять скорость встряхивания, например, от 10 об/мин до 200 об/мин или от 30 об/мин до 150 об/мин.
[0076] В настоящем изобретении мегакариоцитам обеспечена возможность созревать, а тромбоциты получают из его цитоплазмы путем культивирования мегакариоцитов способом, описанным выше. Здесь созревание мегакариоцитов связано с тем, что мегакариоцитам обеспечена возможность становиться многоядерными и высвобождать тромбоциты.
[0077] Нет отдельных ограничений на среду, используемую при культивировании мегакариоцитов, и в соответствии с этим можно использовать известные среды или среды, которые являются предпочтительными для получения тромбоцитов из мегакариоцитов. Например, для использования в качестве базальных сред могут быть получены среды, используемые для культивирования клеток животных. Примеры базальных сред включают среду IMDM, среду 199, минимальную эссенциальную среду Игла (EMEM), αMEM, среду Игла в модификации Дульбекко (DMEM), среду Хэма F12, среду RPMI 1640, среду Фишера, нейробазальную среду (Life Technologies Corporation) и смешанные среды.
[0078] Среда может содержать сыворотку или плазму или может быть бессывороточной. Среда может содержать одно или более веществ, таких как альбумин, инсулин, трансферрин, селен, жирные кислоты, следовые элементы, 2-меркаптоэтанол, тиоглицерин, монотиоглицерин (MTG), липид, аминокислоты (такие как L-глутамин), аскорбиновая кислота, гепарин, незаменимые аминокислоты, витамины, факторы роста, низкомолекулярные соединения, антибиотики, антиоксиданты, пировиноградная кислота, буферы, неорганические соли или цитокины при необходимости. Цитокины представляют собой белки, которые способствуют гемопоэтической дифференцировке, а их примеры включают фактор роста эндотелия сосудов (VEGF), тромбопоэтин (TPO), различные типы TPO-подобных агентов, фактор стволовых клеток (SCF), добавку инсулин-трансферрин-селенит (ITS) и ингибиторы ADAM. В настоящем изобретении предпочтительно используется среда IMDM, содержащая сыворотку, инсулин, трансферрин, селен, тиоглицерин, аскорбиновую кислоту и ТРО. Эта среда IMDM может дополнительно содержать SCF и может дополнительно содержать гепарин. Для концентрации каждого вещества нет отдельных ограничений и, например, концентрация TPO может составлять от приблизительно 10 нг/мл до приблизительно 200 нг/мл или от приблизительно 50 нг/мл до приблизительно 100 нг/мл, концентрация SCF может составлять от приблизительно 10 нг/мл до приблизительно 200 нг/мл или приблизительно 50 нг/мл, а концентрация гепарина может составлять от приблизительно 10 Ед/мл до приблизительно 100 Ед/мл или приблизительно 25 Ед/мл. Также можно добавить форболовый эфир (такой как форбол 12-миристат-13-ацетат (PMA)).
[0079] В случае использования сыворотки предпочтительной является сыворотка человека. В дополнение, вместо сыворотки можно использовать человеческую плазму и тому подобное. Согласно способу настоящего изобретения, тромбоциты, эквивалентные тромбоцитам, полученным при использовании сыворотки, могут быть получены даже при использовании этих компонентов.
[0080] В случае использования для сверхэкспрессии гена или ее прекращения чувствительной к лекарственным средствам системы индуцирования экспрессии гена в виде системы Tet-on® или Tet-off®, на стадии сверхэкспрессии в среде содержится соответствующее лекарственное средство, такое как тетрациклин или доксициклин, и сверхэкспрессия может быть подавлена путем удаления из среды лекарственного средства.
[0081] Стадия культивирования мегакариоцитов в настоящем изобретении может быть проведена в отсутствие питающих клеток. Как указано в примерах, которые будут описаны ниже, в соответствии со способом настоящего изобретения функциональные тромбоциты могут быть получены, даже если культивирование проводится в отсутствие питающих клеток.
[0082] В настоящем описании «питающие клетки» относятся к клеткам, культивированным с клетками, которые должны быть пролиферированы или дифференцированы (целевые клетки) с целью предоставления среды, необходимой для культивирования целевых клеток. Питающие клетки включают клетки, полученные из тех же видов и клеток, полученных из разных видов, при условии, что они являются клетками, которые отличаются от целевых клеток. Питающие клетки могут представлять собой клетки, которые были обработаны антибиотиком или гамма-лучами, чтобы они не пролиферировали, или могут представлять собой клетки, не подвергнутые такой обработке.
[0083] Настоящее изобретение также включает тромбоциты, полученные согласно способу настоящего изобретения. Как указано в примерах, которые будут далее описаны, тромбоциты, полученные согласно способу настоящего изобретения, демонстрируют более совершенное развитие открытой каналикулярной системы по сравнению с тромбоцитами, полученными in vitro в соответствии с обычными способами, и ввиду возможности подтверждения наличия митохондрий наблюдается, что они морфологически сходны с естественными тромбоцитами.
[0084] Способ получения препарата тромбоцитов в соответствии с настоящим изобретением включает стадию получения тромбоцитов в зрелых мегакариоцитах, полученных описанным выше способом, и необязательно включает стадию извлечения богатой тромбоцитами фракции из культуры и стадию удаления клеточных компонентов крови, за исключения тромбоцитов, из тромбоцитарной фракции. Стадия удаления клеточных компонентов крови может проводиться путем удаления клеточных компонентов крови, не являющихся тромбоцитами, включая мегакариоциты, с использованием фильтра для удаления лейкоцитов (как, например, изготовленный Terumo Corporation или Asahi Kasei Medical Co., Ltd.). Конкретный пример способа получения препарата тромбоцитов описан в WO 2011/034073.
[0085] Способ получения препарата крови в соответствии с настоящим изобретением включает стадию получения вышеупомянутого препарата тромбоцитов и стадию смешивания препарата тромбоцитов с другими компонентами. Примером других компонентов являются эритроциты.
[0086] К препарату тромбоцитов и препарату крови также могут быть добавлены другие компоненты, способствующие стабилизации клеток.
[0087] В дополнение, настоящее изобретение также включает композицию, содержащую многоядерные мегакариоциты, антагонист AhR и среду. Настоящая композиция позволяет путем культивирования получать высокофункциональные тромбоциты, которые подвергнуты или могут быть подвергнуты лиофилизации. В частности, в случае лиофилизации композиция может содержать ДМСО, глицерин или коммерчески доступный реагент для криоконсервации клеток, который защищает клетки во время замораживания. Высокофункциональные тромбоциты могут быть получены путем оттаивания и культивирования замороженной композиции.
[0088] Раскрытие всех патентных документов и непатентных документов, приведенных в настоящем описании, включено в настоящее описание в полном объеме посредством ссылки.
Пример 1
[0089] Хотя нижеследующее дает подробное объяснение настоящего изобретения на основе его примеров, настоящее изобретение этим не ограничивается. Рядовой специалист в данной области может модифицировать настоящее изобретение различными способами, не отклоняясь от смысла настоящего изобретения, и такие модификации включены в объем настоящего изобретения.
[0090] 1. Получение иммортализованных мегакариоцитов
1-1. Получение Гемопоэтических Клеток-предшественников из iPS клеток
Человеческие iPS клетки (TKDN SeV2: фибробласты, полученные из кожи эмбриона человека, созданные с использованием вируса Сендай) культивировали для дифференцировки в клетки крови согласно способу, описанному в Takayama, N., et al., J. Exp. Med., 2817-2830 (2010). А именно, для получения гемопоэтических клеток-предшественников (HPC) колонии человеческих ES/iPS клеток совместно культивировали в течение 14 дней с питающими клетками C3H10T1/2 в присутствии VEGF (R&D Systems, Inc.) при 20 нг/мл. Культивирование проводили в условиях культивирования 20% O2 и 5% CO2 (применять аналогично в дальнейшем, если специально не указано иное).
[0091] 1-2. Инфицирование вирусом c-MYC и BMI1 Гемопоэтических Клеток-предшественников
HPC, полученные описанным ранее способом, высевали по 5×104 клеток/лунку в 6-луночном планшете, предварительно засеянном питающими клетки C3H10T1/2, за чем следовала сверхэкспрессия c-MYC и BMI1 с использованием лентивирусного метода. В это время для каждой клеточной линии использовали 6 лунок. А именно, вирусные частицы соответственно добавляли к среде при показателе MOI, составляющем 20, и клетки инфицировали отцентрифугированным инфекционным материалом (посредством центрифугирования при 32°С и 900 об/мин в течение 60 минут). Эту процедуру проводили дважды с интервалом в 12 часов. В это время в качестве среды использовали среду, полученную путем дополнительного добавления протамина до итоговой концентрации, составляющей 10 мкг/мл, в среду, содержащую 50 нг/мл человеческого тромбопоэтина (TPO) (R&D Systems, Inc.), 50 нг/мл человеческого фактора роста для стволовых клеток (SCF) (R&D Systems, Inc.) и 2 мкг/мл доксициклина (Dox) в базальной среде (IMDM (среда Дульбекко в модификации Искова) (Sigma-Aldrich Company Ltd.), содержащей 15% фетальной бычьей сыворотки (Gibco Corporation), 1% пенициллин-стрептомицин-глутамин (Gibco Corporation), 1% инсулин, раствор трансферрина и селена (ITS-G) (Gibco Corporation), 0,45 мМ 1-тиоглицерина (Sigma-Aldrich Company Ltd.) и 50 мкг/мл L-аскорбиновой кислоты (Sigma-Aldrich Company Ltd.)) (называемой средой для дифференцировки). Кроме того, лентивирусный вектор представлял собой регулируемый тетрациклином индуцибельный вектор, полученный посредством рекомбинации кассеты mOKS LV-TRE-mOKS-Ubc-tTA-I2G (Kobayashi, T., et al., Cell, 142, 787-799 (2010)) в c-MYC, BMI1 и BCL-xL (называемых соответственно LV-TRE-c-Myc-Ubc-tTA-I2G, LV-TRE-BMI1-Ubc-tTA-I2G и LV-TRE-BCL-xL-Ubc-tTA-I2G). Вирусные частицы, используемые для инфицирования, были получены посредством экспрессии упомянутого выше лентивирусного вектора в клетках 293T.
[0092] 1-3. Получение и поддержание культивирования самообновляющихся мегакариоцитарных линий
После определения дня, когда в соответствии с вышеупомянутым методом было выполнено инфицирование вирусами cMYC и BMI1, как 0 день инфицирования, самовосстанавливающиеся линии мегакариоцитов были соответственно получены путем культивирования клеток мегакариоцитов, введенных с cMYC и BMI1, как описано ниже.
[0093] От 2 дня инфицирования до 11 дня инфицирования
Клетки крови, инфицированные вирусом, полученные согласно описанному выше методу, извлекали пипеткой, и после удаления супернатанта посредством центрифугирования в течение 5 минут при 1200 об/мин клетки суспендировали в свежей среде для дифференцировки и высевали на свежие питательные клетки C3H10T1/2 (6-луночный планшет). Пересевание проводили посредством выполнения такой же процедуры на 9-й день инфицирования. После подсчета количества клеток клетки распределяли на питательных клетках C3H10T1/2 при 1×105 клеток/2 мл/лунку (6-луночный планшет).
[0094] От 12 дня инфицирования до 13 дня инфицирования
Была проведена та же процедура, что и во 2 день инфицирования. После подсчета количества клеток клетки были распределены на питающих клетках C3H10T1/2 при 3×105 клеток/10 мл/100 мм чашку (100 мм чашку).
[0095] 14 день инфицирования
Клетки крови, в которых инфицирование вирусом было завершено, выделяли и подвергали взаимодействию с антителами с использованием 2 мкл, 1 мкл и 1 мкл античеловеческого антитела CD41a-APC (BioLegend Inc.), античеловеческого антитела CD42b-PE (eBioscience, Inc.) и античеловеческого антитела CD235ab-Pacific Blue (BioLegend Inc.), соответственно, на 1,0×105 клеток. После взаимодействия клетки подвергали анализу с использованием FACS Verse (Becton Dickinson and Company). Считалось, что те клетки, которые имели положительный показатель CD41a, составляющий на 14 день инфицирования 50% или выше, составляют самовосстанавливающиеся линии мегакариоцитов.
[0096] 1-4. Инфицирование вирусом BCL-xL саморазмножающихся линий мегакариоцитов
На 14-й день инфицирования в вышеупомянутые самообновляющиеся линии мегакариоцитов вводили ген BCL-xL с использованием лентивирусного метода. Вирусные частицы добавляли в среду до показателя MOI, составляющего 10, с последующим инфицированием отцентрифугированным инфекционным материалом (посредством центрифугирования при 32°C и 900 об/мин в течение 60 минут).
[0097] 1-5. Получение и поддержание культивирования иммортализованных мегакариоцитарных линий
От 14 дня инфицирования до 18 дня инфицирования
Самоподдерживающиеся линии мегакариоцитов с введенным геном BCL-xL, полученные описанным выше методом, извлекали и центрифугировали в течение 5 минут при 1200 об/мин. После центрифугирования осажденные клетки суспендировали в свежей среде для дифференцировки с последующим посевом на свежие питающие клетки C3H10T1/2 по 2×105 клеток/2 мл/лунку (6-луночный планшет).
[0098] 18 день инфицирования: пересевание
После подсчета количества клеток клетки высевали по 3×105 клеток/10 мл/100 мм чашку.
[0099] День инфицирования 24: Субкультивирование
После подсчета количества клеток клетки высевали по 1×105 клеток/10 мл/100 мм чашку. Потом проводили поддерживающее культивированием путем пересевания каждые 4-7 дней.
[0100] На 24 день инфицирования самоподдерживающиеся линии мегакариоцитов с введенным геном BCL-xL извлекали, а после иммуноокрашивания с использованием 2 мкл, 1 мкл и 1 мкл анти-человеческих антител CD41a-APC (BioLegend Inc.), анти-человеческих антител CD42b-PE (eBioscience, Inc.) и анти-человеческих антител CD235ab-Pacific Blue (анти-CD235ab-PB) (BioLegend Inc.), соответственно, на 1,0×105 клеток, клетки анализировали с использованием FACS Verse (Becton Dickinson and Company) и считали, что эти клетки, имеющие положительный уровень CD41a, равный 50% или выше, на 24 день инфицирования, составляют линию иммортализованных мегакариоцитов.
[0101] В результате поддерживающего культивирования упомянутых выше самоподдерживающихся линий мегакариоцитов с введенным геном BCL-xL, клетки, полученные из iPS клеток (692D2, 1108A2), были способны к пролиферации в течение 24 дней или более после инфицирования. Считали, что эти клетки составляют линию иммортализованных мегакариоцитов (SeV2-MKCL).
[0102] Полученные в результате клетки SeV2-MKCL статически культивировали в 10 см чашке (10 мл/чашку). Среду получали путем добавления следующих компонентов в IMDM, служащую в качестве базовой среды (концентрации обозначают итоговые концентрации).
FBS (#172012, Lot No. 12E261 (Sigma)): 15%
L-глютамин (#25030-081 (Gibco Corporation)): 2 мМ
ITS (#41400-045 (Gibco Corporation)): 100-кратное разбавление
MTG (монотиоглицерин, #6145-25ML (Sigma)): 450 мкМ
Аскорбиновая кислота (#A4544 (Sigma)): 50 мкг/мл
Пуромицин (#P8833-100MG (Sigma)): 2 мкг/мл
SCF (#193-15513 (Wako Pure Chemical Industries, Ltd.)): 50 нг/мл
Агент аналогичный TOP: 200 нг/мл
Культивирование осуществляли в условиях 37°C и 5% CO2.
Сверхэкспрессию гена BMI1, гена c-MYC и гена BCL-xL проводили путем добавления в среду 1 мкг/мл доксициклина (#631311 (Clontech Laboratories, Inc.)).
[0103] 2. Исследование Концентрации SR-1
Линию иммортализованных мегакариоцитов (SeV2-MKCL), полученных согласно способу, описанному в разделе 1, промывали два раза PBS(-), а затем культивировали в среде, не содержащей доксициклин, для окончания сверхэкспрессии. Культивирование осуществляли путем посева клеток по 2 мл/лунку в 6-луночном планшете при посевной концентрации 1×105 клеток/мл с последующим статическим культивированием в среде, указанной ниже.
Среду получали путем добавления следующих компонентов в IMDM, служащую в качестве базовой среды (концентрации обозначают итоговые концентрации).
FBS: 15%
L-глютамин (#25030-081 (Gibco Corporation)): 2 мм
ITS (#41400-045 (Gibco Corporation)): 100-кратное разбавление
MTG (монотиоглицерин, #M6145-25ML (Sigma)): 450 мкМ
Аскорбиновая кислота (#A4544 (Sigma)): 50 мкг/мл
SCF (#193-15513 (Wako Pure Chemical Industries, Ltd.)): 50 мкг/мл
Агент аналогичный TPO: 200 нг/мл
Ингибитор ADAM: 15 мкМ
Культивирование осуществляли в условиях 37°C и 5% CO2.
После одновременного добавления SR-1 в концентрации, показанной на фиг. 1, и культивирования в течение 7 дней измеряли количество и функцию тромбоцитов. Способ измерения показан ниже.
Супернатант культуры осторожно суспендировали с использованием 1 мл Pipetman через 7 дней после культивирования для окончания экспрессии генов. 200 мкл бульона с культурой дозировали в 5 мл пробирку с образцами с последующим окрашиванием антителами, указанными ниже.
0,5 мкл PB-меченых антител анти-CD42a (#48-0428-42 (eBioscience, Inc.))
0,5 мкл PE-меченых антител анти-CD42b (#303906 (BioLegend, Inc.))
0,5 мкл APC-меченых антител CD62a (#304910 (BioLegend, Inc.))
10 мкл FITC-меченых антител PAC-1 (#304910 (Becton, Dickinson and Company))
Тромбоциты стимулировали посредством реакции при комнатной температуре после добавления PMA (форбол 12-миристат-13-ацетат, #P1585-1MG (Sigma)) в итоговой концентрации 0,2 мкМ, ADP (#A2754 (Sigma)) в итоговой концентрации 20 мкМ, TRAP-6 (пептидный активатор 6 рецептора тромбина, соли TFA, #H8365 (Bachem)) в итоговой концентрации 20 мкМ, коллагена (Collagen Reagent HORM, Moriya Sangyo K. K.) в итоговой концентрации 1 мкг/мл или их смеси.
Измерение проводили с использованием FACS Verse, производства Becton Dickinson and Company через 30 минут после реакции. Непосредственно перед измерением добавляли 400 мкл буфера Тироде Ca+, чтобы довести до общего объема 600 мкл. Этот общий объем 600 мкл использовали для образца для измерения посредством FACS.
Считали, что количество CD42a- и CD42b-позитивных частиц отображает количество тромбоцитов, а перед и после стимуляции рассчитывали соотношение средней интенсивности флуоресценции (MFI) PAC-1 и CD62p в этой фракции тромбоцитов.
[0104] Результаты показаны на фиг. 1. Было подтверждено, что количество тромбоцитов, связанных PAC-1 и антителами анти-CD62P, увеличивается после добавления SR-1, и было подтверждено, что функция более высокая, чем в случае отсутствия SR-1. На основании результатов в частности для PAC-1, в последующих экспериментах SR-1 использовали в концентрации 750 нМ.
[0105] 3. Исследование Продолжительности Сверхэкспрессии гена BMI1, гена c-MYC и гена BCL-xL
Эксперимент проводили таким же образом, как в разделе 2, делая период времени от последнего дня пересевания при получении иммортализованных мегакариоцитов раздела 1 до промывания клеток PBS(-), равным 1 дню, 2 дням или 3 дням, делая концентрацию SR-1 равной 75 нМ или 750 нМ после завершения сверхэкспрессии, и делая плотность посева равной 1×105 клеток/мл.
Результаты показаны на фиг. 2. Хотя почти не наблюдалось различий в количестве тромбоцитов, полученных с 1 по 3 день сверхэкспрессии, наблюдали, что проведение сверхэкспрессии в течение двух дней или более приводит к тенденции в сторону более высокой функции.
[0106] 4. Исследование Культивирования со Встряхиванием
Эксперимент проводили таким же образом, как в разделах 2 и 3, за исключением проведения культивирования со встряхиванием после посева клеток вместо 6-луночного планшета в колбу E125 по 25 мл/колбу и с плотностью посева 1×105 клеток/мл для исследования взаимосвязи между концентрацией SR-1 и плотностью посева иммортализованных мегакариоцитов.
Результаты показаны на фигурах 3 и 4. Получены результаты, аналогичные результатам статического культивирования.
[0107] 5. Исследование аналогов SR-1
Эксперимент проводили таким же образом, как в разделе 2, за исключением использования в качестве антагонистов AhR аналогов SR-1 в концентрациях, показанных на схеме.
Результаты показаны на фиг. 5. Было подтверждено, что количество полученных тромбоцитов и их функция улучшаются независимо от того, какой антагонист AhR был добавлен. В дополнение, на фигурах 6A и 6B более подробно показаны результаты изменения концентраций антагонистов AhR.
[0108] 6. Исследование эффекта совместного добавления антагониста AhR и ингибитора ROCK
Исследовали эффект добавления как SR-1 (антагониста AhR), так и Y27632 (ингибитора ROCK). Иммортализованные мегакариоциты, полученные согласно способу, описанному в разделе 1, два раза промывали PBS(-) с последующим удалением доксициклина для окончания сверхэкспрессии, статически культивировали после посева клеток в 6-луночный планшет по 2 мл/лунку и с плотностью посева 1×105 клеток/мл, а затем культивирования со встряхиванием в колбе E125 по 25 мл/колба и с плотностью посева 1×105 клеток/мл.
Среду получали путем добавления в IMDM, служащую в качестве базовой среды, следующих компонентов (концентрации обозначают итоговые концентрации).
FBS: 15%
L-глютамин
ITS
MTG
Аскорбиновая кислота
SCF: 50 нг/мл
Аналогичный TOP агент: 200 нг/мл
SR-1: 750 нМ
Y27632: 10 мкМ
Культивирование осуществляли в условиях 37°C, 5% CO2 и 20% O2. Количества тромбоцитов и PAC-1 положительных клеток измеряли с использованием того же способа, как описано в упомянутом выше разделе 2.
Результаты показаны на фигурах 7 и 8. Было подтверждено, что совместное добавление SR-1 и Y27632 приводит к синергетическому повышению количества и функции полученных тромбоцитов по сравнению со случаем добавления одного из них. Аналогичные синергетические эффекты были подтверждены для комбинаций SR-1 и других ингибиторов ROCK (таких как Y39983, фазудила гидрохлорид, рипазудил, SLX-2119, RKI-1447, азаиндол-1 или SR-3677). На фиг. 9 показаны результаты для Y-39983, которые продемонстрировали заметный синергетический эффект, который превышал эффект Y27632. Фазудила гидрохлорид и рипазудил также продемонстрировали зависящие от концентрации синергетические эффекты, сопоставимые с Y27632. Когда впоследствии изучали количество полученных тромбоцитов и др. для комбинаций Y27632 и других антагонистов AhR, синергетические эффекты наблюдали для всех их комбинаций. На фиг. 10 показаны результаты для GNF-351 и CH-223191, которые продемонстрировали заметные синергетические эффекты, которые превышали эффект SR-1. Хотя результаты не показаны, комбинация GNF-351 и Y-39983 в частности продемонстрировала неожиданно заметный эффект.
[0109] В дополнение, хотя количество полученных тромбоцитов увеличивалось с числом дней культивирования, количество PAC1-положительных функциональных тромбоцитов имело тенденцию к достижению максимума приблизительно на 5 день добавления.
[0110] 7. Исследование заменителей FBS
Эксперимент проводили таким же образом, как эксперимент, описанный в упомянутом выше разделе 2 или 6 за исключением использования 15% сыворотки человеческого происхождения (обозначенной на чертеже как человеческая сыворотка, объединенная сыворотка здоровых людей (#12181201 (Kohjin Bio Co., Ltd.))) или 15% плазмы человеческого происхождения (обозначенной на чертеже как человеческих плазма, объединенная плазма здоровых людей, обработанная гепарином (#12250210 (Kohjin Bio Co., Ltd.))) вместо 15% FBS для исследования, может ли или не может FBS быть заменен компонентом человеческого происхождения.
Результаты показаны на фиг. 11. Определили, что функциональные тромбоциты получают, даже если вместо FBS используется 15% человеческая сыворотка или 15% человеческая плазма. Поскольку использование человеческой сыворотки или человеческой плазмы обеспечивает возможность устранения любых компонентов, полученных от различных видов животных, могут быть получены тромбоциты, которые имеют более высокую степень безопасности.
[0111] Далее эксперимент проводили в тех же условиях, как на Фиг. 11, за исключением проведения культивирования со встряхиванием в присутствии SR-1 и Y27632.
Результаты показаны на фиг. 12. Функциональные тромбоциты получали с использованием 15% человеческой сыворотки и 15% человеческой плазмы даже в случае культивирования со встряхиванием вместо статического культивирования. Культивирование со встряхиванием обеспечивает как крупномасштабное культивирование, так и крупномасштабное производство.
[0112] В целом известно, что для использования в качестве добавки к среде человеческая плазма более предпочтительна, чем человеческая сыворотка, поскольку добавление в среду сыворотки вызывает реакцию коагуляции, приводящую к большей чувствительности к разнице между партиями. Вследствие этого исследовали зависимость количества полученных тромбоцитов от концентрации для человеческой плазмы путем проведения культивирования со встряхиванием в присутствии SR-1 и Y27632.
Результаты показаны на фиг. 13. Хотя некоторую степень зависимости от концентрации наблюдали для количества полученных тромбоцитов, было подтверждено, что можно получать адекватное количество функциональных тромбоцитов, даже если концентрация плазмы снижалась до 1%. Способность понижать концентрацию человеческой плазмы в среде обеспечивает возможность уменьшения стоимости производства препаратов тромбоцитов.
[0113] Продолжая, аналогичный эксперимент проводили путем снижения концентрации человеческой сыворотки. Статическое культивирование проводили с использованием обработанной цитратом объединенной плазмы здоровых людей (#12250110 (Kohjin Bio Co., Ltd.)) для человеческой плазмы, и объединенной сыворотки здоровых людей (#12181201 (Kohjin Bio Co., Ltd.)) для человеческой сыворотки.
Результаты показаны на фигурах 14 и 15. Было подтверждено, что адекватное количество функциональных тромбоцитов получали, даже если концентрация сыворотки снижалась до 1%.
[0114] 8. Ингибирование HMGA2
Гены shRUNX1 с GFP, shHMGA2 с GFP и SCRAMBLE с GFP вводили в иммортализованные мегакариоциты, полученные в упомянутом выше разделе 1 с использованием вирусного вектора. Затем сортировали клетки, введенные с генами выше (GFP-положительные клетки). В таблице 1 ниже показаны используемые shRNA.
[Таблица 1]
[0115] на фигурах 16 и 17 показан обзор экспериментaльного метода и его результаты. Поскольку нокдаун HMGA2 приводил к уменьшению количества CD41a-положительных клеток, определили, что HMGA2 является фактором, необходимым для саморепликации мегакариоцитов, перед тем как они становятся многоядерными во время фазы роста. С другой стороны, поскольку нокдаун RUNX1 приводил к увеличению количества CD41a-положительных клеток, полагали, что RUNX1 незначительно ингибирует рост мегакариоцитов, перед тем как они становятся многоядерными.
[0116] Далее получение тромбоцитов оценивали после окончания сверхэкспрессии генов cMYC, BMI1 и BCL-xL с использованием способа, описанного в упомянутом выше разделе 1-5. Результаты показаны на фигурах 18 и 19.
Как показано на чертежах, содержание CD41a- и CD42b-позитивных мегакариоцитов после окончания сверхэкспрессии (OFF MGK) увеличивалось по сравнению с их содержанием перед окончанием сверхэкспрессии (ON MGK), и было подтверждено, что CD41a- и CD42b-позитивные тромбоциты получены в больших количествах. Как показано в верхней части фиг. 19, нокдаун HMGA2 приводит к существенному содействию мультинуклеации мегакариоцитов, и как показано в нижней части фиг. 19, было подтверждено, что существенно увеличивается количество полученных тромбоцитов на мегакариоцит.
[0117] 9. Результаты Ингибирования HMGA2, антагонистов AhR и ингибиторов ROCK
Гены shRUNX1 с GFP, shHMGA2 с GFP и shSCRAMBLE с GFP вводили в иммортализованные мегакариоциты, полученные в предыдущем разделе 1, таким же образом, как в разделе 8 выше, а после добавления среды мегакариоцитов, содержащей 1 мкг/мл доксициклина (DOX) (а именно, IMDM, содержащей 15% FBS, L-глютамин, ITS, MTG, аскорбиновую кислоту, 50 нг/мл SCF и 50 нг/мл TPO), и культивирования в течение 7 дней, клетки, введенные с упомянутыми выше генами (GFP-положительные клетки), выделяли путем сортировки. 1×105 выделенных клеток, введенных с shHMGA2, высевали в 6-луночный планшет и культивировали в течение 7 дней в несодержащей DOX среде мегакариоцитов (а именно, среде для прерывания экспрессии экзогенных генов) в отсутствии всякого добавления, после добавления только 750 нМ SR-1, после добавления только 10 мкМ Y27632 или после добавления 750 нМ SR-1 и 10 мкМ Y27632.
С другой стороны, выделенные клетки, введенные с shRUNX1 и shSCRAMBLE, культивировали в течение 7 дней в несодержащей DOX среде мегакариоцитов, содержащей 750 нМ SR-1 и 10 мкМ Y27632. Полученные в результате клетки прилипали к предметному стеклу при использовании цитоцентрифуги, и их наблюдали с помощью электронного микроскопа (фиг. 20 вверху).
В дополнение, тромбоциты (CD41a-позитивные, CD42b- позитивные), имеющиеся в супернатантах культуры, измеряли с использованием FACS (фиг. 20 внизу). В результате наблюдали многоядерные и увеличенные клетки в результате культивирования мегакариоцитов, подвергнутых нокдауну HMGA2 в среде, содержащей антагонист AhR и ингибитор ROCK, и было подтверждено, что количество полученных тромбоцитов на одну клетку существенно увеличивается. В дополнение было подтверждено, что в случае комбинации антагониста AhR и ингибитора ROCK эффективность выработки тромбоцитов становятся еще выше.
10. Ингибирование HMGA2 и Созревание Мегакариоцитов
Клетки, введенные с генами shRUNX1, shHMGA2 и shSCRAMBLE, полученные в разделе 9 выше, культивировали в несодержащей DOX среде мегакариоцитов, содержащей SR-1 и Y27632, и их исследовали с помощью электронного микроскопа.
Результаты показаны на фиг. 21. В результате, в случае введения shRUNX1 было множество маленьких содержащих ядро клеток, в клетках отсутствовало развитие разграничивающих мембранных систем (DMS), и было подтверждено, что секреторные гранулы образуются только в умеренной степени. Аналогично, в случае введения shSCRAMBLE было множество маленьких содержащих ядро клеток, в клетках отсутствовало развитие DMS, и было подтверждено, что образование секреторных гранул почти непроисходило. С другой стороны, в случае введения shHMGA2 наблюдали многоядерные и увеличенные клетки, и в этих клетках наблюдалось образование DMS и секреторных гранул.
На основе вышеуказанных результатов было подтверждено, что ингибирование HMGA2 в мегакариоцитах обеспечивает возможность повышения эффективности выработки тромбоцитов, в результате комбинации антагониста AhR и ингибитора ROCK полученные в результате мегакариоциты становятся многоядерными и увеличиваются таким же образом, как мегакариоциты в организме, наблюдается созревание мегакариоцитов до степени, когда наблюдается образование DMS и секреторных гранул, а в результате этого эффективность выработки тромбоцитов становится еще выше.
Произвольный Текст Списка Последовательностей
[0118] SEQ ID NO: 1 показывает целевую последовательность shSCRAMBLE.
SEQ ID NO: 2 показывает последовательность ДНК shSCRAMBLE.
SEQ ID NO: 3 показывает целевую последовательность shRUNX1.
SEQ ID NO: 4 показывает последовательность ДНК shRUNX1.
SEQ ID NO: 5 показывает целевую последовательность shHMGA2.
SEQ ID NO: 6 показывает последовательность ДНК shHMGA2.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> KYOTO UNIVERSITY
Megakaryon Corporation
<120> Способ получения высокофункциональных тромбоцитов
<130> 5032
<140> PCT/JP2016/068015
<141> 2016-06-16
<150> JP2015-121456
<151> 2015-06-16
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 1
gaggtcacac tagagagtta ta 22
<210> 2
<211> 71
<212> ДНК
<213> Искусственная
<220>
<223> синтезированная ДНК
<400> 2
gatccccgag gtcacactag agagttatat tcaagagata taactctcta gtgtgacctc 60
tttttggaaa a 71
<210> 3
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 3
actttccagt cgactctca 19
<210> 4
<211> 65
<212> ДНК
<213> Искусственная
<220>
<223> синтезированная ДНК.
<400> 4
gatccccact ttccagtcga ctctcattca agagatgaga gtcgactgga aagttttttg 60
gaaaa 65
<210> 5
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 5
atgagacgaa atgctgatgt at 22
<210> 6
<211> 71
<212> ДНК
<213> Искусственная
<220>
<223> синтезированная ДНК.
<400> 6
gatccccatg agacgaaatg ctgatgtatt tcaagagaat acatcagcat ttcgtctcat 60
tttttggaaa a 71
<---
Реферат
Изобретение относится к области биотехнологии, а именно к получению тромбоцитов и средству, способствующему получению PAC-1-позитивных тромбоцитов. Способ включает введение в контакт с мегакариоцитами или с их клетками-предшественниками средства, содержащего один или множество антагонистов арил-гидрокарбонового рецептора (AhR) и один или множество ингибиторов Rho-ассоциированных суперспираль-формирующих киназ (ROCK). Изобретение позволяет расширить арсенал технических средств. 2 н. и 10 з.п. ф-лы, 21 ил., 1 табл., 1 пр.

Комментарии