Бета-лактамазы с улучшенными свойствами для лечения - RU2678124C2
Код документа: RU2678124C2
Чертежи
























Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет по предварительной заявке на патент №61/980884, поданной 17 апреля 2014 года, и предварительной заявке на патент №62/046627, поданной 5 сентября 2014 года, обе из которых в полном объеме включены в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение, в частности, относится к композициям бета-лактамаз и способам применения этих ферментов, например, при расстройствах желудочно-кишечного тракта (ЖК-тракта), таких как вызванных инфекцией C. difficile (CDI).
УРОВЕНЬ ТЕХНИКИ
Люди могут считаться "суперорганизмом", который представляет собой конгломерат клеток млекопитающих и микробных клеток, причем количество последних по оценке превышает количество предыдущих в соотношении десять к одному. Этот микробный компонент и его микробный генетический репертуар, микробном, приблизительно в 100 раз превышает таковой человека-хозяина. Удивительно, что несмотря на это огромное разнообразие чужеродных организмов, иммунная система человека обычно сохраняет состояние синергизма. Этот факт особенно справедлив по отношению к дистальному ЖК-тракту, который является домом для до 1000 различных видов бактерий и по оценке превышает 1×1014 микроорганизмов и оказывается центральным в определении состояния здоровья человека-хозяина. Потеря точного баланса в микробиоме, особенно в ЖК-тракте, может приводить к различным заболеваниям.
Однако виды медицинского лечения антибиотиками, которые необходимы для лечения некоторых аспектов заболевания, могут индуцировать нарушения в микробиоме, включая расстройства в ЖК-тракте, и приводить к дополнительному заболеванию. Например, некоторые парентерально вводимые бета-лактамы, как ампициллин, цефтриаксон, цефоперазон и пиперациллин, в частности, выводятся посредством экскреции желчи в проксимальную часть тонкого кишечника (двенадцатиперстной кишки). Остаточные неабсорбированные бета-лактамы могут вызывать в кишечнике нежелательное влияние на экологическое равновесие нормальной кишечной микробиоты, приводя, к примеру, к CDI, антибиотик-ассоциированной диарее, избыточному размножению патогенных бактерий, таких как устойчивые к ванкомицину энтерококки (VRE), грамотрицательные бациллы, продуцирующие бета-лактамазы расширенного спектра (ESBL), и грибки, и отбору устойчивых к антибиотикам штаммов, как среди нормальной кишечной микробиоты, так и потенциально патогенных бактерий.
Один подход для избежания этого или восстановления экологического равновесия нормальной кишечной микробиоты заключается в терапевтическом применении бета-лактамаз, например, путем инактивации экскретированных или неабсорбированных антибиотиков в ЖК-тракте, тем самым поддерживая нормальную кишечную микробиоту и предотвращая избыточное размножение в ней потенциально патогенных микроорганизмов.
Сохраняется необходимость в агентах и лекарственных средствах, обладающими ферментативными свойствами, которые наилучшим образом подходят для данных видов применения, для лечения расстройств желудочно-кишечного тракта (ЖК-тракта), таких как инфекция C. difficile (CDI).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно в настоящем изобретении предлагаются бета-лактамазы, содержащие аминокислотную последовательность, которая основана на бета-лактамазе Р1А, но содержащие полезные мутации, которые, например, изменяют специфичность к субстрату и/или активность, и предлагаются для терапевтических применений. Например, такие мутанты имеют по меньшей мере 70% идентичности последовательности с SEQ ID NO: 1 и имеют одну или более мутаций в следующих положениях классификации Ambler F33, Q135, G156, А232, А237, А238, S240, Т243, R244, S266 и D276. Такие бета-лактамазы обладают способностью гидролизировать как пенициллины, так и цефалоспарины, и выполняют это с требуемыми ферментативными характеристиками, такими как низкие значение KM и высокие значения Vmax для выбранных антибиотических субстратов.
Эти улучшенные бета-лактамазы находят применение в ряде терапий, включая предотвращение или лечение CDI и/или ассоциированного с C. difficile заболевания или других антибиотик-индуцированных неблагоприятных эффектов в ЖК-тракте. Например, бета-лактамазы находят применение таким образом, что позволяют пациенту проходить антибиотикотерапию, оставаясь защищенным от заболевания, которое могло бы возникнуть в результате избытка антибиотиков, отрицательно влияющего на микробиом. Такое применение не препятствует системному функционированию антибиотика. Точнее бета-лактамазы удаляют избыток антибиотика, который может занимать части ЖК-тракта и, при этом предотвращают разрушение микробиоты, которое связано с различными болезненными состояниями, описанными в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1 показан гель Criterion XT с 12% Bis-Tris для ДСН-ПААГ-электрофореза (BioRad) с концентрированными образцами (см. обозначения образцов с правой стороны геля) из среды для выращивания В. subtilis с 10 г/л глюкозы. MWM = маркер молекулярной массы Precision Plus (BioRad), RS310=Р1А штамм В. subtilis, a P1A A18K31 = эталонный образец P1A. Обозначение "P1A →" отмечает правильный размер P1A и мутантных белков.
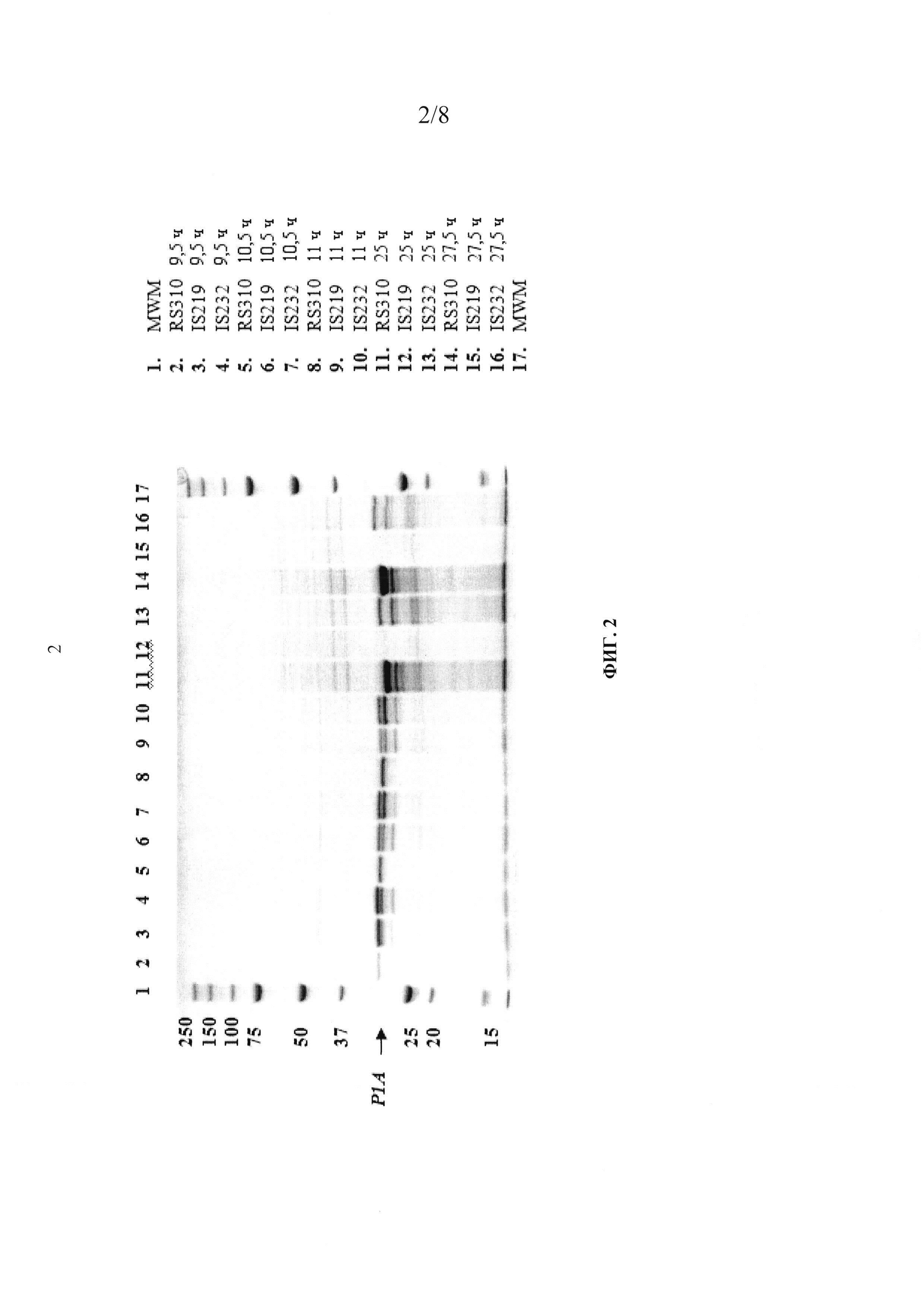
На фиг. 2 показан гель Criterion XT с 12% Bis-Tris для ДСН-ПААГ-электрофореза (BioRad) с образцами супернатантов (см. обозначения образцов с правой стороны геля) из среды для выращивания В. subtilis с 5 г/л глюкозы. На гель наносили 14 мкл каждого супернатанта. MWM = маркер молекулярной массы Precision Plus (BioRad), RS310=P1A штамм В. subtilis, а обозначение "P1A →" отмечает правильный размер P1A и мутантных белков.
На фиг. 3 показана диаграмма элюирования из анализа ХГВ. Места отобранных фракций элюирования отмечены стрелками и черными пунктирными линиями (самые удаленные пунктирные линии справа), оба типа обозначения перпендикулярны Х-оси. На диаграмме легко видны проточные фракции А7-В8. График А280 представлен в виде сплошной линии (верхняя линия) и проводимость элюированного раствора - сплошной линией (вторая линия сверху). Введение образца отмечено пунктирными линиями (самая удаленная пунктирная линии слева), а фракции - множеством сплошных линий, оба типа обозначения перпендикулярны Х-оси.
На фиг. 4 показана диаграмма элюирования из анализа ХГВ. Места отобранных фракций элюирования отмечены стрелками и черными пунктирными линиями (самые удаленные пунктирные линии справа), оба типа обозначения перпендикулярны Х-оси. На диаграмме легко видны проточные фракции А1-А8. График А280 представлен в виде сплошной линии (вторая линия сверху) и проводимость элюированного раствора - сплошной линией (верхняя линия). Введение образца отмечено пунктирными линиями (самая удаленная пунктирная линии слева), а фракции - множеством сплошных линий, оба типа обозначения перпендикулярны Х-оси.
На фиг. 5 показана диаграмма элюирования из анализа ХГВ. Места отобранных фракций элюирования отмечены стрелками и черными пунктирными линиями (самые удаленные пунктирные линии справа), оба типа обозначения перпендикулярны Х-оси. На диаграмме легко видны проточные фракции А1-В1. График А280 представлен в виде сплошной линии (вторая линия сверху) и проводимость элюированного раствора - сплошной линией (верхняя линия). Введение образца отмечено пунктирными линиями (самая удаленная пунктирная линии слева), а фракции - множеством сплошных линий, оба типа обозначения перпендикулярны Х-оси. Область перед нулем на Х-оси представляет собой уравновешивание колонки с помощью буфера А.
На фиг. 6 показан гель ДСН-ПААГ с анализом фракций трех очисток ХГВ, показанных на Фиг. 3-5. AS-доб = фильтрат сульфата аммония, использованный в конкретной очистке, т.е. исходное вещество для очистки. В1 161008, В7 161008, В8 161008, А2 041108, А7 041108 и В1 121108: проточные фракции для каждой из очисток. С3-С8 161008, C9-D1 161008, D2-D8 161008, В2-В10 041108 и В8-С3 121108: пики элюированных белков, объединенные фракции. A18K31 Р1А: эталонное вещество, 0,64 мкг/дорожку.
На фиг. 7 продемонстрирована методика SOE (перекрывающихся расширений после сплайсинга). Целевые аминокислоты В3 β-цепи Р1А так близко расположены друг к другу, что использованием методики SOE могут заменяться все четыре аминокислоты. Участок, охватывающий данные замены, содержит 24 нуклеотида (8 аминокислотных кодонов) и включает перекрывающуюся часть расширения двух праймеров ПЦР. Сначала мутировавший ген реnР двумя частями амплифицируется ПЦР, с использованием праймеров А+В и C+D. Затем два продукта ПЦР комбинируются и амплифицируются с использованием праймеров А и D, комплементарных 5' и 3' частям гена реnР. В праймеры А и D включены сайты клонирования. Как только конструкция получена дополнительные мутации могут добавляться с использованием набора Multi. Показаны аминокислотные последовательности, кодированные перекрывающимися праймерами (В и С).
На фиг. 8 демонстрируется активность разрушения антибиотиков Р1А (левые столбцы) и Р4А (правые столбцы). Против указанных антибиотиков применяли концентрации 10 или 100 нг/мл фермента. Данные построены в виде наибольшей концентрации антибиотиков, которая разрушается указанной бета-лактамазой (использованные концентрации антибиотиков составляли 10, 100 или 1000 мкг/мл).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, в частности, на открытии некоторых ферментов бета-лактамаз, которые имеют требуемые свойства для применения в терапии, включая, например, способность гидролизовать один или более из пенициллинов и цефалоспоринов.
В некоторых аспектах в настоящем изобретении предлагаются бета-лактамазы и фармацевтические композиции данных бета-лактамаз. В различных аспектах настоящего изобретения бета-лактамазы и/или фармацевтические композиции получают путем мутации из SEQ ID NO: 1 (Bacillus licheniformis PenP, т.е. Р1А). Соответственно, в различных аспектах в настоящем изобретении предлагаются бета-лактамазы и/или фармацевтические композиции, которые являются производными Р1А.
Р1А разрабатывали для инактивации парентерально вводимых бета-лактамов, группы пенициллина (например, пенициллина, амоксициллина, ампициллина и пиперациллина) с или без ингибиторов бета-лактамаз (например, тазобактама, сульбактама, клавулановой кислоты), экскретируемых через желчевыделительную систему (см. международные публикации патентов WO 1993/013795 и WO 2008/065247; Tarkkanen, A.M. et al., Antimicrob Agents Chemother. 53: 2455, содержание которых включено в данный документ посредством ссылки в полном объеме). Фермент Р1А представляет собой рекомбинантную форму малой экзо бета-лактамазы Bacillus licheniformis 749/C (WO 2008/065247), которая принадлежит к классу А и по функциональной классификации размещается в подгруппе 2а. Бета-лактамаза В. licheniformis и ее производное Р1А считаются пенициллиназами, которые имеют высокую гидролитическую способность разрушать например, пенициллин, ампициллин, амоксициллин или пиперациллин, и они обычно ингибируются активными сайт-специфическими ингибиторами бета-лактамаз, такими как клавулановая кислота, сульбактам или тазобактам. Однако фермент Р1А имеет ограниченную способность инактивировать бета-лактамные антибиотики, которые принадлежат цефалоспорину или группе карбапенема. Поскольку применяемые бета-лактамазы обладают слабой активностью по отношению к цефалоспоринам, то они не могут применяться в сочетании с парентеральной цефалоспориновой терапией для инактивации неабсорбированного бета-лактама в тракте тонкого кишечника. Поэтому в некоторых вариантах реализации изобретения бета-лактамазы и/или фармацевтические композиции по настоящему изобретению улучшают за счет свойств Р1А, согласно настоящему описанию.
В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают требуемыми характеристиками, включающими, например, способность эффективно таргетировать широкий спектр антибиотиков. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают требуемыми ферментативными кинетическими характеристиками. Например, в некоторых вариантах реализации изобретения бета-лактамазы обладают низким значением KM по отношению к по меньшей мере одному цефалоспорину, включая, например, значение KM меньше, чем около 500 мкМ или около 100 мкМ, или около 10 мкМ, или около 1 мкМ, или около 0,1 мкМ (100 нМ), или около 0,01 мкМ (10 нМ), или около 1 нМ. Например, в некоторых вариантах реализации изобретения бета-лактамазы обладают низким значением KM по отношению к по меньшей мере одному пенициллину, включая, например, значение KM меньше, чем около 500 мкМ или около 100 мкМ, или около 10 мкМ, или около 1 мкМ, или около 0,1 мкМ (100 нМ), или около 0,01 мкМ (10 нМ), или около 1 нМ. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают высоким значением Vmax по отношению к по меньшей мере одному цефалоспорину, включая, например, значение Vmax, которое больше, чем около 100 с-1 или около 1000 с-1, или около 10000 с-1, или около 100000 с-1, или около 1000000 с-1. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают высоким значением Vmax по отношению к по меньшей мере одному пенициллину, включая, например, значение Vmax, которое больше, чем около 100 с-1 или около 1000 с-1, или около 10000 с-1, или около 100000 с-1, или около 1000000 с-1. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают каталитической эффективностью по отношению к по меньшей мере одному цефалоспорину более чем около 106 M-1 с-1. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают каталитической эффективностью по отношению к по меньшей мере одному пенициллину более чем около 106 М-1 с-1. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают требуемыми ферментативными кинетическими характеристиками по отношению к по меньшей мере одному из или обеим из цефалоспоринов и пенициллинов. В различных вариантах реализации изобретения предлагаются специфические антибиотики (например, цефалоспорины и пенициллины, описанные в данном документе).
В данном документе предлагается последовательность из 263 аминокислот фермента Р1А (после удаления сигнальной последовательности из 31 аминокислоты и пентапептида QASKT (Gln-Ala-Ser-Lys-Thr) на N-конце см. SEQ ID NO: 3). Согласно настоящему описанию для создания изобретательских бета-лактамаз в эту последовательность могут быть введены мутации.
SEQ ID NO: 1

В некоторых вариантах реализации изобретения SEQ ID NO: 1 может содержать остаток Met и/или Thr, предшествующий первому остатку последовательности. В различных вариантах реализации изобретения остаток Met может быть отщеплен. Согласно настоящему описанию для создания изобретательских бета-лактамаз в эту последовательность могут быть введены мутации, содержащие остаток Met и/или Thr, предшествующий первому остатку последовательности.
В данном документе также предлагается последовательность из 299 аминокислот фермента Р1А перед удалением сигнальной последовательности из 31 аминокислоты и пентапептида QASKT (Gln-Ala-Ser-Lys-Thr) на N-конце в виде SEQ ID NO: 3:
SEQ ID NO: 3

Дополнительно в настоящем изобретении предлагаются также дополнительные остатки в прямом направлении от первого остатка SEQ ID NO: 1 (см., например, JBC 258 (18): 11211, 1983, содержание которой таким образом включено в данный документ посредством ссылки, включая экзо-большие и экзо-малые варианты penP и penP1). Дополнительно в настоящем изобретении предлагаются также дополнительные остатки в обратном направлении от последнего остатка SEQ ID NO: 1.
Полинуклеотидная последовательность Р1А (после удаления сигнальной последовательности из 31 аминокислоты и пентапептида QASKT на N-конце) также предлагается в виде SEQ ID NO: 2. Согласно настоящему описанию для создания изобретательских бета-лактамаз в эту последовательность могут быть введены мутации (включая принятие во внимание вырожденность генетического кода).
SEQ ID NO: 2

Полинуклеотидная последовательность Р1А перед удалением сигнальной последовательности из 31 аминокислоты и пентапептида QASKT на N-конце также предлагается в виде SEQ ID NO: 4. Согласно настоящему описанию для создания изобретательских бета-лактамаз в эту последовательность могут быть введены мутации (включая принятие во внимание вырожденность генетического кода).
SEQ ID NO: 4

В различных вариантах реализации изобретение относится к мутагенезу бета-лактамазы (например, бета-лактамазы класса А) для получения полезных фрементов (например, таких, которые могут таргетировать широкий спектр антибиотиков). В некоторых вариантах реализации изобретение включает сайт-направленный мутагенез, случайный мутагенез и/или подходы направленной эволюции. В некоторых вариантах реализации изобретения схема мутаций основана на, в частности, данных структуры (например, данных кристаллической структуры, гомологичных моделях и т.д.) из следующих данных: кристаллическая структура Р1А (Knox and Moews, J. Mol Biol., 220, 435-455 (1991)), CTX-M-44 (1BZA (Ibuka et al. Journal of Molecular Biology Volume 285, Issue 5 2079-2087 (1999), 1IYS (Ibuka et al. Biochemistry, 2003, 42 (36): 10634-43), 1IYO, HYP и 1IYQ (Shimamura et al. 2002 J. Biol. Chem. 277: 46601-08), Proteus vulgaris K1 (1HZO, Nugaka et al. J Mol Biol. 2002 Mar 15; 317(1): 109-17) и HugA Proteus penneri (Liassine et al. Antimicrob Agents Chemother. 2002 Jan; 46(1): 216-9. 2002) и обзор в Bonnet, Antimicrob. Agents Chemother 48(1): 1-14 (2004) (для СТМ-Х), содержание всех из этих документов таким образом включено в данный документ посредством ссылки в полном объеме). В некоторых вариантах реализации изобретения о представленных мутациях стало известно с помощью анализа данных структуры (например, данных кристаллической структуры, гомологичных моделей т.д.) любой из следующих бета-лактамаз: Р1А (см., например, патент США №5607671, содержание которого таким образом включено в данный документ посредством ссылки), Р2А (см., например, WO 2007/147945, содержание которого таким образом включено в данный документ посредством ссылки), Р3А (см., например, WO 2011/148041, содержание которого таким образом включено в данный документ посредством ссылки), СТХ-М-3, СТХ-М-4, СТХ-М-5, СТХ-М-9, СТХ-М-10, СТХ-М-14, СТХ-М-15, СТХ-М-16, СТХ-М-18, СТХ-М-19, СТХ-М-25, СТХ-М-26, СТХ-М-27, СТХ-М-32, CTX-M-44, СТХ-М-45 и СТХ-М-54. Такая информация доступна специалисту в данной области техники в известных базах данных, например, банке данных белковых последовательностей Swiss-Prot, NCBI и PDB.
В некоторых вариантах реализации изобретение относится к одной или более (например, около 1 или около 2, или около 3, или около 4, или около 5, или около 6, или около 7, или около 8, или около 9, или около 10, или около 15, или около 20, или около 30, или около 40, или около 50, или около 60, или около 70, или около 80, или около 90, или около 100, или около 110, или около 120, или около 130, или около 140, или около 150) мутаций в SEQ ID NO: 1 или SEQ ID NO: 3 или последовательности с по меньшей мере 30, 35, 40, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5, 99,8, 99,9% идентичности к SEQ ID NO: 1 или SEQ ID NO: 3 (или около 70%, или около 75%, или около 80%, или около 85%, или около 90, или около 95%, или около 96%, или около 97%, или около 98%, или около 99% идентичности к SEQ ID NO: 1 или SEQ ID NO: 3). В различных вариантах реализации изобретения одна или более аминокислот из SEQ ID NO: 1 или SEQ ID NO: 3 замещены встречающейся в природе аминокислотой, такой как гидрофильная аминокислота (например, полярная и положительно заряженная гидрофильная аминокислота, такая как аргинин (R) или лизин (K); полярная и нейтральная из заряженной гидрофильной аминокислоты, такая как аспарагин (N), глутамин (Q), серин (S), треонин (Т), пролин (Р) и цистеин (С), полярная и отрицательно заряженная гидрофильная аминокислота, такая как аспартат (D) или глутамат (Е), или ароматическая полярная и положительно заряженная гидрофильная аминокислота, такая как гистидин (Н)) или гидрофобная аминокислота (например гидрофобная алифатическая аминокислота, такая как глицин (G), аланин (А), лейцин (L), изолейцин (I), метионин (М) или валин (V), гидрофобная ароматическая аминокислота, такая как фенилаланин (F), триптофан (W) или тирозин (Y), или неканоническая аминокислота (например, селеноцистеин, пирролизин, N-формилметионин-β-аланин, ГАМК и δ-аминолевулиновая кислота. 4-Аминобензойная кислота (ПАБК), D-изомеры традиционных аминокислот, 2,4-диаминомасляная кислота, α-аминоизомасляная кислота, 4-аминомасляная кислота, Abu, 2-аминомасляная кислота, γ-Abu, ε-Ahx, 6-аминокапроновая кислота, Aib, 2-аминоизомасляная кислота, 3-аминопропионовая кислота, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, гомоцитруллин, цистеиновая кислота, трет-бутилглицин, трет-бутилаланин, фенилглицин, циклогексилаланин, β-аланин, фтораминокислоты, сконструированные аминокислоты, такие как β-метиламинокислоты, C α-метиламинокислоты, N α-метиламинокислоты, и вообще аналоги аминокислот).
В иллюстративных вариантах реализации изобретения изобретательские мутации включают, но не ограничиваются одной или более (например, около 1 или около 2, или около 3, или около 4, или около 5, или около 6, или около 7, или около 8, или около 9, или около 10, или около 15, или около 20, или около 30, или около 40, или около 50, или около 60, или около 70, или около 80, или около 90, или около 100, или около 110, или около 120, или около 130, или около 140, или около 150) из следующих мутаций в SEQ ID NO: 1 или SEQ ID NO: 3 или последовательности с по меньшей мере 30, 35, 40, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5, 99,8, 99,9% идентичности к SEQ ID NO: 1 или SEQ ID NO: 3 (или около 70%, или около 75%, или около 80%, или около 85%, или около 90, или около 95%, или около 96%, или около 97%, или около 98%, или около 99% идентичности к SEQ ID NO: 1 или SEQ ID NO: 3):





















В некоторых вариантах реализации изобретения SEQ ID NO: 1 может содержать остаток Met и/или Thr, предшествующий первому остатку последовательности. Эти остатки могут быть аналогичным образом мутировавшими, как указано выше.
Во всех этих мутантах нумерация остатков соответствует SEQ ID NO: 1. Эти номера остатков могут конвертироваться в номера по Ambler (Ambler et al., 1991, стандартная схема нумерации для β-лактамаз класса A, Biochem. J. 276: 269-272, полное содержание которой таким образом включено в настоящий документ посредством ссылки) посредством применения традиционного метода биоинформатики, например, путем применения BLAST (основное средство поиска локального выравнивания) или FASTA (FAST-АII). Например, остаток 224 соответствует номеру 226 по Ambler. Например, могут применяться следующие конверсии:


Кроме того, процент идентичности также может оцениваться традиционными методами биоинформатики.
В одном аспекте настоящее изобретение относится к бета-лактамазам и/или фармацевтическим композициям, содержащим аминокислотную последовательность, имеющую по меньшей мере 70% (например, около 70% или около 71%, или около 72%, или около 73%, или около 74%, или около 75%, или около 76%, или около 77%, или около 78%, или около 79%, или около 80%, или около 81%, или около 82%, или около 83%, или около 84%, или около 85%, или около 86%, или около 87%, или около 88%, или около 89%, или около 90%, или около 91%, или около 92%, или около 93%, или около 94%, или около 95%, или около 96%, или около 97%, или около 98%, или около 99%) идентичности последовательности с SEQ ID NO: 1 или SEQ ID NO: 3 и одну или более из следующих мутаций согласно классификации Ambler: F33X, Q135X, G156X, А232Х, А237Х, А238Х, S240X, Т243Х, R244X, S266X и D276X, где Х представляет собой встречающуюся в природе аминокислоту, но при условии, что D276X отсутствует в контексте одиночного мутанта. В некоторых вариантах реализации изобретения Х представляет собой встречающийся в природе остаток гидрофильной или гидрофобной аминокислоты, или неканонической аминокислоты.
В другом аспекте настоящее изобретение относится к бета-лактамазам и/или фармацевтическим композициям, содержащим аминокислотную последовательность, имеющую по меньшей мере 70% идентичности последовательности с SEQ ID NO: 1 или SEQ ID NO: 3 и одну или более из следующих мутаций согласно классификации Ambler: гидрофобный остаток, кроме фенилаланина (F) в положении 33; гидрофобный остаток, кроме глутамина (Q) в положении 135; гидрофобный остаток, кроме глицина (G) в положении 156; гидрофобный остаток, кроме аланина (А) в положении 232; гидрофильный остаток, кроме аланина (А) в положении 237; гидрофобный или гидрофильный остаток, кроме аланина (А) в положении 238; гидрофильный остаток, кроме серина (S) в положении 240; гидрофобный остаток, кроме треонина (Т) в положении 243; гидрофобный остаток, кроме аргинина (R) в положении 244; гидрофильный остаток, кроме серина (S) в положении 266, и гидрофильный остаток, кроме аспартата (D) в положении 276, с оговоркой, что гидрофильный аминокислотный остаток, кроме аспарагиновой кислоты (D) в положении соответствующему положению 276, отсутствует в контексте одиночного мутанта.
Как используется во всем документе, остаток гидрофильной аминокислоты может включать полярный и положительно заряженный гидрофильный остаток, выбранный из аргинина (R) или лизина (K); полярный и нейтрально заряженный гидрофильный остаток, выбранный из аспарагина (N), глутамина (Q), серина (S), треонина (Т), пролина (Р) и цистеина (С), полярный и отрицательно заряженный гидрофильный остаток, выбранный из аспартата (D) и глутамата (Е), или ароматический полярный и положительно заряженный гидрофильный остаток, включающий гистидин (Н). Как используется во всем документе, гидрофобный аминокислотный остаток может включать гидрофобную алифатическую аминокислоту, выбранную из глицина (G), аланина (А), лейцина (L), изолейцина (I), метионина (М) или валина (V), или гидрофобную ароматическую аминокислоту, выбранную из фенилаланина (F), триптофана (W) или тирозина (Y).
Мутации могут быть введены в генную последовательность бета-лактамазы (например, SEQ ID NO: 3 и 4) в отношении генетического кода, включающего принятие во внимание вырожденность кодонов.
В некоторых вариантах реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат одну или более из следующих мутаций в положениях согласно классификации Ambler: F33Y, Q135M, G156R, A232G, A237S, A238G или Т, S240P или D, T243I, R244T, S266N, D276N или R или K, при условии, что D276N или R или K отсутствуют в контексте одиночного мутанта. В одном варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат Q135M. В другом варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат G156R и А238Т. В другом варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат F33Y и D276N. В еще одном другом варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат F33Y, S240P и D276N. В одном варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат F33Y, А238Т и D276N. В другом варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат A232G, A237S, A238G и S240D. В дополнительном варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат A232G, A237S, A238G, S240D и R244T. В другом варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат A232G, A237S, A238G, S240D и D276R. В одном варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат A232G, A237S, A238G, S240D и D276K. В одном варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат A232G, A237S, A238G, S240D и Q135M. В одном варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат А238Т. В одном варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат T243I, S266 и D276N. В одном варианте реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат A232G, A237S, A238G, S240D и D276N.
В других вариантах реализации изобретения бета-лактамазы и/или фармацевтические композиции содержат аминокислотную последовательность, имеющую по меньшей мере 70% идентичности последовательности с SEQ ID NO: 2 и следующие согласно классификации Ambler: гидрофобный остаток, кроме аланина (А) в положении 232; гидрофильный остаток, кроме аланина (А) в положении 237; гидрофобный остаток, кроме аланина (А) в положении 238; гидрофильный остаток, кроме серина (S) в положении 240, и гидрофильный остаток, кроме аспартата (D) в положении 276. В некоторых вариантах реализации изобретения гидрофобный остаток, кроме аланина (А) в положении 232, представляет собой глицин (G). В некоторых вариантах реализации изобретения гидрофильный остаток, кроме аланина (А) в положении 237, представляет собой серин (S). В некоторых вариантах реализации изобретения гидрофобный остаток, кроме аланина (А) в положении 238, представляет собой глицин (G). В некоторых вариантах реализации изобретения гидрофильный остаток, кроме серина (S) в положении 240 представляет собой аспартат (D). В некоторых вариантах реализации изобретения остаток, кроме аспартата (D) в положении 276, представляет собой аспарагин (N). В некоторых вариантах реализации изобретения бета-лактамаза и/или фармацевтическая композиция содержит одну или более из A232G, A237S, A238G, S240D и D276N. В некоторых вариантах реализации изобретения бета-лактамаза и/или фармацевтическая композиция содержит все из A232G, A237S, A238G, S240D и D276N, последовательность которой может быть SEQ ID NO: 5:
SEQ ID NO: 5

SEQ ID NO: 6: SEQ ID NO: 5, включая сигнальные и добавление аминокислот QASKT (кодирующий участок - подчеркнут):

В изобретении также предлагаются полинуклеотиды, кодирующие любые из бета-лактамаз по данному изобретению, включающие, например, векторы, содержащие такие полинуклеотиды. Такие полинуклеотиды, в дополнение к последовательностям, кодирующим любые из бета-лактамаз по данному изобретению, могут дополнительно содержать один или более элементов контроля экспрессии. Например, полинуклеотид может содержать, в качестве элементов контроля экспрессии, один или более промоторов или транскрипционных энхансеров, участки связывания рибосом, сигналы терминации транскрипции и сигналы полиаденилирования. Полинуклеотид может быть встроен в любой подходящий вектор, который для экспрессии может быть помещен внутрь подходящей клетки-хозяина. Иллюстративный полинуклеотид по данному изобретению имеет SEQ ID NO: 7:
SEQ ID NO: 7
Полная нуклеотидная последовательность мутанта A232G, A237S, A238G, S240D и D276N, сайта Hind III AAGCTT - выделен жирным шрифтом) и дополнительных аминокислот K и Т. Подчеркнуты лидерные и дополнительные нуклеотиды (сайт Hind III и аминокислоты K и Т - для добавления аминокислотной последовательности QASKT).

В некоторых вариантах реализации изобретения вектор может оставаться эписомальным или становиться интегрированным в хромосому, при условии, что вставка, кодирующая терапевтический агент, может транскрибироваться. Векторы могут быть сконструированными путем стандартной технологии рекомбинантных ДНК. Векторы могут быть, например, плазмидами, фагами, космидами, фагемидами, вирусома или любыми другими типами, известными в данной области техники, которые применяются для репликации и экспрессии в прокариотических или эукариотических клетках (например, аденовирусом; ретровирусом; лентивирусом; scAAV; вектором pGEX; вектором рЕТ и вектором рНТ). Специалисту в данной области техники ясно, что в такие векторы могут включать большое разнообразие компонентов, известных в данной области техники (таких как элементы контроля экспрессии), включая большое разнообразие сигналов транскрипции, таких как промоторы и другие последовательности, которые регулируют связывание РНК-полимеразы на промоторе. Для инициирования экспрессии терапевтического агента может применяться любой промотор, известный как эффективный в клетках, в которых данный вектор будет экспрессироваться. Подходящие промоторы могут быть индуцируемыми или конститутивными. Примеры подходящих промоторов включают систему рЕТ (INVITROGEN), промотор lac, tac, trc, T7, промотор Т7А3, PhoA, plux и фаг лямбда pR, промотор лямбда pL (см., например, J Ind Microbiol Biotechnol (2012) 39: 383-399; Curr Opin Biotech 2001, 12: 195, содержание которой таким образом включено в данный документ посредством ссылки). Промотор может быть индуцибельным (например, посредством IPTG, метаболитов, температуры). Примеры подходящих промоторов включают участок раннего промотора SV40, промотор, содержащий длинный 3'-концевой повтор вируса саркомы Рауса, промотор тимидинкиназы ВПГ-1, регуляторные последовательности гена металлотионеина и т.д., а также следующие участки транскрипционного контроля животных, которые демонстрируют тканевую специфичность и применялись в трансгенных животных: участок контроля гена эластазы I, который активен в панкреатических ацинарных клетках поджелудочной железы; участок контроля гена инсулина, который активен в бета-клетках поджелудочной железы, участок контроля гена иммуноглобулинов, который активен в лимфатических клетках, участок контроля вируса опухоли молочной железы мышей, который активен в клетках яичек, молочной железы, лимфатических и тучных клетках, участок контроля гена альбумина, который активен в печени, участок контроля гена альфа-фетопротеина, который активен в печени, участок контроля гена альфа 1-антитрипсина, который активен в печени, участок контроля гена бета-глобина, который активен в эритроидных клетках, участок контроля гена основного белка миелина, который активен в олигодендроцитах в головном мозге, участок контроля гена легкой цепи-2 миозина, который активен в скелетных мышцах, и участок контроля гена гонадотропин-высвобождающего гормона, который активен в гипоталамусе.
В изобретении предложены полинуклеотиды, такие как полинуклеотиды, содержащие нуклеотидную последовательность бета-лактамазы по данному изобретению. Например, нуклеотидная последовательность, которая кодирует бета-лактамазу по данному изобретению. Такие полинуклеотиды могут дополнительно содержать дополнительный(е) элемент(ы) контроля функционально связанные с нуклеотидной последовательностью, такие как промоторные элементы и/или другие сигналы транскрипции или связанные с экспрессией сигналы. Полинуклеотид может был вставлен в различные векторы, который могут быть пригодны для продуцирования терапевтического агента в клетках-хозяевах, включающих, например, бактериальные и эукариотические клетки-хозяева. Бета-лактамаза по данному изобретению может быть получена с помощью известных методик для рекомбинантной экспрессии. Например, для продуцирования рекомбинантным способом бета-лактамазы по данному изобретению последовательность нуклеиновой кислоты, кодирующую соответствующий ген, функционально связывают с подходящей промоторной последовательностью так, чтобы последовательность нуклеиновой кислоты, кодирующая такую бета-лактамазу по данному изобретению, была бы транскрибируемой и/или транслируемой в клетках-хозяевах. Иллюстративные промоторы являются пригодными для экспрессии в различных системах, такие как промотор Т7, Pspac, PgroES, Pgsi и Plux и промотор amyQ и/или сигнальный пептид amyQ из Bacillus amyloliquefaciens (в качестве неограничивающего примера Gen Bank ID № J01542.1, содержание которого таким образом включено в данный документ посредством ссылки). Может использоваться любая традиционно применяемая система экспрессии, включающая эукариотические или прокариотические системы. Их конкретные примеры включают дрожжевые (например, Saccharomyces spp., Pichia spp.), системы млекопитающих и бакуловирусные, бактериальные системы, такие как Е.coli, В. subtillis и Caulobacter.
Клетки-хозяева по настоящему изобретению включают, например, прокариотические, эукариотические, бактериальные, дрожжевые клетки, клетки водорослей, насекомых и/или млекопитающих. В некоторых вариантах реализации изобретение охватывает любой тип клетки, которая рекомбинантно экспрессирует гены, связанные с данным изобретением, включающим прокариотические и эукариотические клетки. В некоторых вариантах реализации изобретения клетка представляет собой бактериальную клетку, такую как, например, Escherichia spp., Streptomyces spp., Zymonas spp., Acetobacter spp., Citrobacter spp., Synechocystis spp., Rhizobium spp., Clostridium spp., Corynebacterium spp., Streptococcus spp., Xanthomonas spp., Lactobacillus spp., Lactococcus spp., Bacillus spp., Alcaligenes spp., Pseudomonas spp., Aeromonas spp., Azotobacter spp., Comamonas spp., Mycobacterium spp., Rhodococcus spp., Gluconobacter spp., Ralstonia spp., Acidithiobacillus spp., Microlunatus spp., Geobacter spp., Geobacillus spp., Arthrobacter spp., Flavobacterium spp., Serratia spp., Saccharopolyspora spp., Thermus spp., Stenotrophomonas spp., Chromobacterium spp., Sinorhizobium spp., Saccharopolyspora spp., Agrobacterium spp.и Pantoea spp. Бактериальная клетка может быть грамотрицательной, такой как клетка Escherichia coli (Е.coli), или грамположительной, такой как виды Bacillus. В других вариантах реализации изобретения клетка представляет собой грибковую клетку, такую как, например, дрожжевая клетка, например, Saccharomyces spp., Schizosaccharomyces spp., Pichia spp., Paffia spp., Kluyveromyces spp., Candida spp., Talaromyces spp., Brettanomyces spp., Pachysolen spp., Debaryomyces spp., Yarrowia spp.и промышленные полиплоидные дрожжевые штаммы. Дрожжевой штамм может быть штаммом S. cerevisiae или штаммом Yarrowia spp. Другие примеры грибков включают, например, Aspergillus spp., Pennicilium spp., Fusarium spp., Rhizopus spp., Acremonium spp., Neurospora spp., Sordaria spp., Magnaporthe spp., Allomyces spp., Ustilago spp., Botrytis spp.и Trichoderma spp.В других вариантах реализации клетка представляет собой клетку водоросли или клетку растения (например, A thaliana, С. reinhardtii, Arthrospira, Р. tricomutum, Т. suecica, P. carterae, P. tricomutum, Chlorella spp., такие как Chlorella vulgaris). Целевые клетки могут включать трансгенные и рекомбинантные клеточные линии. В дополнение к этому, могут применяться гетерологичные клеточные линии, такие как клетки яичников китайского хомячка (СНО). Клетки-хозяева могут быть одноклеточными клетками-хозяевами или многоклеточными клетками-хозяевами.
В различных вариантах реализации изобретения бета-лактамазы по данному изобретению обладают функциональными характеристиками, которые делают их желательными для различного применения, включая терапевтические применения. Методы определения характеристик бета-лактамаз хорошо известны в данной области техники (например, анализ с нитроцефином, как описано O'Callaghan, et al., Antimicrob. Agents Chemother, 1: 283-288; различные методы Viswanatha et al. Methods Mol Med. 2008; 142: 239-60).
В одном варианте реализации изобретения изобретательские бета-лактамазы гидролизуют один или более из пенициллинов и цефалоспоринов. Как используется во всем документе, пенициллины включают, например, амоксициллин (например, NOVAMOX, AMOXIL); ампициллин (например, PRINCIPEN); азлоциллин; карбенициллин (например, GEOCILLIN); клоксациллин (например, TEGOPEN); диклоксациллин (например, DYNAPEN); флуклоксациллин (например, FLOXAPEN); мезлоциллин (например, MEZLIN); метициллин (например, STAPHCILLIN); нафциллин (например, UNIPEN); оксациллин (например, PROSTAPHLIN); пенициллин G (например, PENTIDS или PFIZERPEN); пенициллин V (например, VEETIDS (PEN-VEE-K)); пиперациллин (например, PIPRACIL); темоциллин (например, NEGABAN) и тикарциллин (например, TICAR). Как используется во всем документе, цефалоспорины включают, например, первое поколение цефалоспоринов (например, цефадроксил (например, DURICEF); цефазолин (например, ANCEF); цефтолозан, цефалотин/цефалосин (например, KEFLIN); цефалексин (например, KEFLEX); второе поколение цефалоспоринов (например, цефаклор (например, DISTACLOR); цефамандол (например, MANDOL); цефокситин (например, MEFOXIN); цефпрозил (например, CEFZIL); цефуроксим (например, CEFTIN, ZINNAT)); третье поколение цефалоспоринов (например, цефиксим (например, SUPRAX); цефдинир (например, OMNICEF, CEFDIEL); цефдиторен (например, SPECTRACEF); цефоперазон (например, CEFOBID); цефотаксим (например, CLAFORAN); цефподоксим (например, VANTIN); цефтазидим (например, FORTAZ); цефтибутен (например, CEDAX); цефтизоксим (например, CEFIZOX) и цефтриаксон (например, ROCEPHIN)); четвертое поколение цефалоспоринов (например, цефепим (например, MAXIPIME)) или пятое поколение цефалоспоринов (например, цефтаролина фозамил (например, TEFLARO); цефтобипрол (например, ZEFTERA)). В конкретном варианте реализации изобретения цефалоспорины включают, например, цефоперазон, цефтриаксон или цефазолин. В конкретном варианте реализации изобретения изобретательские бета-лактамазы обладают улучшенной каталитической эффективностью против цефалоспоринов по сравнению с SEQ ID NO: 1.
В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают требуемыми ферментативными кинетическими характеристиками. Например, в некоторых вариантах реализации изобретения бета-лактамазы обладают низким значением KM по отношению к по меньшей мере одному цефалоспорину, включающему, например, значение KM меньше, чем около 500 мкМ или около 100 мкМ, или около 10 мкМ, или около 1 мкМ, или около 0,1 мкМ (100 нМ), или около 0,01 мкМ (10 нМ), или около 1 нМ. Например, в некоторых вариантах реализации изобретения бета-лактамазы обладают низким значением KM по отношению к по меньшей мере одному пенициллину, включающему, например, значение KM меньше, чем около 500 мкМ или около 100 мкМ, или около 10 мкМ, или около 1 мкМ, или около 0,1 мкМ (100 нМ), или около 0,01 мкМ (10 нМ), или около 1 нМ. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают высоким значением Vmax по отношению к по меньшей мере одному цефалоспорину, включая, например, значение Vmax, которое больше, чем около 100 с-1 или около 1000 с-1, или около 10000 с-1, или около 100000 с-1, или около 1000000 с-1. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают высоким значением Vmax по отношению к по меньшей мере одному пенициллину, включая, например, значение Vmax, которое больше, чем около 100 с-1 или около 1000 с-1, или около 10000 с-1, или около 100000 с-1, или около 1000000 с-1. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают каталитической эффективностью по отношению к по меньшей мере одному цефалоспорину более чем около 106 M-1 c-1. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают каталитической эффективностью по отношению к меньшей мере одному пенициллину более чем около 106 M-1 c-1. В различных вариантах реализации изобретения изобретательские бета-лактамазы обладают требуемыми ферментативными кинетическими характеристиками по отношению к по меньшей мере одному из или обеим из цефалоспоринов и пенициллинов.
В различных вариантах реализации изобретения изобретательские бета-лактамазы стабильны и/или активны в ЖК-тракте, например, в одном или более из рта, пищевода, желудка, двенадцатиперстной кишки, тонкого кишечника, двенадцатиперстной кишки, тощей кишки, подвздошной кишки, толстого кишечника, поперечной ободочной кишки, нисходящей ободочной кишки, восходящей ободочной кишки, сигмовидной ободочной кишки, слепой кишки и прямой кишки. В конкретном варианте реализации изобретения бета-лактамазы стабильны в толстом кишечнике, необязательно выбранном из одной или более из поперечной ободочной кишки, нисходящей ободочной кишки, восходящей ободочной кишки, сигмовидной ободочной кишки и слепой кишки. В конкретном варианте реализации изобретения бета-лактамазы стабильны в тонком кишечнике, необязательно выбранном из одной или более из двенадцатиперстной кишки, тощей кишки и подвздошной кишки. В некоторых вариантах реализации изобретения бета-лактамазы устойчивы к протеазам в ЖК-тракте, включающем, например, тонкий кишечник. В некоторых вариантах реализации изобретения бета-лактамазы по существу активны при рН от около 6,0 до около 7,5, например, около 6,0 или около 6,1, или около 6,2, или около 6,3, или около 6,4, или около 6,5, или около 6,6, или около 6,7, или около 6,8, или около 6,9, или около 7,0, или около 7,1, или около 7,2, или около 7,3, или около 7,4, или около 7,5 (включая, например, использование лекарственной формы, согласно настоящему описанию). В различных вариантах реализации изобретения бета-лактамазы по настоящему изобретению устойчивы к одному или более ингибиторов бета-лактамаз, необязательно выбранных из авибактама, тазобактама, сульбактама и клавулановой кислоты. В некоторых вариантах реализации изобретения термин "устойчивый" относится к ферменту, который имеет достаточно длительный период полувыведения и сохраняет достаточную активность для терапевтической эффективности.
В различных вариантах реализации настоящее изобретение относится к фармацевтическим композициям, содержащим бета-лактамазы, описанные в данном документе, и один или более из приемлемого носителя или вспомогательного вещества, согласно настоящему описанию. В конкретном варианте реализации изобретения фармацевтическую композицию готовят в лекарственной форме для перорального введения, например, в виде таблетки или присыпки с множеством частиц, или капсулы с множеством частиц. Однако согласно настоящему описанию, также предложены другие пути введения и лекарственные формы.
В некоторых вариантах реализации изобретения фармацевтические композиции могут применяться в сочетании или быть совместно введены в лекарственные формы с дополнительным агентом. В некоторых вариантах реализации изобретения дополнительный агент представляет собой дополнительный фермент для разрушения антибиотиков, такой как, например, бета-лактамаза класса ЕС 3.5.2.6. В различных вариантах реализации изобретение фермент для разрушения антибиотиков выбирается из функциональной группы 1, группы 2, группы 3 или группы 4 бета-лактамазы (см., например. Bush et al., Antimicrob. Agents Chemother, 39: 1211, содержание которой таким образом включено в данный документ посредством ссылки): безотносительно к какой-либо теории, группа 1 состоит из цефалоспориназ, которые не достаточно ингибируются клавулановой кислотой; группа 2 состоит из пенициллиназ, цефалоспориназ и бета-лактамаз широкого спектра, которые обычно ингибируются активными сайт-специфическими ингибиторами бета-лактамаз; группа 3 состоит из металло-бета-лактамаз, которые гидролизуют пенициллины, цефалоспорины и карбапенемы, и которые слабо ингибируются практически всеми содержащими бета-лактам молекулами, а группа 4 состоит из пенициллиназ, которые не достаточно ингибируются клавулановой кислотой), и/или бета-лактамазы молекулярного/Ambler класса А или класса В, или класса С, или класса D (см., например. Ambler 1980, Philos Trans R Soc Lond В Biol Sci. 289: 321, содержание которой таким образом включено в данный документ посредством ссылки), безотносительно к какой-либо теории: классы А, С и D собирают в эволюционно отличающиеся группы сериновых бета-лактамазных ферментов, а класс В - в цинк-зависимые (ингибируемые ЭДТА) бета-лактамазные ферменты (см. Ambler R.P. et al., 1991, Biochem J. 276: 269-270, содержание которой таким образом включено в данный документ посредством ссылки). В различных вариантах реализации изобретение фермент для разрушения антибиотиков представляет собой сериновую бета-лактамазу или цинк-зависимую (ингибируемую ЭДТА) бета-лактамазу. Например, в некоторых вариантах реализации изобретения бета-лактамаза представляет собой одну или более из Р1А, Р2А или Р3А. Дополнительно бета-лактамаза может быть бета-лактамазой расширенного спектра (ESBL), необязательно выбранной из бета-лактамаз ТЕМ, SHV, СТХ-М, ОХА, PER, VEB, GES и IBC. Дополнительно бета-лактамаза может быть устойчивой к ингибиторам β-лактамаз, необязательно выбранной из β-лактамаз типа AmpC, карбапенемаз, карбапенемаз типа IMP (металло-β-лактамазы), VIM (кодированная интегроном Verona металло-β-лактамаза), группы ОХА (оксациллиназа) β-лактамаз, КРС (карбапенемаза K. pneumonia), CMY (класс С), SME, IMI, NMC и CcrA, и NDM (металло-β-лактамаза Нью-Дели, например, NDM-1) бета-лактамаз.
В некоторых вариантах реализации изобретения дополнительный агент введен для вспомогательной терапии, в которой он применяется, например, для лечения CDI, согласно настоящему описанию. В некоторых вариантах реализации изобретения дополнительный агент представляет собой метронидазол (например, FLAGYL), фидаксомицин (например, DIFICID) или ванкомицин (например, Vancocin), рифамиксин, фекальную трансплантацию, применение связующих на основе активированного угля (например, DAV132), пробиотикотерапию (см., например, Intnat'l J Inf Dis, 16 (II): е786, содержание которой таким образом включено в данный документ посредством ссылки, иллюстративные пробиотики включают Saccharomyces boulardii; Lactobacillus rhamnosus GG; Lactobacillus plantarum 299v; Clostridium butyricum M588; Clostridium difficile VP20621 (нетоксиногенный штамм C. difficile); комбинацию из Lactobacillus casei, Lactobacillus acidophilus (Bio-K + CL1285); комбинацию из Lactobacillus casei, Lactobacillus bulgaricus. Streptococcus thermophilus (Actimel); комбинацию из Lactobacillus acidophilus, Bifidobacterium bifidum (Florajen3); комбинацию из Lactobacillus acidophilus, Lactobacillus bulgaricus delbrueckii subsp.bulgaricus, Lactobacillus bulgaricus casei, Lactobacillus bulgaricus plantarum, Bifidobacterium longum, Bifidobacterium infantis, Bifidobacterium breve. Streptococcus salivarius subsp.thermophilus (VSL#3)) и антитела или другое лечение биологическими препаратами (например, моноклональные антитела против токсинов А и В C. difficile, как описано в N Engi J Med. 2010; 362(3): 197, содержание которой таким образом включено в данный документ посредством ссылки в полном объеме; нейтрализующие связывающие белки, например, упорядоченные в виде мультимеров, которые направлены против одной или более из SEQ ID NO., приведенных в публикации патента США №2013/0058962 (например, одной или более из SEQ ID No.: 59, 60, 95, 67, 68 и 87), содержание которой таким образом включено в данный документ посредством ссылки); или любой нейтрализующий связывающий белок направленный против бинарного токсина C. difficile. В некоторых вариантах реализации изобретения дополнительным агентом могут быть любые пенициллины и цефалоспорины, описанные в данном документе.
Согласно настоящему описанию могут применяться все дополнительные композиции и способы, таргетирующие различные части ЖК-тракта.
В некоторых вариантах реализации изобретения изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, включают производные, которые модифицированы, например, ковалентным присоединением любого типа молекулы к композиции таким образом, что такое ковалентное присоединение не препятствует активности композиции. Например, но не в качестве ограничения, производные включают композицию, которая была модифицирована путем, в частности, гликозилирования, липидизации, ацетилирования, пэгилирования, фосфорилирования, амидирования, дериватизации путем использования известных защитных/блокирующих групп, протеолитического расщепления и связывания с клеточным лигандом или другим белком и т.д. Могут производиться любые из многочисленных модификаций известными методиками, включающими, но не ограниченными этим, специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез в присутствии туникамицина и т.д. Дополнительно производное может содержать одну или более неканонических аминокислот.
В еще одних других вариантах реализации изобретения изобретательские бета-лактамазы и/или фармацевтические композиции, описанные в данном документе, могут модифицироваться для добавления эффекторных фрагментов, таких как химические линкеры, выявляемые фрагменты, такие как, например, флуоресцентные красители, ферменты, субстраты, биолюминисцентные вещества, радиоактивные вещества и хемилюминисцентные фрагменты или функциональные фрагменты, такие как, например, стрептавидин, авидин, биотин, цитотоксин, цитотоксический агент и радиоактивные вещества.
Изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, могут обладать достаточно основной функциональной группой, которая может реагировать с неорганической или органической кислотой, или карбоксильной группой, которая может реагировать с неорганическим или органическим основанием, с образованием фармацевтически приемлемой соли. Фармацевтически приемлемая соль присоединения кислоты образуется из фармацевтически приемлемой кислоты, как хорошо известна в данной области техники. Такие соли включают фармацевтически приемлемые соли, перечисленные, например, в Journal of Pharmaceutical Science, 66, 2-19 (1977) и The Handbook of Pharmaceutical Salts; Properties, Selection, and Use. P.H. Stahl and C.G. Wermuth (eds.), Verlag, Zurich (Switzerland) 2002, которые таким образом включены в данный документ посредством ссылки в полном объеме.
Фармацевтически приемлемые соли включают, в качестве неограничивающего примера, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, камфорсульфонат, памоат, фенилацетат, трифторацетат, акрилат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, изобутират, фенилбутират, α-гидроксибутират, бутин-1,4-дикарбоксилат, гексин-1,4-дикарбоксилат, капрат, каприлат, циннамат, гликоллат, гептаноат, гиппурат, малат, гидроксималеат, малонат, манделат, мезилат, никотинат, фталат, терефталат, пропиолат, пропионат, фенилпропионат, себакат, суберат, п-бромбензолсульфонат, хлорбензолсульфонат, этилсульфонат, 2-гидроксиэтилсульфонат, метилсульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, нафталин-1,5-сульфонат, ксилолсульфонат и соли тартратов.
Термин "фармацевтически приемлемая соль" также относится к соли композиций по настоящему изобретению, содержащей кислотную функциональную группу, такую как карбоксильную кислую функциональную группу, и основание. Подходящие основания включают, но не ограничены этим, гидроксиды щелочных металлов, таких как натрий, калий и литий; гидроксиды щелочноземельных металлов, таких как кальций и магний; гидроксиды других металлов; таких как алюминий и цинк; аммония и органических аминов, таких как незамещенные и гидроксизамещенные моно-, ди- или триалкиламины, дициклогексиламин; трибутиламин; пиридин; N-метил, N-этиламин; диэтиламин; триэтиламин; моно-, бис- или трис-(2-ОН-низшие алкиламины), такие как моно-, бис- или трис-(2-гидроксиэтил)амин, 2-гидрокси-трет-бутиламин или трис-(гидроксиметил)метиламин, N,N-ди-низшие алкил-N-(гидроксил-низший алкил)-амины, такие как N,N-диметил-N-(2-гидроксиэтил)амин или три-(2-гидроксиэтил)амин; N-метил-D-глюкамин и аминокислоты, такие как аргинин, лизин и тому подобные.
В некоторых вариантах реализации композиции, описанные в данном документе, получают в форме фармацевтически приемлемой соли.
Дополнительно любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, могут вводится субъекту в виде компонента композиции, который содержит фармацевтически приемлемый носитель или несущую среду. Такие композиции необязательно содержат подходящее количество фармацевтически приемлемого вспомогательного вещества для того, чтобы обеспечить получение формы для надлежащего введения.
Фармацевтические вспомогательные вещества могут быть жидкостями, такими как вода и масла, включающими нефтяные масла, масла животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобные. Фармацевтические вспомогательные вещества могут быть, например, солевым раствором, гуммиарабиком, желатином, крахмальным клейстером, тальком, кератином, коллоидным диоксидом кремния, мочевиной и тому подобным. В дополнение к этому могут использоваться вспомогательные, стабилизирующие, загущающие, смазывающие и окрашивающие агенты. В одном варианте реализации изобретения фармацевтически приемлемые вспомогательные вещества при введении пациенту являются стерильными. Вода является пригодным вспомогательным веществом, когда любой агент, описанный в данном документе, вводится внутривенно. Солевые растворы и водные растворы декстрозы и глицерина также могут применяться в качестве жидких вспомогательных веществ, особенно для инъекционных растворов. Подходящие фармацевтические вспомогательные вещества также включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и тому подобное. При желании любой агент, описанный в данном документе, может также содержать незначительные количества увлажняющих или эмульгирующих агентов, или рН-буферизирующих веществ.
Настоящее изобретение включает описанные изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) в различных лекарственных формах. Любая изобретательская бета-лактамаза и/или фармацевтическая композиция (и/или дополнительные агенты), описанные в данном документе, может приниматься в форме растворов, суспензий, эмульсии, капель, таблеток, пилюль, пеллет, капсул, капсул, содержащих жидкости, порошков, лекарственных форм замедленного высвобождения, суппозиториев, эмульсий, аэрозолей, спреев, суспензий или любых других форм, подходящих для применения. В одном варианте реализации изобретения композиция представлена в форме капсулы (см., например, патент США №5698155). Другие примеры подходящих фармацевтических вспомогательных веществ описаны в Remington's Pharmaceutical Sciences 1447-1676 (Alfonso R. Gennaro eds., 19th ed. 1995), включенной в данный документ посредством ссылки.
При необходимости изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) могут также включать солюбилизирующий агент. Агенты также могут доставляться подходящим носителем или устройством для доставки, как известно в данной области техники. Композиции для введения необязательно могут включать местный анестетик, такой как лидокаин, для облегчения боли в участке инъекции. Комбинированные лекарственные средства, отмеченные в данном документе, могут совместно доставляться в одном носителе для доставки или устройстве для доставки.
Лекарственные формы, содержащие изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) по настоящему изобретению в целях удобства могут быть представлены в единичных дозированных формах, и могут быть приготовлены с помощью любых способов, хорошо известных в области фармации. Такие способы обычно включают стадию объединения терапевтических агентов ингредиента с носителем, который состоит из одного или более вспомогательных ингредиентов. Как правило, лекарственные формы получают путем однородного и тщательного объединения терапевтического агента с жидким носителем, тонко измельченным твердым носителем или обоими и затем, при необходимости, приданием формы продукта в виде дозированных форм требуемой лекарственной формы (например, влажной или сухой грануляцией, смешиванием порошков и т.д., с последующим таблетированием с использованием традиционных способов, известных в данной области).
В одном варианте реализации изобретения любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, приготовлены в лекарственной форме в соответствии с рутинными процедурами в виде композиции, приспособленной для способа введения, описанного в данном документе.
В некоторых вариантах реализации изобретения введение любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов) является любым из перорального, внутривенного и парентерального. В некоторых вариантах реализации изобретения введение любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов) не является любым внутривенным для того, чтобы предотвратить взаимодействие с системно введенным антибиотиком. В других вариантах реализации изобретения пути введения включают, например: пероральный, внутрикожный, внутримышечный, интраперитонеальный, внутривенный, подкожный, интраназальный, эпидуральный, подъязычный, интраназальный, внутрицеребральный, интравагинальный, трансдермальный, ректально, путем ингаляции или местно, в частности, в уши, нос, глаза или на кожу. В некоторых вариантах реализации изобретения введение осуществляется перорально или путем парентеральной инъекции. Способ введения может быть оставлен на усмотрение практикующего врача и отчасти зависит от места оказания помощи по медицинскому показанию. В большинстве случаев введение приводит к высвобождению любого агента, описанного в данном документе, в кровоток.
Любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, могут вводится перорально. Любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) также могут быть введены любым другим удобным путем, например, путем внутривенной инфузии или болюсной инъекции, путем абсорбции через эпителиальные или кожно-слизистые оболочки (например, слизистая оболочка полости рта, слизистая оболочка прямой кишки и кишечника и т.д.) и могут быть введены вместе с дополнительным агентом. Введение может быть системным или местным. В некоторых вариантах реализации введение не проводят в месте инъекции для избежания, например, гидролиза антибиотика в месте введения. Известны различные системы доставки, и они могут использоваться для введения, например, инкапсулирование в липосомы, микрочастицы, микрокапсулы, капсулы и т.д.
В конкретных вариантах реализации изобретения при необходимости лечения может быть желательным вводить препараты местно.
В одном варианте реализации изобретения любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, приготовлены в лекарственной форме в соответствии с рутинными процедурами в виде композиции, приспособленной для перорального введения людям. Композиции для пероральной доставки могут быть, например, в форме таблеток, пастилок, водных или масляных суспензий, гранул, порошков, обсыпок, эмульсий, капсул, сиропов или эликсиров. Соединения, предназначенные для перорального применения, могут содержать один или несколько агентов, например, подсластителей, таких как фруктоза, аспартам или сахарин; ароматизаторов, таких как перечная мята, винтергриновое или вишневое масло; красителей и консервантов, для того чтобы предоставить фармацевтически приятный на вкус препарат. Более того, в случае формы таблеток или пилюль, композиции могут быть покрыты для замедления дезинтеграции для обеспечения пролонгированного действия в течение длительного периода времени. Для перорально вводимых композиций также подходят избирательно проницаемые мембраны, окружающие осмотически активный агент, перемещающий любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе. В этих последних платформах жидкость из среды, окружающей капсулу, впитывается перемещающим соединением, которое расширяется для перемещения агента или композиции агента через пору. Эти платформы для доставки могут обеспечить профиль доставки практически нулевого порядка в отличие от пиковых профилей лекарственных форм с немедленным высвобождением. Может также быть применимым замедляющее вещество, такое как моностеарат глицерина или стеарат глицерина. Пероральные композиции могут включать стандартные вспомогательные вещества, такие как маннит, лактоза, крахмал, стеарат магния, сахаринат натрия, целлюлоза, этакриловая кислота и ее производные полимеры, и карбонат магния. В одном варианте реализации изобретения вспомогательные вещества имеют фармацевтическую категорию чистоты. Суспензии, в дополнение к активному соединению, могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, мета-гидроксид алюминия, бентонит, агар-агар и трагакант и т.п. и их смеси.
Дозированные формы, подходящие для парентерального введения (например, внутривенная, внутримышечная, интраперитонеальная, подкожная и внутрисуставная инъекция или инфузия) включают, например, растворы, суспензии, дисперсии, эмульсии и тому подобное. Они также могут производиться в форме стерильных твердых композиций (например, лиофилизированная композиция), которые непосредственно перед применением могут быть растворены или суспендированы в стерильной инъекционной среде. Они могут содержать, например, суспендирующие или диспергирующие агенты, известные в данной области техники.
Изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) могут вводиться субъекту, например, путем прямого или непрямого приведения в контакт со слизистыми тканями желудочно-кишечного тракта. Желудочно-кишечный тракт включает пищеварительную систему, такую как рот, пищевод, желудок, двенадцатиперстную кишку, тонкий кишечник, толстый кишечник и прямую кишку, и включает все их подотделы (например, тонкий кишечник может включать двенадцатиперстную кишку, тощую кишку и подвздошную кишку; толстый кишечник может включать поперечную ободочную кишку, нисходящую ободочную кишку, восходящую ободочную кишку, сигмовидную кишку и слепую кишку). Для приготовления лекарственной формы и/или доставки агентов, описанных в данном документе, до представляющего интерес локализации могут применяться различные способы. Например, изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, могут быть приготовлены в лекарственной форме для доставки в один или более из желудка, тонкого кишечника, толстого кишечника и прямой кишки и включает все их подотделы (например, двенадцатиперстную кишку, тощую кишку и подвздошную кишку, поперечную ободочную кишку, нисходящую ободочную кишку, восходящую ободочную кишку, сигмовидную кишку и слепую кишку). В некоторых вариантах реализации изобретения композиции, описанные в настоящем документе, могут быть приготовлены в лекарственной форме для доставки в верхний или нижний ЖК-тракт.
В некоторых вариантах реализации композиции по данному изобретению приготовлены в лекарственной форме для кишечной доставки. Например, композиции, могут быть приготовлены в виде капсул или таблеток для пероральной доставки и могут содержать покрытие для замедленного высвобождения, содержащее один или более кишечнорастворимых агентов. Покрытие для замедленного высвобождения практически устойчиво в желудочном соке и практически неустойчиво (например, быстро растворяется или физически неустойчиво) в кишечном соке, таким образом обеспечивая значительное высвобождение действующего вещества из композиции в пораженном участке тонкого кишечника, например, двенадцатиперстной кишке, тощей кишке и/или подвздошной кишке, или толстом кишечнике, например, поперечной ободочной кишке, нисходящей ободочной кишке, восходящей ободочной кишке, сигмовидной кишке и слепой кишке.
Изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) в целом устойчивы в желудочном соке и искусственном кишечном соке, другими словами композиции устойчивы в кислотных условиях среды.
Таким образом композиции высвобождают менее 30% по массе действующего вещества в желудочном соке с рН 5 или менее, или искусственном кишечном соке с рН 5 или менее в течение приблизительно 120 минут. Композиции по данному изобретению могут высвобождать от около 0% до около 25% или от около 0 % до около 10% по массе действующего вещества в желудочном соке с рН 5 или менее, или искусственном кишечном соке с рН 5 или менее в течение приблизительно 120 минут. Композиции по данному изобретению в некоторых вариантах реализации изобретения высвобождают не более чем около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9% или около 10% по массе действующего вещества в желудочном соке или искусственном кишечном соке с рН 5 или менее в течение приблизительно 120 минут. Фармацевтические композиции обычно высвобождают действующее вещество для местного воздействия в областях тонкого или толстого кишечника. В некоторых вариантах реализации изобретения композиция по данному изобретению высвобождает около 70% или более по массе действующего вещества в тонком или толстом кишечнике в пределах около 120 минут. В некоторых вариантах реализации изобретения композиция высвобождает 80% или более, или 90% или более действующего вещества в тонком или толстом кишечнике в пределах около девяноста минут или в пределах около 120 минут. В некоторых вариантах реализации изобретения это высвобождение в тонком или толстом кишечнике опосредовано рН желудочного сока или искусственного желудочного сока, например, высвобождение при рН около 5 или больше (например, рН около 5,5-6,5 для высвобождения в двенадцатиперстной кишке, рН около 6-7 для высвобождения в восходящей ободочной кишке или тощей кишке, рН около 6,5-7 для высвобождения в подвздошной кишке, рН около 7-7,5 для высвобождения в нисходящей ободочной кишке).
Фармацевтическая композиция может контролировать кишечное высвобождение действующего вещества посредством одного или более покрытия(й) для замедленного высвобождения, которые остаются по существу интактными и/или которые могут по существу быть нерастворимыми в желудочном соке. Устойчивость покрытия для замедленного высвобождения может зависеть от рН. Покрытия для замедленного высвобождения, зависимые от рН, будут практически устойчивыми в кислотных условиях среды (рН 5 или менее), и практически неустойчивыми в от почти нейтральных до щелочных условий среды (рН более 5). Например, покрытие с замедленным высвобождением по существу может дезинтегрироваться или растворяться при от почти нейтральных до щелочных условий среды, таких как обнаруженные в тонком кишечнике или толстом кишечнике, таким образом высвобождая действующее вещество местно возле заболевшей или пораженной ткани.
Примеры искусственного желудочного сока или искусственного кишечного сока, включают, но не ограничиваются такими, которые описаны в Фармакопее 2005 года 23NF/28USP в разделе "Испытуемые растворы" на странице 2858 и/или другие виды искусственного желудочного сока или виды искусственного кишечного сока, известные специалистам в данной области техники, например, искусственный желудочный сок и/или искусственный кишечный сок, приготовленный без ферментов.
В альтернативном варианте устойчивость покрытия для замедленного высвобождения может зависеть от присутствия ферментов. Покрытия для замедленного высвобождения, зависимые от присутствия ферментов, будут практически устойчивыми в жидкости, которая не содержит конкретного фермента, и практически неустойчивыми в жидкости, содержащими фермент. Покрытие с замедленным высвобождением по существу будет дезинтегрироваться или растворяться в жидкости, содержащей подходящий фермент. Контроль с зависимостью от ферментов обусловлен, например, путем применения веществ, которые высвобождают действующее вещество только при воздействии ферментов в кишечнике, таких как галактоманнаны.
В некоторых вариантах реализации изобретения орган-мишень для высвобождения действующего вещества из композиций по данному изобретению, которое включает устойчивые в желудке капсулы и таблетки, представляет собой тонкий кишечник, такой как двенадцатиперстная кишка и тощая кишка или толстый кишечник, например, поперечная ободочная кишка, нисходящая ободочная кишка, восходящая ободочная кишка, сигмовидная кишка и слепая кишка. См. книгу Remington's Pharmaceutical Sciences, 16th Ed., Eds. Osol, Mack Publishing Co., Chapter 89 (1980); Digenis et al., J. Pharm. Sci., 83: 915-921 (1994); Vantini et al., Clinica Terapeutica, 145: 445-451 (1993); Yoshitomi et al., Chem. Pharm. Bull., 40: 1902-1905 (1992); Thoma et al., Pharmazie, 46: 331-336 (1991); Morishita et al., Drug Design and Delivery, 7: 309-319 (1991) и Lin et al., Pharmaceutical Res., 8: 919-924 (1991), в качестве примеров получения таких таблеток или капсул (содержание предшествующих ссылок таким образом включено в данный документ посредством ссылки в полном объеме).
В некоторых вариантах реализации композиции по настоящему изобретению могут быть приготовлены в лекарственной форме с использованием системы EUDRAGIT, как известно в данной области техники и описано в Pharma Polymer No. 7, Oct. 2000, содержание которой таким образом включено в данный документ посредством ссылки в полном объеме.
Дозировка любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов), описанных в данном документе, а также режим дозирования может зависеть от разнообразных параметров, включающих, но не ограничивающихся этим, излечиваемое заболевание, общее состояние здоровья субъекта и усмотрения лечащего врача относительно введения. Любой агент, описанный в данном документе, можно вводить за (например, 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель), одновременно или через (например, 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 недель, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель) после введения дополнительного терапевтического агента нуждающемуся в этом субъекту. В различных вариантах реализации изобретения любой агент, описанный в данном документе вводится с 1 минутой раздельно, 10 минутами раздельно, 30 минутами раздельно, менее чем 1 часом раздельно, 1 часом раздельно, от 1 до 2 часов раздельно, от 2 до 3 часов раздельно, от 3 до 4 часов раздельно, от 4 до 5 часов раздельно, от 5 до 6 часов раздельно, от 6 до 7 часов раздельно, от 7 до 8 часов раздельно, от 8 до 9 часов раздельно, от 9 до 10 часов раздельно, от 10 до 11 часов раздельно, от 11 до 12 часов раздельно, не более чем с 24 часами раздельно или не более чем с 48 часами раздельно.
Количество любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов), описанных в данном документе, которые смешиваются с веществами-носителями для получения одной дозировки, может изменяться в зависимости от подлежащего лечению субъекта и конкретного режима введения. Для того чтобы помочь определить оптимальные диапазоны дозировок могут использоваться анализы in vitro или in vivo.
В целом, пригодные дозы известны специалистам в данной области техники. Например, дозы могут определяться согласно ссылке Physicians' Desk Reference, 66th Edition, PDR Network; 2012 издание (27 декабря 2011 г.), содержание которой включено в данный документ посредством ссылки в полном объеме. В некоторых вариантах реализации настоящее изобретение дает возможность пациенту получать дозы, которые превышают такие согласно ссылки Physicians' Desk Reference.
Дозировка любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов), описанных в данном документе, может зависеть от нескольких факторов, включающих тяжесть состояния, того, проходит ли данное состояние лечение или предотвращение, и возраста, веса и состояния здоровья подлежащего лечению субъекта. В дополнение к этому, информация о фармакогеномике (влиянии генотипа на фармакокинетический, фармакодинамический профили или профиль эффективности терапевтического вещества) конкретного субъекта может влиять на применяемую дозировку. Более того, точные индивидуальные дозировки могут слегка корректироваться в зависимости от различных факторов, включающих специфическую комбинацию вводимых агентов, времени введения, пути введения, природы лекарственной формы, скорости выведения, конкретного подлежащего лечению заболевания, тяжести расстройства и анатомической локализации расстройства. Могут предполагаться некоторые вариации дозировки.
В конкретных вариантах реализации изобретения концентрация любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов) составляет от около 0,2 до около 20 г/л при пероральном введении или около 4 г/мл при внутривенном введении.
В некоторых вариантах реализации изобретения при пероральном введении млекопитающему дозировка любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов), описанных в данном документе, может составлять от около 0,001 мг/кг/сутки до около 100 мг/кг/сутки, от около 0,01 мг/кг/сутки до около 50 мг/кг/сутки или от около 0,1 мг/кг/сутки до около 10 мг/кг/сутки. При перорально введении человеку дозировка любого агента, описанного в данном документе, обычно составляет от около 0,001 мг до около 1000 мг в сутки, от около 1 мг до около 600 мг в сутки или от около 5 мг до около 30 мг в сутки. В одном варианте реализации изобретения 100 мг изобретательских бета-лактамаз и/или фармацевтических композиций перорально вводится человеку. Для введения любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов), описанных в данном документе, путем парентеральной инъекции дозировка обычно составляет от около 0,1 мг до около 250 мг в сутки, от около 1 мг до около 20 мг в сутки или от около 3 мг до около 5 мг в сутки. Инъекции могут вводиться ежесуточно до четырех раз. В общем, при пероральном или парентеральном введении дозировка любого агента, описанного в данном документе, обычно составляет от около 0,1 мг до около 1500 мг в сутки или от около 0,5 мг до около 10 мг в сутки, или от около 0,5 мг до около 5 мг в сутки. Может вводиться дозировка вплоть до 3000 мг в сутки. В некоторых вариантах реализации изобретения дозировка может составлять около 1000 мг в сутки. В некоторых вариантах реализации изобретения может применяться следующий режим дозирования: 100 мг, четыре раза в сутки.
В различных вариантах реализации изобретения вводится дозировка любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов), описанных в данном документе, для достижения концентрации в кишечнике от около 1 нг/мл до около 10000 нг/мл, от около 1 нг/мл до около 5000 нг/мл, от около 1 нг/мл до около 2500 нг/мл, от около 1 нг/мл до около 1000 нг/мл, от около 1 нг/мл до около 500 нг/мл, от около 1 нг/мл до около 250 нг/мл, от около 1 нг/мл до около 100 нг/мл, от около 1 нг/мл до около 50 нг/мл, от около 1 нг/мл до около 25 нг/мл, от около 1 нг/мл до около 10 нг/мл, от около 10 нг/мл до около 10000 нг/мл, от около 10 нг/мл до около 5000 нг/мл, от около 10 нг/мл до около 2500 нг/мл, от около 10 нг/мл до около 1000 нг/мл, от около 10 нг/мл до около 500 нг/мл, от около 10 нг/мл до около 250 нг/мл, от около 10 нг/мл до около 100 нг/мл, от около 10 нг/мл до около 50 нг/мл, от около 10 нг/мл до около 25 нг/мл, от около 100 нг/мл до около 10000 нг/мл, от около 100 нг/мл до около 5000 нг/мл, от около 100 нг/мл до около 2500 нг/мл, от около 100 нг/мл до около 1000 нг/мл, от около 100 нг/мл до около 500 нг/мл или от около 100 нг/мл до около 250 нг/мл. В различных вариантах реализации изобретения концентрация в кишечнике любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов), описанных в данном документе, составляет 10 нг/мл, 100 нг/мл или 1000 нг/мл.
В другом варианте реализации изобретения доставка может проводиться в везикуле, в частности в липосоме (см. Langer, 1990, Science 249: 1527-1533; Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989).
Любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, могут вводиться с помощью средств для контролированного высвобождения или замедленного высвобождения, или устройствами для доставки, которые хорошо известны специалистам в данной области техники. Примеры включают, но не ограничиваются такими, как описанные в патентах США №№3845770; 3916899; 3536809; 3598123; 4008719; 5674533; 5059595; 5591767; 5120548; 5073543; 5639476; 5354556 и 5733556, каждый из которых включен в данный документ посредством ссылки в полном объеме. Такие дозированные формы могут быть пригодны для обеспечения контролированного или замедленного высвобождения одного или более активных ингредиентов с использованием, например, гидропропилцеллюлозы, гидропропилметилцеллюлозы, поливинилпирролидона, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, липосом, микросфер или их комбинаций в различных пропорциях для обеспечения требуемого профиля высвобождения. Подходящие лекарственные формы с контролированным или замедленным высвобождением, известные специалистам в данной области, включающие те, которые описаны в настоящем документе, могут быть легко выбраны для применения с активными ингредиентами из агентов, описанных в данном изобретении. Таким образом в данном изобретении предлагаются единичные дозированные формы для однократного применения, подходящие для перорального введения, такие как, но не ограничиваясь этим, таблетки, капсулы, желатиновые капсулы и капсуловидные таблетки, которые выполнены с возможностью контролированного или замедленного высвобождения.
Контролированное или замедленное высвобождение активного ингредиента может стимулироваться с помощью разных условий, включающих, но не ограниченных ими, изменения рН, изменения температуры, стимуляция соответствующей длиной волны света, концентрация или наличие ферментов, концентрация или наличие воды, или других физиологических условий или соединений.
В другом варианте реализации изобретения можно применять полимерные материалы (см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J., Macromol. Sci. Rev. Macromol. Chem. 23: 61; см. также Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25: 351; Howard et al., 1989, J. Neurosurg. 71: 105).
В другом варианте реализации система контролированного высвобождения может быть помещена вблизи от подлежащей лечению области-мишени, таким образом требуя применения лишь части системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, выше, vol. 2, pp. 115-138 (1984)). Можно использовать другие системы контролируемого высвобождения, которые обсуждаются в обзоре Langer, 1990, Science 249: 1527-1533.
Введение любых изобретательских бета-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов), описанных в данном документе, может независимо проводиться от одного до шести раз ежесуточно (например, 1 или 2, или 3, или 4, или 5, или 6 раз в сутки) или от одного до четырех раз в месяц, или от одного до шести раз в год, или один раз каждые два, три, четыре или пять лет. Введение может проводиться в течение периода времени одних суток или одного месяца, двух месяцев, трех месяцев, шести месяцев, одного года, двух лет, трех лет и может даже проводиться в течение жизни субъекта. Хроническое долговременное введение может назначаться во многих случаях. Дозировка может вводиться в виде разовой дозы или разделенной на множество доз. В целом, требуемая дозировка должна вводиться в течение продолжительного периода с набором интервалов, обычно по меньшей мере в течение нескольких недель или месяцев, хотя могут потребоваться более длительные периоды введения в несколько месяцев или лет, или более.
Режим дозировки, использующий любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, может выбираться в соответствии с разнообразными факторами, включающими тип, вид, возраст, вес, пол и медицинское состояние субъекта; тяжесть подлежащего лечению состояния; пути введения; функционирования почек или печени субъекта; фармакогеномного характера индивидуума и примененного конкретного соединения по данному изобретению. Любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, могут вводится в виде однократной ежесуточной дозы или общая ежесуточная дозировка может вводиться в виде разделенных доз за два, три или четыре раза ежесуточно. Кроме того, любые изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты), описанные в данном документе, могут вводится скорее постоянно, чем периодически в течение всего режима дозирования.
В различных аспектах в настоящем изобретении предлагаются способы лечения или профилактики антибиотик-индуцированного неблагоприятного эффекта в ЖК-тракте, включающие введение эффективного количества бета-лактамазы и/или фармацевтической композиции (и/или дополнительного агента), описанных в данном документе, нуждающемуся в этом пациенту. В одном аспекте в настоящем изобретении предлагаются способы профилактики антибиотик-индуцированного неблагоприятного эффекта в ЖК-тракте, включающие введение эффективного количества бета-лактамазы и/или фармацевтической композиции (и/или дополнительного агента), описанных в данном документе, нуждающемуся в этом пациенту (в качестве не ограничивающего примера, пациент, которому вводят или будут вводить антибиотик, включает тех, которые описаны в данном документе). В различных аспектах в настоящем изобретении предлагаются способы лечения или профилактики инфекции C. difficile (CDI) и/или ассоциированного с C. difficile заболевания, включающие введение эффективного количества бета-лактамазы и/или фармацевтической композиции (и/или дополнительного агента), описанных в данном документе, нуждающемуся в этом пациенту. В одном аспекте в настоящем изобретении предлагаются способы профилактики инфекции C. difficile (CDI) и/или ассоциированного с C. difficile заболевания, включающие введение эффективного количества бета-лактамазы и/или фармацевтической композиции (и/или дополнительного агента), описанных в данном документе, нуждающемуся в этом пациенту (в качестве не ограничивающего примера, пациент, которому вводят или будут вводить антибиотик, включает тех, которые описаны в данном документе.
В различных вариантах реализации изобретения антибиотик-индуцированный неблагоприятный эффект и/или CDI или ассоциированное с C. difficile заболевания представляет собой одно или более из: ассоциированной с антибиотиком диареи, диареи от C. difficile (CDD), воспалительного заболевания кишечника от C. difficile, колита, псевдомембранозного колита, озноба, боли в животе, обезвоживания и нарушения состава электролитов, расширения толстой кишки, перитонита и перфорации и/или разрыва толстой кишки.
В различных аспектах в настоящем изобретении предлагаются способы защиты желудочно-кишечного микробиома субъекта, включающие введение эффективного количества бета-лактамазы и/или фармацевтической композиции (и/или дополнительного агента), описанных в данном документе. В различных вариантах реализации изобретения субъект проходит лечение или недавно проходил лечение с помощью антибиотика. В различных вариантах реализации изобретения бета-лактамаза и/или фармацевтическая композиция (и/или дополнительный агент), описанная в данном документе, способна вызвать разрушение или инактивацию антибиотика.
В различных вариантах реализации изобретения субъекты включают, но не ограничиваются, субъектами, которые подвержены особенному риску возникновения, опосредованного микробиомом нарушения, такого как в качестве неограничивающего примера, те, которые проходят лечение или недавно проходили лечение с помощью антибиотика. Например, субъект мог принимать антибиотик в течение предыдущих около 30 или около того суток и/или иммунную систему, которая является ослабленной (например, из-за хронической болезни) и/или является женщиной и/или пожилым человеком (например, возрастом более около 65 лет) и/или является пожилой женщиной и/или проходит (или проходил) лечение от изжоги или расстройств с кислотностью в желудке (например, с помощью таких агентов как PREVACID, TAGAMET, PRILOSEC или NEXIUM и родственных лекарственных средств) и/или недавно пребывал в больнице, включая отделение интенсивной терапии или проживает в центре сестринского ухода. Соответственно в некоторых вариантах реализации изобретения предлагаются способы и применения по настоящему изобретению для лечения или профилактики нозокомиальной инфекции и/или вторично возникшей инфекции и/или приобретенной в больнице инфекции (HAI).
В различных вариантах реализации изобретения способы по данному изобретению включают лечение или предотвращение опосредованного микробиомом расстройства. Иллюстративное опосредованное микробиомом расстройство включает, но не ограничивается, например, теми, которые могут быть найдены в табл. 3 WO 2014/121298, полное содержание которого включено в настоящий документ посредством ссылки. Например, опосредованное микробиомом расстройство может выбираться из антибиотик-индуцированного неблагоприятного эффекта, инфекции C. difficile (CDI), ассоциированного с C. difficile заболевания, язвенного колита, болезни Крона и синдрома раздражимого кишечника. В различных вариантах реализации изобретения опосредованное микробиомом заболевание представляет собой антибиотик-индуцированный неблагоприятный эффект, инфекцию C. difficile (CDI) или ассоциированное с C. difficile заболевание. В одном варианте реализации в настоящем изобретении предлагаются способы лечения антибиотик-индуцированного неблагоприятного эффекта в ЖК-тракте, включающие введение эффективного количества бета-лактамазы и/или фармацевтической композиции (и/или дополнительного агента), описанных в данном документе, субъекту, который проходит лечение или недавно проходил лечение с помощью антибиотика. В другом варианте реализации в настоящем изобретении предлагаются способы профилактики антибиотик-индуцированного неблагоприятного эффекта в ЖК-тракте, включающие введение эффективного количества бета-лактамазы и/или фармацевтической композиции (и/или дополнительного агента), описанных в данном документе, субъекту, который проходит лечение или недавно проходил лечение с помощью антибиотика.
В различных вариантах реализации изобретения настоящие применения и способы относятся к совместному лечению (одновременному или последовательному) с помощью бета-лактамаз и/или фармацевтических композиций по настоящему изобретению и любого дополнительного агента, описанным в данном документе, и/или любой начальной терапией и/или вспомогательной терапией, или лечение с совместной лекарственной формой бета-лактамаз и/или фармацевтических композиций по настоящему изобретению и любым дополнительным агентом, описанным в данном документе, и/или любой начальной терапией и/или вспомогательной терапией для лечения различных заболеваний, описанных в данном документе, или способов лечения различных заболеваний, описанных в данном документе, у пациента, проходящего лечение с помощью любого дополнительного агента, описанного в данном документе, или любой начальной терапии и/или вспомогательной терапии, описанной в данном документе, путем введения пациенту бета-лактамаз и/или фармацевтических композиций по настоящему изобретению.
В различных вариантах реализации изобретения CDI или ассоциированное с C. difficile заболевание подвергают лечению или предотвращают в контексте начального проявления или рецидива/повторного проявления (например, вследствие длительной или повторно начатой антибиотикотерапии). Например, пациенту, который раннее страдал от CDI, данные бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) могут вводиться при первых симптомах повторного проявления. В качестве не ограничивающего примера симптомы повторного проявления включают, в легком случае, от около 5 до около 10 водянистых опорожнений кишечника в сутки, отсутствие значительного озноба или только слабые судороги в животе, в то время как анализы крови могут показывать слабое повышение числа лейкоцитов вплоть до 15000 (нормальные уровни считаются до около 10000) и, в тяжелом случае, более чем около 10 водянистых испражнений в сутки, тошноту, рвоту, высокую температуру (например, около 102-104°F), ректальное кровотечение, сильную боль в животе (например, с болезненностью), вздутие живота и высокое число лейкоцитов (например, от около 15000 до около 40000).
Независимо от начального проявления или рецидива/повторного проявления CDI и/или ассоциированное с C. difficile заболевание может диагностироваться посредством любого из симптомов, описанных в данном документе (например, водянистая диарея около 3 или более раз в сутки в течение около 2 суток или более, от слабых до сильных судорог и боли в животе, озноб, кровь или гной в испражнениях, тошнота, обезвоживание, потеря аппетита, потеря веса тела и т.д.). Независимо от начального проявления или рецидива/повторного проявления CDI и/или ассоциированное с C. difficile заболевание также может диагностироваться посредством ферментных иммуноанализов например, для выявления токсина А или В C. difficile, антигена и/или глутаминдегидрогеназы (GDH), которые продуцируются микроорганизмами C. difficile), полимеразной цепной реакцией (например, для выявления гена токсина А или В C. difficile или его части (например, tcdA или tcdB), включая анализ ILLUMIGENE LAMP), анализ с определением цитотоксичности клеток. Например, может использоваться любой из следующих анализов: Meridian ImmunoCard Toxins А/В; Wampole Toxin А/В Quik Chek; Wampole C. diff Quik Chek Complete; Remel Xpect Clostridium difficile Toxin A/B; Meridian Premier Toxins A/B; Wampole C. difficile Tox A/B II; Remel Prospect Toxin A/B EIA; Biomerieux Vidas C. difficile Toxin A&B; BD Geneohm C diff; Prodesse Progastro CD и Cepheld Xpert C. diff. В различных вариантах реализации изобретения клинический образец представляет собой пробу фекалий пациента.
Также для оценки состояния пациента могут применяться "эндоскоп-анализ с использованием гибкой сигмоидоскопии или рентген брюшной полости и/или сканирование компьютерной томографии (КТ), которая обеспечивает получение изображений кишечника (например, для поиска характерных кремово-белых или желтых бляшек, прикрепленных к стенке кишечника). Дополнительно для оценки наличия у пациента потенциальной CDI и/или ассоциированного с C. difficile заболевания может использоваться биопсия (например, в любом участке ЖК-тракта).
Кроме того, пациенты по данному изобретению включают, но не ограничиваются, пациентами, которые особенно подвержены риску CDI и/или ассоциированному с C. difficile заболеванию, такие как те, которые принимали антибиотик в течение последних 30 или около того суток и/или обладают иммунной системой, которая является ослабленой (например из-за хронической болезни) и/или пациенты являются женщинами и/или пожилыми людьми (например, возрастом более около 65 лет) и/или пожилыми женщинами и/или проходят (или проходили) лечение от изжоги или расстройств с кислотностью в желудке (например, с помощью таких агентов как PREVACID, TAGAMET, PRILOSEC или NEXIUM и родственных лекарственных средств) и/или недавно пребывали в больнице, включая отделение интенсивной терапии или проживают в центре сестринского ухода. Соответственно в некоторых вариантах реализации изобретения предлагаются способы и применения по настоящему изобретению для лечения или профилактики нозокомиальной инфекции и/или вторично возникшей инфекции и/или приобретенной в больнице инфекции (HAI).
В некоторых вариантах реализации изобретения предлагаются способы по данному изобретению лечения или профилактики ассоциированного с применением цефтриаксона неблагоприятного эффекта (например, диарея, тошнота, рвота, дисгевзия и заболевание псевдомембранозный колит и/или их симптомов).
В некоторых вариантах реализации изобретения способы и применения по настоящему изобретению относятся к пациенту, который проходит лечение или недавно проходил лечение с помощью одного или более первичных антибиотиков. "Первичный антибиотик" относится к антибиотику, который вводится пациенту и который может приводить к возникновению CDI или ассоциированного с C. difficile заболевания. Эти антибиотики включают такие, которые чаще всего вызывают CDI или ассоциированное с C. difficile заболевание: фторхинолоны, цефалоспорины, клиндамицин и пенициллины.
В некоторых вариантах реализации изобретения способы и применения по настоящему изобретению относятся к изобретательским бета-лактамазам и/или фармацевтическим композициям (и/или дополнительным агентам), которые гидролизуют первичный антибиотик перед тем как он попадает в толстый кишечник. В некоторых вариантах реализации изобретения способы и применения по настоящему изобретению относятся к изобретательским бета-лактамазам и/или фармацевтическим композициям (и/или дополнительным агентам), которые гидролизуют избыток остаточного антибиотика в ЖК-тракте. В некоторых вариантах реализации изобретения способы и применения по настоящему изобретению относятся к изобретательским бета-лактамазам и/или фармацевтическим композициям (и/или дополнительным агентам), которые поддерживают нормальную микробиоту кишечника и/или предотвращают избыточное размножение одного или более патогенных микроорганизмов в ЖК-тракте пациента. В различных вариантах реализации изобретения бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) практически не влияют на уровни первичного антибиотика в плазме. Например, бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) по настоящему изобретению дают возможность пациенту принимать первичный антибиотик, который может требоваться для лечения инфекции и не препятствовать системному применению антибиотика. Точнее бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) инактивируют избыток антибиотика, который может занимать части ЖК-тракта и при этом предотвращает разрушение микробиоты, которое связано с различными течениями заболевания, описанными в данном документе.
В различных вариантах реализации изобретения изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) системно не абсорбируются. В различных вариантах реализации изобретения изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) практически не препятствуют активности системно введенных антибиотиков. В различных вариантах реализации изобретения изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) функционируют в отношении удаления влияния антибиотиков на микробиоту микробиома (например, пищеварительного канала, включающего толстый кишечник). В некоторых вариантах реализации изобретения изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) не препятствуют абсорбции антибиотиков из пищевого канала и/или недостаточно активны в отношении кишечно-печеночной деятельности для изменения периодов полувыведения антибиотиков из кровообращения. В некоторых вариантах реализации изобретения изобретательские бета-лактамазы и/или фармацевтические композиции (и/или дополнительные агенты) не препятствуют абсорбции антибиотиков из пищевого канала и/или недостаточно активны в отношении кишечно-печеночной деятельности, чтобы считаться клинически важными.
В некоторых вариантах реализации изобретения способы и применения по настоящему изобретению включают такие, которые вводятся пациенту при начальной и/или вспомогательной терапии. Начальный и/или вспомогательный препарат означает препарат, применяемый для лечения CDI и/или ассоциированного с C. difficile заболевания при обнаружении такого заболевания. В некоторых вариантах реализации изобретения начальный и/или вспомогательный препарат представляет собой один или более из метронидазола, ванкомицина, фидаксомицина, рифаксимина, фекальной трансплантации, пробиотикотерапии и терапии с применением антител, согласно настоящему описанию. В различных вариантах реализации изобретения способы и применения по настоящему изобретению включают применение изобретательских бета-лактамаз в качестве адъювантов в любой из этих начальных и/или вспомогательных терапий (включая совместное введение или последовательное введение). В различных вариантах реализации изобретения способы и применения по настоящему изобретению включают применение изобретательских бета-лактамаз пациенту, получающему начальную и/или вспомогательную терапии.
В других аспектах в настоящем изобретении предлагаются бета-лактамазы и/или фармацевтические композиции для применения при лечении антибиотик-индуцированного неблагоприятного эффекта в ЖК-тракте и/или предотвращении или лечении инфекции C. difficile (CDI) и/или ассоциированного с C. difficile заболевания. В других аспектах предлагаются применения бета-лактамаз и/или фармацевтических композиций для лечения антибиотик-индуцированного неблагоприятного эффекта в ЖК-тракте и/или профилактики или лечения инфекции C. difficile (CDI) и/или ассоциированного с C. difficile заболевания. Дополнительно в некоторых аспектах предлагается применение описанных бета-лактамаз для производства лекарственного средства для применения при лечении антибиотик-индуцированного неблагоприятного эффекта в ЖК-тракте и/или предотвращении или лечении инфекции C. difficile (CDI) и/или ассоциированного с C. difficile заболевания.
В различных вариантах реализации в настоящем изобретении предлагаются композиции и способы, которые уменьшают и/или предотвращают избыточное размножение различных колиформ в пищевом канале пациента (включая формы, которые являются вирулентными и/или антибиотикоустойчивыми). В различных аспектах способы и композиции, описанные в данном документе, предотвращают или ослабляют вторичные инфекции устойчивых микроорганизмов и, в некоторых вариантах реализации изобретения, могут ослаблять развитие устойчивости к бета-лактамам. Дополнительно способы и композиции, описанные в данном документе, могут давать возможность применять бета-лактамные антибиотики, которые в данное время избегают вследствие проблем с развитием устойчивости, и/или снижать необходимость совместного введения или совместного применения в лекарственной форме с одним или более ингибиторами бета-лактамаз (например, AUGMENTIN - смесь амоксициллина и клавулановой кислоты).
В некоторых вариантах реализации изобретения термины "пациент" и "субъект" используются взаимозаменяемо. В некоторых вариантах реализации изобретения субъект и/или животное представляет собой млекопитающее (например, человек, мышь, крыса, морская свинка, собака, кошка, лошадь, корова, свинья, кролик, овца или примат, кроме человека, такой как обезьяна, шимпанзе или бабуин. В других вариантах реализации настоящего изобретения субъект и/или животное не является млекопитающим, например, рыба данио. В некоторых вариантах реализации изобретения субъект и/или животное может содержать флуоресцентно меченые клетки (например, GFP). В некоторых вариантах реализации изобретения субъект и/или животное представляет собой трансгенное животное, содержащее флуоресцентную клетку.
В некоторых вариантах реализации изобретения субъект и/или животное является человеком. В некоторых вариантах реализации изобретения человеком является ребенок. В другом варианте реализации настоящего изобретения человеком является взрослый человек. В другом варианте реализации настоящего изобретения человеком является пожилой человек. В других вариантах реализации изобретения к человеку могут относиться как к пациенту.
В некоторых вариантах реализации изобретения человек имеет возраст в диапазоне от около 6 до около 18 месяцев, от около 18 до около 36 месяцев, от около 1 до около 5 лет, от около 5 до около 10 лет, от около 10 до около 15 лет, от около 15 до около 20 лет, от около 20 до около 25 лет, от около 25 до около 30 лет, от около 30 до около 35 лет, от около 35 до около 40 лет, от около 40 до около 45 лет, от около 45 до около 50 лет, от около 50 до около 55 лет, от около 55 до около 60 лет, от около 60 до около 65 лет, от около 65 до около 70 лет, от около 70 до около 75 лет, от около 75 до около 80 лет, от около 80 до около 85 лет, от около 85 до около 90 лет, от около 90 до около 95 лет or от около 95 до около 100 лет.
В других вариантах реализации изобретения субъект представляет собой животное, кроме человека, и поэтому изобретение относится к ветеринарной области применения. В конкретном варианте реализации изобретения животное, кроме человека, представляет собой животное для домашнего содержания. В конкретном варианте реализации изобретения животное, кроме человека, представляет собой сельскохозяйственное животное.
В изобретении предлагаются наборы, которые упрощают введение любого агента, описанного в данном документе. Типовой набор по данному изобретению содержит любую композицию, описанную в данном документе в виде единичной дозированной формы. В одном варианте реализации изобретения единичная дозированная форма представляет собой контейнер, такой как предварительно наполненный шприц, который может быть стерильным, содержащим любой агент, описанный в данном документе, и фармацевтически приемлемый носитель, растворитель, вспомогательное вещество или несущую среду. Набор может дополнительно содержать этикетку или напечатанные инструкции по применению любого описанного в данном документе агента. Набор также может включать векорасширитель, местный анестетик и очищающий агент для места введения. Набор также дополнительно может содержать один или более дополнительных агентов, описанных в настоящем документе. В одном варианте реализации изобретения набор содержит эффективное количество композиции по данному изобретению и эффективное количество другой композиции, такой как описанные в данном документе.
Это изобретение дополнительно проиллюстрировано дополнительными неограничивающими примерами.
ПРИМЕРЫ
Следующие аббревиатуры использованы в документе повсеместно.
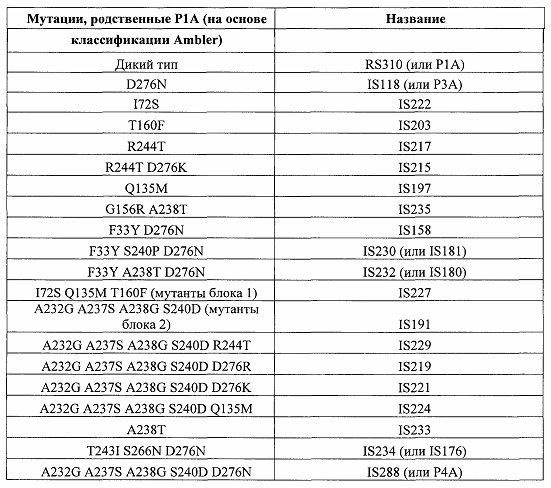
Пример 1. Материалы и методы
Разные мутанты Р1А получали либо сайт-направленным мутагенезом с использованием SOE или набора для множественного сайт-направленного мутагенеза QUIKCHANGE (Stratagene, штат Калифорния, США) либо случайным мутагенезом с использованием набора для случайного мутагенеза GeneMorph® II (Stratagene, штат Калифорния, США). Мутировавшей ДНК трансформировали бактерии либо Е.coli либо В. subtilis, которые подвергали скринингу на цефотаксиме (сайт-специфические мутанты) или на цефтриаксоне (случайные мутанты). Присутствие β-лактамазы в колониях дополнительно подтверждали с помощью теста с нитроцефином и положительные колонии отбирали для дальнейшего анализа. Последовательности ДНК мутантных β-лактамаз подтверждали секвенированием.
Активность β-лактамаз мутантов дополнительно характеризовали из лизатов клеток Е.coli и супернатантов среды для выращивания В. subtilis с помощью ампицилина, цефотаксима, цефтриаксона, цефуроксима, цефтазидима, меропенема и имипенема. Значения активности определяли с использованием только одной концентрации субстрата каждого испытанного антибиотика. Выбор концентрации антибиотика выполняли с помощью концентрации антибиотика вплоть до практически применимой, [S]>>Km. На основе этих предварительных экспериментов для пары мутантов как из исследуемых линий сайт-направленного, так и случайного мутагенеза определяли более точные кинетические параметры. Все мутантные ферменты, отобранные на более точное исследование, экспрессировали в штамме-хозяине RS303 В. subtilis. Клетки, несущие мутированные белки, выращивали на минимальной среде в течение ночи, после чего клетки собирали и концентрировали супернатант в соотношении 1:10 в центрифужных устройствах Amicon Ultra-4, с отсечением молекулярной массы MWCO 10000 (Amicon). Концентрацию белка в супернатанте каждой культуры оценивали в анализе 12% ДСН-ПААГ - электрофореза (Criterion XT Bis-Tris, BioRad, штат Калифорния, США) с использованием в качестве стандарта эталонного вещества Р1А серии A18K31. Кинетические параметры измеряли для каждого выбранного мутантного штамма по цефотаксиму, цефтриаксону и цефуроксиму. Сайт-специфические мутанты были разработаны для гидролиза цефотаксима, а случайные мутанты подвергали скринингу с цефтриаксоном, что сделало эти антибиотики естественным выбором для определения кинетических параметров.
Модификации Р1А Созданные наборы мутаций в Р1А включают:

Параллельно сайт-направленному мутагенезу, для Р1А и Р3А проводили случайный мутагенез с помощью цефтриаксона в качестве антибиотика для скрининга.
Получены также две модификации мутантов Р1А, которые сделаны для исследований по контролю качества: P1A-N293D (IS205, "мутант с деамидированием") и Р1А-ΔMNGK (IS206, "мутант с делецией"). Оба этих штамма, как и P1A-штамм RS310, росли одинаково хорошо, а также приблизительно одинаковой была их продукция белка. Эти мутации также никак не влияли на способность белка к кристаллизации.
Последовательности выбранных СТХ-М-ферментов получали из банка данных белковых последовательностей Swiss-Prot, а 3D-структуры получали из банка данных белковых структур (PDB). Инвентарные номера индивидуальных последовательностей и структур представлены ниже. В некоторых случаях эти данные использованы для предсказания структурно-функциональной активности.

В качестве исследовательской платформы использовали рабочую станцию Linux и операционную систему Fedora Core 5. Выравнивание последовательностей и анализ, а также моделирование и анализ 3D-структур, выполняли с помощью окружения для молекулярного моделирования Bodil.
Дополнительно конструировали и получали несколько дополнительных мутантов Р1А. Одним из этих мутантов был IS288, который имел следующие мутации: A232G, A237S, A238G, A240S и D276N. Четыре мутации A232G, A237S, A238G и A240S были так называемой мутацией "блок 2". Пятый мутант D276N представлял собой мутацию "Р3А", которая сама по себе дает белку способность разрушать цефтриаксон. Р1А-вариант IS288 получен в результате двух циклов мутагенеза гена Р1А и предварительных анализов активности секретированных P1A-вариантов. Несколько P1A-вариантов, полученных сайт-направленным мутагенезом, клонировали в продуцирующем хозяине В. subtilis и проводили культивирования в колбах на шейкере. Супернатанты сред для выращивания этих мутантных штаммов концентрировали и использовали для измерения способности каждого штамма разрушать выбранные цефалоспорины. В большом объеме продуцировался IS288, и его очищали осаждением сульфатом аммония, хроматографией с гидрофобным взаимодействием и ультрафильтрацией. Исследование планировали для более подробного получения характеристик выбранного P1A-варианта IS288.
В дополнение к очистке с помощью ХГВ были разработаны методы для дополнительного обессоливания и определения характеристик по количеству и чистоте белка в элюированном пике белка.
Хроматография с гидрофобным взаимодействием, т.е. ХГВ, представляет собой метод, в котором разделение биомолекул основано на взаимодействии между гидрофобностью среды, природе и составе образца, доли и распределения доступных поверхностных остатков гидрофобных аминокислот и типе и концентрации соли в буфере для связывания. Адсорбция белка в матрице геля зависит от концентрации антихаотропных солей, таких как (NH4)2SO4 и Na2SO4; чем больше концентрация солей, тем сильнее адсорбционная способность среды для ХГВ. Матрица для ХГВ может содержать разные типы гидрофобных заместителей, как бутильные, октильные и фенильные группы. В качестве матрицы для ХГВ выбирали бутилсефарозу, так как Р1А сильно связывается с октилсефарозой и не может надлежащим образом элюироваться.
Процедура очистки IS288:
В первый день небольшое количество замороженной культуры клеток Bacillus subtilis IS288 наносили полосами на чашку с агаром ЛБ, содержащим 10 мкг/мл канамицина. Из этой чашки отбирали полученные утренние единичные культуры и инокулировали в 10×3 мл минимальной среды для выращивания с целью культивирования в колбах на шейкере. В обед того же дня из 3 мл предварительной культуры отбирали объем, который обеспечивал исходное значение ОП600 0,01 для 100 мл культуры, культивируемой в течение ночи (т/н). Культуры объемом 100 мл инкубировали на шейкере в течение ночи при +37°С. Из пары предварительных культур объемом 3 мл с ОП600=1 получали маточные культуры в глицерине (10% глицерин). Маточные культуры в глицерине хранили при -70°С.
На третьи сутки через ~ 16 часов культивирования измеряли конечное значение ОП600 результата культивировании в колбах на шейкере и центрифугировали клетки (Sorvall RC6) с использованием ротора SLA-3000, 7000 об/мин, 10 минут при +4°С). Супернатанты культур собирали, объединяли и затем фильтровали на фильтре с размером пор 0,2 мкм. Измеряли объем фильтрата, оказавшийся равным ~ 745 мл. Взвешивали 326,86 г твердого вещества (NH4)2SO4, обеспечивавшее 70% насыщение (NH4)2SO4, и добавляли в виде аликвот по ~ 33 г в супернатант при непрерывном перемешивании. Как только вся соль растворялась, раствор переносили в холодильник на +4°С.
На следующее утро раствор сульфата аммония центрифугировали (Sorvall RC6) на роторе SLA-3000, 90 минут, 10500 об/мин, +4°С, ускорение 9 и замедление 4). После центрифугирования супернатанты объединяли и фильтровали через стерильный фильтр с размером пор 0,2 мкм. Для хроматографии с гидрофобным взаимодействием (ХГВ) отбирали 72,5 мл фильтрата. Оставшийся фильтрат разделяли на аликвоты 17×50 мл и сначала хранили при +4°С, а позже переносили на -20°С. Более того, отбирали два образца фильтрата по 1 мл и сначала хранили при +4°С, а позже переносили на -20°С.
Концентрацию (NH4)2SO4 в фильтрате сульфата аммония оценивали равной ~ 2,7 М и разбавляли ее так, чтобы концентрация (NH4)2SO4 снижалась до ~ 2 М с помощью 190 мМ Na-H-фосфатного буфера, рН 6,8. Фильтрат подвергали ХГВ на колонке HiTrap Butyl FF объемом 5 мл, уравновешенной 50 мМ Na-H-фосфатным буфером, рН 6,9, 2 М (NH4)2SO4. Через колонку всего прокачивали 50 мл образца и собирали проточные фракции в виде фракций по 5 мл. Несвязавшийся образец промывали 50 мМ Na-H-фосфатным буфером, рН 6,9, 2 М (NH4)2SO4. Связавшийся IS288 элюировали уменьшавшейся концентрацией (NH4)2SO4 с использованием ступенчатого градиента и 50 мМ Na-H-фосфатного буфера, рН 6,8. При первом проведении анализа фракции элюирования составляли 1 мл. Фракции, содержащие элюированный продукт, объединяли в три набора С3-С8, C9-D1 и D2-D8. Проточные фракции и остальные фракции хранили при +4°С. Образцы отбирали из проточных фракций В1 и В8, а также из объединенных фракций белка и хранили при +4°С.
Этап ХГВ повторяли два раза для разных объемов образца, а именно 65 мл и 125 мл уравновешенного сульфатом аммония фильтрата. Эти последние анализы ХГВ были несколько изменены по сравнению с первым анализом. Объем промывания для несвязанного образца составлял 3 и 4 объема колонок (CV), объем проточных фракций увеличивали до 10 мл, а объем фракций элюирования увеличивали до 1,5 мл. Других модификаций условий анализа не проводилось.
Объединенные фракции белка, а также проточные фракции В1 и В8 первого анализа, проходили ультрафильтрацию и концентрирование с использованием концентраторов Amicon Ultra-4 с NMWL 10000. Образцы центрифугировали шесть раз и после каждого центрифугирования, за исключением последнего, к ретентату добавляли оставшийся образец или буфер так, чтобы получался объем 4 мл. После шестого этапа концентрирования ретентаты собирали, измеряли и хранили при +4°С. Образцы из успешных проведений ХГВ, а также еще одной фракции из первого анализа, проходили ультрафильтрацию и концентрирование с использованием Amicon Ultra-15 с NMWL 10000 и требовалось проведение только четырех циклов центрифугирования. Эти образцы также хранили при +4°С. Фильтраты сульфата аммония проходили ультрафильтрацию и концентрирование, а проточные фракции еще раз концентрировали с использованием фильтровальных планшетов с мембраной Ultracell-10, NMWL 10000. Концентрацию белка в проточных образцах измеряли перед этим последним этапом концентрирования, в то же время в фильтратах сульфата аммония концентрация белка не определялась.
Концентрацию белка образцов измеряли с помощью набора для анализа содержания белка с ВСА. На основании пика элюирования, полученного из

Наконец, образцы из всех трех очисток анализировали ДСН-ПААГ-электрофорезом Criterion XT с 12% Bis-Tris с использованием подвижного буфера MOPS для оптимального разделения белков размером 6-66 кДа. Максимальное количество белка добавляли к фильтратам сульфата аммония и всем проточным фракциям, за исключением В1121108, для которой содержание белка определили равным 0,21 мг/мкл в 33 X концентрированном образце. Количество фракций с пиками белков, наносимых пипеткой, рассчитывали так, чтобы нагрузка на гель составляла 0,5 мкг белка.
Для определения активности IS288 в единице массы использовали раствор очищенного белка IS288. Для выяснения того разрушается ли белок или может ли он модифицироваться другим способом во время хранения исследовали стабильность IS288 в условиях хранения. Определяли также стабильность белка в матрице целевого сайта. Для оценки времени, которое необходимо для удаления IS288 остатков антибиотиков в тонком кишечнике результаты анализа стабильности в матрице целевого сайта комбинировали с результатами анализа активности.
В дополнение к получению более подробной информации для P1A-варианта IS288 для определения характеристик других последующих P1A-вариантов применяли схему определения характеристик, созданную во время исследования.
Метод исследования уровней продукции P1A-варианта IS288
При культивировании Bacillus subtilis в колбах на шейкере в различные моменты времени отбирали образцы для оценки уровня продукции IS288. Для каждого из моментов времени измеряли значение ОП600, а также наблюдали, как росли клетки. Количество продуцированного белка оценивали ДСН-ПААГ-электрофорезом.
Способ исследования ферментативной активности и спектра антибиотиков при разных уровнях рН
Антибиотики, использованные в этом исследовании, были выбором из, например, внутривенно вводимых цефалоспоринов. Безотносительно к какой-либо теории, можно считать, что концентрации выбранных антибиотиков приняты насколько возможно близкими к сообщенным в литературе концентрациям в желчи или двенадцатиперстной кишке. Это эксперимент также выполняли при изменяющихся значениях рН.
Способ исследования ферментной стабильности в химусе ободочной кишки человека
Разные количества очищенного фермента инкубировали в химусе ободочной кишки человека при соответствующей температуре в течение установленного периода времени. Образцы отбирали в разные моменты времени. Паттерн разрушения IS288 анализировали с помощью ДСН-ПААГ-электрофореза, а активность IS288 анализировали с использованием в качестве субстрата нитроцефина.
Соединения и бактериальный штамм: ампициллин, цефтриаксон, цефтазидим, меропенем, цефепим, цефазолин, амп/сульбактам, цефоперазон, цефотаксим и цефуроксим приобретали из коммерческих источников и хранили в виде замороженных маточных растворов по 15 мг/мл и 10 мг/мл соответственно. Р1А поставлялся компанией Synthetic Biologies в виде маточной концентрации 32 мг/мл и хранился при -80°С. Штамм Escherichia coli ATCC 25922 получали из Американской коллекции типов культур (ATCC, г. Манассас, штат Вирджиния).
Определение эффективной ингибирующей концентрации в отсутствии и присутствии Р1А (RS310), Р3А (IS118) и Р4А (IS288): Эффективные ингибирующие концентрации (ЕС50, 90) ампициллина, цефтриаксона, цефтазидима, меропенема, цефепима, цефазолина, амп/сульбактама, цефоперазона, цефотаксима и цефуроксима определяли анализом микроразбавления бульона в соответствии с руководствами CLSI (M07-A9: Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard - Ninth Edition). Штамм 25922 Escherichia coli культивировали из маточных культур в глицерине до стадии логарифмического роста в бульоне Мюллера-Хинтона с коррекцией содержания катионов при 37°С в окружении атмосферой и разбавляли в бульоне Мюллера-Хинтона с коррекцией содержания катионов для достижения начальной концентрации в лунке 5×105 КОЕ/мл. В бульоне Мюллера-Хинтона с коррекцией содержания катионов готовили серийное 2-кратное разведение антимикробных соединений для получения конечной концентрации в лунке от 128 мкг/мл до 0,13 мкг/мл для ампициллина и 4 мкг/мл или 4 нг/мл в отсутствии или присутствии серийных 10-кратных разведении стандарта β-лактамаз Р1А, Р3А или Р4А, от 5 пг/мл до 50 нг/мл для ампициллина и 50 пг/мл до 500 нг/мл для цефтриаксона, цефтазидима, меропенема, цефепима, цефазолина, амп/сульбактама, цефоперазона, цефотаксима и цефуроксима. Антибиотики либо добавляли к Р1А и инкубировали в течение 30 мин при 37°С (предварительная инкубация) перед добавлением бактерий, либо добавляли в планшеты после добавления Р1А, Р3А, Р4А и бактерий (одновременно). Все концентрации и комбинации оценивали в трех повторах в формате 96-луночного планшета, который содержал только среду, только соединение плюс среда (колориметрический контроль) и необработанные бактериальные контроли. После последующей инкубации в течение ночи измеряли ОП625 планшетов на устройстве для считывания планшетов Spectramax 384, а данные импортировали в специализированный лист Excel для определения путем линейного регрессионного анализа эффективной концентрации, которая ингибировала рост бактерий на 50%, 90% и 99% (ЕС50, 90, 99).
Пример 2. Результаты мутагенеза
Схема мутаций основана на, в частности, данных структуры (например, данных кристаллической структуры, гомологичных моделях и т.д.) из следующих данных: кристаллическая структура Р1А (Knox and Moews, J. Mol Biol., 220, 435-455 (1991)), CTX-M-44 (1BZA (Ibuka et al. Journal of Molecular Biology Volume 285, Issue 5 2079-2087 (1999), 1IYS (Ibuka et al. Biochemistry, 2003, 42 (36): 10634-43), 1IYO, 1IYP и 1IYQ (Shimamura et al. 2002 J. Biol. Chem. 277: 46601-08), Proteus vulgaris K1 (1HZO, Nugaka et al. J Mol Biol. 2002 Mar 15; 317(1): 109-17) и Proteus penneri HugA (Liassine et al. Antimicrob Agents Chemother. 2002 Jan; 46(1): 216-9. 2002) и обзор в Bonnet, Antimicrob. Agents Chemother 48(1): 1-14 (2004) (для СТМ-Х), содержание всех из этих документов таким образом включено в данный документ посредством ссылки в полном объеме). В некоторых вариантах реализации изобретения о настоящих мутациях стало известно с помощью анализа данных структуры (например, данных кристаллической структуры, гомологичных моделей и т.д.) любой из следующих бета-лактамаз: Р1А, Р2А, Р3А, СТХ-М-3, СТХ-М-4, СТХ-М-5, СТХ-М-9, СТХ-М-10, СТХ-М-14, СТХ-М-15, СТХ-М-16, СТХ-М-18, СТХ-М-19, СТХ-М-25, СТХ-М-26, СТХ-М-27, СТХ-М-32, CTX-M-44, СТХ-М-45 и СТХ-М-54. Такая информация доступна специалисту в данной области техники в известных базах данных, например, банке данных белковых последовательностей Swiss-Prot, NCBI и PDB.
Результаты сайт-направленного и случайного мутагенеза обобщены в табл. 2 и 3 соответственно. Ферментативная активность выбранных мутантов представлена в табл. 4, а кинетические параметры представлены в табл. 5. В эту таблицу также включены кинетические параметры для предыдущих ферментов Р1А, Р3А и Р2А.
Блок мутаций 1. I72S, Q135M и T160F
Первый блок мутаций, включающий I72S, Q135M и T160F, встраивали в мутагенные праймеры в одной реакции с использованием набора для множественного сайт-направленного мутагенеза QUIKCHANGE (для краткости названного набором Multi), Stratagene. В качестве матрицы в реакции мутагенеза применяли плазмиду, несущую ген penP. Мутантными одноцепочечными плазмидами трансформировали Е.coli XL10Gold и проводили отбор канамицином/хлорамфениколом. Компетентные клетки XL10 Gold исследовали набором Multi. Собирали колонии (10-30) и испытывали с помощью нитроцефина для проверки на β-лактамазную активность. Часть колонии использовали как матрицу в ПЦР, а получившийся фрагмент, если он был чистый, отправляли на секвенирование ДНК. Оставшуюся часть колонии культивировали в среде Лурия с соответствующим антибиотиком в течение ночи при 37°С и часть культуры хранили в глицерине (≤10%, конечная), другую часть использовали для выделения плазмиды. После подтверждения требуемых мутаций с помощью секвенирования ДНК более подробно определяли характеристики мутантных клонов. Готовили периплазматические лизаты и анализировали в ДСН-ПААГ, а кинетику гидролиза цефотаксима измеряли спектрофотометрически.
Блок мутаций 2. A232G, A237S, A238G и S240D
Аминокислоты-мишени В3 β-цепи Р1А так близко расположены друг к другу, что использование протокола Multi-Site было неприменимым, по меньшей мере за один цикл. Вместо этого все четыре аминокислоты заменяли с использованием методики SOE. Участок, охватывающий замены, содержал 24 нуклеотида (8 аминокислотных кодонов) и включал перекрывающуюся часть расширения двух праймеров ПЦР. Сначала мутировавший ген penР двумя частями амплифицировали ПЦР с использованием праймеров А+В и C+D (Фиг. 7). Затем два продукта ПЦР комбинировали и амплифицировали с использованием праймеров А и D, комплементарных 5' и 3' частям гена penР. В праймеры А и D включены сайты клонирования. Как только была получена конструкция, дополнительные мутации добавлялись с использованием набора Multi.
Дополнительные мутации R244T и D276R(K)
Эти мутации добавляли с использованием методики набора Multi-Site и раннее полученных мутантных плазмид в качестве матриц. Перечень сконструированных мутаций показан в табл. 1. Количество комбинаций мутаций легко и последовательно увеличивали, определение характеристик проводили с помощью более робастных методов, чем измерение кинетики разрушения цефотаксима отдельными клонами. Первичным определением характеристик было определение цефотаксима MIC.





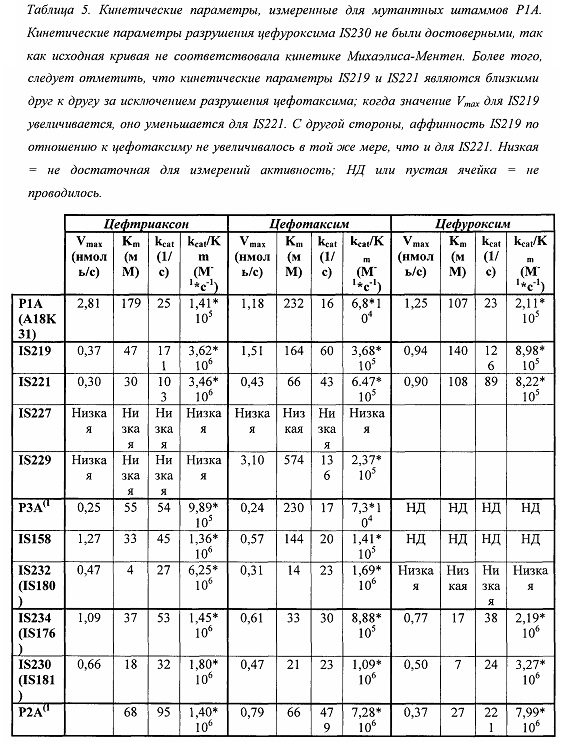

Ферментативная активность и кинетические параметры
По кинетическим параметрам, измеренным для Р1А по цефотаксиму, цефтриаксону и цефуроксиму, безотносительно к какой-либо теории сделан вывод, что Р1А обладает низкой собственной цефалоспориназной активностью. В целом аффинность мутантов в отношении лигандов увеличилась (т.е. уменьшилось Km). У мутанта IS229 (блок 2 + R244T) значение Vmax увеличилось, а аффинность уменьшилась (увеличилось Km) (табл. 5). Для IS229 значение kcat увеличилось больше всего.
Скрининг результатов случайного мутагенеза с помощью цефтриаксона предпочтительно привел к получению мутантов с низким значением Km (высокая аффинность) по отношению к антибиотику.
Уменьшение по Km при последующих циклах мутаций показано в сериях мутаций Р3А → IS158 → IS232; IS232 имела чрезвычайно высокую аффинность по отношению к цефтриаксону. Значение Vmax для цефтриаксона последовательно не увеличивалось, оставаясь наибольшим для IS158, но тем не менее значение kcat уменьшалось при прохождении циклов мутаций. Первые два мутанта этого цикла не обладали цефотаксимазной активностью, но IS232 с дополнительной заменой А238Т имел цефотаксимазную активность.
Сайт-специфические мутации блок 2 (IS191) сами по себе не увеличивали в значительной степени P1A-производную активность по отношению к цефалоспоринам, но активность по отношению к ампициллину снизилась 20-кратно (табл. 4). Цефалоспориназная активность мутанта блок 2 + D276R/K (IS219/IS221) была значительно лучше, чем такая активность IS191. Кинетические параметры сайт-специфических мутантов IS219 и IS221 выявили, что сайт-направленный мутагенез предпочтительно увеличил ферментативную активность в отношении целевых антибиотиков.
Анализ стабильности/стресс-испытание с глюкозой
Для испытания на стабильность мутантов в условиях выращивания Bacillus subtilis проводили культивирование в колбах на шейкере с RS310, IS219 и IS232. Культивирование осуществляли при двух разных концентрациях глюкозы 5 г/л и 10 г/л.
Р1А (RS310) и два мутанта IS219 и IS232 культивировали в колбах на шейкере (100 мл) в минимальной среде с 5 или 10 г/л глюкозы. Состояние клеток отслеживали с помощью микроскопа, потребление глюкозы измеряли от 5 г/л при росте, а образцы из супернатантов культур (концентрированные и неконцентрированные) анализировали на ДСН-ПААГ с 12% Bis-Tris (Criterion, BioRad) (Фиг. 1 и 2). Отслеживали также значения ОП культур клеток.
В культурах с 10 г/л глюкозы Р1А и IS232 продуцировали сопоставимые количества, но продукция IS219 была ниже (дорожки 2-4, Фиг. 1). Во время концентрирования выход IS219 дополнительно снижался (дорожки 6, 9 и 16, Фиг. 1). На дорожке 16 можно было видеть слабую полосу ~ 29 кДа на Фиг. 1. Снова можно было сконцентрировать Р1А и IS232 (дорожки 5, 7, 8, 10, 15 и 16 Фиг. 1).
В присутствии 5 г/л глюкозы P1A-штамм RS310 начинал расти медленнее, чем другие два штамма. Тем не менее к концу культивирования количество Р1А превысило количество других белков (Фиг. 2). Мутантный штамм IS219 начинал продуцировать приблизительно с такой же скоростью, что и штамм IS232, но к 10 часам культивирования его продукция начала отставать от IS232 и его количество с течением времени снижалось. К 9,5 часам культивирования вся глюкоза потреблялась как при культивировании IS219, так и IS232, и с этой точки зрения предположили, что количество протеаз начинало увеличиваться. Вследствие того что RS310 рос медленнее, то некоторое количество глюкозы оставалось к 11 часам культивирования, но до следующего утра RS310 также потребил всю глюкозу. Вследствие того что в течение ночи из RS310 не отбирались образцы, точный момент времени, в который RS310 использовал всю свою глюкозу и начал продуцировать протеазы, не мог быть установлен. К 27,5 часам культивирования количество Р1А увеличилось, но количество как IS219, так и IS232, по сравнению с предыдущим днем уменьшилось. По результатам исследования безотносительно к какой-либо теории можно сделать вывод, что IS232 переносит протеазы лучше, чем IS219, который не переносит их совсем.
На основании обоих культивировании с 10 г/л глюкозы и 5 г/л глюкозы безотносительно к какой-либо теории, можно сказать, что модификации Р1А снижают переносимость белковых протеаз. Депривация глюкозой приводит в случае IS219 и IS232 к появлению продуктов деградации, а количество продуктов деградации увеличилось после потребления всей глюкозы. Белок IS219 был более чувствительным к разрушению, так как его количество уменьшалось больше, чем IS232. Безотносительно к какой-либо теории это может указывать или на более низкую способность к секреции или на большую чувствительность к протеазам Bacillus, или на обе причины. В заключение, продукция IS219 была невозможна при использовании таких же условий роста как для RS310 и IS232. Стресс-испытание с глюкозой также продемонстрировало, что этот тест может использоваться для оценки переносимости протеаз созданных мутантов.
С помощью стресс-испытания с глюкозой было продемонстрировало, что мутация блок 2 + D276R = IS219 (а вероятнее всего блок 2 + D276K = IS221) уменьшает переносимость ферментативных протеаз. Вероятнее всего, безотносительно к какой-либо теории нестабильность обеспечивается из-за мутации D276R, которая создает сайт расщепления протеазами на поверхности белка.
Мутация D276N на IS191, которая могла бы привести к получению мутанта блок 2 + D276N. Безотносительно к какой-либо теории предполагается, что мутация аспарагиновой кислоты в аспарагин увеличивает активность цефтриаксона (и может быть цефотаксима) IS191, но в то же время делает фермент более устойчивым к протеазам, чем IS219 (и IS221). Мутация R244T может комбинироваться с блоком 2 и D276N для того чтобы увидеть может ли с этой мутацией увеличиться значение Vmax (и kcat). Мутация R244T также может комбинироваться с IS219 и IS221.
Анализ активности мутации R244T (IS217) (табл. 4) показал потерю практически всей ферментативной активности Р1А. Некоторая активность получена для двойного мутанта R244T + D276K (IS215), но ее уровень не достиг уровня фермента дикого типа. Таким образом мутация R244T сама по себе не может обеспечить цефалоспориназную активность Р1А.
На основании кинетических данных (табл. 5) мутация блока 1 (I72S/Q135M/T160F, IS227) не улучшила способность Р1А к гидролизу цефалоспоринов. В других анализах активности ни Q135M, ни T160F сами по себе не увеличивали способность Р1А гидролизовать цефалоспорины, вместо этого обе одиночные мутации привели к потере практически всей ферментативной активности Р1А даже в отношении ампициллина. Однако существовал мутант блок 2 + Q135M (IS224), который имел активность в отношении цефотаксиму и цефтриаксону между мутантами блок 2 (IS191) и блок 2 + D276R/K (IS219/IS221). Безотносительно к какой-либо теории блок 1 может "ослабить" Ω-петлю, в которой расположен каталитический Glul66. Мутация T160F является довольно большой модификацией в ядре структуры белка. Она может полностью разрушить структуру или по меньшей мере сделать белок неспособным правильно функционировать. Для того чтобы избежать эту возможность для сопровождения мутации T160F в Р1А были добавлены две компенсирующие мутации, а именно I72S и Q135M, и эту комбинацию назвали "блок 1".
Пример 3. Результаты продукции и очистки P1A-мутанта IS288
Результаты отражены в виде фигур с пиками элюирования (Фиг. 3, 4, и 5) и таблиц пиков, в виде концентраций белка и изображения (изображений) ДСН-ПААГ (Фиг. 6).
Хроматограммы хроматографии с гидрофобным взаимодействием
Проводили хроматографию с гидрофобным взаимодействием (ХГВ) для трех отдельных случаев с отличающимися параметрами. В первом анализе (16.10.08, Фиг. 3) объем образца составлял ~ 50 мл, объем проточных фракций 5 мл, объем промывания для несвязанного образца 2 CV, а объем фракций элюирования 1,0 мл. В следующем анализе ХГВ (4.11.08, Фиг. 4) объем образца увеличивали до 65 мл, объем проточных фракций увеличивали до 10 мл, а объем промывания для несвязанного образца до 3 CV и размер фракции до 1,5 мл. В последнем анализе (12.11.08, Фиг. 5) от предшествующего анализа отличались только объем образца и объем промывания для несвязанного образца, составившие соответственно 125 мл и 4 CV.
Все графики анализов ХГВ (Фиг. 3, 4, и 5) представлены в одинаковой общей форме. Проточные фракции давали постоянное поглощение ~ 700 мЕА при 280 нм для всех введений образцов, в то время как во время промывания несвязанного образца поглощение 280 нм упало до нуля, подымаясь снова, когда элюировался связанный белок. Проводимость образца была несколько ниже в образцах, введенных на Фиг. 3 и Фиг. 4, чем в подвижном буфере А, содержащем 2 М (NH4)2SO4, в то время как при анализе 12.11.2008 она оставалась такой же, как в А-буфере. В двух анализах концентрация (NH4)2SO4 фильтрата сульфата аммония оценивалась равной 2,7 М и в последнем анализе 2,6 М. Похоже, что оценка 2,6 М была ближе к действительной концентрации (NH4)2SO4 фильтрата сульфата аммония, так как проводимость выходящего раствора не падала во время введения образца (Фиг. 5).
Элюирование начинали сразу после введение в колонку буфера для элюирования (буфер В). Это указывает, что белок с трудом связывался с колонкой, поскольку он элюировался в градиенте так рано. Таким образом очень важно, чтобы проводимость образца никогда не становилась меньше чем ~ 240 мСм/см.
Связанный белок элюировался в виде типичного пика элюирования с резко возрастающим углом наклона и постепенным снижением угла наклона, давая слегка асимметрический пик. Размер пика был наибольшим при первом анализе ~ 18 мл (18 фракций × 1 мл) Фиг. 3). Это пик собирали в три набора: первый из 6 мл (фракции С3-С8), второй из 5 мл (фракции C9-D1) и третий из 7 мл (фракции D2-D8), так как в пике элиюрования между фракциями С8 и С9 существовало "плечо", то приняли во внимание, что последние 7 фракций могут быть слишком разбавленными для концентрирования. В двух последующих анализах ХГВ (4.11.2008 и 12.11.2008, Фиг. 4 и 5 соответственно) пик элюирования составил 13,5 мл (9 фракций × 1,5 мл, 4.11.2008) и 12 мл (8 фракций × 1,5 мл, 12.11.2008) и весь пик был объединен в одну фракцию.
В табл. 7 даны статистические значения для графиков А280 трех анализов ХГВ. Для оценки содержания белка данного образца использовали площадь пика, и она использовалась для оценки коэффициента разведения для разных образцов в анализе с ВСА. Для расчетов требовался теоретический коэффициент поглощения белка, который рассчитывался с использованием ProtParamTool на веб-сервисе ExPASy. Для IS288 этот коэффициент составил 25440 M-1 cm-1 и дал для 0,1% (= 1 г/л) раствора значение A280 0,869.
Применяя вышеприведенную пропорцию, количества белка в образцах элюированных образцов белка и известные объемы этих образцов рассчитывали количество белка, элюированного из колонки. Применялась формула: ((мЕА*мл)*10^-3/Vфракции)/0,869*Vфракции→(мЕА*мл)*10^-3/0,869, которая дала результат: 3,36 мг белка 161008, 2,95 мг 041108 и 3,60 мг 121108.
Таблица 7. Таблица с пиками из трех отдельных анализов ХГВ
Дата анализа, название пика, время удерживания, т.е. объем, при котором пик достигает своего максимального значения, площадь пика и максимальная высота пика. Для оценки количества элюированного белка во фракции элюирования использовали площадь пика.

Ультрафильтрация и концентрирование проточных фракций и фракций элюированных белков
Из каждой из очисток отбирали одну, две или три проточные фракций для концентрирования, а также все фракции, содержащие элюированный пик белка. Отобранные образцы представлены в табл. 8. В таблице также представлены начальный объем данного образца, а также конечный объем и коэффициент концентрирования.
Таблица 8. Образцы отбирали для ультрафильтрации и концентрирования с помощью Amicon Ultra-4, NMWL 10000.
Представлены исходный объем образца и конечный объем образца после концентрирования, а также коэффициент концентрирования. Коэффициент концентрирования рассчитывался путем деления исходного объема на конечный объем образца после концентрирования.

Проточные фракции, выбранные для ультрафильтрации, были взяты из начала (B1161008 и A2041108) и из окончания введения образца (B7161008, B8161008, A7041108 и B1121108). Эти образцы анализировали для того чтобы увидеть превышается ли емкость колонки данным количеством конкретного образца.
Более того, для каждой из очисток подвергали ультрафильтрации и концентрированию фильтраты сульфата аммония и сразу после концентрирования проточные фракции еще дополнительно концентрировали на планшетах MultiScreen с помощью мембраны Ultracell-10, NMWL 10000. Результаты этого концентрирования представлены в табл. 9.
Таблица 9. Образцы, выбранные для ультрафильтрации и концентрирования с помощью планшетов для фильтрования MultiScreen с мембранной Ultracell-10, NMWL 10000.
Указаны как исходный объем, так и объем образца после концентрирования. Коэффициент концентрирования рассчитывался путем деления исходного объема образца на конечный объем образца.

Таким образом проточные фракции анализов ХГВ были сконцентрированы на коэффициент 16 или более. Коэффициенты конечного концентрирования проточных фракций перечислены в табл. 10.
Таблица 10. Коэффициенты конечного концентрирования проточных фракций
Коэффициенты конечного концентрирования рассчитывали путем умножения коэффициента концентрирования первого концентрирования на коэффициент концентрирования второго концентрирования.

Результаты анализа с ВСА
Результаты анализа с ВСА представлены в табл. 11. Перед последним этапом концентрирования с помощью планшетов MultiScreen с мембраной Ultracell-10 измеряли концентрацию белка проточных фракций.
Таблица 11. Концентрации белка в проточных фракциях ХГВ и фракциях пиков
Концентрацию белка определяли из двух повторов двух разных разведении данного образца. Конечный объем образца измерялся после концентрирования.
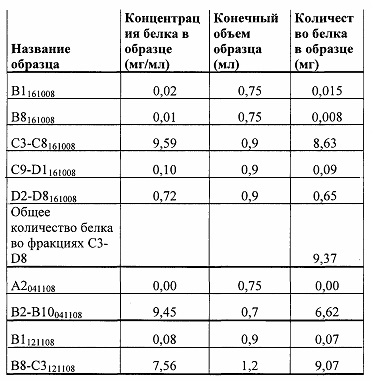
Хроматограммы анализов ХГВ дали достаточно высокие, ~ 700 мЕА, значения A280 для всего введения образца для выходного раствора. Пики элюированного белка содержали достаточные количества белка. Они находились около предполагаемой емкости связывания колонки, 10 мг. Площадь пика из

ДСН-ПААГ-электрофорез
Максимальным объемом образца (17,5 мкл) нагружали ДСН-ПААГ (Фиг. 6) для фильтратов сульфата аммония и проточных фракций, за исключением В1121108 для которых использовали нагрузку 6,5 мкл. Объем образцов из пиков белков рассчитывали так, чтобы на дорожку приходилось ~ 0,5 мкг белка, и считали, что весь белок в образце был P1A-производным IS288. Результаты ДСН-ПААГ-электрофореза представлены на Фиг. 6.
Все образцы фильтратов сульфата аммония содержали двойную полосу около 30 кДа (ММ IS288 равна 29288 Да, а Р1А - 29273 Да). Такая же двойная полоса сопровождалась слегка меньшей дополнительной полосой, которая была четко видна для проточной фракции В1121108 и несколько более слабо для проточной фракции А7041108. С другой стороны, обе из этих фракций исчезли из пиков элюированных белков. Некоторые незначительные примеси можно было увидеть для последних объединенных фракций очистки D2-D8 161008, когда нагружали ~ 10-кратное предполагаемое количество белка. Можно заключить, что очищенный белок был основной формой белка и что по данным анализа молекулярной массы это был Р1А-вариант IS288.
Пример 4. Испытание на бета-лактамазную активность путем микробиологического скрининга
Эффективную ингибирующую концентрацию 50% (ЕС50) ампициллина и цефтриаксона против Escherichia coli определяли в отсутствии и присутствии β-лактамазы Р1А. Для целей этих исследований принимали, что установленная эффективная концентрация была начальной концентрацией ампициллина или цефтриаксона, добавленной в начале эксперимента, а не концентрацией, измеренной в ходе эксперимента или в конце периода инкубации. Результаты анализа представлены в табл. 12-14.
Для начальной оценки использовали Р1А в концентрациях от 0,5 нг/мл до 5 мкг/мл и ампициллин и цефтриаксон в концентрациях от 0,13 мкг/мл до 128 мкг/мл. Добавление самой низкой концентрации Р1А (0,5 нг/мл) сдвигало ЕС50 ампициллина от 16 мкг/мл до более чем максимальной испытуемой концентрации 128 мкг/мл, если он добавлялся одновременно, и до 64 мкг/мл, если Р1А предварительно инкубировали с ампициллином перед добавлением бактерий (табл. 12). При использовании одинаковых концентраций P1A от 0,13 мкг/мл до 128 мкг/мл цефтриаксона было обнаружено, что цефтриаксон полностью ингибировался при самой низкой концентрации (ЕС99<0,13 мкг/мл), а ЕС50 цефтриаксона сдвигалась до 0,25 мкг/мл в присутствии 5 нг/мл Р1А при одновременном добавлении и до 128 мкг/мл, если 50 нг/мл Р1А предварительно инкубировали с антибиотиком. На основании этого анализа концентрации Р1А и цефтриаксона корректировали до охвата пределов ингибирующих концентраций обоих.
При использовании концентрации Р1А от 5 пг/мл до 50 нг/мл с от 0,13 мкг/мл до 128 мкг/мл ампициллина ЕС50 ампициллина сдвигалась от 16 мкг/мл в отсутствии Р1А до 128 мкг/мл в присутствии 50 пг/мл при предварительном инкубировании или одновременном добавлении. Более низкие концентрации Р1А (5 пг/мл) не оказывали влияния на ЕС50 ампициллина. ЕС50 цефтриаксона сдвигалась от 0,03 мкг/мл в отсутствии Р1А до более чем 4 мкг/мл в присутствии 50 нг/мл или больше Р1А при предварительном инкубировании или одновременном добавлении (табл. 13). Более низкие концентрации Р1А (от 50 пг/мл до 5 нг/мл) не оказали влияния на ЕС50 цефтриаксона. Результаты с одновременным добавлением Р1А с ампициллином или цефтриаксоном были подтверждены посредством повторного анализа (табл. 14).
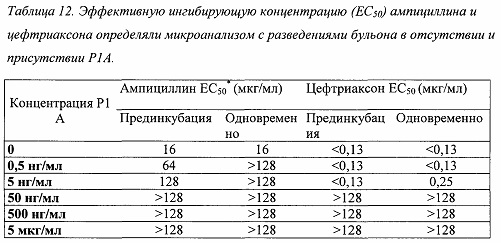
Антибиотики либо добавляли к Р1А и инкубировали в течение 30 мин при 37°С (предварительное инкубирование) перед добавлением бактерий, либо добавляли к планшетам после добавления Р1А и бактерий (одновременно). Все концентрации и комбинации оценивали в трех повторах в формате 96-луночного планшета. После инкубирования в течение ночи измеряли ОП625 планшетов на устройстве для считывания планшетов Spectramax 384, а данные импортировали в специализированный лист Excel для определения 50% эффективной ингибирующей концентрации (ЕС50) путем линейного регрессионного анализа. Для целей этих исследований принимали, что установленная эффективная концентрация является начальной концентрацией ампициллина или цефтриаксона, добавленной в начале эксперимента, а не концентрацией, измеренной в ходе эксперимента или в конце периода инкубации.

Антибиотики либо добавляли к Р1А и инкубировали в течение 30 мин при 37°С (предварительное инкубирование) перед добавлением бактерий либо добавляли к планшетам после добавления Р1А и бактерий (одновременно). Все концентрации и комбинации оценивали в трех повторах в формате 96-луночного планшета. После инкубирования в течение ночи измеряли ОП625 планшетов на устройстве для считывания планшетов Spectramax 384, а данные импортировали в специализированный лист Excel для определения 50% эффективной ингибирующей концентрации (ЕС50).


Антибиотики добавляли к Р1А и бактериям (одновременно). Все концентрации и комбинации оценивали в трех повторах в формате 96-луночного планшета. После инкубирования в течение ночи измеряли ОП625 планшетов на устройстве для считывания планшетов Spectramax 384, а данные импортировали в специализированный лист Excel для определения 50% эффективной ингибирующей концентрации (ЕС50) путем линейного регрессионного анализа.
Эти результаты продемонстрировали, что Р1А эффективно ингибировал активность ампициллина и цефтриаксона в микробиологическом анализе in vitro, и показали, что Р1А в микробиологическом анализе является 1000-кратно более активным против ампициллина, чем цефтриаксона.
Далее определяли 90% эффективную ингибирующую концентрацию (ЕС90) для ампициллина, цефтриаксона, цефтазидима, меропенема, цефепима, цефазолина, амп/сульбактама, цефоперазона, цефотаксима и цефуроксима против Escherichia coli в отсутствии и присутствии Р1А, Р3А или Р4А β-лактамазы. Для целей этих исследований принимали, что установленная эффективная концентрация была начальной концентрацией ампициллина, цефтриаксона, цефтазидима, меропенема, цефепима, цефазолина, амп/сульбактама, цефоперазона, цефотаксима и цефуроксима, добавленной в начале эксперимента, а не концентрацией, измеренной в ходе эксперимента или в конце периода инкубации. Результаты анализа представлены в табл. 15-17. Каждая ячейка в таблицах ниже (табл. 15-17) содержит два числа, разделенных косой чертой, данные два числа являются значениями продублированных анализов, все эти числа показали четкое согласование.
Конкретно анализы выполняли путем разведения (2-кратные этапы) выбранного антибиотика по рядам 96-луночной чашки. Значение минимальной ингибирующей концентрации MIC определяли как точку, в которой переходы разбавленных антибиотиков менялись от обеспечения гибели до отсутствия гибели бактерий (в этом случае штамм Е.coli являлся чувствительным ко всем антибиотикам). Р1А, Р3А и Р4А разбавляли (10-кратные этапы) вдоль колонок (концентрации β-лактамазы увеличивались при движении по колонкам вниз). Так как концентрация β-лактамазы увеличивалась, то она достигала уровня, на котором она разрушала антибиотик в достаточной степени, чтобы изменить результаты считывания кажущегося значения MIC (в действительности значение MIC не изменяется, но кажется, что оно изменяется потому что количество антибиотика, остающееся в лунке, было меньше количества добавленного в лунку). В большинстве случаев существует две точки перехода: первая, в которой MIC кажется немного увеличившимся, а затем более высокая десятикратная концентрация, при которой MIC превышает максимальное количество испытуемого антибиотика. Последняя точка использовалась в качестве точки отсечения. Важно отметить, что с этой Е.coli значение MIC отличалось для каждого антибиотика. Однако в этом анализе абсолютное значение MIC не было наиболее важным параметром. Наиболее значимым индикатором была концентрация β-лактамазы, при которой кажущееся значение MIC увеличивалось до максимального количества испытуемого антибиотика.
Если точка отсечения отмечалась для низкой концентрации β-лактамазы, то это значило, что β-лактамаза была активной при разрушении антибиотика. Если требовалось много β-лактамазы для смещения MIC, тогда β-лактамаза была относительно слабой для данного антибиотика. Этот анализ был разработан безотносительно к какой-либо теории для получения прогноза эффективности in vivo каждой β-лактамазы для данного антибиотика. Эти данные могут комбинироваться с кинетическими данными in vitro.

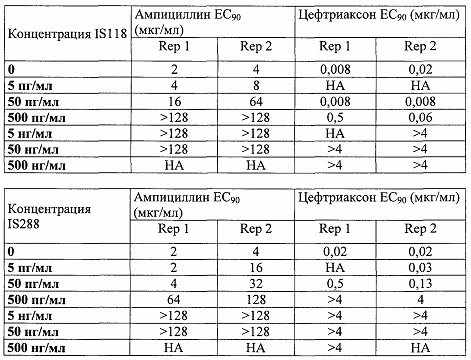
В 96-луночном планшете в течение ночи инкубировали Е coli 29522 в присутствии серийных разведении антибиотика и указанных количеств белка β-лактамазы из супернатантов культур клеток. Измеряли бактериальную плотность (ОП625) культур и определяли концентрацию, при которой плотность снижалась на 90% относительно необработанного бактериального контроля (ЕС90). Анализы выполняли в два разных дня и данные представляли как Rep1 и Rep2. НА = не анализировали.


В 96-луночном планшете в течение ночи инкубировали Е coli 29522 в присутствии серийных разведении антибиотика и указанных количеств белка β-лактамазы из супернатантов культур клеток. Измеряли бактериальную плотность (ОП625) культур и определяли концентрацию, при которой плотность снизилась на 90% относительно необработанного бактериального контроля (ЕС90). Анализы выполняли в два разных дня и данные представляли и данные представляли в виде двух числовых значений, разделенных косой чертой. НА = не анализировали.


В 96-луночном планшете в течение ночи инкубировали Е coli 29522 в присутствии серийных разведении антибиотика и указанных количеств белка β-лактамазы из супернатантов культур клеток. Измеряли бактериальную плотность (ОП625) культур и определяли концентрацию, при которой плотность снизилась на 90% относительно необработанного бактериального контроля (ЕС90). Анализы выполняли в два разных дня и данные представляли и данные представляли в виде двух числовых значений, разделенных косой чертой. НА = не анализировали.
Безотносительно к какой-либо теории эти данные предполагают большую активность in vitro, чем прогнозированная по соответствующим кинетическим данным. Например, кинетические данные по цефтазидиму прогнозировали отсутствие терапевтической эффективности, но эти данные показали активность при 500 нг/мл с 10-кратным улучшением для Р4А. Далее наблюдалось, что Р1А и Р3А были достаточно эффективными для ампициллина, тогда как Р4А терял некоторую активность для ампициллина. Данные по амп/сульбактаму подтвердили, что сульбактам эффективно ингибируется Р1А, Р3А и Р4А. Поскольку данные по по амп/сульбактаму подтвердили, что сульбактам является эффективным ингибитором β-лактамазы, этот факт не следует интерпретировать в значении, что эти бета-лактамазы не будут эффективны in vivo. Конкретно если фармакокинетика для экскреции желчи отличается для антибиотика и ингибитора, то антибиотик может обнаруживаться в тонком кишечнике в отсутствии своего ингибитора. Например, показано что Р1А должен быть эффективным для людей с пиперациллином/тазобактамом. Данные по меропенему подтвердили ожидаемое, что Р1А, Р3А и Р4А β-лактамазы представляют собой пенициллиназы и цефалоспориназы. Наконец, обнаружили, что Р4А должен быть в высшей степени эффективным при разрушении цефтриаксона, лучше чем Р3А. Р4А был также эффективен по отношению к цефтриаксону, как и к ампициллину. Р4 также обладал улучшенной активностью по отношению к некоторым важным цефалоспоринам за исключением цефепима. По сравнению с Р1А Р4А проявил около 10-кратную или большую β-лактамазную активность по отношению к цефтриаксону, цефотаксиму, цефтазидиму, цефазолину, цефоперазону и цефуроксиму.
Пример 5. Анализ свойств по разрушению антибиотиков Р1А, Р3А и Р4А
Р1А и Р4А подвергали скринингу на разрушение ампициллина, цефтриаксона, цефотаксима, цефазолина, цефуроксима, цефоперазона, цефепима и цефтазидима в анализе активности на планшетах для микротитрования, который разработан для имитации активности бета-лактамаз в пищевом канале в присутствии высоких концентраций антибиотика. Анализ выполняли смешиванием 10, 100 или 1000 мкг/мл указанных антибиотиков с Р1А или Р4А, в концентрациях 10 или 100 нг/мл. Планшеты инкубировали либо в течение одного часа при 37°С, после чего добавляли Е.coli (АТСС 25922) либо Е.coli добавляли непосредственно после добавления ферментов бета-лактамаз. Планшеты инкубировали в течение ночи и количественно определяли бактериальный рост измерением поглощения при 625 нм (ОП625) в устройстве для считывания планшетов Spectramax 384 Plus. Анализ для каждой бета-лактамазы и антибиотика выполняли дважды. Бета-лактамазную активность супернатантов культур определяли, как положительную или отрицательную на основе наличия бактериального роста в отдельных лунках. Значение ОП625 равное 1,0 или больше указывало на максимальный бактериальный рост и поэтому на полное разрушение антибиотика и высокую бета-лактамазную активность. ОП625 менее чем 1,0 указывает на низкий бактериальный рост и поэтому на неполное разрушение антибиотика и, следовательно, низкую бета-лактамазную активность.
Результаты анализа показаны на Фиг. 8. Для планшетов, которые предварительно инкубировали с бета-лактамазой и антибиотиком, по сравнению с планшетами, которые не подвергались преинкубации, не было отличий.
Для всех антибиотиков, кроме ампициллина, для Р4А показана улучшенная активность по сравнению с Р1А. Для Р1А показано отсутствие активности для цефтриаксона, цефотаксима и цефтазидима. Для Р4А показана большая активность для цефотаксима, цефазолина, цефоперазона, цефепима и цефтазидима.
Соответственно модификация пяти (Р4А) аминокислот в Р1А усилила цефалоспориназную активность 10-1000-кратно. Таким образом пероральное введение Р4А может защищать флору пищевого канала от обычно применяемых цефалоспоринов и продлевать клиническое применение этой профилактической стратегии для предотвращения, например, CDI. Конкретно анализы, представленные в данном документе, показывают, что в концентрациях, которые могут быть легко достижимыми в тонком кишечнике, Р4А может разрушать цефалоспорины и другие антибиотики и имеет улучшенный субстратный профиль по отношению к Р1А.
ОПРЕДЕЛЕНИЯ
В связи с изобретением, описанным в данном документе, применяются следующие определения. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, что обычно понятно специалисту в данной области техники, к которой относится настоящее изобретение.
В данном контексте единственное число может означать один или более чем один.
Дополнительно термин "около", при использовании в связи упоминаемым числовым значением, означает упоминаемое числовое значение плюс или минус до 10% от данного упоминаемого числового значения. Например, выражение "около 50" охватывает диапазон от 45 до 55.
"Эффективное количество" при использовании в связи с медицинскими применениями представляет собой количество, которое эффективно для обеспечения измеряемого лечения, предотвращения или снижения скорости патогенеза, представляющего интерес заболевания.
Как изложено в данном документе, все процентные содержания в композиции приведены по массе от общей массы композиции, если не указано иное. В данном контексте слово "включать" и его варианты не подразумевают ограничение объема изобретения, поэтому указание объектов в перечне не исключает другие подобные объекты, которые могут быть полезны в композициях и способах этой технологии. Сходным образом термины "может" и "возможно" и их варианты не подразумевают ограничение объема изобретения, поэтому указание того, что вариант изобретения может или возможно содержит определенные элементы или признаки не исключает другие варианты реализации настоящей технологии, которая не содержит таких элементов или признаков.
Несмотря на то что неисчерпывающий термин "заключающий", как синоним таких терминов как включающий, содержащий или имеющий, используется в данном документе для описания и заявления изобретения, настоящего изобретения или его вариантов, альтернативно может описываться с использованием альтернативных терминов, таких как "состоящий из" или "по сути состоящий из".
В данном контексте слова "предпочтительный" и "предпочтительно" относятся к вариантам реализации технологии, которая обеспечивают определенные преимущества при определенных условиях. Тем не менее другие варианты также могут быть предпочтительными при тех же самых или других обстоятельствах. Кроме того, упоминание одного или более предпочтительных вариантов реализации изобретения не означает, что другие варианты реализации нельзя использовать, и не предназначено для исключения других вариантов реализации из объема технологии.
Количество композиций, описанных в данном документе, необходимых для достижения терапевтического эффекта, может определяться эмпирически в соответствии с традиционными процедурами для конкретной цели. В целом, для введения терапевтических агентов (например, изобретательских β-лактамаз и/или фармацевтических композиций (и/или дополнительных агентов) для терапевтических целей, терапевтические агенты дают в фармакологически эффективной дозе. "Фармакологически эффективное количество", "фармакологически эффективная доза", "терапевтически эффективное количество" или "эффективное количество" относится к количеству, достаточному для получения требуемого физиологического эффекта, или количеству, достаточному для достижения требуемого результата, особенно для лечения расстройства или заболевания. Эффективное количество, в данном контексте может включать количество достаточное, например, для задержки развития симптома расстройства или заболевания, изменения протекания симптома расстройства или заболевания (например, замедления прогрессирования симптома заболевания), снижения или устранения одного или более симптомов или проявлений расстройства или заболевания и обратного развития симптома расстройства или заболевания. Например, введение терапевтических агентов пациенту, страдающему от расстройства ЖКТ (например, CDI) обеспечивает терапевтическую пользу не только когда искореняется или облегчается первопричинное состояние, но когда пациент также сообщает о тяжести или длительности симптомов, связанных с заболеванием. Терапевтическая польза также включает остановку или замедление прогрессирования превопричинного заболевания или расстройства независимо от того достигнуто ли улучшение.
Эффективные количества, токсичность и терапевтическая эффективность могут быть определены с помощью стандартных фармацевтических процедур на культурах клеток или экспериментальных животных, например, для определения ЛД50 (дозы, летальной для около 50% популяции) и ЭФ50 (дозы, терапевтически эффективной для около 50% популяции). Дозировка может изменяться в зависимости от применяемой дозированной формы и используемого пути введения. Соотношение доз между токсическими и терапевтическими эффектами представляет собой терапевтический индекс и может выражаться как соотношение ЛД50/ЭФ50. В некоторых вариантах реализации изобретения композиции и способы, которые проявляют высокие терапевтические индексы, являются предпочтительными. Терапевтически эффективная доза сначала может оцениваться по анализам in vitro, включая, например, анализы на культурах клеток. Доза также может быть определена на животных моделях для достижения диапазона циркулирующих в плазме концентраций, который включает IC50, определенную на культуре клеток, или на соответствующей животной модели. Уровни описанных композиций в плазме могут измеряться, например, методом высокоэффективной жидкостной хроматографии. Влияния любой конкретной дозировки может отслеживаться подходящим биологическим анализом. Дозировка может определяться врачом или, при необходимости, корректироваться для соответствия наблюдаемым эффектам лечения.
В некоторых вариантах реализации изобретения эффект будет обусловлен определяемым количественно изменением на по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 30%, по меньшей мере около 50%, по меньшей мере около 70% или по меньшей мере около 90%. В некоторых вариантах реализации изобретения эффект будет обусловлен определяемым количественно изменением на около 10%, около 20%, около 30%, около 50%, около 70% или около 90% или более. В некоторых вариантах реализации изобретения эффект будет обусловлен определяемым количественно изменением двукратным или трехкратным, или четырехкратным, или пятикратным или десятикратным. Терапевтическая польза также включает остановку или замедление прогрессирования превопричинного заболевания или расстройства, или снижения токсичности независимо от того достигнуто ли улучшение.
ЭКВИВАЛЕНТЫ
Поскольку изобретение описано в связи с его конкретными вариантами реализации, следует понимать, что по отношению к нему правомочны дополнительные модификации и эта заявка предполагает отхват любых вариаций, применений или адаптации изобретения, в целом следуя принципам изобретения и включая такие отступления от настоящего описания, что исходят из известного или привычно практикуемого в данной области техники, к которой относится изобретение, и что могут применяться к существенным признакам, изложенным в данном документе, и попадать в объем прилагаемой формулы изобретения.
С применением всего лишь рутинных экспериментов специалисты в данной области техники поймут или будут в состоянии определить множество эквивалентов конкретных вариантов реализации изобретения, конкретно описанных в данном документе. Такие эквиваленты предназначены для того, чтобы находиться в пределах объема следующей формулы изобретения.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Все патенты и публикации, цитируемые в данном документе, таким образом в полном объеме включены в данный документ посредством ссылки.
Публикации, рассмотренные в настоящем документе, представлены лишь в отношении их описания до даты подачи настоящей заявки. Информацию в данном документе не следует толковать как признание того, что настоящее изобретение не имеет права датировать такую публикацию более ранним числом из-за действия более раннего изобретения.
В данном контексте все заголовки приведены просто для организации текста и не предназначены для ограничения описания каким-либо способом. Содержание любого конкретного раздела может в равной степени применяться ко всем разделам.
Реферат
Изобретение относится к биотехнологии и представляет собой бета-лактамазу, содержащую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности последовательности с SEQ ID NO: 1 и одну или более из следующих мутаций согласно классификации Ambler в положениях 33, 135, 156, 232, 237, 237, 240, 243, 244, 266 и 276 с оговоркой, что остаток гидрофильной аминокислоты, кроме аспарагиновой кислоты (D) в положении, соответствующем положению 276, отсутствует в контексте одиночного мутанта. Изобретение позволяет расширить ассортимент бета-лактамаз. 24 з.п. ф-лы, 8 ил., 14 табл., 5 пр.
Формула
Документы, цитированные в отчёте о поиске
Модифицированная бета-лактамаза и способ ее получения

Комментарии