Пролекарства соединений 2,4-пиримидиндиамина и их применения - RU2416616C2
Код документа: RU2416616C2
Чертежи















Описание
1. ПЕРЕКРЕСТНАЯ ССЫЛКА
По настоящей заявке испрашивается приоритет согласно § 119(e) 35 U.S.C. на основании предварительной заявки на выдачу патента с регистрационным No. 60/645424, поданной 19 января 2005, и предварительной заявки на выдачу патента с регистрационным No. 60/654620, поданной 18 января 2005. Описания обеих указанных предварительных заявок на выдачу патента включены в данное описание в виде ссылки в полном объеме.
2. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее описание относится к пролекарствам биологически активных соединений 2,4-пиримидиндиамина, к фармацевтическим композициям, содержащим пролекарства, к промежуточным соединениям и способам синтеза для получения пролекарств и к способам применения пролекарств и композиций в различных ситуациях, например для лечения или профилактики различных заболеваний.
3. УРОВЕНЬ ТЕХНИКИ
Поперечные сшивки Fc-рецепторов, таких как высокоаффинный рецептор IgE (FcεRI) и/или высокоаффинный рецептор IgG (FcγRI), активируют каскад передачи сигнала в тучных клетках, базофилах и других иммунных клетках, что приводит к высвобождению химических медиаторов, ответственных за многочисленные неблагоприятные явления. Например, такие поперечные сшивки приводят к высвобождению предварительно образованных медиаторов анафилактических реакций гиперчувствительности типа I (немедленного типа), таких как гистамин, из мест хранения в гранулах в результате дегрануляции. Сшивки также приводят к синтезу и высвобождению других медиаторов, включая лейкотриены, простагландины и активирующие тромбоциты факторы (PAF), которые играют важные роли в воспалительных реакциях. Дополнительные медиаторы, которые синтезируются и высвобождаются при поперечном сшивании Fc-рецепторов, включают цитокины и оксид азота.
Каскад(ды) передачи сигнала, активируемый поперечным сшиванием Fc-рецепторов, таких как FcεRI и/или FcγRI, содержит ряд клеточных белков. Одними из наиболее важных распространителей внутриклеточного сигнала являются тирозинкиназы. При этом важной тирозинкиназой, вовлеченной в пути сигнальной трансдукции, связанной с поперечным сшиванием рецепторов FcεRI и/или FcγRI, а также в другие каскады сигнальной трансдукции, является киназа Syk (см. обзор Valent et al., 2002, Intl. J. Hematol. 75(4): 257-362).
Медиаторы, высвобождаемые в результате поперечного сшивания рецепторов FcεRI и FcγRI, ответственны или играют важные роли в проявлении многочисленных неблагоприятных событий. Недавно были открыты различные классы соединений 2,4-пиримидиндиаминов, которые ингибируют каскады передачи сигналов FcεRI и/или FcγRI и которые имеют огромное количество терапевтических применений. См., например, заявку на выдачу патента США с регистрационным No. 10/355543, поданную 31 января 2003 (US 2004/0029902A1), международную заявку на выдачу патента с регистрационным No. PCT/US03/03022, поданную 31 января 2003 (WO 03/063794), заявку на выдачу патента США с регистрационным No. 10/631029, поданную 29 июля 2003, международную заявку на выдачу патента с регистрационным No. PCT/US03/24087 (WO 2004/014382), заявку на выдачу патента США с регистрационным No. 10/903263, поданную 30 июля 2004 (US2005/0234049), и международную заявку на выдачу патента с регистрационным No. PCT/US2004/24716. Хотя многие из указанных соединений имеют хорошую биодоступность, в некоторых случаях может требоваться подгонка их растворимости или других свойств так, чтобы оптимизировать их биодоступность при конкретных путях введения.
4. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к пролекарствам соединений 2,4-пиримидиндиаминов, которые обладают огромным количеством биологических активностей, и к терапевтическим применениям, композициям, содержащим пролекарства, способам и промежуточным соединениям, применимым для синтеза пролекарств, и к способам применения пролекарств в различных ситуациях in vitro и in vivo, включая лечение и/или профилактику заболеваний, опосредованных, по меньшей мере частично, активацией каскадов передачи сигнала Fc-рецепторов.
Пролекарства обычно содержат биологически активное соединение 2,4-пиримидиндиамина, которое замещено у атома азота одной или несколькими первичными или вторичными аминогруппами прогруппы RP, которая метаболизируется или иным образом превращается в условиях применения, давая активный 2,4-пиримидиндиамин. В некоторых вариантах прогруппа RP представляет собой содержащую фосфор прогруппу. В некоторых вариантах прогруппа включает группу или остаток, который метаболизируется в условиях применения, давая нестабильное α-гидроксиметильное, α-аминометильное или α-тиометильное промежуточное соединение, которое затем метаболизируется in vivo, давая активное 2,4-пиримидиндиаминное лекарственное средство. В некоторых вариантах пролекарство содержит α-гидроксиалкильный, α-аминоалкильный или α-тиоалкильный остаток, например α-гидроксиметильный, α-аминометильный, α-тиометильный остаток, который метаболизируется в условиях применения, давая активное 2,4-пиримидиндиаминное лекарственное средство. Например, в некоторых вариантах прогруппа RP имеет формулу -CRdRd-AR3, где каждый Rd независимо от других выбран из водорода, цианогруппы, необязательно замещенного (C1-C20)алкила, (C1-C20)перфторалкила, необязательно замещенного (C7-C30)арилалкила и необязательно замещенного 6-30-членного гетероарилалкила, где каждый необязательный заместитель независимо от других выбран из водорода, алкила, арила, арилалкила, гетероарила и гетероалкила или, альтернативно, два Rd, взятые вместе с атомом углерода, с которым они связаны, образуют циклоалкил, содержащий от 3 до 8 атомов углерода; A выбран из O, S и NR50, где R50 выбран из водорода, алкила, арила, арилалкила, гетероарила, гетероарилалкила и циклогетероалкила, или, альтернативно, объединен с R3 и вместе с атомом азота, с которым они связаны, образуют трех-семичленный цикл; и R3 означает группу, которая может метаболизироваться in vivo, давая группу формулы -CRdRd-AH, где Rd и A имеют значения, определенные ранее.
Природа R3 не является критической при условии, что он может метаболизироваться в требуемых условиях применения, например, в кислых условиях, встречающихся в желудке, и/или ферментами, встречающимися in vivo, давая группу формулы -CRdRd-AH, где A и Rd имеют значения, определенные ранее. Таким образом, специалистам в данной области будет понятно, что R3 фактически может содержать любую известную или позднее открытую защитную группу гидроксила, амина или тиола. Не ограничивающие примеры подходящих защитных групп можно найти, например, в Protective Groups in Organic Synthesis, Greene and Wuts, 2nd Ed., John Wiley and Sons, New York, 1991 (особенно страницы 10-142 (спирты), 277-308 (тиолы) и 309-405 (амины), описание которых включено в данную публикацию в виде ссылки).
В конкретном варианте R3 включает в себя вместе с A эфирную, тиоэфирную связь, связь силилового эфира, силилового тиоэфира, сложноэфирную, сложную тиоэфирную, амидную, карбонатную, тиокарбонатную, карбаматную, тиокарбаматную или мочевинную связь, -OCH2SO3R, где R означает водород, алкил, арил, арилалкил или соль металла (например, натрия, лития, калия); -GCH2+N(R51)3M-, где G отсутствует, означает -OPO3-, OSO3- или -CO2-, R51 означает водород, алкил, арил, арилалкил, циклогетероалкил или циклогетероалкилалкил, и M- означает противоион, обычно ион галогенида или тому подобный (ацетат, сульфат, фосфат и т.д.). Конкретные иллюстративные варианты включают без ограничения прогруппы RP, в которых R3 выбран из Rf, -C(O)Rf, -C(O)ORf, -C(O)NRfRf и -SiRfRfRf, где каждый Rf независимо от других выбран из водорода, необязательно замещенного низшего алкила, необязательно замещенного низшего гетероалкила, необязательно замещенного низшего циклоалкила, необязательно замещенного низшего гетероциклоалкила, необязательно замещенного (C6-C10)арила, необязательно замещенного 5-10-членного гетероарила, необязательно замещенного (C7-C18)арилалкила и необязательно замещенного 6-18-членного гетероарилалкила. В конкретном варианте каждый Rf означает одну и ту же группу.
Природа прогруппы(прогрупп) RP может быть выбрана так, чтобы подобрать растворимость в воде и другие свойства лежащего в основе активного соединения 2,4-пиримидиндиамина, чтобы оптимизировать конкретный способ введения. Прогруппа также может быть выбрана так, чтобы обеспечить удаление в конкретных органах и/или тканях в организме, таких, например, как пищеварительный тракт, в крови и/или сыворотке или посредством ферментов, имеющихся в конкретных органах, таких как печень.
В некоторых вариантах прогруппы RP, которые представляют собой содержащие фосфор прогруппы, включают фосфатные остатки, которые могут быть отщеплены in vitro ферментами, такими как эстеразы, липазы и/или фосфатазы. Такие ферменты распространены в организме и находятся, например, в желудке и пищеварительном тракте, крови и/или сыворотке и практически во всех тканях и органах. Такие содержащие фосфат прогруппы RP как правило будут повышать растворимость в воде лежащего в основе активного соединения 2,4-пиримидиндиамина, делая такие содержащие фосфат прогруппы идеально подходящими для способов введения, при которых требуется растворимость в воде, таких, например, как пероральный, буккальный, внутривенный, внутримышечный и глазной способы введения.
В некоторых вариантах каждая содержащая фосфат прогруппа RP в пролекарстве имеет формулу -(CRdRd)y-O-P(O)(OH)(OH) или представляет собой соль, где Rd имеет значение, определенное ранее, и y является целым числом от 1 до 3, обычно 1 или 2. В одном конкретном варианте каждый Rd независимо от других выбран из водорода, замещенного или незамещенного низшего алкила, замещенного или незамещенного фенила, замещенного или незамещенного метила и замещенного или незамещенного бензила. В другом конкретном варианте каждый Rd независимо от других выбран из водорода и незамещенного низшего алкила. Конкретные примеры содержащих фосфат прогрупп RP включают -CH2-O-P(O)(OH)(OH) и -CH2CH2-O-P(O)(OH)(OH) и/или соответствующие соли.
Не имея намерения быть связанными с какой-либо теорией процесса, полагают, что в том случае, когда y равен 1 в примерах содержащих фосфат прогрупп RP, содержащие фосфат прогруппы превращаются in vivo такими ферментами, как фосфатазы, липазы и/или эстеразы, в соответствующие гидроксиметиламины, которые затем метаболизируются in vivo посредством отщепления формальдегида с образованием активного 2,4-пиримидиндиаминного лекарственного соединения. Побочные продукты метаболизма фосфата и формальдегида являются безвредными.
Когда y равен 2 в примерах содержащих фосфат прогрупп, полагают, что пролекарства метаболизируются до активного 2,4-пиримидиндиаминного лекарственного соединения in vivo посредством отщепления енолфосфата, который затем метаболизируется в ацетальдегид и фосфат. Побочные продукты метаболизма фосфата и ацетальдегида являются безопасными.
Специалистам в данной области будет понятно, что некоторые типы предшественников могут быть превращены in vivo в фосфатные группы. Такие предшественники включают в качестве примера и без ограничения сложные фосфатные эфиры, фосфиты и сложные фосфитные эфиры. Например, фосфиты могут быть окислены in vivo до фосфатов. Сложные фосфатные эфиры могут быть гидролизованы in vivo до фосфатов. Сложные фосфитные эфиры могут быть окислены in vivo до фосфатных эфиров, которые в свою очередь могут быть гидролизованы in vivo до фосфатов. Вследствие способности указанных групп-предшественников фосфатов превращаться в фосфаты in vivo пролекарства также могут включать прогруппы, которые содержат такие предшественники фосфатов. В некоторых вариантах группы-предшественники фосфатов могут быть непосредственно метаболизированы до активного 2,4-пиримидиндиаминного лекарственного средства без превращения сначала в фосфатное лекарственное средство. В других вариантах пролекарства, содержащие прогруппы, которые содержат такие предшественники фосфатов, сначала метаболизируются в соответствующее фосфатное пролекарство, которое затем метаболизируется в активное 2,4-пиримидиндиаминное лекарственное средство через гидроксиметиламин, как обсуждается выше.
В некоторых вариантах такими группами-предшественниками фосфатов являются сложные фосфатные эфиры. Сложные фосфатные эфиры могут быть ациклическими или циклическими и могут представлять собой сложные фосфатные триэфиры или сложные фосфатные диэфиры. Такие сложные эфиры обычно менее растворимы в воде, чем соответствующие пролекарства в виде фосфатной кислоты и соответствующие активные 2,4-пиримидиндиаминные соединения, и поэтому обычно подходят для способов доставки пролекарств активных 2,4-пиримидиндиаминных соединений, при которых требуется низкая растворимость в воде, включая в качестве примера и без ограничения введение посредством ингаляции. Растворимость пролекарства может быть специально приспособлена для конкретных способов введения посредством подбора количества и природы этерифицирующих групп в сложных фосфатных эфирах.
Механизм, посредством которого группа сложного фосфатного эфира метаболизируется в соответствующую фосфатную группу, можно контролировать соответствующим подбором этерифицирующих остатков. Например, хорошо известно, что некоторые сложные эфиры являются кислотолабильными (или щелочелабильными), приводя к образованию соответствующего фосфата в кислых условиях, существующих в желудке и пищеварительном тракте. В тех случаях, когда требуется, чтобы пролекарство в виде сложного фосфатного эфира метаболизировалось до соответствующего фосфатного пролекарства в пищеварительном тракте (например, когда пролекарства вводят перорально), могут быть выбраны прогруппы сложного фосфатного эфира, которые являются кислотолабильными. Другие типы сложных фосфатных эфиров являются стабильными при действии кислоты и основания и превращаются в соответствующие фосфаты посредством ферментов, имеющихся в некоторых тканях и органах организма (см., например, различные циклические сложные фосфатные эфиры, описанные в Erion et al, 2004, J. Am. Chem. Soc. 126: 5154-5163, включенной в данное описание в виде ссылки). В тех случаях, когда требуется превращение пролекарства в виде сложного фосфатного эфира в соответствующее фосфатное пролекарство в требуемой ткани или месте в организме, являющемся мишенью, могут быть выбраны сложные фосфатные эфиры, обладающие требуемыми метаболическими свойствами.
В некоторых вариантах каждая прогруппа RP в пролекарстве, содержащая сложный фосфатный эфир, представляет собой ациклический сложный фосфатный эфир формулы -(CRdRd)y-O-P(O)(OH)(ORe) или -(CRdRd)y-O-P(O)(ORe)(ORe) или его соль, где каждый Re независимо от других выбран из замещенного или незамещенного низшего алкила, замещенного или незамещенного (C6-C14)арила (например, фенила, нафтила, 4-низшего алкоксифенила, 4-метоксифенила), замещенного или незамещенного (C7-C20)арилалкила (например, бензила, 1-фенилэтан-1-ила, 2-фенилэтан-1-ила), -(CRdRd)y-ORf, -(CRdRd)y-O-C(O)Rf, -(CRdRd)y-O-C(O)ORf, -(CRdRd)y-S-C(O)Rf, -(CRdRd)y-S-C(O)ORf, -(CRdRd)y-NH-C(O)Rf, -(CRdRd)y-NH-C(O)ORf и -Si(Rd)3, где Rd, Rf и y имеют значения, определенные выше. В конкретном варианте каждый Rd выбран из водорода и незамещенного низшего алкила и/или каждый Re представляет собой незамещенный низший алканил или бензил. Конкретные примеры прогрупп в виде сложного фосфатного эфира включают без ограничения -CH2-O-P(O)(OH)(ORe), -CH2CH2-O-P(O)(OH)(ORe), -CH2-O-P(O)(ORe)(ORe) и -CH2CH2-O-P(O)(ORe)(ORe), где Re выбран из низшего алканила, изопропила и трет-бутила.
В других вариантах каждая прогруппа RP, содержащая сложный фосфатный эфир, представляет собой циклический сложный фосфатный эфир формулы

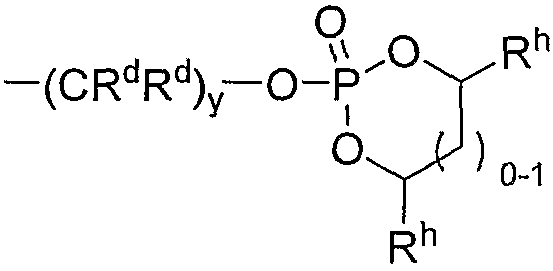
Механизм, посредством которого пролекарства, представляющие собой циклические сложные фосфатные эфиры, включающие такие прогруппы циклического сложного фосфатного эфира, метаболизируются in vivo в активное лекарственное соединение, отчасти зависит от природы заместителя Rh. Например, прогруппы циклического сложного фосфатного эфира, в которых каждый Rh независимо от других выбран из водорода и низшего алкила, расщепляются in vivo эстеразами. Таким образом, в некоторых вариантах прогруппы циклического сложного фосфатного эфира выбирают так, чтобы они могли отщепляться in vivo эстеразами. Конкретные примеры таких прогрупп сложного фосфатного эфира включают без ограничения прогруппы, выбранные из


Альтернативно, пролекарства, представляющие собой сложные фосфатные эфиры, имеющие прогруппы, в которых заместители Rh представляют собой замещенные или незамещенные арильные, арилалкильные и гетероарильные группы, обычно не отщепляются эстеразами, а вместо этого метаболизируются в активное пролекарство такими ферментами, как цитохром P450, который находится в печени. Например, ряд нуклеотидных пролекарств, представляющих собой циклические сложные фосфатные эфиры, которые подвергаются реакции окислительного расщепления, катализируемой ферментом цитохромом P450 (CYP), преимущественно экспрессируемым в печени, описан в Erion et al, 2004, J. Am. Chem. Soc. 126: 5154-5163. В некоторых вариантах прогруппы циклического сложного фосфатного эфира выбирают так, чтобы они могли отщепляться ферментами CYP, экспрессируемыми в печени. Конкретные иллюстративные варианты таких прогрупп RP, содержащих циклические сложные фосфатные эфиры, включают без ограничения прогруппы, имеющие формулу

Как будет понятно специалистам в данной области, фосфиты и сложные фосфитные эфиры могут подвергаться окислению in vivo, давая соответствующие аналоги в виде фосфатов и сложных фосфатных эфиров. Такие реакции могут быть осуществлены in vivo, например, с помощью ферментов оксидаз, ферментов оксоредуктаз и других окислительных ферментов. Таким образом, содержащие фосфор прогруппы RP также могут включать аналоги любых описанных выше прогрупп в виде фосфата и сложного фосфатного эфира, представляющие собой фосфиты и сложные фосфитные эфиры. В некоторых вариантах содержащие фосфор прогруппы RP включают без ограничения группы формулы -(CRdRd)y-O-P(OH)(OH), -(CRdRd)y-O-P(OH)(ORe) и -(CRdRd)y-O-P(ORe)(Re) или их соли, где Rd, Re и y имеют значения, определенные ранее. Конкретные иллюстративные варианты включают группы, в которых каждый Rd независимо от других выбран из водорода и незамещенного низшего алкила, и/или каждый Re независимо от других выбран из незамещенного низшего алканила и бензила. Конкретные примеры прогрупп в виде ацикилических фосфитов и сложных фосфитных эфиров включают без ограничения -CH2-O-P(OH)(OH), -CH2CH2-O-P(OH)(OH), -CH2-O-P(OH)(ORe) и -CH2CH2-O-P(ORe)(ORe), где каждый Re выбран из низшего алканил, изопропила и трет-бутила. Конкретные примеры пролекарств в виде циклических сложных фосфитных эфиров включают фосфитные аналоги описанных выше прогрупп в виде циклических сложных фосфатных эфиров. Концептуально, пролекарственные соединения, содержащие такие прогруппы фосфита и/или сложного фосфитного эфира, можно считать пролекарствами соответствующих пролекарств в виде фосфата и сложного фосфатного эфира.
Как указано выше, полагают, что некоторые содержащие фосфат пролекарства метаболизируются in vivo через соответствующие гидроксиметиламины. Хотя указанные гидроксиметиламины метаболизируются in vivo до соответствующих активных 2,4-пиримидиндиаминнных соединений, они являются стабильными при pH 7 и могут быть получены и введены в виде содержащих гидроксиалкил пролекарств. В некоторых вариантах каждая содержащая гидроксиалкил прогруппа RP таких пролекарств имеет формулу -CRdRd-OH, где Rd имеет значение, определенное ранее. Конкретным примером содержащей гидроксиалкил прогруппы RP является -CH2OH.
Практически любое известное соединение 2,4-пиримидиндиамина, которое обладает биологической и, следовательно, терапевтической активностью, может быть защищено по имеющемуся первичному или вторичному амину одной или несколькими прогруппами RP, которые описаны в данной публикации. Подходящие активные соединения 2,4-пиримидиндиамина описаны, например, в заявке на выдачу патента США с регистрационным No. 10/355543, поданной 31 января 2003 (US2004/0029902A1), международной заявке на выдачу патента с регистрационным No. PCT/US03/03022, поданной 31 января 2003 (WO 03/063794), заявке на выдачу патента США с регистрационным No. 10/631029, поданной 29 июля 2003, международной заявке на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявке на выдачу патента США с регистрационным No. 10/903263, поданной 30 июля 2004 (US2005/0234049), и международной заявке на выдачу патента с регистрационным No. PCT/US2004/24716, описания которых включены в данное описание в виде ссылки. В таких 2,4-пиримидиндиаминных соединениях прогруппа(пы) RP может быть связана с любым имеющимся первичным или вторичным амином, включая, например, атом азота N2 остатка 2,4-пиримидиндиамина, атом азота N4 остатка 2,4-пиримидиндиамина и/или первичный или вторичный атом азота, включенный в заместитель 2,4-пиримидиндиаминного соединения. Использование содержащих фосфат прогрупп RP особенно полезно в случае 2,4-пиримидиндиаминных соединений, которые имеют плохую растворимость в воде в физиологических условиях (например, растворимости менее примерно 10 мкг/мл). Не имея намерения быть связанными с какой-либо теорией процесса, полагают, что содержащие фосфат прогруппы способствуют растворимости лежащего в основе активного 2,4-пиримидиндиаминного соединения, что, в свою очередь, увеличивает его биодоступность при пероральном введении. Полагают, что фосфатные прогруппы RP метаболизируются ферментами фосфатазы, имеющимися в пищеварительном тракте, что способствует всасыванию лежащего в основе активного лекарственного средства.
Обнаружено, что растворимость в воде и биодоступность при пероральном введении конкретного биологически активного соединения 2,4-пиримидиндиамина, показанного ниже (соединение 1), значительно увеличивается в том случае, когда его обрабатывают так, чтобы он содержал прогруппу RP формулы -CH2-O-P(O)(OH)2 у атома азота в цикле, отмеченного звездочкой (соединение 4):

Важно, что в то время как растворимость в воде активного лекарственного средства (соединения 1) находится в диапазоне примерно 1-2 мкг/мл в водном буфере в физиологических условиях, растворимость соответствующего фосфатного пролекарства (соединения 4) составляет более 5 мг/мл в таких же условиях или примерно в 2000 раз выше. Указанная повышенная растворимость в воде дает возможность лучше растворяться в кишечнике, тем самым облегчая пероральное введение. Предполагается, что другие активные 2,4-пиримидиндиаминные соединения, имеющие сходные растворимости в воде, проявляют сходные увеличения растворимости в воде и доступности при пероральном введении в том случае, когда их готовят в виде фосфатных пролекарств.
Как указано выше, пролекарства в виде сложных фосфатных эфиров обычно менее растворимы в воде, чем соответствующие фосфатные пролекарства, и поэтому обычно полезны в случае применений, когда требуется низкая растворимость в воде, например таких, как введение посредством ингаляции. Указанное справедливо и для относительно растворимых в воде пролекарств в виде сложных фосфитных эфиров и фосфитов.
В некоторых вариантах пролекарства, описанные в данной публикации, представляют собой соединения 2,4-пиримидиндиамина, которые замещены у атома азота N4 остатка 2,4-пиримидиндиамина замещенным или незамещенным содержащим азот бициклическим кольцом, которое содержит по меньшей мере одну прогруппу RP, которая описана в данной публикации, у одного или нескольких атомов: атома(ов) азота бициклического кольца, атома азота N2 остатка 2,4-пиримидиндиамина и/или атома азота N4 остатка 2,4-пиримидиндиамина. В конкретном приведенном в качестве примера иллюстративном варианте пролекарство представляет собой соединение согласно структурной формуле (I):

включая его соли, сольваты, гидраты и N-оксиды, где:
Y выбран из CH2, NR24, O, S, S(O) и S(O)2;
Z1 и Z2, каждый независимо друг от друга, выбраны из CH и N;
R2 означает необязательно замещенную низшую алкильную, низшую циклоалкильную, низшую гетероалкильную, низшую циклогетероалкильную, арильную, фенильную или гетероарильную группу;
R5 означает электроотрицательную группу, например, такую как галоген, фтор, цианогруппа, нитрогруппа, тригалогенметильная или трифторметильная группа;
R17 выбран из водорода, галогена, фтора, низшего алкила и метила, или, альтернативно, R17, взятый вместе с R18, может образовывать оксогруппу (=O), или вместе с атомом углерода, с которым они связаны, образовывать спироцикл, содержащий от 3 до 7 атомов углерода;
R18 выбран из водорода, галогена, фтора, низшего алкила и метила, или, альтернативно, R18, взятый вместе с R17, может образовывать оксогруппу (=O), или вместе с атомом углерода, с которым они связаны, образовывать спироцикл, содержащий от 3 до 7 атомов углерода;
R19 выбран из водорода, низшего алкила и метила, или, альтернативно, R19, взятый вместе с R20, может образовывать оксогруппу (=O), или вместе с атомом углерода, с которым они связаны, образовывать спироцикл, содержащий от 3 до 7 атомов углерода;
R20 выбран из водорода, низшего алкила и метила, или, альтернативно, R20, взятый вместе с R19, может образовывать оксогруппу (=O), или вместе с атомом углерода, с которым они связаны, образовывать спироцикл, содержащий от 3 до 7 атомов углерода;
R21, R22 и R23 каждый независимо друг от друга выбран из водорода и прогруппы RP, которая определена в данном описании; и
R24 выбран из водорода, низшего алкила и прогруппы RP, которая определена в данном описании, при условии, что по меньшей мере один R21, R22, R23 и R24 должен представлять собой прогруппу RP. В некоторых вариантах каждый из R21, R22 и R23 означает одну из конкретных прогрупп, приведенных в качестве примеров выше, и R24 означает водород. В некоторых вариантах R21 означает одну из конкретных прогрупп, приведенных в качестве примера выше, и R22, R23 и R24 каждый означают водород. В некоторых вариантах R21, R22 и R23 каждый означает одну из конкретных прогрупп, приведенных в качестве примера выше, и R24 означает низший алкил.
В другом аспекте настоящее изобретение относится к композициям, содержащим одно или несколько пролекарств, указанных в данном описании, и соответствующий носитель, эксципиент или разбавитель. Точная природа носителя, эксципиента или разбавителя будет зависеть от требуемого применения композиции и может быть в диапазоне от применимой или приемлемой для ветеринарных применений до применимой или приемлемой для применения на человеке. Композиция необязательно может содержать одно или несколько дополнительных соединений.
В еще одном аспекте настоящее изобретение относится к промежуточным соединениям, применимым для синтеза пролекарств, описанных в данной публикации. В случае пролекарств, содержащих фосфат или фосфит, промежуточные соединения обычно содержат пролекарства, в которых атомы кислорода содержащих фосфат и/или фосфит прогрупп замаскированы защитными группами, которые можно избирательно удалять в конкретных условиях. В некоторых вариантах защитные группы могут быть избирательно удалены в слабо кислых условиях. В некоторых вариантах промежуточные соединения представляют собой сложные фосфатные или фосфитные эфиры, которые сами по себе являются пролекарствами, которые могут быть метаболизированы в активные соединения 2,4-пиримидиндиамина. В одном иллюстративном варианте промежуточные соединения включают пролекарства, в которых каждая прогруппа RP независимо от других имеет формулу -(CRdRd)y-O-P(O)(ORi)(ORi), -(CRdRd)y-O-P(O)(ORi)(OH), -(CRdRd)y-O-P(ORi)(ORi) или -(CRdRd)y-O-P(ORi)(OH), где каждый Ri независимо от других выбран из низшего незамещенного алканила, замещенного или незамещенного фенила и замещенного или незамещенного бензила, и Rd и y имеют значения, определенные ранее. В конкретном варианте промежуточные соединения включают сложные фосфатные и/или фосфитные эфиры, в которых каждый Ri независимо от других выбран из низшего линейного алканила, низшего разветвленного алканила, изопропила, трет-бутила и низшего циклического алканила.
В некоторых вариантах промежуточные соединения содержат активный 2,4-пиримидиндиамин, который замещен у атома азота первичной или вторичной аминогруппы группой формулы -CRdRd-AH, где Rd и A имеют значения, определенные ранее.
В еще одном аспекте настоящее изобретение относится к способам синтеза промежуточных соединений и/или пролекарств, описанных в данной публикации. Содержащие фосфат пролекарства могут быть синтезированы в результате взаимодействия активного соединения 2,4-пиримидиндиамина с галогенидом сложного фосфатного эфира, например галогенидом сложного фосфатного эфира формулы X-(CRdRd)y-O-P(O)(ORj)(ORj) или X-(CRdRd)y-O-P(O)(ORj)(OH), где каждый Rj независимо от других означает избирательно удаляемую защитную группу; X означает галогенид, например, такой как хлорид; и Rd и y имеют значения, определенные ранее. В некоторых вариантах каждый Rj означает Re, определенный ранее. Удаление избирательно удаляемых защитных групп Rj дает фосфатное пролекарство. В некоторых вариантах каждый Rj имеет одно и то же значение и выбран из низшего линейного алкила, низшего разветвленного алкила и низшего циклоалкила. В некоторых вариантах каждый Rj означает изопропил или трет-бутил. В вариантах, в которых получают смеси промежуточных соединений, например смеси промежуточных соединений, которые содержат разные количества прогрупп или прогруппы в разных положениях молекулы 2,4-пиримидиндиамина, требуемое промежуточное соединение может быть выделено из смеси с использованием стандартных способов разделения и/или выделения (например, хроматографии на колонке). Альтернативно, требуемое пролекарство может быть выделено из смеси разных пролекарств с использованием стандартных способов разделения и/или выделения.
Пролекарства в виде ациклических сложных фосфатных эфиров могут быть получены аналогичным способом в результате взаимодействия активного 2,4-пиримидиндиамина с галогенидом сложного фосфатного эфира, например галогенидом сложного фосфатного эфира формулы X-(CRdRd)y-O-P(O)(OH)(ORe) или X-(CRdRd)y-O-P(O)(ORe)(ORe), где X, Rd, y и Re имеют значения, определенные ранее. В данном случае удаление этерифицирующих групп Re не является обязательным.
Пролекарства в виде ациклических сложных фосфитных и фосфатных эфиров могут быть получены аналогичным образом из соответствующих галогенидов сложных фосфитных эфиров, например галогенидов сложных фосфитных эфиров формулы X-(CRdRd)y-O-P(ORj)(ORj), X-(CRdRd)y-O-P(ORe)(OH), X-(CRdRd)y-O-P(ORe)(ORe), где X, Rd, y, Re и Rj имеют значения, определенные ранее.
Пролекарства в виде циклических сложных фосфатных эфиров и сложных фосфитных эфиров могут быть получены в результате взаимодействия активного соединения 2,4-пиримидиндиамина с соответствующим галогенидом циклического сложного фосфатного эфира или сложного фосфитного эфира, например галогенидом циклического сложного фосфатного эфира формулы
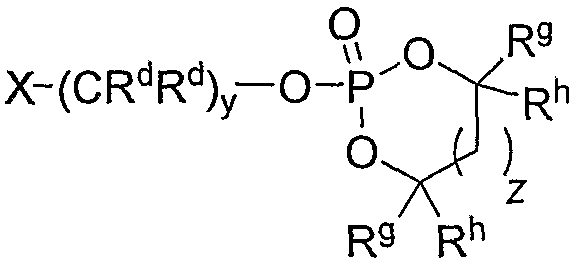
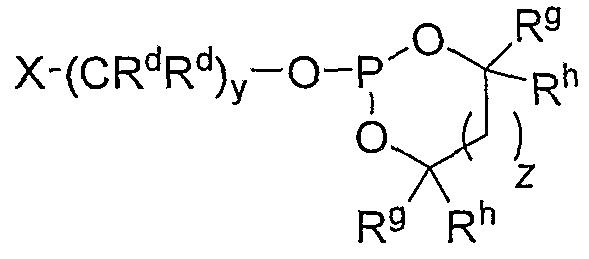
Варианты, в которых RP означает -CRdRd-AR3, могут быть получены из соответствующего 2,4-пиримидиндиаминного лекарственного средства обычными способами. Например, когда A означает O, промежуточные соединения могут быть синтезированы в результате взаимодействия активного соединения 2,4-пиримидиндиамина с альдегидом или кетоном формулы Rd-C(O)-Rd, где Rd имеет значение, определенное ранее, с получением соответствующего промежуточного гидроксиметиламина (где RP означает -CRdRd-OH). Затем промежуточный гидроксиметиламин может быть превращен в пролекарство с использованием стандартного способа. В соответствии с определением RP промежуточный гидроксиметиламин также является пролекарством согласно изобретению. Например, другие лекарственные вещества, содержащие вторичные амины, добавляли к формальдегиду, получая их соответствующие выделяемые аддукты гидроксиметиламина, Bansal et al., J. Pharmaceutical Sci. 1981, 70: (8), 850-854; Bansal et al., J. Pharmaceutical Sci. 1981, 70: (8), 855-856; Khan et al., J. Pharmaceutical and Biomedical Analysis 1989, 7 (6), 685-691. Альтернативно, гидроксиалкилсодержащие пролекарства могут быть получены в две стадии, сначала посредством взаимодействия активного 2,4-пиримидиндиамина с бис-функциональным электрофилом, таким как галогенид формулы X1-CRdRd-X2, где X1 означает первый галогенид, X2 означает второй галогенид, и Rd имеет значение, определенное ранее. В конкретном иллюстративном варианте галогенид имеет формулу I-CRdRd-Cl. Затем не прореагировавший галогенид подвергают гидроксилированию, получая содержащее гидроксиалкил пролекарство, с использованием стандартных способов.
Пролекарства, в которых A означает O, S или NR50, могут быть синтезированы из соответствующих сложных N-метилсодержащих фосфатных эфиров. Согласно данному варианту группы сложных фосфатных эфиров могут быть заменены группой формулы R3-AH, где R3 и A имеют значения, определенные ранее, получая пролекарство, которое более подробно обсуждается ниже.
Многие пролекарства, описанные в данной публикации, и в частности пролекарства согласно структурной формуле (I), метаболизируются, давая соединения 2,4-пиримидиндиамина, которые являются сильными ингибиторами дегрануляции иммунных клеток, таких как тучные клетки, базофилы, нейтрофилы и/или эозинофилы. Дополнительные соединения 2,4-пиримидиндиамина, которые проявляют сходные биологические активности, которые могут быть приготовлены в виде пролекарств, которые описаны в данной публикации, и могут быть использованы в различных способах, приведенных в данном описании, описаны в заявке на выдачу патента США с регистрационным No. 10/355543 поданной 31 января 2003 (US2004/0029902A1), международной заявке на выдачу патента с регистрационным No. PCT/US03/03022, поданной 31 января 2003 (WO 03/063794), заявке на выдачу патента США с регистрационным No. 10/631029, поданной 29 июля 2003, международной заявке на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявке на выдачу патента США с регистрационным No. 10/903263, поданной 30 июля 2004 (US2005/0234049), и международной заявке на выдачу патента с регистрационным No. PCT/US2004/24716, описания которых включены в данное описание в виде ссылки. Таким образом, в еще одном аспекте настоящее изобретение относится к способам регуляции, и в частности к способам ингибирования, дегрануляции таких клеток. Способ в общем заключается в осуществлении контакта клетки, которая подвергается дегрануляции, с определенным количеством подходящего пролекарства, описанного в данной публикации, или его приемлемой соли, гидрата, сольвата, N-оксида и/или композиции, эффективным в отношении регуляции или ингибирования дегрануляции клетки. Способ может быть осуществлен на практике в условиях in vitro при условии, что контактирование осуществляют в таких условиях, при которых прогруппа(пы) метаболизируется, давая активное соединение 2,4-пиримидиндиамина, или в условиях in vivo в качестве терапевтического способа лечения или профилактики заболеваний, характеризуемых, вызванных или связанных с дегрануляцией клеток.
Не имея намерения быть связанными с какой-либо теорией процесса, полагают, что биохимические данные подтверждают, что многие из указанных активных соединений 2,4-пиримидиндиамина проявляют ингибирующее действие на дегрануляцию, по меньшей мере частично, посредством блокирования или ингибирования каскада(дов) сигнальной трансдукции, инициируемых поперечным сшиванием высокоаффинных Fc-рецепторов для IgE («FcεRI») и/или IgG («FcγRI») (см., например, заявку на выдачу патента США с регистрационным No. 10/631029, поданную 29 июля 2003, международную заявку на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявку на выдачу патента США с регистрационным No. 10/903263, поданную 30 июля 2004 (US2005/0234049), и международную заявку на выдачу патента с регистрационным No. PCT/US2004/24716, описание которых включено в данное описание в виде ссылки. Действительно, указанные активные соединения 2,4-пиримидиндиамина являются сильными ингибиторами опосредованной как FcεRI, так и опосредованной FcγRI дегрануляции. Как следствие, указанные в данном описании пролекарства могут быть использованы для ингибирования таких каскадов передачи сигнала Fc-рецепторов в любом типе клеток, экспрессирующих такие рецепторы FcεRI и/или FcγRI, включая без ограничения макрофаги, тучные клетки, базофилы, нейтрофилы и/или эозинофилы.
Способы также обеспечивают регуляцию, и в частности ингибирование, следующих далее процессов, которые происходят вследствие активации такого каскада(дов) передачи сигнала Fc-рецептора. Такие следующие далее процессы включают без ограничения дегрануляцию, опосредованную FcεRI и/или опосредованную FcγRI, продукцию цитокинов и/или продукцию и/или высвобождение липидных медиаторов, таких как лейкотриены и простагландины. Способ обычно заключается в осуществлении контакта клетки, экспрессирующей Fc-рецептор, такой как один из типов клеток, обсуждаемых выше, с таким количеством пролекарства, описанного в данной публикации, или его приемлемой соли, гидрата, сольвата, N-оксида и/или композиции, которое эффективно в регуляции или ингибировании каскада передачи сигнала Fc-рецептора и/или следующего далее процесса, вызванного активацией данного каскада передачи сигнала. Способ может быть осуществлен на практике в условиях in vitro при условии, что контактирование осуществляют в условиях, при которых прогруппа(пы) метаболизируется, давая активное соединения 2,4-пиримидиндиамина, или в условиях in vivo в качестве терапевтического способа лечения или профилактики заболеваний, характеризуемых, вызванных или связанных с каскадом передачи сигнала Fc-рецептора, таких как заболевания, вызванные высвобождением специфичных для гранул химических медиаторов при дегрануляции, высвобождением и/или синтезом цитокинов и/или высвобождением и/или синтезом липидных медиаторов, таких как лейкотриены и простагландины.
В еще одном аспекте настоящее изобретение относится к способам лечения и/или профилактики заболеваний, характеризуемых, вызванных или связанных с высвобождением химических медиаторов вследствие активации каскадов передачи сигнала Fc-рецепторов, таких как каскады передачи сигнала FcεRI и/или FcγRI. Способы могут быть осуществлены на практике в области ветеринарии на животных или на человеке. Способы в общем заключаются во введении животному или человеку такого количества пролекарства, описанного в данной публикации, или его приемлемой соли, гидрата, сольвата, N-оксида и/или композиции, которое эффективно при лечении или профилактике заболевания. Как обсуждалось ранее, активация каскада передачи сигнала рецептора FcεRI или FcγRI в некоторых иммунных клетках приводит к высвобождению и/или синтезу многих химических веществ, которые являются фармакологическими медиаторами широкого множества заболеваний. Любое из таких заболеваний можно лечить или предотвращать согласно способам, предлагаемым в изобретении.
Например, в тучных клетках и базофильных клетках активация каскада передачи сигнала FcεRI или FcγRI приводит к немедленному (т.е. в течение 1-3 мин после активации рецептора) высвобождению предварительно образованных медиаторов атопических реакций и/или реакций гиперчувствительности типа I (например, гистамина, протеаз, таких как триптаза, и т.д.) посредством процесса дегрануляции. Такие атопические реакции или реакции гиперчувствительности типа I включают без ограничения анафилактические реакции на аллергены окружающей среды и другие аллергены (например, пыльцу, яды насекомых и/или животных, продукты питания, лекарственные средства, контрастные красители и т.д.), анафилактоидные реакции, сенную лихорадку, аллергический конъюнктивит, аллергический ринит, аллергическую астму, атопический дерматит, экзему, крапивницу, расстройства слизистой оболочки, тканевые расстройства и некоторые желудочно-кишечные расстройства.
После немедленного высвобождения предварительно образованных медиаторов посредством дегрануляции следует высвобождение и/или синтез множества других химических медиаторов, включая, наряду с прочими, фактор активации тромбоцитов (PAF), простагландины и лейкотриены (например, LTC4), и синтез de novo и высвобождение цитокинов, таких как TNFα, IL-4, IL-5, IL-6, IL-13 и т.д. Первый из указанных двух процессов происходит примерно через 3-30 мин после активации рецептора; последний - примерно через 30 мин - 7 час после активации рецептора. Считают, что указанные медиаторы «поздней стадии» частично ответственны за хронические симптомы перечисленных выше атопических реакций и реакций гиперчувствительности типа I и, кроме того, являются химическими медиаторами воспаления и воспалительных заболеваний (например, остеоартрита, воспалительного заболевания кишечника, язвенного колита, болезни Крона, идиопатического воспалительного заболевания кишечника, синдрома раздраженной кишки, спастического колита и т.д.), неудовлетворительного рубцевания (например, склеродерма, усиленный фиброз, келоиды, постхирургические рубцы, легочный фиброз, спазмы сосудов, мигрень, реперфузионное повреждение и состояние после инфаркта миокарда), и комплекса или синдрома сухости. Все указанные заболевания можно лечить или предотвращать согласно способам, описанным в данной публикации.
Дополнительные заболевания, которые можно лечить или предотвращать согласно способам, описанным в данной публикации, включают заболевания, связанные с патологией базофильных клеток и/или тучных клеток. Примеры таких заболеваний включают без ограничения заболевания кожи, такие как склеродерма, заболевания сердца, такие как состояние после инфаркта миокарда, легочные заболевания, такие как изменения дыхательных мышц или ремоделирование и хроническое обструктивное легочное заболевание (COPD), заболевания кишечника, такие как синдром воспаленного кишечника (спастический колит), острый миелоидный лейкоз (AML) и иммунная тромбоцитопеническая пурпура.
Многие активные соединения 2,4-пиримидиндиамина также являются сильными ингибиторами тирозинкиназы Syk. Примеры таких 2,4-пиримидиндиаминов описаны, например, в заявке на выдачу патента США с регистрационным No. 10/355543, поданной 31 января 2003 (US2004/0029902A1), международной заявке на выдачу патента с регистрационным No. PCT/US03/03022, поданной 31 января 2003 (WO 03/063794), заявке на выдачу патента США с регистрационным No. 10/631029, поданной 29 июля 2003, международной заявке на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявке на выдачу патента США с регистрационным No. 10/903263, поданной 30 июля 2004 (US2005/0234049), и международной заявке на выдачу патента с регистрационным No. PCT/US2004/24716, описания которых включены в данное описание в виде ссылки. Таким образом, в еще одном аспекте настоящее изобретение относится к способам регуляции, и в частности ингибирования активности киназы Syk. Способ в общем заключается в осуществлении контакта киназы Syk или клетки, содержащей киназу Syk, с таким количеством подходящего пролекарства или его приемлемой соли, гидрата, сольвата, N-оксида и/или композиции, которое эффективно для регуляции или ингибирования активности киназы Syk. В одном варианте киназа Syk является изолированной или рекомбинантной киназой Syk. В другом варианте киназа Syk является эндогенной или рекомбинантной киназой Syk, экспрессируемой клеткой, например тучной клеткой или базофильной клеткой. Способ может быть осуществлен на практике в условиях in vitro при условии, что контактирование осуществляют в условиях, при которых прогруппа(пы) метаболизируется, давая активное соединение 2,4-пиримидиндиамина, или в условиях in vivo в качестве терапевтического способа для лечения или профилактики заболеваний, характеризуемых, вызванных или связанных с активностью киназы Syk.
Не имея намерения быть связанными с какой-либо конкретной теорией процесса, полагают, что такие активные соединения 2,4-пиримидиндиамина ингибируют дегрануляцию клеток и/или высвобождение других химических медиаторов главным образом посредством ингибирования киназы Syk, которая становится активированной благодаря гомодимеру гамма-цепей FcεRI. Указанный гомодимер гамма-цепей является общим и для других Fc-рецепторов, включая FcγRI, FcγRIII и FcαRI. В случае всех указанных рецепторов внутриклеточная сигнальная трансдукция опосредуется общим гомодимером гамма-цепей. Связывание и агрегация таких рецепторов приводит к привлечению и активации тирозинкиназ, таких как киназа Syk. Вследствие указанных общих активностей в передаче сигнала пролекарства, описанных в данной публикации, которые метаболизируются до таких активных соединений 2,4-пиримидиндиамина, могут быть использованы для регуляции, и в частности для ингибирования каскадов передачи сигнала Fc-рецепторов, имеющих такой гомодимер гамма-цепи, таких как FcεRI, FcγRI, FcγRIII и FcαRI, а также клеточных ответов, вызванных посредством указанных рецепторов.
Известно, что киназа Syk играет важную роль в других каскадах передачи сигнала. Например, киназа Syk является эффектором передачи сигнала B-клеточного рецептора (BCR) (Turner et al, 2000, Immunology Today 21: 148-154) и существенно важным компонентом передачи сигнала интегрина бета(1), бета(2) и бета(3) в нейтрофилах (Mocsai et al, 2002, Immunity 16: 547-558). Активные соединения 2,4-пиримидиндиамина, которые являются сильными ингибиторами киназы Syk, могут быть использованы для регуляции, и в частности для ингибирования любого каскада передачи сигнала, в котором Syk играет роль, такого как, например, каскады передачи сигналов Fc-рецепторов, BCR и интегрина, а также клеточных ответов, вызванных посредством указанных каскадов передачи сигналов. Таким образом, пролекарства, описанные в данной публикации, которые метаболизируются до таких активных соединений 2,4-пиримидиндиамина, могут быть использованы для регуляции таких активностей. Конкретный регулируемый или ингибируемый клеточный ответ будет зависеть отчасти от конкретного типа клеток и каскада передачи сигнала рецептора, как хорошо известно в данной области. Не ограничивающие примеры клеточных ответов, которые можно регулировать или ингибировать такими пролекарствами, включают респираторный взрыв, адгезию клеток, дегрануляцию клеток, распространение клеток, миграцию клеток, фагоцитоз (например, в макрофагах), поток ионов кальция (например, в тучных клетках, базофилах, нейтрофилах, эозинофилах и B-клетках), агрегацию тромбоцитов и созревание клеток (например, B-клеток).
Таким образом, в другом аспекте настоящее изобретение относится к способам регуляции, и в частности ингибирования каскадов сигнальной трансдукции, в которых Syk играет роль. Способ в общем заключается в осуществлении контакта Syk-зависимого рецептора или клетки, экспрессирующей Syk-зависимый рецептор, с таким количеством подходящего пролекарства, описанного в данной публикации, или его приемлемой соли, гидрата, сольвата, N-оксида и/или композиции, которое является эффективным для регуляции или ингибирования каскада сигнальной трансдукции. Способы также могут быть использованы для регуляции, и в частности для ингибирования следующих далее процессов или клеточных ответов, вызванных активацией конкретного Syk-зависимого каскада сигнальной трансдукции. Способы могут быть осуществлены на практике для регуляции любого каскада сигнальной трансдукции, в котором, как известно в настоящее время или будет открыто позднее, Syk играет роль. Способы могут быть осуществлены на практике в условиях in vitro, при условии, что контактирование осуществляют в условиях, при которых прогруппа(пы) метаболизируется, давая активное соединение 2,4-пиримидиндиамина, или в условиях in vivo в качестве терапевтического способа для лечения или профилактики заболеваний, характеризуемых, вызванных или связанных с активацией Syk-зависимого каскада сигнальной трансдукции. Не ограничивающие примеры таких заболеваний включают заболевания, описанные ранее.
Недавние исследования показали, что активация тромбоцитов коллагеном опосредуется тем же путем, который используется иммунными рецепторами, при этом тирозинкиназный мотив иммунорецепторов на FcRγ играет центральную роль (Watson and Gibbons, 1998, Immunol. Today 19: 260-264), а также что FcRγ играет центральную роль в формировании гиперплазии неоинтимы после повреждения баллонным катетером у мышей, наиболее вероятно посредством индуцированной коллагеном активации тромбоцитов и рекрутинга лейкоцитов (Konishi et al, 2002, Circulation 105: 912-916). Таким образом, пролекарства, описанные в данной публикации, также могут быть использованы для ингибирования индуцированной коллагеном активации тромбоцитов и для лечения или профилактики заболеваний, связанных или вызванных такой активацией тромбоцитов, таких как, например, гиперплазия интимы и рестеноз после повреждения сосудов.
Полученные на клетках и на животных данные также подтверждают, что многие из указанных активных соединений 2,4-пиримидиндиамина также можно использовать для лечения или профилактики аутоиммунных заболеваний и/или симптомов таких заболеваний (см., например, заявку на выдачу патента США с регистрационным No. 10/631029, поданную 29 июля 2003, международную заявку на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявку на выдачу патента США с регистрационным No. 10/903263, поданную 30 июля 2004 (US2005/0234049), и международную заявку на выдачу патента с регистрационным No. PCT/US2004/24716, описания которых включены в данное описание в виде ссылки. Поэтому пролекарства таких активных соединений 2,4-пиримидиндиамина подобным образом могут быть использованы для лечения или профилактики таких аутоиммунных заболеваний и/или симптомов. Способы в общем заключаются во введении субъекту, страдающему от аутоиммунного заболевания, или для которого существует риск развития аутоиммунного заболевания, такого количества подходящего пролекарства, описанного в данной публикации, или его приемлемой соли, N-оксида, гидрата, сольвата или композиции, которое эффективно для лечения или профилактики аутоиммунного заболевания и/или связанных с ним симптомов. Аутоиммунные заболевания, которые можно лечить или предотвращать с использованием пролекарств, включают такие заболевания, которые обычно связаны с неанафилактическими реакциями гиперчувствительности (реакциями гиперчувствительности типа II, типа III и/или типа IV), и/или такие заболевания, которые опосредованы, по меньшей мере частично, активацией каскада передачи сигнала FcγR в моноцитах. Такие аутоиммунные заболевания включают без ограничения такие аутоиммунные заболевания, которые часто называют аутоиммунными заболеваниями одного органа или одного типа клеток, и такие аутоиммунные заболевания, которые часто называют системными аутоиммунными заболеваниями. Не ограничивающие примеры заболеваний, часто называемых аутоиммунными заболеваниями одного органа или одного типа клеток, включают: тиреоидит Хашимото, аутоиммунную гемолитическую анемию, аутоиммунный атрофический гастрит у больных с пернициозной анемией, аутоиммунный энцефаломиелит, аутоиммунный орхит, болезнь Гудпасчера, аутоиммунную тромбоцитопению, симпатическую офтальмию, миастению gravis, диффузный токсический зоб, первичный билиарный цирроз, хронический агрессивный гепатит, язвенный колит и мембранную гломерулопатию. Не ограничивающие примеры заболеваний, часто называемых системным аутоиммунным заболеванием, включают: системную красную волчанку, ревматоидный артрит, синдром Шегрена, синдром Рейтера, полимиозит-дерматомиозит, системный склероз, нодозный полиартрит, рассеянный склероз и буллезный пемфигоид. Дополнительные аутоиммунные заболевания, которые могут быть основаны на β-клетках (гуморальные) или основаны на T-клетках, включают аутоиммунную алопецию, диабет типа I или юношеский диабет и тиреоидит.
5. КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 представлены схемы, иллюстрирующие метаболические пути типичных содержащих фосфор пролекарств.
На фиг.2 представлена схема, иллюстрирующая метаболический путь типичного пролекарства в виде циклического сложного фосфатного эфира.
Фиг.3 иллюстрирует приведенный в качестве примера синтез типичного пролекарства в виде циклического фосфата.
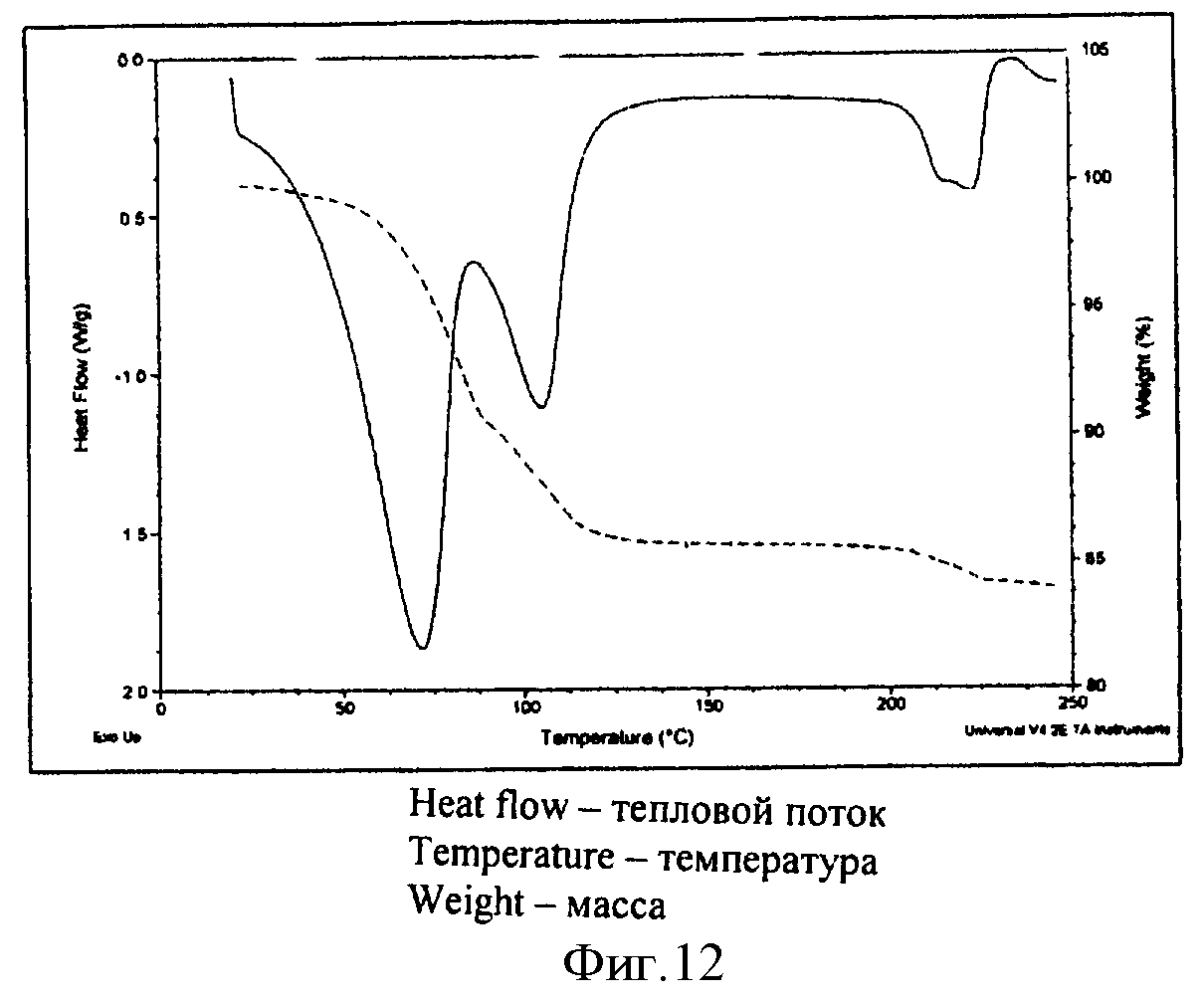
На фиг.4-11 показаны графики, иллюстрирующие различные фармакокинетические данные лекарственного соединения 1 и/или пролекарственного соединения 4.
6. ПОДРОБНОЕ ОПИСАНИЕ
6.1 Определения
В используемом в данном описании смысле подразумевается, что следующие термины имеют следующие значения.
«Алкил» сам по себе или в виде части другого заместителя относится к насыщенному или ненасыщенному, имеющему разветвленную цепь, неразветвленную цепь или циклическому одновалентному углеводородному радикалу, имеющему указанное количество атомов углерода (т.е. C1-C6 означает от одного до шести атомов углерода), который получен удалением одного атома водорода от одного атома углерода исходного алкана, алкена или алкина. Типичные алкильные группы включают без ограничения, метил; этилы, такие как этанил, этенил, этинил; пропилы, такие как пропан-1-ил, пропан-2-ил, циклопропан-1-ил, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил, циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил, проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метилпропан-1-ил, 2-метилпропан-2-ил, циклобутан-1-ил, бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил, бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и тому подобные. В том случае, когда имеют в виду конкретные уровни насыщения, используют номенклатуру «алканил», «алкенил» и/или «алкинил», которые определены ниже. В используемом в данном описании смысле «низший алкил» означает (C1-C8)алкил.
«Алканил» сам по себе или в виде части другого заместителя относится к насыщенному, имеющему разветвленную цепь, неразветвленную цепь или циклическому алкилу, полученному удалением одного атома водорода от одного атома углерода исходного алкана. Типичные алканильные группы включают без ограничения метанил; этанил; пропанилы, такие как пропан-1-ил, пропан-2-ил (изопропил), циклопропан-1-ил и т.д.; бутанилы, такие как бутан-1-ил, бутан-2-ил (втор-бутил), 2-метилпропан-1-ил (изобутил), 2-метилпропан-2-ил (трет-бутил), циклобутан-1-ил и т.д.; и тому подобные. В используемом в данном описании смысле «низший алканил» означает (C1-C8) алканил.
«Алкенил» сам по себе или в виде части другого заместителя относится к ненасыщенному, имеющему разветвленную цепь, неразветвленную цепь или циклическому алкилу, имеющему по меньшей мере одну углерод-углеродную двойную связь, полученному удалением одного атома водорода от одного атома углерода исходного алкена. Группа может быть либо в цис-, либо в транс-конформации относительно двойной связи (связей). Типичные алкенильные группы включают без ограничения этенил; пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил, проп-2-ен-2-ил, циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил и т.д.; и тому подобные. В используемом в данном описании смысле «низший алкенил» означает (C2-C8)алкенил.
«Алкинил» сам по себе или в виде части другого заместителя относится к ненасыщенному, имеющему разветвленную цепь, неразветвленную цепь или циклическому алкилу, имеющему по меньшей мере одну углерод-углеродную тройную связь, полученному удалением одного атома водорода от одного атома углерода исходного алкина. Типичные алкинильные группы включают без ограничения этинил; пропинилы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и тому подобные. В используемом в данном описании смысле «низший алкинил» означает (C2-C8)алкинил.
«Алкилдиил» сам по себе или в виде части другого заместителя относится к насыщенной или ненасыщенной, имеющей разветвленную цепь, неразветвленную цепь или циклической двухвалентной углеводородной группе, имеющей указанное количество атомов углерода (т.е. C1-C6 означает от одного до шести атомов углерода), полученной удалением одного атома водорода от каждого из двух разных атомов углерода исходного алкана, алкена или алкина, или удалением двух атомов водорода от одного атома углерода исходного алкана, алкена или алкина. Два одновалентных радикальных центра или каждая валентность двухвалентного радикального центра могут образовывать связи с такими же или другими атомами. Типичные алкилдиильные группы включают без ограничения метандиил; этилдиилы, такие как этан-1,1-диил, этан-1,2-диил, этен-1,1-диил, этен-1,2-диил; пропилдиилы, такие как пропан-1,1-диил, пропан-1,2-диил, пропан-2,2-диил, пропан-1,3-диил, циклопропан-1,1-диил, циклопропан-1,2-диил, проп-1-ен-1,1-диил, проп-1-ен-1,2-диил, проп-2-ен-1,2-диил, проп-1-ен-1,3-диил, циклопроп-1-ен-1,2-диил, циклопроп-2-ен-1,2-диил, циклопроп-2-ен-1,1-диил, проп-1-ин-1,3-диил и т.д.; бутилдиилы, такие как бутан-1,1-диил, бутан-1,2-диил, бутан-1,3-диил, бутан-1,4-диил, бутан-2,2-диил, 2-метилпропан-1,1-диил, 2-метилпропан-1,2-диил, циклобутан-1,1-диил; циклобутан-1,2-диил, циклобутан-1,3-диил, бут-1-ен-1,1-диил, бут-1-ен-1,2-диил, бут-1-ен-1,3-диил, бут-1-ен-1,4-диил, 2-метилпроп-1-ен-1,1-диил, 2-метанилиденпропан-1,1-диил, бута-1,3-диен-1,1-диил, бута-1,3-диен-1,2-диил, бута-1,3-диен-1,3-диил, бута-1,3-диен-1,4-диил, циклобут-1-ен-1,2-диил, циклобут-1-ен-1,3-диил, циклобут-2-ен-1,2-диил, циклобута-1,3-диен-1,2-диил, циклобута-1,3-диен-1,3-диил, бут-1-ин-1,3-диил, бут-1-ин-1,4-диил, бута-1,3-диин-1,4-диил и т.д.; и тому подобные. В том случае, когда имеют в виду конкретные уровни насыщения, используют номенклатуру алканилдиил, алкенилдиил и/или алкинилдиил. В том случае, когда конкретно имеют в виду, что две валентности имеются у одного и того же атома углерода, используют номенклатуру «алкилиден». В некоторых вариантах алкилдиильной группой является (C1-C8)алкилдиил. Конкретные варианты включают насыщенные ациклические алканилдиильные группы, в которых радикальные центры находятся на концевых атомах углерода, например метандиил (метано-); этан-1,2-диил (этано-); пропан-1,3-диил (пропано-); бутан-1,4-диил (бутано-); и тому подобные (также называемые алкиленогруппами, определенными ниже).
«Алкиленогруппа» сама по себе или в виде части другого заместителя относится к имеющей неразветвленную цепь насыщенной или ненасыщенной алкилдиильной группе, имеющей два концевых одновалентных радикальных центра, полученной удалением одного атома водорода от каждого их двух концевых атомов углерода исходного алкана, алкена или алкина с неразветвленной цепью. Положение двойной или тройной связи, если таковая присутствует, в конкретной алкиленогруппе указано в квадратных скобках. Типичные алкиленогруппы включают без ограничения метаногруппу; этиленогруппы, такие как этано-, этено-, этино-; пропиленогруппы, такие как пропано-, проп[1]ено-, пропа[1,2]диено-, проп[1]ино- и т.д.; бутиленогруппы, такие как бутано-, бут[1]ено-, бут[2]ено-, бута[1,3]диено-, бут[1]ино-, бут[2]ино-, бута[1,3]диино- и т.д.; и тому подобные. В том случае, когда имеют в виду конкретные уровни насыщения, используют номенклатуру алкано-, алкено- и/или алкино-. В некоторых вариантах алкиленогруппой является (C1-C8)- или (C1-C3)алкиленогруппа. Конкретные варианты включают имеющие неразветвленную цепь насыщенные алканогруппы, например метано-, этано-, пропано-, бутано- и тому подобные.
«Гетероалкил», «гетероалканил», «гетероалкенил», «гетероалкинил», «гетероалкилдиил» и «гетероалкиленогруппа» сами по себе или в виде части другого заместителя относятся к алкильной, алканильной, алкенильной, алкинильной, алкилдиильной и алкиленогруппе, соответственно, в которой один или несколько атомов углерода каждый независимо заменены одинаковыми или разными гетероатомами или группами гетероатомов. Типичные гетероатомы и/или группы гетероатомов, которые могут заменять атомы углерода, включают без ограничения -O, -S-, -S-O-, -NR'-, -PH-, -S(O)-, -S(O)2-, -S(O)NR'-, -S(O)2NR'- и тому подобные, включая их комбинации, где каждый R' независимо означает водород или (C1-C8)алкил.
«Циклоалкил» и «гетероциклоалкил» сами по себе или в виде части другого заместителя относятся к циклическим вариантам «алкильных» и «гетероалкильных» групп, соответственно. В случае гетероалкильных групп гетероатом может занимать положение, в котором группа связана с остальной частью молекулы. Типичные циклоалкильные группы включают без ограничения циклопропил; циклобутилы, такие как циклобутанил и циклобутенил; циклопентилы, такие как циклопентанил и циклопентенил; циклогексилы, такие как циклогексанил и циклогексенил; и тому подобные. Типичные гетероциклоалкильные группы включают без ограничения тетрагидрофуранил (например, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил и т.д.), пиперидинил (например, пиперидин-1-ил, пиперидин-2-ил и т.д.), морфолинил (например, морфолин-3-ил, морфолин-4-ил и т.д.), пиперазинил (например, пиперазин-1-ил, пиперазин-2-ил и т.д.), и тому подобные.
«Ациклический гетероатомный мостик» относится к двухвалентному мостику, в котором атомы основной цепи являются исключительно гетероатомами и/или группами гетероатомов. Типичные ациклические гетероатомные мостики включают без ограничения -O-, -S-, -S-O-, -NR'-, -PH-, -S(O)-, -S(O)2-, -S(O)NR'-, -S(O)2NR'-, и тому подобные, включая их комбинации, где каждый R' независимо означает водород или (C1-C8)алкил.
«Исходная ароматическая кольцевая система» относится к ненасыщенной циклической или полициклической кольцевой системе, имеющей сопряженную систему π-электронов. В определение «исходная ароматическая кольцевая система» специально включены конденсированные кольцевые системы, в которых один или несколько циклов являются ароматическими и один или несколько циклов являются насыщенными или ненасыщенными, такие как, например, флуорен, индан, инден, фенален, тетрагидронафталин и т.д. Типичные исходные ароматические кольцевые системы включают без ограничения ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, флуорантен, флуорен, гексацен, гексафен, гексален, индацен, s-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плейаден, пирен, пирантрен, рубицен, тетрагидронафталин, трифенилен, тринафталин и тому подобные.
«Арил» сам по себе или в виде части другого заместителя относится к одновалентной ароматической углеводородной группе, имеющей указанное количество атомов углерода (т.е. C6-C15 означает от 6 до 15 атомов углерода), полученному удалением одного атома водорода от одного атома углерода исходной ароматической кольцевой системы. Типичные арильные группы включают без ограничения группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плейадена, пирена, пирантрена, рубицена, трифенилена, тринафталина и тому подобных, а также их различные гидроизомеры. В предпочтительных вариантах арильная группа представляет собой (C6-C15)арил, при этом более типичным является (C6-C10)арил. Конкретные примеры арилов включают фенил и нафтил.
«Ариларил» сам по себе или в виде части другого заместителя относится к одновалентной углеводородной группе, полученной удалением одного атома водорода от одного атома углерода кольцевой системы, в которой две или более идентичных или неидентичных исходных ароматических кольцевых системы непосредственно связаны вместе одинарной связью, где количество таких непосредственных связей между циклами на одно меньше, чем количество входящих в группу исходных ароматических кольцевых систем. Типичные ариларильные группы включают без ограничения бифенил, трифенил, фенилнафтил, бинафтил, бифенилнафтил и тому подобные. В том случае, когда указано количество атомов углерода в ариларильной группе, количества относятся к атомам углерода, составляющим каждый исходный ароматический цикл. Например, (C6-C15)ариларил означает ариларильную группу, в которой каждый ароматический цикл содержит от 6 до 15 атомов углерода, например бифенил, трифенил, бинафтил, фенилнафтил и т.д. В некоторых вариантах каждая исходная ароматическая кольцевая система ариларильной группы независимо является (C6-C15)ароматической системой, более предпочтительно (C6-C10)ароматической системой. Конкретные иллюстративные ариларильные группы включают группы, в которых все исходные ароматические кольцевые системы идентичны, например бифенил, трифенил, бинафтил, тринафтил и т.д.
«Биарил» сам по себе или в виде части другого заместителя относится к ариларильной группе, имеющей две идентичных исходных ароматических системы, непосредственно связанные вместе одинарной связью. Типичные биарильные группы включают без ограничения бифенил, бинафтил, биантрацил и тому подобные. В некоторых вариантах ароматические кольцевые системы представляют собой (C6-C15)ароматические циклы, более типично (C6-C10)ароматические циклы. Конкретной иллюстративной биарильной группой является бифенил.
«Арилалкил» сам по себе или в виде части другого заместителя относится к ациклической алкильной группе, в которой один из атомов водорода, связанных с атомом углерода, обычно концевым или sp3-атомом углерода, замещен арильной группой. Типичные арилалкильные группы включают без ограничения бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и тому подобные. В том случае, когда имеют в виду конкретные алкильные остатки, используют номенклатуру арилалканил, арилалкенил и/или арилалкинил. В некоторых вариантах арилалкильной группой является (C7-C21)арилалкил, например алканильный, алкенильный или алкинильный остаток арилалкильной группы имеет (C1-C6) атомов углерода, а арильный остаток имеет (C6-C15) атомов углерода. В некоторых конкретных вариантах арилалкильной группой является (C7-C13)группа, например алканильный, алкенильный или алкинильный остаток арилалкильной группы имеет (C1-C3) атомов углерода, а арильный остаток имеет (C6-C10) атомов углерода.
«Исходная гетероароматическая кольцевая система» относится к исходной ароматической кольцевой системе, в которой один или несколько атомов углерода каждый независимо заменены одинаковыми или разными гетероатомами или группами гетероатомов. Типичные гетероатомы группы гетероатомов для замены атомов углерода включают без ограничения N, NH, P, O, S, S(O), S(O)2, Si и т.д. В определение «исходные гетероароматические кольцевые системы» специально включены конденсированные кольцевые системы, в которых один или несколько циклов являются ароматическими, и один или несколько циклов являются насыщенными или ненасыщенными, например, такие как бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантен и т.д. Также в определение «исходная гетероароматическая кольцевая система» включены такие известные циклы, которые содержат общие заместители, например, такие как бензопирон и 1-метил-1,2,3,4-тетразол. Из определения «исходная гетероароматическая кольцевая система» специально исключены бензольные циклы, конденсированные с циклическими полиалкиленгликолями, такими как циклические полиэтиленгликоли. Типичные исходные гетероароматические кольцевые системы включают без ограничения акридин, бензимидазол, бензизоксазол, бензодиоксан, бензодиаксол, бензофуран, бензопирон, бензотиадиазол, бензотиазол, бензотриазол, бензоксазин, бензоксазол, бензоксазолин, карбазол, β-карболин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен и тому подобные.
«Гетероарил» сам по себе или в виде части другого заместителя относится к одновалентной гетероароматической группе, имеющей указанное количество атомов в цикле (например, «5-14-членный» означает от 5 до 14 атомов в цикле), полученной удалением одного атома водорода от одного атома исходной гетероароматической кольцевой системы. Типичные гетероарильные группы включают без ограничения группы, полученные из акридина, бензимидазола, бензизоксазола, бензодиоксана, бензодиоксола, бензофурана, бензопирона, бензотиадиазола, бензотиазола, бензотриазола, бензоксазина, бензоксазола, бензоксазолина, карбазола, β-карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена и тому подобных, а также их различные гидроизомеры. В предпочтительных вариантах гетероарильная группа представляет собой 5-14-членный гетероарил, при этом особенно предпочтительным является 5-10-членный гетероарил.
«Гетероарилгетероарил» сам по себе или в виде части другого заместителя относится к одновалентной гетероароматической группе, полученной удалением одного атома водорода от одного атома кольцевой системы, в которой две или более идентичных или неидентичных исходных гетероароматических кольцевых системы непосредственно связаны вместе одинарной связью, где количество таких непосредственных связей циклов на одно меньше, чем количество входящих в группу исходных гетероароматических кольцевых систем. Типичные гетероарилгетероарильные группы включают без ограничения бипиридил, трипиридил, пиридилпуринил, бипуринил и т.д. В том случае, когда конкретно указано количество атомов, количество относится к количеству атомов, составляющих каждую исходную гетероароматическую кольцевую систему. Например, 5-15-членный гетероарилгетероарил означает гетероарилгетероарильную группу, в которой каждая исходная гетероароматическая кольцевая система содержит от 5 до 15 атомов, например бипиридил, трипиридил и т.д. В некоторых вариантах каждая исходная гетероароматическая кольцевая система независимо является 5-15-членной гетероароматической системой, более типично 5-10-членной гетероароматической системой. Конкретные иллюстративные гетероарилгетероарильные группы включают группы, в которых все исходные гетероароматические кольцевые системы являются идентичными.
«Бигетероарил» сам по себе или в виде части другого заместителя относится к гетероарилгетероарильной группе, имеющей две идентичных исходных гетероароматических кольцевых системы, непосредственно связанных вместе одинарной связью. Типичные бигетероарильные группы включают без ограничения бипиридил, бипуринил, бихинолинил и тому подобные. В некоторых вариантах гетероароматические кольцевые системы являются 5-15-членными гетероароматическими циклами, более типично 5-10-членными гетероароматическими циклами.
«Гетероарилалкил» сам по себе или в виде части другого заместителя относится к ациклической алкильной группе, в которой один из атомов водорода, связанных с атомом углерода, обычно концевым или sp3-атомом углерода, замещен гетероарильной группой. В том случае, когда имеют в виду конкретные остатки алкила, используют номенклатуру гетероарилалканил, гетероарилалкенил и/или гетероарилалкинил. В некоторых вариантах гетероарилалкильная группа является 6-21-членным гетероарилалкилом, например алканильный, алкенильный или алкинильный остаток гетероарилалкила является (C1-C6)алкилом, а гетероарильный остаток является 5-15-членным гетероарилом. В некоторых конкретных иллюстративных вариантах гетероарилалкил является 6-13-членным гетероарилалкилом, например алканильный, алкенильный или алкинильный остаток является (C1-C3)алкилом, а гетероарильный остаток является 5-10-членным гетероарилом.
«Галоген» сам по себе или в виде части другого заместителя, если не оговорено особо, относится к фтору, хлору, брому и йоду.
«Галогеналкил» сам по себе или в виде части другого заместителя относится к алкильной группе, в которой один или несколько атомов водорода заменены атомом галогена. Таким образом, подразумевают, что термин «галогеналкил» включает моногалогеналкилы, дигалогеналкилы, тригалогеналкилы и т.д. до пергалогеналкилов. Например, выражение «(C1-C2)галогеналкил» включает фторметил, дифторметил, трифторметил, 1-фторэтил, 1,1-дифторэтил, 1,2-дифторэтил, 1,1,1-трифторэтил, перфторэтил и т.д.
Названия указанных выше групп могут включать приставки и/или суффиксы, которые обычно используют в данной области для образования дополнительных хорошо известных групп заместителей. В качестве примеров, «алкилоксигруппа» или «алкоксигруппа» относятся к группе формулы -OR”, «алкиламин» относится к группе формулы -NHR” и «диалкиламин» относится к группе формулы -NR”R”, где каждый R” независимо означает алкил. В качестве другого примера «галогеналкоксигруппа» или «галогеналкилоксигруппа» относится к группе формулы -OR'”, где R'” означает галогеналкил.
«Замещенный» при использовании в отношении модификации конкретной группы или радикала означает, что один или несколько атомов водорода конкретной группы или радикала каждый независимо друг от друга замещены одинаковыми или разными заместителями. Группы заместителей, применимые для замещения атомов водорода у насыщенных атомов углерода в конкретной группе или радикале, включают без ограничения -R60, галоген, -O-M+, =O, -OR70, -SR70, -S-M+, =S, -NR80R80, -NR70, =N-OR70, тригалогенметил, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2R70, -S(O)2O-M+, -S(O)2OR70, -OS(O)2R70, -OS(O)2O-M+, -OS(O)2OR70, -P(O)(O-)2(M+)2,
-P(O)(OR70)O-M+, -P(O)(OR70)(OR70), -C(O)R70, -C(S)R70, -C(NR70)R70, -C(O)O-M+, -C(O)OR70, -C(S)OR70, -C(O)NR80R80, -C(NR70)NR80R80, -OC(O)R70, -OC(S)R70, -OC(O)O-M+, -OC(O)OR70, -OC(S)OR70, -NR70C(O)R70, -NR70C(S)R70, -NR70C(O)O-M+, -NR70C(O)OR70, -NR70C(S)OR70, -NR70C(O)NR80R80, -NR70C(NR70)R70 и -NR70C(NR70)NR80R80, где R60 выбран из группы, состоящей из алкила, циклоалкила, гетероалкила, циклогетероалкила, арила, арилалкила, гетероарила и гетероарилалкила; каждый R70 независимо означает водород или R60; каждый R80 независимо означает R70, или, альтернативно, два R80, взятые вместе с атомом азота, с которым они связаны, образуют 5-, 6- или 7-членный циклогетероалкил, который необязательно может содержать от 1 до 4 одинаковых или разных дополнительных гетероатомов, выбранных из группы, состоящей из O, N и S; и каждый M+ означает противоион с положительным зарядом, например, положительный заряд независимо выбран из K+, Na+,+N(R60)4 и Li+, или два M+ объединяются, образуя двухвалентный противоион, например двухвалентный противоион, выбранный из Ca2+, Mg2+ и Ba2+. В качестве конкретных примеров подразумевают, что -NR80R80 включает -NH2, -NH-алкил, N-пирролидинил и N-морфолинил.
Подобным образом, группы заместителей, применимых для замещения атомов водорода у ненасыщенных атомов углерода в конкретной группе или радикале, включают без ограничения -R60, галоген, -O-M+, -OR70, -SR70, -S-M+, -NR80R80, тригалогенметил, -CF3, -CN, -OCN, -SCN, -NO, -NO2, -N3, -S(O)2R70, -S(O)2O-M+, -S(O)2OR70, -OS(O)2R70, -OS(O)2O-M+, -OS(O)2OR70, -P(O)(O-)2(M+)2, -P(O)(OR70)O-M+, -P(O)(OR70)(OR70), -C(O)R70, -C(S)R70, -C(NR70)R70, -C(O)O-M+, -C(O)OR70, -C(S)OR70, -C(O)NR80R80, -C(NR70)NR80R80, -OC(O)R70, -OC(S)R70, -OC(O)O-M+, -OC(O)OR70, -OC(S)OR70, -NR70C(O)R70, -NR70C(S)R70, -NR70C(O)O-M+, -NR70C(O)OR70, -NR70C(S)OR70, -NR70C(O)NR80R80, -NR70C(NR70)R70 и -NR70C(NR70)NR80R80, где R60, R70, R80 и M+ имеют значения, определенные ранее.
Группы заместителей, отличные от RP, применимые для замещения атомов водорода у атомов азота в гетероалкильных и циклогетероалкильных группах, включают без ограничения -R60, -O-M+, -OR70, -SR70, -S-M+, -NR80R80, тригалогенметил, -CF3, -CN, -NO, -NO2, -S(O)2R70, -S(O)2O-M+, -S(O)2OR70, -OS(O)2R70, -OS(O)2O-M+, -OS(O)2OR70, -P(O)(O-)2(M+)2, -P(O)(OR70)O-M+, -P(O)(OR70)(OR70), -C(O)R70, -C(S)R70, -C(NR70)R70, -C(O)OR70, -C(S)OR70, -C(O)NR80R80, -C(NR70)NR80R80, -OC(O)R70, -OC(S)R70, -OC(O)OR70, -OC(S)OR70, -NR70C(O)R70, -NR70C(S)R70, -NR70C(O)OR70, -NR70C(S)OR70, -NR70C(O)NR80R80, -NR70C(NR70)R70 и -NR70C(NR70)NR80R80, где R60, R70, R80 и M+ имеют значения, определенные ранее.
Группы заместителей из приведенного выше списка, применимые для замещения других групп или атомов, обозначенных как «замещенные», будут очевидны для специалистов в данной области.
«Защитная группа» относится к группе атомов, которые при связывании с химически активной функциональной группой в молекуле маскируют, снижают или предотвращают химическую активность функциональной группы. Обычно защитная группа может быть избирательно удалена, когда это требуется в ходе синтеза. Примеры защитных групп можно найти в Greene and Wuts, Protective Groups in Organic Chemistry, 3rd Ed., 1999, John Wiley and Sons, NY и в Harrison et al, Compendium of Synthetic Organic Methods, Vols. 1-8, 1971-1996, John Wiley and Sons, NY. Типичные защитные группы аминогрупп включают без ограничения формил, ацетил, трифторацетил, бензил, бензилоксикарбонил («CBZ»), трет-бутоксикарбонил («Boc»), триметилсилил («TMS»), 2-триметилсилилэтансульфонил («TES»), тритильную и замещенную тритильную группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил («FMOC»), нитровератрилоксикарбонил («NVOC») и тому подобные. Типичные защитные группы гидроксила включают без ограничения группы, в которых гидроксильная группа либо ацилирована, либо алкилирована, такие как бензиловый и тритиловый эфиры, а также алкиловые эфиры, тетрагидропираниловые эфиры, триалкилсилиловые эфиры (например, группы TMS или TIPPS группы) и аллиловые эфиры.
«Fc-рецептор» относится к члену семейства молекул клеточной поверхности, который связывает часть Fc (содержащую специфичную константную область) иммуноглобулина. Каждый Fc-рецептор связывает иммуноглобулины специфичного типа. Например, Fcα-рецептор («FcαR») связывает IgA, FcεR связывает IgE и FcγR связывает IgG.
Семейство FcαR включает полимерный Ig-рецептор, вовлеченный в эпителиальный транспорт IgA/IgM, специфичный для миелоидных клеток рецептор RcαRI (также называемый CD89), Fcα/µR и по меньшей мере два альтернативных рецептора IgA (новый обзор см. в Monteiro and van de Winkel, 2003, Annu. Rev. Immunol, advanced e-publication). FcαRI экспрессируется на нейтрофилах, эозинофилах, моноцитах/макрофагах, дендритных клетках и клетках Купфера. FcαRI содержит одну альфа-цепь и гомодимер FcR-гамма, который несет мотив активации (ITAM) в цитоплазматическом домене и фосфорилирует киназу Syk.
Семейство FcεR включает два типа, называемых FcεRI и FcεRII (также известных как CD23). FcεRI является высоко аффинным рецептором (связывает IgE с аффинностью около 1010 M-1), встречающимся на тучных клетках, базофилах и эозинофилах, который заякоривает мономерный IgE на клеточной поверхности. FcεRI имеет одну альфа-цепь, одну бета-цепь и гомодимер гамма-цепи, который обсуждается выше. FcεRII является низкоаффинным рецептором, экспрессируемым на мононуклеарных фагоцитах, B-лимфоцитах, эозинофилах и тромбоцитах. FcεRII содержит одну полипептидную цепь и не содержит гомодимера гамма-цепи.
Семейство FcγR включает три типа, называемых FcγRI (также известный как CD64), FcγRII (также известны как CD32) и FcγRIII (также известный как CD16). FcγRI является высоко аффинным рецептором (связывает IgG1 с аффинностью 108 М-1), встречающимся на тучных, базофильных, мононуклеарных клетках, нейтрофилах, эозинофилах, дендритных клетках и фагоцитах, который заякоривает мономерный IgG на клеточной поверхности. FcγRI содержит одну альфа-цепь и димер гамма-цепи, общий для FcαRI и FcεRI.
FcγRII является низкоаффинным рецептором, экспрессируемым на нейтрофилах, моноцитах, эозинофилах, тромбоцитах и B-лимфоцитах. FcγRII содержит одну альфа-цепь и не содержит гомодимера гамма-цепи, обсуждаемого выше.
FcγRIII является низкоаффинным (связывает IgG1 с аффинностью 5×105 М-1), экспрессируемым на NK, эозинофилах, макрофагах, нейтрофилах и тучных клетках. Он содержит одну альфа-цепь и гомодимер гамма-цепи, общий для FcαRI, FcεRI и FcγRI.
Специалистам в данной области хорошо известно, что субъединичная структура и связывающие свойства указанных различных Fc-рецепторов, а также типы экспрессирующих их клеток охарактеризованы не полно. Приведенное выше обсуждение отражает только современное состояние уровня техники, относящегося к указанным рецепторам (см., например, Immunobiology: The Immune System in Health and Disease, 5th Edition, Janeway et al, Eds, 2001, ISBN 0-8153-3642-x, фигура 9.30 на стр. 371), и не предназначено для ограничения огромного количества каскадов передачи сигнала рецепторов, которые можно регулировать пролекарствами, описанными в данной публикации.
«Опосредованная Fc-рецептором дегрануляция» или «индуцированная Fc-рецептором дегрануляция» относится к дегрануляции, которая протекает с участием каскада сигнальной трансдукции Fc-рецептора, инициированного поперечным сшиванием Fc-рецептора.
«IgE-индуцированная дегрануляция» или «FcεRI-опосредованная дегрануляция» относится к дегрануляции, которая протекает с участием каскада сигнальной трансдукции IgE-рецептора, инициированного поперечным сшиванием FcεRI-связанного IgE. Поперечное сшивание может быть индуцировано IgE-специфичным аллергеном или другим поливалентным связывающим агентом, таким как анти-IgE-антитело. В тучных клетках и/или базофильных клетках каскад передачи сигнала FcεRI, приводящий к дегрануляции, может быть нарушен на двух стадиях: выше по течению и ниже по течению. Стадия выше по течению включает в себя все процессы, которые происходят перед мобилизацией ионов кальция. Стадия ниже по течению включает в себя мобилизацию ионов кальция и все процессы, протекающие после мобилизации. Соединения, которые ингибируют FcεRI-опосредованную дегрануляцию, могут действовать в любой точке вдоль FcεRI-опосредованного каскада сигнальной трансдукции. Соединения, которые избирательно ингибируют FcεRI-опосредованную дегрануляцию выше по течению, действуют, ингибируя указанную часть каскада передачи сигнала FcεRI выше точки, в которой индуцируется мобилизация ионов кальция. В основанных на клетках анализах соединения, которые избирательно ингибируют FcεRI-опосредованную дегрануляцию выше по течению, ингибируют дегрануляцию таких клеток, как тучные клетки или базофилы, которые активируются или стимулируются IgE-специфичным аллергеном или связывающим агентом (таким как анти-IgE-антитело), но не вызывают существенного ингибирования дегрануляции клеток, которые активируются или стимулируются дегранулирующими агентами, которые обходят FcεRI-путь передачи сигнала, такими как, например, кальциевые ионофоры иономицин и A23187.
«IgG-индуцированная дегрануляция» или «FcγRI-опосредованная дегрануляция» относится к дегрануляции, которая происходит с участием каскада сигнальной трансдукции FcγRI, инициируемого поперечным сшиванием FcγRI-связанного IgG. Поперечное сшивание может быть индуцировано IgG-специфичным аллергеном или другим поливалентным связывающим агентом, таким как анти-IgG-антитело или фрагмент антитела. Подобно каскаду передачи сигнала FcεRI в тучных клетках и базофилах каскад передачи сигнала FcγRI также приводит к дегрануляции, которая может быть нарушена на таких же двух стадиях: выше по течению и ниже по течению. Подобно FcεRI-опосредованной дегрануляции соединения, которые избирательно ингибируют FcγRI-опосредованную дегрануляцию выше по течению, действуют выше точки, в которой индуцируется мобилизация ионов кальция. В основанных на клетках анализах соединения, которые избирательно ингибируют FcγRI-опосредованную дегрануляцию выше по течению, ингибируют дегрануляцию таких клеток, как тучные клетки или базофилы, которые активируются или стимулируются IgG-специфичным аллергеном или связывающим агентом (таким как анти-IgG-антитело или его фрагмент), но не вызывают существенного ингибирования дегрануляции клеток, которые активируются или стимулируются дегранулирующими агентами, которые обходят FcγRI-путь передачи сигнала, такими как, например, кальциевые ионофоры иономицин и A23187.
«Индуцированная ионофором дегрануляция» или «опосредованная ионофором дегрануляция» относится к дегрануляции клетки, такой как тучная клетка или базофильная клетка, которая происходит при воздействии кальциевого ионофора, такого как, например, иономицин или A23187.
«Киназа Syk» относится к хорошо известной нерецепторной (цитоплазматической) тирозиновой протеинкиназе селезенки с молекулярной массой 72 кД, экспрессируемой в B-клетках и других гематопоэтических клетках. Киназа Syk содержит два консенсусных домена гомологии с Src 2 (SH2) в тандеме, которые связываются с основанными на тирозине мотивами активации фосфорилированных иммунорецепторов («ITAM»), «линкерный» домен и каталитический домен (обзор структуры и функции киназы Syk см. в Sada et al, 2001, J. Biochem. (Tokyo) 130: 177-186); см. также Turner et al, 2000, Immunology Today 21: 148-154). Киназу Syk широко исследовали в качестве эффектора передачи сигнала B-клеточного рецептора (BCR) (Turner et al, 2000, выше). Киназа Syk также важна для фосфорилирования тирозина множества белков, которые регулируют важные пути, идущие от иммунорецепторов, такие как мобилизация Ca2+ и каскады активируемых митогенами протеинкиназ (MAPK) и дегрануляция. Киназа Syk также играет решающую роль в передаче сигнала интегрина в нейтрофилах (см., например, Mocsai et al. 2002, Immunity 16: 547-558).
В используемом в данном описании смысле киназа Syk включает киназы любого вида животного, включая без ограничения человека, обезьян, коров, свиней, грызунов и т.д., которые, как известно, относятся к семейству Syk. Специально включены изоформы, варианты сплайсинга, аллельные варианты, мутанты, как встречающиеся в природе, так и искусственно полученные. Аминокислотные последовательности таких Syk-киназ хорошо известны и доступны из GENBANK. Конкретные примеры мРНК, кодирующих разные изоформы киназы Syk человека, можно найти в GENBANK с № доступа gi|21361552|ref|NM__003177.2|, gi|496899|emb|Z29630.1|HSSYKPTK[496899] и gi|15030258|gb|BC011399.1|BC011399[15030258], которые включены в данное описание в виде ссылки.
Специалистам в данной области будет понятно, что тирозинкиназы, относящиеся к другим семействам, могут иметь активные сайты или карманы связывания, которые сходны по трехмерной структуре с сайтами или карманами связывания Syk. Вследствие такого структурного сходства предполагается, что такие киназы, называемые в данном описании «миметиками Syk», катализируют фосфорилирование субстратов, фосфорилируемых Syk. Таким образом, будет понятно, что такие миметики Syk, каскады сигнальной трансдукции, в которых такие миметики Syk играют роль, и биологические ответы, вызываемые такими миметиками Syk и зависимыми от миметиков Syk каскадами передачи сигнала, можно регулировать, и в частности ингибировать многими пролекарствами, описанными в данной публикации.
«Syk-зависимый каскад передачи сигнала» относится к каскаду сигнальной трансдукции, в котором киназа Syk играет роль. Не ограничивающие примеры таких Syk-зависимых каскадов передачи сигнала включают каскады передачи сигналов FcαRI, FcεRI, FcγRI, FcγRIII, BCR и интегральных каскадов передачи сигнала.
«Аутоиммунное заболевание» относится к таким заболеваниям, которые обычно связаны с неанафилактическими реакциями гиперчувствительности (реакции гиперчувствительности типа II, типа III и/или типа IV), которые как правило возникают вследствие собственного гуморального и/или опосредованного клетками иммунного ответа субъекта на одно или несколько иммуногенных веществ эндогенного и/или экзогенного происхождения. Такие аутоиммунные заболевания отличаются от заболеваний, связанных с анафилактическими реакциями гиперчувствительности (типа I или опосредованные IgE).
6.2 Пролекарственные соединения
Как описано в разделе «Сущность изобретения», настоящее изобретение относится к пролекарствам биологически активных соединений 2,4-пиримидиндиамина, таким как различные соединения 2,4-пиримидиндиамина, описанные в заявке на выдачу патента США с регистрационным No. 10/355543, поданной 31 января 2003 (US2004/0029902 A1), международной заявке на выдачу патента с регистрационным No. PCT/US03/03022, поданной 31 января, 2003 (WO 03/063794), заявке на выдачу патента США с регистрационным No. 10/631029, поданной 29 июля 2003, международной заявке на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявке на выдачу патента США с регистрационным No. 10/903263, поданной 30 июля 2004 (US2005/0234049) и международной заявке на выдачу патента с регистрационным No. PCT/US2004/24716, описание которых включено в данное описание в виде ссылки. Пролекарства указанных соединений 2,4-пиримидиндиамина представляют особый интерес, так как такие соединения ингибируют каскады передачи сигнала Fc-рецепторов выше по течению, а также киназу Syk и зависимые от киназы Syk каскады передачи сигналов. Пролекарства обычно содержат такие активные соединения 2,4-пиримидиндиамина, в которых одна или несколько доступных первичных или вторичных аминогрупп маскированы прогруппой RP, которая метаболизируется in vivo, давая активное 2,4-пиримидиндиаминное лекарственное средство. Также, как обсуждалось в разделе «сущность изобретения» и как будет более подробно обсуждаться ниже, природа прогруппы может варьировать и будет зависеть наряду с другими факторами от требуемой растворимости пролекарства в воде, предполагаемого способа его введения и/или предполагаемого механизма или места его метаболизма в активное соединение 2,4-пиримидиндиамина.
Например, было обнаружено, что конкретное активное 2,4-пиримидиндиаминное лекарственное средство (соединение 1 ниже) имеет чрезвычайно высокую растворимость в воде в случае приготовления в виде фосфатного пролекарства (соединение 4 ниже):

Указанное пролекарственное соединение 4 также проявляет превосходную биодоступность по сравнению с соответствующим активным лекарственным соединением 1 при введении перорально тестируемым животным. Действительно, в отличие от лекарственного соединения 1, всасывание пролекарственного соединения 4 не зависит от приготовленного препарата. В фармакокинетических исследованиях, проведенных на крысах, пролекарственное соединение 4 всасывалось одинаково хорошо из растворов (например, растворы в ПЭГ-400 и карбоксиметилцеллюлозе) и порошков (упакованных в твердые желатиновые капсулы). Не имея намерения быть связанными с какой-либо конкретной теорией процесса, полагают, что повышенная пероральная биодоступность пролекарственного соединения 4, а также его всасывание, не зависящее от формы препарата, является следствием, по меньшей мере частично, его более высокой растворимости в воде. Предполагается, что другие активные соединения 2,4-пиримидиндиамина, которые имеют сходные низкие растворимости в воде и поэтому низкую биодоступность при пероральном введении, будут проявлять сходное повышение растворимости в воде и биодоступности при пероральном введении в случае приготовления в виде фосфатных пролекарств.
Наоборот, можно предположить, что соответствующее пролекарство активного лекарственного соединения 1 в виде сложного фосфатного эфира будет иметь более низкую растворимость в воде, чем активное соединение 1. Таким образом, предполагается, что пролекарства активных соединений 2,4-пиримидиндиамина в виде сложного фосфатного эфира, которые имеют более низкую растворимость в воде, чем соответствующие активные соединения 2,4-пиримидиндиамина, будут особенно полезными в случае применений и препаратов, когда требуется низкая растворимость в воде, таких как препараты, приспособленные для доставки посредством ингаляции.
Один класс активных соединений 2,4-пиримидиндиамина, в случае которых, как предполагается, полезны препараты в виде пролекарств, и в частности в виде фосфатных пролекарств, включает 2,4-пиримидиндиамины, в которых N4-заместителем остатка 2,4-пиримидиндиамина является замещенный или незамещенный азотсодержащий гетероарильный цикл формулы

В одном иллюстративном варианте пролекарства представляют собой соединения согласно структурной формуле (I):

включая их соли, сольваты, гидраты и N-оксиды, где:
Y выбран из CH2, NR24, O, S, S(O) и S(O)2;
Z1 и Z2, каждый независимо друг от друга, выбраны из CH и N;
R2 выбран из низшего алкила, необязательно замещенного одной или несколькими одинаковыми или разными группами R8, низшего циклоалкила, необязательно замещенного одной или несколькими одинаковыми или разными группами R8, циклогексила, необязательно замещенного одной или несколькими одинаковыми или разными группами R8, 3-8-членного циклогетероалкила, необязательно замещенного одной или несколькими одинаковыми или разными группами R8, (C6-C14)арила, необязательно замещенного одной или несколькими одинаковыми или разными группами R8, фенила, необязательно замещенного одной или несколькими одинаковыми или разными группами R8, и 5-15-членного гетероарила, необязательно замещенного одной или несколькими одинаковыми или разными группами R8;
R5 выбран из галогена, фтора, цианогруппы, нитрогруппы, тригалогенметила и трифторметила;
R8 выбран из Ra, Rb, Ra, замещенного одной или несколькими, например от одной до четырех, одинаковыми или разными группами Ra или Rb, -ORa, замещенного одной или несколькими одинаковыми или разными группами Ra или Rb, -B(ORa)2, -B(NRcRc)2, -(CH2)m-Rb, -(CHRa)m-Rb, -O-(CH2)m-Rb, -S-(CH2)m-Rb, -O-CHRaRb, -O-CRa(Rb)2, -O-(CHRa)m-Rb, -O-(CH2)m-CH[(CH2)mRb]Rb, -S-(CHRa)m-Rb, -C(O)NH-(CH2)m-Rb, -C(O)NH-(CHRa)m-Rb, -O-(CH2)m-C(O)NH-(CH2)m-Rb, -S-(CH2)m-C(O)NH-(CH2)m-Rb, -O-(CHRa)m-C(O)NH-(CHRa)m-Rb, -S-(CHRa)m-C(O)NH-(CHRa)m-Rb, -NH-(CH2)m-Rb, -NH-(CHRa)m-Rb, -NH[(CH2)mRb], -N[(CH2)mRb]2, -NH-C(O)-NH-(CH2)m-Rb, -NH-C(O)-(CH2)m-CHRbRb и -NH-(CH2)m-C(O)-NH-(CH2)m-Rb;
R17 выбран из водорода, галогена, фтора, низшего алкила и метила, или, альтернативно, R17, взятый вместе с R18, может образовывать оксогруппу (=O), или вместе с атомом углерода, с которым они связаны, образовывать спироцикл, содержащий от 3 до 7 атомов углерода;
R18 выбран из водорода, галогена, фтора, низшего алкила и метила, или, альтернативно, R18, взятый вместе с R17, может образовывать оксогруппу (=O), или вместе с атомом углерода, с которым они связаны, образовывать спироцикл, содержащий от 3 до 7 атомов углерода;
R19 выбран из водорода, низшего алкила и метила, или, альтернативно, R19, взятый вместе с R20, может образовывать оксогруппу (=O), или вместе с атомом углерода, с которым они связаны, образовывать спироцикл, содержащий от 3 до 7 атомов углерода;
R20 выбран из водорода, низшего алкила и метила, или, альтернативно, R20, взятый вместе с R19, может образовывать оксогруппу (=O), или вместе с атомом углерода, с которым они связаны, образовывать спироцикл, содержащий от 3 до 7 атомов углерода;
каждый Ra независимо от других выбран из водорода, низшего алкила, низшего циклоалкила, циклогексила, (C4-C11)циклоалкилалкила, (C6-C10)арила, фенила, (C7-C16)арилалкила, бензила, 2-6-членного гетероалкила, 3-8-членного циклогетероалкила, морфолинила, пиперазинила, гомопиперазинила, пиперидинила, 4-11-членного циклогетероалкилалкила, 5-10-членного гетероарила и 6-16-членного гетероарилалкила;
каждый Rb является подходящей группой, независимо выбранной из =O, -ORa, (C1-C3)галогеналкилоксигруппы, =S, -SRa, =NRa, =NORa, -NRcRc, галогена, -CF3, -CN, -NC, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)Ra, -S(O)2Ra, -S(O)2ORa, -S(O)NRcRc, -S(O)2NRcRc, -OS(O)Ra, -OS(O)2Ra, -OS(O)2ORa, -OS(O)2NRcRc, -C(O)Ra, -C(O)ORa, -C(O)NRcRc, -C(NH)NRcRc, -C(NRa)NRcRc, -C(NOH)Ra, -C(NOH)NRcRc, -OC(O)Ra, -OC(O)ORa, -OC(O)NRcRc, -OC(NH)NRcRc, -OC(NRa)NRcRc, -[NHC(O)]nRa, -[NRaC(O)]nRa, -[NHC(O)]nORa, -[NRaC(O)]nORa, -[NHC(O)]nNRcRc, -[NRaC(O)]nNRcRc, -[NHC(NH)]nNRcRc и -[NRaC(NRa)]nNRcRc;
каждый Rc независимо от других выбран из защитной группы и Ra, или, альтернативно, два Rc, связанные с одним и тем же атомом азота и взятые вместе с указанным атомом азота, образуют 5-8-членный циклогетероалкил или гетероарил, который может необязательно содержать один или несколько одинаковых или разных дополнительных гетероатомов и который необязательно может быть замещен одной или несколькими, например от одной до четырех, одинаковыми или разными группами Ra;
R21, R22 и R23 каждый независимо друг от друга выбран из водорода и прогруппы RP;
R24 выбран из водорода, низшего алкила и прогруппы RP;
каждый m независимо от других является целым числом от 1 до 3; и
каждый n независимо от других является целым числом от 0 до 3 при условии, что по меньшей мере один из R21, R22, R23 и R24 является прогруппой.
В пролекарствах, описанных в данной публикации, и в частности в пролекарствах структурной формулы (I), каждый из R21, R22 и R23 означает либо водород, либо прогруппу RP. Также R24 означает водород, низший алкил или прогруппу RP. Таким образом, пролекарства могут содержать одну прогруппу RP, две прогруппы RP, три прогруппы RP или еще больше прогрупп RP, отчасти в зависимости от природы Y и от того, содержит ли заместитель R2 какие-либо прогруппы RP. В некоторых вариантах пролекарства, описанные в данной публикации, и в частности пролекарства структурной формулы (I), предпочтительно содержат только одну группу RP. Не имея намерения быть связанными с какой-либо теорией процесса, возможно, что разные группы RP в пролекарствах, содержащих более одной прогруппы RP, могут метаболизироваться с разной скоростью. В случае пролекарств, содержащих одну прогруппу RP, можно избежать такой разной кинетики метаболизма. Конкретным вариантом пролекарств согласно структурной формуле (I), которые содержат одну прогруппу RP, являются соединения согласно структурной формуле (Ia):
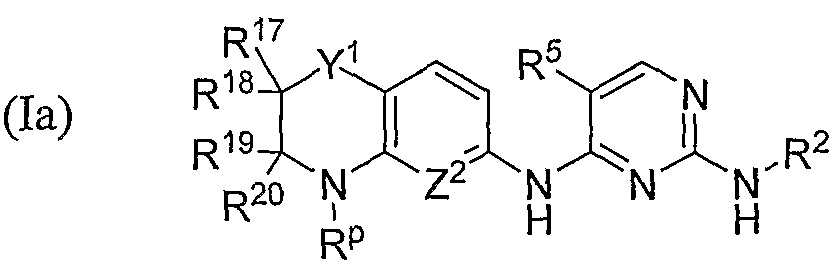
где Y1 выбран из CH2, NR24, O, S, S(O) и S(O)2; и Z2, R2, R5, R17, R18, R19, R20, R24 и RPимеют значения, определенные ранее, при условии, что R2 не содержит никакой группы RP.
Природа любой прогруппы RP, присутствующей в пролекарствах, описанных в данной публикации, не является решающей для успеха, при условии, что она гидролизуется в условиях применения, давая активное соединение 2,4-пиримидиндиамина. Недавно обнаружено, что содержащее фосфат пролекарство согласно структуре, показанной ниже:

метаболизируется in vivo до соответствующего активного соединения 2,4-пиримидиндиамина (соединение 1), показанного ниже:
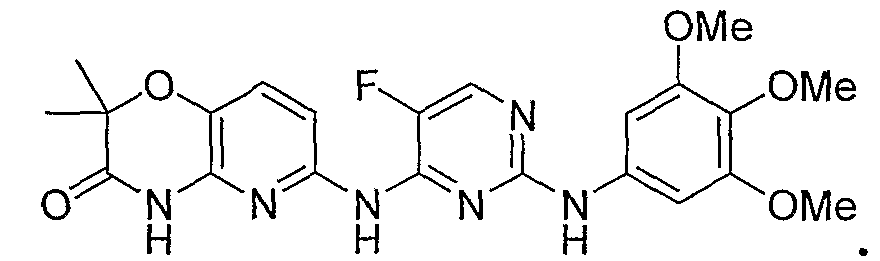
Не имея намерения быть связанными какой-либо конкретной теорией процесса, полагают, что такое пролекарство метаболизируется до активного соединения 1 через соответствующий промежуточный гидроксиметиламин, показанный ниже:
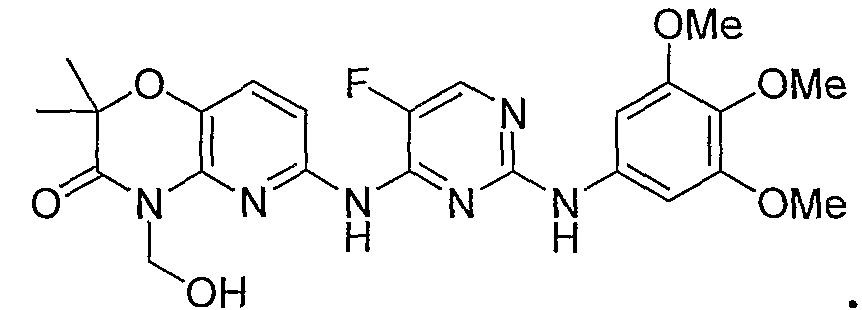
Известно, что такое соединение гидроксиметиламина является нестабильным в физиологических условиях и в разных диапазонах pH, в которых они гидролизуются in vivo, давая формальдегид и активное лекарственное вещество. На основании указанного наблюдения предполагают, что пролекарства, которые содержат «защитные» группы гидроксила, которые могут быть метаболизированы in vivo, например, при действии кислых условий в желудке и/или при действии ферментов, присутствующих в пищеварительном тракте или в других органах и/или тканях или жидкостях организма, давая промежуточный гидроксиметиламин, показанный выше, будут метаболизироваться подобным образом до активного 2,4-пиримидиндиаминного лекарственного средства.
Кроме того, предполагается, что амино- и тиоаналоги указанного промежуточного гидроксиметиламина также будут нестабильными в физиологических условиях и также будут гидролизоваться in vivo до активного 2,4-пиримидиндиаминного лекарственного средства. Соответственно, также предполагается, что соответствующие амино- и тиосоединения, а также соединения, в которых α-аминогруппы и α-тиогруппы замаскированы «защитными» группами, которые удаляются при физиологических условиях применения, давая α-амино- и α-тиогруппы, подобным образом будут давать подходящие пролекарства.
Таким образом, в некоторых вариантах прогруппа(пы) RP в пролекарствах структурных формул (I) и (Ia) имеют формулы -CRdRd-A-R3, где каждый Rd независимо от других выбран из водорода, цианогруппы, -C(O)Re, -C(O)ORe, -C(O)NReRe, -C(ORe)(ORe), необязательно замещенного (C1-C20)алкила, (C1-C20)перфторалкила, необязательно замещенного (C7-C30)арилалкила и необязательно замещенного 6-30-членного гетероарилалкила, где каждый Re независимо от других выбран из водорода, алкила (например, низшего алкила), арила (например, фенила или нафтила), арилалкила (например, бензила), гетероарила и гетероарилалкила; A выбран из O, S и NR50, где R50 выбран из Rd и циклоалкила, или, альтернативно, объединен с R3 так, что R50 и R3вместе с атомом азота, с которым они связаны, образуют трех-семичленный цикл; и R3 означает группу, которая вместе с A метаболизируется в условиях применения, давая промежуточную группу формулы -CRdRd-AH, где Rd и A имеют значения, определенные ранее. Как указано выше, соединения структурной формулы (I) и (Ia), в которых группы RPимеют формулу -CRdRd-AH, спонтанно гидролизуются in vivo, давая активное 2,4-пиримидиндиаминное лекарственное средство.
Механизм, посредством которого группа R3 метаболизируется, давая промежуточную группу -CRdRd-A-H, не является решающим, и может быть обусловлен, например, гидролизом в кислых условиях желудка и/или ферментами, присутствующими в пищеварительном тракте и/или тканях или органах организма. Действительно, группа(пы) R3может быть выбрана так, чтобы она метаболизировалась в конкретном месте в организме. Например, многие сложные эфиры расщепляются в кислых условиях, имеющихся в желудке. В пролекарствах, создаваемых для химического расщепления в желудке до активного 2,4-пиримидиндиамина, можно использовать прогруппы, содержащие такие сложные эфиры. Альтернативно, могут быть получены прогруппы, предназначенные для метаболизма в присутствии ферментов, таких как эстеразы, амидазы, липолазы, фосфатазы, включая АТФазы и киназу и т.д., с получением промежуточной группы формулы -CRdRd-A-H. Прогруппы, содержащие связи, способные метаболизироваться in vivo с образованием такой промежуточной группы, хорошо известны и включают в качестве примера и без ограничения простые эфиры, простые тиоэфиры, силиловые эфиры, силилтиоэфиры, сложные эфиры, сложные тиоэфиры, карбонаты, тиокарбонаты, карбаматы, тиокарбаматы, мочевины, тиомочевины, карбоксамиды и т.д. В некоторых случаях может быть выбрана группа «предшественник», которая окисляется окислительными ферментами, такими как, например, цитохром P450 печени, до метаболизируемой группы.
Природа группы R3 также может быть выбрана так, чтобы придать пролекарству требуемые свойства. Например, могут быть использованы липофильные группы, чтобы уменьшить растворимость в воде, и могут быть использованы гидрофильные группы, чтобы увеличить растворимость в воде. Таким образом могут быть получены пролекарства, специально приспособленные для выбранных способов введения. Группа R3 также может быть предназначена для того, чтобы придать пролекарству другие свойства, например, такие как улучшенное пассивное всасывание в кишечнике, улучшенное опосредованное транспортом всасывание в кишечнике, защита против быстрого метаболизма (пролекарства медленного высвобождения), избирательная в отношении тканей доставка, пассивное обогащение в тканях-мишенях, специфичные для целенаправленной доставки переносчики и т.д. Группы, способные придавать пролекарствам указанные свойства, хорошо известны и описаны, например, в публикации Ettmayer et al., 2004, J. Med. Chem. 47 (10: 2393-2404), описание которой включено в виде ссылки. Все разнообразные группы, описанные в указанных ссылках, могут быть использованы в пролекарствах, указанных в данном описании.
В некоторых вариантах R3 выбран из -Rf, -C(O)Rf, -C(O)NRfRf и -SiRfRfRf, где группы Rf выбраны так, чтобы придать пролекарствам требуемые свойства, обеспечивающие биодоступность, расщепление и/или целенаправленную доставку. В конкретном варианте группы Rf выбраны так, чтобы придать пролекарству более высокую растворимость в воде, чем у лежащего в основе активного 2,4-пиримидиндиаминного лекарственного средства. Таким образом, в некоторых вариантах группы Rf выбраны так, чтобы они, взятые вместе с гетероатомом или группой, с которой они связаны, были гидрофильными по природе. Такие гидрофильные группы могут быть заряженными или незаряженными, как хорошо известно в данной области. В качестве конкретных примеров группы Rf могут быть выбраны из водорода, необязательно замещенного низшего алкила, необязательно замещенного низшего гетероалкила, необязательно замещенного низшего циклоалкила, необязательно замещенного низшего гетероциклоалкила, необязательно замещенного (C6-C10)арила, необязательно замещенного 5-10-членного гетероарила, необязательно замещенного (C7-C18)арилалкила и необязательно замещенного 6-18-членного гетероарилалкила. Природа любого из присутствующих заместителей может широко варьировать, что хорошо известно в данной области. В некоторых вариантах любые присутствующие заместители независимо друг от друга выбраны из Rb, определенных выше.
В конкретном варианте прогруппы на пролекарствах формулы (I) и/или (Ia) имеют формулу -CRdRd-A-R3, где R3 выбран из -(CH2)i-Rb, -C(O)Ra, -C(O)-(CH2)i-Rb, -C(O)O-Ra и -C(O)O-(CH2)i-Rb, где X, Ra, Rb и Rd имеют значения, определенные ранее, и i является целым числом от 0 до 6. Конкретные не ограничивающие примеры типичных повышающих растворимость в воде прогрупп включают, например, и без ограничения такие гидрофильные группы как алкильные, арильные, арилалкильные или циклогетероалкильные группы, замещенные одним или несколькими заместителями: амином, спиртом, карбоновой кислотой, фосфорной кислотой, сульфоксидом, сахаром, аминокислотой, тиолом, полиолом, простым эфиром, простым тиоэфиром и солью четвертичного амина.
Один важный класс прогрупп включает прогруппы, которые содержат фосфатную группу, например, содержащие фосфат прогруппы формулы -(RdRd)y-O-P(O)(OH)2, где Rd имеет значение, определенное выше, и y является целым числом в диапазоне от 1 до 3, обычно 1 или 2. В конкретном варианте каждый Rd независимо от других выбран из водорода, замещенного или незамещенного низшего алкила, замещенного или незамещенного (C6-C14)арила и замещенного или незамещенного (C7-C20)арилалкила.
Не имея намерения быть связанными какой-либо теорией процесса, полагают, что такие содержащие фосфат прогруппы RP действуют в качестве субстратов как щелочной, так и кислой фосфатаз, приводящих к их удалению из пролекарств в физиологических условиях применения. Так как щелочные фосфатазы широко представлены в пищеварительном тракте человека, то содержащие фосфат прогруппы RP, которые могут отщепляться в присутствии щелочных фосфатаз, являются особенно применимыми для приготовления содержащих фосфат пролекарств, предназначенных для перорального введения. Конкретные примеры содержащих фосфат прогрупп RP, подходящих для применения в пролекарствах, предназначенных для перорального введения, включают без ограничения группы формулы -(RdRd)y-O-P(O)(OH)2, в которых каждый Rd независимо от других выбран из водорода и незамещенного низшего алканила. Иллюстративные варианты таких содержащих фосфат прогрупп включают без ограничения -CH2-O-P(O)(OH)2 и -CH2CH2-O-P(O)(OH)2.
Хотя представляют интерес содержащие фосфат пролекарства, подходящие для перорального введения, специалистам в данной области будет понятно, что пролекарства, включающие в себя содержащие фосфат прогруппы RP, могут быть введены другими путями введения, так как фосфатазы распространены по всему организму. Например, было обнаружено, что приведенное в качестве примера пролекарственное соединение 4 метаболизируется до активного лекарственного соединения 1 в экспериментах in vitro, осуществляемых с использованием плазмы крыс, а также препаратов микросом печени и кишечника крыс, что свидетельствует о том, что фосфатазы также присутствуют в плазме. Таким образом, единственным требованием является требование, чтобы конкретная выбранная содержащая фосфат прогруппа RP могла быть удалена в условиях предполагаемого применения.
Не имея намерения быть связанными с какой-либо теорией процесса, полагают, что в том случае, когда y равен 1, содержащие фосфат пролекарства, такие как пролекарства согласно структурной формуле (Ia), метаболизируются до активного соединения 2,4-пиримидиндиамина через соответствующий гидроксиметиламин. Такой метаболизм показан на фиг.1A. Как показано на фиг.1A, удаление остатка фосфорной кислоты из фосфатного пролекарства 16 посредством ферментативного гидролиза дает соответствующий гидроксиметиламин 18, который подвергается гидролизу in vivo, давая формальдегид и активное 2,4-пиримидиндиаминное соединение 10.
Как показано на фиг.1B, полагают, что когда y равен 2 гидролиз in vivo фосфатного пролекарства 26 дает активный 2,4-пиримидиндиамин 10 и енолфосфат, который затем гидролизуется in vivo до ацетальдегида и фосфорной кислоты.
И снова обращаясь к фиг.1A, специалисту в данной области будет понятно, что хотя гидроксиметиламин 18 метаболизируется в физиологических условиях, давая активное соединение 2,4-пиримидиндиамина 10, он является стабильным при pH 7 и поэтому может быть получен и введен в виде гидроксиалкилсодержащего пролекарства активного соединения 10. Таким образом, в некоторых вариантах пролекарств структурной формулы (I) RP означает гидроксиалкилсодержащую прогруппу формулы -CRdRd-OH, где Rd имеет значение, определенное ранее. В конкретном иллюстративном варианте RP означает -CH2OH.
И снова обращаясь к фиг.1A, специалистам в данной области также будет понятно, что фосфатные пролекарства могут быть получены гидролизом in vivo пролекарств в виде сложных фосфатных эфиров, таких как пролекарства в виде сложных фосфатных эфиров 20, и/или окислением in vivo фосфатных пролекарств, таких как фосфитные пролекарства 24. Такие пролекарства в виде сложного фосфатного эфира или фосфита в свою очередь могут быть получены либо окислением, либо гидролизом in vivo пролекарств в виде сложных фосфитных эфиров, таких как пролекарства в виде сложных фосфитных эфиров 22. Соответствующие пролекарства в виде сложного фосфатного эфира, фосфита и сложного фосфитного эфира для получения фосфатного пролекарства 26 показаны на фиг.1B в виде соединений 30, 34 и 32, соответственно. Таким образом, как будет понятно специалистам в данной области, пролекарства, которые содержат предшественники фосфатов, которые могут метаболизироваться в фосфатные группы in vivo, также включены в настоящее изобретение.
В некоторых вариантах таких пролекарств фосфорсодержащая прогруппа RP содержит фосфитную группу. Конкретный иллюстративный вариант таких содержащих фосфит пролекарств включает пролекарственные соединения, в которых прогруппа RP имеет формулу -(CRdRd)y-O-P(OH)(OH), где Rd и y имеют значения, определенные ранее.
В других вариантах таких пролекарств фосфорсодержащая прогруппа RPсодержит группу ациклического сложного фосфатного эфира или сложного фосфитного эфира. Конкретные иллюстративные варианты таких пролекарств в виде ациклических сложных фосфатных эфиров или сложных фосфитных эфиров содержат прогруппы RP формулы -(CRdRd)y-O-P(O)(OH)(ORe), -(CRdRd)y-O-P(O)(ORe)2, -(CRdRd)y-O-P(OH)(ORe) и -(CRdRd)y-O-P(ORe)2, где Re выбран из замещенного или незамещенного низшего алкила, замещенного или незамещенного (C6-C14)арила (например, фенила, нафтила, 4-низшего алкоксифенила, 4-метоксифенила), замещенного или незамещенного (C7-C20)арилалкила (например, бензила, 1-фенилэтан-1-ила, 2-фенилэтан-1-ила), -(CRdRd)y-ORf, -(CRdRd)y-O-C(O)Rf, -(CRdRd)y-O-C(O)ORf, -(CRdRd)y-S-C(O)Rf, -(CRdRd)y-S-C(O)ORf, -(CRdRd)y-NH-C(O)Rf, -(CRdRd)y-NH-C(O)ORf и -Si(Rd)3, где каждый Rf независимо от других выбран из водорода, незамещенного или замещенного низшего алкила, замещенного или незамещенного (C6-C14)арила и замещенного или незамещенного (C7-C20)арилалкила, и Rd и y имеют значения, определенные ранее.
В следующих вариантах фосфорсодержащие пролекарства, которые содержат предшественники фосфата, представляют собой пролекарства, в которых фосфорсодержащая прогруппа RP содержит сложный фосфатный эфир формулы

В следующих вариантах фосфорсодержащие пролекарства, которые содержат предшественники фосфата, представляют собой пролекарства, в которых фосфорсодержащая прогруппа RP содержит циклический сложный фосфитный эфир формулы

В некоторых вариантах заместители Rh таких пролекарств в виде циклических сложных фосфатных эфиров и сложных фосфитных эфиров выбраны так, что прогруппа метаболизируется in vitro ферментами эстеразы. Конкретные примеры таких прогрупп сложного фосфатного эфира и сложного фосфитного эфира включают прогруппы, в которых каждый Rh независимо от других выбран из водорода, низшего алкила, метила, этила и пропила. В некоторых вариантах такие прогруппы выбраны из

Многие указанные сложные фосфатные эфиры и сложные фосфитные эфиры являются кислотолабильными и при пероральном введении метаболизируются до соответствующих фосфатов и фосфитов в кислых условиях желудка и/или кишечника.
Таким образом, в фосфорсодержащих пролекарствах, описанных в данной публикации, природа конкретных используемых фосфорсодержащих прогрупп RP может быть выбрана так, чтобы приспособить пролекарства для конкретных способов доставки и т.д.
Приспособленность любой конкретной прогруппы RP к требуемому способу введения можно подтвердить в биохимических анализах. Например, если пролекарство необходимо ввести путем инъекции в конкретную ткань или орган, и природа различных фосфатаз, экспрессируемых в ткани или органе, известна, то конкретное пролекарство можно тестировать в отношении метаболизма в биохимических анализах с выделенной фосфатазой(ами). Альтернативно, конкретное пролекарство можно тестировать в отношении метаболизма до активного соединения 2,4-пиримидиндиамина с использованием экстрактов ткани и/или органа. Использование экстрактов ткани и/или органа может быть особенно удобным в том случае, когда природа фосфатаз, экспрессируемых в тканях-мишенях или органах-мишенях, неизвестна, или в тех случаях, когда выделенные фосфатазы не являются легко доступными. Специалисты в данной области смогут легко выбрать прогруппы RP, имеющие метаболические свойства (такие как кинетика), подходящие для конкретных применений, с использованием таких тестов in vitro. Конечно, конкретные пролекарства также могут быть тестированы в отношении подходящего метаболизма в моделях на животных in vitro.
В некоторых вариантах пролекарства представляют собой пролекарства согласно структурной формуле (I) или (Ia), которые имеют одно или несколько характерных признаков, выбранных из:
(i) R5 означает фтор;
(ii) R2 означает фенил, необязательно замещенный одной или несколькими одинаковыми или разными группами R8;
(iii) R2 означает 3,4,5-три(низший алкокси)фенил;
(iv) R2 означает 3,4,5-триметоксифенил;
(v) Y или Y1 означает O; Z1 означает CH, Z2 означает N; R17 и R18 каждый означают метил; и R19 и R20, взятые вместе, образуют оксогруппу; и
(vi) RP является гидроксиалкилсодержащей прогруппой формулы -CH2OH или фосфатсодержащей прогруппой формулы -(CRdRd)y-O-P(O)(OH)2, или ее аналогом в виде сложного фосфатного эфира, фосфита или сложного фосфитного эфира, где y равен 1 или 2 и каждый Rd независимо от других выбран из водорода и незамещенного низшего алкила, или
(vii) RP выбран из -CH2OH, CH2-SH, -CH2-NH2, -CH2-NHR50, -CH2-N(R50)2, -CH2-A-Rf, -CH2-A-C(O)Rf, -CH2-A-C(O)ORf и -CH2-A-C(O)NRfRf, где A, R50 и Rf имеют значения, определенные ранее.
В некоторых вариантах пролекарства структурных формул (I) и (Ia) имеют два или три из указанных выше характерных признаков. В одном конкретном варианте пролекарства имеют признаки (i), (iii) и (v). В другом конкретном варианте пролекарства имеют признаки (i), (iv) и (v). В еще одном конкретном варианте пролекарства имеют признаки (i), (iii), (v) и (vi) или (vii). В еще одном конкретном варианте пролекарства имеют признаки (i), (iv), (v) и (vi) или (vii). В еще одном конкретном варианте RP является фосфатсодержащей прогруппой формулы -(CRdRd)y-O-P(O)(OH)2.
Во всех соединениях, описанных в данной публикации, которые содержат альтернативные заместители, которые могут быть замещены, например, такие как некоторые альтернативные заместители, указанные для Rd, Re, Rf, Rg, Rh, Ri и Rj, заместители обычно выбраны независимо друг от друга из числа групп Rb, описанных в связи со структурной формулой (I). В конкретном варианте любые присутствующие заместители независимо друг от друга выбраны из гидроксила, низшей алкоксигруппы, (C6-C14)арилоксигруппы, низшего алкоксиалкила, метоксиметила, метоксиэтила, этоксиметила, этоксиэтила и галогена.
Специалистам в данной области будет понятно, что многим из описанных в данной публикации пролекарств, а также различным видам пролекарств, конкретно описанным и/или проиллюстрированным в данном описании, свойственна таутомерия, конформационная изомерия, геометрическая изомерия и/или оптическая изомерия. Например, пролекарства могут содержать один или несколько хиральных центров и/или двойных связей и вследствие этого могут существовать в виде стереоизомеров, таких как изомеры по двойной связи (т.е. геометрические изомеры), энантиомеры и диастереомеры и их смеси, такие как рацемические смеси. В качестве другого примера пролекарства могут существовать в нескольких таутомерных формах, включая енольную форму, кетоформу и их смеси. В то время как различные названия, формулы и чертежи различных соединений в описании и формуле изобретения могут представлять только одну возможную таутомерную форму или одну форму конформационного изомера, оптического изомера или геометрического изомера, следует понимать, что изобретение охватывает любые таутомерные формы, формы конформационных изомеров, оптических изомеров и/или геометрических изомеров пролекарств, имеющих одно или несколько применений, описанных в данной публикации, а также смеси указанных различных изомерных форм. В случаях ограниченного вращения вокруг остатка 2,4-пиримидиндиамина также возможны атропоизомеры, и они также специально включены в качестве соединений согласно изобретению.
Кроме того, специалистам в данной области будет понятно, что в том случае, когда списки альтернативных заместителей включают члены, которые вследствие требований валентности или по другим причинам не могут быть использованы для замещения конкретной группы, подразумевается, что список необходимо читать в таком контексте, чтобы включить такие представители списка, которые подходят для замещения конкретной группы. Например, специалистам в данной области будет понятно, что хотя все перечисленные альтернативные варианты Rb могут быть использованы для замещения алкильной группы, некоторые альтернативные заместители, такие как =O, не могут быть использованы для замещения фенильной группы. Следует понимать, что имеются в виду только возможные комбинации пар групп-заместителей.
Пролекарства, описанные в данной публикации, можно идентифицировать либо по их химической структуре, либо по их химическому названию. Когда имеется противоречие между химической структурой и химическим названием, химическая структура является определяющей в отношении природы конкретного пролекарства.
В зависимости от природы различных заместителей пролекарства, описанные в данной публикации, могут быть в форме солей. Такие соли включают соли, подходящие для фармацевтических применений («фармацевтически приемлемые соли»), соли, подходящие для ветеринарных применений, и т.д. Такие соли могут быть получены из кислот или оснований, как хорошо известно в данной области.
В одном варианте соль является фармацевтически приемлемой солью. В общем фармацевтически приемлемыми солями являются такие соли, которые по существу сохраняют одну или несколько требуемых фармакологических активностей исходного соединения и которые подходят для введения человеку. Фармацевтически приемлемые соли включают кислотно-аддитивные соли, образованные с неорганическими кислотами или органическими кислотами. Неорганические кислоты, подходящие для образования фармацевтически приемлемых кислотно-аддитивных солей, включают в качестве примера и без ограничения галогенводородные кислоты (например, хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту и т.д.), серную кислоту, азотную кислоту, фосфорную кислоту и тому подобные. Органические кислоты, подходящие для образования фармацевтически приемлемых кислотно-аддитивных солей, включают в качестве примера и без ограничения уксусную кислоту, трифторуксусную кислоту, пропионовую кислоту, капроевую кислоту, циклопентанпропионовую кислоту, гликолевую кислоту, щавелевую кислоту, пировиноградную кислоту, молочную кислоту, малоновую кислоту, янтарную кислоту, яблочную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, пальмитиновую кислоту, бензойную кислоту, 3-(4-гидроксибензоил)бензойную кислоту, коричную кислоту, миндальную кислоту, алкилсульфоновые кислоты (например, метансульфоновую кислоту, этансульфоновую кислоту, 1,2-этандисульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту и т.д.), арилсульфоновые кислоты (например, бензолсульфоновую кислоту, 4-хлорбензолсульфоновую кислоту, 2-нафталинсульфоновую кислоту, 4-толуолсульфоновую кислоту, камфорсульфоновую кислоту и т.д.), 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновую кислоту, глюкогептоновую кислоту, 3-фенилпропионовую кислоту, триметилуксусную кислоту, трет-бутилуксусную кислоту, лаурилсерную кислоту, глюконовую кислоту, глутаминовую кислоту, гидроксинафтойную кислоту, салициловую кислоту, стеариновую кислоту, муконовую кислоту и тому подобные.
Фармацевтически приемлемые соли также включают соли, образованные в том случае, когда протон кислоты, присутствующий в исходном соединении, либо заменяется ионом металла (например, ионом щелочного металла, ионом щелочноземельного металла или ионом аммония), либо координирует с органическим основанием (например, этаноламином, диэтаноламином, триэтаноламином, N-метилглюкамином, морфолином, пиперидином, диметиламином, диэтиламином и т.д.).
Пролекарства, описанные в данной публикации, а также их соли также могут быть в форме гидратов, сольватов и N-оксидов, которые хорошо известны в данной области. Если не оговорено особо, подразумевается, что выражение «пролекарство» охватывает такие соли, гидраты, сольваты и/или N-оксиды. Конкретные иллюстративные соли включают без ограничения одно- и двузамещенные соли натрия, одно- и двузамещенные соли калия, одно- и двузамещенные соли лития, моно- и диалкиламинные соли, однозамещенные соли магния, однозамещенные соли кальция и соли аммония.
6.3 Способы синтеза
Пролекарства, описанные в данной публикации, а также промежуточные соединения могут быть синтезированы множеством различных способов синтеза с применением коммерчески доступных исходных веществ и/или исходных веществ, полученных обычными способами синтеза. Подходящие иллюстративные способы, которые могут быть использованы в стандартном виде и/или адаптированы для синтеза активных соединений 2,4-пиримидиндиамина, можно найти в патенте США No. 5958935, заявке на выдачу патента США с регистрационным No. 10/355543, поданной 31 января 2003 (US2004/0029902A1), международной заявке на выдачу патента с регистрационным No. PCT/US03/03022, поданной 31 января 2003 (WO 03/063794), заявке на выдачу патента США с регистрационным No. 10/631029, поданной 29 июля 2003, международной заявке на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявке на выдачу патента США с регистрационным No. 10/903263, поданной 30 июля 2004 (US2005/0234049), и международной заявке на выдачу патента с регистрационным No. PCT/US2004/24716, описания которых включены в данное описание в виде ссылки. Такие активные соединения 2,4-пиримидиндиамина могут быть использованы в качестве исходных веществ для синтеза пролекарств. Конкретные примеры, описывающие синтез соединения фосфатного пролекарства 4, а также промежуточного продукта его синтеза представлены в разделе «Примеры». Все пролекарства, описанные в данной публикации, могут быть синтезированы посредством стандартной адаптации указанного способа.
Например, некоторые варианты пролекарств согласно структурной формуле (I) и/или (Ia) могут быть получены в результате взаимодействия соответствующего активного 2,4-пиримидиндиамина (т.е. соединений согласно структурным формулам (I) и/или (Ia), в которых каждый RP означает водород) с альдегидом или кетоном с получением α-гидроксиметиламина, который затем может быть подвергнут взаимодействию с электрофилом с получением пролекарства. Типичный синтез такого типа показан на схеме (I) ниже:

На схеме (I) Y1, Z1, Z2, R2, R5, R17, R18, R19 и R20 имеют значения, определенные для структурной формулы (I) или (Ia). R3 и Rd имеют значения, определенные в тексте выше. Согласно схеме (I) активный 2,4-пиримидиндиамин 10 подвергают взаимодействию с кетоном 12, получая смесь четырех продуктов: не прореагировавшее исходное вещество 10 (не показано) и соединения 14a, 14b и 14c. На данной стадии продукты могут быть отделены друг от друга с использованием стандартного способа хроматографии. Взаимодействие с электрофильным R3 дает пролекарства 15a, 15b и 15c.
Как показано выше, α-гидроксиметиламины 14a, 14b и 14c могут быть превращены во множество различных типов пролекарств 15a, 15b и 15c. Например, α-гидроксиметиламины могут быть подвергнуты взаимодействию со спиртом в присутствии в качестве катализатора сильной кислоты, или с углеродсодержащим галогенидом (например, CH3Br), получая соответствующие производные в виде простых эфиров (например, соединения, в которых R3 означает Rf, где Rf имеет значение, определенное ранее).
Взаимодействие α-гидроксиметиламинов 14a, 14b и 14c с карбоновой кислотой в присутствии в качестве катализатора сильной кислоты, или с ангидридом карбоновой кислоты, или с галогенангидридом карбоновой кислоты (например, с соответствующей ловушкой кислоты) дает соответствующие сложноэфирные производные (например, соединения, в которых R3 означает -C(O)Rf, где Rf имеет значение, определенное выше).
Взаимодействие α-гидроксиметиламинов 14a, 14b и 14c со сложным эфиром галогенмуравьиной кислоты (например, Cl-C(O)OCH3) дает соответствующие карбонатные производные (например, соединения, в которых R3 означает -C(O)ORf, где Rf имеет значение, определенное ранее).
Взаимодействие α-гидроксиметиламинов 14a, 14b и 14c с галогенформамидом (например, Cl-C(O)N(CH3)2) дает соответствующие карбаматные или уретановые производные (например, соединения, в которых R3 означает -C(O)NRfRf, где Rf имеет значение, определенное ранее).
Как будет понятно специалистам в данной области, также можно использовать другие защитные группы гидроксила, включая, например, различные защитные группы гидроксила, описанные в Green and Wuts, “Protective Groups in Organic Chemistry” 2d Edition, John Wiley and Sons, New York, pp. 10-142, описание которой включено в данное описание в виде ссылки.
Альтернативно, пролекарства согласно структурным формулам (I) и (Ia) могут быть синтезированы посредством нуклеофильного замещения соответствующих сложных фосфатных эфиров. Пример такого способа синтеза показан на схеме (II) ниже:

Согласно схеме (II) активный 2,4-пиримидиндиамин 10 подвергают взаимодействию с ди-трет-бутилхлорметилфосфатом 13 в присутствии карбоната цезия, получая смесь четырех продуктов: не прореагировавшее исходное вещество 10 (не показано) и сложные фосфатные эфиры 17a, 17b и 17c, которые сами по себе являются пролекарствами, которые описаны в данной публикации. В том случае, когда R2 означает сложный 3,4,5-триметоксифенил, основным продуктом является сложный фосфатный эфир 17a. Взаимодействие указанного сложного фосфатного эфира 17a с R3-AH (где A означает O, S или NR50), дает пролекарство 19. Минорные сложные фосфатные эфиры 17b и 17c могут быть подобным образом подвергнуты взаимодействию с получением соответствующих пролекарств.
Ди-трет-бутилхлорметилфосфат 13 может быть получен из ди-трет-бутилфосфата как показано на схеме (III) ниже:

Согласно схеме (III) ди-трет-бутилфосфат 9 получают из соответствующего ди-трет-бутилфосфита 7, как описано в Krise et al., 1990, J. Med. Chem. 42: 3793-3794. Взаимодействие фосфата 9 с хлорметилхлорсульфатом 11 (доступным из Synergetica, Inc., Sicklerville, NJ 08081), как описано в Mantyla et al., 2002, Tet. Lett. 43:3793-3794, дает ди-трет-бутилхлорметилфосфат 13, который можно использовать, как показано на схеме (II) выше, в виде сырого продукта без очистки.
Хотя на схемах, приведенных выше, изображен синтез пролекарств, которые содержат одну прогруппу, могут быть получены пролекарства, имеющие множество прогрупп, посредством корректировки количества эквивалентов используемого реагента 12 или 13.
В качестве другой альтернативы способа, показанного на схеме (I), гидроксиметиламин 14a может быть получен посредством двухстадийного процесса сначала взаимодействием активного 2,4-пиримидиндиамина 10 с бис-функциональным электрофилом, таким как, например, хлорйодметан (I-CH2Cl), с получением промежуточного соединения, содержащего хлорметил, которое затем может быть гидроксилировано в результате взаимодействия с основным гидроксидом или подвергнуто взаимодействию с различными нуклеофильными реагентами, такими как алкоксиды, амины или сульфид, чтобы получить RP. Конкретные условия осуществления реакций указанного типа, которые можно использовать для синтеза пролекарств, описанных в данной публикации, можно найти, например, в Bansal et al., 1981, J. Pharm. Sci. 70(8): 850-854 и Bansal et al., 1981, J. Pharm. Sci. 70(8): 855-857, описания которых включены в данное описание в виде ссылки.
Типичный путь синтеза, который можно использовать для синтеза приведенного в качестве примера фосфатного пролекарства 16 согласно структурной формуле (Ia), показан на схеме (IV) ниже. Указанный способ может быть стандартным образом адаптирован для синтеза всего диапазона фосфатных пролекарств, указанных в данном описании.

На схеме (IV) Y1, Z1, Z2, R2, R5, R17, R18, R19 и R20 имеют значения, определенные для структурной формулы (I) или (Ia). Согласно схеме (IV) активный 2,4-пиримидиндиамин 10 подвергают взаимодействию с ди-трет-бутилхлорметилфосфатом 13 в присутствии карбоната цезия, получая смесь четырех продуктов: не прореагировавшее исходное вещество 10 (не показано) и соединения 17a, 17b и 17c. В том случае, когда R2 означает 3,4,5-триметилоксифенил, основным продуктом является соединение 17a. На данной стадии основной продукт может быть отделен от минорных продуктов с использованием стандартного способа хроматографии. Удаление трет-бутильных групп дает смесь требуемого продукта 16 и примесей 18 и 10. Требуемый продукт 16 может быть выделен с использованием стандартного способа.
Альтернативный способ получения фосфатного пролекарства 16 показан на схеме (V) ниже.

Согласно схеме (V) взаимодействие активного 2,4-пиримидиндиамина 10 снова дает смесь четырех продуктов: не прореагировавшего пиримидиндиамина 10 (не показано), основного продукта 17a и минорных продуктов 17b и 17c. Основной продукт 17a может быть выделен кристаллизацией (см. раздел «Примеры» в отношении подходящих условий), растворен в смеси уксусной кислоты и воды (4:1 AcOH:H2O) и нагрет до 65°C в течение примерно 3 час с получением фосфатного пролекарства 16 в качестве основного продукта.
Хотя на схемах (IV) и (V) показан синтез фосфатного пролекарства, в котором фосфатная прогруппа представляет собой -CH2-O-P(O)(OH)2, специалистам в данной области будет понятно, что легко могут быть получены фосфатные пролекарства, содержащие другие фосфатные прогруппы, согласно тем же самым способам с применением подходящего реагента 13. Пролекарства в виде сложных фосфатных эфиров, пролекарства в виде фосфитов и пролекарства в виде сложных фосфитных эфиров также могут быть синтезированы посредством стандартной адаптации способов с применением подходящих галогенидов сложного фосфатного эфира, фосфита и сложного фосфитного эфира 13. Иллюстративные способы синтеза пролекарств в виде циклических сложных фосфатных эфиров, которые можно применять в качестве пролекарств в различных приведенных в данном описании способах или превратить в фосфатные пролекарства, показаны на фиг.3. Кроме того, хотя на схемах (I) и (III) изображено соединение 16 в качестве требуемого продукта, пролекарства, имеющие прогруппы в других положениях в молекуле пролекарства, могут быть легко получены, например, выделением минорного продукта 17a или 17b и/или в результате корректировки количества эквивалентов используемого реагента 13.
Как показано на фиг.3, диолы 21 превращают в соответствующие циклические фосфаты 23, используя описанные в литературе способы, которые изображены. Циклические фосфаты 23 превращают в соответствующие сложные хлорметилфосфатные эфиры 25 любым из трех изображенных путей. Соединение 1 превращают в производные, представляющие собой циклические сложные фосфатные эфиры 27, 29 и 31, посредством добавления 25 в условиях, которые описаны ранее для синтеза соединений 17a-c. Производные в виде циклических сложных фосфатных эфиров 27, 29 и 31 превращают в соответствующие фосфатные производные обработкой в кислых условиях, как описано для синтеза соединения 16, или гидрированием с использованием, например, палладиевого катализатора.
Специалистам в данной области будет понятно, что в некоторых случаях активные соединения 2,4-пиримидиндиамина, используемые в качестве исходных веществ, могут содержать функциональные группы, которые требуют защиты во время синтеза. Точная природа любой используемой защитной группы (групп) будет зависеть от природы защищаемой функциональной группы и будет очевидна для специалистов в данной области. Руководство по выбору подходящих защитных групп, а также способов синтеза для их присоединения и удаления можно найти, например, в Greene and Wuts, Protective Groups in Organic Synthesis, 3d Edition, John Wiley and Sons, Inc., New York (1999) и цитированных в указанной работе ссылках (в дальнейшем «Greene and Wuts»).
6.4 Ингибирование каскадов передачи сигналов Fc-рецепторов
Многие пролекарства, описанные в данной публикации, и в частности пролекарства согласно структурным формулам (I) и (Ia), метаболизируются до активных соединений 2,4-пиримидиндиамина, которые ингибируют каскады передачи сигналов Fc-рецепторов, которые наряду с прочим приводят к дегрануляции клеток. В качестве конкретного примера указанные активные соединения ингибируют каскады передачи сигналов FcεRI и/или FcγRI, которые приводят к дегрануляции иммунных клеток, таких как нейтрофильные, эозинофильные, тучные и/или базофильные клетки. Как тучные, так и базофильные клетки играют центральную роль в индуцированных аллергенами заболеваниях, включая, например, аллергический ринит и астму. При действии аллергенов, которые, наряду с прочим, могут представлять собой пыльцу или паразитов, аллерген-специфичные IgE-антитела синтезируются B-клетками, активированными IL-4 (или IL-13) и другими посредниками, с переключением синтеза на синтез специфичных антител класса IgE. Такие специфичные для аллергенов IgE связываются с высокоаффинным FcεRI. При связывании антигена IgE, связанные с FcεRI, поперечно сшиваются, и активируется путь сигнальной трансдукции рецептора IgE, который приводит к дегрануляции клеток и последующему высвобождению и/или синтезу химических медиаторов хозяина, включая гистамин, протеазы (например, триптазу и химазу), липидные медиаторы, такие как лейкотриены (например, LTC4), фактор активации тромбоцитов (PAF) и простагландины (например, PGD2) и ряд цитокинов, включая TNF-α, IL-4, IL-13, IL-5, IL-6, IL-8, GMCSF, VEGF и TGF-β. Высвобождение и/или синтез указанных медиаторов из тучных и/или базофильных клеток отвечает за реакции ранней и поздней стадии, индуцированные аллергенами, и непосредственно связаны с происходящими далее событиями, которые приводят к стойкому воспалительному состоянию.
Молекулярные события в пути сигнальной трансдукции FcεRI, которые приводят к высвобождению предварительно образованных медиаторов вследствие дегрануляции и высвобождению и/или синтезу других химических медиаторов, хорошо известны. FcεRI является гетеротетрамерным рецептором, состоящим из IgE-связывающей альфа-субъединицы, бета-субъединицы и двух гамма-субъединиц (гамма-гомодимер). Поперечное сшивание IgE, связанного с FcεRI, поливалентными связывающими агентами (включая, например, IgE-специфичные аллергены или анти-IgE-антитела или фрагменты) индуцирует быструю ассоциацию и аткивацию Src-родственной киназы Lyn. Lyn фосфорилирует основанные на тирозине мотивы активации иммунорецептора (ITAMS) на внутриклеточных бета- и гамма-субъединицах, что приводит к привлечению дополнительной Lyn к бета-субъединице и киназы Syk к гамма-гомодимеру. Указанные связанные с рецептором киназы, которые активируются внутри- и межмолекулярным фосфорилированием, фосфорилируют другие компоненты пути, такие как киназа Btk, LAT и фосфолипаза C-гамма (PLC-гамма). Активированная PLC-гамма инициирует пути, которые приводят к активации протеинкиназы C и мобилизации Ca2+, которые необходимы для дегрануляции. Поперечное сшивание FcεRI также активирует три основных класса активируемых митогенами протеинкиназ (MAP), т.е. ERK1/2, JNK1/2 и p38. Активация указанных путей является важной для регуляции транскрипции провоспалительных медиаторов, таких как TNF-α и IL-6, а также липидного медиатора лейкотриена C4 (LTC4).
Предполагают, что каскад передачи сигнала FcγRI имеет общие элементы с каскадом передачи сигнала FceRI. Важно, что подобно FcεRI, FcγRI содержит гамма-гомодимер, который фосфорилируется и привлекает Syk, и подобно FcεRI активация каскада передачи сигнала FcγRI приводит, наряду с прочим, к дегрануляции. Другие Fc-рецепторы, которые имеют общий гамма-гомодимер и которые можно регулировать активными соединениями 2,4-пиримидиндиамина, включают без ограничения, FcαRI и FcγRIII.
Анализы in vitro и клеточные анализы, подходящие для подтверждения активности конкретного соединения 2,4-пиримидиндиамина, подробно описаны в заявке на выдачу патента США с регистрационным No. 10/355543, поданной 31 января 2003 (US2004/0029902A1), международной заявке на выдачу патента с регистрационным No. PCT/US03/03022, поданной 31 января 2003 (WO 03/063794), заявке на выдачу патента США с регистрационным No. 10/631029, поданной 29 июля 2003, международной заявке на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявке на выдачу патента США с регистрационным No. 10/903263, поданной 30 июля 2004 (US2005/0234049), и международной заявке на выдачу патента с регистрационным No. PCT/US2004/24716.
Способность конкретного пролекарства метаболизироваться до активного соединения 2,4-пиримидиндиамина в требуемых условиях применения можно подтвердить в анализах in vitro и/или in vivo, как описано ранее.
6.5 Применения композиций
Как обсуждалось ранее, описанные в данной публикации пролекарства, такие как пролекарства согласно структурным формулам (I) и (Ia), метаболизируются при введении животным и человеку до активных соединений, которые ингибируют каскады передачи сигналов Fc-рецепторов, особенно Fc-рецепторов, содержащих гамма-гомодимер, таких как каскады передачи сигнала FcεRI и/или FcγRI, которые приводят, наряду с прочим, к высвобождению и/или синтезу химических медиаторов из клеток, либо посредством дегрануляции, либо посредством других процессов. Как обсуждалось, активные соединения также являются сильными ингибиторами киназы Syk. Вследствие указанных активностей пролекарства таких активных соединений можно применять в различных условиях in vitro, in vivo и ex vivo для регуляции или ингибирования киназы Syk, каскадов передачи сигналов, в которых киназа Syk играет роль, каскадов передачи сигналов Fc-рецепторов и биологических ответов, вызываемых такими каскадами передачи сигналов. Например, в одном варианте пролекарства могут быть использованы для ингибирования киназы Syk, либо in vitro, либо in vivo, практически в любом типе клеток, экспрессирующих киназу Syk. Пролекарства также могут быть использованы для регуляции каскадов сигнальной трансдукции, в которых киназа Syk играет роль. Такие Syk-зависимые каскады сигнальной трансдукции включают без ограничения каскады сигнальной трансдукции FcεRI, FcγRI, FcγRIII, BCR и интегрина. Пролекарства также можно использовать in vitro или in vivo, чтобы регулировать, и в частности ингибировать, клеточные или биологические ответы, вызванные такими Syk-зависимыми каскадами сигнальной трансдукции. Такие клеточные или биологические ответы включают без ограничения респираторный взрыв, адгезию клеток, дегрануляцию клеток, распространение клеток, миграцию клеток, агрегацию клеток, фагоцитоз, синтез и высвобождение цитокинов, созревание клеток и поток Ca2+. Важно, что пролекарства могут быть использованы для ингибирования киназы Syk in vivo в качестве терапевтического подхода к лечению или профилактике заболеваний, опосредованных, либо полностью, либо частично, активностью киназы Syk. Не ограничивающими примерами опосредованных киназой Syk заболеваний, которые можно лечить или предотвращать пролекарствами, являются заболевания, более подробно обсуждаемые ниже.
В другом варианте пролекарства могут быть использованы для регуляции или ингибирования каскадов передачи сигналов Fc-рецепторов и/или опосредованной FcεRI и/или FcγRI дегрануляции в качестве терапевтического подхода к лечению или профилактике заболеваний, характеризуемых, вызванных и/или связанных с высвобождением или синтезом химических медиаторов таких каскадов передачи сигналов Fc-рецепторов или дегрануляции. Такое лечение можно проводить животным в области ветеринарии или человеку. Заболевания, которые характеризуются, вызваны или связаны с таким высвобождением медиаторов, синтезом или дегрануляцией и которые следовательно можно лечить или предотвращать активными соединениями, включают в качестве примера и без ограничения атопические реакции или реакции анафилактической гиперчувствительности или аллергические реакции, аллергии (например, аллергический конъюнктивит, аллергический ринит, атопическую астму, атопический дерматит и пищевые аллергии), неудовлетворительное рубцевание (например, склеродерму, усиленный фиброз, келоиды, постхирургические рубцы, легочный фиброз, спазмы сосудов, мигрень, реперфузионное повреждение и состояние после инфаркта миокарда), заболевания, связанные с разрушением тканей (например, COPD, кардиобронхит и состояние после инфаркта миокарда), заболевания, связанные с воспалением тканей (например, синдром раздраженной кишки, спастический колит и воспалительное заболевание кишечника), воспаление и рубцевание.
Недавние исследования показали, что активация тромбоцитов коллагеном опосредуется тем же путем, который используется иммунными рецепторами, при этом тирозинкиназный мотив иммунорецепторов на FcRγ играет центральную роль (Watson and Gibbons, 1998, Immunol. Today 19: 260-264), а также что FcRγ играет центральную роль в формировании гиперплазии неоинтимы после повреждения баллонным катетером у мышей, наиболее вероятно посредством индуцированной коллагеном активации тромбоцитов и рекрутинга лейкоцитов (Konishi et al, 2002, Circulation 105: 912-916). Таким образом, пролекарства, описанные в данной публикации, также могут быть использованы для ингибирования индуцированной коллагеном активации тромбоцитов и для лечения или профилактики заболеваний, связанных или вызванных такой активацией тромбоцитов, таких как, например, гиперплазия интимы и рестеноз после повреждения сосудов.
Кроме огромного количества заболеваний, обсуждаемых выше, полученные на клетках и животных эмпирические данные подтверждают, что активные соединения 2,4-пиримидиндиамина, описанные в заявке на выдачу патента США с регистрационным No. 10/631029, поданной 29 июля 2003, международной заявке на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявке на выдачу патента США с регистрационным No. 10/903263, поданной 30 июля 2004 (US2005/0234049), и международной заявке на выдачу патента с регистрационным No. PCT/US2004/24716, также применимы для лечения или профилактики аутоиммунных заболеваний, а также различных симптомов, связанных с такими заболеваниями. Таким образом, пролекарства указанных активных соединений применимы для лечения или профилактики таких заболеваний и/или симптомов. Типы аутоиммунных заболеваний, которые можно лечить или предотвращать такими пролекарствами, в общем включают такие заболевания, в которые вовлечено повреждение ткани, которое происходит в результате гуморального и/или опосредованного клетками иммунного ответа на иммуногены или антигены эндогенного и/или экзогенного происхождения. Такие заболевания часто называют заболеваниями, в которые вовлечены неанафилактические (т.е. типа II, типа III и/или типа IV) реакции гиперчувствительности.
Как обсуждалось ранее, реакции гиперчувствительности типа I обычно возникают в результате высвобождения фармакологически активных веществ, таких как гистамин, из тучных и/или базофильных клеток после контакта со специфичным экзогенным антигеном. Как указано выше, такие реакции типа I играют роль в многочисленных заболеваниях, включая аллергическую астму, аллергический ринит и т.д.
Реакции гиперчувствительности типа II (также называемые цитотоксическими, зависимыми от цитолитической функции комплемента или стимулирующими клетки реакциями гиперчувствительности) возникают в том случае, когда иммуноглобулины взаимодействуют с антигенными компонентами клеток или ткани или с антигеном или гаптеном, который оказался тесно связанным с клетками или тканью. Заболевания, которые обычно связаны с реакциями гиперчувствительности типа II, включают без ограничения аутоиммунную гемолитическую анемию, врожденную анемию новорожденных и болезнь Гудпасчера.
Реакции гиперчувствительности типа III (также называемые реакциями гиперчувствительности, связанными с токсическими комплексами, растворимыми комплексами или иммунными комплексами) возникают в результате отложения растворимых циркулирующих комплексов антиген-иммуноглобулин в сосудах или в тканях с сопутствующими острыми воспалительными реакциями в месте отложения иммунных комплексов. Не ограничивающие примеры составляющих прототип заболеваний, связанных с реакциями типа III, включают феномен Артюса, ревматоидный артрит, сывороточную болезнь, системную красную волчанку, некоторые типы гломерулонефрита, рассеянный склероз и буллезный пемфигоид.
Реакции гиперчувствительности типа IV (часто называемые клеточными, опосредованными клетками, реакциями гиперчувствительности замедленного типа или туберкулинового типа) вызваны сенсибилизированными T-лимфоцитами, которые возникают в результате контакта со специфичным антигеном. Не ограничивающими примерами заболеваний, приведенных в качестве заболеваний, в которые вовлечены реакции типа IV, являются контактный дерматит и отторжение аллотрансплантата.
Аутоиммунные заболевания, связанные с любой из описанных выше неанафилактических реакций гиперчувствительности, можно лечить или предотвращать, используя пролекарства согласно структурным формулам (I) и (Ia). В частности, способы можно применять для лечения или профилактики аутоиммунных заболеваний, часто характеризуемых аутоиммунными заболеваниями одного органа или одного типа клеток, включая без ограничения: тиреоидит Хашимото, аутоиммунную гемолитическую анемию, аутоиммунный атрофический гастрит у больных с пернициозной анемией, аутоиммунный энцефаломиелит, аутоиммунный орхит, болезнь Гудпасчера, аутоиммунную тромбоцитопению, симпатическую офтальмию, миастению gravis, диффузный токсический зоб (болезнь Грейвса), первичный билиарный цирроз, хронический агрессивный гепатит, язвенный колит и мембранную гломерулопатию, а также аутоиммунных заболеваний, часто характеризуемых как заболевания, в которые вовлечено системное аутоиммунное расстройство, которые включают без ограничения: системную красную волчанку (СКВ), ревматоидный артрит, синдром Шегрена, синдром Рейтера, полимиозит-дерматомиозит, системный склероз, нодозный полиартрит, рассеянный склероз и буллезный пемфигоид.
Специалистам в данной области будет понятно, что многие перечисленные выше аутоиммунные заболевания связаны с тяжелыми симптомами, ослабление которых обеспечивает существенную терапевтическую пользу даже в тех случаях, когда лежащее в основе аутоиммунное заболевание не может быть ослаблено. Многие такие симптомы, а также лежащие в их основе патологические состояния возникают вследствие активации каскада передачи сигнала FcγR в моноцитах. Так как пролекарства структурных формул (I) и (Ia) метаболизируются до соединений 2,4-пиримидиндиамина, которые являются сильными ингибиторами такой передачи сигнала FcγR в моноцитах и других клетках, то способы находят применение для лечения и/или профилактики множества неблагоприятных симптомов, связанных с перечисленными выше аутоиммунными заболеваниями.
В качестве конкретного примера ревматоидный артрит (RA) обычно приводит к опуханию, боли, потере подвижности и болезненности пораженных суставов в организме. RA характеризуется хроническим воспалением синовии, в которой имеются плотные скопления лимфоцитов. Синовиальная оболочка, которая обычно является однослойной, приобретает повышенную клеточность и принимает форму, сходную с лимфоидной тканью, включая дендритные клетки, T-, B- и NK-клетки, макрофаги и кластеры плазматических клеток. Указанный процесс, а также множество иммунопатологических механизмов, включая образование комплексов антиген-иммуноглобулин, в конечном итоге приводят к нарушению целостности сустава, приводя к деформации, долговременной потере функции и/или эрозии костей в суставе или вблизи сустава. Способы можно применять для лечения или ослабления любого одного, нескольких или всех указанных симптомов RA. Таким образом, полагают, что в контексте RA способы обеспечивают терапевтическую пользу (более широко обсуждаемую ниже) в том случае, когда достигается уменьшение или ослабление любого из симптомов, обычно связанных с RA, независимо от того, приводит ли лечение к сопутствующему лечению лежащего в основе RA и/или к уменьшению количества циркулирующего ревматоидного фактора («RF»).
Американская коллегия ревматологии (ACR) разработала критерии для определения улучшения или клинической ремиссии при RA. Иногда такой параметр ACR20 (критерий ACR для 20% клинического улучшения) требует 20% улучшения счета болезненных и припухлых суставов, а также 20% улучшения 3 из следующих 5 параметров: общая оценка эффективности по мнению пациента, общая оценка эффективности по мнению врача, оценка боли по мнению пациента, оценка потери трудоспособности и уровень острофазовых реагентов. Указанные критерии были увеличены в случае 50% и 70% улучшения в виде ACR50 и ACR70, соответственно. Другие критерии включают критерии Паулюса и радиографическое прогрессирование (например, счет Шарпа).
В некоторых вариантах терапевтическая польза у пациентов, страдающих RA, достигается в том случае, когда у пациента наблюдают ARC20. В конкретных вариантах можно достичь ARC50 или даже ARC70.
Системная красная волчанка («СКВ») обычно связана с такими симптомами, как повышенная температура, боль в суставах (артралгии), артрит и серозит (плеврит или перикардит). В контексте СКВ полагают, что способы приносят терапевтическую пользу в том случае, когда достигается уменьшение или ослабление любого из симптомов, обычно связанных с СКВ, независимо от того, приводит ли лечение к сопутствующему лечению лежащей в основе СКВ.
Рассеянный склероз («РС») травмирует пациента в результате нарушения остроты зрения; стимуляции двойного зрения; нарушения моторных функций, влияющих на походку и работу рук; вызывая недержание кала и мочи; спастичность; и сенсорные недостаточности (тактичной, болевой и температурной чувствительности). В контексте РС полагают, что способы приносят терапевтическую пользу в том случае, когда достигается улучшение или снижение прогрессирования любого одного или нескольких поражающих эффектов, обычно связанных с РС, независимо от того, приводит ли лечение к сопутствующему лечению лежащего в основе РС.
При использовании для лечения или профилактики таких заболеваний пролекарства, описанные в данной публикации, можно вводить отдельно, в виде смесей, содержащих одно или несколько пролекарств, или в смеси или в комбинации с другими средствами, применимыми для лечения таких заболеваний и/или симптомов, связанных с такими заболеваниями. Пролекарства также можно вводить в смеси или в комбинации со средствами, применимыми для лечения других заболеваний или расстройств, такими как стероиды, стабилизаторы мембран, ингибиторы 5LO, ингибиторы синтеза и рецепторов лейкотриенов, ингибиторы переключения на изотип IgE или синтеза IgE, ингибиторы переключения на изотип IgG или синтеза IgG, β-агонисты, ингибиторы триптазы, аспирин, ингибиторы ЦОГ, метотрексат, анти-TNF-средства, ретуксин, ингибиторы PD4, ингибиторы p38, ингибиторы PDE4 и антигистамины, наряду с другими средствами. Пролекарства можно вводить в форме соединений как таковых или в виде фармацевтических композиций, содержащих пролекарство.
Фармацевтические композиции, содержащие пролекарство(ва) могут быть получены обычными способами смешивания, растворения, гранулирования, измельчения для получения драже, эмульгирования, заключения в капсулы, улавливания или лиофилизации. Композиции могут быть приготовлены обычным способом с использованием одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных средств, которые облегчают переработку пролекарств в препараты, которые можно применять фармацевтически.
Пролекарство может быть приготовлено в фармацевтической композиции как таковое или в форме гидрата, сольвата, N-оксида или фармацевтически приемлемой соли, которые описаны ранее. Обычно такие соли лучше растворимы в водных растворах, чем соответствующие свободные кислоты и основания, но также могут быть образованы соли, имеющие более низкую растворимость, чем соответствующие свободные кислоты и основания.
Фармацевтические композиции могут принимать форму, подходящую практически для любого способа введения, включая, например, местное, глазное, пероральное, буккальное, системное, назальное, инъекционное, трансдермальное, ректальное, вагинальное и т.д., или форму, подходящую для введения путем ингаляции или инсуффляции.
Для местного введения пролекарство(ва) может быть приготовлено в виде растворов, гелей, мазей, кремов, суспензий и т.д., которые хорошо известны в данной области.
Системные препараты включают препараты, предназначенные для введения посредством инъекции, например подкожной, внутривенной, внутримышечной, интратекальной или внутрибрюшинной инъекции, а также препараты, предназначенные для трансдермального введения, введения через слизистую оболочку, перорального или легочного введения.
Применимые инъекционные препараты включают стерильные суспензии, растворы или эмульсии активного соединения(ий) в водных или масляных наполнителях. Композиции также могут содержать средства для приготовления препарата, такие как суспендирующее, стабилизирующее и/или диспрегирующее средство. Препараты для инъекции могут быть представлены в дозированной лекарственной форме, например в ампулах или в емкостях, содержащих множество доз, и могут содержать добавленные консерванты.
Альтернативно, инъекционный препарат может быть представлен в форме порошка для перерастворения перед применением в подходящем наполнителе, включая без ограничения стерильную апирогенную воду, буфер, раствор декстрозы и т.д. С этой целью активное соединение(ия) может быть высушено любым известным в данной области способом, таким как лиофилизация, и перерастворен перед применением.
Для введения через слизистую оболочку в препарате используют проникающие средства, подходящие для барьера, через который необходимо проникнуть. Такие проникающие вещества известны в данной области.
Для перорального введения фармацевтические композиции могут иметь, например, форму лепешек, таблеток или капсул, полученных обычными способами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, пептизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); скользящие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие средства (например, картофельный крахмал или гликолят натрий-крахмала); или увлажнители (например, лаурилсульфат натрия). Таблетки могут быть покрыты способами, хорошо известными в данной области, например сахарами, пленками или кишечнорастворимыми покрытиями. Фосфатные пролекарства, в которых прогруппа(пы) имеет формулу -(CRdRd)y-O-P(O)(OH)2, где каждый Rd независимо от других выбран из водорода и низшего алкила, и y равен 1 или 2, и которые имеют растворимость в воде в диапазоне примерно от 0,1 до 1000 мг/мл при физиологическом значении pH, особенно применимы для перорального введения с использованием таблеток и капсул. При введении крысам Sprague-Dawley перорально в капсулах пролекарственное соединение 4 имеет биодоступность в расчете на лекарственное соединение 1 примерно 30% (см. фиг.5), при этом всасывание почти идентично всасыванию активного лекарственного соединения 1 (см. фиг.6). Предполагается, что другие фосфатные пролекарства, имеющие свойства растворимости в воде, сходные со свойствами пролекарственного соединения 4, имеют сходные фармакокинетические свойства.
Конкретный иллюстративный препарат в форме таблеток в случае пролекарственного соединения 4 (а также других содержащих фосфат пролекарств) содержит примерно 50-400 мг пролекарственного соединения (или его соли), примерно от 0,05 до 0,5% масс. коллоидного диоксида кремния, примерно от 0,5 до 5,0% масс. кроскармеллозы натрия, примерно от 0,25 до 5,0% масс. стеарата магния и примерно от 20 до 80% масс. микрокристаллической целлюлозы. При необходимости таблетки могут быть покрыты пленкой, такой как пленка из гипромеллозы, карбоксиметилцеллюлозы или фруктозы, которая необязательно может содержать красители, такие как, например, FD&C синий №1, PD&C зеленый № 3, FD&C желтый № 6 и диоксид титана.
Жидкие препараты для перорального введения могут иметь форму, например, эликсиров, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для перерастворения в воде или другом наполнителе перед применением. Такие жидкие препараты могут быть приготовлены обычными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбитный сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные наполнители (например, миндальное масло, маслянистые сложные эфиры, этиловый спирт, кремофор™ или ректифицированные растительные масла); и консерванты (например, метил- или пропил-пара-гидроксибензоаты или сорбиновая кислота). Препараты также могут содержать подходящие буферные соли, консерванты, корригенты, красители и подсластители.
Препараты для перорального введения соответствующим образом могут быть приготовлены для получения контролируемого высвобождения пролекарства, как хорошо известно.
Для буккального введения композиции могут иметь форму таблеток или лепешек, приготовленных обычным способом.
Для ректального и вагинального путей введения пролекарство(ва) может быть приготовлено в виде растворов (для удерживающих клизм), суппозиториев или мазей, содержащих обычные основы для суппозиториев, такие как масло какао или другие глицериды.
Для назального введения или введения путем ингаляции или инсуффляции пролекарство(ва) может быть легко доставлено в форме аэрозольного спрея из емкости под давлением или распылителя с использованием подходящего газа-распылителя, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, фторуглеродов, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением единицу дозы можно определять благодаря клапану для доставки дозированного количества. Могут быть приготовлены капсулы и картриджи для применения в ингаляторе или инсуффляторе (например, капсулы и картриджи, состоящие из желатина), содержащие порошкообразную смесь соединения и подходящей порошкообразной основы, такой как лактоза или крахмал.
Для глазного введения пролекарство(ва) может быть приготовлено в виде раствора, эмульсии, суспензии и т.д., подходящих для введения в глаза. В данной области известно множество наполнителей, подходящих для введения соединений в глаза. Конкретные не ограничивающие примеры описаны в патенте США No. 6261547, патенте США No. 6197934, патенте США No. 6056950, патенте США No. 5800807, патенте США No. 5776445, патенте США No. 5698219, патенте США No. 5521222, патенте США No. 5403841, патенте США No. 5077033, патенте США No. 4882150 и патенте США No. 4738851.
Для пролонгированной доставки пролекарство(ва) может быть приготовлено в виде депонируемого препарата для введения путем имплантации или внутримышечной инъекции. Пролекарство(ва) может быть приготовлено вместе с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде труднорастворимых производных, например в виде труднорастворимой соли. Альтернативно, можно использовать трансдермальные системы доставки, изготовленные в виде клейкого диска или пластыря, который медленно высвобождает пролекарство(ва) для чрезкожного всасывания. С этой целью можно использовать усилители проницаемости, чтобы облегчить трансдермальное проникновение пролекарства (пролекарств). Подходящие трансдермальные пластыри описаны, например, в патенте США No. 5407713, патенте США No. 5352456, патенте США No. 5332213, патенте США No. 5336168, патенте США No. 5290561, патенте США No. 5254346, патенте США No. 5164189, патенте США No. 5163899, патенте США No. 5088977, патенте США No. 5087240, патенте США No. 5008110 и патенте США No. 4921475.
Альтернативно, можно использовать другие фармацевтические системы доставки. Липосомы и эмульсии являются хорошо известными примерами носителей для доставки, которые можно использовать для доставки пролекарства (пролекарств). Также можно использовать некоторые органические растворители, такие как диметилсульфоксид (ДМСО), хотя обычно ценою более высокой токсичности.
Фармацевтические композиции при необходимости могут быть представлены в виде упаковки или раздаточного устройства, которые могут содержать одну или несколько дозированных форм, содержащих пролекарство(ва). Упаковка, например, может содержать металлическую фольгу или полимерную пленку, например блистерная упаковка. К упаковке или раздаточному устройству могут прилагаться инструкции по введению.
6.6 Эффективные дозы
Пролекарство(ва), описанное в данной публикации, или его композиции обычно будут применяться в количестве, эффективном для достижения планируемого результата, например в количестве, эффективном для лечения или профилактики конкретного заболевания, подвергаемого лечению. Пролекарство(ва) может быть введено терапевтически для достижения терапевтической пользы или профилактически для достижения профилактической пользы. Под терапевтической пользой подразумевают ликвидацию или ослабление лежащего в основе заболевания, подвергаемого лечению, и/или ликвидацию или ослабление одного или нескольких симптомов, связанных с лежащим в основе заболеванием, так что пациент сообщает об улучшении самочувствия или состояния, но тем не менее пациент все еще может быть поражен лежащим в основе заболеванием. Например, введение соединения пациенту, страдающему от аллергии, обеспечивает терапевтическую пользу не только в том случае, когда лежащая в основе аллергическая реакция устранена или ослаблена, но также и тогда, когда пациент сообщает о снижении тяжести или продолжительности симптомов, связанных с аллергией, после воздействия аллергена. В качестве другого примера терапевтическая польза в контексте астмы включает улучшение дыхания после начала астматического приступа или снижение частоты или тяжести астматических приступов. Терапевтическая польза в контексте RA также включает ACR20, или ACR50, или ACR70, которые описаны ранее. Терапевтическая польза также обычно включает остановку или замедление прогрессирования заболевания независимо от того, произошло ли улучшение.
В случае профилактического введения пролекарство(ва) может быть введено пациенту, для которого существует риск развития одного из ранее описанных заболеваний. Например, если неизвестно, имеется ли у пациента аллергия на конкретное лекарственное средство, пролекарство(ва) можно вводить перед введением лекарственного средства, чтобы избежать или ослабить аллергическую реакцию на лекарственное средство. Альтернативно, профилактическое введение можно применять для того, чтобы избежать появления симптомов у пациента, у которого диагностировано лежащее в основе расстройство. Например, пролекарство(ва) можно вводить страдающему аллергией пациенту перед предполагаемым воздействием аллергена. Пролекарство(ва) также можно вводить профилактически здоровым людям, которые многократно подвергаются воздействию агентов, которые, как известно, являются агентами, вызывающими описанные выше заболевания, чтобы предотвратить появление расстройства. Например, пролекарство(ва) можно вводить здоровому человеку, который многократно подвергается воздействию аллергена, который, как известно, индуцирует аллергию, такого как латекс, чтобы попытаться предотвратить развитие аллергии у человека. Альтернативно, пролекарство(ва) можно вводить пациенту, страдающему астмой, перед началом осуществления активностей, которые запускают приступы астмы, чтобы уменьшить тяжесть или полностью избежать астматический приступ.
Количество вводимого пролекарства (пролекарств) будет зависеть от множества факторов, включая, например, конкретное показание, подвергаемое лечению, способ введения, является ли требуемая польза профилактической или терапевтической, тяжесть показания, подвергаемого лечению, и возраст и масса пациента, биодоступность конкретного пролекарства (пролекарств), скорость и эффективность превращения в активное лекарственное соединение при выбранном пути введения, и т.д. Определение эффективной дозы пролекарства (пролекарств) для конкретного применения и способа введения хорошо известно специалистам в данной области.
Эффективные дозы можно сначала оценить в анализах активности и метаболизма in vitro. Например, начальная доза пролекарства для применения на животных может быть приготовлена так, чтобы достичь концентрации в циркулирующей крови или сыворотке метаболита в виде активного соединения, которая равна или выше IC50 конкретного соединения, которую измеряют в анализе in vitro, таком как CHMC или BMMC in vitro и другие анализы in vitro, описанные в заявке на выдачу патента США с регистрационным No. 10/355543, поданной 31 января 2003 (US2004/0029902A1), международной заявке на выдачу патента с регистрационным No. PCT/US03/03022, поданной 31 января 2003 (WO 03/063794), заявке на выдачу патента США с регистрационным No. 10/631029, поданной 29 июля 2003, международной заявке на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявку на выдачу патента США с регистрационным No. 10/903263, поданной 30 июля 2004 (US2005/0234049), и международной заявке на выдачу патента с регистрационным No. PCT/US2004/24716. Расчет доз для достижения таких концентраций в циркулирующей крови или сыворотке с учетом биодоступности конкретного пролекарства в случае требуемого пути введения хорошо известен специалистам в данной области. В отношении руководства читатель может обратиться к Fingl and Woodbury, «General Principles», в: Goodman and Gilman's The Pharmaceutical Basis of Therapeutics, Chapter 1, pp. 1-46, последняя редакция, Pagamonon Press, и к цитированным в указанной работе ссылкам.
Начальные дозы пролекарства также можно оценить на основе данных in vivo, таких как данные, полученные на животных моделях. Модели на животных, применимые для тестирования эффективности активных метаболитов для лечения или профилактики различных заболеваний, описанных выше, хорошо известны в данной области. Подходящие животные модели гиперчувствительности или аллергических реакций описаны в Foster, 1995, Allergy 50 (21 Suppl.): 6-9, обсуждение 34-38, и Tumas et al, 2001, J. Allergy Clin. Immunol. 107(6): 1025-1033. Подходящие модели на животных аллергического ринита описаны в Szelenyi et al., 2000, Arzneimittelforschung 50(11): 1037-42; Kawaguchi et al., 1994, Clin. Exp. Allergy 24(3): 238-244 и Sugimoto et al., 2000, Immunopharmacology 48(1): 1-7. Подходящие модели на животных аллергического конъюнктивита описаны в Carreras et al., 1993, Br. J. Ophthalmol. 77(8): 509-514; Saiga et al., 1992, Ophthalmic Res. 24(1): 45-50, и Kunert et al., 2001, Invest. Ophthalmol. Vis. Sci. 42(11): 2483-2489. Подходящие модели на животных системного мастоцитоза описаны в O'Keefe et al., 1987, J. Vet. Intern. Med. 1(2): 75-80 и Bean-Knudsen et al, 1989, Vet. Pathol. 26(1): 90-92. Подходящие модели на животных синдрома гипер-IgE описаны в Claman et al., 1990, Clin. Immunol. Immunopathol. 56(1): 46-53. Подходящие модели на животных B-клеточной лимфомы описаны в Hough et al., 1998, Proc. Natl. Acad. Sci. USA 95: 13853-13858 и Hakim et al., 1996, J. Immunol. 157(12): 5503-5511. Подходящие модели на животных атопических расстройств, таких как атопический дерматит, атопическая экзема и атопическая астма, описаны в Chan et al., 2001, J. Invest. Dermatol. 117(4): 977-983 и Suto et al., 1999, Int. Arch. Allergy Immunol. 120 (Suppl. 1): 70-75. Модели на животных, подходящие для тестирования биодоступности и/или метаболизма пролекарств в активные метаболиты, также хорошо известны. Специалисты в данной области без труда могут адаптировать такую информацию, чтобы определить дозы конкретных пролекарств, подходящих для введения человеку. Дополнительные подходящие модели на животных описаны в разделе «Примеры».
Дозируемые количества обычно будут в диапазоне примерно от 0,0001 мг/кг/сутки, 0,001 мг/кг/сутки или 0,01 мг/кг/сутки до примерно 100 мг/кг/сутки, но могут быть выше или ниже, в зависимости, наряду с прочими факторами, от активности активного соединения-метаболита, биодоступности пролекарства, кинетики его метаболизма и других фармакокинетических свойств, способа введения и других различных факторов, обсуждаемых выше. Дозируемое количество и интервал можно корректировать индивидуально, чтобы обеспечить уровни в плазме пролекарства (пролекарств) и/или активного метаболита (метаболитов), которые достаточны для поддержания терапевтического или профилактического эффекта. Например, пролекарства можно вводить раз в неделю, несколько раз в неделю (например, через день), один раз в сутки или несколько раз в сутки, в зависимости, наряду с другими факторами, от способа введения, конкретного показания для лечения и решения лечащего врача. В случаях локального введения или избирательного поглощения, таких как местное введение, эффективная локальная концентрация пролекарства (пролекарств) и/или активного соединения(ий)-метаболита(ов) не связаны с концентрацией в плазме. Специалисты в данной области смогут оптимизировать эффективные локальные дозы без чрезмерного экспериментирования.
Предпочтительно, пролекарства будут метаболизироваться в активное соединение (соединения), которое будет обеспечивать терапевтическую или профилактическую пользу, не вызывая существенной токсичности. Токсичность активного и других метаболитов, а также неметаболизированного пролекарства можно определить с использованием стандартных фармацевтических способов. Дозовое соотношение между токсическим и терапевтическим (или профилактическим) эффектами представляет собой терапевтический индекс. Предпочтительно пролекарство (пролекарства), которое имеет высокий терапевтический индекс.
При описании изобретения следующие примеры предлагаются с целью иллюстрации, но не для ограничения.
7. ПРИМЕРЫ
7.1. Синтез пролекарственного соединения 4
7.1.1. N4-(2,2-диметил-4-[(ди-трет-бутилфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 3)
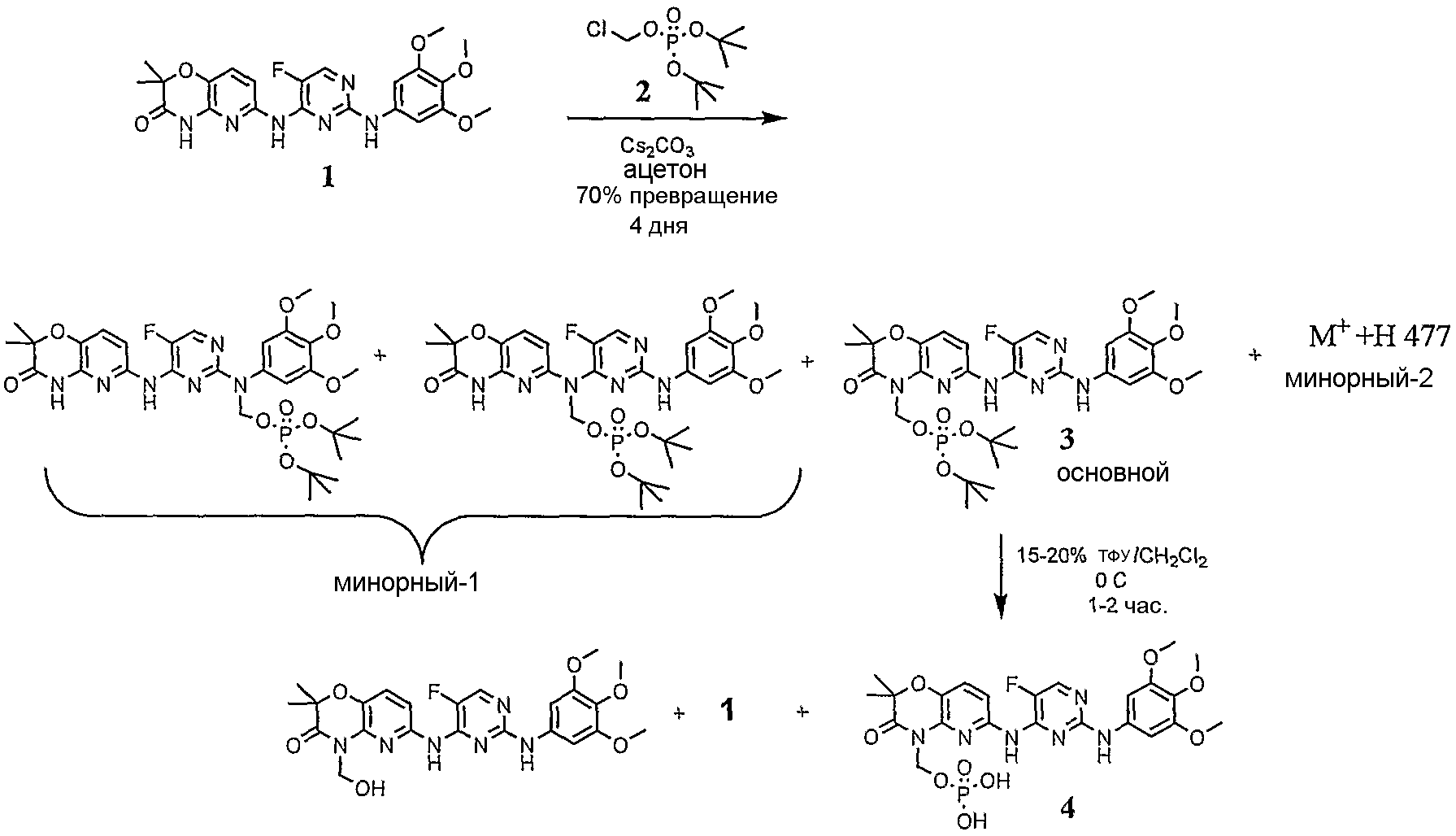
N4-(2,2-диметил-3-оксо-4H-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (1, 1,0 г, 2,12 ммоль), Cs2CO3 (1,0 г, 3,07 ммоль) и ди-трет-бутилхлорметилфосфат (2, 0,67 г, 2,59 ммоль) в ацетоне (20 мл) перемешивали при комнатной температуре в атмосфере азота. Протекание реакции контролировали с помощью ЖХ/МС. Неочищенная реакционная смесь имела три пика продуктов с близким временем удержания с M++H 693 (минорный-1), 693 (основной; 3) и 477 (минорный-2), кроме исходного вещества (соединение 1). При перемешивании содержимого в течение 4 суток (70% расход), реакционную смесь концентрировали и разбавляли водой. Образованный в результате бледно-желтый преципитат собирали фильтрованием и сушили. Неочищенное твердое вещество очищали хроматографией на колонке с силикагелем (предварительно обработанной 10% NEt3/CH2Cl2 с последующим элюированием гексанами) используя градиентное элюирование 70% EtOAc/гексаны - 100% EtOAc). Фракции, содержащие соединение 1 и M++H 693, собирали и концентрировали. Полученное в результате неочищенное белое твердое вещество подвергали повторной очистке способом, подобным способу, который описан ранее, но элюируя 30%-50%-75%-100% EtOAc/гексаны. Пик основного продукта с M++H 693 собирали в виде белого твердого вещества (270 мг, 18%) и характеризовали как N4-(2,2-диметил-4-[(ди-трет-бутилфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 3).1H ЯМР (ДМСО-d6): δ 9,21 (с, 1H), 9,17 (с, 1H), 8,16 (д, 1Н, J=2,6 Гц), 7,76 (д, 1H, J=8,5 Гц), 7,44 (д, 1H, J=8,5 Гц), 7,02 (с, 2H), 5,78 (д, 1H, J3PH=6,1 Гц), 3,64 (с, 6H), 3,58 (с, 3H), (с, 6H), 1,33 (с, 9H). ЖХМС: время удерживания: 14,70 мин; чистота: 95%; MC (m/e): 693 (MH+).31P ЯМР (ДМСО-d6): -11,36.
7.1.2. N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 4)
Трифторуксусную кислоту (1,5 мл) по каплям добавляли в неразбавленном виде в течение 5 мин к N4-(2,2-диметил-4-[(ди-трет-бутилфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамину (соединению 3, 120 мг, 0,173 ммоль), растворенному в CH2Cl2 (10 мл), при 0°C в атмосфере азота. Содержимому давали возможность перемешиваться в течение 1,5 час. Протекание реакции в смеси контролировали, используя ЖХ/МС. После завершения расходования исходного вещества реакционную смесь концентрировали, сушили и растирали в эфире. Эфирный слой декантировали и сушили, получая неочищенное твердое вещество. Анализ ЖХ/МС неочищенного продукта показал три пика с M++H 581, 471 и 501. Пик, соответствующий M++H 581, собирали при хроматографической очистке препаративной ВЭЖХ. Фракции подвергали лиофилизации и сушили, получая 53 мг (52%) не совсем белого рыхлого твердого вещества, которое характеризовали как N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 4).1H ЯМР (ДМСО-d6): δ 9,21 (ушир.с, 2H), 8,16 (д, 1H, J=2,6 Гц), 7,93 (д, 1H, J=8,5 Гц), 7,39 (д, 1H, J=8,5 Гц), 7,05 (с, 2H), 5,79 (д, 1H, J3PH=6,6 Гц), 3,67 (с, 6H), 3,59 (с, 3H), 1,44 (с, 6H). ЖХМС: время удерживания: 8,52 мин; чистота: 95%; MC (m/e): 581 (MH+),31P ЯМР (ДМСО-d6): -2,17.
7.2. Альтернативный синтез пролекарственного соединения 4
Ниже предлагается альтернативный способ синтеза пролекарствнного соединения 4, который снижает необходимость в колоночной хроматографии и очистке ВЭЖХ.
7.2.1. Синтез N4-(2,2-диметил-4-[(ди-трет-бутилфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (соединения 3)

N4-(2,2-диметил-3-оксо-4H-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидинамин (соединение 1, 19,73 г, 41,97 ммоль), Cs2CO3 (15,04 г, 46,16 ммоль) и ди-трет-бутилхлорметилфосфат (13,0 г, 50,38 ммоль) в ДМФА (100 мл) перемешивали при комнатной температуре в атмосфере азота. Протекание реакции контролировали в процессе ЖХ/МС. Неочищенная реакционная смесь имела два пика продуктов (соотношение 1:6,5) с близкими временами удержания с M++H 693 (минорный) и 693 (основной) наряду с исходным веществом (соединение 1). Исходная желтая реакционная смесь превращалась в оливково-зеленую по мере протекания реакции. Обработку осуществляли следующим образом.
1. После перемешивания содержимого в течение 30 час (92% расход) реакционную смесь вливали в ледяную воду (400 мл) и перемешивали содержимое, добавляя насыщенный раствор соли (200 мл). Образовавшееся тонкодисперсное желто-коричневое твердое вещество отфильтровывали, промывали водой и сушили в течение ночи.
2. Твердое вещество (35 г) растворяли в MTBE (500 мл) и промывали водой (400 мл). Водный слой экстрагировали MTBE (2×350 мл) до отсутствия УФ на ТСХ. Объединенные органические слои сушили над безводным Na2SO4 и декантировали.
Примечание: стадия 2 может быть осуществлена непосредственно, однако экстракция ДМФА снова в раствор затрудняет стадию кристаллизации.
3. Темно-красный прозрачный раствор подвергали обработке 10 г активированного угля, нагревали до кипения и фильтровали.
4. Темно-красный прозрачный раствор концентрировали обычным нагреванием до 400 мл объема и оставляли для кристаллизации. Твердое вещество, кристаллизованное в виде гранул, отфильтровывали, гранулы измельчали до порошка, промывали MTBE (400 мл) и сушили в условиях высокого вакуума. См. стадию 7 обработки маточного раствора. Масса твердого вещества: 17 г; чистота: 90% (соединение 3), 6,26% (соединение 1), 1,8% (минорное соединение M+ 693).
5. На данной стадии твердое вещество собирали в 500 мл этилового эфира и нагревали до кипения. Охлаждали и фильтровали, чтобы удалить нерастворенное вещество. Фильтрат концентрировали.
6. Указанный выше концентрат подвергали кристаллизации в MTBE (300 мл). Образованное белое твердое вещество отфильтровывали, промывали MTBE (100 мл) и сушили в условиях высокого вакуума, получая требуемый N4-(2,2-диметил-4-[(ди-трет-бутилфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 3) 97% чистоты.1H ЯМР (ДМСО-d6): δ 9,21 (с, 1H), 9,17 (с, 1H), 8,16 (д, 1H, J=2,6 Гц), 7,76 (д, 1H, J=8,5 Гц), 7,44 (д, 1H, J=8,5 Гц), 7,02 (с, 2H), 5,78 (д, 1H, J3PH=6,1 Гц), 3,64 (с, 6H), 3,58 (с, 3H), 1,45 (с, 6H), 1,33 (с, 9H). ЖХМС: время удерживания: 14,70 мин; чистота: 95%; MC (m/e): 693 (MH+).31P ЯМР (ДМСО-d6): -11,36. Масса твердого вещества: 15,64 г (выход: 55%); чистота: 97% (R935787), 3% (соединение 1).
7. Маточный раствор концентрировали и стадии 5 и 6 повторяли, получая соединение 3.
7.2.2. Синтез N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 4)
N4-(2,2-диметил-4-[(ди-трет-бутилфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 3) (15,0 г, 21,67 ммоль), растворенный в смеси AcOH:H2O (225 мл, 4:1) нагревали при 65°C (температура масляной бани). Протекание реакции контролировали в ходе ЖХ/МС. Реакционная смесь превращалась в белое со слабым желто-коричневым оттенком твердое вещество после 1 час нагревания. В указанной точке большая часть соединения 3 превращалась в моно-дез-трет-бутил-содержащий продукт. После 3 час нагревания наблюдали поглощение исходного вещества и полное превращение промежуточного соединения (моно-дез-трет-бутилированного) в продукт.
Реакционную смесь охлаждали, вливали в ледяную воду (200 мл), перемешивали в течение 20 мин и фильтровали. Белый осадок на фильтре последовательно промывали водой (600 мл) и ацетоном (200 мл), сушили в течение 2 час с последующей сушкой в условиях высокого вакуума над P2O5 в эксикаторе. Масса твердого вещества: 12,70 г; чистота: 97% (соединение 3) и 3% (соединение 1).1H-ЯМР показал наличие уксусной кислоты (1:1).
Чтобы удалить уксусную кислоту, твердое вещество собирали в ацетонитриле (300 мл) и концентрировали в вакууме, используя роторный испаритель. Указанный процесс повторяли 2 раза с ацетонитрилом и толуолом (3×300 мл). Полученное твердое вещество сушили в условиях высокого вакуума при 50°C.
Наконец, твердое вещество собирали в ацетоне (400 мл), фильтровали и сушили, получая N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 4).1H ЯМР (ДМСО-d6): δ 9,21 (ушир.с, 2H), 8,16 (д, 1Н, J=2,6 Гц), 7,93 (д, 1Н, J=8,5 Гц), 7,39 (д, 1H, J=8,5 Гц), 7,05 (с, 2H), 5,79 (д, 1H, J3PH=6,6 Гц), 3,67 (с, 6H), 3,59 (с, 3H), 1,44 (с, 6H). ЖХМС: время удерживания: 8,52 мин; чистота: 95%; MC (m/e): 581 (MH+).31P ЯМР (ДМСО-d6): -2,17.
7.3. Синтез монокальциевой соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (соединение 6)

Водный раствор (10 мл) NaHCO3 (0,17 г, 2,02 ммоль) по каплям добавляли к суспензии N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (0,5 г, 0,86 ммоль) в воде (5 мл) при комнатной температуре при перемешивании содержимого. Образованный прозрачный раствор по каплям обрабатывали водным раствором (10 мл) CaCl2 (0,11 г в 10 мл воды, 0,99 ммоль) при комнатной температуре. Добавление приводило к преципитации белого твердого вещества из реакционной смеси. После завершения добавления содержимое перемешивали в течение 30 мин, фильтровали, промывали водой (40 мл) и сушили. Чистое белое твердое вещество собирали в воде (30 мл) и нагревали на качалке до кипения. Раствор охлаждали, фильтровали и сушили. Белое твердое вещество собирали и затем сушили в условиях высокого вакуума при 80°C в течение 32 час, получая монокальциевую соль 0,41 г (83%) N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (соединение 6).
7.4. Синтез пролекарственного соединения 8

N4-(2,2-диметил-4-[(ди-трет-бутилфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (полученный, как описано выше) (0,2 г, 0,29 ммоль) добавляли к смеси MeOH (5 мл) и Et2O (5 мл). Добавляли 2N водный раствор NaOH (0,023 г, 0,58 ммоль) при перемешивании содержимого при комнатной температуре. Протекание реакции контролировали ЖХ/МС. После перемешивания в течение 8 час преципитированное твердое вещество отфильтровывали и сушили, получая N4-(2,2-диметил-4-метоксиметил-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамин (соединение 8) в виде белого твердого вещества (0,11 г, 74%).1H ЯМР (ДМСО-d6): δ 9,47 (с, 1H), 9,15 (с, 1H), 8,16 (д, 1H, J=3,8 Гц), 7,87 (д, 1H, J=8,5 Гц), 7,37 (д, 1H, J=8,5 Гц), 7,03 (с, 2H), 5,40 (с, 2H), 3,66 (с, 6H), 3,59 (с, 3H), 3,27 (с, 3H), 1,44 (с, 6H). ЖХМС: время удерживания: 12,88 мин; чистота: 92%; MC (m/e): 515 (MH+).
7.5. Активные соединения 2,4-пиримидиндиамина являются переносимыми для животных
Способность многочисленных биологически активных соединений 2,4-пиримидиндиамина проявлять свою активность в дозах ниже тех доз, которые проявляют токсичность у животных, была показана ранее (см., например, заявку на выдачу патента США с регистрационным No. 10/355543, поданную 31 января 2003 (US2004/0029902A1), международную заявку на выдачу патента с регистрационным No. PCT/US03/03022, поданную 31 января 2003 (WO 03/063794), заявку на выдачу патента США с регистрационным No. 10/631029, поданную 29 июля 2003, международную заявку на выдачу патента с регистрационным No. PCT/US03/24087 (WO2004/014382), заявку на выдачу патента США с регистрационным No. 10/903263, поданную 30 июля 2004 (US2005/0234049), и международную заявку на выдачу патента с регистрационным No. PCT/US2004/24716.
Фармакологическую безопасность активного соединения 1 исследовали в основной батарее исследований (дыхательная система, ЦНС, сердечно-сосудистая система и HERG). Небольшое уменьшение частоты сердцебиений и увеличение интервала RR отмечали при концентрации 50 мг/кг в исследовании сердечно-сосудистой системы, и также наблюдали небольшое влияние на некоторые поведенческие параметры при концентрации 50 мг/кг в исследовании ЦНС (Irwin). Во всем остальном в исследованиях фармакологической безопасности определили, что соединение 1 было хорошо переносимым. Токсикологические исследования GLP включали исследования негативной мутагенности и кластогенности (тест Эймса, хромосомные аберрации и микроядра у мышей). В 28-суточных исследованиях токсичности на крысах и обезьянах получены данные об обратимом влиянии высоких доз на гематологию, трансаминазу печени (небольшое влияние только у крыс), размер селезенки и тимуса (только у крыс) и клеточность костного мозга (крысы и обезьяны). Иммунофенотипирование в исследованиях на крысах выявило значительное уменьшение процентного содержания клеток CD3+ при высоких дозах у крыс, в то время как отмечено значимое увеличение количества клеток CD45RA+ после восстановления. Гистопатология заслуживает внимания только в отношении небольшого снижения клеточности костного мозга при высоких дозах. Не получено доказательств в отношении неблагоприятного влияния на гуморальный иммунитет при оценке анти-KLH-антител. Уровень воздействия, при котором не наблюдается неблагоприятный эффект (NOAEL), составляет 10-30 мг/кг/сутки для крыс и 100 мг/кг/сутки для обезьян.
7.6. Лекарственное соединение 1 является биологически активным в анализах in vitro
Соединение 1 блокирует FcεRI-зависимую активацию полученных из пуповинной крови первичных тучных клеток человека (CHMC) зависимым от дозы образом с EC50, составляющее примерно 43 нМ, которую оценивали, измеряя активность триптазы, высвобождаемой при дегрануляции. Соединение 1 не ингибирует индуцированную иономицином дегрануляцию CHMC. Иономицин является кальциевым ионофором, который индуцирует дегрануляцию CHMC, обходя ранние этапы передачи сигнала FcR, что свидетельствует о том, что соединение 1 является специфичным по отношению к передаче сигнала FcR, а не по отношению к дегрануляции как таковой. Соединение 1 также ингибирует зависимую от FcεRI продукцию и высвобождение LTC4 (EC50=39 нМ) и всех тестированных цитокинов (EC50 в диапазоне от 158 нМ до 462 нМ).
7.7. Лекарственное соединение 1 эффективно в моделях ревматоидного артрита на животных
Биологическая активность соединения 1 при IC-опосредованном отеке сосудов (феномен Артюса у крысы), при индуцированном коллагеновыми антителами артрите у мыши и в модели индуцированного коллагеном артрита у крыс.
7.7.1. Феномен Артюса
IC-опосредованное острое воспалительное поражение ткани вовлечено во многие аутоиммунные заболевания человека, включая васкулит, сывороточную болезнь, системную красную волчанку, RA и гломерулонефрит. Классической экспериментальной моделью IC-опосредованного поражения ткани является обратный пассивный феномен Артюса (RPA). Внутривенная инъекция антигена (овальбумин, OVA) после интрадермальной инъекции антител, специфичных к OVA (кроличий анти-OVA-IgG) приводит к периваскулярному отложению ИК и быстрому воспалительному ответу, характеризуемому отеком, инфильтрацией нейтрофилов и геморрагией в местах инъекции (Szalai, et al., 2000, J. Immunol. 164(1): 463-468).
Однократная пероральная обработка крыс соединением 1 за один час до введения антигена/антитела уменьшала кожную реакцию RPA и воспалительный отек зависимым от дозы образом. Пероральное введение 10 мг/кг соединения 1 ингибировало внесосудистую утечку красителя Эванса голубого (OD610) из биопсий ткани на 80% по сравнению с контрольным наполнителем.
7.7.2. Индуцированный коллагеновыми антителами артрит
Противовоспалительную активность соединения 1 оценивали в модели индуцированного коллагеновыми антителами артрита (CAIA) у мышей, в которой для индукции артрита применяют смесь антител против коллагена типа II (Teroto et al., 1992, J. Immunol. 148(7): 2103-2108; McCoy et al., 2002, J. Clin. Invest. 110(5): 651-658; Kagari et al., 2002, J. Immunol. 169(3): 1459-1466). Такая пассивная модель отличается от традиционного индуцированного коллагеном артрита (CIA) у грызунов тем, что симптомы заболевания появляются быстро (развиваясь через 24-48 час после в/в-инъекции антител), артрит индуцируется как у CIA-чувствительных, так и у CIA-резистентных линий мышей, и это позволяет оценивать воспаление, которое не зависит от продукции антител.
CAIA индуцировали у мышей Balb/c внутривенной инъекцией смеси моноклональных антител Arthrogen-CIA® (Chemicon International, Inc., Temecula, CA) через хвостовую вену и спустя 2 суток внутрибрюшинной инъекцией ЛПС. Пероральное лечение соединением 1 начинали не позднее 4 часов после введения антитела (0 день). Тяжесть артрита задних лап оценивали ежедневно (шкала 0-4 на лапу, сумма оценок для обеих задних лап). На 5 день обе контрольные группы, с физиологическим раствором и наполнителем, достигали пиковой клинической оценки с частотой заболевания 100%.
Уменьшенное воспаление и опухание было выражено у животных, которых лечили соединением 1, и артрит прогрессировал медленнее. Лечение соединением 1 (дважды в сутки) значимо снижало клинические признаки артрита (p<0,05) по сравнению с животными, которых лечили только наполнителем, при этом более низкие уровни доз соединения 1 демонстрировали тенденцию к пониженной тяжести заболевания, частоте заболевания и времени проявления; однако различия были незначимыми (p>0,05).
7.7.3. Индуцированный коллагеном артрит
Одной из экспериментальных моделей IC-опосредованного поражения ткани является CIA у грызунов (Kleinau et al., 2000, J. Exp. Med. 191: 1611-1616). Инъекция коллагена типа II (CII) грызунам приводит к иммунной реакции, которая обычно заключается в воспалительном разрушении хряща и кости дистальных суставов с сопутствующим опуханием окружающих тканей. CIA у крыс обычно используют для оценки соединений, которые могут потенциально применяться в качестве лекарственных средств для лечения ревматоидного артрита и других хронических воспалительных состояний, и его индуцируют у чувствительных линий либо мышей, либо крыс инъекцией CII в неполном адъюванте Фрейнда (IFA). Введение указанной эмульсии вызывает полиартрит, характеризуемый гиперплазией синовии, инфильтрацией мононуклеарных клеток, образованием паннуса и деструкцией хряща и кости. Ранее было убедительно подтверждено, что антитела к CII являются необходимым условием для CIA у мышей, так как у мышей с B-клеточной недостаточностью артрит не развивается (Svensson et al., 1998, Clin. Exp. Immunol. 111: 521-526).
Сингенных крыс LOU иммунизировали в 0 день нативным CII цыпленка/IFA. Пероральное лечение начинали при появлении симптомов артрита (10 день). Всего 59 крыс лечили либо контрольным наполнителем, либо соединением 1 при одном из четырех уровней доз (1, 3, 10 и 30 мг/кг, ежедневно посредством кормления через пероральный зонд). Задние конечности оценивали ежедневно в отношении тяжести клинических проявлений артрита, используя стандартизованный способ, основанный на степени воспаления суставов. В конце исследования получали цифровые рентгенограммы с высоким разрешением задних конечностей (28 день). Задние конечности также анализировали в отношении гистопатологических изменений. IgG-антитела к нативному CII измеряли в четырех повторах с помощью ELISA. Имело место значимое снижение (p<0,05) тяжести артрита, которое было выраженным через 7 дней после начала терапии в группе с применением высокой дозы (30 мг/кг), и улучшение продолжалось на всем протяжении исследования. На 28 день клиническая оценка животных, которых лечили только наполнителем, составляла 6,08±0,67, по сравнению с 2,54±0,98 в группе, которую лечили соединением 1 в дозе 30 мг/кг (p<0,001). Слепые рентгенограммы в конце исследования (28 день) показали значимое уменьшение повреждения суставов: 3,66±0,71 (наполнитель) по сравнению с 1,63±0,67 (соединение 1) (p<0,02) (E. Brahn, 2004). Слепые комбинированные гистопатологические исследования подтвердили регрессию паннуса и эрозий: средние модифицированные оценки согласно Mankin составляли 11,8±0,9 (наполнитель) по сравнению с 3,7±0,9 (30 мг/кг соединения 1) (p<0,001). Уровень антитела к нативному CII не снижался у крыс, обработанных соединением 1.
7.8. Пролекарственные соединения являются биодоступными при пероральном введении
Пролекарственное соединение 4 тестировали в отношении биодоступности при пероральном введении. Для исследования пролекарство растворяли в различных наполнителях (например, в растворе ПЭГ 400 и суспензии CMC) для внутривенного и перорального введения доз крысам. В указанных случаях активный метаболит, представляющий собой соединение 1 (лекарственное средство), готовили и вводили в таких же наполнителях. После введения пролекарства и/или лекарственного средства получали образцы плазмы и экстрагировали. Концентрации в плазме пролекарства и/или лекарственного средства определяли способами высокоэффективной жидкостной хроматографии/тандемной масс-спектрометрии (ЖХ/МС/МС). Фармакокинетические анализы осуществляли на основе данных о концентрациях в плазме. Представляющие интерес фармакокинетические параметры включают клиренс (CL), стационарный объем распределения (Vss), конечное время полужизни (t1/2) и биодоступность при пероральном введении (%F).
Результаты указанных различных фармакокинетических экспериментов показаны на фиг.4-11.
Как видно на фиг.4, ФК-профили показаны для в/в- и п/о-введения крысам Spraque-Dawley. В случае в/в-введения соединение 4 растворяли в ПЭГ-400 и вводили в дозе 1 мг/кг. Наблюдали быстрое исчезновение пролекарственного соединения 4 и обнаруживали лекарственное соединение 1 в образцах плазмы, полученных из яремной вены. При пероральном введении в таком же наполнителе пролекарственное соединение 4 не присутствовало системно в организме, но были обнаружены высокие уровни лекарственного метаболита, соединения 1.
На фиг.5 суммированы ФК-параметры исследования, описанного на фиг.4. Пролекарственное соединение 4 подвергалось быстрому клиренсу и частично превращалось в лекарственное соединение 1. При пероральном введении в дозе 4 мг/кг биодоступность определили на уровне 29,9%. Указанное значение биодоступности основано на данных, полученных в результате предшествующего исследования (данные не показаны), в котором лекарственное соединение 1 вводили в виде болюсной в/в-дозы 1 мг/кг.
На фиг.6 приведено сравнение воздействия лекарственного соединения 1 на крыс Sprague-Dawley после перорального введения либо лекарственного соединения 1 (2,5 мг/кг в ПЭГ-400), либо пролекарственного соединения 4 (4 мг/кг в ПЭГ-400). Значения AUC/дозу были почти идентичными, свидетельствуя о том, что пролекарственное соединение 4 всасывается так же, как и лекарственное соединение 1.
На фиг.7 показан график зависимости cLogD от pH, рассчитанной с использованием прогностической оценки in situ соединения 1 и соединения 4. Соединение 1 является высоколипофильным и только слабо ионизируемым (измеряемая растворимость составляет менее 1 мкг/мл в фосфатном буфере при pH 7,5, данные не показаны). Напротив, соединение 4 является высокополярным при нейтральном pH. Измеряемые значения растворимости согласуются с рассчитанными значениями cLogD при pH 7,5.
На фиг.8 показано, что пролекарственное соединение 4 является стабильным в кислых и нейтральных условиях при 37°C.
На фиг.9 показано превращение пролекарственного соединения 4 в лекарственное соединение 1 в препаратах микросом. Пролекарственное соединение 4 не могло превращаться в лекарственное соединение 1 в препаратах микросом, полученных из Xenotech. В последующих исследованиях с использованием микросом из кишечника и печени, полученных из другого источника, наблюдали превращение соединения 4 в соединение 1 (данные не показаны).
Фиг.10 иллюстрирует, что пролекарственное соединение 4 является нестабильным в плазме крыс - наблюдается гидролиз в лекарственное соединение 1, и считают, что превращение в соединение 1 катализируется ферментом фосфатазой. Присутствие фосфатазной активности в плазме крыс подтвердили с использованием пара-нитрофенилфосфата - известного субстрата фосфатазы.
Фиг.11 иллюстрирует всасывание пролекарственного соединения 4 из разных наполнителей. В отличие от лекарственного соединения 1 всасывание пролекарственного соединения 4 не зависит от препарата. Пролекарственное соединение 4 одинаково хорошо всасывается в случае препаратов в виде растворов (ПЭГ-400 и карбоксиметилцеллюлоза (CMC)) и в виде порошка в твердых желатиновых капсулах.
На основании фармакокинетических данных определили, что биодоступность при пероральном введении (%F) пролекарственного соединения 4 из всех трех тестированных наполнителей (раствор в ПЭГ-400; раствор в CMC; и порошок в капсулах) составляла примерно 30%.
ПРИЛОЖЕНИЕ
Пример 1. Синтез гексагидрата динатриевой соли и мононатриевой соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина

В круглодонную колбу помещали 10,00 г N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (соединение 4) и 140 мл воды с получением суспензии, имеющей рН между 3,6 и 3,7. рН доводили до диапазона от 9,3 до 10,3 добавлением 1 М водного NaOH, сначала получая мутный раствор, который при длительном перемешивании обратно превращался в суспензию. Смесь нагревали при температуре кипячения с обратным холодильником, затем горячий мутный раствор фильтровали через фильтровальную бумагу. Твердое вещество, собранное в фильтровальной бумаге, промывали 10 мл горячей воды. К фильтрату добавляли изопропанол (75 мл), получая прозрачный раствор, которому позволяли охладиться до комнатной температуры в течение приблизительно 1,5 часов при перемешивании, в ходе которых осаждалось твердое вещество. Осадок собирали фильтрацией, промывали 47 мл изопропанола и отбирали в 73 мл ацетона с получением суспензии, которую перемешивали в течение 1,5 часов при комнатной температуре. Твердое вещество снова собирали фильтрацией и промывали 18 мл ацетона, затем сушили при приблизительно 40°С в вакууме до удаления по существу всего изопропанола и ацетона (т.е. до уровня менее 0,5 масс.% каждого). Продукт подвергали воздействию воздуха при относительной влажности приблизительно 40% и комнатной температуре до стабилизации содержания воды на уровне приблизительно 15% при титровании Карла Фишера, с получением 8,18 г указанного в заголовке соединения.1Н-ЯМР (D2O): δ 7,67 (d, 1Н, J=3,8 Hz), 7,49 (d, 1Н, J=8,8 Hz), 6,87 (d, 1H, J=8,8 Hz), 6,50 (s, 2H), 5,52 (d, 1H, J3PH=2,0 Hz), 3,53 (s, 3H), 3,47 (s, 6H), 1,32 (s, 6H).31Р-ЯМР (D20): 2,75. Гидрат соли пролекарства получали в качестве чисто-белого высококристаллического материала. Микроскопическое исследование показало, что кристаллиты являются пластинчатыми с размером частиц менее 10 мкм. Микроскопия в поляризованном свете выявила двулучепреломление, подтверждающее кристаллическую природу гидрата. Мононатриевую соль можно получать из N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина и гидроксида натрия путем надлежащего контроля рН; рН 5-5,5 приводит к преимущественному образованию соли мононатрия.
Пример 2. Получение дикалиевой соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина

Суспензию N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина, комплекса уксусной кислоты (1,0 г, 1,56 ммоль), в воде (15 мл) нагревали при 70°С (температура водяной бани) в течение 10 мин (рН 2,9). К указанной выше перемешиваемой суспензии капельно добавляли водный раствор KOH (2,1 М, 1,5 мл), и выявили, что рН составляет 5,9. Одновременно при мониторинге рН капельно добавляли 2,5 М водный раствор KOH. Когда значение рН достигало 10,5 (после 0,95 мл), добавление останавливали и прозрачный раствор перемешивали при той же температуре в течение 15 мин. Теплый раствор фильтровали в коническую колбу и фильтровальную бумагу промывали водой до общего объема 45 мл. Фильтрат переносили на нагревательную плиту и к горячему раствору порционно добавляли изопропанол (175 мл) до тех пор, пока при нагревании сохранялась мутность. Затем капельно добавляли воду только до тех пор, пока раствор не становился прозрачным при температуре кипения. Коническую колбу снимали с нагревательной плиты и позволяли ей охладиться до комнатной температуры. Образовывалось кристаллическое твердое вещество, которое собирали фильтрацией с отсасыванием, промывали минимальным количеством изопропанола и сушили в течение 30 мин. Полученное белое твердое вещество сушили в вакууме в течение ночи при 70°С с получением дикалиевой соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (0,95 г, 1,44 ммоль, 92%, чистый на 99%).1Н-ЯМР (D2O): δ 7, 68 (d, 1Н, J=3,8 Hz), 7,49 (d, 1H, J=8,8 Hz), 6,87 (d, 1H, J=8,8 Hz), 6,51 (s, 2H), 5,52 (d, 1H, J3PH=2,0 Hz), 3,54 (s, 3H), 3,48 (s, 6H), 1,32 (s, 6H).31Р-ЯМР (D2O): 2,7.
Пример 3. Получение соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина с ди-L-аргинином
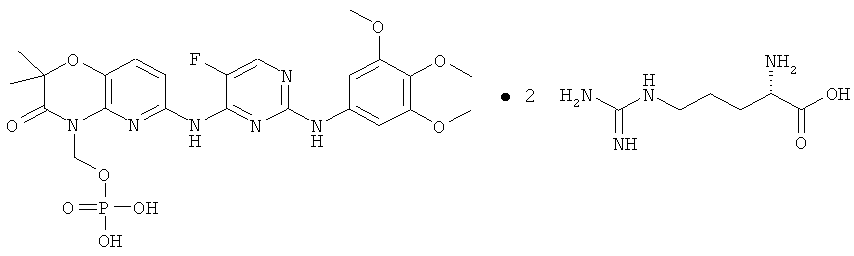
Суспензию N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (0,25 г, 0,43 ммоль) и L-аргинина (0,15 г, 0,86 ммоль) в EtOH (15 мл) нагревали при 90°С (температура масляной бани) в течение 10 мин. К горячей перемешиваемой суспензии капельно добавляли воду (7,5 мл) до тех пор, пока она не становилась прозрачным раствором. После нагревания при перемешивании в течение 1 ч горячий раствор фильтровали во флакон Erlenmeyer. Фильтрат во флаконе Erlenmeyer доводили до кипения на нагревательной плите и позволяли охладиться до комнатной температуры. Образовывалось твердое вещество, которое собирали гравитационной фильтрацией и сушили в вакууме в течение ночи при 80°С с получением гидрата соли рассматриваемого пролекарства (0,28 г, 0,3 ммоль, 69%).1Н-ЯМР (D2O): δ 7, 64 (d, 1Н, J=3,5 Hz), 7,42 (d, 1H, J=8,8 Hz), 6,80 (d, 1H, J=8,8 Hz), 6,45 (s, 2H), 5,53 (d, 1H, J3PH=2,8 Hz), 3,57 (t, 2H, J=6,0 Hz), 3,51 (s, 3H), 3,44 (s, 6H), 3,01 (t, 4H, J=6,5 Hz), 1, 74-1, 69 (m, 4H), 1, 55-1, 46 (m, 4H), 1,30 (s, 6H).31Р-ЯМР (D2O): 2,56.
Пример 4. Получение соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина с ди-L-лизином

Суспензию N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (0,25 г, 0,43 ммоль) и L-лизина (0,125 г, 0,86 ммоль) в EtOH (15 мл) нагревали при 90°С (температура масляной бани) в течение 10 мин. К горячей перемешиваемой суспензии капельно добавляли воду (4,5 мл) пока не образовывался прозрачный раствор. После нагревания и перемешивания в течение 1 ч реакционную смесь фильтровали, охлаждали и концентрировали в вакууме. При добавлении EtOH (5 мл) наблюдали исходный концентрат. После концентрирования смеси полученное твердое вещество перемешивали в течение ночи при комнатной температуре в t-BuOMc. Твердое вещество собирали гравитационной фильтрацией и сушили в вакууме в течение ночи при 80°С (0,32 г, 83%).1H-ЯМР (D2O): δ 7, 67 (d, 1Н, J=3,8 Hz), 7,47 (d, 1H, J=8,8 Hz), 6,84 (d, 1H, J=8,8 Hz), 6,48 (s, 2H), 5,54 (d, 1H, J3PH=3,5 Hz), 3,57 (t, 2H, J=6,0 Hz), 3,51 (s, 3H), 3,44 (s, 6H), 2,86 (t, 4H, J=6,7 Hz), 1, 77-1, 70 (m, 4H), 1,62-1,52 (app q, 4H, J 6,3 Hz), 1,38-1,26 (m, 10Н).31Р-ЯМР (D2O): 2, 59.
Пример 5. Синтез мономагниевой соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4, 5-триметоксифенил)-2,4-пиримидиндиамина

Суспензию дикалиевой соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (0,5 г, 0,76 ммоль) в 10 мл воды помещали на предварительно нагретую масляную баню при 80°С и перемешивали до превращения суспензии в прозрачный раствор. Горячий раствор фильтровали, и фильтровальную бумагу промывали дополнительными 10 мл воды. Прозрачный фильтрат нагревали при перемешивании при 80°С. MgCl2 (0,076 г, 0,8 ммоль) растворяли в воде (10 мл), фильтровали во флакон через фильтровальную колонку (промывая 10 мл воды), и нагревали при 90°С (рН 7,52). К указанному выше раствору MgCl2 капельно добавляли предварительно нагретый раствор дикалиевой соли в течение 15 мин при перемешивании содержимого. Исходная образованная белая пенистая суспензия медленно превращалась в прозрачное белое твердое вещество при нагревании содержимого при 80°С в течение 1,5 ч (рН 6,3-6,7). Твердое вещество собирали фильтрацией с отсасыванием и промывали водой до тех пор, пока ионы хлорида более не выявлялись (тест AgNO3). Твердое вещество сушили с отсасыванием в течение 2 ч, затем подвергали вакуумной сушке при 70°С в течение ночи с получением мономагниевой соли N4-(2,2-диметил-4-[(диводородфосфонокси)метил]-3-оксо-5-пиридо[1,4]оксазин-6-ил)-5-фтор-N2-(3,4,5-триметоксифенил)-2,4-пиримидиндиамина (0,43 мг, 93%).
Исследование стабильности гидратов солей
Гидрат, полученный по примеру 1, подвергали термальному анализу, анализу сорбции влаги, анализу порошковой рентгеновской дифракции (XRPD) для определения его стабильности и кристалличности.
Термограммы дифференциальной сканирующей калориметрии (DSC) получали с использованием DSC Q 100 (ТА Instruments, New Castle, DE). Температурные оси и постоянные ячеек DSC калибровали с помощью индия (10 мг, чистый на 99,9%, температура плавления 156,6°С, нагревание сплава 28,4 Дж/г). Образцы (2,0-5,0 мг) взвешивали в алюминиевых емкостях на аналитических весах. Для анализа использовали алюминиевые емкости без крышек. Образцы уравновешивали при 25°С и нагревали до 250-300°С со скоростью нагревания 10°С/мин при постоянном потоке азота. Термогравиметрический анализ (TGA) образцов проводили с помощью Q50 (ТА Instruments, New Castle, DE). Образцы (2,0-5,0 мг) анализировали в открытых алюминиевых емкостях в потоке азота (50 мл/мин) при от 25°С до 210°С со скоростью нагревания 10°С/мин.
Образцу для анализа увлажнения позволяли высохнуть при 25°С в течение вплоть до 4 часов в потоке сухого азота. Затем относительную влажность постепенно повышали от 10 до 90% относительной влажности (сканирование адсорбции), позволяя образцу уравновешиваться в течение максимум четырех часов перед взвешиванием и переходом на следующую стадию. Сканирование десорбции проводили от 85 до 0% относительной влажности с тем же временем уравновешивания. Затем образец сушили при 80°С в течение 2 часов или до тех пор, пока более не наблюдали уменьшения массы в потоке сухого азота.
Данные рентгеновской порошковой дифракции получали с использованием системы Miniflex Tabletop XRD (Rigaku/MSC, The Woodlands, TX) от 5° до 45° с шагом 0,1°, и время измерения составляло 1,0 секунда/стадия. Все образцы перед воздействием излучения измельчали до сходного размера. Образцы порошка облучали с использованием CuKα-излучения (λ=1,54056 Å) при 30 кВ и 15 мА.
Данные XRPD при переменной температуре получали с использованием Huber Imaging Plate Guinier Camera 670 с использованием Ni-фильтрованного излучения CuKα1 (k=1,5405981 Å), вырабатываемого при 40 кВ и 20 мА генератором Philips PW1120/00, оборудованным длинной острофокусной трубкой Huber PW2273/20 и Huber Guinier Monochromator Series 611/15. Исходный порошок помещали в капилляр Lindemann (Hilgenberg, Germany) с исходным диаметром 1 мм и толщиной стенки 0,01 мм. Образец нагревали со средней скоростью 5 K/мин-1 с использованием модуля Huber High Temperature Controller HTC 9634 с устройством для вращения капилляров 670,2. Температуру держали постоянной при выбранных интервалах в течение 10 мин, в то время как на образец воздействовали рентгеновскими лучами и проводили несколько сканирований. Использовали интервал 2θ 4,00-100,0° с размером шага 0,005° 2θ.
На фиг.12 представлены термограммы DSC и TGA для образца гексагидрата по примеру 1. Термограмма DSC выявила три эндотермических перехода: исходный пик с температурой начала 42,98±2,01°С и максимальной температурой 70,26±1,78°С, сразу за которым следует другая эндотерма с началом 90,33±3,21°С и пиком при 106,19±2,89°С. Величина энтальпии, связанная с первым переходом, составляет 209,70±12,34 Дж/г, в то время как второй переход требует приблизительно 67,24±4,56 Дж/г. Согласно с переходами DSC, анализ TGA указывает на три отдельных стадии снижения массы. В ходе первой стадии образец утрачивает 9,64±0,18% массы с последующим небольшим изменением наклона, ведущим к другому снижению массы 5,13±0,11%. Таким образом, образец утрачивает всего приблизительно 14,74±0,14% вплоть до температуры 150°С. Этот результат согласуется с данными титрования Карла Фишера, которые указывают на то, что содержание воды в образце составляет приблизительно 14,82±0,17%, что соответствует 6 моль воды на 1 моль соли пролекарства. Таким образом, первые два перехода в термальном профиле гекасагидрата по примеру 1 являются следствием дегидратации образца. Конечный переход DSC начинается на уровне 206,54±4,63°С с максимумом пика при 223,35±2,27°С и энтальпией 35,26±5,44 Дж/г, и полагают, что он является следствием плавления. TGA указывает на снижение массы в ходе этого перехода, которое свойственно снижению массы вследствие распада образца.
Профиль сорбции влаги образца гексагидрата по примеру 4, представленный на фиг.13, демонстрирует, что форма гексагидрата является стабильной при широком диапазоне относительной влажности. Когда образец сушат при температуре окружающей среды и приблизительно 0% относительной влажности, образец имеет тенденцию к снижению большей части содержания влаги. Как представлено на фиг.13, содержание влаги в образце составляет приблизительно 4,0% в сухих условиях. Это указывает на то, что при этой низкой влажности утрачивается приблизительно 4 молекулы воды на гексагидрат по примеру 1. Однако как только влажность возрастает, образец вновь приобретает все молекулы воды и возвращается к приблизительно 14,0% содержанию воды. Примечательно, что этот сдвиг от 4,0 до 14,0% воды происходит в очень узком диапазоне (0-10%) относительной влажности. По сравнению с изменением, происходящим в этом узком диапазоне влажности, изменение содержания влаги от 10,0 до 95,0% относительной влажности является небольшим.
Без связи с конкретными объяснениями, авторы изобретения предполагают, что это поведение может быть объяснено поведением изоморфной системы сольват-десольват. При низкой влажности образец теряет большую часть молекул воды, но сохраняет трехмерную организацию кристаллической решетки. Дегидратированная неперестроенная решетка остается крайне гигроскопичной и ресорбирует воду, как только влажность возрастает. После повторной сорбции молекул воды решетка становится стабильной и дальнейшего изменения гидратации не наблюдается.
На фиг.14 представлена рентгенограмма XRPD образца гексагидрата по примеру 1. Как очевидно из рентгенограммы, образец обладает четко определенной кристаллической структурой и высокой степенью кристалличности. Данные XRPD обобщенно представлены в таблицах 1 и 2 ниже.
Данные XRPD с переменной температурой, представленные на фиг.15, обеспечивают дальнейшие доказательства существования изоморфной системы сольват-десольват. Как очевидно из фиг.15, порошковые рентгенограммы, полученные при 25°С и 60°С, являются по существу идентичными. Из термального анализа, описанного выше, известно, что дегидратация образца начинается уже при 40°С и достигает пика на уровне приблизительно 70°С с потерей 4 из 6 его молекул воды. XRPD не указывает на какие-либо структурные изменения при 60°С, подтверждая, что потеря молекул воды не изменяет трехмерную организацию кристаллической решетки. Структурные изменения в образце отмечаются при повышении температуры до приблизительно 110°С. Как показывают термальные данные, при этой температуре утрачиваются практически все молекулы воды. Это указывает на то, что после того как утрачиваются все молекулы воды, кристалл претерпевает структурную перестройку. Как было предположено по утрате пиков в XRPD, по мере повышения температуры кристаллическая решетка разрушается, и материал окончательно распадается.
Проводили рентгенодиффракцию монокристалла гексагидрата по примеру 1, и она показала, что кристалл по изобретению по существу не содержит метанола и содержит шесть молекул воды на молекулу пролекарства. Экспериментально определенные параметры единичной ячейки кристалла и данные сбора параметров для гексагидрата по примеру 1 обобщенно представлены в таблице 3.
Поведение гексагидрата по примеру 1 указывает на то, что можно ожидать, что он обладает длительной стабильностью при хранении. Форма гексагидрата является стабильной при широком диапазоне относительной влажности и требует существенного нагревания (например, выше 40°С) для начала утраты включенных молекул воды. Высокая влажность не влияет на гексагидрат; крайне низкая влажность (т.е. менее 10% RH) может вызвать дегидратацию гексагидрата, однако повторное воздействие условий окружающей среды вызывает обратное изменение гексагидрата. Отсутствие наблюдаемых структурных изменений в условиях низкой влажности и при нагревании вплоть до 110°С позволяет потере воды быть обратимой после охлаждения. Кроме того, гексагидрат по примеру 4 обладает повышенной растворимостью (10 мг/мл в воде) относительно исходного фосфатного пролекарства 4 и кальциевой соли, соли пролекарства 6 (15 мкг/мл в воде).
Реферат
Настоящее изобретение относится к новым пролекарствам биологически активного соединения 2,4-пиримидиндиамина, соответствующего структурной формуле, указанной ниже, ее гидрату, сольвату и их фармацевтически приемлемым солям Соединения обладают свойствами ингибирования каскада передачи сигнала Fc-рецептора, таких как FcαRI, FcγRI, FcγRIII и FcεRI, дегрануляции или активности киназы Syk. Соединения могут быть использованы для лечения или профилактики ревматоидного артрита, аутоиммунных заболеваний. Изобретение также относится к вариантам композиций на основе указанных соединений. Структурная формула: ! ! 3 н. и 22 з.п. ф-лы, 15 ил., 3 табл.
Формула
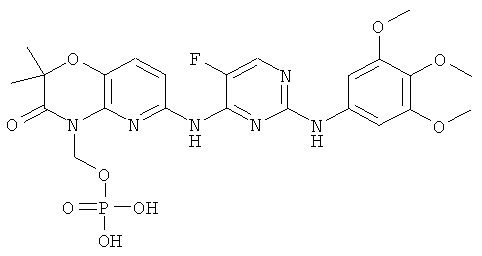
или его фармацевтически приемлемая соль или гидрат, сольват, или их фармацевтически приемлемые соли.

в воде.
Документы, цитированные в отчёте о поиске
Хиназолиновые соединения или их фармацевтически приемлемые соли и фармацевтическая композиция

Комментарии