Замещенные пиразоло[1,5-a]пиримидиновые соединения как ингибиторы трк киназы - RU2523544C2
Код документа: RU2523544C2
Описание
Область техники, к которой относится изобретение
Изобретение касается новых соединений, фармацевтических композиций, содержащих эти соединения, способа получения этих соединений и применения данных соединений в терапии. Более конкретно, оно касается замещенных пиразоло[1,5-а]пиримидиновых соединений, которые проявляют ингибирование Трк семейства протеин-тирозин-киназы и которые применяются в лечении боли, воспалений, рака и некоторых инфекционных заболеваний.
Уровень техники
В современных схемах лечения болевых состояний используется несколько классов соединений. Опиоиды (такие как морфин) имеют несколько недостатков, включая рвотный, закрепляющий и негативный респираторный эффекты, а также обладают недостатком в отношении потенциального привыкания. Нестероидные противовоспалительные анальгетики (NSAIDs, такие как СОХ-1 или СОХ-2) также имеют недостатки, включая недостаточную эффективность в лечении сильной боли. Кроме того, СОХ-1 ингибиторы могут вызывать язвы слизистой оболочки. Соответственно, существует постоянная потребность в новых и более эффективных способах лечения для облегчения боли, особенно хронической.
Трк являются высокоаффинными рецепторными тирозин киназами, которые активируются группой растворимых факторов роста, называемых нейротрофинами (НТ). Трк рецепторное семейство имеет три члена - TrkA, TrkB и TrkC. К нейротрофинам относятся (i) фактор роста нервной ткани (NGF), который активирует TrkA, (ii) выделенный из мозга нейротрофиновый фактор (BDNF) и NT-4/5, которые активируют TrkB, и (iii) NT3, который активирует TrkC. Трк широко экспрессированы в нейронной ткани и задействованы в системах поддержания, живучести и передачи сигнала нейронных клеток (Patapoutian, A. et al., Current Opinion in Neurobiology, 2001, 11, 272-280).
Как было показано, ингибиторы Трк/нейротрофинного пути являются эффективными в многочисленных доклинических животных моделях боли. Например, антагонистические NGF и TrkA антитела (например, RN-624), как было показано, являются эффективными в воспалительных и невропатических животных моделях боли и в клинических испытаниях на человеке (Woolf, C.J. et al. (1994) Neuroscience 62,327-331; Zahn, P.K. et al. (2004) J. Pain 5, 157-163; McMahon, S.В. et al., (1995) Nat. Med. 1, 774-780; Ma, Q.Р. и Woolf, С.J. (1997) Neuroreport 8, 807-810; Shelton, D.L. et al. (2005) Pain 116, 8-16; Delafoy, L. et al. (2003) Pain 105, 489-497; Lamb, К. et al. (2003) Neurogastroenterol. Motil. 15, 355-361; Jaggar, S. I. et al. (1999) Br. J. Anaesth. 83, 442-448). Кроме того, как указывается в недавно опубликованных работах, после воспаления уровни BDNF и TrkB сигнализации в ганглии заднего корешка повышены (Cho, L. et al. Brain Research 1997, 749, 358), и в нескольких исследованиях показано, что антитела, которые снижают передачу сигнала через BDNF/TrkB путь, ингибируют нейронную гиперсенсибилизацию и ассоциированную боль (Chang-Qi, L. et al. Molecular Pain 2008, 4: 27).
Кроме того, было показано, что опухолевые клетки псаммомы, которые поражают макрофаги, прямо стимулируют TrkA, расположенные на периферических болевых нервных волокнах. С использованием разных опухолевых моделей на мышах и крысах было показано, что нейтрализация NGF моноклональным антителом ингибирует боль, связанную с раком, в такой степени, которая сравнима или превосходит обеспечиваемую самой высокой переносимой дозой морфина. Кроме того, активация BDNF/TrkB пути была задействована в многочисленных исследованиях как модулятор различных типов боли, включая боль воспалительного характера (Matayoshi, S., J. Physiol. 2005, 569:685-95), невропатическую боль (Thompson, S.W., Proc. Natl. Acad. Sci. USA 1999, 96: 7714-18) и хирургическую боль (Li, C.-Q. et al.. Molecular Pain, 2008, 4 (28), 1-11). Поскольку TrkA и TrkB киназы могут служить медиатором управляемых NGF биологических реакций, ингибиторы TrkA и/или других Трк киназ могут представлять эффективное средство лечения хронических болевых состояний.
В недавно опубликованной литературе также показано, что гиперэкспрессия, активация, амплификация и/или мутация Трк ассоциируются со многими видами рака, включая нейробластому (Brodeur, G. M., Nat. Rev. Cancer 2003, 3, 203-216), рак яичника (Davidson. В., et al., Clin. Cancer Res. 2003, 9, 2248-2259), рак молочной железы (Kruettgen et al. Brain Pathology 2006, 16: 304-310), рак предстательной железы (Dionne et al., Clin. Cancer Res. 1998, 4 (8): 1887-1898), рак поджелудочной железы (Dang et al., Journal of Gastroenterology and Hepatology 2006, 21 (5): 850-858), множественную миелому (Hu et al., Cancer Genetics and Cytogenetics 2007, 178: 1-10), астроцитому и медуллобластому (Kruettgen et al., Brain Pathology 2006, 16: 304-310), глиому (Hansen et al. Journal of Neurochemistry 2007, 103: 259-275), меланому (Truzzi et al. Journal of Investigative Dermatology 2008, 128 (8): 2031-2040), рак щитовидной железы (Brzezianska et al., Neuroendocrinology Letters 2007, 28 (3), 221-229), аденокарциному легких (Perez-Pinera et al. Molecular and Cellular Biochemistry 2007, 295 (1&2), 19-26), нейроэндокринные опухоли больших клеток (Marchetti et al. Human Mutation 2008, 29 (5), 609-616) и колоректальный рак (Bardelli, A., Science 2003, 300, 949). В доклинических моделях рака Трк ингибиторы являются эффективными как в ингибировании роста опухолей, так и остановке метастаза опухолей. В частности, неселективные маломолекулярные ингибиторы Trk А, В и С и Trk/Fc химер были эффективными как в ингибировании роста опухолей, так и остановке метастаза опухолей (Nakagawara, А. (2001) Cancer Letters 169: 107-114; Meyer, J. et al. (2007) Leukemia, 1-10; Pierottia, M.A. and Greco A., (2006) Cancer Letters 232: 90-98; Eric Adriaenssens, E. et al. Cancer Res (2008) 68: (2) 346-351) (Truzzi et al., Journal of Investigative Dermatology 2008, 128 (8): 2031-2040. Таким образом, ингибитор Трк семейства киназ, как ожидается, имеет применение в лечении рака.
Кроме того, как было показано, ингибирование нейротрофин/Trk пути эффективно в лечении в доклинических моделях заболеваний воспалительного характера. Например, ингибирование нейротрофин/Trk пути было задействовано в доклинических моделях легочных заболеваний, включая астму (Freund-Michel, V; Frossard, N.; Pharmacology & Therapeutics (2008), 117 (1), 52-76), интерстициальный цистит (Hu Vivian Y; et. al. The Journal of Urology (2005), 173 (3), 1016-21), кишечные заболевания, включая язвенный колит и болезнь Крона (Di Mola, F.F, et. al., Gut (2000), 46 (5), 670-678), и кожные заболевания, такие как атопический дерматит (Dou, Y.-C.; et. al. Archives of Dermatological Research (2006), 298 (1), 31-37), экзему и псориаз (Raychaudhuri, S.P. et. al. Journal of Investigative Dermatology (2004), 122 (3), 812-819).
Путь Нейротрофин/Trk, в частности BDNF/TrkB, был также задействован в этиологии нейродегенеративных заболеваний, включая рассеянный склероз, болезни Паркинсона и Альцгеймера (Sohrabji, Farida; Lewis, Danielle K. Frontiers in Neuroendocrinology (2006), 27 (4), 404-414). Модуляция пути нейротрофин/Trk может иметь применение в лечении этих и подобных заболеваний.
TrkA рецептор, как полагают, играет также критическую роль в процессе заболевания, вызванного паразитарной инфекцией Typanosoma cruzi (болезнь Шагаса) в хозяине паразита у человека (de Melo-Jorge, M. et al. Cell Host & Microbe (2007), 1 (4), 251-261). Таким образом, TrkA ингибирование может иметь применение в лечении болезни Шагаса и родственных протозойных инфекционных заболеваний.
Трк ингибиторы могут также найти применение в лечении болезни, связанной с дисбалансом регуляции реконструкции костей, такой как остеопороз, ревматоидный артрит и костный метастаз. Костный метастаз является частым осложнением рака, который встречается у до 70 процентов пациентов с прогрессирующим раком молочной железы или простаты (1) и у приблизительно от 15 до 30 процентов пациентов с раком легких, ободовой кишки, желудка, мочевого пузыря, матки, прямой кишки, щитовидной железы или почек. Остеолитические метастазы могут вызывать сильную боль, патологические переломы, опасную для жизни гиперкальцемию, компрессию спинного мозга и другие нервно-компрессионные синдромы. По этим причинам костный метастаз является серьезным и дорогостоящим осложнением рака. В связи с этим, агенты, которые могут индуцировать апоптоз пролиферирующих остеобластов, были бы очень полезными. Экспрессия TrkA и TrkC рецепторов наблюдалась в области формирования костной ткани в моделях перелома костей на мышах (К.Asaumi, et al., Bone (2000) 26 (6) 625-633). Кроме того, локализация NGF наблюдалась почти во всех клетках, формирующих костную ткань (К.Asaumi, et al.). Недавно было продемонстрировано, что пэн-Трк ингибитор ингибирует передачу сигнала тирозином, активированную нейротрофинами, связывающимися со всеми тремя Трк рецепторами в человеческих hFOB остеобластах (J.Pinski, et al., (2002) 62, 986-989). Эти данные подтверждают правильность логического обоснования для использования Трк ингибиторов в лечении заболеваний, связанных с реконструкцией костной ткани, таких как костный метастаз у больных раком.
Известно несколько классов маломолекулярных ингибиторов Трк киназ, которые, как известно, используются для лечения боли или рака (Expert Opin. Ther. Patents (2009) 19 (3)).
В публикациях международных патентных заявок WO 2006/115452 и WO 2006/087538 описано несколько классов малых молекул, известных как ингибиторы Трк киназ, которые могли бы быть полезными для лечения боли или рака.
Известны пиразоло[1,5-а]пиримидиновые соединения. Например, публикация международной патентной заявки WO 2008/037477 раскрывает пиразоло[1,5-а]пиримидиновые соединения, несущие алкильную, арильную или гетероциклическую группу в 3-положении. Эти соединения заявляются как PI3K и/или mTOR липид-киназные ингибиторы.
В публикации международной патентной заявки WO 2008/058126 раскрыты пиразоло[1,5-а]пиримидиновые соединения, несущие фенильную группу в 3-положении. Эти соединения заявляются как Pim-киназные ингибиторы.
Публикация US 2006/0094699 раскрывает пиразоло[1,5-а]пиримидиновые соединения, несущие -С(=O)NH-фенил, -С(=O)(4-метилпиперидинил) или -С(=O)NMe(СН2-триметилпиразолил) группу в 3-положении, для использования в комбинационной терапии совместно с агонистом глюкокортикоидного рецептора.
Раскрытие изобретения
Как теперь установлено, некоторые пиразоло[1,5-а]пиримидиновые соединения, несущие замещенную арилом или гетероарилом гетероциклическую группу в 5-положении и группу, имеющую формулу NR1C(=O)R2, в 3-положении, где R1 и R2 являются такими, как здесь определено, представляют собой ингибиторы Трк киназ, в частности ингибиторы TrkA и/или TrkB, и они могут использоваться для лечения расстройств и болезней, которые могут лечиться путем ингибирования TrkA и/или TrkB киназ, таких как боль, включая хроническую и острую боль, или рак. Некоторые соединения, которые являются двойными ингибиторами TrkA и TrkB, могут использоваться в лечении множественных типов болей, включая боль воспалительного характера, невропатическую боль, хирургическую боль, и боль, связанную с раком, хирургией и переломом костей. При использования в лечении боли особенно желательно, чтобы соединения были селективны в отношении TrkA и/или TrkB. Кроме того, соединения данного изобретения могут использоваться для лечения рака, воспалений, нейродегенеративных болезней и некоторых инфекционных заболеваний.
Соответственно, один вариант настоящего изобретения представляет соединение общей формулы I:

или его фармацевтически приемлемую соль, где:
R1 представляет собой Н или (1-6С алкил);
R2 представляет собой NRbRc, (1-4С)алкил, (1-4С)фторалкил, CF3, (1-4С)гидроксиалкил, -(1-4 Салкил)hetAr1, -(1-4Салкил)NH2, -(1-4 Салкил)NH(1-4С алкил), -(1-4 Салкил)N(1-4C алкил)2, hetAr2, hetCyc1, hetCyc2, фенил, замещенный, при необходимости, NHSO2(1-4C алкилом) или (3-6С)циклоалкилом, замещенным, при необходимости, (1-4С алкилом), CN, ОН, ОМе, NH2, NHMe, N(CH3)2, F, CF3, CO2(1-4С алкилом), CO2H, С(=O)NReRf или С(=O)ORg;
Rb является Н или (1-6С алкилом);
Rc представляет собой Н, (1-4С)алкил, (1-4С)гидроксиалкил, hetAr3 или фенил, где указанный фенил замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, CN, CF3 и -O(1-4С алкила),
или NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, ОН, (1-4С алкила), (1-4С)алкокси, -ОС(=O)(1-4С алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4С)гидроксиалкила,
или NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеющее, при необходимости, второй гетероатом или группу, выбранную из N, О и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, галогена, CF3, (1-4С)алкила, CO2(1-4С алкила), СО2Н, NH2, NHC(=O)O(1-4C алкила) и оксо,
или NRbRc образует 7-8-членное мостиковое гетероциклическое кольцо с атомом азота, и, при необходимости, имеющее второй гетероатом, выбранный из N и О, где указанное кольцо замещено, при необходимости, CO2(1-4С алкилом);
hetAr1 представляет собой 5-членное гетероарильное кольцо, имеющее в кольце 1-3 атома азота;
hetAr2 представляет собой 5-6-членное гетероарильное кольцо, имеющее, по меньшей мере, один атом азота и, при необходимости, имеющее в кольце второй гетероатом, выбранный, независимо, из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила), галогена, -(1-4С)алкокси и NH(1-4C алкила);
hetCyc1 представляет собой связанное с углеродом 4-6-членное азациклическое кольцо, замещенное, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила) и CO2(1-4С алкила);
hetCyc2 представляет собой пиридиновое или пиридазиноновое кольцо, которое замещено, при необходимости, заместителем, выбранными из (1-4С)алкила;
hetAr3 представляет собой 5-6-членное гетероарильное кольцо, имеющее 1-2 гетероатома, которые выбираются, независимо, из N и О, и, при необходимости, замещенное одним или несколькими заместителями, которые выбираются, независимо, из (1-4С)алкила;
Re представляет собой Н или (1-4С)алкил;
Rf представляет собой Н, (1-4С)алкил или (3-6С)циклоалкил;
или NReRf образует 5-6-членное азациклическое кольцо, имеющее, при необходимости, дополнительный гетероатом, выбранный из N и О, где данное азациклическое кольцо замещено, при необходимости, ОН;
Rg представляет собой Н или (1-6С)алкил;
Y представляет собой (i) фенил, замещенный, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2, или (ii) 5-6-членное гетероарильное кольцо, имеющее гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими галогеновыми атомами;
X отсутствует или представляет собой -CH2-, -CH2CH2-, -СН2О- или CH2NRd-;
Rd представляет собой Н или (1-4С алкил);
R3 представляет собой Н или (1-4С алкил);
каждый R4 выбран, независимо, из галогена, (1-4С)алкила, ОН, (1-4С)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1, 2, 3, 4, 5 или 6.
В некоторых вариантах формулы I, R2 выбран из любого из описанных выше элементов, отличных от С(=O)NReRf или C(=O)ORg.
В некоторых вариантах формулы I, R1 представляет собой водород.
В некоторых вариантах формулы I, R1 представляет собой (1-6С)алкил. Конкретным примером служит метил.
В некоторых вариантах формулы I, R2 представляет собой группу, имеющую формулу NRbRc, такую, что данная группа в 3 положении пиразоло[1,5-а]пиримидинового ядра формулы I имеет формулу -NR1C(=O)NRbRc.
В некоторых вариантах, Rb представляет собой Н или (1-6С алкил).
В некоторых вариантах, Rb является Н. В некоторых вариантах, Rb представляет собой (1-6С алкил), например, Me.
В некоторых вариантах, R2 представляет собой NRbRc, где Rc представляет собой Н, (1-4С)алкил, (1-4С)гидроксиалкил, hetAr3 или фенил, где указанный фенил замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, CN, CF3 и -O(1-4С алкила).
В некоторых вариантах, R2 является NRbRc, где Rc является водородом. В отдельных вариантах группа, представленная NRbRc, является NH2.
В некоторых вариантах, R2 является NRbRc, где Rc представляет собой (1-4С)алкил. Примеры включают метил, этил, пропил, изопропил, бутил, изобутил и тому подобное. В отдельных вариантах группа, представленная NRbRc, включает NHMe, NMe2 и NH(t-бутил).
В некоторых вариантах, R2 является NRbRc, где Rc представляет собой (1-4С)гидроксиалкил. Примеры включают CH2CH2OH и CH2CH2CH2OH. В отдельных вариантах, группа, представленная NRbRc, включает NMe(CH2CH2OH).
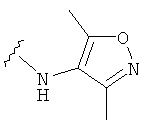
В некоторых вариантах, R2 является NbbRc, где Rc представляет собой hetAr3, и hetAr3 представляет собой замещенное, при необходимости, 5-6-членное гетероарильное кольцо, имеющее 1-2 гетероатома, которые выбираются, независимо, из N и О. Пример hetAr3 включает изоксазолил. В некоторых вариантах, hetAr3 является незамещенным. В других вариантах, hetAr3 замещена одним или несколькими заместителями, которые выбираются, независимо, из (1-4С)алкила, например, одного или нескольких заместителей, которые выбраны, независимо, из метила и этила. Примеры hetAr3 включают диметилизоксазолил. В отдельных вариантах, группа, представленная NRbRc, включает группу, имеющую структуру:
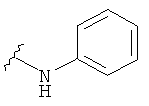
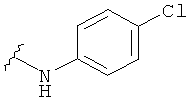
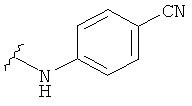
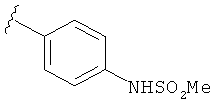
В некоторых вариантах, R2 представляет собой NRbRc, где Rc является фенильной группой, замещенной, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, CN, CF3 и O-(1-4С алкила). Примеры Rc включают фенил, фторфенил, хлорфенил, цианфенил, метоксифенил, трифторметилфенил, дихлорфенил и триметоксифенил. Более конкретные примеры включают 4-фторфенил, 3-хлорфенил, 4-хлорфенил, 3-цианфенил, 4-цианфенил, 4-метоксифенил, 2-4-дихлорфенил, 3-(трифторметил)фенил, 3,5-дихлорфенил и 3,4,5-триметоксифенил. В отдельных вариантах, группа, представленная NRbRc, включает структуры:


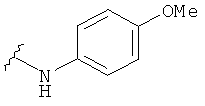


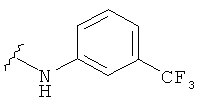


В некоторых вариантах, R2 является NRbRc, где Rc выбрана из Н, Me, t-бутила, CH2CH2OH и CH2CH2CH2OH, диметилизоксазолила, фенила, фторфенила, хлорфенила, цианфенила, метоксифенила, трифторметилфенила, дихлорфенила и триметоксифенила. Более конкрктные примеры включают 4-фторфенил, 3-хлорфенил, 4-хлорфенил, 3-цианфенил, 4-цианфенил, 4-метоксифенил, 2-4-дихлорфенил, 3-(трифторметил)фенил, 3,5-дихлорфенил и 3,4,5-триметоксифенил. В одном варианте, R6 является Н. В одном из вариантов, Rb является (1-6С алкилом), например, метилом.
В некоторых вариантах, R2 является -NRbRc, где:
(i) NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, ОН, (1-4С алкила), (1-4С)алкокси, -ОС(=O)(1-4С алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4С)гидроксиалкила, или
(ii) NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеющее, при необходимости, второй гетероатом или группу, которая выбрана из N, О и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из ОН, галогена, CF3, (1-4С)алкила, СО3(1-4С алкила), СО3Н, NH2, NHC(=O)O(1-4C алкила) и оксо, или
(iii) NRbRc образует 7-8-членное мостиковое гетероциклическое кольцо с атомом азота, и имеющее, при необходимости, второй гетероатом, выбранный из N и О, где указанное кольцо замещено, при необходимости, СО3(1-4С алкилом).
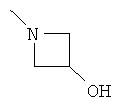
В некоторых вариантах, R2 является -NRbRc, где -NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, ОН, (1-4С алкила), -O(1-4С алкила), -ОС(=O)(1-4С алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4С)гидроксиалкила. Примеры включают азетидиновые кольца, замещенные, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из F, ОН, метила, ОМе, ОС(=O)С(СН3)2, NH2, -NHC(=O)ОС(СН3)2 и CH2OH. Отдельные примеры R2, представленного -NRbRc, где -NRbRc образует 4-членное гетероциклическое кольцо, включают структуры:






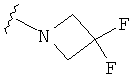
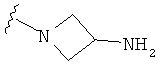
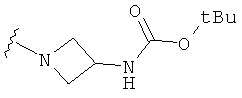
В некоторых вариантах, R2 является -NRbRc, где -NRbRc образует 4-членное азациклическое кольцо, замещенное, при необходимости, одним или двумя заместителями, которые выбираются, независимо, из ОН, (1-4С алкила) и -O(1-4С алкила), например ОН, Me и ОМе.
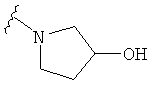
В некоторых вариантах, R2 является -NRbRc, где -NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеющее, при необходимости, второй гетероатом, выбранный из N, О и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из ОН, галогена, CF3, (1-4С)алкила, CO2(1-4С алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо. Примеры включают замещенные, при необходимости, кольца, такие как пирролидинил, пиперидинил, пиперазинил морфолинил и пиперидинсульфон. Примеры заместителей в 5-6-членном гетероциклическом кольце включают ОН, F, NH2, CO2H, CO2Et, NHCO2C(СН3)3, CF3, метил, этил, изопропил, CO2C(СН2)3 и оксо. В одном варианте, данное гетероциклическое кольцо замещено, при необходимости, одним или двумя из указанных заместителей. Отдельные примеры R2, представленной -NRbRc, где -NRbRc образует 5-6-членное гетероциклическое кольцо, включают структуры:

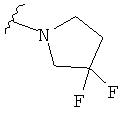
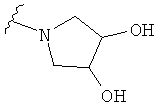
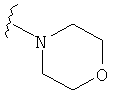
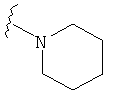


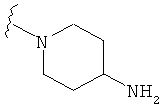

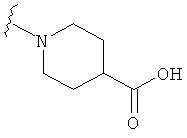
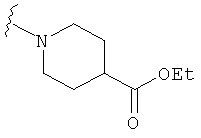

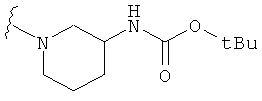
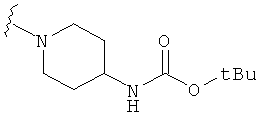



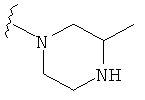

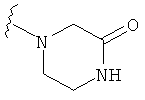
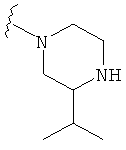


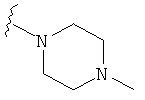
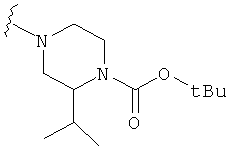

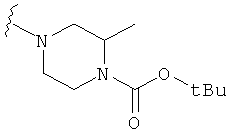
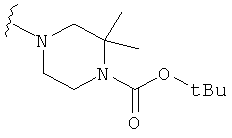
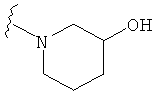
В некоторых вариантах, R2 является -NRbRc, где -NRbRc образует 5-членное гетероциклическое кольцо, замещенное, при необходимости, одним или двумя заместителями, которые выбираются, независимо, из ОН и (1-4С) алкила, например ОН и Me. В некоторых вариантах, -NRbRc образует азациклическое кольцо, замещенное, при необходимости, одним или двумя заместителями, которые выбираются, независимо, из ОН и Me.
В некоторых вариантах, R2 является -NRbRc, где -NRbRc образует 6-членное гетероциклическое кольцо, замещенное, при необходимости, одним или двумя заместителями, которые выбираются, независимо, из ОН и (1-4С) алкила, например ОН и Me.
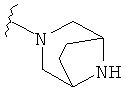
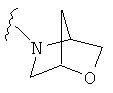
В некоторых вариантах, R2 является -NRbRc, где NRbRc образует 7-8-членное мостиковое гетероциклическое кольцо с атомом азота, и имеющее, при необходимости, второй гетероатом, выбранный из N и О, где указанное кольцо замещено, при необходимости, CO2(1-4С алкилом). Примеры мостиковых гетероциклических колец включают диазабициклооктановые кольца, такие как 3,8-диазабицикло[3.2.1]октановое и окса-азабицикло[2.2.1]гептановое кольца, которые замещены, при необходимости, CO2(1-4С алкилом), таким как CO2C(СН3)3. Отдельные примеры R2, представленной -NRbRc, где -NRbRc образует 7-8-членное мостиковое гетероциклическое кольцо, включают структуры:

В некоторых вариантах, R2 выбран из (1-4С)алкила, (1-4С)фторалкила, CF3, -(1-4С)гидроксиалкила, (1-4С алкил)hetAr1 и -(1-4С алкил)NH(1-4С алкила).
В некоторых вариантах, R2 представляет собой (1-4С)алкил. Отдельные примеры включают метил, изопропил и трет-бутил.
В некоторых вариантах, R2 представляет собой (1-4С)фторалкил. Отдельный пример включает CF(СН3)2.
В некоторых вариантах, R2 является CF3.
В некоторых вариантах, R2 представляет собой (1-4С)гидроксиалкил. Отдельные примеры включают С(СН3)2OH и С(СН3)2CH2OH.
В некоторых вариантах, R2 представляет собой -(1-4С алкил)netAr1, где hetAr1является 5-членным гетероарильным кольцом с 1-3 атомами азота. Примером hetAr является триазолильное кольцо, такое как 1,2,4-триазолил. Примеры (1-4С)алкильной части включают метилен, этилен, диметилметилен и тому подобное. Конкретным примером для R2, представленной -(1-4С алкил)hetAr1, является структура:
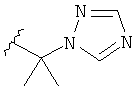
В некоторых вариантах, R2 является -(1-4С алкил)МН(1-4С алкилом). Примеры включают группы, имеющие формулу (1-4С алкил)NHCH3. Конкретный пример включает -C(CH3)2NHCH3.
В некоторых вариантах, R2 выбирается из метила, изопропила, трет-бутила, CF(СН3)2, CF3, С(СН3)2OH и С(СН3)2CH2OH, 2-(1,2,4-триазолил)пропан-2-ила и -С(СН3)2NHCH3.
В некоторых вариантах, R2 является (3-6С циклоалкилом), который, при необходимости, замещен (1-4С)алкилом, CN, ОН, ОМе, NH2, NHMe, N(CH3)2, F, CF3, CO2(1-4С алкилом) или CO2H. В некоторых вариантах, R2 представляет собой циклопропильное кольцо, замещенное, при необходимости, (1-4С алкилом), CN, ОН, CF3, CO2(1-4С алкилом) или CO2H. Конкретные примеры R2 включают структуры:
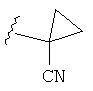

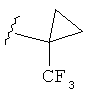


В некоторых вариантах, R представляет собой (3-6С циклоалкил), включая циклопропил, циклобутил и циклопентил, замещенные, при необходимости, (1-4С алкилом), CN, ОН, CF3, CO2(1-4С алкилом) или CO2H. Примеры включают циклобутил и циклопентил, замещенные, при необходимости, ОН. Дополнительные примеры R2включают структуры:
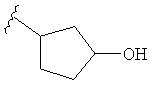
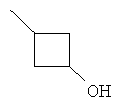
В некоторых вариантах, R2 выбирается из hetAr2, hetCyc1 и hetCyc2.
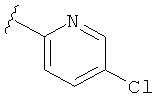
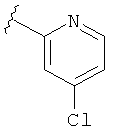
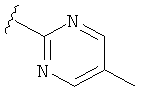
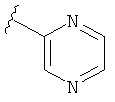
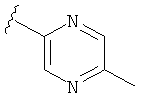
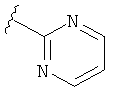
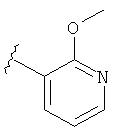
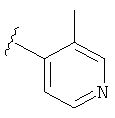
В некоторых вариантах, R2 является hetAr2. Примеры hetAr2 включают пиридил, пиримидил, пиразинил, пиразолил, имидазолил и тиазолил, замещенные, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила), галогена, (1-4С)алкокси и NH(1-4C алкила). Отдельные примеры заместителей для hetAr2 включают метил, этил, хлор, ОМе и NHCH(CH3)2. В некоторых вариантах, hetAr2 замещена, при необходимости, 1 или 2 из указанных заместителей. Конкретные примеры R2, представленной hetAr2, включают структуры:
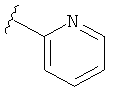

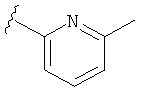
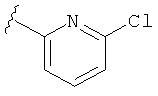








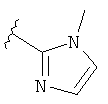
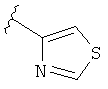
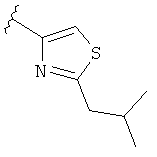
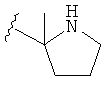
В некоторых вариантах, R2 является hetCyc1. Примеры hetCyc1 включают связанные с углеродом азетидинил, пирролидинил и пиперидинил, замещенные, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила), CO2H и CO2(1-4С алкила). Примеры заместителей включают метил, этил, пропил, СО3Ме, CO2Et и CO2C(СН3)3. В одном варианте, группа hetCyc1 замещена, при необходимости, одним или двумя из указанных заместителей. Конкретные примеры для R2, представленного hetCyc1, включают структуры:
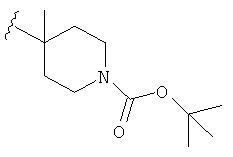


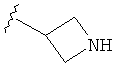
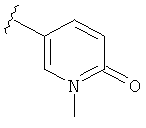
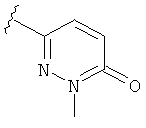
В некоторых вариантах, R2 является hetCyc2. Примеры включают пиридинон или пиридазинон, замещенные, при необходимости, заместителем, выбранным из (1-4С)алкила, такого как метильная или этильная группа. Отдельные примеры R2, представленной hetCyc2, включают структуры:
В некоторых вариантах, R выбирается из (i) пиридила, пиримидила, пиразинила, пиразолила, имидазолила и тиазолила, замещенных, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила), галогена, (1-4С)алкокси и NH(1-4C алкила); (ii) связанных с углеродом азетидинила, пирролидинила и пиперидинила, замещенных, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила), CO2H и СО3(1-4С алкила); и (iii) пиридинона или пиридазинона, которые замещены, при необходимости, заместителем, выбранным из (1-4С)алкила.
В некоторых вариантах, R2 выбирается из следующих структур:



























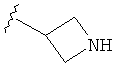


В некоторых вариантах, R2 является фенилом, который замещен, при необходимости, NHSO2(1-4C алкил) группой, такой как метансульфонамидогруппа. Отдельные примеры для R2 включают следующие структуры:


В некоторых вариантах, R2 является С(=O)NReRf или С(=O)ORg.
В некоторых вариантах, R2 является C(O=)NReRf. В некоторых вариантах, Re представляет собой Н или (1-4С)алкил, и Rf является Н, (1-4С)алкилом или (3-6С)циклоалкилом. Отдельные примеры для R2 включают C(=O)NH2, C(=O)NMe, C(=O)NMe2 и С(=O)NH-циклопропил.
В некоторых вариантах, R2 является С(=O)NReRf, где NReRf образует 4-6-членное азациклическое кольцо, имеющее, при необходимости, дополнительный гетероатом, выбранный из N и О, где данное азациклическое кольцо замещено, при необходимости, ОН. Отдельные примеры для R2 включают структуры:

В некоторых вариантах, R2 является С(=O)ORg. Отдельные примеры включают С(=O)ОН и С(=О)Ме.
Что касается заместителей в кольце, находящемся в 5-положении формулы I, в одном варианте Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2. В одном варианте, Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из F, Cl, ОМе, CF3 и CHF2. В некоторых вариантах, Y является фенилом, который замещен, при необходимости, одним или двумя из указанных заместителей. Отдельные примеры для Y включают фенил, 3-фторфенил, 2,5-дифторфенил, 2-хлор-5-фторфенил, 2-метоксифенил, 2-метокси-5-фторфенил, 2-трифторметил-5-фторфенил, 2-дифторметил-5-фторфенил и 3-хлор-5-фторфенил.
В одном варианте, Y является 5-6-членным гетероарильным кольцом с гетероатомом, выбранным из N и S, и которое замещено, при необходимости, одним или несколькими атомами галогена. Примеры включают пиридил и тиенил, замещенные, при необходимости, одним или несколькими атомами галогена, например одним или несколькими атомами фтора. Отдельные примеры для Y включают 2-пиридил, 3-пиридил, 5-фторпирид-3-ил и 2-тиенил.
В одном варианте, Y группа имеет абсолютную конфигурацию формулы Ia:

Что касается заместителя R3, в одном варианте R3 является Н. В одном варианте, R3 является (1-4С)алкилом, например метилом, этилом, пропилом, изопропилом или бутилом. Отдельные примеры для R3 включают водород и метил.
Что касается заместителя R4, в одном варианте R4 является галогеном. Отдельными примерами служат фтор и хлор.
В одном варианте, R4 является (1-4С)алкилом, таким как метил, этил, пропил, изопропил или бутил. Отдельным примером является метил.
В одном варианте, R4 является ОН.
В одном варианте, R4 является (1-4С)алкокси, например ОМе и OEt.
В одном варианте, R4 является NH2.
В одном варианте, R4 представляет собой NH(1-4C алкил), например NHMe, NHEt, NHPr, NHiPr или NHBu. Отдельным примером является NHMe.
В одном варианте, R4 является CH2OH.
В одном варианте, каждая R4 выбирается, независимо, из F, Cl, ОН, ОМе, NH2, Me, CH2OH и NHMe.
В одном варианте, n равняется 0, 1, 2, 3 или 4. В одном варианте, n равняется 0, 1, 2 или 3. В одном варианте, n равняется 0, 1 или 2.
Что касается кольца в 5-положении формулы I, в некоторых вариантах Х отсутствует или является -СН2- или -СН2СН2-.
В одном варианте Х отсутствует, так что гетероциклическое кольцо в 5-положении формулы I имеет структуру:

где R3, R4, Y и n являются такими, как здесь определено. В одном варианте, Y является фенилом, замещенным, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2. В одном варианте, Y является 5-6-членным гетероарильным кольцом, которое имеет гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена. В одном варианте, R является водородом. В другом варианте, R3 является метилом. Отдельный пример кольца в 5-положении формулы I, при отсутствующем X, включает следующие структуры:
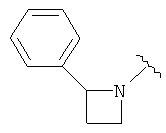


В одном варианте, Х является CH2, так что гетероциклическое кольцо в 5-положении формулы I имеет структуру:

где R3, R4, Y и n являются такими, как определено выше. В одном варианте Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2. В одном варианте, Y является 5-6-членным гетероарильным кольцом, имеющим гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена. В одном варианте, R3 является водородом. В другом варианте, R3 является метилом. В одном варианте, каждая из R4выбирается, независимо, из F, Cl, Me, ОН, ОМе, NH2, NHMe, CH2OH, CHF2 и CF3. В одном варианте, n равняется 0, 1 или 2. Отдельные примеры данного кольца в 5-положении формулы I, когда Х является СН3, включают следующие структуры:
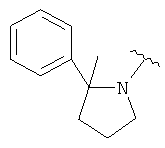
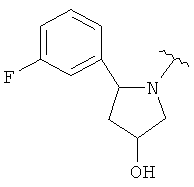

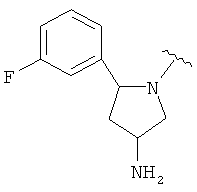
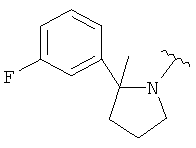




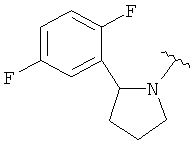
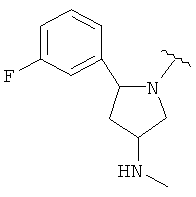

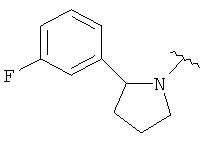
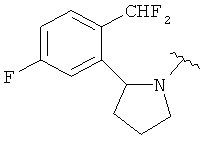


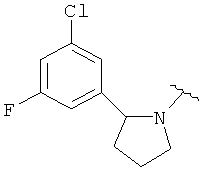
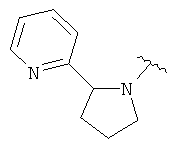


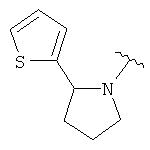
В одном варианте, Х является СН2СН2, так что гетероциклическое кольцо в 5-положении формулы I имеет следующую структуру:

где R3, R4, Y и n являются такими, как здесь определено. В одном варианте, фенил замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2. В одном варианте, Y является 5-6-членным гетероарильным кольцом, имеющим гетероатом, который выбран из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена. В одном варианте, R3 является водородом. В другом варианте, R3 является метилом. В одном варианте, n равняется 0, 1 или 2. В одном варианте, n равняется 0. Отдельные примеры кольца в 5-положении формулы I, где Х является СН2СН2, включают следующие структуры:


В одном варианте, Х является -CH2O-. В одном варианте, гетероциклическое кольцо в 5-положении формулы I имеет структуру:

где R3, R4, Y и n являются такими, как здесь определено. В одном варианте, Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2. В одном варианте, Y является фенилом, замещенным, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из F и (1-4С)алкокси. В одном варианте, Y является 5-6-членным гетероарильным кольцом, которое имеет гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена. В одном варианте, R3 является водородом. В другом варианте, R3 является метилом. В одном варианте, n равняется 0, 1 или 2. Отдельные примеры кольца в 5-положении формулы I, когда Х является -CH2O-, включают следующие структуры:
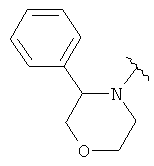
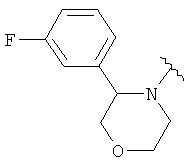

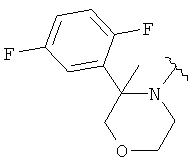
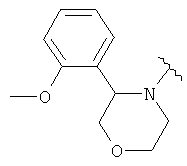

В одном варианте, Х является -CH2NRd-. В одном варианте, гетероциклическое кольцо в 5-положении формулы I имеет структуру:

где R3, R4, Y, Rd и n являются такими, как здесь определено. В одном варианте, Rd является Н. В одном варианте, Rd является (1-4С алкилом), например, метилом, этилом, пропилом, изопропилом или бутилом. Отдельным примером служит метил. В одном варианте, Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2. В одном варианте, Y является 5-6-членным гетероарильным кольцом, которое имеет гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена. В одном варианте, n равняется 0. Отдельные примеры кольца в 5-положении формулы I, когда Х является -CH2NRd-, включают следующие структуры:
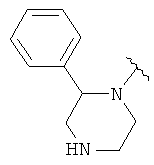
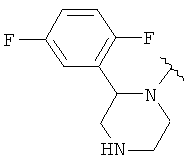


Соединения формулы I включают соединение формулы Ib, где
R1 является Н или (1-6С алкилом);
R2 является NRbRc;
NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, ОН, (1-4С алкила), (1-4 С)алкокси, -ОС(=O)(1-4С алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4С)гидроксиалкила,
или NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеет, при необходимости, второй гетероатом или группу, которые выбираются из N, О и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, галогена, CF3, (1-4С)алкила, CO2(1-4С алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо;
Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2;
Х равняется нулю, -СН2- или -СН2СН2-;
R3 является Н или (1-4С алкилом);
каждая R4 выбирается, независимо, из галогена, (1-4С)алкила, ОН, (1-4С)алкокси, NH2, NHQ-4C алкила) и CH2OH; и n равняется 0, 1 или 2.
В одном варианте формулы Ib, Y является фенилом, который замещен, при необходимости, одним или несколькими атомами галогена. В одном варианте формулы Ib, Y является фенилом, замещенным, при необходимости, одним или двумя атомами фтора.
В одном варианте Формулы Ib, NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, ОН, (1-4С алкила), (1-4С)алкокси, -ОС(=O)(1-4С алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4С)гидроксиалкила, или (ii) NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеет, при необходимости, второй гетероатом или группу, которые выбираются из N, О и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, галогена, CF3, (1-4С)алкила, CO2(1-4С алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо.
В одном варианте формулы Ib, NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеет, при необходимости, второй гетероатом или группу, выбранную из N, О и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, галогена, CF3, (1-4С)алкила, CO2(1-4С алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо.
В одном варианте формулы Ib, n является нулем или единицей.
В одном варианте формулы Ib, R3 является водородом.
Соединения формулы Ib включают соединения формулы Ic, где:
R1 является Н или (1-6С алкилом);
R2 является NRbRc;
NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, ОН, (1-4С алкила), (1-4С)алкокси, -ОС(=O)(1-4С алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4С)гидроксиалкила;
Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, выбранными из галогена, (1-4С)алкокси, CF3 и CHF2;
Х является -СН2-;
R3 является Н или (1-4С алкилом);
каждая R4 выбирается, независимо, из галогена, (1-4С)алкила, ОН, (1-4С)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1 или 2.
В одном варианте формулы Ic, гетероциклическое кольцо, образованное NRbRc, замещено, при необходимости, одним или двумя заместителями, которые выбираются, независимо, из F, ОН, метила, ОМе, ОС(=O)С(СН3)2, NH2, -OC(=O)ОС(СН3)2 и CH2OH.
В одном варианте формулы Iс, гетероциклическое кольцо, образованное NRbRc, является 4-членным азациклическим кольцом, которое замещено, при необходимости, одним или двумя заместителями, выбранными, независимо, из ОН, (1-4С алкила), и -O(1-4С алкила), например ОН, Me и ОМе.
В одном варианте формулы Ic, Y является фенилом, который замещен, при необходимости, одним или несколькими атомами галогена. В одном варианте формулы Ic, Y является фенилом, который замещен, при необходимости, одним или двумя атомами фтора.
Соединения формулы Ib также включают соединения формулы Id, где:
R1 является Н или (1-6С алкилом);
R2 является NRbRc;
NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеет, при необходимости, второй гетероатом или группу, выбранную из N, О и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, галогена, CF3, (1-4С)алкила, CO2(1-4С алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо;
Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2;
Х является -СН2-;
R3 является Н или (1-4С алкилом);
каждая R4 выбирается, независимо, из галогена, (1-4С)алкила, ОН, (1-4С)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1 или 2.
В одном варианте формулы Id, гетероциклическое кольцо, образованное NRbRc, замещено, при необходимости, одним или двумя заместителями, которые выбираются, независимо, из ОН, F, NH2, CO2H, CO2Et, NHCO2C(СН3)3, CF3, метила, этила, изопропила, CO2C(СН2)3 и оксо.
В одном варианте формулы Id, гетероциклическое кольцо, образованное NRbRc, является 5-6-членным азациклическим кольцом, которое замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, F, NH2, CO2H, CO2Et, NHCO2C(СН3)3, CF3, метила, этила, изопропила, CO2C(СН2)3 и оксо.
В одном варианте формулы Id, гетероциклическое кольцо, образованное NRbRc, является 5-членным азациклическим кольцом, которое замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, F, NH2, CO2H, CO2Et, NHCO2C(СН3)3, CF3, метила, этила, изопропила, CO2C(СН2)3 и оксо.
В некоторых вариантах формулы Id, NRbRc образует 5-членное азациклическое кольцо, которое замещено, при необходимости, одним или двумя заместителями, выбранными, независимо, из ОН и Me.
В одном варианте формулы Id, гетероциклическое кольцо, образованное NRbRc, является 6-членным азациклическим кольцом, которое замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, F, NH2, CO2H, CO2Et, NHCO2C(СН3)3, CF3, метила, этила, изопропила, CO2C(СН2)3 и оксо.
В одном варианте формулы Id, гетероциклическое кольцо, образованное NRbRc, является 6-членным азациклическим кольцом, которое замещено, при необходимости, одним или двумя заместителями, выбранными, независимо, из ОН и (1-4С) алкила, например ОН и Me.
В одном варианте формулы Id, Y является фенилом, который замещен, при необходимости, одним или несколькими атомами галогена. В одном варианте формулы Id, Y является фенилом, который замещен, при необходимости, одним или двумя атомами фтора.
В одном варианте формулы Ic или Id, n является нулем или единицей.
В одном варианте формулы Ic или Id, R3 является водородом.
В одном варианте формулы Ic или Id, R1 является водородом.
Соединения формулы I включают соединение формулы Ie, где:
R1 является Н или (1-6С алкилом);
R2 является NRbRc;
NRbRc образует 4-членное гетероциклическое кольцо с атомами азота, где указанное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, ОН, (1-4С алкила), (1-4 С)алкокси, -ОС(O)(1-4С алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4С)гидроксиалкила,
или NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеет, при необходимости, второй гетероатом или группу, выбранную из N, О и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, галогена, CF3, (1-4С)алкила, СО2(1-4С алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо;
Y является 5-6-членным гетероарильным кольцом, которое имеет гетероатом,
выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена;
Х равен нулю, является -СН2- или -CH2CH2-;
R3 является Н или (1-4С алкилом);
каждая R4 выбирается, независимо, из галогена, (1-4С)алкила, ОН, (1-4С)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1 или 2.
Соединения формулы I включают соединения формулы If, где:
R1 является Н или (1-6С алкилом);
R2 представляет собой (1-4С)алкил, (1-4С)фторалкил, CF3, (1-4С)гидроксиалкил, -(1-4С алкил)hetAr1, -(1-4С алкил)NH2, -(1-4С алкил)NH(1-4С алкил), -(1-4С алкил)М(1-4С алкил)2, hetAr2, hetCyc', hetCyc2, фенил, который замещен, при необходимости, NHSO2(1-4С алкилом) или (3-6С)циклоалкилом, который замещен, при необходимости, (1-4С алкилом), CN, ОН, ОМе, NH2, NHMe, N(СН3)2, F, CF3, CO2(1-4С алкилом), CO2H, C(=O)NReRf или С(=O)ORg;
hetAr1 является 5-членным гетероарильным кольцом, имеющим в кольце 1-3 атома азота;
hetAr2 является 5-6-членным гетероарильным кольцом, которое имеет, по меньшей мере, один атом азота и имеет в кольце, при необходимости, второй гетероатом, выбранный, независимо, из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила), галогена, -(1-4С)алкокси и NH(1-4C алкила);
hetCyc1 является связанным с углеродом 4-6-членным азациклическим кольцом, которое замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из (1-4С алкила) и CO2(1-4С алкила);
hetCyc2 является пиридиновым или пиридазиноновым кольцом, которое замещено, при необходимости, заместителем, выбранным из (1-4С)алкила;
Re является Н или (1-4С)алкилом;
Rf является Н, (1-4С)алкилом или (3-6С)циклоалкилом;
или NRbRc образует 5-6-членное азациклическое кольцо, которое имеет, при необходимости, дополнительный гетероатом, выбранный из N и О, где данное азациклическое кольцо замещено, при необходимости, ОН;
Rg является Н или (1-6С)алкилом;
Y является (i) фенилом, который замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2, или (ii) 5-6-членным гетероарильным кольцом, которое имеет гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена;
Х равно нулю, является -СН2-, -CH2CH2-;
Rd является Н или (1-4С алкилом);
R3 является Н или (1-4С алкилом);
каждая R4 выбирается, независимо, из галогена, (1-4С)алкила, ОН, (1-4С алкокси), NH2, NH(1-4C алкила) и СН2ОН; и
n равняется 0, 1, 2, 3, 4, 5 или 6.
В одном варианте формулы If, Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2.
В одном варианте формулы If, Y является 5-6-членным гетероарильным кольцом, которое имеет гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена.
В одном варианте формулы If, R2 выбирается из (1-4С)алкила, (1-4С)фторалкила, CF3, -(1-4С)гидроксиалкила, (1-4С алкил)hetAr1 и -(1-4С алкил)NH(1-4С алкила).
В одном варианте формулы If, R2 выбирается из метила, изопропила, трет-бутила, CF(СН3)2, CF3, С(СН3)2OH и С(СН3)2CH2OH, 2-(1,2,4-триазолил)пропан-2-ила и -С(СН3)2NHCH3.
В одном варианте формулы If, R2 является циклопропилом, циклобутилом и циклопентилом, замещенным, при необходимости, (1-4С алкилом), CN, ОН, CF3, CO2(1-4С алкилом) или CO2H.
В одном варианте формулы If, R2 выбирается из hetAr2, hetCyc1 и hetCyc2.
В одном варианте формулы If, R2 выбирается из (i) пиридила, пиримидила, пиразинила, пиразолила, имидазолила и тиазолила, замещенных, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила), галогена, (1-4С)алкокси и NH(1-4C алкила); (ii) связанного с углеродом азетидинила, пирролидинила и пиперидинила, замещенных, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С алкила), CO2H и CO2(1-4С алкила); и (iii) пиридинона или пиридазинона, замещенных, при необходимости, заместителем, выбранным из (1-4С)алкила.
В одном варианте формулы If, R2 является C(=O)NRbRc или С(=O)OR8.
Соединения формулы I включают формулу Ig, где
R1 является Н или (1-6С алкилом);
R2 является NRbRc;
Rb является Н или (1-6С алкилом);
Rc представляет собой Н, (1-4С)алкил, (1-4С)гидроксиалкил, hetAr3 или фенил, где указанный фенил замещен, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, CN, CF3 и -O(1-4С алкила);
hetAr3 является 5-6-членным гетероарильным кольцом, которое имеет 1-2 гетероатома, выбранные из N и О, и замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4С)алкила;
Y представляет собой (i) фенил, замещенный, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2, или (и) 5-6-членное гетероарильное кольцо, которое имеет гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена;
Х равно нулю, является -СН2- или -CH2CH2-;
Rd является Н или (1-4С алкилом);
R является Н или (1-4С алкилом);
каждая R4 выбирается, независимо, из галогена, (1-4С)алкила, ОН, (1-4С)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1, 2, 3, 4, 5 или 6.
В одном варианте формулы Ig, Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, (1-4С)алкокси, CF3 и CHF2.
В одном варианте формулы Ig, Y является 5-6-членным гетероарильным кольцом, которое имеет гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена.
В одном варианте формулы Ig, R6 выбирается из Н, Me, t-бутила, CH2CH2OH и CH2CH2CH2OH, диметилизоксазолила, фенила, фторфенила, хлорфенила, цианфенила, метоксифенила, трифторметилфенила, дихлорфенила и триметоксифенила. Более конкретные примеры включают 4-фторфенил, 3-хлорфенилл, 4-хлорфенил, 3-цианфенил, 4-цианфенил, 4-метоксифенил, 2,4-дихлорфенил, 3-(трифторметилфенил)фенил, 3,5-дихлорфенил и 3,4,5-триметоксифенил.
В одном варианте формулы Ig, n равняется 0, 1 или 2.
Следует понимать, что некоторые соединения, в соответствии с данным изобретением, могут содержать один или несколько центров асимметрии и могут поэтому быть получены и выделены в смеси изомеров, такой как рацемическая или диастереомерная смесь, или в энантиомерно чистой форме. Предполагается, что все стереоизомерные формы соединений данного изобретения, включая, но не ограничиваясь этим, диастереомеры, энантиомеры и атропизомеры, так же как и их смеси, такие как рацемические смеси, составляют часть настоящего изобретения.
В показанных здесь структурах, где стереохимия какого-либо конкретного хирального атома не определена, подразумеваются все стереоизомеры, которые включены как соединения данного изобретения. Там, где стереохимия обозначена жирным клином или пунктиром, представляющим конкретную конфигурацию, этот стереоизомер является именно таким образом обозначенным и определенным.
Следует также понимать, что некоторые соединения формулы I могут использоваться как промежуточные для дополнительных соединений формулы I.
Соединения формулы I включают их фармацевтически приемлемые соли. Кроме того, соединения формулы I также включают другие соли таких соединений, которые не обязательно являются фармацевтически приемлемыми солями и которые могут использовалься как промежуточные соединения для получения и/или очистки соединений формулы I и/или для разделения энантиомеров соединений формулы I. Примеры отдельных солей включают гидросульфаты, гидрохлориды и трифторацетаты.
Следует также понимать, что соединения формулы I и их соли могут быть выделены в форме сольватов, и, соответственно, любой такой сольват включен в объем настоящего изобретения.
Соединения формулы I также включают соединения, которые отличаются лишь присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения данного изобретения включают соединения, где один или несколько водородных атомов заменены дейтерием или тритием или один или несколько углеродных атомов заменены13С- или14C-обогащенным углеродом, и они также включены в объем данного изобретения.
Термин "(1-4С) алкил", как здесь используется, касается насыщенных моновалентных углеводородных радикалов, линейных или с разветвленными цепями, с одним-четырьмя углеродными атомами, соответственно. Примеры включают, но не ограничиваются этим, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-метил-1-пропил, 2-бутил и 2-метил-2-пропил.
Термин "(1-4С) алкокси", как здесь используется, касается насыщенных линейных или с разветвленными цепями моновалентных радикалов с одним-четырьмя атомами углерода, соответственно, где данный радикал находится на кислородном атоме.
Термин "(1-4С)гидроксиалкил", как здесь используется, касается насыщенных линейных или с разветвленными цепями моновалентных углеводородных радикалов с одним-четырьмя атомами углерода, соответственно, где один из водородных атомов заменен ОН группой.
Термин "галоген" включает фтор, хлор, бром и йод.
В соответствии с другим аспектом, данное изобретение представляет способ получения соединения формулы I или его фармацевтически приемлемой соли, как здесь определено, который включает:
(а) для соединения формулы I, где R2 является NRbRc, реакцию соединения формулы II

с соединением формулы HNRbRc, в присутствии агента сочетания; или
(b) для соединения формулы I, где R2 является NRbRc и Rb является Н, реакцию соединения формулы II с соединением формулы O=C=N-Rc; или
(c) для соединения формулы I, где R2 является hetAr2 или фенилом, который замещен, при необходимости, NHSO2(1-4C алкилом), реакцию соединения формулы II с соединением формулы HOC(=O)R2, в присутствии агента сочетания и основания; или
(d) для соединения формулы I, где R2 представляет собой (1-4С)алкил, (1-4С)фторалкил, CF3, (1-4С)гидроксиалкил или (3-6С)циклоалкил, замещенный, при необходимости, (1-4С алкилом), CN, ОН, CF3, CO2(1-4С алкилом) или CO2H, реакцию соединения формулы II с соединением формулы (R2CO)2O, в присутствии основания; или
(e) для соединения формулы I, где R2 представляет собой (1-4С)алкил, (1-4С)фторалкил, CF3, (1-4С)гидроксиалкил или (3-6С)циклоалкил, который замещен, при необходимости, (1-4С алкилом), CN, ОН, CF3, CO2(1-4С алкилом) или CO2H, реакцию соединения формулы II с соединением формулы HOC(=O)R2, в присутствии агента сочетания и основания; или
(f) для соединения формулы I, где R2 является C(=O)NReRf, реакцию соединения формулы VII
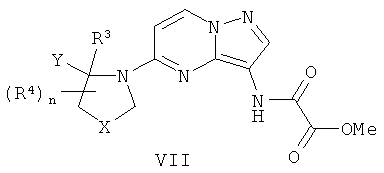
с соединением формулы HNReRf, в присутствии основания;
или
(g) для соединения формулы I, где R2 является С(=O)ORg, реакцию соединения формулы II с метил 2-хлор-2-оксоацетатом и обработку гидроксидом щелочного металла с получением соединения формулы I, где Rg является Н; и
удаление или введение любой защитной группы, при необходимости, и, при необходимости, получение соли.
Что касается способов (а) и (е), примеры подходящих агентов сочетания включают КДИ (карбонил диимидазол), фосген и бис(трихлорметил) карбонат. Данная реакция проводится, при необходимости, в присутствии основания третичного амина, такого как ДИЭА (диизопропилэтиламин). Подходящие растворители включают дихлорметан, дихлорэтан, ТГФ и ДМФА. Реакция проводится, обычно, при комнатной температуре.
Соединения формулы II

могут быть получены путем восстановления соединения формулы III
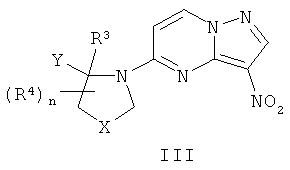
в стандартных условиях восстановления, например по реакции соединения формулы II с цинковой пылью в кислых условиях, таких как в присутствии NH4Cl (насыщенного водного), HCl или уксусной кислоты. Еще один пример таких стандартных условий восстановления включает реакцию соединений формулы III под атмосферой водорода в присутствии катализатора из благородного металла с соединениями формулы II.
Соединения формулы III могут быть получены путем нитрования соединения формулы IV
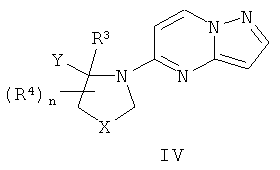
в стандартных услових нитрования, известных в данной области, например, по реакции соответствующего соединения формулы IV с азотной кислотой в присутствии активирующего агента, такого как ТФУК или концентрированная серная кислота.
Соединения формулы IV могут быть получены путем реакции сочетания соединения формулы V

где Z является уходящей группой или атомом, таким как галоген (например, Сl), с соответствующим соединением, имеющим формулу VI

где R3, R4, n, X и Y являются такими, как здесь определено, в соответствующем растворителе, таком как спирт (например, н-бутанол или изопропанол), при повышенных температурах, например при температурах от 100 до 180°С, например при температуре около 140°С. Соединения формулы V коммерчески доступны или могут быть получены с помощью стандартных способов, известных в данной области.
Соединения формул II и III, как предполагается, являются новыми и представляют собой дополнительный вариант этого изобретения.
Что касается способа (b), подходящие растворители включают дихлорметан, дихлорэтан, ТГФ и ДМФА. Реакция обычно проводится при комнатной температуре.
Что касается способа (с), подходящие агенты сочетания включают HATU, HBTU, TBTU, ДХК (N,N'-дихлоргексилкарбодиимид), ДИЭК (1-(3-диметиламинопропил)-3-этилкарбоиимид) и любые другие амидные агенты сочетания, хорошо известные специалистам в данной области. Подходящие основания включают третичные амины, такие как диизопропилэтиламин (ДИЭА) и триэтиламин. Подходящие растворители включают ДМФА и CH3CN. Данная реакция проводится, обычно, при температурах в области от 0°С до комнатной температуры.
Что касается способа (d), подходящие основания включают амины, такие как пиридин или триэтиламин, и подходящие агенты сочетания включают HATU, HBTU, TBTU, ДХК (N,N'-дициклогексилкарбодиимид), ДИЭК (1-(3-диметиламинопропил)-3-этилкарбоиимид) и любые другие амидные агенты сочетания, хорошо известные специалистам в данной области. Подходящие растворители включают дихлорметан и дихлорэтан. Данная реакция проводится, обычно, при температурах в области от 0°С до комнатной температуры.
Способность соединений действовать как TrkA ингибиторы может быть продемонстрирована с помощью анализов, которые описаны в примере В.
Соединения формулы I могут применяться для лечения хронической и острой боли, включая боль, связанную с раком, хирургией и переломом костей. Некоторые соединения, которые являются ингибиторами TrkA и/или TrkB, могут быть полезными в лечении многих видов болей, включая боль воспалительного характера, невропатическую боль и боль, связанную с раком, хирургией и переломом костей.
Соединения формулы I полезны также для лечения разных видов рака, включая нейробластому, рак яичника и колоректальный рак.
Соединения формулы I также полезны для лечения воспалений и некоторых инфекционных заболеваний.
Кроме того, соединения формулы I могут также применяться для лечения интерстициального цистита (ИЦ), синдрома болезненного мочевого пузыря (БМП), недержания мочи, астмы, анорексии, атопического дерматита и псориаза.
Соединения формулы I могут также использоваться для лечения демиелинизации и дисмиелинизации путем промотирования миелинизации, живучести нейронов и дифференциации олигодендроцитов через блокирование взаимодействия Sp35-TrkA.
Соединения формулы I, которые являются двойными ингибиторами TrkA и TrkB, могут быть полезными в лечении многих видов болей, включая боль воспалительного характера, невропатическую боль, хирургическую боль и боль, связанную с раком.
Соединения формулы I могут иметь терапевтическое применение в лечении заболеваний, связанных с костной тканью (таких как те, что включают резорбцию костной ткани). Примеры таких заболеваний включают метастазирующее заболевание костей, разрежение кости, индуцированное лечением, остеопороз, ревматоидный артрит, анкилозирующий спонделоартрит, болезнь Педжета и периодонтоз. Остеопороз может быть связан с (1) менопаузой у женщин, (2) старением мужчин и женщин, (3) субоптимальным ростом костной ткани в детстве и подростковом возрасте, который не дает возможности достичь пиковой костной массы, и/или (4) разрежением костной ткани, вторичным по отношению к другим болезненным состояниям, расстройствам, связанным с питанием, лекарственной терапией и/или другими видами медицинского лечения.
Другие остеолитические заболевания, которые могут лечиться в соответствии с настоящим изобретением, более локализованы. Отдельным примером является метастазирующий индуцированный опухолью остеолиз. В этом состоянии рак кости или костные метастазы индуцируют локализованный остеолиз, который вызывает боль, слабость костной ткани и переломы. Такой локализованный остеолиз также позволяет опухолям расти до больших размеров путем создания большего пространства для них в кости и выделения факторов роста из костной матрицы. Виды рака, которые, как теперь известно, вызывают индуцированный опухолью остеолиз, включают гематологические злокачественные образования (например, миелома и лимфома) и твердые опухоли (например, молочной железы, простаты, легких, почек и щитовидной железы), которые все предполагается лечить с помощью настоящего изобретения.
Как здесь используется, термин лечение включает профилактику, так же как и исцеление существующего состояния.
Соответственно, еще один аспект этого изобретения представляет способ лечения болезней или медицинских состояний у млекопитающих, где указанная болезнь или состояние поддается лечению ингибитором TrkA и/или TrkB, включающий введение указанному млекопитающему одного или нескольких соединений формулы I или их фармацевтически приемлемых солей в количестве, эффективном для лечения или предупреждения указанного расстройства. В отдельном варианте данное изобретение представляет способ лечения боли, рака, воспаления, нейродегенеративной болезни или инфекции Typanosoma cruzi у млекопитающего, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
В другом варианте, данное изобретение представляет способ лечения остеолитической болезни у млекопитающих, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли.
Соединения настоящего изобретения могут использоваться в комбинации с одним или несколькими дополнительными лекарствами, которые действуют по такому же самому или иному механизму. Такое объединенное лечение может достигаться путем одновременного, последовательного или раздельного использования индивидуальных компонентов данного лечения. Примеры включают противовоспалительные соединения, стероиды (например, дексаметазон, кортизон и флютиказон), анальгетики, такие как NSAIDs (например, аспирин, ибупрофен, индометацин и кетопрофен) и опиоиды (такие как морфин), и химиотерапевтические агенты.
В области медицинской онкологии нормальной практикой является использование комбинации различных форм терапии для лечения каждого пациента от рака. В медицинской онкологии другой компонент(ы) такого объединенного лечения в дополнение к композициям настоящего изобретения может представлять, например, хирургию, радиотерапию, химиотерапию, ингибиторы сигнальной трансдукции и/или моноклональные антитела.
Соответственно, соединения формулы I могут использоваться в комбинации с одним или несколькими агентами, выбранными из митотических ингибиторов, алкилирующих агентов, анти-метаболитов, антисмысловых ДНК или РНК, интеркалирующих антибиотиков, ингибиторов факторов роста, ингибиторов сигнальной трансдукции, ингибиторов клеточного цикла, ферментативных ингибиторов, модуляторов ретиноидного рецептора, протеасомных ингибиторов, ингибиторов топоизомеразы, модификаторов биологической реакции, антигормонов, ингибиторов ангиогенезиса, цитостатических агентов анти-андрогенов, антител против клетки-мишени, ингибиторов гидроксиметилглютарил-СоА редуктазы и ингибиторов пренил-протеин трансферазы.
Фраза "эффективное количество" означает количество соединения, которое, при назначении млекопитающему, нуждающемуся в таком лечении, достаточно для (i) лечения или предупреждения конкретного заболевания, состояния или расстройства, которые могут лечиться с помощью ингибитора TrkA и/или TrkB, (ii) смягчения, ослабления или исключения одного или нескольких симптомов конкретной болезни, состояния или расстройства или (iii) предупреждения или задержки начала одного или нескольких симптомов конкретной болезни, состояния или расстройства, описанных здесь.
Количество соединения формулы I, которое будет соответствовать указанному количеству, будет варьировать в зависимости от факторов, таких как конкретное соединение, состояние болезни и ее тяжесть, идентичность (например, вес) млекопитающего, которое нуждается в таком лечении, но может, тем не менее, быть определено обычным образом специалистом в данной области.
Как здесь используется, термин "млекопитающее" касается теплокровного животного, которое заболело или имеет риск развития болезни, описанной здесь, и включает, но не ограничиваясь этим, морских свинок, собак, котов, крыс, мышей, хомячков и приматов, включая людей.
Соединения настоящего изобретения могут использоваться по любой удобной схеме, например через желудочно-кишечный тракт (например, ректально или перорально), нос, легкие, мышцы или сосудистую систему, или трансдермально, или путем нанесения на кожу. Соединения могут использоваться в виде любой удобной лекарственной формы, например таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, спреев, суппозиториев, гелей, эмульсий, пэтчей и др. Такие композиции могут содержать компоненты, обычные в фармацевтических препаратах, например разбавители, носители, модификаторы рН, подсластители, наполнители и другие активные агенты. Если необходимо парентеральное применение, данные композиции будут стерильными и в форме раствора или суспензии, подходящей для инъекции или инфузии. Такие композиции составляют дополнительный аспект данного изобретения.
В соответствии с еще одним аспектом, настоящее изобретение представляет фармацевтическую композицию, содержащую соединение формулы I или его фармацевтически приемлемую соль, как определено выше. В одном варианте, данная фармацевтическая композиция содержит соединение формулы I совместно с фармацевтически приемлемым разбавителем или носителем.
В соответствии с еще одним аспектом, настоящее изобретение представляет соединение формулы I или его фармацевтически приемлемую соль, для применения в терапии, такой как лечение состояния, которое поддается лечению ингибитором или TrkA и/или TrkB, такого как состояние, опосредствованное TrkA и/или TrkB, такого как одно или несколько состояний, которые здесь описаны.
В соответствии с еще одним аспектом, настоящее изобретение представляет применение соединения формулы I или его фармацевтически приемлемой соли в терапии состояния, которое может лечиться с помощью ингибитора TrkA и/или TrkB, такого как опосредствованное TrkA и/или TrkB состояние, такого как состояние, определенное выше. В одном варианте, данное изобретение представляет соединение формулы I или его фармацевтически приемлемую соль, для применения в лечении боли, рака, воспаления, нейродегенративного заболевания или инфекции Typanosoma cruzi.
В одном варианте, соединение данного изобретения выбирается из следующих любых соединений:
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин- 1-карбоксамид;
(R)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1,1 -диметилмочевина;
(R)-1-трет-бутил-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3 -ил)мочевина;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-фенилмочевина;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)изобутирамид;
(R)-R-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-6-оксо-1,6-дигидропиридазин-3-карбоксамид;
(R)-N-(5-(4,4-дифтор-2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамид;
N-(5-(2-(3-фторфенил)-2-метилпирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид;
(R)-N-(5-(2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид;
(R)-N-(5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамид;
(S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(3R,4R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3,4-дигидроксипирролидин-1-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамид;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамид;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-(4-фторфенил)мочевина;
(R)-1-(4-хллрофенил)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а] пиримидин-3-ил)мочевина;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-(4-метоксифенил)мочевина;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамид;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамид;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамид;
(S)-трет-бутил 4-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)-2-метилпиперазин-1-карбоксилат;
(S)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиперазин-1-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-изопропилпиперазин-1-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-этилпиперазин-1-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-метилпиперазин-1-карбоксамид;
N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3,5-диметилпиперазин-1-карбоксамид;
(S)-трет-бутил 4-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)-2-метилпиперазин-1-карбоксилат;
(S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиперазин-1-карбоксамид гидрохлорид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид;
(R)-метил 1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)циклопропанкарбоксилат;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)циклопропанкарбоновая кислота;
(S)-N-(5-((R)-2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(R)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(S)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(R)-N-(5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-гидроксипиперидин-1-карбоксамид;
(R)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид;
(S)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид;
(R)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-гидроксипиперидин-1-карбоксамид;
(R)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид;
(S)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиваламид;
(R)-трет-бутил 3-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)азетидин-1-карбоксилат;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло [1,5-а]пиримидин-3-ил)азетидин-3-карбоксамид;
(R)-трет-бутил 4-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а] пиримидин-3-илкарбамоил)-4-метилпиперидин-1-карбоксилат;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-метилпиперидин-4-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-гидрокси-2-метилпропанамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-(трифторметил)циклопропанкарбоксамид;
(R)-1-циан-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3 -ил)циклопропанкарбоксамид;
(R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-метилпирролидин-2-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1 -ил)пиразоло[1,5-а]пиримидин-3-ил)-2-фтор-2-метилпропанамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-(изопропиламино)тиазол-4-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-метил-2-(1Н-1,2,4-триазол-1-ил)пропанамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиразин-2-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-5-метилпиразин-2-карбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метилпиколинамид;
(R)-5-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид;
(R)-4-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3 -ил)пиколинамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиколинамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-2,2-диметилпропанамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-гидроксициклопропанкарбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-метил-2-(метиламино)пропанамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиримидин-2-карбоксамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиколинамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-2-оксо-1,2-дигидропиридин-4-карбоксамид;
(R)-6-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид;
(R)-4-(этилсульфонамидо)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)бензамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-1H-пиразол-3-карбоксамид;
(R)-N-(5-(2-(3-фторфенили)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1Н-пиразол-3-карбоксамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метоксипиколинамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)никотинамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)изоникотинамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метилникотинамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-метоксиникотинамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилизоникотинамид;
(S)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-5-метилпиразин-2-карбоксамид;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-1Н-имидазол-2-карбоксамид;
(S)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(R)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(R)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид;
(S)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид;
(S)-N-(5-((R)-2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(R)-N-(5-((R)-2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(S)-N-(5-((R)-2-(5-фтор-2-метоксифенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(S)-N-(5-((R)-2-(5-фтор-2-метоксифенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид;
(1S,4S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
(R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид;
(1S,3R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксициклопентанкарбоксамид;
(1S,3S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксициклопентанкарбоксамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксициклобутанкарбоксамид;
(R)-N1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-N2,N2-диметилоксаламид;
(R)-N1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-N2-метилоксаламид;
(R)-N1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)оксаламид;
(R)-N1-циклопропил-N2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)оксаламид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-(3-гидроксиазетидин-1-ил)-2-оксоацетамид;
N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-((S)-3-гидроксипирролидин-1-ил)-2-оксоацетамид;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-морфолино-2-оксоацетамид;
(R)-метил 2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-иламино)-2-оксоацетат;
(R)-2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-иламино)-2-оксоуксусная кислота;
и их соли.
Отдельные примеры солей рассмотренных выше соединений включают гидросульфаты, гидрохлориды и трифторацетаты.
Осуществление изобретения
Примеры
Следующие примеры иллюстрируют данное изобретение. В описанных ниже примерах все температуры, если не оговорено иное, представлены в градусах Цельсия. Реактивы приобретались у коммерческих поставщиков, таких как компания Aldrich Chemical Company, Lancaster, TCI или Maybridge, и использовались без дополнительной очистки, если не оговорено иное. Тетрагидрофуран (ТГФ), дихлорметан (ДХМ), метиленхлорид, толуол и диоксан приобретались у компании Aldrich в бутылках Sure/Seal™ и использовались в полученном виде.
Реакции, рассмотренные ниже, проводились, в общем, под избыточным давлением азота или аргона или с помощью осушительного патрона (если не указано иное) в безводных растворителях, и реакционные колбы были обычно снабжены резиновыми диафрагмами для введения субстратов и реактивов через шприц. Стеклянную посуду высушивали в печи и/или теплом.
Колоночная хроматография проводилась на системе Biotage (производитель: корпорация Dyax Corporation), имеющей силикагелевую колонку или колонку с обратной фазой С-18, или на кремнеземном картридже SepPak (Waters).
Сокращения в данных примерах имеют следующие значения:
Пример А
ELISA анализ TrkA
Для оценки TrkA киназной активности в присутствии ингибиторов был использован иммуноферментный твердофазный анализ (ELISA). Иммулоновые 4НВХ 384-лунковые титрационные микропланшеты (Thermo part #8755) покрывались 0,025 мг/мл раствором соли (Glu, Ala, Туr; 6:3:1; Sigma P3899). Различные концентрации испытываемого соединения, 2,5 нМ TrkA (корпорация Invitrogen Corp., меченный гистидином рекомбинантный TrkA человека, цитоплазматический домен) и 500 мкМ АТФ инкубировали в течение 25 минут при комнатной температуре в покрытых планшетах при встряхивании. Буфер для анализа состоял из 25 мМ MOPS pH 7,5, 0,005% (объем/объем) Triton Х-100 и 5 мМ MgCl2. Реакционную смесь удаляли из планшета путем промывания PBS, содержащего 0,1% (объем/объем) Tween 20. Фосфорилированный продукт реакции выявляли с использованием 0,2 мкг/мл фосфотирозин-специфического моноклонального антитела (клон PY20), конъюгированного с пероксидазой хрена совместно с пероксидазной субстратной системой ТМВ Peroxidase Substrate System (KPL). После добавления 1 М фосфорной кислоты интенсивность окраски хромогенного субстрата анализировалась количественно по оптической плотности при 450 нм. Значения IC50 вычислялись с использованием подгонки способом 4 или 5-параметрической логистической кривой.
В этом анализе соединения данного изобретения имели среднее значение IC50 ниже 1000 нМ. Некоторые соединения имели среднее значение IC50 ниже 100 нМ. В таблице 1 представлены конкретные значения IC50 для соединений этого изобретения, тестированных в данном анализе.
Пример В
TrkA и TrkB Omnia анализ
Trk ферментативная селективность оценивалась с использованием реактивов Omnia™ Kinase Assay от корпорации Invitrogen Corp. Фермент (или TrkA, или TrkB от корпорации Invitrogen Corp.) и испытываемое соединение (разные концентрации) инкубировали в течение 10 минут при комнатной температуре в 384-луночном белом полипропиленовом планшете (Nunc каталог #267462). Затем в планшет вводили Omnia Туr пептид #4 (для TrkA) или #5 (для TrkB), так же как и АТФ. Конечные концентрации были следующими: 20 нМ фермент, 500 мкМ АТФ для TrkA анализа или 1 мМ АТФ для TrkB анализа, 10 мкМ пептидный субстрат. Буфер для анализа состоял из 25 мМ MOPS pH 7,5, 0,005% (объем/объем) Triton Х-100 и 5 мМ MgCl2. Образование фосфорилированного пептида постоянно контролировалось в течение 70 минут с использованием микропланшетного ридера Molecular Devices FlexStation II (возбуждение = 360 нм; эмиссия = 485 нм). Первоначальные скорости вычислялись по ходу кривых. IC50 значения затем определялись из этих скоростей с использованием подгонки способом 4 или 5-параметрической логистической кривой.
В этом анализе соединения данного изобретения имели среднее значение IC50 ниже 1000 нМ. Некоторые соединения имели среднее значение IC50 ниже 100 нМ.
Способ получения А

Получение (R)-2-(2,5-дифторфенил)пирролидина
Стадия А: Получение (R)-трет-бутил 2-(2,5-дифторфенил)пирролидин-1-карбоксилата. Раствор трет-бутилпирролидин-1-карбоксилата (20 г, 116,8 ммоль) и (-)спартеина (32,9, 140 ммоль) в МТБЭ метил-трет-бутил этил (360 мл) охлаждали до -78°С и втор-BuLi (100 мл, 140 ммоль, 1,4 М в циклогексане) вводили по каплям через канюлю, поддерживая внутреннюю температуру на уровне ниже -70°С. Результирующий раствор перемешивали в течение 3 часов при -78°С, с последующим добавлением раствора ZnCl2 (93,4 мл, 93,4 ммоль, 1 М в Et2O) по каплям при быстром перемешивании, поддерживая внутреннюю температуру на уровне ниже -65°С. Результирующую светлую суспензию перемешивали при -78°С в течение 30 минут и затем подогревали до комнатной температуры. Результирующую смесь загружали 2-бром-1,4-дифторбензолом (14,5 мл, 128 ммоль), затем Pd(OAc)2 (1,31 г, 5,8 ммоль) и t-Bu3P-HBF4 (2,03 г, 7,0 ммоль) одной порцией. После перемешивания в течение ночи при комнатной температуре добавляли 10,5 мл раствора NH4OH и данную реакционную смесь перемешивали еще в течение часа. Результирующую суспензию фильтровали через целит (CELITE) и промывали Et2O (1 л). Фильтрат промывали HCl (0,5 л, 1 М водн.) и рассолом. Органический слой фильтровали и концентрировали и неочищенный продукт подвергали очистке способом колоночной (кремнезем) хроматографии с элюированием 5-10% EtOAc/гексаны с получением продукта (R)-трет-бутил 2-(2,5-дифторфенил)пирролидин-1-карбоксилата в виде желтого масла (23,9 г, 72% выход).
Стадия В: Получение (R)-2-(2,5-дифторфенил)пирролидина. К (R)-трет-бутил 2-(2,5-дифторфенил)пирролидин-1-карбоксилату (23,9 г, 84,4 ммоль) добавляли 56,2 мл 4N HCl (диоксан). После перемешивания при комнатной температуре в течение 2 часов добавляли 200 мл эфира и данную смесь перемешивали в течение 10 минут. Результирующую суспензию фильтровали с получением гидрохлорида данного продукта в виде белого твердого вещества (17,2 г). Для получения свободного основания продукт соли HCl диспергировали в смеси EtOAc (200 мл) и раствора NaOH (100 мл, 2 N водн.) Слои разделяли и водный слой экстрагировали EtOAc. Объединенные органические экстракты фильтровали и концентрировали с получением необходимого продукта в виде жидкости (13,2 г, 85% выход).
Стадия С: Определение энантиомерного избытка (э.и. %) (R)-2-(2,5-дифторфенил)пирролидина. К раствору в этаноле (R)-2-(2,5-дифторфенил)пирролидина добавляли избыток N-(2,4-динитро-5-фторфенил)-L-аланин амида (ФДАА, реактив Мэрфи). Данную смесь нагревали с обратным холодильником в течение приблизительно дыух минут. После охлаждения до комнатной температуры данную реакционную смесь разбавляли ацетонитрилом и инъектировали в систему для высокоэффетивной жидкостной хроматографии (ВЭЖХ) (YMC ODS-AQ 4.6×50 мм 3 мкм 120 Å колонка; подвижная фаза: 5-95% растворитель В в А; растворитель А: Н2О/1% IPA/10 мМ ацетат аммония, и растворитель В: ACN/1% IPA/10 мМ ацетат аммония; скорость потока: 2 мл/мин) для определения энантиомерного избытка данного продукта путем вычисления площадей пиков двух образовавшихся диастереомерных производных. Был получен 1:1 рацемический образец в соответствии с такой же самой описанной здесь процедурой, заменяющий (R)-2-(2,5-дифторфенил)пирролидин (рац)-2-(2,5-дифторфенил)пирролидином. Значение э.и. % данного полученного продукта, как описано выше, составляло >93%.
Способ получения В

Получение (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а] пиримидин-3-амина
Стадия А: Получение (R)-5-(2-(2,5-дифторфенил)пирролидин-1 -ил)пиразоло[1,5-а1 пиримидина. В реакционной трубке высокого давления смешивали 5-хлорпиразоло[1,5-а]пиримидин (4,2 г, 27 ммоль), (R)-2-(2,5-дифторфенил) пирролидин (способ получения А; 5,3 г, 29 ммоль), безводный н-бутанол (5 мл, 55 ммоль) и ДИЭА (DIEA) (9,5 мл, 55 ммоль). Желтоватую суспензию герметизировали и нагревали на масляной бане (160°С) в течение ночи. Данную реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (250 мл) и фильтровали, ополаскивая твердую фазу EtOAc. Фильтрат (330 мл) промывали водой (2×150 мл), рассолом (100 мл), концентрировали и очищали способом кремнеземной хроматографии с элюированием 2:1 EtOAc/гексаны с получением продукта в виде яркого желтоватого твердого вещества (5,6 г, 68% выход).
Стадия В: Получение (R)-5-(2-(2,5-диФторфенил)пирролидин-1-ил)-3-нитропиразоло[1,5-a]пиримидина: (R)-5-(2-(2,5-дифторфенил)пирролидин-1 -ил)пиразоло[1,5-а]пиримидин (3,3 г, 10,99 ммоль) растворяли в 25 мл ТФУК при комнатной температуре с получением прозрачного желтоватого растовора, затем к данному раствору при быстром перемешивании по каплям добавляли азотную кислоту (3,434 мл, 54,94 ммоль). После добавления реакционную смесь перемешивали еще в течение 15 минут при комнатной температуре, затем гасили путем выливания на лед при быстром перемешивании. Результирующую желтоватую суспензию фильтровали, ополаскивали водой, потом твердую фазу растирали с МеОН (50 мл, при краткой обработке ультразвуком) и подвергали вакуум-фильтрации с получением чистого продукта в виде тонкого беловатого порошка (2,2 г, 58% выход).
Стадия С: Получение (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. К желтоватому раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)-3-нитропиразоло[1,5-а]пиримидина (2,3 г, 6,66 ммоль), в 1:1 смеси MeOH/DCM (30 мл/30 мл) добавляли цинковую пыль (4,36 г, 66,6 ммоль) [<10 микрон, Aldrich] при перемешивании. К этой суспензии при быстром перемешивании по каплям добавляли насыщенный водный раствор NH4Cl (30 мл). После того как добавление NH4Cl было завершено, данную реакционную смесь охлаждали до комнатной температуры и перемешивали еще 15 минут. Реакционную смесь разбавляли дихлорметаном (DCM) (50 мл) и фильтровали через бумагу GF/F, споласкивая влажную лепешку с помощью DCM. Органический слой фильтрата отделяли и водный слой экстрагировали DCM (2×50 мл). Органические слои объединяли, промывали рассолом (100 мл), осушивали над Na2SO4 и концентрировали с получением, по сути, чистого продукта в виде коричневатого пенистого твердого вещества (2,08 г, 99% выход), которое было использовано без дополнительной очистки.
Пример 1
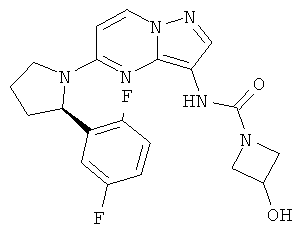
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид
К DCM (1,0 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 50 мг, 0,16 ммоль) добавляли КДИ (39 мг, 0,24 ммоль) при комнатной температуре одной порцией. После перемешивания в течение двух часов одной порцией добавляли азетидин-3-ол гидрохлорид (35 мг, 0,32 ммоль) [приобретенный у фирмы Oakwood] с последующим добавлением ДИЭА (0,083 мл, 0,48 ммоль). После перемешивания на протяжении 5 минут данную реакционную смесь концентрировали и непосредственно очищали способом колоночной хроматографии с обратной фазой, с элюированием смесью 5-48% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (66 мг, 100% выход). МС (химическая ионизация при атмостферном давлении) m/z=415.2 (M+H).
Пример 1А
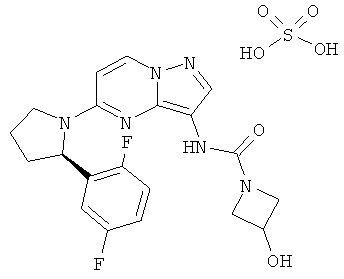
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид сульфат
К раствору (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида (44 мг, 0,11 ммоль) в метаноле (3 мл) при комнатной температуре добавляли серную кислоту в метаноле (531 мкл, 0,11 ммоль). Результирующий раствор перемешивали в течение 30 минут, затем концентрировали с получением (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид сульфата (38 мг, 0,074 ммоль, 70% выход) в виде желтого твердого вещества.
Пример 1В

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид гидрохлорид
К раствору в метаноле (1 мл) (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида (5,2 мг, 0,013 ммоль) добавляли НСl в виде раствора в диоксане (30 мкл). Через 30 минут данную реакционную смесь концентрировали с получением (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид гидрохлорида (5,7 мг, 0,013 ммоль, 101% выход) в виде твердого вещества желтого цвета.
Пример 2

(R)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1,1-диметилмочевина
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 30 мг, 0,095 ммоль) добавляли КДИ (31 мг, 0,19 ммоль) при комнатной температуре одной порцией. После перемешивания в течение двух часов одной порцией добавляли диметиламин (0,095 мл × 2 N ТГФ, 0,19 ммоль). Данную реакционную смесь перемешивали в течение 5 минут, затем концентрировали и остаток подвергали прямой очистке способом колоночной хроматографии с обратной фазой, с элюированием 0-60% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (33 мг, 90% выход). МС (химическая ионизация при атмосферном давлении) m/z=387.2 (М+Н).
Пример 2А
(R)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1,1-диметилмочевина гидрохлорид
К раствору в метаноле (1 мл) (R)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1,1-диметилмочевины (8,5 мг, 0,022 ммоль) добавляли HCl в виде раствора в диоксане (30 мкл). Через 30 минут данную реакционную смесь концентрировали с получением (R)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1,1-диметил мочевина гидрохлорида (6,7 мг, 0,016 ммоль, 72% выход) в виде твердого вещества желтого цвета.
Пример 3

(R)-1-трет-бутил-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а] пиримидин-3 -ил)мочевина
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 25 мг, 0,079 ммоль) по каплям при комнатной температуре добавляли 2-изоцианато-2-метилпропан (9,4 мг, 0,095 ммоль) с последующим добавлением ДИЭА (0,028 мл, 0,16 ммоль). Данную реакционную смесь перемешивали в течение 4 часов, затем концентрировали и остаток непосредственно очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-65% ацетонитрил/вода с получением конечного продукта в виде твердого вещества бледно-желтого цвета (27 мг, 82% выход). МС (химическая ионизация при атмосферном давлении) m/z=415.1 (М+Н).
Пример 4
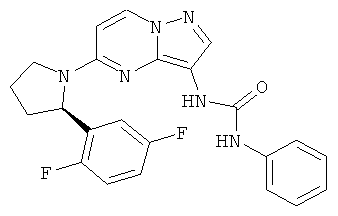
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-фенилмочевина
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 25 мг, 0,079 ммоль) при комнатной температуре по каплям добавляли изоцианатобензол (19 мг, 0,16 ммоль). Данную реакционную смесь перемешивали в течение 5 минут, затем концентрировали и остаток непосредственно очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-60% ацетонитрил/вода с получением конечного продукта в виде бледно-желтоватого твердого вещества (30 мг, 87% выход). МС (химическая ионизация при атмосферном давлении) m/z=435.2 (М+Н).
Пример 4А
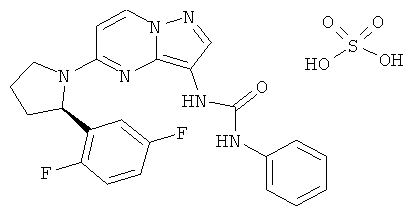
(R)-1(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-фенилмочевина сульфат
К раствору (R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-фенилмочевины (10,1 мг, 0,0232 ммоль) в метаноле (0,5 мл) при комнатной температуре добавляли серную кислоту в метаноле (232 мкл, 0,0232 ммоль). Результирующий раствор перемешивали в течение 30 минут, затем концентрировали с получением (R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-фенилмочевина сульфата (12 мг, 0,0225 ммоль, 96,9% выход) в виде твердого вещества желтого цвета.
Пример 5
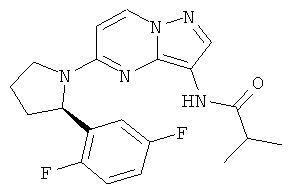
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)изобутирамид
ДХМ (0,5 мл) раствор (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 20 мг, 0,063 ммоль) охлаждали на ледяной бане, затем добавляли ангидрид изомасляной кислоты (11,0 мг, 0,070 ммоль) и пиридин (10 мг, 0,12 ммоль) по каплям. Данную реакционную смесь подогревали до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь непосредственно очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-60% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого твердого вещества (17 мг, 71%). МС (химическая ионизация при атмосферном давлении) m/z=386.2 (M+H).
Пример 6
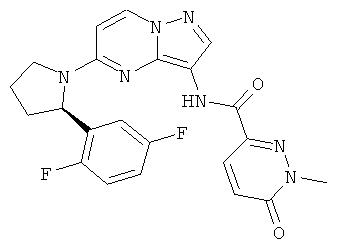
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-6-оксо-1,6-дигидропиридазин-3-карбоксамид
Стадия А: Получение (R)-5-[2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, с замещением (R)-2-(2,5-дифторфенил)пирролидина на Стадии А (R)-2-(3-фторфенил)пирролидином.
Стадия В: Получение (R)-2-(3-фторфенил)пирролидина. Получен в соответствии со способом получения А, с замещением 2-бром-1,4-дифторбензола 1-бром-3-фторбензолом на Стадии А.
Стадия С: Получение (R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-6-оксо-1,6-дигидропиридазин-3-карбоксамида. К смеси (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (30 мг, 0,10 ммоль), 1-метил-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты (34 мг, 0,22 ммоль) и HATU (84 мг, 0,22 ммоль) добавляли 0,8 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси добавляли по каплям ДИЭА (0,053 мл, 0,30 ммоль). Данную реакционную смесь подогревали до комнатной температуры и перемешивали в течение ночи. Результирующую тонкую желтоватую суспензию из реакционной смеси отфильтровывали, ополаскивали сначала ДМФА и затем эфиром с получением конечного продукта в виде твердого вещества желтоватого цвета (14,4 мг, 33% выход). МС (химическая ионизация при атмосферном давлении) m/z=434.2 (М+Н).
Пример 7
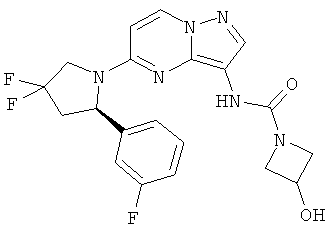
(R)-N-(5-(4,4-дифтор-2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид
Стадии А1-А6: Получение (R)-4,4-дифтор-2-(3-фторфенил)-пирролидина
Стадия А1. Получение (R)-3-(трет-бутилдиметилсилилокси)-5-(3-фторфенил)-3,4-дигидро-2Н-пиррола: (3-фторфенил)магний бромид (203,2 мл × 0,5 М эфир, 102 ммоль) медленно добавляли (через шприц) к раствору (R)-3-(трет-бутилдиметилсилилокси)-4-хлорбутаннитрила (9,5 г, 40,6 ммоль) в 120 мл МТВЕ. Данную реакционную смесь перемешивали в течение двух часов и затем медленно в течение 15 минут добавляли ДМЭ (35 мл), с последующим добавлением EtOH (23 мл). После перемешивания в течение ночи к реакционной смеси добавляли рассол и 1 М NaOH (по 50 мл каждого). После перемешивания в течение одного часа данную реакционную смесь фильтровали через целит, ополаскивали твердую фазу EtOAc. Фильтрат промывали 1 N NaOH и рассолом, фильтровали через фильтровальную бумагу для разделения фаз и концентрировали с получением неочищенного продукта, который переносился на следующую стадию без дополнительной очистки (12,8 г, 107% выход).
Стадия А2. Получение (3R,5R)-5-(3-фторфенил)пирролидин-3-ола: (R)-3-(трет-бутилдиметилсилилокси)-5-(3-фторфенил)-3,4-дигидро-2Н-пиррол (5,0 г, 17,0 ммоль) растворяли в 50 мл метанола и 10 мл АсОН и охлаждали до -40°С. Малыми порциями медленно добавляли NaBH4 (1,6 г, 43 ммоль). Данную реакционную смесь подогревали до комнатной температуры. Большую часть растворителя удаляли способом роторного выпаривания. Реакционную смесь растворяли в 200 мл EtOAc, промывали 1 N NaOH и фильтровали через фильтровальную бумагу для разделения фаз и концентрировали. Неочищенный продукт растворяли в 20 мл 2 N HCl в диоксане. Реакционную смесь концентрировали, растворяли в 200 мл EtOAc, промывали 1 N NaOH, фильтровали и концентрировали, с получением неочищенного продукта, который переносили на следующую стадию без дополнительной очистки (2,93 г, 95% выход).
Стадия A3. Получение (2R,4R)-трет-бутил 2-(3-фторфенил)-4-гидроксипирролидин-1-карбоксилата. К смеси (3R,5R)-5-(3-фторфенил)пирролидин-3-ола (3,4 г, 18,8 ммоль), ди-трет-бутил дикарбоната (4,91 г, 22,5 ммоль) и ПС-ДМАП (2,29 г, 18,8 ммоль) добавляли 100 мл ДХМ и 50 мл ТГФ и данную реакционную смесь выдерживали в течение одной недели с периодической обработкой ультразвуком. Смесь фильтровали, концентрировали и очищали способом кремнеземной колоночной хроматографии, с элюированием 2-10% МеОН/ДХМ с получением чистого продукта (4 г, 76% выход).
Стадия А4. Получение (R)-трет-бутил 2-(3-фторфенил)-4-оксопирролидин-1-карбоксилата: (2R,4R)-трет-бутил 2-(3-фторфенил)-4-гидроксипирролидин-1-карбоксилат (1,4 г, 4,98 ммоль) и периодинан Десса-Мартина (Dess-Martin) (2,53 г, 5,97 ммоль) смешивали в 50 мл ДХМ и перемешивали при комнатной температуре в течение ночи. Для обработки, 20 мл 1 N NaOH добавляли к реакционной смеси и перемешивали в течение 30 минут, затем добавляли 20 мл рассола. Данную реакционную смесь экстрагировали несколькими порциями ДХМ. Объединенные органические экстракты фильтровали через фильтровальную бумагу для разделения фаз, концентрировали и очищали способом хроматографии с обратной фазой, с элюированием 20-70% ацетонитрил/вода с получением продукта в виде масла желтого цвета (600 мг, 43% выход).
Стадия А5. Получение (R)-трет-бутил 4,4-дифтор-2-(3-фторфенил)пирролидин-1-карбоксилата: (R)-трет-бутил 2-(3-фторфенил)-4-оксопирролидин-1-карбоксилат (200 мг, 0,72 ммоль) и [бис(2-метоксиэтил)амино]серы трифторид (238 мг, 1,07 ммоль) смешивали в 25 мл ДХМ и перемешивали при комнатной температуре в течение ночи.
Для обработки добавляли 5 мл 1 N NaOH и данную реакционную смесь перемешивали в течение 30 минут. Реакционную смесь фильтровали через целит, ополаскивали ДХМ. К фильтрату добавляли рассол (2 мл) и смесь фильтровали через фритту для разделения фаз Biotage (Biotage Phase Separator frit), промывали несколькими порциями дихлорметана. Объединенные органические экстракты концентрировали и очищали способом хроматографии с обратной фазой, с элюированием 20-90% ацетонитрил/вода с получением продукта в виде прозрачного масла (180 мг, 83%).
Стадия А6. Получение (R)-4,4-дифтор-2-(3-фторфенил)пирролидина. К (R)-трет-бутил 4,4-дифтор-2-(3-фторфенил)пирролидин-1-карбоксилату (180 мг, 0,6 ммоль в реакционной трубке высокого давления добавляли раствор HCl (2 мл, 4 N диоксан, 8 ммоль), затем реакционную смесь герметизировали и нагревали при 60°С в течение 4 часов. Для обработки данную реакционную смесь выливали в смесь льда и 1 М NaOH и экстрагировали несколькими порциями EtOAc. Объединенные органические экстракты фильтровали через фильтровальную бумагу для разделения фаз (Phase Separator filter paper) и концентрировали с получением конечного продукта в виде прозрачного масла, которое использовалось на следующей стадии без дополнительной очистки.
Стадия В: Получение (R)-5-(4,4-дифтор-2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, с замещением (R)-2-(2,5-дифторфенил)пирролидина на Стадии 1 (R)-4,4-дифтор-2-(3-фторфенил)-пирролидином.
Стадия С: Получение (R)-N-(5-(4,4-дифтор-2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида. К ДХМ (0,7 мл) раствору (R)-5-(4,4-дифтор-2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (25 мг, 0,074 ммоль) добавляли одной порцией КДИ (18 мг, 0,11 ммоль) при комнатной температуре. После перемешивания в течение двух часов одной порцией добавляли азетидин-3-ол гидрохлорид (16 мг, 0,15 ммоль), затем ДИЭА (0,039 мл, 0,22 ммоль). Данную реакционную смесь перемешивали в течение ночи, затем концентрировали и остаток непосредственно очищали способом колоночной хроматографии с обратной фазой, с элюированием 0-45% ацетонитрил/вода с получением конечного продукта в виде желтоватого масла (15 мг, 48% выход). МС (химическая ионизация при атмосферном давлении) m/z=433.1 (М+Н).
Пример 8
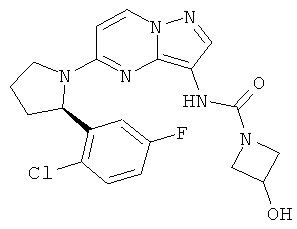
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид
Стадия А: Получение (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, с замещением (R)-2-(2,5-дифторфенил)пирролидина на Стадии 1 (R)-2-(2-хлор-5-фторфенил)пирролидином.
Стадия В: Получение (R)-2-(2-хлор-5-фторфенил)пирролидина. Получен по способу получения А, с замещением 2-бром-1,4-дифторбензола 2-бром-1-хлор-4-фторбензолом на Стадии А.
Стадия С: Получение (R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида. К ДХМ (0,8 мл) раствору (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (30 мг, 0,090 ммоль) добавляли при комнатной температуре КДИ (29 мг, 0,18 ммоль) одной порцией. После перемешивания в течение двух часов одной порцией добавляли азетидин-3-ол гидрохлорид (20 мг, 0,18 ммоль), затем ДИЭА (0,047 мл, 0,27 ммоль). Реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-50% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (33 мг, 85% выход). МС (химическая ионизация при атмосферном давлении) m/z=431.1 (М+Н).
Пример 8А

(R)-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид
К раствору (R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида (11,1 мг, 0,0258 ммоль) в метаноле (1 мл) при комнатной температуре добавляли серную кислоту в метаноле (258 мкл, 0,0258 ммоль). Результирующий раствор перемешивали в течение 30 минут, затем концентрировали с получением (R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид сульфата (10 мг, 0,0189 ммоль, 73,4% выход) в виде желтого твердого вещества.
Пример 9

(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамид
Стадия А: Получение (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, с замещением (R)-2-(2,5-дифторфенил)пирролидина на Стадии А (R)-2-(3-фторфенил)пирролидином.
Стадия В: Получение (R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамида. К ДХМ (0,8 мл) раствору (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (50 мг, 0,17 ммоль) добавляли одной порцией при комнатной температуре КДИ (41 мг, 0,25 ммоль). После перемешивания в течение двух часов одной порцией добавляли морфолин (22 мг, 0,25 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-54% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (69 мг, 100% выход). МС (химическая ионизация при атмосферном давлении) m/z=411.2 (М+Н).
Пример 10
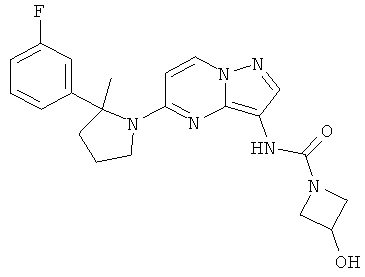
N-(5-(2-(3-фторфенил)-2-метилпирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид
Стадия А: Получение трет-бутил 4-(3-фторфенил)-4-оксобутилкарбамата. В круглодонную колбу загружали трет-бутил 2-оксопирролидин-1-карбоксилат (2,2 г, 11,9 ммоль) и ТГФ (25 мл). Смесь сначала охлаждали до -78°С, затем медленно, в течение 15 минут добавляли (3-фторфенил)магний бромид (17,8 мл, 17,8 ммоль, 1,0 М раствор в ТГФ). Данную смесь перемешивали в течение 3 часов, и за это время температура бани возросла от -78°С до -10°С. Реакцию гасили путем покапельного добавления 1 N HCl (2 мл) и смесь подогревали до комнатной температуры, затем добавляли EtOAc и воду. После отделения органического слоя водный слой трижды экстрагировали EtOAc. Объединенные органические слои осушивали над Na2SO4 и концентрировали с получением продукта в виде прозрачного масла.
Стадия В: Получение 5-(3-фторфенил)-3,4-дихлордигидро-2Н-пиррола. Неочищенный трет-бутил 4-(3-фторфенил)-4-оксобутилкарбамат сначала растворяли в 10 мл CH2Cl2, затем добавляли 10 мл 4N HCl (диоксан). Данную реакционную смесь перемешивали при комнатной температуре в течение 4 часов и фильтровали с получением HCl соли необходимого продукта в виде белого твердого вещества (~2 г). Для получения продукта в виде свободного основания EtOAc и насыщенный NaHCO3 (водн.) раствор добавляли к HCl соли данного продукта. После отделения органического слоя водный слой трижды экстрагировали EtOAc. Объединенные органические экстракты осушивали над Na2SO4 и концентрировали с получением 5-(3-фторфенил)-3,4-дигидро-2Н-пиррола (1,46 г, 75%).
Стадия С: Получение 2-(3-фторфенил)-2-метилпирролидина. Раствор 5-(3-фторфенил)-3,4-дигидро-2Н-пиррола (6,1 г, 37,4 ммоль) в 100 мл ТГФ охлаждали до -78°С и в течение 5 минут по каплям добавляли диэтиловый эфир трифторборной кислоты (9,47 мл, 74,8 ммоль). Результирующую мутную реакционную смесь перемешивали при -78°С в течение 40 минут. По каплям в течение 10 минут добавляли MeLi (1,6 M в диэтиловом эфире, 46,7 мл, 74,8 ммоль). Данную смесь перемешивали при -78°С в течение еще 2 часов, затем подогревали до комнатной температуры в течение ночи. Для обработки, к данной реакционной смеси добавляли воду и EtOAc и водный слой подкисляли раствором HCl. После отделения и отбрасывания органического слоя водный слой подщелачивали NaOH (6 N, водн.) до рН 12 и дважды экстрагировали EtOAc. Объединенные органические экстракты осушивали над Na2SO4 и концентрировали с получением смеси необходимого продукта (2-(3-фторфенил)-2-метилпирролидина) и исходного материала (4,3 г, 1,3:1 необходимый продукт: исходный материал, 37% выход). Неочищенный продукт был использован на последующей стадии без какой-либо дополнительной очистки.
Стадия D: Получение 5-(2-(3-фторфенил)-2-метилпирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, с замещением (R)-2-(2,5-дифторфенил)пирролидина на Стадии 1 2-(3-фторфенил)-2-метилпирролидином.
Стадия Е: Получение N-(5-(2-(3-фторфенил)-2-метилпирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида. К ДХМ (0,7 мл) раствору 5-(2-(3-фторфенил)-2-метилпирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (25 мг, 0,08 ммоль) при комнатной температуре одной порцией добавляли КДИ (20 мг, 0,12 ммоль). После перемешивания в течение одного часа одной порцией добавляли азетидин-3-ол гидрохлорид (20 мг, 0,12 ммоль), затем ДИЭА (0,028 мл, 0,16 ммоль). Данную реакционную смесь перемешивали в течение 30 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-60% ацетонитрил/вода с получением конечного продукта в виде желтоватого масла (18 мг, 55% выход). МС (химическая ионизация при атмосферном давлении) m/z=411.2 (M+H).
Пример 11

(R)-N-(5-(2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а1пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид
Стадия А: Получение (R)-5-(2-(3-хлор-5-фторфенил)пирролидин-1 -ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, с замещением (R)-2-(2,5-дифторфенил)пирролидина на Стадии А (R)-2-(3-хлор-5-фторфенил)пирролидином.
Стадия В: Получение (R)-2-С3-хлор-5-фторфенил)пирролидина. Получен в соответствии со способом получения А, с замещением 2-бром-1,4-дифторбензола 1-бром-3-хлор-5-фторбензолом на Стадии А.
Стадия С: Получение (R)-N-(5-(2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида. К ДХМ (0,7 мл) раствору (R)-5-(2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (20 мг, 0,06 моль, полученного, как описано в следующем разделе) при комнатной температуре одной порцией добавляли КДИ (20 мг, 0,12 ммоль). После перемешивания в течение двух часов одной порцией добавляли азетидин-3-ол гидрохлорид (20 мг, 0,18 ммоль), затем ДИЭА (0,032 мл, 0,18 ммоль). Данную реакционную смесь перемешивали в течение ночи перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-60% ацетонитрил/вода с получением конечного продукта в виде твердого вещества (29 мг, 74% выход). МС (химическая ионизация при атмосферном давлении) m/z=431.2 (М+Н).
Пример 12

(R)-N-(5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид
Стадия А: Получение (R)-5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, с замещением (R)-2-(2,5-дифторфенил)пирролидина на Стадии А (R)-2-(2-(дифторметил)-5-фторфенил)пирролидином.
Стадия В: Получение (R)-2-(3-хлор-5-фторфенил)пирролидина. Получен в соответствии со способом получения А, с замещением 2-бром-1,4-дифторбензола 2-бром-1-(дифторметил)-4-фторбензолом на Стадии А.
Стадия С: Получение (R)-N-(5-(2-(2-(дифторметил)-5-Фторфенил) пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида. К ДХМ (0,6 мл) раствору (R)-5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (10 мг, 0,028 ммоль, полученного, как описано в следующем разделе) при комнатной температуре одной порцией добавляли КДИ (9 мг, 0,056 ммоль). После перемешивания в течение двух часов одной порцией добавляли азетидин-3-ол гидрохлорид (6 мг, 0,056 ммоль), затем ДИЭА (0,015 мл, 0,084 ммоль). Данную реакционную смесь перемешивали в течение ночи перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-50% ацетонитрил/вода с получением конечного продукта в виде твердого вещества. МС (химическая ионизация при атмосферном давлении) m/z=447.2 (М+Н).
Пример 13

(R)-N-(5-(2-(2,5-дифторфенил1)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 30 мг, 0,095 ммоль) одной порцией при комнатной температуре добавляли КДИ (31 мг, 0,19 ммоль). После перемешивания в течение двух часов одной порцией добавляли морфолин (17 мг, 0,19 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-55% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (37 мг, 91% выход). МС (химическая ионизация при атмосферном давлении) m/z=429.2 (М+Н).
Пример 14

(S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 30 мг, 0,095 ммоль) при комнатной температуре одной порцией добавляли КДИ (31 мг, 0,19 ммоль). После перемешивания в течение двух часов одной порцией добавляли (В)-пирролидин-3-ол (17 мг, 0,19 ммоль) [приобретенный у фирмы Suven Life Sciences]. Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-50% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (30 мг, 74% выход). МС (химическая ионизация при атмосферном давлении) m/z=429.2 (М+Н).
Пример 14А
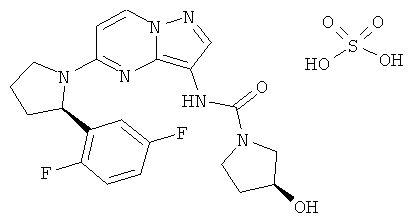
(S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид сульфат
К раствору (S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида (4,5 мг, 0,011 ммоль) в метаноле (1 мл) при комнатной температуре добавляли серную кислоту в МеОН (105 мкл, 0,011 ммоль). Результирующий раствор перемешивали в течение 30 минут, затем концентрировали с получением (S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид сульфата (5,2 мг, 0,0099 ммоль, 94% выход) в виде твердого вещества желтого цвета.
Пример 15
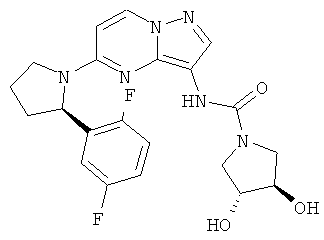
(3R,4R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3,4-дигидроксипирролидин-1-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 26 мг, 0,08 ммоль) при комнатной температуре одной порцией добавляли КДИ (27 мг, 0,16 ммоль). После перемешивания в течение двух часов одной порцией добавляли (3R,4R)-пирролидин-3,4-диол (17,3 мг, 0,16 ммоль) [полученный путем депротектирования бензильной функции в коммерчески доступном (3R,4R)-1-бензилпирролидин-3,4-диоле]. Несколько капель ДМСО добавляли для получения прозрачного реакционного раствора. Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-45% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (27 мг, 74% выход). МС (химическая ионизация при атмосферном давлении) m/z=445.2 (М+Н).
Пример 16

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 30 мг, 0,095 ммоль) при комнатной температуре одной порцией добавляли КДИ (31 мг, 0,19 ммоль). После перемешивания в течение двух часов одной порцией добавляли 3-метоксиазетидин 2,2,2-трифторацетат (38 мг, 0,19 ммоль) [полученный путем N-депротектирования коммерчески доступного трет-бутил 3-метоксиазетидин-1-карбоксилата с использованием ТФУК в диметилхлорметане], с последующим добавлением ДИЭА (0,050 мл, 0,29 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-55% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (34 мг, 83% выход). МС (химическая ионизация при атмосферном давлении) m/z=429.2 (М+Н).
Пример 16А
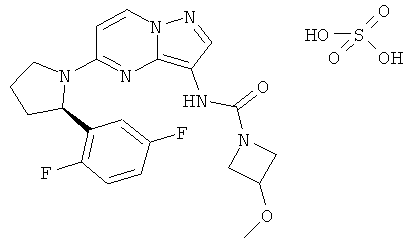
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамид сульфат
К раствору (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамида (6,2 мг, 0,014 ммоль) в метаноле (1 мл) при комнатной температуре добавляли серную кислоту в метаноле (145 мкл, 0,014 ммоль). Результирующий раствор перемешивали в течение 30 минут, затем концентрировали с получением (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамид сульфата (7,2 мг, 0,014 ммоль, 94% выход) в виде твердого вещества желтого цвета.
Пример 17

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 30 мг, 0,095 ммоль) при комнатной температуре одной порцией добавляли КДИ (31 мг, 0,19 ммоль). После перемешивания в течение двух часов одной порцией добавляли 3-метоксиазетидин 3-метилазетидин-3-ол гидрохлорид (26 мг, 0,19 ммоль) [полученный путем N-депротектирования коммерчески доступного 1-бензгидрил-3-метилазетидин-3-ола при условиях гидрирования, которым благоприятствовал Pd(OH)2 в EtOH и 1% ТФУК], с последующим добавлением ДИЭА (0,050 мл, 0,29 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-50% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (27 мг, 66% выход). МС (химическая ионизация при атмосферном давлении) m/z=429.2 (М+Н).
Пример 17А

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамид сульфат
К раствору (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамида (3,1 мг, 0,0072 ммоль) в метаноле (1 мл) при комнатной температуре добавляли серную кислоту в метаноле (145 мкл, 0,014 ммоль). Результирующий раствор перемешивали в течение 30 минут, затем концентрировали с получением (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамид сульфата (3,3 мг, 0,0063 ммоль, 87% выход) в виде твердого вещества желтого цвета.
Пример 17В
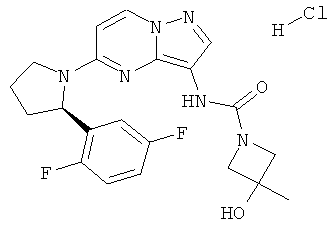
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамид гидрохлорид
К раствору в метаноле (1 мл) (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамида (10,2 мг, 0,0238 ммоль) добавляли HCl в виде раствора в диоксане (30 мкл). Через 30 минут реакционную смесь концентрировали с получением (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамид гидрохлорида (8,3 мг, 0,0179 ммоль, 75.0% выход) в виде твердого вещества желтого цвета.
Пример 18
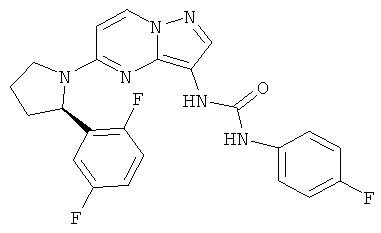
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-(4-фторфенил)мочевина
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 25 мг, 0,079 ммоль) при комнатной температуре по каплям добавляли 1-фтор-4-изоцианатобензол (13 мг, 0,095 ммоль) затем ДИЭА (0,028 мл, 0,16 ммоль). Данную реакционную смесь перемешивали в течение 90 минут перед ее концентрированием и непосредственной очисткой способом кремнеземной колоночной хроматографии с элюированием 3:1 EtOAc/гексаны с получением конечного продукта в виде твердого вещества (30 мг, 84% выход). МС (химическая ионизация при атмосферном давлении) m/z=453.2 (М+Н).
Пример 19
(R)-1-(4-хлорфенил)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)мочевина
Получена по способу, описанному в примере 18, замещение 1-фтор-4-изоцианатобензола 1-хлор-4-изоцианатобензолом дало конечный продукт в виде тонкого белого твердого вещества (33 мг, 89%). МС (химическая ионизация при атмосферном давлении) m/z=469.1 (М+Н).
Пример 20
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-1]пиримидин-3-ил)-3-(4-метоксифенил)мочевина
Получена по способу, описанному в примере 18, замещение 1-фтор-4-изоцианатбензола 1-метокси-4-изоцианатбензолом и элюирование сначала 4:1 EtOAc/гексаны и затем 100% EtOAc на стадии очистки способом кремнеземной колоночной хроматографии дало конечный продукт в виде тонкого белого твердого вещества (34 мг, 92%). МС (химическая ионизация при атмосферном давлении) m/z=465.2 (М+Н).
Пример 21

(R)-N-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамид
Стадия А: Получение (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В с замещением (R)-2-(2,5-дифторфенил)пирролидина на Стадии А (R)-2-(2-хлор-5-фторфенил)пирролидином.
Стадия В: Получение (R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамида. К ДХМ (0,8 мл) раствору (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (30 мг, 0,090 ммоль) при комнатной температуре одной порцией добавляли КДИ (29 мг, 0,18 ммоль). После перемешивания в течение двух часов одной порцией добавляли 3-метоксиазетидин 2,2,2-трифторацетат (36 мг, 0,18 ммоль) [полученный путем N-депротектирования коммерчески доступного трет-бутил 3-метоксиазетидин-1-карбоксилата с использованием ТФУК в ДХМ], затем ДИЭА (0,047 мл, 0,27 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-60% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (36 мг, 89% выход). МС (химическая ионизация при атмосферном давлении) m/z=445.2 (М+Н).
Пример 22

(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2-хлор-5-фторфенил1)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 8, Стадия А; 22 мг, 0,066 ммоль) при комнатной температуре одной порцией добавляли КДИ (22 мг, 0,13 ммоль). После перемешивания в течение двух часов одной порцией добавляли 3-метоксиазетидин 3-метилазетидин-3-ол гидрохлорид (18 мг, 0,13 ммоль) с последующим добавлением ДИЭА (0,035 мл, 0,20 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-50% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (21 мг, 71% выход). МС (химическая ионизация при атмосферном давлении) m/z=445.2 (М+Н).
Пример 23
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамид
Получен в соответствии со способом примера 22, замещение (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а] пиримидин-3-амина морфолином дало продукт в виде желтоватого пенистого порошка (26 мг, 76% выход). МС (химическая ионизация при атмосферном давлении) m/z=445.1 (М+Н).
Пример 24
(S)-трет-бутил 4-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)-2-метилпиперазин-1-карбоксилат
Получен в соответствии со способом примера 22, замещение (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (S)-трет-бутил 2-метилпиперазин-1-карбоксилатом дало продукт в виде желтоватого пенистого порошка (47 мг, 80% выход). МС (химическая ионизация при атмосферном давлении) m/z=558.1 (М+Н).
Пример 25
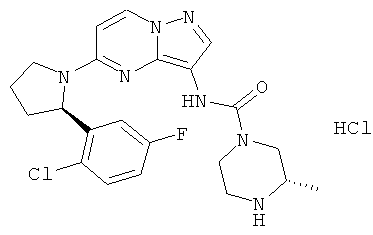
(S)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиперазин-1-карбоксамид гидрохлорид
К (S)-трет-бутил 4-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)-2-метилпиперазин-1-карбоксилату (пример 24; 47 мг, 0,084 ммоль) добавляли 1 мл 4 N HCl (диоксан) раствора и перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь концентрировали, обрабатывали эфиром и фильтровали с получением конечного продукта соли HCl в виде тонкого порошка бежевого цвета. МС (химическая ионизация при атмосферном давлении) m/z=458.1 (М+Н).
Пример 26

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-изопропилпиперазин-1 -карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 30 мг, 0,095 ммоль) при комнатной температуре одной порцией добавляли КДИ (31 мг, 0,19 ммоль). После перемешивания в течение двух часов одной порцией добавляли 1-изопропилпиперазин (24 мг, 0,19 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-45% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенящегося порошка (40 мг, 90% выход). МС (химическая ионизация при атмосферном давлении) m/z=470.1 (М+Н).
Пример 27
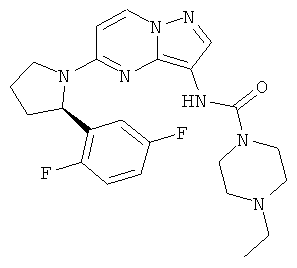
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-этилпиперазин-1-карбоксамид
Получен по способу, описанному в примере 26, замена 1-изопропилпиперазина 1-этилпиперазином дала конечный продукт в виде желтоватого твердого вещества (40 мг, 92%). МС (химическая ионизация при атмосферном давлении) m/z=456.1 (М+Н).
Пример 28
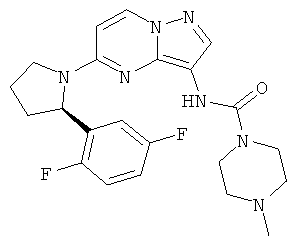
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-метилпиперазин-1-карбоксамид
Получен по способу, описанному в примере 26, замена 1-изопропилпиперазина 1-метилпиперазином дала конечный продукт в виде желтоватого твердого вещества (38 мг, 90%). МС (химическая ионизация при атмосферном давлении) m/z=442.2 (М+Н).
Пример 28А
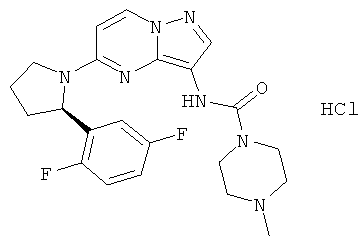
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-метилпиперазин-1-карбоксамид гидрохлорид
К раствору в метаноле (1 мл) (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-метилпиперазин-1-карбоксамида добавляли HCl как раствор в диоксане (30 мкл). Через 30 минут данную реакционную смесь концентрировали с получением (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-метилпиперазин-1-карбоксамид гидрохлорида в виде твердого вещества желтого цвета.
Пример 29
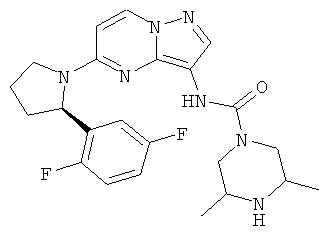
N-(5-((R)-2-(2,5-дифторфеншрпирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3,5-диметилпиперазин-1-карбоксамид
Получен по способу, описанному в примере 26, замена 1-изопропилпиперазина 2,6-диметилпиперазином [главным образом, cis, Aldrich] дала конечный продукт в виде твердого вещества желтоватого цвета (34 мг, 78%). МС (химическая ионизация при атмосферном давлении) m/z=456.2 (М+Н).
Пример 30

(S)-трет-бутил 4-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)-2-метилпиперазин-1-карбоксилат
Получен по способу, описанному в примере 26, замена 1-изопропилпиперазина (S)-трет-бутил 2-метилпиперазин-1-карбоксилатом дает конечный продукт в виде твердого вещества желтоватого цвета (47 мг, 90%). МС (химическая ионизация при атмосферном давлении) m/z=542.2 (М+Н).
Пример 31
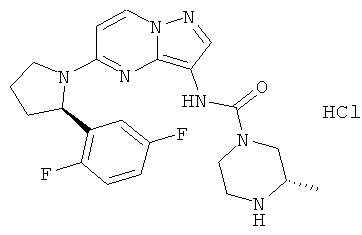
(S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиперазин-1-карбоксамид гидрохлорид
К (S)-трет-бутил 4-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)-2-метилпиперазин-1-карбоксилату (пример 30; 47 мг, 0,087 ммоль) добавляли 1 мл 4 N HCl (диоксан) раствор и перемешивали при комнатной температуре в течение 1 часа. Данную реакционную смесь концентрировали, обрабатывали эфиром и фильтровали с получением конечного продукта как HCl соли в виде тонкого желтоватого порошка. МС (химическая ионизация при атмосферном давлении) m/z=442.2 (М+Н).
Пример 32
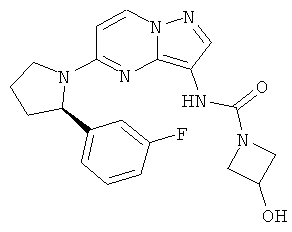
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 6, Стадия А; 50 мг, 0,17 ммоль) при комнатной температуре одной порцией добавляли КДИ (41 мг, 0,25 ммоль). После перемешивания в течение двух часов одной порцией добавляли азетидин-3-ол гидрохлорид (28 мг, 0,25 ммоль), с последующим добавлением ДИЭА (0,059 мл, 0,34 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-55% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (64 мг, 96% выход). МС (химическая ионизация при атмосферном давлении) m/z=397.2 (М+Н).
Пример 33

(R)-метил 1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)циклопропанкарбоксилат
К смеси (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 43 мг, 0,14 ммоль), 1-(метоксикарбонил)циклопропанкарбоновой кислоты (24 мг, 0,16 ммоль) и HATU (62 мг, 0,16 ммоль) добавляли 0,7 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси добавляли по каплям ДИЭА (0,053 мл, 0,30 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 10 минут. Реакционную смесь разбавляли EtOAc (15 мл), промывали водой, рассолом (по 5 мл каждого), концентрировали и очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-72% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенистого порошка (36 мг, 60% выход). МС (химическая ионизация при атмосферном давлении) m/z=442.2 (М+Н).
Пример 34
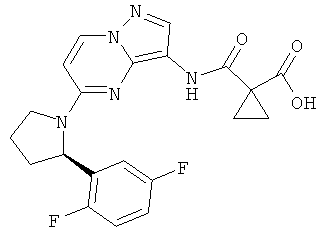
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)циклопропанкарбоновая кислота
(R)-метил 1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)циклопропанкарбоксилат (пример 33; 24 мг, 0,054 ммоль) растворяли в смеси растворителей ТГФ/МеОН/вода (0,3/0,3/0,2 мл), затем добавляли литийгидроксид моногидрат (6 мг, 0,14 ммоль). После перемешивания при комнатной температуре в течение пяти часов данную реакционную смесь разбавляли водой (15 мл), подкисляли 1 N HCl (водн.) до рН ~3 и фильтровали с получением конечного продукта в виде тонкого белого порошка (19 мг, 82% выход). МС (химическая ионизация при атмосферном давлении) m/z=428.2 (М+Н).
Пример 35

(S)-N-(5-((R)-2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
К ДХМ (0,6 мл) раствору (R-)-5-(2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 11, Стадия А; 20 мг, 0,06 ммоль) при комнатной температуре одной порцией добавляли КДИ (20 мг, 0,12 ммоль). После перемешивания в течение двух часов одной порцией добавляли (S)-пирролидин-3-ол (16 мг, 0,18 ммоль). Данную реакционную смесь перемешивали в течение ночи перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-60% ацетонитрил/вода с получением конечного продукта в виде твердого вещества (50 мг, 83% выход). МС (химическая ионизация при атмосферном давлении) m/z=445.2 (М+Н).
Пример 36
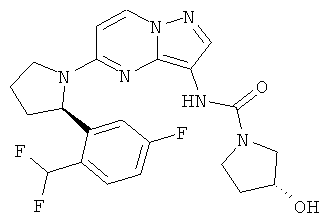
(R)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
Стадия А: Получение (R)-5-(2-(2-(диФторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, замена (R)-2-(2,5-дифторфенил)пирролидин на Стадии 1 (R)-2-(2-(дифторметил)-5-фторфенил)пирролидином.
Стадия В: Получение (R)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида. К ДХМ (0,6 мл) раствору (R)-5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (10 мг, 0,028 ммоль, полученного, как описано в следующем разделе) при комнатной температуре одной порцией добавляли КДИ (9 мг, 0,056 ммоль). После перемешивания в течение двух часов одной порцией добавляли (S)-пирролидин-3-ол (8 мг, 0,084 ммоль). Данную реакционную смесь перемешивали в течение ночи, затем концентрировали и подвергали непосредственной очистке способом колоночной хроматографии с обратной фазой, с элюированием 0-50% ацетонитрил/вода с получением конечного продукта в виде твердого вещества (9 мг, 69%). МС (химическая ионизация при атмосферном давлении) m/z=461.2 (М+Н).
Пример 37

(S)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
Получен по способу, описанному в примере 36, замена (S)-пирролидин-3-ола (R)-пирролидин-3-олом дала конечный продукт в виде твердого вещества (12 мг, 89%). МС (химическая ионизация при атмосферном давлении) m/z=461.2 (М+Н).
Пример 38

(R)-N-(5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-гидроксипиперидин-1-карбоксамид
Получен по способу, описанному в примере 36, замена (S)-пирролидин-3-ола пиперидин-4-олом дала конечный продукт в виде твердого вещества (11 мг, 80%). МС (химическая ионизация при атмосферном давлении) m/z=475.2 (М+Н).
Пример 39
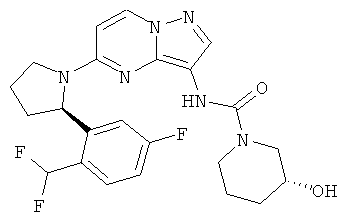
(R)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид
Получен по способу, описанному в примере 36, замена (S)-пирролидин-3-ола (R)-пиперидин-3-ол гидрохлоридом (с последующим добавлением 3 эквивалентов ДИЭА) дала конечный продукт в виде твердого вещества (10 мг, 74%). МС (химическая ионизация при атмосферном давлении) m/z=475.2 (М+Н).
Пример 40
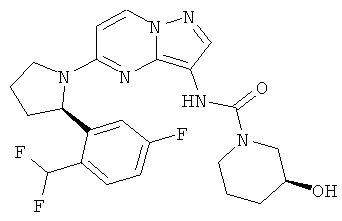
(S)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид
Получен по способу, описанному в примере 36, замена (S)-пирролидин-3-ола (S)-пиперидин-3-ол гидрохлоридом (с последующим добавлением 3 эквивалентов ДИЭА) дала конечный продукт в виде твердого вещества (11 мг, 80%). МС (химическая ионизация при атмосферном давлении) m/z=475.2 (М+Н).
Пример 41
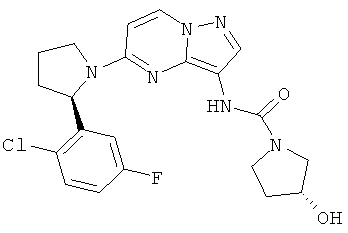
(R)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (10 мг, 0,030 ммоль, полученного, как в примере 8) при комнатной температуре одной порцией добавляли КДИ (10 мг, 0,06 ммоль). После перемешивания в течение двух часов одной порцией добавляли (S)-пирролидин-3-ол (5 мг, 0,06 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 20 часов перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-50% ацетонитрил/вода с получением конечного продукта в виде твердого вещества (9 мг, 67% выход). МС (химическая ионизация при атмосферном давлении) m/z=445.2 (М+Н).
Пример 42
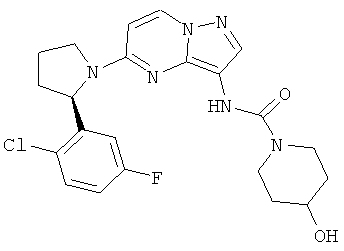
(R)-N-(5-(2-(2-хлор-5-фторфенил)пиролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-гидроксипиперидин-1-карбоксамид
Получен по способу, описанному в примере 41, замена (S)-пирролидин-3-ола пиперидин-4-олом дала конечный продукт в виде твердого вещества (8 мг, 60%). МС (химическая ионизация при атмосферном давлении) m/z=459.2 (М+Н).
Пример 43

(R)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид
Получен по способу, описанному в примере 41, замена (S)-пирролидин-3-ола (R)-пиперидин-3-ол гидрохлоридом (с последующим добавлением 3 эквивалентов ДИЭА) дала конечный продукт в виде твердого вещества (9,4 мг, 69%). МС (химическая ионизация при атмосферном давлении) m/z=459.1 (М+Н).
Пример 44

(R)-N-(5-(2-(-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид
Получен по способу, описанному в примере 41, замена (S)-пирролидин-3-ола гидрохлоридом (S)-пиперидин-3-ола (с последующим добавлением 3 эквивалентов ДИЭА) дала конечный продукт в виде твердого вещества (9,3 мг, 68%). МС (химическая ионизация при атмосферном давлении) m/z=459.2 (М+Н).
Пример 45

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло(1,5-а]пиримидин-3-ил)пиваламид
ДХМ (0,5 мл) раствор (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 20 мг, 0,063 ммоль) охлаждали на ледяной бане с последующим добавлением по каплям ангидрида пивалиновой кислоты (26 мг, 0,14 ммоль) и пиридина (12 мг, 0,14 ммоль). Данную реакционную смесь подогревали до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь подвергали непосредственной очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-65% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенящегося твердого вещества (19 мг, 75%). МС (химическая ионизация при атмосферном давлении) m/z=400.2 (М+Н).
Пример 46

(R)-трет-бутил 3-(5-(2-(2-хлор-5-Фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)азетидин-1-карбоксилат
К смеси (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 8, Стадия А; 20 мг, 0,06 ммоль), 1-(трет-бутоксикарбонил)азетидин-3-карбоновой кислоты (15 мг, 0,072 ммоль) и HATU (28 мг, 0,072 ммоль) добавляли 0,6 мл ацетонитрила с получением раствора. После охлаждения на ледяной бане в течение 10 минут к реакционной смеси по каплям добавляли ДИЭА (0,032 мл, 0,18 ммоль). Данную реакционную смесь подогревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь подвергали непосредственной очистке способом колоночной хроматографии с обратной фазой, с элюированием 5 - 70% ацетонитрил/вода с получением конечного продукта в виде беловатого твердого вещества (19 мг, 61% выход). МС (химическая ионизация при атмосферном давлении) m/z=515.0 (М+Н).
Пример 47
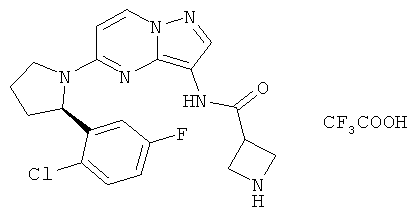
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)азетидин-3 -карбоксамид трифторацетат
К (R)-трет-бутил 3-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)азетидин-1-карбоксилату (пример 46; 17 мг, 0,033 ммоль) добавляли 0,5 мл 50% ТФУК раствора в ДХМ и перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь концентрировали, обрабатывали эфиром и фильтровали с получением конечного продукта (соли трифторуксусной кислоты) в виде тонкого порошка бежевого цвета (12 мг, 88% выход). МС (химическая ионизация при атмосферном давлении) m/z=415.2 (М+Н).
Пример 48
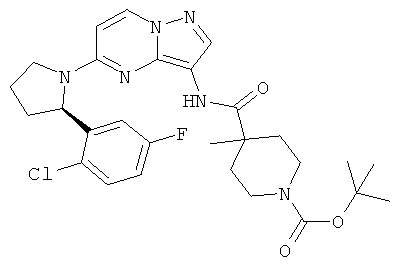
(R)-трет-бутил 4-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-шрпиразоло[1,5-а]пиримидин-3-илкарбамоил)-4-метилпиперидин-1-карбоксилат
К смеси (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 8, Стадия А; 25 мг, 0,075 ммоль), 1-(трет-бутоксикарбонил)-4-метилпиперидин-4-карбоновой кислоты (22 мг, 0,090 ммоль) и HATU (34 мг, 0,090 ммоль) добавляли 0,6 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к реакционной смеси по каплям добавляли ДИЭА (0,039 мл, 0,23 ммоль). Данную реакционную смесь подогревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь подвергали непосредственной очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-80% ацетонитрил/вода с получением конечного продукта в виде желтоватого порошка (28 мг, 67% выход). МС (химическая ионизация при атмосферном давлении) m/z=557,1 (М+Н).
Пример 49

(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-]пиримидин-3-ил)-4-метилпиперидин-4-карбоксамид гидрохлорид
К (R)-трет-бутил 4-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)-4-метилпиперидин-1-карбоксилату (пример 48; 28 мг, 0,05 ммоль) добавляли 1 мл 4 N HCl раствора в диоксане и перемешивали при комнатной температуре в течение 10 минут. Данную реакционную смесь концентрировали, обрабатывали эфиром и фильтровали с получением конечного продукта (HCl соли) в виде тонкого порошка бежевого цвета. МС (химическая ионизация при атмосферном давлении) m/z=457.1 (М+Н).
Пример 50

(R)-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-гидрокси-2-метилпропанамид
К смеси (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 25 мг, 0,079 ммоль), 2-гидрокси-2-метилпропановой кислоты (10 мг, 0,095 ммоль) и HATU (36 мг, 0,095 ммоль) добавляли 0,6 мл ацетонитрила с получением раствора. После охлаждения на ледяной бане в течение 10 минут к реакционной смеси по каплям добавляли ДИЭА (0,041 мл, 0,24 ммоль). Данную реакционную смесь подогревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали, повторно растворяли в метаноле и очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-55% ацетонитрил/вода с получением конечного продукта в виде беловатого твердого вещества (21 мг, 66% выход). МС (химическая ионизация при атмосферном давлении) m/z=402.2 (М+Н).
Пример 51
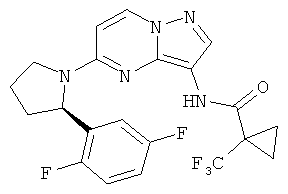
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-(трифторметил)циклопропанкарбоксамид
К смеси (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 25 мг, 0,079 ммоль), 1-(трифторметил)циклопропанкарбоновой кислоты (15 мг, 0,095 ммоль) и HATU (36 мг, 0,095 ммоль) добавляли 0,6 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси по каплям добавляли ДИЭА (0,041 мл, 0,24 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляли EtOAc (15 мл), промывали водой и рассолом (каждого по 5 мл), концентрировали и подвергали очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-72% ацетонитрил/вода с получением конечного продукта в виде твердого вещества бежевого цвета (23 мг, 63% выход). МС (химическая ионизация при атмосферном давлении) m/z=452.2 (М+Н).
Пример 52

(R)-1-циан-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)циклопропанкарбоксамид
Получен по способу, описанному в примере 51, замена 1-(трифторметил)циклопропанкарбоновой кислоты 1-цианциклопропанкарбоновой кислотой дала конечный продукт в виде белого твердого вещества (18 мг, 56% выход). МС (химическая ионизация при атмосферном давлении) m/z=409.2 (М+Н).
Пример 53
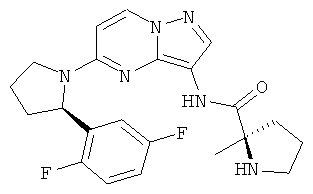
(R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-метилпирролидин-2-карбоксамид
К смеси (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 25 мг, 0,079 ммоль), (R)-1-(трет-бутоксикарбонил)-2-метилпирролидин-2-карбоновой кислоты (22 мг, 0,095 ммоль) и HATU (36 мг, 0,095 ммоль) добавляли 0,6 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к реакционной смеси по каплям добавляли ДИЭА (0,041 мл, 0,24 ммоль). Данную реакционную смесь подогревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляли EtOAc (15 мл), промывали водой и рассолом (по 5 мл каждого), концентрировали и подвергали очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-68% ацетонитрил/вода с получением N-Boc-защищенного продукта, (R)-трет-бутил 2-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)-2-метилпирролидин-1-карбоксилата в виде твердого вещества бежевого цвета (32 мг, 73% выход). Депротектирование было проведено путем добавления 1 мл 4 N HCl раствора в диоксане к вышеуказанному защищенному продукту. Через 1 час выдержки при комнатной температуре реакционную смесь концентрировали, обрабатывали эфиром (1 мл) и фильтровали с получением конечного продукта в виде беловатого твердого вещества. МС (химическая ионизация при атмосферном давлении) m/z=427.2 (М+Н).
Пример 54

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-фтор-2-метилпропанамид
Получен по способу, описанному в примере 51, замена 1-(трифторметил)-циклопропан-карбоновой кислоты 2-фтор-2-метилпропановой кислотой дала конечный продукт в виде бледно-желтоватого твердого вещества (25 мг, 77% выход). МС (химическая ионизация при атмосферном давлении) m/z=404.2 (М+Н).
Пример 55
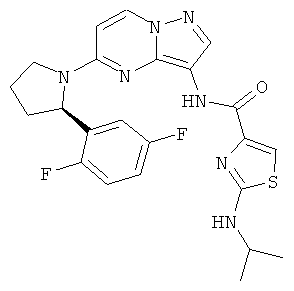
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-(изопропиламино)тиазол-4-карбоксамид
Получен по способу, описанному в примере 51, замена 1-(трифторметил)-циклопропан-карбоновой кислоты гидробромидом 2-(изопропиламино)тиазол-4-карбоновой кислоты дала конечный продукт в виде твердого вещества бежевого цвета (34 мг, 89% выход). МС (химическая ионизация при атмосферном давлении) m/z=484.2 (М+Н).
Пример 56

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-метил-2-[1Н-1,2,4-триазол-1-ил)пропанамид
Получен по способу, описанному в примере 51, замена 1-(трифторметил)-циклопропан-карбоновой кислоты 2-метил-2-(1Н-1,2,4-триазол-1-ил)пропановой кислотой дала конечный продукт в виде бледно-желтоватого твердого вещества (26 мг, 72% выход). МС (химическая ионизация при атмосферном давлении) m/z=453.1 (М+Н).
Пример 57
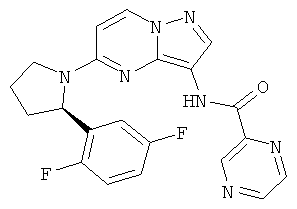
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиразин-2-карбоксамид
К смеси (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 25 мг, 0,079 ммоль), пиразин-2-карбоновой кислоты (12 мг, 0,095 ммоль) и HATU (36 мг, 0,095 ммоль) добавляли 0,6 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси добавляли по каплям ДИЭА (0,041 мл, 0,24 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 10 минут. Реакционную смесь разбавляли EtOAc (15 мл), промывали водой и рассолом (по 5 мл каждого), концентрировали и очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-65% ацетонитрил/вода с получением конечного продукта в виде желтоватого твердого вещества (31 мг, 93% выход). МС (химическая ионизация при атмосферном давлении) m/z=422.2 (М+Н).
Пример 58
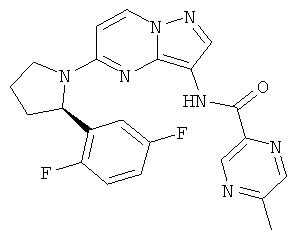
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-5-метилпиразин-2-карбоксамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты 5-метилпиразин-2-карбоновой кислотой дала конечный продукт в виде желтоватого твердого вещества (9 мг, 26% выход). МС (химическая ионизация при атмосферном давлении) m/z=436.2 (М+Н).
Пример 59
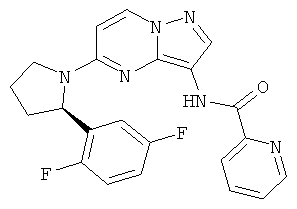
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты пиколиновой кислотой дала конечный продукт в виде желтоватого твердого вещества (31 мг, 93% выход). МС (химическая ионизация при атмосферном давлении) m/z=421.2 (М+Н).
Пример 60

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метилпиколинамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты 6-метилпиколиновой кислотой дала конечный продукт в виде желтоватого твердого вещества (30 мг, 87% выход). МС (химическая ионизация при атмосферном давлении) m/z=435.2 (М+Н).
Пример 60А

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метилпиколинамид гидрохлорид
К раствору в метаноле (1 мл) (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиколинамида (10,3 мг, 0,0237 ммоль) добавляли HCl как раствор в диоксане (30 мкл). Через 30 минут данную реакционную смесь концентрировали с получением (R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиколинамид гидрохлорида в виде твердого вещества желтого цвета.
Пример 61

(R)-5-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты 5-хлорпиколиновой кислотой дала конечный продукт в виде твердого вещества желтоватого цвета (24 мг, 67% выход). МС (химическая ионизация при атмосферном давлении) m/z=455.2 (М+Н).
Пример 62

(R)-4-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты 4-хлорпиколиновой кислотой дала конечный продукт в виде твердого вещества бежевого цвета (30 мг, 83% выход). МС (химическая ионизация при атмосферном давлении) m/z=455.2 (М+Н).
Пример 63
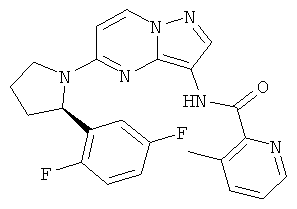
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиколинамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты 3-метилпиколиновой кислотой дала конечный продукт в виде твердого вещества бежевого цвета (33 мг, 96% выход). МС (химическая ионизация при атмосферном давлении) m/z=435.2 (М+Н).
Пример 64
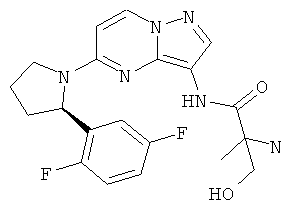
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-2,2-диметилпропанамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты 3-гидрокси-2,2-диметилпропановой кислотой дала конечный продукт в виде бледно-желтоватого твердого вещества (22 мг, 66% выход). МС (химическая ионизация при атмосферном давлении) m/z=416.2 (М+Н).
Пример 65

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-гидроксициклопропанкарбоксамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты 1-гидроксициклопропанкарбоновой кислотой дала конечный продукт в виде твердого вещества бежевого цвета (6 мг, 16% выход). МС (химическая ионизация при атмосферном давлении) m/z=400.2 (М+Н).
Пример 66
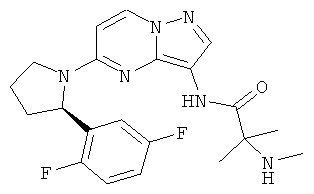
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-метил-2-(метиламино)пропанамид
Получен по способу, описанному в примере 57, замена пиразин-2-карбоновой кислоты гидрохлоридом 2-метил-2-(метиламино)пропановой кислоты дала конечный продукт в виде твердого вещества (2 мг, 6% выход). МС (химическая ионизация при атмосферном давлении) m/z=415.1 (М+Н).
Пример 67
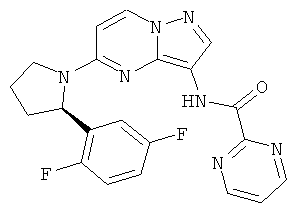
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиримидин-2-карбоксамид
К смеси (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 25 мг, 0,079 ммоль), пиримидин-2-карбоновой кислоты (12 мг, 0,095 ммоль) и HATU (36 мг, 0,095 ммоль) добавляли 0,6 мл ДМФА. Для получения раствора добавляли несколько капель ДМСО. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси добавляли по каплям ДИЭА (0,041 мл, 0,24 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение одного часа, затем при 80°С в течение 16 часов. Реакция не достигла своего завершения перед обработкой. Реакционную смесь разбавляли EtOAc (15 мл), промывали водой и рассолом (по 5 мл каждого), концентрировали и подвергали непосредственной очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-60% ацетонитрил/вода с получением конечного продукта в виде светло-желтоватого твердого вещества). МС (химическая ионизация при атмосферном давлении) m/z=422.2 (М+Н).
Пример 68
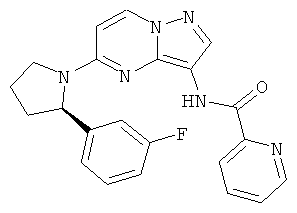
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид
К смеси (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 6, Стадия А; 30 мг, 0,1 ммоль), пиколиновой кислоты (15 мг, 0,12 ммоль) и HATU (46 мг, 0,12 ммоль) добавляли 0,7 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси добавляли по каплям ДИЭА (0,053 мл, 0,3 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 10 минут. Данную реакционную смесь разбавляли EtOAc (15 мл), промывали водой и рассолом (по 5 мл каждого), концентрировали и очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-70% ацетонитрил/вода с получением конечного продукта в виде твердого вещества желтоватого цвета (35 мг, 86% выход). МС (химическая ионизация при атмосферном давлении) m/z=403.2 (М+Н).
Пример 69
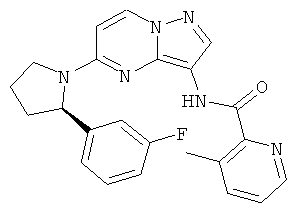
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиколинамид
Получен по способу, описанному в примере 68, замена пиколиновой кислоты 3-метилпиколиновой кислотой дала конечный продукт в виде твердого вещества (35 мг, 83% выход). МС (химическая ионизация при атмосферном давлении) m/z=417.2 (М+Н).
Пример 70
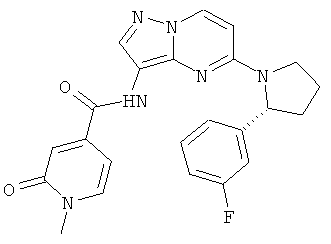
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-2-оксо-1,2-дигидропиридин-4-карбоксамид
Получен по способу, описанному в примере 68, замена пиколиновой кислоты 1-метил-2-оксо-1,2-дигидропиридин-4-карбоновой кислотой дала конечный продукт в виде желтоватого твердого вещества (18 мг, 41% выход). МС (химическая ионизация при атмосферном давлении) m/z=433.2 (М+Н).
Пример 71

(R)-6-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамид
Получен по способу, описанному в примере 68, замена (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амином (Способ получения В) и замена пиколиновой кислоты 6-хлорпиколиновой кислотой дали конечный продукт в виде твердого вещества желтоватого цвета (9,1 мг, 31% выход). МС (химическая ионизация при атмосферном давлении) m/z=455.2 (М+Н).
Пример 72
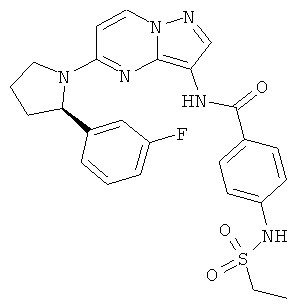
(R)-4-(этилсульфонамидо)-N-(5-(2-(-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)бензамид
Получен по способу, описанному в примре 68, замена пиколиновой кислоты 4-(этилсульфонамидо)бензойной кислотой дала конечный продукт в виде твердого вещества желтоватого цвета (32 мг, 62% выход). МС (химическая ионизация при атмосферном давлении) m/z=509.2 (М+Н).
Пример 73
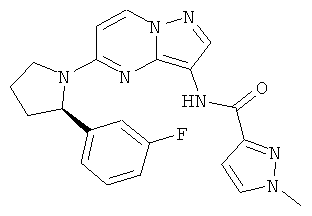
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-1H-пиразол-3-карбоксамид
Получен по способу, описанному в примере 68, замена пиколиновой кислоты 1-метил-1H-пиразол-3-карбоновой кислотой дала конечный продукт в виде твердого вещества желтоватого цвета (32 мг, 78% выход). МС (химическая ионизация при атмосферном давлении) m/z=406.3 (М+Н).
Пример 74
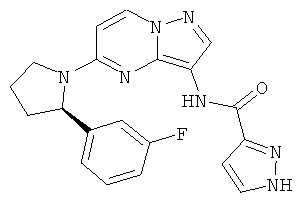
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1Н-пиразол-3-карбоксамид
Получен по способу, описанному в примере 68, замена пиколиновой кислоты 1Н-пиразол-3-карбоновой кислотой дала конечный продукт в виде твердого вещества желтоватого цвета (14 мг, 35% выход). МС (химическая ионизация при атмосферном давлении) m/z=392.2 (М+Н).
Пример 75
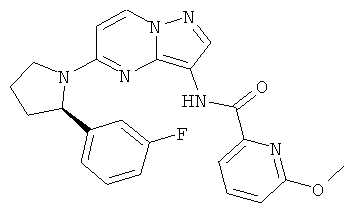
(R)-N-(5-(2-Г3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метоксипиколинамид
Получен по способу, описанному в примере 68, замена пиколиновой кислоты 6-метоксипиколиновой кислотой дала конечный продукт в виде желтоватого твердого вещества (28 мг, 64% выход). МС (химическая ионизация при атмосферном давлении) m/z=433.2 (М+Н).
Пример 75А

(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метоксипиколинамида гидрохлорид
К раствору в метаноле (1 мл) (R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метоксипиколинамида (10,1 мг, 0,0234 ммоль) добавляли HCl в виде раствора в диоксане (30 мкл). Через 10 минут данную реакционную смесь концентрировали с получением (R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метоксипиколинамида гидрохлорида в виде желтого твердого вещества.
Пример 76
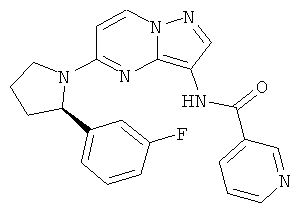
(R)-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)никотинамид
К смеси (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 6, Стадия А; 30 мг, 0,1 ммоль), никотиновой кислоты (25 мг, 0,2 ммоль) и HATU (77 мг, 0,2 ммоль) добавляли 0,7 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси добавляли по каплям ДИЭА (0,053 мл, 0,3 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 3 часов. Реакционную смесь разбавляли EtOAc (15 мл), промывали водой и рассолом (по 5 мл каждого), концентрировали и подвергали очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-57% ацетонитрил/вода с получением конечного продукта в виде твердого вещества желтоватого цвета (30 мг, 74% выход). МС (химическая ионизация при атмосферном давлении) m/z=403.2 (М+Н).
Пример 77
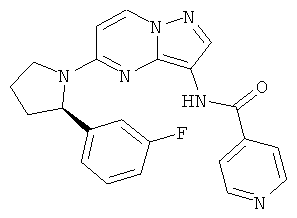
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)изоникотинамид
Получен по способу, описанному в примере 76, замена никотиновой кислоты изоникотиновой кислотой дала конечный продукт в виде твердого вещества желтоватого цвета (20 мг, 49% выход). МС (химическая ионизация при атмосферном давлении) m/z=403.2 (М+Н).
Пример 78

(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-6-метилникотинамид
Получен по способу, описанному в примере 76, замещение никотиновой кислоты 6-метилникотиновой кислотой дало конечный продукт в виде твердого вещества желтоватого цвета (27 мг, 64% выход). МС (химическая ионизация при атмосферном давлении) m/z=417.2 (М+Н).
Пример 79
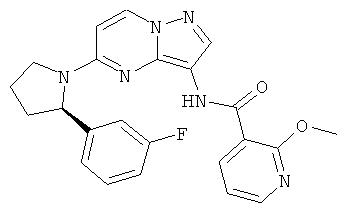
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-метоксиникотинамид
Получен по способу, описанному в примере 76, замена никотиновой кислоты 2-метоксиникотиновой кислотой дала конечный продукт в виде твердого вещества желтоватого цвета (32 мг, 73% выход). МС (химическая ионизация при атмосферном давлении) m/z=433.2 (М+Н).
Пример 80

(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилизоникотинамид
Получен по способу, описанному в примере 76, замена никотиновой кислоты 3-метилизоникотиновой кислотой дала конечный продукт в виде твердого вещества желтоватого цвета (22 мг, 52% выход). МС (химическая ионизация при атмосферном давлении) m/z=417.2 (M+H).
Пример 81
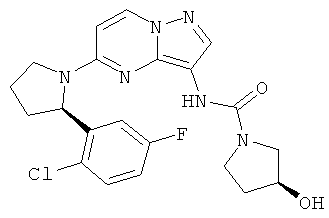
(S)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
К ДХМ (0,8 мл) раствору (R)-5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 8, Стадия А; 30 мг, 0,09 ммоль) одной порцией при комнатной температуре добавляли КДИ (29 мг, 0,18 ммоль). После перемешивания в течение двух часов одной порцией добавляли (S)-пирролидин-3-ол (15,8 мг, 0,181 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 5-53% ацетонитрил/вода с получением конечного продукта в виде желтоватого пенящегося порошка (33 мг, 81% выход). МС (химическая ионизация при атмосферном давлении) m/z=445.2 (M+H).
Пример 82

(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-5-метилпиразин-2-карбоксамид
К смеси (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 6, Стадия А; 50 мг, 0,17 ммоль, полученного, как описано в предыдущем примере), 5-метилпиразин-2-карбоновой кислоты (46 мг, 0,34 ммоль) и HATU (128 мг, 0,34 ммоль) добавляли 0,7 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси добавляли по каплям ДИЭА (0,088 мл, 0,5 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 2 часов. Данную реакционную смесь непосрдственно фильтровали, ополаскивали ацетонитрилом и затем эфиром с получением конечного продукта в виде твердого вещества бежевого цвета (44 мг, 63% выход). МС (химическая ионизация при атмосферном давлении) m/z=418.2 (М+Н).
Пример 83

(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-1Н-имидазол-2-карбоксамид
К смеси (R)-5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (пример 6, Стадия А; 40 мг, 0,13 ммоль, полученного, как описано в предыдущем примере), 1-метил-1Н-имидазол-2-карбоновой кислоты (34 мг, 0,27 ммоль) и HATU (102 мг, 0,27 ммоль) добавляли 1,0 мл ДМФА с получением раствора. После охлаждения на ледяной бане в течение 10 минут к данной реакционной смеси по каплям добавляли ДИЭА (0,07 мл, 0,4 ммоль). Реакционную смесь подогревали до комнатной температуры и перемешивали в течение 10 минут. Реакционную смесь разбавляли EtOAc (15 мл), промывали водой и рассолом (по 5 мл каждого), концентрировали и очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-65% ацетонитрил/вода с получением конечного продукта в виде твердого вещества желтоватого цвета (37 мг, 68% выход). МС (химическая ионизация при атмосферном давлении) m/z=406.2 (М+Н).
Пример 84

(S)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
Стадия А: Получение (R)-5-(2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, заменяя (R)-2-(2,5-дифторфенил)пирролидин на Стадии 1 (R)-2-(5-фтор-2-(трифторметил)фенил)пирролидином.
Стадия В: Получение (R)-2-(5-фтор-2-(трифторметил)фенил)пирролидина. Получен в соответствии со способом получения А, заменяя 2-бром-1,4-дифторбензол 2-бром-4-фтор-1-(трифторметил)бензолом на Стадии А.
Стадия С: Получение (S)-N-((R)-2-(5-фтор-2-(трифторметил)фенил)пирродидин-1-ил)пиразодо[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида. К ДХМ (1 мл) раствору (R)-5-(2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (25 мг, 0,068 ммоль) при комнатной температуре одной порцией добавляли КДИ (22 мг, 0,14 ммоль). После перемешивания в течение двух часов одной порцией добавляли (S)-пирролидин-3-ол (18 мг, 0,21 ммоль). Данную реакционную смесь перемешивали в течение ночи перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-60% ацетонитрил/вода с получением конечного продукта в виде желтоватого твердого вещества (28 мг, 86% выход). МС (химическая ионизация при атмосферном давлении) m/z=479.2 (М+Н).
Пример 85

(R)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
Получен по способу, описанному в примере 84, замена (S)-пирролидин-3-ола на Стадии С (R)-пирролидин-3-олом дала конечный продукт в виде твердого вещества желтоватого цвета (26 мг, 79%). МС (химическая ионизация при атмосферном давлении) m/z=479.2 (М+Н).
Пример 86

(R)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид
Получен способом, описанным в примере 84, замена (S)-пирролидин-3-ола на Стадии С (R)-пиперидин-3-олом дала конечный продукт в виде твердого вещества желтоватого цвета (37 мг, 91%). МС (химическая ионизация при атмосферном давлении) m/z=493.2 (М+Н).
Пример 87
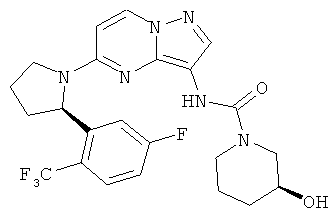
(S)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид
Получен способом, описанным в примере 84, замена (S)-пирролидин-3-ола на Стадии С (S)-пиперидин-3-олом дала конечный продукт в виде твердого вещества желтоватого цвета (39 мг, 97%). МС (химическая ионизация при атмосферном давлении) m/z=493.2 (M+H).
Пример 88
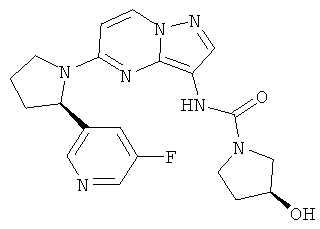
(S)-N-(5-((R)-2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
Стадия А: Получение ((R)-5-(2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, заменяя (R)-2-(2,5-дифторфенил)пирролидин на Стадии 1 (R)-3-фтор-5-(пирролидин-2-ил)пиридином.
Стадия В: Получение (R)-3-фтор-5-(пирролидин-2-ил)пиридина. Получен в соответствии со способом получения А, заменяя 2-бром-1,4-дифторбензола 3-бром-5-фторпиридином на Стадии А.
Стадия С: Получение (S)-N-(5-((R)-2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида. К ДХМ (1 мл) раствору (R)-5-(2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (25 мг, 0,084 ммоль) при комнатной температуре одной порцией добавляли КДИ (27 мг, 0,17 ммоль). После перемешивания в течение двух часов одной порцией добавляли (S)-пирролидин-3-ол (15 мг, 0,17 ммоль). Данную реакционную смесь перемешивали в течение ночи перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой с элюированием 0-40% ацетонитрил/вода с получением конечного продукта в виде твердого вещества (27 мг, 78% выход). МС (химическая ионизация при атмосферном давлении) m/z=412.2 (М+Н).
Пример 89

(R)-N-(5-((R)-2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
Получен способом, описанным в примере 88, замена (S)-пирролидин-3-ола на Стадии С (R)-пирролидин-3-олом дала конечный продукт в виде твердого вещества (28 мг, 81%). МС (химическая ионизация при атмосферном давлении) m/z=412.2 (М+Н).
Пример 90

(S)-N-(5-((R)-2-(5-фтор-2-метоксифенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
Стадия А: Получение (R)-5-(2-(5-фтор-2-метоксифенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина. Получен в соответствии со способом получения В, заменяя (R)-2-(2,5-дифторфенил)пирролидин на Стадии 1 (R)-2-(5-фтор-2-метоксифенил)пирролидином.
Стадия В: Получение ((R)-2-(5-фтор-2-метоксифенил)пирролидина. Получен в соответствии со способом получения А, заменяя 2-бром-1,4-дифторбензол 2-бром-4-фтор-1-метоксибензолом на Стадии А.
Стадия С: Получение (S)-N-(5-((R)-2-(5-фтор-2-метоксифенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида. К ДХМ (5 мл) раствору (R)-5-(2-(5-фтор-2-метоксифенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (25 мг, 0,076 ммоль) и ДИЭА (0,04 мл, 0,23 ммоль) при комнатной температуре одной порцией добавляли КДИ (25 мг, 0,15 ммоль). После перемешивания в течение одного часа одной порцией добавляли (S)-пирролидин-3-ол (20 мг, 0,23 ммоль). Данную реакционную смесь перемешивали в течение ночи перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-60% ацетонитрил/вода с получением конечного продукта в виде твердого вещества желтоватого цвета (28 мг, 83% выход). МС (химическая ионизация при атмосферном давлении) m/z=441.2 (М+Н).
Пример 91
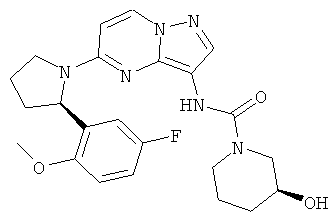
(S)-N-(5-((R)-2-(5-фтор-2-метокеифенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамид
Получен по способу, описанному в примере 90, замена (S)-пирролидин-3-ола на Стадии С (S)-пиперидин-3-олом дала конечный продукт в виде твердого вещества желтоватого цвета МС (химическая ионизация при атмосферном давлении) m/z=455.2 (М+Н).
Пример 92
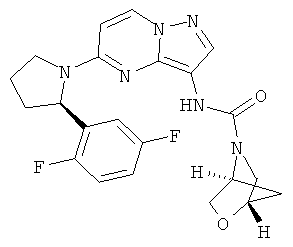
(1S,4S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
К ДХМ (1,0 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 50 мг, 0,16 ммоль) при комнатной температуре одной порцией добавляли КДИ (51 мг, 0,32 ммоль). После перемешивания в течение 90 минут одной порцией добавляли (1S,4S)-2-окса-5-азабицикло[2.2.1]гептан гидрохлорид (43 мг, 0,32 ммоль), затем ДИЭА (0,083 мл, 0,48 ммоль). Данную реакционную смесь перемешивали в течение 5 минут перед ее концентрированием и непосредственной очисткой способом колоночной хроматографии с обратной фазой, с элюированием 0-60% ацетонитрил/вода с получением конечного продукта в виде бледно-желтоватого порошка (60 мг, 86% выход). МС (химическая ионизация при атмосферном давлении) m/z=441.2 (М+Н).
Пример 93
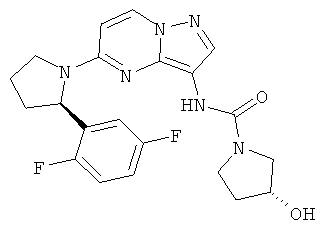
(R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамид
Получен по способу, описанному в примере 92, заменяя (1S,4S)-2-окса-5-азабицикло[2.2.1]гептан гидрохлорид (R)-пирролидин-3-олом. Неочищенный материал подвергали очистке способом колоночной хроматографии с обратной фазой с использованием 5-50% ацетонитрил/водного элюента, с получением конечного продукта в виде твердого вещества (89 мг, 66% выход). МС (химическая ионизация при атмосферном давлении) m/z=429.2 (М+Н).
Пример 94
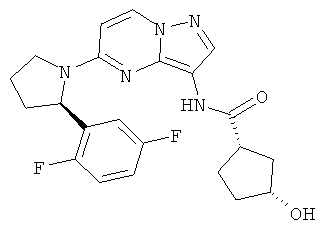
(1S,3S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксициклопентанкарбоксамид
ДМА (1 мл) раствор (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 50 мг, 0,16 ммоль), (1S,3R)-3-гидроксициклопентанкарбоновую кислоту (23 мг, 0,17 ммоль) [приобретенную у фирмы AFID Therapeutics Inc.] и 2-(1Н-бензо[d][1,2,3триазол-1-ил)-1,1,3,3-тетраметилуроний тетрафторборат (TBTU) (56 мг, 0,17 ммоль) сначала охлаждали на бане с ледяной водой, затем к данной реакционной смеси добавляли по каплям ДИЭА (0,083 мл, 0,48 ммоль). Затем ледяную баню забирали и данную реакционную смесь перемешивали при комнатной температуре в течение 1 часа для завершения реакции. Реакционную смесь разбавляли водой (10 мл) и подвергали вакуумной фильтрации с получением неочищенного продукта в виде твердого вещества бежевого цвета. Неочищенный продукт подвергали очистке способом колоночной хроматографии с обратной фазой с элюированием 5-57% ацетонитрил/вода с получением конечного продукта в виде твердого вещества (20 мг, 30% выход). МС (химическая ионизация при атмосферном давлении) m/z=428.2 (М+Н).
Пример 95
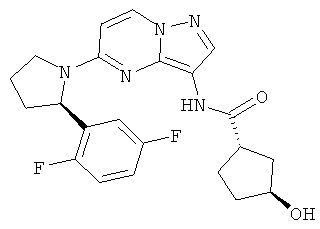
(1S,3S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксициклопентанкарбоксамид
Получен тем же самым способом, который описан в примере 94, заменяя (1S,3R)-3-гидроксициклопентанкарбоновую кислоту (18,38)-3-гидроксициклопентанкарбоновой кислотой (23 мг, 0,17 ммоль) [приобретенной у фирмы AFID Therapeutics Inc.]. Неочищенный продукт подвергали очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-53% ацетонитрил/вода с получением конечного продукта в виде твердого вещества (35 мг, 52% выход). МС (химическая ионизация при атмосферном давлении) m/z=428.2 (М+Н).
Пример 96

(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксициклобутанкарбоксамид
Получен тем же самым способом, который описан в примере 94, заменяя (1S,3R)-3-гидроксициклопентанкарбоновую кислоту 3-гидроксициклобутанкарбоновой кислотой (20 мг, 0,17 ммоль) [приобретенной у фирмы Parkway Scientific]. Неочищенный продукт подвергали очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-53% ацетонитрил/вода с получением конечного продукта в виде твердого вещества (8 мг, 12% выход). МС (химическая ионизация при атмосферном давлении) m/z=414.2 (М+Н).
Пример 97
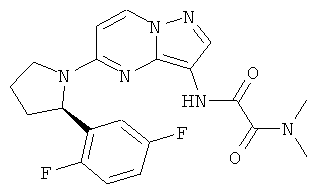
(R)-N1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-N2,N2-диметилоксаламид
К ДХМ (1 мл) раствору (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 50 мг, 0,16 ммоль) по каплям добавляли метил 2-хлор-2-оксоацетат (19,4 мг, 0,159 ммоль), затем ДИЭА (0,0829 мл, 0,476 ммоль). После затухания мягкой экзотермической реакции и снижения температуры реакционной смеси до комнатной добавляли диметиламин (0,8 мл, 1,6 ммоль) [2 М, ТГФ]. Данную реакционную смесь осторожно кипятили с обратным холодильником в течение нескольких минут, вновь охлаждали до комнатной температуры и перемешивали в течение 1 часа для завершения реакции. Реакционную смесь концентрировали и непосредственно очищали способом колоночной хроматографии с обратной фазой, с элюированием 5-60% ацетонитрил/вода с получением конечного продукта в виде бледно-желтоватого твердого вещества (48 мг, 73% выход). МС (химическая ионизация при атмосферном давлении) m/z=415.1 (М+Н).
Пример 98

(R)-N1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-N2-метилоксаламид
Получен тем же самым способом, который описан в примере 97, заменяя диметиламин метанамином (2 М, ТГФ), и данная реакция проводилась при комнатной температуре, вместо кипячения с обратным холодильником. Неочищенный продукт подвергался очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-60% ацетонитрил/вода с получением конечного продукта в виде твердого вещества белого цвета (50 мг, 79% выход). МС (химическая ионизация при атмосферном давлении) m/z=401.1 (М+Н).
Пример 99
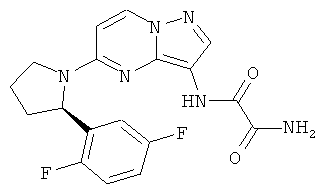
(R)-N1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)оксаламид
Получен тем же самым способом, который описан в примере 97, заменяя диметиламин аммиаком (7 М, метанол), и данная реакция проводилась при 50°С в течение ночи. Неочищенный продукт подвергался очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-55% ацетонитрил/вода с получением конечного продукта в виде твердого вещества белого цвета (50 мг, 82% выход). МС (химическая ионизация при атмосферном давлении) m/z=387.1 (М+Н).
Пример 100
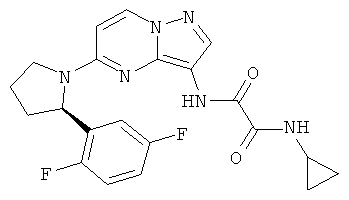
(R)-Nl-циклопропил-N2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)оксаламид
Получен тем же самым способом, который описан в примере 97, заменяя диметиламин циклопропанамином, и данная реакция проводилась при комнатной температуре, вместо кипячения с обратным холодильником. Неочищенный продукт подвергался очистке способом колоночной хрооматографии с обратной фазой, с элюированием 5-65% ацетонитрил/вода с получением конечного продукта в виде твердого вещества белого цвета (50 мг, 74% выход). МС (химическая ионизация при атмосферном давлении) m/z=427.2 (М+Н).
Пример 101
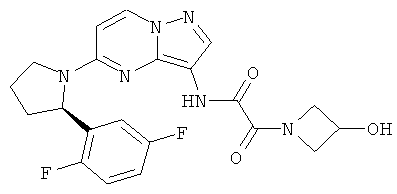
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-С3-гидроксиазетидин-1-ил)-2-оксоацетамид
Получен тем же самым способом, который описан в примере 97, заменяя диметиламин азетидин-3-олом, и данная реакция проводилась при 50°С в течение ночи. Неочищенный продукт подвергался очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-55% ацетонитрил/вода с получением конечного продукта в виде бледно-желтоватого твердого вещества (53 мг, 75% выход). МС (химическая ионизация при атмосферном давлении) m/z=443.1 (М+Н).
Пример 102
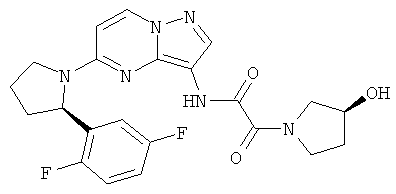
N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-((S)-3-гидроксипирролидин-1-ил)-2-оксоацетамид
Получен тем же самым способом, который описан в примере 97, заменяя диметиламин (S)-пирролидин-3-олом, и данная реакция проводилась при комнатной температуре в течение 1 часа, вместо кипячения с обратным холодильником. Неочищенный продукт подвергался очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-55% ацетонитрил/вода с получением конечного продукта в виде бледно-желтоватого твердого вещества (54 мг, 75% выход). МС (химическая ионизация при атмосферном давлении) m/z=457.2 (М+Н).
Пример 103
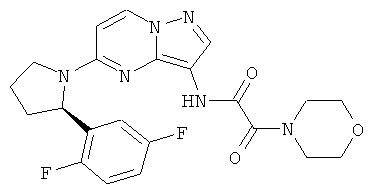
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-2-морфолино-2-оксоацетамид
Получен тем же самым способом, который описан в примере 97, заменяя диметиламин морфолином, и данная реакция проводилась при 50°С в течение 1 часа. Неочищенный продукт подвергался очистке способом колоночной хроматографии с обратной фазой, с элюированием 5-60% ацетонитрил/вода с получением конечного продукта в виде бледно-желтоватого твердого вещества (52 мг, 72% выход). МС (химическая ионизация при атмосферном давлении) m/z=457.1 (М+Н).
Пример 104
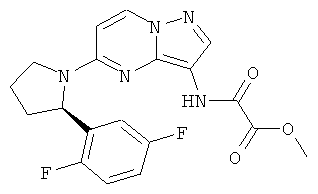
(R)-метил 2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-иламино)-2-оксоацетат
ДХМ (5 мл, 0,7928 ммоль) раствор (R)-5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-амина (Способ получения В; 250 мг, 0,7928 ммоль) и ДИЭА (0,2071 мл, 1,189 ммоль) сначала охлаждали на бане с ледяной водой, затем к данной реакционной смеси добавляли по каплям метил 2-хлор-2-оксоацетат (0,07657 мл, 0,8325 ммоль). Ледяную баню удаляли и данную реакционную смесь перемешивали при комнатной температуре в течение приблизительно 10 минут для завершения реакции. Реакционную смесь промывали 10% лимонной кислотой (водный раствор). Водный слой подвергали промывке обратной струей дихлорметаном. Объединенный органический слой промывали смесью 1:1 вода/рассол, осушивали над Na2SO4 и концентрировали. Неочищенный масляный остаток подвергали непосредственной очистке способом кремнеземной хроматографии, с элюированием EtOAc/гексаны 1:1-2:1, с получением конечного продукта в виде бледно-желтоватого пенистого порошка (270 мг, 85% выход). МС (химическая ионизация при атмосферном давлении) m/z=402.2 (М+Н).
Пример 105
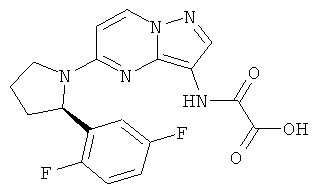
(R)-2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-иламино)-2-оксоуксусная кислота
(R)-метил 2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-иламино-2-оксоацетат (пример 104; 100 мг, 0,249 ммоль) растворяли в смеси растворителей ТНР:МеОН:вода (2:2:1, 1 мл), с последующим добавлением LiOH-H2O (31,4 мг, 0,747 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 10 минут для завершения реакции. Реакционную смесь концентрировали, повторно растворяли в воде (20 мл) и подкисляли 6 N HCl. Осадок подвергался вакуумной фильтрации, ополаскивался водой, гептаном и высушивался в высоком вакууме, с получением конечного продукта в виде тонкого бледно-желтоватого порошка (50 мг, 52% выход). МС (химическая ионизация при разрежении) m/z=386.1 (М-Н).
Реферат
Изобретение относится к новым производным пиразоло[1,5-a]пиримидинов, обладающим ингибирующей активностью в отношении тропомиозин-зависимых киназ (Trk). В формуле I Rявляется H или (1-6C алкилом); Rпредставляет собой NRR, (1-4C)алкил, (1-4C)фторалкил, CF, (1-4С)гидроксиалкил, -(1-4Cалкил)hetAr, -(1-4Cалкил)NH, -(1-4C алкил)NH(1-4Салкил), -(1-4Cалкил)N(1-4Cалкил), hetAr, hetCyc, hetCyc, фенил, замещенный, при необходимости, NHSO(1-4Cалкилом) или (3-6С)циклоалкилом, замещенным, при необходимости, (1-4C алкилом), CN, OH, OMe, NH, NHMe, N(CH), F, CF, CO(1-4C алкилом), COH; C(=O)NRRили C(=O)OR; Rявляется H или (1-6C алкилом); Rпредставляет собой H, (1-4C)алкил, (1-4C)гидроксиалкил, hetArили фенил, где указанный фенил замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, CN, CFи -O(1-4C алкила); Rпредставляет собой H или (1-4C)алкил; Rпредставляет собой H, (1-4C)алкил или (3-6C)циклоалкил; Rпредставляет собой H или (1-6C)алкил; X отсутствует или является -CH-, -CHCH-, -CHO- или -CHNR; Rпредставляет собой H или (1-4C алкил); Rпредставляет собой H или (1-4C алкил); и n равняется 0-6. Значения радикалов NRR, Y, hetAr, hetAr, hetAr, hetCyc, hetCyc, NRR, Rприведены в формуле изобретения. Изобретение также относится к фармацевтической композиции, содержащей указанные соединения, к способу лечения опосредованных Trk-киназами заболеваний и состояний, таких как боль, рак, воспаление, нейродегенеративное заболевание, инфекция Typanosoma cruzi, остеолетическое заболевание, и к способу получения указанных соединений. 9 н. и 33 з.п. ф-лы, 1 табл., 105 пр.
Формула

или его фармацевтически приемлемая соль, где:
R1 является H или (1-6C алкилом);
R2 представляет собой NRbRc, (1-4C)алкил, (1-4C)фторалкил, CF3, (1-4С)гидроксиалкил, -(1-4Cалкил)hetAr1, -(1-4Cалкил)NH2, -(1-4C алкил)NH(1-4Салкил), -(1-4Cалкил)N(1-4Cалкил)2, hetAr2, hetCyc1, hetCyc2, фенил, замещенный, при необходимости, NHSO2(1-4Cалкилом) или (3-6С)циклоалкилом, замещенным, при необходимости, (1-4C алкилом), CN, OH, OMe, NH2, NHMe, N(CH3)2, F, CF3, CO2(1-4C алкилом), CO2H; C(=O)NReRf или
C(=O)ORg;
Rb является H или (1-6C алкилом);
Rc представляет собой H, (1-4C)алкил, (1-4C)гидроксиалкил, hetAr3 или фенил, где указанный фенил замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, CN, CF3 и -O(1-4C алкила),
или NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, OH, (1-4C алкила), (1-4C)алкокси, -OC(=O)(1-4C алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4C)гидроксиалкила,
или NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеющее, при необходимости, второй гетероатом или группу, выбранные из N, O и SO2, где указанное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из ОН, галогена, CF3, (1-4C)алкила, CO2(1-4C алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо,
или NRbRc образует 7-8-членное мостиковое гетероциклическое кольцо с атомом азота, и имеющее, при необходимости, второй гетероатом, выбранный из N и O, где указанное кольцо замещено, при необходимости, CO2(1-4C алкилом);
hetAr1 является 5-членным гетероарильным кольцом, имеющим в кольце 1-3 атома азота;
hetAr2 является 5-6-членным гетероарильным кольцом с, по меньшей мере, одним атомом азота, и имеющим, при необходимости, второй гетероатом, выбранный, независимо, из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из (1-4C алкила), галогена, -(1-4C)алкокси и NH(1-4C алкила);
hetCyc1 является связанным с углеродом 4-6-членным азациклическим кольцом, которое замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из (1-4C алкила) и CO2(1-4C алкила);
hetCyc2 является пиридиноновым или пиридазиноновым кольцом, которое замещено, при необходимости, заместителем, выбранным из (1-4C)алкила;
hetAr3 является 5-6-членным гетероарильным кольцом, которое имеет 1-2 гетероатома, выбранных, независимо, из N и O, и замещенным, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из (1-4C)алкила;
Re представляет собой H или (1-4C)алкил;
Rf представляет собой H, (1-4C)алкил или (3-6C)циклоалкил;
или NReRf образует 4-6-членное азациклическое кольцо, которое имеет, при необходимости, дополнительный гетероатом, выбранный из N и O, где данное азациклическое кольцо замещено, при необходимости, OH;
Rg представляет собой H или (1-6C)алкил;
Y представляет собой (i) фенил, замещенный, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, (1-4C)алкокси, CF3 и CHF2, или (ii) 5-6-членное гетероарильное кольцо, имеющее гетероатом, выбранный из N и S, где указанное гетероарильное кольцо замещено, при необходимости, одним или несколькими атомами галогена;
X отсутствует или является -CH2-, -CH2CH2-, -CH2O- или -CH2NRd;
Rd представляет собой H или (1-4C алкил);
R3 представляет собой H или (1-4C алкил);
каждый R4 выбирается, независимо, из галогена, (1-4C)алкила, OH, (1-4C)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1, 2, 3, 4, 5 или 6.
NRbRc образует 4-членное гетероциклическое кольцо, имеющее атом азота, где указанное кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из галогена, OH, (1-4C алкила), (1-4C)алкокси, -OC(=O)(1-4C алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4C)гидроксиалкила,
или NRbRc образует 5-6-членное гетероциклическое кольцо c гетероатомом, который является азотом, и имеющее, при необходимости, второй гетероатом или группу, выбранные из N, O и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, которые выбираются, независимо, из OH, галогена, CF3, (1-4C)алкила, CO2(1-4C алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо,
или NRbRc образует 7-8-членное мостиковое гетероциклическое кольцо с атомом азота, и имеющее, при необходимости, второй гетероатом, выбранный из N и О, где указанное кольцо замещено, при необходимости, CO2(1-4C алкилом).
Rc представляет собой H, (1-4C)алкил, (1-4C)гидроксиалкил, hetAr3 или фенил, где указанный фенил замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, CN, CF3 и -O(1-4C алкила).
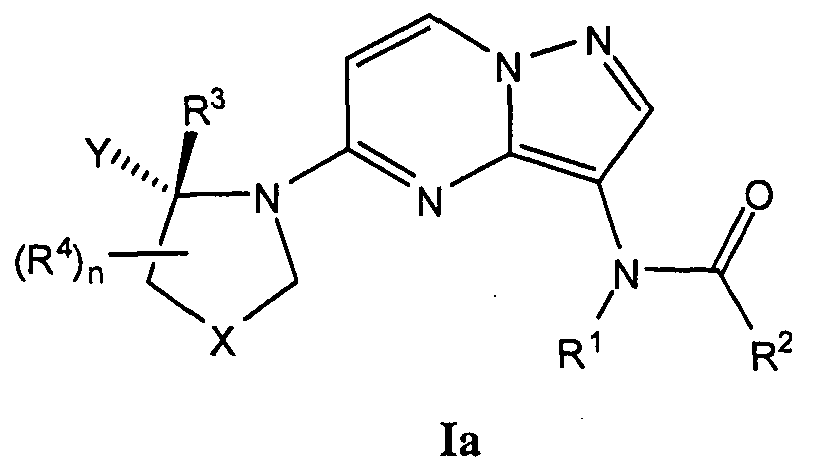
R1 является Н или (1-6C алкилом);
R2 является NRbRc;
NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, OH, (1-4C алкила), (1-4C)алкокси, -OC(=O)(1-4C алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4C)гидроксиалкила, или NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеющее, при необходимости, второй гетероатом или группу, выбранные из N, O и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из OH, галогена, CF3, (1-4C)алкила, CO2(1-4C алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо;
Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, (1-4C)алкокси, CF3 и CHF2;
X отсутствует или является -CH2- или -CH2CH2-;
R3 является H или (1-4C алкилом);
каждый R4 выбирается, независимо, из галогена, (1-4C)алкила, OH, (1-4C)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1 или 2.
R1 является Н или (1-6C алкилом);
R2 является NRbRc;
NRbRc образует 5-6-членное гетероциклическое кольцо с гетероатомом, который является азотом, и имеющее, при необходимости, второй гетероатом или группу, выбранные из N, O и SO2, где данное гетероциклическое кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из OH, галогена, CF3, (1-4C)алкила, CO2(1-4C алкила), CO2H, NH2, NHC(=O)O(1-4C алкила) и оксо;
Y является фенилом, который замещен, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, (1-4C)алкокси, CF3 и CHF2;
X является -СН2-;
R3 является H или (1-4C алкилом);
каждый R4 выбирается, независимо, из галогена, (1-4C)алкила, OH, (1-4C)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1 или 2.
R1 является Н или (1-6C алкилом);
R2 является NRbRc;
NRbRc образует 4-членное гетероциклическое кольцо с атомом азота, где указанное кольцо замещено, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, OH, (1-4C алкила), (1-4C)алкокси, -OC(=O)(1-4C алкила), NH2, -NHC(=O)O(1-4C алкила) и (1-4C)гидроксиалкила;
Y является фенилом, замещенным, при необходимости, одним или несколькими заместителями, выбранными, независимо, из галогена, (1-4C)алкокси, CF3 и CHF2;
X является -CH2-;
R3 является Н или (1-4C алкилом);
каждый R4 выбирается, независимо, из галогена, (1-4C)алкила, OH, (1-4C)алкокси, NH2, NH(1-4C алкила) и CH2OH; и
n равняется 0, 1 или 2.
(а) для соединения формулы I, где R2 является NRbRc, реакцию соединения формулы II
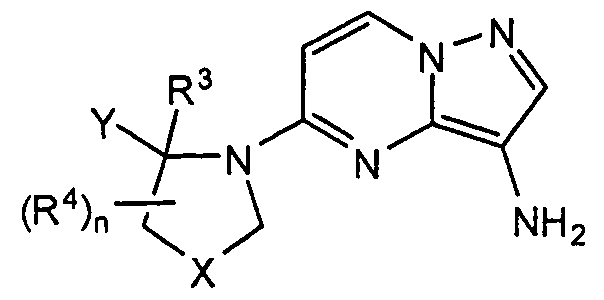
II
с соединением формулы HNRbRc, в присутствии агента сочетания; или
(b) для соединения формулы I, где R2 является NRbRc и Rb является H, реакцию соединения формулы II с соединением формулы O=C=N-Rc,
где X, Y, R3, R4, n, Rc, Rb имеют значения, указанные в п.1; и
удаление или введение, при необходимости, любых защитных групп, и получение, при необходимости, соли.
(c) для соединения формулы I, где R2 является hetAr2 или фенилом, который замещен, при необходимости, NHSO2(1-4C алкилом), реакцию соединения формулы II

II
с соединением формулы HOC(=O)R2, в присутствии агента сочетания и основания; или
(d) для соединения формулы I, где R2 представляет собой (1-4C)алкил, (1-4C)фторалкил, CF3, (1-4C)гидроксиалкил или (3-6C)циклоалкил, замещенный, при необходимости, (1-4C алкилом), CN, OH, CF3, CO2(1-4C алкилом) или CO2H, реакцию соединения формулы II с соединением формулы (R2CO)2O, в присутствии основания; или
(e) для соединения формулы I, где R2 представляет собой (1-4C)алкил, (1-4C)фторалкил, CF3, (1-4C)гидроксиалкил или (3-6C)циклоалкил, который замещен, при необходимости, (1-4C алкилом), CN, OH, CF3, CO2(1-4C алкилом) или CO2H, реакцию соединения формулы II с соединением формулы HOC(=O)R2, в присутствии агента сочетания и основания;
где X, Y, R3, R4, n, hetAr2 имеет значения, указанные в п.1; и
удаление или введение, при необходимости, любых защитных групп и получение, при необходимости, соли.
(f) для соединения формулы I, где R2 является C(=O)NReRf, реакцию соединения формулы VII
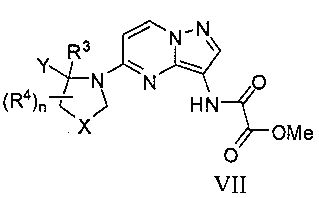
с соединением формулы HNReRf в присутствии основания;
где X, Y, R3, R4, n, Re, Rf имеют значения, указанные в п.1; и
удаление или введение, при необходимости, любых защитных групп и получение, при необходимости, соли.
(g) для соединения формулы I, где R2 является С(=O)ORg и Rg имеет значения, указанные в п.1, реакцию соединения формулы II

II
где X, Y, R3, R4, n имеет значения, указанные в п.1;
с метил 2-хлор-2-оксоацетатом и обработку гидроксидом щелочного металла с получением соединения формулы I, где Rg является H; и
удаление или введение, при необходимости, любых защитных групп и получение, при необходимости, соли.
(R)-N(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида;
(R)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1,1-диметилмочевины;
(R)-1-трет-бутил-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)мочевины;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-фенилмочевины;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)изобутирамида;
(R)-N(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-1-метил-6-оксо-1,6-дигидропиридазин-3-карбоксамида;
(R)-N-(5-(4,4-дифтор-2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида;
(R)-N(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамида;
N-(5-(2-(3-фторфенил)-2-метилпирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида;
(R)-N-(5-(2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида;
(R)-N-(5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамида;
(S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(3R,4R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3,4-дигидроксипирролидин-1-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамида;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-(4-фторфенил)мочевины;
(R)-1-(4-хлорфенил)-3-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)мочевины;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-(4-метоксифенил)мочевины;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метоксиазетидин-1-карбоксамида;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидрокси-3-метилазетидин-1-карбоксамида;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)морфолин-4-карбоксамида;
(S)-трет-бутил 4-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-илкарбамоил)-2-метилпиперазин-1-карбоксилата;
(S)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиперазин-1-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-изопропилпиперазин-1-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-этилпиперазин-1-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-4-метилпиперазин-1-карбоксамида;
N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3,5-диметилпиперазин-1-карбоксамида;
(S)-трет-бутил 4-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-илкарбамоил)-2-метилпиперазин-1-карбоксилата;
(S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-метилпиперазин-1-карбоксамид гидрохлорида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксиазетидин-1-карбоксамида;
(R)-метил 1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-илкарбамоил)циклопропанкарбоксилата;
(R)-1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-илкарбамоил)циклопропанкарбоновой кислоты;
(S)-N-(5-((R)-2-(3-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(R)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(S)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(R)-N-(5-(2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-4-гидроксипиперидин-1-карбоксамида;
(R)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамида;
(S)-N-(5-((R)-2-(2-(дифторметил)-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамида;
(R)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-4-гидроксипиперидин-1-карбоксамида;
(R)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамида;
(S)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)пиваламида;
(R)-трет-бутил 3-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-илкарбамоил)азетидин-1-карбоксилата;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)азетидин-3-карбоксамида;
(R)-трет-бутил 4-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-илкарбамоил)-4-метилпиперидин-1-карбоксилата;
(R)-N-(5-(2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-4-метилпиперидин-4-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-гидрокси-2-метилпропанамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-1-(трифторметил)циклопропанкарбоксамида;
(R)-1-циано-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)циклопропанкарбоксамида;
(R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-метилпирролидин-2-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-фтор-2-метилпропанамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-(изопропиламино)тиазол-4-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-метил-2-(1H-1,2,4-тиазол-1-ил)пропанамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)пиразин-2-карбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-5-метилпиразин-2-карбоксамида;
(R)-N(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)пиколинамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-6-метилпиколинамида;
(R)-5-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)пиколинамида;
(R)-4-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-метилпиколинамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидрокси-2,2-диметилпропанамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-1-гидроксициклопропанкарбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-метил-2-(метиламино)пропанамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)пиримидин-2-карбоксамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)пиколинамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-метилпиколинамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-1-метил-2-оксо-1,2-дигидропиридин-4-карбоксамида;
(R)-6-хлор-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)пиколинамида;
(R)-4-(этилсульфонамидо)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)бензамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-1-метил-1H-пиразол-3-карбоксамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-1H-пиразол-3-карбоксамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-6-метоксипиколинамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)никотинамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)изоникотинамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-6-метилникотинамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-метоксиникотинамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-метилизоникотинамида;
(S)-N-(5-((R)-2-(2-хлор-5-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-5-метилпиразин-2-карбоксамида;
(R)-N-(5-(2-(3-фторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-1-метил-1H-имидазол-2-карбоксамида;
(S)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(R)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(R)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамида;
(S)-N-(5-((R)-2-(5-фтор-2-(трифторметил)фенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамида;
(S)-N-(5-((R)-2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(R)-N-(5-((R)-2-(5-фторпиридин-3-ил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(S)-N-(5-((R)-2-(5-фтор-2-метоксифенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(S)-N-(5-((R)-2-(5-фтор-2-метоксифенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипиперидин-1-карбоксамида;
(1S,4S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамида;
(R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(1S,3R)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксициклопентанкарбоксамида;
(1S,3S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксициклопентанкарбоксамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксициклобутанкарбоксамида;
(R)-N1-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-N2,N2-диметилоксальамида;
(R)-Nl-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[l,5-a]пиримидин-3-ил)-N2-метилоксальамида;
(R)-Nl-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[l,5-a]пиримидин-3-ил)оксальамида;
(R)-Nl-циклопропил-N2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)оксальамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-(3-гидроксиазетидин-1-ил)-2-оксоацетамида;
N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-((S)-3-гидроксипирролидин-1-ил)-2-оксоацетамида;
(R)-N-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-ил)-2-морфолино-2-оксоацетамида;
(R)-метил 2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-иламино)-2-оксоацетата;
(R)-2-(5-(2-(2,5-дифторфенил)пирролидин-1-ил)пиразоло[1,5-a]пиримидин-3-иламино)-2-оксоуксусной кислоты;
или его фармацевтически приемлемые соли.

Комментарии