Композиции и способы для диагностики и лечения опухоли - RU2563359C2
Код документа: RU2563359C2
Чертежи

















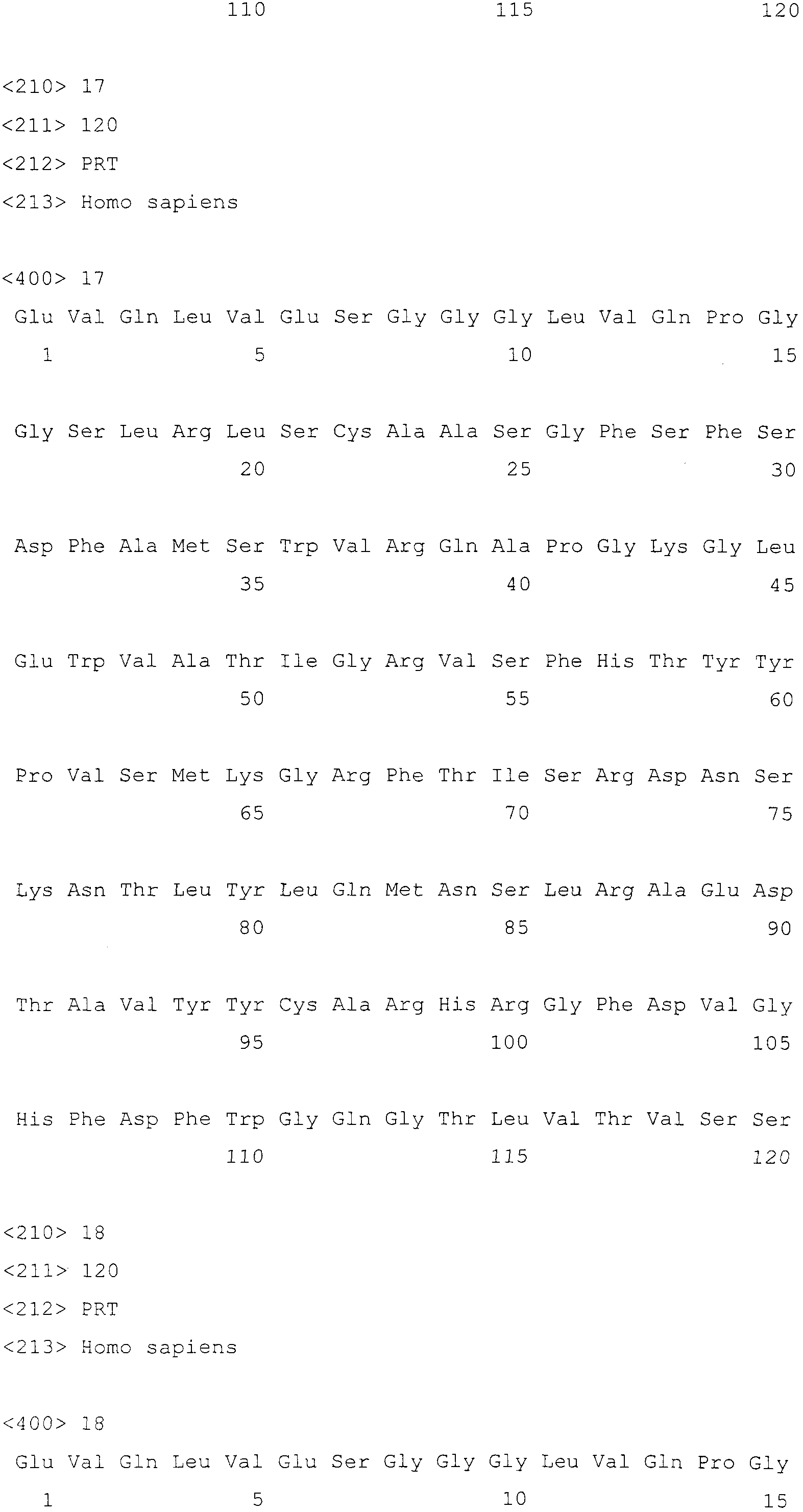















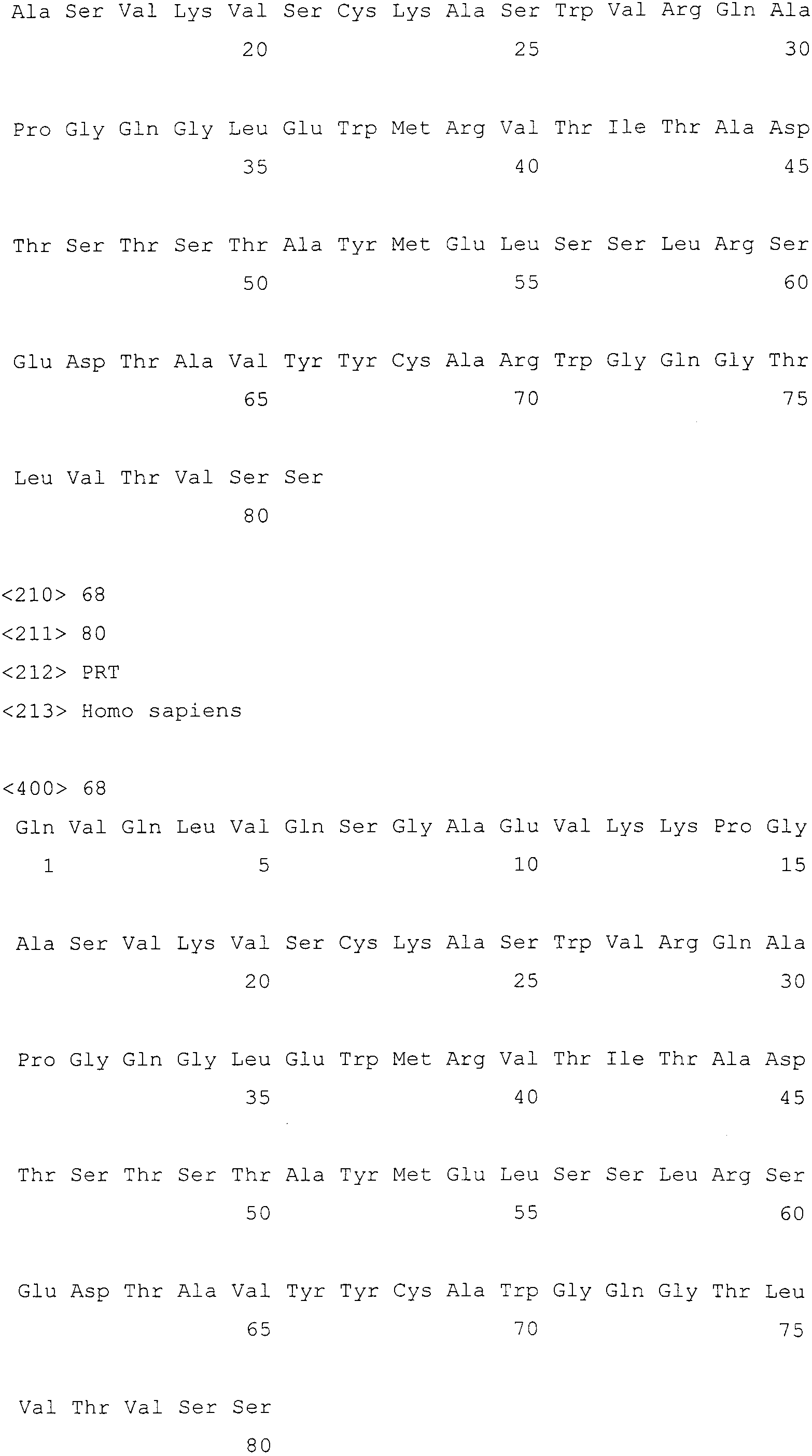









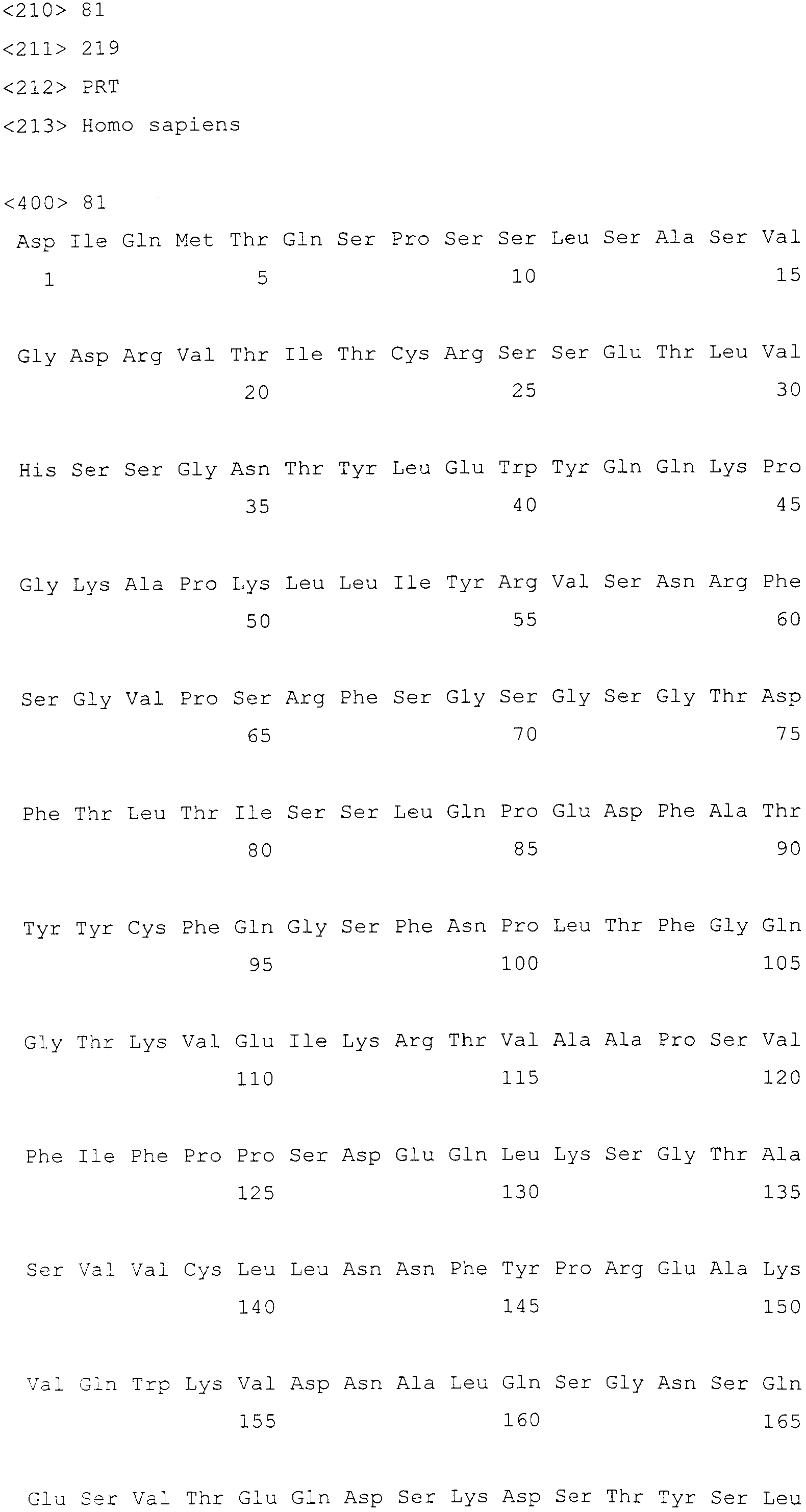























Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка является непредварительной заявкой, поданной в соответствии с 37 C.F.R. § 1.53(b)(1), и по ней испрашивается приоритет в соответствии с 35 U.S.C. § 119(e) предварительной заявки США № 61/265262, поданной 30 ноября 2009 г., и предварительной заявки США № 61/384467, поданной 20 сентября 2010 г., содержание которых приведено в настоящем описании в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям, которые могут использоваться для диагностики и лечения опухоли у млекопитающих, и к способам применения этих композиций для тех же целей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Злокачественные опухоли (раковые заболевания) являются второй ведущей причиной смерти в Соединенных Штатах, после заболеваний сердца (Boring et al., CA Cancel J. Clin. 43:7 (1993)). Рак характеризуется увеличением количества патологических или неопластических клеток, являющихся производными нормальной ткани, которые пролиферируют с образованием опухолевой массы, инвазией близлежащих тканей этими неопластическими опухолевыми клетками, и продукцией злокачественных клеток, которые постепенно распространяются через кровь или лимфатическую систему к региональным лимфатическим узлам и к удаленным участкам посредством процесса, именуемого метастазированием. При раковом состоянии, клетка пролиферирует в условиях, при которых нормальные клетки не смогли бы расти. Рак существует в широком разнообразии форм, отличающихся различными степенями инвазивности и агрессивности.
В попытках обнаружить эффективные клеточные мишени для диагностики и терапии рака, исследователи изыскивают пути для идентификации трансмембранных или других связанных с мембраной полипептидов, которые специфично экспрессируются на поверхности одного или более конкретных типов раковых клеток по сравнению с одной или более нормальных нераковых клеток. Часто, такие мембранно-связанные полипептиды более широко экспрессируются на поверхности раковых клеток по сравнению с поверхностью нераковых клеток. Идентификация таких опухоле-связанных антигенных полипептидов клеточной поверхности обеспечивает способность специфически метить раковые клетки для разрушения посредством терапий, основанных на антителах. В этом отношении, отмечается, что терапия на основе антител оказалась очень эффективной при лечении некоторых видов раков. Например, HERCEPTIN® и RITUXAN® (оба от Genentech Inc., South San Francisco, California) представляют собой антитела, которые успешно использовались для лечения рака молочной железы неХоджкинской лимфомы, соответственно. Более конкретно, HERCEPTIN® представляет собой рекомбинантные ДНК-производные гуманизированные моноклональные антитела, которые селективно связываются с внеклеточным доменом прото-онкогена рецептора 2 фактора роста эпидермиса (HER2) человека. Сверхэкспрессия белка HER2 наблюдается у 25-30% из первичных раков молочной железы. RITUXAN® представляет собой генно-инженерные химерные моноклональные антитела мыши/человека, направленные против антигена CD20, обнаруженного на поверхности нормальных и малигнизированных B лимфоцитов. Оба вида этих антител рекомбинантно продуцируются в клетках CHO.
Несмотря на указанные выше достижения в терапии рака молочной железы, существует огромная потребность в дополнительных диагностических и терапевтических средствах, способных к обнаружению присутствия опухоли у млекопитающего и к эффективному ингибированию роста неопластических клеток, соответственно. Соответственно, целью настоящего изобретения является идентификация клеточных мембранно-связанных полипептидов, которые более распространенно экспрессируются у одного или более типов раковых клеток по сравнению с нормальными клетками или у других отличных раковых клеток и применение этих полипептидов, и кодирующих их нуклеиновых кислот, для получения композиций веществ, применимых в терапевтическом лечении и диагностическом обнаружении рака у млекопитающих.
КРАТКОЕ СОДЕРЖАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем описании заявители впервые описывают идентификацию клеточных полипептидов (и кодирующих их нуклеиновых кислот или их фрагментов), которые экспрессируются в большей степени на поверхности одного или более типов раковых клеток по сравнению с поверхностью одного или более типов нормальных нераковых клеток. Эти полипептиды в настоящем описании называются опухоле-связанными антигенными полипептидами-мишенями (полипептидами "TAT") и, предполагается, что они могут служить в качестве эффективных мишеней для лечения и диагностики рака млекопитающих.
Соответственно, в одном из вариантов осуществления настоящего изобретения, изобретение относится к выделенной молекуле нуклеиновой кислоты, имеющей нуклеотидную последовательность, которая кодирует опухоле-связанный антигенный полипептид-мишень или его фрагмент (полипептид "TAT").
В некоторых аспектах, выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая по меньшей мере приблизительно на 80% идентична последовательности нуклеиновой кислоты, альтернативно по меньшей мере приблизительно на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности нуклеиновой кислоты, по отношению к (a) молекуле ДНК, кодирующей непроцессированный полипептид ТАТ, имеющий аминокислотную последовательность, как описано в настоящей заявке, аминокислотную последовательность полипептида ТАТ без сигнального пептида, как описано в настоящей заявке, внеклеточный домен трансмембранного полипептида ТАТ, с сигнальным пептидом или без него, как описано в настоящей заявке, или любой другой конкретно определенный фрагмент аминокислотной последовательности непроцессированного полипептида ТАТ, как описано в настоящей заявке, или (b) комплемент молекулы ДНК (a).
В других аспектах, выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая по меньшей мере приблизительно на 80% идентична последовательности нуклеиновой кислоты, альтернативно по меньшей мере приблизительно на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности нуклеиновой кислоты по отношению к (a) молекуле ДНК, содержащей кодирующую последовательность кДНК непроцессированного полипептида ТАТ, как описано в настоящей заявке, кодирующую последовательность полипептида ТАТ без сигнального пептида, как описано в настоящей заявке, кодирующую последовательность внеклеточного домена трансмембранного полипептида ТАТ, с сигнальным пептидом или без него, как описано в настоящей заявке, или кодирующую последовательность любого другого конкретно определенного фрагмента аминокислотной последовательности непроцессированного полипептида ТАТ, как описано в настоящей заявке, или (b) комплемент молекулы ДНК (a).
В еще одном из аспектов изобретение относится к выделенной молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полипептид ТАТ, который имеет либо делецию трансмембранного домена, либо инактивацию трансмембранного домена, или является комплементарной такой кодирующей нуклеотидной последовательности, где трансмембранные домен(ы) таких полипептидов описаны в настоящей заявке. Следовательно, рассматриваются растворимые внеклеточные домены описанных в настоящей заявке полипептидов ТАТ.
В других аспектах настоящее изобретение относится к выделенным молекулам нуклеиновых кислот, которые гибридизируются с (a) нуклеотидной последовательностью, кодирующей полипептид ТАТ, имеющий непроцессированную аминокислотную последовательность, как описано в настоящей заявке, аминокислотную последовательность полипептида ТАТ без сигнального пептида, как описано в настоящей заявке, внеклеточный домен трансмембранного полипептида ТАТ, с сигнальным пептидом или без него, как описано в настоящей заявке, или любой другой конкретно определенный фрагмент аминокислотной последовательности непроцессированного полипептида ТАТ, как описано в настоящей заявке, или (b) комплемент нуклеотидной последовательности (a). В этом отношении в одном из вариантов осуществления настоящее изобретение относится к последовательности, кодирующей фрагменты непроцессированного полипептида ТАТ, или его комплемента, как описано в настоящей заявке, что может найти применение в качестве, например, зондов гибридизации, используемых в качестве, например, диагностических зондов, праймеров ПЦР, антисмысловых олигонуклеотидных зондов, или для кодирования фрагментов непроцессированного полипептида ТАТ, которые могут необязательно кодировать полипептид, содержащий участок связывания для антитела против полипептида ТАТ. Такие фрагменты нуклеиновой кислоты имеют обычно по меньшей мере приблизительно 5 нуклеотидов по длине, альтернативно по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 нуклеотидов по длине, где в данном контексте термин "приблизительно" означает указываемую длину нуклеотидной последовательности плюс или минус 10% от этой указанной длины. Кроме того, такие фрагменты нуклеиновой кислоты обычно состоят из последовательных нуклеотидов, производных от последовательности, кодирующей непроцессированный полипептид ТАТ или его комплемент. Отмечают, что новые фрагменты нуклеотидной последовательности, кодирующей полипептид ТАТ или его комплемент, могут быть определены рутинным образом посредством выравнивания нуклеотидной последовательности, кодирующей полипептид ТАТ с другими известными нуклеотидными последовательностями с использованием любой из ряда хорошо известных программ выравнивания последовательностей и определения того, какие фрагмент(ы) нуклеотидной последовательности, кодирующие полипептид ТАТ, или его комплемент, являются новыми. Все из таких фрагментов нуклеотидных последовательностей, кодирующих полипептид ТАТ, или их комплемент, рассматриваются в настоящем документе. Также рассматриваются фрагменты полипептида ТАТ, кодируемые этими нуклеотидными фрагментами молекулы, предпочтительно, такие фрагменты полипептида ТАТ, которые содержат участок связывания для антитела против ТАТ.
В еще одном варианте осуществления изобретение относится к выделенным полипептидам ТАТ, кодируемым любыми из последовательностей выделенной нуклеиновой кислоты, идентифицированнных в настоящей заявке выше.
В определенном аспекте изобретение относится к выделенному полипептиду ТАТ, содержащему аминокислотную последовательность, которая по меньшей мере приблизительно на 80% идентична аминокислотной последовательности, альтернативно по меньшей мере приблизительно 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности, по отношению к полипептиду ТАТ, имеющему непроцессированную аминокислотную последовательность, как описано в настоящей заявке, аминокислотной последовательности полипептида ТАТ без сигнального пептида, как описано в настоящей заявке, внеклеточному домену трансмембранного полипептидного ТАТ белка, с сигнальным пептидом или без него, как описано в настоящей заявке, аминокислотной последовательности, кодируемой любой из последовательностей нуклеиновой кислоты, описанной в настоящей заявке, или любого другого конкретно определенного фрагмента аминокислотной последовательности непроцессированного полипептида ТАТ, как описано в настоящей заявке.
В другом дополнительном аспекте, изобретение относится к выделенному полипептиду ТАТ, содержащему аминокислотную последовательность, которая кодируется нуклеотидной последовательностью, которая гибридизируется с комплементом молекулы ДНК, кодирующим (a) полипептид ТАТ, имеющий непроцессированную аминокислотную последовательность, как описано в настоящей заявке, (b) аминокислотную последовательность полипептида ТАТ без сигнального пептида, как описано в настоящей заявке, (c) внеклеточный домен трансмембранного полипептидного ТАТ белка, с сигнальным пептидом или без него, как описано в настоящей заявке, (d) аминокислотную последовательность, кодируемую любой из последовательностей нуклеиновой кислоты, раскрытых в настоящей заявке, или (e) любой другой конкретно определенный фрагмент аминокислотной последовательности непроцессированного полипептида ТАТ, как описано в настоящей заявке.
В конкретном аспекте изобретение относится к выделенному полипептиду ТАТ без N-концевой сигнальной последовательности и/или без инициирующего метионина, и который кодируется нуклеотидной последовательностью, которая кодирует такую аминокислотную последовательность, как описано в настоящей заявке выше. Способы для их получения также описаны в настоящей заявке, где способы включают культивирование клетки-хозяина, содержащей вектор, который содержит соответствующую кодирующую молекулу нуклеиновой кислоты при условиях, подходящих для экспрессии полипептида ТАТ и выделения полипептида ТАТ из клеточной культуры.
В другом аспекте изобретение относится к выделенному полипептиду ТАТ, который имеет любо делецию трансмембранного домена, либо инактивацию трансмембранного домена. Способы для их получения также описаны в настоящей заявке, где эти способы включают культивирование клетки-хозяина, содержащей вектор, который содержит соответствующую кодирующую молекулу нуклеиновой кислоты при условиях, подходящих для экспрессии полипептида ТАТ и выделения полипептида ТАТ из клеточной культуры.
В других вариантах осуществления настоящего изобретения изобретение относится к векторам, содержащим ДНК, кодирующим любые из описанных в настоящей заявке полипептидов. Также изобретение относится к клеткам-хозяевам, содержащим любой такой вектор. Посредством примера, клетки-хозяева могут представлять собой CHO клетки, E. coli клетки или дрожжевые клетки. Дополнительно предоставлен способ получения любых описанных в настоящей заявке полипептидов, который включает культивирование клеток-хозяев при условиях, подходящих для экспрессии желательного полипептида и выделения желательного полипептида из клеточной культуры.
В других вариантах осуществления изобретение относится к выделенным химерным полипептидам, содержащим любой из описанных полипептидов ТАТ, рекомбинированных с гетерологичным (не-TAT) полипептидом. Примеры таких химерных молекул содержат любые из описанных в настоящей заявке полипептидов ТАТ, рекомбинированных с гетерологичным полипептидом, таким как, например, последовательность эпитопной метки или Fc-область иммуноглобулина.
В еще одном варианте осуществления изобретение относится к антителу, которое связывается, предпочтительно, конкретно, с любым из указанных выше или описанных ниже полипептидов. Необязательно, антитело представляет собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело, антитело с единственной цепью или антитело, которое конкурентно ингибирует связывание антитела против полипептида ТАТ с его соответствующим антигенным эпитопом. Антитела по настоящему изобретению могут необязательно быть конъюгированы с агентом, ингибирующим рост, или цитотоксическим агентом, таким как токсин, включающим, например, майтансиноид или калихеамицин, антибиотик, радиоактивный изотоп, нуклеолитический фермент или т.п. Антитела по настоящему изобретению могут необязательно продуцироваться в CHO клетках или бактериальных клетках и, предпочтительно, ингибируют рост или пролиферацию или индуцируют смерть клетки, с которой они связываются. Для диагностических целей, антитела по настоящему изобретению могут быть помечены для обнаружения, присоединены к твердому носителю, или т.п.
В других вариантах осуществления настоящего изобретения изобретение относится к векторам, содержащим ДНК, кодирующим любые из описанных в настоящей заявке антител. Также изобретение относится к клеткам-хозяевам, содержащим любой такой вектор. В качестве примера, клетки-хозяева могут представлять собой CHO клетки, клетки E. coli или дрожжевые клетки. Дополнительно, изобретение относится к способу получения любого из описанных в настоящей заявке антител, который включает культивирование клеток-хозяев при условиях, подходящих для экспрессии желательного антитела и выделения желательного антитела из клеточной культуры.
В другом дополнительном варианте осуществления изобретение относится к композиции, содержащей полипептид ТАТ, как описано в настоящей заявке, химерный полипептид ТАТ, как описано в настоящей заявке, или антитело против ТАТ, как описано в настоящей заявке, в комбинации с носителем. Необязательно, носитель представляет собой фармацевтически приемлемый носитель.
В еще одном другом варианте осуществления изобретение относится к изделию, содержащему контейнер и композицию веществ, содержащуюся внутри контейнера, где композиция веществ может содержать полипептид ТАТ, как описано в настоящей заявке, химерный полипептид ТАТ, как описано в настоящей заявке, или антитело против ТАТ, как описано в настоящей заявке. Изделие может дополнительно необязательно содержать этикетку, прикрепленную к контейнеру, или листок-вкладыш, включенный в контейнер, который относится к применению композиции веществ для терапевтического лечения или диагностического обнаружения опухоли.
В другом варианте осуществления настоящее изобретение относится к применению полипептида ТАТ, как описано в настоящей заявке, химерного полипептида ТАТ, как описано в настоящей заявке, или антитела против полипептида ТАТ, как описано в настоящей заявке, для получения лекарственного средства, используемого для лечения состояния, которое является восприимчивым к полипептиду ТАТ, химерному полипептиду ТАТ, или антителу против полипептида ТАТ.
Другие варианты осуществления настоящего изобретения относятся к любому выделенному антителу, содержащему одну или более из последовательностей CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 или CDR-H3, раскрытых в настоящей заявке, или любое антитело, которое связывается с тем же самым эпитопом как любое такое антитело.
В другом варианте осуществления настоящее изобретение относится к способу ингибирования роста клетки, которая экспрессирует полипептид ТАТ, где способ предусматривает приведение в контакт клетки с антителом, которое связывается с полипептидом ТАТ, и, где связывание антитела с полипептидом ТАТ вызывает ингибирование роста клетки, экспрессирующей полипептид ТАТ. В предпочтительных вариантах осуществления клетка представляет собой раковую клетку, и связывание антитела с полипептидом ТАТ вызывает смерть клетки, экспрессирующей полипептид ТАТ. Необязательно, антитело представляет собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело или антитело с единственной цепью. Антитела, используемые в способах настоящего изобретения, могут необязательно быть конъюгированы с агентом, ингибирующим рост, или цитотоксическим агентом, таким как токсин, включающим, например, майтансиноид или калихеамицин, антибиотик, радиоактивный изотоп, нуклеолитический фермент, или т.п. Антитела, используемые в способах настоящего изобретения, могут необязательно продуцироваться в CHO клетках или бактериальных клетках.
В другом варианте осуществления настоящее изобретение относится к способу терапевтического лечения млекопитающего, имеющего раковую опухоль, содержащую клетки, которые экспрессируют полипептид ТАТ, где способ включает введение млекопитающему терапевтически эффективного количества антитела, которое связывается с полипептидом ТАТ, посредством чего приводя в результате к эффективному терапевтическому лечению опухоли. Необязательно, антитело представляет собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело или антитело с единственной цепью. Антитела, используемые в способах настоящего изобретения, могут необязательно быть конъюгированы с агентом, ингибирующим рост, или цитотоксическим агентом, таким как токсин, включающим, например, майтансиноид или калихеамицин, антибиотик, радиоактивный изотоп, нуклеолитический фермент, или т.п. Антитела, используемые в способах настоящего изобретения, могут необязательно продуцироваться в CHO клетках или бактериальных клетках.
Другой вариант осуществления настоящего изобретения относится к способу определения присутствия полипептида ТАТ в образце, подозреваемом на содержание полипептида ТАТ, где способ включает воздействие образца на антитело, которое связывается с полипептидом ТАТ, и определение связывания антитела с полипептидом ТАТ в образце, где присутствие такого связывания указывает на присутствие полипептида ТАТ в образце. Необязательно, образец может содержать клетки (которые могут являться раковыми клетками), в которых предполагают экспрессию полипептида ТАТ. Антитело, используемое в способе, может необязательно быть меченным для обнаружения, присоединено к твердому носителю, или т.п.
Дополнительный вариант осуществления настоящего изобретения относится к способу диагностики присутствия опухоли у млекопитающего, где способ включает обнаружение уровня экспрессии гена, кодирующего полипептид ТАТ (a) в тестируемом образце клеток ткани, полученных от указанного млекопитающего, и (b) в контрольном образце известных нормальных нераковых клеток такого же тканевого происхождения или типа, где более высокий уровень экспрессии полипептида ТАТ в тестируемом образце, по сравнению с контрольным образцом, указывает на присутствие опухоли у млекопитающего, от которого был получен тестируемый образец.
В другом варианте осуществления настоящее изобретение относится к способу диагностики присутствия опухоли у млекопитающего, где способ предусматривает (a) приведение в контакт тестируемого образца, содержащего тканевые клетки, полученные от млекопитающего, с антителом, которое связывается с полипептидом ТАТ, и (b) обнаружение образования комплекса между антителом и полипептидом ТАТ в тестируемом образце, где образование комплекса указывает на присутствие опухоли у млекопитающего. Необязательно, используемое антитело является меченым для обнаружения, присоединено к твердому носителю, или т.п., и/или тестируемый образец клеток ткани получают от индивидуума, подозреваемого как имеющего раковую опухоль.
В еще одном варианте осуществления настоящее изобретение относится к способу лечения или профилактики клеточного пролиферативного нарушения, связанного с измененной, предпочтительно, увеличенной, экспрессией или активностью полипептида ТАТ, способ, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества антагониста полипептида ТАТ. Предпочтительно, клеточное пролиферативное нарушение является раком, а антагонист полипептида ТАТ представляет собой антитело против ТАТ полипептида или антисмысловой олигонуклеотид. Эффективное лечение или профилактика клеточного пролиферативного нарушения может являться результатом непосредственного уничтожения или ингибирования роста клеток, которые экспрессируют полипептид ТАТ или посредством антагонизации клеточного роста, потенцирующего активность полипептида ТАТ.
В еще одном варианте осуществления настоящее изобретение относится к способу связывания антитела с клеткой, которая экспрессирует полипептид ТАТ, где способ предусматривает приведение в контакт клетки, которая экспрессирует полипептид ТАТ с указанным антителом при условиях, которые являются подходящими для связывания антитела с указанным полипептидом ТАТ и обеспечение связывания между ними. В предпочтительных вариантах осуществления, антитело метят молекулой или соединением, которые используются для качественного и/или количественного определения расположения и/или количества связывания антитела с клеткой.
Другие варианты осуществления настоящего изобретения относятся к применению полипептида ТАТ, нуклеиновой кислоты, кодирующей полипептид ТАТ, или вектора или клетки-хозяина, содержащей эту нуклеиновую кислоту, или антитела против полипептида ТАТ при получении лекарственного средства, применимого для (i) терапевтического лечения или диагностического обнаружения рака или опухоли, или (ii) терапевтического лечения или профилактики клеточного пролиферативного нарушения.
В еще одном варианте осуществления настоящее изобретение относится к способу ингибирования роста раковой клетки, где рост указанной раковой клетки является по меньшей мере отчасти зависимым от потенцирующих рост эффекта(ов) полипептида ТАТ (где полипептид ТАТ может экспрессироваться либо самой раковой клеткой, либо клеткой, которая продуцирует полипептид(ы), которые обладают потенцирующим рост эффектом на раковые клетки), где способ включает приведение в контакт полипептида ТАТ с антителом, которое связывается с полипептидом ТАТ, посредством чего антагонизируя рост-потенцирующую активность полипептида ТАТ и, в свою очередь, ингибируя рост раковой клетки. Предпочтительно, рост раковой клетки рака полностью ингибируется. Даже более предпочтительно, связывание антитела с полипептидом ТАТ индуцирует смерть раковой клетки. Необязательно, антитело представляет собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело или антитело с единственной цепью. Антитела, используемые в способах настоящего изобретения, могут необязательно быть конъюгированы с агентом, ингибирующим рост, или цитотоксическим агентом, таким как токсин, включающий, например, майтансиноид или калихеамицин, антибиотик, радиоактивный изотоп, нуклеолитический фермент, или т.п. Антитела, используемые в способах настоящего изобретения, могут необязательно продуцироваться в CHO клетках или бактериальных клетках.
В еще одном варианте осуществления настоящее изобретение относится к способу терапевтического лечения опухоли у млекопитающего, где рост указанной опухоли является по меньшей мере частично зависимым от рост-потенцирующих эффекта(ов) полипептида ТАТ, где способ включает введение млекопитающему терапевтически эффективного количества антитела, которое связывается с полипептидом ТАТ, посредством чего антагонизируя рост-потенцирующую активность указанного полипептида ТАТ и приводя в результате к эффективному терапевтическому лечению опухоли. Необязательно, антитело представляет собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело или антитело с единственной цепью. Антитела, используемые в способах настоящего изобретения, могут необязательно быть конъюгированы с агентом, ингибирующим рост, или цитотоксическим агентом, таким как токсин, включающий, например, майтансиноид или калихеамицин, антибиотик, радиоактивный изотоп, нуклеолитический фермент, или т.п. Антитела, используемые в способах настоящего изобретения, могут необязательно продуцироваться в CHO клетках или бактериальных клетках.
В еще дополнительных вариантах осуществления изобретение относится к следующему набору потенциальных пунктов формулы изобретения для данной или будущей заявок:
1. Выделенная нуклеиновая кислота, имеющая нуклеотидную последовательность, которая по меньшей мере на 80% идентична последовательности нуклеиновой кислоты по отношению к (a) молекуле ДНК, кодирующей аминокислотную последовательность, показанную как SEQ ID NO:2, (b) молекуле ДНК, кодирующей аминокислотную последовательность, показанной как SEQ ID NO:2, в которой отсутствует его связанный сигнальный пептид, (c) молекуле ДНК, кодирующей внеклеточный домен полипептида, показанной как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) молекуле ДНК, кодирующей внеклеточный домен полипептида, показанной как SEQ ID NO:2, в которой отсутствует его связанный сигнальный пептид, (e) нуклеотидной последовательности, показанной как SEQ ID NO:1, (f) непроцессированной кодирующей последовательности нуклеотидной последовательности, показанной как SEQ ID NO:1, или (g) комплементу (a), (b), (c), (d), (e) или (f).
2. Выделенная нуклеиновая кислота, имеющая (a) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, показанную как SEQ ID NO:2, (b) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, показанную как SEQ ID NO:2, в которой отсутствует его связанный сигнальный пептид, (c) нуклеотидную последовательность, которая кодирует внеклеточный домен полипептида, показанный как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) нуклеотидную последовательность, которая кодирует внеклеточный домен полипептида, показанный как SEQ ID NO:2, в котором отсутствует его связанный сигнальный пептид, (e) нуклеотидную последовательность, показанную как SEQ ID NO:1, (f) непроцессированную кодирующую область нуклеотидной последовательности, показанную как SEQ ID NO:1, или (g) комплемент (a), (b), (c), (d), (e) или (f).
3. Выделенная нуклеиновая кислота, которая гибридизируется с (a) нуклеиновой кислотой, которая кодирует аминокислотную последовательность, показанную как SEQ ID NO:2, (b) нуклеиновой кислотой, которая кодирует аминокислотную последовательность, показанную как SEQ ID NO:2, без его связанного сигнального пептида, (c) нуклеиновой кислотой, которая кодирует внеклеточный домен полипептида, показанный как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) нуклеиновой кислотой, которая кодирует внеклеточный домен полипептида, показанный как SEQ ID NO:2, без его связанного сигнального пептида, (e) нуклеотидной последовательностью, показанной как SEQ ID NO:1, (f) непроцессированной кодирующей областью нуклеотидной последовательности, показанной как SEQ ID NO:1, или (g) комплементом (a), (b), (c), (d), (e) или (f).
4. Нуклеиновая кислота по п.3, где гибридизация происходит при строгих условиях.
5. Нуклеиновая кислота по п.3, которая содержит по меньшей мере приблизительно 5 нуклеотидов по длине.
6. Экспрессионный вектор, содержащий нуклеиновую кислоту по п.1, 2 или 3.
7. Экспрессионный вектор по п.6, где указанная нуклеиновая кислота является функционально связанной с контрольными последовательностями, распознаваемыми клеткой-хозяином, трансформированной вектором.
8. Клетка-хозяин, содержащая экспрессионный вектор по п.7.
9. Клетка-хозяин по п.8, которая представляет собой CHO клетку, клетку E. coli или дрожжевую клетку.
10. Способ продуцирования полипептида, включающий культивирование клетки-хозяина по п.8 при условиях, подходящих для экспрессии указанного полипептида и выделения указанного полипептида из клеточной культуры.
11. Выделенный полипептид, который по меньшей мере на 80% идентичен аминокислотной последовательности по отношению к (a) полипептиду, показанному как SEQ ID NO:2, (b) полипептиду, показанному как SEQ ID NO:2, в котором отсутствует его связанный сигнальный пептид, (c) внеклеточному домену полипептида, показанному как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточному домену полипептида, показанному как SEQ ID NO:2, в котором отсутствует его связанный сигнальный пептид, (e) полипептиду, кодируемому нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептиду, кодируемому кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
12. Выделенный полипептид, имеющий (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
13. Химерный полипептид, содержащий полипептид по п.11 или 12, рекомбинированный с гетерологичным полипептидом.
14. Химерный полипептид по п.13, где указанный гетерологичный полипептид представляет собой последовательность эпитопной метки или Fc-область иммуноглобулина.
15. Выделенное антитело, которое связывается с полипептидом, имеющим аминокислотную последовательность, которая по меньшей мере на 80% идентична аминокислотной последовательности по отношению к (a) полипептиду, показанному как SEQ ID NO:2, (b) полипептиду, показанному как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточному домену полипептида, показанному как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточному домену полипептида, показанному как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептиду, кодируемому нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептиду, кодируемому кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
16. Выделенное антитело, которое связывается с полипептидом, имеющим (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
17. Антитело по п.15 или 16, которое представляет собой моноклональное антитело.
18. Антитело по п.15 или 16, которое представляет собой фрагмент антитела.
19. Антитело по п.15 или 16, которое представляет собой химерное или гуманизированное антитело.
20. Антитело по п.15 или 16, которое является конъюгированным с агентом, ингибирующим рост.
21. Антитело по п.15 или 16, которое является конъюгированным с цитотоксическим агентом.
22. Антитело по п.21, где цитотоксический агент выбирают из группы, состоящей из токсинов, антибиотиков, радиоактивных изотопов и нуклеолитических ферментов.
23. Антитело по п.21, где цитотоксический агент представляет собой токсин.
24. Антитело по п.23, где токсин выбирают из группы, состоящей из майтансиноида и калихеамицин.
25. Антитело по п.23, где токсин представляет собой майтансиноид.
26. Антитело по п.15 или 16, которое продуцируется в бактериях.
27. Антитело по п.15 или 16, которое продуцируется в CHO клетках.
28. Антитело по п.15 или 16, которое индуцирует смерть клетки, с которой оно связывается.
29. Антитело по п.15 или 16, которое метят для обнаружения.
30. Выделенная нуклеиновая кислота, имеющая нуклеотидную последовательность, которая кодирует антитело по п.15 или 16.
31. Экспрессионный вектор, содержащий нуклеиновую кислоту по п.30, функционально связанную с контрольными последовательностями распознаваемыми клетками-хозяевами, трансформированными вектором.
32. Клетка-хозяин, содержащая экспрессионный вектор по п.31.
33. Клетка-хозяин по п.32, которая представляет собой СНО клетку, клетку E. coli или дрожжевую клетку.
34. Способ продуцирования антитела, включающий культивирование клетки-хозяина по п.32 при условиях, подходящих для экспрессии указанного антитела и выделения указанного антитела из клеточной культуры.
35. Композиция веществ, содержащая (a) полипептид по п.11, (b) полипептид по п.12, (c) химерный полипептид по п.13, (d) антитело по п.15 или (e) антитело по п.16 в комбинации с носителем.
36. Композиция веществ по п.35, где указанный носитель представляет собой фармацевтически приемлемый носитель.
37. Изделие, содержащее (a) контейнер и (b) композицию веществ по п.35, содержащуюся внутри указанного контейнера.
38. Изделие по п.37, дополнительно содержащее этикетку, прикрепленную к указанному контейнеру, или листок-вкладыш, включенный с указанным контейнером, относящийся к применению указанной композиции веществ для терапевтического лечения или диагностического обнаружения рака.
39. Способ ингибирования роста клетки, которая экспрессирует белок, который по меньшей мере на 80% идентичен аминокислотной последовательности с (a) полипептидом, показанным, как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, указанный способ, включающий приведение в контакт указанной клетки с антителом, которое связывается с указанным белком, связывание указанного антитела с указанным белком таким образом, вызывая ингибирование роста указанной клетки.
40. Способ по п.39, где указанное антитело представляет собой моноклональное антитело.
41. Способ по п.39, где указанное антитело представляет собой фрагмент антитела.
42. Способ по п.39, где указанное антитело представляет собой химерное или гуманизированное антитело.
43. Способ по п.39, где указанное антитело является конъюгированным с агентом, ингибирующим рост.
44. Способ по п.39, где указанное антитело является конъюгированным с цитотоксическим агентом.
45. Способ по п.44, где указанный цитотоксический агент выбирают из группы, состоящей из токсинов, антибиотиков, радиоактивных изотопов и нуклеолитических ферментов.
46. Способ по п.44, где цитотоксический агент представляет собой токсин.
47. Способ по п.46, где токсин выбирают из группы, состоящей из майтансиноида и калихеамицина.
48. Способ по п.46, где токсин представляет собой майтансиноид.
49. Способ по п.39, где указанное антитело продуцируется в бактериях
50. Способ по п.39, где указанное антитело продуцируется в СНО клетках.
51. Способ по п.39, где указанная клетка представляет собой раковую клетку.
52. Способ по п.51, где указанная раковая клетка дополнительно подвергается лучевой терапии или воздействию химиотерапевтического агента.
53. Способ по п.51, где указанную раковую клетку выбирают из группы, состоящей из клетки рака молочной железы, клетки колоректального рака, клетки рака легких, клетки рака яичника, клетки рака центральной нервной системы, клетки рака печени, клетки рака мочевого пузыря, клетки рака поджелудочной железы, клетки рака шейки матки, клетки меланомы и лейкемической клетки.
54. Способ по п.51, где указанный белок в большей степени экспрессируется указанными раковыми клетками по сравнению с нормальной клеткой такого же тканевого происхождения.
55. Способ по п.39, который вызывает смерть указанной клетки.
56. Способ по п.39, где указанный белок имеет (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
57. Способ терапевтического лечения млекопитающего, имеющего раковую опухоль, содержащую клетки, которые экспрессируют белок, который по меньшей мере на 80% идентичен аминокислотной последовательности с (a) полипептидом, показанным как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанного как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1; или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, указанный способ, включающий введение указанному млекопитающему терапевтически эффективного количества антитела, которое связывается с указанным белком, посредством чего эффективно излечивая указанное млекопитающее.
58. Способ по п.57, где указанное антитело представляет собой моноклональное антитело.
59. Способ по п.57, где указанное антитело представляет собой фрагмент антитела.
60. Способ по п.57, где указанное антитело представляет собой химерное или гуманизированное антитело.
61. Способ по п.57, где указанное антитело является конъюгированным с агентом, ингибирующим рост.
62. Способ по п.57, где указанное антитело является конъюгированным с цитотоксическим агентом.
63. Способ по п.62, где указанный цитотоксический агент выбирают из группы, состоящей из токсинов, антибиотиков, радиоактивных изотопов и нуклеолитических ферментов.
64. Способ по п.62, где цитотоксический агент представляет собой токсин.
65. Способ по п.64, где токсин выбирают из группы, состоящей из майтансиноида и калихеамицина.
66. Способ по п.64, где токсин представляет собой майтансиноид.
67. Способ по п.57, где указанное антитело продуцируется в бактериях.
68. Способ по п.57, где указанное антитело продуцируется в СНО клетках.
69. Способ по п.57, где указанная опухоль дополнительно подвергается лучевой терапии или воздействию химиотерапевтического агента.
70. Способ по п.57, где указанная опухоль представляет собой опухоль молочной железы, колоректальную опухоль, опухоль легкого, опухоль яичника, опухоль центральной нервной системы, опухоль печени, опухоль мочевого пузыря, опухоль поджелудочной железы или опухоль шейки матки.
71. Способ по п.57, где указанный белок в большей степени экспрессируется раковыми клетками указанной опухоли по сравнению с нормальной клеткой такого же тканевого происхождения.
72. Способ по п.57, где указанный белок имеет (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
73. Способ определения присутствия белка в образце, подозреваемого на содержание указанного белка, где указанный белок по меньшей мере на 80% идентичен аминокислотной последовательности с (a) полипептидом, показанным как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, указанный способ, включающий подвергание указанного образца воздействию антитела, которое связывается с указанным белком, и определение связывание указанного антитела с указанным белком в указанном образце, где связывание антитела с указанным белком указывает на присутствие указанного белка в указанном образце.
74. Способ по п.73, где указанный образец содержит клетку, подозреваемую на экспрессию указанного белка.
75. Способ по п.74, где указанная клетка представляет собой раковую клетку.
76. Способ по п.73, где указанное антитело является меченым для обнаружения.
77. Способ по п.73, где указанный белок имеет (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
78. Способ диагностики присутствия опухоли у млекопитающего, где указанный способ включает определение уровня экспрессии гена, кодирующего белок, который по меньшей мере на 80% идентичен аминокислотной последовательности с (а) полипептидом, показанным как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, в тестируемом образце клеток ткани, полученных от указанного млекопитающего и в контрольном образце известных нормальных клеток такого же тканевого происхождения, где более высокий уровень экспрессии указанного белка в тестируемом образце, по сравнению с контрольным образцом, указывает на присутствие опухоли у млекопитающего, из которого был получен тестируемый образец.
79. Способ по п.78, где стадия определения уровня экспрессии гена, кодирующего указанный белок, включает использование олигонуклеотида при гибридизации in situ или анализе методом РВ-ПЦР.
80. Способ по п.78, где стадия определения уровня экспрессии гена, кодирующего указанный белок, включает использование антитела при иммуногистохимии или анализе методом вестерн-блоттинга.
81. Способ по п.78, где указанный белок имеет (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
82. Способ диагностики присутствия опухоли у млекопитающего, где указанный способ включает приведение в контакт тестируемого образца клеток ткани, полученных от указанного млекопитающего с антителом, которое связывается с белком, который по меньшей мере на 80% идентичен аминокислотной последовательности с (а) полипептидом, показанным как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, и обнаружение образования комплекса между указанным антителом и указанным белком в тестируемом образце, где образование комплекса указывает на присутствие опухоли у указанного млекопитающего.
83. Способ по п.82, где указанное антитело является меченным для обнаружения.
84. Способ по п.82, где указанный тестируемый образец клеток ткани получают от индивидуума, подозреваемого на наличие раковой опухоли.
85. Способ по п.82, где указанный белок имеет (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
86. Способ лечения или профилактики клеточного пролиферативного нарушения, связанного с увеличенной экспрессией или активностью белка, который по меньшей мере на 80% идентичен аминокислотной последовательности с (а) полипептидом, показанным как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, указанный способ, включающий введение субъекту, нуждающемуся в таком лечении эффективного количества антагониста указанного белка, посредством чего эффективно излечивая или предотвращая указанное клеточное пролиферативное нарушение.
87. Способ по п.86, где указанное клеточное пролиферативное нарушение представляет собой рак.
88. Способ по п.86, где указанный антагонист представляет собой антитело против полипептида ТАТ или антисмысловой олигонуклеотид.
89. Способ связывания антитела с клеткой, которая экспрессирует белок, который по меньшей мере на 80% идентичен аминокислотной последовательности с (а) полипептидом, показанным как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, где указанный способ включает приведение в контакт указанной клетки с антителом, которое связывается с указанным белком и обеспечивает наличие связывания антитела с указанным белком, таким образом, связывая указанное антитело с указанной клеткой.
90. Способ по п.89, где указанное антитело представляет собой моноклональное антитело.
91. Способ по п.89, где указанное антитело представляет собой фрагмент антитела.
92. Способ по п.89, где указанное антитело представляет собой химерное или гуманизированное антитело.
93. Способ по п.89, где указанное антитело является конъюгированным с агентом, ингибирующим рост.
94. Способ по п.89, где указанное антитело является конъюгированным с цитотоксическим агентом.
95. Способ по п.94, где указанный цитотоксический агент выбирают из группы, состоящей из токсинов, антибиотиков, радиоактивных изотопов и нуклеолитических ферментов.
96. Способ по п.94, где цитотоксический агент представляет собой токсин.
97. Способ по п.96, где токсин выбирают из группы, состоящей из майтансиноида и калихеамицина.
98. Способ по п.96, где токсин представляет собой майтансиноид.
99. Способ по п.89, где указанное антитело продуцируется в бактериях.
100. Способ по п.89, где указанное антитело продуцируется в СНО клетках.
101. Способ по п.89, где указанная клетка представляет собой раковую клетку.
102. Способ по п.101, где указанная раковая клетка дополнительно подвергается лучевой терапии или воздействию химиотерапевтического агента.
103. Способ по п.101, где указанную раковую клетку выбирают из группы, состоящей из клетки рака молочной железы, клетки колоректального рака, клетки рака легких, клетки рака яичника, клетки рака центральной нервной системы, клетки рака печени, клетки рака мочевого пузыря, клетки рака поджелудочной железы, клетки рака шейки матки, клетки меланомы и лейкемической клетки.
104. Способ по п.103, где указанный белок в большей степени экспрессируется указанной раковой клеткой по сравнению с нормальной клеткой такого же тканевого происхождения.
105. Способ по п.89, который вызывает смерть указанной клетки.
106. Применение нуклеиновой кислоты по любому из пп.1-5 или 30 при получении лекарственного средства для терапевтического лечения или диагностического обнаружения рака.
107. Применение нуклеиновой кислоты по любому из пп.1-5 или 30 при получении лекарственного средства для лечения опухоли.
108. Применение нуклеиновой кислоты по любому из пп.1-5 или 30 при получении лекарственного средства для лечения или профилактики клеточного пролиферативного нарушения.
109. Применение экспрессионного вектора по любому из пп.6, 7 или 31 при получении лекарственного средства для терапевтического лечения или диагностического обнаружения рака.
110. Применение экспрессионного вектора по любому из пп.6, 7 или 31 при получении лекарственного средства для лечения опухоли.
111. Применение экспрессионного вектора по любому из пп.6, 7 или 31 при получении лекарственного средства для лечения или профилактики клеточного пролиферативного нарушения.
112. Применение клетки-хозяина по любому из пп.8, 9, 32 или 33 при получении лекарственного средства для терапевтического лечения или диагностического обнаружения рака.
113. Применение клетки-хозяина по любому из пп.8, 9, 32 или 33 при получении лекарственного средства для лечения опухоли.
114. Применение клетки-хозяина по любому из пп.8, 9, 32 или 33 при получении лекарственного средства для лечения или профилактики клеточного пролиферативного нарушения.
115. Применение полипептида по любому из пп.11-14 при получении лекарственного средства для терапевтического лечения или диагностического обнаружения рака.
116. Применение полипептида по любому из пп.11-14 при получении лекарственного средства для лечения опухоли.
117. Применение полипептида по любому из пп.11-14 при получении лекарственного средства для лечения или профилактики клеточного пролиферативного нарушения.
118. Применение антитела по любому из пп.15-29 при получении лекарственного средства для терапевтического лечения или диагностического обнаружения рака.
119. Применение антитела по любому из пп.15-29 при получении лекарственного средства для лечения опухоли.
120. Применение антитела по любому из пп.15-29 при получении лекарственного средства для лечения или профилактики клеточного пролиферативного нарушения.
121. Применение композиции веществ по любому из пп.35 или 36 при получении лекарственного средства для терапевтического лечения или диагностического обнаружения рака.
122. Применение композиции веществ по любому из пп.35 или 36 при получении лекарственного средства для лечения опухоли.
123. Применение композиции веществ по любому из пп.35 или 36 при получении лекарственного средства для лечения или профилактики клеточного пролиферативного нарушения.
124. Применение изделия по любому из пп.37 или 38 при получении лекарственного средства для терапевтического лечения или диагностического обнаружения рака.
125. Применение изделия по любому из пп.37 или 38 при получении лекарственного средства для лечения опухоли.
126. Применение изделия по любому из пп.37 или 38 при получении лекарственного средства для лечения или профилактики клеточного пролиферативного нарушения.
127. Способ ингибирования роста клетки, где рост указанной клетки является по меньшей мере отчасти зависимым от рост-потенцирующего эффекта белка, который по меньшей мере на 80% идентичен аминокислотной последовательности с (а) полипептидом, показанным как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, где указанный способ включает приведение в контакт указанного белка с антителом, которое связывается с указанным белком, посредством чего ингибируя рост указанной клетки.
128. Способ по п.127, где указанная клетка представляет собой раковую клетку.
129. Способ по п.127, где указанный белок экспрессируется указанной клеткой.
130. Способ по п.127, где связывание указанного антитела с указанным белком антагонизирует клеточную рост-потенцирующую активность указанного белка.
131. Способ по п.127, где связывание указанного антитела с указанным белком индуцирует смерть указанной клетки.
132. Способ по п.127, где указанное антитело представляет собой моноклональное антитело.
133. Способ по п.127, где указанное антитело представляет собой фрагмент антитела.
134. Способ по п.127, где указанное антитело представляет собой химерное или гуманизированное антитело.
135. Способ по п.127, где указанное антитело является конъюгированным с агентом, ингибирующим рост.
136. Способ по п.127, где указанное антитело является конъюгированным с цитотоксическим агентом.
137. Способ по п.136, где указанный цитотоксический агент выбирают из группы, состоящей из токсинов, антибиотиков, радиоактивных изотопов и нуклеолитических ферментов.
138. Способ по п.136, где цитотоксический агент представляет собой токсин.
139. Способ по п.138, где токсин выбирают из группы, состоящей из майтансиноида и калихеамицина.
140. Способ по п.138, где токсин представляет собой майтансиноид.
141. Способ по п.127, где указанное антитело продуцируется в бактериях.
142. Способ по п.127, где указанное антитело продуцируется в СНО клетках.
143. Способ по п.127, где указанный белок имеет (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
144. Способ терапевтического лечения опухоли у млекопитающего, где рост указанной опухоли является по меньшей мере частично зависимым от рост-потенцирующего эффекта белка, который по меньшей мере на 80% идентичен аминокислотной последовательности с (а) полипептидом, показанным как SEQ ID NO:2, (b) полипептидом, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (c) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, с его связанным сигнальным пептидом, (d) внеклеточным доменом полипептида, показанным как SEQ ID NO:2, без его связанного сигнального пептида, (e) полипептидом, кодируемым нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) полипептидом, кодируемым кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1, указанный способ, включающий приведение в контакт указанного белка с антителом, которое связывается с указанным белком, посредством чего эффективно излечивая указанную опухоль.
145. Способ по п.144, где указанный белок экспрессируется клетками указанной опухоли.
146. Способ по п.144, где связывание указанного антитела с указанным белком антагонизирует клеточную рост-потенцирующую активность указанного белка.
147. Способ по п.144, где указанное антитело представляет собой моноклональное антитело.
148. Способ по п.144, где указанное антитело представляет собой фрагмент антитела.
149. Способ по п.144, где указанное антитело представляет собой химерное или гуманизированное антитело.
150. Способ по п.144, где указанное антитело является конъюгированным с агентом, ингибирующим рост.
151. Способ по п.144, где указанное антитело является конъюгированным с цитотоксическим агентом.
152. Способ по п.151, где указанный цитотоксический агент выбирают из группы, состоящей из токсинов, антибиотиков, радиоактивных изотопов и нуклеолитических ферментов.
153. Способ по п.151, где цитотоксический агент представляет собой токсин.
154. Способ по п.153, где токсин выбирают из группы, состоящей из майтансиноида и калихеамицина.
155. Способ по п.153, где токсин представляет собой майтансиноид.
156. Способ по п.144, где указанное антитело продуцируется в бактериях.
157. Способ по п.144, где указанное антитело продуцируется в СНО клетках.
158. Способ по п.144, где указанный белок имеет (a) аминокислотную последовательность, показанную как SEQ ID NO:2, (b) аминокислотную последовательность, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (c) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, с последовательностью его связанного сигнального пептида, (d) аминокислотную последовательность внеклеточного домена полипептида, показанную как SEQ ID NO:2, без последовательности его связанного сигнального пептида, (e) аминокислотную последовательность, кодируемую нуклеотидной последовательностью, показанной как SEQ ID NO:1, или (f) аминокислотную последовательность, кодируемую кодирующей областью непроцессированной нуклеотидной последовательности, показанной как SEQ ID NO:1.
159. Выделенное антитело, которое связывается с таким же эпитопом, связанным с антителом по любому из пп.15-29.
160. Антитело по п.159, которое представляет собой моноклональное антитело.
161. Антитело по п.159, которое представляет собой фрагмент антитела.
162. Антитело по п.159, которое представляет собой химерное или гуманизированное антитело.
163. Антитело по п.159, которое является конъюгированным с агентом, ингибирующим рост.
164. Антитело по п.159, которое является конъюгированным с цитотоксическим агентом.
165. Антитело по п.164, где цитотоксический агент выбирают из группы, состоящей из токсинов, антибиотиков, радиоактивных изотопов и нуклеолитических ферментов.
166. Антитело по п.164, где цитотоксический агент представляет собой токсин.
167. Антитело по п.166, где токсин выбирают из группы, состоящей из майтансиноида и калихеамицина.
168. Антитело по п.166, где токсин представляет собой майтансиноид.
169. Антитело по п.159, которое продуцируется в бактериях.
170. Антитело по п.159, которое продуцируется в CHO клетках.
171. Антитело по п.159, которое индуцирует смерть клетки, с которой оно связывается.
172. Антитело по п.159, которое метят для обнаружения.
173. Антитело по п.159, которое содержит по меньшей мере одну из областей определения комплементарности любого антитела по пп.15-29.
174. Клетка гибридомы, которая продуцирует моноклональное антитело, которое связывается с полипептидом ТАТ.
175. Способ идентификации антитела, которое связывается с эпитопом, связанным с любым антителом по пп.15-29, указанный способ, включающий определение способности тестируемого антитела блокировать связывание любого антитела по пп.15-29, где способность указанного тестируемого антитела блокировать связывание указанного любого антитела по пп.15-29 с полипептидом ТАТ на по меньшей мере 40% и при равных концентрациях антитела указывает на то, что указанное тестируемое антитело обладает способностью к связыванию с эпитопом, связанным с указанным любым антителом по пп.15-29.
Еще дополнительные варианты осуществления настоящего изобретения будут очевидными для квалифицированного специалиста в данной области при прочтении настоящего описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 показывает нуклеотидную последовательность (SEQ ID NO:1) кДНК TAT211, где SEQ ID NO:1 является клоном, обозначенным в настоящей заявке как "ДНК219894".
Фигура 2 показывает аминокислотную последовательность (SEQ ID NO:2), являющуюся производной кодирующей последовательности SEQ ID NO:1, показанной на Фигуре 1.
Фигуры 3A-C показывают выравнивание в линейную цепь аминокислотных последовательностей вариабельных легких цепей для следующих: консенсусная последовательность подгруппы I человека (huKI; SEQ ID NO:3) с легкой цепью, мышиное 10H1 антитело против ТАТ211 (mu10H1-L; SEQ ID NO:4), привитое "гуманизированное" антитело 10H1 против ТАТ211 (10H1-графт; SEQ ID NO:5), и разнообразные другие "гуманизированные" антитела против ТАТ211 (SEQ ID NO:6-11).
Фигуры 4A-C показывают выравнивание в линейную цепь аминокислотных последовательностей вариабельных тяжелых цепей для следующих: консенсусная последовательность подгруппы III человека с тяжелой цепью (hum III; SEQ ID NO:12), мышиное антитело 10H1 против ТАТ211 (mu10H1-H; SEQ ID NO:13), привитое "гуманизированное" антитело 10H1 против ТАТ211 (10H1-графт; SEQ ID NO:14), и разнообразные другие "гуманизированные" антитела против ТАТ211 (SEQ ID NO: 15-20).
Фигура 5 показывает разнообразные CDR-L1 последовательности (SEQ ID NO:21-34) выбранных 10Н1-производных антител с созревшей аффинностью.
Фигура 6 показывает разнообразные CDR-L2 последовательности (SEQ ID NO:35-38) выбранных 10Н1-производных антител с созревшей аффинностью.
Фигура 7 показывает разнообразные CDR-L3 последовательности (SEQ ID NO:39-41) выбранных 10Н1-производных антител с созревшей аффинностью.
Фигура 8 показывает разнообразные CDR-H1 последовательности (SEQ ID NO:42-45) выбранных 10Н1-производных антител с созревшей аффинностью.
Фигура 9 показывает разнообразные CDR-H2 последовательности (SEQ ID NO:46-60) выбранных 10Н1-производных антител с созревшей аффинностью.
Фигура 10 показывает разнообразные CDR-H3 последовательности (SEQ ID NO:61-65) выбранных 10Н1-производных антител с созревшей аффинностью.
Фигура 11 показывает примерные акцепторные консенсусные каркасные последовательности человека для применения при практической реализации настоящего изобретения со следующими идентификаторами последовательностей: VH подгруппы I консенсусная каркасная человека минус CDR Кабата (SEQ ID NO:66), VH подгруппы I консенсусная каркасная человека минус расширенные гипервариабельные области (SEQ ID NO:67-69), VH подгруппы II консенсусная каркасная человека минус CDR Кабата (SEQ ID NO:70), VH подгруппы II консенсусная каркасная человека минус расширенные гипервариабельные области (SEQ ID NO:71-73), VH подгруппы III консенсусная каркасная человека минус CDR Кабата "L-вариант" (SEQ ID NO:74), и VH подгруппы III консенсусная каркасная человека минус CDR Кабата "F-вариант" (SEQ ID NO:75).
Фигура 12 показывает примерные акцепторные консенсусные каркасные последовательности человека для применения при практической реализации настоящего изобретения со следующими идентификаторами последовательностей: VL каппа подгруппы I консенсусная каркасная человека минус CDR Кабата (SEQ ID NO:76), VL каппа подгруппы II консенсусная каркасная человека минус CDR Кабата (SEQ ID NO:77), VL каппа подгруппы III консенсусная каркасная человека минус CDR Кабата (SEQ ID NO:78), и VL каппа подгруппы IV консенсусная каркасная человека минус CDR Кабата (SEQ ID NO: 79).
Фигура 13 показывает аминокислотную последовательность тяжелой цепи антитела 10H1.1.4B (SEQ ID NO:80).
Фигура 14 показывает аминокислотную последовательность легкой цепи антитела 10H1.1.4B (SEQ ID NO:81).
Фигура 15 показывает уничтожение in vitro клеток OVCAR-3 клетки (которые эндогенно экспрессируют полипептид ТАТ211 на клеточной поверхности) посредством обработки следующими ADC vc-MMAE конъюгированными антителами, 10H1.11 (♦), 10H1.11.1 (■), 10H1.11.2B (▲), 10H1.11.4B (●), 10H1.11.6B (X), 10H1-графт (o), против-человеческие gD ( | ), против-агглютинина пыльцы (□).
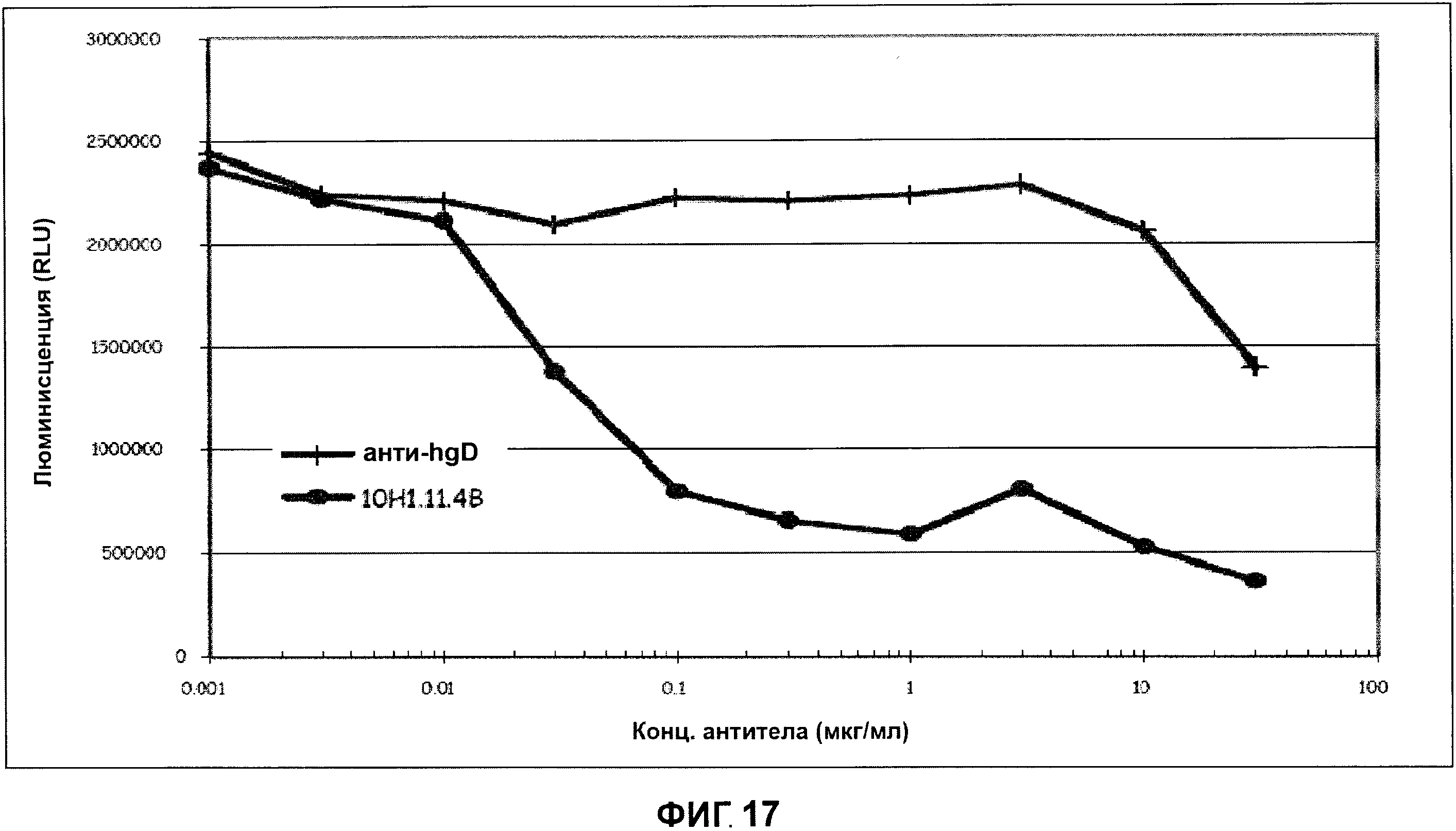
Фигура 16 показывает уничтожение in vitro 293 клеток (которые не экспрессируют полипептид ТАТ211 на клеточной поверхности) посредством обработки следующими ADC vc-MMAE конъюгированными антителами, 10H1.11.4B (●), или против-человеческими gD ( | ). Фигура 17 показывает уничтожение in vitro 293/TAT211 клеток (которые были созданы методом генной инженерии для экспрессии полипептида ТАТ 211 на клеточной поверхности) посредством обработки следующими ADC vc-MMAE конъюгированными антителами, 10H1.11.4B (●), или против-человеческими gD ( | ).
Фигура 18 показывает уничтожение in vivo опухолей OVCAR-3 в эксперименте с жировым слоем мышиной молочной железы со следующими ADC vc-MMAE конъюгированными антителами, только средой (□), 10H1.11 (♦), 10H1.11.1 (■), 10H1.11.2B (▲), 10H1.11.4B (●), 10H1.11.6B (+), и 10H1-графт (o).
Фигура 19 показывает уничтожение in vivo опухолей OVCAR-3 в эксперименте с жировым слоем мышиной молочной железы со следующими ADC vc-MMAE конъюгированными антителами, только средой (X), 10H1.11.4B при 3 мг/кг (■), 10H1.11.4B при 1 мг/кг (●), или неспецифичным против-gp120 контрольным антителом, которое не связывается с TAT211 (▲).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Термины "полипептид ТАТ" и "TAT", как используют в настоящей заявке и когда сразу сопровождаются числовым обозначением, относятся к разнообразным полипептидам, где полное обозначение (т.е. TAT/номер) относится к конкретным полипептидным последовательностям, как описано в настоящей заявке. Термины "TAT/номер полипептида" и "TAT/номер", где термин "номер" предоставлен как действительное числовое обозначение, как используют в настоящей заявке, охватывают нативные последовательности полипептидов, полипептидные варианты и фрагменты нативных последовательностей полипептидов и полипептидные варианты (которые далее определяются в настоящей заявке). Полипептиды ТАТ, описанные в настоящей заявке, могут быть выделены из разнообразных источников, таких как тканевые типы человека или еще один другой источник, или получены посредством рекомбинантных или синтетических способов. Термин "полипептид ТАТ" относится к каждому индивидуальному TAT/номер полипептиду, раскрытому в настоящей заявке. Все раскрытия в данном описании, которые относятся к "полипептиду ТАТ" относятся к каждому из полипептидов индивидуально, а также совместно. Например, описания их получения, очистки, получения производных, образования антител к ним или против, образования TAT-связывающих олигопептидов к ним или против, образования TAT-связывающих органических молекул к ним или против, их введения, композиций, содержащих их, лечения заболевания с их использованием и т.д. относятся к каждому полипептиду изобретения индивидуально. Термин "полипептид ТАТ" также включает варианты TAT/номер полипептидов, раскрытых в настоящей заявке. В одном варианте осуществления, полипептидная последовательность TAT211 показана как SEQ ID NO:2.
"Полипептид ТАТ с нативной последовательностью" включает полипептид, имеющий такую же аминокислотную последовательность, как и соответствующий полипептид ТАТ, полученный в природе. Такие полипептиды ТАТ с нативной последовательностью могут быть выделены из природных источников или могут быть продуцированы посредством рекомбинантных или синтетических средств. Термин "полипептид ТАТ с нативной последовательностью" конкретно охватывает встречающиеся в природе процессированные или секретируемые формы конкретного полипептида ТАТ (например, последовательности внеклеточного домена), встречающиеся в природе вариантные формы (например, альтернативно сплайсированные формы) и встречающиеся в природе аллельные варианты полипептида. В определенных вариантах осуществления изобретения, полипептиды ТАТ с нативной последовательностью, описанные в настоящей заявке, представляют собой зрелые или непроцессированные (с полной длиной) полипептиды с нативной последовательностью, содержащие аминокислотные последовательности с полной длиной, показанные на соответствующих фигурах. Стартовые и стоп-кодоны (если указаны) показаны жирным шрифтом и подчеркнуты на фигурах. Остатки нуклеиновой кислоты, указанные как "N" или "X" на соответствующих фигурах, являются любым остатком нуклеиновой кислоты. Однако, в то время как показано, что полипептиды ТАТ, раскрытые на соответствующих фигурах, начинаются с остатков метионина, обозначенных в настоящей заявке как аминокислотное положение 1 на фигурах, является понятным и возможным, что другие остатки метионина, расположенные либо вверх по направлению или вниз по направлению от аминокислотного положения 1 на фигурах, могут использоваться как исходный аминокислотный остаток для полипептидов ТАТ.
"Внеклеточный домен" полипептида ТАТ или "ECD" относится к форме полипептида ТАТ, которая по существу не содержит трансмембранных и цитоплазматических доменов. Обычно, ECD полипептида ТАТ будет составлять менее чем 1% от таких трансмембранных и/или цитоплазматических доменов и предпочтительно, будет составлять менее чем 0,5% от таких доменов. Будет понятным, что любые трансмембранные домены, идентифицированные для полипептидов ТАТ настоящего изобретения, идентифицированы в соответствии с критериями, традиционно используемыми в данной области для идентификации этого типа гидрофобного домена. Точные границы трансмембранного домена могут изменяться, но наиболее вероятно на не более чем приблизительно 5 аминокислот по обоим концам домена, как первоначально идентифицировано в настоящей заявке. Необязательно, следовательно, внеклеточный домен полипептида ТАТ может содержать от приблизительно 5 или менее аминокислот по обеим сторонам границы трансмембранного домена/внеклеточного домена, как идентифицировано в Примерах или описании, и такие полипептиды, со связанным сигнальным пептидом или без него, и нуклеиновая кислота, кодирующая их, предусмотрены настоящим изобретением.
Приблизительное расположение "сигнальных пептидов" разнообразных полипептидов ТАТ, раскрытых в настоящей заявке, может быть показано в настоящем описании и/или на соответствующих фигурах. Отмечают, однако, что C-концевая граница сигнального пептида может изменяться, но, наиболее вероятно, не более чем на приблизительно 5 аминокислот по обеим сторонам C-концевой границы сигнального пептида, как первоначально идентифицировано в настоящей заявке, где C-концевая граница сигнального пептида может быть идентифицирована в соответствии с критериями, традиционно используемыми в данной области для идентификации этого типа элемента аминокислотной последовательности (например, Nielsen et al., Prot. Eng. 10: 1-6 (1997) и von Heinje et al., Nucl. Acids. Res. 14:4683-4690 (1986)). Кроме того, также признают, что, в некоторых случаях, расщепление сигнальной последовательности из секретируемого полипептида не является полностью однородным, приводя в результате к более чем одному секретируемому виду. Эти зрелые полипептиды, где сигнальный пептид расщепляется в пределах не более чем приблизительно 5 аминокислот по обеим сторонам C-концевой границы сигнального пептида, как идентифицировано в настоящей заявке, и полинуклеотиды, кодирующие их, предусмотрены настоящим изобретением.
"Вариант полипептида ТАТ" означает полипептид ТАТ, предпочтительно, активный полипептид ТАТ, как определено в настоящей заявке, имеющий по меньшей мере приблизительно 80% идентичность аминокислотной последовательности с последовательностью полипептида ТАТ с непроцессированной нативной последовательностью, как описано в настоящей заявке, с последовательностью полипептида ТАТ без сигнального пептида, как описано в настоящей заявке, внеклеточным доменом полипептида ТАТ, с сигнальным пептидом или без него, как описано в настоящей заявке, или любым другим фрагментом последовательности непроцессированного полипептида ТАТ, как описано в настоящей заявке (такие как кодируемые нуклеиновой кислотой, которая представляет только часть полной кодирующей последовательности для полипептида ТАТ непроцессированный). Такие варианты полипептидов ТАТ включают, например, полипептиды ТАТ, где добавлены или удалены (подвергнуты делеции) один или более аминокислотных остатков, по N- или C-концу нативной аминокислотной последовательности непроцессированный. Обычно, вариант полипептида ТАТ будет иметь по меньшей мере приблизительно 80% идентичность аминокислотной последовательности, альтернативно по меньшей мере приблизительно 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%), 98% или 99% идентичность аминокислотной последовательности, с нативной последовательностью непроцессированной последовательности полипептида ТАТ, как описано в настоящей заявке, с последовательностью полипептида ТАТ без сигнального пептида, как описано в настоящей заявке, внеклеточным доменом полипептида ТАТ, с сигнальным пептидом или без него, как описано в настоящей заявке, или любым другим конкретно определенным фрагментом последовательности непроцессированного полипептида ТАТ, как описано в настоящей заявке. Обычно, вариантные полипептиды ТАТ составляют по меньшей мере приблизительно 10 аминокислот по длине, альтернативно по меньшей мере приблизительно 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600 аминокислот по длине или более. Необязательно, вариантные полипептиды ТАТ будут иметь не более чем одну консервативную замену аминокислоты по сравнению с последовательностью полипептида ТАТ, альтернативно не более чем 2, 3, 4, 5, 6, 7, 8, 9 или 10 консервативных замен аминокислот, по сравнению с нативной последовательностью полипептида ТАТ.
"Процент (%) идентичности аминокислотной последовательности" по отношению к последовательностям полипептида ТАТ, идентифицированного в настоящей заявке, определяют как процентное содержание аминокислотных остатков в кандидатной последовательности, которые являются идентичными аминокислотным остаткам в конкретной последовательности полипептида ТАТ, после выравнивания последовательностей и введения пробелов, если необходимо, для достижения максимального процента идентичности последовательности, и без учета любых консервативных замен как части идентичности последовательности. Выравнивание в линию с целью определения процента идентичности аминокислотной последовательности может достигаться разнообразными путями, которые находятся в пределах объема квалификации в области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Квалифицированные специалисты в области могут определить соответствующие параметры для измерения выравнивания в линию, включающие любые алгоритмы, необходимые для достижения максимального выравнивания в линию на протяжении непроцессированных сравниваемых последовательностей. Для целей данного изобретения в настоящей заявке, однако, значения % идентичности аминокислотной последовательности генерируют, используя компьютерную программу сравнения последовательностей ALIGN-2, где полный исходный текст для программы ALIGN-2 предоставлен в патенте США № 7160985, который включен в настоящую заявку посредством ссылки. Компьютерная программа сравнения последовательностей ALIGN-2 имеет авторские права от Genentech, Inc. и ее полный исходный текст был подан вместе с документацией пользователя в Бюро регистрации авторских прав США, Вашингтон, D.C., 20559, где он зарегистрирован под регистрационным номером TXU510087. Программа ALIGN-2 является общедоступной от Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть составлена по полному исходному тексту. Программа ALIGN-2 должна быть составлена для применения с операционной системой UNIX, предпочтительно, цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не изменяются.
В ситуациях, где ALIGN-2 используют для сравнений аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности А по отношению, с, или против данной аминокислотной последовательности B (которая может быть альтернативно перефразирована как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности по отношению, с, или против данной аминокислотной последовательности B) рассчитывают следующим образом:
100-кратная фракция X/Y,
где X является числом аминокислотных остатков, оцениваемых как идентичные совпадения посредством программы выравнивания в линию последовательностей ALIGN-2 в этом программном выравнивании в линию А и B, и где Y является полным числом аминокислотных остатков в B. Следует учитывать, что там, где длина аминокислотной последовательности А не является равной длине аминокислотной последовательности B, % идентичности аминокислотной последовательности А с B не будет равен % идентичности аминокислотной последовательности B с A.
"Полинуклеотид TAT варианта" или "последовательность нуклеиновой кислоты TAT варианта" означает молекулу нуклеиновой кислоты, которая кодирует полипептид ТАТ, предпочтительно, активный полипептид ТАТ, как определено в настоящей заявке, и, который имеет по меньшей мере приблизительно 80% идентичность последовательности нуклеиновой кислоты с последовательностью нуклеотидной кислоты, кодирующей последовательность непроцессированного полипептида ТАТ с нативной последовательностью, как описано в настоящей заявке, последовательность непроцессированного полипептида ТАТ с нативной последовательностью без сигнального пептида, как описано в настоящей заявке, внеклеточный домен полипептида ТАТ, с сигнальным пептидом или без него, как описано в настоящей заявке, или любой другой фрагмент последовательности непроцессированного полипептида ТАТ, как описано в настоящей заявке (такие как кодируемые нуклеиновой кислотой, которая представляет только часть полной кодирующей последовательности для непроцессированного полипептида ТАТ). Обычно, полинуклеотид TAT варианта будет иметь по меньшей мере приблизительно 80% идентичности последовательности нуклеиновой кислоты, альтернативно по меньшей мере приблизительно 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности нуклеиновой кислоты с последовательностью нуклеиновой кислоты, кодирующей последовательность непроцессированного полипептида ТАТ с нативной последовательностью, как описано в настоящей заявке, последовательность непроцессированного полипептида ТАТ с нативной последовательностью без сигнального пептида, как описано в настоящей заявке, внеклеточный домен полипептида ТАТ, с сигнальной последовательностью или без нее, как описано в настоящей заявке, или любой другой фрагмент непроцессированной последовательности полипептида ТАТ, как описано в настоящей заявке. Варианты не охватывают нативную нуклеотидную последовательность.
Обычно полинуклеотиды TAT вариантов составляют по меньшей мере приблизительно 5 нуклеотидов по длине, альтернативно по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 нуклеотидов по длине, где в данном контексте термин "приблизительно" означает сравниваемую длину нуклеотидной последовательности плюс или минус 10% от этой сравниваемой длины.
"Процент (%) идентичности последовательности нуклеиновой кислоты" по отношению к TAT-кодирующим последовательностям нуклеиновой кислоты, идентифицированным в настоящей заявке, определяют как процентное содержание нуклеотидов в кандидатной последовательности, которые являются идентичными нуклеотидам в последовательности TAT-нуклеиновой кислоты, представляющей интерес, после выравнивания последовательностей и введения пробелов, если необходимо, для достижения максимального процента идентичности последовательности. Выравнивание в линию с целью определения процента идентичности последовательности нуклеиновой кислоты может достигаться разнообразными путями, которые находятся в пределах объема квалификации в области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Для целей данного изобретения в настоящей заявке, однако, значения % идентичности аминокислотной последовательности генерируют, используя компьютерную программу сравнения последовательностей ALIGN-2, где полный исходный текст для программы ALIGN-2 предоставлен в патенте США № 7160985, который включен в настоящую заявку посредством ссылки. Компьютерная программа сравнения последовательностей ALIGN-2 имеет авторские права от Genentech, Inc. и ее полный исходный текст был подан вместе с документацией пользователя в Бюро регистрации авторских прав США, Вашингтон, D.C., 20559, где он зарегистрирован под регистрационным номером TXU510087. Программа ALIGN-2 является общедоступной от Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть составлена по полному исходному тексту. Программа ALIGN-2 должна быть составлена для применения с операционной системой UNIX, предпочтительно, цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не изменяются.
В ситуациях, где ALIGN-2 используют для сравнений последовательности нуклеиновой кислоты, % идентичности последовательности нуклеиновой кислоты данной последовательности нуклеиновой кислоты C по отношению к, с или против данной последовательности нуклеиновой кислоты D (которая альтернативно может быть перефразирована как данная последовательность нуклеиновой кислоты C, которая имеет или содержит определенный % идентичности последовательности нуклеиновой кислоты по отношению к, с или против данной последовательности нуклеиновой кислоты D) рассчитывают следующим образом:
100-кратная фракция W/Z
где W является числом нуклеотидов, оцениваемых как идентичные совпадения посредством программы выравнивания в линию последовательностей ALIGN-2 в этом программном выравнивании в линию C и D, и, где Z является общим числом нуклеотидов в D. Следует учитывать, что там, где длина последовательности нуклеиновой кислоты C не является равной длине последовательности нуклеиновой кислоты D, % идентичности последовательности нуклеиновой кислоты C с D не будет равен % идентичности последовательности нуклеиновой кислоты D с C.
В других вариантах осуществления, полинуклеотиды TAT варианта представляют собой молекулы нуклеиновой кислоты, которые кодируют полипептид ТАТ и которые являются способными к гибридизации, предпочтительно, при условиях строгой гибридизации и промывки, с нуклеотидными последовательностями, кодирующими непроцессированный полипептид ТАТ, как описано в настоящей заявке. Полипептиды TAT варианта могут являться полипептидами, которые кодируются полинуклеотидом TAT варианта.
Термин "непроцессированная кодирующая область", когда используется по отношению к нуклеиновой кислоте, кодирующей полипептид ТАТ, относится к последовательности нуклеотидов, которая кодирует непроцессированный полипептид ТАТ изобретения (который часто показывают между стартовыми и стоп-кодонами, включая их, на соответствующих фигурах). Термин "непроцессированная кодирующая область", когда используется по отношению к нуклеиновой кислоте, депонированной в ATCC, относится к полипептид ТАТ-кодирующей части кДНК, которую вводят в вектор, депонированный вместе с ATCC (который часто показывают между стартовыми и стоп-кодонами, включая их, на соответствующих фигурах).
"Выделенный", когда используют для описания разнообразных полипептидов ТАТ, раскрытых в настоящей заявке, означает полипептид, который был идентифицирован и выделен и/или извлечен из компонента его природного окружения. Загрязняющие компоненты его природного окружения представляют собой вещества, которые обычно оказывают влияния при диагностических или терапевтических применениях полипептида, и могут включать ферменты, гормоны, и другие белковые или небелковые растворимые вещества. В предпочтительных вариантах осуществления, полипептид будет очищен (1) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности посредством применения секвенатора с вращающимся стаканом, или (2) до гомогенности посредством SDS-PAGE при невосстанавливающих или восстанавливающих условиях, используя Кумасси синий или, предпочтительно, серебряный краситель. Выделенный полипептид включает полипептид in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент природного окружения полипептида ТАТ не будет присутствовать. Обычно, однако, выделенный полипептид будет получен посредством по меньшей мере одной стадии очистки.
"Выделенная" полипептид ТАТ-кодирующая нуклеиновая кислота или другая полипептид-кодирующая нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, которую идентифицируют и отделяют от по меньшей мере одной контаминантной молекулы нуклеиновой кислоты, с которой она обычно связана в природном источнике полипептид-кодирующей нуклеиновой кислоты. Выделенная полипептид-кодирующая молекула нуклеиновой кислоты отличается по форме или характеристикам, с которыми ее обнаруживают в природе. Выделенные полипептид-кодирующие молекулы нуклеиновой кислоты, следовательно, различаются от конкретной полипептид-кодирующей молекулы нуклеиновой кислоты, как она существует в природных клетках. Однако выделенная полипептид-кодирующая молекула нуклеиновой кислоты включает полипептид-кодирующую молекулу нуклеиновой кислоты, содержащуюся в клетках, которая обычно экспрессируют полипептид, где, например, молекула нуклеиновой кислоты находится в хромосомном расположении, отличном от расположения в природных клетках.
Термин "контрольные последовательности" относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Контрольные последовательности, которые являются пригодными для прокариотов, например, включают промотор, необязательно операторную последовательность, и участок связывания рибосомы. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является "функционально связанной", когда ее помещают в функциональное взаимодействие с еще одной другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или секреторного лидера функционально связывают с ДНК для полипептида, если он экспрессируется как белок-предшественник, который участвует в секреции полипептида; промотор или энхансер является функционально связанным с кодирующей последовательностью, если он оказывает воздействие на транскрипцию последовательности; или участок связывания рибосомы является функционально связанным с кодирующей последовательностью, если он расположен таким образом, чтобы облегчить трансляцию. В целом, "функционально связанные" означает, что последовательности ДНК будучи связанными являются перекрывающимися, и, в случае секреторного лидера, перекрывающимися и в фазе считывания. Однако энхансеры не должны быть перекрывающимися. Связывание завершается лигированием по удобным рестрикционным сайтам. Если такие сайты не существуют, применяют синтетические олигонуклеотидные адапторы или линкеры в соответствии с общепринятой практикой.
"Строгость" реакций гибридизаций легко определяется рядовым специалистом в данной области и, как правило, является эмпирическим расчетом, зависимым от длины зонда, температуры промывки и концентрации соли. В целом, более длинные зонды требуют более высоких температур для нужной ренатурации, в то время как более короткие зонды нуждаются в более низких температурах. Гибридизация в целом зависит от способности денатурированной ДНК к вторичной ренатурации, когда комплементарные нити присутствуют в окружении ниже их температуры плавления. Чем выше степень желательной гомологии между зондом и гибридизируемой последовательностью, тем выше относительная температура, которая может применяться. В результате следует, что более высокие относительные температуры будут иметь тенденцию сделать условия реакции более строгими, в то время как более низкие температуры менее строгими. Для дополнительных подробностей и объяснения строгости реакций гибридизации, см. Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995).
"Строгие условия" или "условия высокой строгости", как определено в настоящей заявке, могут быть идентифицированы как такие условия, при которых: (1) используют низкую ионную силу и высокую температуру для промывки, например 0,015 M хлорид натрия/0,0015 M цитрат натрия/0,1% додецилсульфат натрия при 50°C; (2) используют во время гибридизации денатурирующий агент, такой как формамид, например, 50% (об/об) формамид с 0,1% альбумин бычьей сыворотки/0,1% Фиколл/0,1% поливинилпирролидон/буфер 50 мМ фосфат натрия при pH 6,5 с 750 мМ хлоридом натрия, 75 мМ цитрат натрия при 42°C; или (3) используют гибридизацию в течение ночи в растворе, в котором используют 50% формамид, 5 × SSC (0,75 M NaCl, 0,075 M цитрат натрия), 50 мМ фосфат натрия (pH 6,8), 0,1% пирофосфат натрия, 5 × раствор Денхардта, озвученную ДНК спермы лосося (50 мкг/мл), 0,1% SDS, и 10% декстрансульфата при 42°C, с 10 минутной промывкой при 42°C в 0,2 × SSC (хлорид натрия/цитрат натрия) с последующей 10 минутной промывкой в строгих условиях, состоящей из 0,1 × SSC, содержащей ЭДТА при 55°C.
"Умеренно строгие условия" могут быть идентифицированы, как описано у Sambrook et al., Molecular Cloning: Laboratory Manual, New York: Cold Spring Harbor Press, 1989, и включают применение промывочного раствора и условий гибридизации (например, температуры, ионной силы и % SDS) менее строгих, чем условия, описанные выше. Пример умеренно строгих условий представляет собой инкубацию в течение ночи при 37°C в растворе, содержащем: 20% формамид, 5 × SSC (150 мМ NaCl, 15 мМ цитрат тринатрия), 50 мМ фосфат натрия (pH 7,6), 5 × раствор Денхардта, 10% декстрансульфат, и 20 мг/мл денатурированной деформированной ДНК спермы лосося, с последующей промывкой фильтров в 1 × SSC при приблизительно 37-50°C. Квалифицированный специалист в области сможет понять, как регулировать температуру, ионную силу, и т.д. по необходимости для аккомодации факторов, таких как длина зонда и т.п.
Термин "маркированный эпитопом", когда используют в настоящей заявке, относится к химерному полипептиду, содержащему полипептид ТАТ или антитело против ТАТ, рекомбинированное с "маркерным полипептидом". Маркерный полипептид имеет достаточно остатков, чтобы предоставить эпитоп, против которого может быть получено антитело, все еще достаточно короткий, чтобы не оказывать воздействие на активность полипептида, с которым он слит. Маркерный полипептид, предпочтительно, также является вполне уникальным, таким образом, что антитело по существу не реагирует перекрестно с другими эпитопами. Подходящие маркерные полипептиды, как правило, имеют по меньшей мере шесть аминокислотных остатков и обычно между приблизительно 8 и 50 аминокислотными остатками (предпочтительно, между приблизительно 10 и 20 аминокислотными остатками).
"Активный" или "активность" для целей данного изобретения относится к форме (формам) полипептида ТАТ, который сохраняет биологическую и/или иммунологическую активность нативного или встречающегося в природе TAT, где "биологическая" активность относится к биологической функции (либо ингибиторной или стимуляторной), вызываемой нативным или встречающимся в природе TAT, отличной от способности индуцировать продуцирование антител против антигенного эпитопа, которым обладает нативный или встречающийся в природе TAT, а "иммунологическая" активность относится к способности индуцировать продуцирование антитела против антигенного эпитопа, которым обладает нативный или встречающийся в природе TAT.
Термин "антагонист" применяют в самом широком смысле, и включает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность нативного полипептида ТАТ, раскрытого в настоящей заявке. Аналогичным образом, термин "агонист" применяют в самом широком смысле, и включает любую молекулу, которая имитирует биологическую активность нативного полипептида ТАТ, раскрытого в настоящей заявке. Подходящие молекулы агониста или антагониста конкретно включают агонистическое или антагонистическое антитела или фрагменты антител, фрагменты или аминокислотную последовательность вариантов нативных полипептидов ТАТ, пептиды, антисмысловые олигонуклеотиды, малые органические молекулы и т.д. Способы идентификации агонистов или антагонистов полипептида ТАТ могут включать приведение в контакт полипептида ТАТ с кандидатной молекулой агониста или антагониста и измерение обнаруживаемого изменения одной или более биологических активностей, обычно ассоциируемых с полипептидом ТАТ.
"Излечение", или "лечение", или "смягчение" относится как к терапевтическому лечению, так и профилактическим или предупредительным мерам, где цель состоит в предотвращении или замедлении (снижении) целевого патологического состояния или нарушения. Нуждающиеся в лечении включают тех, которые уже имеют нарушение, а также имеющих склонность к заболеванию или тех, у которых нарушение должно предотвращаться. Субъекта или млекопитающего считают успешно "вылеченными" от полипептид ТАТ-экспрессирующего рака, после получения терапевтического количества антитела против ТАТ, TAT-связывающего олигопептида или TAT-связывающей органической молекулы в соответствии со способами настоящего изобретения, пациент показывает наблюдаемое и/или измеряемое снижение или отсутствие одного или нескольких из следующих: снижения количества раковых клеток или отсутствия раковых клеток; снижения размера опухоли; ингибирования (т.е. замедления в некоторой степени и, предпочтительно, остановки) инфильтрации раковых клеток в периферические органы, включающей распространение рака в мягкие ткани и кости; ингибирования (т.е. замедления в некоторой степени и, предпочтительно, остановки) опухолевых метастазов; ингибирования, в некоторой степени, опухолевого роста; и/или смягчения в некоторой степени, одного или более из симптомов, связанных с конкретным раком; сниженную заболеваемость и смертность, и улучшение качества жизненных показателей. В той степени, в которой антитело против ТАТ или ТАТ-связывающий олигопептид могут предотвращать рост и/или уничтожать существующие раковые клетки, они могут быть цитостатическими и/или цитотоксическими. Снижение этих признаков или симптомов могут также ощущаться пациентом.
Указанные выше параметры для оценки успешного лечения и улучшения состояния заболевания являются легко измеряемыми посредством обычных методик, известных терапевту. Для лечения рака, эффективность может быть измерена, например, посредством оценки времени до развития заболевания (TTP) и/или определения степени отклика (RR). Метастазы могут определяться посредством стадийных тестов и сканирования костных тканей, и тестов на уровень кальция и других ферментов для определения распространения в костную ткань. КТ-сканирования могут также проводиться для поиска распространения в области таза и лимфатических узлов. Рентгеновские исследования грудной клетки и измерение уровней ферментов печени известными способами применяют для поиска метастазов в легких и печени, соответственно. Другие традиционные методы для мониторинга заболевания включают трансректальную ультразвуковую эхографию (TRUS) и трансректальную игольную биопсию (TRNB).
"Постоянное" введение относится к введению агента(агентов) в непрерывном режиме в противоположность острому режиму, таким образом, чтобы поддерживать первоначальный терапевтический эффект (активность) в течение продолжительного периода времени. "Дробное" введение представляет собой лечение, не проводится без прерывания, но в большей степени является циклическим по природе.
"Млекопитающее" для целей лечения, облегчения симптомов или диагностики рака относится к любому животному, классифицируемому как млекопитающее, включая людей, домашних и сельскохозяйственных животных, и животных в зоопарках, спортивных или домашних животных, таких как собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи, козы, кролики и т.д. Предпочтительно, млекопитающее является человеком.
Введение "в комбинации с" одним или более дополнительными терапевтическими агентами включает одновременное (сопутствующее) и последовательное введение в любом порядке.
"Носители", как используют в настоящей заявке, включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергаемых их воздействию при используемых дозировках и концентрациях. Часто физиологически приемлемый носитель представляет собой водный pH-забуференный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту; низкомолекулярный (менее чем приблизительно 10 остатков) полипептид; белки, такие как альбумин сыворотки, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; спиртосахара, такие как маннитол или сорбитол; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как TWEEN®, полиэтиленгликоль (PEG) и PLURONICS®.
"Твердая фаза" или "твердый носитель" обозначает неводную матрицу, к которой антитело, ТАТ-связывающий олигопептид или ТАТ-связывающая органическая молекула настоящего изобретения могут прилипать или присоединяться. Примеры твердых фаз, охватываемых в настоящей заявке, включают фазы, образованные частично или полностью из стекла (например, стекла с контролируемым размером пор), полисахариды (например, агарозу), полиакриламиды, полистирол, поливиниловый спирт и силиконы. В определенных вариантах осуществления, в зависимости от контекста, твердая фаза может содержать лунку аналитической плашки; в других представляет собой колонку для очистки (например, колонку для аффинной хроматографии). Этот термин также включает прерывистую твердую фазу из дискретных частиц, такую как те, что описаны в патенте США № 4275149.
"Липосома" представляет собой небольшой пузырек, составленный из разнообразных типов липидов, фосфолипидов и/или поверхностно-активного вещества, которое является применимым для доставки лекарственного средства (такого как полипептид ТАТ, антитело к нему или ТАТ-связывающий олигопептид) млекопитающему. Компоненты липосомы обычно расположены в двухслойном образовании, сходным с расположением липидов биологических мембран.
В настоящей заявке определено, что "малая" молекула или "малая" органическая молекула имеют молекулярную массу ниже приблизительно 500 Дальтонов.
"Эффективное количество" полипептида, антитела, ТАТ-связывающего олигопептида, ТАТ-связывающей органической молекулы или ее агониста или антагониста, как описано в настоящей заявке, представляет собой количество, достаточное для осуществления конкретно установленной цели. "Эффективное количество" может быть определено эмпирически и традиционным образом, по отношению к установленной цели.
Термин "терапевтически эффективное количество" относится к количеству антитела, полипептида, ТАТ-связывающего олигопептида, ТАТ-связывающей органической молекулы или другого лекарственного средства, эффективного, чтобы "лечить" заболевание или нарушение у субъекта или млекопитающего. В случае рака, терапевтически эффективное количество лекарственного средства может снижать количество раковых клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять до некоторой степени и, предпочтительно, останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. замедлять до некоторой степени и, предпочтительно, останавливать метастазы опухоли; ингибировать, до некоторой степени рост опухоли; и/или облегчать до некоторой степени один или более из симптомов, связанных с раком. См. определение, данное в настоящей заявке "излечению". В той степени, которой лекарственное средство может предотвращать рост и/или уничтожать существующие раковые клетки, оно может являться цитостатическим и/или цитотоксическим.
"Ингибирующее рост количество" антитела против ТАТ, полипептида ТАТ, ТАТ-связывающего олигопептида или ТАТ-связывающей органической молекулы представляет собой количество, способное к ингибированию роста клетки, особенно, опухолевой, например, раковой клетки, либо in vitro или in vivo. "Ингибирующее рост количество" антитела против ТАТ, полипептида ТАТ, ТАТ-связывающего олигопептида или ТАТ-связывающей органической молекулы с целью ингибирования роста неопластической клетки может быть определено эмпирически и традиционным образом.
"Цитотоксическое количество" антитела против ТАТ, полипептида ТАТ, ТАТ-связывающего олигопептида или ТАТ-связывающей органической молекулы представляет собой количество, способное вызывать деструкцию клетки, особенно опухолевой, например, раковой клетки, либо in vitro или in vivo. "Цитотоксическое количество" антитела против ТАТ, полипептида ТАТ, ТАТ-связывающего олигопептида или ТАТ-связывающей органической молекулы с целью ингибирования роста неопластической клетки может быть определено эмпирически и традиционным образом.
Термин "антитело" применяют в самом широком смысле, и он конкретно охватывает, например, единичные против ТАТ моноклональные антитела (включающие агонистические, антагонистические, и нейтрализующие антитела), композиции антитела против ТАТ с полиэпитопной специфичностью, поликлональные антитела, одноцепочечные антитела против ТАТ, и фрагменты антител против ТАТ (см. ниже), поскольку они проявляют желательную биологическую или иммунологическую активность. Термин "иммуноглобулин" (Ig) применяют в настоящей заявке взаимозаменяемо с антителом.
"Выделенное антитело" представляет собой антитело, которое было идентифицировано и отделено и/или извлечено из компонента его природного окружения. Загрязняющие компоненты его природного окружения представляют собой вещества, которые обычно оказывают влияние при диагностических или терапевтических применениях антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворимые вещества. В предпочтительных вариантах осуществления, антитело будет очищено (1) до более чем 95% масс. антитела, как определяют по методу Лоури, и наиболее предпочтительно, более чем 99% масс., (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности посредством применения секвенатора с вращающимся стаканом, или (3) до гомогенности посредством SDS-PAGE при невосстанавливающих или восстанавливающих условиях, используя Кумасси синий или, предпочтительно, серебряный краситель. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент природного окружения антитела не будет присутствовать. Обычно, однако, выделенное антитело будет получено посредством по меньшей мере одной стадии очистки.
Базовая единица 4-цепочечного антитела представляет собой гетеротетрамерный гликопротеин, составленный из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей (IgM антитело состоит из 5 базовых гетеротетрамерных единиц наряду с дополнительным полипептидом, именуемым J цепь, и, следовательно, содержит 10 антиген-связывающих участков, в то время как секретируемые IgA антитела могут полимеризоваться с образованием поливалентных агрегатов, содержащих 2-5 базовых 4-цепочечных единиц, наряду с J цепью). В случае IgG, 4-цепочечная единица составляет, как правило, приблизительно 150000 Дальтонов. Каждая L цепь связана с Н цепью посредством одной ковалентной дисульфидной связи, в то время как две Н цепи связаны друг с другом посредством одной или более дисульфидных связей в зависимости от изотипа Н цепи. Каждая Н и L цепь также имеет внутрицепочечные дисульфидные мостики с регулярными интервалами. Каждая Н цепь имеет N-конец, вариабельный домен (VH) с последующими тремя константными доменами (CH) для каждой из α и γ цепей и четырьмя CH доменами для μ и ε изотипов. Каждая L цепь имеет N-конец, вариабельный домен (VL) с последующим константным доменом (CL) по ее другому концу. VL выравнен с VH, и CL выравнен с первым константным доменом тяжелой цепи (CH1). Полагают, что конкретные аминокислотные остатки образуют границу раздела фаз между вариабельными доменами с легкой цепью и с тяжелой цепью. Образование пары VH и VL вместе образует единичный антиген-связывающий участок. По структуре и свойствам различных классов антител, см., например, Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Trictram G. Parslow (eds.), Appleton & Lange, Hopwalk, CT, 1994, page 71 and Chapter 6.
L цепь от любого вида позвоночных может быть отнесена к одному из двух четко различимых типов, именуемых каппа и лямбда, на основании аминокислотных последовательностей их константных доменов. В зависимости от аминокислотной последовательности их константных доменов с тяжелой цепью (CH), иммуноглобулины могут быть отнесены к различным классам или изотипам. Существуют пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющие тяжелые цепи, обозначенные α, δ, ε, γ и μ, соответственно. γ и α классы дополнительно разделены на подклассы на основании относительно минорных различий в CH последовательности и функции, например, люди экспрессируют следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Термин "вариабельный" относится к тому факту, что некоторые сегменты вариабельных доменов отличаются по последовательности между антителами. V домен опосредует связывание антигена и определяет специфичность конкретного антитела для его конкретного антигена. Однако вариабельность не однородно распределена на протяжении 110-аминокислотной протяженности вариабельных доменов. Вместо этого, V области состоят из относительно инвариантных участков, именуемых каркасными областями (FR) из 15-30 аминокислот, разделенных более короткими областями крайней вариабельности, именуемых "гипервариабельными областями", которые имеют каждая 9-12 аминокислот по длине. Вариабельные домены нативных тяжелых и легких цепей каждый содержит четыре FR, в основном принимающих β-листовую конфигурацию, соединенных посредством трех гипервариабельных областей, которые образуют петли, соединяющие, и в некоторых случаях образующие часть, структуры β-листа. Гипервариабельные области в каждой цепи удерживаются вместе в тесной близости посредством FR и, вместе с гипервариабельными областями от другой цепи, способствуют образованию антиген-связывающего участка антитела (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes Health, Bethesda, MD. (1991)). Константные домены не являются включенными непосредственно в связывание антитела с антигеном, но проявляют разнообразные эффекторные функции, такие как участие антитела в зависимой от антитела клеточной цитотоксичности (ADCC).
Термин "моноклональное антитело" как используют в настоящей заявке, относится к антителу, полученному от популяции по существу гомогенных антител, т.е. индивидуальные антитела, содержащиеся в популяции, являются идентичными за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против единичного антигенного участка. Кроме того, в противоположность препаратам поликлональных антител, которые включают различные антитела, направленные против различных детерминантов (эпитопов), каждое моноклональное антитело направлено против единичного детерминанта на антигене. В дополнение к их специфичности, моноклональные антитела являются преимущественными в том, что они могут быть синтезированы незагрязненными другими антителами. Определение "моноклональный" не подразумевается как требующее продуцирование антитела посредством любого конкретного способа. Например, моноклональные антитела, применимые в настоящем изобретении, могут быть получены посредством гибридомной методологии, впервые описанной Kohler et al., Nature, 256:495 (1975), или могут быть получены с использованием методов с рекомбинантной ДНК в бактериальных, эукариотических животных или растительных клетках (см., например, патент США № 4816567). "Моноклональные антитела" могут также быть выделены из библиотек фаговых антител, с использованием методов, описанных, например, у Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol, 222:581-597 (1991).
Моноклональные антитела в настоящей заявке включают "химерные" антитела, в которых часть тяжелой и/или легкой цепи является идентичной с или гомологичной соответствующим последовательностям в антителах, производных от конкретных видов или принадлежащих конкретному классу или подклассу антитела, в то время как оставшаяся часть цепи (цепей) является идентичной с или гомологичной соответствующим последовательностям в антителах, производных от еще одного другого вида или принадлежащих к еще одному другому классу или подклассу антител, а также фрагменты таких антител, поскольку они проявляют желательную биологическую активность (см. патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). Химерные антитела, представляющие интерес, в настоящей заявке включают "приматизированные" антитела, содержащие вариабельный домен антиген-связывающих последовательностей, производных от нечеловеческого примата (например, обезьяны Старого Света, примата и т.д.), и константную область последовательностей человека.
"Интактное" антитело представляет собой антитело, которое содержит антиген-связывающий участок, а также CL и по меньшей мере константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой константные домены нативной последовательности (например, константные домены нативной последовательности человека) или их вариант аминокислотной последовательности. Предпочтительно, интактное антитело имеет одну или более эффекторных функций.
"Фрагменты антитела" содержат часть интактного антитела, предпочтительно, антиген-связывающую или вариабельную область интактного антитела. Примеры фрагментов антитела включают Fab, Fab', F(ab')2, и Fv фрагменты; диатела; линейные антитела (см. патент США № 5641870, Пример 2; Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]); молекулы антител с единственной цепью; и мультиспецифичные антитела, образованные из фрагментов антител.
Расщепление антител папаином продуцирует два идентичных антиген-связывающих фрагмента, именуемых "Fab" фрагменты, и остаточный "Fc" фрагмент, обозначение, отражающее способность легко кристаллизоваться. Fab фрагмент состоит из полной L цепи наряду с доменом вариабельной области Н цепи (VH), и первый константный домен одной тяжелой цепи (CH1). Каждый Fab фрагмент является моновалентным по отношению к связыванию антигена, т.е. он имеет единичный антиген-связывающий участок. Обработка антитела пепсином дает на выходе единичный крупный F(ab')2 фрагмент, который приблизительно соответствует двум дисульфидно связанным Fab фрагментам, имеющим дивалентную антиген-связывающую активность, и все еще способным к сшивке с антигеном. Fab' фрагменты отличаются от Fab фрагментов тем, что имеют дополнительные несколько остатков по карбокси-концу домена CH1, включающего один или более цистеинов шарнирной области антитела. Fab'-SH представляет собой обозначение, данное в настоящей заявке для Fab', в котором цистеиновые остаток(остатки) константных доменов несут свободную тиольную группу. F(ab')2 фрагменты антител изначально были получены как пары Fab' фрагментов, которые имеют шарнирные цистеины между ними. Известны также другие химические сочетания фрагментов антител.
Fc фрагмент содержит карбокси-концевые части обеих Н цепей, удерживаемых вместе посредством дисульфидов. Эффекторные функции антител определяются последовательностями в Fc-области, которая также представляет собой часть, распознаваемую Fc рецепторами (FcR), обнаруженными на некоторых типах клеток.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антиген-распознающий и -связывающий участок. Этот фрагмент состоит из димера одного с тяжелой цепью и одного с легкой цепью доменов вариабельной области в плотной, нековалентной ассоциации. От изгибов этих двух доменов происходит образование шести гипервариабельных петель (3 петли от каждой из Н и L цепей), что способствует связыванию антигена аминокислотными остатками и придает специфичность связыванию антигена с антителом. Однако даже единичный вариабельный домен (или половина Fv, содержащая только три CDR, специфичные для антигена) обладает способностью к распознаванию и связыванию антигена, хотя при более низком сродстве, чем для полного участка связывания.
"Единично-цепочечные Fv", также сокращаемые как "sFv" или "scFv", представляют собой фрагменты антител, которые содержат VH и VL домены антител, соединенные в единичную полипептидную цепь. Предпочтительно, sFv полипептид дополнительно содержит полипептидный линкер между VH и VL доменами, который позволяет sFv образовывать желательные структуры для связывания антигена. Обзор по sFv, см. Pluckthun in Pharmacology Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrebaeck 1995, ниже.
Термин "диатела" относится к небольшим фрагментам антител, полученных посредством сборки sFv фрагментов (см. предыдущий параграф) с короткими линкерами (приблизительно 5-10 остатков) между VH и VL доменами, таким образом, что достигается межцепочечное, но не внутрицепочечное спаривание V доменов, что приводит в результате к бивалентному фрагменту, т.е. фрагменту, имеющему два антиген-связывающих участка. Биспецифичные диатела представляют собой гетеродимеры двух "перекрестных" sFv фрагментов, в которых VH и VL домены двух антител присутствуют на различных полипептидных цепях. Диатела описаны более полно в, например, EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
"Гуманизированные" формы нечеловеческих антител (например, грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, производную от нечеловеческого антитела. Большей частью, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены на остатки из гипервариабельной области нечеловеческих видов (донорное антитело), таких как мыши, крысы, кролики или приматы, не являющихся человеком, имеющей специфичность, сродство и способность желательного антитела. В некоторых случаях, остатки каркасной области (FR) иммуноглобулина человека заменены на соответствующие нечеловеческие остатки. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в реципиентном антителе или в донорном антителе. Эти модификации проделывают, чтобы дополнительно улучшить эффективность действия антитела. Как правило, гуманизированное антитело будет содержать по существу все из по меньшей мере одного, и обычно двух, вариабельных доменов, в которых все или по существу все из гипервариабельных петель соответствуют петлям нечеловеческого иммуноглобулина, и все или по существу все из FR представляют собой FR последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), обычно из иммуноглобулина человека. Дополнительные подробности, см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
"Видозависимое антитело", например, антитело млекопитающего против IgE человека, представляет собой антитело, которое имеет более высокое сродство к связыванию для антигена от первого вида млекопитающего, чем оно имеет для гомолога этого антигена от второго вида млекопитающего. Обычно, видозависимое антитело "связывается специфически" с антигеном человека (т.е. имеет значение сродства к связыванию (Kd), равное не более чем приблизительно 1 × 10-7 M, предпочтительно, не более чем приблизительно 1 × 10-8, и, наиболее предпочтительно, не более чем приблизительно 1 × 10-9 M), но имеет сродство связывания для гомолога антигена от второго нечеловеческого вида млекопитающего, которое по меньшей мере приблизительно в 50 раз, или по меньшей мере приблизительно в 500 раз, или по меньшей мере приблизительно в 1000 раз, слабее, чем его сродство связывания для антигена человека. Видозависимое антитело может представлять собой любой из разнообразных типов антител, как определено выше, но, предпочтительно, является гуманизированным антителом или антителом человека.
Термин "нумерация остатков вариабельного домена по Кабату" или "нумерация аминокислотного положения по Кабату", и их вариации, относится к системе нумерации, используемой для вариабельных доменов с тяжелой цепью или вариабельных доменов с легкой цепью из компиляции антител в Kabat et al., Sequences Proteins Immunological Interest, 5th Ed. Public Health Service, National Institutes Health, Bethesda, MD. (1991). С использованием этой системы нумерации, действительная линейная аминокислотная последовательность может содержать меньшее количество или дополнительные аминокислоты, соответствующие укорочению, или введению в, FR или CDR вариабельного домена. Например, вариабельный домен с тяжелой цепью может включать единичную аминокислотную вставку (остаток 52a в соответствии с Кабат) после остатка 52 из H2 и введенные остатки (например, остатки 82a, 82b и 82c и т.д., в соответствии с Кабат) после остатка с тяжелой цепью FR 82. Нумерация остатков по Кабат может быть определена для данного антитела посредством выравнивания в линию в областях гомологии последовательности антитела со "стандартной" пронумерованной по Кабат последовательности.
Фраза "по существу сходные" или "по существу такие же", как используют в настоящей заявке, обозначает достаточно высокую степень сходства между двумя числовыми значениями (обычно, одним, связанным с антителом изобретения, и другим, связанным с референтным/для сравнения антителом) таким образом, что квалифицированный специалист в области будет считать различие между двумя значениями маленьким или не имеющим биологической и/или статистической значимости в пределах контекста биологической характеристики, измеренной по указанным значениям (например, значениям Kd). Различие между указанными двумя значениями, предпочтительно, составляет меньше чем приблизительно 50%, предпочтительно, меньше чем приблизительно 40%, предпочтительно, меньше чем приблизительно 30%, предпочтительно, меньше чем приблизительно 20%, предпочтительно, меньше чем приблизительно 10% как функция значения для референтного/для сравнения антитела.
"Сродство связывания", в целом, относится к прочности общей суммы нековалентных взаимодействий между единичным участком связывания молекулы (например, антитела) и его партнером связывания (например, антигеном). Если не указано иначе, как используют в настоящей заявке, "сродство связывания" относится к характеристическому сродству связывания, которое отражает 1:1 взаимодействие между элементами пары связывания (например, антитела и антигена). Сродство молекулы X к ее партнеру Y может, в целом, представлено посредством константы диссоциации (Kd). Сродство может быть измерено посредством общепринятых способов, известных в данной области, включающих способы, описанные в настоящей заявке. Низкоаффинные антитела, как правило, связывают антиген медленно и имеют тенденцию легко диссоциировать, в то время как высокоаффинные антитела, как правило, связывают антиген быстрее и имеют тенденцию оставаться связанными дольше. Разнообразные способы измерения сродства связывания известны в данной области, любые из которых могут применяться для целей настоящего изобретения. Конкретные иллюстративные варианты осуществления описаны далее.
В одном варианте осуществления, "Kd" или "значение Kd" в соответствии с данным изобретением измеряют посредством анализа связывания радиоактивно-меченого антигена (RIA), осуществляемого с Fab версией антитела, представляющего интерес, и его антигена, как описано посредством последующего анализа, который измеряет сродство связывания раствора Fab к антигену посредством уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии титровального ряда немеченого антигена, затем захвата связанного антигена с планшетом, покрытым антителами против-Fab (Chen, et al., (1999) J. Mol Biol 293:865-881). Для установления условий для анализа, титрационные микропланшеты (Dynex) покрывают в течение ночи 5 мкг/мл захватывающего антитела против-Fab (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6), и далее блокируют 2% (м/об) альбумином бычьей сыворотки в PBS в течение двух-пяти часов при комнатной температуре (приблизительно 23°С). В неадсорбирующем планшете (Nunc #269620), 100 пМ или 26 пМ [125I]-антиген смешивают с серийными разведениями Fab, представляющего интерес, (например, в соответствии с оценкой антитела против-VEGF, Fab-12, в Presta et al., (1997) Cancer Res. 57:4593-4599). Fab, представляющий интерес, далее инкубируют в течение ночи; однако, инкубация может продолжаться в течение более длительного периода (например, 65 часов) для гарантии, что равновесие достигнуто. Затем, смеси переносят в планшет для захвата для инкубации при комнатной температуре (например, в течение одного часа). Раствор затем удаляют, и планшет удаляют восемь раз с 0,1% Твин-20 в PBS. Когда планшеты высушивают, добавляют 150 мкл/лунку сцинтиллятора (МикроScint-20; Packard), и планшеты подсчитывают на гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают меньше, чем или равные 20% от максимального связывания выбирают для применения в анализах с конкурентным связыванием. В соответствии с еще одним другим вариантом осуществления Kd или значение Kd измеряют посредством использования анализов поверхностного плазмонного резонанса, применяя BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с чипами с иммобилизованным антигеном CM5 при ~10 единицах отклика (RU). Вкратце, биосенсорные чипы (CM5, BIAcore Inc.) с карбоксиметилированным декстраном активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, в 5 мкг/мл (~0,2 мкМ) перед инъекционным вводом при скорости потока, равной 5 мкл/минуту для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена, 1M этаноламин инъецируют в блок-непрореагировавшие группы. Для измерений кинетики, двукратные серийные разведения Fab (0,78 нМ до 500 нМ) инъекционно вводят в PBS с 0,05% Твин 20 (PBST) при 25°С при скорости потока, равной приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания один-к-одному Лэнгмюра (BIAcore Evaluation Software version 3.2) посредством одновременной аппроксимации сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol Biol 293:865-881. Если скорость ассоциации превышает 106 M-1 S-1 по результатам анализа поверхностного плазмонного резонанса, упомянутого выше, затем скорость ассоциации может быть определена посредством использования метода гашения флуоресценции, который измеряет увеличение или уменьшение интенсивности эмиссии флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, 16 нм полоса пропускания) при 25°C 20 нМ антитела против-антигена (Fab форма) в PBS, pH 7,2, в присутствии увеличивающейся концентрации антигена, как измеряют спектрометром, таким как спектрофотометр, оборудованный остановкой потока (Aviv Instruments) или SLM-Aminco спектрофотометр 8000-серии (Thermo Spectronic) с перемешиваемой кюветой.
"Скорость ассоциации", или "степень ассоциации", или "ассоциационная скорость", или "kon" в соответствии с данным изобретением может также определяться с помощью того же метода поверхностного плазмонного резонанса, описанного выше, с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) 25°C с чипами с иммобилизованным антигеном CM5 при ~10 единицах ответа (RU). Вкратце, биосенсорные чипы (CM5, BIAcore Inc.) с карбоксиметилированным декстраном активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, в 5 мкг/мл (~0,2 мкМ) перед инъекционным вводом при скорости потока, равной 5 мкл/минуту для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена, 1M этаноламин инъецируют в блок-непрореагировавшие группы. Для измерений кинетики, двукратные серийные разведения Fab (0,78 нМ до 500 нМ) инъекционно вводят в PBS с 0,05% Твин 20 (PBST) при 25°С при скорости потока, равной приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания один-к-одному Лэнгмюра (BIAcore Evaluation Software version 3.2) посредством одновременной аппроксимации сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol Biol 293:865-881. Если скорость ассоциации превышает 106 M-1 S-1 по результатам анализа поверхностного плазмонного резонанса, упомянутого выше, затем скорость ассоциации может быть определена посредством использования метода гашения флуоресценции, который измеряет увеличение или уменьшение интенсивности эмиссии флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, 16 нм полоса пропускания) при 25°C 20 нМ антитела против-антигена (Fab форма) в PBS, pH 7,2, в присутствии увеличивающейся концентрации антигена, как измеряют спектрометром, таким как спектрофотометр, оборудованный остановкой потока (Aviv Instruments) или SLM-Aminco спектрофотометр 8000-серии (Thermo Spectronic) с перемешиваемой кюветой. "Kd" или "значение Kd" в соответствии с данным изобретением в одном варианте осуществления измеряют посредством анализа связывания радиоактивно-меченого антигена (RIA), осуществляемого с Fab версией антитела, представляющего интерес, и его антигена, как описано посредством последующего анализа, который измеряет сродство связывания раствора Fab к антигену посредством уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии титровального ряда немеченого антигена, затем захвата связанного антигена с планшетом, покрытым антителами против-Fab (Chen, et al., (1999) J. Mol Biol 293:865-881). Для установления условий для анализа, титрационные микропланшеты (Dynex) покрывают в течение ночи 5 мкг/мл захватывающего антитела против-Fab (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6), и далее блокируют 2% (мас/об) альбумином бычьей сыворотки в PBS в течение двух-пяти часов при комнатной температуре (приблизительно 23°С). В неадсорбирующем планшете (Nunc #269620), 100 пМ или 26 пМ [125I]-антиген смешивают с серийными разведениями Fab, представляющего интерес, (например, в соответствии с оценкой антитела против-VEGF, Fab-12, в Presta et al., (1997) Cancer Res. 57:4593-4599). Fab, представляющий интерес, далее инкубируют в течение ночи; однако инкубация может продолжаться в течение более длительного периода (например, 65 часов) для гарантии, что равновесие достигнуто. Затем смеси переносят в планшет для захвата для инкубации при комнатной температуре (например, в течение одного часа). Раствор затем удаляют и планшет промывают восемь раз с 0,1% Твин-20 в PBS. Когда планшеты высушивают, добавляют 150 мкл/лунку сцинтиллятора (МикроScint-20; Packard) и планшеты подсчитывают на гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают меньше чем или равные 20% от максимального связывания, выбирают для применения в анализах с конкурентным связыванием. В соответствии с еще одним другим вариантом осуществления Kd или значение Kd измеряют посредством использования анализов поверхностного плазмонного резонанса, применяя BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с чипами с иммобилизованным антигеном CM5 при ~10 единицах отклика (RU). Вкратце, биосенсорные чипы (CM5, BIAcore Inc.) с карбоксиметилированным декстраном активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, в 5мкг/мл (~0,2 мкМ) перед инъекционным вводом при скорости потока, равной 5 мкл/минуту для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена, 1M этаноламин инъецируют в блок-непрореагировавшие группы. Для измерений кинетики, двукратные серийные разведения Fab (0,78 нМ до 500 нМ) инъекционно вводят в PBS с 0,05% Твин 20 (PBST) при 25°С при скорости потока, равной приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания один-к-одному Лэнгмюра (BIAcore Evaluation Software version 3.2) посредством одновременной аппроксимации сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol Biol 293:865-881. Если скорость ассоциации превышает 106 M-1 S-1 по результатам анализа поверхностного плазмонного резонанса, упомянутого выше, затем скорость ассоциации может быть определена посредством использования метода гашения флуоресценции, который измеряет увеличение или уменьшение интенсивности эмиссии флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, 16 нм полоса пропускания) при 25°C 20 нМ антитела против-антигена (Fab форма) в PBS, pH 7,2, в присутствии увеличивающейся концентрации антигена, как измеряют спектрометром, таким как спектрофотометр, оборудованный остановкой потока (Aviv Instruments) или SLM-Aminco спектрофотометр 8000-серии (Thermo Spectronic) с перемешиваемой кюветой.
В одном варианте осуществления, "скорость ассоциации" или "степень ассоциации" или "ассоциационная скорость" или "kon" в соответствии с данным изобретением может также определяться с помощью того же метода поверхностного плазмонного резонанса, описанного выше, с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) 25°C с чипами с иммобилизованным антигеном CM5 при ~10 единицах ответа (RU). Вкратце, биосенсорные чипы (CM5, BIAcore Inc.) с карбоксиметилированным декстраном активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, в 5 мкг/мл (~0,2 мкМ) перед инъекционным вводом при скорости потока, равной 5 мкл/минуту для достижения приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена, 1M этаноламин инъецируют в блок-непрореагировавшие группы. Для измерений кинетики, двукратные серийные разведения Fab (0,78 нМ до 500 нМ) инъекционно вводят в PBS с 0,05% Твин 20 (PBST) при 25°С при скорости потока, равной приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую модель связывания один-к-одному Лэнгмюра (BIAcore Evaluation Software version 3.2) посредством одновременной аппроксимации сенсограммы ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol Biol 293:865-881. Если скорость ассоциации превышает 106 M-1 S-1 по результатам анализа поверхностного плазмонного резонанса, упомянутого выше, затем скорость ассоциации может быть определена посредством использования метода гашения флуоресценции, который измеряет увеличение или уменьшение интенсивности эмиссии флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, 16 нм полоса пропускания) при 25°C 20 нМ антитела против-антигена (Fab форма) в PBS, pH 7,2, в присутствии увеличивающейся концентрации антигена, как измеряют спектрометром, таким как спектрофотометр, оборудованный остановкой потока (Aviv Instruments) или SLM-Aminco спектрофотометр 8000-серии (Thermo Spectronic) с перемешиваемой кюветой.
Фраза "значительно сниженные" или "значительно отличающиеся", как используют в настоящей заявке, обозначает достаточно высокую степень различия между двумя числовыми значениями (как правило, одного, связанного с антителом изобретения и другого, связанного с референтным/для сравнения антителом), таким образом, что квалифицированный специалист в области будет рассматривать различие между двумя значениями, как имеющее статистическую значимость в пределах контекста биологической характеристики, измеренной по указанным значениям (например, значения Kd, отклик HAMA). Различие между указанными двумя значениями является, предпочтительно, выше чем приблизительно 10%, предпочтительно, выше чем приблизительно 20%, предпочтительно, выше чем приблизительно 30%, предпочтительно, выше чем приблизительно 40%, предпочтительно, выше чем приблизительно 50%, как функция значения для референтного/для сравнения антитела.
"Антиген" представляет собой предварительно определенный антиген, с которым антитело может селективно связываться. Целевой антиген может представлять собой полипептид, углевод, нуклеиновую кислоту, липид, гаптен или другое встречающееся в природе или синтетическое соединение. Предпочтительно, целевой антиген является полипептидом. "Акцепторный каркас человека" для целей в настоящей заявке представляет собой каркас, содержащий аминокислотную последовательность каркаса VL или VH, производного от каркаса иммуноглобулина человека или от консенсусного каркаса человека. Акцепторный каркас человека, "производный от" каркаса иммуноглобулина человека, или консенсусный каркас человека могут содержать одинаковую их аминокислотную последовательность или могут содержать предварительно существующие изменения аминокислотной последовательности. Там, где присутствуют предварительно существующие аминокислотные изменения, предпочтительно, не более чем 5 и, предпочтительно, 4 или менее, или 3 или менее, предварительно существующие аминокислотные изменения присутствуют. Там, где предварительно существующие аминокислотные изменения присутствуют в VH, предпочтительно, эти изменения присутствуют только по трем, двум или одному из положений 71H, 73H и 78H; например, аминокислотные остатки по этим положениям могут являться 71A, 73T и/или 78A. В одном варианте осуществления, VL акцепторный каркас человека является идентичным по последовательности с каркасной последовательностью VL иммуноглобулина человека или консенсусной каркасной последовательностью человека.
Антитела настоящего изобретения могут обладать способностью к конкуренции за связывание с одним и тем же эпитопом, связанным со вторым антителом. Считают, что моноклональные антитела делят "один и тот же эпитоп", если каждое блокирует связывание другого на 40% или выше при такой же концентрации антитела в стандартном анализе in vitro конкурентного связывания антител.
"Консенсусный каркас человека" представляет собой каркас, который представляет наиболее часто встречающийся аминокислотный остаток при выборе VL или VH каркасных последовательностей иммуноглобулина человека. В целом, выбор VL или VH последовательностей иммуноглобулина человека происходит из подгруппы последовательностей вариабельного домена. В целом, подгруппы последовательностей являются подгруппами, как приведено у Kabat et al. В одном варианте осуществления, для VL, подгруппа является подгруппой каппа I, как у Kabat et al. В одном варианте осуществления, для VH, подгруппа является подгруппой III как у Kabat et al.
"Консенсусный каркас VH подгруппы III" содержит консенсусную последовательность, полученную из аминокислотных последовательностей в вариабельной тяжелой подгруппе III по Kabat et al.
"Консенсусный каркас VL подгруппы I" содержит консенсусную последовательность, полученную из аминокислотных последовательностей в вариабельной легкой каппа подгруппе I по Kabat et al.
"Немодифицированный каркас человека" представляет каркас человека, который имеет такую же аминокислотную последовательность, как и акцепторный каркас человека, например, без от человеческих до нечеловеческих аминокислотных замен в акцепторном каркасе человека.
"Измененная гипервариабельная область" для целей данного изобретения представляет собой гипервариабельную область, содержащую одну или более (например, от одной до приблизительно 16) аминокислотных замен в них.
"Немодифицированная гипервариабельная область" для целей данного изобретения представляет собой гипервариабельную область, имеющую такую же аминокислотную последовательность, как и нечеловеческое антитело, из которого она была получена, т.е. область, в которой отсутствуют одна или более аминокислотных замен.
Термин "гипервариабельная область", "HVR", "HV" или "CDR", когда используют в настоящей заявке, относится к областям вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно определенные петли. В целом, антитела содержат шесть гипервариабельных областей; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). Ряд разграничений гипервариабельных областей находятся в применении и охвачены в настоящей заявке. Области определения комплементарности по Кабат (CDR) основаны на вариабельности последовательности и используются наиболее часто (Kabat et al., Sequences Proteins Immunological Interest, 5th Ed. Public Health Service, National Institutes Health, Bethesda, MD. (1991)). Chothia дает вместо этого ссылки на расположение структурных петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). "Контактные" гипервариабельные области основаны на анализе доступных комплексных кристаллических структур. Остатки от каждой из этих гипервариабельных областей отмечены ниже. Если не обозначено иначе, будет использована нумерация по Кабат. Расположения гипервариабельной области, как правило, являются следующими: аминокислоты 24-34 (HVR-L1), аминокислоты 49-56 (HVR-L2), аминокислоты 89-97 (HVR-L3), аминокислоты 26-35A (HVR-H1), аминокислоты 49-65 (HVR-H2) и аминокислоты 93-102 (HVR-H3).
Гипервариабельные области могут также содержать "расширенные гипервариабельные области" следующим образом: аминокислоты 24-36 (L1), и аминокислоты 46-56 (L2) в VL. Остатки вариабельного домена нумеруются в соответствии с Kabat et al., выше для каждого из этих определений.
"Каркасные" или "FR" остатки представляют собой такие остатки вариабельного домена, отличные от остатков гипервариабельной области, как в настоящей заявке определено.
"Антитело человека" представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует последовательности антитела, продуцируемой человеком, и/или была получена с использованием любого из методов для получения антител человека, как описано в настоящей заявке. Это определение антитела человека конкретно исключает гуманизированное антитело, содержащее нечеловеческие антиген-связывающие остатки.
Антитело "созревшей аффинности" представляет собой антитело с одним или более изменениями в одной или более их CDR, которые приводят к улучшению сродства антитела к антигену, по сравнению с родительским антителом, которое не обладает этими изменениями. Предпочтительные антитела созревшей аффинности будут иметь наномолярные или даже пикомолярные значения сродства к целевому антигену. Антитела созревшей аффинности получают посредством методик, известных в данной области. Marks et al. Bio/Technology 10:779-783 (1992) описывает созревшую аффинность посредством перетасовки VH и VL доменов. Статистический мутагенез CDR и/или каркасных остатков описан в: Barbas et al. Proc Nat. Acad. Sci, USA 91: 3809-3813 (1994); Schier et al. Gene 169: 147-155 (1995); Yelton et al. J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
"Блокирующее" антитело или "антагонистическое" антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. Предпочтительные блокирующие антитела или антагонистические антитела по существу или полностью ингибируют биологическую активность антигена.
"ТАТ-связывающий олигопептид" представляет собой олигопептид, который связывается, предпочтительно, специфично, с полипептидом ТАТ, как описано в настоящей заявке. ТАТ-связывающие олигопептиды могут быть синтезированы химически с использованием известной методологии синтеза олигопептидов или могут быть получены и очищены с использованием рекомбинантной технологии. ТАТ-связывающие олигопептиды содержат обычно по меньшей мере приблизительно 5 аминокислот по длине, альтернативно по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислот по длине или более, где такие олигопептиды обладают способностью к связыванию, предпочтительно, конкретно, с полипептидом ТАТ, как описано в настоящей заявке. ТАТ-связывающие олигопептиды могут быть идентифицированы без излишнего экспериментирования с использованием хорошо известных методов. В этом отношении отмечают, что методы скрининга библиотек олигопептидов для олигопептидов, обладающих способностью специфично связываться с полипептидной мишенью, являются хорошо известными в области (см., например, патенты США №№ 5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; Публикацию заявок PCT №№ WO 84/03506 и WO 84/03564; Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984); Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 82: 178-182 (1985); Geysen et al., в Synthetic Peptides as Antigens, 130-149 (1986); Geysen et al., J. Immunol. Meth., 102:259-274 (1987); Schoofs et al., J. Immunol, 140:611-616 (1988), Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378; Lowman, H.B. et al. (1991) Biochemistry, 30: 10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol, 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363, и Smith, G. P. (1991) Current Opin. Biotechnol, 2:668).
"ТАТ-связывающая органическая молекула" представляет собой органическую молекулу, отличающуюся от олигопептида или антитела, как определено в настоящей заявке, которая связывается, предпочтительно, специфично, с полипептидом ТАТ, как описано в настоящей заявке. ТАТ-связывающая органическая молекула может быть идентифицирована и химически синтезирована с использованием известной методологии (см., например, публикацию заявок PCT №№ WO 00/00823 и WO 00/39585). ТАТ-связывающие органические молекулы обычно составляют меньше чем приблизительно 2000 Дальтонов по размеру, альтернативно, меньше чем приблизительно 1500, 750, 500, 250 или 200 Дальтонов по размеру, где такие органические молекулы, которые обладают способностью к связыванию, предпочтительно, специфично, с полипептидом ТАТ, как описано в настоящей заявке, могут быть идентифицированы без излишнего экспериментирования с использованием хорошо известных методов. В этом отношении отмечают, что методы скрининга библиотек органических молекул для молекул, которые обладают способностью к связыванию с полипептидной мишенью, являются хорошо известными в области (см., например, публикации заявок РСТ №№ WO 00/00823 и WO 00/39585).
Антитело, олигопептид или другая органическая молекула, "которая связывается" с антигеном, представляющим интерес, например, мишенью опухоле-связанного полипептидного антигена, представляет собой молекулу, которая связывается с антиген с достаточным сродством, таким образом, что антитело, олигопептид или другая органическая молекула является применимой в качестве диагностического и/или терапевтического агента при направленном воздействии на клетку или ткань, экспрессирующие антиген, и не имеют существенного перекрестного взаимодействия с другими белками. В таких вариантах осуществления, степень связывания антитела, олигопептида или другой органической молекулы с "нецелевым" белком будет составлять меньше, чем приблизительно 10% от связывания антитела, олигопептида или другой органической молекулы с их конкретным целевым белком, как определяют посредством анализа сортировки флуоресцентно-активированных клеток (FACS) или радиоиммунопреципитации (RIA). По отношению к связыванию антитела, олигопептида или другой органической молекулы с целевой молекулой, термин "специфичное связывание" или "специфически связывается с" или является "специфичным для" конкретного полипептида или эпитопа на конкретной полипептидной мишени означает связывание, которое является измеряемо отличным от неспецифического взаимодействия. Специфичное связывание может быть измерено, например, посредством определения связывания молекулы по сравнению со связыванием контрольной молекулы, которая, обычно является молекулой сходной структуры, которая не имеет активности связывания. Например, специфичное связывание может быть определено посредством конкуренции с контрольной молекулой, которая является сходной с мишенью, например, избытком немеченой мишени. В данном случае, специфичное связывание проявляется, если связывание меченой мишени с зондом конкурентно ингибируется избытком немеченой мишени. Термин "специфичное связывание" или "специфически связывается с" или является "специфичным для" конкретного полипептида или эпитопа на конкретной полипептидной мишени, как используют в настоящей заявке, может быть продемонстрирован, например, молекулой, имеющей Kd для мишени, равную по меньшей мере приблизительно 10-4 M, альтернативно по меньшей мере приблизительно 10-5 M, альтернативно по меньшей мере приблизительно 10-6 M, альтернативно по меньшей мере приблизительно 10-7 M, альтернативно по меньшей мере приблизительно 10-8 M, альтернативно по меньшей мере приблизительно 10-9 M, альтернативно по меньшей мере приблизительно 10-10 M, альтернативно по меньшей мере приблизительно 10-11 M, альтернативно по меньшей мере приблизительно 10-12 M, или выше. В одном варианте осуществления, термин "специфичное связывание" относится к связыванию, где молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или полипептидным эпитопом.
Антитело, олигопептид или другая органическая молекула, которые "ингибируют рост опухолевых клеток, экспрессирующих полипептид ТАТ" или "ингибирующие рост" антитело, олигопептид или другая органическая молекула, представляют собой молекулу, которая приводит в результате к измеряемому ингибированию роста раковых клеток, экспрессирующих или сверхэкспрессирующих соответствующий полипептид ТАТ. Полипептид ТАТ может представлять собой трансмембранный полипептид, экспрессирующийся на поверхности раковой клетки, или может представлять собой полипептид, который продуцируется и секретируется раковой клеткой. Предпочтительные ингибирующие рост антитела против ТАТ, олигопептиды или органические молекулы ингибируют рост TAT-экспрессирующих опухолевых клеток на более чем 20%, предпочтительно, от приблизительно 20% до приблизительно 50%, и даже более предпочтительно, на более чем 50% (например, от приблизительно 50% до приблизительно 100%) по сравнению с соответствующим контролем, контролем обычно являются опухолевые клетки, не обработанные тестируемыми антителом, олигопептидом или другой органической молекулой. В одном варианте осуществления, ингибирование роста может быть измерено при концентрации антитела, равной приблизительно от 0,1 до 30 мкг/мл или приблизительно от 0,5 нМ до 200 нМ в культуре клеток, где ингибирование роста определяют через 1-10 дней после подвергания опухолевых клеток воздействию антитела. Ингибирование роста опухолевых клеток in vivo может быть определено разнообразными путями, такими, как описано в разделе Экспериментальные Примеры ниже. Антитело является ингибирующим рост in vivo, если введение антитела против ТАТ при приблизительно 1 мкг/кг до приблизительно 100 мг/кг массы тела приводит в результате к уменьшению размера опухоли или пролиферации опухолевых клеток в пределах приблизительно от 5 дней до 3 месяцев от первого введения антитела, предпочтительно, в пределах приблизительно от 5 до 30 дней.
Антитело, олигопептид или другая органическая молекула, которые "индуцируют апоптоз", представляют собой молекулу, которая индуцирует программируемую смерть клеток как определяют посредством связывания аннексина V, фрагментации ДНК, сжатия клеток, дилатации эндоплазматической сети, фрагментации клеток и/или образования мембранных везикул (именуемых апоптозными тельцами). Клетка обычно представляет собой клетку, которая сверхэкспрессирует полипептид ТАТ. Предпочтительно, клетка представляет собой опухолевую клетку, например клетку простаты, молочной железы, яичника, желудка, эндометрия, легкого, почки, толстой кишки, мочевого пузыря. Разнообразные методы являются доступными для оценки клеточных событий, связанных с апоптозом. Например, транслокация фосфатидилсерина (ФС) может быть измерена посредством связывания с аннексином; фрагментация ДНК может быть оценена посредством электрофоретического расщепления ДНК; и ядерная/хроматиновая конденсация наряду с фрагментацией ДНК может быть оценена по любому увеличению гиподиплоидных клеток. Предпочтительно, антитело, олигопептид или другая органическая молекула, которые индуцируют апоптоз, представляют собой молекулу, которая приводит в результате к приблизительно 2-50 кратной, предпочтительно, приблизительно 5-50 кратной, и наиболее предпочтительно, приблизительно 10-50 кратной, индукции связывания аннексина относительно необработанных клеток в анализе связывания аннексина.
"Эффекторные функции" антитела относятся к биологическим активностям, характерным для Fc-области (Fc-область нативной последовательности или вариантная Fc-область аминокислотной последовательности) антитела, и изменяются вместе с изотипом антитела. Примеры эффекторных функций антитела включают: C1q связывание и комплемент-зависимая цитотоксичность; связывание с Fc рецептором; антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC); фагоцитоз; отрицательная негативная модуляция рецепторов поверхности клетки (например, рецептора B клеток); и активация B клеток.
"Антитело-зависимая клеточно-опосредованная цитотоксичность" или "ADCC" относится к форме цитотоксичности, в которой секретируемый Ig, связанный на Fc рецепторах (FcR), присутствует на определенных цитотоксических клетках (например, естественных киллерных (NK) клетках, нейтрофилах и макрофагах) делают возможным для этих цитотоксических эффекторных клеток связываться специфично с антиген-несущей целевой клеткой и в последующем уничтожать целевую клетку цитотоксинами. Антитела "вооружают" цитотоксические клетки, и абсолютно требуются для такого уничтожения. Первичные клетки для опосредования ADCC, клетки NK, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках представлена в обобщенном виде в Таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оценки ADCC активности молекул, представляющих интерес, может осуществляться анализ ADCC in vitro, такой как описан в патенте США № 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают моноядерные клетки периферической крови (PBMC) и естественные киллерные (NK) клетки. Альтернативно, или дополнительно, ADCC активность молекул, представляющих интерес, может быть оценена in vivo, например, на животной модели, такой как раскрыта в Clynes et al. (USA) 95:652-656 (1998).
"Fc рецептор" или "FcR" описывает рецептор, который связывается с Fc-областью антитела. Предпочтительный FcR представляет собой нативную последовательность FcR человека. Кроме того, предпочтительный FcR является рецептором, который связывается с IgG антителом (гамма рецептор) и включает рецепторы подклассов FcyRI, FcyRII и FcyRIII, включающие аллельные варианты и альтернативно сплайсированные формы этих рецепторов. FcyRII рецепторы включают FcyRIIA ("активирующий рецептор") и FcyRIIB ("ингибирующий рецептор"), которые имеют сходные аминокислотные последовательности, которые отличаются прежде всего по их цитоплазматическим доменам. Активирующий рецептор FcyRIIA содержит иммунорецепторный тирозиновый активирующий мотив (ITAM) в его цитоплазматическом домене. Ингибирующий рецептор FcyRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в его цитоплазматическом домене, (см. обзор M. в Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR обзорно рассмотрены в Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, включающие те, что будут идентифицированы в будущем, охвачены в настоящей заявке термином "FcR". Термин также включает неонатальный рецептор, FcRn, который является ответственным за перенос материнских IgG к плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)).
"Эффекторные клетки человека" представляют собой лейкоциты, которые экспрессируются одним или более из FcR и осуществляют эффекторные функции. Предпочтительно, клетки экспрессируют по меньшей мере FcyRIII и осуществляют ADCC эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают моноядерные клетки периферической крови (PBMC), естественные киллерные (NK) клетки, моноциты, цитотоксические T клетки и нейтрофилы; причем клетки PBMC и NK являются предпочтительными. Эффекторные клетки могут быть выделены из природного источника, например, из крови.
"Комплемент-зависимая цитотоксичность" или "CDC" относится к лизису целевых клеток в присутствии комплемента. Активация классического пути комплемента инициируется посредством связывания первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны с их когнатным антигеном. Для оценки активации комплемента, может осуществляться анализ CDC, например, как описан в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Термины "рак" и "раковые" относятся к или описывают физиологическое состояние у млекопитающих, которое типично характеризуется посредством нерегулируемого роста клеток. Примеры рака включают, но не ограничены лишь ими, злокачественные состояния карциномы, лимфомы, бластомы, саркомы и лейкемии или лимфоидные. Более конкретных примеры таких раков включают рак сквамозных клеток (например, рак эпителиальных сквамозных клеток), рак легких, включающий мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легкого и сквамозную карциному легкого, рак брюшной полости, гепатоклеточный рак, желудочный или рак желудка, включающий желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, рак мочевыводящих путей, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки или ренальный рак, рак простаты рак, вульварный рак, рак щитовидной железы, карциному печени, анальную карциному, пенильную карциному, меланому, множественную миелому и B-клеточную лимфому, рак мозга, а также рак головы и шеи и связанные метастазы.
Термины "клеточное пролиферативное нарушение" и "пролиферативное нарушение" относятся к нарушениям, которые связаны с некоторой степенью пролиферации аномальных клеток. В одном варианте осуществления, клеточное пролиферативное нарушение представляет собой рак.
"Опухоль", как используют в настоящей заявке, относится к росту и пролиферации всех неопластических клеток, либо злокачественных или доброкачественных, и всех предраковых и раковых клеток и тканей.
Антитело, олигопептид или другая органическая молекула, которая "индуцирует смерть клеток" представляет собой молекулу, которая вызывает превращение жизнеспособных клеток в нежизнеспособные. Клетка представляет собой клетку, которая экспрессирует полипептид ТАТ, предпочтительно, клетку, которая сверхэкспрессирует полипептид ТАТ, по сравнению с нормальной клеткой такого же типа ткани. Полипептид ТАТ может представлять собой трансмембранный полипептид, экспрессируемый на поверхности раковых клеток или может представлять собой полипептид, который продуцируется и секретируется раковой клеткой. Предпочтительно, клетка представляет собой раковую клетку, например клетку молочной железы, яичника, желудка, эндометрия, слюнной железы, легкого, почки, толстой кишки, щитовидной железы, поджелудочной железы или мочевого пузыря. Смерть клеток in vitro может быть определена в отсутствие комплементных и иммунных эффекторных клеток, чтобы различить смерть клеток, индуцируемую антитело-зависимой клеточно-опосредованной цитотоксичностью (ADCC) или комплемент-зависимой цитотоксичностью (CDC). Таким образом, анализ на смерть клеток может осуществляться с использованием сыворотки, инактивированной нагреванием (т.е. в отсутствие комплемента) и в отсутствие иммунных эффекторных клеток. Чтобы определить, способны ли антитело, олигопептид или другая органическая молекула индуцировать смерть клеток, потеря целостности мембраны, как оценивают посредством поглощения пропидиййодида (PI), трипанового синего (см. Moore et al. Cytotechnology 17: 1-11 (1995)) или 7AAD может оцениваться по отношению к необработанным клеткам. Предпочтительные антитела, олигопептиды или другие органические молекулы, индуцирующие смерть клеток, представляют собой молекулы, которые индуцируют поглощение PI в анализе поглощения PI клетками BT474.
"TAT-экспрессирующая клетка" представляет собой клетку, которая экспрессирует эндогенный или трансфицированный полипептид ТАТ либо на клеточной поверхности или в секретируемой форме. "TAT-экспрессирующий рак" представляет собой рак, содержащий клетки, которые имеют полипептид ТАТ, присутствующий на клеточной поверхности или которые продуцируют и секретируют полипептид ТАТ. "TAT-экспрессирующий рак" необязательно продуцирует достаточные уровни полипептида ТАТ на поверхности его клеток, таким образом, что антитело против ТАТ, олигопептид или другая органическая молекула могут связываться с ним и обладать терапевтическим эффектом по отношению к раку. В еще одном варианте осуществления, "TAT-экспрессирующий рак" необязательно продуцирует и секретирует достаточные уровни полипептида ТАТ, таким образом, что антитело против ТАТ, олигопептид или антагонистическая другая органическая молекула могут связываться с ним и обладать терапевтическим эффектом по отношению к раку. В отношении последнего, антагонист может представлять собой антисмысловой олигонуклеотид, который снижает, ингибирует или предотвращает выработку и секрецию секретируемого полипептида ТАТ опухолевыми клетками. Рак, который "сверхэкспрессирует" полипептид ТАТ, представляет собой рак, который имеет существенно более высокие уровни полипептида ТАТ на поверхности его клеток или продуцирует и секретирует, по сравнению с нераковой клеткой такого же типа ткани. Такая сверхэкспрессия может быть вызвана амплификацией гена или посредством увеличенной транскрипции или трансляции. Сверхэкспрессия полипептида ТАТ может быть определена в диагностическом или прогностическом анализе посредством оценки увеличенных уровней TAT белка, присутствующего на поверхности клетки, или секретируемого клеткой (например, посредством иммуногистохимического анализа с использованием антител против ТАТ, полученных против выделенного полипептида ТАТ, который может быть получен с использованием технологии рекомбинантной ДНК из выделенной нуклеиновой кислоты кодирующей полипептид ТАТ; анализа FACS и т.д.). Альтернативно, или дополнительно, можно измерить уровни полипептид ТАТ-кодирующей нуклеиновой кислоты или мРНК в клетке, например, посредством флуоресцентной гибридизации in situ с использованием зонда на основе нуклеиновой кислоты, соответствующего TAT-кодирующей нуклеиновой кислоте или ее комплементу (FISH; см. WO 98/45479, публикация октябрь, 1998), саузерн-блоттинга, нозерн-блоттинга или методов полимеразной цепной реакции (ПЦР), таких как количественная ПЦР в реальном времени (RT-ПЦР). Можно также исследовать сверхэкспрессию полипептида ТАТ посредством измерения "слущивающегося" антигена в биологической жидкости, такой как сыворотка, например, с использованием анализов на основе антител (см. также, например, патент США № 4933294, выданный 12 июня, 1990; WO 91/05264, опубликованный 18 апреля, 1991; патент США № 5401638, выданный 28 марта 28, 1995; и Sais et al., J. Immunol. Methods 132:73-80 (1990)). Помимо указанных выше анализов, разнообразные анализы in vivo являются доступными для квалифицированного практика. Например, можно подвергнуть клетки в организме пациента воздействию антитела, которое необязательно метят обнаруживаемой меткой, например радиоактивным изотопом, и связывание антитела с клетками у пациента можно оценить, например, посредством внешнего сканирования радиоактивности или посредством анализа биопсийной пробы, взятой от пациента, ранее подвергнутому воздействию антитела.
Как используют в настоящей заявке, термин "иммуноадгезин" обозначает антитело-подобную молекулу, которая сочетает специфичность связывания гетерологичного белка ("адгезина") с эффекторными функциями постоянных доменов иммуноглобулина. Структурно, иммуноадгезины содержат слияние аминокислотной последовательности с желательной специфичностью связывания, которая является другой, чем распознавание антигена и участок связывания антитела (т.е. является "гетерологичной"), и последовательности постоянного домена иммуноглобулина. Адгезиновая часть молекулы иммуноадгезина обычно накладывается на аминокислотную последовательность, содержащую по меньшей мере участок связывания рецептора или лиганда. Последовательность постоянного домена иммуноглобулина в иммуноадгезине может быть получена от любого иммуноглобулина, такого как подтипы IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включающие IgA-1 и IgA-2), IgE, IgD или IgM.
Слово "метка", когда используется в настоящей заявке, относится к обнаруживаемым соединению или композиции, которые являются конъюгированными непосредственно или опосредованно с антителом, олигопептидом или другой органической молекулой, так, чтобы генерировать "меченые" антитело, олигопептид или другую органическую молекулу. Метка может быть обнаруживаемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химическое изменение субстратного соединения или композиции, которая является обнаруживаемой.
Термин "цитотоксический агент", как используют в настоящей заявке, относится к веществу, которое ингибирует или предотвращает функцию клетки и/или вызывает деструкцию клетки. Подразумевают, что термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включающие фрагменты и/или их варианты, и разнообразные противоопухолевые или противораковые агенты, раскрытые ниже. Другие цитотоксические агенты описаны ниже. Туморицидный агент вызывает деструкцию опухолевой клетки.
"Химиотерапевтический агент" представляет собой химическое соединение, применимое для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфамид, триэтилентиофосфамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапакон; лапакол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин, и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (особенно, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; мустаргены, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацильный мустард; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно, калихеамицин гамма1I и калихеамицин омегаI1 (см., например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также неокарзиностатиновый хромофор и родственные хромопротеиновые хромофоры энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицинис, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, АДРИАМИЦИН® доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и деоксидоксорубицин), эпирубицин, эсорубицин, идарубицин, марцелломицин, митомицины такие как митомицин C, микофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; анти-метаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамипирин, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; против-адреналины, такие как аминоглутетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; энилурацил; амсакрин; бетрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиниума ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидайнин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Narural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно T-2 токсин, верракурин A, роридин А и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); тиотеапа; таксоиды, например, TAXOL® паклитаксел (Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANETM без Кремофор, сконструированная из альбумина лекарственная форма наночастиц паклитаксела (American Pharmaceutical Partners, Schaumberg, Illinois) и TAXOTERE® доксетаксел (Rhone-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейкововин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (XELODA®); фармацевтически приемлемые соли, кислоты или производные любого из приведенных выше; а также комбинации двух или более из приведенных выше, такие как CHOP, аббревиатура для комбинированной терапии циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, аббревиатура для режима лечения оксалиплатином (ELOXATINTM), комбинированного с 5-ФУ и лейкововином.
Также включенными в это определение являются антигормональные агенты, которые действуют, чтобы регулировать, снижать, блокировать или ингибировать эффекты гормонов, которые могут способствовать росту рака, и часто находятся в форме системного лечения или лечения всего организма. Они сами могут являться гормонами. Примеры включают антиэстрогены и селективные модуляторы рецепторов эстрогенов (SERM), включая, например, тамоксифен (включая NOLVADEX® тамоксифен), EVISTA® ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон, и FARESTON® торемифен; антипрогестероны; понижающие регуляторы рецепторов эстрогенов (ERD); агенты, которые функционируют, чтобы подавить или остановить работу яичников, например, агонисты леутинизирующий гормон-высвобождающего гормона (LHRH), такие как LUPRON® и ELIGARD® леупролида ацетат, госерелина ацетат, бусерелина ацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует выработку эстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, MEGASE® мегестрола ацетат, AROMASIN® экземестан, форместани, фадрозол, RIVISOR® ворозол, FEMARA® летрозол, и ARIMIDEX® анастрозол. Дополнительно, такое определение химиотерапевтических агентов включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), DIDROCAL® этидронат, NE-58095, ZOMETA® золедроновую кислоту/золедронат, FOSAMAX® алендронат, AREDIA® памидронат, SKELID® тилудронат, или ACTONEL® ризедронат; а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, особенно те, которые ингибируют экспрессию генов в сигнальных путях, вовлеченных в пролиферации аберрантных клеток, такие как, например, PKC-альфа, Raf, H-Ras, и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как THERATOPE® вакцина и вакцины генной терапии, например, ALLOVECTIN® вакцина, LEUVECTIN® вакцина, и VAXID® вакцина; LURTOTECAN® ингибитор топоизомеразы 1; ABARELIX® rmRH; лапатиниба дитозилат (ErbB-2 и EGFR двойной низкомолекулярный ингибитор тирозинкиназы, также известный как GW572016); и фармацевтически приемлемые соли, кислоты или производные любого из приведенных выше.
"Агент, ингибирующий рост", когда используют в настоящей заявке, относится к соединению или композиции, которые ингибируют рост клетки, особенно TAT-экспрессирующей раковой клетки, либо in vitro или in vivo. Таким образом, агент, ингибирующий рост, может представлять собой агент, который значительно снижает процентное содержание TAT-экспрессирующих клеток в S фазе. Примеры агентов, ингибирующих рост, включают агенты, которые блокируют развитие клеточного цикла (в месте, отличном от S фазы), такие как агенты, которые индуцируют блокировку G1 и M-фазы. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Такие агенты, которые блокируют G1, также выходят за пределы в блокировке S-фазы, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил, и ара-C. Дополнительную информацию можно найти в Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, entitled "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно p. 13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, оба из которых получают из тисового дерева. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из Европейского тиса, представляет собой полусинтетический аналог паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел инициируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки посредством предотвращения деполимеризации, которое приводит в результате к ингибированию митоза в клетках.
"Доксорубицин" представляет собой антрациклиновый антибиотик. Полное химическое наименование доксорубицина представляет собой (8S-cis)-10-[(3-амино-2,3,6-тридезокси-α-L-ликсо-гексапиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендион.
Термин "цитокин" представляет собой родовой термин для белков, высвобождаемых одной клеточной популяции, которые действуют на еще одну другую клетку как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. Включенными в ряд цитокинов являются гормон роста, такой как гормон роста человека, N-метионильный гормон роста человека и бычий гормон роста; гормон паращитовидной железы; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), стимулирующий гормон щитовидной железы (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фибробластный фактор роста; пролактин; плацентарный лактоген; фактор некроза опухоли-α и -β; мюллерова ингибирующая субстанция; мышиный гонадотропин-связанный пептид; ингибин; активин; сосудистый эндотелиальный фактор роста; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-β; тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF) такие как макрофаг-CSF (M-CSF); гранулоцит-макрофаг-CSF (GM-CSF); и гранулоцит-CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1a, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12; факторы некроза опухоли, такие как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и наборный лиганд (KL). Как используют в настоящей заявке, термин цитокин включает белки из природных источников или культуры рекомбинантных клеток и биологически активных эквивалентов нативных последовательностей цитокинов.
Термин "листок-вкладыш" применяют для обозначения инструкций, обычным образом включенные в промышленные упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предостережениях, касающихся применения таких терапевтических продуктов.
II. Композиции и способы изобретения
A. Антитела против ТАТ
В одном варианте осуществления, настоящее изобретение предоставляет антитела против ТАТ, которые могут найти применение в настоящей заявке в качестве терапевтических и/или диагностических агентов. Примерные антитела включают поликлональные, моноклональные, гуманизированные, биспецифические и гетероконъюгатные антитела.
1. Поликлональные антитела
Поликлональные антитела, предпочтительно, индуцируются у животных посредством множественных подкожных (sc) или внутрибрюшинных (ip) инъекций соответствующего антигена и адъюванта. Может быть применимым конъюгировать соответствующий антиген (особенно, когда применяют синтетические пептиды) с белком, который является иммуногенным у вида, подлежащего иммунизации. Например, антиген может быть конъюгирован с гемоцианином лимфы улитки (KLH), альбумином сыворотки, бычьим тироглобулином или соевым трипсиновым ингибитором, с использованием бифункционального или дериватизирующего агента, например, малеимидобензоилсульфосукцинимидного сложного эфира (конъюгация через цистеиновые остатки), N-гидроксисукцинимида (через лизиновые остатки), глютаральдегида, ангидрида янтарной кислоты, SOCl2 или R1N=C=NR, где R и R1 являются различными алкильными группами.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных посредством комбинирования, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и инъекции раствора внутрикожно во множество участков. Через один месяц, животных повторно иммунизируют от 1/5 до 1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда посредством подкожной инъекции во множество участков. Через семь-14 дней, у животных производят отбор крови и сыворотку анализируют на титр антител. Животных повторно иммунизируют, пока не достигают плато титра. Конъюгаты также могут быть получены в рекомбинантной клеточной культуре как гибриды белков. Также агрегирующие агенты, такие как квасцы, подходящим образом применяют для усиления иммунного ответа.
2. Моноклональные антитела
Моноклональные антитела могут быть получены с использованием гибридомного метода, впервые описанного Kohler et al., Nature, 256:495 (1975), или могут быть получены посредством методов рекомбинантных ДНК (патент США № 4816567).
В гибридомном методе, мышь или другое соответствующее животное-хозяин, такое как хомяк, иммунизируют, как описано выше, чтобы активировать лимфоциты, которые продуцируют или обладают способностью продуцировать антитела, которые будут специфически связываться с белком, применяемым для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. После иммунизации, лимфоциты выделяют и затем гибридизируют с линией клеток миеломы с использованием подходящего агента слияния, такого как полиэтиленгликоль, с образованием гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Гибридомные клетки, полученные таким образом, высевают и выращивают в подходящей культуральной среде, причем среда, предпочтительно, содержит одно или более веществ, которые ингибируют рост или выживание негибридизированных, родительских клеток миеломы (также именуемых партнером слияния). Например, если родительские клетки миеломы не имеют фермента гипоксантингуанинфосфорибозилтрансферазы (HGPRT или HPRT), селективная культуральная среда для гибридом обычно будет включать гипоксантин, аминоптерин и тимидин (HAT среда), вещества, которые препятствуют росту HGPRT-дефицитных клеток.
Предпочтительные партнерские клетки миеломы для слияния представляют собой клетки, которые эффективно гибридизируются, поддерживают стабильную на высоком уровне выработку антител посредством выбранных антитело-продуцирущих клеток, и являются чувствительными к селективной среде, которая направлена противнегибридизированных родительских клеток. Предпочтительные линии клеток миеломы представляют собой линии мышиной миеломы, такие как линии, производные от мышиных опухолей MOPC-21 и MPC-11, доступные от Salk Institute Cell Distribution Center, San Diego, California USA, и SP-2 и производные от, например, клеток X63-Ag8-653, доступных от Американской Коллекции Типовых Культур, Manassas, Virginia, USA. Линии клеток миеломы человека и клеток мыши-человека также были описаны для выработки моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); и Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральная среда, в которой гибридомные клетки растут, анализируется на предмет выработки моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют посредством иммунопреципитации или посредством анализа связывания in vitro, такого как радиоиммуноанализ (RIA) или фермент-связанный иммуносорбентный анализ (ELISA).
Сродство связывания моноклонального антитела может, например, быть определено посредством анализа Скэтчарда, описанного в Munson et al., Anal. Biochem., 107:220 (1980).
Как только гибридомные клетки, которые продуцируют антитела с желательными специфичностью, сродством и/или активностью идентифицируют, клоны могут быть субклонированы посредством методик ограничивающего разбавления и выращены посредством стандартных способов (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящие культуральные среды для этой цели включают, например, среду D-MEM или RPMI-1640. Дополнительно, гибридомные клетки могут быть выращены in vivo в виде асцитов опухолей в животном напр., посредством i.p. инъекции клеток в мышь.
Моноклональные антитела, секретируемые субклонами, подходящим образом отделяют от культуральной среды, асцитной жидкости или сыворотки посредством общепринятых методик очистки антител, таких как, например, аффинная хроматография (например, с использованием белка А- или белка G-Сефарозы) или ионообменной хроматографии, хроматографии на гидроксиапатите, гель-электрофореза, диализа и т.д.
ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют с использованием общепринятых методик (например, посредством использования олигонуклеотидных зондов, которые обладают способностью связываться специфически с генами, кодирующими тяжелые и легкие цепи мышиных антител). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. Как только ее выделяют, ДНК можно поместить в экспрессионные вектора, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки обезьяньей COS, клетки яичника китайского хомяка (CHO), или клетки миеломы, которые не продуцируют иным образом белок антител, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующих антитело, включают Skerra et al., Curr. Opinion в Immunol., 5:256-262 (1993) и Pluckthun, Immunol. Revs. 130: 151-188 (1992).
В дополнительном варианте осуществления, моноклональные антитела или фрагменты антител могут быть выделены из библиотек фаговых антител, генерируемых с использованием методов, описанных у McCafferty et al., Nature, 348:552-554 (1990). Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описывают выделение антител мыши и человека, соответственно, с использованием библиотек фагов. Последующие публикации описывают выработку антител человека с высоким сродством (нМ диапазон) посредством перетасовки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторной инфекции и рекомбинации in vivo в качестве стратегии для конструирования очень крупных библиотек фагов (Waterhouse et al., Nuc. Acids. Res. 21: 2265-2266 (1993)). Таким образом, эти методы являются жизнеспособными альтернативами традиционным гибридомным методам получения моноклональных антител для выделения моноклональных антител.
ДНК, которая кодирует антитело, может быть модифицирована для выработки химерных или гибридных полипептидов антитела, например, посредством замены последовательностей человека константных доменов с тяжелой цепью и с легкой цепью (CH и CL) на гомологичные мышиные последовательности (патент США № 4816567; и Morrison, et al., Proc. Natl Acad. Sci. USA, 81:6851 (1984)), или посредством гибридизации последовательности, кодирующей иммуноглобулин со всей кодирующей последовательностью для неиммуноглобулинового полипептида (гетерологичного полипептида) или ее частью. Последовательности неиммуноглобулинового полипептида могут заменять константные домены антитела, или их заменяют на вариабельные домены одного антиген-комбинирующего участка антитела для создания химерного бивалентного антитела, содержащего один антиген-комбинирующий участок, имеющий специфичность для антигена, и еще один другой антиген-комбинирующий участок, имеющий специфичность для отличного антигена.
3. Антитела человека и гуманизированные антитела
Антитела против ТАТ данного изобретения могут дополнительно содержать гуманизированные антитела или антитела человека. Гуманизированные формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антиген-связывющие субпоследовательности антител), которые содержат минимальную последовательность, производную от нечеловеческого иммуноглобулина. Гуманизированные антитела включают иммуноглобулины человека (реципиентное антитело), в котором остатки от области, определяющей комплементарность, (CDR) реципиента заменены на остатки из CDR нечеловеческого вида (донорное антитело), такого как мышь, крыса или кролик, имеющие желательную специфичность, сродство и потенциал. В некоторых случаях, Fv каркасные остатки иммуноглобулина человека заменены на соответствующие нечеловеческие остатки. Гуманизированные антитела могут также содержать остатки, которые не обнаружены ни в реципиентном антителе, ни в импортированных CDR или каркасных последовательностях. В общем случае, гуманизированное антитело будет содержать по существу все из по меньшей мере одного, и обычно двух, вариабельных доменов, в которых все или по существу все из CDR областей соответствуют областям нечеловеческого иммуноглобулина и все или по существу все из FR областей являются областями консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело оптимально также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), обычно области иммуноглобулина человека [Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol, 2:593-596 (1992)].
Способы гуманизации нечеловеческих антител являются хорошо известными в данной области. Обычно, гуманизированное антитело имеет один или более аминокислотных остатков, введенных в него из источника, который является нечеловеческим. Эти нечеловеческие аминокислотные остатки часто называют "импортными" остатками, которые обычно берутся из "импортного" вариабельного домена. Гуманизация может быть по существу выполнена, следуя способу Winter и сотр. [Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)], посредством замены последовательностей CDR или CDR грызунов на соответствующие последовательности антитела человека. Соответственно, такие "гуманизированные" антитела представляют собой химерные антитела (патент США № 4816567), где значительно меньше, чем интактный вариабельный домен человека был заменен на соответствующую последовательность от нечеловеческого вида. На практике, гуманизированные антитела представляют собой типично антитела человека, в которых некоторые CDR остатки и возможно некоторые FR остатки являются замененными на остатки из аналогичных участков в антителах грызунов.
Выбор вариабельных доменов человека, как легких, так и тяжелых, для применения в получении гуманизированных антител является очень важным для снижения антигенности и HAMA ответа (антитела человека против мыши), когда антитело предназначено для человеческого терапевтического применения. В соответствии с так называемым "наилучшим образом подобранным" способом, последовательность вариабельного домена антител грызуна скринируют против полной библиотеки известных последовательностей вариабельных доменов человека. V домен человека, последовательность которого является наиболее близкой к последовательности грызуна, идентифицирован и каркасная область (FR) человека внутри него принята для гуманизированного антитела (Sims et al., J. Immunol. 151: 2296 (1993); Chothia et al., J. Mol. Biol, 196:901 (1987)). В еще одном другом способе применяют конкретную каркасную область, производную от консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Такой же каркас может применяться для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol. 151: 2623 (1993)).
Дополнительно является важным, что антитела были гуманизированы с сохранением высокого сродства связывания для антигена и других благоприятных биологических свойств. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизированные антитела получают посредством процесса анализа родительских последовательностей и разнообразных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и знакомы квалифицированным специалистам в данной области. Доступными являются компьютерные программы, которые иллюстрируют и визуализируют вероятные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Рассмотрение этих визуализаций позволяет проводить анализ вероятной роли остатков в функционировании кандидатных последовательностей иммуноглобулинов, т.е. анализ остатков, которые влияют на способность кандидатного иммуноглобулина связывать его антиген. Таким образом, FR остатки могут быть выбраны и объединены из реципиентной и импортной последовательностей так, чтобы достигалось желательная характеристика антитела, такая как увеличенное сродство к целевому антигену (антигенам). В общем случае, остатки гипервариабельной области являются непосредственно и наиболее значительно вовлечены в воздействие на связывание антигена.
Рассматриваются разнообразные формы гуманизированных антител против ТАТ. Например, гуманизированное антитело может представлять собой фрагмент антитела, такой как Fab, который является необязательно конъюгированным с одним или более цитотоксическим агентом (агентами), чтобы генерировать иммуноконъюгат. Альтернативно, гуманизированное антитело может представлять собой интактное антитело, такое как интактное антитело IgG1.
В качестве альтернативы гуманизации, могут быть генерированы антитела человека. Например, в настоящее время возможно получать трансгенных животных (например, мышей), которые способны, при иммунизации, к продуцированию полного набора антител человека в отсутствие выработки эндогенных иммуноглобулинов. Например, было описано, что гомозиготная делеция гена соединяющей области с тяжелой цепью антитела (JH) в химерных и мутантных мышах зародышевой линии приводит в результате к полному ингибированию эндогенной выработки антител. Перенос генной матрицы иммуноглобулина человека зародышевой линии у таких мутантных мышей зародышевой линии будет приводить в результате к выработке антител человека при стимуляции антигеном. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year в Immuno. 7:33 (1993); патенты США №№ 5545806, 5569825, 5591669 (все от GenPharm); 5545807; и WO 97/17852.
Альтернативно, технология фагового отображения (McCafferty et al., Nature 348:552-553 [1990]) может применяться для выработки антител человека и фрагментов антител in vitro, из наборов генов вариабельного (V) домена иммуноглобулина от неиммунизированных доноров. В соответствии с этим методом, гены домена V антитела клонируют внутри рамки в либо основной или минорный ген покрывающего белка нитевидного бактериофага, такого как M13 или fd, и отображаются в виде функциональных фрагментов антитела на поверхности частиц фага. Поскольку нитевидная частица содержит однонитевую копию ДНК генома фага, селекции на основе функциональных свойств антител также приводят в результате к селекции гена, кодирующего антитело, проявляющего эти свойства. Таким образом, фаг имитирует некоторые из свойств B-клетки. Отображение фага может осуществляться в разнообразных форматах, рассмотренных в обзоре, например, у Johnson, Kevin S. и Chiswell, David J., Current Opinion в Structural Biology 3:564-571 (1993). Некоторые источники сегментов V-гена могут применяться для отображения фага. Clackson et al., Nature, 352:624-628 (1991) выделил разнообразный повтор антител против оксазолона из небольшой статистической комбинаторной библиотеки V генов, полученных из селезенок иммунизированных мышей. Может быть построен набор V генов от неиммунизированных доноров человека, и антитела к разнообразному повтору антигенов (включая само-антигены) может быть выделен, по существу следуя методам, описанным Marks et al., J. Mol. Biol. 222:581-597 (1991), или Griffith et al., EMBO J. 12:725-734 (1993). См. также патенты США №№ 5565332 и 5573905.
Как обсуждается выше, антитела человека также могут генерироваться посредством активированных in vitro B клеток (см. патенты США №№ 5567610 и 5229275).
4. Фрагменты антител
При некоторых обстоятельствах существуют преимущества использования фрагментов антител, в большей степени, чем цельных антител. Более мелкий размер фрагментов обеспечивает быстрое выведение и может приводить к улучшенному доступу к солидным опухолям.
Разнообразные методы были разработаны для получения фрагментов антител. Традиционно, эти фрагменты производили посредством протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal Biochemical and Biophysical Methods 24: 107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты в настоящее время могут быть получены непосредственно посредством рекомбинантных клеток-хозяев. Fab, Fv и ScFv фрагменты антител могут все экспрессироваться в и секретироваться из E. coli, таким образом, обеспечивая простое получение крупных количеств этих фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, Fab'-SH фрагменты могут быть непосредственно извлечены из E. coli и химически связаны с образованием фрагментов F(ab')2 (Carter et al., Bio/Technology 10: 163-167 (1992)). В соответствии с еще одним подходом, F(ab')2 фрагменты могут выделяться непосредственно из культуры рекомбинантных клеток-хозяев. Фрагмент Fab и F(ab')2 с увеличенным периодом полужизни in vivo, содержащий остатки эпитопа связывания рецептора спасения, описан в патенте США № 5869046. Другие методы получения фрагментов антитела будут очевидными для опытного практика. В других вариантах осуществления, антитело выбора представляет собой одноцепочечный Fv фрагмент (scFv). См. WO 93/16185; патент США № 5571894; и патент США № 5587458. Fv и sFv являются единственным видом с интактными комбинирующими участками, которые лишены константной области; таким образом, они являются подходящими для сниженного неспецифического связывания во время применения in vivo. Гибридные белки sFv могут быть построены, чтобы давать на выходе гибридизацию эффекторного белка по либо амино или карбокси концу sFv. См. Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела также может представлять собой "линейное антитело", например, как описано в патенте США № 5641870, например. Такие линейные фрагменты антитела могут быть моноспецифическими или биспецифическими.
5. Биспецифические антитела
Биспецифические антитела представляют собой антитела, которые имеют специфичности связывания для по меньшей мере двух различных эпитопов. Примерные биспецифические антитела могут связываться с двумя различными эпитопами TAT белка, как описано в настоящей заявке. Другие такие антитела могут сочетать ТАТ-связывающий участок с участком связывания для еще одного другого белка. Альтернативно, плечо против ТАТ может сочетаться с плечом, которое связывается с инициирующей молекулой на лейкоците, такой как молекула рецептора T-клетки (например CD3), или Fc рецепторы для IgG (FcyR), такие как FcyRI (CD64), FcyRII (CD32) и FcyRIII (CD16), так, чтобы сфокусировать и локализовать клеточные защитные механизмы по отношению к TAT-экспрессирующей клетке. Биспецифические антитела также могут применяться для локализации цитотоксических агентов к клеткам, которые экспрессируют TAT. Эти антитела обладают плечом TAT-связывания и плечом, которое связывает цитотоксический агент (например, сапорин, анти-интерферон-α, алкалоид барвинка, цепь рицина А, метотрексат или гаптен с радиоактивным изотопом). Биспецифические антитела могут быть получены как первичные антитела или фрагменты антитела (например, F(ab')2 биспецифические антитела).
WO 96/16673 описывает биспецифическое антитело против-ErbB2/против-FcYRIII и патент США № 5837234 раскрывает биспецифическое антитело против-ErbB2/против-FcyRI. Биспецифическое антитело против-ErbB2/Fca показано в WO 98/02463. Патент США № 5821337 излагает биспецифическое антитело против-ErbB2/против-CD3.
Способы получения биспецифических антител известны в данной области. Традиционное получение первичных биспецифических антител основано на co-экспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, где две цепи имеют различные специфичности (Millstein et al., Nature 305:537-539 (1983)). Вследствие статистического распределения тяжелых и легких цепей иммуноглобулина, эти гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна имеет корректные биспецифические структуры. Очистка корректной молекулы, которую обычно проводят посредством стадий аффинной хроматографии, является довольно трудоемкой, и выходы продукта являются низкими. Аналогичные методики раскрыты в WO 93/08829, и в Traunecker et al., EMBO J. 10:3655-3659 (1991).
В соответствии с отличным подходом, вариабельные домены антитела с желательными специфичностями связывания (комбинирующие участки антитело-антиген) являются рекомбинированными с последовательностями константного домена иммуноглобулина. Предпочтительно, гибридизация протекает с константным доменом тяжелой цепи Ig, содержащим по меньшей мере часть шарнирной, областей CH2 и CH3. Является предпочтительным иметь первую константную область с тяжелой цепью (CH1), содержащую участок, необходимый для связывания легкой цепи, присутствующей в по меньшей мере одном из гибридов. ДНК, кодирующие гибриды тяжелой цепи иммуноглобулина и, если желательно, легкую цепь иммуноглобулина, вводят в отдельные экспрессионные векторы, и co-трансфицируют в подходящую клетку-хозяина. Это предоставляет значительно большую гибкость при регулировке взаимных пропорций трех полипептидных фрагментов в вариантах осуществления, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, обеспечивают оптимальный выход желательного биспецифического антитела. Возможным, однако, является ввести кодирующие последовательности для двух или всех трех полипептидных цепей в единичный экспрессионный вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит в результате к высоким выходам или когда соотношения не имеют значительного воздействия на выход желательной комбинации цепей.
В предпочтительном варианте осуществления этого подхода, биспецифические антитела составлены из тяжелой цепи гибридного иммуноглобулина с первой специфичностью связывания в одном плече, и пары тяжелая цепь-легкая цепь гибридного иммуноглобулина (предоставляющей вторую специфичность связывания) в другом плече. Было обнаружено, что эта асимметрическая структура облегчает отделение желательного биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы предоставляет легкий путь разделения. Этот подход раскрыт в WO 94/04690. Дополнительные подробности по генерации биспецифических антител см., например, Suresh et al., Methods in Enzymology 121: 210 (1986).
В соответствии с еще одним подходом, описанном в патенте США № 5731168, граница раздела между парой молекул антитела может быть сконструирована для максимизации процентного содержания гетеродимеров, которые извлекают из рекомбинантной клеточной культуры. Предпочтительная граница раздела содержит, по меньшей мере часть CH3 домена. В этом способе, одну или более небольших аминокислотных боковых цепей от границы раздела первой молекулы антитела заменяют цепями более крупного размера (например, тирозин или триптофан). Компенсаторные "полости" идентичного или сходного размера к крупной боковой цепи(цепям) создаются на границе раздела второй молекулы антитела посредством замены крупных аминокислотных боковых цепей на более мелкие (например, аланин или треонин). Это предоставляет механизм для увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают сшитые или "гетероконъюгатные" антитела. Например, одно из антител в гетероконъюгате может сочетаться с авидином, другое с биотином. Такие антитела были, например, предложены для нацеливания клеток иммунной системы на нежелательные клетки (патент США № 4676980) и для лечения инфекции ВИЧ (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгатные антитела могут быть получены с использованием любых общепринятых способов сшивки. Подходящие сшивающие агенты являются хорошо известными в области и раскрыты в патенте США № 4676980, наряду с рядом способов сшивки.
Методы генерации биспецифических антител из фрагментов антител также были описаны в литературе. Например, биспецифические антитела могут быть получены с использованием химического связывания. Brennan et al., Science 229:81 (1985) описывают методику, где интактные антитела протеолитически расщепляются для генерации фрагментов F(ab')2. Эти фрагменты восстанавливают в присутствии дитиольного комплексообразующего агента, арсенита натрия, чтобы стабилизировать вицинальные дитиолы и предотвратить образование межмолекулярного дисульфида. Генерируемые Fab' фрагменты, затем преобразуют в тионитробензоатные (TNB) производные. Одно из Fab'-TNB производных затем повторно преобразуют в Fab'-тиол посредством восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого Fab'-TNB производного с образованием биспецифического антитела. Полученные биспецифические антитела могут применяться в качестве агентов для селективной иммобилизации ферментов.
Недавний прогресс облегчил прямое извлечение Fab'-SH фрагментов из E. coli, которые могут химически сочетаться с образованием биспецифических антител. Shalaby et al., J. Exp. Med. 175: 217-225 (1992) описывает получение молекулы полностью гуманизированного биспецифического антитела F(ab')2. Каждый Fab' фрагмент раздельно секретировался из E. coli и подвергался направленному химическому сочетанию in vitro с образованием биспецифического антитела. Биспецифическое антитело, таким образом полученное, было способно к связыванию с клетками, сверхэкспрессирующими рецептор ErbB2, и нормальными T клетками человека, а также инициировать литическую активность цитотоксических лимфоцитов человека против мишеней опухолей молочной железы человека. Разнообразные методы получения и выделения фрагментов биспецифических антител непосредственно из рекомбинантных клеточных культур также были описаны. Например, биспецифические антитела получали с использованием лейциновых "молний". Kostelny et al., J. Immunol. 148(5): 1547-1553 (1992). Лейциновые пептидные "молнии" из белков Fos и Jun связывали с Fab' частями двух различных антител посредством слияния генов. Гомодимеры антитела восстанавливали по шарнирной области с образованием мономеров и затем повторно окисляли с образованием гетеродимеров антитела. Этот способ может также применяться для получения гомодимеров антител. Технология "диатела", описанная Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993), предоставила альтернативный механизм для получения фрагментов биспецифических антител. Фрагменты содержат VH, соединенный с VL посредством линкера, который является слишком коротким, чтобы обеспечить образование пар между двумя доменами на одной и той же цепи. Соответственно, VH и VL домены одного фрагмента принуждаются образовать пару с комплементарными VL и VH доменами еще одного фрагмента, посредством этого образуя два антиген-связывающих участка. Также сообщается о еще одной стратегии получения фрагментов биспецифических антител посредством применения одноцепочечных Fv (sFv) димеров. См. Gruber et al., J. Immunol, 152:5368 (1994).
Рассматриваются антитела с более чем двумя валентностями. Например, могут быть получены триспецифические антитела. Tutt et al., J. Immunol. 147:60 (1991).
6. Гетероконъюгатные антитела
Гетероконъюгатные антитела также находятся в пределах объема настоящего изобретения. Гетероконъюгатные антитела составлены из двух ковалентно соединенных антител. Такие антитела были, например, предложены для нацеливания клеток иммунной системы клетки на нежелательные клетки [Патент США № 4676980], и для лечения ВИЧ-инфекции [WO 91/00360; WO 92/200373; EP 03089]. Предусматривается, что антитела могут быть получены in vitro с использованием известных способов в синтетической химии белка, включая способы, включающие в себя сшивающие агенты. Например, иммунотоксины могут быть построены с использованием реакции дисульфидного обмена или посредством образования связи. Примеры подходящих реагентов для данной цели включают иминотиолат и метил-4-меркаптобутиримидат и реагенты, раскрытые, например, в патенте США № 4676980.
7. Поливалентные антитела
Поливалентное антитело может быть интернализировано (и/или катаболизировано) быстрее, чем бивалентное антитело клеткой, экспрессирующей антиген, с которой антитела связываются. Антитела настоящего изобретения могут представлять собой поливалентные антитела (которые отличаются от класса IgM) тремя или более антиген-связывающими участками (например, тетравалентные антитела), которые могут быть легко получены посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антиген-связывающих участков. Предпочтительный домен димеризации содержит (или состоит из) Fc-области или шарнирной области. По этому сценарию, антитело будет содержать Fc-область и три или более антиген-связывающих участков амино-концевых по отношению к Fc-область. Предпочтительное поливалентное антитело в настоящей заявке содержит (или состоит из) от трех до приблизительно восьми, но, предпочтительно, четырех, антиген-связывающих участков. Поливалентное антитело содержит по меньшей мере одну полипептидную цепь (и, предпочтительно, две полипептидных цепи), где полипептидные цепь (цепи) содержат два или более вариабельных домена. Например, полипептидные цепь (цепи) могут содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 является первым вариабельным доменом, VD2 является вторым вариабельным доменом, Fc является одной полипептидной цепью Fc-области, X1 и X2 представляют аминокислоту или полипептид, и n равно 0 или 1. Например, полипептидные цепь (цепи) могут содержать: VH-CH1-гибкую цепь линкер-VH-CH1-Fc-области; или цепь VH-CH1-VH-CH1-Fc-области. Поливалентное антитело в настоящей заявке, предпочтительно, дополнительно содержит по меньшей мере два (и, предпочтительно, четыре) полипептида вариабельного домена с легкой цепью. Поливалентное антитело в настоящей заявке может, например, содержать от приблизительно двух до приблизительно восьми полипептидов вариабельного домена с легкой цепью. Полипептиды вариабельного домена с легкой цепью, предусмотренные в настоящей заявке, содержат вариабельный домен с легкой цепью и, необязательно, дополнительно содержат CL домен.
8. Конструирование эффекторной функции
Может быть желательным модифицировать антитело изобретения по отношению к эффекторной функции, например, таким образом, чтобы усилить антиген-зависимую клеточно-опосредованную цитотоксичность (ADCC) и/или комплемент-зависимую цитотоксичность (CDC) антитела. Это может достигаться посредством введения одной или более аминокислотных замен в Fc-области антитела. Альтернативно или дополнительно, цистеиновые остаток(остатки) могут быть введены в Fc-область, посредством этого обеспечивая образование межцепной дисульфидной связи в этой области. Гомодимерное антитело, таким образом генерируемое, может иметь улучшенную способность к интернализации и/или увеличенные комплемент-опосредованное уничтожение клеток и антитело-зависимую клеточную цитотоксичность (ADCC). См. Caron et al., J. Exp Med. 176: 1191-1195 (1992) и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с усиленной противоопухолевой активностью также могут быть получены с использованием гетеробифункциональных кросс-линкеров, как описано у Wolff et al., Cancer Research 53:2560-2565 (1993). Альтернативно, может быть сконструировано антитело, которое имеет двойные Fc-области и может посредством этого иметь усиленные лизис комплемента и способности ADCC. См. Stevenson et al., Anti-Cancer Drug Design 3:219-230 (1989). Чтобы увеличить период полужизни антитела в сыворотке, можно ввести эпитоп, связывающий рецептор реутилизации в антитело (особенно фрагмент антитела), как описано в патенте США 5739277, например. Как используют в настоящей заявке, термин "эпитоп, связывающий рецептор реутилизации" относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2 IgG3 или IgG4), который отвечает за увеличение периода полужизни в сыворотке молекулы IgG.
9. Иммуноконъюгаты
Изобретение также касается иммуноконъюгатов, содержащих антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, агент, ингибирующий рост, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или их фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
Химиотерапевтические агенты, применимые в генерации таких иммуноконъюгатов, были описаны выше. Ферментативно активные токсины и их фрагменты, которые могут применяться, включают цепь дифтерии А, несвязывющие активные фрагменты дифтерийного токсина, цепь экзотоксина А (из Pseudomonas aeruginosa), цепь рицина А, цепь абрина А, цепь модессина А, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор момордики харантской, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Разнообразные радионуклиды являются доступными для получения радиоконъюгированных антител. Примеры включают212Bi,131I,131In,90Y и186Re. Конъюгаты антитела и цитотоксического агента получают с использованием разнообразных бифункциональных агентов сочетания белков, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис(п-азидобензоил) гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен, как описано у Vitetta et al., Science, 238: 1098 (1987). Углерод-14-меченая 1-изотиоцианатобензил-3-метилдиэтилен триаминпентауксусная кислота (MX-DTPA) представляет собой примерный хелатирующий агент для конъюгации радионуклеотида с антителом. См. WO 94/11026.
Конъюгаты антитела и одного или более низкомолекулярных токсинов, таких как калихеамицин, майтансиноиды, трихотен и CC1065, и производных этих токсинов, которые имеют активность токсина, также рассматриваются в настоящей заявке.
Майтансин и майтансиноиды
В одном предпочтительном варианте осуществления, антитело против ТАТ (первичное или фрагменты) изобретения являются конъюгированными с одной или более молекулами майтансиноида.
Майтансиноиды представляют собой митотические ингибиторы, которые действуют посредством ингибирования полимеризации тубулина. Майтансин был впервые выделен из восточноафриканского кустарника tenus serrata (патент США № 3896111). Впоследствии, было обнаружено, что некоторые микробы также продуцируют майтансиноиды, такие как майтансинол и C-3 сложные эфиры майтансинола (патент США № 4151042). Синтетический майтансинол и его производные и аналоги раскрыты, например, в патентах США №№ 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663; и 4371533, раскрытия которых включены в настоящей заявке намеренно посредством ссылки.
Конъюгаты майтансиноид-антитело
В попытке улучшить их терапевтический показатель, майтансин и майтансиноиды были конъюгированы антителами, специфически связывающимися с антигенами опухолевых клеток. Иммуноконъюгаты, содержащие майтансиноиды, и их терапевтическое применение, раскрыты, например, в патентах США №№ 5208020, 5416064 и Европейском патенте EP 0425235 B1, раскрытия которых включены в настоящей заявке намеренно посредством ссылки. Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описал иммуноконъюгаты, содержащие майтансиноид, обозначенный DM1, связанный с моноклональным антителом C242, направленным против колоректального рака человека. Было обнаружено, что конъюгат является высокоцитотоксическим по отношению к культивируемым клеткам рака толстой кишки, и демонстрирует противоопухолевую активность при анализе опухолевого роста in vivo. Chari et al., Cancer Research 52: 127-131 (1992) описывают иммуноконъюгаты, в которых майтансиноид был конъюгирован через дисульфидный линкер с мышиным антителом A7, связывающимся с антигеном клеточных линиях рака толстой кишки человека, или с еще одним мышиным моноклональным антителом, TA.1, которое связывает онкоген HER-2/neu. Цитотоксичность конъюгата TA.1-майтансиноид тестировали in vitro на клеточных линиях рака молочной железы человека SK-BR-3, которые экспрессируют 3 × 105 поверхностных антигенов HER-2 на клетку. Лекарственный конъюгат достигал степени цитотоксичности, сходной с несвязанным майтансиноидным лекарственным средством, которая может быть увеличена посредством увеличения числа молекул майтансиноида на молекулу антитела. A7-майтансиноидный конъюгат показал низкую системную цитотоксичность у мышей.
Конъюгаты антитело против полипептида ТАТ-майтансиноид (иммуноконъюгаты)
Конъюгаты антитело против ТАТ-майтансиноид получают посредством химического связывания антитела против-TAT с молекулой майтансиноида без существенного снижения биологической активности либо антитела или молекулы майтансиноида. В среднем 3-4 молекулы майтансиноида, конъюгированные на молекулу антитела показали эффективность при усилении цитотоксичности для целевых клеток без отрицательного воздействия на функцию или растворимость антитела, несмотря на то, что даже от одной молекулы токсина/антитела можно было бы ожидать усиления цитотоксичности по сравнению с применением оголенного антитела. Майтансиноиды являются хорошо известными в области и могут быть синтезированы известными методами или выделены из природных источников. Подходящие майтансиноиды раскрыты, например, в патенте США № 5208020 и в других патентах и непатентных публикациях, на которые в настоящей заявке ссылаются выше. Предпочтительные майтансиноиды представляют собой майтансинол и аналоги майтансинола, модифицированные в ароматическом кольце или по другим положениям молекулы майтансинола, такие как разнообразные сложные эфиры майтансинола.
Существует много связывающих групп, известных в данной области, для получения конъюгатов антитело-майтансиноид, включающих, например, группы, раскрытые в патенте США № 5208020 или EP Патенте 0425235B1, Chari et al., Cancer Research 52: 127-131 (1992), и Заявке на патент США № 10/960,602, поданной 8 октября 2004 г., раскрытия которых включены в настоящей заявке намеренно посредством ссылки. Конъюгаты антитело-майтансиноид, содержащие линкерный компонент SMCC, могут быть получены как раскрыто в Заявке на патент США № 10/960602, поданной 8 октября 2004 г. Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, группы, лабильные к действию пептидазы, или группы, лабильные к действию эстеразы, как раскрыто в идентифицированных выше патентах, причем дисульфидные и тиоэфирные группы являются предпочтительными. Дополнительные связывающие группы в настоящей заявке описаны и приведены в качестве примеров.
Конъюгаты антитела и майтансиноида могут быть получены с использованием разнообразных бифункциональных агентов сочетания белков, таких как N-сукцинимидил-3-(2-пиридилдитио) пропионат (SPDP), сукцинимидил-4-(N-малеимидометил) циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат HCL), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Конкретно, предпочтительные агенты сочетания включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для предоставления дисульфидного связывания.
Линкер может быть присоединен к молекуле майтансиноида в разнообразных положениях, в зависимости от типа связывания. Например, сложноэфирное связывание может быть образовано посредством реакции с гидроксильной группой с использованием общепринятых методов сочетания. Реакция может происходить по C-3 положению, имеющему гидроксильную группу, C-14 положению, модифицированному гидроксиметилом, C-15 положению, модифицированному гидроксильной группой, и C-20 положению, имеющему гидроксильную группу. В предпочтительном варианте осуществления, связывание образовано по C-3 положению майтансинола или аналога майтансинола.
Ауристатины и долостатины
В некоторых вариантах осуществления, иммуноконъюгат содержит антитело изобретения, конъюгированное с долостатинами или пептидными аналогами и производными долостатина, ауристатинами (патенты США №№ 5635483; 5780588). Было показано, что долостатины и ауристатины оказывают воздействие на динамику микротрубочек, гидролиз М и ядерное и клеточное деление (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и имеют противораковую (патент США 5663149) и противогрибковую активность (Pettit et al (1998) Antimicrob. Agents and Chemother. 42:2961-2965). Фрагмент лекарственного средства доластатина или ауристатина может быть присоединен к антителу через N (амино) конец или C (карбоксил) конец фрагмента пептидного лекарственного средства (WO 02/088172).
Примерные варианты осуществления ауристатина включают связанные через N-конец фрагменты DE и DF лекарственного средства монометилауристатина (т.е. MMAE и MMAF), раскрытого в "Senter et al., Proceedings American Association for Cancer Research, Volume 45, Abstract Number 623, представленного 28 Марта, 2004 г., раскрытие которого намеренно включено посредством ссылки во всей его полноте.
Типично, фрагменты лекарственных средств на основе пептидов могут быть получены посредством образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть получены, например, в соответствии со способом жидкофазного синтеза (см. E. Schroder and K. Lubke, "The Petides", volume 1, pp 76-136, 1965, Academic Press), которые являются хорошо известными в области пептидной химии. Фрагменты лекарственных средств на основе ауристатина/доластатина могут быть получены в соответствии со способами: патент США 5635483; патент США 5780588; Pettit et al (1989) J. Am. Chem. Soc. 111:5463-5465; Pettit et al (1998) Anti-Cancer Drug Design 13:243-277; Pettit, G.R., et al. Synthesis, 1996, 719-725; Pettit et al (1996) J. Chem. Soc. Perkin Trans. 1 5:859-863; и Doronina (2003) Nat Biotechnol 21(7):778-784.
Калихеамицин
Еще один другой иммуноконъюгат, представляющий интерес, содержит антитело против ТАТ, конъюгированное с одной или более молекулами калихеамицина. Антибиотики семейства калихеамицинов обладают способностью производить разрывы в двухцепочечных ДНК при суб-пикомолярных концентрациях. По получению конъюгатов семейства калихеамицинов, см. патенты США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все на имя American Cyanamid Company). Структурные аналоги калихеамицина, которые могут применяться, включают, но не ограничены лишь ими, γ1I, α2Ι, α3Ι, N-ацетил-γ1Ι, PSAG и θΙ1 (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и указанные выше патенты США на имя American Cyanamid). Еще одно другое противоопухолевое лекарственное средство, в котором антитело может быть конъюгировано, представляет собой QFA, который является антифолатом. Как калихеамицин, так и QFA имеют внутриклеточные участки действия и нелегко пересекают плазматическую мембрану. Следовательно, клеточный захват этих агентов через опосредованную антителом интернализацию значительно усиливает их цитотоксические эффекты.
Другие цитотоксические агенты
Другие противоопухолевые агенты, которые могут быть конъюгированы с антителами против ТАТ изобретения, включают BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство агентов, известное совместно как комплекс LL-E33288, описанный в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые может применяться, включают цепь дифтерии А, несвязывающиеся активные фрагменты дифтерийного токсина, цепь экзотоксина А (из Pseudomonas aeruginosa), цепь рицина А, цепь абрина А, цепь модессина А, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII, и PAP-S), ингибитор момордики харантской, курцин, кротин, ингибитор sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, WO 93/21232 опубликована 28 октября, 1993.
Настоящее изобретение дополнительно предусматривает иммуноконъюгат, образованный между антителом и соединением с нуклеодитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для селективной деструкции опухоли, антитело может содержать высокорадиоактивный атом. Разнообразные радиоактивные изотопы являются доступными для получения радиоконъюгированных антител против ТАТ. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда конъюгат применяют для диагностики, он может содержать радиоактивный атом для сцинтиграфических исследований, например, Tc99m или I123 или спиновую метку для визуализации методом ядерного магнитного резонанса (ЯМР) (также известного как магнитно-резонансная визуализация, МРТ), такой как снова йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть введены в конъюгат известными путями. Например, пептид может быть биосинтезирован или может быть синтезирован посредством химического аминокислотного синтеза с использованием подходящих аминокислотных предшественников, включающих в себя, например, фтор-19 вместо водорода. Метки, такие как Tc99m или I123, Re186, Re188 и In111 могут быть присоединены через цистеиновый остаток в пептид. Иттрий-90 может быть присоединен через лизиновый остаток. Метод IODOGEN (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57 может применяться для введения йода-123. "Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) подробно описывает другие методы.
Конъюгаты антитела и цитотоксического агента могут быть получены с использованием разнообразных бифункциональных агентов сочетания белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметил адипимидат HCL), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианаты) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен, как описано в Vitetta et al., Science 238: 1098 (1987). Углерод-14-меченая 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примерным хелатирующим агентом для конъюгации радионуклеотида с антителом. См. W094/11026. Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, может применяться кислото-лабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, диметиловый линкер или дисульфид-содержащий линкер (Chari et al., Cancer Research 52: 127-131 (1992); патент США № 5208020).
Соединения изобретения намеренно предусматривают, но не ограничены лишь ими, ADC, полученные с помощью кросс-линкерных реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, и сульфо-SMPB, и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются доступными на рынке (например, от Pierce Biotechnology, Inc., Rockford, IL., U.S.A). См. страницы 467-498, 2003-2004 Справочник по применению и Каталог.
Альтернативно, гибридный белок, содержащий антитело против ТАТ и цитотоксический агент, может быть получен, например, посредством рекомбинантных методов или пептидного синтеза. Длина ДНК может содержать соответствующие области, кодирующие две части конъюгата, либо смежные с еще одной или разделенные областью, кодирующей линкерный пептид, который не нарушает желательные свойства конъюгата.
В еще одном другом варианте осуществления, антитело может быть конъюгированным с "рецептором" (таким как стрептавидин) для использования в предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту, с последующим удалением несвязанного конъюгата из кровообращения с использованием очищающего агента и введением затем "лиганда" (например, авидина), который является конъюгированным с цитотоксическим агентом (например, радионуклеотидом).
10. Иммунолипосомы
Антитела против ТАТ, описанные в настоящей заявке, могут также быть составлены как иммунолипосомы. "Липосома" представляет собой небольшой пузырек, составленный из разнообразных типов липидов, фосфолипидов и/или поверхностно-активного вещества, который является применимым для доставки лекарственного средства млекопитающему. Компоненты липосомы обычно расположены в бислойном образовании, аналогичном липидному расположению биологических мембран. Липосомы, содержащие антитело, получают посредством способов, известных в данной области, таких, как описаны у Epstein et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA 77:4030 (1980); патенты США №№ 4485045 и 4544545; и W097/38731, опубликованная 23 октября 1997 г. Липосомы с увеличенным временем циркуляции раскрыты в патенте США № 5013556.
Особенно применимые липосомы могут быть генерированы посредством метода испарения с обращенной фазой с липидной композицией, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизированный фосфатидилэтаноламин (ПЭГ-ФЭ). Липосомы подвергают экструзии через фильтры с определенным размером пор для получения на выходе липосом с желательным диаметром. Fab' фрагменты антител настоящего изобретения могут быть конъюгированы с липосомами, как описано у Martin et al., J. Biol. Chem. 257:286-288 (1982) через реакцию дисульфидного взаимообмена. Химиотерапевтический агент необязательно содержится внутри липосом. См. Gabizon et al., J. National Cancer Inst. 81(19): 1484 (1989).
B. ТАТ-связывающие олигопептиды
ТАТ-связывающие олигопептиды настоящего изобретения представляют собой олигопептиды, которые связываются, предпочтительно, специфически, с полипептидом ТАТ, как описано в настоящей заявке. ТАТ-связывающие олигопептиды могут быть химически синтезированы с использованием известной методологии олигопептидного синтеза или могут быть получены и очищены с использованием рекомбинантной технологии. ТАТ-связывающие олигопептиды обычно состоят из по меньшей мере приблизительно 5 аминокислот по длине, альтернативно по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислот по длине или более, где такие олигопептиды обладают способностью к связыванию, предпочтительно, специфически, с полипептидом ТАТ, как описано в настоящей заявке. ТАТ-связывающие олигопептиды могут быть идентифицированы без излишнего экспериментирования с использованием хорошо известных методов. В этом отношении, отмечают, что методы для скрининга олигопептидных библиотек для олигопептидов, которые обладают способностью к специфическому связыванию с полипептидной мишенью, являются хорошо известными в области (см., например, патенты США №№ 5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; Публикации заявок РСТ №№ WO 84/03506 и WO 84/03564; Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984); Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 82: 178-182 (1985); Geysen et al., в Synthetic Peptides as Antigens, 130-149 (1986); Geysen et al., J. Immunol. Meth., 102:259-274 (1987); Schoofs et al., J. Immunol., 140:611- 616 (1988), Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378; Lowman, H.B. et al. (1991) Biochemistry, 30: 10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol, 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363, и Smith, G. P. (1991) Current Opin. Biotechnol., 2:668).
В этом отношении, отображение бактериофага (фага) является одним хорошо известным методом, который позволяет проводить скрининг крупных олигопептидных библиотек для идентификации элемента(элементов) этих библиотек, которые обладают способностью к специфическому связыванию с полипептидной мишенью. Отображение фага является методом, посредством которого вариантные полипептиды отображаются как гибридные белки с покрывающим белком на поверхности частиц бактериофага (Scott, J.K. и Smith, G. P. (1990) Science 249: 386). Применимость фагового отображения основана на том факте, что крупные библиотеки селективно рандомизированных белковых вариантов (или статистически клонированных кДНК) могут быть быстро и эффективно отсортированы по тем последовательностям, которые связываются с целевой молекулой с высоким сродством. Отображение пептидных (Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378) или белковых (Lowman, H.B. et al. (1991) Biochemistry, 30: 10832; Clackson, T. et al. (1991) Nature, 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol, 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363) библиотек на фаг использовали для скрининга миллионов полипептидов или олигопептидов для тех, которые обладают свойствами специфического связывания (Smith, G. P. (1991) Current Opin. Biotechnol, 2:668). Сортировка фаговых библиотек статистических мутантов требует стратегии для построения и размножения большого числа вариантов, методики аффинной очистки с использованием целевого рецептора и средств оценки результатов обогащения по связыванию. патенты США №№ 5223409, 5403484, 5571689 и 5663143.
Несмотря на то, что в большинстве способов фагового отображения использовали нитевидный фаг, также известны системы отображения лямбдоидного фага (WO 95/34683; Патент США № 5,627,024), системы отображения T4 фага (Ren et al., Gene, 215: 439 (1998); Zhu et al., Cancer Research, 58(15): 3209-3214 (1998); Jiang et al., Infection & Immunity, 65(11): 4770-4777 (1997); Ren et al., Gene, 195(2):303-311 (1997); Ren, Protein Sci., 5: 1833 (1996); Efimov et al., Virus Genes, 10: 173 (1995)) и системы отображения T7 фага (Smith и Scott, Methods in Enzymology, 217: 228-257 (1993); патент США № 5766905).
В настоящее время разработано много других улучшений и вариаций основной концепции фагового отображения. Эти улучшения усиливают способность систем отображения проводить скрининг пептидных библиотек на предмет связывания с выбранными целевыми молекулами и отображать функциональные белки с возможностью скрининга этих белков на предмет желательных свойств. Комбинаторные реакционные устройства для реакций фагового отображения были разработаны (WO 98/14277) и библиотеки отображения фагов применялись для анализа и управления бимолекулярных взаимодействий (WO 98/20169; WO 98/20159) и свойствами напряженных спиральных пептидов (WO 98/20036). WO 97/35196 описывает способ выделения аффинного лиганда, в котором библиотека отображения фага контактирует с одним раствором, в котором лиганд будет связываться с целевой молекулой, и второй раствор, в котором аффинный лиганд не будет связываться с целевой молекулой, чтобы селективно выделить связывающиеся лиганды. WO 97/46251 описывает способ биопэннинга статистической библиотеки отображения фага с сродство очищенным аффинным антителом, и затем выделения связывающего фага, с последующим способом микропэннинга с использованием лунок микропланшета для выделения фага с высоким сродством связывания. Также сообщалось о применении белка А Staphylococcus aureus в качестве аффинной метки (Li et al. (1998) Mol Biotech., 9: 187). WO 97/47314 описывает применение библиотек вычитания субстрата для различения специфичностей фермента с использованием комбинаторной библиотеки, которая может быть библиотекой отображения фагов. Способ отбора ферментов, подходящих для применения в детергентах с использованием отображения фагов, описан в WO 97/09446. Дополнительные способы отбора белков со специфическим связыванием описаны в патентах США №№ 5498538, 5432018 и WO 98/15833.
Способы генерации пептидных библиотек и скрининга этих библиотек также раскрыты в патентах США №№ 5723286, 5432018, 5580717, 5427908, 5498530, 5770434, 5734018, 5698426, 5763192 и 5723323.
C. ТАТ-связывающие органические молекулы
ТАТ-связывающие органические молекулы представляют собой органические молекулы, отличные от олигопептидов или антител, как определено в настоящей заявке, которые связываются, предпочтительно, специфически, с полипептидом ТАТ, как описано в настоящей заявке. ТАТ-связывающие органические молекулы могут быть идентифицированы и химически синтезированы с использованием известной методологии (см., например, Публикации заявок РСТ №№ WO 00/00823 и WO 00/39585). ТАТ-связывающие органические молекулы имеют обычно меньше, чем приблизительно 2000 Дальтонов в размере, альтернативно, меньше, чем приблизительно 1500, 750, 500, 250 или 200 Дальтонов в размере, где такие органические молекулы, которые обладают способностью к связыванию, предпочтительно, специфически, с полипептидом ТАТ, как описано в настоящей заявке, могут быть идентифицированы без излишнего экспериментирования с использованием хорошо известных методов. В этом отношении, отмечают, что методы для скрининга библиотек органических молекул на предмет молекул, которые обладают способностью к связыванию с полипептидной мишенью, являются хорошо известными в области (см., например, Публикации заявок РСТ №№ WO 00/00823 и WO 00/39585). ТАТ-связывающие органические молекулы могут представлять собой, например, альдегиды, кетоны, оксимы, гидразоны, семикарбазоны, карбазиды, первичные амины, вторичные амины, третичные амины, N-замещенные гидразины, гидразиды, спирты, эфиры, тиолы, тиоэфиры, дисульфиды, карбоновые кислоты, сложные эфиры, амиды, мочевины, карбаматы, карбонаты, кетали, тиокетали, ацетали, тиоацетали, арилгалогениды, арилсульфонаты, алкилгалогениды, алкилсульфонаты, ароматические соединения, гетероциклические соединения, анилины, алкены, алкины, диолы, аминоспирты, оксазолидины, оксазолины, тиазолидины, тиазолины, енамины, сульфонамиды, эпоксиды, азиридины, изоцианаты, сульфонилхлориды, диазосоединения, ацилхлориды или т.п.
D. Скрининг антител против ТАТ, ТАТ-связывающих олигопептидов и TAT-связывающих органических молекул с желательными свойствами
Методы генерации антител, олигопептидов и органических молекул, которые связываются с полипептидами ТАТ, были описаны выше. Можно, по желанию, дополнительно проводить отбор антител, олигопептидов или других органических молекул с определенными биологическими характеристиками.
Эффекты ингибирования роста от антитела против ТАТ, олигопептида или другой органической молекулы изобретения могут быть оценены способами, известными в данной области, например, с использованием клеток, которые экспрессируют полипептид ТАТ либо эндогенно или после трансфекции геном TAT. Например, соответствующие линии опухолевых клеток и TAT-трансфицированные клетки могут быть обработаны моноклональным антителом против ТАТ, олигопептидом или другой органической молекулой изобретения при разнообразных концентрациях в течение нескольких дней (например, 2-7) дней и окрашены кристаллическим фиолетовым или MTT или проанализированы посредством некоторого другого колориметрического анализа. Еще один другой способ измерения пролиферации может быть осуществлен посредством сравнения захвата3H-тимидина клетками, обработанными в присутствии или отсутствии антитела против ТАТ, ТАТ-связывающего олигопептида или ТАТ-связывающей органической молекулы изобретения. После обработки, клетки собирают и количество радиоактивности, введенное в ДНК, количественно определяют в сцинтилляционном счетчике. Соответствующие положительные контроли включают обработку выбранной клеточной линии антителом, ингибирующим рост, известным как ингибирующее рост этой клеточной линии. Ингибирование роста опухолевых клеток in vivo может быть определено разнообразными путями, известными в данной области. Предпочтительно, опухолевая клетка является клеткой, которая сверхэкспрессирует полипептид ТАТ. Предпочтительно, антитело против ТАТ, ТАТ-связывающий олигопептид или ТАТ-связывающая органическая молекула будут ингибировать клеточную пролиферацию TAT-экспрессирующих опухолевых клеток in vitro или in vivo на приблизительно 25-100% по сравнению с необработанной опухолевой клеткой, более предпочтительно, на приблизительно 30-100%, и даже более предпочтительно, на приблизительно 50-100% или 70-100%, в одном варианте осуществления, при концентрации антитела, равной приблизительно от 0,5 до 30 мкг/мл. Ингибирование роста может быть измерено при концентрации антитела, равной приблизительно от 0,5 до 30 мкг/мл или приблизительно от 0,5 нМ до 200 нМ в культуре клеток, где ингибирование роста определяют через 1-10 дней после подвергания опухолевых клеток воздействию антитела. Антитело является ингибирующим рост in vivo, если введение антитела против ТАТ при приблизительно от 1 мкг/кг до приблизительно 100 мг/кг массы тела приводит в результате к снижению размера опухоли или уменьшению пролиферации опухолевых клеток в пределах приблизительно от 5 дней до 3 месяцев от первого введения антитела, предпочтительно, в пределах от приблизительно 5 до 30 дней.
Для отбора антитела против ТАТ, ТАТ-связывающего олигопептида или ТАТ-связывающей органической молекулы, которая индуцирует смерть клеток, потерю целостности мембраны на что указывает, например, поглощение пропидиййодида (ПИ), трипанового синего или 7AAD может быть оценена относительно контроля. Анализ поглощения ПИ может быть осуществлен в отсутствие комплемента и иммунных эффекторных клеток. Полипептид ТАТ-экспрессирующие опухолевые клетки инкубируют со средой по отдельности или средой, содержащей соответствующее антитело против ТАТ (например, при приблизительно 10 мкг/мл), ТАТ-связывающий олигопептид или ТАТ-связывающую органическую молекулу. Клетки инкубируют в течение 3-дневного периода времени. После каждой обработки, клетки отмывают и аликвотируют в 35 мМ закупированные стекателем пробирки 12 × 75 (1 мл на пробирку, 3 пробирки на группу обработки) для удаления сгустков клеток. В пробирки затем вводят ПИ (10 мкг/мл). Образцы могут быть проанализированы с использованием проточного цитометра FACSCAN® и программного обеспечения FACSCONVERT® CellQuest (Becton Dickinson). Те антитела против ТАТ, ТАТ-связывающих олигопептидов или ТАТ-связывающих органических молекул, которые индуцируют статистически значимые уровни смерти клеток, как определяют посредством поглощения ПИ, могут быть отобраны как индуцирующие смерть клеток антитела против ТАТ, ТАТ-связывающие олигопептиды или ТАТ-связывающие органические молекулы.
Для скрининга антител, олигопептидов или других органических молекул, которые связываются с эпитопом на полипептиде ТАТ, связанном антителом, представляющим интерес, может осуществляться рутинный эпитоп-перекрестный конкурентный анализ, такой как описан в Antibodies, Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow и David Lane (1988). Этот анализ может применяться, чтобы определить связывается ли тестируемое антитело, олигопептид или другая органическая молекула с тем же участком или эпитопом, как известное антитело против ТАТ. Альтернативно, или дополнительно, картирование эпитопа может осуществляться способами, известными в данной области. Например, последовательность антитела может быть мутагенизирована таким образом, как посредством сканирования аланином, для идентификации контактных остатков. Мутантное антитело первоначально тестируют на предмет связывания с поликлональным антителом для гарантии необходимой складчатости. При отличном способе, пептиды, соответствующие различным областям полипептида ТАТ, могут применяться в конкурентных анализах с тестируемыми антителами или с тестируемым антителом и антителом с охарактеризованным или известным эпитопом.
E. Антитело-зависимая опосредованная ферментами пролекарственная терапия (ADEPT)
Антитела настоящего изобретения также могут применяться в ADEPT посредством конъюгации антитела с пролекарство-активирующим ферментом, который преобразует пролекарство (например, пептидильный химиотерапевтический агент, см. WO 81/01145) в активное противораковое лекарственное средство. См., например, WO 88/07378 и патент США № 4975278.
Ферментный компонент иммуноконъюгата, применимый для ADEPT, включает любой фермент, способный к действию на пролекарство, таким образом, чтобы преобразовать его в более активную, цитотоксическую форму.
Ферменты, которые являются применимыми в способе данного изобретения, включают, но не ограничены лишь ими, щелочную фосфатазу, применимую для преобразования фосфат-содержащих пролекарств в свободные лекарственные средства; арилсульфатазу, применимую для преобразования сульфат-содержащих пролекарств в свободные лекарственные средства; цитозиндеаминазу, применим для преобразования нетоксичного 5-фторцитозина в противораковое лекарственное средство, 5-фторурацил; протеазы, такие как протеаза серратии, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины B и L), которые являются применимыми для преобразования пептидсодержащих пролекарств в свободные лекарственные средства; D-аланилкарбоксипептидазы, применимые для преобразования пролекарств, которые содержат D-аминокислотные заместители; углевод-расщепляющие ферменты, такие как β-галактозидаза и нейраминидаза, применимые для преобразования гликозилированных пролекарств в свободные лекарственные средства; β-лактамазу, применимую для преобразования лекарственных средств, дериватизированных β-лактамами, в свободные лекарственные средства; и пенициллинамидазы, такие как амидаза пенициллина V или амидаза пенициллина G, применимые для преобразования лекарственных средств, дериватизированных по их аминным азотам феноксиацетильными или фенилацетильными группами, соответственно, в свободные лекарственные средства. Альтернативно, антитела с ферментативной активностью, также известные в данной области как "абзимы", могут применяться для преобразования пролекарств изобретения в свободные активные лекарственные средства (см., например, Massey, Nature 328:457-458 (1987)). Конъюгаты антитело-абзим могут быть получены, как описано в настоящей заявке, для доставки абзима в популяцию опухолевых клеток. Ферменты данного изобретения могут быть ковалентно связаны с антителами против ТАТ, посредством методов, хорошо известных в данной области, таких как применение гетеробифункциональных сшивающих реагентов, обсуждаемых выше. Альтернативно, гибридные белки, содержащие по меньшей мере антигенсвязывающую область антитела изобретения, связанную с по меньшей мере функционально активной частью фермента изобретения, могут быть построены с использованием методов рекомбинантной ДНК, хорошо известных в данной области (см., например, Neuberger et al., Nature 312:604-608 (1984).
F. Непроцессированные полипептиды ТАТ
Настоящее изобретение также предоставляет недавно идентифицированные и выделенные нуклеотидные последовательности, кодирующие полипептиды, именуемые в настоящей заявке как полипептиды ТАТ. Конкретно, кДНК (частичные и первичные), кодирующие разнообразные полипептиды ТАТ, были идентифицированы и выделены, как раскрыто дополнительно в подробностях в Примерах, приведенных ниже.
Как раскрыто в Примерах ниже, разнообразные клоны кДНК были депонированы в ATCC. Действительные нуклеотидные последовательности этих клонов могут быть легко определены квалифицированным специалистом в области посредством секвенирования депонированного клона с использованием рутинных способов в данной области. Предсказанная аминокислотная последовательность может быть определена из нуклеотидной последовательности с использованием рутинной квалификации. Для полипептидов ТАТ и кодирующих нуклеиновых кислот, описанных в настоящей заявке, в некоторых случаях, заявители идентифицировали, что, как полагают, является рамкой считывания, наилучшим образом идентифицируемой с информацией о последовательности, доступной в настоящее время.
G. Антитело против ТАТ и вариантные полипептиды ТАТ
В дополнение к антителам против ТАТ и непроцессированным полипептидам ТАТ с нативной последовательностью, описанным в настоящей заявке, предусматривают, что могут быть получены антитело против ТАТ и вариантные полипептиды ТАТ. Антитело против ТАТ и вариантные полипептиды ТАТ могут быть получены посредством введения соответствующих нуклеотидных изменений в кодирующую ДНК, и/или посредством синтеза желательных антитела или полипептида. Квалифицированные специалисты в области оценят, что аминокислотные изменения могут изменить пост-трансляционные процессы антитела против ТАТ или полипептида ТАТ, такие как изменения числа или положения участков гликозилирования или изменения мембран-закрепляющих характеристик.
Вариации в антителах против ТАТ и полипептидах ТАТ, описанных в настоящей заявке, могут быть проведены, например, с использованием любого из методов и руководств для проведения консервативных и неконсервативных мутаций приведенным, например, в патенте США № 5364934. Вариации могут представлять собой замену, делецию или введение одного или более кодонов, кодирующих антитело или полипептид, которые приводят в результате к изменениям в аминокислотной последовательности по сравнению с нативной последовательностью антитела или полипептида. Необязательно, вариация осуществляется посредством замены по меньшей мере одной аминокислоты на любую другую аминокислоту в одном или более из доменов антитела против ТАТ или полипептида ТАТ. Путь определения, по которому аминокислотный остаток может быть введен, замещен или подвергнут делеции без неблагоприятного воздействия на желательную активность, может быть найден посредством сравнения последовательности антитела против ТАТ или полипептида ТАТ с последовательностью, гомологичной известной белковой молекуле и минимизации количества замен в аминокислотной последовательности, проведенных в областях с высокой гомологией. Аминокислотные замены могут быть результатом замещения одной аминокислоты еще одной другой аминокислотой, имеющей сходные структурные и/или химические свойства, такого как замещение лейцина серином, т.е. консервативные аминокислотные замены. Введения или делеции могут необязательно находиться в интервале приблизительно 1-5 аминокислот. Разрешенная вариация может быть определена посредством систематически проводимых введений, делеций или замещений аминокислот в последовательности и тестирования полученных в результате вариантов на предмет активности проявляемой непроцессированной или зрелой нативной последовательностью.
В данном описании предоставлены фрагменты антитела против ТАТ и полипептида ТАТ. Такие фрагменты могут быть процессированы по N-концу или C-концу, или в них могут отсутствовать внутренние остатки, например, когда проводят сравнение с непроцессированным нативным антителом или белком. В определенных фрагментах отсутствуют аминокислотные остатки, которые не являются существенными для желательной биологической активности антитела против-TAT или полипептида ТАТ.
Фрагменты антитела против ТАТ и полипептида ТАТ могут быть получены посредством любого из ряда общепринятых методов. Желательные пептидные фрагменты могут быть химически синтезированы. Альтернативный подход включает в себя генерацию фрагментов антитела или полипептида посредством ферментативного расщепления, например, посредством обработки белки ферментом, про который известно, что он расщепляет белки по участкам, определяемым конкретными аминокислотными остатками, или посредством расщепления ДНК подходящими рестрикционными ферментами и выделения желательного фрагмента. Еще один другой подходящий метод включает в себя выделение и амплификацию фрагмента ДНК, кодирующего фрагмент желательных антитела или полипептида, посредством полимеразной цепной реакции (ПЦР). Олигонуклеотиды, которые определяют желательные концы фрагмента ДНК, используются при 5' и 3' праймерах в ПЦР. Предпочтительно, фрагменты антитела против ТАТ и полипептида ТАТ разделяют по меньшей мере одну биологическую и/или иммунологическую активность с нативным антителом против ТАТ или полипептидом ТАТ, раскрытым в настоящей заявке.
В конкретных вариантах осуществления, консервативные замещения, представляющие интерес, показаны в Таблице 1 под заголовком предпочтительных замещений. Если такие замещения приводят в результате к изменению биологической активности, затем более значительные изменения, обозначенные примерные замещения в Таблице 1, или как дополнительно описано ниже со ссылкой на классы аминокислот, вводят и продукты подвергают скринингу.
Существенные модификации в функции или иммунологической идентичности антитела против ТАТ или полипептида ТАТ выполняют посредством отбора замещений, которые отличаются значительно по их эффекту на поддержание (a) структуры полипептидного скелета в области замены, например, в виде листа или спиральной конформации, (b) заряда или гидрофобности молекулы на целевом участке или (c) объема боковой цепи. Встречающиеся в природе остатки подразделяют на группы на основании общих свойств боковой цепи:
(1) гидрофобные: Норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr; Asn; Gln
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые оказывают влияние на ориентацию цепи: Gly, Pro; и
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замещения повлекут за собой обмен элемента одного из этих классов на еще один класс. Такие замененные остатки также могут быть введены в участки консервативного замещения или, более предпочтительно, в оставшиеся (неконсервативные) участки.
Вариации могут быть проведены с использованием способов, известных в данной области, таких как олигонуклеотид-опосредованный (сайт-направленный) мутагенез, аланиновое сканирование и ПЦР мутагенез. Сайт-направленный мутагенез [Carter et al., Nucl. Acids Res., 13:4331 (1986); Zoller et al., Nucl. Acids Res., 10:6487 (1987)], кассетный мутагенез [Wells et al., Gene, 34:315 (1985)], рестрикционный селекционный мутагенез [Wells et al., Philos. Trans. R. Soc. London SerA, 317:415 (1986)] или другие известные методы могут осуществляться на клонированной ДНК для получения антител против ТАТ или вариантной ДНК полипептида ТАТ.
Сканирующий аминокислотный анализ может также использоваться для идентификации одной или более аминокислот вдоль смежной последовательности. Среди предпочтительных сканирующих аминокислот находятся относительно малые, нейтральные аминокислоты. Такие аминокислоты включают аланин, глицин, серин и цистеин. Аланин обычно представляет собой предпочтительную сканирующую аминокислоту среди этой группы, поскольку он элиминирует боковую-цепь вне бета-углерода и наименее вероятно изменяет конформацию основной цепи варианта [Cunningham and Wells, Science, 244: 1081-1085 (1989)]. Аланин также обычно является предпочтительным, поскольку он является наиболее общей аминокислотой. Кроме того, его часто обнаруживают как в замаскированном, так и развернутом положениях [Creighton, Proteins, (W.H. Freeman & Co., N.Y.); Chothia, J. Mol. Biol, 150: 1 (1976)]. Если аланиновая замена не дает на выходе адекватных количеств варианта, может применяться изостерическая аминокислота.
Любой цистеиновый остаток, не вовлеченный в поддержание нужной конформации антитела против-TAT или полипептида ТАТ, также может быть замещен, как правило, на серин, чтобы улучшить окислительную устойчивость молекулы и предотвратить аберрантную сшивку. Напротив, цистеиновые связь(связи) могут быть добавлены к антителу против ТАТ или полипептиду ТАТ для улучшения устойчивости (особенно там, где антитело представляет собой фрагмент антитела, такой как Fv фрагмент).
Особенно предпочтительный тип заместительного варианта включает в себя замену одного или более остатков гипервариабельной области родительского антитела (например, гуманизированного антитела или антитела человека). В целом, полученные в результате вариант(ы), выбранные для дополнительной разработки, будут иметь улучшенные биологические свойства относительно родительского антитела, из которого их генерируют. Удобный путь для генерации таких заместительных вариантов включает в себя созревание аффинности с использованием фагового отображения. Вкратце, несколько участков гипервариабельной области (например, 6-7 участков) подвергают мутации для генерации всех возможных аминозамещений на каждом участке. Варианты антитела, генерируемые, таким образом отображаются моновалентным образом из нитевидных фаговых частиц как гибриды с продуктом гена III M13, упакованном внутри каждой частицы. Фаг-отображенные варианты затем подвергают скринингу на предмет их биологической активности (например, сродства связывания) как описано в настоящей заявке. Чтобы идентифицировать участки кандидатной гипервариабельной области для модификации, сканирующий аланином мутагенез может осуществляться для идентификации остатков гипервариабельной области, способствующих значительно связыванию с антигеном. Альтернативно, или дополнительно, может быть благоприятным анализировать кристаллические структуры комплекса антиген-антитело для идентификации точек контакта между антителом и полипептидом ТАТ человека. Такие контактные остатки и соседние остатки являются кандидатами для замещения в соответствии с методами, разработанными в настоящей заявке. Как только такие варианты генерируются, панель вариантов подвергают скринингу, как описано в настоящей заявке, и антитела с превосходными свойствами по одному или более соответствующим анализам могут быть выбраны для дополнительной разработки.
Молекулы нуклеиновой кислоты, кодирующие аминокислотные варианты последовательности антитела против ТАТ, получают посредством разнообразных способов, известных в данной области. Эти способы включают, но не ограничены лишь ими, выделение из природного источника (в случае встречающихся в природе вариантов аминокислотной последовательности) или получение посредством олигонуклеотид-опосредованного (или сайт-направленного) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза ранее полученной вариантной или невариантной версии антитела против ТАТ.
H. Модификации антител против ТАТ и полипептидов ТАТ
Ковалентные модификации антител против ТАТ и полипептидов ТАТ включены в объем притязаний данного изобретения. Один тип ковалентной модификации включает взаимодействие целевых аминокислотных остатков антител против ТАТ или полипептида ТАТ с органическим дериватизирующим агентом, который способен к взаимодействию с выбранными боковыми цепями или N- или C-концевых остатков антитела против ТАТ или полипептида ТАТ. Дериватизация бифункциональными агентами является применимой, например, для сшивки антитела против ТАТ или полипептида ТАТ с водонерастворимой поддерживающей матрицей или поверхностью для применения в способе очистки антител против ТАТ и наоборот. Обычно применяемые сшивающие агенты включают, например, 1,1-бис(диазоацетил)-2-фенилэтан, глутаральдегид, N-гидроксисукцинимидные сложные эфиры, например, сложные эфиры с 4-азидосалициловой кислотой, гомобифункциональные сложные имидоэфиры, включая дисукцинимидильные сложные эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-октан и агенты, такие как метил-3-[(п-азидофенил)дитио]пропиоимидат.
Другие модификации включают деамидирование глутаминильного и аспарагинильного остатков до соответствующих глутамильного и аспартильного остатков, соответственно, гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп серильного или треонильного остатков, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина [T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)], ацетилирование N-концевого амина, и амидирование любой C-концевой карбоксильной группы.
Еще один тип ковалентной модификации антитела против ТАТ или полипептида ТАТ, включенный в объем притязаний данного изобретения, содержит изменение нативной схемы гликозилирования антитела или полипептида. "Изменение нативной схемы гликозилирования" предназначено для целей данного изобретения, чтобы обозначить один или более углеводных фрагментов, обнаруженных в нативной последовательности антитела против ТАТ или полипептида ТАТ (либо посредством удаления основополагающего участка гликозилирования или посредством делеции гликозилирования химическими и/или ферментативными средствами), и/или добавление одного или более участков гликозилирования, которые не присутствуют в нативной последовательности антитела против ТАТ или полипептида ТАТ. Дополнительно, фраза включает качественные изменения в гликозилировании нативных белков, включающие в себя изменения природы и пропорций разнообразных присутствующих углеводных фрагментов.
Гликозилирование антител и других полипептидов является обычно либо N-связанным или O-связанным. N-связанное относится к присоединению углеводного фрагмента к боковой цепи аспарагинового остатка. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту за исключением пролина, являются распознающими последовательностями для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие одной из двух этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, наиболее часто серину или треонину, хотя 5-гидроксипролин или 5-гидроксилизин также могут применяться.
Добавления участка гликозилирования к антителу против ТАТ или полипептиду ТАТ общепринято осуществляют посредством изменения аминокислотной последовательности таким образом, что она содержит одну или более из вышеописанных трипептидных последовательностей (для N-связанных участков гликозилирования). Изменение также может быть проведено посредством дополнения или замены одного или более остатков серина или треонина остатками к последовательности исходного антитела против ТАТ или полипептида ТАТ (для O-связанных участков гликозилирования). Аминокислотная последовательность антитела против ТАТ или полипептида ТАТ может необязательно быть изменена через изменения на уровне ДНК, конкретно, посредством мутации ДНК, кодирующей антитело против ТАТ или полипептид ТАТ по предварительно выбранным основаниям таким образом, что генерируются кодоны, которые будут транслированы в желательные аминокислоты.
Еще одно другое средство увеличения числа углеводных фрагментов на антителе против ТАТ или полипептиде ТАТ представляет собой химическое или ферментативное сочетание гликозидов с полипептидом. Такие способы описаны в данной области, например, в WO 87/05330, опубликованной 11 сентября 1987 г., и у Aplin and Wriston, CRC Crit. Rev. Biochem., pp. 259-306 (1981).
Удаление углеводных фрагментов, присутствующих на антителе против ТАТ или полипептиде ТАТ, может выполняться химически или ферментативно или посредством мутационной замены кодонов, кодирующих аминокислотные остатки, которые служат в качестве мишеней для гликозилирования. Методы химического дегликозилирования известны в данной области и описаны, например, Hakimuddin, et al., Arch. Biochem. Biophys., 259:52 (1987) и Edge et al., Anal. Biochem., 118: 131 (1981). Ферментативное отщепление углеводных фрагментов на полипептидах может достигаться посредством применения разнообразных эндо- и экзогликозидаз, как описано Thotakura et al., Meth. EnzymoL, 138:350 (1987).
Еще один другой тип ковалентной модификации антитела против ТАТ или полипептида ТАТ включает связывание антитела или полипептида с одним из разнообразных небелковых полимеров, например, полиэтиленгликолем (PEG), полипропиленгликолем или полиоксилкиленами, образом, изложенном в патентах США №№ 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337. Антитело или полипептид также могут быть заключены в микрокапсулы, полученные, например, методом коацервации или межфазной полимеризацией (например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилат)ные микрокапсулы, соответственно), в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed. (1980).
Антитело против ТАТ или полипептид ТАТ настоящего изобретения также могут быть модифицированы таким образом, чтобы образовать химерные молекулы, содержащие антитело против ТАТ или полипептид ТАТ, рекомбинированные с еще одним, гетерологичным полипептидом или аминокислотной последовательностью.
В одном варианте осуществления, такая химерная молекула содержит гибрид антитела против ТАТ или полипептида ТАТ с полипептидом с меткой, который предоставляет эпитоп, с которым антитело против метки может селективно связываться. Эпитопную метку обычно размещают по амино- или карбоксильному концу антитела против ТАТ или полипептида ТАТ. Присутствие таких эпитоп-меченных форм антитела против ТАТ или полипептида ТАТ может быть обнаружено с использованием антитела против полипептида с меткой. Также, предоставление эпитопной метки обеспечивает легкую очистку антитела против TAT или полипептида ТАТ посредством аффинной очистки с использованием антитела против метки или еще одного типа аффинной матрицы, которая связывается с эпитопной меткой. Разнообразные полипептиды с меткой и их соответствующие антитела являются хорошо известными в области. Примеры включают метки поли-гистидин (поли-his) или поли-гистидин-глицин (поли-his-gly); полипептид с меткой flu HA и его антитело 12CA5 [Field et al., Mol. Cell. Biol, 8:2159-2165 (1988)]; метку c-myc и 8F9, 3C7, 6E10, G4, B7 и 9E10 антитела к нему [Evan et al., Molecular and Cellular Biology, 5:3610-3616 (1985)]; и метка гликопротеин D (gD) вируса Herpes Simplex и ее антитело [Paborsky et al., Protein Engineering, 3(6):547-553 (1990)]. Другие полипептиды с меткой включают Flag-пептид [Hopp et al., BioTechnology, 6: 1204-1210 (1988)]; эпитопный пептид KT3 [Martin et al., Science, 255: 192-194 (1992)]; α-тубулиновый эпитопный пептид [Skinner et al., J. Biol. Chem., 266: 15163-15166 (1991)]; и пептидную метку белка 10 гена T7 [Lutz-Freyermuth et al., Proc. Natl. Acad. Sci. USA, 87:6393-6397 (1990)].
В альтернативном варианте осуществления, химерная молекула может содержать гибрид антитела против TAT или полипептида ТАТ с иммуноглобулином или конкретной областью иммуноглобулина. Для бивалентной формы химерной молекулы (также именуемой "иммуноадгезин"), такая гибридизация может проводиться с Fc-областью молекулы IgG. Гибриды Ig, предпочтительно, включают замену растворимой (трансмембранный домен подвергнут делеции или инактивирован) формы антитела против ТАТ или полипептида ТАТ вместо по меньшей мере одной вариабельной области внутри молекулы Ig. В особенно предпочтительном варианте осуществления, иммуноглобулиновый гибрид включает шарнир, CH2 и CH3, или шарнир, CH1, CH2 и CH3 области молекулы IgG1. О получении иммуноглобулиновых гибридов см. также патент США № 5428130, выданный 27 июня 1995 г.
I. Получение антител против ТАТ и полипептидов ТАТ
Описание ниже относится прежде всего к получению антител против ТАТ и полипептидов ТАТ посредством культивирования клеток, трансформированных или трансфицированных вектором, содержащим нуклеиновую кислоту, кодирующую антитело против ТАТ и полипептид ТАТ. Предусматривают, конечно, что альтернативные способы, которые являются хорошо известными в области, могут использоваться для получения антител против ТАТ и полипептидов ТАТ. Например, соответствующая аминокислотная последовательность, или ее части, могут быть получены посредством непосредственного пептидного синтеза с использованием твердофазных методов [см., например, Stewart et al., Solid-Phase Peptide Synthesis, W.H. Freeman Co., San Francisco, CA (1969); Merrifield, J. Am. Chem. Soc, 85:2149-2154 (1963)]. Синтез белка in vitro может осуществляться с использованием ручных методов или посредством автоматизации. Автоматизированный синтез может осуществляться, например, с использованием пептидного синтезатора от Applied Biosystems (Foster City, CA) с использованием инструкций производителя. Разнообразные части антитела против ТАТ или полипептида ТАТ могут быть химически синтезированы раздельно и объединены с использованием химических или ферментативных способов для получения желательных антитела против ТАТ или полипептида ТАТ.
1. Выделение ДНК, кодирующей антитело против ТАТ или полипептид ТАТ
ДНК, кодирующая антитело против ТАТ или полипептид ТАТ, может быть получена из библиотеки кДНК, полученной из ткани, которая, как полагают, обладает мРНК антитела против ТАТ или полипептида ТАТ, и экспрессируют ее на обнаруживаемом уровне. Соответственно, ДНК человека для антитела против ТАТ или полипептида ТАТ может быть удобным образом получена из библиотеки кДНК, полученной из ткани человека. Ген, кодирующий антитело против ТАТ или полипептид ТАТ, также может быть полученных из геномной библиотеки или посредством известных синтетических методик (например, автоматизированного синтеза нуклеиновой кислоты).
Библиотеки могут быть подвергнуты скринингу с помощью зондов (таких как олигонуклеотиды, из по меньшей мере приблизительно 20-80 оснований) сконструированных для идентификации гена, представляющего интерес, или белка, кодируемого им. Скрининг кДНК или геномной библиотеки с помощью выбранного зонда может проводиться с использованием стандартных методик, таких как описаны у Sambrook et al., Molecular Cloning: Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989). Альтернативным средством для выделения гена, кодирующего антитело против ТАТ или полипептид ТАТ, является применение методологии ПЦР [Sambrook et al., выше; Dieffenbach et al., PCR Primer: Laboratory Manual (Cold Spring Harbor Laboratory Press, 1995)].
Методы скрининга библиотеки кДНК являются хорошо известными в области. Олигонуклеотидные последовательности, выбранные в качестве зондов, должны иметь достаточную длину и быть достаточно однозначными, чтобы ложноположительные результаты были минимизированы. Олигонуклеотид, предпочтительно, метят таким образом, чтобы он мог быть обнаружен при гибридизации с ДНК в библиотеке, подвергаемой скринингу. Способы мечения являются хорошо известными в области, и включают применение радиоактивных меток, подобно32P-меченному АТФ, биотинилированию или мечению фермента. Условия гибридизации, включающие умеренную строгость и высокую строгость, предоставлены в Sam brook et al., выше.
Последовательности, идентифицированные в таких способах скрининга библиотек, могут сравниваться и выравниваться с другими известными последовательностями, депонированными и доступными в общедоступных базах данных, таких как GenBank или другие частные базы данных последовательностей. Идентичность последовательности (либо на аминокислотном или нуклеотидном уровне) внутри определенных областей молекулы или вдоль непроцессированный последовательности может быть определена с использованием способов, известных в данной области, и как описано в настоящей заявке.
Нуклеиновая кислота, имеющая последовательность, кодирующую белок, может быть получена посредством скрининга выбранной кДНК или геномных библиотек с использованием расшифрованной аминокислотной последовательности, описанной в настоящей заявке в первый раз, и, если необходимо, с использованием общепринятых методик достройки праймера, как описано в Sambrook et al., выше, для обнаружения предшественников и процессинга интермедиатов мРНК, которые могут не быть обратно-транскрибированными в кДНК.
2. Выбор и трансформация клеток-хозяев
Клетки-хозяева трансфицируют или трансформируют с помощью векторов экспрессии или клонирования, описанных в настоящей заявке для получения антитела против ТАТ или полипептида ТАТ, и культивируют в общепринятых питательных средах, модифицированных соответствующим образом для индуцирования промоторов, селекции трансформантов или амплификации генов, кодирующих желательные последовательности. Условия культивирования, такие как среды, температура, pH и т.п., могут быть выбраны квалифицированным специалистом без излишнего экспериментирования. В целом, принципы, протоколы и практические методы для максимизации производительности клеточных культур можно найти в Mammalian Cell Biotechnology: a Practical Approach, M. Butler, ed. (IRL Press, 1991) и Sambrook et al., выше.
Способы трансфекции эукариотических клеток и трансформации прокариотических клеток известны рядовому специалисту в области, например, CaCl2, CaPO4, липосом-опосредованная и электропорация. В зависимости от применяемой клетки-хозяина, трансформацию осуществляют с использованием стандартных методов, подходящих для таких клеток. Обработку кальцием с использованием хлорида кальция, как описано в Sambrook et al., выше, или электропорация обычно применяют для прокариотов. Инфекцию с Agrobacterium tumefaciens применяют для трансформации некоторых растительных клеток, как описано у Shaw et al., Gene, 23:315 (1983) и в WO 89/05859, опубликованной 29 июня 1989 г. Для клеток млекопитающих без таких клеточных стенок может использоваться метод осаждения фосфатом кальция Graham и van der Eb, Virology, 52:456-457 (1978). Общие аспекты трансфекций систем клеток-хозяев млекопитающих был описан в патенте США № 4399216. Трансформации в дрожжи обычно проводят в соответствии со способом Van Solingen et al., J. Bact., 130:946 (1977) и Hsiao et al., Proc. Natl. Acad. Sci. (USA), 76:3829 (1979). Однако также могут применяться другие способы для введения ДНК в клетки, такие как посредством ядерной микроинъекции, электропорации, гибридизации бактериальных протопластов с интактными клетками, или поликатионы, например, полибрен, полиорнитин. Разнообразные методы трансформации клеток млекопитающих, см. Keown et al., Methods in Enzymology, 185:527-537 (1990) и Mansour et al., Nature, 336:348-352 (1988).
Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах в настоящей заявке включают клетки прокариотов, дрожжей или высшие эукариотические клетки. Подходящие прокариоты включают, но не ограничены лишь ими, эубактерии, такие как Грам-отрицательные или Грам-положительные организмы, например, такие как E. coli. Разнообразные штаммы E. coli являются общедоступными, такие как E. coli K12 штамм ММ294 (ATCC 31,446); E. coli X1776 (ATCC 31,537); E. coli штамм W3110 (ATCC 27,325) и K5 772 (ATCC 53,635). Другие подходящие прокариотические клетки-хозяева включают Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, раскрытые в DD 266710, опубликованной 12 Апреля 1989 г.), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Эти примеры являются иллюстративными в большей степени, чем ограничивающими. Штамм W3110 является одним особенно предпочтительным хозяином или родительским хозяином, поскольку он представляет собой общий штамм хозяина для ферментаций продукта рекомбинантной ДНК. Предпочтительно, клетка-хозяин секретирует минимальные количества протеолитических ферментов. Например, штамм W3110 может быть модифицирован для оказания воздействия на генетическую мутацию в генах, кодирующих белки, эндогенные для хозяина, с примерами таких хозяев, включающих E. coli W3110 штамм 1A2, который имеет полный генотип tonA; E. coli W3110 штамм 9E4, который имеет полный генотип tonA ptr3; E. coli W3110 штамм 27C7 (ATCC 55,244), который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT kanr; E. coli W3110 штамм 37D6, который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kanr; E. coli W3110 штамм 40B4, который является штаммом 37D6 с не-канамицин резистентной degP делеционной мутацией; и E. coli штамм, имеющий мутантную периплазматическую протеазу, раскрытую в патенте США № 4946783, выданном 7 августа 1990 г. Альтернативно, подходящими являются способы клонирования in vitro, например, ПЦР или другие полимеразные реакции нуклеиновых кислот.
Первичное антитело, фрагменты антитела и гибридные белки антитела, могут продуцироваться в бактериях, особенно тогда, когда гликозилирование и Fc эффекторные функции не являются необходимыми, в таких случаях, когда терапевтическое антитело является конъюгированным с цитотоксическим агентом (например, токсином) и иммуноконъюгат сам по себе показывает эффективность при деструкции опухолевой клетки. Первичные антитела имеют более высокий период полужизни при циркуляции. Получение в E. coli является более быстрым и более экономичным. По экспрессии фрагментов антител и полипептидов в бактериях, см., например, патент США № 5648237 (Carter et. al), патент США № 5789199 (Joly et al) и патент США № 5840523 (Simmons et al.), который описывает ямку трансляции-инициации (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции, причем эти патенты включены в настоящей заявке посредством ссылки. После экспрессии, антитело выделяют из клеточной пасты E. coli в растворимую фракцию, и оно может быть очищено посредством, например, колонки с белком А или G в зависимости от изотипа. Окончательную очистку можно проводить аналогично способу очистки антитела, экспрессируемого, например, в клетках CHO.
В дополнение к прокариотам, эукариотические микробы, такие как мицелиальные грибы или дрожжи, являются подходящими хозяевами для клонирования или экспрессии векторов, кодирующих антитело против ТАТ или полипептид ТАТ. Saccharomyces cerevisiae представляет собой обычно используемый низший эукариотический микроорганизм-хозяин. Другие включают Schizosaccharomyces pombe (Beach и Nurse, Nature, 290: 140 [1981]; EP 139383 опубликован 2 Мая 1985); Kluyveromyces хозяева (патент США № 4943529; Fleer et al., Bio/Technology, 9:968-975 (1991)) такие как, например, K. lactis (MW98-8C, CBS683, CBS4574; Louvencourt et al., J. Bacteriol., 154(2):737-742 [1983]), K. fragilis (ATCC 12,424), K. bulgaricus (ATCC 16,045), K. wickeramii (ATCC 24,178), K. waltii (ATCC 56,500), K. drosophilarum (ATCC 36,906; Van den Berg et al., Bio/Technology, 8: 135 (1990)), K. thermotolerans, и K. marxianus; yarrowia (EP 402,226); Pichia pastoris (EP 183,070; Sreekrishna et al., J. Basic Microbiol, 28:265-278 [1988]); Candida; Trichoderma reesia (EP 244,234); Neurospora crassa (Case et al., Proc. Natl. Acad. Sci. USA, 76:5259-5263 [1979]); Schwanniomyces, такие как Schwanniomyces occidentalis (EP 394538 опубликован 31 Октября 1990); и мицелиальные грибы такие как, например, Neurospora, Penicillium, Tolypocladium (WO 91/00357 опубликован 10 января 1991 г.), и хозяева Aspergillus, такие как A. nidulans (Ballance et al., Biochem. Biophys. Res. Commun., 112:284-289 [1983]; Tilburn et al., Gene, 26:205-221 [1983]; Yelton et al., Proc. Natl. Acad. Sci. USA, 81: 1470-1474 [1984]) и A. niger (Kelly и Hynes, EMBO J., 4:475-479 [1985]). Метилотропные дрожжи являются подходящими в настоящей заявке, и включают, но не ограничены лишь ими, дрожжи, способные к росту на метаноле, выбранные из родов, состоящих из Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula. Перечень конкретных видов, которые являются представительными примерами этого класса дрожжей можно найти в C. Anthony, Biochemistry Methylotrophs, 269 (1982).
Подходящие клетки-хозяева для экспрессии гликозилированных антител против ТАТ или полипептида ТАТ производят из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки насекомых, таких как Drosophila S2 и Spodoptera Sf9, а также растительные клетки, такие как культуры клеток хлопка, кукурузы, картофеля, соевых бобов, петуньи, томатов и табака. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки-хозяева насекомых из хозяев, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Разнообразные вирусные штаммы для трансфекции являются общедоступными, например, L-1 вариант Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут применяться в настоящей заявке в качестве вируса в соответствии с настоящим изобретением, конкретно для трансфекции клеток Spodoptera frugiperda.
Однако наибольший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (культура ткани) стало обычной методикой. Примерами применимых линий клеток-хозяев млекопитающих является линия клеток почки обезьяны CV1, трансформированная посредством SV40 (COS-7, ATCC CRL 1651); линия клеток почки эмбриона человека (293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки хомячков (BHK, ATCC CCL 10); клетки яичника китайского хомяка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки мышей Сертоли (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки человека карциномы шейки матки (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени бычьей крысы (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линии гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессионными или клонирующими векторами для выработки антител против ТАТ или полипептида ТАТ и культивируют в общепринятых питательных средах, модифицированных соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желательные последовательности.
3. Селекция и применение реплицируемого вектора
Нуклеиновая кислота (например, кДНК или геномная ДНК), кодирующая антитела против ТАТ или полипептида ТАТ, может быть введена в реплицируемый вектор для клонирования (амплификации ДНК) или для экспрессии. Разнообразные векторы являются общедоступными. Вектор может, например, находиться в виде плазмиды, космиды, вирусной частицы или фага. Соответствующая последовательность нуклеиновой кислоты может быть введена в вектор посредством разнообразных методик. Как правило, ДНК вводят в соответствующие сайт(ы) рестрикционной эндонуклеазы с использованием методов, известных в данной области. Векторные компоненты обычно включают, но не ограничены лишь ими, одну или более из сигнальных последовательностей, источник репликации, один или более маркерных генов, энхансерный элемент, промотор, и последовательность терминации транскрипции. В конструкции подходящих векторов, содержащих один или более из этих компонентов, используют стандартные методы лигирования, которые являются известными для квалифицированного специалиста в области.
TAT может продуцироваться рекомбинантно не только непосредственно, но также как полипептид, гибридный с гетерологичным полипептидом, который может представлять собой сигнальную последовательность или другой полипептид, имеющий специфичный участок расщепления по N-концу зрелого белка или полипептида. В целом, сигнальная последовательность может представлять собой компонент вектора, или она может являться частью антитела против ТАТ- или полипептид ТАТ-кодирующей ДНК, которую вводят в вектор. Сигнальная последовательность может представлять собой прокариотическую сигнальную последовательность, выбран, например, из группы лидеров по щелочной фосфатазе, пенициллиназе, lpp или термостабильному энтеротоксину II. Для секреции дрожжами сигнальная последовательность может представлять собой, например, лидер по дрожжевой инвертазе, лидер по альфа-фактору (включая лидеров по α-фактору для Saccharomyces и Kluyveromyces, последний описан в патенте США № 5010182), или лидер по кислотной фосфатазе, лидер по глюкоамилазе для C. albicans (EP 362179 опубликована 4 апреля 1990), или сигнальная последовательность, описанная в WO 90/13646, опубликованной 15 ноября 1990. При экспрессии клетками млекопитающих, сигнальные последовательности млекопитающих могут применяться для непосредственной секреции белка, такие как сигнальные последовательности от секретируемых полипептидов такого же или родственного вида, а также вирусные секреторные лидеры.
Как экспрессионные, так и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая обеспечивает репликацию вектора в одной или более выбранных клетках-хозяевах. Такие последовательности являются хорошо известными для разнообразных бактерий, дрожжей и вирусов. Точка начала репликации из плазмиды pBR322 является подходящей для большинства грамотрицательных бактерий, точка начала репликации 2μ плазмиды является подходящей для дрожжей, и разнообразные вирусные точки (SV40, полиомы, аденовируса, VSV или BPV) являются применимыми для клонирования векторов в клетках млекопитающих.
Экспрессионные и клонирующие векторы будут типовым образом содержать ген селекции, также называемый селектируемым маркером. Типичные гены селекции кодируют белки, которые (a) придают резистентность к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину, (b) дополняют ауксотрофные недостатки, или (c) поставляют критические питательные компоненты, недоступные из сложных сред, например, ген, кодирующий рацемазу D-аланина для Bacilli.
Примером подходящих селектируемых маркеров для клеток млекопитающих являются маркеры, которые позволяют проводить идентификацию клеток, компетентных за перенос антител против ТАТ- или полипептид ТАТ-кодирующей нуклеиновой кислоты, такие как DHFR или тимидинкиназа. Соответствующие клетки-хозяева, когда используют DHFR дикого типа, представляет собой линию клеток СНО с отсутствием активности DHFR, полученную и размноженную, как описано Urlaub et al., Proc. Natl. Acad. Sci. USA, 77:4216 (1980). Подходящий ген селекции для применения в дрожжах представляет собой ген trp1, присутствующий в дрожжевой плазмиде YRp7 [Stinchcomb et al., Nature, 282:39 (1979); Kingsman et al., Gene, 7: 141 (1979); Tschemper et al., Gene, 10: 157 (1980)]. Ген trp1 предоставляет селекционный маркер для мутантного штамма дрожжей, у которых отсутствует способность расти в присутствии триптофана, например, ATCC No. 44076 или PEP4-1 [Jones, Genetics, 85: 12 (1977)].
Экспрессионные и клонирующие векторы обычно содержат промотор, функционально связанный с антителом против TAT или последовательностью полипептид ТАТ-кодирующей нуклеиновой кислоты, чтобы направлять синтез мРНК. Промоторы, признанные различными потенциальными клетками-хозяевами, являются хорошо известными. Промоторы, подходящие для применения с прокариотическими хозяевами, включают промоторные системы β-лактамазы и лактозы [Chang et al., Nature, 275:615 (1978); Goeddel et al., Nature, 281:544 (1979)], щелочной фосфатазы, триптофановую (trp) промоторную систему [Goeddel, Nucleic Кислоты Res., 8:4057 (1980); EP 36776] и гибридные промоторы, такие как tac промотор [deBoer et al., Proc. Natl. Acad. Sci. USA, 80:21-25 (1983)]. Промоторы для применения в бактериальных системах также будут содержать Shine-Dalgarno (S.D.) последовательность, функционально связанную с ДНК, кодирующей антитело против ТАТ или полипептид ТАТ.
Примеры подходящих промотирующих последовательностей для применения с дрожжевыми хозяевами, включают промоторы для 3-фосфоглицераткиназы [Hitzeman et al., J. Biol. Chem., 255:2073 (1980)] или других гликолитических ферментов [Hess et al., J. Adv. Фермент Reg., 7: 149 (1968); Holland, Biochemistry, 17:4900 (1978)], таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозефосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другие дрожжевые промоторы, которые представляют собой индуцируемые промоторы, имеющие дополнительное преимущество в транскрипции, контролируемой условиями роста, являются промоторными областями для алкогольдегидрогеназы 2, изоцитохрома C, кислотной фосфатазы, деградационных ферментов связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, отвечающих за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для применения в экспрессии дрожжей дополнительно описаны в EP 73657.
Транскрипция антитела против ТАТ или полипептида ТАТ из векторов у клеток-хозяев млекопитающих контролируется, например, промоторами, полученными от геномов вирусов, таких как вирус полиомы, вирус оспы кур (UK 2211504 опубликован 5 Июля 1989), аденовирус (такой как Аденовирус 2), вирус бычьей папилломы, вирус птичьей саркомы, цитомегаловирус, ретровирус, вирус гепатита B и Вирус Обезьян 40 (SV40), от гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, и от промоторов теплового шока, при условии, что такие промоторы являются совместимыми с системами клетки-хозяина.
Транскрипция ДНК, кодирующей антитело против ТАТ или полипептид ТАТ, высшими эукариотами может быть увеличена посредством введения энхансерной последовательности в вектор. Энхансеры являются цис-действующими элементами ДНК, обычно приблизительно от 10 до 300 п.о., которые действуют на промотор для увеличения его транскрипции. Многие энхансерные последовательности из генов млекопитающих являются в настоящее время известными (глобин, эластаза, альбумин, α-фетопротеин и инсулин). Типично, однако, будет применяться энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40 на концевой стороне точки начала репликации (п.о. 100-270), цитомегаловирус энхансер раннего промотора, энхансер полиомы на концевой стороне точки начала репликации и аденовирусные энхансеры. Энхансер может быть сплайсирован в вектор по положению 5' или 3' последовательности, кодирующей антитело против ТАТ или полипептид ТАТ, но, предпочтительно, расположен на сайте 5' от промотора.
Экспрессионные векторы, применяемые в эукариотических клетках-хозяевах (дрожжевых, грибковых, насекомых, растительных, животных, человеческих или ядросодержащих клетках из других многоклеточных организмов) будут также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно являются доступными от 5' и, иногда 3', нетранслированных областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые как полиаденилированные фрагменты внетранслированной части мРНК, кодирующей антитело против ТАТ или полипептид ТАТ.
Еще другие методы, векторы и клетки-хозяева, подходящие для адаптации к синтезу антитела против ТАТ или полипептида ТАТ в культуре рекомбинантных клеток позвоночных описаны в Gething et al., Nature, 293:620-625 (1981); Mantei et al., Nature, 281:40-46 (1979); EP 117060; и EP 117058.
4. Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования антител против ТАТ или полипептида ТАТ данного изобретения, могут культивироваться в разнообразных средах. Доступные на рынке среды, такие как Ham's F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma), RPMI-1640 (Sigma), и модифицированная Дульбекко среда Игла ((DMEM), Sigma) являются подходящими для культивирования клеток-хозяев. В дополнение, любая из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem.102:255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или патенте США Re. 30985, может применяться в качестве культуральной среды для клеток-хозяев. Любая из этих сред может быть дополнена по необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин, или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеотидами (такими, как аденозин и тимидин), антибиотиками (такими как лекарственное средство ГЕНТАМИЦИН™), следовыми элементами (определенными как неорганические соединения, обычно присутствующие при конечной концентрации в микромолярном диапазоне) и глюкозой или эквивалентный источник энергии. Любые другие необходимые добавки также могут быть включены при соответствующих концентрациях, которые будут известными для квалифицированных специалистов в данной области. Условия культивирования, такие как температура, pH и т.п., представляют собой условия, которые ранее применялись с клеткой-хозяином, выбранной для экспрессии, и будут очевидными для рядового специалиста в области.
5. Обнаружение амплификации/экспрессии гена
Амплификация и/или экспрессия гена могут быть измерены в образце непосредственно, например, посредством общепринятого саузерн-блоттинга, нозерн-блоттинга для количественной оценки транскрипции мРНК [Thomas, Proc. Natl. Acad. Sci. USA, 77:5201-5205 (1980)], дот-блоттинга (анализа ДНК), или гибридизации in situ, с использованием соответствующим образом меченого зонда, на основании последовательностей, предоставленных в настоящей заявке. Альтернативно, могут использоваться антитела, которые могут распознавать конкретные дуплексы, включая ДНК дуплексы, РНК дуплексы и ДНК-РНК гибридные дуплексы или ДНК-белковые дуплексы. Антитела в свою очередь могут быть меченными, и может осуществляться анализ, где дуплекс связан с поверхностью, таким образом, что при образовании дуплекса на поверхности присутствие антитела, связанного с дуплексом, может быть обнаружено.
Экспрессия гена, альтернативно, может быть измерена посредством иммунологических методов, таких как иммуногистохимическое окрашивание клеток или срезов тканей и анализ клеточной культуры или жидкостей организма, для непосредственной количественной оценки экспрессии генного продукта. Антитела, применимые для иммуногистохимического окрашивания и/или анализа образца текучих сред, могут быть либо моноклональными, или поликлональными, и могут быть получены в любом млекопитающем. Общепринято, могут быть получены антитела против полипептида ТАТ с нативной последовательностью или против синтетического пептида на основе последовательностей ДНК, предоставленных в настоящей заявке, или против экзогенной последовательности, рекомбинированной с ДНК TAT и кодирующей конкретный эпитоп антитела.
6. Очистка антитела против ТАТ и полипептида ТАТ
Формы антитела против ТАТ и полипептида ТАТ могут быть извлечены из культуральной среды или из лизатов клеток-хозяев. Если оно является мембранно-связанным, оно может высвобождаться из мембраны с использованием подходящего раствора детергента (например, Triton-X 100) или посредством ферментативного расщепления. Клетки, используемые при экспрессии антитела против ТАТ и полипептида ТАТ, могут быть разрушены разнообразными физическими или химическими средствами, такие как циклическое проведение замораживания-оттаивания, разрушение ультразвуком, механическое разрушение, или агентами, лизирующими клетки.
Может быть желательным очищать антитела против ТАТ и полипептида ТАТ от белков или полипептидов рекомбинантных клеток. Следующие методики являются представительными примерами подходящих методик очистки: фракционирование на ионообменной колонке; осаждение этанолом; обращенно-фазовая ВЭЖХ; хроматография на оксиде кремния или на катионообменной смоле, такой как DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония; гель-фильтрация с использованием, например, Сефрадекса G-75; колонки с Сефарозой и белком А, для удаления загрязняющих компонентов, таких как IgG; и колонки, хелатирующие металлы, для связывания меченные эпитопом формы антитело против ТАТ и полипептида ТАТ. Могут использоваться разнообразные методы очистки белка и такие методы являются известными в данной области и описаны, например в Deutscher, Methods in Enzymology, 182 (1990); Scopes, Protein Purification: Principles and Practice, Springer-Verlag, New York (1982). Выбранные стадия(ии) очистки будут зависеть, например, от природы способа получения и конкретного продуцируемого антитела против ТАТ или полипептида ТАТ.
Когда используют рекомбинантные технологии, антитела могут продуцироваться внутриклеточно, в периплазматическом пространстве, или непосредственно секретироваться в среду. Если антитело, продуцируется внутриклеточно, на первой стадии, остатки в виде частиц, либо клеток-хозяев или лизированных фрагментов, удаляют, например, посредством центрифугирования или ультрафильтрации. Carter et al., Bio/Technology 10: 163-167 (1992) описывают методику выделения антител, которые секретируются в периплазматическое пространство E. coli. Вкратце, клеточную пасту оттаивают в присутствии ацетата натрия (pH 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 мин. Остатки клеток могут удаляться центрифугированием. В тех случаях, где антитело секретируется в среду, супернатанты от таких экспрессионных систем, как правило, сначала концентрируют с использованием промышленно производимого фильтра для концентрации белка, например, ультрафильтрационного блока Amicon или Millipore Pellicon. Ингибитор протеаз, такой как PMSF, может быть включен в любую из перечисленных выше стадий для ингибирования протеолиза, и антибиотики могут быть включены для предотвращения роста непредусмотренных загрязняющих организмов.
Композиция антитела, полученная из клеток, может быть очищена с использованием, например, хроматографии на гидроксиапатите, гель-электрофореза, диализа и аффинной хроматографии, причем аффинная хроматография является предпочтительным методом очистки. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа Fc домена любого иммуноглобулина, который присутствует в антителе. Белок А может применяться для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендован для всех мышиных изотипов и для γ3 человека (Guss et al., EMBO J. 5: 15671575 (1986)). Матрикс, к которому аффинный лиганд присоединен, наиболее часто представляет собой агарозу, но доступны и другие матриксы. Механически устойчивые матриксы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол обеспечивают более быстрые скорости потока и более короткое время обработки, чем может достигаться с агарозой. Там, где антитело содержит CH3 домен, смола Bakerbond ABX™ (J. T. Baker, Phillipsburg, NJ) является применимой для очистки. Другие методы для очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на оксиде кремния, хроматография на СЕФАРОЗЕ™ с гепарином, хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония также являются доступными в зависимости от извлекаемого антитела.
После любых предварительной стадии(ий) очистки, смесь, содержащая антитело, представляющее интерес, и загрязняющие компоненты могут быть подвергнуты хроматографии гидрофобного взаимодействия с низким значением pH с использованием элюирующего буфера при pH приблизительно 2,5-4,5, предпочтительно, осуществляемой при низкой концентрации соли (например, приблизительно 0-0,25M соли).
J. Фармацевтические лекарственные формы
Терапевтические лекарственные формы антител против ТАТ, ТАТ-связывающих олигопептидов, ТАТ-связывающих органических молекул и/или полипептидов ТАТ, применяемые в соответствии с настоящим изобретением, получают для хранения посредством смешивания антитела, полипептида, олигопептида или органической молекулы, имеющих желательную степень чистоты с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в виде лиофилизированных лекарственных форм или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях и включают буферы, такие как ацетат, Трис, фосфат, цитрат и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензэтония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); полипептиды с низкой молекулярной массой (менее чем приблизительно 10 остатков); белки, такие как альбумин сыворотки, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; тонизирующие средства, такие как трегалоза и хлорид натрия; сахара, такие как сахароза, маннитол, трегалоза или сорбитол; поверхностно-активное средство, такое как полисорбат; солеобразующие противоионы, такие как ион натрия; комплексы с металлами (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как ТВИН®, PLURONICS® или полиэтиленгликоль (PEG). Антитело, предпочтительно, содержит антитело при концентрации 5-200 мг/мл, предпочтительно, 10-100 мг/мл.
Лекарственные формы в настоящей заявке могут также содержать более чем одно активное соединение, по необходимости для конкретного показания, для лечения, предпочтительно, соединения с комплементарными активностями, которые не оказывают неблагоприятного воздействия друг на друга. Например, в дополнение к антителу против ТАТ, ТАТ-связывающему олигопептиду или ТАТ-связывающей органической молекуле, может быть желательным включать в одну лекарственную форму дополнительное антитело, например второе антитело против TAT, которое связывается с различным эпитопом на полипептиде ТАТ, или антитело к некоторой другой мишени, такой как фактор роста, которое воздействует на рост конкретного рака. Альтернативно, или дополнительно, композиция может дополнительно содержать химиотерапевтический агент, цитотоксический агент, цитокин, агент, ингибирующий рост, антигормональный агент и/или кардиопротектор. Такие молекулы подходящим образом присутствуют в комбинации в количествах, которые являются эффективными для предназначенной цели.
Активные ингредиенты также могут быть инкапсулированы в микрокапсулы, полученные, например, посредством методов коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилат)ные микрокапсулы, соответственно, в системах доставки коллоидального лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методы раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антитело, причем матрицы находятся в виде формованных изделий, например, пленок или микрокапсул. Примеры матриц замедленного высвобождения включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ этил-L-глутамата, неразрушаемый этилен-винилацетат, разрушаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT® (инъецируемые микросферы, составленные из сополимера молочной кислоты-гликолевой кислоты и ацетата леупролида), и поли-D-(-)-3-гидроксимасляная кислота.
Лекарственные формы, применяемые для введения in vivo, должны быть стерильными. Это легко достигается посредством фильтрации через стерильные фильтрационные мембраны.
K. Диагностика и лечение с помощью антител против TAT, ТАТ-связывающих олигопептидов и ТАТ-связывающих органических молекул
Для определения экспрессии TAT при раке, доступны разнообразные диагностические анализы. В одном варианте осуществления, сверхэкспрессия полипептида ТАТ может быть проанализирована посредством иммуногистохимии (ИГХ). Погруженные в парафин срезы тканей из биопсийных проб опухоли могут быть подвергнуты ИГХ анализу и соответствующие критерии интенсивности окрашивания TAT белка являются следующими:
Балльная оценка 0 - окрашивания не наблюдают или окрашивание мембран наблюдают у меньше чем 10% опухолевых клеток.
Балльная оценка 1+ - слабое/едва воспринимаемое окрашивание мембран обнаруживают у более чем 10% опухолевых клеток. Клетки являются окрашенными только частично по их мембране.
Балльная оценка 2+ - от слабого до умеренно полного окрашивания мембран наблюдают у более чем 10% опухолевых клеток.
Балльная оценка 3+ - от умеренного до сильно полного окрашивания мембран наблюдают у более чем 10% опухолевых клеток.
Такие опухоли с балльными оценками 0 или 1+ для экспрессии полипептида ТАТ могут характеризоваться как не сверхэкспрессирующие TAT, в то время как эти опухоли с балльными оценками 2+ или 3+ могут характеризоваться как сверхэкспрессирующие TAT.
Альтернативно, или дополнительно, FISH анализы, такие как INFORM® (поставляемый Ventana, Arizona) или PATHVISION® (Vysis, Illinois) могут осуществляться на фиксированной в формалине, погруженной в парафин опухолевой ткани, чтобы определить степень (если имеется) сверхэкспрессии TAT в опухоли.
Сверхэкспрессия или амплификация TAT могут быть оценены с использованием диагностического анализа in vivo, например, посредством введения молекулы (такой как антитело, олигопептид или органическая молекула), которая связывается с молекулой, подлежащей обнаружению, и метится обнаруживаемой меткой (например, радиоактивным изотопом или флуоресцентной меткой), и внешнего сканирования пациента для локализации метки.
Как описано выше, антитела против TAT, олигопептиды и органические молекулы изобретения имеют разнообразные нетерапевтические применения. Антитела против ТАТ, олигопептиды и органические молекулы настоящего изобретения могут быть применимыми для диагностики и определения стадии полипептид ТАТ-экспрессирующих раков (например, при радиологической визуализации). Антитела, олигопептиды и органические молекулы являются также применимыми для очистки или иммунопреципитации полипептида ТАТ из клетки, для обнаружения и количественной оценки полипептида ТАТ in vitro, например, при ELISA или Вестерн-блоттинге, для уничтожения и устранения TAT-экспрессирующих клеток из популяции смешанных клеток в качестве стадии при очистке других клеток.
В настоящее время, в зависимости от стадии рака, лечение рака включает в себя одну терапию или комбинацию из следующих терапий: хирургическое вмешательство для удаления раковой ткани, лучевую терапию и химиотерапию. Терапия с применением антитела против ТАТ, олигопептида или органической молекулы может быть особенно желательной у пожилых пациентов, которые плохо переносят токсичность и побочные эффекты химиотерапии, и при метастазирующем заболевании, где лучевая терапия имеет ограниченную применимость. Направленное воздействие на опухоль антителами против TAT, олигопептидами и органическими молекулами изобретения является применимым для облегчения протекания TAT-экспрессирующих раков при первоначальной диагностике заболевания или во время обострения. Для терапевтических применений, антитело против TAT, олигопептид или органическая молекула может применяться по отдельности или в комбинированной терапии с использованием, например, гормонов, антиангиогенов или соединений, меченных радиоактивными изотопами, или с помощью хирургического вмешательства, криотерапии и/или лучевой терапии. Лечение с использованием антитела против TAT, олигопептида или органической молекулы может проводиться в сочетании с другими видами общепринятой терапии, либо последовательно, с пре- или пост-общепринятой терапией. Химиотерапевтические лекарственные средства, такие как TAXOTERE® (доцетаксел), TAXOL® (паклитаксел), эстрамустин и митоксантрон применяют при лечении рака, особенно, у надежных пациентов. В настоящем способе изобретения для лечения или облегчения рака, раковому пациенту может вводиться антитело против TAT, олигопептид или органическая молекула в сочетании с лечением одним или более из предшествующих химиотерапевтических агентов. В частности, предусматривается комбинированная терапия паклитакселом и модифицированными производными (см., например, EP0600517). Антитело против TAT, олигопептид или органическая молекула будут вводиться вместе с терапевтически эффективной дозой химиотерапевтического агента. В еще одном варианте осуществления, антитело против TAT, олигопептид или органическую молекулу вводят в сочетании с химиотерапией для усиления активности и эффективности воздействия химиотерапевтического агента, например, паклитаксела. Настольный справочник врача (PDR) раскрывает дозировки этих агентов, которые использовались при лечении разнообразных раков. Режим дозирования и дозировки этих упомянутых выше химиотерапевтических лекарственных средств, которые являются терапевтически эффективными, будут зависеть от конкретного рака, подвергаемого лечению, степени развития заболевания и других факторов, с которыми знаком квалифицированный терапевт в данной области, и которые могут быть определены терапевтом.
В одном конкретном варианте осуществления, конъюгат, содержащий антитело против TAT, олигопептид или органическую молекулу, конъюгированные с цитотоксическим агентом, вводят пациенту. Предпочтительно, иммуноконъюгат, связанный с TAT белком интернализуется клеткой, приводя в результате к увеличенной терапевтической эффективности воздействия иммуноконъюгата при уничтожении раковой клетки, с которой он связывается. В предпочтительном варианте осуществления цитотоксический агент направленно действует или оказывает воздействие на нуклеиновую кислоту в раковой клетке. Примеры таких цитотоксических агентов описаны выше и включают майтансиноиды, калихеамицины, рибонуклеазы и эндонуклеазы ДНК. Антитела против TAT, олигопептиды, органические молекулы или их конъюгаты с токсином вводят пациенту-человеку в соответствии с известными методами, такими как внутривенное введение, например, в виде болюса или посредством непрерывной инфузии в течение периода времени, посредством внутримышечного, внутрибрюшинного, интрацереброспинального, подкожного, внутрисуставного, интасиновиального, интратекального, перорального, местного или ингаляционного путей. Внутривенное или подкожное введение антитела, олигопептида или органической молекулы является предпочтительным.
Другие терапевтические режимы могут комбинироваться с введением антитела против TAT, олигопептида или органической молекулы. Комбинированное введение включает совместное введение, с использованием раздельных лекарственных форм или единичной фармацевтической лекарственной формы, и последовательное введение в альтернативном порядке, где, предпочтительно, предусмотрен период времени, в то время как оба (или все) активные агенты одновременно проявляют их биологические активности. Предпочтительно, такая комбинированная терапия приводит в результате к синергистическому терапевтическому эффекту.
Может также быть желательным комбинировать введение антител против TAT или антител, олигопептидов или органических молекул, с введением антитела, направленного против еще одного другого опухолевого антигена, связанного с конкретным раком.
В еще одном варианте осуществления, способы терапевтического лечения настоящего изобретения включают в себя комбинированное введение антител против ТАТ (или антител), олигопептидов или органических молекул и одного или более химиотерапевтических агентов или агентов, ингибирующих рост, включающие совместное введение из различных химиотерапевтических агентов. Химиотерапевтические агенты включают эстрамустина фосфат, преднимустин, цисплатин, 5-фторурацил, мелфалан, циклофосфамид, гидроксимочевину и гидроксиуреатаксаны (такие как паклитаксел и доксетаксел) и/или антрациклиновые антибиотики. Получение и режимы дозирования для таких химиотерапевтических агентов могут применяться в соответствии с инструкциями производителя или определяют эмпирически квалифицированным практиком. Получение и режимы дозирования для такой химиотерапии также описаны в Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Антитело, олигопептид или органическая молекула могут комбинироваться с антигормональным соединением; например, антиэстрогенным соединением, таким как тамоксифен; анти-прогестероном, таким как онапристон (см., EP 616812); или антиандрогеном, таким как флутамид, в дозировках, известных для таких молекул. В тех случаях, где рак, подвергаемый лечению, представляет собой андроген-независимый рак, пациент может предварительно быть подвергнут антиандрогенной терапии и, после того как рак станет андроген-независимым, антитело против ТАТ, олигопептид или органическая молекула (и необязательно другой агент, как описано в настоящей заявке) могут вводиться пациенту.
Иногда может быть благоприятным также совместно вводить пациенту кардиопротектор (для предотвращения или снижения дисфункции миокарда, связанной с терапией) или один или более цитокинов. В дополнение к указанным выше терапевтическим режимам, пациент может быть подвергнут хирургическому удалению раковых клеток и/или лучевой терапии, перед, одновременно с или после терапии антителом, олигопептидом или органической молекулой. Подходящие дозировки для любого из указанных выше совместно вводимых агентов представляют собой дозировки, применяемые в настоящее время, и могут быть снижены вследствие комбинированного действия (синергизма) агента и антитела против ТАТ, олигопептида или органической молекулы.
Для профилактики или лечения заболевания, дозировка и режим введения будут выбраны терапевтом в соответствии с известными критериями. Соответствующая дозировка антитела, олигопептида или органической молекулы будут зависеть от типа заболевания, подлежащего лечению, как определено выше, тяжести и протекания заболевания, независимо от того, вводят ли антитело, олигопептид или органическую молекулу в превентивных или терапевтических целях, предшествующей терапии, истории болезни пациента и ответа на антитело, олигопептид или органическую молекулу, и суждения лечащего врача. Антитело, олигопептид или органическую молекулу подходящим образом вводят пациенту за один раз или в течение ряда терапий. Предпочтительно, антитело, олигопептид или органическую молекулу вводят посредством внутривенной инфузии или посредством подкожных инъекций. В зависимости от типа и тяжести заболевания, приблизительно от 1 мкг/кг до приблизительно 50 мг/кг массы тела (например, приблизительно 0,1-15 мг/кг/дозу) антитела может являться первоначальной кандидатной дозировкой для введения пациенту, либо, например, посредством одного или более раздельных введений, или посредством непрерывной инфузии. Режим дозирования может включать введение первоначальной нагрузочной дозы, равной приблизительно 4 мг/кг, с последующим недельным поддержанием дозы, равной приблизительно 2 мг/кг антитела против ТАТ. Однако могут быть применимы другие режимы дозировки. Типовая ежедневная дозировка может находиться в интервале от приблизительно 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Для повторных введений в течение нескольких дней или более, в зависимости от состояния, лечение поддерживают, пока не появляется желательное подавление симптомов заболевания. Прогресс этой терапии может легко регистрироваться общепринятыми методами и анализами и основан на критериях, известных терапевту или другим специалистам, квалифицированным в данной области.
Помимо введения белка антитела пациенту, настоящая заявка предусматривает введение антитела посредством генной терапии. Такое введение нуклеиновой кислоты, кодирующей антитело, охватывается выражением "введение терапевтически эффективного количества антитела". См., например, WO 96/07321, опубликованную 14 марта 1996 г., касающуюся применения генной терапии для генерации внутриклеточных антител.
Существует два основных подхода к доставке нуклеиновой кислоты (необязательно содержащейся в векторе) в клетки пациента; in vivo и ex vivo. Для доставки in vivo нуклеиновую кислоту непосредственно вводят инъекционно в пациента, обычно на участке, где требуется антитело. Для лечения ex vivo клетки пациента удаляют, нуклеиновую кислоту вводят в эти выделенные клетки, и модифицированные клетки вводят пациенту либо непосредственно или, например, инкапсулированными внутри пористых мембран, которые имплантируют в пациента (см., например, патенты США №№ 4892538 и 5283187). Существуют разнообразные способы, доступные для введения нуклеиновых кислот в жизнеспособные клетки. Методы варьируют в зависимости от того, переносится ли нуклеиновая кислота в культивируемые клетки in vitro или in vivo в клетки предназначенного хозяина. Методы, подходящие для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают применение липосом, электропорации, микроинъекции, гибридизации клеток, DEAE-декстрана, метод осаждения фосфатом кальция, и т.д. Обычно применяемый вектор для доставки гена ex vivo является ретровирусным вектором.
В настоящее время предпочтительные методы переноса нуклеиновой кислоты in vivo включают трансфекцию вирусными векторами (такими как аденовирус, вирус Herpes simplex I или адено-связанный вирус) и системы на основе липидов (применимые липиды для липид-опосредованного переноса представляют собой DOTMA, DOPE и DC-Choi, например). Для обзора известных в настоящее время методик маркировки генов и генной терапии см. Anderson et al., Science 256:808-813 (1992). См. также WO 93/25673 и ссылки, цитируемые в ней.
Антитела против ТАТ изобретения могут находиться в различных формах, охваченных в настоящей заявке определением "антитело". Таким образом, антитела включают с полной длиной или интактное антитело, фрагменты антитела, антитело с нативной последовательностью или аминокислотные варианты, гуманизированные, химерные или гибридные антитела, иммуноконъюгаты и их функциональные фрагменты. В гибридных антителах последовательность антитела является рекомбинированной с гетерологичной полипептидной последовательностью. Антитела могут быть модифицированы по Fc-области для обеспечения желательных эффекторных функций. Как обсуждается более подробно в настоящей заявке в разделах, с соответствующими Fc-областями, оголенное антитело, связанное на клеточной поверхности, может индуцировать цитотоксичность, например, через антитело-зависимую клеточную цитотоксичность (ADCC) или посредством вовлечения комплемента в комплемент-зависимую цитотоксичность, или некоторого другого механизма. Альтернативно, там, где желательно устранить или снизить эффекторную функцию, таким образом, чтобы минимизировать побочные эффекты или терапевтические осложнения, могут применяться некоторые другие Fc-области.
В одном варианте осуществления антитело конкурирует за связывание или связывается по существу с тем же эпитопом, что и антитела изобретения. Антитела, имеющие биологические характеристики настоящих антител изобретения против ТАТ, также предусматриваются, конкретно включая направленное воздействие на опухоль in vivo и любое ингибирование пролиферации клеток или цитотоксические характеристики.
Способы получения указанных выше антител описаны в настоящей заявке подробно.
Настоящие антитела против ТАТ, олигопептиды и органические молекулы являются применимыми для лечения TAT-экспрессирующего рака или облегчения одного или более симптомов рака у млекопитающего. Такой рак включает рак простаты, рак мочевыводящих путей, рак легкого, рак молочной железы, рак толстой кишки и рак яичника, более конкретно, аденокарциному простаты, карциномы почечных клеток, колоректальные аденокарциномы, аденокарциномы легких, карциномы легочных сквамозных клеток и плевральную мезотелиому. Раки охватывают метастатические раки любого рака из предшествующих. Антитело, олигопептид или органическая молекула обладают способностью связываться с по меньшей мере частью раковых клеток, которые экспрессируют полипептид ТАТ у млекопитающего. В предпочтительном варианте осуществления, антитело, олигопептид или органическая молекула являются эффективными для разрушения или уничтожения TAT-экспрессирующих опухолевых клеток или ингибирования роста таких опухолевых клеток, in vitro или in vivo, при связывании с полипептидом ТАТ на клетке. Такое антитело включает оголенное антитело против TAT (не конъюгированное с каким-либо агентом). Оголенные антитела, которые имеют цитотоксические или ингибирующие рост клеток свойства, могут быть дополнительно сопряжены с цитотоксическим агентом для придания им даже большей активности при деструкции опухолевых клеток. Цитотоксические свойства могут быть приданы антителу против TAT посредством, например, конъюгации антитела с цитотоксическим агентом, с образованием иммуноконъюгата, как описано в настоящей заявке. Цитотоксический агент или агент, ингибирующий рост, предпочтительно, представляет собой небольшую молекулу. Токсины, такие как калихеамицин или майтансиноид и их аналоги или производные, являются предпочтительными.
Изобретение предоставляет композицию, содержащую антитело против ТАТ, олигопептид или органическую молекулу изобретения, и носитель. С целью лечения рака, композиции могут вводиться пациенту, нуждающемуся в таком лечении, где композиция может содержать одно или более антител против ТАТ, присутствующих как иммуноконъюгат или как оголенное антитело. В дополнительном варианте осуществления, композиции могут содержать эти антитела, олигопептиды или органические молекулы в комбинации с другими терапевтическими агентами, такими как цитотоксические или ингибирующие рост агенты, включая химиотерапевтические агенты. Изобретение также предоставляет лекарственные формы, содержащие антитело против ТАТ, олигопептид или органическую молекулу изобретения, и носитель. В одном варианте осуществления лекарственная форма представляет собой терапевтическую лекарственную форму, содержащую фармацевтически приемлемый носитель.
Еще одним другим аспектом изобретения являются выделенные нуклеиновые кислоты, кодирующие антитела против ТАТ. Нуклеиновые кислоты, кодирующие как H, так и L цепи, и особенно остатки гипервариабельной области, цепи которых кодируют антитело с нативной последовательностью, а также варианты, модификации и гуманизированные версии антитела являются охваченными.
Изобретение также предоставляет способы, применимые для лечения полипептид ТАТ-экспрессирующего рака или смягчения одного или более симптомов рака у млекопитающего, включающие введение терапевтически эффективного количества антитела против ТАТ, олигопептида или органической молекулы млекопитающему. Терапевтические композиции антитела, олигопептида или органической молекулы могут вводиться кратковременно (в остром режиме) или хронически или с перерывами, как указано терапевтом. Также предоставлены способы ингибирования роста и уничтожения полипептид ТАТ-экспрессирующих клеток.
Изобретение также предоставляет наборы и промышленные изделия, содержащие по меньшей мере одно антитело против TAT, один олигопептид или одну органическую молекулу. Наборы, содержащие антитела против ТАТ, олигопептиды или органические молекулы, находят применение, например, для анализов уничтожения TAT клеток, для очистки или иммунопреципитации полипептида ТАТ из клеток. Например, для выделения и очистки TAT, набор может содержать антитело против ТАТ, олигопептид или органическую молекулу, связанную с шариками (например, шариками сефарозы). Могут быть предоставлены наборы, которые содержат антитела, олигопептиды или органические молекулы для обнаружения и количественного определения TAT in vitro, например, при ELISA или Вестерн-блоттинге. Такое антитело, олигопептид или органическая молекула, применимые для обнаружения, могут быть предоставлены вместе с меткой, такой как флуоресцентная или радиоактивная метка.
L. Промышленные изделия и наборы
Еще один другой вариант осуществления изобретения представляет собой изделие, содержащее материалы, применимые для лечения против ТАТ экспрессирующего рака. Изделие содержит контейнер и метку или листок-вкладыш на контейнере или связанные с контейнером.
Подходящие контейнеры включают, например, бутыли, пузырьки, шприцы и т.д. Контейнеры могут быть образованы из разнообразных материалов, таких как стекло или пластик. Контейнер удерживает композицию, которая является эффективной для лечения ракового состояния и может иметь стерильное входное отверстие (например, контейнер может представлять собой мешок с внутривенным раствором или пузырек, имеющий пробку, поддающуюся прокалыванию иглой для гиподермальной инъекции). По меньшей мере один активный агент в композиции представляет собой антитело против ТАТ, олигопептид или органическую молекулу изобретения. Метка или листок-вкладыш указывает на то, что композицию применяют для лечения рака. Метка или листок-вкладыш будут дополнительно содержать инструкции для введения композиции антитела, олигопептида или органических молекул раковому пациенту. Дополнительно, изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическую воду для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он может дополнительно включать другие материалы, желательные с коммерческой точки зрения и точки зрения пользователя, включающие другие буферы, разбавители, фильтры, иглы и шприцы.
Также предоставлены наборы, которые являются применимыми для разнообразных целей, например, для анализов уничтожения TAT-экспрессирующих клеток, для очистки или иммунопреципитации полипептида ТАТ из клеток. Для выделения и очистки полипептида ТАТ, набор может содержать антитело против ТАТ, олигопептид или органическую молекулу, связанную с шариками (например, шариками сефарозы). Могут быть предоставлены наборы, которые содержат антитела, олигопептиды или органические молекулы для обнаружения и количественного определения полипептида ТАТ in vitro, например, при ELISA или Вестерн-блоттинге. Как и изделие, набор содержит контейнер и метку или листок-вкладыш на контейнере или связанные с контейнером. Контейнер удерживает композицию, содержащую по меньшей мере одно антитело против ТАТ, один олигопептид или одну органическую молекулу изобретения. Могут быть включены дополнительные контейнеры, которые содержат, например, разбавители и буферы, контрольные антитела. Метка или листок-вкладыш могут предоставлять описание композиции, а также инструкции для предназначенного in vitro или диагностического применения.
M. Применения полипептидов ТАТ и нуклеиновых кислот, кодирующих TAT-полипептид
Нуклеотидные последовательности (или их комплемент), кодирующие полипептиды ТАТ, имеют разнообразные применения в области молекулярной биологии, включая применения в качестве зондов гибридизации, в хромосоме и картировании генов и в генерации антисмысловых РНК и ДНК зондов. TAT-кодирующая нуклеиновая кислота будет также применимой для получения полипептидов ТАТ посредством рекомбинантных методов, описанных в настоящей заявке, где эти полипептиды ТАТ могут найти применение, например, при получении антител против ТАТ, как описано в настоящей заявке.
Непроцессированная нативная последовательность гена TAT или ее части могут применяться в качестве зондов гибридизации для библиотеки кДНК для выделения непроцессированной кДНК TAT или для выделения еще других кДНК (например, кодирующих встречающиеся в природе вариантов TAT или TAT из других видов), которые имеют желательную идентичность последовательности с нативной последовательностью TAT, описанной в настоящей заявке. Необязательно, длина зондов будет составлять приблизительно от 20 до приблизительно 50 оснований. Зонды гибридизации могут быть производными по меньшей мере частично, от новых областей первичной нативной нуклеотидной последовательности, где эти области могут быть определены без излишнего экспериментирования или из геномных последовательностей, включающих промоторы, энхансерные элементы и интроны нативной последовательности TAT. Посредством примера, метод скрининга будет включать выделение кодирующей области гена ТАТ с использованием известной последовательности ДНК для синтеза выбранного зонда из приблизительно 40 оснований. Зонды гибридизации могут быть мечены разнообразными метками, включая радионуклеотиды, такими как32P или35S, или ферментативными метками, такими как щелочная фосфатаза, связанная с зондом через системы связывания авидин/биотин. Меченые зонды, имеющие последовательность, комплементарную с последовательностью гена ТАТ настоящего изобретения, могут применяться для скринирования библиотек кДНК человека, геномных ДНК или мРНК, чтобы определить, с какими элементами таких библиотек зонд гибридизируется. Методы гибридизации описаны с дополнительными подробностями ниже в примерах. Любые EST последовательности, раскрытые в настоящей заявке, могут сходным образом использоваться в качестве зондов, с использованием методов, раскрытых в настоящей заявке.
Другие применимые фрагменты нуклеиновых кислот, кодирующих TAT, включают антисмысловые или смысловые олигонуклеотиды, содержащие однонитевую последовательность нуклеиновой кислоты, (либо РНК, либо ДНК), способную к связыванию с целевыми последовательностями мРНК (смысловой) TAT или ДНК (антисмысловой) TAT. Антисмысловые или смысловые олигонуклеотиды, в соответствии с настоящим изобретением, содержат фрагмент кодирующей области ДНК TAT. Такой фрагмент, обычно содержит по меньшей мере приблизительно 14 нуклеотидов, предпочтительно, от приблизительно 14 до 30 нуклеотидов. Способность производить антисмысловой или смысловой олигонуклеотид, на основе последовательности кДНК, кодирующей данный белок описана, например, у Stein и Cohen (Cancer Res. 48:2659, 1988) и van der Krol et al. (BioTechniques 6:958, 1988).
Связывание антисмысловых или смысловых олигонуклеотидов с целевыми последовательностями нуклеиновой кислоты приводит в результате к образованию дуплексов, которые блокируют транскрипцию или трансляцию целевой последовательности посредством одного из нескольких средств, включающих усиленную деградацию дуплексов, преждевременную терминацию транскрипции или трансляции или посредством других средств. Такие способы охвачены настоящим изобретением. Антисмысловые олигонуклеотиды, таким образом, могут применяться для блокирования экспрессии TAT белков, где эти TAT белки могут играть роль в индукции рака у млекопитающих. Антисмысловые или смысловые олигонуклеотиды дополнительно содержат олигонуклеотиды, имеющие модифицированные сахарно-фосфодиэфирные остовы (или другие сахарные связывания, такие как описанные в WO 91/06629), и, где такие сахарные связывания являются резистентными к эндогенным нуклеазам. Такие олигонуклеотиды с резистентными сахарными связываниями являются стабильными in vivo (т.е. способными сопротивляться ферментативной деградации), но сохраняют специфичность последовательности, чтобы быть способными к связыванию с целевыми нуклеотидными последовательностями.
Предпочтительные интрагенные сайты для антисмыслового связывания включают область, включающую трансляционный инициационный/стартовый кодон (5'-AUG/5'-ATG) или терминационный/остановочный кодон (5'-UAA, 5'-UAG и 5-UGA/5'-TAA, 5'-TAG и 5'-TGA) открытой рамки считывания (ORF) гена. Эти области относятся к части мРНК или гена, которая охватывает от приблизительно 25 до приблизительно 50 смежных нуклеотидов в обоих направлениях (т.е. 5' или 3') от кодона трансляции инициации или терминации. Другие предпочтительные области для антисмыслового связывания включают: интроны; экзоны; интрон-экзонные сочленения; открытую рамку считывания (ORF) или "кодирующую область", которая является областью между кодоном трансляции инициации и кодоном трансляции терминации; 5'-кэп мРНК, которая содержит N7-метилированный остаток гуанозина, соединенный с 5'-наибольшим остатком мРНК через 5'-5' трифосфатную связь и включает сами 5'-кэп структуры, а также первые 50 нуклеотидов, примыкающие к концу; 5' нетранслированная область (5'UTR), часть мРНК в 5' направлении от кодона трансляции инициации, и, таким образом, включающая нуклеотиды между 5' кэп-сайтом и кодоном трансляции инициации мРНК или соответствующие нуклеотиды на гене; и 3' нетранслированную область (3'UTR), часть мРНК в 3' направлении от кодона трансляции терминации, и, таким образом, включающую нуклеотиды между кодоном трансляции терминации и 3' концом мРНК или соответствующие нуклеотиды на гене.
Конкретные примеры предпочтительных антисмысловых соединений, применимых для ингибирования экспрессии TAT белков, включают олигонуклеотиды, содержащие модифицированные остовы или неприродные межнуклеозидные связи. Олигонуклеотиды, имеющие модифицированные скелеты, включают олигонуклеотиды, которые сохраняют атом фосфора в скелете, и олигонуклеотиды, которые не имеют атома фосфора в скелете. Для целей данного описания, и как иногда именуются в области, модифицированные олигонуклеотиды, которые не имеют атома фосфора в их межнуклеозидном скелете, могут также рассматриваться как олигонуклеозиды. Предпочтительные модифицированные олигонуклеотидные скелеты включают, например, фосфотиоаты, хиральные фосфотиоаты, фосфодитиоаты, сложные фосфотриэфиры, аминоалкилфосфотриэфиры, метил- и другие алкилфосфонаты, включающие 3'-алкиленфосфонаты, 5'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включающие 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры, селенофосфаты и борано-фосфаты, имеющие нормальные 3'-5' связывания, их 2'-5' связанные аналоги, и имеющие обращенную полярность, где одно или более межнуклеотидными связями являются связи 3' с 3', 5' с 5' или 2' с 2'. Предпочтительные олигонуклеотиды, имеющие обращенную полярность, содержат единичную 3' с 3' связь при 3'-наибольшей межнуклеотидной связи, т.е. единичный обращенный нуклеозидный остаток, который может быть абазическим (нуклеооснование пропущено или имеется гидроксильная группа вместо него). Разнообразные соли, смешанные соли и свободные кислотные формы также включены. Представительные патенты Соединенных Штатов, в которых изложено получение фосфорсодержащих связываний, включают, но не ограничены лишь ими, патенты США №№: 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361; 5194599; 5565555; 5527899; 5721218; 5672697 и 5625050, каждый из которых включен в настоящую заявку посредством ссылки.
Предпочтительные модифицированные олигонуклеотидные скелеты, которые не включают в себя атом фосфора, имеют скелеты, которые образованы посредством короткоцепных алкильных или циклоалкильных межнуклеозидных связей, смешанных гетероатомных и алкильных или циклоалкильных межнуклеозидных связей, или одной или более короткоцепных гетероатомных или гетероциклических межнуклеозидных связей. Такие включают скелеты, имеющие морфолино-связи (образованные частично от сахарной части нуклеозида); силоксановые скелеты; сульфидные, сульфоксидные и сульфоновые скелеты; формацетильные и тиоформацетильные скелеты; метиленформацетильные и тиоформацетильные скелеты; рибоацетильные скелеты; алкенсодержащие скелеты; сульфаматные скелеты; метиленимино и метиленгидразиновые скелеты; сульфонатные и сульфонамидные скелеты; амидные скелеты; и другие, имеющие смешанные N, O, S и CH.суб.2 компонентные части. Представительные Патенты Соединенных Штатов, в которых изложено получение таких олигонуклеозидов включают, но не ограничены лишь ими, патенты США №№: 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437; 5792608; 5646269 и 5677439, каждый из которых включен в настоящую заявку посредством ссылки.
В других предпочтительных антисмысловых олигонуклеотидах, как сахар, так и межнуклеозидная связь, т.е. скелет, нуклеотидных структурные единицы замещены новыми группами. Единицы оснований поддерживаются для гибридизации с помощью целевого соединения соответствующей нуклеиновой кислоты. Одно такое олигомерное соединение, олигонуклеотидомиметик, который показал превосходные гибридизационные свойства, называют пептидной нуклеиновой кислотой (PNA). В соединениях PNA, сахарный скелет олигонуклеотида замещен амидом, содержащим скелет, в частности аминоэтилглициновый скелет. Нуклеооснования сохраняются и связаны непосредственно или опосредованно с аза-азотными атомами амидной части скелета. Представительные патенты Соединенных Штатов, в которых изложено получение соединений PNA, включают, но не ограничены лишь ими, патенты США №№: 5539082; 5714331; и 5719262, каждый из которых включен в настоящую заявку посредством ссылки. Дополнительное руководство по соединениям PNA можно найти у Nielsen et al., Science, 1991, 254, 1497-1500.
Предпочтительные антисмысловые олигонуклеотиды включают фосфотиоатные скелеты и/или гетероатомные скелеты, и в частности, -CH2-NH-О-CH2-, -CH2-N(CH3)-О-CH2- [известный как метилен (метилимино) или мМI скелет], -CH2-О-N(CH3)-CH2-, -CH2-N(CH3)-N(CH3)-CH2- и -О-N(CH3)-CH2-CH2- [где нативный фосфодиэфирный скелет представлен как -О-P-О-CH2-], описанные в указанном выше патенте США № 5489677, и амидные скелеты указанного выше патента США № 5602240. Также предпочтительными являются антисмысловые олигонуклеотиды, имеющие структуры морфолино-скелета указанного выше патента США № 5034506.
Модифицированные олигонуклеотиды могут также содержать один или более замещенных сахарных фрагментов. Предпочтительные олигонуклеотиды содержат один из следующих в 2' положении: OH; F; O-алкил, S-алкил, или N-алкил; O-алкенил, S- алкенил или N-алкенил; O-алкинил, S-алкинил или N-алкинил; или O-алкил-O-алкил, где алкил, алкенил и алкинил могут быть замещены или не замещены C1-C10 алкилом или C2-C10 алкенилом и алкинилом. Особенно предпочтительными являются О[(CH2)nO]mCH3, О(CH2)nOCH3, О(CH2)nNH2, О(CH2)nCH3, О(CH2)nONH2 и О(CH2)nON[(CH2)nCH3)]2, где n и m составляют от 1 до приблизительно 10. Другие предпочтительные антисмысловые олигонуклеотиды содержат один из следующих в 2' положении: C1-C10 низший алкил, замещенный низший алкил, алкенил, алкинил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, РНК-расщепляющую группу, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида, и другие заместители, имеющие сходные свойства. Предпочтительная модификация включает 2'-метоксиэтокси (2'-О-CH2CH2OCH3, также известную как 2'-О-(2-метоксиэтил) или 2'-MOE) (Martin et al., Helv. Chim. Acta, 1995, 78, 486-504) т.е. алкоксиалкокси группу. Дополнительная предпочтительная модификация включает 2'-диметиламинооксиэтокси, т.е. О(CH2)2ON(CH3)2 группу, также известную как 2'-DMAOE, как описано в настоящей заявке в примерах ниже, и 2'-диметиламиноэтоксиэтокси (также известную в данной области как 2'-О-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е. 2'-O-CH2-O-CH2-N(CH2).
Дополнительная предпочтительная модификация включает Закрытые Нуклеиновые кислоты (LNA), в которых 2'-гидроксильная группа связана с 3' или 4' углеродным атомом сахарного кольца, посредством чего образуя бициклический сахарный фрагмент. Связь является, предпочтительно, метиленовой (-CH2-)n группой, образуя мостик между 2' кислородным атомом и 4' углеродным атомом, где n равно 1 или 2. LNA и их получение описаны в WO 98/39352 и WO 99/14226.
Другие предпочтительные модификации включают 2'-метокси (2'-О-CH3), 2'-аминопропокси (2-OCH2CH2CH2NH2), 2'-аллил (2'-CH2-CH=CH2), 2'-О-аллил (2'-О-CH2-CH=CH2) и 2'-фтор (2'-F). 2'-модификация может находиться в арабино (верхнем) положении или рибо (нижнем) положении. Предпочтительной 2'-арабино модификацией является 2'-F. Аналогичные модификации могут также быть сделаны по другим положениям на олигонуклеотиде, конкретно 3' положении сахара на 3' концевом нуклеотиде или в 2'-5' связанных олигонуклеотидах и 5' положении 5' концевого нуклеотида. Олигонуклеотиды могут также иметь сахаромиметики, такие как циклобутильные фрагменты вместо пентофуранозильного сахара. Представительные патенты Соединенных Штатов, в которых изложено получение таких модифицированных сахарных структур, включают, но не ограничены лишь ими, патенты США №№: 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; 5792747; и 5700920, каждый из которых включен в настоящую заявку посредством ссылки во всей его полноте.
Олигонуклеотиды могут также включать модификации или замещения нуклеинового основания (часто именуемого в области просто как "основание"). Как используют в настоящей заявке, "немодифицированные" или "природные" нуклеиновые основания включают пуриновые основания аденин (A) и гуанин (G), и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеиновые основания включают другие синтетические и природные нуклеиновые основания, такие как 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метильные и другие алкильные производные аденина и гуанина, 2-пропильные и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил (-C=C-CH3 или -CH2-C=CH) урацил и цитозин и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, особенно 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-амино-аденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин, и 3-деазагуанин и 3-деазааденин. Дополнительные модифицированные нуклеиновые основания включают трициклические пиримидины, такие как феноксазинцитидин(1H-пиримидо[5,4- b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин (1H-пиримидо[5,4-b][1,4]бензотиазин-2(3H)-он), G-зажимы, такие как замещенный феноксазинцитидин (например, 9-(2-аминоэтокси)-H-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), карбазолцитидин (2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин (H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он). Модифицированные нуклеиновые основания могут также включать основания, в которых пуриновое или пиримидиновое основание замещено другими гетероциклами, например 7-деаза-аденин, 7-деазагуанозин, 2-аминопиридин и 2-пиридон. Дополнительные нуклеиновые основания включают основания, раскрытые в патенте США № 3687808, основания, раскрытые в Concise Encyclopedia Polymer Science and Engineering, pages 858-859, Kroschwitz, J. I., ed. John Wiley & Sons, 1990, и основания, раскрытые Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613. Некоторые из этих нуклеиновых оснований являются особенно применимыми для увеличения сродства связывания олигомерных соединений изобретения. Такие включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и О-6 замещенные пурины, включающие 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Было показано, что 5-метилцитозиновые замещения увеличивают устойчивость дуплекса нуклеиновой кислоты на 0,6-1,2 градусов C. (Sanghvi et al., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278) и являются предпочтительными замещениями основания, даже более особенно, когда сочетаются с 2'-О-метоксиэтильными сахарными модификациями. Представительные патенты Соединенных Штатов, в которых изложено получение модифицированных нуклеиновых оснований, включают, но не ограничены лишь ими: патент США № 3687808, а также патенты США №№: 4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121, 5596091; 5614617; 5645985; 5830653; 5763588; 6005096; 5681941 и 5750692, каждый из которых включен в настоящую заявку посредством ссылки.
Еще одной другой модификацией антисмысловых олигонуклеотидов является химическое связывание с олигонуклеотидом одного или более фрагментов или конъюгатов, которые усиливают активность, клеточное распределение или клеточный захват олигонуклеотида. Соединения изобретения могут включать конъюгатные группы, ковалентно связанные с функциональными группами, такими как первичные или вторичные гидроксильные группы. Конъюгатные группы изобретения включают интеркаляторы, репортерные молекулы, полиамины, полиамиды, полиэтиленгликоли, простые полиэфиры, группы, которые усиливают фармакодинамические свойства олигомеров, и группы, которые усиливают фармакокинетические свойства олигомеров. Типичные группы конъюгатов включают холестерины, липиды, катионные липиды, фосфолипиды, катионные фосфолипиды, биотин, феназин, фолат, фенантритдин, антахинон, акридин, флуоресцеины, родамины, кумарины и красители. Группы, которые усиливают фармакодинамические свойства, в контексте данного изобретения, включают группы, которые улучшают захват олигомера, усиливают резистентность олигомера к деградации, и/или усиливают последовательность-специфичную гибридизацию с РНК. Группы, которые усиливают фармакокинетические свойства, в контексте данного изобретения, включают группы, которые улучшают захват олигомера, распределение, метаболизм или экскрецию. Конъюгатные фрагменты включают, но не ограничены лишь ими, липидные фрагменты, такие как холестериновый фрагмент (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), холевую кислоту (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538), алифатическую цепь, например, остатки додекандиола или ундецила (Saison-Behmoaras et al., EMBO J., 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie, 1993, 75, 49-54), фосфолипид, например, ди-гексадецил-rac-глицерин или 1,2-ди-O-гексадецил-rac-глицеро-3-H-фосфонат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), полиамин или цепь полиэтиленгликоля (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973), или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654), пальмитильный фрагмент (Mishra et al., Biochim. Biophys. Acta, 1995, 1264, 229-237), или октадециламин или гексиламино-карбонил-оксихолестериновый фрагмент. Олигонуклеотиды изобретения могут также быть конъюгированными с активными лекарственными веществами, например, аспирином, варфарином, фенилбутазоном, ибупрофеном, супрофеном, фенбуфеном, кетопрофеном, (S)-(+)-проанопрофеном, карпрофеном, дансилсаркозином, 2,3,5-трийодбензойной кислотой, флуфенаминовой кислотой, фолиновой кислотой, бензотиадиазидом, хлортиазидом, диазепином, индометацином, барбитуратом, цефалоспорином, сульфамидным лекарственным средством, антидиабетическим средством, антибактериальным средством или антибиотиком. Конъюгаты олигонуклеотид-лекарственное средство и их получение описаны в патентной заявке США № 09/334130 (поданной 15 июня, 1999 г.) и патентах США №№: 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717 5580731; 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241 5391723; 5416203, 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941, каждый из которых включен в настоящую заявку посредством ссылки.
Не является необходимым для всех положений в данном соединении быть однородно модифицированными, и, фактически, более чем одна из вышеуказанных модификаций может быть введена в единичное соединение или даже в единичный нуклеозид в олигонуклеотиде. Настоящее изобретение также включает антисмысловые соединения, которые являются химерными соединениями. "Химерные" антисмысловые соединения или "химеры" в контексте данного изобретения представляют собой антисмысловые соединения, в частности, олигонуклеотиды, которые содержат две или более химически различимых областей, каждая из которых сделана из по меньшей мере одной мономерной единицы, т.е. нуклеотида в случае олигонуклеотидного соединения. Эти олигонуклеотиды типично содержат по меньшей мере одну область, где олигонуклеотид модифицирован таким образом, чтобы придать олигонуклеотиду увеличенную резистентность к нуклеазной деградации, увеличенный клеточный захват и/или увеличенное сродство связывания для целевой нуклеиновой кислоты. Дополнительная область олигонуклеотида может служить в качестве субстрата для ферментов, способных к расщеплению гибридов РНК:ДНК или РНК:РНК. Посредством примера, РНКаза H является клеточной эндонуклеазой, которая расщепляет нить РНК дуплекса РНК:ДНК. Активация РНКазы H, следовательно, приводит в результате к расщеплению РНК-мишени, посредством чего значительно усиливая эффективность олигонуклеотидного ингибирования гена экспрессии. Следовательно, сравнимые результаты могут часто быть получены с более короткими олигонуклеотидами, когда применяют химерные олигонуклеотиды, по сравнению с фосфотиоатными дезоксиолигонуклеотидами, гибридизирующимися с той же целевой областью. Химерные антисмысловые соединения изобретения могут быть образованы как композитные структуры двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или олигонуклеотидных миметиков, как описано выше. Предпочтительные химерные антисмысловые олигонуклеотиды включают по меньшей мере один 2' модифицированный сахар (предпочтительно, 2'-O-(CH2)2-О-CH3) по 3' концу для придания резистентности к нуклеазам, и область с по меньшей мере 4 смежными 2'-H сахарами для придания активности РНКазы H. Такие соединения также называют в данной области гибридами или гапмерами (химерными олигонуклеотидами). Предпочтительные гапмеры имеют область 2' модифицированных сахаров (предпочтительно, 2'-O-(CH2)2-O-CH3) по 3'-концу и по 5' концу, разделенные по меньшей мере одной областью, имеющей по меньшей мере 4 смежных 2'-H сахара, и, предпочтительно, включают связи фосфотиоатного скелета. Представительные патенты Соединенных Штатов, в которых изложено получение таких гибридных структур, включают, но не ограничены лишь ими, патенты США №№ 5013830; 5149797; 5220007; 5256775; 5366878; 5403711; 5491133; 5565350; 5623065; 5652355; 5652356; и 5700922, каждый из которых включен в настоящую заявку посредством ссылки во всей его полноте.
Антисмысловые соединения, применяемые в соответствии с данным изобретением, могут быть удобным образом и традиционно получены посредством хорошо известного метода твердофазного синтеза. Оборудование для такого синтеза поставляется несколькими продавцами, включая, например, Applied Biosystems (Foster City, Calif). Могут дополнительно или альтернативно использоваться любые другие средства для такого синтеза, известные в данной области. Хорошо известным является применение сходных методов для получения олигонуклеотидов, таких как фосфотиоаты и алкилированные производные. Соединения изобретения могут также быть добавлены в смеси, инкапсулированы, конъюгированы или иным образом связаны с другими молекулами, структурами молекул или смесями соединений, как например, липосомы, молекулы, нацеленными на рецептор, пероральные, ректальные, местные или другие лекарственные формы, чтобы способствовать захвату, распределению и/или всасыванию. Представительные патенты Соединенных Штатов, в которых изложено получение таких лекарственных форм, способствующих захвату, распределению и/или всасыванию, включают, но не ограничены лишь ими, патенты США №№ 5108921; 5354844; 5416016; 5459127; 5521291; 5543158; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575; и 5595756, каждый из которых включен в настоящую заявку посредством ссылки.
Другие примеры смысловых или антисмысловых олигонуклеотидов включают такие олигонуклеотиды, которые являются ковалентно связанными с органическими фрагментами, такими как фрагменты, описанные в WO 90/10048, и другими фрагментами, которые увеличивают сродство олигонуклеотида к целевой последовательности нуклеиновой кислоты, такими как поли-(L-лизин). Еще дополнительно, интеркалирующие агенты, такие как эллиптицин, и алкилирующие агенты или комплексы металлов могут быть присоединены к смысловым или антисмысловым олигонуклеотидам, чтобы модифицировать специфичности связывания антисмыслового или смыслового олигонуклеотида к целевой нуклеотидной последовательности.
Антисмысловые или смысловые олигонуклеотиды могут быть введены в клетку, содержащую целевую последовательность нуклеиновой кислоты посредством любого метода генного переноса, включающего, например, CaPO4-опосредованную трансфекцию ДНК, электропорацию, или посредством использования векторов генного переноса, таких как вирус Эпштейна-Барра. В предпочтительной методике, антисмысловой или смысловой олигонуклеотид вводят в подходящий ретровирусный вектор. Клетка, содержащая целевую последовательность нуклеиновой кислоты, контактирует с рекомбинантным ретровирусным вектором, либо in vivo или ex vivo. Подходящие ретровирусные векторы включают, но не ограничены лишь ими, векторы, производные от мышиного ретровируса M-MuLV, N2 (ретровируса, производного от M-MuLV), или векторов двойного копирования, обозначенных DCT5A, DCT5B и DCT5C (см. WO 90/13641).
Смысловые или антисмысловые олигонуклеотиды также могут быть внедрены в клетку, содержащую целевую нуклеотидную последовательность посредством образования конъюгата с лиганд-связывающей молекулой, как описано в WO 91/04753. Подходящие лиганд-связывающие молекулы включают, но не ограничены лишь ими, рецепторы клеточной поверхности, факторы роста, другие цитокины или другие лиганды, которые связываются с рецепторами клеточной поверхности. Предпочтительно, конъюгация лиганд-связывающей молекулы не оказывает существенного воздействия на способность лиганд-связывающей молекулы к связыванию с ее соответствующими молекулой или рецептором, или блокирует вход смыслового или антисмыслового олигонуклеотида или его конъюгированной версии в клетку.
Альтернативно, смысловой или антисмысловой олигонуклеотид может быть внедрен в клетку, содержащую целевую последовательность нуклеиновой кислоты посредством образования комплекса олигонуклеотид-липид, как описано в WO 90/10448. Комплекс смысловой или антисмысловой олигонуклеотид-липид, предпочтительно, диссоциирует внутри клетки под действием эндогенной липазы.
Антисмысловые или смысловые молекулы РНК или ДНК обычно содержат по меньшей мере приблизительно 5 нуклеотидов по длине, альтернативно по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, или 1000 нуклеотидов по длине, где в данном контексте термин "приблизительно" означает ссылочную длину нуклеотидной последовательности плюс или минус 10% от этой ссылочной длины.
Зонды могут также использоваться в методах ПЦР для генерации пула последовательностей для идентификации близко родственных последовательностей, кодирующих TAT.
Нуклеотидные последовательности, кодирующие TAT, могут также применяться для конструирования зондов гибридизации для картирования гена, который кодирует этот TAT, и для генетического анализа индивидуумов с генетическими нарушениями. Нуклеотидные последовательности, предоставленные в настоящей заявке, могут быть картированы в хромосому и конкретные области хромосомы с использованием известных методов, таких как гибридизация in situ, анализ связывания против известных хромосомных маркеров и скрининг гибридизации с помощью библиотек.
Когда кодирующие последовательности для TAT кодируют белок, который связывается с еще одним другим белком (пример, где TAT является рецептором), TAT может применяться в анализах для идентификации других белков или молекул, вовлеченных во взаимодействие связывания. Посредством таких способов, ингибиторы взаимодействия связывания рецептор/лиганд могут быть идентифицированы. Белки, вовлеченные в такие взаимодействия связывания, могут также применяться для скрининга пептида или низкомолекулярных ингибиторов или агонистов взаимодействия связывания. Также, рецептор TAT может применяться для выделения корреляционного лиганда (лигандов). Скрининговые анализы могут быть сконструированы, чтобы найти ведущие соединения, которые имитируют биологическую активность нативного TAT или рецептора для TAT. Такие скрининговые анализы будут включать анализы, поддающиеся скринингу химических библиотек с высокой пропускной способностью, делая их особенно подходящими для идентификации низкомолекулярных кандидатов в лекарственные средства. Рассматриваемые небольшие молекулы включают синтетические органические или неорганические соединения. Анализы могут осуществляться в разнообразных форматах, включающих анализы белок-белкового связывания, биохимические скрининговые анализы, иммуноанализы и анализы на клеточной основе, которые хорошо охарактеризованы в данной области.
Нуклеиновые кислоты, которые кодируют TAT или его модифицированные формы, могут также применяться для генерации либо трансгенных животных или животных с "выключенным геном", которые, в свою очередь, являются применимыми при разработке и скрининге терапевтически применимых реагентов. Трансгенное животное (например, мышь или крыса) представляет собой животное, имеющее клетки, которые содержат трансген, причем трансген был введен в животное или предок животного на пренатальной, например, эмбриональной стадии. Трансген представляет собой ДНК, которую интегрируют в геном клетки, из которой трансгенное животное развивается. В одном варианте осуществления, кДНК, кодирующая TAT, может применяться для клонирования геномной ДНК, кодирующей TAT в соответствии с установленными методами, и геномными последовательностями, применяемыми для генерации трансгенных животных, которые содержат клетки, которые экспрессируют ДНК, кодирующую TAT. Способы генерации трансгенных животных, особенно, животных, таких как мыши или крысы, стали общепринятыми в данной области и описаны, например, в патентах США №№ 4736866 и 4870009. Типично, конкретные клетки будут намечены для TAT трансгенного внедрения с помощью ткане-специфичных энхансеров. Трансгенные животные, которые включают копию трансгена, кодирующего TAT, вводимого в зародышевую линию животного на эмбриональной стадии, могут применяться для исследования эффекта увеличенной экспрессии ДНК, кодирующей TAT. Такие животные могут применяться как тестерные животные для реагентов, предполагаемых для придания защиты, от, например, патологических состояний, связанных с его сверхэкспрессией. В соответствии с данной гранью изобретения, животное обрабатывают реагентом, и сниженная частота наступления патологического состояния, по сравнению с необработанными животными, несущими трансген, будет указывать на потенциальное терапевтическое вмешательство для патологического состояния.
Альтернативно, нечеловеческие гомологи TAT могут применяться для создания животного "с выключенным" TAT, которое имеет дефектный или измененный ген, кодирующий TAT в результате гомологичной рекомбинации между эндогенным геном, кодирующим TAT, и измененной геномной ДНК, кодирующей TAT, введенной в эмбриональный ствол клеток животного. Например, кДНК, кодирующая TAT, может применяться для клонирования геномной ДНК, кодирующей TAT в соответствии с установленными методами. Часть геномной ДНК, кодирующая TAT, может быть подвергнута делеции или замещена еще одним другим геном, таким как ген, кодирующий селектируемый маркер, который может применяться для регистрации интеграции. Обычно, некоторые килооснования неизмененной фланкирующей ДНК (как по 5', так и по 3' концам) включают в вектор [см., например, Thomas and Capecchi, Cell, 51:503 (1987) для описания гомологичных рекомбинационных векторов]. Вектор внедряют в эмбриональную линию стволовых клеток (например, посредством электропорации), и клетки, в которых внедренная ДНК гомологично рекомбинировала с эндогенной ДНК, подвергают селекции [см. например, Li et al., Cell, 69:915 (1992)]. Выбранные клетки затем инъецируют в бластоцисту животного (например, мыши или крысы) для образования агрегационных химер [см., например, Bradley, в Teratocarcinomas и Embryonic Stem Cells: Practical Approach, E. J. Robertson, ed. (IRL, Oxford, 1987), pp. 113-152]. Химерный эмбрион может затем быть имплантирован в подходящую псевдобеременную самку приемного животного, и привнесенный эмбрион используют для создания животного с "выключенным геном". Потомство, удерживающее гомологично рекомбинированную ДНК в своих зародышевых клетках, может быть идентифицировано посредством стандартных методов и применяться для выведения животных, у которых все клетки животного содержат гомологично рекомбинированную ДНК. Животные с выключенным геном могут характеризоваться, например, по их способности защищаться против некоторых патологических состояний и по развитию у них патологических состояний вследствие отсутствия полипептида ТАТ.
Нуклеиновую кислоту, кодирующую полипептиды ТАТ, можно также применять в генной терапии. В приложениях генной терапии, гены вводят в клетки, чтобы достичь синтеза in vivo терапевтически эффективного генетического продукта, например, для замены дефектного гена. "Генная терапия" включает как общепринятую генную терапию, где продолжительный эффект достигается посредством разового лечения, так и введение гена терапевтических агентов, которое включает однократное или повторное введение терапевтически эффективных ДНК или мРНК. Антисмысловые РНК и ДНК могут применяться в качестве терапевтических агентов для блокирования экспрессии определенных генов in vivo. Уже было показано, что короткие антисмысловые олигонуклеотиды могут быть импортированы в клетки, где они действуют в качестве ингибиторов, несмотря на их низкие внутриклеточные концентрации, вызванные их ограниченным захватом клеточной мембраной (Zamecnik et al., Proc. Natl. Acad. Sci. USA 83:4143-4146 [1986]). Олигонуклеотиды могут быть модифицированы для усиления их захвата, например, посредством замещения их отрицательно заряженных фосфодиэфирных групп незаряженными группами.
Существуют разнообразные способы, доступные для введения нуклеиновых кислот в жизнеспособные клетки. Методы различаются в зависимости от того, переносится ли нуклеиновая кислота в культивируемые клетки in vitro или in vivo в клетки предназначенного хозяина. Методы, подходящие для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают применение липосом, электропорацию, микроинъекцию, гибридизацию клеток, DEAE-декстран, метод осаждения фосфатом кальция и т.д. В настоящее время предпочтительные методы генного переноса in vivo включают трансфекцию вирусными (типично ретровирусными) векторами и вирусную трансфекцию опосредованную покрытыми белком липосомами (Dzau et al., Trends in Biotechnology 11, 205-210 [1993]). В некоторых ситуациях является желательным предоставить источник нуклеиновой кислоты вместе с агентом, который нацелен на целевые клетки, такие как антитело, специфичные для мембранного белка клеточной поверхности мембран или целевой клетки, лиганд для рецептора на целевой клетке и т.д. Там, где используются липосомы, белки, которые связываются с мембранным белком клеточной поверхности, связанным с эндоцитозом, могут применяться для нацеливания и/или для облегчения захвата, например капсидные белки или их фрагменты, тропные для конкретного типа клеток, антитела для белков, которые претерпевают интернализацию в фазе клеточного цикла, белки, которые нацеливают внутриклеточную локализацию и увеличивают внутриклеточный период полужизни. Метод рецептор-опосредованного эндоцитоза описан, например, Wu et al., J. Biol. Chem. 262, 4429-4432 (1987); и Wagner et al., Proc. Natl. Acad. Sci. USA 87, 3410-3414 (1990). Для обзора по маркированию генов и протоколам генной терапии см. Anderson et al., Science 256, 808-813 (1992).
Молекулы нуклеиновой кислоты, кодирующие полипептиды ТАТ или их фрагменты, описанные в настоящей заявке, являются применимыми для идентификации хромосом. В этом отношении, существует постоянная потребность идентифицировать новые хромосомные маркеры, поскольку относительно несколько реагентов для маркировки хромосом, на основании действительных данных о последовательности являются доступными в настоящее время. Каждая молекула нуклеиновой кислоты для TAT настоящего изобретения может применяться в качестве маркера хромосом.
Полипептиды ТАТ и молекулы нуклеиновых кислот настоящего изобретения могут также применяться диагностически для гистотипирования, где полипептиды ТАТ настоящего изобретения могут дифференциально экспрессироваться в одной ткани по сравнению с еще одной другой, предпочтительно, в больной ткани по сравнению с нормальной тканью такого же типа ткани. Молекулы нуклеиновых кислот для TAT смогут найти применение для генерации зондов для ПЦР, Норзерн-анализа, Саузерн-анализа и Вестерн-анализа.
Данное изобретение охватывает способы скрининга соединений для идентификации соединений, которые имитируют действие полипептида ТАТ (агонистов) или предотвращают эффект полипептида ТАТ (антагонистов). Скрининговые анализы для кандидатов в лекарственные средства-антагонисты спроектированы для идентификации соединений, которые связываются или образуют комплекс или комплекс с полипептидами ТАТ, кодируемыми генами, идентифицированными в настоящей заявке, или иным образом воздействуют на взаимодействие кодируемых полипептидов с другими клеточными белками, включая, например, ингибирование экспрессии полипептида ТАТ из клеток. Такие скрининговые анализы будут включать анализы, поддающиеся скринингу химических библиотек с высокой пропускной способностью, делая их особенно подходящими для идентификации низкомолекулярных кандидатов в лекарственные средства.
Анализы могут осуществляться в разнообразных форматах, включающих анализы белок-белкового связывания, биохимические скрининговые анализы, иммуноанализы и анализы на клеточной основе, которые хорошо охарактеризованы в данной области.
Все анализы для антагонистов имеют общие черты в том, что они вызывают приведение в контакт кандидата в лекарственное средство с полипептидом ТАТ, кодируемым нуклеиновой кислотой, идентифицированной в настоящей заявке, при условиях и в течение времени, достаточного для обеспечения взаимодействия этих двух компонентов.
В анализах связывания, взаимодействием является связывание, и образованный комплекс может быть выделен или обнаружен в реакционной смеси. В конкретном варианте осуществления, полипептид ТАТ, кодируемый геном, идентифицированным в настоящей заявке, или кандидат в лекарственное средство иммобилизуют на твердой фазе, например на титрационном микропланшете, посредством ковалентных или нековалентных прикреплений. Нековалентное прикрепление, в целом, осуществляется посредством покрытия твердой поверхности раствором полипептида ТАТ и сушки. Альтернативно, иммобилизованное антитело, например моноклональное антитело, специфичное для полипептида ТАТ, подлежащего иммобилизации, может применяться для закрепления его на твердой поверхности. Анализ осуществляют посредством добавления неиммобилизованного компонента, который может быть помечен обнаруживаемой меткой, к иммобилизованному компоненту, например покрытой поверхности, содержащей закрепленный компонент. Когда реакция завершается, непрореагировавшие компоненты удаляют, например, промывкой, и комплексы, закрепленные на твердой поверхности, обнаруживают. Когда исходно неиммобилизованный компонент несет обнаруживаемую метку, обнаружение метки, иммобилизованной на поверхности, указывает на то, что комплексообразование произошло. Там, где исходно неиммобилизованный компонент не несет метку, комплексообразование может быть обнаружено, например, посредством использования меченого антитела, специфично связывающегося с иммобилизованным комплексом.
Если соединение-кандидат взаимодействует с, но не связывается с конкретным полипептидом ТАТ, кодируемым геном, идентифицированным в настоящей заявке, его взаимодействие с этим полипептидом может быть проанализировано методами, хорошо известными для обнаружения белок-белковых взаимодействий. Такие анализы включают традиционные подходы, такие как, например, сшивка, co-иммунопреципитация, и co-очистка через градиенты или хроматографические колонки. Дополнительно, белок-белковые взаимодействия могут регистрироваться посредством использования генетической системы на основе дрожжей, описанной Fields и сотр. (Fields and Song, Nature (London), 340:245-246 (1989); Chien et al., Proc. Natl. Acad. Sci. USA, 88:9578-9582 (1991)), как раскрыто Chevray and Nathans, Proc. Natl. Acad. Sci. USA, 89: 5789-5793 (1991). Многие транскрипционные активаторы, такие как дрожжевой GAL4, состоят из двух физически дискретных модулярных доменов, один из которых действует как ДНК-связывающий домен, а другой функционирует как транскрипционно-активационный домен. Дрожжевая экспрессионная система, описанная в приведенных выше публикациях (обычно называемая "двух-гибридной системой") имеет преимущество из этого свойства, и использует два гибридных белка, один из которых является целевым белком, который рекомбинирован с ДНК-связывающим доменом GAL4, и другой, в котором кандидатные активирующие белки рекомбинированы с активационным доменом. Экспрессия GAL1-lacZ репортерного гена под контролем GAL4-активированного промотора зависит от восстановления активности GAL4 через белок-белковое взаимодействие. Колонии, содержащие взаимодействующие полипептиды, обнаруживают с хромогенным субстратом для β-галактозидазы. Полный набор (MATCHMAKERTM) для идентификации белок-белковых взаимодействий между двумя конкретными белками с использованием двух-гибридного метода является промышленно доступным от Clontech. Эта система также может быть распространена для картирования белковых доменов, вовлеченных в конкретные белковые взаимодействия, а также для определения точного положения аминокислотных остатков, которые являются решающими для этих взаимодействий.
Соединения оказывают воздействие на взаимодействие гена, кодирующего полипептид ТАТ, идентифицированного в настоящей заявке, и других внутри- или внеклеточных компонентов могут быть тестированы следующим образом: обычно получают реакционную смесь, содержащую продукт гена и внутри- или внеклеточный компонент при условиях и в течение времени, обеспечивающих взаимодействие и связывание двух продуктов. Для тестирования способности кандидатного соединения ингибировать связывание, реакцию проводят в отсутствии и в присутствии тестируемого соединения. Дополнительно, может быть добавлено плацебо к третьей реакционной смеси, чтобы служить в качестве положительного контроля. Связывание (образование комплекса) между тестируемым соединением и внутри- или внеклеточным компонентом, присутствующим в смеси регистрируют, как описано в настоящей заявке выше. Образование комплекса в контрольной реакции (реакциях), но не в реакционной смеси, содержащей тестируемое соединение, указывает на то, что тестируемое соединение оказывает воздействие на взаимодействия тестируемого соединения и его партнера реакции.
Для анализа на антагонисты, полипептид ТАТ может быть добавлен к клетке, наряду с соединением, подвергаемого скринингу на предмет специфичной активности и способности соединения ингибировать активность, представляющую интерес, в присутствии полипептида ТАТ, указывает на то, что соединение является антагонистом по отношению к полипептиду ТАТ. Альтернативно, антагонисты могут быть обнаружены посредством объединения полипептида ТАТ и потенциального антагониста с мембранно-связанными рецепторами полипептида ТАТ или рекомбинантными рецепторами при соответствующих условиях для анализа конкурентного ингибирования. Полипептид ТАТ может быть помечен, например, радиоактивностью, таким образом, что число молекул полипептида ТАТ, связанных с рецептором, может применяться, чтобы определить эффективность потенциального антагониста. Ген, кодирующий рецептор, может быть идентифицирован многочисленными методами, известными специалистам в данной области, например, лиганд-пэннингом и FACS-сортингом. Coligan et al., Current Protocols in Immun., 1(2): Chapter 5 (1991). Предпочтительно, экспрессионное клонирование используют там, где полиаденилированную РНК получают из клетки, восприимчивой к полипептиду ТАТ и библиотеку кДНК, созданную из этой РНК делят на пулы и используют для трансфекции COS клеток или других клеток, которые не являются восприимчивыми к полипептиду ТАТ. Трансфицированные клетки, которые выращивают на стеклянных слайдах, подвергают воздействию меченого полипептида ТАТ. Полипептид ТАТ может быть помечен разнообразными средствами, включая йодирование или включение сайта распознавания для сайт-специфичных протеинкиназ. После фиксации и инкубации, слайды подвергают авторалиографическому анализу. Положительные пулы идентифицируют и суб-пулы получают и ре-трансфицируют с использованием процесса интерактивного суб-пулинга и ре-скрининга, в конечном счете, получая единичный клон, который кодирует предполагаемый рецептор.
В качестве альтернативного подхода для идентификации рецептора, меченый полипептид ТАТ может быть фотоаффинно-связан с клеточной мембраной или препаратами экстракта, которые экспрессируют молекулу рецептора. Сшитый материал разделяют посредством PAGE и экспонируют на рентгеновскую пленку. Меченый комплекс, содержащий рецептор, может быть вырезан, разделен на пептидные фрагменты, и подвергнут микро-секвенированию белка. Аминокислотная последовательность, полученная в результате микро-секвенирования, может использоваться для конструирования набора вырожденных олигонуклеотидных зондов для скрининга библиотеки кДНК, чтобы идентифицировать ген, кодирующий предполагаемый рецептор.
В еще одном другом анализе на антагонисты, клетки млекопитающих или мембранный препарат, экспрессирующие рецептор, будут инкубироваться с меченным полипептидом ТАТ в присутствии кандидатного соединения. Способность соединения усиливать или блокировать это взаимодействие, затем может быть измерена.
Более конкретные примеры потенциальных антагонистов включают олигонуклеотид, который связывается с гибридами иммуноглобулина с полипептидом ТАТ, и, в частности, антителами, включая, без ограничения, поли- и моноклональные антитела и фрагменты антител, единично-цепочечные антитела, антиидиотипические антитела и химерные или гуманизированные версии таких антител или фрагментов, а также антитела человека и фрагменты антител. Альтернативно, потенциальный антагонист может являться близкородственным белком, например, мутировавшей формой полипептида ТАТ, который распознает рецептор, но не оказывает никакого эффекта, посредством чего конкурентно ингибируя действие полипептида ТАТ.
Еще одним другим потенциальным антагонистом полипептида ТАТ является конструкция антисмысловой РНК или ДНК, полученная с использованием антисмысловой технологии, где, например, антисмысловая молекула РНК или ДНК действует, чтобы блокировать непосредственно трансляцию мРНК посредством гибридизации с целевой мРНК и предотвращая трансляцию белка. Антисмысловая технология может применяться для контроля генной экспрессии через образование тройной спирали или антисмысловые ДНК или РНК, причем оба метода основаны на связывании полинуклеотида с ДНК или РНК. Например, 5' кодирующая часть полинуклеотидной последовательности, которая кодирует зрелые полипептиды ТАТ, в настоящей заявке, применяют для конструирования антисмыслового РНК-олигонуклеотида из приблизительно от 10 до 40 пар оснований по длине. ДНК-олигонуклеотид конструируют, чтобы он был комплементарным области гена, вовлеченной в транскрипцию (тройная спираль - см. Lee et al., Nucl. Acids Res., 6:3073 (1979); Cooney et al., Science, 241: 456 (1988); Dervan et al., Science, 251: 1360 (1991)), посредством этого предотвращая транскрипцию и выработку полипептида ТАТ. Антисмысловой РНК-олигонуклеотид гибридизируется с мРНК in vivo и блокирует трансляцию молекулы мРНК в полипептиде ТАТ (антисмысловые - Okano, Neurochem., 56:560 (1991); Oligodeoxynucleotides as Antisense Ingibitors Gene Expression (CRC Press: Boca Raton, FL, 1988). Олигонуклеотиды, описанные выше, могут также быть доставлены в клетки таким образом, что антисмысловая РНК или ДНК может экспрессироваться in vivo для ингибирования выработки полипептида ТАТ. Когда применяют антисмысловую ДНК, олигодезоксирибонуклеотиды, производные от сайта трансляции-инициации, например, между приблизительно -10 и +10 положениями целевой нуклеотидной последовательности гена, являются предпочтительными.
Потенциальные антагонисты включают малые молекулы, которые связываются с активным сайтом, участком связывания рецептора или фактором роста или другим соответствующим участком связывания полипептида ТАТ, посредством этого блокируя нормальную биологическую активность полипептида ТАТ. Примеры малых молекул включают, но не ограничены лишь ими, небольшие пептиды или пептидоподобные молекулы, предпочтительно, растворимые пептиды, и синтетические непептидильные органические или неорганические соединения.
Рибозимы представляют собой ферментативные молекулы РНК, способные катализировать специфичное расщепление РНК. Рибозимы действуют посредством последовательность-специфичной гибридизации с комплементарной целевой РНК, с последующим эндонуклеолитическим расщеплением. Специфичные участки расщепления рибозимов в потенциальной целевой РНК могут быть идентифицированы известными методами. Дополнительные подробности см., например, у Rossi, Current Biology, 4:469-471 (1994), и публикация заявки РСТ № WO 97/33551 (опубликована 18 сентября, 1997 г).
Молекулы нуклеиновой кислоты при образовании тройной спирали, используемые для ингибирования транскрипции, должны быть однонитевыми и составленными из дезоксинуклеотидов. Композицию оснований этих олигонуклеотидов конструируют таким образом, что она способствует образованию тройной спирали через правила спаривания оснований Хугстина, которые, как правило, требуют участков значительного размера из пуринов или пиримидинов на одной нити дуплекса. Дополнительные подробности см., например, в публикации патентной заявки PCT № WO 97/33551, выше.
Эти малые молекулы могут быть идентифицированы посредством любых одного или более из скрининговых анализов, обсуждаемых в настоящей заявке выше, и/или посредством любых других скрининговых методов, хорошо известных квалифицированным специалистам в области.
Выделенная полипептид ТАТ-кодирующая нуклеиновая кислота может применяться в настоящей заявке для рекомбинантной выработки полипептида ТАТ с использованием методов, хорошо известных в данной области, и, как описано в настоящей заявке. В свою очередь, продуцируемые полипептиды ТАТ могут использоваться для генерации антител против ТАТ с использованием методов, хорошо известных в данной области, и, как описано в настоящей заявке.
Антитела, специфично связывающиеся с полипептидом ТАТ, идентифицированные в настоящей заявке, а также другие молекулы, идентифицированные посредством скрининговых анализов, раскрытых в настоящей заявке ранее, могут вводиться для лечения разнообразных нарушений, включающих рак, в виде фармацевтических композиций.
Если полипептид ТАТ является внутриклеточным и цельные антитела используются в качестве ингибиторов, интернализующиеся антитела являются предпочтительными. Однако липофекции или липосомы также могут применяться для доставки антитела или фрагмента антитела в клетки. Там, где применяют фрагменты антител, наименьший ингибирующий фрагмент, который специфически связывается с доменом связывания целевого белка, является предпочтительным. Например, на основе последовательностей вариабельных областей антитела, может быть сконструирована пептидная молекула, которая сохраняет способность к связыванию целевой последовательности белка. Такие пептиды могут быть синтезированы химически и/или получены посредством технологии рекомбинантной ДНК. См., например, Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993).
Лекарственная форма в настоящей заявке может также содержать более чем одно активное соединение, как необходимо для конкретного показания для лечения, предпочтительно, такие соединения с комплементарными активностями, которые не оказывают неблагоприятного воздействия друг на друга. Альтернативно, или дополнительно, композиция может содержать агент, который усиливает ее функцию, такой как, например, цитотоксический агент, цитокин, химиотерапевтический агент или агент, ингибирующий рост. Такие молекулы подходящим образом присутствуют в комбинации в количествах, которые являются эффективными для предназначенной цели.
Следующие примеры предлагаются только в иллюстративных целях, и не предназначены для ограничений объема притязаний настоящего изобретения любым образом.
Все патентные и литературные ссылки, цитируемые в настоящем описании, включены в данный документ посредством ссылки во всей полноте.
ПРИМЕРЫ
Промышленно доступные реагенты, на которые ссылаются в примерах, применяли в соответствии с инструкциями изготовителя, если не указано иначе. Источник этих клеток, идентифицированных в следующих примерах, и по всему описанию, посредством номеров доступа ATCC представляет собой Американскую коллекцию типовых культур, Manassas, VA.
ПРИМЕР 1: Профилирование тканевой экспрессии с использованием GeneExpress®
Фирменная база данных, содержащая информацию о генной экспрессии (GeneExpress®, Gene Logic Inc., Gaithersburg, MD), была проанализирована в попытке идентифицировать полипептиды (и кодирующие их нуклеиновые кислоты), чья экспрессия значительно и обнаруживаемо регулируется по восходящей в конкретных опухолевых ткани(ях) человека, представляющих интерес по сравнению с другими опухолью(ями) человека и/или нормальной тканью человека. Конкретно, анализ базы данных GeneExpress® проводили с использованием либо программного обеспечения, доступного через Gene Logic Inc., Gaithersburg, MD, для применения с базой данных GeneExpress® или с фирменным программным обеспечением, написанным и разработанным Genentech, Inc. для применения с базой данных GeneExpress®. Рейтинг положительных хитов в анализе основан на нескольких критериях, включающих, например, тканевую специфичность, опухолевую специфичность и уровень экспрессии в нормальной по существу и/или нормальной пролиферирующей тканях. С использованием этого анализа экспрессии мРНК, определяли, что мРНК, кодирующая полипептид ТАТ211, существенным образом, воспроизводимо и обнаруживаемо сверхэкспрессируется в опухолях легкого, яичника и щитовидной железы человека по сравнению с соответствующими нормальными тканями легкого, яичника и щитовидной железы человека, соответственно.
ПРИМЕР 2: Гибридизация in situ
Гибридизация in situ представляет собой мощный и разносторонний метод для обнаружения и локализации последовательностей нуклеиновых кислот в препаратах клеток или тканей. Она может быть применима, например, для идентификации участков генной экспрессии, анализа тканевого распределения транскрипции, идентификации и локализации вирусной инфекции, вытекающих изменений в конкретном синтезе мРНК и помощи в картировании хромосом.
Гибридизацию in situ осуществляют, следуя оптимизированной версии протокола Lu and Gillett, Cell Vision 1: 169-176 (1994), с использованием ПЦР-генерированных32P-меченных рибозондов. Вкратце, фиксированные в формалине, погруженные в парафин ткани человека нарезают, депарафинизируют, депротеинизируют в протеиназе K (20 г/мл) в течение 15 минут при 37°C, и дополнительно обрабатывают для гибридизации in situ, как описано Lu and Gillett, выше.32P-UTP-меченный антисмысловой рибозонд генерировали из продукта ПЦР и гибридизировали при 55°C в течение ночи. Слайды погружали в эмульсию для ядерных треков Kodak NTB2 и выдерживали в течение 4 недель.
Синтез32P-Рибозонда
6,0 мкл (125 мКи)32P-UTP (Amersham BF 1002, SA<2000 Ки/ммоль) сушили с помощью быстрого вакуумирования. К каждой пробирке, содержащей высушенный32P-UTP, добавляли следующие ингредиенты: 2,0 мкл 5× транскрипционного буфера, 1,0 мкл DTT (100 мМ), 2,0 мкл смеси NTP (2,5 мМ:10 мкм; каждый 10 мМ GTP, CTP & ATP + 10 мкл H2O), 1,0 мкл UTP (50 мкΜ), 1,0 мкл Rnasin, 1,0 мкл ДНК матрицы (1 мкг), 1,0 мкл Н2O, 1,0 мкл РНК полимеразы (для продуктов ПЦР T3=AS, T7=S, обычно).
Пробирки инкубировали при 37°C в течение одного часа. Добавляли 1,0 мкл RQ1 ДНКазы, с последующей инкубацией при 37°C в течение 15 минут. Добавляли 90 мкл TE (10 мМ Трис pH 7,6/1 мМ ЭДТА pH 8,0), и смесь наносили пипеткой на бумагу DE81. Оставшийся раствор загружали в ультрафильтрационный блок Microcon-50, и вращали с использованием программы 10 (6 минут). Фильтрационный блок инвертировали над второй пробиркой и вращали с использованием программы 2 (3 минуты). После окончательного выделения вращением, добавляли 100 мкл TE. 1 мкл конечного продукта наносили пипеткой на бумагу DE81 и подсчитывали в 6 мл Biofluor II.
Зонд запускали в геле TBE/мочевина. 1-3 мкл зонда или 5 мкл РНК Mrk III добавляли к 3 мкл загрузочного буфера. После нагрева на блоке нагрева с 95°C в течение трех минут, зонд немедленно помещали на лед. Лунки геля были вскрыты, образец загружали, и запускали при 180-250 Вольт в течение 45 минут. Гель обертывали сарановой оберткой и экспонировали на пленку XAR с интенсифицирующим экраном в морозильной камере с -70°C от одного часа до в течение ночи.
32P-Гибридизация
A. Предварительная обработка замороженных срезов
Слайды удаляли из морозильной камеры, помещали на алюминиевые поддоны и оттаивали при комнатной температуре в течение 5 минут. Поддоны помещали в инкубатор при 55°C в течение пяти минут, для снижения конденсации. Слайды фиксировали в течение 10 минут в 4% параформальдегиде на льду в вытяжном шкафу, и промывали в 0,5 × SSC в течение 5 минут, при комнатной температуре (25 мл 20 × SSC + 975 мл SQ H2O). После депротеинизации в 0,5 мкг/мл протеиназе K в течение 10 минут при 37°C (120,5 мкл 10 мг/мл исходного раствора в 250 мл предварительно нагретого не содержащего РНКазы буфере для РНКазы), срезы промывали в 00,5 × SSC в течение 10 минут при комнатной температуре. Срезы дегидратировали в 70%, 95%, 100% этаноле, по 2 минуты каждый.
B. Предварительная обработка погруженных в парафин срезов
Слайды депарафинизировали, помещали в SQ H2O и споласкивали дважды в 2 x SSC при комнатной температуре, в течение 5 минут каждый раз. Срезы депротеинизировали в 20 мкг/мл протеиназы K (500 мкл 10 мг/мл в 250 мл не содержащего РНКазы буфера для РНКазы; 37°C, 15 минут) - эмбрион человека, или 8 × протеиназы K (100 мкл в 250 мл буфера для РНКазы, 37°C, 30 минут) - формалиновые ткани. Последующее споласкивание в 0,5 × SSC и дегидратацию осуществляли, как описано выше.
C. Прегибридизация
Слайды были уложены в пластиковую коробку, смоченную буфером Box (4 × SSC, 50% формамид) - насыщенная фильтровальная бумага.
D. Гибридизация
Зонд с 1,0 × 106 счетов в минуту и 1,0 мкл тРНК (50 мг/мл исходный раствор) на слайд нагревали при 95°C в течение 3 минут. Слайды охлаждали на льду, и 48 мкл гибридизационного буфера добавляли на слайд. После интенсивного встряхивания, 50 мкл32P смеси добавляли к 50 мкл прегибридизации на слайде. Слайды инкубировали в течение ночи при 55°C.
E. Промывки
Промывку проводили 2 × 10 минут с помощью 2×xSSC, ЭДТА при комнатной температуре (400 мл 20 × SSC + 16 мл 0,25M ЭДТА, Vf=4L), с последующей обработкой РНКазой при 37°C в течение 30 минут (500 мкл 10 мг/мл в 250 мл буфера для РНКазы = 20 мкг/мл). Слайды промывали 2 × 10 минут 2 × SSC, ЭДТА при комнатной температуре. Строгость условий промывки была следующей: 2 часа при 55°C, 0,1 × SSC, ЭДТА (20 мл 20 × SSC + 16 мл ЭДТА, Vf=4L).
F. Олигонуклеотиды
Анализ in situ анализ осуществляли на разнообразных последовательностях ДНК, раскрытых в настоящей заявке. Олигонуклеотиды, используемые для этих анализов, получали таким образом, чтобы они были комплементарными нуклеиновым кислотам (или их комплементам), как показано на сопроводительных Фигурах.
G. Результаты
По отношению к экспрессии TAT211 в нормальных тканях человека, от слабой до умеренной экспрессии наблюдали в подгруппе тестируемых образцов эпителия млекопитающих, слизистой мочевого пузыря, легком, и почечных канальцев. Все другие тестируемые нормальные ткани человека, включая как нормальную строму яичника человека, так и миометрия матки, были отрицательными по экспрессии TAT211. Напротив, сильную экспрессию TAT211 наблюдали у 16 из 27 (59%) тестируемых крупноклеточных карцином человека. Дополнительно, сильную экспрессию TAT211 также наблюдали у 8 из 9 (89%) тестируемых карцином эндометрия человека. Окончательно, сильную экспрессию TAT211 наблюдали у 12 из 14 тестируемых карцином яичника.
ПРИМЕР 3: Получение антител, которые связываются с полипептидами ТАТ211
Данный пример иллюстрирует получение моноклональных антител, которые могут специфически связываться с TAT211.
Методы получения моноклональных антител известны в данной области и описаны, например, у Goding, выше. Иммуногены, которые могут использоваться, включают очищенный TAT, рекомбинантные белки, содержащие TAT, и клетки, экспрессирующие рекомбинантный TAT на клеточной поверхности. Выбор иммуногена может быть проведен квалифицированным специалистом в области без излишнего экспериментирования.
Мышей, таких как Balb/c, иммунизируют иммуногеном TAT, эмульгированным в полном адъюванте Фрейнда, и инъецируют подкожно или внутрибрюшинно в количестве 1-100 микрограммов. Альтернативно, иммуноген эмульгируют в адъюванте MPL-TDM (Ribi Immunochemical Research, Hamilton, MT) и инъецируют в задние подушечки стопы животного. Иммунизированных мышей затем повторно иммунизируют через 10-12 дней дополнительным иммуногеном, эмульгированном в выбранном адъюванте. Затем, в течение нескольких недель, мыши также могут быть иммунизированы дополнительными иммунизационными инъекциями. Образцы сыворотки могут быть периодически получены от мышей посредством ретро-орбитального забора крови для тестирования в анализах ELISA для обнаружения антител против-TAT.
После обнаружения подходящего титра антител, животные "положительные" на антитела, могут быть инъецированы окончательной внутривенной инъекцией TAT. Три-четыре дня спустя, мышей умерщвляют и собирают клетки селезенки. Клетки селезенки затем гибридизируют (с использованием 35% полиэтиленгликоля) с клетками выбранной линии мышиной миеломы, такой как P3X63 AgU.1, доступной из ATCC, No. CRL 1597. Гибриды генерируют гибридомные клетки, которые затем могут помещаться в 96-луночные планшеты для тканевых культур, содержащие HAT (гипоксантин, аминоптерин и тимидин) среду для ингибирования пролиферации негибридных клеток, миеломных гибридов, и гибридов клеток селезенки.
Гибридомные клетки будут скринированы в ELISA на реактивность против TAT. Определение "положительных" гибридомных клеток, секретирующих желательные моноклональные антитела против TAT, находится в пределах квалификации в области.
Положительные гибридомные клетки могут быть инъецированы внутрибрюшинно сингенным мышам Balb/c для получения асцитов, содержащих моноклональные антитела против ТАТ. Альтернативно, гибридомные клетки могут быть выращены в колбах для тканевых культур или роллерных бутылях. Очистка моноклональных антител, продуцируемых в асцитах, может осуществляться с использованием осаждения сульфатом аммония, с последующей гель-эксклюзионной хроматографией. Альтернативно, может использоваться аффинная хроматография, основанная на связывании антитела с белком А или белком G.
С использованием вышеописанного метода, были генерированы разнообразные отдельные и четко различимые клеточные линии гибридом, каждая из которых продуцирует моноклональные антитела, которые связываются с нативным полипептидом ТАТ211. Моноклональные антитела, продуцируемые этими гибридомными линиями, продемонстрировали связывание с полипептидом ТАТ211 с использованием хорошо известных и рутинно применяемых методов, таких как Вестерн-блоттинг, анализ ELISA, анализ сортировки FACS, клеток, экспрессирующих полипептид ТАТ211, и/или иммуногистохимический анализ. Одна конкретная линия мышиной гибридомы (которая экспрессирует мышиное моноклональное антитело, обозначенное в настоящей заявке как 10H1, также именуемая mu10H1) была выбрана для дополнительных исследований. Аминокислотные последовательности, связанные с моноклональным антителом 10H1, и разнообразные другие его версии, включающие домены VL, VH и/или CDR, показаны на Фигурах 3-12.
ПРИМЕР 4: Анализы конкурентного связывания и картирование эпитопов
TAT211 эпитопы, связанные описанными моноклональными антителами, могут быть определены посредством стандартного анализа конкурентного связывания (Fendly et al., Cancer Research 50: 1550-1558 (1990)). Исследования перекрестного блокирования могут быть проведены на антителах посредством снятия прямой флуоресценции на интактных клетках PC3, сконструированных для экспрессии TAT211 с использованием машины для скрининга PANDEX™ для количественной оценки флуоресценции. Каждое моноклональное антитело конъюгируют с изотиоцианатом флуоресцеина (FITC), с использованием установленных методик (Wofsy et al., Selected Methods in Cellular Immunology, p. 287, Mishel и Schiigi (eds.) San Francisco: W.J. Freeman Co. (1980)). Конфлюентные монослои TAT211-экспрессирующих клеток PC3 трипсинизируют, промывают однократно и ресуспендируют при 1,75 × 106клеток /мл в холодном PBS, содержащем 0,5% альбумин бычьей сыворотки (BSA) и 0,1% NaN3. Конечную концентрацию 1% латексных частиц (IDC, Portland, OR) добавляют для снижения закупорки мембран планшетов PANDEX™. Клетки в суспензии, 20 мкл, и 20 мкл очищенных моноклональных антител (от 100 мкг/мл до 0,1 мкг/мл) добавляют в лунки планшетов PANDEX™ и инкубируют на льду в течение 30 минут. Предварительно определенное разбавление FITC-меченных моноклональных антител в 20 мкл добавляют к каждой лунке, инкубируют в течение 30 минут, промывают, и флуоресценцию количественно оценивают на машине для скрининга PANDEX™. Моноклональные антитела рассматривают, как разделяющие эпитоп, если каждое блокировало связывание другого на 40% или более в сравнении с контрольными нерелевантными моноклональными антителами и при такой же концентрации антитела. С использованием этого анализа, рядовой специалист в области может идентифицировать другие моноклональные антитела, которые связываются с тем же самым эпитопом, как антитела, описанные выше.
Анализ делеции может быть проведен для идентификации приблизительного расположения в полипептидной последовательности, показанной как SEQ ID NO:2 антигенных эпитопов. В одном эксперименте, было продемонстрировано, что моноклональные антитела против ТАТ211 связываются с антигенным эпитопом, расположенным между аминокислотами 320-361 последовательности полипептида ТАТ211, показанной на Фигуре 2. Полипептиды, содержащие любой из этих конкретно идентифицированных участков антигенного эпитопа, молекулы нуклеиновых кислот, кодирующие эти полипептиды, и антитела, связывающиеся с этими полипептидами, все охвачены объемом настоящего изобретения.
ПРИМЕР 5: Иммуногистохимический анализ
Антитела против TAT211 были получены, как описано выше, и иммуногистохимический анализ осуществляли с использованием функционального моноклонального антитела против ТАТ211 следующим образом. Тканевые срезы сначала фиксировали в течение 5 минут в смеси ацетон/этанол (замороженные или погруженные в парафин). Срезы затем промывали в PBS и затем блокировали авидином и биотином (Векторный набор) в течение 10 минут каждый с последующей промывкой в PBS. Срезы затем блокировали 10% сывороткой в течение 20 минут и затем блоттировали для удаления избытка. Первичное антитело затем добавляли к срезам при концентрации, равной 10 мкг/мл в течение 1 часа, и затем срезы промывали в PBS. Биотинилированное вторичное антитело (против-первичного антитела) затем добавляли к срезам в течение 30 минут и затем срезы промывали в PBS. Срезы затем подвергали воздействию реагентов набора Вектор ABC в течение 30 минут, и затем срезы промывали в PBS. Срезы затем подвергали воздействию Диаминобензидина (Pierce) в течение 5 минут и затем промывали в PBS. Срезы затем контрастно окрашивали с помощью гематоксилина Майерса, покрывали покровным стеклом и визуализировали. Иммуногистохимический анализ также может осуществляться, как описано у Sambrook et al., Molecular Cloning: Laboratory Manual, New York: Cold Spring Harbor Press, 1989 и Ausubel et al., Current Protocols Molecular Biology, Unit 3.16, John Wiley и Sons (1997).
Результаты этих анализов демонстрируют, что используемое моноклональное антитело против ТАТ211 не связывается обнаруживаемо с любой из следующих нормальных тканей человека: мозг, сердце, печень, простата, кожа, селезенка, аорта, яичко, щитовидная железа, тонкий и толстый кишечник, желудок и строма яичника, и наблюдали только слабое связывание в нормальных альвеолярных клетках легкого, эпителии молочной железы, субпопуляции почечных канальцев и миндалинах.
Напротив, от умеренной до сильной экспрессии TAT211 наблюдали в 9 из 11 независимых образцах клеток прозрачной аденокарциномы яичника, 19 из 20 независимых образцах эндометриоидной аденокарциномы яичника, 4 из 10 независимых образцах слизеобразующей аденокарциномы яичника и 23 из 25 независимых образцах серозной аденокарциномы яичника. В целом, обнаруживаемую экспрессию TAT211 наблюдали в общем в 58 из 66 (88%) всех тестируемых независимых образцов аденокарциномы яичника.
Кроме того, от умеренной до сильной экспрессии TAT211 наблюдали в 24 из 31 независимых образцах аденокарциномы легкого. В целом, обнаруживаемую экспрессию TAT211 наблюдали в общем в 27 из 31 (87%) всех тестируемых независимых образцов аденокарциномы легкого.
От умеренной до сильной экспрессии TAT211 также наблюдали в 19 из 23 независимых образцах папиллярной карциномы щитовидной железы. В целом, обнаруживаемую экспрессию TAT211 наблюдали в общем в 21 из 23 (91%) всех тестируемых независимых образцов папиллярной карциномы щитовидной железы.
С использованием моноклонального антитела 10H1 против ТАТ211 (связанные аминокислотные последовательности, показанные на Фигурах 3-12), иммуногистохимический анализ использовали на разнообразных образцах ткани первичной и сопряженной местной метастатической карциномы, чтобы определить, поддерживается ли экспрессия TAT211 в метастатическом (по сравнению с первичным) состоянии. Результаты этих анализов демонстрировали, что существует высокая степень соответствия в экспрессии TAT211 в первичных и сопряженных местных метастатических образцах. Конкретно, из 10 тестируемых образцов аденокарциномы яичника 9 показали один и тот же от умеренного до высокого уровня экспрессии TAT211 как в первичной опухоли, так и сопряженных местных метастазах. Из 14 тестируемых образцов аденокарциномы легкого, 12 показали один и тот же от умеренного до высокого уровня экспрессии TAT211 как в первичной опухоли, так и сопряженных местных метастазах. Окончательно, из 3 тестируемых образцов сквамозных клеток карциномы легкого, 2 показали один и тот же от умеренного до высокого уровня экспрессии TAT211 как в первичной опухоли, так и сопряженных местных метастазах.
ПРИМЕР 6: Гуманизация мышиных моноклональных антител
Данный пример демонстрирует применимость способов гуманизации мышиного антитела 10H1, направленного против TAT211.
Внеклеточный домен TAT211 экспрессировали в E. coli (негликозилированный) и в качестве иммуноадгезина (Fc гибрид) в клетках CHO (гликозилированный) и очищали общепринятыми средствами. Мышиную гибридому, экспрессирующую антитело 10H1, получали посредством иммунизации мышей рекомбинантным внеклеточным доменом TAT211, полученным из E. coli, и идентифицировали по ее способности к связыванию с планшетами, покрытыми TAT211 посредством ELISA.
Клонирование мышиных вариабельных доменов 10H1
Общую РНК экстрагировали из гибридомных клеток, продуцирующих 10H1 с использованием стандартных способов. Вариабельные легкие (VL) и вариабельные тяжелые (VH) домены амплифицировали с использованием РВ-ПЦР с вырожденными праймерами к тяжелой и легкой цепям. Прямые праймеры были специфическими для N-концевой аминокислотной последовательности VL и VH областей. Соответственно, LC и HC обратные праймеры были сконструированы для ренатурации с областью в константном легком (CL) и константном тяжелом домене 1 (CH1), которые являются высоко консервативными для всех видов. Полинуклеотидную последовательность вставок определяли с использованием рутинных способов секвенирования. Аминокислотные последовательности mu10H1 VL (SEQ ID NO:4) и VH (SEQ ID NO:13) показаны на Фигурах 3 и 4, соответственно.
Прямые графты гипервариабельной области на акцепторный консенсусный каркас человека
Фагмид, применяемый для этой работы, представляет собой моновалентный вектор отображения Fab-g3 и состоит из 2 открытых рамок считывания под контролем единичного промотора phoA. Первая открытая рамка считывания состоит из сигнальной последовательности stII, рекомбинированной с VL и CH1 доменами акцепторной легкой цепи, а вторая состоит из сигнальной последовательности stII, рекомбинированной с VH и CH1 доменами акцепторной тяжелой цепи, с последующим минорным фаговым покрывающим белком P3.
VL и VH домены из мышиного 10H1 (mu10H1) были выравнены с консенсусными последовательностями VL каппа I (huKI) и VH подгруппы III (huIII) человека. Для создания графта CDR, гипервариабельные области из mu10H1 трансплантировали в консенсусные акцепторные каркасы huKI и huIII для генерации "10H1-графта", прямого CDR-графта (Фигуры 3 и 4). В VL домене следующие области были трансплантированы в консенсусный акцептор человека: положения 24-34 (L1), 50-56 (L2) и 89-97 (L3). В VH домене, были трансплантированы положения 26-35 (HI), 49-65 (H2) и 93-102 (H3). MacCallum et al. (J. Mol. Biol. 262: 732-745 (1996)) проанализировали кристаллические структуры комплекса антитела и антигена и обнаружили, что положения 49 и 93 тяжелой цепи являются частью контактной области, таким образом, кажется целесообразным включать эти положения в определение CDR-H2 и CDR-H3, при гуманизации антител.
"10H1-графт" генерировали как IgG посредством мутагенеза Кункеля LC и HC экспрессионных векторов с использованием отдельных олигонуклеотидов для каждой гипервариабельной области. Аминокислотные изменения для увеличения сродства или устойчивости были также проведены с использованием мутагенеза Кункеля. Корректные клоны идентифицировали посредством секвенирования ДНК.
Рандомизация гипервариабельных областей
Разнообразие последовательностей вводили раздельно в каждую гипервариабельную область 10H1-графт с использованием мягкой стратегии рандомизации, которая поддерживает уклон в сторону последовательности мышиной гипервариабельной области. Это осуществляли с использованием стратегии синтеза отравленных олигонуклеотидов, впервые описанной Gallop et al., J. Med. Chem. 37: 1233-1251 (1994). Для данного положения внутри гипервариабельной области, подлежащей мутации, кодон, кодирующий аминокислоту дикого типа, отравляют 70-10-10-10 смесью нуклеотидов, что приводит в результате к 50 процентной степени мутации по каждому положению.
Мягким способом рандомизированные олигонуклеотиды были расположены после последовательностей мышиных гипервариабельных областей и охватывали такие же области, определяемые прямыми графтами гипервариабельной области. Аминокислотное положение в начале H2 (положение 49) в VH домене, было ограничено по разнообразию последовательности до A, G, S или T посредством использования кодона RGC.
Чтобы избежать повторного выбора CDR-привитой последовательности дикого типа, стоп-кодон (TAA) вводили в середину каждой CDR 10H1-графта посредством мутагенеза Кункеля, приводящего к 6 различным матрицам, каждая со стоп-кодоном, введенным в различную CDR. Рандомизированные олигонуклеотиды применяли для введения разнообразия, а также для восстановления стоп-кодона в соответствующей матрице.
Генерация фаговых библиотек
Пулы рандомизированных олигонуклеотидов, сконструированных для введения разнообразия в каждую гипервариабельную область, как изложено выше, фосфорилировали раздельно в 20 мкл реакционных смесях, содержащих 660 нг олигонуклеотида, 50 мМ Трис pH 7,5, 10 мМ MgC12, 1 мМ АТФ, 20 мМ DTT, и 5 Ед полинуклеотидкиназы в течение 1 ч при 37°C. Каждый фосфорилированный пул олигонуклеотидов, направленный для введения разнообразия в единичную CDR, объединяли с 20 мкг матрицы Кункеля, содержащей соответствующий стоп-кодон. Реакцию осуществляли в 50 мМ Трис pH 7,5, 10 мМ MgCl2вконечном объеме, равном 500 мкл, что приводило к соотношению олигонуклеотида к матрице, равному 3. Смесь ренатурировали при 90°C в течение 4 мин, 50°C в течение 5 мин и затем охлаждали на льду. Ренатурированную матрицу (250 мкл) затем заполняли посредством добавления 1 мкл 100 мМ АТФ, 10 мкл 25 мМ dNTPs (25 мМ каждого из dATP, dCTP, dGTP и dTTP), 15 мкл 100 мМ DTT, 25 мкл 10X TM буфера (0,5 M Трис pH 7,5, 0,1 M MgCl2), 2400 Ед T4 лигазы, и 30 Ед T7 полимеразы в течение 3 часов при комнатной температуре. Продукт-наполнитель затем извлекали и электропорировали в клетки SS320 и размножали в присутствии хелперного фага M13/KO7, как описано Sidhu et al., Methods in Enzymology 328:333-363 (2000). Размеры библиотек находились в интервале от 1-2 × 109 независимых клонов. Случайные клоны из первоначальных библиотек секвенировали для оценки качества библиотеки.
Селекция фага
Для селекций фагов, полученный из CHO внеклеточный домен TAT211 (2 мкг/мл) иммобилизовали в PBS на титрационных микропланшетах MaxiSorp (Nunc) в течение ночи при 4°C. Планшеты блокировали в течение по меньшей мере 1 ч с использованием Casein Blocker (Pierce). Фаг собирали из культурального супернатанта и суспендировали в PBS, содержащем 0,5% BSA и 0,05% Твин 20 (PBSBT). После селекции фага, микротитровальные лунки промывали большим количеством PBS, содержащего 0,05% Твин 20 (PBST), и связанный фаг элюировали посредством инкубации лунок с 100 мМ HC1 в течение 30 мин. Фаг нейтрализовали 1 M Трис, pH 8 и амплифицировали с использованием клеток XL1-Blue и хелперного фага M13/KO7 и выращивали в течение ночи при 37°C в 2YT, 50 мкг/мл карбенациллина. Титры фага, элюированного из мишень-содержащей лунки, сравнивали с титрами фага, извлеченного из лунки, не содержащей мишень, для оценки обогащения.
Получение Fab и IgG
Для экспрессии Fab белка для измерений сродства, стоп-кодон вводили между тяжелой цепью и g3 в векторе фагового отображения. Клоны трансформировали в клетках E. coli 34B8 клетки и выращивали в среде Complete C.R.A.P. при 30°C (Presta et al. Cancer Res. 57: 4593-4599 (1997)). Клетки собирали центрифугированием, суспендировали в PBS, 100 мкМ PMSF, 100 мкМ бензамидина, 2,5 мМ ЭДТА и разрушали открытым способом с использованием микрофлуидайзера. Fab очищали с помощью аффинной хроматографии с Белком G.
Для целей скрининга, IgG варианты первоначально получали в клетках 293. Векторы, кодирующие VL и VH (25 мкг) трансфицировали в клетки 293 с использованием системы FuGene. 500 мкл FuGene смешивали с 4,5 мл среды DMEM, не содержащей FBS и инкубировали при комнатной температуре в течение 5 мин. Каждую цепь (25 мкг) добавляли к этой смеси и инкубировали при комнатной температуре в течение 20 мин и затем переносили в пять колб T-150 для трансфекции в течение ночи при 37°C в 5% CO2. На следующий день, среды, содержащие трансфекционную смесь, удаляют и заменяют на 23 мл среды PS04 с 0,1 мл/л следовых элементов (A0934) и 10 мг/л инсулина (A0940). Клетки инкубировали в течение дополнительных 5 дней, после которых среды собирали при 1000 об/мин в течение 5 мин и стерильно фильтровали с использованием 0,22 мкм фильтра с низким связыванием белка. Образцы могут храниться при 4°C после добавления 2,5 мл 0,1% PMSF для каждых 125 мл среды. IgG очищали с использованием аффинной хроматографии с Белком G.
Определения сродства
Определения сродства осуществляли посредством анализа Скэтчарда и поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или A100.
Biacore 2000
Внеклеточный домен TAT211 (гликозилированный) иммобилизовали (приблизительно 100-400 RU, в 10 мМ ацетата натрия pH 4,8 на сенсорном чипе CM5) и вариант антитела 10H1 служил в качестве анализируемой пробы (инжектируемой при скорости потока, равной 30 мкл/мин, с использованием 2-кратного серийного разведения от 4 до 1000 нМ в PBST). Каждый образец анализировали с 4-минутной ассоциацией и 10-минутной диссоциацией. После каждой инжекции чип регенерировали с использованием 10 мМ Глицина pH 1,7.
Результаты и обсуждение
Акцепторный каркас человека, используемый для гуманизации, основан на консенсусном каппа I VL домене человека и консенсусном VH домене подгруппы III человека. VL и VH домены mu10H1 выравнивали с доменами каппа I и подгруппы III человека; каждая область, определяющая комплементарность (CDR), была идентифицирована и трансплантирована в акцепторный каркас человека для генерации CDR-графта, который мог быть экспрессирован как IgG (10H1-графт) (Фигуры 3 и 4). Сродство 10H1-графта как Fab оценивали с использованием поверхностного плазмонного резонанса, и было обнаружено сродство, равное 74 нМ для CHO-производного внеклеточного домена TAT211, указывая на то, что CDR графт потерял приблизительно 2-кратное сродство относительно антитела гибридомы mu10H1. Анализом Скэтчарда сродство mu10H1 IgG определяли как равное 36, 37, 59 и 61 нМ для связывания с клетками P828, OVCAR4, P701sc20 и Igrovl (все экспрессирующие TAT211), соответственно.
Были сгенерированы библиотеки фагового отображения Fab, в которых разнообразие вводили раздельно в каждую CDR 10H1-графта и проводили пэннинг против CHO-производного внеклеточного домена TAT211. Обогащение наблюдали после второго раунда во всех 6 библиотеках. После 6 раунда, клоны поднимали для анализа последовательностей ДНК из каждой библиотеки и отображали изменения последовательности, нацеленные в каждой из шести CDR (Фигуры 3 и 4). Эти изменения последовательности, идентифицированные из библиотеки, могли бы представить изменения, которые ведут к вариантам с улучшенным связыванием или просто указать на аминокислотные изменения по положениям, которые не имеют воздействия на связывание внеклеточного домена TAT211.
Некоторые выбранные клоны экспрессировали как Fab и характеризовали по связыванию с внеклеточным доменом TAT211 посредством Biacore. Все клоны, связанные с TAT211 на поверхности клеток, и большинство связанных клонов имели значения сродства, значительно улучшенные относительно 10H1-графта.
Устранение потенциального деамидирования и участков, образующих изо-аспарагиновую кислоту, в CDR-L1 10H1-графта
Чтобы избежать потенциальных производственных проблем, потенциальный участок образования изо-аспарагиновой кислоты Asn28-Gly29 в CDR-L1 10H1-графта устраняли посредством отбора остатков, обнаруженных в других антителах в этих положениях. Изменение Asn28 на Ser28 в CDR-L1 10H1-графта (10H1.v11.1) было найдено подходящей заменой и служило для устранения потенциального деамидирования и образования изо-аспарагиновой кислоты. Дополнительно, было обнаружено, что обратная мутация V93A в VH имела небольшое воздействие на связывание (10H1.11.2b, Фигура 4) и была введена в более поздние гуманизированные варианты, так как аланин является более обычно найденным в этом положении.
Созревание аффинности 10H1.11
Дополнительные фаговые библиотеки генерировали для сродства связывания зрелого 10H1.11 с внеклеточным доменом TAT211. Разнообразие было предназначено в 10H1.11.2B для часто изменяемых положений в предыдущей библиотеке и включало положения 27, 27c, 27e, 29, 93 и 94 в легкой цепи и 54, 55 и 61 в тяжелой цепи. Последовательности, идентифицированные из этих библиотек, показаны на Фигурах 3-12.
Из выбранных последовательностей, некоторые были переформатированы в IgG для оценки посредством Biacore и анализа Скэтчарда. 10H1.11.4B генерировали из подразделяющихся изменений, наблюдаемых в 10H1.11.2B, и оно имело наивысшее сродство по результатам анализа Скэтчарда. Было показано, что антитело 10H1.11.4B, имеющее аминокислотную последовательность VL SEQ ID NO:9 (аминокислотной последовательности легкой цепи SEQ ID NO:81) и аминокислотную последовательность VH SEQ ID NO:18 (аминокислотной последовательности тяжелой цепи SEQ ID NO: 80), связывается с TAT211 на поверхности клетки с более высоким сродством, чем мышиное 10H1, и, как таковое, было выбрано в качестве лидирующего кандидата для дополнительной разработки.
ПРИМЕР 7: Получение антител, конъюгированных с токсином, которые связываются с TAT211
Применение конъюгатов антитело-лекарственное средство (ADC), т.е. иммуноконъюгатов, для местной доставки цитотоксических или цитостатических агентов, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток при лечении рака (Payne (2003) Cancer Cell 3:207-212; Syrigos and Epenetos (1999) AntiCancer Research 19:605-614; Niculescu-Duvaz и Springer (1997) Adv. Drug Del. Rev. 26: 151-172; патент США № 4975278) обеспечивает направленную доставку фрагмента лекарственного средства к опухолям и его внутриклеточную аккумуляцию, где системное введение этих неконъюгированных лекарственных агентов может приводить в результате к неприемлемым уровням токсичности для нормальных клеток, также как и для опухолевых клеток, которые пытаются устранить (Baldwin et al., (1986) Lancet (Mar. 15, 1986) pp. 603-05; Thorpe, (1985) "Antibody Carriers Cytotoxic agents in Cancer Therapy: Review," в Monoclonal Antibodies '84: Biological and Clinical Applications, Pinchera et al. (eds.), pp. 475-506). Таким образом, пытаются достичь максимальной эффективности с минимальной токсичностью. Попытки сконструировать и очистить ADC фокусировались на селективности моноклональных антител (mAb), а также лекарство-связывающих и лекарство-высвобождающих свойствах. Сообщалось, что как поликлональные антитела, так и моноклональные антитела являются применимыми при этих стратегиях (Rowland et al., (1986) Cancer Immunol. Immunother., 21: 183-87). Лекарственные средства, применяемые в этих способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986) выше). Токсины, применяемые в конъюгатах антитело-токсин включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al. (2000) J. Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10: 1025-1028; Mandler et al. (2002) Bioconjugate Chem. 13:786-791), майтансиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623), и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342).
В конъюгатах антитела с лекарственным средством (ADC) изобретения, антитело (Ab) является конъюгированным с одним или более из фрагментов лекарственного средства (D), например, приблизительно от 1 до приблизительно 20 фрагментов лекарственного средства на антитело, через линкер (L). ADC имеющий формулу:
Ab-(L-D)p
могут быть получены посредством нескольких путей, с использованием реакций органической химии, условий и реагентов, известных квалифицированным специалистам в данной области, включающих: (1) реакцию нуклеофильной группы антитела с бивалентным линкерным реагентом, чтобы образовать Ab-L, через ковалентную связь, с последующей реакцией с фрагментом лекарственного средства D; и (2) реакцию нуклеофильной группы фрагмента лекарственного средства с бивалентным линкерным реагентом, чтобы образовать D-L, через ковалентную связь, с последующей реакцией с нуклеофильной группой антитела. Дополнительные способы получения ADC описаны в настоящей заявке.
Линкер может быть составлен из одного или более линкерных компонентов. Примерные линкерные компоненты включают 6-малеимидокапроил ("MC"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit"), аланин-фенилаланин ("ala-phe"), п-аминобензилоксикарбонил ("PAB"), N-Сукцинимидил 4-(2-пиридилтио)пентаноат ("SPP"), N-Сукцинимидил 4-(N-малеимидометил) циклогексан-1-карбоксилат ("SMCC) и N-Сукцинимидил (4-йодо-ацетил)аминобензоат ("SIAB"). Дополнительные линкерные компоненты являются известными в данной области и некоторые описаны в настоящей заявке.
В некоторых вариантах осуществления, линкер может содержать аминокислотные остатки. Примерные аминокислотные линкерные компоненты включают дипептид, трипептид, тетрапептид или пентапептид. Примерные дипептиды включают: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Примерные трипептиды включают: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые содержат аминокислотный линкерный компонент включают остатки, встречающиеся в природе, а также минорные аминокислоты и невстречающихся в природе аминокислотные аналоги, такие как цитруллин. Аминокислотные линкерные компоненты могут быть сконструированы и оптимизированы по их селективности для ферментативного расщепления конкретными ферментами, например, опухоле-связанными протеазами, катепсин B, C и D или плазминовая протеаза.
Нуклеофильные группы на антителах включают, но не ограничены лишь ими: (i) N-концевые аминные группы, (ii) аминные группы боковой цепи, например лизин, (iii) тиольные группы боковой цепи, например цистеин, и (iv) сахарные гидроксильная или аминогруппы, где антитело является гликозилированным. Аминные, тиольные, гидроксильные, гидразидные, оксимные, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы являются нуклеофильными и способны к взаимодействию с образованием ковалентных связей с электрофильными группами на линкерных фрагментах и линкерных реагентах, включающих: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и ацилгалогениды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливаемые межцепочечные дисульфиды, т.е. цистеиновые мостики. Антитела могут быть получены реакционноспособными для конъюгации с линкерными реагентами посредством обработки восстанавливающим агентом, таким как DTT (дитиотреитол). Каждый цистеиновый мостик будет таким образом образовывать, теоретически, два реакционноспособных тиольных нуклеофила. Дополнительные нуклеофильные группы могут быть введены в антитела через реакцию лизинов с 2-иминотиоланом (реагент Трота), приводящую в результате к конверсии амина в тиол. Реакционноспособные тиольные группы могут быть введены в антитело (или его фрагмент) посредством введения одного, двух, трех, четырех или более цистеиновых остатков (например, получая мутантные антитела, содержащие один или более ненативных цистеиновых аминокислотных остатков).
Конъюгаты антитела с лекарственным средством изобретения также могут быть получены посредством модификации антитела для введения электрофильных фрагментов, которые могут взаимодействовать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител могут быть окислены, например перйодатными окисляющими реагентами, с образованием альдегидных или кетоновых групп, которые могут взаимодействовать с аминной группой линкерных реагентов или фрагментов лекарственных средств. Полученные иминовые группы основания Шиффа могут образовывать устойчивую связь, или могут быть восстановлены, например боргидридными реагентами с образованием устойчивых аминных связей. В одном варианте осуществления, реакция углеводной части гликозилированного антитела либо с галактозоксидазой или мета-перйодатом натрия могут давать на выходе карбонильные (альдегидные и кетоновые) группы в белке, которые могут взаимодействовать с соответствующими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В еще одном варианте осуществления, белки, содержащие N-концевые остатки серина или треонина, могут взаимодействовать с мета-перйодатом натрия, что приводит в результате к получению альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3: 138-146; Патент США № 5362852). Такой альдегид может взаимодействовать фрагментом лекарственного средства или линкерным нуклеофилом.
Альтернативно, гибридный белок, содержащий антитело и цитотоксический агент, может быть получен, например, посредством рекомбинантных методов или пептидного синтеза. Цепь ДНК по длине может содержать соответствующие области, кодирующие две части конъюгата, либо примыкающие одна к другой, или разделенные областью кодирующей линкерный пептид, который не разрушает желательные свойства конъюгата.
В еще одном другом варианте осуществления, антитело может быть конъюгировано с "рецептором" (таким как стрептавидин) для использования при предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту, с последующим удалением несвязанного конъюгата из кровообращения с использованием очищающего агента и затем введением "лиганда" (например, авидина), который является конъюгированным с цитотоксическим агентом (например, радионуклеотидом).
Конкретные методы для получения конъюгатов антитело-лекарственное средство посредством связывания токсинов с очищенными антителами являются хорошо известными и традиционно используемыми в данной области. Например, конъюгация очищенного моноклонального антитела с токсином DM1 может выполняться следующим образом. Очищенное антитело дериватизируют N-сукцинимидил-4-(2-пиридилтио)пентаноатом для введения дитиопиридильной группы. Антитело (376,0 мг, 8 мг/мл) в 44,7 мл 50 мМ калийфосфатного буфера (pH 6,5), содержащего NaCl (50 мМ) и ЭДТА (1 мМ) обрабатывают SPP (5,3 молярных эквивалента в 2,3 мл этанола). После инкубации в течение 90 минут под аргоном при температуре окружающей среды, реакционную смесь подвергают гель-фильтрации через колонку Сефадекс G25, уравновешивающую 35 мМ цитрата натрия, 154 мМ NaCl и 2 мМ ЭДТА. Фракции, содержащие антитело затем собирают и анализируют. Антитело-SPP-Py (337,0 мг с высвобождаемой 2-тиопиридиновой группой) разбавляют указанным выше буфером 35 мМ цитрата натрия, pH 6,5, до конечной концентрации, равной 2,5 мг/мл. DM1 (1,7 эквивалента, 16,1 молей) в 3,0 мМ диметилацетамиде (DMA, 3% об/об в конечной реакционной смеси) затем добавляют к раствору антитела. Обеспечивают протекание реакции при температуре окружающей среды под аргоном в течение 20 часов. Реакционную смесь загружают на колонку для гель-фильтрации с Сефакрил S300 (5,0 см × 90,0 см, 1,77 л), уравновешивающую 35 мМ цитратом натрия, 154 мМ NaCl, pH 6,5. Объемная скорость потока составляет 5,0 мл/мин и 65 фракций (20,0 мл каждая) собирают. Фракции отбирают и анализируют, где количество молекул лекарственного средства DM1, связанных на молекулу антитела (p'), определяют посредством измерения поглощения при 252 нм и 280 нм.
В иллюстративных целях, конъюгация очищенного моноклонального антитела с токсином DM1 также может осуществляться следующим образом. Очищенное антитело дериватизируют (Сукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилатом (SMCC, Pierce Biotechnology, Inc) для введения SMCC линкера. Антитело обрабатывают при 20 мг/мл в 50 мМ фосфат калия/50 мМ хлорид натрия/2 мМ ЭДТА, pH 6,5 7,5 молярными эквивалентами SMCC (20 мМ в DMSO, 6,7 мг/мл). После перемешивания в течение 2 часов под аргоном при температуре окружающей среды, реакционную смесь фильтруют через колонку с Сефадекс G25, уравновешивающую 50 мМ фосфат калия/50 мМ хлорид натрия/2 мМ ЭДТА, pH 6,5. Фракции, содержащие антитело отбирают и анализируют. Антитело-SMCC затем разбавляют 50 мМ фосфат калия/50 мМ хлорид натрия/2 мМ ЭДТА, pH 6,5, до конечной концентрации, равной 10 мг/мл, и приводят во взаимодействие с 10 мМ раствором DM1 (1,7 эквивалентов, предполагающих 5 SMCC/антитело, 7,37 мг/мл) в диметилацетамиде. Реакционную смесь перемешивают при температуре окружающей среды под аргоном 16,5 часов. Реакционную смесь конъюгации затем фильтруют через колонку для гель-фильтрации с Сефадекс G25 (1,5 × 4,9 см) с 1 × PBS при pH 6,5. Отношение DM1/антитело (p) затем измеряют по поглощению при 252 нм и при 280 нм.
Кроме того, свободный цистеин на антителе выбора может быть модифицирована посредством бис-малеимидо реагента BM(PEO)4 (Pierce Chemical), оставляя непрореагировавшую малеимидо группу на поверхности антитела. Это может осуществляться посредством растворения BM(PEO)4 в смеси 50% этанол/вода до концентрации, равной 10 мМ, и добавления десятикратного молярного избытка к раствору, содержащему антитело в забуференном фосфатом физрастворе при концентрации, равной приблизительно 1,6 мг/мл (10 микромолей) и обеспечивая его взаимодействие в течение 1 часа. Избыток BM(PEO)4 удаляют гель-фильтрацией в 30 мМ цитрате, pH 6 с 150 мМ NaCl буфером. Приблизительно 10-кратный молярный избыток DM1 растворяют в диметилацетамиде (DMA) и добавляют к интермедиату антитело-BMPEO. Диметилформамид (DMF) также может использоваться для растворения реагента фрагмента лекарственного средства. Обеспечивают взаимодействие реакционной смеси в течение ночи перед гель-фильтрацией или диализом в PBS для удаления непрореагировавшего лекарственного средства. Гель-фильтрация на колонках S200 в PBS применяют для удаления высокомолекулярных агрегатов и получения очищенного конъюгата антитело-BMPEO-DM1.
Цитотоксические лекарственные средства обычно конъюгировали с антителами через частые многочисленные лизиновые остатки антитела. Конъюгация через тиольные группы, присутствующие, или встроенные в, антитело, представляющее интерес, также осуществлялась. Например, цистеиновые остатки были введены в белки методами генетической инженерии для образования участков ковалентного присоединения для лигандов (Better et al. (1994) J. Biol. Chem. 13:9644-9650; Bernhard et al. (1994) Bioconjugate Chem. 5: 126-132; Greenwood et al. (1994) Therapeutic Immunology 1:247-255; Tu et al. (1999) Proc. Natl. Acad. Sci USA 96:4862-4867; Kanno et al. (2000) J. Biotechnology, 76:207-214; Chmura et al. (2001) Proc. Nat. Acad. Sci. USA 98(15):8480-8484; Патент США № 6,248,564). Как только свободный цистеиновый остаток появляется в антителе, представляющем интерес, токсины могут быть связаны с этим участком. В качестве примера, лекарственные линкерные реагенты, малеимидокапроил-монометил ауристатин E (MMAE), т.е. MC-MMAE, малеимидокапроил-монометил ауристатин F (MMAF), т.е. MC-MMAF, MC-val-cit-PAB- мМAE или MC-val-cit-PAB-MMAF, растворенные в ДМСО, разбавляют в ацетонитриле и воде при известной концентрации, и добавляют к охлажденному цистеин-дериватизированному антителу в забуференном фосфатом физрастворе (PBS). Через приблизительно один час, добавляют избыток малеимида для гашения реакции и купирования любых непрореагировавших тиольных групп антитела. Реакционную смесь концентрируют центрифужной ультрафильтрацией и антитело, конъюгированное с токсином, очищают и обессоливают посредством элюирования через смолу G25 в PBS, фильтруют через 0,2м фильтры в стерильных условиях, и замораживают для хранения.
Дополнительно, антитела против ТАТ211 настоящего изобретения могут быть конъюгированы с ауристатиновыми и долостатиновыми токсинами (такими как мМAE и мМAF) с использованием следующего метода. Антитело, растворенное в 500 мМ борате натрия и 500 мМ хлориде натрия при pH 8,0, обрабатывают избытком 100 мМ дитиотреитола (DTT). После инкубации при 37°C в течение приблизительно 30 минут, буфер обменивают посредством элюирования через смолу Сефадекс G25 и элюируют PBS с 1 мМ DTPA. Значение тиол/Ab проверяют посредством определения концентрации восстановленного антитела по поглощению при 280 нм раствора, а концентрацию тиола посредством реакции с DTNB (Aldrich, Milwaukee, WI) и определения поглощения при 412 нм. Восстановленное антитело, растворенное в PBS, охлаждают на льду.
Лекарственный линкерный реагент, (1) малеимидокапроил-монометил ауристатин E (MMAE), т.е. MC-MMAE, (2) MC-MMAF, (3) MC-val-cit-PAB-MMAE или (4) MC-val-cit-PAB-MMAF, растворенный в ДМСО, разбавляют в ацетонитриле и воде при известной концентрации, и добавляют к охлажденному восстановленному антителу в PBS. Через приблизительно один час, добавляют избыток малеимида для гашения реакции и купирования любых непрореагировавших тиольных групп антитела. Реакционную смесь концентрируют центрифужной ультрафильтрацией и антитело, конъюгированное с токсином, очищают и обессоливают посредством элюирования через смолу G25 в PBS, фильтруют через 0,2м фильтры в стерильных условиях, и замораживают для хранения.
ПРИМЕР 8: Анализ уничтожения опухолевых клеток in vitro
Клетки млекопитающих, экспрессирующие полипептид ТАТ211, представляющий интерес, могут быть получены с использованием стандартных методов экспрессионного вектора и клонирования. Альтернативно, множество линий опухолевых клеток, экспрессирующих полипептиды ТАТ211, представляющие интерес, являются общедоступными, например, через ATCC и могут быть рутинно идентифицированы с использованием стандартного ELISA или FACS анализа. Моноклональные антитела против полипептида ТАТ211 (и его производных конъюгированных с токсином) могут затем использоваться в анализах, чтобы определить способность антитела уничтожать клетки, экспрессирующие полипептид ТАТ211 in vitro.
Например, клетки экспрессирующие полипептид ТАТ211, представляющий интерес, получают, как описано выше, и помещают в 96-луночные чашки. В одном анализе, конъюгат антитело/токсин (или оголенное антитело) включен на протяжении инкубации клеток в течение периода, равного 4 дням. Во втором независимом анализе, клетки инкубируют в течение 1 часа с конъюгатом антитело/токсин (или оголенным антителом) и затем промывают и инкубируют в отсутствие конъюгата антитело/токсин в течение периода, равного 4 дням. Жизнеспособность клеток затем измеряют с использованием Cell Titer-Glo Luminescent Cell Viability Assay от Promega (Cat# G7571). Необработанные клетки служат в качестве отрицательного контроля.
В первом эксперименте и с конкретным отношением к настоящему изобретению, разнообразные концентрации конъюгатов токсина ADC MC-vc-PAB-MMAE с гуманизированными антителами против ТАТ211 10H1 и контрольных антител (против-человеческого gD или против-агглютинина амброзии), которые являются неспецифическими для связывания с TAT211, тестировали на способность к связыванию и уничтожению полипептид ТАТ211-экспрессирующей клеточной линии OVCAR-3. Более конкретно, клетки OVCAR-3 высевали при 3000 клеток на лунку в 96-луночных планшетах и затем обрабатывали разнообразными концентрациями антител. Уничтожение клеток количественно оценивали на день 7 с использованием реагента Cell Titer-Glo. Антитела, используемые в этих анализах, представляли собой (i) антитело против ТАТ211 10H1-графт, имеющее VL аминокислотную последовательность, показанную как SEQ ID NO: 5, и VH аминокислотную последовательность, показанную как SEQ ID NO:14, (ii) неспецифическое антитело против человеческого gD, (iii) неспецифическое антитело против агглютинина амброзии, (iv) гуманизированное антитело 10H1.11 против ТАТ211, имеющее VL аминокислотную последовательность, показанную как SEQ ID NO: 6, и VH аминокислотную последовательность, показанную как SEQ ID NO:15, (v) гуманизированное антитело 10H1.11.2B против ТАТ211, имеющее VL аминокислотную последовательность, показанную как SEQ ID NO: 8, и VH аминокислотную последовательность, показанную как SEQ ID NO:17, (vi) гуманизированное антитело 10H1.11.4B против ТАТ211, имеющее VL аминокислотную последовательность, показанную как SEQ ID NO: 9, и VH аминокислотную последовательность, показанную как SEQ ID NO:18, (vii) гуманизированное антитело 10H1.11,6B против TAT211, имеющее VL аминокислотную последовательность, показанную как SEQ ID NO:11, и VH аминокислотную последовательность, показанную как SEQ ID NO:20, и (viii) гуманизированное антитело 10H1.11.1 против ТАТ211, имеющее VL аминокислотную последовательность, показанную как SEQ ID NO: 7, и VH аминокислотную последовательность, показанную как SEQ ID NO:16. Результаты этих экспериментов показаны на Фигуре 15 и демонстрируют, что каждое из антител против ТАТ211, конъюгированных с токсином вызывало значительные уровни смерти клеток у клеток OVCAR-3 (т.е. клеток, которые экспрессируют полипептид ТАТ211 на клеточной поверхности), в то время как никакого значительного уничтожения клеток не наблюдали для любых неспецифических антител. Эти данные демонстрируют, что тестируемые антитела против ТАТ211 способны к связыванию с полипептидом ТАТ211 на поверхности клеток, экспрессирующих этот полипептид и вызывают смерть этих клеток in vitro.
Во втором эксперименте, разнообразные концентрации либо (i) конъюгированного с MC-vc-PAB-MMAE 10H1.11.4B, или (ii) контрольного антитела против gD человека, тестировали in vitro на способность уничтожать либо клетки 293 (которые эндогенно не экспрессируют полипептид ТАТ211) или клетки 293, которые были рекомбинантно построены, чтобы экспрессировать полипептид ТАТ211 на их клеточной поверхности (клетки 293/TAT211). Более конкретно, клетки 293 или 293/TAT211 высевали при 2000 клетках на лунку в 96-луночных планшетах и затем обрабатывали разнообразными концентрациями антител. Уничтожение клеток количественно оценивали на день 7 с использованием реагента Cell Titer-Glo. Результаты, полученные с клетками 293, показаны на Фигуре 16, где данные демонстрируют, что ни неспецифическое контрольное антитело против gD человека, ни антитело против ТАТ211 10H1.11.4B не обладали способностью продуцировать значительное уничтожение клеток 293 (которые не экспрессируют полипептид ТАТ211). Напротив, однако, результаты, полученные с клетками 293/TAT211 (Фигура 17), которые экспрессируют полипептид ТАТ211 на клеточной поверхности, демонстрируют, что антитело против ТАТ211 10H1.11.4B, конъюгированное с токсином, вызывает значительное уничтожение клеток in vitro.
Эти данные демонстрируют, что разнообразные антитела против ТАТ211, используемые в этих анализах, обладают способностью к связыванию с TAT211 полипептидом на клеточной поверхности и индуцируют смерть тех клеток, с которыми связывается антитело.
ПРИМЕР 9: Анализ уничтожения опухоли in vivo
Для тестирования эффективности действия разнообразных антител против ТАТ211 для уничтожения опухоли использовали модель in vivo OVCAR-3 жирового тела молочной железы. Конкретно, была разработана модель №. 4382-061404 OVCAR-3 трансплантата жирового тела молочной железы с использованием TAT211-экспрессирующей клеточной линии OVCAR-3 аденокарциномы яичника, которая была получена от Американской Коллекции Типовых Культур (Manassas, VA). Клетки OVCAR-3 вводили инъекционно внутрибрюшинно самкам мышей C.B-17 с тяжелой комбинированной иммунной недостаточностью с бежевой мутацией (C.B-17 SCID.beige). Донорную опухоль вырезали из мыши, несущей внутрибрюшинные опухоли, измельчали, и хирургически имплантировали в правое грудное жировое тело молочной железы самкам реципиентных мышей C.B-17 SCID.beige. Опухоли жирового тела молочной железы серийно пассировали для поддержания линии трансплантата и для обеспечения мышей-опухоленосителей для исследований эффективности действия (обычно готовых через 14-18 дней после трансплантации). Мыши C.B-17 SCID.beige, используемые для поддержания линии трансплантата, имели возраст 6-8 недель и были получены от Charles River Laboratories, Inc. (San Diego, CA). Разнообразные концентрации, включая 3 мг/кг, разнообразных антител затем использовали, чтобы определить их эффект на средний объем опухоли in vivo.
Результаты этих разнообразных анализов in vivo показаны на Фигурах 18 и 19. Эти результаты демонстрируют, что тестируемые разнообразные антитела против ТАТ211 обладают способностью к связыванию с полипептидом ТАТ211 на поверхности опухолевых клеток in vivo и индуцированию смерти этих TAT211-экспрессирующих опухолевых клеток. Следовательно, результаты этих экспериментов показывают, что тестируемые разнообразные антитела против ТАТ211 являются эффективными при терапевтическом лечении TAT211-экспрессирующих опухолей in vivo.
ПРИМЕР 10: Клеточная интернализация антител против ТАТ211
Чтобы определить являются ли антитела против ТАТ211, описанные в настоящей заявке, интернализированными в TAT211-экспрессирующие клетки при связывании антитела с полипептидом ТАТ211 на клеточной поверхности, клетки высевали на 8-луночные предметные стекла (Nalge Nunc Intl.) (100000 клеток/лунка для OVCAR3 и 30000 клетки/лунка для Igrovl или 293) и инкубировали при 37°C/5% CO2в течение 24-48 часов. Антитела против ТАТ211 добавляли при 2-5 мкг/мл в среды для роста либо в течение ночи или в течение 2 часов вместе с ингибиторами протеаз (50 мкг/мл Лейпептина и 5 мкг/мл Пепстатина). Эти ингибиторы протеаз предотвращают деградацию первичного антитела, обеспечивая обнаружение антитела в лизосомах. Для живого мечения, клетки инкубировали с антителами при комнатной температуре в течение 45 минут. Все клетки затем промывали, фиксировали в 3% формальдегиде в течение 10 минут, пермеабилизировали с 0,05% сапонином в течение 5-10 минут и участки неспецифического связывания антитела блокировали PBS+1% BSA в течение 20 минут при комнатной температуре. Клетки затем инкубировали с вторичными антителами, меченными Alexa-488 (Molecular Probes) при 37°C в течение 1 часа, промывали, и затем камерные вкладыши удаляли, чтобы нанести клетки на стеклянный слайд. Слайды устанавливали, применяя VectaShield с DAPI для мечения ядер (Vector Laboratories), затем помещали под покровное стекло и герметизировали прозрачным лаком для ногтей.
Результаты этих анализов демонстрировали, что разнообразные антитела против ТАТ211, описанные в настоящей заявке, связывались с полипептидом ТАТ211 на поверхности живых клеток и самостоятельно интернализировались в клетке и располагались в лизосомах клетки в пределах менее чем 20 часов после добавления антител к клеткам. Как таковые, антитела против ТАТ211, описанные в настоящей заявке, представляют собой превосходные кандидаты для токсин-конъюгированной опухолевой терапии для опухолей, которые экспрессируют полипептиды ТАТ211.
ПРИМЕР 11: Применение TAT в качестве гибридизационного зонда
Следующий способ описывает применение нуклеотидной последовательности, кодирующей TAT, в качестве гибридизационного зонда для, т.е. диагностики присутствия опухоли у млекопитающего.
ДНК, содержащая кодирующую последовательность непроцессированного или зрелого TAT, как описано в настоящей заявке, может также использоваться в качестве зонда для скрининга гомологичных ДНК (таких как кодирующие встречающиеся в природе варианты TAT) в библиотеках кДНК тканей человека или геномных библиотеках тканей человека.
Гибридизацию и промывку фильтров, содержащих любую из двух библиотек ДНК, осуществляют при следующих условиях высокой строгости. Гибридизацию меченного радиоактивным изотопом TAT-производного зонда к фильтрам осуществляют в растворе 50% формамида, 5× SSC, 0,1% SDS, 0,1% пирофосфата натрия, 50 мМ фосфата натрия, pH 6,8, 2× Раствор Денхардта, и 10% декстрансульфата при 42°C в течение 20 часов. Промывку фильтров осуществляют в водном растворе 0,1× SSC и 0,1% SDS при 42°C.
ДНК, имеющие желательную идентичность последовательности с ДНК, кодирующей непроцессированную нативную последовательность TAT, могут затем быть идентифицированы с использованием стандартных методов известных в данной области.
ПРИМЕР 12: Экспрессия TAT в E. coli
Данный пример иллюстрирует получение негликозилированной формы TAT посредством рекомбинантной экспрессии в E. coli.
Последовательность ДНК, кодирующую TAT, первоначально амплифицируют с использованием выбранных ПЦР праймеров.
Праймеры должны содержать участки рестрикционных ферментов, которые соответствуют участкам рестрикционных ферментов на выбранном экспрессионном векторе. Могут использоваться разнообразные экспрессионные векторы. Примером подходящего вектора является pBR322 (полученный из E. coli; см. Bolivar et al., Gene, 2:95 (1977)), который содержит гены резистентности для ампициллина и тетрациклина. Вектор расщепляют с помощью рестрикционного фермента и дефосфорилируют. ПЦР амплифицированные последовательности затем лигируют в вектор. Вектор будет, предпочтительно, включать последовательности, которые кодируют ген резистентности к антибиотикам, trp промотор, полиhis лидер (включающий первые шесть STII кодонов, полиhis последовательность, и участок расщепления для энтерокиназы), TAT кодирующую область, лямбда транскрипционный терминатор, и ген argU.
Лигирующую смесь затем применяют для трансформации выбранного штамма E. coli с использованием способов, описанных у Sambrook et al., выше. Трансформанты идентифицируют по их способности расти на планшетах LB, и затем отбирают колонии, резистентные к антибиотикам. Плазмидная ДНК может быть выделена и подтверждена посредством рестрикционного анализа и секвенированием ДНК.
Выбранные клоны могут быть выращены в течение ночи в жидкой культуральной среде, такой как бульон LB, дополненный антибиотиком. Ночная культура может впоследствии применяться для инокуляции культуры в более крупном масштабе. Клетки затем выращивают до желательной оптической плотности, во время которой экспрессионный промотор включается.
После культивирования клеток в течение нескольких дополнительных часов, клетки могут быть собраны центрифугированием. Сгусток клеток, полученный центрифугированием, может быть солюбилизирован с использованием разнообразных агентов, известных в данной области, и солюбилизированный TAT белок может затем быть очищен с использованием хелатирующей металл колонки при условиях, которые обеспечивают прочное связывание белка.
TAT может экспрессироваться в E. coli в поли-His меченной форме, с использованием следующей методики. ДНК, кодирующую TAT, первоначально амплифицируют с использованием выбранных праймеров ПЦР. Праймеры будут содержать участки для рестрикционных ферментов, которые соответствуют участкам для рестрикционных ферментов на выбранном экспрессионном векторе, и другие полезные последовательности, предоставляющие эффективную и надежную инициацию трансляции, быструю очистку на хелатирующей металл колонке, и протеолитическое удаление с помощью энтерокиназы. ПЦР-амплифицированные, поли-His меченые последовательности затем лигируют в экспрессионный вектор, который применяют для трансформации хозяина E. coli на основе штамма 52 (W3110 fufiA(tonA) lon galE rpoHts(htpRts) clpP(lacIq). Трансформанты сначала выращивают в LB, содержащем 50 мг/мл карбенициллина при 30°C со встряхиванием, до достижения O.D,600 из 3-5. Культуры затем разбавляют 50-100-кратно средой CRAP (полученной смешиванием 3,57 г (NH4)2S04, 0,71 г цитрата натрия ·2H2O, 1,07 г KCl, 5,36 г дрожжевого экстракта Difco, 5,36 г гидролизата казеина Шеффилда в 500 мл воды, а также 110 мМ MPOS, pH 7,3, 0,55% (м/об) глюкозы и 7 мМ MgSO4) и выращивают в течение приблизительно 20-30 часов при 30°C со встряхиванием.
Образцы удаляют для верификации экспрессии посредством SDS-PAGE анализа, и объемную культуру центрифугируют для сгущения клеток. Сгустки клеток замораживают до очистки и рефолдинга.
Пасту E. coli от 0,5 до 1 л ферментаций (6-10 г сгустков) ресуспендируют в 10 объемах (м/об) в буфере с 7 M гуанидином, 20 мМ Трис, pH 8. Твердые сульфит натрия и тетратионат натрия добавляют для создания конечных концентраций 0,1M и 0,02 M, соответственно, и раствор перемешивают в течение ночи при 4°C. Эта стадия приводит в результате к денатурированному белку, в котором все цистеиновые остатки блокированы сульфитолизацией. Раствор центрифугируют при 40000 об. в мин. в ультрацентрифуге Beckman в течение 30 мин. Супернатант разбавляют 3-5 объемами буфера для металл-хелатирующей колонки (6 M гуанидин, 20 мМ Трис, pH 7,4) и фильтруют через 0,22 микронные фильтры для осветления. Осветленный экстракт загружают на 5 мл Qiagen Ni-NTA металл-хелатирующую колонку, уравновешивающую в буфере для металл-хелатирующей колонки. Колонку промывают дополнительным буфером, содержащим 50 мМ имидазола (Calbiochem, Utrol grade), pH 7,4. Белок элюируют буфером, содержащим 250 мМ имидазола. Фракции, содержащие желательный белок, отбирают и хранят при 4°C. Концентрацию белка оценивают по его поглощению при 280 нм с использованием рассчитанного коэффициента экстинкции, исходя из его аминокислотной последовательности.
Белки подвергают рефолдингу посредством разбавления образца медленно в свежеполученный буфер для рефолдинга, состоящий из: 20 мМ Трис, pH 8,6, 0,3 M NaCl, 2,5 M мочевины, 5 мМ цистеина, 20 мМ глицина и 1 мМ ЭДТА. Объемы рефолдинга выбирают таким образом, что конечная концентрация белка находится в интервале от 50 до 100 микрограммов/мл. Раствор для рефолдинга осторожно перемешивают при 4°C в течение 12-36 часов. Реакцию рефолдинга гасят посредством добавления TFA до конечной концентрации, равной 0,4% (pH приблизительно 3). Перед дополнительной очисткой белка, раствор фильтруют через 0,22 микронный фильтр и добавляют ацетонитрил до 2-10% конечной концентрации. После рефолдинга белок хроматографируют на обращено-фазовой колонке Poros R1/H с использованием подвижного буфера из 0,1% TFA с элюированием при градиенте ацетонитрила от 10 до 80%. Аликвоты фракций с поглощением при A280 анализируют на SDS полиакриламидных гелях, и фракции, содержащие гомогенный белок после рефолдинга объединяют. Как правило, надлежащим образом виды большинства белков после рефолдинга, элюируют при самых низких концентрациях ацетонитрила, поскольку эти виды являются наиболее компактными, причем их гидрофобные внутренние части экранированы от взаимодействия с обращено-фазовой смолой. Агрегированные виды обычно элюируются при более высоких концентрациях ацетонитрила. В дополнение к разделению неправильно упакованных форм белков от желательной формы, на стадии с обращенной фазой также удаляют эндотоксин из образцов.
Фракции, содержащие желательный складчатый полипептид ТАТ, объединяют, и ацетонитрил удаляют с использованием слабого потока азота, направленного на раствор. Белки составляют в 20 мМ Hepes, pH 6,8 с 0,14 M хлорида натрия и 4% маннитола посредством диализа или гель-фильтрацией с использованием G25 Superfine (Pharmacia) смол, уравновешивают в буфере для состава и фильтруют в стерильных условиях.
Некоторые из полипептидов ТАТ, раскрытых в настоящей заявке, были успешно экспрессированы и очищены с использованием этих метода(методов).
ПРИМЕР 13: Экспрессия TAT в клетках млекопитающих
Данный пример иллюстрирует получение потенциально гликозилированной формы TAT посредством рекомбинантной экспрессии в клетках млекопитающих.
Вектор pRK5 (см. EP 307,247, опубликованную 15 Марта, 1989 г.), используют в качестве экспрессионного вектора. Необязательно, ДНК TAT лигируют в pRK5 с выбранными рестрикционными ферментами для обеспечения ввода ДНК TAT с использованием способов лигирования, таких как описаны в Sambrook et al., выше. Полученный в результате вектор именуют pRK5-TAT.
В одном варианте осуществления, выбранные клетки-хозяева могут представлять собой клетки 293. Клетки 293 человека (ATCC CCL 1573) выращивают до слияния в чашках для тканевых культур в среде, такой как DMEM, дополненной сывороткой зародыша телят, и необязательно, питательные компоненты и/или антибиотики.
Приблизительно 10 мкг ДНК pRK5-TAT смешивают с приблизительно 1 мкг ДНК, кодирующей ген VA РНК [Thimmappaya et al., Cell, 31:543 (1982)] и растворяют в 500 мкл 1 мМ Трис-HCl, 0,1 мМ ЭДТА, 0,227 M CaC12. К этой смеси добавляют, по каплям, 500 мкл 50 мМ HEPES (pH 7,35), 280 мМ NaCl, 1,5 мМ NaP04, и обеспечивают образование осадка в течение 10 минут при 25°C. Осадок суспендируют и добавляют к клеткам 293 и дают осадиться в течение приблизительно четырех часов при 37°C. Культуральную среду аспирируют и 2 мл 20% глицерина в PBS добавляют в течение 30 секунд. Клетки 293 затем промывают средой, не содержащей сыворотки, добавляют свежую среду, и клетки инкубируют в течение приблизительно 5 дней.
Приблизительно через 24 часа после трансфекций, культуральную среду удаляют и заменяют на культуральную среду (по отдельности) или культуральную среду, содержащую 200 мкКи/мл35S-цистеина и 200 мкКи/мл35S-метионина. Через 12 часов инкубации, кондиционированную среду собирают, концентрируют на центробежном фильтре, и загружают на 15% SDS гель. Обработанный гель может быть высушен и экспонирован на пленку в течение выбранного периода времени, чтобы отобразить присутствие полипептида ТАТ. Культуры, содержащие трансфицированные клетки, могут претерпевать дополнительную инкубацию (в среде, не содержащей сыворотку), и среду тестируют в выбранных биоанализах.
В альтернативном методе, TAT может быть введен в клетки 293 временно с использованием способа с декстрансульфатом, описанного Somparyrac et al., Proc. Natl. Acad. Sci., 12:7575 (1981). Клетки 293 выращивают до максимальной плотности в роллерной колбе и добавляют 700 мкг ДНК pRK5-TAT. Клетки сначала концентрируют из роллерной колбы посредством центрифугирования и промывают PBS. Осадок ДНК-декстрана инкубируют на сгустке клеток в течение четырех часов. Клетки обрабатывают 20% глицерином в течение 90 секунд, промывают тканевой культуральной средой, и повторно вводят в роллерную колбу, содержащую тканевую культуральную среду, 5 мкг/мл бычьего инсулина и 0,1 мкг/мл бычьего трансферрина. Через приблизительно четыре дня, кондиционированную среду центрифугируют и фильтруют для удаления клеток и дебриса. Образец, содержащий экспрессируемый TAT, затем может быть концентрирован и очищен любым выбранным способом, таким как диализ и/или колоночная хроматография.
В еще одном варианте осуществления, TAT может быть экспрессирован в CHO клетках. pRK5-TAT может быть трансфицирован в клетки CHO с использованием известных реагентов, таких как CaPO4 или DEAE-декстран. Как описано выше, клеточные культуры могут быть инкубированы, и среда заменена на культуральную среду (по отдельности) или среду, содержащую радиоактивную метку, такую как35S-метионин. После определения присутствия полипептида ТАТ, культуральная среда может быть заменена на среду, не содержащую сыворотки. Предпочтительно, культуры инкубируют в течение приблизительно 6 дней, и затем кондиционированную среду собирают. Среда, содержащая экспрессированный TAT, затем может быть концентрирована и очищена посредством любого выбранного способа.
Эпитоп-меченный TAT также может быть экспрессирован в хозяйских CHO клетках. TAT может быть субклонирован из вектора pRK5. Субклоновая вставка может претерпевать ПЦР для гибридизации в рамке с выбранной эпитопной меткой, такой как поли-his метка в Бакуловирусном экспрессионном векторе. Поли-his меченная TAT вставка затем может быть субклонирована в управляемый SV40 вектор, содержащий селекционный маркер, такой как DHFR для селекции стабильных клонов. В конечном счете, CHO клетки могут быть трансфицированы (как описано выше) управляемым SV40 вектором. Мечение может осуществляться, как описано выше, для верификации экспрессии. Культуральная среда, содержащая экспрессированный поли-His меченный TAT, затем может быть концентрирована и очищена посредством любого выбранного способа, такого как Ni2+-хелатная аффинная хроматография.
TAT также может быть экспрессирован в CHO и/или COS клетках посредством методики транзиторной экспрессии или в CHO клетках посредством еще одной методики стабильной экспрессии.
Стабильную экспрессию в CHO клетках осуществляют с использованием следующей методики. Белки экспрессируют как конструкцию IgG (иммуноадгезин), в которой кодирующие последовательности для растворимых форм (например, внеклеточных доменов) соответствующих белков рекомбинируют с последовательностью константной области IgG1, содержащей шарнир, CH2 и CH2 домены и/или являются поли-His меченой формой.
После ПЦР амплификации, соответствующие ДНК субклонируют в экспрессионном векторе CHO с использованием стандартных методов, как описано в Ausubel et al., Current Protocols Molecular Biology, Unit 3.16, John Wiley and Sons (1997). Экспрессионные векторы CHO построены так, чтобы иметь совместимые рестрикционные сайты 5 ' и 3 ' у ДНК, представляющей интерес, для обеспечения удобного возвратно-поступательного движения кДНК. Вектор использует экспрессию в CHO клетках, как описано у Lucas et al., Nucl. Acids Res. 24:9 (1774-1779 (1996), и использует ранний промотор/энхансер SV40, чтобы управлять экспрессией кДНК, представляющей интерес, и дигидрофолатредуктазы (DHFR). Экспрессия DHFR позволяет проводить селекцию для стабильного поддержания плазмиды после трансфекции.
Двенадцать микрограммов желательной плазмидной ДНК вводят в приблизительно 10 миллионов CHO клеток с использованием доступных на рынке трансфекционных реагентов SUPERFECT® (Quiagen), DOSPER® или FUGENE® (Boehringer Mannheim). Клетки выращивают, как описано у Lucas et al., выше. Приблизительно 3 × 107 клетки замораживают в ампуле для дальнейшего роста и выработки, как описано ниже.
Ампулы, содержащие плазмидную ДНК, оттаивают посредством помещения в водяную баню и смешивают посредством интенсивного перемешивания. Содержимое переносят пипеткой в центрифужную пробирку, содержащую 10 мл среды, и центрифугируют при 1000 об. в мин. в течение 5 минут. Супернатант аспирируют и клетки ресуспендируют в 10 мл селективной среды (через 0,2 мкм отфильтрованный PS20 с 5% 0,2 мкм диафильтрованной зародышевой телячьей сывороткой). Клетки затем аликвотируют в 100 мл флакон, содержащий 90 мл селективной среды. Через 1-2 дня, клетки переносят в 250 мл флакон, заполненный 150 мл селективной среды для роста, и инкубируют при 37°C. Через еще другие 2-3 дня, флаконы объемом 250 мл, 500 мл и 2000 мл засевают 3 × 105 клеток/мл. Клеточную среду заменяют на свежую среду центрифугированием и ресуспендированием в среде для получения. Несмотря на то, что могут использоваться любые подходящие среды для CHO, среда для получения, описанная в Патенте США № 5,122,469, выданном 16 Июня 1992г, может действительно применяться. Колбу для получения объемом 3L засевают при 1,2 × 106 клеток/мл. В день 0, определяют количество клеток и pH. В день 1, из колбы отбирают образцы и проводят продувку фильтрованным воздухом. На день 2, из колбы отбирают образцы, температуру смещают до 33°C, и добавляют 30 мл 500 г/л глюкозы и 0,6 мл 10% пеногасителя (например, 35% полидиметилсилоксановую эмульсию, Dow Corning 365 Medical Grade Emulsion). На протяжении всего получения, pH регулируют по необходимости, чтобы удерживать его приблизительно равным 7,2. Через 10 дней, или до тех пор, пока жизнеспособность не упадет ниже 70%, клеточную культуру собирают посредством центрифугирования и фильтрации через 0,22 мкм фильтр. Фильтрат либо хранили при 4°C или немедленно загружали на колонки для очистки.
Для поли-His меченых конструкций, белки очищают с использованием Ni-NTA колонки (Qiagen). Перед очисткой, имидазол добавляют к кондиционированной среде до концентрации, равной 5 мМ. Кондиционированную среду подают насосом на Ni-NTA колонку объемом 6 мл, уравновешенную в буфере 20 мМ Hepes, pH 7,4, содержащем, 0,3 M NaCl и 5 мМ имидазола, при скорости потока, равной 4-5 мл/мин. при 4°C. После загрузки, колонку промывают дополнительным уравновешивающим буфером и белок элюируют уравновешивающим буфером, содержащим 0,25 M имидазола. Высокоочищенный белок далее обессоливают в буфере для хранения, содержащем 10 мМ Hepes, 0,14 M NaCl и 4% маннитола, pH 6,8, с помощью колонки объемом 25 мл с G25 Superfine (Pharmacia) и хранят при -80°C.
Иммуноадгезиновые (Fc-содержащие) конструкции очищают из кондиционированной среды следующим образом. Кондиционированную среду подают насосом на колонку объемом 5 мл с Белком А (Pharmacia), которая была уравновешена в 20 мМ Na фосфатном буфере, pH 6,8. После загрузки, колонку промывают большим объемом уравновешивающего буфера перед элюированием 100 мМ лимонной кислоты, pH 3,5. Элюированный белок немедленно нейтрализуют посредством сбора 1 мл фракций в пробирки, содержащие 275 мкл 1 M Тирс буфера, pH 9. Высокоочищенный белок далее обессоливают в буфере для хранения, как описано выше для поли-His меченых белков. Гомогенность оценивают посредством SDS полиакриламидных гелей и N-концевого аминокислотного секвенирования с деградацией по Эдману.
Некоторые из полипептидов ТАТ, раскрытых в настоящей заявке, были успешно экспрессированы и очищены с использованием этих метода(методов).
ПРИМЕР 14: Экспрессия TAT в дрожжах
Следующий способ описывает рекомбинантную экспрессию TAT в дрожжах.
Сначала, создают дрожжевые экспрессионные векторы для внутриклеточного получения или секреции TAT из ADH2/GAPDH промотора. ДНК, кодирующую TAT, и промотор вводят в подходящие участки для рестрикционных ферментов в выбранной плазмиде, чтобы направить внутриклеточную экспрессию TAT. Для секреции, ДНК, кодирующая TAT, может быть клонирована в выбранной плазмиде, вместе с ДНК, кодирующей ADH2/GAPDH промотор, нативный TAT сигнальный пептид или другой сигнальный пептид млекопитающих, или, например, дрожжевой альфа-фактор или инвертаза-секреторную сигнальную/лидерную последовательность, и линкерные последовательности (по необходимости) для экспрессии TAT.
Дрожжевые клетки, такие как дрожжевой штамм AB110, могут затем быть трансформированы с экспрессионными плазмидами, описанными выше, и культивированы в выбранных ферментационных средах. Трансформированные дрожжевые супернатанты могут быть проанализированы посредством осаждения 10% трихлоруксусной кислотой и разделения с помощью SDS-PAGE, с последующим окрашиванием гелей красителем Кумасси Синим.
Рекомбинантный TAT может далее быть выделен и очищен посредством удаления дрожжевых клеток из ферментационной среды посредством центрифугирования и затем концентрирования среды с использованием выбранных картриджных фильтров. Концентрат, содержащий TAT, может дополнительно быть очищен с использованием выбранных смол для колоночной хроматографии.
Некоторые из полипептидов ТАТ, раскрытых в настоящей заявке, были успешно экспрессированы и очищены с использованием этих метода(методов).
ПРИМЕР 15: Экспрессия TAT в клетках насекомых, инфицированных бакуловирусом
Следующий способ описывает рекомбинантную экспрессию TAT в клетках насекомых, инфицированных бакуловирусом.
Последовательность, кодирующая TAT, представляет собой гибридную восходящую линию эпитопной метки, содержащейся внутри бакуловирусного экспрессионного вектора. Такие эпитопные метки включают поли-his метки и иммуноглобулиновые метки (подобно Fc-областям IgG). Могут использоваться разнообразные плазмиды, включая плазмиды, производные от промышленно доступных плазмид, такие как pVL1393 (Novagen). Вкратце, последовательность, кодирующую TAT, или желательную часть кодирующей последовательности TAT, такую как последовательность, кодирующая внеклеточный домен трансмембранного белка, или последовательность, кодирующая зрелый белок, если белок является внеклеточным, амплифицируют посредством ПЦР с праймерами, комплементарными 5' и 3' областям. 5' праймер может вводить фланкирующие (выбранные) участки для рестрикционных ферментов. Продукт затем расщепляют этими выбранными рестрикционными ферментами и субклонируют в экспрессионный вектор.
Рекомбинантный бакуловирус генерируют посредством co-трансфекции указанной выше плазмиды и вирусной ДНК BACULOGOLD™ (Pharmingen) в клетки Spodoptera frugiperda ("Sf9") (ATCC CRL 1711) с использованием липофектина (доступен на рынке от GIBCO-BRL). Через 4-5 дней инкубации при 28°C, высвобождаемые вирусы собирают и применяют для дополнительных амплификаций. Вирусная инфекция и белковая экспрессия осуществляются, как описано O'Reilley et al., Baculovirus expression vectors: Laboratory Manual, Oxford: Oxford University Press (1994).
Экспрессированный поли-his меченый TAT может затем быть очищен, например, посредством Ni2+-хелатной аффинной хроматографии следующим образом. Экстракты получают из рекомбинантных вирус-инфицированных клеток Sf9, как описано Rupert et al., Nature, 362: 175-179 (1993). Вкратце, клетки Sf9 отмывают, ресуспендируют в буфере для озвучивания (25 мл Hepes, pH 7,9; 12,5 мМ MgC12; 0,1 мМ ЭДТА; 10% глицерина; 0,1% NP-40; 0,4 M KC1), и обрабатывают ультразвуком дважды в течение 20 секунд на льду. Обработанные ультразвуком образцы осветляют центрифугированием, и супернатант разбавляют 50-кратно в загрузочном буфере (50 мМ фосфата, 300 мМ NaCl, 10% глицерина, pH 7,8) и фильтруют через 0,45 мкм фильтр. Готовят колонку с Ni2+-NTA агарозой (доступна на рынке от Qiagen) с объемом слоя, равным 5 мл, промывают 25 мл воды и уравновешивают 25 мл загрузочного буфера. Отфильтрованный клеточный экстракт загружают на колонку при 0,5 мл в минуту. Колонку промывают до базовой линии A280 загрузочным буфером, и на этой отметке начинают сбор фракций. Далее, колонку промывают вторичным промывочным буфером (50 мМ фосфата; 300 мМ NaCl, 10% глицерина, pH 6,0), который элюирует неспецифически связанный белок. После повторного достижения базовой линии A280, колонку проявляют от 0 до 500 мМ градиентом имидазола во вторичном промывочном буфере. Собирают фракции по одному мл и анализируют посредством SDS-PAGE и окрашивания серебром или Вестерн-блоттинга с Ni2+-NTA-конъюгированной со щелочной фосфатазой (Qiagen). Фракции, содержащие элюированный His10-меченный TAT, объединяют и диализуют против загрузочного буфера.
Альтернативно, очистка IgG меченного (или Fc меченного) TAT может осуществляться с использованием известных хроматографических методов, включающих, например, колоночную хроматографию с белком А или белком G.
Некоторые из полипептидов ТАТ, раскрытых в настоящей заявке, были успешно экспрессированы и очищены с использованием этих метода(методов).
ПРИМЕР 16: Очистка полипептидов ТАТ с использованием специфических антител
Нативные или рекомбинантные полипептиды ТАТ могут быть очищены посредством разнообразных стандартных методов в области очистки белка. Например, полипептид про-ТАТ, зрелый полипептид ТАТ, или полипептид пре-ТАТ очищают посредством иммуноаффинной хроматографии с использованием антител, специфических для полипептида ТАТ, представляющего интерес. В целом, иммуноаффинную колонку создают посредством ковалентного сочетания антитела против полипептида ТАТ с активированной хроматографической смолой.
Поликлональные иммуноглобулины получают из иммунной сыворотки либо осаждением сульфатом аммония или посредством очистки на иммобилизованном белке А (Pharmacia LKB Biotechnology, Piscataway, N.J.). Аналогично, моноклональные антитела получают из асцитной жидкости мышей осаждением сульфатом аммония или хроматографией на иммобилизованном Белке A. Частично очищенный иммуноглобулин ковалентно присоединяют к хроматографической смоле, такой как CnBr-активированная SEPHAROSETM (Pharmacia LKB Biotechnology). Антитело сочетают со смолой, смолу блокируют, и производную смолу промывают в соответствии с инструкциями изготовителя.
Такую иммуноаффинную колонку используют при очистке полипептида ТАТ посредством получения фракции из клеток, содержащих полипептид ТАТ в растворимой форме. Этот препарат производят посредством солюбилизации цельной клетки или субклеточной фракции, получаемой через дифференциальное центрифугирование посредством добавления детергента или посредством других способов, хорошо известных в данной области. Альтернативно, растворимый полипептид ТАТ, содержащий сигнальную последовательность, может секретироваться в применимом количестве в среду, в которой клетки выращивают.
Препарат, содержащий растворимый полипептид ТАТ, пропускают через иммуноаффинную колонку, и колонку промывают при условиях, которые обеспечивают предпочтительную абсорбцию полипептида ТАТ (например, буферы с высокой ионной силой в присутствии детергента). Затем, колонку элюируют при условиях, которые разрушают связывание антитело/полипептид ТАТ (например, буфер с низким pH, таким как приблизительно pH 2-3, или с высокой концентрацией хаотропа, такого как мочевина или ион тиоцианата), и полипептид ТАТ собирают.
Считают, что приведенное выше письменное описание является достаточным, чтобы дать возможность квалифицированному специалисту в области практически реализовать изобретение. Настоящее изобретение не будет ограниченным по объему посредством сохраненного построения, поскольку сохраненный вариант осуществления предназначен для единичной иллюстрации некоторых аспектов изобретения, и любые построения, которые являются функционально эквивалентными входят в объем притязаний данного изобретения. Сохранение материала в настоящей заявке не составляет допущение, что письменное описание, содержащееся в данном документе, является несоответствующим, чтобы обеспечить практическую реализацию любого аспекта изобретения, включая его наилучший режим, и не должно рассматриваться как ограничивающее объем правовых притязаний до конкретных иллюстраций, которое оно представляет. Несомненно, разнообразные модификации изобретения в дополнение к тем, что показаны и описаны в настоящей заявке, будут очевидными для квалифицированных специалистов в данной области из приведенного выше описания и попадают в пределы объема прилагаемой формулы изобретения.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> GENENTECH, INC. et al.
<120> КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛИ
<130> P5041R1WO
<140> PCT/US2010/058197
<141> 2010-11-29
<150> US 61/384,467
<151> 2010-09-20
<150> US 61/265,262
<151> 2009-11-30
<160> 81
<210> 1
<211> 2366
<212> ДНК
<213> Homo sapiens
<400> 1
cagcccagca cctgcggagg gagcgctgac catggctccc tggcctgaat 50
tgggagatgc ccagcccaac cccgataagt acctcgaagg ggccgcaggt 100
cagcagccca ctgcccctga taaaagcaaa gagaccaaca aaacagataa 150
cactgaggca cctgtaacca agattgaact tctgccgtcc tactccacgg 200
ctacactgat agatgagccc actgaggtgg atgacccctg gaacctaccc 250
actcttcagg actcggggat caagtggtca gagagagaca ccaaagggaa 300
gattctctgt ttcttccaag ggattgggag attgatttta cttctcggat 350
ttctctactt tttcgtgtgc tccctggata ttcttagtag cgccttccag 400
ctggttggag gaaaaatggc aggacagttc ttcagcaaca gctctattat 450
gtccaaccct ttgttggggc tggtgatcgg ggtgctggtg accgtcttgg 500
tgcagagctc cagcacctca acgtccatcg ttgtcagcat ggtgtcctct 550
tcattgctca ctgttcgggc tgccatcccc attatcatgg gggccaacat 600
tggaacgtca atcaccaaca ctattgttgc gctcatgcag gtgggagatc 650
ggagtgagtt cagaagagct tttgcaggag ccactgtcca tgacttcttc 700
aactggctgt ccgtgttggt gctcttgccc gtggaggtgg ccacccatta 750
cctcgagatc ataacccagc ttatagtgga gagcttccac ttcaagaatg 800
gagaagatgc cccagatctt ctgaaagtca tcactaagcc cttcacaaag 850
ctcattgtcc agctggataa aaaagttatc agccaaattg caatgaacga 900
tgaaaaagcg aaaaacaaga gtcttgtcaa gatttggtgc aaaactttta 950
ccaacaagac ccagattaac gtcactgttc cctcgactgc taactgcacc 1000
tccccttccc tctgttggac ggatggcatc caaaactgga ccatgaagaa 1050
tgtgacctac aaggagaaca tcgccaaatg ccagcatatc tttgtgaatt 1100
tccacctccc ggatcttgct gtgggcacca tcttgctcat actctccctg 1150
ctggtcctct gtggttgcct gatcatgatt gtcaagatcc tgggctctgt 1200
gctcaagggg caggtcgcca ctgtcatcaa gaagaccatc aacactgatt 1250
tcccctttcc ctttgcatgg ttgactggct acctggccat cctcgtcggg 1300
gcaggcatga ccttcatcgt acagagcagc tctgtgttca cgtcggcctt 1350
gacccccctg attggaatcg gcgtgataac cattgagagg gcttatccac 1400
tcacgctggg ctccaacatc ggcaccacca ccaccgccat cctggccgcc 1450
ttagccagcc ctggcaatgc attgaggagt tcactccaga tcgccctgtg 1500
ccactttttc ttcaacatct ccggcatctt gctgtggtac ccgatcccgt 1550
tcactcgcct gcccatccgc atggccaagg ggctgggcaa catctctgcc 1600
aagtatcgct ggttcgccgt cttctacctg atcatcttct tcttcctgat 1650
cccgctgacg gtgtttggcc tctcgctggc cggctggcgg gtgctggttg 1700
gtgtcggggt tcccgtcgtc ttcatcatca tcctggtact gtgcctccga 1750
ctcctgcagt ctcgctgccc acgcgtcctg ccgaagaaac tccagaactg 1800
gaacttcctg ccgctgtgga tgcgctcgct gaagccctgg gatgccgtcg 1850
tctccaagtt caccggctgc ttccagatgc gctgctgctg ctgctgccgc 1900
gtgtgctgcc gcgcgtgctg cttgctgtgt ggctgcccca agtgctgccg 1950
ctgcagcaag tgctgcgagg acttggagga ggcgcaggag gggcaggatg 2000
tccctgtcaa ggctcctgag acctttgata acataaccat tagcagagag 2050
gctcagggtg aggtccctgc ctcggactca aagaccgaat gcacggcctt 2100
gtaggggacg ccccagattg tcagggatgg ggggatggtc cttgagtttt 2150
gcatgctctc ctccctccca cttctgcacc ctttcaccac ctcgaggaga 2200
tttgctcccc attagcgaat gaaattgatg cagtcctacc taactcgatt 2250
ccctttggct tggtgggtag gcctgcaggg cacttttatt ccaacccatg 2300
gcctccatga ctttttcaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2350
aaaaaaaaaa aaaaaa 2366
<210> 2
<211> 690
<212> PRT
<213> Homo sapiens
<400> 2
Met Ala Pro Trp Pro Glu Leu Gly Asp Ala Gln Pro Asn Pro Asp
1 5 10 15
Lys Tyr Leu Glu Gly Ala Ala Gly Gln Gln Pro Thr Ala Pro Asp
20 25 30
Lys Ser Lys Glu Thr Asn Lys Thr Asp Asn Thr Glu Ala Pro Val
35 40 45
Thr Lys Ile Glu Leu Leu Pro Ser Tyr Ser Thr Ala Thr Leu Ile
50 55 60
Asp Glu Pro Thr Glu Val Asp Asp Pro Trp Asn Leu Pro Thr Leu
65 70 75
Gln Asp Ser Gly Ile Lys Trp Ser Glu Arg Asp Thr Lys Gly Lys
80 85 90
Ile Leu Cys Phe Phe Gln Gly Ile Gly Arg Leu Ile Leu Leu Leu
95 100 105
Gly Phe Leu Tyr Phe Phe Val Cys Ser Leu Asp Ile Leu Ser Ser
110 115 120
Ala Phe Gln Leu Val Gly Gly Lys Met Ala Gly Gln Phe Phe Ser
125 130 135
Asn Ser Ser Ile Met Ser Asn Pro Leu Leu Gly Leu Val Ile Gly
140 145 150
Val Leu Val Thr Val Leu Val Gln Ser Ser Ser Thr Ser Thr Ser
155 160 165
Ile Val Val Ser Met Val Ser Ser Ser Leu Leu Thr Val Arg Ala
170 175 180
Ala Ile Pro Ile Ile Met Gly Ala Asn Ile Gly Thr Ser Ile Thr
185 190 195
Asn Thr Ile Val Ala Leu Met Gln Val Gly Asp Arg Ser Glu Phe
200 205 210
Arg Arg Ala Phe Ala Gly Ala Thr Val His Asp Phe Phe Asn Trp
215 220 225
Leu Ser Val Leu Val Leu Leu Pro Val Glu Val Ala Thr His Tyr
230 235 240
Leu Glu Ile Ile Thr Gln Leu Ile Val Glu Ser Phe His Phe Lys
245 250 255
Asn Gly Glu Asp Ala Pro Asp Leu Leu Lys Val Ile Thr Lys Pro
260 265 270
Phe Thr Lys Leu Ile Val Gln Leu Asp Lys Lys Val Ile Ser Gln
275 280 285
Ile Ala Met Asn Asp Glu Lys Ala Lys Asn Lys Ser Leu Val Lys
290 295 300
Ile Trp Cys Lys Thr Phe Thr Asn Lys Thr Gln Ile Asn Val Thr
305 310 315
Val Pro Ser Thr Ala Asn Cys Thr Ser Pro Ser Leu Cys Trp Thr
320 325 330
Asp Gly Ile Gln Asn Trp Thr Met Lys Asn Val Thr Tyr Lys Glu
335 340 345
Asn Ile Ala Lys Cys Gln His Ile Phe Val Asn Phe His Leu Pro
350 355 360
Asp Leu Ala Val Gly Thr Ile Leu Leu Ile Leu Ser Leu Leu Val
365 370 375
Leu Cys Gly Cys Leu Ile Met Ile Val Lys Ile Leu Gly Ser Val
380 385 390
Leu Lys Gly Gln Val Ala Thr Val Ile Lys Lys Thr Ile Asn Thr
395 400 405
Asp Phe Pro Phe Pro Phe Ala Trp Leu Thr Gly Tyr Leu Ala Ile
410 415 420
Leu Val Gly Ala Gly Met Thr Phe Ile Val Gln Ser Ser Ser Val
425 430 435
Phe Thr Ser Ala Leu Thr Pro Leu Ile Gly Ile Gly Val Ile Thr
440 445 450
Ile Glu Arg Ala Tyr Pro Leu Thr Leu Gly Ser Asn Ile Gly Thr
455 460 465
Thr Thr Thr Ala Ile Leu Ala Ala Leu Ala Ser Pro Gly Asn Ala
470 475 480
Leu Arg Ser Ser Leu Gln Ile Ala Leu Cys His Phe Phe Phe Asn
485 490 495
Ile Ser Gly Ile Leu Leu Trp Tyr Pro Ile Pro Phe Thr Arg Leu
500 505 510
Pro Ile Arg Met Ala Lys Gly Leu Gly Asn Ile Ser Ala Lys Tyr
515 520 525
Arg Trp Phe Ala Val Phe Tyr Leu Ile Ile Phe Phe Phe Leu Ile
530 535 540
Pro Leu Thr Val Phe Gly Leu Ser Leu Ala Gly Trp Arg Val Leu
545 550 555
Val Gly Val Gly Val Pro Val Val Phe Ile Ile Ile Leu Val Leu
560 565 570
Cys Leu Arg Leu Leu Gln Ser Arg Cys Pro Arg Val Leu Pro Lys
575 580 585
Lys Leu Gln Asn Trp Asn Phe Leu Pro Leu Trp Met Arg Ser Leu
590 595 600
Lys Pro Trp Asp Ala Val Val Ser Lys Phe Thr Gly Cys Phe Gln
605 610 615
Met Arg Cys Cys Cys Cys Cys Arg Val Cys Cys Arg Ala Cys Cys
620 625 630
Leu Leu Cys Gly Cys Pro Lys Cys Cys Arg Cys Ser Lys Cys Cys
635 640 645
Glu Asp Leu Glu Glu Ala Gln Glu Gly Gln Asp Val Pro Val Lys
650 655 660
Ala Pro Glu Thr Phe Asp Asn Ile Thr Ile Ser Arg Glu Ala Gln
665 670 675
Gly Glu Val Pro Ala Ser Asp Ser Lys Thr Glu Cys Thr Ala Leu
680 685 690
<210> 3
<211> 91
<212> PRT
<213> Homo sapiens
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Gly Lys Ala Pro Lys Leu Leu
20 25 30
Ile Tyr Ala Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe
35 40 45
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
50 55 60
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn
65 70 75
Ser Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
80 85 90
Arg
<210> 4
<211> 113
<212> PRT
<213> Homo sapiens
<400> 4
Asp Ile Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu
1 5 10 15
Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Glu Thr Leu Val
20 25 30
His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Leu
35 40 45
Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Lys Ile Ser Arg Leu Glu Ala Glu Asp Leu Gly Val
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser His Asn Pro Leu Thr Phe Gly Ala
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 5
<211> 113
<212> PRT
<213> Homo sapiens
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val
20 25 30
His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser His Asn Pro Leu Thr Phe Gly Gln
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 6
<211> 113
<212> PRT
<213> Homo sapiens
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val
20 25 30
His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser Phe Asn Pro Leu Thr Phe Gly Gln
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 7
<211> 113
<212> PRT
<213> Homo sapiens
<400> 7
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val
20 25 30
His Ser Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser Phe Asn Pro Leu Thr Phe Gly Gln
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 8
<211> 113
<212> PRT
<213> Homo sapiens
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val
20 25 30
His Ser Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser Phe Asn Pro Leu Thr Phe Gly Gln
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 9
<211> 113
<212> PRT
<213> Homo sapiens
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val
20 25 30
His Ser Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser Phe Asn Pro Leu Thr Phe Gly Gln
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 10
<211> 113
<212> PRT
<213> Homo sapiens
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val
20 25 30
His Trp Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser Phe Asn Pro Leu Thr Phe Gly Gln
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 11
<211> 113
<212> PRT
<213> Homo sapiens
<400> 11
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gly Thr Leu Arg
20 25 30
His Trp Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser Phe Asn Pro Leu Thr Phe Gly Gln
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 12
<211> 113
<212> PRT
<213> Homo sapiens
<400> 12
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
35 40 45
Glu Trp Val Ser Val Ile Ser Gly Asp Gly Gly Ser Thr Tyr Tyr
50 55 60
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
80 85 90
Thr Ala Val Tyr Tyr Cys Ala Arg Gly Phe Asp Tyr Trp Gly Gln
95 100 105
Gly Thr Leu Val Thr Val Ser Ser
110
<210> 13
<211> 120
<212> PRT
<213> Homo sapiens
<400> 13
Glu Val Met Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly
1 5 10 15
Gly Ser Leu Lys Val Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser
20 25 30
Asp Phe Ala Met Ser Trp Val Arg Arg Thr Pro Asp Lys Arg Leu
35 40 45
Glu Trp Val Ala Thr Ile Gly Arg Val Ala Ser His Thr Tyr Tyr
50 55 60
Pro Asp Ser Met Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ser Asp Asp
80 85 90
Thr Ala Ile Tyr Tyr Cys Val Arg His Arg Gly Phe Asp Val Gly
95 100 105
His Phe Asp Phe Trp Gly Gln Gly Thr Leu Leu Thr Val Ser Ala
110 115 120
<210> 14
<211> 120
<212> PRT
<213> Homo sapiens
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser
20 25 30
Asp Phe Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
35 40 45
Glu Trp Val Ala Thr Ile Gly Arg Val Ala Ser His Thr Tyr Tyr
50 55 60
Pro Asp Ser Met Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
80 85 90
Thr Ala Val Tyr Tyr Cys Val Arg His Arg Gly Phe Asp Val Gly
95 100 105
His Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
110 115 120
<210> 15
<211> 120
<212> PRT
<213> Homo sapiens
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser
20 25 30
Asp Phe Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
35 40 45
Glu Trp Val Ala Thr Ile Gly Arg Val Ala Ser His Thr Tyr Tyr
50 55 60
Pro Asp Ser Met Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
80 85 90
Thr Ala Val Tyr Tyr Cys Val Arg His Arg Gly Phe Asp Val Gly
95 100 105
His Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
110 115 120
<210> 16
<211> 120
<212> PRT
<213> Homo sapiens
<400> 16
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser
20 25 30
Asp Phe Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
35 40 45
Glu Trp Val Ala Thr Ile Gly Arg Val Ala Ser His Thr Tyr Tyr
50 55 60
Pro Asp Ser Met Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
80 85 90
Thr Ala Val Tyr Tyr Cys Val Arg His Arg Gly Phe Asp Val Gly
95 100 105
His Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
110 115 120
<210> 17
<211> 120
<212> PRT
<213> Homo sapiens
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser
20 25 30
Asp Phe Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
35 40 45
Glu Trp Val Ala Thr Ile Gly Arg Val Ser Phe His Thr Tyr Tyr
50 55 60
Pro Val Ser Met Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
80 85 90
Thr Ala Val Tyr Tyr Cys Ala Arg His Arg Gly Phe Asp Val Gly
95 100 105
His Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
110 115 120
<210> 18
<211> 120
<212> PRT
<213> Homo sapiens
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser
20 25 30
Asp Phe Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
35 40 45
Glu Trp Val Ala Thr Ile Gly Arg Val Ala Phe His Thr Tyr Tyr
50 55 60
Pro Asp Ser Met Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
80 85 90
Thr Ala Val Tyr Tyr Cys Ala Arg His Arg Gly Phe Asp Val Gly
95 100 105
His Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
110 115 120
<210> 19
<211> 120
<212> PRT
<213> Homo sapiens
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser
20 25 30
Asp Phe Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
35 40 45
Glu Trp Val Ala Thr Ile Gly Arg Val Ala Ser His Thr Tyr Tyr
50 55 60
Pro Asp Ser Met Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
80 85 90
Thr Ala Val Tyr Tyr Cys Ala Arg His Arg Gly Phe Asp Val Gly
95 100 105
His Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
110 115 120
<210> 20
<211> 95
<212> PRT
<213> Homo sapiens
<400> 20
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Ile Gly Arg Val Ala
20 25 30
Ser His Thr Tyr Tyr Pro Asp Ser Met Lys Gly Arg Phe Thr Ile
35 40 45
Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser
50 55 60
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg His Arg
65 70 75
Gly Phe Asp Val Gly His Phe Asp Phe Trp Gly Gln Gly Thr Leu
80 85 90
Val Thr Val Ser Ser
95
<210> 21
<211> 11
<212> PRT
<213> Homo sapiens
<400> 21
Arg Ala Ser Gln Ser Ile Ser Asn Tyr Leu Ala
5 10
<210> 22
<211> 16
<212> PRT
<213> Homo sapiens
<400> 22
Arg Ser Ser Glu Thr Leu Val His Ser Asn Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 23
<211> 16
<212> PRT
<213> Homo sapiens
<400> 23
Arg Ser Ser Glu Thr Leu Val His Ser Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 24
<211> 16
<212> PRT
<213> Homo sapiens
<400> 24
Arg Ser Ser Glu Thr Leu Val His Trp Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 25
<211> 16
<212> PRT
<213> Homo sapiens
<400> 25
Arg Ser Ser Gly Thr Leu Arg His Trp Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 26
<211> 16
<212> PRT
<213> Homo sapiens
<400> 26
Arg Ser Ser Gly Thr Leu Leu His Asn Asn Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 27
<211> 16
<212> PRT
<213> Homo sapiens
<400> 27
Arg Ser Ser Glu Thr Leu Val His Arg Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 28
<211> 16
<212> PRT
<213> Homo sapiens
<400> 28
Arg Ser Ser Glu Thr Leu Val His Thr Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 29
<211> 16
<212> PRT
<213> Homo sapiens
<400> 29
Arg Ser Ser Glu Thr Leu Val His Gly Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 30
<211> 16
<212> PRT
<213> Homo sapiens
<400> 30
Arg Ser Ser Glu Thr Leu Val His Ala Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 31
<211> 16
<212> PRT
<213> Homo sapiens
<400> 31
Arg Ser Ser Glu Thr Leu Val His Asn Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 32
<211> 16
<212> PRT
<213> Homo sapiens
<400> 32
Arg Ser Ser Glu Thr Leu Val His Lys Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 33
<211> 16
<212> PRT
<213> Homo sapiens
<400> 33
Arg Ser Ser Arg Thr Leu Glu His Ala Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 34
<211> 16
<212> PRT
<213> Homo sapiens
<400> 34
Arg Ser Ser Gln Thr Leu Gln His Trp Ser Gly Asn Thr Tyr Leu
1 5 10 15
Glu
<210> 35
<211> 7
<212> PRT
<213> Homo sapiens
<400> 35
Ala Ala Ser Ser Leu Glu Ser
5
<210> 36
<211> 7
<212> PRT
<213> Homo sapiens
<400> 36
Arg Val Ser Asn Arg Phe Ser
5
<210> 37
<211> 7
<212> PRT
<213> Homo sapiens
<400> 37
Arg Val Ser Gln Arg Phe Thr
5
<210> 38
<211> 7
<212> PRT
<213> Homo sapiens
<400> 38
Arg Val Ser Asn Arg Phe Arg
5
<210> 39
<211> 9
<212> PRT
<213> Homo sapiens
<400> 39
Gln Gln Tyr Asn Ser Leu Pro Trp Thr
5
<210> 40
<211> 9
<212> PRT
<213> Homo sapiens
<400> 40
Phe Gln Gly Ser His Asn Pro Leu Thr
5
<210> 41
<211> 9
<212> PRT
<213> Homo sapiens
<400> 41
Phe Gln Gly Ser Phe Asn Pro Leu Thr
5
<210> 42
<211> 10
<212> PRT
<213> Homo sapiens
<400> 42
Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser
5 10
<210> 43
<211> 10
<212> PRT
<213> Homo sapiens
<400> 43
Gly Phe Ser Phe Ser Asp Phe Ala Met Ser
5 10
<210> 44
<211> 10
<212> PRT
<213> Homo sapiens
<400> 44
Ser Ser Ser Phe Ser Asp Phe Ala Leu Ser
5 10
<210> 45
<211> 10
<212> PRT
<213> Homo sapiens
<400> 45
Gly Phe Asn Phe Arg Gly Phe Ala Met Ser
5 10
<210> 46
<211> 18
<212> PRT
<213> Homo sapiens
<400> 46
Ser Val Ile Ser Gly Asp Gly Gly Ser Thr Tyr Tyr Ala Asp Ser
1 5 10 15
Val Lys Gly
<210> 47
<211> 18
<212> PRT
<213> Homo sapiens
<400> 47
Ala Thr Ile Gly Arg Val Ala Ser His Thr Tyr Tyr Pro Asp Ser
1 5 10 15
Met Lys Gly
<210> 48
<211> 18
<212> PRT
<213> Homo sapiens
<400> 48
Ala Thr Ile Gly Arg Val Ser Phe His Thr Tyr Tyr Pro Val Ser
1 5 10 15
Met Lys Gly
<210> 49
<211> 18
<212> PRT
<213> Homo sapiens
<400> 49
Ala Thr Ile Gly Arg Val Ala Phe His Thr Tyr Tyr Pro Asp Ser
1 5 10 15
Met Lys Gly
<210> 50
<211> 18
<212> PRT
<213> Homo sapiens
<400> 50
Ser Thr Ile Gly Arg Val Ala Ser His Thr Tyr Tyr Pro Val Gly
1 5 10 15
Met Thr Gly
<210> 51
<211> 18
<212> PRT
<213> Homo sapiens
<400> 51
Ala Thr Ile Gly Arg Val Trp Tyr His Arg Tyr Tyr Pro Asp Ser
1 5 10 15
Met Val Arg
<210> 52
<211> 18
<212> PRT
<213> Homo sapiens
<400> 52
Gly Thr Ile Gly Trp Met Val Ser His Thr Tyr Tyr Pro Gln Arg
1 5 10 15
Leu Asn Gly
<210> 53
<211> 18
<212> PRT
<213> Homo sapiens
<400> 53
Ala Thr Ile Gly Arg Val Thr Ser Arg Thr Tyr Tyr Pro Asp Ser
1 5 10 15
Met Lys Gly
<210> 54
<211> 18
<212> PRT
<213> Homo sapiens
<400> 54
Ala Thr Ile Gly Arg Val Tyr Arg His Thr Tyr Tyr Pro Thr Ser
1 5 10 15
Met Lys Gly
<210> 55
<211> 18
<212> PRT
<213> Homo sapiens
<400> 55
Ala Thr Ile Gly Arg Val Pro Leu His Thr Tyr Tyr Pro Arg Ser
1 5 10 15
Met Lys Gly
<210> 56
<211> 18
<212> PRT
<213> Homo sapiens
<400> 56
Ala Thr Ile Gly Arg Val Pro Leu His Thr Tyr Tyr Pro Gly Ser
1 5 10 15
Met Lys Gly
<210> 57
<211> 18
<212> PRT
<213> Homo sapiens
<400> 57
Ala Thr Ile Gly Arg Val Pro Leu His Thr Tyr Tyr Pro Ala Ser
1 5 10 15
Met Lys Gly
<210> 58
<211> 18
<212> PRT
<213> Homo sapiens
<400> 58
Ala Thr Ile Gly Arg Val Glu Gln His Thr Tyr Tyr Pro Gln Ser
1 5 10 15
Met Lys Gly
<210> 59
<211> 18
<212> PRT
<213> Homo sapiens
<400> 59
Ala Thr Ile Gly Arg Val Ala Ser His Thr Tyr Tyr Pro Gly Ser
1 5 10 15
Met Lys Gly
<210> 60
<211> 18
<212> PRT
<213> Homo sapiens
<400> 60
Ala Thr Ile Gly Arg Val Ala Leu His Thr Tyr Tyr Pro Gln Ser
1 5 10 15
Met Lys Gly
<210> 61
<211> 6
<212> PRT
<213> Homo sapiens
<400> 61
Ala Arg Gly Phe Asp Tyr
5
<210> 62
<211> 13
<212> PRT
<213> Homo sapiens
<400> 62
Val Arg His Arg Gly Phe Asp Val Gly His Phe Asp Phe
5 10
<210> 63
<211> 13
<212> PRT
<213> Homo sapiens
<400> 63
Ala Arg His Arg Gly Phe Asp Val Gly His Phe Val Phe
5 10
<210> 64
<211> 13
<212> PRT
<213> Homo sapiens
<400> 64
Ala Arg His Arg Gly Trp Val Val Gly His Phe Asp Leu
5 10
<210> 65
<211> 13
<212> PRT
<213> Homo sapiens
<400> 65
Ala Arg His Arg Gly Phe Asp Val Gly His Phe Asp Phe
5 10
<210> 66
<211> 87
<212> PRT
<213> Homo sapiens
<400> 66
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr
20 25 30
Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Arg
35 40 45
Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr Met Glu
50 55 60
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
65 70 75
Arg Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
80 85
<210> 67
<211> 81
<212> PRT
<213> Homo sapiens
<400> 67
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Trp Val Arg Gln Ala
20 25 30
Pro Gly Gln Gly Leu Glu Trp Met Arg Val Thr Ile Thr Ala Asp
35 40 45
Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser
50 55 60
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Trp Gly Gln Gly Thr
65 70 75
Leu Val Thr Val Ser Ser
80
<210> 68
<211> 80
<212> PRT
<213> Homo sapiens
<400> 68
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Trp Val Arg Gln Ala
20 25 30
Pro Gly Gln Gly Leu Glu Trp Met Arg Val Thr Ile Thr Ala Asp
35 40 45
Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser
50 55 60
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Trp Gly Gln Gly Thr Leu
65 70 75
Val Thr Val Ser Ser
80
<210> 69
<211> 79
<212> PRT
<213> Homo sapiens
<400> 69
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Trp Val Arg Gln Ala
20 25 30
Pro Gly Gln Gly Leu Glu Trp Met Arg Val Thr Ile Thr Ala Asp
35 40 45
Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser
50 55 60
Glu Asp Thr Ala Val Tyr Tyr Cys Trp Gly Gln Gly Thr Leu Val
65 70 75
Thr Val Ser Ser
<210> 70
<211> 87
<212> PRT
<213> Homo sapiens
<400> 70
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser
20 25 30
Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Arg
35 40 45
Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys
50 55 60
Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
65 70 75
Arg Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
80 85
<210> 71
<211> 81
<212> PRT
<213> Homo sapiens
<400> 71
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Thr Leu Ser Leu Thr Cys Thr Val Ser Trp Ile Arg Gln Pro
20 25 30
Pro Gly Lys Gly Leu Glu Trp Ile Arg Val Thr Ile Ser Val Asp
35 40 45
Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala
50 55 60
Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Trp Gly Gln Gly Thr
65 70 75
Leu Val Thr Val Ser Ser
80
<210> 72
<211> 80
<212> PRT
<213> Homo sapiens
<400> 72
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Thr Leu Ser Leu Thr Cys Thr Val Ser Trp Ile Arg Gln Pro
20 25 30
Pro Gly Lys Gly Leu Glu Trp Ile Arg Val Thr Ile Ser Val Asp
35 40 45
Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala
50 55 60
Ala Asp Thr Ala Val Tyr Tyr Cys Ala Trp Gly Gln Gly Thr Leu
65 70 75
Val Thr Val Ser Ser
80
<210> 73
<211> 79
<212> PRT
<213> Homo sapiens
<400> 73
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Thr Leu Ser Leu Thr Cys Thr Val Ser Trp Ile Arg Gln Pro
20 25 30
Pro Gly Lys Gly Leu Glu Trp Ile Arg Val Thr Ile Ser Val Asp
35 40 45
Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala
50 55 60
Ala Asp Thr Ala Val Tyr Tyr Cys Trp Gly Gln Gly Thr Leu Val
65 70 75
Thr Val Ser Ser
<210> 74
<211> 79
<212> PRT
<213> Homo sapiens
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Trp Val Arg Gln Ala
20 25 30
Pro Gly Lys Gly Leu Glu Trp Val Arg Phe Thr Ile Ser Arg Asp
35 40 45
Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala
50 55 60
Glu Asp Thr Ala Val Tyr Tyr Cys Trp Gly Gln Gly Thr Leu Val
65 70 75
Thr Val Ser Ser
<210> 75
<211> 79
<212> PRT
<213> Homo sapiens
<400> 75
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Trp Val Arg Gln Ala
20 25 30
Pro Gly Lys Gly Leu Glu Trp Val Arg Phe Thr Ile Ser Arg Asp
35 40 45
Asn Ser Lys Asn Thr Phe Tyr Leu Gln Met Asn Ser Leu Arg Ala
50 55 60
Glu Asp Thr Ala Val Tyr Tyr Cys Trp Gly Gln Gly Thr Leu Val
65 70 75
Thr Val Ser Ser
<210> 76
<211> 80
<212> PRT
<213> Homo sapiens
<400> 76
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Trp Tyr Gln Gln Lys Pro Gly
20 25 30
Lys Ala Pro Lys Leu Leu Ile Gly Val Pro Ser Arg Phe Ser Gly
35 40 45
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
50 55 60
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gly Gln Gly Thr Lys
65 70 75
Val Glu Ile Lys Arg
80
<210> 77
<211> 80
<212> PRT
<213> Homo sapiens
<400> 77
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro
1 5 10 15
Gly Glu Pro Ala Ser Ile Ser Cys Trp Tyr Leu Gln Lys Pro Gly
20 25 30
Gln Ser Pro Gln Leu Leu Ile Tyr Gly Val Pro Asp Arg Phe Ser
35 40 45
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val
50 55 60
Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gly Gln Gly Thr
65 70 75
Lys Val Glu Ile Lys
80
<210> 78
<211> 80
<212> PRT
<213> Homo sapiens
<400> 78
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro
1 5 10 15
Gly Glu Arg Ala Thr Leu Ser Cys Trp Tyr Gln Gln Lys Pro Gly
20 25 30
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ile Pro Asp Arg Phe Ser
35 40 45
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu
50 55 60
Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Phe Gly Gln Gly Thr
65 70 75
Lys Val Glu Ile Lys
80
<210> 79
<211> 80
<212> PRT
<213> Homo sapiens
<400> 79
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Glu Arg Ala Thr Ile Asn Cys Trp Tyr Gln Gln Lys Pro Gly
20 25 30
Gln Pro Pro Lys Leu Leu Ile Tyr Gly Val Pro Asp Arg Phe Ser
35 40 45
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
50 55 60
Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Phe Gly Gln Gly Thr
65 70 75
Lys Val Glu Ile Lys
80
<210> 80
<211> 449
<212> PRT
<213> Homo sapiens
<400> 80
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
1 5 10 15
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser
20 25 30
Asp Phe Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
35 40 45
Glu Trp Val Ala Thr Ile Gly Arg Val Ala Phe His Thr Tyr Tyr
50 55 60
Pro Asp Ser Met Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
65 70 75
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
80 85 90
Thr Ala Val Tyr Tyr Cys Ala Arg His Arg Gly Phe Asp Val Gly
95 100 105
His Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
110 115 120
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
125 130 135
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
140 145 150
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
155 160 165
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
170 175 180
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
185 190 195
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
200 205 210
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
215 220 225
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
320 325 330
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
335 340 345
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
350 355 360
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
365 370 375
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
380 385 390
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
395 400 405
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
410 415 420
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
425 430 435
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
440 445
<210> 81
<211> 219
<212> PRT
<213> Homo sapiens
<400> 81
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
1 5 10 15
Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val
20 25 30
His Ser Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro
35 40 45
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe
50 55 60
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
80 85 90
Tyr Tyr Cys Phe Gln Gly Ser Phe Asn Pro Leu Thr Phe Gly Gln
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val
110 115 120
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
125 130 135
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
140 145 150
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
155 160 165
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
170 175 180
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
185 190 195
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
200 205 210
Thr Lys Ser Phe Asn Arg Gly Glu Cys
215
Реферат
Изобретение относится к области биохимии, в частности к выделенному антителу, которое специфически связывается с TAT211, или его функциональному фрагменту. Также раскрыты конъюгат, содержащий указанное антитело и который специфически связывает TAT211, нуклеиновая кислота, кодирующая заявленное антитело, и клетка, которая продуцирует заявленное антитело. Раскрыты способ идентификации антитела, способ ингибирования роста клетки, которая экспрессирует полипептид TAT211, способ терапевтического лечения млекопитающего, имеющего раковую опухоль, содержащую клетки, которые экспрессируют полипептид TAT211, способ определения присутствия TAT211 белка в образце и способ диагностики присутствия опухоли у млекопитающего. Изобретение обладает способностью специфически связываться с TAT211, что позволяет эффективно лечить заболевания, ассоциированные с экспрессией полипептида TAT211. 15 н. и 22 з.п. ф-лы, 19 ил., 1 табл., 16 пр.
Формула
a. CDR-L1 последовательность SEQ ID NO: 23;
b. CDR-L2 последовательность SEQ ID NO: 36;
c. CDR-L3 последовательность SEQ ID NO: 41;
d. CDR-H1 последовательность SEQ ID NO: 43;
e. CDR-H2 последовательность SEQ ID NO: 49; и
f. CDR-H3 последовательность SEQ ID NO: 65.

Комментарии