Комбинированная терапия на основе афукозилированного антитела к cd20 в сочетании с конъюгатом антитело к cd79b-лекарственное средство - RU2670971C9
Код документа: RU2670971C9
Чертежи










































































































Описание
В настоящей заявке испрашивается приоритет по дате подачи предварительной заявки на патент США №61/818811, зарегистрированной 2 мая 2013 г., полное содержание которой включено в настоящее описание в качестве ссылки.
В настоящем изобретении предложена комбинированная терапия на основе афукозилированного антитела к CD20 в сочетании с конъюгатом антитело к CD79b-лекарственное средство для лечения рака.
Предпосылки создания изобретения
Афукозилированные антитела
Опосредованные клеткой эффекторные функции моноклональных антител можно усиливать путем конструирования их олигосахаридного компонента согласно методу, описанному у
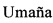


Опубликованы исследования, в которых обсуждается активность афукозилированных и фукозилированных антител, включая антитела к CD20 (см., например, Iida S. и др., Clin. Cancer Res. 12, 2006, сс. 2879-2887; Natsume А. и др., J. Immunol. Methods 306, 2005, сс. 93-103; Satoh М. и др., Expert Opin. Biol. Ther. 6, 2006, cc. 1161-1173; Kanda Y., и др., Biotechnol. Bioeng. 94, 2006, cc. 680-688; Davies J. и др., Biotechnol. Bioeng. 74, 2001, cc. 288-294).
CD20 и антитела к CD20
Молекула CD20 (которую называют также эволюционно консервативным дифференцировочным антигеном человеческих В-лимфоцитов или Вр35) представляет собой широко известный гидрофобный трансмембранный белок, локализованный на пре-В и зрелых В-лимфоцитах (Valentine М.А. и др., J. Biol. Chem. 264, 1989, сс. 11282-11287; и Einfeld D.A. и др., EMBO J. 7, 1988, сс. 711-717; Tedder T.F. и др., Proc. Natl. Acad. Sci. U.S.A. 85, 1988, cc. 208-212; Stamenkovic I. и др., J. Exp. Med. 167, 1988, cc. 1975-1980; Tedder T.F. и др., J. Immunol. 142, 1989, cc. 2560-2568). При неходжкинских лимфомах (HXJI) CD20 экспрессируется на поверхности более 90% В-клеток (Anderson K.С. и др., Blood 63, 1984, сс. 1424-1433), но он не выявлен на гематопоэтических стволовых клетках, про-В-клетках, здоровых плазматических клетках или в других здоровых тканях (Tedder T.F. и др., J. Immunol. 135, 1985, сс. 973-979).
Существуют два различных типа антител к CD20, которые существенно отличаются механизмом связывания CD20 и биологической активностью (Cragg M.S. и др., Blood 103, 2004, сс. 2738-2743; и Cragg M.S. и др., Blood, 101, 2003, сс. 1045-1052). Антитела типа I, такие, например, как ритуксимаб (не афукозилированное антитело с содержанием фукозы 85% или более), обладают сильной опосредуемой комплементом цитотоксичностью.
Антитела типа II, такие, например, как тозитумомаб (B1), 11В8, АТ80 или гуманизированные антитела B-Ly1, эффективно инициируют гибель клеток-мишеней посредством независимого от каспазы апоптоза при сопутствующей обработке фосфатидилсерином.
Конъюгаты антитело к CD79b-лекарственное средство
CD79 представляет собой сигнальный компонент В-клеточного рецептора, который состоит из ковалентного гетеродимера, содержащего CD79a (Igα, mb-1) и CD79b (Igβ, B29). CD79a и CD79b каждый содержат внеклеточный иммуноглобулиновый (Ig) домен, трансмембранный домен и внутриклеточный сигнальный домен, домен тирозинкиназного активационного мотива иммунорецептора (ITAM). CD79 экспрессируется на В-клетках и клетках неходжкинской лимфомы (НХЛ) (Cabezudo и др., Haematologica, 84, 1999, сс. 413-418; D'Arena и др., Am. J. Hematol., 64, 2000, сс. 275-281; Olejniczak и др., Immunol. Invest., 35, 2006, сс. 93-114). CD79a и CD79b, и slg, все необходимы для экспрессии CD79 на поверхности (Matsuuchi и др., Curr. Opin. Immunol., 13(3), 2001, сс. 270-277). Средний уровень экспрессии CD79b на поверхности клеток НХЛ сходен с его уровнем на здоровых В-клетках, но характеризуется более значительным разбросом (Matsuuchi и др., Curr. Opin. Immunol., 13(3), 2001, сс. 270-287).
В тех случаях, когда имеет место экспрессия CD79b, желательно получать терапевтические антитела к антигену CD79b, которые характеризуются минимальной антигенностью или ее отсутствием при введении пациентам, прежде всего при длительном лечении. Настоящее изобретение позволяет решить эту и другие проблемы. В настоящем изобретении предложены антитела к CD79b, которые позволяют преодолеть ограничения, присущие существующим в настоящее время терапевтическим композициям, а также они обладают дополнительными преимуществами, которые должны стать очевидными после ознакомления с представленным ниже подробным описанием изобретения.
Применение конъюгатов антитело-лекарственное средство (ADC), т.е. иммуноконъюгатов, для местного введения цитотоксических или цитостатических агентов, т.е. лекарственных средств, предназначенных для уничтожения или ингибирования опухолевых клеток при лечении рака (Lambert J. Curr. Opinion in Pharmacology 5, 2005, cc. 543-549; Wu и др., Nature Biotechnology 23(9), 2005, cc. 1137-1146; Payne G., Cancer Cell 3, 2003, cc. 207-212; Syrigos и Epenetos, Anticancer Research 19, 1999, cc. 605-614; Niculescu-Duvaz и Springer, Adv. Drug Del. Rev. 26, 1997, cc. 151-172; US №4975278), позволяет осуществлять направленное введение фрагмента, представляющего собой лекарственное средство, в опухоли и накапливать его внутри клеток, в то время как системное введение таких лекарственных агентов в неконъюгированном виде может приводить к неприемлемым уровням токсичности в отношении здоровых клеток, а не только к токсичности в отношении опухолевых клеток, которые требуется элиминировать (Baldwin и др., Lancet, 15 марта 1986, сс. 603-605; Thorpe, «Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review» в Monoclonal Antibodies '84: Biological And Clinical Applications, под ред. Pinchera и др., 1985, cc. 475-506). Усилия, направленные на повышение терапевтического индекса, т.е. максимальной эффективности при минимальной токсичности, были сфокусированы на использовании селективности поликлональных (Rowland и др., Cancer Immunol. Immunother., 21, 1986, сс. 183-187) и моноклональных антител (МАт), а также характеристик связывания лекарственного средства и высвобождения лекарственного средства (Lambert J., Curr. Opinion in Pharmacology 5, 2005, cc. 543-549). В качестве фрагментов, представляющих собой лекарственные средства, применяемых в конъюгатах антитело-лекарственное средство, использовали бактериальные белковые токсины, такие как дифтерийный токсин, растительные белковые токсины, такие как рицин, низкомолекулярные токсины, такие как ауристатины, гелданамицин (Mandler и др., J. of the Nat. Cancer Inst. 92(19), 2000, cc. 1573-1581; Mandler и др., Bioorganic & Med. Chem. Letters 10, 2000, cc. 1025-1028; Mandler и др. Bioconjugate Chem. 13, 2002, cc. 786-791), майтанзиноиды (ЕР 1391213; Liu и др., Proc. Natl. Acad. Sci. USA 93, 1996, cc. 8618-8623), калихеамицин (Lode и др. Cancer Res. 58, 1998, c. 2928; Hinman и др. Cancer Res. 53, 1993, cc. 3336-3342), дауномицин, доксорубицин, метотрексат и виндесин (Rowland и др., 1986, выше). Фрагменты, представляющие собой лекарственные средства, могут обладать механизмами цитотоксической и цитостатической активности, включая связывание тубулина, связывание ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства имеют тенденцию инактивироваться или обладать пониженной активностью при конъюгировании с крупными антителами или белковыми лигандами рецепторов.
Ауристатиновые пептиды, ауристатин Е (АЕ) и монометилауристатин (ММАЕ), синтетические аналоги доластатина (WO 02/088172), конъюгировали в качестве фрагментов, представляющих собой лекарственные средства, с I) химерными моноклональными антителами cBR96 (специфическими в отношении антигена Y Льюиса на карциномах); II) с АС 10, специфическим в отношении CD30 на гематологических злокачественных новообразованиях (Klussman и др., Bioconjugate Chemistry 15(4), 2004, сс. 765-773; Doronina и др., Nature Biotechnology 21(7), 2003, сс. 778-784; «Monomethylvaline Compounds Capable of Conjugation to Ligands»; Francisco и др., Blood 102(4), 2003, cc. 1458-1465; US №2004/0018194; (III) антителами к CD20, такими как ритуксан (WO 04/032828), для лечения экпрессирующих CD20 видов рака и иммунных нарушений; (IV) антителом к EphB2 2Н9 для лечения колоректального рака (Мао и др., Cancer Research 64(3), 2004, сс. 781-788); (V) антителом к Е-селектину (Bhaskar и др., Cancer Res. 63, 2003, сс. 6387-6394); (VI) трастузумабом (HERCEPTIN®, US 2005/0238649) и (VI) антителами к CD30 (WO 03/043583). Варианты ауристатина Е описаны в US №5767237 и US №6124431. Конъюгаты монометилауристатина Е с моноклональными антителами описаны у Senter и др., Proceedings of the American Association for Cancer Research, т. 45, номер реферата 623, презентация от 28 марта 2004 г. Аналоги ауристатина ММАЕ и MMAF конъюгировали с различными антителами (US №2005/0238649).
Обычные методы присоединения к антителу, т.е. сцепления с помощью ковалентных связей, фрагмента, представляющего собой лекарственное средство, как правило, приводят к получению гетерогенной смеси молекул, в которой фрагменты, представляющие собой лекарственное средство, присоединены к нескольким сайтам на антителе. Например, цитотоксические лекарственные средства, как правило, конъюгировали с антителами через остатки лизина, часто присутствующие в большом количестве на антителе, в результате чего получали гетерогенную смесь конъюгатов антитело-лекарственное средство. В зависимости от условий реакции гетерогенная смесь, как правило, содержит конъюгаты, в которых к антителу присоединено от 0 до примерно 8 или более фрагментов, представляющих собой лекарственное средство. Кроме того, каждая подгруппа конъюгатов с конкретным целочисленным соотношением присоединенных к антителу фрагментов, представляющих собой лекарственное средство, потенциально представляет собой гетерогенную смесь, в которой фрагмент, представляющий собой лекарственное средство, присоединен к различным сайтам на антителе. Аналитические и препаративные методы могут оказаться непригодными для разделения и характеризации видов молекул конъюгатов антитело-лекарственное средство в гетерогенной смеси, полученной в результате реакции конъюгации. Антитела представляют собой крупные, сложные и отличающиеся структурным разнообразием биомолекулы, которые часто имеют несколько реакционноспособных функциональных групп. Их реакционная способность в отношении линкерных реагентов и промежуточных продуктов типа лекарственное средство-линкер зависит от таких факторов, как значение рН, концентрация, концентрация солей и присутствие сорастворителей. Кроме того, многостадийный процесс конъюгации может оказаться невоспроизводимым вследствие трудностей, связанных с контролем условий реакции и характеризацией реактантов и промежуточных продуктов.
Цистеиновые тиолы являются реакционноспособными при нейтральном значении рН, в отличие от большинства аминов, которые являются протонированными и менее нуклеофильными при значениях рН, близких к 7. Поскольку свободные тиольные (RSH, сульфгидрил) группы являются сравнительно реакционноспособными, то белки, несущие остатки цистеина, часто находятся в окисленной форме в виде сцепленных дисульфидами олигомеров или имеют образующие внутренние мостики дисульфидные группы. Внеклеточные белки, как правило, не несут свободных тиолов (Garman, Non-Radioactive Labelling: A Practical Approach, изд-во Academic Press, London, 1997, c. 55). Цистеиновые тиольные группы антител, как правило, являются более реакционноспособными, т.е. более нуклеофильными, в отношении электрофильных реагентов для конъюгации, чем аминные или гидроксильные группы антитела. Цистеиновые остатки интродуцировали в белки с помощью методов генетической инженерии для обеспечения ковалентного присоединения к лигандам или для образования новых внутримолекулярных дисульфидных связей (Better и др., J. Biol. Chem. 13, 1994, сс. 9644-9650; Bernhard и др., Bioconjugate Chem. 5, 1994, сс. 126-132; Greenwood и др., Therapeutic Immunology 1, 1994, сс. 247-255; Tu и др., Proc. Natl. Acad. Sci USA 96, 1999, cc. 4862-4867; Kanno и др., J. of Biotechnology, 76, 2000, cc. 207-214; Chmura и др., Proc. Nat. Acad. Sci. USA 98(15), 2001, cc. 8480-8484; №US 6248564). Однако конструирование цистеиновых тиольных групп путем мутации различных аминокислотных остатков в белке на цистеиновые аминокислоты потенциально является проблематичным, прежде всего в случае наличия неспаренных (свободных Cys) остатков или остатков, сравнительно легко доступных для взаимодействия или окисления. В концентрированных растворах белка, присутствующих в периплазме Е. coli, супернатантах культуры или частично или полностью очищенном белке неспаренные остатки Cys на поверхности белка могут спариваться и окисляться с образованием межмолекулярных дисульфидов, и, следовательно, димеров или мультимеров белка. Образование дисульфидных димеров приводит к тому, что новые Cys становятся нереакционноспособными для конъюгации с лекарственным средством, лигандом или другой меткой. Кроме того, если в белке в результате окисления образуется внутримолекулярная дисульфидная связь между новым интродуцированным остатком Cys и существующим остатком Cys, то обе содержащие Cys тиольные группы оказываются непригодными для применения в активном сайте и участия во взаимодействиях. Кроме того, белок может становиться неактивным или утрачивать специфичность в результате неправильной укладки или утраты третичной структуры (Zhang и др., Anal. Biochem. 311, 2002, сс. 1-9).
Сконструированные с помощью цистеина антитела создавали в виде FAB-фрагментов антитела (raoFab) и экспрессировали в виде полноразмерных, моноклональных антител (тиоМАт) IgG-формата (Junutula J.R. и др., J Immunol Methods 332, 2008, сс. 41-52; US №2007/0092940, содержание указанных документов включено в настоящее описание в качестве ссылки). Антитела в виде THoFab и тиоМАт конъюгировали через линкеры на новых интродуцированных цистеиновых тиолах с помощью вступающих во взаимодействие с тиолом линкерных реагентов и вступающих во взаимодействие с лекарственным средством линкерных реагентов с получением конъюгатов антитело-лекарственное средство (тиoADC).
Все процитированные в настоящем описании ссылки, включая заявки на патент и публикации, полностью включены в настоящее описание в качестве ссылки.
Краткое изложение сущности изобретения
При создании изобретения было установлено, что комбинация афукозилированного антитела к CD20 с конъюгатом антитело к CD79b-лекарственное средство обладает значительно более сильными антипролиферативными действиями.
Одним из объектов изобретения является афукозилированное антитело к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для лечения рака в сочетании с конъюгатом антитело к CD79b-лекарственное средство.
Другим объектом изобретения является применение афукозилированного антитела к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для приготовления лекарственного средства для лечения рака в сочетании с конъюгатом антитело к CD79b-лекарственное средство.
Другим объектом изобретения является способ лечения пациента, страдающего раком, заключающийся в том, что вводят пациенту, который нуждается в таком лечении, афукозилированное антитело к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, в сочетании с конъюгатом антитело к CD79b-лекарственное средство.
В одном из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297. Согласно другому варианту осуществления изобретения содержание фукозы составляет 0% от общего количества олигосахаридов (сахаров) на Asn297.
Согласно одному из вариантов осуществления изобретения афукозилированное антитело к CD20 представляет собой антитело изотипа IgG1. В другом варианте осуществления изобретения указанный рак представляет рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз. В одном из вариантов осуществления изобретения указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1. В конкретном варианте осуществления изобретения антитело к CD20 представляет собой обинутузумаб (рекомендованное INN, WHO Drug Information, т. 26, №4, 2012, с. 453). В контексте настоящего описания обинутузумаб является синонимом GA101. Это название заменяет все предыдущие версии (например, т. 25, №1, 2011, сс. 75-76), и предыдущее название афутузумаб (рекомендованное INN, WHO Drug Information, т. 23, №2, 2009, с. 176; т. 22, №2, 2008, с. 124).
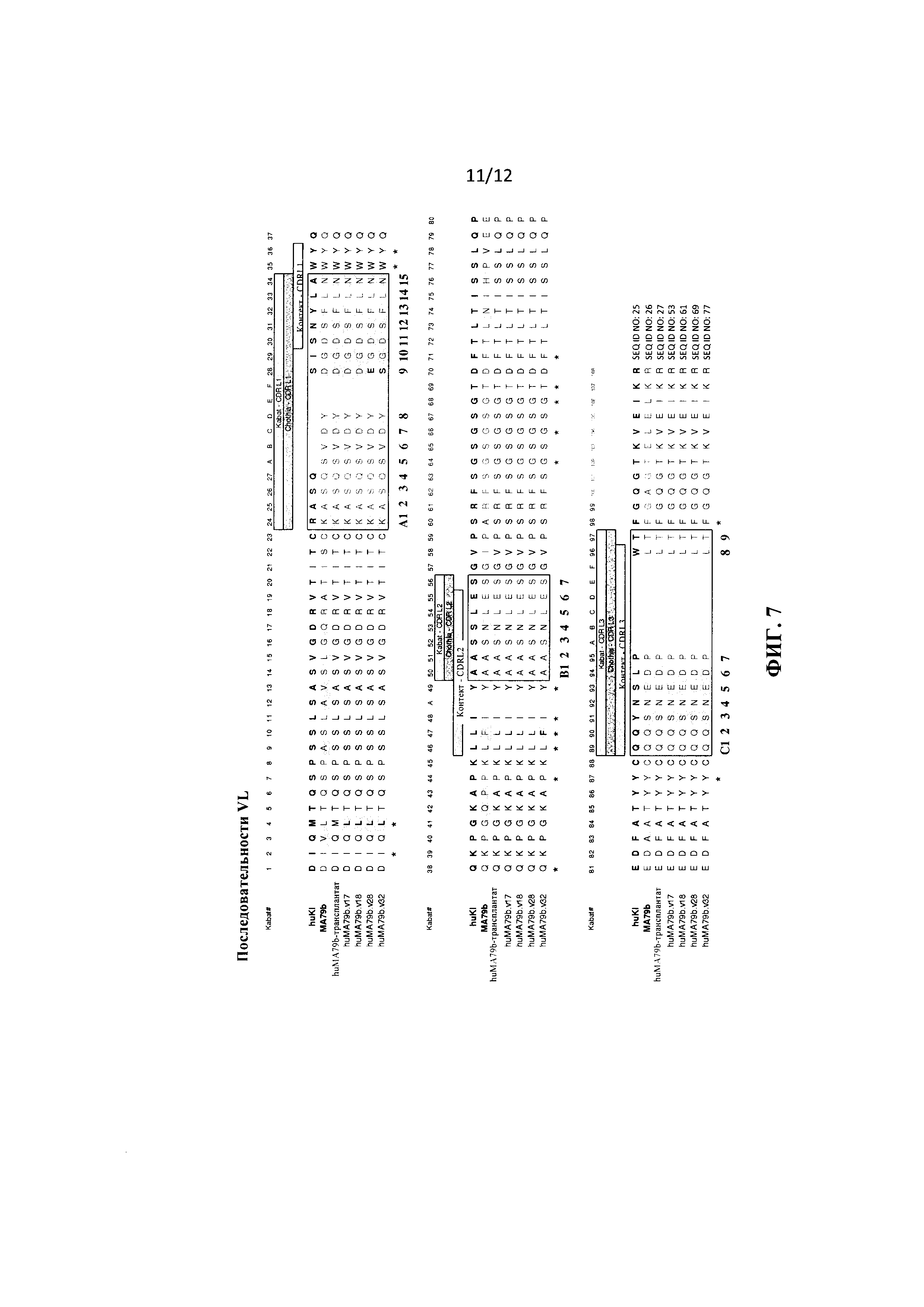
В одном из объектов изобретения антитело к CD79b в конъюгате антитело к CD79b-лекарственное средство, предлагаемом в изобретении, представляет собой гуманизированное антитело к CD79b, одновалентная аффинность которого (например, аффинность к CD79b антитела в виде Fab-фрагмента) или аффинность антитела к CD79b в его двухвалентной форме (например, аффинность к CD79b антитела в виде IgG-фрагмента) является практически такой же, более низкой или более высокой по сравнению с одновалентной аффинностью или аффинностью в двухвалентной форме соответственно мышиного антитела (например, аффинностью к CD79b мышиного антитела в виде Fab-фрагмента или в виде IgG-фрагмента) или химерного антитела (например, аффинностью к CD79b химерного антитела в виде Fab-фрагмента или в виде IgG-фрагмента), содержащего последовательности вариабельного домена легкой цепи и вариабельного домена тяжелой цепи, представленные на фиг. 7 (SEQ ID NO: 26) и фиг. 8 (SEQ ID NO: 29), состоящего или практически состоящего из указанных последовательностей.
В одном из объектов изобретения антитело к CD79b в конъюгате антитело к CD79b-лекарственное средство, предлагаемом в изобретении, представляет собой гуманизированное антитело к CD79b, где аффинность к CD79b антитела в его двухвалентной форме (например, аффинность к CD79b антитела в виде IgG) составляет 0,4, 0,2 или 0,5нМ.
В одном из объектов изобретения антитело к CD79b в конъюгате антитело к CD79b-лекарственное средство содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из группы, состоящей из:
(I) HVR-L1, который содержит последовательность А1-А15, в которой А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31);
(II) HVR-L2, который содержит последовательность В1-В7, в которой В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(III) HVR-L3, который содержит последовательность С1-С9, в которой С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(IV) HVR-H1, который содержит последовательность D1-D10, в которой D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(V) HVR-H2, который содержит последовательность Е1-Е18, в которой Е1-Е18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(VI) HVR-H3, который содержит последовательность F1-F10, в которой F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36).
В одном из объектов изобретения антитело, которое связывается с CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, содержит по меньшей мере один вариант HVR, где вариант последовательности HVR содержит модификацию по меньшей мере одного остатка в последовательности, представленной в SEQ ID NO: 31, 32, 33, 34, 35 или 36.
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен тяжелой цепи, содержащий последовательность(и) HVR1-HC, HVR2-HC и/или HVR3-HC, представленную(ые) на фиг. 3Б (SEQ ID NO: 50-52).
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен легкой цепи, содержащий последовательность(и) HVR1-LC, HVR2-LC и/или HVR3-LC, представленную(ые) на фиг. 3А (SEQ ID NO: 47-49).
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен тяжелой цепи, содержащий последовательность(и) HVR1-HC, HVR2-HC и/или HVR3-HC, представленную(ые) на фиг. 4Б (SEQ ID NO: 58-60).
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен легкой цепи, содержащий последовательность(и) HVR1-LC, HVR2-LC и/или HVR3-LC, представленную(ые) на фиг. 4А (SEQ ID NO: 55-57).
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен тяжелой цепи, содержащий последовательность(и) HVR1-HC, HVR2-HC и/или HVR3-HC, представленную(ые) на фиг. 5В (SEQ ID NO: 66-68).
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен легкой цепи, содержащий последовательность(и) HVR1-LC, HVR2-LC и/или HVR3-LC, представленную(ые) на фиг. 5А (SEQ ID NO: 63-65).
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен тяжелой цепи, содержащий последовательность(и) HVR1-HC, HVR2-HC и/или HVR3-HC, представленную(ые) на фиг. 6Б (SEQ ID NO: 74-76).
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен легкой цепи, содержащий последовательность(и) HVR1-LC, HVR2-LC и/или HVR3-LC, представленную(ые) на фиг. 6А (SEQ ID NO: 71-73).
Один из объектов изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен тяжелой цепи, выбранный из SEQ ID NO: 54, 62, 70 или 78. Другой объект изобретения относится к антителу, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит вариабельный домен легкой цепи, выбранный из SEQ ID NO: 53, 61, 69 или 77.
Один из объектов изобретения относится к сконструированному с помощью цистеина антителу к CD79b, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит одну или большее количество свободных цистеиновых аминокислот и последовательность, выбранную из SEQ ID NO: 83-130. Сконструированное с помощью цистеина антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, может связываться с полипептидом CD79b. Сконструированное с помощью цистеина антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, можно получать с помощью способа, заключающегося в том, что заменяют один или несколько аминокислотных остатков в родительском антителе к CD79b на цистеин.
Один из объектов изобретения относится к сконструированному с помощью цистеина антителу к CD79b, входящему в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, которое содержит одну или большее количество свободных цистеиновых аминокислот, где сконструированное с помощью цистеина антитело к CD79b связывается с полипептидом CD79b, и его получают с помощью способа, заключающегося в том, что заменяют один или несколько аминокислотных остатков в родительском антителе к CD79b на цистеин, где родительское антитело содержит по меньшей мере одну последовательность HVR, выбранную из:
(I) HVR-L1, который содержит последовательность А1-А15, где А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31) или KASQSVDYEGDSFLN (SEQ ID NO: 37);
(II) HVR-L2, который содержит последовательность В1-В7, где В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(III) HVR-L3, который содержит последовательность С1-С9, где С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(IV) HVR-H1, который содержит последовательность D1-D10, где D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(V) HVR-H2, который содержит последовательность Е 1-Е 18, где Е1-Е18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(VI) HVR-H3, который содержит последовательность F1-F10, где F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36) или TRRVPIRLDY (SEQ ID NO: 38).
В одном из объектов изобретения антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, содержит вариабельную последовательность легкой цепи, выбранную из группы, которая состоит из консенсусной последовательности человеческой легкой каппа-цепи I (обозначена как «huKI»; SEQ ID NO: 25), содержащей VL-FR1, VL-FR2, VL-FR3, VL-FR4 (SEQ ID NO: 39-42 соответственно), мышиного антитела к CD79b (обозначено как «MA79b»; SEQ ID NO: 26), «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 27), варианта 17 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v17»; SEQ ID NO: 53), варианта 18 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v18»; SEQ ID NO: 61), варианта 28 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v28»; SEQ ID NO: 69) и варианта 32 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v32»; SEQ ID NO: 77).
В одном из объектов изобретения антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, содержит вариабельную последовательность тяжелой цепи, выбранную из группы, которая состоит из: консенсусной последовательности человеческой тяжелой цепи подгруппы III (обозначена как «humIII»; SEQ ID NO: 28), содержащей VH-FR1, VH-FR2, VH-FR3 и VH-FR4 (SEQ ID NO: 43-46), мышиного антитела к CD79b (обозначено как «MA79b»; SEQ ID NO: 29), «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 30) (содержащего 71 А, 73Т и 78А), варианта 17 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v17»; SEQ ID NO: 54) (содержащего 71A, 73T и 78А), варианта 18 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v18»; SEQ ID NO: 62) (содержащего 71A, 73T и 78A), варианта 28 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v28»; SEQ ID NO: 70) (содержащего 71A, 73T и 78А) и варианта 32 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v32»; SEQ ID NO: 78) (содержащего 71A, 73T и 78А).
В одном из вариантов осуществления изобретения антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, содержит сконструированное с помощью цистеина антитело к CD79b, содержащее одну или большее количество свободных цистеиновых аминокислот, где сконструированное с помощью цистеина антитело к CD79b связывается с полипептидом CD79b и его получают с помощью способа, заключающегося в том, что заменяют один или несколько аминокислотных остатков в родительском антителе к CD79b на цистеин, где родительское антитело содержит по меньшей мере одну последовательность HVR, выбранную из:
(а) HVR-L1, который содержит последовательность А1-А15, где А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31) или KASQSVDYEGDSFLN (SEQ ID NO: 37);
(б) HVR-L2, который содержит последовательность В1-В7, где В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(в) HVR-L3, который содержит последовательность С1-С9, где С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(г) HVR-H1, который содержит последовательность D1-D10, где D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(д) HVR-H2, который содержит последовательность Е 1-Е 18, где Е 1-Е 18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(е) HVR-H3, который содержит последовательность F1-F10, где F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36) или TRRVPIRLDY (SEQ ID NO: 38).
В одном из вариантов осуществления изобретения конъюгат антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p (формула I), в которой
(а) Ab обозначает антитело к CD79b, представленное в настоящем описании;
(б) L обозначает линкер;
(в) D обозначает фрагмент, представляющий собой лекарственное средство.
Таким образом, антитело может быть конъюгировано с лекарственным средством либо непосредственно, либо через линкер. В формуле I, р обозначает среднее количество фрагментов, представляющих собой лекарственное средство, на антитело, которое может находиться в пределах, например, от примерно 1 до примерно 20 фрагментов, представляющих собой лекарственное средство, на антитело, а в некоторых вариантах осуществления изобретения от 1 до примерно 8 фрагментов, представляющих собой лекарственное средство, на антитело. Под объем изобретения подпадает композиция, содержащая смесь соединений антитело-лекарственное средство формулы I, в которой средняя загрузка лекарственного средства на антитело составляет от примерно 2 до примерно 5, или от примерно 3 до примерно 4.
В одном из вариантов конъюгата антитело к CD79b-лекарственное средство, имеющего формулу Ab-(L-D)p, L выбран из 6-малеимидокапроила (МС), малеимидопропаноила (MP), валин-цитруллина (val-cit), аланин-фенилаланина (ala-phe), лара-аминобензилоксикарбонила (РАВ), N-сукцинимидил-4-(2-пиридилтио)пентоата (SPP), N-сукцинимидил-4-N-малеимидометил)циклогексан-1 карбоксилата (SMCC) и N-сукцинимидил-(4-йодацетил)аминобензоата (SIAB).
В одном из вариантов конъюгата антитело к CD79b-лекарственное средство, имеющего формулу Ab-(L-D)p, D выбран из группы, состоящей из ауристатина, долостатина, DM1, DM3, DM4, ММАЕ и MMAF.
В одном из вариантов осуществления изобретения указанный конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-МС-vc-PAB-MMAE. В конкретном варианте осуществления изобретения антитело к CD79b, входящее в указанный конъюгат, представляет собой huMA79b.v28.
В одном из вариантов осуществления изобретения афукозилированное антитело к CD20 связывается с CD20 с величиной KD, составляющей от 10-8 М до 10-13М.
Одним из вариантов осуществления изобретения является композиция, содержащая афукозилированное антитело к CD20, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, (в одном из вариантов осуществления изобретения оно представляет собой афукозилированное гуманизированное антитело B-Ly1), и конъюгат антитело к CD79b-лекарственное средство. В одном из вариантов композиции, предлагаемой в изобретении, указанное антитело к CD20 представляет собой обинутузумаб.
В одном из вариантов композиции, предлагаемой в изобретении, указанное антитело к CD79b в конъюгате антитело к CD79b-лекарственное средство содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из группы, состоящей из:
(I) HVR-L1, который содержит последовательность А1-А15, в которой А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31);
(И) HVR-L2, который содержит последовательность В1-В7, в которой В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(III) HVR-L3, который содержит последовательность С1-С9, в которой С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(IV) HVR-H1, который содержит последовательность D1-D10, в которой D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(V) HVR-H2, который содержит последовательность Е1-Е18, в которой E1-E18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(VI) HVR-H3, который содержит последовательность F1-F10, в которой F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36).
В одном из вариантов композиции, предлагаемой в изобретении, антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, содержит последовательность вариабельной легкой цепи, выбранную из группы, которая состоит из консенсусной последовательности человеческой легкой каппа-цепи I (обозначена как «huKI»; SEQ ID NO: 25), содержащей VL-FR1, VL-FR2, VL-FR3, VL-FR4 (SEQ ID NO: 39-42 соответственно), мышиного антитела к CD79b (обозначено как «MA79b»; SEQ ID NO: 26), «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 27), варианта 17 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v17»; SEQ ID NO: 53), вариант 18 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v18»; SEQ ID NO: 61), варианта 28 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v28»; SEQ ID NO: 69) и варианта 32 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v32»; SEQ ID NO: 77).
В одном из вариантов композиции, предлагаемой в изобретении, антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, содержит последовательность вариабельной тяжелой цепи, выбранную из группы, которая состоит из: консенсусной последовательности человеческой тяжелой цепи подгруппы III (обозначена как «humIII»; SEQ ID NO: 28), содержащей VH-FR1, VH-FR2, VH-FR3 и VH-FR4 (SEQ ID NO: 43-46), мышиного антитела к CD79b (обозначено как «MA79b»; SEQ ID NO: 29), «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 30) (содержащего 71А, 73Т и 78А), варианта 17 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v17»; SEQ ID NO: 54) (содержащего 71A, 73T и 78A), варианта 18 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v18»; SEQ ID NO: 62) (содержащего 71A, 73T и 78А), варианта 28 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v28»; SEQ ID NO: 70) (содержащего 71 A, 73T и 78A) и варианта 32 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v32»; SEQ ID NO: 78) (содержащего 71 A, 73T и 78A).
В одном из вариантов композиции, предлагаемой в изобретении, применяют один или несколько дополнительных других цитотоксических, химиотерапевтических или противораковых агентов или соединения или ионизирующее излучение, которые повышают действие указанных агентов.
В одном из вариантов композиции, предлагаемой в изобретении, конъюгат антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p (формула I), в которой
(а) Ab обозначает антитело к CD79b, представленное в настоящем описании;
(б) L обозначает линкер;
(в) D обозначает фрагмент, представляющий собой лекарственное средство. В одном из вариантов композиции, предлагаемой в изобретении, конъюгат
антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p, в которой L выбран из 6-малеимидокапроила (МС), малеимидопропаноила (MP), валин-цитруллина (val-cit), аланин-фенилаланина (ala-phe), пара-аминобензилоксикарбонила (РАВ), N-сукцинимидил-4-(2-пиридилтио)пентоата (SPP), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1 карбоксилата (SMCC) и N-сукцинимидил-(4-йодацетил)аминобензоата (SIAB).
В одном из вариантов композиции, предлагаемой в изобретении, конъюгат антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p, в которой D выбран из группы, состоящей из ауристатина, долостатина, DM1, DM3, DM4, ММАЕ и MMAF.
В одном из вариантов композиции, предлагаемой в изобретении, конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-МС-vc-PAB-MMAE для лечения рака. В конкретном варианте осуществления изобретения антитело к CD79b в указанном конъюгате представляет собой huMA79b.v28. Афукозилированное антитело к CD20 с содержанием фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 применяют для лечения рака в сочетании с конъюгатом антитело к CD79b-лекарственное средство.
Один из вариантов осуществления изобретения относится к способу лечения пациента, страдающего раком, заключающемуся в том, что вводят афукозилированное антитело к CD20 с содержанием фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 в сочетании с конъюгатом антитело к CD79b-лекарственное средство пациенту, нуждающемуся в таком лечении.
В одном из вариантов осуществления изобретения способ отличается тем, что указанный рак представляет собой рак, при котором происходит экспрессия CD20.
В одном из вариантов осуществления изобретения способ отличается тем, что указанный рак, при котором происходит экспрессия CD20, представляет собой лимфому или лимфоцитарный лейкоз.
В одном из вариантов осуществления изобретения способ отличается тем, что указанное антитело к CD20 представляет собой гуманизированное антитело B-Ly1.
В одном из вариантов осуществления изобретения способ отличается тем, что указанное антитело к CD20 представляет собой обинутузумаб.
В одном из вариантов осуществления изобретения способ отличается тем, что применяют один или несколько дополнительных других цитотоксических, химиотерапевтических или противораковых агентов, или соединения или ионизирующее излучение, которые повышают действие указанных агентов.
В одном из вариантов осуществления изобретения способ отличается тем, что указанное антитело к CD20 в конъюгате антитело к CD79b-лекарственное средство содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из группы, состоящей из:
(I) HVR-L1, который содержит последовательность А1-А15, в которой А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31);
(II) HVR-L2, который содержит последовательность В1-В7, в которой В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(III) HVR-L3, который содержит последовательность С1-С9, в которой С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(IV) HVR-H1, который содержит последовательность D1-D10, в которой D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(V) HVR-H2, который содержит последовательность Е1-Е18, в которой Е1-Е18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(VI) HVR-H3, который содержит последовательность F1-F10, в которой F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36).
В одном из вариантов способа, предлагаемого в изобретении, антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, содержит последовательность вариабельной легкой цепи, выбранную из группы, которая состоит из консенсусной последовательности человеческой легкой каппа-цепи I (обозначена как «huKI»; SEQ ID NO: 25), содержащей VL-FR1, VL-FR2, VL-FR3, VL-FR4 (SEQ ID NO: 39-42 соответственно), мышиного антитела к CD79b (обозначено как «MA79b»; SEQ ID NO: 26), «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 27), варианта 17 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v17»; SEQ ID NO: 53), вариант 18 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v18»; SEQ ID NO: 61), варианта 28 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v28»; SEQ ID NO: 69) и варианта 32 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v32»; SEQ ID NO: 77).
В одном из вариантов способа, предлагаемого в изобретении, антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, содержит последовательность вариабельной тяжелой цепи, выбранную из группы, которая состоит из: консенсусной последовательности человеческой тяжелой цепи подгруппы III (обозначена как «humIII»; SEQ ID NO: 28), содержащей VH-FR1, VH-FR2, VH-FR3 и VH-FR4 (SEQ ID NO: 43-46), мышиного антитела к CD79b (обозначено как «MA79b»; SEQ ID NO: 29), «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 30) (содержащего 71А, 73Т и 78А), варианта 17 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v17»; SEQ ID NO: 54) (содержащего 71 A, 73T и 78A), варианта 18 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v18»; SEQ ID NO: 62) (содержащего 71 A, 73T и 78A), варианта 28 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v28»; SEQ ID NO: 70) (содержащего 71 A, 73T и 78A) и варианта 32 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v32»; SEQ ID NO: 78) (содержащего 71 A, 73T и 78A).
В одном из вариантов способа, предлагаемого в изобретении, конъюгат антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p, в которой
(а) Ab обозначает антитело к CD79b, представленное в настоящем описании;
(б) L обозначает линкер;
(в) D обозначает фрагмент, представляющий собой лекарственное средство. В одном из вариантов способа, предлагаемого в изобретении, конъюгат
антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p, в которой L выбран из 6-малеимидокапроила (МС), малеимидопропаноила (MP), валин-цитруллина (val-cit), аланин-фенилаланина (ala-phe), пара-аминобензилоксикарбонила (РАВ), N-сукцинимидил-4-(2-пиридилтио)пентоата (SPP), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1 карбоксилата (SMCC) и N-сукцинимидил-(4-йодацетил)аминобензоата (SIAB).
В одном из вариантов способа, предлагаемого в изобретении, конъюгат антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p, в которой D выбран из группы, состоящей из ауристатина, долостатина, DM1, DM3, DM4, ММАЕ и MMAF.
В одном из вариантов способа, предлагаемого в изобретении, конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-МС-vc-PAB-MMAE.
В одном из вариантов способа, предлагаемого в изобретении, антитело к CD79b в указанном конъюгате антитело к CD79b-лекарственное средство представляет собой huMA79b.v28.
Один из вариантов осуществления изобретения относится к применению афукозилированного антитела к CD20 с содержанием фукозы 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 для приготовления лекарственного средства, предназначенного для лечения рака, в сочетании с конъюгатом антитело к CD79b-лекарственное средство.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что указанный рак представляет собой рак, при котором происходит экспрессия CD20.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что указанный рак, при котором происходит экспрессия CD20, представляет собой лимфому или лимфоцитарный лейкоз.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что указанное антитело к CD20 представляет собой гуманизированное антитело B-Ly1.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что указанное антитело к CD20 представляет собой обинутузумаб.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что применяют один или несколько дополнительных других цитотоксических, химиотерапевтических или противораковых агентов или соединения или ионизирующее излучение, которые повышают действие указанных агентов.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что указанное антитело к CD20 в конъюгате антитело к CD79b-лекарственное средство содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из группы, состоящей из:
(I) HVR-L1, который содержит последовательность А1-А15, в которой А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31);
(II) HVR-L2, который содержит последовательность В1-В7, в которой В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(III) HVR-L3, который содержит последовательность С1-С9, в которой С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(IV) HVR-H1, который содержит последовательность D1-D10, в которой D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(V) HVR-H2, который содержит последовательность Е1-Е18, в которой Е1-Е18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(VI) HVR-H3, который содержит последовательность F1-F10, в которой F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36).
В одном из вариантов применения, предлагаемого в изобретении, антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, содержит последовательность вариабельной легкой цепи, выбранную из группы, которая состоит из консенсусной последовательности человеческой легкой каппа-цепи I (обозначена как «huKI»; SEQ ID NO: 25), содержащей VL-FR1, VL-FR2, VL-FR3, VL-FR4 (SEQ ID NO: 39-42 соответственно), мышиного антитела к CD79b (обозначено как «MA79b»; SEQ ID NO: 26), «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 27), варианта 17 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v17»; SEQ ID NO: 53), вариант 18 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v18»; SEQ ID NO: 61), варианта 28 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v28»; SEQ ID NO: 69) и варианта 32 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v32»; SEQ ID NO: 77).
В одном из вариантов применения, предлагаемого в изобретении, антитело к CD79b, входящее в конъюгат антитело к CD79b-лекарственное средство, содержит последовательность вариабельной тяжелой цепи, выбранную из группы, которая состоит из: консенсусной последовательности человеческой тяжелой цепи подгруппы III (обозначена как «humIII»; SEQ ID NO: 28), содержащей VH-FR1, VH-FR2, VH-FR3 и VH-FR4 (SEQ ID NO: 43-46), мышиного антитела к CD79b (обозначено как «MA79b»; SEQ ID NO: 29), «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 30) (содержащего 71А, 73Т и 78А), варианта 17 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v17»; SEQ ID NO: 54) (содержащего 71 A, 73T и 78A), варианта 18 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v18»; SEQ ID NO: 62) (содержащего 71A, 73T и 78А), варианта 28 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v28»; SEQ ID NO: 70) (содержащего 71A, 73T и 78A) и варианта 32 «гуманизированного» антитела с трансплантированным MA79b (обозначено как «huMA79b.v32»; SEQ ID NO: 78) (содержащего 71 A, 73T и 78A).
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что конъюгат антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p, в которой
(а) Ab обозначает антитело к CD79b, представленное в настоящем описании;
(б) L обозначает линкер;
(в) D обозначает фрагмент, представляющий собой лекарственное средство. Один из вариантов применения, предлагаемого в изобретении, отличается
тем, что конъюгат антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p, в которой L выбран из 6-малеимидокапроила (МС), малеимидопропаноила (MP), валин-цитруллина (val-cit), аланин-фенилаланина (ala-phe), пара-аминобензилоксикарбонила (РАВ), N-сукцинимидил-4-(2-пиридилтио)пентоата (SPP), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1 карбоксилата (SMCC) и N-сукцинимидил-(4-йодацетил)аминобензоата (SIAB).
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что конъюгат антитело к CD79b-лекарственное средство имеет формулу Ab-(L-D)p, в которой D выбран из группы, состоящей из ауристатина, долостатина, DM1, DM3, DM4, ММАЕ и MMAF.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-MC-vc-PAB-MMAE.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что антитело к CD79b в указанном конъюгате антитело к CD79b-лекарственное средство представляет собой huMA79b.v28.
Один из вариантов применения, предлагаемого в изобретении, отличается тем, что применяют один или несколько дополнительных других цитотоксических, химиотерапевтических или противораковых агентов, или соединения или ионизирующее излучение, которые повышают действие указанных агентов.
Описание чертежей
На чертежах показано:
на фиг. 1 - воздействие обинутузумаба (GA101), ритуксимаба, анти-CD79b-ADC и комбинаций антитела к CD79b с GA101 или ритуксимабом, изученное на модели диссеминированной лимфомы из клеток зоны мантии (MCL) линии Z138, созданной на SCID beige-мышах (мыши с тяжелым комбинированным иммунодефицитом с врожденным отсутствием естественных клеток-киллеров);
на фиг. 2 - результаты статистического анализа данных, представленных на фиг. 1, с помощью парного теста Вилкоксона и парного логрангового теста;
на фиг. 3А (легкая цепь) и 3Б (тяжелая цепь) - аминокислотные последовательности антитела, предлагаемого в изобретении (huMA79b.v17). На фиг. 3А (легкая цепь) и 3Б (тяжелая цепь) представлены аминокислотные последовательности каркасного участка (FR), гипервариабельного участка (HVR), первого константного домена (CL или CH1) и Fc-области (Fc) одного из вариантов антитела, предлагаемого в изобретении (huMA79b.v17) (SEQ ID NO: 131-134, 47-49 и 135 (фиг. 3А) и SEQ ID NO: 136-139, 50-52, 140-141 (фиг. 3Б)). Представлены полноразмерные аминокислотные последовательности (вариабельные и константные области) легкой и тяжелой цепей huMA79b.v17 (SEQ ID NO: 176 (фиг. 3А) и 177 (фиг. 3Б) соответственно, при этом константные домены подчеркнуты. Представлены аминокислотные последовательности вариабельных доменов (SEQ ID NO: 53 (фиг. 3А - легкая цепь) и SEQ ID NO: 54 (фиг. 3Б - тяжелая цепь));
на фиг. 4А (легкая цепь) и 4Б (тяжелая цепь) - аминокислотные последовательности антитела, предлагаемого в изобретении (huMA79b.v18). На фиг. 4А (легкая цепь) и 4Б (тяжелая цепь) представлены аминокислотные последовательности каркасного участка (FR), гипервариабельного участка (HVR), первого константного домена (CL или CH1) и Fc-области (Fc) одного из вариантов антитела, предлагаемого в изобретении (huMA79b.v18) (SEQ ID NO: 142-145, 55-57 и 147 (фиг. 4А) и SEQ ID NO: 148-151, 58-60 и 152-153 (фиг. 4Б)). Представлены полноразмерные аминокислотные последовательности (вариабельные и константные области) легкой и тяжелой цепей huMA79b.v18 (SEQ ID NO: 178 (фиг. 4A) и 179 (фиг. 4Б) соответственно, при этом константные домены подчеркнуты. Представлены аминокислотные последовательности вариабельных доменов (SEQ ID NO: 61 (фиг. 4А -легкая цепь) и SEQ ID NO: 62 (фиг. 4Б - тяжелая цепь));
на фиг. 5А (легкая цепь) и 5Б (тяжелая цепь) - аминокислотные последовательности антитела, предлагаемого в изобретении (huMA79b.v28). На фиг. 5А (легкая цепь) и 5Б (тяжелая цепь) представлены аминокислотные последовательности каркасного участка (FR), гипервариабельного участка (HVR), первого константного домена (CL или CH1) и Fc-области (Fc) одного из вариантов антитела, предлагаемого в изобретении (huMA79b.v28) (SEQ ID NO: 154-157, 63-65 и 158 (фиг. 5А) и SEQ ID NO: 159-162, 66-68 и 163-164 (фиг. 5Б). Представлены полноразмерные аминокислотные последовательности (вариабельные и константные области) легкой и тяжелой цепей huMA79b.v28 (SEQ ID NO: 180 (фиг. 5А) и 181 (фиг. 5Б) соответственно, при этом константные домены подчеркнуты. Представлены аминокислотные последовательности вариабельных доменов (SEQ ID NO: 69 (фиг. 7 - легкая цепь) и SEQ ID NO: 70 (фиг. 8 - тяжелая цепь));
на фиг. 6А (легкая цепь) и 6Б (тяжелая цепь) - аминокислотные последовательности антитела, предлагаемого в изобретении (huMA79b.v32). На фиг. 6А (легкая цепь) и 6Б (тяжелая цепь) представлены аминокислотные последовательности каркасного участка (FR), гипервариабельного участка (HVR), первого константного домена (CL или CH1) и Fc-области (Fc) одного из вариантов антитела, предлагаемого в изобретении (huMA79b.v32) (SEQ ID NO: 165-168, 71-73 и 169 (фиг. 6А) и SEQ ID NO: 170-173, 74-76 и 174-175 (фиг. 6Б). Представлены полноразмерные аминокислотные последовательности (вариабельные и константные области) легкой и тяжелой цепей huMA79b.v32 (SEQ ID NO: 182 (фиг. 6А) и 146 (фиг. 6Б) соответственно, при этом константные домены подчеркнуты. Представлены аминокислотные последовательности вариабельных доменов (SEQ ID NO: 77 (фиг. 6А - легкая цепь) и SEQ ID NO: 78 (фиг. 6Б - тяжелая цепь));
на фиг. 7 - выравнивание последовательностей вариабельных легких цепей для следующих вариантов: консенсусная последовательность человеческой легкой каппа-цепи I (обозначена как «huKI»; SEQ ID NO: 25), содержащая VL-FR1, VL-FR2, VL-FR3, VL-FR4 (SEQ ID NO: 39-42 соответственно), мышиное антитело к CD79b (обозначено как «MA79b»; SEQ ID NO: 26), «гуманизированное» антитело с трансплантированным MA79b (обозначено как «HuMA79b-трансплантат»; SEQ ID NO: 27), вариант 17 «гуманизированного» антитела с трансплантированным MA79b (обозначен как «huMA79b.v17»; SEQ ID NO: 53), вариант 18 «гуманизированного» антитела с трансплантированным MA79b (обозначен как «huMA79b.v18»; SEQ ID NO: 61), вариант 28 «гуманизированного» антитела с трансплантированным MA79b (обозначен как «huMA79b.v28»; SEQ ID NO: 69) и вариант 32 «гуманизированного» антитела с трансплантированным MA79b (обозначен как «huMA79b.v32»; SEQ ID NO: 77). Положения пронумерованы согласно Кэботу, гипервариабельные участки (HVR), трансплантированные из MA79b в консенсусный каркасный участок вариабельной легкой каппа-цепи I, выделены прямоугольником;
на фиг. 8 - выравнивание последовательностей вариабельных тяжелых цепей для следующих вариантов: консенсусная последовательность человеческой тяжелой цепи подгруппы III (обозначена как «humIII»; SEQ ID NO: 28), содержащей VH-FR1, VH-FR2, VH-FR3 и VH-FR4 (SEQ ID NO: 43-46), мышиное антитело к CD79b (обозначено как «MA79b»; SEQ ID NO: 29), «гуманизированное» антител с трансплантированным MA79b (обозначено как «huMA79b-трансплантат»; SEQ ID NO: 30) (содержащее 71А, 73Т и 78А), вариант 17 «гуманизированного» антитела с трансплантированным MA79b (обозначен как «huMA79b.v17»; SEQ ID NO: 54) (содержащий 71A, 73T и 78A), вариант 18 «гуманизированного» антитела с трансплантированным MA79b (обозначен как «huMA79b.v18»; SEQ ID NO: 62) (содержащий 71A, 73T и 78A), вариант 28 «гуманизированного» антитела с трансплантированным MA79b (обозначен как «huMA79b.v28»; SEQ ID NO: 70) (содержащий 71A, 73T и 78A) и вариант 32 «гуманизированного» антитела с трансплантированным MA79b (обозначен как «huMA79b.v32»; SEQ ID NO: 78) (содержащий 71A, 73T и 78А). Положения пронумерованы согласно Кэботу, гипервариабельные участки (HVR), трансплантированные из MA79b в консенсусный каркасный участок вариабельной тяжелой цепи подгруппы III, выделены прямоугольником.
Подробное описание изобретения
В изобретении предложено афукозилированное антитело к CD20 IgG1- или IgG3-изотипа, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для лечения рака в сочетании с конъюгатом антитело к CD79b-лекарственное средство.
В изобретении предложено применение афукозилированного антитела к CD20 IgG1- или IgG3-изотипа, в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для приготовления лекарственного средства, предназначенного для лечения рака в сочетании с конъюгатом антитело к CD79b-лекарственное средство.
Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от общего количества олигосахаридов (сахаров) на Asn297.
Понятие «антитело» относится к различным формам антител, включая (но, не ограничиваясь только ими) полные антитела, человеческие антитела, гуманизированные антитела и созданные с помощью генной инженерии антитела, такие как моноклональные антитела, химерные антитела или рекомбинантные антитела, а также фрагменты указанных антител, если они сохраняют отличительные признаки антител, предлагаемых в изобретении. Понятия «моноклональное антитело» или «композиция моноклонального антитела» в контексте настоящего описания относятся к препарату, содержащему молекулы антитела, которые имеют одинаковый аминокислотный состав. Соответственно понятие «человеческое моноклональное антитело» относится к антителам, обладающим одинаковой специфичностью связывания, которые имеют вариабельную и константную области, полученные из последовательностей иммуноглобулина человеческой зародышевой линии. Согласно одному из вариантов осуществления изобретения человеческие моноклональные антитела получают с помощью гибридомы, которая включает В-клетку, полученную из трансгенного животного кроме человека, например, трансгенной мыши, имеющей геном, который содержит трансген человеческой тяжелой цепи и трансген человеческой легкой цепи, слитую с иммортализованной клеткой.
Понятие «химерное антитело» относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, выведенную из одного источника или вида, и по меньшей мере часть константной области, выведенную из другого источника или вида, которое, как правило, получают методами рекомбинантной ДНК. Наиболее предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Такие мышиные/человеческие химерные антитела являются продуктом экспрессируемых генов иммуноглобулина, содержащих сегменты ДНК, которые кодируют мышиные вариабельные области иммуноглобулина, и сегменты ДНК, которые кодируют человеческие константные области иммуноглобулина. Другими формами «химерных антител», подпадающих под объем настоящего изобретения, являются антитела, в которых класс или подкласс модифицирован или изменен по сравнению с исходным антителом. Такие «химерные» антитела называют также «антителами переключенного класса». Методы получения химерных антител основаны на общепринятых методиках рекомбинантной ДНК и методиках генной трансфекции, и в настоящее время являются хорошо известными в данной области (см., например, Morrison S.L. и др., Proc. Natl. Acad Sci. USA 81, 1984, cc. 6851-6855; US №5202238 и US №5204244).
Понятие «гуманизированное антитело» относится к антителам, в которых каркасный участок или «гипервариабельные участки» (CDR) модифицированы таким образом, что они содержат CDR иммуноглобулина другой специфичности по сравнению с родительским иммуноглобулином. В предпочтительном варианте осуществления изобретения мышиный CDR трансплантируют в каркасный участок человеческого антитела, в результате чего образуется «гуманизированное антитело» (см., например, Riechmann L. и др., Nature 332, 1988, сс. 323-327; и Neuberger M.S. и др., Nature 314, 1985, сс. 268-270). Наиболее предпочтительные CDR соответствуют CDR, которые имеют последовательности, распознающие антигены, указанные выше для химерных и бифункциональных антител.
Подразумевается, что в контексте настоящего описания понятие «человеческое антитело» включает антитела, имеющие вариабельную и константную области, происходящие из последовательностей иммуноглобулина человеческой зародышевой линии. Человеческие антитела хорошо известны в данной области (van Dijk М.А. и van de Winkel J.G., Curr. Opin. Chem. Biol. 5, 2001, cc. 368-374). На основе указанной технологии можно получать человеческие антитела к широкому разнообразию мишеней. Примеры человеческих антител описаны у Kellermann S.A. и др., Curr Opin Biotechnol. 13, 2002, сс. 593-597.
Подразумевается, что понятие «рекомбинантное человеческое антитело» в контексте настоящего описания включает все человеческие антитела, которые получают, экспрессируют, создают или выделяют методами рекомбинации, такие как антитела, выделенные из клетки-хозяина, такой как NS0- или СНО-клетка, или из животного (например, из мыши), которое является трансгенным по генам человеческого иммуноглобулина, или антитела, экспрессируемые с помощью рекомбинантного экспрессионного вектора, которым трансфектируют клетку-хозяина. Такие рекомбинантные человеческие антитела имеют вариабельную и константную области, происходящие из последовательностей иммуноглобулина человеческой зародышевой линии, в преобразованной форме. Рекомбинантные человеческие антитела, предлагаемые в изобретении, подвергали in vivo соматической гипермутации. Так, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые, хотя и происходят из последовательностей VH- и VL-областей человеческой зародышевой линии и являются родственными им, но могут не встречаться в существующем в естественных условиях in vivo спектре зародышевых линий человеческого антитела.
В контексте настоящего описания понятие «связывается (связывание)» или «специфически связывается (специфическое связывание)» относится к связыванию антитела с эпитопом опухолевого антигена по данным анализа in vitro, предпочтительно по данным анализа методом поверхностного плазмонного резонанса (BIAcore, фирма GE-Healthcare, Уппсала, Швеция) при использовании очищенного антигена дикого типа. Аффинность связывания определяют в понятиях ka (константа скорости ассоциации антитела при образовании комплекса антитело/антиген), kD (константа диссоциации) и KD (kD/ka). Считается, что имеет место связывание или специфическое связывание, если аффинность связывания (KD) составляет 10-8 М или менее, предпочтительно от 10-8 М до 10-13 М (в одном из вариантов осуществления от 10-9 М до 10-13 М). Таким образом, афукозилированное антитело, предлагаемое в изобретении, специфически связывается с опухолевым антигеном, что характеризуется аффинностью связывания (KD), составляющей 10-8 моля/л или менее, предпочтительно от 10-8 М до 10-13 М (в одном из вариантов осуществления изобретения от 10-9 М до 10-13 М).
Подразумевается, что понятие «молекула нуклеиновой кислоты» в контексте настоящего описания относится к молекулам ДНК и молекулам РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно она представляет собой двухцепочечную ДНК.
«Константные домены» не участвуют непосредственно в связывании антитела с антигеном, но они участвуют в эффекторных функциях (таких как ADCC, связывание комплемента и CDC).
Понятия «вариабельная область» (вариабельная область легкой цепи (VL), вариабельная область тяжелой цепи (VH)) в контексте настоящего описания обозначают области каждой из пар легких и тяжелых цепей, которые принимают непосредственное участие в связывании антитела с антигеном. Домены человеческих вариабельных легкой и тяжелой цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасных участка (FR), последовательности которых в значительной степени являются консервативными, соединенные тремя «гипервариабельными участками» (или определяющими комплементарность участками, CDR). Каркасные участки адоптированы к β-складчатой конформации, и CDR могут образовывать петли, соединяющие β-складчатую структуру. CDR в каждой цепи поддерживают свою трехмерную структуру с помощью каркасных участков и образуют вместе с CDR из другой цепи антигенсвязывающий сайт.
Понятия «гипервариабельный участок» или «антигенсвязывающий участок антитела» в контексте настоящего описания относятся к аминокислотным остаткам антитела, которые ответственны за связывание с антигеном. Гипервариабельный участок содержит аминокислотные остатки из «определяющих комплементарность участков» или «CDR». «Каркасные» или «FR»-участки представляют собой участки вариабельного домена, отличные от остатков гипервариабельного участка, как он определен в настоящем описании. Таким образом, легкая и тяжелая цепи антитела содержат в направлении от N- к С-концу следующие домены: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR3 тяжелой цепи представляет собой участок, который вносит основной вклад в связывание с антигеном. CDR- и FR-участки определяют согласно стандартной номенклатуре Kabat и др., Sequences of Proteins of Immunological Interest, 5-e изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991) и/или как участки из «гипервариабельной петли».
Понятие «афукозилированное антитело» относится к антителу изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1) с измененной схемой гликозилирования в Fc-области в положении Asn297, которое имеет пониженное количество остатков фукозы. Гликозилирование человеческих IgG1 или IgG3 имеет место в положении Asn297, оно обусловлено присутствием корового фукозилированного биантенного сложного олигосахарида в сайте гликозилирования, имеющего на конце вплоть до 2 остатков Ga1. Эти структуры обозначают как G0-, G1 - (α1,6 или α1,3) или G2-гликановые остатки в зависимости от количества концевых остатков Ga1 (Raju T.S., BioProcess Int. 1, 2003, cc. 44-53). СНО-тип гликозилирования Fc-областей антител описан, например, у Routier F.H., Glycoconjugate J. 14, 1997, сс. 201-207. Антитела, полученные в результате рекомбинантной экспрессии в клетках-хозяевах СНО, не имеющих модификации гликозилирования (гликомодификация), как правило, имеют уровень фукозилирования в положении Asn297, составляющий по меньшей мере 85%. Очевидно, что в контексте настоящего описания понятие афукозилированное антитело включает также и антитело, у которого в его схеме гликозилирования фукоза отсутствует. Хорошо известно, что обычное положение гликозилированного остатка в антителе соответствует аспарагину в положении 297 согласно системе нумерации EU («Asn297»).
«Систему нумерации EU» или «EU-индекс», как правило, применяют для обозначения положения остатка в константной области тяжелой цепи иммуноглобулина (например, EU-индекс описан у Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991, публикация специально включена в настоящее описание в качестве ссылки).
Таким образом, афукозилированное антитело, предлагаемое в настоящем изобретении, представляет собой антитело изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297 (это означает, что по меньшей мере 40% или более олигосахаридов на Asn297 в Fc-области являются афукозилированными). В одном из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60% от количества олигосахаридов на Asn297 в Fc-области. В другом варианте осуществления изобретения содержание фукозы составляет 50% или менее, а в следующем варианте осуществления изобретения содержание фукозы составляет 30% или менее от количества олигосахаридов на Asn297 в Fc-области. Согласно изобретению «содержание фукозы» означает количество указанного олигосахарида (фукозы) в олигосахаридной (сахарной) цепи на Asn297 относительно суммы всех олигосахаридов (сахаров), присоединенных к Asn 297 (например, сложных, гибридных и имеющих высокое содержание маннозы структур), измеренное с помощью MALDI-TOF-масс-спектрометрии и рассчитанное в виде среднего значения (подробный метод определения количества фукозы описан, например, в WO 2008/077546). Согласно еще одному варианту осуществления изобретения олигосахариды Fc-области являются бисекционными. Афукозилированное антитело, предлагаемое в изобретении, можно экспрессировать в гликомодифицированной клетке-хозяине, сконструированной с целью экспрессии по меньшей мере одной нуклеиновой кислоты, кодирующей полипептид, который обладает GnTIII-активностью, в количестве, достаточном для частичного фукозилирования олигосахаридов в Fc-области. Согласно одному из вариантов осуществления изобретения, полипептид, обладающий GnTIII-активностью, представляет собой слитый полипептид. В альтернативном варианте α1,6-фукозилтрансферазную активность клетки-хозяина можно снижать или элиминировать согласно методу, описанному в №US 6946292, с получением гликомодифицированных клеток-хозяев. Уровень фукозилирования антитела можно предопределять, например, либо путем изменения условий ферментации (например, продолжительности ферментации), либо путем объединения по меньшей мере двух антител с различным уровнем фукозилирования. Указанные афукозилированные антитела и соответствующие методы гликоинженерии описаны в WO 2005/044859, WO 2004/065540, WO 2007/031875, у Umana Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180), WO 1999/54342, WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2005/011735, WO 2005/027966, WO 97/028267, US №2006/0134709, US №2005/0054048, US №2005/0152894, WO 2003/035835, WO 2000/061739. Указанные антитела, полученные с помощью методов гликоинженерии, обладают повышенной ADCC. Другие методы гликоинженерии, которые позволяют получать афукозилированные антитела, предлагаемые в изобретении, описаны, например, у Niwa R. и др., J. Immunol. Methods 306, 2005, сс. 151-160; Shinkawa Т. и др., J. Biol. Chem. 278, 2003, сс. 3466-3473; WO 03/055993 или US №2005/0249722.
Таким образом, одним из объектов изобретения является афукозилированное антитело к CD20 изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), которое специфически связывается с CD20, и в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, предназначенное для лечения рака в сочетании с конъюгатом антитело к CD79b-лекарственное средство. Другим объектом изобретения является применение афукозилированного антитела к CD20 изотипа IgG1 или IgG3 (предпочтительно изотипа IgG1), которое специфически связывается с CD20, и в котором содержание фукозы составляет 60% или менее от общего количества олигосахаридов (сахаров) на Asn297, для приготовления лекарственного средства, предназначенного для лечения рака в сочетании с конъюгатом антитело к CD79b-лекарственное средство. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 60% до 20% от общего количества олигосахаридов (сахаров) на Asn297. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет от 60% до 40% от общего количества олигосахаридов (сахаров) на Asn297. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет 0% от общего количества олигосахаридов (сахаров) на Asn297.
CD20 (который называют также В-лимфоцитарным антигеном CD20, В-лимфоцитарным поверхностным антигеном B1, Leu-16, Вр35, ВМ5 и LF5; последовательность представлена в базе данных SwissProt под номером Р11836) представляет собой гидрофобный трансмембранный белок с молекулярной массой примерно 35 кДа, локализованный на пре-В и зрелых В-лимфоцитах (Valentine М.А. и др., J. Biol. Chem. 264, 1989, сс. 11282-11287; Tedder T.F. и др., Proc. Natl. Acad. Sci. U.S.A. 85, 1988, cc. 208-212; Stamenkovic I. и др., J. Exp. Med. 167, 1988, cc. 1975-1980; Einfeld D.A. и др., EMBO J. 7, 1988, cc. 711-717; Tedder T.F. и др., J. Immunol. 142, 1989, cc. 2560-2568). Соответствующий человеческий ген представляет собой имеющий 4 трансмембранных домена представитель 1 подсемейства А, известный также как MS4A1. Этот ген кодирует представителя семейства трансмембранных генов 4А. Представители этого нового семейства белков отличаются общими структурными особенностями и сходными интрон/экзонными сочленениями (границы сплайсинга) и отличаются уникальными схемами экспрессии для гематопоэтических клеток и нелимфоидных тканей. Этот ген кодирует поверхностную молекулу В-лимфоцитов, которая играет роль в развитии и дифференцировке В-клеток в плазматические клетки. Этот представитель семейства локализован на 11q12 в кластере представителей семейства. Альтернативный сплайсинг этого гена приводит к образованию двух транскрипционных вариантов, которые кодируют один и тот же белок.
Понятия «CD20» и «антиген CD20» в контексте настоящего описания используют взаимозаменяемо, и они включают любые варианты, изоформы и видовые гомологи человеческого CD20, которые в естественных условиях экспрессируются клетками или экспрессируются на клетках, трансфектированных геном CD20. Связывание антитела, предлагаемого в изобретении, с антигеном CD20 опосредует цитолиз клеток, экспрессирующих CD20 (например, опухолевой клетки), путем инактивации CD20. Цитолиз клеток, экспрессирующих CD20, может происходить посредством одного или нескольких из следующих механизмов: индукция клеточной гибели/апоптоза, ADCC и CDC.
Синонимами CD20, принятыми в данной области, являются антиген CD20 В-лимфоцитов, поверхностный антиген В-лимфоцитов Bl, Leu-16, Вр35, ВМ5 и LF5.
Понятие «антитело к CD20», предлагаемое в изобретении, относится к антителу, которое специфически связывается с антигеном CD20. В зависимости от характеристик связывания и биологической активности антитела к CD20 в отношении антигена CD20 можно различать два типа антител к CD20 (антитела к CD20 типа I и типа II) согласно Cragg M.S. и др., Blood 103, 2004, сс. 2738-2743; и Cragg M.S. и др., Blood 101, 2003, сс. 1045-1052 (см. таблицу 1).


Примерами антител к CD20 типа II являются, например, гуманизированное антитело B-Ly1 изотипа IgG1 (химерное гуманизированное антитело изотипа IgG1, описанное в WO 2005/044859), 11 В8 IgG1 (описанное в WO 2004/035607) и АТ80 IgG1. Как правило, антитела к CD20 типа II изотипа IgG1 обладают характерными CDC-свойствами. Антитела к CD20 типа II обладают пониженной CDC (если относятся к изотипу IgG1) по сравнению с антителами типа I изотипа IgG1.
Примерами антител к CD20 типа I являются, например, ритуксимаб, HI47 IgG3 (ЕСАСС, гибридома), 2С6 IgG1 (описанное в WO 2005/103081), 2F2 IgG1 (описанное в WO 2004/035607 и WO 2005/103081) и 2Н7 IgG1 (описанное в WO 2004/056312).
Согласно одному из вариантов осуществления изобретения афукозилированные антитела к CD20, предлагаемые в изобретении, представляют собой антитело к CD20 типа II, а согласно другому варианту осуществления изобретения представляет собой афукозилированное гуманизированное антитело B-Ly1.
Афукозилированные антитела к CD20, предлагаемые в изобретении, обладают повышенной антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC) по сравнению с антителами к CD20, у которых не снижено содержание фукозы.
Под «афукозилированным антителом к CD20 с повышенной антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC)» понимают афукозилированное антитело к CD20, как оно определено в настоящем описании, обладающее повышенной ADCC по данным оценки с помощью любого приемлемого метода, известного обычному специалисту в данной области. Один из приемлемых методов анализа in vitro ADCC заключается в том, что:
1) в анализе используют клетки-мишени, для которых известно, что они экспрессируют антиген-мишень, распознаваемый антигенсвязывающей областью антитела;
2) в качестве эффекторных клеток в анализе используют мононуклеарные клетки периферической крови человека (РВМС), выделенные из крови произвольно выбранного здорового донора;
3) анализ осуществляют согласно следующему протоколу:
I) выделяют РВМС с помощью стандартных процессов центрифугирования в градиенте плотности и суспендируют из расчета 5×106 клеток/мл в RPMI-среде для культивирования клеток;
0II) выращивают клетки-мишени с помощью стандартных методов культивирования тканей, собирают клетки на экспоненциальной фазе роста, жизнеспособность которых превышает 90%, отмывают в RPMI-среде для культивирования клеток, метят51Cr (100 мкКи), отмывают дважды в среде для культивирования клеток и ресуспендируют в среде для культивирования клеток с плотностью 105 клеток/мл;
III) осуществляют трансфекцию, используя по 100 мкл указанной выше конечной суспензии клеток-мишеней на каждую лунку 96-луночного титрационного микропланшета;
IV) осуществляют серийное разведение антитела от 4000 до 0,04 нг/мл в среде для культивирования клеток и добавляют по 50 мкл образовавшихся растворов антитела к клеткам-мишеням в 96-луночном титрационном микропланшете, оценивают антитело в различных концентрациях, охватывающих весь диапазон указанных выше концентраций, в трех повторностях;
V) для контроля максимального высвобождения (MR) в 3 дополнительные лунки в планшете, содержащие меченые клетки-мишени, вносят по 50 мкл 2%-ного (VN) водного раствора неионогенного поверхностно-активного вещества (Nonidet, фирма Sigma, Сент-Луис) вместо раствора антитела (пункт IV, выше);
VI) для контроля спонтанного высвобождения (SR) в 3 дополнительные лунки в планшете, содержащие меченые клетки-мишени, вносят по 50 мкл RPMI-среды для культивирования клеток вместо раствора антитела (пункт IV, выше);
VII) затем 96-луночный титрационный микропланшет центрифугируют при 50×g в течение 1 мин и инкубируют в течение 1 ч при 4°С;
VIII) добавляют по 50 мкл суспензии РВМС (пункт I, выше) в каждую лунку для обеспечения соотношения эффекторная клетка:клетка-мишень 25:1, и планшеты помещают в инкубатор в атмосферу, содержащую 5% СО2, на 4 ч при 37°С;
IX) собирают бесклеточный супернатант из каждой лунки и количественно оценивают высвободившуюся в эксперименте радиоактивность (ER) с помощью гамма-счетчика;
X) рассчитывают процент удельного лизиса для каждой концентрации антитела с помощью формулы (ER-MR)/(MR-SR)×100, где ER представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для указанной концентрации антитела, MR представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для MR-контролей (см. пункт V, выше), a SR представляет собой среднюю радиоактивность (см. пункт IX, выше), определенную для SR-контролей (см. пункт VI, выше);
4) считают, что имеет место «повышенный уровень ADCC», если установлено: или повышение максимального процента удельного лизиса, обнаруженного в указанном выше диапазоне концентраций антитела, и/или снижение концентрации антитела, требуемой для достижения половины от максимального процента специфического лизиса, обнаруженного в указанном выше диапазоне концентраций антитела. Повышение уровня ADCC определяют относительно уровня ADCC, измеренного с помощью описанного выше анализа, опосредуемого таким же антителом, полученным с использованием такого же типа клеток-хозяев, с использованием таких же стандартных методов получения, приготовления форм и хранения, которые хорошо известны специалистам в данной области, но которое не получено с использованием клеток-хозяев, сконструированных так, что они сверхэкспрессируют GnTIII.
Указанную «повышенную (повышенный уровень) ADCC» можно получать с помощью модификации указанных антител методами гликоинженерии, что означает повышение встречающихся в естественных условиях опосредуемых клеткой эффекторных функций моноклональных антител путем конструирования их олигосахаридного компонента согласно методу, описанному у Umana, Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180 и в US №6602684.
Понятие «комплементзависимая цитотоксичность (CDC)» относится к лизису человеческих опухолевых клеток-мишеней антителом, предлагаемым в изобретении, в присутствии комплемента. CDC предпочтительно оценивают путем обработки препарата экспрессирующих CD20 клеток антителом к CD20, предлагаемым в изобретении, в присутствии комплемента. Считается, что имеет место CDC, если антитело при его использовании в концентрации 100 нМ индуцирует лизис (гибель клеток) 20% или большего количества опухолевых клеток в течение 4 ч. Анализ предпочтительно осуществляют с помощью меченных51Cr или Ей опухолевых клеток и оценивают высвобождение51Cr или Eu. В качестве контроля опухолевые клетки-мишени инкубируют с комплементом без антитела.
Антитело «ритуксимаб» (референс-антитело; пример антитела к CD20 типа I) представляет собой созданное с помощью генетической инженерии химерное человеческое/мышиное содержащее человеческую гамма-1 константную область моноклональное антитело к человеческому антигену CD20. Химерное антитело содержит человеческие гамма-1 константные области и оно идентифицировано под названием «С2 В8» в US №5736137 (Anderson K.С. и др.), выданном 17 апреля 1998 г. на имя фирмы IDEC Pharmaceuticals Corporation. Ритуксимаб разрешен для лечения пациентов, страдающих рецидивирующей или рефрактерной, низкой степени злокачественности или фолликулярной, CD20-позитивной, В-клеточной неходжкинской лимфомой. Изучение механизма действия в опытах in vitro продемонстрировало, что ритуксимаб обладает зависимой от человеческого комплемента цитотоксичностью (CDC) (Reff М.Е. и др., Blood 83(2), 1994, сс. 435-445). Кроме того, он обладает выраженной активностью в анализах по оценке антитело-обусловленной клеточнозависимой цитотоксичности (ADCC). Ритуксимаб не является афукозилированным.

Понятие «гуманизированное антитело B-Ly1» относится к гуманизированному антителу B-Ly1, описанному в WO 2005/044859 и WO 2007/031875, которое получали из мышиного моноклонального антитела к CD20 B-Ly1 (вариабельная область мышиной тяжелой цепи (VH): SEQ ID NO: 1; вариабельная область мышиной легкой цепи (VL): SEQ ID NO: 2 (см. Poppema S. и Visser L., Biotest Bulletin 3, 1987, cc. 131-139) путем химеризации с использованием человеческой константной области из IgG1 и последующей гуманизации (см. WO 2005/044859 и WO 2007/031875). Эти «гуманизированные антитела B-Ly1» описаны подробно в WO 2005/044859 и WO 2007/031875.
Согласно одному из вариантов осуществления изобретения «гуманизированное антитело B-Ly1» имеет вариабельную область тяжелой цепи (VH), выбранную из SEQ ID NO: 3 - SEQ ID NO: 19 (B-HH2-B-HH9 и B-HL8 -B-HL17, которые описаны в WO 2005/044859 и WO 2007/031875). В одном из конкретных вариантов осуществления изобретения указанный вариабельный домен выбирают из группы, состоящей из SEQ ID NO: 3, 4, 7, 9, 11, 13 и 15 (В-НН2, ВНН-3, В-НН6, В-НН8, B-HL8, B-HL11 и B-HL13 в WO 2005/044859 и WO 2007/031875). В предпочтительном варианте осуществления изобретения «гуманизированное антитело B-Ly1» имеет вариабельную область легкой (VL) SEQ ID NO: 20 (B-KV1 в WO 2005/044859 и WO 2007/031875). Согласно одному из конкретных вариантов осуществления изобретения «гуманизированное антитело B-Ly1» имеет вариабельную область тяжелой цепи (VH) SEQ ID NO: 7 (В-НН6 в WO 2005/044859 и WO 2007/031875), и имеет вариабельную область легкой цепи (VL) SEQ ID NO: 20 (B-KV1 в WO 2005/044859 и WO 2007/031875). Кроме того, в одном из вариантов осуществления изобретения гуманизированное антитело B-Ly1 предпочтительно представляет собой антитело изотипа IgG1. Указанные афукозилированные гуманизированные антитела B-Ly1, предлагаемые в изобретении, созданы с помощью гликоинженерии (GE) в Fc-области согласно методам, описанным в WO 2005/044859, WO 2004/065540, WO 2007/031875, у Umana Р. и др., Nature Biotechnol. 17, 1999, сс. 176-180 и WO 99/154342. Согласно одному из вариантов осуществления изобретения афукозилированное созданное с помощью гликоинженерии гуманизированное антитело B-Ly1 представляет собой В-НН6-B-KV1 GE. В одном из вариантов осуществления изобретения антитело к CD20 представляет собой обинутузумаб (рекомендованное INN, WHO Drug Information, т.26, №4, 2012, с. 453). В контексте настоящего описания обинутузумаб является синонимом GA101 или RO5072759. Это название заменяет все предыдущие версии (например, т. 25, №1, 2011, с. 75-76), и предыдущее название афутузумаб (рекомендованное INN, WHO Drug Information, т. 23, №2, 2009, с. 176; т. 22, №2, 2008, с. 124).
Указанные созданные с помощью гликоинженерии гуманизированные антитела B-Ly1 имеют измененную схему гликозилирования в Fc-области, предпочтительно имеют пониженный уровень остатков фукозы. Согласно одному из вариантов осуществления изобретения содержание фукозы составляет 60% или менее от общего количества олигосахаридов на Asn297 (в одном из вариантов осуществления изобретения содержание фукозы составляет от 40% до 60%, в другом варианте осуществления изобретения содержание фукозы составляет 50% или менее и еще в одном варианте осуществления изобретения содержание фукозы составляет 30% или менее). Согласно другому варианту осуществления изобретения олигосахариды Fc-области предпочтительно являются бисекционными. Эти созданные с помощью гликоинженерии гуманизированные антитела B-Ly1 обладают повышенной ADCC.
В контексте настоящего описания понятие «CD79b» относится к любому нативному CD79b, источником которого является любое позвоночное животное, включая млекопитающих, таких как приматы (например, человек, обезьяны циномолгус (cyno)) и грызуны (например, мыши и крысы), если не указано иное. В настоящем описании человеческий CD79b обозначен также как «PR036249» (SEQ ID NO: 22), и он кодируется нуклеотидной последовательностью (SEQ ID NO: 21), которая в настоящем описании обозначена также как «DNA225786». В настоящем описании CD79b обезьян циномолгус обозначен также как «cyno CD79b» или «PR0283627» (SEQ ID NO: 80), и он кодируется нуклеотидной последовательностью (SEQ ID NO: 79), которая в настоящем описании обозначена также как «DNA548455». Под понятие «CD79b» подпадает также «полноразмерный» непроцессированный CD79b, а также любая форма CD79b, полученная в результате процессинга в клетке. Понятие включает также встречающиеся в естественных условиях варианты CD79b, например, сплайсинговые варианты, аллельные варианты и изоформы. Представленные в настоящем описании полипептиды CD79b можно выделять из разнообразных источников, таких как различные типы человеческой ткани, или из другого источника, или получать с помощью методов рекомбинации или синтеза. «Полипептид CD79b с нативной последовательностью» содержит полипептид, имеющий ту же самую аминокислотную последовательность, что и соответствующий полипептид CD79b, полученный из природного источника. Такие полипептиды CD79b с нативной последовательностью можно выделять из природного источника или можно получать методами рекомбинации или синтеза. Понятие «полипептид CD79b с нативной последовательностью» специально включает встречающиеся в естественных условиях укороченные или секретируемые формы конкретного полипептида CD79b (например, последовательность внеклеточного домена), варианты встречающихся в естественных условиях форм (например, полученные в результате альтернативного сплайсинга формы) и встречающиеся в естественных условиях аллельные варианты полипептида.
В настоящем описании понятие «MA79b» или «мышиное антитело к CD79b», или «мышиное анти-CD79b антитело» применяют конкретно для обозначения мышиного моноклонального антитела к CD79b, где мышиное моноклональное антитело к CD79b содержит вариабельный домен легкой цепи, имеющий SEQ ID NO: 26 (фиг. 7), и вариабельный домен тяжелой цепи, имеющий SEQ ID NO: 29 (фиг. 8). Мышиное моноклональное антитело к CD79b можно покупать у коммерческих поставщиков, таких как фирма Biomeda (антитело к человеческому CD79b; Фостер-Сити, шт. Калифорния), фирма BDbioscience (антитело к человеческому CD79b; Сан-Диего, шт. Калифорния) или фирма Ancell (антитело к человеческому CD79b; Бэйпорт, шт. Миннесота), или создавать из клона гибридомы ЗА2-2Е7, находящегося в Американской коллекции типовых культур ткани (АТСС), номер депозита НВ11413, депонированного в АТСС 20 июля 1993 г.
В настоящем описании понятие «chMA79b» или «химерное антитело MA79b» применяют специально для обозначения химерного антитела к человеческому CD79b (ранее описанному в заявке на патент США №11/462336, зарегистрированной 3 августа 2006 г.), где химерное антитело к CD79b содержит легкую цепь, имеющую SEQ ID NO: 23. Легкая цепь, имеющая SEQ ID NO: 23, содержит также вариабельный домен, имеющий SEQ ID NO: 26 (фиг. 7) и константный домен легкой цепи человеческого IgG1. Химерное антитело к CD79b содержит также тяжелую цепь, имеющую SEQ ID NO: 24. Тяжелая цепь, имеющая SEQ ID NO: 24, содержит также вариабельный домен, имеющий SEQ ID NO: 29 (фиг. 8) и константный домен тяжелой цепи человеческого IgG1.
В настоящем описании понятие «антитело к cynoCD79b» или «анти-cyno CD79b» применяют для обозначения антител, которые связываются с cyno CD79b (SEQ ID NO: 80, ранее описана в заявке на патент США №11/462336, зарегистрированной 3 августа 2006 г.). В настоящем описании «анти-cynoCD79b (ch10D10)» или «ch10D10» применяют для обозначения химерного анти-cynoCD79b (ранее описанного в заявке на патент США №11/462336, зарегистрированной 3 августа 2006 г. ), которое связывается с cynoCD79b (SEQ ID NO: 80). AHTH-cynoCD79b(ch10D10) или ch10DIO представляет собой химерное антитело к cynoCD79b, которое содержит легкую цепь, имеющую SEQ ID NO: 81. AHTH-cynoCD79b(ch10D10) или ch10D10 содержит также тяжелую цепь, имеющую SEQ ID NO: 82.
В настоящем описании понятие «MA79b-трансплантат» или ««гуманизированное» антитело с трансплантированным MA79b», или «huMA79b-трансплантат» применяют специально для обозначения полученного в результате трансплантации продукта, который создан путем трансплантации гипервариабельных участков из мышиного антитела к CD79b (MA79b) в акцепторную человеческую консенсусную VL каппа I (huKI) и человеческую консенсусную VH подгруппы III (huIII) с модификациями R71A, N73T и L78A (Carter и др., Proc. Natl. Acad. Sci. USA, 89, 1992, с. 4285) (см. SEQ ID NO: 27 (фиг. 7) и SEQ ID NO: 30 (фиг. 8)).
Понятие «антитело к CD79b» или «антитело, которое связывается с CD79b» относится к антителу, которое обладает способностью связываться с CD79b с достаточной аффинностью, которая позволяет применять антитело в качестве диагностического и/или терапевтического средства для направленного воздействия на CD79b. Предпочтительно уровень связывания антитела к CD79b с неродственным белком, не представляющим собой CD79b, составляет менее чем примерно 10% от уровня связывания антитела к CD79b по данным измерений, например, с помощью радиоиммуноанализа (РИА). В некоторых вариантах осуществления изобретения антитело, которое связывается с CD79b, характеризуется константой диссоциации (Kd), составляющей ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1нМ или ≤0,1 нМ. В некоторых вариантах осуществления изобретения антитело к CD79b связывается с эпитопом CD79b, который является консервативным среди CD79b из различных видов. Понятие «антитело к CD79b» относится, в частности, к любому из антител к CD79b, описанных в WO 2009/099728, полное содержание которой включено в настоящее описание в качестве ссылки.
«Выделенное антитело» представляет собой антитело, которое идентифицировано и выделено и/или отделено от компонентов его естественного окружения. Загрязняющие компоненты, присутствующие в его естественном окружении, представляют собой субстанции, которые могут влиять на терапевтическое применение антитела и могут включать ферменты, гормоны и другие протеиногенные и непротеиногенные растворенные вещества. В предпочтительных вариантах осуществления изобретения антитело должно быть очищено (1) до уровня, составляющего более 95% в пересчете на массу антитела, по данным анализа методом Лоури, наиболее предпочтительно до уровня, составляющего более 99 мас. %, (2) до уровня, достаточного для получения по меньшей мере 15 остатков N-концевой или внутренней области аминокислотной последовательности с использованием секвенатора с вращающимся стаканом, или (3) до гомогенного состояния по данным анализа методом ДСН-ПААГ в восстанавливающих или невосстанавливающих условиях с использованием кумасси голубого или предпочтительно окрашивания серебром. К выделенному антителу относится антитело in situ в рекомбинантных клетках, если отсутствует по меньшей мере один компонент естественного окружения антитела. Однако, как правило, выделенное антитело получают с применением по меньшей мере одной стадии очистки.
Основная 4-цепочечная структурная единица антитела представляет собой гетеротетрамерный гликопротеин, состоящий двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей (антитело изотипа IgM состоит из 5 основных гетеротетрамерных структурных единиц и дополнительного полипептида, называемого J-цепью, и, следовательно, содержит 10 антигенсвязывающих сайтов, в то время как секретируемые антитела изотипа IgA могут полимеризоваться с образованием многовалентных ансамблей, содержащих 2-5 основных 4-цепочечных структурных единиц и J-цепь). В случае IgG 4-цепочечная структурная единица, как правило, имеет молекулярную массу примерно 150000 дальтон. Каждая L-цепь сцеплена с Н-цепью с помощью одной ковалентной дисульфидной связи, в то время как две Н-цепи сцеплены друг с другом с помощью одной или нескольких дисульфидных связей в зависимости от изотипа Н-цепи. Каждая Н- и L-цепь имеет также расположенные на определенном расстоянии друг от друга внутрицепочечные дисульфидные мостики. Каждая Н-цепь имеет на N-конце вариабельный домен (VH), за которым следуют три константных домена (CH) в каждой из α- и γ-цепей и четыре CH-домена в случае изотипов μ и ε. Каждая L-цепь имеет на N-конце вариабельный домен (VL), за которым следует расположенный на его другом конце константный домен (CL). VL выровнена с VH, и CL выровнен с первым константным доменом тяжелой цепи (CH1). Считается, что определенные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи. В результате спаривания VH VL друг с другом образуется один антигенсвязывающий сайт. Описание структуры и свойств различных классов антител см., например, в Basic and Clinical Immunology, 8-е изд., под ред. Daniel P. Stites, Abba I. Terr и Tristram G. Parslow, изд-во Appleton & Lange, Norwalk, CT, 1994, c. 71 и глава 6.
L-цепь из любого вида позвоночных может быть отнесена к одному из двух четко различающихся типов, которые обозначают каппа и лямбда на основе аминокислотных последовательностей их константных доменов. В зависимости аминокислотной последовательности константного домена их тяжелых цепей (CH) иммуноглобулины могут быть отнесены к различным классам или изотипам. Существуют пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, тяжелые цепи которых обозначают α, δ, ε, γ и μ соответственно. Классы у и а дополнительно подразделяют на подклассы на основе относительно небольших различий в последовательности и функции CH, например, в организме человека экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IGa1 и IgA2.
Понятие «вариабельная область» или «вариабельный домен» антитела относится к аминоконцевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи можно обозначать как «VH». Вариабельный домен легкой цепи можно обозначать как «VL». Указанные домены, как правило, представляют собой наиболее вариабельные участки антитела и содержат антигенсвязывающие сайты.
Понятие «вариабельный» характеризует тот факт, что последовательности определенных сегментов вариабельных доменов значительно отличаются друг от друга среди антител. V-домен опосредует связывание с антигеном и определяет специфичность конкретного антитела в отношении его конкретного антигена. Однако вариабельность не распределена равномерно по длине состоящих из 110 аминокислот вариабельных доменов. Фактически, V-области состоят из сравнительно инвариантных называемых каркасными участками (FR) сегментов, состоящих из 15-30 аминокислот, которые разделены более короткими участками, отличающимися очень сильной вариабельностью, которые называют «гипервариабельными участками», каждый из которых состоит из 9-12 аминокислот. Каждый из вариабельных доменов нативных тяжелой и легкой цепей содержит четыре FR, в значительной степени адаптированных к β-складчатой конфигурации, которые соединены тремя гипервариабельными участками, которые образуют петли, соединяющие и в некоторых случаях формирующие часть β-складчатой структуры. Гипервариабельные участки в каждой цепи поддерживаются в тесной близости друг к другу с помощью FR и вместе с гипервариабельными участками из другой цепи участвуют в образовании антигенсвязывающего сайта антител (см. Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но опосредуют различные эффекторные функции, такие как участие антитела в антитело-обусловленной клеточнозависимой цитотоксичности (ADCC).
«Интактное» антитело представляет собой антитело, которое содержит антигенсвязывающий сайт, а также CL и по меньшей мере константные домены тяжелой цепи CH1, СН2 и СН3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены с человеческой нативной последовательностью) или с вариантами указанной аминокислотной последовательности. Предпочтительно интактное антитело обладает одной или несколькими эффекторными функциями.
В контексте настоящего описания «оголенное антитело» представляет собой антитело, не конъюгированное с цитотоксическим фрагментом или радиоактивной меткой.
«Фрагменты антитела» содержат часть интактного антитела, предпочтительно антигенсвязывающую или вариабельную область интактного антитела. Примерами фрагментов антитела являются Fab-, Fab'-, F(ab')2- и Fv-фрагменты; димерные антитела (диабоди); линейные антитела (см. U.S. №5641870, пример 2; Zapata и др., Protein Eng. 8(10), 1995, сс. 1057-1062); одноцепочечные молекулы антитела и мультиспецифические антитела, образованные из фрагментов антител. В одном из вариантов осуществления изобретения фрагмент антитела содержит антигенсвязывающий сайт интактного антитела и, таким образом, сохраняет способность связываться с антигеном.
Расщепление антител папаином приводит к получению двух идентичных антигенсвязывающих фрагментов, которые называют «PAb»-фрагментами, и оставшегося «Рс»-фрагмента, его название отражает способность легко кристаллизоваться. Fab-фрагмент состоит из полной L-цепи наряду с доменом вариабельной области Н-цепи (VH) и первого константного домена одной из тяжелых цепей (CH1). Каждый Fab-фрагмент является одновалентным с точки зрения связывания с антигеном, т.е. он имеет один антигенсвязывающий сайт. Обработка антитела пепсином приводит к получению одного крупного F(ab')2-фрагмента, который примерно соответствует двум связанным дисульфидом Fab-фрагментам, он обладает двухвалентной антигенсвязывающей активностью и также еще сохраняет способность перекрестно сшиваться с антигеном. Fab'-фрагменты отличаются от Fab-фрагментов наличием дополнительных нескольких остатков на карбокси-конце CH1-домена, включая один или несколько цистеинов из шарнирной области антитела. В настоящем описании Fab'-SH обозначает Fab', в котором остаток(ки) цистеина в константных доменах несут свободную тиольную группу. F(ab')2-фрагменты антитела исходно получали в виде пар Fab'-фрагментов, между которыми находились шарнирные цистеины. Известны также и другие химические сочетания фрагментов антител.
Fc-фрагмент содержит карбокси-концевые участки обеих Н-цепей, которые соединены друг с другом дисульфидами. Эффекторные функции антител определяются последовательностями Fc-области, указанная область представляет собой также участок, распознаваемый Fc-рецепторами (FcR), присутствующими на определенных типах клеток.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий сайт. Этот фрагмент состоит из димера, содержащего один домен вариабельной области тяжелой цепи и один домен вариабельной области легкой цепи, находящихся в тесной нековалентной ассоциации. В одноцепочечных типах Fv (scFv) один домен вариабельной области тяжелой цепи и один домен вариабельной области легкой цепи могут быть ковалентно сцеплены с помощью гибкого пептидного линкера, в результате чего легкая и тяжелая цепи могут быть ассоциированы в виде «димерной» структуры, аналогичной структуре, присущей двухцепочечным типам Fv. В результате укладки этих двух доменов возникают шесть гипервариабельных петель (по 3 петли из каждой Н- и L-цепи), аминокислотные остатки которых участвуют в связывании с антигеном и придают антителу антигенсвязывающую специфичность. Однако, даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных в отношении антигена) обладает способностью распознавать антиген и связываться с ним, хотя и с более низкой аффинностью, чем полный связывающий сайт.
«Одноцепочечные Fv», которые сокращенно обозначают также как «sFv» или «scFv», представляют собой фрагменты антител, которые содержат VH- и VL-домены антитела, соединенные в виде одной полипептидной цепи. Предпочтительно полипептид sFv содержит также полипептидный линкер между VH- и VL-доменами, который позволяет sFv формировать структуру, необходимую для связывания с антигеном. Обзор sFv представлен у Pluckthun в The Pharmacology of Monoclonal Antibodies, т. 113, под ред. Rosenburg and Moore, изд-во Springer-Verlag, New York, 1994, cc. 269-315; Borrebaeck, 1995, ниже.
Понятие «диабоди» относится к фрагментам антител с двумя антигенсвязывающими сайтами, указанные фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL), в виде одной полипептидной цепи (VH-VL). Небольшие фрагменты антител получают путем конструирования sFv-фрагментов (см. предыдущий раздел) с использованием коротких линкеров (состоящих примерно из 5-10 остатков) между VH- и VL-доменами, в результате чего обеспечивается межцепочечное, но не внутрицепочечное спаривание V-доменов, приводящее к образованию двухвалентного фрагмента, т.е. фрагмента, имеющего два антигенсвязывающих сайта. Диабоди могут быть двухвалентными или биспецифическими. Биспецифические диабоди представляют собой гетеродимеры, содержащие два «кроссовер»-sFv-фрагмента, в которых VH- и VL-домены двух антител присутствуют на различных полипептидных цепях. Диабоди описаны более подробно, например, в ЕР 404097; WO 93/11161; у Hudson и др., Nat. Med. 9, 2003, сс. 129-134; и Hollinger и др., Proc. Natl. Acad. Sci. USA, 90, 1993, cc. 6444-6448. У Hudson и др., Nat. Med. 9, 2003, cc. 129-134 описаны триабоди и тетрабоди.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны друг другу за исключением возможных встречающиеся в естественных условиях мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высоко специфичными, они направлены против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело направлено против одной детерминанты антигена. Помимо своей специфичности моноклональные антитела обладают тем преимуществом, что их можно синтезировать без загрязнения другими антителами. Прилагательное «моноклональный» не означает, что антитело требуется получать каким-либо конкретным методом. Например, моноклональные антитела, которые можно применять согласно настоящему изобретению, можно получать методом гибридом, впервые описанным Kohler и др., Nature, 256, 1975, с. 495, или можно создавать методами рекомбинантной ДНК в бактериальных, эукариотических животных или растительных клетках (см., например, U.S. №4816567). «Моноклональные антитела» можно выделять также из фаговых библиотек с помощью методов, описанных, например, у Clackson и др., Nature, 352, 1991, сс. 624-628 и у Marks и др., J. Mol. Biol., 222, 1991, сс. 581-597.
В контексте настоящего описания моноклональные антитела включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, происходящих из конкретных видов или относящихся к конкретному классу или подклассу антител, в то время как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям антител, происходящих из других видов или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, если они обладают требуемой биологической активностью (см. U.S. №4816567; и Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, cc. 6851-6855). В контексте настоящего описания представляющие интерес химерные антитела включают «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, происходящие из примата кроме человека (например, обезьяны Старого Света, человекообразной обезьяны и т.д.), и человеческие последовательности константной области.
«Гуманизированные» формы нечеловеческих антител (например, антител грызунов) представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую из нечеловеческого антитела. В основном, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из гипервариабельного участка реципиента заменены на остатки из гипервариабельного участка вида животного кроме человека (донорское антитело), такого как мышь, крыса, кролик или примат кроме человека, обладающего требуемой специфичностью, аффинностью и свойствами антитела. В некоторых случаях остатки каркасного участка (FR) человеческого иммуноглобулина заменяют на соответствующие нечеловеческие остатки. Кроме того, гуманизированные антитела могут содержать остатки, не присутствующие в реципиентном антителе или в донорском антителе. Такие модификации осуществляют для дополнительного улучшения характеристик антитела. В целом, гуманизированное антитело должно содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в котором(ых) все или практически все гипервариабельные петли соответствуют петлям нечеловеческого иммуноглобулина, а все или практически все FR представляют собой FR из последовательности человеческого иммуноглобулина. Гуманизированное антитело необязательно может содержать также по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, человеческого иммуноглобулина. Более подробное описание см. у Jones и др., Nature 321, 1986, сс. 522-525; Riechmann и др., Nature 332, 1988, сс. 323-329; и Presta, Curr. Op. Struct. Biol. 2, 1992, cc. 593-596. См. также следующие обзорные статьи и процитированные в них ссылки: Vaswani и Hamilton, Ann. Allergy, Asthma and Immunol., 1, 1998, cc. 105-115; Harris, Biochem. Soc. Transactions, 23, 1995, cc. 1035-1038; Hurle и Gross, Curr. Op. Biotech., 5, 1994, cc. 428-433.
В контексте настоящего описания приставка «тио» применительно к антителу относится к сконструированному с помощью цистеина антителу, а приставка «hu» применительно к антителу в контексте настоящего описания относится к гуманизированному антителу.
«Человеческое антитело» представляет собой антитело, имеющее аминокислотную последовательность, которая соответствует последовательности антитела, полученного в организме человека и/или созданного с помощью любых методов получения человеческих антител, представленных в настоящем описании. Это определение человеческого антитела специально исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки. Человеческие антитела можно получать с помощью различных методов, известных в данной области, включая фаговые дисплейные библиотеки (Hoogenboom и Winter, J. Mol. Biol., 227, 1991, с. 381; Marks и др., J. Mol. Biol., 222, 1991, с. 581). Для получения человеческих моноклональных антител можно применять также методы, описанные у Cole и др., Monoclonal Antibodies and Cancer Therapy, изд-во Alan R. Liss, 1985, c. 77; Boerner и др., J. Immunol, 147(1), 1991, cc. 86-95. См. также van Dijk и van de Winkel, Curr. Opin. Pharmacol., 5, 2001, cc. 368-374. Человеческие антитела можно получать путем введения антигена трансгенному животному, которое было модифицировано для продуцирования таких антител в ответ на контрольное заражение антигеном, но у которого нарушены эндогенные локусы, такому, например, как иммунизированная ксеномышь (см., например, U.S. №» 6075181 и 6150584 касательно технологии XENOMOUSE™). См. также, например, Li и др., Proc. Natl. Acad. Sci. USA, 103, 2006, cc. 3557-3562 касательно человеческих антител, созданных с помощью технологии на основе человеческой В-клеточной гибридомы.
В контексте настоящего описания понятие «гипервариабельный участок», «HVR», или «HV» относится к участкам вариабельного домена антитела, которые характеризуются гипервариабельностью последовательности и/или образуют структурно выраженные петли. Как правило, антитела содержат шесть гипервариабельных участков; три в VH (HI, Н2, НЗ) и три в VL (L1, L2, L3). Известен ряд определений гипервариабельного участка и они применяются в настоящем описании. Согласно Кэботу определяющие комплементарность участки (CDR) выявляют на основе вариабельности последовательности, и этот подход используют наиболее часто (Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991). Определение согласно Хотиа основано вместо этого на положении структурных петель (Chothia и Lesk J. Mol. Biol. 196, 1987, cc. 901-917). Конец CDR-H1-петли по Хотиа, если нумерацию осуществляют с использованием системы нумерации Кэбота, варьируется между положениями Н32 и Н34 в зависимости от длины петли (это обусловлено тем, что в схеме нумерации Кэбота используются инсерции в Н35А и Н35В; если отсутствуют и 35А, и 35В, то петля оканчивается в положении 32; если присутствует только 35А, то петля оканчивается в положении 33; если присутствуют оба 35А и 35 В, то петля оканчивается в положении 34). Определение гипервариабельных областей согласно AbM представляет собой компромисс между CDR по Кэботу и структурными петлями по Хотиа, оно используется в программе моделирования антитела, разработанной Oxford Molecular's AbM. «Контактные» гипервариабельные участки определяют на основе анализа пригодных комплексных кристаллических структур. Ниже представлены остатки, входящие в каждый из указанных гипервариабельных участков.

Гипервариабельные участки могут содержать «удлиненные гипервариабельные участки», такие как: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 (L3) в VL и 26-35 В (HI), 50-65, 47-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (НЗ) в VH. Остатки вариабельного домена нумеруют согласно Kabat и др., выше, для каждого из указанных определений.
Остатки «каркасного участка» или «FR» представляют собой остатки вариабельного домена, отличные от остатков гипервариабельного участка, указанных в настоящем описании.
Понятие «нумерация остатков вариабельного домена по Кэботу» или нумерация аминокислотных положений по Кэботу» и их варианты относятся к системе нумерации, применяемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи, представленной в справочнике антител Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD., 1991. При использовании указанной системы нумерации следует иметь в виду, что фактическая аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительные аминокислоты, что соответствует укорочению или инсерции в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать инсерцию одной аминокислоты (остаток 52а согласно Кэботу) после остатка 52 в Н2 и инсерции остатков (например, остатков 82а, 82b и 82 с и т.д. согласно Кэботу) после остатка 82 в FR тяжелой цепи. Для рассматриваемого антитела нумерацию остатков по Кэботу можно определять путем выравнивания областей гомологии последовательности антитела со «стандартной» последовательностью, пронумерованной по Кэботу.
Систему нумерации по Кэботу, как правило, применяют для обозначения номера остатка в вариабельном домене (примерно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (см., например, Kabat и др., Sequences of Immunological Interest. 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, Md., 1991). «EU-систему нумерации» или «EU-индекс», как правило, применяют для обозначения номера остатка в константной области тяжелой цепи иммуноглобулина (описание EU-индекса дано, например, у Kabat и др., выше). «EU-индекс по Кэботу» относится к нумерации остатков в человеческом EU-антителе IgG1-типа. Если в настоящем описании не указано иное, то при ссылке на номера остатков в вариабельном домене антител подразумевается, что остатки пронумерованы согласно системе нумерации по Кэботу. Если в настоящем описании не указано иное, то при ссылке на номера остатков в константном домене антител подразумевается, что остатки пронумерованы согласно EU-системе нумерации по Кэботу (см., например, предварительную заявку на патент США №60/640323, чертежи, касающиеся EU-нумерации).
Антитело «с созревшей аффинностью» означает антитело с одним или несколькими изменениями в одном или нескольких HVR, приводящими к повышению аффинности антитела к антигену по сравнению с родительским антителом, которое не содержит указанного(ых) изменения(й). Предпочтительно антитела с созревшей аффинностью характеризуются аффинностью к антигену-мишени, находящейся в наномолярном или даже в пикомолярном диапазоне. Антитела с созревшей аффинностью получают с помощью процедур, известных в данной области. У Marks и др., Bio/Technology 10, 1992, сс. 779-783 описан метод осуществления созревания аффинности путем перестановки доменов VH и VL. Неспецифический мутагенез остатков HVR и/или каркасных участков описан у: Barbas и др., Proc Nat. Acad. Sci, USA 91, 1994, cc. 3809-3813; Schier и др., Gene 169, 1995, cc. 147-155; Yelton и др., J. Immunol. 155, 1995, cc. 1994-2004; Jackson и др., J. Immunol. 154(7), 1995, cc. 3310-3319; и Hawkins и др., J. Mol. Biol. 226, 1992, cc. 889-896.
«Блокирующее» антитело или «антагонистическое» антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. Предпочтительно блокирующие антитела или антагонистические антитела практически полностью или полностью ингибируют биологическую активность антигена.
В контексте настоящего описания «агонистическое антитело» представляет собой антитело, которое имитирует по меньшей мере один из видов функциональной активности представляющего интерес полипептида.
«Видозависимое (видоспецифическое) антитело», например, античеловеческое антитело млекопитающего IgE-типа, представляет собой такое антитело, которое обладает более сильной аффинностью связывания с антигеном первого вида млекопитающего по сравнению с гомологом этого антигена у второго вида млекопитающего. В норме видозависимое антитело «специфически связывается» с человеческим антигеном (то есть характеризуется величиной аффинности связывания (Kd), составляющей не более чем приблизительно 1×10-7 М, предпочтительно, не более чем приблизительно 1×10-8 М, наиболее предпочтительно, не более чем приблизительно 1×10-9 М), но характеризуется аффинностью связывания с гомологом антигена из второго вида млекопитающего, отличного от человека, которая по меньшей мере примерно в 50 раз или, по меньшей мере примерно в 500 раз или, по меньшей мере примерно в 1000 раз слабее его аффинности связывания с человеческим антигеном. Видозависимым антителом может быть любое из антител различных типов, определенных выше, но, предпочтительно, оно представляет собой гуманизированное или человеческое антитело.
Понятие «аффинность связывания», как правило, относится к сумме всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). В контексте настоящего описания, если не указано иное, «аффинность связывания» относится к присущей молекуле аффинности связывания, отражающей взаимодействие по типу 1:1 между компонентами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y, как правило, можно характеризовать с помощью константы диссоциации (Kd). Аффинность можно оценивать с помощью общепринятых методов, известных в данной области, включая те, которые представлены в настоящем описании. Антитела с низкой аффинностью, как правило, медленнее связываются с антигеном и имеют тенденцию к более легкой диссоциации, в то время как высокоаффинные антитела, как правило, связываются с антигеном быстрее и имеют тенденцию оставаться в связанном состоянии в течение более продолжительного периода времени. В данной области известны различные методы оценки аффинности связывания, любые из них можно применять для целей настоящего изобретения. Ниже в качестве иллюстрации представлены конкретные варианты осуществления изобретения.
В контексте настоящего описания выражение «или лучше (или менее)» применительно к аффинности связывания относится к более сильному связыванию молекулы с ее партнером по связыванию. В контексте настоящего описания выражение «или лучше (или менее)» относится к более сильному связыванию, которое характеризуется более низким численным значением Kd. Например, для антитела, которое имеет аффинность к антигену «0,6 нМ или лучше» («0,6 нМ или менее»), аффинность к антигену составляет <0,6 нМ, т.е. 0,59, 0,58, 0,57 нМ или имеет любое значение, меньшее 0,6 нМ.
В одном из вариантов осуществления изобретения «Kd» или «величину Kd» согласно настоящему изобретению измеряют с помощью анализа связывания несущего радиоактивную метку антигена (RIA), который осуществляют с использованием Fab-версии представляющего интерес антитела и его антигена согласно описанному ниже протоколу анализа, в котором измеряют в растворе аффинность связывания Fab с антигеном путем уравновешивания Fab минимальной концентрацией1251-меченного антигена в присутствии титрационных разведений немеченого антигена, осуществляя затем захват антигена на сенсибилизированном антителом к Fab планшете (Chen, и др., J. Mol Biol 293, 1999, сс. 865-881). Для обеспечения условий, необходимых для проведения анализа, титрационные микропланшеты (фирма Dynex) сенсибилизируют в течение ночи захватывающим антителом к Fab (фирма Cappel Labs) в концентрации 5 мкг/мл в 50 мМ карбонате натрия (рН 9,6) и затем блокируют с помощью 2% (мас./об) бычьего сывороточного альбумина в ЗФР в течение 2-5 ч при комнатной температуре (примерно 23°С). В неадсорбирующем планшете (фирма Nunc, №269620) смешивают взятый в концентрации 100 или 26 пМ меченный с помощью125I антиген с серийными разведениями представляющего интерес Fab (например, пригодного для оценки антитела к VEGF, Fab-12, см. Presta и др., Cancer Res. 57, 1997, сс.4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубацию можно осуществлять в течение более продолжительного периода времени (например, в течение 65 ч) для того, чтобы гарантировать достижение равновесия. После этого смеси переносят в подготовленный для захвата планшет и инкубируют при комнатной температуре (например, в течение 1 ч). Затем раствор удаляют и планшет промывают восемь раз 0,1% Твин-20 в ЗФР. После просушки планшетов в них добавляют по 150 мкл/лунку сцинтилляционной жидкости (MicroScint-20; фирма Packard) и осуществляют считывание планшетов с помощью гамма-счетчика Topcount (фирма Packard) в течение 10 мин. Для осуществления анализа связывания в условиях конкуренции выбирают концентрации каждого Fab, обеспечивающие уровень связывания, составляющий менее или равный 20% от максимального.
Согласно другому варианту осуществления изобретения Kd или величину Kd измеряют методом поверхностного плазмонного резонанса с помощью устройства BIAcoreTM-2000 или BIAcoreTM-3000 (фирма BIAcore, Inc., Пискатавей, шт. Нью-Джерси) при 25°С с использованием СМ5-чипов с иммобилизованным антигеном при уровне иммобилизации, соответствующем ~10 единиц ответа (RU). В целом метод заключается в следующем. Биосенсорные чипы на основе карбоксиметилированного декстрана (СМ5, фирма BIAcore Inc.) активируют с помощью гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям поставщика. Антиген разводят 10 мМ ацетатом натрия, рН 4,8 до концентрации 5 мкг/мл (~0,2 мкМ), после чего осуществляют инъекцию при скорости потока 5 мкл/мин до достижения уровня связанного белка, соответствующего примерно 10 единицам ответа (RU). После инъекции антигена осуществляют инъекцию 1М этаноламина для блокирования непрореагировавших групп. Для измерения кинетических характеристик инъецируют двукратные серийные разведения Fab (от 0,78 до 500 нМ) в ЗФР, содержащем 0,05% Твин 20 (PBST) при 25°С при скорости потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают на основе лэнгмюровской модели связывания 1:1 (программа BIAcore Evaluation Software, версия 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия диссоциации (Kd) рассчитывают в виде отношения koff/kon (см., например, Chen Y., и др., J. Mol Biol, 293, 1999, сс. 865-881). Если величина скорости ассоциации превышает 106М-1⋅c-1 по данным описанного выше анализа методом поверхностного плазмонного резонанса, то скорости ассоциации можно определять методом флуоресцентного гашения, который позволяет измерять увеличение или уменьшение интенсивности эмиссии флуоресценции (длина волны возбуждения = 295 нМ; длина волны испускания = 340 нМ, полоса пропускания 16 нМ) при 25°С с использованием 20 нМ антитела к антигену (Fab-форма) в ЗФР, рН 7,2, в присутствии антигена в возрастающих концентрациях, которую измеряют спектрометром, таким как спектрофотометр, снабженный устройством для остановки потока (фирма Aviv Instruments), или спектрофотометр SLM-Aminco серии 8000 (фирма ThermoSpectronic) с перемешиваемой красной кюветой.
Согласно настоящему изобретению «on-скорость» или «скорость ассоциации» или «скорость ассоциирования» или «kon» можно определять также описанным выше методом поверхностного плазмонного резонанса с использованием устройства В1Асоге™-2000 иди В1Асоге™-3000 (фирма BIAcore, Inc., Пискатавей, шт. Нью-Джерси) как описано выше.
В контексте настоящего описания выражение «практически сходный» или «практически одинаковый» означает достаточно высокую степень близости двух численных значений (одно из которых, как правило, ассоциировано с антителом, предлагаемым в изобретении, а другое ассоциировано с референс-антителом/антителом, с которым производится сравнение), так что специалист в данной области может рассматривать разницу между двумя значениями как имеющую небольшую биологическую или статистическую значимость или не имеющую статистической значимости с точки зрения биологических характеристик, оцениваемых указанными величинами (например, значения Kd). Разница между указанными двумя значениями предпочтительно составляет менее примерно 50%, предпочтительно менее примерно 40%, предпочтительно менее примерно 30%, предпочтительно менее примерно 20%, предпочтительно менее примерно 10% относительно значения для референс-антитела/антитела, с которым производится сравнение.
В контексте настоящего описания выражение «существенно более низкий» или «существенно отличающийся» означает достаточно высокую степень различия между двумя численными значениями (одно из которых, как правило, ассоциировано с антителом, предлагаемым в изобретении, а другое ассоциировано с референс-антителом/антителом, с которым производится сравнение), так что специалист в данной области может рассматривать разницу между двумя значениями как статистически значимую с точки зрения биологических характеристик, оцениваемых указанными величинами (например, значения Kd, НАМА-ответ). Разница между указанными двумя значениями предпочтительно составляет более примерно 10%, предпочтительно более примерно 20%, предпочтительно более примерно 30%, предпочтительно более примерно 40%, предпочтительно более примерно 50% относительно значения для референс-антитела/антитела, с которым производится сравнение.
«Антиген» представляет собой заранее определенный антиген, с которым антитело может избирательно связываться. Антиген-мишень может представлять собой полипептид, углевод, нуклеиновую кислоту, липид, гаптен или иное встречающееся в естественных условиях или синтетическое соединение. Предпочтительно антиген-мишень представляет собой полипептид.
Для целей настоящего изобретения понятие «акцепторный человеческий каркасный участок» обозначает каркасный участок, содержащий аминокислотную последовательность каркасного участка VL или VH, происходящую из каркасного участка человеческого иммуноглобулина или из человеческого консенсусного каркасного участка. Акцепторный человеческий каркасный участок «происходящий из» каркасного участка человеческого иммуноглобулина или человеческого консенсусного каркасного участка, может содержать ту же самую аминокислотную последовательность, что и указанные участки, или может содержать существовавшие ранее изменения аминокислотной последовательности. В случае наличия существовавших ранее аминокислотных изменений предпочтительно присутствуют не более 5 и предпочтительно не более 4 или меньшее количество, или 3 или меньшее количество существовавших ранее аминокислотных изменений. Если существовавшие ранее аминокислотные изменения присутствуют в VH, то предпочтительно указанные изменения присутствуют только в трех, двух или одном из положений 71Н, 73Н и 78Н; например, аминокислотные остатки в этих положениях могут представлять собой 71А, 73Т и/или 78А. В одном из вариантов осуществления изобретения акцепторный человеческий каркасный участок VL идентичен последовательности каркасного участка человеческого иммуноглобулина или человеческого консенсусного каркасного участка VL.
«Человеческий каркасный участок» представляет собой каркасный участок, который имеет наиболее часто встречающиеся аминокислотные остатки в выборке последовательностей каркасных участков VL или VH человеческого иммуноглобулина. Как правило, выборку последовательностей VL или VH человеческого иммуноглобулина осуществляют из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу согласно Kabat и др. В одном из вариантов осуществления изобретения в случае VL подгруппа представляет собой подгруппу каппа I согласно Kabat и др. В одном из вариантов осуществления изобретения в случае VH подгруппа представляет собой подгруппу III согласно Kabat и др.
«Консенсусный каркасный участок VH подгруппы III» содержит консенсусную последовательность, полученную из аминокислотных последовательностей вариабельной тяжелой цепи подгруппы III согласно Kabat и др. В одном из вариантов осуществления изобретения аминокислотная последовательность консенсусного каркасного участка VH подгруппы III содержит по меньшей мере часть каждой из представленных ниже последовательностей или всю ее полностью:

«Консенсусный каркасный участок VL подгруппы I» содержит консенсусную последовательность, полученную из аминокислотных последовательностей вариабельной легкой каппа-цепи подгруппы I согласно Kabat и др. В одном из вариантов осуществления изобретения аминокислотная последовательность консенсусного каркасного участка VL подгруппы I содержит по меньшей мере часть каждой из представленных ниже последовательностей или всю ее:

В контексте настоящего описания «немодифицированный каркасный участок» представляет собой человеческий каркасный участок, который имеет такую же аминокислотную последовательность, что и акцепторный человеческий каркасный участок, например, отсутствует(ют) замены человеческих аминокислот на нечеловеческие аминокислоты в акцепторном человеческом каркасном участке.
В контексте настоящего описания «измененный гипервариабельный участок» представляет собой гипервариабельный участок, содержащий одну или несколько (например, от одной до примерно 16) аминокислотных замен.
В контексте настоящего описания «немодифицированный гипервариабельный участок» представляет собой гипервариабельный участок, имеющий ту же самую аминокислотную последовательность, что и последовательность нечеловеческого антитела, из которого она происходит, т.е. она не содержит одну или несколько аминокислотных замен.
«Антитело, которое связывается» с представляющим интерес антигеном, например, полипептидом ассоциированного с опухолью антигена-мишени, представляет собой антитело, которое связывается с антигеном с аффинностью, достаточной для того, чтобы антитело можно было применять в качестве терапевтического средства для направленного воздействия на клетку или ткань, экспрессирующую антиген, и не обладает значительной перекрестной реактивностью в отношении других белков. В таких вариантах осуществления изобретения степень связывания антитела с белком, «не представляющим собой мишень», может составлять менее чем примерно 10% от связывания антитела с конкретным белком-мишенью по данным анализа методом с использованием клеточного сортера с возбуждением флуоресценции (FACS) или радиоиммунопреципитации (RIA). Касательно связывания антитела с молекулой-мишенью понятие «специфическое связывание» или «специфически связывается с», или «обладает специфичностью к», применяемое в отношении конкретного полипептида или эпитопа на конкретном полипептиде-мишени, означает связывание, которое с помощью измерений можно отличить от неспецифического взаимодействия. Специфическое связывание можно оценивать, например, путем измерения связывания молекулы по сравнению со связыванием контрольной молекулы, которая, как правило, представляет собой молекулу, имеющую сходную структуру, но не обладающую связывающей активностью. Например, специфическое связывание можно оценивать в условиях конкуренции с использованием контрольной молекулы, сходной с мишенью, например, применяя избыток немеченой мишени. В этом случае считается, что имеет место специфическое связывание, если происходит ингибирование связывания меченой мишени с зондом в условиях конкуренции при использовании избытка немеченой мишени. Понятие «специфическое связывание» или «специфически связывается с», или «обладает специфичностью к», применяемое в отношении конкретного полипептида или эпитопа на конкретном полипептиде-мишени, может относиться, например, к молекуле, имеющей величину Kd в отношении мишени, которая составляет по меньшей мере примерно 10-4 М, в другом варианте по меньшей мере примерно 10-5 М, в другом варианте по меньшей мере примерно 10-6 М, в другом варианте по меньшей мере примерно 10-7 М, в другом варианте по меньшей мере примерно 10-8 М, в другом варианте по меньшей мере примерно 10-9 М, в другом варианте по меньшей мере примерно 10-10 М, в другом варианте по меньшей мере примерно 10-11 М, в другом варианте по меньшей мере примерно 10-12 М или менее. В одном из вариантов осуществления изобретения понятие «специфическое связывание относится к такому связыванию, когда молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде, но практически не связывается с любым другим полипептидом или эпитопом на полипептиде.
Антитело, которое «ингибирует рост опухолевых клеток, экспрессирующих полипептид CD79b» или «ингибирующее рост» антитело представляет собой антитело, которое вызывает поддающееся измерению ингибирование роста раковых клеток, экспрессирующих или сверхэкспрессирующих соответствующий полипептид CD79b. Полипептид CD79b может представлять собой трансмембранный полипептид, экспрессируемый на поверхности раковой клетки, или может представлять собой полипептид, который продуцируется и секретируется раковой клеткой. Предпочтительные ингибирующие рост антитела к CD79b ингибируют рост экспрессирующих CD79b опухолевых клеток более чем на 20%, предпочтительно от примерно 20 до примерно 50%, и еще более предпочтительно более чем на 50% (например, от примерно 50 до примерно 100%) по сравнению с соответствующим контролем, где контроль, как правило, представляет собой опухолевые клетки, не обработанные тестируемым антителом. В одном из вариантов осуществления изобретения ингибирование роста можно измерять при концентрации антитела, составляющей примерно от 0,1 до 30 мкг/мл или примерно от 0,5 до 200 нМ, в клеточной культуре, где ингибирование роста определяют через 1-10 дней после обработки опухолевых клеток антителом. Ингибирование роста опухолевых клеток in vivo можно определять различными путями, такими как описанные ниже в разделе «Экспериментальные примеры». Считается, что антитело ингибирует рост in vivo, если введение антитела к CD79b в дозе, составляющей от примерно 1 мкг/кг до примерно 100 мг/кг веса тела приводит к уменьшению размера опухоли или пролиферации опухолевых клеток в течение периода времени примерно от 5 дней до 3 месяцев после первого введения антитела, предпочтительно в течение примерно от 5 до 30 дней.
Антитело, которое «индуцирует апоптоз», представляет собой антитело, индуцирующее запрограммированную гибель клеток, которую оценивают по связыванию аннексина V, фрагментации ДНК, сжатию клеток, расширению эндоплазматического ретикулума, клеточной фрагментации и/или образованию мембранных везикул (которые называют апоптозными тельцами). Клетка, как правило, представляет собой клетку, сверхэкспрессирующую полипептид CD79b. Предпочтительно клетка представляет собой опухолевую клетку, например, гематопоэтическую клетку, такую как В-клетка, Т-клетка, базофил, эозинофил, нейтрофил, моноцит, тромбоцит или эритроцит. Можно применять различные методы для оценки клеточных событий, ассоциированных с апоптозом. Например, транслокацию фосфатидилсерина (PS) можно измерять по связыванию аннексина; фрагментацию ДНК можно оценивать с помощью электрофоретического расщепления ДНК; а конденсацию (ядерного) хроматина наряду с фрагментацией ДНК можно оценивать по любому увеличению количества гиподиплоидных клеток. Предпочтительно антитело, индуцирующее апоптоз, представляет собой антитело, которое приводит примерно к 2-50-кратной, предпочтительно примерно к 5-50-кратной, и наиболее предпочтительно примерно к 10-50-кратной индукции связывания аннексина по сравнению с необработанной клеткой по данным анализа связывания аннексина.
Антитело, которое «индуцирует гибель клетки», представляет собой антитело, которое приводит к тому, что живая клетка погибает. Клетка представляет собой клетку, которая экспрессирует полипептид CD79b, и она относится к клеточному типу, который характеризуется специфической экспрессией или сверхэкспрессией полипептида CD79b. Клетка может представлять собой раковую или здоровую клетку конкретного клеточного типа. Полипептид CD79b может представлять собой трансмембранный полипептид, экспрессируемый на поверхности раковой клетки, или может представлять собой полипептид, который продуцируется и секретируется раковой клеткой. Клетка может представлять собой раковую клетку, например, В-клетку или Т-клетку. Гибель клеток in vitro можно определять в отсутствии комплемента и иммунных эффекторных клеток для того, чтобы отличать ее от гибели клеток, индуцируемой антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC) или комплементзависимой цитотоксичностью (CDC). Так, анализ гибели клеток можно осуществлять с использованием инактивированной тепловой обработкой сыворотки (т.е. в отсутствии комплемента) и в отсутствии иммунных эффекторных клеток. Для определения того, обладает ли антитело способностью индуцировать гибель клеток, можно оценивать нарушение целостности мембраны по поглощению пропидия йодида (PI), трипанового синего (см. Moore и др., Cytotechnology 17, 1995, сс. 1-11) или 7AAD по сравнению с необработанными клетками. Предпочтительными индуцирующими гибель клеток антителами являются антитела, которые индуцируют поглощение PI при проведении анализа поглощения PI на клетках линии ВТ474.
Понятие «эффекторные функции» антитела относится к видам биологической активности, которые могут опосредоваться Fc-областью (имеющей нативную последовательность Fc-областью или Fc-областью, имеющей вариант указанной аминокислотной последовательности) антитела и варьируются в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность; связывание Fc-рецептора; антитело-обусловленную клеточнозависимую цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора); и активацию В-клеток.
В контексте настоящего описания понятие «Fc-область» используют для определения С-концевой области тяжелой цепи иммуноглобулина, включая имеющие нативные последовательности Fc-области и варианты Fc-областей. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи человеческого IgG, как правило, определяют как участок, простирающийся от аминокислотного остатка в положении Cys226 или от Pro230, до ее карбокси-конца. С-концевой лизин (остаток 447 согласно EU-системе нумерации) Fc-области может быть удален, например, в процессе производства или очистки антитела, или при создании методами рекомбинации нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Таким образом, композиция интактных антител может содержать популяции антител, в которых удалены все остатки K447, популяции антител, в которых не удален ни один из остатков K447, и популяции антител, в которых присутствует смесь антител, как с удаленным, так и сохраненным остатком K447.
«Функциональная Fc-область» обладает «эффекторной функцией», присущей Fc-области, имеющей нативную последовательность. Примеры «эффекторных функций» включают связывание C1q; CDC; связывание Fc-рецептора; ADCC; фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора; BCR) и т.д. Такие эффекторные функции, как правило, требуют, чтобы Fc-область была объединена со связывающим доменом (например, вариабельным доменом антитела), и их можно оценивать с помощью различных анализов, описанных, например, в разделе настоящего описания, посвященном определениям.
«Fc-область, имеющая нативную последовательность» содержит аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, встречающейся в естественных условиях. Имеющие нативную последовательность человеческие Fc-области включают имеющую нативную последовательность Fc-область человеческого IgG1 (не-А- и А-аллотипов); имеющую нативную последовательность Fc-область человеческого IgG2; имеющую нативную последовательность Fc-область человеческого IgG3; и имеющую нативную последовательность Fc-область человеческого IgG4, а также их встречающиеся в естественных условиях варианты.
«Вариант Fc-области» содержит аминокислотную последовательность, которая отличается от последовательности Fc-области, имеющей нативную последовательность, по меньшей мере одной аминокислотной модификацией, предпочтительно одной или несколькими аминокислотной(ыми) заменой(ами). Предпочтительно вариант Fc-области имеет по меньшей мере одну аминокислотную замену по сравнению с имеющей нативную последовательность Fc-областью или с Fc-областью родительского полипептида, например, от примерно одной до примерно десяти аминокислотных замен, и предпочтительно от примерно одной до примерно пяти аминокислотных замен в имеющей нативную последовательность Fc-области или Fc-области родительского полипептида. Вариант Fc-области предпочтительно должен обладать по меньшей мере примерно 80%-ной гомологией с имеющей нативную последовательность Fc-областью и/или с Fc-областью родительского полипептида, и наиболее предпочтительно по меньшей мере примерно 90%-ной гомологией с указанной областью, более предпочтительно по меньшей мере примерно 95%-ной гомологией с указанной областью.
Понятие « антитело-обусловленная клеточнозависимая цитотоксичность» или «ADCC» относится к виду цитотоксичности, при которой секретируемый Ig, связанный с Fc-рецепторами (FcR), присутствующими на определенных цитотоксических клетках (например, естественных клетках-киллерах (NK), нейтрофилах и макрофагах), дает возможность указанным цитотоксическим эффекторным клеткам специфически связываться с несущей антиген клеткой-мишенью и затем уничтожать клетку-мишень с помощью цитотоксинов.
Антитела «руководят» цитотоксическими клетками и являются абсолютно необходимыми для такого уничтожения. Первичные клетки, опосредующие ADCC, т.е. NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Сведения об экспрессии FcR на гематопоэтических клетках обобщены в таблице 3 на с. 464 публикации Ravetch и Kinet, Annu. Rev. Immunol. 9, 1991, cc. 457-492. Для оценки ADCC-активности представляющей интерес молекулы можно проводить анализ ADCC in vitro, такой который описан в US №5500362 или №5821337. Пригодные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, с использованием созданных на животных моделей, например, описанных у Clynes и др. (USA) 95, 1998, сс.652-656.
«Fc-рецептор» или «FcR» обозначает рецептор, который связывается с Fc-областью антитела. Предпочтительным FcR является имеющий нативную последовательность человеческий FcR. Кроме того, предпочтительным FcR является рецептор, который связывается с антителом IgG-типа (рецептор гамма), он включает рецепторы FcγRI-, FcγRII- и FcγRIII-подклассов, в том числе аллельные варианты и полученные в результате альтернативного сплайсинга формы указанных рецепторов. FcγRII-рецепторы включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, различающиеся в основном своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене тирозинсодержащий активационный мотив иммунорецептора (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене тирозинсодержащий ингибиторный мотив иммунорецептора (ITIM) (см. обзор М. у Daeron, Annu. Rev. Immunol. 15, 1997, cc. 203-234). Обзор FcR представлен у Ravetch и Kinet, Annu. Rev. Immunol. 9, 1991, cc. 457-492; Capel и др., Immunomethods 4, 1994, cc. 25-34 и у de Haas и др., J. Lab. Clin. Med. 126, 1995, cc. 330-341. В контексте настоящего описания под понятие «FcR» подпадают и другие FcR, включая те, которые будут идентифицированы в будущем. Понятие включает также неонатальный рецептор, FcRn, который ответствен за перенос материнских IgG в плод (Guyer и др., J. Immunol. 117, 1976, с. 587 и Kim и др., J. Immunol. 24, 1994, с. 249.
Связывание с человеческим FcRn in vivo и время полужизни в сыворотке полипептидов, связывающихся с высокой аффинностью с человеческим FcRn, можно оценивать, например, на трансгенных мышах или трансфектированных человеческих линиях клеток, экспрессирующих человеческий FcRn, или на приматах, которым вводят полипептиды с вариантной Fc-областью. В WO 2000/42072 (на имя Presta) описаны варианты антител с повышенной или пониженной способностью к связыванию с FcR. См., например, также Shields и др. J. Biol. Chem. 9(2), 2001, сс. 6591-6604.
«Человеческие эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. Предпочтительно клетки экспрессируют по меньшей мере FcγRIII и выполняют эффекторную ADCC-функцию. Примерами человеческих лейкоцитов, опосредующих ADCC, являются мононуклеарные клетки периферической крови (РВМС), естественные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы; предпочтительными являются РВМС и NK-клетки. Эффекторные клетки можно выделять из нативного источника, например, из крови.
Понятие «комплементзависимая цитотоксичность» или «CDC» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется посредством связывания первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связываются с их когнатным антигеном. Для оценки активации комплемента можно осуществлять анализ CDC, например, согласно методу, описанному у Gazzano-Santoro и др., J. Immunol. Methods 202, 1996, с. 163. Варианты полипептидов с измененными аминокислотными последовательностями Fc-области (полипептиды с вариантами Fc-области) и повышенной или пониженной способностью к связыванию C1q описаны, например, в US №6194551 В1 и WO 1999/51642, см. также, например, Idusogie и др., J. Immunol. 164, 2000, сс. 4178-4184.
Понятие «содержащее Fc-область антитело» относится к антителу, которое содержит Fc-область. С-концевой лизин (остаток 447 согласно EU-системе нумерации) в Fc-области можно удалять, например, в процессе очистки антитела или конструирования методами рекомбинации нуклеиновой кислоты, кодирующей антитело. Таким образом, композиция, содержащая антитело, которое имеет Fc-область, предлагаемая в настоящем изобретении, может содержать антитело, имеющее K447, антитела с полностью удаленными K447 или смесь антител, имеющих остаток K447, и антител без указанного остатка.
Понятие «внеклеточный домен» полипептида CD79b или «ECD» относится к форме полипептида CD79b, у которой практически отсутствуют трансмембранный и цитоплазматический домены. Как правило, ECD полипептида CD79b должен содержать менее 1% указанных трансмембранного и/или цитоплазматического доменов и предпочтительно он должен содержать менее 0,5% указанных доменов. Следует иметь в виду, что любые трансмембранные домены, идентифицированные для полипептидов CD79b, предлагаемых в настоящем изобретении, идентифицируют в соответствии с критериями, обычно применяемыми в данной области для идентификации гидрофобного домена указанного типа. Точные границы трансмембранного домена могут варьироваться, но наиболее вероятно не более чем примерно на 5 аминокислот с любой стороны домена, как он первоначально определен в настоящем описании. Таким образом, внеклеточный домен полипептида CD79b необязательно может содержать примерно 5 или меньшее количество аминокислот с любой стороны трансмембранного домена/границы внеклеточного домена, как он определен в Примерах или спецификации, и подразумевается, что такие полипептиды, содержащие или не содержащие ассоциированный сигнальный пептид, и кодирующая их нуклеиновая кислота подпадают под объем настоящего изобретения.
Примерное положение «сигнальных пептидов» полипептида CD79b, предлагаемого в настоящем изобретении, может быть указано в настоящем описании. Следует отметить, однако, что С-концевая граница сигнального пептида может варьироваться, но наиболее вероятно не более чем примерно на 5 аминокислот с любой стороны С-концевой границы сигнального пептида, как он первоначально идентифицирован в настоящем описании, при этом С-концевую границу сигнального пептида можно идентифицировать в соответствии с критериями, обычно применяемыми в данной области для идентификации элемента аминокислотной последовательности указанного типа (см., например, Nielsen и др., Prot. Eng. 10, 1997, сс. 1-6; von Heinje и др., Nucl. Acids. Res. 14, 1986, cc. 4683-4690). Кроме того, очевидно, что в некоторых случаях отщепление сигнальной последовательности от секретированного полипептида не является полностью одинаковым, что приводит к образованию более чем одного секретированного вида. Такие зрелые полипептиды, от которых сигнальный пептид отщепляют с погрешностью, составляющей не более чем 5 аминокислот с любой стороны С-концевой границы сигнального пептида, как он идентифицирован в настоящем описании, и полинуклеотиды, кодирующие их, подпадают под объем настоящего изобретения. Сокращения
Линнкерные компоненты:
МС обозначает 6-малеимидокапроил;
Val-Cit или «vc» обозначает валин-цитруллин (пример дипептида в расщепляемом протеазой линкере);
цитруллин обозначает 2-амино-5-уреидопентановую кислоту;
РАВ обозначает пара-аминобензилоксикарбонил (пример «самоэлиминирующегося» линкерного компонента);
Me-Val-Cit обозначает N-метил-валин-цитруллин (в этом случае линкерная пептидная связь модифицирована для предупреждения ее расщепления катепсином В);
МС(ПЭГ)6-ОН обозначает малеимидокапроил-полиэтиленгликоль (может быть присоединен к цистеинам антитела).
Цитотоксические лекарственные средства:
ММАЕ обозначает монометилауристатин Е (ММ 718);
MMAF обозначает вариант ауристатина Е (ММАЕ), содержащий фенилаланин на С-конце лекарственного средства (ММ 731.5);
MMAF-DMAEA обозначает MMAF, содержащий DMAEA (диметиламиноэтиламин) в амидной связи с С-концевым фенилаланином (ММ 801.5);
MMAF-TEG обозначает MMAF, содержащий тетраэтиленгликоль, этерифицированный до фенилаланина;
MMAF-NtBu обозначает N-трет-бутил, присоединенный в качестве амида к С-концу MMAF;
DM1 обозначает N(2')-деацетил-N(2')-(3-меркапто-1-оксопропил)майтанзин;
DM3 обозначает N(2')-деацетил-N2-(4-меркапто-1-оксопентил)майтанзин;
DM4 обозначает N(2')-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)майтанзин.
Другие сокращения имеют следующие значения: АЕ обозначает ауристатин Е, Вое обозначает N-трет-бутоксикарбонил), cit обозначает цитруллин, dap обозначает долапроин, ДЦК обозначает 1,3-дициклогексилкарбодиимид, ДХМ обозначает дихлорметан, ДЭА обозначает диэтиламин, ДЭАД обозначает диэтилазодикарбоксилат, ДЭФЦ обозначает диэтилфосфорилцианидат, ДИАД обозначает диизопропилазодикарбоксилат, ДИЭА обозначает N,N-диизопропилэтиламин, dil обозначает долаизолейцин, ДМА обозначает диметилацетамид, ДМАП обозначает 4-диметиламинопиридин, ДМЭ обозначает диметиловый эфир этиленгликоля (или 1,2-диметоксиэтан), ДМФ обозначает N,N-диметилформамид, ДМСО обозначает диметилсульфоксид, doe обозначает долафенин, dov обозначает N,N-диметилвалин, ДТНБ обозначает 5,5'-дитиобис (2-нитробензойную кислоту), ДЭПК обозначает диэтилентриаминопентауксусную кислоту, ДТТ обозначает дитиотреитол, ЭДКИ обозначает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, ЭЭДХ обозначает 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, ES-MC обозначает масс-спектрометрию с ионизацией электроспрея, EtOAs обозначает этилацетат, Fmoc обозначает N-(9-флуоренилметоксикарбонил), gly обозначает глицин, ГАТУ обозначает гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, ГОБТ обозначает 1-гидроксибензотриазол, ЖХВД обозначает жидкостную хроматографию высокого давления, ile обозначает изолейцин, lys обозначает лизин, MeCN (CH3CN) обозначает ацетонитрил, МеОН обозначает метанол, Mtr обозначает 4-анисилдифенилметил (или 4-метокситритил), nor обозначает (1S, 2R)-(+)-норэфедрин, ЗФР обозначает забуференный фосфатом физиологический раствор (рН 7,4), ПЭГ обозначает полиэтиленгликоль, Ph обозначает фенил, Pnp обозначает иорд-нитрофенил, МК обозначает 6-малеимидокапроил, phe обозначает L-фенилаланин, PyBrop обозначает гексафторфосфат бром-трис-пирролидинофосфония, SEC обозначает гель-фильтрацию, Su обозначает сукцинимид, ТФК обозначает трифторуксусную кислоту, ТСХ обозначает тонкослойную хроматографию, УФ обозначает ультрафиолет и val обозначает валин.
Одним из объектов изобретения является сконструированное с помощью цистеина антитело к CD79b, входящее в указанный конъюгат антитело-лекарственное средство, предлагаемый в изобретении, которое содержит одну или несколько свободных цистеиновых аминокислот, где сконструированное с помощью цистеина антитело к CD79b связывается с полипептидом CD79b и его получают с помощью способа, заключающегося в том, что заменяют один или несколько аминокислотных остатков родительского антитела к CD79b на цистеин, где родительское антитело содержит по меньшей мере одну последовательность HVR, выбранную из:
(I) HVR-L1, который содержит последовательность А1-А15, где А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31) или KASQSVDYEGDSFLN (SEQ ID NO: 37);
(II) HVR-L2, который содержит последовательность В1-В7, где В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(III) HVR-L3, который содержит последовательность С1-С9, где С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(IV) HVR-H1, который содержит последовательность D1-D10, где D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(V) HVR-H2, который содержит последовательность Е1-Е18, где Е1-Е18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(VI) HVR-H3, который содержит последовательность F1-F10, где F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36) или TRRVPIRLDY (SEQ ID NO: 38).
\ Конкретный объект настоящего изобретения относится к сконструированному с помощью цистеина антителу к CD79b, входящему в указанный конъюгат антитело-лекарственное средство, предлагаемый в изобретении, которое содержит аминокислотную последовательность, идентичную по меньшей мере примерно на 80%, в альтернативном варианте по меньшей мере примерно на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности сконструированного с помощью цистеина антитела, имеющего полноразмерную аминокислотную последовательность, представленную в настоящем описании, или аминокислотной последовательности сконструированного с помощью цистеина антитела, в которой отсутствует сигнальный пептид, указанной в настоящем описании.
Следующий объект изобретения относится к комбинации антитела к CD20, указанной в настоящем описании, с выделенным сконструированным с помощью цистеина антителом к CD79b, входящим в указанный конъюгат антитело-лекарственное средство, предлагаемый в изобретении, которое содержит аминокислотную последовательность, кодируемую нуклеотидной последовательностью, которая гибридизуется с комплементом молекулы ДНК, кодирующей (а) сконструированное с помощью цистеина антитело, имеющее указанную в настоящем описании полноразмерную аминокислотную последовательность, (б) сконструированное с помощью цистеина антитело, в аминокислотной последовательности которого отсутствует указанный в настоящем описании сигнальный пептид, (в) внеклеточный домен трансмембранного белка сконструированного с помощью цистеина антитела, в котором присутствует или отсутствует указанный в настоящем описании сигнальный пептид, (г) аминокислотную последовательность, кодируемую любой из указанных в настоящем описании нуклеотидных последовательностей, или (е) любой другой специально определенный фрагмент полноразмерной аминокислотной последовательности сконструированного с помощью цистеина антитела, указанного в настоящем описании.
Конкретным объектом изобретения является комбинация антитела к CD20, представленным в настоящем описании, с выделенным сконструированным с помощью цистеина антителом к CD79b, входящим в указанный конъюгат антитело-лекарственное средство, предлагаемый в изобретении, в котором отсутствует N-концевая сигнальная последовательность и/или отсутствует инициирующий метионин, и которое кодируется нуклеотидной последовательностью, кодирующей такую аминокислотную последовательность, которая представлена в настоящем описании. В настоящем описании представлены также способы получения указанного антитела, указанные способы заключаются в том, что культивируют клетку-хозяина, содержащую вектор, который содержит соответствующую молекулу кодирующей нуклеиновой кислоты, в условиях, пригодных для экспрессии сконструированного с помощью цистеина антитела, и выделяют сконструированное с помощью цистеина антитело из клеточной культуры.
Другим объектом изобретения является комбинация антитела к CD20, представленным в настоящем описании, с выделенным сконструированным с помощью цистеина антителом к CD79b, входящим в указанный конъюгат антитело-лекарственное средство, предлагаемый в изобретении, в котором либо трансмембранный домен удален в результате делеции, либо трансмембранный домен инактивирован. В настоящем описании представлены также способы получения указанного антитела, указанные способы заключаются в том, что культивируют клетку-хозяина, содержащую вектор, который содержит соответствующую молекулу кодирующей нуклеиновой кислоты, в условиях, пригодных для экспрессии сконструированного с помощью цистеина антитела, и выделяют сконструированное с помощью цистеина антитело из клеточной культуры.
Следующие объекты изобретения относятся к комбинации антитела к CD20, указанной в настоящем описании, с выделенными химерными сконструированными с помощью цистеина антителами к CD79b, входящими в указанный предлагаемый в изобретении конъюгат антитело-лекарственное средство, который содержит любое из представленных в настоящем описании сконструированных с помощью цистеина антител, слитых с гетерологичным (не-CD79b) полипептидом. Примерами таких химерных молекул являются любые из представленных в настоящем описании сконструированных с помощью цистеина антител, слитых с гетерологичным полипептидом, таким, например, как последовательность эпитопа-метки или Fc-область иммуноглобулина.
Сконструированное с помощью цистеина антитело к CD79b, входящее в указанные предлагаемые в изобретении конъюгаты антитело-лекарственное средство, может представлять собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело, одноцепочечное антитело или антитело, которое конкурентно ингибирует связывание полипептида антитела к CD79b с соответствующим его антигенным эпитопом. Антитела, предлагаемые в настоящем изобретении, необязательно можно конъюгировать с ингибирующим рост средством или цитотоксическим средством, таким как токсин, включая например, ауристатин, майтанзиноид, производное долостатина или калихеамицин, антибиотик, радиоактивный изотоп, нуклеолитический фермент или т.п. Антитела, предлагаемые в настоящем изобретении, необязательно можно получать в СНО-клетках или бактериальных клетках, и они предпочтительно ингибируют рост или пролиферацию, или индуцируют гибель клетки, с которой они связываются. Для диагностических целей антитела, предлагаемые в настоящем изобретении, можно снабжать обнаруживаемой меткой, присоединять к твердой подложке или т.п.
Другими объектами настоящего изобретения являются векторы, содержащие ДНК, которые кодируют любые из представленных в настоящем описании антител к CD79b и сконструированных с помощью цистеина антител к CD79b, входящих в указанные конъюгаты антитело-лекарственное средство, предлагаемые в изобретении. Предложены также клетки-хозяева, содержащие указанные векторы. Клетки-хозяева могут представлять собой, например, СНО-клетки, клетки Е. coli или клетки дрожжей. Предложен также способ получения любого из указанных в настоящем описании полипептидов, заключающийся в том, что культивируют клетки-хозяева в условиях, пригодных для экспрессии требуемого полипептида, и выделяют требуемый полипептид из клеточной культуры.
Сконструированные с помощью цистеина антитела, входящие в указанные предлагаемые в изобретении конъюгаты антитело-лекарственное средство, применяемые в комбинации, предлагаемой в изобретении, можно применять для лечения рака, и они включают антитела, обладающие специфичностью в отношении рецепторов клеточной поверхности и трансмембранных рецепторов, и ассоциированных с опухолью антигенов (ТАА). Такие антитела можно применять в виде «оголенных» антител (неконъюгированных с фрагментом, представляющим собой лекарственное средство или метку) или в виде конъюгатов антитело-лекарственное средство (ADC). Сконструированные с помощью цистеина антитела, предлагаемые в изобретении, можно сайт-специфически и эффективно связывать с реакционноспособным в отношении тиольной группы реагентом. Реакционноспособный в отношении тиольной группы реагент может представлять собой многофункциональный линкерный реагент, захватывающий реагент-метку, флуорофорный реагент или промежуточный продукт лекарственное средство-линкер. Сконструированное с помощью цистеина антитело можно снабжать обнаруживаемой меткой, иммобилизовывать на твердофазной подложке и/или конъюгировать с фрагментом, представляющим собой лекарственное средство. Тиольную реакционноспособность можно придавать любому антителу, в котором замену аминокислот на реакционноспособные цистеиновые кислоты можно осуществлять в участках легкой цепи, выбранных из участков, включающих следующие положения: L10-L20, L105-L115, L109-L119, L116-L126, L122-L132, L163-L173, L200-L210; и в участках тяжелой цепи, выбранных из участков, включающих следующие положения: Н1-Н10, Н18-Н28, Н79-Н89, Н107-Н117, Н109-Н119, Н111-Н121, и в Fc-области в участках, выбранных из Н270-Н280, Н366-Н376, Н391-401, где нумерацию аминокислотных положений начинают с положения 1 согласно системе нумерации Кэбота (Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991) и затем последовательно продолжают как описано в WO 2006/034488; US 2007/0092940. Тиольную реакционноспособность можно придавать также определенным доменам антитела, таким как константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, СН2 и СН3. Замены на цистеин, приводящие к величинам тиольной реакционноспособности, составляющим 0,6 и выше, можно осуществлять в константных доменах тяжелой цепи α, δ, ε, γ и μ интактных антител IgA-, IgD-, IgE-, IgG- и IgM-классов соответственно, включая подклассы IgG: IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Такие антитела и их применения описаны в WO 2006/034488; US 2007/0092940.
Сконструированные с помощью цистеина антитела, которые применяют в комбинации, предлагаемой в изобретении, предпочтительно сохраняют антигенсвязывающую способность, присущую их аналогам, представляющим собой родительские антитела дикого типа. Так, сконструированные с помощью цистеина антитела обладают способностью связываться, предпочтительно специфически, с антигенами. Такие антигены включают, например, ассоциированные с опухолью антигены (ТАА), белки рецепторов клеточной поверхности и другие молекулы клеточной поверхности, трансмембранные белки, сигнальные белки, факторы, регулирующие выживаемость клеток, факторы, регулирующие пролиферацию клеток, молекулы, ассоциированные с развитием или дифференцировкой ткани (например, в отношении которых известно или предполагается, что они принимают функциональное участие в указанных процессах), лимфокины, цитокины, молекулы, участвующие в регуляции клеточного цикла, молекулы, участвующие в васкулогенезе и молекулы, ассоциированные с ангиогенезом (например, в отношении которых известно или предполагается, что они принимают функциональное участие в указанном процессе). Ассоциированный с опухолью антиген может представлять собой фактор кластера дифференцировки (т.е. CD-белок, включая (но, не ограничиваясь только им) CD79b. Сконструированные с помощью цистеина антитела к CD79b, предлагаемые в изобретении, сохраняют антигенсвязывающую способность, присущую их аналогам, представляющим собой родительские антитела к CD79b. Так, сконструированные с помощью цистеина антитела к CD79b, предлагаемые в изобретении, обладают способностью связываться, предпочтительно специфически, с антигенами CD79b, включая изоформы бета и/или альфа человеческого антитела к CD79b, в том числе в тех случаях, когда такие антигены экспрессируются на поверхности клеток, включая (но, не ограничиваясь только ими) В-клетки.
Согласно одному из объектов изобретения антитела, входящие в комбинацию, предлагаемую в изобретении, можно конъюгировать с любым фрагментом, представляющим собой метку, который может быть ковалентно присоединен к антителу с помощью реакционноспособного фрагмента, активированного фрагмента или реакционноспособной тиольной группы цистеина (Singh и др., Anal. Biochem. 304, 2002, сс. 147-115; Harlow Е. и Lane D., Using Antibodies: A Laboratory Manual, изд-во Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY, 1999; Lundblad R.L., Chemical Reagents for Protein Modification, 2-е изд., изд-во CRC Press, Boca Raton, FL, 1991). Присоединенная метка может обладать следующими функциями, а именно, она может: (I) продуцировать обнаруживаемый сигнал; (II) взаимодействовать со второй меткой и тем самым модифицировать обнаруживаемый сигнал, создаваемый первой или второй меткой, например, посредством FRET (флуоресцентный резонансный перенос энергии); (III) стабилизировать взаимодействие или повышать аффинность связывания с антигеном или лигандом; (IV) влиять на подвижность, например электрофоретическую подвижность или на клеточную проницаемость посредством заряда, гидрофобности, формы или других физических параметров; или (V) образовывать захватывающий фрагмент, и тем самым модулировать аффинность к лиганду, связывание антитела с антигеном или образование ионных комплексов.
В конкретных вариантах осуществления изобретения предложен полинуклеотид, кодирующий любое из указанных выше антител. В одном из вариантов осуществления изобретения предложен вектор, содержащий полинуклеотид. В одном из вариантов осуществления изобретения предложена клетка-хозяин, содержащая вектор. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой клетку яичника китайского хомячка (СНО). В одном из вариантов осуществления изобретения предложен способ получения антитела к CD79b, заключающийся в том, что культивируют клетку-хозяина в условиях, пригодных для экспрессии полинуклеотида, кодирующего антитело, и выделяют антитело.
Конъюгаты антитело-лекарственное средство
Другим объектом изобретения является комбинация антитела к CD20, представленного в настоящем описании, с иммуноконъюгатами или конъюгатами антитело-лекарственное средство (ADC), которые содержат антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, лекарственное средство, ингибирующий рост агент, токсин (например, обладающий ферментативной активностью токсин бактериального, грибного, растительного или животного происхождения или их фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат). Другим объектом изобретения являются также способы применения иммуноконъюгатов. В одном из объектов изобретения иммуноконъюгат содержит любое из указанных выше антител к CD79b, ковалентно связанное с цитотоксическим агентом или выявляемым агентом.
Согласно одному из объектов изобретения антитело к CD79b, входящее в комбинацию, предлагаемую в изобретении, связывается с тем же самым эпитопом на CD79b, с которым связывается другое антитело к CD79b. В другом варианте осуществления изобретения антитело к CD79b, предлагаемое в изобретении, связывается с тем же самым эпитопом на CD79b, с которым связывается Fab-фрагмент моноклонального антитела, созданного с использованием гибридом, депонированных в АТСС под номером НВ11413 20 июля 1993 г., моноклональное антитело, содержащее вариабельные домены, имеющие SEQ ID NO: 26 (фиг. 7) и SEQ ID NO: 29 (фиг. 8), или химерное антитело, содержащее вариабельный домен любого антитела, созданного с использованием гибридом НВ11413, депонированных в АТСС 20 июля 1993 г., и константные домены из IgG1, или вариабельные домены моноклонального антитела, содержащих последовательности SEQ ID NO: 26 (фиг. 7) и SEQ ID NO: 29 (фиг. 8). В другом варианте осуществления изобретения антитело к CD79b, предлагаемое в изобретении, связывается с тем же самым эпитопом на CD79b, с которым связывается другое антитело к CD79b (т.е. СВ3.1 (фирма BD Biosciences, каталожный номер 555678; Сан-Хосе, шт. Калифорния), АТ105-1 (фирма AbD Serotec, каталожный номер МСА2208; Рэлей, шт. Северная Каролина), AT 107-2 (фирма AbD Serotec, каталожный номер МСА2209), античеловеческое антитело к CD79b (фирма BD Biosciences, каталожный номер 557592; Сан-Хосе, шт. Калифорния)).
Согласно другому объекту изобретения антитело к CD79b, входящее в комбинацию, предлагаемую в изобретении, связывается с эпитопом на CD79b, отличным от эпитопа, с которым связывается другое антитело к CD79b. В другом варианте осуществления изобретения антитело к CD79b, предлагаемое в изобретении, связывается с эпитопом на CD79b, отличным от эпитопа, с которым связывается Fab-фрагмент моноклонального антитела, созданного с использованием гибридом, депонированных в АТСС под номером НВ11413 20 июля 1993 г., моноклональное антитело, содержащее вариабельные домены, имеющие SEQ ID NO: 26 (фиг. 7) и SEQ ID NO: 29 (фиг. 8), или химерное антитело, содержащее вариабельный домен любого антитела, созданного с использованием гибридом НВ11413, депонированных в АТСС 20 июля 1993 г., и константные домены из IgG1, или вариабельные доменов моноклонального антитела, содержащие последовательности SEQ ID NO: 26 (фиг. 7) и SEQ ID NO: 29 (фиг. 8). В другом варианте осуществления изобретения антитело к CD79b, предлагаемое в изобретении, связывается с эпитопом на CD79b, отличным от эпитопа, с которым связывается другое антитело к CD79b (т.е. СВ3.1 (фирма BD Biosciences, каталожный номер 555678; Сан-Хосе, шт. Калифорния), АТ105-1 (фирма AbD Serotec, каталожный номер МСА2208; Рэлей, шт. Северная Каролина), AT 107-2 (фирма AbD Serotec, каталожный номер МСА2209), античеловеческое антитело к CD79b (фирма BD Biosciences, каталожный номер 557592; Сан-Хосе, шт. Калифорния)).
Согласно другому объекту изобретения антитело к CD79b, входящее в комбинацию, предлагаемую в изобретении, отлично от (т.е. не представляет собой) Fab-фрагмента моноклонального антитела, созданного с использованием гибридом, депонированных в АТСС под номером НВ11413 20 июля 1993 г., моноклонального антитело, содержащего вариабельные домены, имеющие SEQ ID NO: 26 (фиг. 7) и SEQ ID NO: 29 (фиг. 8), или химерного антитела, содержащего вариабельный домен любого антитела, созданного с использованием гибридом НВ11413, депонированных в АТСС 20 июля 1993 г., и константные домены из IgG1, или вариабельные домены моноклонального антитела, содержащие последовательности SEQ ID NO: 26 (фиг. 7) и SEQ ID NO: 29 (фиг. 8). В другом варианте осуществления изобретения антитело к CD79b, предлагаемое в изобретении, отлично от (т.е. не представляет собой) Fab-фрагмента другого антитела к CD79b (т.е. СВ3.1 (фирма BD Biosciences, каталожный номер 555678; Сан-Хосе, шт. Калифорния), ATI05-1 (фирма AbD Serotec, каталожный номер МСА2208; Рэлей, шт. Северная Каролина), AT107-2 (фирма AbD Serotec, каталожный номер МСА2209), античеловеческое антитело к CD79b (фирма BD Biosciences, каталожный номер 557592; Сан-Хосе, шт. Калифорния)).
Согласно одному из объектов изобретения антитело, предлагаемое в изобретении, специфически связывается с CD79b первого вида животного и не связывается специфически с CD79b второго вида животного. В одном из вариантов осуществления изобретения первый вид животного представляет собой человека и/или приматов (например, обезьян-циномолгус), а вторым видом животного являются представители мышиных (например, мышь) и/или собак. В другом варианте осуществления изобретения первый вид животных представляет собой человека. В одном из вариантов осуществления изобретения первый вид животных представляет собой примата, например, обезьяну-циномолгус). В одном из вариантов осуществления изобретения вторым видом животных являются представители мышиных, например, мышь. В другом варианте осуществления изобретения вторым видом животных являются представители собачьих.
Одним из объектов изобретения является антитело, которое связывается с CD79b, экспрессируемым на поверхности клетки. В одном из вариантов осуществления изобретения антитело связывается с эпитопом, который находится в области человеческого или мышиного CD79b, содержащей домен 1 или домен 2, или домены 1 и 2. В одном из вариантов осуществления изобретения клетка представляет собой клетку млекопитающего. В одном из вариантов осуществления изобретения клетка представляет собой человеческую клетку. В одном из вариантов осуществления изобретения клетка представляет собой раковую клетку. В одном из вариантов осуществления изобретения клетка представляет собой В-клетку. В одном из вариантов осуществления изобретения раковая клетка представляет собой В-клетку.
В конкретных вариантах осуществления изобретения любое из указанных выше антител представляет собой моноклональное антитело. В одном из вариантов осуществления изобретения антитело представляет собой фрагмент антитела, выбранный из Fab-, Fab'-SH-, Fv-, scFv- или (Pab')2-фрагмента. В одном из вариантов осуществления изобретения антитело является гуманизированным. В одном из вариантов осуществления изобретения антитело является человеческим.
Ниже представлено подробное описание примеров антител к CD79b, представляющих собой компонент конъюгата антитело-лекарственное средство, входящего в комбинацию с антителом к CD20, предлагаемую в изобретении:
Конкретные варианты антител к CD79b
Один из объектов изобретения относится к антителу, которое связывается, предпочтительно специфически, с любым из описанных выше или ниже полипептидов. Антитело необязательно представляет собой моноклональное антитело, фрагмент антитела, включая Fab-, Fab'-, F(ab')2- и Fv-фрагмент, диабоди, одноцепочечное антитело, химерное антитело, гуманизированное антитело, одноцепочечное антитело или антитело, которое конкурентно ингибирует связывание полипептида антитела к CD79b с соответствующим антигенным эпитопом. Антитела, предлагаемые в настоящем изобретении, необязательно могут быть конъюгированы с ингибирующим рост средством или цитотоксическим средством, таким как токсин, включая, например, ауристатин, майтанзиноид, производное долостатина или калихеамицин, антибиотик, радиоактивный изотоп, нуклеолитический фермент или т.п. Антитела, предлагаемые в настоящем изобретении, необязательно можно получать в СНО-клетках или бактериальных клетках, и они предпочтительно индуцируют гибель клетки, с которой они связываются. Для целей обнаружения антитела, предлагаемые в настоящем изобретении, можно снабжать обнаруживаемой меткой, присоединять к твердой подложке или т.п.
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, одновалентная аффинность которого (например, аффинность к CD79b антитела в виде Fab-фрагмента) или аффинность антитела к CD79b в его двухвалентной форме (например, аффинность к CD79b антитела в виде IgG-фрагмента) является практически такой же, более низкой или более высокой по сравнению с одновалентной аффинностью или аффинностью в двухвалентном формате соответственно мышиного антитела (например, аффинностью к CD79b мышиного антитела в виде Fab-фрагмента или в виде IgG-фрагмента) или химерного антитела (например, аффинностью к CD79b химерного антитела в виде Fab-фрагмента или в виде IgG-фрагмента), содержащего последовательности вариабельного домена легкой цепи и вариабельного домена тяжелой цепи, представленные на фиг. 7 (SEQ ID NO: 26) и фиг. 8 (SEQ ID NO: 29), состоящего или практически состоящего из указанных последовательностей.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где одновалентная аффинность антитела к CD79b (например, аффинность к CD79b антитела в виде Fab-фрагмента) является более низкой, например, более низкой по меньшей мере в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55 или 60 раз, чем одновалентная аффинность мышиного антитела (например, аффинность к CD79b мышиного антитела в виде Fab-фрагмента) или химерного антитела (например, аффинность к CD79b химерного антитела в виде Fab-фрагмента), содержащего последовательности вариабельного домена легкой цепи и вариабельного домена тяжелой цепи, представленные на фиг. 7 (SEQ ID NO: 26) и фиг. 8 (SEQ ID NO: 29), состоящего или практически состоящего из указанных последовательностей.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где одновалентная аффинность антитела к CD79b (например, аффинность к CD79b антитела в виде Fab-фрагмента) является более высокой, например, более высокой по меньшей мере в 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз, чем одновалентная аффинность мышиного антитела (например, аффинность к CD79b мышиного антитела в виде Fab-фрагмента) или химерного антитела (например, аффинность к CD79b химерного антитела в виде Fab-фрагмента), содержащего последовательности вариабельного домена легкой цепи и вариабельного домена тяжелой цепи, представленные на фиг. 7 (SEQ ID NO: 26) и фиг. 8 (SEQ ID NO: 29), состоящего или практически состоящего из указанных последовательностей.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность антитела к CD79b в его двухвалентной (например, аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) является практически такой же, что и аффинность мышиного антитела (например, аффинность к CD79b антитела в виде IgG) или аффинность химерного антитела (например, аффинность к CD79b химерного антитела в виде Fab-фрагмента) в его двухвалентном формате, содержащего последовательности вариабельного домена легкой цепи и вариабельного домена тяжелой цепи, представленные на фиг. 7 (SEQ ID NO: 26) и фиг. 8 (SEQ ID NO: 29), состоящего или практически состоящего из указанных последовательностей.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность к CD79b антитела в его двухвалентной форме (например, аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) является более низкой, например, более низкой по меньшей мере в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55 или 60 раз, чем аффинность мышиного антитела (например, аффинность к CD79b антитела в виде IgG) или аффинность химерного антитела (например, аффинность к CD79b химерного антитела в виде Fab-фрагмента) в его двухвалентном формате, содержащего последовательности вариабельного домена легкой цепи и вариабельного домена тяжелой цепи, представленные на фиг. 7 (SEQ ID NO: 26) и фиг. 8 (SEQ ID NO: 29), состоящего или практически состоящего из указанных последовательностей.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) является более высокой, например, более высокой по меньшей мере в 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз, чем аффинность мышиного антитела (например, аффинность к CD79b антитела в виде IgG) или аффинность химерного антитела (например, аффинность к CD79b химерного антитела в виде Fab-фрагмента) в его двухвалентном формате, содержащего последовательности вариабельного домена легкой цепи и вариабельного домена тяжелой цепи, представленные на фиг. 7 (SEQ ID NO: 26) и фиг. 8 (SEQ ID NO: 29), состоящего или практически состоящего из указанных последовательностей.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,4 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,4±0,04 нМ.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,3 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,32 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,36 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,4 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,44 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,48 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,5 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,3 нМ до 0,5 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,32 нМ до 0,48 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,36 нМ до 0,44 нМ.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,2 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,2±0,02 нМ.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,1 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,12 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,14 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,16 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,18 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,2 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,22 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,24 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,26 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,28 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,3 О нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,1 до 0,З нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,12 до 0,28 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,14 до 0,26 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,16 до 0,24 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,18 до 0,22 нМ.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,5 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,5±0,1 нМ.
Другой объект изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с гуманизированным антителом к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,4 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,5 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,6 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,7 нМ или менее. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,3 до 0,7 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,4 до 0,6 нМ. Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет от 0,5 до 0,55 нМ.
Согласно одному из объектов изобретения одновалентная аффинность мышиного антитела к CD79b является практически такой же, что аффинность связывания Fab-фрагмента, содержащего последовательности вариабельного домена, представленные в SEQ ID NO: 26 (фиг. 7) и SEQ ID NO: 29 (фиг. 8). Согласно другому объекту изобретения одновалентная аффинность мышиного антитела к CD79b является практически такой же, что аффинность связывания Fab-фрагмента, содержащего последовательности вариабельного домена, созданного с использованием гибридомы, которая депонирована в АТСС под номером НВ11413 20 июля 1993 г., или химерного антитела, содержащего вариабельные домены антитела, созданного с использованием гибридомы, которая депонирована в АТСС под номером НВ11413 20 июля 1993 г.
Как хорошо известно в данной области, аффинность связывания лиганда с его рецептором можно определять с помощью любого из широкого набора анализов и выражать в виде различных количественных величин, используя соответствующие термины. Так, в одном из вариантов осуществления изобретения аффинность связывания выражают в виде величин Kd и она отражает присущую субстанции аффинность связывания (например, с минимальными эффектами авидности). Как правило, и предпочтительно аффинность связывания измеряют in vitro в бесклеточной среде или в присутствии клеток. Как описано более подробно ниже, кратную разницу в аффинности связывания можно определять количественно в виде отношения величины одновалентной аффинности связывания гуманизированного антитела (например, в форме Fab) и величины одновалентной аффинности связывания референс-антитела/антитела, с которым производится сравнение (например, в форме Fab) (например, мышиного антитела, имеющего донорские последовательности гипервариабельных участков), где величины аффинности связывания определяют в сходных условиях анализа. Так, в одном из вариантов осуществления изобретения кратную разницу в аффинности связывания определяют в виде отношения величин Kd гуманизированного антитела в форме Fab и указанного референс-антитела/антитела, с которым производится сравнение в форме Fab. Например, в одном из вариантов осуществления изобретения, если предлагаемое в изобретении антитело (А) имеет аффинность, «в 3 раза более низкую», чем аффинность референс-антитела (М), то, если величина Kd для А составляет 3х, то величина Kd для М должна быть 1х, а отношение Kd антитела А к величине Kd антитела М должно составлять 3:1. И, наоборот, в одном из вариантов осуществления изобретения, если предлагаемое в изобретении антитело (С) имеет аффинность, «в 3 раза более высокую», чем аффинность референс-антитела (R), то, если величина Kd для С составляет 1х, то величина Kd для R должна составлять 3х, а отношение Kd антитела С к величине Kd антитела R должно составлять 1:3. Для измерения аффинности связывания можно применять любой из многочисленных известных в данной области анализов, включая представленные в настоящем описании анализы, например Biacore®, радиоиммуноанализ (РИА) и ELISA.
Другой объект изобретения относится к гуманизированному антителу к CD79b, где аффинность к CD79b антитела в его двухвалентном формате (например, аффинность к CD79b антитела в виде IgG) составляет 0,4, 0,2 или 0,5 нМ.
Один из объектов изобретения относится к антителу, которое связывается с CD79b, предназначенному для применения в комбинации с антителом к CD20, представленным в настоящем описании, где антитело содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из группы, состоящей из:
(I) HVR-L1, который содержит последовательность А1-А15, в которой А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31);
(II) HVR-L2, который содержит последовательность В1-В7, в которой В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(III) HVR-L3, который содержит последовательность С1-С9, в которой С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(IV) HVR-H1, который содержит последовательность D1-D10, в которой D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(V) HVR-H2, который содержит последовательность Е1-Е18, в которой E0-E18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(VI) HVR-H3, который содержит последовательность F1-F10, в которой F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое связывается с CD79b, где антитело содержит по меньшей мере один вариант HVR, где вариант последовательности HVR содержит модификацию по меньшей мере одного остатка в последовательности SEQ ID NO: 31, 32, 33, 34, 35 или 36.
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое содержит вариабельный домен тяжелой цепи, содержащий последовательность(и) HVR1-НС, HVR2-HC и/или HVR3-HC, представленную(ые) на фиг. 3Б (SEQ ID NO: 50-52).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое содержит вариабельный домен легкой цепи, содержащий последовательность(и) HVR1-LC, HVR2-LC и/или HVR3-LC, представленную(ые) на фиг. 3А (SEQ ID NO: 47-49).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое содержит вариабельный домен тяжелой цепи, содержащий последовательность(и) HVR1-НС, HVR2-HC и/или HVR3-HC, представленную(ые) на фиг. 4Б (SEQ ID NO: 58-60).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое содержит вариабельный домен легкой цепи, содержащий последовательность(и) HVR1-LC, HVR2-LC и/или HVR3-LC, представленную(ые) на фиг. 4А (SEQ ID NO: 55-57).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое содержит вариабельный домен тяжелой цепи, содержащий последовательность(и) HVR1-НС, HVR2-HC и/или HVR3-HC, представленную(ые) на фиг. 5Б (SEQ ID NO: 66-68).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое содержит вариабельный домен легкой цепи, содержащий последовательность(и) HVR1-LC, HVR2-LC и/или HVR3-LC, представленную(ые) на фиг. 5А (SEQ ID NO: 63-65).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое содержит вариабельный домен тяжелой цепи, содержащий последовательность(и) HVR1-НС, HVR2-HC и/или HVR3-HC, представленную(ые) на фиг. 6Б (SEQ ID NO: 74-76).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом, которое содержит вариабельный домен легкой цепи, содержащий последовательность(и) HVR1-LC, HVR2-LC и/или HVR3-LC, представленную(ые) на фиг. 6А (SEQ ID NO: 71-73).
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, с антителом к CD79b, которое содержит вариабельный домен тяжелой цепи, выбранный из SEQ ID NO: 54, 62, 70 или 78. Другой объект изобретения относится к антителу, которое содержит вариабельный домен легкой цепи, выбранный из SEQ ID NO: 53, 61, 69 или 77.
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, со сконструированным с помощью цистеина антителом к CD79b, которое содержит одну или большее количество свободных цистеиновых аминокислот и последовательность, выбранную из SEQ ID NO: 83-130. Сконструированное с помощью цистеина антитело к CD79b может связываться с полипептидом CD79b. Сконструированное с помощью цистеина антитело к CD79b можно получать с помощью способа, заключающегося в том, что заменяют одну или несколько аминокислотных остатков в родительском антителе к CD79b на цистеин.
Один из объектов изобретения относится к комбинации антитела к CD20, представленного в настоящем описании, со сконструированным с помощью цистеина антителом к CD79b, которое содержит одну или большее количество свободных цистеиновых аминокислот, где сконструированное с помощью цистеина антитело к CD79b связывается с полипептидом CD79b и его получают с помощью способа, заключающегося в том, что заменяют один или несколько аминокислотных остатков в родительском антителе к CD79b на цистеин, где родительское антитело содержит по меньшей мере одну последовательность HVR, выбранную из:
(I) HVR-L1, который содержит последовательность А1-А15, где А1-А15 представляет собой KASQSVDYDGDSFLN (SEQ ID NO: 31) или KASQSVDYEGDSFLN (SEQ ID NO: 37);
(II) HVR-L2, который содержит последовательность В1-В7, где В1-В7 представляет собой AASNLES (SEQ ID NO: 32);
(III) HVR-L3, который содержит последовательность С1-С9, где С1-С9 представляет собой QQSNEDPLT (SEQ ID NO: 33);
(IV) HVR-H1, который содержит последовательность D1-D10, где D1-D10 представляет собой GYTFSSYWIE (SEQ ID NO: 34);
(V) HVR-H2, который содержит последовательность Е1-Е18, где Е 1-Е 18 представляет собой GEILPGGGDTNYNEIFKG (SEQ ID NO: 35) и
(VI) HVR-H3, который содержит последовательность F1-F10, где F1-F10 представляет собой TRRVPVYFDY (SEQ ID NO: 36) или TRRVPIRLDY (SEQ ID NO: 38).
Сконструированное с помощью цистеина антитело к CD79b может представлять собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело, одноцепочечное антитело или антитело, которое конкурентно ингибирует связывание полипептида антитела к CD79b с соответствующим антигенным эпитопом. Антитела, предлагаемые в настоящем изобретении, можно конъюгировать с ингибирующим рост средством или цитотоксическим средством, таким как токсин, включая например, ауристатин или майтанзиноид. Антитела, предлагаемые в настоящем изобретении, необязательно можно получать в СНО-клетках или бактериальных клетках, и они предпочтительно ингибируют рост или пролиферацию, или индуцируют гибель клетки, с которой они связываются. Для диагностических целей антитела, предлагаемые в настоящем изобретении, можно снабжать обнаруживаемой меткой, присоединять к твердой подложке или т.п.
Понятие «конъюгат антитело к CD79b-лекарственное средство («ADC»)» применительно к комбинации, предлагаемой в изобретении, может относиться к конъюгату представленной ниже формулы I, в котором антитело конъюгировано (т.е. ковалентно присоединено) к одному или нескольким фрагменту(ам), представляющему(им) собой лекарственное средство (D), необязательно через линкер (L). ADC могут включать конъюгаты тиоМАb-лекарственное средство («TDC»).

Таким образом, антитело может быть конъюгировано с лекарственным средством либо непосредственно, либо через линкер. В формуле I р означает среднее количество фрагментов, представляющих собой лекарственное средство, на антитело, где указанное число может составлять, например, от примерно 1 до примерно 20 фрагментов, представляющих собой лекарственное средство, на антитело, а в некоторых вариантах изобретения от 1 до примерно 8 фрагментов, представляющих собой лекарственное средство. Настоящее изобретение относится к композиции, содержащей смесь соединений «антитело-лекарственное средство» формулы I, где средняя загрузка лекарственного средства на антитело составляет от примерно 2 до примерно 5 или от примерно 3 до примерно 4.
В одном из вариантов комбинации, предлагаемой в изобретении, конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-МС-vc-PAB-MMAE.
а. Примеры линкеров
Линкер может содержать один или несколько линкерных компонентов. Примерами линкерных компонентов являются 6-малеимидокапроил («МС»), малеимидопропаноил («МР»), валин-цитруллин («val-cit»), аланин-фенилаланин («ala-phe»), иара-аминобензилоксикарбонил («РАВ»), N-сукцинимидил-4-(2-пиридилтио)пентаноат («SPP»), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат («SMCC») и N-сукцинимидил-(4-йодацетил)аминобензоат («SIAB»). В данной области известны другие линкерные компоненты, и некоторые из них описаны ниже.
Линкер может представлять собой «отщепляемый линкер», облегчающий высвобождение лекарственного средства в клетке. Так, например, можно применять линкер, неустойчивый в кислой среде линкер (например, гидразон); линкер, чувствительный к действию протеаз (например, пептидазы); фотолабильный линкер; диметильный линкер или дисульфидсодержащий линкер (Chari и др., Cancer Research 52, 1992, сс. 127-131, US №5208020).
В некоторых вариантах осуществления изобретения линкер имеет представленную ниже формулу II:

в которой А обозначает удлиняющий компонент; а обозначает целое число 0 или 1; W обозначает аминокислотный компонент; w обозначает целое число от 0 до 12; Y означает спейсерный компонент; у обозначает 0, 1 или 2, a Ab, D и р имеют значения, указанные выше для формулы I. Репрезентативные варианты таких линкеров описаны в US №2005-0238649 A1, которая специально включена в настоящее описание в качестве ссылки.
В некоторых вариантах осуществления изобретения линкерный компонент может содержать «удлиняющий компонент», который связывает антитело с другим линкерным компонентом или с фрагментом, представляющим собой лекарственное средство. Примеры удлиняющих компонентов представлены ниже (где волнистая линия означает сайты ковалентного присоединения к антителу):




В некоторых вариантах осуществления изобретения линкерный компонент может содержать аминокислотный компонент. В одном из таких вариантов изобретения аминокислотный компонент позволяет осуществлять расщепление линкера протеазой, что облегчает высвобождение лекарственного средства из иммуноконъюгата после воздействия на него внутриклеточных протеаз, таких как лизосомные ферменты. См., например, Doronina и др., Nat. Biotechnol. 21, 2003, сс. 778-784. Примерами аминокислотных компонентов являются (но не ограничиваясь только ими) дипептид, трипептид, тетрапептид и пентапептид. Примерами дипептидов являются валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe), фенилаланин-лизин (fk или phe-lys); или N-метил-валин-цитруллин (Me-val-cit). Примерами трипептидов являются глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотный компонент может содержать встречающиеся в естественных условиях аминокислотные остатки, а также минорные аминокислоты и не встречающиеся в естественных условиях аминокислотные аналоги, такие как цитруллин. Аминокислотные компоненты могут быть сконструированы и оптимизированы в отношении их селективности с точки зрения ферментативного расщепления конкретным ферментом, например, ассоциированной с опухолью протеазой, катепсином В, С и D, или плазминовой протеазой.
В некоторых вариантах осуществления изобретения линкерный компонент может содержать «спейсерный» компонент, который связывает антитело с фрагментом, представляющим собой лекарственное средство, либо непосредственно, либо через удлиняющий компонент и/или аминокислотный компонент. Спейсерным компонентом может быть «самоэлиминирующийся» или «несаморасщепляющийся» компонент.«Несамоэлиминирующийся» спейсерный компонент представляет собой компонент, где часть спейсерного компонента или весь этот компонент остаются связанными с фрагментом, представляющим собой лекарственное средство, после ферментативного (например, протеолитического) расщепления ADC. Примерами несамоэлиминирующихся спейсерных компонентов являются (но не ограничиваясь только ими) глициновый спейсерный компонент и глицин-глициновый спейсерный компонент. Можно рассматривать также и другие комбинации пептидных спейсеров, чувствительных к последовательность-специфическому ферментативному расщеплению. Так, например, ферментативное расщепление ADC, содержащего глицин-глициновый спейсерный компонент, протеазой, ассоциированной с опухолевыми клетками, должно приводить к высвобождению фрагмента «глицин-глицин-лекарственное средство» из остальной части ADC. В одном из таких вариантов осуществления изобретения фрагмент «глицин-глицин-лекарственное средство» подвергается одностадийному гидролизу в опухолевой клетке, что приводит к отщеплению глицин-глицинового спейсерного компонента от фрагмента, представляющего собой лекарственное средство.
«Самоэлиминирующийся» спейсерный компонент обеспечивает высвобождение фрагмента, представляющего собой лекарственное средство, без осуществления одностадийного гидролиза. В некоторых вариантах осуществления изобретения спейсерный компонент линкера содержит пара-аминобензильную группу. В одном из таких вариантов иоря-аминобензиловый спирт присоединен к аминокислотному компоненту через амидную связь, а карбамат, метилкарбамат или карбонат встраивают между бензиловым спиртом и цитотоксическим агентом. См., например, Hamann и др., Expert Opin. Ther. Patents 15, 2005, cc. 1087-1103. В одном из вариантов осуществления изобретения спейсерный компонент представляет собой пара-аминобензилоксикарбонил (РАВ). В некоторых вариантах осуществления изобретения фениленовый фрагмент пара-аминобензильной группы замещен Qm, где Q представляет собой -С1-С8алкил, -O-(С1-С8алкил), галоген, нитрогруппу или цианогруппу; m обозначает целое число от 0 до 4. Другими примерами самоэлиминирующихся спейсерных компонентов являются (но не ограничиваясь только ими) ароматические соединения, которые по своим электронным характеристикам аналогичны «ара-аминобензиловому спирту (см. например, US №2005/0256030 A1), такому как 2-аминоимидазол-5-метанольные производные (Hay и др., Bioorg. Med. Chem. Lett. 9, 1999, с. 2237) и орто- или иора-аминобензилацетали. Можно применять спейсеры, которые подвергаются циклизации после гидролиза амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues и др., Chemistry Biology 2, 1995, с. 223), соответствующим образом замещенные кольцевые бицикло[2.2.1]- и бицикло[2.2.2]-системы (Storm и др., J. Amer. Chem. Soc. 94, 1972, с. 5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry и др., J. Org. Chem. 55, 1990, с. 5867). Примерами самоэлиминирующихся спейсеров, которые можно применять в ADC, являются также аминосодержащие лекарственные средства, замещенные в а-положении глицина (Kingsbury и др., J. Med. Chem. 27, 1984, с. 1447).
В одном из вариантов осуществления изобретения спейсерный компонент представляет собой имеющий указанную ниже структуру разветвленный бис(гидроксиметил)стирольный компонент (BHMS), который можно использовать для включения и высвобождения нескольких лекарственных средств.

в которой Q обозначает -С1-С8алкил, -O-(С1-С8алкил), галоген, нитрогруппу или цианогруппу; m обозначает целое число от 0 до 4; n обозначает О или 1; а p обозначает число от 1 до примерно 20.
В другом варианте осуществления изобретения линкер L может представлять собой линкер дендритного типа, используемый для ковалентного связывания более чем одного фрагмента, представляющего собой лекарственное средство, к антителу посредством разветвленного многофункционального линкерного фрагмента (Sun и др., Bioorganic & Medicinal Chemistry Letters 12, 2002, cc. 2213-2215; Sun и др., Bioorganic & Medicinal Chemistry 11, 2003, cc. 1761-1768). С использованием дендритных линкеров можно повышать молярное отношение лекарственного средства к антителу, то есть загрузку, которая связана с эффективностью ADC. Таким образом, если сконструированное с помощью цистеина антитело содержит только одну реакционноспособную тиольную группу цистеина, то с помощью дендритного линкера можно присоединять несколько фрагментов, представляющих собой лекарственное средство.
Ниже представлены примеры линкерных компонентов и их комбинаций, которые можно применять в контексте ADC формулы II:



Линкерные компоненты, включая удлиняющие, спейсерные и аминокислотные компоненты, можно синтезировать методами, известными в данной области, например методами, описанными в US №2005-0238649 Al.
б. Примеры фрагментов, представляющих собой лекарственное средство
(1) Майтанзин и майтанзиноиды
В некоторых вариантах осуществления изобретения комбинация антитела к CD20, представленного в настоящем описании, с иммуноконъюгатом содержит антитело, конъюгированное с одной или несколькими молекулами майтанзиноида. Майтанзиноиды представляют собой ингибиторы митоза, которые проявляют действие посредством ингибирования полимеризации тубулина. Майтанзин впервые был выделен из восточноафриканского кустарника Maytenus serrata (US №3896111). Далее было установлено, что определенные микроорганизмы также продуцируют майтанзиноиды, такие как майтанзинол и сложные С-3-эфиры майтанзинола (US №4151042). Синтетический майтанзинол и его производные, и аналоги описаны, например в US №№. 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268;4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Фрагменты, представляющие собой майтанзиноидные лекарственные средства, являются привлекательными компонентами в качестве лекарственных средств, входящих в конъюгаты антитела и лекарственного средства, поскольку они: (I) относительно легко могут быть получены путем ферментации или химической модификации, или дериватизации продуктов ферментации, (И) применимы для дериватизации с помощью функциональных групп, пригодных для конъюгации с антителами через дисульфидные и недисульфидные линкеры, (III) стабильны в плазме и (IV) эффективны в отношении различных линий опухолевых клеток.
Производные майтанзина, которые можно применять в качестве фрагментов, представляющих собой майтанзиноидные лекарственные средства, хорошо известны в данной области, и их можно выделять из природных источников с помощью известных методов или получать с помощью методов генетической инженерии и ферментации (US 6790952; US 2005/0170475; Yu и др., PNAS 99, 2002, сс. 7968-7973). Майтанзинол и аналоги майтанзинола можно получать с помощью известных методов синтеза.
Примеры фрагментов, представляющих собой майтанзиноидные лекарственные средства, включают соединения, имеющие модифицированное ароматическое кольцо, такие как: C-19-дехлор (US №4256746) (получали путем восстановления анзамитоцина Р2 алюмогидридом лития (ЛАГ)); C-20-гидрокси (или C-20-деметил)±C-19-дехлор (US №№4361650 и 4307016) (получали деметилированием с использованием Streptomyces или Actinomyces или дехлорированием с помощью ЛАГ); и C-20-деметоксигруппа, С-20-ацилоксигруппа (-OCOR), +/-дехлор (US №4294757) (получали ацилированием с помощью ацилхлоридов), и имеющие модификации в других положениях.
Примеры фрагментов, представляющих собой майтанзиноидные лекарственные средства, включают также соединения, имеющие следующие модификации: C-9-SH (US №4424219) (получали путем взаимодействия майтанзинола с H2S или P2S5); С-14-алкоксиметил(деметоксигруппа/CH2OR)(US №4331598); C-14-гидроксиметил- или ацилоксиметил (СН2ОН или СН2ОАс) (US №4450254) (получали из Nocardia); C-15-гидроксигруппу/ацилоксигруппу (US №4364866) (получали путем конверсии майтанзинола с помощью Streptomyces); C-15-метоксигруппу (US №№4313946 и 4315929) (выделяли из Trewia nudlflora); C-18-N-деметил (US №№4362663 и 4322348) (получали деметилированием майтанзинола с помощью Streptomyces); и 4,5-дезоксигруппу (US №4371533) (получали путем восстановления майтанзинола с помощью трихлорида титана/ЛАГ).
Известно, что многие положения в майтанзиновых соединениях, в зависимости от типа связи, могут быть использованы в качестве положения присоединения. Так, например, для образования сложноэфирной связи, пригодными являются С-3-положение, имеющее гидроксильную группу, С-14-положение, модифицированное гидроксиметилом, C-15-положение, модифицированное гидроксильной группой, и C-20-положение, имеющее гидроксильную группу (US 5208020; US RE39151; US 6913748; US 7368565; US 2006/0167245; US 2007/0037972).
Фрагменты, представляющие собой лекарственное средство, включают соединения, имеющие следующую структуру:

в которой волнистая линия обозначает ковалентное присоединение атома серы фрагмента, представляющего собой майтанзиноидное лекарственное средство, к линкеру ADC. R независимо могут обозначать Н или C1-С6алкил. Алкиленовая цепь, связывающая амидную группу с атомом серы, может представлять собой метанил, этанил или пропил, т.е. m равно 1, 2 или 3 (US 633410; US 5208020; US 7276497; Chari и др., Cancer Res. 52, 1992, cc. 127-131; Liu и др., 1996) Proc. Natl. Acad. Sci USA 93, 1996, cc. 8618-8623).
Для соединений, предлагаемых в изобретении, можно рассматривать все стереоизомеры фрагментов, представляющих собой майтанзиноидное лекарственное средство, то есть любую комбинацию R- и S-конфигураций на хиральных атомах углерода D. В одном из вариантов осуществления изобретения фрагмент, представляющий собой майтанзиноидное лекарственное средство, имеет представленную ниже стереохимическую структуру:

Примеры вариантов фрагментов, представляющих собой лекарственное средство, включают: DM1; DM3 и DM4, имеющие следующие структуры:



в которых волнистая линия означает ковалентное присоединение атома серы лекарственного средства, к линкеру (L) в конъюгате «антитело-лекарственное средство» (WO 2005/037992; US 2005/0276812 A1).
Другие примеры конъюгатов «антитело-майтанзиноидное лекарственное средство» имеют представленные ниже структуры и обозначения (где AB обозначает антитело, а р обозначает число от 1 до примерно 8):



Примеры конъюгатов «антитело-лекарственное средство», в которых DM1 присоединен через линкер ВМРЕО к тиольной группе антитела, имеют представленную ниже структуру и обозначения:

в которой Ab обозначает антитело; п обозначает 0, 1 или 2; и p обозначает 1, 2, 3 или 4.
Иммуноконъюгаты, содержащие майтанзиноиды, методы их получения и их терапевтическое применение описаны, например, у Erickson и др., Cancer Res. 66(8), 2006, сс.4426-4433; в US №№5208020, 5416064, в US №2005/0276812 Al и в Европейской заявке на патент ЕР 0425235 В1, которые специально включены в настоящее описание в качестве ссылки.
Конъюгаты «антитело-майтанзиноид», применяемые в комбинации, предлагаемой в настоящем изобретении, получают путем химического связывания антитела с молекулой майтанзиноида, где указанное связывание не приводит к значительному снижению биологической активности антитела или молекулы майтанзиноида. См., например, US №5208020 (содержание которого специально включено в настоящее описание в качестве ссылки). Майтанзиноиды можно синтезировать известными методами или выделять из природных источников. Пригодные майтанзиноиды описаны, например, в US №5208020 и в других патентах и в непатентных публикациях, указанных выше, такими майтанзиноидами являются майтанзинол и аналоги майтанзинола, имеющие модификации в ароматическом кольце или в других положениях молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
В данной области известно много линкерных групп, пригодных для создания конъюгатов антитело-майтанзиноид, в том числе, например, группы, описанные в US №№5208020, 6441163 или ЕР 0425235 В1, у Chad и др., Cancer Research 52, 1992, сс. 127-131 и US №2005/0169933 A1, описание которых специально включено в настоящее описание в качестве ссылки. Конъюгаты антитело-майтанзиноид, которые содержат в качестве линкера SMCC, можно получать согласно методу, описанному в US №11/141344, озаглавленной «Antibody-drug conjugates and Methods» (Конъюгаты антитело-лекарственное средство и способы получения). Линкерные группы включают дисульфидные группы, тиоэфирные группы, неустойчивые в кислой среде группы, фотолабильные группы, чувствительные к действию пептидаз группы или чувствительные к действию эстераз группы, которые описаны в вышеперечисленных патентах. Известны и другие линкерные группы, и они приведены в качестве примеров в настоящем описании.
Конъюгаты антитела и майтанзиноида можно создавать с помощью разнообразных бифункциональных сшивающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат⋅HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид, бисазидопроизводные (такие как бис(пара-азидобензоил)гександиамин), производные бисдиазония (такие как бис(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоциант), и активные бис-соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительными сшивающими агентами, которые участвуют в образовании дисульфидного мостика, являются N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson и др, Biochem. J. 173, 1978, сс. 723-737) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP).
Линкер можно присоединять к молекуле майтанзиноида в различных положениях в зависимости от типа связи. Например, сложноэфирную связь можно получать путем взаимодействия с гидроксильной группой с использованием общепринятых методов сочетания. Реакция может иметь место в положении С-3, несущем гидроксильную группу, в положении С-14, которое модифицировано гидроксиметилом, в положении С-15, которое модифицировано гидроксильной группой, и в положении С-20, несущем гидроксильную группу. В одном из вариантов осуществления изобретения связь создают в положении С-3 майтанзинола или аналога майтанзинола.
Ауристатины и долостатины
В некоторых вариантах осуществления изобретения иммуноконъюгат содержит антитело, предлагаемое в изобретении, конъюгированное с долостатинами или пептидными аналогами и производными долостатина, например, ауристатинами (US №№5635483; 5780588). Установлено, что долостатины и ауристатины оказывают воздействие на динамику микротрубочек, гидролиз ГТФ и деление ядер и клеток (Woyke и др. Antimicrob. Agents and Chemother. 45 (12), 2001, cc. 3580-3584) и обладают противораковой (US №5663149) и фунгицидной активностью (Pettit и др. Antimicrob. Agents Chemother. 42, 1998, сс. 2961-2965). Фрагмент, представляющий собой долостатиновое или ауристатиновое лекарственное средство, можно присоединять к антителу через N-(амино)-конец или С-(карбоксильный)-конец пептидного фрагмента лекарственного средства (WO 02/088172).
Приведенные в качестве примера варианты ауристатина включают связанные на N-конце монометилауристатиновые фрагменты лекарственных средств DE и DF (US 2005/0238649, описанные у Senter и др., Proceedings of the American Association for Cancer Research, т. 45, реферат №623, презентация от 28 марта 2004 г., публикация специально полностью включена в настоящее описании в качестве ссылки).
Пептидный фрагмент, представляющий собой лекарственное средство, можно выбирать из соединений формул DE и DF, представленных ниже:


в которых волнистая линия в DE и DF обозначает сайт ковалентного присоединения к антителу или к компоненту антитело-линкер;
и в каждом положении, независимо:
R2 выбран из Н и С1-С8алкила;
R3 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R4 выбран из Н, С1-С8валкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил(С3-С8гетероцикла);
R5 выбран из Н и метила;
или R4 и R5 вместе, образуют карбоциклическое кольцо и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из Н, С1-С8алкила и С3-С8карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из Н и С1-С8алкила;
R7 выбран из Н, С1-С8алкила, С3-С8карбоцикла, арила, С1-С8алкиларила, С1-С8алкил-(С3-С8карбоцикла), С3-С8гетероцикла и С1-С8алкил-(С3-С8гетероцикла);
R8 каждый независимо выбран из Н, ОН, С1-С8алкила, С3-С8карбоцикла и O-(С1-С8алкила);
R9 выбран из Н и С1-С8алкила;
R10 выбран из арила или С3-С8гетероцикла;
Z обозначает О, S, NH или NR12, где R12 обозначает С1-С8алкил;
R11 выбран из Н, C1-С20алкила, арила, С3-С8гетероцикла, -(R13O)m-R14 или -(R13O)m-CH(R15)2;
m обозначает целое число от 1 до 1000;
R13 обозначает С2-С8алкил;
R14 обозначает Н или С1-С8алкил;
R15 в каждом случае независимо обозначает Н, СООН, -(CH2)n-N(R16)2, -(CH2)n-SO3H или -(СН2)n-SO3-С1-С8алкил;
R16 в каждом случае независимо обозначает Н, С1-С8алкил или -(СН2)n-СООН;
R18 выбран из -C(R8)2-C(R8)2-арила, -С(R8)2-С(R8)2-(С3-С8гетероцикла) и -C(R8)2-C(R8)2-(C3-C8карбоцикла); и
n обозначает целое число от 0 до 6.
В одном из вариантов осуществления изобретения R3, R4 и R7 независимо друг от друга обозначают изопропил или втор-бутил, a R5 обозначает -Н или метил. В одно из примеров осуществления изобретения R3 и R4 каждый обозначает изопропил, R5 обозначает -Н, a R7 обозначает втор-бутил.
В другом варианте осуществления изобретения R2 и R6 каждый обозначает метил, a R9 обозначает -Н.
Еще в одном варианте изобретения R8 в каждом случае обозначает -ОСН3. В репрезентативном варианте осуществления изобретения R3 и R4 каждый обозначает изопропил, R2 и R6 каждый обозначает метил, R5 обозначает -Н, R7 обозначает втор-бутил, R в каждом случае обозначает -ОСН3, a R9 обозначает -Н.
В одном из вариантов осуществления изобретения Z обозначает -О- или -NH-.
В одном из вариантов осуществления изобретения R10 обозначает арил.
В репрезентативном варианте осуществления изобретения R10 обозначает фенил.
В репрезентативном варианте осуществления изобретения, когда Z обозначает -О-, то R11 обозначает -Н, метил или трет-бутил.
В одном из вариантов осуществления изобретения, когда Z обозначает -NH, то R11 обозначает -CH(R15)2, где R15 обозначает -(CH2)n-N(R16)2, a R16 обозначает -С1-С8алкил или -(СН2)n-СООН.
В другом варианте осуществления изобретения, когда Z обозначает -NH, то R11 обозначает -CH(R15)2, где R15 обозначает -(СН2)n-SO3H.
Репрезентативным вариантом ауристатина формулы DE является ММАЕ, где волнистая линия означает ковалентное связывание конъюгата «антитело-лекарственное средство» с линкером (L):

Репрезентативным вариантом ауристатина формулы DF является MMAF, где волнистая линия означает ковалентное связывание конъюгата «антитело-лекарственное средство» с линкером (L) (см. в US №2005/0238649 и у Doronina и др., Bioconjugate Chem. 17, 2006, сс. 114-124):

Другими репрезентативными вариантами являются монометилвалиновые производные, имеющие фенилаланинкарбокси-модификации на С-конце фрагмента, представляющего собой пентапептидное ауристатиновое лекарственное средство (WO 2007/008848), и монометилвалиновые производные, имеющие фенилаланиновые модификации боковой цепи на С-конце фрагмента, представляющего собой пентапептидное ауристатиновое лекарственное средство (WO 2007/008603).
Другими фрагментами, представляющими собой лекарственное средство, являются представленные ниже производные MMAF, где волнистая линия означает ковалентное связывание конъюгата «антитело-лекарственное средство» с линкером (L):









В одном из объектов изобретения гидрофильными группами являются (но не ограничиваясь только ими) сложные эфиры триэтиленгликоля (TEG), представленные выше, которые могут быть присоединены к фрагменту, представляющему собой лекарственное средство, в положении R11. Не ограничиваясь какой-либо конкретной теорией, можно лишь отметить, что гидрофильные группы улучшают интернализацию фрагмента, представляющего собой лекарственное средство, и предотвращают его агломерацию.
Репрезентативные варианты комбинации антитела к CD20 с ADC формулы I, содержащие ауристатин/доластатин или их производные, описаны в US 2005-0238649 и у Doronina и др., Bioconjugate Chem. 17, 2006, сс. 114-124, указанные документы специально включены в настоящее описание в качестве ссылки. Репрезентативные варианты ADC формулы I, содержащие ММАЕ или MMAF и различные линкерные компоненты, имеют представленные ниже структуры и обозначения (где «AB» обозначает антитело; р обозначает число от 1 до примерно 8, «Val-Cit» или «vc» обозначает дипептид валин-цитруллин, a «S» обозначает атом серы). При этом следует отметить, что в некоторых описаниях структуры ADC, связанного с атомом серы, антитело имеет обозначение «Ab-S», которое указывает лишь на связь с атомом серы, но не указывает на то, что конкретный атом серы присоединен к нескольким фрагментам, представляющим собой «линкер-лекарственное средство». В представленных ниже структурах левую скобку можно поставить также слева от атома серы, между AB и S, и такая запись будет эквивалентна описанию ADC, предлагаемого в изобретении, которое представлено в настоящей заявке.

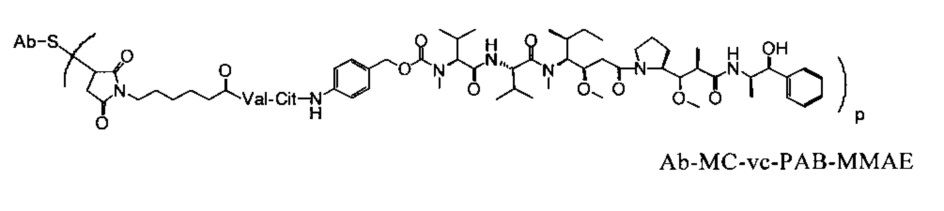


Репрезентативные варианты комбинации антитела к CD20 с ADC формулы I, содержащими MMAF и различные линкерные компоненты, также включают Ab-MC-PAB-MMAF и Ab-PAB-MMAF. Интересно отметить, что, как было установлено, иммуноконъюгаты, которые содержат MMAF, присоединенный к антителу посредством линкера, который не подвергается протеолитическому расщеплению, обладают активностью, сравнимой с активностью иммуноконъюгатов, которые содержат MMAF, присоединенный к антителу посредством протеолитически расщепляемого линкера. См., Doronina и др., Bioconjugate Chem. 17, 2006, сс. 114-124. В таких случаях высвобождение лекарственного средства, очевидно, происходит благодаря разложению антитела в клетке (см. ниже).
Как правило, фрагменты, представляющие собой лекарственное средство на основе пептидов, можно получать путем образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно создавать, например, методом синтеза в жидкой фазе (см. Е.


В частности, фрагменты, представляющие собой ауристатиновые/доластатиновые лекарственные средства формулы DF, такие как MMAF и их производные, можно получать методами, описанными в US 2005-0238649 A1 и у Doronina и др., Bioconjugate Chem. 17, 2006, сс. 114-124. Фрагменты, представляющие собой ауристатиновые/доластатиновые лекарственные средства формулы DE, такие как ММАЕ и их производные, можно получать методами, описанными у Doronina и др., Nat. Biotech. 21, 2003, сс. 778-784. Фрагменты, представляющие собой «лекарственное средство-линкер» MC-MMAF, МС-ММАЕ, MC-vc-PAB-MMAF и MC-vc-PAB-MMAE, можно соответствующим образом синтезировать стандартными методами, например, как описано у Doronina и др., Nat. Biotech. 21, 2003, сс. 778-784, и в публикации заявки на патент №US 2005/0238649 A1, а затем их можно конъюгировать с представляющим интерес антителом.
(3) Калихеамицин
В других вариантах осуществления изобретения комбинация антитела с CD20, представленного в настоящем описании, с иммуноконъюгатом содержит антитело, предлагаемое в изобретении, конъюгированное с одной или несколькими молекулами калихеамицина. Представители семейства калихеамициновых антибиотиков в субпикомолярных концентрациях обладают способностью вызывать двухцепочечные разрывы ДНК. Получение конъюгатов калихеамицина описано в US №№5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все на имя фирмы American Cyanamid Company). Структурные аналоги калихеамицина, которые можно применять, включают (но не ограничиваясь ими) γ11, α11, α31, N-ацетил-γ11, PSAG и θ11 (Hinman и др., Cancer Research 53, 1993, сс. 3336-3342; Lode и др., Cancer Research 58, 1998, сс. 2925-2928 и перечисленные выше патенты США на имя фирмы American Cyanamid). Другим противоопухолевым лекарственным средством, которое можно включать в конъюгаты с антителом, является QFA, представляющий собой антифолат. Как калихеамицин, так и QFA, имеют внутриклеточные места действия и плохо проникают через плазматическую мембрану. Таким образом, проникновение этих агентов в клетку в результате опосредуемой антителом интернализации значительно повышает их цитотоксическое действие.
в. Другие цитотоксические агенты
Другие противоопухолевые агенты, которые можно конъюгировать с антителом, представляют собой BCNU, стрептозоцин, винкристин и 5-фторурацил, семейство агентов, известных под общим названием LL-E33288-комплекс, которые описаны в US №№5053394, 5770710, а также эсперамицины (US №5877296).
Обладающие ферментативной активностью токсины и их фрагменты, которые можно применять, включают цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модеццина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (см., например, WO 93/21232, опубликованную 28 октября 1993 г. ).
Настоящее изобретение относится также к комбинации антитела к CD20, представленного в настоящем описании, с иммуноконъюгатом, образованным антителом и соединением, обладающим нуклеолитической активностью (таким, например, как рибонуклеаза или ДНК-эндонуклеаза, такая как дезоксирибонуклеаза; ДНКаза).
В конкретных вариантах осуществления изобретения комбинация антитела к CD20, представленного в настоящем описании, с иммуноконъюгатом может содержать атом с высоким уровнем радиоактивности. Для создания радиоконъюгированных антител можно применять широкое разнообразие радиоактивных изотопов. Их примерами являются At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, Р32, Pb212 и радиоактивные изотопы Lu. Когда иммуноконъюгат применяют для обнаружения, он может содержать радиоактивный атом, применяемый для сцинтиграфических исследований, например, Tc99m или I123, или спиновую метку для визуализации с использованием ядерного магнитного резонанса (ЯМР) (который называют также ЯМР-томография), такую как тот же йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо. Радиоактивные или другие метки можно включать в конъюгат с использованием известных методов. Например, пептид можно получать путем биосинтеза или синтезировать посредством химического аминокислотного синтеза с использованием приемлемых аминокислотных предшественников, которые, например, содержат фтор-19 вместо водорода. Такие метки, как Tc99m или I123, Re186, Re188 и In111, можно присоединять к пептиду через остаток цистеина. Иттрий-90 можно присоединять через остаток лизина. Для включения йода-123 можно применять IODOGEN-метод (Fraker и др., Biochem. Biophys. Res. Commun. 80, 1978, cc. 49-57). В руководстве «Monoclonal Antibodies in Immunoscintigraphy» (Chatal, изд-во CRC Press, 1989) подробно описаны другие методы.
В некоторых вариантах осуществления изобретения кормбинация антитела к CD20, представленного в настоящем описании, с иммуноконъюгатом может содержать антитело, конъюгированное с пролекарство-активирующим ферментом, который превращает пролекарство (например, пептидильное химиотерапевтическое средство, см. WO 81/01145) в активное лекарственное средство, такое как противораковое лекарственное средство. Такие иммуноконъюгаты можно использовать в антитело-направленной фермент-опосредованной пролекарственной терапии («ADEPT»). Ферментами, которые можно конъюгировать с антителом, являются (но не ограничиваясь только ими) щелочные фосфатазы, которые можно применять для превращения фосфатсодержащих пролекарств в свободные лекарственные средства; арилсульфатазы, которые можно применять для превращения сульфатсодержащих пролекарств в свободные лекарственные средства; цитозиндезаминаза, которую можно применять для превращения нетоксичного 5-фторцитозина в противораковое лекарственное средство, а именно в 5-фторурацил; протеазы, такие как протеаза Serratia, термолизин, субтилизин, карбоксипептидазы и катепсины (такие как катепсины В и L), которые можно применять для превращения пептидсодержащих пролекарств в свободные лекарственные средства; D-аланилкарбоксипептидазы, которые можно применять для превращения пролекарств, содержащих D-аминокислотные заместители; углевод-расщепляющие ферменты, такие как β-галактозидаза и нейраминидаза, которые можно применять для превращения гликозилированных пролекарств в свободные лекарственные средства; β-лактамаза, которую можно применять для превращения лекарственных средств, дериватизированных β-лактамами, в свободные лекарственные средства; и пенициллин-амидазы, такие как пенициллин V-амидаза или пенициллин G-амидаза, которую можно применять для превращения лекарственных средств, дериватизированных на атомах азота амина феноксиацетильными или фенилацетильными группами, соответственно, в свободные лекарственные средства. Ферменты можно ковалентно присоединять к антителам методами рекомбинантной ДНК, хорошо известными специалистам (см., например, Neuberger и др., Nature, 312, 1984, сс. 604-608).
г. Загрузка лекарственного средства
Загрузку лекарственного средства обозначают символом «р», она представляет собой среднее число фрагментов, представляющих собой лекарственное средство, на антитело в молекуле формулы I. Загрузка лекарственного средства может составлять от 1 до 20 фрагментов, представляющих собой лекарственное средство (D), на антитело. ADC формулы I включают наборы антител, конъюгированных с фрагментами, представляющими собой лекарственное средство, в количестве от 1 до 20. Среднее число фрагментов, представляющих собой лекарственное средство, на антитело в препаратах ADC, полученных в результате реакций конъюгации, можно охарактеризовать с помощью стандартных методов, таких как масс-спектроскопия, ELISA-анализ и ЖХВР. Можно определять также количественное распределение ADC, выраженное в «р». В некоторых случаях отделение, очистку и характеризацию гомогенного ADC, где р представляет собой определенную величину, от ADC с другой загрузкой лекарственного средства, можно осуществлять с помощью ЖХВР с обращенной фазой или электрофореза. Так, фармацевтические композиции конъюгатов «антитело-лекарственное средство» формулы I могут представлять собой гетерогенную смесь таких конъюгатов с антителами, присоединенными к 1, 2, 3, 4 или большему количеству фрагментов, представляющих собой лекарственное средство.
Для некоторых конъюгатов «антитело-лекарственное средство» р может ограничиваться числом сайтов связывания на антителе. Так, например, если присоединение происходит посредством тиола цистеина, как в репрезентативных вариантах осуществления изобретения, описанных выше, то антитело может иметь только одну или несколько тиольных групп цистеина или оно может иметь только одну или несколько достаточно реакционноспособных тиольных групп, посредством которых можно присоединять линкер. В некоторых вариантах осуществления изобретения более высокая загрузка лекарственного средства, например, р>5, может приводить к агрегации, нерастворимости, токсичности или к потере способности некоторых конъюгатов «антитело-лекарственное средство» проникать в клетки. В некоторых вариантах осуществления изобретения загрузка лекарственного средства для ADC, предлагаемых в изобретении, составляет от 1 до примерно 8, от примерно 2 до примерно 6 или от примерно 3 до примерно 5. Фактически, было установлено, что для некоторых ADC оптимальное соотношение фрагментов, представляющих собой лекарственное средство, на антитело может составлять менее чем 8, оно может составлять от примерно 2 до примерно 5 (см. US 2005-0238649 A1).
В некоторых вариантах осуществления изобретения в процессе реакции конъюгации фрагменты, представляющие собой лекарственное средство, конъюгируют с антителом в количестве меньше теоретического максимума. Антитело может содержать, например, лизиновые остатки, которые не реагируют с промежуточным соединением «лекарственное средство-линкер» или с линкерным реагентом, как обсуждено ниже. Как правило, антитела не содержат большого количества свободных и реакционноспособных тиольных групп цистеина, которые можно связывать с фрагментом, представляющим собой лекарственное средство, фактически большинство несущих тиольные группы цистеиновых остатков в антителах присутствуют в виде дисульфидных мостиков. В некоторых вариантах осуществления изобретения антитело можно восстанавливать с помощью восстановителя, такого как дитиотреитол (ДТТ) или трикарбонилэтилфосфин (ТКЭФ), в условиях частичного или полного восстановления с образованием реакционноспособных тиольных групп цистеина. В некоторых вариантах осуществления изобретения антитело подвергают реакции в денатурирующих условиях с образованием реакционноспособных нуклеофильных групп, таких как лизин или цистеин.
Загрузку (отношение лекарственное средство/антитело) ADC можно регулировать различными методами, например, путем (I) ограничения молярного избытка промежуточного соединения «лекарственное средство-линкер» или линкерного реагента по отношению к антителу, (II) ограничения времени реакции или температуры реакции конъюгации и (III) применения условий частичного или ограниченного восстановления для модификации тиольных групп цистеина.
Следует отметить, что в том случае, когда с промежуточным соединением «лекарственное средство-линкер» или с линкерным реагентом, а затем с реагентом, таким как фрагмент, представляющий собой лекарственное средство, вступает во взаимодействие более чем одна нуклеофильная группа, то полученный продукт представляет собой смесь соединений ADC с распределением одного или нескольких фрагментов, представляющих собой лекарственное средство, присоединенных к антителу. Среднее число фрагментов, представляющих собой лекарственное средство, на антитело можно рассчитывать для смеси с помощью «сэндвичл-ELISA, т.е. анализа с использованием двух антител, который является специфическим для антитела и для лекарственного средства. Отдельные молекулы ADC в этой смеси можно идентифицировать с помощью масс-спектроскопии и разделять с помощью ЖХВР, например, с помощью хроматографии гидрофобного взаимодействия (см., например, McDonagh и др., Prot. Engr. Design & Selection 19(7), 2006, cc. 299-307; Hamblett и др., Clin. Cancer Res. 10, 2004, cc. 7063-7070; Hamblett K.J. и др., «Effect of drug loading on the pharmacology, pharmacokinetics, and toxicity of an anti-CD30 antibody-drug conjugate», реферат №624, American Association for Cancer Research, 2004 Annual Meeting, 27-31 марта 2004 г., Proceedings of the AACR, т. 45, март 2004 г.; Alley S.C. и др., «Controlling the location of drug attachment in antibody-drug conjugates)), реферат №627, American Association for Cancer Research, 2004 Annual Meeting, 27-31 марта 2004 г., Proceedings of the AACR, т.45, март 2004 г.). В некоторых вариантах изобретения гомогенный ADC с одинаковой величиной загрузки можно выделять из смеси для конъюгирования с помощью электрофореза или хроматографии.
Получение конъюгатов антител и лекарственных средств
Конъюгаты антитело-лекарственное средство (ADC), применяемые в комбинации, представленной в настоящем описании, можно получать с помощью методов, известных специалисту в данной области. Примеры методов описаны, например, в WO 2009/099728. Указанные методы описаны, например, в WO 2009/099728 в параграфах 538-545 (получение иммуноконъюгатов), параграфах 546-585 (получение репрезентативных иммуноконъюгатов -конъюгатов тио-антитело-лекарственное средство), параграфах 586-591 (линкеры), параграфах 592-605 (удлиняющие компоненты), параграфах 606-610 (аминокислотные компоненты), параграфах 611-617 (спейсерные компоненты), параграфах 618-624 (дендритные линкеры), параграфах 625-632 (линкерные реагенты); параграфах 633-636 (получение конъюгатов сконструированное с помощью цистеина антитело к CD79b-лекарственное средство), все указанные разделы включены в настоящее описание в качестве ссылки.
Анализ активности in vitro, основанный на определении ICsn конъюгата антитело к CP79b-лекарственное средство, предназначенного для применения в комбинации, предлагаемой в изобретении
«IC50» означает концентрацию конкретного соединения, требуемую для ингибирования на 50% конкретной измеряемой активности. IC50 агентов, которые ингибируют взаимодействие с CD79b, можно измерять, среди прочего, согласно описанному ниже методу.
Понятие «цитотоксическая активность» относится к цитолитическому, цитостатическому или ростингибирующему действию конъюгата антитело-лекарственное средство или внутриклеточного метаболита конъюгата антитело-лекарственное средство. Цитотоксическую активность можно выражать в виде величины IC50, которая представляет собой концентрацию (молярную или массовую) на единицу объема, при которой выживает половина клеток.
Поверхностная экспрессия человеческого CD79b на нескольких клеточных линиях лимфом
Девятнадцать клеточных линий лимфом, экспрессирующих различные уровни CD79b на их поверхности, культивировали и собирали на логарифмической фазе роста. Клетки ресуспендировали в FACS-буфере для отмывки (ЗФР; 0,5% бычьего сывороточного альбумина; 0,1% азида натрия), содержащего по 100 мкг/мл2 нормального мышиного IgG и нормального человеческого IgG, и сохраняли на льду. Примерно 1×106 клеток/100 мкл окрашивали антителом к CD79b, конъюгированным с АРС (mlgGl, клон RFB4, фирма Southern Biotech, №9361-11) или мышиным антителом IgG1-изотипа, конъюгированным с АРС (фирма BD Pharmingen, №555751), в течение 30 мин на льду. Мертвые клетки окрашивали 7-AAD (фирма BD Pharmingen, №559925). Данные получали с использованием проточного цитометра BD FacsCalibur™ и анализировали с помощью программы FlowJo™. Определяли IC50 для huMA79b.v28-MCvcPAB-DMl или huMA79b.v28-MCvcPAB-MMAF, или huMA79b.v28-MCvcPAB-MMAE, или каждого свободного лекарственного средства (DM1, MMAF или ММАЕ) путем культивирования, как указано выше, клеток лимфомы, сбора культивированных клеток на логарифмической фазе роста и посева 5000 клеток в 90 мкл культуральной среды на лунку 96-луночного планшета. ADC и свободное лекарственное средство серийно разводили в диапазоне, соответствующем диапазону обнаружения (начиная с 300 мкг/мл2 для ADC или 90 нМ для свободного лекарственного средства и осуществляя разведение до достижения практически нулевого значения в отношении анализируемой мишени). Аликвоты по 10 мкл разведенного ADC или свободного лекарственного средства добавляли с дублированием в лунки, содержащие клетки, и инкубировали в течение 3 дней при 37°С. В каждую лунку добавляли по 100 мкл реагента CellTiter Glo™ и инкубировали в течение 30 мин. Определяли хемилюминесценцию и данные анализировали с помощью программы Prism™.
Олигосахаридный компонент может оказывать существенное воздействие на свойства, связанные с эффективностью терапевтического гликопротеина, включая физическую стабильность, устойчивость к действию протеаз, взаимодействия с иммунной системой, фармакокинетические свойства и специфическая биологическая активность. Указанные свойства могут зависеть не только от присутствия или отсутствия олигосахаридов, но также от их специфических структур. Можно сделать некоторые обобщения зависимости между олигосахаридной структурой и функцией гликопротеина. Например, некоторые олигосахаридные структуры опосредуют быстрый клиренс гликопротеина из кровотока посредством взаимодействий со специфическими углеводсвязывающими белками, в то время как другие могут связываться антителами и запускать нежелательные иммунные реакции (Jenkins N. и др., Nature Biotechnol. 14, 1996, сс. 975-981).
Клетки млекопитающих являются предпочтительными хозяевами для производства терапевтических гликопротеинов благодаря их способности гликозилировать белки с получением наиболее приемлемой для применения на человеке формы (Cumming D.A. и др., Glycobiology 1, 1991, сс. 115-130; Jenkins N. и др., Nature Biotechnol. 14, 1996, сс. 975-981). Бактерии очень редко гликозилируют белки, и подобно другим типам обычных хозяев, таких как клетки дрожжей, нитчатых грибов, насекомых и растений, обеспечивают схемы гликозилирования, ассоциированные с быстрым клиренсом из кровотока, нежелательными иммунными взаимодействиями и в некоторых случаях пониженной биологической активностью. Среди клеток млекопитающих клетки яичника китайского хомячка (СНО) нашли наиболее широкое применение в течение двух последних десятилетий. Помимо обеспечения приемлемых схем гликозилирования эти клетки позволяют устойчиво получать генетически стабильные, высокопродуктивные клональные клеточные линии. Их можно культивировать, достигая высокой плотности, в простых биореакторах с использованием бессывороточных сред, и на их основе можно разрабатывать безопасные и воспроизводимые биопроцессы. Другими обычно применяемыми клетками животных являются клетки почки детеныша хомяка (ВНК), клетки мышиной миеломы NS0 и SP2/0. В последние годы изучали также возможность их производства в организме трансгенных животных (Jenkins N. и др., Nature Biotechnol. 14, 1996, сс. 975-981).
Все антитела содержат углеводные структуры в консервативных положениях в константных областях тяжелой цепи, при этом каждый изотип характеризуется различной организацией N-связанных углеводных структур, которые оказывают различное действие на сборку, секрецию или функциональную активность белка (Wright А. и Morrison S.L., Trends Biotech. 15, 1997, сс. 26-32). Структура присоединенного N-связанного углевода значительно варьируется в зависимости от степени процессирования и может включать имеющие высокое содержание маннозы, множество разветвлений, а также биантенные сложные олигосахариды (Wright А. и Morrison S.L., Trends Biotech. 15, 1997, сс. 26-32). Как правило, имеет место гетерогенный процессинг коровых олигосахаридных структур, присоединенных в конкретном сайте гликозилирования, в результате чего даже моноклональные антитела существуют в виде нескольких гликоформ. Было установлено также, что основные различия в гликозилировании антител имеют место между клеточными линиями, и даже при выращивании рассматриваемой клеточной линии в других условиях культивирования имеют место небольшие различия (Lifely M.R. и др., Glycobiology 5(8), 1995, сс. 813-22).
Одним из путей достижения значительного повышения эффективности при сохранении простого процесса производства и возможности избежать значительных нежелательных побочных действий является усиление природных опосредуемых клеткой эффекторных функций моноклональных антител путем конструирования их олигосахаридного компонента согласно методу, описанному у Umana Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180 и в US №6602684. Антитела IgG1-типа, представляющие собой антитела, наиболее часто используемые в иммунотерапии рака, являются гликопротеинами, которые имеют консервативный N-связанный сайт гликозилирования в положении Asn297 в каждом СН2-домене. Два сложных биантенных олигосахарида, которые присоединены к Asn297, размещаются между СН2-доменами, образуя обширные контакты с каркасом полипептида, и их наличие является существенным для способности антитела опосредовать эффекторные функции, такие как антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) (Lifely M.R. и др., Glycobiology, 5, 1995, сс. 813-822; Jefferis R. и др., Immunol. Rev., 163, 1998, сс. 59-76; Wright А. и Morrison S.L., Trends Biotechnol., 15, 1997, cc. 26-32).
Ранее было установлено, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), гликозилтрансферазы, катализирующей образование бисекционных олигосахаридов, существенно повышает ADCC-активность in vitro антинейробластомного химерного моноклонального антитела (chCE7), продуцируемого сконструированными клетками СНО (см. Umafia Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180; и WO 1999/54342, полное содержание указанных документов включено в настоящее описание в качестве ссылки). Антитело chCE7 относится к большому классу неконъюгированных моноклональных антител, которые обладают высокой аффинностью и специфичностью в отношении опухолей, но имеют слишком низкую эффективность для клинического применения при их получении в стандартных промышленных клеточных линиях, в которых отсутствует фермент GnTIII (Umana Р. и др., Nature Biotechnol., 17, 1999, сс. 176-180). Это исследование было первым, в котором установлено, что существенных повышений ADCC-активности можно достигать путем конструирования продуцирующих антитело клеток, которые экспрессируют GnTIII, что приводит также к повышению относительного содержания ассоциированных с константной областью (Fc) бисекционных олигосахаридов, включая бисекционные нефукозилированные олигосахариды, по сравнению с уровнями, характерными для встречающихся в естественных условиях антител.
Понятие «рак» в контексте настоящего описания относится к таким видам рака, как лимфомы, лимфолейкозы, рак легкого, немелкоклеточный рак легкого (NSCL), бронхоальвеолярно-клеточный рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожная или внутриглазная меланома, рак матки, рак яичника, ректальный рак, рак анальной области, рак желудка, гастральный рак, рак ободочной кишки, рак молочной железы, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркома мягкой ткани, рак мочеиспускательного канала, рак пениса, рак предстательной железы, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, карцинома почечных лоханок, мезотелиома, печеночно-клеточный рак, билиарный рак, неоплазмы центральной нервной системы (ЦНС), опухоль позвоночника, глиома ствола головного мозга, мультиформная глиобластома, астроцитомы, шванномы, эпендимомы, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденома гипофиза, в том числе устойчивые варианты любого из указанных выше видов рака или комбинации одного или нескольких из указанных выше видов рака. Согласно одному из вариантов осуществления изобретения понятие рак относится к раку, при котором происходит экспрессия CD20.
Подразумевается, что понятие «экспрессия антигена CD20» относится к значимому уровню экспрессии антигена CD20 в клетке, предпочтительно на клеточной поверхности Т- или В-клетки, более предпочтительно В-клетки опухоли или рака соответственно, предпочтительно опухоли, которая не относится к солидным опухолям. Пациентов, которые имеют «рак, при котором происходит экспрессия CD20», можно выявлять с помощью стандартных анализов, известных в данной области. Например, экспрессию антигена CD20 можно оценивать иммуногистохимическим (ИГХ) методом, FACS или путем выявления соответствующей мРНК с помощью ПЦР.
Понятие «рак, при котором происходит экспрессия CD20» в контексте настоящего описания относится ко всем видам раковых клеток, для которых характерна экспрессия антигена CD20. В контексте настоящего описания рак, при котором происходит экспрессия CD20, предпочтительно относится к лимфомам (предпочтительно В-клеточным неходжкинским лимфомам (НХЛ)) и лимфолейкозам. Указанные лимфомы и лимфолейкозы включают, например, а) фолликулярные лимфомы, б) мелкоклеточые с нерасщепленными ядрами лимфомы/лимфому Беркитта (включая эндемическую лимфому Беркитта, спорадическую лимфому Беркитта и не-беркиттовскую лимфому), в) лимфомы маргинальной зоны (включая экстранодальную В-клеточную лимфому маргинальной зоны (лимфомы лимфоидной ткани слизистых оболочек, MALT), нодальную В-клеточную лимфому марганальной зоны и лимфому маргинальной зоны селезенки), г) лимфому из клеток зоны мантии (MCL), д) крупноклеточную лимфому (включая В-клеточную диффузную крупноклеточную лимфому (DLCL), диффузную смешанно-клеточную лимфому, иммунобластную лимфому, первичную медиастинальную В-клеточную лимфому, ангиоцентрическую лимфому-легочную В-клеточную лимфому), е) волосковоклеточный лейкоз, ж) лимфоцитарную лимфому, Вальденстрема макроглобулинемию, з) острый лимфобластный лейкоз (ALL), хронический лимфолейкоз (СХЕ)/мелкоклеточный лимфолейкоз (SLL), В-клеточный пролимфоцитарный лейкоз, и) неоплазмы из плазматических клеток, миеломы из плазматических клеток, множественную миелому, плазмацитому, к) болезнь Ходжкина.
Согласно одному из вариантов осуществления изобретения рак, при котором происходит экспрессия CD20, представляет собой В-клеточные неходжкинские лимфомы (НХЛ)). Согласно другому варианту осуществления изобретения рак, при котором происходит экспрессия CD20, представляет собой лимфому из клеток зоны мантии (MCL), острый лимфобластный лейкоз (ALL), хронический лимфолейкоз (CLL), В-клеточную диффузную крупноклеточную лимфому (DLCL), лимфому Беркитта, волосковоклеточный лейкоз, фолликулярную лимфому, множественную миелому, лимфому маргинальной зоны, пост-трансплантационное лимфопролиферативное нарушение (PTLD), ассоциированную с ВИЧ лимфому, Вальденстрема макроглобулинемию или первичную лимфому ЦНС.
Понятие «метод лечения» или его эквивалент применительно, например, к раку, относится к процедуре или протоколу лечения, которую/который разрабатывают с целью снижения или устранения некоторого количества раковых клеток в организме пациента или для облегчения симптомов рака. «Метод лечения» рака или другого пролиферативного нарушения не обязательно подразумевает, что раковые клетки или другие нарушения должны быть фактически элиминированы, что количество клеток или уровень нарушения фактически должны быть снижены, или что другие симптомы рака или другого нарушения фактически должны быть облегчены. Часто метод лечения рака можно осуществлять даже с небольшой вероятностью успеха, но он с учетом истории болезни пациента и оцененной перспективы выживаемости, тем не менее, как предполагается, может оказывать общее благоприятное воздействие.
Понятия «совместное применение» «введение в сочетании (комбинации)» относятся к введению указанного афукозилированного антитела к CD20 и указанного конъюгата антитело к CD79b-лекарственное средство в виде двух различных препаративных форм (или в виде одной индивидуальной препаративной формы). Совместное применение может быть одновременным или последовательным в любом порядке, при этом предпочтительно существует период времени, в течение которого оба действующих вещества (или все действующие вещества) одновременно проявляют свое биологическое действие. Указанное афукозилированное антитело к CD20 и указанный конъюгат антитело к CD79b-лекарственное средство совместно вводят либо одновременно, либо последовательно (например, внутривенно (i.v.) с помощью непрерывной инфузии (одной для антитела к CD20 и, как правило, еще одной для указанного конъюгата антитело к CD79b-лекарственное средство; или антитело к CD20 вводят внутривенно (i.v.) с помощью непрерывной инфузии и указанный конъюгат антитело к CD79b-лекарственное средство вводят орально). Когда оба терапевтических агента совместно вводят последовательно, то вводимую дозу применяют либо в один и тот же день в виде двух различных введений, либо один из агентов вводят в день 1, а второй совместно применяемый агент вводят в день 2 - день 7, предпочтительно день 2 - день 4. Таким образом, понятие «последовательно» означает в пределах 7 дней после введения дозы первого компонента (антитело к CD20 или конъюгат антитело к CD79b-лекарственное средство), предпочтительно в пределах 4 дней после введения дозы первого компонента; а понятие «одновременно» означает в одно и тоже время. Понятие «совместное применение» касательно поддерживающих доз указанного афукозилированного антитела к CD20 и конъюгата антитело к CD79b-лекарственное средство означает, что поддерживающие дозы можно совместно вводить одновременно, если цикл лечения обоими лекарственными средствами пригоден для этого, например, каждую неделю. Или конъюгат антитело к CD79b-лекарственное средство, вводят, например, каждый первый-третий день, а указанное афукозилированное антитело вводят каждую неделю. Или поддерживающие дозы применяют совместно последовательно либо в один день, либо в пределах нескольких дней.
Очевидно, что антитела вводят пациенту в «терапевтически эффективном количестве» (или просто в «эффективном количестве»), которое представляет собой количество соответствующего соединения или комбинации, вызывающее биологический или медицинский ответ ткани, системы, животного или человека, ожидаемый исследователем, ветеринаром, лечащим врачом или другим клиницистом.
Количество вводимых совместно афукозилированного антитела к CD20 и указанного конъюгата антитело к CD79b-лекарственное средство и время совместного введения должны зависеть от типа (вид, пол, возраст, вес и т.д.) и состояния пациента, подлежащего лечению, и серьезности подлежащего лечению заболевания или состояния. Предпочтительно указанное афукозилированное антитело к CD20 и конъюгат антитело к CD79b-лекарственное средство следует вводить пациенту один раз или в виде серий обработок, например, в один и тот же день или день спустя.
Если введение является внутривенным, то продолжительность начальной инфузии указанного афукозилированного антитела к CD20 и конъюгата антитело к CD79b-лекарственное средство может быть длиннее, чем продолжительности последующих инфузий, например, может составлять примерно 90 мин для начальной инфузии и примерно 30 мин для последующих инфузий (если начальная инфузия хорошо переносится).
В зависимости от типа и серьезности заболевания начальная возможная доза при совместном применении обоих лекарственных средств пациенту может составлять примерно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) для указанного афукозилированного антитела к CD20; и от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) для указанного конъюгата антитело к CD79b-лекарственное средство. Согласно одному из вариантов осуществления изобретения предпочтительная доза указанного афукозилированного антитела к CD20 (предпочтительно афукозилированного гуманизированного антитела В-Ly1) должна составлять от примерно 0,05 до примерно 30 мг/кг. Так, для совместного применения пациенту можно использовать одну или несколько из следующих доз: примерно 0,5, 2,0, 4,0, 10 или 30 мг/кг (или любую их комбинацию). Согласно одному из вариантов осуществления изобретения предпочтительная доза указанного конъюгата антитело к CD79b-лекарственное средство должна составлять от примерно 0,05 примерно 30 мг/кг. Так, пациенту можно вводить совместно одну или несколько доз, составляющих примерно 0,5, 2,0, 4,0, 10 или 30 мг/кг (или любую их комбинацию).
Согласно одному из вариантов осуществления изобретения для лечения указанных видов рака указанный конъюгат антитело к CD79b-лекарственное средство вводят путем внутривенной инфузии, указанной выше. Вводимая путем инфузии доза составляет от примерно 1 до примерно 10000 мкг/м2 на дозу, как правило, из расчета одна доза в неделю, при этом в общей сложности вводят одну, две, три или четыре дозы. Альтернативно этому, дозы составляют от примерно 1 до примерно 1000 мкг/м2, примерно от 1 до примерно 800 мкг/м2, примерно от 1 до примерно 600 мкг/м2, примерно от 1 до примерно 400 мкг/м2, примерно от 10 до примерно 500 мкг/м2, примерно от 10 до примерно 300 мкг/м2, примерно от 10 до примерно 200 мкг/м2 и примерно от 1 до примерно 200 мкг/м2. Дозу можно вводить 1 раз в день, 1 раз в неделю, несколько раз в неделю, но реже, чем 1 раз в день, несколько раз в месяц, но реже, чем 1 раз в день, несколько раз в месяц, но реже, чем 1 раз в неделю, один раз в месяц или прерывисто для ослабления или облегчения симптомов заболевания. Введение может продолжаться в течение любого из указанных интервалов вплоть до достижения ремиссии опухоли или симптомов лимфомы, лейкоза, подлежащих лечению. Лечение можно продолжать после достижения ремиссии или уменьшения симптомов, если указанная ремиссия или указанное облегчение пролонгируются с помощью такого продолжающегося лечения.
В зависимости от типа (вид, пол, возраст, вес и т.д.) и состояния пациента и от типа афукозилированного антитела к CD20 доза и схема введения указанного афукозилированного антитела к CD20 может отличаться от указанных для конъюгата антитела к CD79b-лекарственное средство. Например, указанное афукозилированное антитело к CD20 можно вводить, например, каждые 1-3 недели, и указанный конъюгат антитело к CD79b-лекарственное средство можно вводить ежедневно или каждые 2-10 дней. Можно применять начальную более высокую ударную дозу, после чего применять одну или несколько более низких доз.
Согласно одному из вариантов осуществления изобретения предпочтительная доза указанного афукозилированного антитела к CD20 (предпочтительно афукозилированного гуманизированного антитела B-Ly1), применяемого в сочетании с указанным конъюгатом антитело к CD79b-лекарственное средство, предлагаемым в изобретении, должна составлять от 800 до 1600 мг (в одном из вариантов осуществления изобретения от 800 до 1200 мг) в день 1, 8, 15 при осуществлении 3-6-недельных циклов дозирования, затем доза должна составлять от 400 до 1200 мг (в одном из вариантов осуществления изобретения от 800 до 1200 мг) в день 1 при осуществлении вплоть до девяти 3-4-недельных циклов дозирования. Наиболее предпочтительно доза представляет собой постоянную дозу 1000 мг, которую применяют для трехнедельной схемы дозирования, с возможностью применения дополнительного цикла с использованием постоянной дозы 1000 мг на второй неделе.
В следующем варианте осуществления изобретения доза указанного конъюгата антитело к CD79b-лекарственное средство, применяемого в комбинации с афукозилированным антителом к CD20, предлагаемым в изобретении, составляет от примерно 1,5 до примерно 3 мг/кг при трехнедельной схеме дозирования, предпочтительно от примерно 1,7 до примерно 2,5 мг/кг, наиболее предпочтительно примерно 1,8 или примерно 2,4 мг/кг. Указанные наиболее предпочтительные дозы в настоящее время проходят фазу II испытаний, в которых конъюгат антитело к CD79b-лекарственное средство применяют в режиме монотерапии.
В следующем варианте осуществления изобретения доза афукозилированного антитела к CD20, применяемого в комбинации с конъюгатом антитело к CD79b-лекарственное средство, предлагаемым в изобретении, представляет собой постоянную дозу, составляющую примерно 1000 мг, в день 1 (цикл 1, день 1 (C1D1)), другую постоянную дозу, составляющую примерно 1000 мг, в день 8 (C1D8) и следующую постоянную дозу, составляющую примерно 1000 мг, в день 15 (C1D15), за которой следует еще шесть постоянных доз примерно по 1000 мг указанного афукозилированного антитела к CD20 (цикл 2) каждые три недели: день 22 (C2D1), день 43 (C2D2), день 64 (C2D3), день 85 (C2D4), день 106 (C2D5) и день 127 (C2D6). В указанном варианте осуществления изобретения доза конъюгата антитело к CD79b-лекарственное средство, применяемого в комбинации с афукозилированным антителом к CD20, предлагаемым в изобретении, составляет примерно 2,4 мг/кг каждые три недели или в альтернативном варианте 1,8 мг/кг каждые три недели. В указанном варианте осуществления изобретения дозирование конъюгата антитело к CD79b-лекарственное средство, применяемого в комбинации с афукозилированным антителом к CD20, предлагаемым в изобретении, осуществляют в день 1 (C1D1), день 22 (C2D1), день 43 (C2D2), день 64 (C2D3), день 85 (C2D4), день 106 (C2D5) и день 127 (C2D6).
Предпочтительно в описанных выше режимах дозирования афукозилированное антитело к CD20 представляет собой обинутузумаб или GA101. Предпочтительно также в описанных выше режимах дозирования указанный конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-MC-vc-PAB-MMAE.
В изобретении предложен также способ облегчения аутоиммунного заболевания, заключающийся в том, что вводят пациенту, страдающему аутоиммунным заболеванием, в терапевтически эффективном количестве указанное афукозилированное антитело к CD20, представленное в настоящем описании, и конъюгат гуманизированное антитело huMA79b.у28-лекарственное средство по одному из предыдущих вариантах осуществления изобретения. В предпочтительных вариантах осуществления изобретения антитело вводят внутривенно или подкожно. Конъюгат антитело-лекарственное средство вводят внутривенно в дозе, составляющей от примерно 1 мкг/м2 до примерно 100 мг/м2 на дозу, и в конкретном варианте осуществления изобретения доза составляет от 1 до примерно 500 мкг/м2. Дозу можно вводить один раз в день, один раз в неделю, несколько раз в неделю, но реже чем 1 раз в день, несколько раз в месяц, но реже, чем один раз в день, несколько раз в месяц, но реже, чем один раз в неделю, один раз в месяц или прерывисто, для ослабления или облегчения симптомов заболевания. Введение может продолжаться в течение любого из указанных интервалов вплоть до достижения ремиссии опухоли или ослабления симптомов аутоиммунного заболевания, подлежащего лечению. Лечение можно продолжать после достижения ремиссии или ослабления симптомов, если указанная ремиссия или указанное ослабление пролонгируются с помощью такого продолжающегося лечения.
В изобретении предложен также способ лечения В-клеточного нарушения, заключающийся в том, что вводят пациенту, страдающему В-клеточным нарушением, таким как В-клеточное пролиферативное нарушение (включая (но не ограничиваясь только ими) лимфому и лейкоз), или аутоиммунным заболеванием, в терапевтически эффективном количестве указанное афукозилированное антитело к CD20, представленное в настоящем описании, и гуманизированное антитело huMA79b.v28 по одному из предыдущих вариантов осуществления изобретения, где антитело не конъюгировано с цитотоксической молекулой или выявляемой молекулой. Антитело, как правило, следует вводить в дозах, составляющих от примерно 1 мкг/м2 до примерно 1000 мг/м2.
Рекомендованная доза может варьироваться в зависимости от того, осуществляют ли дополнительное совместное введение химиотерапевтического средства, и в зависимости от типа химиотерапевтического средства.
В одном из предпочтительных вариантов осуществления изобретения лекарственное средство можно применять для предупреждения или снижения метастазов или дальнейшей их диссеминации у пациента, страдающего раком, предпочтительно раком, при котором происходит экспрессия CD20. Лекарственное средство можно применять для удлинения продолжительности жизни указанного пациента, удлинения продолжительности жизни до прогрессирования болезни у указанного пациента, удлинения продолжительности ответа, что приводит к статистически значимому и клинически заметному улучшению состояния подвергнутого лечению пациента при оценке по продолжительности жизни, продолжительности жизни до прогрессирования болезни, уровню ответа или продолжительности ответа. В предпочтительном варианте осуществления изобретения лекарственное средство можно применять для повышения уровня ответа у группы пациентов.
В контексте настоящего изобретения для лечения рака можно применять дополнительные другие цитотоксические, химиотерапевтические или противораковые средства или соединения, повышающие эффективность указанных средств (например, цитокины), в комбинации с афукозилированным антителом к CD20 и указанным конъюгатом антитело к CD79b-лекарственное средство. Указанные молекулы должны присутствовать в комбинации в количествах, эффективных для поставленных целей. Согласно одному из вариантов осуществления изобретения лечение с использованием указанного афукозилированного антитела к CD20 в комбинации с указанным конъюгатом антитело к CD79b-лекарственное средство осуществляют без применения указанных дополнительных цитотоксических, химиотерапевтических или противораковых средств или соединений, повышающих эффективность указанных средств.
Такие средства представляют собой, например, алкилирующие агенты или агенты, обладающие алкилирующей активностью, такие как циклофосфамид (СТХ; например, Cytoxan®), хлорамбуцил (CHL; например, leukeran®), цисплатин (CisP; например, platinol®), бусульфан (например, myleran®), мелфалан, кармустин (BCNU), стрептозотоцин, триэтиленмеламин (ТЕМ), митомицин С, и т.п.; антиметаболиты, такие как метотрексат (МТХ), этопозид (VP 16; например, vepesid®), 6-меркаптопурин (6МР), 6-тиогуанин (6TG), цитарабин (Ara-С), 5-фторурацил (5-FU), капецитабин (например, Xeloda®), дакарбазин (DTIC) и т.п.; антибиотики, такие как актиномицин D, доксорубицин (DXR; например, adriamycin®), даунорубицин (дауномицин), блеомицин, митрамицин и т.п.; алкалоиды, такие как алкалоиды барвинка, такие как винкристин (VCR), винбластин и т.п.; и другие противоопухолевые агенты, такие как паклитаксел (например, taxol®) и производные паклитаксела, цитостатические агенты, глюкокортикоиды, такие как дексаметазон (DEX; например, decadron®) и кортикостероиды, такие как преднизон, ингибиторы нуклеозидных ферментов, такие как гидроксимочевина, истощающие аминокислоты ферменты, такие как аспарагиназа, лейковорин и другие производные фолиевой кислоты, и аналогичные другие противоопухолевые агенты. В качестве дополнительных средств можно применять также следующие агенты: арнифостин (например, ethyol®), дактиномицин, мехлоретамин (азотный аналог горчичного газа), стрептозоцин, циклофосфамид, ломустин (CCNU), доксорубицин липо (например, doxil®), гемцитабин (например, gemzar®), даунорубицин липо (например, daunoxome®), прокарбазин, митомицин, доцетаксел (например, taxotere®), альдеслейкин, карбоплатин, оксалиплатин, кладрибин, камптотецин, СРТ 11 (иринотекан), 10-гидрокси-7-этилкамптотецин (SN38), флоксуридин, флударабин, ифосфамид, идарубицин, месну, интерферон бета, интерферон альфа, митоксантрон, топотекан, леупролид, мегестрол, мелфалан, меркаптопурин, пликамицин, митотан, пэгаспаргазу, пентостатин, пипоброман, пликамицин, тамоксифен, тенипозид, тестолактон, тиогуанин, тиотепу, урациловый аналог горчичного газа, винорелбин, хлорамбуцил. В одном из вариантов осуществления изобретения комбинированное лечение с использованием афукозилированного антитела к CD20 и указанного конъюгата антитело к CD79b-лекарственное средство осуществляют без указанных дополнительных средств.
Применение цитотоксических и противораковых средств, описанных выше, а также антипролиферативных мишеньспецифических противораковых лекарственных средств типа ингибиторов протеинкиназ, в химиотерапевтических схемах, как правило, хорошо охарактеризовано в области лечения рака, и в данном случае при их применении следует учитывать аналогичные положения касательно мониторинга толерантности и эффективности и контроля путей введения и доз с определенными корректировками. Например, фактические дозы цитотоксических агентов можно изменять в зависимости от ответа культивируемых клеток пациента, определенного с использованием методов на основе гистокультур. Как правило, дозы должны быть ниже по сравнению с количеством, в котором указанное средство применяют в отсутствии других дополнительных агентов.
Типичные дозы эффективного цитотоксического средства могут находиться в диапазонах, рекомендованных производителем, и с учетом ответов in vitro или ответов, полученных на созданных на животных моделях, их концентрацию или количество можно снижать на величину, составляющую примерно вплоть до одного порядка. Так, фактическая доза должна зависеть от рекомендаций лечащего врача, состояния пациента и эффективности терапевтического метода, определенного на основе чувствительности in vitro первичных культур злокачественных клеток или образца ткани из гистокультуры, или ответов, обнаруженных на соответствующих созданных на животных моделях.
В контексте настоящего изобретения эффективное количество ионизирующего излучения и/или радиофармацевтических средств можно применять в дополнение к комбинированному лечению рака, при котором происходит экспрессия CD20, с использованием афукозилированного антитела к CD20 и указанного конъюгата антитело к CD79b-лекарственное средство. Источник излучения может быть внутренним или внешним относительно пациента, подлежащего лечению. Когда источник является внешним относительно пациента, то терапию называют наружной лучевой терапией (EBRT). Когда источник излучения является внутренним относительно пациента, то лечение обозначают как брахитерапия (ВТ). Радиоактивные атомы, которые можно применять согласно настоящему изобретению, можно выбирать из группы, включающей (но не ограничиваясь только ими) радий, цезий-137, иридий-192, америций-241, золото-198, кобальт-57, медь-67, технеций-99, йод-123, йод-131 и индий-111. Можно также метить антитело соответствующими радиоактивными изотопами. В одном из вариантов осуществления изобретения комбинированную терапию с использованием афукозилированного антитела к CD20 и указанного конъюгата антитело к CD79b-лекарственное средство применяют без ионизирующего излучения.
Лучевая терапия является стандартным средством лечения для контроля нерезектабельных или неоперабельных опухолей и/или метастазов опухолей. Улучшенные результаты были получены, когда лучевую терапию объединяли с химиотерапией. Лучевая терапия основана на принципе, что высокая доза излучения, поставляемая к области-мишени, может приводить к гибели репродуктивных клеток как в опухоли, так и в здоровых тканях. Схема введения излучения, как правило, определяют в понятиях абсорбированной дозы излучения (Гр), времени и фракционирования, и ее должен тщательно подбирать онколог. Количество излучения, полученное пациентом, должно зависеть от различных обстоятельств, но двумя наиболее важными являются локализация опухоли относительно других имеющих решающее значение структур или органов в организме и степень распространения опухоли. Типичный курс лечения пациента, подвергающегося лучевой терапии, представляет собой схему лечения в течение периода времени, составляющего от 1 до 6 недель, при этом общую дозу от 10 до 80 Гр вводят пациенту в виде однократной суточной фракционированной дозы, составляющей от 1,8 до 2,0 Гр, 5 дней в неделю. В предпочтительном варианте осуществления настоящего изобретения имеет место синергизм, когда опухоли у больных людей подвергают комбинированной терапии, предлагаемой в изобретении, и излучению. Другими словами, ингибирование роста опухолей с помощью агентов, входящих в комбинацию, предлагаемую в изобретении, повышается при объединении с излучением, необязательно в сочетании с дополнительными химиотерапевтическими или противораковыми средствами. Параметры вспомогательной лучевой терапии описаны, например, в WO 1999/60023.
Афукозилированные антитела к CD20 и/или конъюгат антитело к CD79b-лекарственное средство, предлагаемый в изобретении, вводят пациенту с помощью известных методов с использованием внутривенного введения в виде болюса или непрерывной инфузии в течение определенного периода времени, с помощью внутримышечного, внутрибрюшинного, спинномозгового, подкожного, внутрисуставного, интрасиновиального или подоболочечного пути введения. В одном из вариантов осуществления изобретения антитело вводят внутривенно или подкожно.
В контексте настоящего описания понятие «фармацевтически приемлемый носитель» включает любой и все материалы, пригодные для фармацевтического введения, включая растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, придающие изотоничность и замедляющие абсорбцию агенты и другие материалы и соединения, которые являются пригодными для фармацевтического введения. За исключением случая, когда они являются несовместимыми с действующим веществом, в композициях, предлагаемых в изобретении, можно применять любые общепринятые среды или агенты. В композиции можно включать также дополнительные действующие вещества.
Фармацевтические композиции
Фармацевтические композиции можно получать обработкой антитела к CD20 и/или конъюгата антитело к CD79b-лекарственное средство, предлагаемого в настоящем изобретении, в сочетании с фармацевтически приемлемыми неорганическими или органическими носителями. В качестве носителей, например, для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул, можно применять лактозу, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и т.п. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Однако в зависимости от природы действующего вещества, как правило, для мягких желатиновых капсул носители не требуются. Приемлемыми носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и т.п. Приемлемыми носителями для суппозиториев являются, например, встречающиеся в естественных условиях или гидрогенизированные масла, воски, жиры, полутвердые или жидкие полиолы и т.п.
Кроме того, в состав фармацевтических композиций могут входить консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для изменения осмотического давления, буферы, маскирующие вещества или антиоксиданты. Они могут содержать также другие терапевтически эффективные субстанции.
Одним из вариантов осуществления изобретения является композиция, содержащая как указанное афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело B-Ly1), так и конъюгат антитело к CD79b-лекарственное средство, предназначенная для применения при лечении рака, прежде всего рака, при котором происходит экспрессия CD20 (предпочтительно лимфомы или лимфоцитарного лейкоза, например, В-клеточной неходжкинской лимфомы (НХЛ)).
Указанная фармацевтическая композиция может содержать также один или несколько фармацевтически приемлемых носителей.
Настоящее изобретение относится также к фармацевтической композиции, которую применяют, прежде всего, при раке, содержащей (I) в эффективном количестве афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело B-Ly1), и (II) в эффективном количестве конъюгат антитело к CD79b-лекарственное средство. Указанная композиция необязательно содержит фармацевтически приемлемые носители и/или эксципиенты.
Фармацевтические композиции, содержащие только афукозилированное антитело к CD20, которые применяют согласно настоящему изобретению, приготавливают для хранения путем смешения антитела, имеющего требуемую степень чистоты, необязательно в сочетании с фармацевтически приемлемыми носителями, экципиентами или стабилизаторами (Remington's Pharmaceutical Sciences, под ред. Osol А.Е., 16-е изд., 1980), в форме лиофилизированных препаративных форм или водных растворов. Пригодные носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный и буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмонийхлорид; гексаметонийхлорид; бензалконийхлорид, бензетонийхлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и мета-крезол); низкомолекулярые (состоящие менее чем примерно из 10 остатков) полипептиды; белки, такие сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; образующие соли противоионы, такие как натрий; комплексы с металлами (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEEN, PLURONICS или полиэтиленгликоль (ПЭГ).
Фармацевтические композиции конъюгатов антитело к CD79b-лекарственное средство могут быть сходными с описанными выше для афукозилированного антитела к CD20.
Фармацевтические композиции низкомолекулярного конъюгата антитело к CD79b-лекарственное средство включают композиции, пригодные для орального, назального, местного (включая трансбуккальное и подъязычное), ректального, вагинального и/или парентерального введения. Предпочтительно композиции могут представлять собой стандартную дозу лекарственного средства и их можно приготавливать с помощью любых методов, хорошо известных в области фармации. Количество действующего вещества, которое можно объединять с материалом носителя, с получением однократной лекарственной формы должно зависеть от хозяина, подлежащего лечению, а также конкретного пути введения. Количество действующего вещества, которое можно объединять с материалом носителя, с получением однократной лекарственной формы должно, как правило, представлять собой количество соединения формулы I, которое обеспечивает терапевтическое действие. Как правило, в пересчете на 100% указанное количество должно находиться в диапазоне от примерно 1% до примерно 99% действующего вещества, предпочтительно от примерно 5% до примерно 70%, наиболее предпочтительно от примерно 10% до примерно 30%. Методы получения указанных композиций включают стадию приведения в контакт конъюгата антитело к CD79b-лекарственное средство с носителем и необязательно одним или несколькими вспомогательными ингредиентами. Как правило, фармацевтические композиции конъюгата антитело к CD79b-лекарственное средство получают путем тщательного и равномерного смешения конъюгата антитело к CD79b-лекарственное средство с жидкими носителями или тонко измельченными твердыми носителями или с обоими типами носителей, при необходимости с приданием продукту формы. Композиции, пригодные для орального введения, могут иметь форму капсул, облаток, саше, пилюль, таблеток, лепешек (полученных с использованием, корригентной основы, как правило, сахарозы и гуммиарабика или трагаканта), порошков, гранул или представлять собой растворы или суспензии в воде или не представляющей собой воду жидкости, или представляют собой жидкую эмульсию типа масло-в-воде или вода-в-масле, или представляют собой эликсир или сироп, или представляют собой пастилки (полученные с использованием инертной основы, такой как желатин и глицерин или сахароза и гуммиарабик), и/или средство для полоскания полости рта и т.п., которые в каждом случае содержат предварительно определенное количество соединения, предлагаемого в настоящем изобретении в качестве действующего вещества. Соединение, предлагаемое в настоящем изобретении, можно вводить также в виде болюса, электуария (лекарственная кашка) или пасты.
Согласно одному из дополнительных вариантов осуществления изобретения афукозилированное антитело к CD20 и конъюгат антитело к CD79b-лекарственное средство приготавливают в виде двух различных фармацевтических композиций.
Действующие вещества можно включать в микрокапсулы, полученные, например, методом коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозы, или в желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы для введения лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Указанные методы описаны в Remington's Pharmaceutical Sciences, под ред. Osol А.Е., 16-е изд., 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобные полимеров, содержащих антитело, указанные матрицы имеют форму изделий определенной конфигурации, например, пленок или микрокапсул. Примерами матриц с замедленным высвобождением являются сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (US №3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразложимый этиленвинилацетат, разложимые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и леупролидацетата), и поли-0-(-)-3-гидроксимасляная кислота.
Препаративные формы, предназначенные для введения in vivo, должны быть стерильными. Для этой цели можно применять фильтрацию через стерильные фильтрующие мембраны.
Одним из вариантов осуществления изобретения является композиция, содержащая гуманизированное антитело B-Ly1, которое является афукозилированным с содержанием фукозы, составляющим 60% или менее относительно общего количества олигосахаридов (сахара) на Asn297, и конъюгат антитело к CD79b-лекарственное средство, представленный в настоящем описании, которая предназначена для лечения рака.
Настоящее изобретение относится также в способу лечения рака, заключающемуся в том, что вводят пациенту, который нуждается в таком лечении, (I) в эффективном первом количестве афукозилированное антитело к CD20 с содержанием фукозы, составляющим 60% или менее (предпочтительно афукозилированное гуманизированное антитело B-Ly1), и (II) в эффективном втором количестве конъюгат антитело к CD79b-лекарственное средство.
В одном из вариантов осуществления изобретение фукоза присутствует в количестве от 40% до 60%.
Предпочтительно рак представляет собой рак, при котором происходит экспрессия CD20.
Предпочтительно рак, при котором происходит экспрессия CD20, представляет собой лимфому или лимфоцитарный лейкоз.
Предпочтительно указанное афукозилированное антитело к CD20 представляет собой антитело к CD20 типа II.
Предпочтительно антитело представляет собой гуманизированное антитело B-Ly1. Предпочтительно указанное гуманизированное антитело B-Ly1 представляет собой обинутузумаб.
Предпочтительно указанный конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-MC-vc-PAB-MMAE. Предпочтительно антитело к CD79b в указанном конъюгате антитело к CD79b-лекарственное средство представляет собой huMA79b.v28.
Наиболее предпочтительно указанное антитело к CD20 представляет собой обинутузумаб, применяемый в сочетании с указанным конъюгатом антитело к CD79b-лекарственное средство, который представляет собой анти-CD79b-МС-vc-PAB-MMAE.
Предпочтительно указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1 и указанный конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-MC-vc-PAB-MMAE, и указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз.
В контексте настоящего описания понятие «пациент» предпочтительно относится к человеку, который нуждается в лечении с использованием афукозилированного антитела к CD20 (например, к пациенту, страдающему раком, при котором происходит экспрессия CD20), для любой цели, и наиболее предпочтительно к человеку, который нуждается в указанном лечении рака или предракового состояния или повреждения. Однако понятие «пациент» можно относить также к животным кроме человека, предпочтительно к млекопитающим, среди прочего, таким как собаки, кошки, лошади, коровы, свиньи, овцы и приматы кроме человека.
Изобретение относится также к афукозилированному антителу к CD20 с содержанием фукозы, составляющим 60% или менее, и конъюгату антитело к CD79b-лекарственное средство, предназначенным для применения при лечении рака.
Предпочтительно указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1.
Предпочтительно указанный конъюгат антитело к CD79b-лекарственное средство в одном из вариантов способа, предлагаемого в изобретении, представляет собой анти-CD79b-MC-vc-PAB-MMAE. Предпочтительно антитело к CD79b в указанном конъюгате антитело к CD79b-лекарственное средство представляет собой huMA79b.v28.
Предпочтительно указанное афукозилированное антитело к CD20 представляет собой гуманизированное антитело B-Ly1 и указанный конъюгат антитело к CD79b-лекарственное средство представляет собой анти-CD79b-MC-vc-PAB-MMAE. Наиболее предпочтительно антитело к CD79b в указанном конъюгате антитело к CD79b-лекарственное средство представляет собой huMA79b.v28.
Предпочтительно указанный рак представляет собой рак, при котором происходит экспрессия CD20, предпочтительно лимфому или лимфоцитарный лейкоз.
Приведенные ниже примеры и чертежи представлены с целью пояснения настоящего изобретения, истинный объем которого представлен в прилагаемой формуле изобретения. Очевидно, что в указанные процедуры можно вносить модификации без отклонения от сущности изобретения.
Экспериментальные процедуры
Пример 1 - Конъюгаты антитело к CP79b-лекарственное средство
Ксенотрансплантаты BJAB-люцифераза (лимфома Беркитта)
Анализ in vivo цитолиза опухолевых клеток
А. Ксенотрансплантаты - конъюгаты с DM1
Для тестирования эффективности IgG-вариантов «гуманизированного» антитела с трансплантированным MA79b, имеющих изменения в HVR-L2 и HVR-H3 (huMA79b L2/H3), вариант huMA79b L2/H3 конъюгировали с DM1 и анализировали действие конъюгированного варианта на опухоли у мышей.
Более конкретно оказалось возможным проанализировать способность антител обеспечивать регресс опухолей на многих моделях с использованием ксенотрансплантатов, включая клетки RAMOS, клетки BJAB (клеточная линия лимфомы Беркитта, которая содержит транслокацию t(2;8)(p112;q24) (IGK-MYC), мутантный ген Р53, и которая является негативной по вирусу Эпштейна-Барра (EBV)) (Drexler H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: изд-во Academic Press, 2001)), клетки Granta 519 (клеточная линия лимфомы из клеток мантии, которая содержит: транслокацию t(11;14)(q13;q32) (BCL1-IGH), приводящую к сверхэкспрессии циклина D1 (BCL1); которая содержит делеции P16INK4B и P16INK4A и является EBV-позитивной) (Drexler H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: изд-во Academic Press, 2001)), клетки U698M (В-клеточная линия лимфобластной лимфосаркомы; (Drexler H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: изд-во Academic Press, 2001) и клетки DoHH2 (клеточная линия фолликулярной лимфомы, содержащая транслокацию, ответственную за развитие фолликулярной лимфомы, а именно t(14;18)(q32;q21), которая приводит к сверхэкспрессии Вс1-2, регулируемой тяжелой цепью Ig; делецию P16INK4A, и транслокацию t(8;14)(q24;q32) (IGH-MYC), а также является EBV-негативной) (Drexler H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: изд-во Academic Press, 2001)).
Для анализа эффективности вариантов «гуманизированного антитела» с трансплантированным MA79b самкам SCID-мышей линии СВ17 ICR (возрастом 6-8 недель, полученным от фирмы Charles Rivers Laboratories; Холлистер, шт. Калифорния) подкожно инокулировали 2×107 клеток линии BJAB, содержащих люциферазу, или клеток линии Granta-519 путем инъекции в боковые области SCID-мышей линии СВ17 ICR, и опухолевым ксенотрансплантатам давали возможность расти до достижения их среднего размера 200 мм2. День 0 означал день, в который размер опухоли составлял в среднем 200 мм2, и в этот день вводили первую или только единственную дозу предназначенного для обработки средства, если ниже специально не указано иное. Объем опухоли рассчитывали на основе размеров в двух направлениях, измеренных с помощью кронциркуля, по формуле: V=0,5a×b2, где а и b означают большой и малый диаметры опухоли соответственно, и выражали в мм3. Данные, собранные для каждой экспериментальной группы, выражали в виде среднего значения ±С.К.О. Группы по 10 мышей обрабатывали путем внутривенного (i.v.) введения одной дозы, составляющей от 50 до 210 мкг связанного с антителом лекарственного средства/м2 мыши (что соответствовало 1-4 мг/кг веса тела мыши), а именно вводили конъюгаты вариантов «гуманизированного» антитела с трансплантированным MA79b или конъюгат контрольное антитело-лекарственное средство. На протяжении всего эксперимента опухоли измеряли один или два раза в неделю. Массу тела мышей измеряли один или два раза в
неделю на протяжении всего эксперимента. Когда объем опухоли достигал 3000 мм3 или когда опухоли приводили к появлению признаков угрожающего жизни изъязвления, мышей умерщвляли. Все протоколы проведения экспериментов на животных были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC).
В качестве линкеров между антителом и токсином для связывания с DM1 использовали тиоэфирный перекрестно-связывающий линкер SMCC. Другими линкерами могут служить дисульфидный линкер SPP или тиоэфирный перекрестно-сшивающий линкер SMCC для DM1 или МС или МС-валин-цитруллин(ус)-РАВ или дипептидный линкерный реагент (валин-цитруллин(ус)), имеющий малеимидный компонент и пара-аминобензилкарбамоильный (РАВ) самоэлиминирующийся компонент для монометилауристатина Е (ММАЕ) или монометилауристатина F (MMAF). В качестве токсинов применяли DM1. Дополнительными токсинами могут служить ММАЕ или MMAF.
В качестве антител к CD79b в данном эксперименте применяли химерные антитела MA79b (chMA79b), описанные в заявке на патент США №11/462336, зарегистрированной 3 августа 2006 г., а также представленные в настоящем описании варианты «гуманизированного» антитела с трансплантированным MA79b. Другими антителами могут служить поступающие в продажу антитела, включая антитело к CD79b и моноклональные антитела MA79b, полученные с использованием гибридом, депонированных в АТСС под номером НВ11413 20 июля 1993 г.
Б. Ксенотрансплантаты - другие конъюгаты
Негативные контроли включали конъюгаты на основе антитела к HER2 (HERCEPTIN® (трастузумаба))(SMCC-ВМ1). В аналогичном опыте с использованием того же протокола исследования с использованием ксенотрансплантата, который описан в примере А (выше), варьируя содержащие лекарственное средство конъюгаты и дозы, тестировали эффективность других содержащих лекарственное средство конъюгатов на SCID-мышах линии СВ17, несущих трансплантаты BJAB-люцифераза (лимфома Беркитта). Содержащие лекарственное средство конъюгаты и дозы (введение осуществляли в день 0 для всех ADC и контролей) представлены ниже в таблице 3.
В качестве контрольного антитела использовали huMA79b.v28 (конъюгированное с SMCC-DM1). Контрольное НС (А118С) тиоМАВ представляло собой тио-hu-анти-НЕ112-НС(А118С) антитело тиоМАВ (конъюгированное с BMPEO-DM1, MC-MMAF или MCvcPAB-MMAE), тио-huMA79b.v28-HC(A118C) тиоМАВ или THO-hu-анти-CD22(10F4v3)-HC(A118C) тиоМАВ (конъюгированное с MC-MMAF). Результаты представлены ниже в таблице 3.
Введение конъюгатов тиоМAB-лекарственное средство: THO-huMA79b.v28-НС(A118C)-BMPEO-DM1, THO-huMA79b.v28-HC(A118Q-MC-MMAF и тио-huMA79b.v28-HC(A118C)-MCvcPAB-MMAE приводило к ингибированию роста опухоли по сравнению с используемыми в качестве отрицательного контроля конъюгатами антитело-лекарственное средство (тио-hu-анти-НЕ112-НС(А118С)-BMPEO-DM1, THO-hu-анти-HER2-HC(A118C)-MC-MMAF и тио-hu-анти-HER2-НС(A118C)-MCvcPAB-MMAE). В качестве других контролей применяли тио-huMA79b.v28-HC(A118C), huMA79b.v28-SMCC-DM1 и тио-hu-анти-CD22(10F4v3)-HC(A118C)-MC-MMAF.
Кроме того, в этом же опыте определяли изменение веса тела (в %) в течение первых 7 дней в каждой группе обработки. Результаты показали, что введение указанных конъюгатов тиоМAB-лекарственное средство не приводило к значимому снижению веса тела (в %) или потере веса в течение рассмотренного периода времени.
Кроме того, в таблице 3 указано количество мышей из общего количества протестированных мышей, у которых выявлен частичный регресс (PR) (т.е. уменьшение объема опухоли в любой момент времени после введения до уровня, составляющего менее 50% от объема опухоли, измеренного в день 0) или выявлена полная ремиссия (CR) (т.е. уменьшение объема опухоли в любой момент времени после введения до 0 мм3), NA означает не применимо. (DAR обозначает отношение лекарственное средство/антитело).

Пример 2 - Комбинация GA101 с конъюгатом антитело к CD79b-лекарственное средство
Эксперименты проводили с использованием GA101 (обинутузумаб, указанный в настоящем описании) в комбинации с конъюгатом антитело к CD79b-лекарственное средство анти-CD79b-MC-vc-PAB-MMAE, в данном случае антитело к CD79b в указанном конъюгате антитело к CD79b-лекарственное средство представляло собой huMA79b.v28. Указанный конъюгат антитело к CD79b-лекарственное средство в настоящем описании обозначен как «CD79b-ADC». Основная цель исследования заключалась в изучении действия GA101 в комбинации с CD79b-ADC на созданной с помощью ксенотрансплантата модели диссеминированной лимфомы из клеток мантии (MCL) линии Z138 в сравнении с монотерапией с использованием GA101, с монотерапией с использованием ритуксимаба и терапией с использованием комбинации ритуксимаба и CD79b-ADC на SCID beige-мышах. План опыта представлен в таблице 4.

Культивирование клеток и применение клеток
Клетки человеческой лимфомы из клеток мантии (MCL) линии Z138 исходно получали от профессора Martin Dyer и после размножения депонировали во внутреннем банке клеток фирмы Glycart. Линию опухолевых клеток культивировали общепринятым методом в среде DMEM, содержащей 10% FCS (фирма Gibco), при 37°С в насыщенной водяным паром атмосфере, содержащей 5% СО2. Пассаж 26 использовали для трансплантации клеток, жизнеспособность которых составляла 96,4%. В хвостовую вену инъецировали i.v. по 10×106 клеток на животное в 200 мкл среды для культивирования клеток Aim V (фирма GIBCO). Экспрессию CD20 и CD79b на клетках MCL линии Z138 подтверждали с помощью FACS. Для этой цели 0,2 млн клеток окрашивали в трех повторностях антителом к человеческому CD20, конъюгированному с РЕ (фирма BD Bioscience, №555623), антителом к человеческому CD79b, конъюгированному с РЕ (фирма BD Bioscience, №337899), или применяемыми в качестве контролей изотипов мышиным IgG1 (фирма BD Bioscience, №555749) или мышиным IgG2b (фирма BD Bioscience, №555743). Измеряли средний уровень флуоресценции с использованием протокола для планшет-ридеров FACS CantoII (программа FACS Diva).
Животные
62 самок мышей с тяжелым комбинированным иммунодефицитом с врожденным отсутствием естественных клеток-киллеров (SCID beige-мыши), возраст которых в начале эксперимента составлял 7-8 недель (покупали у фирмы Taconic, Дания), содержали в среде, в которой отсутствовали специфические патогены, с суточным циклом 12 ч света/12 ч темноты согласно прилагаемым руководствам (GV-Solas; Felasa; TierschG). Протокол экспериментального исследования был проверен и утвержден местным ветеринарным органом, лицензия №Р2008016. После доставки животных их выдерживали в течение 1 недели, давая пройти акклиматизацию к новым условиям окружающей среды, и для обследования. Постоянный мониторинг состояния здоровья проводили на регулярной основе.
Обработка
Обработку начинали в день 21 после трансплантации клеток. Терапевтические антитела и соответствующий наполнитель вводили i.v. в дни опыта 21, 28 и 35 в дозе 30 мг/кг в виде индивидуальных агентов. CD79b-ADC вводили в день опыта 21 в дозе 4 мг/кг. Использовали свежеприготовленные непосредственно перед введением разведения антител из маточного раствора. Опыт завершали в день 309.
Мониторинг, критерии окончания и аутопсия
У животных ежедневно контролировали клинические симптомы и выявляли нежелательные явления. Критериями окончания опыта были видимые проявления заболевания: неопрятная шерсть, вздутый бок, затрудненное дыхание, нарушенная локомоция, HLP (паралич задней лапы). Когда удовлетворялся критерий окончания, мышей умерщвляли. В начале эксперимента получали один предварительный рентгеновский снимок для оценки объема опухоли. Мышей умерщвляли в соответствии с критериями окончания.
Статистическая обработка
Данные о выживаемости статистически анализировали с помощью парного теста Вилкоксона и парного логрангового теста.
Результаты
Человеческие клетки лимфомы из клеток мантии линии Z138 инокулировали внутривенно (10×106 клеток) в хвостовую вену мышей. Мышей произвольно разделяли на группы перед осуществлением 1-й терапевтической обработки и обработку начинали через 21 день после трансплантации. Конъюгат антитело-лекарственное средство вводили один раз в день 21 в дозе 4 мг/кг, а GA101, ритуксимаб и соответствующий наполнитель вводили i.v. в дни опыта 21, 28 и 35 в дозе 30 мг/кг. Животным в контрольной группе вводили ЗФР. У всех животных ежедневно контролировали клинические симптомы и выявляли нежелательные явления, и их умерщвляли согласно указанным критериям окончания. Опыт завершали в день 309. Данные о выживаемости представлены в виде кривой выживаемости (фиг. 1) и их статистический анализ осуществляли с использованием парного теста Вилкоксона и парного логрангового теста (фиг. 2). Для величин, обозначенных символом * на фиг. 2, характерно значимое различие. Величины медианной и общей выживаемости для разных групп обработки представлены в таблице 4 и таблице 5 Установлено, что все животные, которые оставались живыми в день 309, когда эксперимент завершали, не имели опухолей по данным биопсии.


Для всех групп с помощью парного логрангового теста обнаружено значимое различие с обработанной наполнителем группой за исключением группы, обработанной ритуксимабом. Для обеих комбинаций GA101 плюс CD79b-ADC, а также ритуксимаб плюс CD79b-ADC, обнаружено значимое повышение выживаемости по сравнению с соответствующими монотерапиями. Для комбинации GA101+CD79b-ADC выявлена наилучшая медианная выживаемость, следующей по эффективности оказалась комбинация ритуксимаб + CD79b-ADC, их применение приводило к элиминации опухолей у 2/10 и 3/10 животных соответственно. Кроме того, для комбинаций ритуксимаба и GA101 с CD79b-ADC выявлена выраженная противоопухолевая активность по сравнению с монотерапиями с использованием RTX, GA101 или анти-CD79b-ADC с позиций общей выживаемости.
Реферат
Группа изобретений относится к области медицины, в частности к применению комбинации или композиции обинутузумаба с конъюгатом антитело к CD79b-лекарственное средство, который представляет собой aнти-CD79b-MC-vc-PAB-ММАЕ, для лечения рака, где aнти-CD79b антитело в указанном конъюгате представляет собой huMA79b.v28, включающее вариабельный домен легкой цепи SEQ ID NО: 69 и вариабельный домен тяжелой цепи SEQ ID NO: 70. В одном из вариантов рак представляет собой CD20 экспрессирующий рак, в частности лимфому или лимфоцитарный лейкоз. Изобретения обеспечивают усиление антипролиферативного действия при лечении рака. 2 н. и 4 з.п. ф-лы, 12 ил., 6 табл., 2 пр.

Комментарии