Производные 2-окси-4н-3,1-бензоксазин-4-она для предотвращения и/или лечения ожирения или сопуствующего нарушения - RU2245331C2
Код документа: RU2245331C2
Описание
Настоящее изобретение относится к известным и новым соединениям, их применению в ингибировании фермента, преимущественное действие которого заключается в катализировании гидролиза сложноэфирных функциональных групп (in vivo, поскольку фермент природного происхождения), их применении в медицине и, в частности, в предупреждении и/или лечении ожирения или связанных с ожирением заболеваний. Предложены также способы предупреждения и/или лечения ожирения или связанных с ожирением заболеваний и промотирования/способствования снижению веса без применения медицинских средств и применения соединений в производстве лекарственных препаратов указанного выше назначения. В отношении новых соединений согласно изобретению предложены способы их получения, составы, их содержащие, и способы получения таких составов.
В последние 20 лет наблюдалась растущая тенденция к полноте в развитых странах мира. Увеличение числа случаев ожирения обусловлено частично широкой доступностью продуктов питания в многочисленных магазинах розничной продажи и западными диетами с использованием высоконасыщенных жиров при низком содержании клетчатки, т.е. высококалорийных продуктов. Кроме того, образ жизни населения в развитых странах становится все более малоподвижным с увеличением механизации и при постоянном снижении числа предприятий с высокой трудоемкостью ручного труда. Таким образом, возникает энергетический дисбаланс между потреблением энергии с выкокалорийной пищей и снижением расхода энергии при малоподвижном образе жизни. Некоторое количество избыточной энергии откладывается в виде жиров в жировых тканях, накапливание которых в течение некоторого периода времени приводит к ожирению и может оказаться существенным фактором при развитии других заболеваний и нарушений.
В настоящее время ожирение считается нарушением обмена веществ. В США, по оценкам, 25% взрослого населения считается подверженным клиническому ожирению (индекс массы тела >30). Ожирение может оказаться ослабляющим здоровье состоянием, которое снижает качество жизни и увеличивает риск сопутствующих заболеваний, таких как диабет, сердечно-сосудистые заболевания и гипертония. По оценкам, в США 45 миллиардов долларов, или 8% от годовых расходов на здоровье, составляют расходы, связанные с непосредственными результатами ожирения. Традиционный подход к программам долгосрочного контроля веса, например диеты и физические упражнения, оказались неэффективными для контроля роста ожирения. Сегодня, более чем когда-либо, существует значительный интерес к разработке безопасных, эффективных препаратов для лечения ожирения.
Фармакологический подход к лечению ожирения заключается в разработке препаратов, либо способствующих увеличению расхода энергии, либо снижению энергопотребления. Одним из подходов к снижению энергопотребления является снижение способности организма переваривать и усваивать пищу, в частности жиры. Основными ферментами, участвующими в расщеплении жиров, являются ферменты гидролиза. Наиболее важными ферментами расщепления жиров являются липазы, в первую очередь, но не исключительно, панкреатические липазы, которые выделяются поджелудочной железой в пищеварительный тракт. Ферментный ингибитор липстатин явился основой лекарственного препарата против ожирения - орлистата. Орлистат является предметом опубликованной заявки на Европейский патент ЕР 129748, который относится к соединению формулы

где А представляет собой -(СН2)5-, или:

и их применение в ингибировании панкреатической липазы и лечении гиперлипемии и ожирения. Орлистат имеет в качестве основной активной группы бэта-лактоновую группу, которая реагирует с образованием сложного эфира с гидроксильной группой боковой цепи серина 152 в области активного центра панкреатической липазы.
Даже несмотря на то, что орлистат представляет собой эффективное средство лечения ожирения, сохраняется потребность в альтернативном лекарственном препарате и способе для контроля и лечения ожирения, сопутствующих заболеваний и немедицинском снижении веса. Предложены ингибиторы ферментов, участвующих в расщеплении жиров, а также показана их эффективность в предупреждении и/или лечении ожирения, сопутствующих заболеваний и/или для косметического снижения веса.
В патенте США 4665070 (Syntex) описан широкий класс соединений 2-окси-4Н-3,1-бензоксазин-4-она формулы
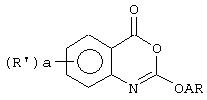
где а - целое число от 0 до 4, каждый R' может быть выбран из большого числа заместителей; А - связь или C1-8 алкиленовая группа, R - водород (за исключением случаев, когда А - связь), фенил, имидазолил или С3-6 циклоалкил, причем каждое из этих колец может иметь заместители. R' группы предпочтительно могут находиться в 5 и/или 7 положении кольца. Предпочтительное значение А - низший алкилен, имеющий 1-4 атомов углерода. В наиболее предпочтительных соединениях А - этилен. Соединения полезны в качестве ингибиторов протеазы серина и для лечения физиологических состояний и заболеваний, в которых, насколько известно, участвуют протеазы серина, или в качестве контрацептивов. В описании изобретения описаны различные состояния и заболевания с участием ферментационных процессов, включая воспаления, артрит, метастазы раковых клеток, эмфизема легких, синдром мукокутанеозных лимфатических узлов, респираторные расстройства у взрослых и панкреатит. Предположено также, что соединения могут иметь антипаразитарное, антикоагулирующее и/или антивирусное действие. Аналогичные соединения описаны также в патенте США 4745116.
В международной заявке на патент WO 89/07639 (ВР Chemicals Ltd) описаны составы моющих средств в водных растворах, содержащие поверхностно-активное вещество, соединение-прекурсор, дающее перекисное соединение в присутствии воды, вещество, снижающее пенообразование, моющее основание и активатор отбеливания, которые могут иметь следующую формулу:

где R - может быть, среди прочих, алкоксигруппой, и R1, R2, R3 и R4 (которые могут быть одинаковыми или различными) выбраны из галогена, алкила, алкенила, арила, гидроксила, алкоксила, амино-, алкиламино-, -COOR5 и карбонильной функциональных групп. Число атомов углерода в алкильных группах и группировках не определено, но конкретные примеры относятся к низшим алкильным или алкоксильным группам, например R может быть этоксигруппой.
В патенте ГДР 246996 А1 описан способ получения 2-алкокси- и 2-арилокси-3,1 -бензоксазин-4-она формулы
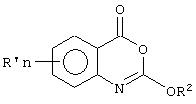
Где R'n представляет собой один или более атомов водорода, и/или других заместителей, таких как алкил, алкокси-, аралкил, арил, тиоцианато-, меркапто-, алкилтио-, галогеном или нитро-, a R2 представляет собой алкильный, аралкильный или арильный остаток. Известно, что такие соединения применяются в гербицидов, фунгицидов и имеют активность в качестве ингибиторов химотрипсина. Конкретными примерами R2 являются этил, бензил и фенил.
Нами было обнаружено, что один из классов соединений бензоксазинона проявляет активность как ингибитор липазы.
Таким образом, согласно первому аспекту настоящего изобретения предложено применение соединения формулы (I)

или его фармацевтически приемлемая соль, эфир, амид или предшественник, в производстве лекарственного препарата для лечения состояний, в которых требуется ингибирование фермента, преимущественное действие которого заключается в катализировании гидролиза эфирных функциональных групп, где в формуле (I)
А - шестичленное ароматическое или гетероароматическое кольцо,
R1 - разветвленный или неразветвленный алкил (углеродная цепочка которого, возможно, прервана одним или более атомами кислорода), алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, восстановленный арилалкил, арилалкенил, гетероарил, гетероарилалкил, гетероарилалкенил, восстановленный арил, восстановленный гетероарил, восстановленный гетероарилалкил или их замещенное производное, в котором заместителем является один или более независимо выбранный из группы: галоген, алкил, замещенный галогеном алкил, арил, арилалкил, гетероарил, восстановленный гетероарил, восстановленный гетероарилалкил, арилалкокси-, циан-, нитро-, -C(O)R4, -CO2R4, -SOR4, -SO2R4, -NR6R7, -OR6, -SR6, -C(O)CX1X2 NR6R7, -C(O)NR4R5, -C(O)N(OR5)R6, -NR6C(O)R4, -CR6(NH2)CO2R6, -NCX1X2CO2R6, -N(OH)С(О)NR6R7, N(OH)C(O)R4, -NHC(O)NR6R7, C(O)NHNR6R7, -C(O)N(OR5)R6, или липид, или стероид (природный или синтетический), при условии, что любой замещающий гетероатом в R1 должен быть отделен от экзоциклического атома кислорода по меньшей мере двумя атомами углерода (предпочтительно насыщенными), и где
R4 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, восстановленный гетероарил или восстановленный гетероарилалкил, -OR6, -NHCX1X2CO2R6 или -NR6 R7,
R5 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, восстановленный гетероарил или восстановленный гетероарилалкил,
R6 и R7 независимо выбраны из водорода, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, арила, арилалкила, гетероарила, восстановленного гетероарила, гетероарилалкила, восстановленного гетероарилалкила или -(CH2)n(OR5)m, где n - от 1 до 12, предпочтительно от 2 до 10, a m - от 1 до 3, и R5 наиболее предпочтительно алкил C2-10, и
X1 и X2 независимо представляют собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, восстановленный гетероарил, гетероарилалкил, или восстановленный гетероарилалкил.
В соединениях формулы (I) любая алкильная, алкенильная или алкинильная группа или группировка может представлять собой линейную (неразветвленную) или разветвленную цепь. Линейные цепи алкильных, алкенильных или алкинильных групп или группировок могут содержать от 1 до 30 атомов углерода, например, от 1 до 25 атомов углерода, предпочтительно от 1 до 20 атомов углерода. Разветвленные цепи алкильных, алкенильных или алкинильных групп или группировок могут содержать от 1 до 50 атомов углерода, предпочтительно от 1 до 30 атомов углерода.
Предпочтительные значения для R1, R4, R5, R6, R7, X1 и X2 такие же, как определены ниже для формул (I) и (IIа). В частности, предпочтительные значения для R4, R5 и R6 такие же, как для R13, и предпочтительные значения для R7 такие же, как для R14.
В данном контексте "восстановленные", например "восстановленный гетероарил", означает полностью или частично насыщенный.
Арильные группы включают, например, возможно замещенные ненасыщенные моноциклические или бициклические кольца, содержащие до 12 атомов углерода, такие как фенил и нафтил, и частично насыщенные бициклические кольца, такие как тетрагидронафтил. Примеры заместителей, которые могут присутствовать в арильных группах, включают один или более галоген, амино, нитро, алкил, галогеноалкил, алкокси, фенокси и фенокси, замещенные одним или более галогеном, алкилом или алкокси.
Гетероарильная группа или группировка может представлять собой например, возможно замещенное 5- или 6-членное гетероциклическое ароматическое кольцо, которое может содержать от 1 до 4 гетероатомов, выбранных из О, N и S. Гетероциклическое кольцо возможно может быть сопряжено с фенильным кольцом. Примеры гетероарильных групп включают фурил, тиенил, пирролил, оксазолил, оксазинил, тиазолил, имидазолил, оксадиазолил, тиадиазолил, пиридил, тиазолил, тиазинил, пиридазил, пиримидинил, пиразолил, индолил, индазолил, бензофуранил, бензотиенил, бензимидазолил, беноксазолил, бензоксазинил, хиноксалинил, хиназолинил, хиннолинил, бензотиазолил, пиридопирролил. Подходящие заместители включают один или более галоген, оксо, амино, нитро, алкил, галогеноалкил, алкокси, фенокси и фенокси, замещенные одним или более галогеном, галогеноалкилом, алкилом или алкоксигруппой.
Востановленные гетероарильные группы или группировки могут представлять собой, например, полностью или частично насыщенные производные вышеуказанных гетероарильных групп. Примеры восстановленных гетероарильных групп включают пирродинил, тетрагидрофурил, тетрагидротиенил и пиперидинил.
Соединения формулы (I) являются полезными ингибиторами ферментов, участвующих в расщеплении жиров. Предпочтительно поэтому, первый аспект изобретения включает применение соединения формулы (I), как указано выше, или его фармацевтически приемлемой соли, эфира, амида или предшественника, в производстве лекарственного препарата для контроля или лечения ожирения, сопутствующих расстройств или для облегчения немедицинской потери веса.
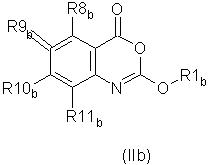
Предпочтительно соединение согласно первому аспекту изобретения представляет собой соединение формулы (II)

или его фармацевтически приемлемую соль, эфир, амид или предшественник,
где R1, R4, R5, R6, R7, X1 и X2 такие же, как определены выше для формулы (I),
R8, R9, R10, R11 каждый независимо представляют собой водород, галоген, гидрокси-, амино-, нитро-, циано-
или группу R1, как определено выше,
или группу R12Q, где Q представляет собой О, СО, CONH, NHCO, S, SO, SO2, SO2NH2, и R12 представляет собой водород или группу R1 как определено выше,
или группу R1R2 N, где R1 - как определено выше и R2 - водород или R1, при условии, что любой замещающий гетероатом в R1 и/или R2 должен быть отделен от экзоциклического атома азота по меньшей мере двумя атомами углерода (предпочтительно насыщенными).
Предпочтительные значения R1, R8, R9, R10 и R11 - такие, как определено ниже для соединений формулы (IIа).
Более предпочтительно, соединение для применения согласно первому аспекту изобретения включает соединение формулы (II), или его фармацевтически приемлемую соль, эфир, амид или предшественник, где:
R1 представляет собой либо разветвленную или неразветвленную алкильную группу, имеющую до 25, т.е. например, до 20 атомов углерода, арил (например, возможно замещенный фенил или 2-нафтил), или арилалкильную группу, в которой арильная группировка имеет до 25 атомов углерода, например до 20 атомов углерода; или ариларильную группу; где арилалкильная группа или ариларильная группа может быть отделена спейсером, где спейсер может быть эфиром, амидом, О, СН2 или кетоном и где арильная группа предпочтительно представляет собой фенил, возможно замещенный алкилом, галогеноалкилом или галогеном,
R8 - водород или фтор,
R9 - низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода, предпочтительно метил; циклоалкил, имеющий от 3 до 6 атомов углерода, предпочтительно циклопропил; галогеноалкил, предпочтительно трифторметил; или галоген, наиболее предпочтительно хлор или фтор;
R10 - предпочтительно водород, низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода, предпочтительно метил; циклоалкил, имеющий от 3 до 6 атомов углерода, предпочтительно циклопропил, галоалкил, предпочтительно трифторметил; или галоген, наиболее предпочтительно хлор или фтор;
R11 - предпочтительно водород, низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода; предпочтительно метил или галоген, предпочтительно фтор.
В частности, R1 - может быть неразветвленной алкильной группой, имеющей 12, 14, 15, 16, 17 или 18 атомов углерода в алкильной цепи. В дополнение к этому, в частности, R1, R9 может быть метилом.
Согласно второму аспекту настоящего изобретения предложено соединение формулы (IIа)

или его фармацевтически приемлемая соль, эфир, амид или предшественник, где
R1a - представляет собой
(i) разветвленный или неразветвленный С10-30алкил, возможно замещенный одним или более независимо выбранным из группы С3-6 циклоалкилом, С3-6 циклоалкенилом, арилом, гетероарилом, восстановленным гетероарилом, -C(O)R13, -CO2R13, -SOR13, -SO2R13, -NR13R14, -OR13, -SR13, -C(O)NR13R14, -NR14C(O)R13, галоген, циано и нитро и/или возможно прерванный одним или более атомом кислорода, при условии, что любой гетероатом в R1 должен быть отделен от экзоциклического атома кислорода (или от любого другого гетероатома) по меньшей мере двумя атомами углерода (предпочтительно насыщенными), или
(ii) С2-25алкенил, С2-25алкинил, С3-6циклоалкенил, арил-С2-25 алкенил, гетероарил-С2-25 -алкенил, восстановленный гетероарил, восстановленный гетероарил C1-25 алкил или их замещенное производное, в котором заместителем является один или более независимо выбранный из группы: C1-6алкил, галогензамщенный C1-6алкил, арил, арил-С1-6алкил, гетероарил, восстановленный гетероарил, восстановленный гетероарил-С1-6алкил, C1-6 алкокси-, арил С1-6алкокси-, -C(O)R13, -CO2R13, -SOR13, -SO2R13, -NR13R14, -OR13, -SR13, -C(O)NR13R14, -NR14C(O)R13, галоген, циано- и нитро-, при условии, что любой гетероатом в R1 должен быть отделен от экзоциклического атома кислорода (или любого другого гетероатома) по меньшей мере двумя атомами углерода (предпочтительно насыщенными),
(iii) С1-9алкил, возможно прерванный одним или более атомом кислорода и возможно замещенный одним или более независимо выбранным из С3-6циклоалкенил, С3-6-циклоалкенил, арил, гетероарил, восстановленный гетероарил, -C(O)R13, -CO2R13, -SOR13, -SO2R13, -NR13R14, -OR13, -SR13, -C(O)NR13R14, -NR14C(O)R13, галоген, циано- и нитро-, при условии, что любой гетероатом в R1 должен быть отделен от экзоциклического атома кислорода (или любого другого гетероатома) по меньшей мере двумя атомами углерода (предпочтительно насыщенными),
(iv) С1-9алкил, замещенный группой, выбранной из -C(O)R13, -CO2R13, -SOR13, -SO2R13, -NR13R14, -OR13, -SR13, -C(O)NR13R14, -NR14C(O)R13, галоген, циано-, нитро-, бициклоарил, бициклогетероарил, моноциклический или бициклический восстановленный гетероарил и моноциклический гетероарил, отличный от имидазола,
(v) фенил, замещенный группой, выбранной из OR17, -COR13, -CO2R13, -SOR13, -SO2R13, -CONR13R14, -NR13 C(O)R13, галогензамещенный C1-6алкил, арил, арил C1-9алкил, гетероарил или гетероарил C1-9алкил, или
(vi) бициклоарил, бициклогетероарил, моноциклический или бициклический восстановленный гетероарил и моноциклический гетероарил, отличный от имидазола, возможно замещенный группой, выбранной из OR17, -COR13, -CO2R13, -SOR13, -SO2R13, -CONR13R14, -NR14C(O)R13, галогензамещенный C1-6алкил, арил, арил C1-9алкил, гетероарил или гетероарил С1-9алкил,
где R13 и R14 каждый независимо представляют собой водород, C1-10 алкил, С2-10 алкенил, С3-6циклоалкил, С3-6циклоалкенил, арил, арил-C1-10 алкил, гетероарил, гетероарил C1-10алкил, восстановленный гетероарил, или восстановленный гетероарил- С1-10алкил, а R17 представляет собой водород или С2-10алкенил, С2-10алкинил, С3-6 циклоалкил, С3-6 циклоалкенил, арил, арил-С1-10алкил, гетероарил, гетероарил C1-10алкил, восстановленный гетероарил, или восстановленный гетероарил-С1-10алкил,
R8а, R9а R10а и R11а каждый независимо представляет собой водород, галоген, гидрокси-, амино-, нитро-, циано-, тиол, C1-10алкил, C1-10 алкокси, C1-10 циклоалкил, C1-10циклоалкокси, C(O)R15, C(O)NR15R16, S(O)R15 или галогеноС1-10алкил,
R15 и R16 каждый независимо представляют собой водород или C1-10 алкил.
В соединениях формулы (IIа).
Если R1a представляет собой группу, определенную в (i), то это предпочтительно разветвленный или неразветвленный С10-25алкил, например разветвленный или неразветвленный С10-20алкил, преимущественно С12-18алкил, например разветвленный или неразветвленный С14-18алкил, возможно замещенный одним или более атомом кислорода. Возможные заместители алкильной группы предпочтительно выбраны из одного или более арилов, например фенил, гетероарилов, например триенил; арилокси, например фенокси; гетероарилокси, например беноксазинилокси; -CO2R13, например СООН; -NR13R14, например NH2; -CONR13R14, например, СОNНСН3, циано, нитро, галоген и ОН. R13 и R14 каждый независимо представляют собой водород или C1-6алкил.
Если R1a представляет собой группу, определенную в (ii), то это предпочтительно С10-25алкил, например разветвленный или неразветвленный алкенил или алкинил, преимущественно C14-18 разветвленный или неразветвленный алкенил или алкинил.
Если R1a представляет собой группу, определенную в (iii), то C1-9 группа предпочтительно содержит один или два атома кислорода. Предпочтительные возможные заместители, такие как определены для групп в (i) и (ii).
Если R1a представляет собой группу, определенную в (iv), то предпочтительные заместители такие, как определены для групп (i) -(iii).
Если R1a представляет собой группу, определенную в (v), то предпочтительные заместители выбраны из OR17, -CO2R13, C(O)NR13R14, -NR14C(O)R13 и арил С1-10алкил. Фенильная группа R1a и любая другая фенильная группа или группировка в заместителе может быть также замещена одним или более галогеном, алкилом или галогеноалкилом.
Если R1a представляет собой группу, определенную в (vi), то он предпочтительно выбран из нафтила, пиридила, пирролила и пиперидинила.
Предпочтительно R1a выбран из групп (i) и (v), как определено выше.
R1a предпочтительно представляет собой разветвленный или неразветвленный С10-20 алкил, возможно прерванный одним или более атомом кислорода, и/или возможно замещенный одним или более арилом, например фенилом, арилокси, например фенокси, где фенильная группа может быть замещена алкилом, галогеноалкилом, галогеном или фенокси, гетероарилом, например тиенилом, гетероарилокси, например беноксазинилокси (который может нести оксо-заместитель), циано-, нитро-, -C(O)R13, -NR13R14, -C(O)NR13R14, ОН или галоген.
R1a также предпочтительно фенил, замещенный одним или более, но предпочтительно одним из -OR17, -CO2 R13, -C(O)NR13R14, -NR14C(O)R13 и арилС1-10алкилом,
где R13 и R14 предпочтительно каждый независимо представляют собой водород, C1-6алкил,
где R17 предпочтительно представляет собой фенил, возможно замещенный алкилом, галогеноалкилом, галогеном или фенокси, причем фенильная группа может быть замещена алкилом, галогеноалкилом или галогеном.
Наиболее предпочтительно R1a представляет собой неразветвленную алкильную цепочку из 14,15,16,17 или 18 атомов углерода.
R8a представляет собой водород или галоген, например, фтор, наиболее предпочтительно водород,
R9a - предпочтительно водород или низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода, предпочтительно от 1 до 6 атомов углерода, предпочтительно метил, циклоалкил, имеющий от 3 до 6 атомов углерода, предпочтительно циклопропил, галогено C1-6алкил, предпочтительно трифторметил или галоген, предпочтительно хлор или фтор;
R10a - предпочтительно водород, низший разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода, предпочтительно от 1 до 6 атомов углерода, предпочтительно метил, циклоалкил, имеющий от 3 до 6 атомов углерода, предпочтительно циклопропил, галогено C1-6алкил, предпочтительно трифторметил или галоген, предпочтительно хлор или фтор;
R11a - предпочтительно водород, галоген, например фтор, или разветвленный или неразветвленный алкил, имеющий от 1 до 10 атомов углерода, предпочтительно от 1 до 6 атомов углерода, например метил.
Предпочтительно в соединениях формулы (IIа) по меньшей мере один из R8a, R9a, R10a и R11a представляет собой заместитель, отличный от водорода. Так, например, R8a может быть атомом водорода, a R9a, R10a и R11a - такими, как определено выше. В еще одном предпочтительном примере реализации каждый из R8a и R11a представляет собой атом водорода, a R9a представляет собой заместитель, такой как определено выше, a R10a представляет собой атом водорода или заместитель. В другом предпочтительном примере релизации каждый из R8a, R9a и R10a представляют собой атом водорода, a R11a представляет собой заместитель, такой как определено выше, например метил. Наиболее предпочтительно каждый из R8a, R10a и R11a представляют собой атом водорода, a R9a представляет собой заместитель, такой как определено выше, предпочтительно C1-6алкил, например метил.
Еще одной группой новых соединений формулы (II) являются такие, в которых R1 определен формулой (II) и по меньшей мере один из R8, R9, R10 и R11 представляет собой С8-10 алкильную группу, предпочтительно С8-10 алкил. Наиболее предпочтительно в этом примере реализации либо R8, либо R9представляет собой С8-10 алкильную группу, а все остальные заместители в бензольном кольце являются водородом.
Примеры фармацевтически приемлемых солей этой формулы включают соли органических кислот, таких как метансульфокислота, бензолсульфокислота и п-толуолсульфокислота, соли минеральных кислот, например соляной и серной и аналогичные, с образованием метансульфоната, бензолсульфоната, п-толуолсульфоната, хлорида, сульфата и т.п., соответственно, или производные от оснований, таких как органические и неорганические основания. Примеры подходящих неорганических оснований для образования солей соединения согласно настоящему изобретению включают гидроксиды, карбонаты и бикарбонаты аммония, литий, натрий, кальций, калий, алюминий, магний, цинк и другие. Соли могут быть также образованы с подходящими органическими основаниями. Такие основания, подходящие для образования фармацевтически приемлемых солей, полученных путем присоединения оснований к соединениям настоящего изобретения, включают такие органические основания, которые нетоксичны и являются достаточно сильными для образования солей. Подобные органические основания хорошо известны специалистам и могут включать аминокислоты, например аргинин и лизин, моно-, ди- и тригидроксиалкиламины, такие как моно-, ди- и триэтаноламин, холин, моно-, ди- и триалкиламины, такие как метиламин, диметиламин и триметиламин, гуанидин, N-метилглюкозамин, N-метилпиперазин, морфолин, этилендиамин, N-бензилфенетиламин, трис(гидроксиметил) аминометан, и другие.
Соли могут быть приготовлены традиционным образом хорошо известными способами. Соли кислотного присоединения указанных основных соединений могут быть приготовлены путем растворения соединений со свободными основаниями согласно первому или второму аспектам настоящего изобретения, в водном или водно-спиртовом растворе или другом подходящем растворителе, содержащем требуемую кислоту. Если соединение формулы (I) содержит кислотную функциональную группу, основная соль указанного соединения может быть приготовлена путем взаимодействия этого соединения с подходящим основанием. Кислотная или основная соль могут выделиться непосредственно или могут быть получены концентрированием раствора, например выпариванием. Соединения согласно изобретению могут также существовать в сольватированной или гидратированной формах.
Изобретение включает также предшественники указанных оснований. Предшественником считается обычно описываемое как неактивное или защищенное производное активного ингредиента или лекарственного препарата, которое затем превращают в активный ингредиент или лекарственный препарат в теле пациента.
Примеры соединений согласно первому и/или второму аспектам настоящего изобретения включают соединения, представленные в таблице 1.


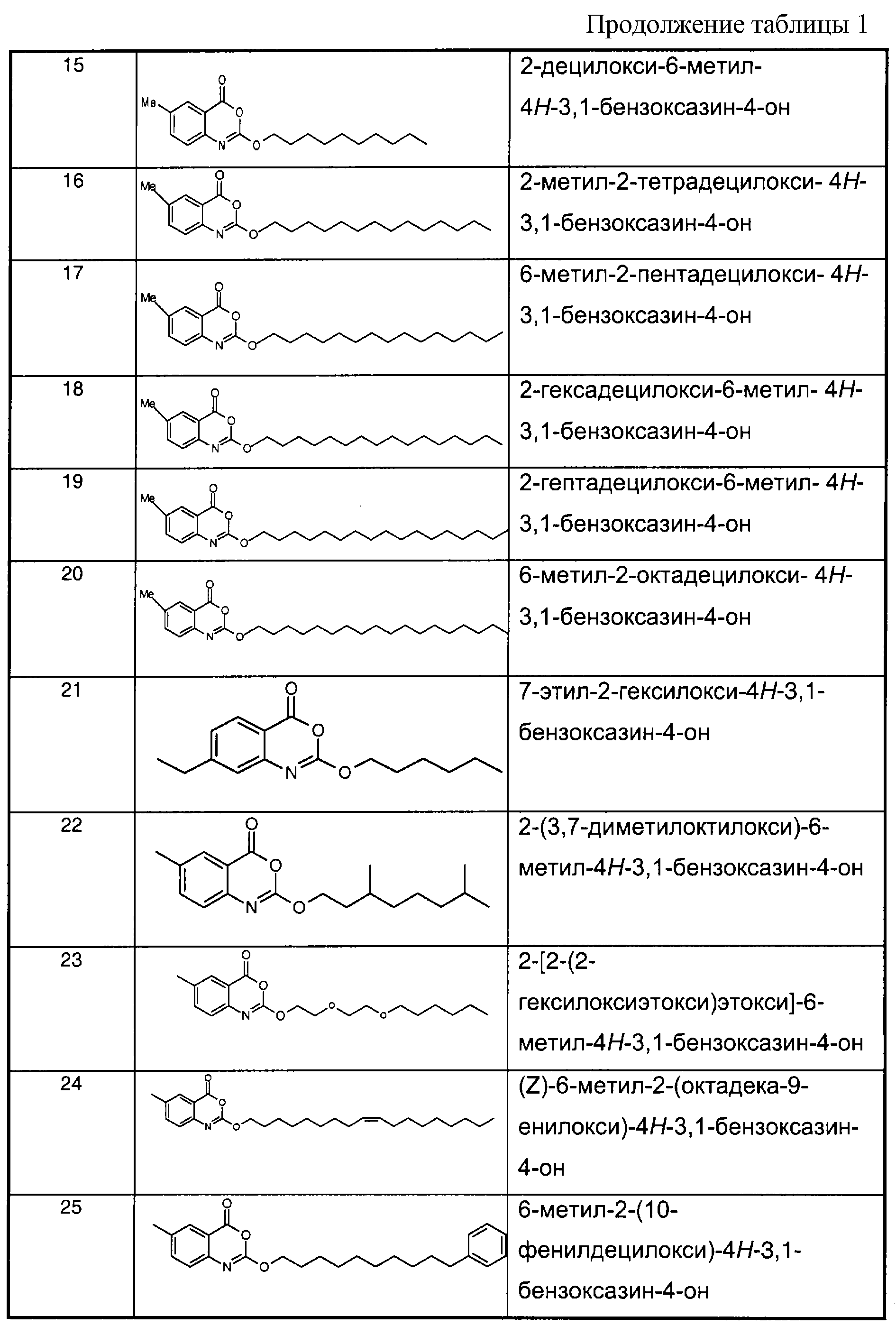

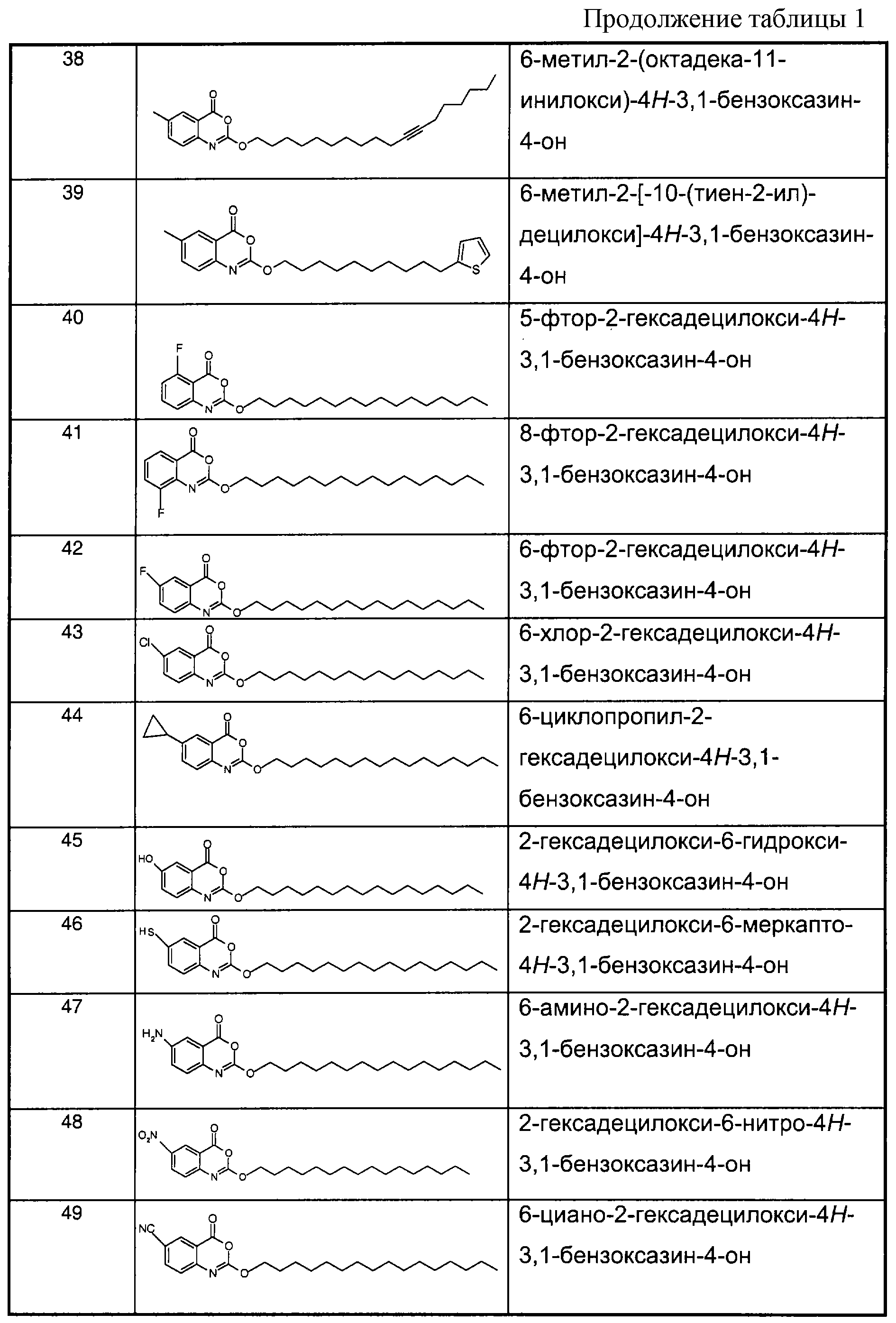



В отличие от соединений 1-3, 6, 7 и 9 соединения, представленные в таблице 1, являются, по мнению заявителей, новыми, и таким образом, образуют предпочтительные примеры реализации настоящего изобретения.
Предпочтительные соединения формулы (II) из перечисленных в таблице 1 включают соединения 4, 5, 8, 10, 11, 12, 13, 14, 21, 26, 27, 28, 30, 32, 33, 34, 35 и 78.
Эти конкретные соединения являются, по мнению заявителей, новыми, и таким образом, представляют собой еще один аспект настоящего изобретения.
Предпочтительные соединения формулы (IIа) из перечисленных в таблице 1 включают соединения 15, 16, 17, 18, 19, 20, 22, 23, 24, 25, 29, 31, 36, 37, 38, 39, 79, 80, 81, 82, 84 и 85.
В особенности предпочтительными соединениями формулы (IIа) являются следующие:
15: 2-децилокси-6-метил-4H-3,1-бензоксазин-4-он
16: 6-метил-2-тетрадецилокси-4Н-3, 1-бензоксазин-4-он
18: 2-гексадецилокси-6-метил-4H-3,1-бензоксазин-4-он
Предпочтительные соединения формулы (IIb) из перечисленных в таблице 1 включают соединения 2, 6, 7, 8, 10, 15, 21 и 24.
Предпочтительные соединения согласно настоящему изобретению включают также таутомеры перечисленных выше соединений, а также (не ограничиваясь ими) фармацевтически приемлемые соли, эфиры, амиды или предшественники этих соединений или их производных, полученных путем присоединения одной или более липидных групп (природных или синтетических).
Согласно третьему аспекту изобретения предложен способ получения любого или нескольких новых соединений или производных согласно первому или второму аспекту изобретения. Так, в настоящем изобретении предложен способ получения нового соединения формулы (II), в частности (IIа), который включает:
способ (А) проведения реакции соединения формулы (IV)

с соединением формулы (V):

или
способ (В) проведения циклизации соединения формулы (VI)

где R1 и R8-R11 - как определено выше и R18 представляет собой водород или C1-6 алкил, или
способ (С) проведения реакции соединения формулы (VII)

с соединением формулы (VIII)

или
способ (D) превращения соединения формулы (I), (II) или (IIа) в различные соединения формулы (IIа), например, путем
(1) восстановления соединения формулы (IIа), где R1, R8, R9, R10 и R11 содержат алкенильную или алкинильную группу или группировку, в соответствующую алкильную или алкенильную группу или группировку, или
(2) алкилирования соединения формулы (IIа), где один или более из R8, R9, R10 и R11 представляют собой атом галогена.
Способ (А) можно осуществить путем проведения реакции соединения (IV) с хлорформиатом формулы (V). Способ предпочтительно осуществляют в щелочной среде, например, с использованием пиридина. Реакцию можно проводить при охлаждении, чтобы избежать перегрева. Полученное промежуточное соединение карбамата затем подвергают циклизации путем реакции с избытком хлорформиата или путем добавления другого агента циклизации, который промотирует замыкание кольца. Подходящие агенты циклизации включают, например, метилхлорформиат, карбонилдиимидазол, уксусный ангидрид, фосген, оксалилхлорид, тионилхлорид или пептидный сшивающий агент, такой как дициклогексил карбодиимид (DCC). Предпочтительно, агент циклизации представляет собой фосген, трифосген или тионилхлорид. Специалисту должно быть понятно, что если для проведения циклизации используют хлорформиат, ее можно провести с использованием избытка соединения формулы (V). Предпочтительно, однако, используют низкомолекулярный хлорформиат, поскольку он дешевле и при этом легче удалить образующийся спирт.
Соединения формулы (V) могут быть получены множеством известных в данной области способов, например путем реакции соответствующего спирта R1OH с фосгеном в таком растворителе, как толуол. Этот продукт может быть выделен традиционным способом путем удаления растворителя и летучих побочных продуктов.
Способ (В) можно осуществить путем реакции соединения формулы (VI), где R18 - водород, с агентом циклизации, например алкилхлорформиатом, например, как описано в способе (А). Альтернативно, соединение формулы (VI) может быть подвергнуто циклизации путем обработки дегидратирующим агентом, например, таким как концентрированная серная кислота.
Соединения формулы (VI), где R18 - алкильная группа, могут быть получены путем взаимодействия эфира, соответствующего соединению формулы (VI), например, с фосгеном и основанием, таким как пиридин, с получением соответственного изоцианата, с последующей обработкой спиртом R1OH. При желании эфир (т.е. такой, где R18 - алкил) может быть гидролизован до соответствующей кислоты (R18 - водород) с использованием, например, гидроксида лития, например, в водном тетрагидрофуране или водном диоксане.
Следует отметить, что способ (А) также осуществляют через промежуточное соединение формулы (VI), и таким образом, он является вариантом способа (В).
Способ (С) можно осуществить путем реакции соединения формулы (VII) со спиртом R1OH в присутствии основания, например основания Кенига (диизопропилэтиламина).
Соединение формулы (VII) может быть получено из соответствующего ангидрида формулы (IX)

путем реакции например, с оксихлоридом фосфора (РОСl3) при повышенной температуре, например при 100°С.
Ангидрид формулы (IX) может быть получен путем циклизации соединения формулы (IV), например с фосгеном или его синтетическим эквивалентом.
В способе (D) восстановление алкенильной или алкинильной групп можно провести, например, каталитической гидрогенизацией с использованием, например, нанесенного на активированный уголь 10% палладия в спиртовом растворителе, таком как этанол, при давлении водорода 1 атмосфера.
Алкилирование согласно способу (D) (ii) можно провести по методу Stille или путем поперечной сшивки, катализируемой палладием, с применением, например, тетраалкилолова, такого как тетраметилолово, и РhСН2Рd(РРН3)2Сl в НРМА при повышенной температуре, например при 50-100°С. В качестве исходных веществ можно использовать другие другие галиды или псевдогалиды, например трифлаты.
Согласно четвертому аспекту изобретения предложены соединения согласно первому и второму аспектам изобретения (т.е. соединения формул (I), (II) и (IIа)) в медицине. Предпочтительные признаки по первому и второму аспектам изобретения справедливы также для четвертого аспекта. Другие признаки четвертого аспекта изложены далее.
Согласно пятому аспекту изобретения предложены соединения согласно первому и/или второму аспектам изобретения для применения в ингибировании ферментов, преимущественное действие которых заключается в катализировании гидролиза эфирных групп. Это применение включает как применение in vivo, так и in vitro, а также другие области применения, например в промышленности. Подобные ферменты катализируют процесс разложения основы, содержащей эфирные функциональные группы, путем добавления воды, в результате чего происходит расщепление химической связи. Такие ферменты также участвуют в ключевых процессах, протекающих в организме. Ферменты согласно изобретению включают липазы (гидролиз эфиров жирных кислот), эстеразы (гидролиз сложных эфиров) и фосфатазы (гидролиз эфиров фосфорной кислоты).
Предпочтительными ферментами являются липазы. Липазы включают липазу поджелудочной железы, липазу желудка, липопротеиновую липазу, лингвальную липазу, липазу жировой ткани, гормоночувствительную липазу, фосфолипазу А1, А2, В, С, D и др., печеночную липазу и другие триацил-, диацил- и моноацилглицероловые липазы в организме млекопитающих. Многие другие подобные липазы также известны в растениях, грибках и микроорганизмах.
Согласно изобретению рассмотрены также такие ферменты, как эстеразы и фосфатазы. Эстеразы включают эстеразу печени свиньи, холестерил эстеразу, ретинил эстеразу, 1-алкил-2-ацетилглицерофосфохолин эстеразу, гидролазу эфира карбоновой кислоты и холестерол эстеразу. Фосфатазные ферменты включают фосфатазы РР1, РР2 и РР3 серина/треонина, фосфатазу фосфопротеина, фосфатазу миозина с легкой цепью, фосфатазу 2С протеина и фосфатазу протеина тирозина.
Соединения согласно изобретению для применения в медицине в первую очередь относятся к соединениям для применения в предотвращении и/или лечении по таким медицинским показаниям, как ожирение, гиперлипемия, гиперлипидемия и сопутствующие заболевания, как например гипергликемия (диабет типа II), гипертензия, сердечно-сосудистые заболевания, инсульт, желудочно-кишечные заболевания и состояния. Соединения согласно первому и/или второму аспекту изобретения применимы в этих и других условиях благодаря их способности ингибировать ферменты, преимущественное действие которых заключается в катализировании гидролиза эфирных функциональных групп. Изобретение относится также к немедицинскому снижению веса, такому как косметическое снижение веса, и включает в улучшение внешнего вида в принципе. В контексте данного описания предотвращение и/или лечение любого расстройства означает любое действие, которое уменьшает любой вред или медицинское нарушение, в любой степени, и включает преотвращение и лечение их самих. Термин "лечение" означает любое улучшение в отношении нарушения, заболевания, синдрома, состояния, боли или комбинации из двух и более таких факторов.
Очевидно, что важное применение изобретения относится к снижению веса (любого из описанных выше типов) человека. Однако изобретение относится также к медицинскому и немедицинскому снижению веса любых животных, в которых метаболизм жиров и производных жиров происходит с участием ферментов, преимущественное действие которых заключается в катализировании гидролиза эфирных функциональных групп. Таким образом, изобретение имеет также ветеринарное применение и в особенности полезно в отношении животных-спутников человека, таких как домашние кошки и собаки, а также животных, которые обеспечивают потребность человека в мясе. В последнем случае применение настоящего изобретения заключается в уменьшении содержания жиров с получением обедненного жиром (т.е. постного) мяса.
Предположительно, соединения согласно настоящему изобретению также могут оказаться полезными в снижении содержания токсинов (например, диоксинов и РСВ), которые откладываются в жировых тканях. Не желая быть связанным какой-то одной теорией, авторы полагают, что увеличение количества нерасщепленных жиров, проходящих через организм улучшает диффузию токсинов из жира, отложенного в организме, в жиры крови и, таким образом, в кишечник.
Пятый аспект изобретения имеет важное применение. Это применение включает испытания и диагностические методы и контроль и ингибирование нежелательных ферментов, предпочтительно липаз, в любом процессе или продукте. Процессы или продукты, в которых предпочтительно участвуют липазы, включают обработку сельскохозяйственных продуктов (например, жиросодержащих семян), выделение и извлечение ферментов из биотехнологических процессов (например, включающих лизис микроорганизмов), производство и извлечение сырой нефти (в частности, масел и пластиков), промышленное производство триглицеридов и других жиров, производство предметов по уходу за телом, которые включают поверхносто-активные вещества, мыла или детергенты (например, масла для ванны, кремы), производство и переработка липосом (например, предметов по уходу за телом, в диагностике, в генной терапии), переработка промышленных отходов (например, переработка бумажных отходов) и предотвращение разложения продуктов питания, содержащих жиры (например, обработка шоколада). Таким образом, изобретение относится также к этим продуктам и процессам, например к продуктам питания с высоким содержанием жиров, таким, как торты, печенье, выпечка, и т.п., а также к шоколадным продуктам. Предпочтительные признаки изобретения согласно пятому аспекту, включая предпочтительные ферменты, такие же, как было указано для предыдущих аспектов изобретения.
Согласно шестому аспекту изобретения предложен состав, включающий новые соединения согласно первому и второму аспектам изобретения, в сочетании с фармацевтически приемлемым носителем или разбавителем. Подходящие носители и/или разбавители хорошо известны специалистам и включают фармацевтически чистый крахмал, маннитол, лактозу, стеарат марганца, сахарин натрия, тальк, целлюлозу, глюкозу, сахарозу (или другие виды сахара), карбонат марганца, желатин, масло, спирт, детергенты, эмульгаторы, или воду (предпочтительно стерильную). Состав может представлять собой смешанный препарат состава или комбинированный препарат для одновременного, раздельного или последовательного применения (включая прием).
Соединения согласно изобретению для применения согласно вышеуказанным назначениям могут быть назначены для приема любым из подходящих способов, например перорально (включая ингаляцию), парентально, через слизистую (например, через рот или щеку, под язык, через нос), ректально или трансдермально, и соответственно адаптированы.
Для орального применения соединения могут быть изготовлены в жидком и твердом виде, например в виде растворов, сиропов, суспензий или эмульсий, таблеток, капсул и лепешек.
Жидкие составы, как правило, состоят из суспензий или растворов или физиологически приемлемых солей в подходящих водных или неводных жидких носителях, например в воде, этаноле, глицерине, полиэтиленгликоле или в масле. Состав может также содержать суспедирующий агент, консервант, отдушку или окрашивающий агент.
Состав в виде таблетки может быть приготовлен с использованием любого подходящего фармацевтического носителя или носителей, обычно используемых в приготовлении твердых составов. Примеры таких носителей включают стеарат марганца, крахмал, лактозу, сахарозу и микрокристаллическую целлюлозу.
Состав в виде капсул может быть приготовлен с использованием обычных методик капсулирования. Например, порошки, гранулы или таблетки, содержащие активный компонент, могут быть приготовлены с использованием стандартных носителей и затем помещены в твердую желатиновую капсулу, альтернативно может быть приготовлена дисперсия или суспензия с использованием любого фармацевтического носителя или носителей, например водных смол, целлюлозы, силикатов или масел, и затем дисперсия или суспензия помещена в мягкую желатиновую капсулу.
Составы для орального применения могут быть разработаны для защиты активного компонента от разложения по мере прохождения через пищеварительный тракт, например, посредством нанесения внешней оболочки на состав в таблетке или капсуле.
Обычные парентеральные составы состоят из раствора или суспензии соединения или физиологически приемлемой соли в стерильном водном носителе или неводном или парентерально приемлемом масле, например полиэтиленгликоле, поливинилпирролидоне, лецитине, арахисовом масле или кунжутовом масле. Альтернативно раствор может быть лиофилизирован и затем восстановлен подходящим растворителем непосредственно перед приемом.
Составы для назального или орального приема могут быть получены в виде аэрозоля, капель, геля или порошка. Аэрозольные составы обычно содержат раствор или тонкую суспензию активного вещества в физиологически приемлемом водном или неводном растворителе и обычно представлены в количестве одной или нескольких доз в стерильной форме в герметичном контейнере, выполненного в форме картриджа или заполняемого баллона, используемого с распыляющим устройством. Альтернативно герметичный контейнер может быть выполнен в виде единого распределительного устройства, такого как назальный ингалятор, рассчитанный на одну дозу, или аэрозольный дозатор, снабженный измерительным клапаном, который предназначен на выброс после того, как содержимое контейнера будет израсходовано. Если дозируемая форма находится в аэрозольном дозаторе, она также включает фармацевтически приемлемый пропеллент. Аэрозольные дозируемые формы могут также находиться в распылителе с сжатым газом.
Составы, пригодные для приема через рот или щеку, или под язык, включают таблетки, лепешки и пастилки, в которых активный компонент составлен с добавлением носителя, такого как сахар и акация, трагакант, или желатин и глицерин.
Составы для ректального или вагинального применения обычно назначают в форме суппозиториев (содержащих обычное основание для суппозиториев, такое как кокосовое масло), маточных колец, вагинальных таблеток, пенок или клизм.
Составы для чрезкожного приема включают мази, гели и пластыри, а также инъекции, включая порошковые инъекции.
Обычно составы находятся в дозированной форме, такой как таблетки, капсулы или ампулы.
Составы согласно шестому аспекту изобретения полезны для предотвращения и/или лечения ожирения, сопутствующих расстройств, других форм медицинского снижения веса и немедицинского снижения веса. Предпочтительные признаки этого аспекта изобретения такие же, как описаны для первого - пятого аспектов изобретения.
Согласно седьмому аспекту изобретения, предложен способ получения состава согласно шестому аспекту изобретения. Получение состава можно осуществить по стандартной методике, хорошо известной специалистам, и оно включает приготовление композиции, включающей соединение согласно первому или второму аспектам изобретения и фармацевтически приемлемого носителя или разбавителя. Состав может быть в любой форме, например в виде таблетки, в жидком виде, в форме капсулы и порошка, или в форме продукта питания, например пищи функционального назначения. В последнем случае продукт питания сам по себе может выступать как фармацевтически приемлемый носитель.
Согласно восьмому аспекту изобретения предложен способ предотвращения и/или лечения ожирения или сопутствующих расстройств, причем способ включает применение соединения согласно первому или второму аспектам изобретения, предпочтительно в сочетании с фармацевтически приемлемым носителем или разбавителем (как в шестом аспекте изобретения). Сопутствующие ожирению заболевания включают гиперлипемию, гиперлипидемию, гипергликемию, гипертензию, сердечно-сосудистые заболевания, инсульт, желудочно-кишечные заболевания и желудочно-кишечные состояния. Соединения или составы предпочтительно назначают пациентам, которые в этом нуждаются, и в количествах, достаточных для предотвращения и/или лечения симптомов этих состояний, расстройств или заболеваний. Для всех аспектов изобретения, в особенности медицинских, прием соединения или состава должен быть строго дозирован под обязательным наблюдением врача и с учетом таких факторов, как используемое соединение, тип животного, возраст, вес, серьезность симптомов, способ приема, неблагоприятные реакции и/или другие противопоказания. Конкретно назначаемые дозы могут быть определены в результате стандартно разработанных клинических испытаний при полном контроле за изменением состояния пациента и выздоровлением. В подобных испытаниях могут быть использованы возрастающие дозы причем в качестве стартовой дозы для человека может быть взят низкий процент от максимально допустимой дозы в животных.
Физиологически приемлемые соединения согласно изобретению обычно могут назначаться в виде суточной дозы (для взрослого пациента) которая может составлять, например: для пероральной дозы - от 1 мг до 2000 мг, предпочтительно от 30 мг до 1000 мг, например от 10 до 250 мг; для внутривенной, подкожной или внутримышечной дозы - от 0,1 мг до 100 мг, предпочтительно от 0,1 мг до 50 мг, например от 1 до 25 мг соединения формулы (I) или ее физиологически приемлемой соли, рассчитанной как свободное основание, причем соединение принимают от 1 до 4 раз в сутки. Соединение может быть назначено в течение периода непрерывного лечения, например, в течение недели или более.
Согласно девятому аспекту изобретения предложен способ косметического поддержания данного веса, или косметического снижения веса, при этом способ включает прием соединения согласно первому аспекту изобретения, предпочтительно в сочетании с фармацевтически приемлемым носителем или разбавителем (как в пятом аспекте изобретения). Медицинский препарат предпочтительно назначают пациенту, которые в нем нуждается, и в количестве, достаточном для поддержания данного веса или для косметического снижения веса.
Восьмой и девятый аспекты изобретения относятся к способам лечения человека и животных, в частности животных-спутников человека и других животных, которые обеспечивают потребности человека в мясе, таких как крупный рогатый скот, свиньи и овцы (любого возраста).
Изобретение далее будет описано со ссылкой на следующие неограничивающие примеры.
Методики биологических испытаний и результаты
Испытываемые соединения
Соединения бензоксазинона, используемые в следующих испытаниях, обозначены номерами, которые соответствуют номерам соединений в таблице 1.
Определение активности липазы колориметрическим анализом с использованием хининдииминного красителя
Инигибирующее действие выбранных соединений по отношению к панкреатической липазе было измерено при проведении следующего анализа, набор для которого поставляется фирмой Sigma Ltd (Lipase PS™ каталог 805-А):





Глицерол, выделенный под действием панкреатической и моноглицеридной липаз, был окислен с выделением Н2О2. Затем на стадии реакции с участием пероксидазы образуется хининный краситель, который имеет розовый цвет и поглощает свет с длиной волны 550 нм.
Ингибитор
Индивидуальные соединения растворяли в ДМСО (диметилсульфоксиде) при 10 мМ. ДМСО использовали с тем, чтобы избежать проблем в случае нерастворимых в воде соединений.
Для индивидуальных соединений IC50 (концентрация, при которой активность липазы ингибируется до 50% от максимальной активности) рассчитывали путем измерения ингибирующего действия по логарифмическим кривым зависимости логарифма дозы в интервале ингибирующих концентраций.
Результаты
Методом колориметрического анализа с хининдииминным красителем, который позволяет быстро измерить ингибирующее действие липазы, был исследован ряд соединений. Ни одно из испытуемых соединений не участвовало в колориметирческой реакции, т.е. не было ложных положительных результатов.
Наблюдали интервал ингибирующих концентраций испытываемых соединений бензоксазинона, что указывает на то, что эти соединения являются ингибиторами панкреатической липазы человека. Следующие соединения имели IC50≤1 мкМ: 9, 11-16, 18-22, 23, 24-39, 77, 79-82, 84 и 85.
Определение активности фермента липазы методом титрования NaOH
Ингибирующее действие выбранных соединений по отношению к панкреатической липазе было измерено при проведении анализа, описанного в Pasquier et al., 1986, Vol.7, Nutritional Biochemistry, 293-302.
Логарифмические кривые зависимости ответа от логарифма дозы были построены для интервала ингибирующих концентраций.
Результаты
Выбранные соединения бензоксазинона исследовали методом титрования NaOH. В этом анализе фиксируется активность панкреатической липазы свиньи в системе, содержащей липидные мицеллы. Эти условия, таким образом, аналогичны тем, что наблюдаются в желудочно-кишечном тракте.
Наблюдали интервал ингибирующих концентраций испытываемых соединений бензоксазинона, указывающих на то, что эти соединения являются ингибиторами панкреатической липазы свиньи. Следующие соединения имели IC50≤1 мкМ: 1, 2, 4, 6-9, 11-16, 18, 22-25, 27-36, 37-39, 78, 82, 84 и 85.
Таким образом, результаты показывают, что испытываемые соединения бензоксазинона являются ингибиторами расщепления жиров и что эти соединения могут быть в особенности подходящими для лечения ожирения.
Измерение активности трипсина
Трипсин свиньи (Boeringer) растворяли при концентрации 1 мг/мл в 100 мМ MOPS (3-[N-морфолино]пропансульфоновая кислота) с рН 7,3, содержащего 2 мМ CaCl2. Перед использованием фермент разбавляли в 500 раз с получением конечной концентрации 2 мкг/мл.
Выбранные соединения хранили при обычных условиях в виде 5 мМ растворов в ДМСО (диметилсульфоксиде) при минус 20° С. Для анализа, аликвотные порции размораживали и приготовляли ряд растворов (× 100, × 200, × 1000, × 2000, × 10000, × 20000 и × 100000) в 100 мМ MOPS при рН 7,3, содержащего 2 мМ CaCl2. Основу из Bz-Phe-Arg-pNA (бензоил-фенилаланин-валил-аргинин-р-нитроанилид) растворяли в ДМСО с получением 10 мМ раствора. Непосредственно перед применением основу разбавляли до 0,3 мМ (30 мкл/мл) в 100 мМ MOPS, содержащего 2 М СаСl2.
Анализ проводили 3 раза на пластинках ELISA с 96 ячейками. При этом последовательно добавляли 10 мкл 2 мкг/мл трипсина, 26 мкл разбавленного ингибитора и 190 мкл основы. Пластинки затем инкубировали при 37° С в установке BioRad BenchMark Microplate Reader. Измеренная скорость освобождения р-нитроанилина при 405 нМ превышала на 10 мин скорость для фермента без ингибитора.
Измерение активности химотрипсина
Химотрипсин коровы (Sigma Type 11 Cat.No. C4129) растворяли при концентрации 1 мг/мл в 100 мМ Tris с рН 7,8. Перед использованием фермент разбавляли в 20 раз в том же буфере.
Выбранные соединения хранили при обычных условиях в виде 5 мМ растворов в ДМСО (диметилсульфоксиде) при минус 20° С. Для анализа, аликвотные порции размораживали и приготовляли ряд растворов (× 100, × 200, × 1000, × 2000, × 10000, × 20000 и × 100000) в 100 мМ Tris с рН 7,8. Основу из H-Ala-Ala-Phe-pNA (Н-аланин-аланил-фенилаланин-р-нитроанилид) (Bachem Cat. No.L-1095) растворяли в ДМСО с получением 10 мМ раствора и хранили при 4° С до момента использования. Непосредственно перед применением основу разбавляли до 0,3 мМ до конечной концентрации 30 мкл/мл.
Анализ проводили 3 раза на пластинках ELISA с 96 ячейками. При этом последовательно добавляли 10 мкл 50 мкг/мл химотрипсина, 50 мкл разбавленного ингибитора и 190 мкл основы. Пластинки затем инкубировали при 37° С в установке BioRad BenchMark Microplate Reader. Измеренная скорость освобождения р-нитроанилина при 405 нМ превышала на 10 мин скорость для фермента без ингибитора.
Результаты
В этом анализе была измерена селективность соединения 18 по отношению к панкреатической липазе человека, трипсину и химотрипсину. Ингибирующую активность соединения 18 по отношению к липазе оценивали по данным колориметрического анализа с хинидииминным красителем.
При 500 нМ соединение 18 ингибировало 98,7% активности панкреатической липазы, но только 4% активности трипсина и 12,5% активности химотрипсина. Таким образом, результаты показывают, что соединение 18 является высокоселективным ингибитором липазы.
Испытание на модели мыши
Соединение 18 испытывали на модели мыши, как описано Isler et al., British Journal of Nutrition, 1995, 73, 851-862, при этом было обнаружено, что это соединение является потенциальным ингибитором липазы.
Синтез промежуточных соединений
Синтез 4-замещенных антраниловых кислот
Пример: 4-октил антраниловая кислота (4-октил-2-аминобензойная кислота)
Способ основан на методике, описанной LA.Paquette et al, J.Am.Soc. 99, 3734 (1981).

Раствор 1-бром-4-октилбензола (9,9 г, 36 ммоль) в серной кислоте (20 мл) охладили на ледяной бане. Затем добавили азотную кислоту (1,44 мл, 36 ммоль). Удалили ледяную баню и смесь перемешивали при комнатной температуре в течение 20 мин. Добавили еще одну порцию азотной кислоты (0,07 мл, 1,75 ммоль) и продолжали перемешивать еще 20 мин. Смесь перелили в водный раствор карбоната калия, который экстрагировали этилацетатом. Органический экстракт промывали насыщенным водным раствором карбоната калия, водой и рассол затем высушивали (MgSO4) и концентрировали. При последующей очистке сырого продукта флэш-хроматографией (1% ЕtOАс/гексан) происходит удаление нежелательных (основных) региоизомеров с выходом требуемого продукта в виде желтого масла (1,7 г, 5,4 ммоль).

Основу (1,7 г, 5,4 ммоль), цианид меди (I) (0,533 г, 5,9 ммоль) и пиридин (20 мл) подвергали дефлегмации при 150° в течение 2 суток. Последующее концентрирование под вакуумом и очистка флэш-хроматографией (от 10% до 20% ЕtOАс/гексан) дает выход требуемого продукта в виде коричневого масла (739 мг, 2,8 ммоль).
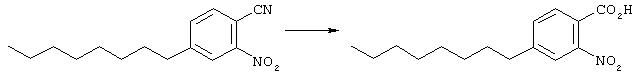
Основу (694 мг, 2,7 ммоль) нагревали при 150° в смеси с водой (2 мл), АсОН (1 мл) и серной кислоты (1 мл) в течение 2 суток. Смесь экстрагировали этилацетатом, органическую фазу промывали водой (2 раза), высушивали (Na2 SO4) и концентрировали с получением требуемого материала (744 мг, 2,7 ммоль).
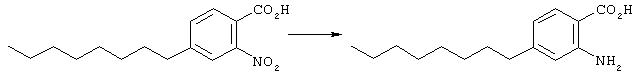
Исходный материал (744 мг, 2,7 ммоль) растворяли в этаноле (10 мл), и к раствору добавляли взвесь 10% палладия, нанесенного на активированный уголь (40 мг) в этаноле (4 мл). Колбу продували азотом и затем водородом (1 атм), после чего перемешивали всю ночь. Затем добавляли следующие порции катализатора (5 мг и 25 мг), и реакция завершилась в последующие 24 часа. Реакционную смесь фильтровали на целите, тщательно ополаскивали метанолом и этилацетатом. Концентрирование дало антраниловую кислоту (597 мг, 2,4 ммоль) достаточной степени чистоты для использования без последующей очистки; σH (400 МГц, CDCl3) 0,79-0,81 (3Н, m, Me), 1,12-1,36 (10Н, m, 5× СН2), 1,52 (2Н, br.s. ArСН2СН2), 2,45 (2Н, br.s. ArСН2), 6,42 (2Н, br.s. 2х ArH), 7,74 (1Н, br.s. ArH); m/z (ES+) 250 (МН+).
Синтез 5- замещенных антраниловых кислот
Пример: получение 5-октил антраниловой кислоты
Способ основан на методике, описанной B.R.Baker и др. в J.Org.Chem. 17, 141 (1952).

Хлоралгидрат (3,97 г, 24 ммоль) растворили в воде (50 мл). К этому раствору добавили последовательно безводный сульфат натрия (5,5 г, 39 ммоль), 4-октиланилин (5 мл, 22 ммоль), воду (15 мл), концентрированную хлористоводородную кислоту (2,3 мл) и водный раствор гидроксиламина гидрохлорида (4,5 г в 22 мл, 65 ммоль). Гетерогенную смесь нагревали до 95° С в течение 2 ч, затем до 110° С еще один час. Реакционную смесь затем охладили до комнатной температуры, коричневый осадок отфильтровали и промыли водой. Результат растворили в дихлорметане, высушили (MgSO4) и концентрировали с выходом 5,6 сырого материала, который очистили флэш-хроматографией на силикагеле (20% ЕtOАс/гексан) с получением желаемого материала (2 г, 7,2 ммоль).

Оксим (1,8 г, 6,5 ммоль) добавляли к смеси концентрированной серной кислоты (13 мл) и воды (1 мл) при 60° С в течение 15 мин. Смесь затем нагрели до 80° С в течение 2 ч и оставили на ночь. Затем провели экстракцию этилацетатом (× 3), соединенные органические слои промывали насыщенным водным бикарбонатом натрия и водой до получения нейтральной реакции промывной воды. Органическую фазу затем высушивали (MgSO4) и концентрировали с выходом изатина в виде красного осадка (1,5 г, 5,8 ммоль), который использовали без дальнейшей очистки.

Смесь изатина (1,5 г, 5,8 ммоль) и 1,5 М гидроксида натрия (13 мл) нагревали до 50° С. Нагрев прекращали и добавляли раствор 35% водного пероксида водорода (1,5 мл), при скорости которая обеспечивала поддержание температуры 50-55° С. Затем реакционную смесь оставляли охлаждаться, и перемешивали при комнатной температуре в течение 30 мин. Добавление концентрированной соляной кислоты до рН 2 приводило к выпадению осадка. Жидкость декантировали, осадок промывали водой. Осадок разделили между водой и дихлорметаном, органическую фазу промывали рассолом, сушили (MgSO4) и концентрировали с получением требуемой антраниловой кислоты (1,4 г, 5,6 ммоль). Дальнейшей очистки не требовалось: σH (400 МГц, CDCl3) 0,81 (3Н, t, J 6.6, Me), 1,20-1,23 (10Н, m, 5× СН2), 1,49 (2Н, br.s., ArСН2СН2), 2,41-2,44 (2Н, m, ArCH2), 6,55 (1Н, d, J 8.3, ArН), 7,65 (1Н, s, ArH); m/z (ES+) 250 (МН+).
Получение арилформиатов:
Пример: 4-феноксифенилхлорформиат

4-феноксифенол (1,68 г, 9 ммоль), 1,4-диметилимидазолидин-2-он (0,051 мл, 0,45 ммоль) и раствор фосгена (4,5 мл 20%-ного раствора в толуоле, 9 ммоль) нагревали до 40° С в течение 30 мин. Затем температуру подняли до 80° С и добавили еще 5 порций раствора фосгена (2,25 мл каждая, 4,5 ммоль) с интервалом в 30 мин. Через 30 мин после последнего добавления, раствор оставили охлаждаться до комнатной температуры и выдержали в течение ночи. Аликвотную порцию добавили к МеОН/пиридину с образованием стабильного метилкарбамата, после чего тонкослойная хроматография (10% ЕtOAс/гексан) показала почти полное исчезновение исходного материала. Раствор хлорформиата использовали непосредственно в приготовлении соединения 29 по методике, описанной в примере 4 ниже.
Синтез новых соединений согласно изобретению
Пример 1
Синтез 6-метил-2-октилокси-4H-3,1-бензоксазин-4-она (номер 11)
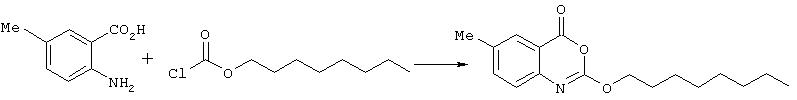
Раствор 2-амино-5-метилбензойной кислоты (302 мг, 2 ммоль) в пиридине (10 мл) охладили до 0° С и добавили по капле октилформиат (1,15 мл, 6 ммоль). Полученную смесь оставили нагреваться до комнатной температуры и перемешивали втечение 4 ч. Пиридин затем удалили под вакуумом и остаток растворили в этилацетате (50 мл). Этот раствор промыли 1 М HCl (10 мл) и рассолом (5 мл), высушили (MgSO4) и растворитель удалили под вакуумом с получением бледно-оранжевого маслянистого остатка. Рекристаллизация из гексана дала желаемый продукт в виде почти белого твердого остатка. (144 мг, 25%); σH (400 МГц, ДМСО-d6) 0,68 (3Н, t, J7, СН2 СН3), 1,26-1,40 (10Н, m, 5× СН2), 1,73 (2Н, tt, J, J'7, ОСН2СН2СН3), 2,35 (3Н, s, СН3), 4,35 (2Н, t, J7, ОСН2), 7,34 (1Н, d, J 8, Ph), 7,65 (1Н, d, J8, Ph), 7,83 (1H, s, Ph), m/z (ES+) 290 (MH+).
Пример 2
6-метил-2-фенокси-4Н-3,1-бензоксазин-4-он (соединение номер 8)

Раствор 2-амино-5-метилбензойной кислоты (302 мг, 2 ммоль) в пиридине (10 мл) охладили до 0° C и добавили по капле фенилхлорформиат (3,3 мл, 26 ммоль). Полученную смесь оставили нагреваться до комнатной температуры при перемешивании в течение 16 ч, после чего пиридин удалили под вакуумом. Остаток промыли водой (20 мл) и высушили под вакуумом. Рекристаллизация из толуола дала желаемый продукт в виде бледно-коричневого твердого остатка (692 мг, 41%); σH (400 МГц, ДМСО-d6) 2,40 (3Н, s, СН3), 7,33-7,45 (3Н, m, Рh), 7,48-7,55 (3Н, m, Рh), 7,63 (1Н, d, J8, Рh), 7,89 (1Н, s, Рh-Н5), m/z (ES+) 254 (МH+).
Пример 3
2-пропокси-6-метил-4Н-3, 1-бензоксазин-4-он (соединение номер 9)

Раствор 2-амино-5-метилбензойной кислоты (1,0 г, 6,6 моль) в пиридине (10 мл) охладили до 0°С и добавили по капле пропилхлорформиат (3,0 мл, 26 ммоль). Полученную смесь оставили нагреваться до комнатной температуры при перемешивании в течение 4 ч, после чего пиридин удалили под вакуумом. Остаток промыли водой (25 мл) и высушили под вакуумом с получением желаемого продукта в виде почти белого твердого остатка (0,96 г, 66%); σH (400 МГц, ДМСО-d6) 1,03 (3Н, t, J7, СН2СН3), 1,82 (2Н, tq, J, J'7, СН2СН3), 2,46 (3Н, s, СН3), 4,42 (2Н, t, J7, ОСН2), 7,40 (1Н, d, J8, Рh), 7,71 (1Н, d, J8, Рh), 7,89 (1Н, s, Рh), m/z (ES+) 219 (МН+).
Пример 4
2-гексадецилокси-6-метил-4Н-3, 1-бензоксазин-4-он (номер 18)
Способ получения 1
Шаг 1:

1-гексадеканол (0,78 г, 3,2 ммоль, 1 экв.) растворили в минимальном количестве ТГФ (тетрагидрофурана) в атмосфере азота. К результату добавили 20%-ный раствор фосгена в толуоле (2,34 мл, 5, 5 ммоль, 1,5 экв.). Через 45 мин добавили вторую такую же порцию раствора фосгена. Еще через 45 мин аппарат продули азотом (который на выходе пропускали через скруббер с 5 М гидроксидом натрия) для удаления избытка фосгена.
Шаг 2:

2-амино-5-метилбензойную кислоту (100 мг, 0,64 ммоль, 0,2 экв.) растворили в пиридине (10 мл). По капле добавили хлорформиат из пипетки и смесь перемешивали при комнатной температуре в течение 2 ч. Затем смесь разбавили этилацетатом (100 мл) и промыли 10%-ным раствором лимонной кислоты (100 мл, х2), насыщенным раствором бикарбоната натрия (100 мл, х2), водой и насыщенным рассолом (100 мл). Органическую фазу высушили (MgSO4) и концентрировали под вакуумом.
Остаток очистили флэш-хроматографией на силикагеле, с элюентом 1:5:94 диизопропилэтиламин/этилацетат/гексан с получением белого твердого остатка (40 мг, 15%); σH (400 МГц, CDCI3) 0,87 (3Н, t, J6.8, СH2СН3), 1,24-1,45 (26Н, m, 13× CH2), 1,75-1,82 (2Н, m, ОСН2СН3), 2,41 (3Н, s, ArСН3), 4,41 (2Н, t, J6.7, ОСН2), 7,30 (1Н, d, J8, ArH), 7,51 (1Н, dd, J8.5, 2.0, ArH), 7,90 (1Н, d, J1.1, ArH), m/z (ES+ ) 402 (MH+); MPt. 72-73°C.
Тонкослойные хроматограммы (растворитель 1% диизопропиламин/5% этилацетат/94% гексан) наблюдали в УФ свете и фосфомолибденовой кислоте в этаноле (Rf соединения 18=0,6).
Способ получения 2
Шаг 1:

1-гексадеканол (5,01 г, 20,6 ммоль, 1 экв.), растворили в ТГФ (10 мл) в атмосфере азота и добавили 20%-ный раствор фосгена в толуоле (29 мл, 62,5 ммоль, 3 экв.). Смесь перемешивали при комнатной температуре в течение 2 ч, затем аппарат продули азотом (который на выходе пропускали через скруббер с 5 М гидроксидом натрия) для удаления избытка фосгена.
Шаг 2:

2-амино-5-метилбензойную кислоту (2,71 г, 17,9 ммоль, 0,87 экв.) растворили в пиридине (24 мл) и добавили к раствору хлорформиата, приготовленному как указано выше. Смесь перемешивали при комнатной температуре в течение 1,75 ч. Затем медленно добавили метилхлорформиат (13,6 мл, 176 ммоль, 8,5 экв.) и смесь оставили перемешиваться при комнатной температуре на ночь. Затем смесь разбавили этилацетатом (20 мл) и промыли водой (15 мл) и 10%-ным раствором лимонной кислоты (20 мл). Соединенные органические фазы экстрагировали этилацетатом (20 мл). Органические экстракты собрали и промыли водой (20 мл) и рассолом (20 мл) и затем концентрировали с получением осадка. Осадок суспендировали в пентане (5 мл), отфильтровали и очистили флэш-хроматографией на силикагеле (1,5% диизопропилэтиламина в дихлорметане) с получением белого твердого остатка (2,51 г, 31%); σH (400 МГц, CDCl3) 0,87 (3Н, t, J6.8, СН2СН3), 1,24-1,45 (26Н, m, 13× СН2), 1,75-1,82 (2Н, m, ОСН2СН3), 2,41 (3Н, s, ArСН3), 4,41 (2Н, t, J6.7, OCH2), 7, 30 (1Н, d, J8, ArH), 7,51 (1Н, dd, J8.5, 2.0, ArH), 7,90 (1Н, d, J1.1, ArH), m/z (ES+) 402 (MH+); MPt. 72-73° C.
Пример 5
Остальные соединения из таблицы 1 могут быть получены аналогично примерам 1-4. В частности, следующие соединения были получены при использовании исходных веществ, приведенных в таблице 2.


В вышеприведенном описании подробно рассмотрены конкретные соединения, составы, способы и применения, которые могут быть использованы для осуществления настоящего изобретения. Однако специалистам в данной области должно быть понятно, как можно использовать альтернативные способы реализации альтернативных вариантов настоящего изобретения, охватываемых формулой изобретения.
Реферат
Изобретение относится к органической химии и может найти применение в медицине. Описывается способ предотвращения или лечения состояний, в которых требуется ингибирование фермента, преимущественное действие которого заключается в катализировании гидролиза эфирных функциональных групп, где указанное состояние представляет собой ожирение или сопутствующее нарушение, при котором назначают соединение формулы (I),

или его фармацевтически приемлемой соли, эфира, амида или предшественника, в производстве лекарственного препарата для предотвращения или лечения состояний, в которых требуется ингибирование фермента, преимущественное действие которого заключается в катализировании гидролиза эфирных функциональных групп, где в формуле (I): А - шестичленное ароматическое или гетероароматическое кольцо, R1 - разветвленный или неразветвленный алкил (углеродная цепочка которого, возможно, прервана одним или более атомами кислорода), алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, восстановленный арилалкил, арилалкенил, гетероарил, гетероарилалкил, гетероарилалкенил, восстановленный арил, восстановленный гетероарил, восстановленный гетероарилалкил или их замещенное производное, в котором заместителем является один или более независимо выбранный из группы: галоген, алкил, замещенный галогеном алкил, арил, арилалкил, гетероарил, восстановленный гетероарил, восстановленный гетероарилалкил, арилалкокси-, циано-, нитро-, -С(О)R4, -СО2R4, SOR4, -SO2R4, -NR6R7, -OR6, -SR6, -C(О)СХ1X2NR6R7, -С(О)NR4R5, -C(O)N(OR5)R6, -NR6C(O)R4, -CR6(NH2 )CO2R6, -NCX1X2CO2R6, -N(ОН)С(О)NR6 R7, -N(ОН)С(О)R4, -NHC(О)NR6R7, С(О)NHNR6R7, -C(О)N(OR5)R6, или липид, или стероид (природный или синтетический), при условии, что любой замещающий гетероатом в R1 или R2 должен быть отделен от экзоциклического атома азота по меньшей мере двумя атомами углерода (предпочтительно насыщенными), и где R4 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, восстановленный гетероарил или восстановленный гетероарилалкил, OR6, NHCX1X2CO2R6 или NR6R7, R5 представляет собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, гетероарилалкил, восстановленный гетероарил или восстановленный гетероарилалкил, R6 и R7 независимо выбраны из водорода, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, арила, арилалкила, гетероарила, восстановленного гетероарила, гетероарилалкила, восстановленного гетероарилалкила или (CH2)n(OR5)m, где n - от 1 до 12, предпочтительно от 2 до 10, а m - от 1 до 3, и R5 наиболее предпочтительно алкил С2-10, и X1 и X2 независимо представляют собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, арил, арилалкил, гетероарил, восстановленный гетероарил, гетероарилалкил или восстановленный гетероарилалкил. Также описываются соединение формулы II, IIa, IIb, способ получения соединения II, IIa, IIb, фармацевтическая композиция для предотвращения или лечения ожирения и/или сопутствующего нарушения, продукт питания, способ предотвращения или лечения ожирения или сопутствующих нарушений, способ ингибирования ферментов, способ снижения содержания жира в животных, косметический способ поддержания данного веса и новое промежуточное соединение формулы IV. Технический результат - раскрыта возможность предотвращения или лечения ожирения или сопутствующих нарушений. 13 н. и 20 з.п. ф-лы, 2 табл.
Формула









Комментарии